KR20100128286A - 조혈계 기원의 종양 치료용 조성물 및 방법 - Google Patents
조혈계 기원의 종양 치료용 조성물 및 방법 Download PDFInfo
- Publication number
- KR20100128286A KR20100128286A KR1020107019272A KR20107019272A KR20100128286A KR 20100128286 A KR20100128286 A KR 20100128286A KR 1020107019272 A KR1020107019272 A KR 1020107019272A KR 20107019272 A KR20107019272 A KR 20107019272A KR 20100128286 A KR20100128286 A KR 20100128286A
- Authority
- KR
- South Korea
- Prior art keywords
- seq
- antibody
- amino acid
- acid sequence
- group
- Prior art date
Links
- 0 C*C(N(C)[C@](C)C(O[C@@](CC(N(C)c(cc(CC(C)=CC=C[C@]([C@@](C1)(N2)O)OC)cc3OC)c3Cl)=O)[C@]3(C)O[C@]3[C@](C)[C@]1OC2=O)=O)=O Chemical compound C*C(N(C)[C@](C)C(O[C@@](CC(N(C)c(cc(CC(C)=CC=C[C@]([C@@](C1)(N2)O)OC)cc3OC)c3Cl)=O)[C@]3(C)O[C@]3[C@](C)[C@]1OC2=O)=O)=O 0.000 description 1
- HVSWNFDRECNCOE-UHFFFAOYSA-N CC(C)(C)OC(NNCC(ON(C(CC1)=O)C1=O)=O)=O Chemical compound CC(C)(C)OC(NNCC(ON(C(CC1)=O)C1=O)=O)=O HVSWNFDRECNCOE-UHFFFAOYSA-N 0.000 description 1
- ZTMBXTMPSQKDCW-UHFFFAOYSA-N CC(C)(C)OC(NNc(cc1)ccc1C(ON(C(CC1)=O)C1=O)=O)=O Chemical compound CC(C)(C)OC(NNc(cc1)ccc1C(ON(C(CC1)=O)C1=O)=O)=O ZTMBXTMPSQKDCW-UHFFFAOYSA-N 0.000 description 1
- QYEAAMBIUQLHFQ-UHFFFAOYSA-N O=C(CCSSc1ncccc1)NCCCCCC(ON(C(CC1)=O)C1=O)=O Chemical compound O=C(CCSSc1ncccc1)NCCCCCC(ON(C(CC1)=O)C1=O)=O QYEAAMBIUQLHFQ-UHFFFAOYSA-N 0.000 description 1
- JWDFQMWEFLOOED-UHFFFAOYSA-N O=C(CCSSc1ncccc1)ON(C(CC1)=O)C1=O Chemical compound O=C(CCSSc1ncccc1)ON(C(CC1)=O)C1=O JWDFQMWEFLOOED-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
- A61K47/6811—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates the drug being a protein or peptide, e.g. transferrin or bleomycin
- A61K47/6817—Toxins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6851—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/624—Disulfide-stabilized antibody (dsFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/77—Internalization into the cell
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Organic Chemistry (AREA)
- Molecular Biology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biochemistry (AREA)
- Cell Biology (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Hematology (AREA)
- Urology & Nephrology (AREA)
- Epidemiology (AREA)
- Toxicology (AREA)
- Biomedical Technology (AREA)
- Oncology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Food Science & Technology (AREA)
- Gastroenterology & Hepatology (AREA)
- Biotechnology (AREA)
- Hospice & Palliative Care (AREA)
- Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Zoology (AREA)
- Microbiology (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
Abstract
본 발명은 포유동물에서 조혈계 종양의 치료에 유용한 물질의 조성물, 및 그를 위한 물질의 조성물의 사용 방법에 관한 것이다.
Description
본 발명은 포유동물에서 조혈계 종양의 치료에 유용한 물질의 조성물, 및 그를 위한 물질의 조성물의 사용 방법에 관한 것이다.
악성 종양 (암)은 심장병에 이어 미국에서 두 번째 주요 사인이다 (Boring et al., CA Cancel J. Clin. 43:7 (1993)). 암은 증식하여 종양 덩어리를 형성하는, 정상 조직으로부터 유래하는 비정상적이거나 신생물성 세포의 수의 증가, 이들 신생물성 종양 세포에 의한 인접한 조직의 침습, 및 궁극적으로 혈액 또는 림프계를 통해 부위 림프절로 및 전이로 불리는 과정을 통해 먼 부위로 확산하는 악성 세포의 생성을 특징으로 한다. 암성 상태에서, 세포는 정상 세포가 성장하지 않을 조건 하에 증식한다. 암은 상이한 정도의 침습성 및 공격성을 특징으로 하는 매우 다양한 형태로 나타난다.
그에 의해 혈액의 세포성 요소, 예를 들어 림프구, 백혈구, 혈소판, 적혈구 및 천연 킬러 (natural killer) 세포가 생성되는 과정인 조혈작용 동안 생성되는 세포를 수반하는 암을 조혈계암으로 칭한다. 혈액 및 림프 조직에서 발견할 수 있고 면역 반응에 중요한 림프구는 2개의 주요 클래스의 림프구로 나누어진다: B 림프구 (B 세포) 및 T 림프구 (T 세포) (이들은 각각 체액성 및 세포 매개 면역을 매개한다).
B 세포는 골수 내에서 성숙하고, 그들의 세포 표면 상에 항원 결합 항체를 발현하는 골수를 떠난다. 나이브 (naive) B 세포가 처음으로 그에 대해 그의 막-결합된 항체가 특이적인 항원을 만나면, 세포는 빠르게 분열하기 시작하고, 그의 자손체는 기억 B 세포 및 "형질세포"로 불리는 효과기 (effector) 세포로 분화한다. 기억 B 세포는 수명이 길고, 원래의 모 세포와 동일한 특이성을 갖는 막-결합형 항체를 계속하여 발현한다. 형질세포는 막-결합형 항체를 생산하지 않지만, 대신에 분비될 수 있는 형태로 항체를 생산한다. 분비된 항체는 체액성 면역의 주요 효과기 분자이다.
T 세포는 미성숙 T 세포의 증식 및 분화를 위한 환경을 제공하는 흉선 내에서 성숙한다. T 세포 성숙 동안, T 세포는 T-세포 수용체를 생산하는 유전자 재배열, 및 성숙 T 세포의 세포-표면 표현형을 결정하는 것을 돕는 양성 및 음성 선택을 거친다. 성숙 T 세포의 특징적인 세포 표면 마커 (marker)는 CD3:T-세포 수용체 복합체 및 보조수용체 중 하나, 즉, CD4 또는 CD8이다.
암 치료를 위한 효과적인 세포성 표적을 밝히기 위한 시도에서, 연구자들은 하나 이상의 정상 비-암성 세포(들)에 비해 하나 이상의 특정 종류(들)의 암세포의 표면 상에서 특이적으로 발현되는 막횡단 또는 막-회합된 폴리펩티드를 확인하고자 하였다. 종종, 상기 막-회합된 폴리펩티드는 비-암성 세포의 표면 상에 비해 암세포의 표면 상에서 더 풍부하게 발현된다. 상기 종양-연관 세포 표면 항원 폴리펩티드를 확인하면 항체-기반 요법을 통한 파괴를 위해 암세포를 특이적으로 표적화하는 능력을 제공한다. 이와 관련하여, 항체-기반 요법은 특정 암의 치료에서 매우 효과적인 것으로 입증되었음에 주목한다. 예를 들어, HERCEPTIN® 및 RITUXAN® (둘 모두 제넨테크 인크. (Genentech Inc., 미국 캘리포니아주 사우쓰 샌프란시스코))은 각각 유방암 및 비-호지킨 (Hodgkin) 림프종을 치료하기 위해 성공적으로 사용되고 있는 항체이다. 보다 구체적으로, HERCEPTIN®은 인간 표피 성장 인자 수용체 2 (HER2) 원-종양유전자의 세포외 도메인에 선택적으로 결합하는 재조합 DNA-유래 인간화 모노클로날 항체이다. HER2 단백질 과다발현은 원발성 유방암의 25-30%에서 관찰된다. RITUXAN®은 정상 및 악성 B 림프구의 표면에서 발견되는 CD20 항원에 대해 생성된 유전공학 처리된 키메라 (chimera) 쥐/인간 모노클로날 항체이다. 이들 항체는 둘 모두 CHO 세포에서 재조합 방식으로 생산된다.
암 치료를 위한 효과적인 세포성 표적을 밝히기 위한 다른 시도에서, 연구자들은 (1) 하나 이상의 특정 종류(들)의 비-암성 정상 세포(들)에 비해 하나 이상의 특정 종류(들)의 암세포(들)에 의해 특이적으로 생산되는 비-막-회합된 폴리펩티드, (2) 하나 이상의 정상 비-암성 세포(들)의 것보다 유의하게 더 높은 발현 수준에서 암세포에 의해 생산되는 폴리펩티드, 또는 (3) 암성 및 비-암성 상태 (예를 들어, 정상 전립선 및 전립선 종양 조직) 모두에서 그의 발현이 단일 (또는 매우 제한된 수의 상이한) 조직 종류(들)에만 특이적으로 제한되는 폴리펩티드를 확인하고자 하였다. 그러한 폴리펩티드는 세포 내에 위치하여 유지될 수 있거나 암세포에 의해 분비될 수 있다. 또한, 그러한 폴리펩티드는 암세포 자체에 의해서가 아니라, 오히려 암세포에 대한 강화 또는 성장-향상 효과를 갖는 폴리펩티드를 생산하고/하거나 분비하는 세포에 의해 발현될 수 있다. 그러한 분비된 폴리펩티드는 종종 정상 세포에 비해 암세포에 성장 잇점을 제공하는 단백질이고, 예를 들어, 혈관신생 인자, 세포 부착 인자, 성장 인자 등을 포함한다. 그러한 비-막 회합 폴리펩티드의 길항제의 확인은 그러한 암의 치료를 위한 효과적인 치료제로서 역할을 하는 것으로 예상될 것이다. 또한, 그러한 폴리펩티드의 발현 패턴의 확인은 포유동물에서 특정 암의 진단을 위해 유용할 것이다.
포유동물 암 치료에서 상기 확인된 진보에도 불구하고, 각각 포유동물에서 종양의 존재를 검출할 수 있는 추가의 치료제, 및 신생물성 세포 성장을 효과적으로 억제하기 위한 치료제가 매우 필요하다. 따라서, 본 발명의 목적은 암성 및 비-암성 상태 모두에서 그의 발현이 단일 (또는 매우 제한된 수의 상이한) 조직 종류(들), 조혈 조직에만 특이적으로 제한되는 폴리펩티드, 세포막-회합된, 분비된 또는 세포내 폴리펩티드를 확인하고, 포유동물에서 조혈계 암의 치료 목적의 처치 및 검출에서 유용한 물질의 조성물을 생산하기 위해 이들 폴리펩티드 및 그들의 코딩 핵산을 사용하는 것이다.
CD79는 CD79a (Igα, mb-1) 및 CD79b (Igβ, B29)를 함유하는 공유 이종이량체로 이루어지는 B-세포 수용체의 신호전달 성분이다. CD79a 및 CD79b는 각각 세포외 면역글로불린 (Ig) 도메인, 막횡단 도메인, 및 세포내 신호전달 도메인, 면역수용체 티로신계 활성화 모티프 (ITAM) 도메인을 함유한다. CD79 발현은 B 세포에 제한되고, 비-호지킨 림프종 세포 (NHL)에서 발현된다 ([Cabezudo et al., Haematologica, 84:413-418 (1999)]; [D'Arena et al., Am. J. Hematol., 64: 275-281 (2000)]; [Olejniczak et al., Immunol. Invest., 35: 93-114 (2006)]). CD79a 및 CD79b 및 sIg는 모두 CD79의 표면 발현을 위해 요구된다 (Matsuuchi et al., Curr. Opin. Immunol., 13(3): 270-7)). NHL 상의 CD79b의 평균 표면 발현은 정상 B-세포 상에서와 유사하지만, 보다 큰 범위이다 (Matsuuchi et al., Curr. Opin. Immunol., 13(3): 270-7 (2001)).
따라서, 특히 장기 치료를 위해 환자에게 투여될 때 항원성이 최소이거나 없는 CD79a 및 CD79b 항원에 대한 치료 항체를 생산하는 것이 유익하다. 본 발명은 상기 및 다른 필요를 만족시킨다. 본 발명은 현재의 치료 조성물의 한계를 극복하고, 또한 아래 상세한 설명으로부터 명백해질 추가의 잇점을 제공하는 항-CD79a 및 항-CD79b 항체를 제공한다.
암의 치료에서 세포독성제 또는 세포 증식 억제제, 즉 종양 세포를 사멸시키거나 억제하는 약물의 국소 전달을 위한 항체-약물 접합체 (ADC), 즉, 면역접합체의 사용 ([Lambert, J. (2005) Curr. Opinion in Pharmacology 5:543-549]; [Wu et al (2005) Nature Biotechnology 23(9):1137-1146]; [Payne, G. (2003) Cancer Cell 3:207-212]; [Syrigos and Epenetos (1999) Anticancer Research 19:605-614]; [Niculescu-Duvaz and Springer (1997) Adv. Drug Del. Rev. 26:151-172]; US 4975278)은 종양으로의 약물 모이어티 (moiety)의 표적화된 전달, 및 그 내부의 세포내 축적을 허용하고, 여기서 이들 비접합된 약물 물질의 전신 투여는 제거하고자 하는 종양 세포뿐만 아니라 정상 세포에도 허용되지 않는 수준의 독성을 일으킬 수 있다 ([Baldwin et al., (1986) Lancet pp. (Mar. 15, 1986):603-05]; [Thorpe (1985) "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review," in Monoclonal Antibodies '84: Biological And Clinical Applications, A. Pinchera et al. (ed.s), pp. 475-506]). ADC의 치료 지수, 즉, 최대 효능 및 최소 독성을 개선하기 위한 노력은 약물-연결 및 약물-방출 특성 (Lambert, J. (2005) Curr. Opinion in Pharmacology 5:543-549)뿐만 아니라 폴리클로날 항체 (Rowland et al (1986) Cancer Immunol. Immunother., 21: 183-87) 및 모노클로날 항체 (mAb)의 선택성에 촛점을 맞추었다. 항체 약물 접합체에 사용되는 약물 모이어티는 세균 단백질 독소, 예를 들어 디프테리아 독소, 식물 단백질 독소, 예를 들어 리신, 소분자 독소, 예를 들어 오리스타틴 (auristatin), 겔다나마이신 ([Mandler et al (2000) J. of the Nat. Cancer Inst. 92(19): 1573-1581]; [Mandler et al (2000) Bioorganic & Med. Chem. Letters 10: 1025-1028]; [Mandler et al (2002) Bioconjugate Chem. 13:786-791]), 메이탄시노이드 (EP 1391213; [Liu et al., (1996) Proc. Natl. Acad. Sci. USA 93:8618-8623]), 및 칼리케아미신 ([Lode et al (1998) Cancer Res. 58:2928]; [Hinman et al (1993) Cancer Res. 53:3336-3342]), 다우노마이신, 독소루비신, 메토트렉세이트, 및 빈데신 (Rowland et al (1986), 상기 문헌)을 포함한다. 약물 모이어티는 튜불린 결합, DNA 결합, 또는 토포이소머라제 억제를 포함한 세포독성 및 세포 증식 억제 메카니즘에 영향을 줄 수 있다. 일부 세포독성 약물은 큰 항체 또는 단백질 수용체 리간드에 접합될 때 불활성이거나 활성이 작은 경향이 있다.
오리스타틴 펩티드, 오리스타틴 E (AE) 및 모노메틸오리스타틴 (MMAE) (돌라스타틴의 합성 유사체) (WO 02/088172)가 (i) 키메라 모노클로날 항체 cBR96 (암종 상의 Lewis Y에 특이적인); (ii) 혈액암 상의 CD30에 특이적인 cAC10 ([Klussman, et al (2004), Bioconjugate Chemistry 15(4):765-773]; [Doronina et al (2003) Nature Biotechnology 21(7):778-784]; [Francisco et al (2003) Blood 102(4): 1458-1465]; US 2004/0018194); (iii) CD20-발현 암 및 면역 질환의 치료를 위한 항-CD20 항체, 예를 들어 Rituxan (WO 04/032828); (iv) 결직장암 치료를 위한 항-EphB2R 항체 2H9 (Mao et al (2004) Cancer Research 64(3): 781-788); (v) E-셀렉틴 항체 (Bhaskar et al (2003) Cancer Res. 63:6387-6394); (vi) 트라스투주맙 (HERCEPTIN®, US 2005/0238649), 및 (vii) 항-CD30 항체 (WO 03/043583)에 약물 모이어티로서 접합되었다. 오리스타틴 E의 변이체는 US 5767237 및 US 6124431에 개시되어 있다. 모노클로날 항체에 접합된 모노메틸 오리스타틴 E는 2004년 3월 28일 간행된 문헌 [Senter et al., Proceedings of the American Association for Cancer Research, Volume 45, Abstract Number 623]에 개시되어 있다. 오리스타틴 유사체 MMAE 및 MMAF가 각종 항체에 접합되었다 (US 2005/0238649).
약물 모이어티를 항체에 부착시키는, 즉, 공유 결합을 통해 연결시키는 통상적인 수단은 일반적으로 약물 모이어티가 항체 상의 많은 부위에 부착되는 분자의 불균질 혼합물을 생성시킨다. 예를 들어, 세포독성 약물은 대개 항체의 종종 수많은 라이신 잔기를 통해 항체에 접합되어, 불균질 항체-약물 접합체 혼합물을 생성한다. 반응 조건에 따라, 불균질 혼합물은 대개 0 내지 약 8개 또는 그보다 많은 부착된 약물 모이어티를 갖는 항체의 분포를 포함한다. 추가로, 약물 모이어티 대 항체의 특정 정수비를 갖는 접합체의 각각의 하위군 내에 약물 모이어티가 항체 상의 다양한 부위에 부착되는 잠재적으로 불균질한 혼합물이 존재한다. 분석 및 제조 방법은 접합 반응으로부터 생성되는 불균질 혼합물 내에서 항체-약물 접합체 종 분자를 분리하고 특성화하기에 부적당할 수 있다. 항체는 종종 많은 반응성 관능기를 갖는 크고 복잡하고 구조상 다양한 생체분자이다. 그들의 링커 시약 및 약물-링커 중간체와의 반응성은 pH, 농도, 염 농도, 및 공용매와 같은 인자에 의존성이다. 또한, 다단계 접합 과정은 반응 조건을 제어하고 반응물 및 중간체를 특성화하는 어려움 때문에 재현가능하지 않을 수 있다.
pH 7 부근에서 양성자화되고 덜 친핵성인 대부분의 아민과는 달리, 시스테인 티올은 중성 pH에서 반응성이다. 유리 티올 (RSH, 술프히드릴)기는 비교적 반응성이므로, 시스테인 잔기를 갖는 단백질은 종종 디술피드-연결된 올리고머로서 산화된 형태로 존재하거나, 내부에 가교된 디술피드기를 갖는다. 세포외 단백질은 일반적으로 유리 티올을 갖지 않는다 (Garman, 1997, Non-Radioactive Labelling: A Practical Approach, Academic Press, London, at page 55). 항체 시스테인 티올기는 일반적으로 항체 아민 또는 히드록실기보다 친전자성 접합 시약에 대해 더 반응성이고, 즉, 더 친핵성이다. 시스테인 잔기는 유전공학 기술에 의해 단백질 내로 도입되어, 리간드에 공유 결합에 의해 부착을 형성하거나 새로운 분자내 디술피드 결합을 형성하였다 ([Better et al (1994) J. Biol. Chem. 13: 9644-9650]; [Bernhard et al (1994) Bioconjugate Chem. 5: 126-132]; [Greenwood et al (1994) Therapeutic Immunology 1:247-255]; [Tu et al (1999) Proc. Natl. Acad. Sci USA 96:4862-4867]; [Kanno et al (2000) J. of Biotechnology, 76:207-214]; [Chmura et al (2001) Proc. Nat. Acad. Sci. USA 98(15):8480-8484]; US 6248564). 그러나, 단백질의 다양한 아미노산 잔기의 시스테인 아미노산으로의 돌연변이에 의한 시스테인 티올기의 조작은, 특히 쌍을 이루지 않은 (유리 Cys) 잔기 또는 반응 또는 산화반응을 위해 비교적 접근가능한 것의 경우에 잠재적으로 문제가 된다. 이. 콜라이 (E. coli)의 주변세포질, 배양 상등액, 또는 부분적으로 또는 완전히 정제된 단백질 내에서 인지를 불문하고, 단백질의 농축 용액에서, 단백질의 표면 상의 쌍을 이루지 않은 Cys 잔기는 쌍을 이루고 산화되어 분자내 디술피드를 형성할 수 있고, 따라서 단백질 이량체 또는 다량체를 형성할 수 있다. 디술피드 이량체 형성은 새로운 Cys가 약물, 리간드, 또는 다른 표지 (label)에 대한 접합에 대해 비반응성이 되도록 한다. 또한, 단백질이 새로 조작된 Cys와 존재하는 Cys 잔기 사이에서 분자내 디술피드 결합을 산화에 의해 형성하면, 두 Cys 티올기는 활성 부위 참여 및 상호작용에 이용가능하지 않다. 또한, 단백질은 미스폴딩 (misfolding) 또는 3차 구조의 손실에 의해 불활성 또는 비-특이적으로 될 수 있다 (Zhang et al (2002) Anal. Biochem. 311: 1-9).
시스테인-조작된 항체는 FAB 항체 단편 (thioFab)으로서 설계되고, 전장, IgG 모노클로날 (thioMab) 항체로서 표현된다 (US 2007/0092940, 그 내용을 참조로 포함된다). ThioFab 및 ThioMab 항체는 새로 도입된 시스테인 티올에서 링커를 통해 티올-반응성 링커 시약 및 약물-링커 시약과 접합되어, 항체 약물 접합체 (Thio ADC)를 생성하였다.
특허 출원 및 공개를 포함한 본원에 인용된 모든 참조문은 그 전문이 참조로 포함된다.
<발명의 개요>
A. 실시태양
본 명세서에서, 본 출원인은 특이적인 세포 종류, 예를 들어 조혈작용 동안 생성되는 세포, 즉 림프구, 백혈구, 적혈구 및 혈소판의 종양 및 정상 세포 모두에 의해 특이적으로 발현되는 다양한 세포성 폴리펩티드 (및 그의 코딩 핵산 또는 그의 단편)의 최초 확인에 대해 설명한다. 모든 상기 폴리펩티드는 본원에서 조혈계 기원의 종양 항원 ("TAHO (Tumor Antigens of Hematopoietic Origin)") 폴리펩티드로 언급되고, 포유동물의 암 치료를 위한 효과적인 표적으로서 기능할 것으로 예상된다.
본 발명은 항-CD79a 및 항-CD79b 항체 또는 그의 기능성 단편, 및 조혈계 종양의 치료에서 그의 사용 방법을 제공한다.
따라서, 본 발명의 한 실시태양에서, 본 발명은 조혈계 기원 종양 항원 폴리펩티드 ("TAHO" 폴리펩티드) 또는 그의 단편을 코딩하는 뉴클레오티드 서열을 갖는 단리된 핵산 분자를 제공한다.
특정 측면에서, 단리된 핵산 분자는 (a) 본원에서 개시되는 아미노산 서열을 갖는 전장 TAHO 폴리펩티드, 본원에서 개시되는 신호 펩티드가 결여된 TAHO 폴리펩티드 아미노산 서열, 신호 펩티드가 존재하거나 존재하지 않는 본원에서 개시되는 막횡단 TAHO 폴리펩티드의 세포외 도메인, 또는 본원에서 개시되는 전장 TAHO 폴리펩티드 아미노산 서열의 임의의 다른 구체적으로 규정된 단편을 코딩하는 DNA 분자, 또는 (b) (a)의 DNA 분자의 보체에 대해 적어도 약 80%의 핵산 서열 동일성, 별법으로 적어도 약 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 100%의 핵산 서열 동일성을 갖는 뉴클레오티드 서열을 포함한다.
다른 측면에서, 단리된 핵산 분자는 (a) 본원에서 개시되는 전장 TAHO 폴리펩티드 cDNA의 코딩 서열, 본원에서 개시되는 신호 펩티드가 결여된 TAHO 폴리펩티드의 코딩 서열, 신호 펩티드가 존재하거나 존재하지 않는 본원에서 개시되는 막횡단 TAHO 폴리펩티드의 세포외 도메인의 코딩 서열, 또는 본원에서 개시되는 전장 TAHO 폴리펩티드 아미노산 서열의 임의의 다른 구체적으로 규정된 단편의 코딩 서열을 포함하는 DNA 분자, 또는 (b) (a)의 DNA 분자의 보체에 대해 적어도 약 80%의 핵산 서열 동일성, 별법으로 적어도 약 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 100%의 핵산 서열 동일성을 갖는 뉴클레오티드 서열을 포함한다.
추가의 측면에서, 본 발명은 (a) 본원에서 개시되는 ATCC에 기탁된 임의의 인간 단백질 cDNA의 전장 코딩 영역에 의해 코딩되는 동일한 성숙 폴리펩티드를 코딩하는 DNA 분자, 또는 (b) (a)의 DNA 분자의 보체에 대해 적어도 약 80%의 핵산 서열 동일성, 별법으로 적어도 약 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 100%의 핵산 서열 동일성을 갖는 뉴클레오티드 서열을 포함하는 단리된 핵산 분자에 관한 것이다.
본 발명의 또다른 측면은 막횡단 도메인-결실 또는 막횡단 도메인-불활성화된 TAHO 폴리펩티드를 코딩하는 뉴클레오티드 서열, 또는 상기 코딩 뉴클레오티드 서열에 상보성인 서열을 포함하는 단리된 핵산 분자를 제공하고, 상기 폴리펩티드(들)의 막횡단 도메인(들)은 본원에 개시된 것이다. 따라서, 본원에서 설명되는 TAHO 폴리펩티드의 가용성 세포외 도메인이 고려된다.
다른 측면에서, 본 발명은 (a) 본원에서 개시되는 전장 아미노산 서열을 갖는 TAHO 폴리펩티드, 본원에서 개시되는 신호 펩티드가 결여된 TAHO 폴리펩티드 아미노산 서열, 신호 펩티드가 존재하거나 존재하지 않는 본원에서 개시되는 막횡단 TAHO 폴리펩티드의 세포외 도메인, 또는 본원에서 개시되는 전장 TAHO 폴리펩티드 아미노산 서열의 임의의 다른 구체적으로 규정된 단편을 코딩하는 뉴클레오티드 서열, 또는 (b) (a)의 뉴클레오티드 서열의 보체에 혼성화하는 단리된 핵산 분자에 관한 것이다. 이와 관련하여, 본 발명의 실시태양은 예를 들어 검출 프로브, 안티센스 올리고뉴클레오티드 프로브로서 유용한, 예를 들어 혼성화 프로브로서 유용할 수 있는, 본원에서 개시되는 전장 TAHO 폴리펩티드 코딩 서열의 단편, 또는 그의 보체 또는 임의로 항-TAHO 폴리펩티드 항체, 또는 TAHO 결합 올리고펩티드 또는 TAHO 폴리펩티드에 결합하는 다른 작은 유기 분자에 대한 결합 부위를 포함하는 폴리펩티드를 코딩할 수 있는 전장 TAHO 폴리펩티드의 코딩 단편에 관한 것이다. 상기 핵산 단편의 길이는 대체로 적어도 약 5개 뉴클레오티드, 별법으로 적어도 약 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790, 800, 810, 820, 830, 840, 850, 860, 870, 880, 890, 900, 910, 920, 930, 940, 950, 960, 970, 980, 990, 또는 1000개의 뉴클레오티드이고, 여기서 용어 "약"은 언급된 뉴클레오티드 서열 길이±언급된 길이의 10%를 의미한다. TAHO 폴리펩티드-코딩 뉴클레오티드 서열의 신규한 단편은 임의의 많은 잘 공지된 서열 정렬 프로그램을 사용하여 TAHO 폴리펩티드-코딩 뉴클레오티드 서열을 다른 공지의 뉴클레오티드 서열과 정렬하고 어떤 TAHO 폴리펩티드-코딩 뉴클레오티드 서열 단편(들)이 신규한 것인지를 결정함으로써 통상적인 방식으로 결정될 수 있음이 이해된다. TAHO 폴리펩티드-코딩 뉴클레오티드 서열의 모든 상기 신규한 단편이 본원에서 고려된다. 또한, 상기 뉴클레오티드 분자 단편에 의해 코딩되는 TAHO 폴리펩티드 단편, 바람직하게는 항-TAHO 항체, TAHO 결합 올리고펩티드 또는 TAHO 폴리펩티드에 결합하는 다른 작은 유기 분자에 대한 결합 부위를 포함하는 TAHO 폴리펩티드 단편이 고려된다.
특정 측면에서, 본 발명은 본원에서 개시되는 전장 아미노산 서열을 갖는 TAHO 폴리펩티드, 본원에서 개시되는 신호 펩티드가 결여된 TAHO 폴리펩티드 아미노산 서열, 신호 펩티드가 존재하거나 존재하지 않는 본원에서 개시되는 막횡단 TAHO 폴리펩티드 단백질의 세포외 도메인, 본원에서 개시되는 임의의 핵산 서열에 의해 코딩되는 아미노산 서열 또는 본원에서 개시되는 전장 TAHO 폴리펩티드 아미노산 서열의 임의의 다른 구체적으로 규정된 단편에 대해 적어도 약 80%의 아미노산 서열 동일성, 별법으로 적어도 약 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 100%의 아미노산 서열 동일성을 갖는 아미노산 서열을 포함하는 단리된 TAHO 폴리펩티드에 관한 것이다.
추가의 측면에서, 본 발명은 본원에서 개시되는 ATCC에 기탁된 임의의 인간 단백질 cDNA에 의해 코딩되는 아미노산 서열에 대해 적어도 약 80%의 아미노산 서열 동일성, 별법으로 적어도 약 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99%의 아미노산 서열 동일성을 갖는 아미노산 서열을 포함하는 단리된 TAHO 폴리펩티드에 관한 것이다.
특정 측면에서, 본 발명은 N-말단 신호 서열이 없고/없거나 개시 메티오닌이 없고 상기 설명한 아미노산 서열을 코딩하는 뉴클레오티드 서열에 의해 코딩되는 단리된 TAHO 폴리펩티드를 제공한다. 이를 생산하는 방법도 본원에서 설명되고, 이 방법은 TAHO 폴리펩티드의 발현에 적합한 조건 하에 적절한 코딩 핵산 분자를 포함하는 벡터를 포함하는 숙주 세포를 배양하고, 세포 배양액으로부터 TAHO 폴리펩티드를 회수하는 것을 포함한다.
본 발명의 또다른 측면은 막횡단 도메인-결실 또는 막횡단 도메인-불활성화된 단리된 TAHO 폴리펩티드를 제공한다. 이를 생산하는 방법도 본원에서 설명되고, 이 방법은 TAHO 폴리펩티드의 발현에 적합한 조건 하에 적절한 코딩 핵산 분자를 포함하는 벡터를 포함하는 숙주 세포를 배양하고, 세포 배양액으로부터 TAHO 폴리펩티드를 회수하는 것을 포함한다.
본 발명의 다른 실시태양에서, 본 발명은 임의의 본원에서 설명되는 폴리펩티드를 코딩하는 DNA를 포함하는 벡터를 제공한다. 임의의 상기 벡터를 포함하는 숙주 세포도 제공된다. 예를 들어, 숙주 세포는 CHO 세포, 이. 콜라이 세포, 또는 효모 세포일 수 있다. 임의의 본원에서 설명되는 폴리펩티드의 제조 방법도 제공되고, 이는 목적하는 폴리펩티드의 발현에 적합한 조건 하에 숙주 세포를 배양하고, 세포 배양액으로부터 목적하는 폴리펩티드를 회수하는 것을 포함한다.
다른 실시태양에서, 본 발명은 이종성 (비-TAHO) 폴리펩티드에 융합된 임의의 본원에서 설명되는 TAHO 폴리펩티드를 포함하는 단리된 키메라 폴리펩티드를 제공한다. 상기 키메라 분자의 예는 이종성 폴리펩티드, 예를 들어 에피토프 태그 서열 또는 면역글로불린의 Fc 영역에 융합된 임의의 본원에서 설명되는 TAHO 폴리펩티드를 포함한다.
다른 실시태양에서, 본 발명은 바람직하게는 상기하거나 아래에서 설명되는 임의의 폴리펩티드에 특이적으로 결합하는 항체를 제공한다. 임의로, 항체는 모노클로날 항체, 항체 단편, 예를 들어 Fab, Fab', F(ab')2, 및 Fv 단편, 디아바디 (diabody), 단일 도메인 항체, 키메라 항체, 인간화 항체, 단쇄 항체 또는 항-TAHO 폴리펩티드 항체의 그의 각각의 항원성 에피토프에 대한 결합을 경쟁적으로 억제하는 항체이다. 본 발명의 항체는 임의로 성장 억제제 또는 세포독성제, 예를 들어 독소, 예를 들어 메이탄시노이드, 돌로스타틴 유도체 또는 칼리케아미신, 항생제, 방사성 동위원소, 뉴클레오티드 분해 효소 등에 접합될 수 있다. 본 발명의 항체는 임의로 CHO 세포 또는 세균 세포에서 생산될 수 있고, 바람직하게는 그 항체가 결합하는 세포의 사멸을 유도할 수 있다. 검출을 위해, 본 발명의 항체는 검출가능하게 표지되거나, 고체 지지체에 부착되는 등과 같이 처리될 수 있다.
다른 실시태양에서, 본 발명은 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 및/또는 cyno CD79b (TAHO40) 폴리펩티드에 결합하는 항-TAHO 항체를 제공하고, 상기 항-TAHO 항체는
(a) 서열 97, 99 또는 101로부터 선택되는 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 경쇄 가변 도메인 서열; 및/또는
(b) 서열 98, 100 또는 102로부터 선택되는 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 중쇄 가변 도메인 서열
을 포함한다.
다른 실시태양에서, 본 발명은 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 및/또는 cyno CD79b (TAHO40) 폴리펩티드에 결합하는 항-TAHO 항체를 제공하고, 상기 항-TAHO 항체는
(a) 서열 10, 33 또는 41로부터 선택되는 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 경쇄 가변 도메인 서열; 및/또는
(b) 서열 12, 35 또는 43으로부터 선택되는 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 중쇄 가변 도메인 서열
을 포함한다.
다른 실시태양에서, 본 발명은 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 및/또는 cyno CD79b (TAHO40) 폴리펩티드에 결합하는 항-TAHO 항체를 제공하고, 상기 항-TAHO 항체는
(a) 서열 4의 아미노산 29-39를 포함하는 아미노산 서열;
(b) 서열 8의 아미노산 30-40을 포함하는 아미노산 서열; 또는
(c) 서열 13의 아미노산 29-39를 포함하는 아미노산 서열
로 이루어지는 군 중에서 선택되는, TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 및/또는 cyno CD79b (TAHO40) 폴리펩티드의 영역 내의 에피토프에 결합한다.
추가의 실시태양에서, 본 발명은 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 및/또는 cyno CD79b (TAHO40) 폴리펩티드에 결합하는 항-TAHO 항체를 제공하고, 상기 항-TAHO 항체는 위치 30, 34 및 36의 아미노산이 Arg인 서열 4의 아미노산 29-39를 포함하는 에피토프에 결합한다. 추가의 실시태양에서, 본 발명은 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 및/또는 cyno CD79b (TAHO40) 폴리펩티드에 결합하는 항-TAHO 항체를 제공하고, 상기 항-TAHO 항체는 위치 35의 아미노산이 Leu인 서열 8의 아미노산 29-39를 포함하는 에피토프에 결합한다.
다른 실시태양에서, 본 발명은 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 및/또는 cyno CD79b (TAHO40) 폴리펩티드에 결합하는 항-TAHO 항체를 제공하고, 상기 항-TAHO 항체는 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 및/또는 cyno CD79b (TAHO40) 폴리펩티드의 영역 내의 에피토프에 결합하고, 상기 에피토프는
(a) 서열 4의 아미노산 29-39를 포함하는 아미노산 서열;
(b) 서열 8의 아미노산 30-40을 포함하는 아미노산 서열; 또는
(c) 서열 13의 아미노산 29-39를 포함하는 아미노산 서열
에 적어도 80%의 아미노산 서열 동일성을 갖는다.
추가의 실시태양에서, 본 발명은 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 및/또는 cyno CD79b (TAHO40) 폴리펩티드에 결합하는 항-TAHO 항체를 제공하고, 상기 항-TAHO 항체는 위치 30, 34 및 36의 아미노산이 Arg인 서열 4의 아미노산 29-39를 포함하는 에피토프에 결합한다. 추가의 실시태양에서, 본 발명은 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 및/또는 cyno CD79b (TAHO40) 폴리펩티드에 결합하는 항-TAHO 항체를 제공하고, 상기 항-TAHO 항체는 위치 35의 아미노산이 Leu인 서열 8의 아미노산 29-39를 포함하는 에피토프에 결합한다.
한 측면에서, 본 발명의 항체는 WO2006/034488; US 2007/0092940 (그 전부가 본원에 참고로 포함됨)에 개시된 바와 같이 모 항체의 하나 이상의 아미노산이 유리 시스테인 아미노산으로 대체된 시스테인 조작된 항체를 포함한다. 임의의 형태의 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체가 조작, 즉 돌연변이될 수 있다. 예를 들어, 모 Fab 항체 단편은 본원에서 "ThioFab"로서 언급되는 시스테인 조작된 Fab를 형성하도록 조작될 수 있다. 유사하게, 모 모노클로날 항체는 "ThioMab"를 형성하도록 조작될 수 있다. 단일 부위 돌연변이는 ThioFab에 단일 조작된 시스테인 잔기를 생성시키지만, 단일 부위 돌연변이는 IgG 항체의 이량체 특성 때문에 ThioMab에 2개의 조작된 시스테인 잔기를 생성시킴을 이해하여야 한다. 본 발명의 시스테인 조작된 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 및 항-cyno CD79b (TAHO40) 항체는 세포-결합된 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 및/또는 cyno CD79b (TAHO40) 폴리펩티드에 우선적으로 결합하는 모노클로날 항체, 인간화 또는 키메라 모노클로날 항체, 및 항체의 항원 결합 단편, 융합 폴리펩티드 및 유사체를 포함한다. 시스테인 조작된 항체는 별법으로 예를 들어 파지 디스플레이 항체 설계 및 선택에 의해 또는 경쇄 및/또는 중쇄 프레임워크 서열 및 불변 영역의 드 노보 (de novo) 설계를 통해 모 항체를 꼭 변경시키지는 않는 서열 설계 및/또는 선택에 의해 생성되는, 항체 또는 Fab 내의 본원에서 개시되는 위치에 시스테인을 포함하는 항체를 포함할 수 있다. 시스테인 조작된 항체는 티올 반응성 값이 0.6 내지 1.0; 0.7 내지 1.0 또는 0.8 내지 1.0인 하나 이상의 유리 시스테인 아미노산을 포함한다. 유리 시스테인 아미노산은 모 항체 내로 조작되었지만 디술피드 다리의 일부는 아닌 시스테인 잔기이다. 시스테인 조작된 항체는 예를 들어 말레이미드 또는 할로아세틸을 통한, 조작된 시스테인 부위에 대한 세포독성 및/또는 영상화 화합물의 부착에 유용하다. 말레이미드기에 대한 Cys 잔기의 티올 관능기의 친핵성 반응성은 단백질 내의 임의의 다른 아미노산 관능기, 예를 들어 라이신 잔기의 아미노기 또는 N-말단 아미노기에 비해 약 1000배 더 크다. 요오도아세틸 및 말레이미드 시약 내의 티올 특이적 관능기는 아민기와 반응할 수 있지만, 더 높은 pH (>9.0) 및 더 긴 반응 시간이 필요하다 (Garman, 1997, Non-Radioactive Labelling: A Practical Approach, Academic Press, London).
한 실시태양에서, 본 발명의 시스테인 조작된 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체는 다음 위치 중의 임의의 하나에 조작된 시스테인을 포함하고, 상기 위치는 경쇄에서 카바트 (Kabat) 등에 따라 넘버링되고 (문헌 [Kabat et al (1991) Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD] 참조), 중쇄 (Fc 영역 포함)에서 EU 넘버링에 따라 넘버링되고 (Kabat et al. (1991), 상기 문헌), 도 30A, 31A, 35A 및 36A에 밑줄로 표시된 경쇄 불변 영역은 위치 109 (카바트 넘버링)에서 시작하고, 도 30B, 31B, 35B 및 36B에 밑줄로 표시된 중쇄 불변 영역은 위치 118 (EU 넘버링)에서 시작한다. 또한, 위치는 도 30-31 및 35에 제시된 전장 경쇄 또는 중쇄의 아미노산의 순차적인 넘버링 내의 그의 위치에 의해 언급될 수 있다. 본 발명의 한 실시태양에 따르면, 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40)는 LC-V205C (카바트 넘버: Val 205; 그 위치에서 Cys으로 조작되는 도 30A 및 도 36A의 순차적인 번호 208)에 조작된 시스테인을 포함한다. 경쇄 내의 조작된 시스테인은 도 30A 및 36A에서 굵은 글씨체로 이중 밑줄로 제시된다. 한 실시태양에 따르면, 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 및 항-cyno CD79b (TAHO40) 항체는 HC-A118C (EU 번호: Ala 118; 카바트 번호 114; 그 위치에서 Cys으로 조작되는 도 31B 또는 35B의 순차적인 번호 118)에 조작된 시스테인을 포함한다. 중쇄 내의 조작된 시스테인은 도 31B 또는 35B에서 굵은 글씨체로 이중 밑줄로 제시된다. 한 실시태양에 따르면, 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40)는 Fc-S400C (EU 번호: Ser 400; 카바트 번호 396; 그 위치에서 Cys으로 조작되는 도 31B 또는 35B의 순차적인 번호 400)에 조작된 시스테인을 포함한다. 다른 실시태양에서, 중쇄 (Fc 영역 포함)의 조작된 시스테인은 다음 위치 중의 임의의 하나에 존재한다 (카바트 넘버링에 따름 (괄호 내에는 EU 넘버링): 5, 23, 84, 112, 114 (118 EU 넘버링), 116 (120 EU 넘버링), 275 (279 EU 넘버링), 371 (375 EU 넘버링) 또는 396 (400 EU 넘버링). 따라서, 본 발명의 모 키메라 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 항체에 대한 상기 위치에서의 아미노산의 변화는 다음과 같다: Q5C, K23C, S84C, S112C, A114C (A118C EU 넘버링), T116C (T120C EU 넘버링), V275C (V279C EU 넘버링), S371C (S375C EU 넘버링) 또는 S396C (S400C EU 넘버링). 따라서, 본 발명의 모 항-cynoCD79b (TAHO40) 항체에 대한 상기 위치에서의 아미노산의 변화는 다음과 같다: Q5C, T23C, S84C, S112C, A114C (A118C EU 넘버링), T116C (T120C EU 넘버링), V275C (V279C EU 넘버링), S371C (S375C EU 넘버링) 또는 S396C (S400C EU 넘버링). 다른 실시태양에서, 경쇄의 조작된 시스테인은 다음 위치 중의 임의의 하나에 존재한다 (카바트 넘버링에 따름): 15, 110, 114, 121, 127, 168, 205. 따라서, 본 발명의 모 키메라 항-인간 CD79b (TAHO5) 항체에 대한 상기 위치에서의 아미노산의 변화는 다음과 같다: L15C, V110C, S114C, S121C, S127C, S168C, 또는 V205C. 따라서, 본 발명의 모 항-cynoCD79b (TAHO40) 항체에 대한 상기 위치에서의 아미노산의 변화는 다음과 같다: L15C, V110C, S114C, S121C, S127C, S168C, 또는 V205C.
시스테인 조작된 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체는 하나 이상의 유리 시스테인 아미노산을 포함하고, 여기서 시스테인 조작된 항-TAHO, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체는 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 및/또는 cyno CD79b (TAHO40) 폴리펩티드에 결합하고, 모 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체의 하나 이상의 아미노산 잔기를 시스테인으로 치환하는 것을 포함하는 방법에 의해 제조되고, 여기서 모 항체는
(a) 서열 97, 99 또는 101로부터 선택되는 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 경쇄 가변 도메인 서열; 및/또는
(b) 서열 98, 100 또는 102로부터 선택되는 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 중쇄 가변 도메인 서열을 포함한다.
시스테인 조작된 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체는 하나 이상의 유리 시스테인 아미노산을 포함하고, 여기서 시스테인 조작된 항-TAHO, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체는 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 및/또는 cyno CD79b (TAHO40) 폴리펩티드에 결합하고, 모 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체의 하나 이상의 아미노산 잔기를 시스테인으로 치환하는 것을 포함하는 방법에 의해 제조되고, 여기서 모 항체는
(a) 서열 10, 33 또는 41로부터 선택되는 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 경쇄 서열; 및/또는
(b) 서열 12, 35 또는 43으로부터 선택되는 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 중쇄 가변 도메인 서열을 포함한다.
특정 측면에서, 본 발명은 본원에서 개시되는 전장 아미노산 서열을 갖는 시스테인 조작된 항체, 또는 본원에서 개시되는 신호 펩티드가 결여된 시스테인 조작된 항체 아미노산 서열에 대해 적어도 약 80%의 아미노산 서열 동일성, 별법으로 적어도 약 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 100%의 아미노산 서열 동일성을 갖는 아미노산 서열을 포함하는 시스테인 조작된 항-TAHO, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체에 관한 것이다.
추가의 측면에서, 본 발명은 (a) 본원에서 개시되는 전장 아미노산 서열을 갖는 시스테인 조작된 항체, (b) 본원에서 개시되는 신호 펩티드가 결여된 시스테인 조작된 항체 아미노산 서열, (c) 신호 펩티드가 존재하거나 존재하지 않는, 본원에서 개시되는 막횡단 시스테인 조작된 항체 단백질의 세포외 도메인, (d) 본원에서 개시되는 임의의 핵산 서열에 의해 코딩되는 아미노산 서열 또는 (e) 본원에서 개시되는 전장 시스테인 조작된 항체 아미노산 서열의 임의의 다른 구체적으로 규정된 단편을 코딩하는 DNA 분자의 보체에 혼성화하는 뉴클레오티드 서열에 의해 코딩되는 아미노산 서열을 포함하는 단리된 시스테인 조작된 항-TAHO, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체에 관한 것이다
특정 측면에서, 본 발명은 N-말단 신호 서열이 없고/없거나 개시 메티오닌이 없고 본원에서 설명되는 상기 아미노산 서열을 코딩하는 뉴클레오티드 서열에 의해 코딩되는 단리된 시스테인 조작된 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체를 제공한다. 이를 생산하는 방법도 본원에서 설명되고, 이 방법은 시스테인 조작된 항체의 발현에 적합한 조건 하에 적절한 코딩 핵산 분자를 포함하는 벡터를 포함하는 숙주 세포를 배양하고, 세포 배양액으로부터 시스테인 조작된 항체를 회수하는 것을 포함한다.
본 발명의 또다른 측면은 막횡단 도메인-결실 또는 막횡단 도메인-불활성화된 단리된 시스테인 조작된 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체를 제공한다. 이를 생산하는 방법도 본원에서 설명되고, 이 방법은 시스테인 조작된 항체의 발현에 적합한 조건 하에 적절한 코딩 핵산 분자를 포함하는 벡터를 포함하는 숙주 세포를 배양하고, 세포 배양액으로부터 시스테인 조작된 항체를 회수하는 것을 포함한다.
다른 실시태양에서, 본 발명은 이종성 (비-TAHO, 예를 들어 비-인간 CD79b (TAHO5) 또는 비-cyno CD79b (TAHO40)) 폴리펩티드에 융합된 임의의 본원에서 설명되는 시스테인 조작된 항체를 포함하는 단리된 항-TAHO, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40), 키메라 시스테인 조작된 항체를 제공한다. 상기 키메라 분자의 예는 이종성 폴리펩티드, 예를 들어 에피토프 태그 서열 또는 면역글로불린의 Fc 영역에 융합된 임의의 본원에서 설명되는 시스테인 조작된 항체를 포함한다.
시스테인 조작된 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체는 모노클로날 항체, 항체 단편, 키메라 항체, 인간화 항체, 단쇄 항체 또는 항-TAHO, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40), 폴리펩티드 항체의 그의 각각의 항원성 에피토프에 대한 결합을 경쟁적으로 억제하는 항체일 수 있다. 본 발명의 항체는 성장 억제제 또는 세포독성제, 예를 들어 독소, 예를 들어, 오리스타틴, 항생제, 방사성 동위원소, 뉴클레오티드 분해 효소 등에 임의로 접합될 수 있다. 본 발명의 항체는 임의로 CHO 세포 또는 세균 세포에서 생산될 수 있고, 바람직하게는 항체가 결합하는 세포의 성장 또는 증식을 억제하거나 사멸을 유도할 수 있다. 진단을 위해, 본 발명의 항체는 검출가능하게 표지되거나, 고체 지지체에 부착되는 등과 같이 처리될 수 있다.
시스테인 조작된 항체는 암 치료에 유용할 수 있고, 세포 표면 및 막횡단 수용체, 및 종양 관련 항원 (TAA)에 특이적인 항체를 포함한다. 상기 항체는 네이키드 (naked) 항체 (약물 또는 표지 모이어티에 접합되지 않은)로서 또는 항체-약물 접합체 (ADC)로서 사용될 수 있다. 본 발명의 시스테인 조작된 항체는 티올-반응성 시약과 부위-특이적으로 및 효율적으로 커플링될 수 있다. 티올-반응성 시약은 다기능성 링커 시약, 포획 표지 시약, 형광단 시약, 또는 약물-링커 중간체일 수 있다. 시스테인 조작된 항체는 검출가능한 표지로 표지되고, 고상 지지체에 고정되고/되거나 약물 모이어티와 접합될 수 있다. 티올 반응성은 반응성 시스테인 아미노산으로의 아미노산 치환이 L10-L20, L105-L115, L109-L119, L116-L126, L122-L132, L163-L173, L200-L210의 아미노산 범위로부터 선택된 경쇄의 범위 내에서; H1-H10, H18-H28, H79-H89, H107-H117, H109-H119, H111-H121의 아미노산 범위로부터 선택된 중쇄의 범위 내에서; 및 H270-H280, H366-H376, H391-401에서 선택된 범위 내의 Fc 영역에서 이루어질 수 있는 임의의 항체로 일반화될 수 있고, 여기서 아미노산 위치의 넘버링은 카바트 넘버링 시스템 (Kabat et al. (1991) Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD)의 위치 1에서 시작되고, 이후에 WO2006034488; US 2007/0092940에 개시된 바와 같이 순차적으로 계속된다. 또한, 티올 반응성은 항체의 특정 도메인, 예를 들어 경쇄 불변 도메인 (CL) 및 중쇄 불변 도메인, CH1, CH2 및 CH3으로 일반화될 수도 있다. 0.6 이상의 티올 반응성 값을 유도하는 시스테인 교체는 무손상 항체 IgA, IgD, IgE, IgG 및 IgM (IgG 하위클래스 IgG1, IgG2, IgG3, IgG4, IgA 및 IgA2 포함) 각각의 중쇄 불변 도메인 α, δ, ε, γ 및 μ에서 만들어질 수 있다. 상기 항체 및 그의 용도는 WO2006/034488; US 2007/0092940에 개시되어 있다.
본 발명의 시스테인 조작된 항체는 바람직하게는 그의 야생형 모 항체 대응물의 항원 결합 능력을 보유한다. 따라서, 시스테인 조작된 항체는 바람직하게는 항원에 특이적으로 결합할 수 있다. 상기 항원은 예를 들어 종양 관련 항원 (TAA), 세포 표면 수용체 단백질 및 다른 세포 표면 분자, 막횡단 단백질, 신호전달 단백질, 세포 생존 조절 인자, 세포 증식 조절 인자, 조직 발달 또는 분화와 연관된 분자 (예를 들어, 조직 발달 또는 분화에 기능적으로 기여하는 것으로 알려져 있거나 의심되는), 림포킨, 시토킨, 세포 주기 조절에 관여하는 분자, 혈관형성에 관여하는 분자 및 혈관신생에 관여하는 분자 (예를 들어, 혈관신생에 기능적으로 기여하는 것으로 알려져 있거나 의심되는)를 포함한다. 종양 관련 항원은 클러스터 (cluster) 분화 인자 (즉, TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 및/또는 cyno CD79b (TAHO40)를 포함하고 이로 제한되지 않는 CD 단백질)일 수 있다. 본 발명의 시스테인 조작된 항-TAHO, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체는 그의 모 항-TAHO, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체 대응물의 항원 결합 능력을 보유한다. 따라서, 바람직하게는 본 발명의 시스테인 조작된 항-TAHO, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체는, B 세포를 포함하고 이로 제한되지 않는 세포의 표면 상에 항원이 발현될 때를 포함하여 TAHO, 예를 들어 인간 CD79b (TAHO5) 및/또는 cyno CD79b (TAHO40) 항원, 예를 들어 인간 항-TAHO, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항원, 예를 들어 이소형 베타 및/또는 알파에 특이적으로 결합할 수 있다.
한 측면에서, 본 발명의 항체는 반응성 모이어티, 활성화된 모이어티, 또는 반응성 시스테인 티올기를 통해 항체에 공유 결합에 의해 부착될 수 있는 임의의 표지 모이어티에 접합될 수 있다 ([Singh et al (2002) Anal. Biochem. 304:147-15]; [Harlow E. and Lane, D. (1999) Using Antibodies: A Laboratory Manual, Cold Springs Harbor Laboratory Press, Cold Spring Harbor, NY]; [Lundblad R.L. (1991) Chemical Reagents for Protein Modification, 2nd ed. CRC Press, Boca Raton, FL]). 부착된 표지는 리간드 친화도, 항체/항원 결합, 또는 이온 복합체 형성을 조정하기 위해 (i) 검출가능한 신호를 제공하거나, (ii) 제2 표지와 상호작용하여 제1 또는 제2 표지에 의해 제공되는 검출가능한 신호를 변형시켜, 예를 들어 FRET (형광 공명 에너지 전달)를 생성시키거나; (iii) 항원 또는 리간드와의 상호작용을 안정화하거나 이들과의 결합 친화도를 증가시키거나, (iv) 이동성, 예를 들어 전기영동 이동성, 또는 세포-투과도에 대해 전하, 소수성, 형태 또는 다른 물리적 파라미터로 인한 영향을 주거나, 또는 (v) 포획 모이어티를 제공하는 기능을 할 수 있다.
표지된 시스테인 조작된 항체는 예를 들어 특이적 세포, 조직, 또는 혈청에서 목적하는 항원의 발현을 검출하기 위한 진단 분석에서 유용할 수 있다. 진단 용도를 위해, 항체는 대개 검출가능한 모이어티로 표지될 것이다. 일반적으로 하기 범주로 분류될 수 있는 수많은 표지를 이용할 수 있다:
방사성 동위원소 (방사성 핵종), 예를 들어 3H, 11C, 14C, 18F, 32P, 35S, 64Cu, 68Ga, 86Y, 99Tc, 111In, 123I, 124I, 125I, 131I, 133Xe, 177Lu, 211At 또는 213Bi. 방사성 동위원소 표지된 항체는 수용체 표적화된 영상화 실험에 유용하다. 항체는 문헌 [Current Protocols in Immunology, Volumes 1 and 2, Coligen et al., Ed. Wiley-Interscience, New York, NY, Pubs. (1991)]에 기재된 기술을 이용하여 방사성 동위원소 금속에 결합하거나 킬레이팅되거나 또는 다른 방식으로 복합체를 형성하며 항체의 조작된 시스테인 티올과 반응성인 리간드 시약으로 표지될 수 있다. 금속 이온과 착물을 형성할 수 있는 킬레이팅 리간드로는 DOTA, DOTP, DOTMA, DTPA 및 TETA (마크로시클릭스 (Macrocyclics), 미국 텍사스주 댈러스) 등이 있다. 방사성 핵종은 본 발명의 항체-약물 접합체와의 복합체 형성을 통해 표적화될 수 있다 [Wu et al. (2005) Nature Biotechnology 23(9):1137-1146].
링커 시약, 예를 들어 DOTA-말레이미드 (4-말레이미도부티르아미도벤질-DOTA)는 문헌 [Axworthy et al. (2000) Proc. Natl. Acad. Sci. USA 97(4):1802-1807]의 절차에 따라 아미노벤질-DOTA를 이소프로필클로로포르메이트 (알드리치 (Aldrich))로 활성화시킨 4-말레이미도부티르산 (플루카 (Fluka))과 반응시켜 제조할 수 있다. DOTA-말레이미드 시약은 시스테인 조작된 항체의 유리 시스테인 아미노산과 반응하여 항체 상에 금속 착물 형성 리간드를 제공한다 [Lewis et al. (1998) Bioconj. Chem. 9:72-86]. 킬레이팅 링커 표지 시약, 예를 들어 DOTA-NHS (1,4,7,10-테트라아자시클로도데칸-1,4,7,10-테트라아세트산 모노(N-히드록시숙신이미드 에스테르)는 시판되고 있다 (마크로시클릭스). 방사성 핵종 표지된 항체를 사용한 수용체 표적 영상화는 종양 조직 중 항체의 점진적인 축적을 검출 및 정량함으로써 경로 활성화의 마커를 제공할 수 있다 [Albert et al. (1998) Bioorg. Med. Chem. Lett. 8:1207-1210]. 접합된 방사성 금속은 리소좀 분해 후 세포 내에 남아있을 수 있다.
영상화 실험에 항체 표지로서 적합한 금속-킬레이트 복합체는 US 5342606; US 5428155; US 5316757; US 5480990; US 5462725; US 5428139; US 5385893; US 5739294; US 5750660; US 5834456; 문헌 [Hnatowich et al (1983) J. Immunol. Methods 65: 147-157]; [Meares et al (1984) Anal. Biochem. 142:68-78]; [Mirzadeh et al (1990) Bioconjugate Chem. 1:59-65]; [Meares et al (1990) J. Cancerl990, Suppl. 10:21-26]; [Izard et al (1992) Bioconjugate Chem. 3:346-350]; [Nikula et al (1995) Nucl. Med. Biol. 22:387-90]; [Camera et al (1993) Nucl. Med. Biol. 20:955-62]; [Kukis et al (1998) J. Nucl. Med. 39:2105-2110]; [Verel et al (2003) J. Nucl. Med. 44:1663-1670]; [Camera et al (1994) J. Nucl. Med. 21:640-646]; [Ruegg et al (1990) Cancer Res. 50:4221-4226]; [Verel et al (2003) J. Nucl. Med. 44:1663-1670]; [Lee et al (2001) Cancer Res. 61:4474-4482]; [Mitchell et al (2003) J. Nucl. Med. 44:1105-1112]; [Kobayashi et al (1999) Bioconjugate Chem. 10:103-111]; [Miederer et al (2004) J. Nucl. Med. 45: 129-137]; [DeNardo et al (1998) Clinical Cancer Research 4:2483-90]; [Blend et al (2003) Cancer Biotherapy & Radiopharmaceuticals 18:355-363]; [Nikula et al (1999) J. Nucl. Med. 40:166-76]; [Kobayashi et al (1998) J. Nucl. Med. 39:829-36]; [Mardirossian et al (1993) Nucl. Med. Biol. 20:65-74]; [Roselli et al (1999) Cancer Biotherapy & Radiopharmaceuticals, 14:209-20]에 개시되어 있다.
형광 표지, 예를 들어 희토류 킬레이트 (유로퓸 킬레이트), FITC, 5-카르복시플루오레세인, 6-카르복시플루오레세인 등을 비롯한 플루오레세인 종류, TAMRA 등을 비롯한 로다민 종류; 단실; 리싸민 (Lissamine); 시아닌; 피코에리트린; 텍사스 레드 (Texas Red) 및 이들의 유사체를 사용할 수 있다. 형광 표지는 예를 들어 문헌 [Current Protocols in Immunology, 상기 문헌]에 개시된 기술을 이용하여 항체에 접합될 수 있다. 형광 염료 및 형광 표지 시약은 인비트로겐 (Invitrogen)/몰레큘라 프로브스 (Molecular Probes, 미국 오레곤주 유진) 및 피어스 바이오테크놀로지, 인크. (Pierce Biotechnology, Inc., 미국 일리노이주 록포드)에서 시판하는 것을 포함한다.
다양한 효소-기질 표지가 이용가능하거나 문헌에 개시되어 있다 (US 4275149). 효소는 일반적으로 다양한 기술을 이용하여 측정할 수 있는 발색 기질의 화학적 변경을 촉매한다. 예를 들어, 효소는 기질에서 색상 변화를 촉매할 수 있고, 이것은 분광학적으로 측정할 수 있다. 별법으로, 효소는 기질의 형광 또는 화학발광을 변경시킬 수 있다. 형광 변화를 정량하는 기술은 상기한 바와 같다. 화학발광 기질은 화학 반응에 의해 전자적으로 여기되고, 이후에는 (예를 들어 화학발광 측정기를 사용하여) 측정될 수 있는 광을 방출하거나 형광 수용자에게 에너지를 제공할 수 있다. 효소 표지의 예로는 루시퍼라제 (예, 반딧불이 루시퍼라제 및 세균 루시퍼라제, US 4737456), 루시페린, 2,3-디히드로프탈라진디온, 말레이트 데히드로게나제, 우레아제, 퍼옥시다제, 예를 들어 양고추냉이 퍼옥시다제 (HRP), 알칼리성 포스파타제 (AP), β-갈락토시다제, 글루코아밀라제, 리소자임, 당류 옥시다제 (예, 글루코스 옥시다제, 갈락토스 옥시다제 및 글루코스-6-포스페이트 데히드로게나제), 헤테로시클릭 옥시다제 (예를 들어 우리카제 및 잔틴 옥시다제), 락토퍼옥시다제, 마이크로퍼옥시다제 등이 있다. 효소를 항체에 접합시키는 기술은 문헌 [O'Sullivan et al. (1981) "Methods for the Preparation of Enzyme-Antibody Conjugates for use in Enzyme Immunoassay", in Methods in Enzym. (ed J. Langone & H. Van Vunakis), Academic Press, New York, 73:147-166]에 기재되어 있다.
효소-기질 조합의 예는 예를 들어 다음을 포함한다:
(i) 양고추냉이 퍼옥시다제 (HRP)와 기질로서의 수소 퍼옥시다제 - (여기서, 수소 퍼옥시다제는 염료 전구체 (예, 오르토페닐렌 디아민 (OPD) 또는 3,3',5,5'-테트라메틸벤지딘 염산염 (TMB))를 산화시킴),
(ii) 알칼리성 포스파타제 (AP)와 발색 기질로서의 파라-니트로페닐 포스페이트, 및
(iii) β-D-갈락토시다제 (β-D-Gal)와 발색 기질 (예, p-니트로페닐-β-D-갈락토시다제) 또는 형광 기질 4-메틸움벨리페릴-β-D-갈락토시다제.
당업자는 많은 다른 효소-기질 조합을 이용할 수 있다. 일반적인 검토를 위해서 US 4275149 및 US 4318980을 참조한다.
표지는 아미노산 측쇄, 활성화된 아미노산 측쇄, 시스테인 조작된 항체 등에 간접적으로 접합될 수 있다. 예를 들어, 항체를 비오틴과 접합시키고, 상기 언급한 표지의 3가지 광범위한 범주 중 임의의 표지가 아비딘 또는 스트렙타비딘에 접합될 수도 있고, 또는 그 반대로 접합될 수도 있다. 비오틴은 스트렙타비딘에 선택적으로 결합하기 때문에, 표지는 이와 같은 간접적인 방식으로 항체에 접합될 수 있다. 별법으로, 표지를 폴리펩티드 변이체와 간접적으로 접합시키기 위해서, 폴리펩티드 변이체는 작은 합텐 (예, 디곡신)과 접합시키고 상기 언급한 여러 종류의 표지 중 하나를 항-합텐 폴리펩티드 변이체 (예, 항-디곡신 항체)와 접합시킨다. 따라서, 표지를 폴리펩티드 변이체와 간접적으로 접합시킬 수 있다 [Hermanson, G. (1996) in Bioconjugate Techniques Academic Press, San Diego].
본 발명의 항체는 임의의 공지된 분석 방법, 예를 들어 ELISA, 경쟁적 결합 분석, 직접 및 간접 샌드위치 분석 및 면역침전 분석 등에 사용될 수 있다 [Zola, (1987) Monoclonal Antibodies: A Manual of Techniques, pp.147-158, CRC Press, Inc.].
검출 표지는 결합 또는 인식 사건을 국소화하고 가시화하며 정량하는데 유용할 수 있다. 본 발명의 표지된 항체는 세포-표면 수용체를 검출할 수 있다. 검출가능하게 표지된 항체의 또다른 용도는 비드를 형광 표지된 항체와 접합시키고, 리간드의 결합시에 형광 신호를 검출하는 것을 포함하는 비드-기반 면역포획 (immunocapture) 방법이다. 유사한 결합 검출 방법은 표면 플라즈몬 공명 (SPR) 효과를 이용하여 항체-항원 상호작용을 측정하고 검출한다.
검출 표지, 예를 들어 형광 염료 및 화학발광 염료 [Briggs et al. (1997) "Synthesis of Functionalised Fluorescent Dyes and Their Coupling to Amines and Amino Acids," J. Chem. Soc, Perkin-Trans. 1:1051-1058]는 검출가능한 신호를 제공하고, 일반적으로 다음 특성을 바람직하게 갖는 항체 표지에 적용가능한 것이 바람직하다: (i) 표지된 항체는 낮은 배경으로 매우 높은 신호를 생성하여 소량의 항체가 무-세포 분석 및 세포-기반 분석 둘 모두에서 민감하게 검출될 수 있도록 해야 하고, (ii) 표지된 항체는 광안정성이어서 형광 신호가 유의한 광표백 (photo bleaching) 없이 관찰되고 모니터링되며 기록될 수 있어야 한다. 표지된 항체를 특히 살아있는 세포의 막 또는 세포 표면에 결합시키는 것을 포함하는 용도를 위해서는, 상기 표지가 (iii) 효과적인 접합체 농도 및 검출 감수성 달성을 위해 양호한 수 용해도를 보유하고, (iv) 세포의 정상적인 대사 과정을 파괴하거나 조기 세포 사멸을 초래하지 않도록 살아있는 세포에 무독성인 것이 바람직하다.
세포 형광 강도의 직접 정량화 및 형광 표지 사건의 확인, 예를 들어 펩티드-염료 접합체의 세포 표면 결합은 살아있는 세포 또는 비드와의 혼합/해독 (mix-and-read), 비-방사성 분석을 자동화한 시스템 (FMAT® 8100 HTS 시스템, 어플라이드 바이오시스템즈 (Applied Biosystems, 미국 캘리포니아 포스터 시티))에서 수행될 수 있다 [Miraglia, "Homogeneous cell- and bead-based assays for high throughput screening using fluorometric microvolume assay technology", (1999) J. of Biomolecular Screening 4:193-204]. 표지된 항체의 용도에는, 세포 표면 수용체 결합 분석, 면역포획 분석, 형광 연결 면역흡착 분석 (FLISA), 카스파제-절단 ([Zheng, "Caspase-3 controls both cytoplasmic and nuclear events associated with Fas-mediated apoptosis in vivo", (1998) Proc. Natl. Acad. Sci. USA 95:618-23], US 6372907), 세포자멸 [Vermes, "A novel assay for apoptosis. Flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled Annexin V" (1995) J. Immunol. Methods 184:39-51] 및 세포독성 분석도 포함된다. 형광 마이크로부피 분석 기술은, 세포 표면에 표적화된 분자에 의한 상향 또는 하향 조절을 확인하는데 이용될 수 있다 [Swartzman, "A homogeneous and multiplexed immunoassay for high-throughput screening using fluorometric microvolume assay technology", (1999) Anal. Biochem. 271:143-51].
본 발명의 표지된 항체는 생체의학적 영상화와 분자 영상화의 다양한 방법 및 기술, 예를 들어 (i) MRI (자기 공명 영상화), (ii) MicroCT (컴퓨터 단층촬영), (iii) SPECT (단일 광자 방출 컴퓨터 단층촬영), (iv) PET (양전자 방출 단층촬영) [Chen et al (2004) Bioconjugate Chem. 15:41-49], (v) 생체발광, (vi) 형광, 및 (vii) 초음파에 의한 영상화 생체마커 및 프로브로서 유용하다. 면역섬광조영술 (immunoscintigraphy)은 방사성 물질로 표지된 항체를 동물 또는 인간 환자에게 투여하고 항체가 위치하는 신체 부위의 사진을 찍는 영상화 절차이다 (US 6528624). 영상화 생체마커는 객관적으로 측정되어 정상적인 생물학적 과정, 발병 과정 또는 치료 개입에 대한 약물 반응의 지시자로서 평가될 수 있다. 생체 마커는 여러 종류일 수 있다: 제0형은 질환의 천연 병력 마커이며, 공지된 임상 지표, 예를 들어 류마티스성 관절염에서 활액 염증의 MRI 평가와 장기적으로 상관관계가 있고; 제I형 마커는 작용 메카니즘이 임상 결과와 관련되지 않을 수 있는 경우에도 이 메카니즘에 따른 개입 효과를 보여주며; 제II형 마커는 대리 종말점으로서 기능하여, 생체마커의 변화 또는 생체마커로부터의 신호가 표적화된 반응의 "유효성", 예를 들어 류마티스성 관절염에서 CT에 의한 골 침식 측정치에 대한 임상적 잇점을 예측한다. 따라서, 영상화 생체마커는 (i) 표적 단백질의 발현, (ii) 표적 단백질에 대한 치료제의 결합, 즉 선택성, 및 (iii) 소실율 및 반감기 약력학 데이타에 대한 약동학 (PD) 치료 정보를 제공할 수 있다. 시험관에서 사용되는 생체마커에 비해 생체내 영상화 생체마커의 잇점은 비-침습적 치료, 정량화가능한 전신 평가, 반복적 투여 및 평가, 즉 여러 시점에서의 투여 및 평가, 및 전임상 결과 (작은 동물)로부터 임상 (인간) 결과로의 잠재적으로 전이가능한 효과를 포함한다. 몇몇 용도의 경우, 생체영상화는 전임상 연구에서의 동물 실험을 대체하거나 그 횟수를 최소화한다.
펩티드 표지 방법은 잘 알려져 있다 (문헌 [Haugland, 2003, Molecular Probes Handbook of Fluorescent Probes and Research Chemicals, Molecular Probes, Inc.]; [Brinkley, 1992, Bioconjugate Chem. 3:2]; [Garman, (1997) Non-Radioactive Labelling: A Practical Approach, Academic Press, London]; [Means (1990) Bioconjugate Chem. 1:2]; [Glazer et al (1975) Chemical Modification of Proteins. Laboratory Techniques in Biochemistry and Molecular Biology (T. S. Work and E. Work, Eds.) American Elsevier Publishing Co., New York]; [Lundblad, R. L. and Noyes, C. M. (1984) Chemical Reagents for Protein Modification, Vols. I and II, CRC Press, New York]; [Pfleiderer, G. (1985) "Chemical Modification of Proteins", Modern Methods in Protein Chemistry, H. Tschesche, Ed., Walter DeGryter, Berlin and New York]; 및 [Wong (1991) Chemistry of Protein Conjugation and Cross-linking, CRC Press, Boca Raton, Fla.)]; [De Leon-Rodriguez et al (2004) Chem.Eur. J. 10: 1149-1155]; [Lewis et al (2001) Bioconjugate Chem. 12:320-324]; [Li et al (2002) Bioconjugate Chem. 13: 110-115]; [Mier et al (2005) Bioconjugate Chem. 16:240-237] 참조).
충분히 근접한 두 모이어티, 즉 형광 리포터 및 켄쳐 (quencher)로 표지된 펩티드 및 단백질에서는 형광 공명 에너지 전달 (FRET)이 일어난다. 리포터기는 대체로 특정 파장의 광에 의해 여기되고 최대 밝기에서 방출될 수 있는 적절한 스톡스 이동 (Stokes shift)으로 에너지를 수용기 또는 켄쳐기에게 전달하는 형광 염료이다. 형광 염료에는 연장된 방향성 (extended aromaticity)을 갖는 분자, 예를 들어 플루오레세인 및 로다민, 및 이들의 유도체 등이 있다. 형광 리포터는 무손상 펩티드 중의 켄쳐 모이어티에 의해 부분적으로 또는 유의하게 켄칭될 수 있다. 펩티다제 또는 프로테아제에 의한 펩티드의 절단시에, 검출가능한 형광 증가가 측정될 수 있다 [Knight, C. (1995) "Fluorimetric Assays of Proteolytic Enzymes", Methods in Enzymology, Academic Press, 248:18-34].
본 발명의 표지된 항체는 친화도 정제제로서 사용될 수도 있다. 이 과정에서, 표지된 항체는 당업계에 공지된 방법을 이용하여 세파덱스 (Sephadex) 수지 또는 여과지와 같은 고상에 고정된다. 고정된 항체를 정제될 항원을 함유하는 샘플과 접촉시킨 후, 지지체를 정제될 항원을 제외하고는 샘플 중에 존재하는 실질적으로 모든 물질을 제거할 적합한 용매로 세척하고, 여기서 상기 항원은 고정된 폴리펩티드 변이체에 결합한다. 최종적으로, 상기 지지체를 폴리펩티드 변이체로부터 항원을 방출시킬 또다른 적합한 용매, 예를 들어 글라이신 버퍼 (pH 5.0)로 세척한다.
표지 시약은 전형적으로 (i) 시스테인 조작된 항체의 시스테인 티올과 직접 반응하여 표지된 항체를 형성할 수 있거나, (ii) 링커 시약과 반응하여 링커-표지 중간체를 형성할 수 있거나, 또는 (iii) 링커 항체와 반응하여 표지된 항체를 형성할 수 있는 반응성 관능기를 보유한다. 표지 시약의 반응성 관능기로는, 말레이미드, 할로아세틸, 요오도아세트아미드 숙신이미딜 에스테르 (예, NHS, N-히드록시숙신이미드), 이소티오시아네이트, 술포닐 클로라이드, 2,6-디클로로트리아지닐, 펜타플루오로페닐 에스테르 및 포스포르아미다이트 등이 있으나, 다른 관능기도 사용될 수 있다.
예시적인 반응성 관능기는 검출가능한 표지, 예를 들어 비오틴 또는 형광 염료의 카르복실기 치환체 중의 N-히드록시숙신이미딜 에스테르 (NHS)이다. 표지의 NHS 에스테르는 예비 형성, 단리, 정제 및/또는 특성화될 수 있거나, 또는 계내 형성되어 항체의 친핵성 기와 반응할 수 있다. 전형적으로, 표지의 카르복실 형태는 카르보디이미드 시약, 예를 들어 디시클로헥실카르보디이미드, 디이소프로필카르보디이미드, 또는 유로늄 시약, 예를 들어 TSTU (O-(N-숙신이미딜)-N,N,N',N'-테트라메틸유로늄 테트라플루오로보레이트, HBTU (O-벤조트리아졸-1-일)-N,N,N',N'-테트라메틸유로늄 헥사플루오로포스페이트) 또는 HATU (O-(7-아자벤조트리아졸-1-일)-N,N,N',N'-테트라메틸유로늄 헥사플루오로포스페이트), 활성제, 예를 들어 1-히드록시 벤조트리아졸 (HOBt) 및 N-히드록시숙신이미드의 몇가지 조합과의 반응으로 활성화되어 표지의 NHS 에스테르를 형성한다. 몇몇 경우에는, 표지 및 항체가 표지의 계내 활성화 및 항체와의 반응으로 커플링되어 표지-항체 접합체를 1단계로 형성할 수 있다. 다른 활성화 및 커플링 시약으로는, TBTU (2-(1H-벤조트리아조-1-일)-1,1,3,3-테트라메틸유로늄 헥사플루오로포스페이트), TFFH (N,N',N",N'"-테트라메틸유로늄 2-플루오로-헥사플루오로포스페이트), PyBOP (벤조트리아졸-1-일-옥시-트리스-피롤리디노-포스포늄 헥사플루오로포스페이트, EEDQ (2-에톡시-1-에톡시카르보닐-1,2-디히드로-퀴놀린), DCC (디시클로헥실카르보디이미드), DIPCDI (디이소프로필카르보디이미드), MSNT (1-(메시틸렌-2-술포닐)-3-니트로-1H-1,2,4-트리아졸 및 아릴 술포닐 할라이드, 예를 들어 트리이소프로필벤젠술포닐 클로라이드 등이 있다.
본 발명의 알부민 결합 펩티드- Fab 화합물:
한 측면에서, 본 발명의 항체는 알부민 결합 단백질에 융합된다. 혈장-단백질 결합은 수명이 짧은 분자의 약력학 특성을 개선시키는데 효과적인 수단일 수 있다. 알부민은 혈장에서 가장 풍부한 단백질이다. 혈청 알부민 결합 펩티드 (ABP)는 조직 흡수, 투과 및 확산의 변경 등을 비롯하여 융합된 활성 도메인 단백질의 약동학을 변경시킬 수 있다. 이들 약동학 파라미터는 적절한 혈청 알부민 결합 펩티드 서열의 특이적 선택을 통해 조정될 수 있다 (US 20040001827). 일련의 알부민 결합 펩티드가 파지 디스플레이 스크리닝을 통해 확인되었다 ([Dennis et al. (2002) "Albumin Binding As A General Strategy For Improving The Pharmacokinetics Of Proteins" J Biol. Chem. 277:35035-35043], WO 01/45746). 본 발명의 화합물은 (i) 문헌 [Dennis et al. (2002) J Biol. Chem. 277:35035-35043]의 표 III 및 표 IV, 35038 페이지, (ii) US 20040001827의 서열 9-22, 및 (iii) WO 01/45746의 12 내지 13 페이지에 제시되어 있는 ABP 서열을 포함하며, 상기 문헌 모두가 본원에 참조로 포함된다. 알부민 결합 펩티드를 Fab 중쇄의 C-말단에 1:1의 화학양론적 비율 (1 ABP/1 Fab)로 융합시켜 알부민 결합 (ABP)-Fab를 조작한다. 이들 ABP-Fab와 알부민의 회합은 토끼 및 마우스에서 항체 반감기를 25배 초과로 증가시키는 것으로 나타났다. 따라서, 상기 설명한 반응성 Cys 잔기는 이들 ABP-Fab에 도입되어 세포독성 약물과의 부위-특이적 접합 및 이후의 생체내 동물 연구에 사용될 수 있다.
예시적인 알부민 결합 펩티드 서열은 서열 52-56에 나열된 아미노산 서열을 포함하고, 이로 제한되지 않는다:
항체-약물 접합체
다른 측면에서, 본 발명은 세포독성제, 예를 들어 화학요법제, 약물, 성장 억제제, 독소 (예를 들어, 세균, 진균, 식물 또는 동물 기원의 효소 활성 독소, 또는 그의 단편), 또는 방사성 동위원소 (즉, 방사성 접합체)에 접합된 항체를 포함하는 면역접합체, 또는 항체-약물 접합체 (ADC)를 제공한다. 다른 측면에서, 본 발명은 추가로 면역접합체를 사용하는 방법을 제공한다. 한 측면에서, 면역접합체는 세포독성제 또는 검출가능한 물질에 공유 결합에 의해 부착된 임의의 상기 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO) 항체를 포함한다.
한 실시태양에서, 본 발명의 TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40 항체는 다른 TAHO 항체, 예를 들어 다른 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체에 의해 결합되는 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 및/또는 cyno CD79b (TAHO40) 상의 동일한 에피토프에 결합한다. 다른 실시태양에서, 본 발명의 TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40)는 로스웰 파크 캔서 인스티튜트 (Roswell Park Cancer Institute)로부터 수득한 하이브리도마로부터 생성된 SN8 모노클로날 항체 (Okazaki et al., Blood, 81(1): 84-95 (1993)), 서열 10 (도 10) 및 서열 12 (도 12)의 가변 도메인을 포함하는 모노클로날 항체 또는 로스웰 파크 캔서 인스티튜트로부터 수득한 하이브리도마로부터 생성된 항체의 가변 도메인 (Okazaki et al., Blood, 81(1): 84-95 (1993)) 및 IgG1로부터의 불변 도메인, 또는 서열 10 (도 10) 및 서열 11 (도 2)의 서열을 포함하는 모노클로날 항체의 가변 도메인을 포함하는 키메라 항체의 Fab 단편이 결합하는 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 및/또는 cyno CD79b (TAHO40) 상의 동일한 에피토프에 결합한다. 다른 실시태양에서, 본 발명의 TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체는 다른 TAHO 항체, 예를 들어 항-CD79b (즉, CB3.1 (비디 바이오사이언시즈 (BD Biosciences) 카탈로그 #555678; 미국 캘리포니아주 산 호세), AT105-1 (에이비디 세로텍 (AbD Serotec) 카탈로그 #MCA2208; 미국 노쓰캐롤라이나주 롤리), AT107-2 (에이비디 세로텍 카탈로그 #MCA2209), 항-인간 CD79b (TAHO5) 항체 (비디 바이오사이언시즈 카탈로그 #557592)가 결합하는 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 및/또는 cyno CD79b (TAHO40) 상의 동일한 에피토프에 결합한다.
다른 실시태양에서, 본 발명의 TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체는 다른 TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-CD79b (TAHO40) 항체가 결합하는 에피토프와 구분되는, TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 및/또는 cyno CD79b (TAHO40) 상의 에피토프에 결합한다. 다른 실시태양에서, 본 발명의 TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체는 로스웰 파크 캔서 인스티튜트로부터 수득한 하이브리도마로부터 생성된 SN8 모노클로날 항체 (Okazaki et al., Blood, 81(1): 84-95 (1993)), 서열 10 (도 10) 및 서열 12 (도 12)의 가변 도메인을 포함하는 모노클로날 항체 또는 로스웰 파크 캔서 인스티튜트로부터 수득한 하이브리도마로부터 생성된 항체의 가변 도메인 (Okazaki et al., Blood, 81(1): 84-95 (1993)) 및 IgG1로부터의 불변 도메인, 또는 서열 10 (도 10) 및 서열 12 (도 12)의 서열을 포함하는 모노클로날 항체의 가변 도메인을 포함하는 키메라 항체의 Fab 단편이 결합하는 에피토프와 구분되는, TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 및/또는 cyno CD79b (TAHO40) 상의 동일한 에피토프에 결합한다. 다른 실시태양에서, 본 발명의 TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40)는 다른 TAHO 항체, 예를 들어 항-CD79b (즉, CB3.1 (비디 바이오사이언시즈 카탈로그 #555678), AT105-1 (에이비디 세로텍 카탈로그 #MCA2208), AT107-2 (에이비디 세로텍 카탈로그 #MCA2209), 항-인간 CD79b 항체 (비디 바이오사이언시즈 카탈로그 #557592)가 결합하는 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 및/또는 cyno CD79b (TAHO40) 상의 동일한 에피토프에 결합한다.
다른 실시태양에서, 본 발명의 TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체는 로스웰 파크 캔서 인스티튜트로부터 수득한 하이브리도마로부터 생성된 모노클로날 항체 (Okazaki et al., Blood, 81(1): 84-95 (1993)), 서열 10 (도 10) 및 서열 12 (도 12)의 가변 도메인을 포함하는 모노클로날 항체 또는 로스웰 파크 캔서 인스티튜트로부터 수득한 하이브리도마로부터 생성된 항체의 가변 도메인 (Okazaki et al., Blood, 81(1): 84-95 (1993)) 및 IgG1로부터의 불변 도메인, 또는 서열 10 (도 10) 및 서열 12 (도 12)의 서열을 포함하는 모노클로날 항체의 가변 도메인을 포함하는 키메라 항체의 Fab 단편과 구분된다 (즉, Fab 단편이 아니다). 다른 실시태양에서, 본 발명의 TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40)는 다른 TAHO 항체, 예를 들어 항-CD79b (즉, CB3.1 (비디 바이오사이언시즈 카탈로그 #555678), AT105-1 (에이비디 세로텍 카탈로그 #MCA2208), AT107-2 (에이비디 세로텍 카탈로그 #MCA2209), 항-인간 CD79b 항체 (비디 바이오사이언시즈 카탈로그 #557592)의 Fab 단편과 구분된다 (즉, Fab 단편이 아니다).
한 실시태양에서, 본 발명의 항체는 제1 동물 종의 CD79b에 특이적으로 결합하고, 제2 동물 종의 CD79b에는 특이적으로 결합하지 않는다. 한 실시태양에서, 제1 동물 종은 인간 및/또는 영장류 (예를 들어, 사이노몰거스 원숭이)이고, 제2 동물 종은 쥐 (예를 들어, 마우스) 및/또는 개이다. 한 실시태양에서, 제1 동물 종은 인간이다. 한 실시태양에서, 제1 동물 종은 영장류, 예를 들어 사이노몰거스 원숭이이다. 한 실시태양에서, 제2 동물 종은 쥐, 예를 들어 마우스이다. 한 실시태양에서, 제2 동물 종은 개이다.
본 발명의 다른 실시태양에서, 본 발명은 임의의 본원에서 설명되는 항체, 예를 들어 시스테인-조작된 항체를 코딩하는 DNA를 포함하는 벡터를 제공한다. 임의의 상기 벡터를 포함하는 숙주 세포도 제공된다. 예를 들어, 숙주 세포는 CHO 세포, 이. 콜라이 세포, 또는 효모 세포일 수 있다. 임의의 본원에서 설명되는 항체의 제조 방법도 제공되고, 이는 목적하는 항체의 발현에 적합한 조건 하에 숙주 세포를 배양하고, 세포 배양액으로부터 목적하는 항체를 회수하는 것을 포함한다.
다른 실시태양에서, 본 발명은 바람직하게는 임의의 상기하거나 아래에서 설명되는 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 및/또는 cyno CD79b (TAHO40) 폴리펩티드에 특이적으로 결합하는 올리고펩티드 ("TAHO 결합 올리고펩티드", 예를 들어 "인간 CD79b (TAHO5) 결합 올리고펩티드" 또는 "cyno CD79b (TAHO40) 결합 올리고펩티드")를 제공한다. 임의로, 본 발명의 TAHO 결합 올리고펩티드, 예를 들어 인간 CD79b (TAHO5) 결합 올리고펩티드 또는 cyno CD79b (TAHO40) 결합 올리고펩티드는 성장 억제제 또는 세포독성제, 예를 들어 독소, 예를 들어 메이탄시노이드, 돌로스타틴 유도체 또는 칼리케아미신, 항생제, 방사성 동위원소, 뉴클레오티드 분해 효소 등에 접합될 수 있다. 본 발명의 TAHO 결합 올리고펩티드, 예를 들어 인간 CD79b (TAHO5) 결합 올리고펩티드 또는 cyno CD79b (TAHO40) 결합 올리고펩티드는 임의로 CHO 세포 또는 세균 세포에서 생산될 수 있고, 바람직하게는 그가 결합하는 세포의 사멸을 유도할 수 있다. 검출을 위해, 본 발명의 TAHO 결합 올리고펩티드, 예를 들어 인간 CD79b (TAHO5) 결합 올리고펩티드 또는 cyno CD79b (TAHO40) 결합 올리고펩티드는 검출가능하게 표지되거나, 고체 지지체에 부착되는 등과 같이 처리될 수 있다.
본 발명의 다른 실시태양에서, 본 발명은 임의의 본원에서 설명되는 TAHO 결합 올리고펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40) 결합 올리고펩티드를 코딩하는 DNA를 포함하는 벡터를 제공한다. 임의의 상기 벡터를 포함하는 숙주 세포도 제공된다. 예를 들어, 숙주 세포는 CHO 세포, 이. 콜라이 세포, 또는 효모 세포일 수 있다. 임의의 본원에서 설명되는 TAHO 결합 올리고펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40) 결합 올리고펩티드의 제조 방법도 추가로 제공되고, 이는 목적하는 올리고펩티드의 발현에 적합한 조건 하에 숙주 세포를 배양하고, 세포 배양액으로부터 목적하는 올리고펩티드를 회수하는 것을 포함한다.
다른 실시태양에서, 본 발명은 바람직하게는 임의의 상기하거나 아래에서 설명되는 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 및/또는 cyno CD79b (TAHO40) 폴리펩티드에 특이적으로 결합하는 작은 유기 분자 ("TAHO 결합 유기 분자", 예를 들어 "인간 CD79b (TAHO5) 결합 유기 분자" 또는 "cyno CD79b (TAHO40) 결합 유기 분자")를 제공한다. 임의로, 본 발명의 TAHO 결합 유기 분자, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40) 결합 유기 분자는 성장 억제제 또는 세포독성제, 예를 들어 독소, 예를 들어 메이탄시노이드, 돌라스타틴 유도체 또는 칼리케아미신, 항생제, 방사성 동위원소, 뉴클레오티드 분해 효소 등에 접합될 수 있다. 본 발명의 TAHO 결합 유기 분자, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40) 결합 유기 분자는 바람직하게는 그가 결합하는 세포의 사멸을 유도할 수 있다. 검출을 위해, 본 발명의 TAHO 결합 유기 분자, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40) 결합 유기 분자는 검출가능하게 표지되거나, 고체 지지체에 부착되는 등과 같이 처리될 수 있다.
또다른 실시태양에서, 본 발명은 본원에서 설명되는 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 및/또는 cyno CD79b (TAHO40) 폴리펩티드, 본원에서 설명되는 키메라 TAHO 폴리펩티드, 예를 들어 키메라 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40) 폴리펩티드, 본원에서 설명되는 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체, 본원에서 설명되는 TAHO 결합 올리고펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40) 결합 올리고펩티드, 또는 본원에서 설명되는 TAHO 결합 유기 분자, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40) 결합 유기 분자를 담체와 함께 포함하는 물질의 조성물에 관한 것이다. 임의로, 담체는 제약상 허용되는 담체이다.
또다른 실시태양에서, 본 발명은 용기 및 용기 내에 포함되는 물질의 조성물을 포함하는 제품에 관한 것이고, 여기서 물질의 조성물은 본원에서 설명되는 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40) 폴리펩티드, 본원에서 설명되는 키메라 TAHO 폴리펩티드, 예를 들어 키메라 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40) 폴리펩티드, 본원에서 설명되는 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체, 본원에서 설명되는 TAHO 결합 올리고펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40) 결합 올리고펩티드, 또는 본원에서 설명되는 TAHO 결합 유기 분자, 예를 들어 TAHO40 결합 유기 분자를 포함할 수 있다. 제품은 임의로 치료 목적의 처치를 위한 물질의 조성물의 용도를 나타내는, 용기에 부착된 라벨, 또는 용기와 함께 포함된 포장 삽입물을 더 포함할 수 있다.
한 측면에서, 본 발명은 본 발명의 하나 이상의 TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체를 포함하는 조성물을 포함하는 제1 용기; 및 버퍼를 포함하는 제2 용기를 포함하는 키트를 제공한다. 한 실시태양에서, 버퍼는 제약상 허용되는 것이다. 한 실시태양에서, 길항제 항체를 포함하는 조성물은 담체를 더 포함하고, 이는 일부 실시태양에서 제약상 허용되는 것이다. 한 실시태양에서, 키트는 조성물 (예를 들어, 항체)를 대상에게 투여하기 위한 사용지시서를 더 포함한다.
본 발명의 또다른 실시태양은 TAHO 폴리펩티드, 예를 들어 CD79 폴리펩티드, 키메라 TAHO 폴리펩티드, 예를 들어 키메라 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40) 폴리펩티드, 항-TAHO 폴리펩티드 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체, TAHO 결합 올리고펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40) 결합 올리고펩티드, 또는 TAHO 결합 유기 분자, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40) 결합 유기 분자에 반응성인 병태의 치료에 유용한 의약의 제조를 위한, 본원에서 설명되는 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40) 폴리펩티드, 본원에서 설명되는 키메라 TAHO 폴리펩티드, 예를 들어 키메라 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40) 폴리펩티드, 본원에서 설명되는 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체, 본원에서 설명되는 TAHO 결합 올리고펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40) 결합 올리고펩티드, 또는 본원에서 설명되는 TAHO 결합 유기 분자, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40) 결합 유기 분자의 용도에 관한 것이다.
한 측면에서, 본 발명은 암, 종양 및/또는 세포 증식성 질환과 같은 질병의 치료 목적의 및/또는 예방 목적의 처치를 위한 의약의 제조에 있어서 본 발명의 TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체의 용도를 제공한다. 한 실시태양에서, 암, 종양 및/또는 세포 증식성 질환은 림프종, 비-호지킨 림프종 (NHL), 공격성 NHL, 재발성 공격성 NHL, 재발성 무통성 NHL, 불응성 NHL, 불응성 무통성 NHL, 만성 림프구성 백혈병 (CLL), 소림프구성 림프종, 백혈병, 유모세포 백혈병 (HCL), 급성 림프구성 백혈병 (ALL), 및 외투 (mantle) 세포 림프종 중에서 선택된다.
한 측면에서, 본 발명은 암, 종양 및/또는 세포 증식성 질환과 같은 질병의 치료 목적의 및/또는 예방 목적의 처치를 위한 의약의 제조에 있어서 본 발명의 핵산의 용도를 제공한다. 한 실시태양에서, 암, 종양 및/또는 세포 증식성 질환은 림프종, 비-호지킨 림프종 (NHL), 공격성 NHL, 재발성 공격성 NHL, 재발성 무통성 NHL, 불응성 NHL, 불응성 무통성 NHL, 만성 림프구성 백혈병 (CLL), 소림프구성 림프종, 백혈병, 유모세포 백혈병 (HCL), 급성 림프구성 백혈병 (ALL), 및 외투 세포 림프종 중에서 선택된다.
한 측면에서, 본 발명은 암, 종양 및/또는 세포 증식성 질환과 같은 질병의 치료 목적의 및/또는 예방 목적의 처치를 위한 의약의 제조에 있어서 본 발명의 발현 벡터의 용도를 제공한다. 한 실시태양에서, 암, 종양 및/또는 세포 증식성 질환은 림프종, 비-호지킨 림프종 (NHL), 공격성 NHL, 재발성 공격성 NHL, 재발성 무통성 NHL, 불응성 NHL, 불응성 무통성 NHL, 만성 림프구성 백혈병 (CLL), 소림프구성 림프종, 백혈병, 유모세포 백혈병 (HCL), 급성 림프구성 백혈병 (ALL), 및 외투 세포 림프종 중에서 선택된다.
한 측면에서, 본 발명은 암, 종양 및/또는 세포 증식성 질환과 같은 질병의 치료 목적의 및/또는 예방 목적의 처치를 위한 의약의 제조에 있어서 본 발명의 숙주 세포의 용도를 제공한다. 한 실시태양에서, 암, 종양 및/또는 세포 증식성 질환은 림프종, 비-호지킨 림프종 (NHL), 공격성 NHL, 재발성 공격성 NHL, 재발성 무통성 NHL, 불응성 NHL, 불응성 무통성 NHL, 만성 림프구성 백혈병 (CLL), 소림프구성 림프종, 백혈병, 유모세포 백혈병 (HCL), 급성 림프구성 백혈병 (ALL), 및 외투 세포 림프종 중에서 선택된다.
한 측면에서, 본 발명은 암, 종양 및/또는 세포 증식성 질환과 같은 질병의 치료 목적의 및/또는 예방 목적의 처치를 위한 의약의 제조에 있어서 본 발명의 제품의 용도를 제공한다. 한 실시태양에서, 암, 종양 및/또는 세포 증식성 질환은 림프종, 비-호지킨 림프종 (NHL), 공격성 NHL, 재발성 공격성 NHL, 재발성 무통성 NHL, 불응성 NHL, 불응성 무통성 NHL, 만성 림프구성 백혈병 (CLL), 소림프구성 림프종, 백혈병, 유모세포 백혈병 (HCL), 급성 림프구성 백혈병 (ALL), 및 외투 세포 림프종 중에서 선택된다.
한 측면에서, 본 발명은 암, 종양 및/또는 세포 증식성 질환과 같은 질병의 치료 목적의 및/또는 예방 목적의 처치를 위한 의약의 제조에 있어서 본 발명의 키트의 용도를 제공한다. 한 실시태양에서, 암, 종양 및/또는 세포 증식성 질환은 림프종, 비-호지킨 림프종 (NHL), 공격성 NHL, 재발성 공격성 NHL, 재발성 무통성 NHL, 불응성 NHL, 불응성 무통성 NHL, 만성 림프구성 백혈병 (CLL), 소림프구성 림프종, 백혈병, 유모세포 백혈병 (HCL), 급성 림프구성 백혈병 (ALL), 및 외투 세포 림프종 중에서 선택된다.
한 측면에서, 본 발명은 임의의 상기하거나 아래에서 설명되는 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40)를 발현하는 세포의 성장을 억제하는 방법을 제공하고, 상기 방법은 상기 세포를 본 발명의 항체와 접촉시켜, 상기 세포의 성장의 억제를 유발하는 것을 포함한다. 한 실시태양에서, 항체는 세포독성제에 접합된다. 한 실시태양에서, 항체는 성장 억제제에 접합된다.
한 측면에서, 본 발명은 임의의 상기하거나 아래에서 설명되는 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40)를 발현하는 세포를 포함하는 암성 종양을 갖는 포유동물을 치료 목적으로 처치하는 방법을 제공하고, 상기 방법은 상기 포유동물에게 치료 유효량의 본 발명의 항체를 투여하여, 상기 포유동물을 효과적으로 치료하는 것을 포함한다. 한 실시태양에서, 항체는 세포독성제에 접합된다. 한 실시태양에서, 항체는 성장 억제제에 접합된다.
한 측면에서, 본 발명은 임의의 상기하거나 아래에서 설명되는 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40)의 증가된 발현과 연관된 세포 증식성 질환을 치료 또는 예방하는 방법을 제공하고, 상기 방법은 그 치료를 필요로 하는 대상에게 유효량의 본 발명의 항체를 투여하여, 상기 세포 증식성 질환을 효과적으로 치료 또는 예방하는 것을 포함한다. 한 실시태양에서, 상기 증식성 질환은 암이다. 한 실시태양에서, 항체는 세포독성제에 접합된다. 한 실시태양에서, 항체는 성장 억제제에 접합된다.
한 측면에서, 본 발명은 그 성장이 임의의 상기하거나 아래에서 설명되는 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40)의 성장 강화 효과에 적어도 부분적으로 의존적인 세포의 성장을 억제하는 방법을 제공하고, 상기 방법은 상기 세포를 유효량의 본 발명의 항체와 접촉시켜, 상기 세포의 성장을 억제하는 것을 포함한다. 한 실시태양에서, 항체는 세포독성제에 접합된다. 한 실시태양에서, 항체는 성장 억제제에 접합된다.
한 측면에서, 본 발명은 그 성장이 임의의 상기하거나 아래에서 설명되는 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40)의 성장 강화 효과에 적어도 부분적으로 의존적인 종양을 치료하는 방법을 제공하고, 상기 방법은 상기 세포를 유효량의 본 발명의 항체와 접촉시켜 상기 종양을 치료하는 것을 포함한다. 한 실시태양에서, 항체는 세포독성제에 접합된다. 한 실시태양에서, 항체는 성장 억제제에 접합된다.
또한, 본 발명은 환자에게 본원에서 설명되는 면역접합체, 허용되는 희석제, 담체 또는 부형제를 포함하는 제약 제제를 투여하는 것을 포함하는, 암의 치료 방법을 제공한다. 한 실시태양에서, 암은 림프종, 비-호지킨 림프종 (NHL), 공격성 NHL, 재발성 공격성 NHL, 재발성 무통성 NHL, 불응성 NHL, 불응성 무통성 NHL, 만성 림프구성 백혈병 (CLL), 소림프구성 림프종, 백혈병, 유모세포 백혈병 (HCL), 급성 림프구성 백혈병 (ALL) 및 외투 세포 림프종 중에서 선택된다. 한 실시태양에서, 환자에게 세포독성제를 항체-약물 접합체 화합물과 함께 투여한다.
또한, 본 발명은 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40)에 대한 면역접합체의 결합을 허용하는 조건 하에 본 발명의 항체를 포함하는 면역접합체에 세포를 노출시키는 것을 포함하는, B 세포 증식을 억제하는 방법을 제공한다. 한 실시태양에서, B 세포 증식은 림프종, 비-호지킨 림프종 (NHL), 공격성 NHL, 재발성 공격성 NHL, 재발성 무통성 NHL, 불응성 NHL, 불응성 무통성 NHL, 만성 림프구성 백혈병 (CLL), 소림프구성 림프종, 백혈병, 유모세포 백혈병 (HCL), 급성 림프구성 백혈병 (ALL) 및 외투 세포 림프종 중에서 선택된다. 한 실시태양에서, B 세포는 이종이식편이다. 한 실시태양에서, 노출은 시험관 내에서 실시된다. 한 실시태양에서, 노출은 생체 내에서 발생한다.
한 측면에서, 본 발명은 임의의 상기하거나 아래에서 설명되는 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40)를 함유하는 것으로 의심되는 샘플 내에서 임의의 상기하거나 아래에서 설명되는 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40)의 존재를 결정하는 방법을 제공하고, 상기 방법은 상기 샘플을 본 발명의 항체에 노출시키고, 상기 샘플 내의 임의의 상기하거나 아래에서 설명되는 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40)에 대한 상기 항체의 결합을 결정하는 것을 포함하고, 여기서 상기 샘플 내의 임의의 상기하거나 아래에서 설명되는 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40)에 대한 상기 항체의 결합은 상기 샘플 내에 상기 단백질이 존재함을 나타낸다. 한 실시태양에서, 샘플은 생물학적 샘플이다. 추가의 실시태양에서, 생물학적 샘플은 B 세포를 포함한다. 한 실시태양에서, 생물학적 샘플은 림프종, 비-호지킨 림프종 (NHL), 공격성 NHL, 재발성 공격성 NHL, 재발성 무통성 NHL, 불응성 NHL, 불응성 무통성 NHL, 만성 림프구성 백혈병 (CLL), 소림프구성 림프종, 백혈병, 유모세포 백혈병 (HCL), 급성 림프구성 백혈병 (ALL) 및 외투 세포 림프종을 포함하고 이로 제한되지 않는 B 세포 질환 및/또는 B 세포 증식성 질환을 겪고 있거나 겪고 있는 것으로 의심되는 포유동물로부터 채취한 것이다.
한 측면에서, 임의의 상기하거나 아래에서 설명되는 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40)를 발현하는 세포, 예를 들어 B 세포의 증가와 연관된 세포 증식성 질환을 진단하는 방법을 제공하고, 상기 방법은 생물학적 샘플 내의 시험 세포를 임의의 상기 항체와 접촉시키고; TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40)에 대한 항체의 결합을 검출함으로써 샘플 내의 시험 세포에 결합된 항체의 수준을 결정하고; 대조 샘플 내의 세포에 결합된 항체의 수준과 비교하는 것을 포함하고, 여기서 결합된 항체의 수준은 시험 및 대조 샘플 내의 TAHO-발현 세포, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40)-발현 세포의 수로 표준화되고, 대조 샘플에 비해 시험 샘플 내의 결합된 항체의 수준이 더 높은 것은 임의의 상기하거나 아래에서 설명되는 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40)를 발현하는 세포와 연관된 세포 증식성 질환의 존재를 나타낸다.
한 측면에서, 혈액 또는 혈청 내에서 임의의 상기하거나 아래에서 설명되는 가용성 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40)를 검출하는 방법을 제공하고, 상기 방법은 B 세포 증식성 질환을 겪는 것으로 의심되는 포유동물로부터의 혈액 또는 혈청의 시험 샘플을 본 발명의 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체와 접촉시키고, 정상 포유동물로부터의 혈액 또는 혈청의 대조 샘플에 비해 시험 샘플 내에서 임의의 상기하거나 아래에서 설명되는 가용성 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40)의 증가를 검출하는 것을 포함한다. 한 실시태양에서, 검출 방법은 포유동물의 혈액 또는 혈청 내에서 임의의 상기하거나 아래에서 설명되는 가용성 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40)의 증가와 연관된 B 세포 증식성 질환을 진단하는 방법으로서 유용하다.
한 측면에서, 본 발명의 항체, 올리고펩티드 또는 유기 분자를 임의의 상기하거나 아래에서 설명되는 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40)를 발현하는 세포에 결합시키는 방법이 제공되고, 상기 방법은 상기 세포를 본 발명의 항체와 접촉시키는 것을 포함한다. 한 실시태양에서, 항체는 세포독성제에 접합된다. 한 실시태양에서, 항체는 성장 억제제에 접합된다.
본 발명의 방법은 임의의 상기하거나 아래에서 설명되는 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40)의 발현과 연관된 임의의 적합한 병적 상태, 예를 들어 세포 및/또는 조직에 영향을 주기 위해 사용될 수 있다. 한 실시태양에서, 본 발명의 방법에서 표적화되는 세포는 조혈 세포이다. 예를 들어, 조혈 세포는 림프구, 백혈구, 혈소판, 적혈구 및 자연 살해 세포로 이루어지는 군 중에서 선택될 수 있다. 한 실시태양에서, 본 발명의 방법에서 표적화되는 세포는 B 세포 또는 T 세포이다. 한 실시태양에서, 본 발명의 방법에서 표적화되는 세포는 암 세포이다. 예를 들어, 암 세포는 림프종 세포, 백혈병 세포, 또는 골수종 세포로 이루어지는 군 중에서 선택될 수 있다.
본 발명의 방법은 추가의 처리 단계를 더 포함할 수 있다. 예를 들어, 한 실시태양에서, 방법은 표적화된 세포 및/또는 조직 (예를 들어, 암 세포)을 방사선 치료 또는 화학요법제에 노출시키는 단계를 더 포함한다.
본원에서 설명되는 바와 같이, CD79b는 B 세포 수용체의 신호전달 성분이다. 따라서, 본 발명의 방법의 한 실시태양에서, 표적화되는 세포 (예를 들어, 암 세포)는 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40)를 발현하지 않는 세포에 비해 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40)가 발현되는 세포이다. 추가의 실시태양에서, 표적화되는 세포는 동일한 조직 종류의 정상적인 비-암 세포에 비해 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40) 발현이 증강된 암 세포이다. 한 실시태양에서, 본 발명의 방법은 표적화된 세포의 사멸을 유발한다.
본 발명의 또다른 실시태양은 항-TAHO 폴리펩티드 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체에 반응성인 병태의 치료에 유용한 의약의 제조를 위한, 본원에서 설명되는 항-TAHO 폴리펩티드 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체의 용도에 관한 것이다.
본 발명의 또다른 측면은 암성 종양이 존재하는 포유동물의 치료 목적의 처치의 안전성을 시험하기 위해 본원에서 설명되는 항-cyno CD79b (TAHO40) 항체 또는 시스테인 조작된 항-cyno CD79b (TAHO40) 항체, 또는 항-cyno CD79b 항체 또는 시스테인 조작된 항-cyno CD79b (TAHO40) 항체를 포함하는 ADC의 사용 방법을 제공하고, 상기 처치는 본원에서 설명되는 항-인간 CD79b (TAHO5) 항체 또는 시스테인 조작된 항-인간 CD79b (TAHO5) 항체, 또는 항-인간 CD79b (TAHO5) 항체 또는 시스테인 조작된 항-인간 CD79b (TAHO5) 항체를 포함하는 ADC의 투여를 포함한다.
본 발명의 또다른 측면은 화학식 I의 항체-약물 화합물의 혼합물을 포함하는 조성물이고, 여기서 항체당 평균 약물 로드는 약 2 내지 약 5, 또는 약 3 내지 약 4이다.
본 발명의 또다른 측면은 화학식 I의 ADC 화합물, 화학식 I의 ADC 화합물의 혼합물, 또는 그의 제약상 허용되는 염 또는 용매화물, 및 제약상 허용되는 희석제, 담체, 또는 부형제를 포함하는 제약 조성물이다.
또다른 측면은 화학식 I의 ADC 화합물 및 항암 특성 또는 다른 치료 효과를 갖는 제2 화합물을 포함하는 제약 조합 제제를 제공한다.
또다른 측면은 종양 세포 또는 암 세포를 사멸시키거나 상기 세포의 증식을 억제하기에 효과적인 양의 화학식 I의 항체-약물 접합체, 또는 그의 제약상 허용되는 염 또는 용매화물로 세포를 처리하는 것을 포함하는, 종양 세포 또는 암 세포를 사멸시키거나 상기 세포의 증식을 억제하는 방법이다.
또다른 측면은 환자에게 치료 유효량의 화학식 I의 ADC를 포함하는 제약 조성물을 투여하는 것을 포함하는 암의 치료 방법이다.
또다른 측면은 항체-약물 접합체, 용기, 및 치료를 표시하는 포장 삽입물 또는 라벨을 포함하는 제품, 즉, 키트를 포함한다.
도 1은 TAHO4 (PRO36248) cDNA의 뉴클레오티드 서열 (서열 1)을 도시한 것이고, 여기서 서열 1은 본원에서 "DNA225785"로서 지정된 클론 (본원에서 "인간 CD79a"로서도 언급됨)이다. 뉴클레오티드 서열은 인간 CD79a를 코딩하고, 여기서 출발 및 정지 코돈을 굵은 글씨체로 밑줄로 표시한다.
도 2는 도 1에 제시된 서열 7의 코딩 서열로부터 유래된 아미노산 서열 (서열 2)을 도시한 것이다.
도 3은 TAHO5 (PRO36249) cDNA의 뉴클레오티드 서열 (서열 3)을 도시한 것이고, 여기서 서열 3은 본원에서 "DNA225786"으로서 지정된 클론 (본원에서 "인간 CD79b"로서도 언급됨)이다. 뉴클레오티드 서열은 인간 CD79b를 코딩하고, 여기서 출발 및 정지 코돈을 굵은 글씨체로 밑줄로 표시한다.
도 4는 도 3에 제시된 서열 3의 코딩 서열로부터 유래된 아미노산 서열 (서열 4)을 도시한 것이다.
도 5는 TAHO39 (PRO283626) cDNA의 뉴클레오티드 서열 (서열 5)을 도시한 것이고, 여기서 서열 5는 본원에서 "DNA548454"로서 지정된 클론 (본원에서 "cyno CD79a" 또는 "cyno CD79a"로서도 언급됨)이다. 뉴클레오티드 서열은 사이노몰거스 CD79a를 코딩하고, 여기서 출발 및 정지 코돈을 굵은 글씨체로 밑줄로 표시한다.
도 6은 도 5에 제시된 서열 6의 코딩 서열로부터 유래된 아미노산 서열 (서열 6)을 도시한 것이다.
도 7은 TAHO40 (PRO283627) cDNA의 뉴클레오티드 서열 (서열 7)을 도시한 것이고, 여기서 서열 7은 "DNA548455"로서 지정된 클론 (본원에서 "cyno CD79b" 또는 "cyno CD79b"로서도 언급됨)이다. 뉴클레오티드 서열은 사이노몰거스 CD79b를 코딩하고, 여기서 출발 및 정지 코돈을 굵은 글씨체로 밑줄로 표시한다.
도 8은 도 7에 제시된 서열 7의 코딩 서열로부터 유래된 아미노산 서열 (서열 8)을 도시한 것이다.
도 9는 키메라 SN8 IgG1 (항-인간 CD79b (TAHO5) 항체 (chSN8))의 경쇄의 뉴클레오티드 서열 (서열 9)을 도시한 것이다. 뉴클레오티드 서열은 항-인간 CD79b (TAHO5) 항체 (chSN8)의 경쇄를 코딩하고, 여기서 출발 및 정지 코돈은 굵은 글씨체로 밑줄로 표시한다.
도 10은 도 9에 제시된 서열 9의 코딩 서열로부터 유래된, 처음 18개 아미노산 신호 서열이 빠진 아미노산 서열 (서열 10)을 도시한 것이다. 가변 영역은 밑줄로 표시하지 않은 영역이다.
도 11은 키메라 SN8 IgG1 (항-인간 CD79b (TAHO5) 항체 (chSN8))의 중쇄의 뉴클레오티드 서열 (서열 11)을 도시한 것이다. 뉴클레오티드 서열은 항-인간 CD79b (TAHO5) 항체 (chSN8)의 중쇄를 코딩하고, 여기서 출발 및 정지 코돈은 굵은 글씨체로 밑줄로 표시한다.
도 12는 도 11에 제시된 서열 11의 코딩 서열로부터 유래된, 처음 18개 아미노산 신호 서열과 정지 코돈 앞의 마지막 라이신 (K)이 빠진 아미노산 서열 (서열 12)을 도시한 것이다. 가변 영역은 밑줄로 표시하지 않은 영역이다.
도 13은 인간 (서열 4), 사이노몰거스 원숭이 (cyno) (서열 8) 및 마우스 (서열 13)로부터의 CD79b의 아미노산 서열의 정렬을 도시한 것이다. 인간 및 cyno-CD79b는 85%의 아미노산 동일성을 갖는다. 신호 서열, 시험 펩티드 (실시예 9에 기재된 11개 아미노산 펩티드), 막횡단 (TM) 도메인 및 면역수용체 티로신계 활성화 모티프 (ITAM) 도메인을 나타낸다. 네모로 표시한 영역은 CD79b의 스플라이스 변이체 (실시예 9에 기재된) 내에 부재하는 CD79b의 영역이다.
도 14는 정상 샘플에서 및 이환된 샘플에서 TAHO4의 발현, 예를 들어 NHL 샘플 및 다발 골수종 샘플 (MM), 및 정상 소뇌 및 정상 혈액에서 유의한 발현을 보여주는 마이크로어레이 데이타를 보여준다. 도면에서 사용된 약어는 다음과 같다: 비-호지킨 림프종 (NHL), 여포성 림프종 (FL), 정상 림프절 (NLN), 정상 B 세포 (NB), 다발 골수종 세포 (MM), 소장, 태아 간, 평활근, 태아 뇌, 자연 살해 세포 (NK), 호중구, 수지상세포 (DC), 기억 B 세포 (기억 B), 형질세포 (PC), 골수 형질세포 (BM PC).
도 15는 정상 샘플 및 이환된 샘플에서 TAHO5의 발현, 예를 들어 NHL 샘플에서 유의한 발현을 보여주는 마이크로어레이 데이타를 보여준다. 도면에서 사용된 약어는 다음과 같다: 비-호지킨 림프종 (NHL), 여포성 림프종 (FL), 정상 림프절 (NLN), 정상 B 세포 (NB), 다발 골수종 세포 (MM), 소장, 태아 간, 평활근, 태아 뇌, 자연 살해 세포 (NK), 호중구, 수지상세포 (DC), 기억 B 세포 (기억 B), 형질세포 (PC), 골수 형질세포 (BM PC).
도 16은 항-인간 CD79b (TAHO5) 항체 (ch2F2)의 경쇄의 뉴클레오티드 서열 (서열 32)을 보여준다. 뉴클레오티드 서열은 도 17에 도시된 항-인간 CD79b (TAHO5) 항체 (ch2F2)의 경쇄를 코딩한다.
도 17은 도 16에 도시된 서열 32의 코딩 서열로부터 유도된 아미노산 서열 (서열 33)을 보여준다. 가변 영역은 밑줄로 표시하지 않은 영역이다.
도 18은 항-인간 CD79b (TAHO5) 항체 (ch2F2)의 중쇄의 뉴클레오티드 서열 (서열 34)을 보여준다. 뉴클레오티드 서열은 도 19에 도시된 항-인간 CD79b (TAHO5) 항체 (2F2)의 중쇄를 코딩한다.
도 19는 도 18에 제시된 서열 34의 코딩 서열로부터 유래된, 정지 코돈 앞의 마지막 라이신 (K)이 빠진 아미노산 서열 (서열 35)을 도시한 것이다. 가변 영역은 밑줄로 표시하지 않은 영역이다.
도 20은 항-cyno CD79b (TAHO40) 항체 (ch10D10)의 경쇄의 뉴클레오티드 서열 (서열 40)을 보여준다. 뉴클레오티드 서열은 항-cyno CD79b (TAHO40) 항체 (ch10D10)의 경쇄를 코딩하고, 여기서 출발 및 정지 코돈을 굵은 글씨체로 밑줄로 표시한다.
도 21은 도 20에 제시된 서열 40의 코딩 서열로부터 유래된, 처음 18개 아미노산 신호 서열이 빠진 아미노산 서열 (서열 41)을 도시한 것이다. 가변 영역은 밑줄로 표시하지 않은 영역이다.
도 22는 항-cyno CD79b (TAHO40) 항체 (ch10D10)의 중쇄의 뉴클레오티드 서열 (서열 42)을 보여준다. 뉴클레오티드 서열은 항-cyno CD79b (TAHO40) 항체 (ch10D10)의 중쇄를 코딩하고, 여기서 출발 및 정지 코돈을 굵은 글씨체로 밑줄로 표시한다.
도 23은 도 22에 제시된 서열 42의 코딩 서열로부터 유래된, 처음 18개 아미노산 신호 서열과 정지 코돈 앞의 마지막 라이신 (K)이 빠진 아미노산 서열 (서열 43)을 도시한 것이다. 가변 영역은 밑줄로 표시하지 않은 영역이다.
도 24는 실시예 9에 설명되는 바와 같은 면역글로불린 경쇄의 발현을 위한 플라스미드 pDR1의 서열 (서열 48; 5391 bp)을 보여준다. pDR1은 관련되지 않은 항체인 인간화 항-CD3 항체의 경쇄를 코딩하는 서열을 포함하고 (Shalaby et al., J. Exp. Med., 175: 217-225 (1992)), 그에 대한 출발 및 정지 코돈을 굵은 글씨체로 밑줄로 표시한다.
도 25는 실시예 9에 설명되는 바와 같은 면역글로불린 중쇄의 발현을 위한 플라스미드 pDR2의 서열 (서열 49; 6135 bp)을 보여준다. pDR2는 관련되지 않은 항체인 인간화 항-CD3 항체의 중쇄를 코딩하는 서열을 포함하고 (Shalaby et al., 상기 문헌), 그에 대한 출발 및 정지 코돈을 굵은 글씨체로 밑줄로 표시한다.
도 26은 실시예 9에 설명되는 바와 같은 면역글로불린 경쇄의 발현을 위한 플라스미드 pRK.LPG3.HumanKappa의 서열 (서열 50)을 보여준다 (Shields et al., J Biol. Chem, 276: 6591-6604 (2000)).
도 27은 실시예 9에 설명되는 바와 같은 면역글로불린 중쇄의 발현을 위한 플라스미드 pRK.LPG4.HumanHC의 서열 (서열 51)을 보여준다 (Shields et al., J Biol. Chem, 276: 6591-6604 (2000)).
도 28은 약물 모이어티가 경쇄 (LC-ADC); 중쇄 (HC-ADC); 및 Fc 영역 (Fc-ADC) 내에서 조작된 시스테인기에 부착되는, 시스테인 조작된 항-TAHO 항체 약물 접합체 (ADC)의 도면이다.
도 29는 (i) 환원제 TCEP (트리스(2-카르복시에틸)포스핀 염산염)을 사용하여 시스테인 조작된 항-TAHO 항체 (ThioMab) 내에서 시스테인 디술피드 부가물 및 사슬간 및 사슬내 디술피드를 환원시키고; (ii) dhAA (데히드로아스코르브산)을 사용하여 부분적으로 산화, 즉, 재산화시켜 사슬간 및 사슬내 디술피드를 재형성하고; 및 (iii) 재산화된 항체를 약물-링커 중간체와 접합시켜 시스테인 항-TAHO 약물 접합체 (ADC)를 형성하는 단계를 도시한 것이다.
도 30은 시스테인 조작된 항-인간 CD79b (TAHO5) 항체 (thio-chSN8-LC-V205C)의 (A) 경쇄 서열 (서열 58) 및 (B) 중쇄 서열 (서열 57)을 도시한 것이고, 여기서 경쇄의 카바트 위치 205의 발린 (순차적인 위치 발린 208)이 시스테인으로 변경되었다. 약물 모이어티는 경쇄 내의 조작된 시스테인기에 부착될 수 있다. 각각의 도면에서, 변경된 아미노산은 굵은 글씨체로 이중 밑줄로 나타낸다. 단일 밑줄은 불변 영역을 나타낸다. 가변 영역은 밑줄로 표시하지 않은 영역이다. Fc 영역은 이탤릭체로 표시한다. "Thio"는 시스테인-조작된 항체를 나타낸다.
도 31은 시스테인 조작된 항-인간 CD79b (TAHO5) 항체 (thio-chSN8-HC-A118C)의 (A) 경쇄 서열 (서열 60) 및 (B) 중쇄 서열 (서열 59)을 도시한 것이고, 여기서 중쇄의 EU 위치 118의 알라닌 (순차적인 위치 알라닌 118; 카바트 위치 114)이 시스테인으로 변경되었다. 약물 모이어티는 중쇄 내의 조작된 시스테인기에 부착될 수 있다. 각각의 도면에서, 변경된 아미노산은 굵은 글씨체로 이중 밑줄로 나타낸다. 단일 밑줄은 불변 영역을 나타낸다. 가변 영역은 밑줄로 표시하지 않은 영역이다. Fc 영역은 이탤릭체로 표시한다. "Thio"는 시스테인-조작된 항체를 나타낸다.
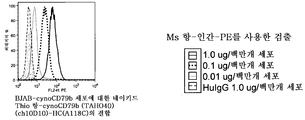
도 32a-b는 BJAB-루시퍼라제 세포의 표면 상에 발현된 인간 CD79b (TAHO5)에 대한 본 발명의 항-인간 CD79b (TAHO5) thioMAb 약물 접합체 (TDC)의 결합이, MMAF와 접합된 chSN8의 (a) LC (V205C) thioMAb 변이체 및 (b) HC (A118C) thioMAb 변이체에 대한 것과 유사함을 나타내는 FACS 플롯이다. 검출에는 MS 항-인간IgG-PE를 사용하였다. "Thio"는 시스테인-조작된 항체를 나타낸다.
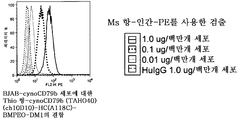
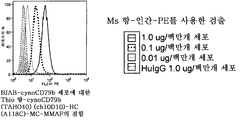
도 33a-d는 cynoCD79b (TAHO40)를 발현하는 BJAB-세포의 표면 상에 발현된 CD79b에 대한 본 발명의 항-cynoCD79b (TAHO40) thioMAb 약물 접합체 (TDC)의 결합이, 항-cynoCD79b (TAHO40) (ch10D10)의 (a) 네이키드 (접합되지 않은) HC(A118C) thioMAb 변이체, 및 제시된 상이한 약물 접합체와 접합된 항-cynoCD79b (TAHO40) (ch10D10)의 HC(A118C) thioMAb 변이체 ((b) MMAE, (c) DM1 및 (d) MMAF))에 대한 것과 유사함을 나타내는 FACS 플롯이다. 검출에는 MS 항-huIgG-PE를 사용하였다. "Thio"는 시스테인-조작된 항체를 나타낸다.
도 34a는 인간 B 세포 종양을 보유하는 SCID 마우스에게 조작된 시스테인의 위치 (LC (V205C) 또는 HC (A118C))가 상이하고/하거나 상이한 약물 투여량의 항-인간 CD79b (TAHO5) TDC를 투여하면 종양 성장을 유의하게 억제하였음을 보여주는, Granta-519 (인간 외투 세포 림프종) 이종이식편 모델에서 생체내 종양 성장 억제의 그래프이다. thio chSN8-HC(A118C)-MC-MMAF (약물 로드는 약 1.9임 (표 21)) 또는 thio chSN8-LC(V205C)-MC-MMAF (약물 로드는 약 1.8임 (표 21))로 처리한 이종이식편 모델은 연구 동안 종양 성장의 유의한 억제를 보였다. 대조군은 hu-항-HER2-MC-MMAF 및 thio hu-항-HER2-HC(A118C)-MC-MMAF 및 chSN8-MC-MMAF를 포함하였다. 도 34b는 연구의 처음 14일 동안 체중의 유의한 변화가 없었음을 보여주는, Granta-519 이종이식편 연구 (도 33a 및 표 21)로부터의 마우스에서 체중 변화 비율 (%)의 플롯이다. "Thio"는 시스테인-조작된 항체를 나타내는 한편, "hu"는 인간화 항체를 나타낸다.
도 35는 시스테인 조작된 항-cynoCD79b (TAHO40) 항체 (Thio-항-cynoCD79b (TAHO40) (ch10D10)-HC-A118C)의 (A) 경쇄 서열 (서열 62) 및 (B) 중쇄 서열 (서열 61)을 도시한 것이고, 여기서 중쇄의 EU 위치 118의 알라닌 (순차적인 위치 알라닌 118; 카바트 위치 114)이 시스테인으로 변경되었다. 중쇄의 EU 위치 6의 아미노산 D (도면의 음영)는 별법으로 E일 수 있다. 약물 모이어티는 중쇄 내의 조작된 시스테인기에 부착될 수 있다. 각각의 도면에서, 변경된 아미노산은 굵은 글씨체로 이중 밑줄로 나타낸다. 단일 밑줄은 불변 영역을 나타낸다. 가변 영역은 밑줄로 표시하지 않은 영역이다. Fc 영역은 이탤릭체로 표시한다. "Thio"는 시스테인-조작된 항체를 나타낸다.
도 36은 시스테인 조작된 항-cynoCD79b (TAHO40) 항체 (Thio-항-cynoCD79b (TAHO40) (ch10D10)-LC-V205C)의 (A) 경쇄 서열 (서열 96) 및 (B) 중쇄 서열 (서열 95)을 도시한 것이고, 여기서 경쇄의 카바트 위치 205의 발린 (순차적인 위치 발린 208)이 시스테인으로 변경되었다. 중쇄의 EU 위치 6의 아미노산 D (도면의 음영)는 별법으로 E일 수 있다. 약물 모이어티는 중쇄 내의 조작된 시스테인기에 부착될 수 있다. 각각의 도면에서, 변경된 아미노산은 굵은 글씨체로 이중 밑줄로 나타낸다. 단일 밑줄은 불변 영역을 나타낸다. 가변 영역은 밑줄로 표시하지 않은 영역이다. Fc 영역은 이탤릭체로 표시한다. "Thio"는 시스테인-조작된 항체를 나타낸다.
도 37은 인간 B 세포 종양을 보유하는 SCID 마우스에게 상이한 링커 약물 모이어티 (BMPEO-DM1, MC-MMAF 또는 MCvcPAB-MMAE)에 접합된 항-cynoCD79b (TAHO40) TDC를 투여하면 종양 성장을 유의하게 억제하였음을 보여주는, BJAB-cynoCD79b (cynoCD79b (TAHO40)를 발현하는 BJAB 세포) (버킷 (Burkitt) 림프종) 이종이식편 모델에서 생체내 종양 성장 억제의 그래프이다. 항-cynoCD79b (TAHO40) (ch10D10)-HC(A118C)-BMPEO-DM1 (약물 로드는 약 1.8임 (표 22)), thio 항-cynoCD79b (TAHO40) (ch10D10)-HC(A118C)-MC-MMAF (약물 로드는 약 1.9임 (표 22)), 또는 thio 항-cynoCD79b (TAHO40) (ch10D10)-HC(A118C)-MCvcPAB-MMAE (약물 로드는 약 1.86임 (표 22))로 처리한 이종이식편 모델은 연구 동안 종양 성장의 유의한 억제를 보였다. 대조군은 항-HER2 대조군 (thio hu-항-HER2-HC(A118C)-BMPEO-DM1, thio hu-항-HER2-HC(A118C)-MCvcPAB-MMAE, thio hu-항-HER2-HC(A118C)-MC-MMAF)를 포함하였다. "Thio"는 시스테인-조작된 항체를 나타내는 한편, "hu"는 인간화 항체를 나타낸다.
도 38은 인간 B 세포 종양을 보유하는 SCID 마우스에게 상이한 양으로 투여되는 BMPEO-DM1 링커 약물 모이어티와 함께 항-cynoCD79b (TAHO40) TDC를 투여하면 종양 성장을 유의하게 억제하였음을 보여주는, BJAB-cynoCD79b (cynoCD79b (TAHO40)를 발현하는 BJAB-세포) (버킷 림프종) 이종이식편 모델에서 생체내 종양 성장 억제의 그래프이다. thio 항-cynoCD79b (TAHO40) (ch10D10)-HC(A118C)-BMPEO-DM1 (약물 로드는 약 1.8임 (표 23))로 처리한 이종이식편 모델은 연구 동안 종양 성장의 유의한 억제를 보였다. 대조군은 항-HER2 대조군 (thio hu-항-HER2-HC(A118C)-BMPEO-DM1) 및 항-cynoCD79b (TAHO40) (ch10D10) 대조군 (thio 항-cynoCD79b (TAHO40) (ch10D10)-HC(A118C))를 포함하였다. "Thio"는 시스테인-조작된 항체를 나타내는 한편, "hu"는 인간화 항체를 나타낸다.
도 2는 도 1에 제시된 서열 7의 코딩 서열로부터 유래된 아미노산 서열 (서열 2)을 도시한 것이다.
도 3은 TAHO5 (PRO36249) cDNA의 뉴클레오티드 서열 (서열 3)을 도시한 것이고, 여기서 서열 3은 본원에서 "DNA225786"으로서 지정된 클론 (본원에서 "인간 CD79b"로서도 언급됨)이다. 뉴클레오티드 서열은 인간 CD79b를 코딩하고, 여기서 출발 및 정지 코돈을 굵은 글씨체로 밑줄로 표시한다.
도 4는 도 3에 제시된 서열 3의 코딩 서열로부터 유래된 아미노산 서열 (서열 4)을 도시한 것이다.
도 5는 TAHO39 (PRO283626) cDNA의 뉴클레오티드 서열 (서열 5)을 도시한 것이고, 여기서 서열 5는 본원에서 "DNA548454"로서 지정된 클론 (본원에서 "cyno CD79a" 또는 "cyno CD79a"로서도 언급됨)이다. 뉴클레오티드 서열은 사이노몰거스 CD79a를 코딩하고, 여기서 출발 및 정지 코돈을 굵은 글씨체로 밑줄로 표시한다.
도 6은 도 5에 제시된 서열 6의 코딩 서열로부터 유래된 아미노산 서열 (서열 6)을 도시한 것이다.
도 7은 TAHO40 (PRO283627) cDNA의 뉴클레오티드 서열 (서열 7)을 도시한 것이고, 여기서 서열 7은 "DNA548455"로서 지정된 클론 (본원에서 "cyno CD79b" 또는 "cyno CD79b"로서도 언급됨)이다. 뉴클레오티드 서열은 사이노몰거스 CD79b를 코딩하고, 여기서 출발 및 정지 코돈을 굵은 글씨체로 밑줄로 표시한다.
도 8은 도 7에 제시된 서열 7의 코딩 서열로부터 유래된 아미노산 서열 (서열 8)을 도시한 것이다.
도 9는 키메라 SN8 IgG1 (항-인간 CD79b (TAHO5) 항체 (chSN8))의 경쇄의 뉴클레오티드 서열 (서열 9)을 도시한 것이다. 뉴클레오티드 서열은 항-인간 CD79b (TAHO5) 항체 (chSN8)의 경쇄를 코딩하고, 여기서 출발 및 정지 코돈은 굵은 글씨체로 밑줄로 표시한다.
도 10은 도 9에 제시된 서열 9의 코딩 서열로부터 유래된, 처음 18개 아미노산 신호 서열이 빠진 아미노산 서열 (서열 10)을 도시한 것이다. 가변 영역은 밑줄로 표시하지 않은 영역이다.
도 11은 키메라 SN8 IgG1 (항-인간 CD79b (TAHO5) 항체 (chSN8))의 중쇄의 뉴클레오티드 서열 (서열 11)을 도시한 것이다. 뉴클레오티드 서열은 항-인간 CD79b (TAHO5) 항체 (chSN8)의 중쇄를 코딩하고, 여기서 출발 및 정지 코돈은 굵은 글씨체로 밑줄로 표시한다.
도 12는 도 11에 제시된 서열 11의 코딩 서열로부터 유래된, 처음 18개 아미노산 신호 서열과 정지 코돈 앞의 마지막 라이신 (K)이 빠진 아미노산 서열 (서열 12)을 도시한 것이다. 가변 영역은 밑줄로 표시하지 않은 영역이다.
도 13은 인간 (서열 4), 사이노몰거스 원숭이 (cyno) (서열 8) 및 마우스 (서열 13)로부터의 CD79b의 아미노산 서열의 정렬을 도시한 것이다. 인간 및 cyno-CD79b는 85%의 아미노산 동일성을 갖는다. 신호 서열, 시험 펩티드 (실시예 9에 기재된 11개 아미노산 펩티드), 막횡단 (TM) 도메인 및 면역수용체 티로신계 활성화 모티프 (ITAM) 도메인을 나타낸다. 네모로 표시한 영역은 CD79b의 스플라이스 변이체 (실시예 9에 기재된) 내에 부재하는 CD79b의 영역이다.
도 14는 정상 샘플에서 및 이환된 샘플에서 TAHO4의 발현, 예를 들어 NHL 샘플 및 다발 골수종 샘플 (MM), 및 정상 소뇌 및 정상 혈액에서 유의한 발현을 보여주는 마이크로어레이 데이타를 보여준다. 도면에서 사용된 약어는 다음과 같다: 비-호지킨 림프종 (NHL), 여포성 림프종 (FL), 정상 림프절 (NLN), 정상 B 세포 (NB), 다발 골수종 세포 (MM), 소장, 태아 간, 평활근, 태아 뇌, 자연 살해 세포 (NK), 호중구, 수지상세포 (DC), 기억 B 세포 (기억 B), 형질세포 (PC), 골수 형질세포 (BM PC).
도 15는 정상 샘플 및 이환된 샘플에서 TAHO5의 발현, 예를 들어 NHL 샘플에서 유의한 발현을 보여주는 마이크로어레이 데이타를 보여준다. 도면에서 사용된 약어는 다음과 같다: 비-호지킨 림프종 (NHL), 여포성 림프종 (FL), 정상 림프절 (NLN), 정상 B 세포 (NB), 다발 골수종 세포 (MM), 소장, 태아 간, 평활근, 태아 뇌, 자연 살해 세포 (NK), 호중구, 수지상세포 (DC), 기억 B 세포 (기억 B), 형질세포 (PC), 골수 형질세포 (BM PC).
도 16은 항-인간 CD79b (TAHO5) 항체 (ch2F2)의 경쇄의 뉴클레오티드 서열 (서열 32)을 보여준다. 뉴클레오티드 서열은 도 17에 도시된 항-인간 CD79b (TAHO5) 항체 (ch2F2)의 경쇄를 코딩한다.
도 17은 도 16에 도시된 서열 32의 코딩 서열로부터 유도된 아미노산 서열 (서열 33)을 보여준다. 가변 영역은 밑줄로 표시하지 않은 영역이다.
도 18은 항-인간 CD79b (TAHO5) 항체 (ch2F2)의 중쇄의 뉴클레오티드 서열 (서열 34)을 보여준다. 뉴클레오티드 서열은 도 19에 도시된 항-인간 CD79b (TAHO5) 항체 (2F2)의 중쇄를 코딩한다.
도 19는 도 18에 제시된 서열 34의 코딩 서열로부터 유래된, 정지 코돈 앞의 마지막 라이신 (K)이 빠진 아미노산 서열 (서열 35)을 도시한 것이다. 가변 영역은 밑줄로 표시하지 않은 영역이다.
도 20은 항-cyno CD79b (TAHO40) 항체 (ch10D10)의 경쇄의 뉴클레오티드 서열 (서열 40)을 보여준다. 뉴클레오티드 서열은 항-cyno CD79b (TAHO40) 항체 (ch10D10)의 경쇄를 코딩하고, 여기서 출발 및 정지 코돈을 굵은 글씨체로 밑줄로 표시한다.
도 21은 도 20에 제시된 서열 40의 코딩 서열로부터 유래된, 처음 18개 아미노산 신호 서열이 빠진 아미노산 서열 (서열 41)을 도시한 것이다. 가변 영역은 밑줄로 표시하지 않은 영역이다.
도 22는 항-cyno CD79b (TAHO40) 항체 (ch10D10)의 중쇄의 뉴클레오티드 서열 (서열 42)을 보여준다. 뉴클레오티드 서열은 항-cyno CD79b (TAHO40) 항체 (ch10D10)의 중쇄를 코딩하고, 여기서 출발 및 정지 코돈을 굵은 글씨체로 밑줄로 표시한다.
도 23은 도 22에 제시된 서열 42의 코딩 서열로부터 유래된, 처음 18개 아미노산 신호 서열과 정지 코돈 앞의 마지막 라이신 (K)이 빠진 아미노산 서열 (서열 43)을 도시한 것이다. 가변 영역은 밑줄로 표시하지 않은 영역이다.
도 24는 실시예 9에 설명되는 바와 같은 면역글로불린 경쇄의 발현을 위한 플라스미드 pDR1의 서열 (서열 48; 5391 bp)을 보여준다. pDR1은 관련되지 않은 항체인 인간화 항-CD3 항체의 경쇄를 코딩하는 서열을 포함하고 (Shalaby et al., J. Exp. Med., 175: 217-225 (1992)), 그에 대한 출발 및 정지 코돈을 굵은 글씨체로 밑줄로 표시한다.
도 25는 실시예 9에 설명되는 바와 같은 면역글로불린 중쇄의 발현을 위한 플라스미드 pDR2의 서열 (서열 49; 6135 bp)을 보여준다. pDR2는 관련되지 않은 항체인 인간화 항-CD3 항체의 중쇄를 코딩하는 서열을 포함하고 (Shalaby et al., 상기 문헌), 그에 대한 출발 및 정지 코돈을 굵은 글씨체로 밑줄로 표시한다.
도 26은 실시예 9에 설명되는 바와 같은 면역글로불린 경쇄의 발현을 위한 플라스미드 pRK.LPG3.HumanKappa의 서열 (서열 50)을 보여준다 (Shields et al., J Biol. Chem, 276: 6591-6604 (2000)).
도 27은 실시예 9에 설명되는 바와 같은 면역글로불린 중쇄의 발현을 위한 플라스미드 pRK.LPG4.HumanHC의 서열 (서열 51)을 보여준다 (Shields et al., J Biol. Chem, 276: 6591-6604 (2000)).
도 28은 약물 모이어티가 경쇄 (LC-ADC); 중쇄 (HC-ADC); 및 Fc 영역 (Fc-ADC) 내에서 조작된 시스테인기에 부착되는, 시스테인 조작된 항-TAHO 항체 약물 접합체 (ADC)의 도면이다.
도 29는 (i) 환원제 TCEP (트리스(2-카르복시에틸)포스핀 염산염)을 사용하여 시스테인 조작된 항-TAHO 항체 (ThioMab) 내에서 시스테인 디술피드 부가물 및 사슬간 및 사슬내 디술피드를 환원시키고; (ii) dhAA (데히드로아스코르브산)을 사용하여 부분적으로 산화, 즉, 재산화시켜 사슬간 및 사슬내 디술피드를 재형성하고; 및 (iii) 재산화된 항체를 약물-링커 중간체와 접합시켜 시스테인 항-TAHO 약물 접합체 (ADC)를 형성하는 단계를 도시한 것이다.
도 30은 시스테인 조작된 항-인간 CD79b (TAHO5) 항체 (thio-chSN8-LC-V205C)의 (A) 경쇄 서열 (서열 58) 및 (B) 중쇄 서열 (서열 57)을 도시한 것이고, 여기서 경쇄의 카바트 위치 205의 발린 (순차적인 위치 발린 208)이 시스테인으로 변경되었다. 약물 모이어티는 경쇄 내의 조작된 시스테인기에 부착될 수 있다. 각각의 도면에서, 변경된 아미노산은 굵은 글씨체로 이중 밑줄로 나타낸다. 단일 밑줄은 불변 영역을 나타낸다. 가변 영역은 밑줄로 표시하지 않은 영역이다. Fc 영역은 이탤릭체로 표시한다. "Thio"는 시스테인-조작된 항체를 나타낸다.
도 31은 시스테인 조작된 항-인간 CD79b (TAHO5) 항체 (thio-chSN8-HC-A118C)의 (A) 경쇄 서열 (서열 60) 및 (B) 중쇄 서열 (서열 59)을 도시한 것이고, 여기서 중쇄의 EU 위치 118의 알라닌 (순차적인 위치 알라닌 118; 카바트 위치 114)이 시스테인으로 변경되었다. 약물 모이어티는 중쇄 내의 조작된 시스테인기에 부착될 수 있다. 각각의 도면에서, 변경된 아미노산은 굵은 글씨체로 이중 밑줄로 나타낸다. 단일 밑줄은 불변 영역을 나타낸다. 가변 영역은 밑줄로 표시하지 않은 영역이다. Fc 영역은 이탤릭체로 표시한다. "Thio"는 시스테인-조작된 항체를 나타낸다.
도 32a-b는 BJAB-루시퍼라제 세포의 표면 상에 발현된 인간 CD79b (TAHO5)에 대한 본 발명의 항-인간 CD79b (TAHO5) thioMAb 약물 접합체 (TDC)의 결합이, MMAF와 접합된 chSN8의 (a) LC (V205C) thioMAb 변이체 및 (b) HC (A118C) thioMAb 변이체에 대한 것과 유사함을 나타내는 FACS 플롯이다. 검출에는 MS 항-인간IgG-PE를 사용하였다. "Thio"는 시스테인-조작된 항체를 나타낸다.
도 33a-d는 cynoCD79b (TAHO40)를 발현하는 BJAB-세포의 표면 상에 발현된 CD79b에 대한 본 발명의 항-cynoCD79b (TAHO40) thioMAb 약물 접합체 (TDC)의 결합이, 항-cynoCD79b (TAHO40) (ch10D10)의 (a) 네이키드 (접합되지 않은) HC(A118C) thioMAb 변이체, 및 제시된 상이한 약물 접합체와 접합된 항-cynoCD79b (TAHO40) (ch10D10)의 HC(A118C) thioMAb 변이체 ((b) MMAE, (c) DM1 및 (d) MMAF))에 대한 것과 유사함을 나타내는 FACS 플롯이다. 검출에는 MS 항-huIgG-PE를 사용하였다. "Thio"는 시스테인-조작된 항체를 나타낸다.
도 34a는 인간 B 세포 종양을 보유하는 SCID 마우스에게 조작된 시스테인의 위치 (LC (V205C) 또는 HC (A118C))가 상이하고/하거나 상이한 약물 투여량의 항-인간 CD79b (TAHO5) TDC를 투여하면 종양 성장을 유의하게 억제하였음을 보여주는, Granta-519 (인간 외투 세포 림프종) 이종이식편 모델에서 생체내 종양 성장 억제의 그래프이다. thio chSN8-HC(A118C)-MC-MMAF (약물 로드는 약 1.9임 (표 21)) 또는 thio chSN8-LC(V205C)-MC-MMAF (약물 로드는 약 1.8임 (표 21))로 처리한 이종이식편 모델은 연구 동안 종양 성장의 유의한 억제를 보였다. 대조군은 hu-항-HER2-MC-MMAF 및 thio hu-항-HER2-HC(A118C)-MC-MMAF 및 chSN8-MC-MMAF를 포함하였다. 도 34b는 연구의 처음 14일 동안 체중의 유의한 변화가 없었음을 보여주는, Granta-519 이종이식편 연구 (도 33a 및 표 21)로부터의 마우스에서 체중 변화 비율 (%)의 플롯이다. "Thio"는 시스테인-조작된 항체를 나타내는 한편, "hu"는 인간화 항체를 나타낸다.
도 35는 시스테인 조작된 항-cynoCD79b (TAHO40) 항체 (Thio-항-cynoCD79b (TAHO40) (ch10D10)-HC-A118C)의 (A) 경쇄 서열 (서열 62) 및 (B) 중쇄 서열 (서열 61)을 도시한 것이고, 여기서 중쇄의 EU 위치 118의 알라닌 (순차적인 위치 알라닌 118; 카바트 위치 114)이 시스테인으로 변경되었다. 중쇄의 EU 위치 6의 아미노산 D (도면의 음영)는 별법으로 E일 수 있다. 약물 모이어티는 중쇄 내의 조작된 시스테인기에 부착될 수 있다. 각각의 도면에서, 변경된 아미노산은 굵은 글씨체로 이중 밑줄로 나타낸다. 단일 밑줄은 불변 영역을 나타낸다. 가변 영역은 밑줄로 표시하지 않은 영역이다. Fc 영역은 이탤릭체로 표시한다. "Thio"는 시스테인-조작된 항체를 나타낸다.
도 36은 시스테인 조작된 항-cynoCD79b (TAHO40) 항체 (Thio-항-cynoCD79b (TAHO40) (ch10D10)-LC-V205C)의 (A) 경쇄 서열 (서열 96) 및 (B) 중쇄 서열 (서열 95)을 도시한 것이고, 여기서 경쇄의 카바트 위치 205의 발린 (순차적인 위치 발린 208)이 시스테인으로 변경되었다. 중쇄의 EU 위치 6의 아미노산 D (도면의 음영)는 별법으로 E일 수 있다. 약물 모이어티는 중쇄 내의 조작된 시스테인기에 부착될 수 있다. 각각의 도면에서, 변경된 아미노산은 굵은 글씨체로 이중 밑줄로 나타낸다. 단일 밑줄은 불변 영역을 나타낸다. 가변 영역은 밑줄로 표시하지 않은 영역이다. Fc 영역은 이탤릭체로 표시한다. "Thio"는 시스테인-조작된 항체를 나타낸다.
도 37은 인간 B 세포 종양을 보유하는 SCID 마우스에게 상이한 링커 약물 모이어티 (BMPEO-DM1, MC-MMAF 또는 MCvcPAB-MMAE)에 접합된 항-cynoCD79b (TAHO40) TDC를 투여하면 종양 성장을 유의하게 억제하였음을 보여주는, BJAB-cynoCD79b (cynoCD79b (TAHO40)를 발현하는 BJAB 세포) (버킷 (Burkitt) 림프종) 이종이식편 모델에서 생체내 종양 성장 억제의 그래프이다. 항-cynoCD79b (TAHO40) (ch10D10)-HC(A118C)-BMPEO-DM1 (약물 로드는 약 1.8임 (표 22)), thio 항-cynoCD79b (TAHO40) (ch10D10)-HC(A118C)-MC-MMAF (약물 로드는 약 1.9임 (표 22)), 또는 thio 항-cynoCD79b (TAHO40) (ch10D10)-HC(A118C)-MCvcPAB-MMAE (약물 로드는 약 1.86임 (표 22))로 처리한 이종이식편 모델은 연구 동안 종양 성장의 유의한 억제를 보였다. 대조군은 항-HER2 대조군 (thio hu-항-HER2-HC(A118C)-BMPEO-DM1, thio hu-항-HER2-HC(A118C)-MCvcPAB-MMAE, thio hu-항-HER2-HC(A118C)-MC-MMAF)를 포함하였다. "Thio"는 시스테인-조작된 항체를 나타내는 한편, "hu"는 인간화 항체를 나타낸다.
도 38은 인간 B 세포 종양을 보유하는 SCID 마우스에게 상이한 양으로 투여되는 BMPEO-DM1 링커 약물 모이어티와 함께 항-cynoCD79b (TAHO40) TDC를 투여하면 종양 성장을 유의하게 억제하였음을 보여주는, BJAB-cynoCD79b (cynoCD79b (TAHO40)를 발현하는 BJAB-세포) (버킷 림프종) 이종이식편 모델에서 생체내 종양 성장 억제의 그래프이다. thio 항-cynoCD79b (TAHO40) (ch10D10)-HC(A118C)-BMPEO-DM1 (약물 로드는 약 1.8임 (표 23))로 처리한 이종이식편 모델은 연구 동안 종양 성장의 유의한 억제를 보였다. 대조군은 항-HER2 대조군 (thio hu-항-HER2-HC(A118C)-BMPEO-DM1) 및 항-cynoCD79b (TAHO40) (ch10D10) 대조군 (thio 항-cynoCD79b (TAHO40) (ch10D10)-HC(A118C))를 포함하였다. "Thio"는 시스테인-조작된 항체를 나타내는 한편, "hu"는 인간화 항체를 나타낸다.
I. 정의
본원에서 사용되고 수치 지정이 바로 뒤에 위치하는 용어 "TAHO 폴리펩티드" 및 "TAHO"는 다양한 폴리펩티드를 의미하고, 여기서 완전한 명칭 (즉, TAHO/숫자)은 본원에서 설명되는 특정 폴리펩티드 서열을 의미한다. 용어 "숫자"가 본원에서 사용되는 실제 수치 지정으로서 제시되는 용어 "TAHO/숫자 폴리펩티드" 및 "TAHO/숫자"는 천연 서열 폴리펩티드, 폴리펩티드 변이체 및 천연 서열 폴리펩티드 및 폴리펩티드 변이체의 단편 (본원에서 추가로 설명됨)을 포함한다. 본원에서 설명되는 TAHO 폴리펩티드는 다양한 공급원, 예를 들어 인간 조직 종류 또는 다른 공급원으로부터 단리되거나, 또는 재조합 또는 합성 방법에 의해 제조될 수 있다. 용어 "TAHO 폴리펩티드"는 본원에 개시되는 각각의 개별적인 TAHO/숫자 폴리펩티드를 의미한다. "TAHO 폴리펩티드"를 언급하는 본 명세서 내의 모든 개시문은 각각의 폴리펩티드를 개별적으로 및 공동으로 나타내는 것이다. 예를 들어, 항체의 제조, 정제, 유도, 형성, TAHO 결합 올리고펩티드의 형성, TAHO 결합 유기 분자의 형성, 조성물 투여, 질병 치료 등에 대한 설명은 본 발명의 각각의 폴리펩티드에 개별적으로 관련된다.
"TAHO4"는 본원에서 "인간 CD79a"로도 언급된다. "TAHO5"는 본원에서 "인간 CD79b"로도 언급된다. "TAHO39"는 본원에서 "cyno CD79a" 또는 "사이노몰거스 CD79a"로도 언급된다. "TAHO40"은 본원에서 "cyno CD79b" 또는 "사이노몰거스 CD79b"로도 언급된다. "사이노몰거스"는 또한 본원에서 "cyno"로도 언급된다.
본원에서 사용되는 용어 "CD79b"는 달리 지시하지 않으면 임의의 척추동물 공급원, 예를 들어 포유동물, 예를 들어 영장류 (예를 들어 인간, 사이노몰거스 원숭이 (cyno)) 및 설치류 (예를 들어, 마우스 및 래트)로부터의 임의의 천연 CD79b를 의미한다. 인간 CD79b는 또한 본원에서 "PRO36249" (서열 2) 또는 "TAHO5"로도 언급되고, 본원에서 "DNA225786"으로도 언급되는 뉴클레오티드 서열 (서열 1)에 의해 코딩된다. 사이노몰거스 CD79b는 또한 본원에서 "cyno CD79b" 또는 "PRO283627" (서열 239) 또는 "TAHO40"으로도 언급되고, 본원에서 "DNA548455"로도 언급되는 뉴클레오티드 서열 (서열 238)에 의해 코딩된다. 용어 "CD79b"는 "전장" 비처리 CD79b 및 세포 내에서의 처리에 의해 생성되는 임의의 형태의 CD79b를 포함한다. 또한, 이 용어는 CD79b의 자연 발생 변이체, 예를 들어, 스플라이스 변이체, 대립유전자 변이체 및 이소형을 포함한다. 본원에서 설명되는 CD79b 폴리펩티드는 다양한 공급원, 예를 들어 인간 조직 종류 또는 다른 공급원으로부터 단리되거나, 또는 재조합 또는 합성 방법에 의해 제조될 수 있다. "천연 서열 TAHO 폴리펩티드"는 자연에서 유래하는 대응하는 TAHO 폴리펩티드와 동일한 아미노산 서열을 갖는 폴리펩티드를 포함한다. 상기 천연 서열 TAHO 폴리펩티드는 자연에서 단리될 수 있거나 또는 재조합 또는 합성 수단에 의해 제조될 수 있다. 용어 "천연 서열 TAHO 폴리펩티드"는 구체적으로 특정 TAHO 폴리펩티드의 자연 발생 말단 절단된 (truncated) 또는 분비된 형태 (예를 들어, 세포외 도메인 서열), 폴리펩티드의 자연 발생 변이체 형태 (예를 들어, 선택적으로 스플라이싱된 형태) 및 자연 발생 대립유전자 변이체를 포함한다. 본 발명의 특정 실시태양에서, 본원에 개시된 천연 서열 TAHO 폴리펩티드는 첨부 도면에 제시된 전장 아미노산 서열을 포함하는 성숙 또는 전장 천연 서열 폴리펩티드이다. 출발 및 정지 코돈 (표시된 경우)은 도면에 굵은 폰트로 밑줄로 표시된다. 첨부 도면에서 "N"으로 표시된 핵산 잔기는 임의의 핵산 잔기이다. 그러나, 첨부 도면에 개시된 TAHO 폴리펩티드는 도면에 아미노산 위치 1로서 본원에서 지정된 메티오닌 잔기로 시작하지만, 도면에서 아미노산 위치 1의 상류 또는 하류에 위치한 다른 메티오닌 잔기를 TAHO 폴리펩티드에 대한 출발 아미노산 잔기로서 사용할 수 있음이 생각될 수 있고, 또한 가능하다.
본원에서 "B-세포 표면 마커" 또는 "B-세포 표면 항원"은 그에 대해 결합하는 길항제, 예를 들어 자연 발생 B-세포 항원에 대한 리간드의 결합을 길항할 수 있는, B-세포 표면 항원 또는 가용성 형태의 B-세포 표면 항원에 대한 항체 (이로 제한되지 않음)로 표적화될 수 있는, B 세포의 표면 상에 발현되는 항원이다. 예시적인 B-세포 표면 마커는 CD10, CD19, CD20, CD21, CD22, CD23, CD24, CD37, CD40, CD53, CD72, CD73, CD74, CDw75, CDw76, CD77, CDw78, CD79a, CD79b, CD80, CD81, CD82, CD83, CDw84, CD85 및 CD86 백혈구 표면 마커를 포함한다 (이에 대한 설명은 문헌 [The Leukocyte Antigen Facts Book, 2nd Edition. 1997, ed. Barclay et al. Academic Press, Harcourt Brace & Co., New York]을 참고). 다른 B-세포 표면 마커는 RP105, FcRH2, B-세포 CR2, CCR6, P2X5, HLA-DOB, CXCR5, FCER2, BR3, BAFF, BLyS, Btig, NAG14, SLGC16270, FcRH1, IRTA2, ATWD578, FcRH3, IRTA1, FcRH6, BCMA, 및 239287을 포함한다. 특히 목적하는 B-세포 표면 마커는 포유동물의 다른 비-B-세포 조직에 비해 B 세포 상에 우선적으로 발현되고, 전구체 B 세포와 성숙 B 세포 모두 상에 발현될 수 있다.
TAHO 폴리펩티드 "세포외 도메인" 또는 "ECD"는 본질적으로 막횡단 및 세포질 도메인이 존재하지 않는 TAHO 폴리펩티드의 형태를 의미한다. 통상적으로, TAHO 폴리펩티드 ECD는 1% 미만의 상기 막횡단 및/또는 세포질 도메인을 가질 것이고, 바람직하게는 0.5% 미만의 상기 도메인을 가질 것이다. 본 발명의 TAHO 폴리펩티드에 대해 확인된 임의의 막횡단 도메인은 소수성 도메인의 종류를 확인하기 위해 당업계에서 통상적으로 사용되는 기준에 따라 확인됨이 이해될 것이다. 막횡단 도메인의 정확한 경계는 상이할 수 있지만, 본원에서 초기에 확인된 도메인의 어느 한 말단 상의 약 5개 이하의 아미노산이 상이할 가능성이 가장 크다. 따라서, 임의로 TAHO 폴리펩티드의 세포외 도메인은 실시예 또는 명세서에서 확인된 막횡단 도메인/세포외 도메인 경계의 어느 한 측면에 약 5개 이하의 아미노산을 함유할 수 있고, 관련 신호 펩티드가 존재하거나 존재하지 않는 상기 폴리펩티드 및 이들을 코딩하는 핵산이 본 발명에서 고려된다.
본원에 개시된 다양한 TAHO 폴리펩티드의 "신호 펩티드"의 대략적인 위치가 본 명세서 및/또는 첨부 도면에 제시될 수 있다. 그러나, 신호 펩티드의 C-말단 경계는 상이할 수 있지만, 본원에서 초기에 확인된 신호 펩티드 C-말단 경계의 어느 한 측면 상의 약 5개 이하의 아미노산이 상이할 가능성이 가장 크고, 여기서 신호 펩티드의 C-말단 경계는 아미노산 서열 요소의 종류를 확인하기 위해 당업계에서 통상적으로 사용되는 기준에 따라 확인될 수 있음이 이해될 것이다 (예를 들어, 문헌 [Nielsen et al., Prot. Eng. 10:1-6 (1997)] 및 [von Heinje et al., Nucl. Acids. Res. 14:4683-4690 (1986)]). 또한, 일부 경우에, 분비된 폴리펩티드로부터 신호 서열의 절단이 완전히 균일하지는 않고, 따라서 2 이상의 분비된 종류가 생성됨이 이해된다. 신호 펩티드가 본원에서 확인된 신호 펩티드의 C-말단 경계의 어느 한 측면 상의 약 5개 이하의 아미노산 내에서 절단된 상기 성숙 폴리펩티드 및 이를 코딩하는 폴리뉴클레오티드가 본 발명에서 고려된다.
"TAHO 폴리펩티드 변이체"는 본원에 개시된 전장 천연 서열 TAHO 폴리펩티드 서열, 본원에 개시된 신호 펩티드가 결여된 TAHO 폴리펩티드 서열, 본원에 개시된 신호 펩티드가 존재하거나 존재하지 않는 TAHO 폴리펩티드의 세포외 도메인 또는 본원에 개시된 전장 TAHO 폴리펩티드 서열의 임의의 다른 단편 (예를 들어, 전장 TAHO 폴리펩티드의 완전한 코딩 서열의 일부만을 나타내는 핵산에 의해 코딩되는 것)과 적어도 약 80%의 아미노산 서열 동일성을 갖는, 본원에 정의된 바와 같은 TAHO 폴리펩티드, 바람직하게는 활성 TAHO 폴리펩티드를 의미한다. 상기 TAHO 폴리펩티드 변이체는 예를 들어 하나 이상의 아미노산 잔기가 전장 천연 아미노산 서열의 N- 또는 C-말단에서 부가 또는 결실된 TAHO 폴리펩티드를 포함한다. 통상적으로, TAHO 폴리펩티드 변이체는 본원에 개시된 전장 천연 서열 TAHO 폴리펩티드 서열, 본원에 개시된 신호 펩티드가 결여된 TAHO 폴리펩티드 서열, 본원에 개시된 신호 펩티드가 존재하거나 존재하지 않는 TAHO 폴리펩티드의 세포외 도메인 또는 본원에 개시된 전장 TAHO 폴리펩티드 서열의 임의의 다른 구체적으로 규정된 단편과 적어도 약 80%의 아미노산 서열 동일성, 별법으로 적어도 약 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99%의 아미노산 서열 동일성을 가질 것이다. 통상적으로, TAHO 변이체 폴리펩티드의 길이는 적어도 약 10개 아미노산, 별법으로 적어도 약 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600개 이상의 아미노산이다. 임의로, TAHO 변이체 폴리펩티드는 천연 TAHO 폴리펩티드 서열에 비해 1개 이하의 보존적 아미노산 치환, 별법으로 천연 TAHO 폴리펩티드 서열에 비해 2, 3, 4, 5, 6, 7, 8, 9, 또는 10개 이하의 보존적 아미노산 치환을 가질 것이다.
본원에서 확인된 TAHO 폴리펩티드 서열에 대한 "아미노산 서열 동일성 비율 (%)"은 서열을 정렬시키고 필요한 경우 최대 서열 동일성 비율을 달성하도록 갭 (gap)을 도입시킨 후, 특이적인 TAHO 폴리펩티드 서열 내의 아미노산 잔기와 동일한 후보 서열 내의 아미노산 잔기의 백분율로서 정의되고, 임의의 보존적 치환은 서열 동일성의 일부로 간주하지 않는다. 아미노산 서열 동일성 비율을 결정하기 위한 정렬은 당업계의 기술 범위에 포함되는 다양한 방법, 예를 들어 공개적으로 입수가능한 컴퓨터 소프트웨어, 예를 들어 BLAST, BLAST-2, ALIGN, 또는 Megalign (DNASTAR) 소프트웨어를 사용하여 달성할 수 있다. 당업자는 비교되는 전장 서열에 걸친 최대 정렬의 달성에 필요한 임의의 알고리즘을 포함하는, 정렬을 측정하기 위한 적절한 파라미터를 결정할 수 있다. 그러나, 본원의 목적을 위해, 아미노산 서열 동일성 값 %는 서열 비교 컴퓨터 프로그램 ALIGN-2를 사용하여 생성되고, ALIGN-2 프로그램의 완전한 소스 코드 (source code)는 하기 표 1에 제시된다. ALIGN-2 서열 비교 컴퓨터 프로그램은 제넨테크, 인크. 소유로서, 하기 표 1에 제시된 소스 코드는 미국 저작국 (U.S. Copyright Office, 미국 워싱턴 디. 씨. 20559)에 사용자 제출서류로 출원되어 미국 저작권 등록 번호 TXU510087 하에 등록되었다. ALIGN-2 프로그램은 제넨테크, 인크.로부터 공개적으로 입수가능하거나, 하기 표 1에 제시된 소스 코드로부터 컴파일링될 수 있다. ALIGN-2 프로그램은 UNIX 운영 체제, 바람직하게는 디지탈 UNIX V4.0D에서 사용하기 위해 컴파일링되어야 한다. 모든 서열 비교 파라미터는 ALIGN-2 프로그램에 의해 설정되고, 변하지 않는다.
아미노산 서열 비교를 위해 ALIGN-2가 사용되는 상황에서, 제시된 아미노산 서열 A의 제시된 아미노산 서열 B에 대한 아미노산 서열 동일성 % (별법으로 제시된 아미노산 서열 B에 대해 특정 아미노산 서열 동일성 %를 갖거나 포함하는 제시된 아미노산 서열 A로 표현될 수 있음)는 다음과 같이 계산된다:
100 x X/Y
상기 식에서, X는 서열 정렬 프로그램 ALIGN-2에 의한 A 및 B의 정렬시에 상기 프로그램에 의해 동일한 것으로 평가된 아미노산 잔기의 수이고, Y는 B의 아미노산 잔기의 총수이다. 아미노산 서열 A의 길이가 아미노산 서열 B의 길이와 동일하지 않을 경우, B에 대한 A의 아미노산 서열 동일성 %는 A에 대한 B의 아미노산 서열 동일성 %와 동일하지 않을 것임이 이해될 것이다. 상기 방법을 사용한 아미노산 서열 동일성 % 계산의 예로서, 하기 표 2 및 3은 "비교 단백질"로 지정된 아미노산 서열의 "TAHO"로 지정된 아미노산 서열에 대한 아미노산 서열 동일성 %를 계산하는 방법을 제시하고, 여기서 "TAHO"는 목적하는 가설 TAHO 폴리펩티드의 아미노산 서열을 나타내고, "비교 단백질"은 목적하는 "TAHO" 폴리펩티드가 그에 대해 비교되는 폴리펩티드의 아미노산 서열을 나타내고, "X", "Y" 및 "Z"는 각각 상이한 가설 아미노산 잔기를 나타낸다. 구체적으로 달리 진술하지 않으면, 본원에서 사용되는 모든 아미노산 서열 동일성 값 %는 ALIGN-2 컴퓨터 프로그램을 사용하여 바로 직전의 문단에서 설명된 바와 같이 얻는다.
"TAHO 변이체 폴리뉴클레오티드" 또는 "TAHO 변이체 핵산 서열"은 본원에서 정의된 바와 같은 TAHO 폴리펩티드, 바람직하게는 활성 TAHO 폴리펩티드를 코딩하고, 본원에 개시된 전장 천연 서열 TAHO 폴리펩티드 서열, 본원에 개시된 신호 펩티드가 결여된 전장 천연 서열 TAHO 폴리펩티드 서열, 본원에 개시된 신호 펩티드가 존재하거나 존재하지 않는 TAHO 폴리펩티드의 세포외 도메인 또는 본원에 개시된 전장 TAHO 폴리펩티드 서열의 임의의 다른 단편 (예를 들어, 전장 TAHO 폴리펩티드의 완전한 코딩 서열의 일부만을 나타내는 핵산에 의해 코딩되는 것)을 코딩하는 뉴클레오티드 서열과 적어도 약 80%의 핵산 서열 동일성을 갖는 핵산 분자를 의미한다. 통상적으로, TAHO 변이체 폴리뉴클레오티드는 본원에 개시된 전장 천연 서열 TAHO 폴리펩티드 서열, 본원에 개시된 신호 펩티드가 결여된 전장 천연 서열 TAHO 폴리펩티드 서열, 본원에 개시된 신호 서열이 존재하거나 존재하지 않는 TAHO 폴리펩티드의 세포외 도메인 또는 본원에 개시된 전장 TAHO 폴리펩티드 서열의 임의의 다른 단편을 코딩하는 핵산 서열과 적어도 약 80%의 핵산 서열 동일성, 별법으로 적어도 약 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99%의 핵산 서열 동일성을 가질 것이다. 변이체는 천연 뉴클레오티드 서열을 포함하지 않는다.
통상적으로, TAHO 변이체 폴리뉴클레오티드의 길이는 적어도 약 5개 뉴클레오티드, 별법으로 적어도 약 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790, 800, 810, 820, 830, 840, 850, 860, 870, 880, 890, 900, 910, 920, 930, 940, 950, 960, 970, 980, 990, 또는 1000개 뉴클레오티드이고, 상기 맥락에서 용어 "약"은 언급된 뉴클레오티드 서열 길이 ± 언급된 길이의 10%를 의미한다.
본원에서 확인된 TAHO 코딩 핵산 서열에 대한 "핵산 서열 동일성 비율 (%)"은 서열을 정렬시키고 필요한 경우 최대 서열 동일성 비율을 달성하도록 갭을 도입시킨 후, TAHO 핵산 서열 내의 뉴클레오티드와 동일한 후보 서열 내의 뉴클레오티드의 백분율로서 정의된다. 핵산 서열 동일성 비율을 결정하기 위한 정렬은 당업계의 기술 범위에 포함되는 다양한 방법, 예를 들어 공개적으로 입수가능한 컴퓨터 소프트웨어, 예를 들어 BLAST, BLAST-2, ALIGN, 또는 Megalign (DNASTAR) 소프트웨어를 사용하여 달성할 수 있다. 그러나, 본원의 목적을 위해, 핵산 서열 동일성 값 %는 서열 비교 컴퓨터 프로그램 ALIGN-2를 사용하여 생성되고, ALIGN-2 프로그램의 완전한 소스 코드는 하기 표 1에 제시된다. ALIGN-2 서열 비교 컴퓨터 프로그램은 제넨테크, 인크. 소유로서, 하기 표 1에 제시된 소스 코드는 미국 저작국에 사용자 제출서류로 출원되어 미국 저작권 등록 번호 TXU510087 하에 등록되었다. ALIGN-2 프로그램은 제넨테크, 인크.로부터 공개적으로 입수가능하거나, 하기 표 1에 제시된 소스 코드로부터 컴파일링될 수 있다. ALIGN-2 프로그램은 UNIX 운영 체제, 바람직하게는 디지탈 UNIX V4.0D에서 사용하기 위해 컴파일링되어야 한다. 모든 서열 비교 파라미터는 ALIGN-2 프로그램에 의해 설정되고, 변하지 않는다.
핵산 서열 비교를 위해 ALIGN-2가 사용되는 상황에서, 제시된 핵산 서열 C의 제시된 핵산 서열 D에 대한 핵산 서열 동일성 % (별법으로 제시된 핵산 서열 D에 대해 특정 핵산 서열 동일성 %를 갖거나 포함하는 제시된 핵산 서열 C로 표현될 수 있음)는 다음과 같이 계산된다:
100 x W/Z
상기 식에서, W는 서열 정렬 프로그램 ALIGN-2에 의한 C 및 D의 정렬시에 상기 프로그램에 의해 동일한 것으로 평가된 뉴클레오티드의 수이고, Z는 D의 뉴클레오티드의 총수이다. 핵산 서열 C의 길이가 핵산 서열 D의 길이와 동일하지 않을 경우, D에 대한 C의 핵산 서열 동일성 %는 C에 대한 D의 핵산 서열 동일성 %와 동일하지 않을 것임이 이해될 것이다. 핵산 서열 동일성 % 계산의 예로서, 하기 표 4 및 5는 "비교 DNA"로 지정된 핵산 서열의 "TAHO-DNA"로 지정된 핵산 서열에 대한 핵산 서열 동일성 %를 계산하는 방법을 제시하고, 여기서 "TAHO-DNA"는 목적하는 가설 TAHO 코딩 핵산 서열을 나타내고, "비교 DNA"는 목적하는 "TAHO-DNA" 핵산 분자가 그에 대해 비교되는 핵산 분자의 뉴클레오티드 서열을 나타내고, "N", "L" 및 "V"는 각각 상이한 가설 뉴클레오티드를 나타낸다. 구체적으로 달리 나타내지 않으면, 본원에 사용된 모든 핵산 서열 동일성 값 %는 ALIGN-2 컴퓨터 프로그램을 사용하여 바로 앞 문단에서 설명된 바와 같이 얻는다.
다른 실시태양에서, TAHO 변이체 폴리뉴클레오티드는 TAHO 폴리펩티드를 코딩하고, 바람직하게는 엄격한 혼성화 및 세척 조건 하에 본원에 개시된 전장 TAHO 폴리펩티드를 코딩하는 뉴클레오티드 서열에 혼성화할 수 있는 핵산 분자이다. TAHO 변이체 폴리펩티드는 TAHO 변이체 폴리뉴클레오티드에 의해 코딩되는 것일 수 있다.
TAHO 폴리펩티드를 코딩하는 핵산에 대해 사용될 때, 용어 "전장 코딩 영역"은 본 발명의 전장 TAHO 폴리펩티드를 코딩하는 뉴클레오티드의 서열을 의미한다 (첨부 도면에 종종 출발 코돈과 정지 코돈 사이의 서열로 제시됨). ATCC에 기탁된 핵산에 대해 사용될 때, 용어 "전장 코딩 영역"은 ATCC에 기탁된 벡터 내에 삽입된 cDNA의 TAHO 폴리펩티드-코딩 부분을 의미한다 (첨부 도면에 종종 출발 코돈과 정지 코돈 사이의 서열로 제시됨 (출발 및 정지 코돈은 도면에서 굵은 글씨체로 밑줄로 나타낸다)).
본원에 개시된 다양한 TAHO 폴리펩티드를 설명하기 위해 사용될 때, "단리된"은 그의 자연 환경의 성분으로부터 확인 및 분리 및/또는 회수된 폴리펩티드를 의미한다. 그의 자연 환경의 오염 성분은 일반적으로 폴리펩티드의 치료 용도를 방해하는 물질이고, 효소, 호르몬 및 다른 단백질성 또는 비단백질성 용질을 포함할 수 있다. 바람직한 실시태양에서, 폴리펩티드는 (1) 스피닝 컵 서열분석기 (spinning cup sequenator)를 사용하여 N-말단 또는 내부 아미노산 서열의 적어도 15개의 잔기를 얻기에 충분한 수준까지 또는 (2) 쿠마시 블루 (Coomassie Blue) 또는 바람직하게는 은 염색을 사용하여 비-환원 또는 환원 조건 하에 SDS-PAGE에 의해 균질할 때까지 정제될 것이다. 단리된 폴리펩티드는 TAHO 폴리펩티드의 자연 환경의 적어도 한 성분도 존재하지 않을 것이기 때문에 재조합 세포 내의 계내 폴리펩티드를 포함한다. 그러나, 통상적으로 단리된 폴리펩티드는 적어도 하나의 정제 단계에 의해 제조될 것이다.
"단리된" TAHO 폴리펩티드-코딩 핵산 또는 다른 폴리펩티드-코딩 핵산은 폴리펩티드-코딩 핵산의 천연 공급원에서 그와 통상적으로 회합되는 적어도 하나의 오염 핵산 분자로부터 분리된 핵산 분자이다. 단리된 폴리펩티드-코딩 핵산 분자는 자연에서 발견되는 형태 또는 환경과 다른 것이다. 따라서, 단리된 폴리펩티드-코딩 핵산 분자는 자연 세포에 존재하는 특정 폴리펩티드-코딩 핵산 분자와 구별된다. 그러나, 단리된 폴리펩티드-코딩 핵산 분자는, 예를 들어 핵산 분자가 천연 세포의 염색체 위치와 상이한 염색체 위치에 존재하는, 폴리펩티드를 통상적으로 발현하는 세포 내에 함유된 폴리펩티드-코딩 핵산 분자를 포함한다.
용어 "제어 서열"은 특정 숙주 유기체 내에서 작동가능하게 연결된 코딩 서열의 발현에 필요한 DNA 서열을 의미한다. 예를 들어, 원핵생물에 적합한 제어 서열은 프로모터, 임의로 오퍼레이터 서열 및 리보좀 결합 부위를 포함한다. 진핵 세포는 프로모터, 폴리아데닐화 신호 및 인핸서 (enhancer)를 이용하는 것으로 알려져 있다.
핵산은 다른 핵산 서열과 기능적 관계에 있을 때 "작동가능하게 연결된" 것이다. 예를 들어, 예비 서열 또는 분비 리더용 DNA는 폴리펩티드의 분비에 참여하는 예비 단백질로서 발현될 경우 폴리펩티드용 DNA에 작동가능하게 연결되고, 프로모터 또는 인핸서는 서열의 전사에 영향을 줄 경우 코딩 서열에 작동가능하게 연결되고, 리보좀 결합 부위는 번역을 촉진하도록 위치할 경우 코딩 서열에 작동가능하게 연결된 것이다. 일반적으로, "작동가능하게 연결된"은 연결되는 DNA 서열이 인접함을 의미하고, 분비 리더의 경우 인접하고 리딩 페이스 (reading phase)로 존재한다. 그러나, 인핸서는 인접할 필요는 없다. 연결은 편리한 제한 부위에서 라이게이션에 의해 달성된다. 상기 부위가 존재하지 않을 경우, 합성 올리고뉴클레오티드 어댑터 (adaptor) 또는 링커가 통상의 용례에 따라 사용된다.
혼성화 반응의 "엄격성"은 당업자에 의해 쉽게 결정될 수 있고, 일반적으로 프로브 길이, 세척 온도 및 염 농도에 따라 실험적으로 계산된다. 일반적으로, 프로브가 길수록 적절한 어닐링을 위해 더 높은 온도가 필요하고, 프로브가 짧으면 보다 낮은 온도가 필요하다. 혼성화는 일반적으로 상보성 가닥이 그의 융점 미만의 환경에 존재할 때 변성 DNA가 재어닐링되는 능력에 따라 결정된다. 프로브와 혼성화 서열 사이의 요구되는 상동성 정도가 클수록 사용될 수 있는 상대적 온도가 더 높다. 그 결과, 보다 높은 상대 온도는 반응 조건을 보다 엄격하게 만들고, 보다 낮은 온도는 덜 엄격하게 만드는 경향이 있다. 혼성화 반응의 엄격성에 대한 추가의 상세한 내용 및 설명에 대해서는 문헌 [Ausubel et al.. Current Protocols in Molecular Biology, Wiley Interscience Publishers, (1995)]을 참조한다.
본원에서 규정되는 바와 같은 "엄격한 조건" 또는 "고엄격성 조건"은 (1) 세척을 위해 낮은 이온 강도 및 높은 온도, 예를 들어 50℃의 0.015 M 염화나트륨/0.0015 M 시트르산나트륨/0.1% 소듐 도데실 술페이트의 사용; (2) 혼성화 동안 변성제, 예를 들어 포름아미드, 예를 들어 50% (v/v) 포름아미드 + 0.1% 소 혈청 알부민/0.1% Ficoll/0.1% 폴리비닐피롤리돈/50 mM 인산나트륨 버퍼 (pH 6.5) + 750 mM 염화나트륨, 75 mM 시트르산나트륨 (42℃)의 사용; 또는 (3) 42℃의 0.2 x SSC (염화나트륨/시트르산나트륨)를 사용한 10분 세척, 이어서 55℃의 EDTA 함유 0.1 x SSC로 구성된 10분 동안의 고엄격성 세척과 함께, 42℃에서 50% 포름아미드, 5 x SSC (0.75 M NaCl, 0.075 M/시트르산나트륨), 50 mM 인산나트륨 (pH 6.8), 0.1% 피로인산나트륨, 5 x 덴하르트 (Denhardt) 용액, 초음파 처리된 연어 정자 DNA (50 ㎍/ml), 0.1% SDS, 및 10% 덱스트란 술페이트를 사용한 철야 혼성화에 의해 확인될 수 있다.
"중등 엄격성 조건"은 문헌 [Sambrook et al., Molecular Cloning: A Laboratory Manual, New York: Cold Spring Harbor Press, 1989]에 기재된 바와 같이 확인할 수 있고, 상기한 것보다 엄격성이 낮은 세척 용액 및 혼성화 조건 (예를 들어, 온도, 이온 강도 및 %SDS)의 사용을 포함한다. 중등 엄격성 조건의 예는 20% 포름아미드, 5 x SSC (150 mM NaCl, 15 mM 시트르산삼나트륨), 50 mM 인산나트륨 (pH 7.6), 5 x 덴하르트 용액, 10% 덱스트란 술페이트, 및 20 mg/ml 변성 전단 처리 연어 정자 DNA를 포함하는 용액 중에서 37℃에서의 철야 인큐베이션, 이어서 약 37-50℃의 1 x SSC를 사용한 필터의 세척을 포함한다. 당업자는 프로브 길이 등과 같은 인자를 조정하기 위해 필요한 온도, 이온 강도 등의 조정 방법을 알 것이다.
본원에서 사용되는 용어 "에피토프 태깅된 (tagged)"은 "태그 폴리펩티드"에 융합된 TAHO 폴리펩티드 또는 항-TAHO 항체를 포함하는 키메라 폴리펩티드를 의미한다. 태그 폴리펩티드는 항체가 작용할 수 있는 에피토프를 제공하도록 충분한 잔기를 갖지만, 그가 융합되는 폴리펩티드의 활성을 방해하지 않을 정도로 충분히 짧다. 또한, 태그 폴리펩티드는 바람직하게는 상기 항체가 다른 에피토프에는 실질적으로 교차반응하지 않도록 매우 특이적이다. 적합한 태그 폴리펩티드는 일반적으로 적어도 6개의 아미노산 잔기, 보통 약 8 내지 약 50개의 아미노산 잔기 (바람직하게는, 약 10 내지 약 20개의 잔기)를 갖는다.
본 발명의 목적을 위해 "활성의" 또는 "활성"은 천연 또는 자연 발생 TAHO의 생물학적 및/또는 면역학적 활성을 보유하는 TAHO 폴리펩티드의 형태(들)를 의미하고, "생물학적" 활성은 천연 또는 자연 발생 TAHO가 갖는 항원 에피토프에 대해 작용하는 항체의 생산을 유도하는 능력 이외의 다른, 천연 또는 자연 발생 TAHO에 의해 유발되는 생물학적 기능 (억제성 또는 자극성)을 의미하고, "면역학적" 활성은 천연 또는 자연 발생 TAHO가 갖는 항원 에피토프에 대해 작용하는 항체의 생산을 유도하는 능력을 의미한다.
용어 "길항제"는 가장 넓은 의미로 사용되고, 본원에 개시된 천연 TAHO 폴리펩티드의 생물학적 활성을 부분적으로 또는 완전히 차단, 억제 또는 중화하는 임의의 분자를 포함한다. 유사한 방식으로, 용어 "작용제"는 가장 넓은 의미로 사용되고, 본원에 개시된 천연 TAHO 폴리펩티드의 생물학적 활성을 모방하는 임의의 분자를 포함한다. 적합한 작용제 또는 길항제 분자는 구체적으로 작용제 또는 길항제 항체 또는 항체 단편, 천연 TAHO 폴리펩티드의 단편 또는 아미노산 서열 변이체, 펩티드, 안티센스 올리고뉴클레오티드, 유기 소분자 등을 포함한다. TAHO 폴리펩티드의 작용제 또는 길항제를 확인하기 위한 방법은 TAHO 폴리펩티드를 후보 작용제 또는 길항제 분자와 접촉시키고 TAHO 폴리펩티드와 통상적으로 관련되는 하나 이상의 생물학적 활성의 검출가능한 변화를 측정하는 것을 포함할 수 있다.
"정제된"은 그를 함유하는 샘플의 적어도 95 중량%, 또는 적어도 98 중량%의 농도로 분자가 샘플 내에 존재함을 의미한다.
"단리된" 핵산 분자는 예를 들어 그의 자연 환경에서 그와 통상적으로 회합되는 적어도 하나의 다른 핵산 분자로부터 분리된 핵산 분자이다. 단리된 핵산 분자는 핵산 분자를 통상적으로 발현하는 세포 내에 함유된 핵산 분자를 더 포함하지만, 핵산 분자는 염색체 외부에 존재하거나 또는 그의 천연 염색체 위치와 상이한 염색체 위치에 존재한다.
본원에서 사용될 때 용어 "벡터"는 그가 연결된 다른 핵산을 운반할 수 있는 핵산 분자를 나타내도록 의도된다. 한 종류의 벡터는 그 내부에 추가의 DNA 세그먼트가 라이게이션될 수 있는 원형 이중 가닥 DNA 루프를 의미하는 "플라스미드"이다. 다른 종류의 벡터는 파지 벡터이다. 또다른 종류의 벡터는 바이러스 벡터이고, 여기서 추가의 DNA 세그먼트가 바이러스 게놈 내로 라이게이션될 수 있다. 특정 벡터는 그가 도입되는 숙주 세포 내에서 자동 복제할 수 있다 (예를 들어, 세균 복제 기점을 갖는 세균 벡터 및 에피좀 포유동물 벡터). 다른 벡터 (예를 들어, 비-에피좀 포유동물 벡터)는 숙주 세포 내로 도입 시에 숙주 세포의 게놈 내로 통합될 수 있고, 그에 의해 숙주 게놈과 함께 복제된다. 또한, 특정 벡터는 그들이 작동가능하게 연결되는 유전자의 발현을 지시할 수 있다. 상기 벡터는 본원에서 "재조합 발현 벡터" (또는 단순히 "재조합 벡터")로서 칭한다. 일반적으로, 재조합 DNA 기술에 유용한 발현 벡터는 종종 플라스미드 형태로 존재한다. 플라스미드는 벡터의 가장 일반적으로 사용되는 형태이므로, 본 명세서에서 "플라스미드" 및 "벡터"는 상호교환가능하게 사용될 수 있다.
"치료하는" 또는 "치료" 또는 "완화"는 표적 병적 상태 또는 질환을 억제하거나 그의 진행 속도를 느리게 하는 (완화하는) 것을 목적으로 하는 치료 목적의 처치 및 예방 또는 억제 처치를 모두 의미한다. 치료가 필요한 대상은 질환이 이미 발생한 대상 및 질환이 발생하기 쉬운 대상 또는 질환이 억제되어야 하는 대상을 포함한다. 대상 또는 포유동물은 본 발명의 방법에 따라, 치료량의 항-TAHO 항체, TAHO 결합 올리고펩티드 또는 TAHO 결합 유기 분자를 투여한 후, 환자가 다음 중 하나 이상의 관찰가능한 및/또는 측정가능한 감소 또는 부재를 보일 경우에 TAHO 폴리펩티드-발현 암에 대해 성공적으로 "치료된다": 암 세포의 수 감소 또는 암 세포의 부재; 종양 크기의 감소; 암의 연조직 및 뼈 내로의 전이를 포함하여 말초 장기 내로 암 세포 침윤의 억제 (즉, 어느 정도 지연시키고 바람직하게는 정지시킴); 종양 전이의 억제 (즉, 어느 정도 지연시키고 바람직하게는 정지시킴); 종양 성장의 어느 정도의 억제 및/또는 특정 암과 연관된 하나 이상의 증상의 어느 정도의 경감; 이환률 및 사망률 감소, 및 삶의 질 개선. 항-TAHO 항체 또는 TAHO 결합 올리고펩티드가 암세포 성장을 억제하고/하거나 존재하는 암세포를 사멸시킬 정도로, 이들은 세포증식 억제성 및/또는 세포독성일 수 있다. 또한, 상기 징후 또는 증상의 감소는 환자가 지각할 수도 있다.
질병의 성공적인 치료 및 개선을 평가하기 위한 상기 파라미터는 의사에게 잘 알려진 통상적인 절차에 의해 쉽게 측정가능하다. 암 치료를 위해, 효능은 예를 들어 질병 진행시까지의 시간 (TTP)의 평가 및/또는 반응 속도 (RR)의 결정에 의해 측정할 수 있다. 전이는 병기 분류 시험 및 뼈 스캔 및 칼슘 수준 및 뼈 내로의 전이의 정도를 결정하기 위한 다른 효소에 대한 시험에 의해 결정될 수 있다. 또한, 영역 내의 골반 및 림프절로의 전이를 관찰하기 위해 CT 스캔을 수행할 수 있다. 흉부 X-선 및 공지의 방법에 의한 간 효소 수준의 측정을 사용하여 폐 및 간으로의 전이를 각각 관찰한다. 질병을 모니터링하기 위한 다른 통상적인 방법은 경직장 초음파영상 (TRUS) 및 경직장 생검침 (TRNB)을 포함한다.
보다 국소 암인 방광암에 대해, 질병의 진행을 결정하기 위한 방법은 방광경 검사에 의한 소변 세포 평가, 소변 내 혈액의 존재 모니터링, 초음파 검사 또는 정맥 신우 조영사진에 의한 요로상피의 가시화, 컴퓨터 단층촬영 (CT) 및 자기 공명 영상화 (MRI)를 포함한다. 원격 전이의 존재는 복부 CT, 흉부 x-선, 또는 골격의 방사성 핵종 영상화에 의해 평가될 수 있다.
"만성" 투여는 급성 방식과 달리 연장된 기간 동안 초기 치료 효과 (활성)를 유지하기 위해 연속적인 방식으로 물질(들)을 투여하는 것을 의미한다. "간헐적" 투여는 중단없이 연속적으로 행해지지는 않지만, 특성상 주기적인 치료이다.
"개체"는 척추동물이다. 특정 실시태양에서, 척추동물은 포유동물이다. 포유동물은 농장 동물 (예를 들어 소), 스포츠 동물, 애완동물 (예를 들어 고양이, 개 및 말), 영장류, 마우스 및 래트를 포함하고 이로 제한되지 않는다. 특정 실시태양에서, 포유동물은 인간이다.
암 증상의 완화 치료를 위한 "포유동물"은 인간, 가축 및 농장 동물, 및 동물원, 스포츠, 또는 애완 동물, 예를 들어 개, 고양이, 소, 말, 양, 돼지, 염소, 토끼 등을 포함하여 포유동물로서 분류된 임의의 동물을 의미한다. 바람직하게는, 포유동물은 인간이다.
하나 이상의 추가의 치료제와 "조합한" 투여는 동시 (병용) 및 임의의 순서로 연속 투여하는 것을 포함한다.
본원에서 사용될 때, "담체"는 사용되는 용량 및 농도에서 그에 대해 노출되는 세포 또는 포유동물에게 무독성인 제약상 허용되는 담체, 부형제, 또는 안정화제를 포함한다. 종종, 생리학상 허용되는 담체는 pH 완충된 수용액이다. 생리학상 허용되는 담체의 예는 버퍼, 예를 들어 포스페이트, 시트레이트 및 다른 유기산; 항산화제, 예를 들어 아스코르브산; 저분자량 (약 10개의 잔기 미만) 폴리펩티드; 단백질, 예를 들어 혈청 알부민, 젤라틴 또는 면역글로불린; 친수성 중합체, 예를 들어 폴리비닐피롤리돈; 아미노산, 예를 들어 글라이신, 글루타민, 아스파라긴, 아르기닌, 또는 라이신; 단당류, 이당류 및 다른 탄수화물, 예를 들어 글루코스, 만노스, 또는 덱스트린; 킬레이팅제, 예를 들어 EDTA; 당 알콜, 예를 들어 만니톨 또는 소르비톨; 염 형성 반대이온, 예를 들어 나트륨; 및/또는 비이온성 계면활성제, 예를 들어 TWEEN®, 폴리에틸렌 글리콜 (PEG) 및 PLURONICS®를 포함한다.
"고상" 또는 "고체 지지체"는 본 발명의 항체, TAHO 결합 올리고펩티드 또는 TAHO 결합 유기 분자가 점착 또는 부착될 수 있는 비-수성 매트릭스를 의미한다. 본원에 포함되는 고상의 예는 부분적으로 또는 전적으로 유리 (예를 들어, 제어된 공극 유리), 다당류 (예를 들어, 아가로스), 폴리아크릴아미드, 폴리스티렌, 폴리비닐 알콜 및 실리콘으로 형성된 것을 포함한다. 특정 실시태양에서, 문맥에 따라, 고상은 분석 플레이트의 웰을 포함할 수 있고; 다른 부분에서는 정제 컬럼 (예를 들어, 친화도 크로마토그래피 컬럼)일 수 있다. 또한, 이 용어는 미국 특허 4,275,149에 기재된 것과 같은, 별개 입자의 비연속적 고상을 포함한다.
"리포좀"은 약물 (예를 들어, TAHO 폴리펩티드, 그에 대한 항체 또는 TAHO 결합 올리고펩티드)을 포유동물에게 전달하기 위해 유용한 다양한 종류의 지질, 인지질 및/또는 계면활성제로 구성된 작은 소포이다. 리포좀의 성분은 통상적으로 생물학적 막의 지질 배열과 유사한 2층 구조로 배열된다.
"소분자" 또는 "유기 소분자"는 본원에서 분자량이 약 500 달톤 미만인 것으로 규정된다.
용어 "제약 제제"는 활성 성분의 생물학적 활성이 효과를 보이도록 하는 형태이고 제제가 투여되는 대상에게 허용되지 않은 독성을 보이는 추가의 성분을 함유하지 않는 제제를 의미한다. 상기 제제는 멸균 상태이다.
"멸균" 제제는 무균 상태이거나 또는 모든 살아있는 미생물 및 이들의 포자가 존재하지 않는다.
본원에서 개시되는 폴리펩티드, 항체, TAHO 결합 올리고펩티드, TAHO 결합 유기 분자 또는 그의 작용제 또는 길항제의 "유효량"은 구체적으로 언급된 목적을 수행하기에 충분한 양이다. "유효량"은 언급된 목적과 관련하여 통상적인 방법으로 실험에 의해 결정될 수 있다.
용어 "치료 유효량"은 대상 또는 포유동물에서 질병 또는 질환의 "치료"에 효과적인 항체, 폴리펩티드, TAHO 결합 올리고펩티드, TAHO 결합 유기 분자 또는 다른 약물의 양을 지칭한다. 암의 경우, 치료 유효량의 약물은 암 세포 수의 감소, 종양 크기의 감소, 말초 장기로의 암 세포 침윤의 억제 (즉, 어느 정도의 지연 및 바람직하게는 정지); 종양 전이의 억제 (즉, 어느 정도의 지연 및 바람직하게는 정지); 어느 정도의 종양 성장의 억제; 및/또는 암과 관련된 하나 이상의 증상의 어느 정도의 경감을 달성할 수 있다. 상기 "치료"에 대한 본원의 정의를 참고한다. 약물이 암세포 성장을 억제하고/하거나 존재하는 암세포를 사멸시킬 정도로, 상기 약물은 세포증식 억제성 및/또는 세포독성일 수 있다. "예방 유효량"은 필요한 투여량에서 필요한 기간 동안 목적하는 예방 결과를 달성하기 위해 효과적인 양을 나타낸다. 반드시는 아니지만 대개, 예방 용량은 질병의 보다 초기 단계 전에, 또는 보다 초기 단계에서 대상에서 사용되기 때문에, 예방 유효량은 치료 유효량보다 적을 것이다.
항-TAHO 항체, TAHO 폴리펩티드, TAHO 결합 올리고펩티드 또는 TAHO 결합 유기 분자의 "성장 억제량"은 세포, 특히 종양, 예를 들어, 암 세포의 성장을 시험관 내에서 또는 생체 내에서 억제할 수 있는 양이다. 신생물성 세포 성장을 억제하기 위한 항-TAHO 항체, TAHO 폴리펩티드, TAHO 결합 올리고펩티드 또는 TAHO 결합 유기 분자의 "성장 억제량"은 통상적으로 방식으로 실험적으로 결정될 수 있다.
항-TAHO 항체, TAHO 폴리펩티드, TAHO 결합 올리고펩티드 또는 TAHO 결합 유기 분자의 "세포독성량"은 세포, 특히 종양, 예를 들어, 암 세포를 시험관 내에서 또는 생체 내에서 파괴할 수 있는 양이다. 신생물성 세포 성장을 억제하기 위한 항-TAHO 항체, TAHO 폴리펩티드, TAHO 결합 올리고펩티드 또는 TAHO 결합 유기 분자의 "세포독성량"은 통상적으로 방식으로 실험적으로 결정될 수 있다.
용어 "항체"는 가장 넓은 의미에서 사용되고, 예를 들어 단일 항-TAHO 모노클로날 항체 (작용제, 길항제 및 중화 항체 포함), 다중 에피토프 특이성을 갖는 항-TAHO 항체 조성물, 폴리클로날 항체, 단쇄 항-TAHO 항체, 및 목적하는 생물학적 또는 면역학적 활성을 보이는 항-TAHO 항체의 단편 (아래 참조)을 구체적으로 포함한다. 용어 "면역글로불린" (Ig)은 본원에서 항체와 상호 교환가능하게 사용된다.
용어 "SN8"은 본원에서 상업적인 공급처, 예를 들어 바이오메다 (Biomeda, 미국 캘리포니아주 포스터 시티), 비디바이오사이언스 (BDbioscience, 미국 캘리포니아주 샌디에고) 또는 안셀 (Ancell, 미국 미네소타주 베이포트)로부터 구입한 항-인간 CD79b (TAHO5) 모노클로날 항체, 로스웰 파크 캔서 인스티튜트로부터 수득한 하이브리도마로부터 생성된 모노클로날 항체 (Okazaki et al., Blood, 81(1): 84-95 (1993)) 또는 로스웰 파크 캔서 인스티튜트로부터 수득한 하이브리도마로부터 생성된 항체 (Okazaki et al., Blood, 81(1): 84-95 (1993))를 사용하여 생성된 키메라 항체 (본원에서 "chSN8"로도 언급됨)를 지칭하기 위해 사용된다.
용어 "10D10"은 본원에서 2006년 7월 11일에 ATCC에 항-cyno CD79b (TAHO40) 10D10 (10D10.3)로서 PTA-7715로 기탁된 하이브리도마로부터 생성된 항-cyno CD79b (TAHO40) 모노클로날 항체 또는 2006년 7월 11일에 ATCC에 항-cyno CD79b (TAHO40) 10D10 (10D10.3)로서 PTA-7715로 기탁된 하이브리도마로부터 생성된 항체를 사용하여 생성된 키메라 항체 (본원에서 "ch10D10"으로도 언급됨)를 지칭하기 위해 사용된다.
항체에 대해 사용될 때 "ch"는 본원에서 구체적으로 키메라 항체를 나타내기 위해 사용된다.
"항-cynoCD79b" 또는 "항-cyno CD79b"는 본원에서 cyno CD79b (도 8의 서열 8)에 결합하는 항체 (2006년 8월 3일 출원된 미국 특허 출원 11/462,336에 기재됨)를 나타내기 위해 사용된다. "항-cynoCD79b(ch10D10)" 또는 "항-cynoCD79b (TAHO40) (ch10D10)" 또는 "ch10D10"은 cynoCD79b (도 43의 서열 239)에 결합하는 키메라 항-cynoCD79b (2006년 8월 3일 출원된 미국 특허 출원 11/462,336에 기재됨)를 나타내기 위해 본원에서 사용된다. 항-cynoCD79b(ch10D10) 또는 ch10D10은 서열 41의 경쇄 (도 21)를 포함하는 키메라 항-cynoCD79b 항체이다. 항-cynoCD79b(ch10D10) 또는 ch10D10은 서열 43의 중쇄를 더 포함한다 (도 23).
"단리된 항체"는 그의 천연 환경의 성분으로부터 확인 및 분리 및/또는 회수된 것이다. 그의 천연 환경의 오염 성분은 항체의 치료 용도를 방해하는 물질이고, 효소, 호르몬 및 다른 단백질성 또는 비단백질성 용질을 포함할 수 있다. 바람직한 실시태양에서, 항체는 (1) 로우리 (Lowry) 방법에 의해 측정시에 항체의 95 중량% 초과, 가장 바람직하게는 99 중량% 초과의 수준까지, (2) 스피닝 컵 서열분석기를 사용하여 N-말단 또는 내부 아미노산 서열의 적어도 15개의 잔기를 얻기에 충분한 수준까지 또는 (3) 쿠마시 블루 또는 바람직하게는 은 염색을 사용하여 환원 또는 비환원 조건 하에 SDS-PAGE에 의해 균질할 때까지 정제될 것이다. 단리된 항체는 항체의 자연 환경의 적어도 하나의 성분도 존재하지 않을 것이기 때문에 재조합 세포 내의 계내 항체를 포함한다. 그러나, 통상적으로 단리된 항체는 하나 이상의 정제 단계에 의해 제조될 것이다.
기본 4쇄 항체 단위는 2개의 동일한 경쇄 (L) 및 2개의 동일한 중쇄 (H)로 이루어진 이종4량체 당단백질이다 (IgM 항체는 J 사슬로 불리는 추가의 폴리펩티드와 함께 5개의 기본 이종4량체 단위로 이루어지고, 따라서 10개의 항원 결합 부위를 포함하는 한편, 분비된 IgA 항체는 중합되어, J 사슬과 함께 2-5개의 기본 4쇄 단위를 포함하는 다가 조립체를 형성할 수 있다). IgG의 경우에, 4쇄 단위는 일반적으로 약 150,000 달톤이다. 각각의 L 사슬은 하나의 공유 디술피드 결합에 의해 H 사슬에 연결되는 한편, 2개의 H 사슬은 H 사슬 이소형에 따라 하나 이상의 디술피드 결합에 의해 서로 연결된다. 각각의 H 및 L 사슬은 또한 규칙적으로 이격된 사슬내 디술피드 다리를 갖는다. 각각의 H 사슬은 N-말단에서 가변 도메인 (VH)을 갖고, 이어서 각각 α 및 γ 사슬에 대해 3개의 불변 도메인 (CH) 및 μ 및 ε 이소형에 대해 4개의 CH 도메인을 갖는다. 각각의 L 사슬은 N-말단에서 가변 도메인 (VL)을 갖고, 이어서, 그의 다른 단부에서 불변 도메인 (CL)을 갖는다. VL은 VH와 정렬되고, CL은 중쇄의 제1 불변 도메인 (CH1)과 정렬된다. 특정 아미노산 잔기는 경쇄 및 중쇄 가변 도메인 사이의 계면을 형성하는 것으로 생각된다. VH 및 VL의 페어링은 함께 단일 항원 결합 부위를 형성한다. 상이한 클래스의 항체의 구조 및 특성에 대해서는 예를 들어 문헌 [Basic and Clinical Immunology, 8th Edition, Daniel P. Stites, Abba I. Terr and Tristram G. Parlsow (eds.), Appleton & Lange, Norwalk, CT, 1994, page 71 and Chapter 6]을 참조한다.
임의의 척추동물종의 L 사슬은 그들의 불변 도메인의 아미노산 서열에 기초하여 카파 및 람다로 불리는 2개의 분명하게 구분되는 종류 중 하나로 지정될 수 있다. 그들의 중쇄 (CH)의 불변 도메인의 아미노산 서열에 따라, 면역글로불린은 상이한 클래스 또는 이소형으로 지정될 수 있다. 5가지 클래스의 면역글로불린, 즉, 각각 α, δ, ε, γ 및 μ로 지정된 중쇄를 갖는 IgA, IgD, IgE, IgG 및 IgM이 존재한다. γ 및 α 클래스는 CH 서열 및 기능에서 비교적 작은 차이에 기초하여 하위클래스로 추가로 나누어지고, 예를 들어 인간은 IgG1, IgG2, IgG3, IgG4, IgA1 및 IgA2의 하위클래스를 발현한다.
용어 "가변"은 가변 도메인의 특정 세그먼트가 항체들 사이에서 서열이 크게 상이함을 나타낸다. V 도메인은 항원 결합을 매개하고, 그의 특정 항원에 대한 특정 항체의 특이성을 규정한다. 그러나, 가변성은 가변 도메인의 110개 아미노산 범위에 걸쳐 균등하게 분포되지 않는다. 대신에, V 영역은 각각 9-12개 아미노산 길이의 "초가변 영역"으로 불리는 가변성이 매우 높은 보다 짧은 영역에 의해 분리되는 15-30개 아미노산의 프레임워크 영역 (FR)으로 불리는 비교적 가변성이 낮은 스트레치로 구성된다. 천연 중쇄 및 경쇄의 가변 도메인은, 루프 연결부를 형성하고 일부 경우에 β-시트 구조의 일부를 형성하는 3개의 초가변 영역에 의해 연결된, 주로 β-시트 입체형태를 취하는 4개의 FR 영역을 각각 포함한다. 각 사슬 내의 초가변 영역은 FR에 의해 매우 근접하게 함께 유지되고, 다른 사슬의 초가변 영역과 함께 항체의 항원 결합 부위의 형성에 기여한다 ([Kabat et al., Sequences of Immunological Interest, 5th Ed. Public Health Service, National Institute of Health, Bethesda, MD (1991)] 참조). 불변 도메인은 항원에 대한 항체의 결합에 직접 관여하지 않지만, 다양한 효과기 기능, 예를 들어 항체 의존성 세포 독성 (ADCC)에서 항체의 참여를 나타낸다.
본원에서 사용되는 용어 "초가변 영역"은 항원 결합에 필요한 항체의 아미노산 잔기를 의미한다. 초가변 영역은 일반적으로 "상보성 결정 영역" 또는 "CDR"로부터의 아미노산 잔기 (예를 들어, VL의 대략 잔기 24-34 (L1), 50-56 (L2) 및 89-97 (L3), 및 VH의 대략 1-35 (H1), 50-65 (H2) 및 95-102 (H3) (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institute of Health, Bethesda, MD (1991)) 및/또는 "초가변 루프"로부터의 잔기 (예를 들어, VL의 잔기 26-32 (L1), 50-52 (L2) 및 91-96 (L3), 및 VH의 26-32 (H1), 53-55 (H2) 및 96-101 (H3); [Chothia and Lesk J. Mol. Biol. 196: 901-917 (1987)])를 포함한다.
본원에서 사용되는 용어 "모노클로날 항체"는 실질적으로 균질한 항체 집단으로부터 수득된 항체를 의미한다. 즉, 이 집단을 구성하는 개개의 항체는 일반적으로 소량으로 존재할 수도 있는, 가능한 천연 발생 돌연변이를 제외하고는 동일하다. 모노클로날 항체는 단일 항원 부위에 대해 작용하여 특이성이 높다. 또한, 상이한 결정자 (에피토프)에 대해 작용하는 상이한 항체를 포함하는 폴리클로날 항체 제제에 대조적으로, 각각의 모노클로날 항체는 항원 상의 단일 결정자에 대해 작용한다. 그의 특이성에 추가로, 모노클로날 항체는 합성되고, 다른 항체에 의해 오염되지 않는다는 점에서 유리하다. 변형 표현 "모노클로날"은 임의의 특정 방법에 의한 항체의 생산을 요구하는 것으로 생각하지 않아야 한다. 예를 들어, 본 발명에서 유용한 모노클로날 항체는 문헌 [Kohler et al., Nature, 256:495 (1975)]에 처음 기재된 하이브리도마 방법에 의해 제조될 수 있거나, 또는 세균, 진핵 동물 또는 식물 세포에서 재조합 DNA 방법을 사용하여 제조할 수 있다 (예를 들어, 미국 특허 4,816,567 참조). "모노클로날 항체"는 또한 예를 들어 문헌 [Clackson et al., Nature, 352:624-628 (1991)] 및 [Marks et al., J. Mol. Biol., 222:581-597 (1991)]에 기재된 기술을 사용하여 파지 항체 라이브러리로부터 단리될 수 있다.
모노클로날 항체는 본원에서 중쇄 및/또는 경쇄의 일부는 특정 종에서 유래하거나 특정 항체 클래스 또는 하위클래스에 속하는 항체 내의 대응하는 서열과 동일하거나 상동성인 한편, 사슬(들)의 나머지는 다른 종으로부터 유래하거나 다른 항체 클래스 또는 하위클래스에 속하는 항체 내의 대응하는 서열과 동일하거나 상동성인 "키메라" 항체뿐만 아니라 목적하는 생물학적 활성을 나타내는 한 상기 항체의 단편을 포함한다 (미국 특허 4,816,567; [Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984)] 참조). 본원에서 목적하는 키메라 항체는 비-인간 영장류 (예를 들어 구세계 원숭이, 유인원 등)로부터 유래한 가변 도메인 항원 결합 서열, 및 인간 불변 영역 서열을 포함하는 영장류화 (primatized) 항체를 포함한다.
"무손상" 항체는 항원 결합 부위 및 CL 및 적어도 중쇄 불변 도메인, CH1, CH2 및 CH3을 포함하는 것이다. 불변 도메인은 천연 서열 불변 도메인 (예를 들어, 인간 천연 서열 불변 도메인) 또는 그의 아미노산 서열 변이체일 수 있다. 바람직하게는, 무손상 항체는 하나 이상의 효과기 기능을 가질 수 있다.
"항체 단편"은 무손상 항체의 일부, 바람직하게는 무손상 항체의 항원 결합 또는 가변 영역을 포함한다. 항체 단편의 예는 Fab, Fab', F(ab')2 및 Fv 단편; 디아바디; 선형 항체 (미국 특허 5,641,870의 실시예 2; [Zapata et al., Protein Eng. 8(10): 1057-1062 [1995]] 참조); 단쇄 항체 분자; 및 항체 단편으로부터 형성된 다중특이적 항체를 포함한다.
항체를 파파인으로 소화시키면, "Fab" 단편으로 불리는 2개의 동일한 항원 결합 단편, 및 나머지 "Fc" 단편 (이 명칭은 쉽게 결정화하는 그의 능력을 반영한다)이 생성된다. Fab 단편은 H 사슬의 가변 영역 도메인 (VH), 및 하나의 중쇄의 제1 불변 도메인 (CH1)과 함께 전체 L 사슬로 이루어진다. 각각의 Fab 단편은 항원 결합에 관하여 1가이고, 즉, 하나의 항원 결합 부위를 갖는다. 항체를 펩신으로 처리하면, 2가 항원 결합 활성을 갖는 2개의 디술피드 연결된 Fab 단편에 대략적으로 대응하고 여전히 항원에 가교결합할 수 있는 하나의 큰 F(ab')2 단편이 생성된다. Fab' 단편은 항체 힌지 영역으로부터의 하나 이상의 시스테인을 포함하는 CH1 도메인의 카르복시 말단에서 몇 개의 잔기가 추가된다는 점에서 Fab 단편과 상이하다. Fab'-SH는 본원에서 불변 도메인의 시스테인 잔기(들)이 유리 티올기를 보유하는 Fab'의 명칭이다. F(ab')2 항체 단편은 본래 그들 사이에 힌지 시스테인을 갖는 한쌍의 Fab' 단편으로서 생산되었다. 항체 단편의 다른 화학 커플링도 당업계에 공지되어 있다.
Fc 단편은 디술피드에 의해 함께 유지되는 두 H 사슬의 카르복시-말단 부분을 포함한다. 항체의 효과기 기능은 Fc 영역 내의 서열에 의해 결정되고, 이 영역은 또한 특정 종류의 세포 상에서 발견되는 Fc 수용체 (FcR)에 의해 인식되는 부분이다.
"Fv"는 완전한 항원-인식 및 -결합 부위를 함유하는 최소 항체 단편이다. 상기 단편은 강한 비공유 회합 상태의 하나의 중쇄 및 하나의 경쇄 가변 영역 도메인의 이량체로 이루어진다. 이들 2개의 도메인의 폴딩은 항원 결합을 위한 아미노산 잔기에 기여하고 항체에 대한 항원 결합 특이성을 부여하는 6개의 초가변 루프 (H 및 L 사슬로부터 각각 3개의 루프)를 생성시킨다. 그러나, 단일 가변 도메인 (또는 항원에 특이적인 3개의 CDR만을 포함하는 Fv의 절반)이라도 전체 결합 부위보다 더 낮은 친화도이지만 항원을 인식하고 결합하는 능력을 갖는다.
"단쇄 Fv" (또한 "sFv" 또는 "scFv"로 약칭함)는 단일 폴리펩티드 사슬로 연결된 VH 및 VL 항체 도메인을 포함하는 항체 단편이다. 바람직하게는, sFv 폴리펩티드는 sFv가 항원 결합을 위한 목적하는 구조를 형성할 수 있도록 하는, VH 및 VL 도메인 사이의 폴리펩티드 링커를 더 포함한다. sFv에 관해서는 문헌 [Pluckthun in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994)]; 및 [Borrebaeck 1995, 하기 문헌]을 참조한다.
용어 "디아바디"는 V 도메인의 사슬 내가 아니라 사슬간 페어링이 달성되어 2가 단편, 즉, 2개의 항원 결합 부위를 갖는 단편을 생성하도록, VH 및 VL 도메인 사이에 짧은 링커 (약 5-10개 잔기)를 갖는 sFv 단편 (상기 문단 참조)을 구성함으로써 제조되는 작은 항체 단편을 의미한다. 이중특이적 디아바디는 2개의 "교차 (crossover)" sFv 단편의 이종이량체이고, 여기서 2개의 항체의 VH 및 VL 도메인은 상이한 폴리펩티드 사슬 상에 존재한다. 디아바디는 예를 들어 EP 404,097; WO 93/11161; 문헌 [Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993)]에 보다 상세히 설명되어 있다.
비-인간 (예를 들어, 설치류) 항체의 "인간화" 형태는 비-인간 항체에서 유래한 최소 서열을 포함하는 키메라 항체이다. 대부분의 경우에, 인간화 항체는 수여자의 초가변 영역의 잔기가 목적하는 항체 특이성, 친화도 및 능력을 갖는 비-인간종 (공여 항체), 예를 들어 마우스, 래트, 토끼 또는 비-인간 영장류의 초가변 영역의 잔기로 치환된 인간 면역글로불린 (수여 항체)이다. 일부 경우에, 인간 면역글로불린의 프레임워크 영역 (FR) 잔기는 대응하는 비-인간 잔기로 치환된다. 또한, 인간화 항체는 수여 항체 또는 공여 항체에서 발견되지 않는 잔기를 포함할 수 있다. 이러한 변형은 항체 성능을 보다 개선하기 위해 수행된다. 일반적으로, 인간화 항체는 실질적으로 적어도 하나, 일반적으로 2개의 가변 도메인을 모두 포함할 것이고, 여기서 모든 또는 실질적으로 모든 초가변 루프는 비인간 면역글로불린의 초가변 루프에 대응하고, 모든 또는 실질적으로 모든 FR은 인간 면역글로불린 서열의 FR에 대응한다. 인간화 항체는 또한 임의로 적어도 일부의 면역글로불린 불변 영역 (Fc), 일반적으로 인간 면역글로불린의 불변 영역을 포함할 것이다. 보다 상세한 내용은 문헌 [Jones et al., Nature 321:522-525 (1986)]; [Riechmann et al., Nature 332:323-329 (1988)]; 및 [Presta, Curr. Op. Struct. Biol. 2:593-596 (1992)])을 참조한다.
"종 의존성 항체", 예를 들어 포유동물 항-인간 IgE 항체는 제2 포유동물 종으로부터의 항원의 상동체에 대한 것보다 더 큰, 제1 포유동물 종으로부터의 항원에 대한 결합 친화도를 갖는 항체이다. 보통, 종 의존성 항체는 인간 항원에 "특이적으로 결합하지만" (즉, 결합 친화도 (Kd) 값이 약 1 x 10-7 M 이하, 바람직하게는 약 1 x 10-8 M 이하, 가장 바람직하게는 약 1 x 10-9 M 이하이지만), 제2 비-인간 포유동물 종으로부터의 항원의 상동체에 대한 결합 친화도는 인간 항원에 대한 그의 결합 친화도보다 적어도 약 50배, 또는 적어도 약 500배, 또는 적어도 약 1000배 더 작다. 종 의존성 항체는 상기 정의된 바와 같은 임의의 다양한 종류의 항체일 수 있지만, 바람직하게는 인간화 또는 인간 항체이다.
"TAHO 결합 올리고펩티드"는 바람직하게는 본원에서 설명되는 TAHO 폴리펩티드에 특이적으로 결합하는 올리고펩티드이다. TAHO 결합 올리고펩티드는 공지의 올리고펩티드 합성 방법을 사용하여 화학적으로 합성될 수 있거나 또는 재조합 기술을 사용하여 제조하고 정제될 수 있다. TAHO 결합 올리고펩티드의 길이는 대체로 적어도 약 5개 아미노산, 별법으로 적어도 약 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 또는 100개 아미노산이고, 상기 올리고펩티드는 바람직하게는 본원에서 설명되는 TAHO 폴리펩티드에 특이적으로 결합할 수 있다. TAHO 결합 올리고펩티드는 공지된 기술을 사용하여 과도한 실험을 수행하지 않으면서 확인할 수 있다. 이와 관련하여, 폴리펩티드 표적에 특이적으로 결합할 수 있는 올리고펩티드에 대해 올리고펩티드 라이브러리를 스크리닝하는 기술이 당업계에 공지되어 있다 (예를 들어, 미국 특허 5,556,762, 5,750,373, 4,708,871, 4,833,092, 5,223,409, 5,403,484, 5,571,689, 5,663,143; PCT 공개 WO 84/03506 및 WO84/03564; [Geysen et al., Proc. Natl. Acad. Sci. U.S.A., 81:3998-4002 (1984)]; [Geysen et al., Proc. Natl. Acad. Sci. USA, 82:178-182 (1985)]; [Geysen et al., in Synthetic Peptides as Antigens, 130-149 (1986)]; [Geysen et al., J. Immunol. Meth., 102:259-274 (1987)]; [Schoofs et al., J. Immunol., 140:611-616 (1988)], [Cwirla, S. E. et al. (1990) Proc. Natl. Acad. Sci. USA, 87:6378]; [Lowman, H. B. et al. (1991) Biochemlstry, 30: 10832]; [Clackson, T. et al. (1991) Nature, 352: 624]; [Marks, J. D. et al. (1991), J. Mol. Biol., 222:581]; [Kang, A.S. et al. (1991) Proc. Natl. Acad. Sci. USA, 88:8363], 및 [Smith, G. P. (1991) Current Opin. Biotechnol., 2:668] 참조).
"TAHO 결합 유기 분자"는 바람직하게는 본원에서 설명되는 TAHO 폴리펩티드에 특이적으로 결합하는, 본원에서 설명되는 올리고펩티드 또는 항체 이외의 다른 유기 분자이다. TAHO 결합유기 분자는 공지의 방법을 사용하여 확인되고 화학적으로 합성될 수 있다 (예를 들어, PCT 공개 WO00/00823 및 WO00/39585 참조). TAHO 결합 유기 분자의 크기는 대체로 약 2000 달톤 미만, 별법으로 약 1500, 750, 500, 250 또는 200 달톤 미만이고, 바람직하게는 본원에서 설명되는 TAHO 폴리펩티드에 특이적으로 결합하는 상기 유기 분자는 공지의 기술을 사용하여 과도한 실험을 수행하지 않으면서 확인할 수 있다. 이와 관련하여, 폴리펩티드 표적에 결합할 수 있는 분자에 대해 유기 분자 라이브러리를 스크리닝하는 기술이 당업계에 공지되어 있다 (예를 들어, PCT 공개 WO00/00823 및 WO00/39585 참조).
목적하는 항원, 예를 들어 종양 관련 폴리펩티드 항원 표적에 "결합하는" 항체, 올리고펩티드 또는 다른 유기 분자는 항체, 올리고펩티드 또는 다른 유기 분자가 항원을 발현하는 세포 또는 조직을 표적화할 때 치료제로서 유용하도록 충분한 친화도로 항원에 결합하고, 다른 단백질과 유의하게 교차반응하지 않는 것이다. 상기 실시태양에서, "비-표적" 단백질에 대한 항체, 올리고펩티드 또는 다른 유기 분자의 결합의 정도는 형광 활성화 세포 분류 (FACS) 분석 또는 방사성 면역침전 (RIA)에 의해 결정할 때 그의 특정 표적 단백질에 대한 항체, 올리고펩티드 또는 다른 유기 분자의 결합의 약 10% 미만일 것이다. 특정 폴리펩티드 또는 특정 폴리펩티드 표적 상의 에피토프에 대한 "특이적인 결합" 또는 "특이적으로 결합하는" 또는 "특이적인"은 비-특이적인 상호작용과 측정가능하게 상이한 결합을 의미한다. 특이적인 결합은 예를 들어 일반적으로 결합 활성을 갖지 않는 유사한 구조의 분자인 대조 분자의 결합에 비교하여 분자의 결합을 결정함으로써 측정될 수 있다. 예를 들어, 특이적인 결합은 표적, 예를 들어 과량의 비-표지된 표적에 유사한 대조 분자와의 경쟁에 의해 결정될 수 있다. 이 경우에, 특이적인 결합은 프로브에 대한 표지된 표적의 결합이 과량의 비표지된 표적에 의해 경쟁적으로 억제될 경우에 표시된다. 본원에서 사용될 때, 용어 특정 폴리펩티드 또는 특정 폴리펩티드 표적 상의 에피토프에 대한 "특이적인 결합" 또는 "특이적으로 결합하는" 또는 "특이적인"은 예를 들어 표적에 대한 Kd가 적어도 약 10-4 M, 별법으로 적어도 약 10-5 M, 별법으로 적어도 약 10-6 M, 별법으로 적어도 약 10-7 M, 별법으로 적어도 약 10-8 M, 별법으로 적어도 약 10-9 M, 별법으로 적어도 약 10-10 M, 별법으로 적어도 약 10-11 M, 별법으로 적어도 약 10-12 M, 또는 이보다 큰 분자에 의해 제시될 수 있다. 한 실시태양에서, 용어 "특이적인 결합"은 분자가 임의의 다른 폴리펩티드 또는 폴리펩티드 에피토프에 실질적으로 결합하지 않으면서 특정 폴리펩티드 또는 특정 폴리펩티드 상의 에피토프에 결합하는 경우의 결합을 의미한다.
"TAHO 폴리펩티드를 발현하는 종양 세포의 성장을 억제하는" 항체, 올리고펩티드 또는 다른 유기 분자 또는 "성장 억제성" 항체, 올리고펩티드 또는 다른 유기 분자는 적절한 TAHO 폴리펩티드를 발현하거나 과다발현하는 암 세포의 측정가능한 성장 억제를 유도하는 것이다. TAHO 폴리펩티드는 암 세포의 표면 상에 발현된 막횡단 폴리펩티드일 수 있거나 또는 암 세포에 의해 생산되고 분비되는 폴리펩티드일 수 있다. 바람직한 성장 억제성 항-TAHO 항체, 올리고펩티드 또는 다른 유기 분자는 적절한 대조군 (일반적으로, 대조군은 시험되는 항체, 올리고펩티드 또는 다른 유기 분자로 처리되지 않은 종양 세포임)에 비해 TAHO-발현 종양 세포의 성장을 20% 초과, 바람직하게는 약 20% 내지 약 50%, 훨씬 더 바람직하게는 50% 초과 (예를 들어, 약 50% 내지 약 100%)의 수준으로 억제한다. 한 실시태양에서, 성장 억제는 세포 배양액에서 약 0.1 내지 30 ㎍/ml 또는 약 0.5 nM 내지 200 nM의 항체 농도에서 측정될 수 있고, 여기서 성장 억제는 종양 세포의 항체에 대한 노출 1-10일 후에 결정한다. 생체 내에서 종양 세포의 성장 억제는 하기 실험 실시예 섹션에서 설명되는 바와 같이 다양한 방식으로 결정될 수 있다. 항체는 항-TAHO 항체를 약 1 ㎍/kg 내지 약 100 mg/kg 체중으로 투여할 때 종양 크기 또는 종양 세포 증식이 처음 항체 투여시로부터 약 5 내지 3개월 내에, 바람직하게는 약 5 내지 30일 이내에 감소하면 생체 내에서 성장 억제성인 것이다.
"세포자멸을 유도하는" 항체, 올리고펩티드 또는 다른 유기 분자는 아넥신 V의 결합, DNA의 절편화, 세포 수축, 소포체의 팽창, 세포 단편화 및/또는 멤브레인 베지클 (세포자멸체로 칭함)의 형성에 의해 결정되는, 프로그래밍된 (programmed) 세포 사멸을 유도하는 것이다. 세포는 대체로 TAHO 폴리펩티드를 과다발현하는 것이다. 바람직하게는, 세포는 종양 세포, 예를 들어, 조혈 세포, 예를 들어 B 세포, T 세포, 호염기구, 호산구, 호중구, 단핵구, 혈소판 또는 적혈구이다. 세포자멸과 관련된 세포 사건을 평가하기 위한 다양한 방법이 이용가능하다. 예를 들어, 포스파티딜 세린 (PS) 전위 (translocation)는 아넥신 결합에 의해 측정할 수 있고; DNA 절편화는 DNA 래더링 (laddering)을 통해 평가할 수 있고; DNA 절편화와 함께 핵/염색질의 응축은 저이배체 (hypodiploid) 세포의 임의의 증가에 의해 평가할 수 있다. 바람직하게는, 세포자멸을 유도하는 항체, 올리고펩티드 또는 다른 유기 분자는 아넥신 결합 분석에서 비처리 세포에 비해 아넥신 결합의 유도를 약 2 내지 50배, 바람직하게는 약 5 내지 50배, 가장 바람직하게는 약 10 내지 50배 야기하는 것이다.
항체 "효과기 기능"은 항체의 Fc 영역 (천연 서열 Fc 영역 또는 아미노산 서열 변이체 Fc 영역)에 기인한 생물학적 활성을 의미하고, 항체 이소형에 따라 상이하다. 항체 효과기 기능의 예는 C1q 결합 및 보체 의존성 세포독성 (CDC); Fc 수용체 결합; 항체 의존성 세포 매개 세포독성 (ADCC); 포식작용; 세포 표면 수용체 (예를 들어 B 세포 수용체)의 하향 조절; 및 B 세포 활성화를 포함한다.
"항체 의존성 세포 매개 세포독성" 또는 "ADCC"는 특정 세포독성 세포 (예를 들어 천연 킬러 (NK) 세포, 호중구 및 대식세포)에 존재하는 Fc 수용체 (FcR)에 결합된 분비된 Ig가, 상기 세포독성의 효과기 세포가 항원 보유 표적 세포에 특이적으로 결합한 후, 표적 세포를 세포독소로 사멸시키도록 만드는 세포독성의 한 형태를 의미한다. 항체는 세포독성 세포를 "무장시키고", 상기 사멸에 절대적으로 필요하다. ADCC를 매개하는 1차 세포인 NK 세포는 FcγRIII만을 발현하고, 단핵구는 FcγRI, FcγRII 및 FcγRIII을 발현한다. 조혈세포 상의 FcR 발현은 문헌 [Ravetch and Kinet, Annu. Rev. Immunol., 9:457-92 (1991)]의 464 페이지 표 3에 요약되어 있다. 목적하는 분자의 ADCC 활성을 평가하기 위해서, 미국 특허 5,500,362 또는 5,821,337에 기재된 바와 같은 시험관내 ADCC 분석을 수행할 수 있다. 상기 분석에 유용한 효과기 세포는 말초혈 단핵 세포 (PBMC) 및 천연 킬러 (NK) 세포를 포함한다. 별법으로, 또는 추가로, 목적하는 분자의 ADCC 활성은 생체 내에서, 예를 들어 문헌 [Clynes et al., (USA) 95:652-656 (1998)]에 개시된 동물 모델에서 평가할 수 있다.
"Fc 수용체" 또는 "FcR"은 항체의 Fc 영역에 결합하는 수용체를 설명한다. 바람직한 FcR은 천연 서열 인간 FcR이다. 바람직한 FcR은 IgG 항체 (감마 수용체)에 결합하고 상기 수용체의 대립유전자 변이체 및 선택적으로 스플라이싱된 형태를 포함하여 FcγRI, FcγRII 및 FcγRIII 하위클래스의 수용체를 포함하는 것이다. FcγRII 수용체는 FcγRIIA ("활성화 수용체") 및 FcγRIIB ("억제 수용체")를 포함하고, 이들은 그의 세포질 도메인에서 주로 상이한 유사한 아미노산 서열을 갖는다. 활성화 수용체 FcγRIIA는 그의 세포질 도메인에 면역수용체 티로신계 활성화 모티프 (ITAM)를 포함한다. 억제 수용체 FcγRIIB는 그의 세포질 도메인에 면역수용체 티로신계 억제 모티프 (ITIM)를 포함한다 (예를 들어, 문헌 [Daeron, Annu. Rev. Immunol. 15:203-234 (1997)] 참조). FcR은 예를 들어 문헌 ([Ravetch and Kinet, Annu. Rev. Immunol 9: 457-92 (1991)]; [Capel et al., Immunomethods 4: 25-34 (1994)]; 및 [de Haas et al., J. Lab. Clin. Med. 126: 330-41 (1995)]에 개시되어 있다. 미래에 확인되는 것을 포함하여 다른 FcR이 본원의 용어 "FcR"에 포함된다. 상기 용어는 또한 모체 IgG의 태아로의 전달 ([Guyer et al., J. Immunol. 117:587 (1976)] 및 [Kim et al., J. Immunol. 24:249 (1994)])을 담당하는 신생아의 수용체인 FcRn을 포함한다.
"인간 효과기 세포"는 하나 이상의 FcR을 발현하고 효과기 기능을 수행하는 백혈구이다. 바람직하게는, 세포는 적어도 FcγRIII을 발현하고 ADCC 효과기 기능을 수행한다. ADCC를 매개하는 인간 백혈구의 예는 말초혈 단핵 세포 (PBMC), 천연 킬러 (NK) 세포, 단핵구, 세포독성 T 세포 및 호중구를 포함하고, PBMC 및 NK 세포가 일반적으로 바람직하다. 효과기 세포는 천연 공급원, 예를 들어 혈액으로부터 단리할 수 있다.
"보체 의존성 세포독성" 또는 "CDC"는 보체의 존재 하에 표적 세포의 용해를 의미한다. 전통적인 보체 경로의 활성화는 보체 시스템의 제1 성분 (C1q)을 동족 (cognate) 항원에 결합된 항체 (적절한 하위클래스의)에 결합시킴으로써 개시된다. 보체 활성화를 평가하기 위해서, 예를 들어 문헌 [Gazzano-Santoro et al., J. Immunol. Methods 202: 163 (1996)]에 기재된 CDC 분석을 수행할 수 있다.
용어 "암" 및 "암성"은 일반적으로 비조절된 세포 성장의 특징을 갖는 포유동물의 생리학적 상태를 나타내거나 설명한다. 암의 예는 조혈계 암 또는 혈액-관련 암, 예를 들어 림프종, 백혈병, 골수종 또는 림프양 악성종양, 및 비장암, 림프절의 암을 포함하지만 이로 제한되지 않는다. 암의 보다 특정한 예는 B-세포 연관 암, 예를 들어 고등급, 중등급 및 저등급 림프종 (B 세포 림프종, 예를 들어 점막-연관-림프양 조직 B 세포 림프종 및 비-호지킨 림프종, 외투 세포 림프종, 버킷 림프종, 소림프구성 림프종, 변연대 림프종, 미만성 대세포 림프종, 여포성 림프종, 및 호지킨 림프종 및 T 세포 림프종 포함) 및 백혈병 (2차 백혈병, 만성 림프구성 백혈병, 예를 들어 B 세포 백혈병 (CD5+ B 림프구), 골수성 백혈병, 예를 들어 급성 골수성 백혈병, 만성 골수성 백혈병, 림프구성 백혈병, 예를 들어 급성 림프모구 백혈병 및 골수이형성증), 다발 골수종, 예를 들어 형질세포 악성종양, 및 다른 혈액 및/또는 B 세포- 또는 T-세포-연관 암을 포함한다. 또한, 추가의 조혈 세포, 예를 들어 다형핵 백혈구, 예를 들어 호염기구, 호산구, 호중구 및 단핵구, 수지상 세포, 혈소판, 적혈구 및 자연 살해 세포의 암도 포함된다. B-세포 암의 기원은 다음을 포함한다: 변연대 B-세포 림프종은 변연대의 기억 B-세포에서 유래하고, 여포성 림프종 및 미만성 거대 B-세포 림프종은 배 중심의 명 대역 내의 중심세포에서 유래하고, 다발 골수종은 형질세포에서 유래하고, 만성 림프구성 백혈병 및 소림프구성 백혈병은 B1 세포 (CD5+)에서 유래하고, 외투 세포 림프종은 외투층 내의 나이브 B-세포에서 유래하고, 버킷 림프종은 배 중심의 암 대역의 중심모세포에서 유래한다. 본원에서 "조혈 세포 조직"으로 언급되는 조혈 세포를 포함하는 조직은 흉선 및 골수 및 말초 림프 조직, 예를 들어 비장, 림프절, 점막과 연관된 림프 조직, 예를 들어 장-연관 림프 조직, 편도, 파이어 판 (Peyer's patch) 및 충수돌기 및 다른 점막, 예를 들어 기관지 내막과 연관된 림프 조직을 포함한다. 상기 암의 추가의 특정 예는 편평세포암, 소세포 폐암, 비-소세포 폐암, 폐의 선암종, 폐의 편평세포 암종, 복막암, 간세포암, 위장관암, 췌장암, 신경아교종, 자궁경부암, 난소암, 간암, 방광암, 간암종, 유방암, 결장암, 결장직장암, 자궁내막 또는 자궁 암종, 침샘 암종, 신장암, 간암, 전립선암, 외음부암, 갑상선암, 간암종, 백혈병 및 다른 림프구 증식성 질환, 및 다양한 종류의 두경부암을 포함한다.
본원에서 "B-세포 종양"은 비-호지킨 림프종 (NHL), 예를 들어 저등급/여포성 NHL, 소림프구성 (SL) NHL, 중등급/여포성 NHL, 중등급 미만성 NHL, 고등급 면역모세포 NHL, 고등급 림프모구 NHL, 고등급 작은 비-절단된 세포 NHL, 큰 종양 (bulky disease) NHL, 외투 세포 림프종, AIDS-관련 림프종, 및 발덴스트롬 (Waldenstrom) 마크로글로불린혈증, 비-호지킨 림프종 (NHL), 림프구 우세 호지킨병 (LPHD), 소림프구성 림프종 (SLL), 만성 림프구성 백혈병 (CLL), 무통성 NHL, 예를 들어 재발성 무통성 NHL 및 리툭시맙-불응성 무통성 NHL; 백혈병, 예를 들어 급성 림프모구 백혈병 (ALL), 만성 림프구성 백혈병 (CLL), 유모세포 백혈병, 만성 골수모구성 백혈병; 외투 세포 림프종; 및 다른 혈액 종양을 포함한다. 상기 종양은 B-세포 표면 마커, 예를 들어 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 및/또는 cyno CD79b (TAHO40)에 대해 작용하는 항체로 치료될 수 있다. 상기 질병은 B 세포 표면 마커, 예를 들어 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 및/또는 cyno CD79b (TAHO40)에 대해 작용하는 항체의 투여에 의해 치료되는 것으로 본원에서 고려되고, 비접합된 ("네이키드") 항체 또는 본원에 개시되는 세포독성제에 접합된 항체의 투여를 포함한다. 또한, 상기 질병은 본 발명의 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체 또는 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체 약물 접합체를 다른 항체 또는 항체 약물 접합체, 다른 세포독성제, 방사선 조사 또는 다른 치료와 동시에 또는 연속적으로 투여하는 조합 요법에 의해 치료되는 것으로 본원에서 고려된다. 본 발명의 예시적인 치료 방법에서, 본 발명의 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체는 항-CD20 항체, 면역글로불린, 또는 그의 CD20 결합 단편과 조합되어 동시에 또는 순차적으로 투여된다. 항-CD20 항체는 네이키드 항체 또는 항체 약물 접합체일 수 있다. 조합 요법의 실시태양에서, 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체는 본 발명의 항체이고, 항-CD20 항체는 Rituxan® (리툭시맙)이다.
본원에서 사용되는 용어 "비-호지킨 림프종" 또는 "NHL"은 호지킨 림프종 이외의 림프계의 암을 의미한다. 호지킨 림프종은 일반적으로 호지킨 림프종에 리드-스턴버그 (Reed-Sternberg) 세포가 존재하고 비-호지킨 림프종에 상기 세포가 존재하지 않는다는 사실에 의해 비-호지킨 림프종과 구별될 수 있다. 본원에서 사용되는 상기 용어에 포함되는 비-호지킨 림프종의 예는 당업계에 공지된 분류 방식, 예를 들어 문헌 [Color Atlas of Clinical Hematology (3rd edition), A. Victor Hoffbrand and John E. Pettit (eds.) (Harcourt Publishers Ltd., 2000)]에 기재된 Revised European-American Lymphoma (REAL) 방식에 따라 당업자 (예를 들어, 종양학자 또는 병리학자)에 의해 확인되는 임의의 림프종을 포함한다 (특히, 도 11.57, 11.58 및 11.59의 목록 참조). 보다 구체적인 예는 재발된 또는 불응성 NHL, 전선 (front line) 저등급 NHL, 단계 III/IV NHL, 화학요법 내성 NHL, 전구체 B 림프모구 백혈병 및/또는 림프종, 소림프구 림프종, B 세포 만성 림프구성 백혈병 및/또는 전림프구성 백혈병 및/또는 소림프구성 림프종, B-세포 전림프구성 림프종, 면역종 및/또는 림프형질세포성 림프종, 림프형질세포성 림프종, 변연대 B 세포 림프종, 비장 변연대 림프종, 림프절외 변연대 - MALT 림프종, 림프절 변연대 림프종, 유모세포 백혈병, 형질세포종 및/또는 형질세포 골수종, 저등급/여포성 림프종, 중등급/여포성 NHL, 외투세포 림프종, 여포 중심 림프종 (여포성), 중등급 미만성 NHL, 미만성 거대 B-세포 림프종, 공격성 NHL (공격성 전선 NHL 및 공격성 재발 NHL), 자가 줄기세포 이식 후에 재발된 또는 이식에 불응성인 NHL, 원발성 종격의 거대 B-세포 림프종, 원발성 삼출 림프종, 고등급 면역모세포성 NHL, 고등급 림프모구 NHL, 고등급 비-절단된 소세포 (small non-cleaved cell) NHL, 큰 종양 NHL, 버킷 림프종, 전구체 (말초) 대과립 림프구성 백혈병, 균상식육종 및/또는 세자리 (Sezary) 증후군, 피부 (cutaneous) 림프종, 큰세포 역형성 림프종, 혈관중심성 림프종을 포함하고 이로 제한되지 않는다.
"질환"은 본 발명의 물질/분자 또는 방법을 사용한 치료로부터 이익을 얻는 임의의 병태이다. 이것은 포유동물이 문제의 질병에 걸리기 쉽게 하는 병적 상태를 포함하는 만성 및 급성 질환 또는 질병을 포함한다. 본원에서 치료하고자 하는 질환의 비제한적인 예는 암성 병태, 예를 들어 악성 및 양성 종양; 비-백혈병 및 림프양 악성종양; 신경세포, 아교세포, 성상세포, 시상하부 및 다른 선, 포식세포, 상피, 간질 및 포배강 (blastocoelic) 질환; 및 염증, 면역 및 다른 혈관신생-관련 질환을 포함한다. 질환은 추가로 암성 병태, 예를 들어 B 세포 증식성 질환 및/또는 B 세포 종양, 예를 들어, 림프종, 비-호지킨 림프종 (NHL), 공격성 NHL, 재발성 공격성 NHL, 재발성 무통성 NHL, 불응성 NHL, 불응성 무통성 NHL, 만성 림프구성 백혈병 (CLL), 소림프구 림프종, 백혈병, 유모세포 백혈병 (HCL), 급성 림프구성 백혈병 (ALL), 및 외투 세포 림프종을 포함한다.
용어 "세포 증식성 질환" 및 "증식성 질환"은 일정 정도의 비정상적인 세포 증식과 연관된 질환을 나타낸다. 한 실시태양에서, 세포 증식성 질환은 암이다.
본원에서 사용될 때 "종양"은 악성이든 양성이든 모든 신생물성 세포 성장 및 증식, 및 모든 전암성 및 암성 세포 및 조직을 나타낸다.
"세포 사멸을 유도하는" 항체, 올리고펩티드 또는 다른 유기 분자는 생육가능한 세포를 비생육가능한 것으로 만드는 것이다. 상기 세포는 TAHO 폴리펩티드를 발현하고, TAHO 폴리펩티드를 특이적으로 발현하거나 과다발현하는 세포 종류의 세포이다. 세포는 특정 세포 종류의 암성 또는 정상 세포일 수 있다. TAHO 폴리펩티드는 암세포의 표면에 발현된 막횡단 폴리펩티드일 수 있거나 또는 암세포에 의해 생산되어 분비된 폴리펩티드일 수 있다. 세포는 암 세포, 예를 들어, B 세포 또는 T 세포일 수 있다. 시험관 내 세포 사멸은 항체 의존성 세포 매개 세포독성 (ADCC) 또는 보체 의존성 세포독성 (CDC)에 의해 유도된 세포 사멸을 구별하기 위해서 보체 및 면역 효과기 세포의 부재 하에 결정할 수 있다. 따라서, 세포 사멸에 대한 분석은 열 불활성화된 혈청을 사용하여 (즉, 보체의 부재 하에) 및 면역 효과기 세포의 부재 하에 수행할 수 있다. 항체, 올리고펩티드 또는 다른 유기 분자가 세포 사멸을 유도할 수 있는 지를 결정하기 위해, 요오드화프로피듐 (PI), 트리판 블루 ([Moore et al. Cytotechnology 17:1-11 (1995)] 참조) 또는 7AAD의 흡수에 의해 평가되는 막 통합성의 상실을 비처리 세포와 비교하여 평가할 수 있다. 바람직한 세포 사멸-유도 항체는 BT474 세포에서의 PI 흡수 분석에서 PI 흡수를 유도하는 것이다.
"TAHO-발현 세포"는 내인성 또는 형질감염된 TAHO 폴리펩티드를 세포 표면 상에 또는 분비된 형태로 발현하는 세포이다. "TAHO-발현 암"은 세포 표면 상에 존재하는 TAHO 폴리펩티드를 갖거나 또는 TAHO 폴리펩티드를 생산하고 분비하는 세포를 포함하는 암이다. "TAHO-발현 암"은 항-TAHO 항체, 올리고펩티드 또는 다른 유기 분자가 그에 대해 결합하여 암에 대해 치료 효과를 가질 수 있도록, 그의 세포 표면 상에 충분한 수준의 TAHO 폴리펩티드를 임의로 생산한다. 다른 실시태양에서, "TAHO-발현 암"은 항-TAHO 항체, 올리고펩티드 또는 다른 유기 분자 길항제가 그에 대해 결합하여 암에 대해 치료 효과를 가질 수 있도록, 임의로 충분한 수준의 TAHO 폴리펩티드를 생산하고 분비한다. 후자의 경우에, 길항제는 종양 세포에 의한 분비된 TAHO 폴리펩티드의 생산 및 분비를 감소, 억제 또는 방지하는 안티센스 올리고뉴클레오티드일 수 있다. TAHO 폴리펩티드를 "과다발현하는" 암은 동일한 조직 종류의 비-암성 세포에 비해 그의 세포 표면에서 유의하게 더 높은 수준의 TAHO 폴리펩티드를 갖거나, 생산하고 분비하는 것이다. 상기 과다발현은 유전자 증폭 또는 전사 또는 번역 증가에 기인할 수 있다. TAHO 폴리펩티드 과다발현은 세포 표면 상에 존재하거나 또는 세포에 의해 분비된 증가된 수준의 TAHO 단백질을 평가함으로써 검출 또는 예측 분석으로 결정될 수 있다 (예를 들어, TAHO 폴리펩티드를 코딩하는 단리된 핵산으로부터 재조합 DNA 기술을 사용하여 제조될 수 있는 단리된 TAHO 폴리펩티드에 대해 제조된 항-TAHO 항체를 사용한 면역조직화학 분석; FACS 분석 등을 통해). 별법으로, 또는 추가로, TAHO 폴리펩티드-코딩 핵산 또는 mRNA의 수준은 예를 들어 TAHO-코딩 핵산 또는 그의 상보체에 대응하는 핵산 기반 프로브를 사용한 형광 계내 혼성화 (FISH; 1998년 10월 공개된 WO98/45479 참조), 서던 (Southern) 블로팅, 노던 (Northern) 블로팅, 또는 중합효소 연쇄 반응 (PCR) 기술, 예를 들어 실시간 정량적 PCR (RT-PCR)을 통해 세포에서 측정할 수 있다. TAHO 폴리펩티드 과다발현은 예를 들어 항체 기반 분석 (또한, 예를 들어, 1990년 6월 12일 등록된 미국 특허 4,933,294; 1991년 4월 18일 공개된 WO91/05264; 1995년 3월 28일 등록된 미국 특허 5,401,638; 및 문헌 [Sias et al., J. Immunol. Methods 132:73-80 (1990)] 참조)을 사용하여 생물학적 유체, 예를 들어 혈청 내의 발산된 항원을 측정하여 연구할 수 있다. 상기 분석 외에, 다양한 생체 내 분석을 당업자는 이용할 수 있다. 예를 들어, 환자의 신체 내의 세포를 검출가능한 표지, 예를 들어, 방사성 동위원소로 임의로 표지된 항체에 노출시킨 후, 예를 들어, 방사성의 외부 스캐닝에 의해 또는 항체에 기노출된 환자로부터 얻은 생검의 분석에 의해, 환자에서 항체의 세포에 대한 결합을 평가할 수 있다.
본원에서 사용되는 바와 같이, 용어 "면역어드헤신 (immunoadhesin)"은 이종 단백질 ("어드헤신")의 "결합 특이성"을 면역글로불린 불변 도메인의 효과기 기능과 조합한 항체 유사 분자를 나타낸다. 구조적으로, 면역어드헤신은 항체의 항원 인식 및 결합 부위 이외의 (즉, "이종"인) 다른 목적하는 결합 특이성을 갖는 아미노산 서열과 면역글로불린 불변 도메인 서열의 융합체를 포함한다. 면역어드헤신 분자의 어드헤신 부분은 일반적으로 적어도 수용체 또는 리간드의 결합 부위를 포함하는 인접한 아미노산 서열이다. 면역어드헤신 내의 면역글로불린 불변 도메인 서열은 임의의 면역글로불린, 예를 들어 IgG-1, IgG-2, IgG-3, 또는 IgG-4 서브타입, IgA (IgA-1 및 IgA-2 포함), IgE, IgD 또는 IgM으로부터 얻을 수 있다.
본원에서 사용되는 바와 같이, 용어 "표지"는 "표지된" 항체, 올리고펩티드 또는 다른 유기 분자를 생성시키기 위해 항체, 올리고펩티드 또는 다른 유기 분자에 직접 또는 간접적으로 접합된 검출가능한 화합물 또는 조성물을 의미한다. 표지는 그 자체로 검출가능하거나 (예를 들어 방사성 동위원소 표지 또는 형광 표지), 또는 효소 표지의 경우에, 검출가능한 기질 화합물 또는 조성물의 화학적 변경을 촉매할 수 있다.
본원에서 사용되는 용어 "세포독성제"는 세포의 기능을 억제 또는 제한하고/하거나 세포의 파괴를 야기하는 물질을 나타낸다. 상기 용어는 방사성 동위원소 (예를 들어 At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32 및 Lu의 방사성 동위원소), 화학요법제 (예를 들어, 메토트렉세이트, 아드리아미신, 빈카 알칼로이드 (빈크리스틴, 빈블라스틴, 에토포시드), 독소루비신, 멜팔란, 미토마이신 C, 클로람부실, 다우노루비신 또는 다른 삽입제 (intercalating agent), 효소 및 그의 단편, 예를 들어 뉴클레오티드 분해 효소, 항생제, 및 독소, 예를 들어 소분자 독소 또는 세균, 진균, 식물 또는 동물 기원의 효소 활성 독소, 및 그의 단편 및/또는 변이체, 및 아래에 개시된 다양한 항종양제 또는 항암제를 포함하고자 의도된다. 다른 세포독성제는 아래에서 설명된다. 살종양제는 종양 세포를 파괴한다.
"독소"는 세포의 성장 또는 증식에 유해한 효과를 보일 수 있는 임의의 물질이다.
"화학요법제"는 작용 메카니즘과 상관없이 암의 치료에 유용한 화학적 화합물이다. 화학요법제의 종류는 다음을 포함하고 이로 제한되지 않는다: 알킬화제, 항대사물질, 방추체 독 (spindle poison) 식물 알칼로이드, 세포독성/항종양 항생제, 토포이소머라제 억제제, 항체, 광감수성 증가 물질 (photosensitizer), 및 키나제 억제제. 화학요법제는 "표적화 요법" 및 통상적인 화학요법에 사용되는 화합물을 포함한다. 화학요법제의 예는 다음을 포함한다: 에를로티닙 (TARCEVA®, 제넨테크/오에스아이 팜. (OSI Pharm.)), 도세탁셀 (TAXOTERE®, 사노피-아벤티스 (Sanofi-Aventis)), 5-FU (플루오로우라실, 5-플루오로우라실, CAS No. 51-21-8), 겜시타빈 (GEMZAR®, 릴리 (Lilly)), PD-0325901 (CAS No. 391210-10-9, 화이자 (Pfizer)), 시스플라틴 (시스-디아민, 디클로로백금(II), CAS No. 15663-27-1), 카르보플라틴 (CAS No. 41575-94-4), 파클리탁셀 (TAXOL®, 브리스톨-마이어스 스퀴브 온콜로지 (Bristol-Myers Squibb Oncology, 미국 뉴욕주 프린스톤), 트라스투주맙 (HERCEPTIN®, 제넨테크), 테모졸로미드 (4-메틸-5-옥소-2,3,4,6,8-펜타아자비시클로 [4.3.0] 노나-2,7,9-트리엔-9-카르복사미드, CAS No. 85622-93-1, TEMODAR®, TEMODAL®, 쉐링 플로 (Schering Plough)), 타목시펜 ((Z)-2-[4-(1,2-디페닐부트-1-에닐)페녹시]-N,N-디메틸-에탄아민, NOLVADEX®, ISTUBAL®, VALODEX®), 및 독소루비신 (ADRIAMYCIN®), Akti-1/2, HPPD, 및 라파마이신.
화학요법제의 보다 많은 예는 다음을 포함한다: 옥살리플라틴 (ELOXATIN®, 사노피), 보르테조밉 (VELCADE®, 밀레니엄 팜. (Millennium Pharm.)), 수텐트 (SUNITINIB®, SU11248, 화이자), 레트로졸 (FEMARA®, 노바티스 (Novartis)), 이마티닙 메실레이트 (GLEEVEC®, 노바티스), XL-518 (Mek 억제제, 엑셀릭시스 (Exelixis), WO 2007/044515), ARRY-886 (Mek 억제제, AZD6244, 어레이 바이오파마 (Array BioPharma), 아스트라제네카 (AstraZeneca)), SF-1126 (PI3K 억제제, 세마포어 파마슈티칼스 (Semafore Pharmaceuticals)), BEZ-235 (PI3K 억제제, 노바티스), XL-147 (PI3K 억제제, 엑셀릭시스), PTK787/ZK 222584 (노바티스), 풀베스트란트 (FASLODEX®, 아스트라제네카), 류코보린 (폴린산), 라파마이신 (시롤리무스, RAPAMUNE®, 와이어스 (Wyeth)), 라파티닙 (TYKERB®, GSK572016, 글락소스미스클라인 (GlaxoSmithKline)), 로나파르닙 (SARASAR™, SCH 66336, 쉐링 플로), 소라페닙 (NEXAVAR®, BAY43-9006, 바이엘 랩스 (Bayer Labs)), 게피티닙 (IRESSA®, 아스트라제네카), 이리노테칸 (CAMPTOSAR®, CPT-11, 화이자), 티피파르닙 (ZARNESTRA™, 존슨 & 존슨 (Johnson & Johnson)), ABRAXANE™ (크레모포르-프리 (Cremophor-free)), 파클리탁셀의 알부민-조작된 나노입자 제제 (아메리칸 파마슈티칼 파트너스 (American Pharmaceutical Partners, 미국 일리노이주 샤움버그)), 반데타닙 (rINN, ZD6474, ZACTIMA®, 아스트라제네카), 클로람부실, AG1478, AG1571 (SU 5271; 수겐 (Sugen)), 템시롤리무스 (TORISEL®, 와이어스), 파조파닙 (글락소스미스클라인), 칸포스파미드 (TELCYTA®, 텔릭 (Telik)), 티오테파 및 시클로스포스파미드 (CYTOXAN®, NEOSAR®); 알킬 술포네이트, 예를 들어 부술판, 임프로술판 및 피포술판; 아지리딘, 예를 들어 벤조도파, 카르보쿠온, 메트우레도파 및 우레도파; 에틸렌이민 및 메틸아멜라민, 예를 들어 알트레타민, 트리에틸렌멜라민, 트리에틸렌포스포라미드, 트리에틸렌티오포스포라미드 및 트리메틸올로멜라민; 아세토게닌 (특히 불라타신 및 불라타시논); 캄포테신 (합성 유사체 토포테칸 포함); 브리오스타틴; 칼리스타틴; CC-1065 (그의 아도제레신, 카르제레신 및 비제레신 합성 유사체 포함); 크립토파이신 (특히 크립토파이신 1 및 크립토파이신 8); 돌라스타틴; 두오카르마이신 (합성 유사체, KW-2189 및 CB1-TM1 포함); 에류테로빈; 판크라티스타틴; 사르코딕타이인; 스폰기스타틴; 질소 머스타드, 예를 들어 클로람부실, 클로나파진, 클로로포스파미드, 에스트라무스틴, 이포스파미드, 메클로레타민, 메클로레타민 옥시드 염산염, 멜팔란, 노벤비친, 페네스테린, 프레드니무스틴, 트로포스파미드, 우라실 머스타드; 니트로소우레아, 예를 들어 카르무스틴, 클로로조토신, 포테무스틴, 로무스틴, 니무스틴 및 라니무스틴; 항생제, 예를 들어 에네디와인 항생제 (예를 들어, 칼리케아미신, 특히 칼리케아미신 감마lI 및 칼리케아미신 오메가Il (Angew, Chem Intl. Ed. Engl. (1994) 33: 183-186); 다이네미신, 예를 들어 다이네미신 A; 비스포스포네이트, 예를 들어 클로드로네이트; 에스페라미신; 및 네오카르지노스타틴 발색단 (chromophore) 및 관련 발색단백질 에네디와인 항생제 발색단), 아클라시노마이신, 악티노마이신, 아우쓰라마이신, 아자세린, 블레오마이신, 칵티노마이신, 카라비신, 카르미노마이신, 카르지노필린, 크로모마이시니스, 닥티노마이신, 다우노루비신, 데토루비신, 6-디아조-5-옥소-L-노르류신, 모르폴리노-독소루비신, 시아노모르폴리노-독소루비신, 2-피롤리노-독소루비신 및 데옥시독소루비신, 에피루비신, 에소루비신, 이다루비신, 마르셀로마이신, 미토마이신, 예를 들어 미토마이신 C, 미코페놀산, 노갈라마이신, 올리보마이신, 페플로마이신, 포르피로마이신, 푸로마이신, 쿠엘라마이신, 로도루비신, 스트렙토니그린, 스트렙토조신, 튜버시딘, 우베니멕스, 지노스타틴, 조루비신, 항대사제, 예를 들어 메토트렉세이트 및 5-플루오로우라실 (5-FU); 엽산 유사체, 예를 들어 데노프테린, 메토트렉세이트, 프테로프테린, 트리메트렉세이트; 퓨린 유사체, 예를 들어 플루다라빈, 6-머캅토퓨린, 티아미프린, 티오구아닌; 피리미딘 유사체, 예를 들어 안시타빈, 아자시티딘, 6-아자우리딘, 카르모푸르, 시타라빈, 디데옥시우리딘, 독시플루리딘, 에노시타빈, 플로스우리딘; 안드로겐, 예를 들어 칼루스테론, 드로모스타놀론 프로피오네이트, 에피티오스타놀, 메피티오스탄, 테스토락톤; 항-아드레날, 예를 들어 아미노글루테치미드, 미토탄, 트리로스탄; 엽산 보충제, 예를 들어 프로리닌산; 아세글라톤; 알도포스파미드 글리코사이드; 아미노레불린산; 에닐우라실; 암사크린; 베스트라부실; 비산트렌; 에다트렉세이트; 데포파민; 데메콜신; 디아지쿠온; 엘포르니틴; 엘립티늄 아세테이트; 에포틸론; 에토글루시드; 질산갈륨; 히드록시우레아; 렌티난; 로니다이닌; 메이탄시노이드, 예를 들어 메이탄신 및 안사미토신; 미토구아존; 미톡산트론; 모피단몰; 니트라에린; 펜토스타틴; 페나메트; 피라루비신; 로속산트론; 포도필린산; 2-에틸히드라지드; 프로카르바진; PSK® 다당류 복합체 (제이에이치에스 내쳐럴 프로덕츠 (JHS Natural Products, 미국 오레곤주 유진)); 로족산; 리족신; 시조피란; 스피로게르마늄; 테누아존산; 트리아지쿠온; 2,2',2"-트리클로로트리에틸아민; 트리코테센 (특히 T-2 독소, 베라쿠린 A, 로리딘 A 및 안귀딘); 우레탄; 빈데신; 다카르바진; 만노무스틴; 미토브로니톨; 미토락톨; 피포브로만; 가시토신; 아라비노시드 ("Ara-C"); 시클로포스파미드; 티오테파; 6-티오구아닌; 머캅토퓨린; 메토트렉세이트; 백금 유사체, 예를 들어 시스플라틴 및 카르보플라틴; 빈블라스틴; 에토포시드 (VP-16); 이포스파미드; 미톡산트론; 빈크리스틴; 비노렐빈 (NAVELBINE®); 노반트론; 테니포시드; 에다트렉세이트; 다우노마이신; 아미노프테린; 카페시타빈 (XELODA®, 로슈 (Roche)); 이반드로네이트; CPT-11; 토포이소머라제 억제제 RFS 2000; 디플루오로메틸오르니틴 (DMFO); 레티노이드, 예를 들어 레티노산; 및 상기 임의의 물질의 제약상 허용되는 염, 산 및 유도체.
또한, "화학요법제"의 정의에는 다음이 포함된다: (i) 종양에 대한 호르몬 작용을 조절하거나 억제하는 작용을 하는 항-호르몬제, 예를 들어 항-에스트로겐 및 선택적 에스트로겐 수용체 조절인자 (SERM), 예를 들어 타목시펜 (NOLVADEX®; 타목시펜 시트레이트 포함), 랄록시펜, 드로록시펜, 4-히드록시타목시펜, 트리옥시펜, 케옥시펜, LY117018, 오나프리스톤, 및 FARESTON® (토레미펜 시트레이트); (ii) 부신선에서 에스트로겐 생산을 조절하는 효소 아로마타제를 억제하는 아로마타제 억제제, 예를 들어, 4(5)-이미다졸, 아미노글루테치미드, MEGASE® (메게스트롤 아세테이트), AROMASIN® (엑세메스탄; 화이자), 포르메스탄, 파드로졸, RIVISOR® (보로졸), FEMARA® (레트로졸; 노바티스), 및 ARIMIDEX® (아나스트로졸; 아스트라제네카); (iii) 항-안드로겐, 예를 들어 플루타미드, 닐루타미드, 비칼루타미드, 류프롤리드, 및 고세렐린; 및 트록사시타빈 (1,3-디옥솔란 뉴클레오시드 시토신 유사체); (iv) 단백질 키나제 억제제, 예를 들어 MEK 억제제 (WO 2007/044515); (v) 지질 키나제 억제제; (vi) 안티센스 올리고뉴클레오티드, 특히 이상 세포 증식에 연관되는 신호 전달 경로에서 유전자의 발현을 억제하는 것, 예를 들어 PKC-알파, Raf, H-Ras, 예를 들어 오블리메르센 (GENASENSE®, 겐타 인크. (Genta Inc.)); (vii) 리보자임, 예를 들어 VEGF 발현 억제제 (예를 들어, ANGIOZYME®) 및 HER2 발현 억제제; (viii) 백신, 예를 들어 유전자 요법 백신, 예를 들어 ALLOVECTIN®, LEUVECTIN®, 및 VAXID®; PROLEUKIN® rIL-2; 토포이소머라제 1 억제제, 예를 들어 LURTOTECAN®; ABARELIX® rmRH; (ix) 항-혈관신생제, 예를 들어 베바치주맙 (AVASTIN®, 제넨테크); 및 상기 임의의 물질의 제약상 허용되는 염, 산 및 유도체.
또한, "화학요법제"의 정의에는 치료 항체, 예를 들어 알렘투주맙 (캄파쓰 (Campath)), 베바치주맙 (AVASTIN®, 제넨테크); 세툭시맙 (ERBITUX®, 임클론 (Imclone)); 파니투무맙 (VECTIBIX®, 암젠 (Amgen)), 리툭시맙 (Rituxan®, 제넨테크/바이오겐 이덱 (Biogen Idec)), 퍼투주맙 (OMNITARG™, 2C4, 제넨테크), 트라스투주맙 (HERCEPTIN®, 제넨테크), 토시투모맙 (벡사 (Bexxar), 코릭시아 (Corixia)), 및 항체 약물 접합체, 겜투주맙 오조가미신 (MYLOTARG®, 와이어스)이 포함된다.
본원에서 사용될 때, "성장 억제제"는 시험관 내에서 또는 생체 내에서 세포, 특히 TAHO-발현 암세포의 성장을 억제하는 화합물 또는 조성물을 의미한다. 따라서, 성장 억제제는 S기에서 TAHO-발현 세포의 비율을 유의하게 감소시키는 것일 수 있다. 성장 억제제의 예는 세포 주기 진행을 (S기 이외의 다른 시기에) 차단하는 물질, 예를 들어 G1 정지 및 M기 정지를 유도하는 물질을 포함한다. 전통적인 M기 차단제는 빈카 (빈크리스틴 및 빈블라스틴), 탁산 및 토포이소머라제 II 억제제, 예를 들어 독소루비신, 에피루비신, 다우노루비신, 에토포시드 및 블레오마이신을 포함한다. G1을 정지시키는 물질, 예를 들어 DNA 알킬화제, 예를 들어 타목시펜, 프레드니손, 다카르바진, 메클로레타민, 시스플라틴, 메토트렉세이트, 5-플루오로우라실 및 아라-C는 S기 정지로까지 이어질 수 있다. 추가의 정보는 문헌 [The Molecular Basis of Cancer, Mendelsohn and Israel, eds., Chapter 1, entitled "Cell cycle regulation, oncogenes, and antineoplastic drugs" by Murakami et al., (WB Saunders: Philadelphia, 1995), 특히 p.13]에서 볼 수 있다. 탁산 (파클리탁셀 및 도세탁셀)은 주목에서 유도된 항암 약물이다. 유럽 주목에서 유도된 도세탁셀 (TAXOTERE®, 롱-프랑 로러 (Rhone-Poulenc Rorer))은 파클리탁셀 (TAXOL®, 브리스톨-마이어스 스퀴브)의 반합성 유사체이다. 파클리탁셀 및 도세탁셀은 튜불린 이량체로부터 미세관의 회합을 촉진시키고, 세포의 유사분열을 억제하는 탈중합을 억제함으로써 미세관을 안정화시킨다.
"독소루비신"은 안트라사이클린 항생제이다. 독소루비신의 전체적인 화학 명칭은 (8S-cis)-10-[(3-아미노-2,3,6-트리데옥시-α-L-릭소-헥사피라노실)옥시]-7,8,9,10-테트라히드로-6,8,11-트리히드록시-8-(히드록시아세틸)-1-메톡시-5,12-나프타센디온이다.
용어 "시토킨"은 세포간 매개자로서 다른 세포에 대해 작용하는 한 세포 집단에 의해 방출되는 단백질에 대한 관용어이다. 상기 시토킨의 예는 림포킨, 모노킨 및 전통적인 폴리펩티드 호르몬이다. 시토킨에는 성장 호르몬, 예를 들어 인간 성장 호르몬, N-메티오닐 인간 성장 호르몬 및 소 성장 호르몬; 부갑상선 호르몬; 티록신; 인슐린; 전구인슐린; 릴랙신; 프로릴랙신; 당단백질 호르몬, 예를 들어 난포 자극 호르몬 (FSH), 갑상선 자극 호르몬 (TSH) 및 황체 형성 호르몬 (LH); 간 성장인자; 섬유모세포 성장인자; 프로락틴; 태반 락토겐; 종양 괴사 인자-α 및 -β; 뮬러관 억제 물질; 마우스 고나도트로핀-회합 펩티드; 인히빈; 악티빈; 혈관내피 성장인자; 인테그린; 트롬보포이에틴 (TPO); 신경 성장인자, 예를 들어 NGF-β; 혈소판-성장인자; 전환 성장인자 (TGF), 예를 들어 TGF-α 및 TGF-β; 인슐린 유사 성장인자-I 및 -II; 에리트로포이에틴 (EPO); 골유도 인자; 인터페론, 예를 들어 인터페론-α, -β 및 -γ; 콜로니 자극 인자 (CSF), 예를 들어 대식세포-CSF (M-CSF); 과립구-대식세포-CSF (GM-CSF); 및 과립구-CSF (G-CSF); 인터루킨 (IL), 예를 들어 IL-1, IL-1a, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-11, IL-12; 종양 괴사 인자, 예를 들어 TNF-α 또는 TNF-β; 및 LIF 및 kit 리간드 (KL)를 포함하는 다른 폴리펩티드 인자가 포함된다. 본원에서 사용되는 바와 같이, 용어 시토킨은 천연 공급원 또는 재조합 세포 배양액으로부터의 단백질 및 천연 서열 시토킨의 생물학적 활성 균등물을 포함한다.
용어 "포장 삽입물"은 적응증, 사용, 투여량, 투여에 대한 정보, 금기사항 및/또는 치료 제품 사용에 대한 경고를 포함하는, 치료 제품의 상업적 포장에 통상적으로 포함되는 사용 지시물을 지칭하기 위해 사용된다.
용어 "세포내 대사물질"은 항체-약물 접합체 (ADC)에 대한 세포 내부의 대사 과정 또는 반응으로부터 생성되는 화합물이다. 대사 과정 또는 반응은 효소 과정, 예를 들어 ADC의 펩티드 링커의 단백 분해 절단, 또는 관능기, 예를 들어 히드라존, 에스테르, 또는 아미드의 가수분해일 수 있다. 세포내 대사물질은 세포 내로의 도입, 확산, 섭취 또는 수송 후에 세포내 절단을 겪는 항체 및 유리 약물을 포함하고 이로 제한되지 않는다.
용어 "세포 내에서 절단된" 및 "세포내 절단"은 약물 모이어티 (D)와 항체 (Ab) 사이의 공유 결합에 의해 부착, 즉 링커가 파괴되어 유리 약물을 세포 내에서 항체로부터 해리시키는, 항체-약물 접합체 (ADC)에 대한 세포 내의 대사 과정 또는 반응을 의미한다. 따라서, ADC의 절단된 모이어티는 세포내 대사물질이다.
용어 "생체이용률"은 환자에게 투여된 약물의 소정량의 전신 이용률 (즉, 혈액/혈장 수준)을 의미한다. 생체이용률은 투여된 투여형으로부터 전신 순환계에 도달하는 약물의 시간 (속도) 및 총량 (정도)의 측정치를 나타내는 절대적인 용어이다.
용어 "세포독성 활성"은 ADC 또는 ADC의 세포내 대사물질의 세포-사멸, 세포증식 억제 또는 성장 억제 효과를 의미한다. 세포독성 활성은 1/2의 세포가 생존하는 단위 부피당 농도 (몰 또는 질량)인 IC50 값으로서 표현될 수 있다.
용어 "알킬"은 본원에서 사용될 때 1 내지 12개의 탄소 원자 (C1-C12)의 포화 직쇄 또는 분지쇄 1가 탄화수소 라디칼을 나타내고, 여기서 알킬 라디칼은 임의로 아래에서 설명되는 하나 이상의 치환체로 독립적으로 치환될 수 있다. 다른 실시태양에서, 알킬 라디칼은 1 내지 8개의 탄소 원자 (C1-C8), 또는 1 내지 6개의 탄소 원자 (C1-C6)이다. 알킬기의 예는 메틸 (Me, -CH3), 에틸 (Et, -CH2CH3), 1-프로필 (n-Pr, n-프로필, -CH2CH2CH3), 2-프로필 (i-Pr, i-프로필, -CH(CH3)2), 1-부틸 (n-Bu, n-부틸, -CH2CH2CH2CH3), 2-메틸-1-프로필 (i-Bu, i-부틸, -CH2CH(CH3)2), 2-부틸 (s-Bu, s-부틸, -CH(CH3)CH2CH3), 2-메틸-2-프로필 (t-Bu, t-부틸, -C(CH3)3), 1-펜틸 (n-펜틸, -CH2CH2CH2CH2CH3), 2-펜틸 (-CH(CH3)CH2CH2CH3), 3-펜틸 (-CH(CH2CH3)2), 2-메틸-2-부틸 (-C(CH3)2CH2CH3), 3-메틸-2-부틸 (-CH(CH3)CH(CH3)2), 3-메틸-1-부틸 (-CH2CH2CH(CH3)2), 2-메틸-1-부틸 (-CH2CH(CH3)CH2CH3), 1-헥실 (-CH2CH2CH2CH2CH2CH3), 2-헥실 (-CH(CH3)CH2CH2CH2CH3), 3-헥실 (-CH(CH2CH3)(CH2CH2CH3)), 2-메틸-2-펜틸 (-C(CH3)2CH2CH2CH3), 3-메틸-2-펜틸 (-CH(CH3)CH(CH3)CH2CH3), 4-메틸-2-펜틸 (-CH(CH3)CH2CH(CH3)2), 3-메틸-3-펜틸 (-C(CH3)(CH2CH3)2), 2-메틸-3-펜틸 (-CH(CH2CH3)CH(CH3)2), 2,3-디메틸-2-부틸 (-C(CH3)2CH(CH3)2), 3,3-디메틸-2-부틸 (-CH(CH3)C(CH3)3, 1-헵틸, 1-옥틸 등을 포함하고 이로 제한되지 않는다.
용어 "알케닐"은 적어도 하나의 불포화 부위, 즉 탄소-탄소, sp2 이중 결합을 갖는 2 내지 8개의 탄소 원자 (C2-C8)의 선형 또는 분지쇄 1가 탄화수소 라디칼을 나타내고, 여기서 알케닐 라디칼은 임의로 본원에서 설명되는 하나 이상의 치환체로 독립적으로 치환될 수 있고, "시스" 및 "트랜스" 배향, 또는 별법으로, "E" 및 "Z" 배향을 갖는 라디칼을 포함한다. 그 예는 에틸렌 또는 비닐 (-CH=CH2), 알릴 (-CH2CH=CH2) 등을 포함한다.
용어 "알키닐"은 적어도 하나의 불포화 부위, 즉 탄소-탄소, sp 삼중 결합을 갖는 2 내지 8개의 탄소 원자 (C2-C8)의 선형 또는 분지쇄 1가 탄화수소 라디칼을 나타내고, 여기서 알키닐 라디칼은 임의로 본원에서 설명되는 하나 이상의 치환체로 독립적으로 치환될 수 있다. 그 예는 에티닐 (-C≡CH), 프로피닐 (프로파르길, -CH2C≡CH) 등을 포함하고 이로 제한되지 않는다.
용어 "카르보사이클", "카르보시클릴", "카르보시클릭 고리" 및 "시클로알킬"은 모노시클릭 고리로서 3 내지 12개의 탄소 원자 (C2-C12) 또는 비시클릭 고리로서 7 내지 12개의 탄소 원자를 갖는 1가의 비-방향족 포화 또는 부분 불포화 고리를 의미한다. 7 내지 12개의 원자를 갖는 비시클릭 카르보사이클은 예를 들어 비시클로 [4,5], [5,5], [5,6] 또는 [6,6] 시스템으로 배열될 수 있고, 9 또는 10개의 고리 원자를 갖는 비시클릭 카르보사이클은 비시클로 [5,6] 또는 [6,6] 시스템으로서, 또는 가교 시스템, 예를 들어 비시클로[2.2.1]헵탄, 비시클로[2.2.2]옥탄 및 비시클로[3.2.2]노난으로서 배열될 수 있다. 모노시클릭 카르보사이클의 예는 시클로프로필, 시클로부틸, 시클로펜틸, 1-시클로펜트-1-에닐, 1-시클로펜트-2-에닐, 1-시클로펜트-3-에닐, 시클로헥실, 1-시클로헥스-1-에닐, 1-시클로헥스-2-에닐, 1-시클로헥스-3-에닐, 시클로헥사디에닐, 시클로헵틸, 시클로옥틸, 시클로노닐, 시클로데실, 시클로운데실, 시클로도데실 등을 포함하고 이로 제한되지 않는다.
"아릴"은 모 방향족 고리계의 단일 탄소 원자로부터 하나의 수소 원자의 제거에 의해 유도된 6-20개의 탄소 원자 (C6-C20)의 1가 방향족 탄화수소 라디칼을 의미한다. 일부 아릴기는 예시적인 구조에서 "Ar"로 표시된다. 아릴은 포화, 부분 불포화 고리, 또는 방향족 카르보시클릭 고리에 융합된 방향족 고리를 포함하는 비시클릭 라디칼을 포함한다. 일반적인 아릴기는 벤젠으로부터 유도된 라디칼 (페닐), 치환 벤젠, 나프탈렌, 안트라센, 비페닐, 인데닐, 인다닐, 1,2-디히드로나프탈렌, 1,2,3,4-테트라히드로나프틸 등을 포함하고 이로 제한되지 않는다. 아릴기는 임의로 본원에서 설명되는 하나 이상의 치환체로 독립적으로 치환된다.
용어 "헤테로사이클", "헤테로시클릴" 및 "헤테로시클릭 고리"는 본원에서 상호 교환가능하게 사용되고, 적어도 하나의 고리 원자가 질소, 산소, 인 및 황 중에서 선택된 헤테로원자이고, 나머지 고리 원자는 C인 3 내지 20개의 고리 원자의 포화 또는 부분 불포화 (즉, 하나 이상의 이중 및/또는 삼중 결합을 고리 내에 갖는다) 카르보시클릭 라디칼을 의미하고, 여기서 하나 이상의 고리 원자는 임의로 아래에서 설명되는 하나 이상의 치환체로 독립적으로 치환된다. 헤테로사이클은 3 내지 7원의 모노사이클 (2 내지 6개의 탄소 원자 및 N, O, P, 및 S 중에서 선택된 1 내지 4개의 헤테로원자) 또는 7 내지 10원의 비사이클 (4 내지 9개의 탄소 원자 및 N, O, P, 및 S 중에서 선택된 1 내지 6개의 헤테로원자), 예를 들어 비시클로 [4,5], [5,5], [5,6], 또는 [6,6] 시스템일 수 있다. 헤테로사이클은 문헌 [Paquette, Leo A.; "Principles of Modern Heterocyclic Chemistry" (W.A. Benjamin, New York, 1968), 특히 Chapters 1, 3, 4, 6, 7, and 9]; ["The Chemistry of Heterocyclic Compounds, A series of Monographs" (John Wiley & Sons, New York, 1950 to present), 특히 Volumes 13, 14, 16, 19, and 28]; 및 [J. Am. Chem. Soc. (1960) 82:5566]에 기재되어 있다. 또한, "헤테로시클릴"은 헤테로사이클 라디칼이 포화, 부분 불포화 고리, 또는 방향족 카르보시클릭 또는 헤테로시클릭 고리에 융합된 라디칼을 포함한다. 헤테로시클릭 고리의 예는 피롤리디닐, 테트라히드로푸라닐, 디히드로푸라닐, 테트라히드로티에닐, 테트라히드로피라닐, 디히드로피라닐, 테트라히드로티오피라닐, 피페리디노, 모르폴리노, 티오모르폴리노, 티옥사닐, 피페라지닐, 호모피페라지닐, 아제티디닐, 옥세타닐, 티에타닐, 호모피페리디닐, 옥세파닐, 티에파닐, 옥사제피닐, 디아제피닐, 티아제피닐, 2-피롤리닐, 3-피롤리닐, 인돌리닐, 2H-피라닐, 4H-피라닐, 디옥사닐, 1,3-디옥솔라닐, 피라졸리닐, 디티아닐, 디티올라닐, 디히드로피라닐, 디히드로티에닐, 디히드로푸라닐, 피라졸리디닐이미다졸리닐, 이미다졸리디닐, 3-아자비시클로[3.1.0]헥사닐, 3-아자비시클로[4.1.0]헵타닐, 아자비시클로[2.2.2]헥사닐, 3H-인돌릴 퀴놀리지닐 및 N-피리딜 우레아를 포함하고 이로 제한되지 않는다. 또한, 스피로 모이어티가 상기 정의 내에 포함된다. 2개의 고리 탄소 원자가 옥소 (=O) 모이어티로 치환된 헤테로시클릭기의 예는 피리미디노닐 및 1,1-디옥소-티오모르폴리닐이다. 본원에서 헤테로사이클기는 임의로 본원에서 설명되는 하나 이상의 치환체로 독립적으로 치환된다.
용어 "헤테로아릴"은 5원, 6원, 또는 7원 고리의 1가 방향족 라디칼을 의미하고, 질소, 산소, 및 황 중에서 독립적으로 선택된 하나 이상의 헤테로원자를 함유하는, 5-20개 원자의 융합 고리계 (이 중 적어도 하나는 방향족임)를 포함한다. 헤테로아릴기의 예는 피리디닐 (예를 들어 2-히드록시피리디닐 포함), 이미다졸릴, 이미다조피리디닐, 피리미디닐 (예를 들어 4-히드록시피리미디닐 포함), 피라졸릴, 트리아졸릴, 피라지닐, 테트라졸릴, 푸릴, 티에닐, 이속사졸릴, 티아졸릴, 옥사졸릴, 이소티아졸릴, 피롤릴, 퀴놀리닐, 이소퀴놀리닐, 인돌릴, 벤즈이미다졸릴, 벤조푸라닐, 신놀리닐, 인다졸릴, 인돌리지닐, 프탈라지닐, 피리다지닐, 트리아지닐, 이소인돌릴, 프테리디닐, 푸리닐, 옥사디아졸릴, 트리아졸릴, 티아디아졸릴, 티아디아졸릴, 푸라자닐, 벤조푸라자닐, 벤조티오페닐, 벤조티아졸릴, 벤즈옥사졸릴, 퀴나졸리닐, 퀴녹살리닐, 나프티리디닐, 및 푸로피리디닐이다. 헤테로아릴기는 임의로 본원에서 설명되는 하나 이상의 치환체로 독립적으로 치환된다.
헤테로사이클 또는 헤테로아릴기는 가능한 경우에 탄소 (탄소-연결된), 또는 질소 (질소-연결된) 결합될 수 있다. 비제한적인 예로서, 탄소 결합되는 헤테로사이클 또는 헤테로아릴은 피리딘의 위치 2, 3, 4, 5, 또는 6, 피리다진의 위치 3, 4, 5, 또는 6, 피리미딘의 위치 2, 4, 5, 또는 6, 피라진의 위치 2, 3, 5, 또는 6, 푸란, 테트라히드로푸란, 티오푸란, 티오펜, 피롤 또는 테트라히드로피롤의 위치 2, 3, 4, 또는 5, 옥사졸, 이미다졸 또는 티아졸의 위치 2, 4, 또는 5, 이속사졸, 피라졸, 또는 이소티아졸의 위치 3, 4, 또는 5, 아지리딘의 위치 2 또는 3, 아제티딘의 위치 2, 3, 또는 4, 퀴놀린의 위치 2, 3, 4, 5, 6, 7, 또는 8 또는 이소퀴놀린의 위치 1, 3, 4, 5, 6, 7, 또는 8에 결합된다.
비제한적인 예로서, 질소 결합되는 헤테로사이클 또는 헤테로아릴은 아지리딘, 아제티딘, 피롤, 피롤리딘, 2-피롤린, 3-피롤린, 이미다졸, 이미다졸리딘, 2-이미다졸린, 3-이미다졸린, 피라졸, 피라졸린, 2-피라졸린, 3-피라졸린, 피페리딘, 피페라진, 인돌, 인돌린, 1H-인다졸의 위치 1, 이소인돌, 또는 이소인돌린의 위치 2, 모르폴린의 위치 4, 및 카르바졸, 또는 β-카르볼린의 위치 9에 결합된다.
"알킬렌"은 1-18개 탄소 원자의 포화, 분지쇄 또는 직쇄 또는 시클릭 탄화수소 라디칼을 의미하고, 모 알칸의 동일한 또는 2개의 상이한 탄소 원자로부터 2개의 수소 원자의 제거에 의해 유도되는 2개의 1가 라디칼 중심을 갖는다. 대표적인 알킬렌 라디칼은 메틸렌 (-CH2-), 1,2-에틸 (-CH2CH2-), 1,3-프로필 (-CH2CH2CH2-), 1,4-부틸 (-CH2CH2CH2CH2-) 등을 포함하고 이로 제한되지 않는다.
"C1-C10 알킬렌"은 화학식 -(CH2)1-10-의 직쇄, 포화 탄화수소기이다. C1-C10 알킬렌의 예는 메틸렌, 에틸렌, 프로필렌, 부틸렌, 펜틸렌, 헥실렌, 헵틸렌, 옥틸렌, 노닐렌 및 데칼렌을 포함한다.
"알케닐렌"은 2-18개 탄소 원자의 불포화, 분지쇄 또는 직쇄 또는 시클릭 탄화수소 라디칼을 의미하고, 모 알켄의 동일한 또는 2개의 상이한 탄소 원자로부터 2개의 수소 원자의 제거에 의해 유도되는 2개의 1가 라디칼 중심을 갖는다. 대표적인 알케닐렌 라디칼은 1,2-에틸렌 (-CH=CH-)을 포함하고 이로 제한되지 않는다.
"알키닐렌"은 2-18개 탄소 원자의 불포화, 분지쇄 또는 직쇄 또는 시클릭 탄화수소 라디칼을 의미하고, 모 알킨의 동일한 또는 2개의 상이한 탄소 원자로부터 2개의 수소 원자의 제거에 의해 유도되는 2개의 1가 라디칼 중심을 갖는다. 대표적인 알키닐렌 라디칼은 아세틸렌 (-C≡C-), 프로파르길 (-CH2C≡C-), 및 4-펜티닐 (-CH2CH2CH2C≡C-)을 포함하고 이로 제한되지 않는다.
"아릴렌"은 하기 구조로 제시되는 바와 같이 2개의 공유 결합을 가지며 오르토, 메타, 또는 파라 입체형태로 존재할 수 있는 아릴기이다:
상기 식에서, 페닐 기는 비치환되거나, 또는 -C1-C8 알킬, -O-(C1-C8 알킬), -아릴, -C(O)R', -OC(O)R', -C(O)OR', -C(O)NH2, -C(O)NHR', -C(O)N(R')2-NHC(O)R', -S(O)2R', -S(O)R', -OH, -할로겐, -N3, -NH2, -NH(R'), -N(R')2 및 -CN (여기서, 각각의 R'는 독립적으로 H, -C1-C8 알킬 및 아릴로부터 선택됨)을 포함하고 이로 제한되지 않는 4개 이하의 기로 치환될 수 있다.
"아릴알킬"은 탄소 원자 (통상적으로 말단 또는 sp3 탄소 원자)에 결합한 수소 원자 중의 하나가 아릴 라디칼로 대체된 비환식 알킬 라디칼을 의미한다. 대표적인 아릴알킬기는 벤질, 2-페닐에탄-1-일, 2-페닐에텐-1-일, 나프틸메틸, 2-나프틸에탄-1-일, 2-나프틸에텐-1-일, 나프토벤질, 2-나프토페닐에탄-1-일 등을 포함하고 이로 제한되지 않는다. 아릴알킬기는 6 내지 20개의 탄소 원자를 포함하고, 예를 들어 알카닐, 알케닐 또는 알키닐기를 포함하는, 아릴알킬기의 알킬 모이어티는 1 내지 6개의 탄소 원자를 포함하고, 아릴 모이어티는 5 내지 14개의 탄소 원자를 포함한다.
"헤테로아릴알킬"은 탄소 원자, 통상적으로 말단 또는 sp3 탄소 원자에 결합한 수소 원자 중의 하나가 헤테로아릴 라디칼로 대체된 비환식 알킬 라디칼을 의미한다. 통상적인 헤테로아릴알킬기는 2-벤즈이미다졸릴메틸, 2-푸릴에틸 등을 포함하고 이로 제한되지 않는다. 헤테로아릴알킬기는 탄소 원자 6 내지 20개를 포함하며, 예를 들어, 알카닐, 알케닐 또는 알키닐기를 포함하는, 헤테로아릴알킬기의 알킬 모이어티는 1 내지 6개의 탄소 원자를 포함하고 헤테로아릴 모이어티는 5 내지 14개의 탄소 원자 및 N, O, P, 및 S로부터 선택된 1 내지 3개의 헤테로원자를 포함한다. 헤테로아릴알킬기의 헤테로아릴 모이어티는 3 내지 7원의 모노사이클 (탄소 원자 2 내지 6개) 또는 7 내지 10원의 비사이클 (탄소 원자 4 내지 9개 및 N, O, P, 및 S로부터 선택된 헤테로원자 1 내지 3개), 예를 들어 비시클로 [4,5], [5,5], [5,6], 또는 [6,6] 시스템일 수 있다.
본원에 사용되는 용어 "전구약물"은 모 화합물 또는 약물에 비해 세포에 대한 세포독성이 작을 수 있고 효소에 의해 또는 가수분해에 의해 활성화되거나 보다 활성의 모 형태로 전환될 수 있는, 본 발명의 화합물의 전구체 또는 유도체 형태를 의미한다 (예를 들어, [Wilman, "Prodrugs in Cancer Chemotherapy" Biochemical Society Transactions, 14, pp. 375-382, 615th Meeting Belfast (1986)] 및 [Stella et al., "Prodrugs: A Chemical Approach to Targeted Drug Delivery," Directed Drug Delivery, Borchardt et al. (ed.), pp. 247-267, Humana Press (1985)] 참조). 본 발명의 전구약물은 보다 활성인 세포독성 유리 약물로 전환될 수 있는 포스페이트-함유 전구약물, 티오포스페이트-함유 전구약물, 술페이트-함유 전구약물, 펩티드-함유 전구약물, D-아미노산-변형 전구약물, 글리코실화 전구약물, 베타-락탐-함유 전구약물, 임의 치환된 페녹시아세타미드-함유 전구약물, 임의 치환된 페닐아세타미드-함유 전구약물, 5-플루오로시토신 및 다른 5-플루오로우리딘 전구약물을 포함하지만 이로 제한되지 않는다. 본 발명에서 사용하기 위한 전구약물 형태로 유도체화될 수 있는 세포독성 약물의 예는 상기한 본 발명의 화합물 및 화학요법제를 포함하지만 이로 제한되지 않는다.
"대사물질"은 특정 화합물 또는 그의 염의 신체 내의 대사를 통해 생산된 산물이다. 화합물의 대사물질은 당업계에 공지된 통상적인 기술을 사용하여 확인할 수 있고, 그 활성은 본원에서 설명되는 바와 같은 시험을 사용하여 결정할 수 있다. 상기 산물은 예를 들어 투여된 화합물의 산화, 환원, 가수분해, 아미드화, 탈아미드화, 에스테르화, 탈에스테르화, 효소에 의한 절단 등에 의해 생성될 수 있다. 따라서, 본 발명은 본 발명의 화합물을 그의 대사 산물 생성에 충분한 시간 동안 포유동물과 접촉시키는 것을 포함하는 과정에 의해 생산된 화합물을 포함하는, 본 발명의 화합물의 대사물질을 포함한다.
"리포좀"은 약물을 포유동물에게 전달하기 위해 유용한 다양한 종류의 지질, 인지질 및/또는 계면활성제로 구성된 작은 소포이다. 리포좀의 성분들은 통상적으로 생물학적 막의 지질 배열에 유사한 2층 구조로 배열된다.
"링커"는 공유 결합을 포함하는 화학적 모이어티 또는 항체를 약물 모이어티에 공유 결합에 의해 부착시키는 원자의 사슬을 의미한다. 다양한 실시태양에서, 링커는 알킬디일, 아릴디일, 헤테로아릴디일과 같은 2가 라디칼, 알킬옥시의 반복 단위 -(CR2)nO(CR2)n- (예를 들어, 폴리에틸레녹시, PEG, 폴리메틸레녹시), 및 알킬아미노 (예를 들어, 폴리에틸렌아미노, 제프아민 (Jeffamine)™))와 같은 모이어티; 및 숙시네이트, 숙신아미드, 디글리콜레이트, 말로네이트, 및 카프로아미드를 포함하는 이산 에스테르 및 아미드를 포함한다.
용어 "키랄"은 거울상 파트너에 겹쳐질 수 없는 특성을 갖는 분자를 의미하고, 용어 "아키랄"은 그의 거울상 파트너에 겹쳐질 수 있는 분자를 의미한다.
용어 "입체 이성질체"는 동일한 화학적 구성을 갖지만, 공간의 원자 또는 기의 배열에서 상이한 화합물을 의미한다.
"부분 입체 이성질체"는 2 이상의 키랄 중심이 있고 이들 분자가 서로 거울상이 아닌 입체 이성질체를 의미한다. 부분 입체 이성질체는 상이한 물리적 특성, 예를 들어, 융점, 비점, 스펙트럼 성질, 및 반응성을 갖는다. 부분 입체 이성질체의 혼합물은 전기영동 및 크로마토그래피와 같은 고 분해능 분석 절차 하에 분리될 수 있다.
"거울상 이성질체"는 서로 겹쳐질 수 없는 거울상인 두 개의 입체 이성질체 화합물을 의미한다.
본원에서 사용된 입체화학 정의 및 규약은 일반적으로 문헌 ([S. P. Parker, Ed., McGraw-Hill Dictionary of Chemical Terms (1984) McGraw-Hill Book Company, New York]; 및 [Eliel, E. and Wilen, S., Stereochemistry of Organic Compounds (1994) John Wiley & Sons, Inc. New York])을 따른다. 많은 유기 화합물은 광학 활성 형태로 존재한다. 즉, 이들은 평면 편광의 평면을 회전하는 능력을 가진다. 광학 활성 화합물을 설명함에 있어서, 접두어 D 및 L, 또는 R 및 S는 그의 키랄 중심(들)에 대해 분자의 절대적 입체형태를 표시하기 위해 사용된다. 접두어 d 및 l 또는 (+) 및 (-)은 화합물에 의한 평면 평광 회전 표시를 나타내기 위해 사용되는데, (-) 또는 l은 화합물이 좌선성임을 의미한다. 접두어 (+) 또는 d로 표시된 화합물은 우선성이다. 주어진 화학적 구조에서, 이 입체 이성질체는 이들이 서로 거울상이라는 것만 제외하고는 동일하다. 특정 입체 이성질체는 또한 거울상 이성질체로 불릴 수 있고, 이러한 이성질체의 혼합물은 종종 거울상 이성질체 혼합물로 불린다. 거울상 이성질체의 50:50 혼합물은 라세미 혼합물 또는 라세미체로 불리는데, 이들은 화학적 반응 또는 과정에 있어, 임의의 입체선택성 또는 입체특이성도 존재하지 않은 경우가 있을 수 있다. 용어 "라세미 혼합물" 및 "라세미체"는 광학 활성이 없는, 두 개의 거울상 이성질체 종의 등몰 혼합물을 의미한다.
용어 "호변 이성질체" 또는 "호변 이성질체 형태"는 낮은 에너지 장벽을 통해 상호 전환될 수 있는 상이한 에너지의 구조 이성질체를 의미한다. 예를 들어, 양성자 호변 이성질체 (양성자성 (prototropic) 호변 이성질체로도 알려짐)는 양성자의 이동을 통한 상호전환, 예를 들어 케토-에놀 및 이민-엔아민 이성체화를 포함한다. 원자가 (valence) 호변 이성질체는 결합 전자의 일부의 재구성에 의해 상호전환을 포함한다.
구문 "제약상 허용되는 염"은 본원에서 사용될 때 본 발명의 화합물의 제약상 허용되는 유기 또는 무기 염을 의미한다. 예시적인 염은 술페이트, 시트레이트, 아세테이트, 옥살레이트, 클로라이드, 브로마이드, 요오다이드, 니트레이트, 비술페이트, 포스페이트, 산 포스페이트, 이소니코티네이트, 락테이트, 살리실레이트, 산 시트레이트, 타르트레이트, 올레에이트, 탄네이트, 판토테네이트, 비타르트레이트, 아스코르베이트, 숙시네이트, 말레에이트, 겐티시네이트, 푸마레이트, 글루코네이트, 글루쿠로네이트, 사카레이트, 포르메이트, 벤조에이트, 글루타메이트, 메탄술포네이트 "메실레이트", 에탄술포네이트, 벤젠술포네이트, p-톨루엔술포네이트, 및 파모에이트 (즉, 1,1'-메틸렌-비스(2-히드록시-3-나프토에이트)) 염을 포함하지만 이로 제한되지 않는다. 제약상 허용되는 염은 다른 분자, 예를 들어 아세테이트 이온, 숙시네이트 이온 또는 다른 반대 이온의 도입을 수반할 수 있다. 반대 이온은 모 화합물의 전하를 안정화시키는 임의의 유기 또는 무기 모이어티일 수 있다. 또한, 제약상 허용되는 염은 그의 구조 내에 2 이상의 하전 원자를 가질 수 있다. 다수의 하전 원자가 제약상 허용되는 염의 일부인 경우에는 다수의 반대 이온을 가질 수 있다. 따라서, 제약상 허용되는 염은 하나 이상의 하전 원자 및/또는 하나 이상의 반대 이온을 가질 수 있다.
본 발명의 화합물이 염기이면, 목적하는 제약상 허용되는 염은 당업계에 이용가능한 임의의 적합한 방법, 예를 들어 유리 염기의 무기산, 예를 들어 염산, 브롬화수소산, 황산, 질산, 메탄술폰산, 인산 등, 또는 유기산, 예를 들어 아세트산, 트리플루오로아세트산, 말레산, 숙신산, 만델산, 푸마르산, 말론산, 피루브산, 옥살산, 글리콜산, 살리실산, 피라노시드산, 예를 들어 글루쿠론산 또는 갈락투론산, 알파 히드록시산, 예를 들어 시트르산 또는 타르타르산, 아미노산, 예를 들어 아스파르트산 또는 글루탐산, 방향족 산, 예를 들어 벤조산 또는 신남산, 술폰산, 예를 들어 p-톨루엔술폰산 또는 에탄술폰산 등의 처리에 의해 제조될 수 있다.
본 발명의 화합물이 산이면, 목적하는 제약상 허용되는 염은 임의의 적합한 방법, 예를 들어 유리 산의 무기 또는 유기 염기, 예를 들어 아민 (1차, 2차 또는 3차), 알칼리 금속 수산화물 또는 알칼리 토금속 수산화물 등의 처리에 의해 제조될 수 있다. 적합한 염의 예는 아미노산, 예를 들어 글라이신 및 아르기닌, 암모니아, 1차, 2차 및 3차 아민, 및 시클릭 아민, 예를 들어 피페리딘, 모르폴린 및 피페라진으로부터 유도된 유기 염, 및 나트륨, 칼슘, 칼륨, 마그네슘, 망간, 철, 구리, 아연, 알루미늄 및 리튬으로부터 유도된 무기 염을 포함하지만 이로 제한되지 않는다.
구문 "제약상 허용되는"은 물질 또는 조성물이 제제를 구성하는 다른 성분, 및/또는 그로 치료되는 포유동물과 화학적으로 및/또는 독성학적으로 상용성이어야 함을 나타낸다.
"용매화물"은 하나 이상의 용매 분자와 본 발명의 화합물의 회합체 또는 복합체를 의미한다. 용매화물을 형성하는 용매의 예는 물, 이소프로판올, 에탄올, 메탄올, DMSO, 에틸 아세테이트, 아세트산, 및 에탄올아민을 포함하지만 이로 제한되지 않는다. 용어 "수화물"은 용매 분자가 물인 복합체를 의미한다.
용어 "보호기"는 화합물 상의 다른 관능기와 반응하면서 특정 관능기를 차단 또는 보호하기 위해 통상적으로 사용되는 치환기를 의미한다. 예를 들어, "아미노-보호기"는 화합물 내의 아미노 관능기를 차단 또는 보호하는, 아미노기에 부착된 치환기이다. 적합한 아미노-보호기는 아세틸, 트리플루오로아세틸, t-부톡시카르보닐 (BOC), 벤질옥시카르보닐 (CBZ) 및 9-플루오레닐메틸렌옥시카르보닐 (Fmoc)을 포함한다. 유사하게, "히드록시-보호기"는 히드록시 관능기를 차단 또는 보호하는, 히드록시기의 치환기를 의미한다. 적합한 보호기는 아세틸 및 실릴을 포함한다. "카르복시-보호기"는 카르복시 관능기를 차단 또는 보호하는, 카르복시기의 치환기를 의미한다. 통상적인 카르복시-보호기는 페닐술포닐에틸, 시아노에틸, 2-(트리메틸실릴)에틸, 2-(트리메틸실릴)에톡시메틸, 2-(p-톨루엔술포닐)에틸, 2-(p-니트로페닐술페닐)에틸, 2-(디페닐포스피노)-에틸, 니트로에틸 등을 포함한다. 보호기 및 그의 용도에 대하 일반적인 설명에 대해서는, 문헌 [T. W. Greene, Protective Groups in Organic Synthesis, John Wiley & Sons, New York, 1991]을 참조한다.
"이탈기"는 또다른 관능기에 의해 치환될 수 있는 관능기를 의미한다. 이러한 이탈기는 당업계에 잘 알려져 있으며, 그 예는 할라이드 (예, 클로라이드, 브로마이드, 요오다이드), 메탄술포닐 (메실), p-톨루엔술포닐 (토실), 트리플루오로메틸술포닐 (트리플레이트), 및 트리플루오로메틸술포네이트를 포함하고 이로 제한되지 않는다.
약어
링커 성분:
MC = 6-말레이미도카프로일
Val-Cit 또는 "vc" = 발린-시트룰린 (프로테아제 절단가능 링커 내의 예시적인 디펩티드)
시트룰린 = 2-아미노-5-우레이도 펜탄산
PAB = p-아미노벤질옥시카르보닐 ("자기희생적 (self immolative)" 링커 성분의 예)
Me-Val-Cit = N-메틸-발린-시트룰린 (여기서, 링커 펩티드 결합은 카텝신 B에 의한 그의 절단을 방지하기 위해 변형됨)
MC(PEG)6-OH = 말레이미도카프로일-폴리에틸렌 글리콜 (항체 시스테인에 부차될 수 있음)
세포독성 약물:
MMAE = 모노-메틸 오리스타틴 E (MW 718)
MMAF = 약물의 C-말단에 페닐알라닌이 존재하는 오리스타틴 E의 변이체 (MMAE) (MW 731.5)
MMAF-DMAEA = DMAEA (디메틸아미노에틸아민)가 C-말단 페닐알라닌에 아미드 연결된 MMAF (MW 801.5)
MMAF-TEG = 테트라에틸렌 글리콜이 페닐알라닌에 에스테르화된 MMAF
MMAF-NtBu = MMAF의 C-말단에 아미드로서 부착된 N-t-부틸
DM1 = N(2')-데아세틸-N(2')-(3-머캅토-1-옥소프로필)-메이탄신
DM3 = N(2')-데아세틸-N2-(4-머캅토-1-옥소펜틸)-메이탄신
DM4 = N(2')-데아세틸-N2-(4-머캅토-4-메틸-1-옥소펜틸)-메이탄신
추가의 약어는 다음과 같다: AE는 오리스타틴 E, Boc는 N-(t-부톡시카르보닐), cit는 시트룰린, dap는 돌라프로인, DCC는 1,3-디시클로헥실카르보디이미드, DCM은 디클로로메탄, DEA는 디에틸아민, DEAD는 디에틸아조디카르복실레이트, DEPC는 디에틸포스포릴시아니데이트, DIAD는 디이소프로필아조디카르복실레이트, DIEA는 N,N-디이소프로필에틸아민, dil는 돌라이소류신, DMA는 디메틸아세트아미드, DMAP는 4-디메틸아미노피리딘, DME는 에틸렌글리콜 디메틸 에테르 (또는 1,2-디메톡시에탄), DMF는 N,N-디메틸포름아미드, DMSO는 디메틸술폭사이드, doe는 돌라페닌, dov는 N,N-디메틸발린, DTNB는 5,5'-디티오비스(2-니트로벤조산), DTPA는 디에틸렌트리아민펜타아세트산, DTT는 디티오트레이톨, EDCI는 1-(3-디메틸아미노프로필)-3-에틸카르보디이미드 염산염, EEDQ는 2-에톡시-1-에톡시카르보닐-1,2-디히드로퀴놀린, ES-MS는 전자 분사 질량분석법, EtOAc는 에틸 아세테이트, Fmoc는 N-(9-플루오레닐메톡시카르보닐), gly는 글라이신, HATU는 O-(7-아자벤조트리아졸-1-일)-N,N,N',N'-테트라메틸우로늄 헥사플루오로포스페이트, HOBt는 1-히드록시벤조트리아졸, HPLC는 고압 액체 크로마토그래피, ile는 이소류신, lys는 라이신, MeCN(CH3CN)는 아세토니트릴, MeOH는 메탄올, Mtr는 4-아니실디페닐메틸 (또는 4-메톡시트리틸), nor는 (1S,2R)-(+)-노르에페드린, PBS는 포스페이트 완충 염수 (pH 7.4), PEG는 폴리에틸렌 글리콜, Ph는 페닐, Pnp는 p-니트로페닐, MC는 6-말레이미드카프로일, phe는 L-페닐알라닌, PyBrop는 브로모 트리스-피롤리디노 포스포늄 헥사플루오로포스페이트, SEC는 크기 배제 크로마토그래피, Su는 숙신이미드, TFA는 트리플루오로아세트산, TLC는 박막 크로마토그래피, UV는 자외선, 및 val는 발린이다.
"유리 시스테인 아미노산"은 모 항체 내로 조작되고, 티올 관능기 (-SH)를 갖고, 분자내 또는 분자간 디술피드 다리로서 페어링되지 않는 시스테인 아미노산 잔기를 의미한다.
용어 "티올 반응성 값"은 유리 시스테인 아미노산의 반응성에 대한 정량적 특성이다. 티올 반응성 값은 티올-반응성 시약과 반응하는, 시스테인 조작된 항체 내의 유리 시스테인 아미노산의 비율이고, 최대 1의 값으로 전환된다. 예를 들어, 100% 수율로 티올-반응성 시약, 예를 들어 비오틴-말레이미드 시약과 반응하여 비오틴-표지된 항체를 형성하는, 시스테인 조작된 항체 상의 유리 시스테인 아미노산의 티올 반응성 값은 1.0이다. 80% 수율로 티올-반응성 시약과 반응하는, 동일한 또는 상이한 모 항체 내로 조작된 다른 시스테인 아미노산의 티올 반응성 값은 0.8이다. 티올-반응성 시약과 전혀 반응하지 못하는, 동일한 또는 상이한 모 항체 내로 조작된 다른 시스테인 아미노산의 티올 반응성 값은 0이다. 특정 시스테인의 티올 반응성 값 결정은 ELISA 분석, 질량 분광분석, 액체 크로마토그래피, 자가방사선촬영, 또는 다른 정량 분석 시험에 의해 수행할 수 있다.
"모 항체"는 그로부터 하나 이상의 아미노산 잔기가 하나 이상의 시스테인 잔기로 치환된 아미노산 서열을 포함하는 항체이다. 모 항체는 천연 또는 야생형 서열을 포함할 수 있다. 모 항체는 다른 천연, 야생형, 또는 변형된 형태의 항체에 비해 기존재하는 아미노산 서열 변형 (예를 들어 부가, 결실 및/또는 치환)을 가질 수 있다. 모 항체는 목적하는 표적 항원, 예를 들어 생물학상 중요한 폴리펩티드에 대해 작용할 수 있다. 또한, 비폴리펩티드 항원 (예를 들어 종양-결합 당지질 항원; US 5091178 참조)에 대해 작용하는 항체도 고려된다.
II. 본 발명의 조성물 및 방법
A. 항- TAHO 항체
한 실시태양에서, 본 발명은 본원에서 치료제로서 사용될 수 있는 항-TAHO 항체를 제공한다. 예시적인 항체는 폴리클로날, 모노클로날, 인간화, 이중특이적 및 이종접합체 항체를 포함한다.
1. 폴리클로날 항체
폴리클로날 항체는 바람직하게는 관련 항원 및 어쥬번트 (adjuvant)의 다중 피하 (sc) 또는 복강내 (ip) 주사에 의해 동물에서 생성시킬 수 있다. 관련 항원 (특히 합성 펩티드가 사용될 때)을 면역화되는 종에서 면역원성인 단백질에 접합시키는 것이 유용할 수 있다. 예를 들어, 항원은 2관능성제 또는 유도화제, 예를 들어, 말레이미도벤조일 술포숙신이미드 에스테르 (시스테인 잔기를 통한 접합), N-히드록시숙신이미드 (리신 잔기를 통한), 글루타르알데히드, 숙신산 무수물, SOCl2, 또는 R1N=C=NR (여기서 R 및 R1은 상이한 알킬기임)을 사용하여, 키홀 림펫 (keyhole limpet) 헤모시아닌 (KLH), 혈청 알부민, 소 티로글로불린 및 대두 트립신 억제제에 접합될 수 있다.
동물은 예를 들어 100 ㎍ 또는 5 ㎍의 단백질 또는 접합체 (각각 토끼 또는 마우스에 대해)를 3 부피의 프로인트 (Freund) 완전 어쥬번트와 합한 후 용액을 다중 부위에 피내 주사함으로써 항원, 면역원성 접합체, 또는 유도체에 대해 면역화된다. 1개월 후에, 동물은 프로인트 완전 어쥬번트 중의 펩티드 또는 접합체를 처음 양의 1/5 내지 1/10로 다중 부위에 피하 주사하여 부스터된다. 7일 내지 14일 후에, 동물에서 채혈하여 혈청의 항체 역가를 분석한다. 동물은 역가 평탄역까지 부스터한다. 접합체는 또한 단백질 융합체로서 재조합 세포 배양으로 제조될 수도 있다. 또한, 면역 반응을 증강시키기 위해 응집제, 예를 들어 명반을 적절하게 사용한다.
2. 모노클로날 항체
모노클로날 항체는 문헌 [Kohler et al., Nature, 256:495 (1975)]에 처음 기재된 하이브리도마 방법에 의해 제조할 수 있거나, 또는 재조합 DNA 방법 (미국 특허 4,816,567)에 의해 제조할 수 있다.
하이브리도마 방법에서, 마우스 또는 다른 적절한 숙주 동물, 예를 들어 햄스터는 면역화를 위해 사용된 단백질에 특이적으로 결합하는 항체를 생성하거나 생성할 수 있는 림프구를 유도하기 위해 상기 설명한 바와 같이 면역화된다. 별법으로, 림프구는 시험관 내에서 면역화될 수 있다. 면역화 후에, 림프구는 단리된 후, 하이브리도마 세포를 형성하기 위해 적합한 융합제, 예를 들어 폴리에틸렌 글리콜을 사용하여 골수종 세포주와 융합된다 (Goding, Monoclonal Antibodies: Principles and Practice, pp. 59-103 (Academic Press, 1986)).
이와 같이 제조한 하이브리도마 세포는 바람직하게는 융합되지 않은 모골수종 세포 (본원에서 융합 파트너로 칭함)의 성장 또는 생존을 억제하는 하나 이상의 물질을 포함하는 적합한 배양 배지에 접종하여 성장시킨다. 예를 들어, 모골수종 세포에 효소 하이포잔틴 구아닌 포스포리보실 트랜스퍼라제 (HGPRT 또는 HPRT)가 결핍된 경우, 하이브리도마의 선택 배양 배지는 일반적으로 하이포잔틴, 아미노프테린 및 티미딘 (HAT 배지)를 포함할 것이고, 이들 물질은 HGPRT-결핍 세포의 성장을 억제한다.
바람직한 융합 파트너 골수종 세포는, 효율적으로 융합하고, 선택된 항체 생성 세포에 의한 항체의 안정적인 고수준 생성을 지지하고, 융합되지 않은 모세포에 대해 선택하는 선택 배지에 민감한 세포이다. 바람직한 골수종 세포주는 쥐 골수종 라인, 예를 들어 MOPC-21 및 MPC-11 마우스 종양 (솔크 인스티튜트 셀 디스트리뷰션 센터 (Salk Institute Cell Distribution Center, 미국 캘리포니아주 샌디에고)) 및 SP-2 및 유도체, 예를 들어 X63-Ag8-653 세포 (아메리칸 타입 컬쳐 컬렉션 (American Type Culture Collection, 미국 버지니아주 매나서스))에서 유도된 것이다. 인간 골수종 및 마우스-인간 이종골수종 세포주도 인간 모노클로날 항체 생성을 위해 설명된 바 있다 ([Kozbor, J. Immunol., 133:3001 (1984)]; 및 [Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987)]).
하이브리도마 세포가 성장하는 배지는 항원에 대해 작용하는 모노클로날 항체의 생성에 대해 분석된다. 바람직하게는, 하이브리도마 세포에 의해 생성되는 모노클로날 항체의 결합 특이성은 면역침전 또는 시험관내 결합 분석, 예를 들어 방사성 면역분석 (RIA) 또는 효소 연결 면역흡착 분석 (ELISA)에 의해 결정한다.
모노클로날 항체의 결합 친화도는 예를 들어 문헌 [Munson et al., Anal. Biochem., 107:220 (1980)]에 기재된 스캐챠드 (Scatchard) 분석에 의해 결정될 수 있다.
목적하는 특이성, 친화도 및/또는 활성의 항체를 생성하는 하이브리도마 세포가 확인된 후에, 클론은 제한 희석 절차에 의해 서브클로닝하고 표준 방법 (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986))으로 성장시킬 수 있다. 상기 목적에 적합한 배양 배지는 예를 들어 D-MEM 또는 RPMI-1640 배지를 포함한다. 또한, 하이브리도마 세포는 예를 들어 마우스 내로 세포의 i.p. 주사에 의해 동물에서 복수 종양으로서 생체 내에서 성장시킬 수 있다.
서브클론에서 분비되는 모노클로날 항체는 통상적인 항체 정제 과정, 예를 들어 친화도 크로마토그래피 (예를 들어, 단백질 A 또는 단백질 G-세파로스 사용) 또는 이온-교환 크로마토그래피, 히드록실아파타이트 크로마토그래피, 겔 전기영동, 투석 등에 의해 배양 배지, 복수액 또는 혈청으로부터 적합하게 분리된다.
모노클로날 항체를 코딩하는 DNA는 통상적인 절차를 이용하여 (예를 들어, 쥐 항체의 중쇄 및 경쇄를 코딩하는 유전자에 특이적으로 결합할 수 있는 올리고뉴클레오티드 프라이머를 사용함으로써) 쉽게 단리되고 서열 결정된다. 하이브리도마 세포는 상기 DNA의 바람직한 공급원 역할을 한다. 일단 단리된 DNA는 발현 벡터에 삽입되고, 이 벡터는 재조합 숙주 세포에서 모노클로날 항체를 합성하기 위해 본래 항체 단백질을 생성하지 않는 숙주 세포, 예를 들어 이. 콜라이 세포, 원숭이 COS 세포, 차이니즈 햄스터 난소 (CHO) 세포 또는 골수종 세포를 형질감염시킨다. 항체를 코딩하는 DNA의 세균에서의 재조합 발현에 대한 문헌은 문헌 [Skerra et al., Curr. Opinion in Immunol., 5:256-262 (1993) 및 [Plueckthun, Immunol. Revs. 130:151-188 (1992)]을 포함한다.
추가의 실시태양에서, 모노클로날 항체 또는 항체 단편은 문헌 [McCafferty et al., Nature, 348:552-554 (1990)]에 기재된 기술을 이용하여 생성된 항체 파지 라이브러리로부터 단리될 수 있다. 문헌 [Clackson et al., Nature, 352:624-628 (1991)] 및 [Marks et al., J. Mol. Biol. 222:581-597 (1991)]에서는 파지 라이브러리를 사용하여 각각 쥐 및 인간 항체의 단리를 설명하고 있다. 후속 문헌은 사슬 셔플링에 의한 고친화도 (nM 범위) 인간 항체의 생성 (Marks et al., Bio/Technology, 10:779-783 (1992)), 및 매우 큰 파지 라이브러리 제조를 위한 전략으로서 조합 감염 및 생체내 재조합 (Waterhouse et al., Nuc. Acids. Res., 21:2265-2266 (1993))을 설명하고 있다. 따라서, 이들 기술은 모노클로날 항체 단리를 위한 전통적인 모노클로날 항체 하이브리도마 기술의 실행가능한 대안이다.
항체를 코딩하는 DNA는 예를 들어 상동성 쥐 서열 대신에 인간 중쇄 및 경쇄 불변 도메인 (CH 및 CL) 서열을 치환시키거나 (미국 특허 4,816,567; [Morrison, et al., Proc. Natl. Acad. Sci. USA, 81:6851 (1984)]), 면역글로불린 코딩 서열을 비-면역글로불린 폴리펩티드 (이종 폴리펩티드)의 코딩 서열의 전부 또는 일부와 융합시킴으로써 키메라 또는 융합 항체 폴리펩티드를 생산하도록 변형시킬 수 있다. 비-면역글로불린 폴리펩티드 서열은 항체의 불변 도메인을 대체하거나, 항체의 한 항원 결합 부위의 가변 도메인을 대체하여 항원에 대한 특이성을 갖는 하나의 항원 결합 부위 및 상이한 항원에 대한 특이성을 갖는 다른 항원 결합 부위를 포함하는 키메라 2가 항체를 생성시킨다.
3. 인간 및 인간화 항체
본 발명의 항-TAHO 항체는 추가로 인간화 항체 또는 인간 항체를 포함할 수 있다. 비-인간 (예를 들어, 쥐) 항체의 인간화 형태는 비-인간 면역글로불린에서 유래한 최소 서열을 포함하는 키메라 면역글로불린, 면역글로불린 사슬, 또는 그의 단편 (예를 들어 Fv, Fab, Fab', F(ab')2 또는 항체의 다른 항원-결합 하위서열)이다. 인간화 항체는 수여자의 상보성 결정 영역 (CDR)의 잔기가 목적하는 특이성, 친화도 및 능력을 갖는 비인간종 (공여 항체), 예를 들어 마우스, 래트 또는 토끼의 CDR의 잔기로 치환된 인간 면역글로불린 (수여 항체)을 포함한다. 일부 경우에, 인간 면역글로불린의 Fv 프레임워크 잔기는 대응하는 비인간 잔기로 치환된다. 또한, 인간화 항체는 수여 항체 또는 도입된 CDR 또는 프레임워크 서열에서 발견되지 않는 잔기를 포함할 수 있다. 일반적으로, 인간화 항체는 실질적으로 적어도 하나, 일반적으로 2개의 가변 도메인을 모두 포함할 것이고, 여기서 모든 또는 실질적으로 모든 CDR 영역은 비인간 면역글로불린의 CDR 영역에 대응하고, 모든 또는 실질적으로 모든 FR 영역은 인간 면역글로불린 컨센서스 서열의 FR 영역에 대응한다. 인간화 항체는 또한 적어도 일부의 면역글로불린 불변 영역 (Fc), 일반적으로 인간 면역글로불린의 일부의 대응 영역을 포함하는 것이 최적일 것이다 ([Jones et al., Nature, 321:522-525 (1986)]; [Riechmann et al., Nature, 332:323-329 (1988)]; 및 [Presta, Curr. Op. Struct. Biol. 2:593-596 (1992)]).
비-인간 항체를 인간화시키는 방법은 당업계에 공지되어 있다. 일반적으로, 인간화 항체는 그 내부에 비-인간으로부터 유도된 하나 이상의 아미노산 잔기가 도입된 것이다. 이들 비-인간 아미노산 잔기는 "도입 (import)" 잔기로서 종종 언급되고, 일반적으로 "도입" 가변 도메인으로부터 취한다. 인간화는 본질적으로 인간 항체의 대응하는 서열을 설치류 CDR 또는 CDR 서열로 대체함으로써 윈터 (Winter) 등의 방법 ([Jones et al., Nature, 321:522-525 (1986)]; [Riechmann et al., Nature, 332:323-327 (1988)]; [Verhoeyen et al., Science, 239:1534-1536 (1988)])을 따라 수행할 수 있다. 따라서, 상기 "인간화" 항체는 무손상 인간 가변 도메인보다 실질적으로 더 작은 도메인이 비-인간종의 대응하는 서열로 대체된 키메라 항체 (미국 특허 4,816,567)이다. 실제로, 인간화 항체는 일반적으로 일부 CDR 잔기 및 가능하게는 일부 FR 잔기가 설치류 항체의 유사 부위로부터의 잔기로 대체된 인간 항체이다.
인간화 항체 제조에 사용되는 경쇄 및 중쇄 모두의 인간 가변 도메인의 선택은 항체가 인간 치료용으로 의도될 때 항원성 및 HAMA (인간 항-마우스 항체) 반응의 감소를 위해 매우 중요하다. 소위 "최적 맞춤 (best-fit)" 방법에 따르면, 설치류 항체의 가변 도메인 서열은 공지의 인간 가변 도메인 서열의 전체 라이브러리에 대해 스크리닝된다. 설치류와 가장 근접한 인간 V 도메인 서열이 확인되고, 그 안의 인간 프레임워크 영역 (FR)이 인간화 항체에 대해 허용된다 ([Sims et al., J. Immunol., 151:2296 (1993)]; [Chothia et al., J. Mol. Biol., 196:901 (1987)]). 다른 방법은 경쇄 또는 중쇄의 특정 하위군의 모든 인간 항체의 컨센서스 서열로부터 유래한 특정 프레임워크 영역을 이용한다. 동일한 프레임워크가 복수 개의 상이한 인간화 항체에 대해 사용될 수 있다 ([Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285 (1992)]; [Presta et al., J. Immunol., 151:2623 (1993)]).
항체가 항원에 대한 높은 결합 친화도 및 다른 바람직한 생물학적 특성을 보유하도록 인간화되는 것이 더욱 중요하다. 이를 달성하기 위해서, 바람직한 방법에 따라, 인간화 항체는 모 서열 및 인간화 서열의 3차원 모델을 이용하는 모 서열 및 다양한 개념적 인간화 생성물의 분석의 과정에 의해 제조한다. 3차원 면역글로불린 모델은 통상적으로 입수가능하고, 당업자에게 잘 알려져 있다. 선택된 후보 면역글로불린 서열의 가능한 3차원 입체형태 구조를 그리고 디스플레이하는 컴퓨터 프로그램이 이용가능하다. 이들 디스플레이를 조사하면 후보 면역글로불린 서열의 기능에서 잔기의 가능한 역할의 분석, 즉 후보 면역글로불린이 그의 항원에 결합하는 능력에 영향을 끼치는 잔기의 분석이 가능하다. 이러한 방식으로, FR 잔기는 수용 서열 및 도입 서열로부터 선택 및 조합되어 목적하는 항체 특성, 예를 들어 표적 항원(들)에 대한 친화도 증가를 달성할 수 있다. 일반적으로, 초가변 영역 잔기는 항원 결합에 대한 영향에 직접적으로 가장 실질적으로 관련된다.
다양한 형태의 인간화 항-TAHO 항체가 고려된다. 예를 들어, 인간화 항체는 면역접합체를 생성하기 위해 하나 이상의 세포독성제(들)과 임의로 접합된 항체 단편, 예를 들어 Fab일 수 있다. 별법으로, 인간화 항체는 무손상 항체, 예를 들어 무손상 IgG1 항체일 수 있다.
인간화에 대한 대안으로서, 인간 항체를 생성시킬 수 있다. 예를 들어, 면역화시에 내인성 면역글로불린 생산의 부재 하에 인간 항체의 전체 레퍼토리를 생산할 수 있는 트랜스제닉 (transgenic) 동물 (예를 들어, 마우스)을 현재 생산할 수 있다. 예를 들어, 키메라 및 생식계열 (germ-line) 돌연변이체 마우스의 항체 중쇄 연결 영역 (JH) 유전자의 동종접합성 결실은 내인성 항체 생성을 완전히 억제하는 것으로 설명되었다. 그러한 생식계열 돌연변이체 마우스 내로 인간 생식계열 면역글로불린 유전자 어레이를 전달하면 항원 시험 접종시에 인간 항체를 생산할 것이다 (예를 들어, 문헌 [Jakobovits et al., Proc. Natl. Acad. Sci. USA. 90:2551 (1993)]; [Jakobovits et al., Nature, 362:255-258 (1993)]; [Bruggemann et al., Year in Immuno. 7:33 (1993)]; 미국 특허 5,545,806, 5,569,825, 5,591,669 (모두 젠팜 (GenPharm)); 5,545,807; 및 WO 97/17852 참조).
별법으로, 파지 디스플레이 기술 (McCafferty et al., Nature 348: 552-553 [1990])을 사용하여, 비면역화된 공여체로부터의 면역글로불린 가변 (V) 도메인 유전자 레퍼토리로부터 인간 항체 및 항체 단편을 시험관 내에서 생산할 수 있다. 상기 기술에 따라, 항체 V 도메인 유전자는 필라멘트형 박테리오파지, 예를 들어 M13 또는 fd의 주 또는 부 코트 단백질 유전자 내로 인-프레임 (in-frame)으로 클로닝되고, 파지 입자의 표면 상에 기능성 항체 단편으로서 디스플레이된다. 필라멘트형 입자는 파지 게놈의 단일 가닥 DNA 카피를 포함하므로, 항체의 기능적 특성에 기초한 선택은 또한 이들 특성을 보이는 항체를 코딩하는 유전자를 선택하는 것이다. 따라서, 파지는 B-세포의 특성의 일부를 모방한다. 파지 디스플레이는 예를 들어 문헌 [Johnson, Kevin S. and Chiswell, David J., Current Opinion in Structural Biology 3: 564-571 (1993)]에 검토된 다양한 포맷으로 수행할 수 있다. V-유전자 세그먼트의 복수의 공급원을 파지 디스플레이에 사용할 수 있다. 문헌 [Clackson et al., Nature, 352:624-628 (1991)]에서는 면역화된 마우스의 비장으로부터 유래된 V 유전자의 작은 무작위 조합 라이브러리로부터 항-옥사졸론 항체의 다양성 어레이를 단리하였다. 비면역화된 인간 공여체로부터 V 유전자의 레퍼토리를 제조할 수 있고, 항원 (자가항원 포함)의 다양성 어레이에 대한 항체는 본질적으로 문헌 [Marks et al., J. Mol. Biol. 222:581-597 (1991)], 또는 [Griffith et al., EMBO J. 12:725-734 (1993)]에 기재된 기술에 따라 단리할 수 있다 (또한, 미국 특허 5,565,332 및 5,573,905 참조).
상기 논의한 바와 같이, 인간 항체는 또한 시험관 내 활성화된 B 세포에 의해 생성할 수 있다 (미국 특허 5,567,610 및 5,229,275 참조).
4. 항체 단편
특정 상황에서, 전체 항체보다 항체 단편을 사용하는 것이 유리하다. 단편의 보다 작은 크기로 인해 신속한 소실이 가능하고, 고형 종양에 대한 접근성을 개선시킬 수 있다.
항체 단편의 생산을 위한 다양한 기술이 개발되었다. 전통적으로, 이들 단편은 무손상 항체의 단백 분해 소화를 통해 유도되었다 (예를 들어, [Morimoto et al., Journal of Biochemical and Biophysical Methods 24:107-117 (1992)] 및 [Brennan et al., Science 229:81 (1985)] 참조). 그러나, 이들 단편은 이제 재조합 숙주 세포에 의해 직접 생산할 수 있다. Fab, Fv 및 scFv 항체 단편은 모두 이. 콜라이에서 발현되어 분비될 수 있고, 이에 의해 다량의 이들 단편을 쉽게 생산할 수 있다. 항체 단편은 상기 논의한 항체 파지 라이브러리로부터 단리할 수 있다. 별법으로, Fab'-SH 단편은 이. 콜라이로부터 직접 회수되고 화학적으로 커플링되어 F(ab')2 단편을 형성할 수 있다 (Carter et al., Bio/Technology 10:163-167 (1992)). 다른 방법에 따라, F(ab')2 단편은 재조합 숙주 세포 배양액으로부터 직접 단리할 수 있다. 샐비지 (salvage) 수용체 결합 에피토프 잔기를 포함하는, 생체 내 반감기가 증가된 Fab 및 F(ab')2 단편은 미국 특허 5,869,046에 기재되어 있다. 항체 단편의 생산을 위한 다른 기술은 당업자에게 명백할 것이다. 다른 실시태양에서, 선택되는 항체는 단쇄 Fv 단편 (scFv)이다 (WO 93/16185; 미국 특허 5,571,894; 및 미국 특허 5,587,458 참조). Fv 및 sFv는 불변 영역이 결여된 무손상 결합 부위를 갖는 유일한 종류이고; 따라서 생체 내 사용 동안 비특이적 결합의 감소에 적합하다. sFv 융합 단백질은 sFv의 아미노 또는 카르복시 말단에서 효과기 단백질의 융합체를 생성하도록 제조될 수 있다 (Antibody Engineering, ed. Borrebaeck, 상기 문헌). 항체 단편은 또한 예를 들어 미국 특허 5,641,870에 기재된 바와 같은 "선형 항체"일 수 있다. 그러한 선형 항체 단편은 단일특이적 또는 이중특이적일 수 있다.
5. 이중특이적 항체
이중특이적 항체는 적어도 2종의 상이한 에피토프에 결합 특이성을 갖는 항체이다. 예시적인 이중특이적 항체는 본원에 설명된 TAHO 단백질의 2개의 상이한 에피토프에 결합할 수 있다. 다른 그러한 항체는 TAHO 결합 부위를 다른 단백질에 대한 결합 부위와 조합할 수 있다. 별법으로, 항-TAHO 아암 (arm)은 TAHO-발현 세포에 대한 세포성 방어 메카니즘에 집중하고 편재시키기 위해, 백혈구 상의 촉발 분자, 예를 들어 T-세포 수용체 분자 (예를 들어 CD3), 또는 IgG의 Fc 수용체 (FcγR), 예를 들어 FcγRI (CD64), FcγRII (CD32) 및 FcγRIII (CD16)에 결합하는 아암과 조합될 수 있다. 이중특이적 항체는 또한 세포독성제를 TAHO를 발현하는 세포에 편재시키기 위해 사용할 수 있다. 이들 항체는 TAHO-결합 아암, 및 세포 독성제 (예를 들어 사포린, 항-인터페론-α, 빈카 알칼로이드, 리신 A 사슬, 메토트렉세이트 또는 방사성 동위원소 합텐)에 결합하는 아암을 갖는다. 이중특이적 항체는 전장 항체 또는 항체 단편 (예를 들어 F(ab')2 이중특이적 항체)으로서 제조할 수 있다.
WO 96/16673에서는 이중특이적 항-ErbB2/항-FcγRIII 항체를 설명하고, 미국 특허 5,837,234에서는 이중특이적 항-ErbB2/항-FcγRI 항체를 설명한다. 이중특이적 항-ErbB2/Fcα 항체는 WO 98/02463에 제시되어 있다. 미국 특허 5,821,337에서는 이중특이적 항-ErbB2/항-CD3 항체를 교시하고 있다.
이중특이적 항체의 제조 방법은 당업계에 공지되어 있다. 전장 이중특이적 항체의 전통적인 생산은 2개의 면역글로불린 중쇄-경쇄 쌍의 동시발현에 기초하고, 여기서 2개의 사슬은 상이한 특이성을 갖는다 (Millstein et al., Nature, 305:537-539 (1983)). 면역글로불린 중쇄 및 경쇄의 무작위 분류 때문에, 이들 하이브리도마 (콰드로마 (quadroma))는 그 중 하나만이 정확한 이중특이적 구조를 갖는 10종의 상이한 항체 분자들의 잠재적인 혼합물을 생산한다. 대체로 친화도 크로마토그래피 단계에 의해 수행되는 정확한 분자의 정제는 다소 성가시고 생산 수율이 낮다. 유사한 절차가 WO 93/08829 및 문헌 [Traunecker et al., EMBO J. 10, 3655-3659 (1991)]에 개시되어 있다.
상이한 방법에 따라, 목적하는 결합 특이성 (항체-항원 결합 부위)를 갖는 항체 가변 도메인을 면역글로불린 불변 도메인 서열에 융합시킨다. 바람직하게는, 융합은 힌지의 적어도 일부, CH2 및 CH3 영역을 포함하는 Ig 중쇄 불변 도메인을 사용한다. 경쇄 결합에 필요한 부위를 함유하는 제1 중쇄 불변 영역 (CH1)이 융합체의 적어도 하나에 존재하는 것이 바람직하다. 면역글로불린 중쇄 융합체 및 필요한 경우 면역글로불린 경쇄를 코딩하는 DNA를 별개의 발현 벡터 내로 삽입하고, 적합한 숙주 세포 내로 동시형질감염시킨다. 이는 제작에 사용된 3개의 폴리펩티드 사슬의 불균등한 비율이 목적하는 이중특이적 항체의 최적 수율을 제공하는 실시태양에서 3개의 폴리펩티드 단편의 상호 비율을 조정하는데 있어서 큰 탄력성을 제공한다. 그러나, 균등 비율의 적어도 2개의 폴리펩티드 사슬의 발현이 고수율을 생산할 때 또는 상기 비가 목적하는 사슬 조합의 생성에 유의한 영향을 갖지 않을 때, 단일 발현 벡터 내에 2개 또는 3개 모두의 폴리펩티드 사슬의 코딩 서열을 삽입하는 것이 가능하다.
상기 방법의 바람직한 실시태양에서, 이중특이적 항체는 한쪽 아암에 제1 결합 특이성을 갖는 하이브리드 면역글로불린 중쇄, 및 다른 쪽 아암에 하이브리드 면역글로불린 중쇄-경쇄쌍 (제2 결합 특이성 제공)으로 이루어진다. 이중특이적 분자의 절반에만 면역글로불린 경쇄가 존재하는 것이 손쉬운 분리 방법을 제공하므로, 상기 비대칭 구조는 원치 않는 면역글로불린 사슬 조합물로부터 목적하는 이중특이적 화합물의 분리를 용이하게 하는 것으로 밝혀졌다. 상기 방법은 WO 94/04690에 개시되어 있다. 이중특이적 항체를 생성하는 추가의 상세한 내용에 대해서는 예를 들어 문헌 [Suresh et al., Methods in Enzymology, 121:210 (1986)]을 참조한다.
미국 특허 5,731,168에 기재된 다른 방법에 따라, 한쌍의 항체 분자들 사이의 계면은 재조합 세포 배양물로부터 회수되는 이종이량체의 비율을 최대화하도록 처리될 수 있다. 바람직한 계면은 CH3 도메인의 적어도 일부를 포함한다. 상기 방법에서, 제1 항체 분자의 계면으로부터 하나 이상의 작은 아미노산 측쇄가 보다 큰 측쇄 (예, 티로신 또는 트립토판)으로 교체된다. 큰 아미노산 측쇄를 보다 작은 것 (예, 알라닌 또는 트레오닌)으로 교체함으로써, 큰 측쇄(들)과 동일하거나 유사한 크기의 보상적 "캐비티 (cavity)"가 제2 항체 분자의 계면 상에 생성된다. 이는 다른 원치않는 최종 생성물, 예를 들어 동종이량체 (homodimer)에 비해 이종이량체의 수율을 증가시키기 위한 메카니즘을 제공한다.
이중특이적 항체는 가교결합된 또는 "이종접합체" 항체를 포함한다. 예를 들어, 이종접합체 내의 항체 중 하나는 아비딘에 커플링되고, 다른 하나는 비오틴에 커플링될 수 있다. 그러한 항체는 예를 들어 면역계 세포를 원치 않는 세포에 표적화시키기 위해 (미국 특허 4,676,980), 및 HIV 감염의 치료를 위해 (WO 91/00360, WO 92/200373 및 EP 03089) 제안되었다. 이종접합체 항체는 임의의 통상적인 가교결합 방법을 이용하여 제조할 수 있다. 적합한 가교결합제는 당업계에 잘 알려져 있고, 많은 가교결합 기술과 함께 미국 특허 4,676,980에 개시되어 있다.
항체 단편으로부터 이중특이적 항체를 생성하기 위한 기술은 또한 문헌에서 설명되었다. 예를 들어, 이중특이적 항체는 화학적 연결기를 이용하여 제조할 수 있다. 문헌 [Brennan et al., Science, 229: 81 (1985)]에서는 무손상 항체가 단백 분해 방식으로 절단되어 F(ab')2 단편을 생성하는 절차를 기술하고 있다. 이들 단편은 인접 디티올을 안정화시키고 분자간 디술피드 형성을 방지하기 위해 디티올 착화제인 아비소산나트륨의 존재 하에 환원된다. 이어서, 생성된 Fab' 단편은 티오니트로벤조에이트 (TNB) 유도체로 전환된다. 이어서, Fab'-TNB 유도체 중 하나는 머캅토에틸아민으로 환원시켜 Fab'-티올로 재전환되고, 등몰량의 다른 Fab'-TNB 유도체와 혼합되어 이중특이적 항체를 형성한다. 생산된 이중특이적 항체는 효소의 선택적 고정화를 위한 물질로서 사용할 수 있다.
최근의 기술 발달은 이중특이적 항체를 형성하도록 화학적으로 커플링될 수 있는, 이. 콜라이로부터의 Fab'-SH 단편의 직접 회수를 용이하게 하였다. 문헌 [Shalaby et al., J. Exp. Med., 175: 217-225 (1992)]에서는 완전 인간화 이중특이적 항체 F(ab')2 분자의 생산을 기술하고 있다. 각각의 Fab' 단편은 이. 콜라이로부터 따로 분비시키고, 이중특이적 항체를 형성하도록 시험관 내에서 유도 화학 커플링 반응시켰다. 이렇게 형성된 이중특이적 항체는 ErbB2 수용체를 과발현하는 세포 및 정상 인간 T 세포에 결합할 뿐만 아니라, 인간 유방 종양 표적에 대한 인간 세포독성 림프구의 용해 활성을 촉발할 수 있었다.
이중특이적 항체 단편을 재조합 세포 배양액으로부터 직접 제조하고 단리하기 위한 다양한 기술이 또한 설명되었다. 예를 들어, 이중특이적 항체는 류신 지퍼를 사용하여 생산되었다 (Kostelny et al., J. Immunol., 148(5):1547-1553 (1992)). Fos 및 Jun 단백질로부터의 류신 지퍼 펩티드가 유전자 융합에 의해 2개의 상이한 항체의 Fab' 부분에 연결되었다. 항체 동종이량체는 힌지 영역에서 환원되어 단량체를 형성한 후, 재산화되어 항체 이종이량체를 형성하였다. 상기 방법은 또한 항체 동종이량체의 생산에 이용할 수 있다. 문헌 [Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993)]에 기재된 "디아바디" 기술은 이중특이적 항체 단편 제조를 위한 다른 메카니즘을 제공하였다. 이 단편은 동일한 사슬 상의 2개의 도메인 사이에 페어링을 허용하기에는 너무 짧은 링커에 의해 VL에 연결된 VH를 포함한다. 따라서, 하나의 단편의 VH 및 VL 도메인은 다른 단편의 상보성 VL 및 VH 도메인과 페어링하고, 이에 의해 2개의 항원 결합 부위를 형성한다. 단쇄 Fv (sFv) 이량체를 사용한 이중특이적 항체 단편의 다른 제조 전략도 보고된 바 있다 ([Gruber et al., J. Immunol., 152:5368 (1994)] 참조).
2가 초과의 항체가 고려된다. 예를 들어, 삼중특이적 항체를 제조할 수 있다 (Tutt et al. J. Immunol. 147:60 (1991)).
6. 이종접합체 항체
또한, 이종접합체 항체가 본 발명의 범위 내에 있다. 이종접합체 항체는 2개의 공유연결된 항체로 이루어진다. 그러한 항체는 예를 들어 면역계 세포를 원치 않는 세포에 대해 표적화시키기 위해 [미국 특허 4,676,980], 및 HIV 감염의 치료를 위해 [WO 91/00360 및 WO 92/200373; EP 03089] 제안되었다. 항체는 가교결합제를 수반하는 것을 포함한, 합성 단백질 화학에 공지된 방법을 사용하여 시험관 내에서 제조할 수 있음이 고려된다. 예를 들어, 면역독소는 디술피드 교환 반응을 이용하여, 또는 티오에테르 결합을 형성함으로써 제조할 수 있다. 상기 목적에 적합한 시약의 예는 이미노티올레이트 및 메틸-4-머캅토부티르이미데이트와 예를 들어 미국 특허 4,676,980에 개시된 것을 포함한다.
7. 다가 항체
다가 항체는 항체가 결합하는 항원을 발현하는 세포에 의해 2가 항체보다 빠르게 내재화 (및/또는 이화)될 수 있다. 본 발명의 항체는 항원 결합 부위가 3개 이상인 (예를 들어 4가 항체) 다가 항체 (IgM 클래스 이외의 것)일 수 있고, 이는 항체의 폴리펩티드 사슬을 코딩하는 핵산의 재조합 발현에 의해 쉽게 생산될 수 있다. 다가 항체는 이량체화 도메인 및 3개 이상의 항원 결합 부위를 포함할 수 있다. 바람직한 이량체화 도메인은 Fc 영역 또는 힌지 영역을 포함한다 (또는 이로 이루어진다). 상기 시나리오에서, 항체는 Fc 영역, 및 Fc 영역의 아미노 말단에 3개 이상의 항원 결합 부위를 포함할 것이다. 본원에서 바람직한 다가 항체는 3 내지 약 8개, 바람직하게는 4개의 항원 결합 부위를 포함한다 (또는 이로 이루어진다). 다가 항체는 적어도 하나의 폴리펩티드 사슬 (바람직하게는 2개의 폴리펩티드 사슬)을 포함하고, 여기서 폴리펩티드 사슬(들)은 2개 이상의 가변 도메인을 포함한다. 예를 들어, 폴리펩티드 사슬(들)은 VD1-(X1)n-VD2-(X2)n-Fc (여기서, VD1은 제1 가변 도메인이고, VD2는 제2 가변 도메인이고, Fc는 Fc 영역의 하나의 폴리펩티드 사슬이고, X1 및 X2는 아미노산 또는 폴리펩티드를 나타내고, n은 0 또는 1이다)를 포함할 수 있다. 예를 들어, 폴리펩티드 사슬(들)은 VH-CH1-가요성 링커-VH-CH1-Fc 영역 사슬; 또는 VH-CH1-VH-CH1-Fc 영역 사슬을 포함할 수 있다. 본원에서 다가 항체는 바람직하게는 적어도 2개 (바람직하게는 4개)의 경쇄 가변 도메인 폴리펩티드를 더 포함한다. 본원에서 다가 항체는 예를 들어 약 2 내지 약 8개의 경쇄 가변 도메인 폴리펩티드를 포함할 수 있다. 본원에서 고려되는 경쇄 가변 도메인 폴리펩티드는 경쇄 가변 도메인을 포함하고, 임의로 CL 도메인을 더 포함한다.
8. 효과기 기능 조작
예를 들어 항체의 항원 의존성 세포 매개 세포독성 (ADCC) 및/또는 보체 의존성 세포독성 (CDC)을 향상시키도록 효과기 기능에 관하여 본 발명의 항체를 변형시키는 것이 바람직할 수 있다. 이것은 항체의 Fc 영역에 하나 이상의 아미노산 치환을 도입함으로써 달성할 수 있다. 별법으로 또는 추가로, 시스테인 잔기(들)이 Fc 영역 내에 도입되어, 상기 영역 내에서 사슬내 디술피드 결합을 형성할 수 있다. 이렇게 생성된 동종이량체 항체는 개선된 내재화 능력 및/또는 증가된 보체 매개 세포 사멸 및 항체 의존성 세포성 세포독성 (ADCC)을 가질 수 있다 ([Caron et al., J. Exp Med. 176:1191-1195 (1992)] 및 [Shopes, B. J. Immunol. 148:2918-2922 (1992)] 참조). 향상된 항-종양 활성을 갖는 동종이량체성 항체도 또한 문헌 [Wolff et al., Cancer Research 53:2560-2565 (1993)]에 기재된 바와 같은 이종2관능성 가교결합기를 사용하여 제조할 수 있다. 별법으로, 이중 Fc 영역을 갖는 항체는 조작될 수 있고, 그에 의해 향상된 보체 용해 및 ADCC 능력을 가질 수 있다 ([Stevenson et al., Anti-Cancer Drug Design 3:219-230 (1989)] 참조). 항체의 혈청 반감기를 증가시키기 위해, 예를 들어 미국 특허 5,739,277에 기재된 바와 같이 샐비지 수용체 결합 에피토프를 항체 (특히 항체 단편) 내로 포함시킬 수 있다. 본원에서 사용될 때, 용어 "샐비지 수용체 결합 에피토프"는 IgG 분자의 생체내 혈청 반감기 증가를 담당하는 IgG 분자 (예를 들어, IgG1, IgG2, IgG3, 또는 IgG4)의 Fc 영역의 에피토프를 나타낸다.
9. 면역접합체
본 발명은 또한 세포독성제, 예를 들어 화학요법제, 성장 억제제, 독소 (예를 들어, 세균, 진균, 식물, 또는 동물 기원의 효소 활성 독소, 또는 그의 단편), 또는 방사성 동위원소 (즉, 방사성 접합체)에 접합된 항체를 포함하는 면역접합체 (상호교환가능하게 "항체-약물 접합체", 또는 "ADC"로서 언급됨)에 관한 것이다.
특정 실시태양에서, 면역접합체는 항체 및 화학요법제 또는 다른 독소를 포함한다. 그러한 면역접합체의 생성에 유용한 화학요법제는 상기 기재되어 있다. 사용할 수 있는 효소 활성 독소 및 그의 단편은 디프테리아 A 사슬, 디프테리아 독소의 비결합 활성 단편, 외독소 A 사슬 (슈도모나스 애루기노사 (Pseudomonas aeruginosa)로부터 유래됨), 리신 A 사슬, 아브린 A 사슬, 모데신 A 사슬, 알파-사르신, 알류리테스 포르디이 (Aleurites fordii) 단백질, 디안틴 단백질, 피톨라카 아메리카나 (Phytolaca americana) 단백질 (PAPI, PAPII, 및 PAP-S), 모모르디카 카란티아 (momordica charantia) 억제제, 쿠르신, 크로틴, 사파오나리아 오피시날리스 (sapaonaria officinalis) 억제제, 겔로닌, 미토겔린, 레스트릭토신, 페노마이신, 에노마이신 및 트리코테센을 포함한다. 방사성 접합된 항체의 생산을 위해 다양한 방사성 핵종이 이용가능하다. 그 예는 212Bi, 131I, 131In, 90Y, 및 186Re를 포함한다. 항체 및 세포독성제의 접합체는 다양한 2기능성 단백질-커플링제, 예를 들어 N-숙신이미딜-3-(2-피리딜디티오) 프로피오네이트 (SPDP), 이미노티올란 (IT), 이미도에스테르의 2기능성 유도체 (예를 들어 디메틸 아디피미데이트 HCl), 활성 에스테르 (예를 들어 디숙신이미딜 수베레이트), 알데히드 (예를 들어 글루타르알데히드), 비스-아지도 화합물 (예를 들어 비스(p-아지도벤조일) 헥산디아민), 비스-디아조늄 유도체 (예를 들어 비스-(p-디아조늄벤조일)-에틸렌디아민), 디이소시아네이트 (예를 들어 톨루엔 2,6-디이소시아네이트), 및 비스-활성 불소 화합물 (예를 들어 1,5-디플루오로-2,4-디니트로벤젠)을 사용하여 제조한다. 예를 들어, 리신 면역독소는 문헌 [Vitetta et al., Science, 238:1098 (1987)]에 기재된 바와 같이 제조할 수 있다. 탄소-14-표지된 1-이소티오시아나토벤질-3-메틸디에틸렌 트리아민펜타아세트산 (MX-DTPA)은 방사성 뉴클레오티드를 항체에 접합시키기 위한 예시적인 킬레이팅제이다. WO 94/11026을 참조한다.
항체 및 하나 이상의 작은 분자 독소, 예를 들어 칼리케아미신, 오리스타틴 펩티드, 예를 들어 모노메틸오리스타틴 (MMAE) (돌라스타틴의 합성 유사체), 메이탄시노이드, 예를 들어 DM1, 트리코텐, 및 CC1065, 및 독소 활성을 갖는 이들 독소의 유도체의 접합체가 또한 본원에서 고려된다.
예시적인
면역접합체
- 항체-약물 접합체
본 발명의 면역접합체 (또는 "항체-약물 접합체" ("ADC"))는 아래 화학식 I의 것일 수 있고, 여기서 항체는 선택적인 링커 (L)을 통해 하나 이상의 약물 모이어티 (D)에 접합된다 (즉, 공유 결합에 의해 부착된다). ADC는 thioMAb 약물 접합체 ("TDC")를 포함할 수 있다.
<화학식 I>
따라서, 항체는 직접 또는 링커를 통해 약물에 접합될 수 있다. 화학식 I에서, p는 항체당 약물 모이어티의 평균 수이고, 이는 예를 들어 항체당 약 1 내지 약 20개의 약물 모이어티, 특정 실시태양에서 항체당 1 내지 약 8개의 약물 모이어티일 수 있다. 본 발명은 화학식 I의 항체-약물 화합물의 혼합물을 포함하는 조성물을 포함하고, 여기서 항체당 평균 약물 로딩은 약 2 내지 약 5, 또는 약 3 내지 약 4이다.
a. 예시적인 링커
링커는 하나 이상의 링커 성분을 포함할 수 있다. 예시적인 링커 성분은 6-말레이미도카프로일 ("MC"), 말레이미도프로파노일 ("MP"), 발린-시트룰린 ("val-cit" 또는 "vc"), 알라닌-페닐알라닌 ("ala-phe"), p-아미노벤질옥시카르보닐 ("PAB"), 및 링커 시약과의 접합으로부터 생성된 것; N-숙신이미딜 4-(2-피리딜티오) 펜타노에이트 ("SPP"), N-숙신이미딜 4-(N-말레이미도메틸) 시클로헥산-1 카르복실레이트 ("SMCC"), 및 N-숙신이미딜 (4-요오도-아세틸) 아미노벤조에이트 ("SIAB")를 포함한다. 다양한 링커 성분은 당업계에 공지되어 있고, 일부를 아래에 기재한다.
링커는 세포에서 약물의 방출을 용이하게 하는 "절단가능한 링커"일 수 있다. 예를 들어, 산 불안정 링커 (예를 들어, 히드라존), 프로테아제-감수성 (예를 들어, 펩티다제-감수성) 링커, 광불안정 링커, 디메틸 링커 또는 디술피드 함유 링커 ([Chari et al., Cancer Research, 52:127-131 (1992)]; 미국 특허 5,208,020)를 사용할 수 있다.
특정 실시태양에서, 링커는 하기 화학식 II에 제시된 바와 같다:
<화학식 II>
상기 식에서, A는 스트레쳐 (stretcher) 단위이고, a는 0 내지 1의 정수이고; W는 아미노산 단위이고, w는 0 내지 12의 정수이고; Y는 스페이서 단위이고, y는 0, 1 또는 2이고; Ab, D, 및 p는 화학식 I에서 상기 정의되어 있다. 상기 링커의 예시적인 실시태양은 본원에 참고로 분명하게 포함되는 US 2005-0238649 A1에 기재되어 있다.
일부 실시태양에서, 링커 성분은 항체를 다른 링커 성분 또는 약물 모이어티에 연결시키는 "스트레쳐 단위"를 포함할 수 있다. 예시적인 스트레쳐 단위를 아래에 제시한다 (여기서, 파선은 항체에 대한 공유 결합에 의해 부착의 부위를 나타낸다):
일부 실시태양에서, 링커 성분은 아미노산 단위를 포함할 수 있다. 하나의 상기 실시태양에서, 아미노산 단위는 프로테아제에 의한 링커의 절단을 허용함으로써, 세포내 프로테아제, 예를 들어 리소좀 효소에 대한 노출시에 면역접합체로부터 약물의 방출을 용이하게 한다 (예를 들어, 문헌 [Doronina et al. (2003) Nat. Biotechnol. 21:778-784] 참조). 예시적인 아미노산 단위는 디펩티드, 트리펩티드, 테트라펩티드, 및 펜타펩티드를 포함하고 이에 제한되지 않는다. 예시적인 디펩티드는 발린-시트룰린 (vc 또는 val-cit), 알라닌-페닐알라닌 (af 또는 ala-phe); 페닐알라닌-라이신 (fk 또는 phe-lys); 또는 N-메틸-발린-시트룰린 (Me-val-cit)을 포함한다. 예시적인 트리펩티드는 글라이신-발린-시트룰린 (gly-val-cit) 및 글라이신-글라이신-글라이신 (gly-gly-gly)을 포함한다. 아미노산 단위는 천연 발생 아미노산 잔기 및 소수의 아미노산 및 비-천연 발생 아미노산 유사체, 예를 들어 시트룰린을 포함할 수 있다. 아미노산 단위는 특정 효소, 예를 들어 종양 관련 프로테아제, 카텝신 B, C 및 D, 또는 플라스민 프로테아제에 의한 효소 절단에 대한 그들의 선택성 측면에서 설계되고 최적화될 수 있다.
일부 실시태양에서, 링커 성분은 항체를 약물 모이어티에 직접 또는 스트레쳐 단위 및/또는 아미노산 단위에 의해 연결시키는 "스페이서" 단위를 포함할 수 있다. 스페이서 단위는 "자기희생적" 또는 "비-자기희생적"일 수 있다. "비-자기희생적" 스페이서 단위는 그의 일부 또는 모두가 ADC의 효소에 의한 (예를 들어, 단백 분해) 절단시에 약물 모이어티에 결합된 상태로 유지되는 단위이다. 비-자기희생적 스페이서 단위의 예는 글라이신 스페이서 단위 및 글라이신-글라이신 스페이서 단위를 포함하고 이로 제한되지 않는다. 서열-특이적인 효소에 의한 절단에 감수성인 펩티드 스페이서의 다른 조합도 고려된다. 예를 들어, 종양 세포 관련 프로테아제에 의한, 글라이신-글라이신 스페이서 단위를 함유하는 ADC의 효소에 의한 절단은 ADC의 나머지로부터 글라이신-글라이신-약물 모이어티를 방출시킬 것이다. 이어서, 하나의 상기 실시태양에서, 글라이신-글라이신-약물 모이어티는 종양 세포 내에서 별도의 가수분해 단계를 거치고, 이에 의해 글라이신-글라이신 스페이서 단위를 약물 모이어티로부터 절단한다.
"자기희생적" 스페이서 단위는 별도의 가수분해 단계를 수행하지 않으면서 약물 모이어티를 방출시킨다. 특정 실시태양에서, 링커의 스페이서 단위는 p-아미노벤질 단위를 포함한다. 하나의 상기 실시태양에서, p-아미노벤질 알콜은 아미드 결합을 통해 아미노산 단위에 부착되고, 카르바메이트, 메틸카르바메이트, 또는 카르보네이트가 벤질 알콜과 세포독성제 사이에 형성된다 (예를 들어, 문헌 [Hamann et al. (2005) Expert Opin. Ther. Patents (2005) 15:1087-1103] 참조). 한 실시태양에서, 스페이서 단위는 p-아미노벤질옥시카르보닐 (PAB)이다. 특정 실시태양에서, p-아미노 벤질 단위의 페닐렌 부분은 Qm으로 치환되고, 여기서 Q는 -C1-C8 알킬, -O-(C1-C8 알킬), -할로겐, -니트로 또는 -시아노이고; m은 0-4의 정수이다. 자기희생적 스페이서 단위의 예는 p-아미노벤질 알콜에 전기적으로 유사한 방향족 화합물 (예를 들어, US 2005/0256030 A1 참조), 예를 들어 2-아미노이미다졸-5-메탄올 유도체 (Hay et al. (1999) Bioorg. Med. Chem. Lett. 9:2237) 및 오르토- 또는 파라-아미노벤질아세탈을 더 포함하고 이로 제한되지 않는다. 아미드 결합 가수분해시에 고리화되는 스페이서, 예를 들어 치환 및 비치환 4-아미노부티르산 아미드 (Rodrigues et al., Chemistry Biology, 1995, 2, 223); 적절하게 치환된 비시클로[2.2.1] 및 비시클로[2.2.2] 고리계 (Storm, et al., J. Amer. Chem. Soc, 1972, 94, 5815); 및 2-아미노페닐프로피온산 아미드 (Amsberry, et al., J. Org. Chem., 1990, 55,5867)를 사용할 수 있다. 글라이신의 a-위치에서 치환된 아민-함유 약물의 제거 (Kingsbury, et al., J. Med. Chem., 1984, 27, 1447)도 또한 ADC에서 유용한 자기희생적 스페이서의 예이다.
한 실시태양에서, 스페이서 단위는 아래에 제시된 분지된 비스(히드록시메틸)스티렌 (BHMS) 단위이고, 이것은 다수의 약물을 도입하고 방출시키는데 사용될 수 있다:
상기 식에서, Q는 -C1-C8 알킬, -O-(C1-C8 알킬), -할로겐, -니트로 또는 -시아노이고; m은 0-4의 정수이고, n은 O 또는 1이고; p는 1 내지 약 20이다.
다른 실시태양에서, 링커 L은 하나 초과의 약물 모이어티를 분지화 다기능성 링커 모이어티를 통해 항체에 공유 결합에 의해 부착시키기 위한 수지상 유형의 링커일 수 있다 ([Sun et al (2002) Bioorganic & Medicinal Chemistry Letters 12:2213-2215]; [Sun et al (2003) Bioorganic & Medicinal Chemistry 11:1761-1768]). 수지상 링커는 ADC의 효능과 관계가 있는 약물 대 항체의 몰비, 즉 로딩을 증가시킬 수 있다. 따라서, 시스테인 조작된 항체가 단지 하나의 반응성 시스테인 티올기를 보유하는 경우에는, 다수의 약물 모이어티를 수지상 링커를 통하여 부착시킬 수 있다.
예시적인 링커 성분 및 그의 조합물은 화학식 II의 ADC와 관련하여 아래에 제시된다:
스트레쳐, 스페이서, 및 아미노산 단위를 포함하는 링커 성분은 당업계에 공지된 방법, 예를 들어 US 2005-0238649 A1에 기재된 방법에 의해 합성할 수 있다.
b. 예시적인 약물
모이어티
(1)
메이탄신
및
메이탄시노이드
일부 실시태양에서, 면역접합체는 하나 이상의 메이탄시노이드 분자에 접합된 항체를 포함한다. 메이탄시노이드는 튜불린 중합을 억제함으로써 작용하는 유사분열 억제제이다. 메이탄신은 동아프리카 관목 메이테누스 세라타 (Maytenus serrata)로부터 처음 단리되었다 (미국 특허 3896111). 이어서, 특정 미생물이 또한 메이탄시노이드, 예를 들어 메이탄시놀 및 C-3 메이탄시놀 에스테르를 생산하는 것으로 밝혀졌다 (미국 특허 4,151,042). 합성 메이탄시놀 및 그의 유도체 및 유사체는 예를 들어 미국 특허 4,137,230; 4,248,870; 4,256,746; 4,260,608; 4,265,814; 4,294,757; 4,307,016; 4,308,268; 4,308,269; 4,309,428; 4,313,946; 4,315,929; 4,317,821; 4,322,348; 4,331,598; 4,361,650; 4,364,866; 4,424,219; 4,450,254; 4,362,663; 및 4,371,533에 개시되어 있다.
메이탄시노이드 약물 모이어티는, 이들이 (i) 발효 또는 화학적 변형, 또는 발효 생성물의 유도체화에 의한 제조에 비교적 이용가능하고, (ii) 비-디술피드 링커를 통해 항체에 접합되기에 적합한 관능기로 유도체화될 수 있고, (iii) 혈장에서 안정하며, (iv) 다양한 종양 세포주에 대해 효과적이기 때문에, 항체-약물 접합체에서 매력적인 약물 모이어티이다.
메이탄시노이드 약물 모이어티로서 사용하기 적합한 메이탄신 화합물은 당업계에 널리 공지되어 있으며, 공지된 방법에 따라 천연 공급원으로부터 단리하거나 유전공학 기술을 사용하여 생산할 수 있다 (Yu et al., (2002) PNAS 99:7968-7973). 메이탄시놀 및 메이탄시놀 유사체는 또한 공지된 방법에 따라 합성 방식으로 제조할 수 있다.
예시적인 메이탄시노이드 약물 모이어티는 변형된 방향족 고리를 갖는 것, 예를 들어 C-19-데클로로 (미국 특허 4256746) (안사미토신 P2의 수소화알루미늄리튬 환원에 의해 제조됨); C-20-히드록시 (또는 C-20-데메틸) +/- C-19-데클로로 (미국 특허 4361650 및 4307016) (스트렙토마이세스 (Streptomyces) 또는 악티노마이세스 (Actinomyces)를 사용한 탈메틸화, 또는 LAH를 사용한 탈염소화에 의해 제조됨); 및 C-20-데메톡시, C-20-아실옥시 (-OCOR), +/- 데클로로 (미국 특허 4,294,757) (아실 클로라이드를 사용한 아실화에 의해 제조됨), 및 다른 위치에 변형을 갖는 것을 포함한다.
예시적인 메이탄시노이드 약물 모이어티는 또한 C-9-SH (미국 특허 4424219) (메이탄시놀과 H2S 또는 P2S5의 반응에 의해 제조됨); C-14-알콕시메틸(데메톡시/CH2OR) (US 4331598); C-14-히드록시메틸 또는 아실옥시메틸 (CH2OH 또는 CH2OAc) (미국 특허 4450254) (노카르디아 (Nocardia)로부터 제조됨); C-15-히드록시/아실옥시 (US 4364866) (스트렙토마이세스에 의한 메이탄시놀의 전환에 의해 제조된); C-15-메톡시 (미국 특허 4313946 및 4315929) (트레위아 누들를로라 (Trewia nudlflora)로부터 단리됨); C-18-N-데메틸 (미국 특허 4362663 및 4322348) (스트렙토마이세스에 의한 메이탄시놀의 탈메틸화에 의해 제조됨); 및 4,5-데옥시 (US 4371533) (메이탄시놀의 삼염화티탄/LAH 환원에 의해 제조됨)와 같은 변형을 갖는 것을 포함한다.
메이탄신 화합물 상의 많은 위치가 연결 유형에 따라 연결 위치로서 유용한 것으로 공지되어 있다. 예를 들어, 에스테르 연결을 형성하기 위해, 히드록실기를 갖는 C-3 위치, 히드록시메틸로 변형된 C-14 위치, 히드록실기로 변형된 C-15 위치, 및 히드록실기를 갖는 C-20 위치가 모두 적합하다.
메이탄시노이드 약물 모이어티는 다음 구조를 갖는 것을 포함한다:
상기 식에서, 파선은 ADC의 링커에 대한 메이탄시노이드 약물 모이어티의 황 원자의 공유 결합에 의해 부착을 나타낸다. R은 독립적으로 H 또는 C1-C6 알킬일 수 있다. 아미드기를 황 원자에 부착시키는 알킬렌 사슬은 메타닐, 에타닐, 또는 프로필일 수 있다. 즉, m은 1, 2, 또는 3이다 (US 633410; US 5208020; [Chari et al (1992) Cancer Res. 52: 127-131]; [Liu et al (1996) Proc. Natl. Acad. Sci USA 93:8618-8623]).
메이탄시노이드 약물 모이어티의 모든 입체 이성질체, 즉, D의 키랄 탄소에서 R 및 S 입체형태의 임의의 조합이 본 발명의 화합물에 고려된다. 한 실시태양에서, 메이탄시노이드 약물 모이어티는 다음 입체화학 구조를 가질 것이다:
메이탄시노이드 약물 모이어티의 예시적인 실시태양은 다음 구조를 갖는 DM1; DM3; 및 DM4를 포함한다:
상기 식에서, 파선은 항체-약물 접합체의 링커 (L)에 대한 약물의 황 원자의 공유 결합에 의해 부착을 나타낸다 (WO 2005/037992; US 2005/0276812 A1).
다른 예시적인 메이탄시노이드 항체-약물 접합체는 다음 구조 및 약어를 갖는다 (여기서 Ab는 항체이고, p는 1 내지 약 8임):
DM1이 BMPEO 링커를 통해 항체의 티올기에 연결된 예시적인 항체-약물 접합체는 다음 구조 및 약어를 갖는다:
상기 식에서, Ab는 항체이고; n은 0, 1 또는 2이고; p는 1, 2, 3 또는 4이다.
DM1과 같은 메이탄시노이드는 튜불린 중합을 억제함으로써 작용하는 유사분열 억제제이다. 메이탄신은 동아프리카 관목 메이테누스 세라타로부터 처음 단리되었다 (미국 특허 3,896,111). 이어서, 특정 미생물이 또한 메이탄시노이드, 예를 들어 메이탄시놀 및 C-3 메이탄시놀 에스테르를 생산하는 것으로 밝혀졌다 (미국 특허 4,151,042). 합성 메이탄시놀 및 그의 유도체 및 유사체는 예를 들어 그 개시 내용이 본원에 분명히 참고로 포함되는 미국 특허 4,137,230; 4,248,870; 4,256,746; 4,260,608; 4,265,814; 4,294,757; 4,307,016; 4,308,268; 4,308,269; 4,309,428; 4,313,946; 4,315,929; 4,317,821; 4,322,348; 4,331,598; 4,361,650; 4,364,866; 4,424,219; 4,450,254; 4,362,663; 및 4,371,533에 개시되어 있다.
그의 치료 지수를 개선하기 위한 시도에서, 메이탄신 및 메이탄시노이드는 종양 세포 항원에 특이적으로 결합하는 항체에 접합되었다. 메이탄시노이드를 함유하는 면역접합체 및 그의 치료 용도는 예를 들어 그 개시 내용이 본원에 분명하게 참고로 포함되는 미국 특허 5,208,020, 5,416,064 및 유럽 특허 EP 0 425 235 B1에 개시되어 있다.
항-TAHO 항체-메이탄시노이드 접합체는 항체 또는 메이탄시노이드 분자의 생물학적 활성을 유의하게 감소시키지 않으면서 항-TAHO 항체를 메이탄시노이드 분자에 화학적으로 연결시킴으로써 제조된다 (예를 들어, 그 개시 내용이 본원에 분명하게 참고로 포함되는 미국 특허 5,208,020 참조). 메이탄시노이드는 공지된 기술에 의해 합성하거나 천연 공급원으로부터 단리할 수 있다. 적합한 메이탄시노이드가 예를 들어 미국 특허 5,208,020, 및 본원에서 상기 언급된 다른 특허 및 비특허 간행물에 개시되어 있고, 상기 메이탄시노이드는 메이탄시놀, 및 메이탄시놀 분자의 방향족 고리 또는 다른 위치에서 변형된 메이탄시놀 유사체, 예를 들어 다양한 메이탄시놀 에스테르이다.
예를 들어 그 개시 내용이 본원에 분명하게 참고로 포함되는 미국 특허 5208020 또는 유럽 특허 0 425 235 B1; 문헌 [Chari et al., Cancer Research 52:127-131 (1992)]; 및 US 2005/016993 A1에 개시된 것을 포함한, 항체-메이탄시노이드 접합체의 제조를 위한, 많은 연결기가 당업계에 공지되어 있다. 링커 성분 SMCC를 포함하는 항체-메이탄시노이드 접합체는 US 2005/0276812 A1 ("Antibody Drug Conjugates and Methods")에 개시된 바와 같이 제조할 수 있다. 연결기는 상기 확인된 특허에 개시된 바와 같은 디술피드기, 티오에테르기, 산불안정기, 광불안정기, 펩티다제 불안정기, 또는 에스테라제 불안정기를 포함한다. 추가의 링커를 본원에 기재하고 예시한다.
항체 및 메이탄시노이드의 접합체는 다양한 2기능성 단백질 커플링제, 예를 들어 N-숙신이미딜-3-(2-피리딜디티오) 프로피오네이트 (SPDP), 숙신이미딜-4-(N-말레이미도메틸) 시클로헥산-1-카르복실레이트, 이미노티올란 (IT), 이미도에스테르의 2기능성 유도체 (예를 들어 디메틸 아디피미데이트 HCl), 활성 에스테르 (예를 들어 디숙신이미딜 수베레이트), 알데히드 (예를 들어 글루타르알데히드), 비스-아지도 화합물 (예를 들어 비스(p-아지도벤조일) 헥산디아민), 비스-디아조늄 유도체 (예를 들어 비스-(p-디아조늄벤조일)-에틸렌디아민), 디이소시아네이트 (예를 들어 톨루엔 2,6-디이소시아네이트), 및 비스-활성 불소 화합물 (예를 들어 1,5-디플루오로-2,4-디니트로벤젠)을 사용하여 제조할 수 있다. 디술피드 연결을 제공하기 위해 특히 바람직한 커플링제는 N-숙신이미딜-3-(2-피리딜디티오) 프로피오네이트 (SPDP) (Carlsson et al., Biochem. J. 173:723-737 [1978]), 술포숙신이미딜 말레이미도메틸 시클로헥산 카르복실레이트 (SMCC) 및 N-숙신이미딜-4-(2-피리딜티오)펜타노에이트 (SPP)를 포함한다. 다른 유용한 링커는 cys-MC-vc-PAB (말레이미드 성분 및 파라-아미노벤질카르바모일 (PAB) 자기희생적 성분을 갖는 발린-시트룰린 (vc) 디펩티드 링커 시약)를 포함한다.
링커는 연결 종류에 따라 다양한 위치에서 메이탄시노이드 분자에 부착될 수 있다. 예를 들어, 에스테르 연결은 통상적인 커플링 기술을 이용하여 히드록실기와 반응시킴으로써 형성할 수 있다. 반응은 히드록실기를 갖는 C-3 위치, 히드록시메틸로 변형된 C-14 위치, 히드록실기로 변형된 C-15 위치, 및 히드록실기를 갖는 C-20 위치에서 일어날 수 있다. 한 실시태양에서, 연결은 메이탄시놀 또는 메이탄시놀 유사체의 C-3 위치에서 형성된다.
(2)
오리스타틴
및
돌라스타틴
일부 실시태양에서, 면역접합체는 돌라스타틴 또는 돌라스타틴 펩티드 유사체 및 유도체, 예를 들어 오리스타틴 (미국 특허 5635483; 5780588)에 접합된 항체를 포함한다. 돌라스타틴 및 오리스타틴은 미세관 역학, GTP 가수분해, 및 핵 및 세포 분열을 방해하며 [Woyke et al., (2001) Antimicrob. Agents and Chemother. 45(12):3580-3584], 항암 (미국 특허 5663149) 및 항진균 활성 [Pettit et al., (1998) Antimicrob. Agents Chemother. 42:2961-2965]을 갖는 것으로 나타났다. 돌라스타틴 또는 오리스타틴 약물 모이어티는 펩티드 약물 모이어티의 N (아미노) 말단 또는 C (카르복실) 말단을 통해 항체에 부착될 수 있다 (WO 02/088172).
예시적인 오리스타틴 실시태양은 2004년 3월 28일 제시된 문헌 [Senter et al., Proceedings of the American Association for Cancer Research, Volume 45, Abstract Number 623] (그 개시내용의 전문이 분명하게 본원에 참고로 포함된 US 2005/0238649)에 개시된, N-말단 연결된 모노메틸오리스타틴 약물 모이어티 DE 및 DF 포함한다.
펩티드 약물 모이어티는 하기 화학식 DE 및 DF 중에서 선택될 수 있다:
상기 식에서, DE 및 DF의 파선은 독립적으로 각각의 위치에서 항체 또는 항체-링커 성분에 대한 공유 결합에 의해 부착 부위를 나타내고;
R2는 H 및 C1-C8 알킬로부터 선택되고;
R3은 H, C1-C8 알킬, C3-C8 카르보사이클, 아릴, C1-C8 알킬-아릴, C1-C8 알킬-(C3-C8 카르보사이클), C3-C8 헤테로사이클 및 C1-C8 알킬-(C3-C8 헤테로사이클)로부터 선택되고;
R4는 H, C1-C8 알킬, C3-C8 카르보사이클, 아릴, C1-C8 알킬-아릴, C1-C8 알킬-(C3-C8 카르보사이클), C3-C8 헤테로사이클 및 C1-C8 알킬-(C3-C8 헤테로사이클)로부터 선택되고;
R5는 H 및 메틸로부터 선택되거나;
또는 R4 및 R5는 함께 화학식 -(CRaRb)n-의 카르보시클릭 고리를 형성하고, 여기서 Ra 및 Rb는 독립적으로 H, C1-C8 알킬 및 C3-C8 카르보사이클로부터 선택되고, n은 2, 3, 4, 5 및 6으로부터 선택되고;
R6은 H 및 C1-C8 알킬로부터 선택되고;
R7은 H, C1-C8 알킬, C3-C8 카르보사이클, 아릴, C1-C8 알킬-아릴, C1-C8 알킬-(C3-C8 카르보사이클), C3-C8 헤테로사이클 및 C1-C8 알킬-(C3-C8 헤테로사이클)로부터 선택되고;
각각의 R8은 독립적으로 H, OH, C1-C8 알킬, C3-C8 카르보사이클 및 0-(C1-C8 알킬)로부터 선택되고;
R9는 H 및 C1-C8 알킬로부터 선택되고;
R10은 아릴 또는 C3-C8 헤테로사이클로부터 선택되고;
Z는 O, S, NH, 또는 NR12이고, 여기서 R12는 C1-C8 알킬이고;
R11은 H, C1-C20 알킬, 아릴, C3-C8 헤테로사이클, -(R13O)m-R14, 또는 -(R13O)m-CH(R15)2로부터 선택되고;
m은 1-1000의 정수이고;
R13은 C2-C8 알킬이고;
R14는 H 또는 C1-C8 알킬이고;
각각의 R15는 독립적으로 H, COOH, -(CH2)n-N(R16)2, -(CH2)n-SO3H, 또는 -(CH2)nSO3-C1-C8 알킬이고;
각각의 R16은 독립적으로 H, C1-C8 알킬, 또는 -(CH2)n-COOH이고;
R18은 -C(R8)2-C(R8)2-아릴, -C(R8)2-C(R8)2-(C3-C8 헤테로사이클), 및 -C(R8)2-C(R8)2-(C3-C8 카르보사이클)로부터 선택되고;
n은 0 내지 6의 정수이다.
한 실시태양에서, R3, R4 및 R7은 독립적으로 이소프로필 또는 sec-부틸이고, R5는 -H 또는 메틸이다. 예시적인 실시태양에서, R3 및 R4는 각각 이소프로필이고, R5는 -H이고, R7은 sec-부틸이다.
또다른 실시태양에서, R2 및 R6은 각각 메틸이고, R9는 -H이다.
또다른 실시태양에서, 각각의 R8은 -OCH3이다.
예시적인 실시태양에서, R3 및 R4은 각각 이소프로필이고, R2 및 R6은 각각 메틸이고, R5는 -H이고, R7은 sec-부틸이고, 각각의 R8은 -OCH3이고, R9는 -H이다.
한 실시태양에서, Z는 -O- 또는 -NH-이다.
한 실시태양에서, R10은 아릴이다.
예시적인 실시태양에서, R10은 -페닐이다.
예시적인 실시태양에서, Z가 -O-일 때, R11은 -H, 메틸 또는 t-부틸이다.
한 실시태양에서, Z가 -NH일 때, R11은 -CH(R15)2이고, 여기서 R15는 -(CH2)n-N(R16)2이고, R16은 -C1-C8 알킬 또는 -(CH2)n-COOH이다.
다른 실시태양에서, Z가 -NH일 때, R11은 -CH(R15)2이고, 여기서 R15는 -(CH2)n-SO3H이다.
화학식 DE의 예시적인 오리스타틴 실시태양은 MMAE이고, 여기서 파선은 항체-약물 접합체의 링커 (L)에 대한 공유 결합에 의해 부착을 나타낸다:
화학식 DF의 예시적인 오리스타틴 실시태양은 MMAF이고, 여기서 파선은 항체-약물 접합체의 링커 (L)에 대한 공유 결합에 의해 부착을 나타낸다 (US 2005/0238649 및 문헌 [Doronina et al. (2006) Bioconjugate Chem. 17:114-124] 참조):
다른 예시적인 실시태양은 펜타펩티드 오리스타틴 약물 모이어티의 C-말단에 페닐알라닌 카르복시 변형을 갖는 모노메틸발린 화합물 (WO 2007/008848), 및 펜타펩티드 오리스타틴 약물 모이어티의 C-말단에 페닐알라닌 측쇄 변형을 갖는 모노메틸발린 화합물 (WO 2007/008603)을 포함한다.
다른 약물 모이어티는 다음 MMAF 유도체들을 포함하고, 여기서 파선은 항체-약물 접합체의 링커 (L)에 대한 공유 결합에 의해 부착을 나타낸다:
한 측면에서, 상기 제시한 바와 같은 트리에틸렌 글리콜 에스테르 (TEG)를 포함하고 이에 제한되지 않는 친수성 기가 R11에서 약물 모이어티에 부착될 수 있다. 임의의 특정 이론에 매이지 않지만, 친수성 기는 약물 모이어티의 내재화 및 응집 방지를 돕는다.
오리스타틴/돌라스타틴 또는 그의 유도체를 포함하는 화학식 I의 ADC의 예시적인 실시태양은 본원에 참고로 분명하게 포함되는 US 2005-0238649 및 문헌 [Doronina et al. (2006) Bioconjugate Chem. 17:114-124]에 기재되어 있다. MMAE 또는 MMAF 및 다양한 링커 성분을 포함하는 화학식 I의 ADC의 예시적인 실시태양은 다음 구조 및 약어를 갖는다 (여기서, "Ab"는 항체이고; p는 1 내지 약 8이고, "Val-Cit" 또는 "vc"는 발린-시트룰린 디펩티드이고; "S"는 황 원자이다):
MMAF 및 다양한 링커 성분을 포함하는 화학식 I의 ADC의 예시적인 실시태양은 Ab-MC-PAB-MMAF 및 Ab-PAB-MMAF를 더 포함한다. 흥미롭게도, 단백 분해에 의해 절단가능하지 않은 링커에 의해 항체에 부착된 MMAF를 포함하는 면역접합체는 단백 분해에 의해 절단가능한 링커에 의해 항체에 부착된 MMAF를 포함하는 면역접합체에 대응하는 활성을 갖는 것으로 밝혀졌다 (문헌 [Doronina et al. (2006) Bioconjugate Chem. 17:114-124] 참조). 상기한 경우에, 약물 방출은 세포 내에서 항체 분해에 의해 이루어지는 것으로 생각된다 (상기 문헌 참조).
일반적으로, 펩티드-기반 약물 모이어티는 2개 이상의 아미노산 및/또는 펩티드 단편 사이의 펩티드 결합을 형성함으로써 제조할 수 있다. 이러한 펩티드 결합은 예를 들어 펩티드 화학 분야에 잘 알려져 있는 액상 합성 방법 (문헌 [E. Schroeder and K. Luebke, "The Peptides", volume 1, pp 76-136, 1965, Academic Press] 참조)에 따라 제조할 수 있다. 오리스타틴/돌라스타틴 약물 모이어티는 US 2005-0238649 A1; 미국 특허 5635483; 미국 특허 5780588; 문헌 ([Pettit et al., (1989) J. Am. Chem. Soc. 111:5463-5465]; [Pettit et al., (1998) Anti-Cancer Drag Design 13:243-277]; [Pettit, G.R., et al. Synthesis, 1996, 719-725]; [Pettit et al., (1996) J. Chem. Soc. Perkin Trans. 15:859-863] 및 [Doronina (2003) Nat. Biotechnol. 21(7):778-784])의 방법에 따라 제조할 수 있다.
특히, 화학식 DF의 오리스타틴/돌라스타틴 약물 모이어티, 예를 들어 MMAF 및 그의 유도체는 US 2005-0238649 A1 및 문헌 [Doronina et al. (2006) Bioconjugate Chem. 17:114-124]에 기재된 방법을 사용하여 제조할 수 있다. 화학식 DE의 오리스타틴/돌라스타틴 약물 모이어티, 예를 들어 MMAE 및 그의 유도체는 문헌 [Doronina et al. (2003) Nat. Biotech. 21:778-784]에 기재된 방법을 사용하여 제조할 수 있다. 약물-링커 모이어티 MC-MMAF, MC-MMAE, MC-vc-PAB-MMAF, 및 MC-vc-PAB-MMAE는 예를 들어 문헌 [Doronina et al. (2003) Nat. Biotech. 21:778-784], 및 미국 특허 출원 공개 US 2005/0238649 A1에 기재된 바와 같은 통상적인 방법으로 편리하게 합성한 후, 목적하는 항체에 접합할 수 있다.
(3)
칼리케아미신
다른 실시태양에서, 면역접합체는 하나 이상의 칼리케아미신 분자에 접합된 항체를 포함한다. 칼리케아미신 패밀리의 항생제는 피코몰 미만의 농도에서 이중 가닥 DNA 절단을 만들 수 있다. 칼리케아미신 패밀리의 접합체의 제조에 대해서는, 미국 특허 5,712,374, 5,714,586, 5,739,116, 5,767,285, 5,770,701, 5,770,710, 5,773,001, 5,877,296 (모두 아메리칸 시아나미드 컴퍼니 (American Cyanamid Company))을 참조한다. 사용할 수 있는 칼리케아미신의 구조적 유사체는 γ1 I, α2 I, α3 I, N-아세틸-γ1 I, PSAG 및 θI 1을 포함하고 이로 제한되지 않는다 ([Hinman et al., Cancer Research 53:3336-3342 (1993)], [Lode et al., Cancer Research 58:2925-2928 (1998)]; 및 상기 언급된 아메리칸 시아나미드의 미국 특허). 항체가 접합될 수 있는 다른 항-종양 약물은 항엽산제인 QFA이다. 칼리케아미신 및 QFA는 둘 모두 세포내 작용 부위를 갖고, 형질막을 쉽게 통과하지 않는다. 따라서, 항체-매개 내재화를 통한 이들 물질의 세포 내 흡수는 그들의 세포독성 효과를 크게 향상시킨다.
c. 다른
세포독성제
본 발명의 항-TAHO 항체에 접합될 수 있는 다른 항종양 물질은 BCNU, 스트렙토조신, 빈크리스틴 및 5-플루오로우라실, 미국 특허 5,053,394, 5,770,710에 기재된, 집합적으로 LL-E33288 복합체로 공지된 물질의 패밀리, 및 에스페라미신 (미국 특허 5,877,296)을 포함한다.
사용할 수 있는 효소 활성 독소 및 그의 단편은 디프테리아 A 사슬, 디프테리아 독소의 비결합 활성 단편, 외독소 A 사슬 (슈도모나스 애루기노사로부터 유래됨), 리신 A 사슬, 아브린 A 사슬, 모데신 A 사슬, 알파-사르신, 알류리테스 포르디이 단백질, 디안틴 단백질, 피톨라카 아메리카나 단백질 (PAPI, PAPII, 및 PAP-S), 모모르디카 카란티아 억제제, 쿠르신, 크로틴, 사파오나리아 오피시날리스 억제제, 겔로닌, 미토겔린, 레스트릭토신, 페노마이신, 에노마이신 및 트리코테센을 포함한다 (예를 들어, 1993년 10월 28일 공개된 WO 93/21232 참조).
본 발명은 항체와 뉴클레오티드 분해 활성을 갖는 화합물 (예를 들어, 리보뉴클레아제 또는 DNA 엔도뉴클레아제, 예를 들어 데옥시리보뉴클레아제; DNase) 사이에 형성된 면역접합체를 추가로 고려한다.
종양의 선택적인 파괴를 위해, 항체는 고도의 방사성 원자를 포함할 수 있다. 다양한 방사성 동위원소가 방사성 접합된 항-TAHO 항체의 생산을 위해 이용가능하다. 그 예는 At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212, 및 Lu의 방사성 동위원소를 포함한다. 면역접합체는 검출용으로 사용되는 경우에 섬광조영 연구를 위한 방사성 원자, 예를 들어 tc99m 또는 I123을 포함하거나, 핵자기 공명 (NMR) 영상화 (자기 공명 영상화, mri로도 공지됨)용 스핀 (spin) 표지, 예를 들어 요오드-123, 요오드-131, 인듐-111, 불소-19, 탄소-13, 질소-15, 산소-17, 가돌리늄, 망간 또는 철을 포함할 수 있다.
방사성 표지 또는 다른 표지를 공지된 방식으로 접합체 내에 혼입시킬 수 있다. 예를 들어, 펩티드는 생합성할 수 있거나, 또는 예를 들어 수소 대신에 불소-19를 포함하는 적합한 아미노산 전구체를 사용하는 화학적 아미노산 합성에 의해 합성할 수 있다. tc99m 또는 I123, Re186, Re188 및 In111과 같은 표지가 펩티드 내의 시스테인 잔기를 통해 부착될 수 있다. 이트륨-90은 라이신 잔기를 통해 부착될 수 있다. 요오도겐 (IODOGEN) 방법 (Fraker et al. (1978) Biochem. Biophys. Res. Commun. 80:49-57)을 사용하여 요오드-123을 혼입시킬 수 있다. 문헌 ["Monoclonal Antibodies in Immunoscintigraphy" (Chatal, CRC Press 1989)]에는 다른 방법이 상세히 기재되어 있다.
특정 실시태양에서, 면역접합체는 전구약물 (예를 들어, 펩티딜 화학요법제, WO 81/01145 참조)을 활성 약물, 예를 들어 항암 약물로 전환시키는 전구약물-활성화 효소에 접합된 항체를 포함할 수 있다. 그러한 면역접합체는 항체 의존성 효소 매개 전구약물 요법 ("ADEPT")에서 유용하다. 항체에 접합될 수 있는 효소는 포스페이트 함유 전구약물을 유리 약물로 전환시키는데 유용한 알칼리성 포스파타제; 술페이트 함유 전구약물을 유리 약물로 전환시키는데 유용한 아릴술파타제; 무독성 5-플루오로시토신을 항암 약물인 5-플루오로우라실로 전환시키는데 유용한 시토신 데아미나제; 펩티드 함유 전구약물을 유리 약물로 전환시키는데 유용한 프로테아제, 예를 들어 세라티아 (serratia) 프로테아제, 테르몰리신, 섭틸리신, 카르복시펩티다제 및 카텝신 (예를 들어, 카텝신 B 및 L); D-아미노산 치환체를 함유하는 전구약물을 전환시키는데 유용한 D-알라닐카르복시펩티다제; 글리코실화된 전구약물을 유리 약물로 전환시키는데 유용한 탄수화물-절단 효소, 예를 들어 β-갈락토시다제 및 뉴라미니다제; β-락탐으로 유도체화된 약물을 유리 약물로 전환시키는데 유용한 β-락타마제; 및 그들의 아민 질소에서 각각 페녹시아세틸기 또는 페닐아세틸기로 유도체화된 약물을 유리 약물로 전환시키는데 유용한 페니실린 아미다제, 예를 들어 페니실린 V 아미다제 또는 페니실린 G 아미다제를 포함하고 이로 제한되지 않는다. 효소는 당업계에 공지된 재조합 DNA 기술에 의해 항체에 공유 결합될 수 있다 (예를 들어, 문헌 [Neuberger et al., Nature 312:604-608 (1984)] 참조).
d. 약물 로딩
약물 로딩은 화학식 I의 분자에서 항체당 약물 모이어티의 평균 수인 p로 표시된다. 약물 로딩은 항체당 1 내지 20개의 약물 모이어티 (D)일 수 있다. 화학식 I의 ADC는 1 내지 20개의 약물 모이어티와 접합된 항체의 집합체를 포함한다. 접합 반응에 의한 ADC의 제조에서 항체당 약물 모이어티의 평균 수는 통상적인 수단, 예를 들어 질량 분광분석법, ELISA 분석, 및 HPLC에 의해 특성화될 수 있다. 또한, p의 측면에서 ADC의 정량적 분포를 결정할 수 있다. 일부 경우에, p가 다른 약물 로딩을 갖는 ADC로부터의 특정 값인 균질 ADC의 분리, 정제 및 특성 결정은 역상 HPLC 또는 전기영동과 같은 수단에 의해 달성할 수 있다. 따라서, 화학식 I의 항체-약물 접합체의 제약 제제는 그러한 접합체와, 1, 2, 3 또는 4개 이상의 약물 모이어티에 연결된 항체의 불균질 혼합물일 수 있다.
일부 항체-약물 접합체에 대해, p는 항체 상의 부착 부위의 수에 의해 제한될 수 있다. 예를 들어, 상기 예시적인 실시태양에서와 같이 부착이 시스테인 티올인 경우에, 항체는 단지 하나 또는 수개의 시스테인 티올기를 가질 수 있거나, 또는 그를 통해 링커가 부착될 수 있는 충분히 반응성인 티올기를 단지 하나 또는 여러 개 가질 수 있다. 특정 실시태양에서, 보다 큰 약물 로딩, 예를 들어 p>5는 특정 항체-약물 접합체의 응집, 불용성, 독성, 또는 세포 투과도 손실을 일으킬 수 있다. 특정 실시태양에서, 본 발명의 ADC에 대한 약물 로딩은 1 내지 약 8; 약 2 내지 약 6; 또는 약 3 내지 약 5이다. 실제로, 특정 ADC에 대해, 항체당 약물 모이어티의 최적비는 8 미만일 수 있고, 약 2 내지 약 5일 수 있음이 밝혀졌다. US 2005-0238649 A1을 참조한다
특정 실시태양에서, 이론적 최대치 미만의 약물 모이어티가 접합 반응 동안 항체에 접합된다. 항체는 예를 들어, 아래에서 논의되는 바와 같이 약물-링커 중간체 또는 링커 시약과 반응하지 않는 라이신 잔기를 포함할 수 있다. 일반적으로, 항체는 약물 모이어티에 연결될 수 있는 많은 유리 및 반응성 시스테인 티올기를 함유하지 않고; 실제로 항체 내의 대부분의 시스테인 티올 잔기는 디술피드 다리로서 존재한다. 특정 실시태양에서, 항체를 부분 또는 완전 환원 조건 하에 환원제, 예를 들어 디티오트레이톨 (DTT) 또는 트리카르보닐에틸포스핀 (TCEP)으로 환원시켜 반응성 시스테인 티올기를 생성할 수 있다. 특정 실시태양에서, 항체는 변성 조건에 적용되어 반응성 친핵성 기, 예를 들어 라이신 또는 시스테인을 제시한다.
ADC의 로딩 (약물/항체 비)은 상이한 방식, 예를 들어 (i) 항체에 비해 몰 과량의 약물-링커 중간체 또는 링커 시약의 제한, (ii) 접합 반응 시간 또는 온도의 제한, 및 (iii) 시스테인 티올 변형에 대한 부분 또는 제한 환원 조건에 의해 제어할 수 있다.
하나 초과의 친핵성 기가 약물-링커 중간체 또는 링커 시약과, 이어서 약물 모이어티 시약과 반응하면, 생성되는 생성물은 항체에 부착된 하나 이상의 약물 모이어티의 분포를 갖는 ADC 화합물의 혼합물임을 이해하여야 한다. 항체당 약물의 평균 수는 항체에 특이적이고 약물에 특이적인 이중 ELISA 항체 분석에 의해 혼합물로부터 계산할 수 있다. 개별 ADC 분자는 질량 분광분석법에 의해 혼합물 내에서 확인하고, HPLC, 예를 들어 소수성 상호작용 크로마토그래피에 의해 분리할 수 있다 (예를 들어, 문헌 [McDonagh et al (2006) Prot. Engr. Design & Selection 19(7):299-307]; Hamblett et al (2004) Clin. Cancer Res. 10:7063-7070]; [Hamblett, K. J., et al. "Effect of drug loading on the pharmacology, pharmacokinetics, and toxicity of an anti-CD30 antibody-drug conjugate", Abstract No. 624, American Association for Cancer Research, 2004 Annual Meeting, March 27-31, 2004, Proceedings of the AACR, Volume 45, March 2004]; [Alley, S.C., et al. "Controlling the location of drug attachment in antibody-drug conjugates", Abstract No. 627, American Association for Cancer Research, 2004 Annual Meeting, March 27-31, 2004, Proceedings of the AACR, Volume 45, March 2004] 참조). 특정 실시태양에서, 단일 로딩 값을 갖는 균질 ADC는 전기영동 또는 크로마토그래피에 의해 접합 혼합물로부터 단리할 수 있다.
e.
면역접합체
제조를 위한 특정 방법
화학식 I의 ADC는 다음을 포함한, 당업자에게 공지된 유기 화학 반응, 조건 및 시약을 사용하는 몇몇 경로에 의해 제조할 수 있다: (1) 항체의 친핵성 기를 2가 링커 시약과 반응시켜, 공유 결합을 통해 Ab-L을 형성시킨 후, 이를 약물 모이어티 D와 반응시키는 방법; 및 (2) 약물 모이어티의 친핵성 기를 2가 링커 시약과 반응시켜, 공유 결합을 통해 D-L을 형성시킨 후, 이를 항체의 친핵성 기와 반응시키는 방법. 후자의 경로를 통해 화학식 I의 ADC를 제조하는 예시적인 방법은 본원에 참고로 분명하게 포함되는 US 2005-0238649 A1에 기재되어 있다.
항체 상의 친핵성 기는 (i) N-말단 아민기; (ii) 측쇄 아민기, 예를 들어 라이신; (iii) 측쇄 티올기, 예를 들어 시스테인; 및 (iv) 당 히드록실 또는 아미노기 (여기서, 항체는 글리코실화됨)를 포함하고 이로 제한되지 않는다. 아민, 티올 및 히드록실기는 친핵성이고, 반응하여 링커 모이어티 및 링커 시약 상의 친전자성 기, 예를 들어 (i) 활성 에스테르, 예를 들어 NHS 에스테르, HOBt 에스테르, 할로포르메이트 및 산 할라이드; (ii) 알킬 및 벤질 할라이드, 예를 들어 할로아세트아미드; (iii) 알데히드, 케톤, 카르복실 및 말레이미드기와 공유 결합을 형성할 수 있다. 특정 항체는 환원가능한 사슬간 디술피드, 즉 시스테인 다리를 갖는다. 항체는 항체가 완전히 또는 부분적으로 환원되도록 환원제, 예를 들어 DTT (디티오트레이톨) 또는 트리카르보닐에틸포스핀 (TCEP)로 처리함으로써 링커 시약과의 접합을 위해 반응성이 되도록 할 수 있다. 따라서, 각각의 시스테인 다리는 이론상 2개의 반응성 티올 친핵체를 형성할 것이다. 추가의 친핵성 기는 라이신 잔기의 변형을 통해, 예를 들어 라이신 잔기와 2-이미노티올란 (트라우트 (Traut) 시약)을 반응시켜 아민을 티올로 전환시켜 항체 내로 도입될 수 있다. 반응성 티올기는 1, 2, 3 또는 4개 이상의 시스테인 잔기를 도입함으로써 (예를 들어, 하나 이상의 비-천연 시스테인 아미노산 잔기를 포함하는 변이체 항체를 제조함으로써) 항체 내로 도입될 수 있다.
본 발명의 항체-약물 접합체는 또한 항체 상의 친전자성 기, 예를 들어 알데히드 또는 케톤 카르보닐기와 링커 시약 또는 약물 상의 친핵성 기 사이의 반응에 의해 생성할 수 있다. 링커 시약 상의 유용한 친핵성 기는 히드라지드, 옥심, 아미노, 히드라진, 티오세미카르바존, 히드라진 카르복실레이트, 및 아릴히드라지드를 포함하고 이로 제한되지 않는다. 한 실시태양에서, 항체를 변형시켜 링커 시약 또는 약물 상의 친핵성 치환기와 반응할 수 있는 친전자성 모이어티를 도입한다. 다른 실시태양에서, 글리코실화된 항체의 당은 예를 들어 퍼요오데이트 산화 시약으로 산화시켜, 링커 시약 또는 약물 모이어티의 아민기와 반응할 수 있는 알데히드 또는 케톤기를 형성할 수 있다. 생성되는 이민 쉬프 (Schiff) 염기 기는 안정한 연결을 형성할 수 있거나, 또는 예를 들어 수소화붕소 시약에 의해 환원되어 안정한 아민 연결을 형성할 수 있다. 한 실시태양에서, 글리코실화된 항체의 탄수화물 부분을 갈락토스 옥시다제 또는 나트륨 메타-퍼요오데이트와 반응시키면, 약물 상의 적절한 기와 반응할 수 있는 카르보닐 (알데히드 및 케톤) 기가 항체 내에 생성될 수 있다 (Hermanson, Bioconjugate Techniques). 다른 실시태양에서, N-말단 세린 또는 트레오닌 잔기를 함유하는 항체를 나트륨 메타-퍼요오데이트와 반응시키면, 제1 아미노산 대신에 알데히드를 생성할 수 있다 ([Geoghegan & Stroh, (1992) Bioconjugate Chem. 3:138-146]; US 5362852). 그러한 알데히드는 약물 모이어티 또는 링커 친핵체와 반응할 수 있다.
약물 모이어티 상의 친핵성 기는, 반응하여 링커 모이어티 및 링커 시약 상의 친전자성 기, 예를 들어 (i) 활성 에스테르, 예를 들어 NHS 에스테르, HOBt 에스테르, 할로포르메이트 및 산 할라이드; (ii) 알킬 및 벤질 할라이드, 예를 들어 할로아세트아미드; (iii) 알데히드, 케톤, 카르복실 및 말레이미드기와 공유 결합을 형성할 수 있는, 아민, 티올, 히드록실, 히드라지드, 옥심, 히드라진, 티오세미카르바존, 히드라진 카르복실레이트, 및 아릴히드라지드기를 포함하고 이로 제한되지 않는다.
본 발명의 화합물은 상업적으로 이용가능한 (예를 들어 피어스 바이오테크놀로지, 인크.로부터; [2003-2004 Applications Handbook and Catalog]의 페이지 467-498 참조) 다음 가교결합제 시약을 사용하여 제조된 ADC를 명백히 고려하고 이로 제한되지 않는다: BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, 술포-EMCS, 술포-GMBS, 술포-KMUS, 술포-MBS, 술포-SIAB, 술포-SMCC, 및 술포-SMPB, 및 SVSB (숙신이미딜-(4-비닐술폰)벤조에이트).
항체 및 세포독성제의 접합체는 다양한 2기능성 단백질 커플링제, 예를 들어 N-숙신이미딜-3-(2-피리딜디티오) 프로피오네이트 (SPDP), 숙신이미딜-4-(N-말레이미도메틸) 시클로헥산-1-카르복실레이트, 이미노티올란 (IT), 이미도에스테르의 2기능성 유도체 (예를 들어 디메틸 아디피미데이트 HCl), 활성 에스테르 (예를 들어 디숙신이미딜 수베레이트), 알데히드 (예를 들어 글루타르알데히드), 비스-아지도 화합물 (예를 들어 비스(p-아지도벤조일) 헥산디아민), 비스-디아조늄 유도체 (예를 들어 비스-(p-디아조늄벤조일)-에틸렌디아민), 디이소시아네이트 (예를 들어 톨루엔 2,6-디이소시아네이트), 및 비스-활성 불소 화합물 (예를 들어 1,5-디플루오로-2,4-디니트로벤젠)을 사용하여 제조할 수 있다. 예를 들어, 리신 면역독소는 문헌 [Vitetta et al., Science, 238:1098 (1987)]에 기재된 바와 같이 제조할 수 있다. 탄소-14-표지된 1-이소티오시아나토벤질-3-메틸디에틸렌 트리아민펜타아세트산 (MX-DTPA)은 방사성 뉴클레오티드를 항체에 접합시키기 위한 예시적인 킬레이팅제이다 (WO94/11026 참조). 링커는 세포 내에서 세포독성 약물의 방출을 용이하게 하는 "절단가능 링커"일 수 있다. 예를 들어, 산 불안정 링커, 펩티다제-감수성 링커, 광 불안정 링커, 디메틸 링커 또는 디술피드-함유 링커 ([Chari et al., Cancer Research 52:127-131 (1992)]; 미국 특허 5,208,020)가 사용될 수 있다.
별법으로, 항-TAHO 항체 및 세포독성제를 포함하는 융합 단백질은 예를 들어 재조합 기술 또는 펩티드 합성에 의해 제조할 수 있다. DNA 길이는 서로 인접하거나 또는 접합체의 목적하는 특성을 파괴하지 않는 링커 펩티드를 코딩하는 영역에 의해 분리되는 접합체의 두 부분을 코딩하는 각각의 영역을 포함할 수 있다.
또다른 실시태양에서, 항체를 종양 예비표적화에 이용하기 위해 "수용체" (예를 들어 스트렙타비딘)에 접합할 수 있고, 여기서 항체-수용체 접합체를 환자에게 투여하고, 이어서 소실제를 사용하여 결합되지 않은 접합체를 순환계로부터 제거한 후, 세포독성제 (예를 들어, 방사성 뉴클레오티드)에 접합된 "리간드" (예를 들어, 아비딘)를 투여한다.
예시적인
면역접합체
-
Thio
-항체 약물 접합체
a. 시스테인 조작된 항-
TAHO
항체의 제조
본 발명의 시스테인 조작된 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 및 항-cyno CD79b (TAHO40) 및 모 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 및 항-cyno CD79b (TAHO40)의 아미노산 서열 변이체를 코딩하는 DNA는 천연 공급원으로부터의 단리 (자연 발생 아미노산 서열 변이체의 경우), 부위-지정 (또는 올리고뉴클레오티드-매개된) 돌연변이 유발에 의한 제조 ([Carter (1985) et al Nucleic Acids Res. 13:4431-4443]; [Ho et al (1989) Gene (Amst.) 77:51-59]; [Kunkel et al (1987) Proc. Natl. Acad. Sci. USA 82:488]; [Liu et al (1998) J. Biol. Chem. 273:20252-20260]), PCR 돌연변이 유발 ([Higuchi, (1990) in PCR Protocols, pp.177-183, Academic Press]; [Ito et al (1991) Gene 102:67-70]; [Bernhard et al (1994) Bioconjugate Chem. 5: 126-132]; 및 [Vallette et al (1989) Nuc. Acids Res. 17:723-733]), 및 폴리펩티드를 코딩하는 기제조된 DNA의 카세트 돌연변이 유발 (Wells et al (1985) Gene 34:315-323)을 포함하고 이로 제한되지 않는 다양한 방법에 의해 제조한다. 돌연변이 유발 프로토콜, 키트, 및 시약은 상업적으로 이용가능하고, 예를 들어 QuikChange® 다중 부위 지정 돌연변이 유발 키트 (스트라타젠 (Stratagene, 미국 캘리포니아주 라 졸라)이 존재한다. 단일 돌연변이는 또한 PCR 기반 돌연변이 유발에 의해 주형으로서 이중 가닥 플라스미드 DNA를 사용하는 올리고뉴클레오티드 유도 돌연변이 유발에 의해서 생성된다 ([Sambrook and Russel, (2001) Molecular Cloning: A Laboratory Manual, 3rd edition]; [Zoller et al (1983) Methods Enzymol. 100:468-500]; [Zoller, M.J. and Smith, M. (1982) Nucl. Acids Res. 10:6487-6500]). 재조합 항체의 변이체는 제한 단편 조작에 의해 또는 합성 올리고뉴클레오티드를 사용한 중복 연장 (overlap extension) PCR에 의해서도 제조할 수 있다. 돌연변이 유발 프라이머는 시스테인 코돈 치환(들)을 코딩한다. 표준 돌연변이 유발 기술을 사용하여 그러한 돌연변이체 시스테인 조작된 항체를 코딩하는 DNA를 생성할 수 있다 ([Sambrook et al Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1989]; 및 [Ausubel et al Current Protocols in Molecular Biology, Greene Publishing and Wiley-Interscience, New York, N. Y., 1993]).
파지 디스플레이 기술 (McCafferty et al (1990) Nature 348:552-553)을 사용하여, 항-TAHO 인간 항체 및 항체 단편을 비면역화된 공여체로부터의 면역글로불린 가변 (V) 도메인 유전자 레퍼토리로부터 시험관 내에서 생산할 수 있다. 상기 기술에 따라, 항체 V 도메인 유전자는 필라멘트형 박테리오파지, 예를 들어 M13 또는 fd의 주 또는 부 코트 단백질 유전자 내로 인-프레임으로 클로닝되고, 파지 입자의 표면 상에 기능성 항체 단편으로서 디스플레이된다. 필라멘트형 입자는 파지 게놈의 단일 가닥 DNA 카피를 포함하므로, 항체의 기능적 특성에 기초한 선택은 또한 이들 특성을 보이는 항체를 코딩하는 유전자를 선택하는 것이다. 따라서, 파지는 B-세포의 특성의 일부를 모방한다 ([Johnson et al (1993) Current Opinion in Structural Biology 3:564-571]; [Clackson et al (1991) Nature, 352:624-628]; [Marks et al (1991) J. Mol. Biol. 222:581-597]; [Griffith et al (1993) EMBO J. 12:725-734]; US 5565332; US 5573905; US 5567610; US 5229275).
항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체는 공지의 올리고펩티드 합성 방법을 사용하여 화학적으로 합성할 수 있거나, 재조합 기술을 사용하여 제조하고 정제할 수 있다. 적절한 아미노산 서열, 또는 그의 일부는 고상 기술을 사용하여 직접 펩티드 합성에 의해 생산할 수 있다 ([Stewart et al., Solid-Phase Peptide Synthesis, (1969) W.H. Freeman Co., San Francisco, CA]; [Merrifield, (1963) J. Am. Chem. Soc, 85:2149-2154]). 시험관내 단백질 합성은 수동 기술을 사용하여 또는 자동화에 의해 수행할 수 있다. 자동화 고상 합성은 예를 들어 t-BOC 또는 Fmoc 보호된 아미노산을 사용하고 어플라이드 바이오시스템즈 펩티드 합성기를 제조사의 지시에 따라 이용하여 달성할 수 있다. 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체, 또는 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40)의 다양한 부분들은 별개로 화학적으로 합성하고, 목적하는 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체, 또는 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40)를 생산하기 위해 화학적 또는 효소적 방법을 사용하여 조합할 수 있다.
항체 단편을 생산하기 위한 다양한 기술이 개발되었다. 전통적으로, 이들 단편은 무손상 항체의 단백 분해 소화를 통해 유도되거나 ([Morimoto et al (1992) Journal of Biochemical and Biophysical Methods 24:107-117]; 및 [Brennan et al (1985) Science, 229:81]), 재조합 숙주 세포에 의해 직접 생산되었다. Fab, Fv 및 ScFv 항-TAHO 항체 단편은 모두 이. 콜라이에서 발현되고 이로부터 분비되어 다량의 이들 단편을 용이하게 생산할 수 있다. 항체 단편은 본원에서 논의된 항체 파지 라이브러리로부터 단리할 수 있다. 별법으로, Fab'-SH 단편은 이. 콜라이로부터 직접 회수되고 화학적으로 커플링되어 F(ab')2 단편을 형성할 수 있거나 (Carter et al (1992) Bio/Technology 10:163-167), 재조합 숙주 세포 배양액으로부터 직접 단리할 수 있다. 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체는 (scFv) 단쇄 Fv 단편일 수 있다 (WO 93/16185; US 5571894; US 5587458). 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체 단편은 또한 "선형 항체"일 수 있다 (US 5641870). 그러한 선형 항체 단편은 단일특이적 또는 이중 특이적일 수 있다.
아래의 설명은 주로 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체 코딩 핵산을 함유하는 벡터로 형질전환되거나 형질감염된 세포를 배양함으로써 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체를 생산하는 것에 관한 것이다. 항-TAHO 항체를 코딩하는 DNA는 항-TAHO 항체 mRNA를 보유하고 이를 검출가능한 수준으로 발현하는 것으로 생각되는 조직으로부터 제조된 cDNA 라이브러리로부터 얻을 수 있다. 따라서, 인간 항-TAHO 항체 또는 TAHO 폴리펩티드 DNA는 인간 조직으로부터 제조된 cDNA 라이브러리로부터 편리하게 얻을 수 있다. 항-TAHO 항체-코딩 유전자는 또한 게놈 라이브러리로부터 얻을 수 있거나 공지의 합성 과정 (예를 들어, 자동 핵산 합성)에 의해 얻을 수 있다.
본 발명의 설계, 선택 및 제조 방법에 의해 친전자성 관능기와 반응성인 시스테인 조작된 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 및 항-cyno CD79b (TAHO40) 항체를 얻을 수 있다. 이들 방법에 의해, 지정되고 설계된 선택적인 부위에서 약물 분자를 갖는 항체 접합체 화합물, 항체-약물 접합체 (ADC) 화합물을 추가로 얻을 수 있다. 항체 표면 상의 반응성 시스테인 잔기는 티올 반응기, 예를 들어 말레이미드 또는 할로아세틸을 통한 약물 모이어티의 특이적 접합을 허용한다. 말레이미드기에 대한 Cys 잔기의 티올 관능기의 친핵 반응성은 단백질 내의 임의의 다른 아미노산 관능기, 예를 들어 라이신 잔기의 아미노기 또는 N-말단 아미노기에 비해 약 1000배 더 크다. 요오도아세틸 및 말레이미드 시약 내의 티올 특이적 관능기는 아민기와 반응할 수 있지만, 보다 높은 pH (>9.0) 및 보다 긴 반응 시간이 요구된다 (Garman, 1997, Non-Radioactive Labelling: A Practical Approach, Academic Press, London). 단백질 내의 유리 티올의 양은 표준 엘만 (Ellman) 분석에 의해 추정할 수 있다. 면역글로불린 M은 디술피드-연결된 펜타머의 예이고, 면역글로불린 G는 함께 서브유닛을 결합시키는 내부 디술피드 다리를 갖는 단백질의 예이다. 이와 같은 단백질에서, 반응성 유리 티올을 생성하기 위해 디티오트레이톨 (DTT) 또는 셀레놀과 같은 시약 (Singh et al (2002) Anal. Biochem. 304: 147-156)을 사용하여 디술피드 결합을 환원하는 것이 요구된다. 상기 방법은 항체 3차 구조 및 항원 결합 특이성을 손실시킬 수 있다.
PHESELECTOR (반응성 티올의 선택을 위한 파지 ELISA) 분석을 통해 ELISA 파지 포맷으로 항체 내의 반응성 시스테인기를 검출하고, 이에 의해 시스테인 조작된 항체의 설계를 도울 수 있다 (WO 2006/034488; US 2007/0092940). 시스테인 조작된 항체를 웰 표면에 코팅한 후, 파지 입자와 함께 인큐베이션하고, HRP 표지된 2차 항체를 첨가하고, 흡광도를 검출한다. 파지 상에 디스플레이된 돌연변이체 단백질은 신속하고 강력하고 고효율 방식으로 스크리닝할 수 있다. 시스테인 조작된 항체의 라이브러리를 제조하고, 항체 또는 다른 단백질의 무작위 단백질-파지 라이브러리로부터 유리 Cys 통합을 위한 적절하게 반응성인 부위를 확인하기 위해 동일한 방법을 사용하여 결합에 대해 선택할 수 있다. 상기 기술은 파지 상에 디스플레이된 시스테인 돌연변이체 단백질을 또한 티올-반응성인 친화도 시약 또는 리포터기와 반응시키는 것을 포함한다.
PHESELECTOR 분석은 항체 내의 반응성 티올기의 스크리닝을 허용한다. 이 방법에 의한 A118C 변이체의 확인은 예시적인 것이다. 전체 Fab 분자는 반응성 티올기를 갖는 보다 많은 ThioFab 변이체를 확인하기 위해 효과적으로 검색될 수 있다. 분획별 표면 접근성 (fractional surface accessibility) 파라미터를 사용하여 폴리펩티드 내의 아미노산 잔기에 대한 용매의 접근성을 확인하고 정량하였다. 표면 접근성은 용매 분자, 예를 들어 물이 접촉할 수 있는 표면적 (Å2)으로 표현할 수 있다. 물의 점유 공간은 1.4 Å 반경 구체와 비슷하다. 소프트웨어는 공지의 x-선 결정학 유도 좌표를 사용하여 단백질의 각각의 아미노산의 표면 접근성을 계산하기 위한 알고리즘을 이용하는 결정학 프로그램의 CCP4 Suite ("The CCP4 Suite: Programs for Protein Crystallography" (1994) Acta. Cryst. D50:760-763)로서 무료로 이용가능하거나 허가를 받아 사용할 수 있다 (Secretary to CCP4, Daresbury Laboratory, Warrington, WA4 4AD, United Kingdom, Fax: (+44) 1925 603825, 또는 인터넷 웹사이트 www.ccp4.ac.uk/dist/html/INDEX.html). 표면 접근성 계산을 수행하는 2개의 예시적인 소프트웨어 모듈은 문헌 [B. Lee and F. M. Richards (1971) J. Mol. Biol. 55:379-400]의 알고리즘을 기초로 한 "AREAIMOL" 및 "SURFACE"이다. AREAIMOL은 단백질의 용매 접근가능한 표면을 프로브 구 (용매 분자를 나타냄)의 중심의 궤적으로서 정의하는데, 이것이 단백질의 판 데르 발스 (Van der Waals) 표면 위로 굴러다니기 때문이다. AREAIMOL은 (원자 반경과 프로브 반경의 합과 동일한, 원자 중심으로부터의 거리에서) 각각의 원자 주위의 연장된 구 상에 표면 지점을 생성하고 이웃하는 원자들과 회합된 동등한 구 내에 놓인 것을 제거하여 용매 접근가능한 표면적을 계산한다. AREAIMOL은 PDB 좌표 파일에서 원자의 용매 접근가능한 면적을 찾아내고, 잔기에 의해, 사슬에 의해 및 전체 분자에 대해 접근가능한 면적을 요약한다. 개별 원자에 대한 접근가능한 면적 (또는 면적 차이)은 슈도-PDB (pseudo-PDB) 출력 파일에 기록될 수 있다. AREAIMOL은 각각의 원소에 대해 단일 반경을 추정하고, 오직 제한된 수의 상이한 원소들만을 인식한다.
AREAIMOL 및 SURFACE는 절대적 접근성, 즉 제곱 옹스트롬(Å)의 수를 보고한다. 분획별 표면 접근성은 폴리펩티드 내의 아미노산과 관련된 표준 상태를 참조하여 계산된다. 참조 상태는 트리펩티드 Gly-X-Gly이고, 여기서 X는 목적하는 아미노산이고, 참조 상태는 '연장된' 입체형태, 즉, 베타-가닥으로 존재하는 것과 같아야 한다. 연장된 입체형태는 X의 접근성을 최대화한다. 접근가능한 면적의 계산치를 Gly-X-Gly 트리펩티드 참조 상태 내의 접근가능한 면적으로 나누고 그 몫을 보고하는데, 이것이 분획별 접근성이다. 접근성 (%)은 분획별 접근성 X 100의 값이다. 표면 접근성 계산을 위한 다른 예시적 알고리즘은, 물 구체에 대한 아미노산 잔기의 분획별 접근성을 폴리펩티드의 X선 좌표에 기초하여 계산하는 프로그램 xsae의 SOLV 모듈을 기초로 한다 [Broger, C,F. Hoffman-LaRoche, Basel]. 항체 내의 모든 아미노산에 대한 분획별 표면 접근성은 이용가능한 결정 구조 정보 [Eigenbrot et al. (1993) J Mol Biol. 229:969-995]를 이용하여 계산할 수 있다.
시스테인 조작된 항체를 코딩하는 DNA는 통상적인 절차를 이용하여 (예를 들어, 쥐 항체의 중쇄 및 경쇄를 코딩하는 유전자에 특이적으로 결합할 수 있는 올리고뉴클레오티드 프로브를 사용하여) 쉽게 단리하고 서열 결정된다. 하이브리도마 세포는 상기 DNA의 공급원 역할을 한다. 일단 단리된 후, DNA를 발현 벡터 내로 도입할 수 있고, 이어서 이를 숙주 세포, 예를 들어 이. 콜라이 세포, 원숭이 COS 세포, 차이니즈 햄스터 난소 (CHO) 세포, 또는 그렇지 않으면 항체 단백질을 생산하지 않는 다른 포유동물 숙주 세포, 예를 들어 골수종 세포 (US 5807715, US 2005/0048572, US2004/0229310) 등으로 형질감염시켜, 재조합 숙주 세포 내에서 모노클로날 항체를 합성한다.
설계 및 선택 후에, 조작되고 고도로 반응성이고 쌍을 이루지 않은 Cys 잔기인 "유리 시스테인 아미노산"을 갖는 시스테인 조작된 항체, 예를 들어 ThioFab는, (i) 세균, 예를 들어 이. 콜라이 시스템 ([Skerra et al (1993) Curr. Opinion in Immunol. 5:256-262]; [Pluckthun (1992) Immunol. Revs. 130:151-188]) 또는 포유동물 세포 배양 시스템 (WO 01/00245), 예를 들어 차이니즈 햄스터 난소 세포 (CHO)에서의 발현, 및 (ii) 통상의 단백질 정제 기술을 이용한 정제 [Lowman et al. (1991) J. Biol. Chem. 266(17):10982-10988]를 통해 생산할 수 있다.
조작된 Cys 티올기는 친전자성 링커 시약 및 약물-링커 중간체와 반응하여, 시스테인 조작된 항체 약물 접합체 및 다른 표지된 시스테인 조작된 항체를 형성한다. 쌍을 이루어 사슬간 및 사슬내 디술피드 결합을 형성하는 모 항체에 존재하는 시스테인 조작된 항체의 Cys 잔기는 임의의 반응성 티올기를 갖지 않고 (환원제로 처리하지 않으면), 친전자성 링커 시약 또는 약물-링커 중간체와 반응하지 않는다. 새로 조작된 Cys 잔기는 쌍을 이루지 않은 채로 유지되어, 친전자성 링커 시약 또는 약물-링커 중간체, 예를 들어 약물-말레이미드와 반응, 즉 접합될 수 있다. 예시적인 약물-링커 중간체는 MC-MMAE, MC-MMAF, MC-vc-PAB-MMAE, 및 MC-vc-PAB-MMAF를 포함한다. 중쇄 및 경쇄의 조작된 Cys 잔기의 구조적 위치는 순차적인 넘버링 시스템에 따라 넘버링한다. 이 순차적인 넘버링 시스템은 N-말단에서 출발하는 카바트 넘버링 시스템 [Kabat et al., (1991) Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD]과 상관관계가 있으며, 이는 a, b, c로 표시한 삽입에서 카바트 넘버링 방식 (아래쪽 열)과 다르다. 카바트 넘버링 시스템을 사용하여, 실제 선형 아미노산 서열은 가변 도메인의 FR 또는 CDR의 단축 또는 이 내부로의 삽입에 대응하는 더 적은 또는 추가의 아미노산을 함유할 수 있다. 시스테인 조작된 중쇄 변이체 부위는 순차적인 넘버링 및 카바트 넘버링 방식에 의해 확인된다.
한 실시태양에서, 시스테인 조작된 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40)는
(a) 모 항-TAHO 항체의 하나 이상의 아미노산 잔기를 시스테인으로 치환하고;
(b) 시스테인 조작된 항-TAHO 항체를 티올-반응성 시약과 반응시켜, 시스테인 조작된 항-TAHO 항체의 티올 반응성을 결정하는 것
을 포함하는 방법에 의해 제조된다.
시스테인 조작된 항체는 모 항체보다 티올-반응성 시약에 대한 반응성이 더 클 수 있다.
유리 시스테인 아미노산 잔기는 중쇄 또는 경쇄에, 또는 불변 또는 가변 도메인에 위치할 수 있다. 항체 단편, 예를 들어 Fab도 항체 단편의 아미노산을 치환하는 하나 이상의 시스테인 아미노산으로 조작되어 시스테인 조작된 항체 단편을 형성할 수 있다.
본 발명의 다른 실시태양에서는
(a) 하나 이상의 시스테인 아미노산을 모 항-TAHO 항체 내로 도입하여 시스테인 조작된 항-TAHO 항체를 생성하고;
(b) 티올-반응성 시약을 사용하여 시스테인 조작된 항체의 티올 반응성을 결정하는 것
을 포함하고; 여기서, 시스테인 조작된 항체가 모 항체보다 티올-반응성 시약에 대한 반응성이 더 큰 것인, 시스테인 조작된 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체를 제조하는 (만드는) 방법을 제공한다.
시스테인 조작된 항체를 제조하는 방법의 단계 (a)는
(i) 시스테인 조작된 항체를 코딩하는 핵산 서열을 돌연변이시키고;
(ii) 시스테인 조작된 항체를 발현시키고;
(iii) 시스테인 조작된 항체를 단리하고 정제하는 것
을 포함할 수 있다.
시스테인 조작된 항체를 제조하는 방법의 단계 (b)는 파지 또는 파지미드 입자로부터 선택되는 바이러스 입자 상에 시스테인 조작된 항체를 발현시키는 것을 포함할 수 있다.
시스테인 조작된 항체를 제조하는 방법의 단계 (b)는 또한
(i) 시스테인 조작된 항체를 티올-반응성 친화도 시약과 반응시켜 친화도 표지된, 시스테인 조작된 항체를 생성하고;
(ii) 친화도 표지된, 시스테인 조작된 항체의 포획 매질 (capture media)에 대한 결합을 측정하는 것
을 포함할 수 있다.
본 발명의 또다른 실시태양은
(a) 하나 이상의 시스테인 아미노산을 모 항체 내로 도입하여 시스테인 조작된 항체를 생성하고;
(b) 시스테인 조작된 항체를 티올-반응성 친화도 시약과 반응시켜 친화도 표지된, 시스테인 조작된 항체를 생성하고;
(c) 친화도 표지된, 시스테인 조작된 항체의 포획 매질에 대한 결합을 측정하고;
(d) 티올-반응성 시약을 사용하여 시스테인 조작된 항체의 티올 반응성을 결정하는 것
을 포함하는, 고도로 반응성인 쌍을 이루지 않은 시스테인 아미노산을 갖는 시스테인 조작된 항체를 티올 반응성에 대해 스크리닝하기 위한 방법에 관한 것이다.
시스테인 조작된 항체를 스크리닝하는 방법의 단계 (a)는
(i) 시스테인 조작된 항체를 코딩하는 핵산 서열을 돌연변이시키고;
(ii) 시스테인 조작된 항체를 발현시키고;
(iii) 시스테인 조작된 항체를 단리하고 정제하는 것
을 포함할 수 있다.
시스테인 조작된 항체를 스크리닝하는 방법의 단계 (b)는 파지 또는 파지미드 입자로부터 선택되는 바이러스 입자 상에 시스테인 조작된 항체를 발현시키는 것을 포함할 수 있다.
시스테인 조작된 항체를 스크리닝하는 방법의 단계 (b)는 또한
(i) 시스테인 조작된 항체를 티올-반응성 친화도 시약과 반응시켜 친화도 표지된, 시스테인 조작된 항체를 생성하고;
(ii) 친화도 표지된, 시스테인 조작된 항체의 포획 매질에 대한 결합을 측정하는 것
을 포함할 수 있다.
b. 항-
TAHO
IgG
변이체의
시스테인 조작
시스테인은 본원에서 설명되는 시스테인 조작 방법에 의해 중쇄 118 (EU 넘버링) (순차적인 넘버링의 중쇄 위치 118에 해당) 부위에서 전장 키메라 모 모노클로날 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체에, 또는 경쇄 205 (카바트 넘버링) (순차적인 넘버링의 경쇄 위치 208에 해당) 부위에서 전장 키메라 모 모노클로날 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체에 도입하였다.
생성된 중쇄 118 (EU 넘버링)에서 시스테인을 갖는 시스테인 조작된 항체는 (a) 중쇄 서열 (서열 54)과 경쇄 서열 (서열 55)를 갖는 thio-chSN8-HC(A118C) (도 31); 및 (b) 중쇄 서열 (서열 56)과 경쇄 서열 (서열 57)을 갖는 thio-항-cynoCD79b (TAHO40) (ch10D10)-HC(A118C) (도 35)이었다.
생성된 경쇄 205 (카바트 넘버링)에서 시스테인을 갖는 시스테인 조작된 항체는 (a) 중쇄 서열 (서열 52)와 경쇄 서열 (서열 53)를 갖는 thio-chSN8-LC(V205C) (도 30) 및 (b) 중쇄 서열 (서열 95)와 경쇄 서열 (서열 96)을 갖는 thio-항-cynoCD79b (TAHO40) (ch10D10)-LC(V205C) (도 36)이었다.
이들 시스테인 조작된 모노클로날 항체는 1 mM 시스테인을 함유하는 배지 내에서 일시적 발효에 의해 CHO (차이니즈 햄스터 난소) 세포에서 발현시켰다.
한 실시태양에 따르면, 키메라 SN8 시스테인 조작된 항-인간 CD79b (TAHO5) 항체는 유리 시스테인 아미노산을 갖는 다음 중쇄 서열 (서열 63-71, 표 6) 중 하나 이상을 포함한다.
한 실시태양에 따르면, 항-cynoCD79b (TAHO40) (ch10D10) 시스테인 조작된 항-cynoCD79b (TAHO40) 항체는 유리 시스테인 아미노산을 갖는 다음 중쇄 서열 (서열 72-80, 표 7) 중 하나 이상을 포함한다.
한 실시태양에 따르면, 키메라 SN8 시스테인-조작된 항-인간 CD79b (TAHO5) 항체는 유리 시스테인 아미노산을 갖는 다음 경쇄 서열 (서열 81-87, 표 8) 중 하나 이상을 포함한다.
한 실시태양에 따르면, 항-cynoCD79b (TAHO40) (ch10D10) 시스테인-조작된 항-cynoCD79b (TAHO40) 항체는 유리 시스테인 아미노산을 갖는 다음 경쇄 서열 (서열 88-94, 표 9) 중 하나 이상을 포함한다.
c.
표지된
시스테인 조작된 항-
TAHO
항체
시스테인 조작된 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체는 부위-특이적으로 및 효율적으로 티올-반응성 시약과 커플링될 수 있다. 티올-반응성 시약은 다기능성 링커 시약, 포획, 즉 친화도, 표지 시약 (예를 들어 비오틴-링커 시약), 검출 표지 (예를 들어 형광단 시약), 고상 고정 시약 (예를 들어 SEPHAROSE™, 폴리스티렌, 또는 유리), 또는 약물-링커 중간체일 수 있다. 티올-반응성 시약의 한 예는 N-에틸 말레이미드 (NEM)이다. 예시적인 실시태양에서, ThioFab와 비오틴-링커 시약을 반응시키면 조작된 시스테인 잔기의 존재 및 반응성을 그에 의해 검출 및 측정할 수 있는 비오티닐화 ThioFab을 제공한다. ThioFab와 다기능성 링커 시약을 반응시키면 약물 모이어티 시약 또는 다른 표지와 추가로 반응할 수 있는 관능화된 링커를 갖는 ThioFab을 제공한다. ThioFab와 약물-링커 중간체를 반응시키면 ThioFab 약물 접합체를 제공한다.
본원에 기재된 예시적인 방법은 일반적으로 항체의 확인 및 생산에, 및 보다 일반적으로 본원에 설명된 설계 및 스크리닝 단계의 적용을 통해 다른 단백질에 적용될 수 있다.
상기 방법은 반응성 기가 예를 들어 말레이미드, 요오도아세트아미드, 피리딜 디술피드, 또는 다른 티올-반응성 접합 파트너인 다른 티올-반응성 시약의 접합에 적용될 수 있다 ([Haugland, 2003, Molecular Probes Handbook of Fluorescent Probes and Research Chemicals, Molecular Probes, Inc.]; [Brinkley, 1992, Bioconjugate Chem. 3:2]; [Garman, 1997, Non-Radioactive Labelling: A Practical Approach, Academic Press, London]; [Means (1990) Bioconjugate Chem. 1:2]; [Hermanson, G. in Bioconjugate Techniques (1996) Academic Press, San Diego, pp. 40-55, 643-671]). 티올-반응성 시약은 약물 모이어티, 형광단, 예를 들어 플루오레세인 또는 로다민과 같은 형광 염료, 영상화 또는 방사성 치료 금속에 대한 킬레이팅제, 펩티딜 또는 비-펩티딜 표지 또는 검출 태그, 또는 소실-변형제, 예를 들어 폴리에틸렌 글리콜의 다양한 이성질체, 제3 성분에 결합하는 펩티드, 또는 다른 탄수화물 또는 친지질성 물질일 수 있다.
d. 시스테인 조작된 항-
TAHO
항체의 용도
시스테인 조작된 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체 및 그의 접합체는 치료제 및/또는 진단제로서 사용될 수 있다. 본 발명은 추가로 B-세포 관련 질환과 연관된 하나 이상의 증상의 예방, 관리, 치료 또는 개선 방법을 제공한다. 특히, 본 발명은 세포 증식성 질환, 예를 들어 암, 예를 들어, 림프종, 비-호지킨 림프종 (NHL), 공격성 NHL, 재발성 공격성 NHL, 재발성 무통성 NHL, 불응성 NHL, 불응성 무통성 NHL, 만성 림프구성 백혈병 (CLL), 소림프구성 림프종, 백혈병, 유모세포 백혈병 (HCL), 급성 림프구성 백혈병 (ALL), 및 외투 세포 림프종과 연관된 하나 이상의 증상의 예방, 관리, 치료 또는 개선 방법을 제공한다. 본 발명은 또한 CD79b 관련 질환 또는 상기 질환을 발병할 소인의 진단 방법, 및 B 세포-연관 CD79b 폴리펩티드에 우선적으로 결합하는 항체 및 항체의 항원 결합 단편의 확인 방법을 추가로 제공한다.
본 발명의 다른 실시태양은 B 세포 관련 질환에 반응성인 병태의 치료에 유용한 의약의 제조를 위한, 시스테인 조작된 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체의 용도에 관한 것이다.
e. 시스테인 조작된 항체 약물 접합체 (
Thio
-항체 약물 접합체 (
TDC
))
본 발명의 또다른 측면은 시스테인 조작된 항-TAHO 항체 (Ab), 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체, 및 오리스타틴 약물 모이어티 (D)를 포함하는, 하기 화학식 I의 항체-약물 접합체 화합물에 관한 것이고, 여기서 시스테인 조작된 항체는 링커 모이어티 (L)에 의해 하나 이상의 유리 시스테인 아미노산을 통해 D에 부착된다:
<화학식 I>
상기 식에서, p는 1, 2, 3 또는 4이고; 시스테인 조작된 항체는 모 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체의 하나 이상의 아미노산 잔기를 하나 이상의 유리 시스테인 아미노산으로 교체하는 것을 포함하는 방법에 의해 제조된다.
본 발명의 다른 측면은 화학식 I의 항체-약물 화합물의 혼합물을 포함하는 조성물이고, 여기서 항체당 평균 약물 로딩은 약 2 내지 약 5, 또는 약 3 내지 약 4이다.
도 30-31 및 35-36은 오리스타틴 약물 모이어티가 경쇄 (LC-ADC) 또는 중쇄 (HC-ADC) 내의 조작된 시스테인기에 부착된, 시스테인 조작된 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체 약물 접합체 (ADC)의 실시태양을 보여준다.
시스테인 조작된 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체 약물 접합체의 잠재적인 잇점은 개선된 안전성 (보다 큰 치료 지수), 개선된 PK 파라미터, 접합체를 안정화시키고 그의 활성 결합 입체형태를 유지할 수 있는 항체 사슬간 디술피드 결합, 잘 규정된 약물 접합의 부위, 및 보다 균질한 생성물을 생성하는, 약물-링커 시약에 대한 시스테인 조작된 항체의 접합에 의한 시스테인 조작된 항체 약물 접합체의 제조를 포함한다.
링커
"링커", "링커 단위", 또는 "연결"은 항체를 약물 모이어티에 공유 결합에 의해 부착시키는 공유 결합 또는 원자의 사슬을 포함하는 화학적 모이어티를 의미한다. 다양한 실시태양에서, 링커는 L로 표시된다. "링커" (L)은 하나 이상의 약물 모이어티 (D) 및 항체 단위 (Ab)를 연결하여 화학식 I의 항체-약물 접합체 (ADC)를 형성할 수 있는 2기능성 또는 다기능성 모이어티이다. 항체-약물 접합체 (ADC)는 약물 및 항체에 결합하기 위한 반응성 관능기를 갖는 링커를 사용하여 편리하게 제조할 수 있다. 시스테인 조작된 항체 (Ab)의 시스테인 티올은 링커 시약, 약물 모이어티 또는 약물-링커 중간체의 친전자성 관능기와 결합을 형성할 수 있다.
한 측면에서, 링커는 항체 상에 존재하는 친핵성 시스테인에 반응성인 친전자성 기를 갖는 반응성 부위를 갖는다. 항체의 시스테인 티올은 링커 상의 친전자성 기와 반응성이고, 링커에 대한 공유 결합을 형성한다. 유용한 친전자성 기는 말레이미드 및 할로아세트아미드기를 포함하고 이로 제한되지 않는다.
링커는 알킬디일, 아릴디일, 헤테로아릴디일과 같은 2가 라디칼, 알킬옥시의 반복 단위 -(CR2)nO(CR2)n- (예를 들어, 폴리에틸레녹시, PEG, 폴리메틸레녹시), 및 알킬아미노 (예를 들어, 폴리에틸렌아미노, Jeffamine™)와 같은 모이어티; 및 숙시네이트, 숙신아미드, 디글리콜레이트, 말로네이트, 및 카프로아미드를 포함하는 이산 에스테르 및 아미드를 포함한다.
시스테인 조작된 항체는 문헌 [Klussman, et al (2004), Bioconjugate Chemistry 15(4):765-773]의 766페이지의 접합 방법, 및 실시예 18의 프로토콜에 따라 링커 시약 또는 약물-링커 중간체, 친전자성 관능기, 예를 들어 말레이미드 또는 α-할로 카르보닐과 반응한다.
링커는 하나 이상의 링커 성분으로 이루어질 수 있다. 예시적인 링커 성분은 6-말레이미도카프로일 ("MC"), 말레이미도프로파노일 ("MP"), 발린-시트룰린 ("val-cit" 또는 "vc"), 알라닌-페닐알라닌 ("ala-phe" 또는 "af"), p-아미노벤질옥시카르보닐 ("PAB"), N-숙신이미딜 4-(2-피리딜티오) 펜타노에이트 ("SPP"), N-숙신이미딜 4-(N-말레이미도메틸) 시클로헥산-1 카르복실레이트 ("SMCC"), N-숙신이미딜 (4-요오도-아세틸) 아미노벤조에이트 ("SIAB"), 하나 이상의 반복 단위로서의 에틸렌옥시 -CH2CH2O- ("EO" 또는 "PEO")를 포함한다. 추가의 링커 성분은 당업계에 공지되어 있고, 일부를 본원에 기재한다.
한 실시태양에서, ADC의 링커 L은 하기 화학식으로 표시된다:
상기 식에서,
-A-는 항체 (Ab)의 시스테인 티올에 공유 결합에 의해 부착된 스트레쳐 단위이고;
a는 0 또는 1이고;
각각의 W는 독립적으로 아미노산 단위이고;
w는 독립적으로 0 내지 12의 정수이고;
-Y-는 약물 모이어티에 공유 결합에 의해 부착된 스페이서 단위이고;
y는 0, 1 또는 2이다.
스트레쳐
단위
스트레쳐 단위 (-A-)는 존재하는 경우, 항체 단위를 아미노산 단위 (-W-)에 연결시킬 수 있다. 이와 관련하여, 항체 (Ab)는 스트레쳐의 관능기와 결합을 형성할 수 있는 관능기를 갖는다. 자연적으로 또는 화학 조작을 통해 항체 상에 존재할 수 있는 유용한 관능기는 술프히드릴 (-SH), 아미노, 히드록실, 카르복시, 탄수화물의 아노머 히드록실기, 및 카르복실을 포함하고 이로 제한되지 않는다. 한 측면에서, 항체 관능기는 술프히드릴 또는 아미노이다. 술프히드릴기는 항체의 분자내 디술피드 결합의 환원에 의해 생성될 수 있다. 별법으로, 술프히드릴기는 2-이미노티올란 (트라우트 시약) 또는 다른 술프히드릴 생성 시약을 사용한 항체의 라이신 모이어티의 아미노기의 반응에 의해 생성될 수 있다. 한 실시태양에서, 항체 (Ab)는 스트레쳐 단위의 친전자성 관능기와 결합을 형성할 수 있는 유리 시스테인 티올기를 갖는다. 화학식 I의 접합체에서 예시적인 스트레쳐 단위를 화학식 II 및 III에 도시하고, 여기서 Ab-, -W-, -Y-, -D, w 및 y는 상기 정의된 바와 같고, R17은 (CH2)r, C3-C8 카르보시클릴, O-(CH2)r, 아릴렌, (CH2)r-아릴렌, -아릴렌-(CH2)r-, (CH2)r-(C3-C8 카르보시클릴), (C3-C8 카르보시클릴)-(CH2)r, C3-C8 헤테로시클릴, (CH2)r-(C3-C8 헤테로시클릴), -(C3-C8 헤테로시클릴)-(CH2)r-, -(CH2)rC(O)NRb(CH2)r-, -(CH2CH2O)r-, -(CH2CH2O)r-CH2-, -(CH2)rC(O)NRb(CH2CH2O)r-, -(CH2)rC(O)NRb(CH2CH2O)r-CH2-, -(CH2CH2O)rC(O)NRb(CH2CH2O)r-, -(CH2CH2O)rC(O)NRb(CH2CH2O)r-CH2-, 및 -(CH2CH2O)rC(O)NRb(CH2)r-로부터 선택되는 2가 라디칼이고; 여기서 Rb는 H, C1-C6 알킬, 페닐, 또는 벤질이고; r은 독립적으로 1-10의 정수이다.
아릴렌은 방향족 고리계로부터 2개의 수소 원자를 제거함으로써 유도된 6-20개 탄소 원자의 2가 방향족 탄화수소 라디칼을 포함한다. 전형적인 아릴렌기는 벤젠, 치환 벤젠, 나프탈렌, 안트라센, 비페닐 등으로부터 유도된 라디칼을 포함하고 이로 제한되지 않는다.
헤테로시클릴기는 하나 이상의 고리 원자가 헤테로원자, 예를 들어, 질소, 산소, 및 황인 고리계를 포함한다. 헤테로사이클 라디칼은 탄소 원자 1 내지 20개, 및 N, O, P 및 S로부터 선택된 헤테로원자 1 내지 3개를 포함한다. 헤테로사이클은 3 내지 7개의 고리원을 갖는 모노사이클 (탄소 원자 2 내지 6개, 및 N, O, P 및 S로부터 선택된 헤테로원자 1 내지 3개)일 수 있거나, 또는 7 내지 10개의 고리원을 갖는 비사이클 (탄소 원자 4 내지 9개, 및 N, O, P 및 S로부터 선택된 헤테로원자 1 내지 3개), 예를 들어 비시클로 [4,5], [5,5], [5,6], 또는 [6,6] 시스템일 수 있다. 헤테로사이클은 문헌 ([Paquette, Leo A.; "Principles of Modern Heterocyclic Chemistry" (W.A. Benjamin, New York, 1968), 특히 제1, 3, 4, 6, 7, 및 9장]; ["The Chemistry of Heterocyclic Compounds, A series of Monographs" (John Wiley & Sons, New York, 1950 to present), 특히 제13, 14, 16, 19 및 28권]; 및 [J. Am. Chem. Soc. (1960) 82:5566]에 기재되어 있다.
헤테로사이클의 예는 피리딜, 디히드로피리딜, 테트라히드로피리딜 (피페리딜), 티아졸릴, 테트라히드로티오페닐, 황 산화 테트라히드로티오페닐, 피리미디닐, 푸라닐, 티에닐, 피롤릴, 피라졸릴, 이미다졸릴, 테트라졸릴, 벤조푸라닐, 티아나프탈레닐, 인돌릴, 인돌레닐, 퀴놀리닐, 이소퀴놀리닐, 벤즈이미다졸릴, 피페리디닐, 4-피페리도닐, 피롤리디닐, 2-피롤리도닐, 피롤리닐, 테트라히드로푸라닐, 비스-테트라히드로푸라닐, 테트라히드로피라닐, 비스-테트라히드로피라닐, 테트라히드로퀴놀리닐, 테트라히드로이소퀴놀리닐, 데카히드로퀴놀리닐, 옥타히드로이소퀴놀리닐, 아조시닐, 트리아지닐, 6H-1,2,5-티아디아지닐, 2H,6H-1,5,2-디티아지닐, 티에닐, 티안트레닐, 피라닐, 이소벤조푸라닐, 크로메닐, 크산테닐, 페녹사티닐, 2H-피롤릴, 이소티아졸릴, 이속사졸릴, 피라지닐, 피리다지닐, 인돌리지닐, 이소인돌릴, 3H-인돌릴, 1H-인다졸릴, 푸리닐, 4H-퀴놀리지닐, 프탈라지닐, 나프티리디닐, 퀴녹살리닐, 퀴나졸리닐, 시놀리닐, 프테리디닐, 4Ah-카르바졸릴, 카르바졸릴, β-카르볼리닐, 페난트리디닐, 아크리디닐, 피리미디닐, 페난트롤리닐, 페나지닐, 페노티아지닐, 푸라자닐, 페녹사지닐, 이소크로마닐, 크로마닐, 이미다졸리디닐, 이미다졸리닐, 피라졸리디닐, 피라졸리닐, 피페라지닐, 인돌리닐, 이소인돌리닐, 퀴누클리디닐, 모르폴리닐, 옥사졸리디닐, 벤조트리아졸릴, 벤즈이속사졸릴, 옥신돌릴, 벤족사졸리닐 및 이사티노일을 포함하고 이로 제한되지 않는다.
카르보시클릴기는 모노사이클로서 탄소 원자 3 내지 7개, 또는 비사이클로서 탄소 원자 7 내지 12개를 갖는 포화 또는 불포화 고리를 포함한다. 모노시클릭 카르보사이클은 고리 원자 3 내지 6개, 보다 일반적으로 고리 원자 5 또는 6개를 갖는다. 비시클릭 카르보사이클은 예를 들어 비시클로 [4,5], [5,5], [5,6] 또는 [6,6] 시스템으로 배열된 7 내지 12개의 고리 원자, 또는 비시클로 [5,6] 또는 [6,6] 시스템으로 배열된 9 또는 10개의 고리 원자를 갖는다. 모노시클릭 카르보사이클의 예는 시클로프로필, 시클로부틸, 시클로펜틸, 1-시클로펜트-1-에닐, 1-시클로펜트-2-에닐, 1-시클로펜트-3-에닐, 시클로헥실, 1-시클로헥스-1-에닐, 1-시클로헥스-2-에닐, 1-시클로헥스-3-에닐, 시클로헵틸, 및 시클로옥틸을 포함한다.
화학식 I의 ADC의 모든 예시적인 실시태양, 예를 들어 화학식 II-VI으로부터, 명확하게 도시되지 않은 경우에도 조작된 시스테인 잔기의 수에 따라 1 내지 4개의 약물 모이어티가 항체 (p = 1-4)에 연결됨을 이해해야 한다.
R17이 -(CH2)5-이고, 말레이미도카프로일 (MC)로부터 유도된 화학식 II의 예시적인 스트레쳐 단위:
R17이 -(CH2)2-이고, 말레이미도-프로파노일 (MP)로부터 유도된 화학식 II의 예시적인 스트레쳐 단위:
R17이 -(CH2CH2O)r-CH2-이고, r이 2인 화학식 II의 예시적인 다른 스트레쳐 단위:
R17이 -(CH2)rC(O)NRb(CH2CH2O)r-CH2-이고, Rb가 H이고, 각각의 r이 2인 화학식 II의 예시적인 다른 스트레쳐 단위:
R17이 -(CH2)5-인 화학식 III의 예시적인 스트레쳐 단위:
다른 실시태양에서, 스트레쳐 단위는 항체의 조작된 시스테인 황 원자와 스트레쳐 단위의 황 원자 간의 디술피드 결합을 통해 시스테인 조작된 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체에 연결된다. 상기 실시태양의 대표적인 스트레쳐 단위는 하기 화학식 IV에 도시되고, 여기서 R17, Ab-, -W-, -Y-, -D, w 및 y는 상기 정의된 바와 같다.
또다른 실시태양에서, 스트레쳐의 반응성 기는 항체의 유리 시스테인 티올과 결합을 형성할 수 있는 티올-반응성 관능기를 함유한다. 티올-반응성 관능기의 예는 말레이미드, α-할로아세틸, 활성화된 에스테르, 예를 들어 숙신이미드 에스테르, 4-니트로페닐 에스테르, 펜타플루오로페닐 에스테르, 테트라플루오로페닐 에스테르, 무수물, 산 클로라이드, 술포닐 클로라이드, 이소시아네이트 및 이소티오시아네이트를 포함하고 이로 제한되지 않는다. 상기 실시태양의 대표적인 스트레쳐 단위는 하기 화학식 Va 및 Vb에 도시된 바와 같고, 여기서 -R17-, Ab-, -W-, -Y-, -D, w 및 y는 상기 정의된 바와 같다.
다른 실시태양에서, 링커는 하나 초과의 약물 모이어티를 분지화 다기능성 링커 모이어티를 통해 항체에 공유 결합에 의해 부착시키기 위한 수지상 유형의 링커일 수 있다 ([Sun et al (2002) Bioorganic & Medicinal Chemistry Letters 12:2213-2215]; [Sun et al (2003) Bioorganic & Medicinal Chemistry 11:1761-1768]; [King (2002) Tetrahedron Letters 43: 1987-1990]). 수지상 링커는 ADC의 효능과 관계가 있는 약물 대 항체의 몰비, 즉 로딩을 증가시킬 수 있다. 따라서, 시스테인 조작된 항체가 단지 하나의 반응성 시스테인 티올기를 보유하는 경우에는, 다수의 약물 모이어티를 수지상 링커를 통하여 부착시킬 수 있다.
아미노산 단위
링커는 아미노산 잔기를 포함할 수 있다. 아미노산 단위 (-Ww-)는 존재하는 경우에 본 발명의 시스테인 조작된 항체-약물 접합체 (ADC)의 약물 모이어티 (D)에 항체 (Ab)를 연결시킨다.
-Ww-는 디펩티드, 트리펩티드, 테트라펩티드, 펜타펩티드, 헥사펩티드, 헵타펩티드, 옥타펩티드, 노나펩티드, 데카펩티드, 운데카펩티드 또는 도데카펩티드 단위이다. 아미노산 단위를 포함하는 아미노산 잔기는 천연 발생 아미노산, 및 또한 소수의 아미노산 및 비-천연 발생 아미노산 유사체, 예를 들어 시트룰린을 포함한다. 각각의 -W- 단위는 독립적으로 하기 꺾쇠 괄호 내에 표시된 화학식으로 표시되고, w는 0 내지 12의 정수이다:
상기 식에서, R19는 수소, 메틸, 이소프로필, 이소부틸, sec-부틸, 벤질, p-히드록시벤질, -CH2OH, -CH(OH)CH3, -CH2CH2SCH3, -CH2CONH2, -CH2COOH, -CH2CH2CONH2, -CH2CH2COOH, -(CH2)3NHC(=NH)NH2, -(CH2)3NH2, -(CH2)3NHCOCH3, -(CH2)3NHCHO, -(CH2)4NHC(=NH)NH2, -(CH2)4NH2, -(CH2)4NHCOCH3, -(CH2)4NHCHO, -(CH2)3NHCONH2, -(CH2)4NHCONH2, -CH2CH2CH(OH)CH2NH2, 2-피리딜메틸-, 3-피리딜메틸-, 4-피리딜메틸-, 페닐, 시클로헥실,
이다.
R19가 수소 이외의 다른 기인 경우에, R19가 부착되는 탄소 원자는 키랄이다. R19가 부착되는 각각의 탄소 원자는 독립적으로 (S) 또는 (R) 입체형태, 또는 라세미 혼합물로 존재한다. 따라서, 아미노산 단위는 거울상 이성질체상으로 순수하거나, 라세미체, 또는 부분 입체 이성질체일 수 있다.
예시적인 -Ww-아미노산 단위는 디펩티드, 트리펩티드, 테트라펩티드 또는 펜타펩티드를 포함한다. 예시적인 디펩티드는 발린-시트룰린 (vc 또는 val-cit), 알라닌-페닐알라닌 (af 또는 ala-phe)을 포함된다. 예시적인 트리펩티드는 글라이신-발린-시트룰린 (gly-val-cit) 및 글라이신-글라이신-글라이신 (gly-gly-gly)을 포함한다. 아미노산 링커 성분을 포함하는 아미노산 잔기는 천연 발생 아미노산 잔기, 및 소수의 아미노산 및 비-천연 발생 아미노산 유사체, 예를 들어 시트룰린을 포함한다.
아미노산 단위는 종양-연관 프로테아제를 포함한 하나 이상의 효소에 의해 효소 활성을 통해 절단되어 약물 모이어티 (-D)를 방출시킬 수 있고, 한 실시태양에서, 이는 방출시에 생체 내에서 양성자화되어 약물 (D)를 제공한다. 아미노산 링커 성분은 특정 효소, 예를 들어 종양-연관 프로테아제, 카텝신 B, C 및 D, 또는 플라스민 프로테아제에 의한 효소 절단에 대한 그의 선택성을 고려하여 설계되고 최적화될 수 있다.
스페이서
단위
스페이서 단위 (-Yy-)는 존재하는 경우 (y = 1 또는 2), 아미노산 단위가 존재할 때 (w = 1-12) 아미노산 단위 (-Ww-)를 약물 모이어티 (D)에 연결시킨다. 별법으로, 스페이서 단위는 아미노산 단위가 부재할 때 스트레쳐 단위를 약물 모이어티에 연결시킨다. 아미노산 단위 및 스트레쳐 단위가 모두 부재할 때 (w, y = 0), 스페이서 단위는 또한 약물 모이어티를 항체 단위에 연결시킨다. 스페이서 단위는 자기희생적 및 비-자기희생적 단위의 두 종류가 존재한다. 비-자기희생적 스페이서 단위는 항체-약물 접합체 또는 약물 모이어티-링커로부터 아미노산 단위의 절단, 특히 효소적 절단 후에 일부 또는 모든 스페이서 단위가 약물 모이어티에 결합된 상태로 유지되는 단위이다. 글라이신-글라이신 스페이서 단위 또는 글라이신 스페이서 단위를 포함하는 ADC가 종양 세포 연관 프로테아제, 암 세포 연관 프로테아제 또는 림프구 연관 프로테아제를 통한 효소적 절단을 거칠 경우, 글라이신-글라이신-약물 모이어티 또는 글라이신-약물 모이어티는 Ab-Aa-Ww-로부터 절단된다. 한 실시태양에서, 독립적인 가수분해 반응이 표적 세포 내에서 일어나고, 이는 글라이신-약물 모이어티 결합을 절단하여 약물을 방출시킨다.
다른 실시태양에서, -Yy-는 그의 페닐렌 부분이 Qm으로 치환된 p-아미노벤질카르바모일 (PAB) 단위이고, 여기서 Q는 -C1-C8 알킬, -O-(C1-C8 알킬), -할로겐, -니트로 또는 -시아노이고; m은 0-4의 정수이다.
비-자기희생적 스페이서 단위 (-Y-)의 예시적인 실시태양은 -Gly-Gly-; -Gly-; -Ala-Phe-; -Val-Cit-이다.
한 실시태양에서, 스페이서 단위가 부재하는 (y=0) 약물 모이어티-링커 또는 ADC, 또는 그의 제약상 허용되는 염 또는 용매화물을 제공한다.
별법으로, 자기희생적 스페이서 단위를 포함하는 ADC는 -D를 방출할 수 있다. 한 실시태양에서, -Y-는 PAB기의 아미노 질소 원자를 통해 -Ww-에 연결되고 카르보네이트, 카르바메이트 또는 에테르기를 통해 -D에 직접 연결된 PAB기이고, 여기서 ADC는 다음과 같은 예시적인 구조를 갖는다:
상기 식에서, Q는 -C1-C8 알킬, -O-(C1-C8 알킬), -할로겐, -니트로 또는 -시아노이고; m은 0-4의 정수이고, p는 1 내지 4이다.
자기희생적 스페이서의 다른 예는 PAB기에 전기적으로 유사한 방향족 화합물, 예를 들어 2-아미노이미다졸-5-메탄올 유도체 (Hay et al. (1999) Bioorg. Med. Chem. Lett. 9:2237), 헤테로시클릭 PAB 유사체 (US 2005/0256030), 베타-글루쿠로나이드 (WO 2007/011968), 및 오르토- 또는 파라-아미노벤질아세탈을 포함하고 이로 제한되지 않는다. 아미드 결합 가수분해시에 고리화되는 스페이서, 예를 들어 치환 및 비치환된 4-아미노부티르산 아미드 (Rodrigues et al (1995) Chemistry Biology 2:223); 적절하게 치환된 비시클로[2.2.1] 및 비시클로[2.2.2] 고리계 (Storm et al (1972) J. Amer. Chem. Soc. 94:5815); 및 2-아미노페닐프로피온산 아미드 (Amsberry, et al (1990) J. Org. Chem. 55:5867)를 사용할 수 있다. 글라이신에서 치환된 아민-함유 약물의 제거 (Kingsbury et al (1984) J. Med. Chem. 27:1447)도 또한 ADC에서 유용한 자기희생적 스페이서의 예이다.
예시적인 스페이서 단위 (-Yy-)는 하기 화학식 X 내지 XII로 표시된다:
수지상 링커
다른 실시태양에서, 링커 L은 1개 초과의 약물 모이어티를 분지화 다기능성 링커 모이어티를 통해 항체에 공유 결합에 의해 부착시키기 위한 수지상 유형의 링커일 수 있다 ([Sun et al (2002) Bioorganic & Medicinal Chemistry Letters 12:2213-2215]; [Sun et al (2003) Bioorganic & Medicinal Chemistry 11:1761-1768]). 수지상 링커는 ADC의 효능과 관계가 있는 약물 대 항체의 몰비, 즉 로딩을 증가시킬 수 있다. 따라서, 시스테인 조작된 항체가 단지 하나의 반응성 시스테인 티올기를 보유하는 경우에는, 다수의 약물 모이어티를 수지상 링커를 통하여 부착시킬 수 있다. 분지형 수지상 링커의 예시적인 실시태양은 2,6-비스(히드록시메틸)-p-크레졸 및 2,4,6-트리스(히드록시메틸)-페놀 덴드리머 단위를 포함한다 (WO 2004/01993; [Szalai et al (2003) J. Amer. Chem. Soc. 125: 15688-15689]; [Shamis et al (2004) J. Amer. Chem. Soc. 126:1726-1731]; [Amir et al (2003) Angew. Chem. Int. Ed. 42:4494-4499]).
한 실시태양에서, 스페이서 단위는 2-(4-아미노벤질리덴)프로판-1,3-디올 덴드리머 단위 (WO 2004/043493; [de Groot et al (2003) Angew. Chem. Int. Ed. 42:4490-4494])를 포함하는, 아래에 제시된 구조를 갖는 분지쇄 비스(히드록시메틸)스티렌 (BHMS)이고, 이것은 다수의 약물을 도입하고 방출시키기 위해 사용될 수 있다.
상기 식에서, Q는 -C1-C8 알킬, -O-(C1-C8 알킬), -할로겐, -니트로 또는 -시아노이고; m은 0-4의 정수이고, n은 O 또는 1이고; p는 1 내지 4이다.
화학식 I의 항체-약물 접합체 화합물의 예시적인 실시태양은 화학식 XIIIa (MC), XIIIb (val-cit), XIIIc (MC-val-cit), 및 XIIId (MC-val-cit-PAB)의 화합물을 포함한다:
화학식 Ia의 항체-약물 접합체 화합물의 다른 예시적인 실시태양은 하기 화학식 XIVa-e의 화합물을 포함한다:
이고,
이고,
R은 독립적으로 H 또는 C1-C6 알킬이고; n은 1 내지 12이다.
다른 실시태양에서, 링커는 항체 상에 존재하는 친전자성 기에 반응성인 친핵성 기를 갖는 반응성 관능기를 갖는다. 항체 상의 유용한 친전자성 기는 알데히드 및 케톤 카르보닐기를 포함하고 이로 제한되지 않는다. 링커의 친핵성 기의 헤테로원자는 항체 상의 친전자성 기와 반응하여 항체 단위에 공유 결합을 형성할 수 있다. 링커 상의 유용한 친핵성 기는 히드라지드, 옥심, 아미노, 히드라진, 티오세미카르바존, 히드라진 카르복실레이트, 및 아릴히드라지드를 포함하고 이로 제한되지 않는다. 항체 상의 친전자성 기는 링커에 대한 편리한 부착 부위를 제공한다.
일반적으로, 펩티드형 링커는 2개 이상의 아미노산 및/또는 펩티드 단편 사이에 펩티드 결합을 형성함으로써 제조할 수 있다. 상기 펩티드 결합은 예를 들어 펩티드 화학 분야에 잘 알려져 있는 액상 합성 방법 (E. Schroeder and K. Luebke (1965) "The Peptides", volume 1, pp 76-136, Academic Press)에 따라 제조할 수 있다. 링커 중간체는 스페이서, 스트레쳐 및 아미노산 단위를 포함하는 임의의 조합 또는 반응 순서로 조립될 수 있다. 스페이서, 스트레쳐 및 아미노산 단위는 특성상 친전자성, 친핵성, 또는 유리 라디칼인 반응성 관능기를 이용할 수 있다. 반응성 관능기는 카르복실, 히드록실, 파라-니트로페닐카르보네이트, 이소티오시아네이트, 및 이탈기, 예를 들어 O-메실, O-토실, -Cl, -Br, -I; 또는 말레이미드를 포함하고 이로 제한되지 않는다.
예를 들어, 하전된 치환체, 예를 들어 술포네이트 (-SO3 -) 또는 암모늄은 시약의 수용해도를 증가시키고, 링커 시약과 항체 또는 약물 모이어티의 커플링 반응을 용이하게 하거나, 또는 ADC 제조에 사용되는 합성 경로에 따라 Ab-L (항체-링커 중간체)과 D, 또는 D-L (약물-링커 중간체)과 Ab와의 커플링 반응을 용이하게 할 수 있다.
링커 시약
항체 및 오리스타틴의 접합체는 다양한 2기능성 링커 시약, 예를 들어 N-숙신이미딜-3-(2-피리딜디티오) 프로피오네이트 (SPDP), 숙신이미딜-4-(N-말레이미도메틸) 시클로헥산-1-카르복실레이트 (SMCC), 이미노티올란 (IT), 이미도에스테르의 2기능성 유도체 (예를 들어 디메틸 아디피미데이트 HCl), 활성 에스테르 (예를 들어 디숙신이미딜 수베레이트), 알데히드 (예를 들어 글루타르알데히드), 비스-아지도 화합물 (예를 들어 비스(p-아지도벤조일) 헥산디아민), 비스-디아조늄 유도체 (예를 들어 비스-(p-디아조늄벤조일)-에틸렌디아민), 디이소시아네이트 (예를 들어 톨루엔 2,6-디이소시아네이트), 및 비스-활성 불소 화합물 (예를 들어 1,5-디플루오로-2,4-디니트로벤젠)을 사용하여 제조할 수 있다.
항체 약물 접합체는 또한 링커 시약, 즉, BMPEO, BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMPB, SMPH, 술포-EMCS, 술포-GMBS, 술포-KMUS, 술포-MBS, 술포-SIAB, 술포-SMCC, 및 술포-SMPB, 및 SVSB (숙신이미딜-(4-비닐술폰)벤조에이트), 및 비스-말레이미드 시약, 즉, DTME, BMB, BMDB, BMH, BMOE, 1,8-비스-말레이미도디에틸렌글리콜 BM(PEO)2), 및 및 1,11-비스-말레이미도트리에틸렌글리콜 (BM(PEO)3) (이는 피어스 바이오테크놀로지, 인크., 써모사이언티픽 (ThermoScientific, 미국 일리노이주 록포드) 및 다른 시약 공급처로부터 상업적으로 이용가능함)을 사용하여 제조할 수 있다. 비스-말레이미드 시약은 시스테인 조작된 항체의 티올기가 순차적 또는 동시 방식으로, 티올-함유 약물 모이어티, 표지 또는 링커 중간체에 부착할 수 있도록 한다. 시스테인 조작된 항체의 티올기, 약물 모이어티, 표지, 또는 링커 중간체와 반응성인, 말레이미드 이외의 다른 관능기는 요오도아세트아미드, 브로모아세트아미드, 비닐 피리딘, 디술피드, 피리딜 디술피드, 이소시아네이트 및 이소티오시아네이트를 포함한다.
유용한 링커 시약은 또한 다른 공급원, 예를 들어 몰레큘라 바이오사언시스 인크. (Molecular Biosciences Inc., 미국 콜로라도주 보울더)를 통해 입수할 수 있거나, 또는 문헌 [Toki et al (2002) J. Org. Chem. 67: 1866-1872]; [Walker, M.A. (1995) J. Org. Chem. 60:5352-5355]; [Frisch et al (1996) Bioconjugate Chem. 7: 180-186]; US 6214345; WO 02/088172; US 2003130189; US2003096743; WO 03/026577; WO 03/043583; 및 WO 04/032828)에 설명된 절차에 따라 합성할 수 있다.
화학식 IIIa의 스트레쳐는 하기 링커 시약을 아미노산 단위의 N-말단과 반응시킴으로써 링커 내로 도입할 수 있다:
상기 식에서, n은 1-10의 정수이고, T는 -H 또는 -SO3Na이다.
상기 식에서, n은 0-3의 정수이다.
스트레쳐 단위는 하기 2기능성 시약을 아미노산 단위의 N-말단과 반응시킴으로써 링커 내로 도입할 수 있다:
상기 식에서, X는 Br 또는 I이다.
스트레쳐 단위는 또한 하기 2기능성 시약을 아미노산 단위의 N-말단과 반응시킴으로써 링커 내로 도입할 수 있다:
말레이미드 스트레쳐 및 파라-아미노벤질카르바모일 (PAB) 자기희생적 스페이서를 갖는 예시적인 발린-시트룰린 (val-cit 또는 vc) 디펩티드 링커 시약은 다음 구조를 갖는다:
말레이미드 스트레쳐 단위 및 PAB 자기희생적 스페이서 단위를 갖는 예시적인 phe-lys(Mtr, 모노-4-메톡시트리틸) 디펩티드 링커 시약은 문헌 [Dubowchik, et al. (1997) Tetrahedron Letters, 38:5257-60]에 따라 제조할 수 있고, 다음 구조를 갖는다:
본 발명의 예시적인 항체-약물 접합체 화합물은 다음을 포함한다:
상기 식에서, Val은 발린이고; Cit는 시트룰린이고, vc는 발린 시트룰린이고, p는 1, 2, 3 또는 4이고; Ab는 시스테인 조작된 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체이다.
시스테인 조작된 항-
TAHO
항체-약물 접합체의 제조
화학식 I의 ADC는 다음을 포함하는, 당업자에게 공지된 유기 화학 반응, 조건 및 시약을 이용하여 몇몇 경로에 의해 제조할 수 있다: (1) 시스테인 조작된 항체의 시스테인기를 링커 시약과 반응시켜, 공유 결합을 통해 항체-링커 중간체 Ab-L을 형성시킨 후, 이를 활성화된 약물 모이어티 D와 반응시키는 방법; 및 (2) 약물 모이어티의 친핵성 기를 링커 시약과 반응시켜, 공유 결합을 통해 약물-링커 중간체 D-L을 형성시킨 후, 이를 시스테인 조작된 항체의 시스테인기와 반응시키는 방법. 접합 방법 (1) 및 (2)는 다양한 시스테인 조작된 항체, 약물 모이어티 및 링커를 사용하여 화학식 I의 항체-약물 접합체를 제조할 수 있다.
항체 시스테인 티올기는 친핵성이고, (i) 활성 에스테르, 예를 들어, NHS 에스테르, HOBt 에스테르, 할로포르메이트 및 산 할라이드; (ii) 알킬 및 벤질 할라이드, 예를 들어, 할로아세트아미드; (iii) 알데히드, 케톤, 카르복실 및 말레이미드기; 및 (iv) 디술피드, 예를 들어 피리딜 디술피드 (술피드 교환을 통한)를 포함하는, 링커 시약 및 약물-링커 중간체 상의 친전자성 기와 공유 결합을 형성할 수 있다. 약물 모이어티 상의 친핵성 기는 링커 모이어티 및 링커 시약 상의 친전자성 기와 반응하여 공유 결합을 형성할 수 있는, 아민, 티올, 히드록실, 히드라지드, 옥심, 히드라진, 티오세미카바존, 히드라진 카르복실레이트, 및 아릴히드라지드기를 포함하고 이로 제한되지 않는다.
시스테인 조작된 항체는 환원제, 예를 들어 DTT (클레란드 (Cleland) 시약, 디티오트레이톨) 또는 TCEP (트리스(2-카르복시에틸)포스핀 염산염; [Getz et al (1999) Anal. Biochem. Vol 273:73-80]; 솔텍 벤쳐스 (Soltec Ventures, 미국 매사추세츠주 비벌리))로 처리한 후, 재산화시켜 사슬간 및 사슬내 디술피드 결합을 재형성함으로써 링커 시약과의 접합을 위해 반응성이 되도록 만들 수 있다 (실시예 17). 예를 들어, CHO 세포에서 발현시킨 전장 시스테인 조작된 모노클로날 항체 (ThioMab)를 약 50배 몰과량의 TCEP로 3 hr 동안 37℃에서 환원시켜, 새로 도입된 시스테인 잔기와 배양 배지 내에 존재하는 시스테인 사이에 형성될 수 있는 시스테인 부가물 내의 디술피드 결합을 환원시킨다. 환원된 ThioMab을 희석하고, HiTrap S 컬럼 상으로 10 mM 아세트산나트륨 (pH 5) 내에서 로딩하고, 0.3M 염화나트륨을 함유하는 PBS로 용출시킨다. 디술피드 결합은 실온에서 철야로 묽은 (200 nM) 수성 황산구리 (CuSO4)를 사용하여 모 Mab 내에 존재하는 시스테인 잔기들 사이에서 재확립되었다. 별법으로, 데히드로아스코르브산 (DHAA)이 시스테인 부가물의 환원에 의한 절단 후에 시스테인 조작된 항체의 사슬내 디술피드기를 재확립하기 위해 효과적인 산화제이다. 당업계에 공지된 다른 산화제, 즉, 산화제, 및 산화 조건을 사용할 수 있다. 주변 공기 산화도 효과적이다. 상기 약한 부분 재산화 단계는 높은 신뢰도로 사슬내 디술피드를 효율적으로 형성하고, 새로 도입된 시스테인 잔기의 티올기를 보존한다. 약 10배 과량의 약물-링커 중간체, 예를 들어 MC-vc-PAB-MMAE를 첨가하고, 혼합하고, 약 1시간 동안 실온에서 정치시켜 접합을 수행하고, 항-TAHO, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체-약물 접합체를 형성시켰다. 접합 혼합물을 겔 여과하고, HiTrap S 컬럼에 로딩하고 이 컬럼을 통해 용출시켜 과량의 약물-링커 중간체 및 다른 불순물을 제거하였다.
도 29는 접합을 위한 세포 배양액으로부터 발현된 시스테인 조작된 항체를 제조하기 위한 일반적인 과정을 보여준다. 세포 배양 배지가 시스테인을 함유하면, 디술피드 부가물이 새로 도입된 시스테인 아미노산과 배지로부터의 시스테인 사이에 형성될 수 있다. 도 29에서 예시적인 ThioMab (좌측)에서 원으로 표시한 이들 시스테인 부가물은 환원되어 접합에 대해 반응성인 시스테인 조작된 항체를 생성해야 한다. 시스테인 부가물은 아마도 다양한 사슬간 디술피드 결합과 함께, TCEP와 같은 환원제를 사용하여 환원에 의해 절단되어 환원된 형태의 항체를 제공한다. 쌍을 이룬 시스테인 잔기들 사이의 사슬간 디술피드 결합은 황산구리, DHAA, 또는 주변 산소에 대한 노출을 이용한 부분 산화 조건 하에 재형성된다. 새로 도입되고, 조작되고, 쌍을 이루지 않은 시스테인 잔기는 링커 시약 또는 약물-링커 중간체와의 반응을 위해 이용가능하게 유지되어, 본 발명의 항체 접합체를 형성한다. 포유동물 세포주에서 발현된 ThioMab은 -S-S- 결합 형성을 통해 조작된 Cys에 대해 외부에서 접합된 Cys 부가물을 생성시킨다. 따라서, 정제된 ThioMab을 실시예 17에 설명된 바와 같은 환원 및 재산화 절차로 처리하여 반응성 ThioMab을 생산한다. 이들 ThioMab은 세포독성 약물, 형광단, 및 다른 표지를 함유한 말레이미드와 접합하기 위해 사용된다.
10. 면역리포좀
본원에 개시된 항-TAHO 항체는 또한 면역리포좀으로서 제제화될 수 있다. "리포좀"은 약물을 포유동물에게 전달하기 위해 유용한 다양한 종류의 지질, 인지질 및/또는 계면활성제로 구성된 작은 소포이다. 리포좀의 성분들은 통상적으로 생물학적 막의 지질 배열과 유사한 2층 구조로 배열된다. 항체를 함유하는 리포좀은 문헌 ([Epstein et al., Proc. Natl. Acad. Sci. USA, 82:3688 (1985)]; [Hwang et al., Proc. Natl. Acad. Sci. USA, 77: 4030 (1980)]; 미국 특허 4,485,045 및 4,544,545; 및 1997년 10월 23일 공개된 WO97/38731)에 기재된 것과 같은 당업계에 공지된 방법에 의해 제조된다. 향상된 순환 시간을 갖는 리포좀은 미국 특허 5,013,556에 개시되어 있다.
특히 유용한 리포좀은 포스파티딜콜린, 콜레스테롤 및 PEG-유도체화된 포스파티딜에탄올아민 (PEG-PE)을 포함하는 지질 조성물을 사용하여 역상 증발법에 의해 생성할 수 있다. 리포좀은 목적하는 직경을 갖는 리포좀을 수득하도록 규정된 공극 크기의 필터를 통해 압출된다. 본 발명의 항체의 Fab' 단편은 디술피드 상호교환 반응을 통해 문헌 [Martin et al. J. Biol. Chem. 257: 286-288 (1982)]에 기재된 바와 같이 리포좀에 접합할 수 있다. 화학요법제는 임의로 리포좀 내에 함유된다 ([Gabizon et al., J. National Cancer Inst. 81(19):1484 (1989)] 참조).
B. TAHO 결합 올리고펩티드
본 발명의 TAHO 결합 올리고펩티드는 바람직하게는 본원에서 설명되는 TAHO 폴리펩티드에 특이적으로 결합하는 올리고펩티드이다. TAHO 결합 올리고펩티드는 공지의 올리고펩티드 합성 방법을 사용하여 화학적으로 합성될 수 있거나 또는 재조합 기술을 사용하여 제조하고 정제될 수 있다. TAHO 결합 올리고펩티드의 길이는 대체로 적어도 약 5개 아미노산, 별법으로 적어도 약 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 또는 100개 아미노산이고, 상기 올리고펩티드는 바람직하게는 본원에서 설명되는 TAHO 폴리펩티드에 특이적으로 결합할 수 있다. TAHO 결합 올리고펩티드는 공지된 기술을 사용하여 과도한 실험을 수행하지 않으면서 확인할 수 있다. 이와 관련하여, 폴리펩티드 표적에 특이적으로 결합할 수 있는 올리고펩티드에 대해 올리고펩티드 라이브러리를 스크리닝하는 기술이 당업계에 공지되어 있다 (예를 들어, 미국 특허 5,556,762, 5,750,373, 4,708,871, 4,833,092, 5,223,409, 5,403,484, 5,571,689, 5,663,143; PCT 공개 WO 84/03506 및 WO84/03564; [Geysen et al., Proc. Natl. Acad. Sci. U.S.A., 81:3998-4002 (1984)]; [Geysen et al., Proc. Natl. Acad. Sci. USA, 82:178-182 (1985)]; [Geysen et al., in Synthetic Peptides as Antigens, 130-149 (1986)]; [Geysen et al., J. Immunol. Meth., 102:259-274 (1987)]; [Schoofs et al., J. Immunol., 140:611-616 (1988)], [Cwirla, S. E. et al. (1990) Proc. Natl. Acad. Sci. USA, 87:6378]; [Lowman, H. B. et al. (1991) Biochemlstry, 30: 10832]; [Clackson, T. et al. (1991) Nature, 352: 624]; [Marks, J. D. et al. (1991), J. Mol. Biol., 222:581]; [Kang, A.S. et al. (1991) Proc. Natl. Acad. Sci. USA, 88:8363], 및 [Smith, G. P. (1991) Current Opin. Biotechnol., 2:668] 참조).
이와 관련하여, 박테리오파지 (파지) 디스플레이는 폴리펩티드 표적에 특이적으로 결합할 수 있는 라이브러리의 멤버(들)을 확인하기 위해 큰 올리고펩티드 라이브러리를 스크리닝할 수 있는 하나의 잘 공지된 기술이다. 파지 디스플레이는 변이체 폴리펩티드를 박테리오파지 입자의 표면 상에 코트 단백질에 대한 융합 단백질로서 디스플레이시키는 기술이다 (Scott, J.K. and Smith, G. P. (1990) Science, 249: 386). 파지 디스플레이의 유용성은 선택적으로 무작위화된 단백질 변이체 (또는 무작위로 클로닝된 cDNA)의 큰 라이브러리를 표적 분자에 고친화도로 결합하는 서열에 대해 신속하고 효율적으로 분류할 수 있다는 점에 있다. 파지 상의 펩티드 (Cwirla, S. E. et al. (1990) Proc. Natl. Acad. Sci. USA. 87:6378) 또는 단백질 ([Lowman, H.B. et al. (1991) Biochemistry. 30:10832]; [Clackson, T. et al. (1991) Nature, 352: 624]; [Marks, J. D. et al. (1991), J. Mol. Biol., 222:581]; [Kang, A.S. et al. (1991) Proc. Natl. Acad. Sci. USA, 88:8363]) 라이브러리의 디스플레이는 특이적 결합 특성을 갖는 것을 수백만 개의 폴리펩티드 또는 올리고펩티드에서 스크리닝하기 위해 사용되어 왔다 (Smith, G. P. (1991) Current Opin. Biotechnol., 2:668). 무작위 돌연변이체의 파지 라이브러리의 분류는 매우 많은 변이체의 구성 및 증식 전략, 표적 수용체를 사용한 친화도 정제 절차, 및 결합 농축 결과의 평가 수단을 필요로 한다 (미국 특허 5,223,409, 5,403,484, 5,571,689, 및 5,663,143).
대부분의 파지 디스플레이 방법은 필라멘트성 파지를 이용하지만, 람다상 (lambdoid) 파지 디스플레이 시스템 (WO 95/34683; U.S. 5,627,024), T4 파지 디스플레이 시스템 ([Ren et al., Gene. 215: 439 (1998)]; [Zhu et al., Cancer Research. 58(15): 3209-3214 (1998)]; [Jiang et al.. Infection & Immunity. 65(11): 4770-4777 (1997)]; [Ren et al., Gene, 195(2):303-311 (1997)]; [Ren, Protein Sci., 5: 1833 (1996)]; [Efimov et al.. Virus Genes. 10: 173 (1995)]) 및 T7 파지 디스플레이 시스템 ([Smith and Scott, Methods in Enzvmology, 217: 228-257 (1993)]; U.S. 5,766,905)도 알려져 있다.
기본적인 파지 디스플레이 개념에 대한 많은 다른 개선 및 변경이 현재 개발되고 있다. 상기 개선은 선택된 표적 분자에 대한 결합에 대해 펩티드 라이브러리를 스크리닝하고 목적하는 특성에 대해 기능성 단백질을 스크리닝할 수 있으면서 기능성 단백질을 제시하는 디스플레이 시스템의 능력을 향상시킨다. 파지 디스플레이 반응을 위한 조합 반응 장치가 개발되었고 (WO 98/14277), 파지 디스플레이 라이브러리를 사용하여 생체분자의 상호작용 (WO 98/20169; WO 98/20159) 및 제한된 (constrained) 나선형 펩티드의 특성 (WO 98/20036)을 분석하고 조절하였다. WO 97/35196에는 결합 리간드를 선택적으로 단리하기 위해 파지 디스플레이 라이브러리를, 리간드가 표적 분자에 결합하는 제1 용액 및 친화도 리간드가 표적 분자에 결합하지 않는 제2 용액과 접촉시키는 친화도 리간드의 단리 방법이 기재되어 있다. WO 97/46251에는 무작위 파지 디스플레이 라이브러리를 친화도 정제된 항체로 바이오패닝 (biopanning)한 후, 결합 파지를 단리하고, 이어서 고 친화도 결합 파지를 단리하기 위해 마이크로플레이트 웰을 사용하는 마이크로패닝 (micropanning)을 실시하는 방법이 기재되어 있다. 친화도 태그로서 스타필로코커스 아우레우스 (Staphylococcus aureus) 단백질 A를 사용하는 것도 보고된 바 있다 (Li et al. (1998) Mol Biotech., 9:187). WO 97/47314에는 파지 디스플레이 라이브러리일 수 있는 조합 라이브러리를 사용하여 효소 특이성을 구별하기 위해 기질 공제 (substrate subtraction) 라이브러리를 사용하는 것이 기재되어 있다. 파지 디스플레이를 사용하여 세제에 사용하기 적합한 효소를 선택하는 방법은 WO 97/09446에 기재되어 있다. 특이적인 결합 단백질을 선택하는 추가의 방법은 미국 특허 5,498,538, 5,432,018, 및 WO 98/15833에 기재되어 있다.
또한, 펩티드 라이브러리를 생성시키고 라이브러리를 스크리닝하는 방법이 미국 특허 5,723,286, 5,432,018, 5,580,717, 5,427,908, 5,498,530, 5,770,434, 5,734,018, 5,698,426, 5,763,192, 및 5,723,323에 개시되어 있다.
C. TAHO 결합 유기 분자
TAHO 결합 유기 분자는 바람직하게는 본원에서 설명되는 TAHO 폴리펩티드에 특이적으로 결합하는, 본원에서 설명되는 올리고펩티드 또는 항체 이외의 다른 유기 분자이다. TAHO 결합유기 분자는 공지의 방법을 사용하여 확인되고 화학적으로 합성될 수 있다 (예를 들어, PCT 공개 WO00/00823 및 WO00/39585 참조). TAHO 결합 유기 분자의 크기는 대체로 약 2000 달톤 미만, 별법으로 약 1500, 750, 500, 250 또는 200 달톤 미만이고, 바람직하게는 본원에서 설명되는 TAHO 폴리펩티드에 특이적으로 결합할 수 있는 상기 유기 분자는 공지의 기술을 사용하여 과도한 실험을 수행하지 않으면서 확인할 수 있다. 이와 관련하여, 폴리펩티드 표적에 결합할 수 있는 분자에 대해 유기 분자 라이브러리를 스크리닝하는 기술이 당업계에 공지되어 있다 (예를 들어, PCT 공개 WO00/00823 및 WO00/39585 참조). TAHO 결합 유기 분자는 예를 들어 알데히드, 케톤, 옥심, 히드라존, 세미카르바존, 카르바지드, 1차 아민, 2차 아민, 3차 아민, N-치환 히드라진, 히드라지드, 알콜, 에테르, 티올, 티오에테르, 디술피드, 카르복실산, 에스테르, 아미드, 우레아, 카르바메이트, 카르보네이트, 케탈, 티오케탈, 아세탈, 티오아세탈, 아릴 할라이드, 아릴 술포네이트, 알킬 할라이드, 알킬 술포네이트, 방향족 화합물, 헤테로시클릭 화합물, 아닐린, 알켄, 알킨, 디올, 아미노 알콜, 옥사졸리딘, 옥사졸린, 티아졸리딘, 티아졸린, 에나민, 술폰아미드, 에폭시드, 아지리딘, 이소시아네이트, 술포닐 클로라이드, 디아조 화합물, 산 클로라이드 등일 수 있다.
D. 목적하는 특성을 갖는 항- TAHO 항체, TAHO 결합 올리고펩티드 및 TAHO 결합 유기 분자에 대한 스크리닝
TAHO 폴리펩티드에 결합하는 항체, 올리고펩티드 및 유기 분자를 생성하기 위한 기술은 상기 설명되었다. 요구되는 경우에 특정 생물학적 특징을 갖는 항체, 올리고펩티드 또는 다른 유기 분자를 추가로 선택할 수 있다.
본 발명의 항-TAHO 항체, 올리고펩티드 또는 다른 유기 분자의 성장 억제 효과는 당업계에 공지된 방법에 의해, 예를 들어 내인성으로 또는 TAHO 유전자로 형질감염된 후 TAHO 폴리펩티드를 발현하는 세포를 사용하여 평가할 수 있다. 예를 들어, 적절한 종양 세포주 및 TAHO로 형질감염된 세포를 수일 (예를 들어, 2-7일) 동안 다양한 농도의 항-TAHO 모노클로날 항체로 처리하고, 크리스탈 바이올렛 또는 MTT로 염색하거나, 일부 다른 비색 분석에 의해 분석할 수 있다. 증식을 측정하는 또다른 방법은 본 발명의 항-TAHO 항체, TAHO 결합 올리고펩티드 또는 TAHO 결합 유기 분자의 존재 또는 부재 하에 처리된 세포에 의한 3H-티미딘 흡수를 비교하는 것이다. 처리 후에, 세포를 수거하고, DNA 내로 혼입된 방사성의 양을 섬광 계수기에서 정량한다. 적절한 양성 대조군은 선택된 세포주를 세포주의 성장을 억제하는 것으로 공지된 성장 억제 항체로 처리하는 것을 포함한다. 생체 내에서 종양 세포의 성장 억제는 당업계에 공지된 다양한 방식으로 결정할 수 있다. 종양 세포는 TAHO 폴리펩티드를 과다발현하는 것일 수 있다. 항-TAHO 항체, TAHO 결합 올리고펩티드 또는 TAHO 결합 유기 분자는 시험관 내에서 또는 생체 내에서 TAHO-발현 종양 세포의 증식을 미처리된 종양 세포에 비해, 한 실시태양에서 약 0.5 내지 30 ㎍/ml의 항체 농도에서 약 25-100%, 보다 바람직하게는 약 30-100%, 훨씬 더 바람직하게는 약 50-100% 또는 70-100%까지 억제할 것이다. 성장 억제는 세포 배양액 중의 약 0.5 내지 30 ㎍/ml 또는 약 0.5 nM 내지 200 nM의 항체 농도에서 측정할 수 있고, 여기서 성장 억제는 종양 세포를 항체에 노출시키고 1-10일 경과한 후에 결정한다. 항체는 항-TAHO 항체를 약 1 ㎍/kg 내지 약 100 mg/kg (체중)으로 투여할 때 항체의 제1 투여로부터 약 5일 내지 3개월 내에, 바람직하게는 약 5 내지 30일 내에 종양 크기를 감소시키거나 종양 세포 증식을 감소시킬 경우에 생체 내에서 성장 억제성인 항체이다.
세포 사멸을 유도하는 항-TAHO 항체, TAHO 결합 올리고펩티드 또는 TAHO 결합 유기 분자를 선택하기 위해, 예를 들어 요오드화프로피듐 (PI), 트리판 블루 또는 7AAD 흡수에 의해 표시되는 바와 같은 막 통합성의 상실을 대조군과 비교하여 평가할 수 있다. PI 흡수 분석은 보체 및 면역 효과기 세포의 부재 하에 수행할 수 있다. TAHO 폴리펩티드-발현 종양 세포를 배지 단독으로 또는 적절한 항-TAHO 항체 (예를 들어, 약 10 ㎍/ml), TAHO 결합 올리고펩티드 또는 TAHO 결합 유기 분자를 함유하는 배지와 함께 인큐베이팅한다. 세포를 3일 동안 인큐베이팅한다. 각각의 처리 후에, 세포를 세척하고, 세포 덩어리를 제거하기 위해 35 mm의 스트레이너 (strainer) 마개가 있는 12 x 75 mm 튜브 (튜브 당 1 ml, 처리군 당 3개의 튜브) 내로 분취한다. 이어서, 튜브에 PI (10 ㎍/ml)를 넣는다. 샘플을 FACSCAN® 유동 세포 측정기 및 FACSCONVERT® CellQuest 소프트웨어 (벡톤 디킨슨 (Becton Dickinson))를 사용하여 분석할 수 있다. PI 흡수에 의해 결정할 때 통계학상 유의한 수준의 세포 사멸을 유도하는 항-TAHO 항체, TAHO 결합 올리고펩티드 또는 TAHO 결합 유기 분자를 세포 사멸-유도 항-TAHO 항체, TAHO 결합 올리고펩티드 또는 TAHO 결합 유기 분자로서 선택할 수 있다.
목적하는 항체가 결합하는 TAHO 폴리펩티드 상의 에피토프에 결합하는 항체, 올리고펩티드 또는 다른 유기 분자를 스크리닝하기 위해, 문헌 [Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow and David Lane (1988)]에 기재된 것과 같은 통상적인 교차-차단 분석을 수행할 수 있다. 상기 분석은 시험 항체, 올리고펩티드 또는 다른 유기 분자가 공지의 항-TAHO 항체와 동일한 부위 또는 에피토프에 결합하는지를 결정하는데 사용할 수 있다. 별법으로 또는 추가로, 에피토프 매핑 (mapping)을 당업계에 공지된 방법에 의해 수행할 수 있다. 예를 들어, 접촉 잔기를 확인하기 위해 항체 서열을 알라닌 스캐닝에 의해서와 같이 돌연변이시킬 수 있다. 돌연변이체 항체는 초기에 적합한 폴딩 (folding)을 보장하기 위해 폴리클로날 항체와의 결합에 대해 시험된다. 상이한 방법에서, TAHO 폴리펩티드의 상이한 영역에 대응하는 펩티드를 시험 항체와의, 또는 시험 항체 및 특성이 결정되거나 공지된 에피토프를 갖는 항체와의 경쟁 분석에 사용할 수 있다.
E. 항체 의존 효소 매개 전구약물 요법 ( ADEPT )
본 발명의 항체는 또한 전구약물 (예를 들어, 펩티딜 화학요법제, WO81/01145 참조)을 활성 항암 약물로 전환시키는 전구약물-활성화 효소에 항체를 접합함으로써 ADEPT에서 사용할 수 있다 (예를 들어, WO 88/07378 및 미국 특허 4,975,278 참조).
ADEPT에 유용한 면역접합체의 효소 성분은 전구약물을 그의 활성이 더 큰 세포독성 형태로 전환시키는 방식으로 전구약물에 대해 작용할 수 있는 임의의 효소를 포함한다.
본 발명의 방법에 유용한 효소는 포스페이트 함유 전구약물을 유리 약물로 전환시키는데 유용한 알칼리성 포스파타제; 술페이트 함유 전구약물을 유리 약물로 전환시키는데 유용한 아릴술파타제; 무독성 5-플루오로시토신을 항암 약물인 5-플루오로우라실로 전환시키는데 유용한 시토신 데아미나제; 펩티드 함유 전구약물을 유리 약물로 전환시키는데 유용한 프로테아제, 예를 들어 세라티아 프로테아제, 테르몰리신, 섭틸리신, 카르복시펩티다제 및 카텝신 (예를 들어, 카텝신 B 및 L); D-아미노산 치환체를 함유하는 전구약물을 전환시키는데 유용한 D-알라닐카르복시펩티다제; 글리코실화된 전구약물을 유리 약물로 전환시키는데 유용한 탄수화물-절단 효소, 예를 들어 β-갈락토시다제 및 뉴라미니다제; β-락탐으로 유도체화된 약물을 유리 약물로 전환시키는데 유용한 β-락타마제; 및 그들의 아민 질소에서 각각 페녹시아세틸기 또는 페닐아세틸기로 유도체화된 약물을 유리 약물로 전환시키는데 유용한 페니실린 아미다제, 예를 들어 페니실린 V 아미다제 또는 페니실린 G 아미다제를 포함하고 이로 제한되지 않는다. 별법으로, 본 발명의 전구약물을 유리 활성 약물로 전환시키기 위해 효소 활성을 갖는 항체 (당업계에서 "아브자임 (abzyme)"으로도 공지됨)를 사용할 수 있다 (예를 들어, 문헌 [Massey, Nature 328:457-458 (1987)] 참조). 항체-아브자임 접합체는 종양 세포 집단에 아브자임을 전달하기 위해 본원에 기재된 바와 같이 제조할 수 있다.
본 발명의 효소는 당업계에 공지된 기술에 의해, 예를 들어 상기 논의된 이종2관능성 가교결합 시약을 사용하여 항-TAHO 항체에 공유 결합될 수 있다. 별법으로, 적어도 본 발명의 효소의 기능적 활성 부분에 연결된 본 발명의 항체의 항원 결합 영역을 적어도 포함하는 융합 단백질은 당업계에 공지된 재조합 DNA 기술을 이용하여 구성될 수 있다 (예를 들어, [Neuberger et al., Nature 312:604-608 (1984)] 참조).
F. 전장 TAHO 폴리펩티드
본 발명은 또한 본원에서 TAHO 폴리펩티드로 언급되는 폴리펩티드를 코딩하는 새로 확인되고 단리된 뉴클레오티드 서열을 제공한다. 특히, 다양한 TAHO 폴리펩티드를 코딩하는 cDNA (부분 및 전장)가 아래의 실시예에 추가로 상세히 개시되는 바와 같이 확인되고 단리되었다.
아래 실시예에 개시된 바와 같이, 다양한 cDNA 클론이 ATCC에 기탁되었다. 이들 클론의 실제 뉴클레오티드 서열은 당업계에서 통상적인 방법을 사용하여 기탁된 클론을 서열 결정함으로써 당업자에 의해 쉽게 결정될 수 있다. 예측된 아미노산 서열은 통상적인 기술을 사용하여 뉴클레오티드 서열로부터 결정될 수 있다. 본원에서 설명되는 TAHO 폴리펩티드 및 코딩 핵산에 대해, 몇몇 경우에, 본 발명자들은 그 당시에 이용가능한 서열 정보를 사용하여 가장 우수하게 확인가능한 해독 프레임인 것으로 생각되는 것을 확인하였다
G. 항- TAHO 항체 및 TAHO 폴리펩티드 변이체
본원에서 설명되는 항-TAHO 항체 및 전장 천연 서열 TAHO 폴리펩티드에 추가로, 항-TAHO 항체 및 TAHO 폴리펩티드 변이체를 제조할 수 있음이 고려된다. 항-TAHO 항체 및 TAHO 폴리펩티드 변이체는 코딩 DNA에 적절한 뉴클레오티드 변화를 도입함으로써 및/또는 목적하는 항체 또는 폴리펩티드의 합성에 의해 제조할 수 있다. 당업자는 아미노산 변화가 항-TAHO 항체 또는 TAHO 폴리펩티드의 번역후 처리를 변경하고, 예를 들어 글리코실화 부위의 수 또는 위치를 변화시키거나 막 고정 (anchoring) 특징을 변경시킬 수 있음을 알 것이다.
본원에서 설명되는 항-TAHO 항체 및 TAHO 폴리펩티드의 변이는 예를 들어 미국 특허 5,364,934에 제시된 보존적 및 비-보존적 돌연변이를 위한 임의의 기술 및 지침을 사용하여 형성시킬 수 있다. 변이는 천연 서열 항체 또는 폴리펩티드에 비해 아미노산 서열을 변경시키는, 항체 또는 폴리펩티드를 코딩하는 하나 이상의 코돈의 치환, 결실 또는 삽입일 수 있다. 임의로, 변이는 항-TAHO 항체 또는 TAHO 폴리펩티드의 하나 이상의 도메인에서 적어도 하나의 아미노산을 임의의 다른 아미노산으로 치환함으로써 발생한다. 어떤 아미노산 잔기가 목적하는 활성에 유해한 영향을 주지 않으면서 삽입, 치환 또는 결실될 수 있는지를 결정할 때의 지침은 항-TAHO 항체 또는 TAHO 폴리펩티드의 서열을 공지의 상동성 단백질 분자의 서열과 비교하고 높은 상동성 영역에서 이루어지는 아미노산 서열 변화의 수를 최소화함으로써 밝혀질 수 있다. 아미노산 치환은 하나의 아미노산을 유사한 구조적 및/또는 화학적 특성을 갖는 다른 아미노산으로 치환하는, 예를 들어 류신을 세린으로 치환하는, 즉, 보존적 아미노산 치환의 결과일 수 있다. 삽입 또는 결실은 임의로 약 1 내지 5개의 아미노산에 걸칠 수 있다. 허용되는 변이는 서열에서 아미노산의 삽입, 결실 또는 치환을 체계적으로 만들고, 생성되는 변이체를 전장 또는 성숙 천연 서열이 제시하는 활성에 대해 시험함으로써 결정할 수 있다.
항-TAHO 항체 및 TAHO 폴리펩티드 단편이 본원에서 제공된다. 상기 단편은 예를 들어 전장 천연 항체 또는 단백질과 비교할 때 N-말단 또는 C-말단에서 말단절단될 수 있거나 내부 잔기가 결여될 수 있다. 특정 단편은 항-TAHO 항체 또는 TAHO 폴리펩티드의 목적하는 생물학적 활성에 필수적이지 않은 아미노산 잔기가 결여된다.
항-TAHO 항체 및 TAHO 폴리펩티드 단편은 임의의 많은 통상적인 기술에 의해 제조할 수 있다. 목적하는 펩티드 단편은 화학적으로 합성할 수 있다. 다른 방법은 효소에 의한 소화에 의해, 예를 들어 특정 아미노산 잔기에 의해 규정된 부위에서 단백질을 절단하는 것으로 알려진 효소로 단백질을 처리하거나 적합한 제한 효소로 DNA를 소화시킴으로써 항체 또는 폴리펩티드 단편을 생성하고, 목적하는 단편을 단리하는 것을 수반한다. 또다른 적합한 기술은 목적하는 항체 또는 폴리펩티드 단편을 코딩하는 DNA 단편을 단리하고 중합효소 연쇄 반응 (PCR)에 의해 증폭하는 것을 수반한다. DNA 단편의 목적하는 말단을 규정하는 올리고뉴클레오티드는 PCR에서 5' 및 3' 프라이머에 사용된다. 바람직하게는, 항-TAHO 항체 및 TAHO 폴리펩티드 단편은 적어도 하나의 생물학적 및/또는 면역학적 활성을 본원에 개시된 천연 항-TAHO 항체 또는 TAHO 폴리펩티드와 공유한다.
특정 실시태양에서, 목적하는 보존적 치환을 표 10에 바람직한 치환의 표제 하에 제시한다. 상기 치환이 생물학적 활성을 변경하면, 하기 표 10에 예시적인 치환으로 명명하거나 아미노산 클래스에 대해 아래에 상세히 설명한 보다 실질적인 변화를 도입하고, 생성물을 스크리닝한다.
항-TAHO 항체 또는 TAHO 폴리펩티드의 기능 또는 면역학적 실체의 실질적인 변형은 (a) 예를 들어, 시트 또는 나선 입체형태로서의 치환 영역 내의 폴리펩티드 백본의 구조, (b) 표적 부위의 분자의 전하 또는 소수성, 또는 (c) 대부분의 측쇄를 유지하는 것에 대한 그의 효과가 유의하게 상이한 치환을 선택함으로써 달성한다. 천연 발생 잔기는 공통적인 측쇄 특성을 기초로 하여 다음 군으로 나누어진다:
(1) 소수성: 노르류신, met, ala, val, leu, ile;
(2) 중성 친수성: cys, ser, thr;
(3) 산성: asp, glu;
(4) 염기성: asn, gln, his, lys, arg;
(5) 사슬 배향을 영향을 미치는 잔기: gly, pro; 및
(6) 방향족: trp, tyr, phe.
비-보존적 치환은 이들 클래스의 하나의 멤버를 다른 클래스와 교환하는 것을 수반한다. 상기 치환된 잔기를 또한 보존적 치환 부위 내로, 또는 보다 바람직하게는 나머지 (비-보존된) 부위 내로 도입할 수 있다.
변이는 당업계에 공지된 방법, 예를 들어 올리고뉴클레오티드-매개 (부위 지정) 돌연변이 유발, 알라닌 스캐닝, 및 PCR 돌연변이 유발을 사용하여 발생시킬 수 있다. 항-TAHO 항체 또는 TAHO 폴리펩티드 변이체 DNA를 생산하기 위해 클로닝된 DNA에 대해 부위 지정 돌연변이 유발 ([Carter et al., Nucl. Acids Res., 12:4331 (1986)]; [Zoller et al., Nucl. Acids Res., 10:6487 (1987)]), 카세트 돌연변이 유발 [Wells et al., Gene, 34:315 (1985)], 제한 선택 돌연변이 유발 [Wells et al., Philos. Trans. R. Soc. London SerA, 317:415 (1986)] 또는 다른 공지의 기술을 수행할 수 있다.
인접 서열을 따라 하나 이상의 아미노산을 확인하기 위해 스캐닝 아미노산 분석을 또한 사용할 수 있다. 바람직한 스캐닝 아미노산에는 비교적 작은 중성 아미노산이 존재한다. 상기 아미노산은 알라닌, 글라이신, 세린, 및 시스테인을 포함한다. 알라닌이 상기 군 중에서 일반적으로 바람직한 스캐닝 아미노산이고, 그 이유는 알라닌이 베타-탄소를 지나서 존재하는 측쇄를 제거하고, 변이체의 주쇄 입체형태를 변경시킬 가능성이 작기 때문이다 [Cunningham and Wells, Science, 244: 1081-1085 (1989)]. 알라닌은 또한 가장 흔한 아미노산이기 때문에 일반적으로 바람직하다. 추가로, 알라닌은 종종 매립된 위치 및 노출된 위치 모두에서 발견된다 ([Creighton, The Proteins, (W.H. Freeman & Co., N.Y.)]; [Chothia, J. Mol. Biol., 150:1 (1976)]). 알라닌 치환이 적당량의 변이체를 생성하지 않을 경우에, 이소테릭 (isoteric) 아미노산을 사용할 수 있다.
항-TAHO 항체 또는 TAHO 폴리펩티드의 적합한 입체형태 유지에 관여하지 않는 임의의 시스테인 잔기도 또한 분자의 산화 안정성을 개선하고 이상 가교결합을 억제하기 위해 일반적으로 세린으로 치환시킬 수 있다. 이와 반대로, 그의 안정성 (특히 항체가 항체 단편, 예를 들어 Fv 단편인 경우)을 개선하기 위해, 시스테인 결합(들)을 항-TAHO 항체 또는 TAHO 폴리펩티드에 첨가할 수 있다.
특히 바람직한 종류의 치환 변이체는 모 항체 (예를 들어, 인간화 또는 인간 항체)의 하나 이상의 초가변 영역 잔기의 치환을 수반한다. 일반적으로, 추가 개발을 위해 선택된 생성되는 변이체(들)은 그들이 생성되는 모 항체에 비해 개선된 생물학적 특성을 가질 것이다. 상기 치환 변이체를 생성하기 위한 편리한 방법은 파지 디스플레이를 사용한 친화도 증진을 수반한다. 간단히 설명하면, 몇몇 초가변 영역 부위 (예를 들어 6-7개의 부위)를 각 부위에서 모든 가능한 아미노 치환을 생성하도록 돌연변이시킨다. 이렇게 생성된 항체 변이체를 각 입자 내에 패키지된 M13의 유전자 III 산물에 대한 융합체로서 필라멘트형 파지 입자로부터 1가 양식으로 디스플레이시킨다. 이어서 파지-디스플레이된 변이체를 본원에 개시된 바와 같이 그들의 생물학적 활성 (예를 들어 결합 친화도)에 대해 스크리닝한다. 변형을 위한 후보 초가변 영역 부위를 확인하기 위해, 항원 결합에 유의하게 기여하는 초가변 영역 잔기를 확인하도록 알라닌 스캐닝 돌연변이 유발을 수행할 수 있다. 별법으로 또는 추가로, 항체와 인간 TAHO 폴리펩티드 사이의 접촉점을 확인하기 위해 항원-항체 복합체의 결정 구조를 분석하는 것이 유익할 수 있다. 상기 접촉 잔기 및 이웃 잔기가 본원에서 설명되는 기술에 따른 치환을 위한 후보이다. 일단 그러한 변이체가 생성되면, 변이체의 패널을 본원에 기재된 바와 같이 스크리닝하고, 하나 이상의 관련 분석에서 우수한 특성을 갖는 항체를 추가 개발을 위해 선택할 수 있다.
항-TAHO 항체의 아미노산 서열 변이체를 코딩하는 핵산 분자는 당업계에 공지된 다양한 방법에 의해 제조한다. 이들 방법은 천연 공급원으로부터의 단리 (천연 발생 아미노산 서열 변이체의 경우에), 또는 기제조된 변이체 또는 비-변이체 버전의 항-TAHO 항체의 올리고뉴클레오티드-매개 (또는 부위 지정) 돌연변이 유발, PCR 돌연변이 유발, 및 카세트 돌연변이 유발에 의한 제조를 포함하고 이로 제한되지 않는다.
H. 항- TAHO 항체 및 TAHO 폴리펩티드의 변형
항-TAHO 항체 및 TAHO 폴리펩티드의 공유 변형이 본 발명의 범위 내에 포함된다. 하나의 종류의 공유 변형은 항-TAHO 항체 또는 TAHO 폴리펩티드의 표적화된 아미노산 잔기를, 항-TAHO 항체 또는 TAHO 폴리펩티드의 선택된 측쇄 또는 N- 또는 C-말단 잔기와 반응할 수 있는 유기 유도체화제와 반응시키는 것을 포함한다. 2관능성 물질을 사용한 유도체화는 예를 들어 항-TAHO 항체를 정제하기 위한 방법에서 사용하기 위한 수불용성 지지체 매트릭스 또는 표면에 항-TAHO 항체 또는 TAHO 폴리펩티드를 가교결합시키기 위해, 및 그 반대를 위해 유용하다. 통상적으로 사용되는 가교결합제는 예를 들어 1,1-비스(디아조아세틸)-2-페닐에탄, 글루타르알데히드, N-히드록시숙신이미드 에스테르, 예를 들어 4-아지도살리실산을 갖는 에스테르, 동종2관능성 이미도에스테르, 예를 들어 디숙신이미딜 에스테르, 예를 들어 3,3'-디티오비스(숙신이미딜프로피오네이트), 2관능성 말레이미드, 예를 들어 비스-N-말레이미도-1,8-옥탄 및 메틸-3-[(p-아지도페닐)디티오]프로피오이미데이트와 같은 물질을 포함한다.
다른 변형은 글루타미닐 및 아스파라기닐 잔기의 각각 대응하는 글루타밀 및 아스파르틸 잔기로의 탈아미드화, 프롤린 및 라이신의 히드록실화, 세릴 또는 트레오닐 잔기의 히드록실기의 인산화, 라이신, 아르기닌, 및 히스티딘 측쇄의 α-아미노기의 메틸화 [T.E. Creighton, Proteins: Structure and Molecular Properties, W.H. Freeman & Co., San Francisco, pp. 79-86 (1983)], N-말단 아민의 아세틸화, 및 임의의 C-말단 카르복실기의 아미드화를 포함한다.
본 발명의 범위 내에 포함된 항-TAHO 항체 또는 TAHO 폴리펩티드의 다른 종류의 공유 변형은 항체 또는 폴리펩티드의 천연 글리코실화 패턴의 변경을 포함한다. "천연 글리코실화 패턴의 변경"은 본원의 목적에서 천연 서열 항-TAHO 항체 또는 TAHO 폴리펩티드에서 발견된 하나 이상의 탄수화물 모이어티의 삭제 (근본적인 글리코실화 부위의 제거에 의해 또는 화학적 및/또는 효소 수단에 의한 글리코실화의 제거에 의해), 및/또는 천연 서열 항-TAHO 항체 또는 TAHO 폴리펩티드에 존재하지 않는 하나 이상의 글리코실화 부위의 부가를 의미하고자 의도된다. 또한, 상기 구문은 존재하는 다양한 탄수화물 모이어티의 특성 및 비율의 변화를 포함하는, 천연 단백질의 글리코실화의 정성적인 변화를 포함한다.
항체 및 다른 폴리펩티드의 글리코실화는 대개 N-연결되거나 0-연결된다. N-연결된은 아스파라긴 잔기의 측쇄에 탄수화물 모이어티의 부착을 나타낸다. 트리펩티드 서열 아스파라긴-X-세린 및 아스파라긴-X-트레오닌 (여기서, X는 프롤린을 제외한 임의의 아미노산임)이 아스파라긴 측쇄에 대한 탄수화물 모이어티의 효소에 의한 부착을 위한 인식 서열이다. 따라서, 폴리펩티드 내에 이들 트리펩티드 서열 중 하나의 존재는 잠재적인 글리코실화 부위를 생성한다. 0-연결된 글리코실화는 히드록시아미노산, 가장 일반적으로 세린 또는 트레오닌에 당, 즉 N-아세일갈락토사민, 갈락토스 또는 자일로스 중의 하나의 부착을 나타내지만, 5-히드록시프롤린 또는 5-히드록시라이신이 또한 사용될 수 있다.
항-TAHO 항체 또는 TAHO 폴리펩티드에 대한 글리코실화 부위의 부가는 하나 이상의 상기한 트리펩티드 서열을 함유하도록 아미노산 서열을 변경함으로써 달성할 수 있다 (N-연결된 글리코실화 부위의 경우). 변경은 또한 본래의 항-TAHO 항체 또는 TAHO 폴리펩티드의 서열에 하나 이상의 세린 또는 트레오닌 잔기를 부가하거나 치환시켜 형성시킬 수 있다 (0-연결된 글리코실화 부위의 경우). 항-TAHO 항체 또는 TAHO 폴리펩티드 아미노산 서열은 특히 목적하는 아미노산으로 번역될 코돈이 생성되도록 항-TAHO 항체 또는 TAHO 폴리펩티드를 코딩하는 DNA를 기선택된 염기에서 돌연변이시킴으로써, 임의로 DNA 수준에서의 변화를 통해 변경시킬 수 있다.
항-TAHO 항체 또는 TAHO 폴리펩티드 상의 탄수화물 모이어티의 수를 증가시키는 다른 수단은 폴리펩티드에 글리코시드를 화학적으로 또는 효소에 의해 커플링시키는 것이다. 상기 방법은 예를 들어 1987년 9월 11일 공개된 WO 87/05330 및 문헌 [Aplin and Wriston, CRC Crit. Rev. Biochem. pp. 259-306 (1981)]에 기재되어 있다.
항-TAHO 항체 또는 TAHO 폴리펩티드 상에 존재하는 탄수화물 모이어티의 제거는 화학적으로 또는 효소에 의해, 또는 글리코실화의 표적으로 기능하는 아미노산 잔기를 코딩하는 코돈의 돌연변이에 의한 치환에 의해 달성할 수 있다. 화학적 탈글리코실화 기술은 당업계에 공지되어 있고, 예를 들어 문헌 [Hakimuddin, et al., Arch. Biochem. Biophys., 259:52 (1987)] 및 [Edge et al., Anal. Biochem. 118:131 (1981)]에 기재되어 있다. 폴리펩티드 상의 탄수화물 모이어티의 효소에 의한 절단은 문헌 [Thotakura et al., Meth. Enzymol., 138:350 (1987)]에 기재된 바와 같이 다양한 엔도- 및 엑소-글리코시다제의 사용에 의해 달성할 수 있다.
항-TAHO 항체 또는 TAHO 폴리펩티드의 다른 종류의 공유 변형은 미국 특허 4,640,835; 4,496,689; 4,301,144; 4,670,417; 4,791,192 또는 4,179,337에 제시된 방식으로 항체 또는 폴리펩티드를 다양한 비단백질성 중합체, 예를 들어, 폴리에틸렌 글리콜 (PEG), 폴리프로필렌 글리콜, 또는 폴리옥시알킬렌 중의 하나에 연결시키는 것을 포함한다. 항체 또는 폴리펩티드는 또한 예를 들어 액적 형성 기술 또는 계면 중합에 의해 제조되는 마이크로캡슐 (예를 들어, 각각 히드록시메틸셀룰로스 또는 젤라틴-마이크로캡슐 및 폴리-(메틸메타크릴레이트) 마이크로캡슐) 내에, 콜로이드성 약물 전달계 (예를 들어, 리포좀, 알부민 미세구, 마이크로에멀젼, 나노입자 및 나노캡슐) 내에 또는 마크로에멀젼 내에 봉입될 수 있다. 이러한 기술은 문헌 [Remington's Pharmaceutical Sciences 16th edition, Oslo, A. Ed. (1980)]에 개시되어 있다.
본 발명의 항-TAHO 항체 또는 TAHO 폴리펩티드는 또한 다른 이종성 폴리펩티드 또는 아미노산 서열에 융합된 항-TAHO 항체 또는 TAHO 폴리펩티드를 포함하는 키메라 분자를 형성하는 방식으로 변형될 수 있다.
한 실시태양에서, 상기 키메라 분자는 항-태그 항체가 그에 대해 선택적으로 결합할 수 있는 에피토프를 제공하는 태그 폴리펩티드와 항-TAHO 항체 또는 TAHO 폴리펩티드의 융합체를 포함한다. 에피토프 태그는 일반적으로 항-TAHO 항체 또는 TAHO 폴리펩티드의 아미노- 또는 카르복실-말단에 위치한다. 그러한 에피토프-태깅된 형태의 항-TAHO 항체 또는 TAHO 폴리펩티드의 존재는 태그 폴리펩티드에 대한 항체를 사용하여 검출할 수 있다. 또한, 에피토프 태그를 제공함으로써 항-태그 항체 또는 에피토프 태그에 결합하는 다른 종류의 친화도 매트릭스를 사용한 친화도 정제에 의해 항-TAHO 항체 또는 TAHO 폴리펩티드를 쉽게 정제할 수 있다. 다양한 태그 폴리펩티드와 그들의 각각의 항체는 당업계에 공지되어 있다. 그 예는 폴리-히스티딘 (poly-his) 또는 폴리-히스티딘-글라이신 (poly-his-gly) 태그; flu HA 태그 폴리펩티드 및 그의 항체 12CA5 [Field et al., Mol. Cell. Biol. 8:2159-2165 (1988)]; c-myc 태그 및 그에 대한 8F9, 3C7, 6E10, G4, B7 및 9E10 항체 [Evan et al., Molecular and Cellular Biology, 5:3610-3616 (1985)]; 및 단순 포진 바이러스 당단백질 D (gD) 태그 및 그의 항체 [Paborsky et al., Protein Engineering. 3(6):547-553 (1990)]를 포함한다. 다른 태그 폴리펩티드는 Flag-펩티드 [Hopp et al., BioTechnology, 6:1204-1210 (1988)]; KT3 에피토프 펩티드 [Martin et al., Science, 255:192-194 (1992)]; α-튜불린 에피토프 펩티드 [Skinner et al., J. Biol. Chem. 266:15163-15166 (1991)]; 및 T7 유전자 10 단백질 펩티드 태그 [Lutz-Freyermuth et al., Proc. Natl. Acad. Sci. USA, 87:6393-6397 (1990)]를 포함한다.
별도의 실시태양에서, 키메라 분자는 면역글로불린 또는 면역글로불린의 특정 영역과 항-TAHO 항체 또는 TAHO 폴리펩티드의 융합체를 포함할 수 있다. 2가 형태의 키메라 분자 (본원에서 "면역어드헤신"으로도 칭함)에 대해, 상기 융합체는 IgG 분자의 Fc 영역에 대한 것일 수 있다. Ig 융합체는 바람직하게는 Ig 분자 내의 적어도 하나의 가변 영역 대신에 가용성 (막횡단 도메인이 결실된 또는 불활성화된) 형태의 항-TAHO 항체 또는 TAHO 폴리펩티드를 치환한 것을 포함한다. 특히 바람직한 실시태양에서, 면역글로불린 융합체는 힌지, IgG1 분자의 CH2 및 CH3, 또는 힌지, CH1, CH2 및 CH3 영역을 포함한다. 면역글로불린 융합체의 생산에 대해서는 또한 미국 특허 5,428,130 (1995년 6월 27일 등록)을 참조한다.
I. 항- TAHO 항체 및 TAHO 폴리펩티드의 제조
아래에 제시되는 설명은 주로 항-TAHO 항체- 및 TAHO 폴리펩티드-코딩 핵산을 함유하는 벡터로 형질전환 또는 형질감염된 세포의 배양에 의한 항-TAHO 항체 및 TAHO 폴리펩티드의 생산에 관한 것이다. 물론, 항-TAHO 항체 및 TAHO 폴리펩티드를 제조하기 위해 당업계에 공지되어 있는 다른 방법을 사용할 수 있음이 고려된다. 예를 들어, 적절한 아미노산 서열, 또는 그의 일부는 고상 기술을 이용한 직접 펩티드 합성 (예를 들어, 문헌 [Stewart et al., Solid-Phase Peptide Synthesis, W.H. Freeman Co., San Francisco, CA (1969)]; [Merrifield, J. Am. Chem. Soc. 85:2149-2154 (1963)] 참조)에 의해 생산할 수 있다. 시험관내 단백질 합성은 수동 기술 또는 자동화 기술에 의해 수행할 수 있다. 자동화 합성은 예를 들어 어플라이드 바이오시스템즈 (Applied Biosystems) 펩티드 합성기 (미국 캘리포니아주 포스터 시티)를 제조사의 지시에 따라 사용하여 달성할 수 있다. 항-TAHO 항체 또는 TAHO 폴리펩티드의 다양한 부분들은 별개로 화학적으로 합성하고, 목적하는 항-TAHO 항체 또는 TAHO 폴리펩티드를 생산하기 위해 화학적 또는 효소적 방법을 사용하여 조합할 수 있다.
1. 항- TAHO 항체 또는 TAHO 폴리펩티드를 코딩하는 DNA 의 단리
항-TAHO 항체 또는 TAHO 폴리펩티드를 코딩하는 DNA는 항-TAHO 항체 또는 TAHO 폴리펩티드 mRNA를 갖고 이를 검출가능한 수준으로 발현하는 것을 생각되는 조직으로부터 제조된 cDNA 라이브러리로부터 얻을 수 있다. 따라서, 인간 항-TAHO 항체 또는 TAHO 폴리펩티드 DNA는 인간 조직으로부터 제조된 cDNA 라이브러리로부터 편리하게 얻을 수 있다. 항-TAHO 항체- 또는 TAHO 폴리펩티드-코딩 유전자는 또한 게놈 라이브러리로부터 또는 공지의 합성 절차 (예를 들어, 자동화 핵산 합성)에 의해 얻을 수 있다.
라이브러리는 목적하는 유전자 또는 그에 의해 코딩되는 단백질을 확인하도록 설계된 프로브 (예를 들어, 적어도 약 20-80개 염기의 올리고뉴클레오티드)를 사용하여 스크리닝할 수 있다. 선택된 프로브를 사용한 cDNA 또는 게놈 라이브러리의 스크리닝은 문헌 [Sambrook et al., Molecular Cloning: A Laboratory Manual (New York: Cold Spring Harbor Laboratory Press, 1989)]에 기재된 바와 같은 표준 절차를 사용하여 수행할 수 있다. 항-TAHO 항체 또는 TAHO 폴리펩티드를 코딩하는 유전자를 단리하는 별도의 수단은 PCR 방법을 사용하는 것이다 ([Sambrook et al., 상기 문헌]; [Dieffenbach et al., PCR Primer: A Laboratory Manual (Cold Spring Harbor Laboratory Press, 1995)]).
cDNA 라이브러리를 스크리닝하기 위한 기술은 당업계에 공지되어 있다. 프로브로서 선택된 올리고뉴클레오티드 서열은 충분한 길이이고 가양성 (false positive)이 최소화되도록 충분히 분명해야 한다. 올리고뉴클레오티드는 바람직하게는 스크리닝되는 라이브러리 내의 DNA에 대한 혼성화시에 검출될 수 있도록 표지된다. 표지하는 방법은 당업계에 공지되어 있고, 32P-표지된 ATP와 같은 방사성 표지, 비오티닐화 또는 효소 표지의 사용을 포함한다. 중등 엄격성 및 고 엄격성을 포함한 혼성화 조건은 문헌 [Sambrook et al., 상기 문헌]에 제시되어 있다.
상기 라이브러리 스크리닝 방법에서 확인된 서열은 공공 데이타베이스, 예를 들어 GenBank 또는 다른 사설 서열 데이타베이스에 기탁되고 이로부터 이용가능한 다른 공지의 서열과 비교되고 정렬될 수 있다. 분자의 규정된 영역 내의 또는 전장 서열에 걸친 서열 동일성 (아미노산 또는 뉴클레오티드 수준에서)은 당업계에 공지되고 본원에서 설명되는 방법을 사용하여 결정할 수 있다.
단백질 코딩 서열을 갖는 핵산은 처음으로 본원에 개시된 추정 아미노산 서열을 사용하고, 필요한 경우에 cDNA로 역전사될 수 없는 mRNA의 전구체 및 처리 중간체를 검출하기 위해 문헌 [Sambrook et al., 상기 문헌]에 기재된 바와 같이 통상적인 프라이머 연장 절차를 이용하여, 선택된 cDNA 또는 게놈 라이브러리를 스크리닝함으로써 얻을 수 있다.
2. 숙주 세포의 선택 및 형질전환
숙주 세포를 항-TAHO 항체 또는 TAHO 폴리펩티드 생산을 위해 본원에 기재된 발현 또는 클로닝 벡터로 형질감염 또는 형질전환시키고, 프로모터를 유도하거나, 형질전환체를 선택하거나, 목적하는 서열을 코딩하는 유전자를 증폭시키기 위해 적절하게 변형된 통상적인 영양 배지 내에서 배양한다. 배양 조건, 예를 들어 배지, 온도, pH 등은 과도한 실험을 수행하지 않으면서 당업자가 선택할 수 있다. 일반적으로, 세포 배양액의 생산성을 최대화하기 위한 원칙, 프로토콜 및 실용적 기술은 문헌 [Mammalian Cell Biotechnology: A Practical Approach, M. Butler, ed. (IRL Press, 1991)] 및 [Sambrook et al., 상기 문헌])에서 찾을 수 있다.
진핵 세포 형질감염 및 원핵 세포 형질전환의 방법, 예를 들어 CaCl2, CaPO4, 리포좀-매개 및 전기천공은 당업자에게 공지되어 있다. 사용된 숙주 세포에 따라, 형질전환은 상기 세포에 적절한 표준 기술을 사용하여 수행된다. 문헌 [Sambrook et al., 상기 문헌]에 기재된 바와 같이 염화칼슘을 사용한 칼슘 처리, 또는 전기천공은 일반적으로 원핵생물에 대해 사용된다. 아그로박테리움 투메파시엔스 (Agrobacterium tumefaciens)를 사용한 감염은 문헌 [Shaw et al., Gene. 23:315 (1983)] 및 1989년 6월 29일 공개된 WO 89/05859에 기재된 바와 같은 특정 식물 세포의 형질전환을 위해 사용된다. 상기 세포벽이 없는 포유동물 세포에 대해서는, 문헌 [Graham and van der Eb, Virology, 52:456-457 (1978)]의 인산칼슘 침전 방법을 사용할 수 있다. 포유동물 세포 숙주 시스템 형질감염의 일반적인 측면은 미국 특허 4,399,216에 기재되어 있다. 효모 내로의 형질전환은 일반적으로 문헌 [Van Solingen et al., J. Bact., 130:946 (1977)] 및 [Hsiao et al. Proc. Natl. Acad. Sci. (USA), 76:3829 (1979)]의 방법에 따라 수행한다. 그러나, DNA를 세포 내로 도입하기 위한 다른 방법, 예를 들어 핵 미세주사, 전기천공, 무손상 세포와 세균 원형질체 융합, 또는 다가양이온, 예를 들어, 폴리브렌, 폴리오르니틴에 의한 방법도 사용할 수 있다. 포유동물 세포를 형질전환하기 위한 다양한 기술에 대해서는 문헌 [Keown et al., Methods in Enzymology, 185:527-537 (1990)] 및 [Mansour et al., Nature, 336:348-352 (1988)]을 참조한다.
본원에서 벡터 내에서 DNA를 클로닝 또는 발현시키기 위해 적합한 숙주 세포는 원핵생물, 효모, 또는 고등 진핵 세포를 포함한다. 적합한 원핵생물은 진정세균, 예를 들어 그람 음성 또는 그람 양성 유기체, 예를 들어 엔테로박테리아세애 (Enterobacteriaceae), 예를 들어 이. 콜라이를 포함하고 이로 제한되지 않는다. 다양한 이. 콜라이 균주, 예를 들어 이. 콜라이 K12 균주 MM294 (ATCC 31,446); 이. 콜라이 X1776 (ATCC 31,537); 이. 콜라이 균주 W3110 (ATCC 27,325) 및 K5 772 (ATCC 53,635)가 공개적으로 이용가능하다. 다른 적합한 원핵 숙주 세포는 엔테로박테리아세애, 예를 들어 에스케리치아 (Escherichia), 예를 들어 이. 콜라이, 엔테로박터 (Enterobacter), 에르위니아 (Erwinia), 클렙시엘라 (Klebsiella), 프로테우스 (Proteus), 살모넬라 (Salmonella), 예를 들어, 살모넬라 티피무륨 (Salmonella typhimurium), 세라티아 (Serratia), 예를 들어, 세라티아 마르세스칸스 (Serratia marcescans) 및 시겔라 (Shigella), 및 바실러스 (Bacilli), 예를 들어 비. 섭틸리스 (B. subtilis) 및 비. 리케니포르미스 (B. licheniformis) (예를 들어, 1989년 4월 12일 공개된 DD 266,710에 개시된 비. 리케니포르미스 41P), 슈도모나스 (Pseudomonas), 예를 들어 피. 애루기노사 (P. aeruginosa) 및 스트렙토마이세스 (Streptomyces)를 포함한다. 이들 예는 제한적인 것이 아니라 예시적인 것이다. 균주 W3110은 재조합 DNA 생성물 발효를 위한 통상적인 숙주 균주이기 때문에 특히 바람직한 하나의 숙주 또는 모 숙주이다. 바람직하게는, 숙주 세포는 최소량의 단백 분해 효소를 분비한다. 예를 들어, 균주 W3110은 숙주에 내인성인 단백질을 코딩하는 유전자에 유전자 돌연변이를 발생시키도록 변형될 수 있고, 상기 숙주의 예는 완전한 유전자형 tonA를 갖는 이. 콜라이 W3110 균주 1A2; 완전한 유전자형 tonA ptr3을 갖는 이. 콜라이 W3110 균주 9E4; 완전한 유전자형 tonA ptr3 phoA E15 (argF-lac)169 degP ompT kanr을 갖는 이. 콜라이 W3110 균주 27C7 (ATCC 55,244); 완전한 유전형 tonA ptr3 phoA E15 (argF-lac)169 degP ompT rbs7 ilvG kanr을 갖는 이. 콜라이 W3110 균주 37D6; 비-카나마이신 내성 degP 결실 돌연변이가 존재하는 균주 37D6인 이. 콜라이 W3110 균주 40B4; 및 1990년 8월 7일 등록된 미국 특허 4,946,783에 개시된 돌연변이체 주변 세포질 프로테아제를 갖는 이. 콜라이 균주를 포함한다. 별법으로, 시험관내 클로닝 방법, 예를 들어 PCR 또는 다른 핵산 중합효소 반응이 적합하다.
전장 항체, 항체 단편, 및 항체 융합 단백질은 특히 글리코실화 및 Fc 효과기 기능이 필요하지 않을 때, 예를 들어 치료 항체가 세포독성제 (예를 들어, 독소)에 접합되고 면역접합체 자체가 종양 세포 파괴에 유효성을 보일 때 세균에서 생산할 수 있다. 전장 항체는 순환 반감기가 보다 길다. 이. 콜라이 내에서의 생산은 보다 빠르고 보다 비용 효율적이다. 세균에서의 항체 단편 및 폴리펩티드의 발현에 대해서는 예를 들어 U.S. 5,648,237 (Carter et. al), U.S. 5,789,199 (Joly et al.), 및 발현 및 분비의 최적화를 위한 번역 개시 영역 (TIR) 및 신호 서열을 설명하는 U.S. 5,840,523 (Simmons et al.) (이들 특허는 본원에 참고로 포함된다)을 참조한다. 발현 후에, 항체는 가용성 분획 내의 이. 콜라이 세포 페이스트로부터 단리하고, 예를 들어 이소형에 따라 단백질 A 또는 G 컬럼을 통해 정제할 수 있다. 최종 정제는 예를 들어 CHO 세포 내에서 발현된 항체를 정제하기 위한 방법과 유사하게 수행할 수 있다.
원핵생물에 추가로, 진핵 미생물, 예를 들어 필라멘트형 진균 또는 효모가 항-TAHO 항체- 또는 TAHO 폴리펩티드-코딩 벡터에 적합한 클로닝 또는 발현 숙주이다. 사카로마이세스 세레비지애 (Saccharomyces cerevisiae)가 흔히 사용되는 저등 진핵 숙주 미생물이다. 다른 숙주는 쉬조사카로마이세스 폼베 (Schizosaccharomyces pombe ) ([Beach and Nurse, Nature, 290: 140 [1981]]; 1985년 5월 2일 공개된 EP 139,383); 클루이베로마이세스 (Kluyveromyces) 숙주 (미국 특허 4,943,529; [Fleer et al., Bio/Technology, 9:968-975 (1991)]), 예를 들어, 케이. 락티스 (K. lactis) (MW98-8C, CBS683, CBS4574; [Louvencourt et al., J. Bacteriol. 154(2):737-742 [1983]]), 케이. 프라길리스 (K. fragilis) (ATCC 12,424), 케이. 불가리쿠스 (K. bulgaricus) (ATCC 16,045), 케이. 위커라미 (K. wickeramii) (ATCC 24,178), 케이. 왈티 (K. waltii) (ATCC 56,500), 케이. 드로소필라룸 (K. drosophilarum) (ATCC 36,906; [Van den Berg et al., Bio/Technology, 8:135 (1990)]), 케이. 테르모톨레란스 (K. thermotolerans) 및 케이. 마르시아누스 (K. marxianus); 야로위아 (yarrowia) (EP 402,226); 피키아 파스토리스 (Pichia pastoris) (EP 183,070; [Sreekrishna et al., J. Basic Microbiol. 28:265-278 [1988]]); 칸디다 (Candida); 트리코데르마 레에시아 (Trichoderma reesia) (EP 244,234); 뉴로스포라 크라사 (Neurospora crassa) (Case et al., Proc. Natl. Acad. Sci. USA, 76:5259-5263 [1979]); 쉬바니오마이세스 (Schwanniomyces), 예를 들어 쉬바니오마이세스 옥시덴탈리스 (S. occidentalis) (1990년 10월 31일 공개된 EP 394,538); 및 필라멘트형 진균, 예를 들어, 뉴로스포라, 페니실리움 (Penicillium), 톨리포클라디움 (Tolypocladium) (1991년 1월 10일 공개된 WO 91/00357), 및 아스퍼질러스 (Aspergillus) 숙주, 예를 들어 에이. 니둘란스 (A. nidulans) ([Ballance et al., Biochem. Biophys. Res. Commun., 112:284-289 [1983]]; [Tilburn et al., Gene. 26:205-221 [1983]]; [Yelton et al., Proc. Natl. Acad. Sci. USA. 81: 1470-1474 [1984]]) 및 에이. 니거 (A. niger) (Kelly and Hynes, EMBO J., 4:475-479 [1985])를 포함한다. 메탄올 자화 (methylotropic) 효모가 본원에서 적합하고, 한세눌라 (Hansenula), 칸디다, 클로에케라 (Kloeckera), 피키아, 사카로마이세스, 토룰롭시스 (Torulopsis) 및 로도토룰라 (Rhodotorula)로 구성된 속으로부터 선택된, 메탄올에서 성장할 수 있는 효모를 포함하고 이로 제한되지 않는다. 상기 효모 클래스의 예시적인 특정 종은 문헌 [C. Anthony, The Biochemistry of Methylotrophs, 269 (1982)]에 제시되어 있다.
글리코실화된 항-TAHO 항체 또는 TAHO 폴리펩티드의 발현에 적합한 숙주 세포는 다세포 유기체로부터 유래된다. 무척추동물 세포의 예는 곤충 세포, 예를 들어 드로소필라 (Drosophila) S2 및 스포돕테라 (Spodoptera) Sf9, 및 식물 세포, 예를 들어 면화, 옥수수, 감자, 대두, 페튜니아, 토마토 및 담배의 세포 배양액을 포함한다. 많은 바큘로바이러스 균주 및 변이체, 및 스포돕테라 프루기페르다 (Spodoptera frugiperda; 쐐기벌레), 아에데스 아에깁티 (Aedes aegypti, 모기), 아에데스 알보픽투스 (Aedes albopictus, 모기), 드로소필라 멜라노가스터 (Drosophila melanogaster, 과일파리), 및 봄빅스 모리 (Bombyx mori)와 같은 숙주로부터의 대응하는 허용성 곤충 숙주 세포가 확인되었다. 형질감염을 위한 다양한 바이러스 균주, 예를 들어 오토그라파 칼리포르니카 (Autographa californica) NPV의 L-1 변이체, 및 봄빅스 모리 NPV의 Bm-5 균주가 공개적으로 이용가능하고, 상기 바이러스는 특히 스포돕테라 프루기페르다 세포의 형질감염을 위해 본 발명에 따라 본원에서 바이러스로서 사용할 수 있다.
그러나, 척추동물 세포에 대한 연구가 가장 많이 수행되어 왔고, 배양액 (조직 배양액)에서 척추동물 세포의 증식은 통상적인 절차가 되었다. 유용한 포유동물 숙주 세포주의 예는 SV40에 의해 형질전환된 원숭이 신장 CV1주 (COS-7, ATCC CRL 1651); 인간 배아 신장주 (293 세포 또는 현탁 배양으로 성장을 위해 서브클로닝된 293 세포 [Graham et al., J. Gen Virol. 36:59 (1997)]); 새끼 햄스터 신장 세포 (BHK, ATCC CCL 10); 차이니즈 햄스터 난소 세포/-DHFR (CHO, [Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)]); 마우스 세르톨리 세포 (TM4, [Mather, Biol. Reprod. 23:243-251 (1980)]); 원숭이 신장 세포 (CV1 ATCC CCL 70); 아프리카 초록 원숭이 신장 세포 (VERO-76, ATCC CRL-1587); 인간 자궁경부 암종 세포 (HELA, ATCC CCL 2); 개 신장 세포 (MDCK, ATCC CCL 34); 버팔로 래트 간세포 (BRL 3A, ATCC CRL 1442); 인간 폐세포 (W138, ATCC CCL 75); 인간 간세포 (Hep G2, HB 8065); 마우스 유방 종양 (MMT 060562, ATCC CCL51); TRI 세포 (Mather et al., Annals N.Y. Acad. Sci. 383:44-68 (1982)); MRC 5 세포; FS4 세포; 및 인간 간암세포주 (Hep G2)이다.
숙주 세포를 항-TAHO 항체 또는 TAHO 폴리펩티드 생산을 위한 상기한 발현 또는 클로닝 벡터로 형질전환시키고, 프로모터를 유도하거나, 형질전환체를 선택하거나, 목적하는 서열을 코딩하는 유전자를 증폭시키기 위해 적절하게 변형된 통상적인 영양 배지 내에서 배양한다.
3. 복제가능한 벡터의 선택 및 사용
항-TAHO 항체 또는 TAHO 폴리펩티드를 코딩하는 핵산 (예를 들어, cDNA 또는 게놈 DNA)은 클로닝 (DNA의 증폭) 또는 발현을 위해 복제가능한 벡터 내로 삽입될 수 있다. 다양한 벡터는 공개적으로 입수할 수 있다. 벡터는 예를 들어 플라스미드, 코스미드, 바이러스 입자, 또는 파지 형태로 존재할 수 있다. 적절한 핵산 서열은 다양한 절차에 의해 벡터 내로 삽입될 수 있다. 일반적으로, DNA는 당업계에 공지된 기술을 이용하여 적절한 제한 엔도뉴클레아제 부위(들) 내로 삽입된다. 벡터 성분은 일반적으로 하나 이상의 신호 서열, 복제 기점, 하나 이상의 마커 유전자, 인핸서 요소, 프로모터, 및 전사 종결 서열 중 하나 이상을 포함하고 이로 제한되지 않는다. 하나 이상의 이들 성분을 포함하는 적합한 벡터의 구성에는 당업자에게 공지된 표준 라이게이션 기술을 이용한다.
TAHO는 직접적으로, 및 또한 신호 서열, 또는 성숙 단백질 또는 폴리펩티드의 N-말단에 특이적 절단 부위를 갖는 다른 폴리펩티드일 수 있는 이종성 폴리펩티드와의 융합 폴리펩티드로서 재조합 방식으로 생산할 수 있다. 일반적으로, 신호 서열은 벡터의 성분일 수 있거나, 또는 벡터 내로 삽입되는 항-TAHO 항체- 또는 TAHO 폴리펩티드-코딩 DNA의 일부일 수 있다. 신호 서열은 예를 들어 알칼리성 포스파타제, 페니실리나제, lpp, 또는 열안정성 엔테로톡신 II 리더의 군 중에서 선택된 원핵생물 신호 서열일 수 있다. 효모 분비를 위해, 신호 서열은 예를 들어 효모 인버타제 리더, 알파 인자 리더 (사카로마이세스 α-인자 리더 및 미국 특허 5,010,182에 기재된 클루이베로마이세스 α-인자 리더 포함), 또는 산 포스파타제 리더, 씨. 알비칸스 (C. albicans) 글루코아밀라제 리더 (1990년 4월 4일 공개된 EP 362,179) 또는 1990년 11월 15일 공개된 WO 90/13646에 기재된 신호일 수 있다. 포유동물 세포 발현에서, 단백질의 분비를 지시하기 위해 포유동물 신호 서열, 예를 들어 동일한 또는 관련 종의 분비된 폴리펩티드로부터의 신호 서열 및 바이러스 분비 리더를 사용할 수 있다.
발현 및 클로닝 벡터는 모두 벡터가 하나 이상의 선택된 숙주 세포 내에서 복제하도록 하는 핵산 서열을 포함한다. 그러한 서열은 다양한 세균, 효모 및 바이러스에 대해 잘 알려져 있다. 플라스미드 pBR322로부터의 복제 기점이 대부분의 그람-음성 세균에 대해 적합하고, 2μ 플라스미드 기점은 효모에 대해 적합하고, 다양한 바이러스 기점 (SV40, 폴리오마, 아데노바이러스, VSV 또는 BPV)이 포유동물 세포에서 클로닝 벡터에 대해 유용하다.
발현 및 클로닝 벡터는 일반적으로 선택가능한 마커로도 불리는 선택 유전자를 포함할 것이다. 전형적인 선택 유전자는 (a) 항생제 또는 다른 독소, 예를 들어 암피실린, 네오마이신, 메토트렉세이트, 또는 테트라사이클린에 대한 내성을 부여하거나, (b) 영양요구성 결핍을 보완하거나, (c) 복합 배지로부터 이용가능하지 않은 중요 영양분을 공급하는 단백질을 코딩하고, 예를 들어 바실러스에 대한 D-알라닌 라세마제를 코딩하는 유전자이다.
포유동물 세포에 적합한 선택가능한 마커의 예는 항-TAHO 항체- 또는 TAHO 폴리펩티드-코딩 핵산을 흡수하는 능력을 갖는 세포의 확인을 가능하게 하는 것, 예를 들어 DHFR 또는 티미딘 키나제이다. 야생형 DHFR을 사용할 때 적절한 숙주 세포는 문헌 [Urlaub et al., Proc. Natl. Acad. Sci. USA, 77:4216 (1980)]에 기재된 바와 같이 제조하고 증식시킨, DHFR 활성이 결여된 CHO 세포주이다. 효모에서 사용하기 적합한 선택 유전자는 효모 플라스미드 YRp7에 존재하는 trp1 유전자이다 ([Stinchcomb et al., Nature, 282:39 (1979)]; [Kingsman et al., Gene, 7:141 (1979)]; [Tschemper et al., Gene, 10:157 (1980)]). trp1 유전자는 트립토판 내에서 성장하는 능력이 결여된 효모의 돌연변이체 균주, 예를 들어 ATCC No. 44076 또는 PEP4-1에 대한 선택 마커를 제공한다 [Jones, Genetics, 85:12 (1977)].
발현 및 클로닝 벡터는 대체로 mRNA 합성을 지시하도록 항-TAHO 항체- 또는 TAHO 폴리펩티드-코딩 핵산 서열에 작동가능하게 연결된 프로모터를 함유한다. 다양한 잠재적인 숙주 세포에 의해 인식되는 프로모터는 공지되어 있다. 원핵생물 숙주와 함께 사용하기 위해 적합한 프로모터는 β-갈락타마제 및 락토스 프로모터 시스템 ([Chang et al., Nature, 275:615 (1978)]; [Goeddel et al., Nature, 281:544 (1979)]), 알칼리성 포스파타제, 트립토판 (trp) 프로모터 시스템 ([Goeddel, Nucleic Acids Res., 8:4057 (1980)]; EP 36,776), 및 하이브리드 프로모터, 예를 들어 tac 프로모터 [deBoer et al., Proc. Natl. Acad. Sci. USA, 80:21-25 (1983)]를 포함한다. 세균 시스템에서 사용하기 위한 프로모터는 또한 항-TAHO 항체 또는 TAHO 폴리펩티드를 코딩하는 DNA에 작동가능하게 연결된 샤인-달가노 (Shine-Dalgarno; S.D.) 서열을 포함할 것이다.
효모 숙주와 함께 사용하기 위해 적합한 프로모팅 서열의 예는 3-포스포글리세레이트 키나제 [Hitzeman et al., J. Biol. Chem., 255:2073 (1980)] 또는 다른 당분해 효소 ([Hess et al., J. Adv. Enzyme Reg., 7:149 (1968)]; [Holland, Biochemistry, 17:4900 (1978)]), 예를 들어 에놀라제, 글리세르알데히드-3-포스페이트 데히드로게나제, 헥소키나제, 피루베이트 데카르복실라제, 포스포프럭토키나제, 글루코스-6-포스페이트 이소머라제, 3-포스포글리세레이트 뮤타제, 피루베이트 키나제, 트리오스포스페이트 이소머라제, 포스포글루코스 이소머라제 및 글루코키나제를 위한 프로모터를 포함한다.
성장 조건에 의해 제어되는 전사의 추가의 잇점을 갖는 유도가능 프로모터인 다른 효모 프로모터는 알콜 데히드로게나제 2, 이소시토크롬 C, 산 포스파타제, 질소 대사에 연관된 분해 효소, 메탈로티오네인, 글리세르알데히드-3-포스페이트 데히드로게나제, 및 말토스와 갈락토스 이용을 담당하는 효소를 위한 프로모터 영역이다. 효모 발현에 사용하기 위해 적합한 벡터 및 프로모터는 EP 73,657에 추가로 기재되어 있다.
포유동물 숙주 세포에서 벡터로부터 항-TAHO 항체 또는 TAHO 폴리펩티드 전사는 프로모터가 숙주 세포 시스템과 상용성이라면, 폴리오마 바이러스, 조류폭스 바이러스 (1989년 7월 5일 공개된 UK 2,211,504), 아데노바이러스 (예를 들어 아데노바이러스 2), 소 유두종 바이러스, 조류 육종 바이러스, 사이토메갈로바이러스, 레트로바이러스, B형 간염 바이러스 및 원숭이 바이러스 40 (SV40)과 같은 바이러스의 게놈으로부터, 이종 포유동물 프로모터, 예를 들어 액틴 프로모터 또는 면역글로불린 프로모터로부터, 및 열 충격 프로모터로부터 얻은 프로모터에 의해 제어된다.
고등 진핵생물에 의한 항-TAHO 항체 또는 TAHO 폴리펩티드를 코딩하는 DNA의 전사는 인핸서 서열을 벡터 내로 삽입함으로써 증가시킬 수 있다. 인핸서는 그의 전사를 증가시키도록 프로모터에 대해 작용하는, 대체로 약 10 내지 300 bp인 DNA의 시스 작용성 (cis-acting) 요소이다. 많은 인핸서 서열이 현재 포유동물 유전자 (글로빈, 엘라스타제, 알부민, α-페토단백질 및 인슐린)로부터 공지되어 있다. 그러나, 일반적으로 진핵 세포 바이러스로부터의 인핸서를 사용할 것이다. 그 예는 복제 기점의 하류 쪽의 SV40 인핸서 (bp 100-270), 사이토메갈로바이러스 조기 프로모터 인핸서, 복제 기점 하류 쪽의 폴리오마 인핸서 및 아데노바이러스 인핸서를 포함한다. 인핸서는 항-TAHO 항체 또는 TAHO 폴리펩티드 코딩 서열의 위치 5' 또는 3'에서 벡터 내로 스플라이싱될 수 있지만, 바람직하게는 프로모터로부터 부위 5'에 위치한다.
진핵 숙주 세포 (효모, 진균, 곤충, 식물, 동물, 인간 또는 다른 다세포 유기체로부터의 유핵 (nucleated) 세포)에 사용되는 발현 벡터도 전사 종결 및 mRNA의 안정화에 필요한 서열을 포함할 것이다. 상기 서열은 진핵생물 또는 바이러스 DNA 또는 cDNA의 5' 및 때때로 3' 비번역 영역으로부터 통상적으로 이용가능하다. 이들 영역은 항-TAHO 항체 또는 TAHO 폴리펩티드를 코딩하는 mRNA의 비번역 부분 내의 폴리아데닐화 단편으로서 전사된 뉴클레오티드 세그먼트를 포함한다.
재조합 척추동물 세포 배양액에서 항-TAHO 항체 또는 TAHO 폴리펩티드의 합성에 적용하기 적합한 또다른 방법, 벡터, 및 숙주 세포는 문헌 [Gething et al., Nature, 293:620-625 (1981)]; [Mantei et al., Nature, 281:40-46 (1979)]; EP 117,060; 및 EP 117,058에 기재되어 있다.
4. 숙주 세포의 배양
본 발명의 항-TAHO 항체 또는 TAHO 폴리펩티드를 생산하기 위해 사용되는 숙주 세포는 다양한 배지 내에서 배양할 수 있다. 상업적으로 이용가능한 배지, 예를 들어 햄 (Ham) F10 (시그마 (Sigma)), 최소 필수 배지 (MEM, 시그마), RPMI-1640 (시그마), 및 둘베코 (Dulbecco) 개질 이글 (Eagle) 배지 (DMEM, 시그마)가 숙주 세포를 배양하기 위해 적합하다. 또한, 문헌 [Ham et al., Meth. Enz. 58:44 (1979)], [Barnes et al., Anal. Biochem. 102:255 (1980)], 미국 특허 4,767,704; 4,657,866; 4,927,762; 4,560,655; 또는 5,122,469; WO 90/03430; WO 87/00195; 또는 미국 특허 Re. 30,985에 설명된 임의의 배지를 숙주 세포에 대한 배양 배지로서 사용할 수 있다. 임의의 이들 배지에는 필요하다면 호르몬 및/또는 다른 성장 인자 (예를 들어, 인슐린, 트랜스페린 또는 표피 성장 인자), 염 (예를 들어, 염화나트륨, 칼슘, 마그네슘 및 포스페이트), 버퍼 (예를 들어 HEPES), 뉴클레오티드 (예를 들어, 아데노신 및 티미딘), 항생제 (예를 들어, GENTAMYCIN™ 약물), 미량 원소 (대체로 마이크로몰 범위의 최종 농도로 존재하는 무기 화합물로서 정의됨) 및 글루코스 또는 동등 에너지원으로 보충할 수 있다. 임의의 다른 필수 보충물도 당업자에게 공지된 적절한 농도로 포함시킬 수 있다. 배양 조건, 예를 들어 온도, pH 등은 발현을 위해 선택된 숙주 세포와 함께 이전에 사용된 것이고, 당업자에게 명백할 것이다.
5. 유전자 증폭/발현의 검출
유전자 증폭 및/또는 발현은 예를 들어 본원에 제시된 서열을 기초로 하여, mRNA의 전사를 정량하는 통상적인 서던 블로팅, 노던 블로팅 [Thomas, Proc. Natl. Acad. Sci. USA 77:5201-5205 (1980)], 도트 블로팅 (DNA 분석), 또는 적절하게 표지된 프로브를 사용한 계내 혼성화에 의해 샘플 내에서 직접 측정할 수 있다. 별법으로, DNA 이중체, RNA 이중체, 및 DNA-RNA 하이브리드 이중체 또는 DNA-단백질 이중체를 포함하는 특이적 이중체를 인식할 수 있는 항체를 사용할 수 있다. 다시 항체는 표지될 수 있고, 표면 상에서 이중체의 형성시에 이중체에 결합된 항체의 존재를 검출할 수 있도록 이중체가 표면에 결합되어 분석이 수행될 수 있다.
별법으로, 유전자 발현은 면역학적 방법, 예를 들어 세포 또는 조직 절편의 면역조직화학 염색, 및 유전자 생성물의 발현을 직접 정량하기 위해 세포 배양액 또는 체액의 분석에 의해 측정할 수 있다. 면역조직화학 염색 및/또는 샘플 유체의 분석에 유용한 항체는 모노클로날 또는 폴리클로날 항체일 수 있고, 임의의 포유동물에서 제조할 수 있다. 편리하게는, 항체는 천연 서열 TAHO 폴리펩티드에 대해, 또는 본원에 제공된 DNA 서열에 기반한 합성 펩티드에 대해, 또는 TAHO DNA에 융합되고 특이적 항체 에피토프를 코딩하는 외인성 서열에 대해 제조할 수 있다.
6. 항- TAHO 항체 및 TAHO 폴리펩티드의 정제
항-TAHO 항체 및 TAHO 폴리펩티드의 형태는 배양 배지 또는 숙주 세포 용해물로부터 회수할 수 있다. 막 결합형인 경우에는, 항체는 적합한 세제 용액 (예를 들어 Triton-X 100)을 사용하여 또는 효소에 의한 절단에 의해 막으로부터 방출시킬 수 있다. 항-TAHO 항체 및 TAHO 폴리펩티드의 발현에 사용되는 세포는 다양한 물리적 또는 화학적 수단, 예를 들어 동결-해동 순환, 초음파 처리, 기계적 파괴, 또는 세포용해제에 의해 파괴할 수 있다.
재조합 세포 단백질 또는 폴리펩티드로부터 항-TAHO 항체 및 TAHO 폴리펩티드를 정제하는 것이 바람직할 수 있다. 다음 절차는 적합한 정제 절차의 예이다: 이온-교환 컬럼 상의 분획화; 에탄올 침전; 역상 HPLC; 실리카 또는 양이온-교환 수지, 예를 들어 DEAE 상의 크로마토그래피; 크로마토포커싱 (chromatofocusing); SDS-PAGE; 황산암모늄 침전; 예를 들어, 세파덱스 G-75를 사용한 겔 여과; 오염물, 예를 들어 IgG를 제거하기 위한 단백질 A 세파로스 컬럼; 및 항-TAHO 항체 및 TAHO 폴리펩티드의 에피토프-태깅된 형태에 결합하는 금속 킬레이팅 컬럼. 단백질 정제의 다양한 방법을 사용할 수 있고, 상기 방법은 당업계에 공지되어 있고, 예를 들어 문헌 [Deutscher, Methods in Enzvmology, 182 (1990)]; [Scopes, Protein Purification: Principles and Practice, Springer-Verlag, New York (1982)]에 기재되어 있다. 선택된 정제 단계(들)은 예를 들어 사용된 생산 공정의 특성, 및 생산된 특정 항-TAHO 항체 또는 TAHO 폴리펩티드에 따라 결정될 것이다.
재조합 기술을 사용할 때, 항체는 세포 내에서, 주변 세포질 공간 내에서 생산되거나 배지 내로 직접 분비될 수 있다. 항체가 세포 내에서 생산되면, 제1 단계로서, 입자형 파쇄물인 숙주 세포 또는 용해된 단편은 예를 들어 원심분리 또는 한외여과 (ultrafiltration)에 의해 제거된다. 문헌 [Carter et al. Bio/Technology 10: 163-167 (1992)]에서는 이. 콜라이의 주변 세포질 공간에 분비된 항체를 단리하기 위한 절차가 설명되어 있다. 간단히 설명하면, 세포 페이스트를 아세트산나트륨 (pH 3.5), EDTA 및 페닐메틸술포닐플루오라이드 (PMSF)의 존재 하에 약 30분에 걸쳐 해동시킨다. 세포 파쇄물은 원심분리에 의해 제거할 수 있다. 항체가 배지 내로 분비되는 경우에, 상기 발현 시스템으로부터의 상등액을 일반적으로 먼저 상업적으로 이용가능한 단백질 농축 필터, 예를 들어, 아미콘 (Amicon) 또는 밀리포어 펠리콘 (Millipore Pellicon) 한외여과 유닛을 사용하여 농축시킨다. 단백 분해를 억제하기 위해 프로테아제 억제제, 예를 들어 PMSF가 임의의 선행 단계에서 포함될 수 있고, 우발적인 오염물의 성장을 방지하기 위해 항생제가 포함될 수 있다.
세포로부터 제조된 항체 조성물은 예를 들어 히드록실아파타이트 크로마토그래피, 겔 전기영동, 투석 및 친화도 크로마토그래피를 사용하여 정제할 수 있고, 친화도 크로마토그래피가 바람직한 정제 기술이다. 친화도 리간드로서 단백질 A의 적합성은 항체 내에 존재하는 임의의 면역글로불린 Fc 도메인의 종 및 이소형에 의해 결정된다. 단백질 A가 인간 γ1, γ2 또는 γ4 중쇄를 기초로 한 항체를 정제하기 위해 사용될 수 있다 (Lindmark et al. J. Immunol. Meth. 62: 1-13 (1983)). 단백질 G는 모든 마우스 이소형 및 인간 γ3에 대해 권장된다 (Guss et al., EMBO J. 5: 15671575 (1986)). 친화도 리간드가 부착되는 매트릭스는 가장 종종 아가로스이지만, 다른 매트릭스도 이용가능하다. 기계적으로 안정한 매트릭스, 예를 들어 제어된 공극 유리 또는 폴리(스티렌디비닐)벤젠이 아가로스를 사용하여 달성될 수 있는 것보다 더 빠른 유동 속도와 더 짧은 처리 시간을 허용한다. 항체가 CH3 도메인을 포함하는 경우에, Bakerbond ABX™ 수지 (제이.티. 베이커 (J.T. Baker, 미국 뉴저지주 필립스버그))가 정제를 위해 유용하다. 단백질 정제를 위한 다른 기술, 예를 들어 이온-교환 컬럼 상의 분획화, 에탄올 침전, 역상 HPLC, 실리카 상의 크로마토그래피, 헤파린 SEPHAROSE™ 상의 크로마토그래피, 음이온 또는 양이온 교환 수지 (예를 들어 폴리아스파르트산 컬럼) 상의 크로마토그래피, 크로마토포커싱, SDS-PAGE, 및 황산암모늄 침전도 회수할 항체에 따라 이용가능하다.
임의의 예비 정제 단계(들) 후에, 목적하는 항체 및 오염물을 포함하는 혼합물은 pH가 약 2.5-4.5인 용출 버퍼를 사용하는, 바람직하게는 낮은 염 농도 (예를 들어, 약 0-0.25M 염)에서 수행되는 낮은 pH 소수성 상호작용 크로마토그래피에 적용될 수 있다.
J. 제약 제제
본 발명의 항체-약물 접합체 (ADC)는 치료되는 병태에 적절한 임의의 경로로 투여될 수 있다. ADC는 일반적으로 비경구로, 즉 주입, 피하, 근육내, 정맥내, 피부내, 경막내 및 경막외로 투여될 것이다.
이들 암을 치료하기 위해, 한 실시태양에서, 항체-약물 접합체는 정맥내 주입을 통해 투여된다. 주입을 통해 투여되는 투여량은 용량당 약 1 ㎍/m2 내지 약 10,000 ㎍/m2이고, 일반적으로 총 1, 2, 3 또는 4회 용량을 위해 1주당 1회 투여한다. 별법으로, 투여량 범위는 약 1 ㎍/m2 내지 약 1000 ㎍/m2, 약 1 ㎍/m2 내지 약 800 ㎍/m2, 약 1 ㎍/m2 내지 약 600 ㎍/m2, 약 1 ㎍/m2 내지 약 400 ㎍/m2, 약 10 ㎍/m2 내지 약 500 ㎍/m2, 약 10 ㎍/m2 내지 약 300 ㎍/m2, 약 10 ㎍/m2 내지 약 200 ㎍/m2, 및 약 1 ㎍/m2 내지 약 200 ㎍/m2이다. 용량은 1일 1회, 1주 1회, 1주 다수회로서 1일 1회 미만, 1개월 다수회로서 1일 1회 미만, 1개월 다수회로서 1주 1회 미만, 1개월 1회로 투여되거나, 또는 질병의 증상을 경감 또는 완화시키기 위해 간헐적으로 투여될 수 있다. 투여는 치료되는 림프종, 백혈병의 종양 또는 증상의 완화시까지 임의의 개시된 간격으로 계속될 수 있다. 증상의 완화 또는 경감이 상기 계속된 투여에 의해 연장되는 경우에는 증상의 완화 또는 경감이 달성된 후에도 투여가 계속될 수 있다.
본 발명은 또한 자가면역 질병에 걸린 환자에게 치료 유효량의 임의의 하나의 선행 실시태양의 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체-약물 접합체를 투여하는 것을 포함하는, 자가면역 질병의 완화 방법을 제공한다. 바람직한 실시태양에서, 항체는 정맥내 또는 피하 투여한다. 항체-약물 접합체는 용량당 약 1 ㎍/m2 내지 약 100 mg/m2의 투여량으로 정맥내로 투여되고, 특정 실시태양에서, 투여량은 1 ㎍/m2 내지 약 500 ㎍/m2이다. 용량은 1일 1회, 1주 1회, 1주 다수회로서 1일 1회 미만, 1개월 다수회로서 1일 1회 미만, 1개월 다수회로서 1주 1회 미만, 1개월 1회로 투여되거나, 또는 질병의 증상을 경감 또는 완화시키기 위해 간헐적으로 투여될 수 있다. 투여는 치료되는 자가면역 질병의 증상의 경감 또는 완화시까지 임의의 개시된 간격으로 계속될 수 있다. 증상의 완화 또는 경감이 상기 계속된 투여에 의해 연장되는 경우에는 증상의 완화 또는 경감이 달성된 후에도 투여가 계속될 수 있다.
본 발명은 또한 B 세포 질환, 예를 들어 B 세포 증식성 질환 (비제한적으로 림프종 및 백혈병 포함) 또는 자가면역 질병으로 고통받는 환자에게, 세포독성 분자 또는 검출가능한 분자에 접합되지 않은 임의의 하나의 선행 실시태양의 SN8 항체의 치료 유효량을 투여하는 것을 포함하는, B 세포 질환의 치료 방법을 제공한다. 항체는 일반적으로 약 1 ㎍/m2 내지 약 1000 mg/m2의 투여량 범위로 투여될 것이다.
한 측면에서, 본 발명은 본 발명의 적어도 하나의 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체 및/또는 그의 적어도 하나의 면역접합체 및/또는 본 발명의 적어도 하나의 그의 면역접합체 및/또는 본 발명의 적어도 하나의 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체-약물 접합체를 포함하는 제약 제제를 추가로 제공한다. 일부 실시태양에서, 제약 제제는 (1) 본 발명의 항체 및/또는 그의 면역접합체, 및 (2) 제약상 허용되는 담체를 포함한다. 일부 실시태양에서, 제약 제제는 (1) 본 발명의 항체 및/또는 그의 면역접합체, 및 임의로 (2) 적어도 하나의 추가의 치료제를 포함한다. 추가의 치료제는 아래에서 설명되는 것을 포함하고 이로 제한되지 않는다. ADC는 일반적으로 비경구로, 즉 주입, 피하, 근육내, 정맥내, 피부내, 경막내 및 경막외로 투여될 것이다.
본 발명에 따라 사용되는 항-CD79b 항체, TAHO 결합 올리고펩티드, TAHO 결합 유기 분자 및/또는 TAHO 폴리펩티드의 치료 제제는 목적하는 순도를 갖는 항체, 폴리펩티드, 올리고펩티드 또는 유기 분자를 임의의 제약상 허용되는 담체, 부형제 또는 안정화제 (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980))와 혼합하여 동결건조된 제제 또는 수용액의 형태로 보관을 위해 제조된다. 허용되는 담체, 부형제 또는 안정화제는 사용되는 투여량 및 농도에서 수용자에게 무독성이고, 버퍼, 예를 들어 아세테이트, Tris, 포스페이트, 시트레이트, 및 다른 유기산; 항산화제, 예를 들어 아스코르브산 및 메티오닌; 방부제 (예를 들어, 옥타데실디메틸벤질 암모늄 클로라이드; 헥사메토늄 클로라이드; 벤즈알코늄 클로라이드, 벤제토늄 클로라이드; 페놀, 부틸 또는 벤질 알코올; 알킬 파라벤, 예를 들어 메틸 또는 프로필 파라벤; 카테콜; 레소르시놀; 시클로헥산올; 3-펜탄올; 및 m-크레졸); 저분자량 (약 10개 미만 잔기) 폴리펩티드; 단백질, 예를 들어, 혈청 알부민, 젤라틴 또는 면역글로불린; 친수성 중합체, 예를 들어 폴리비닐피롤리돈; 아미노산, 예를 들어 글라이신, 글루타민, 아스파라긴, 히스티딘, 아르기닌 또는 라이신; 단당류, 이당류 및 다른 탄수화물, 예를 들어 글루코스, 만노스 또는 덱스트린; 킬레이팅제, 예를 들어 EDTA; 등장제, 예를 들어 트레할로스 및 염화나트륨; 당, 예를 들어 수크로스, 만니톨, 트레할로스 또는 소르비톨; 계면활성제, 예를 들어 폴리소르베이트; 염-형성 반대 이온, 예를 들어 나트륨; 금속 착물 (예를 들어, Zn-단백질 착물); 및/또는 비이온성 계면활성제, 예를 들어 TWEEN®, PLURONICS® 또는 폴리에틸렌 글리콜 (PEG)을 포함한다. 항체는 5-200 mg/ml, 바람직하게는 10-100 mg/ml의 농도에서 항체를 포함하는 것이 바람직하다.
본원의 제제는 또한 치료되는 특정 적응증에 필요한 하나 초과의 활성 화합물, 바람직하게는 서로 불리한 영향을 미치지 않는 상보적 활성을 갖는 화합물을 함유할 수 있다. 예를 들어, 항-TAHO 항체, TAHO 결합 올리고펩티드, 또는 TAHO 결합 유기 분자에 추가로, 하나의 제제 내에, 추가의 항체, 예를 들어, TAHO 폴리펩티드 상의 상이한 에피토프에 결합하는 제2 항-TAHO 항체, 또는 특정 암의 성장에 영향을 미치는 성장 인자와 같은 일부 다른 표적에 대한 항체를 포함하는 것이 바람직할 수 있다. 별법으로 또는 추가로, 조성물은 화학요법제, 세포독성제, 시토킨, 성장 억제제, 항-호르몬제, 및/또는 심장보호제를 더 포함할 수 있다. 상기 분자는 적합하게는 의도된 목적에 효과적인 양으로 조합물 내에 존재한다.
활성 성분은 또한 예를 들어 액적 형성 기술 또는 계면 중합에 의해 제조되는 마이크로캡슐, 예를 들어 각각 히드록시메틸셀룰로스 또는 젤라틴-마이크로캡슐 및 폴리-(메틸메타크릴레이트) 마이크로캡슐 내에, 콜로이드성 약물 전달계 (예를 들어, 리포좀, 알부민 미세구, 마이크로에멀젼, 나노입자 및 나노캡슐) 내에 또는 마크로에멀젼 내에 봉입될 수 있다. 이러한 기술은 문헌 [Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)]에 개시되어 있다.
지속 방출 제제를 제조할 수 있다. 지속 방출 제제의 적합한 예는 항체를 함유하는 소수성 고체 중합체의 반투과성 매트릭스를 포함하고, 상기 매트릭스는 성형품, 예를 들어 필름 또는 마이크로캡슐 형태이다. 지속 방출 매트릭스의 예는 폴리에스테르, 히드로겔 (예를 들어 폴리(2-히드록시에틸-메타크릴레이트) 또는 폴리(비닐알콜)), 폴리락티드 (미국 특허 3,773,919), L-글루탐산과 γ 에틸-L-글루타메이트의 공중합체, 비-분해성 에틸렌-비닐 아세테이트, 분해성 락트산-글리콜산 공중합체, 예를 들어 LUPRON DEPOT® (락트산-글리콜산 공중합체 및 류프롤리드 아세테이트로 구성된 주사가능 미세구), 및 폴리-D-(-)-3-히드록시부티르산을 포함한다.
생체내 투여에 사용되는 제제는 멸균되어야 한다. 이는 멸균 여과막을 통한 여과에 의해 쉽게 달성된다.
K. 항- TAHO 항체, TAHO 결합 올리고펩티드 및 TAHO 결합 유기 분자를 사용한 치료
암에서 TAHO 발현을 결정하기 위해, 다양한 검출 분석이 이용가능하다. 한 실시태양에서, TAHO 폴리펩티드 과다발현은 면역조직화학 (IHC)에 의해 분석할 수 있다. 종양 생검물로부터의 파라핀 포매 조직 절편을 IHC 분석에 적용하고, 다음과 같이 TAHO 단백질 염색 강도 기준을 부여할 수 있다:
스코어 0 - 염색이 관찰되지 않거나, 10% 미만의 종양 세포에서 막 염색이 관찰된다.
스코어 1+ - 희미한/거의 지각할 수 없는 막 염색이 10% 초과의 종양 세포에서 검출된다. 세포는 단지 그의 막의 일부에서만 염색된다.
스코어 2+ - 약한 정도 내지 중정도의 완전한 막 염색이 10% 초과의 종양 세포에서 관찰된다.
스코어 3+ - 중정도 내지 강한 정도의 완전한 막 염색이 10% 초과의 종양 세포에서 관찰된다.
TAHO 폴리펩티드 발현에 대해 0 또는 1+ 스코어를 갖는 종양은 TAHO를 과다발현하지 않는 것으로 특성 결정될 수 있는 반면, 2+ 또는 3+ 스코어를 갖는 종양은 TAHO를 과다발현하는 것으로 특성 결정될 수 있다.
별법으로 또는 추가로, 종양에서 TAHO 과다발현 (존재하는 경우)의 정도를 결정하기 위해 FISH 분석, 예를 들어 INFORM® (벤타나 (Ventana, 미국 아리조나주)에서 시판) 또는 PATHVISION® (비시스 (Vysis, 미국 일리노이주))을 포르말린-고정되고 파라핀-포매된 종양 조직에 대해 수행할 수 있다.
TAHO 과다발현 또는 증폭은 예를 들어 검출할 분자에 결합하고 검출가능한 표지 (예를 들어, 방사성 동위원소 또는 형광 표지)로 태깅된 분자 (예를 들어 항체, 올리고펩티드 또는 유기 분자)를 투여하고 표지의 위치 결정을 위해 환자를 외부에서 스캐닝함으로써 생체내 검출 분석을 사용하여 평가할 수 있다.
상기한 바와 같이, 본 발명의 항-TAHO 항체, 올리고펩티드 및 유기 분자는 다양한 비-치료 용도를 갖는다. 본 발명의 항-TAHO 항체, 올리고펩티드 및 유기 분자는 TAHO 폴리펩티드-발현 암의 병기 결정에 (예를 들어, 방사선촬영에서) 유용할 수 있다. 항체, 올리고펩티드 및 유기 분자는 또한 세포로부터 TAHO 폴리펩티드의 정제 또는 면역침전을 위해, 시험관 내에서, 예를 들어, ELISA 또는 웨스턴 블롯에서 TAHO 폴리펩티드의 검출 및 정량을 위해, 다른 세포의 정제에서 하나의 단계로서 혼합된 세포의 집단으로부터 TAHO-발현 세포를 사멸 및 제거하기 위해 유용하다.
현재, 암의 기수에 따라, 암 치료는 다음 요법 중의 하나 또는 조합을 수반한다: 암성 조직의 제거 수술, 방사선 요법, 및 화학요법. 항-TAHO 항체, 올리고펩티드 또는 유기 분자 요법은 화학요법의 독성 및 부작용을 잘 견디지 못하는 노인 환자에서, 및 방사선 요법의 유용성이 제한되는 전이성 질병에 특히 바람직할 수 있다. 본 발명의 종양을 표적으로 하는 항-TAHO 항체, 올리고펩티드 및 유기 분자는 질병의 초기 진단시에 또는 재발 동안 TAHO-발현 암의 완화에 유용하다. 치료 용도를 위해, 항-TAHO 항체, 올리고펩티드 또는 유기 분자는 단독으로, 또는 예를 들어 호르몬, 항혈관신생제, 또는 방사성 표지된 화합물과 조합하여, 또는 수술, 한랭요법 및/또는 방사선 요법과 함께 사용될 수 있다. 항-TAHO 항체, 올리고펩티드 또는 유기 분자 치료제는 다른 형태의 통상적인 요법과 함께 그와 연속적으로 또는 통상적인 요법 전에 또는 후에 투여될 수 있다. 화학요법 약물, 예를 들어 TAXOTERE® (도세탁셀), TAXOL® (파클리탁셀), 에스트라무스틴 및 미톡산트론은 특히 위험도가 낮은 환자에서 암을 치료하는데 사용된다. 암을 치료 또는 완화하기 위한 본 발명의 방법에서, 암 환자에게 항-TAHO 항체, 올리고펩티드 또는 유기 분자를 하나 이상의 상기한 화학요법제를 사용한 치료와 함께 투여할 수 있다. 특히, 파클리탁셀 및 변형된 유도체를 사용한 조합 요법 (예를 들어, EP0600517 참조)이 고려된다. 항-TAHO 항체, 올리고펩티드 또는 유기 분자는 치료 유효 용량의 화학요법제와 함께 투여될 것이다. 다른 실시태양에서, 항-TAHO 항체, 올리고펩티드 또는 유기 분자는 화학요법제, 예를 들어, 파클리탁셀의 활성 및 효능을 향상시키기 위해 화학요법제와 함께 투여된다. 문헌 [Physicians' Desk Reference (PDR)]에는 다양한 암의 치료에 사용된 이들 물질의 투여량이 개시되어 있다. 치료상 효과적인 이들 언급된 화학요법 약물의 투약 방법 및 투여량은 치료되는 특정 암, 질병의 정도 및 관련 의사가 잘 알고 있는 다른 요인에 따라 결정될 것이고, 의사가 결정할 수 있다.
한 특정 실시태양에서, 세포독성제에 접합된 항-TAHO 항체, 올리고펩티드 또는 유기 분자를 포함하는 접합체가 환자에게 투여된다. 바람직하게는, TAHO 단백질에 결합된 면역접합체는 세포에 의해 내재화되어, 면역접합체가 결합한 암 세포를 사멸시키는데 있어서 면역접합체의 치료 효능을 증가시킨다. 바람직한 실시태양에서, 세포독성제는 암 세포에서 핵산을 표적으로 하거나 저해한다. 상기 세포독성제의 예는 상기에서 설명되어 있고, 메이탄시노이드, 칼리케아미신, 리보뉴클레아제 및 DNA 엔도뉴클레아제를 포함한다.
항-TAHO 항체, 올리고펩티드, 유기 분자 또는 그의 독소 접합체는 공지된 방법에 따라, 예를 들어 정맥내 투여, 예를 들어 볼러스 (bolus)로서 또는 일정 시간에 걸친 연속 주입에 의해, 근육내, 복강내, 뇌척수내, 피하, 관절내, 활액내, 경막내, 경구, 국소, 또는 흡입 경로에 의해 인간 환자에게 투여된다. 항체의 정맥내 또는 피하 투여가 바람직하다.
다른 치료 요법이 항-TAHO 항체, 올리고펩티드 또는 유기 분자의 투여와 조합될 수 있다. 조합 투여는 별개의 제제 또는 단일 제약 제제를 사용하는 동시 투여, 및 임의의 순서로 투여하는 연속 투여를 포함하고, 여기서, 바람직하게는 두 (또는 모든) 활성제는 그들의 생물학적 활성을 동시에 발휘하는 일정 시간이 존재한다. 바람직하게는, 그러한 조합 요법은 상승적 치료 효과를 생성시킨다.
항-TAHO 항체 또는 항체들, 올리고펩티드 또는 유기 분자의 투여를 특정 암과 연관된 다른 종양 항원에 대해 생성된 항체의 투여와 조합하는 것이 또한 바람직할 수 있다.
다른 실시태양에서, 본 발명의 치료 목적의 처치 방법은 항-TAHO 항체 (또는 항체들), 올리고펩티드 또는 유기 분자, 및 하나 이상의 화학요법제 또는 성장 억제제의 조합 투여 (상이한 화학요법제의 칵테일 (cocktail)의 동시 투여 포함)를 포함한다. 화학요법제는 에스트라무스틴 포스페이트, 프레드니무스틴, 시스플라틴, 5-플루오로우라실, 멜파란, 시클로포스파미드, 히드록시우레아 및 히드록시우레아탁산 (예를 들어, 파클리탁셀 및 도세탁셀) 및/또는 안트라사이클린 항생제를 포함한다. 그러한 화학요법제에 대한 제조 및 투약 스케줄은 제조자의 지시에 따라 또는 당업자가 경험적으로 결정하는 바와 같이 사용될 수 있다. 그러한 화학요법에 대한 제조 및 투약 스케줄은 또한 문헌 [Chemotherapy Service Ed., M.C. Perry, Williams & Wilkins, Baltimore, MD (1992)]에 기재되어 있다.
항체, 올리고펩티드 또는 유기 분자는 항-호르몬 화합물; 예를 들어, 항-에스트로겐 화합물, 예를 들어 타목시펜; 항-프로게스테론, 예를 들어 오나프리스톤 (EP 616 812 참조); 또는 항-안드로겐, 예를 들어 플루타미드와 그러한 분자에 대해 공지된 용량으로 조합될 수 있다. 치료되는 암이 안드로겐 비의존 암인 경우에, 환자는 사전에 항-안드로겐 요법을 받을 수 있고, 암이 안드로겐 비의존성으로 된 후, 항-TAHO 항체, 올리고펩티드 또는 유기 분자 (및 임의로 본원에 기재된 다른 물질)를 환자에게 투여할 수 있다.
때때로, 심장보호제 (요법과 연관된 심근 기능부전을 예방 또는 감소시키기 위해) 또는 하나 이상의 시토킨을 환자에게 동시 투여하는 것도 유익할 수 있다. 상기 치료 요법에 추가로, 환자는 항체, 올리고펩티드 또는 유기 분자 요법 시행 전에, 동시에 또는 그 후에 암 세포의 수술 제거 및/또는 방사선 요법을 받을 수 있다. 상기 동시 투여되는 임의의 물질에 대한 적합한 투여량은 현재 사용되고 있는 양이고, 물질과 항-TAHO 항체, 올리고펩티드 또는 유기 분자의 조합 작용 (상승작용)으로 인해 감량될 수 있다.
질병의 예방 또는 치료를 위해, 투여량 및 투여 방식은 공지된 기준에 따라 의사가 선택할 것이다. 항체, 올리고펩티드 또는 유기 분자의 적절한 투여량은 상기 규정한 바와 같은 치료할 질병의 종류, 질병의 심도 및 과정, 항체, 올리고펩티드 또는 유기 분자가 예방 목적으로 투여되는지 치료 목적으로 투여되는지 여부, 선행 요법, 환자의 임상력 및 항체, 올리고펩티드 또는 유기 분자에 대한 반응, 및 담당의의 판단에 따라 결정될 것이다. 항체, 올리고펩티드 또는 유기 분자는 적합하게는 1회에 또는 일련의 처리에 걸쳐 환자에게 투여된다. 바람직하게는, 항체, 올리고펩티드 또는 유기 분자는 정맥내 주입 또는 피하 주사에 의해 투여된다. 질병의 종류 및 심도에 따라, 예를 들어 1회 이상의 별개 투여에 의해서든 연속 주입에 의해서든 약 1 ㎍/kg 내지 약 50 mg/kg (체중) (예를 들어 약 0.1-15 mg/kg/용량)의 항체가 환자에게 투여하기 위한 초기 후보 투여량일 수 있다. 투약 요법은 약 4 mg/kg의 초기 로딩 용량, 이어서 약 2 mg/kg의 항-TAHO 항체의 매주 유지 용량의 투여를 포함할 수 있다. 그러나, 다른 투여 요법이 유용할 수 있다. 전형적인 일일 투여량은 상기 언급된 인자에 따라 약 1 ㎍/kg 내지 100 mg/kg 또는 그 이상일 수 있다. 수일 이상에 걸친 반복 투여를 위해, 병태에 따라 치료는 질병 증상이 목적하는 수준으로 억제될 때까지 지속될 것이다. 상기 요법의 진행은 통상적인 방법 및 분석에 의해 및 의사 또는 다른 당업자에게 공지되어 있는 기준에 기초하여 쉽게 모니터링될 수 있다.
항체 단백질을 환자에 투여하는 것 이외에, 본원은 유전자 요법에 의한 항체의 투여를 고려한다. 항체를 코딩하는 핵산의 상기 투여는 표현 "치료 유효량의 항체의 투여"에 포함된다. 예를 들어, 세포 내에서 항체를 생산하기 위한 유전자 요법의 사용에 대해서는 WO96/07321 (1996년 3월 14일 공개)를 참조한다.
핵산 (임의로 벡터에 포함된)을 생체 내에서 및 생체 외에서 환자의 세포 내로 도입하기 위한 2가지의 주요 방법이 존재한다. 생체 내 전달을 위해, 핵산은 대체로 항체가 필요한 부위에서 환자 내로 직접 주사된다. 생체 외 치료를 위해, 환자의 세포를 분리하고, 핵산을 이들 단리된 세포 내로 도입하고, 변형된 세포를 직접 또는 예를 들어 환자 내로 이식되는 다공성 막 내에 봉입시켜 환자에게 투여한다 (예를 들어, 미국 특허 4,892,538 및 5,283,187 참조). 핵산을 생육가능한 세포 내로 도입하기 위해 다양한 기술이 이용가능하다. 기술은 핵산이 시험관 내에서 배양된 세포 내로 전달되는지, 또는 생체 내에서 의도하는 숙주의 세포 내로 전달되는지에 따라 상이하다. 시험관 내에서 포유동물 세포 내로 핵산의 전달에 적합한 기술은 리포좀의 사용, 전기천공, 미세주사, 세포 융합, DEAE-덱스트란, 인산칼슘 침전법 등을 포함한다. 유전자의 생체외 전달을 위해 흔히 사용되는 벡터는 레트로바이러스 벡터이다.
현재 바람직한 생체 내 핵산 전달 기술은 바이러스 벡터 (예를 들어 아데노바이러스, 제1형 단순 포진 바이러스, 또는 아데노-연관 바이러스) 및 지질 기반 시스템 (유전자의 지질 매개 전달에 유용한 지질은 예를 들어 DOTMA, DOPE 및 DC-Chol임)을 사용한 형질감염을 포함한다. 현재 공지된 유전자 마킹 및 유전자 요법 프로토콜에 대해서는, 문헌 [Anderson et al., Science 256:808-813 (1992)]을 참조한다. 또한, WO 93/25673과 여기에 인용된 참고문헌을 참조한다.
본 발명의 항-TAHO 항체는 본원에서 "항체"의 정의에 포함되는 상이한 형태로 존재할 수 있다. 따라서, 항체는 전장 또는 무손항 항체, 항체 단편, 천연 서열 항체 또는 아미노산 변이체, 인간화, 키메라 또는 융합 항체, 면역접합체, 및 그의 기능성 단편을 포함한다. 융합 항체에서, 항체 서열은 이종성 폴리펩티드 서열에 융합된다. 항체는 목적하는 효과기 기능을 제공하도록 Fc 영역에서 변형될 수 있다. 본원의 섹션에서 보다 상세히 논의한 바와 같이, 적절한 Fc 영역을 사용하여, 세포 표면에 결합된 네이키드 항체는 예를 들어, 항체 의존성 세포 독성 (ADCC)을 통해 또는 보체 의존성 세포독성에서 보체를 동원함으로써, 또는 일부 다른 메카니즘에 의해 세포독성을 유도할 수 있다. 별법으로, 부작용 또는 치료 합병증을 최소화하기 위해 효과기 기능을 제거하거나 감소시키는 것이 바람직한 경우에는, 다른 특정 Fc 영역을 사용할 수 있다.
한 실시태양에서, 항체는 본 발명의 항체와 동일한 에피토프에 대한 결합을 위해 경쟁하고 실질적으로 결합한다. 본 발명의 항-TAHO 항체의 생물학적 특징, 구체적으로 예를 들어 생체내 종양 표적화 및 임의의 세포 증식 억제 또는 세포독성 특징을 갖는 항체도 고려된다.
상기 항체의 생산 방법은 본원에 상세히 설명한다.
본 발명의 항-TAHO 항체, 올리고펩티드 및 유기 분자는 포유동물에서 TAHO-발현 암을 치료하거나, 암의 하나 이상의 증상을 완화시키기 위해 유용하다. 그러한 암은 조혈계 암 또는 혈액-관련 암, 예를 들어 림프종, 백혈병, 골수종 또는 림프양 악성종양, 및 비장암 및 림프절의 암을 포함하고 이로 제한되지 않는다. 암의 보다 특정한 예는 그러한 B-세포 연관 암, 예를 들어 고등급, 중등급 및 저등급 림프종 (B 세포 림프종, 예를 들어 점막-연관-림프양 조직 B 세포 림프종 및 비-호지킨 림프종, 외투 세포 림프종, 버킷 림프종, 소림프구성 림프종, 변연대 림프종, 미만성 대세포 림프종, 여포성 림프종, 및 호지킨 림프종 및 T 세포 림프종 포함) 및 백혈병 (2차 백혈병, 만성 림프구성 백혈병, 예를 들어 B 세포 백혈병 (CD5+ B 림프구 포함), 골수성 백혈병, 예를 들어 급성 골수성 백혈병, 만성 골수성 백혈병, 림프구성 백혈병, 예를 들어 급성 림프모구 백혈병 및 골수이형성증), 다발 골수종, 예를 들어 형질세포 악성종양, 및 다른 혈액 및/또는 B 세포- 또는 T-세포-연관 암을 포함한다. 암은 상기한 임의의 암의 전이성 암을 포함한다. 항체, 올리고펩티드 또는 유기 분자는 포유동물에서 TAHO 폴리펩티드를 발현하는 암 세포의 적어도 일부에 결합할 수 있다. 바람직한 실시태양에서, 항체, 올리고펩티드 또는 유기 분자는 세포 상의 TAHO 폴리펩티드에 결합시에 TAHO-발현 종양 세포를 파괴하거나 사멸시키기 위해, 또는 시험관 내에서 또는 생체 내에서 그러한 종양 세포의 성장을 억제하기 위해 효과적이다. 그러한 항체는 네이키드 항-TAHO 항체 (임의의 물질에 접합되지 않은)를 포함한다. 세포독성 또는 세포 성장 억제 특성을 갖는 네이키드 항체에는 종양 세포 파괴에서 더욱 강력하게 만드는 세포독성제를 더 포함시킬 수 있다. 세포독성 특성은 항체를 세포독성제와 접합시켜 본원에 기재된 바와 같은 면역접합체를 형성함으로써 항-TAHO 항체에 부여될 수 있다. 세포독성제 또는 성장 억제제는 바람직하게는 소분자이다. 독소, 예를 들어 칼리케아미신 또는 메이탄시노이드 및 그의 유사체 또는 유도체가 바람직하다.
본 발명은 본 발명의 항-TAHO 항체, 올리고펩티드 또는 유기 분자, 및 담체를 포함하는 조성물을 제공한다. 암을 치료하기 위해, 조성물은 그러한 치료를 필요로 하는 환자에게 투여될 수 있고, 여기서 조성물은 면역접합체로서 또는 네이키드 항체로서 존재하는 하나 이상의 항-TAHO 항체를 포함할 수 있다. 추가의 실시태양에서, 조성물은 이들 항체, 올리고펩티드 또는 유기 분자를 다른 치료제, 예를 들어 세포독성제 또는 성장 억제제, 예를 들어 화학요법제와 조합으로 포함할 수 있다. 본 발명은 또한 본 발명의 항-TAHO 항체, 올리고펩티드 또는 유기 분자, 및 담체를 포함하는 제제를 제공한다. 한 실시태양에서, 제제는 제약상 허용되는 담체를 포함하는 치료 제제이다.
본 발명의 다른 측면은 항-TAHO 항체를 코딩하는 단리된 핵산이다. 천연 서열 항체뿐만 아니라 항체의 변이체, 변형 및 인간화 버전을 코딩하는, H 및 L 사슬 모두 및 특히 초가변 영역 잔기를 코딩하는 핵산이 포함된다.
본 발명은 또한 치료 유효량의 항-TAHO 항체, 올리고펩티드 또는 유기 분자를 포유동물에게 투여하는 것을 포함하는, 포유동물에서 TAHO 폴리펩티드-발현 암을 치료하거나 암의 하나 이상의 증상을 완화시키기 위해 유용한 방법을 제공한다. 항체, 올리고펩티드 또는 유기 분자 치료 조성물은 의사의 지시에 따라 단기 (급성) 또는 만성적으로, 또는 간헐적으로 투여될 수 있다. TAHO 폴리펩티드-발현 세포의 성장을 억제하고, 상기 세포를 사멸시키는 방법을 또한 제공한다.
본 발명은 또한 적어도 하나의 항-TAHO 항체, 올리고펩티드 또는 유기 분자를 포함하는 키트 및 제품을 제공한다. 항-TAHO 항체, 올리고펩티드 또는 유기 분자를 함유하는 키트는 예를 들어 TAHO 세포 사멸 분석, 세포로부터 TAHO 폴리펩티드의 정제 또는 면역침전을 위해 사용된다. 예를 들어, TAHO의 단리 및 정제를 위해, 키트는 비드 (예를 들어, 세파로스 비드)에 커플링된 항-TAHO 항체, 올리고펩티드 또는 유기 분자를 포함할 수 있다. 시험관 내에서, 예를 들어, ELISA 또는 웨스턴 블롯에서 TAHO 폴리펩티드의 검출 및 정량을 위한 항체, 올리고펩티드 또는 유기 분자를 포함하는 키트를 제공할 수 있다. 검출을 위해 유용한 상기 항체, 올리고펩티드 또는 유기 분자에는 형광 또는 방사성 표지와 같은 표지가 제공될 수 있다.
L. 항체-약물 접합체 치료
본 발명의 항체-약물 접합체 (ADC)는 예를 들어 종양 항원의 과다발현을 특징으로 하는 다양한 질병 또는 질환을 치료하기 위해 사용될 수 있는 것으로 고려된다. 예시적인 병태 또는 과다증식성 질환은 양성 또는 악성 종양; 백혈병 및 림프양 악성종양을 포함한다. 다른 질환은 신경, 신경교, 성상세포, 시상하부, 선상, 포식세포, 상피, 기질성, 포배강, 염증성, 혈관신생성 및 면역, 예를 들어 자가면역 질환을 포함한다.
동물 모델 및 세포-기반 분석으로 확인되는 ADC 화합물은 종양을 보유하는 보다 고등한 영장류 및 인간 임상 시험으로 추가로 시험할 수 있다. 인간 임상 시험은 비제한적으로 림프종, 비-호지킨 림프종 (NHL), 공격성 NHL, 재발성 공격성 NHL, 재발성 무통성 NHL, 불응성 NHL, 불응성 무통성 NHL, 만성 림프구성 백혈병 (CLL), 소림프구성 림프종, 백혈병, 유모세포 백혈병 (HCL), 급성 림프구성 백혈병 (ALL), 및 외투 세포 림프종을 포함한 B 세포 증식성 질환을 겪는 환자에서 본 발명의 항-TAHO, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 모노클로날 항체 또는 면역접합체의 효능을 시험하기 위해 설계될 수 있다. 임상 시험은 공지의 치료 요법, 예를 들어 공지의 화학요법제 및/또는 세포독성제를 수반한 방사선 요법 및/또는 화학요법과 조합하여 ADC의 효능을 평가하도록 설계될 수 있다.
일반적으로, 치료되는 질병 또는 질환은 과다증식성 질환, 예를 들어 B 세포 증식성 질환 및/또는 B 세포 암이다. 본원에서 치료되는 암의 예는 림프종, 비-호지킨 림프종 (NHL), 공격성 NHL, 재발성 공격성 NHL, 재발성 무통성 NHL, 불응성 NHL, 불응성 무통성 NHL, 만성 림프구성 백혈병 (CLL), 소림프구성 림프종, 백혈병, 유모세포 백혈병 (HCL), 급성 림프구성 백혈병 (ALL), 및 외투 세포 림프종 중에서 선택되는 B 세포 증식성 질환을 포함하고 이로 제한되지 않는다.
암은 본 발명의 ADC가 암 세포에 결합할 수 있도록, TAHO-발현 세포, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40)-발현 세포를 포함할 수 있다. 암에서 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40) 발현을 결정하기 위해, 다양한 진단/예후 분석이 이용가능하다. 한 실시태양에서, TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40) 과다발현은 IHC에 의해 분석할 수 있다. 종양 생검으로부터의 파라핀-포매 조직 절편을 IHC 분석에 적용하고, 검사되는 종양 세포의 염색 정도에 대해 및 검사되는 비율에서 TAHO 단백질, 예를 들어 인간 CD79b (TAHO5) 또는 cyno CD79b (TAHO40) 단백질 염색 강도 기준을 부여할 수 있다.
질병의 예방 또는 치료를 위해, ADC의 적절한 투여량은 상기 규정된 바와 같이 치료되는 질병의 종류, 질병의 심도 및 과정, 분자가 예방 목적으로 투여되는지 치료 목적으로 투여되는지의 여부, 선행 요법, 환자의 임상력 및 항체에 대한 반응, 및 담당의의 판단에 따라 결정될 것이다. 분자는 적합하게는 1회에 또는 일련의 처리에 걸쳐 환자에게 투여된다. 질병의 종류 및 심도에 따라, 예를 들어 1회 이상의 별개 투여에 의해서든 연속 주입에 의해서든 약 1 ㎍/kg 내지 15 mg/kg (예를 들어 0.1 mg/kg 내지 20 mg/kg)의 분자가 환자에게 투여하기 위한 초기 후보 투여량이다. 전형적인 일일 투여량은 상기 언급된 인자에 따라 약 1 ㎍/kg 내지 100 mg/kg 또는 그 이상일 수 있다. 환자에게 투여할 ADC의 예시적인 투여량은 약 0.1 내지 약 10 mg/kg (환자 체중) 범위이다.
병태에 따라 수일 이상에 걸친 반복 투여의 경우에, 치료는 질병 증상의 목적하는 억제가 달성될 때까지 지속한다. 예시되는 투약 요법은 약 4 mg/kg의 초기 로딩 용량의 항-ErbB2 항체를 투여한 후, 약 2 mg/kg의 매주 유지 용량을 투여하는 것을 포함한다. 다른 투약 요법도 유용할 수 있다. 이러한 요법의 진행은 통상적인 기술 및 분석에 의해 쉽게 모니터링된다.
M. 조합 요법
본 발명의 항체-약물 접합체 (ADC)는 항암 특성을 지닌 제2 화합물과 제약 조합 제제 내에 또는 조합 요법으로서 투약 방법으로 조합될 수 있다. 제약 조합 제제 또는 투약 방법의 제2 화합물은 바람직하게는 서로 불리한 영향을 미치지 않도록 조합물의 ADC에 대한 상보성 활성을 갖는다.
제2 화합물은 화학요법제, 세포독성제, 시토킨, 성장 억제제, 항-호르몬제, 및/또는 심장보호제일 수 있다. 이러한 분자는 적합하게는 의도된 목적에 유효한 양으로 조합물 내에 존재한다. 본 발명의 ADC를 함유하는 제약 조성물은 또한, 치료 유효량의 화학요법제, 예를 들어 튜불린-형성 억제제, 토포이소머라제 억제제 또는 DNA 결합제를 가질 수 있다.
한 측면에서, 제1 화합물은 본 발명의 항-TAHO, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) ADC이고, 제2 화합물은 항-CD20 항체 (네이키드 항체 또는 ADC)이다. 한 실시태양에서, 제2 화합물은 항-CD20 항체 리툭시맙 (Rituxan®) 또는 2H7 (제넨테크, 인크.)이다. 본 발명의 항-CD79b ADC와의 조합 면역 요법에 유용한 다른 항체는 비제한적으로 항-VEGF (예를 들어, Avastin®)를 포함한다.
비제한적으로 방사선 요법 및/또는 골수 및 말초혈액 이식, 및/또는 세포독성제, 화학요법제, 또는 성장 억제제를 포함한 다른 치료 요법을 본 발명에 따라 확인된 항암제의 투여와 조합할 수 있다. 그러한 한 실시태양에서, 화학요법제는 하나의 물질 또는 물질들의 조합물, 예를 들어, 시클로포스파미드, 히드록시다우노루비신, 아드리아마이신, 독소루비신, 빈크리스틴 (Oncovin™), 프레드니솔론, CHOP, CVP, 또는 COP, 또는 면역치료제, 예를 들어 항-CD20 (예를 들어, Rituxan®) 또는 항-VEGF (예를 들어, Avastin®)이다.
조합 요법은 동시 또는 순차적 요법으로서 투여할 수 있다. 순차적으로 투여될 때, 조합물을 2회 이상의 투여로 투여할 수 있다. 조합 투여는 별개의 제제 또는 단일 제약 제제를 사용하는 동시 투여, 및 임의의 순서로 투여하는 연속 투여를 포함하고, 여기서, 바람직하게는 두 (또는 모든) 활성제는 그들의 생물학적 활성을 동시에 발휘하는 일정 시간이 존재한다.
한 실시태양에서, ADC를 이용한 치료는 본원에서 확인된 항암제, 및 하나 이상의 화학요법제 또는 성장 억제제의 조합 투여 (상이한 화학요법제들의 칵테일의 조합 투여 포함)를 포함한다. 화학요법제는 탁산 (예를 들어, 파클리탁셀 및 도세탁셀) 및/또는 안트라사이클린 항생제를 포함한다. 그러한 화학요법제에 대한 제조 및 투약 스케줄은 제조자의 지시에 따라 또는 당업자가 경험적으로 결정하는 바와 같이 사용될 수 있다. 그러한 화학요법에 대한 제조 및 투약 스케줄은 또한 문헌 ["Chemotherapy Service", (1992) Ed., M.C. Perry, Williams & Wilkins, Baltimore, Md]에 기재되어 있다.
상기 동시 투여되는 임의의 물질에 대한 적합한 투여량은 현재 사용되고 있는 양이고, 새로 확인된 물질과 다른 화학요법제 또는 치료의 조합 작용 (상승작용)으로 인해 감량될 수 있다.
조합 요법은 "상승작용"을 제공할 수 있고, "상승적"인 것으로 입증되었고, 즉, 활성 성분들을 함께 사용할 때 달성된 효과가 화합물을 별개로 사용하여 얻은 효과들의 합보다 더 크다. 상승적 효과는 활성 성분들을 (1) 조합된 단위 투여 제제로 동시-제제화하고 투여하거나 동시에 전달하거나; (2) 별개의 제제로서 교대로 또는 병행하여 전달하거나; (3) 몇몇 다른 요법에 의해 획득할 수 있다. 교대 요법으로 전달되는 경우에, 상승적 효과는 화합물을 예를 들어 별개의 주사기로 상이한 주사에 의해 순차적으로 투여 또는 전달할 때 획득할 수 있다. 일반적으로, 교대 요법 동안에는 각각의 활성 성분의 유효 투여량을 순차적으로, 즉 연속적으로 투여하는 반면, 조합 요법에서는 2가지 이상 활성 성분의 유효 투여량을 함께 투여한다.
N. 제품 및 키트
본 발명의 다른 실시태양은 TAHO-발현 암의 치료에 유용한 물질을 함유하는 제품이다. 제품은 용기, 및 용기 위에 있거나 용기에 부속된 라벨 또는 포장 삽입물을 포함한다. 적합한 용기에는 예를 들어 병, 바이알, 주사기 등이 포함된다. 용기는 다양한 물질, 예를 들어 유리 또는 플라스틱으로부터 형성될 수 있다. 용기는 암 병태의 치료에 효과적인 조성물을 보유하고, 멸균 유입 포트를 가질 수 있다 (예를 들어, 용기는 피하 주사 바늘로 뚫을 수 있는 마개를 갖는 정맥내 용액 백 또는 바이알일 수 있다). 조성물 내의 적어도 하나의 활성제는 본 발명의 항-TAHO 항체, 올리고펩티드 또는 유기 분자이다. 라벨 또는 포장 삽입물은 조성물이 암의 치료를 위해 사용됨을 나타낸다. 라벨 또는 포장 삽입물은 암 환자에게 항체, 올리고펩티드 또는 유기 분자 조성물을 투여하기 위한 사용지시서를 더 포함할 것이다. 추가로, 제품은 제약상 허용되는 버퍼, 예를 들어 주사용 정균수 (BWFI), 포스페이트 완충 염수, 링거 (Ringer)액 및 덱스트로스 용액을 포함하는 제2 용기를 더 포함할 수 있다. 제품은 상업적 및 사용자 관점에서 바람직한 다른 물질, 예를 들어 다른 버퍼, 희석제, 필터, 바늘 및 주사기를 더 포함할 수 있다.
다양한 목적, 예를 들어 TAHO-발현 세포 사멸 분석, 세포로부터 TAHO 폴리펩티드의 정제 또는 면역침전을 위해 유용한 키트도 제공된다. TAHO 폴리펩티드의 단리 및 정제를 위해, 키트는 비드 (예를 들어, 세파로스 비드)에 커플링된 항-TAHO 항체, 올리고펩티드 또는 유기 분자를 포함할 수 있다. 시험관 내에서, 예를 들어, ELISA 또는 웨스턴 블롯에서 TAHO 폴리펩티드의 검출 및 정량을 위한 항체, 올리고펩티드 또는 유기 분자를 포함하는 키트를 제공할 수 있다. 제품처럼, 키트는 용기, 및 용기 위에 있거나 용기에 부속된 라벨 또는 포장 삽입물을 포함한다. 용기는 본 발명의 적어도 하나의 항-TAHO 항체, 올리고펩티드 또는 유기 분자를 포함하는 조성물을 보유한다. 예를 들어, 희석제 및 버퍼, 대조 항체를 함유하는 추가의 용기가 포함될 수 있다. 라벨 또는 포장 삽입물은 조성물에 대한 설명 및 의도하는 시험관 내 또는 검출 용도에 대한 설명서를 제공할 수 있다.
O. TAHO 폴리펩티드 및 TAHO -폴리펩티드 코딩 핵산의 용도
TAHO 폴리펩티드를 코딩하는 뉴클레오티드 서열 (또는 그들의 상보체)은 혼성화 프로브로서, 염색체 및 유전자 매핑에서 및 안티센스 RNA 및 DNA 프로브의 생성에서의 용도를 포함하여 분자 생물학 분야의 다양한 용도를 갖는다. TAHO-코딩 핵산은 또한 본원에서 설명되는 재조합 기술에 의한 TAHO 폴리펩티드의 제조에 유용할 것이고, 상기 TAHO 폴리펩티드는 예를 들어 본원에서 설명되는 항-TAHO 항체의 제조에 유용할 수 있다.
전장 천연 서열 TAHO 유전자, 또는 그의 일부는 전장 TAHO cDNA를 단리하기 위한 또는 본원에 개시된 천연 TAHO 서열에 목적하는 서열 동일성을 갖는 다른 cDNA (예를 들어, TAHO의 자연 발생 변이체 또는 다른 종으로부터의 TAHO를 코딩하는 것)를 단리하기 위한, cDNA 라이브러리에 대한 혼성화 프로브로서 사용될 수 있다. 임의로, 프로브의 길이는 약 20 내지 약 50개 염기일 것이다. 혼성화 프로브는 전장 천연 뉴클레오티드 서열의 적어도 부분적으로 신규한 영역으로부터 유도될 수 있고, 상기 영역은 과도한 실험 없이 또는 천연 서열 TAHO의 프로모터, 인핸서 요소 및 인트론을 포함하는 게놈 서열로부터 결정될 수 있다. 예를 들어, 스크리닝 방법은 약 40개 염개의 선택된 프로브를 합성하기 위해서 공지의 DNA 서열을 사용하여 TAHO 유전자의 코딩 영역을 단리하는 것을 포함할 것이다. 혼성화 프로브는 방사성 뉴클레오티드, 예를 들어 32P 또는 35S, 또는 효소 표지, 예를 들어 아비딘/비오틴 커플링 시스템을 통해 프로브에 커플링된 알칼리성 포스파타제를 포함하여 다양한 표지에 의해 표지될 수 있다. 본 발명의 TAHO 유전자에 상보성인 서열을 갖는 표지된 프로브는 프로브가 라이브러리의 어떤 멤버에 혼성화하는지를 결정하기 위해 인간 cDNA, 게놈 DNA 또는 mRNA의 라이브러리를 스크리닝하기 위해 사용될 수 있다. 혼성화 기술은 아래의 실시예에 추가로 상세히 설명되어 있다. 본원에 개시된 임의의 EST 서열은 본원에 개시된 방법을 사용하여 유사하게 프로브로서 사용될 수 있다.
TAHO-코딩 핵산의 다른 유용한 단편은 표적 TAHO mRNA (센스) 또는 TAHO DNA (안티센스) 서열에 결합할 수 있는 단일가닥 핵산 서열 (RNA 또는 DNA)을 포함하는 안티센스 또는 센스 올리고뉴클레오티드를 포함한다. 본 발명에 따르면, 안티센스 또는 센스 올리고뉴클레오티드는 TAHO DNA의 코딩 영역의 단편을 포함한다. 상기 단편은 일반적으로 적어도 약 14개의 뉴클레오티드, 바람직하게는 약 14 내지 30개의 뉴클레오티드를 포함한다. 주어진 단백질을 코딩하는 cDNA 서열을 기초로 하여 안티센스 또는 센스 올리고뉴클레오티드를 유도하는 방법은 예를 들어 문헌 [Stein and Cohen, Cancer Res. 48:2659, 1988] 및 [van der Krol et al. BioTechniques 6:958, 1988]에 기재되어 있다.
안티센스 또는 센스 올리고뉴클레오티드의 표적 핵산 서열에 대한 결합은 이중체의 분해 증가, 전사 또는 번역의 조기 종결을 포함하는 복수의 수단 중의 하나에 의해, 또는 다른 수단에 의해 표적 서열의 전사 또는 번역을 차단하는 이중체를 형성시킨다. 상기 방법은 본 발명에 포함된다. 따라서, 안티센스 올리고뉴클레오티드는 포유동물에서의 암 유발에서 일정한 기능을 수행할 수 있는 TAHO 단백질의 발현을 차단하기 위해 사용될 수 있다. 안티센스 또는 센스 올리고뉴클레오티드는 변형된 당-포스포디에스테르 백본 (또는 다른 당 연결, 예를 들어 WO 91/06629에 기재된 것)을 갖는 올리고뉴클레오티드를 더 포함하고, 상기 당 연결은 내인성 뉴클레아제에 저항성이다. 저항성의 당 연결을 갖는 상기 올리고뉴클레오티드는 생체 내에서 안정하지만 (즉, 효소에 의한 분해를 견딜 수 있음), 표적 뉴클레오티드 서열에 결합할 수 있는 서열 특이성을 보유한다.
안티센스 결합에 바람직한 유전자내 부위는 유전자의 개방 해독 프레임 (ORF)의 번역 개시/출발 코돈 (5'-AUG / 5'-ATG) 또는 종결/정지 코돈 (5'-UAA, 5'-UAG 및 5'-UGA / 5'-TAA, 5'-TAG 및 5'-TGA)을 포함하는 영역을 포함한다. 상기 영역은 번역 개시 또는 종결 코돈으로부터 임의의 방향 (즉, 5' 또는 3')으로 약 25 내지 약 50개의 연속적인 뉴클레오티드를 포함하는 mRNA 또는 유전자의 일부를 의미한다. 안티센스 결합을 위한 다른 바람직한 영역은 다음을 포함한다: 인트론; 엑손; 인트론-엑손 연결부; 개방 해독 프레임 (ORF) 또는 번역 개시 코돈과 번역 종결 코돈 사이에 위치하는 영역인 "코딩 영역"; 5'-5' 트리포스페이트 연결을 통해 mRNA의 5'-잔기에 연결된 N7-메틸화 구아노신 잔기를 포함하고 5' 캡 (cap) 구조 자체와 캡에 인접한 처음 50개의 뉴클레오티드를 포함하는 mRNA의 5' 캡; 번역 개시 코돈으로부터 5' 방향의 mRNA의 일부로서, 5' cap 부위와 mRNA의 번역 개시 코돈 사이의 뉴클레오티드 또는 유전자 상의 대응하는 뉴클레오티드를 포함하는 5' 비번역 영역 (5'UTR); 및 번역 종결 코돈으로부터 3' 방향의 mRNA의 일부로서, mRNA의 번역 종결 코돈과 3' 말단 사이의 뉴클레오티드 또는 유전자 상의 대응하는 뉴클레오티드를 포함하는 3' 비번역 영역 (3'UTR).
TAHO 단백질의 발현 억제에 유용한 바람직한 안티센스 화합물의 구체적인 예는 변형된 백본 또는 비-천연 뉴클레오시드간 연결을 함유하는 올리고뉴클레오티드를 포함한다. 변형된 백본을 갖는 올리고뉴클레오티드는 백본에 인 원자를 보유하는 것 및 백본에 인 원자를 갖지 않는 것을 포함한다. 본 명세서의 목적에서, 및 때로 당업계에서 언급되는 바와 같이, 뉴클레오시드간 백본에 인 원자를 갖지 않는 변형된 올리고뉴클레오티드도 올리고뉴클레오시드로 간주될 수 있다. 바람직한 변형된 올리고뉴클레오티드 백본은 예를 들어 포스포로티오에이트, 키랄 포스포로티오에이트, 포스포로디티오에이트, 포스포트리에스테르, 아미노알킬포스포트리에스테르, 메틸 및 다른 알킬 포스포네이트, 예를 들어 3'-알킬렌 포스포네이트, 5'-알킬렌 포스포네이트 및 키랄 포스포네이트, 포스피네이트, 포스포르아미데이트, 예를 들어 3'-아미노 포스포르아미데이트 및 아미노알킬포스포르아미데이트, 티오노포스포르아미데이트, 티오노알킬포스포네이트, 티오노알킬포스포트리에스테르, 정상적인 3'-5' 연결을 갖는 셀레노포스페이트 및 보라노-포스페이트, 이들의 2'-5' 연결 유사체, 및 하나 이상의 뉴클레오티드간 연결이 3'-3', 5'-5' 또는 2'-2' 연결인 역극성 (inverted polarity)을 갖는 것을 포함한다. 역극성을 갖는 바람직한 올리고뉴클레오티드는 3'-뉴클레오티드간 연결에 하나의 3'-3' 연결, 즉 염기가 소실될 수 있는 (핵염기가 소실되거나 그 대신에 히드록실기를 보유함) 하나의 도립된 뉴클레오시드 잔기를 포함한다. 다양한 염, 혼합된 염 및 유리 산 형태도 포함된다. 인-함유 연결의 제조에 대해 교시하고 있는 대표적인 미국 특허는 각각 본원에 참고로 포함되는 미국 특허 3,687,808; 4,469,863; 4,476,301; 5,023,243; 5,177,196; 5,188,897; 5,264,423; 5,276,019; 5,278,302; 5,286,717; 5,321,131; 5,399,676; 5,405,939; 5,453,496; 5,455,233; 5,466,677; 5,476,925; 5,519,126; 5,536,821; 5,541,306; 5,550,111; 5,563,253; 5,571,799; 5,587,361; 5,194,599; 5,565,555; 5,527,899; 5,721,218; 5,672,697 및 5,625,050을 포함하고, 이로 제한되지 않는다.
인 원자를 그 내부에 포함하지 않는 바람직한 변형된 올리고뉴클레오티드 백본은 단쇄 알킬 또는 시클로알킬 뉴클레오시드간 연결, 혼합된 헤테로원자 및 알킬 또는 시클로알킬 뉴클레오시드간 연결, 또는 하나 이상의 단쇄 헤테로원자 또는 헤테로시클릭 뉴클레오시드간 연결에 의해 형성된다. 이들은 모르폴리노 연결 (부분적으로 뉴클레오시드의 당 부분으로 형성됨)을 갖는 것; 실록산 백본; 술피드, 술폭시드 및 술폰 백본; 포름아세틸 및 티오포름아세틸 백본; 메틸렌 포름아세틸 및 티오포름아세틸 백본; 리보아세틸 백본; 알켄 함유 백본; 술파메이트 백본; 메틸렌이미노 및 메틸렌히드라지노 백본; 술포네이트 및 술폰아미드 백본; 아미드 백본; 및 혼합된 N, O, S 및 CH2 성분 부분을 갖는 것을 포함한다. 상기 올리고뉴클레오시드의 제조를 교시하고 있는 대표적인 미국 특허는 각각 본원에 참고로 포함되는 미국 특허 5,034,506; 5,166,315; 5,185,444; 5,214,134; 5,216,141; 5,235,033; 5,264,562; 5,264,564; 5,405,938; 5,434,257; 5,466,677; 5,470,967; 5,489,677; 5,541,307; 5,561,225; 5,596,086; 5,602,240; 5,610,289; 5,602,240; 5,608,046; 5,610,289; 5,618,704; 5,623,070; 5,663,312; 5,633,360; 5,677,437; 5,792,608; 5,646,269 및 5,677,439를 포함하고, 이로 제한되지 않는다.
다른 바람직한 안티센스 올리고뉴클레오티드에서, 뉴클레오티드 단위의 당과 뉴클레오시드간 연결 모두, 즉 백본은 신규한 기로 대체된다. 염기 단위는 적절한 핵산 표적 화합물과의 혼성화를 위해 유지된다. 뛰어난 혼성화 특성을 갖는 것으로 밝혀진 올리고뉴클레오티드 모방체 (mimetic)인 하나의 상기 올리고머 화합물은 펩티드 핵산 (PNA)으로 언급된다. PNA 화합물에서, 올리고뉴클레오티드의 당-백본은 아미드 함유 백본, 특히 아미노에틸글라이신 백본으로 대체된다. 핵염기는 유지되고, 백본의 아미드 부분의 아자 질소 원자에 직접 또는 간접적으로 결합된다. PNA 화합물의 제조를 교시하고 있는 대표적인 미국 특허는 각각 본원에 참고로 포함되는 미국 특허 5,539,082; 5,714,331; 및 5,719,262를 포함하고, 이로 제한되지 않는다. PNA 화합물에 대한 추가의 교시내용은 문헌 [Nielsen et al., Science, 1991, 254, 1497-1500]에서 볼 수 있다.
바람직한 안티센스 올리고뉴클레오티드는 포스포로티오에이트 백본 및/또는 헤테로원자 백본, 특히 -CH2-NH-O-CH2-, -CH2-N(CH3)-O-CH2- [메틸렌 (메틸이미노) 또는 MMI 백본], -CH2-O-N(CH3)-CH2-, -CH2-N(CH3)-N(CH3)-CH2- 및 -O-N(CH3)-CH2-CH2- [여기서, 천연 포스포디에스테르 백본은 -O-P-O-CH2-로 표시됨] (미국 특허 5,489,677에 기재됨), 아미드 백본 (미국 특허 5,602,240)을 포함한다. 또한, 미국 특허 5,034,506의 모르폴리노 백본 구조를 갖는 안티센스 올리고뉴클레오티드가 바람직하다.
또한, 변형된 올리고뉴클레오티드는 하나 이상의 치환된 당 모이어티를 함유할 수 있다. 바람직한 올리고뉴클레오티드는 2' 위치에 다음 중의 하나를 포함한다: OH; F; O-알킬, S-알킬, 또는 N-알킬; O-알케닐, S-알케닐, 또는 N-알케닐; O-알키닐, S-알키닐 또는 N-알키닐; 또는 O-알킬-O-알킬 (여기서, 알킬, 알케닐 및 알키닐은 치환 또는 비치환된 C1 내지 C10 알킬 또는 C2 내지 C10 알케닐 및 알키닐임). 특히 바람직한 것은 O[(CH2)nO]mCH3, O(CH2)nOCH3, O(CH2)nNH2, O(CH2)nCH3, O(CH2)nONH2, 및 O(CH2)n0N[(CH2)nCH3)]2 (여기서, n 및 m은 1 내지 약 10임)이다. 다른 바람직한 안티센스 올리고뉴클레오티드는 2' 위치에 다음 중의 하나를 포함한다: C1 내지 C10 저급 알킬, 치환된 저급 알킬, 알케닐, 알키닐, 알크아릴, 아르알킬, O-알크아릴 또는 O-아르알킬, SH, SCH3, OCN, Cl, Br, CN, CF3, OCF3, SOCH3, SO2CH3, ONO2, NO2, N3, NH2, 헤테로시클로알킬, 헤테로시클로알크아릴, 아미노알킬아미노, 폴리알킬아미노, 치환된 실릴, RNA 절단기, 리포터기, 인터컬레이터 (intercalator), 올리고뉴클레오티드의 약력학 특성을 개선시키기 위한 기, 또는 올리고뉴클레오티드의 약동학 특성을 개선시키기 위한 기, 및 유사한 특성을 갖는 다른 치환체. 바람직한 변형은 2'-메톡시에톡시 (2'-O-CH2CH2OCH3, 2'-O-(2-메톡시에틸) 또는 2'-MOE로도 알려짐) (Martin et al., Helv. Chim. Acta, 1995, 78, 486-504), 즉 알콕시알콕시기를 포함한다. 추가의 바람직한 변형은 2'-디메틸아미노옥시에톡시, 즉, 하기 실시예에서 설명되는 바와 같이 2'-DMAOE로도 알려진 O(CH2)2ON(CH3)2 기, 및 2'-디메틸아미노에톡시에톡시 (당업계에서 2'-O-디메틸아미노에톡시에틸 또는 2'-DMAEOE로도 공지되어 있음), 즉, 2'-O-CH2-O-CH2-N(CH2)를 포함한다.
추가의 바람직한 변형은 2'-히드록실기가 당 고리의 3' 또는 4' 탄소 원자에 연결되어 비시클릭 당 모이어티를 형성하는 잠금 핵산 (LNA)을 포함한다. 연결은 바람직하게는 2' 산소 원자 및 4' 탄소 원자를 가교시키는 메틸렌 (-CH2-)n 기 (여기서, n은 1 또는 2임)이다. LNA 및 그의 제조는 WO 98/39352 및 WO 99/14226에 기재되어 있다.
다른 바람직한 변형은 2'-메톡시 (2'-O-CH3), 2'-아미노프로폭시 (2'-OCH2CH2CH2NH2), 2'-알릴 (2'-CH2-CH=CH2), 2'-O-알릴 (2'-O-CH2-CH=CH2) 및 2'-플루오로 (2'-F)를 포함한다. 2'-변형은 아라비노 (상) 위치 또는 리보 (하) 위치에서 이루어질 수 있다. 바람직한 2'-아라비노 변형은 2'-F이다. 또한, 유사한 변형이 올리고뉴클레오티드의 다른 위치, 특히 3' 말단 뉴클레오티드 상의 또는 2'-5' 연결된 올리고뉴클레오티드 내의 당의 3' 위치 및 5' 말단 뉴클레오티드의 5'에서 이루어질 수 있다. 올리고뉴클레오티드는 또한 펜토푸라노실 당 대신에 당 모방체, 예를 들어 시클로부틸 모이어티를 보유할 수 있다. 상기 변형된 당 구조의 제조를 교시하는 대표적인 미국 특허는 각각 본원에 참고로 포함되는 미국 특허 4,981,957; 5,118,800; 5,319,080; 5,359,044; 5,393,878; 5,446,137; 5,466,786; 5,514,785; 5,519,134; 5,567,811; 5,576,427; 5,591,722; 5,597,909; 5,610,300; 5,627,053; 5,639,873; 5,646,265; 5,658,873; 5,670,633; 5,792,747; 및 5,700,920을 포함하고, 이로 제한되지 않는다.
또한, 올리고뉴클레오티드는 핵염기 (종종 당업계에서 간단히 "염기"로서 칭함) 변형 또는 치환을 포함할 수 있다. 본원에서 사용되는 바와 같이, "비변형된" 또는 "천연" 핵염기는 퓨린 염기 아데닌 (A) 및 구아닌 (G), 및 피리미딘 염기 티민 (T), 시토신 (C) 및 우라실 (U)을 포함한다. 변형된 핵염기는 다른 합성 및 천연 핵염기, 예를 들어 5-메틸시토신 (5-me-C), 5-히드록시메틸 시토신, 잔틴, 하이포잔틴, 2-아미노아데닌, 아데닌 및 구아닌의 6-메틸 및 다른 알킬 유도체, 아데닌 및 구아닌의 2-프로필 및 다른 알킬 유도체, 2-티오우라실, 2-티오티민 및 2-티오시토신, 5-할로우라실 및 시토신, 5-프로피닐 (-C≡C-CH3 또는 -CH2-C≡CH) 우라실 및 시토신 및 피리미딘 염기의 다른 알키닐 유도체, 6-아조 우라실, 시토신 및 티민, 5-우라실 (슈도우라실), 4-티오우라실, 8-할로, 8-아미노, 8-티올, 8-티오알킬, 8-히드록실 및 다른 8-치환된 아데닌 및 구아닌, 5-할로, 특히 5-브로모, 5-트리플루오로메틸 및 다른 5-치환된 우라실 및 시토신, 7-메틸구아닌 및 7-메틸아데닌, 2-F-아데닌, 2-아미노-아데닌, 8-아자구아닌 및 8-아자아데닌, 7-데아자구아닌 및 7-데아자아데닌 및 3-데아자구아닌 및 3-데아자아데닌을 포함한다. 추가의 변형된 핵염기는 트리시클릭 피리미딘, 예를 들어 페녹사진 시티딘(1H-피리미도[5,4-b][1,4]벤족사진-2(3H)-온), 페노티아진 시티딘 (1H-피리미도[5,4-b][1,4]벤조티아진-2(3H)-온), G-클램프, 예를 들어 치환된 페녹사진 시티딘 (예를 들어, 9-(2-아미노에톡시)-H-피리미도[5,4-b][1,4]벤족사진-2(3H)-온), 카르바졸 시티딘 (2H-피리미도[4,5-b]인돌-2-온), 피리도인돌 시티딘 (H-피리도[3',2':4,5]피롤로[2,3-d]피리미딘-2-온)을 포함한다. 또한, 변형된 핵염기는 퓨린 또는 피리미딘 염기가 다른 헤테로사이클, 예를 들어 7-데아자-아데닌, 7-데아자구아노신, 2-아미노피리딘 및 2-피리돈으로 치환된 것을 포함할 수 있다. 추가의 핵염기는 미국 특허 3,687,808에 개시된 것, 문헌 [The Concise Encyclopedia Of Polymer Science And Engineering, pages 858-859, Kroschwitz, J. I., ed. John Wiley & Sons, 1990]에 개시된 것, 및 문헌 [Englisch et al., Angewandte Chemie, International Edition, 1991, 30, 613]에 개시된 것을 포함한다. 특정한 상기 핵염기는 특히 본 발명의 올리고머 화합물의 결합 친화도 증가에 유용하다. 이들은 5-치환된 피리미딘, 6-아자피리미딘 및 N-2, N-6 및 O-6 치환된 퓨린, 예를 들어 2-아미노프로필아데닌, 5-프로피닐우라실 및 5-프로피닐시토신을 포함한다. 5-메틸시토신 치환은 0.6-1.2℃만큼 핵산 이중체 안정성을 증가시키는 것으로 밝혀졌고 (Sanghvi et al., Antisense Research and Applications, CRC Press, Boca Raton, 1993, pp. 276-278), 특히 2'-O-메톡시에틸 당 변형과 조합될 때 바람직한 염기 치환이다. 변형된 핵염기의 제조를 교시하는 대표적인 미국 특허는 각각 본원에 참고로 포함되는 미국 특허 3,687,808, 및 미국 특허 4,845,205; 5,130,302; 5,134,066; 5,175,273; 5,367,066; 5,432,272; 5,457,187; 5,459,255; 5,484,908; 5,502,177; 5,525,711; 5,552,540; 5,587,469; 5,594,121, 5,596,091; 5,614,617; 5,645,985; 5,830,653; 5,763,588; 6,005,096; 5,681,941 및 5,750,692를 포함하고, 이로 제한되지 않는다.
안티센스 올리고뉴클레오티드의 또다른 변형은 올리고뉴클레오티드에 올리고뉴클레오티드의 활성, 세포 분포 또는 세포 흡수를 향상시키는 하나 이상의 모이어티 또는 접합체를 화학적으로 연결시키는 것이다. 본 발명의 화합물은 관능기, 예를 들어 1차 또는 2차 히드록실기에 공유 연결된 접합체기를 포함할 수 있다. 본 발명의 접합체기는 인터컬레이터, 리포터 분자, 폴리아민, 폴리아미드, 폴리에틸렌 글리콜, 폴리에테르, 올리고머의 약동학 특성을 향상시키는 기, 및 올리고머의 약력학 특성을 향상시키는 기를 포함한다. 전형적인 접합체기는 콜레스테롤, 지질, 양이온 지질, 인지질, 양이온성 인지질, 비오틴, 페나진, 엽산, 페난트리딘, 안트라퀴논, 아크리딘, 플루오레세인, 로다민, 쿠마린 및 염료를 포함한다. 본 발명의 측면에서, 약동학 특성을 향상시키는 기는 올리고머 섭취의 개선, 올리고머의 분해 내성 향상, 및/또는 RNA와의 서열-특이적 혼성화 강화를 유도하는 기를 포함한다. 본 발명의 측면에서, 약력학 특성을 향상시키는 기는 올리고머 섭취, 분포, 대사 또는 분비를 개선시키는 기를 포함한다. 접합체 모이어티는 지질 모이어티, 예를 들어 콜레스테롤 모이어티 (Letsinger et al., Proc. Natl. Acad. Sci. USA, 1989, 86, 6553-6556), 콜산 (Manoharan et al., Bioorg. Med. Chem. Let., 1994, 4, 1053-1060), 티오에테르, 예를 들어 헥실-S-트리틸티올 ([Manoharan et al., Ann. N.Y. Acad. Sci, 1992, 660, 306-309]; [Manoharan et al., Bioorg. Med. Chem. Let, 1993, 3, 2765-2770), 티오콜레스테롤 (Oberhauser et al., Nucl. Acids Res, 1992, 20, 533-538), 지방족 사슬, 예를 들어, 도데칸디올 또는 운데실 잔기 ([Saison-Behmoaras et al., EMBO J., 1991, 10, 1111-1118]; [Kabanov et al., FEBS Lett, 1990, 259, 327-330]; [Svinarchuk et al., Biochimie, 1993, 75, 49-54), 인지질, 예를 들어, 디-헥사데실-rac-글리세롤 또는 트리에틸-암모늄 1,2-디-O-헥사데실-rac-글리세로-3-H-포스포네이트 ([Manoharan et al., Tetrahedron Lett, 1995, 36, 3651-3654]; [Shea et al., Nucl. Acids Res, 1990, 18, 3777-3783]), 폴리아민 또는 폴리에틸렌 글리콜 사슬 (Manoharan et al., Nucleosides & Nucleotides, 1995, 14, 969-973), 또는 아다만탄 아세트산 (Manoharan et al., Tetrahedron Lett, 1995, 36, 3651-3654), 팔미틸 모이어티 (Mishra et al., Biochim. Biophys. Acta, 1995, 1264, 229-237), 또는 옥타데실아민 또는 헥실아미노-카르보닐-옥시콜레스테롤 모이어티를 포함하고, 이로 제한되지 않는다. 본 발명의 올리고뉴클레오티드는 또한 활성 약물 물질, 예를 들어, 아스피린, 와파린, 페닐부타존, 이부프로펜, 수프로펜, 펜부펜, 케토프로펜, (S)-(+)-프라노프로펜, 카르프로펜, 단실사르코신, 2,3,5-트리요오도벤조산, 플루페남산, 폴린산, 벤조티아디아지드, 클로로티아지드, 디아제핀, 인도메티신, 바르비투레이트, 세팔로스포린, 술파 약물, 당뇨병약, 항균제 또는 항생제에 접합될 수 있다. 올리고뉴클레오티드-약물 접합체 및 그의 제조는 각각 본원에 참고로 포함되는 미국 특허 출원 09/334,130 (1999년 6월 15일 출원) 및 미국 특허: 4,828,979; 4,948,882; 5,218,105; 5,525,465; 5,541,313; 5,545,730; 5,552,538; 5,578,717, 5,580,731; 5,580,731; 5,591,584; 5,109,124; 5,118,802; 5,138,045; 5,414,077; 5,486,603; 5,512,439; 5,578,718; 5,608,046; 4,587,044; 4,605,735; 4,667,025; 4,762,779; 4,789,737; 4,824,941; 4,835,263; 4,876,335; 4,904,582; 4,958,013; 5,082,830; 5,112,963; 5,214,136; 5,082,830; 5,112,963; 5,214,136; 5,245,022; 5,254,469; 5,258,506; 5,262,536; 5,272,250; 5,292,873; 5,317,098; 5,371,241, 5,391,723; 5,416,203, 5,451,463; 5,510,475; 5,512,667; 5,514,785; 5,565,552; 5,567,810; 5,574,142; 5,585,481; 5,587,371; 5,595,726; 5,597,696; 5,599,923; 5,599,928 및 5,688,941에 기재되어 있다.
제시된 화합물 내의 모든 위치가 균일하게 변형될 필요는 없고, 사실상 하나 초과의 상기 변형이 단일 화합물 내에 또는 심지어 올리고뉴클레오티드 내의 하나의 뉴클레오시드에 도입될 수 있다. 본 발명은 또한 키메라 화합물인 안티센스 화합물을 포함한다. 본 발명의 측면에서 "키메라" 안티센스 화합물 또는 "키메라"는 각각 적어도 하나의 단량체 단위, 즉, 올리고뉴클레오티드 화합물의 경우에 뉴클레오티드로 구성된 2 이상의 화학적으로 구별되는 영역을 함유하는 안티센스 화합물, 특히 올리고뉴클레오티드이다. 이들 올리고뉴클레오티드는 일반적으로 뉴클레아제 분해에 대한 저항성 증가, 세포 흡수 증가, 및/또는 표적 핵산에 대한 결합 친화도 증가를 올리고뉴클레오티드에 대해 부여하기 위해 올리고뉴클레오티드가 변형된 적어도 하나의 영역을 함유한다. 올리고뉴클레오티드의 추가의 영역은 RNA:DNA 또는 RNA:RNA 하이브리드를 절단할 수 있는 효소의 기질로서 작용할 수 있다. 예를 들어, RNase H는 RNA:DNA 이중체의 RNA 가닥을 절단하는 세포성 엔도뉴클레아제이다. 따라서, RNase H의 활성화는 RNA 표적을 절단하여 유전자 발현의 올리고뉴클레오티드 억제 효율을 크게 향상시킨다. 그 결과, 동일한 표적 영역에 혼성화하는 포스포로티오에이트 데옥시올리고뉴클레오티드에 비교할 때, 키메라 올리고뉴클레오티드를 이용할 때 더 짧은 올리고뉴클레오티드를 사용하여 대등한 결과를 종종 얻을 수 있다. 본 발명의 키메라 안티센스 화합물은 2 이상의 올리고뉴클레오티드, 변형된 올리고뉴클레오티드, 올리고뉴클레오시드 및/또는 상기 설명된 바와 같은 올리고뉴클레오티드 모방체의 복합 구조체로서 형성될 수 있다. 바람직한 키메라 안티센스 올리고뉴클레오티드는 뉴클레아제 내성을 부여하기 위해 3' 말단에 적어도 하나의 2' 변형된 당 (바람직하게는 2'-O-(CH2)2-O-CH3) 및 RNase H 활성을 부여하기 위해 적어도 4개의 연속적인 2'-H 당이 존재하는 영역을 포함한다. 또한, 상기 화합물은 당업계에서 하이브리드 또는 갭머 (gapmer)로 언급되고 있다. 바람직한 갭머는 적어도 4개의 연속적인 2'-H 당을 갖는 적어도 하나의 영역에 의해 분리된, 3'-말단 및 5' 말단에 2' 변형된 당 (바람직하게는 2'-O-(CH2)2-O-CH3)의 영역을 갖고, 바람직하게는 포스포로티오에이트 백본 연결을 포함한다. 상기 하이브리드 구조의 제조를 교시하는 대표적인 미국 특허는 각각 그 전부가 본원에 참고로 포함되는 미국 특허 5,013,830; 5,149,797; 5,220,007; 5,256,775; 5,366,878; 5,403,711; 5,491,133; 5,565,350; 5,623,065; 5,652,355; 5,652,356; 및 5,700,922를 포함하고, 이로 제한되지 않는다.
본 발명에 따라 사용되는 안티센스 화합물은 공지의 고상 합성 기술을 통해 편리하게 및 통상적인 방식으로 제조할 수 있다. 상기 합성을 위한 장비는 예를 들어 어플라이드 바이오시스템즈를 포함하여 여러 공급 회사에서 시판하고 있다. 상기 합성을 위한 당업계에 공지된 임의의 다른 수단을 추가로 또는 별법으로 사용할 수 있다. 올리고뉴클레오티드, 예를 들어 포스포로티오에이트 및 알킬화된 유도체를 제조하기 위해 유사한 기술을 사용하는 것이 공지되어 있다. 또한, 본 발명의 화합물은 예를 들어 리포좀, 수용체 표적화 분자, 섭취, 분배 및/또는 흡수를 돕기 위한 경구, 직장, 국소 또는 다른 제제로서 다른 분자, 분자 구조체 또는 화합물의 혼합물과 혼합되거나, 봉입되거나, 접합되거나 달리 회합될 수 있다. 상기 섭취, 분배 및/또는 흡수를 돕는 제제의 제조를 교시하고 있는 대표적인 미국 특허는 각각 본원에 참고로 포함된 미국 특허 5,108,921; 5,354,844; 5,416,016; 5,459,127; 5,521,291; 5,543,158; 5,547,932; 5,583,020; 5,591,721; 4,426,330; 4,534,899; 5,013,556; 5,108,921; 5,213,804; 5,227,170; 5,264,221; 5,356,633; 5,395,619; 5,416,016; 5,417,978; 5,462,854; 5,469,854; 5,512,295; 5,527,528; 5,534,259; 5,543,152; 5,556,948; 5,580,575; 및 5,595,756을 포함하고, 이로 제한되지 않는다.
센스 또는 안티센스 올리고뉴클레오티드의 다른 예는 유기 모이어티, 예를 들어 WO 90/10048에 기재된 것 및 표적 핵산 서열에 대한 올리고뉴클레오티드의 친화도를 증가시키는 다른 모이어티, 예를 들어 폴리-(L-라이신)에 공유 연결된 올리고뉴클레오티드를 포함한다. 또한, 안티센스 또는 센스 올리고뉴클레오티드의 표적 뉴클레오티드 서열에 대한 결합 특이성을 변경시키기 위해 중격제 (intercalating agent), 예를 들어 엘립티신 및 알킬화제 또는 금속 복합체가 센스 또는 안티센스 올리고뉴클레오티드에 부착될 수 있다.
안티센스 또는 센스 올리고뉴클레오티드는 예를 들어 CaPO4-매개 DNA 형질감염, 전기천공을 포함하는 임의의 유전자 전달 방법에 의해, 또는 유전자 전달 벡터, 예를 들어 엡스타인-바아 (Epstein-Barr) 바이러스를 사용하여 표적 핵산 서열을 포함하는 세포 내로 도입될 수 있다. 바람직한 절차에서, 안티센스 또는 센스 올리고뉴클레오티드는 적합한 레트로바이러스 벡터 내에 삽입된다. 표적 핵산 서열을 포함하는 세포는 생체 내에서 또는 생체 외에서 재조합 레트로바이러스 벡터와 접촉한다. 적합한 레트로바이러스 벡터는 쥐 레트로바이러스 M-MuLV, N2 (M-MuLV로부터 유도된 레트로바이러스)로부터 유도된 것, 또는 DCT5A, DCT5B 및 DCT5C로 명명된 이중 카피 벡터를 포함하고, 이로 제한되지 않는다 (WO 90/13641 참조).
또한, 센스 또는 안티센스 올리고뉴클레오티드는 WO 91/04753에 기재된 바와 같은 리간드 결합 분자와의 접합체 형성에 의해 표적 뉴클레오티드 서열을 포함하는 세포 내로 도입될 수 있다. 적합한 리간드 결합 분자는 세포 표면 수용체, 성장 인자, 다른 시토킨, 또는 세포 표면 수용체에 결합하는 다른 리간드를 포함하고, 이로 제한되지 않는다. 바람직하게는, 리간드 결합 분자의 접합은 그의 대응하는 분자 또는 수용체에 결합하는 리간드 결합 분자의 능력을 실질적으로 방해하거나 센스 또는 안티센스 올리고뉴클레오티드 또는 그의 접합된 형태의 세포 내로의 도입을 차단하지 않는다.
별법으로, 센스 또는 안티센스 올리고뉴클레오티드는 WO 90/10448에 기재된 바와 같은 올리고뉴클레오티드-지질 복합체의 형성에 의해 표적 핵산 서열을 포함하는 세포 내로 도입될 수 있다. 센스 또는 안티센스 올리고뉴클레오티드-지질 복합체는 바람직하게는 내인성 리파제에 의해 세포 내에서 해리된다.
안티센스 또는 센스 RNA 또는 DNA 분자의 길이는 일반적으로 적어도 약 5개의 뉴클레오티드, 별법으로 적어도 약 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790, 800, 810, 820, 830, 840, 850, 860, 870, 880, 890, 900, 910, 920, 930, 940, 950, 960, 970, 980, 990, 또는 1000개의 뉴클레오티드이고, 이와 관련하여 용어 "약"은 언급된 뉴클레오티드 서열 길이 ± 언급된 길이의 10%를 의미한다.
또한, 프로브는 밀접하게 관련된 TAHO 코딩 서열을 확인하기 위한 서열의 풀 (pool)을 생성하기 위해 PCR 기술에 사용될 수 있다.
TAHO를 코딩하는 뉴클레오티드 서열은 또한 TAHO를 코딩하는 유전자의 매핑 및 유전 질환이 있는 개체의 유전자 분석을 위한 혼성화 프로브를 구성하기 위해 사용될 수 있다. 본원에서 제공되는 뉴클레오티드 서열은 공지의 기술, 예를 들어 계내 혼성화, 공지의 염색체 마커에 대한 연결 분석, 및 라이브러리를 사용한 혼성화 스크리닝을 사용하여 염색체 및 염색체의 특정 영역에 매핑될 수 있다.
TAHO의 코딩 서열이 다른 단백질에 결합하는 단백질을 코딩할 때 (예를 들어, TAHO가 수용체인 경우), TAHO는 결합 상호작용에 관련되는 다른 단백질 또는 분자를 확인하기 위해 분석에 사용될 수 있다. 상기 방법에 의해, 수용체/리간드 결합 상호작용의 억제제를 확인할 수 있다. 또한, 상기 결합 상호작용에 관련되는 단백질은 결합 상호작용의 펩티드 또는 소분자 억제제 또는 작용제를 스크리닝하기 위해 사용될 수 있다. 또한, 수용체 TAHO는 서로 관련되는 리간드(들)를 단리하기 위해 사용될 수 있다. 스크리닝 분석은 천연 TAHO 또는 TAHO에 대한 수용체의 생물학적 활성을 모방하는 선도 화합물을 찾기 위해 설계될 수 있다. 상기 스크리닝 분석은 화학물질 라이브러리의 고출력 스크리닝을 수행할 수 있고, 이에 의해 소분자 약물 후보의 확인에 특히 적합한 분석을 포함할 것이다. 고려되는 소분자는 합성 유기 또는 무기 화합물을 포함한다. 이 분석은 당업계에서 잘 특성화된 다양한 방식, 예를 들어 단백질-단백질 결합 분석, 생화학적 스크리닝 분석, 면역분석 및 세포 기반 분석으로 수행될 수 있다.
또한, TAHO 또는 그의 변형된 형태를 코딩하는 핵산은 치료에 유용한 시약의 개발 및 스크리닝에 유용한 트랜스제닉 동물 또는 "낙 아웃 (knock out)" 동물의 생성을 위해 이용될 수 있다. 트랜스제닉 동물 (예를 들어, 마우스 또는 래트)는 도입유전자 (transgene)를 함유하는 세포를 갖는 동물이고, 상기 도입유전자는 태아, 예를 들어, 배아기에 동물 또는 동물의 선조 내로 도입되었다. 도입유전자는 그로부터 트랜스제닉 동물이 발생하는 세포의 게놈 내로 통합된 DNA이다. 한 실시태양에서, TAHO를 코딩하는 cDNA는 확립된 기술에 따라 TAHO를 코딩하는 게놈 DNA 및 TAHO를 코딩하는 DNA를 발현하는 세포를 함유하는 트랜스제닉 동물을 생성시키기 위해 사용되는 게놈 서열을 클로닝하기 위해 사용될 수 있다. 트랜스제닉 동물, 특히 마우스 또는 래트와 같은 동물의 생성 방법은 당업계에 통상적인 방법이 되었고, 예를 들어 미국 특허 4,736,866 및 4,870,009에 기재되어 있다. 일반적으로, 특정 세포가 조직-특이적 인핸서와 함께 TAHO 도입유전자 통합을 위해 표적화될 것이다. 배아기에 동물의 생식계열 내로 도입된 TAHO를 코딩하는 도입유전자의 카피를 포함하는 트랜스제닉 동물은 TAHO를 코딩하는 DNA의 증가된 발현의 효과를 조사하기 위해 사용될 수 있다. 상기 동물은 예를 들어 그의 과다발현과 연관된 병적 상태에 대한 보호를 제공하는 것으로 생각되는 시약에 대한 시험 동물로 이용될 수 있다. 본 발명의 상기 측면에 따르면, 동물은 시약으로 처리되고, 도입유전자를 보유하는 비처리 동물에 비해 병적 상태의 발생 감소는 병적 상태에 대한 잠재적인 치료 개입을 나타낼 것이다.
별법으로, TAHO의 비-인간 상동체는 TAHO를 코딩하는 내인성 유전자와 동물의 배아 줄기세포 내로 도입된 TAHO를 코딩하는 변경된 게놈 DNA 사이의 상동성 재조합의 결과로서 TAHO를 코딩하는 결함 또는 변경된 유전자를 갖는 TAHO "낙 아웃" 동물을 구성하기 위해 사용될 수 있다. 예를 들어, TAHO를 코딩하는 cDNA는 확립된 기술에 따라 TAHO를 코딩하는 게놈 DNA를 클로닝하기 위해 사용할 수 있다. TAHO를 코딩하는 게놈 DNA의 일부는 결실되거나 다른 유전자, 예를 들어 통합을 모니터링하기 위해 사용될 수 있는 선택가능한 마커를 코딩하는 유전자로 대체될 수 있다. 일반적으로, 수 kb의 비변경된 측면에 접하는 DNA (5' 및 3' 말단 모두의)가 벡터에 포함된다 [예를 들어, 상동성 재조합 벡터의 설명에 대해서는 문헌 [Thomas and Capecchi, Cell, 51:503 (1987)] 참조]. 벡터는 배아 줄기 세포주 (예를 들어, 전기천공에 의해) 내로 도입되고, 도입된 DNA가 내인성 DNA와 상동성 재조합되는 세포가 선택된다 [예를 들어, 문헌 [Li et al., Cell, 69:915 (1992)] 참조]. 이어서, 선택된 세포는 응집 키메라를 형성하기 위해서 동물 (예를 들어, 마우스 또는 래트)의 포배 내로 주사된다 (예를 들어, 문헌 [Bradley, in Teratocarcinomas and Embryonic Stem Cells: A Practical Approach, E. J. Robertson, ed. (IRL, Oxford, 1987), pp. 113-152] 참조). 이어서, 키메라 배아를 적합한 위임신 (pseudopregnant) 암컷 대리모 동물 내로 착상시키고, 배아를 출산하여 "낙아웃" 동물을 생성시킬 수 있다. 그의 생식 세포에 상동성 재조합된 DNA를 보유하는 자손체는 표준 기술에 의해 확인되고, 동물의 모든 세포가 상동성 재조합된 DNA를 함유하는 동물을 번식시키기 위해 사용될 수 있다. 낙아웃 동물은 예를 들어 특정 병적 상태 및 TAHO 폴리펩티드의 부재로 인한 그들의 병적 상태의 발생에 대해 방어하는 그의 능력에 대해 특성화될 수 있다.
TAHO 폴리펩티드를 코딩하는 핵산은 또한 유전자 요법에 사용될 수 있다. 유전자 요법 적용시에, 유전자는 예를 들어 결함 유전자의 대체를 위해 치료상 효과적인 유전자 산물의 생체내 합성을 달성하기 위해서 세포 내로 도입된다. "유전자 요법"은 지속 효과가 단일 치료에 의해 달성되는 통상적인 유전자 요법과 치료상 효과적인 DNA 또는 mRNA의 1회 또는 반복 투여를 수반하는 유전자 치료제의 투여를 모두 포함한다. 안티센스 RNA 및 DNA는 생체 내에서 특정 유전자의 발현을 차단하기 위해 치료제로서 사용될 수 있다. 짧은 안티센스 올리고뉴클레오티드는 세포막에 의한 제한된 흡수에 의해 야기되는 그의 낮은 세포내 농도에도 불구하고 억제제로서 작용하는 세포 내로 도입될 수 있음이 이미 밝혀졌다 (Zamecnik et al., Proc. Natl. Acad. Sci. USA 83:4143-4146 [1986]). 올리고뉴클레오티드는 그 흡수를 향상시키기 위해, 예를 들어 그의 음대전된 포스포디에스테르기를 비대전된 기로 치환함으로써 변형될 수 있다.
핵산을 생육가능한 세포 내로 도입하기 위해 이용가능한 다양한 기술이 존재한다. 이 기술은 핵산이 배양된 세포 내로 시험관 내에서 또는 의도되는 숙주의 세포 내로 생체 내에서 전달되는지의 여부에 따라 상이하다. 핵산을 시험관 내에서 포유동물 세포 내로 전달하기 위한 적합한 기술은 리포좀의 사용, 전기천공, 미세주사, 세포 융합, DEAE-덱스트란, 인산칼슘 침전법 등을 포함한다. 현재 바람직한 생체내 유전자 전달 기술은 바이러스 (일반적으로 레트로바이러스) 벡터를 사용한 형질감염 및 바이러스 코트 단백질-리포좀 매개된 형질감염을 포함한다 (Dzau et al., Trends in Biotechnology 11, 205-210 [1993]). 일부 상황에서, 핵산 공급원에게 표적 세포를 표적화하는 물질, 예를 들어 세포 표면 막 단백질 또는 표적 세포에 특이적인 항체, 표적 세포 상의 수용체에 대한 리간드 등을 제공하는 것이 바람직하다. 리포좀이 사용되는 경우, 세포내이입과 연관되는 세포 표면 막 단백질에 결합하는 단백질이, 예를 들어 캡시드 단백질 또는 특정 세포 종류에 대해 작용하는 그의 단편, 사이클링시에 내재화를 겪는 단백질에 대한 항체, 세포내 국재화를 표적화하고 세포내 반감기를 향상시키는 단백질의 표적화 및/또는 흡수 용이화를 위해 사용될 수 있다. 수용체-매개 세포내이입의 기술은 예를 들어 문헌 [Wu et al., J. Biol. Chem. 262, 4429-4432 (1987)]; 및 [Wagner et al., Proc. Natl. Acad. Sci. USA 87, 3410-3414 (1990)]에 기재되어 있다. 유전자 마킹 및 유전자 요법 프로토콜에 대해서는, 문헌 [Anderson et al., Science 256, 808-813 (1992)]을 참조한다.
본원에서 설명되는 TAHO 폴리펩티드 또는 그의 단편을 코딩하는 핵산 분자는 염색체 확인을 위해 유용하다. 이와 관련하여, 실제 서열 데이타를 기초로 하여 비교적 적은 염색체 마킹 시약만이 현재 이용가능하기 때문에, 새로운 염색체 마커를 확인할 필요성이 존재한다. 본 발명의 각각의 TAHO 핵산 분자는 염색체 마커로서 사용될 수 있다.
또한, 본 발명의 TAHO 폴리펩티드 및 핵산 분자는 조직형 검사를 위해 진단 목적으로 사용될 수 있고, 여기서 본 발명의 TAHO 폴리펩티드는 다른 조직에 비해 한 조직에서, 바람직하게는 동일한 조직 종류의 정상 조직에 비해 이환된 조직에서 차별적으로 발현될 수 있다. TAHO 핵산 분자는 PCR, 노던 분석, 서던 분석 및 웨스턴 분석을 위한 프로브를 생성시키기 위해 사용될 수 있을 것이다.
본 발명은 TAHO 폴리펩티드를 모방하는 것 (작용제) 또는 TAHO 폴리펩티드의 효과를 억제하는 것 (길항제)을 확인하기 위한 화합물의 스크리닝 방법을 포함한다. 길항제 약물 후보의 스크리닝 분석은 본원에서 확인된 유전자에 의해 코딩되는 TAHO 폴리펩티드에 결합하거나 복합체를 형성하거나, 또는 코딩되는 폴리펩티드와 다른 세포 단백질의 상호작용을 방해하는, 예를 들어 세포로부터 TAHO 폴리펩티드의 발현을 억제하는 화합물을 확인하기 위해 설계된다. 상기 스크리닝 분석은 화학물질 라이브러리의 고출력 스크리닝을 수행할 수 있고, 이에 의해 소분자 약물 후보의 확인에 특히 적합한 분석을 포함할 것이다.
이 분석은 당업계에서 잘 특성화된 다양한 방식, 예를 들어 단백질-단백질 결합 분석, 생화학적 스크리닝 분석, 면역분석 및 세포 기반 분석으로 수행될 수 있다.
길항제에 대한 모든 분석은 약물 후보를 본원에서 확인된 핵산에 의해 코딩되는 TAHO 폴리펩티드와, 두 성분이 상호작용할 수 있을 정도로 충분한 조건 하에 및 충분한 시간 동안 접촉시키는 것을 필요로 한다는 점에서 공통적이다.
결합 분석에서, 상호작용은 결합이고, 형성된 복합체는 반응 혼합물에서 단리 또는 검출될 수 있다. 특정 실시태양에서, 본원에서 확인된 유전자에 의해 코딩되는 TAHO 폴리펩티드 또는 약물 후보는 공유 또는 비-공유 결합에 의해 부착에 의해 고상, 예를 들어 미세적정 플레이트 상에 고정된다. 비-공유 결합에 의해 부착은 일반적으로 TAHO 폴리펩티드의 용액으로 고체 표면을 코팅하고 건조시킴으로써 달성된다. 별법으로, TAHO 폴리펩티드에 특이적인 고정된 항체, 예를 들어, 모노클로날 항체를 사용하여 폴리펩티드를 고체 표면에 고정시킬 수 있다. 분석은 검출가능한 표지로 표지될 수 있는 비-고정된 성분을 고정된 성분, 예를 들어 고정된 성분을 함유하는 코팅된 표면에 첨가함으로써 수행된다. 반응이 완료될 때, 비-반응된 성분은 예를 들어 세척에 의해 제거되고, 고체 표면 상에 고정된 복합체가 검출된다. 본래 비-고정된 성분이 검출가능한 표지를 보유하는 경우에, 표면에 고정된 표지의 검출은 복합체가 형성되었음을 나타낸다. 본래 비-고정된 성분이 표지를 보유하지 않을 경우에, 복합체 형성은 예를 들어 고정된 복합체에 특이적으로 결합하는 표지된 항체를 사용하여 검출될 수 있다.
후보 화합물이 본원에서 확인된 유전자에 의해 코딩되는 특정 TAHO 폴리펩티드와 상호작용하지만 결합하지는 않는 경우, 그의 폴리펩티드와의 상호작용은 단백질-단백질 상호작용의 검출을 위해 당업계에 공지된 방법에 의해 분석될 수 있다. 상기 분석은 전통적인 방법, 예를 들어 가교결합, 동시-면역침전, 및 구배 또는 크로마토그래피 컬럼을 통한 동시-정제를 포함한다. 또한, 단백질-단백질 상호작용은 문헌 [Chevray and Nathans, Proc. Natl. Acad. Sci. USA 89, 5789-5793 (1991)]에 개시된 바와 같이 문헌 [Fields and Song, Nature (London) 340, 245-246 (1989)]; [Chien et al., Proc. Natl. Acad. Sci. USA 88, 9578-9582 (1991)]에 기재된 효모-기반 유전자 시스템을 사용하여 모니터링할 수 있다. 많은 전사 활성제, 예를 들어 효모 GAL4는 2개의 물리적으로 분리된 모듈형 도메인으로 구성되고, 상기 도메인 중의 하나는 DNA-결합 도메인으로 작용하고, 다른 하나는 전사 활성화 도메인으로 기능한다. 상기 문헌에 기재된 효모 발현 시스템 (일반적으로 "이중 하이브리드 (two-hybrid) 시스템"으로 불림)은 상기 특성을 이용하고, 2개의 하이브리드 단백질을 사용하며, 여기서 한 단백질에서 표적 단백질이 GAL4의 DNA-결합 도메인에 융합되고, 다른 단백질에서는 후보 활성화 단백질이 활성화 도메인에 융합된다. GAL4-활성화된 프로모터의 조절 하에서의 GAL1-lacZ 리포터 유전자의 발현은 단백질-단백질 상호작용을 통한 GAL4 활성의 재구성에 의해 결정된다. 상호작용하는 폴리펩티드를 함유하는 콜로니는 β-갈락토시다제에 대한 발색 기질을 사용하여 검출된다. 이중 하이브리드 기술을 사용하여 두 특이적인 단백질 사이의 단백질-단백질 상호작용을 확인하기 위한 완전한 키트 (MATCHMAKER™)는 클론테크 (Clontech)로부터 상업적으로 이용가능하다. 또한, 상기 시스템은 특정 단백질 상호작용에 관련되는 단백질 도메인의 매핑 및 이들 상호작용에 중요한 아미노산 잔기 위치의 정확한 제시로까지 확장될 수 있다.
본원에서 확인되는 TAHO 폴리펩티드를 코딩하는 유전자 및 다른 세포내 또는 세포외 성분의 상호작용을 방해하는 화합물은 다음과 같이 시험할 수 있다: 대체로 유전자 산물 및 세포내 또는 세포외 성분을 함유하는 반응 혼합물을 두 물질의 상호작용을 허용하는 조건 하에 및 허용하는 시간 동안 제조한다. 후보 화합물이 결합을 억제하는 능력을 시험하기 위해서, 반응을 시험 화합물의 부재 및 존재 하에 실시한다. 또한, 위약이 양성 대조군으로서 기능하기 위해 제3 반응 혼합물에 첨가될 수 있다. 혼합물에 존재하는 시험 화합물과 세포내 또는 세포외 성분 사이의 결합 (복합체 형성)은 상기한 바와 같이 모니터링된다. 대조 반응(들)에서는 복합체가 형성되지만 시험 화합물을 함유하는 반응 혼합물에서는 형성되지 않으면, 이것은 시험 화합물이 시험 화합물과 그의 반응 파트너의 상호작용을 방해함을 나타낸다.
길항제에 대해 분석하기 위해, TAHO 폴리펩티드를 특정 활성에 대해 스크리닝할 화합물과 함께 세포에 첨가할 수 있고, TAHO 폴리펩티드의 존재 하에 목적하는 활성을 억제하는 화합물의 능력은 화합물이 TAHO 폴리펩티드에 대한 길항제임을 나타낸다. 별법으로, 길항제는 경쟁 억제 분석에 적절한 조건 하에 TAHO 폴리펩티드 및 잠재적인 길항제를 막-결합된 TAHO 폴리펩티드 수용체 또는 재조합 수용체와 조합함으로써 검출할 수 있다. 수용체에 결합된 TAHO 폴리펩티드 분자의 수를 사용하여 잠재적인 길항제의 유효성을 결정할 수 있도록, TAHO 폴리펩티드는 예를 들어 방사성에 의해 표지할 수 있다. 수용체를 코딩하는 유전자는 당업자에게 공지된 수많은 방법, 예를 들어 리간드 패닝 및 FACS 분류에 의해 확인할 수 있다 (Coligan et al., Current Protocols in Immun., 1(2): Chapter 5 (1991)). 바람직하게는, 폴리아데닐화 RNA를 TAHO 폴리펩티드에 반응성인 세포로부터 제조하고, 상기 RNA로부터 생성된 cDNA 라이브러리를 풀 (pool)로 분할하고 TAHO 폴리펩티드에 비반응성인 COS 세포 또는 다른 세포를 형질감염시키기 위해 사용하는 발현 클로닝이 사용된다. 유리 슬라이드 상에서 성장시킨 형질감염된 세포를 표지된 TAHO 폴리펩티드에 노출시킨다. TAHO 폴리펩티드는 요오드화, 또는 부위-특이적 단백질 키나제에 대한 인식 부위의 도입을 포함한 다양한 수단에 의해 표지될 수 있다. 고정 및 인큐베이션 후에, 슬라이드를 자가방사선 기록 분석에 적용한다. 양성 풀을 확인하고, 하위 풀을 제조하고, 상호작용성 하위 풀 수거를 사용하여 재형질감염시키고, 재-스크리닝 과정을 통해 최종적으로 추정 수용체를 코딩하는 단일 클론을 생성시킨다.
또다른 수용체 확인 방법으로서, 표지된 TAHO 폴리펩티드는 수용체 분자를 발현하는 세포막 또는 추출물 제제와 광친화도-연결될 수 있다. 가교결합된 물질은 PAGE에 의해 분리하여 X-선 필름에 노출시킨다. 수용체를 함유하는 표지된 복합체를 절제하고, 펩티드 단편으로 분리한 후, 단백질 미세 서열 결정 (micro-sequencing) 과정에 적용할 수 있다. 미세 서열 결정으로부터 얻은 아미노산 서열은 추정 수용체를 코딩하는 유전자를 확인하기 위해 cDNA 라이브러리를 스크리닝하귀 위해 다의성 올리고뉴클레오티드 프로브의 세트를 디자인하기 위해 사용될 것이다.
길항제에 대한 다른 분석에서, 수용체를 발현하는 포유동물 세포 또는 막 제제를 후보 화합물의 존재 하에 표지된 TAHO 폴리펩티드와 함께 인큐베이팅할 것이다. 이어서, 상기 상호작용을 향상 또는 차단하는 화합물의 능력을 측정할 수 있다.
잠재적인 길항제의 보다 특정한 예는 면역글로불린과 TAHO 폴리펩티드의 융합체에 결합하는 올리고뉴클레오티드, 및 특히 비제한적으로 폴리클로날 및 모노클로날 항체 및 항체 단편, 단쇄 항체, 항-개별특이형 항체, 및 상기 항체 또는 단편의 키메라 또는 인간화 형태, 및 인간 항체 및 항체 단편을 포함하는 항체를 포함한다. 별법으로, 잠재적인 길항제는 밀접하게 관련된 단백질, 예를 들어 수용체를 인식하지만 효과를 나타내지 못하여 TAHO 폴리펩티드의 작용을 경쟁적으로 억제하는 돌연변이된 형태의 TAHO 폴리펩티드일 수 있다.
다른 잠재적인 TAHO 폴리펩티드 길항제는 예를 들어 안티센스 RNA 또는 DNA 분자가 표적 mRNA에 혼성화하여 단백질 번역을 억제함으로써 mRNA의 번역을 직접적으로 차단하는 작용을 하는 안티센스 기술을 사용하여 제조된 안티센스 RNA 또는 DNA 구성체이다. 안티센스 기술은 삼중 나선 형성 또는 안티센스 DNA 또는 RNA를 통해 유전자 발현을 조절하기 위해 사용될 수 있고, 두 방법은 폴리뉴클레오티드의 DNA 또는 RNA에 대한 결합에 기초한 것이다. 예를 들어, 본원에서 성숙 TAHO 폴리펩티드를 코딩하는 폴리뉴클레오티드 서열의 5' 코딩 부분은 약 10 내지 40 염기쌍 길이의 안티센스 RNA 올리고뉴클레오티드를 설계하기 위해 사용된다. DNA 올리고뉴클레오티드는 전사에 관련되는 유전자의 영역에 상보성이어서 TAHO 폴리펩티드의 전사 및 생산을 억제하도록 설계된다 (삼중 나선 - [Lee et al., Nucl. Acids Res. 6:3073 (1979)]; [Cooney et al., Science 241:456 (1988)]; [Dervan et al., Science 251:1360 (1991)] 참조). 안티센스 RNA 올리고뉴클레오티드는 생체 내에서 mRNA에 혼성화하여 mRNA 분자의 TAHO 폴리펩티드로의 번역을 차단한다 (안티센스 - [Okano, Neurochem. 56:560 (1991)]; [Oligodeoxynucleotides as Antisense Inhibitors of Gene Expression (CRC Press: Boca Raton, FL, 1988)]). 상기한 올리고뉴클레오티드는 안티센스 RNA 또는 DNA가 TAHO 폴리펩티드의 생산을 억제하기 위해 체내에서 발현될 수 있도록 세포에 전달될 수도 있다. 안티센스 DNA를 사용할 때, 표적 유전자 뉴클레오티드 서열의 번역 개시 부위, 예를 들어 약 -10 내지 +10 위치로부터 유도된 올리고데옥시리보뉴클레오티드가 바람직하다.
잠재적인 길항제는 TAHO 폴리펩티드의 활성 부위, 수용체 결합 부위 또는 성장 인자 또는 다른 관련 결합 부위에 결합하여 TAHO 폴리펩티드의 정상적인 생물학적 활성을 차단하는 소분자를 포함한다. 소분자의 예는 작은 펩티드 또는 펩티드-유사 분자, 바람직하게는 가용성 펩티드, 및 합성 비펩티딜 유기 또는 무기 화합물을 포함하고, 이로 제한되지 않는다.
리보자임은 RNA의 특이적인 절단을 촉매할 수 있는 효소 활성의 RNA 분자이다. 리보자임은 상보성 표적 RNA에 대한 서열 특이적 혼성화, 이어서 뉴클레오티드 내부 분해 (endonucleolytic)에 의한 절단에 의해 작용한다. 잠재적인 RNA 표적 내의 특이적인 리보자임 절단 부위는 공지의 기술로 확인할 수 있다. 추가의 상세한 내용은 예를 들어 문헌 [Rossi, Current Biology 4:469-471 (1994)] 및 PCT 공개 WO 97/33551 (1997년 9월 18일 공개)을 참고한다.
전사 억제를 위해 사용되는 삼중 나선 형성시의 핵산 분자는 단일 가닥이고, 데옥시뉴클레오티드로 구성되어야 한다. 상기 올리고뉴클레오티드의 염기 조성은 일반적으로 이중체의 한 가닥 상에 퓨린 또는 피리미딘의 상당한 크기의 스트레치를 필요로 하는 훅스틴 (Hoogsteen) 염기쌍 규칙을 통해 삼중 나선 형성을 촉진하도록 설계된다. 보다 상세한 내용은 예를 들어 PCT 공개 WO 97/33551를 참고할 수 있다.
상기 소분자는 상기 논의한 임의의 하나 이상의 스크리닝 분석에 의해 및/또는 당업자에게 공지된 임의의 다른 스크리닝 기술에 의해 확인할 수 있다.
단리된 TAHO 폴리펩티드-코딩 핵산은 당업계에 잘 공지되고 본원에서 설명된 기술을 사용하여 재조합 방식으로 TAHO 폴리펩티드를 생산하기 위해 본원에서 사용될 수 있다. 다시, 생산된 TAHO 폴리펩티드는 당업계에 잘 공지되고 본원에서 설명된 기술을 사용하여 항-TAHO 항체를 생성시키기 위해 사용될 수 있다.
본원에서 확인된 TAHO 폴리펩티드 및 상기 개시된 스크리닝 분석에 의해 확인된 다른 분자에 특이적으로 결합하는 항체는 암을 포함한 다양한 질환의 치료를 위해 제약 조성물의 형태로 투여될 수 있다.
TAHO 폴리펩티드가 세포 내에 존재하고, 전체 항체가 억제제로서 사용되면, 내재화 항체가 바람직하다. 그러나, 항체 또는 항체 단편을 세포 내로 전달하기 위해 리포펙션 (lipofection) 또는 리포좀이 또한 사용될 수 있다. 항체 단편이 사용되는 경우에, 표적 단백질의 결합 도메인에 특이적으로 결합하는 최소 억제 단편이 바람직하다. 예를 들어, 항체의 가변 영역 서열을 기초로 하여, 표적 단백질 서열에 결합하는 능력을 보유하는 펩티드 분자를 설계할 수 있다. 상기 펩티드는 화학적으로 합성하고/하거나 재조합 DNA 기술에 의해 생산할 수 있다 (예를 들어, 문헌 [Marasco et al., Proc. Natl. Acad. Sci. USA, 90: 7889-7893 (1993)] 참조).
본원의 제제는 또한 치료되는 특정 적응증에 필요한 2 이상의 활성 화합물, 바람직하게는 서로 불리한 영향을 미치지 않는 상보적 활성을 갖는 화합물을 함유할 수 있다. 별법으로 또는 추가로, 조성물은 그의 기능을 향상시키는 물질, 예를 들어 세포독성제, 시토킨, 화학요법제 또는 성장억제제를 포함할 수 있다. 상기 분자는 적합하게는 의도된 목적에 효과적인 양으로 조합되어 존재한다.
P. 항체 유도체
본 발명의 항체는 당업계에 공지되고 쉽게 이용가능한 추가의 비단백질성 모이어티를 함유하도록 추가로 변형될 수 있다. 바람직하게는, 항체의 유도체화에 적합한 모이어티는 수용성 중합체이다. 수용성 중합체의 비-제한적인 예로는 폴리에틸렌 글리콜 (PEG), 에틸렌 글리콜/프로필렌 글리콜의 공중합체, 카르복시메틸셀룰로스, 덱스트란, 폴리비닐 알코올, 폴리비닐 피롤리돈, 폴리-1,3-디옥솔란, 폴리-1,3,6-트리옥산, 에틸렌/말레산 무수물 공중합체, 폴리아미노산 (단독중합체 또는 무작위 공중합체), 및 덱스트란 또는 폴리(n-비닐 피롤리돈)폴리에틸렌 글리콜, 프로프로필렌 글리콜 단독중합체, 폴리프로필렌 옥시드/에틸렌 옥시드 공중합체, 폴리옥시에틸화 폴리올 (예를 들어 글리세롤), 폴리비닐 알코올 및 이들의 혼합물을 포함하고 이로 제한되지 않는다. 폴리에틸렌 글리콜 프로피온알데히드는 그의 물에서의 안정성 때문에 제조상 잇점을 가질 수 있다. 중합체는 임의의 분자량의 것일 수 있고, 분지되거나 비분지될 수 있다. 항체에 부착된 중합체의 수는 다양할 수 있고, 하나 초과의 중합체가 부착되는 경우에 이들은 동일하거나 상이한 분자일 수 있다. 일반적으로, 유도체화에 사용되는 중합체의 수 및/또는 종류는 개선시킬 항체의 특정 특성 또는 기능, 항체 유도체가 규정된 조건 하에 요법에 사용될 것인지의 여부 등을 포함하나 이에 제한되지 않는 고려사항을 기초로 하여 결정할 수 있다.
Q. 스크리닝 방법
본 발명의 또다른 실시태양은 TAHO 폴리펩티드를 함유하는 것으로 의심되는 샘플 내에서 TAHO 폴리펩티드의 존재를 결정하는 방법에 관한 것이고, 상기 방법은 샘플을 TAHO 폴리펩티드에 결합하는 그의 항체 약물 접합체에 노출시키고, 샘플 내의 TAHO 폴리펩티드에 대한 그의 항체 약물 접합체의 결합을 결정하는 것을 포함하고, 여기서 상기 결합의 존재는 샘플 내에 TAHO 폴리펩티드의 존재를 표시한다. 임의로, 샘플은 TAHO 폴리펩티드를 발현하는 것으로 의심되는 세포 (암 세포일 수 있음)를 함유할 수 있다. 방법에 사용되는 그의 항체 약물 접합체는 임의로 검출가능하게 표지되거나, 고체 지지체에 부착되는 등과 같이 처리될 수 있다.
본 발명의 다른 실시태양은 포유동물에서 종양의 존재를 진단하는 방법에 관한 것이고, 상기 방법은 (a) 포유동물로부터 얻은 조직 세포를 포함하는 시험 샘플을 TAHO 폴리펩티드에 결합하는 그의 항체 약물 접합체와 접촉시키고, (b) 그의 항체 약물 접합체와 시험 샘플 내의 TAHO 폴리펩티드 사이의 복합체의 형성을 검출하는 것을 포함하고, 여기서 복합체의 형성이 포유동물에서 종양의 존재를 표시한다. 임의로, 그의 항체 약물 접합체는 예를 들어 검출가능하게 표지되고, 고체 지지체에 부착되는 등과 같이 처리될 수 있고/있거나 조직 세포의 시험 샘플은 암성 종양이 있는 것으로 의심되는 개체로부터 얻는다.
IV. 항- TAHO 항체 및 면역접합체의 추가의 사용 방법
A. 진단 방법 및 검출 방법
한 측면에서, 본 발명의 항-TAHO 항체 및 면역접합체는 생물학적 샘플 내에서 TAHO 폴리펩티드의 존재를 검출하기 위해 유용하다. 용어 "검출하는"은 본원에서 사용될 때 정량적 또는 정성적 검출을 포함한다. 특정 실시태양에서, 생물학적 샘플은 세포 또는 조직을 포함한다. 특정 실시태양에서, 상기 조직은 다른 조직에 비해 더 높은 수준으로 TAHO 폴리펩티드를 발현하는 정상 및/또는 암성 조직, 예를 들어 B 세포 및/또는 B 세포 연관 조직을 포함한다.
한 측면에서, 본 발명은 생물학적 샘플 내에서 TAHO 폴리펩티드의 존재를 검출하는 방법을 제공한다. 특정 실시태양에서, 방법은 생물학적 샘플을 TAHO 폴리펩티드에 대한 항-TAHO 항체의 결합을 허용하는 조건 하에 항-TAHO 항체와 접촉시키고, 항-TAHO 항체와 TAHO 폴리펩티드 사이에 복합체가 형성되는지 검출하는 것을 포함한다.
한 측면에서, 본 발명은 TAHO 폴리펩티드의 증가된 발현과 연관된 질환을 진단하는 방법을 제공한다. 특정 실시태양에서, 방법은 시험 세포를 항-TAHO 항체와 접촉시키고; TAHO 폴리펩티드에 대한 항-TAHO 항체의 결합을 검출함으로써 시험 세포에 의한 TAHO 폴리펩티드의 발현 수준을 (정량적으로 또는 정성적으로) 결정하고; 시험 세포에 의한 TAHO 폴리펩티드의 발현 수준을 대조 세포 (예를 들어, 시험 세포와 동일한 조직에서 기원하는 정상 세포, 또는 상기 정상 세포와 대등한 수준으로 TAHO 폴리펩티드를 발현하는 세포)에 의한 TAHO 폴리펩티드의 발현 수준과 비교하는 것을 포함하고, 여기서 대조 세포에 비해 시험 세포에 의한 TAHO 폴리펩티드의 더 높은 발현 수준이 TAHO 폴리펩티드의 증가된 발현과 연관된 질환의 존재를 나타낸다. 특정 실시태양에서, 시험 세포는 TAHO 폴리펩티드의 증가된 발현과 연관된 질환이 있는 것으로 의심되는 개체로부터 얻는다. 특정 실시태양에서, 질환은 세포 증식성 질환, 예를 들어 암 또는 종양이다.
본 발명의 항체를 사용하여 진단할 수 있는 예시적인 세포 증식성 질환은 림프종, 비-호지킨 림프종 (NHL), 공격성 NHL, 재발성 공격성 NHL, 재발성 무통성 NHL, 불응성 NHL, 불응성 무통성 NHL, 만성 림프구성 백혈병 (CLL), 소림프구성 림프종, 백혈병, 유모세포 백혈병 (HCL), 급성 림프구성 백혈병 (ALL), 및 외투 세포 림프종을 포함하고 이로 제한되지 않는 B 세포 질환 및/또는 B 세포 증식성 질환을 포함한다.
특정 실시태양에서, 상기한 바와 같은 진단 또는 검출의 방법은 세포 표면 상에서 또는 그의 표면 상에 TAHO 폴리펩티드를 발현하는 세포로부터 얻은 막 제제 내에서 발현된 TAHO 폴리펩티드에 대한 항-TAHO 항체의 결합을 검출하는 것을 포함한다. 특정 실시태양에서, 이 방법은 세포를 TAHO 폴리펩티드에 대한 항-TAHO 항체의 결합을 허용하는 조건 하에 항-TAHO 항체와 접촉시키고, 항-TAHO 항체와 세포 표면 상의 TAHO 폴리펩티드 사이에 복합체가 형성되는지를 결정하는 것을 포함한다. 세포의 표면 상에 발현된 TAHO 폴리펩티드에 대한 항-TAHO 항체의 결합을 검출하기 위한 예시적인 분석은 "FACS" 분석이다.
TAHO 폴리펩티드에 대한 항-TAHO 항체의 결합을 검출하기 위해 다른 특정 방법이 사용될 수 있다. 상기 방법은 당업계에 잘 공지된 항원 결합 분석, 예를 들어 웨스턴 블롯, 방사성 면역분석, ELISA (효소 연결 면역흡착 분석), "샌드위치 (sandwich)" 면역분석, 면역침전 분석, 형광 면역분석, 단백질 A 면역분석, 및 면역조직화학 (IHC)을 포함하고 이로 제한되지 않는다.
특정 실시태양에서, 항-TAHO 항체는 표지된다. 표지는 직접 검출되는 표지 또는 모이어티 (예를 들어 형광, 발색, 전자 밀집 (electron-dense), 화학발광, 및 방사성 표지), 및 간접적으로, 예를 들어 효소 반응 또는 분자 상호작용을 통해 검출되는 모이어티, 예를 들어 효소 또는 리간드를 포함하고 이로 제한되지 않는다. 예시적인 표지는 방사성 동위원소 32P, 14C, 125I, 3H, 131I, 형광단, 예를 들어 희토류 킬레이트 또는 플루오레세인 및 그의 유도체, 로다민 및 그의 유도체, 단실, 움벨리페론, 또는 루시퍼라제, 예를 들어, 반딧불이 루시퍼라제 및 세균 루시퍼라제 (미국 특허 4,737,456), 루시페린, 2,3-디히드로프탈라진디온, 양고추냉이 퍼옥시다제 (HRP), 알칼리성 포스파타제, β-갈락토시다제, 글루코아밀라제, 리소자임, 사카라이드 옥시다제, 예를 들어, 글루코스 옥시다제, 갈락토스 옥시다제, 및 글루코스-6-포스페이트 데히드로게나제, 염료 전구체를 산화시키기 위해 과산화수소를 사용하는 효소, 예를 들어 HRP, 락토퍼옥시다제, 또는 마이크로퍼옥시다제와 커플링된 헤테로시클릭 옥시다제, 예를 들어 유리카제 및 잔틴 옥시다제, 비오틴/아비딘, 스핀 (spin) 표지, 박테리오파지 표지, 안정한 유리 라디칼 등을 포함하고 이로 제한되지 않는다.
특정 실시태양에서, 항-TAHO 항체는 불용성 매트릭스 상에 고정된다. 고정은 용액 내에 유리 상태로 남아있는 임의의 TAHO 폴리펩티드로부터 항-TAHO 항체를 분리하는 것을 수반한다. 이것은 통상적으로 분석 절차 전에 항-TAHO 항체의 불용화에 의해, 수불용성 매트릭스 또는 표면에 대한 흡착에 의해 (U.S. 3,720,760 (Bennich 등)), 또는 공유 커플링 (예를 들어, 글루타르알데히드 가교결합의 사용)에 의해, 또는 예를 들어 면역침전에 의해 항-TAHO 항체와 TAHO 폴리펩티드 사이의 복합체 형성 후에 항-TAHO 항체의 불용화에 의해 달성된다.
진단 또는 검출의 임의의 상기 실시태양은 항-TAHO 항체 대신에 또는 그에 추가로 본 발명의 면역접합체를 사용하여 수행할 수 있다.
B. 치료 방법
본 발명의 항체 또는 면역접합체는 예를 들어 시험관 내에서, 생체 외에서 및 생체 내에서 치료 방법에 사용될 수 있다. 한 측면에서, 본 발명은 생체 내에서 또는 시험관 내에서 세포 성장 또는 증식을 억제하는 방법을 제공하고, 이 방법은 세포를 TAHO 폴리펩티드에 대한 면역접합체의 결합을 허용하는 조건 하에 항-TAHO 항체 또는 그의 면역접합체에 노출시키는 것을 포함한다. "세포 성장 또는 증식을 억제하는"은 세포의 성장 또는 증식을 적어도 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 또는 100% 감소시키는 것을 의미하고, 세포 사멸의 유도를 포함한다. 특정 실시태양에서, 세포는 종양 세포이다. 특정 실시태양에서, 세포는 B 세포이다. 특정 실시태양에서, 세포는 예를 들어 본원에 예시된 바와 같은 이종이식편이다.
한 측면에서, 본 발명의 항체 또는 면역접합체는 B 세포 증식성 질환을 치료하거나 예방하기 위해 사용된다. 특정 실시태양에서, 세포 증식성 질환은 TAHO 폴리펩티드의 증가된 발현 및/또는 활성과 연관된다. 예를 들어, 특정 실시태양에서, B 세포 증식성 질환은 B 세포의 표면에서 TAHO 폴리펩티드의 증가된 발현과 연관된다. 특정 실시태양에서, B 세포 증식성 질환은 종양 또는 암이다. 본 발명의 항체 또는 면역접합체에 의해 치료되는 B 세포 증식성 질환의 예는 림프종, 비-호지킨 림프종 (NHL), 공격성 NHL, 재발성 공격성 NHL, 재발성 무통성 NHL, 불응성 NHL, 불응성 무통성 NHL, 만성 림프구성 백혈병 (CLL), 소림프구성 림프종, 백혈병, 유모세포 백혈병 (HCL), 급성 림프구성 백혈병 (ALL), 및 외투 세포 림프종을 포함하고 이로 제한되지 않는다.
한 측면에서, 본 발명은 개체에게 유효량의 항-TAHO 항체 또는 그의 면역접합체를 투여하는 것을 포함하는, B 세포 증식성 질환을 치료하는 방법을 제공한다. 특정 실시태양에서, B 세포 증식성 질환을 치료하는 방법은 개체에게 항-TAHO 항체 또는 항-TAHO 면역접합체 및 임의로 적어도 하나의 추가의 치료제, 예를 들어 아래에 제시된 것을 포함하는 제약 제제의 유효량을 투여하는 것을 포함한다. 특정 실시태양에서, 세포 증식성 질환을 치료하는 방법은 개체에게 1) 항-TAHO 항체 및 세포독성제를 포함하는 면역접합체; 및 임의로 2) 적어도 하나의 추가의 치료제, 예를 들어 아래에 제시되는 것을 포함하는 제약 제제의 유효량을 투여하는 것을 포함한다.
한 측면에서, 본 발명의 항체 또는 면역접합체의 적어도 일부는 인간 이외의 다른 종으로부터 유래한 TAHO 폴리펩티드에 결합할 수 있다. 따라서, 본 발명의 항체 또는 면역접합체는 예를 들어 TAHO 폴리펩티드를 함유하는 세포 배양액 내에서, 인간에서, 또는 본 발명의 항체 또는 면역접합체가 교차-반응하는 TAHO 폴리펩티드를 갖는 다른 포유동물 (예를 들어 침팬지, 비비 (baboon), 마모셋, 사이노몰거스 원숭이 및 붉은털 (rhesus) 원숭이, 돼지 또는 마우스)에서 TAHO 폴리펩티드에 결합하기 위해 사용될 수 있다. 한 실시태양에서, 항-TAHO 항체 또는 면역접합체는, 면역접합체의 접합된 세포독소가 세포 내부로 접근하도록 항체 또는 면역접합체를 TAHO 폴리펩티드와 접촉시켜 항체 또는 면역접합체-항원 복합체를 형성시킴으로써 B 세포 상의 TAHO 폴리펩티드를 표적화하기 위해 사용될 수 있다. 한 실시태양에서, TAHO 폴리펩티드는 인간 TAHO 폴리펩티드이다.
한 실시태양에서, 항-TAHO 항체 또는 면역접합체는 증가된 TAHO 폴리펩티드 발현 및/또는 활성과 연관된 질환으로 고통받는 개체에서 TAHO 폴리펩티드를 결합시키는 방법에서 사용될 수 있고, 이 방법은 개체 내에 존재하는 TAHO 폴리펩티드가 결합되도록 개체에게 항체 또는 면역접합체를 투여하는 것을 포함한다. 한 실시태양에서, 결합된 항체 또는 면역접합체는 TAHO 폴리펩티드를 발현하는 B 세포 내로 내재화된다. 한 실시태양에서, TAHO 폴리펩티드는 인간 TAHO 폴리펩티드이고, 개체는 인간 개체이다. 별법으로, 개체는 항-TAHO 항체가 결합하는 TAHO 폴리펩티드를 발현하는 포유동물일 수 있다. 또한, 개체는 TAHO 폴리펩티드가 도입된 (예를 들어, TAHO 폴리펩티드의 투여에 의해 또는 TAHO 폴리펩티드를 코딩하는 도입유전자의 발현에 의해) 포유동물일 수 있다.
항-TAHO 항체 또는 면역접합체는 치료 목적으로 인간에게 투여될 수 있다. 또한, 항-TAHO 항체 또는 면역접합체는 수의용으로 또는 인간 질병의 동물 모델로서, 항체가 교차-반응하는 TAHO 폴리펩티드를 발현하는 비-인간 포유동물 (예를 들어, 영장류, 돼지, 래트 또는 마우스)에게 투여될 수 있다. 인간 질병의 동물 모델의 경우에, 상기 동물 모델은 본 발명의 항체 또는 면역접합체의 치료 효능을 평가하는데 (예를 들어, 투여량 및 투여의 시간 과정을 시험하는데) 유용할 수 있다.
본 발명의 항체 또는 면역접합체는 요법에서 단독으로 또는 다른 조성물과 조합되어 사용될 수 있다. 예를 들어, 본 발명의 항체 또는 면역접합체는 적어도 하나의 추가의 치료제 및/또는 어쥬번트와 동시 투여될 수 있다. 특정 실시태양에서, 추가의 치료제는 세포독성제, 화학요법제, 또는 성장 억제제이다. 그러한 한 실시태양에서, 화학요법제는 하나의 물질 또는 물질들의 조합물, 예를 들어, 시클로포스파미드, 히드록시다우노루비신, 아드리아마이신, 독소루비신, 빈크리스틴 (Oncovin™), 프레드니솔론, CHOP, CVP, 또는 COP, 또는 면역치료제, 예를 들어 항-CD20 (예를 들어, Rituxan®) 또는 항-VEGF (예를 들어, Avastin®)이고, 여기서 조합 요법은 암 및/또는 B 세포 질환, 예를 들어 림프종, 비-호지킨 림프종 (NHL), 공격성 NHL, 재발성 공격성 NHL, 재발성 무통성 NHL, 불응성 NHL, 불응성 무통성 NHL, 만성 림프구성 백혈병 (CLL), 소림프구성 림프종, 백혈병, 유모세포 백혈병 (HCL), 급성 림프구성 백혈병 (ALL), 및 외투 세포 림프종을 포함한 B 세포 증식성 질환의 치료에 유용하다.
상기한 그러한 조합 요법은 조합 투여 (여기서, 2 이상의 치료제가 동일한 또는 별개의 제제에 포함된다) 및 별개의 투여를 포함하고, 이 경우에, 본 발명의 항체 또는 면역접합체의 투여는 추가의 치료제 및/또는 어쥬번트의 투여 전, 투여와 동시에 및/또는 투여 후에 수행될 수 있다. 본 발명의 항체 또는 면역접합체는 또한 방사선 요법과 조합되어 사용될 수도 있다.
본 발명의 항체 또는 면역접합체 (및 임의의 추가의 치료제 또는 어쥬번트)는 비경구, 피하, 복강내, 폐내 및 비내, 및 국소 치료용으로 필요할 경우에 병변내 투여를 비롯한 임의의 적합한 수단에 의해 투여될 수 있다. 비경구 주입은 근육내, 정맥내, 동맥내, 복강내 또는 피하 투여를 포함한다. 또한, 항체 또는 면역접합체는 적합하게는 특히, 감소하는 투여량의 항체 또는 면역접합체를 사용하는 경우에 펄스 주입에 의해 투여된다. 투약은 임의의 적합한 경로에 의해, 예를 들어 부분적으로는 투여가 단기인지 또는 장기인지에 따라 정맥내 또는 피하 주사와 같은 주사에 의해 수행할 수 있다.
본 발명의 항체 또는 면역접합체는 우수 의료 실무와 일치하는 방식으로 제제화되고 투여량 결정되고 투여될 것이다. 이러한 측면에서 고려되는 인자는 치료되는 특정 질환, 치료되는 특정 포유동물, 개별 환자의 임상 상태, 질환의 원인, 물질의 전달 부위, 투여 방법, 투여 스케줄, 및 의료인에게 공지된 다른 인자를 포함한다. 항체 또는 면역접합체는 반드시 그럴 필요는 없지만 임의로 해당 질환을 예방 또는 치료하기 위해 현재 사용되는 하나 이상의 물질과 함께 제제화된다. 그러한 다른 물질의 유효량은 제제 내에 존재하는 항체 또는 면역접합체의 양, 질환 또는 치료의 종류, 및 상기 논의된 다른 인자에 따라 결정된다. 이들은 일반적으로 본원에 기재된 바와 동일한 투여량 및 투여 경로로, 또는 본원에 기재된 투여량의 약 1 내지 99%로, 또는 경험적으로/임상적으로 적절한 것으로 결정된 임의의 투여량 및 경로로 사용된다.
질병의 예방 또는 치료를 위해, 본 발명의 항체 또는 면역접합체의 적절한 투여량 (단독으로 또는 하나 이상의 다른 추가의 치료제, 예를 들어 화학요법제와 조합되어 사용될 때)은 치료되는 질병의 종류, 항체 또는 면역접합체의 종류, 질병의 심도 및 과정, 항체 또는 면역접합체가 예방 또는 치료 목적으로 투여되는지의 여부, 선행 요법, 환자의 임상력 및 항체 또는 면역접합체에 대한 반응, 및 담당 의사의 판단에 따라 결정될 것이다. 항체 또는 면역접합체는 적합하게는 1회에 또는 일련의 처리에 걸쳐 환자에게 투여된다. 질병의 종류 및 심도에 따라, 예를 들어 1회 이상의 별개 투여에 의해서든 연속 주입에 의해서든 약 1 ㎍/kg 내지 100 mg/kg (예를 들어 0.1 mg/kg - 20 mg/kg)의 항체 또는 면역접합체가 환자에게 투여하기 위한 초기 후보 투여량일 수 있다. 한 가지 전형적인 일일 투여량은 상기 언급된 인자에 따라 약 1 ㎍/kg 내지 100 mg/kg 또는 그 이상일 수 있다. 수일 이상에 걸친 반복 투여의 경우에, 병태에 따라 치료는 일반적으로 질병 증상이 목적하는 수준으로 억제될 때까지 지속될 것이다. 항체 또는 면역접합체의 한 가지 예시적인 투여량은 약 0.05 mg/kg 내지 약 10 mg/kg 범위일 것이다. 따라서, 약 0.5 mg/kg, 2.0 mg/kg, 4.0 mg/kg 또는 10 mg/kg (또는 이들의 임의의 조합)의 항체 또는 면역접합체 중 하나 이상의 용량이 환자에게 투여될 수 있다. 그러한 용량은 간헐적으로, 예를 들어 매주 또는 3주마다 (예를 들어 환자가 약 2 내지 약 20회, 또는 예를 들어 약 6회 용량의 항체 또는 면역접합체를 투여받도록) 투여될 수 있다. 보다 높은 초기 로딩 용량, 이어서 1회 이상의 보다 낮은 용량이 투여될 수 있다. 예시적인 투약 용법은 약 4 mg/kg의 항체의 초기 로딩 용량 후에 약 2 mg/kg의 항체의 매주 유지 용량을 투여하는 것을 포함한다. 그러나, 다른 투약 용법도 유용할 수 있다. 상기 요법의 진행은 통상적인 기술 및 분석에 의해 쉽게 모니터링된다.
C. 활성 분석
본 발명의 항-TAHO 항체 및 면역접합체는 당업계에 공지된 다양한 분석에 의해 그들의 물리/화학적 특성 및/또는 생물학적 활성에 대해 특성을 결정할 수 있다.
1. 활성 분석
한 측면에서, 생물학적 활성을 갖는 항-TAHO 항체 또는 그의 면역접합체를 확인하기 위한 분석이 제공된다. 생물학적 활성은 예를 들어 세포 성장 또는 증식을 억제하는 능력 (예를 들어, "세포 사멸" 활성), 또는 프로그래밍된 세포 사멸 (세포자멸)을 포함한 세포 사멸을 유도하는 능력을 포함할 수 있다. 생체 내에서 및/또는 시험관 내에서 그러한 생물학적 활성을 갖는 항체 또는 면역접합체도 제공된다.
특정 실시태양에서, 항-TAHO 항체 또는 그의 면역접합체는 시험관 내에서 세포 성장 또는 증식을 억제하는 그의 능력에 대해 시험된다. 세포 성장 또는 증식 억제에 대한 분석은 당업계에 공지되어 있다. 본원에 설명되는 "세포 사멸" 분석으로 예시되는 세포 증식에 대한 특정 분석에서는 세포 생존력을 측정한다. 그러한 분석의 하나는 CellTiter-Glo™ 발광 세포 생존력 분석 (Luminescent Cell Viability Assay)이고, 이는 프로메가 (Promega, 미국 위스콘신주 매디슨))로부터 상업적으로 입수가능하다. 상기 분석은 대사적 활성 세포를 나타내는, 존재하는 ATP의 정량을 기초로 하여 배양액 내의 생육가능한 세포의 수를 결정한다 ([Crouch et al (1993) J. Immunol. Meth. 160:81-88], 미국 특허 6602677 참조). 분석은 자동화 고출력 스크리닝 (HTS)을 가능하게 하는 96- 또는 384-웰 포맷으로 수행할 수 있다 (문헌 [Cree et al (1995) Anticancer Drugs 6:398-404] 참조). 분석 절차는 단일 시약 (CellTiter-Glo® 시약)을 배양된 세포에 직접 첨가하는 것을 수반한다. 이에 의해 세포 용해, 및 루시퍼라제 반응에 의해 생산된 발광 신호의 생성이 일어난다. 발광 신호는 존재하는 ATP의 양에 비례하고, 이는 배양액 내에 존재하는 생육가능한 세포의 수에 정비례한다. 데이타는 발광분석기 또는 CCD 카메라 영상화 장치에 의해 기록할 수 있다. 발광 출력은 상대 광 단위 (RLU)로서 표현한다.
세포 증식을 위한 다른 분석은 미토콘드리아 환원효소에 의한 3-(4,5-디메틸티아졸-2-일)-2,5-디페닐테트라졸륨 브로마이드의 포르마잔으로의 산화를 측정하는 비색 분석인 "MTT" 분석이다. CellTiter-Glo™ 분석과 같이, 상기 분석은 세포 배양액 내에 존재하는 대사 활성 세포의 수를 나타낸다 (예를 들어, 문헌 [Mosmann (1983) J. Immunol. Meth. 65:55-63], 및 [Zhang et al. (2005) Cancer Res. 65:3877-3882] 참조).
한 측면에서, 항-TAHO 항체를 시험관 내에서 세포 사멸을 유도하는 그의 능력에 대해 시험한다. 세포 사멸의 유도에 대한 분석은 당업계에 공지되어 있다. 일부 실시태양에서, 상기 분석은 예를 들어 요오드화프로피듐 (PI), 트리판 블루 ([Moore et al. (1995) Cytotechnology 17:1-11] 참조) 또는 7AAD의 흡수에 의해 표시되는 막 통합성의 상실을 측정한다. 예시적인 PI 흡수 분석에서, 세포를 10% 열-불활성화된 FBS (하이클론 (Hyclone)) 및 2 mM L-글루타민을 보충한 둘베코 개질 이글 배지 (D-MEM):햄의 F-12 (50:50) 내에서 배양한다. 따라서, 분석은 보체 및 면역 효과기 세포의 부재 하에 수행한다. 세포를 100 x 20 mm 디쉬 내에 디쉬 당 3x106의 밀도로 접종하고, 철야 부착시킨다. 배지를 제거하고 신선한 배지 단독으로 또는 다양한 농도의 항체 또는 면역접합체를 함유하는 배지로 교체한다. 세포를 3일 동안 인큐베이팅한다. 처리 후에, 단층을 PBS로 세척하고, 트립신화에 의해 탈착시킨다. 이어서, 세포를 1200 rpm에서 5분 동안 4℃에서 원심분리하고, 펠렛을 3 ml의 냉 Ca2 + 결합 버퍼 (10 mM Hepes, pH 7.4, 140 mM NaCl, 2.5 mM CaCl2) 내에 재현탁시키고, 세포 덩어리를 제거하기 위해 35 mm의 스트레이너 마개가 있는 12 x 75 mm 튜브 (1 ml/튜브, 처리군 당 3개 튜브) 내로 분취한다. 이어서, 튜브에 PI (10 ㎍/ml)를 넣는다. 샘플은 FACSCAN® 유동 세포 측정기 및 FACSCONVERT™ CellQuest 소프트웨어 (벡톤 디킨슨)를 사용하여 분석한다. 이에 의해, PI 흡수에 의해 결정할 때 통계학상 유의한 수준의 세포 사멸을 유도하는 항체 또는 면역접합체가 확인된다.
한 측면에서, 항-TAHO 항체 또는 면역접합체를 시험관 내에서 세포자멸 (프로그래밍된 세포 사멸)을 유도하는 그의 능력에 대해 시험한다. 세포자멸을 유도하는 항체 또는 면역접합체에 대한 예시적인 분석은 아넥신 결합 분석이다. 예시적인 아넥신 결합 분석에서, 선행 문단에서 논의한 바와 같이 세포를 배양하고 디쉬 내에 접종한다. 배지를 제거하고, 신선한 배지 단독으로 또는 0.001 내지 10 ㎍/ml의 항체 또는 면역접합체를 함유하는 배지로 교체한다. 3일의 인큐베이션 기간 후에, 단층을 PBS로 세척하고, 트립신화에 의해 탈착시킨다. 이어서, 세포를 원심분리하고, Ca2 + 결합 버퍼 내에 재현탁시키고, 선행 문단에 논의된 바와 같이 튜브 내로 분취한다. 이어서, 튜브에 표지된 아넥신 (예를 들어, 아넥신 V-FITC) (1 ㎍/ml)을 넣는다. 샘플을 FACSCAN™ 유동 세포 측정기 및 FACSCONVERT™ CellQuest 소프트웨어 (비디 바이오사이언시즈)를 사용하여 분석한다. 이에 의해 대조군에 비해 통계학상 유의한 수준의 아넥신 결합을 유도하는 항체 또는 면역접합체가 확인된다. 세포자멸을 유도하는 항체 또는 면역접합체에 대한 다른 예시적인 분석은 게놈 DNA의 뉴클레오좀내 분해를 검출하기 위한 히스톤 DNA ELISA 비색 분석이다. 상기 분석은 예를 들어 세포 사멸 검출 ELISA 키트 (로슈 (Roche, 미국 캘리포니아주 팔로 알토))를 사용하여 수행할 수 있다.
임의의 상기 시험관 내 분석에 사용하기 위한 세포는 자연적으로 TAHO 폴리펩티드를 발현하거나 TAHO 폴리펩티드를 발현하도록 조작된 세포 또는 세포주를 포함한다. 상기 세포는 동일한 조직 기원의 정상 세포에 비해 TAHO 폴리펩티드를 과다발현하는 종양 세포를 포함한다. 상기 세포는 또한 TAHO 폴리펩티드를 발현하는 세포주 (종양 세포주 포함), 및 정상적으로는 TAHO 폴리펩티드를 발현하지 않지만 TAHO 폴리펩티드를 코딩하는 핵산으로 형질감염된 세포주를 포함한다.
한 측면에서, 항-TAHO 항체 또는 그의 면역접합체를 생체 내에서 세포 성장 또는 증식을 억제하는 그의 능력에 대해 시험한다. 특정 실시태양에서, 항-TAHO 항체 또는 그의 면역접합체를 생체 내에서 종양 성장을 억제하는 그의 능력에 대해 시험한다. 생체 내 모델 시스템, 예를 들어 이종이식편 모델을 상기 시험을 위해 사용할 수 있다. 예시적인 이종이식편 시스템에서, 인간 종양 세포를 적합하게 면역손상시킨 비-인간 동물, 예를 들어 SCID 마우스에 도입한다. 본 발명의 항체 또는 면역접합체를 동물에게 투여한다. 종양 성장을 억제하거나 감소시키는 항체 또는 면역접합체의 능력을 측정한다. 상기 이종이식편 시스템의 특정 실시태양에서, 인간 종양 세포는 인간 환자로부터의 종양 세포이다. 이종이식편 모델의 제조에 유용한 상기 세포는 비제한적으로 BJAB-luc 세포 (루시퍼라제 리포터 유전자로 형질감염된 EBV-음성 버킷 림프종 세포주), Ramos 세포 (ATCC, CRL-1923), SuDHL-4 세포 (DSMZ, 독일 브라운쉬바이크, AAC 495), DoHH2 세포 ([Kluin-Neilemans, H.C. et al., Leukemia 5:221-224 (1991)], 및 [Kluin-Neilemans, H.C. et al., Leukemia 8: 1385-1391 (1994)] 참조), Granta-519 세포 ([Jadayel, D.M. et al., Leukemia 11(1):64-72 (1997)] 참조)를 포함하는 인간 백혈병 및 림프종 세포주를 포함한다. 특정 실시태양에서, 인간 종양 세포는 피하 주사에 의해 적합하게 면역손상시킨 비-인간 동물 내로 또는 이식에 의해 적합한 부위, 예를 들어 유지방체 (mammary fat pad) 내로 도입된다.
2. 결합 분석 및 다른 분석
한 측면에서, 항-TAHO 항체를 그의 항원 결합 활성에 대해 시험한다. 예를 들어, 특정 실시태양에서, 항-TAHO 항체를 세포의 표면 상에 발현된 TAHO 폴리펩티드에 결합하는 그의 능력에 대해 시험한다. 그러한 시험을 위해 FACS 분석을 사용할 수 있다.
한 측면에서, TAHO 폴리펩티드에 대한 결합을 위해 쥐 SN8 항체와 경쟁하는 모노클로날 항체를 확인하기 위해 경쟁 분석을 사용할 수 있다. 특정 실시태양에서, 상기 경쟁 항체는 쥐 SN8 항체가 결합하는 것과 동일한 에피토프 (예를 들어, 선형 또는 입체형태적 에피토프)에 결합한다. 예시적인 경쟁 분석은 문헌 [Harlow and Lane (1988) Antibodies: A Laboratory Manual ch.14 (Cold Spring Harbor Laboratory, Cold Spring Harbor, NY)]에 제시된 것과 같은 통상적인 분석을 포함하고 이로 제한되지 않는다. 항체가 결합하는 에피토프를 매핑하기 위한 상세한 예시적인 방법은 문헌 [Morris (1996) "Epitope Mapping Protocols", in Methods in Molecular Biology vol. 66 (Humana Press, Totowa, NJ)]에 제시되어 있다. 2개의 항체가 각각 서로 다른 항체의 결합을 50% 이상 차단하는 경우에 2개의 항체는 동일한 에피토프에 결합하는 것으로 말해진다.
예시적인 경쟁 분석에서, 고정된 TAHO 폴리펩티드를, TAHO 폴리펩티드에 결합하는 제1 표지된 항체 (예를 들어, 쥐 SN8 항체) 및 TAHO 폴리펩티드에 대한 결합을 위해 제1 항체와 경쟁하는 그의 능력에 대해 시험되는 제2 비표지된 항체를 포함하는 용액 내에서 인큐베이팅한다. 제2 항체는 하이브리도마 상등액에 존재할 수 있다. 대조군으로서, 고정된 TAHO 폴리펩티드를, 제1 표지된 항체만을 포함하고 제2 비표지된 항체는 포함하지 않는 용액 내에서 인큐베이팅한다. TAHO 폴리펩티드에 대한 제1 항체의 결합을 허용하는 조건 하에 인큐베이팅한 후, 과량의 결합되지 않은 항체를 제거하고, 고정된 TAHO 폴리펩티드와 회합된 표지의 양을 측정한다. 고정된 TAHO 폴리펩티드와 회합된 표지의 양이 대조 샘플에 비해 시험 샘플에서 실질적으로 감소하면, 이것은 제2 항체가 TAHO 폴리펩티드에 대한 결합을 위해 제1 항체와 경쟁함을 나타낸다. 특정 실시태양에서, 고정된 TAHO 폴리펩티드는 세포의 표면 상에, 또는 그의 표면 상에 TAHO 폴리펩티드를 발현하는 세포로부터 수득한 막 제제 내에 존재한다.
한 측면에서, 정제된 항-TAHO 항체는 N-말단 서열 결정, 아미노산 분석, 비-변성 크기 배제 고압 액체 크로마토그래피 (HPLC), 질량 분광법, 이온 교환 크로마토그래피 및 파파인 소화를 포함하고 이로 제한되지 않는 일련의 분석에 의해 추가로 특성이 결정될 수 있다.
한 실시태양에서, 본 발명은 항체를, 항체의 생체내 반감기가 중요하지만 특정 효과기 기능 (예를 들어, 보체 및 ADCC)에는 불필요하거나 유해한 많은 용도에 대한 바람직한 후보가 되도록 만드는, 모든 효과기 기능은 아니지만 일부의 효과기 기능을 보유하는 변경된 항체를 고려한다. 특정 실시태양에서, 목적하는 특성만이 유지되는 것을 보장하기 위해 항체의 Fc 활성을 측정한다. 시험관 내 및/또는 생체 내 세포독성 분석을 수행하여 CDC 및/또는 ADCC 활성의 감소/고갈을 확인할 수 있다. 예를 들어, Fc 수용체 (FcR) 결합 분석은 항체에 FcγR 결합이 결여되어 있지만 (따라서 ADCC 활성이 결여될 수 있음), 항체가 FcRn 결합능을 보유하는 것을 보장하기 위해 수행될 수 있다. ADCC를 매개하는 1차 세포인 NK 세포는 FcγRIII만을 발현하는 반면, 단핵구는 FcγRI, FcγRII 및 FcγRIII을 발현한다. 조혈 세포 상의 FcR 발현은 문헌 [Ravetch and Kinet, Annu. Rev. Immunol. 9:457-92 (1991)]의 464페이지 표 3에 요약되어 있다. 목적하는 분자의 ADCC 활성을 평가하기 위한 시험관내 분석의 예는 미국 특허 5,500,362 또는 5,821,337에 기재되어 있다. 상기 분석에 유용한 효과기 세포는 말초혈 단핵 세포 (PBMC) 및 천연 킬러 (NK) 세포를 포함한다. 별법으로 또는 추가로, 목적하는 분자의 ADCC 활성은 생체 내에서, 예를 들어 문헌 [Clynes et al. PNAS (USA) 95:652-656 (1998)]에 개시된 것과 같은 동물 모델에서 평가할 수 있다. 또한, 항체가 C1q에 결합할 수 없고, 따라서 CDC 활성이 결여되는 지를 확인하기 위해 C1q 결합 분석을 수행할 수 있다. 보체 활성화를 평가하기 위해, 예를 들어 문헌 [Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996)]에 기재된 바와 같은 CDC 분석을 수행할 수 있다. 또한, 당업계에 공지된 방법을 이용하여 FcRn 결합 및 생체내 소실율/반감기 결정을 수행할 수 있다.
다음 실시예는 단지 예시의 목적으로 제공되고, 어떠한 방식으로도 본 발명의 범위를 제한하려는 의도는 없다.
본 명세서에 인용된 모든 특허 및 문헌 참조문은 그 전문을 본원에 참고로 포함시킨다.
실시예
실시예에서 언급한 상업적으로 이용가능한 시약은 달리 나타내지 않으면 제조자의 지시에 따라 사용하였다. 실시예에서 사용된 항체는 상업적으로 이용가능한 항체이고, 항-CD180 (이바이오사이언스 (eBioscience) MRH73-11, 비디 파밍엔 (BD Pharmingen) G28-8 및 세로텍 (Serotec) MHR73), 항-CD20 (안셀 2H7 및 비디 파밍엔 2H7), 항-CD72 (비디 파밍엔 J4-117), 항-CXCR5 (알앤디 시스템즈 (R&D Systems) 51505), 항-CD22 (안셀 RFB4, 다코 (DAKO) To15, 다이아텍 (Diatec) 157, 시그마 HIB-22 및 모노산 (Monosan) BL-BC34), 항-CD22 (레인코 (Leinco) RFB-4 및 네오마커스 (NeoMarkers) 22C04), 항-CD21 (ATCC HB-135 및 ATCC HB5), 항-HLA-DOB (비디 파밍엔 DOB.L1), 항-인간 CD79a (ZL7-4 (칼태그 (Caltag) 또는 세로텍), 항-인간 CD79b (SN8 항체 (바이오메다 또는 비디바이오사이언스 또는 안셀로부터 구입), 로스웰 파크 캔서 인스티튜트로부터 수득한 하이브리도마로부터 생성된 SN8 항체 (Okazaki et al., Blood, 81(1): 84-95 (1993)) 또는 로스웰 파크 캔서 인스티튜트로부터 수득한 하이브리도마로부터 생성된 항체를 사용하여 생성된 SN8 키메라 항체 (Okazaki et al., Blood, 81(1): 84-95 (1993)) 및 CB3-1 (비디 파밍엔), 항-CD19 (바이오메다 CB-19), 항-FCER2 (안셀 BU38 및 세로텍 D3.6 및 비디 파밍엔 M-L233)를 포함하고 이로 제한되지 않는다. ATCC 기탁 번호에 의해 다음 실시예 및 명세서 전체에서 확인된 세포의 공급원은 아메리칸 타입 컬쳐 컬렉션이다.
실시예
1:
TAHO
발현의
마이크로어레이
데이타
분석
마이크로어레이 데이타는 조직 및 배양된 세포로부터의 매우 다양한 RNA 샘플에 대한 DNA 마이크로어레이 분석의 수행에 의한 TAHO 발현의 분석을 포함한다. 샘플은 휴지기에 및 외부 자극 후에 모두 정상 및 암성 인간 조직 및 다양한 종류의 정제된 면역 세포를 포함한다. 이들 RNA 샘플은 애질런트 (Agilent) 마이크로어레이 상에서 규정 마이크로어레이 프로토콜에 따라 분석할 수 있다.
본 실험에서, 세포로부터 RNA를 단리하고, 애질런트 로 인풋 (Low Input) RNA 형광 선형 증폭 키트 (애질런트)를 사용하는 시험관내 전사에 의해 시아닌-3 및 시아닌-5 표지된 cRNA 프로브를 생성하였다. 시아닌-5를 사용하여 PRO 폴리펩티드의 발현을 위해 시험할 샘플, 예를 들어, 골수종 및 형질세포를 표지하고, 시아닌-3을 사용하여 시험 샘플의 발현을 그와 비교하는 범용 참조물 (스트라타젠 세포주 풀)을 표지하였다. 0.1 g - 0.2 g의 시아닌-3 및 시아닌-5 표지된 cRNA 프로브를 계내 혼성화 키트 플러스 (애질런트)를 사용하여 애질런트 60-mer 올리고뉴클레오티드 어레이 칩에 혼성화시켰다. 이들 프로브를 마이크로어레이에 혼성화시켰다. 다발 골수종 분석을 위해, 프로브를 표준 애질런트 권장 조건 및 버퍼 (애질런트)를 사용하여 애질런트 전체 인간 게놈 올리고뉴클레오티드 마이크로어레이에 혼성화시켰다.
cRNA 프로브를 4 RPM으로 설정된 혼성화 회전자 (rotator) 상에서 60℃에서 17시간 동안 마이크로어레이에 혼성화시켰다. 세척한 후에, 마이크로어레이를 시아닌-3 및 시아닌-5 형광 분자를 여기시키고 그로부터의 형광 (532 및 633 nm 레이저선)을 검출할 수 있는 애질런트 마이크로어레이 스캐너 (scanner)로 스캐닝였다. 특질 인식, 배경 공제 및 표준화를 담당하는 애질런트 특질 추출 소프트웨어를 사용하여 스캐닝된 마이크로어레이 영상으로부터 60-mer 올리고뉴클레오티드 어레이 상의 각각의 유전자에 대한 데이타를 추출하고, 생성되는 데이타를 로제타 리졸버 (Rosetta Resolver) 유전자 발현 데이타 분석 시스템 (로제타 인파르마틱스, 인크. (Rosetta Inpharmatics, Inc.))으로서 공지된 소프트웨어 패키지 내에 로딩하였다. 로제타 리졸버는 상관적인 데이타베이스, 및 다량의 강도 또는 비 유전자 발현 데이타를 저장, 검색 및 분석하기 위해 수많은 분석 도구를 포함한다.
본 실시예에서, B 세포 및 T 세포 (대조군)를 마이크로어레이 분석을 위해 얻었다. 나이브 및 기억 B 세포 및 형질세포의 단리를 위해, 인간 말초혈 단핵 세포 (PBMC)를 4명의 건강한 남성 공여자에 의해 제공된 류코팩 (leukopack)으로부터 또는 몇몇 정상 공여자의 전혈로부터 분리하였다. MACS (밀테니이 바이오텍 (Miltenyi Biotec)) 자성 세포 분류 시스템 및 항-CD138 비드를 사용하여 CD138+ 형질세포를 PBMC로부터 단리하였다. 별법으로, 항-CD19 비드 및 MACS 분류를 이용하여 총 CD19+ B 세포를 선택하였다. CD19+의 농축 (순도 약 90%) 후에, FACS (Moflo) 분류를 수행하여 나이브 및 기억 B 세포를 분리하였다. 샘플을 원심분리시켜 분류된 세포를 수집하였다. 분류된 세포를 LTR 버퍼 내에 즉시 용해시키고, QIAshredder (퀴아겐 (Qiagen)) 스핀 컬럼으로 균질화시킨 후, RNeasy 미니 키트를 사용하여 RNA 정제하였다. RNA 수율은 0.4-10 ㎍으로 가변적이고, 세포수에 의존적이었다.
대조군으로서, T 세포를 마이크로어레이 분석으로부터 단리하였다. 말초 혈액 CD8 세포를 스템 셀 테크놀로지스 (Stem Cell Technologies) CD8 세포 단리 키트 (Rosette Separation)를 사용하는 음성 선택에 의해 류코팩으로부터 단리하고, CD8 세포 단리 키트를 사용하는 MACS 자기 세포 분류 시스템에 의해 추가로 정제하고, CD45RO 마이크로비드를 첨가하여 CD45RO 세포를 제거하였다 (밀테니이 바이오텍). CD8 T 세포를 3개의 샘플로 나누고, 각각의 샘플을 다음과 같이 자극하였다: (1) 항-CD3 및 항-CD28 + IL-12 및 항-IL4 항체, (2) 시토킨 또는 중화 항체를 첨가하지 않으면서 항-CD3 및 항-CD29, 및 (3) 항-CD3 및 항-CD28 + IL-4 항-IL12 항체 및 항-IFN-γ 항체. 자극 48시간 후에, RNA를 수집하였다. 72시간 후에, 신선한 배지로 8배 희석하여 첨가함으로써 세포를 팽창시켰다. RNA를 수집한 7일 후에, CD8 세포를 수집하고, 세척하고, 항-CD3 및 항-CD28로 재자극하였다. 16시간 후에, RNA의 제2 컬렉션을 제조하였다. 재자극 48시간 후에, RNA의 제3 컬렉션을 제조하였다. 제1 RW1 세척 단계 후에 온-컬럼 DNAse I 소화효소를 첨가하여 매뉴얼 내의 지시에 따라 퀴아겐 Midi prep을 사용함으로써 RNA를 수집하였다. RNA를 RNAse가 없는 물 내에 용출시키고, 후속적으로 에탄올 침전에 의해 농축시켰다. 침전된 RNA를 뉴클레아제가 없는 물에 0.5 ㎍/㎕의 최종 최소 농도로 용해시켰다.
추가의 대조 마이크로어레이를 CD4+ T 헬퍼 T 세포, 천연 킬러 (NK) 세포, 호중구 (N'phil), CD14+, CD16+ 및 CD16- 단핵구 및 수지상 세포 (DC)로부터 단리된 RNA에 대해 수행하였다.
추가의 마이크로어레이를 암성 조직, 예를 들어 비-호지킨 림프종 (NHL), 여포성 림프종 (FL) 및 다발 골수종 (MM)으로부터 단리된 RNA에 대해 수행하였다. 추가의 마이크로어레이를 정상 세포, 예를 들어 정상 림프절 (NLN), 정상 B 세포, 예를 들어 중심모세포, 중심세포 및 여포 외투로부터의 B 세포, 기억 B 세포, 및 정상 형질세포 (PC) (B 세포 계열로부터의 것이고 골수종 세포의 정상적인 대응물임), 예를 들어 편도 형질세포, 골수 형질세포 (BM PC), CD19+ 형질세포 (CD19+ PC), CD19- 형질세포 (CD19-PC)로부터 단리된 RNA에 대해 수행하였다. 추가의 마이크로어레이를 정상 조직, 예를 들어 소뇌, 심장, 전립선, 부신, 방광, 소장, 결장, 태아 간, 자궁, 신장, 태반, 폐, 췌장, 근육, 뇌, 타액, 골수, 혈액, 흉선, 편도, 비장, 고환, 및 유선에 대해 수행하였다.
아래 나열된 분자들은 비-B 세포에 비해 B 세포에서 유의하게 발현되는 것으로서 확인되었다. 구체적으로, 분자들은 비-B 세포, 예를 들어 T 세포에 비해 나이브 B 세포, 기억 B 세포 (IgGA+ 또는 IgM+임) 및 PBMC 또는 골수로부터의 형질세포에서 차별적으로 발현된다. 따라서, 이들 분자는 포유동물에서 종양의 치료법을 위한 뛰어난 표적을 나타낸다.
요약
도 14-15에서, 유의한 mRNA 발현은 일반적으로 2를 초과하는 비값으로서 표시된다 (도 14-15의 수직축). 도 14-15에서, 비-B 세포, 예를 들어 전립선, 비장 등에서의 임의의 명백한 발현은 인공물, 림프구에 의한 정상 조직의 침윤, 또는 시판회사에 의한 샘플 통합성의 손실을 나타낼 수 있다.
(1) TAHO4 (또한 본원에서 CD79a로서 칭함)는 비-호지킨 림프종 (NHL) 다발 골수종 (MM) 샘플 및 정상 소뇌 및 정상 혈액에서 유의하게 발현된다. 추가로 TAHO4는 소뇌, 혈액 및 비장에서 유의하게 발현된다 (도 14). 그러나, 상기 지시된 바와 같이, 비-B 세포, 예를 들어 전립선, 비장, 혈액 등에서의 임의의 명백한 발현은 인공물, 림프구에 의한 정상 조직의 침윤, 또는 시판회사에 의한 샘플 통합성의 손실을 나타낼 수 있다.
(2) TAHO5 (또한 본원에서 인간 CD79b로서 칭함)는 비-호지킨 림프종 (NHL)에서 유의하게 발현된다 (도 15).
TAHO4 및 TAHO5는 마이크로어레이 분석에 의해 검출할 때 비-B 세포에 비해 B 세포에서 및 B-세포 연관 질병, 예를 들어 비-호지킨 림프종, 여포성 림프종 및 다발 골수종으로부터의 샘플에서 유의하게 발현되는 것으로서 확인되었으므로, 분자는 포유동물에서 B-세포 연관 암, 예를 들어 림프종, 백혈병, 골수종, 및 조혈 세포의 다른 암을 포함한 종양의 치료법을 위한 뛰어난 표적이다.
실시예
2:
TAHO
mRNA
발현의 정량적 분석
본 분석에서, 상이한 세포 종류, 예를 들어 다른 1차 백혈구 종류에 비해 특이적인 조직 종류, 예를 들어 B 세포에서 유의하게 과다발현되고, 추가로 특이적인 조직 종류의 비-암성 세포에 비해 특이적인 조직 종류의 암성 세포에서 과다발현될 수 있는 유전자를 찾기 위해 5' 뉴클레아제 분석 (예를 들어, TaqMan®) 및 실시간 정량적 PCR (예를 들어, Mx3000P™ 실시간 PCR 시스템 (스트라타젠)을 사용하였다. 5' 뉴클레아제 분석 반응은 유전자 발현을 실시간으로 모니터링하기 위해 Taq DNA 중합효소의 5' 엑소뉴클레아제 활성을 이용하는 형광 PCR-기반 기술이다. 2개의 올리고뉴클레오티드 프라이머 (그의 서열은 목적하는 유전자 또는 EST 서열에 기반한다)를 사용하여 PCR 반응을 대표하는 앰플리콘을 생성하였다. 2개의 PCR 프라이머 사이에 위치하는 뉴클레오티드 서열을 검출하기 위해 제3 올리고뉴클레오티드, 또는 프로브를 설계하였다. 프로브는 Taq DNA 중합효소에 의해 비-연장가능하고, 리포터 형광 염료 및 켄쳐 형광 염료로 표지된다. 리포터 염료로부터의 임의의 레이저-유도된 방출은 2개의 염료가 프로브 상에 존재하는 것과 같이 서로 가까이 놓일 때 켄칭 염료에 의해 켄칭된다. PCR 증폭 반응 동안, Taq DNA 중합효소는 프로브를 주형-의존 방식으로 절단한다. 생성되는 프로브 단편은 용액 중에서 분리되고, 방출된 리포터 염료로부터의 신호는 제2 형광단의 켄칭 효과를 받지 않는다. 리포터 염료의 하나의 분자는 합성된 각각의 새로운 분자에 대해 유리되고, 비켄칭된 리포터 염료의 검출은 데이타의 정량적 해석을 위한 기초를 제공한다.
5' 뉴클레아제 절차를 실시간 정량적 PCR 장치, 예를 들어 Mx3000™ 실시간 PCR 시스템 상에서 실행한다. 시스템은 써모사이클러 (thermocycler), 석영-텅스텐 램프, 검출을 위한 광전증배관 (PMT) 및 컴퓨터로 이루어진다. 시스템은 써모사이클러 상에서 96-웰 포맷에서 샘플을 증폭시킨다. 증폭 동안, 레이저-유도된 형광 신호를 96개의 웰 모두에 대해 광섬유 케이블을 통해 실시간으로 수집하고, PMT에서 검출한다. 시스템은 기기를 실행시키고 데이타를 분석하기 위한 소프트웨어를 포함한다.
스크린을 위한 출발 물질은 다양한 상이한 백혈구 종류 (호중구 (Neutr), 자연 살해 세포 (NK), 수지상 세포 (Dend.), 단핵구 (Mono), T 세포 (CD4+ 및 CD8+ 하위세트), 줄기세포 (CD34+) 및 공여자 변이성을 시험하기 위해 20개의 별개의 B 세포 공여자 (공여자 Id 310, 330, 357, 362, 597, 635, 816, 1012, 1013, 1020, 1072, 1074, 1075, 1076, 1077, 1086, 1096, 1098, 1109, 1112)로부터 단리된 mRNA (50 ng/웰, 이중으로 실행)이었다. 모든 RNA는 상업적으로 구입하였고 (올셀즈, 엘엘씨 (AllCells, LLC, 미국 캘리포니아주 버컬리), 각각의 농도를 수령시에 정확하게 측정하였다. mRNA는 예를 들어, 형광측정에 의해 정확하게 측정된다.
5' 뉴클레아제 분석 데이타는 초기에 Ct, 즉 역치 사이클로서 표현한다. 이는 리포터 신호가 배경 수준의 형광을 넘어 축적하는 사이클로서 정의된다. ΔCt 값은 핵산 샘플 내에서 특정 표적 서열의 출발 카피의 상대수의 정량적 측정치로서 사용된다. 1 Ct 단위는 1 PCR 사이클, 또는 정상에 비해 약 2배 상대 증가에 상응하고, 2 단위는 4배 상대 증가에 상응하고, 3 단위는 8배 상대 증가에 상응하는 등이므로, 2개 이상의 상이한 조직 사이에서 mRNA 발현의 상대 증가 배수를 정량적으로 측정할 수 있다. 샘플 내에서 Ct 값이 낮을수록, 특정 유전자의 출발 카피수가 더 높다. 표준 곡선을 분석에 포함시키면, 각각의 표적의 상대적인 양을 외삽할 수 있고, 보다 높은 카피수가 또한 상대적인 양을 갖는 것으로서 (보다 높은 카피수가 보다 낮은 Ct 값을 갖는 것에 반대로) 데이타의 관찰을 용이하게 하고, 또한 2배 증가 규칙과 동일한 일반화된 1 Ct의 임의의 변이에 대해 교정한다. 상기 기술을 이용하여, 아래 나열된 분자가 상이한 조직 또는 세포 종류 (동일한 및 상이한 조직 공여자 모두로부터의)에 비해 단일 (또는 제한된 수)의 특이적인 조직 또는 세포 종류에서 유의하게 과다발현된 (즉, 적어도 2배) 것으로서 확인되었고, 그 중 일부는 또한 특정 조직 또는 세포 종류의 정상 세포에 비해 암성 세포에서 유의하게 과다발현된 (즉, 적어도 2배) 것으로서 확인되고, 따라서, 포유동물에서 암의 치료법을 위한 뛰어난 폴리펩티드 표적을 나타낸다.
요약
정제된 B 세포로부터 또는 20개의 B 세포 공여자 (310-1112) (올셀즈)로부터의 B 세포 및 평균 (Avg. B)으로부터 단리된 총 RNA에서 TAHO4 및 TAHO5 발현 수준은 몇몇 백혈구 종류, 호중구 (Neutr), 자연 살해 세포 (NK) (T 세포 하위세트), 수지상 세포 (Dend), 단핵구 (Mono), CD4+ T 세포, CD8+ T 세포, CD34+ 줄기세포 (데이타를 제시하지 않음)로부터 단리된 총 RNA에서 각각의 TAHO4 및 TAHO5 발현 수준보다 유의하게 더 높았다.
따라서, TAHO4 및 TAHO5는 TaqMan 분석에 의해 검출될 때 비-B 세포에 비해 B 세포 상에서 유의하게 발현되므로, 분자는 포유동물에서 B-세포 연관 암, 예를 들어 림프종 (즉, 비-호지킨 림프종), 백혈병 (즉, 만성 림프구성 백혈병), 골수종 (즉, 다발 골수종), 및 조혈 세포의 다른 암을 포함한 종양의 치료법을 위한 뛰어난 표적이다.
실시예
3:
계내
혼성화
계내 혼성화는 세포 또는 조직 제제 내에서 핵산 서열의 검출 및 국재화를 위한 강력한 다목적 기술이다. 이는 예를 들어, 유전자 발현의 부위를 확인하고, 전사의 조직 분포를 분석하고, 바이러스 감염을 확인하고 국재화하고, 특이적 mRNA 합성에서 변화를 추적하고 염색체 매핑을 돕기 위해 유용할 수 있다.
계내 혼성화는 PCR-생성된 33P-표지된 리보프로브를 사용하여 문헌 [Lu and Gillett, Cell Vision 1:169-176 (1994)]에 의한 프로토콜의 최적화된 버전에 따라 수행하였다. 간단히 설명하면, 포르말린-고정시키고 파라핀-포매한 인간 조직을 절편화하고, 파라핀제거하고, 프로테이나제 K (20 g/ml) 내에서 15분 동안 37EC에서 단백질 제거하고, 문헌 [Lu and Gillett, 상기 문헌]에 설명된 바와 같이 계내 혼성화를 위해 추가로 처리하였다. [33-P] UTP-표지된 안티센스 리보프로브를 PCR 생성물로부터 생성하고, 55EC에서 밤새 혼성화시켰다. 슬라이드를 Kodak NTB2 핵 트랙 (track) 에멀젼 내에 담그고, 4주 동안 노출시켰다.
33
P-
리보프로브
합성
6.0 ㎕ (125 mCi)의 33P-UTP (아머샴 (Amersham) BF 1002, SA<2000 Ci/mmol)를 고속 진공 건조시켰다. 건조된 33P-UTP를 함유하는 각각의 튜브에, 다음 성분을 첨가하였다:
2.0 ㎕ 5x 전사 버퍼
1.0 ㎕ DTT (100 mM)
2.0 ㎕ NTP 믹스 (2.5 mM: 10 μ; 각각의 10 mM GTP, CTP & ATP + 10 ㎕ H2O)
1.0 ㎕ UTP (50 μM)
1.0 ㎕ Rnasin
1.0 ㎕ DNA 주형 (1 ㎍)
1.0 ㎕ H2O
1.0 ㎕ RNA 중합효소 (대체로 PCR 생성물 T3 = AS, T7 = S)
튜브를 37EC에서 1시간 동안 인큐베이팅하였다. 1.0 ㎕ RQ1 DNase를 첨가한 후, 37EC에서 15분 동안 인큐베이팅하였다. 90 ㎕ TE (10 mM Tris pH 7.6/1 mM EDTA pH 8.0)를 첨가하고, 혼합물을 DE81 종이 상으로 피펫팅하였다. 남아있는 용액을 Microcon-50 한외여과 유닛 내에 로딩하고, 프로그램 10 (6분)을 이용하여 회전시켰다. 여과 유닛을 제2 튜브 위에 뒤집고, 프로그램 2 (3분)를 이용하여 회전시켰다. 최종 회수 회전 후에, 100 ㎕ TE를 첨가하였다. 1 ㎕의 최종 생성물을 DE81 종이 상에 피펫팅하고, 6 ml의 Biofluor II에서 계수하였다.
프로브를 TBE/우레아 겔 상에서 진행시켰다. 1-3 ㎕의 프로브 또는 5 ㎕의 RNA Mrk III을 3 ㎕의 로딩 버퍼에 첨가하였다. 95EC 가열 블록 상에서 3분 동안 가열한 후, 프로브를 즉시 얼음 상에 놓았다. 겔의 웰을 플러싱하고, 샘플을 로딩하고, 180-250 볼트에서 45분 동안 진행시켰다. 겔을 사란 (saran) 랩으로 싸고, -70EC 동결기 내에서 1시간 내지 밤새 증감지 (intensifying screen)가 있는 XAR 필름에 노출시켰다.
33
P-
혼성화
A. 동결된 절편의 예비처리
슬라이드를 동결기로부터 제거하여, 알루미늄 트레이 상에 놓고, 실온에서 5분 동안 해동시켰다. 트레이를 55EC 인큐베이터 내에 5분 동안 넣어 응축을 감소시켰다. 슬라이드를 흄 (fume) 후드 내에서 얼음 상에서 4% 파라포름알데히드로 10분 동안 고정시키고, 0.5 x SSC 내에서 5분 동안 실온에서 (25 ml 20 x SSC + 975 ml SQ H2O) 세척하였다. 0.5 ㎍/ml 프로테이나제 K 내에서 10분 동안 37EC에서 단백질 제거 후에 (250 ml 예온시킨 RNase가 없는 RNAse 버퍼 중 12.5 ㎕의 10 mg/ml 원액), 절편을 0.5 x SSC 내에서 10분 동안 실온에서 세척하였다. 절편을 70%, 95%, 100% 에탄올 내에서 각각 2분 탈수시켰다.
B. 파라핀- 포매된 절편의 예비처리
슬라이드를 파라핀제거하고, SQ H2O 내에 넣고, 실온에서 2 x SSC 내에서 2회, 각각 5분 동안 세정하였다. 절편을 20 ㎍/ml 프로테이나제 K (250 ml RNase이 없는 RNase 버퍼 중 500 ㎕의 10 mg/ml; 37EC, 15분) - 인간 배아, 또는 8 x 프로테이나제 K (250 ml Rnase 버퍼 중 100 ㎕, 37EC, 30분) - 포르말린 조직 내에서 단백질 제거하였다. 0.5 x SSC 내에서 후속적인 세정 및 탈수를 상기 설명한 바와 같이 수행하였다.
C. 예비혼성화
슬라이드를 버퍼 (4 x SSC, 50% 포름아미드)-포화 여과지가 대여진 플라스틱 상자 내에 펼쳐놓았다.
D. 혼성화
슬라이드당 1.0 x 106 cpm 프로브 및 1.0 ㎕ tRNA (50 mg/ml 원액)을 95EC에서 3분 동안 가열하였다. 슬라이드를 얼음 상에서 냉각시키고, 슬라이드당 48 ㎕ 혼성화 버퍼를 첨가하였다. 볼텍싱 후에, 50 ㎕ 33P 믹스를 슬라이드 상의 50 ㎕ 예비혼성화액에 첨가하였다. 슬라이드를 55EC에서 밤새 인큐베이팅하였다.
E. 세척
세척은 2xSSC, EDTA로 실온에서 2 x 10분으로 이루어졌고 (400 ml 20 x SSC + 16 ml 0.25M EDTA, Vf=4L), 이어서 37EC에서 30분 동안 RNaseA 처리하였다 (250 ml Rnase 버퍼 중 500 ㎕의 10 mg/ml = 20 ㎍/ml), 슬라이드를 2 x 10분 동안 2 x SSC, EDTA로 실온에서 세척하였다. 엄격성 세척 조건은 다음과 같았다: 55EC에서 2시간, 0.1 x SSC, EDTA (20 ml 20 x SSC + 16 ml EDTA, Vf=4L).
F. 올리고뉴클레오티드
계내 분석을 본원에 개시된 다양한 DNA 서열에 대해 수행하였다. 이들 분석을 위해 사용된 올리고뉴클레오티드는 첨부 도면에 제시된 바와 같은 핵산 (또는 그의 상보체)에 대해 상보성이도록 얻었다.
(1) DNA225785 ( TAHO4 )
G. 결과
계내 분석을 본원에 개시된 다양한 DNA 서열에 대해 수행하였다. 이들 분석으로부터의 결과는 다음과 같다.
(1) DNA225785 ( TAHO4 )
발현은 림프계 세포에서 관찰되었다. 구체적으로, 정상 조직에서, 발현은 비장 및 림프절에서 관찰되었고, B 세포 영역, 예를 들어 배 중심, 외투, 및 변연대과 일치한다. 유의한 발현이 다양한 악성 림프종, 예를 들어 호지킨 림프종, 여포성 림프종, 미만성 대세포 림프종, 소림프구성 림프종 및 비-호지킨 림프종의 조직 절편 또한 관찰되었다. 상기 데이타는 조혈계 종양, 구체적으로 B-세포 종양에서 상기 분자의 잠재적인 역할과 일치한다.
실시예
4:
혼성화
프로브로서
TAHO
의 용도
다음 방법은 혼성화 프로브로서, 즉, 포유동물에서 TAHO의 존재의 검출을 위한 TAHO를 코딩하는 뉴클레오티드 서열의 용도를 설명한다.
본원에서 개시되는 전장 또는 성숙 TAHO의 코딩 서열을 포함하는 DNA는 또한 인간 조직 cDNA 라이브러리 또는 인간 조직 게놈 라이브러리 내에서 상동성 DNA (예를 들어, TAHO의 자연 발생 변이체를 코딩하는 것)를 스크리닝하기 위해 프로브로서 사용될 수 있다.
라이브러리 DNA를 함유하는 필터의 혼성화 및 세척을 다음 고 엄격성 조건 하에 수행한다. 필터에 대한 방사선 표지된 TAHO-유래된 프로브의 혼성화는 50% 포름아미드, 5x SSC, 0.1% SDS, 0.1% 피로인산나트륨, 50 mM 인산나트륨 (pH 6.8), 2x 덴하르트 용액, 및 10% 덱스트란 술페이트의 용액 내에서 42℃에서 20시간 동안 수행한다. 필터의 세척은 0.1x SSC 및 0.1% SDS의 수용액 내에서 42℃에서 수행한다.
이어서, 전장 천연 서열 TAHO를 코딩하는 DNA과 목적하는 서열 동일성을 갖는 DNA를 당업계에 공지된 표준 기술을 이용하여 확인할 수 있다.
실시예
5: 이.
콜라이에서
TAHO
의 발현
본 실시예는 이. 콜라이 내에서 재조합 발현에 의한 비글리코실화된 형태의 TAHO의 제조를 예시한다.
TAHO를 코딩하는 DNA 서열을 선택된 PCR 프라이머를 사용하여 초기에 증폭시킨다. 프라이머는 선택된 발현 벡터 상의 제한 효소 부위에 대응하는 제한 효소 부위를 함유해야 한다. 다양한 발현 벡터를 사용할 수 있다. 적합한 벡터의 예는 암피실린 및 테트라사이클린 내성에 대한 유전자를 함유하는 pBR322 (이. 콜라이로부터 유래함; [Bolivar et al., Gene, 2:95 (1977)] 참조)이다. 벡터를 제한 효소로 소화시키고 탈인산화시킨다. 이어서, PCR 증폭된 서열을 벡터 내로 라이게이팅시킨다. 벡터는 바람직하게는 항생제 내성 유전자, trp 프로모터, 폴리his 리더 (제1 STII 코돈 6개 , 폴리his 서열, 및 엔테로키나제 절단 부위 포함), TAHO 코딩 영역, 람다 전사 종결자, 및 argU 유전자를 코딩하는 서열을 포함할 것이다.
이어서, 라이게이션 혼합물을 사용하여, 문헌 [Sambrook et al., 상기 문헌]에 설명된 방법을 이용하여 선택된 이. 콜라이 균주를 형질전환시킨다. 형질전환체는 LB 플레이트 상에서 성장하는 그의 능력에 의해 확인되고, 이어서 항생제 내성 콜로니를 선택한다. 제한 분석 및 DNA 서열 결정에 의해 플라스미드 DNA를 단리하고 확인할 수 있다.
선택된 클론을 액체 배양 배지, 예를 들어 항생제를 보충한 LB 브로쓰 내에서 밤새 성장시킬 수 있다. 후속적으로 철야 배양액을 사용하여 보다 대규모 배양액을 접종한다. 이어서, 세포를 목적하는 광학 밀도로 성장시키고, 이 동안 발현 프로모터가 작동한다.
세포를 추가의 수시간 동안 배양한 후, 세포를 원심분리에 의해 회수할 수 있다. 원심분리에 의해 수득한 세포 펠렛을 당업계에 공지된 다양한 물질을 이용하여 가용화시킬 수 있고, 이어서, 가용화된 TAHO 단백질을 단백질의 밀접한 결합을 허용하는 조건 하에 금속 킬레이팅 컬럼을 사용하여 정제할 수 있다.
TAHO는 다음 절차를 이용하여 이. 콜라이 내에서 폴리-His 태깅된 형태로 발현될 수 있다. TAHO를 코딩하는 DNA는 선택된 PCR 프라이머를 사용하여 초기에 증폭시킨다. 프라이머는 선택된 발현 벡터 상의 제한 효소 부위에 대응하는 제한 효소 부위, 및 효율적이고 신뢰가능한 번역 개시, 금속 킬레이션 컬럼 상의 신속한 정제, 및 엔테로키나제를 사용한 단백 분해 제거를 제공하는 다른 유용한 서열을 함유할 것이다. 이어서, PCR-증폭시킨 폴리-His 태깅된 서열을 발현 벡터 내로 라이게이팅시키고, 이를 사용하여 균주 52에 기반한 이. 콜라이 숙주 (W3110 fuhA(tonA) lon galE rpoHts(htpRts) clpP(lacIq)를 형질전환시킨다. 형질전환체를 처음에 50 mg/ml 카르베니실린을 함유하는 LB 내에서 30EC에서 교반하면서 3-5의 O.D.600에 도달할 때까지 성장시킨다. 이어서, 배양액을 CRAP 배지 (500 mL 물 중에 3.57 g (NH4)2SO4, 0.71 g 시트르산나트륨·2H2O, 1.07 g KCl, 5.36 g Difco 효모 추출물, 5.36 g Sheffield 하이카제 SF뿐만 아니라 110 mM MPOS (pH 7.3), 0.55% (w/v) 글루코스 및 7 mM MgSO4) 내로 50-100배 희석시키고, 약 20-30시간 동안 30EC에서 교반하면서 성장시킨다. 샘플을 제거하여 SDS-PAGE 분석에 의해 발현을 입증하고, 벌크 배양액을 원심분리하여 세포를 펠렛화시킨다. 정제 및 재폴딩 (refolding)때까지 세포 펠렛을 동결시킨다.
0.5 내지 1 L 발효액으로부터의 이. 콜라이 페이스트 (6-10 g 펠렛)를 10 부피 (w/v)로 7 M 구아니딘, 20 mM Tris, pH 8 버퍼 내에 재현탁시킨다. 고체 아황산나트륨 및 나트륨 테트라티오네이트를 첨가하여 각각 0.1 M 및 0.02 M의 최종 농도로 제조하고, 용액을 밤새 4EC에서 교반한다. 상기 단계는 모든 시스테인 잔기가 술피톨화 (sulfitolization)에 의해 차단된 변성된 단백질을 생성시킨다. 용액을 40,000 rpm에서 벡맨 (Beckman) 초원심분리기 내에서 30 min 동안 원심분리한다. 상등액을 3-5 부피의 금속 킬레이트 컬럼 버퍼 (6 M 구아니딘, 20 mM Tris, pH 7.4)로 희석하고, 0.22 미크론 필터를 통해 여과하여 청정화시킨다. 청정화된 추출물을 금속 킬레이트 컬럼 버퍼 내에 평형화시킨 5 ml 퀴아겐 Ni-NTA 금속 킬레이트 컬럼 상에 로딩한다. 컬럼을 50 mM 이미다졸 (칼바이오켐 (Calbiochem), Utrol 등급), pH 7.4를 함유하는 추가의 버퍼로 세척한다. 단백질을 250 mM 이미다졸을 함유하는 버퍼로 용출시킨다. 목적하는 단백질을 함유하는 분획을 모으고 4EC에서 저장한다. 단백질 농도는 그의 아미노산 서열에 기반하여 계산된 소광 계수를 이용하여 280 nm에서 그의 흡광도에 의해 추정한다.
샘플을 20 mM Tris, pH 8.6, 0.3 M NaCl, 2.5 M 우레아, 5 mM 시스테인, 20 mM 글라이신 및 1 mM EDTA로 이루어지는 새로 제조한 재폴딩 버퍼 내에 서서히 희석함으로써 단백질을 재폴딩시킨다. 재폴딩 부피는 최종 단백질 농도가 50 내지 100 ㎍/ml이도록 선택된다. 재폴딩 용액을 4EC에서 12-36시간 동안 부드럽게 교반한다. 재폴딩 반응은 TFA를 0.4%의 최종 농도 (pH 약 3)로 첨가함으로써 켄칭시킨다. 단백질의 추가의 정제 전에, 용액을 0.22 미크론 필터를 통해 여과하고, 아세토니트릴을 2-10% 최종 농도로 첨가한다. 재폴딩된 단백질을 Poros R1/H 역상 컬럼 상에서 10 내지 80%의 아세토니트릴 구배로 용출시키면서 0.1% TFA의 이동상 버퍼를 사용하여 크로마토그래피한다. A280 흡광도를 갖는 분획의 분취액을 SDS 폴리아크릴아미드 겔 상에서 분석하고, 균질한 재폴딩된 단백질을 함유하는 분획을 모은다. 일반적으로, 대부분의 단백질의 적합하게 재폴딩된 종은 최소 농도의 아세토니트릴에서 용출되고, 이는 이들 종이 그들의 소수성 내부가 역상 수지와의 상호작용으로부터 차폐되어 가장 치밀하기 때문이다. 응집된 종은 대체로 보다 높은 아세토니트릴 농도에서 용출된다. 미스폴딩된 형태의 단백질을 목적하는 형태로부터 분리하는 것에 추가로, 역상 단계는 또한 샘플로부터 내독소를 제거한다.
목적하는 폴딩된 TAHO 폴리펩티드를 함유하는 분획을 모으고, 용액에 보내진 질소의 부드러운 스트림을 이용하여 아세토니트릴을 제거한다. 단백질을 0.14 M 염화나트륨 및 4% 만니톨을 갖는 20 mM Hepes (pH 6.8) 내로 투석에 의해 또는 제제화 버퍼 내에 평형화시킨 G25 Superfine (파마시아 (Pharmacia)) 수지를 사용하는 겔 여과에 의해 제제화시키고 멸균 여과한다.
본원에 개시된 특정 TAHO 폴리펩티드는 상기 기술(들)을 이용하여 성공적으로 발현되고 정제되었다.
실시예
6: 포유동물 세포에서
TAHO
의 발현
본 실시예는 포유동물 세포에서 재조합 발현에 의한 잠재적으로 글리코실화된 형태의 TAHO의 제조를 예시한다.
벡터 pRK5 (EP 307,247 (1989년 3월 15일 공개) 참조)를 발현 벡터로서 사용한다. 임의로, TAHO DNA를 문헌 [Sambrook et al., 상기 문헌]에 설명된 것과 같은 라이게이션 방법을 이용하여 TAHO DNA의 삽입을 허용하도록 선택된 제한 효소를 사용하여 pRK5 내로 라이게이팅시킨다. 생성되는 벡터는 pRK5-TAHO로 불린다.
한 실시태양에서, 선택된 숙주 세포는 293 세포일 수 있다. 인간 293 세포 (ATCC CCL 1573)를 조직 배양 플레이트 내에서 태 송아지 혈청 및 임의로 영양 성분 및/또는 항생제를 보충한 DMEM과 같은 배지 내에서 융합까지 성장시킨다. 약 10 ㎍ pRK5-TAHO DNA를 VA RNA 유전자를 코딩하는 DNA 약 1 ㎍과 혼합하고 [Thimmappaya et al., Cell, 31:543 (1982)], 500 ㎕의 1 mM Tris-HCl, 0.1 mM EDTA, 0.227 M CaCl2에 용해시킨다. 상기 혼합물에 500 ㎕의 50 mM HEPES (pH 7.35), 280 mM NaCl, 1.5 mM NaPO4를 적가하고, 10분 동안 25℃에서 침전물을 형성시킨다. 침전물을 현탁시키고 293 세포에 첨가하고, 약 4시간 동안 37℃에서 침강시킨다. 배양 배지를 흡인 제거하고, PBS 중 20% 글리세롤 2 ml을 30초 동안 첨가한다. 이어서, 293 세포를 무혈청 배지로 세척하고, 신선한 배지를 첨가하고, 세포를 약 5일 동안 인큐베이팅한다.
형질감염 약 24시간 후에, 배양 배지를 제거하고 배양 배지 (단독), 또는 200 μCi/ml 35S-시스테인 및 200 μCi/ml 35S-메티오닌을 함유하는 배양 배지로 교체한다. 12시간 인큐베이션 후에, 조건화된 배지를 수집하고, 스핀 (spin) 필터 상에서 농축시키고, 15% SDS 겔 상에 로딩한다. 처리된 겔을 건조시키고, TAHO 폴리펩티드의 존재를 밝히기 위해 선택된 기간 동안 필름에 노출시킬 수 있다. 형질감염된 세포를 함유하는 배양액을 추가로 인큐베이션시킬 수 있고 (무혈청 배지 내에서), 배지를 선택된 생물검정으로 시험한다.
별도의 기술에서, TAHO는 문헌 [Somparyrac et al., Proc. Natl. Acad. Sci., 12:7575 (1981)]에 설명된 덱스트란 술페이트 방법을 이용하여 293 세포 내로 일시적으로 도입될 수 있다. 293 세포를 스피너 (spinner) 플라스크 내에서 최대 밀도로 성장시키고, 700 ㎍ pRK5-TAHO DNA를 첨가한다. 세포는 원심분리에 의해 스피너 플라스크로부터 처음 농축시키고, PBS로 세척한다. DNA-덱스트란 침전물을 세포 펠렛 상에서 4시간 동안 인큐베이팅한다. 세포를 90초 동안 20% 글리세롤로 처리하고, 조직 배양 배지로 세척하고, 조직 배양 배지, 5 ㎍/ml 소 인슐린 및 0.1 ㎍/ml 소 트랜스페린을 함유하는 스피너 플라스크 내로 재도입시킨다. 약 4일 후에, 조건화된 배지를 원심분리하고, 여과하여 세포 및 파쇄물을 제거한다. 이어서, 발현된 TAHO를 함유하는 샘플을 임의의 선택된 방법, 예를 들어 투석 및/또는 컬럼 크로마토그래피에 의해 농축하고 정제할 수 있다.
다른 실시태양에서, TAHO는 CHO 세포에서 발현될 수 있다. pRK5-TAHO는 CaPO4 또는 DEAE-덱스트란과 같은 공지의 시약을 사용하여 CHO 세포 내로 형질감염될 수 있다. 상기 설명된 바와 같이, 세포 배양액을 인큐베이팅하고, 배지를 배양 배지 (단독), 또는 35S-메티오닌과 같은 방사성 표지를 함유하는 배지로 교체할 수 있다. TAHO 폴리펩티드의 존재를 결정한 후에, 배양 배지를 무혈청 배지로 교체할 수 있다. 바람직하게는, 배양액을 약 6일 동안 인큐베이팅한 후, 조건화된 배지를 회수한다. 이어서, 발현된 TAHO를 함유하는 배지를 임의의 선택된 방법에 의해 농축하고 정제할 수 있다.
에피토프-태깅된 TAHO가 또한 숙주 CHO 세포에서 발현될 수 있다. TAHO는 pRK5 벡터에서 서브클로닝될 수 있다. 서브클론 삽입물은 PCR를 거쳐, 선택된 에피토프 태그, 예를 들어 폴리-his 태그와 인 프레임 (in frame)으로 바큘로바이러스 발현 벡터 내로 융합될 수 있다. 이어서, 폴리-his 태깅된 TAHO 삽입물은 안정한 클론의 선택을 위한 DHFR과 같은 선택 마커를 함유하는 SV40 구동 (driven) 벡터 내로 서브클로닝될 수 있다. 마지막으로, CHO 세포는 SV40 구동 벡터로 형질감염될 수 있다 (상기 설명된 바와 같이). 표지는 발현을 입증하기 위해 상기 설명된 바와 같이 수행될 수 있다. 이어서, 발현된 폴리-His 태깅된 TAHO를 함유하는 배양 배지를 임의의 선택된 방법, 예를 들어 Ni2 +-킬레이트 친화도 크로마토그래피에 의해 농축하고 정제할 수 있다.
TAHO는 또한 일시적인 발현 절차에 의해 CHO 및/또는 COS 세포 내에서, 또는 다른 안정한 발현 절차에 의해 CHO 세포 내에서 발현될 수 있다.
CHO 세포에서 안정한 발현은 다음 절차를 이용하여 수행한다. 단백질은 IgG 구성체 (면역어드헤신) (여기서 각각의 단백질의 가용성 형태 (예를 들어 세포외 도메인)에 대한 코딩 서열이 힌지, CH2 및 CH2 도메인을 함유하는 IgG1 불변 영역 서열에 융합된다)로서 발현되고/되거나 폴리-His 태깅된 형태이다.
PCR 증폭 후에, 각각의 DNA는 문헌 [Ausubel et al., Current Protocols of Molecular Biology, Unit 3.16, John Wiley and Sons (1997)]에 설명된 바와 같이 표준 기술을 이용하여 CHO 발현 벡터 내에서 서브클로닝된다. CHO 발현 벡터는 cDNA의 편리한 셔틀링 (shuttling)을 허용하도록 목적하는 DNA의 5' 및 3'에 상호적합성인 제한 부위를 갖도록 구성된다. CHO 세포에서 발현에 사용된 벡터는 문헌 [Lucas et al., Nucl. Acids Res. 24:9 (1774-1779) (1996)]에 설명된 바와 같고, 목적하는 cDNA의 발현을 구동시키는 SV40 조기 프로모터/인핸서, 및 디히드로폴레이트 환원효소 (DHFR)를 사용한다. DHFR 발현은 형질감염 후에 플라스미드의 안정한 유지를 위한 선택을 허용한다.
12 ㎍의 목적하는 플라스미드 DNA를 상업적으로 이용가능한 형질감염 시약 Superfect® (퀴아겐 (Quiagen)), Dosper® 또는 Fugene® (뵈링거 만하임 (Boehringer Mannheim))을 사용하여 약 1천만의 CHO 세포 내로 도입시킨다. 세포는 문헌 [Lucas et al., 상기 문헌]에 설명된 바와 같이 성장시킨다. 약 3 x 107개의 세포를 아래 설명된 바와 같이 추가의 성장 및 생산을 위해 앰플 내에서 동결시킨다.
플라스미드 DNA를 함유하는 앰플을 수조 내에 놓아 해동시키고 볼텍싱에 의해 혼합한다. 내용물을 10 mL의 배지를 함유하는 원심분리관 내로 피펫팅하고, 1000 rpm에서 5분 동안 원심분리한다. 상등액을 흡인시키고, 세포를 10 mL의 선택 배지 (5% 0.2 Φm 투석여과된 태아 소 혈청을 갖는 0.2 Φm 여과된 PS20) 내에 재현탁시킨다. 이어서, 세포를 90 mL의 선택 배지를 함유하는 100 mL 스피너 플라스크 내에 분취한다. 1-2일 후에, 세포를 150 mL 선택 성장 배지를 채운 250 mL 스피너에 옮기고, 37℃에서 인큐베이팅한다. 추가로 2-3일 후에, 250 mL, 500 mL 및 2000 mL 스피너에 3 x 105 세포/mL로 접종한다. 세포 배지를 원심분리 및 생산 배지 내에 재현탁에 의해 신선한 배지로 교환한다. 임의의 적합한 CHO 배지를 사용할 수 있지만, 미국 특허 5,122,469 (1992년 6월 16일 등록)에 기재된 생산 배지를 실제로 사용할 수 있다. 3L 생산 스피너를 1.2 x 106 세포/mL로 접종한다. 제0일에, 세포 수, pH를 결정한다. 제1일에, 스피너를 샘플링하고, 여과된 공기 분사를 시작한다. 제2일에, 스피너를 샘플링하고, 온도를 33℃로 바꾸고, 30 mL의 500 g/L 글루코스 및 0.6 mL의 10% 소포제 (예를 들어, 35% 폴리디메틸실록산 에멀젼, 다우 코닝 (Dow Corning) 365 의료 등급 에멀젼)을 첨가한다. 생산 기간 내내, pH를 필요한 대로 약 7.2에 유지하도록 조정한다. 10일 후에, 또는 생존력이 70% 미만으로 떨어질 때까지, 세포 배양액을 원심분리 및 0.22 Φm 필터를 통한 여과에 의해 회수한다. 여과액을 4℃에서 저장하거나, 정제를 위해 컬럼 상에 즉시 로딩한다.
폴리-His 태깅된 구성체에 대해, Ni-NTA 컬럼 (퀴아겐)을 사용하여 단백질을 정제한다. 정제 전에, 이미다졸을 조건화된 배지에 5 mM의 농도로 첨가한다. 조건화된 배지를 4℃에서 0.3 M NaCl 및 5 mM 이미다졸을 함유하는 20 mM Hepes (pH 7.4) 버퍼 내에 평형화시킨 6 ml Ni-NTA 컬럼 상으로 4-5 ml/min의 유속으로 펌핑한다. 로딩 후에, 컬럼을 추가의 평형화 버퍼로 세척하고, 단백질을 0.25 M 이미다졸을 함유하는 평형화 버퍼로 용출시킨다. 고도로 정제된 단백질을 후속적으로 25 ml G25 Superfine (파마시아) 컬럼을 사용하여 10 mM Hepes, 0.14 M NaCl 및 4% 만니톨 (pH 6.8)을 함유하는 저장 버퍼로 탈염시키고, -80℃에서 저장한다.
면역어드헤신 (Fc-함유) 구성체를 다음과 같이 조건화된 배지로부터 정제한다. 조건화된 배지를 20 mM Na 포스페이트 버퍼 (pH 6.8) 내에 평형화시킨 5 ml 단백질 A 컬럼 (파마시아) 상으로 펌핑한다. 로딩 후에, 컬럼을 평형화 버퍼로 광범하게 세척한 후, 100 mM 시트르산 (pH 3.5)으로 용출시킨다. 용출된 단백질을 1 ml 분획을 275 ΦL의 1 M Tris 버퍼 (pH 9)를 함유하는 튜브 내로 수집함으로써 즉시 중화시킨다. 고도로 정제된 단백질을 후속적으로 폴리-His 태깅된 단백질에 대해 상기 설명한 바와 같이 저장 버퍼 내로 탈염시킨다. 균질성은 SDS 폴리아크릴아미드 겔에 의해 및 Edman 분해법에 의한 N-말단 아미노산 서열 결정에 의해 평가한다.
본원에 개시된 특정 TAHO 폴리펩티드는 상기 기술(들)을 이용하여 성공적으로 발현되고 정제되었다.
실시예
7:
효모에서
TAHO
의 발현
다음 방법은 효모에서 TAHO의 재조합 발현을 설명한다.
먼저, ADH2/GAPDH 프로모터로부터 TAHO의 세포내 생산 또는 분비를 위한 효모 발현 벡터를 구성한다. TAHO 및 프로모터를 코딩하는 DNA를 TAHO의 세포내 발현을 지시하도록 선택된 플라스미드 내의 적합한 제한 효소 부위 내로 삽입한다. 분비를 위해, TAHO를 코딩하는 DNA는 TAHO의 발현을 위한 ADH2/GAPDH 프로모터를 코딩하는 DNA, 천연 TAHO 신호 펩티드 또는 다른 포유동물 신호 펩티드, 또는 예를 들어, 효모 알파-인자 또는 인버타제 분비 신호/리더 서열, 및 링커 서열 (필요한 경우)과 함께 선택된 플라스미드 내로 클로닝될 수 있다.
이어서, 효모 세포, 예를 들어 효모 균주 AB110를 상기 설명된 발현 플라스미드로 형질전환시키고, 선택된 발효 배지 내에서 배양할 수 있다. 형질전환된 효모 상등액은 10% 트리클로로아세트산을 사용하는 침전 및 SDS-PAGE에 의한 분리, 이어서, 쿠마시 블루 염색제를 사용한 겔의 염색에 의해 분석할 수 있다.
재조합 TAHO는 후속적으로 발효 배지로부터 효모 세포를 원심분리에 의해 제거한 후, 선택된 카트리지 필터를 사용하여 배지를 농축시킴으로써 단리하고 정제할 수 있다. TAHO를 함유하는 농축물은 선택된 컬럼 크로마토그래피 수지를 사용하여 추가로 정제할 수 있다.
본원에 개시된 특정 TAHO 폴리펩티드는 상기 기술(들)을 이용하여 성공적으로 발현되고 정제되었다.
실시예
8:
바큘로바이러스
-감염된 곤충 세포에서
TAHO
의 발현
다음 방법은 바큘로바이러스-감염된 곤충 세포에서 TAHO의 재조합 발현을 설명한다.
TAHO를 코딩하는 서열을 바큘로바이러스 발현 벡터 내에 함유된 에피토프 태그의 상류에 융합시킨다. 그러한 에피토프 태그는 폴리-his 태그 및 면역글로불린 태그 (IgG의 Fc 영역과 같은)를 포함한다. pVL1393 (노바겐 (Novagen))과 같은 상업적으로 이용가능한 플라스미드로부터 유래된 플라스미드를 포함한 다양한 플라스미드를 사용할 수 있다. 간단히 설명하면, TAHO를 코딩하는 서열 또는 TAHO의 코딩 서열의 목적하는 부분, 예를 들어 막횡단 단백질의 세포외 도메인을 코딩하는 서열, 또는 단백질이 세포외 단백질인 경우에 성숙 단백질을 코딩하는 서열은 5' 및 3' 영역에 상보성인 프라이머를 사용하는 PCR에 의해 증폭시킨다. 5' 프라이머는 측면에 접하는 (선택된) 제한 효소 부위를 포함할 수 있다. 이어서, 생성물을 선택된 제한 효소로 소화시키고, 발현 벡터 내로 서브클로닝시킨다.
재조합 바큘로바이러스는 리포펙틴 (GIBCO-BRL로부터 상업적으로 이용가능함)을 사용하여 상기 플라스미드 및 BaculoGold™ 바이러스 DNA (파밍엔 (Pharmingen))을 스포돕테라 프루기페르다 ("Sf9") 세포 (ATCC CRL 1711) 내로 동시-형질감염시킴으로써 생성된다. 28℃에서 인큐베이션의 4 - 5일 후에, 방출된 바이러스를 회수하고 추가의 증폭을 위해 사용한다. 바이러스 감염 및 단백질 발현은 문헌 [O'Reilley et al., Baculovirus expression vectors; A Laboratory Manual Oxford: Oxford University Press (1994)]에 설명된 바와 같이 수행한다.
이어서, 발현된 폴리-his 태깅된 TAHO를 예를 들어, 다음과 같이 Ni2 +-킬레이트 친화도 크로마토그래피에 의해 정제할 수 있다. 문헌 [Rupert et al., Nature, 362: 175-179 (1993)]에 설명된 바와 같이 재조합 바이러스-감염된 Sf9 세포로부터 추출물을 제조한다. 간단히 설명하면, Sf9 세포를 세척하고, 초음파분해 버퍼 (25 mL Hepes, pH 7.9; 12.5 mM MgCl2; 0.1 mM EDTA; 10% 글리세롤; 0.1% NP-40; 0.4 M KCl) 내에 재현탁하고, 얼음 상에서 20초 동안 2회 초음파분해한다. 초음파분해물을 원심분리에 의해 청정화하고, 상등액을 로딩 버퍼 (50 mM 포스페이트, 300 mM NaCl, 10% 글리세롤, pH 7.8) 내에 50배 희석하고, 0.45 Φm 필터를 통해 여과한다. Ni2 +-NTA 아가로스 컬럼 (퀴아겐으로부터 상업적으로 이용가능함)을 5 mL의 층 부피로 제조하고, 25 mL의 물로 세척하고, 25 mL의 로딩 버퍼로 평형화시킨다. 여과된 세포 추출물 컬럼 상으로 0.5 mL/분으로 로딩한다. 컬럼을 로딩 버퍼를 사용하여 기준선 A280으로 세척하고, 이 시점에서 분획 수집을 시작한다. 이어서, 컬럼을 비특이적으로 결합된 단백질을 용출시키는 2차 세척 버퍼 (50 mM 포스페이트; 300 mM NaCl, 10% 글리세롤, pH 6.0)로 세척한다. A280 기준선에 다시 도달한 후, 컬럼을 2차 세척 버퍼 중의 0 내지 500 mM 이미다졸 구배로 발색시킨다. 1 mL 분획을 수집하고, SDS-PAGE 및 은 염색 또는 알칼리성 포스파타제 (퀴아겐)에 접합된 Ni2 +-NTA를 사용하는 웨스턴 블롯에 의해 분석하였다. 용출된 His10-태깅된 TAHO를 함유하는 분획을 모으고 로딩 버퍼에 대해 투석한다.
별법으로, IgG 태깅된 (또는 Fc 태깅된) TAHO의 정제는 공지의 크로마토그래피 기술, 예를 들어, 단백질 A 또는 단백질 G 컬럼 크로마토그래피를 이용하여 수행할 수 있다.
본원에 개시된 특정 TAHO 폴리펩티드는 상기 기술(들)을 이용하여 성공적으로 발현되고 정제되었다.
실시예
9:
TAHO
에 결합하는 항체의 제조
본 실시예는 TAHO에 특이적으로 결합할 수 있는 모노클로날 항체의 제조를 예시한다.
모노클로날 항체를 생산하기 위한 기술은 당업계에 공지되어 있고, 예를 들어, [Goding, 상기 문헌]에 설명되어 있다. 사용할 수 있는 면역원은 정제된 TAHO, TAHO를 함유하는 융합 단백질, 및 세포 표면 상에 재조합 TAHO를 발현하는 세포를 포함한다. 면역원의 선택은 당업자에 의해 과도한 실험 없이 이루어질 수 있다.
마우스, 예를 들어 Balb/c를 완전 프로인트 어쥬번트 내에 유화시킨 TAHO 면역원으로 1-100 ㎍의 양으로 피하 또는 복강내 주사하여 면역화시킨다. 별법으로, 면역원을 MPL-TDM 어쥬번트 (리비 이뮤노케미칼 리서치 (Ribi Immunochemical Research, 미국 미주리주 해밀턴))에 유화시키고, 동물의 뒷발바닥에 주사한다. 이어서, 면역화된 마우스에게 10 내지 12일 후에 선택된 어쥬번트 내에 유화된 추가의 면역원을 추가접종한다. 그 후에, 수주 동안, 마우스에게 추가의 면역화 주사를 또한 추가접종할 수 있다. 항-TAHO 항체를 검출하기 위해 ELISA 분석으로 시험하기 위해 혈청 샘플을 마우스로부터 후안와 출혈에 의해 주기적으로 취한다.
적합한 항체 역가가 검출된 후, 항체에 "양성"인 동물에게 면역원의 최종 정맥내 주사를 주사할 수 있다. 3 내지 4일 후에, 마우스를 희생시키고, 비장 세포를 회수한다. 이어서, 비장 세포를 (35% 폴리에틸렌 글리콜을 사용하여) 선택된 쥐 골수종 세포주, 예를 들어 P3X63AgU.1 (ATCC로부터 입수가능함, No. CRL 1597)에 융합시킨다. 융합은 하이브리도마 세포를 생성시키고, 이어서 이를 비-융합된 세포, 골수종 하이브리드, 및 비장 세포 하이브리드의 증식을 억제하기 위해 HAT (하이포잔틴, 아미노프테린, 및 티미딘) 배지를 함유하는 96 웰 조직 배양 플레이트 내에 플레이팅할 수 있다.
하이브리도마 세포는 면역원에 대한 반응성에 대해 ELISA로 스크리닝될 것이다. 면역원에 대한 목적하는 모노클로날 항체를 분비하는 "양성" 하이브리도마 세포의 결정은 당업계의 기술 내에 있다.
양성 하이브리도마 세포를 동계 Balb/c 마우스에 복강내 주사하여 항-면역원 모노클로날 항체를 함유하는 복수를 생산할 수 있다. 별법으로, 하이브리도마 세포를 조직 배양 플라스크 또는 롤러 병 (roller bottle) 내에서 성장시킬 수 있다. 복수에서 생산된 모노클로날 항체의 정제는 황산암모늄 침전에 이어 겔 배제 크로마토그래피에 의해 달성할 수 있다. 별법으로, 단백질 A 또는 단백질 G에 대한 항체의 결합에 기반하는 친화도 크로마토그래피를 사용할 수 있다.
본원에 개시된 특정 TAHO 폴리펩티드에 대해 생성되는 항체는 상기 기술(들)을 이용하여 성공적으로 생산할 수 있다. 보다 구체적으로, 인간 및 사이노몰거스 형태의 TAHO 단백질을 포함한 TAHO 단백질을 인식하고 결합할 수 있는 기능적 모노클로날 항체 (표준 ELISA, FACS 분류 분석 및/또는 면역조직화학 분석에 의해 측정할 때)는 본원에서 개시된 바와 같이 인간 및 사이노몰거스 형태의 TAHO 단백질을 포함한 다음 TAHO 단백질에 대해 성공적으로 생성될 수 있다: TAHO4 (인간 CD79a) (DNA225785), TAHO5 (인간 CD79b) (DNA225786), TAHO39 (cyno CD79a) (DNA548454) 및 TAHO40 (cyno CD79b) (DNA548455).
본원에 설명된 바와 같이 인간 및 사이노몰거스 형태의 TAHO 폴리펩티드를 포함한 TAHO 폴리펩티드에 대해 생성된 모노클로날 항체의 제조에 추가로, 많은 모노클로날 항체가 세포 독소를 인간 및 사이노몰거스 형태의 TAHO 폴리펩티드를 포함하는 목적하는 TAHO 폴리펩티드를 발현하는 (시험관 내에서 및 생체 내에서 모두) 세포 (또는 조직)으로 안내하는데 사용하기 위해 세포 독소에 성공적으로 접합될 수 있다. 예를 들어, 독소 (예를 들어, DM1) 유도체화된 모노클로날 항체는 본원에 설명된 바와 같이 인간 및 사이노몰거스 형태의 TAHO 단백질을 포함한 다음 TAHO 폴리펩티드에 대해 성공적으로 생성될 수 있다: TAHO4 (인간 CD79a) (DNA225785), TAHO5 (인간 CD79b) (DNA225786), TAHO39 (cyno CD79a) (DNA548454) 및 TAHO40 (cyno CD79b) (DNA548455).
CD79a
/
CD79b
(
TAHO4
,
TAHO5
)에 대한
모노클로날
항체의 생성
마우스의 면역화를 위한 단백질은 인간 CD79a, 인간 CD79b 또는 사이노몰거스 원숭이 CD79b의 Fc-태깅된 또는 His-태깅된 세포외 도메인 (ECD)을 발현하는 벡터를 CHO 세포 내로 일시적으로 형질감염시켜 생성하였다. 단백질은 단백질 A 컬럼 상에서 형질감염된 세포 상등액으로부터 정제하고, 단백질의 동일성은 N-말단 서열 결정에 의해 확인하였다.
CD79a (인간) 항체에 대해, 10마리의 Balb/c 마우스 (찰스 리버 래보래토리스 (Charles River Laboratories; 미국 캘리포니아주 홀리스터))를 인간 CD79a의 재조합 Fc-태깅된 ECD로 과면역화시켰다. CD79b (인간) 항체에 대해, 10마리의 Balb/c 마우스 (찰스 리버 래보래토리스)를 인간 CD79b의 재조합 Fc-태깅된 또는 His-태깅된 ECD로 과면역화시켰다. CD79b (사이노몰거스 원숭이) 항체에 대해, 10마리의 Balb/c 마우스 (찰스 리버 래보래토리스)를 리비 어쥬번트 (리비 이뮤노케미칼 리서치) 중의 사이노몰거스 원숭이 CD79b 단백질의 재조합 Fc-태깅된 ECD로 과면역화시켰다.
인간 CD79a 항체에 대해, 직접적 ELISA에 의해 인간 CD79a 면역원에 대해 높은 항체 역가, 및 Raji 세포 (CD79- B-세포주)에 대해 Ramos 세포 (CD79+ B-세포주)에 특이적인 결합을 나타내는 마우스로부터의 B-세포를 이전에 설명된 바와 같이 마우스 골수종 세포 (X63.Ag8.653; 아메리칸 타입 컬쳐 컬렉션 (미국 매릴랜드주 록빌))와 융합시켰다 ([Hongo, J.S. et al., Hybridoma, 14:253-260 (1995)]; [Kohler, G. et al., Nature, 256:495-497 (1975)]; [Freund, Y.R. et al., J. Immunol., 129:2826-2830 (1982)]). 인간 CD79b 항체에 대해, 직접적 ELISA에 의해 인간 CD79b 면역원에 대해 높은 항체 역가, 및 Ramos 세포에 특이적인 결합을 나타내는 마우스로부터의 B-세포를 이전에 설명된 바와 같이 마우스 골수종 세포 (X63.Ag8.653; 아메리칸 타입 컬쳐 컬렉션)와 융합시켰다 ([Hongo, J.S. et al., Hybridoma, 14:253-260 (1995)]; [Kohler, G. et al., Nature, 256:495-497 (1975)]; [Freund, Y.R. et al., J. Immunol., 129:2826-2830 (1982)]). 사이노몰거스 원숭이 CD79b 항체에 대해, 직접적 ELISA에 의해 원숭이 CD79b 면역원에 대해 높은 항체 역가, 및 사이노몰거스 원숭이 말초혈 단핵 세포 (PBMC)의 B-세포 집단에 대해 특이적인 결합을 나타내는 마우스로부터의 B-세포를 이전에 설명된 바와 같이 마우스 골수종 세포 (X63.Ag8.653; 아메리칸 타입 컬쳐 컬렉션)와 융합시켰다 ([Hongo, J.S. et al., Hybridoma, 14:253-260 (1995)]; [Kohler, G. et al., Nature, 256:495-497 (1975)]; [Freund, Y.R. et al., J. Immunol., 129:2826-2830 (1982)]).
인간 CD79a, 인간 CD79b 및 사이노몰거스 원숭이 CD79b 항체에 대해, 10 내지 12일 후에, 상등액을 회수하고, 상기 지시된 바와 같이 직접적 ELISA 및 FACS에 의해 항체 생산 및 결합에 대해 스크리닝하였다. 제한 희석에 의해 제2 라운드의 서브클로닝 후에 최고 면역결합을 보이는 양성 클론을 인간 CD79a, 인간 CD79b 또는 사이노몰거스 원숭이 CD79b 특이성 및 교차-반응성을 포함한 추가의 특성 결정을 위해 팽창시키고 배양하였다. 각각의 하이브리도마 계열로부터 회수된 상등액을 이전에 설명된 바와 같이 친화도 크로마토그래피 (파마시아 신속 단백질 액체 크로마토그래피 (FPLC); 파마시아 (스웨덴 웁살라))에 의해 정제하였다 ([Hongo, J.S. et al., Hybridoma, 14:253-260 (1995)]; [Kohler, G. et al., Nature, 256:495-497 (1975)]; [Freund, Y.R. et al., J. Immunol., 129:2826-2830 (1982)]). 이어서, 정제된 항체 제제를 멸균 여과하고 (0.2-Φm 공극 크기; 날젠 (Nalgene, 미국 뉴욕주 로체스터)), 4EC에서 포스페이트 완충 염수 (PBS) 내에 저장하였다.
TAHO 단백질을 인식하고 결합할 수 있는 모노클로날 항체 (표준 ELISA, FACS 분류 분석 (B-세포 특이성에 대해) 및/또는 면역조직화학 분석에 의해 측정할 때)는 인간-TAHO4 (CD79a)에 대해 성공적으로 생성되었고, 항-인간-CD79a-8H9 (본원에서 "8H9" 또는 "8H9.1.1"로서 칭함)로 명명하고 ATCC에 2006년 7월 11일에 ATCC No. PTA-7719 (항-인간 CD79a 쥐 모노클로날 항체 8H9.1.1)로서 기탁하고, 항-인간-CD79a-5C3 (본원에서 "5C3" 또는 "5C3.1.1"로서 칭함)으로 명명하고 ATCC에 2006년 7월 11일에 ATCC No. PTA-7718 (항-인간 CD79a 쥐 모노클로날 항체 5C3.1.1)으로서 기탁하고, 항-인간-CD79a-7H7 (본원에서 "7H7" 또는 "7H7.1.1"로서 칭함)로 명명하고 ATCC에 2006년 7월 11일에 ATCC No. PTA-7717 (항-인간 CD79a 쥐 모노클로날 항체 7H7.1.1)로서 기탁하고, 항-인간-CD79a-8D11 (본원에서 "8D11" 또는 "8D11.1.1"로서 칭함)로 명명하고 ATCC에 2006년 7월 11일에 ATCC No. PTA-7722 (항-인간 CD79a 쥐 모노클로날 항체 8D11.1.1)로서 기탁하고, 항-인간-CD79a-15E4 (본원에서 "15E4" 또는 "15E4.1.1"로서 칭함)로 명명하고 ATCC에 2006년 7월 11일에 ATCC No. PTA-7721 (항-인간 D791 쥐 모노클로날 항체 15E4.1.1)로서 기탁하고, 항-인간-CD79a-16C11 (본원에서 "16C11" 또는 "16C11.1.1"로서 칭함)로 명명하고 ATCC에 2006년 7월 11일에 ATCC No. PTA-7720 (항-인간 CD79a 쥐 모노클로날 항체 16C11.1.1)으로서 기탁하였다.
TAHO 단백질을 인식하고 결합할 수 있는 모노클로날 항체 (표준 ELISA, FACS 분류 분석 (B-세포 특이성에 대해) 및/또는 면역조직화학 분석에 의해 측정할 때)는 TAHO5 (인간 CD79b)에 대해 성공적으로 생성되었고, 항-인간-CD79b-2F2 (본원에서 "2F2" 또는 "2F2.20.1"로서 칭함)로 명명하고, ATCC에 2006년 7월 11일에 ATCC No. PTA-7712 (항-인간 CD79b 2F2.20.1)로서 기탁하였다.
TAHO 단백질을 인식하고 결합할 수 있는 모노클로날 항체 (표준 ELISA, FACS 분류 분석 (B-세포 특이성에 대해) 및/또는 면역조직화학 분석에 의해 측정할 때)는 cyno-TAHO40 (CD79b)에 대해 성공적으로 생성되었고, 항-cyno-CD79b-3H3 (본원에서 "3H3" 또는 "3H3.1.1"로서 칭함)로 명명하고 ATCC에 2006년 7월 11일에 ATCC No. PTA-7714 (항-cyno CD79b 3H3.1.1)로서 기탁하고, 항-cyno-CD79b-8D3 (본원에서 "8D3" 또는 "8D3.7.1"로서 칭함)으로 명명하고 ATCC에 2006년 7월 11일에 ATCC No. PTA-7716 (항-cyno CD79b 8D3.7.1)으로서 기탁하고, 항-cyno-CD79b-9H11 (본원에서 "9H11", 또는 "9H11.3.1"로서 칭함)으로 명명하고 ATCC에 2006년 7월 11일에 ATCC No. PTA-7713 (항-cyno CD79b 9H11.3.1)으로서 기탁하고, 항-cyno-CD79b-10D10 (본원에서 "10D10" 또는 "10D10.3"으로서 칭함)으로 명명하고 ATCC에 2006년 7월 11일에 ATCC No. PTA-7715 (항-cyno CD79b 10D10.3)으로서 기탁하였다.
키메라
항-인간
CD79b
(
TAHO5
) 항체 (
chSN8
)의 구성 및 서열 결정
키메라 SN8 IgG1의 구성을 위해, 총 RNA를 퀴아겐 RNeasy 미니 키트 (Cat # 74104) 및 제조자 제안 프로토콜을 이용하여 SN8 하이브리도마 세포 (로스웰 파크 캔서 인스티튜트로부터 수득함 (Okazaki et al., Blood, 81(1): 84-95 (1993))로부터 추출하였다. SN8 모노클로날 항체의 경쇄 및 중쇄에 대해 얻어진 N-말단 아미노산 서열을 이용하여, 각각의 사슬에 특이적인 PCR 프라이머를 설계하였다. N-말단 서열에 상응하는 유전자 패밀리의 프레임워크 4를 매칭시키기 위해 RT-PCR을 위한 역방향 프라이머를 설계하였다. 클로닝을 위해 목적하는 제한 부위를 부가하기 위해 프라이머를 또한 설계하였다. 경쇄에 대해, 이들은 N-말단에서 Eco RV, 및 프레임워크 4의 3' 단부에서 RsrII였다. 중쇄에 대해, 부가된 부위는 N-말단에서 PvuII, 및 VH-CH1 연결부의 약간 하류에서 ApaI이었다. 프라이머 서열은 다음과 같다:
경쇄 및 중쇄에 대한 RT-PCR 반응을 퀴아겐 원-스텝 (One-step) RT-PCR 키트 (Cat # 210210) 및 제안된 반응 믹스 및 조건을 사용하여 수행하였다. IgG의 포유동물 세포 발현을 위한 pRK 벡터는 이전에 설명되었다 (Gorman et al., DNA Prot Eng Tech 2:3-10 (1990)). 키메라 SN8의 경쇄 가변 도메인을 클로닝하기 위한 벡터는 그 내부로 부위-지정 돌연변이 유발에 의해 RsrII 부위가 도입된 pDR1 (Shalaby et al., J. Exp. Med., 175(1): 217-225 (1992); 또한 도 24 참조)의 유도체이고, 인간 카파 불변 도메인을 함유한다. 경쇄 RT-PCR 생성물을 EcoRV 및 RsrII로 소화시키고, 겔 정제하고, 상기 벡터의 EcoRV/RsrII 부위 내로 클로닝하였다.
유사하게, 키메라 SN8의 중쇄 가변 도메인의 클로닝을 위해, 중쇄 RT-PCR 생성물을 PvuII 및 ApaI로 소화시키고, 벡터 pDR2의 PvuII-ApaI 부위 내로 클로닝하였다 (Shalaby et al., J. Exp. Med., 175(1): 217-225 (1992); 또한 도 25 참조). 상기 pDR2 벡터는 인간 IgG1의 CH1, 힌지, CH2 및 CH3 도메인을 함유한다.
항-인간 CD79b (chSN8)에 대한 생성되는 쥐-인간 키메라 경쇄 (도 9) 및 중쇄 (도 11)의 전체 코딩 영역에 대한 DNA 서열을 얻었다. DNA에 의해 코딩되는 쥐-인간 키메라 경쇄 및 중쇄에 대한 코딩된 폴리펩티드를 각각 도 10 및 12에 제시한다. DNA 서열 결정 후에, 플라스미드의 발현을 분석하였다.
플라스미드를 CHO 세포에 대해 상기 설명된 바와 같이 293 세포 (아데노바이러스-형질전환된 인간 배아 신장 세포주 (Graham et al., J. Gen. Virol, 36: 59-74 (1977))에 일시적으로 형질감염시켰다. 구체적으로, 293 세포를 형질감염 전날에 쪼개고, 혈청-함유 배지 내에 플레이팅하였다. 다음날, 인산칼슘 침전물로서 제조된 이중 가닥 DNA를 첨가한 후 pAdVAntage™ DNA (프로메가)를 첨가하고, 세포를 37℃에서 밤새 인큐베이팅하였다. 세포를 무혈청 배지 내에서 배양하고 4일 후에 회수하였다. 항체 단백질을 형질감염된 세포 상등액으로부터 단백질 A 컬럼 상에서 정제한 후, 10 mM 숙신산나트륨, 140 mM NaCl (pH 6.0) 내로 버퍼 교환하고, Centricon-10 (아미콘)을 사용하여 농축시켰다. 단백질의 동일성은 N-말단 서열 결정에 의해 확인하였다. 단백질 농도는 정량적 아미노산 분석에 의해 결정하였다. 항체를 상기 설명된 바와 같이 BJAB 또는 RAMOS 세포 내에서 FACS에 의해 인간 CD79b (TAHO5)에 대한 결합에 대해 시험하였다.
항-인간
CD79b
(
TAHO5
) 항체 (
ch2F2
)의 구성 및 서열 결정
키메라 2F2 IgG1의 구성을 위해, 총 RNA를 2F2 하이브리도마 세포로부터 퀴아겐 RNeasy 미니 키트 (Cat # 74104) 및 제조자 제안 프로토콜을 이용하여 추출하였다. 2F2 모노클로날 항체의 경쇄 및 중쇄에 대해 얻어진 N-말단 아미노산 서열을 이용하여, 각각의 사슬에 특이적인 PCR 프라이머를 설계하였다. N-말단 서열에 상응하는 유전자 패밀리의 프레임워크 4를 매칭시키기 위해 RT-PCR을 위한 역방향 프라이머를 설계하였다. 클로닝을 위해 목적하는 제한 부위를 부가하기 위해 프라이머를 또한 설계하였다. 경쇄에 대해, 이들은 N-말단에서 Eco RV, 및 프레임워크 4의 3' 단부에서 KpnI이었다. 중쇄에 대해, 부가된 부위는 N-말단에서 BsiWI, 및 VH-CH1 연결부의 약간 하류에서 ApaI이었다. 프라이머 서열은 다음과 같다:
경쇄 및 중쇄에 대한 RT-PCR 반응을 퀴아겐 원-스텝 RT-PCR 키트 (Cat # 210210) 및 제안된 반응 믹스 및 조건을 사용하여 수행하였다. IgG의 포유동물 세포 발현을 위한 pRK 벡터는 이전에 설명되었다 (Gorman et al., DNA Prot Eng Tech 2:3-10 (1990)). 벡터는 변형되었고 클로닝 및 발현을 용이하게 하기 위해 특정 엔도뉴클레아제 제한 효소 인식 부위를 포함하였다 (Shields et al., J Biol. Chem 2000; 276: 6591-6604). 증폭된 VL은 부위 EcoRV 및 KpnI을 이용하여 인간 카파 불변 도메인을 함유하는 pRK 포유동물 세포 발현 벡터 (pRK.LPG3.Human Kappa; 도 26) 내로 클로닝하였다. 증폭된 VH는 부위 BsiWI 및 ApaI을 이용하여 전장 인간 IgG1 불변 도메인을 코딩하는 pRK 포유동물 세포 발현 벡터 (pRK.LPG4.LPG4.Human HC; 도 27) 내로 삽입하였다.
항-인간 CD79b (2F2)에 대한 생성되는 쥐-인간 키메라 경쇄 (도 16) 및 중쇄 (도 18)의 전체 코딩 영역에 대한 DNA 서열을 얻었다. DNA에 의해 코딩되는 쥐-인간 키메라 경쇄 및 중쇄에 대한 코딩된 폴리펩티드를 각각 도 17 및 19에 제시한다. DNA 서열 결정 후에, 플라스미드의 발현을 분석하였다.
플라스미드를 CHO 세포에 대해 상기 설명된 바와 같이 293 세포 (아데노바이러스-형질전환된 인간 배아 신장 세포주 (Graham et al., J. Gen. Virol, 36: 59-74 (1977))에 일시적으로 형질감염시켰다. 항체 단백질은 단백질 A 컬럼 상에서 형질감염된 세포 상등액으로부터 정제하고, 단백질의 동일성은 N-말단 서열 결정에 의해 확인하였다. 항체를 상기 설명된 바와 같이 BJAB 또는 RAMOS 세포 내에서 FACS에 의해 인간 CD79b (TAHO5)에 대한 결합에 대해 시험하였다.
항-
cyno
CD79b
(
TAHO40
) 항체 (
ch10D10
)의 구성 및 서열 결정
키메라 항-cyno CD79b (TAHO40) (ch10D10) IgG1의 구성을 위해, 총 RNA를 10D10 하이브리도마 세포로부터 퀴아겐 RNeasy 미니 키트 (Cat # 74104) 및 제조자 제안 프로토콜을 이용하여 추출하였다. 10D10 Mab의 경쇄 및 중쇄에 대해 얻어진 N-말단 아미노산 서열을 이용하여, 각각의 사슬에 특이적인 PCR 프라이머를 설계하였다. N-말단 서열에 상응하는 유전자 패밀리의 프레임워크 4를 매칭시키기 위해 RT-PCR을 위한 역방향 프라이머를 설계하였다. 클로닝을 위해 목적하는 제한 부위를 부가하기 위해 프라이머를 또한 설계하였다. 경쇄에 대해, 이들은 N-말단에서 Eco RV, 및 프레임워크 4의 3' 단부에서 RsrII이었다. 중쇄에 대해, 부가된 부위는 N-말단에서 PvuII, 및 VH-CH1 연결부의 약간 하류에서 ApaI이었다. 프라이머 서열은 다음과 같다:
경쇄에 대한 RT-PCR 반응을 퀴아겐 원-스텝 RT-PCR 키트 (Cat # 210210) 및 제안된 반응 믹스 및 조건을 사용하여 수행하였다. 중쇄에 대해, RT-PCR에 대한 Superscript III 제1 가닥 합성 시스템 (인비트로겐 cat # 18080-051)을 사용한 후, Platinum Taq DNA 중합효소 (인비트로겐)을 사용하여 증폭시켰다. 반응 및 조건은 제조자가 권장한 바와 같았다. IgG의 포유동물 세포 발현을 위한 pRK 벡터는 이전에 설명되었다 (Gorman et al., DNA Prot Eng Tech 2:3-10 (1990)). 키메라 10D10의 경쇄 가변 도메인을 클로닝하기 위한 벡터는 그 내부로 부위-지정 돌연변이 유발에 의해 RsrII 부위가 도입된 pDR1 (Shalaby et al., J. Exp. Med, 175(1): 217-225 (1992); 또한 도 24 참조)의 유도체이고, 인간 카파 불변 도메인을 함유한다. 경쇄 RT-PCR 생성물을 EcoRV 및 RsrII로 소화시키고, 겔 정제하고, 상기 벡터의 EcoRV/RsrII 부위 내로 클로닝하였다.
유사하게, 키메라 10D10의 중쇄 가변 도메인의 클로닝을 위해, 중쇄 RT-PCR 생성물을 PvuII 및 ApaI로 소화시키고, 벡터 pDR2의 PvuII-ApaI 부위 내로 클로닝하였다 (Shalaby et al., J. Exp. Med., 175(1): 217-225 (1992); 또한 도 22 참조). 상기 pDR2 벡터는 인간 IgG1의 CH1, 힌지, CH2 및 CH3 도메인을 함유한다.
항-cyno CD79b (ch10D10)에 대한 생성되는 쥐-인간 키메라 경쇄 (도 20) 및 중쇄 (도 22)의 전체 코딩 영역에 대한 DNA 서열을 얻었다. DNA에 의해 코딩되는 쥐-인간 키메라 경쇄 및 중쇄에 대한 코딩된 폴리펩티드를 각각 도 21 및 23에 제시한다. DNA 서열 결정 후에, 플라스미드의 발현을 분석하였다.
플라스미드를 CHO 세포에 대해 상기 설명된 바와 같이 293 세포 (아데노바이러스-형질전환된 인간 배아 신장 세포주 (Graham et al., J. Gen. Virol, 36: 59-74 (1977))에 일시적으로 형질감염시켰다. 구체적으로, 293 세포를 형질감염 전날에 쪼개고, 혈청-함유 배지 내에 플레이팅하였다. 다음날, 인산칼슘 침전물로서 제조된 이중 가닥 DNA를 첨가한 후 pAdVAntage™ DNA (프로메가)를 첨가하고, 세포를 37℃에서 밤새 인큐베이팅하였다. 세포를 무혈청 배지 내에서 배양하고 4일 후에 회수하였다. 항체 단백질을 형질감염된 세포 상등액으로부터 단백질 A 컬럼 상에서 정제한 후, 10 mM 숙신산나트륨, 140 mM NaCl (pH 6.0) 내로 버퍼 교환하고, Centricon-10 (아미콘)을 사용하여 농축시켰다. 단백질의 동일성은 N-말단 서열 결정에 의해 확인하였다. 단백질 농도는 정량적 아미노산 분석에 의해 결정하였다. 항체를 아래에서 설명되는, BJAB-cyno CD79b 세포 (cyno CD79b (TAHO40)를 발현하는 BJAB 세포주) 내에서 FACS에 의해 cyno CD79b (TAHO40)에 대한 결합에 대해 시험하였다.
CD79b
항체의 특성 결정
항-인간 CD79b (TAHO5) 항체 및 항-cyno-CD79b (TAHO40) 항체가 결합하는 에피토프를 결정하였다. 에피토프의 결정을 위해, 인간 및 마우스 CD79b 사이에서 매우 보존적인 (이는 그가 영장류에서 또한 보존적일 것임을 제안한다), CD79b 유전자의 비-코딩 영역에 측면에 접하는 프라이머를 사용하여 사이노몰거스 및 붉은털 원숭이 모두로부터의 CD79b 유전자를 클로닝하였다.
선택적으로 스플라이싱된 형태의 인간 CD79b (TAHO5) (전체 세포외 Ig-유사 도메인이 결핍되는 전장 및 말단 절단된 형태 (스플라이싱된 말단 절단된 형태의 CD79b 내에 존재하지 않는 세포외 Ig-유사 도메인은 도 13에서 상자로 표시한다))가 정상 및 악성 B 세포에서 설명되었다 ([Hashimoto, S. et al., Mol Immunol., 32(9): 651-9 (1995)]; [Alfarano et al. Blood, 93(7): 2327-35 (1999)]). 시판 항-인간 CD79b (TAHO5) 항체, 예를 들어 CB3-1 (비디 파밍엔; 영국 콜리) 및 SN8 (안셀 및 바이오메다)은 두 형태의 인간 CD79b (TAHO5)를 모두 인식하였고, 이는 항-인간 CD79b 항체에 대한 에피토프가 막횡단 도메인에 대해 먼 세포외 펩티드 영역 내에 위치하고 전장 및 말단 절단된 인간 CD79b 형태 모두 내에 존재함을 제안한다 (Cragg, Blood, 100(9): 3068-76 (2002)). 추가로, 시판 항-인간-CD79b (TAHO5) 항체 (CB3-1 및 SN8) 및 상기 설명된 항-인간-CD79b (TAHO5) 항체 (2F2)는 사이노몰거스 또는 붉은털 원숭이 B 세포를 인식하지 않는다 (데이타를 제시하지 않음).
막횡단 도메인에 대해 멀고 전장 및 말단 절단된 인간 CD79b 형태 모두에 존재하는 세포외 펩티드 영역을 사이노몰거스 및 붉은털 원숭이 CD79b 내의 동일한 영역에 비교하였다. 인간 CD79b (TAHO5) 및 사이노몰거스 (TAHO40) 또는 붉은털 원숭이 CD79b 사이에서, 신호 펩티드 서열을 제외한 상기 영역에서의 유일한 차이는 11개 아미노산 영역이고, 단지 3개의 아미노산 차이를 갖는다: (인간) (서열 16) 및 (사이노몰거스 및 붉은털 원숭이) (서열 17). 인간, 사이노몰거스 및 쥐 CD79b에서 11개 아미노산 영역을 도 13에 제시하고, "시험 펩티드"로서 표지한다 (본원에서 "11mer"로서도 칭함).
11개 아미노산 영역을 갖는 펩티드가 항체 결합에 대해 경쟁할 수 있는지 결정하기 위해, BJAB 세포를 경쟁 분석에서 사용하였다. 11개 아미노산 영역을 포함하는 21mer 펩티드를 인간 CD79b (TAHO5) 및 cyno CD79b (TAHO40)에 대해 생성하였고, 서열은 각각 서열 26 및 서열 27 이다. 항-인간 CD79b (TAHO5) 또는 항-사이노몰거스 CD79b (TAHO40) 항체를 먼저 인간 CD79b (TAHO5) 또는 사이노몰거스 CD79b (TAHO40) 단백질의 ECD 부분 (1:3의 항체:단백질 비)과 함께, 또는 인간 CD79b (TAHO5)와 사이노몰거스 CD79b (TAHO40) 사이에서 상이한 영역을 포함한 21mer 인간 또는 cyno 펩티드 (1:10의 항체:단백질 비)와 함께 실온에서 30분 인큐베이팅하였다. 예비-인큐베이션 단계 후에, 항체를 BJAB 세포에 첨가하고, 규정 염색 및 FACS 단계로 처리하고, 여기서 래트 항-마우스 IgG1-PE 항체 (비디 바이오사이언스, 클론 G18-145)를 2차 항체로서 사용하였다.
인간 CD79b (TAHO5) 21mer 펩티드는 항-인간 CD79b (TAHO5) 항체, 예를 들어 CB3-1 (비디바이오사이언스), SN8 (바이오메다 또는 비디바이오사이언스), AT105 (압캠 (Abcam, 미국 매사추세츠주 캠브리지)), 및 2F2 (상기 설명됨))의 결합을 억제하였고, 대조 항-cyno CD79b (TAHO40) 항체 (3H3, 8D3, 9H11 또는 10D10) 또는 항-인간 CD79a (TAHO4) 항체 (ZL7-4; 칼태그 또는 세로텍 (미국 노쓰캐롤라이나주 랄리))의 결합을 억제하지 않았다 (Zhang, L. et al., Ther. Immunol., 2:191-202 (1997)). cyno CD79b (TAHO40) 20mer 펩티드는 항-cyno CD79b (TAHO40) 항체, 예를 들어 3H3, 8D3, 9H11 및 10D10 (상기 설명됨)의 결합을 억제하였고, 대조 항-인간 CD79b (TAHO5) 항체 (CB3-1, SN8, AT105, 2F2) 또는 항-인간 CD79a (TAHO4) 항체 (ZL7-4)의 결합을 억제하지 않았다. 대조군으로서, 인간 CD79b (TAHO5)의 ECD는 항-인간 CD79b (TAHO5) 항체, 예를 들어 CB3-1 (비디바이오사이언스), SN8 (바이오메다 또는 비디바이오사이언스), AT105 (압캠), 및 2F2 (상기 설명됨))의 결합을 억제하였고, 대조 항-인간 CD79a (TAHO4) 항체 (ZL7-4; 칼태그 또는 세로텍)의 결합을 억제하지 않았다 (Zhang, L. et al., Ther. Immunol., 2:191-202 (1997)).
항-인간 CD79b (TAHO5) 항체의 에피토프 결합을 추가로 결정하기 위해, 11-mer 인간 CD79b 펩티드 (N 말단 - - C 말단) (서열 16)의 3개의 11mer 펩티드를, cyno CD79 펩티드 내의 동일한 각각의 위치의 아미노산으로 돌연변이시킨 인간 CD79b 펩티드 내의 3개의 Arg 잔기의 단일 아미노산 돌연변이를 갖도록 생성하였고, 본원에서 펩티드 돌연변이 1-3으로 명명하였다. 펩티드 돌연변이 1 (N 말단 - - C 말단; 서열 18)은 서열 16의 위치 2에서 Arg 잔기의 돌연변이를 포함하였다. 펩티드 돌연변이 2 (N 말단 - - C 말단; 서열 19)는 서열 16의 위치 6에서 Arg 잔기의 돌연변이를 포함하였다. 펩티드 돌연변이 3 (N 말단 - - C 말단; 서열 20)은 서열 16의 위치 8에서 Arg 잔기의 돌연변이를 포함하였다. 경쟁 분석을 상기 설명된 바와 같이 수행하였다. 경쟁 분석에서는 11mer 인간 CD79b 펩티드 내의 3개의 모든 Arg 잔기 (서열 16의 위치 2, 6, 및 8에서)가 항-인간 CD79b (TAHO5) (SN8) 항체의 결합에 중요하지만, 11mer 인간 CD79b 펩티드 내의 중간 Arg 잔기 (서열 16의 위치 6에서)가 항-인간 CD79b (TAHO5) (2F2) 항체 결합에 중요함을 추가로 입증하였다.
항-cyno CD79b (TAHO40) 항체의 에피토프 결합을 추가로 결정하기 위해, 11-mer cyno CD79b 펩티드 (N 말단 - - C 말단; 서열 17)의 11mer 펩티드를, cyno CD79b 펩티드에서 Leu 잔기의 단일 아미노산 돌연변이를 갖도록 생성하였고, "펩티드 돌연변이 4"로서 명명하였다. 펩티드 돌연변이 4 (N 말단 - - C 말단; 서열 25)는 서열 17의 위치 6에서 Leu 잔기 대신에 Arg 잔기를 포함하였다. 경쟁 분석을 상기 설명된 바와 같이 수행하였다. 경쟁 분석에서는 11mer cyno CD79b 펩티드 내의 Leu 잔기 (서열 17 내의 위치 6에서)는 항-cyno CD79b (TAHO40) 항체 (10D10)의 결합을 위해 중요함을 추가로 입증하였다.
항-인간 CD79b (TAHO5) 및 항-cyno CD79b (TAHO40) 항체에 대한 BJAB-cyno CD79b 세포 (실시예 11에 설명된 cyno CD79b (TAHO40)를 발현하는 BJAB 세포주) 상의 Kd 스캐챠드 분석에서는 유사한 Kd 값을 보여주었다. 항-인간 CD79b (SN8)는 세포에 0.5 nM kD로 결합하는 반면, 항-cyno CD79b (10D10)는 세포에 1.0 nM Kd로 결합하였다. 항-cynoCD79b (3H3)은 세포에 2.0 nM Kd로 결합하였다. 항-cyno CD79b (8D3)은 세포에 2.5 nM Kd로 결합하였다. 항-cyno CD79b (9H11)은 세포에 2.6 nM Kd로 결합하였다.
인간
CD79a
(
TAHO4
), 인간
CD79b
(
TAHO5
) 및
cyno
CD79b
(
TAHO40
)에 대한 항체를 사용한 항체-약물 접합체 (
ADC
)의 생성
항-인간 CD79a (TAHO4), 항-인간 CD79b (TAHO5) 및 항-cyno CD79b (TAHO40)에 대한 항체 약물 접합체 (ADC)의 생성을 위해 사용되는 약물은 메이탄시노이드 DM1 및 돌라스타틴10 유도체인 모노메틸오리스타틴 E (MMAE) 및 모노메틸오리스타틴 F (MMAF)를 포함하였다 (모두 그 전문을 본원에 참고로 포함시킨 US 2005/0276812; US 2005/0238649; [Doronina et al., Bioconjug. Chem., 17:114-123 (2006)]; [Doronina et al., Nat. Biotechnol., 21: 778-784 (2003)]; [Erickson et al., Cancer Res., 66: 4426-4433 (2006)] 참조). MMAF는 MMAE 및 DM1과는 달리 중성 pH에서 상대적인 막 불투과성이고, 따라서 유리 약물로서 비교적 작은 활성을 갖지만, 일단 세포 내에서는 매우 강력하다 (Doronina et al., Bioconjug. Chem., 17:114-123 (2006)). DM1, MMAE 및 MMAF는 NHL의 화학요법 치료에 사용되는 빈카 알칼로이드 유사분열 억제제보다 적어도 100배 더 세포독성인 유사분열 억제제이다 ([Doronina et al., Bioconjug. Chem., 17:114-123 (2006)]; [Doronina et al., Nat. Biotechnol, 21:778-784 (2003)]; [Erickson et al., Cancer Res., 66: 4426-4433 (2006)]). ADC의 생성을 위해 사용되는 링커는 DM1에 대해 SPP 또는 SMCC, 및 MMAE 및 MMAF에 대해 MC 또는 MC-vc-PAB이었다. DM1에 대해, 항체는 링커 시약 SMCC를 사용하여 라이신의 ε-아미노기를 통해 DM1의 티오기에 연결되었다. 별법으로, DM1에 대해, 항체는 SPP 링커를 사용하여 라이신의 ε-아미노기를 통해 DM1에 연결되었다. SPP (N-숙신이미딜 4-(2'-피리딜디티오) 펜타노에이트)는 라이신의 엡실론 아미노기와 반응하여 단백질 상에 반응성 2-피리딘 디술피드 링커를 남긴다. SPP 링커를 사용할 때, 유리 술프히드랄 (예를 들어 DM1)와의 반응 시에, 피리딘기가 교체되어, 환원성 디술피드 결합을 통해 부착된 DM1을 남긴다. SPP 링커를 통해 부착된 DM1은 환원 조건 하에 (즉, 예를 들어, 세포 내에서) 방출되는 반면, SMCC 링커를 통해 부착된 DM1은 환원 조건에서 절단에 대해 내성이다. 추가로, SMCC-DM1 ADC는 ADC가 내재화되고 리소좀에 표적화되어 라이신-Nε-DM1의 방출을 일으키면 세포 독성을 유도하고, 상기 라이신-Nε-DM1는 세포 내에서 효과적인 항-유사분열제이고, 세포로부터 방출될 때 라이신-Nε-DM1은 무독성이다 (Erickson et al., Cancer Res., 66: 4426-4433 (2006)). MMAE 및 MMAF에 대해, 항체는 말레이미도카프로일-발린-시트룰린 (vc)-p-아미노벤질옥시카르보닐 (MC-vc-PAB)에 의해 시스테인을 통해 MMAE 또는 MMAF에 연결되었다. MMAF에 대해, 항체는 별법으로 말레이미도카프로일 (MC) 링커에 의해 시스테인을 통해 MMAF에 연결되었다. MC-vc-PAB 링커는 세포간 프로테아제, 예를 들어 카텝신 B에 의해 절단될 수 있고, 절단될 때 유리 약물을 방출하는 한편 (Doronina et al., Nat. Biotechnol., 21: 778-784 (2003)), MC 링커는 세포내 프로테아제에 의한 절단에 대해 내성일 수 있다.
SMCC 및 DM1을 사용하는 항-인간 CD79a (TAHO4), 항-인간 CD79b (TAHO5), 및 항-cyno CD79b (TAHO40)에 대한 항체 약물 접합체 (ADC)는 US 2005/0276812에 기재된 절차에 유사하게 생성하였다. 정제된 항-인간 CD79a (TAHO4), 항-인간 CD79b (TAHO5), 및 항-cyno CD79b (TAHO40) 항체를 50 mM 인산칼륨 및 2 mM EDTA (pH 7.0)을 함유하는 용액 내로 버퍼-교환하였다. SMCC (피어스 바이오테크놀로지)를 디메틸아세트아미드 (DMA)에 용해시키고, 항체 용액에 첨가하여 10:1의 최종 SMCC/Ab 몰비로 하였다. 반응을 3시간 동안 실온에서 혼합하면서 진행시켰다. SMCC-변형된 항체를 후속적으로 150 mM NaCl 및 2 mM EDTA (pH 6.0)을 함유하는 35 mM 시트르산나트륨 내에 평형화시킨 GE Healthcare HiTrap 탈염 컬럼 (G-25) 상에서 정제하였다. DMA 내에 용해시킨 DM1을 SMCC 항체 제제에 첨가하여 10:1의 DM1 대 항체의 몰비를 제공하였다. 반응을 4-20시간 동안 실온에서 혼합하면서 진행시켰다. DM1-변형된 항체 용액을 20 부피의 PBS로 투석여과하여 비반응 DM1을 제거하고, 멸균 여과하고, 4℃에서 저장하였다. 일반적으로, 상기 과정을 통해 40-60%의 항체 수율이 달성되었다. 제제는 겔 여과 및 레이저 광 산란에 의해 평가할 때 대체로 >95% 단량체성이었다. DM1은 252 nm에서 흡수 최대치를 가지므로, 항체에 결합된 약물의 양은 252 및 280 nm에서 차별적인 흡수 측정치에 의해 결정할 수 있다. 일반적으로, 약물 대 항체 비는 3 내지 4이었다.
SPP-DM1 링커를 사용하는 항-인간 CD79a (TAHO4), 항-인간 CD79b (TAHO5), 및 항-cyno CD79b (TAHO40)에 대한 항체 약물 접합체 (ADC)는 US 2005/0276812에 기재된 절차에 유사하게 생성하였다. 정제된 항-인간 CD79a (TAHO4), 항-인간 CD79b (TAHO5), 및 항-cyno CD79b (TAHO40) 항체를 50 mM 인산칼륨 및 2 mM EDTA (pH 7.0)을 함유하는 용액 내로 버퍼-교환하였다. SPP (이뮤노겐 (Immunogen))을 DMA에 용해시키고, 항체 용액에 첨가하여 약 10:1의 최종 SPP/Ab 몰비로 하였고, 여기서 정확한 비는 항체의 목적하는 약물 로딩에 의존한다. 10:1 비가 대체로 약 3-4의 약물 대 항체 비를 생성시킬 것이다. SPP를 3-4시간 동안 실온에서 혼합하면서 반응시켰다. SPP-변형된 항체를 후속적으로 150 mM NaCl 및 2 mM EDTA (pH 6.0)를 함유하는 35 mM 시트르산나트륨 또는 포스페이트 완충 염수 (pH 7.4) 내에 평형화시킨 GE Healthcare HiTrap 탈염 컬럼 (G-25) 상에서 정제하였다. DM1을 DMA에 용해시키고 SPP 항체 제제에 첨가하여 10:1의 DM1 대 항체의 몰비를 제공하였고, 이는 항체 상의 이용가능한 SPP 링커에 비해 3-4배 몰 과량을 생성시킨다. DM1과의 반응을 4-20시간 동안 실온에서 혼합하면서 진행시켰다. DM1-변형된 항체 용액을 20 부피의 PBS로 투석여과하여 비반응 DM1을 제거하고, 멸균 여과하고, 4℃에서 저장하였다. 일반적으로, 상기 과정을 통해 40-60% 이상의 항체 수율이 달성되었다. 항체-약물 접합체는 겔 여과 및 레이저 광 산란에 의해 평가할 때 대체로 >95% 단량체성이었다. 결합된 약물의 양은 SMCC-DM1 접합체의 제조 (상기 설명됨)에 대해 설명된 바와 같이 252 및 280 nm에서 차별적인 흡수 측정치에 의해 결정한다.
MC-MMAF, MC-MMAE, MC-val-cit (vc)-PAB-MMAE 또는 MC-val-cit (vc)-PAB-MMAF 약물 링커를 사용하는 항-인간 CD79a (TAHO4), 항-인간 CD79b (TAHO5) 및 항-cyno CD79b (TAHO40) 항체에 대한 항체 약물 접합체 (ADC)는 US 2005/0238649에 기재된 절차에 유사하게 생성하였다. 정제된 항-인간 CD79a (TAHO4), 항-인간 CD79b (TAHO5), 또는 항-cyno CD79b (TAHO40) 항체를 500 mM 붕산나트륨 및 500 mM 염화나트륨 내에 pH 8.0에서 용해시키고, 과량의 100 MM 디티오트레이톨 (DTT)로 추가로 처리하였다. 37℃에서 약 30분 인큐베이션 후에, 세파덱스 G25 수지 상의 용출에 의해 버퍼를 교환하고, 1 mM DTPA를 갖는 PBS로 용출시킨다. 용액의 280 nm에서 흡광도로부터 환원된 항체 농도를 결정함으로써 티올/Ab 값을 검토하고, DTNB (알드리치, 미국 위스콘신주 밀워키)와의 반응 및 412 nm에서 흡광도의 결정에 의해 티올 농도를 검토하였다. PBS 내에 용해시킨 환원된 항체를 얼음 상에서 냉각시켰다. DMSO 중의 약물 링커, 예를 들어, MC-val-cit (vc)-PAB-MMAE를 아세토니트릴 및 물에 용해시키고, PBS 중의 냉각시킨 환원된 항체에 첨가하였다. 1시간 인큐베이션 후에, 과량의 말레이미드를 첨가하여 반응을 켄칭하고 임의의 비반응 항체 티올기를 캐핑 (capping)하였다. 반응 혼합물을 원심분리 한외여과에 의해 농축시키고, 항체 약물 접합체를 PBS 내에서 G25 수지를 통한 용출에 의해 정제하고 탈염시키고, 0.2 ㎛ 필터를 통해 멸균 조건 하에 여과하고, 저장을 위해 동결시켰다.
실시예
10: 특이적 항체를 사용하는
TAHO
폴리펩티드의 정제
천연 또는 재조합 TAHO 폴리펩티드는 단백질 정제 분야의 다양한 표준 기술에 의해 정제할 수 있다. 예를 들어, 프로-TAHO 폴리펩티드, 성숙 TAHO 폴리펩티드, 또는 프레-TAHO 폴리펩티드는 목적하는 TAHO 폴리펩티드에 특이적인 항체를 사용하는 면역친화도 크로마토그래피에 의해 정제된다. 일반적으로, 면역친화도 컬럼은 항-TAHO 폴리펩티드 항체를 활성화된 크로마토그래피 수지에 공유 커플링함으로써 구성된다.
폴리클로날 면역글로불린을 면역 혈청으로부터 황산암모늄을 사용한 침전에 의해 또는 고정된 단백질 A (파마시아 엘케이비 바이오테크놀로지 (Pharmacia LKB Biotechnology, 미국 뉴저지주 피츠카타웨이)) 상의 정제에 의해 제조하였다. 마찬가지로, 모노클로날 항체를 마우스 복수액으로부터 황산암모늄 침전 또는 고정된 단백질 A 상의 크로마토그래피에 의해 제조하였다. 부분적으로 정제된 면역글로불린을 크로마토그래피 수지, 예를 들어 CnBr-활성화된 SEPHAROSE™ (파마시아 엘케이비 바이오테크놀로지)에 공유 결합에 의해 부착시켰다. 항체를 수지에 커플링하고, 수지를 차단하고, 유도체 수지를 제조자의 지시에 따라 세척하였다.
그러한 면역친화도 컬럼은 TAHO 폴리펩티드를 가용성 형태로 함유하는 세포로부터 분획을 제조함으로써 TAHO 폴리펩티드의 정제에서 이용된다. 상기 제제는 세제의 첨가에 의해 또는 당업계에 잘 공지된 다른 방법에 의한 전체 세포의 또는 분별 원심분리를 통해 얻은 하위세포형 분획의 가용화에 의해 유래된다. 별법으로, 신호 서열을 함유하는 가용성 TAHO 폴리펩티드는 세포가 성장하는 배지 내로 유용한 양으로 분비될 수 있다.
가용성 TAHO 폴리펩티드-함유 제제를 면역친화도 컬럼 위로 통과시키고, 컬럼을 TAHO 폴리펩티드 우선적 흡수를 허용하는 조건 (예를 들어, 세제의 존재 하에 고 이온 강도 버퍼) 하에 세척한다. 이어서, 컬럼을 항체/TAHO 폴리펩티드 결합을 파괴하는 조건 (예를 들어, 낮은 pH 버퍼, 예를 들어 약 pH 2-3, 또는 고농도의 카오트로프 (chaotrope), 예를 들어 우레아 또는 티오시아네이트 이온) 하에 용출하고, TAHO 폴리펩티드를 수집한다.
실시예
11:
시험관내
종양 세포 사멸 분석
목적하는 TAHO 폴리펩티드를 발현하는 포유동물 세포는 표준 발현 벡터 및 클로닝 기술을 이용하여 얻을 수 있다. 별법으로, 목적하는 TAHO 폴리펩티드를 발현하는 많은 종양 세포주는 예를 들어 ATCC를 통해 공개적으로 이용가능하고, 표준 ELISA 또는 FACS 분석을 이용하여 일상적으로 확인할 수 있다. 이어서, 항-TAHO 폴리펩티드 모노클로날 항체 (상업적으로 이용가능한 및 그의 독소 접합된 유도체)를 TAHO 폴리펩티드 발현 세포를 시험관 내에서 사멸시키는 항체의 능력을 결정하기 위한 분석에서 사용할 수 있다.
예를 들어, 목적하는 TAHO 폴리펩티드를 발현하는 세포를 상기 설명된 바와 같이 얻고, 96 웰 디쉬 내로 플레이팅하였다. 하나의 분석에서, 항체/독소 접합체 (또는 네이키드 항체)를 세포 인큐베이션 전체에 4일 동안 포함시켰다. 제2 독립 분석에서, 세포를 1시간 동안 항체/독소 접합체 (또는 네이키드 항체)와 함께 인큐베이팅한 후, 세척하고 항체/독소 접합체의 부재 하에 4일 동안 인큐베이팅하였다. 이어서, CellTiter-Glo 발광 세포 생존력 분석 (프로메가 (Cat# G7571))를 이용하여 세포 생존력을 측정하였다. 비처리 세포가 음성 대조군 역할을 하였다.
항-인간 CD79a (TAHO4) 및 항-인간 CD79b (TAHO5) 항체의 분석을 위해, B 세포주 (ARH-77, BJAB, Daudi, DOHH-2, Su-DHL-4, Raji 및 Ramos)를 5000 세포/웰로 별개의 멸균 둥근 바닥 96웰 조직 배양액 처리 플레이트 (셀스타 (Cellstar) 650 185)에서 제조하였다. 세포를 분석 배지 (RPMI 1460, 1% L-글루타민, 10% 태아 소 혈청 (FBS; 하이클론) 및 10 mM HEPES) 내에서 배양하였다. 세포를 즉시 37℃ 인큐베이터 내에 밤새 넣어두었다.
항-cyno CD79b (TAHO40) 항체의 분석을 위해, 트랜스제닉 cyno CD79b (TAHO40) BJAB 세포주 (본원에서 "BJAB-cyno CD79b" 또는 "BJAB.cynoCD79b" 또는 "BJAB cynoCD79b"로서 칭함)를 생성하였다. BJAB 세포주 (t(2;8)(p112;q24) (IGK-MYC) 전위, 돌연변이된 p53 유전자를 함유하고, 엡스타인-바 바이러스 (EBV) 음성인 버킷 림프종 세포주) (Drexler, H.G., The Leukemia-Lymphoma Cell Line Facts Book, San Diego: Academic Press, 2001)를 cyno CD79b (TAHO40)를 함유하는 발현 벡터 (본원에서 "pRK.CMF.PD.cynoCD79b"로서 칭함)로 보통 AMAXA 뉴클레오펙션 (nucleofection) 프로토콜 (Solution T, Program T-16) (아막사 인크. (AMAXA Inc., 미국 매릴랜드주 게이터스버그))에 의해 형질감염시켰다. pRK.CMF.PD.cynoCD79b에 대해, 사이노몰거스 CD79b (TAHO40)를 클로닝하였다. 사이노몰거스 CD79a (TAHO39) 및 CD79b (TAHO40)의 클로닝을 위해, cyno CD79a (TAHO39) 및 cyno CD79b (TAHO40)에 대한 마우스 및 인간 DNA 서열을 정렬시켰다. 개방 해독 프레임에 측면에 접하는 보존된 서열에 대한 프라이머를 다음과 같이 생성하였다:
cyno CD79a (TAHO39) 및 CD79b (TAHO40) 프라이머를 사용하여, 사이노몰거스 CD79a (TAHO39) 및 CD79b (TAHO40)에 대한 유전자를 사이노몰거스 비장 DNA 라이브러리에서 증폭시켰다. PCR 생성물을 TA 벡터 (인비트로겐) 내로 클로닝하고, 서열 결정하였다. 사이노몰거스 CD79a 및 사이노몰거스 CD79b ORF를 푸로마이신 내성 유전자를 함유하고 CMV 프로모터에 의해 구동된 발현 벡터 (본원에서 "pRK.CMV.PD"로서 칭함) 내로 서브클로닝하였다.
pRK.CMF.PD.cynoCD79b를 BJAB 세포 내로 형질감염시키고 푸로마이신 (칼바이오켐, 미국 캘리포니아주 샌디에고) 선택한 후, 생존하는 세포를 항-cyno CD79b 항체 (3H3)를 사용하여 상위 5% 발현주에 대해 FACS 자동클로닝하였다. cyno CD79b (TAHO40)를 발현하는 최상의 발현 BJAB 세포주는 FACS 분석에 의해 선택하였다. cyno CD79b (TAHO40)을 발현하는 형질감염된 BJAB 세포는 또한 인간 CD79a (TAHO4) 및 인간 CD79b (TAHO5)를 발현한다. 대조군으로서, 인간 CD79a (TAHO4) 및 인간 CD79b (TAHO5)를 발현하는 비-형질감염된 BJAB B-세포를 사용하였다.
항체 약물 접합체 (상업적으로 이용가능한 항-인간 CD79a (TAHO4), 예를 들어 ZL7-4, 및 항-인간 CD79b (TAHO5), 예를 들어 SN8, 또는 실시예 9에 설명된 항-인간 CD79a (TAHO4), 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40) 항체를 사용하는)를 2 x 10 ㎍/ml로 분석 배지 내에 희석하였다. 접합체를 가교연결기 SMCC 또는 디술피드 링커 SPP를 사용하여 메이탄시노이드 DM1 독소에 연결시켰다 (실시예 9 및 US 특허 출원 11/141,344 (2005년 5월 31일 출원) 및 US 특허 출원 10/983,340 (2004년 11월 5일 출원) 참조). 추가로, 접합체를 MC-발린-시트룰린 (vc)-PAB 또는 MC를 사용하여 돌라스타틴10 유도체인 모노메틸오리스타틴 E (MMAE) 독소 또는 모노메틸오리스타틴 F (MMAF) 독소에 연결시킬 수 있다 (실시예 9, US 특허 출원 11/141,344 (2005년 5월 31일 출원) 및 US 특허 출원 10/983,340 (2004년 11월 5일 출원) 참조). 음성 대조군은 HERCEPTIN® (트라스투주맙) 기반 접합체 (SMCC-DM1 또는 SPP-DM1 또는 MC-vc-MMAE 또는 MC-vc-MMAF)를 포함하였다. 양성 대조군은 접합체 로딩 용량에 동등한 유리 L-DM1을 포함하였다. 희석에 앞서 균질한 혼합물을 보장하기 위해 샘플을 볼텍싱하였다. 항체 약물 접합체를 추가로 1:3 연속 희석하였다. 세포주에 Rapidplate® 96/384 Zymark 자동화 시스템을 이용하여 각 열당 50 ㎕의 각각의 샘플을 로딩하였다. 전체 플레이트를 로딩했을 때, 플레이트를 3일 동안 재인큐베이팅하여 독소가 효과를 나타내도록 하였다. 10분 동안 100 ㎕/웰의 Cell Glo (프로메가, Cat. #G7571/2/3)을 모든 웰에 적용함으로써 반응을 중지시켰다. 100 ㎕의 중지된 웰을 96 웰 백색 조직 배양 처리된 플레이트, 투명 바닥 (코스타 (Costar) 3610)에 옮기고, 발광을 판독하고 상대 광 단위 (RLU)로서 기록하였다. 본 실험을 위한 TAHO 항체는 상업적으로 이용가능한 항체, 예를 들어 항-인간 CD79a (TAHO4) (ZL7-4) 및 항-인간 CD79b (TAHO5) (SN8)을 포함하였다.
요약
a. 항-인간 CD79a (TAHO4)
DM1 독소에 접합된 항-인간-CD79a (TAHO4) (ZL7-4) 항체 (항-인간-CD79a (ZL7-4)-SMCC-DM1)는 RAMOS 세포에서 항-인간-CD79a (TAHO4) (ZL7-4) 항체 단독 또는 DM1 독소에 접합된 음성 대조 항-HER2 (항-HER2-SMCC-DM1)에 비해 유의한 종양 세포 사멸을 보였다 (데이타를 제시하지 않음).
b-1. 항-인간 CD79b (TAHO5)
DM1 독소에 접합된 항-인간-CD79b (TAHO5) (SN8) 항체 (항-인간-CD79b (SN8)-SMCC-DM1)는 RAMOS 세포에서 항-인간-CD79b (TAHO5) (SN8) 항체 단독 또는 DM1 독소에 접합된 음성 대조군 항-HER2 (항-HER2-SMCC-DM1)에 비해 유의한 종양 세포 사멸을 보였다.
b-2. 항-cyno CD79b (TAHO40)
(1) DM1 ADC
(a) BJAB-cyno CD79b 세포
DM1과 접합된 항-cyno CD79b (TAHO40) 항체 (10D10) (항-cyno CD79b (10D10)-SMCC-DM1)는 BJAB-cyno CD79b 세포에서 유의한 종양 사멸을 보였다. 사멸을 음성 대조군, 항-cyno CD79b (TAHO40) 항체 (10D10) 단독, DM1과 접합된 HERCEPTIN® (트라스투주맙) 항체 (HERCEPTIN® (트라스투주맙)-SMCC-DM1) (음성 대조군), 및 BJAB-cyno CD79b 세포에서 유의한 종양 세포 사멸을 보이지 않은 항체 부재에 대해 비교하였다. 양성 대조군으로서, DM-1 이량체 단독, 및 DM1과 접합된 항-인간 CD79b (TAHO5) 항체 (SN8) (항-인간 CD79b (SN8)-SMCC-DM1)을 또한 비교하였고, BJAB-cyno CD79b 세포에서 유의한 종양 세포 사멸을 보였다.
IC50이 0.33 nM인 항-cyno CD79b (10D10)-SMCC-DM1은 IC50이 1.2 nM인 항-인간 CD79b (SN8)-SMCC-DM1 또는 IC50이 26 nM인 HERCEPTIN® (트라스투주맙)-SMCC-DM1 (이는 BJAB-cyno CD79b 세포에서 유의한 종양 사멸을 보이지 않았다)보다 BJAB-cyno CD79b 세포의 더 큰 사멸을 보였다.
(b) BJAB 세포
대조군으로서, DM1과 접합된 항-cyno CD79b (TAHO40) 항체 (10D10) (항-cyno CD79b (10D10)-SMCC-DM1)를 BJAB 세포 (형질감염되지 않은)에서 분석하였고, 이는 BJAB 세포에서 유의한 종양 사멸을 보이지 않았다. 음성 대조군, 항-cyno CD79b (TAHO40) 항체 (10D10) 단독, DM1과 접합된 HERCEPTIN® (트라스투주맙) 항체 (HERCEPTIN® (트라스투주맙)-SMCC-DM1) 및 항체 부재는 또한 BJAB 세포에서 유의한 종양 세포 사멸을 보이지 않았다. 양성 대조군으로서, DM-1 이량체 단독, 및 DM1과 접합된 항-인간 CD79b (TAHO5) 항체 (SN8) (항-인간 CD79b (SN8)-SMCC-DM1)를 또한 비교하였고, 이들은 BJAB 세포에서 유의한 종양 세포 사멸을 보였다.
IC50이 10 nM인 항-cyno CD79b (10D10)-SMCC-DM1 및 IC50이 30 nM인 HERCEPTIN® (트라스투주맙)-SMCC-DM1은 BJAB 세포에서 유의한 사멸을 보이지 않은 반면, IC50이 0.4 nM인 항-인간 CD79b (SN8)-SMCC-DM1은 BJAB 세포의 유의한 사멸을 보였다.
(2) MMAF ADC
(a) BJAB-cyno CD79b 세포
MMAF와 접합된 항-cyno CD79b (TAHO40) 항체 (10D10) (항-cyno CD79b (10D10)-MC-MMAF)는 음성 대조군, 항-cyno CD79b (TAHO40) 항체 (10D10), 항-인간 CD79b (TAHO5) 항체 (SN8), HERCEPTIN® (트라스투주맙) 항체, 및 MMAF와 접합된 HERCEPTIN® (트라스투주맙) (HERCEPTIN® (트라스투주맙)-MC-MMAF) (이는 BJAB-cyno CD79b 세포에서 유의한 종양 세포 사멸을 보이지 않았다)에 비해 BJAB-cyno CD79b 세포에서 유의한 종양 세포 사멸을 보였다. 양성 대조군, MMAF와 접합된 항-인간 CD79b (TAHO5) (SN8) 항체 (항-인간 CD79b (SN8)-MC-MMAF)를 또한 비교하였고, 이는 BJAB-cyno CD79b 세포에서 유의한 종양 세포 사멸을 보였다.
IC50이 0.07 nM인 항-cyno CD79b (10D10)-MC-MMAF는 IC50이 0.6 nM인 항-인간 CD79b (SN8)-MC-MMAF보다 BJAB-cyno CD79b 세포의 더 큰 사멸을 보였다.
(b) BJAB 세포
대조군으로서, MMAF와 접합된 항-cyno CD79b (TAHO40) 항체 (10D10) (항-cyno CD79b (10D10)-MC-MMAF)를 BJAB 세포에서 분석하였고, 이는 BJAB 세포에서 유의한 종양 세포 사멸을 보이지 않았다. 음성 대조군, 항-cyno CD79b (TAHO40) 항체 (10D10), 항-인간 CD79b (TAHO5) 항체 (SN8), HERCEPTIN® (트라스투주맙) 항체, 및 MMAF와 접합된 HERCEPTIN® (트라스투주맙) (HERCEPTIN® (트라스투주맙)-MC-MMAF)는 또한 BJAB 세포에서 유의한 종양 세포 사멸을 보이지 않았다. 양성 대조군, MMAF와 접합된 항-인간 CD79b (TAHO5) (SN8) 항체 (항-인간 CD79b (SN8)-MC-MMAF)를 또한 비교하였고, BJAB 세포에서 유의한 종양 세포 사멸을 보였다.
IC50이 694 nM인 항-cyno CD79b (10D10)-MC-MMAF는 BJAB 세포에서 유의한 종양 세포 사멸을 보이지 않은 반면, IC50이 0.2 nM인 항-인간 CD79b (SN8)-MC-MMAF는 BJAB 세포에서 유의한 종양 세포 사멸을 보였다.
유의한 종양 세포 사멸을 보이는 항-TAHO 항체의 능력의 면에서, TAHO 분자는 포유동물에서 B-세포 연관 암, 예를 들어 림프종 (즉, 비-호지킨 림프종), 백혈병 (즉, 만성 림프구성 백혈병), 골수종 (즉, 다발 골수종), 및 조혈 세포의 다른 암을 포함한 종양의 치료법을 위한 뛰어난 표적일 수 있다. 항-TAHO 폴리펩티드 모노클로날 항체는 B-세포 연관 암, 예를 들어 림프종 (즉, 비-호지킨 림프종), 백혈병 (즉, 만성 림프구성 백혈병), 골수종 (즉, 다발 골수종), 및 조혈 세포의 다른 암을 포함한 종양의 시험관내 종양 성장을 감소시키기 위해 유용하다. 구체적으로, 항-인간 CD79b (TAHO5) 항체와의 항-cyno CD79b (TAHO40) 항체의 에피토프, 친화도 및 시험관내 효능의 유사성이 주어지면, 항-cyno CD79b (TAHO40) 항체는 항-인간 CD79b (TAHO5) 항체에 대한 사이노몰거스 원숭이에서 독성학 연구 및 효능 연구에서 뛰어난 대용물일 수 있다.
실시예
12:
생체내
종양 세포 사멸 분석
1. 이종이식편
접합된 또는 비접합된 항-TAHO 폴리펩티드 모노클로날 항체의 효능을 시험하기 위해, 마우스에서 종양에 대한 항-TAHO 항체의 효과를 분석하였다. 구체적으로, 다수의 이종이식편 모델, 예를 들어 RAJI 세포, RAMOS 세포, BJAB 세포 (t(2;8)(p112;q24) (IGK-MYC) 전위, 돌연변이된 p53 유전자를 함유하고, 엡스타인-바 바이러스 (EBV) 음성인 버킷 림프종 세포주) (Drexler, H.G., The Leukemia-Lymphoma Cell Line Facts Book, San Diego: Academic Press, 2001)), Granta 519 세포 (사이클린 D1 (BCL1)의 과다발현을 일으키는 t(11;14)(q13;q32) (BCL1-IGH) 전위를 함유하고, P16INK4B 및 P16INK4A 결실을 함유하고, EBV 양성인 외투 세포 림프종 세포주) (Drexler, H.G., The Leukemia-Lymphoma Cell Line Facts Book, San Diego: Academic Press, 2001)), U698M 세포 (림프모구성 림프육종 B 세포주; (Drexler, H.G., The Leukemia-Lymphoma Cell Line Facts Book, San Diego: Academic Press, 2001)) 및 DoHH2 세포 (Ig 중쇄에 의해 구동된 Bcl-2의 과다발현을 일으키는 여포성 림프종 t(14;18)(q32;q21)의 전위 특징을 함유하고, P16INK4A 결실을 함유하고, t(8;14)(q24;q32) (IGH-MYC) 전위를 함유하고, EBV 음성인 여포성 림프종 세포주) (Drexler, H.G., The Leukemia-Lymphoma Cell Line Facts Book, San Diego: Academic Press, 2001))에서 종양을 퇴행시키는 항체의 능력을 검사하였다.
항-인간 CD79a 또는 항-인간 CD79b 항체의 효능 분석을 위해, 암컷 CB17 ICR SCID 마우스 (6-8주령, 찰스 리버 래보래토리스)로부터)에게 5 X 106 RAJI 세포, 5 X 106 RAMOS 세포, 2 X 107 BJAB-루시퍼라제 세포, 2 X 107 Granta 519 세포, 5 X 106 U698M 세포, 또는 2 X 107 DoHH2 세포를 피하 접종하였다. 이종이식편 종양을 평균 200 mm2로 성장시켰다. 제0일은 아래에 구체적으로 지시하지 않으면 종양이 평균 200 mm2로 되고 제1/또는 유일 용량의 치료제를 투여한 날을 나타낸다. 종양 부피는 캘리퍼스를 사용하여 측정한 2개 치수에 기초하여 계산하고, 식 V = 0.5a X b2 (여기서, a 및 b는 각각 종양의 긴 직경과 짧은 직경임)에 따라 mm3로 표현하였다. 각각의 실험군으로부터 수집한 데이타는 평균±SE로서 표현하였다. 마우스를 평균 종양 부피가 100-200 mm3 (이때 정맥내 (i.v.) 치료를 시작하였다)인 8-10마리 마우스의 군으로 분리하였다. 항체 또는 ADC의 투약은 200-500 ㎍/m2의 약물 농도에 상응하는 2-10 mg/kg 마우스의 단일 용량, 또는 2 내지 3주 동안 매주, 각 용량이 3-10 mg/kg 마우스이고 약물 농도가 200-500 ㎍/m2인 다수 용량이었다. 항체는 ADC 또는 대조군으로서 비접합된 항체이었다. 종양을 실험 내내 매주 1 또는 2회 측정하였다. 종양 부피가 3000 mm3에 도달하기 전에, 또는 종양이 임박한 궤양형성의 징후를 보일 때 마우스를 안락사시켰다. 모든 동물 프로토콜은 IACUC (Institutional Animal Care and Use Committee)에서 승인받았다.
사용된 항체와 독소 사이의 링커는 DM1에 대해 디술피드 링커 SPP 또는 티오에테르 가교연결기 SMCC, 또는 모노메틸오리스타틴 E (MMAE) 또는 모노메틸오리스타틴 F (MMAF)에 대해 말레이미드 성분 및 파라-아미노벤질카르바모일 (PAB) 자기희생 성분을 갖는 MC 또는 MC-발린-시트룰린 (vc)-PAB 또는 (발린-시트룰린 (vc)) 디펩티드 링커 시약)이었다. 사용된 독소는 DM1, MMAE 또는 MMAF이었다. 본 실험을 위한 TAHO 항체는 상업적으로 이용가능한 항체, 예를 들어 상업적으로 이용가능한 항체인 항-인간 CD79a (TAHO4) (ZL7-4) 및 항-인간 CD79b (TAHO5) (SN8), 및 실시예 9에 기재된 항체, 예를 들어 항-인간 CD79b (TAHO5) (2F2) 및 항-인간 CD79a (TAHO4) (8H9, 5C3, 7H7, 8D11, 15E4 및 16C11) 항체를 포함하였다. 실시예 9에 기재된 항-cyno CD79b (TAHO40) (3H3, 8D3, 9H11 및 10D10)를 또한 사용할 수 있다.
음성 대조군은 HERCEPTIN® (트라스투주맙) 기반 접합체 (SMCC-DM1 또는 SPP-DM1 또는 MC-MMAF 또는 MC-vc-PAB-MMAF 또는 MC-vc-PAB-MMAE)를 포함하고 이로 제한되지 않았다. 양성 대조군은 접합체 로딩 용량에 동등한 유리 L-DM1을 포함하고 이로 제한되지 않았다.
요약
(1) 항-인간 CD79a (TAHO4)
(a) Ramos 이종이식편
18일의 시간 과정에서, DM1과 접합된 항-인간 CD79a (TAHO4) 항체 (항-인간 CD79a-SMCC-DM1)는 음성 대조군인 항-헤르셉틴 (herceptin)-SMCC-DM1에 비해 RAMOS 종양이 있는 SCID 마우스에서 종양 성장의 억제를 보였다. ADC는 제0일에 단일 용량으로서 투여하였다.
(b) BJAB 이종이식편
18일의 시간 과정에서, 제0일에 단일 용량 (표 8에 지시된 바와 같이)으로 투여된, DM1과 접합된 항-CD79a (TAHO4) 항체, 예를 들어 5C3, 7H7, 8D11, 15E4 및 16C11 항체 (항-인간 CD79a (5C3, 7H7, 8D11, 15E4 또는 16C11)-SMCC-DM1)은 음성 대조군인 HERCEPTIN® (트라스투주맙)-SMCC-DM1에 비해 BJAB-루시퍼라제 종양이 있는 SCID 마우스에서 종양 성장의 억제를 보였다. ADC는 모든 ADC 및 대조군에 대해 제0일에 단일 용량 (표 11에 지시된 바와 같이)으로 투여하였다. 구체적으로, 항-인간 CD79a (5C3, 7H7, 8D11, 15E4 또는 16C11)-SMCC-DM1 및 항-인간 CD79b (2F2 또는 SN8)-SMCC-DM1은 종양 배가 (doubling)를 유의하게 억제하였다 (데이타를 제시하지 않음). 추가로, 표 8에서, 시험된 마우스의 총수 중, PR = 부분 퇴행 (투여 후 임의의 시점에서 종양 부피가 제0일에 측정된 종양 부피의 50% 미만으로 떨어진 경우) 또는 CR = 완전 관해 (투여 후 임의의 시점에서 종양 부피가 0 mm3로 떨어진 경우)를 보이는 마우스의 수를 표시한다.
(c) BJAB 이종이식편
14일의 시간 과정에서, 단일 용량 (표 12에 지시된 바와 같이)으로 DM1과 접합된 항-인간 CD79a (TAHO4) 항체, 예를 들어 8H9 항체, 및 항-인간 CD79b (SN8) 항체 (각각 항-인간 CD79a (8H9)-SMCC-DM1 및 항-인간 CD79b (SN8)-SMCC-DM1)은 음성 대조군, PBS, 항-당단백질-120 (본원에서 "gp120"으로서 칭함), 항-인간 CD79b (SN8), 항-인간 CD79a (8H9), 및 DM1과 접합된 항-gp120 (항-gp120-SMCC-DM1)에 비해 BJAB-루시퍼라제 종양이 있는 SCID 마우스에서 종양 성장의 억제를 보였다. ADC는 모든 ADC 및 대조군에 대해 제0일에 단일 용량 (표 9에 지시된 바와 같이)으로 투여하였다. 구체적으로, 항-인간 CD79a (8H9)-SMCC-DM1 및 항-인간 CD79b (SN8)-SMCC-DM1은 종양 배가를 유의하게 억제하였다 (데이타를 제시하지 않음). 추가로, 표 9에서, 시험된 마우스의 총수 중, PR = 부분 퇴행 (투여 후 임의의 시점에서 종양 부피가 제0일에 측정된 종양 부피의 50% 미만으로 떨어진 경우) 또는 CR = 완전 관해 (투여 후 임의의 시점에서 종양 부피가 0 mm3로 떨어진 경우)를 보이는 마우스의 수를 표시한다.
(2A) 항-인간 CD79b (TAHO5)
DM1과 접합된 항-인간 CD79b (TAHO5) (항-인간 CD79b-SMCC-DM1)은 단일 용량의 약물 접합체를 사용하여 Ramos 이종이식편에서 부분 퇴행 (PI) 또는 완전 관해 (CR)를 보였다.
추가로, DM1 또는 MMAF와 접합된 항-인간 CD79b (TAHO5) 항체 (항-인간 CD79b-SMCC-DM1 또는 항-인간 CD79b-MC-MMAF)는 단일 용량의 약물 접합체를 사용하여 BJAB, Granta519 및 DoHH2 이종이식편에서 부분 퇴행 (PI) 또는 완전 관해 (CR)을 보였다.
(a) Ramos 이종이식편
18일의 시간 과정에서, DM1과 접합된 항-인간 CD79b (TAHO5) 항체 (항-인간 CD79b-SMCC-DM1)은 음성 대조군인 항-헤르셉틴-SMCC-DM1에 비해 RAMOS 종양이 있는 SCID 마우스에서 종양 성장의 억제를 보였다. ADC는 제0일에 단일 용량으로서 투여하였다.
(b) BJAB 이종이식편
14일의 시간 과정에서, DM1과 접합된 항-인간 CD79b (TAHO5) 항체 (항-인간 CD79b-SMCC-DM1)은 음성 대조군인 항-헤르셉틴-SMCC-DM1 또는 항-헤르셉틴 항체에 비해 BJAB-루시퍼라제 종양이 있는 SCID 마우스에서 종양 성장의 억제를 보였다. 항-인간 CD79b-SMCC-DM1 항체에 의한 억제 수준은 항-CD20 항체에 의한 억제 수준과 유사하였다. 구체적으로, 제15일에, 항-인간 CD79b-SMCC-DM1로 처리한 10마리 마우스 중 1마리가 종양의 부분 퇴행을 보였고, 항-인간 CD79b-SMCC-DM1로 처리한 10마리 마우스 중 9마리가 종양의 완전 퇴행을 보였다. 제15일에, 항-헤르셉틴-SMCC-DM1, 항-헤르셉틴 항체로 처리한 10마리 마우스 중 10마리가 종양 발생을 보였다. 제15일에, 항-CD20 항체로 처리한 10마리 마우스 중 5마리가 종양의 부분 퇴행을 보였다. ADC는 모든 ADC 및 대조군에 대해 제0일 및 제5일에 다수 용량 (각 용량을 표 13에 지시된 농도에서)으로 투여하였다. 항-인간 CD79b-SMCC-DM1의 추가의 처리는 제14일에 투여하였다. 구체적으로, 항-인간 CD79b (SN8)-SMCC-DM1 및 항-CD20은 종양 배가를 유의하게 억제하였다 (데이타를 제시하지 않음). 추가로, 표 13에서, 시험된 마우스의 총수 중, PR = 부분 퇴행 (투여 후 임의의 시점에서 종양 부피가 제0일에 측정된 종양 부피의 50% 미만으로 떨어진 경우) 또는 CR = 완전 관해 (투여 후 임의의 시점에서 종양 부피가 0 mm3로 떨어진 경우)를 보이는 마우스의 수를 표시한다.
(c) BJAB 이종이식편 (MMAE, MMAF, DM1)
80일의 시간 과정에서, MMAF (항-인간 CD79b (SN8)-MC-MMAF 또는 항-인간 CD79b (SN8)-MC-vc-PAB-MMAF), DM1 (항-인간 CD79b (SN8)-SMCC-DM1) 또는 MMAE (항-인간 CD79b (SN8)-MC-vc-PAB-MMAE)와 접합된 항-인간 CD79b (TAHO5) 항체 (SN8)는 음성 대조군, MMAE 또는 MMAF에 접합된 HERCEPTIN® (트라스투주맙) (HERCEPTIN® (트라스투주맙)-MC-MMAF, HERCEPTIN® (트라스투주맙)-MC-vc-PAB-MMAE 및 HERCEPTIN® (트라스투주맙)-MC-vc-PAB-MMAF)에 비해 BJAB-루시퍼라제 (버킷 림프종) 종양이 있는 SCID 마우스에서 종양 성장의 억제를 보였다. ADC는 모든 ADC 및 대조군에 대해 제0일에 단일 용량 (표 14에 지시된 바와 같이)으로 투여하였다. 구체적으로, 항-인간 CD79b (SN8)-MC-MMAF, 항-인간 CD79b (SN8)-SMCC-DM1 및 항-CD79b (SN8)-MC-vc-PAB-MMAF는 종양 배가를 유의하게 억제하였다 (데이타를 제시하지 않음). MC-vc-PAB-MMAE와 접합된 대조군 HERCEPTIN® (트라스투주맙) ADC 및 항-인간 CD79b (SN8) ADC (HERCEPTIN® (트라스투주맙)-MC-vc-PAB-MMAE 및 항-인간 CD79b (SN8)-MC-vc-PAB-MMAE)는 종양 배가를 유의하게 억제하였다 (데이타를 제시하지 않음). 추가로, 표 11에서, 시험된 마우스의 총수 중, PR = 부분 퇴행 (투여 후 임의의 시점에서 종양 부피가 제0일에 측정된 종양 부피의 50% 미만으로 떨어진 경우) 또는 CR = 완전 관해 (투여 후 임의의 시점에서 종양 부피가 0 mm3로 떨어진 경우)를 보이는 마우스의 수를 표시한다.
(d) BJAB 이종이식편
또한 추가로, 30일의 시간 과정에서, MMAF (항-인간 CD79b (SN8)-MC-MMAF) 또는 DM1 (항-인간 CD79b (SN8)-SMCC-DM1)과 접합된 항-인간 CD79b (TAHO5) 항체 (SN8)는 음성 대조군, 항-인간 CD79b (TAHO5) 항체 (SN8), 항-gp120 단독, MMAF와 접합된 항-gp120 (항-gp120-MC-MMAF) 또는 DM1과 접합된 항-gp120 (항-gp120-SMCC-DM1)에 비해 BJAB-루시퍼라제 (버킷 림프종) 종양이 있는 SCID 마우스에서 종양 성장의 억제를 보였다. ADC는 모든 ADC 및 대조군에 대해 제0일에 단일 용량 (표 15에 지시된 바와 같이)으로 투여하였다. 구체적으로, 항-인간 CD79b (SN8)-MC-MMAF 및 항-인간 CD79b (SN8)-SMCC-DM1은 약물 농도 50 ㎍/m2 및 150 ㎍/m2 모두에서 종양 배가를 유의하게 억제하였다 (데이타를 제시하지 않음). 추가로, 표 12에서, 시험된 마우스의 총수 중, PR = 부분 퇴행 (투여 후 임의의 시점에서 종양 부피가 제0일에 측정된 종양 부피의 50% 미만으로 떨어진 경우) 또는 CR = 완전 관해 (투여 후 임의의 시점에서 종양 부피가 0 mm3로 떨어진 경우)를 보이는 마우스의 수를 표시한다.
(e) BJAB 이종이식편
또한 추가로, 20일의 시간 과정에서, MMAF와 접합된 항-인간 CD79b (TAHO5) 항체 (SN8) (SN8-MC-MMAF)는 음성 대조군, MMAF (항-gp120-MC-MMAF, 항-gp120-MC-vc-PAB-MMAF) 또는 MMAE (항-gp120-MC-MMAE)와 접합된 항-gp120에 비해 BJAB-루시퍼라제 (버킷 림프종) 종양이 있는 SCID 마우스에서 종양 성장의 억제를 보였다. 양성 대조군인 MMAE 또는 MMAF와 접합된 항-CD22를 또한 비교하였다. ADC는 모든 ADC 및 대조군에 대해 제0일에 단일 용량 (표 16에 지시된 바와 같이)으로 투여하였다. 구체적으로, 항-인간 CD79b (SN8)-MC-MMAF 및 항-인간 CD79b (SN8)-MC-vc-PAB-MMAF 및 상기 설명된 양성 대조군은 종양 배가를 유의하게 억제하였다 (데이타를 제시하지 않음). MC-vc-PAB-MMAE를 갖는 대조군 항-gp-120-ADC 및 항-인간 CD79b (SN8) ADC (항-gp120-MC-vc-PAB-MMAE 및 항-인간 CD79b (SN8)-MC-vc-PAB-MMAE)는 모두 종양 배가를 유의하게 억제하였다 (데이타를 제시하지 않음). 추가로, 표 13에서, 시험된 마우스의 총수 중, PR = 부분 퇴행 (투여 후 임의의 시점에서 종양 부피가 제0일에 측정된 종양 부피의 50% 미만으로 떨어진 경우) 또는 CR = 완전 관해 (투여 후 임의의 시점에서 종양 부피가 0 mm3로 떨어진 경우)를 보이는 마우스의 수를 표시한다.
(f) Granta 이종이식편
21일의 시간 과정에서, MMAF (SN8-MC-MMAF) 또는 DM-1 (SN8-SMCC-DM1)과 접합된 항-인간 CD79b (TAHO5) 항체 (SN8)는 음성 대조군, 항-인간 CD79b (TAHO5) 항체 (SN8), 항-gp120, 또는 MMAF 또는 DM1과 접합된 항-gp120 (항-gp120-MC-MMAF 또는 항-gp120-SMCC-DM1)에 비해 Granta-519 (외투 세포 림프종) 종양이 있는 SCID 마우스에서 종양 성장의 억제를 보였다. 양성 대조군인 MMAF와 접합된 항-CD22 항체 (10F4v3) (10F4v3-MC-MMAF)를 또한 비교하였다. ADC는 모든 ADC 및 대조군에 대해 제0일에 단일 용량 (표 17에 지시된 바와 같이)으로 투여하였다. 구체적으로, 항-인간 CD79b (SN8)-SMCC-DM1 및 항-인간 CD79b (SN8)-MC-MMAF 및 상기 설명된 양성 대조군은 약물 농도 100 ㎍/m2 및 300 ㎍/m2 모두에서 종양 배가를 유의하게 억제하였다 (데이타를 제시하지 않음). 추가로, 표 14에서, 시험된 마우스의 총수 중, PR = 부분 퇴행 (투여 후 임의의 시점에서 종양 부피가 제0일에 측정된 종양 부피의 50% 미만으로 떨어진 경우) 또는 CR = 완전 관해 (투여 후 임의의 시점에서 종양 부피가 0 mm3로 떨어진 경우)를 보이는 마우스의 수를 표시한다.
(g) DoHH2 이종이식편
21일의 시간 과정에서, MMAF 또는 DM1과 접합된 항-인간 CD79b (TAHO5) 항체 (SN8) (SN8-MC-MMAF 또는 SN8-MC-DM1), 또는 항-인간 CD79b (TAHO5) (SN8) 단독은 음성 대조군, 항-gp120, 또는 MMAF 또는 DM1과 접합된 항-gp120 (항-gp120-MC-MMAF 또는 항-gp120-SMCC-DM1)에 비해 DoHH2 (여포성 림프종) 종양이 있는 SCID 마우스에서 종양 성장의 억제를 보였다. 양성 대조군인 MMAF에 접합된 항-CD22 (10F4v3) (항-CD22 (10F4v3)-MC-MMAF)를 또한 비교하였다. ADC는 모든 ADC 및 대조군에 대해 제0일에 단일 용량 (표 18에 지시된 바와 같이)으로 투여하였다. 구체적으로, 항-인간 CD79b (SN8)-SMCC-DM1, 항-인간 CD79b (SN8)-MC-MMAF는 약물 농도 100 ㎍/m2 및 300 ㎍/m2 모두에서 종양 배가를 유의하게 억제하였다 (데이타를 제시하지 않음). 추가로, 표 15에서, 시험된 마우스의 총수 중, PR = 부분 퇴행 (투여 후 임의의 시점에서 종양 부피가 제0일에 측정된 종양 부피의 50% 미만으로 떨어진 경우) 또는 CR = 완전 관해 (투여 후 임의의 시점에서 종양 부피가 0 mm3로 떨어진 경우)를 보이는 마우스의 수를 표시한다.
(h) U698M 이종이식편
21일의 시간 과정에서, DM1과 접합된 항-인간 CD79b (TAHO5) 항체 (SN8) (항-인간 CD79b (SN8)-SPP-DM1)은 음성 대조군, DM1과 접합된 HERCEPTIN® (트라스투주맙) (HERCEPTIN® (트라스투주맙)-SPP-DM1)에 비해 U698M (림프모구성 림프육종 B 세포) 종양이 있는 SCID 마우스에서 종양 성장의 억제를 보였다. ADC는 모든 ADC 및 대조군에 대해 제2일, 제8일 및 제15일에 다수 용량 (표 19에 지시된 바와 같이)으로 투여하였다. 구체적으로, 항-인간 CD79b (SN8)-SPP-DM1은 종양 배가를 유의하게 억제하였다 (데이타를 제시하지 않음). 추가로, 표 16에서, 시험된 마우스의 총수 중, PR = 부분 퇴행 (투여 후 임의의 시점에서 종양 부피가 제0일에 측정된 종양 부피의 50% 미만으로 떨어진 경우) 또는 CR = 완전 관해 (투여 후 임의의 시점에서 종양 부피가 0 mm3로 떨어진 경우)를 보이는 마우스의 수를 표시한다.
(2B) 항-cyno CD79b (TAHO40)
접합된 또는 비접합된 항-cyno CD79b (TAHO40) 모노클로날 항체의 효능을 시험하기 위해, 마우스에서 종양에 대한 항-TAHO 항체의 효과를 상기 설명된 바와 같이 분석할 수 있다. 구체적으로, 다수의 이종이식편 모델, 예를 들어 RAJI 세포, BJAB 세포 (t(2;8)(p112;q24) (IGK-MYC) 전위, 돌연변이된 p53 유전자를 함유하고, 엡스타인-바 바이러스 (EBV) 음성인 버킷 림프종 세포주) (Drexler, H.G., The Leukemia-Lymphoma Cell Line Facts Book, San Diego: Academic Press, 2001)), Granta 519 세포 (사이클린 D1 (BCL1)의 과다발현을 일으키는 t(11;14)(q13;q32) (BCL1-IGH) 전위를 함유하고, P16INK4B 및 P16INK4A 결실을 함유하고, EBV 양성인 외투 세포 림프종 세포주) (Drexler, H.G., The Leukemia-Lymphoma Cell Line Facts Book, San Diego: Academic Press, 2001)), 및 DoHH2 세포 (Ig 중쇄에 의해 구동된 Bcl-2의 과다발현을 일으키는 여포성 림프종 t(14;18)(q32;q21)의 전위 특징을 함유하고, P16INK4A 결실을 함유하고, t(8;14)(q24;q32) (IGH-MYC) 전위를 함유하고, EBV 음성인 여포성 림프종 세포주) (Drexler, H.G., The Leukemia-Lymphoma Cell Line Facts Book, San Diego: Academic Press, 2001))에서 종양을 퇴행시키는 항체의 능력을 검사할 수 있다.
2. 파종성 이종이식편
접합된 또는 비접합된 항-TAHO 폴리펩티드 모노클로날 항체의 효능을 추가로 시험하기 위해, 마우스에서 파종성 종양에 대한 항-TAHO 항체의 효과를 분석하였다.
루시퍼라제를 안정하게 발현하는 BJAB 세포를 SCID 마우스의 꼬리 정맥 내로 주사하였다. 종양 진행을 모니터링하기 위해 생체발광 영상화를 사용하였다. 세포 주사 후 제10일에, 마우스를 발광 신호에 기초하여 분류하고, ADC로 처리하였다. 마우스를 대조군 ADC HERCEPTIN® (트라스투주맙)-SMCC-DM1 (7마리의 마우스) 또는 DM1에 접합된 항-인간 CD79b (TAHO5) (SN8) (항-인간 CD79b (SN8)-SMCC-DM1) (8마리의 마우스)로 5 mg/kg의 항체 용량에서 2회 (주사 후 제7일 및 제14일에) 처리하였다.
대조군 내의 마우스를 다음과 같이 안락사시켰다: 뒷다리 마비 때문에 7마리 마우스 중 2마리를 제21일에, 나머지 5마리 마우스를 제5일에 안락사시켰다. 항-인간 CD79b (SN8)-SMCC-DM1로 처리한 8마리 마우스 중 1마리는 제70일에 영상화할 때 종양의 징후를 보이고 제81일에 안락사시킨 반면, 항-인간-CD79b (SN8)-SMCC-DM1로 처리한 8마리 마우스 중 7마리는 건강하고 제152일까지 종양의 징후를 보이지 않았다. 따라서, 2개 용량의 항-인간 CD79b (SN8)-SMCC-DM1은 5 mg/kg의 항체 용량에서 처리된 동물의 87%에서 파종성 BJAB 종양을 제거하였다.
3. B 세포 수용체의 내재화
ADC를 사용한 종양의 치료 효과를 결정하기 위해, B 세포 수용체의 표면 발현을 종양 BJAB 이종이식편에서 분석하였다.
B 세포 수용체의 표면 발현의 분석을 위해, 13일의 시간 과정의 BJAB 이종이식편 연구를 다음 차이를 가지면서 상기 설명된 바와 같이 개시하였다. BJAB 종양을 500 mm2로 성장시키고, 시간 0에서 DM1에 접합된 항-인간 CD79b (TAHO5) (SN8 또는 2F2) (항-인간 CD79b-SMCC-DM1) 또는 대조군 항체, 항-인간 CD79b (TAHO5) 단독 (SN8 또는 2F2) 또는 항-gp120, 또는 DM1과 접합된 항-gp120 (항-gp120-SMCC-DM1)으로 단일 용량 (표 19에 지시된 바와 같이)으로 처리하였다. 항체 처리 2일 후에, 각각의 처리군에 대해 종양 중 2개를 제거하여, B 세포 수용체의 표면 발현을 유동 세포측정법에 의해 검사하였다.
유동 세포측정 분석을 위해 선택되지 않은 나머지 종양을 13일의 시간 과정의 나머지 기간으로 처리하였다. DM1과 접합된 항-인간 CD79b (TAHO5) 항체 (SN8 또는 2F2) (SN8-SCC-DM1 또는 2F2-SMCC-DM1)는 음성 대조군, 항-인간 CD79b (TAHO5) 항체 (SN8), 항-인간 CD79b (TAHO5) (2F2), 항-gp120, 또는 DM1과 접합된 항-gp120 (항-gp120-SMCC-DM1)에 비해 BJAB-루시퍼라제 종양이 있는 SCID 마우스에서 종양 성장의 억제를 보였다. ADC는 모든 ADC 및 대조군에 대해 제0일에 단일 용량 (표 17에 지시된 바와 같이)으로 투여하였다. 구체적으로, 항-인간 CD79b (SN8 또는 2F2)-SMCC-DM1은 종양 배가를 유의하게 억제하였다 (데이타를 제시하지 않음). 추가로, 표 20에서, 시험된 마우스의 총수 중, PR = 부분 퇴행 (투여 후 임의의 시점에서 종양 부피가 제0일에 측정된 종양 부피의 50% 미만으로 떨어진 경우) 또는 CR = 완전 관해 (투여 후 임의의 시점에서 종양 부피가 0 mm3로 떨어진 경우)를 보이는 마우스의 수를 표시한다.
FACS
분석에 대한 요약
FACS 분석으로부터, CD79a, CD79b 및 IgM의 표면 발현은 항-gp120 또는 DM1과 접합된 항-gp120 (항-gp120-SMCC-DM1)로 처리한 종양보다 항-인간 CD79b (TAHO5) 항체 (SN8 또는 2F2) 또는 DM1과 접합된 항-인간 CD79b (TAHO5) (항-인간 CD79b-SMCC-DM1)로 처리한 종양에서 실질적으로 더 낮았다. CD22의 표면 발현은 항-인간 CD79b (TAHO5) 항체 (SN8 또는 2F) 또는 DM1과 접합된 항-인간 CD79b (TAHO5) 항체 (항-인간 CD79b-SMCC-DM1)를 사용한 처리에 의해 영향을 받지 않았다.
이종이식편 및 파종성 이종이식편에서 종양 배가를 유의하게 억제하는 항-TAHO 항체의 능력의 면에서, TAHO 분자는 포유동물에서 B-세포 연관 암, 예를 들어 림프종 (즉, 비-호지킨 림프종), 백혈병 (즉, 만성 림프구성 백혈병), 골수종 (즉, 다발 골수종), 및 조혈 세포의 다른 암을 포함한 종양의 치료법을 위한 뛰어난 표적일 수 있다. 추가로, 항-TAHO 폴리펩티드 모노클로날 항체는 B-세포 연관 암, 예를 들어 림프종 (즉, 비-호지킨 림프종), 백혈병 (즉, 만성 림프구성 백혈병), 골수종 (즉, 다발 골수종), 및 조혈 세포의 다른 암을 포함한 종양의 생체내 종양 성장을 감소시키기 위해 유용하다.
또한 추가로, 항-인간 CD79a (TAHO4) 및 항-인간 CD79b (TAHO5) ADC의 효능 (상기 설명된 이종이식편 연구에서)은 단백질 표적의 표면 발현 수준 또는 유리 약물에 대한 감수성과 상호관련되지 않았다. 따라서, 항-TAHO 폴리펩티드 모노클로날 항체는 낮은 발현 수준의 TAHO 폴리펩티드를 갖는 종양의 생체내 종양 성장을 감소시키기 위해 유용할 수 있다.
실시예
13: 면역조직화학
TAHO 폴리펩티드의 조직 발현을 결정하기 위해 및 실시예 1로부터의 마이크로어레이 결과를 확인하기 위해, TAHO 폴리펩티드 발현의 면역조직화학적 검출을 급속 동결시킨 포르말린-고정되고 파라핀-포매된 (FFPE) 림프계 조직, 예를 들어 구개 편도, 비장, 림프절 및 파이어 판 (제넨테크 인간 조직 은행)에서 검사하였다.
TAHO 표적 발현의 만연 (prevalence)을 FFPE 림프종 조직 마이크로어레이 (사이브리디 (Cybrdi)) 및 24개 동결된 인간 림프종 시료의 패널에 대해 평가하였다. 동결된 조직 시료를 5 ㎛로 절편화하고, 공기 건조시키고, 아세톤 내에서 5분 동안 고정시킨 후 면역염색한다. 파라핀-포매된 조직을 5 ㎛로 절편화하고, SuperFrost Plus 현미경 슬라이드 (VWR) 상에 탑재한다.
동결된 절편에 대해, 슬라이드를 0.05% 나트륨 아지드를 함유하는 TBST, 1% BSA 및 10% 정상 말 혈청 내에 30분 동안 넣은 후, 아비딘/비오틴 차단 키트 (벡터 (Vector)) 시약와 함께 인큐베이팅한 후, 1차 항체를 첨가한다. 마우스 모노클로날 1차 항체 (상업적으로 이용가능한)를 비오티닐화 말 항-마우스 IgG (벡터)로 검출한 후, 아비딘-비오틴 퍼옥시다제 복합체 (ABC 5 Elite, 벡터) 및 금속-강화 디아미노벤지딘 테트라히드로클로라이드 (DAB, 피어스) 내에서 인큐베이팅한다. 대조 절편을 이소형-매칭된 비관련 마우스 모노클로날 항체 (파밍엔)와 함께 동등한 농도에서 인큐베이팅한다. ABC-HRP 시약을 적용한 후, 절편을 증폭 희석제 내에서 비오티닐-타이라미드 (퍼킨 엘머 (Perkin Elmer))와 함께 5-10분 동안 인큐베이팅하고, 세척하고, 다시 ABC-HRP 시약과 함께 인큐베이팅한다. 검출은 상기 설명된 바와 같이 DAB를 사용한다.
FFPE 인간 조직 절편을 증류수 내로 탈랍시키고 (dewaxing), 20분 동안 비등 수조 내에서 표적 회수 (Target Retrieval) 용액 (다코)으로 처리한 후, 20분 냉각기를 갖는다. 잔류 내인성 퍼옥시다제 활성은 1X 차단 용액 (KPL)을 사용하여 4분 동안 차단한다. 절편을 아비딘/비오틴 차단 시약 및 10% 정상 말 혈청을 함유하는 차단 버퍼와 함께 인큐베이팅한 후, 차단 버퍼 내에 0.5 - 5.0 ㎍/ml로 희석시킨 모노클로날 항체를 첨가한다. 이어서, 절편을 비오티닐화 항-마우스 2차 항체에 이어 ABC-HRP와 순차적으로 인큐베이팅하고, DAB로 발색을 검출한다. 상기 설명된 타이라미드 신호 증폭을 사용하여 많은 TAHO 표적 (CD21, CD22, HLA-DOB)에 대한 염색의 감수성을 증가시킨다.
TAHO 분자는 포유동물에서 B-세포 연관 암, 예를 들어 림프종 (즉, 비-호지킨 림프종), 백혈병 (즉, 만성 림프구성 백혈병), 골수종 (즉, 다발 골수종), 및 조혈 세포의 다른 암을 포함한 종양의 치료법을 위한 뛰어난 표적일 수 있다.
실시예
14: 유동 세포측정
TAHO 분자의 발현을 결정하기 위해, 정상 세포 및 이환된 세포, 예를 들어 만성 림프구성 백혈병 (CLL) 세포를 포함한 다양한 세포를 사용하여 FACS 분석을 수행하였다.
A. 정상 세포: TAHO4 (인간 CD79a) 및 TAHO5 (인간 CD79b )
편도 B 세포 하위형에 대해, 신선한 편도를 냉 HBSS 내에서 갈고 70 ㎛ 세포 스트레이너를 통해 통과시켰다. 세포를 1회 세척하고 계수하였다. CD19+ B 세포를 AutoMACS (밀테니이)를 사용하여 농축시켰다. 간단히 설명하면, 편도 세포를 인간 IgG로 차단시키고, 항-CD19 마이크로비드와 함께 인큐베이팅하고, 세척한 후, AutoMACS 위에서 양성 선택하였다. CD19+ B 세포의 분획을 형질세포의 유동 세포측정 분석을 위해 저장하였다. 나머지 CD19+ 세포를 B-세포 아집단의 분류를 위해 FITC-CD77, PE-IgD, 및 APC-CD38로 염색하였다. CD19+ 농축은 PE-Cy5-CD19를 사용하여 분석하였고, 순도는 94-98% CD19+이었다. 편도 B 아집단을 18,000-20,000 세포/초의 유속에서 마이클 해밀턴 (Michael Hamilton)에 의해 MoFlo 상에서 분류하였다. 여포 외투 세포를 IgD+/CD38- 분획으로서 수집하고, 기억 B 세포는 IgD-/CD38-이고, 중심세포는 IgD-/CD38+/CD77-이고, 중심모세포는 IgD-/CD38+/CD77+이었다. 세포를 50% 혈청 내에 밤새 저장하거나, 염색하고 2% 파라포름알데히드로 고정시켰다. 형질세포 분석을 위해, 총 편도 B 세포를 CD138-PE, CD20-FITC, 및 스트렙타비딘-PE-Cy5로 검출되는 목적하는 표적에 대한 비오티닐화 항체로 염색하였다. 편도 B 아집단을 목적하는 표적에 대한 비오티닐화 항체로 염색하고, 스트렙타비딘-PE-Cy5로 검출하였다. 유동 분석은 BD FACSCaliber 상에서 수행하고, 데이타는 FlowJo 소프트웨어 v4.5.2 (트리스타 (TreeStar))를 이용하여 추가로 분석하였다. 상업적으로 이용가능한 비오틴-접합된 항체, 예를 들어 항-인간 CD79a (TAHO4) (ZL7-4) 및 항-인간 CD79b (TAHO5) (CB-3)을 유동 세포측정에서 사용하였다.
정상 세포에 대한
TAHO4
(인간
CD79a
) 및
TAHO5
(인간
CD79b
)의 요약
분류된 편도-B 하위형 상의 발현 패턴은 목적하는 TAHO 폴리펩티드에 특이적인 모노클로날 항체를 사용하여 수행하였다. TAHO4 (인간 CD79a) (항-인간 CD79a 사용) 및 TAHO5 (인간 CD79b) (항-인간 CD79b 사용)는 기억 B 세포, 여포 외투 세포, 중심모세포 및 중심세포에서 유의한 발현을 보였다 (데이타를 제시하지 않음).
편도 형질세포 상의 발현 패턴은 목적하는 TAHO 폴리펩티드에 특이적인 모노클로날 항체를 사용하여 수행하였다. TAHO4 (CD79a) (항-인간 CD79a (TAHO4) 사용) 및 TAHO5 (CD79b) (항-인간 CD79b (TAHO5) 사용)은 형질세포에서 유의한 발현을 보였다 (데이타를 제시하지 않음).
따라서, FACS에 의해 평가할 때 편도-B 하위형 상의 TAHO4 및 TAHO5 발현 패턴의 면에서, 분자는 포유동물에서 B-세포 연관 암, 예를 들어 림프종 (즉, 비-호지킨 림프종), 백혈병 (즉, 만성 림프구성 백혈병), 골수종 (즉, 다발 골수종), 및 조혈 세포의 다른 암을 포함한 종양의 치료법을 위한 뛰어난 표적이다.
B. CLL 세포: TAHO4 (인간 CD79a ) 및 TAHO5 (인간 CD79b )
다음 정제된 또는 형광색소-접합된 mAb를 CLL 샘플의 유동 세포측정을 위해 사용하였다: CD5-PE, CD19-PerCP Cy5.5, CD20-FITC, CD20-APC (비디 파밍엔으로부터 상업적으로 이용가능함). 추가로, CD22 (RFB4, 안셀), CD23 (M-L233, 비디 파밍엔), CD79a (ZL7-4, 세로텍 또는 칼태그), CD79b (CB-3, 비디 파밍엔), CD180 (MHR73-11, 이바이오사이언스), CXCR5 (51505, 알앤디 시스템즈)에 대한 상업적으로 이용가능한 비오티닐화 항체를 유동 세포측정을 위해 사용하였다. CD5, CD19 및 CD20 항체를 사용하여 CLL 세포에 대해 게이팅(gating)하고, 세포 생존력을 검토하기 위해 PI 염색을 수행하였다.
세포 (100 리터 부피 중 106 개의 세포)를 먼저 1 g의 각각의 CD5, CD19 및 CD20 항체 및 10 g의 각각의 인간 및 마우스 감마 글로불린 (잭슨 이뮤노리서치 래보래토리스 (Jackson ImmunoResearch Laboratories, 미국 펜실베니아주 웨스트 그로브))과 인큐베이팅하여 비특이적 결합을 차단한 후, 최적 농도의 mAb와 30분 동안 암소에서 4℃에서 인큐베이팅하였다. 비오티닐화 항체가 사용되면, 스트렙타비딘-PE 또는 스트렙타비딘-APC (잭슨 이뮤노리서치 래보래토리스)를 제조자의 지시에 따라 첨가하였다. 유동 세포측정을 FACS calibur (비디 바이오사이언시즈) 상에서 수행하였다. 전방 산란 (FSC) 및 측방 산란 (SSC) 신호를 선형 방식으로 기록하고, 형광 신호를 로그 방식으로 기록하였다. 죽은 세포 및 파쇄을 세포의 산란 특성을 이용하여 게이팅하였다. 데이타는 CellQuest Pro 소프트웨어 (비디 바이오사이언시즈) 및 FlowJo (트리스타 인크. (TreeStar Inc.))를 사용하여 분석하였다.
CLL
샘플에 대한
TAHO4
(인간
CD79a
) 및
TAHO5
(인간
CD79b
)의 요약
CLL 샘플에 대한 발현 패턴을 목적하는 TAHO 폴리펩티드에 특이적인 모노클로날 항체를 사용하여 수행하였다. TAHO4 (인간 CD79a) 및 TAHO5 (인간 CD79b)는 CLL 샘플에서 유의한 발현을 보였다 (데이타를 제시하지 않음).
따라서, FACS에 의해 평가할 때 만성 림프구성 백혈병 (CLL) 샘플 상의 TAHO4 및 TAHO5 발현 패턴의 면에서, 분자는 포유동물에서 B-세포 연관 암, 예를 들어 림프종 (즉, 비-호지킨 림프종), 백혈병 (즉, 만성 림프구성 백혈병), 골수종 (즉, 다발 골수종), 및 조혈 세포의 다른 암을 포함한 종양의 치료법을 위한 뛰어난 표적이다.
실시예
15:
TAHO
내재화
TAHO 항체의 B-세포주 내로의 내재화를 Raji, Ramos, Daudi 및 다른 B 세포주, 예를 들어 ARH77, SuDHL4, U698M, huB 및 BJAB 세포주에서 평가하였다.
20회 이하의 반응에 사용하기 위한 세포를 갖는 1개의 세분용 (ready-to-split) 15 cm 디쉬의 B-세포 (~50 x 106 세포)를 사용하였다. 세포는 계대배양 25회 미만이고 (8주 미만), 임의의 미코플라스마 없이 건강하게 성장하는 것이었다.
느슨하게 마개를 한 15 ml Falcon 튜브 내에서 1 ㎍/ml 마우스 항-TAHO 항체를 2.5 x 106개의 세포에, 1:10 FcR 블록 (MACS 키트, 아지드를 제거하기 위해 투석함), 1% pen/strep, 5 μM 펩스타틴 A, 10 ㎍/ml 류펩틴 (리소좀 프로테아제 억제제) 및 25 ㎍/ml Alexa488-트랜스페린 (이는 재생 경로를 표지하고, 어떠한 세포가 살아있는지 표시한다; 별법으로 모든 경로를 표식하기 위해 Ax488 덱스트란 유체상 마커를 사용하였다)을 함유하는 2 ml 정상 성장 배지 (예를 들어 RPMI/10% FBS/1% 글루타민) 내에서 24시간 동안 37℃ 5% CO2 인큐베이터 내에서 첨가한다. 빠르게-내재화하는 항체에 대해, 5분마다 시점을 취하였다. 1시간 이내에 취한 시점에 대해, 1 ml 완전 카르보네이트-비함유 배지 (깁코 (Gibco) 18045-088 + 10% FBS, 1% 글루타민, 1% pen/strep, 10 mM Hepes pH 7.4)를 사용하였고, 반응은 CO2 인큐베이터 대신 37℃ 수조에서 수행하였다.
시간 과정의 완료 후에, 세포를 원심분리 (G6-SR 내에서 5분 동안 1500 rpm 4℃, 또는 4℃ 벤치탑 (bench top) 에펜도르프 (eppendorf) 원심분리관에서 2500 rpm 3분)에 의해 수집하고, 1.5 ml 카르보네이트 비함유 배지 (에펜도르프관 내에서) 또는 15 ml Falcon 튜브에 대해 10 ml 배지 내에서 1회 세척하였다. 세포를 제2 원심분리하고, 20분 동안 실온에서 PBS 중 3% 파라포름알데히드 (EMS) 0.5 ml 내에 재현탁시켜 세포를 고정시켰다.
다음의 모든 단계 후에 원심분리를 통해 세포를 수집하였다. 세포를 PBS 내에 세척한 후, 10분 동안 PBS 중 50 mM NH4Cl (시그마) 0.5 ml 내에서 켄칭시키고, 4분의 원심분리 회전시에 4분 동안 PBS 중 0.1% Triton-X-100 0.5 ml를 투과시켰다. 세포를 PBS 내에서 세척하고, 원심분리하였다. 1 ㎍/ml Cy3-항 마우스 (또는 항-종 1차 항체)를 첨가하여, 20분 동안 실온에서 200 ㎕ 완전 카르보네이트 비함유 배지 내에서 항체의 섭취를 검출하였다. 세포를 카르보네이트 비함유 배지 내에서 2회 세척하고, 25 ㎕ 카르보네이트 비함유 배지 내에 재현탁시키고, 세포를 적어도 1시간 동안 (또는 냉장고에서 밤새) 폴리라이신-코팅된 8-웰 LabtekII 슬라이드의 하나의 웰 상으로 드롭 (drop)으로서 침강시켰다. 임의의 비-결합된 세포를 흡인시키고, 슬라이드를 50x24mm 커버슬립 하에 DAPI-함유 Vectashield의 웰 당 한 드롭으로 탑재하였다. 세포를 항체의 내재화에 대해 100x 대물렌즈 하에 검사하였다.
요약
(1) TAHO4/CD79a (항-인간 CD79a (TAHO4) 항체 세로텍 ZL7-4 또는 칼태그 ZL7-4를 사용하여 검출할 때)는 1시간 내에 Ramos 세포 내에, 1시간 내에 Daudi 세포 내에, 및 1시간 내에 SuDHL4 세포 내에 내재화되고, 3시간 내에 리소좀에 전달되었다.
(2) TAHO5/CD79b (항-인간 CD79b (TAHO5) 항체 안셀 SN8을 사용하여 검출할 때)는 20분 내에 Ramos, Daudi 및 Su-DHL4 세포 내에 내재화되고, 1시간 내에 리소좀에 전달되었다.
따라서, 각각의 항-TAHO 항체를 사용하는 면역형광에 의해 평가할 때 B-세포주 상의 TAHO4 및 TAHO5 내재화의 면에서, 분자는 포유동물에서 B-세포 연관 암, 예를 들어 림프종 (즉, 비-호지킨 림프종), 백혈병 (즉, 만성 림프구성 백혈병), 골수종 (즉, 다발 골수종), 및 조혈 세포의 다른 암을 포함한 종양의 치료법을 위한 뛰어난 표적이다.
실시예
16:
TAHO
동시국재화
항-TAHO 항체가 세포 내로 내재화 시에 전달되는 장소를 결정하기 위해, B-세포주 내로 내재화된 TAHO 항체의 동시국재화 연구를 Ramos 세포주에서 평가하였다. LAMP-1은 후기 엔도좀/리소좀-유사 컴파트먼트인 MHC 클래스 II 컴파트먼트 (MIIC)를 포함하는, 후기 엔도좀 및 리소좀에 대한 마커이다 ([Kleijmeer et al., Journal of Cell Biology, 139(3): 639-649 (1997)]; [Hunziker et al., Bioessays, 18:379-389 (1996)]; [Mellman et al., Annu. Rev. Dev. Biology, 12:575-625 (1996)]). HLA-DM은 MIIC에 대한 마커이다.
Ramos 세포를 리소좀 분해를 억제하기 위해 10 ㎍/ml 류펩틴 (로슈) 및 5 μM 펩스타틴 (로슈)의 존재 하에 완전 카르보네이트-비함유 배지 (깁코) 내에서 1 ㎍/ml 항-인간 CD79b (SN8) 항체, FcR 블록 (밀테니이) 및 25 ㎍/ml Alexa647-트랜스페린 (몰레큘라 프로브스)과 함께 3시간 동안 37℃에서 인큐베이팅하였다. 이어서, 세포를 2회 세척하고, 3% 파라포름알데히드 (일렉트론 마이크로스코피 사이언시즈 (Electron Microscopy Sciences))로 20분 동안 실온에서 고정시키고, 50 mM NH4Cl (시그마)로 켄칭시키고, 0.4% 사포닌/2% FBS/1% BSA로 20분 동안 투과시킨 후, 1 ㎍/ml Cy3 항-마우스 (잭슨 이뮤노리서치)와 함께 20분 동안 인큐베이팅하였다. 이어서, 반응을 20분 동안 마우스 IgG (몰레큘라 프로브스)로 차단시킨 후, Image-iT FX 신호 증강제 (몰레큘라 프로브스)와 함께 30분 인큐베이팅하였다. 마지막으로, 세포를 Zenon Alexa488-표지된 마우스 항-LAMP1 (비디 파밍엔) (리소좀 및 MIIC (MHC 클래스 II 경로의 일부인 리소좀-유사 컴파트먼트) 모두에 대한 마커)과 함께 20분 동안 인큐베이팅하고, 3% PFA로 후-고정시켰다. 세포를 20 ㎕ 사포닌 버퍼 내에 재현탁시키고, 폴리-라이신 (시그마) 코팅된 슬라이드에 부착시킨 후, DAPI-함유 VectaShield를 갖는 커버글래스 (벡터 래보래토리스 (Vector Laboratories))에 탑재하였다. MIIC 또는 리소좀의 면역형광을 위해, 세포를 위에서와 같이 고정시키고 투과시키고 증강시킨 후, 제조자의 지시 (몰레큘라 프로브스)에 따라 과량의 마우스 IgG의 존재 하에 Zenon 표지된 Alexa555-HLA-DM (비디 파밍엔) 및 Alexa488-Lamp1로 동시-염색하였다.
요약
항-인간 CD79b (TAHO5) (SN8) 항체는 1 내지 3시간의 섭취 사이에 LAMP1과 동시국재화되고, 재생 마커 트랜스페린과는 유의하게 더 적은 동시국재화를 보였다.
따라서, 각각의 항-TAHO 항체를 사용하는 면역형광에 의해 평가할 때 B-세포주의 MIIC 또는 리소좀 내로 항-인간 CD79b (TAHO5) 내재화의 면에서, 분자는 포유동물에서 B-세포 연관 암, 예를 들어 림프종 (즉, 비-호지킨 림프종), 백혈병 (즉, 만성 림프구성 백혈병), 골수종 (즉, 다발 골수종), 및 조혈 세포의 다른 암을 포함한 종양의 치료법을 위한 뛰어난 표적이다.
실시예
17: 시스테인 조작된 항-
TAHO
항체의 제조
시스테인 조작된 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 및 항-cyno CD79b (TAHO40)의 제조를 본원에 개시된 바와 같이 수행하였다.
chSN8 항체를 코딩하는 DNA (경쇄, 서열 10, 도 10; 및 중쇄, 서열 12, 도 12)를 경쇄 및 중쇄를 변형시키기 위해 본원에 개시된 방법에 의해 돌연변이시켰다. chSN8 항체를 코딩하는 DNA (중쇄, 서열 12; 도 12)를 또한 중쇄의 Fc 영역을 변형시키기 위해 본원에 개시된 방법에 의해 돌연변이시킬 수 있다.
항-cyno CD79b (TAHO40) 항체 (ch10D10)를 코딩하는 DNA (경쇄, 서열 41, 도 21, 및 중쇄, 서열 43, 도 23)를 경쇄 및 중쇄를 변형시키기 위해 본원에 개시된 방법에 의해 돌연변이시켰다. 항-cyno CD79b (TAHO40) 항체 (ch10D10)를 코딩하는 DNA (중쇄, 서열 43, 도 23)를 또한 중쇄의 Fc 영역을 변형시키기 위해 본원에 개시된 방법에 의해 돌연변이시킬 수 있다.
시스테인 조작된 항-CD79b 항체의 제조에서, 경쇄를 코딩하는 DNA는 도 30 (chSN8 thioMAb의 경쇄 서열 58) 및 도 36 (thioMAb 항-cynoCD79b (TAHO40) (ch10D10)의 경쇄 서열 96)에 제시된 바와 같이 경쇄 내의 카바트 위치 205 (순차적인 위치 208)에서 발린을 시스테인으로 치환시키도록 돌연변이시켰다. 중쇄를 코딩하는 DNA는 도 35 (thioMAb 항-cynoCD79b (TAHO40) (ch10D10) 항체의 중쇄 서열 61) 및 도 31 (chSN8 thioMAb의 중쇄 서열 60)에 제시된 바와 같이 중쇄 내의 EU 위치 118 (순차적인 위치 118; 카바트 번호 114)에서 알라닌을 시스테인으로 치환시키도록 돌연변이시켰다. 항-CD79b 항체의 Fc 영역은 표 6-7에 제시된 바와 같이 중쇄 Fc 영역 내의 EU 위치 400 (순차적인 위치 400; 카바트 번호 396)에서 세린을 시스테인으로 치환시키도록 돌연변이시킬 수 있다.
A. 환원 및 재산화에 의한 접합
을
위한 시스테인 조작된 항-
TAHO
항체의 제조
전장, 시스테인 조작된 항-TAHO, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40), 모노클로날 항체 (ThioMab)을 CHO 세포에서 발현시키고, 단백질 A 친화도 크로마토그래피에 이어 크기 배제 크로마토그래피에 의해 정제하였다. 정제된 항체를 500 mM 붕산나트륨 및 500 mM 염화나트륨 (약 pH 8.0) 내에 재구성하고, 약 50-100배 몰 과량의 1 mM TCEP (트리스(2-카르복시에틸)포스핀 염산염; [Getz et al (1999) Anal. Biochem. VoI 273:73-80]; 솔텍 벤쳐스)로 약 1-2시간 동안 37℃에서 환원시킨다. 환원된 ThioMab을 희석하고, 10 mM 아세트산나트륨 (pH 5) 내에서 HiTrap S 컬럼 상에 로딩하고, 0.3M 염화나트륨을 함유하는 PBS로 용출시켰다. 용출된 환원된 ThioMab을 2 mM 데히드로아스코르브산 (dhAA)으로 pH 7에서 3시간 동안, 또는 2 mM 수성 황산구리 (CuSO4)로 실온에서 밤새 처리하였다. 주변 공기 산화가 또한 효과적일 수 있다. 버퍼를 세파덱스 G25 수지 상의 용출에 의해 교환하고, 1 mM DTPA를 함유하는 PBS로 용출시켰다. 티올/Ab 값은 용액의 280 nm에서 흡광도로부터 환원된 항체 농도, 및 DTNB (알드리치)와의 반응 및 412 nm에서 흡광도의 결정에 의해 티올 농도를 결정함으로써 추정하였다.
실시예
18: 시스테인 조작된 항-
TAHO
항체 및 약물-링커 중간체의 접합
에
의한 시스테인 조작된 항-
TAHO
항체 약물 접합체
의
제조
실시예 17의 환원 및 재산화 절차 후에, 시스테인 조작된 항-TAHO 항체, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40)를 PBS (포스페이트 완충 염수) 버퍼 내에 재구성하고, 얼음 상에서 냉각시켰다. 항체당 조작된 시스테인에 비해 약 1.5 몰 당량의 오리스타틴 약물 링커 중간체, 예를 들어 MC-MMAE (말레이미도카프로일-모노메틸 오리스타틴 E), MC-MMAF, MC-val-cit-PAB-MMAE, 또는 MC-val-cit-PAB-MMAF (말레이미도와 같은 티올-반응성 관능기를 갖는)를 DMSO에 용해시키고, 아세토니트릴 및 물에 희석하고, PBS 중의 냉각시킨 환원되고 재산화된 항체에 첨가하였다. 약 1시간 후에, 과량의 말레이미드를 첨가하여 반응을 켄칭시키고 임의의 미반응된 항체 티올기를 캐핑하였다. 반응 혼합물을 원심분리 한외여과에 의해 농축하고, 시스테인 조작된 항-TAHO, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40), 항체 약물 접합체를 PBS 내에서 G25 수지를 통한 용출에 의해 정제하고 탈염시키고, 0.2 ㎛ 필터를 통해 멸균 조건 하에 여과하고, 저장을 위해 동결시켰다.
항-chSN8-HC(A118C) thioMAb-BMPEO-DM1의 제조를 다음과 같이 수행하였다. 항-chSN8-HC(A118C) thioMAb 상의 유리 시스테인을 비스-말레이미도 시약 BM(PEO)3 (피어스 케미칼 (Pierce Chemical))에 의해 변형시켜, 항체의 표면 상에 비반응된 말레이미도기를 남겼다. 이것은 BM(PEO)3을 50% 에탄올/물 혼합물에 10 mM의 농도로 용해시키고, 10배 몰 과량의 BM(PEO)3을 포스페이트 완충 염수 중의 항-chSN8-HC(A118C) thioMAb을 함유하는 용액에 약 1.6 mg/ml (10 마이크로몰)의 농도로 첨가하고, 이를 1시간 동안 반응시킴으로써 달성하였다. 과량의 BM(PEO)3은 150 mM NaCl 버퍼를 사용하여 30 mM 시트레이트 (pH 6) 내에서 겔 여과 (HiTrap 컬럼, 파마시아)에 의해 제거하였다. 디메틸 아세트아미드 (DMA)에 용해시킨 약 10배 몰 과량의 DM1을 항-chSN8-HC(A118C) thioMAb-BMPEO 중간체에 첨가하였다. 약물 모이어티 시약을 용해시키기 위해 디메틸포름아미드 (DMF)를 또한 사용할 수 있다. 반응 혼합물을 밤새 반응시킨 후, PBS 내로 겔 여과 또는 투석하여 비반응된 약물을 제거하였다. PBS 내에서 S200 컬럼 상의 겔 여과를 이용하여 고분자량 응집물을 제거하고, 정제된 항-chSN8-HC(A118C) thioMAb-BMPEO-DM1을 제공하였다.
동일한 프로토콜에 의해, thio 대조군 hu-항-HER2-HC(A118C)-BMPEO-DM1, thio 대조군 hu-항-HER2-HC(A118C)-MC-MMAF 및 thio 대조군 hu-항-HER2-HC(A118C)-MCvcPAB-MMAE를 생성하였다.
상기 절차에 의해, 다음의 시스테인 조작된 항-TAHO 항체 약물 접합체 (TDC)를 제조하고 시험하였다:
1. A118C thio 항-cynoCD79b (TAHO40) (ch10D10)-HC(A118C) 및 MC-MMAF의 접합에 의한 thio 항-cynoCD79b (TAHO40) (ch10D10)-HC(A118C)-MC-MMAF;
2. A118C thio 항-cynoCD79b (TAHO40) (ch10D10)-HC(A118C) 및 BMPEO-DM1의 접합에 의한 thio 항-cynoCD79b (TAHO40) (ch10D10)-HC(A118C)-BMPEO-DM1;
3. A118C thio 항-cynoCD79b (TAHO40) (ch10D10)-HC(A118C) 및 MC-val-cit-PAB-MMAE의 접합에 의한 thio 항-cynoCD79b (TAHO40) (ch10D10)-HC(A118C)-MCvcPAB-MMAE;
4. thio chSN8-HC(A118C) 및 MC-MMAF의 접합에 의한 thio chSN8-HC(A118C)-MC-MMAF; 및
5. chSN8-LC(V205C) 및 MC-MMAF의 접합에 의한 thio chSN8-LC(V205C)-MC-MMAF.
실시예
19: 세포 표면 항원에 대한 시스테인 조작된
ThioMAb
약물 접합체
의
결합
친화도의
특성 결정
BJAB-루시퍼라제 세포 상에서 발현된 TAHO 폴리펩티드, 예를 들어 인간 CD79b (TAHO5) 또는 cynoCD79b (TAHO40)에 대한 항-TAHO, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40), 약물 접합체의 결합 친화도를 FACS 분석에 의해 결정하였다. 추가로, cynoCD79b (TAHO40)을 발현하는 BJAB 세포 상에 발현된 CD79b에 대한 thio 항-cynoCD79b (TAHO40) (ch10D10) 약물 접합체의 결합 친화도를 FACS 분석에 의해 결정하였다.
간단히 설명하면, 100 ㎕ 중 약 1x106개의 세포를 가변량 (BJAB-루시퍼라제 세포 또는 (항-cynoCD79b thioMAb에 대해) cynoCD79b를 발현하는 BJAB 세포의 백만개 세포당 1.0 ㎍, 0.1 ㎍ 또는 0.01 ㎍의 Ab)의 다음 항-CD79b thioMAb 약물 접합체 또는 네이키드 (대조군으로서 비접합된 Ab) 중 하나와 접촉시켰다: (1) thio chSN8-LC(V205C)-MC-MMAF 또는 (2) thio chSN8-HC(A118C)-MC-MMAF (각각 도 32a-b); 또는 (3) thio 항-cynoCD79b (TAHO40) (ch10D10)-HC(A118C)-MCvcPAB-MMAE, (4) thio 항-cynoCD79b (TAHO40) (ch10D10)-HC(A118C)-BMPEO-DM1 또는 (5) thio 항-cynoCD79b (TAHO40) (ch10D10)-HC(A118C)-MC-MMAF (각각 도 33b-33d 참조). PE 접합된 마우스 항-인간 Ig를 2차 검출 항체로서 사용하였다 (BD Cat#555787).
세포 표면에 결합된 항-CD79b 항체는 PE 접합된 마우스 항-인간 Ig를 사용하여 검출하였다. 도 32-33의 플롯은 항원 결합이 시험된 모든 thioMAb 약물 접합체에 대해 대략 동일하였음을 나타낸다.
실시예
20: 항-
TAHO
ThioMab
약물 접합체
에
의한
시험관내
세포 증식 감소에 대한 분석
항-TAHO, 예를 들어 항-인간 CD79b (TAHO5) 또는 항-cyno CD79b (TAHO40), ThioMAb-약물 접합체의 시험관내 효력을 세포 증식 분석에 의해 측정할 수 있다. CellTiter-Glo® 발광 세포 생존력 분석은 콜레옵테라 (Coleoptera) 루시퍼라제의 재조합 발현에 기반한 상업적으로 이용가능한, 균질한 분석 방법 (프로메가 코퍼레이션 (Promega Corp.))이다 (US 5583024; US 5674713; US 5700670). 상기 세포 증식 분석은 대사적 활성 세포의 지표인 존재하는 ATP의 정량에 기초하여 배양액 내의 생육가능한 세포의 수를 결정한다 ([Crouch et al., J. Immunol. Metho., 160: 81-88 (1993)]; US 6602677). CellTiter-Glo® 분석을 자동화 고출력 스크리닝 (HTS)을 가능하게 하는 96 웰 포맷으로 수행한다 (Cree et al., Anticancer Drugs, 6:398-404 (1995)). 균질한 분석 절차는 단일 시약 (The CellTiter-Glo® 시약)을 혈청-보충된 배지 내에서 배양된 세포에 직접 첨가하는 것을 포함한다.
균질한 "첨가-혼합-측정" 포맷은 세포 용해, 및 존재하는 ATP의 양에 비례하는 발광 신호의 생성을 일으킨다. 기질인 딱정벌레 (Beetle) 루시페린은 재조합 반딧불이 루시퍼라제에 의해 산화적으로 데카르복실화되면서, 동시에 ATP를 AMP로 전환시키고 광자를 생성시킨다. 생존가능한 세포는 상대 발광 단위 (RLU)에 반영된다. 데이타는 발광분석기 또는 CCD 카메라 영상화 장치에 의해 기록할 수 있다. 발광 출력은 시간 경과에 따라 측정된 RLU로서 제시한다. %RLU는 "비-약물-접합체" 대조군에 비해 표준화된 RLU 백분율이다. 별법으로, 발광으로부터의 광자를 섬광제의 존재 하에 섬광 계수기에서 계수할 수 있다. 따라서, 광 단위는 CPS (초당 계수)로서 나타낼 수 있다.
thioMAb-약물 접합체의 효능은 CellTiter Glo 발광 세포 생존력 분석 (프로메가 코퍼레이션. Technical bulletin TB288; [Mendoza et al., Cancer Res., 62: 5485-5488 (2002)])으로부터 채택된, 다음 프로토콜을 사용하는 세포 증식 분석에 의해 측정한다:
1. 배지 중 약 3000 BJAB, Granta-519 또는 WSU-DLCL2 세포를 함유하는 세포 배양액의 40 ㎕ 분취액을 384-웰의 불투명 벽의 플레이트의 각각의 웰에 넣는다.
2. TDC (ThioMab 약물 접합체) (10 ㎕)를 4중 실험의 실험 웰에 10000, 3333, 1111, 370, 123, 41, 13.7, 4.6 또는 1.5 ng/mL의 최종 농도로 첨가하고, 여기서 "비-약물 접합체" 대조군 웰에는 배지만을 넣고, 3일 동안 인큐베이팅한다.
3. 플레이트를 약 30분 동안 실온으로 평형화시킨다.
4. CellTiter-Glo 시약 (50 ㎕)을 첨가한다.
5. 내용물을 회전 진탕기 상에서 2분 동안 혼합하여 세포 용해를 유도한다.
6. 플레이트를 실온에서 10분 동안 인큐베이팅하여 발광 신호를 안정화시킨다.
7. 발광을 그래프에 %RLU (상대 발광 단위)로서 기록하고 보고한다. 약물 접합체-비함유 배지와 인큐베이팅한 세포로부터의 데이타는 0.51 ng/ml에서 플로팅한다.
배지: BJAB, Granta-519 및 WSU-DLCL2 세포는 RPMI1640/10% FBS/2mM 글루타민 내에서 성장시킨다.
실시예
21: 항-
TAHO
ThioMab
약물 접합체
에
의한
생체내
종양 성장의 억제에 대한 분석
A.
Granta
-519 (인간 외투 세포 림프종)
유사한 연구에서, 실시예 12에 개시된 것 (상기 참조)과 동일한 이종이식편 연구 프로토콜을 사용하고, 투여되는 약물 접합체 및 용량을 변화시키면서, CB17 SCID 마우스에서 Granta-519 이종이식편 (인간 외투 세포 림프종)에서 thioMAb 약물 접합체의 효능을 연구하였다. 약물 접합체 및 용량 (모든 ADC 및 대조군에 대해 제0일에 투여됨)은 아래 표 21에 제시한다.
대조군 Ab는 hu-항-HER2-MC-MMAF 또는 chSN8-MC-MMAF이었다. 대조군 HC(A118C) thioMAb는 thio hu-항-HER2-HC(A118C)-MMAF thioMAb이었다. 결과를 표 21 및 도 34에 제시한다.
도 34a는 표 21에 제시된 용량으로 중쇄 A118C 또는 경쇄 V205C 항-CD79b TDC로 처리한 CB17 SCID 마우스에서 Granta-519 이종이식편에서의 시간 경과에 따른 평균 종양 부피의 변화를 플로팅한 그래프이다. 구체적으로, thio chSN8-HC(A118C)-MC-MMAF 및 thio chSN8-LC(V205C)-MC-MMAF를 투여하면 음성 대조군 (항-hu-HER2-MC-MMAF 및 thio-hu-항-HER2-HC(A118C)-MC-MMAF)에 비해 종양 성장의 억제를 보였다. 다른 대조군은 chSN8-MC-MMAF를 포함하였다.
추가로, 동일한 연구에서, 처음 14일 동안 체중 변화 비율 (%)을 각각의 투여량 군에서 결정하였다. 결과 (도 34b)는 이들 thioMAb 약물 접합체를 투여하여도 상기 기간 동안 체중 비율의 유의한 감소 또는 체중 손실을 일으키지 않았음을 나타낸다.
또한 추가로, 표 21에서, 시험된 총수 중, PR = 부분 퇴행 (투여 후 임의의 시점에서 종양 부피가 제0일에 측정된 종양 부피의 50% 미만으로 떨어진 경우) 또는 CR = 완전 관해 (투여 후 임의의 시점에서 종양 부피가 0 mm3로 떨어진 경우)를 보이는 마우스의 수를 표시하고, NA = 적용불가이다 (DAR = 약물 대 항체 비).
B.
BJAB
-
cynoCD79b
(
TAHO40
)
이종이식편
유사한 연구에서, 실시예 12에 개시된 것 (상기 참조)과 동일한 이종이식편 연구 프로토콜을 사용하고, 투여되는 약물 접합체 및 용량을 변화시키면서, CB17 SCID에서 cynoCD79b (TAHO40) 이종이식편을 발현하는 BJAB (버킷 림프종) 세포 (BJAB-cynoCD79b)에서 thioMAb 약물 접합체의 효능을 연구하였다. 약물 접합체 및 용량 (모든 ADC 및 대조군에 대해 제0일에 투여됨)은 아래 표 22에 제시한다.
대조군 Ab는 비히클 (버퍼 단독)이었다. 대조군 thio MAb은 thio-hu-항-HER2-HC(A118C)-BMPEO-DM1, thio-hu-항-HER2-HC(A118C)-MC-MMAF 및 thio-hu-항-HER2-HC(A118C)-MCvcPAB-MMAE 항체 thioMAb이었다. 결과를 표 22 및 도 37에 제시한다.
도 37은 표 22에 제시된 용량에서 중쇄 A118C 항-CD79b TDC로 처리한 CB17 SCID 마우스에서 BJAB-cynoCD79b 이종이식편에서의 시간 경과에 따른 종양 성장의 억제를 플로팅한 그래프이다. 구체적으로, thio-항-cynoCD79b (TAHO40) (ch10D10)-HC(A118C)-BMPEO-DM1, thio-항-cynoCD79b (TAHO40) (ch10D10)-HC(A118C)-MCvcPAB-MMAE 및 thio-항-cynoCD79b (TAHO40) (ch10D10)-HC(A118C)-MC-MMAF를 투여하면 음성 대조군 (thio-항-HER2-HC(A118C)-BMPEO-DM1, thio-항-HER2-HC(A118C)-MCvcPAB-MMAE 및 thio-항-HER2-HC(A118C)-MC-MMAF 및 A-비히클)에 비해 종양 성장의 억제를 보였다.
또한 추가로, 표 22에서, 시험된 총수 중, PR = 부분 퇴행 (투여 후 임의의 시점에서 종양 부피가 제0일에 측정된 종양 부피의 50% 미만으로 떨어진 경우) 또는 CR = 완전 관해 (투여 후 임의의 시점에서 종양 부피가 0 mm3로 떨어진 경우)를 보이는 마우스의 수를 표시하고, NA = 적용불가이다 (DAR = 약물 대 항체 비).
C.
BJAB
-
cynoCD79b
(
TAHO40
)
이종이식편
유사한 연구에서, 실시예 12에 개시된 것 (상기 참조)과 동일한 이종이식편 연구 프로토콜을 사용하고, 투여되는 약물 접합체 및 용량을 변화시키면서, CB17 SCID에서 cynoCD79b (TAHO40) 이종이식편을 발현하는 BJAB (버킷 림프종) 세포 (BJAB-cynoCD79b)에서 thioMAb 약물 접합체의 효능을 연구하였다. 약물 접합체 및 용량 (모든 ADC 및 대조군에 대해 제0일에 투여됨)은 아래 표 23에 제시한다.
대조군 thio MAb는 thio-hu-항-HER2-HC(A118C)-BMPEO-DM1 및 thio-항-cynoCD79b (TAHO40) (ch10D10)-HC(A118C) 항체 thioMAb이었다. 결과를 표 23 및 도 38에 제시한다.
도 38은 표 23에 제시된 용량에서 중쇄 A118C 항-CD79b TDC로 처리한 CB17 SCID 마우스에서 BJAB-cynoCD79b 이종이식편에서의 시간 경과에 따른 종양 성장의 억제를 플로팅하는 그래프이다. 구체적으로, thio-항-cynoCD79b (TAHO40) (ch10D10)-HC(A118C)-BMPEO-DM1을 투여하면 음성 대조군 (thio-항-HER2-HC(A118C)-BMPEO-DM1)에 비해 종양 성장의 억제를 보였다. 다른 대조군은 thio-항-cynoCD79b (TAHO40) (ch10D10)-HC(A118C)을 포함하였다.
결과를 아래 표 23에 제시한다. 표 23에서, 시험된 총수 중, PR = 부분 퇴행 (투여 후 임의의 시점에서 종양 부피가 제0일에 측정된 종양 부피의 50% 미만으로 떨어진 경우) 또는 CR = 완전 관해 (투여 후 임의의 시점에서 종양 부피가 0 mm3로 떨어진 경우)를 보이는 마우스의 수를 표시하고, NA = 적용불가이다 (DAR = 약물 대 항체 비).
물질의 기탁
다음 물질을 아메리칸 타입 컬쳐 컬렉션 (미국 20110-2209 버지니아주 매나서스 유니버시티 블러바드 10801 (ATCC))에 기탁하였다:
이들 기탁은 특허절차상 미생물 기탁의 국제적 승인에 대한 부다페스트 조약의 규정 및 (부다페스트 조약)의 감독하에 이루어졌다. 이것은 기탁일로부터 30년 동안 기탁물의 생존가능한 배양의 유지를 보장한다. 기탁물은 부다페스트 조약의 규정 하에 ATCC로부터 이용가능할 것이고, 이는 제넨테크, 인크.와 ATCC 사이의 협정에 따르며, 상기 협정은 기탁 물질에 대한 공중의 이용가능성에 대해 기탁자가 부과한 모든 제한이 관련 미국 특허의 등록시에 제거되고 이는 취소할 수 없음을 보장하고, 관련 미국 특허의 등록시에 또는 임의의 미국 또는 타국 특허 출원의 공개시에 (두 시점 중에서 빠른 시점에) 공중의 기탁물의 배양 자손체에 대한 영구적이고 비제한적인 이용가능성을 보장하고, 35 USC §122 및 그에 대한 미국 특허청장의 규칙 (특히 886 OG 638에 대한 37 CFR §1.14 포함)에 따라 특허청장에 의해 자격이 인정된 사람의 자손체에 대한 이용가능성을 보장한다.
본원의 양수인은 기탁 중의 물질의 배양물이 적합한 조건 하에 배양될 때 사멸 또는 상실 또는 파괴될 경우에, 물질을 통지시에 동일한 다른 배양물로 신속하게 교체할 것임을 동의하였다. 기탁물의 이용가능성은 해당국 특허법에 따라 임의의 정부 당국에서 승인된 권리를 위배하여 본 발명을 실시할 권리로서 해석되지 않아야 한다.
상기 서면 명세서는 당업자가 본 발명을 실시하기에 충분한 것으로 간주된다. 본 발명은 기탁된 구성물에 의해 범위가 제한되어서는 안 되고, 이는 기탁된 실시태양은 본 발명의 특정 측면의 단일 예시로서 의도되고, 기능상 동등한 임의의 구성물이 본 발명의 범위 내에 있기 때문이다. 본원에서 물질의 기탁은 본원에 포함된 서면 설명이 그의 최상의 방식을 포함한 본 발명의 임의의 측면의 실시를 가능하게 하기에 부적당하거나 특허청구범위의 범위를 그가 나타내는 특정한 예시로 제한하는 것으로 해석되어서는 안 된다는 승인을 구성하지 않는다. 실제로, 본원에 제시되고 설명된 것에 추가로 본 발명의 다양한 변형이 상기한 설명으로부터 당업자에게 명백해질 것이고, 첨부된 특허청구범위의 범위 내에 있다.
Sequence Listing
<110> Genentech, Inc.
Crowley, Craig
deSauvage, Frederic J.
Eaton, Dan L.
Ebens, Jr., Allen J.
Elkins, Kristi
Reddy, Jagath
Hongo, Jo-Anne S.
Ross, Sarajane
Vandlen, Richard L.
Smith, Victoria
Zheng, Bing
Polson, Andrew
<120> COMPOSITIONS AND METHODS FOR THE TREATMENT OF TUMOR
OF HEMATOPOIETIC ORIGIN
<130> GNE-5105P5PCT
<140> Herewith
<141> Not yet Assigned
<150> US 12/023,811
<151> 2008-01-31
<150> US 60/378,885
<151> 2002-05-08
<150> US 60/405,645
<151> 2002-08-21
<150> PCT/US03/11148
<151> 2003-04-10
<150> US 10/411,010
<151> 2003-04-10
<150> PCT/US03/25892
<151> 2003-08-19
<150> US 10/643,795
<151> 2003-08-19
<150> US 60/520,842
<151> 2003-11-17
<150> US 60/532,426
<151> 2003-12-24
<150> US 60/576,517
<151> 2004-06-01
<150> US 60/616,098
<151> 2004-10-05
<150> US 10/989,826
<151> 2004-11-16
<150> PCT/US04/038262
<151> 2004-11-16
<150> PCT/US05/018829
<151> 2005-05-31
<150> US 11/141,344
<151> 2005-05-31
<150> US 11/462,336
<151> 2006-08-03
<160> 102
<210> 1
<211> 1107
<212> DNA
<213> Homo sapiens
<400> 1
tgctgcaact caaactaacc aacccactgg gagaagatgc ctgggggtcc 50
aggagtcctc caagctctgc ctgccaccat cttcctcctc ttcctgctgt 100
ctgctgtcta cctgggccct gggtgccagg ccctgtggat gcacaaggtc 150
ccagcatcat tgatggtgag cctgggggaa gacgcccact tccaatgccc 200
gcacaatagc agcaacaacg ccaacgtcac ctggtggcgc gtcctccatg 250
gcaactacac gtggccccct gagttcttgg gcccgggcga ggaccccaat 300
ggtacgctga tcatccagaa tgtgaacaag agccatgggg gcatatacgt 350
gtgccgggtc caggagggca acgagtcata ccagcagtcc tgcggcacct 400
acctccgcgt gcgccagccg ccccccaggc ccttcctgga catgggggag 450
ggcaccaaga accgaatcat cacagccgag gggatcatcc tcctgttctg 500
cgcggtggtg cctgggacgc tgctgctgtt caggaaacga tggcagaacg 550
agaagctcgg gttggatgcc ggggatgaat atgaagatga aaacctttat 600
gaaggcctga acctggacga ctgctccatg tatgaggaca tctcccgggg 650
cctccagggc acctaccagg atgtgggcag cctcaacata ggagatgtcc 700
agctggagaa gccgtgacac ccctactcct gccaggctgc ccccgcctgc 750
tgtgcaccca gctccagtgt ctcagctcac ttccctggga cattctcctt 800
tcagcccttc tgggggcttc cttagtcata ttcccccagt ggggggtggg 850
agggtaacct cactcttctc caggccaggc ctccttggac tcccctgggg 900
gtgtcccact cttcttccct ctaaactgcc ccacctccta acctaatccc 950
cacgccccgc tgcctttccc aggctcccct cacccagcgg gtaatgagcc 1000
cttaatcgct gcctctaggg gagctgattg tagcagcctc gttagtgtca 1050
ccccctcctc cctgatctgt cagggccact tagtgataat aaattcttcc 1100
caactgc 1107
<210> 2
<211> 226
<212> PRT
<213> Homo sapiens
<400> 2
Met Pro Gly Gly Pro Gly Val Leu Gln Ala Leu Pro Ala Thr Ile
1 5 10 15
Phe Leu Leu Phe Leu Leu Ser Ala Val Tyr Leu Gly Pro Gly Cys
20 25 30
Gln Ala Leu Trp Met His Lys Val Pro Ala Ser Leu Met Val Ser
35 40 45
Leu Gly Glu Asp Ala His Phe Gln Cys Pro His Asn Ser Ser Asn
50 55 60
Asn Ala Asn Val Thr Trp Trp Arg Val Leu His Gly Asn Tyr Thr
65 70 75
Trp Pro Pro Glu Phe Leu Gly Pro Gly Glu Asp Pro Asn Gly Thr
80 85 90
Leu Ile Ile Gln Asn Val Asn Lys Ser His Gly Gly Ile Tyr Val
95 100 105
Cys Arg Val Gln Glu Gly Asn Glu Ser Tyr Gln Gln Ser Cys Gly
110 115 120
Thr Tyr Leu Arg Val Arg Gln Pro Pro Pro Arg Pro Phe Leu Asp
125 130 135
Met Gly Glu Gly Thr Lys Asn Arg Ile Ile Thr Ala Glu Gly Ile
140 145 150
Ile Leu Leu Phe Cys Ala Val Val Pro Gly Thr Leu Leu Leu Phe
155 160 165
Arg Lys Arg Trp Gln Asn Glu Lys Leu Gly Leu Asp Ala Gly Asp
170 175 180
Glu Tyr Glu Asp Glu Asn Leu Tyr Glu Gly Leu Asn Leu Asp Asp
185 190 195
Cys Ser Met Tyr Glu Asp Ile Ser Arg Gly Leu Gln Gly Thr Tyr
200 205 210
Gln Asp Val Gly Ser Leu Asn Ile Gly Asp Val Gln Leu Glu Lys
215 220 225
Pro
<210> 3
<211> 1270
<212> DNA
<213> Homo sapiens
<400> 3
caggggacag gctgcagccg gtgcagttac acgttttcct ccaaggagcc 50
tcggacgttg tcacgggttt ggggtcgggg acagagcagt gaccatggcc 100
aggctggcgt tgtctcctgt gcccagccac tggatggtgg cgttgctgct 150
gctgctctca gctgagccag taccagcagc cagatcggag gaccggtacc 200
ggaatcccaa aggtagtgct tgttcgcgga tctggcagag cccacgtttc 250
atagccagga aacggggctt cacggtgaaa atgcactgct acatgaacag 300
cgcctccggc aatgtgagct ggctctggaa gcaggagatg gacgagaatc 350
cccagcagct gaagctggaa aagggccgca tggaagagtc ccagaacgaa 400
tctctcgcca ccctcaccat ccaaggcatc cggtttgagg acaatggcat 450
ctacttctgt cagcagaagt gcaacaacac ctcggaggtc taccagggct 500
gcggcacaga gctgcgagtc atgggattca gcaccttggc acagctgaag 550
cagaggaaca cgctgaagga tggtatcatc atgatccaga cgctgctgat 600
catcctcttc atcatcgtgc ctatcttcct gctgctggac aaggatgaca 650
gcaaggctgg catggaggaa gatcacacct acgagggcct ggacattgac 700
cagacagcca cctatgagga catagtgacg ctgcggacag gggaagtgaa 750
gtggtctgta ggtgagcacc caggccagga gtgagagcca ggtcgcccca 800
tgacctgggt gcaggctccc tggcctcagt gactgcttcg gagctgcctg 850
gctcatggcc caaccccttt cctggacccc ccagctggcc tctgaagctg 900
gcccaccaga gctgccattt gtctccagcc cctggtcccc agctcttgcc 950
aaagggcctg gagtagaagg acaacagggc agcaacttgg agggagttct 1000
ctggggatgg acgggaccca gccttctggg ggtgctatga ggtgatccgt 1050
ccccacacat gggatggggg aggcagagac tggtccagag cccgcaaatg 1100
gactcggagc cgagggcctc ccagcagagc ttgggaaggg ccatggaccc 1150
aactgggccc cagaagagcc acaggaacat cattcctctc ccgcaaccac 1200
tcccacccca gggaggccct ggcctccagt gccttccccc gtggaataaa 1250
cggtgtgtcc tgagaaacca 1270
<210> 4
<211> 229
<212> PRT
<213> Homo sapiens
<400> 4
Met Ala Arg Leu Ala Leu Ser Pro Val Pro Ser His Trp Met Val
1 5 10 15
Ala Leu Leu Leu Leu Leu Ser Ala Glu Pro Val Pro Ala Ala Arg
20 25 30
Ser Glu Asp Arg Tyr Arg Asn Pro Lys Gly Ser Ala Cys Ser Arg
35 40 45
Ile Trp Gln Ser Pro Arg Phe Ile Ala Arg Lys Arg Gly Phe Thr
50 55 60
Val Lys Met His Cys Tyr Met Asn Ser Ala Ser Gly Asn Val Ser
65 70 75
Trp Leu Trp Lys Gln Glu Met Asp Glu Asn Pro Gln Gln Leu Lys
80 85 90
Leu Glu Lys Gly Arg Met Glu Glu Ser Gln Asn Glu Ser Leu Ala
95 100 105
Thr Leu Thr Ile Gln Gly Ile Arg Phe Glu Asp Asn Gly Ile Tyr
110 115 120
Phe Cys Gln Gln Lys Cys Asn Asn Thr Ser Glu Val Tyr Gln Gly
125 130 135
Cys Gly Thr Glu Leu Arg Val Met Gly Phe Ser Thr Leu Ala Gln
140 145 150
Leu Lys Gln Arg Asn Thr Leu Lys Asp Gly Ile Ile Met Ile Gln
155 160 165
Thr Leu Leu Ile Ile Leu Phe Ile Ile Val Pro Ile Phe Leu Leu
170 175 180
Leu Asp Lys Asp Asp Ser Lys Ala Gly Met Glu Glu Asp His Thr
185 190 195
Tyr Glu Gly Leu Asp Ile Asp Gln Thr Ala Thr Tyr Glu Asp Ile
200 205 210
Val Thr Leu Arg Thr Gly Glu Val Lys Trp Ser Val Gly Glu His
215 220 225
Pro Gly Gln Glu
<210> 5
<211> 1125
<212> DNA
<213> Macaca fascicularis
<400> 5
gtacgcgtag aatcgagacc gaggagaggg ttagggatag gcttaccttc 50
gaaccgcggg ccctctagac tcgagcggcc gccactgtgc tggatatctg 100
cagaattgcc ctttcaaact aaccaaccca ctgggagaag atgcctgggg 150
gtccaggagt cctccaagct ctgcctgcca ccatcttcct cttcttcctg 200
ctgtctgctg cctacctggg tcctgggtgc caggccctgt gggtagatgg 250
gggcccaaca tcattgatgg tgagcctggg ggaagaggcc cacttccaat 300
gcctgcacaa tggcagcaac gccaacgtca cctggtggcg cgtcctccat 350
ggcaactaca cgtggccccc tcagttcgtg ggcaagggcc agggctacaa 400
tggtacgctg accatccaga acgtgaacaa gagccacggg ggcatatacc 450
tgtgccgggt ccaggagggc aataagccac accagcagtc ctgcggcacc 500
tacctccgtg tgcgccatcc gccccccagg cccttcctgg acatggggga 550
gggcaccaag aaccgaatca tcacagccga gggcatcatc ctcctgttct 600
gcgcggtggt gcctgggacg ctgctgctgt tcaggaaacg atggcagaac 650
gagaagctcg ggttggatgc tggggatgaa tatgaagacg aaaaccttta 700
tgaaggcctg aacctggacg actgctccat gtatgaggac atctcccggg 750
gcctccaggg cacctaccag gatgtgggca gcctcaacat aggagatgtc 800
cagctggaga agccatgaca cccctactcc tgccaggctg cccctgcctg 850
ctgtggaccc agctccagtg tctcagttcg cttccctagg acattctccc 900
ttcagccctt ctgggggctt ccttagtcat cttccctcgg tggggagtgg 950
ggggtaatct cactcttctc caggccaggc ctcattggac tcccccgggg 1000
gtatcccact cttcttccct ctaaactgcc ccatctccta acctaatccc 1050
cccctgctgc ctttcccagg ctcccctcac cccagtgggt aatgagccct 1100
taatcgctga agggcaattc cacca 1125
<210> 6
<211> 225
<212> PRT
<213> Macaca fascicularis
<400> 6
Met Pro Gly Gly Pro Gly Val Leu Gln Ala Leu Pro Ala Thr Ile
1 5 10 15
Phe Leu Phe Phe Leu Leu Ser Ala Ala Tyr Leu Gly Pro Gly Cys
20 25 30
Gln Ala Leu Trp Val Asp Gly Gly Pro Thr Ser Leu Met Val Ser
35 40 45
Leu Gly Glu Glu Ala His Phe Gln Cys Leu His Asn Gly Ser Asn
50 55 60
Ala Asn Val Thr Trp Trp Arg Val Leu His Gly Asn Tyr Thr Trp
65 70 75
Pro Pro Gln Phe Val Gly Lys Gly Gln Gly Tyr Asn Gly Thr Leu
80 85 90
Thr Ile Gln Asn Val Asn Lys Ser His Gly Gly Ile Tyr Leu Cys
95 100 105
Arg Val Gln Glu Gly Asn Lys Pro His Gln Gln Ser Cys Gly Thr
110 115 120
Tyr Leu Arg Val Arg His Pro Pro Pro Arg Pro Phe Leu Asp Met
125 130 135
Gly Glu Gly Thr Lys Asn Arg Ile Ile Thr Ala Glu Gly Ile Ile
140 145 150
Leu Leu Phe Cys Ala Val Val Pro Gly Thr Leu Leu Leu Phe Arg
155 160 165
Lys Arg Trp Gln Asn Glu Lys Leu Gly Leu Asp Ala Gly Asp Glu
170 175 180
Tyr Glu Asp Glu Asn Leu Tyr Glu Gly Leu Asn Leu Asp Asp Cys
185 190 195
Ser Met Tyr Glu Asp Ile Ser Arg Gly Leu Gln Gly Thr Tyr Gln
200 205 210
Asp Val Gly Ser Leu Asn Ile Gly Asp Val Gln Leu Glu Lys Pro
215 220 225
<210> 7
<211> 893
<212> DNA
<213> Macaca fascicularis
<400> 7
tcatggtgat ggtgatgatg accggtacgc gtagaatcga gaccgaggag 50
agggttaggg ataggcttac cttcgaaccg cgggccctct agactcgagc 100
ggccgccact gtgctggata tctgcagaat tgcccttggg gacagagcag 150
tgaccatggc caggctggcg ttgtctcctg tgtccagcca ctggctggtg 200
gcgttgctgc tgctgctctc agcagctgag ccagtgccag cagccaaatc 250
agaggacctg tacccgaatc ccaaaggtag tgcttgttct cggatctggc 300
agagcccacg tttcatagcc aggaaacggg gcttcacggt gaaaatgcac 350
tgctacgtga ccaacagcac cttcagcatc gtgagctggc tccggaagcg 400
ggagacggac aaggagcccc aacaggtgaa cctggagcag ggccacatgc 450
atcagaccca aaacagctct gtcaccaccc tcatcatcca agacatccgg 500
tttgaggaca acggcatcta cttctgtcag caggagtgca gcaagacctc 550
ggaggtctac cggggctgcg gcacggagct gcgagtcatg gggttcagca 600
ccttggcaca gctgaagcag aggaacacgc tgaaggatgg catcatcatg 650
atccagacgc tgctgatcat cctcttcatc atcgtgccca tcttcctgct 700
gctggacaag gatgacagca aggccggcat ggaggaagat cacacctacg 750
agggcctgga cattgaccag acggccacct acgaggacat agtgacgctg 800
cggacagggg aagtgaagtg gtctgtgggt gagcacccag gtcaggagtg 850
agagccagga cctccccacg gcctgggtgc aggctcccca gcc 893
<210> 8
<211> 231
<212> PRT
<213> Macaca fascicularis
<400> 8
Met Ala Arg Leu Ala Leu Ser Pro Val Ser Ser His Trp Leu Val
1 5 10 15
Ala Leu Leu Leu Leu Leu Ser Ala Ala Glu Pro Val Pro Ala Ala
20 25 30
Lys Ser Glu Asp Leu Tyr Pro Asn Pro Lys Gly Ser Ala Cys Ser
35 40 45
Arg Ile Trp Gln Ser Pro Arg Phe Ile Ala Arg Lys Arg Gly Phe
50 55 60
Thr Val Lys Met His Cys Tyr Val Thr Asn Ser Thr Phe Ser Ile
65 70 75
Val Ser Trp Leu Arg Lys Arg Glu Thr Asp Lys Glu Pro Gln Gln
80 85 90
Val Asn Leu Glu Gln Gly His Met His Gln Thr Gln Asn Ser Ser
95 100 105
Val Thr Thr Leu Ile Ile Gln Asp Ile Arg Phe Glu Asp Asn Gly
110 115 120
Ile Tyr Phe Cys Gln Gln Glu Cys Ser Lys Thr Ser Glu Val Tyr
125 130 135
Arg Gly Cys Gly Thr Glu Leu Arg Val Met Gly Phe Ser Thr Leu
140 145 150
Ala Gln Leu Lys Gln Arg Asn Thr Leu Lys Asp Gly Ile Ile Met
155 160 165
Ile Gln Thr Leu Leu Ile Ile Leu Phe Ile Ile Val Pro Ile Phe
170 175 180
Leu Leu Leu Asp Lys Asp Asp Ser Lys Ala Gly Met Glu Glu Asp
185 190 195
His Thr Tyr Glu Gly Leu Asp Ile Asp Gln Thr Ala Thr Tyr Glu
200 205 210
Asp Ile Val Thr Leu Arg Thr Gly Glu Val Lys Trp Ser Val Gly
215 220 225
Glu His Pro Gly Gln Glu
230
<210> 9
<211> 929
<212> DNA
<213> Artificial sequence
<220>
<223> Chimeric Ab comprising murine and human sequences (chSN8)
<400> 9
cactcccagc tccaactgca cctcggttct atcgattgaa ttccaccatg 50
ggatggtcat gtatcatcct ttttctagta gcaactgcaa ctggagtaca 100
ttcagatatc gtgctgaccc aatctccagc ttctttggct gtgtctctgg 150
ggcagagggc caccatctcc tgcaaggcca gccaaagtgt tgattatgat 200
ggtgatagtt ttttgaactg gtaccaacag aaaccaggac agccacccaa 250
actcttcatc tatgctgcat ccaatctaga atctgggatc ccagccaggt 300
ttagtggcag tgggtctggg acagacttca ccctcaacat ccatcctgtg 350
gaggaggagg atgctgcaac ctattactgt cagcaaagta atgaggatcc 400
gctcacgttc ggggcaggca ccgagctgga actcaaacgg accgtggctg 450
caccatctgt cttcatcttc ccgccatctg atgagcagtt gaaatctgga 500
actgcctctg ttgtgtgcct gctgaataac ttctatccca gagaggccaa 550
agtacagtgg aaggtggata acgccctcca atcgggtaac tcccaggaga 600
gtgtcacaga gcaggacagc aaggacagca cctacagcct cagcagcacc 650
ctgacgctga gcaaagcaga ctacgagaaa cacaaagtct acgcctgcga 700
agtcacccat cagggcctga gctcgcccgt cacaaagagc ttcaacaggg 750
gagagtgtta agcttggccg ccatggccca acttgtttat tgcagcttat 800
aatggttaca aataaagcaa tagcatcaca aatttcacaa ataaagcatt 850
tttttcactg cattctagtt gtggtttgtc caaactcatc aatgtatctt 900
atcatgtctg gatcgggaat taattcggc 929
<210> 10
<211> 218
<212> PRT
<213> Artificial sequence
<220>
<223> Chimeric Ab comprising murine and human sequences (chSN8)
<400> 10
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu
1 5 10 15
Gly Gln Arg Ala Thr Ile Ser Cys Lys Ala Ser Gln Ser Val Asp
20 25 30
Tyr Asp Gly Asp Ser Phe Leu Asn Trp Tyr Gln Gln Lys Pro Gly
35 40 45
Gln Pro Pro Lys Leu Phe Ile Tyr Ala Ala Ser Asn Leu Glu Ser
50 55 60
Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
65 70 75
Thr Leu Asn Ile His Pro Val Glu Glu Glu Asp Ala Ala Thr Tyr
80 85 90
Tyr Cys Gln Gln Ser Asn Glu Asp Pro Leu Thr Phe Gly Ala Gly
95 100 105
Thr Glu Leu Glu Leu Lys Arg Thr Val Ala Ala Pro Ser Val Phe
110 115 120
Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser
125 130 135
Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val
140 145 150
Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
155 160 165
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
170 175 180
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
185 190 195
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr
200 205 210
Lys Ser Phe Asn Arg Gly Glu Cys
215
<210> 11
<211> 1469
<212> DNA
<213> Artificial sequence
<220>
<223> Chimeric Ab comprising murine and human sequences (chSN8)
<400> 11
tcggttctat cgattgaatt ccaccatggg atggtcatgt atcatccttt 50
ttctagtagc aactgcaact ggagtacatt cagaagttca gctgcagcag 100
tctggggctg aactgatgaa gcctggggcc tcagtgaaga tatcctgcaa 150
ggctactggc tacacattca gtagttactg gatagagtgg gtaaagcaga 200
ggcctggaca tggccttgag tggattggag agattttacc tggaggtggt 250
gatactaact acaatgagat tttcaagggc aaggccacat tcactgcaga 300
tacatcctcc aacacagcct acatgcaact cagcagcctg acatctgagg 350
actctgccgt ctattactgt acaagacgag taccggttta ctttgactac 400
tggggccaag gaacctcagt caccgtctcc tcagcctcca ccaagggccc 450
atcggtcttc cccctggcac cctcctccaa gagcacctct gggggcacag 500
cggccctggg ctgcctggtc aaggactact tccccgaacc ggtgacggtg 550
tcgtggaact caggcgccct gaccagcggc gtgcacacct tcccggctgt 600
cctacagtcc tcaggactct actccctcag cagcgtggtg actgtgccct 650
ctagcagctt gggcacccag acctacatct gcaacgtgaa tcacaagccc 700
agcaacacca aggtggacaa gaaagttgag cccaaatctt gtgacaaaac 750
tcacacatgc ccaccgtgcc cagcacctga actcctgggg ggaccgtcag 800
tcttcctctt ccccccaaaa cccaaggaca ccctcatgat ctcccggacc 850
cctgaggtca catgcgtggt ggtggacgtg agccacgaag accctgaggt 900
caagttcaac tggtacgtgg acggcgtgga ggtgcataat gccaagacaa 950
agccgcggga ggagcagtac aacagcacgt accgtgtggt cagcgtcctc 1000
accgtcctgc accaggactg gctgaatggc aaggagtaca agtgcaaggt 1050
ctccaacaaa gccctcccag cccccatcga gaaaaccatc tccaaagcca 1100
aagggcagcc ccgagaacca caggtgtaca ccctgccccc atcccgggaa 1150
gagatgacca agaaccaggt cagcctgacc tgcctggtca aaggcttcta 1200
tcccagcgac atcgccgtgg agtgggagag caatgggcag ccggagaaca 1250
actacaagac cacgcctccc gtgctggact ccgacggctc cttcttcctc 1300
tacagcaagc tcaccgtgga caagagcagg tggcagcagg ggaacgtctt 1350
ctcatgctcc gtgatgcatg aggctctgca caaccactac acgcagaaga 1400
gcctctccct gtctccgggt aaatgagtgc gacggcccta gagtcgacct 1450
gcagaagctt ggccgccat 1469
<210> 12
<211> 446
<212> PRT
<213> Artificial sequence
<220>
<223> Chimeric Ab comprising murine and human sequences (chSN8)
<400> 12
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Met Lys Pro Gly
1 5 10 15
Ala Ser Val Lys Ile Ser Cys Lys Ala Thr Gly Tyr Thr Phe Ser
20 25 30
Ser Tyr Trp Ile Glu Trp Val Lys Gln Arg Pro Gly His Gly Leu
35 40 45
Glu Trp Ile Gly Glu Ile Leu Pro Gly Gly Gly Asp Thr Asn Tyr
50 55 60
Asn Glu Ile Phe Lys Gly Lys Ala Thr Phe Thr Ala Asp Thr Ser
65 70 75
Ser Asn Thr Ala Tyr Met Gln Leu Ser Ser Leu Thr Ser Glu Asp
80 85 90
Ser Ala Val Tyr Tyr Cys Thr Arg Arg Val Pro Val Tyr Phe Asp
95 100 105
Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr
110 115 120
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
125 130 135
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
140 145 150
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
155 160 165
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
170 175 180
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr
185 190 195
Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
200 205 210
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
215 220 225
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
305 310 315
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
320 325 330
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
335 340 345
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys
350 355 360
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
365 370 375
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
380 385 390
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
395 400 405
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
410 415 420
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
425 430 435
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
440 445
<210> 13
<211> 228
<212> PRT
<213> Mus musculus
<400> 13
Met Ala Thr Leu Val Leu Ser Ser Met Pro Cys His Trp Leu Leu
1 5 10 15
Phe Leu Leu Leu Leu Phe Ser Gly Glu Pro Val Pro Ala Met Thr
20 25 30
Ser Ser Asp Leu Pro Leu Asn Phe Gln Gly Ser Pro Cys Ser Gln
35 40 45
Ile Trp Gln His Pro Arg Phe Ala Ala Lys Lys Arg Ser Ser Met
50 55 60
Val Lys Phe His Cys Tyr Thr Asn His Ser Gly Ala Leu Thr Trp
65 70 75
Phe Arg Lys Arg Gly Ser Gln Gln Pro Gln Glu Leu Val Ser Glu
80 85 90
Glu Gly Arg Ile Val Gln Thr Gln Asn Gly Ser Val Tyr Thr Leu
95 100 105
Thr Ile Gln Asn Ile Gln Tyr Glu Asp Asn Gly Ile Tyr Phe Cys
110 115 120
Lys Gln Lys Cys Asp Ser Ala Asn His Asn Val Thr Asp Ser Cys
125 130 135
Gly Thr Glu Leu Leu Val Leu Gly Phe Ser Thr Leu Asp Gln Leu
140 145 150
Lys Arg Arg Asn Thr Leu Lys Asp Gly Ile Ile Leu Ile Gln Thr
155 160 165
Leu Leu Ile Ile Leu Phe Ile Ile Val Pro Ile Phe Leu Leu Leu
170 175 180
Asp Lys Asp Asp Gly Lys Ala Gly Met Glu Glu Asp His Thr Tyr
185 190 195
Glu Gly Leu Asn Ile Asp Gln Thr Ala Thr Tyr Glu Asp Ile Val
200 205 210
Thr Leu Arg Thr Gly Glu Val Lys Trp Ser Val Gly Glu His Pro
215 220 225
Gly Gln Glu
<210> 14
<211> 21
<212> DNA
<213> Artificial sequence
<220>
<223> Synthesized oligonucleotide primer
<400> 14
gggcaccaag aaccgaatca t 21
<210> 15
<211> 21
<212> DNA
<213> Artificial sequence
<220>
<223> Synthesized oligonucleotide primer
<400> 15
cctagaggca gcgattaagg g 21
<210> 16
<211> 11
<212> PRT
<213> Homo sapiens
<400> 16
Ala Arg Ser Glu Asp Arg Tyr Arg Asn Pro Lys
5 10
<210> 17
<211> 11
<212> PRT
<213> Macaca fascicularis
<400> 17
Ala Lys Ser Glu Asp Leu Tyr Pro Asn Pro Lys
5 10
<210> 18
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> synthetic peptide
<400> 18
Ala Lys Ser Glu Asp Arg Tyr Arg Asn Pro Lys
5 10
<210> 19
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> synthetic peptide
<400> 19
Ala Arg Ser Glu Asp Leu Tyr Arg Asn Pro Lys
5 10
<210> 20
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> synthetic peptide
<400> 20
Ala Arg Ser Glu Asp Arg Tyr Pro Asn Pro Lys
5 10
<210> 21
<211> 24
<212> DNA
<213> Artificial sequence
<220>
<223> Synthesized oligonucleotide primer
<400> 21
tcaaactaac caacccactg ggag 24
<210> 22
<211> 23
<212> DNA
<213> Artificial sequence
<220>
<223> Synthesized oligonucleotide primer
<400> 22
cagcgattaa gggctcatta ccc 23
<210> 23
<211> 20
<212> DNA
<213> Artificial sequence
<220>
<223> Synthesized oligonucleotide primer
<400> 23
tcggggacag agcagtgacc 20
<210> 24
<211> 20
<212> DNA
<213> Artificial sequence
<220>
<223> Synthesized oligonucleotide primer
<400> 24
caagagctgg ggaccagggg 20
<210> 25
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic peptide
<400> 25
Ala Lys Ser Glu Asp Arg Tyr Pro Asn Pro Lys
5 10
<210> 26
<211> 21
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic peptide includes human epitope
<400> 26
Ala Arg Ser Glu Asp Arg Tyr Arg Asn Pro Lys Gly Ser Ala Cys
1 5 10 15
Ser Arg Ile Trp Gln Ser
20
<210> 27
<211> 21
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic peptide includes cyno epitope
<400> 27
Ala Lys Ser Glu Asp Leu Tyr Pro Asn Pro Lys Gly Ser Ala Cys
1 5 10 15
Ser Arg Ile Trp Gln Ser
20
<210> 28
<211> 48
<212> DNA
<213> Artificial sequence
<220>
<223> Synthesized oligonucleotide primer
<400> 28
ggagtacatt cagatatcgt gctgacccaa tctccagctt ctttggct 48
<210> 29
<211> 44
<212> DNA
<213> Artificial sequence
<220>
<223> Synthesized oligonucleotide primer
<400> 29
ggtgcagcca cggtccgttt gatttccagc ttggtgcctc cacc 44
<210> 30
<211> 44
<212> DNA
<213> Artificial sequence
<220>
<223> Synthesized oligonucleotide primer
<400> 30
gcaactggag tacattcaca ggtccagctg cagcagtctg gggc 44
<210> 31
<211> 48
<212> DNA
<213> Artificial sequence
<220>
<223> Synthesized oligonucleotide primer
<400> 31
gaccgatggg cccttggtgg aggctgagga gacggtgact gaggttcc 48
<210> 32
<211> 657
<212> DNA
<213> Artificial sequence
<220>
<223> Chimeric Ab comprising murine and human sequences (ch2F2)
<400> 32
gatatcgtga tgacccagac tccactcact ttgtcggtta ccattggaca 50
accagcctcc atctcttgca agtcaagtca gagcctctta gatagtgatg 100
gaaagacata tttgaattgg ttattacaga ggccaggcca gtctccagag 150
cgcctaattt atctggtgtc taaactggat tctggagtcc ctgacaggtt 200
cactggcagt ggatcaggga cagatttcac actgaaaatc agcagagtgg 250
aggctgagga tttgggagtt tattgttgct ggcaaggtac acattttccg 300
tacacgttcg gagggggtac caaggtggag atcaaacgaa ctgtggctgc 350
accatctgtc ttcatcttcc cgccatctga tgagcagttg aaatctggaa 400
ctgcttctgt tgtgtgcctg ctgaataact tctatcccag agaggccaaa 450
gtacagtgga aggtggataa cgccctccaa tcgggtaact cccaggagag 500
tgtcacagag caggacagca aggacagcac ctacagcctc agcagcaccc 550
tgacgctgag caaagcagac tacgagaaac acaaagtcta cgcctgcgaa 600
gtcacccatc agggcctgag ctcgcccgtc acaaagagct tcaacagggg 650
agagtgt 657
<210> 33
<211> 219
<212> PRT
<213> Artificial sequence
<220>
<223> Chimeric Ab comprising murine and human sequences (ch2F2)
<400> 33
Asp Ile Val Met Thr Gln Thr Pro Leu Thr Leu Ser Val Thr Ile
1 5 10 15
Gly Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu
20 25 30
Asp Ser Asp Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Arg Pro
35 40 45
Gly Gln Ser Pro Glu Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp
50 55 60
Ser Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp
65 70 75
Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Leu Gly Val
80 85 90
Tyr Cys Cys Trp Gln Gly Thr His Phe Pro Tyr Thr Phe Gly Gly
95 100 105
Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val
110 115 120
Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala
125 130 135
Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
140 145 150
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
155 160 165
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
170 175 180
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys
185 190 195
Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val
200 205 210
Thr Lys Ser Phe Asn Arg Gly Glu Cys
215
<210> 34
<211> 1329
<212> DNA
<213> Artificial sequence
<220>
<223> Chimeric Ab comprising murine and human sequences (ch2F2)
<400> 34
caggttcaac tccagcaacc tggggctgag ctggtgaggc ctggggcttc 50
agtgaagctg tcctgcaagg cttctggcta caccttcacc agctactgga 100
tgaactgggt gaagcagagg cctggacaag gccttgaatg gattggtatg 150
attgatcctt cagacagtga aactcactac aatcatatct tcaaggacaa 200
ggccactttg actgtagaca aatcctccag cacagcctac ttgcagctca 250
gcagcctgac atctgaggac tctgcggtct attactgtgc aagaaatctc 300
tacttgtggg gtcaaggaac ctcagtcacc gtctccttag cctccaccaa 350
gggcccatcg gtcttccccc tggcaccctc ctccaagagc acctctgggg 400
gcacagcggc cctgggctgc ctggtcaagg actacttccc cgaaccggtg 450
acggtgtcgt ggaactcagg cgccctgacc agcggcgtgc acaccttccc 500
ggctgtccta cagtcctcag gactctactc cctcagcagc gtggtgactg 550
tgccctctag cagcttgggc acccagacct acatctgcaa cgtgaatcac 600
aagcccagca acaccaaggt ggacaagaaa gttgagccca aatcttgtga 650
caaaactcac acatgcccac cgtgcccagc acctgaactc ctggggggac 700
cgtcagtctt cctcttcccc ccaaaaccca aggacaccct catgatctcc 750
cggacccctg aggtcacatg cgtggtggtg gacgtgagcc acgaagaccc 800
tgaggtcaag ttcaactggt acgtggacgg cgtggaggtg cataatgcca 850
agacaaagcc gcgggaggag cagtacaaca gcacgtaccg ggtggtcagc 900
gtcctcaccg tcctgcacca ggactggctg aatggcaagg agtacaagtg 950
caaggtctcc aacaaagccc tcccagcccc catcgagaaa accatctcca 1000
aagccaaagg gcagccccga gaaccacagg tgtacaccct gcccccatcc 1050
cgggaagaga tgaccaagaa ccaggtcagc ctgacctgcc tggtcaaagg 1100
cttctatccc agcgacatcg ccgtggagtg ggagagcaat gggcagccgg 1150
agaacaacta caagaccacg cctcccgtgc tggactccga cggctccttc 1200
ttcctctaca gcaagctcac cgtggacaag agcaggtggc agcaggggaa 1250
cgtcttctca tgctccgtga tgcatgaggc tctgcacaac cactacacgc 1300
agaagagcct ctccctgtct ccgggtaaa 1329
<210> 35
<211> 442
<212> PRT
<213> Artificial sequence
<220>
<223> Chimeric Ab comprising murine and human sequences (ch2F2)
<400> 35
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Arg Pro Gly
1 5 10 15
Ala Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr
20 25 30
Ser Tyr Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu
35 40 45
Glu Trp Ile Gly Met Ile Asp Pro Ser Asp Ser Glu Thr His Tyr
50 55 60
Asn His Ile Phe Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Ser
65 70 75
Ser Ser Thr Ala Tyr Leu Gln Leu Ser Ser Leu Thr Ser Glu Asp
80 85 90
Ser Ala Val Tyr Tyr Cys Ala Arg Asn Leu Tyr Leu Trp Gly Gln
95 100 105
Gly Thr Ser Val Thr Val Ser Leu Ala Ser Thr Lys Gly Pro Ser
110 115 120
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
125 130 135
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
140 145 150
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
155 160 165
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
170 175 180
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile
185 190 195
Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys
200 205 210
Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
215 220 225
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro
230 235 240
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
260 265 270
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
320 325 330
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
335 340 345
Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
350 355 360
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
365 370 375
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
380 385 390
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
395 400 405
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
410 415 420
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
425 430 435
Ser Leu Ser Leu Ser Pro Gly
440
<210> 36
<211> 30
<212> DNA
<213> Mus musculus
<220>
<221> Misc-feature
<222> 19
<223> B=G/T/C
<220>
<221> Misc-feature
<222> 22
<223> R=A/G
<400> 36
gatcgatatc gtgatgacbc aractccact 30
<210> 37
<211> 21
<212> DNA
<213> Mus musculus
<220>
<221> Misc-feature
<222> 4
<223> D=G/A/T
<220>
<221> Misc-feature
<222> 6
<223> K=G/T
<220>
<221> Misc-feature
<222> 7
<223> Y=C/T
<400> 37
tttdakytcc agcttggtac c 21
<210> 38
<211> 37
<212> DNA
<213> Mus musculus
<220>
<221> Misc-feature
<222> 20
<223> Y=C/T
<220>
<221> Misc-feature
<222> 23
<223> R=A/G
<220>
<221> Misc-feature
<222> 26
<223> S=G/C
<220>
<221> Misc-feature
<222> 32
<223> R=A/G
<400> 38
gatcgacgta cgctcaggty carctscagc arcctgg 37
<210> 39
<211> 43
<212> DNA
<213> Mus musculus
<220>
<221> Misc-feature
<222> 25
<223> M=A/C
<220>
<221> Misc-feature
<222> 26
<223> R=A/G
<220>
<221> Misc-feature
<222> 32
<223> D=G/A/T
<220>
<221> Misc-feature
<222> 37
<223> S=G/C
<220>
<221> Misc-feature
<222> 38
<223> H=A/T/C
<220>
<221> Misc-feature
<222> 39
<223> R=A/G
<220>
<221> Misc-feature
<222> 40
<223> D=G/A/T
<220>
<221> Misc-feature
<222> 41
<223> R=A/G
<400> 39
acagtgggcc cttggtggag gctgmrgaga cdgtgashrd rgt 43
<210> 40
<211> 800
<212> DNA
<213> Artificial sequence
<220>
<223> Chimeric Ab comprising murine and human sequences (ch10D10)
<400> 40
acctcggttc tatcgattga attccaccat gggatggtca tgtatcatcc 50
tttttctagt agcaactgca actggagtac attcagatat cgtgctgacc 100
caatctccac cctctttggc tgtgtctcta gggcagaggg ccaccatatc 150
ctgcagagcc agtgaaagtg ttgatagtta tggcaaaact tttatgcact 200
ggcaccagca gaaaccagga cagccaccca aactcctcat ctatcgtgta 250
tccaacctag aatctgggat ccctgccagg ttcagtggca gtgggtcaag 300
gacagacttc accctcacca ttaatcctgt ggaggctgat gatgttgcaa 350
cctattactg tcagcaaagt aatgaggatc cgttcacgtt cggtggaggc 400
accaagctgg aaatcaaacg gaccgtggct gcaccatctg tcttcatctt 450
cccgccatct gatgagcagt tgaaatctgg aactgcctct gttgtgtgcc 500
tgctgaataa cttctatccc agagaggcca aagtacagtg gaaggtggat 550
aacgccctcc aatcgggtaa ctcccaggag agtgtcacag agcaggacag 600
caaggacagc acctacagcc tcagcagcac cctgacgctg agcaaagcag 650
actacgagaa acacaaagtc tacgcctgcg aagtcaccca tcagggcctg 700
agctcgcccg tcacaaagag cttcaacagg ggagagtgtt aagcttggcc 750
gccatggccc aacttgttta ttgcagctta taatggttac aaataaagca 800
<210> 41
<211> 218
<212> PRT
<213> Artificial sequence
<220>
<223> Chimeric Ab comprising murine and human sequences (ch10D10)
<400> 41
Asp Ile Val Leu Thr Gln Ser Pro Pro Ser Leu Ala Val Ser Leu
1 5 10 15
Gly Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp
20 25 30
Ser Tyr Gly Lys Thr Phe Met His Trp His Gln Gln Lys Pro Gly
35 40 45
Gln Pro Pro Lys Leu Leu Ile Tyr Arg Val Ser Asn Leu Glu Ser
50 55 60
Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe
65 70 75
Thr Leu Thr Ile Asn Pro Val Glu Ala Asp Asp Val Ala Thr Tyr
80 85 90
Tyr Cys Gln Gln Ser Asn Glu Asp Pro Phe Thr Phe Gly Gly Gly
95 100 105
Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe
110 115 120
Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser
125 130 135
Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val
140 145 150
Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
155 160 165
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
170 175 180
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
185 190 195
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr
200 205 210
Lys Ser Phe Asn Arg Gly Glu Cys
215
<210> 42
<211> 1500
<212> DNA
<213> Artificial sequence
<220>
<223> Chimeric Ab comprising murine and human sequences (ch10D10)
<400> 42
cacctcggtt ctatcgattg aattccacca tgggatggtc atgtatcatc 50
ctttttctag tagcaactgc aactggagta cattcagaag ttcagctgca 100
ggagtcggga cctggcctgg tgaaaccttc tcagtctctg tccctcacct 150
gcactgtcac tggctactca atcaccagtg attatgcctg gaactggatc 200
cggcagtttc caggaaacaa actggagtgg atgggcaaca tatggtacag 250
tggtagcact acctacaacc catctctcaa aagtcgaatc tctatcactc 300
gagacacatc caagaaccag ttcttcctgc agttgaattc tgtgacttct 350
gaggacacag ccacatatta ctgttcaaga atggacttct ggggtcaagg 400
caccactctc acagtctcct cagcctccac caagggccca tcggtcttcc 450
ccctggcacc ctcctccaag agcacctctg ggggcacagc ggccctgggc 500
tgcctggtca aggactactt ccccgaaccg gtgacggtgt cgtggaactc 550
aggcgccctg accagcggcg tgcacacctt cccggctgtc ctacagtcct 600
caggactcta ctccctcagc agcgtggtga ctgtgccctc tagcagcttg 650
ggcacccaga cctacatctg caacgtgaat cacaagccca gcaacaccaa 700
ggtggacaag aaagttgagc ccaaatcttg tgacaaaact cacacatgcc 750
caccgtgccc agcacctgaa ctcctggggg gaccgtcagt cttcctcttc 800
cccccaaaac ccaaggacac cctcatgatc tcccggaccc ctgaggtcac 850
atgcgtggtg gtggacgtga gccacgaaga ccctgaggtc aagttcaact 900
ggtacgtgga cggcgtggag gtgcataatg ccaagacaaa gccgcgggag 950
gagcagtaca acagcacgta ccgtgtggtc agcgtcctca ccgtcctgca 1000
ccaggactgg ctgaatggca aggagtacaa gtgcaaggtc tccaacaaag 1050
ccctcccagc ccccatcgag aaaaccatct ccaaagccaa agggcagccc 1100
cgagaaccac aggtgtacac cctgccccca tcccgggaag agatgaccaa 1150
gaaccaggtc agcctgacct gcctggtcaa aggcttctat cccagcgaca 1200
tcgccgtgga gtgggagagc aatgggcagc cggagaacaa ctacaagacc 1250
acgcctcccg tgctggactc cgacggctcc ttcttcctct acagcaagct 1300
caccgtggac aagagcaggt ggcagcaggg gaacgtcttc tcatgctccg 1350
tgatgcatga ggctctgcac aaccactaca cgcagaagag cctctccctg 1400
tctccgggta aatgagtgcg acggccctag agtcgacctg cagaagcttg 1450
gccgccatgg cccaacttgt ttattgcagc ttataatggt tacaaataaa 1500
<210> 43
<211> 441
<212> PRT
<213> Artificial sequence
<220>
<223> Chimeric Ab comprising murine and human sequences (ch10D10)
<400> 43
Glu Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser
1 5 10 15
Gln Ser Leu Ser Leu Thr Cys Thr Val Thr Gly Tyr Ser Ile Thr
20 25 30
Ser Asp Tyr Ala Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys
35 40 45
Leu Glu Trp Met Gly Asn Ile Trp Tyr Ser Gly Ser Thr Thr Tyr
50 55 60
Asn Pro Ser Leu Lys Ser Arg Ile Ser Ile Thr Arg Asp Thr Ser
65 70 75
Lys Asn Gln Phe Phe Leu Gln Leu Asn Ser Val Thr Ser Glu Asp
80 85 90
Thr Ala Thr Tyr Tyr Cys Ser Arg Met Asp Phe Trp Gly Gln Gly
95 100 105
Thr Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
110 115 120
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
125 130 135
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
140 145 150
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
155 160 165
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
170 175 180
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
185 190 195
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val
200 205 210
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
215 220 225
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
230 235 240
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
245 250 255
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
275 280 285
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
320 325 330
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
335 340 345
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
350 355 360
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
365 370 375
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
380 385 390
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
395 400 405
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
410 415 420
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
425 430 435
Leu Ser Leu Ser Pro Gly
440
<210> 44
<211> 47
<212> DNA
<213> Artificial sequence
<220>
<223> Synthesized oligonucleotide primer
<400> 44
ggagtacatt cagatatcgt gctgacccca tctccaccct ctttggc 47
<210> 45
<211> 44
<212> DNA
<213> Artificial sequence
<220>
<223> Synthesized oligonucleotide primer
<400> 45
ggtgcagcca cggtccgttt gatttccagc ttggtgcctc cacc 44
<210> 46
<211> 48
<212> DNA
<213> Artificial sequence
<220>
<223> Synthesized oligonucleotide primer
<400> 46
ggagtacatt cagatgtgca gctgcaggag tcgggacctg gcctggtg 48
<210> 47
<211> 48
<212> DNA
<213> Artificial sequence
<220>
<223> Synthesized oligonucleotide primer
<400> 47
gaccgatggg cccttggtgg aggctgagga gactgtgaga gtggtgcc 48
<210> 48
<211> 5391
<212> DNA
<213> Artificial sequence
<220>
<223> Expression vector containing murine and human sequences
<400> 48
ttcgagctcg cccgacattg attattgact agttattaat agtaatcaat 50
tacggggtca ttagttcata gcccatatat ggagttccgc gttacataac 100
ttacggtaaa tggcccgcct ggctgaccgc ccaacgaccc ccgcccattg 150
acgtcaataa tgacgtatgt tcccatagta acgccaatag ggactttcca 200
ttgacgtcaa tgggtggagt atttacggta aactgcccac ttggcagtac 250
atcaagtgta tcatatgcca agtacgcccc ctattgacgt caatgacggt 300
aaatggcccg cctggcatta tgcccagtac atgaccttat gggactttcc 350
tacttggcag tacatctacg tattagtcat cgctattacc atggtgatgc 400
ggttttggca gtacatcaat gggcgtggat agcggtttga ctcacgggga 450
tttccaagtc tccaccccat tgacgtcaat gggagtttgt tttggcacca 500
aaatcaacgg gactttccaa aatgtcgtaa caactccgcc ccattgacgc 550
aaatgggcgg taggcgtgta cggtgggagg tctatataag cagagctcgt 600
ttagtgaacc gtcagatcgc ctggagacgc catccacgct gttttgacct 650
ccatagaaga caccgggacc gatccagcct ccgcggccgg gaacggtgca 700
ttggaacgcg gattccccgt gccaagagtg acgtaagtac cgcctataga 750
gtctataggc ccaccccctt ggcttcgtta gaacgcggct acaattaata 800
cataacctta tgtatcatac acatacgatt taggtgacac tatagaataa 850
catccacttt gcctttctct ccacaggtgt ccactcccag gtccaactgc 900
acctcggttc tatcgattga attccaccat gggatggtca tgtatcatcc 950
tttttctagt agcaactgca actggagtac attcagatat ccagatgacc 1000
cagtccccga gctccctgtc cgcctctgtg ggcgataggg tcaccatcac 1050
ctgccgtgcc agtcaggaca tccgtaatta tttgaactgg tatcaacaga 1100
aaccaggaaa agctccgaaa ctactgattt actatacctc ccgcctggag 1150
tctggagtcc cttctcgctt ctctggttct ggttctggga cggattacac 1200
tctgaccatc agtagtctgc aaccggagga cttcgcaact tattactgtc 1250
agcaaggtaa tactctgccg tggacgttcg gacagggcac caaggtggag 1300
atcaaacgaa ctgtggctgc accatctgtc ttcatcttcc cgccatctga 1350
tgagcagttg aaatctggaa ctgcctctgt tgtgtgcctg ctgaataact 1400
tctatcccag agaggccaaa gtacagtgga aggtggataa cgccctccaa 1450
tcgggtaact cccaggagag tgtcacagag caggacagca aggacagcac 1500
ctacagcctc agcagcaccc tgacgctgag caaagcagac tacgagaaac 1550
acaaagtcta cgcctgcgaa gtcacccatc agggcctgag ctcgcccgtc 1600
acaaagagct tcaacagggg agagtgttaa gcttggccgc catggcccaa 1650
cttgtttatt gcagcttata atggttacaa ataaagcaat agcatcacaa 1700
atttcacaaa taaagcattt ttttcactgc attctagttg tggtttgtcc 1750
aaactcatca atgtatctta tcatgtctgg atcgatcggg aattaattcg 1800
gcgcagcacc atggcctgaa ataacctctg aaagaggaac ttggttaggt 1850
accttctgag gcggaaagaa ccagctgtgg aatgtgtgtc agttagggtg 1900
tggaaagtcc ccaggctccc cagcaggcag aagtatgcaa agcatgcatc 1950
tcaattagtc agcaaccagg tgtggaaagt ccccaggctc cccagcaggc 2000
agaagtatgc aaagcatgca tctcaattag tcagcaacca tagtcccgcc 2050
cctaactccg cccatcccgc ccctaactcc gcccagttcc gcccattctc 2100
cgccccatgg ctgactaatt ttttttattt atgcagaggc cgaggccgcc 2150
tcggcctctg agctattcca gaagtagtga ggaggctttt ttggaggcct 2200
aggcttttgc aaaaagctgt taacagcttg gcactggccg tcgttttaca 2250
acgtcgtgac tgggaaaacc ctggcgttac ccaacttaat cgccttgcag 2300
cacatccccc cttcgccagc tggcgtaata gcgaagaggc ccgcaccgat 2350
cgcccttccc aacagttgcg tagcctgaat ggcgaatggc gcctgatgcg 2400
gtattttctc cttacgcatc tgtgcggtat ttcacaccgc atacgtcaaa 2450
gcaaccatag tacgcgccct gtagcggcgc attaagcgcg gcgggtgtgg 2500
tggttacgcg cagcgtgacc gctacacttg ccagcgccct agcgcccgct 2550
cctttcgctt tcttcccttc ctttctcgcc acgttcgccg gctttccccg 2600
tcaagctcta aatcgggggc tccctttagg gttccgattt agtgctttac 2650
ggcacctcga ccccaaaaaa cttgatttgg gtgatggttc acgtagtggg 2700
ccatcgccct gatagacggt ttttcgccct ttgacgttgg agtccacgtt 2750
ctttaatagt ggactcttgt tccaaactgg aacaacactc aaccctatct 2800
cgggctattc ttttgattta taagggattt tgccgatttc ggcctattgg 2850
ttaaaaaatg agctgattta acaaaaattt aacgcgaatt ttaacaaaat 2900
attaacgttt acaattttat ggtgcactct cagtacaatc tgctctgatg 2950
ccgcatagtt aagccaactc cgctatcgct acgtgactgg gtcatggctg 3000
cgccccgaca cccgccaaca cccgctgacg cgccctgacg ggcttgtctg 3050
ctcccggcat ccgcttacag acaagctgtg accgtctccg ggagctgcat 3100
gtgtcagagg ttttcaccgt catcaccgaa acgcgcgagg cagtattctt 3150
gaagacgaaa gggcctcgtg atacgcctat ttttataggt taatgtcatg 3200
ataataatgg tttcttagac gtcaggtggc acttttcggg gaaatgtgcg 3250
cggaacccct atttgtttat ttttctaaat acattcaaat atgtatccgc 3300
tcatgagaca ataaccctga taaatgcttc aataatattg aaaaaggaag 3350
agtatgagta ttcaacattt ccgtgtcgcc cttattccct tttttgcggc 3400
attttgcctt cctgtttttg ctcacccaga aacgctggtg aaagtaaaag 3450
atgctgaaga tcagttgggt gcacgagtgg gttacatcga actggatctc 3500
aacagcggta agatccttga gagttttcgc cccgaagaac gttttccaat 3550
gatgagcact tttaaagttc tgctatgtgg cgcggtatta tcccgtgatg 3600
acgccgggca agagcaactc ggtcgccgca tacactattc tcagaatgac 3650
ttggttgagt actcaccagt cacagaaaag catcttacgg atggcatgac 3700
agtaagagaa ttatgcagtg ctgccataac catgagtgat aacactgcgg 3750
ccaacttact tctgacaacg atcggaggac cgaaggagct aaccgctttt 3800
ttgcacaaca tgggggatca tgtaactcgc cttgatcgtt gggaaccgga 3850
gctgaatgaa gccataccaa acgacgagcg tgacaccacg atgccagcag 3900
caatggcaac aacgttgcgc aaactattaa ctggcgaact acttactcta 3950
gcttcccggc aacaattaat agactggatg gaggcggata aagttgcagg 4000
accacttctg cgctcggccc ttccggctgg ctggtttatt gctgataaat 4050
ctggagccgg tgagcgtggg tctcgcggta tcattgcagc actggggcca 4100
gatggtaagc cctcccgtat cgtagttatc tacacgacgg ggagtcaggc 4150
aactatggat gaacgaaata gacagatcgc tgagataggt gcctcactga 4200
ttaagcattg gtaactgtca gaccaagttt actcatatat actttagatt 4250
gatttaaaac ttcattttta atttaaaagg atctaggtga agatcctttt 4300
tgataatctc atgaccaaaa tcccttaacg tgagttttcg ttccactgag 4350
cgtcagaccc cgtagaaaag atcaaaggat cttcttgaga tccttttttt 4400
ctgcgcgtaa tctgctgctt gcaaacaaaa aaaccaccgc taccagcggt 4450
ggtttgtttg ccggatcaag agctaccaac tctttttccg aaggtaactg 4500
gcttcagcag agcgcagata ccaaatactg tccttctagt gtagccgtag 4550
ttaggccacc acttcaagaa ctctgtagca ccgcctacat acctcgctct 4600
gctaatcctg ttaccagtgg ctgctgccag tggcgataag tcgtgtctta 4650
ccgggttgga ctcaagacga tagttaccgg ataaggcgca gcggtcgggc 4700
tgaacggggg gttcgtgcac acagcccagc ttggagcgaa cgacctacac 4750
cgaactgaga tacctacagc gtgagcattg agaaagcgcc acgcttcccg 4800
aagggagaaa ggcggacagg tatccggtaa gcggcagggt cggaacagga 4850
gagcgcacga gggagcttcc agggggaaac gcctggtatc tttatagtcc 4900
tgtcgggttt cgccacctct gacttgagcg tcgatttttg tgatgctcgt 4950
caggggggcg gagcctatgg aaaaacgcca gcaacgcggc ctttttacgg 5000
ttcctggcct tttgctggcc ttttgctcac atgttctttc ctgcgttatc 5050
ccctgattct gtggataacc gtattaccgc ctttgagtga gctgataccg 5100
ctcgccgcag ccgaacgacc gagcgcagcg agtcagtgag cgaggaagcg 5150
gaagagcgcc caatacgcaa accgcctctc cccgcgcgtt ggccgattca 5200
ttaatccagc tggcacgaca ggtttcccga ctggaaagcg ggcagtgagc 5250
gcaacgcaat taatgtgagt tacctcactc attaggcacc ccaggcttta 5300
cactttatgc ttccggctcg tatgttgtgt ggaattgtga gcggataaca 5350
atttcacaca ggaaacagct atgaccatga ttacgaatta a 5391
<210> 49
<211> 6135
<212> DNA
<213> Artificial sequence
<220>
<223> Expression vector containing murine and human sequences
<400> 49
attcgagctc gcccgacatt gattattgac tagttattaa tagtaatcaa 50
ttacggggtc attagttcat agcccatata tggagttccg cgttacataa 100
cttacggtaa atggcccgcc tggctgaccg cccaacgacc cccgcccatt 150
gacgtcaata atgacgtatg ttcccatagt aacgccaata gggactttcc 200
attgacgtca atgggtggag tatttacggt aaactgccca cttggcagta 250
catcaagtgt atcatatgcc aagtacgccc cctattgacg tcaatgacgg 300
taaatggccc gcctggcatt atgcccagta catgacctta tgggactttc 350
ctacttggca gtacatctac gtattagtca tcgctattac catggtgatg 400
cggttttggc agtacatcaa tgggcgtgga tagcggtttg actcacgggg 450
atttccaagt ctccacccca ttgacgtcaa tgggagtttg ttttggcacc 500
aaaatcaacg ggactttcca aaatgtcgta acaactccgc cccattgacg 550
caaatgggcg gtaggcgtgt acggtgggag gtctatataa gcagagctcg 600
tttagtgaac cgtcagatcg cctggagacg ccatccacgc tgttttgacc 650
tccatagaag acaccgggac cgatccagcc tccgcggccg ggaacggtgc 700
attggaacgc ggattccccg tgccaagagt gacgtaagta ccgcctatag 750
agtctatagg cccaccccct tggcttcgtt agaacgcggc tacaattaat 800
acataacctt atgtatcata cacatacgat ttaggtgaca ctatagaata 850
acatccactt tgcctttctc tccacaggtg tccactccca ggtccaactg 900
cacctcggtt ctatcgattg aattccacca tgggatggtc atgtatcatc 950
ctttttctag tagcaactgc aactggagta cattcagaag ttcagctggt 1000
ggagtctggc ggtggcctgg tgcagccagg gggctcactc cgtttgtcct 1050
gtgcagcttc tggctactcc tttaccggct acactatgaa ctgggtgcgt 1100
caggccccag gtaagggcct ggaatgggtt gcactgatta atccttataa 1150
aggtgttact acctatgccg atagcgtcaa gggccgtttc actataagcg 1200
tagataaatc caaaaacaca gcctacctgc aaatgaacag cctgcgtgct 1250
gaggacactg ccgtctatta ttgtgctaga agcggatact acggcgatag 1300
cgactggtat tttgacgtct ggggtcaagg aaccctggtc accgtctcct 1350
cggcctccac caagggccca tcggtcttcc ccctggcacc ctcctccaag 1400
agcacctctg ggggcacagc ggccctgggc tgcctggtca aggactactt 1450
ccccgaaccg gtgacggtgt cgtggaactc aggcgccctg accagcggcg 1500
tgcacacctt cccggctgtc ctacagtcct caggactcta ctccctcagc 1550
agcgtggtga ctgtgccctc tagcagcttg ggcacccaga cctacatctg 1600
caacgtgaat cacaagccca gcaacaccaa ggtggacaag aaagttgagc 1650
ccaaatcttg tgacaaaact cacacatgcc caccgtgccc agcacctgaa 1700
ctcctggggg gaccgtcagt cttcctcttc cccccaaaac ccaaggacac 1750
cctcatgatc tcccggaccc ctgaggtcac atgcgtggtg gtggacgtga 1800
gccacgaaga ccctgaggtc aagttcaact ggtacgtgga cggcgtggag 1850
gtgcataatg ccaagacaaa gccgcgggag gagcagtaca acagcacgta 1900
ccgtgtggtc agcgtcctca ccgtcctgca ccaggactgg ctgaatggca 1950
aggagtacaa gtgcaaggtc tccaacaaag ccctcccagc ccccatcgag 2000
aaaaccatct ccaaagccaa agggcagccc cgagaaccac aggtgtacac 2050
cctgccccca tcccgggaag agatgaccaa gaaccaggtc agcctgacct 2100
gcctggtcaa aggcttctat cccagcgaca tcgccgtgga gtgggagagc 2150
aatgggcagc cggagaacaa ctacaagacc acgcctcccg tgctggactc 2200
cgacggctcc ttcttcctct acagcaagct caccgtggac aagagcaggt 2250
ggcagcaggg gaacgtcttc tcatgctccg tgatgcatga ggctctgcac 2300
aaccactaca cgcagaagag cctctccctg tctccgggta aatgagtgcg 2350
acggccctag agtcgacctg cagaagcttg gccgccatgg cccaacttgt 2400
ttattgcagc ttataatggt tacaaataaa gcaatagcat cacaaatttc 2450
acaaataaag catttttttc actgcattct agttgtggtt tgtccaaact 2500
catcaatgta tcttatcatg tctggatcga tcgggaatta attcggcgca 2550
gcaccatggc ctgaaataac ctctgaaaga ggaacttggt taggtacctt 2600
ctgaggcgga aagaaccatc tgtggaatgt gtgtcagtta gggtgtggaa 2650
agtccccagg ctccccagca ggcagaagta tgcaaagcat gcatctcaat 2700
tagtcagcaa ccaggtgtgg aaagtcccca ggctccccag caggcagaag 2750
tatgcaaagc atgcatctca attagtcagc aaccatagtc ccgcccctaa 2800
ctccgcccat cccgccccta actccgccca gttccgccca ttctccgccc 2850
catggctgac taattttttt tatttatgca gaggccgagg ccgcctcggc 2900
ctctgagcta ttccagaagt agtgaggagg cttttttgga ggcctaggct 2950
tttgcaaaaa gctgttaaca gcttggcact ggccgtcgtt ttacaacgtc 3000
gtgactggga aaaccctggc gttacccaac ttaatcgcct tgcagcacat 3050
ccccccttcg ccagttggcg taatagcgaa gaggcccgca ccgatcgccc 3100
ttcccaacag ttgcgtagcc tgaatggcga atggcgcctg atgcggtatt 3150
ttctccttac gcatctgtgc ggtatttcac accgcatacg tcaaagcaac 3200
catagtacgc gccctgtagc ggcgcattaa gcgcggcggg tgtggtggtt 3250
acgcgcagcg tgaccgctac acttgccagc gccctagcgc ccgctccttt 3300
cgctttcttc ccttcctttc tcgccacgtt cgccggcttt ccccgtcaag 3350
ctctaaatcg ggggctccct ttagggttcc gatttagtgc tttacggcac 3400
ctcgacccca aaaaacttga tttgggtgat ggttcacgta gtgggccatc 3450
gccctgatag acggtttttc gccctttgac gttggagtcc acgttcttta 3500
atagtggact cttgttccaa actggaacaa cactcaaccc tatctcgggc 3550
tattcttttg atttataagg gattttgccg atttcggcct attggttaaa 3600
aaatgagctg atttaacaaa aatttaacgc gaattttaac aaaatattaa 3650
cgtttacaat tttatggtgc actctcagta caatctgctc tgatgccgca 3700
tagttaagcc aactccgcta tcgctacgtg actgggtcat ggctgcgccc 3750
cgacacccgc caacacccgc tgacgcgccc tgacgggctt gtctgctccc 3800
ggcatccgct tacagacaag ctgtgaccgt ctccgggagc tgcatgtgtc 3850
agaggttttc accgtcatca ccgaaacgcg cgaggcagta ttcttgaaga 3900
cgaaagggcc tcgtgatacg cctattttta taggttaatg tcatgataat 3950
aatggtttct tagacgtcag gtggcacttt tcggggaaat gtgcgcggaa 4000
cccctatttg tttatttttc taaatacatt caaatatgta tccgctcatg 4050
agacaataac cctgataaat gcttcaataa tattgaaaaa ggaagagtat 4100
gagtattcaa catttccgtg tcgcccttat tccctttttt gcggcatttt 4150
gccttcctgt ttttgctcac ccagaaacgc tggtgaaagt aaaagatgct 4200
gaagatcagt tgggtgcacg agtgggttac atcgaactgg atctcaacag 4250
cggtaagatc cttgagagtt ttcgccccga agaacgtttt ccaatgatga 4300
gcacttttaa agttctgcta tgtggcgcgg tattatcccg tgatgacgcc 4350
gggcaagagc aactcggtcg ccgcatacac tattctcaga atgacttggt 4400
tgagtactca ccagtcacag aaaagcatct tacggatggc atgacagtaa 4450
gagaattatg cagtgctgcc ataaccatga gtgataacac tgcggccaac 4500
ttacttctga caacgatcgg aggaccgaag gagctaaccg cttttttgca 4550
caacatgggg gatcatgtaa ctcgccttga tcgttgggaa ccggagctga 4600
atgaagccat accaaacgac gagcgtgaca ccacgatgcc agcagcaatg 4650
gcaacaacgt tgcgcaaact attaactggc gaactactta ctctagcttc 4700
ccggcaacaa ttaatagact ggatggaggc ggataaagtt gcaggaccac 4750
ttctgcgctc ggcccttccg gctggctggt ttattgctga taaatctgga 4800
gccggtgagc gtgggtctcg cggtatcatt gcagcactgg ggccagatgg 4850
taagccctcc cgtatcgtag ttatctacac gacggggagt caggcaacta 4900
tggatgaacg aaatagacag atcgctgaga taggtgcctc actgattaag 4950
cattggtaac tgtcagacca agtttactca tatatacttt agattgattt 5000
aaaacttcat ttttaattta aaaggatcta ggtgaagatc ctttttgata 5050
atctcatgac caaaatccct taacgtgagt tttcgttcca ctgagcgtca 5100
gaccccgtag aaaagatcaa aggatcttct tgagatcctt tttttctgcg 5150
cgtaatctgc tgcttgcaaa caaaaaaacc accgctacca gcggtggttt 5200
gtttgccgga tcaagagcta ccaactcttt ttccgaaggt aactggcttc 5250
agcagagcgc agataccaaa tactgtcctt ctagtgtagc cgtagttagg 5300
ccaccacttc aagaactctg tagcaccgcc tacatacctc gctctgctaa 5350
tcctgttacc agtggctgct gccagtggcg ataagtcgtg tcttaccggg 5400
ttggactcaa gacgatagtt accggataag gcgcagcggt cgggctgaac 5450
ggggggttcg tgcacacagc ccagcttgga gcgaacgacc tacaccgaac 5500
tgagatacct acagcgtgag cattgagaaa gcgccacgct tcccgaaggg 5550
agaaaggcgg acaggtatcc ggtaagcggc agggtcggaa caggagagcg 5600
cacgagggag cttccagggg gaaacgcctg gtatctttat agtcctgtcg 5650
ggtttcgcca cctctgactt gagcgtcgat ttttgtgatg ctcgtcaggg 5700
gggcggagcc tatggaaaaa cgccagcaac gcggcctttt tacggttcct 5750
ggccttttgc tggccttttg ctcacatgtt ctttcctgcg ttatcccctg 5800
attctgtgga taaccgtatt accgcctttg agtgagctga taccgctcgc 5850
cgcagccgaa cgaccgagcg cagcgagtca gtgagcgagg aagcggaaga 5900
gcgcccaata cgcaaaccgc ctctccccgc gcgttggccg attcattaat 5950
ccaactggca cgacaggttt cccgactgga aagcgggcag tgagcgcaac 6000
gcaattaatg tgagttacct cactcattag gcaccccagg ctttacactt 6050
tatgcttccg gctcgtatgt tgtgtggaat tgtgagcgga taacaatttc 6100
acacaggaaa cagctatgac catgattacg aatta 6135
<210> 50
<211> 5399
<212> DNA
<213> Artificial sequence
<220>
<223> Expression vector containing murine and human sequences
<400> 50
ttcgagctcg cccgacattg attattgact agttattaat agtaatcaat 50
tacggggtca ttagttcata gcccatatat ggagttccgc gttacataac 100
ttacggtaaa tggcccgcct ggctgaccgc ccaacgaccc ccgcccattg 150
acgtcaataa tgacgtatgt tcccatagta acgccaatag ggactttcca 200
ttgacgtcaa tgggtggagt atttacggta aactgcccac ttggcagtac 250
atcaagtgta tcatatgcca agtacgcccc ctattgacgt caatgacggt 300
aaatggcccg cctggcatta tgcccagtac atgaccttat gggactttcc 350
tacttggcag tacatctacg tattagtcat cgctattacc atggtgatgc 400
ggttttggca gtacatcaat gggcgtggat agcggtttga ctcacgggga 450
tttccaagtc tccaccccat tgacgtcaat gggagtttgt tttggcacca 500
aaatcaacgg gactttccaa aatgtcgtaa caactccgcc ccattgacgc 550
aaatgggcgg taggcgtgta cggtgggagg tctatataag cagagctcgt 600
ttagtgaacc gtcagatcgc ctggagacgc catccacgct gttttgacct 650
ccatagaaga caccgggacc gatccagcct ccgcggccgg gaacggtgca 700
ttggaacgcg gattccccgt gccaagagtg acgtaagtac cgcctataga 750
gtctataggc ccaccccctt ggcttcgtta gaacgcggct acaattaata 800
cataacctta tgtatcatac acatacgatt taggtgacac tatagaataa 850
catccacttt gcctttctct ccacaggtgt ccactcccag gtccaactgc 900
acctcggttc tatcgattga attccaccat gggatggtca tgtatcatcc 950
tttttctagt agcaactgca actggagtac attcagatat ccagctgacc 1000
cagtccccga gctccctgtc cgcctctgtg ggcgataggg tcaccatcac 1050
ctgccgtgcc agtaagccgg tcgacgggga aggtgatagc tacctgaact 1100
ggtatcaaca gaaaccagga aaagctccga aactactgat ttacgcggcc 1150
tcgtacctgg agtctggagt cccttctcgc ttctctggat ccggttctgg 1200
gacggatttc actctgacca tcagcagtct gcagccagaa gacttcgcaa 1250
cttattactg tcagcaaagt cacgaggatc cgtacacatt tggacagggt 1300
accaaggtgg agatcaaacg aactgtggct gcaccatctg tcttcatctt 1350
cccgccatct gatgagcagt tgaaatctgg aactgcttct gttgtgtgcc 1400
tgctgaataa cttctatccc agagaggcca aagtacagtg gaaggtggat 1450
aacgccctcc aatcgggtaa ctcccaggag agtgtcacag agcaggacag 1500
caaggacagc acctacagcc tcagcagcac cctgacgctg agcaaagcag 1550
actacgagaa acacaaagtc tacgcctgcg aagtcaccca tcagggcctg 1600
agctcgcccg tcacaaagag cttcaacagg ggagagtgtt aagcttggcc 1650
gccatggccc aacttgttta ttgcagctta taatggttac aaataaagca 1700
atagcatcac aaatttcaca aataaagcat ttttttcact gcattctagt 1750
tgtggtttgt ccaaactcat caatgtatct tatcatgtct ggatcgggaa 1800
ttaattcggc gcagcaccat ggcctgaaat aacctctgaa agaggaactt 1850
ggttaggtat cttctgaggc ggaaagaacc agctgtggaa tgtgtgtcag 1900
ttagggtgtg gaaagtcccc aggctcccca gcaggcagaa gtatgcaaag 1950
catgcatctc aattagtcag caaccaggtg tggaaagtcc ccaggctccc 2000
cagcaggcag aagtatgcaa agcatgcatc tcaattagtc agcaaccata 2050
gtcccgcccc taactccgcc catcccgccc ctaactccgc ccagttccgc 2100
ccattctccg ccccatggct gactaatttt ttttatttat gcagaggccg 2150
aggccgcctc ggcctctgag ctattccaga agtagtgagg aggctttttt 2200
ggaggcctag gcttttgcaa aaagctgtta acagcttggc actggccgtc 2250
gttttacaac gtcgtgactg ggaaaaccct ggcgttaccc aacttaatcg 2300
ccttgcagca catcccccct tcgccagctg gcgtaatagc gaagaggccc 2350
gcaccgatcg cccttcccaa cagttgcgta gcctgaatgg cgaatggcgc 2400
ctgatgcggt attttctcct tacgcatctg tgcggtattt cacaccgcat 2450
acgtcaaagc aaccatagta cgcgccctgt agcggcgcat taagcgcggc 2500
gggtgtggtg gttacgcgca gcgtgaccgc tacacttgcc agcgccctag 2550
cgcccgctcc tttcgctttc ttcccttcct ttctcgccac gttcgccggc 2600
tttccccgtc aagctctaaa tcgggggctc cctttagggt tccgatttag 2650
tgctttacgg cacctcgacc ccaaaaaact tgatttgggt gatggttcac 2700
gtagtgggcc atcgccctga tagacggttt ttcgcccttt gacgttggag 2750
tccacgttct ttaatagtgg actcttgttc caaactggaa caacactcaa 2800
ccctatctcg ggctattctt ttgatttata agggattttg ccgatttcgg 2850
cctattggtt aaaaaatgag ctgatttaac aaaaatttaa cgcgaatttt 2900
aacaaaatat taacgtttac aattttatgg tgcactctca gtacaatctg 2950
ctctgatgcc gcatagttaa gccaactccg ctatcgctac gtgactgggt 3000
catggctgcg ccccgacacc cgccaacacc cgctgacgcg ccctgacggg 3050
cttgtctgct cccggcatcc gcttacagac aagctgtgac cgtctccggg 3100
agctgcatgt gtcagaggtt ttcaccgtca tcaccgaaac gcgcgaggca 3150
gtattcttga agacgaaagg gcctcgtgat acgcctattt ttataggtta 3200
atgtcatgat aataatggtt tcttagacgt caggtggcac ttttcgggga 3250
aatgtgcgcg gaacccctat ttgtttattt ttctaaatac attcaaatat 3300
gtatccgctc atgagacaat aaccctgata aatgcttcaa taatattgaa 3350
aaaggaagag tatgagtatt caacatttcc gtgtcgccct tattcccttt 3400
tttgcggcat tttgccttcc tgtttttgct cacccagaaa cgctggtgaa 3450
agtaaaagat gctgaagatc agttgggtgc acgagtgggt tacatcgaac 3500
tggatctcaa cagcggtaag atccttgaga gttttcgccc cgaagaacgt 3550
tttccaatga tgagcacttt taaagttctg ctatgtggcg cggtattatc 3600
ccgtgatgac gccgggcaag agcaactcgg tcgccgcata cactattctc 3650
agaatgactt ggttgagtac tcaccagtca cagaaaagca tcttacggat 3700
ggcatgacag taagagaatt atgcagtgct gccataacca tgagtgataa 3750
cactgcggcc aacttacttc tgacaacgat cggaggaccg aaggagctaa 3800
ccgctttttt gcacaacatg ggggatcatg taactcgcct tgatcgttgg 3850
gaaccggagc tgaatgaagc cataccaaac gacgagcgtg acaccacgat 3900
gccagcagca atggcaacaa cgttgcgcaa actattaact ggcgaactac 3950
ttactctagc ttcccggcaa caattaatag actggatgga ggcggataaa 4000
gttgcaggac cacttctgcg ctcggccctt ccggctggct ggtttattgc 4050
tgataaatct ggagccggtg agcgtgggtc tcgcggtatc attgcagcac 4100
tggggccaga tggtaagccc tcccgtatcg tagttatcta cacgacgggg 4150
agtcaggcaa ctatggatga acgaaataga cagatcgctg agataggtgc 4200
ctcactgatt aagcattggt aactgtcaga ccaagtttac tcatatatac 4250
tttagattga tttaaaactt catttttaat ttaaaaggat ctaggtgaag 4300
atcctttttg ataatctcat gaccaaaatc ccttaacgtg agttttcgtt 4350
ccactgagcg tcagaccccg tagaaaagat caaaggatct tcttgagatc 4400
ctttttttct gcgcgtaatc tgctgcttgc aaacaaaaaa accaccgcta 4450
ccagcggtgg tttgtttgcc ggatcaagag ctaccaactc tttttccgaa 4500
ggtaactggc ttcagcagag cgcagatacc aaatactgtc cttctagtgt 4550
agccgtagtt aggccaccac ttcaagaact ctgtagcacc gcctacatac 4600
ctcgctctgc taatcctgtt accagtggct gctgccagtg gcgataagtc 4650
gtgtcttacc gggttggact caagacgata gttaccggat aaggcgcagc 4700
ggtcgggctg aacggggggt tcgtgcacac agcccagctt ggagcgaacg 4750
acctacaccg aactgagata cctacagcgt gagcattgag aaagcgccac 4800
gcttcccgaa gggagaaagg cggacaggta tccggtaagc ggcagggtcg 4850
gaacaggaga gcgcacgagg gagcttccag ggggaaacgc ctggtatctt 4900
tatagtcctg tcgggtttcg ccacctctga cttgagcgtc gatttttgtg 4950
atgctcgtca ggggggcgga gcctatggaa aaacgccagc aacgcggcct 5000
ttttacggtt cctggccttt tgctggcctt ttgctcacat gttctttcct 5050
gcgttatccc ctgattctgt ggataaccgt attaccgcct ttgagtgagc 5100
tgataccgct cgccgcagcc gaacgaccga gcgcagcgag tcagtgagcg 5150
aggaagcgga agagcgccca atacgcaaac cgcctctccc cgcgcgttgg 5200
ccgattcatt aatccagctg gcacgacagg tttcccgact ggaaagcggg 5250
cagtgagcgc aacgcaatta atgtgagtta cctcactcat taggcacccc 5300
aggctttaca ctttatgctt ccggctcgta tgttgtgtgg aattgtgagc 5350
ggataacaat ttcacacagg aaacagctat gaccatgatt acgaattaa 5399
<210> 51
<211> 6132
<212> DNA
<213> Artificial sequence
<220>
<223> Expression vector containing murine and human sequences
<400> 51
attcgagctc gcccgacatt gattattgac tagttattaa tagtaatcaa 50
ttacggggtc attagttcat agcccatata tggagttccg cgttacataa 100
cttacggtaa atggcccgcc tggctgaccg cccaacgacc cccgcccatt 150
gacgtcaata atgacgtatg ttcccatagt aacgccaata gggactttcc 200
attgacgtca atgggtggag tatttacggt aaactgccca cttggcagta 250
catcaagtgt atcatatgcc aagtacgccc cctattgacg tcaatgacgg 300
taaatggccc gcctggcatt atgcccagta catgacctta tgggactttc 350
ctacttggca gtacatctac gtattagtca tcgctattac catggtgatg 400
cggttttggc agtacatcaa tgggcgtgga tagcggtttg actcacgggg 450
atttccaagt ctccacccca ttgacgtcaa tgggagtttg ttttggcacc 500
aaaatcaacg ggactttcca aaatgtcgta acaactccgc cccattgacg 550
caaatgggcg gtaggcgtgt acggtgggag gtctatataa gcagagctcg 600
tttagtgaac cgtcagatcg cctggagacg ccatccacgc tgttttgacc 650
tccatagaag acaccgggac cgatccagcc tccgcggccg ggaacggtgc 700
attggaacgc ggattccccg tgccaagagt gacgtaagta ccgcctatag 750
agtctatagg cccaccccct tggcttcgtt agaacgcggc tacaattaat 800
acataacctt atgtatcata cacatacgat ttaggtgaca ctatagaata 850
acatccactt tgcctttctc tccacaggtg tccactccca ggtccaactg 900
cacctcggtt ctatcgattg aattccacca tgggatggtc atgtatcatc 950
ctttttctag tagcaactgc aactggagcg tacgctgaag ttcagctggt 1000
ggagtctggc ggtggcctgg tgcagccagg gggctcactc cgtttgtcct 1050
gtgcagtttc tggctactcc atcacctccg gatatagctg gaactggatc 1100
cgtcaggccc cgggtaaggg cctggaatgg gttgcatcga ttaagtactc 1150
tggagagact aagtataacc ctagcgtcaa gggccgtatc actataagtc 1200
gcgacgattc caaaaacaca ttctacctgc agatgaacag cctgcgtgct 1250
gaggacactg ccgtctatta ttgtgctcga ggcagccact atttcggtca 1300
ctggcacttc gccgtgtggg gtcaaggaac cctggtcacc gtctcctcgg 1350
cctccaccaa gggcccatcg gtcttccccc tggcaccctc ctccaagagc 1400
acctctgggg gcacagcggc cctgggctgc ctggtcaagg actacttccc 1450
cgaaccggtg acggtgtcgt ggaactcagg cgccctgacc agcggcgtgc 1500
acaccttccc ggctgtccta cagtcctcag gactctactc cctcagcagc 1550
gtggtgactg tgccctctag cagcttgggc acccagacct acatctgcaa 1600
cgtgaatcac aagcccagca acaccaaggt ggacaagaaa gttgagccca 1650
aatcttgtga caaaactcac acatgcccac cgtgcccagc acctgaactc 1700
ctggggggac cgtcagtctt cctcttcccc ccaaaaccca aggacaccct 1750
catgatctcc cggacccctg aggtcacatg cgtggtggtg gacgtgagcc 1800
acgaagaccc tgaggtcaag ttcaactggt acgtggacgg cgtggaggtg 1850
cataatgcca agacaaagcc gcgggaggag cagtacaaca gcacgtaccg 1900
ggtggtcagc gtcctcaccg tcctgcacca ggactggctg aatggcaagg 1950
agtacaagtg caaggtctcc aacaaagccc tcccagcccc catcgagaaa 2000
accatctcca aagccaaagg gcagccccga gaaccacagg tgtacaccct 2050
gcccccatcc cgggaagaga tgaccaagaa ccaggtcagc ctgacctgcc 2100
tggtcaaagg cttctatccc agcgacatcg ccgtggagtg ggagagcaat 2150
gggcagccgg agaacaacta caagaccacg cctcccgtgc tggactccga 2200
cggctccttc ttcctctaca gcaagctcac cgtggacaag agcaggtggc 2250
agcaggggaa cgtcttctca tgctccgtga tgcatgaggc tctgcacaac 2300
cactacacgc agaagagcct ctccctgtct ccgggtaaat gagtgcgacg 2350
gccctagagt cgacctgcag aagcttggcc gccatggccc aacttgttta 2400
ttgcagctta taatggttac aaataaagca atagcatcac aaatttcaca 2450
aataaagcat ttttttcact gcattctagt tgtggtttgt ccaaactcat 2500
caatgtatct tatcatgtct ggatcgatcg ggaattaatt cggcgcagca 2550
ccatggcctg aaataacctc tgaaagagga acttggttag gtaccttctg 2600
aggcggaaag aaccatctgt ggaatgtgtg tcagttaggg tgtggaaagt 2650
ccccaggctc cccagcaggc agaagtatgc aaagcatgca tctcaattag 2700
tcagcaacca ggtgtggaaa gtccccaggc tccccagcag gcagaagtat 2750
gcaaagcatg catctcaatt agtcagcaac catagtcccg cccctaactc 2800
cgcccatccc gcccctaact ccgcccagtt ccgcccattc tccgccccat 2850
ggctgactaa ttttttttat ttatgcagag gccgaggccg cctcggcctc 2900
tgagctattc cagaagtagt gaggaggctt ttttggaggc ctaggctttt 2950
gcaaaaagct gttaacagct tggcactggc cgtcgtttta caacgtcgtg 3000
actgggaaaa ccctggcgtt acccaactta atcgccttgc agcacatccc 3050
cccttcgcca gttggcgtaa tagcgaagag gcccgcaccg atcgcccttc 3100
ccaacagttg cgtagcctga atggcgaatg gcgcctgatg cggtattttc 3150
tccttacgca tctgtgcggt atttcacacc gcatacgtca aagcaaccat 3200
agtacgcgcc ctgtagcggc gcattaagcg cggcgggtgt ggtggttacg 3250
cgcagcgtga ccgctacact tgccagcgcc ctagcgcccg ctcctttcgc 3300
tttcttccct tcctttctcg ccacgttcgc cggctttccc cgtcaagctc 3350
taaatcgggg gctcccttta gggttccgat ttagtgcttt acggcacctc 3400
gaccccaaaa aacttgattt gggtgatggt tcacgtagtg ggccatcgcc 3450
ctgatagacg gtttttcgcc ctttgacgtt ggagtccacg ttctttaata 3500
gtggactctt gttccaaact ggaacaacac tcaaccctat ctcgggctat 3550
tcttttgatt tataagggat tttgccgatt tcggcctatt ggttaaaaaa 3600
tgagctgatt taacaaaaat ttaacgcgaa ttttaacaaa atattaacgt 3650
ttacaatttt atggtgcact ctcagtacaa tctgctctga tgccgcatag 3700
ttaagccaac tccgctatcg ctacgtgact gggtcatggc tgcgccccga 3750
cacccgccaa cacccgctga cgcgccctga cgggcttgtc tgctcccggc 3800
atccgcttac agacaagctg tgaccgtctc cgggagctgc atgtgtcaga 3850
ggttttcacc gtcatcaccg aaacgcgcga ggcagtattc ttgaagacga 3900
aagggcctcg tgatacgcct atttttatag gttaatgtca tgataataat 3950
ggtttcttag acgtcaggtg gcacttttcg gggaaatgtg cgcggaaccc 4000
ctatttgttt atttttctaa atacattcaa atatgtatcc gctcatgaga 4050
caataaccct gataaatgct tcaataatat tgaaaaagga agagtatgag 4100
tattcaacat ttccgtgtcg cccttattcc cttttttgcg gcattttgcc 4150
ttcctgtttt tgctcaccca gaaacgctgg tgaaagtaaa agatgctgaa 4200
gatcagttgg gtgcacgagt gggttacatc gaactggatc tcaacagcgg 4250
taagatcctt gagagttttc gccccgaaga acgttttcca atgatgagca 4300
cttttaaagt tctgctatgt ggcgcggtat tatcccgtga tgacgccggg 4350
caagagcaac tcggtcgccg catacactat tctcagaatg acttggttga 4400
gtactcacca gtcacagaaa agcatcttac ggatggcatg acagtaagag 4450
aattatgcag tgctgccata accatgagtg ataacactgc ggccaactta 4500
cttctgacaa cgatcggagg accgaaggag ctaaccgctt ttttgcacaa 4550
catgggggat catgtaactc gccttgatcg ttgggaaccg gagctgaatg 4600
aagccatacc aaacgacgag cgtgacacca cgatgccagc agcaatggca 4650
acaacgttgc gcaaactatt aactggcgaa ctacttactc tagcttcccg 4700
gcaacaatta atagactgga tggaggcgga taaagttgca ggaccacttc 4750
tgcgctcggc ccttccggct ggctggttta ttgctgataa atctggagcc 4800
ggtgagcgtg ggtctcgcgg tatcattgca gcactggggc cagatggtaa 4850
gccctcccgt atcgtagtta tctacacgac ggggagtcag gcaactatgg 4900
atgaacgaaa tagacagatc gctgagatag gtgcctcact gattaagcat 4950
tggtaactgt cagaccaagt ttactcatat atactttaga ttgatttaaa 5000
acttcatttt taatttaaaa ggatctaggt gaagatcctt tttgataatc 5050
tcatgaccaa aatcccttaa cgtgagtttt cgttccactg agcgtcagac 5100
cccgtagaaa agatcaaagg atcttcttga gatccttttt ttctgcgcgt 5150
aatctgctgc ttgcaaacaa aaaaaccacc gctaccagcg gtggtttgtt 5200
tgccggatca agagctacca actctttttc cgaaggtaac tggcttcagc 5250
agagcgcaga taccaaatac tgtccttcta gtgtagccgt agttaggcca 5300
ccacttcaag aactctgtag caccgcctac atacctcgct ctgctaatcc 5350
tgttaccagt ggctgctgcc agtggcgata agtcgtgtct taccgggttg 5400
gactcaagac gatagttacc ggataaggcg cagcggtcgg gctgaacggg 5450
gggttcgtgc acacagccca gcttggagcg aacgacctac accgaactga 5500
gatacctaca gcgtgagcat tgagaaagcg ccacgcttcc cgaagggaga 5550
aaggcggaca ggtatccggt aagcggcagg gtcggaacag gagagcgcac 5600
gagggagctt ccagggggaa acgcctggta tctttatagt cctgtcgggt 5650
ttcgccacct ctgacttgag cgtcgatttt tgtgatgctc gtcagggggg 5700
cggagcctat ggaaaaacgc cagcaacgcg gcctttttac ggttcctggc 5750
cttttgctgg ccttttgctc acatgttctt tcctgcgtta tcccctgatt 5800
ctgtggataa ccgtattacc gcctttgagt gagctgatac cgctcgccgc 5850
agccgaacga ccgagcgcag cgagtcagtg agcgaggaag cggaagagcg 5900
cccaatacgc aaaccgcctc tccccgcgcg ttggccgatt cattaatcca 5950
actggcacga caggtttccc gactggaaag cgggcagtga gcgcaacgca 6000
attaatgtga gttacctcac tcattaggca ccccaggctt tacactttat 6050
gcttccggct cgtatgttgt gtggaattgt gagcggataa caatttcaca 6100
caggaaacag ctatgaccat gattacgaat ta 6132
<210> 52
<211> 30
<212> PRT
<213> Artificial sequence
<220>
<223> Synthesized Sequence (Albumin binding peptide)
<400> 52
Cys Asp Lys Thr His Thr Gly Gly Gly Ser Gln Arg Leu Met Glu
1 5 10 15
Asp Ile Cys Leu Pro Arg Trp Gly Cys Leu Trp Glu Asp Asp Phe
20 25 30
<210> 53
<211> 20
<212> PRT
<213> Artificial sequence
<220>
<223> Synthesized Sequence (Albumin binding peptide)
<400> 53
Gln Arg Leu Met Glu Asp Ile Cys Leu Pro Arg Trp Gly Cys Leu
1 5 10 15
Trp Glu Asp Asp Phe
20
<210> 54
<211> 20
<212> PRT
<213> Artificial sequence
<220>
<223> Synthesized Sequence (Albumin binding peptide)
<400> 54
Gln Arg Leu Ile Glu Asp Ile Cys Leu Pro Arg Trp Gly Cys Leu
1 5 10 15
Trp Glu Asp Asp Phe
20
<210> 55
<211> 18
<212> PRT
<213> Artificial sequence
<220>
<223> Synthesized Sequence (Albumin binding peptide)
<400> 55
Arg Leu Ile Glu Asp Ile Cys Leu Pro Arg Trp Gly Cys Leu Trp
1 5 10 15
Glu Asp Asp
<210> 56
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Synthesized Sequence (Albumin binding peptide)
<400> 56
Asp Ile Cys Leu Pro Arg Trp Gly Cys Leu Trp
5 10
<210> 57
<211> 446
<212> PRT
<213> Artificial sequence
<220>
<223> Heavy chain of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio chSN8-LC(V205C)-HC)
<400> 57
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Met Lys Pro Gly
1 5 10 15
Ala Ser Val Lys Ile Ser Cys Lys Ala Thr Gly Tyr Thr Phe Ser
20 25 30
Ser Tyr Trp Ile Glu Trp Val Lys Gln Arg Pro Gly His Gly Leu
35 40 45
Glu Trp Ile Gly Glu Ile Leu Pro Gly Gly Gly Asp Thr Asn Tyr
50 55 60
Asn Glu Ile Phe Lys Gly Lys Ala Thr Phe Thr Ala Asp Thr Ser
65 70 75
Ser Asn Thr Ala Tyr Met Gln Leu Ser Ser Leu Thr Ser Glu Asp
80 85 90
Ser Ala Val Tyr Tyr Cys Thr Arg Arg Val Pro Val Tyr Phe Asp
95 100 105
Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr
110 115 120
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
125 130 135
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
140 145 150
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
155 160 165
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
170 175 180
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr
185 190 195
Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
200 205 210
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
215 220 225
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
305 310 315
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
320 325 330
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
335 340 345
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys
350 355 360
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
365 370 375
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
380 385 390
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
395 400 405
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
410 415 420
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
425 430 435
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
440 445
<210> 58
<211> 218
<212> PRT
<213> Artificial sequence
<220>
<223> Light chain of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio chSN8-LC(V205C)-LC)
<400> 58
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu
1 5 10 15
Gly Gln Arg Ala Thr Ile Ser Cys Lys Ala Ser Gln Ser Val Asp
20 25 30
Tyr Asp Gly Asp Ser Phe Leu Asn Trp Tyr Gln Gln Lys Pro Gly
35 40 45
Gln Pro Pro Lys Leu Phe Ile Tyr Ala Ala Ser Asn Leu Glu Ser
50 55 60
Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
65 70 75
Thr Leu Asn Ile His Pro Val Glu Glu Glu Asp Ala Ala Thr Tyr
80 85 90
Tyr Cys Gln Gln Ser Asn Glu Asp Pro Leu Thr Phe Gly Ala Gly
95 100 105
Thr Glu Leu Glu Leu Lys Arg Thr Val Ala Ala Pro Ser Val Phe
110 115 120
Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser
125 130 135
Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val
140 145 150
Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
155 160 165
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
170 175 180
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
185 190 195
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Cys Thr
200 205 210
Lys Ser Phe Asn Arg Gly Glu Cys
215
<210> 59
<211> 446
<212> PRT
<213> Artificial sequence
<220>
<223> Heavy chain of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio chSN8-HC(A118C)-HC)
<400> 59
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Met Lys Pro Gly
1 5 10 15
Ala Ser Val Lys Ile Ser Cys Lys Ala Thr Gly Tyr Thr Phe Ser
20 25 30
Ser Tyr Trp Ile Glu Trp Val Lys Gln Arg Pro Gly His Gly Leu
35 40 45
Glu Trp Ile Gly Glu Ile Leu Pro Gly Gly Gly Asp Thr Asn Tyr
50 55 60
Asn Glu Ile Phe Lys Gly Lys Ala Thr Phe Thr Ala Asp Thr Ser
65 70 75
Ser Asn Thr Ala Tyr Met Gln Leu Ser Ser Leu Thr Ser Glu Asp
80 85 90
Ser Ala Val Tyr Tyr Cys Thr Arg Arg Val Pro Val Tyr Phe Asp
95 100 105
Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Cys Ser Thr
110 115 120
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
125 130 135
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
140 145 150
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
155 160 165
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
170 175 180
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr
185 190 195
Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
200 205 210
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
215 220 225
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
305 310 315
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
320 325 330
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
335 340 345
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys
350 355 360
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
365 370 375
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
380 385 390
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
395 400 405
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
410 415 420
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
425 430 435
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
440 445
<210> 60
<211> 218
<212> PRT
<213> Artificial sequence
<220>
<223> Light chain of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio chSN8-HC(A118C)-LC)
<400> 60
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu
1 5 10 15
Gly Gln Arg Ala Thr Ile Ser Cys Lys Ala Ser Gln Ser Val Asp
20 25 30
Tyr Asp Gly Asp Ser Phe Leu Asn Trp Tyr Gln Gln Lys Pro Gly
35 40 45
Gln Pro Pro Lys Leu Phe Ile Tyr Ala Ala Ser Asn Leu Glu Ser
50 55 60
Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
65 70 75
Thr Leu Asn Ile His Pro Val Glu Glu Glu Asp Ala Ala Thr Tyr
80 85 90
Tyr Cys Gln Gln Ser Asn Glu Asp Pro Leu Thr Phe Gly Ala Gly
95 100 105
Thr Glu Leu Glu Leu Lys Arg Thr Val Ala Ala Pro Ser Val Phe
110 115 120
Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser
125 130 135
Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val
140 145 150
Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
155 160 165
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
170 175 180
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
185 190 195
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr
200 205 210
Lys Ser Phe Asn Arg Gly Glu Cys
215
<210> 61
<211> 441
<212> PRT
<213> Artificial sequence
<220>
<223> Heavy chain of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio anti-cynoCD79b-HC(A118C)-HC)
<400> 61
Asp Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser
1 5 10 15
Gln Ser Leu Ser Leu Thr Cys Thr Val Thr Gly Tyr Ser Ile Thr
20 25 30
Ser Asp Tyr Ala Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys
35 40 45
Leu Glu Trp Met Gly Asn Ile Trp Tyr Ser Gly Ser Thr Thr Tyr
50 55 60
Asn Pro Ser Leu Lys Ser Arg Ile Ser Ile Thr Arg Asp Thr Ser
65 70 75
Lys Asn Gln Phe Phe Leu Gln Leu Asn Ser Val Thr Ser Glu Asp
80 85 90
Thr Ala Thr Tyr Tyr Cys Ser Arg Met Asp Phe Trp Gly Gln Gly
95 100 105
Thr Thr Leu Thr Val Ser Ser Cys Ser Thr Lys Gly Pro Ser Val
110 115 120
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
125 130 135
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
140 145 150
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
155 160 165
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
170 175 180
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
185 190 195
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val
200 205 210
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
215 220 225
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
230 235 240
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
245 250 255
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
275 280 285
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
320 325 330
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
335 340 345
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
350 355 360
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
365 370 375
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
380 385 390
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
395 400 405
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
410 415 420
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
425 430 435
Leu Ser Leu Ser Pro Gly
440
<210> 62
<211> 218
<212> PRT
<213> Artificial sequence
<220>
<223> Light chain of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio anti-cynoCD79b-HC(A118C)-LC)
<400> 62
Asp Ile Val Leu Thr Gln Ser Pro Pro Ser Leu Ala Val Ser Leu
1 5 10 15
Gly Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp
20 25 30
Ser Tyr Gly Lys Thr Phe Met His Trp His Gln Gln Lys Pro Gly
35 40 45
Gln Pro Pro Lys Leu Leu Ile Tyr Arg Val Ser Asn Leu Glu Ser
50 55 60
Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe
65 70 75
Thr Leu Thr Ile Asn Pro Val Glu Ala Asp Asp Val Ala Thr Tyr
80 85 90
Tyr Cys Gln Gln Ser Asn Glu Asp Pro Phe Thr Phe Gly Gly Gly
95 100 105
Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe
110 115 120
Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser
125 130 135
Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val
140 145 150
Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
155 160 165
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
170 175 180
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
185 190 195
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr
200 205 210
Lys Ser Phe Asn Arg Gly Glu Cys
215
<210> 63
<211> 10
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-chSN8 HC-variant)
<400> 63
Glu Val Gln Leu Cys Gln Ser Gly Ala Glu
5 10
<210> 64
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-chSN8 HC-variant)
<400> 64
Val Lys Ile Ser Cys Cys Ala Thr Gly Tyr Thr
5 10
<210> 65
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-chSN8 HC-variant)
<400> 65
Leu Ser Ser Leu Thr Cys Glu Asp Ser Ala Val
5 10
<210> 66
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-chSN8 HC-variant)
<400> 66
Thr Ser Val Thr Val Cys Ser Ala Ser Thr Lys
5 10
<210> 67
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-chSN8 HC-variant)
<400> 67
Val Thr Val Ser Ser Cys Ser Thr Lys Gly Pro
5 10
<210> 68
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-chSN8 HC-variant)
<400> 68
Val Ser Ser Ala Ser Cys Lys Gly Pro Ser Val
5 10
<210> 69
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-chSN8 HC-variant)
<400> 69
Lys Phe Asn Trp Tyr Cys Asp Gly Val Glu Val
5 10
<210> 70
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-chSN8 HC-variant)
<400> 70
Lys Gly Phe Tyr Pro Cys Asp Ile Ala Val Glu
5 10
<210> 71
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-chSN8 HC-variant)
<400> 71
Pro Pro Val Leu Asp Cys Asp Gly Ser Phe Phe
5 10
<210> 72
<211> 10
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-anti-cynoCD79b HC-variant)
<400> 72
Glu Val Gln Leu Cys Glu Ser Gly Pro Gly
5 10
<210> 73
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-anti-cynoCD79b HC-variant)
<400> 73
Leu Ser Leu Thr Cys Cys Val Thr Gly Tyr Ser
5 10
<210> 74
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-anti-cynoCD79b HC-variant)
<400> 74
Leu Asn Ser Val Thr Cys Glu Asp Thr Ala Thr
5 10
<210> 75
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-anti-cynoCD79b HC-variant)
<400> 75
Thr Thr Leu Thr Val Cys Ser Ala Ser Thr Lys
5 10
<210> 76
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-anti-cynoCD79b HC-variant)
<400> 76
Leu Thr Val Ser Ser Cys Ser Thr Lys Gly Pro
5 10
<210> 77
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-anti-cynoCD79b HC-variant)
<400> 77
Val Ser Ser Ala Ser Cys Lys Gly Pro Ser Val
5 10
<210> 78
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-anti-cynoCD79b HC-variant)
<400> 78
Lys Phe Asn Trp Tyr Cys Asp Gly Val Glu Val
5 10
<210> 79
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-anti-cynoCD79b HC-variant)
<400> 79
Lys Gly Phe Tyr Pro Cys Asp Ile Ala Val Glu
5 10
<210> 80
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-anti-cynoCD79b HC-variant)
<400> 80
Pro Pro Val Leu Asp Cys Asp Gly Ser Phe Phe
5 10
<210> 81
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-chSN8-LC-variant)
<400> 81
Ser Leu Ala Val Ser Cys Gly Gln Arg Ala Thr
5 10
<210> 82
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-chSN8-LC-variant)
<400> 82
Glu Leu Lys Arg Thr Cys Ala Ala Pro Ser Val
5 10
<210> 83
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-chSN8-LC-variant)
<400> 83
Thr Val Ala Ala Pro Cys Val Phe Ile Phe Pro
5 10
<210> 84
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-chSN8-LC-variant)
<400> 84
Phe Ile Phe Pro Pro Cys Asp Glu Gln Leu Lys
5 10
<210> 85
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-chSN8-LC-variant)
<400> 85
Asp Glu Gln Leu Lys Cys Gly Thr Ala Ser Val
5 10
<210> 86
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-chSN8-LC-variant)
<400> 86
Val Thr Glu Gln Asp Cys Lys Asp Ser Thr Tyr
5 10
<210> 87
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-chSN8-LC-variant)
<400> 87
Gly Leu Ser Ser Pro Cys Thr Lys Ser Phe Asn
5 10
<210> 88
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-anti-cynoCD79b LC-variant)
<400> 88
Ser Leu Ala Val Ser Cys Gly Gln Arg Ala Thr
5 10
<210> 89
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-anti-cynoCD79b LC-variant)
<400> 89
Glu Ile Lys Arg Thr Cys Ala Ala Pro Ser Val
5 10
<210> 90
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-anti-cynoCD79b LC-variant)
<400> 90
Thr Val Ala Ala Pro Cys Val Phe Ile Phe Pro
5 10
<210> 91
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-anti-cynoCD79b LC-variant)
<400> 91
Phe Ile Phe Pro Pro Cys Asp Glu Gln Leu Lys
5 10
<210> 92
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-anti-cynoCD79b LC-variant)
<400> 92
Asp Glu Gln Leu Lys Cys Gly Thr Ala Ser Val
5 10
<210> 93
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-anti-cynoCD79b LC-variant)
<400> 93
Val Thr Glu Gln Asp Cys Lys Asp Ser Thr Tyr
5 10
<210> 94
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> Partial sequence of variant of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-anti-cynoCD79b LC-variant)
<400> 94
Gly Leu Ser Ser Pro Cys Thr Lys Ser Phe Asn
5 10
<210> 95
<211> 441
<212> PRT
<213> Artificial sequence
<220>
<223> Heavy chain of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-anti-cynoCD79b-LC(V205C)-HC)
<400> 95
Asp Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser
1 5 10 15
Gln Ser Leu Ser Leu Thr Cys Thr Val Thr Gly Tyr Ser Ile Thr
20 25 30
Ser Asp Tyr Ala Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys
35 40 45
Leu Glu Trp Met Gly Asn Ile Trp Tyr Ser Gly Ser Thr Thr Tyr
50 55 60
Asn Pro Ser Leu Lys Ser Arg Ile Ser Ile Thr Arg Asp Thr Ser
65 70 75
Lys Asn Gln Phe Phe Leu Gln Leu Asn Ser Val Thr Ser Glu Asp
80 85 90
Thr Ala Thr Tyr Tyr Cys Ser Arg Met Asp Phe Trp Gly Gln Gly
95 100 105
Thr Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
110 115 120
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
125 130 135
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
140 145 150
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
155 160 165
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
170 175 180
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
185 190 195
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val
200 205 210
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
215 220 225
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
230 235 240
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
245 250 255
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
275 280 285
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
320 325 330
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
335 340 345
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
350 355 360
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
365 370 375
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
380 385 390
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
395 400 405
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
410 415 420
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
425 430 435
Leu Ser Leu Ser Pro Gly
440
<210> 96
<211> 218
<212> PRT
<213> Artificial sequence
<220>
<223> Light chain of cysteine-engineered chimeric Ab comprising murine and human sequences (Thio-anti-cynoCD79b-LC(V205C)-LC)
<400> 96
Asp Ile Val Leu Thr Gln Ser Pro Pro Ser Leu Ala Val Ser Leu
1 5 10 15
Gly Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp
20 25 30
Ser Tyr Gly Lys Thr Phe Met His Trp His Gln Gln Lys Pro Gly
35 40 45
Gln Pro Pro Lys Leu Leu Ile Tyr Arg Val Ser Asn Leu Glu Ser
50 55 60
Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe
65 70 75
Thr Leu Thr Ile Asn Pro Val Glu Ala Asp Asp Val Ala Thr Tyr
80 85 90
Tyr Cys Gln Gln Ser Asn Glu Asp Pro Phe Thr Phe Gly Gly Gly
95 100 105
Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe
110 115 120
Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser
125 130 135
Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val
140 145 150
Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
155 160 165
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
170 175 180
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
185 190 195
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Cys Thr
200 205 210
Lys Ser Phe Asn Arg Gly Glu Cys
215
<210> 97
<211> 112
<212> PRT
<213> Artificial sequence
<220>
<223> Variable domain of chimeric Ab comprising murine and human sequences (chSN8 antibody variable domain of LC)
<400> 97
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu
1 5 10 15
Gly Gln Arg Ala Thr Ile Ser Cys Lys Ala Ser Gln Ser Val Asp
20 25 30
Tyr Asp Gly Asp Ser Phe Leu Asn Trp Tyr Gln Gln Lys Pro Gly
35 40 45
Gln Pro Pro Lys Leu Phe Ile Tyr Ala Ala Ser Asn Leu Glu Ser
50 55 60
Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
65 70 75
Thr Leu Asn Ile His Pro Val Glu Glu Glu Asp Ala Ala Thr Tyr
80 85 90
Tyr Cys Gln Gln Ser Asn Glu Asp Pro Leu Thr Phe Gly Ala Gly
95 100 105
Thr Glu Leu Glu Leu Lys Arg
110
<210> 98
<211> 117
<212> PRT
<213> Artificial sequence
<220>
<223> Variable domain of chimeric Ab comprising murine and human sequences (chSN8 antibody variable domain of HC)
<400> 98
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Met Lys Pro Gly
1 5 10 15
Ala Ser Val Lys Ile Ser Cys Lys Ala Thr Gly Tyr Thr Phe Ser
20 25 30
Ser Tyr Trp Ile Glu Trp Val Lys Gln Arg Pro Gly His Gly Leu
35 40 45
Glu Trp Ile Gly Glu Ile Leu Pro Gly Gly Gly Asp Thr Asn Tyr
50 55 60
Asn Glu Ile Phe Lys Gly Lys Ala Thr Phe Thr Ala Asp Thr Ser
65 70 75
Ser Asn Thr Ala Tyr Met Gln Leu Ser Ser Leu Thr Ser Glu Asp
80 85 90
Ser Ala Val Tyr Tyr Cys Thr Arg Arg Val Pro Val Tyr Phe Asp
95 100 105
Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser
110 115
<210> 99
<211> 113
<212> PRT
<213> Artificial sequence
<220>
<223> Variable domain of chimeric Ab comprising murine and human sequences (2F2 antibody variable domain of LC)
<400> 99
Asp Ile Val Met Thr Gln Thr Pro Leu Thr Leu Ser Val Thr Ile
1 5 10 15
Gly Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu
20 25 30
Asp Ser Asp Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Arg Pro
35 40 45
Gly Gln Ser Pro Glu Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp
50 55 60
Ser Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp
65 70 75
Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Leu Gly Val
80 85 90
Tyr Cys Cys Trp Gln Gly Thr His Phe Pro Tyr Thr Phe Gly Gly
95 100 105
Gly Thr Lys Val Glu Ile Lys Arg
110
<210> 100
<211> 113
<212> PRT
<213> Artificial sequence
<220>
<223> Variable domain of chimeric Ab comprising murine and human sequences (2F2 antibody variable domain of HC)
<400> 100
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Arg Pro Gly
1 5 10 15
Ala Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr
20 25 30
Ser Tyr Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu
35 40 45
Glu Trp Ile Gly Met Ile Asp Pro Ser Asp Ser Glu Thr His Tyr
50 55 60
Asn His Ile Phe Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Ser
65 70 75
Ser Ser Thr Ala Tyr Leu Gln Leu Ser Ser Leu Thr Ser Glu Asp
80 85 90
Ser Ala Val Tyr Tyr Cys Ala Arg Asn Leu Tyr Leu Trp Gly Gln
95 100 105
Gly Thr Ser Val Thr Val Ser Leu
110
<210> 101
<211> 112
<212> PRT
<213> Artificial sequence
<220>
<223> Variable domain of chimeric Ab comprising murine and human sequences (10D10 antibody variable domain of LC)
<400> 101
Asp Ile Val Leu Thr Gln Ser Pro Pro Ser Leu Ala Val Ser Leu
1 5 10 15
Gly Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp
20 25 30
Ser Tyr Gly Lys Thr Phe Met His Trp His Gln Gln Lys Pro Gly
35 40 45
Gln Pro Pro Lys Leu Leu Ile Tyr Arg Val Ser Asn Leu Glu Ser
50 55 60
Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe
65 70 75
Thr Leu Thr Ile Asn Pro Val Glu Ala Asp Asp Val Ala Thr Tyr
80 85 90
Tyr Cys Gln Gln Ser Asn Glu Asp Pro Phe Thr Phe Gly Gly Gly
95 100 105
Thr Lys Leu Glu Ile Lys Arg
110
<210> 102
<211> 112
<212> PRT
<213> Artificial sequence
<220>
<223> Variable domain of chimeric Ab comprising murine and human sequences (10D10 antibody variable domain of HC)
<400> 102
Glu Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser
1 5 10 15
Gln Ser Leu Ser Leu Thr Cys Thr Val Thr Gly Tyr Ser Ile Thr
20 25 30
Ser Asp Tyr Ala Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys
35 40 45
Leu Glu Trp Met Gly Asn Ile Trp Tyr Ser Gly Ser Thr Thr Tyr
50 55 60
Asn Pro Ser Leu Lys Ser Arg Ile Ser Ile Thr Arg Asp Thr Ser
65 70 75
Lys Asn Gln Phe Phe Leu Gln Leu Asn Ser Val Thr Ser Glu Asp
80 85 90
Thr Ala Thr Tyr Tyr Cys Ser Arg Met Asp Phe Trp Gly Gln Gly
95 100 105
Thr Thr Leu Thr Val Ser Ser
110
Claims (427)
- (a) 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 코딩하는 DNA 분자;
(b) 그의 관련 신호 펩티드가 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 코딩하는 DNA 분자;
(c) 그의 관련 신호 펩티드가 존재하는, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산을 갖는 폴리펩티드의 세포외 도메인을 코딩하는 DNA 분자;
(d) 그의 관련 신호 펩티드가 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산을 갖는 폴리펩티드의 세포외 도메인을 코딩하는 DNA 분자;
(e) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열;
(f) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열의 전장 코딩 영역; 또는
(g) (a), (b), (c), (d), (e) 또는 (f)의 보체
에 대해 적어도 80%의 핵산 서열 동일성을 갖는 뉴클레오티드 서열을 갖는 단리된 핵산. - (a) 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 코딩하는 뉴클레오티드 서열;
(b) 그의 관련 신호 펩티드가 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 코딩하는 뉴클레오티드 서열;
(c) 그의 관련 신호 펩티드가 존재하는, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산을 갖는 폴리펩티드의 세포외 도메인을 코딩하는 뉴클레오티드 서열;
(d) 그의 관련 신호 펩티드가 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산을 갖는 폴리펩티드의 세포외 도메인을 코딩하는 뉴클레오티드 서열;
(e) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열;
(f) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열의 전장 코딩 영역; 또는
(g) (a), (b), (c), (d), (e) 또는 (f)의 보체
를 갖는 단리된 핵산. - (a) 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 코딩하는 핵산;
(b) 그의 관련 신호 펩티드가 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 코딩하는 핵산;
(c) 그의 관련 신호 펩티드가 존재하는, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드의 세포외 도메인을 코딩하는 핵산;
(d) 그의 관련 신호 펩티드가 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드의 세포외 도메인을 코딩하는 핵산;
(e) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열;
(f) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열의 전장 코딩 영역; 또는
(g) (a), (b), (c), (d), (e) 또는 (f)의 보체
에 혼성화하는 단리된 핵산. - 제3항에 있어서, 혼성화가 엄격한 조건 하에 발생하는 것인 핵산.
- 제3항에 있어서, 길이가 적어도 약 5개의 뉴클레오티드인 핵산.
- 제1항 내지 제3항 중 어느 한 항의 핵산을 포함하는 발현 벡터.
- 제6항에 있어서, 상기 핵산이 벡터로 형질전환된 숙주 세포에 의해 인식되는 제어 서열에 작동가능하게 연결되는 것인 발현 벡터.
- 제7항의 발현 벡터를 포함하는 숙주 세포.
- 제8항에 있어서, CHO 세포, 이. 콜라이 세포 또는 효모 세포인 숙주 세포.
- 폴리펩티드의 발현에 적합한 조건 하에 제8항의 숙주 세포를 배양하고, 상기 폴리펩티드를 세포 배양액으로부터 회수하는 것을 포함하는, 폴리펩티드의 제조 방법.
- (a) 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드;
(b) 그의 관련 신호 펩티드가 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드;
(c) 그의 관련 신호 펩티드가 존재하는, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드의 세포외 도메인;
(d) 그의 관련 신호 펩티드가 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드의 세포외 도메인;
(e) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열에 의해 코딩되는 폴리펩티드; 또는
(f) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열의 전장 코딩 영역에 의해 코딩되는 폴리펩티드
에 대해 적어도 80%의 아미노산 서열 동일성을 갖는 단리된 폴리펩티드. - (a) 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열;
(b) 그의 관련 신호 펩티드 서열이 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열;
(c) 그의 관련 신호 펩티드 서열이 존재하는, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 폴리펩티드의 세포외 도메인의 아미노산 서열;
(d) 그의 관련 신호 펩티드 서열이 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 폴리펩티드의 세포외 도메인의 아미노산 서열;
(e) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열에 의해 코딩되는 아미노산 서열; 또는
(f) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열의 전장 코딩 영역에 의해 코딩되는 아미노산 서열
을 갖는 단리된 폴리펩티드. - 이종성 폴리펩티드에 융합된 제11항 또는 제12항의 폴리펩티드를 포함하는 키메라 폴리펩티드.
- 제13항에 있어서, 상기 이종성 폴리펩티드가 면역글로불린의 에피토프 태그 서열 또는 Fc 영역인 폴리펩티드.
- (a) 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드;
(b) 그의 관련 신호 펩티드가 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 폴리펩티드;
(c) 그의 관련 신호 펩티드가 존재하는, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드의 세포외 도메인;
(d) 그의 관련 신호 펩티드가 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드의 세포외 도메인;
(e) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열에 의해 코딩되는 폴리펩티드; 또는
(f) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열의 전장 코딩 영역에 의해 코딩되는 폴리펩티드
에 대해 적어도 80%의 아미노산 서열 동일성을 갖는 폴리펩티드에 결합하는 단리된 항체. - (a) 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열;
(b) 그의 관련 신호 펩티드 서열이 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열;
(c) 그의 관련 신호 펩티드 서열이 존재하는, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 폴리펩티드의 세포외 도메인의 아미노산 서열;
(d) 그의 관련 신호 펩티드 서열이 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 폴리펩티드의 세포외 도메인의 아미노산 서열;
(e) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열에 의해 코딩되는 아미노산 서열; 또는
(f) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열의 전장 코딩 영역에 의해 코딩되는 아미노산 서열
을 갖는 폴리펩티드에 결합하는 단리된 항체. - 제15항, 제16항, 제334항 내지 제338항 또는 제339항 내지 제347항 중 어느 한 항에 있어서, 모노클로날 항체인 항체.
- 제15항, 제16항, 제334항 내지 제338항 또는 제339항 내지 제347항 중 어느 한 항에 있어서, 항체 단편인 항체.
- 제15항, 제16항, 제334항 내지 제338항 또는 제339항 내지 제347항 중 어느 한 항에 있어서, 키메라 또는 인간화 항체인 항체.
- 제15항, 제16항, 제334항 내지 제338항 또는 제339항 내지 제347항 중 어느 한 항에 있어서, 성장 억제제에 접합된 항체.
- 제15항, 제16항, 제334항 내지 제338항 또는 제339항 내지 제347항 중 어느 한 항에 있어서, 세포독성제에 접합된 항체.
- 제21항에 있어서, 세포독성제가 독소, 항생제, 방사성 동위원소 및 뉴클레오티드 분해 효소로 이루어지는 군 중에서 선택되는 것인 항체.
- 제21항에 있어서, 세포독성제가 독소인 항체.
- 제23항에 있어서, 독소가 메이탄시노이드, 돌라스타틴 유도체 및 칼리케아미신으로 이루어지는 군 중에서 선택되는 것인 항체.
- 제23항에 있어서, 독소가 메이탄시노이드인 항체.
- 제15항, 제16항, 제334항 내지 제338항 또는 제339항 내지 제347항 중 어느 한 항에 있어서, 세균에서 생산되는 항체.
- 제15항, 제16항, 제334항 내지 제338항 또는 제339항 내지 제347항 중 어느 한 항에 있어서, CHO 세포에서 생산되는 항체.
- 제15항, 제16항, 제334항 내지 제338항 또는 제339항 내지 제347항 중 어느 한 항에 있어서, 결합하는 세포의 사멸을 유도하는 항체.
- 제15항, 제16항, 제334항 내지 제338항 또는 제339항 내지 제347항 중 어느 한 항에 있어서, 검출가능하게 표지된 항체.
- 제15항, 제16항, 제334항 내지 제338항 또는 제339항 내지 제347항 중 어느 한 항의 항체를 코딩하는 뉴클레오티드 서열을 갖는 단리된 핵산.
- 벡터로 형질전환된 숙주 세포에 의해 인식되는 제어 서열에 작동가능하게 연결된 제30항의 핵산을 포함하는 발현 벡터.
- 제31항의 발현 벡터를 포함하는 숙주 세포.
- 제32항에 있어서, CHO 세포, 이. 콜라이 세포 또는 효모 세포인 숙주 세포.
- 항체의 발현에 적합한 조건 하에 제32항의 숙주 세포를 배양하고, 상기 항체를 세포 배양액으로부터 회수하는 것을 포함하는, 항체의 제조 방법.
- (a) 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드;
(b) 그의 관련 신호 펩티드가 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드;
(c) 그의 관련 신호 펩티드가 존재하는, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드의 세포외 도메인;
(d) 그의 관련 신호 펩티드가 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드의 세포외 도메인;
(e) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열에 의해 코딩되는 폴리펩티드; 또는
(f) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열의 전장 코딩 영역에 의해 코딩되는 폴리펩티드
에 대해 적어도 80%의 아미노산 서열 동일성을 갖는 폴리펩티드에 결합하는 단리된 올리고펩티드. - (a) 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열;
(b) 그의 관련 신호 펩티드 서열이 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열;
(c) 그의 관련 신호 펩티드 서열이 존재하는, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 폴리펩티드의 세포외 도메인의 아미노산 서열;
(d) 그의 관련 신호 펩티드 서열이 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 폴리펩티드의 세포외 도메인의 아미노산 서열;
(e) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열에 의해 코딩되는 아미노산 서열; 또는
(f) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열의 전장 코딩 영역에 의해 코딩되는 아미노산 서열
을 갖는 폴리펩티드에 결합하는 단리된 올리고펩티드. - 제35항 또는 제36항에 있어서, 성장 억제제에 접합된 올리고펩티드.
- 제35항 또는 제36항에 있어서, 세포 독성제에 접합된 올리고펩티드.
- 제38항에 있어서, 세포독성제가 독소, 항생제, 방사성 동위원소 및 뉴클레오티드 분해 효소로 이루어지는 군 중에서 선택되는 것인 올리고펩티드.
- 제38항에 있어서, 세포독성제가 독소인 올리고펩티드.
- 제40항에 있어서, 독소가 메이탄시노이드, 돌라스타틴 유도체 및 칼리케아미신으로 이루어지는 군 중에서 선택되는 것인 올리고펩티드.
- 제40항에 있어서, 독소가 메이탄시노이드인 올리고펩티드.
- 제35항 또는 제36항에 있어서, 결합하는 세포의 사멸을 유도하는 올리고펩티드.
- 제35항 또는 제36항에 있어서, 검출가능하게 표지된 올리고펩티드.
- (a) 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드;
(b) 그의 관련 신호 펩티드가 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드;
(c) 그의 관련 신호 펩티드가 존재하는, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드의 세포외 도메인;
(d) 그의 관련 신호 펩티드가 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드의 세포외 도메인;
(e) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열에 의해 코딩되는 폴리펩티드; 또는
(f) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열의 전장 코딩 영역에 의해 코딩되는 폴리펩티드
에 대해 적어도 80%의 아미노산 서열 동일성을 갖는 폴리펩티드에 결합하는 TAHO 결합 유기 분자. - 제45항에 있어서,
(a) 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열;
(b) 그의 관련 신호 펩티드 서열이 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열;
(c) 그의 관련 신호 펩티드 서열이 존재하는, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 폴리펩티드의 세포외 도메인의 아미노산 서열;
(d) 그의 관련 신호 펩티드 서열이 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 폴리펩티드의 세포외 도메인의 아미노산 서열;
(e) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열에 의해 코딩되는 아미노산 서열; 또는
(f) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열의 전장 코딩 영역에 의해 코딩되는 아미노산 서열
을 갖는 폴리펩티드에 결합하는 유기 분자. - 제45항 또는 제46항에 있어서, 성장 억제제에 접합된 유기 분자.
- 제45항 또는 제46항에 있어서, 세포 독성제에 접합된 유기 분자.
- 제48항에 있어서, 세포독성제가 독소, 항생제, 방사성 동위원소 및 뉴클레오티드 분해 효소로 이루어지는 군 중에서 선택되는 것인 유기 분자.
- 제48항에 있어서, 세포독성제가 독소인 유기 분자.
- 제50항에 있어서, 독소가 메이탄시노이드, 돌라스타틴 유도체 및 칼리케아미신으로 이루어지는 군 중에서 선택되는 것인 유기 분자.
- 제50항에 있어서, 독소가 메이탄시노이드인 유기 분자.
- 제45항 또는 제46항에 있어서, 결합하는 세포의 사멸을 유도하는 유기 분자.
- 제45항 또는 제46항에 있어서, 검출가능하게 표지된 유기 분자.
- (a) 제11항의 폴리펩티드;
(b) 제12항의 폴리펩티드;
(c) 제15항의 항체;
(d) 제16항의 항체;
(e) 제332항의 항체;
(f) 제333항의 항체;
(g) 제334항의 항체;
(h) 제335항의 항체;
(i) 제336항의 항체;
(j) 제35항의 올리고펩티드;
(k) 제36항의 올리고펩티드;
(l) 제45항의 TAHO 결합 유기 분자; 또는
(m) 제46항의 TAHO 결합 유기 분자
를 담체와 함께 포함하는 물질의 조성물. - 제55항에 있어서, 상기 담체가 제약상 허용되는 담체인 조성물.
- (a) 용기; 및
(b) 상기 용기 내에 함유된 제55항의 물질의 조성물
을 포함하는 제품. - 제57항에 있어서, 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 상기 물질의 조성물의 용도를 나타내는, 상기 용기에 부착된 라벨 또는 상기 용기와 함께 포함된 포장 삽입물을 더 포함하는 제품.
- (a) 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드;
(b) 그의 관련 신호 펩티드가 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드;
(c) 그의 관련 신호 펩티드가 존재하는, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드의 세포외 도메인;
(d) 그의 관련 신호 펩티드가 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드의 세포외 도메인;
(e) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열에 의해 코딩되는 폴리펩티드; 또는
(f) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열의 전장 코딩 영역에 의해 코딩되는 폴리펩티드
에 대해 적어도 80%의 아미노산 서열 동일성을 갖는 단백질을 발현하는 세포를, 상기 단백질에 결합하는 항체, 올리고펩티드 또는 유기 분자와, 상기 단백질에 결합하는 세포독성제에 접합된 항체, 올리고펩티드 또는 유기 분자와, 또는 상기 단백질에 결합하는 성장 억제제에 접합된 항체, 올리고펩티드 또는 유기 분자와 접촉시키는 것을 포함하고, 여기서 상기 항체, 올리고펩티드 또는 유기 분자, 세포독성제에 접합된 상기 항체, 올리고펩티드 또는 유기 분자, 또는 성장 억제제에 접합된 상기 항체, 올리고펩티드 또는 유기 분자의 상기 단백질에 대한 결합이 상기 세포의 성장의 억제를 일으키는 것인, 상기 세포의 성장을 억제하는 방법. - 제59항에 있어서, 상기 항체가 모노클로날 항체인 방법.
- 제59항에 있어서, 상기 항체가 항체 단편인 방법.
- 제59항에 있어서, 상기 항체가 키메라 또는 인간화 항체인 방법.
- 제59항에 있어서, 상기 항체가 서열 11의 핵산 서열에 의해 코딩되는 중쇄 및 서열 9의 핵산 서열에 의해 코딩되는 경쇄를 포함하는 단리된 항체인 방법.
- 제59항에 있어서, 상기 항체가 서열 34의 핵산 서열에 의해 코딩되는 중쇄 및 서열 32의 핵산 서열에 의해 코딩되는 경쇄를 포함하는 단리된 항체인 방법.
- 제59항에 있어서, 상기 항체가 서열 42의 핵산 서열에 의해 코딩되는 중쇄 및 서열 40의 핵산 서열에 의해 코딩되는 경쇄를 포함하는 단리된 항체인 방법.
- 제59항에 있어서, 상기 항체가 표 24에 제시된 임의의 ATCC 기탁 번호 하에 기탁된 단리된 항체인 방법.
- 제59항에 있어서, 상기 항체가 서열 16 및 서열 17의 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열에 결합하는 것인 방법.
- 제59항에 있어서, 세포독성제가 독소, 항생제, 방사성 동위원소 및 뉴클레오티드 분해 효소로 이루어지는 군 중에서 선택되는 것인 방법.
- 제59항에 있어서, 세포독성제가 독소인 방법.
- 제69항에 있어서, 독소가 메이탄시노이드, 돌라스타틴 유도체 및 칼리케아미신으로 이루어지는 군 중에서 선택되는 것인 방법.
- 제60항에 있어서, 독소가 메이탄시노이드인 방법.
- 제59항에 있어서, 상기 항체가 세균에서 생산되는 것인 방법.
- 제59항에 있어서, 상기 항체가 CHO 세포에서 생산되는 것인 방법.
- 제59항에 있어서, 상기 세포가 조혈 세포인 방법.
- 제74항에 있어서, 상기 조혈 세포가 림프구, 백혈구, 혈소판, 적혈구 및 자연 살해 세포로 이루어지는 군 중에서 선택되는 것인 방법.
- 제75항에 있어서, 상기 림프구가 B 세포 또는 T 세포인 방법.
- 제75항에 있어서, 상기 림프구가 암 세포인 방법.
- 제77항에 있어서, 상기 암세포가 방사선 치료 또는 화학요법제에 추가로 노출되는 것인 방법.
- 제77항에 있어서, 상기 암세포가 림프종 세포, 골수종 세포 및 백혈병 세포로 이루어지는 군 중에서 선택되는 것인 방법.
- 제75항에 있어서, 상기 단백질이 비-조혈 세포에 비해 상기 조혈 세포에 의해 더 풍부하게 발현되는 것인 방법.
- 제59항에 있어서, 상기 억제가 상기 세포의 사멸을 일으키는 것인 방법.
- 제59항에 있어서, 상기 단백질이
(a) 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열;
(b) 그의 관련 신호 펩티드 서열이 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열;
(c) 그의 관련 신호 펩티드 서열이 존재하는, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 폴리펩티드의 세포외 도메인의 아미노산 서열;
(d) 그의 관련 신호 펩티드 서열이 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 폴리펩티드의 세포외 도메인의 아미노산 서열;
(e) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열에 의해 코딩되는 아미노산 서열; 또는
(f) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열의 전장 코딩 영역에 의해 코딩되는 아미노산 서열을 갖는 것인 방법. - (a) 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드;
(b) 그의 관련 신호 펩티드가 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드;
(c) 그의 관련 신호 펩티드가 존재하는, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드의 세포외 도메인;
(d) 그의 관련 신호 펩티드가 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드의 세포외 도메인;
(e) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열에 의해 코딩되는 폴리펩티드; 또는
(f) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열의 전장 코딩 영역에 의해 코딩되는 폴리펩티드
에 대해 적어도 80%의 아미노산 서열 동일성을 갖는 단백질에 결합하는 치료 유효량의 항체, 올리고펩티드 또는 유기 분자, 상기 단백질에 결합하는 세포독성제에 접합된 항체, 올리고펩티드 또는 유기 분자, 또는 상기 단백질에 결합하는 성장 억제제에 접합된 항체, 올리고펩티드 또는 유기 분자를, 상기 단백질을 발현하는 세포를 포함하는 암성 종양이 있는 포유동물에게 투여하는 것을 포함하고, 여기서 상기 결합이 상기 포유동물을 효과적으로 치료하는 것인, 상기 포유동물을 치료 목적으로 처치하는 방법. - 제83항에 있어서, 상기 항체가 모노클로날 항체인 방법.
- 제83항에 있어서, 상기 항체가 항체 단편인 방법.
- 제83항에 있어서, 상기 항체가 키메라 또는 인간화 항체인 방법.
- 제83항에 있어서, 상기 항체가 서열 11의 핵산 서열에 의해 코딩되는 중쇄 및 서열 9의 핵산 서열에 의해 코딩되는 경쇄를 포함하는 단리된 항체인 방법.
- 제83항에 있어서, 상기 항체가 서열 34의 핵산 서열에 의해 코딩되는 중쇄 및 서열 32의 핵산 서열에 의해 코딩되는 경쇄를 포함하는 단리된 항체인 방법.
- 제83항에 있어서, 상기 항체가 서열 42의 핵산 서열에 의해 코딩되는 중쇄 및 서열 40의 핵산 서열에 의해 코딩되는 경쇄를 포함하는 단리된 항체인 방법.
- 제83항에 있어서, 상기 항체가 표 24에 제시된 임의의 ATCC 기탁 번호 하에 기탁된 단리된 항체인 방법.
- 제83항에 있어서, 상기 항체가 서열 16 및 서열 17의 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열에 결합하는 것인 방법.
- 제83항에 있어서, 상기 세포독성제가 독소, 항생제, 방사성 동위원소 및 뉴클레오티드 분해 효소로 이루어지는 군 중에서 선택되는 것인 방법.
- 제83항에 있어서, 세포독성제가 독소인 방법.
- 제93항에 있어서, 독소가 메이탄시노이드, 돌라스타틴 유도체 및 칼리케아미신으로 이루어지는 군 중에서 선택되는 것인 방법.
- 제93항에 있어서, 독소가 메이탄시노이드인 방법.
- 제83항에 있어서, 상기 항체가 세균에서 생산되는 것인 방법.
- 제83항에 있어서, 상기 항체가 CHO 세포에서 생산되는 것인 방법.
- 제83항에 있어서, 상기 종양이 방사선 치료 또는 화학요법제에 추가로 노출되는 것인 방법.
- 제83항에 있어서, 상기 종양이 림프종, 백혈병 또는 골수종 종양인 방법.
- 제83항에 있어서, 상기 단백질이 상기 종양의 비-조혈 세포에 비해 조혈 세포에 의해 더 풍부하게 발현되는 것인 방법.
- 제100항에 있어서, 상기 단백질이 상기 종양의 정상 조혈 세포에 비해 상기 종양의 암성 조혈 세포에 의해 더 풍부하게 발현되는 것인 방법.
- 제83항에 있어서, 상기 단백질이
(a) 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열;
(b) 그의 관련 신호 펩티드 서열이 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열;
(c) 그의 관련 신호 펩티드 서열이 존재하는, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 폴리펩티드의 세포외 도메인의 아미노산 서열;
(d) 그의 관련 신호 펩티드 서열이 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 폴리펩티드의 세포외 도메인의 아미노산 서열;
(e) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열에 의해 코딩되는 아미노산 서열; 또는
(f) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열의 전장 코딩 영역에 의해 코딩되는 아미노산 서열을 갖는 것인 방법. - (a) 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드;
(b) 그의 관련 신호 펩티드가 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드;
(c) 그의 관련 신호 펩티드가 존재하는, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드의 세포외 도메인;
(d) 그의 관련 신호 펩티드가 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드의 세포외 도메인;
(e) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열에 의해 코딩되는 폴리펩티드; 또는
(f) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열의 전장 코딩 영역에 의해 코딩되는 폴리펩티드
에 대해 적어도 80%의 아미노산 서열 동일성을 갖는 단백질을 함유하는 것으로 의심되는 샘플을, 상기 단백질에 결합하는 항체, 올리고펩티드 또는 유기 분자에 노출시키고, 상기 샘플 내의 상기 단백질에 대한 상기 항체, 올리고펩티드 또는 유기 분자의 결합을 결정하는 것을 포함하고, 여기서 상기 단백질에 대한 항체, 올리고펩티드 또는 유기 분자의 결합이 상기 샘플 내에 상기 단백질이 존재함을 표시하는 것인, 상기 단백질을 함유하는 것으로 의심되는 샘플 내에서 단백질의 존재를 결정하는 방법. - 제103항에 있어서, 상기 샘플이 상기 단백질을 발현하는 것으로 의심되는 세포를 포함하는 것인 방법.
- 제103항에 있어서, 상기 세포가 암 세포인 방법.
- 제103항에 있어서, 상기 항체, 올리고펩티드 또는 유기 분자가 검출가능하게 표지되는 것인 방법.
- 제103항에 있어서, 상기 항체가 모노클로날 항체인 방법.
- 제103항에 있어서, 상기 항체가 항체 단편인 방법.
- 제103항에 있어서, 상기 항체가 키메라 또는 인간화 항체인 방법.
- 제103항에 있어서, 상기 항체가 서열 11의 핵산 서열에 의해 코딩되는 중쇄 및 서열 9의 핵산 서열에 의해 코딩되는 경쇄를 포함하는 단리된 항체인 방법.
- 제103항에 있어서, 상기 항체가 서열 34의 핵산 서열에 의해 코딩되는 중쇄 및 서열 32의 핵산 서열에 의해 코딩되는 경쇄를 포함하는 단리된 항체인 방법.
- 제103항에 있어서, 상기 항체가 서열 42의 핵산 서열에 의해 코딩되는 중쇄 및 서열 40의 핵산 서열에 의해 코딩되는 경쇄를 포함하는 단리된 항체인 방법.
- 제103항에 있어서, 상기 항체가 표 24에 제시된 임의의 ATCC 기탁 번호 하에 기탁된 단리된 항체인 방법.
- 제103항에 있어서, 상기 항체가 서열 16 및 서열 17의 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열에 결합하는 것인 방법.
- 제103항에 있어서, 상기 항체가 세균에서 생산되는 것인 방법.
- 제103항에 있어서, 상기 항체가 CHO 세포에서 생산되는 것인 방법.
- 제103항에 있어서, 상기 단백질이 상기 종양의 비-조혈 세포에 비해 조혈 세포에 의해 더 풍부하게 발현되는 것인 방법.
- 제103항에 있어서, 상기 단백질이 상기 종양의 정상 조혈 세포에 비해 상기 종양의 암성 조혈 세포에 의해 더 풍부하게 발현되는 것인 방법.
- 제103항에 있어서, 상기 단백질이
(a) 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열;
(b) 그의 관련 신호 펩티드 서열이 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열;
(c) 그의 관련 신호 펩티드 서열이 존재하는, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 폴리펩티드의 세포외 도메인의 아미노산 서열;
(d) 그의 관련 신호 펩티드 서열이 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 폴리펩티드의 세포외 도메인의 아미노산 서열;
(e) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열에 의해 코딩되는 아미노산 서열; 또는
(f) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열의 전장 코딩 영역에 의해 코딩되는 아미노산 서열을 갖는 것인 방법. - (a) 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드;
(b) 그의 관련 신호 펩티드가 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드;
(c) 그의 관련 신호 펩티드가 존재하는, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드의 세포외 도메인;
(d) 그의 관련 신호 펩티드가 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드의 세포외 도메인;
(e) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열에 의해 코딩되는 폴리펩티드; 또는
(f) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열의 전장 코딩 영역에 의해 코딩되는 폴리펩티드
에 대해 적어도 80%의 아미노산 서열 동일성을 갖는 단백질의 길항제의 유효량을 상기 단백질의 증가된 발현 또는 활성과 연관된 세포 증식성 질환의 효과적인 치료 또는 예방을 필요로 하는 대상에게 투여하여 상기 세포 증식성 질환을 효과적으로 치료 또는 예방하는 것을 포함하는, 상기 단백질의 증가된 발현 또는 활성과 연관된 세포 증식성 질환을 치료 또는 예방하기 위한 방법. - 제120항에 있어서, 상기 세포 증식성 질환이 암인 방법.
- 제120항에 있어서, 상기 길항제가 항-TAHO 폴리펩티드 항체, TAHO 결합 올리고펩티드, TAHO 결합 유기 분자 또는 안티센스 올리고뉴클레오티드인 방법.
- 제120항에 있어서, 상기 항-TAHO 폴리펩티드 항체가 서열 11의 핵산 서열에 의해 코딩되는 중쇄 및 서열 9의 핵산 서열에 의해 코딩되는 경쇄를 포함하는 단리된 항체인 방법.
- 제120항에 있어서, 상기 항체가 서열 34의 핵산 서열에 의해 코딩되는 중쇄 및 서열 32의 핵산 서열에 의해 코딩되는 경쇄를 포함하는 단리된 항체인 방법.
- 제120항에 있어서, 상기 항체가 서열 42의 핵산 서열에 의해 코딩되는 중쇄 및 서열 40의 핵산 서열에 의해 코딩되는 경쇄를 포함하는 단리된 항체인 방법.
- 제120항에 있어서, 상기 항-TAHO 폴리펩티드 항체가 표 24에 제시된 임의의 ATCC 기탁 번호 하에 기탁된 단리된 항체인 방법.
- 제120항에 있어서, 상기 항-TAHO 폴리펩티드 항체가 서열 16 및 서열 17의 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열에 결합하는 것인 방법.
- (a) 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드;
(b) 그의 관련 신호 펩티드가 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드;
(c) 그의 관련 신호 펩티드가 존재하는, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드의 세포외 도메인;
(d) 그의 관련 신호 펩티드가 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드의 세포외 도메인;
(e) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열에 의해 코딩되는 폴리펩티드; 또는
(f) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열의 전장 코딩 영역에 의해 코딩되는 폴리펩티드
에 대해 적어도 80%의 아미노산 서열 동일성을 갖는 단백질을 발현하는 세포를, 항체, 올리고펩티드 또는 유기 분자, 세포독성제에 접합된 항체, 올리고펩티드 또는 유기 분자, 또는 상기 단백질에 결합하는 성장 억제제에 접합된 항체, 올리고펩티드 또는 유기 분자에 접촉시켜, 상기 세포에서 상기 단백질에 대한 상기 항체, 올리고펩티드 또는 유기 분자, 세포독성제에 접합된 상기 항체, 올리고펩티드 또는 유기 분자, 또는 성장 억제제에 접합된 상기 항체, 올리고펩티드 또는 유기 분자의 결합이 일어나도록 하는 것을 포함하는, 항체, 올리고펩티드 또는 유기 분자를 상기 단백질을 발현하는 세포에 결합시키는 방법. - 제128항에 있어서, 상기 항체가 모노클로날 항체인 방법.
- 제128항에 있어서, 상기 항체가 항체 단편인 방법.
- 제128항에 있어서, 상기 항체가 키메라 또는 인간화 항체인 방법.
- 제128항에 있어서, 상기 항체가 서열 11의 핵산 서열에 의해 코딩되는 중쇄 및 서열 9의 핵산 서열에 의해 코딩되는 경쇄를 포함하는 단리된 항체인 방법.
- 제128항에 있어서, 상기 항체가 서열 34의 핵산 서열에 의해 코딩되는 중쇄 및 서열 32의 핵산 서열에 의해 코딩되는 경쇄를 포함하는 단리된 항체인 방법.
- 제128항에 있어서, 상기 항체가 서열 42의 핵산 서열에 의해 코딩되는 중쇄 및 서열 40의 핵산 서열에 의해 코딩되는 경쇄를 포함하는 단리된 항체인 방법.
- 제128항에 있어서, 상기 항체가 표 24에 제시된 임의의 ATCC 기탁 번호 하에 기탁된 단리된 항체인 방법.
- 제128항에 있어서, 상기 항체가 서열 16 및 서열 17의 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열에 결합하는 것인 방법.
- 제128항에 있어서, 상기 세포독성제가 독소, 항생제, 방사성 동위원소 및 뉴클레오티드 분해 효소로 이루어지는 군 중에서 선택되는 것인 방법.
- 제128항에 있어서, 세포독성제가 독소인 방법.
- 제138항에 있어서, 독소가 메이탄시노이드, 돌라스타틴 유도체 및 칼리케아미신으로 이루어지는 군 중에서 선택되는 것인 방법.
- 제139항에 있어서, 독소가 메이탄시노이드인 방법.
- 제128항에 있어서, 상기 항체가 세균에서 생산되는 것인 방법.
- 제128항에 있어서, 상기 항체가 CHO 세포에서 생산되는 것인 방법.
- 제128항에 있어서, 상기 세포가 조혈 세포인 방법.
- 제143항에 있어서, 상기 조혈 세포가 림프구, 백혈구, 혈소판, 적혈구 및 자연 살해 세포로 이루어지는 군 중에서 선택되는 것인 방법.
- 제144항에 있어서, 상기 림프구가 B 세포 또는 T 세포인 방법.
- 제144항에 있어서, 상기 림프구가 암 세포인 방법.
- 제146항에 있어서, 상기 암세포가 방사선 치료 또는 화학요법제에 추가로 노출되는 것인 방법.
- 제146항에 있어서, 상기 암세포가 백혈병 세포, 림프종 세포 및 골수종 세포로 이루어지는 군 중에서 선택되는 것인 방법.
- 제128항에 있어서, 상기 단백질이 비-조혈 세포에 비해 상기 조혈 세포에 의해 더 풍부하게 발현되는 것인 방법.
- 제128항에 있어서, 상기 세포의 사멸을 일으키는 방법.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제1항 내지 제5항 및 제30항 중 어느 한 항에 따른 핵산의 용도.
- 종양의 치료를 위한 의약의 제조에 있어서 제1항 내지 제5항 및 제30항 중 어느 한 항에 따른 핵산의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제1항 내지 제5항 중 어느 한 항에 따른 핵산의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제6항에 따른 발현 벡터의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제6항에 따른 발현 벡터의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제6항에 따른 발현 벡터의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제8항에 따른 숙주 세포의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제8항에 따른 숙주 세포의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제8항에 따른 숙주 세포의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제11항 또는 제12항에 따른 폴리펩티드의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제11항 또는 제12항에 따른 폴리펩티드의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제11항 또는 제12항에 따른 폴리펩티드의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제15항, 제16항, 제334항 내지 제338항 및 제339항 내지 제347항 중 어느 한 항에 따른 항체의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제15항, 제16항, 제334항 내지 제338항 및 제339항 내지 제347항 중 중 어느 한 항에 따른 항체의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제15항, 제16항, 제334항 내지 제338항 및 제339항 내지 제347항 중 어느 한 항에 따른 항체의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제35항 또는 제36항에 따른 올리고펩티드의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제35항 또는 제36항에 따른 올리고펩티드의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제35항 또는 제36항에 따른 올리고펩티드의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제45항 또는 제46항에 따른 TAHO 결합 유기 분자의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제45항 또는 제46항에 따른 TAHO 결합 유기 분자의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제45항 또는 제46항에 따른 TAHO 결합 유기 분자의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제55항에 따른 물질의 조성물의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제55항에 따른 물질의 조성물의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제55항에 따른 물질의 조성물의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제57항에 따른 제품의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제58항에 따른 제품의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제58항에 따른 제품의 용도.
- (a) 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드;
(b) 그의 관련 신호 펩티드가 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드;
(c) 그의 관련 신호 펩티드가 존재하는, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드의 세포외 도메인;
(d) 그의 관련 신호 펩티드가 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드의 세포외 도메인;
(e) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열에 의해 코딩되는 폴리펩티드; 또는
(f) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열의 전장 코딩 영역에 의해 코딩되는 폴리펩티드
에 대해 적어도 80%의 아미노산 서열 동일성을 갖는 단백질을, 상기 단백질에 결합하는 항체, 올리고펩티드 또는 유기 분자, 상기 단백질에 결합하는 세포독성제에 접합된 항체, 올리고펩티드 또는 유기 분자, 또는 성장 억제제에 접합된 항체, 올리고펩티드 또는 유기 분자와 접촉시켜, 그 성장이 상기 단백질의 성장 강화 효과에 적어도 부분적으로 의존하는 세포의 성장을 억제하는 것을 포함하는, 상기 세포의 성장을 억제하는 방법. - 제178항에 있어서, 상기 세포가 조혈 세포인 방법.
- 제178항에 있어서, 상기 단백질이 상기 세포에 의해 발현되는 것인 방법.
- 제178항에 있어서, 상기 단백질에 대한 상기 항체, 올리고펩티드 또는 유기 분자의 결합이 상기 단백질의 세포 성장-강화 활성을 길항하는 것인 방법.
- 제178항에 있어서, 상기 단백질에 대한 상기 항체, 올리고펩티드 또는 유기 분자의 결합이 상기 세포의 사멸을 유도하는 것인 방법.
- 제178항에 있어서, 상기 항체가 모노클로날 항체인 방법.
- 제178항에 있어서, 상기 항체가 항체 단편인 방법.
- 제178항에 있어서, 상기 항체가 키메라 또는 인간화 항체인 방법.
- 제178항에 있어서, 상기 항체가 서열 11의 핵산 서열에 의해 코딩되는 중쇄 및 서열 9의 핵산 서열에 의해 코딩되는 경쇄를 포함하는 단리된 항체인 방법.
- 제178항에 있어서, 상기 항체가 서열 34의 핵산 서열에 의해 코딩되는 중쇄 및 서열 32의 핵산 서열에 의해 코딩되는 경쇄를 포함하는 단리된 항체인 방법.
- 제178항에 있어서, 상기 항체가 서열 42의 핵산 서열에 의해 코딩되는 중쇄 및 서열 40의 핵산 서열에 의해 코딩되는 경쇄를 포함하는 단리된 항체인 방법.
- 제178항에 있어서, 상기 항체가 표 24에 제시된 임의의 ATCC 기탁 번호 하에 기탁된 단리된 항체인 방법.
- 제178항에 있어서, 상기 항체가 서열 16 및 서열 17의 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열에 결합하는 것인 방법.
- 제178항에 있어서, 상기 세포독성제가 독소, 항생제, 방사성 동위원소 및 뉴클레오티드 분해 효소로 이루어지는 군 중에서 선택되는 것인 방법.
- 제178항에 있어서, 세포독성제가 독소인 방법.
- 제192항에 있어서, 독소가 메이탄시노이드, 돌라스타틴 유도체 및 칼리케아미신으로 이루어지는 군 중에서 선택되는 것인 방법.
- 제192항에 있어서, 독소가 메이탄시노이드인 방법.
- 제178항에 있어서, 상기 항체가 세균에서 생산되는 것인 방법.
- 제178항에 있어서, 상기 항체가 CHO 세포에서 생산되는 것인 방법.
- 제178항에 있어서, 상기 단백질이
(a) 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열;
(b) 그의 관련 신호 펩티드 서열이 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열;
(c) 그의 관련 신호 펩티드 서열이 존재하는, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 폴리펩티드의 세포외 도메인의 아미노산 서열;
(d) 그의 관련 신호 펩티드 서열이 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 폴리펩티드의 세포외 도메인의 아미노산 서열;
(e) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열에 의해 코딩되는 아미노산 서열; 또는
(f) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열의 전장 코딩 영역에 의해 코딩되는 아미노산 서열을 갖는 것인 방법. - (a) 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드;
(b) 그의 관련 신호 펩티드가 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드;
(c) 그의 관련 신호 펩티드가 존재하는, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드의 세포외 도메인;
(d) 그의 관련 신호 펩티드가 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열을 갖는 폴리펩티드의 세포외 도메인;
(e) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열에 의해 코딩되는 폴리펩티드; 또는
(f) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열의 전장 코딩 영역에 의해 코딩되는 폴리펩티드
에 대해 적어도 80%의 아미노산 서열 동일성을 갖는 단백질을, 상기 단백질에 결합하는 항체, 올리고펩티드 또는 유기 분자, 세포독성 독소에 접합된 항체, 올리고펩티드 또는 유기 분자, 또는 성장 억제제에 접합된 항체, 올리고펩티드 또는 유기 분자와 접촉시켜, 그 성장이 상기 단백질의 성장 강화 효과에 적어도 부분적으로 의존하는 종양을 효과적으로 치료하는 것을 포함하는, 상기 종양을 포유동물에서 치료 목적으로 처치하는 방법. - 제198항에 있어서, 상기 단백질이 상기 종양의 세포에 의해 발현되는 것인 방법.
- 제198항에 있어서, 상기 단백질에 대한 상기 항체, 올리고펩티드 또는 유기 분자의 결합이 상기 단백질의 세포 성장-강화 활성을 길항하는 것인 방법.
- 제198항에 있어서, 상기 항체가 모노클로날 항체인 방법.
- 제198항에 있어서, 상기 항체가 항체 단편인 방법.
- 제198항에 있어서, 상기 항체가 키메라 또는 인간화 항체인 방법.
- 제198항에 있어서, 상기 항체가 서열 11의 핵산 서열에 의해 코딩되는 중쇄 및 서열 9의 핵산 서열에 의해 코딩되는 경쇄를 포함하는 단리된 항체인 방법.
- 제198항에 있어서, 상기 항체가 서열 34의 핵산 서열에 의해 코딩되는 중쇄 및 서열 32의 핵산 서열에 의해 코딩되는 경쇄를 포함하는 단리된 항체인 방법.
- 제198항에 있어서, 상기 항체가 서열 42의 핵산 서열에 의해 코딩되는 중쇄 및 서열 40의 핵산 서열에 의해 코딩되는 경쇄를 포함하는 단리된 항체인 방법.
- 제198항에 있어서, 상기 항체가 표 24에 제시된 임의의 ATCC 기탁 번호 하에 기탁된 단리된 항체인 방법.
- 제198항에 있어서, 상기 항체가 서열 16 및 서열 17의 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열에 결합하는 것인 방법.
- 제198항에 있어서, 상기 세포독성제가 독소, 항생제, 방사성 동위원소 및 뉴클레오티드 분해 효소로 이루어지는 군 중에서 선택되는 것인 방법.
- 제198항에 있어서, 세포독성제가 독소인 방법.
- 제210항에 있어서, 독소가 메이탄시노이드, 돌라스타틴 유도체 및 칼리케아미신으로 이루어지는 군 중에서 선택되는 것인 방법.
- 제210항에 있어서, 독소가 메이탄시노이드인 방법.
- 제198항에 있어서, 상기 항체가 세균에서 생산되는 것인 방법.
- 제198항에 있어서, 상기 항체가 CHO 세포에서 생산되는 것인 방법.
- 제198항에 있어서, 상기 단백질이
(a) 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열;
(b) 그의 관련 신호 펩티드 서열이 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열;
(c) 그의 관련 신호 펩티드 서열이 존재하는, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 폴리펩티드의 세포외 도메인의 아미노산 서열;
(d) 그의 관련 신호 펩티드 서열이 결여된, 도 2 (서열 2), 도 4 (서열 4), 도 6 (서열 6) 및 도 8 (서열 8)에 제시된 아미노산 서열로 이루어지는 군 중에서 선택되는 폴리펩티드의 세포외 도메인의 아미노산 서열;
(e) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열에 의해 코딩되는 아미노산 서열; 또는
(f) 도 1 (서열 1), 도 3 (서열 3), 도 5 (서열 5) 및 도 7 (서열 7)에 제시된 뉴클레오티드 서열로 이루어지는 군 중에서 선택되는 뉴클레오티드 서열의 전장 코딩 영역에 의해 코딩되는 아미노산 서열을 갖는 것인 방법. - 제13항의 키메라 폴리펩티드를 포함하는 물질의 조성물.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제30항에 따른 핵산의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제7항에 따른 발현 벡터의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제31항에 따른 발현 벡터의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제7항에 따른 발현 벡터의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제31항에 따른 발현 벡터의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제7항에 따른 발현 벡터의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제31항에 따른 발현 벡터의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제9항에 따른 숙주 세포의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제32항에 따른 숙주 세포의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제33항에 따른 숙주 세포의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제9항에 따른 숙주 세포의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제32항에 따른 숙주 세포의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제33항에 따른 숙주 세포의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제9항에 따른 숙주 세포의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제32항에 따른 숙주 세포의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제33항에 따른 숙주 세포의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제13항에 따른 폴리펩티드의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제14항에 따른 폴리펩티드의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제13항에 따른 폴리펩티드의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제14항에 따른 폴리펩티드의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제13항에 따른 폴리펩티드의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제14항에 따른 폴리펩티드의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제17항에 따른 항체의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제18항에 따른 항체의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제19항에 따른 항체의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제20항에 따른 항체의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제21항에 따른 항체의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제22항에 따른 항체의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제23항에 따른 항체의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제24항에 따른 항체의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제25항에 따른 항체의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제26항에 따른 항체의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제27항에 따른 항체의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제28항에 따른 항체의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제29항에 따른 항체의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제17항에 따른 항체의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제18항에 따른 항체의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제19항에 따른 항체의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제20항에 따른 항체의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제21항에 따른 항체의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제22항에 따른 항체의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제23항에 따른 항체의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제24항에 따른 항체의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제25항에 따른 항체의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제26항에 따른 항체의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제27항에 따른 항체의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제28항에 따른 항체의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제29항에 따른 항체의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제17항에 따른 항체의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제18항에 따른 항체의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제17항에 따른 항체의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제18항에 따른 항체의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제19항에 따른 항체의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제20항에 따른 항체의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제21항에 따른 항체의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제22항에 따른 항체의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제23항에 따른 항체의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제24항에 따른 항체의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제25항에 따른 항체의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제26항에 따른 항체의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제27항에 따른 항체의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제28항에 따른 항체의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제29항에 따른 항체의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제37항에 따른 올리고펩티드의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제38항에 따른 올리고펩티드의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제39항에 따른 올리고펩티드의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제40항에 따른 올리고펩티드의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제41항에 따른 올리고펩티드의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제42항에 따른 올리고펩티드의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제43항에 따른 올리고펩티드의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제44항에 따른 올리고펩티드의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제37항에 따른 올리고펩티드의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제38항에 따른 올리고펩티드의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제39항에 따른 올리고펩티드의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제40항에 따른 올리고펩티드의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제41항에 따른 올리고펩티드의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제42항에 따른 올리고펩티드의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제43항에 따른 올리고펩티드의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제44항에 따른 올리고펩티드의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제37항에 따른 올리고펩티드의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제38항에 따른 올리고펩티드의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제39항에 따른 올리고펩티드의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제40항에 따른 올리고펩티드의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제41항에 따른 올리고펩티드의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제42항에 따른 올리고펩티드의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제43항에 따른 올리고펩티드의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제44항에 따른 올리고펩티드의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제47항에 따른 TAHO 결합 유기 분자의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제48항에 따른 TAHO 결합 유기 분자의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제49항에 따른 TAHO 결합 유기 분자의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제50항에 따른 TAHO 결합 유기 분자의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제51항에 따른 TAHO 결합 유기 분자의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제52항에 따른 TAHO 결합 유기 분자의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제53항에 따른 TAHO 결합 유기 분자의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제54항에 따른 TAHO 결합 유기 분자의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제47항에 따른 TAHO 결합 유기 분자의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제48항에 따른 TAHO 결합 유기 분자의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제49항에 따른 TAHO 결합 유기 분자의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제50항에 따른 TAHO 결합 유기 분자의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제51항에 따른 TAHO 결합 유기 분자의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제52항에 따른 TAHO 결합 유기 분자의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제53항에 따른 TAHO 결합 유기 분자의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제54항에 따른 TAHO 결합 유기 분자의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제47항에 따른 TAHO 결합 유기 분자의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제48항에 따른 TAHO 결합 유기 분자의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제49항에 따른 TAHO 결합 유기 분자의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제50항에 따른 TAHO 결합 유기 분자의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제51항에 따른 TAHO 결합 유기 분자의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제52항에 따른 TAHO 결합 유기 분자의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제53항에 따른 TAHO 결합 유기 분자의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제54항에 따른 TAHO 결합 유기 분자의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제56항에 따른 물질의 조성물의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제56항에 따른 물질의 조성물의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제56항에 따른 물질의 조성물의 용도.
- 암의 치료 목적의 처치 또는 진단 목적의 검출을 위한 의약의 제조에 있어서 제58항에 따른 제품의 용도.
- 종양 치료를 위한 의약의 제조에 있어서 제58항에 따른 제품의 용도.
- 세포 증식성 질환의 치료 또는 예방을 위한 의약의 제조에 있어서 제58항에 따른 제품의 용도.
- 서열 11의 핵산 서열에 의해 코딩되는 중쇄 및 서열 9의 핵산 서열에 의해 코딩되는 경쇄를 포함하는 단리된 항체.
- 서열 34의 핵산 서열에 의해 코딩되는 중쇄 및 서열 32의 핵산 서열에 의해 코딩되는 경쇄를 포함하는 단리된 항체.
- 서열 42의 핵산 서열에 의해 코딩되는 중쇄 및 서열 40의 핵산 서열에 의해 코딩되는 경쇄를 포함하는 단리된 항체.
- 표 24에 제시된 임의의 ATCC 기탁 번호 하에 기탁된 단리된 항체.
- 서열 16 및 서열 17의 아미노산 서열로 이루어지는 군 중에서 선택되는 아미노산 서열에 결합하는 단리된 항체.
- 서열 98로부터 선택되는 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 중쇄 가변 도메인을 포함하는, CD79b에 결합하는 항체.
- 서열 97로부터 선택되는 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 경쇄 가변 도메인을 포함하는, CD79b에 결합하는 항체.
- 서열 98로부터 선택되는 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 중쇄 가변 도메인, 및 서열 97로부터 선택되는 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 경쇄 가변 도메인을 포함하는, CD79b에 결합하는 항체.
- 서열 100으로부터 선택되는 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 중쇄 가변 도메인을 포함하는, CD79b에 결합하는 항체.
- 서열 99로부터 선택되는 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 경쇄 가변 도메인을 포함하는, CD79b에 결합하는 항체.
- 서열 100으로부터 선택되는 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 중쇄 가변 도메인, 및 서열 99로부터 선택되는 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 경쇄 서열을 포함하는, CD79b에 결합하는 항체.
- 서열 102로부터 선택되는 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 중쇄 가변 도메인을 포함하는, CD79b에 결합하는 항체.
- 서열 101로부터 선택되는 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 경쇄 가변 도메인을 포함하는, CD79b에 결합하는 항체.
- 서열 102로부터 선택되는 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 중쇄 가변 도메인, 및 서열 101 중에서 선택되는 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 경쇄 서열을 포함하는, CD79b에 결합하는 항체.
- 제15항, 제16항, 제334항 내지 제338항 및 제339항 내지 제347항 중 어느 한 항에 있어서, 하나 이상의 유리 시스테인 아미노산을 포함하는 시스테인 조작된 항체이고, 상기 시스테인 조작된 항체가 모 항체의 하나 이상의 아미노산 잔기를 유리 시스테인 아미노산으로 교체하는 것을 포함하는 방법에 의해 제조되는 것인 항체.
- 제348항에 있어서, 하나 이상의 유리 시스테인 아미노산의 티올 반응성 값이 0.6 내지 1.0인 항체.
- 제348항에 있어서, 모 항체보다 티올-반응성 시약과 더 반응성인 시스테인 조작된 항체.
- 제348항에 있어서, 방법이 시스테인 조작된 항체를 티올-반응성 시약과 반응시킴으로써 시스테인 조작된 항체의 티올 반응성을 결정하는 것을 더 포함하고;
여기서 시스테인 조작된 항체가 모 항체보다 티올-반응성 시약과 더 반응성인 것인 시스테인 조작된 항체. - 제348항에 있어서, 하나 이상의 유리 시스테인 아미노산 잔기가 경쇄 내에 위치하는 것인 시스테인 조작된 항체.
- 제348항에 있어서, 세포독성제에 공유 결합에 의해 부착된 시스테인 조작된 항체를 포함하는 면역접합체인 시스테인 조작된 항체.
- 제353항에 있어서, 세포독성제가 독소, 화학요법제, 약물 모이어티, 항생제, 방사성 동위원소 및 뉴클레오티드 분해 효소 중에서 선택되는 것인 시스테인 조작된 항체.
- 제348항에 있어서, 포획 표지, 검출 표지 또는 고체 지지체에 공유 결합에 의해 부착된 시스테인 조작된 항체.
- 제355항에 있어서, 비오틴 포획 표지에 공유 결합에 의해 부착된 시스테인 조작된 항체.
- 제355항에 있어서, 형광 염료 검출 표지에 공유 결합에 의해 부착된 시스테인 조작된 항체.
- 제357항에 있어서, 형광 염료가 플루오레세인 종류, 로다민 종류, 단실, 리싸민 (Lissamine), 시아닌, 피코에리트린, 텍사스 레드 (Texas Red), 및 그의 유사체 중에서 선택되는 것인 시스테인 조작된 항체.
- 제355항에 있어서, 3H, 11C, 14C, 18F, 32P, 35S, 64Cu, 68Ga, 86Y, 99Tc, 111In, 123I, 124I, 125I, 131I, 133Xe, 177Lu, 211At 및 213Bi 중에서 선택되는 방사성 핵종 검출 표지에 공유 결합에 의해 부착된 시스테인 조작된 항체.
- 제355항에 있어서, 킬레이팅 리간드에 의해 검출 표지에 공유 결합에 의해 부착된 시스테인 조작된 항체.
- 제360항에 있어서, 킬레이팅 리간드가 DOTA, DOTP, DOTMA, DTPA 및 TETA 중에서 선택되는 것인 시스테인 조작된 항체.
- 제15항, 제16항, 제334항 내지 제338항 및 제339항 내지 제347항 중 어느 한 항에 있어서, 알부민 결합 펩티드를 포함하는 항체.
- 제361항에 있어서, 알부민 결합 펩티드가 서열 246-250 중에서 선택되는 것인 항체.
- 제15항, 제16항, 제334항 내지 제338항 및 제339항 내지 제347항 중 어느 한 항에 있어서, 카바트 넘버링 방식에 따른 경쇄의 15, 43, 110, 144, 168 및 205, 및 EU 넘버링 방식에 따른 중쇄의 41, 88, 115, 118, 120, 171, 172, 282 375, 및 400 중에서 선택되는 하나 이상의 위치에 유리 시스테인 아미노산을 더 포함하는 항체.
- 제364항에 있어서, 시스테인이 경쇄의 위치 205에 존재하는 것인 항체.
- 제364항에 있어서, 시스테인이 중쇄의 위치 118에 존재하는 것인 항체.
- 제364항에 있어서, 시스테인이 중쇄의 위치 400에 존재하는 것인 항체.
- 제364항에 있어서, 모노클로날 항체, 이중특이적 항체, 키메라 항체, 인간 항체 및 인간화 항체 중에서 선택되는 항체.
- 제364항에 있어서, 항체 단편인 항체.
- 제369항에 있어서, 항체 단편이 Fab 단편인 항체.
- 제364항에 있어서, 키메라 항체, 인간 항체, 및 인간화 항체 중에서 선택되는 항체.
- 제364항에 있어서, 세균에서 생산되는 항체.
- 제364항에 있어서, CHO 세포에서 생산되는 항체.
- CD79b 단백질을 함유하는 것으로 의심되는 샘플을 제364항에 따른 항체에 노출시키고, 상기 샘플 내의 상기 CD79b 단백질에 대한 상기 항체의 결합을 결정하는 것을 포함하고, 상기 단백질에 대한 항체의 결합이 상기 샘플 내에 상기 단백질이 존재함을 표시하는 것인, 상기 단백질을 함유하는 것으로 의심되는 샘플 내에서 CD79b 단백질의 존재를 결정하는 방법.
- 제374항에 있어서, 상기 샘플이 상기 CD79b 단백질을 발현하는 것으로 의심되는 세포를 포함하는 것인 방법.
- 제374항에 있어서, 상기 세포가 B 세포인 방법.
- 제374항에 있어서, 항체가 형광 염료, 방사성 동위원소, 비오틴, 및 금속 착물 형성 리간드 중에서 선택되는 표지에 공유 결합에 의해 부착되는 것인 방법.
- 제364항에 따른 항-CD79b 항체, 및 제약상 허용되는 희석제, 담체 또는 부형제를 포함하는 제약 제제.
- 제364항에 있어서, 오리스타틴 또는 메이탄시노이드 약물 모이어티에 공유 결합에 의해 부착되어 항체 약물 접합체가 형성하는 항체.
- 제380항에 있어서, p가 2인 항체-약물 접합체 화합물.
- 제382항에 있어서, 하기 화학식으로 표시되는 항체-약물 접합체 화합물.
상기 식에서, PAB는 파라-아미노벤질카르바모일이고, R17은 (CH2)r, C3-C8 카르보시클릴, O-(CH2)r, 아릴렌, (CH2)r-아릴렌, -아릴렌-(CH2)r-, (CH2)r-(C3-C8 카르보시클릴), (C3-C8 카르보시클릴)-(CH2)r, C3-C8 헤테로시클릴, (CH2)r-(C3-C8 헤테로시클릴), -(C3-C8 헤테로시클릴)-(CH2)r-, -(CH2)rC(O)NRb(CH2)r-, -(CH2CH2O)r-, -(CH2CH2O)r-CH2-, -(CH2)rC(O)NRb(CH2CH2O)r-, -(CH2)rC(O)NRb(CH2CH2O)r-CH2-, -(CH2CH2O)rC(O)NRb(CH2CH2O)r-, -(CH2CH2O)rC(O)NRb(CH2CH2O)r-CH2-, 및 -(CH2CH2O)rC(O)NRb(CH2)r-로부터 선택되는 2가 라디칼이고; 여기서 Rb는 H, C1-C6 알킬, 페닐 또는 벤질이고; r은 독립적으로 1-10의 정수이다. - 제382항에 있어서, Ww가 발린-시트룰린인 항체-약물 접합체 화합물.
- 제382항에 있어서, R17이 (CH2)5 또는 (CH2)2인 항체-약물 접합체 화합물.
- 제386항에 있어서, R17이 (CH2)5 또는 (CH2)2인 항체-약물 접합체 화합물.
- 제380항에 있어서, L이 SMCC, SPP 또는 BMPEO인 항체-약물 접합체 화합물.
- 제379항에 있어서, 항체가 모노클로날 항체, 이중특이적 항체, 키메라 항체, 인간 항체, 인간화 항체 및 항체 단편 중에서 선택되는 것인 항체-약물 접합체 화합물.
- 제379항에 있어서, 항체 단편이 Fab 단편인 항체-약물 접합체 화합물.
- 제379항에 있어서, 오리스타틴이 MMAE 또는 MMAF인 항체 약물 접합체.
- 제380항에 있어서, L이 MC-val-cit-PAB 또는 MC인 항체 약물 접합체.
- (a) 세포를 제379항에 따른 항체-약물 접합체 화합물에 노출시키고;
(b) 세포에 대한 항체-약물 접합체 화합물의 결합 정도를 결정하는 것
을 포함하는, B 세포를 검출하기 위한 분석 방법. - 세포 배양 배지 내의 포유동물 암성 B 세포를 제379항에 따른 항체-약물 접합체 화합물로 처리하여, 암성 B 세포의 증식을 억제하는 것을 포함하는, 세포 증식을 억제하는 방법.
- 제379항에 따른 항체 약물 접합체, 및 제약상 허용되는 희석제, 담체 또는 부형제를 포함하는 제약 제제.
- 환자에게 제400항에 따른 제약 제제를 투여하는 것을 포함하는, 암의 치료 방법.
- 제401항에 있어서, 암이 림프종, 비-호지킨 림프종 (NHL), 공격성 NHL, 재발성 공격성 NHL, 재발성 무통성 NHL, 불응성 NHL, 불응성 무통성 NHL, 만성 림프구성 백혈병 (CLL), 소림프구성 림프종, 백혈병, 유모세포 백혈병 (HCL), 급성 림프구성 백혈병 (ALL) 및 외투 세포 림프종으로 이루어진 군 중에서 선택되는 것인 방법.
- 제401항에 있어서, 환자에게 세포독성제를 항체-약물 접합체 화합물과 함께 투여하는 방법.
- 제400항에 따른 제약 제제;
용기; 및
화합물이 CD79b 폴리펩티드의 과다발현을 특징으로 하는 암을 치료하기 위해 사용될 수 있음을 나타내는 포장 삽입물 또는 라벨
을 포함하는 제품. - 제404항에 있어서, 암이 림프종, 비-호지킨 림프종 (NHL), 공격성 NHL, 재발성 공격성 NHL, 재발성 무통성 NHL, 불응성 NHL, 불응성 무통성 NHL, 만성 림프구성 백혈병 (CLL), 소림프구성 림프종, 백혈병, 유모세포 백혈병 (HCL), 급성 림프구성 백혈병 (ALL) 및 외투 세포 림프종으로 이루어진 군 중에서 선택되는 것인 제품.
- (a) 제364항에 따른 항-CD79b 항체 (Ab)의 조작된 시스테인기를 링커 시약과 반응시켜 항체-링커 중간체 Ab-L을 형성하는 단계, 및
(b) Ab-L을 활성화된 약물 모이어티 D와 반응시켜, 항체-약물 접합체를 형성시키는 단계
를 포함하거나, 또는
(c) 약물 모이어티의 친핵성 기를 링커 시약과 반응시켜 약물-링커 중간체 D-L을 형성하는 단계, 및
(d) D-L을 항체의 조작된 시스테인기와 반응시켜, 항체-약물 접합체를 형성시키는 단계
를 포함하는, 제364항에 따른 항-CD79b 항체 (Ab), 및 오리스타틴 또는 메이탄시노이드 약물 모이어티 (D)를 포함하고 항체는 링커 모이어티 (L)에 의해 1개 이상의 조작된 시스테인 아미노산을 통해 D에 부착된 것인 하기 화학식 I의 항체 약물 접합체 화합물의 제조 방법.
<화학식 I>
여기서, p는 1, 2, 3 또는 4이다. - 제406항에 있어서, 차이니즈 햄스터 난소 (CHO) 세포 내에서 항체를 발현시키는 단계를 더 포함하는 방법.
- 제407항에 있어서, 발현된 항체를 환원제로 처리하는 단계를 더 포함하는 방법.
- 제408항에 있어서, 환원제가 TCEP 및 DTT 중에서 선택되는 것인 방법.
- 제409항에 있어서, 발현된 항체를 환원제로 처리한 후 산화제로 처리하는 단계를 더 포함하는 방법.
- 제410항에 있어서, 산화제가 황산구리, 데히드로아스코르브산 및 공기 중에서 선택되는 것인 방법.
- 제364항에 있어서, 서열 12 또는 59 중 어느 하나로부터 선택된 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 중쇄 서열을 포함하는 항체.
- 제364항에 있어서, 서열 10 또는 58 중 어느 하나로부터 선택된 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 경쇄 서열을 포함하는 항체.
- 제364항에 있어서, 서열 10의 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 경쇄 서열, 및 서열 59의 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 중쇄 서열을 포함하는 항체.
- 제364항에 있어서, 서열 58의 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 경쇄 서열, 및 서열 12의 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 중쇄 서열을 포함하는 항체.
- 제364항에 있어서, 서열 43 또는 61 중 어느 하나로부터 선택된 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 중쇄 서열을 포함하는 항체.
- 제364항에 있어서, 서열 41 또는 96 중 어느 하나로부터 선택된 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 경쇄 서열을 포함하는 항체.
- 제364항에 있어서, 서열 41의 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 경쇄 서열, 및 서열 61의 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 중쇄 서열을 포함하는 항체.
- 제364항에 있어서, 서열 96의 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 경쇄 서열, 및 서열 43의 아미노산 서열에 적어도 90%의 서열 동일성을 갖는 중쇄 서열을 포함하는 항체.
- 제15항, 제16항, 제334항 내지 제338항 및 제339항 내지 제347항 중 어느 한 항에 있어서,
(a) 서열 4의 아미노산 29-39를 포함하는 아미노산 서열;
(b) 서열 8의 아미노산 30-40을 포함하는 아미노산 서열; 또는
(c) 서열 13의 아미노산 29-39를 포함하는 아미노산 서열
을 포함하는 군 중에서 선택되는 CD79b의 영역 내의 에피토프에 결합하는 항체. - 제420항에 있어서, 서열 4의 아미노산 29-39로부터의 CD79b의 영역 내의 에피토프에 결합하고, 여기서 위치 30, 34 및 36의 아미노산이 Arg인 항체.
- 제420항에 있어서, 서열 8의 아미노산 30-40으로부터의 CD79b의 영역 내의 에피토프에 결합하고, 여기서 위치 35의 아미노산이 Leu인 항체.
- 제15항, 제16항, 제334항 내지 제338항 및 제339항 내지 제347항 중 어느 한 항에 있어서, CD79b의 영역 내의 에피토프에 결합하고, 여기서 상기 에피토프가
(a) 서열 4의 아미노산 29-39를 포함하는 아미노산 서열;
(b) 서열 8의 아미노산 30-40을 포함하는 아미노산 서열; 또는
(c) 서열 13의 아미노산 29-39를 포함하는 아미노산 서열
에 적어도 80%의 아미노산 서열 동일성을 갖는 것인 항체. - 제423항에 있어서, 서열 4의 아미노산 29-39로부터의 CD79b의 영역 내의 에피토프에 결합하고, 여기서 위치 30, 34 및 36의 아미노산이 Arg인 항체.
- 제423항에 있어서, 서열 8의 아미노산 30-40으로부터의 CD79b의 영역 내의 에피토프에 결합하고, 여기서 위치 35의 아미노산이 Leu인 항체.
- 제15항, 제16항, 제334항 내지 제338항 및 제339항 내지 제347항 중 어느 한 항에 따른 항체 및/또는 제15항, 제16항, 제334항 내지 제338항 및 제339항 내지 제347항 중 어느 한 항에 따른 항체의 중쇄 또는 경쇄를 포함하는 항체와 경쟁하는 항체.
- 제15항, 제16항, 제334항 내지 제338항 및 제339항 내지 제347항 중 어느 한 항에 따른 항-인간 CD79b 항체 또는 항-인간 CD79b 항체를 포함하는 ADC의 투여를 포함하는 암성 종양이 있는 포유동물을 치료 목적으로 처치하는 방법의 안전성을 시험하기 위해, 제15항, 제16항, 제334항 내지 제338항 및 제339항 내지 제347항 중 어느 한 항에 따른 항-cyno CD79b 항체 또는 항-cyno CD79b 항체를 포함하는 ADC를 사용하는 방법.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US12/023,811 US20090068178A1 (en) | 2002-05-08 | 2008-01-31 | Compositions and Methods for the Treatment of Tumor of Hematopoietic Origin |
| US12/023,811 | 2008-01-31 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20100128286A true KR20100128286A (ko) | 2010-12-07 |
Family
ID=40578249
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020107019272A KR20100128286A (ko) | 2008-01-31 | 2009-01-13 | 조혈계 기원의 종양 치료용 조성물 및 방법 |
Country Status (16)
| Country | Link |
|---|---|
| US (4) | US20090068178A1 (ko) |
| EP (1) | EP2247312A2 (ko) |
| JP (1) | JP2011515069A (ko) |
| KR (1) | KR20100128286A (ko) |
| CN (1) | CN102014964A (ko) |
| AR (1) | AR071829A1 (ko) |
| AU (1) | AU2009210627A1 (ko) |
| BR (1) | BRPI0908854A2 (ko) |
| CA (1) | CA2712518A1 (ko) |
| CL (1) | CL2009000082A1 (ko) |
| IL (1) | IL206970A0 (ko) |
| MX (1) | MX2010008199A (ko) |
| NZ (1) | NZ587652A (ko) |
| PE (1) | PE20091404A1 (ko) |
| RU (1) | RU2010136303A (ko) |
| WO (1) | WO2009099719A2 (ko) |
Families Citing this family (56)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8709412B2 (en) | 2001-06-29 | 2014-04-29 | The Board Of Trustees Of The Leland Stanford Junior University | Modulation of TIM receptor activity in combination with cytoreductive therapy |
| US20110045005A1 (en) | 2001-10-19 | 2011-02-24 | Craig Crowley | Compositions and methods for the treatment of tumor of hematopoietic origin |
| US20090068178A1 (en) * | 2002-05-08 | 2009-03-12 | Genentech, Inc. | Compositions and Methods for the Treatment of Tumor of Hematopoietic Origin |
| BR122018071808B8 (pt) | 2003-11-06 | 2020-06-30 | Seattle Genetics Inc | conjugado |
| US20110166319A1 (en) * | 2005-02-11 | 2011-07-07 | Immunogen, Inc. | Process for preparing purified drug conjugates |
| SI1928503T1 (sl) | 2005-08-24 | 2012-11-30 | Immunogen Inc | Postopek za pripravo konjugatov majtansinoid protitelo |
| AU2008276128B2 (en) | 2007-07-16 | 2013-10-10 | Genentech, Inc. | Humanized anti-CD79b antibodies and immunoconjugates and methods of use |
| ES2579323T3 (es) | 2007-07-16 | 2016-08-09 | Genentech, Inc. | Anticuerpos anti-CD79B e inmunoconjugados y métodos de uso |
| CL2009000062A1 (es) | 2008-01-31 | 2010-05-14 | Genentech Inc | Anticuerpo humanizado anti cd79b; con modificaciones de cisterna libre; inmunoconjugado que contiene dicho anticuerpo y una droga; polinucleotido que codifica el anticuerpo; vector, celula huesped; composicion farmaceutica y uso de dicha composicion para tratar cancer, preferentemente linfomas. |
| CN104984360A (zh) | 2009-06-03 | 2015-10-21 | 伊缪诺金公司 | 轭合方法 |
| US9545452B2 (en) | 2010-02-08 | 2017-01-17 | Board Of Regents Of The University Of Nebraska | Biomineral and metal binding liposomes, their synthesis, and methods of use thereof |
| TW201129383A (en) * | 2010-02-10 | 2011-09-01 | Immunogen Inc | CD20 antibodies and uses thereof |
| ES2581314T3 (es) * | 2010-03-02 | 2016-09-05 | Seattle Genetics, Inc. | Métodos de cribado de anticuerpos |
| EP2629801B3 (en) * | 2010-10-22 | 2019-11-27 | Seattle Genetics, Inc. | Synergistic effects between auristatin-based antibody drug conjugates and inhibitors of the pi3k-akt mtor pathway |
| KR102272828B1 (ko) | 2011-03-29 | 2021-07-05 | 이뮤노젠 아이엔씨 | 일-단계 방법에 의한 메이탄시노이드 항체 접합체의 제조 |
| SI2694111T1 (sl) * | 2011-04-01 | 2016-10-28 | Wyeth Llc | Konjugati protitelo-zdravilo |
| CN104640572B (zh) | 2012-05-15 | 2018-04-27 | 索伦托医疗有限公司 | 药物偶联物,偶联方法,及其用途 |
| WO2014022592A1 (en) * | 2012-08-02 | 2014-02-06 | Jn Biosciences Llc | Antibodies or fusion proteins multimerized via cysteine mutation and a mu tailpiece |
| AU2013326881B2 (en) | 2012-10-04 | 2018-08-02 | Immunogen, Inc. | Use of a PVDF membrane to purify cell-binding agent cytotoxic agent conjugates |
| SG11201502430QA (en) * | 2012-10-04 | 2015-04-29 | Immunogen Inc | Use of an ion exchange membrane to remove impurities from cell-binding agent cytotoxic agent conjugates |
| US10260089B2 (en) | 2012-10-29 | 2019-04-16 | The Research Foundation Of The State University Of New York | Compositions and methods for recognition of RNA using triple helical peptide nucleic acids |
| RU2015125343A (ru) * | 2012-11-29 | 2017-01-11 | БАЙЕР ХелсКер ЛЛСи | Гуманизированные моноклональные антитела против активированного белка с и их применение |
| SG10201705150RA (en) | 2012-12-21 | 2017-07-28 | Bioalliance Cv | Hydrophilic self-immolative linkers and conjugates thereof |
| CN115925957A (zh) | 2013-02-08 | 2023-04-07 | Irm责任有限公司 | 用于修饰抗体以制备免疫缀合物的特定位点 |
| CN105188766B (zh) | 2013-03-15 | 2019-07-12 | 瑞泽恩制药公司 | 生物活性分子、其偶联物及治疗用途 |
| SI2968588T1 (sl) * | 2013-03-15 | 2019-05-31 | AbbVie Deutschland GmbH & Co. KG | Formulacije konjugatov protitelo proti-EGFR zdravilo |
| JP6510518B2 (ja) | 2013-08-01 | 2019-05-08 | アジェンシス,インコーポレイテッド | Cd37タンパク質に結合する抗体薬物結合体(adc) |
| BR112016002829A2 (pt) | 2013-08-12 | 2017-09-19 | Genentech Inc | Composto e processo para preparar o composto de conjugado anticorpo-¿droga, composição farmacêutica, método de tratamento do câncer, kit para o tratamento do câncer, intermediário ligante¿-droga, porção e composto de porção droga de dímero cbi |
| BR112016004023A2 (pt) * | 2013-08-26 | 2022-11-16 | Regeneron Pharma | Composição, métodos para preparar uma composição e para tratar uma doença, e, composto |
| EA201690780A1 (ru) | 2013-10-15 | 2016-08-31 | Сиэтл Дженетикс, Инк. | Пегилированные лекарственные средства-линкеры для улучшенной фармакокинетики конъюгатов лиганд-лекарственное средство |
| WO2015057876A1 (en) | 2013-10-15 | 2015-04-23 | Sorrento Therapeutics Inc. | Drug-conjugates with a targeting molecule and two different drugs |
| KR20160092024A (ko) | 2013-12-16 | 2016-08-03 | 제넨테크, 인크. | 1-(클로로메틸)-2,3-디히드로-1H-벤조[e]인돌 이량체 항체-약물 접합체 화합물, 및 사용 및 치료 방법 |
| MX2016007865A (es) | 2013-12-17 | 2017-01-11 | Novartis Ag | Peptidos citotoxicos y conjugados de los mismos. |
| EP3154997B9 (en) | 2014-06-13 | 2021-04-14 | Novartis AG | Auristatin derivatives and conjugates thereof |
| MX2016016490A (es) | 2014-06-20 | 2017-07-28 | Bioalliance Cv | Conjugados de farmaco-anticuerpo anti-receptor de folato alfa (fra) y metodos de uso de los mismos. |
| AU2015300080B2 (en) | 2014-08-06 | 2021-04-01 | Mach5 Therapeutics, Inc. | New anti-human Igbeta antibody |
| MA42561A (fr) * | 2014-09-02 | 2018-04-25 | Immunogen Inc | Procédés de formulation de compositions de conjugués anticorps-médicament |
| EP3689910A3 (en) | 2014-09-23 | 2020-12-02 | F. Hoffmann-La Roche AG | Method of using anti-cd79b immunoconjugates |
| AR102918A1 (es) * | 2014-12-05 | 2017-04-05 | Genentech Inc | Anticuerpos anti-cd79b y métodos de uso |
| ES2918425T3 (es) | 2015-01-28 | 2022-07-15 | Sorrento Therapeutics Inc | Conjugados de anticuerpo-fármaco |
| CN106153935B (zh) * | 2015-03-26 | 2018-05-08 | 广州瑞博奥生物科技有限公司 | 一种定量检测CD79α的酶联免疫试剂盒 |
| MA44334A (fr) | 2015-10-29 | 2018-09-05 | Novartis Ag | Conjugués d'anticorps comprenant un agoniste du récepteur de type toll |
| WO2017087391A1 (en) | 2015-11-17 | 2017-05-26 | Bayer Healthcare, Llc | Epitope of optimized humanized monoclonal antibodies against activated protein c and uses thereof |
| US11793880B2 (en) | 2015-12-04 | 2023-10-24 | Seagen Inc. | Conjugates of quaternized tubulysin compounds |
| AU2016363013B2 (en) | 2015-12-04 | 2022-03-10 | Seagen Inc. | Conjugates of quaternized tubulysin compounds |
| CN108713026B (zh) | 2016-01-08 | 2023-01-06 | 美国全心医药生技股份有限公司 | 四价抗psgl-1抗体及其用途 |
| MA43094B1 (fr) | 2016-01-25 | 2020-10-28 | Regeneron Pharma | Dérivés de maytansinoïde, leurs conjugués, et procédés d'utilisation |
| EA201892040A1 (ru) | 2016-03-25 | 2019-04-30 | Сиэтл Дженетикс, Инк. | Способ получения пегилированных соединений лекарственный препарат - линкер и их промежуточных соединений |
| JP7337698B2 (ja) | 2017-02-28 | 2023-09-04 | シージェン インコーポレイテッド | コンジュゲート化のためのシステイン突然変異抗体 |
| CA3056134A1 (en) | 2017-03-24 | 2018-09-27 | Seattle Genetics, Inc. | Process for the preparation of glucuronide drug-linkers and intermediates thereof |
| CN109893538B (zh) * | 2017-12-07 | 2021-05-07 | 苏州凯祥生物科技有限公司 | 聚炔类在降尿酸中的新用途 |
| BR112021014420A2 (pt) | 2019-01-28 | 2021-09-21 | Tuojie Biotech (Shanghai) Co., Ltd. | Anticorpo anti-cd79b, fragmento de ligação ao antígeno do mesmo e uso farmacêutico do mesmo |
| CN111675762B (zh) * | 2019-03-11 | 2023-12-01 | 凯惠科技发展(上海)有限公司 | 一种含半胱氨酸的抗体、药物偶联物及其应用 |
| AU2021317378A1 (en) | 2020-07-27 | 2023-03-09 | Tuojie Biotech (Shanghai) Co., Ltd. | Anti-CD79B antibody-drug conjugate, and preparation method therefor and pharmaceutical use thereof |
| WO2023287925A2 (en) * | 2021-07-15 | 2023-01-19 | Nx Prenatal Inc. | Longitudinal predictive model for predicting adverse gestational outcomes |
| WO2024129756A1 (en) * | 2022-12-13 | 2024-06-20 | Seagen Inc. | Site-specific engineered cysteine antibody drug conjugates |
Family Cites Families (49)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4137230A (en) * | 1977-11-14 | 1979-01-30 | Takeda Chemical Industries, Ltd. | Method for the production of maytansinoids |
| US4265814A (en) * | 1978-03-24 | 1981-05-05 | Takeda Chemical Industries | Matansinol 3-n-hexadecanoate |
| US4307016A (en) * | 1978-03-24 | 1981-12-22 | Takeda Chemical Industries, Ltd. | Demethyl maytansinoids |
| JPS5562090A (en) * | 1978-10-27 | 1980-05-10 | Takeda Chem Ind Ltd | Novel maytansinoid compound and its preparation |
| US4256746A (en) * | 1978-11-14 | 1981-03-17 | Takeda Chemical Industries | Dechloromaytansinoids, their pharmaceutical compositions and method of use |
| JPS55164687A (en) * | 1979-06-11 | 1980-12-22 | Takeda Chem Ind Ltd | Novel maytansinoid compound and its preparation |
| JPS5566585A (en) * | 1978-11-14 | 1980-05-20 | Takeda Chem Ind Ltd | Novel maytansinoid compound and its preparation |
| JPS55102583A (en) * | 1979-01-31 | 1980-08-05 | Takeda Chem Ind Ltd | 20-acyloxy-20-demethylmaytansinoid compound |
| JPS55162791A (en) * | 1979-06-05 | 1980-12-18 | Takeda Chem Ind Ltd | Antibiotic c-15003pnd and its preparation |
| JPS55164685A (en) * | 1979-06-08 | 1980-12-22 | Takeda Chem Ind Ltd | Novel maytansinoid compound and its preparation |
| JPS55164686A (en) * | 1979-06-11 | 1980-12-22 | Takeda Chem Ind Ltd | Novel maytansinoid compound and its preparation |
| US4309428A (en) * | 1979-07-30 | 1982-01-05 | Takeda Chemical Industries, Ltd. | Maytansinoids |
| JPS5645483A (en) * | 1979-09-19 | 1981-04-25 | Takeda Chem Ind Ltd | C-15003phm and its preparation |
| JPS5645485A (en) * | 1979-09-21 | 1981-04-25 | Takeda Chem Ind Ltd | Production of c-15003pnd |
| EP0028683A1 (en) * | 1979-09-21 | 1981-05-20 | Takeda Chemical Industries, Ltd. | Antibiotic C-15003 PHO and production thereof |
| WO1982001188A1 (en) * | 1980-10-08 | 1982-04-15 | Takeda Chemical Industries Ltd | 4,5-deoxymaytansinoide compounds and process for preparing same |
| US4450254A (en) * | 1980-11-03 | 1984-05-22 | Standard Oil Company | Impact improvement of high nitrile resins |
| US4313946A (en) * | 1981-01-27 | 1982-02-02 | The United States Of America As Represented By The Secretary Of Agriculture | Chemotherapeutically active maytansinoids from Trewia nudiflora |
| US4315929A (en) * | 1981-01-27 | 1982-02-16 | The United States Of America As Represented By The Secretary Of Agriculture | Method of controlling the European corn borer with trewiasine |
| JPS57192389A (en) * | 1981-05-20 | 1982-11-26 | Takeda Chem Ind Ltd | Novel maytansinoid |
| US4816567A (en) * | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US5618920A (en) * | 1985-11-01 | 1997-04-08 | Xoma Corporation | Modular assembly of antibody genes, antibodies prepared thereby and use |
| US4975278A (en) * | 1988-02-26 | 1990-12-04 | Bristol-Myers Company | Antibody-enzyme conjugates in combination with prodrugs for the delivery of cytotoxic agents to tumor cells |
| US5208020A (en) * | 1989-10-25 | 1993-05-04 | Immunogen Inc. | Cytotoxic agents comprising maytansinoids and their therapeutic use |
| US6150584A (en) * | 1990-01-12 | 2000-11-21 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| US6075181A (en) * | 1990-01-12 | 2000-06-13 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| US5644033A (en) * | 1992-12-22 | 1997-07-01 | Health Research, Inc. | Monoclonal antibodies that define a unique antigen of human B cell antigen receptor complex and methods of using same for diagnosis and treatment |
| JPH0719832A (ja) * | 1993-06-21 | 1995-01-20 | Canon Inc | 複数画像の対応点抽出方法 |
| AU689131B2 (en) * | 1993-10-01 | 1998-03-26 | Teikoku Hormone Mfg. Co., Ltd. | Novel peptide derivative |
| US6172213B1 (en) * | 1997-07-02 | 2001-01-09 | Genentech, Inc. | Anti-IgE antibodies and method of improving polypeptides |
| US6248564B1 (en) * | 1997-08-29 | 2001-06-19 | Harvard University | Mutant MHC class I molecules |
| US20040001827A1 (en) * | 2002-06-28 | 2004-01-01 | Dennis Mark S. | Serum albumin binding peptides for tumor targeting |
| PT1240337E (pt) * | 1999-12-24 | 2007-01-31 | Genentech Inc | Métodos e composições para prolongar as meias-vidas de eliminação de compostos bioactivos |
| US20020150573A1 (en) * | 2000-11-10 | 2002-10-17 | The Rockefeller University | Anti-Igalpha-Igbeta antibody for lymphoma therapy |
| US20040018194A1 (en) * | 2000-11-28 | 2004-01-29 | Francisco Joseph A. | Recombinant anti-CD30 antibodies and uses thereof |
| US20110045005A1 (en) * | 2001-10-19 | 2011-02-24 | Craig Crowley | Compositions and methods for the treatment of tumor of hematopoietic origin |
| US20050238650A1 (en) * | 2002-04-17 | 2005-10-27 | Genentech, Inc. | Compositions and methods for the treatment of tumor of hematopoietic origin |
| US20070207142A1 (en) * | 2002-05-08 | 2007-09-06 | Genentech, Inc. | Compositions and methods for the treatment of tumor of hematopoietic origin |
| US20090068178A1 (en) * | 2002-05-08 | 2009-03-12 | Genentech, Inc. | Compositions and Methods for the Treatment of Tumor of Hematopoietic Origin |
| US20110042260A1 (en) * | 2003-04-10 | 2011-02-24 | Craig Crowley | Compositions and methods for the treatment of tumor of hematopoietic origin |
| US8088387B2 (en) * | 2003-10-10 | 2012-01-03 | Immunogen Inc. | Method of targeting specific cell populations using cell-binding agent maytansinoid conjugates linked via a non-cleavable linker, said conjugates, and methods of making said conjugates |
| BR122018071808B8 (pt) * | 2003-11-06 | 2020-06-30 | Seattle Genetics Inc | conjugado |
| EP1689432B1 (en) * | 2003-11-17 | 2009-12-30 | Genentech, Inc. | Compositions and methods for the treatment of tumor of hematopoietic origin |
| JP5064037B2 (ja) * | 2004-02-23 | 2012-10-31 | ジェネンテック, インコーポレイテッド | 複素環式自壊的リンカーおよび結合体 |
| BRPI0510883B8 (pt) * | 2004-06-01 | 2021-05-25 | Genentech Inc | composto conjugado de droga e anticorpo, composição farmacêutica, método de fabricação de composto conjugado de droga e anticorpo e usos de uma formulação, de um conjugado de droga e anticorpo e um agente quimioterapêutico e de uma combinação |
| CA2580141C (en) * | 2004-09-23 | 2013-12-10 | Genentech, Inc. | Cysteine engineered antibodies and conjugates |
| AU2008276128B2 (en) * | 2007-07-16 | 2013-10-10 | Genentech, Inc. | Humanized anti-CD79b antibodies and immunoconjugates and methods of use |
| ES2579323T3 (es) * | 2007-07-16 | 2016-08-09 | Genentech, Inc. | Anticuerpos anti-CD79B e inmunoconjugados y métodos de uso |
| CL2009000062A1 (es) * | 2008-01-31 | 2010-05-14 | Genentech Inc | Anticuerpo humanizado anti cd79b; con modificaciones de cisterna libre; inmunoconjugado que contiene dicho anticuerpo y una droga; polinucleotido que codifica el anticuerpo; vector, celula huesped; composicion farmaceutica y uso de dicha composicion para tratar cancer, preferentemente linfomas. |
-
2008
- 2008-01-31 US US12/023,811 patent/US20090068178A1/en not_active Abandoned
-
2009
- 2009-01-13 KR KR1020107019272A patent/KR20100128286A/ko not_active Application Discontinuation
- 2009-01-13 CA CA2712518A patent/CA2712518A1/en not_active Abandoned
- 2009-01-13 CN CN2009801110932A patent/CN102014964A/zh active Pending
- 2009-01-13 NZ NZ587652A patent/NZ587652A/xx not_active IP Right Cessation
- 2009-01-13 WO PCT/US2009/030851 patent/WO2009099719A2/en active Application Filing
- 2009-01-13 JP JP2010545049A patent/JP2011515069A/ja not_active Withdrawn
- 2009-01-13 AU AU2009210627A patent/AU2009210627A1/en not_active Abandoned
- 2009-01-13 BR BRPI0908854A patent/BRPI0908854A2/pt not_active IP Right Cessation
- 2009-01-13 MX MX2010008199A patent/MX2010008199A/es active IP Right Grant
- 2009-01-13 RU RU2010136303/10A patent/RU2010136303A/ru not_active Application Discontinuation
- 2009-01-13 EP EP09707533A patent/EP2247312A2/en not_active Withdrawn
- 2009-01-16 PE PE2009000055A patent/PE20091404A1/es not_active Application Discontinuation
- 2009-01-16 AR ARP090100153A patent/AR071829A1/es not_active Application Discontinuation
- 2009-01-16 CL CL2009000082A patent/CL2009000082A1/es unknown
-
2010
- 2010-07-13 IL IL206970A patent/IL206970A0/en unknown
- 2010-09-09 US US12/878,920 patent/US20110070243A1/en not_active Abandoned
- 2010-10-12 US US12/902,434 patent/US20110206658A1/en not_active Abandoned
-
2017
- 2017-01-13 US US15/406,583 patent/US20170362318A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| US20110206658A1 (en) | 2011-08-25 |
| CL2009000082A1 (es) | 2012-03-02 |
| WO2009099719A2 (en) | 2009-08-13 |
| EP2247312A2 (en) | 2010-11-10 |
| MX2010008199A (es) | 2010-11-30 |
| US20090068178A1 (en) | 2009-03-12 |
| US20110070243A1 (en) | 2011-03-24 |
| WO2009099719A3 (en) | 2009-10-29 |
| NZ587652A (en) | 2012-12-21 |
| BRPI0908854A2 (pt) | 2019-09-24 |
| CN102014964A (zh) | 2011-04-13 |
| AR071829A1 (es) | 2010-07-21 |
| JP2011515069A (ja) | 2011-05-19 |
| IL206970A0 (en) | 2010-12-30 |
| PE20091404A1 (es) | 2009-09-23 |
| CA2712518A1 (en) | 2009-08-13 |
| RU2010136303A (ru) | 2012-03-10 |
| US20170362318A1 (en) | 2017-12-21 |
| AU2009210627A1 (en) | 2009-08-13 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20100128286A (ko) | 조혈계 기원의 종양 치료용 조성물 및 방법 | |
| US10836831B2 (en) | Anti-PTK7 antibodies and methods of use | |
| KR101960004B1 (ko) | Cldn6 생체내 표적-지향된 항체를 이용하는 암 치료법 | |
| KR101297467B1 (ko) | Dr5 항체 및 그의 용도 | |
| RU2568066C2 (ru) | Антитела против fgfr3 и способы их применения | |
| KR101245983B1 (ko) | 인간화 항-tgf-베타 항체 | |
| JP6527132B2 (ja) | 肝臓がんの診断及び治療のための組成物及び方法 | |
| TW201639887A (zh) | 抗-dll3嵌合抗原受體及其使用方法 | |
| KR20100057009A (ko) | 인간화 항-cd79b 항체 및 면역접합체 및 사용 방법 | |
| EP2817338A2 (en) | Dll3 modulators and methods of use | |
| TW201235049A (en) | Anti-CD79b antibodies and immunoconjugates and methods of use | |
| KR20100124261A (ko) | 항-cd79b 항체 및 면역접합체 및 사용 방법 | |
| KR101432474B1 (ko) | 항-연장된 ⅰ형 글라이코스핑고지질 항체, 이의 유도체 및 용도 | |
| NZ615285B2 (en) | Novel modulators and methods of use | |
| NZ708615B2 (en) | Novel modulators and methods of use |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |