KR20100053598A - Tlr9의 신규한 합성 효능제 - Google Patents
Tlr9의 신규한 합성 효능제 Download PDFInfo
- Publication number
- KR20100053598A KR20100053598A KR1020107004710A KR20107004710A KR20100053598A KR 20100053598 A KR20100053598 A KR 20100053598A KR 1020107004710 A KR1020107004710 A KR 1020107004710A KR 20107004710 A KR20107004710 A KR 20107004710A KR 20100053598 A KR20100053598 A KR 20100053598A
- Authority
- KR
- South Korea
- Prior art keywords
- disease
- tlr9
- subject
- compound
- administering
- Prior art date
Links
- NJLKIOLEEIUEAO-WKLFBTTESA-N CCCOP(O[C@H](C[C@H](C1)O)C[C@@H]1OP(O)(S)=O)(S)=O Chemical compound CCCOP(O[C@H](C[C@H](C1)O)C[C@@H]1OP(O)(S)=O)(S)=O NJLKIOLEEIUEAO-WKLFBTTESA-N 0.000 description 1
- MORAUCXRXRSUGL-NJQWMHSISA-N COP(O[C@@H](C[C@H](C1)O)C[C@@H]1OP(O)(S)=O)(S)=O Chemical compound COP(O[C@@H](C[C@H](C1)O)C[C@@H]1OP(O)(S)=O)(S)=O MORAUCXRXRSUGL-NJQWMHSISA-N 0.000 description 1
- QNZDTZWCUJIVOI-UHFFFAOYSA-N C[C@@H](NC(O)=N1)N=C1O Chemical compound C[C@@H](NC(O)=N1)N=C1O QNZDTZWCUJIVOI-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/711—Natural deoxyribonucleic acids, i.e. containing only 2'-deoxyriboses attached to adenine, guanine, cytosine or thymine and having 3'-5' phosphodiester links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/39—Medicinal preparations containing antigens or antibodies characterised by the immunostimulating additives, e.g. chemical adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/04—Drugs for disorders of the respiratory system for throat disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/10—Drugs for disorders of the urinary system of the bladder
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/14—Drugs for dermatological disorders for baldness or alopecia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/02—Muscle relaxants, e.g. for tetanus or cramps
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/04—Drugs for disorders of the muscular or neuromuscular system for myasthenia gravis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/10—Antimycotics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/02—Antiprotozoals, e.g. for leishmaniasis, trichomoniasis, toxoplasmosis
- A61P33/06—Antimalarials
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/06—Antianaemics
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Immunology (AREA)
- Pulmonology (AREA)
- Oncology (AREA)
- Neurology (AREA)
- Diabetes (AREA)
- Epidemiology (AREA)
- Communicable Diseases (AREA)
- Dermatology (AREA)
- Physical Education & Sports Medicine (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Molecular Biology (AREA)
- Microbiology (AREA)
- Biomedical Technology (AREA)
- Tropical Medicine & Parasitology (AREA)
- Neurosurgery (AREA)
- Pain & Pain Management (AREA)
- Rheumatology (AREA)
- Mycology (AREA)
- Hematology (AREA)
- Biochemistry (AREA)
- Endocrinology (AREA)
- Obesity (AREA)
- Transplantation (AREA)
- Urology & Nephrology (AREA)
- Otolaryngology (AREA)
Abstract
본 발명은 톨-유사 수용체(TLR)-매개 면역 반응의 조절에 유용한 합성 화학 조성물과 관련이 있다. 특히, 본 발명은 특유의 사이토카인 및 케모카인 프로파일을 생성시키는 톨-유사 수용체 9 (TLR9)의 효능제와 관련이 있다.
Description
발명의 배경
관련 출원
본원은 2007년 8월 1일에 출원되 미국 가특허 출원 제 60/953,251호; 2007년 10월 30일에 출원된 미국 가특허 출원 제 60/983,601호; 2007년 11월 12일에 출원된, 미국 가특허 출원 제 60/987,151호; 2007년 12월 20일에 출원된, 미국 가특허 출원 제 61/015,292호에 대한 우선권을 주장하며, 상기 특허문헌의 전체 내용은 참고문헌으로 본원에 통합된다.
발명의 분야
본 발명은 톨-유사 수용체(TLR)-매개 면역 반응의 조절에 유용한 합성 화학 조성물과 관련되어 잇다. 특히, 본 발명은 특유의 사이토카인 및 케모카인 프로파일을 생성시키는 톨-유사 수용체 9(TLR9)의 효능제와 관련되어 있다.
관련 기술의 요약
톨-유사 수용체(TLRs)는 면역 시스템의 많은 세포상에 존재하며 선천성 면역 반응에 관여하는 것으로 드러났다(Hornung, V. et a.l, (2002) J. Immunol. 168:4531-4537). 척추동물에서, 이 패밀리는 세균, 진균, 기생충, 및 바이러스로부터의 병원균 연관 분자 패턴을 인지하는 것으로 알려진 TLR1 내지 TLR11로 불리우는 11개의 단백질들로 구성되어 있다(Poltorak, a. et al. (1998) Science 282:2085-2088; Underhill, D.M., et al. (1999) Nature 401:811-815; Hayashi, F. et. al (2001) Nature 410: 1099-1103; Zhang, D. et al. (2004) Science 303:1522-1526; Meier, A. et al. (2003) Cell. Microbiol. 5:561-570; Campos, M.A. et al. (2001) J. Immunol. 167: 416-423; Hoebe, K. et al. (2003) Nature 424: 743-748; Lund, J. (2003) J. Exp. Med. 198:513-520; Heil, F. et al. (2004) Science 303:1526-1529; Diebold, S.S., et al. (2004) Science 303: 1529-1531; Hornung, V. et al. (2004) J. Immunol. 173:5935-5943).
TLR은 외래 분자를 인지하고 상기 외래 분자에 대한 면역 반응을 일으키는 중요한 수단이며 또한 선천성 및 후천성 면역 반응을 연계시키는 수단을 제공한다(Akira, S. et al. (2001) Nature Immunol. 2:675-680; Medzhitov, R. (2001) Nature Rev. Immunol. 1: 135-145). 몇몇 TLR은 세포 표면상에 자리하여 세포외 병원균을 검출하고 상기 병원균에 대한 반응을 개시시키며 다른 TLR은 세포의 내부에 자리하여 세포내 병원균을 검출하고 상기 병원균에 대한 반응을 개시시킨다.
TLR9은 세균 DNA 및 합성 올리고뉴클레오티드 내의 비메틸화된 CpG 모티프를 인지하는 것으로 알려져 있다. (Hemmi, H. et al. (2000) Nature 408:740-745). CpG-함유 포스포로티오에이트 올리고뉴클레오티드의 다른 변형은 또한 TLR9을 통한 면역 반응의 조절자로서 역할하는 이들의 활성에 영향을 미칠 수 있다(예를 들어, 하기 문헌 참조: Zhao et al., Biochem. Pharmacol. (1996) 51 :173-182; Zhao et al. (1996) Biochem Pharmacol. 52:1537-1544; Zhao et al. (1997) Antisense Nucleic Acid Drug Dev. 7:495-502; Zhao et al (1999) Bioorg. Med. Chem. Lett. 9:3453-3458; Zhao et al. (2000) Bioorg. Med. Chem. Lett. 10: 1051-1054; Yu, D. et al. (2000) Bioorg. Med. Chem. Lett. 10:2585-2588; Yu, D. et al. (2001) Bioorg. Med. Chem. Lett. 11 :2263-2267; 및 Kandimalla, E. et al. (2001) Bioorg. Med. Chem. 9:807-813). TLR9의 자연적으로 생성되는 효능제는 항-종양 활성(예를 들어, 종양 성장 및 혈관신생)을 나타내어 결과적으로 유효한 항-암 반응(예를 들어, 항-백혈병)을 야기시키는 것으로 드러났다(Smith, J.B. and Wickstrom, E. (1998) J. Natl. Cancer Inst. 90: 1146-1154). 또한, TLR9 효능제는 기타 공지의 항-종양 화합물(예를 들어, 세툭시맙, 이리노테칸)과 시너지적으로 작용하는 것으로 드러났다(Vincenzo, D., et al. (2006) Clin. Cancer Res. 12(2):577-583).
특정 TLR9 효능제는 코어 CpR 디뉴클레오티드를 함유한 3'-3' 연결 DNA 구조로 이루어지며, 여기서 R은 변형된 구아노신이다(미국 특허 제7,276,489호). 또한, 특정 화학 변형은 면역 반응의 특유의 조절을 생성시키는 특정 올리고뉴클레오티드 유사체의 제조를 가능케 하였다. 특히, 구조 활성 관계 연구는 면역 반응의 특이적인 조절을 생성시키는 합성 모티프 및 신규한 DNA-기반 화합물의 확인을 가능케 하였으며 이러한 조절은 비메틸화된 CpG 디뉴클레오티드에 의해 생성되는 것들과는 구별된다. (Kandimalla, E. et al. (2005) Proc. Natl. Acad. Sci. U S A 102:6925-6930. Kandimalla, E. et al. (2003) Proc. Nat. Acad. Sci. U S A 100: 14303-14308; Cong, Y. et al. (2003) Biochem Biophys Res. Commun. 310: 1133-1139; Kandimalla, E. et al. (2003) Biochem. Biophys. Res. Commun. 306:948-953; Kandimalla, E. et al. (2003) Nucleic Acids Res. 31:2393-2400; Yu, D. et al. (2003) Bioorg. Med. Chem. 11:459-464; Bhagat, L. et al. (2003) Biochem. Biophys. Res. Commun. 300:853-861; Yu, D. et al. (2002) Nucleic Acids Res. 30:4460-4469; Yu, D. et al. (2002) J. Med. Chem. 45:4540-4548. Yu, D. et al. (2002) Biochem. Biophys. Res. Commun. 297:83-90; Kandimalla. E. et al. (2002) Bioconjug. Chem. 13:966-974; Yu, D. et al. (2002) Nucleic Acids Res. 30: 1613-1619; Yu, D. et al. (2001) Bioorg. Med. Chem. 9:2803-2808; Yu, D. et al. (2001) Bioorg. Med. Chem. Lett. 11 :2263-2267; Kandimalla, E. et al. (2001) Bioorg. Med. Chem. 9:807-813; Yu, D. et al. (2000) Bioorg. Med. Chem. Lett. 10:2585-2588; Putta, M. et al. (2006) Nucleic Acids Res. 34:3231-3238).
본 발명자들은 놀랍게도 코어 CpR 디뉴클레오티드에 플랭킹(flanking)된 서열, 뉴클레오티드들 간의 연결 또는 올리고뉴클레오티드들을 연결하는 링커를 독특하게 변형시키는 것이 시험관내 및 생체내에서 특유의 사이토카인 및 케모카인 프로파일을 생성시키는 신규한 TLR9의 효능제를 생성시킨다는 것을 발견하였다. CpR 함유 올리고뉴클레오티드에 대한 사이토카인 및 케모카인 반응을 "맞춤-조절(custom-tune)"시키는 이러한 능력은 질환-특이적이고 심지어 환자-특이적 방식으로 다양한 질병 상태를 예방하고/하거나 치료하기 위한 능력을 제공한다. 따라서, 이와 같은 맞춤-조절된 반응을 제공하기 위한 신규한 올리고뉴클레오티드 유사체 화합물에 대한 요구가 존재한다.
발명의 간추린 요약
본 발명은 TLR9 효능제로서 이들의 상호작용을 통해 개별적으로 특유의 면역 반응 프로파일을 제공하는 신규한 올리고뉴클레오티드-기반 화합물을 제공한다. 본 발명에 따른 TLR9 효능제는 특이적이고 특유의 화학적 변형에 의해 특징지워지는데, 상기 효능제는 이들의 특유의 면역 반응 활성화 프로파일을 제공한다.
본 발명에 따른 TLR9 효능제는 다양한 세포 유형에서 그리고 다양한 시험관내 및 생체내 실험 모델에서 면역 반응을 유도하는데, 각각의 효능제는 특유의 면역 반응 프로파일을 제공한다. 또한 본 발명에 따른 TLR9 효능제는 단독으로, 기타 약물과 조합하여 투여되거나 동시투여되거나, 백신으로 사용되는 항원을 위한 애주번트로서 다양한 질병의 예방 및/또는 치료에 유용하다. 따라서, 이들은 면역 시스템을 연구하기 위한 도구로서 뿐만 아니라, 다양한 동물 종, 예컨대, 인간과 마우스의 면역 시스템을 비교하기 위한 도구로서 유용하다.
따라서, 제 1 양상에서, 본 발명은 TLR9의 올리고뉴클레오티드-기반 효능제("화합물")를 제공한다.
제 2 양상에서, 본 발명은 본 발명에 따른 올리고뉴클레오티드-기반 TLR9 효능제 및 약제학적으로 허용되는 담체를 포함하는 약제 제형을 제공한다.
제 3 양상에서, 본 발명은 백신을 제공한다. 이 양상에 따른 백신은 본 발명에 따른 약제 제형을 포함하며 항원을 추가로 포함한다.
제 4 양상에서, 본 발명은 개체내에서 TLR9-매개 면역 반응을 생성시키기 위한 방법을 제공하는데, 상기 방법은 상기 개체에게 본 발명에 따른 화합물, 약제 제형 또는 백신을 투여하는 단계를 포함한다.
제 5 양상에서, 본 발명은 질환 또는 장애를 지니는 환자를 치료학적으로 치료하기 위한 방법을 제공하는데, 상기 방법은 상기 환자에게 본 발명에 따른 화합물, 약제 제형 또는 백신을 투여하는 단계를 포함한다.
제 6 양상에서, 본 발명은 질환 또는 장애를 예방하기 위한 방법을 제공하는데, 상기 방법은 상기 환자에게 본 발명에 따른 화합물, 약제 제형 또는 백신을 투여하는 단계를 포함한다.
도면의 간단한 설명
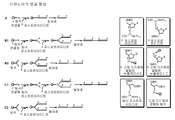
도 1은 본 발명의 면역 조절 화합물의 선형적 합성(linear synthesis)을 위한 합성 도식이다. DMTr = 4,4'-디메톡시트리틸; CE = 시아노에틸.
도 2는 본 발명의 면역 조절 화합물의 병렬적 합성을 위한 합성 도식이다. DMTr = 4,4'-디메톡시트리틸; CE = 시아노에틸.
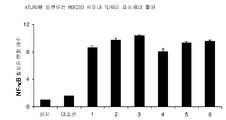
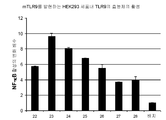
도 3A-3C는 하기 실시예 2에 따라 배양, 처리 및 분석된 TLR9을 발현하는 HEK293 세포내 NF-κB 활성을 도시한다. 요약하면, HEK293 세포를 18시간 동안 본 발명에 따른 면역 조절 올리고뉴클레오티드 10 μg/ml로 자극하고, NF-κB의 수준을 SEAP(인간 배아 알칼라인 포스파타제의 분비형) 검정을 사용하여 측정하였다.
도 3D-3G는 하기 실시예 2에 따라 배양, 처리 및 분석된 TLR9을 발현하는 HEK293 세포내 NF-κB 활성을 도시한다. 요약하면, HEK293 세포를 18시간 동안 본 발명에 따른 면역 조절 올리고뉴클레오티드 0(PBS/배지), 0.1, 0.3, 1.0, 3.0, 또는 10.0 μg/ml로 자극하고, NF-κB의 수준을 SEAP(인간 배아 알칼라인 포스파타제의 분비형) 검정을 사용하여 측정하였다. 도 3A-3G는 본 발명에 따른 신규한 염기, 링커, 및/또는 특유의 변형을 함유하는 면역 조절 올리고뉴클레오티드의 투여가 특유의 TLR9 활성화 프로파일을 생성시킨다는 것을 더 일반적으로 입증한다.
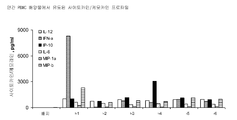
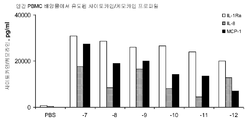
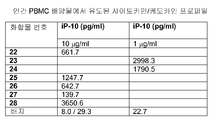
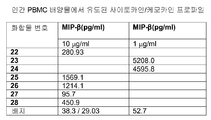
도 4A 및 4B는 하기 실시예 3에 따른 분리, 배양, 처리 및 분석된 인간 PBMC로부터의 사이토카인 및 케모카인 농도를 도시한다. 요약하면, PBMC를 신선하게 획득한 건강한 인간 자원자의 혈액으로부터 분리하고 24시간 동안 본 발명에 따른 면역 조절 올리고뉴클레오티드 10 μg/ml 용량과 함께 배양하였다. 상청액을 수집하고 루미넥스 멀티플렉스 검정(Luminex multiplex assay)으로 사이토카인 및 케모카인 수준을 분석하였다. 도 4A 및 4B는 본 발명에 따른 신규한 염기, 링커, 및/또는 특유의 변형을 함유하는 면역 조절 올리고뉴클레오티드의 투여가 특유의 사이토카인 및 케모카인 프로파일을 생성시킨다는 것을 더 일반적으로 입증한다.
도 4C-4H는 하기 실시예 3에 따른 분리, 배양, 처리 및 분석된 인간 PBMC로부터의 사이토카인 및 케모카인 농도를 도시한다. 요약하면, PBMC를 신선하게 획득한 건강한 인간 자원자의 혈액으로부터 분리하고 24시간 동안 본 발명에 따른 면역 조절 올리고뉴클레오티드 0(PBS), 0.1, 0.3, 1.0, 3.0, 또는 10.0 μg/ml 용량과 함께 배양하였다. 상청액을 수집하고 루미넥스 멀티플렉스 검정으로 사이토카인 및 케모카인 수준을 분석하였다. 상청액을 수집하고 루미넥스 멀티플렉스 검정으로 사이토카인 및 케모카인 수준을 분석하였다. 도 4C-4H는 본 발명에 따른 신규한 염기, 링커, 및/또는 특유의 변형을 함유하는 면역 조절 올리고뉴클레오티드의 투여가 특유의 사이토카인 및 케모카인 프로파일을 생성시킨다는 것을 더 일반적으로 입증한다.
도 41-4N는 하기 실시예 3에 따른 분리, 배양, 처리 및 분석된 인간 PBMC로부터의 사이토카인 및 케모카인 농도를 도시한다. 요약하면, PBMC를 신선하게 획득한 건강한 인간 자원자의 혈액으로부터 분리하고 24시간 동안 본 발명에 따른 면역 조절 올리고뉴클레오티드 0(PBS), 1.0, 또는 10.0 μg/ml 용량과 함께 배양하였다. 상청액을 수집하고 루미넥스 멀티플렉스 검정으로 사이토카인 및 케모카인 수준을 분석하였다. 상청액을 수집하고 루미넥스 멀티플렉스 검정으로 사이토카인 및 케모카인 수준을 분석하였다. 도 4I-4N는 본 발명에 따른 신규한 염기, 링커, 및/또는 특유의 변형을 함유하는 면역 조절 올리고뉴클레오티드의 투여가 특유의 사이토카인 및 케모카인 프로파일을 생성시킨다는 것을 더 일반적으로 입증한다.
도 4O-4FF는 하기 실시예 3에 따른 분리, 배양, 처리 및 분석된 인간 PBMC로부터의 사이토카인 및 케모카인 농도를 도시한다. 요약하면, PBMC를 신선하게 획득한 건강한 인간 자원자의 혈액으로부터 분리하고 24시간 동안 본 발명에 따른 면역 조절 올리고뉴클레오티드 0(PBS), 0.1, 0.3, 1.0, 3.0, 또는 10.0 μg/ml 용량과 함께 배양하였다. 상청액을 수집하고 루미넥스 멀티플렉스 검정으로 사이토카인 및 케모카인 수준을 분석하였다. 상청액을 수집하고 루미넥스 멀티플렉스 검정으로 사이토카인 및 케모카인 수준을 분석하였다. 도 40-4FF는 본 발명에 따른 신규한 염기, 링커, 및/또는 특유의 변형을 함유하는 면역 조절 올리고뉴클레오티드의 투여가 특유의 사이토카인 및 케모카인 프로파일을 생성시킨다는 것을 더 일반적으로 입증한다.
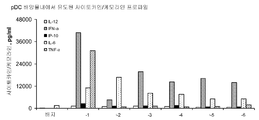
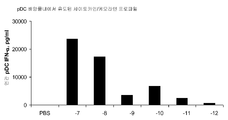
도 5A 및 5B는 하기 실시예 3에 따른 분리, 배양, 처리 및 분석된 인간 형질세포상 수지상 세포(plasmacytoid dendritic cells, pDCs)로부터의 사이토카인 및 케모카인 농도를 도시한다. 요약하면, pDC를 신선하게 획득한 건강한 인간 자원자의 혈액으로부터 분리하고 24시간 동안 본 발명에 따른 면역 조절 올리고뉴클레오티드 10 μg/ml 용량과 함께 배양하였다. 상청액을 수집하고 루미넥스 멀티플렉스 검정으로 사이토카인 및 케모카인 수준을 분석하였다. 도 5A 및 5B는 본 발명에 따른 신규한 염기, 링커, 및/또는 특유의 변형을 함유하는 면역 조절 올리고뉴클레오티드의 투여가 특유의 사이토카인 및 케모카인 프로파일을 생성시킨다는 것을 더 일반적으로 입증한다.
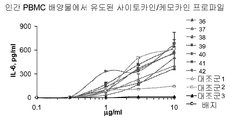
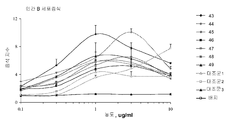
도 6A-6F는 본 발명에 따른 면역 조절 올리고뉴클레오티드에 의해 유도된 인간 B-세포 증식을 도시한다. 인간 B-세포를 하기 실시예 4에 따라 분리, 배양, 처리 및 분석하였다. 요약하면, 신선하게 획득한 건강한 인간 자원자의 PBMC로부터 분리한 인간 B 세포를 68시간 동안 상이한 용량의 본 발명에 따른 면역 조절 올리고뉴클레오티드와 함께 배양하고 6-8시간 동안 3H-티미딘으로 펄싱(pulsing)하였다. 3H-티미딘 흡수(uptake)를 액체 신틸레이션 계수기를 사용하여 측정하였다. 도 6A-6F는 본 발명에 따른 신규한 염기, 링커, 및/또는 특유의 변형을 함유하는 면역 조절 올리고뉴클레오티드의 투여가 특유의 세포 증식 프로파일을 생성시키며, 상기 프로파일은 염기 조성, 특유의 변형, 및 투여되는 올리고뉴클레오티드의 양에 따라 달라진다는 것을 더 일반적으로 입증한다.
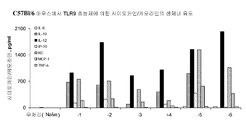
도 7A는 하기 실시예 5에 따라 처리된 C57BL/6 마우스에서 혈청 사이토카인 및 케모카인 유도를 도시한다. 요약하면, 마우스에 본 발명에 따른 면역 조절 올리고뉴클레오티드 1 mg/kg 용량으로 피하로 주사하고 2시간 경과후, 혈청을 수집하고 사이토카인과 케모카인수준에 관해 루미넥스 멀티플렉스 검정으로 분석하였다.
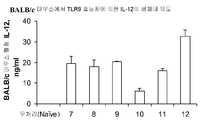
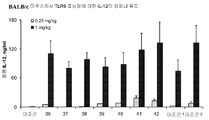
도 7B는 하기 실시예 5에 따라 처리된 BALB/c 마우스에서 혈청 사이토카인 및 케모카인 유도를 도시한다. 요약하면, 마우스에 본 발명에 따른 면역 조절 올리고뉴클레오티드 1 mg/kg 용량으로 피하로 주사하고 2시간 경과후, 혈청을 수집하고 IL-12 수준에 관해 ELISA로 분석하였다.
도 7C-7F는 하기 실시예 5에 따라 처리된 BALB/c 마우스에서 혈청 사이토카인 및 케모카인 유도를 도시한다. 요약하면, 마우스에 본 발명에 따른 면역 조절 올리고뉴클레오티드 0.25 또는 1 mg/kg 용량으로 피하로 주사하고 2시간 경과후, 혈청을 수집하고 IL-12 수준에 관해 ELISA로 분석하였다. 도 7A-7F는 본 발명에 따른 신규한 염기, 링커, 및/또는 특유의 변형을 함유하는 면역 조절 올리고뉴클레오티드의 투여가 특유의 TLR9 활성화 프로파일을 생성시키며, 상기 프로파일은 다양한 질환에서 적용을 발견할 것임을 더 일반적으로 입증한다.
바람직한 구체예의 상세한 설명
본 발명은 TLR9을 지니는 효능제로서 이들의 상호작용을 통한 특유의 면역 반응 프로파일을 개별적으로 제공하는 신규한 올리고뉴클레오티드-기반 화합물을 제공한다. 본 발명에 따른 TLR9 효능제는 특유의 화학적 변형에 의해 특징지워지는데, 상기 변형은 이들의 특유의 면역 반응 활성화 프로파일을 제공한다. 본원에 인용된 모든 간행물은 당해 기술분야의 당업자의 수준을 반영하며 이들의 전체로서 참고문헌으로 여기에 통합된다. 이들 참고문헌의 교시와 본 명세서의 교시 간의 임의의 상충은 본 명세서의 교시를 우선함으로써 해결될 수 있다.
본 발명에 따른 TLR9 효능제는 다양한 세포 유형 및 다양한 생체내 및 시험관내 실험 모델에서 면역 반응을 유도하며, 상기 각각의 효능제는 특유의 면역 반응 프로파일을 제공한다. 따라서, 이들은 면역 시스템을 연구하기 위한 도구로서 뿐만 아니라, 다양한 동물 종, 예컨대, 인간과 마우스의 면역 시스템을 비교하기 위한 도구로서 유용하다. 또한 본 발명에 따른 TLR9 효능제는 단독으로, 기타 약물과 조합하여 또는 동시투여되어, 또는 백신으로 사용되는 항원을 위한 애주번트로서, 다양한 질환의 예방 및/또는 치료에 유용하다.
정의
용어 "2'-치환된 뉴클레오시드" 또는 "2'-치환된 아라비노시드"는 2'-치환되거나 2'-O-치환된 리보뉴클레오시드가 생성되도록 펜토스 또는 아라비노스 모이어티의 2' 위치에 히드록실 기가 치환된 뉴클레오시드 또는 아라비노뉴클레오시드를 일반적으로 포함한다. 특정 구체예에서, 그러한 치환은 1-6개의 포화 또는 불포화 탄소 원자를 함유하는 저급 히드로카빌(hydrocarbyl) 기로, 수소 원자로, 또는 6-10개의 탄소 원자를 지니는 아릴 기로 이루어지며, 여기서 상기 히드로카빌, 또는 아릴 기는 비치환되거나, 예를 들어, 할로, 히드록시, 트리플루오로메틸, 시아노, 니트로, 아실, 아실옥시, 알콕시, 카르복실, 카르보알콕시, 또는 아미노 기로 치환될 수 있다. 2'-O-치환된 리보뉴클레오시드 또는 2'-O-치환된-아라비노시드의 일예는, 이로만 국한되는 것은 아니지만, 2'-아미노, 2'-플루오로, 2'-알일, 2'-O-알킬 and 2'-프로파길 리보뉴클레오시드 또는 아라비노시드, 2'-O- 메틸리보뉴클레오시드 또는 2'-O-메틸아라비노시드 및 2'-O-메톡시에톡시리보뉴클레오시드 또는 2 -O-메톡시에톡시아라비노시드를 포함한다.
방향적으로 사용될 때, 용어 " 3' "은, 일반적으로 동일한 폴리뉴클레오티드 또는 올리고뉴클레오티드내 또 다른 영역 또는 위치로부터 (올리고뉴클레오티드의 3' 위치 쪽으로) 3'쪽의 폴리펩티드 또는 올리고뉴클레오티드내 영역 또는 위치를 지칭한다.
방향적으로 사용될 때, 용어 " 5' "은, 일반적으로 동일한 폴리뉴클레오티드 또는 올리고뉴클레오티드내 또 다른 영역 또는 위치로부터 (올리고뉴클레오티드의 5' 위치 쪽으로) 5'쪽의 폴리펩티드 또는 올리고뉴클레오티드내 영역 또는 위치를 지칭한다.
용어 "약"은 일반적으로 정확한 수가 중요하지 않다는 것을 의미한다. 따라서, 해당 올리고뉴클레오티드내의 뉴클레오시드 잔기의 수는 중요하지 않으며, 1개 또는 2개 미만의 뉴클레오시드 잔기들을 지니거나, 1개 내지 수개의 추가 뉴클레오시드 잔기들을 지니는 올리고뉴클레오티드가 상기한 구체예들 각각의 균등물로서 간주된다는 것을 의미한다.
용어 "기도 염증"은, 이로만 국한되는 것은 아니지만, 일반적으로 천식을 포함하는, 알레르겐에 의해 초래되는 호흡기내 염증을 포함한다.
용어 "알레르겐"은 일반적으로 피검체에 대한 노출시 알레르기 반응을 유발시키는, 항원 또는 분자의 항원성 부분, 일반적으로 단백질을 지칭한다. 전형적으로, 피검체는, 예를 들어, 부스럼(wheal) 및 플레어(flare) 시험 또는 당업계에 공지된 임의의 방법에 의해, 지적한 것과 같이 알레르겐에 대해 알레르기가 있다. 피검체들의 적은 서브세트만이 분자에 노출시 알레르기(예를 들어, IgE) 면역 반응을 나타내는 경우라 하더라도 상기 분자는 알레르겐인 것으로 여겨진다.
용어 "알레르기"는 이로만 국한되는 것은 아니지만, 일반적으로 식품 알레르기, 호흡 알레르기 및 피부 알레르기를 포함한다.
용어 "항원"은 일반적으로 항체 또는 T 세포 항원 수용체에 의해 인지되고 선택적으로 결합되는 물질을 지칭한다. 항원은 펩티드, 단백질, 뉴클레오시드, 뉴클레오티드 및 이의 조합물을 포함할 수 있으나, 이로만 국한되는 것은 아니다. 항원은 천연 또는 합성 항원일 수 있으며 일반적으로 그러한 항원에 특이적인 면역 반응을 유도할 수 있다.
용어 "자가면역질환(autoimmune disorder)"은 일반적으로 "자가 항원"이 면역 시스템에 의해 공격을 받게 되는 질환을 의미한다. 해당 용어는, 이로만 국한되는 것은 아니지만, 홍반성 루푸스, 다발성 경화증, I형 진성 당뇨병, 과민성 대장 증후군, 크론병, 류머티스 관절염, 패혈성 쇼크, 전신성 탈모증, 급성 파종성 뇌척수 염, 애디슨병, 강직성 척추염, 반인지질 항체 증후군, 자가 면역성 용혈성 빈혈, 자가면역성 간염, 수포성 유천포창, 샤가스병(chagas disease), 만성 폐쇄성 폐질환, 복강 질환, 피부근염, 자궁 내막증, 굿패스처 증후군(Goodpasture's syndrome), 그레이브 병, 길랑-바레 증후군, 하시모토병, 화농성한샘염, 특발성 혈소판 감소성 자반병, 간질성 방광염, 반상 경피증, 중증 근무력증, 수면 발작, 신경성 근긴장, 천포창, 악성 빈혈, 다발성근염, 원발성 담즙성 간경변, 정신 분열증, 쇼그렌증후군, 측두동맥염("거세포성 동맥염), 맥관염, 백반, 성기통(vulvodynia) 및 베게너 육아종증, 자가 면역 천식, 패혈성 쇼크, 건선 및 말라리아를 포함한다.
용어 "암"은 이로만 국한되는 것은 아니지만, 일반적으로 비정상 또는 비조절된 세포 증식 및/또는 분열로 초래되는 임의의 악성 성장 또는 종양을 의미한다. 암은 인간 및/또는 동물에서 발생할 수 있고 임의 및 모든 조직에서 생겨날 수 있다. 본 발명으로 암을 지니는 환자를 치료하는 것은 비정상 또는 비조절된 세포 증식 및/또는 분열에 영향을 미치도록 본 발명에 따른 화합물, 약제 제형 또는 백신의 투여를 포함할 수 있다.
용어 "담체"는 일반적으로 임의의 부형제, 희석제, 충진제(filler), 염, 완충액, 안정화제, 가용화제(solubilizer), 오일, 액체, 지질 함유 비히클, 마이크로스피어, 리포좀 캡슐화(liposomal encapsulation), 또는 약제 제형에서 사용을 위한 당업계에 널리 공지된 기타 물질을 포함한다. 담체, 부형제, 또는 희석제의 특성은 특별한 적용을 위한 투여 경로에 좌우될 것임이 이해될 것이다. 이러한 물질을 함유하는 약제학적으로 허용되는 제형의 제조는 예를 들어, 문헌[Remington 's Pharmaceutical Sciences, 18th Edition, ed. A. Gennaro, Mack Publishing Co., Easton, PA, 1990]에 기재되어 있다.
용어 "약제학적으로 허용되는" 또는 "생리학적으로 허용되는"은 일반적으로 본 발명에 따른 화합물의 유효성을 저해하지 않고, 세포, 세포 배양물, 조직, 또는 개체와 같은 생물학적 시스템과 양립가능한 물질을 의미한다. 바람직하게는, 사기 생물학적 시스템은 살아 있는 개체, 예컨대, 척추동물이다.
용어 "동시투여(co-administration)" 또는 "동시투여된(co-administered)"은 일반적으로 면역 반응을 조절하기 위해 적어도 2개의 상이한 물질이 충분히 가까운 시간으로 투여되는 것을 의미한다. 바람직하게는, 동시투여는 2개 이상의 상이한 물질의 동시적 투여를 의미한다.
용어 "약제학적 유효량"은 일반적으로 원하는 생물학적 효과, 예컨대, 이로운 결과에 영향을 미치는데 충분한 양을 의미한다. 따라서, "약제학적 유효량"은 투여되는 정황에 좌우될 것이다. 약제학적 유효량은 하나 이상의 예방적 또는 치료적 투여로 투여될 수 있다.
용어 "~와 조합하여(in combination with)"는 일반적으로 본 발명에 따른 화합물과 환자의 치료 경과에서 상기 화합물의 TLR9 길항 효과를 폐기시키지 않는 질환 또는 병태를 치료하는데 유용한 또 다른 물질을 투여하는 것을 의미한다. 그러한 투여는 동시 투여를 포함하는, 임의의 순서로 진행될 수 있을 뿐만 아니라, 수초 내지 최대 수일 이격된 시간적으로 간격을 둔 순서로 진행될 수 있다. 그러한 조합 처리는 또한 본 발명에 따른 화합물 및/또는 독립하여 다른 물질의 1회 이상의 투여를 포함할 수 있다. 본 발명에 따른 화합물 및 다른 물질의 투여는 동일 경로 또는 상이한 경로로 수행될 수 있다.
용어 "개체(individual)" 또는 "피검체(subject)"는 일반적으로 포유동물, 예컨대, 인간을 의미한다. 포유동물은, 이로만 국한되는 것은 아니지만, 일반적으로, 인간, 비인간 영장류, 래트, 마우스, 고양이, 개, 말, 소, 젓소, 돼지, 양 및 래빗을 포함한다.
용어 "키나아제 억제제"는 일반적으로 세포내에서 인산화-의존성 세포 신호전달 및/또는 성장 경로를 길항시키거나 억제시키는 분자를 의미한다. 키나아제 억제제는 자연적으로 생성되거나 합성될 수 있으며 경구 치료제로서 투여될 수 있는 잠재력을 지니는 작은 분자들을 포함한다. 키나아제 억제제는 표적 키나아제 분자의 활성화를 급속하고 특이적으로 억제시키는 활성을 지닌다. 단백질 키나아제는 매력적인 약물 표적인데, 이는 부분적으로 이들이 폭넓게 다양한 신호전달 및 성장 결로를 조절시키고 다수의 상이한 단백질을 포함하기 때문이다. 따라서, 이들은 암, 심혈관 질환, 염증성 질환, 당뇨, 황반 변성 및 신경학적 장애(neurological disorders)를 포함하는 키나아제 신호전달이 관여하는 질환의 치료에 탁월한 효능을 지닌다. 키나아제 억제제의 일예는 소라페닙(Nexavar®), Sutent®, 다사티닙, Dasatinib™, Zactima™, Tykerb™ 및 STI571을 포함한다.
용어 "선형 합성(linear synthesis)"은 일반적으로 올리고뉴클레오티드의 한쪽 말단에서 시작하여 다른쪽 말단으로 직선으로 진행하는 합성을 의미한다. 선형 합성은 동일하거나 비동일한(길이, 염기 조성 및/또는 통합된 화학적 변형의 측면에서) 단량체 단위의 올리고뉴클레오티드내로의 통합을 가능케 한다.
용어 "포유동물"은, 이로만 국한되는 것은 아니지만, 인간을 포함하는, 온혈, 척추 도물을 포함하기 위해 의도적으로 사용된다.
용어 "변형된 뉴클레오시드"는 일반적으로 변형된 헤테로시클릭 염기, 변형된 당 모이어티, 또는 이들의 임의의 조합을 포함하는 뉴클레오시드이다. 몇몇 구체예에서, 변형된 뉴클레오시드는 본원에 기재된 것과 같은, 비천연 피리미딘 또는 퓨린 뉴클레오시드이다. 본 발명의 목적을 위해, 변형된 뉴클레오시드, 피리미딘 또는 퓨린 유사체 또는 자연적으로 생겨나지 않는 피리미딘 또는 퓨린은 상호교환적으로 사용될 수 있고 자연적으로 생겨나지 않는 염기 및/또는 자연적으로 생겨나지 않는 당 모이어티를 포함하는 뉴클레오시드를 의미한다. 본 발명이 목적을 위해, 염기는 이것이 구아닌, 시토신, 아데닌, 티민 또는 우라실이 아니라면 비자연적인 것으로 간주된다.
용어 "변형" 또는 "조절성(modulatory)"은 일반적으로 반응에서의 증가 또는 TLR9-매개 반응에서의 정량적 차이와 같은, 변화를 의미한다.
용어 "링커"는 일반적으로 당, 염기, 또는 백본을 통해 공유결합 또는 비공유 결합 방식으로 올리고뉴클레오티드에 부착될 수 있는 임의의 모이어티를 의미한다. 링커는 2개 이상의 뉴클레오시드를 부착시키는데 사용될 수 있거나 올리고뉴클레오티드내의 5' 및/또는 3' 말단 뉴클레오티드를 부착시키는데 사용될 수 있다. 본 발명의 특정 구체예에서, 그러한 링커는 비-뉴클레오티드성(non-nucleotidic) 링커일 수 있다.
용어 "비-뉴클레오티드성 링커"는 일반적으로 공유결합 또는 비공유결합 방식으로 올리고뉴클레오티드에 부착될 수 있는 뉴클레오티드성 결합 이외이 화학적 모이어티를 의미한다. 바람직하게는, 그러한 비뉴클레오티드성 링커는 약 2 Å 내지 약 200 Å 기이이고, 시스 또는 트랜스 배향으로 존재할 수 있다.
용어 "뉴클레오티드성 결합(nucleotidic linkage)"은 이들의 당을 통해 인접 뉴클레오시드 사이의 인 원자 및 하전된 기, 또는 중성 기(예를 들어, 포스포디에스테르, 포스포로티오에이트 또는 포스포로디티오에이트)로 구성된 이들의 당(예를 들어, 3'-3', 2'-3', 2'-5', 3'-5')을 통해 2개의 뉴클레오시드를 연결시키는 화학적 결합을 의미한다.
용어 "올리고뉴클레오티드-기반 화합물"은 다수의 연결된 뉴클레오시드 유닛으로부터 형성된 폴리뉴클레오시드를 의미한다. 뉴클레오시드 유닛은 바이러스, 세균, 세포 파쇄물, siRNA 또는 microRNA의 일부이거나 바이러스, 세균, 세포 파쇄물, siRNA 또는 microRNA의 일부로 구성될 수 있다. 그러한 올리고뉴클레오티드는 또한 게노믹 또는 cDNA를 포함하는, 기존 핵산 공급원으로부터 획득될 수 있으나, 합성 방법에 의해 생산되는 것이 바람직하다. 바람직한 구체예에서, 각각의 뉴클레오시드 유닛은 헤테로시클릭 염기 및 펜토푸라노실, 트레할로스, 아라비노스, 2'-데옥시-2'-치환된 뉴클레오시드, 2'-데옥시-2'-치환된 아라비노스, 2'-O-치환된 아라비노스 또는 헥소오스 당 기를 포함한다. 뉴클레오시드 잔기는 수많은 공지된 뉴클레오시드간 연결 중 임의의 연결에 의해 각자 서로에 커플링될 수 있다. 그러한 뉴클레오시드간 연결은, 이로만 국한되는 것은 아니지만, 포스포디에스테트, 포스포로티오에이트, 포스포로디티오에이트, 알킬포스포네이트, 알킬포스포노티오에이트, 포스포트리에스테르, 포스포르아미데이트, 실록산, 카보네이트, 카르보알콕시, 아세트아미데이트, 카바메이트, 몰포리노, 보라노, 티오에테르, 브릿지된 포스포르아미데이트, 브릿지된 메틸렌 포스포네이트, 브릿지된 포스포로티오에이트, 및 설폰 뉴클레오시드간 연결을 포함한다. 용어 "올리고뉴클레오티드-기반 화합물"은 또한 하나 이상의 입체특이적 뉴클레오시드간 연결(예를 들어, (Rp)- 또는 (Sp)-포스포로티오에이트, 알킬포스포네이트, 또는 포스포트리에스테르 연결)을 지니는 폴리뉴클레오시드를 포함한다. 본원에 사용된, 용어 "올리고뉴클레오티드" 및 "디뉴클레오티드"는 연결이 포스페이트 기를 포함하던지 않하던지 간에 상기한 임의의 뉴클레오시드간 연결을 지니는 폴리뉴클레오시드 및 디뉴클레오시드를 포함하기 위해 의도적으로 사용된다. 특정 바람직한 구체예에서, 이렇한 뉴클레오시드간 연결은 포스포디에스테르, 포스포로티오에이트 또는 포스포로디티오에이트 연결, 도는 이의 조합일 수 있다.
용어 "펩티드"는 일반적으로 펩티드가 햅텐인지 여부에 관계없이 생물학적 반응, 예를 ㄷ르어, 항체 생성 또는 사이토카인 활성에 영향을 미치는데 충분한 길이 및 조성을 갖는 폴리펩티드를 의미한다. 용어 "펩티드"는 변형된 아미노산(자연적으로 생성되던지 비자연적으로 생성되던지간에)을 포함할 수 있는데, 상기 변형은, 이로만 국한되는 것은 아니지만, 인산화, 당화, 페길화, 지질화 및 메틸화를 포함한다.
용어 "TLR9 효능제"는 일반적으로 TLR9에 의해 매개되는 면역 자극을 증강, 유도 또는 조절할 수 있는 올리고뉴클레오티드-기반 화합물을 의미한다.
용어 "치료"는 일반적으로 유익하거나 원하는 결과를 획득하기 위해 의도된 방법을 의미하는데, 상기 결과는 증상의 완화, 질병 진행의 지연 또는 개선을 포함할 수 있다.
본 발명에 따른 특정 TLR9 효능제는 하기 표 I에 제시되어 있다. 이 표에서, 올리고뉴클레오티드-기반 TLR9 효능제는, 지적된 곳을 제외하고는, 모든 포스포로티오에이트(PS) 연결을 지닌다. 그러나, 당해 기술분야의 통상의 기술자는 포스포디에스테르(PO) 연결, 또는 PS 및 PO 연결의 혼합이 사용될 수 있다는 것을 인지할 것이다. 지적된 곳을 제외하고는, 모든 뉴클레오티드는 데옥시리보뉴클레오티드이다.
표 I
G1 = 7-데아자-dG; G2 = AraG; G3 = 7-데아자-araG; A/G/C/U = 2'-O-메틸리보뉴클레오티드; dU = U1 = 2'-데옥시-U; o = 포스포디에스테르 연결; po = 5' -모노-포스페이트; ps = 5'-포스포로티에이트 연결; pm = 메틸 포스포네이트(비이온성 연결); L = 1,5-펜탄디올 링커; L = 1,2-디데옥시리보오스; L1 = 트리에틸렌 글리콜 링커; L2 = 테트라에틸렌 글리콜 링커; L3 = 헥사에틸렌 글리콜 링커; M = 시스,시스-1,3,5-시클로헥산트리올 링커; m = 시스,트랜스-1,3,5-시클로헥산트리올 링커; X = 글리세롤 링커; X1 = 1,2,4-부탄트리올 링커; X2 = 1,3,5-트리스(2-히드록시에틸)시아누르산 링커; X3 = 이소부탄트리올 링커; Y = 1,3-프로판디올 링커; Y1 = 1,2-에틸렌디올 링커; Y2 = 1,4-부탄디올 링커; Y3 = 1,5-펜탄디올 링커; Z = 1,3,5-펜탄트리올 링커.
표 I로부터의 예시적인 TLR9 효능제를 실시예 2에 기재된 것과 같이, TLR9을 발현하는 HEK293 세포에서 면역 자극 활성에 관해 시험하였다. 도 3A, 3B, 3C, 3D, 및 3E에 제시된 결과는 3'-3' 연결된 올리고뉴클레오티드에 대한 특정 화학적 변형이 투여 18시간후 이들의 TLR9 매개 NF-kB 활성화 프로파일을 변화시킬 것임을 입증한다. 더 일반적으로, 이러한 데이터는 3'-3' 연결된 올리고뉴클레오티드에 대한 특정 화학적 변형이 NF-kB 활성화를 증가 또는 감소시키는데 사용될 수 있다는 것을 입증한다.
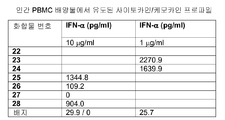
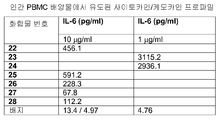
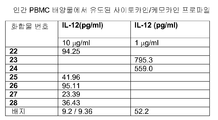
표 I로부터의 예시적인 TLR9 효능제를 실시예 3에 기재된 것과 같이, IL-12, IL-10, IL-8, IL-6, IFN-α, IP-10, MIP-1α, MIP-1β, IL-1Ra, IL-2R, 및 MCP-1에 관한 인간 PBMC 검정으로 면역 자극 활성에 대해 시험하였다. 도 4A 내지 4FF에 제시된 결과는 3'-3' 연결된 올리고뉴클레오티드에 대한 특정 화학적 변형이 인간 PBMC에서 이들의 TLR9 매개 IL-12, IL-10, IL-8, IL-6, IFN-α, IP-IO, MIP-1α, MIP-1β, IL-1Rα, IL-2R, 및/또는 MCP-1 활성화 프로파일을 변화시킬 것임을 입증한다. 더 일반적으로, 이러한 데이터는 3'-3' 연결된 올리고뉴클레오티드에 대한 특정 화학적 변형이 IL-12, IL-10, IL-8, IL-6, IFN-α, IP-10, MIP-1α, MIP-1β, IL-1Rα, IL-2R, 및 MCP-1 활성화를 증가 또는 감소시키는데 사용될 수 있다는 것을 입증한다.
표 I로부터의 예시적인 TLR9 효능제를 실시예 3에 기재된 것과 같이, IL-12, IL-6, IFN-α, IP-IO, MIP-1α, MIP-1β, 및 TNFα에 관한 인간 pDC 검정에서 면역 자극 활성에 관해 시험하였다. 도 5A와 5B에 제시된 결과는 3'-3' 연결된 올리고뉴클레오티드에 대한 특정 화학적 변형이 인간 pDC에서 이들의 TLR9 매개 면역 활성화 프로파일을 변화시킬 것임을 입증한다. 더 일반적으로, 이러한 데이터는 3'-3' 연결된 올리고뉴클레오티드에 대한 특정 화학적 변형이 IL-12, IL-6, IFN-α, IP-10, MIP-1α, MIP-1β, 및 TNFα 활성화를 증가 또는 감소시키는데 사용될 수 있다는 것을 입증한다.
표 I로부터의 예시적인 TLR9 효능제를 실시예 4에 기재된 것과 같이, 인간 B 세포 증식 검정에서 면역 자극 활성에 관해 시험하였다. 도 6A, 6B, 6C, 6D, 6E 및 6F에 제시된 결과는 3'-3' 연결된 올리고뉴클레오티드에 대한 특정 화학적 변형이 이들의 TLR9 매개 B-세포 증식 활성을 변화시킬 것이고 이 활성화 프로파일이 상기 화학적 변형에 따라 용량 의존적일 수 있음을 입증한다. 더 일반적으로, 이러한 데이터는 3'-3' 연결된 올리고뉴클레오티드에 대한 특정 화학적 변형이 B-세포 증식을 조절하는데 사용될 수 있음을 입증한다.
표 I로부터의 예시적인 TLR9 효능제를 실시예 5에 기재된 것과 같이, C57B1/6 및 BALB/c 마우스에서 생체내 면역 자극 활성에 관해 시험하였다. 도 7A, 7B, 7D, 7E 및 8F에 제시된 결과는 3'-3' 연결된 올리고뉴클레오티드에 대한 특정 화학적 변형이 마우스 모델에서 이들의 생체내 TLR9 매개 면역 활성화 프로파일을 변화시킬 것임을 입증한다. 더 일반적으로, 이러한 데이터는 3'-3' 연결된 올리고뉴클레오티드에 대한 특정 화학적 변형이 생체네 사이토카인 및/또는 케모카인 농도를 변화시킬 수 있고 다수의 질환에서 응용법을 발견하게 할 것임을 입증한다.
상기한 바와 같이, 본 발명은, 제 1 양상에서, TLR9의 올리고뉴클레오티드-기반 합성 효능제를 제공한다. 염기, 당, 연결 또는 링커에 대한 특정 화학적 변형에 기반하여, TLR9의 효능제는, 접근가능한 5'-말단을 유지하면서, TLR9 효능제 분자의 다른 것과 결합하고/거나 듀플렉스될 때 증가된 안정성을 가질 수 있다.
일부 구체예들에서, 비뉴클레오티드성 링커는, 이로만 국한되는 것은 아니지만, 표 II에 나열된 링커들을 포함할 수 있다.
제 2 양상에서, 본 발명은 본 발명에 따른 올리고뉴클레오티드-기반 TLR9 효능제("화합물") 및 약제학적으로 허용되는 담체를 포함하는 약제 제형을 제공한다.
활성 화합물은 치료되는 환자내에서 심각한 독성 효과를 초래함이 없이 약제학적 유효량을 환자에게 전달하기에 충분한 양으로 약제학적으로 허용되는 담체 또는 희석제 중에 포함된다. 약제학적으로 허용되는 유도체의 유효 투여량 범위는 전달된 모 화합물의 중량에 기초하거나, 당해 기술 분야의 통상의 기술자에게 공지된 다른 수단에 의해 계산될 수 있다. 유도체가 그 자체로 활성을 나타내면, 유효 투여량은 유도체의 중량을 사용거나, 당해 기술 분야의 통상의 기술자에게 공지된 다른 수단에 의해 상기한 바와 같이 평가될 수 있다.
제 3 양상에서, 본 발명은 백신을 제공한다. 이 양상에 따른 백신은 본 발명에 따른 약제 제형을 포함하며, 항원을 추가로 포함한다. 항원은 특정 면역 반응을 개시시키는 분자이다. 그러한 항원은, 이로만 국한되는 것은 아니나, 단백질, 펩티드, 핵산, 탄수화물 및 상기한 것과 동일한 것들중 임의의 것들의 복합체 또는 조합물을 포함한다. 임의의 그러한 항원은 면역원성 단백질 또는 펩티드, 예컨대, 키홀 림펫 헤모시아닌(keyhole limpet hemocyanin, KLH), 콜레라 톡신 B 소단위체, 또는 임의이 다른 면역원성 담체 단백질에 연결되거나 연결되지 않을 수 있다.
본 발명에 따른 백신은, 이로만 국한되는 것은 아니지만, 프레운트 완전 애주번트, 키홀 림펫 헤모시아닌(KLH), 모노포스포릴 지질 A(MPL), 명반(alum), 사포닌(QS-21을 포함), 이미퀴모드(imiquimod), R848, TLR 효능제 또는 이의 조합물을 포함하는, 다수의 공지의 애주번트 중 임의 애주번트를 추가로 포함할 수 있다.
제 4 양상에서, 본 발명은 개체내에서 TLR9-매개 면역 반응을 생성시키는 방법을 제공하는데, 상기 방법은 상기 개체에서, 본 발명에 따른 화합물, 약제 제형 또는 백신을 투여하는 단계를 포함한다. 몇몇 구체예들에서, 개체는 포유동물이다. 바람직한 구체예들에서, 상기 화합물, 약제 제형 또는 백신은 면역 자극을 필요로 하는 개체에 투여된다.
본 발명이 이 양상에 따른 방법에서, 본 발명에 따른 화합물, 약제 제형 또는 백신의 투여는, 이로만 국한 되는 것은 아니지만, 비경구(parenteral), 경구, 종양내(intratumoral), 설하, 경피(transdermal), 국소, 비내, 에어로졸, 안구내(intraocular), 직장내, 점막, 질내, 유전자 총에 의해, 피부 패치 또는 점안액 또는 구강세척액(mouthwash) 형태를 포함하는 임의의 적절한 경로에 의해 투여될 수 있다. 화합물, 약제 제형 또는 백신의 투여는 증상 또는 질병의 대용 마커(surrogate markers)를 감소시키는데 유효한 투여량 및 시간의 기간 동안 공지의 절차를 이용하여 실행될 수 있다. 전신적으로 투여될 때, 화합물, 약제 제형 또는 백신은 바람직하게는 본 발명에 따른 화합물의 혈중 수준을 약 0.0001 마이크로몰 내지 약 10 마이크로몰에 도달하도록 충분한 투여량으로 투여된다. 국소 투여의 경우, 상기 농도보다 훨씬 더 낮은 노도가 효과적일 수 있으며, 훨씬 더 높은 농도는 유해한 독성 효과 없이 견뎌낼 수 있다. 바람직하게는, 본 발명에 따른 화합물의 총 투여량은 일(日)당 환자당 약 0.001 mg 내지 일(日)당 체중 kg당 약 200 mg의 범위이다. 1회 치료 에피소드로서 개체에 치료학적으로 유효량의 하나 이상의 본 발명의 치료학적 조성물을 동시적으로, 또는 순차적으로 투여하는 것이 바람직할 수 있다.
특정 바람직한 구체예들에서, 본 발명에 따른 화합물, 약제 제형 또는 백신은, 이로만 국한되는 것은 아니지만, 항체, 세포독성제, 알레르겐, 항생제, 안티센스 올리고뉴클레오티드, siRNA, 앱타머(aptamers), 리보자임(ribozymes), 표적화된 치료제(targeted therapies), 키나아제 억제제, 펩티드, 단백질, 유전자 치료 벡터, DNA 백신, 및/또는 면역 반응의 특이성 또는 규모를 향상시키기 위한 애주번트를 포함하는 또 다른 물질과 함께 동시투여되거나 상기 물질과 조합하여 투여된다.
본 발명의 이 양상에 따른 방법은 인간 또는 동물 질환의 예방적 또는 치료적 치료에 유용하다. 예를 들어, 당해 방법은 소아 및 수의(veterinary) 백신 적용에 유용하다. 당해 방법은 또한 면역 시스템의 모델 연구에 유용하다.
제 5 양상에서, 본 발명은 질환 또는 장애를 지니는 환자를 치료학적으로 치료하기 위한 방법을 제공하는데, 상기 방법은 본 발명에 따른 화합물, 약제 제형 또는 백신을 상기 환자에게 투여하는 단계를 포함한다. 다양한 구체예들에서, 치료될 질환 또는 장애는 암, 자가면역질환, 감염성 질환, 기도 염증, 염증성 질환, 알레르기, 천식 또는 병원균 또는 알레르겐에 의해 초래된 질환이다. 병원균은, 예를 들어, 세균, 기생충, 진균, 바이러스, 비로이드(viroids), 및 프리온(prions)를 포함한다. 투여는 본 발명의 제 4 양상에 관해 기재된 것과 같이 실행된다.
제 6 양상에서, 본 발명은 질환 또는 장애를 예방하는 방법을 제공하는데, 상기 방법은 본 발명에 따른 화합물, 약제 제형 또는 백신을 상기 환자에게 투여하는 단계를 포함한다. 다양한 구체예들에서, 예방되는 질환 또는 장애는 암, 자가면역질환, 기도 염증, 염증성 질환, 감염성 질환, 알레르기, 천식 또는 병원균에 의해 초래되는 질병이다. 병원균은, 이로만 국한되는 것은 아니지만, 세균, 기생충, 진균, 바이러스, 비로이드, 및 프리온을 포함한다. 투여는 본 발명의 제 4 양상에 관해 기재된 것과 같이 실행된다.
본 발명에 따른 방법들 중 임의의 방법에서, 본 발명에 따른 화합물, 약제 제형 또는 백신은 본 발명에 따른 화합물, 약제 제형 또는 백신의 면역 자극 효과를 폐기시키지 않는 질환 또는 병태를 예방 또는 치료하는데 유용한 임의의 기타 물질과 동시투여되거나 상기 물질과 조합하여 투여될 수 있다. 본 발명에 따른 방법들 중 임의의 방법에서, 상기 질환 또는 병태를 예방 또는 치료하는데 유용한 물질은, 이로만 국한되는 것은 아니지만, 백신, 항원, 항체, 세포독성제, 알레르겐, 항생제, 안티센스 올리고뉴클레오티드, TLR 효능제, 키나아제 억제제, 펩티드, 단백질, 유전자 치료 벡터, DNA 백신 및/또는 면역 반응의 특이성 또는 규모를 증강시키는 애주번트, 또는 동시-자극 분자, 예컨대, 사이토카인, 케모카인, 단백질 리간드, 트랜스-활성화 인자(trans-activating factors), 펩티드 및 변형된 아미노산을 포함하는 펩티드를 포함한다. 예를 들어, 암의 예방 및/또는 치료에 있어서, 본 발명에 따른 화합물, 약제 제형 또는 백신은 화학치료 화합물 또는 모노클로날 항체와 동시투여되거나 상기 화합물 또는 항체와 조합하여 투여될 수 있다. 바람직한 화학치료제는, 이로만 국한되는 것은 아니지만, 젬시타빈 메토트렉세이트, 빈크리스틴, 아드리아마이신, 시스플라틴, 비-당 함유 클로로에틸니트로소우레아(non-sugar containing chloroethylnitrosoureas), 5-플루오로우라실, 마이토마이신 C, 블레오마이신, 독소루비신, 다카바진, Taxol®, 프라질린(fragyline), 메그라민(Meglamine) GLA, 발루비신, 카무스타인 및 폴리페르포산(poliferposan), MMI270, BAY12-9566, RAS 파메실 전이효소 억제제(famesyl transferase inhibitor), 파메실 전이효소 억제제, MMP, MTA/LY231514, LY264618/로메텍솔(Lometexol), 글라모렉(Glamolec), CI-994, TNP-470, 히캄틴(Hycamtin)/토포테칸(Topotecan), PKC412, 발스포다(Valspodar)/PSC833, Novantrone®/미트록산트론(Mitroxantrone), 메타레트(Metaret)/수라민(Suramin), 바티마스타트(Batimastat), E7070, BCH-4556, CS-682, 9-AC, AG3340, AG3433, 인셀(Incel)/VX-710, VX-853, ZDOlOl, ISI641, ODN 698, TA 2516/마미스타트(Marmistat), BB2516/마미스타트, CDP 845, D2163, PD183805, DX8951f, 레모날(Lemonal) DP 2202, FK 317, 이마티닙 메실레이트/Gleevec®, 피시바닐(Picibanil)/OK-432, AD 32/발루비신(Valrubicin), Metastron®/스트론튬 유도체, 테모달(Temodal)/테모졸로미드(Temozolomide), 에바세트(Evacet)/리포좀 독소루비신(liposomal doxorubicin), 에브탁산(Yewtaxan)/파클리탁셀(Placlitaxel), Taxol®/파클리탁셀, 젤로드(Xeload)/카펙시타빈(Capecitabine), 푸르툴론(Furtulon)/독시플루리딘(Doxifluridine), 시클로팍스(Cyclopax)/경구 파클리탁셀, 경구 탁소이드(Oral Taxoid), SPU-077/시스플라틴, HMR 1275/플라보피리돌Flavopiridol), CP-358(774)/EGFR, CP-609(754)/RAS 암유전자 억제제(oncogene inhibitor), BMS-18275 I/경구 백금(oral platinum), UFT™(테가푸르/우라실)(Tegafur/Uracil)), Ergamisol®/레바미솔(Levamisole), 에닐우라실(Eniluracil)/776C85/5FU 인핸서, 캄프토(Campto)/레바미솔(Levamisole), Camptosar®/이리노테칸(Irinotecan), 투모덱스(Tumodex)/랄리트렉세드(Ralitrexed), Leustatin®/클라드리빈(Cladribine), 파섹스(Paxex)/파클리탁셀, Doxil®/리포좀 독소루비신, 카엘릭스(Caelyx)/리포좀 독소루비신, Fludara®/플루다라빈(Fludarabine), 파마루비신(Pharmarubicin)/에피루비신(Epirubicin), DepoCyt®, ZD1839, LU79553/비스-나프탈리미드(Bis-Naphtalimide), LU103793/돌라스타인(Dolastain), 카에틱스(Caetyx)/리포좀 독소루비신, Gemzar®/젬시타빈, ZD 0473/Anormed®, YM116, 요오드 종자(Iodine seeds), CDK4 및 CDK2 억제제, PARP 억제제, D4809/덱시포사미드(Dexifosamide), 이페스(Ifes)/Mesnex®/이포사미드(Ifosamide), Vumon®/테니포시드(Teniposide), Paraplatin®/카르보플라틴(Carboplatin), 플란티놀(Plantinol)/시스플라틴, 베페시드(Vepeside)/에토포시드(Etoposide), ZD9331, Taxotere®/도세탁셀(Docetaxel), 구아닌 아라비노시드의 전구약물, 탁세인 유사체(Taxane Analog), 니트로소우레아, 알킬화제, 예컨대, 멜페란(melphelan) 및 시클로포스파미드(cyclophosphamide), 아미노글루테티미드(Aminoglutethimide), 아스파라기나아제(Asparaginase), 부설판(Busulfan), 카르보플라틴, 클로람부실(Chlorambucil), 시타라빈(Cytarabine) HCl, 닥티노노마이신(Dactinomycin), 다우노루비신(Daunorubicin) HCl, 에스트라무스틴 포스페이트 소디움(Estramustine phosphate sodium), 에토포시드(Etoposide)(VP 16-213), 플록스우리딘(Floxuridine), 플루오로우라실(5-FU), 플루타미드(Flutamide), 히드록시우레아(Hydroxyurea)(히드록시카르바미드(hydroxycarbamide)), 이포스파미드(Ifosfamide), 인터페론 알파-2a, 알파-2b, 류프로리드 아세테이트(Leuprolide acetate)(LHRH-방출 인자 유사체e), 루모스틴(Lomustine)(CCNU), 메틀로레타민(Mechlorethamine) HCl(니트로젠 머스타드), 머캅토퓨린(Mercaptopurine), 메스나(Mesna), 미토테인(Mitotane)(o.p'-DDD), 미토산트론(Mitoxantrone) HCl, 톡트레오티드(Octreotide), 플리카마이신(Plicamycin), 프로카바진(Procarbazine) HCl, 스트렙토조신(Streptozocin), 타목시펜 시트레이트(Tamoxifen citrate), 티오구아닌(Thioguanine), 티오테파(Thiotepa), 빈블라스틴 설페이트(Vinblastine sulfate), 암사크린(Amsacrine)(m-AMSA), 아자시티딘(Azacitidine), 에리쓰로포이에틴(Erthropoietin), 헥사메틸멜라민(Hexamethylmelamine)(HMM), 인터루킨 2, 미토구아존(Mitoguazone)(메틸-GAG; 메틸 글리옥살 비스-구아닐히드라존(methyl glyoxal bis-guanylhydrazone; MGBG)), 펜토스타틴(Pentostatin)(2'-데옥시코포마이신), 세무스틴(Semustine)(메틸-CCNU), 테니포시드(Teniposide)(VM-26) 및 빈데신(Vindesine) 설페이트를 포함한다. 바람직한 모노클로날 항체는 이로만 국한되는 것은 아니지만 Panorex®(Glaxo-Welicome), Rituxan®(IDEC/Genentech/Hoffman Ia Roche), Mylotarg®(Wyeth), Campath®(Millennium), Zevalin®(IDEC 및 Schering AG), Bexxar®(Corixa/GSK), Erbitux®(Imclone/BMS), Avastin®(Genentech), Herceptin®(Genentech/Hoffman Ia Roche), Tarceva®(OSI Pharmaceuticals/Genentech)을 포함한다.
대안적으로, 질환 또는 병태를 예방 또는 치료하는데 유용한 물질은 항원 또는 알레르겐을 엔코딩하는 DNA를 포함할 수 있다. 이러한 구체예들에서, 본 발명에 따른 화합물, 약제 제형 또는 백신은 애주번트로서 다양하제 작용할 수 있고/있거나 직접적인 면역조절 효과를 생산할 수 있다.
하기 실시예들은 본 발명의 특정 바람직한 구체예들을 더 상세히 설명하기 위해 의도되며 본 발명의 권리범위를 어떤 식으로든 제한하기 위해 의도된 것은 아니다.
실시예 1:
면역 자극 모이어티를 함유하는 올리고뉴클레오티드-기반 화합물의 합성
본 발명에 따른 화학적 실체를 도 1과 2에 개관된 선형 합성 또는 병렬 합성 절차에 따라, 자동화된 DNA 합성기(OligoPilot II, AKTA, (Amersham) 및/또는 Expedite 8909(Applied Biosystem))를 사용하여 1 μmol 내지 0.1 mM 규모로 합성하였다.
5'-DMT dA, dG, dC 및 T 포스포르아미다이트를 프롤리고(Proligo)(Boulder, CO)에서 구입하였다. 5'-DMT 7-데아자-dG 및 araG 포스포르아미다이트를 켐진스(Chemgenes)(Wilmington, MA)에서 획득하였다. DiDMT-글리세롤 링커 고체 지지체를 켐진스로부터 획득하였다. 1-(2'-데옥시-β-D-리보푸라노실)-2-옥소-7-데아자-8-메틸-퓨린 아미다이으틀 글렌 리서치(Glen Research)(Sterling, VA)로부터 입수하고, 2'-O-메틸리보뉴클레오시드 아미다이트를 프로메카(Promega)(Obispo, CA)에서 입수하였다. 본 발명에 따른 모든 화합물을 포스포로티오에이트 백본이 변형되었다.
모든 뉴클레오시드 포스포르아미다이트를 31P 및 1H NMR 스펙트럼으로 특성결정하였다. 변형된 뉴클레오시드를 공급업자에 의해 권장된 정상 커플링 사이클을 사용하여 특정 부위들에 통합시켰다. 합성후, 화합물을 진한 암모늄 히드록시드를 사용하여 탈보호시키고 역상 HPLC, 탈트리틸화(detritylation), 후속하여 투석으로 정제하였다. 소듐 염 형태로 정제된 화합물을 사용하기에 앞서 동결건조시켰다. 순도를 CGE와 MALDI-TOF MS로 시험하였다. 엔도톡신 수준을 LAL 시험으로 측정하였고 1.0 EU/mg으로 나타났다.
실시예 2:
세포 배양 조건 및 시약
마우스 TLR9을 발현하는 HEK293 또는 HEK293XL 세포(Invivogen, San Diego, CA)를 5% CO2 인큐베이터에서 10% 열-불활성화된 FBS가 보충된 250 μl/웰 DMEM에서 48-웰 플레이트에서 배양하였다. 80% 컨플루언스(confluence)에서, 배양물에 배양 배지 중에 4 μl/ml의 리포펙타민(Invitrogen, Carlsbad, CA)의 존재하에 400 ng/ml의 SEAP(인간 배아 알카리성 포스파타제의 분비 형) 리포터 플라스미드(pNifty2-Seap)(Invivogen)를 일시적으로 트랜스펙션시켰다. 플라스미드 DNA 및 리포펙타민을 무혈청 배지로 따로 따로 희석시키고 실온에서 5분 동안 인큐베이션하였다. 인큐베이션후, 희석된 DNA 및 리포펙타민을 혼합하고 혼합물을 실온에서 20분 동안 인큐베이션하였다. 100 ng의 플라스미드 DNA와 1 μl의 리포펙타민을 함유하는 25 μl의 DNA/리포펙타민 혼합물의 분취액을 상기 세포 배양 플레이트의 각각의 웰에 첨가하고, 배양을 4시간 동안 지속하였다.
마우스 TLR9을 발현하는 HEK293 세포에서 표 I로부터의 예시적인 화합물에 의한 사이토카인 유도
트랜스펙션 후, 배지를 신선한 배양 배지로 교체하고, 표 I로부터의 예시적인 화합물을 0, 0.1, 0.3, 1.0, 3.0, 또는 10.0 μg/ml의 농도로 배양물에 첨가하고, 배양을 18시간 동안 지속하였다. 화합물 처리 종결시, NF-κB 수준을 제조업자의 프로토콜(Invivogen)에 따라 SEAP(인간 배아 알카리성 포스파타제의 분비 형) 검정을 사용하여 측정하였다. 요약하면, 30 μl의 배양 상청액을 각각의 처리로부터 얻고 p-니트로페닐(nitrophynyl) 포스페이트 기질과 함께 인큐베이션하고 생성된 노란색을 405 nm에서 플레이트 판독기로 측정하였다(Putta MR et al, Nucleic Acids Res., 2006, 34:3231-8).
실시예 3 :
인간 PBMC, pDC, 및 마우스 비장세포(splenocytes)에서 표 I로부터의 예시적인 화합물에 의한 사이토카인 유도
인간 PBMC 분리
신선하게 채혈된 건강한 자원자 혈액(CBR Laboratories, Boston, MA)으로부터의 말초혈단핵세포(peripheral blood mononuclear cells, PBMCs)를 피콜(Ficoll) 밀도 구배 원심분리 방법(Histopaque-1077, Sigma)으로 분리하였다.
인간 pDC 분리
인간 형질세포상 수지상 세포(pDCs)를 제조업자의 사용설명서에 따라 BDCA4 세포 분리 키트(Miltenyi Biotec)를 사용하여 양성 선별에 의해 신선하게 채혈된 건강한 인간 자원자의 혈액 PBMC로부터 분리하였다.
마우스 비장세포 분리
인간 PBMC를 5x106개 세포/ml를 사용하여 48-웰 플레이트에 플레이팅하였다. 인간 pDC를 1×1O6개 세포/ml를 사용하여 96-웰 디쉬에 플레이팅하였다. DPBS (pH 7.4; Mediatech)에 용해된 표 I로부터의 예시적인 화합물을 0, 0.1, 0.3, 1.0, 3.0, 또는 10.0 μg/ml의 용량으로 세포 배양물에 첨가하였다. 이후 세포를 37℃에서 24시간 동안 인큐베이션하고 상청액을 루미넥스 멀티플렉스 검정 또는 ELISA 검정을 위해 수집하였다. 특정 실험에서, IFN-α, IL-6, 및/또는 IL-12의 수준을 샌드위치 ELISA로 측정하였다. 사이토카인 항체와 표준을 포함하는, 필요한 시약을 파밍겐(PharMingen)으로부터 구입하였다.
사이토카인 루미넥스 멀티플렉스
특정 실험에서, 배양물 상청액 중의 IL-1Ra, IL-6, IL-10, IL- 12, IFN-α, IFN-γ, MIP-1α, MlP-β, MCP-1, 및 IL-12p40p70의 수준을 루미넥스 멀티플렉스 검정으로 측정하였는데, 상기 검정을 루미넥스 100 인스트루먼트 상의 바이오소스(Biosource) 인간 멀티플렉스 사이토카인 검정 키트를 사용하여 수행하였고 데이터를 어플라이드 사이토메트리 시스템즈(Applied Cytometry Systems)(Sacramento, CA)에 의해 제공되는 스타스테이션(StarStation) 소프트웨어를 사용하여 분석하였다.
인간 면역 세포의 활성화.
인간 형질세포상 수지상 세포(pDCs)를 신선하게 채혈된 건강한 인간 혈액 PBMC로부터 분리하고 50 μg/ml의 TLR9 효능제 또는 대조군과 함께 24시간 동안 배양하였다. 세포를 형광단-컨주게이션된(fluorescently-conjugated) Ab(CD123, CD80, CD86)로 염색하고 데이터를 FC500 MPL 사이토메터로 수집하였다. CD123+ 세포 상의 CD80 및 CD86의 평균 형광강도를 플로우 조(Flow Jo) 소프트웨어를 사용하여 분석하였고 PBS 대조군에 대한 변화 배수로 나타내었다.
인간 골수상 수지상 세포(myeloid dendritic cells, mDCs)를 신선하게 채혈된 건강한 인간 혈액 PBMC로부터 분리하고 50 μg/ml의 TLR9 효능제 또는 대조군과 함께 24시간 동안 배양하였다. 세포를 형광단-컨주게이션된 Ab(CD11c, CD80, CD40)로 염색하고 데이터를 FC500 MPL 사이토메터에서 수집하였다. CD11c+ 세포 상의 CD80 및 CD86의 평균 형광강도를 플로우 조 소프트웨어를 사용하여 분석하였고 PBS 대조군에 대한 변화 배수로 나타내었다.
실시예 4:
표 I로부터의 예시적인 화합물의 존재시 인간 B 세포 증식 검정
인간 B 세포를 제조업자의 사용설명서에 따라 CD 19 세포 분리 키트(Miltenyi Biotec, Auburn, CA)를 사용하여 양성 선별로 PBMC로부터 분리하였다.
검정을 위해 사용된 배양 배지는 1.5 mM 글루타민, 1 mM 소듐 피루베이트, 0.1 mM 비필수 아미노산, 50 μM 2-머캅토에탄올, 100 IU/ml 페니실린-스트렙토마이신 믹스 및 10% 열-불활성화 우 태아 혈청가 보충된 RPMI 1640 배지로 구성되었다.
ml 당 총 0.5 X 106개 B 세포(즉, 1 X 105개/200 μl/웰)를 3개 1세트로 상이한 농도의 표 I로부터의 예시적인 화합물로 96 웰 평평한 바닥 플레이트에서 총 68시간 동안 자극시켰다. 68시간 후, 세포를 웰 당 20 μl RPMI 1640 배지(무 혈청) 중의 0.75 μCi의 [3H]-티미딘(ICi = 37 GBq; Perkin Elmer Life Sciences)로 펄싱시키고 6-8시간 후 수확하였다. 이후 상기 플레이트를 세포 수확기를 사용하여 수확하고 방사능동위원소 통합을 표준 액체 신틸레이션 기술을 사용하여 측정하였다. 일부 경우에 있어서, 상응하는 [3H]-T(cpm)을 증식 지수로 전환시키고 그에 따라 보고하였다.
실시예 5:
TLR9 효능제 화합물로 처리된 마우스 모델에서 생체내 사이토카인 분비
5-6주령의, C57BL/6 마우스 및 BALB/c 마우스를 타코닉 팜스(Taconic Farms, Germantown, NY)에서 입수하고 이데라 파마슈티칼(Pharmaceutical)의 IACUC 승인된 동물 프로토콜에 따라 유지하였다. 마우스(n=3)에게 표 I로부터의 개별 면역 조절 화합물을 0.25 또는 1.0 mg/kg(1회 용량)으로 피하로(s.c) 주사하였다. 혈청을 면역 조절 화합물 투여 2시간 경과후 안구후방 채혈(retro-orbital bleeding)로 수집하고 IL-12, IL-1O, IL-6, IP-IO, KC, MCPl, MIG, MIP-1α 및 TNF-α 농도를 샌드위치 ELISA 또는 루미넥스 멀티플렉스 검정으로 측정하였다. 결과는 도 7A, 7B, 7C, 7D, 7E 및 8F에 제시되어 있고 신규한 화학 조성물을 함유하는 면역 조절 화합물의 생체내 투여가 특유의 사이토카인 및 케모카인 프로파일을 생성시킨다는 것을 입증한다. 사이토카인 및 케모카인 항체 및 표준물질(standards)를 포함하는 모든 시약을 파민젠(PharMingen)(San Diego, CA)으로부터 구입하였다.
균등물(EQUIVALENTS)
앞서 기술한 발명이 명확함과 이해를 목적으로 다소 상세하게 기재되었으나, 형태와 세부사항에서의 다양한 변형이 본 발명의 진실한 권리범위 및 첨부된 특허청구범위에서 벗어 남이 없이 이루어질 수 있다는 것을 당해 기술분야의 당업자에 의해 이해될 것이다.
Claims (9)
- 화합물 번호 1 내지 169 중에서 선택된 면역 조절 화합물.
- 제 1항의 면역 조절 화합물 및 생리학적으로 허용되는 담체를 포함하는 조성물.
- 개체내에서 면역 반응을 생성시키는 방법으로서, 약제학적 유효량으로 제 1항에 따른 화합물을 상기 개체에 투여하는 단계를 포함하는, 방법.
- 면역 반응을 조절하는 것이 유익할 수 있는, 질환 또는 장애를 지니는 개체를 치료학적으로 치료하는 방법으로서, 약제학적 유효량으로 제 1항에 따른 화합물을 상기 개체에 투여하는 단계를 포함하는, 방법.
- 제 4항에 있어서, 상기 질환 또는 장애가 암, 자가면역질환, 기도 염증, 염증성 질환, 감염성 질환, 피부질환, 알레르기, 천식 또는 병원균 또는 알레르겐에 의해 유발된 질환인, 방법.
- 제 4항에 있어서, 하나 이상의 화학치료 화합물, 표적화된 치료제, 백신, 항원, 항체, 세포독성제, 알레르겐, 항생제, 안티센스 올리고뉴클레오티드, TLR 효능제, 키나아제 억제제, 펩티드, 단백질, DNA 백신, 애주번트, 동시-자극분자(co-stimulatory molecules) 또는 이의 조합물을 투여하는 단계를 추가로 포함하는, 방법.
- 면역 반응을 조절하는 것이 유익할 수 있는 질환 또는 장애를 지니는 개체를 예방학적으로 치료하는 방법으로서, 약제학적 유효량으로 제 1항에 따른 화합물을 상기 개체에 투여하는 단계를 포함하는, 방법.
- 제 7항에 있어서, 상기 질환 또는 장애가 암, 자가면역질환, 기도 염증, 염증성 질환, 감염성 질환, 피부질환, 알레르기, 천식 또는 개체내의 병원균 또는 알레르겐에 의해 초래된 질환인, 방법.
- 제 7항에 있어서, 하나 이상의 화학치료 화합물, 표적화된 치료제, 백신, 항원, 항체, 세포독성제, 알레르겐, 항생제, 안티센스 올리고뉴클레오티드, TLR 효능제, 키나아제 억제제, 펩티드, 단백질, DNA 백신, 애주번트, 동시-자극 분자 또는 이의 조합물을 투여하는 단계를 추가로 포함하는, 방법.
Applications Claiming Priority (8)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US95325107P | 2007-08-01 | 2007-08-01 | |
| US60/953,251 | 2007-08-01 | ||
| US98360107P | 2007-10-30 | 2007-10-30 | |
| US60/983,601 | 2007-10-30 | ||
| US98715107P | 2007-11-12 | 2007-11-12 | |
| US60/987,151 | 2007-11-12 | ||
| US1529207P | 2007-12-20 | 2007-12-20 | |
| US61/015,292 | 2007-12-20 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20100053598A true KR20100053598A (ko) | 2010-05-20 |
Family
ID=40305273
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020107004710A KR20100053598A (ko) | 2007-08-01 | 2008-07-31 | Tlr9의 신규한 합성 효능제 |
Country Status (13)
| Country | Link |
|---|---|
| US (2) | US7960362B2 (ko) |
| EP (3) | EP2650369B1 (ko) |
| JP (2) | JP5563455B2 (ko) |
| KR (1) | KR20100053598A (ko) |
| CN (3) | CN105177014B (ko) |
| AU (1) | AU2008282172B2 (ko) |
| BR (1) | BRPI0813981A2 (ko) |
| CA (1) | CA2693266C (ko) |
| ES (2) | ES2539353T3 (ko) |
| HK (1) | HK1216430A1 (ko) |
| IN (1) | IN2010KN00195A (ko) |
| RU (1) | RU2468819C2 (ko) |
| WO (1) | WO2009018431A2 (ko) |
Families Citing this family (32)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7276489B2 (en) * | 2002-10-24 | 2007-10-02 | Idera Pharmaceuticals, Inc. | Modulation of immunostimulatory properties of oligonucleotide-based compounds by optimal presentation of 5′ ends |
| US8158768B2 (en) * | 2002-12-23 | 2012-04-17 | Dynavax Technologies Corporation | Immunostimulatory sequence oligonucleotides and methods of using the same |
| US7354907B2 (en) * | 2003-02-07 | 2008-04-08 | Idera Pharmaceuticals, Inc. | Short immunomodulatory oligonucleotides |
| CA2528597C (en) * | 2003-06-11 | 2014-08-05 | Hybridon, Inc. | Stabilized immunomodulatory oligonucleotides |
| EP2363141A1 (en) * | 2003-07-15 | 2011-09-07 | Idera Pharmaceuticals, Inc. | Compsition comprising two oligonucleotides linked directly at their 3'ends wherein at leat one oligonucleotide has an accessible 5'end and the compound further comprising IL-2 used for synergistically stimulating an immune response in a patient. |
| EP1663316A2 (en) * | 2003-09-25 | 2006-06-07 | Coley Pharmaceutical Group, Inc. | Nucleic acid lipophilic conjugates |
| JP5563455B2 (ja) * | 2007-08-01 | 2014-07-30 | イデラ ファーマシューティカルズ インコーポレイテッド | Tlr9の新規な合成アゴニスト |
| US20110293565A1 (en) * | 2009-01-30 | 2011-12-01 | Idera Pharmaceuticals, Inc. | Novel synthetic agonists of tlr9 |
| PT2411521E (pt) | 2009-03-25 | 2015-04-21 | Univ Texas | Composições para estimulação de resistência imunitária inata de mamíferos contra patogénicos |
| US20120045433A1 (en) * | 2010-08-17 | 2012-02-23 | Kapil Dhingra | Combination therapy |
| US8709419B2 (en) | 2010-08-17 | 2014-04-29 | Hoffmann-La Roche, Inc. | Combination therapy |
| US9295669B2 (en) | 2010-12-14 | 2016-03-29 | Hoffman La-Roche Inc. | Combination therapy for proliferative disorders |
| BR112015016420B1 (pt) * | 2013-01-08 | 2022-12-06 | Idera Pharmaceuticals, Inc | Composto de oligonucleotídeo imunorregulatório, composição farmacêutica e uso do composto iro ou da composição farmacêutica |
| AR095882A1 (es) | 2013-04-22 | 2015-11-18 | Hoffmann La Roche | Terapia de combinación de anticuerpos contra csf-1r humano con un agonista de tlr9 |
| GB2514591A (en) * | 2013-05-30 | 2014-12-03 | Mologen Ag | Predictive biomarker for cancer therapy |
| TR201908550T4 (tr) | 2014-06-04 | 2019-07-22 | Exicure Inc | Profilaktik veya terapötik uygulamalar için lipozomal sferik nükleik asitler tarafından immün modülatörlerin çok değerlikli teslimi. |
| WO2016040956A1 (en) * | 2014-09-12 | 2016-03-17 | Vantage Specialty Chemicals, Inc. | Derivatives of 1,3-propanediol |
| WO2016044839A2 (en) | 2014-09-19 | 2016-03-24 | The Board Of Regents Of The University Of Texas System | Compositions and methods for treating viral infections through stimulated innate immunity in combination with antiviral compounds |
| KR20170072244A (ko) * | 2014-10-10 | 2017-06-26 | 이데라 파마슈티칼즈, 인코포레이티드 | 관문 억제제를 가지는 tlr9 효능제를 이용한 암 치료 |
| US11213593B2 (en) | 2014-11-21 | 2022-01-04 | Northwestern University | Sequence-specific cellular uptake of spherical nucleic acid nanoparticle conjugates |
| WO2017052403A1 (ru) * | 2015-09-25 | 2017-03-30 | Анатолий Викторович ЗАЗУЛЯ | Изготовление таблетки с механизмом повышения терапевтической эффективности лекарственного средства нанодозой микрорнк |
| WO2018039629A2 (en) | 2016-08-25 | 2018-03-01 | Northwestern University | Micellar spherical nucleic acids from thermoresponsive, traceless templates |
| IL292658A (en) | 2016-09-15 | 2022-07-01 | Idera Pharmaceuticals Inc | Immune modulation with tlr9 agonists for cancer therapy |
| WO2018106959A1 (en) | 2016-12-07 | 2018-06-14 | Progenity Inc. | Gastrointestinal tract detection methods, devices and systems |
| EP3554344A1 (en) | 2016-12-14 | 2019-10-23 | Progenity, Inc. | Treatment of a disease of the gastrointestinal tract with a tlr modulator |
| US11433131B2 (en) | 2017-05-11 | 2022-09-06 | Northwestern University | Adoptive cell therapy using spherical nucleic acids (SNAs) |
| CN116813705A (zh) | 2017-07-05 | 2023-09-29 | 凯惠科技发展(上海)有限公司 | 一种肽类化合物、其应用及含其的组合物 |
| US11806364B2 (en) | 2017-09-28 | 2023-11-07 | Industry-Academic Cooperation Foundation, Yonsei University | Method for producing myeloid-derived suppressor cells, myeloid-derived suppressor cells produced thereby, and methods thereof |
| JP2022538690A (ja) | 2019-07-05 | 2022-09-05 | タンボ・インコーポレイテッド | トランス-シクロオクテン生体直交型薬剤並びに癌及び免疫療法における使用 |
| US20230107927A1 (en) | 2020-02-28 | 2023-04-06 | First Wave Bio, Inc. | Methods of treating iatrogenic autoimmune colitis |
| WO2022003598A1 (en) | 2020-07-02 | 2022-01-06 | Viiv Healthcare Company | Method of achieving hiv viral remission using long-acting antiretroviral agents |
| EP4295917A3 (en) | 2020-08-07 | 2024-02-28 | Tambo, Inc. | Trans-cyclooctene bioorthogonal agents and uses in cancer and immunotherapy |
Family Cites Families (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20030026782A1 (en) * | 1995-02-07 | 2003-02-06 | Arthur M. Krieg | Immunomodulatory oligonucleotides |
| CA2291483C (en) * | 1997-06-06 | 2012-09-18 | Dynavax Technologies Corporation | Immunostimulatory oligonucleotides, compositions thereof and methods of use thereof |
| US6562798B1 (en) * | 1998-06-05 | 2003-05-13 | Dynavax Technologies Corp. | Immunostimulatory oligonucleotides with modified bases and methods of use thereof |
| US6673613B2 (en) * | 2000-07-26 | 2004-01-06 | Cognis Corporation | Use of CYP52A2A promoter to increase gene expression in yeast |
| US6503734B1 (en) * | 2000-07-26 | 2003-01-07 | Cognis Corporation | Cytochrome b5 gene and protein of Candida tropicalis and methods relating thereto |
| RU2194502C2 (ru) * | 2000-12-27 | 2002-12-20 | Наровлянский Александр Наумович | Иммуномодулятор - метаболик - детоксикант - адаптоген - радиопротектор |
| ATE471374T1 (de) * | 2000-12-27 | 2010-07-15 | Dynavax Tech Corp | Immunomodulatorische polynukleotide und verfahren zur deren verwendung |
| CN100334228C (zh) * | 2001-06-21 | 2007-08-29 | 戴纳瓦克斯技术公司 | 嵌合免疫调制化合物及其使用方法 |
| US7276489B2 (en) | 2002-10-24 | 2007-10-02 | Idera Pharmaceuticals, Inc. | Modulation of immunostimulatory properties of oligonucleotide-based compounds by optimal presentation of 5′ ends |
| EP1992635B1 (en) * | 2002-12-23 | 2012-02-08 | Dynavax Technologies Corporation | Immunostimulatory sequence oligonucleotides and methods of using the same |
| CA2524071A1 (en) * | 2003-04-29 | 2004-11-11 | Centocor, Inc. | Toll-like receptor 9 effector agents and uses thereof |
| CA2528597C (en) * | 2003-06-11 | 2014-08-05 | Hybridon, Inc. | Stabilized immunomodulatory oligonucleotides |
| US20050244410A1 (en) * | 2004-04-29 | 2005-11-03 | Ashlyn Bassiri | Toll-like receptor 9 effector agents and uses thereof |
| NZ552522A (en) * | 2004-06-15 | 2009-04-30 | Idera Pharmaceuticals Inc | Immunostimulatory oligonucleotide multimers |
| CN104278037B (zh) * | 2005-10-12 | 2020-09-15 | 艾德拉药物股份有限公司 | 基于变异应答调制Toll样受体的免疫调节寡核苷酸(IRO)化合物 |
| CA2628306C (en) * | 2005-11-07 | 2014-06-17 | Sudhir Agrawal | Immunostimulatory oligonucleotide-based compounds with glycerol-linked dinucleotides and modified guanosines at cpg and uses thereof |
| CA2632940A1 (en) * | 2005-12-20 | 2007-07-05 | Idera Pharmaceuticals, Inc. | Immunostimulatory activity of palindromic immune modulatory oligonucleotides (imo tm) contiaining different lengths of palindromic segments |
| JP2010512421A (ja) * | 2006-12-12 | 2010-04-22 | イデラ ファーマシューティカルズ インコーポレイテッド | Tlr9の合成アゴニスト |
| US8188058B2 (en) * | 2007-04-19 | 2012-05-29 | University of Pittsburgh—of the Commonwealth System of Higher Education | Use of toll-like receptor-9 agonists, toll-like receptor-4 antagonists, and/or nuclear oligomerization domain-2 agonists for the treatment or prevention of toll-like receptor-4-associated disorders |
| JP5563455B2 (ja) * | 2007-08-01 | 2014-07-30 | イデラ ファーマシューティカルズ インコーポレイテッド | Tlr9の新規な合成アゴニスト |
-
2008
- 2008-07-31 JP JP2010520185A patent/JP5563455B2/ja active Active
- 2008-07-31 EP EP20130171674 patent/EP2650369B1/en active Active
- 2008-07-31 ES ES13171674.8T patent/ES2539353T3/es active Active
- 2008-07-31 BR BRPI0813981A patent/BRPI0813981A2/pt not_active IP Right Cessation
- 2008-07-31 AU AU2008282172A patent/AU2008282172B2/en active Active
- 2008-07-31 EP EP08796942A patent/EP2173912A4/en not_active Withdrawn
- 2008-07-31 IN IN195KON2010 patent/IN2010KN00195A/en unknown
- 2008-07-31 KR KR1020107004710A patent/KR20100053598A/ko not_active Application Discontinuation
- 2008-07-31 ES ES14183548.8T patent/ES2585239T3/es active Active
- 2008-07-31 RU RU2010107207/10A patent/RU2468819C2/ru active
- 2008-07-31 CN CN201510303003.7A patent/CN105177014B/zh active Active
- 2008-07-31 CN CN201210311690.3A patent/CN102864151B/zh active Active
- 2008-07-31 WO PCT/US2008/071738 patent/WO2009018431A2/en active Application Filing
- 2008-07-31 CA CA2693266A patent/CA2693266C/en active Active
- 2008-07-31 EP EP14183548.8A patent/EP2821488B1/en active Active
- 2008-07-31 CN CN2008801098527A patent/CN101878311A/zh active Pending
- 2008-07-31 US US12/183,439 patent/US7960362B2/en active Active
-
2011
- 2011-06-08 US US13/156,140 patent/US8361986B2/en active Active
-
2014
- 2014-06-11 JP JP2014120860A patent/JP5816720B2/ja active Active
-
2016
- 2016-04-18 HK HK16104381.1A patent/HK1216430A1/zh not_active IP Right Cessation
Also Published As
| Publication number | Publication date |
|---|---|
| EP2650369A1 (en) | 2013-10-16 |
| US8361986B2 (en) | 2013-01-29 |
| ES2585239T3 (es) | 2016-10-04 |
| EP2821488B1 (en) | 2016-07-27 |
| WO2009018431A2 (en) | 2009-02-05 |
| RU2468819C2 (ru) | 2012-12-10 |
| JP5563455B2 (ja) | 2014-07-30 |
| CN105177014B (zh) | 2018-04-06 |
| US20090053206A1 (en) | 2009-02-26 |
| BRPI0813981A2 (pt) | 2017-05-09 |
| ES2539353T3 (es) | 2015-06-30 |
| RU2010107207A (ru) | 2011-09-10 |
| CN102864151A (zh) | 2013-01-09 |
| CN101878311A (zh) | 2010-11-03 |
| US20110311518A1 (en) | 2011-12-22 |
| US7960362B2 (en) | 2011-06-14 |
| EP2173912A2 (en) | 2010-04-14 |
| JP5816720B2 (ja) | 2015-11-18 |
| WO2009018431A3 (en) | 2009-12-30 |
| EP2821488A3 (en) | 2015-04-29 |
| AU2008282172B2 (en) | 2014-05-22 |
| JP2010535242A (ja) | 2010-11-18 |
| EP2821488A2 (en) | 2015-01-07 |
| IN2010KN00195A (ko) | 2015-08-28 |
| CN105177014A (zh) | 2015-12-23 |
| CN102864151B (zh) | 2015-07-08 |
| EP2173912A4 (en) | 2013-03-20 |
| AU2008282172A1 (en) | 2009-02-05 |
| CA2693266A1 (en) | 2009-02-05 |
| JP2014205691A (ja) | 2014-10-30 |
| HK1216430A1 (zh) | 2016-11-11 |
| EP2650369B1 (en) | 2015-04-29 |
| CA2693266C (en) | 2015-06-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP2650369B1 (en) | Novel synthetic agonists of TLR9 | |
| US7786089B2 (en) | Immunostimulatory activity of immune modulatory oligonucleotides (IMO™) containing different lengths of palindromic segments | |
| KR101126030B1 (ko) | 사이토킨 및/또는 화학치료제 또는 방사선 치료와 연계하여면역자극 올리고누클레오티드 및/또는 이뮤노머 화합물을이용하여 면역계를 공동 상승 자극시키는 방법 | |
| US20110293565A1 (en) | Novel synthetic agonists of tlr9 | |
| US20080279785A1 (en) | Novel synthetic agonists of toll-like receptors containing CG dinucleotide modifications | |
| KR20060012622A (ko) | 화학요법제와 함께 이뮤노머를 사용하는 상승적 암 치료방법 | |
| AU2014203624B2 (en) | Novel synthetic agonists of TLR9 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |