KR100968354B1 - 바이오센서 디바이스에서의 적절한 샘플 볼륨의 결정 - Google Patents
바이오센서 디바이스에서의 적절한 샘플 볼륨의 결정 Download PDFInfo
- Publication number
- KR100968354B1 KR100968354B1 KR1020020061869A KR20020061869A KR100968354B1 KR 100968354 B1 KR100968354 B1 KR 100968354B1 KR 1020020061869 A KR1020020061869 A KR 1020020061869A KR 20020061869 A KR20020061869 A KR 20020061869A KR 100968354 B1 KR100968354 B1 KR 100968354B1
- Authority
- KR
- South Korea
- Prior art keywords
- sample
- volume
- cell
- biological sample
- biosensor
- Prior art date
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N27/00—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means
- G01N27/02—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means by investigating impedance
- G01N27/22—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means by investigating impedance by investigating capacitance
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N27/00—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means
- G01N27/26—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means by investigating electrochemical variables; by using electrolysis or electrophoresis
- G01N27/28—Electrolytic cell components
- G01N27/30—Electrodes, e.g. test electrodes; Half-cells
- G01N27/327—Biochemical electrodes, e.g. electrical or mechanical details for in vitro measurements
- G01N27/3271—Amperometric enzyme electrodes for analytes in body fluids, e.g. glucose in blood
- G01N27/3274—Corrective measures, e.g. error detection, compensation for temperature or hematocrit, calibration
Abstract
Description
Claims (16)
- 전기화학적 바이오센서(electrochemical biosensor) 내에 보유된 생물학적 샘플의 볼륨을 결정하는 방법에 있어서:선택된 진폭과 선택된 주파수를 갖는 교류 전압을 상기 바이오센서에 인가하는 단계;상기 교류 전압을 인가함으로써 발생된 전류를 측정하는 단계;상기 측정된 전류로부터 상기 바이오센서의 커패시턴스를 결정하는 단계;상기 결정된 커패시턴스에 기초하여 상기 샘플과 접촉하는 상기 바이오센서의 표면적을 결정하는 단계;상기 결정된 표면적에 기초하여 상기 바이오센서 내의 상기 샘플의 볼륨을 결정하는 단계; 및상기 결정된 샘플의 볼륨에 기초하여 상기 생물학적 샘플의 적어도 하나의 특징을 측정하는 단계를 포함하는, 생물학적 샘플의 볼륨을 결정하는 방법.
- 제 1 항에 있어서,상기 샘플 볼륨이 상기 샘플의 상기 특징을 측정하기에 적절한지의 여부를 결정하는 단계를 더 포함하는, 생물학적 샘플의 볼륨을 결정하는 방법.
- 제 2 항에 있어서,상기 샘플 볼륨이 적절하다는 결정에 기초하여 상기 샘플 측정치 내에 존재하는 하나 이상의 선택된 피분석물들(analytes)의 농도를 측정하는 단계를 더 포함하는, 생물학적 샘플의 볼륨을 결정하는 방법.
- 제 2 항에 있어서,상기 샘플 볼륨이 부적절하다는 결정에 기초하여, 상기 부적절한 샘플 볼륨을 보상하는 단계를 더 포함하는, 생물학적 샘플의 볼륨을 결정하는 방법.
- 제 4 항에 있어서,상기 부적절한 샘플 볼륨을 보상하는 단계는, 상기 부적절한 샘플 볼륨을 갖는 상기 바이오센서의 커패시턴스에 대한, 상기 샘플로 완전히 채워졌을 때의 상기 바이오센서의 커패시턴스의 비율을 결정하는 것을 포함하는, 생물학적 샘플의 볼륨을 결정하는 방법.
- 제 1 항에 있어서,상기 측정된 전류로부터 상기 바이오센서의 저항을 결정하는 단계를 더 포함하는, 생물학적 샘플의 볼륨을 결정하는 방법.
- 제 6 항에 있어서,상기 결정된 커패시턴스 및 상기 결정된 저항에 기초하여 상기 샘플과 접촉하는 상기 바이오센서의 표면적을 결정하는 단계를 더 포함하는, 생물학적 샘플의 볼륨을 결정하는 방법.
- 제 1 항에 있어서,직류 전압을 상기 바이오센서에 인가하는 단계를 더 포함하는, 생물학적 샘플의 볼륨을 결정하는 방법.
- 제 8 항에 있어서,상기 직류 전압 및 상기 교류 전압은 동시에 인가되는, 생물학적 샘플의 볼륨을 결정하는 방법.
- 삭제
- 전기화학적 바이오센서 내에 보유된 생물학적 샘플의 적어도 하나의 특징을 측정하는 방법에 있어서:상기 생물학적 샘플의 볼륨을 결정하는 단계;상기 생물학적 샘플의 볼륨의 적정성(adequacy)을 결정하는 단계;상기 볼륨이 부적절하다는 결정에 기초하여 전기화학적 바이오센서 내에 보유된 생물학적 샘플의 부적절한 볼륨을 보상하는 단계; 및상기 보상된 샘플의 볼륨에 기초하여 상기 생물학적 샘플의 상기 적어도 하나의 특징을 정확히 측정하는 단계를 포함하는, 생물학적 샘플의 적어도 하나의 특징을 측정하는 방법.
- 제 11 항에 있어서,상기 적어도 하나의 특징은 상기 샘플 내에 존재하는 하나 이상의 선택된 피분석물들의 농도인, 생물학적 샘플의 적어도 하나의 특징을 측정하는 방법.
- 표면적과 볼륨을 갖는 전기화학적 셀 내의 생물학적 샘플의 볼륨을 결정하는 시스템에 있어서:상기 전기화학적 셀에 전압을 인가하도록 구성된 전압원;상기 전압이 상기 셀에 인가될 때 상기 셀에 의해 발생된 전류를 측정하는 수단;상기 측정된 전류로부터 상기 셀의 커패시턴스를 유도하는 수단;상기 셀 커패시턴스로부터 상기 생물학적 샘플에 의해 덮여진 상기 셀의 표면적을 유도하는 수단;상기 셀 표면적으로부터 상기 생물학적 샘플의 볼륨을 유도하는 수단; 및상기 유도된 샘플의 볼륨에 기초하여 상기 생물학적 샘플의 적어도 하나의 특징을 정확히 측정하는 수단을 포함하는, 생물학적 샘플의 볼륨을 결정하는 시스템.
- 제 13 항에 있어서,상기 샘플 볼륨이 상기 생물학적 샘플 내의 하나 이상의 선택된 피분석물들의 농도를 정확히 측정하기에 적절한지의 여부를 결정하는 수단을 더 포함하는, 생물학적 샘플의 볼륨을 결정하는 시스템.
- 제 14 항에 있어서,상기 생물학적 샘플 내의 상기 하나 이상의 선택된 피분석물들의 농도를 측정하는 수단; 및상기 생물학적 샘플 내의 상기 하나 이상의 선택된 피분석물들의 농도를 측정하는 중에 부적절하다고 결정된 상기 샘플 볼륨을 보상하는 수단을 더 포함하는, 생물학적 샘플의 볼륨을 결정하는 시스템.
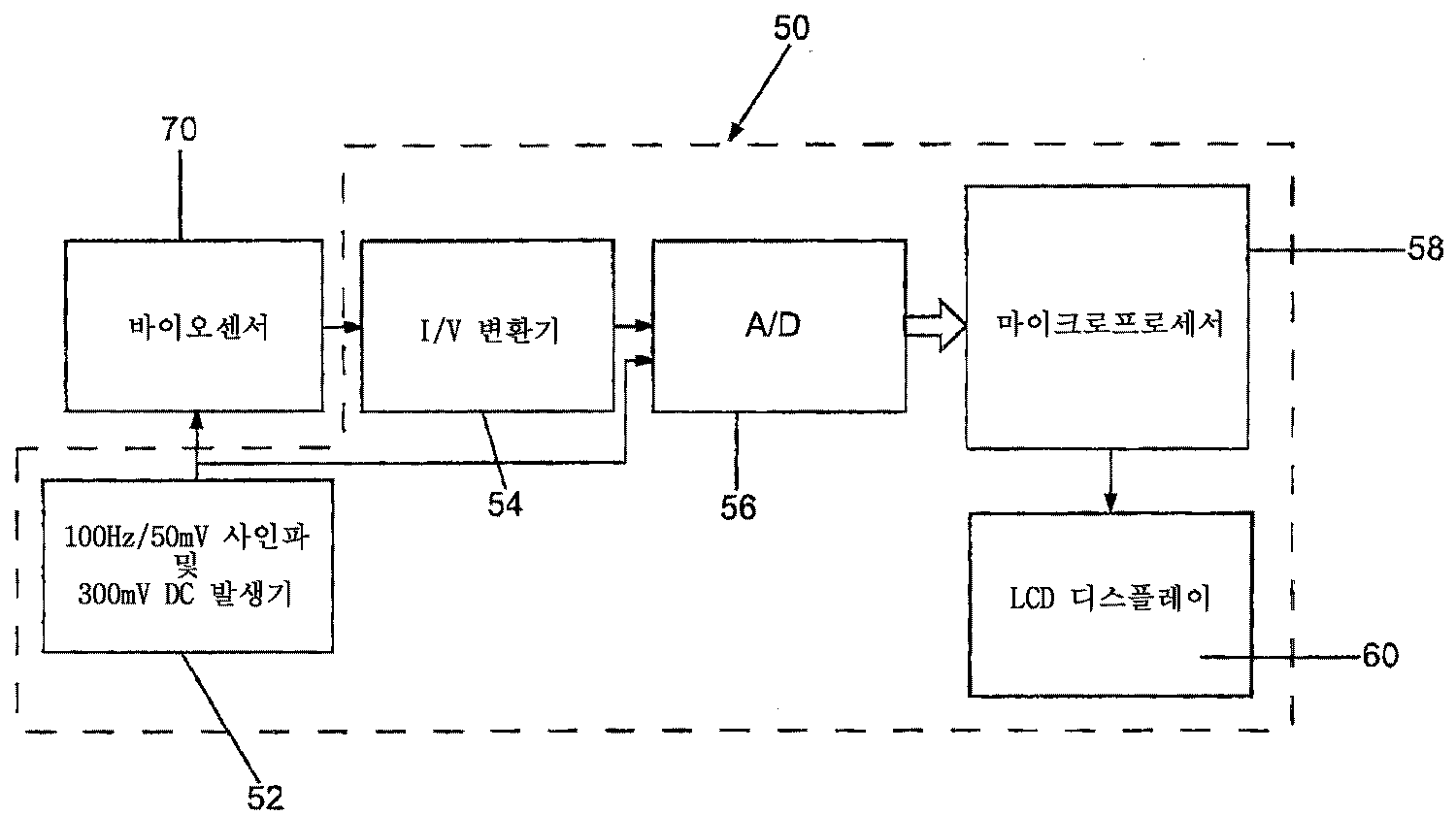
- 전기화학적 셀을 사용하고, 상기 전기화학적 셀 내에 보유된 생물학적 샘플 내의 하나 이상의 선택된 피분석물들의 농도를 측정하도록 구성된 계기(meter)를 사용하는 시스템에 있어서:교류 및/또는 직류 전압을 상기 셀에 인가하도록 구성된 전압원; 및상기 셀에 전압이 인가될 때 상기 전기화학적 셀에 의해 발생된 전류를 수신하고, 상기 발생된 전류를 측정하고, 상기 측정된 전류로부터 상기 셀의 커패시턴스를 결정하고, 상기 셀 커패시턴스로부터 상기 생물학적 샘플에 의해 덮여진 상기 셀의 표면적을 결정하고, 상기 생물학적 샘플에 의해 덮여진 상기 셀 표면적으로부터 상기 생물학적 샘플의 볼륨을 결정하도록 구성된 전기회로를 포함하는, 시스템.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US09/974,597 US6797150B2 (en) | 2001-10-10 | 2001-10-10 | Determination of sample volume adequacy in biosensor devices |
| US09/974,597 | 2001-10-10 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20030030955A KR20030030955A (ko) | 2003-04-18 |
| KR100968354B1 true KR100968354B1 (ko) | 2010-07-06 |
Family
ID=25522238
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020020061869A KR100968354B1 (ko) | 2001-10-10 | 2002-10-10 | 바이오센서 디바이스에서의 적절한 샘플 볼륨의 결정 |
Country Status (12)
| Country | Link |
|---|---|
| US (2) | US6797150B2 (ko) |
| JP (1) | JP4354168B2 (ko) |
| KR (1) | KR100968354B1 (ko) |
| CN (3) | CN102621211B (ko) |
| CA (2) | CA2838176C (ko) |
| CZ (1) | CZ20023368A3 (ko) |
| HK (1) | HK1055463A1 (ko) |
| IL (1) | IL152214A0 (ko) |
| MX (1) | MXPA02010106A (ko) |
| PL (1) | PL208126B1 (ko) |
| RU (1) | RU2292841C2 (ko) |
| TW (1) | TW581866B (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101582098B1 (ko) * | 2015-09-08 | 2016-01-04 | 대윤계기산업주식회사 | 전자기 유도식 전기전도도 센서를 이용한 고농도 액체 측정기 |
Families Citing this family (150)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6036924A (en) | 1997-12-04 | 2000-03-14 | Hewlett-Packard Company | Cassette of lancet cartridges for sampling blood |
| US8071384B2 (en) | 1997-12-22 | 2011-12-06 | Roche Diagnostics Operations, Inc. | Control and calibration solutions and methods for their use |
| US6391005B1 (en) | 1998-03-30 | 2002-05-21 | Agilent Technologies, Inc. | Apparatus and method for penetration with shaft having a sensor for sensing penetration depth |
| US20050103624A1 (en) | 1999-10-04 | 2005-05-19 | Bhullar Raghbir S. | Biosensor and method of making |
| US8641644B2 (en) | 2000-11-21 | 2014-02-04 | Sanofi-Aventis Deutschland Gmbh | Blood testing apparatus having a rotatable cartridge with multiple lancing elements and testing means |
| DE60238119D1 (de) | 2001-06-12 | 2010-12-09 | Pelikan Technologies Inc | Elektrisches betätigungselement für eine lanzette |
| US7316700B2 (en) | 2001-06-12 | 2008-01-08 | Pelikan Technologies, Inc. | Self optimizing lancing device with adaptation means to temporal variations in cutaneous properties |
| US9427532B2 (en) | 2001-06-12 | 2016-08-30 | Sanofi-Aventis Deutschland Gmbh | Tissue penetration device |
| US7699791B2 (en) | 2001-06-12 | 2010-04-20 | Pelikan Technologies, Inc. | Method and apparatus for improving success rate of blood yield from a fingerstick |
| US8337419B2 (en) | 2002-04-19 | 2012-12-25 | Sanofi-Aventis Deutschland Gmbh | Tissue penetration device |
| US9226699B2 (en) | 2002-04-19 | 2016-01-05 | Sanofi-Aventis Deutschland Gmbh | Body fluid sampling module with a continuous compression tissue interface surface |
| US7749174B2 (en) | 2001-06-12 | 2010-07-06 | Pelikan Technologies, Inc. | Method and apparatus for lancet launching device intergrated onto a blood-sampling cartridge |
| US7981056B2 (en) | 2002-04-19 | 2011-07-19 | Pelikan Technologies, Inc. | Methods and apparatus for lancet actuation |
| US9795747B2 (en) | 2010-06-02 | 2017-10-24 | Sanofi-Aventis Deutschland Gmbh | Methods and apparatus for lancet actuation |
| US7025774B2 (en) | 2001-06-12 | 2006-04-11 | Pelikan Technologies, Inc. | Tissue penetration device |
| EP1404232B1 (en) | 2001-06-12 | 2009-12-02 | Pelikan Technologies Inc. | Blood sampling apparatus and method |
| US6797150B2 (en) * | 2001-10-10 | 2004-09-28 | Lifescan, Inc. | Determination of sample volume adequacy in biosensor devices |
| US6872298B2 (en) * | 2001-11-20 | 2005-03-29 | Lifescan, Inc. | Determination of sample volume adequacy in biosensor devices |
| US6856125B2 (en) * | 2001-12-12 | 2005-02-15 | Lifescan, Inc. | Biosensor apparatus and method with sample type and volume detection |
| ES2581779T3 (es) | 2002-02-10 | 2016-09-07 | Agamatrix, Inc | Método para ensayo de propiedades electroquímicas |
| CN100487441C (zh) * | 2002-03-08 | 2009-05-13 | 爱科来株式会社 | 具有信息识别功能的分析装置及其所用分析用部件以及分析装置和分析用部件的组件 |
| AU2003233468A1 (en) * | 2002-04-05 | 2003-10-27 | Eyelab Group, Llc | Monitoring blood substances using self-sampled tears |
| US9795334B2 (en) | 2002-04-19 | 2017-10-24 | Sanofi-Aventis Deutschland Gmbh | Method and apparatus for penetrating tissue |
| US7648468B2 (en) | 2002-04-19 | 2010-01-19 | Pelikon Technologies, Inc. | Method and apparatus for penetrating tissue |
| US7371247B2 (en) | 2002-04-19 | 2008-05-13 | Pelikan Technologies, Inc | Method and apparatus for penetrating tissue |
| US7175642B2 (en) | 2002-04-19 | 2007-02-13 | Pelikan Technologies, Inc. | Methods and apparatus for lancet actuation |
| US9314194B2 (en) | 2002-04-19 | 2016-04-19 | Sanofi-Aventis Deutschland Gmbh | Tissue penetration device |
| US7229458B2 (en) | 2002-04-19 | 2007-06-12 | Pelikan Technologies, Inc. | Method and apparatus for penetrating tissue |
| US7491178B2 (en) | 2002-04-19 | 2009-02-17 | Pelikan Technologies, Inc. | Method and apparatus for penetrating tissue |
| US8267870B2 (en) | 2002-04-19 | 2012-09-18 | Sanofi-Aventis Deutschland Gmbh | Method and apparatus for body fluid sampling with hybrid actuation |
| US8702624B2 (en) | 2006-09-29 | 2014-04-22 | Sanofi-Aventis Deutschland Gmbh | Analyte measurement device with a single shot actuator |
| US8372016B2 (en) | 2002-04-19 | 2013-02-12 | Sanofi-Aventis Deutschland Gmbh | Method and apparatus for body fluid sampling and analyte sensing |
| US7717863B2 (en) | 2002-04-19 | 2010-05-18 | Pelikan Technologies, Inc. | Method and apparatus for penetrating tissue |
| US7713214B2 (en) | 2002-04-19 | 2010-05-11 | Pelikan Technologies, Inc. | Method and apparatus for a multi-use body fluid sampling device with optical analyte sensing |
| US7232451B2 (en) | 2002-04-19 | 2007-06-19 | Pelikan Technologies, Inc. | Method and apparatus for penetrating tissue |
| US7909778B2 (en) | 2002-04-19 | 2011-03-22 | Pelikan Technologies, Inc. | Method and apparatus for penetrating tissue |
| US7901362B2 (en) | 2002-04-19 | 2011-03-08 | Pelikan Technologies, Inc. | Method and apparatus for penetrating tissue |
| US7674232B2 (en) | 2002-04-19 | 2010-03-09 | Pelikan Technologies, Inc. | Method and apparatus for penetrating tissue |
| US7892183B2 (en) | 2002-04-19 | 2011-02-22 | Pelikan Technologies, Inc. | Method and apparatus for body fluid sampling and analyte sensing |
| US9248267B2 (en) | 2002-04-19 | 2016-02-02 | Sanofi-Aventis Deustchland Gmbh | Tissue penetration device |
| US8221334B2 (en) | 2002-04-19 | 2012-07-17 | Sanofi-Aventis Deutschland Gmbh | Method and apparatus for penetrating tissue |
| US7331931B2 (en) | 2002-04-19 | 2008-02-19 | Pelikan Technologies, Inc. | Method and apparatus for penetrating tissue |
| US8360992B2 (en) | 2002-04-19 | 2013-01-29 | Sanofi-Aventis Deutschland Gmbh | Method and apparatus for penetrating tissue |
| US7291117B2 (en) | 2002-04-19 | 2007-11-06 | Pelikan Technologies, Inc. | Method and apparatus for penetrating tissue |
| US7976476B2 (en) | 2002-04-19 | 2011-07-12 | Pelikan Technologies, Inc. | Device and method for variable speed lancet |
| US7297122B2 (en) | 2002-04-19 | 2007-11-20 | Pelikan Technologies, Inc. | Method and apparatus for penetrating tissue |
| US7547287B2 (en) | 2002-04-19 | 2009-06-16 | Pelikan Technologies, Inc. | Method and apparatus for penetrating tissue |
| US8579831B2 (en) | 2002-04-19 | 2013-11-12 | Sanofi-Aventis Deutschland Gmbh | Method and apparatus for penetrating tissue |
| US8784335B2 (en) | 2002-04-19 | 2014-07-22 | Sanofi-Aventis Deutschland Gmbh | Body fluid sampling device with a capacitive sensor |
| US8574895B2 (en) | 2002-12-30 | 2013-11-05 | Sanofi-Aventis Deutschland Gmbh | Method and apparatus using optical techniques to measure analyte levels |
| US8262614B2 (en) | 2003-05-30 | 2012-09-11 | Pelikan Technologies, Inc. | Method and apparatus for fluid injection |
| US7850621B2 (en) | 2003-06-06 | 2010-12-14 | Pelikan Technologies, Inc. | Method and apparatus for body fluid sampling and analyte sensing |
| WO2006001797A1 (en) | 2004-06-14 | 2006-01-05 | Pelikan Technologies, Inc. | Low pain penetrating |
| US7488601B2 (en) * | 2003-06-20 | 2009-02-10 | Roche Diagnostic Operations, Inc. | System and method for determining an abused sensor during analyte measurement |
| US8148164B2 (en) | 2003-06-20 | 2012-04-03 | Roche Diagnostics Operations, Inc. | System and method for determining the concentration of an analyte in a sample fluid |
| US7645421B2 (en) | 2003-06-20 | 2010-01-12 | Roche Diagnostics Operations, Inc. | System and method for coding information on a biosensor test strip |
| US8206565B2 (en) | 2003-06-20 | 2012-06-26 | Roche Diagnostics Operation, Inc. | System and method for coding information on a biosensor test strip |
| US8679853B2 (en) | 2003-06-20 | 2014-03-25 | Roche Diagnostics Operations, Inc. | Biosensor with laser-sealed capillary space and method of making |
| US7718439B2 (en) | 2003-06-20 | 2010-05-18 | Roche Diagnostics Operations, Inc. | System and method for coding information on a biosensor test strip |
| KR100785670B1 (ko) | 2003-06-20 | 2007-12-14 | 에프. 호프만-라 로슈 아게 | 폭이 좁은 균질한 시약 시트립을 제조하는 방법 및 시약 |
| US8058077B2 (en) | 2003-06-20 | 2011-11-15 | Roche Diagnostics Operations, Inc. | Method for coding information on a biosensor test strip |
| US7452457B2 (en) | 2003-06-20 | 2008-11-18 | Roche Diagnostics Operations, Inc. | System and method for analyte measurement using dose sufficiency electrodes |
| US8071030B2 (en) | 2003-06-20 | 2011-12-06 | Roche Diagnostics Operations, Inc. | Test strip with flared sample receiving chamber |
| US7645373B2 (en) | 2003-06-20 | 2010-01-12 | Roche Diagnostic Operations, Inc. | System and method for coding information on a biosensor test strip |
| WO2005033659A2 (en) | 2003-09-29 | 2005-04-14 | Pelikan Technologies, Inc. | Method and apparatus for an improved sample capture device |
| EP1680014A4 (en) | 2003-10-14 | 2009-01-21 | Pelikan Technologies Inc | METHOD AND APPARATUS PROVIDING A VARIABLE USER INTERFACE |
| US7822454B1 (en) | 2005-01-03 | 2010-10-26 | Pelikan Technologies, Inc. | Fluid sampling device with improved analyte detecting member configuration |
| US8668656B2 (en) | 2003-12-31 | 2014-03-11 | Sanofi-Aventis Deutschland Gmbh | Method and apparatus for improving fluidic flow and sample capture |
| CN1918471B (zh) * | 2004-02-06 | 2010-12-29 | 拜尔健康护理有限责任公司 | 电化学生物传感器 |
| CN1938589B (zh) * | 2004-03-31 | 2011-12-28 | 拜尔健康护理有限责任公司 | 用于实现用于生物传感器的基于阈值的校正函数的方法和装置 |
| WO2006011062A2 (en) | 2004-05-20 | 2006-02-02 | Albatros Technologies Gmbh & Co. Kg | Printable hydrogel for biosensors |
| US9775553B2 (en) | 2004-06-03 | 2017-10-03 | Sanofi-Aventis Deutschland Gmbh | Method and apparatus for a fluid sampling device |
| EP1765194A4 (en) | 2004-06-03 | 2010-09-29 | Pelikan Technologies Inc | METHOD AND APPARATUS FOR MANUFACTURING A DEVICE FOR SAMPLING LIQUIDS |
| US7569126B2 (en) | 2004-06-18 | 2009-08-04 | Roche Diagnostics Operations, Inc. | System and method for quality assurance of a biosensor test strip |
| EP1839044B1 (en) * | 2004-12-27 | 2017-06-07 | Becton Dickinson and Company | System for determining the presence or absence of microbes in a specimen |
| US8652831B2 (en) | 2004-12-30 | 2014-02-18 | Sanofi-Aventis Deutschland Gmbh | Method and apparatus for analyte measurement test time |
| AU2011202737B2 (en) * | 2005-04-15 | 2012-05-03 | Agamatrix, Inc. | Determination of partial fill in electrochemical strips |
| US7547382B2 (en) * | 2005-04-15 | 2009-06-16 | Agamatrix, Inc. | Determination of partial fill in electrochemical strips |
| EP3483598A1 (en) * | 2005-09-30 | 2019-05-15 | Ascensia Diabetes Care Holdings AG | Gated voltammetry |
| US7955484B2 (en) * | 2005-12-14 | 2011-06-07 | Nova Biomedical Corporation | Glucose biosensor and method |
| EP1813937A1 (de) * | 2006-01-25 | 2007-08-01 | Roche Diagnostics GmbH | Elektrochemisches Biosensor-Analysesystem |
| US8529751B2 (en) | 2006-03-31 | 2013-09-10 | Lifescan, Inc. | Systems and methods for discriminating control solution from a physiological sample |
| EP2010669A4 (en) * | 2006-04-12 | 2010-11-17 | Astrazeneca Ab | METHOD FOR DETERMINING THE ACTIVITY OF A PROTEASE IN A SAMPLE |
| US7966859B2 (en) * | 2006-05-03 | 2011-06-28 | Bayer Healthcare Llc | Underfill detection system for a biosensor |
| US8033186B2 (en) * | 2006-10-06 | 2011-10-11 | Boule Medical Ab | Device for extraction of a partially defined sample volume from a larger volume |
| US20090288964A1 (en) * | 2006-12-13 | 2009-11-26 | Sung-Kwon Jung | Biosensor with coded information and method for manufacturing the same |
| US8758582B2 (en) * | 2007-07-23 | 2014-06-24 | Agamatrix, Inc. | Electrochemical test strip |
| WO2009020690A1 (en) * | 2007-08-06 | 2009-02-12 | Bayer Healthcare Llc | System and method for automatic calibration |
| KR100915383B1 (ko) * | 2007-09-04 | 2009-09-03 | 주식회사 휴빛 | 바이오센서 및 바이오센서 측정기 |
| US8778168B2 (en) | 2007-09-28 | 2014-07-15 | Lifescan, Inc. | Systems and methods of discriminating control solution from a physiological sample |
| US8241488B2 (en) * | 2007-11-06 | 2012-08-14 | Bayer Healthcare Llc | Auto-calibrating test sensors |
| US7809512B2 (en) * | 2007-11-11 | 2010-10-05 | Bayer Healthcare Llc | Biosensor coding system |
| US8603768B2 (en) * | 2008-01-17 | 2013-12-10 | Lifescan, Inc. | System and method for measuring an analyte in a sample |
| US20090205399A1 (en) * | 2008-02-15 | 2009-08-20 | Bayer Healthcare, Llc | Auto-calibrating test sensors |
| US8097146B2 (en) | 2008-03-27 | 2012-01-17 | Sensor Electronics Corporation | Device and method for monitoring an electrochemical gas sensor |
| EP2265324B1 (en) | 2008-04-11 | 2015-01-28 | Sanofi-Aventis Deutschland GmbH | Integrated analyte measurement system |
| AU2012201915C1 (en) * | 2008-06-09 | 2014-09-25 | Lifescan, Inc. | System and method for measuring an analyte in a sample |
| US8551320B2 (en) * | 2008-06-09 | 2013-10-08 | Lifescan, Inc. | System and method for measuring an analyte in a sample |
| CN102227636A (zh) * | 2008-09-30 | 2011-10-26 | 梅纳伊医疗科技有限公司 | 样品测量系统 |
| US8424763B2 (en) * | 2008-10-07 | 2013-04-23 | Bayer Healthcare Llc | Method of forming an auto-calibration circuit or label |
| MX2011005864A (es) | 2008-12-08 | 2011-06-20 | Bayer Healthcare Llc | Sistema biosensor con ajuste de señal. |
| US9375169B2 (en) | 2009-01-30 | 2016-06-28 | Sanofi-Aventis Deutschland Gmbh | Cam drive for managing disposable penetrating member actions with a single motor and motor and control system |
| US20110057671A1 (en) * | 2009-09-04 | 2011-03-10 | Lifescan Scotland, Ltd. | Methods, system and device to identify a type of test strip |
| CA2776332C (en) * | 2009-11-10 | 2018-05-01 | Bayer Healthcare Llc | Underfill recognition system for a biosensor |
| IL209760A (en) | 2009-12-11 | 2015-05-31 | Lifescan Scotland Ltd | A system and method for measuring filling is satisfactory |
| US8101065B2 (en) * | 2009-12-30 | 2012-01-24 | Lifescan, Inc. | Systems, devices, and methods for improving accuracy of biosensors using fill time |
| US8877034B2 (en) | 2009-12-30 | 2014-11-04 | Lifescan, Inc. | Systems, devices, and methods for measuring whole blood hematocrit based on initial fill velocity |
| US20110168575A1 (en) * | 2010-01-08 | 2011-07-14 | Roche Diaagnostics Operations, Inc. | Sample characterization based on ac measurement methods |
| BR112012021590A2 (pt) * | 2010-02-25 | 2016-09-13 | Lifescan Scotland Ltd | detecção de capacitância em ensaio eletroquímico |
| US20110208435A1 (en) | 2010-02-25 | 2011-08-25 | Lifescan Scotland Ltd. | Capacitance detection in electrochemical assays |
| US8773106B2 (en) * | 2010-02-25 | 2014-07-08 | Lifescan Scotland Limited | Capacitance detection in electrochemical assay with improved sampling time offset |
| US8742773B2 (en) | 2010-02-25 | 2014-06-03 | Lifescan Scotland Limited | Capacitance detection in electrochemical assay with improved response |
| MX2012010860A (es) * | 2010-03-22 | 2013-03-05 | Bayer Healthcare Llc | Compensacion residual para un biosensor. |
| GB201005359D0 (en) | 2010-03-30 | 2010-05-12 | Menai Medical Technologies Ltd | Sampling plate |
| GB201005357D0 (en) | 2010-03-30 | 2010-05-12 | Menai Medical Technologies Ltd | Sampling plate |
| US8965476B2 (en) | 2010-04-16 | 2015-02-24 | Sanofi-Aventis Deutschland Gmbh | Tissue penetration device |
| RU2566382C2 (ru) | 2010-06-07 | 2015-10-27 | БАЙЕР ХЕЛТКЭА ЭлЭлСи | Система управления недостаточным заполнением для биосенсора |
| CN103052881B (zh) | 2010-08-02 | 2014-11-05 | 西拉格国际有限责任公司 | 用于提高对于对照溶液的葡萄糖结果进行温度校正的准确度的系统和方法 |
| US8617370B2 (en) | 2010-09-30 | 2013-12-31 | Cilag Gmbh International | Systems and methods of discriminating between a control sample and a test fluid using capacitance |
| US8932445B2 (en) * | 2010-09-30 | 2015-01-13 | Cilag Gmbh International | Systems and methods for improved stability of electrochemical sensors |
| AU2010366640B2 (en) | 2010-12-31 | 2016-06-02 | Cilag Gmbh International | Systems and methods for high accuracy analyte measurement |
| TWI425211B (zh) * | 2011-04-12 | 2014-02-01 | Eps Bio Technology Corp | 電化學測試片及電化學測試方法 |
| US8888973B2 (en) * | 2011-07-29 | 2014-11-18 | Roche Diagnostics Operations, Inc. | Encoded biosensors and methods of manufacture and use thereof |
| US8580576B2 (en) | 2011-08-04 | 2013-11-12 | Cilag Gmbh International | Method for bodily fluid sample transfer during analyte determination |
| ES2663097T3 (es) | 2011-09-21 | 2018-04-11 | Ascensia Diabetes Care Holdings Ag | Biosensor con compensación de error |
| EP2602620A1 (en) * | 2011-12-07 | 2013-06-12 | Nxp B.V. | An electronic lateral flow test arrangement and method |
| RU2488104C1 (ru) * | 2012-01-27 | 2013-07-20 | Анатолий Иванович Мамаев | Способ определения электрических характеристик и/или идентификации биологических объектов и устройство для его осуществления |
| ITUD20120079A1 (it) | 2012-05-04 | 2013-11-05 | Ct Di Riferimento Oncologico | Metodo per l'analisi del processo di formazione di aggregati in un fluido biologico e relativa apparecchiatura di analisi |
| GB201209664D0 (en) * | 2012-05-30 | 2012-07-11 | Spd Swiss Prec Diagnostics Gmbh | Assay device |
| EP3101415A1 (en) | 2012-06-28 | 2016-12-07 | Siemens Healthcare Diagnostics Inc. | Reader device and method of signal amplification |
| RU2598162C1 (ru) | 2012-09-07 | 2016-09-20 | Цилаг Гмбх Интернэшнл | Электрохимические датчики и способ их изготовления |
| US20140134655A1 (en) | 2012-11-09 | 2014-05-15 | Cilag Gmbh International | System and method for detection of sample volume during initial sample fill of a biosensor to determine glucose concentration in fluid samples or sample fill error |
| US20140275903A1 (en) | 2013-03-14 | 2014-09-18 | Lifescan Scotland Limited | System and method for quick-access physiological measurement history |
| US9903879B2 (en) | 2013-03-14 | 2018-02-27 | Lifescan Scotland Limited | Method to allow for linking temporal record with physiological measurement in buttonless physiological meters |
| US10168313B2 (en) | 2013-03-15 | 2019-01-01 | Agamatrix, Inc. | Analyte detection meter and associated method of use |
| ITUD20130047A1 (it) | 2013-04-03 | 2014-10-04 | Ct Di Riferimento Oncologico | Apparecchiatura per l'analisi del processo di formazione di aggregati in un fluido biologico e relativo metodo di analisi |
| JP6521948B2 (ja) * | 2013-06-10 | 2019-05-29 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | 体液中の分析物を検出するための方法およびシステム |
| US9804112B2 (en) * | 2013-11-20 | 2017-10-31 | Transtech Systems, Inc. | Selective characterization of material under test (MUT) with electromagnetic impedance tomography and spectroscopy |
| GB201321430D0 (en) * | 2013-12-04 | 2014-01-15 | Spd Swiss Prec Diagnostics Gmbh | Assay device |
| WO2016097079A1 (en) | 2014-12-19 | 2016-06-23 | Roche Diagnostics Gmbh | Test element for electrochemically detecting at least one analyte |
| US10234376B2 (en) | 2015-05-12 | 2019-03-19 | Savannah River Nuclear Solutions, Llc | Non-contact monitoring of biofilms and corrosion on submerged surfaces with electrochemical impedance spectroscopy |
| US9739774B2 (en) | 2015-09-03 | 2017-08-22 | Nxp B.V. | Substance detection device |
| JP6403653B2 (ja) * | 2015-11-05 | 2018-10-10 | シラグ・ゲーエムベーハー・インターナショナルCilag GMBH International | 高精度分析物測定用システム及び方法 |
| JP6680702B2 (ja) * | 2017-01-27 | 2020-04-15 | シラグ・ゲーエムベーハー・インターナショナルCilag GMBH International | 高精度分析物測定用システム及び方法 |
| JP6609001B2 (ja) * | 2018-06-04 | 2019-11-20 | シラグ・ゲーエムベーハー・インターナショナル | 高精度分析物測定用システム及び方法 |
| CN109632918B (zh) * | 2019-01-02 | 2021-11-30 | 京东方科技集团股份有限公司 | 电化学检测模组和电化学检测方法 |
| CN109655513B (zh) * | 2019-01-25 | 2023-10-17 | 天津大学 | 一种自校准葡萄糖连续监测系统及其制备方法 |
| US20210197200A1 (en) * | 2019-12-30 | 2021-07-01 | Illumina, Inc. | Systems for Monitoring Fluidics in Reagent Cartridges and Related Methods |
| CN111982992B (zh) * | 2020-08-03 | 2022-05-03 | 南京工业大学 | 葡萄糖宽范围高精度自动检测方法和系统 |
| TWI799926B (zh) * | 2021-07-28 | 2023-04-21 | 五鼎生物技術股份有限公司 | 電化學檢測系統、測量儀及電化學檢測方法 |
Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4059169A (en) * | 1976-02-09 | 1977-11-22 | Hagen Winston H | Monitor for biological volume changes |
| US4810650A (en) * | 1986-09-22 | 1989-03-07 | Kell Douglas B | Determination of biomass |
| US5182193A (en) * | 1987-02-04 | 1993-01-26 | Kabushiki Kaisha Kobe Seiko Sho | Method for measuring biomass |
| JPH0996618A (ja) * | 1995-09-29 | 1997-04-08 | Fuji Koki:Kk | 冷媒量検出装置および冷媒状態検出装置 |
| WO1997039343A1 (en) * | 1996-04-17 | 1997-10-23 | British Nuclear Fuels Plc | Biosensors |
| JPH10206368A (ja) * | 1997-01-16 | 1998-08-07 | Able Kk | 水生動物量測定装置及び測定方法 |
| WO1999047907A1 (en) * | 1998-03-19 | 1999-09-23 | Orgenics Biosensors Ltd. | Device for the determination of blood clotting by capacitance or resistance |
Family Cites Families (30)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE148387C (ko) | 1902-06-24 | 1904-02-16 | ||
| DE208230C (ko) | 1908-04-05 | 1909-03-20 | ||
| JPS5912135B2 (ja) * | 1977-09-28 | 1984-03-21 | 松下電器産業株式会社 | 酵素電極 |
| EP0078636B2 (en) * | 1981-10-23 | 1997-04-02 | MediSense, Inc. | Sensor for components of a liquid mixture |
| JPS5913948A (ja) * | 1982-07-15 | 1984-01-24 | Shimadzu Corp | 静電容量式ヘマトクリツト測定装置 |
| US4932243A (en) | 1985-07-12 | 1990-06-12 | Axiomatics Corporation | Moisture measurement device |
| CA1259374A (en) * | 1985-11-19 | 1989-09-12 | Arnold L. Newman | Capacitive sensor for chemical analysis and measurement |
| US4940945A (en) * | 1987-11-02 | 1990-07-10 | Biologix Inc. | Interface circuit for use in a portable blood chemistry measuring apparatus |
| DE3923420A1 (de) | 1989-07-12 | 1989-12-07 | Thomas Dipl Chem Hinrichs | Kapazitives messverfahren fuer biosensoren |
| JPH0820412B2 (ja) * | 1990-07-20 | 1996-03-04 | 松下電器産業株式会社 | 使い捨てセンサを用いた定量分析方法、及び装置 |
| JPH04248447A (ja) * | 1991-02-01 | 1992-09-03 | Sanyo Electric Co Ltd | 血液分析装置 |
| JP3189416B2 (ja) * | 1992-09-25 | 2001-07-16 | 松下電器産業株式会社 | 液体の成分測定装置 |
| US5352351A (en) * | 1993-06-08 | 1994-10-04 | Boehringer Mannheim Corporation | Biosensing meter with fail/safe procedures to prevent erroneous indications |
| US5366609A (en) * | 1993-06-08 | 1994-11-22 | Boehringer Mannheim Corporation | Biosensing meter with pluggable memory key |
| DE4335241A1 (de) | 1993-10-15 | 1995-04-20 | Ekf Ind Elektronik Gmbh | Verfahren zur kontinuierlichen Analyse von Bestandteilen einer Flüssigkeit |
| US5650062A (en) | 1995-03-17 | 1997-07-22 | Matsushita Electric Industrial Co., Ltd. | Biosensor, and a method and a device for quantifying a substrate in a sample liquid using the same |
| US5628890A (en) | 1995-09-27 | 1997-05-13 | Medisense, Inc. | Electrochemical sensor |
| JP3394262B2 (ja) | 1997-02-06 | 2003-04-07 | セラセンス、インク. | 小体積インビトロ被検体センサー |
| US6645368B1 (en) | 1997-12-22 | 2003-11-11 | Roche Diagnostics Corporation | Meter and method of using the meter for determining the concentration of a component of a fluid |
| US6134461A (en) | 1998-03-04 | 2000-10-17 | E. Heller & Company | Electrochemical analyte |
| US6175752B1 (en) | 1998-04-30 | 2001-01-16 | Therasense, Inc. | Analyte monitoring device and methods of use |
| US6338790B1 (en) | 1998-10-08 | 2002-01-15 | Therasense, Inc. | Small volume in vitro analyte sensor with diffusible or non-leachable redox mediator |
| NL1012197C2 (nl) * | 1999-05-31 | 2000-12-01 | Univ Delft Tech | Inrichting voor het bepalen van een hoeveelheid van een vloeistof. |
| US6287451B1 (en) * | 1999-06-02 | 2001-09-11 | Handani Winarta | Disposable sensor and method of making |
| US6193873B1 (en) * | 1999-06-15 | 2001-02-27 | Lifescan, Inc. | Sample detection to initiate timing of an electrochemical assay |
| CA2305922C (en) * | 1999-08-02 | 2005-09-20 | Bayer Corporation | Improved electrochemical sensor design |
| US6616819B1 (en) | 1999-11-04 | 2003-09-09 | Therasense, Inc. | Small volume in vitro analyte sensor and methods |
| JP3550077B2 (ja) * | 2000-05-10 | 2004-08-04 | 株式会社ジャストシステム | カナ漢字変換モード切替プログラムを記録した記録媒体 |
| CN102012389B (zh) * | 2001-01-17 | 2013-04-10 | 爱科来株式会社 | 使用传感器的定量分析方法和定量分析装置 |
| US6797150B2 (en) * | 2001-10-10 | 2004-09-28 | Lifescan, Inc. | Determination of sample volume adequacy in biosensor devices |
-
2001
- 2001-10-10 US US09/974,597 patent/US6797150B2/en not_active Expired - Lifetime
-
2002
- 2002-10-09 RU RU2002126969/14A patent/RU2292841C2/ru active
- 2002-10-09 IL IL15221402A patent/IL152214A0/xx not_active IP Right Cessation
- 2002-10-09 CN CN201110434646.7A patent/CN102621211B/zh not_active Expired - Lifetime
- 2002-10-09 CA CA2838176A patent/CA2838176C/en not_active Expired - Lifetime
- 2002-10-09 CN CNB021547645A patent/CN100401047C/zh not_active Expired - Lifetime
- 2002-10-09 TW TW091123362A patent/TW581866B/zh not_active IP Right Cessation
- 2002-10-09 CN CN2008100958759A patent/CN101311723B/zh not_active Expired - Lifetime
- 2002-10-09 CA CA2407249A patent/CA2407249C/en not_active Expired - Lifetime
- 2002-10-10 PL PL356578A patent/PL208126B1/pl unknown
- 2002-10-10 MX MXPA02010106A patent/MXPA02010106A/es active IP Right Grant
- 2002-10-10 KR KR1020020061869A patent/KR100968354B1/ko active IP Right Grant
- 2002-10-10 CZ CZ20023368A patent/CZ20023368A3/cs unknown
- 2002-10-10 JP JP2002297798A patent/JP4354168B2/ja not_active Expired - Lifetime
-
2003
- 2003-10-23 HK HK03107676.3A patent/HK1055463A1/xx not_active IP Right Cessation
-
2004
- 2004-08-25 US US10/927,176 patent/US7195704B2/en not_active Expired - Lifetime
Patent Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4059169A (en) * | 1976-02-09 | 1977-11-22 | Hagen Winston H | Monitor for biological volume changes |
| US4810650A (en) * | 1986-09-22 | 1989-03-07 | Kell Douglas B | Determination of biomass |
| US5182193A (en) * | 1987-02-04 | 1993-01-26 | Kabushiki Kaisha Kobe Seiko Sho | Method for measuring biomass |
| JPH0996618A (ja) * | 1995-09-29 | 1997-04-08 | Fuji Koki:Kk | 冷媒量検出装置および冷媒状態検出装置 |
| WO1997039343A1 (en) * | 1996-04-17 | 1997-10-23 | British Nuclear Fuels Plc | Biosensors |
| JPH10206368A (ja) * | 1997-01-16 | 1998-08-07 | Able Kk | 水生動物量測定装置及び測定方法 |
| WO1999047907A1 (en) * | 1998-03-19 | 1999-09-23 | Orgenics Biosensors Ltd. | Device for the determination of blood clotting by capacitance or resistance |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101582098B1 (ko) * | 2015-09-08 | 2016-01-04 | 대윤계기산업주식회사 | 전자기 유도식 전기전도도 센서를 이용한 고농도 액체 측정기 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP4354168B2 (ja) | 2009-10-28 |
| CN101311723A (zh) | 2008-11-26 |
| CN1412548A (zh) | 2003-04-23 |
| MXPA02010106A (es) | 2004-10-14 |
| US7195704B2 (en) | 2007-03-27 |
| US20050023154A1 (en) | 2005-02-03 |
| RU2292841C2 (ru) | 2007-02-10 |
| IL152214A0 (en) | 2003-05-29 |
| CA2407249A1 (en) | 2003-04-10 |
| CA2838176A1 (en) | 2003-04-10 |
| CN100401047C (zh) | 2008-07-09 |
| TW581866B (en) | 2004-04-01 |
| CN101311723B (zh) | 2012-12-26 |
| PL356578A1 (en) | 2003-04-22 |
| US6797150B2 (en) | 2004-09-28 |
| HK1055463A1 (en) | 2004-01-09 |
| PL208126B1 (pl) | 2011-03-31 |
| JP2003185615A (ja) | 2003-07-03 |
| CN102621211B (zh) | 2015-06-24 |
| CZ20023368A3 (cs) | 2003-06-18 |
| CN102621211A (zh) | 2012-08-01 |
| US20030098233A1 (en) | 2003-05-29 |
| CA2407249C (en) | 2015-02-24 |
| KR20030030955A (ko) | 2003-04-18 |
| CA2838176C (en) | 2016-09-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR100968354B1 (ko) | 바이오센서 디바이스에서의 적절한 샘플 볼륨의 결정 | |
| JP4298269B2 (ja) | バイオセンサー装置内のサンプル量の適性の決定方法 | |
| US8298389B2 (en) | In vitro analyte sensor, and methods | |
| EP2411797B1 (en) | System and methods for determination of analyte concentration using time resolved amperometry | |
| US20090026094A1 (en) | Two-pulse systems and methods for determining analyte concentration | |
| JP5837602B2 (ja) | キャパシタンスを使用してコントロールサンプルと試験流体を識別するシステムおよび方法 | |
| EP1422523B1 (en) | Determination of sample volume adequacy in biosensors | |
| US20100018866A1 (en) | Electrochemical system for measuring a biological compound by an enzyme | |
| TW201833549A (zh) | 測定具有干擾物之生理流體的分析物濃度 | |
| TW201636608A (zh) | 測試條及決定測試條相容性的方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| FPAY | Annual fee payment |
Payment date: 20130603 Year of fee payment: 4 |
|
| FPAY | Annual fee payment |
Payment date: 20140603 Year of fee payment: 5 |
|
| FPAY | Annual fee payment |
Payment date: 20150518 Year of fee payment: 6 |
|
| FPAY | Annual fee payment |
Payment date: 20160527 Year of fee payment: 7 |
|
| FPAY | Annual fee payment |
Payment date: 20170601 Year of fee payment: 8 |
|
| FPAY | Annual fee payment |
Payment date: 20180529 Year of fee payment: 9 |
|
| FPAY | Annual fee payment |
Payment date: 20190530 Year of fee payment: 10 |