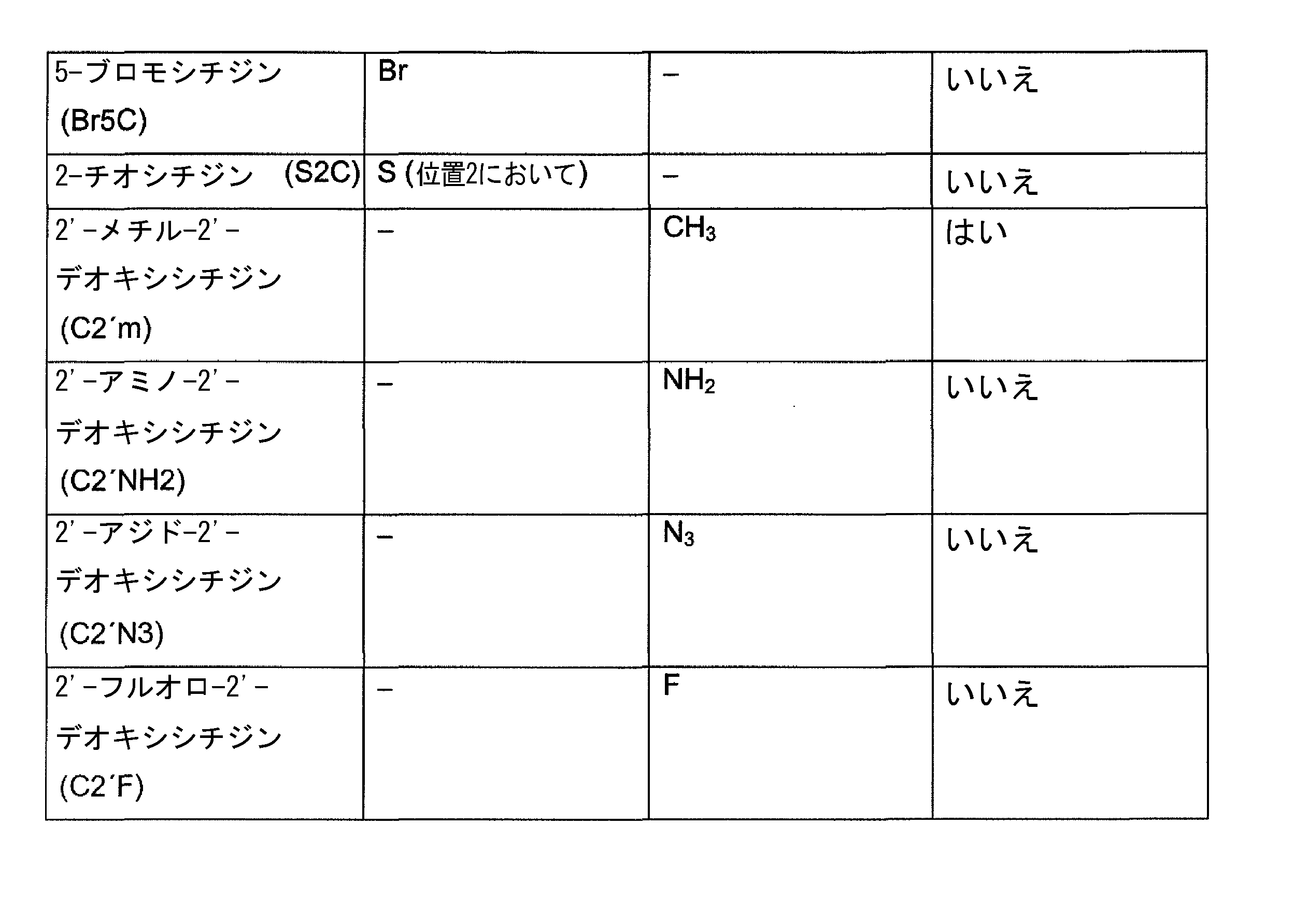
JP7632905B2 - 新規の最小utr配列 - Google Patents
新規の最小utr配列 Download PDFInfo
- Publication number
- JP7632905B2 JP7632905B2 JP2023105810A JP2023105810A JP7632905B2 JP 7632905 B2 JP7632905 B2 JP 7632905B2 JP 2023105810 A JP2023105810 A JP 2023105810A JP 2023105810 A JP2023105810 A JP 2023105810A JP 7632905 B2 JP7632905 B2 JP 7632905B2
- Authority
- JP
- Japan
- Prior art keywords
- rna
- sequence
- seq
- dna
- molecule
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 125000003729 nucleotide group Chemical group 0.000 claims description 186
- 108090000623 proteins and genes Proteins 0.000 claims description 180
- 239000002773 nucleotide Substances 0.000 claims description 173
- 108020004414 DNA Proteins 0.000 claims description 170
- 102000004169 proteins and genes Human genes 0.000 claims description 134
- 108091026890 Coding region Proteins 0.000 claims description 126
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 111
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 103
- 229920001184 polypeptide Polymers 0.000 claims description 102
- 150000007523 nucleic acids Chemical class 0.000 claims description 74
- 108091081024 Start codon Proteins 0.000 claims description 70
- 239000013598 vector Substances 0.000 claims description 69
- 102000004163 DNA-directed RNA polymerases Human genes 0.000 claims description 68
- 108090000626 DNA-directed RNA polymerases Proteins 0.000 claims description 68
- 102000039446 nucleic acids Human genes 0.000 claims description 57
- 108020004707 nucleic acids Proteins 0.000 claims description 57
- 108091028043 Nucleic acid sequence Proteins 0.000 claims description 56
- 230000001419 dependent effect Effects 0.000 claims description 48
- 238000011144 upstream manufacturing Methods 0.000 claims description 33
- 239000008194 pharmaceutical composition Substances 0.000 claims description 29
- 238000002560 therapeutic procedure Methods 0.000 claims description 19
- 108091032973 (ribonucleotides)n+m Proteins 0.000 claims description 17
- 230000006819 RNA synthesis Effects 0.000 claims description 11
- 108700039691 Genetic Promoter Regions Proteins 0.000 claims description 9
- 108700026244 Open Reading Frames Proteins 0.000 claims description 4
- 229920002477 rna polymer Polymers 0.000 description 335
- 102000053602 DNA Human genes 0.000 description 171
- 210000004027 cell Anatomy 0.000 description 164
- 108020004999 messenger RNA Proteins 0.000 description 144
- 108091023045 Untranslated Region Proteins 0.000 description 143
- 235000018102 proteins Nutrition 0.000 description 129
- 230000014509 gene expression Effects 0.000 description 75
- DRTQHJPVMGBUCF-XVFCMESISA-N Uridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C=C1 DRTQHJPVMGBUCF-XVFCMESISA-N 0.000 description 70
- 238000000034 method Methods 0.000 description 60
- 238000013518 transcription Methods 0.000 description 60
- 230000035897 transcription Effects 0.000 description 60
- 238000000338 in vitro Methods 0.000 description 55
- 238000006467 substitution reaction Methods 0.000 description 55
- UHDGCWIWMRVCDJ-ZAKLUEHWSA-N cytidine Chemical group O=C1N=C(N)C=CN1[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O1 UHDGCWIWMRVCDJ-ZAKLUEHWSA-N 0.000 description 52
- 230000014616 translation Effects 0.000 description 48
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 47
- 102000040430 polynucleotide Human genes 0.000 description 47
- 108091033319 polynucleotide Proteins 0.000 description 47
- 239000000203 mixture Substances 0.000 description 46
- 230000000295 complement effect Effects 0.000 description 42
- 238000013519 translation Methods 0.000 description 42
- 108060001084 Luciferase Proteins 0.000 description 38
- 239000005089 Luciferase Substances 0.000 description 37
- 108020003589 5' Untranslated Regions Proteins 0.000 description 33
- 201000010099 disease Diseases 0.000 description 32
- 241000282414 Homo sapiens Species 0.000 description 30
- OIRDTQYFTABQOQ-KQYNXXCUSA-N Adenosine Natural products C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O OIRDTQYFTABQOQ-KQYNXXCUSA-N 0.000 description 29
- NYHBQMYGNKIUIF-UUOKFMHZSA-N Guanosine Chemical compound C1=NC=2C(=O)NC(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O NYHBQMYGNKIUIF-UUOKFMHZSA-N 0.000 description 27
- 108020004459 Small interfering RNA Proteins 0.000 description 26
- 230000000694 effects Effects 0.000 description 24
- 238000001890 transfection Methods 0.000 description 24
- 238000000031 infrared scanning near-field optical microscopy Methods 0.000 description 21
- 238000011282 treatment Methods 0.000 description 21
- 108020005345 3' Untranslated Regions Proteins 0.000 description 20
- 108020004705 Codon Proteins 0.000 description 19
- 230000001225 therapeutic effect Effects 0.000 description 19
- -1 CD3δ Proteins 0.000 description 17
- 150000001413 amino acids Chemical class 0.000 description 17
- DRTQHJPVMGBUCF-PSQAKQOGSA-N beta-L-uridine Natural products O[C@H]1[C@@H](O)[C@H](CO)O[C@@H]1N1C(=O)NC(=O)C=C1 DRTQHJPVMGBUCF-PSQAKQOGSA-N 0.000 description 17
- 230000004048 modification Effects 0.000 description 17
- 238000012986 modification Methods 0.000 description 17
- DRTQHJPVMGBUCF-UHFFFAOYSA-N uracil arabinoside Natural products OC1C(O)C(CO)OC1N1C(=O)NC(=O)C=C1 DRTQHJPVMGBUCF-UHFFFAOYSA-N 0.000 description 17
- 229940045145 uridine Drugs 0.000 description 17
- 238000002474 experimental method Methods 0.000 description 16
- 239000002126 C01EB10 - Adenosine Substances 0.000 description 15
- 241000699670 Mus sp. Species 0.000 description 15
- 229960005305 adenosine Drugs 0.000 description 15
- 230000000692 anti-sense effect Effects 0.000 description 15
- 230000002950 deficient Effects 0.000 description 15
- 208000035475 disorder Diseases 0.000 description 15
- 101001009007 Homo sapiens Hemoglobin subunit alpha Proteins 0.000 description 14
- 238000006243 chemical reaction Methods 0.000 description 14
- 230000030279 gene silencing Effects 0.000 description 14
- UHDGCWIWMRVCDJ-UHFFFAOYSA-N 1-beta-D-Xylofuranosyl-NH-Cytosine Natural products O=C1N=C(N)C=CN1C1C(O)C(O)C(CO)O1 UHDGCWIWMRVCDJ-UHFFFAOYSA-N 0.000 description 13
- UHDGCWIWMRVCDJ-PSQAKQOGSA-N Cytidine Natural products O=C1N=C(N)C=CN1[C@@H]1[C@@H](O)[C@@H](O)[C@H](CO)O1 UHDGCWIWMRVCDJ-PSQAKQOGSA-N 0.000 description 13
- 238000001727 in vivo Methods 0.000 description 13
- 230000001747 exhibiting effect Effects 0.000 description 12
- 230000002452 interceptive effect Effects 0.000 description 12
- 230000008569 process Effects 0.000 description 12
- 241001465754 Metazoa Species 0.000 description 11
- 238000007792 addition Methods 0.000 description 11
- 229940024606 amino acid Drugs 0.000 description 11
- 235000001014 amino acid Nutrition 0.000 description 11
- 230000003042 antagnostic effect Effects 0.000 description 11
- 239000013604 expression vector Substances 0.000 description 11
- 230000009368 gene silencing by RNA Effects 0.000 description 11
- 238000004519 manufacturing process Methods 0.000 description 11
- 102000040650 (ribonucleotides)n+m Human genes 0.000 description 10
- 238000010367 cloning Methods 0.000 description 10
- 239000003814 drug Substances 0.000 description 10
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 10
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 10
- 230000035772 mutation Effects 0.000 description 10
- 238000010899 nucleation Methods 0.000 description 10
- 239000013612 plasmid Substances 0.000 description 10
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 9
- GFFGJBXGBJISGV-UHFFFAOYSA-N Adenine Chemical compound NC1=NC=NC2=C1N=CN2 GFFGJBXGBJISGV-UHFFFAOYSA-N 0.000 description 9
- 102000003951 Erythropoietin Human genes 0.000 description 9
- 108090000394 Erythropoietin Proteins 0.000 description 9
- 208000026350 Inborn Genetic disease Diseases 0.000 description 9
- 108091036066 Three prime untranslated region Proteins 0.000 description 9
- 210000002821 alveolar epithelial cell Anatomy 0.000 description 9
- 230000007812 deficiency Effects 0.000 description 9
- 229940105423 erythropoietin Drugs 0.000 description 9
- 230000004927 fusion Effects 0.000 description 9
- 230000002068 genetic effect Effects 0.000 description 9
- 238000003384 imaging method Methods 0.000 description 9
- 230000001965 increasing effect Effects 0.000 description 9
- OXCMYAYHXIHQOA-UHFFFAOYSA-N potassium;[2-butyl-5-chloro-3-[[4-[2-(1,2,4-triaza-3-azanidacyclopenta-1,4-dien-5-yl)phenyl]phenyl]methyl]imidazol-4-yl]methanol Chemical compound [K+].CCCCC1=NC(Cl)=C(CO)N1CC1=CC=C(C=2C(=CC=CC=2)C2=N[N-]N=N2)C=C1 OXCMYAYHXIHQOA-UHFFFAOYSA-N 0.000 description 9
- MIKUYHXYGGJMLM-GIMIYPNGSA-N Crotonoside Natural products C1=NC2=C(N)NC(=O)N=C2N1[C@H]1O[C@@H](CO)[C@H](O)[C@@H]1O MIKUYHXYGGJMLM-GIMIYPNGSA-N 0.000 description 8
- NYHBQMYGNKIUIF-UHFFFAOYSA-N D-guanosine Natural products C1=2NC(N)=NC(=O)C=2N=CN1C1OC(CO)C(O)C1O NYHBQMYGNKIUIF-UHFFFAOYSA-N 0.000 description 8
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 8
- 101710163270 Nuclease Proteins 0.000 description 8
- 239000012634 fragment Substances 0.000 description 8
- 208000016361 genetic disease Diseases 0.000 description 8
- 238000010362 genome editing Methods 0.000 description 8
- 229940029575 guanosine Drugs 0.000 description 8
- 239000002157 polynucleotide Substances 0.000 description 8
- 108091033409 CRISPR Proteins 0.000 description 7
- 108091035707 Consensus sequence Proteins 0.000 description 7
- 102000004190 Enzymes Human genes 0.000 description 7
- 108090000790 Enzymes Proteins 0.000 description 7
- 108091026898 Leader sequence (mRNA) Proteins 0.000 description 7
- 108091030071 RNAI Proteins 0.000 description 7
- 108091028664 Ribonucleotide Proteins 0.000 description 7
- 108091081021 Sense strand Proteins 0.000 description 7
- 108010017070 Zinc Finger Nucleases Proteins 0.000 description 7
- 229910052799 carbon Inorganic materials 0.000 description 7
- 230000001413 cellular effect Effects 0.000 description 7
- 229940079593 drug Drugs 0.000 description 7
- 229940088598 enzyme Drugs 0.000 description 7
- 239000002609 medium Substances 0.000 description 7
- 239000000546 pharmaceutical excipient Substances 0.000 description 7
- 238000002360 preparation method Methods 0.000 description 7
- 239000002336 ribonucleotide Substances 0.000 description 7
- 125000002652 ribonucleotide group Chemical group 0.000 description 7
- 238000003786 synthesis reaction Methods 0.000 description 7
- 238000012546 transfer Methods 0.000 description 7
- RKSLVDIXBGWPIS-UAKXSSHOSA-N 1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-5-iodopyrimidine-2,4-dione Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(I)=C1 RKSLVDIXBGWPIS-UAKXSSHOSA-N 0.000 description 6
- GJTBSTBJLVYKAU-XVFCMESISA-N 2-thiouridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=S)NC(=O)C=C1 GJTBSTBJLVYKAU-XVFCMESISA-N 0.000 description 6
- LQQGJDJXUSAEMZ-UAKXSSHOSA-N 4-amino-1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-5-iodopyrimidin-2-one Chemical compound C1=C(I)C(N)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 LQQGJDJXUSAEMZ-UAKXSSHOSA-N 0.000 description 6
- ZAYHVCMSTBRABG-JXOAFFINSA-N 5-methylcytidine Chemical compound O=C1N=C(N)C(C)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 ZAYHVCMSTBRABG-JXOAFFINSA-N 0.000 description 6
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 6
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 6
- 108700024394 Exon Proteins 0.000 description 6
- 101001086862 Homo sapiens Pulmonary surfactant-associated protein B Proteins 0.000 description 6
- 206010028980 Neoplasm Diseases 0.000 description 6
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 6
- 101100298458 Pseudescherichia vulneris pqqE gene Proteins 0.000 description 6
- 102100032617 Pulmonary surfactant-associated protein B Human genes 0.000 description 6
- 108020004511 Recombinant DNA Proteins 0.000 description 6
- 108091027967 Small hairpin RNA Proteins 0.000 description 6
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 6
- ISAKRJDGNUQOIC-UHFFFAOYSA-N Uracil Chemical compound O=C1C=CNC(=O)N1 ISAKRJDGNUQOIC-UHFFFAOYSA-N 0.000 description 6
- 239000000969 carrier Substances 0.000 description 6
- 238000007405 data analysis Methods 0.000 description 6
- 239000005547 deoxyribonucleotide Substances 0.000 description 6
- 125000002637 deoxyribonucleotide group Chemical group 0.000 description 6
- 239000008273 gelatin Substances 0.000 description 6
- 229920000159 gelatin Polymers 0.000 description 6
- UYTPUPDQBNUYGX-UHFFFAOYSA-N guanine Chemical compound O=C1NC(N)=NC2=C1N=CN2 UYTPUPDQBNUYGX-UHFFFAOYSA-N 0.000 description 6
- 238000003780 insertion Methods 0.000 description 6
- 230000037431 insertion Effects 0.000 description 6
- 210000004962 mammalian cell Anatomy 0.000 description 6
- 230000008488 polyadenylation Effects 0.000 description 6
- 239000000047 product Substances 0.000 description 6
- 238000009256 replacement therapy Methods 0.000 description 6
- 238000011160 research Methods 0.000 description 6
- 210000003705 ribosome Anatomy 0.000 description 6
- 239000000243 solution Substances 0.000 description 6
- ZAYHVCMSTBRABG-UHFFFAOYSA-N 5-Methylcytidine Natural products O=C1N=C(N)C(C)=CN1C1C(O)C(O)C(CO)O1 ZAYHVCMSTBRABG-UHFFFAOYSA-N 0.000 description 5
- 229930024421 Adenine Natural products 0.000 description 5
- 201000003883 Cystic fibrosis Diseases 0.000 description 5
- 241000206602 Eukaryota Species 0.000 description 5
- 102100033448 Lysosomal alpha-glucosidase Human genes 0.000 description 5
- 108091027974 Mature messenger RNA Proteins 0.000 description 5
- 229930185560 Pseudouridine Natural products 0.000 description 5
- PTJWIQPHWPFNBW-UHFFFAOYSA-N Pseudouridine C Natural products OC1C(O)C(CO)OC1C1=CNC(=O)NC1=O PTJWIQPHWPFNBW-UHFFFAOYSA-N 0.000 description 5
- 229960000643 adenine Drugs 0.000 description 5
- 238000013459 approach Methods 0.000 description 5
- 230000009286 beneficial effect Effects 0.000 description 5
- WGDUUQDYDIIBKT-UHFFFAOYSA-N beta-Pseudouridine Natural products OC1OC(CN2C=CC(=O)NC2=O)C(O)C1O WGDUUQDYDIIBKT-UHFFFAOYSA-N 0.000 description 5
- 201000011510 cancer Diseases 0.000 description 5
- 239000002299 complementary DNA Substances 0.000 description 5
- 150000001875 compounds Chemical class 0.000 description 5
- 239000003623 enhancer Substances 0.000 description 5
- 238000002641 enzyme replacement therapy Methods 0.000 description 5
- 239000000284 extract Substances 0.000 description 5
- 102000037865 fusion proteins Human genes 0.000 description 5
- 108020001507 fusion proteins Proteins 0.000 description 5
- 210000004072 lung Anatomy 0.000 description 5
- 210000000056 organ Anatomy 0.000 description 5
- 239000002953 phosphate buffered saline Substances 0.000 description 5
- 230000000069 prophylactic effect Effects 0.000 description 5
- 238000001243 protein synthesis Methods 0.000 description 5
- 229940096913 pseudoisocytidine Drugs 0.000 description 5
- PTJWIQPHWPFNBW-GBNDHIKLSA-N pseudouridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1C1=CNC(=O)NC1=O PTJWIQPHWPFNBW-GBNDHIKLSA-N 0.000 description 5
- 230000001105 regulatory effect Effects 0.000 description 5
- 239000004055 small Interfering RNA Substances 0.000 description 5
- 238000010561 standard procedure Methods 0.000 description 5
- 239000000126 substance Substances 0.000 description 5
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 5
- 108020005176 AU Rich Elements Proteins 0.000 description 4
- 241000588724 Escherichia coli Species 0.000 description 4
- 208000024720 Fabry Disease Diseases 0.000 description 4
- 208000032007 Glycogen storage disease due to acid maltase deficiency Diseases 0.000 description 4
- 206010053185 Glycogen storage disease type II Diseases 0.000 description 4
- 208000009292 Hemophilia A Diseases 0.000 description 4
- 241000238631 Hexapoda Species 0.000 description 4
- 101000987586 Homo sapiens Eosinophil peroxidase Proteins 0.000 description 4
- 208000002537 Neuronal Ceroid-Lipofuscinoses Diseases 0.000 description 4
- 108091036407 Polyadenylation Proteins 0.000 description 4
- 238000012228 RNA interference-mediated gene silencing Methods 0.000 description 4
- 108010073062 Transcription Activator-Like Effectors Proteins 0.000 description 4
- 239000002253 acid Substances 0.000 description 4
- 230000001154 acute effect Effects 0.000 description 4
- 150000003838 adenosines Chemical class 0.000 description 4
- 238000005415 bioluminescence Methods 0.000 description 4
- 230000029918 bioluminescence Effects 0.000 description 4
- 238000004113 cell culture Methods 0.000 description 4
- 210000004671 cell-free system Anatomy 0.000 description 4
- 239000003795 chemical substances by application Substances 0.000 description 4
- 238000013461 design Methods 0.000 description 4
- 231100000673 dose–response relationship Toxicity 0.000 description 4
- 239000000839 emulsion Substances 0.000 description 4
- 210000003743 erythrocyte Anatomy 0.000 description 4
- 210000003527 eukaryotic cell Anatomy 0.000 description 4
- 239000012091 fetal bovine serum Substances 0.000 description 4
- 230000009395 genetic defect Effects 0.000 description 4
- 201000004502 glycogen storage disease II Diseases 0.000 description 4
- 208000019061 glycogen storage disease due to GLUT2 deficiency Diseases 0.000 description 4
- 102000044890 human EPO Human genes 0.000 description 4
- 238000010348 incorporation Methods 0.000 description 4
- 230000001939 inductive effect Effects 0.000 description 4
- 210000000265 leukocyte Anatomy 0.000 description 4
- 230000000670 limiting effect Effects 0.000 description 4
- 239000007788 liquid Substances 0.000 description 4
- 210000004185 liver Anatomy 0.000 description 4
- 239000000463 material Substances 0.000 description 4
- 108091027963 non-coding RNA Proteins 0.000 description 4
- 102000042567 non-coding RNA Human genes 0.000 description 4
- 125000002467 phosphate group Chemical group [H]OP(=O)(O[H])O[*] 0.000 description 4
- 229920000642 polymer Polymers 0.000 description 4
- 239000013641 positive control Substances 0.000 description 4
- 239000011780 sodium chloride Substances 0.000 description 4
- 210000000952 spleen Anatomy 0.000 description 4
- 235000000346 sugar Nutrition 0.000 description 4
- 208000024891 symptom Diseases 0.000 description 4
- RWQNBRDOKXIBIV-UHFFFAOYSA-N thymine Chemical compound CC1=CNC(=O)NC1=O RWQNBRDOKXIBIV-UHFFFAOYSA-N 0.000 description 4
- 230000014621 translational initiation Effects 0.000 description 4
- 241001515965 unidentified phage Species 0.000 description 4
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 3
- 108700028369 Alleles Proteins 0.000 description 3
- 208000023275 Autoimmune disease Diseases 0.000 description 3
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical compound OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 description 3
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 3
- 208000024172 Cardiovascular disease Diseases 0.000 description 3
- 108090000331 Firefly luciferases Proteins 0.000 description 3
- 208000015872 Gaucher disease Diseases 0.000 description 3
- 208000031220 Hemophilia Diseases 0.000 description 3
- 101000986595 Homo sapiens Ornithine transcarbamylase, mitochondrial Proteins 0.000 description 3
- 241000124008 Mammalia Species 0.000 description 3
- 208000024556 Mendelian disease Diseases 0.000 description 3
- 208000012902 Nervous system disease Diseases 0.000 description 3
- 108700019146 Transgenes Proteins 0.000 description 3
- 208000036142 Viral infection Diseases 0.000 description 3
- 241000021375 Xenogenes Species 0.000 description 3
- 239000004480 active ingredient Substances 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 230000015556 catabolic process Effects 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 239000013599 cloning vector Substances 0.000 description 3
- 238000006731 degradation reaction Methods 0.000 description 3
- 239000003085 diluting agent Substances 0.000 description 3
- 239000002552 dosage form Substances 0.000 description 3
- 230000005782 double-strand break Effects 0.000 description 3
- 239000003937 drug carrier Substances 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 230000002255 enzymatic effect Effects 0.000 description 3
- 238000009472 formulation Methods 0.000 description 3
- 102000053926 human OTC Human genes 0.000 description 3
- 208000016245 inborn errors of metabolism Diseases 0.000 description 3
- 208000015978 inherited metabolic disease Diseases 0.000 description 3
- 230000002401 inhibitory effect Effects 0.000 description 3
- 230000000977 initiatory effect Effects 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- 230000003993 interaction Effects 0.000 description 3
- 238000003670 luciferase enzyme activity assay Methods 0.000 description 3
- 239000012139 lysis buffer Substances 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- 230000001404 mediated effect Effects 0.000 description 3
- 208000022018 mucopolysaccharidosis type 2 Diseases 0.000 description 3
- 229910052757 nitrogen Inorganic materials 0.000 description 3
- 239000002777 nucleoside Substances 0.000 description 3
- 238000005457 optimization Methods 0.000 description 3
- 230000002265 prevention Effects 0.000 description 3
- 108091008146 restriction endonucleases Proteins 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 239000000758 substrate Substances 0.000 description 3
- 208000011580 syndromic disease Diseases 0.000 description 3
- 210000001519 tissue Anatomy 0.000 description 3
- 239000001226 triphosphate Substances 0.000 description 3
- 235000011178 triphosphate Nutrition 0.000 description 3
- 229940035893 uracil Drugs 0.000 description 3
- 230000009385 viral infection Effects 0.000 description 3
- 238000001262 western blot Methods 0.000 description 3
- XJOTXKZIRSHZQV-RXHOOSIZSA-N (3S)-3-amino-4-[[(2S,3R)-1-[[(2S)-1-[[(2S)-1-[(2S)-2-[[(2S,3S)-1-[[(1R,6R,12R,17R,20S,23S,26R,31R,34R,39R,42S,45S,48S,51S,59S)-51-(4-aminobutyl)-31-[[(2S)-6-amino-1-[[(1S,2R)-1-carboxy-2-hydroxypropyl]amino]-1-oxohexan-2-yl]carbamoyl]-20-benzyl-23-[(2S)-butan-2-yl]-45-(3-carbamimidamidopropyl)-48-(hydroxymethyl)-42-(1H-imidazol-4-ylmethyl)-59-(2-methylsulfanylethyl)-7,10,19,22,25,33,40,43,46,49,52,54,57,60,63,64-hexadecaoxo-3,4,14,15,28,29,36,37-octathia-8,11,18,21,24,32,41,44,47,50,53,55,58,61,62,65-hexadecazatetracyclo[32.19.8.26,17.212,39]pentahexacontan-26-yl]amino]-3-methyl-1-oxopentan-2-yl]carbamoyl]pyrrolidin-1-yl]-1-oxo-3-phenylpropan-2-yl]amino]-3-(1H-imidazol-4-yl)-1-oxopropan-2-yl]amino]-3-hydroxy-1-oxobutan-2-yl]amino]-4-oxobutanoic acid Chemical compound CC[C@H](C)[C@H](NC(=O)[C@@H]1CCCN1C(=O)[C@H](Cc1ccccc1)NC(=O)[C@H](Cc1cnc[nH]1)NC(=O)[C@@H](NC(=O)[C@@H](N)CC(O)=O)[C@@H](C)O)C(=O)N[C@H]1CSSC[C@H](NC(=O)[C@@H]2CSSC[C@@H]3NC(=O)[C@@H]4CSSC[C@H](NC(=O)[C@H](Cc5ccccc5)NC(=O)[C@@H](NC1=O)[C@@H](C)CC)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](CCCCN)NC(=O)[C@H](CO)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](Cc1cnc[nH]1)NC3=O)C(=O)NCC(=O)N[C@@H](CCSC)C(=O)N2)C(=O)NCC(=O)N4)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)O)C(O)=O XJOTXKZIRSHZQV-RXHOOSIZSA-N 0.000 description 2
- RHFUOMFWUGWKKO-XVFCMESISA-N 2-thiocytidine Chemical compound S=C1N=C(N)C=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 RHFUOMFWUGWKKO-XVFCMESISA-N 0.000 description 2
- RDPUKVRQKWBSPK-UHFFFAOYSA-N 3-Methylcytidine Natural products O=C1N(C)C(=N)C=CN1C1C(O)C(O)C(CO)O1 RDPUKVRQKWBSPK-UHFFFAOYSA-N 0.000 description 2
- RDPUKVRQKWBSPK-ZOQUXTDFSA-N 3-methylcytidine Chemical compound O=C1N(C)C(=N)C=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 RDPUKVRQKWBSPK-ZOQUXTDFSA-N 0.000 description 2
- NVZFZMCNALTPBY-XVFCMESISA-N 4-amino-1-[(2r,3r,4r,5r)-3-fluoro-4-hydroxy-5-(hydroxymethyl)oxolan-2-yl]pyrimidin-2-one Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@H](F)[C@H](O)[C@@H](CO)O1 NVZFZMCNALTPBY-XVFCMESISA-N 0.000 description 2
- FECRKKQKJNKYNF-XVFCMESISA-N 4-amino-1-[(2r,3r,4s,5r)-3-amino-4-hydroxy-5-(hydroxymethyl)oxolan-2-yl]pyrimidin-2-one Chemical compound N[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)N=C(N)C=C1 FECRKKQKJNKYNF-XVFCMESISA-N 0.000 description 2
- HRDXGYQCVPZEJE-UAKXSSHOSA-N 4-amino-5-bromo-1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]pyrimidin-2-one Chemical compound C1=C(Br)C(N)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 HRDXGYQCVPZEJE-UAKXSSHOSA-N 0.000 description 2
- ZLOIGESWDJYCTF-XVFCMESISA-N 4-thiouridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=S)C=C1 ZLOIGESWDJYCTF-XVFCMESISA-N 0.000 description 2
- AGFIRQJZCNVMCW-UAKXSSHOSA-N 5-bromouridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(Br)=C1 AGFIRQJZCNVMCW-UAKXSSHOSA-N 0.000 description 2
- QXDXBKZJFLRLCM-UAKXSSHOSA-N 5-hydroxyuridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(O)=C1 QXDXBKZJFLRLCM-UAKXSSHOSA-N 0.000 description 2
- PEHVGBZKEYRQSX-UHFFFAOYSA-N 7-deaza-adenine Chemical compound NC1=NC=NC2=C1C=CN2 PEHVGBZKEYRQSX-UHFFFAOYSA-N 0.000 description 2
- HCGHYQLFMPXSDU-UHFFFAOYSA-N 7-methyladenine Chemical compound C1=NC(N)=C2N(C)C=NC2=N1 HCGHYQLFMPXSDU-UHFFFAOYSA-N 0.000 description 2
- 201000011452 Adrenoleukodystrophy Diseases 0.000 description 2
- 208000031277 Amaurotic familial idiocy Diseases 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 206010003591 Ataxia Diseases 0.000 description 2
- 241000894006 Bacteria Species 0.000 description 2
- 102100022440 Battenin Human genes 0.000 description 2
- DWRXFEITVBNRMK-UHFFFAOYSA-N Beta-D-1-Arabinofuranosylthymine Natural products O=C1NC(=O)C(C)=CN1C1C(O)C(O)C(CO)O1 DWRXFEITVBNRMK-UHFFFAOYSA-N 0.000 description 2
- 238000010354 CRISPR gene editing Methods 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 2
- 108091033380 Coding strand Proteins 0.000 description 2
- 206010009944 Colon cancer Diseases 0.000 description 2
- 108010079245 Cystic Fibrosis Transmembrane Conductance Regulator Proteins 0.000 description 2
- 102100023419 Cystic fibrosis transmembrane conductance regulator Human genes 0.000 description 2
- 102000004127 Cytokines Human genes 0.000 description 2
- 108090000695 Cytokines Proteins 0.000 description 2
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 2
- IGXWBGJHJZYPQS-SSDOTTSWSA-N D-Luciferin Chemical compound OC(=O)[C@H]1CSC(C=2SC3=CC=C(O)C=C3N=2)=N1 IGXWBGJHJZYPQS-SSDOTTSWSA-N 0.000 description 2
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 2
- HMFHBZSHGGEWLO-SOOFDHNKSA-N D-ribofuranose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H]1O HMFHBZSHGGEWLO-SOOFDHNKSA-N 0.000 description 2
- 230000007018 DNA scission Effects 0.000 description 2
- 230000004568 DNA-binding Effects 0.000 description 2
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 2
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 2
- 238000002965 ELISA Methods 0.000 description 2
- 108010037179 Endodeoxyribonucleases Proteins 0.000 description 2
- 102000011750 Endodeoxyribonucleases Human genes 0.000 description 2
- 208000010055 Globoid Cell Leukodystrophy Diseases 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- 208000032003 Glycogen storage disease due to glucose-6-phosphatase deficiency Diseases 0.000 description 2
- 206010018464 Glycogen storage disease type I Diseases 0.000 description 2
- 108091093094 Glycol nucleic acid Proteins 0.000 description 2
- 102000018997 Growth Hormone Human genes 0.000 description 2
- 108010051696 Growth Hormone Proteins 0.000 description 2
- 108010054147 Hemoglobins Proteins 0.000 description 2
- 102000001554 Hemoglobins Human genes 0.000 description 2
- 101000920686 Homo sapiens Erythropoietin Proteins 0.000 description 2
- 101000801640 Homo sapiens Phospholipid-transporting ATPase ABCA3 Proteins 0.000 description 2
- 102000002265 Human Growth Hormone Human genes 0.000 description 2
- 108010000521 Human Growth Hormone Proteins 0.000 description 2
- 239000000854 Human Growth Hormone Substances 0.000 description 2
- 208000027747 Kennedy disease Diseases 0.000 description 2
- 208000028226 Krabbe disease Diseases 0.000 description 2
- 208000034800 Leukoencephalopathies Diseases 0.000 description 2
- 101150083522 MECP2 gene Proteins 0.000 description 2
- JLVVSXFLKOJNIY-UHFFFAOYSA-N Magnesium ion Chemical compound [Mg+2] JLVVSXFLKOJNIY-UHFFFAOYSA-N 0.000 description 2
- 102100039124 Methyl-CpG-binding protein 2 Human genes 0.000 description 2
- 241000699666 Mus <mouse, genus> Species 0.000 description 2
- DRBBFCLWYRJSJZ-UHFFFAOYSA-N N-phosphocreatine Chemical compound OC(=O)CN(C)C(=N)NP(O)(O)=O DRBBFCLWYRJSJZ-UHFFFAOYSA-N 0.000 description 2
- 239000012124 Opti-MEM Substances 0.000 description 2
- 108091093037 Peptide nucleic acid Proteins 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Natural products OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- 102100033623 Phospholipid-transporting ATPase ABCA3 Human genes 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- 108010076504 Protein Sorting Signals Proteins 0.000 description 2
- 102000000574 RNA-Induced Silencing Complex Human genes 0.000 description 2
- 108010016790 RNA-Induced Silencing Complex Proteins 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- 208000006289 Rett Syndrome Diseases 0.000 description 2
- PYMYPHUHKUWMLA-LMVFSUKVSA-N Ribose Natural products OC[C@@H](O)[C@@H](O)[C@@H](O)C=O PYMYPHUHKUWMLA-LMVFSUKVSA-N 0.000 description 2
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 2
- 229930006000 Sucrose Natural products 0.000 description 2
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 2
- 238000010459 TALEN Methods 0.000 description 2
- 108020005038 Terminator Codon Proteins 0.000 description 2
- 108091046915 Threose nucleic acid Proteins 0.000 description 2
- 201000007023 Thrombotic Thrombocytopenic Purpura Diseases 0.000 description 2
- IQFYYKKMVGJFEH-XLPZGREQSA-N Thymidine Chemical group O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 IQFYYKKMVGJFEH-XLPZGREQSA-N 0.000 description 2
- 108700009124 Transcription Initiation Site Proteins 0.000 description 2
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 2
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 2
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 2
- 102000003970 Vinculin Human genes 0.000 description 2
- 108090000384 Vinculin Proteins 0.000 description 2
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 2
- 230000002411 adverse Effects 0.000 description 2
- 239000000443 aerosol Substances 0.000 description 2
- HMFHBZSHGGEWLO-UHFFFAOYSA-N alpha-D-Furanose-Ribose Natural products OCC1OC(O)C(O)C1O HMFHBZSHGGEWLO-UHFFFAOYSA-N 0.000 description 2
- 108010028144 alpha-Glucosidases Proteins 0.000 description 2
- 230000003321 amplification Effects 0.000 description 2
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 210000004102 animal cell Anatomy 0.000 description 2
- 239000003963 antioxidant agent Substances 0.000 description 2
- 235000006708 antioxidants Nutrition 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 208000036556 autosomal recessive T cell-negative B cell-negative NK cell-negative due to adenosine deaminase deficiency severe combined immunodeficiency Diseases 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 238000004820 blood count Methods 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 239000007853 buffer solution Substances 0.000 description 2
- YCIMNLLNPGFGHC-UHFFFAOYSA-N catechol Chemical compound OC1=CC=CC=C1O YCIMNLLNPGFGHC-UHFFFAOYSA-N 0.000 description 2
- 210000002421 cell wall Anatomy 0.000 description 2
- 230000033077 cellular process Effects 0.000 description 2
- 239000002738 chelating agent Substances 0.000 description 2
- 239000013611 chromosomal DNA Substances 0.000 description 2
- 230000001276 controlling effect Effects 0.000 description 2
- 239000006071 cream Substances 0.000 description 2
- 238000012258 culturing Methods 0.000 description 2
- OPTASPLRGRRNAP-UHFFFAOYSA-N cytosine Chemical compound NC=1C=CNC(=O)N=1 OPTASPLRGRRNAP-UHFFFAOYSA-N 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- 230000029087 digestion Effects 0.000 description 2
- 239000012467 final product Substances 0.000 description 2
- 238000000684 flow cytometry Methods 0.000 description 2
- 238000007306 functionalization reaction Methods 0.000 description 2
- 230000002538 fungal effect Effects 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 238000010353 genetic engineering Methods 0.000 description 2
- 201000004541 glycogen storage disease I Diseases 0.000 description 2
- 230000012010 growth Effects 0.000 description 2
- 239000003102 growth factor Substances 0.000 description 2
- 239000001963 growth medium Substances 0.000 description 2
- 238000005534 hematocrit Methods 0.000 description 2
- 102000018511 hepcidin Human genes 0.000 description 2
- 108060003558 hepcidin Proteins 0.000 description 2
- 229940066919 hepcidin Drugs 0.000 description 2
- 208000026278 immune system disease Diseases 0.000 description 2
- 230000009851 immunogenic response Effects 0.000 description 2
- 230000005847 immunogenicity Effects 0.000 description 2
- 238000011503 in vivo imaging Methods 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- 238000010253 intravenous injection Methods 0.000 description 2
- 208000017476 juvenile neuronal ceroid lipofuscinosis Diseases 0.000 description 2
- 239000006166 lysate Substances 0.000 description 2
- 230000002132 lysosomal effect Effects 0.000 description 2
- RLSSMJSEOOYNOY-UHFFFAOYSA-N m-cresol Chemical compound CC1=CC=CC(O)=C1 RLSSMJSEOOYNOY-UHFFFAOYSA-N 0.000 description 2
- 229910001425 magnesium ion Inorganic materials 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- 208000030159 metabolic disease Diseases 0.000 description 2
- 229930182817 methionine Natural products 0.000 description 2
- 235000006109 methionine Nutrition 0.000 description 2
- 229960004452 methionine Drugs 0.000 description 2
- 238000001823 molecular biology technique Methods 0.000 description 2
- 238000010369 molecular cloning Methods 0.000 description 2
- 201000002273 mucopolysaccharidosis II Diseases 0.000 description 2
- 201000006417 multiple sclerosis Diseases 0.000 description 2
- 239000002105 nanoparticle Substances 0.000 description 2
- 201000007607 neuronal ceroid lipofuscinosis 3 Diseases 0.000 description 2
- 238000003199 nucleic acid amplification method Methods 0.000 description 2
- 230000005257 nucleotidylation Effects 0.000 description 2
- 210000003463 organelle Anatomy 0.000 description 2
- 230000036961 partial effect Effects 0.000 description 2
- 230000001717 pathogenic effect Effects 0.000 description 2
- 230000037361 pathway Effects 0.000 description 2
- AQIXEPGDORPWBJ-UHFFFAOYSA-N pentan-3-ol Chemical compound CCC(O)CC AQIXEPGDORPWBJ-UHFFFAOYSA-N 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 230000003234 polygenic effect Effects 0.000 description 2
- 229920000136 polysorbate Polymers 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 108010066381 preproinsulin Proteins 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 210000001236 prokaryotic cell Anatomy 0.000 description 2
- QELSKZZBTMNZEB-UHFFFAOYSA-N propylparaben Chemical compound CCCOC(=O)C1=CC=C(O)C=C1 QELSKZZBTMNZEB-UHFFFAOYSA-N 0.000 description 2
- 150000003230 pyrimidines Chemical class 0.000 description 2
- 230000002829 reductive effect Effects 0.000 description 2
- GHMLBKRAJCXXBS-UHFFFAOYSA-N resorcinol Chemical compound OC1=CC=CC(O)=C1 GHMLBKRAJCXXBS-UHFFFAOYSA-N 0.000 description 2
- DWRXFEITVBNRMK-JXOAFFINSA-N ribothymidine Chemical compound O=C1NC(=O)C(C)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 DWRXFEITVBNRMK-JXOAFFINSA-N 0.000 description 2
- RHFUOMFWUGWKKO-UHFFFAOYSA-N s2C Natural products S=C1N=C(N)C=CN1C1C(O)C(O)C(CO)O1 RHFUOMFWUGWKKO-UHFFFAOYSA-N 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 239000000600 sorbitol Substances 0.000 description 2
- 208000002320 spinal muscular atrophy Diseases 0.000 description 2
- 239000005720 sucrose Substances 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 239000003826 tablet Substances 0.000 description 2
- 230000008685 targeting Effects 0.000 description 2
- 229940113082 thymine Drugs 0.000 description 2
- 239000003981 vehicle Substances 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- 239000011701 zinc Substances 0.000 description 2
- 229910052725 zinc Inorganic materials 0.000 description 2
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 1
- YZSZLBRBVWAXFW-LNYQSQCFSA-N (2R,3R,4S,5R)-2-(2-amino-6-hydroxy-6-methoxy-3H-purin-9-yl)-5-(hydroxymethyl)oxolane-3,4-diol Chemical compound COC1(O)NC(N)=NC2=C1N=CN2[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O YZSZLBRBVWAXFW-LNYQSQCFSA-N 0.000 description 1
- MYUOTPIQBPUQQU-CKTDUXNWSA-N (2s,3r)-2-amino-n-[[9-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-2-methylsulfanylpurin-6-yl]carbamoyl]-3-hydroxybutanamide Chemical compound C12=NC(SC)=NC(NC(=O)NC(=O)[C@@H](N)[C@@H](C)O)=C2N=CN1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O MYUOTPIQBPUQQU-CKTDUXNWSA-N 0.000 description 1
- MIXBUOXRHTZHKR-XUTVFYLZSA-N 1-Methylpseudoisocytidine Chemical compound CN1C=C(C(=O)N=C1N)[C@H]2[C@@H]([C@@H]([C@H](O2)CO)O)O MIXBUOXRHTZHKR-XUTVFYLZSA-N 0.000 description 1
- UIYWFOZZIZEEKJ-XVFCMESISA-N 1-[(2r,3r,4r,5r)-3-fluoro-4-hydroxy-5-(hydroxymethyl)oxolan-2-yl]pyrimidine-2,4-dione Chemical compound F[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C=C1 UIYWFOZZIZEEKJ-XVFCMESISA-N 0.000 description 1
- XEVWBBJJPSWWCS-KCRXGDJASA-N 1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(1-hydroxyethyl)oxolan-2-yl]pyrimidine-2,4-dione Chemical compound O[C@@H]1[C@H](O)[C@@H](C(O)C)O[C@H]1N1C(=O)NC(=O)C=C1 XEVWBBJJPSWWCS-KCRXGDJASA-N 0.000 description 1
- KYEKLQMDNZPEFU-KVTDHHQDSA-N 1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-1,3,5-triazine-2,4-dione Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)N=C1 KYEKLQMDNZPEFU-KVTDHHQDSA-N 0.000 description 1
- UTQUILVPBZEHTK-ZOQUXTDFSA-N 1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-3-methylpyrimidine-2,4-dione Chemical compound O=C1N(C)C(=O)C=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 UTQUILVPBZEHTK-ZOQUXTDFSA-N 0.000 description 1
- QLOCVMVCRJOTTM-TURQNECASA-N 1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-5-prop-1-ynylpyrimidine-2,4-dione Chemical compound O=C1NC(=O)C(C#CC)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 QLOCVMVCRJOTTM-TURQNECASA-N 0.000 description 1
- LLIPTMWIZVIUSX-XVFCMESISA-N 1-[(2r,3r,4s,5r)-3-amino-4-hydroxy-5-(hydroxymethyl)oxolan-2-yl]pyrimidine-2,4-dione Chemical compound N[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C=C1 LLIPTMWIZVIUSX-XVFCMESISA-N 0.000 description 1
- MRUKYOQQKHNMFI-XVFCMESISA-N 1-[(2r,3r,4s,5r)-3-azido-4-hydroxy-5-(hydroxymethyl)oxolan-2-yl]pyrimidine-2,4-dione Chemical compound [N-]=[N+]=N[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C=C1 MRUKYOQQKHNMFI-XVFCMESISA-N 0.000 description 1
- HWYVSJPOGFIERF-MTSNSDSCSA-N 1-[(2r,3r,4s,5r)-4-hydroxy-5-(hydroxymethyl)-3-methyloxolan-2-yl]pyrimidine-2,4-dione Chemical compound C[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C=C1 HWYVSJPOGFIERF-MTSNSDSCSA-N 0.000 description 1
- GFYLSDSUCHVORB-IOSLPCCCSA-N 1-methyladenosine Chemical compound C1=NC=2C(=N)N(C)C=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O GFYLSDSUCHVORB-IOSLPCCCSA-N 0.000 description 1
- UTAIYTHAJQNQDW-KQYNXXCUSA-N 1-methylguanosine Chemical compound C1=NC=2C(=O)N(C)C(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O UTAIYTHAJQNQDW-KQYNXXCUSA-N 0.000 description 1
- WJNGQIYEQLPJMN-IOSLPCCCSA-N 1-methylinosine Chemical compound C1=NC=2C(=O)N(C)C=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O WJNGQIYEQLPJMN-IOSLPCCCSA-N 0.000 description 1
- UVBYMVOUBXYSFV-XUTVFYLZSA-N 1-methylpseudouridine Chemical compound O=C1NC(=O)N(C)C=C1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 UVBYMVOUBXYSFV-XUTVFYLZSA-N 0.000 description 1
- UVBYMVOUBXYSFV-UHFFFAOYSA-N 1-methylpseudouridine Natural products O=C1NC(=O)N(C)C=C1C1C(O)C(O)C(CO)O1 UVBYMVOUBXYSFV-UHFFFAOYSA-N 0.000 description 1
- IQFYYKKMVGJFEH-BIIVOSGPSA-N 2'-deoxythymidine Natural products O=C1NC(=O)C(C)=CN1[C@@H]1O[C@@H](CO)[C@@H](O)C1 IQFYYKKMVGJFEH-BIIVOSGPSA-N 0.000 description 1
- CWXIOHYALLRNSZ-JWMKEVCDSA-N 2-Thiodihydropseudouridine Chemical compound C1C(C(=O)NC(=S)N1)[C@H]2[C@@H]([C@@H]([C@H](O2)CO)O)O CWXIOHYALLRNSZ-JWMKEVCDSA-N 0.000 description 1
- NUBJGTNGKODGGX-YYNOVJQHSA-N 2-[5-[(2s,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-2,4-dioxopyrimidin-1-yl]acetic acid Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1C1=CN(CC(O)=O)C(=O)NC1=O NUBJGTNGKODGGX-YYNOVJQHSA-N 0.000 description 1
- VJKJOPUEUOTEBX-TURQNECASA-N 2-[[1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-2,4-dioxopyrimidin-5-yl]methylamino]ethanesulfonic acid Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(CNCCS(O)(=O)=O)=C1 VJKJOPUEUOTEBX-TURQNECASA-N 0.000 description 1
- LCKIHCRZXREOJU-KYXWUPHJSA-N 2-[[5-[(2S,3R,4S,5R)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-2,4-dioxopyrimidin-1-yl]methylamino]ethanesulfonic acid Chemical compound C(NCCS(=O)(=O)O)N1C=C([C@H]2[C@H](O)[C@H](O)[C@@H](CO)O2)C(NC1=O)=O LCKIHCRZXREOJU-KYXWUPHJSA-N 0.000 description 1
- JRYMOPZHXMVHTA-DAGMQNCNSA-N 2-amino-7-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-1h-pyrrolo[2,3-d]pyrimidin-4-one Chemical compound C1=CC=2C(=O)NC(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O JRYMOPZHXMVHTA-DAGMQNCNSA-N 0.000 description 1
- OTDJAMXESTUWLO-UUOKFMHZSA-N 2-amino-9-[(2R,3R,4S,5R)-3,4-dihydroxy-5-(hydroxymethyl)-2-oxolanyl]-3H-purine-6-thione Chemical compound C12=NC(N)=NC(S)=C2N=CN1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O OTDJAMXESTUWLO-UUOKFMHZSA-N 0.000 description 1
- IBKZHHCJWDWGAJ-FJGDRVTGSA-N 2-amino-9-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-1-methylpurine-6-thione Chemical compound C1=NC=2C(=S)N(C)C(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O IBKZHHCJWDWGAJ-FJGDRVTGSA-N 0.000 description 1
- HPKQEMIXSLRGJU-UUOKFMHZSA-N 2-amino-9-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-7-methyl-3h-purine-6,8-dione Chemical compound O=C1N(C)C(C(NC(N)=N2)=O)=C2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O HPKQEMIXSLRGJU-UUOKFMHZSA-N 0.000 description 1
- MWBWWFOAEOYUST-UHFFFAOYSA-N 2-aminopurine Chemical compound NC1=NC=C2N=CNC2=N1 MWBWWFOAEOYUST-UHFFFAOYSA-N 0.000 description 1
- RLZMYTZDQAVNIN-ZOQUXTDFSA-N 2-methoxy-4-thio-uridine Chemical compound COC1=NC(=S)C=CN1[C@H]2[C@@H]([C@@H]([C@H](O2)CO)O)O RLZMYTZDQAVNIN-ZOQUXTDFSA-N 0.000 description 1
- QCPQCJVQJKOKMS-VLSMUFELSA-N 2-methoxy-5-methyl-cytidine Chemical compound CC(C(N)=N1)=CN([C@@H]([C@@H]2O)O[C@H](CO)[C@H]2O)C1OC QCPQCJVQJKOKMS-VLSMUFELSA-N 0.000 description 1
- TUDKBZAMOFJOSO-UHFFFAOYSA-N 2-methoxy-7h-purin-6-amine Chemical compound COC1=NC(N)=C2NC=NC2=N1 TUDKBZAMOFJOSO-UHFFFAOYSA-N 0.000 description 1
- STISOQJGVFEOFJ-MEVVYUPBSA-N 2-methoxy-cytidine Chemical compound COC(N([C@@H]([C@@H]1O)O[C@H](CO)[C@H]1O)C=C1)N=C1N STISOQJGVFEOFJ-MEVVYUPBSA-N 0.000 description 1
- WBVPJIKOWUQTSD-ZOQUXTDFSA-N 2-methoxyuridine Chemical compound COC1=NC(=O)C=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 WBVPJIKOWUQTSD-ZOQUXTDFSA-N 0.000 description 1
- FXGXEFXCWDTSQK-UHFFFAOYSA-N 2-methylsulfanyl-7h-purin-6-amine Chemical compound CSC1=NC(N)=C2NC=NC2=N1 FXGXEFXCWDTSQK-UHFFFAOYSA-N 0.000 description 1
- QEWSGVMSLPHELX-UHFFFAOYSA-N 2-methylthio-N6-(cis-hydroxyisopentenyl) adenosine Chemical compound C12=NC(SC)=NC(NCC=C(C)CO)=C2N=CN1C1OC(CO)C(O)C1O QEWSGVMSLPHELX-UHFFFAOYSA-N 0.000 description 1
- JUMHLCXWYQVTLL-KVTDHHQDSA-N 2-thio-5-aza-uridine Chemical compound [C@@H]1([C@H](O)[C@H](O)[C@@H](CO)O1)N1C(=S)NC(=O)N=C1 JUMHLCXWYQVTLL-KVTDHHQDSA-N 0.000 description 1
- VRVXMIJPUBNPGH-XVFCMESISA-N 2-thio-dihydrouridine Chemical compound OC[C@H]1O[C@H]([C@H](O)[C@@H]1O)N1CCC(=O)NC1=S VRVXMIJPUBNPGH-XVFCMESISA-N 0.000 description 1
- ZVGONGHIVBJXFC-WCTZXXKLSA-N 2-thio-zebularine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=S)N=CC=C1 ZVGONGHIVBJXFC-WCTZXXKLSA-N 0.000 description 1
- UTQUILVPBZEHTK-UHFFFAOYSA-N 3-Methyluridine Natural products O=C1N(C)C(=O)C=CN1C1C(O)C(O)C(CO)O1 UTQUILVPBZEHTK-UHFFFAOYSA-N 0.000 description 1
- FGFVODMBKZRMMW-XUTVFYLZSA-N 4-Methoxy-2-thiopseudouridine Chemical compound COC1=C(C=NC(=S)N1)[C@H]2[C@@H]([C@@H]([C@H](O2)CO)O)O FGFVODMBKZRMMW-XUTVFYLZSA-N 0.000 description 1
- HOCJTJWYMOSXMU-XUTVFYLZSA-N 4-Methoxypseudouridine Chemical compound COC1=C(C=NC(=O)N1)[C@H]2[C@@H]([C@@H]([C@H](O2)CO)O)O HOCJTJWYMOSXMU-XUTVFYLZSA-N 0.000 description 1
- VTGBLFNEDHVUQA-XUTVFYLZSA-N 4-Thio-1-methyl-pseudouridine Chemical compound S=C1NC(=O)N(C)C=C1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 VTGBLFNEDHVUQA-XUTVFYLZSA-N 0.000 description 1
- ZLOIGESWDJYCTF-UHFFFAOYSA-N 4-Thiouridine Natural products OC1C(O)C(CO)OC1N1C(=O)NC(=S)C=C1 ZLOIGESWDJYCTF-UHFFFAOYSA-N 0.000 description 1
- OCMSXKMNYAHJMU-JXOAFFINSA-N 4-amino-1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-2-oxopyrimidine-5-carbaldehyde Chemical compound C1=C(C=O)C(N)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 OCMSXKMNYAHJMU-JXOAFFINSA-N 0.000 description 1
- OZHIJZYBTCTDQC-JXOAFFINSA-N 4-amino-1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-5-methylpyrimidine-2-thione Chemical compound S=C1N=C(N)C(C)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 OZHIJZYBTCTDQC-JXOAFFINSA-N 0.000 description 1
- FEOYKPQEERVCAV-XVFCMESISA-N 4-amino-1-[(2r,3r,4s,5r)-3-azido-4-hydroxy-5-(hydroxymethyl)oxolan-2-yl]pyrimidin-2-one Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@H](N=[N+]=[N-])[C@H](O)[C@@H](CO)O1 FEOYKPQEERVCAV-XVFCMESISA-N 0.000 description 1
- DYPDKNUWDNOWPU-MTSNSDSCSA-N 4-amino-1-[(2r,3r,4s,5r)-4-hydroxy-5-(hydroxymethyl)-3-methyloxolan-2-yl]pyrimidin-2-one Chemical compound C[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)N=C(N)C=C1 DYPDKNUWDNOWPU-MTSNSDSCSA-N 0.000 description 1
- GCNTZFIIOFTKIY-UHFFFAOYSA-N 4-hydroxypyridine Chemical compound OC1=CC=NC=C1 GCNTZFIIOFTKIY-UHFFFAOYSA-N 0.000 description 1
- LOICBOXHPCURMU-UHFFFAOYSA-N 4-methoxy-pseudoisocytidine Chemical compound COC1NC(N)=NC=C1C(C1O)OC(CO)C1O LOICBOXHPCURMU-UHFFFAOYSA-N 0.000 description 1
- SJVVKUMXGIKAAI-UHFFFAOYSA-N 4-thio-pseudoisocytidine Chemical compound NC(N1)=NC=C(C(C2O)OC(CO)C2O)C1=S SJVVKUMXGIKAAI-UHFFFAOYSA-N 0.000 description 1
- 101710169336 5'-deoxyadenosine deaminase Proteins 0.000 description 1
- FAWQJBLSWXIJLA-VPCXQMTMSA-N 5-(carboxymethyl)uridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(CC(O)=O)=C1 FAWQJBLSWXIJLA-VPCXQMTMSA-N 0.000 description 1
- NMUSYJAQQFHJEW-UHFFFAOYSA-N 5-Azacytidine Natural products O=C1N=C(N)N=CN1C1C(O)C(O)C(CO)O1 NMUSYJAQQFHJEW-UHFFFAOYSA-N 0.000 description 1
- NFEXJLMYXXIWPI-JXOAFFINSA-N 5-Hydroxymethylcytidine Chemical compound C1=C(CO)C(N)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 NFEXJLMYXXIWPI-JXOAFFINSA-N 0.000 description 1
- ITGWEVGJUSMCEA-KYXWUPHJSA-N 5-[(2s,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-1-prop-1-ynylpyrimidine-2,4-dione Chemical compound O=C1NC(=O)N(C#CC)C=C1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 ITGWEVGJUSMCEA-KYXWUPHJSA-N 0.000 description 1
- DDHOXEOVAJVODV-GBNDHIKLSA-N 5-[(2s,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-2-sulfanylidene-1h-pyrimidin-4-one Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1C1=CNC(=S)NC1=O DDHOXEOVAJVODV-GBNDHIKLSA-N 0.000 description 1
- BNAWMJKJLNJZFU-GBNDHIKLSA-N 5-[(2s,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-4-sulfanylidene-1h-pyrimidin-2-one Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1C1=CNC(=O)NC1=S BNAWMJKJLNJZFU-GBNDHIKLSA-N 0.000 description 1
- XUNBIDXYAUXNKD-DBRKOABJSA-N 5-aza-2-thio-zebularine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=S)N=CN=C1 XUNBIDXYAUXNKD-DBRKOABJSA-N 0.000 description 1
- OSLBPVOJTCDNEF-DBRKOABJSA-N 5-aza-zebularine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)N=CN=C1 OSLBPVOJTCDNEF-DBRKOABJSA-N 0.000 description 1
- NMUSYJAQQFHJEW-KVTDHHQDSA-N 5-azacytidine Chemical compound O=C1N=C(N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 NMUSYJAQQFHJEW-KVTDHHQDSA-N 0.000 description 1
- RPQQZHJQUBDHHG-FNCVBFRFSA-N 5-methyl-zebularine Chemical compound C1=C(C)C=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 RPQQZHJQUBDHHG-FNCVBFRFSA-N 0.000 description 1
- USVMJSALORZVDV-UHFFFAOYSA-N 6-(gamma,gamma-dimethylallylamino)purine riboside Natural products C1=NC=2C(NCC=C(C)C)=NC=NC=2N1C1OC(CO)C(O)C1O USVMJSALORZVDV-UHFFFAOYSA-N 0.000 description 1
- OZTOEARQSSIFOG-MWKIOEHESA-N 6-Thio-7-deaza-8-azaguanosine Chemical compound Nc1nc(=S)c2cnn([C@@H]3O[C@H](CO)[C@@H](O)[C@H]3O)c2[nH]1 OZTOEARQSSIFOG-MWKIOEHESA-N 0.000 description 1
- CBNRZZNSRJQZNT-IOSLPCCCSA-O 6-thio-7-deaza-guanosine Chemical compound CC1=C[NH+]([C@@H]([C@@H]2O)O[C@H](CO)[C@H]2O)C(NC(N)=N2)=C1C2=S CBNRZZNSRJQZNT-IOSLPCCCSA-O 0.000 description 1
- RFHIWBUKNJIBSE-KQYNXXCUSA-O 6-thio-7-methyl-guanosine Chemical compound C1=2NC(N)=NC(=S)C=2N(C)C=[N+]1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O RFHIWBUKNJIBSE-KQYNXXCUSA-O 0.000 description 1
- MJJUWOIBPREHRU-MWKIOEHESA-N 7-Deaza-8-azaguanosine Chemical compound NC=1NC(C2=C(N=1)N(N=C2)[C@H]1[C@H](O)[C@H](O)[C@H](O1)CO)=O MJJUWOIBPREHRU-MWKIOEHESA-N 0.000 description 1
- ISSMDAFGDCTNDV-UHFFFAOYSA-N 7-deaza-2,6-diaminopurine Chemical compound NC1=NC(N)=C2NC=CC2=N1 ISSMDAFGDCTNDV-UHFFFAOYSA-N 0.000 description 1
- YVVMIGRXQRPSIY-UHFFFAOYSA-N 7-deaza-2-aminopurine Chemical compound N1C(N)=NC=C2C=CN=C21 YVVMIGRXQRPSIY-UHFFFAOYSA-N 0.000 description 1
- ZTAWTRPFJHKMRU-UHFFFAOYSA-N 7-deaza-8-aza-2,6-diaminopurine Chemical compound NC1=NC(N)=C2NN=CC2=N1 ZTAWTRPFJHKMRU-UHFFFAOYSA-N 0.000 description 1
- SMXRCJBCWRHDJE-UHFFFAOYSA-N 7-deaza-8-aza-2-aminopurine Chemical compound NC1=NC=C2C=NNC2=N1 SMXRCJBCWRHDJE-UHFFFAOYSA-N 0.000 description 1
- OGHAROSJZRTIOK-KQYNXXCUSA-O 7-methylguanosine Chemical compound C1=2N=C(N)NC(=O)C=2[N+](C)=CN1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O OGHAROSJZRTIOK-KQYNXXCUSA-O 0.000 description 1
- VJNXUFOTKNTNPG-IOSLPCCCSA-O 7-methylinosine Chemical compound C1=2NC=NC(=O)C=2N(C)C=[N+]1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O VJNXUFOTKNTNPG-IOSLPCCCSA-O 0.000 description 1
- HCAJQHYUCKICQH-VPENINKCSA-N 8-Oxo-7,8-dihydro-2'-deoxyguanosine Chemical compound C1=2NC(N)=NC(=O)C=2NC(=O)N1[C@H]1C[C@H](O)[C@@H](CO)O1 HCAJQHYUCKICQH-VPENINKCSA-N 0.000 description 1
- ABXGJJVKZAAEDH-IOSLPCCCSA-N 9-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-2-(dimethylamino)-3h-purine-6-thione Chemical compound C1=NC=2C(=S)NC(N(C)C)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O ABXGJJVKZAAEDH-IOSLPCCCSA-N 0.000 description 1
- ADPMAYFIIFNDMT-KQYNXXCUSA-N 9-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-2-(methylamino)-3h-purine-6-thione Chemical compound C1=NC=2C(=S)NC(NC)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O ADPMAYFIIFNDMT-KQYNXXCUSA-N 0.000 description 1
- MSSXOMSJDRHRMC-UHFFFAOYSA-N 9H-purine-2,6-diamine Chemical compound NC1=NC(N)=C2NC=NC2=N1 MSSXOMSJDRHRMC-UHFFFAOYSA-N 0.000 description 1
- 102100032290 A disintegrin and metalloproteinase with thrombospondin motifs 13 Human genes 0.000 description 1
- 108091005670 ADAMTS13 Proteins 0.000 description 1
- 102000055025 Adenosine deaminases Human genes 0.000 description 1
- 208000018126 Adrenomyeloneuropathy Diseases 0.000 description 1
- 208000023434 Alpers-Huttenlocher syndrome Diseases 0.000 description 1
- 102100031663 Alpha-tocopherol transfer protein Human genes 0.000 description 1
- 208000024985 Alport syndrome Diseases 0.000 description 1
- 102000052866 Amino Acyl-tRNA Synthetases Human genes 0.000 description 1
- 108700028939 Amino Acyl-tRNA Synthetases Proteins 0.000 description 1
- USFZMSVCRYTOJT-UHFFFAOYSA-N Ammonium acetate Chemical compound N.CC(O)=O USFZMSVCRYTOJT-UHFFFAOYSA-N 0.000 description 1
- 239000005695 Ammonium acetate Substances 0.000 description 1
- 206010061424 Anal cancer Diseases 0.000 description 1
- 208000007860 Anus Neoplasms Diseases 0.000 description 1
- 206010073360 Appendix cancer Diseases 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 200000000007 Arterial disease Diseases 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- 201000001320 Atherosclerosis Diseases 0.000 description 1
- 238000011725 BALB/c mouse Methods 0.000 description 1
- 244000063299 Bacillus subtilis Species 0.000 description 1
- 235000014469 Bacillus subtilis Nutrition 0.000 description 1
- 206010005003 Bladder cancer Diseases 0.000 description 1
- 241001674044 Blattodea Species 0.000 description 1
- 108010017384 Blood Proteins Proteins 0.000 description 1
- 102000004506 Blood Proteins Human genes 0.000 description 1
- 108010049931 Bone Morphogenetic Protein 2 Proteins 0.000 description 1
- 206010005949 Bone cancer Diseases 0.000 description 1
- 102100024506 Bone morphogenetic protein 2 Human genes 0.000 description 1
- 208000018084 Bone neoplasm Diseases 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 208000003174 Brain Neoplasms Diseases 0.000 description 1
- 208000014644 Brain disease Diseases 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- 208000003170 Bronchiolo-Alveolar Adenocarcinoma Diseases 0.000 description 1
- 201000010717 Bruton-type agammaglobulinemia Diseases 0.000 description 1
- 208000029402 Bulbospinal muscular atrophy Diseases 0.000 description 1
- 206010068597 Bulbospinal muscular atrophy congenital Diseases 0.000 description 1
- 208000010482 CADASIL Diseases 0.000 description 1
- 108010040467 CRISPR-Associated Proteins Proteins 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 208000031229 Cardiomyopathies Diseases 0.000 description 1
- 241000700199 Cavia porcellus Species 0.000 description 1
- 208000033221 Cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy Diseases 0.000 description 1
- 208000033935 Cerebral autosomal dominant arteriopathy-subcortical infarcts-leukoencephalopathy Diseases 0.000 description 1
- 206010008342 Cervix carcinoma Diseases 0.000 description 1
- 201000000915 Chronic Progressive External Ophthalmoplegia Diseases 0.000 description 1
- 208000029448 Chylomicron retention disease Diseases 0.000 description 1
- 102100022641 Coagulation factor IX Human genes 0.000 description 1
- 102100026735 Coagulation factor VIII Human genes 0.000 description 1
- 206010053567 Coagulopathies Diseases 0.000 description 1
- 102100033775 Collagen alpha-5(IV) chain Human genes 0.000 description 1
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 1
- 206010010099 Combined immunodeficiency Diseases 0.000 description 1
- 108020004394 Complementary RNA Proteins 0.000 description 1
- 206010010356 Congenital anomaly Diseases 0.000 description 1
- 208000027205 Congenital disease Diseases 0.000 description 1
- 201000006306 Cor pulmonale Diseases 0.000 description 1
- 102100034746 Cyclin-dependent kinase-like 5 Human genes 0.000 description 1
- 206010011777 Cystinosis Diseases 0.000 description 1
- 206010011778 Cystinuria Diseases 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- 102100036951 DNA polymerase subunit gamma-1 Human genes 0.000 description 1
- 230000008265 DNA repair mechanism Effects 0.000 description 1
- CYCGRDQQIOGCKX-UHFFFAOYSA-N Dehydro-luciferin Natural products OC(=O)C1=CSC(C=2SC3=CC(O)=CC=C3N=2)=N1 CYCGRDQQIOGCKX-UHFFFAOYSA-N 0.000 description 1
- 206010012289 Dementia Diseases 0.000 description 1
- 108010008532 Deoxyribonuclease I Proteins 0.000 description 1
- 102000007260 Deoxyribonuclease I Human genes 0.000 description 1
- 108010053770 Deoxyribonucleases Proteins 0.000 description 1
- 102000016911 Deoxyribonucleases Human genes 0.000 description 1
- 239000004375 Dextrin Substances 0.000 description 1
- 229920001353 Dextrin Polymers 0.000 description 1
- 208000004986 Diffuse Cerebral Sclerosis of Schilder Diseases 0.000 description 1
- YKWUPFSEFXSGRT-JWMKEVCDSA-N Dihydropseudouridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1C1C(=O)NC(=O)NC1 YKWUPFSEFXSGRT-JWMKEVCDSA-N 0.000 description 1
- 241000255581 Drosophila <fruit fly, genus> Species 0.000 description 1
- 206010013887 Dysarthria Diseases 0.000 description 1
- 238000008157 ELISA kit Methods 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 206010014476 Elevated cholesterol Diseases 0.000 description 1
- 208000032274 Encephalopathy Diseases 0.000 description 1
- 108010041308 Endothelial Growth Factors Proteins 0.000 description 1
- 241000283073 Equus caballus Species 0.000 description 1
- 108091062183 EsiRNA Proteins 0.000 description 1
- 108010082945 Eukaryotic Initiation Factor-2B Proteins 0.000 description 1
- 201000003542 Factor VIII deficiency Diseases 0.000 description 1
- 208000010255 Familial Hypoadrenocorticism Diseases 0.000 description 1
- 201000006328 Fanconi syndrome Diseases 0.000 description 1
- 208000037251 Fanconi-Bickel syndrome Diseases 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- BJGNCJDXODQBOB-UHFFFAOYSA-N Fivefly Luciferin Natural products OC(=O)C1CSC(C=2SC3=CC(O)=CC=C3N=2)=N1 BJGNCJDXODQBOB-UHFFFAOYSA-N 0.000 description 1
- 208000001914 Fragile X syndrome Diseases 0.000 description 1
- 208000024412 Friedreich ataxia Diseases 0.000 description 1
- 208000027472 Galactosemias Diseases 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 206010064571 Gene mutation Diseases 0.000 description 1
- 206010071602 Genetic polymorphism Diseases 0.000 description 1
- 208000006562 Glycogen Storage Disease Type VII Diseases 0.000 description 1
- 208000032008 Glycogen storage disease due to glycogen debranching enzyme deficiency Diseases 0.000 description 1
- 208000032000 Glycogen storage disease due to muscle glycogen phosphorylase deficiency Diseases 0.000 description 1
- 208000031926 Glycogen storage disease due to muscle phosphofructokinase deficiency Diseases 0.000 description 1
- 206010053250 Glycogen storage disease type III Diseases 0.000 description 1
- 206010018462 Glycogen storage disease type V Diseases 0.000 description 1
- 241000282575 Gorilla Species 0.000 description 1
- 108010017080 Granulocyte Colony-Stimulating Factor Proteins 0.000 description 1
- 102100039619 Granulocyte colony-stimulating factor Human genes 0.000 description 1
- 206010018691 Granuloma Diseases 0.000 description 1
- 208000018565 Hemochromatosis Diseases 0.000 description 1
- 108091005902 Hemoglobin subunit alpha Proteins 0.000 description 1
- 102100027685 Hemoglobin subunit alpha Human genes 0.000 description 1
- 208000032759 Hemolytic-Uremic Syndrome Diseases 0.000 description 1
- 241000711549 Hepacivirus C Species 0.000 description 1
- 241000700721 Hepatitis B virus Species 0.000 description 1
- 208000002972 Hepatolenticular Degeneration Diseases 0.000 description 1
- 208000028523 Hereditary Complement Deficiency disease Diseases 0.000 description 1
- 208000031953 Hereditary hemorrhagic telangiectasia Diseases 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000911390 Homo sapiens Coagulation factor VIII Proteins 0.000 description 1
- 101000710886 Homo sapiens Collagen alpha-5(IV) chain Proteins 0.000 description 1
- 101000945692 Homo sapiens Cyclin-dependent kinase-like 5 Proteins 0.000 description 1
- 101000804964 Homo sapiens DNA polymerase subunit gamma-1 Proteins 0.000 description 1
- 101001043809 Homo sapiens Interleukin-7 receptor subunit alpha Proteins 0.000 description 1
- 101000595929 Homo sapiens POLG alternative reading frame Proteins 0.000 description 1
- 101000738771 Homo sapiens Receptor-type tyrosine-protein phosphatase C Proteins 0.000 description 1
- 101000631760 Homo sapiens Sodium channel protein type 1 subunit alpha Proteins 0.000 description 1
- 101000684813 Homo sapiens Sodium channel subunit beta-1 Proteins 0.000 description 1
- 101000617738 Homo sapiens Survival motor neuron protein Proteins 0.000 description 1
- 101000828537 Homo sapiens Synaptic functional regulator FMR1 Proteins 0.000 description 1
- 101000946860 Homo sapiens T-cell surface glycoprotein CD3 epsilon chain Proteins 0.000 description 1
- 101001057681 Homo sapiens Translation initiation factor eIF-2B subunit beta Proteins 0.000 description 1
- 101000925982 Homo sapiens Translation initiation factor eIF-2B subunit delta Proteins 0.000 description 1
- 101000925985 Homo sapiens Translation initiation factor eIF-2B subunit epsilon Proteins 0.000 description 1
- 101001049688 Homo sapiens Translation initiation factor eIF-2B subunit gamma Proteins 0.000 description 1
- 101000934996 Homo sapiens Tyrosine-protein kinase JAK3 Proteins 0.000 description 1
- 101001061851 Homo sapiens V(D)J recombination-activating protein 2 Proteins 0.000 description 1
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 1
- 241000725303 Human immunodeficiency virus Species 0.000 description 1
- 241000701806 Human papillomavirus Species 0.000 description 1
- 208000015178 Hurler syndrome Diseases 0.000 description 1
- 208000035150 Hypercholesterolemia Diseases 0.000 description 1
- 208000019758 Hypergammaglobulinemia Diseases 0.000 description 1
- 206010020772 Hypertension Diseases 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 208000032571 Infant acute respiratory distress syndrome Diseases 0.000 description 1
- 206010061216 Infarction Diseases 0.000 description 1
- 229930010555 Inosine Natural products 0.000 description 1
- UGQMRVRMYYASKQ-KQYNXXCUSA-N Inosine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C2=NC=NC(O)=C2N=C1 UGQMRVRMYYASKQ-KQYNXXCUSA-N 0.000 description 1
- 102100021593 Interleukin-7 receptor subunit alpha Human genes 0.000 description 1
- 208000008839 Kidney Neoplasms Diseases 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- 239000012097 Lipofectamine 2000 Substances 0.000 description 1
- DDWFXDSYGUXRAY-UHFFFAOYSA-N Luciferin Natural products CCc1c(C)c(CC2NC(=O)C(=C2C=C)C)[nH]c1Cc3[nH]c4C(=C5/NC(CC(=O)O)C(C)C5CC(=O)O)CC(=O)c4c3C DDWFXDSYGUXRAY-UHFFFAOYSA-N 0.000 description 1
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 1
- 206010025323 Lymphomas Diseases 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 208000033868 Lysosomal disease Diseases 0.000 description 1
- 208000015439 Lysosomal storage disease Diseases 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 208000032271 Malignant tumor of penis Diseases 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 208000004451 Membranoproliferative Glomerulonephritis Diseases 0.000 description 1
- 206010051403 Mitochondrial DNA deletion Diseases 0.000 description 1
- 208000002678 Mucopolysaccharidoses Diseases 0.000 description 1
- 206010056886 Mucopolysaccharidosis I Diseases 0.000 description 1
- 108010085220 Multiprotein Complexes Proteins 0.000 description 1
- 102000007474 Multiprotein Complexes Human genes 0.000 description 1
- 102100026784 Myelin proteolipid protein Human genes 0.000 description 1
- RSPURTUNRHNVGF-IOSLPCCCSA-N N(2),N(2)-dimethylguanosine Chemical compound C1=NC=2C(=O)NC(N(C)C)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O RSPURTUNRHNVGF-IOSLPCCCSA-N 0.000 description 1
- SLEHROROQDYRAW-KQYNXXCUSA-N N(2)-methylguanosine Chemical compound C1=NC=2C(=O)NC(NC)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O SLEHROROQDYRAW-KQYNXXCUSA-N 0.000 description 1
- NIDVTARKFBZMOT-PEBGCTIMSA-N N(4)-acetylcytidine Chemical compound O=C1N=C(NC(=O)C)C=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 NIDVTARKFBZMOT-PEBGCTIMSA-N 0.000 description 1
- WVGPGNPCZPYCLK-WOUKDFQISA-N N(6),N(6)-dimethyladenosine Chemical compound C1=NC=2C(N(C)C)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O WVGPGNPCZPYCLK-WOUKDFQISA-N 0.000 description 1
- USVMJSALORZVDV-SDBHATRESA-N N(6)-(Delta(2)-isopentenyl)adenosine Chemical compound C1=NC=2C(NCC=C(C)C)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O USVMJSALORZVDV-SDBHATRESA-N 0.000 description 1
- VQAYFKKCNSOZKM-IOSLPCCCSA-N N(6)-methyladenosine Chemical compound C1=NC=2C(NC)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O VQAYFKKCNSOZKM-IOSLPCCCSA-N 0.000 description 1
- WVGPGNPCZPYCLK-UHFFFAOYSA-N N-Dimethyladenosine Natural products C1=NC=2C(N(C)C)=NC=NC=2N1C1OC(CO)C(O)C1O WVGPGNPCZPYCLK-UHFFFAOYSA-N 0.000 description 1
- UNUYMBPXEFMLNW-DWVDDHQFSA-N N-[(9-beta-D-ribofuranosylpurin-6-yl)carbamoyl]threonine Chemical compound C1=NC=2C(NC(=O)N[C@@H]([C@H](O)C)C(O)=O)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O UNUYMBPXEFMLNW-DWVDDHQFSA-N 0.000 description 1
- LZCNWAXLJWBRJE-ZOQUXTDFSA-N N4-Methylcytidine Chemical compound O=C1N=C(NC)C=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 LZCNWAXLJWBRJE-ZOQUXTDFSA-N 0.000 description 1
- GOSWTRUMMSCNCW-UHFFFAOYSA-N N6-(cis-hydroxyisopentenyl)adenosine Chemical compound C1=NC=2C(NCC=C(CO)C)=NC=NC=2N1C1OC(CO)C(O)C1O GOSWTRUMMSCNCW-UHFFFAOYSA-N 0.000 description 1
- VQAYFKKCNSOZKM-UHFFFAOYSA-N NSC 29409 Natural products C1=NC=2C(NC)=NC=NC=2N1C1OC(CO)C(O)C1O VQAYFKKCNSOZKM-UHFFFAOYSA-N 0.000 description 1
- 206010028974 Neonatal respiratory distress syndrome Diseases 0.000 description 1
- 206010029260 Neuroblastoma Diseases 0.000 description 1
- 102100025247 Neurogenic locus notch homolog protein 3 Human genes 0.000 description 1
- 208000025966 Neurological disease Diseases 0.000 description 1
- 102100027341 Neutral and basic amino acid transport protein rBAT Human genes 0.000 description 1
- 102220500390 Neutral and basic amino acid transport protein rBAT_C33S_mutation Human genes 0.000 description 1
- 102100023620 Neutrophil cytosol factor 1 Human genes 0.000 description 1
- 101710120102 Neutrophil cytosol factor 1 Proteins 0.000 description 1
- 102100023618 Neutrophil cytosol factor 2 Human genes 0.000 description 1
- 101710120095 Neutrophil cytosol factor 2 Proteins 0.000 description 1
- 201000000788 Niemann-Pick disease type C1 Diseases 0.000 description 1
- 108010029756 Notch3 Receptor Proteins 0.000 description 1
- XMIFBEZRFMTGRL-TURQNECASA-N OC[C@H]1O[C@H]([C@H](O)[C@@H]1O)n1cc(CNCCS(O)(=O)=O)c(=O)[nH]c1=S Chemical compound OC[C@H]1O[C@H]([C@H](O)[C@@H]1O)n1cc(CNCCS(O)(=O)=O)c(=O)[nH]c1=S XMIFBEZRFMTGRL-TURQNECASA-N 0.000 description 1
- 108091034117 Oligonucleotide Proteins 0.000 description 1
- 102000007981 Ornithine carbamoyltransferase Human genes 0.000 description 1
- 101710198224 Ornithine carbamoyltransferase, mitochondrial Proteins 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 241000282577 Pan troglodytes Species 0.000 description 1
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 1
- 208000018737 Parkinson disease Diseases 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 208000017493 Pelizaeus-Merzbacher disease Diseases 0.000 description 1
- 208000002471 Penile Neoplasms Diseases 0.000 description 1
- 206010034299 Penile cancer Diseases 0.000 description 1
- 241000009328 Perro Species 0.000 description 1
- 201000011252 Phenylketonuria Diseases 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 201000010769 Prader-Willi syndrome Diseases 0.000 description 1
- 208000002500 Primary Ovarian Insufficiency Diseases 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- 206010036802 Progressive external ophthalmoplegia Diseases 0.000 description 1
- 206010060862 Prostate cancer Diseases 0.000 description 1
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 1
- 101800004937 Protein C Proteins 0.000 description 1
- 102000017975 Protein C Human genes 0.000 description 1
- 201000005660 Protein C Deficiency Diseases 0.000 description 1
- 208000004186 Pulmonary Heart Disease Diseases 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 241000219492 Quercus Species 0.000 description 1
- 102000001183 RAG-1 Human genes 0.000 description 1
- 108060006897 RAG1 Proteins 0.000 description 1
- 108091034057 RNA (poly(A)) Proteins 0.000 description 1
- 108020005093 RNA Precursors Proteins 0.000 description 1
- 102000044126 RNA-Binding Proteins Human genes 0.000 description 1
- 108700020471 RNA-Binding Proteins Proteins 0.000 description 1
- 238000011529 RT qPCR Methods 0.000 description 1
- 102100037422 Receptor-type tyrosine-protein phosphatase C Human genes 0.000 description 1
- 206010038389 Renal cancer Diseases 0.000 description 1
- 208000025747 Rheumatic disease Diseases 0.000 description 1
- 101100273253 Rhizopus niveus RNAP gene Proteins 0.000 description 1
- 102000003661 Ribonuclease III Human genes 0.000 description 1
- 108010057163 Ribonuclease III Proteins 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 108091006311 SLC3A1 Proteins 0.000 description 1
- 241000235070 Saccharomyces Species 0.000 description 1
- 235000014680 Saccharomyces cerevisiae Nutrition 0.000 description 1
- 101800001700 Saposin-D Proteins 0.000 description 1
- 238000012300 Sequence Analysis Methods 0.000 description 1
- 108010071390 Serum Albumin Proteins 0.000 description 1
- 102000007562 Serum Albumin Human genes 0.000 description 1
- 241000700584 Simplexvirus Species 0.000 description 1
- 208000000453 Skin Neoplasms Diseases 0.000 description 1
- 108091060271 Small temporal RNA Proteins 0.000 description 1
- 102100028910 Sodium channel protein type 1 subunit alpha Human genes 0.000 description 1
- 102100023732 Sodium channel subunit beta-1 Human genes 0.000 description 1
- 208000005718 Stomach Neoplasms Diseases 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 102100021947 Survival motor neuron protein Human genes 0.000 description 1
- 241000282898 Sus scrofa Species 0.000 description 1
- 102100023532 Synaptic functional regulator FMR1 Human genes 0.000 description 1
- 102100035794 T-cell surface glycoprotein CD3 epsilon chain Human genes 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- 208000024313 Testicular Neoplasms Diseases 0.000 description 1
- 206010057644 Testis cancer Diseases 0.000 description 1
- 239000004098 Tetracycline Substances 0.000 description 1
- 208000024770 Thyroid neoplasm Diseases 0.000 description 1
- 102100027059 Translation initiation factor eIF-2B subunit alpha Human genes 0.000 description 1
- 102100027065 Translation initiation factor eIF-2B subunit beta Human genes 0.000 description 1
- 102100034266 Translation initiation factor eIF-2B subunit delta Human genes 0.000 description 1
- 102100034267 Translation initiation factor eIF-2B subunit epsilon Human genes 0.000 description 1
- 102100023225 Translation initiation factor eIF-2B subunit gamma Human genes 0.000 description 1
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 1
- 108010039203 Tripeptidyl-Peptidase 1 Proteins 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- 241000209140 Triticum Species 0.000 description 1
- 235000021307 Triticum Nutrition 0.000 description 1
- 229920004890 Triton X-100 Polymers 0.000 description 1
- 208000026911 Tuberous sclerosis complex Diseases 0.000 description 1
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 1
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 1
- 102100025387 Tyrosine-protein kinase JAK3 Human genes 0.000 description 1
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 1
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 1
- 208000002495 Uterine Neoplasms Diseases 0.000 description 1
- 102100029591 V(D)J recombination-activating protein 2 Human genes 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 206010047741 Vulval cancer Diseases 0.000 description 1
- 208000004354 Vulvar Neoplasms Diseases 0.000 description 1
- 208000018839 Wilson disease Diseases 0.000 description 1
- JCZSFCLRSONYLH-UHFFFAOYSA-N Wyosine Natural products N=1C(C)=CN(C(C=2N=C3)=O)C=1N(C)C=2N3C1OC(CO)C(O)C1O JCZSFCLRSONYLH-UHFFFAOYSA-N 0.000 description 1
- 210000001766 X chromosome Anatomy 0.000 description 1
- 208000006269 X-Linked Bulbo-Spinal Atrophy Diseases 0.000 description 1
- 208000010796 X-linked adrenoleukodystrophy Diseases 0.000 description 1
- 208000016349 X-linked agammaglobulinemia Diseases 0.000 description 1
- 201000001875 X-linked intellectual disability-psychosis-macroorchidism syndrome Diseases 0.000 description 1
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- LIPOUNRJVLNBCD-UHFFFAOYSA-N acetyl dihydrogen phosphate Chemical compound CC(=O)OP(O)(O)=O LIPOUNRJVLNBCD-UHFFFAOYSA-N 0.000 description 1
- 239000008186 active pharmaceutical agent Substances 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 201000009628 adenosine deaminase deficiency Diseases 0.000 description 1
- 238000005273 aeration Methods 0.000 description 1
- 239000011543 agarose gel Substances 0.000 description 1
- 230000001476 alcoholic effect Effects 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- 208000006682 alpha 1-Antitrypsin Deficiency Diseases 0.000 description 1
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 1
- 125000000539 amino acid group Chemical group 0.000 description 1
- 235000019257 ammonium acetate Nutrition 0.000 description 1
- 229940043376 ammonium acetate Drugs 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- 239000002870 angiogenesis inducing agent Substances 0.000 description 1
- 239000005557 antagonist Substances 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000002137 anti-vascular effect Effects 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 210000000612 antigen-presenting cell Anatomy 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 239000004599 antimicrobial Substances 0.000 description 1
- 201000011165 anus cancer Diseases 0.000 description 1
- 208000021780 appendiceal neoplasm Diseases 0.000 description 1
- 239000008365 aqueous carrier Substances 0.000 description 1
- 239000003125 aqueous solvent Substances 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 208000006673 asthma Diseases 0.000 description 1
- 210000001130 astrocyte Anatomy 0.000 description 1
- 230000001977 ataxic effect Effects 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 208000005849 atypical Rett syndrome Diseases 0.000 description 1
- 229960002756 azacitidine Drugs 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 229960000686 benzalkonium chloride Drugs 0.000 description 1
- 229960001950 benzethonium chloride Drugs 0.000 description 1
- UREZNYTWGJKWBI-UHFFFAOYSA-M benzethonium chloride Chemical compound [Cl-].C1=CC(C(C)(C)CC(C)(C)C)=CC=C1OCCOCC[N+](C)(C)CC1=CC=CC=C1 UREZNYTWGJKWBI-UHFFFAOYSA-M 0.000 description 1
- 235000019445 benzyl alcohol Nutrition 0.000 description 1
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- IQFYYKKMVGJFEH-UHFFFAOYSA-N beta-L-thymidine Natural products O=C1NC(=O)C(C)=CN1C1OC(CO)C(O)C1 IQFYYKKMVGJFEH-UHFFFAOYSA-N 0.000 description 1
- 230000027455 binding Effects 0.000 description 1
- OWMVSZAMULFTJU-UHFFFAOYSA-N bis-tris Chemical compound OCCN(CCO)C(CO)(CO)CO OWMVSZAMULFTJU-UHFFFAOYSA-N 0.000 description 1
- HUTDDBSSHVOYJR-UHFFFAOYSA-H bis[(2-oxo-1,3,2$l^{5},4$l^{2}-dioxaphosphaplumbetan-2-yl)oxy]lead Chemical compound [Pb+2].[Pb+2].[Pb+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O HUTDDBSSHVOYJR-UHFFFAOYSA-H 0.000 description 1
- 208000015294 blood coagulation disease Diseases 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 210000000988 bone and bone Anatomy 0.000 description 1
- 239000004067 bulking agent Substances 0.000 description 1
- LRHPLDYGYMQRHN-UHFFFAOYSA-N butyl alcohol Substances CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 230000006037 cell lysis Effects 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 238000002659 cell therapy Methods 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 230000030570 cellular localization Effects 0.000 description 1
- 230000005754 cellular signaling Effects 0.000 description 1
- 208000016886 cerebral arteriopathy with subcortical infarcts and leukoencephalopathy Diseases 0.000 description 1
- 230000002490 cerebral effect Effects 0.000 description 1
- 201000010881 cervical cancer Diseases 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 239000003638 chemical reducing agent Substances 0.000 description 1
- 208000016532 chronic granulomatous disease Diseases 0.000 description 1
- 239000007979 citrate buffer Substances 0.000 description 1
- 230000009852 coagulant defect Effects 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 239000003184 complementary RNA Substances 0.000 description 1
- 230000009918 complex formation Effects 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 208000029078 coronary artery disease Diseases 0.000 description 1
- 230000001054 cortical effect Effects 0.000 description 1
- HPXRVTGHNJAIIH-UHFFFAOYSA-N cyclohexanol Chemical compound OC1CCCCC1 HPXRVTGHNJAIIH-UHFFFAOYSA-N 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 229940104302 cytosine Drugs 0.000 description 1
- GVJHHUAWPYXKBD-UHFFFAOYSA-N d-alpha-tocopherol Natural products OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 238000004925 denaturation Methods 0.000 description 1
- 230000036425 denaturation Effects 0.000 description 1
- 210000004443 dendritic cell Anatomy 0.000 description 1
- 238000000326 densiometry Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 235000019425 dextrin Nutrition 0.000 description 1
- ZPTBLXKRQACLCR-XVFCMESISA-N dihydrouridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)CC1 ZPTBLXKRQACLCR-XVFCMESISA-N 0.000 description 1
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 1
- 229940042399 direct acting antivirals protease inhibitors Drugs 0.000 description 1
- 150000002016 disaccharides Chemical class 0.000 description 1
- 238000009509 drug development Methods 0.000 description 1
- 238000007876 drug discovery Methods 0.000 description 1
- 229940088679 drug related substance Drugs 0.000 description 1
- 238000004520 electroporation Methods 0.000 description 1
- 210000002472 endoplasmic reticulum Anatomy 0.000 description 1
- 210000001163 endosome Anatomy 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 206010015037 epilepsy Diseases 0.000 description 1
- 238000012869 ethanol precipitation Methods 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 208000024519 eye neoplasm Diseases 0.000 description 1
- PJMPHNIQZUBGLI-UHFFFAOYSA-N fentanyl Chemical compound C=1C=CC=CC=1N(C(=O)CC)C(CC1)CCN1CCC1=CC=CC=C1 PJMPHNIQZUBGLI-UHFFFAOYSA-N 0.000 description 1
- 229960002428 fentanyl Drugs 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 239000006260 foam Substances 0.000 description 1
- 201000003415 fragile X-associated tremor/ataxia syndrome Diseases 0.000 description 1
- 206010017758 gastric cancer Diseases 0.000 description 1
- 238000001502 gel electrophoresis Methods 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 238000012239 gene modification Methods 0.000 description 1
- 238000012226 gene silencing method Methods 0.000 description 1
- 238000001415 gene therapy Methods 0.000 description 1
- 230000005017 genetic modification Effects 0.000 description 1
- 235000013617 genetically modified food Nutrition 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 208000007345 glycogen storage disease Diseases 0.000 description 1
- 201000004543 glycogen storage disease III Diseases 0.000 description 1
- 201000004534 glycogen storage disease V Diseases 0.000 description 1
- 201000009339 glycogen storage disease VII Diseases 0.000 description 1
- 210000002288 golgi apparatus Anatomy 0.000 description 1
- 239000000122 growth hormone Substances 0.000 description 1
- 229940093915 gynecological organic acid Drugs 0.000 description 1
- 201000010536 head and neck cancer Diseases 0.000 description 1
- 208000014829 head and neck neoplasm Diseases 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 208000024348 heart neoplasm Diseases 0.000 description 1
- 201000002655 heart sarcoma Diseases 0.000 description 1
- 208000009429 hemophilia B Diseases 0.000 description 1
- 208000003215 hereditary nephritis Diseases 0.000 description 1
- 208000008675 hereditary spastic paraplegia Diseases 0.000 description 1
- 208000013746 hereditary thrombophilia due to congenital protein C deficiency Diseases 0.000 description 1
- 230000000971 hippocampal effect Effects 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 230000003284 homeostatic effect Effects 0.000 description 1
- 238000002744 homologous recombination Methods 0.000 description 1
- 230000006801 homologous recombination Effects 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 229920001477 hydrophilic polymer Polymers 0.000 description 1
- 230000005934 immune activation Effects 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 230000007813 immunodeficiency Effects 0.000 description 1
- 208000015446 immunoglobulin a vasculitis Diseases 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 230000000415 inactivating effect Effects 0.000 description 1
- 208000033065 inborn errors of immunity Diseases 0.000 description 1
- 239000000411 inducer Substances 0.000 description 1
- 239000011261 inert gas Substances 0.000 description 1
- 230000007574 infarction Effects 0.000 description 1
- 229960003786 inosine Drugs 0.000 description 1
- 238000002743 insertional mutagenesis Methods 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 201000010982 kidney cancer Diseases 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 201000001996 leukoencephalopathy with vanishing white matter Diseases 0.000 description 1
- DTOSIQBPPRVQHS-PDBXOOCHSA-M linolenate Chemical compound CC\C=C/C\C=C/C\C=C/CCCCCCCC([O-])=O DTOSIQBPPRVQHS-PDBXOOCHSA-M 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 201000007270 liver cancer Diseases 0.000 description 1
- 208000014018 liver neoplasm Diseases 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 238000004020 luminiscence type Methods 0.000 description 1
- 201000005202 lung cancer Diseases 0.000 description 1
- 208000020816 lung neoplasm Diseases 0.000 description 1
- 230000002934 lysing effect Effects 0.000 description 1
- 230000012976 mRNA stabilization Effects 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- HRLIOXLXPOHXTA-UHFFFAOYSA-N medetomidine Chemical compound C=1C=CC(C)=C(C)C=1C(C)C1=CN=C[N]1 HRLIOXLXPOHXTA-UHFFFAOYSA-N 0.000 description 1
- 229960002140 medetomidine Drugs 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 125000001360 methionine group Chemical group N[C@@H](CCSC)C(=O)* 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 1
- 239000004292 methyl p-hydroxybenzoate Substances 0.000 description 1
- 229960002216 methylparaben Drugs 0.000 description 1
- DDLIGBOFAVUZHB-UHFFFAOYSA-N midazolam Chemical compound C12=CC(Cl)=CC=C2N2C(C)=NC=C2CN=C1C1=CC=CC=C1F DDLIGBOFAVUZHB-UHFFFAOYSA-N 0.000 description 1
- 229960003793 midazolam Drugs 0.000 description 1
- 230000000116 mitigating effect Effects 0.000 description 1
- 201000011540 mitochondrial DNA depletion syndrome 4a Diseases 0.000 description 1
- 150000002772 monosaccharides Chemical class 0.000 description 1
- 206010028093 mucopolysaccharidosis Diseases 0.000 description 1
- 201000006938 muscular dystrophy Diseases 0.000 description 1
- 238000002703 mutagenesis Methods 0.000 description 1
- 231100000350 mutagenesis Toxicity 0.000 description 1
- 208000015122 neurodegenerative disease Diseases 0.000 description 1
- 201000008051 neuronal ceroid lipofuscinosis Diseases 0.000 description 1
- 201000001119 neuropathy Diseases 0.000 description 1
- 230000007823 neuropathy Effects 0.000 description 1
- 201000002652 newborn respiratory distress syndrome Diseases 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 230000006780 non-homologous end joining Effects 0.000 description 1
- 239000012457 nonaqueous media Substances 0.000 description 1
- 239000002736 nonionic surfactant Substances 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 230000030147 nuclear export Effects 0.000 description 1
- 238000007899 nucleic acid hybridization Methods 0.000 description 1
- 238000001668 nucleic acid synthesis Methods 0.000 description 1
- 150000003833 nucleoside derivatives Chemical class 0.000 description 1
- 125000003835 nucleoside group Chemical group 0.000 description 1
- 210000004940 nucleus Anatomy 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- 201000008106 ocular cancer Diseases 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 206010030875 ophthalmoplegia Diseases 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 150000002895 organic esters Chemical class 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- LXCFILQKKLGQFO-UHFFFAOYSA-N p-hydroxybenzoic acid methyl ester Natural products COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 1
- 201000002528 pancreatic cancer Diseases 0.000 description 1
- 208000008443 pancreatic carcinoma Diseases 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 1
- 230000000737 periodic effect Effects 0.000 description 1
- 208000033808 peripheral neuropathy Diseases 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 150000004713 phosphodiesters Chemical group 0.000 description 1
- 229930029653 phosphoenolpyruvate Natural products 0.000 description 1
- DTBNBXWJWCWCIK-UHFFFAOYSA-N phosphoenolpyruvic acid Chemical compound OC(=O)C(=C)OP(O)(O)=O DTBNBXWJWCWCIK-UHFFFAOYSA-N 0.000 description 1
- 230000001766 physiological effect Effects 0.000 description 1
- 239000013600 plasmid vector Substances 0.000 description 1
- 229920001983 poloxamer Polymers 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 230000003449 preventive effect Effects 0.000 description 1
- 208000028529 primary immunodeficiency disease Diseases 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 235000010232 propyl p-hydroxybenzoate Nutrition 0.000 description 1
- 239000004405 propyl p-hydroxybenzoate Substances 0.000 description 1
- 229960003415 propylparaben Drugs 0.000 description 1
- 229960000856 protein c Drugs 0.000 description 1
- 208000020016 psychiatric disease Diseases 0.000 description 1
- 150000003212 purines Chemical class 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 230000001172 regenerating effect Effects 0.000 description 1
- 230000008929 regeneration Effects 0.000 description 1
- 238000011069 regeneration method Methods 0.000 description 1
- 210000001995 reticulocyte Anatomy 0.000 description 1
- 239000002342 ribonucleoside Substances 0.000 description 1
- 125000000548 ribosyl group Chemical group C1([C@H](O)[C@H](O)[C@H](O1)CO)* 0.000 description 1
- 239000000523 sample Substances 0.000 description 1
- 239000012723 sample buffer Substances 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 230000001953 sensory effect Effects 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 230000003584 silencer Effects 0.000 description 1
- 201000000849 skin cancer Diseases 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 210000000278 spinal cord Anatomy 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 230000010473 stable expression Effects 0.000 description 1
- SFVFIFLLYFPGHH-UHFFFAOYSA-M stearalkonium chloride Chemical compound [Cl-].CCCCCCCCCCCCCCCCCC[N+](C)(C)CC1=CC=CC=C1 SFVFIFLLYFPGHH-UHFFFAOYSA-M 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 239000008174 sterile solution Substances 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 201000011549 stomach cancer Diseases 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 201000003120 testicular cancer Diseases 0.000 description 1
- 229960002180 tetracycline Drugs 0.000 description 1
- 229930101283 tetracycline Natural products 0.000 description 1
- 235000019364 tetracycline Nutrition 0.000 description 1
- 150000003522 tetracyclines Chemical class 0.000 description 1
- 230000004797 therapeutic response Effects 0.000 description 1
- AYEKOFBPNLCAJY-UHFFFAOYSA-O thiamine pyrophosphate Chemical compound CC1=C(CCOP(O)(=O)OP(O)(O)=O)SC=[N+]1CC1=CN=C(C)N=C1N AYEKOFBPNLCAJY-UHFFFAOYSA-O 0.000 description 1
- 201000002510 thyroid cancer Diseases 0.000 description 1
- 235000010384 tocopherol Nutrition 0.000 description 1
- 229960001295 tocopherol Drugs 0.000 description 1
- 229930003799 tocopherol Natural products 0.000 description 1
- 239000011732 tocopherol Substances 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 239000011573 trace mineral Substances 0.000 description 1
- 235000013619 trace mineral Nutrition 0.000 description 1
- 239000012096 transfection reagent Substances 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 230000009261 transgenic effect Effects 0.000 description 1
- 230000001052 transient effect Effects 0.000 description 1
- 108091005703 transmembrane proteins Proteins 0.000 description 1
- 102000035160 transmembrane proteins Human genes 0.000 description 1
- 125000002264 triphosphate group Chemical group [H]OP(=O)(O[H])OP(=O)(O[H])OP(=O)(O[H])O* 0.000 description 1
- 208000009999 tuberous sclerosis Diseases 0.000 description 1
- 230000037455 tumor specific immune response Effects 0.000 description 1
- 230000007306 turnover Effects 0.000 description 1
- 241000701161 unidentified adenovirus Species 0.000 description 1
- 241000701447 unidentified baculovirus Species 0.000 description 1
- 241001430294 unidentified retrovirus Species 0.000 description 1
- 201000005112 urinary bladder cancer Diseases 0.000 description 1
- 206010046766 uterine cancer Diseases 0.000 description 1
- 238000002255 vaccination Methods 0.000 description 1
- 206010046885 vaginal cancer Diseases 0.000 description 1
- 208000013139 vaginal neoplasm Diseases 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 210000003462 vein Anatomy 0.000 description 1
- 239000013603 viral vector Substances 0.000 description 1
- 239000011782 vitamin Substances 0.000 description 1
- 235000013343 vitamin Nutrition 0.000 description 1
- 229940088594 vitamin Drugs 0.000 description 1
- 229930003231 vitamin Natural products 0.000 description 1
- 201000005102 vulva cancer Diseases 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 210000004885 white matter Anatomy 0.000 description 1
- QAOHCFGKCWTBGC-QHOAOGIMSA-N wybutosine Chemical compound C1=NC=2C(=O)N3C(CC[C@H](NC(=O)OC)C(=O)OC)=C(C)N=C3N(C)C=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O QAOHCFGKCWTBGC-QHOAOGIMSA-N 0.000 description 1
- QAOHCFGKCWTBGC-UHFFFAOYSA-N wybutosine Natural products C1=NC=2C(=O)N3C(CCC(NC(=O)OC)C(=O)OC)=C(C)N=C3N(C)C=2N1C1OC(CO)C(O)C1O QAOHCFGKCWTBGC-UHFFFAOYSA-N 0.000 description 1
- JCZSFCLRSONYLH-QYVSTXNMSA-N wyosin Chemical compound N=1C(C)=CN(C(C=2N=C3)=O)C=1N(C)C=2N3[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O JCZSFCLRSONYLH-QYVSTXNMSA-N 0.000 description 1
- 210000005253 yeast cell Anatomy 0.000 description 1
- RPQZTTQVRYEKCR-WCTZXXKLSA-N zebularine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)N=CC=C1 RPQZTTQVRYEKCR-WCTZXXKLSA-N 0.000 description 1
- GVJHHUAWPYXKBD-IEOSBIPESA-N α-tocopherol Chemical compound OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-IEOSBIPESA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/67—General methods for enhancing the expression
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0688—Cells from the lungs or the respiratory tract
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
- C12N15/8509—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells for producing genetically modified animals, e.g. transgenic
- C12N2015/8527—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells for producing genetically modified animals, e.g. transgenic for producing animal models, e.g. for tests or diseases
- C12N2015/8572—Animal models for proliferative diseases, e.g. comprising an oncogene
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
- C12N15/8509—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells for producing genetically modified animals, e.g. transgenic
- C12N2015/8527—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells for producing genetically modified animals, e.g. transgenic for producing animal models, e.g. for tests or diseases
- C12N2015/859—Animal models comprising reporter system for screening tests
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2800/00—Nucleic acids vectors
- C12N2800/10—Plasmid DNA
- C12N2800/106—Plasmid DNA for vertebrates
- C12N2800/107—Plasmid DNA for vertebrates for mammalian
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2800/00—Nucleic acids vectors
- C12N2800/22—Vectors comprising a coding region that has been codon optimised for expression in a respective host
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2830/00—Vector systems having a special element relevant for transcription
- C12N2830/34—Vector systems having a special element relevant for transcription being a transcription initiation element
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2840/00—Vectors comprising a special translation-regulating system
- C12N2840/10—Vectors comprising a special translation-regulating system regulates levels of translation
- C12N2840/105—Vectors comprising a special translation-regulating system regulates levels of translation enhancing translation
Landscapes
- Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Engineering & Computer Science (AREA)
- Life Sciences & Earth Sciences (AREA)
- Biomedical Technology (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Biotechnology (AREA)
- Organic Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Microbiology (AREA)
- Physics & Mathematics (AREA)
- Plant Pathology (AREA)
- Biophysics (AREA)
- Pulmonology (AREA)
- Cell Biology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Enzymes And Modification Thereof (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Transition And Organic Metals Composition Catalysts For Addition Polymerization (AREA)
Description
2011, 150:238-247; Eur J Pharm Biopharm, 2009, 71:484-489; Nat Biotech, 2011, 29:154-157, and Nat Rev Genet, 2011, 12:861-874)。しかしながら、mRNAの臨床的応用性をさらに確立するためには、従来のmRNAの強い免疫原性と限定的な安定性を克服しなければならない。これに関しては、mRNAの安定性および特にmRNAの翻訳速度が、想定される医療用途に必須のパラメータとなる。これは、mRNAの翻訳速度が、mRNA薬の投与量および投与間隔を決定するからである。
1:236-249 and Cold Spring Harbor Monograph Archive, 2007, 48:87-128)。UTR内の特定のモチーフに応じて、UTRはmRNAの代謝回転を高めることも低減させることも可能である(Cell. Mol. Life Sci., 2012, 69:3613-3634; Nucleic Acids Research, 2005, 33:D141-D146; Science, 2005, 309:1514-1518 and Current Protein & Peptide Science, 2012, 13:294-304)。近年、mRNAの半減期と、対応するUTR配列についてのデータが公開されている(Nucleic Acids Research, 2011, 39:556-566 and Nucleic acids research, 37, e115)。
区域であり、つまり、翻訳されない配列である。これらの領域はコード領域と共に転写され、したがって、該領域は成熟mRNAに存在するエキソンである。mRNAの開始コドンの上流のUTRは、5´UTRと呼ばれ、いったん転写されると、特に、プロモーターの(残留した3´の)一部に相当する配列およびいわゆるコザック配列を宿す。
RNA分子中のこの配列は翻訳開始部位のリボソームにより認識され、ここからタンパク質がそのmRNA分子にコードされている。リボソームは、翻訳を開始するために、この配列かまたは可能性のあるその変種を必要とする。配列は、記号(gcc)gccRccAUGGにより特定され、これは、以下のように、幅広いソース(全部で約699個)からコザックにより解析されたデータを要約するものである:小文字は、ある位置での最も一般的な塩基を表示し(そうは言っても塩基は変わり得るが);大文字は、高度に保存された塩基を示し、つまり、「AUGG」配列は一定で、変わることがあったとしてもまれであり、Rはプリン(アデニンまたはグアニン)が常にその位置で観察されることを示し(コザックはアデニンがより高頻度であると主張する);括弧内の配列((gcc))は、異議不明である。
真核細胞におけるプレプロインスリンおよびアルファグロビン翻訳についての研究により、位置-3のプリン(通常はA)が効率的な翻訳開始に必須であり、このプリンがない場合、位置+4のGが必須であることが明らかになった(J. Cell Biol., 1989, 108:229-41)。mRNA分子から合成されるタンパク質量は、コザックエレメントの配列に強く左
右され:タンパク質のN末端メチオニンをコードしているAUG開始コドンが最も重要である。強いコンセンサスのためには、位置+4(G)および-3(AまたはG)のヌクレオチドが、両方ともコンセンサスと一致しなければならない。十分なコンセンサス配列は、これらの2つの部位の一つのみを有する一方、弱いコンセンサス配列は、位置+4でも-3でも要件を満たさない。-1および-2の2つのシチジン残基は、それほど保存されておらず(Cell, 1986, 44 (2):283-92)、一方、位置-6のGは翻訳開始のために重要
である(Br. J. Haematol., 2004, 124 (2):224-31)。
(a)その5´末端に開始コドンを含み、ポリペプチドをコードするコード領域と;
(b)前記コード配列のすぐ上流にある、以下の(b1)および(b2)からなる群から選択される配列とを有する一本の鎖を含むか;または相補鎖を含み、
(b1)は、R1-CGCCACC(SEQ ID NO:1)か;または、
前記配列において、SEQ ID NO:1の位置6のCがAに置換され、SEQ ID
NO:1の位置7のCがGに置換され;および/もしくはSEQ ID NO:1の位置5のAがGに置換されている配列であり;
(b2)は、R1-CNGCCACC(SEQ ID NO:2)であって、SEQ ID NO:2の位置2のヌクレオチドNがT、G、C、もしくはAから成る群から選択されるヌクレオチドである、配列か;または、
前記配列において、SEQ ID NO:2の位置7のCがAに置換され、SEQ ID
NO:2の位置8のCがGに置換され;および/もしくはSEQ ID NO:2の位置6のAがGに置換されている配列であり、
R1は、DNA依存性RNAポリメラーゼにより認識されるプロモーターである、DNA分子に関する。
鎖は、DNA依存性RNAポリメラーゼにより、転写時に3´末端から5´末端へ読み取られる(3´→5´)。相補的RNAが反対側に5´→3´方向で作られ、これは、ウラシルがチミンにスイッチされることを除き、センス鎖の配列と一致している。この方向性は、RNAポリメラーゼが、成長するmRNA鎖の3´末端にヌクレオチドを加えることだけ可能であるからである。DNAの非鋳型センス鎖は、その配列が、新しく作られるRNA転写物と(ウラシルのチミンへの置換を除き)同じであることから、コード鎖と呼ばれる。これは、DNA配列を提示する本発明の文脈において、慣習により使用される鎖である。
NAまたはRNAの一部であり、エキソンからなり、ポリペプチドまたはタンパク質をコードする。mRNAのコード領域は、エキソンの一部でもある5´非翻訳領域(5´UTR)と3´非翻訳領域(3´UTR)に隣接している。さらに、mRNA分子は、いわゆる5´キャップとポリAテールをさらに含み得る。5´キャップ、5´UTR、3´UTR、およびポリAテールは、タンパク質に翻訳されないmRNA分子の領域である。
含み得る。多くの3´UTRは、また、AUリッチエレメント(ARE)を含有する。さらに、3´UTRは、好適には、ポリ(A)テールと呼ばれる数百のアデニン残基を、mRNA転写物の末端に付加することを指示する配列AAUAAAを含有し得る。
異体は、細胞においてその機能が必要であるか、または、その欠陥型または欠損型が病原性であるタンパク質の機能を細胞において担う断片を意味することを理解されたい。
き起こされ、それぞれの疾患の発現はしばしば流動的で、環境因子に関係する。多遺伝子性障害の例は高血圧、コレステロール値の上昇、がん、神経変性障害、精神疾患、および他である。また、これらの場合、これらの遺伝子の1つまたは複数を表す治療用mRNAが、その患者にとって有益であり得る。さらに、遺伝障害は、両親の遺伝子から受け継がれていないはずであっても、新たな変異によっても引き起こされ得る。これらの場合も、正しい遺伝子配列を表す治療用mRNAが、患者にとって有益であり得る。
II(ハンター症候群)、MPS VI、糖原病II型またはムコ多糖症などの蓄積症。
スコフスキー病、ならびにPTT-1およびTPP1欠乏症を含むニューロンセロイドリポフスチン関連疾患;EIF2B1、EIF2B2、EIF2B3、EIF2B4およびEIF2B5が関連する中枢神経系の髄鞘形成不全/白質消失を伴う小児運動失調;CACNA1AおよびCACNB4が関連する一過性運動失調2型;クラシックレット症候群、MECP2関連重症新生児脳症およびPPM-X症候群を含むMECP2関連障害;CDKL5関連非定型レット症候群;ケネディ病(SBMA);Notch-3関連の皮質梗塞および白質脳症を伴う常染色体優性遺伝性脳動脈症(CADASIL);SCN1AおよびSCN1Bが関連する発作障害;アルパーズ・フッテンロッハー症候群、POLG関連感覚性運動失調性神経障害、構音障害および眼麻痺、およびミトコンドリアDNA欠失を伴う常染色体優性および劣性進行性外眼筋麻痺を含むポリメラーゼG関連障害;X連鎖副腎低形成;X連鎖無ガンマグロブリン血症;ファブリー病;ならびにウィルソン病。
するコード領域」は、ゲノム編集技術において使用され得るポリペプチドまたはタンパク質をコードするコード領域であり得る。ゲノム編集は、ヌクレアーゼを使用して生物のゲノムにDNAを挿入し、欠落させ、または置換する遺伝子工学の一種である。これらのヌクレアーゼは、ゲノムの所望の位置に部位特異的二本鎖切断(DSB)を生じさせる。誘導された二本鎖切断は、非相同末端結合または相同組換えによって修復され、ゲノムに標
的変異をもたらし、それによりゲノムを「編集する」。異なるポリペプチドまたはタンパク質を利用する多数のゲノム編集システム、つまり、例えばCRISPR-Casシステム、メガヌクレアーゼ、ジンクフィンガーヌクレアーゼ(ZFN)および転写活性化因子様エフェクターベースヌクレアーゼ(TALEN)が当該技術分野で既知である。ゲノム工学の方法は、Biotechnology, 2013, 31 (7), 397-405に概説されている。
(b1)は、R1-CGCCACC(SEQ ID NO:1)か;または、
前記配列において、SEQ ID NO:1の位置6のCがAに置換され、SEQ ID
NO:1の位置7のCがGに置換され;および/もしくはSEQ ID NO:1の位置5のAがGに置換されている配列であり;
(b2)は、R1-CNGCCACC(SEQ ID NO:2)であって、SEQ
ID NO:2の位置2のヌクレオチドNが、T、G、C、もしくはAから成る群から選択されるヌクレオチドである、配列か;または、
前記配列において、SEQ ID NO:2の位置7のCがAに置換され、SEQ ID
NO:2の位置8のCがGに置換され;および/もしくはSEQ ID NO:2の位置6のAがGに置換されている配列であり、
R1は、DNA依存性RNAポリメラーゼにより認識されるプロモーターである。
対応するプロモーター配列R1を特異的に検出/結合することが可能であることだけを意味するわけではない。この用語は、また、DNA依存性RNAポリメラーゼが転写を開始し、次に、伸長反応時にRNA分子を生成できることも指す。
により決定され得、一方、多数のDNA依存性RNAポリメラーゼの発見が、Journal of
Biological Chemistry, 2005, 280(52): 42477-42485)に概説されている。
(i)TAATACGACTCACTATAGGGAGA(SEQ ID NO:3)、または、SEQ ID NO:3と比較して1~6個の置換を示し、T7DNA依存性RNAポリメラーゼにより認識される配列;
(ii)AATTAACCCTCACTAAAGGGAGA(SEQ ID NO:4)、または、SEQ ID NO:4と比較し1~6個の置換を示し、T3DNA依存性RNAポリメラーゼにより認識される配列;
(iii)ATTTAGGTGACACTATAGAAG(SEQ ID NO:5)、またはSEQ ID NO:5と比較して1~6個の置換を示し、SP6DNA依存性RNAポリメラーゼにより認識される配列;および、
(iv)AATTAGGGCACACTATAGGGA(SEQ ID NO:6)、またはSEQ ID NO:6と比較して1~6個の置換を示し、K11DNA依存性RNAポリメラーゼにより認識される配列からなる群から選択される。
T3、SP6、およびK11DNA依存性RNAポリメラーゼそれぞれにより認識され得る場合に限る。最も好適には、配列は、1個の置換を示す配列であり得る。ただし、対応する配列がなお、T7、T3、SP6、およびK11DNA依存性RNAポリメラーゼそれぞれにより認識され得る場合に限る。
クローニングベクター」などの用語「ベクター」は、染色体DNAから独立して細胞内で自己複製し、遺伝物質を細胞に運ぶ媒体として使用され、細胞内で遺伝物質は複製されおよび/または発現する(つまり、RNAに転写され、アミノ酸配列に翻訳される)、環状二本鎖DNAユニットとして理解される。外来性DNAを含有するベクターを、組換えDNAという。ベクター自体は、概して、典型的には、挿入物(例えば、本発明の核酸分子/DNA分子)と、ベクターの「骨格」として機能するより大きい配列からなるDNA配列である。本発明の意味でのプラスミドは、細菌で最も頻繁に見られ、細胞間で遺伝子を転移する組換えDNA研究に使用され、それ自体は本発明の意味で使用される「ベクター」の亜集団である。
載されるようなテトラサイクリン制御遺伝子発現、またはCrook, EMBO J. 8 (1989), 513-519等に記載されるようなデキサメタゾン誘導遺伝子発現系である。
な標準的方法によって行うことが可能である。宿主細胞は、特にpH値、温度、塩濃度、通気、抗生物質、ビタミン、微量元素等に関して、使用される特定の宿主細胞の要件を満たす栄養培地で培養される。
細胞株保管所から入手可能である。本発明によれば、初代細胞/細胞培養物は宿主細胞として機能し得ることがさらに想定される。前記細胞は、特に、昆虫(ショウジョウバエ種またはゴキブリ種の昆虫のような)または哺乳動物(ヒト、ブタ、マウスもしくはラットのような)に由来する。前記宿主細胞は、神経芽細胞腫細胞株のような細胞株からの細胞および/またはそれに由来する細胞も含み得る。上記の初代細胞は、当技術分野で周知であり、とりわけ、初代星状膠細胞、(混合)脊髄培養物または海馬培養物が含まれる。
(a)その5´末端に開始コドンを含み、ポリペプチドをコードするコード領域と;
(b)前記コード配列のすぐ上流にある、以下の(b1)および(b2)からなる群から選択されるUTRとを含むRNA分子に関し、
(b1)は、配列R2-CGCCACC(SEQ ID NO:1)のUTRか、または
前記UTR配列において、SEQ ID NO:1の位置6のCがAに置換され、SEQ
ID NO:1の位置7のCがGに置換され;および/もしくはSEQ ID NO:1の位置5のAがGに置換されている配列のUTRであり;
(b2)は、配列R2-CNGCCACC(SEQ ID NO:2)であって、SEQ ID NO:2の位置2のヌクレオチドNがU、G、C、もしくはAからなる群から選択されるヌクレオチドである配列のUTRか、または前記UTR配列において、SEQ ID NO:2の位置7のCがAに置換され、SEQ ID NO:2の位置8のCがGに置換され;および/もしくはSEQ ID NO:2の位置6のAがGに置換されている配列のUTRであり、
R2は、DNA依存性RNAポリメラーゼがRNA合成を開始するヌクレオチドで始まるプロモーター領域の一部に相当するRNA配列である。
A分子ファミリーである。RNAポリメラーゼによる一次転写物mRNA(プレmRNAとして知られる)の転写に続き、プロセシングされた成熟mRNAは、分子生物学のセントラルドグマに要約されるように、アミノ酸のポリマー:タンパク質に翻訳される。DNAの場合と同様に、mRNAの遺伝情報はヌクレオチド配列内にあり、それらは3つの塩基からそれぞれなるコドンに配列される。各コドンは、タンパク質合成を終結させる終止コドンを除き、特定のアミノ酸をコードする。
DNAまたはRNAの一部であり、エキソンからなり、ポリペプチドまたはタンパク質をコードする。mRNAのコード領域は、エキソンの一部でもある5´非翻訳領域(5´UTR)と3´非翻訳領域(3´UTR)に隣接している。さらに、mRNA分子は、いわゆる5´キャップとポリAテールをさらに含み得る。5´キャップ、5´UTR、3´UTR、およびポリAテールは、タンパク質に翻訳されないmRNA分子の領域である。
(b1)は、配列R2-CGCCACC(SEQ ID NO:1)のUTRか、または、
前記UTR配列において、SEQ ID NO:1の位置6のCがAにより置換され、SEQ ID NO:の位置7のCがGに置換され;および/もしくはSEQ ID NO:1の位置5のAがGに置換されている配列のUTRであり;
(b2)は、配列R2-CNGCCACC(SEQ ID NO:2)であって、SEQ ID NO:2の位置2のヌクレオチドNがU、G、C、もしくはAからなる群から選択されるヌクレオチドである配列のUTRか、または前記UTR配列において、SEQ ID NO:2の位置7のCがAに置換され、SEQ ID NO:2の位置8のCがGに置換され;および/もしくはSEQ ID NO:2の位置6のAがGに置換されている配列のUTRであり
R2は、DNA依存性RNAポリメラーゼがRNA合成を開始するヌクレオチドで始まるプロモーター領域の一部に相当するRNA配列である。
TATAGGGAGA(SEQ ID NO:3;つまり、T7DNA依存性RNAポリメラーゼにより認識されるプロモーター)、AATTAACCCTCACTAAAGGGAGA(SEQ ID NO:4;つまり、T3DNA依存性RNAポリメラーゼにより認識されるプロモーター)、ATTTAGGTGACACTATAGAAG(SEQ ID NO:5;つまり、SP6DNA依存性RNAポリメラーゼにより認識されるプロモーター)、およびAATTAGGGCACACTATAGGGA(SEQ ID NO:6;つまり、K11DNA依存性RNAポリメラーゼにより認識されるプロモーター)というプロモーター配列の、下線をひいた配列である。下線を引いた配列は、DNA依存性RNAポリメラーゼがRNA合成を開始する各プロモーターの一部に相当し、従って、該配列は、いったん転写されると、RNA分子に(つまり、転写物に)実際に存在する。
わけではなく、斯かる配列と比較してヌクレオチド付加を示す配列を含むUTR配列とも関連し、前記付加ヌクレオチドは、上記UTRの5´末端に付加され得る。付加ヌクレオチドは、最大0(変化なし)、1、2、3、4、5、6、7、8、9、または10ヌクレオチドの、好適には、最大20ヌクレオチドのポリヌクレオチド鎖を含む。より好適には、11、12、13、14、15、16、17、18、または19ヌクレオチドが5´末端に付加される。さらにより好適には、最大30ヌクレオチドが5´末端に付加される。
luescriptベクターが挙げられる。Ambion社のベクターのpTRIPLEscriptファミリーは、直列した3つのファージポリメラーゼプロモーターを全て(多数のクローニング部位の同じ側に)含有し、3つのポリメラーゼ、SP6、T7、またはT3をいずれも使用可能にする。
ジンの類似体)は、5-メチルシチジン、3-メチルシチジン、2-チオ-シチジン、2´-メチル-2´-デオキシシチジン(C2´m)、2´-アミノ-2´-デオキシシチジン(C2´NH2)、2´-フルオロ-2´-デオキシシチジン(C2´F)、5-ヨードシチジン(I5C)、5-ブロモシチジン(Br5C)および2´-アジド-2´-デオキシシチジン(C2´N3)から選択される。類似体に言及する場合、上記は、それらの5´三リン酸型の類似体も指すことに留意されたい。ある実施形態では、シチジン類似体は5-ヨードシチジンであり、ウリジン類似体は5-ヨードウリジンである。
、4-チオ-シュードウリジン、2-チオ-シュードウリジン、5-ヒドロキシウリジン、3-メチルウリジン、5-カルボキシメチル-ウリジン、1-カルボキシメチル-シュードウリジン、5-プロピニル-ウリジン、1-プロピニル-シュードウリジン、5-タウリノメチルウリジン、1-タウリノメチル-シュードウリジン、5-タウリノメチル-2-チオ-ウリジン、1-タウリノメチル-4-チオ-ウリジン、5-メチル-ウリジン、1-メチル-シュードウリジン、4-チオ-l-メチル-シュードウリジン、2-チオ-l-メチル-シュードウリジン、1-メチル-l-デアザ-シュードウリジン、2-チオ-1-メチル-l-デアザ-シュードウリジン、ジヒドロウリジン、ジヒドロシュードウリジン、2-チオ-ジヒドロウリジン、2-チオ-ジヒドロシュードウリジン、2-メトキシウリジン、2-メトキシ-4-チオ-ウリジン、4-メトキシ-シュードウリジン、4-メトキシ-2-チオ-シュードウリジン、5-アザ-シチジン、シュードイソシチジン、3-メチル-シチジン、N4-アセチルシチジン、5-ホルミルシチジン、5-メチルシチジン、N4-メチルシチジン、5-ヒドロキシメチルシチジン、1-メチル-シュードイソシチジン、ピロロ-シチジン、ピロロ-シュードイソシチジン、2-チオ-シチジン、2-チオ-5-メチル-シチジン、4-チオ-シュードイソシチジン、4-チオ-l-メチル-シュードイソシチジン、4-チオ-l-メチル-1-デアザ-シュードイソシチジン、1-メチル-l-デアザ-シュードイソシチジン、ゼブラリン、5-アザ-ゼブラリン、5-メチル-ゼブラリン、5-アザ-2-チオ-ゼブラリン、2-チオ-ゼブラリン、2-メトキシ-シチジン、2-メトキシ-5-メチル-シチジン、4-メトキシ-シュードイソシチジン、4-メトキシ-l-メチル-シュードイソシチジン、2-アミノプリン、2,6-ジアミノプリン、7-デアザ-アデニン、7-デアザ-8-アザ-アデニン、7-デアザ-2-アミノプリン、7-デアザ-8-アザ-2-アミノプリン、7-デアザ-2,6-ジアミノプリン、7-デアザ-8-アザ-2,6-ジアミノプリン、1-メチルアデノシン、N6-メチルアデノシン、N6-イソペンテニルアデノシン、N6-(シス-ヒドロキシイソペンテニル)アデノシン、2-メチルチオ-N6-(シス-ヒドロキシイソペンテニル)アデノシン、N6-グリシニルカルバモイルアデノシン、N6-トレオニルカルバモイルアデノシン、2-メチルチオ-N6-トレオニルカルバモイルアデノシン、N6,N6-ジメチルアデノシン、7-メチルアデニン、2-メチルチオ-アデニン、2-メトキシ-アデニン、イノシン、1-メチル-イノシン、ワイオシン、ワイブトシン、7-デアザ-グアノシン、7-デアザ-8-アザ-グアノシン、6-チオ-グアノシン、6-チオ-7-デアザ-グアノシン、6-チオ-7-デアザ-8-アザ-グアノシン、7-メチル-グアノシン、6-チオ-7-メチル-グアノシン、7-メチルイノシン、6-メトキシ-グアノシン、1-メチルグアノシン、N2-メチルグアノシン、N2,N2-ジメチルグアノシン、8-オキソ-グアノシン、7-メチル-8-オキソ-グアノシン、1-メチル-6-チオ-グアノシン、N2-メチル-6-チオ-グアノシン、およびN2,N2-ジメチル-6-チオ-グアノシン。
類似体であってもよい)。
る実施形態では、Uの類似体は、Uの2つ以上のタイプの類似体を指す。ある実施形態では、Cの類似体は、Cの単一タイプの類似体を指す。ある実施形態では、Cの類似体は、Cの2つ以上のタイプの類似体を指す。
シチジンの5~30%がシチジン類似体であり、斯かる混合物においてウリジンの10~30%がウリジン類似体である。ある実施形態では、斯かる混合物においてシチジンの5~20%がシチジン類似体であり、斯かる混合物においてウリジンの5~20%がウリジン類似体である。ある実施形態では、斯かる混合物においてシチジンの5~10%がシチジン類似体であり、斯かる混合物においてウリジンの5~10%がウリジン類似体である。ある実施形態では、斯かる混合物においてシチジンの25%がシチジン類似体であり、斯かる混合物においてウリジンの25%がウリジン類似体である。ある実施形態では、投入混合物は、アデノシンおよび/またはグアノシンの類似体を含まない。他の実施形態では、任意選択的に、投入混合物は、1つまたは複数のアデノシンおよび/またはグアノシン(つまり何れか一方はないか、または両方)の類似体を含む。
対位置を指す。本発明の文脈において、上流はRNA分子の5´末端に向かい、下流は分子の3´末端に向かう。
(i)GGGAGA(SEQ ID NO:7);
(ii)GGGAGA(SEQ ID NO:8);
(iii)GAAG(SEQ ID NO:9);および
(iv)GGGA(SEQ ID NO:10)からなる群から選択される。
2の位置7のCがAに置換され、SEQ ID NO:2の位置8のCがGに置換され;および/またはSEQ ID NO:2の位置6のAがGに置換されており、開始コドンのすぐ下流に続くヌクレオチドがA、U、およびCからなる群から選択されるヌクレオチドである、配列である。
ードする遺伝子のDNA(および、したがって、ポリペプチドまたはタンパク質のアミノ酸配列に翻訳され得る遺伝情報)に関して使用されるだけではない。むしろ、本発明の観点からいえば、モジュール(a)および(b)をコードする個々のDNA配列が単一の(キメラ)DNA分子に「融合」または連結されている構成体において、構成体は、タンパク質に翻訳されない成分(つまり、モジュール(b))も含む。それでもなお、モジュール(b)に対応するDNA配列は、UTRの構造の情報、つまり「コード」を提供し、したがって、本発明における用語「コードする」は、例えば、二本鎖核酸分子中に存在する場合に発現し得る、つまり、転写され得るUTRの遺伝情報にも関する。したがって、本発明の文脈における用語「コードする」は、一般にはタンパク質のコード/発現に関してのみ使用されるが、核酸分子が、タンパク質またはポリペプチドをコードする部分(つまり、モジュール(a))とUTRを「コード」する部分(つまり、モジュール(b))を宿す対応するRNA分子に転写され得ると理解するべきであり、ここで、UTRはタンパク質またはポリペプチドに翻訳されないため、後者は発現した場合の最終生成物を表す。斯かる二本鎖核酸は、標準的な分子生物学的技法(例えば、Sambrook et al., Molecular
Cloning, A laboratory manual, 2nd Ed, 1989を参照)によって、発現ベクターに挿入
され得る。本発明の意味における「発現ベクター」または「クローニングベクター」などの用語「ベクター」は、細胞内で染色体DNAとは独立して自己複製し、遺伝物質を細胞に運ぶための運搬体として使用され、そこで自己複製および/または発現し得る(つまり、RNAに転写され、アミノ酸配列に翻訳される)、環状二本鎖のDNAユニットとして理解される。外来性DNAを含有するベクターを、組換えDNAという。ベクター自体は、概して、典型的には、挿入物(つまり、タンパク質に翻訳されないモジュール(b)およびモジュール(a)コード領域)と、ベクターの「骨格」として機能するより大きい配列とからなるDNA配列である。本発明の意味でのプラスミドは、細菌で最も頻繁に見られ、細胞間で遺伝子を転移するための組換えDNA研究に使用され、それ自体は本発明の意味で使用される「ベクター」の亜集団である。
Proc. Natl. Acad. Sci. USA 89 (1992), 5547-5551)およびGossen, Trends Biotech. 12 (1994), 58-62に記載されるようなテトラサイクリン制御遺伝子発現、またはCrook, EMBO J. 8 (1989), 513-519に記載されるようなデキサメタゾン誘導性遺伝子発現系である
。
で遺伝子組み換えした、宿主細胞または宿主に関する。
。
ro翻訳系において容易に使用することが可能である。
における用語「急性処置」は、疾患の発症または疾患の発生の後に疾患を実際に処置するためにとられる措置に関する。処置は、予防的または予防的処置、つまり、疾患の予防のために、例えば感染症および/または疾患の発症を予防するためにとられる措置であり得る。
;塩形成対イオン、例えば、ナトリウムおよびカリウム;低分子量(>10アミノ酸残基)ポリペプチド;タンパク質、例えば血清アルブミン、もしくはゼラチン;親水性ポリマー、例えばポリビニルピロリドン;ヒスチジン、グルタミン、リシン、アスパラギン、アルギニン、もしくはグリシンなどのアミノ酸;グルコース、マンノース、もしくはデキストリンを含む炭水化物;単糖類;二糖類;その他の糖、例えばスクロース、マンニトール、トレハロースもしくはソルビトール;キレート剤、例えばEDTA;非イオン性界面活性剤、例えばTween、プルロニックもしくはポリエチレングリコール;メチオニン、アスコルビン酸およびトコフェロールを含む抗酸化剤;ならびに/または保存料、例えば塩化オクタデシルジメチルベンジルアンモニウム;塩化ヘキサメトニウム;塩化ベンザルコニウム、塩化ベンゼトニウム;フェノール、ブチルもしくはベンジルアルコール;アルキルパラベン、例えばメチルもしくはプロピルパラベン;カテコール;レゾルシノール;シクロヘキサノール;3-ペンタノール;およびm-クレゾール)が含まれる。適切な担体およびそれらの製剤は、Remington's Pharmaceutical Sciences, 17th ed., 1985, Mack Publishing Co.により詳細に記載されている。
の治療に使用することができる。転写物補充療法/酵素補充療法は、有益なことに、根底にある遺伝子欠損に影響を与えず、患者に欠乏している酵素の濃度を高める。例として、ポンペ病では、転写物補充療法/酵素補充療法は、欠乏しているリソソーム酵素酸アルファグルコシダーゼ(GAA)を補充する。
体とを含む医薬組成物にも関する。
次に、RNA誘導サイレンシング複合体(RISC)、つまり、サイレンシングトリガーに対し相同のメッセンジャーRNAを破壊するマルチ複合体ヌクレアーゼの、配列特異的部分を構築する。Elbashir (2001) EMBO J. 20:6877-6888は、21ヌクレオチドRNAの二本鎖を細胞培養において使用して、哺乳類細胞の遺伝子発現を干渉することができることを示した。RNAiは、哺乳類細胞においてsiRNAにより非常に効率的に媒介されるが、安定した細胞株または非ヒト遺伝子導入動物の生成は限定されたことがすでに知られている。しかしながら、新しい世代のベクター、例えば、短ヘアピンRNA(shRNA)を、安定して発現させるために利用することができる。哺乳類細胞におけるsiRNAの安定発現は、とりわけ、Brummelkamp (2002) Science 296:550-553に示されている。また、Paul (2002) Nat. Biotechnol. 20:505-508は、ヒト細胞における小干渉RNAの
効率的な発現について述べた。哺乳類細胞における短干渉RNAおよびヘアピンRNAの発現によるRNA干渉は、また、Yu (2002) PNAS 99:6047-6052により示された。遺伝子
サイレンシングのためのshRNAアプローチは当技術分野で周知であり、st(小分子)RNAの使用を含み得る;とりわけ、Paddison (2002) Genes Dev. 16:948-958を参照
されたい。これらのアプローチは、ベクターベースであり得、例えば、pSUPERベクターまたはRNA pol IIIベクターを、とりわけYu (2002), loc. cit.; Miyagishi (2002), loc. cit. or Brummelkamp (2002), loc. citに例示されているように、利
用することができる。本発明の制御配列は、pSUPERベクターまたはRNA pol
IIIベクターをベースにする系と同様の方法で使用されることが想定される。
プログラムをオンラインで利用可能である(例えば、g. http://www.ambion.com/techlib/misc/siRNA_finder.htmlまたはhttp://katahdin.cshl.org:9331/RNAi/html/RNAi.html)。2-nt 3´オーバーハングのウリジン残基は、活性を失うことなく2´デオキシチミジンで置換することが可能であり、これは、RNA合成のコストを著しく低減させ、哺乳類細胞に適用する場合に、siRNA二本鎖の耐性を高め得る(Elbashir (2001) loc.
cit)。siRNAは、また、T7または他のRNAポリメラーゼを使用して、酵素的に合成することができる(Donze (2002) Nucleic Acids Res 30:e46)。効率的なRNA干
渉(esiRNA)を媒介する短RNA二本鎖は、また、大腸菌RNase IIIを用いた加水分解により生成され得る(Yang (2002) PNAS 99:9942-9947)。さらに、真核細
胞において、小ヘアピンRNAループに連結した二本鎖siRNAを発現する発現ベクターが開発されている(例えば、(Brummelkamp (2002) Science 296:550-553)。これらの構成体の全てを、上記で名づけたプログラムの助けで開発することができる。さらに、配列解析プログラムに組み込まれているか、または別個に売られている、商業的に利用可能な配列予測ツール、例えば、www.oligoEngine.com(シアトル、ワシントン州)により提
供されるsiRNA Design Toolを、siRNA配列予測に使用することができる。
NO:12の位置10のヌクレオチドNがU、G、C、もしくはAからなる群から選択されるヌクレオチドである、配列か、または、SEQ ID NO:12と比較し1~4個の置換を示す配列を含み、これは、本発明のRNA分子のコード領域にコードされたポリペプチドまたはタンパク質をアンタゴナイズする/干渉する/発現停止させることが可能である。
NO:14の位置10のヌクレオチドNがU、G、C、もしくはAからなる群から選択されるヌクレオチドであるが、Aがより好適である、配列か、または、SEQ ID NO:14と比較し1~4個の置換を示す配列を含み、これは、本発明のRNA分子のコード領域にコードされたポリペプチドまたはタンパク質をアンタゴナイズする/干渉する/発現停止させることが可能である。
NO:16の位置10のヌクレオチドNがU、G、C、もしくはAからなる群から選択されるヌクレオチドである、配列か、または、SEQ ID NO:16と比較し1~4個の置換を示す配列を含み、これは、本発明のRNA分子のコード領域にコードされたポリペプチドまたはタンパク質をアンタゴナイズする/干渉する/発現停止させることが可能である。
NO:18の位置10のヌクレオチドNがU、G、C、もしくはAからなる群から選択されるヌクレオチドであるが、Aがより好適である、配列か、または、SEQ ID NO:18と比較し1~4個の置換を示す配列を含み、これは、本発明のRNA分子のコード領域にコードされたポリペプチドまたはタンパク質をアンタゴナイズする/干渉する/発現停止させることが可能である。
:23と比較し1~4個の置換を示す配列を含む。
UGGUGGCGCUUC(SEQ ID NO:27)か、または、SEQ ID NO:27と比較し1~4個の置換を示す配列を含む。
NO:11~34からなる群から選択されるRNA分子に関する。好適には、本発明のUTR配列に対し相補的な上記配列を含む相補配列(つまり、SEQ ID NO:11~34からなる群から選択されるRNA分子)は、好適には、少なくとも15、より好適には少なくとも16、より好適には少なくとも17、より好適には少なくとも18、より好適には少なくとも19、より好適には少なくとも20、21、22、23、または24ヌクレオチドを含む。さらにより好適な実施形態では、これらの配列は、25、30、35、40、またはそれ以上のヌクレオチドを含む。相補配列の特異性を高めることにより不所望の副作用を防ぐために、5´末端の長さを伸ばすことが望ましい場合がある。
(a)その5´末端に開始コドンを含み、ポリペプチドをコードするコード領域と;
(b)前記コード配列のすぐ上流にある、以下の(b1)および(b2)からなる群から選択される配列とを有する一本の鎖を含むか;または相補鎖を含み、
(b1)は、R1-CGCCACC(SEQ ID NO:1)か;または、
前記配列において、SEQ ID NO:1の位置6のCがAに置換され、SEQ ID
NO:1の位置7のCがGに置換され;および/もしくはSEQ ID NO:1の位置5のAがGに置換されている配列であり;
(b2)は、R1-CNGCCACC(SEQ ID NO:2)であって、SEQ ID NO:2の位置2のヌクレオチドNがT、G、C、もしくはAから成る群から選択されるヌクレオチドである、配列か;または、
前記配列において、SEQ ID NO:2の位置7のCがAに置換され、SEQ ID
NO:2の位置8のCがGに置換され;および/もしくはSEQ ID NO:2の位置6のAがGに置換されている配列であり、
R1は、DNA依存性RNAポリメラーゼにより認識されるプロモーターである、DNA分子。
(i)TAATACGACTCACTATAGGGAGA(SEQ ID NO:3)、または、SEQ ID NO:3と比較して1~6個の置換を示し、T7DNA依存性RNAポリメラーゼにより認識される配列;
(ii)AATTAACCCTCACTAAAGGGAGA(SEQ ID NO:4)、または、SEQ ID NO:4と比較し1~6個の置換を示し、T3DNA依存性RNAポリメラーゼにより認識される配列;
(iii)ATTTAGGTGACACTATAGAAG(SEQ ID NO:5)、またはSEQ ID NO:5と比較して1~6個の置換を示し、SP6DNA依存性RNAポリメラーゼにより認識される配列;および、
(iv)AATTAGGGCACACTATAGGGA(SEQ ID NO:6)、またはSEQ ID NO:6と比較して1~6個の置換を示し、K11DNA依存性RNAポリメラーゼにより認識される配列からなる群から選択される、項目1に記載のDNA分子。
(b)前記コード配列のすぐ上流にある、以下の(b1)および(b2)からなる群から選択されるUTRとを含むRNA分子であって、
(b1)は、配列R2-CGCCACC(SEQ ID NO:1)のUTRか、または前記UTR配列において、SEQ ID NO:1の位置6のCがAに置換され、SEQ ID NO:1の位置7のCがGに置換され;および/もしくはSEQ ID NO:1の位置5のAがGに置換されている配列のUTRであり;
(b2)は、配列R2-CNGCCACC(SEQ ID NO:2)であって、SEQ ID NO:2の位置2のヌクレオチドNがU、G、C、もしくはAからなる群から選択されるヌクレオチドである配列のUTRか、または前記UTR配列において、SEQ ID NO:2の位置7のCがAに置換され、SEQ ID NO:2の位置8のC
がGに置換され;および/もしくはSEQ ID NO:2の位置6のAがGに置換されている配列のUTRであり、
R2は、DNA依存性RNAポリメラーゼがRNA合成を開始するヌクレオチドで始まるプロモーター領域の一部に相当するRNA配列である、RNA分子。
(i)GGGAGA(SEQ ID NO:7);
(ii)GGGAGA(SEQ ID NO:8);
(iii)GAAG(SEQ ID NO:9);および
(iv)GGGA(SEQ ID NO:10)からなる群から選択される、項目8に記載のRNA分子。
プラスミドベクター
各5´UTR配列をコドン最適化ルシフェラーゼ配列と共にGeneScriptG(
ニュージャージー州、USA)により合成し、pUC57-Kan(GeneScript)においてクローン化した。EPO(コドン最適化ヒトエリスロポエチン)およびOTC(コドン最適化ヒトオルニチントランスカルバミラーゼ)の場合、コード配列ルシフェラーゼ遺伝子を、EPO(SEQ ID NO:35)とOTC(SEQ ID NO:36)の遺伝子それぞれのコード配列と置き換えた。構成体において使用するUTR配列は、各ルシフェラーゼレポーター構成体の名前と共に図1に示す。
in vitroで転写されたmRNA(IVT mRNA)を生成するために、プラスミドをBstBI消化により直線化し、クロロホルム抽出およびエタノール沈殿により精製した。精製した直鎖状プラスミドをRiboMax Large Scale RNA production System-T7(Promega,ドイツ)を使用して、in vitro転写の鋳型として使用した。アンチリバースキャップアナログ(ARCA)を反応混合物に加えて、5´キャップ化mRNAを生成し、mRNAをポリアデニル化して(Thermo Scientific)、3´ポリAテールを生成した。
ヒト肺胞上皮性細胞株(A549)およびヒト肝細胞がん細胞株(HepG2)を、96ウェルプレートに、それぞれ20,000細胞/ウェルおよび40,000細胞/ウェルという密度で播種した。播種して24時間後に、商業的な遺伝子導入試薬Lipofectamine(登録商標)2000を、1μgのmRNAにつき2.5μLのLipofectamine(登録商標)2000という比率で使用して、細胞に、SNIM RNA構成体をコードする異なるルシフェラーゼを遺伝子導入した(図2-6のX軸は、96ウェルプレートのウェル毎のSNIM RNAのng量を示す)。複合体形成を、以下のように準備した:Lipofectamine(登録商標)2000とmRNAを別々にOptiMEM遺伝子導入媒体で希釈し、それぞれ、45μLの総体積となるまで加えた。これらの混合物を室温で5分間インキュベーションした。次に、Lipofectamine(登録商標)2000溶液をmRNA溶液と混ぜ、次に、室温でもう20分間インキュベーションした。遺伝子導入総体積90μLにおいて、細胞を37℃(5%CO2レベル)で1時間インキュベーションした。その後、遺伝子導入培地を取り除き、細胞をPBSで洗浄した。続いて、細胞を、10%FBSを含有するLeibovitz L-15培地を用いて再度インキュベーションした。
ヒト肺胞腺がん細胞株(A549,ATCC CCL-185)を、10%FBSを補充したHam F12K培地で増殖させた。ヒト肝細胞がん細胞株(HepG2,ATCC HB-8065)を、10%ウシ胎児血清を補充したDMEM培地で培養した。全ての細胞株を、5%CO2レベルの加湿雰囲気において増殖させた。
ホタルルシフェラーゼ(FFL)が共通のレポータータンパク質であり、これは、哺乳動物には内因的に存在せず、発光画像法により容易に検出することが可能である。ルシフェラーゼは、バイオルミネセンス発光を生じさせるルシフェリンと酸素の反応を触媒する。
6~8週齢のメスのBALB/cマウスをJanvier,Route Des Chenes SecsBP5,F-53940 Le Genest St.Isle,Franceより得て、特定病原体除去条件下で維持した。実験前に少なくとも7日間、マウスを動物施設の環境に順応させた。全ての動物手順が地方の倫理員会により承認および制御され、ドイツの動物生態保護法のガイドラインに従って実行された。
リピドイドを以下のようにmRNAと共に製剤化した:C12-(2-3-2)、DOPE、Chol、およびDSPE-PEG2k(3.6:0.18:0.76:1重量比)をエタノールに溶解し、10.5という脂質/mRNA重量比でホタルルシフェラーゼをコードする化学修飾したmRNAを含む、クエン酸緩衝液(10mMクエン酸、150mMNaCl、pH=4.5)に速やかに注入して、20%という最終エタノール濃度を得て、水に対し透析を行った。結果として生じるリピドイド/mRNA複合体は、正に帯電したナノ粒子(92.6±0.7nm;21.0±0.2mV)をもたらし、これを、拘束したマウスの尾静脈に静脈内注射した。第2実験では、静脈内注射の前にリピドイド/mRNA複合体をPBSに適合させたが、これはほぼ帯電していないナノ粒子(91.5±0.6nm;-0.7±0.2mV)をもたらした。
投与して24時間後に、マウスをメデトミジン(11.5μg/kg BW)、ミダゾラム(115μg/kg BW)、およびフェンタニル(1.15μg/kg BW)の腹腔内注射により麻酔した。D-ルシフェリン基質(マウスにつき3mg/100μLPBS)を、静脈内注射により適用した。10分後に、IVIS 100 Imaging
System(Xenogen,アラメダ,USA)とカメラ設定:Bin(HS)、視野10、f1 f-stop、高分解能ビニング、および5分の露出時間を使用して、バイオルミネセンスを測定した。Living Image Software version 2.50(Xenogen,アラメダ,USA)を使用して、シグナルを定量化し、解析した。
凍ったプレートを解凍し、プレートにおいて直接的な細胞溶解を実行した。プロテアーゼ阻害剤(cOmplete,EDTAフリー,Roche Diagnostics,ドイツ)およびDNase(DNase I溶液(2500U/mL),(Thermo
Fisher,USA)を補完した溶解バッファー(25mMTRIS、0.1%Triton-X100、Sigma-Aldrich、ドイツ)を使用して、タンパク質を溶解した。溶解後に、サンプルをNuPage(登録商標)LDS Sample BufferおよびSample Reducing Agent(Thermo Fisher,USA)と混ぜ、70℃で10分間加熱した。NuPAGE 10% Bis-Tris Midi Gelの上で、XCell4 SureLock(商標)Midi,Bio-Rad Criterion(商標)System(Thermo Fisher,USA)を用いて、ゲル電気泳動を15μLの可溶化物を使用して実行した。TransBlot(登録商標)Turbo(商標)Transfer System(Biorad,ドイツ)を30分間使用して、タンパク質を転移させた。転移後、膜を30分間NET-ゼラチンで保護してから、該膜を一晩4℃で一次抗体と共にインキュベーションし、NET-ゼラチン1:2000(OTCポリクローナル抗体(Center),AP6928c-AB Biocat,ドイツ)に希釈した。NET-ゼラチンを用いた3回の洗浄ステップの後、NET-ゼラチンに1:10,000で希釈した、ホースラディッ
シュ・ペルオキシダーゼ結合第2抗体(ヤギ抗ウサギIgG-HRP,sc-2004,Santa Cruz Biotechnology,USA)を室温で一時間加えた。膜を再び、NET-ゼラチンを用いて、シグナルが化学発光基質キット(Luminata Crescendo Western HRP基質,Merck Millipore,ドイツ)で可視化され、ChemiDoc(商標)MP System(Biorad,ドイツ)で可視化されるまで、3回洗浄した。
FBS、Leibovitz L-15培地(Gibco)、Lipofectamine(登録商標)2000、およびOptiMEM(Gibco)を、Invitrogen,ドイツから購入した。無菌PBSは社内で用意した。Ham F-12K、DMEM、およびトリプシン-EDTAをc.c.pro GmbH,ドイツより購入した。
II.a細胞培養実験
配列1を鋳型として使用し、この配列に対し、何れかの単一ヌクレオチド(A、T、G、もしくはC:それぞれ図1の配列番号3-6)、または、30ヌクレオチド長で任意の予想可能な第2構造を欠いたランダム配列(配列7)、またはヒトαグロビン由来の5´UTR(配列8)を、調査する「C」およびコザック配列の間に組み込んだ。
-最良に機能する配列(配列9)と組み合わせた場合のTISUの影響を解明し、
-hAg由来の5´UTRの影響が、細胞特異的な影響であるか、または、5´キャップと開始コドンの間の距離が重要であるか否かを決定する。
結果を図7および図8に示す。
Luc2(+8+A)
Luc2(+8+T)
Luc2(+8+T)+TISU
Luc2-hAg
Luc2-Sp30
Luc2-SUSA UTR
Claims (8)
- (a)その5´末端に開始コドンを含み、ポリペプチドをコードするコード領域と、
(b)前記コード配列のすぐ上流にある、以下の(b1)からなる群から選択されるUTRとを含むRNA分子であって、
(b1)は、配列R2-CGCCACC(SEQ ID NO:1)のUTR、または前記UTR配列において、SEQ ID NO:1の位置6のCがAに置換され、SEQ ID NO:1の位置7のCがGに置換され;および/もしくはSEQ ID NO:1の位置5のAがGに置換されている配列のUTRであり、
R2は、DNA依存性RNAポリメラーゼがRNA合成を開始するヌクレオチドで始まるプロモーター領域の一部に相当するRNA配列であり、
R2は、
(i)GGGAGA(SEQ ID NO:7)、
(ii)GGGAGA(SEQ ID NO:8)、
(iii)GAAG(SEQ ID NO:9)、および
(iv)GGGA(SEQ ID NO:10)からなる群から選択され、
3´末端にはポリAテールを含み、
R2が(i)もしくは(ii)である場合、(b)で定義されるUTRの最大長さは、14ヌクレオチドであり、または、R2が(iii)もしくは(iv)である場合、(b)で定義されるUTRの最大長さは、12ヌクレオチドである、RNA分子、
を含む、RNA分子のコード領域を該コード領域にコードされたポリペプチドまたはタンパク質に翻訳するための、医薬組成物。 - 前記RNA分子のポリAテールの長さは少なくとも120ヌクレオチドである、請求項1に記載の医薬組成物。
- 請求項1または2に記載のRNA分子をコードする核酸分子。
- 請求項3の核酸分子を含むベクター。
- 請求項4のベクターを含む宿主細胞。
- 請求項1または2に記載のRNA分子、請求項3に記載の核酸分子、請求項4に記載のベクター、または請求項5に記載の宿主細胞と、任意選択的に医薬的に許容される担体とを含む、医薬組成物。
- RNAベースの治療で使用される、請求項6の医薬組成物。
- 請求項1または2に記載のRNA分子、請求項3に記載の核酸分子、請求項4に記載のベクター、または、請求項5に記載の宿主細胞を含む、キット。
Applications Claiming Priority (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP16163264 | 2016-03-31 | ||
| EP16163264.1 | 2016-03-31 | ||
| EP16177094 | 2016-06-30 | ||
| EP16177094.6 | 2016-06-30 | ||
| JP2018551463A JP6959654B2 (ja) | 2016-03-31 | 2017-03-30 | 新規の最小utr配列 |
| JP2021135004A JP2021184745A (ja) | 2016-03-31 | 2021-08-20 | 新規の最小utr配列 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021135004A Division JP2021184745A (ja) | 2016-03-31 | 2021-08-20 | 新規の最小utr配列 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2023134529A JP2023134529A (ja) | 2023-09-27 |
| JP7632905B2 true JP7632905B2 (ja) | 2025-02-19 |
Family
ID=58632335
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018551463A Active JP6959654B2 (ja) | 2016-03-31 | 2017-03-30 | 新規の最小utr配列 |
| JP2021135004A Pending JP2021184745A (ja) | 2016-03-31 | 2021-08-20 | 新規の最小utr配列 |
| JP2023105810A Active JP7632905B2 (ja) | 2016-03-31 | 2023-06-28 | 新規の最小utr配列 |
Family Applications Before (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018551463A Active JP6959654B2 (ja) | 2016-03-31 | 2017-03-30 | 新規の最小utr配列 |
| JP2021135004A Pending JP2021184745A (ja) | 2016-03-31 | 2021-08-20 | 新規の最小utr配列 |
Country Status (13)
| Country | Link |
|---|---|
| US (2) | US11352638B2 (ja) |
| EP (1) | EP3436589B1 (ja) |
| JP (3) | JP6959654B2 (ja) |
| KR (1) | KR102312903B1 (ja) |
| CN (2) | CN116814614A (ja) |
| AU (2) | AU2017242794B2 (ja) |
| BR (1) | BR112018069823A2 (ja) |
| CA (1) | CA3018904C (ja) |
| DK (1) | DK3436589T3 (ja) |
| ES (1) | ES2835051T3 (ja) |
| RU (1) | RU2759737C2 (ja) |
| WO (1) | WO2017167910A1 (ja) |
| ZA (1) | ZA201806250B (ja) |
Families Citing this family (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN116814614A (zh) | 2016-03-31 | 2023-09-29 | 埃泽瑞斯公司 | Utr序列 |
| US11253601B2 (en) | 2016-07-11 | 2022-02-22 | Translate Bio Ma, Inc. | Nucleic acid conjugates and uses thereof |
| US11104887B2 (en) * | 2017-01-03 | 2021-08-31 | Ethris Gmbh | Ornithine transcarbamylase coding polyribonucleotides and formulations thereof |
| CA3079428A1 (en) * | 2017-11-22 | 2019-05-31 | Modernatx, Inc. | Polynucleotides encoding ornithine transcarbamylase for the treatment of urea cycle disorders |
| US12178855B2 (en) | 2018-01-10 | 2024-12-31 | Translate Bio Ma, Inc. | Compositions and methods for facilitating delivery of synthetic nucleic acids to cells |
| JP2022546417A (ja) | 2019-08-29 | 2022-11-04 | チューリッヒ大学 | 最小mRNAおよびその使用 |
| CN114846145A (zh) * | 2019-11-26 | 2022-08-02 | 韩国生命工学研究院 | 用于蛋白质表达的mRNA构建体及其用途 |
| PL4240396T3 (pl) | 2020-11-04 | 2025-04-22 | Ethris Gmbh | mRNA IFN-lambda do leczenia zakażeń wirusowych |
| KR102495917B1 (ko) * | 2021-01-08 | 2023-02-06 | 한국생명공학연구원 | 5'-삼인산올리고아데닐레이트 제조방법 |
| CA3149661A1 (en) * | 2021-03-03 | 2022-09-03 | Nuprotein Co., Ltd. | Translation enhancer, translation template mrna, transcription template dna, method of producing translation template mrna, and method of producing protein |
| EP4329799A4 (en) * | 2021-04-30 | 2025-04-30 | Greenlight Biosciences, Inc. | Messenger rna therapeutics and compositions |
| CN116262924A (zh) * | 2022-08-12 | 2023-06-16 | 北京华芢生物技术有限公司 | 一种来源于细胞色素c氧化酶家族基因的3` utr及应用 |
| WO2024121160A1 (en) | 2022-12-05 | 2024-06-13 | Ethris Gmbh | Regulator(s) of energy homeostasis-encoding rna molecule(s) with increased translation efficiency |
| EP4421176A4 (en) * | 2022-12-29 | 2025-01-01 | Themedium Therapeutics Co., Ltd | NON-ENVELOPED 5'-UNTRANSLATED REGIONAL ELEMENT AND USE THEREOF |
| WO2024240962A1 (en) | 2023-05-25 | 2024-11-28 | Ethris Gmbh | Gm-csf-encoding nucleic acids, pharmaceutical compositions, methods and uses thereof |
| KR20250034228A (ko) * | 2023-09-01 | 2025-03-11 | 한양대학교 산학협력단 | 증강된 유전자 발현을 위한 5‘ 비번역 영역을 포함하는 뉴클레오타이드를 포함하는 조성물 및 방법 |
| TW202530405A (zh) * | 2023-09-27 | 2025-08-01 | 南韓商韓美藥品股份有限公司 | 傳訊核糖核酸及用以預防或治療癌症之包括其的醫藥組成物、對其進行編碼的脫氧核糖核酸建構物以及預防或治療癌症的方法 |
| CN117535295B (zh) * | 2024-01-09 | 2024-04-26 | 艾斯拓康医药科技(北京)有限公司 | 一种优化的3`utr序列及其应用 |
| CN118638801B (zh) * | 2024-08-19 | 2025-01-03 | 北京剂泰医药科技有限公司 | 一种编码促红细胞生成素的mRNA分子及其应用 |
| CN119842712B (zh) * | 2025-02-06 | 2025-08-26 | 北京臻知医学科技有限责任公司 | 提高mRNA翻译效率的3’UTR及其应用 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015133920A (ja) | 2014-01-16 | 2015-07-27 | 東ソー株式会社 | コザック配列を有するベクター及びそれを導入した細胞 |
Family Cites Families (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2310686C2 (ru) * | 1999-06-25 | 2007-11-20 | Басф Акциенгезелльшафт | Гены corynebacterium glutamicum, кодирующие белки, участвующие в метаболизме углерода и продуцировании энергии |
| DE10160151A1 (de) | 2001-01-09 | 2003-06-26 | Ribopharma Ag | Verfahren zur Hemmung der Expression eines vorgegebenen Zielgens |
| CA2440747A1 (en) * | 2001-03-15 | 2002-09-26 | Hyseq, Inc. | Novel nucleic acids and polypeptides |
| AU2002364587A1 (en) * | 2001-12-21 | 2003-07-30 | Human Genome Sciences, Inc. | Albumin fusion proteins |
| AR048026A1 (es) | 2004-03-05 | 2006-03-22 | Bayer Cropscience Gmbh | Procedimientos para la identificacion de proteinas con actividad enzimatica fosforiladora de almidon |
| JP5053850B2 (ja) * | 2004-10-08 | 2012-10-24 | バークシス コーポレーション | 抗体遺伝子導入および抗体ポリペプチド産生のためのrnaトランススプライシングの使用 |
| PL2578685T3 (pl) | 2005-08-23 | 2020-01-31 | The Trustees Of The University Of Pennsylvania | Rna zawierający zmodyfikowane nukleozydy i sposoby jego zastosowania |
| PL2468869T3 (pl) * | 2007-01-31 | 2015-08-31 | Pfenex Inc | Bakteryjna sekwencja wiodąca dla zwiększonej ekspresji |
| WO2011012316A2 (de) | 2009-07-31 | 2011-02-03 | Ludwig-Maximilians-Universität | Rna mit einer kombination aus unmodifizierten und modifizierten nucleotiden zur proteinexpression |
| US9733243B2 (en) | 2010-12-15 | 2017-08-15 | Kayteebio, Co. & Ltd. | Test method for rheumatoid arthritis and kit for rheumatoid arthritis test |
| WO2012170930A1 (en) | 2011-06-08 | 2012-12-13 | Shire Human Genetic Therapies, Inc | Lipid nanoparticle compositions and methods for mrna delivery |
| EP2763701B1 (en) * | 2011-10-03 | 2018-12-19 | Moderna Therapeutics, Inc. | Modified nucleosides, nucleotides, and nucleic acids, and uses thereof |
| EP3786298A1 (en) * | 2012-11-01 | 2021-03-03 | Factor Bioscience Inc. | Methods and products for expressing proteins in cells |
| EP3434774A1 (en) * | 2013-01-17 | 2019-01-30 | ModernaTX, Inc. | Signal-sensor polynucleotides for the alteration of cellular phenotypes |
| CN104032031A (zh) * | 2014-07-04 | 2014-09-10 | 华东理工大学 | 一种rna聚合酶和连接酶偶联反应介导的定量检测核酸的pcr分析方法 |
| CN116814614A (zh) | 2016-03-31 | 2023-09-29 | 埃泽瑞斯公司 | Utr序列 |
-
2017
- 2017-03-30 CN CN202310788439.4A patent/CN116814614A/zh active Pending
- 2017-03-30 BR BR112018069823-7A patent/BR112018069823A2/pt active Search and Examination
- 2017-03-30 WO PCT/EP2017/057592 patent/WO2017167910A1/en not_active Ceased
- 2017-03-30 CN CN201780029249.7A patent/CN109154001B/zh active Active
- 2017-03-30 EP EP17719164.0A patent/EP3436589B1/en active Active
- 2017-03-30 KR KR1020187030176A patent/KR102312903B1/ko active Active
- 2017-03-30 CA CA3018904A patent/CA3018904C/en active Active
- 2017-03-30 AU AU2017242794A patent/AU2017242794B2/en active Active
- 2017-03-30 JP JP2018551463A patent/JP6959654B2/ja active Active
- 2017-03-30 ES ES17719164T patent/ES2835051T3/es active Active
- 2017-03-30 DK DK17719164.0T patent/DK3436589T3/da active
- 2017-03-30 US US16/090,588 patent/US11352638B2/en active Active
- 2017-03-30 RU RU2018137279A patent/RU2759737C2/ru active
-
2018
- 2018-09-17 ZA ZA2018/06250A patent/ZA201806250B/en unknown
-
2021
- 2021-08-20 JP JP2021135004A patent/JP2021184745A/ja active Pending
-
2022
- 2022-06-06 US US17/833,858 patent/US11981910B2/en active Active
-
2023
- 2023-03-15 AU AU2023201593A patent/AU2023201593B2/en active Active
- 2023-06-28 JP JP2023105810A patent/JP7632905B2/ja active Active
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015133920A (ja) | 2014-01-16 | 2015-07-27 | 東ソー株式会社 | コザック配列を有するベクター及びそれを導入した細胞 |
Non-Patent Citations (2)
| Title |
|---|
| Database GenBank [online], Accession No. DQ215955.1,<http://www.ncbi.nlm.nih.gov/nuccore/QD215955.1>21-AUG-2008 uploaded, [retrieved on 2022-09-06]WADA, K. et al.,Definition: Taeniopygia guttata clone 0058P0019C09 putative mitochondrial ATP synthase gamma chain mRNA, complete cds; nuclear gene for mitochondrial product |
| Database GenBank [online], Accession No. DQ215956.1,<http://www.ncbi.nlm.nih.gov/nuccore/DQ215956.1>21-AUG-2008 uploaded, [retrieved on 2022-09-06]WADA, K. et al.,Definition: Taeniopygia guttata clone 0058P0019G12 putative mitochondrial ATP synthase gamma chain mRNA, complete cds; nuclear gene for mitochondrial product |
Also Published As
| Publication number | Publication date |
|---|---|
| AU2017242794B2 (en) | 2022-12-15 |
| RU2018137279A (ru) | 2020-04-30 |
| CA3018904C (en) | 2024-04-02 |
| KR20180131577A (ko) | 2018-12-10 |
| AU2017242794A1 (en) | 2018-10-04 |
| KR102312903B1 (ko) | 2021-10-15 |
| JP2019512260A (ja) | 2019-05-16 |
| CN109154001A (zh) | 2019-01-04 |
| RU2018137279A3 (ja) | 2020-10-16 |
| WO2017167910A1 (en) | 2017-10-05 |
| AU2023201593B2 (en) | 2025-03-13 |
| CN116814614A (zh) | 2023-09-29 |
| ZA201806250B (en) | 2019-12-18 |
| JP2023134529A (ja) | 2023-09-27 |
| BR112018069823A2 (pt) | 2019-04-09 |
| US20190144883A1 (en) | 2019-05-16 |
| US11981910B2 (en) | 2024-05-14 |
| US20230086606A1 (en) | 2023-03-23 |
| JP2021184745A (ja) | 2021-12-09 |
| ES2835051T3 (es) | 2021-06-21 |
| US11352638B2 (en) | 2022-06-07 |
| DK3436589T3 (da) | 2020-11-23 |
| EP3436589A1 (en) | 2019-02-06 |
| CA3018904A1 (en) | 2017-10-05 |
| CN109154001B (zh) | 2023-07-18 |
| AU2023201593A1 (en) | 2023-04-27 |
| EP3436589B1 (en) | 2020-09-23 |
| JP6959654B2 (ja) | 2021-11-02 |
| RU2759737C2 (ru) | 2021-11-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7632905B2 (ja) | 新規の最小utr配列 | |
| CN115651927B (zh) | 编辑rna的方法和组合物 | |
| KR102851101B1 (ko) | Rna를 편집하기 위한 방법 및 조성물 | |
| KR102581977B1 (ko) | Rna 분자의 번역 효율을 증가시키는 utr | |
| JP2024507394A (ja) | エアロゾル形成用の製剤および核酸を送達するためのエアロゾル | |
| WO2022138929A1 (ja) | 標的rnaのポリアデニル化シグナル配列を編集するためのガイドrna | |
| BR122024013538A2 (pt) | Molécula de dna, vetor, célula hospedeira, composição, molécula de rna, molécula de ácido nucleico, composição farmacêutica, kit, e, uso de uma utr | |
| US20250223587A1 (en) | Compositions and methods for treating a congenital eye disease | |
| HK40081918A (en) | Methods and compositions for editing rna | |
| HK40061041A (en) | Methods and compositions for editing rnas | |
| HK40056042A (en) | Methods and compositions for editing rnas | |
| HK40056042B (en) | Methods and compositions for editing rnas |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230710 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20230710 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20240709 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20241008 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20250107 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20250130 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7632905 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |