JP7397440B2 - コラーゲン結合薬剤組成物およびその使用方法 - Google Patents
コラーゲン結合薬剤組成物およびその使用方法 Download PDFInfo
- Publication number
- JP7397440B2 JP7397440B2 JP2019543282A JP2019543282A JP7397440B2 JP 7397440 B2 JP7397440 B2 JP 7397440B2 JP 2019543282 A JP2019543282 A JP 2019543282A JP 2019543282 A JP2019543282 A JP 2019543282A JP 7397440 B2 JP7397440 B2 JP 7397440B2
- Authority
- JP
- Japan
- Prior art keywords
- collagen
- binding
- cbd
- bfgf
- seq
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 229920001436 collagen Polymers 0.000 title claims description 374
- 108010035532 Collagen Proteins 0.000 title claims description 353
- 102000008186 Collagen Human genes 0.000 title claims description 353
- 230000027455 binding Effects 0.000 title claims description 199
- 239000003814 drug Substances 0.000 title claims description 76
- 238000000034 method Methods 0.000 title description 36
- 239000000203 mixture Substances 0.000 title description 35
- 229940079593 drug Drugs 0.000 title description 16
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 155
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 130
- 108060005980 Collagenase Proteins 0.000 claims description 122
- 102000029816 Collagenase Human genes 0.000 claims description 122
- 229920001184 polypeptide Polymers 0.000 claims description 110
- 229960002424 collagenase Drugs 0.000 claims description 108
- 229940124597 therapeutic agent Drugs 0.000 claims description 57
- 210000000988 bone and bone Anatomy 0.000 claims description 37
- 150000001413 amino acids Chemical class 0.000 claims description 33
- 208000010392 Bone Fractures Diseases 0.000 claims description 32
- 230000000694 effects Effects 0.000 claims description 30
- 239000012634 fragment Substances 0.000 claims description 29
- 239000003795 chemical substances by application Substances 0.000 claims description 20
- 230000011164 ossification Effects 0.000 claims description 16
- 239000008194 pharmaceutical composition Substances 0.000 claims description 13
- 230000007547 defect Effects 0.000 claims description 9
- 208000001132 Osteoporosis Diseases 0.000 claims description 6
- 238000004519 manufacturing process Methods 0.000 claims description 6
- 239000003937 drug carrier Substances 0.000 claims description 5
- 230000003239 periodontal effect Effects 0.000 claims description 2
- 230000001737 promoting effect Effects 0.000 claims 3
- 108090000445 Parathyroid hormone Proteins 0.000 description 80
- 102000003982 Parathyroid hormone Human genes 0.000 description 79
- 239000000199 parathyroid hormone Substances 0.000 description 79
- 229960001319 parathyroid hormone Drugs 0.000 description 79
- 239000011230 binding agent Substances 0.000 description 66
- 108090000379 Fibroblast growth factor 2 Proteins 0.000 description 54
- 102000003974 Fibroblast growth factor 2 Human genes 0.000 description 54
- 235000001014 amino acid Nutrition 0.000 description 37
- 230000001580 bacterial effect Effects 0.000 description 37
- 102000006461 Parathyroid Hormone Receptors Human genes 0.000 description 34
- 108010058828 Parathyroid Hormone Receptors Proteins 0.000 description 34
- 229940024606 amino acid Drugs 0.000 description 32
- 108020001507 fusion proteins Proteins 0.000 description 31
- 102000037865 fusion proteins Human genes 0.000 description 31
- 108090000623 proteins and genes Proteins 0.000 description 31
- 102000004169 proteins and genes Human genes 0.000 description 30
- 206010017076 Fracture Diseases 0.000 description 29
- 235000018102 proteins Nutrition 0.000 description 29
- 238000011282 treatment Methods 0.000 description 28
- 239000011575 calcium Substances 0.000 description 27
- BZSXSIQTILQTNQ-SCWOKBSMSA-N (prolyl-hydroxylprolyl-glycine)10 Chemical compound N1([C@@H](C[C@H](C1)O)C(=O)NCC(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](C[C@@H](O)C1)C(=O)NCC(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](C[C@@H](O)C1)C(=O)NCC(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](C[C@@H](O)C1)C(=O)NCC(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](C[C@@H](O)C1)C(=O)NCC(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](C[C@@H](O)C1)C(=O)NCC(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](C[C@@H](O)C1)C(=O)NCC(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](C[C@@H](O)C1)C(=O)NCC(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](C[C@@H](O)C1)C(=O)NCC(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](C[C@@H](O)C1)C(=O)NCC(O)=O)C(=O)C1CCCN1 BZSXSIQTILQTNQ-SCWOKBSMSA-N 0.000 description 23
- 210000004027 cell Anatomy 0.000 description 22
- 108010041630 poly(prolyl-hydroxyprolyl-glycyl) Proteins 0.000 description 22
- 230000015572 biosynthetic process Effects 0.000 description 20
- 241000894007 species Species 0.000 description 20
- 239000002464 receptor antagonist Substances 0.000 description 19
- 229940044551 receptor antagonist Drugs 0.000 description 19
- 208000030761 polycystic kidney disease Diseases 0.000 description 18
- 238000000235 small-angle X-ray scattering Methods 0.000 description 18
- 210000001519 tissue Anatomy 0.000 description 18
- 125000003275 alpha amino acid group Chemical group 0.000 description 17
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 16
- 206010020649 Hyperkeratosis Diseases 0.000 description 16
- 230000003993 interaction Effects 0.000 description 16
- 238000006467 substitution reaction Methods 0.000 description 15
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 14
- 239000000018 receptor agonist Substances 0.000 description 14
- 229940044601 receptor agonist Drugs 0.000 description 14
- 125000006850 spacer group Chemical group 0.000 description 14
- 210000000689 upper leg Anatomy 0.000 description 13
- 241000193403 Clostridium Species 0.000 description 12
- 239000005557 antagonist Substances 0.000 description 12
- 239000013078 crystal Substances 0.000 description 12
- 201000010099 disease Diseases 0.000 description 12
- 201000004384 Alopecia Diseases 0.000 description 11
- 102000004190 Enzymes Human genes 0.000 description 11
- 108090000790 Enzymes Proteins 0.000 description 11
- 125000000539 amino acid group Chemical group 0.000 description 11
- 229940088598 enzyme Drugs 0.000 description 11
- 230000035876 healing Effects 0.000 description 11
- 241000193159 Hathewaya histolytica Species 0.000 description 10
- 108700020797 Parathyroid Hormone-Related Proteins 0.000 description 10
- 102000043299 Parathyroid hormone-related Human genes 0.000 description 10
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 10
- 229910052500 inorganic mineral Inorganic materials 0.000 description 10
- 238000003780 insertion Methods 0.000 description 10
- 230000037431 insertion Effects 0.000 description 10
- 239000011707 mineral Substances 0.000 description 10
- 235000010755 mineral Nutrition 0.000 description 10
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 9
- 210000004899 c-terminal region Anatomy 0.000 description 9
- 229910052791 calcium Inorganic materials 0.000 description 9
- 239000003102 growth factor Substances 0.000 description 9
- 230000003779 hair growth Effects 0.000 description 9
- 238000000338 in vitro Methods 0.000 description 9
- 210000003491 skin Anatomy 0.000 description 9
- 208000024891 symptom Diseases 0.000 description 9
- BHPQYMZQTOCNFJ-UHFFFAOYSA-N Calcium cation Chemical compound [Ca+2] BHPQYMZQTOCNFJ-UHFFFAOYSA-N 0.000 description 8
- 241000699666 Mus <mouse, genus> Species 0.000 description 8
- 241000699670 Mus sp. Species 0.000 description 8
- 241000700159 Rattus Species 0.000 description 8
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 8
- 239000000556 agonist Substances 0.000 description 8
- 229960002685 biotin Drugs 0.000 description 8
- 235000020958 biotin Nutrition 0.000 description 8
- 239000011616 biotin Substances 0.000 description 8
- 229910001424 calcium ion Inorganic materials 0.000 description 8
- 238000012217 deletion Methods 0.000 description 8
- 230000037430 deletion Effects 0.000 description 8
- 230000008439 repair process Effects 0.000 description 8
- 108010007726 Bone Morphogenetic Proteins Proteins 0.000 description 7
- 102000007350 Bone Morphogenetic Proteins Human genes 0.000 description 7
- 241001112695 Clostridiales Species 0.000 description 7
- 241001465754 Metazoa Species 0.000 description 7
- 108010013295 Microbial collagenase Proteins 0.000 description 7
- 208000027418 Wounds and injury Diseases 0.000 description 7
- 230000004071 biological effect Effects 0.000 description 7
- 229940112869 bone morphogenetic protein Drugs 0.000 description 7
- 238000010494 dissociation reaction Methods 0.000 description 7
- 230000005593 dissociations Effects 0.000 description 7
- 230000001965 increasing effect Effects 0.000 description 7
- 230000035755 proliferation Effects 0.000 description 7
- 238000002864 sequence alignment Methods 0.000 description 7
- 239000000126 substance Substances 0.000 description 7
- 102000005720 Glutathione transferase Human genes 0.000 description 6
- 108010070675 Glutathione transferase Proteins 0.000 description 6
- 108010077465 Tropocollagen Proteins 0.000 description 6
- 238000003556 assay Methods 0.000 description 6
- 208000022605 chemotherapy-induced alopecia Diseases 0.000 description 6
- 239000002131 composite material Substances 0.000 description 6
- 230000006378 damage Effects 0.000 description 6
- 239000000835 fiber Substances 0.000 description 6
- 230000003676 hair loss Effects 0.000 description 6
- 208000024963 hair loss Diseases 0.000 description 6
- 238000004128 high performance liquid chromatography Methods 0.000 description 6
- 238000002347 injection Methods 0.000 description 6
- 239000007924 injection Substances 0.000 description 6
- 238000010603 microCT Methods 0.000 description 6
- 230000002188 osteogenic effect Effects 0.000 description 6
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 6
- 101000920185 Hathewaya histolytica Collagenase ColG Proteins 0.000 description 5
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 5
- 102000001708 Protein Isoforms Human genes 0.000 description 5
- 108010029485 Protein Isoforms Proteins 0.000 description 5
- 238000004458 analytical method Methods 0.000 description 5
- 239000000872 buffer Substances 0.000 description 5
- 230000011382 collagen catabolic process Effects 0.000 description 5
- 230000006870 function Effects 0.000 description 5
- 210000004209 hair Anatomy 0.000 description 5
- 230000036541 health Effects 0.000 description 5
- 238000001727 in vivo Methods 0.000 description 5
- 238000001338 self-assembly Methods 0.000 description 5
- 239000011780 sodium chloride Substances 0.000 description 5
- 230000001225 therapeutic effect Effects 0.000 description 5
- 108090001008 Avidin Proteins 0.000 description 4
- 241000894006 Bacteria Species 0.000 description 4
- 208000027932 Collagen disease Diseases 0.000 description 4
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical group NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 4
- WZUVPPKBWHMQCE-UHFFFAOYSA-N Haematoxylin Chemical compound C12=CC(O)=C(O)C=C2CC2(O)C1C1=CC=C(O)C(O)=C1OC2 WZUVPPKBWHMQCE-UHFFFAOYSA-N 0.000 description 4
- 101000920186 Hathewaya histolytica Collagenase ColH Proteins 0.000 description 4
- 201000002980 Hyperparathyroidism Diseases 0.000 description 4
- 206010031243 Osteogenesis imperfecta Diseases 0.000 description 4
- 108010090804 Streptavidin Proteins 0.000 description 4
- 206010052428 Wound Diseases 0.000 description 4
- 238000010521 absorption reaction Methods 0.000 description 4
- 231100000360 alopecia Toxicity 0.000 description 4
- 210000004204 blood vessel Anatomy 0.000 description 4
- 230000002950 deficient Effects 0.000 description 4
- 238000011161 development Methods 0.000 description 4
- 230000018109 developmental process Effects 0.000 description 4
- 231100000673 dose–response relationship Toxicity 0.000 description 4
- 238000012377 drug delivery Methods 0.000 description 4
- 230000004927 fusion Effects 0.000 description 4
- 230000004545 gene duplication Effects 0.000 description 4
- 230000012010 growth Effects 0.000 description 4
- 239000004615 ingredient Substances 0.000 description 4
- 239000000463 material Substances 0.000 description 4
- 238000001840 matrix-assisted laser desorption--ionisation time-of-flight mass spectrometry Methods 0.000 description 4
- 238000005259 measurement Methods 0.000 description 4
- 230000007246 mechanism Effects 0.000 description 4
- 230000000394 mitotic effect Effects 0.000 description 4
- 230000004048 modification Effects 0.000 description 4
- 238000012986 modification Methods 0.000 description 4
- 238000004445 quantitative analysis Methods 0.000 description 4
- 238000001542 size-exclusion chromatography Methods 0.000 description 4
- 208000011580 syndromic disease Diseases 0.000 description 4
- 230000008685 targeting Effects 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 108010059616 Activins Proteins 0.000 description 3
- 208000024985 Alport syndrome Diseases 0.000 description 3
- 241000193830 Bacillus <bacterium> Species 0.000 description 3
- 108010049931 Bone Morphogenetic Protein 2 Proteins 0.000 description 3
- 108010049951 Bone Morphogenetic Protein 3 Proteins 0.000 description 3
- 102100024506 Bone morphogenetic protein 2 Human genes 0.000 description 3
- 102100024504 Bone morphogenetic protein 3 Human genes 0.000 description 3
- 208000027734 Caffey disease Diseases 0.000 description 3
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 description 3
- 102000005701 Calcium-Binding Proteins Human genes 0.000 description 3
- 108010045403 Calcium-Binding Proteins Proteins 0.000 description 3
- JOATXPAWOHTVSZ-UHFFFAOYSA-N Celiprolol Chemical compound CCN(CC)C(=O)NC1=CC=C(OCC(O)CNC(C)(C)C)C(C(C)=O)=C1 JOATXPAWOHTVSZ-UHFFFAOYSA-N 0.000 description 3
- 108010039419 Connective Tissue Growth Factor Proteins 0.000 description 3
- 102000015225 Connective Tissue Growth Factor Human genes 0.000 description 3
- 208000035218 Cortical Congenital Hyperostosis Diseases 0.000 description 3
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 3
- 206010016454 Femur fracture Diseases 0.000 description 3
- 102100028071 Fibroblast growth factor 7 Human genes 0.000 description 3
- 108090000385 Fibroblast growth factor 7 Proteins 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 108010017080 Granulocyte Colony-Stimulating Factor Proteins 0.000 description 3
- 102000004269 Granulocyte Colony-Stimulating Factor Human genes 0.000 description 3
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 3
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 3
- 102000018997 Growth Hormone Human genes 0.000 description 3
- 108010051696 Growth Hormone Proteins 0.000 description 3
- 206010073206 Infantile cortical hyperostosis Diseases 0.000 description 3
- 102100026818 Inhibin beta E chain Human genes 0.000 description 3
- 108090000723 Insulin-Like Growth Factor I Proteins 0.000 description 3
- 102000004218 Insulin-Like Growth Factor I Human genes 0.000 description 3
- 241000124008 Mammalia Species 0.000 description 3
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 3
- 208000027077 Stickler syndrome Diseases 0.000 description 3
- 108091005735 TGF-beta receptors Proteins 0.000 description 3
- 102000006747 Transforming Growth Factor alpha Human genes 0.000 description 3
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 3
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 3
- 102000016715 Transforming Growth Factor beta Receptors Human genes 0.000 description 3
- 102000046299 Transforming Growth Factor beta1 Human genes 0.000 description 3
- 101800004564 Transforming growth factor alpha Proteins 0.000 description 3
- 101800002279 Transforming growth factor beta-1 Proteins 0.000 description 3
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 3
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- 239000000488 activin Substances 0.000 description 3
- 230000001195 anabolic effect Effects 0.000 description 3
- 238000003491 array Methods 0.000 description 3
- 238000004630 atomic force microscopy Methods 0.000 description 3
- 239000001110 calcium chloride Substances 0.000 description 3
- 235000011148 calcium chloride Nutrition 0.000 description 3
- 229910001628 calcium chloride Inorganic materials 0.000 description 3
- 150000001720 carbohydrates Chemical class 0.000 description 3
- 235000014633 carbohydrates Nutrition 0.000 description 3
- 230000015556 catabolic process Effects 0.000 description 3
- 230000003197 catalytic effect Effects 0.000 description 3
- 229960002320 celiprolol Drugs 0.000 description 3
- 230000032823 cell division Effects 0.000 description 3
- 239000003153 chemical reaction reagent Substances 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 208000025645 collagenopathy Diseases 0.000 description 3
- 238000006731 degradation reaction Methods 0.000 description 3
- 238000011156 evaluation Methods 0.000 description 3
- 238000009472 formulation Methods 0.000 description 3
- 239000000122 growth hormone Substances 0.000 description 3
- 208000003215 hereditary nephritis Diseases 0.000 description 3
- 229910052588 hydroxylapatite Inorganic materials 0.000 description 3
- 208000014674 injury Diseases 0.000 description 3
- 230000014759 maintenance of location Effects 0.000 description 3
- 239000011159 matrix material Substances 0.000 description 3
- XYJRXVWERLGGKC-UHFFFAOYSA-D pentacalcium;hydroxide;triphosphate Chemical compound [OH-].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O XYJRXVWERLGGKC-UHFFFAOYSA-D 0.000 description 3
- 230000002265 prevention Effects 0.000 description 3
- 102000005962 receptors Human genes 0.000 description 3
- 108020003175 receptors Proteins 0.000 description 3
- 238000011084 recovery Methods 0.000 description 3
- 238000007670 refining Methods 0.000 description 3
- 230000008521 reorganization Effects 0.000 description 3
- 230000028327 secretion Effects 0.000 description 3
- 239000011734 sodium Substances 0.000 description 3
- 239000000243 solution Substances 0.000 description 3
- 239000002904 solvent Substances 0.000 description 3
- 239000000758 substrate Substances 0.000 description 3
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 3
- 230000009466 transformation Effects 0.000 description 3
- 238000002054 transplantation Methods 0.000 description 3
- 125000001493 tyrosinyl group Chemical group [H]OC1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 3
- 239000003981 vehicle Substances 0.000 description 3
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 2
- 125000003088 (fluoren-9-ylmethoxy)carbonyl group Chemical group 0.000 description 2
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 2
- 150000003923 2,5-pyrrolediones Chemical class 0.000 description 2
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 2
- 206010007710 Cartilage injury Diseases 0.000 description 2
- 208000026372 Congenital cystic kidney disease Diseases 0.000 description 2
- 102000004127 Cytokines Human genes 0.000 description 2
- 108090000695 Cytokines Proteins 0.000 description 2
- 208000001708 Dupuytren contracture Diseases 0.000 description 2
- 241000588724 Escherichia coli Species 0.000 description 2
- 201000000628 Gas Gangrene Diseases 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- 239000004471 Glycine Substances 0.000 description 2
- 239000007995 HEPES buffer Substances 0.000 description 2
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 2
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 2
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 2
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 2
- 239000004472 Lysine Substances 0.000 description 2
- 101100537302 Mus musculus Itfg1 gene Proteins 0.000 description 2
- NQTADLQHYWFPDB-UHFFFAOYSA-N N-Hydroxysuccinimide Chemical class ON1C(=O)CCC1=O NQTADLQHYWFPDB-UHFFFAOYSA-N 0.000 description 2
- 241000906034 Orthops Species 0.000 description 2
- 108091033411 PCA3 Proteins 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 2
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 2
- 239000004473 Threonine Substances 0.000 description 2
- 230000002159 abnormal effect Effects 0.000 description 2
- 230000001133 acceleration Effects 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 230000004913 activation Effects 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 208000004631 alopecia areata Diseases 0.000 description 2
- 238000012436 analytical size exclusion chromatography Methods 0.000 description 2
- 238000010171 animal model Methods 0.000 description 2
- 239000002246 antineoplastic agent Substances 0.000 description 2
- 229940041181 antineoplastic drug Drugs 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 229960001230 asparagine Drugs 0.000 description 2
- 235000009582 asparagine Nutrition 0.000 description 2
- 238000002869 basic local alignment search tool Methods 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- 238000006664 bond formation reaction Methods 0.000 description 2
- 230000014461 bone development Effects 0.000 description 2
- 230000008468 bone growth Effects 0.000 description 2
- 230000010072 bone remodeling Effects 0.000 description 2
- 238000011088 calibration curve Methods 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 230000004663 cell proliferation Effects 0.000 description 2
- 238000001516 cell proliferation assay Methods 0.000 description 2
- 239000006285 cell suspension Substances 0.000 description 2
- 238000002659 cell therapy Methods 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 238000010382 chemical cross-linking Methods 0.000 description 2
- 238000002512 chemotherapy Methods 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 230000001268 conjugating effect Effects 0.000 description 2
- 210000002808 connective tissue Anatomy 0.000 description 2
- 230000000875 corresponding effect Effects 0.000 description 2
- 238000004132 cross linking Methods 0.000 description 2
- 238000002425 crystallisation Methods 0.000 description 2
- 230000008025 crystallization Effects 0.000 description 2
- 230000007812 deficiency Effects 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 238000010511 deprotection reaction Methods 0.000 description 2
- 208000035475 disorder Diseases 0.000 description 2
- 238000002296 dynamic light scattering Methods 0.000 description 2
- YQGOJNYOYNNSMM-UHFFFAOYSA-N eosin Chemical compound [Na+].OC(=O)C1=CC=CC=C1C1=C2C=C(Br)C(=O)C(Br)=C2OC2=C(Br)C(O)=C(Br)C=C21 YQGOJNYOYNNSMM-UHFFFAOYSA-N 0.000 description 2
- 239000013613 expression plasmid Substances 0.000 description 2
- 210000002950 fibroblast Anatomy 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 229930004094 glycosylphosphatidylinositol Natural products 0.000 description 2
- 230000031774 hair cycle Effects 0.000 description 2
- 210000003780 hair follicle Anatomy 0.000 description 2
- 230000003659 hair regrowth Effects 0.000 description 2
- IPCSVZSSVZVIGE-UHFFFAOYSA-N hexadecanoic acid Chemical compound CCCCCCCCCCCCCCCC(O)=O IPCSVZSSVZVIGE-UHFFFAOYSA-N 0.000 description 2
- 229940088597 hormone Drugs 0.000 description 2
- 239000005556 hormone Substances 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- 230000026045 iodination Effects 0.000 description 2
- 238000006192 iodination reaction Methods 0.000 description 2
- 230000003902 lesion Effects 0.000 description 2
- 150000002632 lipids Chemical class 0.000 description 2
- 239000002502 liposome Substances 0.000 description 2
- RLSSMJSEOOYNOY-UHFFFAOYSA-N m-cresol Chemical compound CC1=CC=CC(O)=C1 RLSSMJSEOOYNOY-UHFFFAOYSA-N 0.000 description 2
- 238000012423 maintenance Methods 0.000 description 2
- 238000004949 mass spectrometry Methods 0.000 description 2
- 230000009681 mesenchymal cell proliferation Effects 0.000 description 2
- 238000010172 mouse model Methods 0.000 description 2
- 238000002703 mutagenesis Methods 0.000 description 2
- 231100000350 mutagenesis Toxicity 0.000 description 2
- 230000035772 mutation Effects 0.000 description 2
- 108020004707 nucleic acids Proteins 0.000 description 2
- 150000007523 nucleic acids Chemical class 0.000 description 2
- 102000039446 nucleic acids Human genes 0.000 description 2
- 230000008520 organization Effects 0.000 description 2
- 238000012856 packing Methods 0.000 description 2
- 230000000849 parathyroid Effects 0.000 description 2
- 230000001575 pathological effect Effects 0.000 description 2
- 239000013612 plasmid Substances 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 239000002157 polynucleotide Substances 0.000 description 2
- 108091033319 polynucleotide Proteins 0.000 description 2
- 102000040430 polynucleotide Human genes 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 230000000750 progressive effect Effects 0.000 description 2
- 230000002062 proliferating effect Effects 0.000 description 2
- 238000000159 protein binding assay Methods 0.000 description 2
- 230000012846 protein folding Effects 0.000 description 2
- 230000017854 proteolysis Effects 0.000 description 2
- 230000008707 rearrangement Effects 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 229920006395 saturated elastomer Polymers 0.000 description 2
- 230000007017 scission Effects 0.000 description 2
- 150000003384 small molecules Chemical class 0.000 description 2
- 238000001464 small-angle X-ray scattering data Methods 0.000 description 2
- 230000000638 stimulation Effects 0.000 description 2
- 239000006228 supernatant Substances 0.000 description 2
- 239000004094 surface-active agent Substances 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- 230000000699 topical effect Effects 0.000 description 2
- 231100000419 toxicity Toxicity 0.000 description 2
- 230000001988 toxicity Effects 0.000 description 2
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 2
- 230000029663 wound healing Effects 0.000 description 2
- CRDAMVZIKSXKFV-FBXUGWQNSA-N (2-cis,6-cis)-farnesol Chemical compound CC(C)=CCC\C(C)=C/CC\C(C)=C/CO CRDAMVZIKSXKFV-FBXUGWQNSA-N 0.000 description 1
- 239000000260 (2E,6E)-3,7,11-trimethyldodeca-2,6,10-trien-1-ol Substances 0.000 description 1
- FPJHWYCPAOPVIV-VOZMEZHOSA-N (2R,3S,4R,5R,6R)-6-[(2R,3R,4R,5R,6R)-5-acetamido-2-(hydroxymethyl)-6-methoxy-3-sulfooxyoxan-4-yl]oxy-4,5-dihydroxy-3-methoxyoxane-2-carboxylic acid Chemical compound CO[C@@H]1O[C@H](CO)[C@H](OS(O)(=O)=O)[C@H](O[C@@H]2O[C@H]([C@@H](OC)[C@H](O)[C@H]2O)C(O)=O)[C@H]1NC(C)=O FPJHWYCPAOPVIV-VOZMEZHOSA-N 0.000 description 1
- OJISWRZIEWCUBN-QIRCYJPOSA-N (E,E,E)-geranylgeraniol Chemical compound CC(C)=CCC\C(C)=C\CC\C(C)=C\CC\C(C)=C\CO OJISWRZIEWCUBN-QIRCYJPOSA-N 0.000 description 1
- 102000040650 (ribonucleotides)n+m Human genes 0.000 description 1
- DHBXNPKRAUYBTH-UHFFFAOYSA-N 1,1-ethanedithiol Chemical compound CC(S)S DHBXNPKRAUYBTH-UHFFFAOYSA-N 0.000 description 1
- BDNKZNFMNDZQMI-UHFFFAOYSA-N 1,3-diisopropylcarbodiimide Chemical compound CC(C)N=C=NC(C)C BDNKZNFMNDZQMI-UHFFFAOYSA-N 0.000 description 1
- DFPYXQYWILNVAU-UHFFFAOYSA-N 1-hydroxybenzotriazole Chemical compound C1=CC=C2N(O)N=NC2=C1.C1=CC=C2N(O)N=NC2=C1 DFPYXQYWILNVAU-UHFFFAOYSA-N 0.000 description 1
- YKGRXSLQYRREKO-DFOPOJAZSA-N 101380-54-5 Chemical compound C([C@H](N)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(N)=O)C1=CC=CC=C1 YKGRXSLQYRREKO-DFOPOJAZSA-N 0.000 description 1
- 108020004465 16S ribosomal RNA Proteins 0.000 description 1
- VFXZKNGPBLVKPC-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid;sodium Chemical compound [Na].OCCN1CCN(CCS(O)(=O)=O)CC1 VFXZKNGPBLVKPC-UHFFFAOYSA-N 0.000 description 1
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 1
- FZTIWOBQQYPTCJ-UHFFFAOYSA-N 4-[4-(4-carboxyphenyl)phenyl]benzoic acid Chemical compound C1=CC(C(=O)O)=CC=C1C1=CC=C(C=2C=CC(=CC=2)C(O)=O)C=C1 FZTIWOBQQYPTCJ-UHFFFAOYSA-N 0.000 description 1
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 1
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 1
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 206010065687 Bone loss Diseases 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 241000193764 Brevibacillus brevis Species 0.000 description 1
- 238000011746 C57BL/6J (JAX™ mouse strain) Methods 0.000 description 1
- 101000957724 Catostomus commersonii Corticoliberin-1 Proteins 0.000 description 1
- 241000193171 Clostridium butyricum Species 0.000 description 1
- 102000012422 Collagen Type I Human genes 0.000 description 1
- 108010022452 Collagen Type I Proteins 0.000 description 1
- 208000034656 Contusions Diseases 0.000 description 1
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 1
- 102100025698 Cytosolic carboxypeptidase 4 Human genes 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 1
- 206010011878 Deafness Diseases 0.000 description 1
- 229920000045 Dermatan sulfate Polymers 0.000 description 1
- 239000004375 Dextrin Substances 0.000 description 1
- 229920001353 Dextrin Polymers 0.000 description 1
- 108010066486 EGF Family of Proteins Proteins 0.000 description 1
- 102000018386 EGF Family of Proteins Human genes 0.000 description 1
- 241000283073 Equus caballus Species 0.000 description 1
- 241000672609 Escherichia coli BL21 Species 0.000 description 1
- 241000620209 Escherichia coli DH5[alpha] Species 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 208000008924 Femoral Fractures Diseases 0.000 description 1
- 102100028412 Fibroblast growth factor 10 Human genes 0.000 description 1
- 108090001047 Fibroblast growth factor 10 Proteins 0.000 description 1
- 108090000381 Fibroblast growth factor 4 Proteins 0.000 description 1
- 102100028072 Fibroblast growth factor 4 Human genes 0.000 description 1
- 206010016654 Fibrosis Diseases 0.000 description 1
- 108010046569 Galectins Proteins 0.000 description 1
- 102000007563 Galectins Human genes 0.000 description 1
- 101000609762 Gallus gallus Ovalbumin Proteins 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- BCCRXDTUTZHDEU-VKHMYHEASA-N Gly-Ser Chemical compound NCC(=O)N[C@@H](CO)C(O)=O BCCRXDTUTZHDEU-VKHMYHEASA-N 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 241000093166 Hathewaya Species 0.000 description 1
- 101000932590 Homo sapiens Cytosolic carboxypeptidase 4 Proteins 0.000 description 1
- 101001052035 Homo sapiens Fibroblast growth factor 2 Proteins 0.000 description 1
- 101001135770 Homo sapiens Parathyroid hormone Proteins 0.000 description 1
- 101001135995 Homo sapiens Probable peptidyl-tRNA hydrolase Proteins 0.000 description 1
- LCWXJXMHJVIJFK-UHFFFAOYSA-N Hydroxylysine Natural products NCC(O)CC(N)CC(O)=O LCWXJXMHJVIJFK-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 208000033463 Ischaemic neuropathy Diseases 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 238000007476 Maximum Likelihood Methods 0.000 description 1
- 101001033003 Mus musculus Granzyme F Proteins 0.000 description 1
- 230000006181 N-acylation Effects 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 230000006179 O-acylation Effects 0.000 description 1
- 235000021314 Palmitic acid Nutrition 0.000 description 1
- 108020002230 Pancreatic Ribonuclease Proteins 0.000 description 1
- 102000005891 Pancreatic ribonuclease Human genes 0.000 description 1
- 229930040373 Paraformaldehyde Natural products 0.000 description 1
- 102100032256 Parathyroid hormone/parathyroid hormone-related peptide receptor Human genes 0.000 description 1
- 101710180613 Parathyroid hormone/parathyroid hormone-related peptide receptor Proteins 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 208000006735 Periostitis Diseases 0.000 description 1
- 241000009328 Perro Species 0.000 description 1
- 229920002562 Polyethylene Glycol 3350 Polymers 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- BNBBNGZZKQUWCD-IUCAKERBSA-N Pro-Arg-Gly Chemical compound NC(N)=NCCC[C@@H](C(=O)NCC(O)=O)NC(=O)[C@@H]1CCCN1 BNBBNGZZKQUWCD-IUCAKERBSA-N 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 101000933967 Pseudomonas phage KPP25 Major capsid protein Proteins 0.000 description 1
- 241000700157 Rattus norvegicus Species 0.000 description 1
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 1
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 230000006191 S-acylation Effects 0.000 description 1
- 238000011804 SKH1 hairless mouse Methods 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 238000012300 Sequence Analysis Methods 0.000 description 1
- 108050008290 Serpin H1 Proteins 0.000 description 1
- 102100027287 Serpin H1 Human genes 0.000 description 1
- 206010040925 Skin striae Diseases 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- 208000020339 Spinal injury Diseases 0.000 description 1
- 239000012505 Superdex™ Substances 0.000 description 1
- 241000282898 Sus scrofa Species 0.000 description 1
- AUYYCJSJGJYCDS-LBPRGKRZSA-N Thyrolar Chemical class IC1=CC(C[C@H](N)C(O)=O)=CC(I)=C1OC1=CC=C(O)C(I)=C1 AUYYCJSJGJYCDS-LBPRGKRZSA-N 0.000 description 1
- 208000004367 Tibial Fractures Diseases 0.000 description 1
- 102000004142 Trypsin Human genes 0.000 description 1
- 108090000631 Trypsin Proteins 0.000 description 1
- 206010047073 Vascular fragility Diseases 0.000 description 1
- 238000002441 X-ray diffraction Methods 0.000 description 1
- PBCJIPOGFJYBJE-UHFFFAOYSA-N acetonitrile;hydrate Chemical compound O.CC#N PBCJIPOGFJYBJE-UHFFFAOYSA-N 0.000 description 1
- 230000021736 acetylation Effects 0.000 description 1
- 238000006640 acetylation reaction Methods 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 125000002252 acyl group Chemical group 0.000 description 1
- 230000010933 acylation Effects 0.000 description 1
- 238000005917 acylation reaction Methods 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- 230000029936 alkylation Effects 0.000 description 1
- 238000005804 alkylation reaction Methods 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 230000009435 amidation Effects 0.000 description 1
- 238000007112 amidation reaction Methods 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 229940124325 anabolic agent Drugs 0.000 description 1
- 239000003263 anabolic agent Substances 0.000 description 1
- 239000012491 analyte Substances 0.000 description 1
- 230000019552 anatomical structure morphogenesis Effects 0.000 description 1
- 206010068168 androgenetic alopecia Diseases 0.000 description 1
- 201000002996 androgenic alopecia Diseases 0.000 description 1
- 230000002491 angiogenic effect Effects 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 229940121363 anti-inflammatory agent Drugs 0.000 description 1
- 239000002260 anti-inflammatory agent Substances 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 125000000637 arginyl group Chemical group N[C@@H](CCCNC(N)=N)C(=O)* 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 238000003149 assay kit Methods 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- XTKDAFGWCDAMPY-UHFFFAOYSA-N azaperone Chemical group C1=CC(F)=CC=C1C(=O)CCCN1CCN(C=2N=CC=CC=2)CC1 XTKDAFGWCDAMPY-UHFFFAOYSA-N 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 239000012148 binding buffer Substances 0.000 description 1
- 230000008275 binding mechanism Effects 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 238000010504 bond cleavage reaction Methods 0.000 description 1
- 210000002805 bone matrix Anatomy 0.000 description 1
- 230000010478 bone regeneration Effects 0.000 description 1
- 229940098773 bovine serum albumin Drugs 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 210000000845 cartilage Anatomy 0.000 description 1
- 230000022159 cartilage development Effects 0.000 description 1
- 230000003778 catagen phase Effects 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- 230000009920 chelation Effects 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 229960005099 collagenase clostridium histolyticum Drugs 0.000 description 1
- 230000033035 connective tissue development Effects 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- NKLPQNGYXWVELD-UHFFFAOYSA-M coomassie brilliant blue Chemical compound [Na+].C1=CC(OCC)=CC=C1NC1=CC=C(C(=C2C=CC(C=C2)=[N+](CC)CC=2C=C(C=CC=2)S([O-])(=O)=O)C=2C=CC(=CC=2)N(CC)CC=2C=C(C=CC=2)S([O-])(=O)=O)C=C1 NKLPQNGYXWVELD-UHFFFAOYSA-M 0.000 description 1
- 230000009146 cooperative binding Effects 0.000 description 1
- 210000004087 cornea Anatomy 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 238000002447 crystallographic data Methods 0.000 description 1
- 239000012228 culture supernatant Substances 0.000 description 1
- 229960004397 cyclophosphamide Drugs 0.000 description 1
- 238000013480 data collection Methods 0.000 description 1
- 238000001804 debridement Methods 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 229940124447 delivery agent Drugs 0.000 description 1
- YSMODUONRAFBET-UHFFFAOYSA-N delta-DL-hydroxylysine Natural products NCC(O)CCC(N)C(O)=O YSMODUONRAFBET-UHFFFAOYSA-N 0.000 description 1
- 230000036576 dermal application Effects 0.000 description 1
- 235000019425 dextrin Nutrition 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 238000002050 diffraction method Methods 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 150000002016 disaccharides Chemical class 0.000 description 1
- 238000005553 drilling Methods 0.000 description 1
- 238000009510 drug design Methods 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- YSMODUONRAFBET-UHNVWZDZSA-N erythro-5-hydroxy-L-lysine Chemical compound NC[C@H](O)CC[C@H](N)C(O)=O YSMODUONRAFBET-UHNVWZDZSA-N 0.000 description 1
- 239000003797 essential amino acid Substances 0.000 description 1
- 235000020776 essential amino acid Nutrition 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- DEFVIWRASFVYLL-UHFFFAOYSA-N ethylene glycol bis(2-aminoethyl)tetraacetic acid Chemical compound OC(=O)CN(CC(O)=O)CCOCCOCCN(CC(O)=O)CC(O)=O DEFVIWRASFVYLL-UHFFFAOYSA-N 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 210000001723 extracellular space Anatomy 0.000 description 1
- 210000000887 face Anatomy 0.000 description 1
- 229940043259 farnesol Drugs 0.000 description 1
- 229930002886 farnesol Natural products 0.000 description 1
- 230000004761 fibrosis Effects 0.000 description 1
- 239000000706 filtrate Substances 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 230000022244 formylation Effects 0.000 description 1
- 238000006170 formylation reaction Methods 0.000 description 1
- 230000005714 functional activity Effects 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 238000002523 gelfiltration Methods 0.000 description 1
- 230000009395 genetic defect Effects 0.000 description 1
- XWRJRXQNOHXIOX-UHFFFAOYSA-N geranylgeraniol Natural products CC(C)=CCCC(C)=CCOCC=C(C)CCC=C(C)C XWRJRXQNOHXIOX-UHFFFAOYSA-N 0.000 description 1
- OJISWRZIEWCUBN-UHFFFAOYSA-N geranylnerol Natural products CC(C)=CCCC(C)=CCCC(C)=CCCC(C)=CCO OJISWRZIEWCUBN-UHFFFAOYSA-N 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 230000036252 glycation Effects 0.000 description 1
- 125000003147 glycosyl group Chemical group 0.000 description 1
- 230000013595 glycosylation Effects 0.000 description 1
- 238000006206 glycosylation reaction Methods 0.000 description 1
- 208000035474 group of disease Diseases 0.000 description 1
- 229940093915 gynecological organic acid Drugs 0.000 description 1
- 238000012835 hanging drop method Methods 0.000 description 1
- 238000013537 high throughput screening Methods 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 102000058004 human PTH Human genes 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 229920001477 hydrophilic polymer Polymers 0.000 description 1
- QJHBJHUKURJDLG-UHFFFAOYSA-N hydroxy-L-lysine Natural products NCCCCC(NO)C(O)=O QJHBJHUKURJDLG-UHFFFAOYSA-N 0.000 description 1
- 230000033444 hydroxylation Effects 0.000 description 1
- 238000005805 hydroxylation reaction Methods 0.000 description 1
- 238000010191 image analysis Methods 0.000 description 1
- 230000001976 improved effect Effects 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 239000007972 injectable composition Substances 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 230000002601 intratumoral effect Effects 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 210000004153 islets of langerhan Anatomy 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 238000006317 isomerization reaction Methods 0.000 description 1
- 230000006122 isoprenylation Effects 0.000 description 1
- 210000002510 keratinocyte Anatomy 0.000 description 1
- 208000017169 kidney disease Diseases 0.000 description 1
- 210000003127 knee Anatomy 0.000 description 1
- 238000010150 least significant difference test Methods 0.000 description 1
- 210000003041 ligament Anatomy 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- AGBQKNBQESQNJD-UHFFFAOYSA-M lipoate Chemical compound [O-]C(=O)CCCCC1CCSS1 AGBQKNBQESQNJD-UHFFFAOYSA-M 0.000 description 1
- 235000019136 lipoic acid Nutrition 0.000 description 1
- 230000006144 lipoylation Effects 0.000 description 1
- 239000012731 long-acting form Substances 0.000 description 1
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 238000002483 medication Methods 0.000 description 1
- 125000001160 methoxycarbonyl group Chemical group [H]C([H])([H])OC(*)=O 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 230000002025 microglial effect Effects 0.000 description 1
- 230000003278 mimic effect Effects 0.000 description 1
- 230000002297 mitogenic effect Effects 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 150000002772 monosaccharides Chemical class 0.000 description 1
- 230000000877 morphologic effect Effects 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 206010028320 muscle necrosis Diseases 0.000 description 1
- 208000031225 myocardial ischemia Diseases 0.000 description 1
- 230000007498 myristoylation Effects 0.000 description 1
- WQEPLUUGTLDZJY-UHFFFAOYSA-N n-Pentadecanoic acid Natural products CCCCCCCCCCCCCCC(O)=O WQEPLUUGTLDZJY-UHFFFAOYSA-N 0.000 description 1
- 210000004898 n-terminal fragment Anatomy 0.000 description 1
- 238000001426 native polyacrylamide gel electrophoresis Methods 0.000 description 1
- 208000004296 neuralgia Diseases 0.000 description 1
- 208000021722 neuropathic pain Diseases 0.000 description 1
- 239000002736 nonionic surfactant Substances 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 238000001543 one-way ANOVA Methods 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 210000000963 osteoblast Anatomy 0.000 description 1
- 208000030346 palmar fibromatosis Diseases 0.000 description 1
- 230000026792 palmitoylation Effects 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 229920002866 paraformaldehyde Polymers 0.000 description 1
- 108010084846 parathyroid hormone (7-34) Proteins 0.000 description 1
- 210000004417 patella Anatomy 0.000 description 1
- 230000007030 peptide scission Effects 0.000 description 1
- 210000003460 periosteum Anatomy 0.000 description 1
- 239000008024 pharmaceutical diluent Substances 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 229940127557 pharmaceutical product Drugs 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- 125000002467 phosphate group Chemical group [H]OP(=O)(O[H])O[*] 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 229920001983 poloxamer Polymers 0.000 description 1
- 201000010065 polycystic ovary syndrome Diseases 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 230000006267 polysialylation Effects 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 230000013823 prenylation Effects 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 125000001500 prolyl group Chemical group [H]N1C([H])(C(=O)[*])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 239000002516 radical scavenger Substances 0.000 description 1
- 230000007115 recruitment Effects 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000001172 regenerating effect Effects 0.000 description 1
- 238000011069 regeneration method Methods 0.000 description 1
- 230000004043 responsiveness Effects 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 238000004007 reversed phase HPLC Methods 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 238000007480 sanger sequencing Methods 0.000 description 1
- 238000004088 simulation Methods 0.000 description 1
- 210000001626 skin fibroblast Anatomy 0.000 description 1
- 230000008470 skin growth Effects 0.000 description 1
- 238000001988 small-angle X-ray diffraction Methods 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 210000001032 spinal nerve Anatomy 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 229910001220 stainless steel Inorganic materials 0.000 description 1
- 239000010935 stainless steel Substances 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 150000005846 sugar alcohols Chemical class 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 210000002435 tendon Anatomy 0.000 description 1
- 150000003505 terpenes Chemical group 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- TUNFSRHWOTWDNC-HKGQFRNVSA-N tetradecanoic acid Chemical compound CCCCCCCCCCCCC[14C](O)=O TUNFSRHWOTWDNC-HKGQFRNVSA-N 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- WROMPOXWARCANT-UHFFFAOYSA-N tfa trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F.OC(=O)C(F)(F)F WROMPOXWARCANT-UHFFFAOYSA-N 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 150000007970 thio esters Chemical class 0.000 description 1
- HNKJADCVZUBCPG-UHFFFAOYSA-N thioanisole Chemical compound CSC1=CC=CC=C1 HNKJADCVZUBCPG-UHFFFAOYSA-N 0.000 description 1
- 229960002663 thioctic acid Drugs 0.000 description 1
- 239000005495 thyroid hormone Substances 0.000 description 1
- 229940036555 thyroid hormone Drugs 0.000 description 1
- 230000000451 tissue damage Effects 0.000 description 1
- 231100000827 tissue damage Toxicity 0.000 description 1
- 239000012049 topical pharmaceutical composition Substances 0.000 description 1
- CRDAMVZIKSXKFV-UHFFFAOYSA-N trans-Farnesol Natural products CC(C)=CCCC(C)=CCCC(C)=CCO CRDAMVZIKSXKFV-UHFFFAOYSA-N 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- 230000001960 triggered effect Effects 0.000 description 1
- 239000012588 trypsin Substances 0.000 description 1
- WFKWXMTUELFFGS-UHFFFAOYSA-N tungsten Chemical compound [W] WFKWXMTUELFFGS-UHFFFAOYSA-N 0.000 description 1
- 229910052721 tungsten Inorganic materials 0.000 description 1
- 239000010937 tungsten Substances 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 239000000304 virulence factor Substances 0.000 description 1
- 230000007923 virulence factor Effects 0.000 description 1
- 108010047303 von Willebrand Factor Proteins 0.000 description 1
- 102100036537 von Willebrand factor Human genes 0.000 description 1
- 229960001134 von willebrand factor Drugs 0.000 description 1
- 230000003313 weakening effect Effects 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/18—Growth factors; Growth regulators
- A61K38/1825—Fibroblast growth factor [FGF]
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/48—Hydrolases (3) acting on peptide bonds (3.4)
- C12N9/50—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25)
- C12N9/52—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from bacteria or Archaea
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
- A61K38/29—Parathyroid hormone (parathormone); Parathyroid hormone-related peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
- A61K47/64—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent
- A61K47/6415—Toxins or lectins, e.g. clostridial toxins or Pseudomonas exotoxins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K8/00—Cosmetics or similar toiletry preparations
- A61K8/18—Cosmetics or similar toiletry preparations characterised by the composition
- A61K8/30—Cosmetics or similar toiletry preparations characterised by the composition containing organic compounds
- A61K8/64—Proteins; Peptides; Derivatives or degradation products thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K8/00—Cosmetics or similar toiletry preparations
- A61K8/18—Cosmetics or similar toiletry preparations characterised by the composition
- A61K8/30—Cosmetics or similar toiletry preparations characterised by the composition containing organic compounds
- A61K8/64—Proteins; Peptides; Derivatives or degradation products thereof
- A61K8/65—Collagen; Gelatin; Keratin; Derivatives or degradation products thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K8/00—Cosmetics or similar toiletry preparations
- A61K8/18—Cosmetics or similar toiletry preparations characterised by the composition
- A61K8/30—Cosmetics or similar toiletry preparations characterised by the composition containing organic compounds
- A61K8/64—Proteins; Peptides; Derivatives or degradation products thereof
- A61K8/66—Enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61Q—SPECIFIC USE OF COSMETICS OR SIMILAR TOILETRY PREPARATIONS
- A61Q19/00—Preparations for care of the skin
- A61Q19/08—Anti-ageing preparations
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61Q—SPECIFIC USE OF COSMETICS OR SIMILAR TOILETRY PREPARATIONS
- A61Q7/00—Preparations for affecting hair growth
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/475—Growth factors; Growth regulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/475—Growth factors; Growth regulators
- C07K14/50—Fibroblast growth factors [FGF]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/475—Growth factors; Growth regulators
- C07K14/50—Fibroblast growth factors [FGF]
- C07K14/503—Fibroblast growth factors [FGF] basic FGF [bFGF]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/475—Growth factors; Growth regulators
- C07K14/51—Bone morphogenetic factor; Osteogenins; Osteogenic factor; Bone-inducing factor
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/575—Hormones
- C07K14/635—Parathyroid hormone (parathormone); Parathyroid hormone-related peptides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/71—Receptors; Cell surface antigens; Cell surface determinants for growth factors; for growth regulators
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y304/00—Hydrolases acting on peptide bonds, i.e. peptidases (3.4)
- C12Y304/24—Metalloendopeptidases (3.4.24)
- C12Y304/24003—Microbial collagenase (3.4.24.3)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/78—Connective tissue peptides, e.g. collagen, elastin, laminin, fibronectin, vitronectin, cold insoluble globulin [CIG]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
Description
(関連出願の相互引用)本出願は、米国仮特許出願62/457,410(2017年2月10日出願(前記の内容は参照によってその全体が本明細書に含まれる))に関して優先権を主張する。
(配列表)本出願はEFS-Webにより電子出願され、テキスト形式の電子提出配列表を含む。当該テキストファイルは、 “2018-02-09_5965-00084_ST25.txt”の表題の配列表(2018年2月9日作成)を含み、サイズは72,312バイトである。本テキストファイルに含まれる配列表は本出願の部分であり、参照によってその全体が本明細書に含まれる。
(技術分野)
異常または損傷コラーゲンは、いくつかの病的状態(創傷およびコラーゲン症(collagenopathy)を含む)の基礎を成す。コラーゲン症は、コラーゲン構造またはコラーゲン形成が正常ではない多くの疾患を表す。この疾患グループは、骨欠損、血管欠損および皮膚欠損を含む広域症状をもたらす。これらの疾患の多くは利用可能な治療をもたないか、または効果的でない治療しかもたない。
コラーゲンを標的とする薬剤はまた、種々の動物組織または特定組織内の複数の部分部位へ治療薬をデリバリーするために有望な薬剤である。特定の治療薬剤が必要とされる対象の体内の複数部位への効果的な治療薬デリバリーは成長分野である。標的誘導デリバリーシステムは、治療薬剤が必要とされる部位において当該薬剤が最も活性を有し、一方、望ましくない毒性および副作用をもたらし得る当該治療薬剤のオフサイト作用を最小化することを可能にする。体内の特定の部位へ治療薬剤を誘導するために標的誘導リポソームまたはポリペプチド(例えば抗体)を使用することは成功をもたらすことが証明されたが、一方、追加のデリバリー薬剤が必要とされる。したがって、損傷若しくは正常コラーゲンを有する組織を治療するために、またはそのような組織へ適切な治療薬をデリバリーするために用いることができる、コラーゲンを標的とする新規な薬剤が当業界で希求されている。
別の特徴では、医薬組成物が提供される。当該医薬組成物は、本明細書に記載されるコラーゲン結合薬剤のいずれかおよび医薬担体を含むことができる。
さらに別の特徴では、ある状態を治療する方法がまた提供される。当該方法は、本明細書に記載されるコラーゲン結合薬剤または医薬組成物のいずれかを当該状態の治療に有効な量で対象に投与する工程を含むことができる。
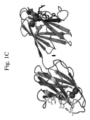
適切には、当該コラーゲン結合薬剤はコラゲナーゼ活性を欠く。“コラゲナーゼ活性”は、コラーゲンを劣化させるまたは破壊するポリぺプチドの能力を指す。例えば、図1Aに示すように、ColGおよびColHタンパク質はコラゲナーゼモジュールを有し、前記モジュールは、これらタンパク質がコラーゲンを劣化させるかまたは破壊することを可能にするいくつかのサブドメインを含む。いくつかの実施態様では、コラーゲン結合薬剤は、これらのまたは類似のコラゲナーゼモジュールを欠く。
本開示のコラーゲン結合薬剤の2つのコラーゲン結合ドメインは、配列番号:1-47のポリペプチドのいずれか1つまたは図5および12に示すそれらポリペプチドから選択され得る。配列番号:1-39は、多様な細菌種のColGおよびColHタンパク質に由来する個々のコラーゲン結合ドメイン(すなわちColG s3a、ColG s3b、ColH s3)を規定する。配列番号:40-47は、多様な細菌種のColGタンパク質で見出されるタンデムコラーゲン結合ドメインを規定する。図5もまた参照されたい。
ポリペプチドにおける“欠失”は、1つ以上のアミノ酸の欠如を生じる、アミノ酸配列における変化を指す。欠失は、少なくとも1、2、3、4、5、6、7、8、9、10、20、50、100、または前記を超えるアミノ酸残基を除去する。欠失には、内部欠失および/または末端欠失(例えば参照ポリペプチドのN-末端切詰め、C-末端切詰めまたは両方)が含まれ得る。
ポリペプチドにおける“挿入”および“付加”は、1つ以上のアミノ酸残基の付加を生じる、アミノ酸配列における変化を指す。挿入または付加は、1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100、または前記を超えるアミノ酸残基を指すことができる。コラーゲン結合ドメインの変種は、N-末端挿入、C-末端挿入、内部挿入、またはN-末端挿入、C-末端挿入および内部挿入の任意の組合せを有することができる。
ポリペプチドの配列同一性は、完全な規定された(例えば特定の配列番号によって規定された)ポリペプチド配列の全長にわたって測定できるか、またはより短い長さにわたって、例えばより大きな規定されたポリペプチド配列から得られるフラグメントの全長にわたって測定することができ、前記フラグメントは、連続する例えば少なくとも15、少なくとも20、少なくとも30、少なくとも40、少なくとも50、少なくとも70または少なくとも150残基である。そのような長さは単なる例示であり、表、図面または配列表で本明細書に示す配列によって支持されるいずれのフラグメント長もパーセンテージ同一性を測定できる長さの記載のために用い得ることは理解されよう。
本明細書に記載されるように、変種コラーゲン結合ドメインおよび薬剤は、配列番号:1-47のいずれか1つと少なくとも50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%または99%配列同一性を有することができる。
本明細書に記載する開示変種コラーゲン結合ドメインおよび薬剤は、参照ポリペプチドによって示される1つ以上の機能的または生物学的活性を有することができる(例えば、野生型コラーゲン結合ドメインおよび薬剤(すなわち配列番号:1-47(図5および12参照)によって示される1つ以上の機能的または生物学的活性)。適切には、開示の変種コラーゲン結合ドメインおよび薬剤は、参照ポリペプチド(すなわち配列番号:1-47(図5および12参照))のコラーゲン結合活性の少なくとも20%、40%、60%、80%、または100%を保持する。
配列番号:1-39はまた図5に示されないコラーゲン結合ドメインを含み、これらのいくつかは図12に含まれている。しかしながら、当業者は、これらのポリペプチド配列を図5および12に示されるポリペプチド配列とアラインメントして、追加の変種がこれら追加のコラーゲン結合ドメインに対して生じ得たものを決定できよう。したがって、ポリペプチドは、本明細書に提供するコラーゲン結合ポリペプチドと85%、88%、90%、92%、94%、95%、96%、97%、98%または99%アミノ酸同一性を有する。変種ポリペプチドはなおコラーゲンと結合する能力を有する。
2つのコラーゲン結合ドメインは、ある細菌種のColG s3bドメインおよびある細菌種のColG s3aドメイン、s3cドメイン、またはColH s3ドメインであり得る。いくつかの実施態様では、コラーゲン結合ドメインの一方は、配列番号:15-30のポリペプチドのいずれか1つ、配列番号:15-30のいずれか1つと少なくとも50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%または99%配列同一性を有する1つのポリペプチド、または配列番号:15-30のいずれか1つの連続する少なくとも8、10、15、20、25、30、40、50、60、70、80、90、100、または100を超えるアミノ酸の1つのフラグメントであることができ、ここで他方のコラーゲン結合ドメインは、配列番号:1-14および31-39のポリペプチドのいずれか1つ、配列番号:1-14および31-39のいずれか1つと少なくとも50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%または99%配列同一性を有する1つのポリペプチド、または配列番号:1-14および31-39のいずれか1つの連続する少なくとも8、10、15、20、25、30、40、50、60、70、80、90、100、または100を超えるアミノ酸の1つのフラグメントであり得る。
2つのコラーゲン結合ドメインは、ある細菌種のColG s3aドメイン、s3bドメイン、またはColH s3ドメインから選択され得る。いくつかの実施態様では、2つのコラーゲン結合ドメインは、配列番号:1-14および31-39のポリペプチドのいずれか1つ、配列番号:1-14および31-39のいずれか1つと少なくとも50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%または99%配列同一性を有する1つのポリペプチド、または配列番号:1-14および31-39のいずれか1つの連続する少なくとも8、10、15、20、25、30、40、50、60、70、80、90、100、または100を超えるアミノ酸の1つのフラグメントであり得る。
2つのコラーゲン結合ドメインは、細菌のColGタンパク質に由来するタンデムコラーゲン結合ドメインであり得る。いくつかの実施態様では、コラーゲン結合薬剤は、配列番号:40-47のポリペプチドのいずれか1つ、配列番号:40-47のいずれか1つと少なくとも50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%または99%配列同一性を有する1つのポリペプチド、または配列番号:40-47のいずれか1つの連続する少なくとも8、10、15、20、25、30、40、50、60、70、80、90、100、または100を超えるアミノ酸の1つのフラグメントであり得る。
ドメインリンカーはまたスペーサーポリペプチドを含むことができる。スペーサーポリペプチドは任意の長さでよく、伝統的または非伝統的アミノ酸を含むことができる。例えば、スペーサーポリペプチドは1-100アミノ酸長でよく、適切には、スペーサーポリペプチドは、コラーゲン結合薬剤の2つのコラーゲン結合ドメインがコラーゲン結合を媒介できるように少なくとも2、3、5、10、15、20、25または25を超えるアミノ酸長である。スペーサーポリペプチドは、配列番号:48-55のポリペプチドのいずれか1つ、GSTタグ、SerリンカーまたはGlyリンカーを含むことができる(ただしこれらに限定されない)。
いくつかの実施態様では、ドメインリンカーはタグ系を含むことができる。タグ系は高親和性で互いに結合することができる任意の薬剤グループを含む。いくつかのタグ系が当業界で周知であり、ビオチン/アビジン、ビオチン/ストレプトアビジン、またはジオキシゲニン(DIG)系を含む(ただしこれらに限定されない)。いくつかの実施態様では、前記タグ系はビオチン/アビジンまたはビオチン/ストレプトアビジンを含む。
ドメインリンカーは、配列番号:48-55のポリペプチドのいずれか1つ、または配列番号:48-55のポリペプチドのいずれか1つと少なくとも50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%または99%配列同一性を有する1つのポリペプチドを含むことができる
“治療薬剤リンカー”は共有結合および/またはリンカー若しくはスペーサー部分を含むことができる。例えば、コラーゲン結合薬剤および治療薬剤は、例えばペプチド結合若しくは化学的交差結合を介して直接的に、または例えばリンカー若しくはスペーサーポリペプチドを介して間接的に連結され得る。有用な治療薬剤リンカーは、ポリペプチド、アミノ酸、核酸とともにホモ官能性リンカーまたはヘテロ官能性リンカーを含む。2つのコラーゲン結合ドメイン間で共有結合の形成を促進できる特に有用な共役試薬は、N-ヒドロキシスクシンイミド(NHS)エステルおよび/またはマレイミドを含むことができる。
例えばコラーゲン症(例えば骨形成不全、スティックラー症候群)、骨粗しょう症またはコラーゲン欠損のために個体に骨折の高リスクをもたらす他の疾患による骨減少は、骨同化ペプチドに連結させたコラーゲン結合薬剤の投与によって治療され得よう。コラーゲン結合薬剤は、コラーゲンの形態発生が異常な部位へ当該骨同化薬剤を誘導することができ、したがって骨折を予防することができる。
例えばエーレルス-ダンロー症候群IV型、アルポート症候群のような欠陥、またはコラーゲン形成不全のために血管破裂が生じやすい他の疾患による脈管脆弱には、脈管の増殖または修復を刺激するペプチドを含むコラーゲン結合薬剤を投与することができる。コラーゲン結合薬剤は当該ペプチドをコラーゲン損傷を有する領域に誘導するであろう(これらの領域は損傷血管を有する可能性が高い)。当該治療薬剤は損傷部位で増殖および修復を刺激し、血管破裂を予防するであろう。
例えばエーレルス-ダンロー症候群、キャフィー病のような異常、またはコラーゲン欠損による皮膚の弱体化が超弾性をもたらす他の疾患による皮膚の脆弱性は、打ち身を起こしやすくし創傷治癒を低下させる。皮膚および上皮増殖因子を治療薬剤として供することができる。前記は、コラーゲン結合薬剤に連結され損傷コラーゲンの領域にデリバリーされるとき、皮膚の増殖および修復を刺激し、皮膚委縮線条を予防し(preventin striae)、治癒を改善するであろう。
別の特徴では、毛の症状(過剰な毛の消失または毛の増殖)を治療する方法が提供される。前記方法は、毛の増殖を誘発または毛の消失を停止するための治療が必要な対象に、PTH/PTHrP受容体アゴニストに連結されたコラーゲン結合薬剤を投与する工程を含むことができる。当該方法は脱毛症の個体に適用でき、前記脱毛症には化学療法誘発脱毛症だけでなく、円形脱毛症、男性型脱毛症、多嚢胞性卵巣症候群によって引き起こされる脱毛症または他の毛の消失が含まれる。組成物は局所的にまたは外用として投与されて毛の消失を治療することができる。
別の特徴では、脱毛処理後の毛の増殖または再生を遅くする方法が提供され、前記方法は、PTH/PTHrP受容体アンタゴニストに連結されたコラーゲン結合薬剤を対象に投与することによる。ある実施態様では、コラーゲン結合薬剤+PTHアンタゴニスト組成物は局所的、外用的に適用される。コラーゲン結合薬剤+PTHアンタゴニストは脱毛処理後に適用されて、毛の再生を予防または遅くすることができる。
本明細書で用いられる有効な量または治療的に有効な量は、ある状態、異常または症状を治療するために対象に投与されたときに、(上記に定義した)治療を達成するために十分である組成物の量を意味する。治療的に有効な量は、当該化合物、処方若しくは組成、当該疾患およびその重篤度、並びに治療されるべき対象の年齢、体重、健康状態および応答性にしたがって変動するであろう。
本明細書に記載する組成物(すなわちコラーゲン結合薬剤および医薬組成物)は、当業者に公知の任意の手段によって投与でき、前記手段には、経口、外用、鼻内、腹腔内、非経口、静脈内、筋肉内、皮下、髄腔内、経皮、鼻咽頭、病巣内、腫瘍内、皮内、または経粘膜吸収が含まれるが、ただしこれらに限定されない。したがって組成物は、摂取可能、注射可能、外用または座薬処方物として処方することができる。組成物はまた、リポソームまたは時宜放出ベヒクルでデリバーすることができる。本発明による対象への組成物の投与は、用量依存態様で有益な作用を示すことができる。したがって、広い制限範囲内では、組成物をより大量に投与すれば、少量の投与よりも有益な生物学的効果の増大が予想される。さらにまた、有効性も毒性が観察されるレベルより低い投薬量で期待される。
ある対象のための最大投薬量は、望ましくないまたは容認し得ない副作用を引き起こさない最高の投薬量である。個々の治療レジメンに関する変数の数は大きく、相当な範囲の用量が予想される。投与ルートもまた投薬量の要件に影響を与えるであろう。組成物の投薬は、無治療と比較して治療される症状を少なくとも10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、または100%を超えて改善するであろう。
本明細書に記載する有効な投薬量は総量を指す。すなわち、2つ以上の組成物が投与される場合、有効な投薬量は投与される総量に一致する。組成物は、単一用量としてまたは分割用量として投与できる。例えば、組成物は、4時間、6時間、8時間、12時間、1日、2日、3日、4日、1週間、2週間または3週間以上離して、2回以上投与できる。
本明細書に記載するコラーゲン結合薬剤または医薬組成物は、治療される症状を効果的に改善するために、対象に1回または2回以上投与することができる。適切な投薬量の範囲は、数百マイクログラムの有効成分の規模であり約0.01から10mg/kg/日、好ましくは約0.1から1mg/kg/日の範囲である。投与に必要とされる有効成分の正確な量は医師の判断に左右され、各対象に固有であり得る。本明細書に記載のコラーゲン結合薬剤または医薬組成物の治療的に有効な量は、とりわけ投与スケジュール、組成物が他の治療薬剤と併用して投与されるか否か、受容者の状況および健康状態、並びに当該組成物の治療活性に左右されることは当業者には明白であろう。
いずれの参考文献も(本明細書に引用された非特許文書または特許文書を含む)従来技術を構成するということを容認するものではない。特に、特段の記載がなければ、本明細書におけるいずれの文書への言及も、これらの文書のいずれかが米国または任意の他の国における技術で共通の一般的知識の部分を形成するということを容認するものではないことは理解されるであろう。当該参考文献のいずれの考察もそれらの著者が主張するものを記述し、本出願人は、本明細書に引用された文書の一切の正確さおよび適切性に反駁する権利を留保する。特段の明白な指示がなければ、本明細書に引用された全ての参考文献は参照によってその全体が本明細書に含まれる。引用された参考文献で見出されるいずれかの定義および/または記載に何らかの相違が存在する場合には、本開示が優先するであろう。
文脈による特段の規定または指示がなければ、“a”、“an”および“the”という用語は“1つ以上”を意味する。例えば、“a protein”または“a RNA”は“1つ以上のタンパク質”または“1つ以上のRNA”とそれぞれ解釈されるべきである。
本明細書で用いられるように、“about(約)”、“approximately(概数で)”、“substantially(実質的には)”および“significantly(有意には)”は、当業者には理解され、さらにそれらが用いられる文脈に応じてある程度変動するであろう。前記用語が用いられる文脈を与えられた当業者にとって明らかではないこれらの用語が使用される場合、“about”および“approximately”は、該当用語のプラスまたはマイナス10%以下を意味し、さらに“substantially”および“significantly”は当該用語のプラスまたはマイナス>10%を意味するであろう。
以下の実施例は例示のみを意図し、本発明の範囲または添付の特許請求の範囲における制限として意図されない。
クロストリジウム・ヒストリチクムは、病毒因子(高度に活性なコラゲナーゼCol1G(クラスI)およびColH(クラスII)を含む)を分泌して、動物組織に侵入する。マルチドメインColGがそのタンデムコラーゲン結合ドメイン(CBD)を利用してそれ自身を不溶性コラーゲンに固着させた後、後に続く階層型基質の分解は進行性切断および原線維の再編を必要とする。本実験では、カルシウム結合CBDの構造が1.9Åの解像度で提示される(Rwork=15.0%;Rfree=19.6%)。CBDの擬似二回転編成は、ColGが55Å離れたコラーゲン分子間でくさびで留めて原線維の再編および進行性切断を強力に補助することを可能にするであろう。実際、前記は、タンデムCBD:コラーゲンの0.1:1から0.5:1の分子比でコラーゲン線維の形成を加速した。1:1以上の分子比では、タンデムCBDは原線維の形成を遅らせた。コラーゲン分子間に留め釘を取り付ける(toggle)ために、より堅固な結合のC-側CBDが結合を開始することができる(前記は、[(Pro-Hyp-Gly)10]3との1:1複合体を形成するタンデムCBDの小角X線散乱(SAXS)によって示された)。その後、より弱い結合のN-側CBDがうつ伏せのコラーゲン分子をしっかりとつかみ、もっとも堅固な既知の原線維結合を提供できる。タンデムCBDの立体配置変化はカルシウム依存性であり、サイズ排除クロマトグラフィーおよびSAXSで測定されたように3-6の範囲のpCaで協調性である。pCa>5では、タンデムCBDは、細菌からの分泌がより容易である伸長構造をとる。3より大きい宿主pCA2+では、結晶構造で観察されるコンパクトな構造が採用される。本明細書に記載する結合及び活性化様式は、部位指定薬剤デリバリーベヒクル開発の先導に役立つであろう。
使用略語:CBD、コラーゲン結合ドメイン;MALDI-TOF-MS、飛行時間質量分析のマトリックス支援レーザー脱離/イオン化時間;DLS、ダイナミック光散乱;SAXS、小角X線散乱。
ColG(s3a、s3b)およびColH(s3)のC-末端ドメインは約120アミノ酸から成るホモローグである。当該ドメインは可溶性のコラーゲン性ペプチドおよび不溶性のコラーゲン原線維と結合する。コラーゲン原線維との結合におけるそれらの役割は、その階層性構造破壊に不可欠である(Matsushita, Jung et al.1998, Matsushita, Koide et al.2001)。完全長ColGまたはColHからCBDを切詰めることは、コラーゲン原線維を分解するそれらの能力を無力化する。そのような酵素は可溶化コラーゲンまたは変性コラーゲン(ゼラチン)を分解できるだけである。変異誘導およびコラーゲン結合試験はs3bの結合表面をマッピングしたが、一方、NMRおよびSAXS試験は、s3bがミニコラーゲンのねじれ不足領域と単一方向で結合することを示した(Philominathan, Koide et al.2009, Philominathan, Koide et al.2012)。最近、高速原子間力顕微鏡法はリアルタイムでコラーゲンを破壊するColGの能力を示した(Watanabe-Nakayama, Itami et al.2016)。分解時に、ColGはC-末端からN-末端へコラーゲン原線維に沿って前進的に移動して原線維を破壊する。ColGもまた、より秩序が乱れたコラーゲン原線維領域を優先的に標的とした。秩序が乱れた領域へのColGの進行性および優先性について構造に関する洞察が記載されている。
細菌コラゲナーゼは、完全な触媒活性およびコラーゲン結合機能の両方でカルシウムを要求する。細菌コラゲナーゼの活性化は、リンカーとのCa2+の結合が引き金となるα-ヘリックスからβ-シートへのドメインの再編を必要とする(Wilson, Matsushita et al.2003, Philominathan, Matsushita et al.2009, Spiriti and van der Vaart 2010, Sides, Liyanage et al.2012, Bauer, Wilson et al.2013, Bauer, Janowska et al.2015)。完全長のapo-ColGは、Ca2+濃度が低い(0.2-0.3x10-6 M)細菌内部では比較的可撓性であって、酵素のより容易な分泌を可能にすると期待される(Wilson, Matsushita et al.2003)。分泌に際して、リンカーはECM中でCa2+(約1.2mM)とキレートして硬直した構造をとる。前記はColGについては示されていないが、SAXSおよび制限的タンパク質分解を用いて明示されたように、Ca2+のキレートは、完全長ColHがより可撓性の低いコンパクトな構造をとるために実際に引き金となる(Ohbayashi, Matsumoto et al.2013)。
生産、精製、結晶化および構造決定
C.ヒストリチクムから得られた個々のs3a、s3bとともにタンデムCBDを、以前に記載された方法を用いてグルタチオンS-トランスフェラーゼ(GST)-融合タンパク質として発現させた(Matsushita, Jung et al.1998)。タンデムCBDの結晶を成長させるために適切な初期条件を高処理スクリーン(Hampton Research Crystal Screen HT)によって確認した。当該初期条件を用い、その後の結晶化をハンギングドロップ法によって実施した。タンデムCBDの結晶(3mMカルシウム(21-26% PEG3350、HEPES pH 7.5、37℃)の存在下で入手)は斜方晶系であり(空間群、P212121)、以下の格子パラメータを有するa=51.5Å、b=54.7Å、c=92.0Å。結晶は37℃で24時間以内に成長したが、4、16および24℃では成長しなかった。結晶は温度感受性で、低温では耐えることができなかった。したがって、回折データは社内のX線施設において室温で1.9Åの解像度で収集し、Cu Kα照射でRigaku 007ジェネレーターを用いた。データセットはd*TREK(Pflugrath 1999)で処理した(表1)。構造は分子交換プログラムMolRep(CCP4パッケージ)で解析した。検索モデルとしてs3b(PDB code 2o8o)を用いた(Murshudov, Vagin et al.1997)。1個のタンデムCBDが非対称ユニットで見出された。したがってVMは2.5Å3/Daで、溶媒含有量は50%であった(Matthews 1968)。タンデムCBDの精錬はRefmac_6.1.13を用いて実施した(Murshudov, Vagin et al.1997)。各CBDがTLS群として作用する原子鎖を維持するためにTLS拘束を適用した。バビネットスケーリングをバルク溶媒精錬に用いた。Rfreeのモニターのためにデータの5%を取りおいた。MIFit(McRee 1999)を用いて、モデルを各精錬サイクル間で手動で調整した。代替立体配置をLys818、Glu945、Tyr970、およびArg1005のために構築した。Procheckプログラム(Laskowski, Macarthur et al.1993)を用いて得た最終構造のためのラマチャンドランプロットは、コア領域において残基の91%を、追加的に許容された領域において残基の9%を示したが、豊富に許容されたまたは非許容領域においては何も示さなかった。最終精錬統計は表1に示される。
a Rmeas=Σhkl {N(hkl)/N(hkl)-1}1/2 Σi|Ii(hkl) -<I(hkl)>| / Σ(hkl)ΣiIi(hkl)
b最高解像殻のデータは括弧内に示される
c精錬から排除された5%のデータ
小角X線散乱(SAXS)のために適切な緩衝条件は不連続ネイティブPAGEを用いて確認した。pCa分析のために、タンデムCBDを10mM HEPES-Na(pH 7.5)、100mM NaCl、および2%グリセロールに対して平衡化した。pCaは合計0.2mMのEGTAで維持し、pCa値を3、4、5および6にするためにCaCl2を添加した。与えられたpCaを得るために必要なCa2+の量はMAXCHELATORを用いて決定した(Bers, Patton et al.2010)。タンデムCBD:[(POG)10]3複合体分析のために、前記複合体を50mM HEPES-Na(pH 7.5)、100mM NaCl、および2mM CaCl2に対して平行化した。[(POG)10]3は5mM酢酸に7.5mg/mLの濃度で溶解し、4℃で24時間保存した。続いてペプチドをタンデムCBDと混合した。タンデムCBD対ミニ-コラーゲンのモル比は1:2であった。測定は各サンプルにつき3つの濃度シリーズで実施した。当該pCaシリーズについて、pCa 4および5および6で用いたタンデムCBDの濃度は1、3および5mg/mLであった。pCa 3では、用いた濃度シリーズは2、4および6mg/mLであった。[(POG)10]3との複合体では、用いた濃度シリーズは1、3および5mg/mLであった。全てのSAXSデータは、バークレーナショナルラブ(Berkley National Lab)のアドバーンスドライトソース(Advanced Light Source)で10℃で収集した(SIBYLSビームライン、12.3.1)。全てのデータ処理は、ATAS 2.6.1ソフトウェアパッケージのPrimusqtを用いて達成された。各pCaのCBDについて、凝集または検出器飽和によって影響を受けなかった濃度グラジエントから得られた暴露データを無限希釈まで外挿した。回転半径(Rg)、最大直径の決定とともに外挿データのアブイニショ形状再現は、Primusqtのダンミフ(dammif)機能を用いて実施された。各回の最後に計算されたχ値は、計算による散乱曲線と実験による散乱曲線との間の一致を示した。当該pCaシリーズで、各形状のχ値は0.8と1.2の間の範囲である。([POG]10)3との複合体では、χ値は0.8である。
コラーゲン分子の自家集合に対するタンデムCBD添加の影響は、37℃で450nmにおける光学密度の増加として濁度を測定することによってモニターされた。氷上で、2mg/mLのラットコラーゲン溶液を40mM HEPES緩衝液(pH7.5)(300mM NaCl、2mM CaCl2添加)で最終濃度0.5mg/mL(2.4μM)に希釈した。次の工程で、コラーゲン結合ドメインを以下のモル濃度比で添加した:0.1:1、0.2:1、0.3:1、0.5:1、1:1、2:1、3:1、5:1。濁度測定は96ウェルプレートで分光光度計Filter Max F5(Molecular Devices)を用いて1分間隔で実施した。濁度曲線から以下のパラメーターが概算された:遅滞期の終わりのtlag-時間、最大濁度、および最大原線維成長速度。
分析用サイズ排除クロマトグラフィー
サイズ排除クロマトグラフィーをHPLC系で室温で実施した。HPLC系には、記載のように0.5mL/分の流速でスーパーデックス75カラム(1x30cm(Pharmacia))が備えられた(Wilson, Matsushita et al.2003)。分子質量標準物質として以下のタンパク質を用いた:ウシ血清アルブミン(67.0kDa)、ニワトリオボアルブミン(43.0kDa)、およびリボヌクレアーゼA(13.7kDa(Pharmacia))。測定は三重に実施した。
コラーゲン性ペプチドとの結合の定量的分析
BIACORE装置(Biacore, Uppsala, Sweden)を用い表面プラズモン共鳴によって、多様なCBDタンパク質とコラーゲン性ペプチドとの結合を測定した。前記装置は、記載されたようにペプチド(Gly-(Pro-Hyp-Gly)12)を固定したセンサーチップ(CM5(Biacore))を有する(Wilson, Matsushita et al.2003)。
コラーゲン原線維結合アッセイ
3つのCBD(s3a、s3b、およびs3as3b)のコラーゲン線維に対する結合親和性を分析した。最初に、10mgのブタの皮膚線維(Nippi,Inc, Japan)を0.2nmのスピンカラムに入れ、200mM NaClおよび5mM CaCl2を補充した50mM Tris-HCl(pH7.5)で洗浄した。続いて、0.5mg/mLのBSA(内部コントロール)および種々の濃度(2.5から20mg/mL)のタンデムCBDを含むタンパク質混合物20μL(上記緩衝液で平衡化されている)を加え、線維と十分に混合した。室温で30分間インキュベートした後、未結合のタンデムCBDを含む上清を収集し、SDS-PAGEを用いて定量した。この工程のために、等体積の未使用タンパク質混合物をコントロールとして用いた。電気泳動後に、クーマシーブリリアントブルーR-250でタンパク質を染色し、タンパク質の相対量をImageJソフトウェア(バージョン1.4.2;National Institutes of Health)によって概算した。これらの概算を基準にして、各CBDについて検定曲線を作成し、前記を用いて各上清のCBD量を定量した。三重にアッセイすることによって得られた結果をスキャチャードプロットで分析し、各CBDについて解離定数(Kd)および結合部位の数(Bmax)を得た。
タンデムCBDの構造の説明
s3aおよびs3bから成るタンデムCBDの結晶構造は1.9Åの解像度で解析された。s3bセグメントは以前に記載されているが、s3aセグメントは本論文で初めて記載される。s3aおよびs3bはともに、非常に類似するβ-サンドイッチ‘ジェリー-ロール’(10個のβ-鎖を含む)を採用する。これらCBDは、塩架橋および水素結合相互作用によって安定化される擬似二回転対照によって関係する。擬似対称軸(図1Bでページの面に対して垂直である)は、タンデムCBDのコラーゲン結合ポケットを55Å離れるように配置する。各ドメインは2つのCa2+をキレートし、すなわち、記載されたように一方のCa2+は双五角錐構造で結合し、他方は反四角柱構造で結合する(Bauer, Wilson et al.2013)。電子密度は、Glu792とPro793との間のプロピル-cis-ペプチド結合、およびGlu899とAsn992との間の非プロピル-cis-ペプチド結合の観察を可能にした。110の等価Cα原子を土台にするオーバーレイは、s3aおよびs3bは0.9Åのr.m.s.d.を共有し、ループでのみ顕著に逸脱する(1.1-2.5Åのr.m.s.d)ことを示す。両CBDのループは最高のB-因子値を示し、一方、β-シート残基は低いβ-因子値を示した。予想されるとおり、Ca2+と相互作用する残基のB-因子値はとりわけ最低である。s3aの平均温度因子は結晶充填のためにs3bよりも低い。holo-s3b(PDBコード4HPK)の以前に報告された構造では、プロテアーゼ感受性で高度に活動的なループ960-968は観察されなかった(Philominathan, Koide et al.2009, Sides, Liyanage et al.2012, Bauer, Wilson et al.2013)。ここに提示する構造では、このループの動力学は結晶充填接触によって抑制される。その他の点では、単独s3bおよびタンデムCBD中のs3bは互いに実質的に同一である(Cα r.m.s.d.0.6Å)。
細菌と宿主のECM内部のCa2+濃度の相違は、宿主中に細菌のコラゲナーゼを効率的に分泌するために利用できよう。クロストリジウムの細胞内Ca2+濃度は、大腸菌(Escherichia coli)のそれ(0.2-0.3x10-6M)とおそらく類似し(Holland, Jones et al.1999)、前記濃度はCa2+に対するタンデムCBDの見かけのKdより十分に低い(図2A)。しかしながら、細胞外組織液は約1.2mMの濃度でCa2+を含む(Maurer and Hohenester, 1997)。サイズ排除クロマトグラフィーでモニターすれば、s3a-s3bのドメイン再オリエンテーションはCa2+によって誘発される協調的事象であり、SAXSデータはこの構造的変化の大きさを裏付けた(図2B)。5以下のpCa(10μM)では、SAXSで演繹されるタンデムCBDのエンベロープは棒状形をとる(図2B)。エンベロープの隆起は、SAXSでα-ヘリックスリンカーが出現する態様に類似する(Sides, Liyanage et al.2012)。pCa=6では、s3bのβ-鎖A’もまた展開してリンカーの活動性を大きく増加させる(Sides, Liyanage et al.2012)。Ca2+濃度を増加させるとき、タンデムCBDは着実によりコンパクトな形状をとる(図2B)。pCa=4(100μM)では、形状は結晶構造に類似するが、ただしs3aのリンカーが活動性を維持していることを示唆するでっぱりを例外とする。pCa=3(1mM)では、形状はタンデムCBDの結晶構造と良好に一致する。SAXS演繹エンベロープでモデル化されたドメイン再編は、12残基長のリンカーを有するs3bで実施された観察と一致する。s3aとs3bとの間のリンカーは、α-ヘリックスからβ-シートへの二次構造形質転換を経ることが示され、これはCa2+結合によって誘発され、ドメイン間のより堅固な接触をもたらす(Wilson, Matsushita et al.2003, Sides, Liyanage et al.2012)。s3bのβ-鎖A’は展開してリンカーの活動性を大きく増加させる(Sides, Liyanage et al.2012)。自由エネルギーシミュレーションは、カルシウムイオンはcis-ペプチド結合を熱力学的に安定化させるだけでなく、その形成もまた触媒することを示した(Spiriti and van der Vaart 2010)。カルシウム依存構造変化は、サイズ排除クロマトグラフィーおよびSAXSによって完全長ColHについてモニターされた(Ohbayashi, Matsumoto et al.2013)。タンデムCBDについての発見を拡大すれば、完全長ColGおよびColHもまたCa2+誘発ドメイン再編を経ることはありそうなことである。細菌内の活動的ColGおよびColHは急速な分泌を可能にし宿主に最大の損傷を誘発する。
我々の結果は、タンデムCBDとコラーゲン原線維またはミニコラーゲンとの間の固有の相互作用を示唆する。コラーゲン原線維は、三重ヘリックス状トロポコラーゲンのジグザグ配列によって構築され、前記は水に不溶性である。一方、合成コラーゲン性ペプチドまたはミニコラーゲン(自然のままのトロポコラーゲンの構造を模倣し水溶性である)は、個々のコラーゲン-タンパク質相互作用の研究に用いられてきた。ミニコラーゲンの使用はまたCBD-コラーゲン相互作用の定量的分析を可能にする。Kd値が不溶性コラーゲン原線維およびミニコラーゲンに対して多様な形態のCBDについて評価され、それらは良好な一致を見た(Matsushita, Koide et al.2001)。タンデムCBDは、被検CBDの中で最も堅固に(約~のKd)、さらにs3aの合計またはs3b単独よりもはるかに堅固に(約100μMのKd)コラーゲン原線維と結合する。しかしながら、タンデムCBDは、s3bと同じ堅固さでのみミニコラーゲンと結合する。タンデムCBDは、固定されたミニコラーゲン密度が高いとき協調的な結合を示す。タンデムCBD:ミニコラーゲンにおけるSAXSの結果はまた1:1複合体を提示した。ミニコラーゲンに対しs3aおよびs3bの結合親和性が与えられるならば、タンデムCBDのs3bセグメントは、[(POG)10]3のC-末端と単一方向で結合し(Philominathan, Koide et al.2009, Philominathan, Koide et al.2012, Bauer, Wilson et al.2013)、したがって前記はそのようなものとしてエンベロープでモデル化された(図2B)。
S3aはs3bよりも低い堅固さでコラーゲンと結合し、おそらくs3aが保存チロシン残基の1つを失っているというのがその理由であろう。CBD配列をアラインメントしたとき、3つのTyr残基(s3bの970、994および996)は良好に保存され、これら残基のいずれかの変異導入はミニコラーゲンとの結合を低下させた(Wilson, Matsushita et al.2003)。代わってタンデムCBDの配列をアラインメントしたとき、N-側CBDとC-側CBDの相違が浮かび上がった。N-側CBDではTyr996の等価物は良好には保存されなかったが、C-側CBDでは3つ全てのTyr残基が良好に保存された(図2B、図5)。s3aもまた保存されたTyr970等価物を欠き、代わってSer851がその位置を占めた。s3aの近傍のHis848がこの残基近くのほぼ同じ空間を占め、より低い程度ながらその役割を満たすことができた。CBDの遺伝子重複は、明らかに、原線維の表面でこのドメイン型が動けなくなるのを防ぐために877位の機能的重要性を低下させることを必要とした。CBDドメインは余分のβ-鎖(β-鎖A’)およびドメイン間相互作用によって位置決めされる。β-鎖A’はs3aおよびs3bの両方に存在するが、それはs3には存在せず、したがって複数のCBDを有するコラゲナーゼにとっては特異である。余分のβ-鎖は非保存側鎖相互作用によって安定化され、このことは遺伝子重複は比較的最近の事象であったことを示唆する。
CBDとミニコラーゲンの観察された1:1複合体は、より強いs3b結合が結合を開始させることを示す。この提唱メカニズムは、タンデムCBDがs3b単独とちょうど同じ堅固さでミニコラーゲンと結合するという観察によって支持される。それにもかかわらず、タンデムCBDはs3b単独よりも堅固にコラーゲン原線維と結合する(Toyoshima, Matsushita et al.2001)。s3bは結合を開始させ中心的な役割を果たすが、s3aは、55Å離れたコラーゲン分子間で生じる間隙への挿入で補助的であるがなお中枢的役割を果たす。CBDは並んで横たわって1つのトロポコラーゲン分子と結合し得ると提唱されたが(Eckhard and Brandstetter 2011)、我々の構造はこの態様の可能性は低いことを示唆する。
ColGとは異なり、ColHは2つのPKD様ドメイン(s2aおよびs2b)を有し、ただ1つのCBD(s3)のみを有する。それ自体コラーゲン結合物質ではないが、s2bはコラーゲンに対するs3の親和性を強化する(Matsushita, Jung et al.1998)。s3aはコラーゲン結合物質であるが、s3aは弱い相互作用の供給源とし機能することによってs2bと同様に働くことができる。前記相互作用は、当該セグメントが、全体的なより堅固なコラーゲン結合部位に寄与するとともに日和見的結合部位を求めて単一トロポコラーゲンをスキャンすることを可能にする。タンデムPKDおよびタンデムCBDセグメントの開発は、ColGおよびColHがコラーゲン線維中の種々のニッチを潜在的に探索することを可能にした。
擬似二回転対称は当該分子の向かい合う末端のコラーゲン結合表面の向きを定め、タンデムCBDが同方向の向きを有する2つのコラーゲン分子と結合することを可能にする(図1B)。コラーゲンは、450nmにおける吸収の変化によってモニターすることができるプロセスで自家集合してコラーゲン原線維を形成する。コラーゲン結合分子(例えばs3b)はコラーゲンと結合し、原線維形成を遅らせる(Okano-Kosugi, Matsushita et al.2009)。しかしながら、タンデムCBDは、2つのコラーゲン分子間でそれ自体をくさびで留めることができるように見えるので、原線維の自家集合を促進するその能力を試験した。コラーゲン原線維形成におけるタンデムCBDの影響を究明するために、タンデムCBDとコラーゲンの混合物の濁度をモニターした(図3)。注目すべきことには、タンデムCBD対コラーゲンの比は、線維形成前の遅滞期時間に著しい影響を有する。タンデムCBDが存在しないとき(コントロール)、原線維形成の遅滞期時間は19分で、以前の観察と一致する(Okano-Kosugi, Matsushita et al.2009)。タンデムCBD:コラーゲン比が0.1:1では、遅滞期時間は15分に減少する。タンデムCBDの濃度がコラーゲンの割合と比較して相対的に高いとき、遅滞期時間は増加する。タンデムCBD:コラーゲン比が5:1では、遅滞期時間は31分である。CBDの割合が低い場合の原線維成長は、タンデムCBDの割合が高いサンプル(吸収は0.005であった)と比較してはるかに高い0.0217の吸収をもたらす。遅滞期時間に対する影響はコラーゲン原線維の厚さに反比例した。タンデムCBD:コラーゲンの0.1:1および0.2:1の混合物は、コラーゲン原線維コントロールよりも約14%厚い原線維をもたらす。5:1比では、厚さはコントロールよりも2%低い。低濃度では、タンデムCBDはコラーゲンアラインメントを助け、したがってコラーゲン自家集合のための核の形成を促進する。CBD対コラーゲンのこの2つの比の範囲の自家集合に対する外見的に反対の影響は、最近明らかにされたように(Watanabe-Nakayama, Itami et al.2016)、どのようにしてColGが集合を解除しコラーゲン原線維を破壊するかを理解するための重要な手掛かりを提供することができる。
高速原子間力顕微鏡法によってリアルタイムでモニターされたColGによるコラーゲン原線維の加水分解は以下を明らかにした:(1)原線維間におけるコラーゲン分子の相互作用はコラゲナーゼ分子の嵌合を防ぐ;(2)ColGにさらされるとき、コラーゲン分子は他の原線維上で再編される;(3)無秩序なD-周期性はコラーゲン原線維をColGによる分解に感受性にする;(4)ColGはC-末端からN-末端に前進的に移動する;(5)パス(pass)毎に、ColGはコラーゲン原線維の厚さを均等にトリミングする。タンデムCBDの構造はColGの作用に何らかの手掛かりを与える。
ドメインの向き合う面における割目の場所が与えられるならば、我々は以下のコラーゲン結合様式を提案する:(i)タンデムCBDは線維間の間隙をくさびで留める(図4B);(ii)タンデムCBDは損傷または再形成コラーゲン線維で見出される割目をくさびで留める(図4C)。線維間の間隙に留め釘を取り付けるために必要な努力はあたかもColGが引き止められているかのように見えるかもしれない。原線維形成を促進するタンデムCBDの能力は、どのようにColGがコラーゲン原線維を再編したかを説明することができた。コラーゲン原線維のD-周期性の機械的破壊はColG結合のためのポケットを導入することができる。原線維が最外側のトロポコラーゲンを除去することによって損傷されるならば、CBDは露出したトロポコラーゲン間でそれ自体をくさびで留めることができよう。そのような作用は、タンデムCBDを用いて損傷コラーゲンに薬剤を標的誘導し得るという興味深い可能性を生じる。また別には、タンデムCBDは2つの原線維間をくさびで留めることができるかもしれない。1つの原線維から別の原線維までの表面対表面距離の中央値は皮膚では約3.2nmである(Kuwaba, Kobayashi et al.2001)。皮膚の線維間間隙のほぼ15%が約6nmの大きさであるはずである。これらの結果は、タンデムCBDは損傷組織へ薬剤を付着させるために有用であり得ることを示唆する。いったんコラーゲン分子間をくさびで留めたら、ColGのC-末端からN-末端への前進性移動はおそらくコラゲナーゼモジュールによって駆動され、したがって均等にトリミングされたコラーゲン原線維が生成される(Eckhard and Brandstetter 2011, Eckhard, Schonauer et al.2011)。
細菌のタンデムコラーゲン結合ドメインの高解像構造が初めて報告される。CBDの擬似対称性編成(遺伝子重複および融合から生じる)は、CBDがコラーゲン原線維の固有のニッチェを認識してコラーゲンの分解を促進することを可能にできよう。タンデムCBDの構造は、それが同方向の向きを有するコラーゲン分子間をくさびで留める得ることを示す。前記構造は、以前に確認されたコラーゲンのねじれ不足領域に対するCBDの優先性と一緒になって、タンデムCBDはコラーゲン原線維の損傷領域にColGを誘導することを示唆する。そのような標的誘導はまた、タンデムCBDが損傷部位に薬剤を堅固に付着させる新規な薬剤標的誘導の道を開く。
An, B., Y.S.Lin and B.Brodsky (2015)."Collagen interactions: Drug design and delivery." Adv Drug Deliv Rev.
Bauer, R., K.Janowska, K.Taylor, B.Jordan, S.Gann, T.Janowski, E.C.Latimer, O.Matsushita and J.Sakon (2015)."Structures of three polycystic kidney disease-like domains from Clostridium histolyticum collagenases ColG and ColH." Acta Crystallogr D Biol Crystallogr 71(Pt 3): 565-577.
Bauer, R., J.J.Wilson, S.T.L.Philominathan, D.Davis, O.Matsushita and J.Sakon (2013)."Structural Comparison of ColH and ColG Collagen-Binding Domains from Clostridium histolyticum." Journal of Bacteriology 195(2): 318-327.
Bers, D.M., C.W.Patton and R.Nuccitelli (2010)."A Practical Guide to the Preparation of Ca2+ a Buffers." Calcium in Living Cells 99: 1-26.
Duarte, A.S., A.Correia and A.C.Esteves (2014)."Bacterial collagenases - A review." Crit Rev Microbiol.
Eckhard, U.and H.Brandstetter (2011)."Polycystic kidney disease-like domains of clostridial collagenases and their role in collagen recruitment." Biol Chem 392(11): 1039-1045.
Eckhard, U., E.Schonauer, D.Nuss and H.Brandstetter (2011)."Structure of collagenase G reveals a chew-and-digest mechanism of bacterial collagenolysis." Nat Struct Mol Biol 18(10): 1109-1114.
Fields, G.B.(2013)."Interstitial collagen catabolism." J Biol Chem 288(13): 8785-8793.
Fujimaki, H., G.Inoue, K.Uchida, M.Miyagi, W.Saito, A.Sato and M.Takaso (2015)."Elevation of Microglial Basic Fibroblast Growth Factor Contributes to Development of Neuropathic Pain after Spinal Nerve Ligation in Rats." Spine (Phila Pa 1976).
Gaston, R.G., S.E.Larsen, G.M.Pess, S.Coleman, B.Dean, B.M.Cohen, G.J.Kaufman, J.P.Tursi and L.C.Hurst (2015)."The Efficacy and Safety of Concurrent Collagenase Clostridium Histolyticum Injections for 2 Dupuytren Contractures in the Same Hand: A Prospective, Multicenter Study." J Hand Surg Am 40(10): 1963-1971.
Holland, I.B., H.E.Jones, A.K.Campbell and A.Jacq (1999)."An assessment of the role of intracellular free Ca2+ in E.coli." Biochimie 81(8-9): 901-907.
Katikaneni, R., T.Ponnapakkam, O.Matsushita, J.Sakon and R.Gensure (2014)."Treatment and prevention of chemotherapy-induced alopecia with PTH-CBD, a collagen-targeted parathyroid hormone analog, in a non-depilated mouse model." Anticancer Drugs 25(1): 30-38.
Katikaneni, R., T.Ponnapakkam, A.Seymour, J.Sakon and R.Gensure (2014)."Parathyroid hormone linked to a collagen binding domain promotes hair growth in a mouse model of chemotherapy-induced alopecia in a dose-dependent manner." Anticancer Drugs 25(7): 819-825.
Katikaneni, R., T.Ponnapakkam, H.Suda, S.Miyata, J.Sakon, O.Matsushita and R.C.Gensure (2012)."Treatment for chemotherapy-induced alopecia in mice using parathyroid hormone agonists and antagonists linked to a collagen binding domain." Int J Cancer 131(5): E813-821.
Katikaneni, R., A.W.Seymour, R.Gulati, T.Ponnapakkam and R.C.Gensure (2015)."Therapy for Alopecia Areata in Mice by Stimulating the Hair Cycle with Parathyroid Hormone Agonists Linked to a Collagen-Binding Domain." J Investig Dermatol Symp Proc 17(2): 13-15.
Kuwaba, K., M.Kobayashi, Y.Nomura, S.Irie and Y.Koyama (2001)."Elongated dermatan sulphate in post-inflammatory healing skin distributes among collagen fibrils separated by enlarged interfibrillar gaps." Biochem J 358(Pt 1): 157-163.
Laskowski, R.A., M.W.Macarthur, D.S.Moss and J.M.Thornton (1993)."Procheck - a Program to Check the Stereochemical Quality of Protein Structures." Journal of Applied Crystallography 26: 283-291.
Lawson, P.A.and F.A.Rainey (2015)."Proposal to restrict the genus Clostridium (Prazmowski) to Clostridium butyricum and related species." Int J Syst Evol Microbiol.
Matsushita, O., C.M.Jung, J.Minami, S.Katayama, N.Nishi and A.Okabe (1998)."A study of the collagen-binding domain of a 116-kDa Clostridium histolyticum collagenase." J Biol Chem 273(6): 3643-3648.
Matsushita, O., T.Koide, R.Kobayashi, K.Nagata and A.Okabe (2001)."Substrate recognition by the collagen-binding domain of Clostridium histolyticum class I collagenase." J Biol Chem 276(12): 8761-8770.
Matthews, B.W.(1968)."Solvent content of protein crystals." J Mol Biol 33(2): 491-497.
McCarthy, R.C., A.G.Breite, M.L.Green and F.E.Dwulet (2011)."Tissue dissociation enzymes for isolating human islets for transplantation: factors to consider in setting enzyme acceptance criteria." Transplantation 91(2): 137-145.
McRee, D.E.(1999)."XtalView/Xfit--A versatile program for manipulating atomic coordinates and electron density." J Struct Biol 125(2-3): 156-165.
Murshudov, G.N., A.A.Vagin and E.J.Dodson (1997)."Refinement of macromolecular structures by the maximum-likelihood method." Acta Crystallogr D Biol Crystallogr 53(Pt 3): 240-255.
Nishi, N., O.Matsushita, K.Yuube, H.Miyanaka, A.Okabe and F.Wada (1998)."Collagen-binding growth factors: production and characterization of functional fusion proteins having a collagen-binding domain." Proc Natl Acad Sci U S A 95(12): 7018-7023.
Ohbayashi, N., T.Matsumoto, H.Shima, M.Goto, K.Watanabe, A.Yamano, Y.Katoh, K.Igarashi, Y.Yamagata and K.Murayama (2013)."Solution structure of clostridial collagenase h and its calcium-dependent global conformation change." Biophys J 104(7): 1538-1545.
Okano-Kosugi, H., O.Matsushita, S.Asada, A.B.Herr, K.Kitagawa and T.Koide (2009)."Development of a high-throughput screening system for the compounds that inhibit collagen-protein interactions." Anal Biochem 394(1): 125-131.
Pflugrath, J.W.(1999)."The finer things in X-ray diffraction data collection." Acta Crystallogr D Biol Crystallogr 55(Pt 10): 1718-1725.
Philominathan, S.T., O.Matsushita, R.Gensure and J.Sakon (2009)."Ca2+-induced linker transformation leads to a compact and rigid collagen-binding domain of Clostridium histolyticum collagenase." FEBS J 276(13): 3589-3601.
Philominathan, S.T.L., T.Koide, K.Hamada, H.Yasui, S.Seifert, O.Matsushita and J.Sakon (2009)."Unidirectional Binding of Clostridial Collagenase to Triple Helical Substrates." Journal of Biological Chemistry 284(16): 10868-10876.
Philominathan, S.T.L., T.Koide, O.Matsushita and J.Sakon (2012)."Bacterial collagen-binding domain targets undertwisted regions of collagen." Protein Science 21(10): 1554-1565.
Ponnapakkam, T., R.Katikaneni, E.Miller, A.Ponnapakkam, S.Hirofumi, S.Miyata, L.J.Suva, J.Sakon, O.Matsushita and R.C.Gensure (2011)."Monthly administration of a novel PTH-collagen binding domain fusion protein is anabolic in mice." Calcif Tissue Int 88(6): 511-520.
Ponnapakkam, T., R.Katikaneni, T.Nichols, G.Tobin, J.Sakon, O.Matsushita and R.C.Gensure (2011)."Prevention of chemotherapy-induced osteoporosis by cyclophosphamide with a long-acting form of parathyroid hormone." J Endocrinol Invest 34(11): e392-397.
Ponnapakkam, T., R.Katikaneni, H.Suda, S.Miyata, O.Matsushita, J.Sakon and R.C.Gensure (2012)."A single injection of the anabolic bone agent, parathyroid hormone-collagen binding domain (PTH-CBD), results in sustained increases in bone mineral density for up to 12 months in normal female mice." Calcif Tissue Int 91(3): 196-203.
Saito, W., K.Uchida, O.Matsushita, G.Inoue, H.Sekiguchi, J.Aikawa, H.Fujimaki and M.Takaso (2015)."Acceleration of callus formation during fracture healing using basic fibroblast growth factor-kidney disease domain-collagen-binding domain fusion protein combined with allogenic demineralized bone powder." J Orthop Surg Res 10: 59.
Sides, C.R., R.Liyanage, J.O.Lay, S.T.L.Philominathan, O.Matsushita and J.Sakon (2012)."Probing the 3-D Structure, Dynamics, and Stability of Bacterial Collagenase Collagen Binding Domain (apo- versus holo-) by Limited Proteolysis MALDI-TOF MS." Journal of the American Society for Mass Spectrometry 23(3): 505-519.
Spiriti, J.and A.van der Vaart (2010)."Mechanism of the calcium-induced trans-cis isomerization of a non-prolyl peptide bond in Clostridium histolyticum collagenase." Biochemistry 49(25): 5314-5320.
Stratford, R., Jr., C.Vu, J.Sakon, R.Katikaneni, R.Gensure and T.Ponnapakkam (2014)."Pharmacokinetics in rats of a long-acting human parathyroid hormone-collagen binding domain peptide construct." J Pharm Sci 103(2): 768-775.
Toyoshima, T., O.Matsushita, J.Minami, N.Nishi, A.Okabe and T.Itano (2001)."Collagen-binding domain of a Clostridium histolyticum collagenase exhibits a broad substrate spectrum both in vitro and in vivo." Connect Tissue Res 42(4): 281-290.
Uchida, K., O.Matsushita, N.Nishi, G.Inoue, K.Horikawa and M.Takaso (2015)."Enhancement of periosteal bone formation by basic fibroblast-derived growth factor containing polycystic kidney disease and collagen-binding domains from Clostridium histolyticum collagenase." J Tissue Eng Regen Med.
Watanabe-Nakayama, T., M.Itami, N.Kodera, T.Ando and H.Konno (2016)."High-speed atomic force microscopy reveals strongly polarized movement of clostridial collagenase along collagen fibrils." Sci Rep 6: 28975.
Wilson, J.J., O.Matsushita, A.Okabe and J.Sakon (2003)."A bacterial collagen-binding domain with novel calcium-binding motif controls domain orientation." Embo Journal 22(8): 1743-1752.
骨折部位における組換え塩基性線維芽細胞増殖因子(bFGF)の保持の増加は、骨折治癒時の骨形成を加速させる。我々は、以前にbFGF並びに多発性嚢胞腎ドメイン(PKD;s2b)およびクロストリジウム・ヒストリチクムクラスIIコラゲナーゼ(ColH)由来コラーゲン結合ドメイン(CBD;s3)から成る融合タンパク質を構築し、融合タンパク質とコラーゲン様ペプチド、ポリ(Pro-Hyp-Gly)10(配列番号:59)の組合せが、骨折部位で間葉系細胞の分裂増殖および仮骨形成を誘発することを報告した。C.クロストリジウムはまた、クラスIコラゲナーゼ(ColG)(C-末端にタンデムCBD(s3aおよびs3b)を有する)を産生することが知られている。まず初めに、我々は、コラゲナーゼペプチド(H-Gly-Pro-Arg-Gly-(Pro-Hyp-Gly)12-NH2(配列番号:60))に対する2つのクロストリジウムコラゲナーゼに由来する4つのコラーゲンアンカーの結合親和性を、表面プラズモン共鳴によって調べ、タンデムCBD(s3a-s3b)がコラーゲン性ペプチドに対して最も高い親和性を有することを明らかにした。続いて、我々は、bFGFおよび単一CBD(bFGF-s3b)またはタンデムCBD(bFGF-s3a-s3b)から成る融合タンパク質を構築して、それらの生物学的能力を以前の融合構築物(bFGF-s2b-s3)の能力と比較した。骨折モデルによる試験は、bFGF-s3a-s3bが間葉系細胞の分裂増殖および骨形成を誘発するために最も高い能力を提示することを示した。総合すれば、より高いコラーゲン結合親和性を有するコラーゲンアンカーは、bFGFがより高い生物学的活性を示すように働く。したがって、ポリ(Pro-Hyp-Gly)10/bFGF-(CBD)2複合物は、当該臨床環境で骨の骨折治癒を促進する潜在能力を有するように思われる。
塩基性線維芽細胞増殖因子(bFGF)は血管形成特性を有する有糸分裂促進タンパク質であり、初期骨修復時の骨再形成に必要とされる(1;2)。組換えヒトbFGFは、骨粗しょう症の動物モデルで骨の骨折および欠損の再生に有効性を示した(3;4)。最近の2つの臨床試験で、bFGFによる治療は、骨切り術および脛骨骨折部位における骨癒合を加速させた(5;6)。これらの試験の所見はbFGFが骨の再形成および再生を促進することを強く示すが、外因的に添加されたbFGFは骨欠損部位から急速に拡散する。
クロストリジウム・ヒストリチクム(病理学的ガス壊疽菌)は、2つのクラスのコラゲナーゼ(クラスI、ColGおよびクラスII、ColH)を分泌する。これらの酵素は一般的には触媒ドメイン(s1)、多発性嚢胞腎ドメイン(PKD、s2(配列番号:61))およびコラーゲン結合ドメイン(CBD、s3)を含む。しかしながら、C-末端のコラーゲンアンカーのPKDおよびCBDのコピー数はColGとColHで相違し、それぞれs2-s3a-s3bおよびs2a-s2b-s3である(7;8)。我々は以前に、bFGFおよびColH由来CBD(bFGF-s3)またはPKD-CBD(bFGF-s2b-s3)から成る融合タンパク質は、コラーゲンシートにローディングしたとき自然のままのbFGFと比較してラットの大腿骨で骨形成を加速することを示した(9)。高密度コラーゲンシートと一緒にしたとき、bFGF-s2b-s3は骨形成をbFGF-s3よりも強く促進した(10)。bFGF-s2b-s3をコラーゲン様ペプチドポリ(Pro-Hyp-Gly)10(配列番号:59)と一緒にしたときもまた、マウスの骨の骨折モデルでbFGF単独と比較してより強く骨形成が誘発された(11)。より最近の研究では、ガレクチンおよびColG由来タンデムCBD(s3aおよびs3b)から成る融合タンパク質は、ColH由来PKDおよびCBD(S2bおよびs3)と融合させた対応するタンパク質よりも高いコラーゲン結合活性を示した(12)。これらの発見に基づいて、我々は、ColGのタンデムCBDを含むbFGF融合タンパク質は、コラーゲン結合活性の強化により骨折部位でのbFGFの保持を増大させ、改善された骨形成および骨折修復をもたらすであろうと推測した。
そこで、我々は、多様なコラーゲンアンカーとミニコラーゲンとの間の解離定数をin vitroで評価した。それら結果にしたがって、我々は、bFGFおよびColG由来の単一CBD(bFGF-s3b)またはタンデムCBD(bFGF-s3a-s3b)から成る融合タンパク質を構築し、これら融合タンパク質の骨形成能力を以前に構築した2つの融合タンパク質(bFGFおよびColH由来コラーゲンアンカーから成る)とともに調べた。
ミニコラーゲンペプチドおよびコラーゲン様ポリペプチド
ミニコラーゲンペプチド、H-Gly-Pro-Arg-Gly-(Pro-Hyp-Gly)12-NH2(配列番号:60)を、Rink-アミド樹脂(Novabiochem, San Diego, CA)上でN-(9-フルオレニル)メトキシカルボニル(Fmoc)-系方法によって合成した。各サイクルで、Fmoc-アミノ酸(5当量(Novabiochem))をN,N'-ジイソプロピルカルボジイミド(5当量(Wako Pure Chemical, Osaka, Japan))およびN,N-ジメチルホルムアミド中の1-ヒドロキシベンゾトリアゾール(5当量(Wako Pure Chemical))の存在下で90分間反応させた。Fmoc脱保護はDMF中の20%(v/v)ピペリジンによって20分間実施した。ペプチド切断および脱保護工程は、標準的なトリフルオロ酢酸(TFA)スカベンジャーカクテル(TFA:m-クレゾール:チオアニゾール:水:エタンジチオール、82.5:5:5:5:2.5(v/v))を用いる処理によって室温で4時間実施した。ペプチドはHPLCによって精製し、HPLCは、Cosmosil 5C18-AR-IIカラム(20x250mm(Nacalai Tesque, Kyoto, Japan))でCH3CN水を用いて実施した(両方とも0.05%(v/v)TFAを含む)。生成物の純度はRP-HPLCで確認し、前記HPLCは、Cosmosil 5C18-AR-IIカラム(4.6x250mm(Nacalai Tesque))でCH3CN水のリニアグラジエントを用いて実施した(両方とも0.05%(v/v)TFAを含む)。質量分光分析はBruker Autoflex III MALDI-TOF MS(Bruker Daltonics, Leipzig, Germany)を用いて実施した。H-Gly-Pro-Arg-Gly-(Pro-Hyp-Gly)12-NH2(配列番号:60):C159H232N44O52([M+H]+)についてのMS(MALDI-TOF)m/z計算値は3590.7で実験値は3590.6であった。H-Gly-Pro-Arg-Gly-(Pro-Hyp-Gly)12-NH2(配列番号:60)のHPLCプロフィールは図11に示される。コラーゲン様ポリペプチド、ポリ(Pro-Hyp-Gly)10(配列番号:59)は業者(PHG Co., Ltd., Hyogo, Japan)から入手した(13)。
クロストリジウムコラゲナーゼ、ColGおよびColHに由来するコラーゲンアンカー
C.クロストリジウムクラスIIコラゲナーゼColHに由来するCBD(s3)およびPKD-CBD(s2b-s3)を以前に記載されたように精製した(14)。C.クロストリジウムクラスIコラゲナーゼColGに由来するCBD(s3b)およびCBD-CBD(s3a-s3b)を以前に記載されたように精製した(17)。
コラーゲン性ペプチドとのコラーゲンアンカーの結合の定量的分析
ミニコラーゲンペプチドとのコラーゲンアンカーの結合を、BIACORE装置(Biacore, Uppsala, Sweden)を用い以前に報告された態様と同じ態様で表面プラズモン共鳴によって測定した(15)。簡単に記せば、ペプチドを0.1mg/mLの濃度で10mM酢酸ナトリウム(pH6.0)中で溶解し、製造業者が推奨する標準的なアミンカップリング手順を用いてCM5センサーチップ(Biacore)に共有結合により固定した。共鳴は、流速20μL/分で25℃で以下の溶液中で測定した:10mM HEPESナトリウム(pH7.4)、150mM NaCl、1mM CaCl2および0.005% Tween-20。各結合工程の後で、0.1 M HClの180-sパルスによりチップを再生させた。見かけの解離定数の値KD(app)を、最小二乗法により以下の等式に直接適合させて8つのタンパク質濃度(100nM-300μM)について平衡結合データから計算した:
cRU=cRUmaxx[タンパク質]/(KD+[タンパク質]) (Eq.1)
式中、cRUは、エタノールアミンで封鎖した偽共役フローセルを用いてバルク屈折インデックス誤差について修正した平衡応答であり、[タンパク質]は分析物の濃度であり、KDは解離定数である。
コラーゲン結合bFGF
4つのコラーゲン結合bFGF融合タンパク質(CB-bFGF)をこの試験に用いた(図6)。2つの融合タンパク質、bFGF-s3およびbFGF-s2b-s3を以前に記載したように調製した(10)(前記融合タンパク質はbFGFおよびColH由来のCBDまたはPKD-CBDから成る)。bFGF-s3b(ColG)を調製するために、発現プラスミドpCHG115のDNAをリンカー領域でBamHIおよびEcoRIで消化し、BglIIおよびEcoRIで前処理したhbFGF-コードDNAフラグメントに連結した(pCHG115 DNAはGSTとC-末端コラーゲン結合ドメイン(s3b(ColG))との間で融合タンパク質をコードする)。大腸菌DH5αを前記連結混合物で形質転換し、得られたプラスミド(pCHG115-hbFGF)のヌクレオチド配列をSangerの配列決定によって確認した。大腸菌BL21 CodonPlus RIL(Agilent Technologies, Santa Clara, CA)を前記プラスミドで形質転換しGST-bFGF-s3b融合タンパク質を発現させた。融合タンパク質を精製し、GST部分を以前に記載されたように切断した(10)。bFGFおよびColG由来のタンデムCBDから成る別の融合タンパク質(bFGF-s3a-s3b)を別の発現プラスミドpCHG112を用いて同じ態様で生成した。
以前に記載されたように(9)、骨膜を10週齢のウィスター(Wistar)ラットの遠位大腿骨から収集し、続いて0.2%のI型コラゲナーゼ(Wako Pure Chemical Industries, Ltd., Tokyo, Japan)により37℃で2時間消化した。消化サンプルを40μmフィルターに通して有核細胞の単一細胞懸濁物を得た。以下を含む6ウェル培養プレートに前記細胞懸濁物を1x104細胞/cm2で播種した:10%ウシ胎児血清、100U/mLペニシリンおよび100μg/mLストレプトマイシンを補充したα-最少必須培地(α-MEM)。プレートを5%CO2雰囲気下で37℃で7日間インキュベートし、続いて、0.25%トリプシンおよび1mM EDTAで5分間処理することによって0継代(P0)細胞をプレート表面から剥がした。細胞を収集し、96ウェルプレートに1.25x103細胞/ウェルで播種した。続いて、bFGF、bFGF-s3(ColH)、bFGF-s2b-s3(ColH)、bFGF-s3b(ColG)、またはbFGF-s3a-s3b(ColG)を含むα-MEMを前記培養上清に0(コントロール)、0.1、および10pMの濃度で添加した。処理2日後に、細胞の分裂増殖を評価した。評価に水溶性テトラゾリウム(WST)アッセイキット(Cell Count Reagent SF; Nacalai Tesque, Kyoto, Japan)を、製造業者のプロトコルおよび以前に記載の手順(9)にしたがって用いた。
骨折モデル
大腿骨骨折モデルを9週齢C57BL/6Jマウスを用いて作出した。マウスには標準的なげっ歯類用固形飼料(CRF-1(Oriental Yeast, Tokyo, Japan))を与え、管理された環境条件下(温度、23±2℃;湿度、55±10%;照明、12時間点灯/消灯サイクル)で、ニッポンチャールズリバーラボラトリーズ(Nippon Charles River Laboratories(Kanagawa, Japan))のセミバリアー系に収容した。まず初めに、無菌的条件下で左膝の膝蓋骨近傍の中央矢状面寄りに4mmの切開を作出した。顆内切痕にドリルで0.5mmの穴を開けた後、0.2mmのタングステンガイドワイヤーを髄内管に逆戻りに挿入し、ワイヤー鋸(直径0.22mm)を用い側方アプローチにより大腿骨切片を取り除いた。骨折を固定するために、ガイドワイヤーを除去した後でステンレススチールのネジ(直径0.5mm)を髄内管に挿入した。骨折作出後に直ちに以下を骨折部位に注入した:PBS(コントロール)、0.058nmoleのbFGF、bFGF-s3、bFGF-s2b-S3、bFGF-s3b、またはbFGF-s3a-s3bを含むポリ(Pro-Hyp-Gly)10(配列番号:59)(各処置でn=8)。bFGFの用量は以前の試験(11)の結果により決定した。全ての動物の処置は、北里大学動物倫理委員会のガイドラインにしたがった。
新しい骨の体積および骨の無機質含有量の定量
コントロールおよび処置領域における新しい骨の体積および骨の無機質含有量を定量するために、骨折処置から4週間後にサクリファイスしたマウスから大腿骨を取り出し、4%パラホルムアルデヒド中で48時間4℃で保存した。大腿骨をPBSに移し、inspeXio SMX-90CTマイクロフォーカスX線CT系(Shimadzu, Tokyo, Japan)を以下の設定で用いて画像化した:加速電圧、90kV;電流、110mA;ボクセルサイズ、20 lm/ピクセル;およびマトリックスサイズ、1024x1024。新しい骨の体積および骨の無機質含有量は、以前に記載されたように(14;16)、Tri-3D-Bon三次元(3D)画像分析ソフトウェア(Ratoc System Engineering, Tokyo, Japan)を用い、中央大腿骨(midfemur)の問題の10mm領域(500スライス)で全大腿骨のマイクロCT画像により定量した。骨の無機質含有量は、マイクロCT画像における各大腿骨サンプルの測定密度をヒドロキシアパタイト(HA)検定曲線のものと比較することによって概算した。前記検定曲線は、200、300、400、500、600、700および800mg HA/cm3を用いて調製されたファントム画像から作成されたデータをプロットすることによって構築された。新しい骨は300mg/cm3以上の閾値道度を有すると定義された。
組織学評価
骨形成におけるポリ(Pro-Hyp-Gly)10/bFGF-s3a-s3b(ColG)の影響を調べるために、骨折発生から14日後にコントロールおよび処置動物から大腿骨を摘出した。前記大腿骨サンプルを20%EDTA溶液で28日間脱無機質化し、続いて残余組織をパラフィンに包埋した。当該大腿骨を前額面で長軸に沿って切片(3μm)を作成し、得られた切片を形態学的分析のためにヘマトキシリンおよびエオシン(HE)で染色した。
統計分析
PBS(コントロール)、bFGF、bFGF-s3、bFGF-s2b-s3、bFGF-s3bおよびbFGF-s3a-s3bの間の相違を、フィッシャーの最小有意差(LSD)試験で一元配置分散分析用いて調べた。有意であるレベルをp<0.05と設定した。全ての統計分析をSPSSソフトウェア(バージョン19.0(SPSS Inc., Chicago, IL))を用いて実施した。
コラーゲンアンカーの結合親和性
4つのコラーゲンアンカーのミニコラーゲンペプチド、H-Gly-Pro-Arg-Gly-(Pro-Hyp-Gly)12-NH2(配列番号:60)に対する解離定数を表面プラズモン共鳴によって測定した(表2)。s2b-s3(PKD-CBD(ColH))は、s3単独(CBD(ColH))と比較してより低いKd値を示したが、s3b(CBD(ColG))およびs3a-s3b(CBD-CBD(ColG))の値は、ColHアンカーの値より約10倍低かった。ColG由来アンカーは、ColH由来アンカーよりも堅固にコラーゲン性ペプチドと結合すると予想できる。
表2に関して、アンカータンパク質はHBS-Ca緩衝液に1x10-7 Mから3x10-4 Mの範囲の濃度で溶解した。コラーゲン性ペプチド、H-Gly-Pro-Arg-Gly-(Pro-Hyp-Gly)12-NH2(配列番号:60)との結合は表面プラズモン共鳴によって測定した。データは、材料と方法のセクションに記載の等式に最小二乗法によって直接適合させ、見かけの解離定数(KD)および不確かさについて値を計算した。
融合タンパク質のin vitro生物学的活性
4つのCB-bFGFの生物学的活性を、ラット骨膜間葉系細胞のin vitro分裂増殖を測定することによって評価した(図7)。0.1pMのbFGF-s3a-s3b(ColG)で処理してから2日後に、培養骨膜間葉系細胞の数は、コントロール(α-MEM)処理グループと比較して有意に増加した。対照的にbFGF、bFGF-s3(ColH)、bFGF-s2b-s3(ColH)、またはbFGF-s3b(ColG)処理細胞では有意な増加は検出されなかった。しかしながら、bFGFまたはCB-bFGFの濃度を1または10pMに増加させたとき、細胞数は、α-MEM処理グループと比較して全ての形態の増殖因子で有意に増加した。
CB-bFGF/poly(Pro-Hyp-Gly) 10 複合物質によって誘発されるin vitro仮骨形成
ポリ(Pro-Hyp-Gly)10ゲルをPBS、bFGF(コントロール)、または4つの調製CB-bFGFの1つと混合し、マウスの大腿骨の骨折部位に適用した。4週間回復させた後、骨折部位の仮骨形成をマイクロCT画像分析によって評価した(図8A-8F)。PBSを注射した骨折部位と比較して、仮骨体積および骨無機質含有量は、bFGFまたはCB-bFGF融合タンパク質と組合わせてポリ(Pro-Hyp-Gly)10で処置した部位で有意に高かった(図9、P<0.05)。しかしながら、注目すべきは、bFGF-s2b-s3(ColH)、bFGF-s3b(ColG)およびbFGF-s3a-s3b(ColG)は、bFGFと比較してより高い仮骨体積および骨無機質含有量をもたらした(図9、P<0.05)。当該3つの融合タンパク質の中で、bFGF- s3a-s3b(ColG)はもっとも高い骨修復有効性を示し、その仮骨体積および骨無機質含有量は他の全てのグループのものよりも有意に高かった(図9、P<0.05)。
組織形態計測所見
ポリ(Pro-Hyp-Gly)10/bFGF-s3a-s3b(ColG)が新規な骨の形成を加速するメカニズムを解明するために、マウス大腿骨骨折モデルで軟仮骨の形成が初めて検出されてから2週間後に、処置した骨折部位の組織学的な評価を実施した。コントロールグループと比較して、bFGF-s2b-s3(ColH)、bFGF-s3b(ColG)またはbFGF-s3a-s3bのいずれかで処置した骨折部位で大きな仮骨が観察された(図10A-10F)。注目すべきは、bFGF-s3a-s3b-処置によって形成された仮骨は、他の処置グループで観察されたものよりもはっきりと大きかった(図10A-10F)。この所見は、ポリ(Pro-Hyp-Gly)10/bFGF-s3a-s3b(ColG)は、骨折治癒の初期段階で骨膜細胞の分裂増殖を加速することを示した。
クロストリジウムのコラゲナーゼはそのC-末端にコラーゲンアンカーを有する。当該アンカーはコラーゲン原線維および三重ヘリックス構造を有するコラーゲン性ペプチドと結合するが、変性コラーゲン(ゼラチン)とは結合しない(17)。アンカーは2つのタイプのドメイン、PKDおよびCBDで形成される(前者は後者の結合を強化する)。前記酵素は多様なコピー数のPKDおよびCBDで形成されるコラーゲンアンカーを有する。以前に我々は、コラーゲン担体(高密度コラーゲンシート/粉末または脱無機質骨マトリックス)およびアンカー融合bFGF(bFGF-PKD-CBD)で形成された複合物質の仮骨誘発能を示した(前記アンカーは、クロストリジウム・ヒストリチクムクラスIIコラゲナーゼ(ColH)由来PKDおよびCBDの各々の単一コピーで形成されている)(14;16)。最近、我々はコラーゲン担体の代わりにコラーゲン性ペプチドゲルを用いることを試みた。なぜならば、コラーゲン性ペプチドは注射によってより容易に適用できるからである。加齢マウスの骨折モデルでは、ポリ(Pro-Hyp-Gly)10およびbFGF-PKD-CBDで形成された新規な複合物質は、ポリ(Pro-Hyp-Gly)10およびbFGFで形成されたものよりも強く骨形成を誘発した(11)。したがって、我々は、多様な結合親和性を有するアンカーをコラーゲン性ペプチドに切り換えることによってこの複合物質の効能を最適化できると推測することができた。
多様なアンカーとペプチド担体(ポリ(Pro-Hyp-Gly)10)との結合親和性を概算するために、我々は、表面プラズモン共鳴アッセイのためのリガンドとしてより長いコラーゲン性ペプチド、H-Gly-Pro-Arg-Gly-(Pro-Hyp-Gly)12-NH2を合成した。前記ペプチドで最初のトリプレット、Pro-Arg-Glyは当該ペプチドの水溶性および三重ヘリックス構造を保つために導入された。ププチドはセンサーチップにN-末端で固定されるので、N-末端近くの変化は結合に顕著には影響しないと予想しても差し支えないであろう。このペプチドに対して単一CBD(Colg s3b)は、より短いコラーゲン性ペプチド(G(POG)8)に対して以前に報告(15)されたKD値(4.54±0.15x10-5 M)と同様なKD値(5.72±0.473x10-5 M)を提示し、ここで実施した定量的分析が再現性を有することを示した。クラスI酵素(ColG)に由来するコラーゲンアンカー(s3a-s3bおよびs3b)は、クラスII酵素(ColH)に由来するもの(s2b-s3およびs3)よりもこのペプチドに対して顕著に高い親和性を示し、前者が当該ペプチド担体に対して後者よりも適切なアンカーであることを示唆した。追加されたCBD(s3a)の存在はこの合成ペプチドに対するColG s3bの結合を有意には強化せず、このアッセイに用いられたペプチドはなお短すぎて2つのCBDの同時結合を許容できないことを示唆した。また別の可能性は、S3aとコラーゲンペプチドとの間の結合は見かけのKD値で反映されるには弱すぎるということである。より長いコラーゲン性ペプチドを用いる結合アッセイおよび/または小角X線回折試験はこの問題の解決に必要であろう。
有効性が結合親和性と相関すると仮定するならば、コラーゲン性ペプチドと組み合わせたときにColGアンカー融合bFGFを用いてより大きな仮骨形成を期待できよう。したがって、我々は、上記に記載のアンカーの1つを有するCB-bFGFを調製した。各CB-bFGF構築物のbFGF部分が完全であることを確認するために、細胞分裂増殖アッセイをin vitroで実施した。4つのCB-bFGFおよびbFGFは用量依存態様で細胞の分裂増殖を促進した。このことは、bFGFが多様なアンカー部分にもかかわらず活性を有することを示している。bFGF-CBD-CBD(s3a-s3b)の比活性は、低濃度(0.1-1.0pM)では他のCB-bFGFよりもわずかに高いように思われ、これは、間葉系細胞によって生成されたコラーゲンに対するこのCB-bFGFの結合に起因しているのかもしれない。
続いて、ポリ(Pro-Hyp-Gly)10および4つのCB-bFGFのいずれかで形成された複合物質の骨発生潜在能力を、マウスの大腿骨骨折モデルを用いて比較した。ポリ(Pro-Hyp-Gly)10で形成されたゲル様担体と組み合わせたとき、bFGF-CBD(ColG)およびbFGF-CBD-CBD(ColG)は、bFGF、bFGF-PKD-CBD(ColH)、またはbFGF-CBD(ColH)と比較して、2週間で大きな軟仮骨形成および骨折治癒時に有意に大きな仮骨を誘発した。被験物質の中では、bFGF-CBD-CBD(ColG)が最高の仮骨体積および骨無機質含有量をもたらした。
コラーゲンアンカーの結合親和性は、対応する融合タンパク質の骨発生活性に影響を与え得る。なぜならば、標的分子の欠損部位からの急速な拡散はそれらの骨発生潜在能力を制限するであろう(10)。以前に我々は、bFGF-PKD-CBD(ColH)が、bFGF-CBD(ColH)と比較してコラーゲン担体に対しより高い結合親和性を有し、より強い骨形成を誘発することを示した(10)。本試験で用いたコラーゲンアンカーの中では、ColG CBDは、コラーゲン性ペプチドに対してColHアンカーよりも約10倍高い親和性を示した。この発見はin vivoの結果と一致する(in vivoでは、ColGアンカーと融合させたbFGFは、ColHアンカー融合bFGFと比較して、コラーゲン性ペプチドと組み合わせたときにより効果的に骨発生を加速した)。
総合すれば、骨発生潜在能力は、少なくとも我々が調べた範囲では、コラーゲンアンカーの結合親和性と相関するように思われる。さらに、コラーゲン様ポリペプチド、ポリ(Pro-Hyp-Gly)10と一緒に導入したとき、タンデムCBD(ColG)は、骨折部位でのbFGF保持時間を最も増加させ、したがって骨形成を加速させるということもまた確実であるように思われる。これらの結果は、ポリ(Pro-Hyp-Gly)10と組み合わせたbFGF-CBD-CBD(ColG)は臨床環境において骨修復の刺激のために有望な治療物質であることを示唆する。
以前の研究は、増殖因子とCBDとの融合タンパク質は、自然のままの増殖因子と比較して優れた生物学的活性を有することを示した(18;19)。例えばHanら(18)は、フォン・ビルブラント因子由来CBDを含む骨形態発生タンパク質は、マウス骨芽細胞株MC3T3-E1のin vitroアルカリホスファターゼ活性を増強させることを報告した。bFGFは骨膜間葉系細胞を刺激するので(9;10;16)、我々は、ラット骨膜間葉系細胞を用いてbFGFおよびいくつかのCB-bFGF融合タンパク質の分裂増殖能力を調べ、bFGF-CBD-CBDは、1pMの低い濃度で調べたタンパク質では最も高い細胞分裂増殖活性を刺激することを示した。総合すれば、この試験の所見は、bFGF-CBD-CBDは高いコラーゲン結合親和性および生物学的活性(骨折治癒時の仮骨形成を刺激する能力を含む)の両方を有することを示した。
C.クロストリジウムクラスIコラゲナーゼColGのタンデムCBDを含む、組換えコラーゲン結合bFGF融合タンパク質は、マウス大腿骨の骨折部位にコラーゲン様ペプチド、ポリ(Pro-Hyp-Gly)10と一緒に注射されるとき骨形成を強く誘発した。bFGF-CBD-CBD/ポリ(Pro-Hyp-Gly)10の高い骨発生特性は、この複合物質が臨床環境において骨折治癒を促進する潜在能力を有することを示唆する。
[1] Khan SN, Bostrom MP, Lane JM: Bone growth factors.Orthop Clin North Am 2000;31:375-388.
[2] Ueno M, Urabe K, Naruse K, Uchida K, Minehara H, Yamamoto T, Steck R, Gregory L, Wullschleger ME, Schuetz MA, Itoman M: Influence of internal fixator stiffness on murine fracture healing: two types of fracture healing lead to two distinct cellular events and FGF-2 expressions.Exp Anim 2011;60:79-87.
[3] Kato T, Kawaguchi H, Hanada K, Aoyama I, Hiyama Y, Nakamura T, Kuzutani K, Tamura M, Kurokawa T, Nakamura K: Single local injection of recombinant fibroblast growth factor-2 stimulates healing of segmental bone defects in rabbits.J Orthop Res 1998;16:654-659.
[4] Kawaguchi H, Kurokawa T, Hanada K, Hiyama Y, Tamura M, Ogata E, Matsumoto T: Stimulation of fracture repair by recombinant human basic fibroblast growth factor in normal and streptozotocin-diabetic rats.Endocrinology 1994;135:774-781.
[5] Kawaguchi H, Jingushi S, Izumi T, Fukunaga M, Matsushita T, Nakamura T, Mizuno K, Nakamura T, Nakamura K: Local application of recombinant human fibroblast growth factor-2 on bone repair: a dose-escalation prospective trial on patients with osteotomy.J Orthop Res 2007;25:480-487.
[6] Kawaguchi H, Oka H, Jingushi S, Izumi T, Fukunaga M, Sato K, Matsushita T, Nakamura K: A local application of recombinant human fibroblast growth factor 2 for tibial shaft fractures: A randomized, placebo-controlled trial.J Bone Miner Res 2010;25:2735-2743.
[7] Bauer R, Wilson JJ, Philominathan ST, Davis D, Matsushita O, Sakon J: Structural comparison of ColH and ColG collagen-binding domains from Clostridium histolyticum.J Bacteriol 2013;195:318-327.
[8] Bauer R, Janowska K, Taylor K, Jordan B, Gann S, Janowski T, Latimer EC, Matsushita O, Sakon J: Structures of three polycystic kidney disease-like domains from Clostridium histolyticum collagenases ColG and ColH.Acta Crystallogr D Biol Crystallogr 2015;71:565-577.
[9] Uchida K, Matsushita O, Naruse K, Mima T, Nishi N, Hattori S, Ogura T, Inoue G, Tanaka K, Takaso M: Acceleration of periosteal bone formation by human basic fibroblast growth factor containing a collagen-binding domain from Clostridium histolyticum collagenase.J Biomed Mater Res A 2014;102:1737-1743.
[10] Uchida K, Matsushita O, Nishi N, Inoue G, Horikawa K, Takaso M: Enhancement of periosteal bone formation by basic fibroblast-derived growth factor containing polycystic kidney disease and collagen-binding domains from Clostridium histolyticum collagenase.J Tissue Eng Regen Med 3-18-2015.
[11] Sekiguchi H, Uchida K, Inoue G, Matsushita O, Saito W, Aikawa J, Tanaka K, Fujimaki H, Miyagi M, Takaso M: Acceleration of bone formation during fracture healing by poly(pro-hyp-gly)10 and basic fibroblast growth factor containing polycystic kidney disease and collagen-binding domains from Clostridium histolyticum collagenase.J Biomed Mater Res A 2016;104:1372-1378.
[12] Fukata Y, Itoh A, Nonaka Y, Ogawa T, Nakamura T, Matsushita O, Nishi N: Direct cytocidal effect of galectin-9 localized on collagen matrices on human immune cell lines.Biochim Biophys Acta 2014;1840:1892-1901.
[13] Kishimoto T, Morihara Y, Osanai M, Ogata S, Kamitakahara M, Ohtsuki C, Tanihara M: Synthesis of poly(Pro-Hyp-Gly)(n) by direct poly-condensation of (Pro-Hyp-Gly)(n), where n=1, 5, and 10, and stability of the triple-helical structure.Biopolymers 10-15-2005;79:163-172.
[14] Saito W, Uchida K, Matsushita O, Inoue G, Sekiguchi H, Aikawa J, Fujimaki H, Takaso M: Acceleration of callus formation during fracture healing using basic fibroblast growth factor-kidney disease domain-collagen-binding domain fusion protein combined with allogenic demineralized bone powder.J Orthop Surg Res 2015;10:59.
[15] Wilson JJ, Matsushita O, Okabe A, Sakon J: A bacterial collagen-binding domain with novel calcium-binding motif controls domain orientation.EMBO J 4-15-2003;22:1743-1752.
[16] Saito W, Uchida K, Ueno M, Matsushita O, Inoue G, Nishi N, Ogura T, Hattori S, Fujimaki H, Tanaka K, Takaso M: Acceleration of bone formation during fracture healing by injectable collagen powder and human basic fibroblast growth factor containing a collagen-binding domain from Clostridium histolyticum collagenase.J Biomed Mater Res A 2014;102:3049-3055.
[17] Matsushita O, Koide T, Kobayashi R, Nagata K, Okabe A: Substrate recognition by the collagen-binding domain of Clostridium histolyticum class I collagenase.J Biol Chem 3-23-2001;276:8761-8770.
[18] Han X, Zhang W, Gu J, Zhao H, Ni L, Han J, Zhou Y, Gu Y, Zhu X, Sun J, Hou X, Yang H, Dai J, Shi Q: Accelerated postero-lateral spinal fusion by collagen scaffolds modified with engineered collagen-binding human bone morphogenetic protein-2 in rats.PLoS One 2014;9:e98480.
[19] Shiozaki Y, Kitajima T, Mazaki T, Yoshida A, Tanaka M, Umezawa A, Nakamura M, Yoshida Y, Ito Y, Ozaki T, Matsukawa A: Enhanced in vivo osteogenesis by nanocarrier-fused bone morphogenetic protein-4.Int J Nanomedicine 2013;8:1349-1360.
本発明の好ましい態様は、下記の通りである。
〔1〕ドメインリンカーによって連結された2つのコラーゲン結合ドメインと、治療薬剤リンカーによって前記コラーゲン結合ドメインの少なくとも1つに連結された治療薬剤とを含むコラーゲン結合治療薬剤であって、前記コラーゲン結合薬剤が、コラゲナーゼ活性を欠き、前記2つのコラーゲン結合ドメインの各々が、配列番号:1-39のポリペプチドのいずれか1つ、配列番号:1-39のいずれか1つと少なくとも90%の配列同一性を有するポリペプチド、および配列番号:1-39のいずれか1つの連続する少なくとも8つのアミノ酸のフラグメントから成る群から選択される、前記コラーゲン結合治療薬剤。
〔2〕前記治療薬剤が、FGF、副甲状腺ホルモン(PTH)、PTH/PTHrP受容体アゴニスト、PTH/PTHrP受容体アンタゴニスト、骨形成タンパク質(BMP)、G-CSF、BMP-2、BMP-3、抗スクレロスチン抗体、成長ホルモン、IGF-1、VEGF、TGF-β、KGF、TGF-α、TGF-β1、TGF-β受容体、CT、GH、GM-CSF、EGF、PDGF、セリプロロール、アクチビン、および結合組織増殖因子から成る群から選択される、前記〔1〕に記載のコラーゲン結合薬剤。
〔3〕前記コラーゲン結合ドメインの1つが、配列番号:15-30のいずれか1つのポリペプチド、配列番号:15-30のいずれか1つと少なくとも90%の配列同一性を有するポリペプチド、および配列番号:15-30のいずれか1つの連続する少なくとも8つのアミノ酸のフラグメントから成る群から選択され、他方のコラーゲン結合ドメインが、配列番号:1-14および31-39のいずれか1つのポリペプチド、配列番号:1-14および31-39のいずれか1つと少なくとも90%の配列同一性を有するポリペプチド、または配列番号:1-14および31-39のいずれか1つの連続する少なくとも8つのアミノ酸のフラグメントから成る群から選択される、前記〔1〕又は〔2〕に記載のコラーゲン結合薬剤。
〔4〕前記2つのコラーゲン結合ドメインが、配列番号:15-30のいずれか1つ、配列番号:15-30のいずれか1つと少なくとも90%の配列同一性を有するポリペプチド、および配列番号:15-30のいずれか1つの連続する少なくとも8つのアミノ酸のフラグメントから成る群から選択される、前記〔1〕~〔3〕のいずれか1項に記載のコラーゲン結合薬剤。
〔5〕前記2つのコラーゲン結合ドメインが、配列番号:1-14および31-39のいずれか1つのポリペプチド、配列番号:1-14および31-39のいずれか1つと少なくとも90%の配列同一性を有するポリペプチド、または配列番号:1-14および31-39のいずれか1つの連続する少なくとも8つのアミノ酸のフラグメントから成る群から選択される、前記〔1〕~〔4〕のいずれか1項に記載のコラーゲン結合薬剤。
〔6〕前記コラーゲン結合薬剤が、配列番号:40-47のポリペプチドのいずれか1つ、配列番号:40-47のいずれか1つと少なくとも90%の配列同一性を有するポリペプチド、および配列番号:40-47のいずれか1つの連続する少なくとも8つのアミノ酸のフラグメントから成る群から選択されるポリペプチドを含む、前記〔1〕~〔5〕のいずれか1項に記載のコラーゲン結合薬剤。
〔7〕前記ドメインリンカーが、ポリペプチドを含む、前記〔1〕~〔6〕のいずれか1項に記載のコラーゲン結合薬剤。
〔8〕前記ドメインリンカーが、配列番号:48-55のポリペプチドのいずれか1つ、または配列番号:48-55のポリペプチドのいずれか1つと少なくとも80%の配列同一性を有するポリペプチドから成る群から選択されるポリペプチドを含む、前記〔1〕~〔7〕のいずれか1項に記載のコラーゲン結合薬剤。
〔9〕前記治療薬剤が、ポリペプチド、ホルモン、増殖因子、サイトカイン、小分子、ポリヌクレオチド、炭水化物、および脂質から成る群から選択される、前記〔1〕~〔8〕のいずれか1項に記載のコラーゲン結合薬剤。
〔10〕前記治療薬剤が、ポリペプチドを含む、前記〔1〕~〔9〕のいずれか1項に記載のコラーゲン結合薬剤。
〔11〕前記治療薬剤が、FGF、副甲状腺ホルモン(PTH)、PTH/PTHrP受容体アゴニスト、およびPTH/PTHrP受容体アンタゴニストから成る群から選択される、前記〔1〕~〔10〕のいずれか1項に記載のコラーゲン結合薬剤。
〔12〕前記治療薬剤リンカーが、ポリペプチドを含む、前記〔1〕~〔11〕のいずれか1項に記載のコラーゲン結合薬剤。
〔13〕前記治療薬剤のC末端が、前記治療薬剤リンカーによって前記コラーゲン結合薬剤のN末端と連結される、前記〔10〕~〔12〕のいずれか1項に記載のコラーゲン結合薬剤。
〔14〕前記〔1〕-〔13〕に記載のコラーゲン結合薬剤のいずれか1つおよび医薬担体を含む、医薬組成物。
〔15〕ある状態を治療する方法であって、前記〔1〕-〔13〕に記載のコラーゲン結合薬剤のいずれか1つまたは前記〔14〕に記載の医薬組成物を、前記状態の治療に有効な量で対象に投与する工程を含む、前記方法。
〔16〕前記対象が、哺乳動物である、前記〔15〕に記載の方法。
〔17〕前記哺乳動物が、ヒトである、前記〔16〕に記載の方法。
〔18〕前記状態が、副甲状腺機能亢進、毛の症状(過剰な毛の増殖または毛の消失)、コラーゲン症、創傷、骨の症状、脊椎固定、虚血性心疾患、抹消神経障害および脊椎損傷から成る群から選択される、前記〔15〕~〔17〕のいずれか1項に記載の方法。
〔19〕前記状態が、骨形成不全、スティックラー症候群、エーレルス-ダンロー症候群、アルポート症候群、キャフェイ病、および限局性コラーゲンまたは軟骨損傷から成る群から選択されるコラーゲン症を含む、前記〔15〕~〔17〕のいずれか1項に記載の方法。
〔20〕ある状態を治療するための医薬の製造における、前記〔1〕~〔14〕のいずれか1項に記載の組成物の使用。
Claims (10)
- ドメインリンカーによって連結された2つのコラーゲン結合ドメインと、治療薬剤リンカーによって前記コラーゲン結合ドメインの少なくとも1つに連結されたFGFポリペプチドとを含む、骨形成を促進するためのコラーゲン結合治療薬剤であって、前記コラーゲン結合治療薬剤が、コラゲナーゼ活性を欠き、前記2つのコラーゲン結合ドメインの一方が、配列番号:1-14のポリペプチドから成る群から選択され、他方のコラーゲン結合ドメインが、配列番号:15-30のポリペプチドから成る群から選択される、前記コラーゲン結合治療薬剤。
- 前記2つのコラーゲン結合ドメインが一緒になって、配列番号:40-47のポリペプチドのいずれか1つ、配列番号:40-47のいずれか1つと少なくとも90%の配列同一性を有するポリペプチド、および配列番号:40-47のいずれか1つの連続する少なくとも8つのアミノ酸のフラグメントから成る群から選択されるポリペプチドを含む、請求項1に記載のコラーゲン結合治療薬剤。
- 前記ドメインリンカーが、ポリペプチドを含む、請求項1~2のいずれか1項に記載のコラーゲン結合治療薬剤。
- 前記ドメインリンカーが、配列番号:48-55のポリペプチド、または配列番号:48-55のポリペプチドのいずれか1つと少なくとも80%の配列同一性を有するポリペプチドから成る群から選択されるポリペプチドを含む、請求項1~3のいずれか1項に記載のコラーゲン結合治療薬剤。
- 前記治療薬剤リンカーが、ポリペプチドを含む、請求項1~4のいずれか1項に記載のコラーゲン結合治療薬剤。
- 前記FGFのC末端が、前記治療薬剤リンカーによって前記コラーゲン結合ドメインのN末端と連結される、請求項1~5のいずれか1項に記載のコラーゲン結合治療薬剤。
- 請求項1-6に記載のコラーゲン結合治療薬剤のいずれか1つおよび医薬担体を含む、骨形成を促進するための医薬組成物。
- 骨形成を促進するための医薬の製造における、請求項1-6に記載のコラーゲン結合治療薬剤のいずれか1つまたは請求項7に記載の医薬組成物の使用。
- 前記医薬が、骨の症状を治療するためのものである、請求項8に記載の使用。
- 前記骨の症状が、骨折、骨粗しょう症、歯周欠損、または他の骨欠損から成る群から選択される、請求項9に記載の使用。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2023044982A JP2023088982A (ja) | 2017-02-10 | 2023-03-22 | コラーゲン結合薬剤組成物およびその使用方法 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201762457410P | 2017-02-10 | 2017-02-10 | |
| US62/457,410 | 2017-02-10 | ||
| PCT/US2018/017665 WO2018148573A1 (en) | 2017-02-10 | 2018-02-09 | Collagen-binding agent compositions and methods of using the same |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2023044982A Division JP2023088982A (ja) | 2017-02-10 | 2023-03-22 | コラーゲン結合薬剤組成物およびその使用方法 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2020508984A JP2020508984A (ja) | 2020-03-26 |
| JP2020508984A5 JP2020508984A5 (ja) | 2021-03-25 |
| JP7397440B2 true JP7397440B2 (ja) | 2023-12-13 |
Family
ID=63107889
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019543282A Active JP7397440B2 (ja) | 2017-02-10 | 2018-02-09 | コラーゲン結合薬剤組成物およびその使用方法 |
| JP2023044982A Pending JP2023088982A (ja) | 2017-02-10 | 2023-03-22 | コラーゲン結合薬剤組成物およびその使用方法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2023044982A Pending JP2023088982A (ja) | 2017-02-10 | 2023-03-22 | コラーゲン結合薬剤組成物およびその使用方法 |
Country Status (3)
| Country | Link |
|---|---|
| US (1) | US11624060B2 (ja) |
| JP (2) | JP7397440B2 (ja) |
| WO (1) | WO2018148573A1 (ja) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DK3391899T3 (da) * | 2011-12-14 | 2020-08-24 | Univ Arkansas | Afgivelse af terapeutiske midler ved hjælp af et kollagenbindende protein |
| US20220257715A1 (en) * | 2021-02-18 | 2022-08-18 | The Board Of Trustees Of The University Of Arkansas | Release of growth factors at wound healing stages |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015513312A (ja) | 2011-12-14 | 2015-05-07 | ザ ボード オブ トラスティーズ オブ ザ ユニバーシティ オブ アーカンソー | コラーゲン結合タンパク質による治療剤の送達 |
Family Cites Families (48)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB8516421D0 (en) | 1985-06-28 | 1985-07-31 | Biotechnology Interface Ltd | Fibronectins |
| ATE209887T1 (de) | 1993-04-02 | 2001-12-15 | Anticancer Inc | Verfahren zur verabreichung von förderlichen zusammensetzungen auf die haarfollikel |
| DE69734157T2 (de) | 1996-07-31 | 2006-07-13 | The General Hospital Corp., Boston | Parathyroidhormon-verwandthe peptidanaloge |
| US20100267012A1 (en) | 1997-11-04 | 2010-10-21 | Bergeron Michel G | Highly conserved genes and their use to generate probes and primers for detection of microorganisms |
| US6387663B1 (en) | 1998-07-31 | 2002-05-14 | University Of Southern California | Targeting pharmaceutical agents to injured tissues |
| US7601685B2 (en) | 1998-08-27 | 2009-10-13 | Eidgenossische Technische Hochschule Zurich | Growth factor modified protein matrices for tissue engineering |
| US20020102709A1 (en) | 1999-02-19 | 2002-08-01 | Tetsuya Ishikawa | Collagen-binding physiologically active polypeptide |
| WO2000049159A1 (en) | 1999-02-19 | 2000-08-24 | Terumo Kabushiki Kaisha | Collagen-binding physiologically active polypeptide |
| US6908994B1 (en) | 1999-05-10 | 2005-06-21 | The Texas A&M University System | Collagen-binding proteins from enterococcal bacteria |
| US7396664B2 (en) | 1999-06-08 | 2008-07-08 | Regeneron Pharmaceuticals, Inc. | VEGF-binding fusion proteins and nucleic acids encoding the same |
| US20050124537A1 (en) | 2000-04-27 | 2005-06-09 | Amgen Inc. | Modulators of receptors for parathyroid hormone and parathyroid hormone-related protein |
| US6756480B2 (en) | 2000-04-27 | 2004-06-29 | Amgen Inc. | Modulators of receptors for parathyroid hormone and parathyroid hormone-related protein |
| EP1314780A4 (en) | 2000-08-15 | 2004-07-28 | Terumo Corp | Collagen-binding hybrid polypeptides |
| JP2002058485A (ja) | 2000-08-16 | 2002-02-26 | Terumo Corp | コラーゲン結合性を有する骨形成促進融合蛋白質 |
| MXPA04006021A (es) | 2001-12-18 | 2005-08-19 | Eth Zuerich | Matrices de proteina modificada con factor de crecimiento para ingenieria de tejidos. |
| JP2003284553A (ja) * | 2002-03-28 | 2003-10-07 | Seikagaku Kogyo Co Ltd | 生理活性タンパク質 |
| AU2003256839B2 (en) | 2002-07-25 | 2009-10-29 | The General Hospital Corporation | Parathyroid hormone receptor activation and hematopoietic progenitor cell expansion |
| ES2269973T3 (es) | 2003-02-13 | 2007-04-01 | Synthes Ag Chur | Mezcla inyectable para sustituir un tejido oseo. |
| US20040220094A1 (en) | 2003-05-01 | 2004-11-04 | Skinner Keith K. | Inverse agonist and agonist peptides that stimulate/inhibit hair growth |
| US20050119183A1 (en) | 2003-11-12 | 2005-06-02 | Nps Allelix Corp. | Method for treating bone loss using parathyroid hormone |
| EP1557176A1 (en) | 2004-01-26 | 2005-07-27 | Ferring B.V. | Treatment of bone metastases by means of PTH receptor agonists |
| US8030448B2 (en) | 2004-02-16 | 2011-10-04 | Techno Network Shikoku Co., Ltd. | Polypeptide having collagen-like structure |
| EP3404102B1 (en) | 2004-04-21 | 2021-08-11 | Alexion Pharmaceuticals, Inc. | Bone delivery conjugates and method of using same to target proteins to bone |
| WO2006073711A2 (en) | 2005-01-06 | 2006-07-13 | Kuros Biosurgery Ag | Use of a matrix comprising a contrast agent in soft tissues |
| US8802396B2 (en) | 2005-12-26 | 2014-08-12 | Yantai Zhenghai Bio-Technology Co., Ltd. | Activated collagen scaffold materials and their special fused active restoration factors |
| WO2008067199A2 (en) | 2006-11-16 | 2008-06-05 | Kai Pharmaceuticals, Inc. | Polycationic calcium modulator peptides for the treatment of hyperparathyroidism and hypercalcemic disorders |
| US8617543B2 (en) | 2007-02-14 | 2013-12-31 | Yolare Pharmaceuticals, LLC | Modified mutant collagenase and its use in fat melting and in scar reduction |
| JP5520811B2 (ja) | 2007-04-09 | 2014-06-11 | ザ ボード オブ トラスティーズ オブ ザ ユニバーシティ オブ アーカンソー | コラーゲン結合領域と副甲状腺ホルモンとの融合タンパク |
| EP2178905B1 (en) | 2007-07-26 | 2013-11-06 | Allergan, Inc. | Methods of activiting clostridial toxins |
| US20100159564A1 (en) | 2007-11-30 | 2010-06-24 | Dwulet Francis E | Protease resistant recombinant bacterial collagenases |
| JP2010172247A (ja) | 2009-01-29 | 2010-08-12 | Kitasato Institute | 積層型高密度培養人工組織の製造方法及び積層型高密度培養人工組織 |
| WO2011060431A2 (en) | 2009-11-16 | 2011-05-19 | University Of Maryland Baltimore | Multivalent live vector vaccine against clostridium difficile-associated disease |
| WO2011142425A1 (ja) | 2010-05-12 | 2011-11-17 | 国立大学法人香川大学 | 上皮層含有組織の再生材および再生評価方法 |
| ES2385239B1 (es) | 2010-09-30 | 2013-06-19 | Proteos Biotech S.L.U. | Uso de colagenasa g recombinante, colagenasa h recombinante y pz-peptidasa recombinante para el tratamiento de enfermedades que cursan con alteraciones del colágeno. |
| ES2726530T3 (es) | 2011-03-16 | 2019-10-07 | Univ Tohoku | Sonda para analizar tejido biológico y método para utilizar la misma |
| WO2012157339A1 (ja) | 2011-05-13 | 2012-11-22 | 学校法人北里研究所 | 成長因子アンカーリング型骨移植材料、成長因子アンカーリング型骨移植材料の製造方法、成長因子アンカーリング型骨移植材料製造用キット、および骨形成方法 |
| WO2013120060A1 (en) | 2012-02-09 | 2013-08-15 | The Board Of Trustees Of The University Of Arkansas | Delivery of therapeutic agents by a collagen binding protein |
| BR112014017229B1 (pt) | 2012-01-12 | 2022-05-17 | Auxilium International Holdings, Inc | Ácido nucleico recombinante, cassette de expressão, vetor, célula hospedeira recombinante, método de produção da colagenase i ou ii, colagenase i ou ii, composição farmacêutica, e método de produção de um produto de droga |
| WO2013120030A1 (en) | 2012-02-08 | 2013-08-15 | Shining Golden Yida Welding & Cutting Machinery Manufacture Ltd. | Rotary vane air motor with improved vanes and other improvements |
| WO2014098249A1 (ja) | 2012-12-21 | 2014-06-26 | 国立大学法人名古屋大学 | 組織修復活性組成物及びその利用 |
| RU2016110842A (ru) | 2013-09-25 | 2017-10-30 | Пронутриа Биосайенсис, Инк. | Композиции и составы для предотвращения и уменьшения опухолеобразования, пролиферации и инвазии раковых клеток, и способы их получения и применения при лечении раковых заболеваний |
| US9539363B2 (en) | 2014-04-24 | 2017-01-10 | Warsaw Orthopedic, Inc. | Collagen matrix |
| JP6699821B2 (ja) | 2014-10-16 | 2020-05-27 | 学校法人北里研究所 | 神経再生用移植材料、神経再生用移植材料の製造方法、及び神経再生用移植材料製造用キット |
| EP3112474A1 (en) | 2015-06-29 | 2017-01-04 | Evonik Degussa GmbH | Method of detecting avian necrotic enteritis |
| HRP20231079T1 (hr) | 2016-09-29 | 2023-12-22 | Ascendis Pharma Bone Diseases A/S | Režim za doziranje pth spoja s kontroliranim oslobađanjem |
| US20190248881A1 (en) | 2017-12-04 | 2019-08-15 | Precithera, Inc. | TGF-ß RECEPTOR FUSION PROTEINS AND OTHER TGF-ß ANTAGONISTS FOR REDUCING TGF-ß SIGNALING |
| WO2019147735A1 (en) | 2018-01-23 | 2019-08-01 | New York University | Antibodies specific to delta 1 chain of t cell receptor |
| WO2019173829A1 (en) | 2018-03-09 | 2019-09-12 | University Of Pittsburgh - Of The Commonwealth System Of Higher Education | Delivering biological drugs to tissues |
-
2018
- 2018-02-09 US US16/485,290 patent/US11624060B2/en active Active
- 2018-02-09 WO PCT/US2018/017665 patent/WO2018148573A1/en active Application Filing
- 2018-02-09 JP JP2019543282A patent/JP7397440B2/ja active Active
-
2023
- 2023-03-22 JP JP2023044982A patent/JP2023088982A/ja active Pending
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015513312A (ja) | 2011-12-14 | 2015-05-07 | ザ ボード オブ トラスティーズ オブ ザ ユニバーシティ オブ アーカンソー | コラーゲン結合タンパク質による治療剤の送達 |
Non-Patent Citations (2)
| Title |
|---|
| Biochim Biophys Acta,2014年,Vol. 1840, Issue 6,p. 1892-1901 |
| J Biomed Mater Res A,2014年,Vol. 102, Issue 6,p. 1737-1743 |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2018148573A1 (en) | 2018-08-16 |
| JP2023088982A (ja) | 2023-06-27 |
| US11624060B2 (en) | 2023-04-11 |
| JP2020508984A (ja) | 2020-03-26 |
| US20190376053A1 (en) | 2019-12-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2023088982A (ja) | コラーゲン結合薬剤組成物およびその使用方法 | |
| JP5753692B2 (ja) | タンパク質製剤 | |
| US7226904B2 (en) | Agents and methods for promoting bone growth | |
| JP7327765B2 (ja) | コラーゲン結合タンパク質による治療剤の送達 | |
| KR20010033268A (ko) | 결정형 테리파라타이드 | |
| KR20120061898A (ko) | 출혈성 장애의 치료요법 및 예방 치료에 있어서의 비정맥내 투여를 위한 알부민 융합 응고 인자 | |
| CN102655877A (zh) | Fgf21突变体及其用途 | |
| CN103917554A (zh) | 用于改善重构后纯化的因子viii的稳定性的方法 | |
| JP2015527350A (ja) | 第viii因子の液体製剤 | |
| AU2010271157A1 (en) | Enhancement of BMP retention | |
| US5880094A (en) | Polypeptides that stimulate bone growth | |
| US6352973B1 (en) | Bone stimulating factor | |
| AU2019343514A1 (en) | Agent for treatment of dermatological disorders | |
| US20150183848A1 (en) | TREATMENT OF lge-MEDIATED DISEASE | |
| WO2021256200A1 (ja) | カテプシンk阻害剤 | |
| US20050256042A1 (en) | Methods of preventing and treating alimentary mucositis | |
| US20100081622A1 (en) | Reduction of parathyroid hormone levels | |
| WO2022204331A1 (en) | Compositions comprising branched kgf-2 derived peptides and methods for use in ocular treatment | |
| US20030027753A1 (en) | Bone stimulating factor | |
| JP2007536381A (ja) | 消化管粘膜炎を予防または処置する方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210209 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20210209 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20220202 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20220426 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20220629 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220801 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20221121 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230322 |
|
| C60 | Trial request (containing other claim documents, opposition documents) |
Free format text: JAPANESE INTERMEDIATE CODE: C60 Effective date: 20230322 |
|
| C11 | Written invitation by the commissioner to file amendments |
Free format text: JAPANESE INTERMEDIATE CODE: C11 Effective date: 20230403 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20230501 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20230601 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20230831 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20231013 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20231026 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20231122 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7397440 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |