JP7161466B2 - グリコピロニウム化合物を作製するための方法及び使用する方法 - Google Patents
グリコピロニウム化合物を作製するための方法及び使用する方法 Download PDFInfo
- Publication number
- JP7161466B2 JP7161466B2 JP2019503315A JP2019503315A JP7161466B2 JP 7161466 B2 JP7161466 B2 JP 7161466B2 JP 2019503315 A JP2019503315 A JP 2019503315A JP 2019503315 A JP2019503315 A JP 2019503315A JP 7161466 B2 JP7161466 B2 JP 7161466B2
- Authority
- JP
- Japan
- Prior art keywords
- compound
- formula
- examples
- solvent
- reaction
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 238000000034 method Methods 0.000 title claims description 179
- ANGKOCUUWGHLCE-HKUYNNGSSA-N [(3s)-1,1-dimethylpyrrolidin-1-ium-3-yl] (2r)-2-cyclopentyl-2-hydroxy-2-phenylacetate Chemical class C1[N+](C)(C)CC[C@@H]1OC(=O)[C@](O)(C=1C=CC=CC=1)C1CCCC1 ANGKOCUUWGHLCE-HKUYNNGSSA-N 0.000 title description 16
- 150000001875 compounds Chemical class 0.000 claims description 405
- 239000000203 mixture Substances 0.000 claims description 76
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 claims description 51
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 44
- 125000000217 alkyl group Chemical group 0.000 claims description 39
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 35
- -1 halide anion Chemical class 0.000 claims description 33
- YNESATAKKCNGOF-UHFFFAOYSA-N lithium bis(trimethylsilyl)amide Chemical compound [Li+].C[Si](C)(C)[N-][Si](C)(C)C YNESATAKKCNGOF-UHFFFAOYSA-N 0.000 claims description 24
- 229910052799 carbon Inorganic materials 0.000 claims description 23
- BAVYZALUXZFZLV-UHFFFAOYSA-N Methylamine Chemical compound NC BAVYZALUXZFZLV-UHFFFAOYSA-N 0.000 claims description 21
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 claims description 20
- 235000011090 malic acid Nutrition 0.000 claims description 20
- 150000003839 salts Chemical class 0.000 claims description 20
- 125000004453 alkoxycarbonyl group Chemical group 0.000 claims description 18
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 claims description 18
- 125000004432 carbon atom Chemical group C* 0.000 claims description 17
- 229940125782 compound 2 Drugs 0.000 claims description 17
- 230000008878 coupling Effects 0.000 claims description 12
- 238000010168 coupling process Methods 0.000 claims description 12
- 238000005859 coupling reaction Methods 0.000 claims description 12
- BRTFVKHPEHKBQF-UHFFFAOYSA-N bromocyclopentane Chemical compound BrC1CCCC1 BRTFVKHPEHKBQF-UHFFFAOYSA-N 0.000 claims description 11
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 claims description 11
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 claims description 11
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 claims description 11
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 claims description 11
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 claims description 11
- 150000001450 anions Chemical class 0.000 claims description 10
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 claims description 10
- 239000003638 chemical reducing agent Substances 0.000 claims description 8
- 239000003795 chemical substances by application Substances 0.000 claims description 4
- 238000004440 column chromatography Methods 0.000 claims description 3
- 238000000926 separation method Methods 0.000 claims 1
- 239000002904 solvent Substances 0.000 description 147
- 238000006243 chemical reaction Methods 0.000 description 145
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 132
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 85
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical group C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 70
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 54
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical group CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 description 48
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 48
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 45
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical group ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 39
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 35
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 30
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 29
- OFBQJSOFQDEBGM-UHFFFAOYSA-N Pentane Chemical group CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 28
- 239000000243 solution Substances 0.000 description 25
- 238000002360 preparation method Methods 0.000 description 24
- 230000015572 biosynthetic process Effects 0.000 description 23
- 201000010099 disease Diseases 0.000 description 23
- 208000035475 disorder Diseases 0.000 description 22
- WFLUEQCOAQCQLP-UHFFFAOYSA-N 2-cyclopentyl-2-hydroxy-2-phenylacetic acid Chemical compound C=1C=CC=CC=1C(O)(C(=O)O)C1CCCC1 WFLUEQCOAQCQLP-UHFFFAOYSA-N 0.000 description 21
- RTZKZFJDLAIYFH-UHFFFAOYSA-N ether Substances CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 21
- MVPPADPHJFYWMZ-UHFFFAOYSA-N chlorobenzene Chemical compound ClC1=CC=CC=C1 MVPPADPHJFYWMZ-UHFFFAOYSA-N 0.000 description 20
- 239000000047 product Substances 0.000 description 19
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 18
- 238000003756 stirring Methods 0.000 description 18
- JWUJQDFVADABEY-UHFFFAOYSA-N 2-methyltetrahydrofuran Chemical compound CC1CCCO1 JWUJQDFVADABEY-UHFFFAOYSA-N 0.000 description 17
- 238000003786 synthesis reaction Methods 0.000 description 17
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 16
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 16
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 16
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical group CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 15
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 14
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 14
- 239000008096 xylene Substances 0.000 description 14
- 150000001335 aliphatic alkanes Chemical class 0.000 description 13
- 150000002148 esters Chemical class 0.000 description 13
- 238000004128 high performance liquid chromatography Methods 0.000 description 13
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 12
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 12
- 239000002585 base Substances 0.000 description 12
- 239000012043 crude product Substances 0.000 description 12
- JMMWKPVZQRWMSS-UHFFFAOYSA-N isopropanol acetate Natural products CC(C)OC(C)=O JMMWKPVZQRWMSS-UHFFFAOYSA-N 0.000 description 12
- 229940011051 isopropyl acetate Drugs 0.000 description 12
- GWYFCOCPABKNJV-UHFFFAOYSA-M isovalerate Chemical compound CC(C)CC([O-])=O GWYFCOCPABKNJV-UHFFFAOYSA-M 0.000 description 12
- 239000010410 layer Substances 0.000 description 12
- KWGKDLIKAYFUFQ-UHFFFAOYSA-M lithium chloride Chemical compound [Li+].[Cl-] KWGKDLIKAYFUFQ-UHFFFAOYSA-M 0.000 description 12
- FLVFPAIGVBQGET-RXMQYKEDSA-N (3r)-1-methylpyrrolidin-3-ol Chemical compound CN1CC[C@@H](O)C1 FLVFPAIGVBQGET-RXMQYKEDSA-N 0.000 description 11
- FJJYHTVHBVXEEQ-UHFFFAOYSA-N 2,2-dimethylpropanal Chemical compound CC(C)(C)C=O FJJYHTVHBVXEEQ-UHFFFAOYSA-N 0.000 description 11
- 125000003545 alkoxy group Chemical group 0.000 description 11
- 239000012044 organic layer Substances 0.000 description 11
- 239000003153 chemical reaction reagent Substances 0.000 description 10
- 238000004519 manufacturing process Methods 0.000 description 10
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 9
- 208000008454 Hyperhidrosis Diseases 0.000 description 9
- 230000037315 hyperhidrosis Effects 0.000 description 9
- 238000004809 thin layer chromatography Methods 0.000 description 9
- IWYDHOAUDWTVEP-SSDOTTSWSA-N (R)-mandelic acid Chemical compound OC(=O)[C@H](O)C1=CC=CC=C1 IWYDHOAUDWTVEP-SSDOTTSWSA-N 0.000 description 8
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 8
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 8
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 8
- 239000007864 aqueous solution Substances 0.000 description 8
- 125000003118 aryl group Chemical group 0.000 description 8
- 238000001914 filtration Methods 0.000 description 8
- 150000002576 ketones Chemical class 0.000 description 8
- ZCSHNCUQKCANBX-UHFFFAOYSA-N lithium diisopropylamide Chemical group [Li+].CC(C)[N-]C(C)C ZCSHNCUQKCANBX-UHFFFAOYSA-N 0.000 description 8
- 239000000546 pharmaceutical excipient Substances 0.000 description 8
- 238000010561 standard procedure Methods 0.000 description 8
- 125000003944 tolyl group Chemical group 0.000 description 8
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 8
- ULGZDMOVFRHVEP-RWJQBGPGSA-N Erythromycin Chemical compound O([C@@H]1[C@@H](C)C(=O)O[C@@H]([C@@]([C@H](O)[C@@H](C)C(=O)[C@H](C)C[C@@](C)(O)[C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)O)[C@H]1C)(C)O)CC)[C@H]1C[C@@](C)(OC)[C@@H](O)[C@H](C)O1 ULGZDMOVFRHVEP-RWJQBGPGSA-N 0.000 description 7
- 150000001721 carbon Chemical group 0.000 description 7
- 239000008194 pharmaceutical composition Substances 0.000 description 7
- ITMCEJHCFYSIIV-UHFFFAOYSA-N triflic acid Chemical compound OS(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-N 0.000 description 7
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 6
- 235000019270 ammonium chloride Nutrition 0.000 description 6
- 229940126214 compound 3 Drugs 0.000 description 6
- 239000013078 crystal Substances 0.000 description 6
- 125000004430 oxygen atom Chemical group O* 0.000 description 6
- MEKOFIRRDATTAG-UHFFFAOYSA-N 2,2,5,8-tetramethyl-3,4-dihydrochromen-6-ol Chemical compound C1CC(C)(C)OC2=C1C(C)=C(O)C=C2C MEKOFIRRDATTAG-UHFFFAOYSA-N 0.000 description 5
- QBWKPGNFQQJGFY-QLFBSQMISA-N 3-[(1r)-1-[(2r,6s)-2,6-dimethylmorpholin-4-yl]ethyl]-n-[6-methyl-3-(1h-pyrazol-4-yl)imidazo[1,2-a]pyrazin-8-yl]-1,2-thiazol-5-amine Chemical compound N1([C@H](C)C2=NSC(NC=3C4=NC=C(N4C=C(C)N=3)C3=CNN=C3)=C2)C[C@H](C)O[C@H](C)C1 QBWKPGNFQQJGFY-QLFBSQMISA-N 0.000 description 5
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 5
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 5
- 239000002253 acid Substances 0.000 description 5
- 229910052783 alkali metal Inorganic materials 0.000 description 5
- 239000000872 buffer Substances 0.000 description 5
- PFKFTWBEEFSNDU-UHFFFAOYSA-N carbonyldiimidazole Chemical compound C1=CN=CN1C(=O)N1C=CN=C1 PFKFTWBEEFSNDU-UHFFFAOYSA-N 0.000 description 5
- 239000000969 carrier Substances 0.000 description 5
- 229940125846 compound 25 Drugs 0.000 description 5
- 238000001816 cooling Methods 0.000 description 5
- 239000003085 diluting agent Substances 0.000 description 5
- 239000003814 drug Substances 0.000 description 5
- 239000003937 drug carrier Substances 0.000 description 5
- 125000001033 ether group Chemical group 0.000 description 5
- 238000012544 monitoring process Methods 0.000 description 5
- 239000012074 organic phase Substances 0.000 description 5
- IUBQJLUDMLPAGT-UHFFFAOYSA-N potassium bis(trimethylsilyl)amide Chemical compound C[Si](C)(C)N([K])[Si](C)(C)C IUBQJLUDMLPAGT-UHFFFAOYSA-N 0.000 description 5
- 238000001953 recrystallisation Methods 0.000 description 5
- 239000007787 solid Substances 0.000 description 5
- 239000000725 suspension Substances 0.000 description 5
- OVGMKPGXRHJNKJ-UHFFFAOYSA-N (1-methylpyrrolidin-3-yl) 2-cyclopentyl-2-hydroxy-2-phenylacetate Chemical compound C1N(C)CCC1OC(=O)C(O)(C=1C=CC=CC=1)C1CCCC1 OVGMKPGXRHJNKJ-UHFFFAOYSA-N 0.000 description 4
- NLKACWKSCREJEL-GSVOUGTGSA-N (3r)-3-hydroxy-1-methylpyrrolidine-2,5-dione Chemical compound CN1C(=O)C[C@@H](O)C1=O NLKACWKSCREJEL-GSVOUGTGSA-N 0.000 description 4
- HUWSZNZAROKDRZ-RRLWZMAJSA-N (3r,4r)-3-azaniumyl-5-[[(2s,3r)-1-[(2s)-2,3-dicarboxypyrrolidin-1-yl]-3-methyl-1-oxopentan-2-yl]amino]-5-oxo-4-sulfanylpentane-1-sulfonate Chemical compound OS(=O)(=O)CC[C@@H](N)[C@@H](S)C(=O)N[C@@H]([C@H](C)CC)C(=O)N1CCC(C(O)=O)[C@H]1C(O)=O HUWSZNZAROKDRZ-RRLWZMAJSA-N 0.000 description 4
- FLVFPAIGVBQGET-YFKPBYRVSA-N (3s)-1-methylpyrrolidin-3-ol Chemical compound CN1CC[C@H](O)C1 FLVFPAIGVBQGET-YFKPBYRVSA-N 0.000 description 4
- NBDAHKQJXVLAID-UHFFFAOYSA-N 5-nitroisophthalic acid Chemical compound OC(=O)C1=CC(C(O)=O)=CC([N+]([O-])=O)=C1 NBDAHKQJXVLAID-UHFFFAOYSA-N 0.000 description 4
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 4
- 230000003197 catalytic effect Effects 0.000 description 4
- 125000000753 cycloalkyl group Chemical group 0.000 description 4
- 230000032050 esterification Effects 0.000 description 4
- 238000005886 esterification reaction Methods 0.000 description 4
- 150000002170 ethers Chemical class 0.000 description 4
- 239000005453 ketone based solvent Substances 0.000 description 4
- 239000007788 liquid Substances 0.000 description 4
- YDCHPLOFQATIDS-UHFFFAOYSA-N methyl 2-bromoacetate Chemical compound COC(=O)CBr YDCHPLOFQATIDS-UHFFFAOYSA-N 0.000 description 4
- 239000003960 organic solvent Substances 0.000 description 4
- 239000002244 precipitate Substances 0.000 description 4
- 239000011541 reaction mixture Substances 0.000 description 4
- 235000017557 sodium bicarbonate Nutrition 0.000 description 4
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 4
- WRIKHQLVHPKCJU-UHFFFAOYSA-N sodium bis(trimethylsilyl)amide Chemical compound C[Si](C)(C)N([Na])[Si](C)(C)C WRIKHQLVHPKCJU-UHFFFAOYSA-N 0.000 description 4
- 229910052938 sodium sulfate Inorganic materials 0.000 description 4
- 235000011152 sodium sulphate Nutrition 0.000 description 4
- 230000000707 stereoselective effect Effects 0.000 description 4
- 229940124597 therapeutic agent Drugs 0.000 description 4
- 239000003981 vehicle Substances 0.000 description 4
- ASTUNMYDURHXIM-RWANSRKNSA-N (5r)-2-tert-butyl-5-phenyl-1,3-dioxolan-4-one Chemical compound O=C1OC(C(C)(C)C)O[C@@H]1C1=CC=CC=C1 ASTUNMYDURHXIM-RWANSRKNSA-N 0.000 description 3
- BJEPYKJPYRNKOW-UWTATZPHSA-N (R)-malic acid Chemical compound OC(=O)[C@H](O)CC(O)=O BJEPYKJPYRNKOW-UWTATZPHSA-N 0.000 description 3
- IWYDHOAUDWTVEP-ZETCQYMHSA-N (S)-mandelic acid Chemical compound OC(=O)[C@@H](O)C1=CC=CC=C1 IWYDHOAUDWTVEP-ZETCQYMHSA-N 0.000 description 3
- OXHNLMTVIGZXSG-UHFFFAOYSA-N 1-Methylpyrrole Chemical compound CN1C=CC=C1 OXHNLMTVIGZXSG-UHFFFAOYSA-N 0.000 description 3
- KYEACNNYFNZCST-UHFFFAOYSA-N 1-methylpyrrolidine-2,5-dione Chemical compound CN1C(=O)CCC1=O KYEACNNYFNZCST-UHFFFAOYSA-N 0.000 description 3
- CAHWDGJDQYAFHM-UHFFFAOYSA-N 2-nitroisophthalic acid Chemical compound OC(=O)C1=CC=CC(C(O)=O)=C1[N+]([O-])=O CAHWDGJDQYAFHM-UHFFFAOYSA-N 0.000 description 3
- 239000004215 Carbon black (E152) Substances 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- OPFJDXRVMFKJJO-ZHHKINOHSA-N N-{[3-(2-benzamido-4-methyl-1,3-thiazol-5-yl)-pyrazol-5-yl]carbonyl}-G-dR-G-dD-dD-dD-NH2 Chemical compound S1C(C=2NN=C(C=2)C(=O)NCC(=O)N[C@H](CCCN=C(N)N)C(=O)NCC(=O)N[C@H](CC(O)=O)C(=O)N[C@H](CC(O)=O)C(=O)N[C@H](CC(O)=O)C(N)=O)=C(C)N=C1NC(=O)C1=CC=CC=C1 OPFJDXRVMFKJJO-ZHHKINOHSA-N 0.000 description 3
- 150000003973 alkyl amines Chemical class 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 229910052786 argon Inorganic materials 0.000 description 3
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 3
- 229940125904 compound 1 Drugs 0.000 description 3
- 229940126086 compound 21 Drugs 0.000 description 3
- 239000000839 emulsion Substances 0.000 description 3
- 238000004817 gas chromatography Methods 0.000 description 3
- 125000005843 halogen group Chemical group 0.000 description 3
- 150000004677 hydrates Chemical class 0.000 description 3
- 229930195733 hydrocarbon Natural products 0.000 description 3
- 150000002430 hydrocarbons Chemical class 0.000 description 3
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 3
- 229910052757 nitrogen Inorganic materials 0.000 description 3
- 239000003921 oil Substances 0.000 description 3
- 235000019198 oils Nutrition 0.000 description 3
- 235000011007 phosphoric acid Nutrition 0.000 description 3
- 230000035484 reaction time Effects 0.000 description 3
- 229930195734 saturated hydrocarbon Natural products 0.000 description 3
- 239000012453 solvate Substances 0.000 description 3
- 239000007858 starting material Substances 0.000 description 3
- NLKACWKSCREJEL-VKHMYHEASA-N (3s)-3-hydroxy-1-methylpyrrolidine-2,5-dione Chemical compound CN1C(=O)C[C@H](O)C1=O NLKACWKSCREJEL-VKHMYHEASA-N 0.000 description 2
- NSNLOMCYOUGTHC-DAFXYXGESA-N (5R)-2-tert-butyl-5-cyclopentyl-5-phenyl-1,3-dioxolan-4-one Chemical compound CC(C)(C)C1OC(=O)[C@@](O1)(C1CCCC1)C1=CC=CC=C1 NSNLOMCYOUGTHC-DAFXYXGESA-N 0.000 description 2
- DEVSOMFAQLZNKR-RJRFIUFISA-N (z)-3-[3-[3,5-bis(trifluoromethyl)phenyl]-1,2,4-triazol-1-yl]-n'-pyrazin-2-ylprop-2-enehydrazide Chemical compound FC(F)(F)C1=CC(C(F)(F)F)=CC(C2=NN(\C=C/C(=O)NNC=3N=CC=NC=3)C=N2)=C1 DEVSOMFAQLZNKR-RJRFIUFISA-N 0.000 description 2
- VPKKBWBYGRMALQ-UHFFFAOYSA-N 1-$l^{1}-azanylpyrrolidine Chemical group [N]N1CCCC1 VPKKBWBYGRMALQ-UHFFFAOYSA-N 0.000 description 2
- WZZBNLYBHUDSHF-DHLKQENFSA-N 1-[(3s,4s)-4-[8-(2-chloro-4-pyrimidin-2-yloxyphenyl)-7-fluoro-2-methylimidazo[4,5-c]quinolin-1-yl]-3-fluoropiperidin-1-yl]-2-hydroxyethanone Chemical compound CC1=NC2=CN=C3C=C(F)C(C=4C(=CC(OC=5N=CC=CN=5)=CC=4)Cl)=CC3=C2N1[C@H]1CCN(C(=O)CO)C[C@@H]1F WZZBNLYBHUDSHF-DHLKQENFSA-N 0.000 description 2
- AUOJZOUOQXWIMJ-UHFFFAOYSA-N 1-methyl-2h-pyridin-3-ol Chemical compound CN1CC(O)=CC=C1 AUOJZOUOQXWIMJ-UHFFFAOYSA-N 0.000 description 2
- YNQLUTRBYVCPMQ-UHFFFAOYSA-N Ethylbenzene Chemical compound CCC1=CC=CC=C1 YNQLUTRBYVCPMQ-UHFFFAOYSA-N 0.000 description 2
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 2
- 208000018522 Gastrointestinal disease Diseases 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- 229940121948 Muscarinic receptor antagonist Drugs 0.000 description 2
- LVDRREOUMKACNJ-BKMJKUGQSA-N N-[(2R,3S)-2-(4-chlorophenyl)-1-(1,4-dimethyl-2-oxoquinolin-7-yl)-6-oxopiperidin-3-yl]-2-methylpropane-1-sulfonamide Chemical compound CC(C)CS(=O)(=O)N[C@H]1CCC(=O)N([C@@H]1c1ccc(Cl)cc1)c1ccc2c(C)cc(=O)n(C)c2c1 LVDRREOUMKACNJ-BKMJKUGQSA-N 0.000 description 2
- 239000007832 Na2SO4 Substances 0.000 description 2
- 208000013738 Sleep Initiation and Maintenance disease Diseases 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
- 239000002671 adjuvant Substances 0.000 description 2
- 239000003513 alkali Substances 0.000 description 2
- 239000002168 alkylating agent Substances 0.000 description 2
- 229940100198 alkylating agent Drugs 0.000 description 2
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 2
- 230000001078 anti-cholinergic effect Effects 0.000 description 2
- 125000001246 bromo group Chemical group Br* 0.000 description 2
- LKXYJYDRLBPHRS-UHFFFAOYSA-N bromocyclopropane Chemical compound BrC1CC1 LKXYJYDRLBPHRS-UHFFFAOYSA-N 0.000 description 2
- GZUXJHMPEANEGY-UHFFFAOYSA-N bromomethane Chemical compound BrC GZUXJHMPEANEGY-UHFFFAOYSA-N 0.000 description 2
- 239000000812 cholinergic antagonist Substances 0.000 description 2
- 229940125898 compound 5 Drugs 0.000 description 2
- 125000004122 cyclic group Chemical group 0.000 description 2
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 2
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 2
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 2
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 2
- 208000010643 digestive system disease Diseases 0.000 description 2
- 208000002173 dizziness Diseases 0.000 description 2
- 230000000694 effects Effects 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 208000018685 gastrointestinal system disease Diseases 0.000 description 2
- 229960002462 glycopyrronium bromide Drugs 0.000 description 2
- 150000004820 halides Chemical class 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-M hydroxide Chemical compound [OH-] XLYOFNOQVPJJNP-UHFFFAOYSA-M 0.000 description 2
- 206010022437 insomnia Diseases 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 239000012035 limiting reagent Substances 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 125000004433 nitrogen atom Chemical group N* 0.000 description 2
- 239000008363 phosphate buffer Substances 0.000 description 2
- 125000001453 quaternary ammonium group Chemical group 0.000 description 2
- 208000023504 respiratory system disease Diseases 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- 125000001424 substituent group Chemical group 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 1
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 description 1
- MPDDTAJMJCESGV-CTUHWIOQSA-M (3r,5r)-7-[2-(4-fluorophenyl)-5-[methyl-[(1r)-1-phenylethyl]carbamoyl]-4-propan-2-ylpyrazol-3-yl]-3,5-dihydroxyheptanoate Chemical compound C1([C@@H](C)N(C)C(=O)C2=NN(C(CC[C@@H](O)C[C@@H](O)CC([O-])=O)=C2C(C)C)C=2C=CC(F)=CC=2)=CC=CC=C1 MPDDTAJMJCESGV-CTUHWIOQSA-M 0.000 description 1
- NSNLOMCYOUGTHC-UHUGOGIASA-N (5S)-2-tert-butyl-5-cyclopentyl-5-phenyl-1,3-dioxolan-4-one Chemical compound CC(C)(C)C1OC(=O)[C@](O1)(C1CCCC1)C1=CC=CC=C1 NSNLOMCYOUGTHC-UHUGOGIASA-N 0.000 description 1
- 125000004454 (C1-C6) alkoxycarbonyl group Chemical group 0.000 description 1
- FLVFPAIGVBQGET-UHFFFAOYSA-N 1-methylpyrrolidin-3-ol Chemical compound CN1CCC(O)C1 FLVFPAIGVBQGET-UHFFFAOYSA-N 0.000 description 1
- ZNOVTXRBGFNYRX-UHFFFAOYSA-N 2-[[4-[(2-amino-5-methyl-4-oxo-1,6,7,8-tetrahydropteridin-6-yl)methylamino]benzoyl]amino]pentanedioic acid Chemical compound C1NC=2NC(N)=NC(=O)C=2N(C)C1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 ZNOVTXRBGFNYRX-UHFFFAOYSA-N 0.000 description 1
- KFIRODWJCYBBHY-UHFFFAOYSA-N 3-nitrophthalic acid Chemical group OC(=O)C1=CC=CC([N+]([O-])=O)=C1C(O)=O KFIRODWJCYBBHY-UHFFFAOYSA-N 0.000 description 1
- 208000019901 Anxiety disease Diseases 0.000 description 1
- 206010006458 Bronchitis chronic Diseases 0.000 description 1
- 102000014914 Carrier Proteins Human genes 0.000 description 1
- 108010078791 Carrier Proteins Proteins 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 description 1
- 206010009900 Colitis ulcerative Diseases 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- 206010012735 Diarrhoea Diseases 0.000 description 1
- KRHYYFGTRYWZRS-UHFFFAOYSA-M Fluoride anion Chemical compound [F-] KRHYYFGTRYWZRS-UHFFFAOYSA-M 0.000 description 1
- 208000007882 Gastritis Diseases 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- VPNYRYCIDCJBOM-UHFFFAOYSA-M Glycopyrronium bromide Chemical class [Br-].C1[N+](C)(C)CCC1OC(=O)C(O)(C=1C=CC=CC=1)C1CCCC1 VPNYRYCIDCJBOM-UHFFFAOYSA-M 0.000 description 1
- 102000008100 Human Serum Albumin Human genes 0.000 description 1
- 108091006905 Human Serum Albumin Proteins 0.000 description 1
- OAKJQQAXSVQMHS-UHFFFAOYSA-N Hydrazine Chemical compound NN OAKJQQAXSVQMHS-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- 235000019485 Safflower oil Nutrition 0.000 description 1
- 206010040741 Sinus bradycardia Diseases 0.000 description 1
- 208000005392 Spasm Diseases 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 1
- 201000006704 Ulcerative Colitis Diseases 0.000 description 1
- 208000025609 Urogenital disease Diseases 0.000 description 1
- 206010047700 Vomiting Diseases 0.000 description 1
- TVXBFESIOXBWNM-UHFFFAOYSA-N Xylitol Natural products OCCC(O)C(O)C(O)CCO TVXBFESIOXBWNM-UHFFFAOYSA-N 0.000 description 1
- OVGMKPGXRHJNKJ-AEFFLSMTSA-N [(3r)-1-methylpyrrolidin-3-yl] (2r)-2-cyclopentyl-2-hydroxy-2-phenylacetate Chemical compound C1N(C)CC[C@H]1OC(=O)[C@](O)(C=1C=CC=CC=1)C1CCCC1 OVGMKPGXRHJNKJ-AEFFLSMTSA-N 0.000 description 1
- 239000008351 acetate buffer Substances 0.000 description 1
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 238000013019 agitation Methods 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 150000001350 alkyl halides Chemical class 0.000 description 1
- 230000002152 alkylating effect Effects 0.000 description 1
- 230000029936 alkylation Effects 0.000 description 1
- 238000005804 alkylation reaction Methods 0.000 description 1
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 1
- 239000004599 antimicrobial Substances 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 230000036506 anxiety Effects 0.000 description 1
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 1
- 208000006673 asthma Diseases 0.000 description 1
- 125000004429 atom Chemical group 0.000 description 1
- 238000010533 azeotropic distillation Methods 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-M benzoate Chemical compound [O-]C(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-M 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- XGIUDIMNNMKGDE-UHFFFAOYSA-N bis(trimethylsilyl)azanide Chemical compound C[Si](C)(C)[N-][Si](C)(C)C XGIUDIMNNMKGDE-UHFFFAOYSA-N 0.000 description 1
- 206010006451 bronchitis Diseases 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 235000010980 cellulose Nutrition 0.000 description 1
- 125000001309 chloro group Chemical group Cl* 0.000 description 1
- 208000007451 chronic bronchitis Diseases 0.000 description 1
- 239000007979 citrate buffer Substances 0.000 description 1
- 239000003240 coconut oil Substances 0.000 description 1
- 235000019864 coconut oil Nutrition 0.000 description 1
- 229940125773 compound 10 Drugs 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 235000012343 cottonseed oil Nutrition 0.000 description 1
- 239000002385 cottonseed oil Substances 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 125000000000 cycloalkoxy group Chemical group 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000002933 cyclohexyloxy group Chemical group C1(CCCCC1)O* 0.000 description 1
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 201000003146 cystitis Diseases 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- VILAVOFMIJHSJA-UHFFFAOYSA-N dicarbon monoxide Chemical group [C]=C=O VILAVOFMIJHSJA-UHFFFAOYSA-N 0.000 description 1
- 150000002016 disaccharides Chemical class 0.000 description 1
- 230000008034 disappearance Effects 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 208000007784 diverticulitis Diseases 0.000 description 1
- 238000012377 drug delivery Methods 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 description 1
- 125000003754 ethoxycarbonyl group Chemical group C(=O)(OCC)* 0.000 description 1
- PQJJJMRNHATNKG-UHFFFAOYSA-N ethyl bromoacetate Chemical compound CCOC(=O)CBr PQJJJMRNHATNKG-UHFFFAOYSA-N 0.000 description 1
- 239000003925 fat Substances 0.000 description 1
- 235000019197 fats Nutrition 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 229940015042 glycopyrrolate Drugs 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000003707 hexyloxy group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])O* 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-M hydrogensulfate Chemical compound OS([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-M 0.000 description 1
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 1
- 150000003949 imides Chemical class 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 150000007529 inorganic bases Chemical class 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-M iodide Chemical compound [I-] XMBWDFGMSWQBCA-UHFFFAOYSA-M 0.000 description 1
- 125000002346 iodo group Chemical group I* 0.000 description 1
- 239000003456 ion exchange resin Substances 0.000 description 1
- 229920003303 ion-exchange polymer Polymers 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- QQVIHTHCMHWDBS-UHFFFAOYSA-L isophthalate(2-) Chemical compound [O-]C(=O)C1=CC=CC(C([O-])=O)=C1 QQVIHTHCMHWDBS-UHFFFAOYSA-L 0.000 description 1
- ZLVXBBHTMQJRSX-VMGNSXQWSA-N jdtic Chemical compound C1([C@]2(C)CCN(C[C@@H]2C)C[C@H](C(C)C)NC(=O)[C@@H]2NCC3=CC(O)=CC=C3C2)=CC=CC(O)=C1 ZLVXBBHTMQJRSX-VMGNSXQWSA-N 0.000 description 1
- 238000005304 joining Methods 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- HEBKCHPVOIAQTA-UHFFFAOYSA-N meso ribitol Natural products OCC(O)C(O)C(O)CO HEBKCHPVOIAQTA-UHFFFAOYSA-N 0.000 description 1
- 125000001160 methoxycarbonyl group Chemical group [H]C([H])([H])OC(*)=O 0.000 description 1
- 229940102396 methyl bromide Drugs 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 125000000250 methylamino group Chemical group [H]N(*)C([H])([H])[H] 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 235000010755 mineral Nutrition 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 239000003607 modifier Substances 0.000 description 1
- 150000002772 monosaccharides Chemical class 0.000 description 1
- 201000003152 motion sickness Diseases 0.000 description 1
- SJPQUECDNWANFT-UHFFFAOYSA-N n-(2-hydroxypropyl)-n-methylnitrous amide Chemical compound CC(O)CN(C)N=O SJPQUECDNWANFT-UHFFFAOYSA-N 0.000 description 1
- 210000002850 nasal mucosa Anatomy 0.000 description 1
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 1
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 1
- 229940068977 polysorbate 20 Drugs 0.000 description 1
- 229920000053 polysorbate 80 Polymers 0.000 description 1
- 229940068968 polysorbate 80 Drugs 0.000 description 1
- 229910000160 potassium phosphate Inorganic materials 0.000 description 1
- 235000011009 potassium phosphates Nutrition 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 230000001376 precipitating effect Effects 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 229940002612 prodrug Drugs 0.000 description 1
- 239000000651 prodrug Substances 0.000 description 1
- 201000007094 prostatitis Diseases 0.000 description 1
- 239000008213 purified water Substances 0.000 description 1
- 239000000376 reactant Substances 0.000 description 1
- 235000005713 safflower oil Nutrition 0.000 description 1
- 239000003813 safflower oil Substances 0.000 description 1
- 210000003296 saliva Anatomy 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 230000001624 sedative effect Effects 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 1
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 239000003549 soybean oil Substances 0.000 description 1
- 235000012424 soybean oil Nutrition 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 239000008362 succinate buffer Substances 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 150000005846 sugar alcohols Polymers 0.000 description 1
- 235000011149 sulphuric acid Nutrition 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 238000010189 synthetic method Methods 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 235000012222 talc Nutrition 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 239000003860 topical agent Substances 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- ODLHGICHYURWBS-LKONHMLTSA-N trappsol cyclo Chemical compound CC(O)COC[C@H]([C@H]([C@@H]([C@H]1O)O)O[C@H]2O[C@@H]([C@@H](O[C@H]3O[C@H](COCC(C)O)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](COCC(C)O)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](COCC(C)O)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](COCC(C)O)[C@H]([C@@H]([C@H]3O)O)O3)[C@H](O)[C@H]2O)COCC(O)C)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@@H]3O[C@@H]1COCC(C)O ODLHGICHYURWBS-LKONHMLTSA-N 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- 238000001665 trituration Methods 0.000 description 1
- 208000000143 urethritis Diseases 0.000 description 1
- 210000001186 vagus nerve Anatomy 0.000 description 1
- 239000004034 viscosity adjusting agent Substances 0.000 description 1
- 239000001993 wax Substances 0.000 description 1
- 239000000811 xylitol Substances 0.000 description 1
- HEBKCHPVOIAQTA-SCDXWVJYSA-N xylitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)CO HEBKCHPVOIAQTA-SCDXWVJYSA-N 0.000 description 1
- 229960002675 xylitol Drugs 0.000 description 1
- 235000010447 xylitol Nutrition 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D207/00—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D207/02—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D207/04—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D207/10—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D207/12—Oxygen or sulfur atoms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/02—Drugs for disorders of the nervous system for peripheral neuropathies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B57/00—Separation of optically-active compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/07—Optical isomers
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Dermatology (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Pyrrole Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Description
本出願は、参照によりその全内容が全ての目的で本明細書に組み込まれている、2016年8月2日に出願された米国仮特許出願第62/370,172号の優先権を主張するものである。
R1及びR2はそれぞれ、いずれの場合も独立して、アルキル、及びアルコキシカルボニルで置換されたアルキルから選択され;
2により示される炭素原子に関する立体化学配置はRであり;
3’により示される炭素原子に関する立体化学配置はRであり;
X-は、アニオンである。)
の化合物を作製するための方法であって、
式(Ia)の化合物と式(Ib)の化合物とをカップリング条件下で接触させて、式(Ic)の化合物を形成するステップ(1)と、
本明細書で使用される「収率」という用語は、所与の化学反応に関する実験収率を指す。収率は、反応が進行して所与の生成物を生成する程度を表すパーセントである。パーセント収率は、化学反応を想定し、化学試薬の全てが反応して生成物になることを想定することによって計算されるが、反応が進行するにつれて最初に消費される試薬である限定試薬によってのみ制限される。この初期の計算は、理論収率として公知のものをもたらす。反応が、実験的に行われたら、生成物を分析する。生成物の量は、集合させ、分光学的に決定し、又はその他の実験手段により決定されてもよい。集合させ、分光学的に決定し、又はその他の実験手段により決定される生成物の量は、実験収率を表す。本明細書で及び特許請求の範囲で使用される「収率」は実験収率/理論収率の商に、次いで100を乗じたものを指す。例えば、反応A+2B→Cにおいて、Aが1モル及びBが1モルある場合、A 1モルと反応するのにB 2モルが必要であるのでBは限定試薬である。反応例により、B 1モルはC 0.5モルを生成することになる。A 1モルがB 1モルと反応し、C 0.4モルが生成されたことが実験的に決定された場合、理論収率は0.5モルになる可能性があり、実験収率は0.4モルになる可能性がある。したがって収率パーセントは、(0.4/0.5)(100)=80%であるので80%と考えられる。
ある特定の実施例で、本明細書では、式(I):
2により示される炭素原子に関する立体化学配置はRであり;
3’により示される炭素原子に関する立体化学配置はRであり;
X-は、アニオンである。
本明細書のある特定の実施例では、本開示は、式(Ib):
一部の実施例では、本明細書において、化合物、化合物の混合物、立体異性体の混合物又はこれらの組合せであって、本明細書に記載される方法により調製された化合物、化合物の混合物、立体異性体の混合物が記載される。
(式中:
R1及びR2がそれぞれいずれの場合も独立して、アルキル、及びアルコキシカルボニルで置換されたアルキルから選択され;
2により示される炭素原子に関する立体化学配置はRであり;
3’により示される炭素原子に関する立体化学配置はRであり;且つ
X-は、アニオンである。)
生成物が提供される。
(式中、R1は、アルキルからなる群から選択される。)
生成物が提供される。
本開示は、疾患、状態又は障害、例えば多汗症を治療する方法であって、それを必要とする対象に、グリコピロニウム化合物(例えば、3’(R)-[R-シクロペンチルフェニルヒドロキシアセトイ]-1’-エチル-1’メトキシカルボニルピロリジニウムブロミドなどのグリコピロニウム塩)などであるがこれらに限定することのない本明細書に開示される療法上有効な量の又は1種若しくは2種以上の化合物を投与するステップを含む、方法について記載する。疾患、障害及び/又は状態には、多汗症又は不安症に関連付けられるものが含まれるがこれらに限定するものではない。疾患、障害及び/又は状態には、抗コリン作用薬が療法剤である任意の徴候が含まれるが、これらに限定するものではない。本明細書の一部の実施例では、疾患、状態又は障害を治療する方法は、胃腸障害を治療するステップを含む。一部の実施例では、疾患、状態又は障害を治療する方法は、胃炎、下痢、幽門痙攣、憩室炎、潰瘍性大腸炎、吐き気及び嘔吐から選択される胃腸障害を治療するステップを含む。
[実施例]
他に指示しない限り、化学試薬は、商業上入手可能な供給元から購入した。
R(-)-シクロペンチルマンデル酸(化合物4)は、図1のスキームによりR(-)-マンデル酸(化合物1)から開始して合成することができる。化合物1及び4は、Sigma-Aldrich社から購入することもできる。
R(-)-マンデル酸(1)をヘキサン中に懸濁し、ピバルデヒド及び触媒量のトリフルオロメタンスルホン酸と室温で混合して、混合物を形成した。詳細には、R(-)-マンデル酸のヘキサン懸濁液(50g、328mmol)を、ピバルデヒド(42.7ml、396mmol)と混合し、次いでトリフルオロメタンスルホン酸(1.23ml、14mmol)と室温で混合した。混合物を36℃に温め、次いで約5時間反応させた。反応の後、出発材料が検出できなくなるまでTLCを5時間行った。次いで混合物を室温に冷却した。次いで混合物を室温に冷却し、8%の水性重炭酸ナトリウムで処理した。水性層を除去し、有機層を無水硫酸ナトリウム上で乾燥した。真空中での溶媒の濾過及び除去後、粗製生成物を再結晶化させて、(5R)-2-(tert-ブチル)-5-フェニル-1,3-ジオキソラン-4-オン(化合物2)が収率88%(S-鏡像異性体収率当たり)で得られた。
一般に、化合物2をリチウムヘキサメチルジシラジド(LiHMDS、lithium hexamethyl disilazide)とヘキサン中で、-78℃で1時間撹拌しながら反応させた。次に、臭化シクロペンチルを、化合物2とLiHMDSとの反応に添加した。反応を約4時間冷却したままにし、次いでゆっくり室温まで温め、さらに少なくとも12時間反応させた。次いで得られた混合物を、10%の水性塩化アンモニウムで処理した。水性層を廃棄し、有機層を無水硫酸ナトリウム上で乾燥した。溶媒を真空中で除去し、残留物をヘキサンから再結晶化して、純粋な生成物(5R)-2-(tert-ブチル)-5-シクロペンチル-5-フェニル-1,3-ジオキソラン-4-オン(3)を、63%の収率(S-鏡像異性体収率当たり)で得た。ある特定の場合、-78℃で、リチウムビス-(トリメチルシリル)アミドのヘキサン溶液(120ml、120mmol、ヘキサン中1.0M)を化合物2(25g、113.5mmol、乾燥THF 100mlに溶解した)に添加し、1時間撹拌し、その後、臭化シクロペンチル(25g、168mmol)を添加した。反応を-78℃で4時間保持し、次いでゆっくりと室温まで温め、さらに12時間反応させた。反応の終了後、TLCを行った。撹拌しながら、NH4Clの10%の溶液(25ml)を混合物に添加した。次いで混合物を、10%のNH4Cl溶液(200ml)が入っている分液漏斗に注いだ。水性層を廃棄し、有機層をNa2SO4上で乾燥した。溶媒を除去して粗製生成物を得、次いでこれをヘキサン中に再結晶化して、純粋な生成物(20.36g、収率63%、白色結晶)を得た。
R(-)-シクロペンチルマンデル酸(化合物4)は、化合物3を、水性メタノール性水酸化カリウム中に65℃で4時間供給することによって、調製した。この混合物を室温まで冷却し、真空中でメタノールを除去した後、水溶液を、塩酸水溶液で酸性化した。次いで水溶液を酢酸エチルで2回抽出し、有機相を無水硫酸ナトリウムで乾燥した。溶媒を除去し、再結晶化を行った後、純粋なR(-)-シクロペンチルマンデル酸(化合物4)を、62%の収率(S-鏡像異性体収率に基づく)で得た。
(R)-1-メチルピロリジン-3-オール(化合物7)を、R(-)-リンゴ酸で開始して調製した。
R(-)-リンゴ酸((S)-2-ヒドロキシコハク酸としても公知である)(化合物5)をメチルアミン(CH3NH2)と反応させて、(R)-3-ヒドロキシ-1-メチルピロリジン-2,5-ジオン(化合物6)を形成した。(R)-3-ヒドロキシ-1-メチルピロリジン-2,5-ジオン(6)を還元剤で処理して、(R)-1-メチルピロリジン-3-オール(化合物7)を形成した。ある場合には、化合物6の還元を、NaAlH4/LiClを使用して行った。塩化リチウム(0.11モル)をTHFに溶かした冷却溶液に、NaAlH4(0.22モル)をトルエン/THFに溶かしたものを、アルゴン中で添加した。N-メチルスクシンイミド(0.083モル)をTHFに溶かしたものを、温度を15℃よりも低く保持しながら添加した。添加が終了した後、反応を室温まで温めた。室温で30分後、反応を、2時間にわたり40℃よりも高く加熱した。次いで反応を5℃未満に冷却し、次いでトルエン(50ml)を添加した。次いで水(9ml)を、温度を15℃よりも低く保持しながらゆっくり添加した。追加のH2O又は水性NaOHを、必要に応じて使用した。不溶性無機塩を、濾過によって除去する。これらの固形分を、追加のTHF又はトルエンで洗浄して、GLC分析により決定されるように、N-メチルピロールを含有した溶液を得る。
ステップ5:化合物8の作製。
1,1-カルボニルジイミドアゾール(CDI)活性化エステル化を使用して、R(-)-シクロペンチルマンデル酸(4)を、(R)-1-メチルピロリジン-3-オール(7)にカップリングし、ジアステレオマーとして純粋な2R3’R-グリコピロレート塩基(化合物8)を作製した。R2R3’R-グリコピロレート塩基(化合物8)を、90%よりも高い収率で得た。
ステップ6:化合物9の作製。
グリコピロレート塩基、化合物8((R)-1-メチルピロリジン-3-イル-(R)-2-シクロペンチル-2-ヒドロキシ-2-フェニルアセテート)を、乾燥アセトニトリル中、ブロモ酢酸メチルで室温で、3時間撹拌しながら処理した。粗製生成物を少量の塩化メチレンに溶解し、乾燥エチルエーテル中に注いで、沈殿物を得た。この手順を3回繰り返して、臭化3’(R)-[R-シクロペンチルフェニルヒドロキシアセトイ]-1’-エチル-1’メトキシカルボニルピロリジニウムとしても公知の臭化(3R)-3-((R)-2-シクロペンチル-2-ヒドロキシ-2-フェニルアセトキシ)-1-(2-エトキシ-2-オキソエチル)-1-メチルピロリジン-1-イウム(化合物9)を、89%の収率で得た。
R(-)-シクロペンチルマンデル酸(化合物4)は、実施例1によるR(-)-マンデル酸(化合物1)で開始して合成することができる。
R(-)-マンデル酸(1)をヘキサンに懸濁し、ピバルデヒド及び触媒量のトリフルオロメタンスルホン酸と室温で混合して、混合物を形成した。混合物を36℃に温め、次いで約5時間反応させた。次いで混合物を室温まで冷却し、8%の水性重炭酸ナトリウムで処理した。水性層を除去し、有機層を無水硫酸ナトリウム上で乾燥した。真空中での溶媒の濾過及び除去の後、粗製生成物を再結晶化させて、(5R)-2-(tert-ブチル)-5-フェニル-1,3-ジオキソラン-4-オン(化合物2)が88%の収率(S-鏡像異性体収率当たり)で得られた。
化合物2を、リチウムヘキサメチルジシラジド(LiHMDS)と、ヘキサン中、-78℃で、1時間撹拌しながら反応させた。次に、臭化シクロペンチルを、化合物2及びLiHMDSを含む反応混合物に添加した。反応を、約4時間冷却したままにし、次いでゆっくり室温まで温め、さらに少なくとも12時間反応させた。次いで得られた混合物を、10%の水性塩化アンモニウムで処理した。水性層を廃棄し、有機層を無水硫酸ナトリウム上で乾燥させた。溶媒を真空中で除去し、残留物をヘキサンから再結晶化させて、純粋な生成物(5R)-2-(tert-ブチル)-5-シクロペンチル-5-フェニル-1,3-ジオキソラン-4-オン(3)を、63%の収率(S-鏡像異性体収率当たり)で得た。
R(-)-シクロペンチルマンデル酸(化合物4)は、化合物3を、水性メタノール性水酸化カリウムに、65℃で4時間にわたり供給することによって調製した。この混合物を室温に冷却し、真空中でメタノールを除去した後、水溶液を、塩酸水溶液で酸性化した。次いで水溶液を、酢酸エチルで2回抽出し、有機相を、無水硫酸ナトリウムで乾燥させた。溶媒を除去し、再結晶化を行った後、純粋なR(-)-シクロペンチルマンデル酸(化合物4)が、62%の収率(S-鏡像異性体収率に基づく)で得られた。
ステップ4:化合物8の作製。
鏡像異性体として純粋なR(-)-シクロペンチルマンデル酸(4)を、1,1-カルボニルジイミドアゾール(CDI)活性化エステル化を使用してラセミ1-メチル-3-ピリジノール(20)にカップリングし、下記のエリトロ-及びトレオ-グリコピロレート塩基(それぞれ、化合物8及び21)の鏡像異性体として純粋な混合物を作製した:
グリコピロレート塩基、化合物8を、乾燥アセトニトリル中、ブロモ酢酸メチルで室温で、3時間撹拌しながら処理した。粗製生成物を少量の塩化メチレンに溶解し、乾燥エチルエーテルに注いで、沈殿物を得た。この手順を3回繰り返して、臭化3’(R)-[R-シクロペンチルフェニルヒドロキシアセトイ]-1’-エチル-1’メトキシカルボニルピロリジニウムとしても公知の臭化(3R)-3-((R)-2-シクロペンチル-2-ヒドロキシ-2-フェニルアセトキシ)-1-(2-エトキシ-2-オキソエチル)-1-メチルピロリジン-1-イウム(化合物9)を、89%の収率で得た。化合物9は、下記の立体異性体:
S(+)-シクロペチルマンデル酸(化合物40)は、図3のスキームによりS(+)-マンデル酸(化合物10)で開始して合成することができる。化合物10及び40は、Sigma-Aldrich社から購入することができる。
S(+)-マンデル酸(10)をヘキサン中に懸濁し、ピバルデヒド及び触媒量のトリフルオロメタンスルホン酸と室温で混合して、混合物を形成した。詳細には、S(+)-マンデル酸のヘキサン懸濁液(50g、328mmol)を、ピバルデヒド(42.7ml、396mmol)と混合し、次いでトリフルオロメタンスルホン酸(1.23ml、14mmol)と室温で混合した。混合物を36℃に温め、次いで約5時間反応させた。反応の後、出発材料が検出できなくなるまでTLCを5時間行った。次いで混合物を室温に冷却した。次いで混合物を室温に冷却し、8%の水性重炭酸ナトリウムで処理した。水性層を除去し、有機層を無水硫酸ナトリウム上で乾燥した。真空中での溶媒の濾過及び除去後、粗製生成物を再結晶化させて、cis-(2R,5S)-2-tert-ブチル)-5-フェニル-1,3-ジオキソラン-4-オン(化合物25)が収率88%(S-鏡像異性体収率当たり)で得られた。
一般に、化合物25をリチウムヘキサメチルジシラジド(LiHMDS)とヘキサン中で、-78℃で1時間撹拌しながら反応させた。次に、臭化シクロペンチルを、化合物25とLiHMDSとの反応に添加した。反応を約4時間冷却したままにし、次いでゆっくり室温まで温め、さらに少なくとも12時間反応させた。次いで得られた混合物を、10%の水性塩化アンモニウムで処理した。水性層を廃棄し、有機層を無水硫酸ナトリウム上で乾燥した。溶媒を真空中で除去し、残留物をヘキサンから再結晶化して、純粋な生成物(5S)-2-(tert-ブチル)-5-シクロペンチル-5-フェニル-1,3-ジオキソラン-4-オン(30)を得た。ある特定の場合、-78℃で、リチウムビス-(トリメチルシリル)アミドのヘキサン溶液(120ml、120mmol、ヘキサン中1.0M)を化合物25(25g、113.5mmol、乾燥THF 100mlに溶解した)に添加し、1時間撹拌し、その後、臭化シクロペンチル(25g、168mmol)を添加した。反応を-78℃で4時間保持し、次いでゆっくりと室温まで温め、さらに12時間反応させた。反応の終了後、TLCを行った。撹拌しながら、NH4Clの10%の溶液(25ml)を混合物に添加した。次いで混合物を、10%のNH4Cl溶液(200ml)が入っている分液漏斗に注いだ。水性層を廃棄し、有機層をNa2SO4上で乾燥した。溶媒を除去して粗製生成物を得、次いで、これをヘキサン中で再結晶化して、純粋な生成物(20.36g、収率63%、白色結晶)を得た。
S(+)-シクロペンチルマンデル酸(化合物40)は、化合物30を、水性メタノール性水酸化カリウム中に65℃で4時間供給することによって、調製した。この混合物を室温まで冷却し、真空中でメタノールを除去した後、水溶液を、塩酸水溶液で酸性化した。次いで水溶液を酢酸エチルで2回抽出し、有機相を無水硫酸ナトリウムで乾燥した。溶媒を除去し、再結晶化を行った後、純粋なS(+)-シクロペンチルマンデル酸(化合物40)が得られた。
(R)-1-メチルピロリジン-3-オール(化合物7)を、R(-)-リンゴ酸で開始して調製した。
R(-)-リンゴ酸((S)-2-ヒドロキシコハク酸としても公知である)(化合物5)をメチルアミン(CH3NH2)と反応させて、(R)-3-ヒドロキシ-1-メチルピロリジン-2,5-ジオン(化合物6)を形成した。(R)-3-ヒドロキシ-1-メチルピロリジン-2,5-ジオン(6)を還元剤で処理して、(R)-1-メチルピロリジン-3-オール(化合物7)を形成した。ある場合には、化合物6の還元を、NaAlH4/LiClを使用して行った。塩化リチウム(0.11モル)をTHFに溶かした冷却溶液に、NaAlH4(0.22モル)をトルエン/THFに溶かしたものを、アルゴン中で添加した。N-メチルスクシンイミド(0.083モル)をTHFに溶かしたものを、温度を15℃よりも低く保持しながら添加した。添加が終了した後、反応を室温まで温めた。室温で30分後、反応を、2時間にわたり40℃よりも高く加熱した。次いで反応を5℃未満に冷却し、次いでトルエン(50ml)を添加した。次いで水(9ml)を、温度を15℃よりも低く保持しながらゆっくり添加した。追加のH2O又は水性NaOHを、必要に応じて使用した。不溶性無機塩を、濾過によって除去する。これらの固形分を、追加のTHF又はトルエンで洗浄して、GLC分析により決定されるように、N-メチルピロールを含有した溶液を得る。
ステップ5:化合物8の作製。
1,1-カルボニルジイミドアゾール(CDI)活性化エステル化を使用して、S(+)-シクロペンチルマンデル酸(40)を、(R)-1-メチルピロリジン-3-オール(7)にカップリングし、ジアステレオマーとして純粋な2S3’R-グリコピロレート塩基(化合物80)を作製した。S2R3’R-グリコピロレート塩基(化合物80)を、90%よりも高い収率で得た。
ステップ6:化合物90の作製。
グリコピロレート塩基、化合物80を、乾燥アセトニトリル中、ブロモ酢酸メチルで室温で、3時間撹拌しながら処理した。粗製生成物を少量の塩化メチレンに溶解し、乾燥エチルエーテル中に注いで、沈殿物を得た。この手順を3回繰り返して、臭化3’(R)-[S-シクロペンチルフェニルヒドロキシアセトイ]-1’-エチル-1’メトキシカルボニルピロリジニウムとしても公知の臭化(3R)-3-((S)-2-シクロペンチル-2-ヒドロキシ-2-フェニルアセトキシ)-1-(2-エトキシ-2-オキソエチル)-1-メチルピロリジン-1-イウム(化合物90)を得た。
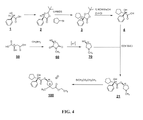
R(-)-シクロペチルマンデル酸(化合物4)は、図4のスキームによりR(-)-マンデル酸(化合物1)で開始して合成することができる。化合物1及び4は、Sigma-Aldrich社から購入することもできる。
R(-)-マンデル酸(1)を、ヘキサンに懸濁し、ピバルデヒド及び触媒量のトリフルオロメタンスルホン酸と室温で混合して、混合物を形成する。詳細には、R(-)-マンデル酸のヘキサン懸濁液(50g、328mmol)を、ピバルデヒド(42.7ml、396mmol)と混合し、次いでトリフルオロメタンスルホン酸(1.23ml、14mmol)と室温で混合する。混合物を36℃に温め、次いで約5時間反応させる。反応の後、出発材料が検出できなくなるまでTLCを5時間行う。次いで混合物を室温に冷却する。次いで混合物を室温に冷却し、8%の水性重炭酸ナトリウムで処理する。水性層を除去し、有機層を無水硫酸ナトリウム上で乾燥する。真空中での溶媒の濾過及び除去後、粗製生成物を再結晶化させて、(5R)-2-(tert-ブチル)-5-フェニル-1,3-ジオキソラン-4-オン(化合物2)を得る。
一般に、化合物2をリチウムヘキサメチルジシラジド(LiHMDS)とヘキサン中で、-78℃で1時間撹拌しながら反応させる。次に、臭化シクロペンチルを、化合物2とLiHMDSとの反応に添加する。反応を約4時間冷却したままにし、次いでゆっくり室温まで温め、さらに少なくとも12時間反応させる。次いで得られた混合物を、10%の水性塩化アンモニウムで処理する。水性層を廃棄し、有機層を無水硫酸ナトリウム上で乾燥する。溶媒を真空中で除去し、残留物をヘキサンから再結晶化して、純粋な生成物(5R)-2-(tert-ブチル)-5-シクロペンチル-5-フェニル-1,3-ジオキソラン-4-オン(3)を得る。ある特定の場合、-78℃で、リチウムビス-(トリメチルシリル)アミドのヘキサン溶液(120ml、120mmol、ヘキサン中1.0M)を化合物2(25g、113.5mmol、乾燥THF 100mlに溶解した)に添加し、1時間撹拌し、その後、臭化シクロペンチル(25g、168mmol)を添加する。反応を-78℃で4時間保持し、次いでゆっくりと室温まで温め、さらに12時間反応させる。反応の終了後、TLCを行う。撹拌しながら、NH4Clの10%の溶液(25ml)を混合物に添加する。次いで混合物を、10%のNH4Cl溶液(200ml)が入っている分液漏斗に注ぐ。水性層を廃棄し、有機層をNa2SO4上で乾燥する。溶媒を除去して粗製生成物を得、次いでこれをヘキサン中に再結晶化させて、純粋な生成物を得る。
R(-)-シクロペンチルマンデル酸(化合物4)は、化合物3を、水性メタノール性水酸化カリウム中に65℃で4時間供給することによって、調製する。この混合物を室温まで冷却し、真空中でメタノールを除去した後、水溶液を、塩酸水溶液で酸性化する。次いで水溶液を酢酸エチルで2回抽出し、有機相を無水硫酸ナトリウムで乾燥する。溶媒を除去し、再結晶化を行った後、純粋なR(-)-シクロペンチルマンデル酸(化合物4)が得られる。
(S)-1-メチルピロリジン-3-オール(化合物70)を、S(+)-リンゴ酸で開始して調製した。
S(+)-リンゴ酸((R)-2-ヒドロキシコハク酸としても公知である)(化合物50)をメチルアミン(CH3NH2)と反応させて、(S)-3-ヒドロキシ-1-メチルピロリジン-2,5-ジオン(化合物60)を形成する。(S)-3-ヒドロキシ-1-メチルピロリジン-2,5-ジオン(6)を還元剤で処理して、(S)-1-メチルピロリジン-3-オール(化合物70)を形成する。ある場合には、化合物60の還元を、NaAlH4/LiClを使用して行う。塩化リチウム(0.11モル)をTHFに溶かした冷却溶液に、NaAlH4(0.22モル)をトルエン/THFに溶かしたものを、アルゴン中で添加する。
ステップ5:化合物21の作製。
1,1-カルボニルジイミドアゾール(CDI)活性化エステル化を使用して、R(-)-シクロペンチルマンデル酸(4)を、(S)-1-メチルピロリジン-3-オール(70)にカップリングし、ジアステレオマーとして純粋な2R3’S-グリコピロレート塩基(化合物21)を作製する。
グリコピロレート塩基、化合物21を、乾燥アセトニトリル中、ブロモ酢酸メチルで室温で、3時間撹拌しながら処理する。粗製生成物を少量の塩化メチレンに溶解し、乾燥エチルエーテル中に注いで、沈殿物を得る。この手順を3回繰り返して、臭化3’(S)-[R-シクロペンチルフェニルヒドロキシアセトイ]-1’-エチル-1’メトキシカルボニルピロリジニウムとしても公知の臭化(3S)-3-((R)-2-シクロペンチル-2-ヒドロキシ-2-フェニルアセトキシ)-1-(2-エトキシ-2-オキソエチル)-1-メチルピロリジン-1-イウム(化合物100)を得る。
Claims (33)
- 式(I)
(式中、
R1及びR2はそれぞれ、いずれの場合も独立して、アルキル、及びアルコキシカルボニルで置換されたアルキルから選択され、
2により示される炭素原子に関する立体化学配置はRであり、
3’により示される炭素原子に関する立体化学配置はRであり、
X-は、アニオンである。)
の化合物を作製するための方法であって、
式(1)の化合物とピバルデヒドとを接触させて式(2)の化合物を形成するステップと、
式(2)の化合物とリチウムヘキサメチルジシラジド(LiHMDS)及び臭化シクロペンチルとを接触させて式(3)の化合物を形成するステップと、
式(3)の化合物
と、メタノール性水酸化カリウムとを接触させて式(4)の化合物を形成し、
式(4)の化合物と式(Ib)の化合物とをカップリング条件下で接触させて、式(Ic)の化合物を形成するステップと、
- 式(I)の化合物の立体異性体として純粋な立体異性体を単離するステップをさらに含む、請求項1に記載の方法。
- 式(I)の化合物の立体異性体として純粋な立体異性体を単離するステップが、カラムクロマトグラフィーによるか、又は擬似移動床(SMB)分離による、請求項2に記載の方法。
- R1がアルキルである、請求項1に記載の方法。
- R1が、メチル、エチル、n-プロピル、i-プロピル、n-ブチル、t-ブチル、i-ブチル、n-ペンチル又はi-ペンチルである、請求項4に記載の方法。
- R1がメチル又はエチルである、請求項5に記載の方法。
- R2がアルキルである、請求項1~6のいずれかに記載の方法。
- R2が、メチル、エチル、n-プロピル、i-プロピル、n-ブチル、t-ブチル、i-ブチル、n-ペンチル又はi-ペンチルである、請求項7に記載の方法。
- R2がメチル又はエチルである、請求項8に記載の方法。
- R1が、アルコキシカルボニルで置換されたアルキルである、請求項1に記載の方法。
- R1が-CH2C(O)OCH2CH3である、請求項10に記載の方法。
- R2がメチルである、請求項11に記載の方法。
- 式(4)の化合物と式(Ib)の化合物とをカップリング条件下で接触させて、式(Ic)の化合物を形成するステップの間、式(4)の化合物及び式(Ib)の化合物が、立体異性体として純粋である、請求項1~12のいずれかに記載の方法。
- 式(Ic)の化合物を、式(Ic)の化合物とその立体異性体との混合物から単離するステップを含む、請求項1に記載の方法であって、当該ステップが、キラル分割剤及び塩を使用することを含む、前記方法。
- R1及びR2が共にアルキルである、請求項1~3のいずれかに記載の方法。
- X-がハロゲン化物アニオンである、請求項1~22のいずれかに記載の方法。
- X-が、F-、Cl-、Br-、I-及びこれらの組合せからなる群から選択される、請求項23に記載の方法。
- 式(4)の化合物を結晶化するステップを含む、請求項1に記載の方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2022165169A JP2022191407A (ja) | 2016-08-02 | 2022-10-14 | グリコピロニウム化合物を作製するための方法及び使用する方法 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662370172P | 2016-08-02 | 2016-08-02 | |
| US62/370,172 | 2016-08-02 | ||
| PCT/US2017/044988 WO2018026869A1 (en) | 2016-08-02 | 2017-08-01 | Processes for making, and methods of using, glycopyrronium compounds |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022165169A Division JP2022191407A (ja) | 2016-08-02 | 2022-10-14 | グリコピロニウム化合物を作製するための方法及び使用する方法 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2019524752A JP2019524752A (ja) | 2019-09-05 |
| JP2019524752A5 JP2019524752A5 (ja) | 2020-09-10 |
| JP7161466B2 true JP7161466B2 (ja) | 2022-10-26 |
Family
ID=59700178
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019503315A Active JP7161466B2 (ja) | 2016-08-02 | 2017-08-01 | グリコピロニウム化合物を作製するための方法及び使用する方法 |
| JP2022165169A Pending JP2022191407A (ja) | 2016-08-02 | 2022-10-14 | グリコピロニウム化合物を作製するための方法及び使用する方法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022165169A Pending JP2022191407A (ja) | 2016-08-02 | 2022-10-14 | グリコピロニウム化合物を作製するための方法及び使用する方法 |
Country Status (5)
| Country | Link |
|---|---|
| US (2) | US10906871B2 (ja) |
| EP (1) | EP3494106B1 (ja) |
| JP (2) | JP7161466B2 (ja) |
| CA (1) | CA3030772A1 (ja) |
| WO (1) | WO2018026869A1 (ja) |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2020020879A1 (en) * | 2018-07-24 | 2020-01-30 | Dr. August Wolff Gmbh & Co. Kg Arzneimittel | Topical emulsion of an anticholinergic compound |
| JP6748329B1 (ja) * | 2019-05-23 | 2020-08-26 | 科研製薬株式会社 | ソフピロニウム臭化物の結晶形態及びその製造方法 |
| WO2021113260A1 (en) | 2019-12-02 | 2021-06-10 | Dermira, Inc. | Diester containing compounds for treating hyperhidrosis |
| CN113321605A (zh) * | 2021-07-02 | 2021-08-31 | 浙江倍合德制药有限公司 | 一种1-甲基-3-吡咯烷醇的制备方法 |
| US11807604B1 (en) | 2022-02-16 | 2023-11-07 | Miralogx Llc | Pharmaceutical compounds, pharmaceutical compositions, and methods of treating asthma and other disorders |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001504459A (ja) | 1996-11-11 | 2001-04-03 | ノエ・クリスティアン・エル | 対掌体純粋な、塩基性アリール―シクロアルキル―ヒドロキシカルボン酸エステル、その製造方法及びこれを薬剤に使用する方法 |
| JP2009515889A (ja) | 2005-11-10 | 2009-04-16 | ボーダー、ニコラス・エス | ソフト型抗コリン作動性エステル |
| CN101759619A (zh) | 2010-01-19 | 2010-06-30 | 苏州天马精细化学品股份有限公司 | (s)-3-羟基吡咯烷及其n-衍生物的制备方法 |
| JP2012523390A (ja) | 2009-04-09 | 2012-10-04 | ノバルティス アーゲー | ピロリジニウム塩の調製方法 |
| CN103012231A (zh) | 2012-12-14 | 2013-04-03 | 沈阳药科大学 | 格隆溴铵手性对映体的制备方法和应用 |
| CN104586841A (zh) | 2013-10-30 | 2015-05-06 | 中国药科大学 | (3r,2’r)-格隆溴铵作为m3毒蕈碱性受体拮抗剂在制药中的用途 |
Family Cites Families (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2956062A (en) | 1959-02-26 | 1960-10-11 | Robins Co Inc A H | Esters of amino alcohols |
| IL22666A (en) | 1964-01-06 | 1968-10-24 | Robins Co Inc A H | Compositions for inhibiting perspiration containing an 1,1-dialkyl-3-hydroxy-pyrrolidinium ester of an alpha-phenyl-alpha-cycloalkyl-clycolic or acetic acid |
| FI49713C (fi) | 1974-05-15 | 1975-09-10 | Medica Pharma Co Ltd | Terapeuttisesti tehokkaan erytro-1-metyyli-3-pyrrolidinyyli-alfa-syklo -pentyylimandelaattimetobromidin valmistusmenetelmä. |
| GB8628138D0 (en) | 1986-11-25 | 1986-12-31 | Greenbank Eng Co Ltd | Suction drying apparatus |
| EP0909172A4 (en) | 1996-07-01 | 1999-06-09 | Sepracor Inc | METHODS AND COMPOSITIONS FOR TREATING URINARY INCONTINENCE WITH ENANTIOMERIC ENRICHED (R, s) -GLYCOPYRROLATE |
| EP0920313A1 (en) | 1996-07-01 | 1999-06-09 | Sepracor, Inc. | Methods and compositions for treating urinary incontinence using enantiomerically enriched (s,s)-glycopyrrolate |
| WO1998000016A1 (en) | 1996-07-01 | 1998-01-08 | Sepracor, Inc. | Methods and compositions for treating urinary incontinence using enantiomerically enriched (r,r)-glycopyrrolate |
| US6433003B1 (en) | 1999-04-23 | 2002-08-13 | Arthur M. Bobrove | Method for treating hyperhidrosis in mammals |
| ES2206021B1 (es) * | 2002-04-16 | 2005-08-01 | Almirall Prodesfarma, S.A. | Nuevos derivados de pirrolidinio. |
| US8252316B2 (en) | 2002-05-03 | 2012-08-28 | Purepharm Inc. | Method of topically applying glycopyrrolate solution using absorbent pad to reduce sweating |
| CA2384922C (en) | 2002-05-03 | 2008-09-02 | Purepharm Inc. | Topical glycopyrrolate product for the reduction of sweating |
| US7399861B2 (en) | 2005-11-10 | 2008-07-15 | Bodor Nicholas S | Soft anticholinergic esters |
| WO2009000109A1 (en) | 2007-06-27 | 2008-12-31 | Brand New Technology Ltd | Shower head with light emitting means |
| WO2009051818A1 (en) | 2007-10-18 | 2009-04-23 | Stiefel Research Australia Pty Ltd | Topical glycopyrrolate formulations |
| US8558008B2 (en) | 2013-02-28 | 2013-10-15 | Dermira, Inc. | Crystalline glycopyrrolate tosylate |
| US9006462B2 (en) | 2013-02-28 | 2015-04-14 | Dermira, Inc. | Glycopyrrolate salts |
| DE102016100354A1 (de) * | 2016-01-11 | 2017-07-13 | Forbo Siegling Gmbh | Transport- oder Antriebsband sowie ein zu dessen Herstellung geeigneter Webkamm |
-
2017
- 2017-08-01 US US16/320,999 patent/US10906871B2/en active Active
- 2017-08-01 JP JP2019503315A patent/JP7161466B2/ja active Active
- 2017-08-01 CA CA3030772A patent/CA3030772A1/en active Pending
- 2017-08-01 WO PCT/US2017/044988 patent/WO2018026869A1/en unknown
- 2017-08-01 EP EP17757600.6A patent/EP3494106B1/en active Active
-
2021
- 2021-01-08 US US17/145,109 patent/US11352323B2/en active Active
-
2022
- 2022-10-14 JP JP2022165169A patent/JP2022191407A/ja active Pending
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001504459A (ja) | 1996-11-11 | 2001-04-03 | ノエ・クリスティアン・エル | 対掌体純粋な、塩基性アリール―シクロアルキル―ヒドロキシカルボン酸エステル、その製造方法及びこれを薬剤に使用する方法 |
| JP2009515889A (ja) | 2005-11-10 | 2009-04-16 | ボーダー、ニコラス・エス | ソフト型抗コリン作動性エステル |
| JP2012523390A (ja) | 2009-04-09 | 2012-10-04 | ノバルティス アーゲー | ピロリジニウム塩の調製方法 |
| CN101759619A (zh) | 2010-01-19 | 2010-06-30 | 苏州天马精细化学品股份有限公司 | (s)-3-羟基吡咯烷及其n-衍生物的制备方法 |
| CN103012231A (zh) | 2012-12-14 | 2013-04-03 | 沈阳药科大学 | 格隆溴铵手性对映体的制备方法和应用 |
| CN104586841A (zh) | 2013-10-30 | 2015-05-06 | 中国药科大学 | (3r,2’r)-格隆溴铵作为m3毒蕈碱性受体拮抗剂在制药中的用途 |
Non-Patent Citations (3)
| Title |
|---|
| Mao, Zhong Yi et al,A novel and versatile method for the enantioselective syntheses of tropane alkaloids,Science China: Chemistry,2014年,57(2),,252-264 |
| Sleevi, Mark C. et al,Optical isomers of rocastine and close analogs: synthesis and H1 antihistaminic activity of its enantiomers and their structural relationship to the classical antihistamines,Journal of Medicinal Chemistry,1991年,34(4),,1314-1328 |
| Wu, W.-M.; Wu, J.; Mori, N.; Buchwald, P.; Bodor, N.,Stereoisomers of N-substituted soft anticholinergics and their zwitterionic metabolite based on glycopyrrolate - syntheses and pharmacological evaluations,Pharmazie,2008年,63(3),,200-209 |
Also Published As
| Publication number | Publication date |
|---|---|
| CA3030772A1 (en) | 2018-02-08 |
| US11352323B2 (en) | 2022-06-07 |
| JP2022191407A (ja) | 2022-12-27 |
| US20190161443A1 (en) | 2019-05-30 |
| WO2018026869A1 (en) | 2018-02-08 |
| EP3494106B1 (en) | 2022-07-20 |
| US20210130289A1 (en) | 2021-05-06 |
| US10906871B2 (en) | 2021-02-02 |
| EP3494106A1 (en) | 2019-06-12 |
| JP2019524752A (ja) | 2019-09-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7161466B2 (ja) | グリコピロニウム化合物を作製するための方法及び使用する方法 | |
| EP3481200B1 (en) | Processes for the preparation of 4-alkoxy-3-(acyl or alkyl)oxypicolinamides | |
| JP7237010B2 (ja) | Hdac6選択的阻害剤およびその製造方法と使用 | |
| WO2019077332A1 (en) | THERAPEUTIC COMPOUNDS | |
| JP2016503401A (ja) | ジアリールヨードニウム塩を製造するための方法及び試薬 | |
| JP6023322B2 (ja) | 2−シアノフェニルボロン酸およびそのエステルの製造プロセス | |
| JP2012521352A (ja) | [2−(8,9−ジオキソ−2,6−ジアザビシクロ[5.2.0]ノナ−1(7)−エン−2−イル)エチル]ホスホン酸およびその前駆体を調製するための方法 | |
| IL301334B1 (en) | DUAL MAGL and FAAH inhibitors | |
| WO2015199167A1 (ja) | 置換されたスピロピリド[1,2-a]ピラジン誘導体の製造方法および中間体 | |
| JP2015523985A (ja) | ジアリールヨードニウム塩を製造するための方法及び反応剤 | |
| US11420959B2 (en) | DACOS type NNRTIS amino acid ester derivative, preparation method thereof, pharmaceutical composition, and application thereof | |
| JP2011057665A (ja) | 光学活性な1−アミノ−2−ビニルシクロプロパンカルボン酸エステルの製造方法 | |
| JP5192856B2 (ja) | オセルタミビル及びその類縁化合物の製造方法 | |
| WO2014009964A1 (en) | Process for enantiomeric enrichment of 2 ', 6 ' - pipecoloxylidide | |
| KR20060119893A (ko) | 사이클로알킬아미노산 화합물, 이를 제조하는 방법 및 이의용도 | |
| WO2018021517A1 (ja) | 4-アルコキシ-3-トリフルオロメチルベンジルアルコールの製造方法 | |
| JP4330097B2 (ja) | 2−(ヒドロキシカルボニル)エチル−3−アミノ−3−(ヒドロキシカルボニル)プロピルホスフィン酸およびその製造方法 | |
| ITMI20121347A1 (it) | Metodo efficiente per la preparazione di mitiglinide ad elevata purezza | |
| KR20240089748A (ko) | 방법 | |
| PT2414323E (pt) | Derivados de aminociclobutano ou aminociclobuteno, o seu processo de preparação e a sua utilização como medicamentos | |
| KR20160136454A (ko) | 니코틴 중독의 예방 또는 치료를 위한 접합체 및 그를 제조하는 연관 방법 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200731 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200731 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20210610 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210712 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20211012 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20211012 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220301 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220301 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220621 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220727 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20220815 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20220909 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20221014 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7161466 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| S201 | Request for registration of exclusive licence |
Free format text: JAPANESE INTERMEDIATE CODE: R314201 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |