JP6998917B2 - 免疫療法のために同種異系かつ高活性のt細胞を操作するための方法 - Google Patents
免疫療法のために同種異系かつ高活性のt細胞を操作するための方法 Download PDFInfo
- Publication number
- JP6998917B2 JP6998917B2 JP2019114231A JP2019114231A JP6998917B2 JP 6998917 B2 JP6998917 B2 JP 6998917B2 JP 2019114231 A JP2019114231 A JP 2019114231A JP 2019114231 A JP2019114231 A JP 2019114231A JP 6998917 B2 JP6998917 B2 JP 6998917B2
- Authority
- JP
- Japan
- Prior art keywords
- cells
- cell
- tale
- tcrα
- gene
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K40/00—Cellular immunotherapy
- A61K40/10—Cellular immunotherapy characterised by the cell type used
- A61K40/11—T-cells, e.g. tumour infiltrating lymphocytes [TIL] or regulatory T [Treg] cells; Lymphokine-activated killer [LAK] cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K40/00—Cellular immunotherapy
- A61K40/30—Cellular immunotherapy characterised by the recombinant expression of specific molecules in the cells of the immune system
- A61K40/31—Chimeric antigen receptors [CAR]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K40/00—Cellular immunotherapy
- A61K40/30—Cellular immunotherapy characterised by the recombinant expression of specific molecules in the cells of the immune system
- A61K40/32—T-cell receptors [TCR]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K40/00—Cellular immunotherapy
- A61K40/40—Cellular immunotherapy characterised by antigens that are targeted or presented by cells of the immune system
- A61K40/41—Vertebrate antigens
- A61K40/42—Cancer antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/38—Drugs for disorders of the endocrine system of the suprarenal hormones
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/7051—T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/70517—CD8
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/70521—CD28, CD152
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70578—NGF-receptor/TNF-receptor superfamily, e.g. CD27, CD30, CD40, CD95
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0634—Cells from the blood or the immune system
- C12N5/0636—T lymphocytes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/16—Hydrolases (3) acting on ester bonds (3.1)
- C12N9/22—Ribonucleases [RNase]; Deoxyribonucleases [DNase]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/80—Vaccine for a specifically defined cancer
- A61K2039/804—Blood cells [leukemia, lymphoma]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/10—Immunoglobulins specific features characterized by their source of isolation or production
- C07K2317/14—Specific host cells or culture conditions, e.g. components, pH or temperature
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/569—Single domain, e.g. dAb, sdAb, VHH, VNAR or nanobody®
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/03—Fusion polypeptide containing a localisation/targetting motif containing a transmembrane segment
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/70—Fusion polypeptide containing domain for protein-protein interaction
- C07K2319/74—Fusion polypeptide containing domain for protein-protein interaction containing a fusion for binding to a cell surface receptor
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/30—Hormones
- C12N2501/38—Hormones with nuclear receptors
- C12N2501/39—Steroid hormones
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/50—Cell markers; Cell surface determinants
- C12N2501/51—B7 molecules, e.g. CD80, CD86, CD28 (ligand), CD152 (ligand)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/50—Cell markers; Cell surface determinants
- C12N2501/515—CD3, T-cell receptor complex
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/50—Cell markers; Cell surface determinants
- C12N2501/599—Cell markers; Cell surface determinants with CD designations not provided for elsewhere
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2502/00—Coculture with; Conditioned medium produced by
- C12N2502/99—Coculture with; Conditioned medium produced by genetically modified cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2510/00—Genetically modified cells
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Immunology (AREA)
- General Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Zoology (AREA)
- Biochemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Molecular Biology (AREA)
- Biophysics (AREA)
- Cell Biology (AREA)
- Biomedical Technology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Pharmacology & Pharmacy (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Wood Science & Technology (AREA)
- Biotechnology (AREA)
- Toxicology (AREA)
- Gastroenterology & Hepatology (AREA)
- Epidemiology (AREA)
- General Engineering & Computer Science (AREA)
- Microbiology (AREA)
- Hematology (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Virology (AREA)
- Plant Pathology (AREA)
- Physics & Mathematics (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Diabetes (AREA)
Description
本発明は、免疫療法のために操作された非アロ反応性T細胞を開発するための方法に関する。本発明は、免疫応答の能力を最大限に引き出すように、T細胞受容体をコードする遺伝子および少なくとも1種類の免疫チェックポイント遺伝子を不活性化することによってT細胞を改変するための方法に関する。本方法は、ドナーまたは初代細胞培養物から入手可能なT細胞にある、いろいろな重要遺伝子を正確に標的化するために、特定のレアカッティングエンドヌクレアーゼ(rare cutting endonuclease)、特に、TALE-ヌクレアーゼ(TALエフェクターエンドヌクレアーゼ)と、このようなポリペプチドをコードするポリヌクレオチドを使用することを伴う。本発明はまた、このような操作されたT細胞に組み入れることができる、さらなる特性、例えば、プレTCRα(「pTα」)およびその機能的誘導体、キメラ抗原受容体(CAR)、多鎖CAR、ならびに免疫療法の効率を高めるための、これらの使用に関する。本発明は、癌およびウイルス感染症を処置するための標準的で手頃な価格の養子免疫療法戦略への道を開く。
エクスビボで生成された自己の抗原特異的T細胞の移入を含む養子免疫治療は、ウイルス感染および癌を処置するための有望な戦略である。養子免疫治療のために使用されるT細胞は、抗原特異的T細胞の増大または遺伝子改変を通したT細胞の向け直しのいずれかによって生成され得る(Park,Rosenberg et al.2011)。ウイルス抗原特異的T細胞の移入は、移植に関連したウイルス感染および稀なウイルス関連悪性疾患の処置のために使用されている、よく確立された手法である。同様に、腫瘍特異的T細胞の単離および移入は、黒色腫の処置において成功が示されている。
一局面において、本発明は、T細胞、特に、ドナーから入手可能な同種異系T細胞が免疫療法目的に適するように、前記T細胞を操作する方法を開示する。本発明の方法は、さらに詳細には、MHC認識および/または免疫チェックポイントタンパク質に関与する遺伝子を不活性化または交換することによって、免疫療法に関係のある細胞のゲノムを正確に改変することを可能にする。ある特定の態様において、免疫療法に関係のある改変された細胞は、特異的な細胞認識のために、CARをコードする外因性組換えポリヌクレオチドをさらに含む。このCARは、シグナリングドメインの連続付加を必要とする1個の融合分子である。シグナリングドメインがその自然の膜近傍位置から動くと、その機能が妨げられる可能性がある。従って、この欠点を克服するために、本発明者らは、全ての関係するシグナリングドメインの正常な膜近傍位置を可能にするために、FcεRIに由来する多鎖CARを設計する。FcεRIα鎖の高親和性IgE結合ドメインは、T細胞特異性を細胞標的に再誘導するためにscFvなどの細胞外リガンド結合ドメインと交換され、共刺激シグナルを正常な膜近傍位置に配置するためにFcεRIβ鎖のN末端テールおよび/またはC末端テールが用いられる。
[本発明1001]
(a)少なくとも、
免疫チェックポイントタンパク質をコードする第1の遺伝子、および
T細胞受容体(TCR)の成分をコードする第2の遺伝子
を不活性化することによってT細胞を改変する工程;ならびに
(b)該T細胞を増殖させる工程
を含む、免疫療法のためにT細胞を調製する方法。
[本発明1002]
(a)免疫チェックポイントタンパク質をコードする遺伝子、および
T細胞受容体(TCR)の1つの成分をコードする少なくとも1種類の遺伝子
をそれぞれDNA切断によって選択的に不活性化することができる少なくとも1種類のレアカッティングエンドヌクレアーゼをT細胞に導入し、かつ
(b)該T細胞を増殖させる
ことによってT細胞を改変する工程を含む、本発明1001の方法。
[本発明1003]
免疫チェックポイント遺伝子が、PD1、CTLA-4、LAG3、Tim3、BTLA、BY55、TIGIT、B7H5、LAIR1、SIGLEC10、および2B4からなる群より選択される、本発明1001の方法。
[本発明1004]
改変されたT細胞が患者の血液中で増殖する、本発明1001の方法。
[本発明1005]
改変されたT細胞がインビボで増殖する、本発明1001の方法。
[本発明1006]
免疫チェックポイント遺伝子がPD1またはCTLA-4である、本発明1001の方法。
[本発明1007]
少なくとも第1および第2の不活性化される遺伝子が、PD1およびTCRα、PD1およびTCRβ、CTLA-4およびTCRα、CTLA-4およびTCRβ、LAG3およびTCRα、LAG3およびTCRβ、Tim3およびTCRα、Tim3およびTCRβ、BTLAおよびTCRα、BTLAおよびTCRβ、BY55およびTCRα、BY55およびTCRβ、TIGITおよびTCRα、TIGITおよびTCRβ、B7H5およびTCRα、B7H5およびTCRβ、LAIR1およびTCRα、LAIR1およびTCRβ、SIGLEC10およびTCRα、SIGLEC10およびTCRβ、2B4およびTCRα、ならびに2B4およびTCRβからなる群より選択される、本発明1001の方法。
[本発明1008]
少なくとも1種類のレアカッティングエンドヌクレアーゼがmRNAによってコードされる、本発明1002の方法。
[本発明1009]
RNAエレクトロポレーションによって、1種または複数種のレアカッティングエンドヌクレアーゼを工程(a)のT細胞に導入する工程を含む、本発明1002の方法。
[本発明1010]
少なくとも1種類のレアカッティングエンドヌクレアーゼがTALE-ヌクレアーゼである、本発明1002の方法。
[本発明1011]
少なくとも1種類のTALE-ヌクレアーゼが、SEQ ID NO:37またはSEQ ID NO:57~SEQ ID NO:60より選択されるTCRαの遺伝子標的配列の1つに対して作られたものである、本発明1010の方法。
[本発明1012]
少なくとも1種類のTALE-ヌクレアーゼが、SEQ ID NO:38およびSEQ ID NO:39からなる群より選択されるTCRβの遺伝子標的配列の1つに対して作られたものである、本発明1010の方法。
[本発明1013]
少なくとも1種類のTALE-ヌクレアーゼが、SEQ ID NO:77 および SEQ ID NO:78からなる群より選択されるPD1の遺伝子標的配列の1つに対して作られたものである、本発明1010の方法。
[本発明1014]
少なくとも1種類のTALE-ヌクレアーゼが、SEQ ID NO:74およびSEQ ID NO:76からなる群より選択されるCTLA-4の遺伝子標的配列の1つに対して作られたものである、本発明1010の方法。
[本発明1015]
キメラ抗原受容体(CAR)をT細胞に導入する工程をさらに含む、本発明1001の方法。
[本発明1016]
工程(a)のT細胞が、炎症性Tリンパ球、細胞傷害性Tリンパ球、制御性Tリンパ球、またはヘルパーTリンパ球に由来する、本発明1001の方法。
[本発明1017]
工程(a)のT細胞がCD4+Tリンパ球および/またはCD8+Tリンパ球に由来する、本発明1001の方法。
[本発明1018]
本発明1001の方法によって入手可能な単離されたT細胞もしくは細胞株、またはその継代培養物。
[本発明1019]
少なくとも2種類の遺伝子が不活性化されており、該遺伝子が、PD1およびTCRα、PD1およびTCRβ、CTLA-4およびTCRα、CTLA-4およびTCRβ、LAG3およびTCRα、LAG3およびTCRβ、Tim3およびTCRα、Tim3およびTCRβ、BTLAおよびTCRα、BTLAおよびTCRβ、BY55およびTCRα、BY55およびTCRβ、TIGITおよびTCRα、TIGITおよびTCRβ、B7H5およびTCRα、B7H5およびTCRβ、LAIR1およびTCRα、LAIR1およびTCRβ、SIGLEC10およびTCRα、SIGLEC10およびTCRβ、2B4およびTCRα、ならびに2B4およびTCRβからなる群より選択される、単離されたT細胞。
[本発明1020]
キメラ抗原受容体をコードする外因性ポリヌクレオチド配列をさらに含む、本発明1019の単離されたT細胞。
[本発明1021]
キメラ抗原受容体が多鎖キメラ抗原受容体である、本発明1020の単離されたT細胞。
[本発明1022]
CD3表面発現を支援するために、少なくともpTαトランスジーン断片を含む外因性核酸をさらに含む、本発明1019の単離されたT細胞。
[本発明1023]
医薬として使用するための、本発明1019の単離されたT細胞。
[本発明1024]
癌またはウイルス感染症を処置するための、本発明1019の単離されたT細胞。
[本発明1025]
リンパ腫を処置するための、本発明1019の単離されたT細胞。
[本発明1026]
本発明1019の少なくとも1つの単離されたT細胞を含む、薬学的組成物。
[本発明1027]
(a)本発明1001の方法に従って改変されたT細胞の集団を調製する工程;および
(b)該改変されたT細胞を患者に投与する工程
を含む、患者を処置するための方法。
[本発明1028]
患者が、癌、ウイルス感染症、自己免疫障害、または移植片対宿主病(GvHD)と診断されている、本発明1027の方法。
前述の特徴に加えて、本発明は、以下の説明ならびに添付の図面から明らかになる他の特徴をさらに含む。本発明とそれに伴う利点の多くのさらに完璧な理解が容易に得られるだろう。同様に、同じことが以下の図面と詳細な説明を参照することによってさらに深く理解される。
表2:GR TALE-ヌクレアーゼおよびヒトGR遺伝子内にあるTALE-ヌクレアーゼ標的部位の配列の説明。
表3:酵母におけるGR TALE-ヌクレアーゼの切断活性。値は0と1の間に含まれる。最大値は1である。
表4:293細胞における内因性TALE-ヌクレアーゼ標的部位での標的変異誘発の割合(%)。
表5:初代Tリンパ球における内因性TALE-ヌクレアーゼ標的部位での標的変異誘発の割合(%)。
表6:CD52 TALE-ヌクレアーゼ、TRAC TALE-ヌクレアーゼ、およびTRBC TALE-ヌクレアーゼならびに対応するヒト遺伝子内にあるTALE-ヌクレアーゼ標的部位の配列の説明。
表7:TRAC TALE-ヌクレアーゼおよびCD52 TALE-ヌクレアーゼのさらなる標的配列。
表8:CD52_T02、TRAC_T01、TRBC_T01、およびTRBC_T02標的を標的とするTALE-ヌクレアーゼについてのインデルの割合(%)。
表9:対応するTALE-ヌクレアーゼ発現ポリヌクレオチドでトランスフェクトした後のCD52陰性Tリンパ球、TCR陰性Tリンパ球、およびCD52/TCR二重陰性Tリンパ球の割合(%)。
表10:TRBC TALE-ヌクレアーゼ発現ポリヌクレオチドでトランスフェクトした後のTCR陰性Tリンパ球の割合(%)。
表11:CTLA4 TALE-ヌクレアーゼおよびPDCD1 TALE-ヌクレアーゼならびに対応するヒト遺伝子内にあるTALE-ヌクレアーゼ標的部位の配列の説明。
表12:pTα構築物のサブセットの説明。
表13: TCRα不活性化ジャーカット細胞における様々なpTα構築物の活性。様々なプレTα構築物でトランスフェクトしたTCRα不活性化ジャーカット細胞におけるCD3発現のフローサイトメトリー分析によって活性を測定した。
表14:PBMC由来T細胞におけるエレクトロポレーションに必要な最低電圧を求めるために使用した様々なcytopulseプログラム
表15:精製T細胞をエレクトロポレーション処理するために使用したCytopulseプログラム
本明細書において特に定義されない限り、使用される技術用語および科学用語は、全て、遺伝子治療、生化学、遺伝学、および分子生物学の領域の当業者によって一般的に理解されるのと同一の意味を有する。
特定の局面において、本発明は、特に免疫療法のために、T細胞を操作する方法に関する。特定の態様において、前記方法は、
(a)T細胞を準備する工程、
(b)免疫チェックポイント遺伝子をDNA切断によって選択的に不活性化することができるレアカッティングエンドヌクレアーゼを前記T細胞に導入する工程、および
(c)前記細胞を増殖させる工程
を含む。
(a)少なくとも、
-免疫チェックポイントタンパク質をコードする第1の遺伝子、および
-T細胞受容体(TCR)の成分をコードする第2の遺伝子
を不活性化することによってT細胞を改変する工程、ならびに
(b)前記細胞を増殖させる工程
を含む。
(a)好ましくは細胞培養物または血液試料から、T細胞を準備する工程、
(b)DNA切断、好ましくは、二本鎖切断によって、
-免疫チェックポイントタンパク質をコードする前記遺伝子、および
-T細胞受容体(TCR)の成分をコードする少なくとも1種類の遺伝子
をそれぞれ選択的に不活性化することができるレアカッティングエンドヌクレアーゼを前記T細胞に導入する工程、
(c)前記細胞を増殖させる工程
の少なくとも1つを含む。
(a)好ましくは細胞培養物または血液試料から、T細胞を準備する工程、
(b)DNA切断、好ましくは、二本鎖切断によって、
-免疫チェックポイントタンパク質をコードする前記遺伝子、および
-T細胞受容体(TCR)の成分をコードする少なくとも1種類の遺伝子
をそれぞれ選択的に不活性化することができるレアカッティングエンドヌクレアーゼをコードする核酸によって前記T細胞を形質転換する工程、
(c)前記レアカッティングエンドヌクレアーゼを前記T細胞内で発現させる工程、
(d)細胞表面にTCRを発現しない、形質転換されたT細胞を分別する工程、
(e)前記細胞を増殖させる工程
を含む。
(a) レアカッティングエンドヌクレアーゼが前記細胞のゲノムの1つの標的とする配列における切断を特異的に触媒するように、少なくとも1種類のレアカッティングエンドヌクレアーゼを前記細胞に導入する工程、
(b)任意で、前記切断の上流側にある配列と相同な第1の領域、前記細胞のゲノムに挿入しようとする配列、および前記切断の下流側にある配列と相同な第2の領域を連続的に含む外因性核酸を前記細胞に導入する工程であって、前記導入される外因性核酸が遺伝子を不活性化し、関心対象の少なくとも1種類の組換えタンパク質をコードする少なくとも1種類の外因性ポリヌクレオチド配列を組み込む、工程。
別の態様において、前記外因性ポリヌクレオチド配列は、免疫チェックポイント遺伝子、TCRα、およびTCRβからなる群より選択される遺伝子内に組み込まれる。
(a)免疫チェックポイント遺伝子、TCRα、およびTCRβからなる群より選択される遺伝子内の標的配列に結合するように操作されている、転写アクチベーター様エフェクター(TALE)DNA結合ドメイン、
(b)切断ドメインまたは切断半ドメイン
を含む、TALE-ヌクレアーゼに関する。
-SEQ ID NO:77およびSEQ ID NO:78(PD1)、
-SEQ ID NO:74~SEQ ID NO:76(CTLA-4)、
-SEQ ID NO:37、57~60(TCRα)、および
-SEQ ID NO:38または39(TCRβ)
からなる群より選択される標的配列を認識および切断するTALE-ヌクレアーゼである。
特定の局面において、本発明は、T細胞を操作する方法、特に、免疫療法のためにT細胞を操作する方法に関する。特に、この方法は、
(a)少なくとも、
-免疫抑制剤の標的を発現する第1の遺伝子、および
-T細胞受容体(TCR)の成分をコードする第2の遺伝子
を不活性化することによってT細胞を改変する工程、
(b)任意で前記免疫抑制剤の存在下で、前記細胞を増殖させる工程
を含む。
(a)好ましくは細胞培養物または血液試料から、T細胞を準備する工程、
(b)免疫抑制剤の標的を発現する前記T細胞内の遺伝子を選択する工程、
(c)DNA切断、好ましくは、二本鎖切断によって、
-前記免疫抑制剤の標的をコードする前記遺伝子、および
-T細胞受容体(TCR)の成分をコードする少なくとも1種類の遺伝子
をそれぞれ選択的に不活性化することができるレアカッティングエンドヌクレアーゼを前記T細胞に導入する工程、
(d)任意で前記免疫抑制剤の存在下で、前記細胞を増殖させる工程
の少なくとも1つを含む。
(a)好ましくは細胞培養物または血液試料から、T細胞を準備する工程、
(b)免疫抑制剤の標的を発現する、前記T細胞内の遺伝子を選択する工程、
(c)DNA切断、好ましくは、二本鎖切断によって、
-前記免疫抑制剤の標的をコードする前記遺伝子、および
-T細胞受容体(TCR)の成分をコードする少なくとも1種類の遺伝子
をそれぞれ選択的に不活性化することができるレアカッティングエンドヌクレアーゼをコードする核酸によって、前記T細胞を形質転換する工程、
(d)前記レアカッティングエンドヌクレアーゼを前記T細胞内で発現させる工程、
(e)細胞表面にTCRを発現しない、形質転換されたT細胞を分別する工程、
(f)任意で前記免疫抑制剤の存在下で、前記細胞を増殖させる工程
を含む。
-SEQ ID NO:1~6(GR)、
-SEQ ID NO:37、57~60(TCRα)、
-SEQ ID NO:38または39(TCRβ)、および
-SEQ ID NO:40、61~65(CD52)
からなる群より選択される標的配列を認識および切断するTALE-ヌクレアーゼである。
(a)前記細胞のゲノムの1つの標的とする配列における切断を特異的に触媒するような少なくとも1種類のレアカッティングエンドヌクレアーゼを前記細胞に導入する工程、
(b)任意で、前記切断の上流側にある配列と相同な第1の領域、前記細胞のゲノムに挿入しようとする配列、および前記切断の下流側にある配列と相同な第2の領域を連続的に含む外因性核酸を前記細胞に導入する工程であって、前記導入された外因性核酸が遺伝子を不活性化し、関心対象の少なくとも1種類の組換えタンパク質をコードする少なくとも1種類の外因性ポリヌクレオチド配列を組み込む、工程。
別の態様において、前記外因性ポリヌクレオチド配列は、CD52、GR、TCRα、およびTCRβからなる群より選択される遺伝子内に組み込まれる。
(a)CD52、GR、TCRα、およびTCRβからなる群より選択される遺伝子内の標的配列に結合するように操作されている、転写アクチベーター様エフェクター(TALE)DNA結合ドメイン、
(b)切断ドメインまたは切断半ドメイン
を含む、TALE-ヌクレアーゼに関する。
-SEQ ID NO:1~6(GR)、
-SEQ ID NO:37、57~60(TCRα)、
-SEQ ID NO:38または39(TCRβ)、および
-SEQ ID NO:40、61~65(CD52)
からなる群より選択される標的配列を認識および切断するTALE-ヌクレアーゼである。
別の局面において、本発明は、TCRα欠損T細胞を増殖させる方法に関し、本方法は、pTα(プレTCRαとも呼ぶ)またはその機能的変種を前記T細胞に導入する工程、および任意でCD3複合体を刺激することによって、前記細胞を増殖させる工程を含む。好ましい態様において、前記方法は、
a)CD3表面発現を支援するために、少なくともpTα断片をコードする核酸で前記細胞を形質転換する工程、
b)前記pTαを前記細胞内で発現させる工程、
c)任意でCD3複合体を刺激することによって、前記細胞を増殖させる工程
を含む。
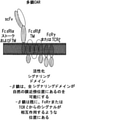
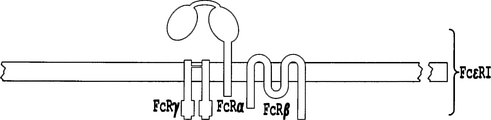
別の態様において、本発明は、特に本発明の操作されたT細胞の作製および増殖に合わせられた、多鎖キメラ抗原受容体(CAR)に関する。多鎖CARは、以下の成分:
a)FcεRIα鎖の膜貫通ドメインおよび細胞外リガンド結合ドメインを含む1つのポリペプチド、
b)FcεRIβ鎖のN末端細胞質テールおよびC末端細胞質テールの一部ならびに膜貫通ドメインを含む1つのポリペプチド、ならびに/または
c)それぞれが、FcεRIγ鎖の細胞質内テールの一部および膜貫通ドメイン含む2つのポリペプチド
の少なくとも2つを含み、異なるポリペプチドが自発的に一緒になって多量体化して、二量体CAR、三量体CAR、または四量体CARを形成する。
さらなる態様によれば、以前に述べた様々な方法によって得られた操作されたT細胞は、二重特異性抗体を用いてさらに曝露されてもよい。前記T細胞は、患者に投与される前にエクスビボで、または患者に投与された後でインビボで、二重特異性抗体に曝露されてもよい。前記二重特異性抗体は、別個の抗原特性をもつ2つの可変領域を含み、これにより、操作された細胞は標的抗原に近接することができる。非限定的な例として、前記二重特異性抗体は、腫瘍マーカーおよびリンパ球抗原、例えば、CD3に対して向けられ、腫瘍に対する任意の循環T細胞を再誘導および活性化する能力を有する。
前記の様々な方法は、pTαまたはその機能的変種、レアカッティングエンドヌクレアーゼ、TALE-ヌクレアーゼ、CARまたは多鎖CARを、任意で、DNA末端処理酵素または外因性核酸と共に細胞に導入する工程を伴う。
本発明のさらに好ましい態様では、本発明によるポリペプチドをコードするポリヌクレオチドは、例えば、エレクトロポレーションによって、細胞に直接導入されるmRNAでもよい。本発明者らは、T細胞におけるmRNAエレクトロポレーションに最適な条件を確かめた。
(a)電圧範囲が2250~3000V/センチメートルであり、パルス幅が0.1msであり、工程(a)の電気パルスと(b)の電気パルスとの間のパルス間隔が0.2~10msである、1回の電気パルス、
(b)電圧範囲が2250~3000Vであり、パルス幅が100msであり、工程(b)の電気パルスと工程(c)の最初の電気パルスとの間のパルス間隔が100msである、1回の電気パルス、;および
(c)電圧が325Vであり、パルス幅が0.2msであり、4回それぞれの電気パルス間のパルス間隔が2msである、4回の電気パルス
からなる素早いパルスシーケンスをT細胞に適用する工程を含む。
(a)電圧が2250V、2300V、2350V、2400V、2450V、2500V、2550V、2400V、2450V、2500V、2600V、2700V、2800V、2900V、または3000V/センチメートルであり、パルス幅が0.1msであり、工程(a)の電気パルスと(b)の電気パルスとの間のパルス間隔が0.2ms、0.5ms、1ms、2ms、3ms、4ms、5ms、6ms、7ms、8ms、9ms、または10msである、1回の電気パルス、;
(b)電圧範囲が2250V、2250V、2300V、2350V、2400V、2450V、2500V、2550V、2400V、2450V、2500V、2600V、2700V、2800V、2900V、または3000Vであり、パルス幅が100msであり、工程(b)の電気パルスと工程(c)の最初の電気パルスとの間のパルス間隔が100msである、1回の電気パルス、および
(c)電圧が325Vであり、パルス幅が0.2msであり、4回それぞれの電気パルス間のパルス間隔が2msである、4回の電気パルス
からなる素早いパルスシーケンスをT細胞に適用する工程とを含む。
T細胞を遺伝子組換えする前でも遺伝子組換えした後でも、T細胞は、一般的に、例えば、米国特許第6,352,694号;同第6,534,055号;同第6,905,680号;同第6,692,964号;同第5,858,358号;同第6,887,466号;同第6,905,681号;同第7,144,575号;同第7,067,318号;同第7,172,869号;同第7,232,566号;同第7,175,843号;同第5,883,223号;同第6,905,874号;同第6,797,514号;同第6,867,041号;および米国特許出願公開第20060121005号に記載の方法を用いて活性化および増殖することができる。T細胞はインビトロで増殖させてもよく、インビボで増殖させてもよい。
本発明の範囲には、以前に述べられた方法のいずれか一つに従って得られた単離されたT細胞も包含される。本発明による前記T細胞は幹細胞に由来してもよい。幹細胞は、成人幹細胞、胚性幹細胞、さらに詳細には、非ヒト幹細胞、臍帯血幹細胞、前駆細胞、骨髄幹細胞、人工多能性幹細胞、全能性幹細胞、たは造血幹細胞でもよい。代表的なヒト細胞はCD34+細胞である。前記単離された細胞はまた、樹状細胞、NK細胞、B細胞、または炎症性Tリンパ球、細胞傷害性Tリンパ球、制御性Tリンパ球、もしくはヘルパーTリンパ球からなる群より選択されるT細胞でもよい。別の態様において、前記細胞は、CD4+Tリンパ球およびCD8+Tリンパ球からなる群に由来してもよい。本発明の細胞の増殖および遺伝子組換えの前に、様々な非限定的な方法によって対象から細胞供給源を得ることができる。T細胞は、末梢血単核球、骨髄、リンパ節組織、臍帯血、胸腺組織、感染部位に由来する組織、腹水、胸水、脾臓組織、および腫瘍を含む多数の非限定的な供給源から得ることができる。本発明のある特定の態様では、入手可能であり、かつ当業者に公知の任意の数のT細胞株を使用することができる。別の態様において、前記細胞は健常ドナーから得られてもよく、癌と診断された患者または感染症と診断された患者から得られてもよい。別の態様において、前記細胞は、異なる表現型特徴を示す細胞の混合集団の一部でもよい。本発明の範囲には、以前に述べられた方法による形質転換T細胞から得られた細胞株も包含される。免疫抑制処置に対して耐性があり、かつ前記の方法によって入手することができる改変された細胞が本発明の範囲に包含される。
(a)前記個体から細胞を回収する工程、
(b)TCRα遺伝子またはTCRβ遺伝子を不活性化することによって前記細胞をエクスビボで遺伝子組換えする工程、
(c)遺伝子組換えされたT細胞をインビトロで適切な条件下で培養して、前記細胞を増幅する工程
を含む。
別の態様において、以前に述べられた様々な方法によって得られた単離された細胞または前記単離された細胞に由来する細胞株は医薬として使用することができる。別の態様において、前記医薬は、癌または感染症の処置を必要とする患者において癌または感染症を処置するのに使用することができる。別の態様において、本発明による前記単離された細胞または前記単離された細胞に由来する細胞株は、癌またはウイルス感染症の処置を必要とする患者において癌またはウイルス感染症を処置するための医薬の製造において使用することができる。
(a)以前に述べた方法のいずれか1つによって入手可能なT細胞を準備する工程、
(b)前記形質転換されたT細胞を前記患者に投与する工程
の少なくとも1つを含む。
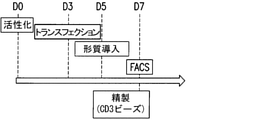
本発明をさらに深く理解するために、免疫療法のためにヒト同種異系細胞を操作する方法の一例を図5に図示した。この方法は、以下の工程の1つまたはいくつかからなる組み合わせを含む。
1.患者一人一人または血液バンクから入手した細胞培養物または血液試料からT細胞を準備する工程、および抗CD3/C28アクチベータービーズを用いて前記T細胞を活性化する工程。このビーズは、T細胞の活性化および増殖に必要な一次シグナルおよび共刺激シグナルを両方とも供給する。
2.a)CD3表面発現を支援するために、およびCD3複合体刺激を介した細胞の増殖を可能にするために、前記細胞にpTαまたはその機能的変種のトランスジーンを形質導入する工程。TCR破壊はTCR複合体を無くし、アロ反応性(GvHD)を取り除くと予想されるが、CD3シグナル伝達成分が消失するために同種異系細胞増殖を変える可能性がある。形質導入された細胞はpTα鎖またはその機能的変種を発現すると予想される。このpTα鎖はTCRβ鎖およびCD3シグナル伝達成分と対になってプレTCR複合体を形成し、従って、機能的CD3複合体を回復させ、不活性化TCRα細胞の活性化または刺激を支援する。TCRα不活性化前またはTCRα不活性化後に、pTαレンチウイルスベクターがT細胞に形質導入され得る。
b)前記細胞に多鎖CARを形質導入すると、リンパ腫および固形腫瘍を含む様々な悪性疾患に由来する標的細胞の表面に発現している抗原に対してT細胞を再誘導することが可能になる。共刺激ドメインの機能を改善するために、本発明者らは、以前に述べたようにFcεRIに由来する多鎖CARを設計した。形質導入がTCRαおよびCD52遺伝子などの他の遺伝子の不活性化の前に成し遂げられてもよく、TCRαおよびCD52遺伝子などの他の遺伝子の不活性化の後に成し遂げられてもよい。
3.非アロ反応性かつ免疫抑制耐性のT細胞を操作する工程:
a)細胞表面からTCRを無くし、同種異系TCRが宿主組織を異物として認識するのを阻止し、従って、GvHDを回避するために、前記細胞においてTCRαを不活性化することが可能である。
b)移植されたT細胞に影響を及ぼすことなく移植片拒絶反応を阻止するために、前記細胞が免疫抑制処置に対して耐性になるように、免疫抑制剤の標的をコードする1種類の遺伝子を不活性化することも可能である。この例では、免疫抑制剤の標的はCD52であり、免疫抑制剤はヒト化モノクローナル抗CD52抗体である。
T細胞において前述の二重不活性化を成し遂げるためには、T細胞内で高いDSB事象率を可能にすることでTALE-ヌクレアーゼを使用することが特に有利であると本発明者らによって示されている。好ましくは、TCRα遺伝子およびCD52遺伝子を標的とするTALE-ヌクレアーゼをコードするmRNAを用いてT細胞をエレクトロポレーション処理することによって前記遺伝子を不活性化する。高い形質転換率をもたらすmRNAを使用することはT細胞に有害でなく、そのため、T細胞を操作するプロセスにおいて重大な意味を持ったことが本発明者らによって見出された。次いで、磁気ビーズを用いて不活性化T細胞を分別した。例えば、CD52を発現するT細胞は固体表面への固定化によって除去され、不活性化細胞は、カラムを通るストレスに曝露されない。この穏やかな方法によって、正しく操作されたT細胞の濃度が上昇する。
4.操作されたT細胞を、CD3複合体刺激を介して、患者に投与する前にインビトロで増殖させるか、または患者に投与した後にインビボで増殖させる。投与工程の前に、患者を、ヒト化モノクローナル抗体抗CD52であるCAMPATH1-Hなどの免疫抑制処置に供することができる。
5.任意で、操作された細胞を標的抗原に近接させるために、前記細胞を患者に投与する前にエクスビボで二重特異性抗体に曝露するか、または前記細胞を患者に投与した後にインビボで二重特異性抗体に曝露する。
ポリペプチド配列内のアミノ酸残基は、1文字コードによって本明細書において表記され、例えば、QはGln、すなわちグルタミン残基を意味し、RはArg、すなわちアルギニン残基を意味し、DはAsp、すなわちアスパラギン酸残基を意味する。
ヒトGR遺伝子のエキソンを標的とする6つのヘテロ二量体TALE-ヌクレアーゼを設計および作製した。以下の表2は、それぞれのTALE-ヌクレアーゼによって切断される標的配列を示す。GR TALE-ヌクレアーゼは2つの独立した実体(半TALE-ヌクレアーゼと呼ぶ)で構成され、それぞれの実体は、15bpスペーサーで分けられた2つの17bp長の配列(半標的と呼ぶ)からなるGR標的配列に結合し、切断するように操作された反復配列を含有した。
以前に述べた本発明者らの酵母SSAアッセイ(国際PCT出願WO2004/067736およびEpinat, Arnould et al. 2003; Chames, Epinat et al. 2005; Arnould, Chames et al. 2006; Smith, Grizot et al. 2006)において、15bpのスペーサーで分けられた、DNA鎖上で互いに向き合っている2つのTALE標的配列を含有してSEQ ID NO:1~6となった、標的に対する6種類のGR-TALE-ヌクレアーゼのヌクレアーゼ活性を37℃および30℃で試験した。TALE-ヌクレアーゼDNA標的配列を含有する酵母標的レポータープラスミドは全て、以前に述べられたように構築した(国際PCT出願WO2004/067736およびEpinat, Arnould et al. 2003; Chames, Epinat et al. 2005; Arnould, Chames et al. 2006; Smith, Grizot et al. 2006)。酵母における、標的に対する個々のクローンのTALE-ヌクレアーゼ切断活性レベルを表3に示した。
それぞれのTALE-ヌクレアーゼ構築物を、制限酵素消化を用いて、pEF1αロングプロモーター制御下で哺乳動物発現ベクターに入れてサブクローニングした。
(フォワードアダプテイター(adaptator)配列)-10N(TAG)-遺伝子座特異的フォワード配列、GRエキソン2の場合:
、GRエキソン3の場合:
およびGRエキソン5の場合:
ならびにリバースプライマー
(リバースアダプター配列)-遺伝子座特異的リバース配列、GRエキソン2の場合:
、GRエキソン3の場合:
およびGRエキソン5の場合:
を用いて、抽出したゲノムDNAに対して遺伝子座特異的PCRを行った。
それぞれのTALE-ヌクレアーゼ構築物を、制限酵素消化を用いて、T7プロモーター制御下で、発現ベクターに入れてサブクローニングした。
実施例1に記載のように、CD52遺伝子を標的とするヘテロ二量体TALE-ヌクレアーゼ、TRAC遺伝子を標的とするヘテロ二量体TALE-ヌクレアーゼ、およびTRBC遺伝子を標的とするヘテロ二量体TALE-ヌクレアーゼを設計および作製した。標的とするゲノム配列は、11bpスペーサーまたは15bpスペーサーで分けられた2つの17bp長の配列(半標的と呼ぶ)からなる。それぞれの半標的は、表6に列挙した半TALE-ヌクレアーゼの反復によって認識される。ヒトゲノムは2つの機能的T細胞受容体β鎖(TRBC1およびTRBC2)を含有する。α/βTリンパ球が発達している間に、これらの2つの定常鎖のうちの1つが各細胞において選択されてTCR-β可変領域にスプライスされ、機能的完全長β鎖を形成する。対応するTALE-ヌクレアーゼがTRBC1およびTRBC2を両方とも同時に切断するように、2つのTRBC標的はTRBC1とTRBC2との間で保存された配列において選択された。
それぞれのTALE-ヌクレアーゼ構築物を、制限酵素消化を用いて、pEF1αロングプロモーター制御下で哺乳動物発現ベクターに入れてサブクローニングした。トランスフェクションの1日前に百万個のHEK293細胞を播種した。細胞を、EF1-αプロモーター制御下で、CD52遺伝子、T細胞受容体α定常鎖領域(TRAC)、もしくはT細胞受容体β定常鎖領域(TRBC)にある関心対象のゲノム配列内の2つの半標的を認識するTALE-ヌクレアーゼをコードする、それぞれ2.5μgの2つのプラスミド、または5μgの対照pUCベクター(pCLS0003)で、25μlのリポフェクタミン(Invitrogen)を用いて製造業者の説明書に従ってコトランスフェクトした。CD52コード配列またはTRACコード配列においてTALE-ヌクレアーゼによって生じる二本鎖切断は、生細胞では、エラープローン機構である非相同末端結合(NHEJ)によって修復される。生細胞におけるTALE-ヌクレアーゼの活性は、標的とされたゲノム遺伝子座での挿入または欠失の頻度によって測定される。トランスフェクションの48時間後に、トランスフェクトされた細胞からゲノムDNAを単離し、以下のプライマー:
(フォワードアダプター配列)-10N(TAG)-遺伝子座特異的フォワード配列、CD52の場合:
、TRACの場合:
、TRBC1の場合:
、またはTRBC2の場合:
、およびリバースプライマー
(リバースアダプター配列)-内因性遺伝子座特異的リバース配列、CD52の場合:
、TRACの場合:
、TRBC1およびTRBC2の場合:
を用いて、遺伝子座特異的PCRを行った。PCR産物を454シークエンシングシステム(454 Life Sciences)によって配列決定した。PCR産物あたり約10,000個の配列を入手し、次いで、部位特異的な挿入事象または欠失事象の存在について分析した。結果を表8に示した。
それぞれのTALE-ヌクレアーゼ構築物を、制限酵素消化を用いて、T7プロモーター制御下で哺乳動物発現ベクターに入れてサブクローニングした。
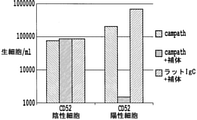
CD52遺伝子不活性化の目的は、Tリンパ球を抗CD52抗体を介した免疫抑制に対して耐性になるようにすることである。前段落に記載のように、Tリンパ球を、CD52を切断するTALE-ヌクレアーゼをコードするmRNAでトランスフェクトした。トランスフェクションの7日後に、細胞を、30%ウサギ補体(Cedarlane)と共に、または伴わずに、50μg/mlの抗CD52モノクローナル抗体(または対照としてラットIgG)で処理した。37℃で2時間インキュベートした後、細胞を、蛍光生死判別色素(eBioscience)と一緒に蛍光色素結合抗CD52抗体で標識し、生細胞間のCD52陽性細胞およびCD52陰性細胞の頻度を測定するためにフローサイトメトリーによって分析した。図6は代表的な実験の結果を示す。これから、CD52陰性細胞は補体媒介性抗CD52抗体毒性に対して完全に耐性があることが証明された。
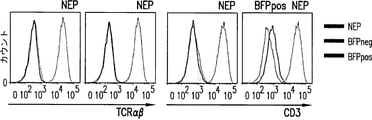
TRAC遺伝子不活性化の目的は、Tリンパ球をT細胞受容体刺激に反応しなくなるようにすることである。前段落に記載のように、Tリンパ球を、TRACまたはCD52を切断するTALE-ヌクレアーゼをコードするmRNAでトランスフェクトした。トランスフェクションの16日後に、細胞を、T細胞受容体を介して作用するT細胞マイトジェンである5μg/mlまでのフィトヘマグルチニン(PHA, Sigma-Aldrich)で処理した。機能的T細胞受容体をもつ細胞のサイズはPHA処理後に大きくなるはずである。3日間インキュベートした後に、細胞を蛍光色素結合抗CD52または抗TCR抗体で標識し、TCR陽性細胞とTCR陰性細胞との間またはCD52陽性細胞とCD52陰性細胞との間で細胞サイズ分布を比較するためにフローサイトメトリーによって分析した。図7は、TCR陽性細胞のサイズがPHA処理後に著しく大きくなるのに対して、TCR陰性細胞のサイズが未処理細胞と同一であることを示す。このことから、TRAC不活性化によって細胞はTCRシグナル伝達に反応しなくなることが分かる。対照的に、CD52陽性およびCD52陰性のサイズは同程度まで大きくなる。
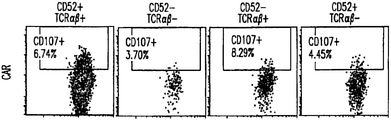
キメラ抗原受容体(CAR)が提供されたときに、T細胞の抗腫瘍活性を示す能力がゲノム操作によって影響を受けなかったことを検証するために、本発明者らは、CD52-TALE-ヌクレアーゼおよびTRAC-TALE-ヌクレアーゼで標的化されているT細胞を、抗CD19 CARをコードするRNA(SEQ ID NO:73)10μgでトランスフェクトした。24時間後に、T細胞をCD19発現ダウジ細胞と4時間インキュベートした。Tリンパ球による細胞傷害性顆粒放出(脱顆粒と呼ぶ)のマーカーであるCD107aの細胞表面アップレギュレーションをフローサイトメトリー分析によって測定した(Betts, Brenchley et al. 2003)。結果を図8に含めた。この結果から、CD52陰性/TCRαβ陰性細胞およびCD52陽性/TCRαβ陽性は、PMA/イオノマイシン(正の対照)またはCD19+ダウジ細胞に応答して脱顆粒する能力が同じであることが分かる。CD107アップレギュレーションはCD19+の存在に依存する。これらのデータから、T細胞の、制御された抗腫瘍応答を開始する能力はゲノム操作によって悪影響を受けないことが示唆される。
本発明者らの構築物はヌクレアーゼサブユニットを含むので、重要な疑問は、複数のTALE-ヌクレアーゼトランスフェクションによって、遺伝毒性および「ぴったり一致する(close match)」標的配列でのオフターゲット切断または半TALE-ヌクレアーゼの誤対合が生じる可能性があるかどうかである。細胞ゲノムの完全性に及ぼすTRAC-TALE-ヌクレアーゼおよびCD52-TALE-ヌクレアーゼの影響を評価するために、本発明者らは、オフサイト切断の可能性を示すヒトゲノム内配列を列挙した。このリストを作成するために、本発明者らは、オリジナルの半標的と比較して4個までの置換を有するゲノム内配列を全て特定し、次いで、互いに9~30bpのスペーサーのある、ヘッドトゥーヘッド方向の潜在的な半標的ペアを特定した。この分析は、1種類の半TALE-ヌクレアーゼ分子からなるホモ二量体、または1種類のCD52半TALE-ヌクレアーゼおよび1種類のTRAC半TALE-ヌクレアーゼによって形成されるヘテロ二量体によって潜在的に標的化される部位を含んだ。本発明者らは、個々の置換のコストおよび置換の位置を考慮して特異性データに基づいて潜在的なオフサイト標的をスコア付けした(半標的の3'末端にある塩基のミスマッチの方が許容される)。本発明者らは切断の可能性の推定値を反映するスコアをもつ173個のユニークな配列を入手した。本発明者らは、上位15位のスコアを選択し、CD52 TALE-ヌクレアーゼおよびTRAC TALE-ヌクレアーゼで同時にトランスフェクトし、CD52陰性、TCRαβ陰性として磁気分離によって精製したT細胞において、ディープシークエンシングによって、これらの遺伝子座において発見された変異の頻度を分析した。結果は図9にある。挿入/欠失の最高頻度は7x10-4である。これらの結果から、推定オフサイト標的が変異している可能性は、意図された標的の少なくとも1/600であることが分かる。従って、この研究において使用したTALE-ヌクレアーゼ試薬は極めて特異的であるように思われる。
実施例1に記載のように、PDCD1遺伝子を標的とするヘテロ二量体TALE-ヌクレアーゼおよびCTLA4遺伝子を標的とするヘテロ二量体TALE-ヌクレアーゼを設計および作製した。標的となるゲノム配列は、11bpスペーサーまたは15bpスペーサーで分けられた2つの17bp長の配列(半標的と呼ぶ)からなる。それぞれの半標的は、表11に列挙した半TALE-ヌクレアーゼの反復によって認識される。
それぞれのTALE-ヌクレアーゼ構築物を、制限酵素消化を用いて、pEF1αロングプロモーター制御下で哺乳動物発現ベクターに入れてサブクローニングした。トランスフェクションの1日前に百万個のHEK293細胞を播種した。細胞を、EF1-αプロモーター制御下で、PDCD1遺伝子およびCTLA-4遺伝子にある関心対象のゲノム配列内の2つの半標的を認識するTALE-ヌクレアーゼをコードする、それぞれ2.5μgの2つのプラスミド、または5μgの対照pUCベクター(pCLS0003)で、25μlのリポフェクタミン(Invitrogen)を用いて製造業者の説明書に従ってコトランスフェクトした。
(フォワードアダプター配列)-10N(TAG)-遺伝子座特異的フォワード配列、CTLA4_T01の場合:
、CTLA4_T03/T04の場合:
、PDCD1_T01の場合:
またはPDCD1_T03の場合:
およびリバースプライマー
(リバースアダプター配列)-内因性遺伝子座特異的リバース配列、CTLA4_T01の場合:
、CTLA4_T03/T04の場合:
、PDCD1_T01の場合:
またはPDCD1_T03の場合:
を用いて、遺伝子座特異的PCRを行った。
ヒト初代T細胞をCD3/28ビーズによって活性化した。5日後に、CTLA4遺伝子について設計された3種類のTALEN(商標)(T1、T2、およびT3)のうちの1つをコードするRNA 20μgを用いて、または対照としてRNAを用いずに5x106個の細胞をエレクトロポレーション処理した。エレクトロポレーションの3日後に、蛍光抗体を用いた細胞内染色およびフローサイトメトリー分析によってCTLA4発現を測定した(図27および図28)。
ヒト初代T細胞をCD3/28ビーズによって活性化した。5日後に、ヒトPD1遺伝子に特異的な2種類のTALENのうちの1つをコードするRNA 20μgを用いて、または対照としてRNAを用いずに5x106個の細胞をエレクトロポレーション処理した。10日後に細胞を再活性化し、再活性化の3日後に、蛍光抗体を用いた表面染色およびフローサイトメトリー分析によってPD1発現を測定した(図29を参照されたい)。
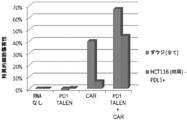
ヒト初代T細胞をCD3/28ビーズによって活性化した。5日後に、ヒトPD1遺伝子に特異的なTALENをコードするRNA 20μgを用いて、または対照としてRNAを用いずに5x106個の細胞をエレクトロポレーション処理した。一週間後、ヒトCD19に特異的なキメラ抗原受容体をコードするmRNAを用いて、または負の対照としてRNAを用いずに細胞をエレクトロポレーション処理した。翌日、CD19+ダウジ細胞(対して対照としてK562)、またはCD19発現ベクターが形質導入されたPD1リガンド1(PDL1)を発現するHCT116細胞(対して対照として親HCT116細胞)を用いた細胞傷害性アッセイにおいて前記細胞の抗腫瘍活性を測定した。標的細胞および対照細胞の生存率を比較することによって細胞傷害活性を求めた。結果を図31の図に示した。PD1 TALENトランスフェクションは、PDL1発現HCT116細胞に対する細胞傷害活性を報告し、ダウジ細胞に対する細胞傷害活性を改善した。
様々なプレTαバージョンの説明:
ヒトpTα遺伝子は、細胞外Ig様ドメイン、疎水性膜貫通ドメイン、および大きなC末端細胞質内テールを含む膜貫通糖タンパク質をコードする。ヒトpTα糖タンパク質に由来する様々なバージョンが設計されており、表12に説明し、図11に示した。
1)pTα欠失変異体:ヒトpTαタンパク質の細胞内細胞質テール(114アミノ酸を含む)に様々な欠失を作製した(SEQ ID NO:107)。試験した構築物には、タンパク質の完全長バージョン(FL)、ならびにタンパク質のC末端から18個、48個、62個、78個、92個、110個、および114個のアミノ酸が欠失された変異体(SEQ ID NO:108~SEQ ID NO:114)が含まれる。
2)細胞内活性化ドメインを含有するpTα変異体:C末端においてCD8、CD28、または41BBの細胞内活性化ドメインと融合したFLおよびΔ48変種(SEQ ID NO:115~SEQ ID NO:120)。
3)pTα/TCRαキメラ変異体:構築物のうちの1つでは、TCRα細胞内ドメイン(IC)をpTαのテールレスバージョン(Δ114)と融合させた(SEQ ID NO:121)。pTα細胞外ドメインを、TCRαに由来する膜貫通(TM)ドメインおよびICドメインと融合させた第2の構築物も作製した(SEQ ID NO:122)。
4)pTα二量体化変異体:いくつかの変異が、プレTCR複合体のオリゴマー化/二量体化能力を変えることができると文献において記載されている。これらの変異体は、構成的シグナル伝達を誘導することなく(プレTCRオリゴマー化の際に誘導されると考えられる)、細胞表面でのプレTCR発現を可能にすると提唱された。これらの変異はpTαΔ48変種に導入されており、
-1xMUT: W46R(SEQ ID NO:123)
-4xMUT: D22A、K24A、R102A、R117A(SEQ ID NO:124)
である。
TCRα不活性化ジャーカット細胞においてCD3表面発現を回復させる能力について様々なpTα変種をスクリーニングするために、TRACを標的とするTALENを用いてTCRα遺伝子が破壊された細胞株を作製した。ジャーカット細胞(T細胞白血病細胞株)を、CytoPulseエレクトロポレーションを用いて、TRACを切断するTALENをコードするプラスミドでトランスフェクトし、次いで、KO細胞(TCRα/β NEG; CD3NEG)を、CD3磁気ビーズを用いた負の選択によって精製した。KO集団(JKT_KOx3細胞)を増幅し、様々なpTα変種のスクリーニングに使用した。百万個のJKT_KOx3細胞を、EF1αプロモーターの制御下で様々なpTα変種をコードするプラスミド15μgでトランスフェクトし、トランスフェクションの48時間後にCD3細胞表面発現のフローサイトメトリー分析を行うことによってスクリーニングを行った。図12は、フローサイトメトリーによって確かめたCD3+細胞の割合(%)に基づく、JKT_KOx3細胞におけるFL、Δ18、およびΔ48p Tα構築物のトランスフェクション効率(BFP+細胞の%)および活性の代表例である。様々な構築物からの結果を表13にグループ分けした。
pTα-FLおよびpTα-Δ48バージョンがTCRα不活性化Tリンパ球においてCD3表面発現を誘導する能力を試験するために、pTα-FLコード配列およびpTα-Δ48コード配列を、SFFVプロモーター下で青色蛍光タンパク質(BFP)をコードし、それに続いて自己切断T2Aペプチドをコードする自己不活性化pLV-SFFV-BFP-2A-PCTRAレンチウイルスベクターに入れてクローニングした(図13)。
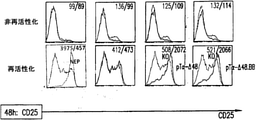
pTαが細胞活性化シグナルを伝達する能力を確かめるために、pTα-Δ48およびpTα-Δ48.41BBが形質導入されたTCRα不活性化T細胞における初期活性化マーカーおよび後期活性化マーカーの発現を分析した。pTα-Δ48およびpTα-Δ48.41BBが形質導入されたTCRα不活性化T細胞は前の項および図14Aに記載のように初代ヒトT細胞から作製した。
プレTCR複合体が長期細胞増殖を支援する能力を評価するために、以前に述べたように作製した細胞の増殖を測定した。初回活性化の10日後に、IL2(非再活性化)の中で、またはIL2と抗CD3/CD28ビーズ(再活性化)の中で細胞を維持した。それぞれの条件について、細胞を計数し、BFP+細胞の数を評価するために様々な時点でフローサイトメトリーによって分析した。BFPまたはBFP-T2A-プレTCRα-Δ48ベクターが形質導入されたTCRα不活性化細胞(KO)の増殖を比較し、これらの細胞の誘導倍率を、再活性化後、2日目に得られた値に対して評価した。図16は2人の無関係のドナーから入手した結果を示す。両方の場合において、pTα-Δ48を発現するTCRα不活性化細胞は、BFP対照ベクターだけ発現するTCRα不活性化細胞より多くの増殖を示した。2人目のドナーについては、pTα-Δ48.41BBまたは完全長pTαを発現するTCRα不活性化細胞も含めた。これらも、BFP対照ベクターだけ発現するTCRα不活性化細胞より多くの増殖を示した。
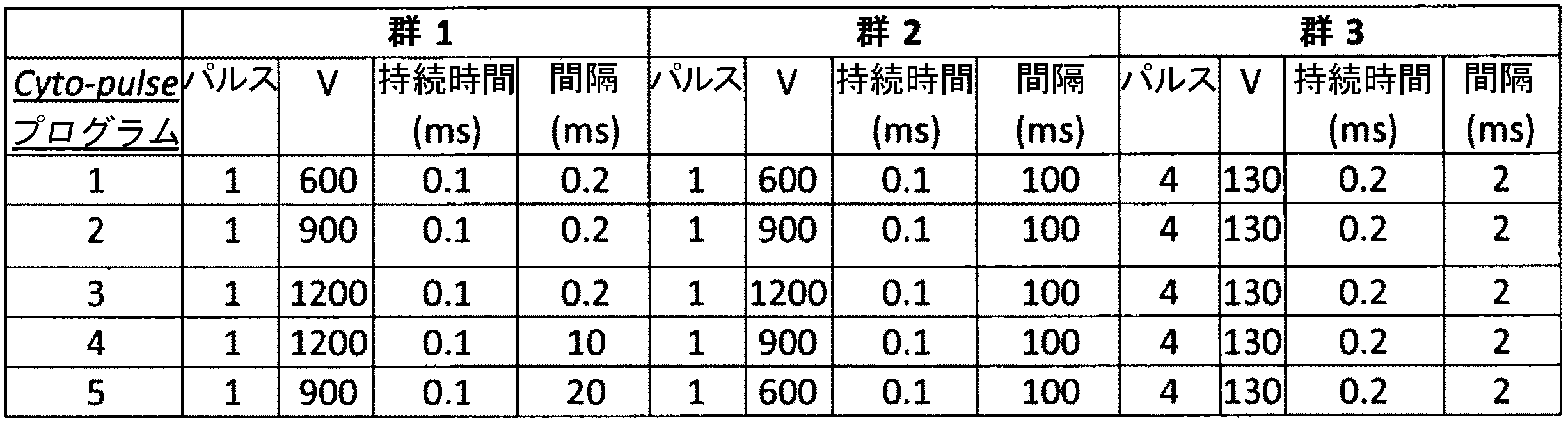
最適化されたcytopulseプログラムの決定
細胞をトランスフェクトすることができる電圧範囲を求めるために、非活性化PBMCに対して第1のセットの実験を行った。表14に記載のように5つの異なるプログラムを試験した。
T細胞の効率的なDNAエレクトロポレーションを可能にする最良のcytopulseプログラムを決定した後に、本発明者らは、この方法がmRNAエレクトロポレーションに適用可能かどうかを試験した。
mRNAエレクトロポレーションによって初代ヒトT細胞においてGFPを効率的に発現できることが証明された後に、本発明者らは、この方法が関心対象の他のタンパク質の発現に適用可能かどうかを試験した。転写アクチベーター様エフェクターヌクレアーゼ(TALE-ヌクレアーゼ)は、TAL DNA結合ドメインとDNA切断ドメインとの融合によって作製された部位特異的ヌクレアーゼである。これらは、実質的に任意の望ましいDNA配列において二本鎖切断を誘導するので強力なゲノム編集ツールである。これらの二本鎖切断は、エラープローンDNA修復機構である非相同末端結合(NHEJ)を活性化し、これによって、潜在的に、関心対象の任意の望ましい遺伝子が不活性化される。または、十分な修復テンプレートが細胞に同時に導入されるのであれば、TALE-ヌクレアーゼによって誘導されるDNA切断は相同組換えによって修復することができ、従って、遺伝子配列を好きなように改変する可能性が生じる。
抗CD3/CD28コーティングビーズおよびIL2によって数日間(3~5日間)、予め活性化した5X106個のT細胞をcytoporation buffer Tに再懸濁し、0.4cmキュベットに入れて、mRNA無しで、または単鎖CARをコードするmRNA(SEQ ID NO:73)10μgと表15に記載のプログラムを用いてエレクトロポレーション処理した。
抗CD3/CD28コーティングビーズおよびIL2によって数日間(3~5日間)、予め活性化した5X106個のT細胞をcytoporation buffer T中でエレクトロポレーション処理し、0.4cmキュベットに入れて、mRNA無しで、または多鎖CARをコードするmRNA(SEQ ID NO:126によってコードされるSEQ ID NO:125、図21Aおよび図4B(csm4))45μgと表15に記載のプログラムを用いてエレクトロポレーション処理した。
Claims (9)
- -PD1をコードする第1の遺伝子、および
-T細胞受容体(TCR)の成分をコードする第2の遺伝子
を不活性化することによってヒトT細胞を遺伝子改変する工程を含む、免疫療法のためにヒトT細胞を調製する方法であって、該遺伝子改変が、
(a)-PD1をコードする前記遺伝子、および
-T細胞受容体(TCR)の1つの成分をコードする少なくとも1種類の遺伝子
をそれぞれDNA切断によって選択的に不活性化することができる少なくとも1種類のレアカッティングエンドヌクレアーゼを前記T細胞に導入し、
(b)該T細胞にキメラ抗原受容体(CAR)を導入し、かつ
(c)該T細胞をインビトロで増殖させる
ことによって実施される、前記方法。 - 前記CARが少なくとも1つのシグナル伝達ドメインを含み、該伝達ドメインがCD137(4-1BB)である、請求項1記載の方法。
- RNAエレクトロポレーションによって、1種または複数種のレアカッティングエンドヌクレアーゼを工程(a)の前記T細胞に導入する工程を含む、請求項1または2記載の方法。
- 前記少なくとも1種類のレアカッティングエンドヌクレアーゼがTALE-ヌクレアーゼである、請求項1~3のいずれか一項記載の方法。
- 少なくとも1種類のTALE-ヌクレアーゼが、SEQ ID NO:37またはSEQ ID NO:57~SEQ ID NO:60より選択されるTCRαの遺伝子標的配列の1つに対して作られたものである、請求項4記載の方法。
- 少なくとも1種類のTALE-ヌクレアーゼが、SEQ ID NO:38およびSEQ ID NO:39からなる群より選択されるTCRβの遺伝子標的配列の1つに対して作られたものである、請求項4記載の方法。
- 工程(a)の前記T細胞が、PBMCに由来する、請求項1~6のいずれか一項記載の方法。
- 工程(a)の前記T細胞がCD4+Tリンパ球および/またはCD8+Tリンパ球に由来する、請求項1~7のいずれか一項記載の方法。
- CARが、PD1をコードする遺伝子およびTCRの成分をコードする遺伝子の不活性化の前に、T細胞に導入される、請求項1~8のいずれか一項記載の方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2021182495A JP7479339B2 (ja) | 2013-05-13 | 2021-11-09 | 免疫療法のために同種異系かつ高活性のt細胞を操作するための方法 |
Applications Claiming Priority (8)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| USPCT/US2013/040766 | 2013-05-13 | ||
| USPCT/US2013/040755 | 2013-05-13 | ||
| US13/892,805 US11603539B2 (en) | 2012-05-25 | 2013-05-13 | Methods for engineering allogeneic and immunosuppressive resistant T cell for immunotherapy |
| PCT/US2013/040755 WO2013176915A1 (en) | 2012-05-25 | 2013-05-13 | Methods for engineering allogeneic and immunosuppressive resistant t cell for immunotherapy |
| US13/892,805 | 2013-05-13 | ||
| PCT/US2013/040766 WO2013176916A1 (en) | 2012-05-25 | 2013-05-13 | Use of pre t alpha or functional variant thereof for expanding tcr alpha deficient t cells |
| US13/942,191 | 2013-07-15 | ||
| US13/942,191 US20150017136A1 (en) | 2013-07-15 | 2013-07-15 | Methods for engineering allogeneic and highly active t cell for immunotherapy |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016513480A Division JP6875124B2 (ja) | 2013-05-13 | 2014-05-13 | 免疫療法のために同種異系かつ高活性のt細胞を操作するための方法 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021182495A Division JP7479339B2 (ja) | 2013-05-13 | 2021-11-09 | 免疫療法のために同種異系かつ高活性のt細胞を操作するための方法 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2019176869A JP2019176869A (ja) | 2019-10-17 |
| JP2019176869A5 JP2019176869A5 (ja) | 2020-04-16 |
| JP6998917B2 true JP6998917B2 (ja) | 2022-02-04 |
Family
ID=51897833
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016513480A Active JP6875124B2 (ja) | 2013-05-13 | 2014-05-13 | 免疫療法のために同種異系かつ高活性のt細胞を操作するための方法 |
| JP2019114231A Active JP6998917B2 (ja) | 2013-05-13 | 2019-06-20 | 免疫療法のために同種異系かつ高活性のt細胞を操作するための方法 |
| JP2021182495A Active JP7479339B2 (ja) | 2013-05-13 | 2021-11-09 | 免疫療法のために同種異系かつ高活性のt細胞を操作するための方法 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016513480A Active JP6875124B2 (ja) | 2013-05-13 | 2014-05-13 | 免疫療法のために同種異系かつ高活性のt細胞を操作するための方法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021182495A Active JP7479339B2 (ja) | 2013-05-13 | 2021-11-09 | 免疫療法のために同種異系かつ高活性のt細胞を操作するための方法 |
Country Status (13)
| Country | Link |
|---|---|
| US (2) | US20150017136A1 (ja) |
| EP (2) | EP3936612A1 (ja) |
| JP (3) | JP6875124B2 (ja) |
| KR (3) | KR20230144570A (ja) |
| CN (1) | CN105378068A (ja) |
| AU (1) | AU2014266830B2 (ja) |
| BR (1) | BR112015028493A2 (ja) |
| CA (1) | CA2912373A1 (ja) |
| DK (1) | DK2997132T3 (ja) |
| ES (1) | ES2828669T3 (ja) |
| MX (1) | MX380738B (ja) |
| RU (1) | RU2736616C2 (ja) |
| WO (1) | WO2014184741A1 (ja) |
Families Citing this family (118)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2734621B1 (en) | 2011-07-22 | 2019-09-04 | President and Fellows of Harvard College | Evaluation and improvement of nuclease cleavage specificity |
| US20150017136A1 (en) * | 2013-07-15 | 2015-01-15 | Cellectis | Methods for engineering allogeneic and highly active t cell for immunotherapy |
| US20230050345A1 (en) * | 2013-05-13 | 2023-02-16 | Cellectis | Methods for engineering allogeneic and highly active t cell for immunotheraphy |
| US20150044192A1 (en) | 2013-08-09 | 2015-02-12 | President And Fellows Of Harvard College | Methods for identifying a target site of a cas9 nuclease |
| US9359599B2 (en) | 2013-08-22 | 2016-06-07 | President And Fellows Of Harvard College | Engineered transcription activator-like effector (TALE) domains and uses thereof |
| US9340800B2 (en) | 2013-09-06 | 2016-05-17 | President And Fellows Of Harvard College | Extended DNA-sensing GRNAS |
| US9388430B2 (en) | 2013-09-06 | 2016-07-12 | President And Fellows Of Harvard College | Cas9-recombinase fusion proteins and uses thereof |
| US9526784B2 (en) | 2013-09-06 | 2016-12-27 | President And Fellows Of Harvard College | Delivery system for functional nucleases |
| CA2930015A1 (en) | 2013-11-07 | 2015-05-14 | Editas Medicine, Inc. | Crispr-related methods and compositions with governing grnas |
| CA2930784C (en) * | 2013-11-22 | 2023-01-31 | Cellectis | Method for generating batches of allogeneic t cells with averaged potency |
| US9840699B2 (en) | 2013-12-12 | 2017-12-12 | President And Fellows Of Harvard College | Methods for nucleic acid editing |
| AU2014368383B2 (en) * | 2013-12-20 | 2020-01-16 | Cellectis | Method of engineering multi-input signal sensitive T cell for immunotherapy |
| MX370272B (es) | 2014-03-19 | 2019-12-09 | Cellectis | Receptores de antigeno quimerico especifico de cd123 para inmunoterapia de cancer. |
| WO2016022363A2 (en) | 2014-07-30 | 2016-02-11 | President And Fellows Of Harvard College | Cas9 proteins including ligand-dependent inteins |
| AU2015339743C1 (en) | 2014-10-31 | 2021-04-22 | The Trustees Of The University Of Pennsylvania | Altering gene expression in modified T cells and uses thereof |
| AU2016212158B2 (en) | 2015-01-26 | 2021-06-03 | Allogene Therapeutics, Inc. | mAb-driven chimeric antigen receptor systems for sorting/depleting engineered immune cells |
| AU2016214301B2 (en) * | 2015-02-06 | 2022-05-19 | Cellectis | Primary hematopoietic cells genetically engineered by slow release of nucleic acids using nanoparticles |
| CN107683333A (zh) * | 2015-03-11 | 2018-02-09 | 塞勒克提斯公司 | 用于工程化同种异体t细胞以增加其在患者中的持久性和/或移植成活率的方法 |
| BR112017020750A2 (pt) * | 2015-03-27 | 2018-06-26 | Harvard College | células t modificadas e métodos de produção e utilização das mesmas |
| RU2706582C2 (ru) | 2015-04-13 | 2019-11-19 | Пфайзер Инк. | Химерные антигенные рецепторы, нацеленные на антиген созревания B-клеток |
| US10441644B2 (en) | 2015-05-05 | 2019-10-15 | The Regents Of The University Of California | H3.3 CTL peptides and uses thereof |
| EP3294342A4 (en) | 2015-05-08 | 2018-11-07 | President and Fellows of Harvard College | Universal donor stem cells and related methods |
| AU2016271147B2 (en) * | 2015-05-29 | 2022-09-08 | Juno Therapeutics, Inc. | Composition and methods for regulating inhibitory interactions in genetically engineered cells |
| EP4043556B1 (en) * | 2015-06-30 | 2024-02-07 | Cellectis | Methods for improving functionality in nk cell by gene inactivation using specific endonuclease |
| WO2017023803A1 (en) | 2015-07-31 | 2017-02-09 | Regents Of The University Of Minnesota | Modified cells and methods of therapy |
| IL258821B (en) | 2015-10-23 | 2022-07-01 | Harvard College | Nucleobase editors and their uses |
| AU2016362129A1 (en) | 2015-12-04 | 2018-06-14 | Intellia Therapeutics, Inc. | Compositions and methods for immunooncology |
| AU2016369490C1 (en) | 2015-12-18 | 2021-12-23 | Sangamo Therapeutics, Inc. | Targeted disruption of the T cell receptor |
| ES2942362T3 (es) | 2016-01-21 | 2023-05-31 | Pfizer | Receptores quiméricos para el antígeno que se dirigen a la variante III del receptor del factor de crecimiento epidérmico |
| EP3429633B1 (en) | 2016-04-15 | 2021-02-24 | Cellectis | A method of engineering drug-specific hypersensitive t-cells for immunotherapy by gene inactivation |
| US11078481B1 (en) | 2016-08-03 | 2021-08-03 | KSQ Therapeutics, Inc. | Methods for screening for cancer targets |
| KR20250103795A (ko) | 2016-08-03 | 2025-07-07 | 프레지던트 앤드 펠로우즈 오브 하바드 칼리지 | 아데노신 핵염기 편집제 및 그의 용도 |
| CA3033327A1 (en) | 2016-08-09 | 2018-02-15 | President And Fellows Of Harvard College | Programmable cas9-recombinase fusion proteins and uses thereof |
| WO2018039333A1 (en) * | 2016-08-23 | 2018-03-01 | Bluebird Bio, Inc. | Tim3 homing endonuclease variants, compositions, and methods of use |
| WO2018039438A1 (en) | 2016-08-24 | 2018-03-01 | President And Fellows Of Harvard College | Incorporation of unnatural amino acids into proteins using base editing |
| US11078483B1 (en) | 2016-09-02 | 2021-08-03 | KSQ Therapeutics, Inc. | Methods for measuring and improving CRISPR reagent function |
| WO2018049226A1 (en) | 2016-09-08 | 2018-03-15 | Bluebird Bio, Inc. | Pd-1 homing endonuclease variants, compositions, and methods of use |
| CA3036972A1 (en) | 2016-09-14 | 2018-03-22 | Janssen Biotech, Inc. | Chimeric antigen receptors comprising bcma-specific fibronectin type iii domains and uses thereof |
| EP3525804A4 (en) * | 2016-10-11 | 2020-09-09 | Minerva Biotechnologies Corporation | HUMANIZED ANTI-MUC1 * ANTIBODIES AND USE OF THE CLIVING ENZYME |
| JP7588390B2 (ja) | 2016-10-14 | 2024-11-22 | プレジデント アンド フェローズ オブ ハーバード カレッジ | 核酸塩基エディターのaav送達 |
| CA3041068A1 (en) | 2016-10-18 | 2018-04-26 | Regents Of The University Of Minnesota | Tumor infiltrating lymphocytes and methods of therapy |
| WO2018073393A2 (en) | 2016-10-19 | 2018-04-26 | Cellectis | Tal-effector nuclease (talen) -modified allogenic cells suitable for therapy |
| WO2018119359A1 (en) | 2016-12-23 | 2018-06-28 | President And Fellows Of Harvard College | Editing of ccr5 receptor gene to protect against hiv infection |
| TW201839136A (zh) | 2017-02-06 | 2018-11-01 | 瑞士商諾華公司 | 治療血色素異常症之組合物及方法 |
| DK3583203T5 (da) | 2017-02-15 | 2024-09-02 | 2Seventy Bio Inc | Donorreparationstemplates multiplex-genomeditering |
| CN110662556A (zh) | 2017-03-09 | 2020-01-07 | 哈佛大学的校长及成员们 | 癌症疫苗 |
| WO2018165504A1 (en) | 2017-03-09 | 2018-09-13 | President And Fellows Of Harvard College | Suppression of pain by gene editing |
| JP2020510439A (ja) | 2017-03-10 | 2020-04-09 | プレジデント アンド フェローズ オブ ハーバード カレッジ | シトシンからグアニンへの塩基編集因子 |
| SG11201907434RA (en) | 2017-03-22 | 2019-10-30 | Novartis Ag | Compositions and methods for immunooncology |
| BR112019019655A2 (pt) | 2017-03-23 | 2020-04-22 | Harvard College | editores de nucleobase que compreendem proteínas de ligação a dna programáveis por ácido nucleico |
| WO2018209320A1 (en) | 2017-05-12 | 2018-11-15 | President And Fellows Of Harvard College | Aptazyme-embedded guide rnas for use with crispr-cas9 in genome editing and transcriptional activation |
| US12296012B2 (en) | 2017-06-02 | 2025-05-13 | Pfizer Inc. | Chimeric antigen receptors targeting FLT3 |
| AU2018288863A1 (en) * | 2017-06-22 | 2020-01-30 | Board Of Regents, The University Of Texas System | Methods for producing regulatory immune cells and uses thereof |
| SG10201705285SA (en) | 2017-06-27 | 2019-01-30 | Agency Science Tech & Res | Antisense oligonucleotides |
| AU2018292181B2 (en) | 2017-06-30 | 2025-04-10 | Cellectis | Cellular immunotherapy for repetitive administration |
| JP2020530307A (ja) | 2017-06-30 | 2020-10-22 | インティマ・バイオサイエンス,インコーポレーテッド | 遺伝子治療のためのアデノ随伴ウイルスベクター |
| KR102869563B1 (ko) | 2017-07-17 | 2025-10-10 | 얀센 바이오테크 인코포레이티드 | 피브로넥틴 iii형 도메인에 대한 항원 결합 영역 및 이의 사용 방법 |
| EP3638260A1 (en) | 2017-07-21 | 2020-04-22 | Cellectis | Engineered immune cells resistant to tumor microoenvironment |
| WO2019016360A1 (en) | 2017-07-21 | 2019-01-24 | Cellectis | MODIFIED IMMUNE CELLS RESISTANT TO TUMOR MICRO-ENVIRONMENT |
| JP2020534795A (ja) | 2017-07-28 | 2020-12-03 | プレジデント アンド フェローズ オブ ハーバード カレッジ | ファージによって支援される連続的進化(pace)を用いて塩基編集因子を進化させるための方法および組成物 |
| US11319532B2 (en) | 2017-08-30 | 2022-05-03 | President And Fellows Of Harvard College | High efficiency base editors comprising Gam |
| MX2020002901A (es) | 2017-09-19 | 2020-07-22 | Massachusetts Inst Technology | Composiciones para la terapia con celulas t con receptores de antigeno quimerico y usos de las mismas. |
| WO2019072824A1 (en) | 2017-10-09 | 2019-04-18 | Cellectis | IMPROVED ANTI-CD123 CAR IN UNIVERSAL MODIFIED IMMUNE T LYMPHOCYTES |
| KR20250107288A (ko) | 2017-10-16 | 2025-07-11 | 더 브로드 인스티튜트, 인코퍼레이티드 | 아데노신 염기 편집제의 용도 |
| EP3699193A4 (en) * | 2017-10-20 | 2022-01-26 | Pharmabcine Inc. | ANTI-VISTA ANTIBODIES AND USE THEREOF |
| US11326156B2 (en) | 2017-11-01 | 2022-05-10 | Allogene Therapeutics, Inc. | Modified caspase-9 polypeptides and methods of use thereof |
| WO2019090202A1 (en) * | 2017-11-06 | 2019-05-09 | Editas Medicine, Inc. | Methods, compositions and components for crispr-cas9 editing of cblb in t cells for immunotherapy |
| US11738047B2 (en) | 2017-12-12 | 2023-08-29 | The Trustees Of The University Of Pennsylvania | Genetically modified immune cells targeting NY-ESO-1 and methods of use thereof |
| WO2019118949A1 (en) | 2017-12-15 | 2019-06-20 | The Broad Institute, Inc. | Systems and methods for predicting repair outcomes in genetic engineering |
| WO2019126555A1 (en) * | 2017-12-20 | 2019-06-27 | Bluebird Bio, Inc. | Ctla4 homing endonuclease variants, compositions, and methods of use |
| WO2019129850A1 (en) | 2017-12-29 | 2019-07-04 | Cellectis | Off-the-shelf engineered cells for therapy |
| US11377500B2 (en) | 2018-02-01 | 2022-07-05 | Pfizer Inc. | Antibodies specific for CD70 and their uses |
| IL322656A (en) | 2018-02-01 | 2025-10-01 | Pfizer | Chimeric antigen receptors against CD70 |
| MX387358B (es) | 2018-02-28 | 2025-03-18 | Pfizer | Variantes de il-15 y usos de las mismas |
| WO2019178420A1 (en) | 2018-03-15 | 2019-09-19 | KSQ Therapeutics, Inc. | Gene-regulating compositions and methods for improved immunotherapy |
| US20190284553A1 (en) | 2018-03-15 | 2019-09-19 | KSQ Therapeutics, Inc. | Gene-regulating compositions and methods for improved immunotherapy |
| WO2019226953A1 (en) | 2018-05-23 | 2019-11-28 | The Broad Institute, Inc. | Base editors and uses thereof |
| WO2020007593A1 (en) | 2018-07-02 | 2020-01-09 | Cellectis | Chimeric antigen receptors (car)-expressing cells and combination treatment for immunotherapy of patients with relapse refractory adverse genetic risk aml |
| EP3844282A4 (en) | 2018-08-29 | 2022-06-01 | Nanjing Legend Biotech Co., Ltd. | ANTI-MESOTHELIN CHIMERAL ANTIGEN RECEPTOR (CAR) CONSTRUCTS AND THEIR USES |
| EP3847196A4 (en) | 2018-09-07 | 2023-01-04 | ITabMed (HK) Limited | BISPECIFIC ANTIGEN BINDING PROTEINS AND USES THEREOF |
| WO2020051562A2 (en) | 2018-09-07 | 2020-03-12 | Beam Therapeutics Inc. | Compositions and methods for improving base editing |
| CN112654245B (zh) * | 2018-09-11 | 2022-05-27 | 得克萨斯州大学系统董事会 | 自身免疫不良事件和免疫检查点阻断治疗的遗传小鼠模型 |
| EP3856763A1 (en) | 2018-09-28 | 2021-08-04 | Massachusetts Institute of Technology | Collagen-localized immunomodulatory molecules and methods thereof |
| WO2020092453A1 (en) | 2018-10-29 | 2020-05-07 | The Broad Institute, Inc. | Nucleobase editors comprising geocas9 and uses thereof |
| WO2020109953A1 (en) | 2018-11-30 | 2020-06-04 | Janssen Biotech, Inc. | Gamma delta t cells and uses thereof |
| KR20210102925A (ko) | 2018-12-10 | 2021-08-20 | 블루버드 바이오, 인코포레이티드. | 호밍 엔도뉴클레아제 변이체 |
| WO2020132810A1 (en) * | 2018-12-24 | 2020-07-02 | Generon (Shanghai) Corporation Ltd. | Multispecific antigen binding proteins capable of binding cd19 and cd3, and use thereof |
| US12351837B2 (en) | 2019-01-23 | 2025-07-08 | The Broad Institute, Inc. | Supernegatively charged proteins and uses thereof |
| MX2021009357A (es) * | 2019-02-04 | 2021-11-17 | Ksq Therapeutics Inc | Dianas de genes de combinacion para mejorar la inmunoterapia. |
| EP3693974A1 (en) * | 2019-02-07 | 2020-08-12 | Koninklijke Philips N.V. | Identifying responsiveness to radio-immuno combination therapy |
| EP3942042A1 (en) | 2019-03-19 | 2022-01-26 | The Broad Institute, Inc. | Methods and compositions for editing nucleotide sequences |
| EP3956349A1 (en) | 2019-04-17 | 2022-02-23 | The Broad Institute, Inc. | Adenine base editors with reduced off-target effects |
| EP3990491A1 (en) | 2019-06-26 | 2022-05-04 | Massachusetts Institute of Technology | Immunomodulatory fusion protein-metal hydroxide complexes and methods thereof |
| AU2020337428A1 (en) | 2019-08-27 | 2022-03-17 | Janssen Biotech, Inc. | Chimeric antigen receptor system and uses thereof |
| WO2021061648A1 (en) | 2019-09-23 | 2021-04-01 | Massachusetts Institute Of Technology | Methods and compositions for stimulation of endogenous t cell responses |
| US12435330B2 (en) | 2019-10-10 | 2025-10-07 | The Broad Institute, Inc. | Methods and compositions for prime editing RNA |
| BR112022017419A2 (pt) | 2020-03-03 | 2022-10-18 | Janssen Biotech Inc | Células t gama-delta e usos das mesmas |
| CA3173981A1 (en) | 2020-03-10 | 2021-09-16 | Massachusetts Institute Of Technology | Compositions and methods for immunotherapy of npm1c-positive cancer |
| KR20240096884A (ko) | 2020-03-10 | 2024-06-26 | 매사추세츠 인스티튜트 오브 테크놀로지 | 조작된 기억-유사 nk 세포 및 이의 조성물을 생성하기 위한 방법 |
| US12433954B2 (en) | 2020-05-01 | 2025-10-07 | Massachusetts Institute Of Technology | Methods of activating anti-CD19 chimeric antigen receptor (CAR) T cells using amphiphilic ligand conjugates comprising CAR-targeting protein sequence motifs |
| WO2021221783A1 (en) | 2020-05-01 | 2021-11-04 | Massachusetts Institute Of Technology | Methods for identifying chimeric antigen receptor-targeting ligands and uses thereof |
| WO2021226558A1 (en) | 2020-05-08 | 2021-11-11 | The Broad Institute, Inc. | Methods and compositions for simultaneous editing of both strands of a target double-stranded nucleotide sequence |
| KR20230040331A (ko) | 2020-07-21 | 2023-03-22 | 알로젠 테라퓨틱스 인코포레이티드 | 강화된 신호 전달 및 활성을 갖는 키메라 항원 수용체 및 이의 용도 |
| US11883432B2 (en) | 2020-12-18 | 2024-01-30 | Century Therapeutics, Inc. | Chimeric antigen receptor system with adaptable receptor specificity |
| CN118019546A (zh) | 2021-03-23 | 2024-05-10 | 艾欧凡斯生物治疗公司 | 肿瘤浸润淋巴细胞的cish基因编辑及其在免疫疗法中的用途 |
| WO2023057285A1 (en) | 2021-10-06 | 2023-04-13 | Miltenyi Biotec B.V. & Co. KG | Method for targeted gene insertion into immune cells |
| WO2023081715A1 (en) | 2021-11-03 | 2023-05-11 | Viracta Therapeutics, Inc. | Combination of car t-cell therapy with btk inhibitors and methods of use thereof |
| EP4502177A1 (en) | 2022-03-24 | 2025-02-05 | Nanjing Legend Biotech Co., Ltd. | Method for preparing dna library and detecting retroviral integration site |
| WO2023230529A1 (en) | 2022-05-26 | 2023-11-30 | Caribou Biosciences, Inc. | Cytokine-receptor fusions for immune cell stimulation |
| JP2025519435A (ja) | 2022-06-06 | 2025-06-26 | カリブー・バイオサイエンシーズ・インコーポレイテッド | 操作された免疫細胞での自己免疫疾患の治療 |
| EP4583890A1 (en) | 2022-09-09 | 2025-07-16 | Iovance Biotherapeutics, Inc. | Processes for generating til products using pd-1/tigit talen double knockdown |
| JP2025531877A (ja) | 2022-09-09 | 2025-09-25 | アイオバンス バイオセラピューティクス,インコーポレイテッド | Pd-1/tigit talenダブルノックダウンを使用したtil製品を生成するためのプロセス |
| CN120153076A (zh) * | 2022-10-28 | 2025-06-13 | 正序(上海)生物医药科技有限公司 | 用于降低免疫原性和移植物抗宿主反应的基因编辑系统和方法 |
| US20250332196A1 (en) | 2022-11-14 | 2025-10-30 | Caribou Biosciences, Inc. | Anti-cll-1 chimeric antigen receptors, engineered cells and related methods |
| KR20240076377A (ko) | 2022-11-23 | 2024-05-30 | 가톨릭대학교 산학협력단 | 인간 혈청 알부민을 이용한 면역억제 t 세포의 대량 생산 방법 |
| KR20250152085A (ko) | 2023-05-01 | 2025-10-22 | 카리부 바이오사이언시스 인코포레이티드 | Bcma-표적화 조작된 면역 세포를 이용한 자가면역 질환의 치료 |
| WO2025171182A1 (en) | 2024-02-08 | 2025-08-14 | Iovance Biotherapeutics, Inc. | Treatment of cancer patients with tumor infiltrating lymphocyte therapies in combination with cancer vaccine |
| WO2025193386A1 (en) | 2024-03-13 | 2025-09-18 | Caribou Biosciences, Inc. | Treatment regimens for autoimmune disease with cd19-targeting engineered immune cells |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20110158957A1 (en) | 2009-11-10 | 2011-06-30 | Sangamo Biosciences, Inc. | Targeted disruption of T cell receptor genes using engineered zinc finger protein nucleases |
| WO2012068380A2 (en) | 2010-11-17 | 2012-05-24 | Sangamo Biosciences, Inc. | Methods and compositions for modulating pd1 |
| JP6875124B2 (ja) | 2013-05-13 | 2021-05-19 | セレクティスCellectis | 免疫療法のために同種異系かつ高活性のt細胞を操作するための方法 |
Family Cites Families (31)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR901228A (fr) | 1943-01-16 | 1945-07-20 | Deutsche Edelstahlwerke Ag | Système d'aimant à entrefer annulaire |
| US4474893A (en) | 1981-07-01 | 1984-10-02 | The University of Texas System Cancer Center | Recombinant monoclonal antibodies |
| US4683195A (en) | 1986-01-30 | 1987-07-28 | Cetus Corporation | Process for amplifying, detecting, and/or-cloning nucleic acid sequences |
| US5858358A (en) | 1992-04-07 | 1999-01-12 | The United States Of America As Represented By The Secretary Of The Navy | Methods for selectively stimulating proliferation of T cells |
| US6534055B1 (en) | 1988-11-23 | 2003-03-18 | Genetics Institute, Inc. | Methods for selectively stimulating proliferation of T cells |
| US6905680B2 (en) | 1988-11-23 | 2005-06-14 | Genetics Institute, Inc. | Methods of treating HIV infected subjects |
| US6352694B1 (en) | 1994-06-03 | 2002-03-05 | Genetics Institute, Inc. | Methods for inducing a population of T cells to proliferate using agents which recognize TCR/CD3 and ligands which stimulate an accessory molecule on the surface of the T cells |
| US7175843B2 (en) | 1994-06-03 | 2007-02-13 | Genetics Institute, Llc | Methods for selectively stimulating proliferation of T cells |
| US7067318B2 (en) | 1995-06-07 | 2006-06-27 | The Regents Of The University Of Michigan | Methods for transfecting T cells |
| US6692964B1 (en) | 1995-05-04 | 2004-02-17 | The United States Of America As Represented By The Secretary Of The Navy | Methods for transfecting T cells |
| US6010613A (en) | 1995-12-08 | 2000-01-04 | Cyto Pulse Sciences, Inc. | Method of treating materials with pulsed electrical fields |
| US6867041B2 (en) | 2000-02-24 | 2005-03-15 | Xcyte Therapies, Inc. | Simultaneous stimulation and concentration of cells |
| US7572631B2 (en) | 2000-02-24 | 2009-08-11 | Invitrogen Corporation | Activation and expansion of T cells |
| US6797514B2 (en) | 2000-02-24 | 2004-09-28 | Xcyte Therapies, Inc. | Simultaneous stimulation and concentration of cells |
| AU4328801A (en) | 2000-02-24 | 2001-09-03 | Xcyte Therapies Inc | Simultaneous stimulation and concentration of cells |
| GB0018901D0 (en) * | 2000-08-03 | 2000-09-20 | Biovation Ltd | Peptides presented by cells |
| WO2004067753A2 (en) | 2003-01-28 | 2004-08-12 | Cellectis | Use of meganucleases for inducing homologous recombination ex vivo and in toto in vertebrate somatic tissues and application thereof. |
| JP4753119B2 (ja) | 2003-03-14 | 2011-08-24 | セレクティス ソシエテ アノニム | 大量処理の生体外エレクトロポレーション法 |
| US20070286857A1 (en) * | 2003-12-22 | 2007-12-13 | Genzyme Corporation | Anti-Cd52 Antibody Treatment for Diabetes |
| CN103025344B (zh) * | 2010-05-17 | 2016-06-29 | 桑格摩生物科学股份有限公司 | 新型dna-结合蛋白及其用途 |
| US8945868B2 (en) | 2010-07-21 | 2015-02-03 | Sangamo Biosciences, Inc. | Methods and compositions for modification of a HLA locus |
| SG189482A1 (en) | 2010-10-27 | 2013-05-31 | Cellectis | Method for increasing the efficiency of double-strand break-induced mutagenesis |
| KR101982360B1 (ko) | 2011-04-05 | 2019-05-24 | 셀렉티스 | 콤팩트 tale-뉴클레아제의 발생 방법 및 이의 용도 |
| US9540623B2 (en) | 2011-07-08 | 2017-01-10 | Cellectis | Method for increasing the efficiency of double-strand-break induced mutagenesis |
| EP2737066B1 (en) | 2011-07-29 | 2017-11-08 | Cellectis | High throughput method for assembly and cloning polynucleotides comprising highly similar polynucleotidic modules |
| CA2854819C (en) * | 2011-11-16 | 2022-07-19 | Sangamo Biosciences, Inc. | Modified dna-binding proteins and uses thereof |
| US10391126B2 (en) * | 2011-11-18 | 2019-08-27 | Board Of Regents, The University Of Texas System | CAR+ T cells genetically modified to eliminate expression of T-cell receptor and/or HLA |
| DK3473707T3 (da) * | 2012-05-25 | 2025-03-17 | Cellectis | Fremgangsmåder til engineering af allogen og immunsuppressiv resistent t-celle til immunoterapi |
| WO2014039523A1 (en) * | 2012-09-04 | 2014-03-13 | Cellectis | Multi-chain chimeric antigen receptor and uses thereof |
| EP2906684B8 (en) * | 2012-10-10 | 2020-09-02 | Sangamo Therapeutics, Inc. | T cell modifying compounds and uses thereof |
| WO2016187104A1 (en) * | 2015-05-15 | 2016-11-24 | Oru Kayak, Inc. | Collapsible kayak with large cockpit |
-
2013
- 2013-07-15 US US13/942,191 patent/US20150017136A1/en not_active Abandoned
-
2014
- 2014-05-13 CN CN201480039917.0A patent/CN105378068A/zh active Pending
- 2014-05-13 AU AU2014266830A patent/AU2014266830B2/en active Active
- 2014-05-13 WO PCT/IB2014/061409 patent/WO2014184741A1/en not_active Ceased
- 2014-05-13 CA CA2912373A patent/CA2912373A1/en active Pending
- 2014-05-13 BR BR112015028493A patent/BR112015028493A2/pt not_active Application Discontinuation
- 2014-05-13 RU RU2015153245A patent/RU2736616C2/ru active
- 2014-05-13 ES ES14727626T patent/ES2828669T3/es active Active
- 2014-05-13 KR KR1020237030308A patent/KR20230144570A/ko active Pending
- 2014-05-13 MX MX2015015639A patent/MX380738B/es unknown
- 2014-05-13 DK DK14727626.5T patent/DK2997132T3/da active
- 2014-05-13 KR KR1020217037383A patent/KR20210143926A/ko not_active Ceased
- 2014-05-13 EP EP20190570.0A patent/EP3936612A1/en active Pending
- 2014-05-13 JP JP2016513480A patent/JP6875124B2/ja active Active
- 2014-05-13 EP EP14727626.5A patent/EP2997132B1/en active Active
- 2014-05-13 US US14/889,686 patent/US11304975B2/en active Active
- 2014-05-13 KR KR1020157035331A patent/KR102329704B1/ko active Active
-
2019
- 2019-06-20 JP JP2019114231A patent/JP6998917B2/ja active Active
-
2021
- 2021-11-09 JP JP2021182495A patent/JP7479339B2/ja active Active
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20110158957A1 (en) | 2009-11-10 | 2011-06-30 | Sangamo Biosciences, Inc. | Targeted disruption of T cell receptor genes using engineered zinc finger protein nucleases |
| WO2012068380A2 (en) | 2010-11-17 | 2012-05-24 | Sangamo Biosciences, Inc. | Methods and compositions for modulating pd1 |
| JP6875124B2 (ja) | 2013-05-13 | 2021-05-19 | セレクティスCellectis | 免疫療法のために同種異系かつ高活性のt細胞を操作するための方法 |
Non-Patent Citations (5)
| Title |
|---|
| J. Immunol. (2000) Vol.165, pp.5566-5572 |
| Mussolino C., et al.,A novel TALE nuclease scaffold enables high genome editing activity in combination with low toxicity,Nucleic Acids Res.,39(21)(2011),9283-9293 |
| Torikai H. et al.,A foundation for universal T-cell based immunotherapy: T cells engineered to express a CD19-specific chimeric-antigen-receptor and eliminate expression of endogenous TCR,Blood,119(24)(2012),5697-5705 |
| Torikai H., et al.,HLA and TCR knockout by zinc finger nucleases: Toward "off-the-shelf" allogeneic T-cell therapy for CD19+ Malignancies,Blood,116(21)(2010),Abstract Number: 3766. |
| Turtle CJ. et al,Engineered T cells for anti-cancer therapy.,Curr Opin Immunol.,24(5)(2012),633-639 |
Also Published As
| Publication number | Publication date |
|---|---|
| RU2015153245A (ru) | 2017-06-21 |
| RU2015153245A3 (ja) | 2018-03-01 |
| RU2736616C2 (ru) | 2020-11-19 |
| MX380738B (es) | 2025-03-12 |
| JP7479339B2 (ja) | 2024-05-08 |
| AU2014266830A1 (en) | 2015-11-26 |
| KR20210143926A (ko) | 2021-11-29 |
| CN105378068A (zh) | 2016-03-02 |
| CA2912373A1 (en) | 2014-11-20 |
| KR102329704B1 (ko) | 2021-11-22 |
| JP2019176869A (ja) | 2019-10-17 |
| DK2997132T3 (da) | 2020-11-09 |
| JP2016520308A (ja) | 2016-07-14 |
| KR20230144570A (ko) | 2023-10-16 |
| WO2014184741A1 (en) | 2014-11-20 |
| JP2022031696A (ja) | 2022-02-22 |
| ES2828669T3 (es) | 2021-05-27 |
| AU2014266830B2 (en) | 2020-07-02 |
| EP2997132A1 (en) | 2016-03-23 |
| BR112015028493A2 (pt) | 2017-09-19 |
| EP3936612A1 (en) | 2022-01-12 |
| US11304975B2 (en) | 2022-04-19 |
| MX2015015639A (es) | 2016-10-28 |
| US20160120905A1 (en) | 2016-05-05 |
| KR20160029017A (ko) | 2016-03-14 |
| JP6875124B2 (ja) | 2021-05-19 |
| EP2997132B1 (en) | 2020-08-12 |
| US20150017136A1 (en) | 2015-01-15 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6998917B2 (ja) | 免疫療法のために同種異系かつ高活性のt細胞を操作するための方法 | |
| JP6991167B2 (ja) | 免疫療法のための同種および免疫抑制耐性t細胞を操作するための方法 | |
| JP6352920B2 (ja) | 多重鎖キメラ抗原受容体およびその使用 | |
| JP6681837B2 (ja) | 同種移植に適合するt細胞を作製するための方法 | |
| JP2016524464A (ja) | 免疫療法のために高活性t細胞を操作するための方法 | |
| US20230050345A1 (en) | Methods for engineering allogeneic and highly active t cell for immunotheraphy | |
| HK40067501A (en) | Methods for engineering allogeneic and highly active t cell for immunotheraphy | |
| HK40071469A (en) | Methods for engineering allogeneic and immunosuppressive resistant t cell for immunotherapy | |
| EA050329B1 (ru) | Способы конструирования неаллореактивной и устойчивой к иммуносупрессии т-клетки для иммунотерапии |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190719 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20190719 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190805 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200309 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20200629 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20200923 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20201225 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20210104 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A132 Effective date: 20210512 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20210721 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20211109 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20211129 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20211130 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20211208 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20211221 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6998917 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |