JP6957813B2 - 薬物を保持した脂肪粒子を含む非水系組成物およびその製造方法 - Google Patents
薬物を保持した脂肪粒子を含む非水系組成物およびその製造方法 Download PDFInfo
- Publication number
- JP6957813B2 JP6957813B2 JP2017070587A JP2017070587A JP6957813B2 JP 6957813 B2 JP6957813 B2 JP 6957813B2 JP 2017070587 A JP2017070587 A JP 2017070587A JP 2017070587 A JP2017070587 A JP 2017070587A JP 6957813 B2 JP6957813 B2 JP 6957813B2
- Authority
- JP
- Japan
- Prior art keywords
- drug
- fat
- emulsion
- aqueous composition
- water
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Landscapes
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Description
また、請求項2記載の非水系組成物は、請求項1記載の非水系組成物において、水溶性担体が糖類であることを特徴とする。
また、請求項3記載の非水系組成物は、請求項2記載の非水系組成物において、糖類がイノシトール、グルコース、ソルビトール、フルクトース、マンニトール、トレハロース、ラクトース、スクロース、マルトース、キシリトールから選択される少なくとも1種であることを特徴とする。
また、請求項4記載の非水系組成物は、請求項1記載の非水系組成物において、水溶性担体がアミノ酸であることを特徴とする。
また、請求項5記載の非水系組成物は、請求項4記載の非水系組成物において、アミノ酸がグリシン、アラニン、ノルバリン、セリン、スレオニン、システイン、メチオニン、プロリン、ヒドロキシプロリン、β−アラニン、γ−アミノ酪酸から選択される少なくとも1種であることを特徴とする。
また、請求項6記載の非水系組成物は、請求項1記載の非水系組成物において、脂肪粒子の平均粒子径が1〜200nmであることを特徴とする。
また、請求項7記載の非水系組成物は、請求項1記載の非水系組成物において、乳化剤の50重量%以上がレシチンであることを特徴とする。
また、本発明の薬物を保持した脂肪粒子を含む非水系組成物の製造方法は、請求項8記載の通り、水難溶性薬物、油脂、乳化剤、水を少なくとも構成成分とする薬物含有脂肪乳剤であって、油脂の含量が2〜120mg/mL(但し2mg/mLを除く)、油脂に対する薬物の重量比率(薬物/油脂)が0.0001〜50(但し薬物と油脂の合計含量は最大で125mg/mL)、乳化剤の含量が30〜200mg/mL(但し30mg/mLを除く)、油脂に対する乳化剤の重量比率(乳化剤/油脂)が2〜300であり、濁度が0.5以下である薬物含有脂肪乳剤に、水溶性担体としての糖類および/またはアミノ酸を加えて溶解した後、乳剤の水相を除去することを特徴とする。
また、請求項9記載の製造方法は、請求項8記載の製造方法において、乳剤の水相の除去を10〜80℃の温度範囲での乾燥処理で行うことを特徴とする。
また、本発明の医薬品製剤は、請求項10記載の通り、請求項1記載の薬物を保持した脂肪粒子を含む非水系組成物それ自体からなるかまたは他の成分と配合してなることを特徴とする。
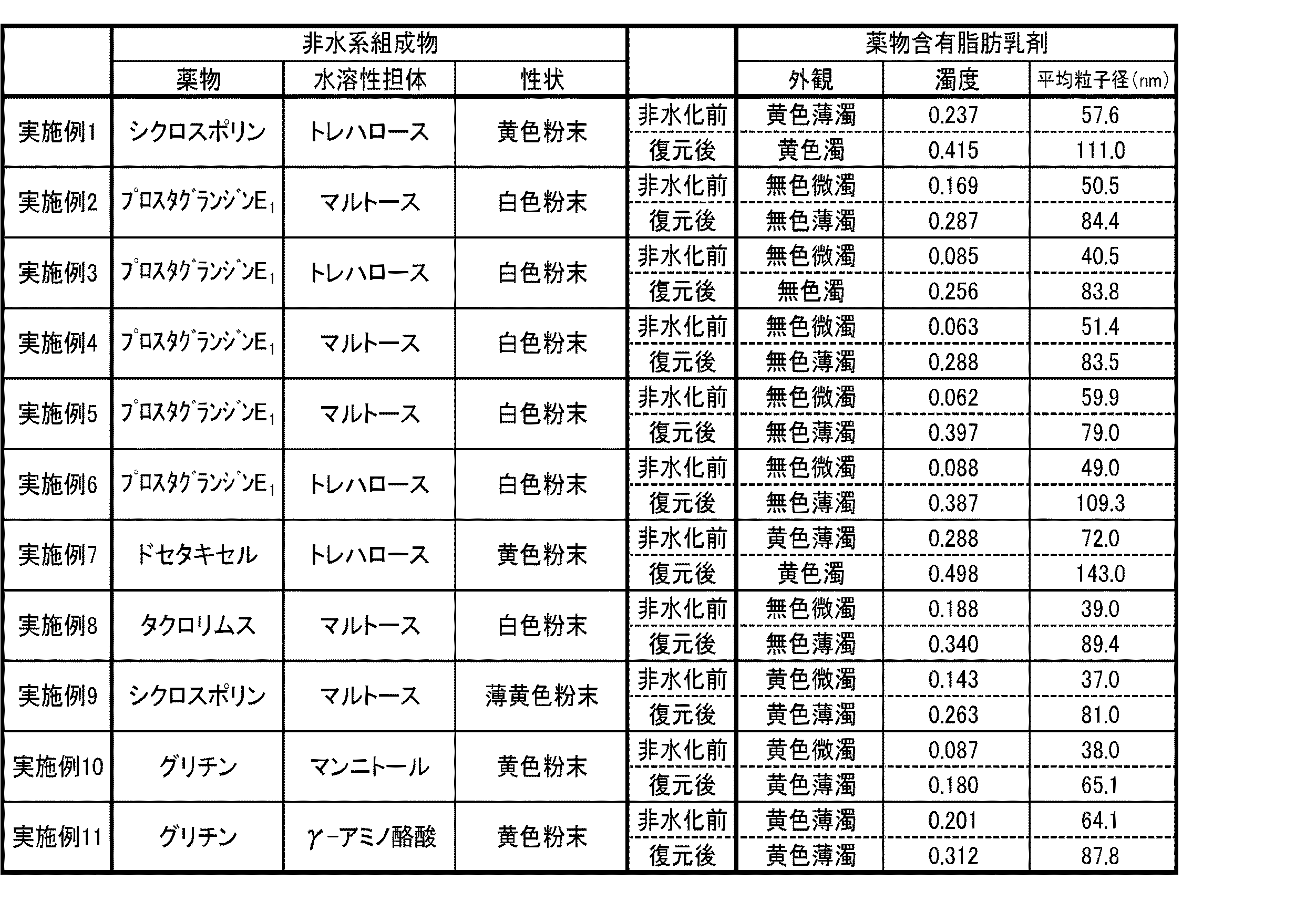
30mLビーカーにシクロスポリン40mg、中鎖脂肪酸トリグリセリド(ODO:日清オイリオ社製、以下同じ)500mg、精製卵黄レシチン(PL−100M:キユーピー社製、以下同じ)1.9g、プロピレングリコール200mgを採り、ホットスターラーで加温し、全量が20mLになるように純水を添加しながら超音波乳化機で乳剤が均一になるまで乳化した(約30分間)。得られた黄色の薄濁したシクロスポリン含有脂肪乳剤20mLに、水溶性担体としてトレハロース5gを加えて均一溶解した。得られたトレハロース溶解脂肪乳剤を、無菌ブース内で、0.22μmφのCA膜でろ過滅菌した後、100mLナスフラスコに入れて、60℃のウォーターバスで加温下、減圧乾燥(エバポレーション)を行って乳剤の水相を除去してから、無菌空気を用いてフラスコ内を常圧に戻すことで、目的とするシクロスポリンを保持した脂肪粒子を含む非水系組成物(黄色粉末、水分率:10%以下)を得た。この黄色粉末300mgを試験管に採り、純水3mLを加えて1分間、手で振とうしたところ、黄色の濁ったシクロスポリン含有脂肪乳剤を復元することができた(表1,2参照)。
30mLビーカーにプロスタグランジンE1600μg、中鎖脂肪酸トリグリセリド(ODO)200mg、精製卵黄レシチン(PC−98N:キユーピー社製、以下同じ)2g、プロピレングリコール200mgを採り、ホットスターラーで加温し、窒素気流下、全量が20mLになるように純水を添加しながら超音波乳化機で乳剤が均一になるまで乳化した(約30分間)。得られた無色の微濁したプロスタグランジンE1含有脂肪乳剤20mLに、水溶性担体としてマルトース12gを加えて均一溶解した。得られたマルトース溶解脂肪乳剤を、無菌ブース内で、0.22μmφのCA膜でろ過滅菌した後、100mLナスフラスコに入れて、60℃のウォーターバスで加温下、減圧乾燥(エバポレーション)を行って乳剤の水相を除去してから、無菌空気を用いてフラスコ内を常圧に戻すことで、目的とするプロスタグランジンE1を保持した脂肪粒子を含む非水系組成物(白色粉末、水分率:10%以下)を得た。この白色粉末300mgを試験管に採り、純水3mLを加えて1分間、手で振とうしたところ、無色の薄濁したプロスタグランジンE1含有脂肪乳剤を復元することができた(表1,2参照)。
30mLビーカーにプロスタグランジンE1600μg、中鎖脂肪酸トリグリセリド(ODO)400mg、精製卵黄レシチン(PC−98N)3g、プロピレングリコール200mgを採り、ホットスターラーで加温し、窒素気流下、全量が20mLになるように純水を添加しながら超音波乳化機で乳剤が均一になるまで乳化した(約30分間)。得られた無色の微濁したプロスタグランジンE1含有脂肪乳剤20mLに、水溶性担体としてトレハロース5gを加えて均一溶解した。得られたトレハロース溶解脂肪乳剤を、無菌ブース内で、0.22μmφのCA膜でろ過滅菌した後、100mLナスフラスコに入れて、60℃のウォーターバスで加温下、減圧乾燥(エバポレーション)を行って乳剤の水相を除去してから、無菌空気を用いてフラスコ内を常圧に戻すことで、目的とするプロスタグランジンE1を保持した脂肪粒子を含む非水系組成物(白色粉末、水分率:10%以下)を得た。この白色粉末300mgを試験管に採り、純水3mLを加えて1分間、手で振とうしたところ、無色の濁ったプロスタグランジンE1含有脂肪乳剤を復元することができた(表1,2参照)。
30mLビーカーにプロスタグランジンE1600μg、中鎖脂肪酸トリグリセリド(ODO)200mg、精製卵黄レシチン(PC−98N)2g、プロピレングリコール2gを採り、ホットスターラーで加温し、窒素気流下、全量が20mLになるように純水を添加しながら超音波乳化機で乳剤が均一になるまで乳化した(約30分間)。得られた無色の微濁したプロスタグランジンE1含有脂肪乳剤20mLに、水溶性担体としてマルトース10gを加えて均一溶解した。得られたマルトース溶解脂肪乳剤を、無菌ブース内で、0.22μmφのCA膜でろ過滅菌した後、100mLナスフラスコに入れて、60℃のウォーターバスで加温下、減圧乾燥(エバポレーション)を行って乳剤の水相を除去してから、無菌空気を用いてフラスコ内を常圧に戻すことで、目的とするプロスタグランジンE1を保持した脂肪粒子を含む非水系組成物(白色粉末、水分率:10%以下)を得た。この白色粉末300mgを試験管に採り、純水3mLを加えて1分間、手で振とうしたところ、無色の薄濁したプロスタグランジンE1含有脂肪乳剤を復元することができた(表1,2参照)。
30mLビーカーにプロスタグランジンE1600μg、中鎖脂肪酸トリグリセリド(ODO)300mg、精製卵黄レシチン(PC−98N)3g、プロピレングリコール1.2gを採り、ホットスターラーで加温し、窒素気流下、全量が20mLになるように純水を添加しながら超音波乳化機で乳剤が均一になるまで乳化した(約30分間)。得られた無色の微濁したプロスタグランジンE1含有脂肪乳剤20mLに、水溶性担体としてマルトース10gを加えて均一溶解した。得られたマルトース溶解脂肪乳剤を、無菌ブース内で、0.22μmφのCA膜でろ過滅菌した後、100mLナスフラスコに入れて、60℃のウォーターバスで加温下、減圧乾燥(エバポレーション)を行って乳剤の水相を除去してから、無菌空気を用いてフラスコ内を常圧に戻すことで、目的とするプロスタグランジンE1を保持した脂肪粒子を含む非水系組成物(白色粉末、水分率:10%以下)を得た。この白色粉末300mgを試験管に採り、純水3mLを加えて1分間、手で振とうしたところ、無色の薄濁したプロスタグランジンE1含有脂肪乳剤を復元することができた(表1,2参照)。
30mLビーカーにプロスタグランジンE1600μg、中鎖脂肪酸トリグリセリド(ODO)300mg、精製卵黄レシチン(PC−98N)2.4g、グリセリン200mgを採り、ホットスターラーで加温し、窒素気流下、全量が20mLになるように純水を添加しながら超音波乳化機で乳剤が均一になるまで乳化した(約30分間)。得られた無色の微濁したプロスタグランジンE1含有脂肪乳剤20mLに、水溶性担体としてトレハロース10gを加えて均一溶解した。得られたトレハロース溶解脂肪乳剤を、無菌ブース内で、0.22μmφのCA膜でろ過滅菌した後、100mLナスフラスコに入れて、60℃のウォーターバスで加温下、減圧乾燥(エバポレーション)を行って乳剤の水相を除去してから、無菌空気を用いてフラスコ内を常圧に戻すことで、目的とするプロスタグランジンE1を保持した脂肪粒子を含む非水系組成物(白色粉末、水分率:10%以下)を得た。この白色粉末300mgを試験管に採り、純水3mLを加えて1分間、手で振とうしたところ、無色の薄濁したプロスタグランジンE1含有脂肪乳剤を復元することができた(表1,2参照)。
30mLビーカーにドセタキセル80mg、中鎖脂肪酸トリグリセリド(ODO)100mg、精製卵黄レシチン(PL−100M)800mgを採り、ホットスターラーで加温し、全量が20mLになるように純水を添加しながら超音波乳化機で乳剤が均一になるまで乳化した(約15分間)。得られた黄色の薄濁したドセタキセル含有脂肪乳剤20mLに、水溶性担体としてトレハロース4gを加えて均一溶解した。得られたトレハロース溶解脂肪乳剤を、無菌ブース内で、0.22μmφのCA膜でろ過滅菌した後、100mLナスフラスコに入れて、60℃のウォーターバスで加温下、減圧乾燥(エバポレーション)を行って乳剤の水相を除去してから、無菌空気を用いてフラスコ内を常圧に戻すことで、目的とするドセタキセルを保持した脂肪粒子を含む非水系組成物(黄色粉末、水分率:10%以下)を得た。この白色粉末150mgを試験管に採り、純水1.5mLを加えて1分間、手で振とうしたところ、黄色の濁ったドセタキセル含有脂肪乳剤を復元することができた(表1,2参照)。
30mLビーカーにタクロリムス40mg、中鎖脂肪酸トリグリセリド(ODO)1g、精製卵黄レシチン(PC−98N)4g、グリセリン200mgを採り、ホットスターラーで加温し、窒素気流下、全量が20mLになるように純水を添加しながら超音波乳化機で乳剤が均一になるまで乳化した(約15分間)。得られた無色の微濁したタクロリムス含有脂肪乳剤20mLに、水溶性担体としてマルトース10gを加えて均一溶解した。得られたマルトース溶解脂肪乳剤を、無菌ブース内で、0.22μmφのCA膜でろ過滅菌した後、100mLナスフラスコに入れて、60℃のウォーターバスで加温下、減圧乾燥(エバポレーション)を行って乳剤の水相を除去してから、無菌空気を用いてフラスコ内を常圧に戻すことで、目的とするタクロリムスを保持した脂肪粒子を含む非水系組成物(白色粉末、水分率:10%以下)を得た。この白色粉末150mgを試験管に採り、純水1.5mLを加えて1分間、手で振とうしたところ、無色の薄濁したタクロリムス含有脂肪乳剤を復元することができた(表1,2参照)。
30mLビーカーにシクロスポリン40mg、中鎖脂肪酸トリグリセリド(ODO)500mg、精製卵黄レシチン(PL−100M)1g、プロピレングリコール460mgを採り、ホットスターラーで加温し、全量が20mLになるように純水を添加しながら超音波乳化機で乳剤が均一になるまで乳化した(約15分間)。得られた黄色の微濁したシクロスポリン含有脂肪乳剤20mLに、水溶性担体としてマルトース10gを加えて均一溶解した。得られたマルトース溶解脂肪乳剤を、無菌ブース内で、0.22μmφのCA膜でろ過滅菌した後、100mLナスフラスコに入れて、60℃のウォーターバスで加温下、減圧乾燥(エバポレーション)を行って乳剤の水相を除去してから、無菌空気を用いてフラスコ内を常圧に戻すことで、目的とするシクロスポリンを保持した脂肪粒子を含む非水系組成物(薄黄色粉末、水分率:10%以下)を得た。この薄黄色粉末150mgを試験管に採り、純水1.5mLを加えて1分間、手で振とうしたところ、黄色の薄濁したシクロスポリン含有脂肪乳剤を復元することができた(表1,2参照)。
30mLビーカーにグリチン100mg、中鎖脂肪酸トリグリセリド(ODO)50mg、精製卵黄レシチン(PL−100M)200mg、ポリソルベート(ポリソルベート80)800mgを採り、ホットスターラーで加温し、全量が20mLになるように純水を添加しながら超音波乳化機で乳剤が均一になるまで乳化した(約20分間)。得られた黄色の微濁したグリチン含有脂肪乳剤20mLに、水溶性担体としてマンニトール4gを加えて均一溶解した。得られたマンニトール溶解脂肪乳剤を、無菌ブース内で、0.22μmφのCA膜でろ過滅菌した後、100mLナスフラスコに入れて、60℃のウォーターバスで加温下、減圧乾燥(エバポレーション)を行って乳剤の水相を除去してから、無菌空気を用いてフラスコ内を常圧に戻すことで、目的とするグリチンを保持した脂肪粒子を含む非水系組成物(黄色粉末、水分率:10%以下)を得た。この白色粉末150mgを試験管に採り、純水1.5mLを加えて1分間、手で振とうしたところ、黄色の薄濁したグリチン含有脂肪乳剤を復元することができた(表1,2参照)。
30mLビーカーにグリチン100mg、中鎖脂肪酸トリグリセリド(ODO)100mg、精製卵黄レシチン(PL−100M)700mg、ポリソルベート(ポリソルベート80)300mgを採り、ホットスターラーで加温し、全量が20mLになるように純水を添加しながら超音波乳化機で乳剤が均一になるまで乳化した(約20分間)。得られた黄色の薄濁したグリチン含有脂肪乳剤20mLに、水溶性担体としてγ−アミノ酪酸4gを加えて均一溶解した。得られたγ−アミノ酪酸溶解脂肪乳剤を、無菌ブース内で、0.22μmφのCA膜でろ過滅菌した後、100mLナスフラスコに入れて、60℃のウォーターバスで加温下、減圧乾燥(エバポレーション)を行って乳剤の水相を除去してから、無菌空気を用いてフラスコ内を常圧に戻すことで、目的とするグリチンを保持した脂肪粒子を含む非水系組成物(黄色粉末、水分率:10%以下)を得た。この白色粉末150mgを試験管に採り、純水1.5mLを加えて1分間、手で振とうしたところ、黄色の薄濁したグリチン含有脂肪乳剤を復元することができた(表1,2参照)。
精製卵黄レシチン(PL−100M)300mgを用いること以外は実施例1と同様の操作を行うと、黄色の濁ったシクロスポリン含有脂肪乳剤から、薄黄色粉末であるシクロスポリンを含む非水系組成物が得られた。この薄黄色粉末150mgを試験管に採り、純水1.5mLを加えて1分間、手で振とうしたところ、相分離が起こり、シクロスポリン含有脂肪乳剤を復元することができなかった。
実施例1で得たシクロスポリンを保持した脂肪粒子を含む非水系組成物(黄色粉末)14.5g、白糖3.5g、カルメロースナトリウム2.0gを小型混合機で攪拌混合することにより、シクロスポリン含有含嗽剤用粉末を得た。
実施例2で得たプロスタグランジンE1を保持した脂肪粒子を含む非水系組成物(白色粉末)それ自体を、プロスタグランジンE1含有注射剤用液体とした。
実施例3で得たプロスタグランジンE1を保持した脂肪粒子を含む非水系組成物(白色粉末)11.9gに、60℃で加温溶解したマクロゴール軟膏88.1gを攪拌しながら徐々に加え、均一になるまで混合し、冷却固化することにより、プロスタグランジンE1含有軟膏を得た。
実施例4で得たプロスタグランジンE1を保持した脂肪粒子を含む非水系組成物(白色粉末)11.9gを注射用水25mLに混合した後、4.5%カルメロースナトリウム溶液75mLを加えて十分に練合することにより、プロスタグランジンE1含有ゲルを得た。
実施例9で得たシクロスポリンを保持した脂肪粒子を含む非水系組成物(薄黄色粉末)37.68g、白糖2.27g、パラオキシ安息香酸メチル33mg、パラオキシ安息香酸プロピル17mgを小型混合機で攪拌混合することにより、シクロスポリン含有経口シロップ剤用粉末を得た。
Claims (10)
- 水難溶性薬物、油脂、乳化剤、水を少なくとも構成成分とする薬物含有脂肪乳剤であって、油脂の含量が2〜120mg/mL(但し2mg/mLを除く)、油脂に対する薬物の重量比率(薬物/油脂)が0.0001〜50(但し薬物と油脂の合計含量は最大で125mg/mL)、乳化剤の含量が30〜200mg/mL(但し30mg/mLを除く)、油脂に対する乳化剤の重量比率(乳化剤/油脂)が2〜300であり、濁度が0.5以下である薬物含有脂肪乳剤に含まれる薬物を保持した脂肪粒子が、水溶性担体としての糖類および/またはアミノ酸に担持されてなり、水分率が10%以下であることを特徴とする薬物を保持した脂肪粒子を含む非水系組成物。
- 水溶性担体が糖類であることを特徴とする請求項1記載の非水系組成物。
- 糖類がイノシトール、グルコース、ソルビトール、フルクトース、マンニトール、トレハロース、ラクトース、スクロース、マルトース、キシリトールから選択される少なくとも1種であることを特徴とする請求項2記載の非水系組成物。
- 水溶性担体がアミノ酸であることを特徴とする請求項1記載の非水系組成物。
- アミノ酸がグリシン、アラニン、ノルバリン、セリン、スレオニン、システイン、メチオニン、プロリン、ヒドロキシプロリン、β−アラニン、γ−アミノ酪酸から選択される少なくとも1種であることを特徴とする請求項4記載の非水系組成物。
- 脂肪粒子の平均粒子径が1〜200nmであることを特徴とする請求項1記載の非水系組成物。
- 乳化剤の50重量%以上がレシチンであることを特徴とする請求項1記載の非水系組成物。
- 水難溶性薬物、油脂、乳化剤、水を少なくとも構成成分とする薬物含有脂肪乳剤であって、油脂の含量が2〜120mg/mL(但し2mg/mLを除く)、油脂に対する薬物の重量比率(薬物/油脂)が0.0001〜50(但し薬物と油脂の合計含量は最大で125mg/mL)、乳化剤の含量が30〜200mg/mL(但し30mg/mLを除く)、油脂に対する乳化剤の重量比率(乳化剤/油脂)が2〜300であり、濁度が0.5以下である薬物含有脂肪乳剤に、水溶性担体としての糖類および/またはアミノ酸を加えて溶解した後、乳剤の水相を除去することを特徴とする薬物を保持した脂肪粒子を含む非水系組成物の製造方法。
- 乳剤の水相の除去を10〜80℃の温度範囲での乾燥処理で行うことを特徴とする請求項8記載の製造方法。
- 請求項1記載の薬物を保持した脂肪粒子を含む非水系組成物それ自体からなるかまたは他の成分と配合してなることを特徴とする医薬品製剤。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2017070587A JP6957813B2 (ja) | 2017-03-31 | 2017-03-31 | 薬物を保持した脂肪粒子を含む非水系組成物およびその製造方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2017070587A JP6957813B2 (ja) | 2017-03-31 | 2017-03-31 | 薬物を保持した脂肪粒子を含む非水系組成物およびその製造方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2018172316A JP2018172316A (ja) | 2018-11-08 |
| JP6957813B2 true JP6957813B2 (ja) | 2021-11-02 |
Family
ID=64108266
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017070587A Active JP6957813B2 (ja) | 2017-03-31 | 2017-03-31 | 薬物を保持した脂肪粒子を含む非水系組成物およびその製造方法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP6957813B2 (ja) |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2937135B2 (ja) * | 1995-09-13 | 1999-08-23 | 日本新薬株式会社 | Pge1含有凍結乾燥製剤及び製法 |
| JP5497336B2 (ja) * | 2009-05-20 | 2014-05-21 | テクノガード株式会社 | 薬物を保持した脂肪粒子を含む非水系組成物およびその製造方法 |
| JP2013018737A (ja) * | 2011-07-11 | 2013-01-31 | Fujifilm Corp | 凍結乾燥製剤及びその製造方法 |
| JP5620561B2 (ja) * | 2013-10-21 | 2014-11-05 | テクノガード株式会社 | 薬物を保持した脂肪粒子を含む非水系組成物およびその製造方法 |
-
2017
- 2017-03-31 JP JP2017070587A patent/JP6957813B2/ja active Active
Also Published As
| Publication number | Publication date |
|---|---|
| JP2018172316A (ja) | 2018-11-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5340954B2 (ja) | 薬物含有脂肪乳剤およびその製造方法 | |
| TWI694823B (zh) | 含有脂質化合物、三酸甘油酯及界面活性劑之組成物與使用該組成物之方法 | |
| WO2009012718A1 (en) | A composite emulsifier, an emulsion prepared from it and the preparation method thereof | |
| WO2015123631A1 (en) | Compositions of nanoemulsion delivery systems | |
| JP5497336B2 (ja) | 薬物を保持した脂肪粒子を含む非水系組成物およびその製造方法 | |
| JP2014088453A (ja) | 異なる物性の薬物の一剤形化 | |
| WO2016104661A1 (ja) | スクリーンフォーマー用の外用組成物 | |
| CN114796110A (zh) | 一种不含乙醇的难溶性药物浓缩液以及由其制备的胶束溶液 | |
| JP6815497B2 (ja) | 自己乳化性を有する組成物、及びその製造方法、並びにナノエマルション、及びその製造方法 | |
| EP3099289B1 (en) | Composition comprising epa and dha triglycerides for parenteral administration | |
| JP7456599B2 (ja) | 薬物含有脂肪乳剤およびその製造方法 | |
| RU2605616C1 (ru) | Липосомальное средство на основе убихинола и способ его получения | |
| IL228528A (en) | Potato-based nanoparticles | |
| JP5620561B2 (ja) | 薬物を保持した脂肪粒子を含む非水系組成物およびその製造方法 | |
| JP6957813B2 (ja) | 薬物を保持した脂肪粒子を含む非水系組成物およびその製造方法 | |
| JP7149611B2 (ja) | 薬物を保持した非水系組成物およびその製造方法 | |
| WO2015121378A1 (en) | Liquid phospholipid-containing compositions for the preparation of pharmaceuticals | |
| JP7097593B2 (ja) | 薬物を保持した脂肪粒子を含む非水系組成物およびその製造方法 | |
| JP2016034918A (ja) | 難水溶性抗酸化物質送達用組成物 | |
| CN103859395A (zh) | 一种高吸收率的辅酶q10的自乳化释药体系及其制备方法及应用 | |
| JP2514995B2 (ja) | 経皮、経粘膜による物質の吸収を促進する組成物 | |
| RU2448731C2 (ru) | Фосфолипидная композиция | |
| JPH05229941A (ja) | フェノール誘導体を含有する注射用乳剤 | |
| CN109985005A (zh) | 氟比洛芬酯脂肪乳及其制备方法 | |
| WO2002009670A1 (en) | Liquid or semi-solid pharmaceutical excipient and pharmaceutical composition comprising the same |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200330 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20210129 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210302 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20210426 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210602 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20210824 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20210913 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6957813 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |