JP6932636B2 - Gタンパク質活性化を監視するためのGβγ相互作用タンパク質に基づいたバイオセンサー - Google Patents
Gタンパク質活性化を監視するためのGβγ相互作用タンパク質に基づいたバイオセンサー Download PDFInfo
- Publication number
- JP6932636B2 JP6932636B2 JP2017520506A JP2017520506A JP6932636B2 JP 6932636 B2 JP6932636 B2 JP 6932636B2 JP 2017520506 A JP2017520506 A JP 2017520506A JP 2017520506 A JP2017520506 A JP 2017520506A JP 6932636 B2 JP6932636 B2 JP 6932636B2
- Authority
- JP
- Japan
- Prior art keywords
- protein
- fused
- ret
- βγip
- gpcr
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/566—Immunoassay; Biospecific binding assay; Materials therefor using specific carrier or receptor proteins as ligand binding reagents where possible specific carrier or receptor proteins are classified with their target compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- C07K14/4701—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals not used
- C07K14/4722—G-proteins
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/72—Receptors; Cell surface antigens; Cell surface determinants for hormones
- C07K14/723—G protein coupled receptor, e.g. TSHR-thyrotropin-receptor, LH/hCG receptor, FSH receptor
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/0004—Oxidoreductases (1.)
- C12N9/0069—Oxidoreductases (1.) acting on single donors with incorporation of molecular oxygen, i.e. oxygenases (1.13)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/66—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving luciferase
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y113/00—Oxidoreductases acting on single donors with incorporation of molecular oxygen (oxygenases) (1.13)
- C12Y113/12—Oxidoreductases acting on single donors with incorporation of molecular oxygen (oxygenases) (1.13) with incorporation of one atom of oxygen (internal monooxygenases or internal mixed function oxidases)(1.13.12)
- C12Y113/12007—Photinus-luciferin 4-monooxygenase (ATP-hydrolysing) (1.13.12.7), i.e. firefly-luciferase
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/6428—Measuring fluorescence of fluorescent products of reactions or of fluorochrome labelled reactive substances, e.g. measuring quenching effects, using measuring "optrodes"
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/536—Immunoassay; Biospecific binding assay; Materials therefor with immune complex formed in liquid phase
- G01N33/542—Immunoassay; Biospecific binding assay; Materials therefor with immune complex formed in liquid phase with steric inhibition or signal modification, e.g. fluorescent quenching
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/60—Fusion polypeptide containing spectroscopic/fluorescent detection, e.g. green fluorescent protein [GFP]
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/6428—Measuring fluorescence of fluorescent products of reactions or of fluorochrome labelled reactive substances, e.g. measuring quenching effects, using measuring "optrodes"
- G01N2021/6439—Measuring fluorescence of fluorescent products of reactions or of fluorochrome labelled reactive substances, e.g. measuring quenching effects, using measuring "optrodes" with indicators, stains, dyes, tags, labels, marks
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/46—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans from vertebrates
- G01N2333/47—Assays involving proteins of known structure or function as defined in the subgroups
- G01N2333/4701—Details
- G01N2333/4719—G-proteins
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/705—Assays involving receptors, cell surface antigens or cell surface determinants
- G01N2333/72—Assays involving receptors, cell surface antigens or cell surface determinants for hormones
- G01N2333/726—G protein coupled receptor, e.g. TSHR-thyrotropin-receptor, LH/hCG receptor, FSH
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2500/00—Screening for compounds of potential therapeutic value
- G01N2500/02—Screening involving studying the effect of compounds C on the interaction between interacting molecules A and B (e.g. A = enzyme and B = substrate for A, or A = receptor and B = ligand for the receptor)
Description
本出願は、2014年10月14日に出願された米国特許仮出願番号第62/063,622号の利益を主張し、その内容全体を参照によって本願明細書に引用したものとする。
1.(A)、または(B)で定義される要素を含む、Gタンパク質活性を検出するためのバイオセンサーシステムであって、
(A)
(a)共鳴エネルギー転移(RET)ドナー;(b)RETアクセプター、または(c)レポータータンパク質の第1の断片に融合したGβγ相互作用タンパク質(βγIP)を含む第1の成分;及び
融合Gβタンパク質または融合Gγタンパク質を含む第2の成分、前記Gβタンパク質または前記Gγタンパク質は、(a)RETドナー;(b)RETアクセプター、または(c)前記レポータータンパク質の第2の断片に融合している;
を含む、(i)第1のバイオセンサー、
(i)で定義される前記第1及び第2の成分;及び
組換えGαタンパク質を含む第3の成分;
(a)前記βγIPが前記RETドナーに融合している場合、前記GβまたはGγタンパク質は、前記RETアクセプターに融合しており;(b)前記βγIPが前記RETアクセプターに融合している場合、前記GβまたはGγタンパク質は、前記RETドナーに融合しており;及び(c)前記βγIPが前記レポータータンパク質の第1の断片に融合している場合、前記GβまたはGγタンパク質は、前記レポータータンパク質の第2の断片に融合している;
を含む、(ii)第2のバイオセンサー、または
(B)
(a)RETドナー;(b)RETアクセプター、または(c)レポータータンパク質の第1の断片に融合したGβγ相互作用タンパク質(βγIP)を含む第1の成分;
融合Gタンパク質共役型レセプター(GPCR)を含む第2の成分、前記GPCRは、そのC末端で(a)RETドナー;(b)RETアクセプター、または(c)前記レポータータンパク質の第2の断片に融合している;
組換えGαタンパク質を含む第3の成分;
(a)前記βγIPが前記RETドナーに融合している場合、前記GPCRは、前記RETアクセプターに融合しており;(b)前記βγIPが前記RETアクセプターに融合している場合、前記GPCRは、前記RETドナーに融合しており;及び(c)前記βγIPが前記レポータータンパク質の第1の断片に融合している場合、前記GPCRは、前記レポータータンパク質の第2の断片に融合している
を含む、(i)バイオセンサー
を含む、前記バイオセンサーシステム。
(i)(a)RETドナー;(b)RETアクセプター、または(c)レポータータンパク質の第1の断片に融合したGβγ相互作用タンパク質(βγIP)を含む第1の成分;及び
(ii)融合原形質膜(PM)標的化部分を含む第2の成分、前記PM標的化部分は、(a)RETドナー;(b)RETアクセプター、または(c)前記レポータータンパク質の第2の断片に融合している;
を含み、
(a)前記βγIPが前記RETドナーに融合している場合、前記PM標的化部分は、前記RETアクセプターに融合しており;(b)前記βγIPが前記RETアクセプターに融合している場合、前記PM標的化部分は、前記RETドナーに融合しており;及び(c)前記βγIPが前記レポータータンパク質の第1の断片に融合している場合、前記PM標的化部分は、前記レポータータンパク質の第2の断片に融合している、前記バイオセンサー。
(1)(A)、(B)、または(C)で定義される要素を含むバイオセンサーを提供すること:
(A)
(i)(a)RETドナー;(b)RETアクセプター、または(c)レポータータンパク質の第1の断片に融合したGβγ相互作用タンパク質(βγIP)を含む第1の成分;
(ii)融合Gβタンパク質または融合Gγタンパク質を含む第2の成分、前記Gβタンパク質または前記Gγタンパク質は、(a)RETドナー;(b)RETアクセプター、または(c)前記レポータータンパク質の第2の断片に融合している、
(a)前記βγIPが前記RETドナーに融合している場合、前記GβまたはGγタンパク質は、前記RETアクセプターに融合しており;(b)前記βγIPが前記RETアクセプターに融合している場合、前記GβまたはGγタンパク質は、前記RETドナーに融合しており;及び(c)前記βγIPが前記レポータータンパク質の第1の断片に融合している場合、前記GβまたはGγタンパク質は、前記レポータータンパク質の第2の断片に融合している;
(iii)組換えGαタンパク質を含む第3の成分;及び
(iv)前記GPCRを含む第4の成分;
(B)
(i)(a)RETドナー;(b)RETアクセプター、または(c)レポータータンパク質の第1の断片に融合したGβγ相互作用タンパク質(βγIP)を含む第1の成分;
(ii)そのC末端で(a)RETドナー;(b)RETアクセプター、または(c)前記レポータータンパク質の第2の断片に融合した前記GPCRを含む第2の成分;
(iii)組換えGαタンパク質を含む第3の成分;
(a)前記βγIPが前記RETドナーに融合している場合、前記GPCRは、前記RETアクセプターに融合しており;(b)前記βγIPが前記RETアクセプターに融合している場合、前記GPCRは、前記RETドナーに融合しており;及び(c)前記βγIPが前記レポータータンパク質の第1の断片に融合している場合、前記GPCRは、前記レポータータンパク質の第2の断片に融合している;または
(C)
(i)(a)RETドナー;(b)RETアクセプター、または(c)レポータータンパク質の第1の断片に融合したGβγ相互作用タンパク質(βγIP)を含む第1の成分;
(ii)融合原形質膜(PM)標的化部分を含む第2の成分、前記PM標的化部分は、(a)RETドナー;(b)RETアクセプター、または(c)前記レポータータンパク質の第2の断片に融合している;
(a)前記βγIPが前記RETドナーに融合している場合、前記PM標的化部分は、前記RETアクセプターに融合しており;(b)前記βγIPが前記RETアクセプターに融合している場合、前記PM標的化部分は、前記RETドナーに融合しており;及び(c)前記βγIPが前記レポータータンパク質の第1の断片に融合している場合、前記PM標的化部分は、前記レポータータンパク質の第2の断片に融合している;
(iii)組換えGαタンパク質を含む第3の成分;及び
(iv)前記GPCRを含む第4の成分;及び
(2)前記試験薬剤の存在下及び不在下において、前記RETアクセプターまたはレポータータンパク質が発したシグナルを測定すること;
前記薬剤の存在下において測定されたより高いシグナルは、前記試験薬剤が前記GPCRの活性を増加させることを示し、前記薬剤の存在下において測定されたより低いシグナルは、前記薬剤が前記GPCRの活性を阻害することを示す
を含む、前記方法。
(a)項目1〜32のいずれか1項に記載のバイオセンサーシステムの前記第1及び第2のバイオセンサー中で前記GPCRアゴニストの存在下及び不在下において、前記RETアクセプターまたはレポータータンパク質が発したシグナルを測定すること、及び
(b)前記RETアクセプターまたはレポータータンパク質が発したシグナルに基づいて、前記Gαタンパク質が前記GPCRアゴニストによって活性化されるかどうかを同定すること;
前記第1のバイオセンサーに対して前記第2のバイオセンサー中の前記GPCRアゴニストの存在下において測定されたシグナルのより高い増加は、前記Gαタンパク質が前記GPCRアゴニストによって活性化されることを示し、前記第1のバイオセンサーに対して前記第2のバイオセンサー中の前記GPCRアゴニストの存在下において測定されたシグナルの同様のまたはより低い増加、または減少は、前記Gαタンパク質が前記GPCRアゴニストによって活性化されないことを示す
を含む、前記方法。
(a)以下の(i)、及び(ii)を含む第1のバイオセンサー中の前記GPCRアゴニストの存在下及び不在下において、RETアクセプターまたはレポータータンパク質が発したシグナルを測定すること:
(i)(a)RETドナー;(b)RETアクセプター、または(c)レポータータンパク質の第1の断片に融合したGβγ相互作用タンパク質(βγIP)を含む第1の成分;及び
(ii)融合Gタンパク質共役型レセプター(GPCR)を含む第2の成分、前記GPCRは、そのC末端で(a)RETドナー;(b)RETアクセプター、または(c)前記レポータータンパク質の第2の断片に融合している;
(b)以下の(i)、及び(ii)を含む第2のバイオセンサー中の前記GPCRアゴニストの存在下及び不在下において、RETアクセプターまたはレポータータンパク質が発したシグナルを測定すること:
(i)(a)で定義される前記第1及び第2の成分;及び
(ii)前記Gαタンパク質の組換え形態を含む第3の成分;
(a)前記βγIPが前記RETドナーに融合している場合、前記GPCRは、前記RETアクセプターに融合しており;(b)前記βγIPが前記RETアクセプターに融合している場合、前記GPCRは、前記RETドナーに融合しており;及び(c)前記βγIPが前記レポータータンパク質の第1の断片に融合している場合、前記GPCRは、前記レポータータンパク質の第2の断片に融合している;
前記第1のバイオセンサーに対して前記第2のバイオセンサー中の前記GPCRアゴニストの存在下において測定されたシグナルのより高い増加は、前記Gαタンパク質が前記GPCRアゴニストによって活性化されることを示し、前記第1のバイオセンサーに対して前記第2のバイオセンサー中の前記GPCRアゴニストの存在下において測定されたシグナルの同様のまたはより低い増加、または減少は、前記Gαタンパク質が前記GPCRアゴニストによって活性化されないことを示す
を含む、前記方法。
(a)項目1〜31のいずれか1項に記載の要素(A)で定義される第2のバイオセンサー(複数可)、
(b)項目1〜31のいずれか1項に記載の要素(B)で定義されるバイオセンサー、または
(c)項目42〜44のいずれか1項に記載のバイオセンサー、
試験薬剤の存在下及び不在下において、及びGPCRアゴニストの存在下において、前記組換えGαタンパク質は、前記GPCRにカップリングしている;及び
(4)前記試験薬剤が前記Gαタンパク質のインヒビターであるかどうかを決定すること;
前記試験薬剤の存在下において測定されたより低いシグナルは、前記試験薬剤が前記Gαタンパク質のインヒビターであることを示し、前記試験薬剤の存在下において測定された同様のまたはより高いシグナルは、前記試験薬剤が前記Gαタンパク質のインヒビターではないことを示す
をさらに含む、項目45に記載の方法。
(1)
(a)項目1〜32のいずれか1項に記載の要素(A)で定義される第2のバイオセンサー(複数可)、
(b)項目1〜32のいずれか1項に記載の要素(B)で定義されるバイオセンサー、または
(c)項目42〜44のいずれか1項に記載のバイオセンサー
をGPCRアゴニストと接触させること、前記組換えGαタンパク質は、前記目的Gαタンパク質に対応する;
(2)前記試験薬剤の存在下及び不在下において、前記RETアクセプターまたはレポータータンパク質が発したシグナルを測定すること;及び
(c)前記試験薬剤が前記Gαタンパク質のインヒビターであるかどうかを決定すること
前記試験薬剤の存在下において測定されたより低いシグナルは、前記試験薬剤が前記目的Gαタンパク質のインヒビターであることを示し、前記試験薬剤の存在下において測定された同様のまたはより高いシグナルは、前記試験薬剤が前記目的Gαタンパク質のインヒビターではないことを示す
を含む、前記方法。
(1)
(a)項目1〜32のいずれか1項に記載の要素(A)で定義される第2のバイオセンサー(複数可)、
(b)項目1〜32のいずれか1項に記載の要素(B)で定義されるバイオセンサー、または
(c)項目42〜44のいずれか1項に記載のバイオセンサー
をGPCRアンタゴニストと接触させること、前記組換えGαタンパク質は、前記目的Gαタンパク質に対応する;
(2)前記試験薬剤の存在下及び不在下において、前記RETアクセプターまたはレポータータンパク質が発したシグナルを測定すること;及び
(3)前記試験薬剤が前記Gαタンパク質活性化因子であるかどうかを決定すること、
前記試験薬剤の存在下において測定されたより高いシグナルは、前記試験薬剤が前記目的Gαタンパク質活性化因子であることを示し、前記試験薬剤の存在下において測定された同様のまたはより低いシグナルは、前記試験薬剤が前記目的Gαタンパク質活性化因子ではないことを示す
を含む、前記方法。
(A)
(a)共鳴エネルギー転移(RET)ドナー;(b)RETアクセプター、または(c)レポータータンパク質の第1の断片に融合したGβγ相互作用タンパク質(βγIP)を含む第1の成分;及び融合Gβタンパク質または融合Gγタンパク質を含む第2の成分、前記Gβタンパク質または前記Gγタンパク質は、(a)RETドナー;(b)RETアクセプター、または(c)前記レポータータンパク質の第2の断片に融合している;を含む、(i)第1のバイオセンサー、
(i)で定義される前記第1及び第2の成分;及び組換えGαタンパク質を含む第3の成分;(a)前記βγIPが前記RETドナーに融合している場合、前記GβまたはGγタンパク質は、前記RETアクセプターに融合しており;(b)前記βγIPが前記RETアクセプターに融合している場合、前記GβまたはGγタンパク質は、前記RETドナーに融合しており;及び(c)前記βγIPが前記レポータータンパク質の第1の断片に融合している場合、前記GβまたはGγタンパク質は、前記レポータータンパク質の第2の断片に融合している;を含む、(ii)第2のバイオセンサー、または
(B)
(a)RETドナー;(b)RETアクセプター、または(c)レポータータンパク質の第1の断片に融合したGβγ相互作用タンパク質(βγIP)を含む第1の成分;融合Gタンパク質共役型レセプター(GPCR)を含む第2の成分、前記GPCRは、そのC末端で(a)RETドナー;(b)RETアクセプター、または(c)前記レポータータンパク質の第2の断片に融合している;組換えGαタンパク質を含む第3の成分;(a)前記βγIPが前記RETドナーに融合している場合、前記GPCRは、前記RETアクセプターに融合しており;(b)前記βγIPが前記RETアクセプターに融合している場合、前記GPCRは、前記RETドナーに融合しており;及び(c)前記βγIPが前記レポータータンパク質の第1の断片に融合している場合、前記GPCRは、前記レポータータンパク質の第2の断片に融合している、を含む、(i)バイオセンサー。
(1)(A)、(B)、または(C)で定義される要素を含むバイオセンサーを提供すること:
(A)(i)(a)RETドナー;(b)RETアクセプター、または(c)レポータータンパク質の第1の断片に融合したGβγ相互作用タンパク質(βγIP)を含む第1の成分;(ii)融合Gβタンパク質または融合Gγタンパク質を含む第2の成分、前記Gβタンパク質または前記Gγタンパク質は、(a)RETドナー;(b)RETアクセプター、または(c)前記レポータータンパク質の第2の断片に融合している、(a)前記βγIPが前記RETドナーに融合している場合、前記GβまたはGγタンパク質は、前記RETアクセプターに融合しており;(b)前記βγIPが前記RETアクセプターに融合している場合、前記GβまたはGγタンパク質は、前記RETドナーに融合しており;及び(c)前記βγIPが前記レポータータンパク質の第1の断片に融合している場合、前記GβまたはGγタンパク質は、前記レポータータンパク質の第2の断片に融合している;(iii)組換えGαタンパク質を含む第3の成分;及び(iv)前記GPCRを含む第4の成分;
(B)(i)(a)RETドナー;(b)RETアクセプター、または(c)レポータータンパク質の第1の断片に融合したGβγ相互作用タンパク質(βγIP)を含む第1の成分;(ii)そのC末端で(a)RETドナー;(b)RETアクセプター、または(c)前記レポータータンパク質の第2の断片に融合した前記GPCRを含む第2の成分;(iii)組換えGαタンパク質を含む第3の成分;(a)前記βγIPが前記RETドナーに融合している場合、前記GPCRは、前記RETアクセプターに融合しており;(b)前記βγIPが前記RETアクセプターに融合している場合、前記GPCRは、前記RETドナーに融合しており;及び(c)前記βγIPが前記レポータータンパク質の第1の断片に融合している場合、前記GPCRは、前記レポータータンパク質の第2の断片に融合している;または
(C)(i)(a)RETドナー;(b)RETアクセプター、または(c)レポータータンパク質の第1の断片に融合したGβγ相互作用タンパク質(βγIP)を含む第1の成分;(ii)融合原形質膜(PM)標的化部分を含む第2の成分、前記PM標的化部分は、(a)RETドナー;(b)RETアクセプター、または(c)前記レポータータンパク質の第2の断片に融合している;(a)前記βγIPが前記RETドナーに融合している場合、前記PM標的化部分は、前記RETアクセプターに融合しており;(b)前記βγIPが前記RETアクセプターに融合している場合、前記PM標的化部分は、前記RETドナーに融合しており;及び(c)前記βγIPが前記レポータータンパク質の第1の断片に融合している場合、前記PM標的化部分は、前記レポータータンパク質の第2の断片に融合している;(iii)組換えGαタンパク質を含む第3の成分;及び(iv)前記GPCRを含む第4の成分;及び
(2)前記試験薬剤の存在下及び不在下において、前記RETアクセプターまたはレポータータンパク質が発したシグナルを測定すること;前記薬剤の存在下において測定されたより高いシグナルは、前記試験薬剤が前記GPCRの活性を増加させることを示し、前記薬剤の存在下において測定されたより低いシグナルは、前記薬剤が前記GPCRの活性を阻害することを示す、を含む。
(3)試験薬剤の存在下及び不在下において、及びGPCRアゴニストの存在下において、本明細書で定義されたバイオセンサー(複数可)で、前記RETアクセプターまたはレポータータンパク質が発したシグナルを測定すること、組換えGαタンパク質は、GPCRにカップリングしている(即ち、GPCRにカップリングまたは活性化されることが知られている);及び
(4)前記試験薬剤が前記Gαタンパク質のインヒビターであるかどうかを決定すること;試験薬剤の存在下において測定されたより低いシグナルは、試験薬剤がGαタンパク質のインヒビターであることを示し、試験薬剤の存在下において測定された同様のまたはより高いシグナルは、試験薬剤がGαタンパク質のインヒビターではないことを示す、をさらに含む。
試薬.アンジオテンシンII(AngII;[Asp−Arg−Val−Tyr−Ile−His−Pro−Phe]、配列番号49)、ポリ−オルニチン、ポリ−D−リジン、イソプロテレノール、ロチゴチン、エピネフリン、ノルエピネフリン、フェニレフリン、及び百日咳毒素は、Sigma(登録商標)社製であった。u46619は、Cayman Chemical(登録商標)(アンナーバー、ミシガン州)社製であった。[Sar1、Ile8]−AngII(SI)、及び[Asp1,Val5、Gly8]−AngII(DVG)[Sar1−Val5−D−Phe8]AngII(SVdF)、及び[Sar1−D−Ala8]AngIIは、Universite de Sherbrooke(カナダ、ケベック州)で合成した。UBO−Qic(L−トレオニン,(3R)−N−アセチル−3−ヒドロキシ−L−ロイシル−(aR)−a−ヒドロキシベンゼンプロパノイル−2,3−イデヒドロ−N−メチルアラニル−L−アラニル−N−メチル−L−アラニル−(3R)−3−[[(2S,3R)−3−ヒドロキシ−4−メチル−1−オキソ−2−[(1−オキソプロピル)アミノ]ペンチル]オキシ]−L−ロイシル−N,O−ジメチル−,(7→1)−ラクトン(9CI))は、Institute for Pharmaceutical Biology of the University of Bonn(ドイツ)から入手した。ダルベッコ改変イーグル培地(DMEM)、ウシ胎児血清、OPTI−MEM(登録商標)、及び他の細胞培養試薬は、Invitrogen(登録商標)から購入した。セレンテラジン400a、セレンテラジンH及びProlume(登録商標)Purple Iは、Goldbio(登録商標)、Biotium(登録商標)、またはNanolight(登録商標)Technologyのいずれかから購入した。ポリエチレンイミン(PEI;25kDa直鎖)は、Polysciences(登録商標)(ウォリントン、米国ペンシルベニア州)から購入した。サケ精子DNAは、Lifetechnologies(ThermoFisher)から購入した。Phusion DNAポリメラーゼは、Thermo Scientific(登録商標)社製であった。制限酵素及びT4 DNAリガーゼは、NEB(登録商標)から入手した。突然変異誘発及びPCR用途のためのオリゴヌクレオチドは、BioCorp DNA(登録商標)で合成した。
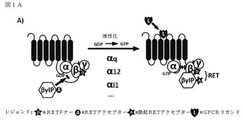
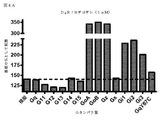
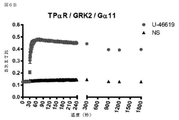
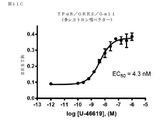
GPCRによる特異的Gタンパク質の活性化を研究するため、アッセイは、Gβγサブユニットと結合するためのGαサブユニットとβγIPの間の競合に基づいて開発した。図1A及び1Bに示すように、レセプター活性化の不在下では、Gαサブユニットは、Gβγ二量体と堅く結合しており、βγIPとの会合を防ぐ。レセプター刺激後、GTP結合Gαは、Gβγ複合体から解離した後、βγIPと自由に相互作用する。従って、βγIPとGβγの間の相互作用は、Gタンパク質活性化を反映する。βγIP及びGβγ(各々を検出システムの2つの成分の1つで標識した)を共発現することによって、様々なサブタイプの非標識Gαで、活性化後の所与のレセプターのカップリングプロファイルを決定することが可能にされている。以下に示すように、共鳴エネルギー転移(RET)アプローチ(図1A:生物発光(BRET)、または蛍光共鳴エネルギー転移(FRET));または図1B:タンパク質相補性(PC)アッセイなどの様々な検出方法を使用して、βγIPとGβγの間の相互作用を評価してもよい。
1. Boularan, C. and J. H. Kehrl (2014). “Implications of non−canonical G−protein signaling for the immune system.” Cell Signal 26(6): 1269−1282.
2. Galandrin, S., G. Oligny−Longpre and M. Bouvier (2007). “The evasive nature of drug efficacy: implications for drug discovery.” Trends in Pharmacological Sciences 28(8): 423−430.
3. Garland, S. L. (2013). “Are GPCRs still a source of new targets?” J Biomol Screen 18(9): 947−966.
4. Gilman, A. G. (1987). “G−proteins: Transducers of receptor−generated signals.” Annu Rev Biochem 56: 615−649.
5. Hamdan, F. F., M. D. Rochdi, B. Breton, D. Fessart, D. E. Michaud, P. G. Charest, S. A. Laporte and M. Bouvier (2007). “Unraveling G protein−coupled receptor endocytosis pathways using real−time monitoring of agonist−promoted interaction between beta−arrestins and AP−2.” J Biol Chem 282(40): 29089−29100.
6. Hancock, J. F. (2003). “Ras proteins: different signals from different locations.” Nat Rev Mol Cell Biol 4(5): 373−384.
7. Heydorn, A., R. J. Ward, R. Jorgensen, M. M. Rosenkilde, T. M. Frimurer, G. Milligan and E. Kostenis (2004). “Identification of a novel site within G protein alpha subunits important for specificity of receptor−G protein interaction.” Mol Pharmacol 66(2): 250−259.
8. Kenakin, T. and A. Christopoulos (2013). “Signalling bias in new drug discovery: detection, quantification and therapeutic impact.” Nat Rev Drug Discov 12(3): 205−216.
9. Leduc, M., B. Breton, C. Gales, C. Le Gouill, M. Bouvier, S. Chemtob and N. Heveker (2009). “Functional selectivity of natural and synthetic prostaglandin EP4 receptor ligands.” J Pharmacol Exp Ther 331(1): 297−307.
10. Mercier, J. F., A. Salahpour, S. Angers, A. Breit and M. Bouvier (2002). “Quantitative assessment of the beta 1 and beta 2−adrenergic receptor homo and hetero−dimerization by bioluminescence resonance energy transfer.” J Biol Chem 277: 44925−44931.
11. Pitcher, J. A., J. Inglese, J. B. Higgins, J. L. Arriza, P. J. Casey, C. Kim, J. L. Benovic, M. M. Kwatra, M. G. Caron and R. J. Lefkowitz (1992). “Role of beta gamma subunits of G proteins in targeting the beta−adrenergic receptor kinase to membrane−bound receptors.” Science 257(5074): 1264−1267.
12. Stefan, E., S. Aquin, N. Berger, C. R. Landry, B. Nyfeler, M. Bouvier and S. W. Michnick (2007). “Quantification of dynamic protein complexes using Renilla luciferase fragment complementation applied to protein kinase A activities in vivo.” Proc Natl Acad Sci U S A 104(43): 16916−16921.
13. Takasaki, J., T. Saito, M. Taniguchi, T. Kawasaki, Y. Moritani, K. Hayashi and M. Kobori (2004). “A novel Galphaq/11−selective inhibitor.” J Biol Chem 279(46): 47438−47445.
14. Touhara, K., J. Inglese, J. A. Pitcher, G. Shaw and R. J. Lefkowitz (1994). “Binding of G protein beta gamma−subunits to pleckstrin homology domains.” J Biol Chem 269(14): 10217−10220.
15. Zhang, J. H., T. D. Chung and K. R. Oldenburg (1999). “A Simple Statistical Parameter for Use in Evaluation and Validation of High Throughput Screening Assays.” J Biomol Screen 4(2): 67−73.
16. Congら、The Journal of Biological Chemistry, 276, 15192−15199.
17. Pitcherら、The Journal of Biological Chemistry, 274, 34531−34534.
18. Penelaら、PNAS, 107(3): 1118−1123.
19. Choudharyら、Mol Cell. 2009 36(2): 326−39.
20. Lindingら、 GlobPlot: exploring protein sequences for globularity and disorder, Nucleic Acid Res 2003 − Vol. 31, No.13, 3701−8.
Claims (19)
- Gタンパク質活性を検出するためのバイオセンサーシステムであって、前記バイオセンサーシステムは、以下の(A)または(B)で定義される要素:
(A)
(i)第1のバイオセンサーを含む第1の真核細胞であって、
(a)共鳴エネルギー転移(RET)ドナー、(b)RETアクセプター、または(c)レポータータンパク質の第1の断片に融合したGβγ相互作用タンパク質(βγIP)を含む第1の成分;
Gβタンパク質及びGγタンパク質を含む第2の成分、前記Gβタンパク質またはGγタンパク質の1つは、(a)RETドナー、(b)RETアクセプター、または(c)前記レポータータンパク質の第2の断片に融合しており、前記レポータータンパク質は、ジヒドロ葉酸リダクターゼ(DHFR)、β−ラクタマーゼ、β−ガラクトシダーゼ、ルシフェラーゼ、または蛍光タンパク質であり、そして、前記第1及び第2の断片は、近接させると、前記レポータータンパク質を非共有的に再構成する;及び
Gタンパク質共役型レセプター(GPCR)である第3の成分、
を含む、第1の真核細胞、
(ii)第2のバイオセンサーを含む第2の真核細胞であって、
(i)で定義される前記第1、第2及び第3の成分;及び
組換えGαタンパク質を含む第4の成分;
を含む、第2の真核細胞、
ここで、
・前記βγIPが前記RETドナーに融合している場合、前記GβまたはGγタンパク質は、前記RETアクセプターに融合しており;
・前記βγIPが前記RETアクセプターに融合している場合、前記GβまたはGγタンパク質は、前記RETドナーに融合しており;及び
・前記βγIPが前記レポータータンパク質の第1の断片に融合している場合、前記GβまたはGγタンパク質は、前記レポータータンパク質の第2の断片に融合している;または
(B)
Gβタンパク質及びGγタンパク質を発現し、かつバイオセンサーを含む真核細胞であって、前記バイオセンサーは、
(a)RETドナー、(b)RETアクセプター、または(c)レポータータンパク質の第1の断片に融合したGβγ相互作用タンパク質(βγIP)を含む第1の成分;
融合Gタンパク質共役型レセプター(GPCR)を含む第2の成分、前記GPCRは、そのC末端で(a)RETドナー、(b)RETアクセプター、または(c)前記レポータータンパク質の第2の断片に融合しており、前記レポータータンパク質は、ジヒドロ葉酸リダクターゼ(DHFR)、β−ラクタマーゼ、β−ガラクトシダーゼ、ルシフェラーゼ、または蛍光タンパク質であり、そして、前記第1及び第2の断片は、近接させると、前記レポータータンパク質を非共有的に再構成する;
組換えGαタンパク質を含む第3の成分;
を含み、
ここで、
・前記βγIPが前記RETドナーに融合している場合、前記GPCRは、前記RETアクセプターに融合しており;
・前記βγIPが前記RETアクセプターに融合している場合、前記GPCRは、前記RETドナーに融合しており;及び
・前記βγIPが前記レポータータンパク質の第1の断片に融合している場合、前記GPCRは、前記レポータータンパク質の第2の断片に融合している、
を含む、前記バイオセンサーシステム。 - 前記Gγタンパク質が、前記RETドナー、RETアクセプター、または第2の断片に融合している、請求項1に記載のバイオセンサーシステム。
- 前記RETドナー、RETアクセプター、または第2の断片が、前記GβまたはGγタンパク質のN末端で融合している、請求項1または2に記載のバイオセンサーシステム。
- 前記RETドナー、RETアクセプター、または第1の断片が、前記βγIPのC末端で融合している、請求項1〜3のいずれか1項に記載のバイオセンサーシステム。
- a)前記βγIPが、前記RETアクセプターに融合しており、そして、b)前記Gβタンパク質、Gγタンパク質またはGPCRが、前記RETドナーに融合している、請求項1〜4のいずれか1項に記載のバイオセンサーシステム。
- 前記RETドナーが、生物発光タンパク質であり、そして、前記RETアクセプターが、蛍光タンパク質である、請求項1〜5のいずれか1項に記載のバイオセンサーシステム。
- 前記生物発光タンパク質が、ルシフェラーゼである、請求項6に記載のバイオセンサーシステム。
- 前記蛍光タンパク質が、GFPである、請求項6または7に記載のバイオセンサーシステム。
- 前記第1の成分が、前記βγIP、RETドナー、RETアクセプター、または第1の断片に融合した原形質膜(PM)標的化部分をさらに含む、請求項1〜8のいずれか1項に記載のバイオセンサーシステム。
- 前記PM標的化部分が、プレニル化モチーフを含む、請求項9に記載のバイオセンサーシステム。
- 前記PM標的化部分が、アミノ酸配列KKKKKKSKTKCVIM(配列番号37)を含む、請求項10に記載のバイオセンサーシステム。
- (i)前記RETドナー、RETアクセプター、または第1の断片と(ii)前記PM標的化部分の間にフレキシブルリンカーをさらに含む、請求項9に記載のバイオセンサーシステムであって、前記フレキシブルリンカーが、50〜500アミノ酸に対応する長さを有する、バイオセンサーシステム。
- 前記組換えGαタンパク質が、Gαq、Gαs、Gαi1、Gαi2、Gαi3、Gαt-cone、Gαt-rod、Gαt-gust、Gαz、GαoA、GαoB、Gαolf、Gα11、Gα12、Gα13、Gα14、及びGα15/Gα16から選択される天然ヒトGαタンパク質、またはG66K、Y67C、及び/又はF75Gの少なくとも1つの突然変異を含むヒトGαqの変異体である、請求項1〜12のいずれか1項に記載のバイオセンサーシステム。
- 前記βγIPが、GRK2またはGRK3のプレクストリン相同(PH)ドメインを含む、請求項1〜13のいずれか1項に記載のバイオセンサーシステム。
- (A)で定義される前記バイオセンサーシステムが、複数の第2のバイオセンサーを含み、前記第2のバイオセンサーの各々が、異なる組換えGαタンパク質を含み、そして、前記異なる組換えGαタンパク質が、以下のGαタンパク質:Gαq、Gαs、Gαi1、Gαi2、Gαi3、Gαt-cone、Gαt-rod、Gαt-gust、Gαz、GαoA、GαoB、Gαolf、Gα11、Gα12、Gα13、Gα14、及びGα15/Gα16の少なくとも2つである、請求項1〜14のいずれか1項に記載のバイオセンサーシステム。
- Gβタンパク質及びGγタンパク質を発現し、かつ以下の成分:
(i)(a)RETドナー、(b)RETアクセプター、または(c)レポータータンパク質の第1の断片に融合したGβγ相互作用タンパク質(βγIP)を含む第1の成分;
(ii)融合原形質膜(PM)標的化部分を含む第2の成分、前記PM標的化部分は、(a)RETドナー、(b)RETアクセプター、または(c)前記レポータータンパク質の第2の断片に融合しており、前記レポータータンパク質は、ジヒドロ葉酸リダクターゼ(DHFR)、β−ラクタマーゼ、β−ガラクトシダーゼ、ルシフェラーゼ、または蛍光タンパク質であり、そして、前記第1及び第2の断片は、近接させると、前記レポータータンパク質を非共有的に再構成する;
(iii)組換えGαタンパク質である第3の成分;
(iv)GPCRである第4の成分;
を含む真核細胞を含む、Gタンパク質活性を検出するためのバイオセンサーであって、
ここで、
・前記βγIPが前記RETドナーに融合している場合、前記PM標的化部分は、前記RETアクセプターに融合しており;
・前記βγIPが前記RETアクセプターに融合している場合、前記PM標的化部分は、前記RETドナーに融合しており;及び
・前記βγIPが前記レポータータンパク質の第1の断片に融合している場合、前記PM標的化部分は、前記レポータータンパク質の第2の断片に融合している、前記バイオセンサー。 - 試験薬剤がGPCRの活性を調節するかどうかの決定方法であって、前記方法は:
(1)以下の(A)、(B)、または(C)で定義される要素を含むバイオセンサーを提供すること:
(A)真核細胞であって、
(i)(a)RETドナー、(b)RETアクセプター、または(c)レポータータンパク質の第1の断片に融合したGβγ相互作用タンパク質(βγIP)を含む第1の成分;
(ii)Gβタンパク質またはGγタンパク質を含む第2の成分、前記Gβタンパク質またはGγタンパク質の1つは、(a)RETドナー、(b)RETアクセプター、または(c)前記レポータータンパク質の第2の断片に融合しており、前記レポータータンパク質は、ジヒドロ葉酸リダクターゼ(DHFR)、β−ラクタマーゼ、β−ガラクトシダーゼ、ルシフェラーゼ、または蛍光タンパク質であり、そして、前記第1及び第2の断片は、近接させると、前記レポータータンパク質を非共有的に再構成する、
ここで、
・前記βγIPが前記RETドナーに融合している場合、前記GβまたはGγタンパク質は、前記RETアクセプターに融合しており;
・前記βγIPが前記RETアクセプターに融合している場合、前記GβまたはGγタンパク質は、前記RETドナーに融合しており;及び
・前記βγIPが前記レポータータンパク質の第1の断片に融合している場合、前記GβまたはGγタンパク質は、前記レポータータンパク質の第2の断片に融合している;
(iii)組換えGαタンパク質を含む第3の成分;及び
(iv)前記GPCRを含む第4の成分、
を含む真核細胞;
(B)真核細胞であって、Gβタンパク質及びGγタンパク質を発現し、かつ
(i)(a)RETドナー、(b)RETアクセプター、または(c)レポータータンパク質の第1の断片に融合したGβγ相互作用タンパク質(βγIP)を含む第1の成分;
(ii)そのC末端で(a)RETドナー、(b)RETアクセプター、または(c)前記レポータータンパク質の第2の断片に融合した前記GPCRを含む第2の成分、ここで、前記レポータータンパク質は、ジヒドロ葉酸リダクターゼ(DHFR)、β−ラクタマーゼ、β−ガラクトシダーゼ、ルシフェラーゼ、または蛍光タンパク質であり、そして、前記第1及び第2の断片は、近接させると、前記レポータータンパク質を非共有的に再構成する;
(iii)組換えGαタンパク質を含む第3の成分;
ここで、
・前記βγIPが前記RETドナーに融合している場合、前記GPCRは、前記RETアクセプターに融合しており;
・前記βγIPが前記RETアクセプターに融合している場合、前記GPCRは、前記RETドナーに融合しており;及び
・前記βγIPが前記レポータータンパク質の第1の断片に融合している場合、前記GPCRは、前記レポータータンパク質の第2の断片に融合している、
を含む真核細胞;または
(C)真核細胞であって、Gβタンパク質及びGγタンパク質を発現し、かつ
(i)(a)RETドナー、(b)RETアクセプター、または(c)レポータータンパク質の第1の断片に融合したGβγ相互作用タンパク質(βγIP)を含む第1の成分;
(ii)融合原形質膜(PM)標的化部分を含む第2の成分、前記PM標的化部分は、(a)RETドナー、(b)RETアクセプター、または(c)前記レポータータンパク質の第2の断片に融合しており、前記レポータータンパク質は、ジヒドロ葉酸リダクターゼ(DHFR)、β−ラクタマーゼ、β−ガラクトシダーゼ、ルシフェラーゼ、または蛍光タンパク質であり、そして、前記第1及び第2の断片は、近接させると、前記レポータータンパク質を非共有的に再構成する;
ここで、
・前記βγIPが前記RETドナーに融合している場合、前記PM標的化部分は、前記RETアクセプターに融合しており;
・前記βγIPが前記RETアクセプターに融合している場合、前記PM標的化部分は、前記RETドナーに融合しており;及び
・前記βγIPが前記レポータータンパク質の第1の断片に融合している場合、前記PM標的化部分は、前記レポータータンパク質の第2の断片に融合している;
(iii)組換えGαタンパク質を含む第3の成分;及び
(iv)前記GPCRを含む第4の成分、
を含む真核細胞;及び
(2)前記試験薬剤の存在下及び不在下において、前記RETアクセプターまたはレポータータンパク質が発したシグナルを測定すること;
ここで、前記薬剤の存在下において測定されたより高いシグナルは、前記試験薬剤が前記GPCRの活性を増加させることを示すか、または、前記薬剤の存在下において測定されたより低いシグナルは、前記薬剤が前記GPCRの活性を阻害することを示す、
を含む、前記方法。 - Gαタンパク質がGPCRアゴニストによって活性化されるかどうかの決定方法であって、前記方法は:
(A)
(a)請求項1〜15のいずれか1項に記載のバイオセンサーシステムの前記第1及び第2のバイオセンサー中で前記GPCRアゴニストの存在下及び不在下において、前記RETアクセプターまたはレポータータンパク質が発したシグナルを測定すること、及び
(b)前記RETアクセプターまたはレポータータンパク質が発したシグナルに基づいて、前記Gαタンパク質が前記GPCRアゴニストによって活性化されるかどうかを同定すること;
ここで、前記第1のバイオセンサーに対して前記第2のバイオセンサー中の前記GPCRアゴニストの存在下において測定されたシグナルのより高い増加は、前記Gαタンパク質が前記GPCRアゴニストによって活性化されることを示すか、または、前記第1のバイオセンサーに対して前記第2のバイオセンサー中の前記GPCRアゴニストの存在下において測定されたシグナルの同様のまたはより低い増加、または減少は、前記Gαタンパク質が前記GPCRアゴニストによって活性化されないことを示す;または
(B)
(a1)Gβタンパク質及びGγタンパク質を発現し、かつ以下の(i)、及び(ii)を含む第1のバイオセンサーを含む第1の真核細胞中の前記GPCRアゴニストの存在下及び不在下において、RETアクセプターまたはレポータータンパク質が発したシグナルを測定すること:
(i)(a)RETドナー、(b)RETアクセプター、または(c)レポータータンパク質の第1の断片に融合したGβγ相互作用タンパク質(βγIP)を含む第1の成分;及び
(ii)融合Gタンパク質共役型レセプター(GPCR)を含む第2の成分、前記GPCRは、そのC末端で(a)RETドナー、(b)RETアクセプター、または(c)前記レポータータンパク質の第2の断片に融合しており、前記レポータータンパク質は、ジヒドロ葉酸リダクターゼ(DHFR)、β−ラクタマーゼ、β−ガラクトシダーゼ、ルシフェラーゼ、または蛍光タンパク質であり、そして、前記第1及び第2の断片は、近接させると、前記レポータータンパク質を非共有的に再構成する;
(b1)Gβタンパク質及びGγタンパク質を発現し、かつ以下の(i)、及び(ii)を含む第2のバイオセンサーを含む第2の真核細胞中の前記GPCRアゴニストの存在下及び不在下において、RETアクセプターまたはレポータータンパク質が発したシグナルを測定すること:
(i)(a1)で定義される前記第1及び第2の成分;及び
(ii)前記Gαタンパク質の組換え形態を含む第3の成分;
ここで、
・前記βγIPが前記RETドナーに融合している場合、前記GPCRは、前記RETアクセプターに融合しており;
・前記βγIPが前記RETアクセプターに融合している場合、前記GPCRは、前記RETドナーに融合しており;及び
・前記βγIPが前記レポータータンパク質の第1の断片に融合している場合、前記GPCRは、前記レポータータンパク質の第2の断片に融合している;
を含み、
ここで:
前記第1のバイオセンサーに対して前記第2のバイオセンサー中の前記GPCRアゴニストの存在下において測定されたシグナルのより高い増加は、前記Gαタンパク質が前記GPCRアゴニストによって活性化されることを示すか、または、前記第1のバイオセンサーに対して前記第2のバイオセンサー中の前記GPCRアゴニストの存在下において測定されたシグナルの同様のまたはより低い増加、または減少は、前記Gαタンパク質が前記GPCRアゴニストによって活性化されないことを示す、前記方法。 - 試験薬剤が目的Gαタンパク質のインヒビターまたは活性化因子であるかどうかの決定方法であって、前記方法は:
(1)
(a)請求項1〜15のいずれか1項に記載の要素(A)で定義される第2のバイオセンサー、または
(b)請求項1〜15のいずれか1項に記載の要素(B)で定義されるバイオセンサー
をGPCRアゴニストまたはアンタゴニストと接触させること、前記組換えGαタンパク質は、前記目的Gαタンパク質に対応する;
(2)前記試験薬剤の存在下及び不在下において、前記RETアクセプターまたはレポータータンパク質が発したシグナルを測定すること;及び
(3)前記試験薬剤が前記Gαタンパク質のインヒビターまたは活性化因子であるかどうかを決定すること、を含み、
ここで、
(i)前記GPCRアゴニストとの接触後に前記試験薬剤の存在下において測定されたより低いシグナルは、前記試験薬剤が前記目的Gαタンパク質のインヒビターであることを示し、前記GPCRアゴニストとの接触後に前記試験薬剤の存在下において測定された同様のまたはより高いシグナルは、前記試験薬剤が前記目的Gαタンパク質のインヒビターではないことを示す;または
(ii)前記GPCRアンタゴニストとの接触後に前記試験薬剤の存在下において測定されたより高いシグナルは、前記試験薬剤が前記目的Gαタンパク質活性化因子であることを示し、前記GPCRアンタゴニストとの接触後に前記試験薬剤の存在下において測定された同様のまたはより低いシグナルは、前記試験薬剤が前記目的Gαタンパク質活性化因子ではないことを示す、前記方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201462063622P | 2014-10-14 | 2014-10-14 | |
| US62/063,622 | 2014-10-14 | ||
| PCT/CA2015/051032 WO2016058094A1 (en) | 2014-10-14 | 2015-10-14 | BIOSENSOR BASED ON GβΥ-INTERACTING PROTEINS TO MONITOR G-PROTEIN ACTIVATION |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2017536104A JP2017536104A (ja) | 2017-12-07 |
| JP2017536104A5 JP2017536104A5 (ja) | 2018-10-18 |
| JP6932636B2 true JP6932636B2 (ja) | 2021-09-08 |
Family
ID=55745919
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017520506A Active JP6932636B2 (ja) | 2014-10-14 | 2015-10-14 | Gタンパク質活性化を監視するためのGβγ相互作用タンパク質に基づいたバイオセンサー |
Country Status (13)
| Country | Link |
|---|---|
| US (1) | US10877036B2 (ja) |
| EP (1) | EP3207052B1 (ja) |
| JP (1) | JP6932636B2 (ja) |
| CN (1) | CN107074926B (ja) |
| AU (1) | AU2015333543B2 (ja) |
| CA (1) | CA2963579C (ja) |
| DK (1) | DK3207052T3 (ja) |
| ES (1) | ES2832331T3 (ja) |
| IL (1) | IL250949B (ja) |
| NZ (1) | NZ729735A (ja) |
| PL (1) | PL3207052T3 (ja) |
| SG (1) | SG11201701895VA (ja) |
| WO (1) | WO2016058094A1 (ja) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2019062744A1 (zh) * | 2017-09-27 | 2019-04-04 | 北京大学 | 融合多肽 |
| SG11202001149TA (en) * | 2017-10-18 | 2020-03-30 | Univ Montreal | Systems and methods for the assessment of g-protein activation |
| WO2019076262A1 (zh) * | 2017-10-18 | 2019-04-25 | 深圳华大生命科学研究院 | 检测目标分子化合物的生物感应器及包含该生物感应器的系统 |
| WO2020117752A1 (en) * | 2018-12-04 | 2020-06-11 | The University Of North Carolina At Chapel Hill | G protein-coupled receptor screening systems |
| CN110981943B (zh) * | 2019-12-02 | 2021-08-03 | 清华大学 | 多肽及其在制备药物中的用途和药物 |
| KR20240049746A (ko) | 2022-10-07 | 2024-04-17 | 성균관대학교산학협력단 | G 단백질 알파 서브유닛의 알파-헬리컬 도메인의 실시간 구조 변화 확인 방법 및 시스템 |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ATE545866T1 (de) * | 2002-04-12 | 2012-03-15 | Schering Corp | Liganden von g-protein-gekoppelten rezeptoren und verfahren |
| US20050042720A1 (en) | 2003-04-24 | 2005-02-24 | 7Tm Pharma A/S | Novel promiscuous G alpha protein mutants and their use |
| US7488583B2 (en) | 2003-09-25 | 2009-02-10 | Odyssey Thera, Inc. | Fragment complementation assays for G-protein-coupled receptors and their signaling pathways |
| WO2005121755A1 (en) * | 2004-06-14 | 2005-12-22 | Commonwealth Scientific And Industrial Research Organisation | Cell free g-protein coupled receptor and ligand assay |
| GB0822259D0 (en) * | 2008-12-05 | 2009-01-14 | Ge Healthcare Uk Ltd | Methods for testing binding of a ligand to a G protein- coupled receptor |
| AU2010207880B2 (en) * | 2009-01-29 | 2012-03-29 | Commonwealth Scientific Industrial Research Organisation | Measuring G protein coupled receptor activation |
| GB0905419D0 (en) * | 2009-03-30 | 2009-05-13 | Ge Healthcare Uk Ltd | Methods for testing ligand binding to G protein-coupled receptors |
| EP2639859A4 (en) | 2010-11-11 | 2015-02-18 | Ube Industries | CONTAINER FOR NONAQUEOUS ELECTROLYTIC SOLUTION, NONAQUEOUS ELECTROLYTIC SOLUTION FOR PLACING IN A CONTAINER, AND METHOD FOR STORING A NONAQUEOUS ELECTROLYTIC SOLUTION |
| WO2012098413A1 (en) * | 2011-01-21 | 2012-07-26 | Heptares Therapeutics Limited | Mutant g-protein coupled receptor proteins and methods for producing them |
| CA2970012C (en) | 2013-12-23 | 2022-07-19 | Universite De Montreal | Systems and methods for the monitoring of protein complex formation in cells |
-
2015
- 2015-10-14 US US15/518,888 patent/US10877036B2/en active Active
- 2015-10-14 SG SG11201701895VA patent/SG11201701895VA/en unknown
- 2015-10-14 ES ES15851395T patent/ES2832331T3/es active Active
- 2015-10-14 JP JP2017520506A patent/JP6932636B2/ja active Active
- 2015-10-14 CN CN201580055471.5A patent/CN107074926B/zh active Active
- 2015-10-14 NZ NZ729735A patent/NZ729735A/en unknown
- 2015-10-14 WO PCT/CA2015/051032 patent/WO2016058094A1/en active Application Filing
- 2015-10-14 AU AU2015333543A patent/AU2015333543B2/en active Active
- 2015-10-14 PL PL15851395T patent/PL3207052T3/pl unknown
- 2015-10-14 CA CA2963579A patent/CA2963579C/en active Active
- 2015-10-14 EP EP15851395.2A patent/EP3207052B1/en active Active
- 2015-10-14 DK DK15851395.2T patent/DK3207052T3/da active
-
2017
- 2017-03-05 IL IL250949A patent/IL250949B/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| AU2015333543A1 (en) | 2017-03-23 |
| CA2963579A1 (en) | 2016-04-21 |
| IL250949A0 (en) | 2017-04-30 |
| CN107074926B (zh) | 2021-09-21 |
| US10877036B2 (en) | 2020-12-29 |
| WO2016058094A1 (en) | 2016-04-21 |
| US20170234870A1 (en) | 2017-08-17 |
| EP3207052B1 (en) | 2020-09-30 |
| EP3207052A1 (en) | 2017-08-23 |
| JP2017536104A (ja) | 2017-12-07 |
| IL250949B (en) | 2021-07-29 |
| CN107074926A (zh) | 2017-08-18 |
| PL3207052T3 (pl) | 2021-02-08 |
| ES2832331T3 (es) | 2021-06-10 |
| SG11201701895VA (en) | 2017-04-27 |
| CA2963579C (en) | 2023-10-31 |
| AU2015333543B2 (en) | 2021-03-04 |
| DK3207052T3 (da) | 2020-11-16 |
| NZ729735A (en) | 2023-05-26 |
| EP3207052A4 (en) | 2018-04-25 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6932636B2 (ja) | Gタンパク質活性化を監視するためのGβγ相互作用タンパク質に基づいたバイオセンサー | |
| Donthamsetti et al. | Using Bioluminescence Resonance Energy Transfer (BRET) to characterize agonist‐induced arrestin recruitment to modified and unmodified G protein‐coupled receptors | |
| US20090298162A1 (en) | Biosensors for monitoring receptor-mediated g-protein activation | |
| JP4955391B2 (ja) | Gタンパク質共役受容体およびそのシグナル伝達経路の断片相補アッセイ | |
| CN107533049B (zh) | 用于监测细胞中生物分子的定位和运输的生物传感器 | |
| JP5553326B2 (ja) | 一分子型プローブ及びその利用 | |
| EP2823044B1 (en) | Membrane span-kinase fusion protein and the uses thereof | |
| Wintgens et al. | Characterizing dynamic protein–protein interactions using the genetically encoded split biosensor assay technique split TEV | |
| US20100203555A1 (en) | Wild-Type Receptor Assays | |
| US10392649B2 (en) | Biosensors that detect NAD+ | |
| EP2329268B1 (en) | Methods and compounds for testing binding of a ligand to a g protein-coupled receptor | |
| US20110244487A1 (en) | Methods for testing binding of a ligand to a g protein-coupled receptor | |
| Perry-Hauser et al. | Assays for detecting arrestin interaction with GPCRs | |
| US20220326229A1 (en) | Assay for real-time simultaneous recruitment of arrestin isoforms to g protein-coupled receptors | |
| Alvarez-Curto et al. | Defining the functional equivalence of wild-type and chemically engineered G protein-coupled receptors | |
| Zheng et al. | In‐Cell Arrestin‐Receptor Interaction Assays | |
| US20120021440A1 (en) | Methods for testing ligand binding to g protein-coupled receptors | |
| CA2775278A1 (en) | Arrestin biosensor |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180904 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20180904 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20191029 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200129 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20200714 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200924 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210302 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210407 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20210803 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20210818 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6932636 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |