JP6913402B2 - 非アルコール性脂肪性肝炎(nash)の治療と予防に適した配合剤 - Google Patents
非アルコール性脂肪性肝炎(nash)の治療と予防に適した配合剤 Download PDFInfo
- Publication number
- JP6913402B2 JP6913402B2 JP2019516717A JP2019516717A JP6913402B2 JP 6913402 B2 JP6913402 B2 JP 6913402B2 JP 2019516717 A JP2019516717 A JP 2019516717A JP 2019516717 A JP2019516717 A JP 2019516717A JP 6913402 B2 JP6913402 B2 JP 6913402B2
- Authority
- JP
- Japan
- Prior art keywords
- preparation
- alcoholic steatohepatitis
- selenium
- zinc
- liver
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 208000008338 non-alcoholic fatty liver disease Diseases 0.000 title claims description 209
- 206010053219 non-alcoholic steatohepatitis Diseases 0.000 title claims description 133
- 229940000425 combination drug Drugs 0.000 title description 35
- 238000011282 treatment Methods 0.000 title description 20
- 230000002265 prevention Effects 0.000 title description 11
- 238000002360 preparation method Methods 0.000 claims description 177
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 claims description 94
- 229910052725 zinc Inorganic materials 0.000 claims description 94
- 239000011701 zinc Substances 0.000 claims description 94
- BUGBHKTXTAQXES-UHFFFAOYSA-N Selenium Chemical compound [Se] BUGBHKTXTAQXES-UHFFFAOYSA-N 0.000 claims description 92
- 229910052711 selenium Inorganic materials 0.000 claims description 92
- 239000011669 selenium Substances 0.000 claims description 92
- 229940091258 selenium supplement Drugs 0.000 claims description 92
- BVTBRVFYZUCAKH-UHFFFAOYSA-L disodium selenite Chemical compound [Na+].[Na+].[O-][Se]([O-])=O BVTBRVFYZUCAKH-UHFFFAOYSA-L 0.000 claims description 70
- 229960001471 sodium selenite Drugs 0.000 claims description 69
- 239000011781 sodium selenite Substances 0.000 claims description 69
- 235000015921 sodium selenite Nutrition 0.000 claims description 69
- 230000001225 therapeutic effect Effects 0.000 claims description 5
- 239000004480 active ingredient Substances 0.000 claims description 4
- 108700035912 polaprezinc Proteins 0.000 description 52
- 229950004693 polaprezinc Drugs 0.000 description 52
- IUWLTSZHVYHOHY-FJXQXJEOSA-L zinc;(2s)-2-(3-azanidylpropanoylazanidyl)-3-(1h-imidazol-5-yl)propanoate Chemical compound [Zn+2].[NH-]CCC(=O)[N-][C@H](C([O-])=O)CC1=CN=CN1 IUWLTSZHVYHOHY-FJXQXJEOSA-L 0.000 description 52
- 210000004185 liver Anatomy 0.000 description 42
- 238000010586 diagram Methods 0.000 description 33
- 230000000694 effects Effects 0.000 description 22
- 230000004054 inflammatory process Effects 0.000 description 22
- 206010061218 Inflammation Diseases 0.000 description 21
- 208000019425 cirrhosis of liver Diseases 0.000 description 19
- 108700018575 Poraprezinc Proteins 0.000 description 17
- 210000003494 hepatocyte Anatomy 0.000 description 16
- 230000002440 hepatic effect Effects 0.000 description 15
- 210000002540 macrophage Anatomy 0.000 description 14
- 230000007850 degeneration Effects 0.000 description 13
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 12
- 206010016654 Fibrosis Diseases 0.000 description 11
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 11
- 108010074328 Interferon-gamma Proteins 0.000 description 10
- 230000006872 improvement Effects 0.000 description 10
- 210000001789 adipocyte Anatomy 0.000 description 9
- 239000003814 drug Substances 0.000 description 9
- 230000002829 reductive effect Effects 0.000 description 9
- 210000002966 serum Anatomy 0.000 description 9
- 101710155857 C-C motif chemokine 2 Proteins 0.000 description 8
- 102000000018 Chemokine CCL2 Human genes 0.000 description 8
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 8
- 230000037396 body weight Effects 0.000 description 8
- 230000004761 fibrosis Effects 0.000 description 8
- PMYDPQQPEAYXKD-UHFFFAOYSA-N 3-hydroxy-n-naphthalen-2-ylnaphthalene-2-carboxamide Chemical compound C1=CC=CC2=CC(NC(=O)C3=CC4=CC=CC=C4C=C3O)=CC=C21 PMYDPQQPEAYXKD-UHFFFAOYSA-N 0.000 description 7
- 102000008857 Ferritin Human genes 0.000 description 7
- 108050000784 Ferritin Proteins 0.000 description 7
- 238000008416 Ferritin Methods 0.000 description 7
- 102100037850 Interferon gamma Human genes 0.000 description 7
- WSMYVTOQOOLQHP-UHFFFAOYSA-N Malondialdehyde Chemical compound O=CCC=O WSMYVTOQOOLQHP-UHFFFAOYSA-N 0.000 description 7
- 150000002632 lipids Chemical class 0.000 description 7
- 229940118019 malondialdehyde Drugs 0.000 description 7
- 229960001881 sodium selenate Drugs 0.000 description 7
- 239000011655 sodium selenate Substances 0.000 description 7
- 235000018716 sodium selenate Nutrition 0.000 description 7
- 230000001629 suppression Effects 0.000 description 7
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- 201000010099 disease Diseases 0.000 description 6
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 6
- 235000013402 health food Nutrition 0.000 description 6
- 208000006454 hepatitis Diseases 0.000 description 6
- 230000002757 inflammatory effect Effects 0.000 description 6
- 238000000034 method Methods 0.000 description 6
- 102000004127 Cytokines Human genes 0.000 description 5
- 108090000695 Cytokines Proteins 0.000 description 5
- 206010019668 Hepatic fibrosis Diseases 0.000 description 5
- 230000008021 deposition Effects 0.000 description 5
- 231100000283 hepatitis Toxicity 0.000 description 5
- 230000008595 infiltration Effects 0.000 description 5
- 238000001764 infiltration Methods 0.000 description 5
- 210000004969 inflammatory cell Anatomy 0.000 description 5
- 210000001865 kupffer cell Anatomy 0.000 description 5
- 230000003908 liver function Effects 0.000 description 5
- 229940124597 therapeutic agent Drugs 0.000 description 5
- 206010065973 Iron Overload Diseases 0.000 description 4
- 241000700605 Viruses Species 0.000 description 4
- 230000007423 decrease Effects 0.000 description 4
- 230000003834 intracellular effect Effects 0.000 description 4
- 229910052742 iron Inorganic materials 0.000 description 4
- 210000005228 liver tissue Anatomy 0.000 description 4
- 238000004519 manufacturing process Methods 0.000 description 4
- 239000000825 pharmaceutical preparation Substances 0.000 description 4
- 229940127557 pharmaceutical product Drugs 0.000 description 4
- 210000001519 tissue Anatomy 0.000 description 4
- UFTFJSFQGQCHQW-UHFFFAOYSA-N triformin Chemical compound O=COCC(OC=O)COC=O UFTFJSFQGQCHQW-UHFFFAOYSA-N 0.000 description 4
- 229940120347 zinc preparations Drugs 0.000 description 4
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- 241000711549 Hepacivirus C Species 0.000 description 3
- 206010020880 Hypertrophy Diseases 0.000 description 3
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 3
- 102000008070 Interferon-gamma Human genes 0.000 description 3
- 241000699670 Mus sp. Species 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- 230000009471 action Effects 0.000 description 3
- 239000013543 active substance Substances 0.000 description 3
- 210000004369 blood Anatomy 0.000 description 3
- 239000008280 blood Substances 0.000 description 3
- 230000007882 cirrhosis Effects 0.000 description 3
- 206010012601 diabetes mellitus Diseases 0.000 description 3
- 235000018823 dietary intake Nutrition 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- 235000019441 ethanol Nutrition 0.000 description 3
- 238000011156 evaluation Methods 0.000 description 3
- 230000036541 health Effects 0.000 description 3
- 229960003130 interferon gamma Drugs 0.000 description 3
- 210000000056 organ Anatomy 0.000 description 3
- 230000036542 oxidative stress Effects 0.000 description 3
- 230000001575 pathological effect Effects 0.000 description 3
- 239000008194 pharmaceutical composition Substances 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- 239000011734 sodium Substances 0.000 description 3
- 229910052708 sodium Inorganic materials 0.000 description 3
- 231100000240 steatosis hepatitis Toxicity 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- MORUQNQGRSLTCD-FJXQXJEOSA-N (2s)-2-(3-aminopropanoylamino)-3-(1h-imidazol-5-yl)propanoic acid;zinc Chemical class [Zn].NCCC(=O)N[C@H](C(O)=O)CC1=CNC=N1 MORUQNQGRSLTCD-FJXQXJEOSA-N 0.000 description 2
- GVJHHUAWPYXKBD-UHFFFAOYSA-N (±)-α-Tocopherol Chemical compound OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 208000004930 Fatty Liver Diseases 0.000 description 2
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- 208000008589 Obesity Diseases 0.000 description 2
- 208000008469 Peptic Ulcer Diseases 0.000 description 2
- 206010039921 Selenium deficiency Diseases 0.000 description 2
- 238000009825 accumulation Methods 0.000 description 2
- 230000001476 alcoholic effect Effects 0.000 description 2
- 238000010171 animal model Methods 0.000 description 2
- 239000000427 antigen Substances 0.000 description 2
- 102000036639 antigens Human genes 0.000 description 2
- 108091007433 antigens Proteins 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 210000004027 cell Anatomy 0.000 description 2
- 239000001913 cellulose Substances 0.000 description 2
- 229920002678 cellulose Polymers 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 230000034994 death Effects 0.000 description 2
- 231100000517 death Toxicity 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 238000003745 diagnosis Methods 0.000 description 2
- 230000004069 differentiation Effects 0.000 description 2
- 229920001971 elastomer Polymers 0.000 description 2
- 208000010706 fatty liver disease Diseases 0.000 description 2
- 239000003112 inhibitor Substances 0.000 description 2
- 201000007270 liver cancer Diseases 0.000 description 2
- 208000019423 liver disease Diseases 0.000 description 2
- 208000014018 liver neoplasm Diseases 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 239000003550 marker Substances 0.000 description 2
- 235000020824 obesity Nutrition 0.000 description 2
- GLDOVTGHNKAZLK-UHFFFAOYSA-N octadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCCCO GLDOVTGHNKAZLK-UHFFFAOYSA-N 0.000 description 2
- 229910052760 oxygen Inorganic materials 0.000 description 2
- 239000001301 oxygen Substances 0.000 description 2
- 208000011906 peptic ulcer disease Diseases 0.000 description 2
- 230000002085 persistent effect Effects 0.000 description 2
- 235000019271 petrolatum Nutrition 0.000 description 2
- -1 polyoxyethylene Polymers 0.000 description 2
- 230000003449 preventive effect Effects 0.000 description 2
- LFULEKSKNZEWOE-UHFFFAOYSA-N propanil Chemical compound CCC(=O)NC1=CC=C(Cl)C(Cl)=C1 LFULEKSKNZEWOE-UHFFFAOYSA-N 0.000 description 2
- 102000004169 proteins and genes Human genes 0.000 description 2
- 108090000623 proteins and genes Proteins 0.000 description 2
- 239000005060 rubber Substances 0.000 description 2
- 229940082569 selenite Drugs 0.000 description 2
- MCAHWIHFGHIESP-UHFFFAOYSA-L selenite(2-) Chemical compound [O-][Se]([O-])=O MCAHWIHFGHIESP-UHFFFAOYSA-L 0.000 description 2
- 238000010186 staining Methods 0.000 description 2
- 230000007863 steatosis Effects 0.000 description 2
- 230000009469 supplementation Effects 0.000 description 2
- 239000006188 syrup Substances 0.000 description 2
- 235000020357 syrup Nutrition 0.000 description 2
- VZGDMQKNWNREIO-UHFFFAOYSA-N tetrachloromethane Chemical compound ClC(Cl)(Cl)Cl VZGDMQKNWNREIO-UHFFFAOYSA-N 0.000 description 2
- 229940126585 therapeutic drug Drugs 0.000 description 2
- 230000003612 virological effect Effects 0.000 description 2
- RUDATBOHQWOJDD-UHFFFAOYSA-N (3beta,5beta,7alpha)-3,7-Dihydroxycholan-24-oic acid Natural products OC1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)CC2 RUDATBOHQWOJDD-UHFFFAOYSA-N 0.000 description 1
- 102000014777 Adipokines Human genes 0.000 description 1
- 108010078606 Adipokines Proteins 0.000 description 1
- 206010002091 Anaesthesia Diseases 0.000 description 1
- 206010003210 Arteriosclerosis Diseases 0.000 description 1
- 241000416162 Astragalus gummifer Species 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- ZZZCUOFIHGPKAK-UHFFFAOYSA-N D-erythro-ascorbic acid Natural products OCC1OC(=O)C(O)=C1O ZZZCUOFIHGPKAK-UHFFFAOYSA-N 0.000 description 1
- 206010012735 Diarrhoea Diseases 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 229940121710 HMGCoA reductase inhibitor Drugs 0.000 description 1
- 206010019708 Hepatic steatosis Diseases 0.000 description 1
- 208000005176 Hepatitis C Diseases 0.000 description 1
- 206010019728 Hepatitis alcoholic Diseases 0.000 description 1
- 206010019799 Hepatitis viral Diseases 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 1
- 208000035150 Hypercholesterolemia Diseases 0.000 description 1
- 208000028958 Hyperferritinemia Diseases 0.000 description 1
- 208000031226 Hyperlipidaemia Diseases 0.000 description 1
- 101000668058 Infectious salmon anemia virus (isolate Atlantic salmon/Norway/810/9/99) RNA-directed RNA polymerase catalytic subunit Proteins 0.000 description 1
- 206010022489 Insulin Resistance Diseases 0.000 description 1
- 108010050904 Interferons Proteins 0.000 description 1
- 102000014150 Interferons Human genes 0.000 description 1
- 208000019926 Keshan disease Diseases 0.000 description 1
- 206010067125 Liver injury Diseases 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- 238000013234 NASH mouse model Methods 0.000 description 1
- BYPFEZZEUUWMEJ-UHFFFAOYSA-N Pentoxifylline Chemical compound O=C1N(CCCCC(=O)C)C(=O)N(C)C2=C1N(C)C=N2 BYPFEZZEUUWMEJ-UHFFFAOYSA-N 0.000 description 1
- 239000004264 Petrolatum Substances 0.000 description 1
- 235000008331 Pinus X rigitaeda Nutrition 0.000 description 1
- 235000011613 Pinus brutia Nutrition 0.000 description 1
- 241000018646 Pinus brutia Species 0.000 description 1
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- 206010047571 Visual impairment Diseases 0.000 description 1
- 229930003268 Vitamin C Natural products 0.000 description 1
- 229930003427 Vitamin E Natural products 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- ZOIORXHNWRGPMV-UHFFFAOYSA-N acetic acid;zinc Chemical compound [Zn].CC(O)=O.CC(O)=O ZOIORXHNWRGPMV-UHFFFAOYSA-N 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 208000038016 acute inflammation Diseases 0.000 description 1
- 230000006022 acute inflammation Effects 0.000 description 1
- 239000000478 adipokine Substances 0.000 description 1
- 210000000577 adipose tissue Anatomy 0.000 description 1
- 208000026594 alcoholic fatty liver disease Diseases 0.000 description 1
- 208000002353 alcoholic hepatitis Diseases 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 230000037005 anaesthesia Effects 0.000 description 1
- 239000002333 angiotensin II receptor antagonist Substances 0.000 description 1
- 229940126317 angiotensin II receptor antagonist Drugs 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 239000003443 antiviral agent Substances 0.000 description 1
- 208000011775 arteriosclerosis disease Diseases 0.000 description 1
- 238000011888 autopsy Methods 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 239000002585 base Substances 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- IIBYAHWJQTYFKB-UHFFFAOYSA-N bezafibrate Chemical compound C1=CC(OC(C)(C)C(O)=O)=CC=C1CCNC(=O)C1=CC=C(Cl)C=C1 IIBYAHWJQTYFKB-UHFFFAOYSA-N 0.000 description 1
- 229960000516 bezafibrate Drugs 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- 239000004359 castor oil Substances 0.000 description 1
- 235000019438 castor oil Nutrition 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 208000037976 chronic inflammation Diseases 0.000 description 1
- 230000006020 chronic inflammation Effects 0.000 description 1
- 238000003759 clinical diagnosis Methods 0.000 description 1
- 230000002301 combined effect Effects 0.000 description 1
- 238000013329 compounding Methods 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 238000011257 definitive treatment Methods 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- 229940042399 direct acting antivirals protease inhibitors Drugs 0.000 description 1
- 239000012153 distilled water Substances 0.000 description 1
- 239000002158 endotoxin Substances 0.000 description 1
- 235000019197 fats Nutrition 0.000 description 1
- 239000010685 fatty oil Substances 0.000 description 1
- WIGCFUFOHFEKBI-UHFFFAOYSA-N gamma-tocopherol Natural products CC(C)CCCC(C)CCCC(C)CCCC1CCC2C(C)C(O)C(C)C(C)C2O1 WIGCFUFOHFEKBI-UHFFFAOYSA-N 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 230000004153 glucose metabolism Effects 0.000 description 1
- 235000011187 glycerol Nutrition 0.000 description 1
- ZEMPKEQAKRGZGQ-XOQCFJPHSA-N glycerol triricinoleate Natural products CCCCCC[C@@H](O)CC=CCCCCCCCC(=O)OC[C@@H](COC(=O)CCCCCCCC=CC[C@@H](O)CCCCCC)OC(=O)CCCCCCCC=CC[C@H](O)CCCCCC ZEMPKEQAKRGZGQ-XOQCFJPHSA-N 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 235000001497 healthy food Nutrition 0.000 description 1
- 238000007490 hematoxylin and eosin (H&E) staining Methods 0.000 description 1
- 231100000234 hepatic damage Toxicity 0.000 description 1
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 1
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 1
- 230000002962 histologic effect Effects 0.000 description 1
- 239000002471 hydroxymethylglutaryl coenzyme A reductase inhibitor Substances 0.000 description 1
- 230000003752 improving hair Effects 0.000 description 1
- 239000000411 inducer Substances 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 229940079322 interferon Drugs 0.000 description 1
- 210000000936 intestine Anatomy 0.000 description 1
- 239000000832 lactitol Substances 0.000 description 1
- VQHSOMBJVWLPSR-JVCRWLNRSA-N lactitol Chemical compound OC[C@H](O)[C@@H](O)[C@@H]([C@H](O)CO)O[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O VQHSOMBJVWLPSR-JVCRWLNRSA-N 0.000 description 1
- 235000010448 lactitol Nutrition 0.000 description 1
- 229960003451 lactitol Drugs 0.000 description 1
- 238000012317 liver biopsy Methods 0.000 description 1
- 230000008818 liver damage Effects 0.000 description 1
- 208000018191 liver inflammation Diseases 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- XZWYZXLIPXDOLR-UHFFFAOYSA-N metformin Chemical compound CN(C)C(=N)NC(N)=N XZWYZXLIPXDOLR-UHFFFAOYSA-N 0.000 description 1
- 229960003105 metformin Drugs 0.000 description 1
- 230000028550 monocyte chemotaxis Effects 0.000 description 1
- 238000010172 mouse model Methods 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 230000003680 myocardial damage Effects 0.000 description 1
- GOQYKNQRPGWPLP-UHFFFAOYSA-N n-heptadecyl alcohol Natural products CCCCCCCCCCCCCCCCCO GOQYKNQRPGWPLP-UHFFFAOYSA-N 0.000 description 1
- 230000001338 necrotic effect Effects 0.000 description 1
- 201000001119 neuropathy Diseases 0.000 description 1
- 230000007823 neuropathy Effects 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 238000010606 normalization Methods 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 230000003950 pathogenic mechanism Effects 0.000 description 1
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 1
- 208000033808 peripheral neuropathy Diseases 0.000 description 1
- 229940066842 petrolatum Drugs 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 1
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 1
- 229920000053 polysorbate 80 Polymers 0.000 description 1
- 229940068968 polysorbate 80 Drugs 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 230000002633 protecting effect Effects 0.000 description 1
- 239000008213 purified water Substances 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 230000007115 recruitment Effects 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- CVHZOJJKTDOEJC-UHFFFAOYSA-N saccharin Chemical compound C1=CC=C2C(=O)NS(=O)(=O)C2=C1 CVHZOJJKTDOEJC-UHFFFAOYSA-N 0.000 description 1
- 229940081974 saccharin Drugs 0.000 description 1
- 235000019204 saccharin Nutrition 0.000 description 1
- 239000000901 saccharin and its Na,K and Ca salt Substances 0.000 description 1
- 238000005070 sampling Methods 0.000 description 1
- 230000002000 scavenging effect Effects 0.000 description 1
- QYHFIVBSNOWOCQ-UHFFFAOYSA-N selenic acid Chemical compound O[Se](O)(=O)=O QYHFIVBSNOWOCQ-UHFFFAOYSA-N 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 238000013517 stratification Methods 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 235000012222 talc Nutrition 0.000 description 1
- 125000005457 triglyceride group Chemical group 0.000 description 1
- 102000003390 tumor necrosis factor Human genes 0.000 description 1
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 1
- RUDATBOHQWOJDD-UZVSRGJWSA-N ursodeoxycholic acid Chemical compound C([C@H]1C[C@@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)CC1 RUDATBOHQWOJDD-UZVSRGJWSA-N 0.000 description 1
- 229960001661 ursodiol Drugs 0.000 description 1
- 238000010200 validation analysis Methods 0.000 description 1
- 230000029812 viral genome replication Effects 0.000 description 1
- 201000001862 viral hepatitis Diseases 0.000 description 1
- 208000029257 vision disease Diseases 0.000 description 1
- 230000004393 visual impairment Effects 0.000 description 1
- 235000019154 vitamin C Nutrition 0.000 description 1
- 239000011718 vitamin C Substances 0.000 description 1
- 235000019165 vitamin E Nutrition 0.000 description 1
- 229940046009 vitamin E Drugs 0.000 description 1
- 239000011709 vitamin E Substances 0.000 description 1
- 230000037221 weight management Effects 0.000 description 1
- 239000003871 white petrolatum Substances 0.000 description 1
- 239000004246 zinc acetate Substances 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4164—1,3-Diazoles
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23L—FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES, NOT OTHERWISE PROVIDED FOR; PREPARATION OR TREATMENT THEREOF
- A23L33/00—Modifying nutritive qualities of foods; Dietetic products; Preparation or treatment thereof
- A23L33/10—Modifying nutritive qualities of foods; Dietetic products; Preparation or treatment thereof using additives
- A23L33/16—Inorganic salts, minerals or trace elements
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/28—Compounds containing heavy metals
- A61K31/315—Zinc compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/35—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom
- A61K31/352—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom condensed with carbocyclic rings, e.g. methantheline
- A61K31/353—3,4-Dihydrobenzopyrans, e.g. chroman, catechin
- A61K31/355—Tocopherols, e.g. vitamin E
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K33/00—Medicinal preparations containing inorganic active ingredients
- A61K33/04—Sulfur, selenium or tellurium; Compounds thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Epidemiology (AREA)
- Inorganic Chemistry (AREA)
- Nutrition Science (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Physiology (AREA)
- Gastroenterology & Hepatology (AREA)
- Food Science & Technology (AREA)
- Polymers & Plastics (AREA)
- Mycology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Coloring Foods And Improving Nutritive Qualities (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Description
さらに詳述すると、本発明は非アルコール性脂肪性肝疾患(NAFLD)および/または非アルコール性脂肪性肝炎(NASH)の治療をするための亜鉛製剤、特にポラプレジンクと、セレン製剤、特に亜セレン酸ナトリウムとの配合剤、ならびに非アルコール性脂肪肝疾患(NAFLD)および/または非アルコール性脂肪性肝炎(NASH)に関連もしくは付随する疾患の治療における亜鉛製剤、特にポラプレジンクと、セレン製剤、特に亜セレン酸ナトリウムとの配合剤に関するものである。本明細書で定義される亜鉛製剤、特にポラプレジンクと、セレン製剤、特に亜セレン酸ナトリウムを含み、1種又は複数の他の活性物質を配合してもよく、非アルコール性脂肪肝疾患(NAFLD) および/または非アルコール性脂肪性肝炎(NASH)の治療及び予防における使用のための医薬配合剤及び健康食品もまた企図される。本明細書は以後亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)と記載する場合があるが、かかる記載は亜鉛製剤及びセレン製剤の代表例を示すものである。
肝炎、特にC型ウイルス性肝炎の治療についてはインターフェロンと抗ウイルス剤による治療から、C型肝炎ウイルスの複製に関わるタンパクを阻害し、ウイルスの増殖を抑制するポリメラーゼ阻害剤やC型肝炎ウイルスのRNA合成を阻害するプロテアーゼ阻害剤等の登場により劇的に変化し、C型肝炎患者の肝炎ウイルス量が測定検出限界以下(SVR:持続性ウイルス学的著効)に改善したという患者が90%以上存在すると言う結果が報告されている。
C型ウイルス性肝炎患者の肝炎ウイルス量を測定検出限界以下(SVR:持続性ウイルス学的著効)に改善する治療薬が開発され、既に臨床応用されているが、肝炎ウイルスが関与しない非アルコール性脂肪性肝疾患(NAFLD)および/または非アルコール性脂肪性肝炎(NASH)に対する確定した治療薬は未だ存在しない。世界的に急増している非アルコール性脂肪性肝疾患(NAFLD)および/または非アルコール性脂肪性肝炎(NASH)に対して、肝硬変、肝がんへの進展を抑制し、肝機能を改善する治療薬の開発が待たれている。
非アルコール性脂肪性肝疾患(NAFLD)および/または非アルコール性脂肪性肝炎(NASH)においては、肝線維化が進行するのは37%であり、糖尿病を合併していると線維化が進行しやすくなり、高BMIであると肝硬変に移行しやすくなる(非特許文献1)。非アルコール性脂肪性肝疾患(NAFLD)および/または非アルコール性脂肪性肝炎(NASH)においては必ずしも線維化が進行するということではないが、重症化抑制には肝線維化の抑制が重要になってくる。又非アルコール性脂肪性肝疾患(NAFLD)および/または非アルコール性脂肪性肝炎(NASH)においては約5%で肝硬変に進展すると報告されている(非特許文献2)。亜鉛製剤(ポラプレジンク)においては、既に肝線維化を抑制することが示され、特許番号4802470号として開示されている(特許文献1)。
具体的には、限定されるものではないが、本発明は、亜鉛製剤としてポラプレジンク、セレン製剤として亜セレン酸ナトリウムとの配合剤であることが望ましい。ポラプレジンクはL−カルノシン亜鉛塩である。
本発明の具体的態様としては、経口投与が好ましく、亜鉛製剤中の亜鉛量としては成人1日あたり0.015g〜0.25g、セレン製剤中のセレン量としての配合量は成人1日あたり10μg〜450μgであることが好ましい。亜鉛製剤中の亜鉛量としては成人1日あたり0.015g未満であると厚生労働省による食事摂取推奨量に足りず、病気の予防・治療には少な過ぎる用量であり、0.25gを超えると、長期投与における安全性が懸念される。医薬品として認可されている亜鉛製剤の1つの酢酸亜鉛では亜鉛の1日最大用量として0.25gとしている点である。またセレン製剤中のセレン量としての配合量は成人1日あたり10μg未満であると、厚生労働省による食事摂取推奨量に足りず、病気の予防・治療には少な過ぎる用量であり、450μgを超えると、厚生労働省による食事摂取上限量を上回るので、安全性に配慮した。
本発明は、亜鉛製剤とセレン製剤とを有効成分として含む配合剤であるが、これにビタミンC、ビタミンE、高山植物である紅景天、インスリン抵抗性を改善するメトホルミン、ピオグリタゾン、DPP−4阻害薬、抗酸化作用を持つEPA(エイコサペンタサ塩酸)、高脂血症を改善するべザフィブラート、HMG−CoA還元酵素阻害薬、高コレステロール血症改善薬、アンジオテンシンII受容体拮抗剤、抗TNF−α作用のあるペントキシフィリンの少なくとも1以上の物質とを組み合わせることでも差し支えない。
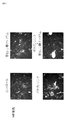
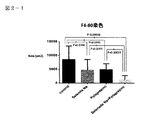
図2−1:4群のF4/80(マクロファージ)染色組織像を示す図である。
図2−2:4群のF4/80(マクロファージ)染色組織像を示す図である。
図3:4群のOil―Red−O染色(細胞内脂肪滴)組織像を示す図である。
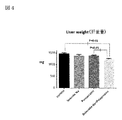
図4:肝重量を示す図である。
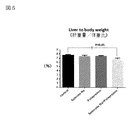
図5:肝重量/体重比データを示す図である。
図6:ALTデータを示す図である。
図7:血清フェリチンデータを示す図である。
図8:MDA(マロンジアルデヒド)データを示す図である。
図9:肝TG(肝中性脂肪)データを示す図である。
図10:MCP−1(単球走行性タンパク質−1)データを示す図である。
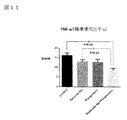
図11:TNF−α(腫瘍壊死因子−α)データを示す図である。
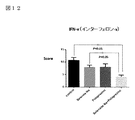
図12:IFN-γ(インターフェロン−γ)データを示す図である。
図13:肝線維化面積比データを示す図である。
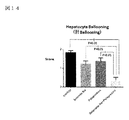
図14:肝Ballooningデータを示す図である。
図15:Lobular inflammation(小葉内炎症)データ を示す図である。
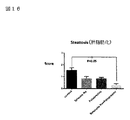
図16:Steatosis(脂肪化)データを示す図である。
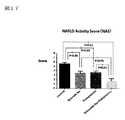
図17:NAS(NAFLD Activity Score)データを示す図である。
特許文献2
特許第5337245号
本発明の有効成分である亜鉛製剤(ポラプレジンク)は特公平3−5367号公報の方法により得ることが出来る。セレン製剤(亜セレン酸ナトリウム)は、亜セレン酸と水酸化ナトリウムから合成され得られる。亜セレン酸ナトリウムは海外において、セレン欠乏によって生じる重篤な視力障害、神経障害、心筋障害、毛髪変化の改善という目的で既に使用されている。又中国ではセレン欠乏によって生ずる克山病の治療に使用されている。亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)という既知の2成分を使用し、確定的な治療薬がない疾病の治療において有効な配合剤が得られたことは極めて重要である。
本発明の医薬品としては、経口投与製剤が好ましい。特に錠剤、カプセル剤、散剤、シロップ剤等が好ましい。
亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤の製造には、亜鉛製剤(ポラプレジンク)として注射用蒸留水、精製水、カルボキシメチルセルロース、マンニット、白糖、トウモロコシ澱粉、結晶セルロース、ラクチトール、セルロース誘導体、アラビアゴム、トラガントゴム、ゼラチン、ポリソルベート80、タルク、ステアリン酸マグネシウム、水、エタノール、白色ワセリン、グリセリン、脂肪、脂肪油、グリコール類、ステアリルアルコールなどの高級アルコール類、プラスチべース、パラフィン、ミツロウ、ポリオキシエチレン硬化ヒマシ油、サッカリン、パインシロップ等を適宜選択組み合わせることができる。セレン製剤(亜セレン酸ナトリウム)としては、亜セレン酸と水酸化ナトリウムから合成され得ることができる。
配合成分としての亜鉛製剤中の亜鉛量としては年齢、体重、病態、治療効果、投与時期、投与回数、投与期間、投与方法によって異なるが、好ましくは成人1日あたり0.015g〜0.25gである。同じくセレン製剤中のセレン量としての配合量は年齢、体重、病態、治療効果、投与時期、投与回数、投与期間、投与方法によって異なるが、好ましくは成人1日あたり10μg〜450μgであり、この配合剤を1日1〜4回に分けて投与することが好ましい。
実施例を挙げて本発明を更に詳細に説明するが、本発明は何ら実施例に限定されるものではない。
実施例
NASHモデルマウスから平均体重が均等になるように体重層別化無作為抽出法によって、4群(8匹/群)に群分を行った。4群とは亜鉛製剤(ポラプレジンク)+セレン製剤(亜セレン酸ナトリウム)群、亜鉛錯体製剤(ポラプレジンク)単独群、セレン製剤(亜セレン酸ナトリウム)単独群、コントロール群である。投与経路は経口投与とし、投与期間は28日間とした。
投与回数は1日1回とした。投与量は10ml/kg体重とし、経口ゾンデを用いて投与した。
各群の投与量は表1に示す。
[表1]
投与終了時にエーテル麻酔下で心臓から血液を採取した。得られた血清をチューブに分注した。採血後、放血致死させ、摘出肝について写真撮影した。全ての剖検動物について、肝臓を4つの各葉(内側右葉/左葉、外側左葉、右葉、尾状葉)に分けて処理し、特に外側左葉は6等分にし、その内の2片づつ3部分を処理し、組織像を解析した。
非アルコール性脂肪性肝疾患(NAFLD)および/または非アルコール性脂肪性肝(NASH)改善に対する評価は、以下の項目によって評価した。
( 1 )HE染色組織
( 2 )F4/80抗体(マクロファージ)染色組織
( 3 )Oil―Red−O染色(細胞内脂肪滴)組織
( 4 )肝重量及び肝重量の体重に対する変化
( 5 )ALTの変化
( 6 )血清フェリチン値の変化
( 7 )MDA(マロンジアルデヒド)の変化
( 8 )肝TG(肝中性脂肪)の変化
( 9 )MCP−1(単球走化性促進因子)の変化
( 10)TNF−α(腫瘍壊死因子)の変化
( 11)IFN−γ(インターフェロン−γ)の変化
( 12)肝線維化面積比の変化
( 13)NAS(脂肪化、小葉内炎症、Ballooning変性とNAS)による活動度変化
図1は4群のHE染色組織像を示す図である。図1において、HE染色の結果、亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤の群は、他の群に比較して、脂肪細胞数及び脂肪細胞のサイズ縮小が観察され、小葉中心性の肝細胞の風船様変性、細胞周囲の線維化が抑えられていた。亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤によって、非アルコール性脂肪性肝疾患(NAFLD)の特徴である肝臓の組織中に大滴性脂肪の沈着、肝細胞の風船状肥大(バルーニング)、炎症細胞の浸潤などの組織像の改善が明白となった。
図2−1は4群のF4/80(マクロファージ)染色組織像を示す図である。
図2−2は4群のF4/80(マクロファージ)染色組織像を示す図である。
図2−1、図2−2において、F4/80はマクロファージに特異的に発現する抗原の1つであり、肝臓類洞に存在するマクロファージであるクッパ―細胞などに常時発現し、発現量も多く、細胞の生理的状態によって調節されている。亜鉛製剤(ポラプレジンク)単独、セレン製剤(亜セレン酸ナトリウム)単独でもコントロールに比べて有意に発現量を抑制しているが、亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤の群は、コントロール群、亜鉛製剤(ポラプレジンク)単独、セレン製剤(亜セレン酸ナトリウム)単独の3群と比較して、発現量が有意に減少している。脂肪変性した肝細胞とマクロファージにより構成される組織学的構造は炎症や線維化の原因となり、非アルコール性脂肪性肝疾患(NAFLD)および/または非アルコール性脂肪性肝炎(NASH)の重症度に比例して出現する(非特許文献8)。マクロファージの減少は非アルコール性脂肪性肝疾患(NAFLD)および/または非アルコール性脂肪性肝炎(NASH)の重症度を軽減することを意味する。抗原発現量の減少はマクロファージが減少していることであり、肝臓類洞に存在するマクロファージであるクッパ―細胞の活性を抑えていることが明白になった。
非特許文献8
Michiko Itoh et.al PLoS ONE 2013.8.12 e82163
Hepatic Crown-Like Structure: A Unique Histological Feature in Non-Alcoholic Steatohepatitis in Mice and Humans
図3は4群のOil―Red−O染色(細胞内脂肪滴)組織像を示す図である。
図3において、Oil―Red−Oは脂肪細胞に触れると細胞内脂質の溶媒に溶け込み、発色するので、脂肪前駆細胞から脂肪細胞への分化を確認するために実施される。脂肪内脂質は赤く染まり、核は青く染まる。亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤の群は、コントロール群、亜鉛製剤(ポラプレジンク)単独群、セレン製剤(亜セレン酸ナトリウム)単独群の3群と比較して、脂肪内脂質の染色面積が少なく、脂肪細胞の脂肪前駆細胞から脂肪細胞への分化が少ないことが明白になった。
図4は肝重量を示す図である。
図4において、非アルコール性脂肪性肝疾患(NAFLD)および/または非アルコール性脂肪性肝炎(NASH)では肝臓に脂肪が蓄積されるので、肝重量が増加する。肝重量において、亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤の群は投与後1,239.9mg、コントロール群は投与後1,467mg、亜鉛製剤(ポラプレジンク)単独群は投与後1,389mg、セレン製剤(亜セレン酸ナトリウム)単独群は投与後1,385.2mgであった。亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤はコントロール群と亜鉛製剤(ポラプレジンク)単独群に対して有意に肝重量を減少させ、セレン製剤(亜セレン酸ナトリウム)単独群に対して減少傾向を示した。
図5に示す肝重量/体重比において、亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤の群は投与後6.82%、コントロール群は投与後7.71%、亜鉛製剤(ポラプレジンク)単独群は投与後7.49%、セレン製剤(亜セレン酸ナトリウム)単独群は投与後7.43%であった。亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤の群はコントロール群に対して有意に低下させ、亜鉛製剤(ポラプレジンク)単独群及びセレン製剤(亜セレン酸ナトリウム)単独群に対して低下傾向を示した。
図6はALTデータを示す図である。
図6において、血清ALT値について、亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤の群は投与後37.8IU/L、コントロール群は投与後74.2IU/L、亜鉛製剤(ポラプレジンク)単独群は投与後58.8IU/L、セレン製剤(亜セレン酸ナトリウム)単独群は投与後54.6IU/Lであった。亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤の群はコントロール群、亜鉛製剤(ポラプレジンク)単独群、セレン製剤(亜セレン酸ナトリウム)単独群の3群と比較して肝臓の炎症度を示すALTを有意に低下させた。
図7において、血清フェリチン値は体内貯蔵鉄量を反映する。従って、血清フェリチン値が高値の場合は、肝臓における鉄蓄積と有意に相関し、鉄過剰であると考えられる。鉄貯蔵臓器である肝臓が障害されると、肝臓から鉄が逸脱する事で、血清フェリチン値は上昇し、鉄過剰によって引き起こされる活性酸素によって、臓器は障害を受ける。鉄過剰はさらにNAS(NAFLD Activity Score)の増大や肝線維化進行に寄与する因子として有意に関連することが報告されている(非特許文献9)。従って、鉄過剰の改善によって臓器を保護する事が重要になってくる。亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤の群では3,448.8ng/mlであり、コントロール群7,207ng/ml、亜鉛製剤(ポラプレジンク)単独群5,740ng/ml、セレン製剤(亜セレン酸ナトリウム)単独群5,251ng/mlの3群と比較して、有意に血清フェリチン値を減少させた。
非特許文献9
Kris V Kowdley et.al Hepatology 2012.55(1):77-85
Elevated serum ferritin is an independent predictor of histologic severity and advanced fibrosis among patients with nonalcoholic fatty liver disease
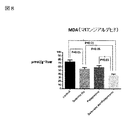
図8において、MDAは酸化ストレスのマーカーとして測定される。NASH進展において酸化ストレスは重要な因子となるが、亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤の群は、コントロール群、亜鉛製剤(ポラプレジンク)単独群、セレン製剤(亜セレン酸ナトリウム)単独群の3群と比較して、酸化ストレスマーカーである過酸化脂質濃度を有意に低下させた。亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤の群は投与後37.8U/L、コントロール群は投与後74.2U/L、亜鉛製剤(ポラプレジンク)単独群は投与後58.8U/L、セレン製剤(亜セレン酸ナトリウム)単独群は投与後54.6U/Lであった。
図9において、中性脂肪が肝細胞に沈着して肝臓に障害をきたすのが非アルコール性脂肪性肝疾患(NAFLD)であり、それが進行すると非アルコール性脂肪性肝炎(NASH)に進展する。亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤の群はコントロール群、亜鉛製剤(ポラプレジンク)単独群、セレン製剤(亜セレン酸ナトリウム)単独群の3群と比較して肝内中性脂肪を有意に減少させ、中性脂肪の肝臓への沈着を抑制した。亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤の群は投与後41.1mg/dl、コントロール群は投与後78.7mg/dl、亜鉛製剤(ポラプレジンク)単独群は投与後64.2mg/dl、セレン製剤(亜セレン酸ナトリウム)単独群は投与後57.3mg/dlであった。
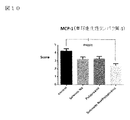
図10において、NASHの病態ではMCP−1など炎症性サイトカインの産生が亢進し、MCP−1はその受容体(CCR2)を介してNASHを進展させることが報告されている(非特許文献10)。亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤の群は、MCP−1産生を抑制し、肝機能保護作用が発揮されていることが示された。亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤の群は投与後2.4、コントロール群は投与後4.2、亜鉛製剤(ポラプレジンク)単独群は投与後3.3、セレン製剤(亜セレン酸ナトリウム)単独群は投与後3.2であった。亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤の群はコントロール群に対してMCP−1を有意に低下させ、亜鉛製剤(ポラプレジンク)単独群及びセレン製剤(亜セレン酸ナトリウム)単独群に対して低下傾向を示した。
非特許文献10
Kouichi Miura et.al Am J Physiol Gastrointest Liver Physiol 2012.302:1310-1321
Hepatic recruitment of macrophages promotes nonalcoholic steatohepatitis through CCR2
図11において、TNF−αは脂肪細胞から分泌されるアディポサイトカイン(生理活性物質)の1つで、筋肉、脂肪組織や肝臓での糖の働きを抑制する作用がある。肥満時には増加し、糖尿病や動脈硬化などのリスクを高める。炎症を誘導するたんぱく質であることが明らかとなり、TNF−αは前炎症性サイトカインとして、急性炎症と慢性炎症を誘導する。肝細胞に脂肪が蓄積する過程で、肝細胞が変性したり、自己死に陥ったり、壊死炎症が生じることで、肝臓のマクロファージであるクッパー細胞が活性化し、更には肥満や常習飲酒家では腸内細菌叢が変化し、増加したエンドトキシンが腸管から肝臓に到達し、クッパー細胞の活性化に繋がる。活性化されたこの細胞からはTNF−α等の炎症性サイトカインが遊出し、肝臓内で炎症反応が進み、肝細胞周囲の線維化に進展して行く。炎症度を示すScoreは亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤の群は8.42で、コントロール群16.29、セレン製剤(亜セレン酸ナトリウム)単独群13.23と比較して有意にTNF−αによる炎症を抑制し、亜鉛製剤(ポラプレジンク)単独群12.80と比較して抑制傾向を示した。
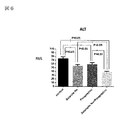
図12において、肝細胞のマクロファージであるクッパ―細胞はIFN−γ刺激によって活性化される。IFN−γはTNF−αなどの炎症性サイトカイン産生に関与し、肝細胞の炎症を進行させる。従って、IFN−γの抑制は肝細胞の炎症、線維化抑制に寄与する。炎症度を示すScoreは亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤の群は4.20、コントロール群10.69、セレン製剤(亜セレン酸ナトリウム)単独群8.02、亜鉛製剤(ポラプレジンク)単独群7.95であり、亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤の群はコントロール群とセレン製剤(亜セレン酸ナトリウム)単独群に対して有意にIFN−γによる炎症を抑制し、亜鉛製剤(ポラプレジンク)単独群に対しては、抑制傾向を示した。
図13において、非アルコール性脂肪性肝疾患(NAFLD)および/または非アルコール性脂肪性肝炎(NASH)では必ずしも肝線維化が進行するわけではない。非アルコール性脂肪性肝疾患(NAFLD)では、37%で肝線維化が進行し、34%が不変、29%が正常に戻ったと報告されている(非特許文献1)。肝線維化面積比において、亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤の群は0.81%であり、コントロール群1.47%、亜鉛製剤(ポラプレジンク)単独群1.16%、セレン製剤(亜セレン酸ナトリウム)単独群1.18%に対して、肝線維化面積が減少する傾向を示した。
非アルコール性脂肪性肝疾患(NAFLD)の評価には、NAS(NAFLD Activity Score)が用いられている。NASはNonalcoholic・Steato・hepatitis・Clinical・Research・Networkによって提唱されている(非特許文献2)。NASは臨床診断と相関し、活性度を8点満点で表し、5点以上ではほとんどがNASHであり、3,4点でNASHの疑いと非NASHが混在している、3点未満でほぼ非NASHであるとされている。NASの活動度は脂肪化、小葉内炎症、Ballooning変性の3つをスコア-化して、評価される。脂肪化と小葉内炎症は0〜3点、肝Ballooning変性は0〜2点の合計8点満点で示される。脂肪化、小葉内炎症、肝Ballooning変性およびNAS(NAFLD Activity Score)を亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤の群、コントロール群、亜鉛製剤(ポラプレジンク)単独群、セレン製剤(亜セレン酸ナトリウム)単独群の4群で比較検討した。非アルコール性脂肪性肝疾患(NAFLD)の診断には特に肝Ballooningが鍵となり、その抑制が重要であることが示唆されている(非特許文献11)。
図14において、亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤の群では0.38であり、コントロール群1.85、亜鉛製剤(ポラプレジンク)単独群1.38、セレン製剤(亜セレン酸ナトリウム)単独群1.23に比べて、有意に肝Ballooningを抑制した。非アルコール性脂肪性肝疾患(NAFLD)は進行度によってtype-1~type-4に分類され、非アルコール性脂肪性肝炎(NASH)と診断されるtype-3、type-4で初めて肝Ballooningが観察される。type-3、type-4では肝硬変への進展ならびに肝疾患関連死がtype-1、type-2と比較して有意に増加する(非特許文献11)ことから、進展には肝Ballooningがより重要と考えられる。故に肝Ballooning進行を抑制することが重要である。亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤は肝Ballooningを有意に抑制することで、非アルコール性脂肪性肝疾患(NAFLD)および/または非アルコール性脂肪性肝炎(NASH)の肝硬変への進展ならびに肝疾患関連死の減少が期待される。
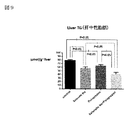
図15において、亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤の群0.85は、コントロール群2.23と比較して、有意に小葉内炎症を抑制した。亜鉛製剤(ポラプレジンク)単独群1.38、セレン製剤(亜セレン酸ナトリウム)単独群1.46に対して、抑制傾向が見られた。
図16において、亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤の群0.54は、コントロール群1.54と比較して、有意に(肝内)脂肪化を抑制した。亜鉛製剤(ポラプレジンク)単独群0.85、セレン製剤(亜セレン酸ナトリウム)単独群0.85に対しては、抑制傾向が見られた。
図17において、亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤の群のNASは1.77であり、コントロール群は5.62、亜鉛製剤(ポラプレジンク)単独群は3.62、セレン製剤(亜セレン酸ナトリウム)単独群は3.54であった。4群中、亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤の群のNASはコントロール群、亜鉛製剤(ポラプレジンク)単独群、セレン製剤(亜セレン酸ナトリウム)単独群の3群と比較して有意に低値であった。
亜鉛製剤(ポラプレジンク)、セレン製剤(亜セレン酸ナトリウム)単独群においても、コントロール群と比較してNAS(NAFLD Activity Score)を有意に低下させたが、亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤の群は、亜鉛製剤(ポラプレジンク)単独群、セレン製剤(亜セレン酸ナトリウム)単独群に比べて、より有意にNAS(NAFLD Activity Score)を改善した。非アルコール性脂肪性肝疾患(NAFLD)および/または非アルコール性脂肪性肝炎(NASH)での診断には特に肝細胞の風船様変性(肝 Ballooning)が鍵となり、その抑制が重要であることが示唆されている(非特許文献11)。
亜鉛製剤(ポラプレジンク)とセレン製剤(亜セレン酸ナトリウム)の配合剤は、この観点からも、非アルコール性脂肪性肝疾患(NAFLD)および/または非アルコール性脂肪性肝炎(NASH)治療薬として、亜鉛製剤(ポラプレジンク)、セレン製剤(亜セレン酸ナトリウム)それぞれの単独製剤に対し、より有意・有効な非アルコール性脂肪性肝疾患(NAFLD)および/または非アルコール性脂肪性肝炎(NASH)治療薬であることを証明するものである。
Claims (1)
- 亜鉛製剤としてのポラプレジンクとセレン製剤としての亜セレン酸ナトリウムを有効成分とし、NASのスコアリングを2点以下とするための、非アルコール性脂肪性肝炎(NASH)の治療用配合剤。
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| PCT/JP2017/043898 WO2019106851A1 (ja) | 2017-11-30 | 2017-11-30 | 非アルコール性脂肪性肝疾患(naflad)および/または非アルコール性脂肪性肝炎(nash)、および/または肝脂肪性変性の治療と予防に適した、配合剤 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPWO2019106851A1 JPWO2019106851A1 (ja) | 2019-12-12 |
| JP6913402B2 true JP6913402B2 (ja) | 2021-08-04 |
Family
ID=66665516
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019516717A Active JP6913402B2 (ja) | 2017-11-30 | 2017-11-30 | 非アルコール性脂肪性肝炎(nash)の治療と予防に適した配合剤 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US20190336523A1 (ja) |
| EP (1) | EP3718552A4 (ja) |
| JP (1) | JP6913402B2 (ja) |
| CN (1) | CN110099690B (ja) |
| WO (1) | WO2019106851A1 (ja) |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11484610B2 (en) | 2019-11-22 | 2022-11-01 | Vector Vitale Ip Llc | Method of treating melanoma |
| JP7755316B2 (ja) * | 2019-12-20 | 2025-10-16 | ベクター・ビターレ・アイピー・リミテッド・ライアビリティ・カンパニー | 非アルコール性脂肪性肝炎の治療方法 |
| US11596650B2 (en) | 2019-12-20 | 2023-03-07 | Vector Vitale Ip Llc | Composition and method for the treatment of type 2 diabetes |
| CN117653600B (zh) * | 2022-08-23 | 2025-10-31 | 四川大学华西医院 | 用于肝脏递送和治疗肝脏疾病的锌脂质体制剂 |
| WO2025028439A1 (ja) * | 2023-07-28 | 2025-02-06 | 株式会社大塚製薬工場 | 静注用医薬組成物 |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5280316A (en) | 1975-12-27 | 1977-07-06 | Nissha Printing | Manufacture of ceramic*tile products having multiicolor tones of under glaze |
| JPS5933270A (ja) | 1982-08-19 | 1984-02-23 | Hamari Yakuhin Kogyo Kk | 抗潰瘍剤 |
| AT394493B (de) * | 1989-05-11 | 1992-04-10 | Homosan Ag | Pharmazeutisches praeparat zur behandlung von lebererkrankungen |
| JP4802470B2 (ja) | 2004-09-27 | 2011-10-26 | ゼリア新薬工業株式会社 | 肝線維化抑制剤 |
| CN100349609C (zh) * | 2006-03-23 | 2007-11-21 | 恩泰柯医药科技(北京)有限公司 | 肝硬化治疗药 |
| US8962687B2 (en) * | 2012-12-05 | 2015-02-24 | Medicinova, Inc. | Method of treating liver disorders |
| CN103340089A (zh) * | 2013-07-26 | 2013-10-09 | 苏州科缔康农业生物科技有限公司 | 一种富锌、硒解酒护肝青萝卜的栽培方法 |
| RU2723559C2 (ru) * | 2014-09-12 | 2020-06-16 | Тобира Терапьютикс, Инк. | Комбинированная терапия с применением препарата ценикривирок для лечения фиброза |
| WO2016139740A1 (ja) * | 2015-03-03 | 2016-09-09 | 株式会社メディコ・コンスル | 肝線維化改善剤 |
-
2017
- 2017-11-30 EP EP17933704.3A patent/EP3718552A4/en not_active Withdrawn
- 2017-11-30 CN CN201780069336.5A patent/CN110099690B/zh active Active
- 2017-11-30 WO PCT/JP2017/043898 patent/WO2019106851A1/ja not_active Ceased
- 2017-11-30 US US16/473,888 patent/US20190336523A1/en not_active Abandoned
- 2017-11-30 JP JP2019516717A patent/JP6913402B2/ja active Active
Also Published As
| Publication number | Publication date |
|---|---|
| WO2019106851A1 (ja) | 2019-06-06 |
| EP3718552A1 (en) | 2020-10-07 |
| JPWO2019106851A1 (ja) | 2019-12-12 |
| EP3718552A4 (en) | 2022-01-05 |
| US20190336523A1 (en) | 2019-11-07 |
| CN110099690A (zh) | 2019-08-06 |
| CN110099690B (zh) | 2021-10-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6913402B2 (ja) | 非アルコール性脂肪性肝炎(nash)の治療と予防に適した配合剤 | |
| JP5878954B2 (ja) | マルチプル・リスク・ファクター症候群を予防又は改善するための組成物 | |
| KR101740893B1 (ko) | Akkermansia muciniphila 균에서 유래하는 세포밖 소포를 유효성분으로 함유하는 대사질환의 치료 또는 예방용 조성물 | |
| KR101809172B1 (ko) | 뮤신이 없는 배지에서 배양한 아커만시아 뮤시니필라 균주 또는 이의 배양액을 유효성분으로 함유하는 대사성 질환의 예방, 개선 또는 치료용 조성물 | |
| JP2008273938A (ja) | アディポネクチン産生促進剤 | |
| CN107073029A (zh) | 包含含金药剂的、用于预防或治疗肝纤维化或肝硬化的药物组合物 | |
| JP6157928B2 (ja) | 肝臓への脂肪蓄積抑制剤 | |
| JP6977053B2 (ja) | ギ酸またはその薬学的に許容可能な塩を有効成分として含む肥満または肥満によって惹起された代謝症候群の予防または治療用組成物 | |
| KR101206543B1 (ko) | 율피 추출물을 포함하는 지방간의 예방 또는 치료용 조성물 | |
| US11058718B2 (en) | Method for treating non-alcoholic steatohepatitis (NASH) with the combination of polaprezinc and sodium selenite | |
| KR20140104090A (ko) | 커큐민을 유효성분으로 포함하는 지방간 질환의 치료 또는 예방용 조성물 | |
| JP4604179B2 (ja) | 糖尿病血糖降下剤及び高脂血症治療剤 | |
| KR102674622B1 (ko) | 데페록사민을 포함하는 근감소증의 예방, 개선 또는 치료용 조성물 | |
| TWI607755B (zh) | 麥角固醇之應用 | |
| KR100732614B1 (ko) | 복어 추출물을 포함하는 비만 또는 당뇨성 질환의 예방또는 치료용 약학 조성물 | |
| WO2015192445A1 (zh) | 赶黄草或其提取物在制备预防或治疗非酒精性脂肪肝的保健品或药物中的用途 | |
| JP7427199B2 (ja) | 代謝改善剤 | |
| KR101474235B1 (ko) | 대장암 예방 건강밥과 그 제조방법 | |
| JP7720104B2 (ja) | トルセミドおよびクロモリンを含む代謝疾患予防または治療用組成物 | |
| CN110693873A (zh) | 冬凌草活性成分组合物的制备及应用 | |
| JP2012031101A (ja) | 非アルコール性脂肪性肝炎の改善用組成物 | |
| CN112972440B (zh) | 麝香酮在制备防治抑郁症的药物中的用途 | |
| JP6533412B2 (ja) | FoxO3aリン酸化阻害試薬 | |
| TWI698244B (zh) | 小分子褐藻醣膠與藻褐素之組合物用於製備改善非酒精性脂肪肝之組成物的用途 | |
| KR102115657B1 (ko) | 제라닉산을 유효성분으로 포함하는 항비만용 조성물 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20190408 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190619 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190626 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20200127 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200311 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20200413 |
|
| C60 | Trial request (containing other claim documents, opposition documents) |
Free format text: JAPANESE INTERMEDIATE CODE: C60 Effective date: 20200709 |
|
| C22 | Notice of designation (change) of administrative judge |
Free format text: JAPANESE INTERMEDIATE CODE: C22 Effective date: 20210317 |
|
| C22 | Notice of designation (change) of administrative judge |
Free format text: JAPANESE INTERMEDIATE CODE: C22 Effective date: 20210416 |
|
| C13 | Notice of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: C13 Effective date: 20210430 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210520 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210603 |
|
| C23 | Notice of termination of proceedings |
Free format text: JAPANESE INTERMEDIATE CODE: C23 Effective date: 20210603 |
|
| C302 | Record of communication |
Free format text: JAPANESE INTERMEDIATE CODE: C302 Effective date: 20210609 |
|
| C03 | Trial/appeal decision taken |
Free format text: JAPANESE INTERMEDIATE CODE: C03 Effective date: 20210701 |
|
| C30A | Notification sent |
Free format text: JAPANESE INTERMEDIATE CODE: C3012 Effective date: 20210701 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20210705 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6913402 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |