JP6125509B2 - 酸化防止剤を含む皮膚充填剤組成物 - Google Patents
酸化防止剤を含む皮膚充填剤組成物 Download PDFInfo
- Publication number
- JP6125509B2 JP6125509B2 JP2014530798A JP2014530798A JP6125509B2 JP 6125509 B2 JP6125509 B2 JP 6125509B2 JP 2014530798 A JP2014530798 A JP 2014530798A JP 2014530798 A JP2014530798 A JP 2014530798A JP 6125509 B2 JP6125509 B2 JP 6125509B2
- Authority
- JP
- Japan
- Prior art keywords
- composition
- skin
- hyaluronic acid
- gel
- aa2g
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 239000000203 mixture Substances 0.000 title claims description 399
- 239000000945 filler Substances 0.000 title claims description 76
- 230000002500 effect on skin Effects 0.000 title description 20
- 239000003963 antioxidant agent Substances 0.000 title description 3
- 230000003078 antioxidant effect Effects 0.000 title 1
- 229920002674 hyaluronan Polymers 0.000 claims description 264
- KIUKXJAPPMFGSW-DNGZLQJQSA-N (2S,3S,4S,5R,6R)-6-[(2S,3R,4R,5S,6R)-3-Acetamido-2-[(2S,3S,4R,5R,6R)-6-[(2R,3R,4R,5S,6R)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2-carboxylic acid Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-DNGZLQJQSA-N 0.000 claims description 221
- 229960003160 hyaluronic acid Drugs 0.000 claims description 217
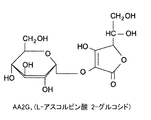
- MLSJBGYKDYSOAE-DCWMUDTNSA-N L-Ascorbic acid-2-glucoside Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)O)=C1O MLSJBGYKDYSOAE-DCWMUDTNSA-N 0.000 claims description 91
- 239000000654 additive Substances 0.000 claims description 54
- 238000004132 cross linking Methods 0.000 claims description 41
- 230000000996 additive effect Effects 0.000 claims description 38
- 150000003700 vitamin C derivatives Chemical class 0.000 claims description 23
- NNJVILVZKWQKPM-UHFFFAOYSA-N Lidocaine Chemical compound CCN(CC)CC(=O)NC1=C(C)C=CC=C1C NNJVILVZKWQKPM-UHFFFAOYSA-N 0.000 claims description 21
- 229960004194 lidocaine Drugs 0.000 claims description 20
- 230000002829 reductive effect Effects 0.000 claims description 17
- 230000003444 anaesthetic effect Effects 0.000 claims description 14
- 239000003431 cross linking reagent Substances 0.000 claims description 12
- SHKUUQIDMUMQQK-UHFFFAOYSA-N 2-[4-(oxiran-2-ylmethoxy)butoxymethyl]oxirane Chemical group C1OC1COCCCCOCC1CO1 SHKUUQIDMUMQQK-UHFFFAOYSA-N 0.000 claims description 6
- 239000007972 injectable composition Substances 0.000 claims description 2
- 229910000147 aluminium phosphate Inorganic materials 0.000 claims 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N phosphoric acid Substances OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 claims 2
- 230000003287 optical effect Effects 0.000 claims 1
- 239000000499 gel Substances 0.000 description 221
- 210000003491 skin Anatomy 0.000 description 168
- 239000000017 hydrogel Substances 0.000 description 153
- 229920000642 polymer Polymers 0.000 description 142
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 112
- 229920002683 Glycosaminoglycan Polymers 0.000 description 63
- 238000000034 method Methods 0.000 description 63
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 60
- 239000000243 solution Substances 0.000 description 55
- KIUKXJAPPMFGSW-MNSSHETKSA-N hyaluronan Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)C1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H](C(O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-MNSSHETKSA-N 0.000 description 47
- 229940099552 hyaluronan Drugs 0.000 description 47
- 150000004676 glycans Chemical class 0.000 description 42
- 239000000872 buffer Substances 0.000 description 41
- 238000000502 dialysis Methods 0.000 description 37
- 229960005070 ascorbic acid Drugs 0.000 description 29
- 235000010323 ascorbic acid Nutrition 0.000 description 28
- 239000011668 ascorbic acid Substances 0.000 description 28
- 230000007547 defect Effects 0.000 description 28
- ZZZCUOFIHGPKAK-UHFFFAOYSA-N D-erythro-ascorbic acid Natural products OCC1OC(=O)C(O)=C1O ZZZCUOFIHGPKAK-UHFFFAOYSA-N 0.000 description 27
- 229930003268 Vitamin C Natural products 0.000 description 27
- 235000019154 vitamin C Nutrition 0.000 description 27
- 239000011718 vitamin C Substances 0.000 description 27
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 27
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 26
- 239000003795 chemical substances by application Substances 0.000 description 25
- 210000004872 soft tissue Anatomy 0.000 description 25
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 23
- 235000002639 sodium chloride Nutrition 0.000 description 23
- NAQMVNRVTILPCV-UHFFFAOYSA-N hexane-1,6-diamine Chemical compound NCCCCCCN NAQMVNRVTILPCV-UHFFFAOYSA-N 0.000 description 22
- MFCMBWRHOUCXEZ-CAHLUQPWSA-N 3-aminopropyl [(2r)-2-[(1s)-1,2-dihydroxyethyl]-3-hydroxy-5-oxo-2h-furan-4-yl] hydrogen phosphate Chemical compound NCCCOP(O)(=O)OC1=C(O)[C@@H]([C@@H](O)CO)OC1=O MFCMBWRHOUCXEZ-CAHLUQPWSA-N 0.000 description 21
- 238000002347 injection Methods 0.000 description 20
- 239000007924 injection Substances 0.000 description 20
- 150000003839 salts Chemical class 0.000 description 20
- 210000004207 dermis Anatomy 0.000 description 19
- SQDAZGGFXASXDW-UHFFFAOYSA-N 5-bromo-2-(trifluoromethoxy)pyridine Chemical compound FC(F)(F)OC1=CC=C(Br)C=N1 SQDAZGGFXASXDW-UHFFFAOYSA-N 0.000 description 17
- 229920001287 Chondroitin sulfate Polymers 0.000 description 17
- 238000006243 chemical reaction Methods 0.000 description 17
- 229940059329 chondroitin sulfate Drugs 0.000 description 17
- -1 vitamin C Natural products 0.000 description 17
- 230000037303 wrinkles Effects 0.000 description 17
- 229920000288 Keratan sulfate Polymers 0.000 description 16
- KXCLCNHUUKTANI-RBIYJLQWSA-N keratan Chemical compound CC(=O)N[C@@H]1[C@@H](O)C[C@@H](COS(O)(=O)=O)O[C@H]1O[C@@H]1[C@@H](O)[C@H](O[C@@H]2[C@H](O[C@@H](O[C@H]3[C@H]([C@@H](COS(O)(=O)=O)O[C@@H](O)[C@@H]3O)O)[C@H](NC(C)=O)[C@H]2O)COS(O)(=O)=O)O[C@H](COS(O)(=O)=O)[C@@H]1O KXCLCNHUUKTANI-RBIYJLQWSA-N 0.000 description 16
- 150000002118 epoxides Chemical class 0.000 description 15
- 230000001815 facial effect Effects 0.000 description 15
- 238000009472 formulation Methods 0.000 description 15
- 238000010438 heat treatment Methods 0.000 description 15
- 239000004971 Cross linker Substances 0.000 description 14
- YRWWOAFMPXPHEJ-OFBPEYICSA-K sodium L-ascorbic acid 2-phosphate Chemical compound [Na+].[Na+].[Na+].OC[C@H](O)[C@H]1OC(=O)C(OP([O-])([O-])=O)=C1[O-] YRWWOAFMPXPHEJ-OFBPEYICSA-K 0.000 description 14
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 13
- 239000007987 MES buffer Substances 0.000 description 13
- NQTADLQHYWFPDB-UHFFFAOYSA-N N-Hydroxysuccinimide Chemical compound ON1C(=O)CCC1=O NQTADLQHYWFPDB-UHFFFAOYSA-N 0.000 description 13
- 230000008859 change Effects 0.000 description 13
- 238000002845 discoloration Methods 0.000 description 13
- 201000010099 disease Diseases 0.000 description 13
- 208000035475 disorder Diseases 0.000 description 13
- 238000003860 storage Methods 0.000 description 13
- FPIPGXGPPPQFEQ-OVSJKPMPSA-N all-trans-retinol Chemical compound OC\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-OVSJKPMPSA-N 0.000 description 12
- 210000001508 eye Anatomy 0.000 description 12
- 229920001282 polysaccharide Polymers 0.000 description 12
- 239000005017 polysaccharide Substances 0.000 description 12
- ZPUCINDJVBIVPJ-LJISPDSOSA-N cocaine Chemical compound O([C@H]1C[C@@H]2CC[C@@H](N2C)[C@H]1C(=O)OC)C(=O)C1=CC=CC=C1 ZPUCINDJVBIVPJ-LJISPDSOSA-N 0.000 description 11
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 10
- 229920002971 Heparan sulfate Polymers 0.000 description 10
- 239000002537 cosmetic Substances 0.000 description 10
- 239000012530 fluid Substances 0.000 description 10
- 239000000463 material Substances 0.000 description 10
- 229920001223 polyethylene glycol Polymers 0.000 description 10
- 238000002360 preparation method Methods 0.000 description 10
- 238000012360 testing method Methods 0.000 description 10
- 230000008901 benefit Effects 0.000 description 9
- 210000000981 epithelium Anatomy 0.000 description 9
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 8
- 230000006872 improvement Effects 0.000 description 8
- 239000003589 local anesthetic agent Substances 0.000 description 8
- 230000001954 sterilising effect Effects 0.000 description 8
- 238000004659 sterilization and disinfection Methods 0.000 description 8
- 239000000126 substance Substances 0.000 description 8
- FPIPGXGPPPQFEQ-UHFFFAOYSA-N 13-cis retinol Natural products OCC=C(C)C=CC=C(C)C=CC1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-UHFFFAOYSA-N 0.000 description 7
- 229920000045 Dermatan sulfate Polymers 0.000 description 7
- SHGAZHPCJJPHSC-YCNIQYBTSA-N all-trans-retinoic acid Chemical compound OC(=O)\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-YCNIQYBTSA-N 0.000 description 7
- 230000009286 beneficial effect Effects 0.000 description 7
- AVJBPWGFOQAPRH-FWMKGIEWSA-L dermatan sulfate Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@H](OS([O-])(=O)=O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O)[C@H](C([O-])=O)O1 AVJBPWGFOQAPRH-FWMKGIEWSA-L 0.000 description 7
- 229940051593 dermatan sulfate Drugs 0.000 description 7
- 150000002016 disaccharides Chemical group 0.000 description 7
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 7
- 238000005259 measurement Methods 0.000 description 7
- 238000002156 mixing Methods 0.000 description 7
- 229940048058 sodium ascorbyl phosphate Drugs 0.000 description 7
- 229960001727 tretinoin Drugs 0.000 description 7
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 6
- 108010035532 Collagen Proteins 0.000 description 6
- 102000008186 Collagen Human genes 0.000 description 6
- IAJILQKETJEXLJ-UHFFFAOYSA-N Galacturonsaeure Natural products O=CC(O)C(O)C(O)C(O)C(O)=O IAJILQKETJEXLJ-UHFFFAOYSA-N 0.000 description 6
- 229920001954 Restylane Polymers 0.000 description 6
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 6
- 229920001436 collagen Polymers 0.000 description 6
- 239000010410 layer Substances 0.000 description 6
- 230000007774 longterm Effects 0.000 description 6
- 206010033675 panniculitis Diseases 0.000 description 6
- 230000009467 reduction Effects 0.000 description 6
- 239000011607 retinol Substances 0.000 description 6
- 229960003471 retinol Drugs 0.000 description 6
- 235000020944 retinol Nutrition 0.000 description 6
- 210000004304 subcutaneous tissue Anatomy 0.000 description 6
- 208000024891 symptom Diseases 0.000 description 6
- 210000001519 tissue Anatomy 0.000 description 6
- 206010013786 Dry skin Diseases 0.000 description 5
- 108010014258 Elastin Proteins 0.000 description 5
- 102000016942 Elastin Human genes 0.000 description 5
- 102100024295 Maltase-glucoamylase Human genes 0.000 description 5
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 5
- 208000031439 Striae Distensae Diseases 0.000 description 5
- 210000000577 adipose tissue Anatomy 0.000 description 5
- 108010028144 alpha-Glucosidases Proteins 0.000 description 5
- 230000015572 biosynthetic process Effects 0.000 description 5
- 210000004204 blood vessel Anatomy 0.000 description 5
- 210000004027 cell Anatomy 0.000 description 5
- 229920002549 elastin Polymers 0.000 description 5
- 238000011049 filling Methods 0.000 description 5
- 210000001061 forehead Anatomy 0.000 description 5
- 239000003193 general anesthetic agent Substances 0.000 description 5
- 238000002513 implantation Methods 0.000 description 5
- 239000011159 matrix material Substances 0.000 description 5
- 239000000178 monomer Substances 0.000 description 5
- 239000002245 particle Substances 0.000 description 5
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 5
- 230000008569 process Effects 0.000 description 5
- 102000004196 processed proteins & peptides Human genes 0.000 description 5
- 108090000765 processed proteins & peptides Proteins 0.000 description 5
- 229930002330 retinoic acid Natural products 0.000 description 5
- 230000037394 skin elasticity Effects 0.000 description 5
- 239000002344 surface layer Substances 0.000 description 5
- 230000000007 visual effect Effects 0.000 description 5
- 229940088594 vitamin Drugs 0.000 description 5
- 229930003231 vitamin Natural products 0.000 description 5
- 235000013343 vitamin Nutrition 0.000 description 5
- 239000011782 vitamin Substances 0.000 description 5
- MSWZFWKMSRAUBD-UHFFFAOYSA-N 2-Amino-2-Deoxy-Hexose Chemical compound NC1C(O)OC(CO)C(O)C1O MSWZFWKMSRAUBD-UHFFFAOYSA-N 0.000 description 4
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 4
- MBLBDJOUHNCFQT-UHFFFAOYSA-N N-acetyl-D-galactosamine Natural products CC(=O)NC(C=O)C(O)C(O)C(O)CO MBLBDJOUHNCFQT-UHFFFAOYSA-N 0.000 description 4
- AEMOLEFTQBMNLQ-WAXACMCWSA-N alpha-D-glucuronic acid Chemical compound O[C@H]1O[C@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O AEMOLEFTQBMNLQ-WAXACMCWSA-N 0.000 description 4
- 229940071097 ascorbyl phosphate Drugs 0.000 description 4
- 239000011575 calcium Substances 0.000 description 4
- 229910052791 calcium Inorganic materials 0.000 description 4
- 229920002678 cellulose Polymers 0.000 description 4
- 150000001875 compounds Chemical class 0.000 description 4
- 210000002808 connective tissue Anatomy 0.000 description 4
- 230000007423 decrease Effects 0.000 description 4
- 210000004709 eyebrow Anatomy 0.000 description 4
- 210000000744 eyelid Anatomy 0.000 description 4
- 210000002950 fibroblast Anatomy 0.000 description 4
- 125000000524 functional group Chemical group 0.000 description 4
- 239000007943 implant Substances 0.000 description 4
- YECIFGHRMFEPJK-UHFFFAOYSA-N lidocaine hydrochloride monohydrate Chemical compound O.[Cl-].CC[NH+](CC)CC(=O)NC1=C(C)C=CC=C1C YECIFGHRMFEPJK-UHFFFAOYSA-N 0.000 description 4
- 229960005015 local anesthetics Drugs 0.000 description 4
- 238000002595 magnetic resonance imaging Methods 0.000 description 4
- 238000012423 maintenance Methods 0.000 description 4
- 238000004519 manufacturing process Methods 0.000 description 4
- 230000007246 mechanism Effects 0.000 description 4
- 239000008194 pharmaceutical composition Substances 0.000 description 4
- 239000011591 potassium Substances 0.000 description 4
- 229910052700 potassium Inorganic materials 0.000 description 4
- 229960004919 procaine Drugs 0.000 description 4
- 230000035484 reaction time Effects 0.000 description 4
- ZKMNUMMKYBVTFN-HNNXBMFYSA-N (S)-ropivacaine Chemical compound CCCN1CCCC[C@H]1C(=O)NC1=C(C)C=CC=C1C ZKMNUMMKYBVTFN-HNNXBMFYSA-N 0.000 description 3
- LEBVLXFERQHONN-UHFFFAOYSA-N 1-butyl-N-(2,6-dimethylphenyl)piperidine-2-carboxamide Chemical compound CCCCN1CCCCC1C(=O)NC1=C(C)C=CC=C1C LEBVLXFERQHONN-UHFFFAOYSA-N 0.000 description 3
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 3
- 102000004190 Enzymes Human genes 0.000 description 3
- 108090000790 Enzymes Proteins 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- XQFRJNBWHJMXHO-RRKCRQDMSA-N IDUR Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(I)=C1 XQFRJNBWHJMXHO-RRKCRQDMSA-N 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- YQKAVWCGQQXBGW-UHFFFAOYSA-N Piperocaine Chemical compound CC1CCCCN1CCCOC(=O)C1=CC=CC=C1 YQKAVWCGQQXBGW-UHFFFAOYSA-N 0.000 description 3
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 3
- KCLANYCVBBTKTO-UHFFFAOYSA-N Proparacaine Chemical compound CCCOC1=CC=C(C(=O)OCCN(CC)CC)C=C1N KCLANYCVBBTKTO-UHFFFAOYSA-N 0.000 description 3
- 206010040829 Skin discolouration Diseases 0.000 description 3
- 206010040925 Skin striae Diseases 0.000 description 3
- 238000010521 absorption reaction Methods 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- 230000032683 aging Effects 0.000 description 3
- 230000009435 amidation Effects 0.000 description 3
- 238000007112 amidation reaction Methods 0.000 description 3
- 229940035674 anesthetics Drugs 0.000 description 3
- 239000002585 base Substances 0.000 description 3
- 229960003150 bupivacaine Drugs 0.000 description 3
- 230000015556 catabolic process Effects 0.000 description 3
- 229960002023 chloroprocaine Drugs 0.000 description 3
- VDANGULDQQJODZ-UHFFFAOYSA-N chloroprocaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1Cl VDANGULDQQJODZ-UHFFFAOYSA-N 0.000 description 3
- 229960003920 cocaine Drugs 0.000 description 3
- 230000008878 coupling Effects 0.000 description 3
- 238000010168 coupling process Methods 0.000 description 3
- 238000005859 coupling reaction Methods 0.000 description 3
- 238000006731 degradation reaction Methods 0.000 description 3
- 230000018044 dehydration Effects 0.000 description 3
- 238000006297 dehydration reaction Methods 0.000 description 3
- AFOSIXZFDONLBT-UHFFFAOYSA-N divinyl sulfone Chemical class C=CS(=O)(=O)C=C AFOSIXZFDONLBT-UHFFFAOYSA-N 0.000 description 3
- 239000003814 drug Substances 0.000 description 3
- 230000000694 effects Effects 0.000 description 3
- 229940088598 enzyme Drugs 0.000 description 3
- 230000032050 esterification Effects 0.000 description 3
- 238000005886 esterification reaction Methods 0.000 description 3
- 239000000835 fiber Substances 0.000 description 3
- 238000007710 freezing Methods 0.000 description 3
- 230000008014 freezing Effects 0.000 description 3
- 230000006870 function Effects 0.000 description 3
- 239000003102 growth factor Substances 0.000 description 3
- 150000002402 hexoses Chemical class 0.000 description 3
- 230000036571 hydration Effects 0.000 description 3
- 238000006703 hydration reaction Methods 0.000 description 3
- XPXMKIXDFWLRAA-UHFFFAOYSA-N hydrazinide Chemical compound [NH-]N XPXMKIXDFWLRAA-UHFFFAOYSA-N 0.000 description 3
- 229960004716 idoxuridine Drugs 0.000 description 3
- 230000000670 limiting effect Effects 0.000 description 3
- 239000011777 magnesium Substances 0.000 description 3
- 229910052749 magnesium Inorganic materials 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 230000037311 normal skin Effects 0.000 description 3
- XYJRXVWERLGGKC-UHFFFAOYSA-D pentacalcium;hydroxide;triphosphate Chemical compound [OH-].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O XYJRXVWERLGGKC-UHFFFAOYSA-D 0.000 description 3
- 239000008363 phosphate buffer Substances 0.000 description 3
- 230000000704 physical effect Effects 0.000 description 3
- 229960001045 piperocaine Drugs 0.000 description 3
- 239000011148 porous material Substances 0.000 description 3
- 239000003755 preservative agent Substances 0.000 description 3
- 230000035755 proliferation Effects 0.000 description 3
- OVARTBFNCCXQKS-UHFFFAOYSA-N propan-2-one;hydrate Chemical compound O.CC(C)=O OVARTBFNCCXQKS-UHFFFAOYSA-N 0.000 description 3
- 229960003981 proparacaine Drugs 0.000 description 3
- 229960001549 ropivacaine Drugs 0.000 description 3
- 238000007665 sagging Methods 0.000 description 3
- 230000037370 skin discoloration Effects 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 239000002904 solvent Substances 0.000 description 3
- 238000013268 sustained release Methods 0.000 description 3
- 239000012730 sustained-release form Substances 0.000 description 3
- 229960002372 tetracaine Drugs 0.000 description 3
- GKCBAIGFKIBETG-UHFFFAOYSA-N tetracaine Chemical compound CCCCNC1=CC=C(C(=O)OCCN(C)C)C=C1 GKCBAIGFKIBETG-UHFFFAOYSA-N 0.000 description 3
- 210000000689 upper leg Anatomy 0.000 description 3
- 150000003722 vitamin derivatives Chemical class 0.000 description 3
- IAJILQKETJEXLJ-KLVWXMOXSA-N (2s,3r,4r,5r)-2,3,4,5-tetrahydroxy-6-oxohexanoic acid Chemical compound O=C[C@H](O)[C@H](O)[C@@H](O)[C@H](O)C(O)=O IAJILQKETJEXLJ-KLVWXMOXSA-N 0.000 description 2
- GVJHHUAWPYXKBD-UHFFFAOYSA-N (±)-α-Tocopherol Chemical compound OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 2
- WZSPWMATVLBWRS-UHFFFAOYSA-N 2-(diethylamino)-n-(2,6-dimethylphenyl)acetamide;n-(2-methylphenyl)-2-(propylamino)propanamide Chemical compound CCCNC(C)C(=O)NC1=CC=CC=C1C.CCN(CC)CC(=O)NC1=C(C)C=CC=C1C WZSPWMATVLBWRS-UHFFFAOYSA-N 0.000 description 2
- PLDLPVSQYMQDBL-UHFFFAOYSA-N 2-[[3-(oxiran-2-ylmethoxy)-2,2-bis(oxiran-2-ylmethoxymethyl)propoxy]methyl]oxirane Chemical compound C1OC1COCC(COCC1OC1)(COCC1OC1)COCC1CO1 PLDLPVSQYMQDBL-UHFFFAOYSA-N 0.000 description 2
- KUQZVISZELWDNZ-UHFFFAOYSA-N 3-aminopropyl dihydrogen phosphate Chemical compound NCCCOP(O)(O)=O KUQZVISZELWDNZ-UHFFFAOYSA-N 0.000 description 2
- 229920000936 Agarose Polymers 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- QTGIAADRBBLJGA-UHFFFAOYSA-N Articaine Chemical compound CCCNC(C)C(=O)NC=1C(C)=CSC=1C(=O)OC QTGIAADRBBLJGA-UHFFFAOYSA-N 0.000 description 2
- 206010003694 Atrophy Diseases 0.000 description 2
- 102000016938 Catalase Human genes 0.000 description 2
- 108010053835 Catalase Proteins 0.000 description 2
- 208000032544 Cicatrix Diseases 0.000 description 2
- VTUSIVBDOCDNHS-UHFFFAOYSA-N Etidocaine Chemical compound CCCN(CC)C(CC)C(=O)NC1=C(C)C=CC=C1C VTUSIVBDOCDNHS-UHFFFAOYSA-N 0.000 description 2
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 2
- IWYRWIUNAVNFPE-UHFFFAOYSA-N Glycidaldehyde Chemical compound O=CC1CO1 IWYRWIUNAVNFPE-UHFFFAOYSA-N 0.000 description 2
- 101000934372 Homo sapiens Macrosialin Proteins 0.000 description 2
- 206010021639 Incontinence Diseases 0.000 description 2
- MIJPAVRNWPDMOR-ZAFYKAAXSA-N L-ascorbic acid 2-phosphate Chemical compound OC[C@H](O)[C@H]1OC(=O)C(OP(O)(O)=O)=C1O MIJPAVRNWPDMOR-ZAFYKAAXSA-N 0.000 description 2
- XDBMXUKHMOFBPJ-ZAFYKAAXSA-N L-ascorbic acid 2-sulfate Chemical compound OC[C@H](O)[C@H]1OC(=O)C(OS(O)(=O)=O)=C1O XDBMXUKHMOFBPJ-ZAFYKAAXSA-N 0.000 description 2
- QAQJMLQRFWZOBN-LAUBAEHRSA-N L-ascorbyl-6-palmitate Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](O)[C@H]1OC(=O)C(O)=C1O QAQJMLQRFWZOBN-LAUBAEHRSA-N 0.000 description 2
- 239000011786 L-ascorbyl-6-palmitate Substances 0.000 description 2
- 102100025136 Macrosialin Human genes 0.000 description 2
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- QPCDCPDFJACHGM-UHFFFAOYSA-N N,N-bis{2-[bis(carboxymethyl)amino]ethyl}glycine Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(=O)O)CCN(CC(O)=O)CC(O)=O QPCDCPDFJACHGM-UHFFFAOYSA-N 0.000 description 2
- OVRNDRQMDRJTHS-CBQIKETKSA-N N-Acetyl-D-Galactosamine Chemical compound CC(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@H](O)[C@@H]1O OVRNDRQMDRJTHS-CBQIKETKSA-N 0.000 description 2
- UEEJHVSXFDXPFK-UHFFFAOYSA-N N-dimethylaminoethanol Chemical compound CN(C)CCO UEEJHVSXFDXPFK-UHFFFAOYSA-N 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 2
- CAJIGINSTLKQMM-UHFFFAOYSA-N Propoxycaine Chemical compound CCCOC1=CC(N)=CC=C1C(=O)OCCN(CC)CC CAJIGINSTLKQMM-UHFFFAOYSA-N 0.000 description 2
- 229920002385 Sodium hyaluronate Polymers 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 229920001492 Tholin Polymers 0.000 description 2
- 102000009618 Transforming Growth Factors Human genes 0.000 description 2
- 108010009583 Transforming Growth Factors Proteins 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 150000001412 amines Chemical group 0.000 description 2
- 229940121363 anti-inflammatory agent Drugs 0.000 description 2
- 239000002260 anti-inflammatory agent Substances 0.000 description 2
- 235000006708 antioxidants Nutrition 0.000 description 2
- 229960003831 articaine Drugs 0.000 description 2
- 235000010385 ascorbyl palmitate Nutrition 0.000 description 2
- 230000037444 atrophy Effects 0.000 description 2
- BLFLLBZGZJTVJG-UHFFFAOYSA-N benzocaine Chemical compound CCOC(=O)C1=CC=C(N)C=C1 BLFLLBZGZJTVJG-UHFFFAOYSA-N 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 229920000249 biocompatible polymer Polymers 0.000 description 2
- VYLDEYYOISNGST-UHFFFAOYSA-N bissulfosuccinimidyl suberate Chemical compound O=C1C(S(=O)(=O)O)CC(=O)N1OC(=O)CCCCCCC(=O)ON1C(=O)C(S(O)(=O)=O)CC1=O VYLDEYYOISNGST-UHFFFAOYSA-N 0.000 description 2
- 210000000481 breast Anatomy 0.000 description 2
- 159000000007 calcium salts Chemical class 0.000 description 2
- 230000006037 cell lysis Effects 0.000 description 2
- 210000000170 cell membrane Anatomy 0.000 description 2
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 2
- PUFQVTATUTYEAL-UHFFFAOYSA-N cinchocaine Chemical compound C1=CC=CC2=NC(OCCCC)=CC(C(=O)NCCN(CC)CC)=C21 PUFQVTATUTYEAL-UHFFFAOYSA-N 0.000 description 2
- 230000007012 clinical effect Effects 0.000 description 2
- 231100000263 cytotoxicity test Toxicity 0.000 description 2
- 229960002887 deanol Drugs 0.000 description 2
- 230000002939 deleterious effect Effects 0.000 description 2
- OWQIUQKMMPDHQQ-UHFFFAOYSA-N dimethocaine Chemical compound CCN(CC)CC(C)(C)COC(=O)C1=CC=C(N)C=C1 OWQIUQKMMPDHQQ-UHFFFAOYSA-N 0.000 description 2
- 229950010160 dimethocaine Drugs 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 230000008030 elimination Effects 0.000 description 2
- 238000003379 elimination reaction Methods 0.000 description 2
- 238000006266 etherification reaction Methods 0.000 description 2
- 229960003976 etidocaine Drugs 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 208000021302 gastroesophageal reflux disease Diseases 0.000 description 2
- 238000007490 hematoxylin and eosin (H&E) staining Methods 0.000 description 2
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 2
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 2
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 2
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 2
- 238000001727 in vivo Methods 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- AEMOLEFTQBMNLQ-CLQWQSTFSA-N l-iduronic acid Chemical compound O[C@H]1O[C@H](C(O)=O)[C@H](O)[C@@H](O)[C@@H]1O AEMOLEFTQBMNLQ-CLQWQSTFSA-N 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 229960004288 levobupivacaine Drugs 0.000 description 2
- LEBVLXFERQHONN-INIZCTEOSA-N levobupivacaine Chemical compound CCCCN1CCCC[C@H]1C(=O)NC1=C(C)C=CC=C1C LEBVLXFERQHONN-INIZCTEOSA-N 0.000 description 2
- 229940119319 lidocaine / prilocaine Drugs 0.000 description 2
- AGBQKNBQESQNJD-UHFFFAOYSA-N lipoic acid Chemical compound OC(=O)CCCCC1CCSS1 AGBQKNBQESQNJD-UHFFFAOYSA-N 0.000 description 2
- 230000005923 long-lasting effect Effects 0.000 description 2
- 229940078752 magnesium ascorbyl phosphate Drugs 0.000 description 2
- 238000011034 membrane dialysis Methods 0.000 description 2
- 229960002409 mepivacaine Drugs 0.000 description 2
- INWLQCZOYSRPNW-UHFFFAOYSA-N mepivacaine Chemical compound CN1CCCCC1C(=O)NC1=C(C)C=CC=C1C INWLQCZOYSRPNW-UHFFFAOYSA-N 0.000 description 2
- 238000000694 mesotherapy Methods 0.000 description 2
- VMGAPWLDMVPYIA-HIDZBRGKSA-N n'-amino-n-iminomethanimidamide Chemical compound N\N=C\N=N VMGAPWLDMVPYIA-HIDZBRGKSA-N 0.000 description 2
- 239000002674 ointment Substances 0.000 description 2
- 230000036407 pain Effects 0.000 description 2
- WXZMFSXDPGVJKK-UHFFFAOYSA-N pentaerythritol Chemical compound OCC(CO)(CO)CO WXZMFSXDPGVJKK-UHFFFAOYSA-N 0.000 description 2
- 230000002688 persistence Effects 0.000 description 2
- 230000035935 pregnancy Effects 0.000 description 2
- 229960001807 prilocaine Drugs 0.000 description 2
- MVFGUOIZUNYYSO-UHFFFAOYSA-N prilocaine Chemical compound CCCNC(C)C(=O)NC1=CC=CC=C1C MVFGUOIZUNYYSO-UHFFFAOYSA-N 0.000 description 2
- 229950003255 propoxycaine Drugs 0.000 description 2
- 102000004169 proteins and genes Human genes 0.000 description 2
- 108090000623 proteins and genes Proteins 0.000 description 2
- OYCGKECKIVYHTN-UHFFFAOYSA-N pyrrocaine Chemical compound CC1=CC=CC(C)=C1NC(=O)CN1CCCC1 OYCGKECKIVYHTN-UHFFFAOYSA-N 0.000 description 2
- 229950000332 pyrrocaine Drugs 0.000 description 2
- 238000004445 quantitative analysis Methods 0.000 description 2
- 239000000376 reactant Substances 0.000 description 2
- BOLDJAUMGUJJKM-LSDHHAIUSA-N renifolin D Natural products CC(=C)[C@@H]1Cc2c(O)c(O)ccc2[C@H]1CC(=O)c3ccc(O)cc3O BOLDJAUMGUJJKM-LSDHHAIUSA-N 0.000 description 2
- 230000000717 retained effect Effects 0.000 description 2
- 231100000241 scar Toxicity 0.000 description 2
- 230000037387 scars Effects 0.000 description 2
- 210000001732 sebaceous gland Anatomy 0.000 description 2
- 230000009759 skin aging Effects 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- 229940010747 sodium hyaluronate Drugs 0.000 description 2
- 239000001488 sodium phosphate Substances 0.000 description 2
- 229910000162 sodium phosphate Inorganic materials 0.000 description 2
- YWIVKILSMZOHHF-QJZPQSOGSA-N sodium;(2s,3s,4s,5r,6r)-6-[(2s,3r,4r,5s,6r)-3-acetamido-2-[(2s,3s,4r,5r,6r)-6-[(2r,3r,4r,5s,6r)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2- Chemical compound [Na+].CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 YWIVKILSMZOHHF-QJZPQSOGSA-N 0.000 description 2
- 238000004611 spectroscopical analysis Methods 0.000 description 2
- 238000001228 spectrum Methods 0.000 description 2
- 238000012453 sprague-dawley rat model Methods 0.000 description 2
- 238000010186 staining Methods 0.000 description 2
- 210000004003 subcutaneous fat Anatomy 0.000 description 2
- 230000002459 sustained effect Effects 0.000 description 2
- 210000000106 sweat gland Anatomy 0.000 description 2
- 208000011580 syndromic disease Diseases 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- 230000008719 thickening Effects 0.000 description 2
- 229960001295 tocopherol Drugs 0.000 description 2
- 239000011732 tocopherol Substances 0.000 description 2
- HTJNEBVCZXHBNJ-XCTPRCOBSA-H trimagnesium;(2r)-2-[(1s)-1,2-dihydroxyethyl]-3,4-dihydroxy-2h-furan-5-one;diphosphate Chemical compound [Mg+2].[Mg+2].[Mg+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O.OC[C@H](O)[C@H]1OC(=O)C(O)=C1O HTJNEBVCZXHBNJ-XCTPRCOBSA-H 0.000 description 2
- 229950002569 trimecaine Drugs 0.000 description 2
- GOZBHBFUQHMKQB-UHFFFAOYSA-N trimecaine Chemical compound CCN(CC)CC(=O)NC1=C(C)C=C(C)C=C1C GOZBHBFUQHMKQB-UHFFFAOYSA-N 0.000 description 2
- VBEQCZHXXJYVRD-GACYYNSASA-N uroanthelone Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CS)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(C)C)[C@@H](C)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)CNC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C1=CC=C(O)C=C1 VBEQCZHXXJYVRD-GACYYNSASA-N 0.000 description 2
- HZGRVVUQEIBCMS-HTRCEHHLSA-N (1s,5r)-8-methyl-8-azabicyclo[3.2.1]oct-3-ene-4-carboxylic acid Chemical compound C1C=C(C(O)=O)[C@H]2CC[C@@H]1N2C HZGRVVUQEIBCMS-HTRCEHHLSA-N 0.000 description 1
- DBSABEYSGXPBTA-RXSVEWSESA-N (2r)-2-[(1s)-1,2-dihydroxyethyl]-3,4-dihydroxy-2h-furan-5-one;phosphoric acid Chemical compound OP(O)(O)=O.OC[C@H](O)[C@H]1OC(=O)C(O)=C1O DBSABEYSGXPBTA-RXSVEWSESA-N 0.000 description 1
- HGKAMARNFGKMLC-MOPGFXCFSA-N (2r)-2-[(4r)-2,2-diphenyl-1,3-dioxolan-4-yl]piperidine Chemical compound C([C@@H]1[C@H]2OC(OC2)(C=2C=CC=CC=2)C=2C=CC=CC=2)CCCN1 HGKAMARNFGKMLC-MOPGFXCFSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- 0 *C1O[C@](C*C(C(OC2C(CO)O)=O)=C2O)C(*)=C[C@@]1(CO)O Chemical compound *C1O[C@](C*C(C(OC2C(CO)O)=O)=C2O)C(*)=C[C@@]1(CO)O 0.000 description 1
- JCIIKRHCWVHVFF-UHFFFAOYSA-N 1,2,4-thiadiazol-5-amine;hydrochloride Chemical compound Cl.NC1=NC=NS1 JCIIKRHCWVHVFF-UHFFFAOYSA-N 0.000 description 1
- LFKLPJRVSHJZPL-UHFFFAOYSA-N 1,2:7,8-diepoxyoctane Chemical compound C1OC1CCCCC1CO1 LFKLPJRVSHJZPL-UHFFFAOYSA-N 0.000 description 1
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimide Substances CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 1
- XPOWTVGPJVIVSX-UHFFFAOYSA-N 2-(3-aminopropoxymethyl)-2-(hydroxymethyl)propane-1,3-diol Chemical compound NCCCOCC(CO)(CO)CO XPOWTVGPJVIVSX-UHFFFAOYSA-N 0.000 description 1
- SXGZJKUKBWWHRA-UHFFFAOYSA-N 2-(N-morpholiniumyl)ethanesulfonate Chemical compound [O-]S(=O)(=O)CC[NH+]1CCOCC1 SXGZJKUKBWWHRA-UHFFFAOYSA-N 0.000 description 1
- ZLMQPGUWYWFPEG-UHFFFAOYSA-N 2-(diethylamino)ethyl 4-amino-2-butoxybenzoate Chemical compound CCCCOC1=CC(N)=CC=C1C(=O)OCCN(CC)CC ZLMQPGUWYWFPEG-UHFFFAOYSA-N 0.000 description 1
- PGMKGZOHRBZSSQ-UHFFFAOYSA-N 2-[2-(oxiran-2-ylmethoxy)ethenoxymethyl]oxirane Chemical group C1OC1COC=COCC1CO1 PGMKGZOHRBZSSQ-UHFFFAOYSA-N 0.000 description 1
- MSWZFWKMSRAUBD-GASJEMHNSA-N 2-amino-2-deoxy-D-galactopyranose Chemical compound N[C@H]1C(O)O[C@H](CO)[C@H](O)[C@@H]1O MSWZFWKMSRAUBD-GASJEMHNSA-N 0.000 description 1
- MSWZFWKMSRAUBD-IVMDWMLBSA-N 2-amino-2-deoxy-D-glucopyranose Chemical compound N[C@H]1C(O)O[C@H](CO)[C@@H](O)[C@@H]1O MSWZFWKMSRAUBD-IVMDWMLBSA-N 0.000 description 1
- IOZLWTIARGQJEJ-UHFFFAOYSA-N 3-[3-(3-aminopropoxy)-2,2-bis(3-aminopropoxymethyl)propoxy]propan-1-amine Chemical compound NCCCOCC(COCCCN)(COCCCN)COCCCN IOZLWTIARGQJEJ-UHFFFAOYSA-N 0.000 description 1
- LSDPXAFNWXPFER-UHFFFAOYSA-N 4-amino-2-(2-methylpropyl)benzoic acid Chemical compound CC(C)CC1=CC(N)=CC=C1C(O)=O LSDPXAFNWXPFER-UHFFFAOYSA-N 0.000 description 1
- XOBTWQWSFMZPNQ-UHFFFAOYSA-N 5-(oxiran-2-ylmethyl)-7-oxabicyclo[4.1.0]heptane Chemical compound C1CCC2OC2C1CC1CO1 XOBTWQWSFMZPNQ-UHFFFAOYSA-N 0.000 description 1
- 241000502561 Acacia irrorata Species 0.000 description 1
- 239000004261 Ascorbyl stearate Substances 0.000 description 1
- LITUBCVUXPBCGA-WMZHIEFXSA-N Ascorbyl stearate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC[C@H](O)[C@H]1OC(=O)C(O)=C1O LITUBCVUXPBCGA-WMZHIEFXSA-N 0.000 description 1
- 206010003591 Ataxia Diseases 0.000 description 1
- BTBUEUYNUDRHOZ-UHFFFAOYSA-N Borate Chemical compound [O-]B([O-])[O-] BTBUEUYNUDRHOZ-UHFFFAOYSA-N 0.000 description 1
- 206010006242 Breast enlargement Diseases 0.000 description 1
- 239000004255 Butylated hydroxyanisole Substances 0.000 description 1
- 239000004322 Butylated hydroxytoluene Substances 0.000 description 1
- NLZUEZXRPGMBCV-UHFFFAOYSA-N Butylhydroxytoluene Chemical compound CC1=CC(C(C)(C)C)=C(O)C(C(C)(C)C)=C1 NLZUEZXRPGMBCV-UHFFFAOYSA-N 0.000 description 1
- OKRJGUKZYSEUOY-UHFFFAOYSA-N CCCCNC(C)C Chemical compound CCCCNC(C)C OKRJGUKZYSEUOY-UHFFFAOYSA-N 0.000 description 1
- 208000035484 Cellulite Diseases 0.000 description 1
- 229920002101 Chitin Polymers 0.000 description 1
- 229920001661 Chitosan Polymers 0.000 description 1
- NMPOSNRHZIWLLL-XUWVNRHRSA-N Cocaethylene Chemical group O([C@H]1C[C@@H]2CC[C@@H](N2C)[C@H]1C(=O)OCC)C(=O)C1=CC=CC=C1 NMPOSNRHZIWLLL-XUWVNRHRSA-N 0.000 description 1
- 101710088194 Dehydrogenase Proteins 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- ZNZYKNKBJPZETN-WELNAUFTSA-N Dialdehyde 11678 Chemical compound N1C2=CC=CC=C2C2=C1[C@H](C[C@H](/C(=C/O)C(=O)OC)[C@@H](C=C)C=O)NCC2 ZNZYKNKBJPZETN-WELNAUFTSA-N 0.000 description 1
- 229940019097 EMLA Drugs 0.000 description 1
- 102400001368 Epidermal growth factor Human genes 0.000 description 1
- 101800003838 Epidermal growth factor Proteins 0.000 description 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 1
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 1
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 1
- 208000034347 Faecal incontinence Diseases 0.000 description 1
- 206010016717 Fistula Diseases 0.000 description 1
- 102000001554 Hemoglobins Human genes 0.000 description 1
- 108010054147 Hemoglobins Proteins 0.000 description 1
- DKLKMKYDWHYZTD-UHFFFAOYSA-N Hexylcaine Chemical compound C=1C=CC=CC=1C(=O)OC(C)CNC1CCCCC1 DKLKMKYDWHYZTD-UHFFFAOYSA-N 0.000 description 1
- 108010003272 Hyaluronate lyase Proteins 0.000 description 1
- 102000001974 Hyaluronidases Human genes 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- PWKSKIMOESPYIA-BYPYZUCNSA-N L-N-acetyl-Cysteine Chemical compound CC(=O)N[C@@H](CS)C(O)=O PWKSKIMOESPYIA-BYPYZUCNSA-N 0.000 description 1
- 239000002211 L-ascorbic acid Substances 0.000 description 1
- 235000000069 L-ascorbic acid Nutrition 0.000 description 1
- 150000000996 L-ascorbic acids Chemical class 0.000 description 1
- AEMOLEFTQBMNLQ-HNFCZKTMSA-N L-idopyranuronic acid Chemical compound OC1O[C@@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O AEMOLEFTQBMNLQ-HNFCZKTMSA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- 108010085895 Laminin Proteins 0.000 description 1
- 208000032912 Local swelling Diseases 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 231100000002 MTT assay Toxicity 0.000 description 1
- 238000000134 MTT assay Methods 0.000 description 1
- 239000012901 Milli-Q water Substances 0.000 description 1
- SQVRNKJHWKZAKO-PFQGKNLYSA-N N-acetyl-beta-neuraminic acid Chemical compound CC(=O)N[C@@H]1[C@@H](O)C[C@@](O)(C(O)=O)O[C@H]1[C@H](O)[C@H](O)CO SQVRNKJHWKZAKO-PFQGKNLYSA-N 0.000 description 1
- YUGZHQHSNYIFLG-UHFFFAOYSA-N N-phenylcarbamic acid [2-[anilino(oxo)methoxy]-3-(1-piperidinyl)propyl] ester Chemical compound C1CCCCN1CC(OC(=O)NC=1C=CC=CC=1)COC(=O)NC1=CC=CC=C1 YUGZHQHSNYIFLG-UHFFFAOYSA-N 0.000 description 1
- VNQABZCSYCTZMS-UHFFFAOYSA-N Orthoform Chemical compound COC(=O)C1=CC=C(O)C(N)=C1 VNQABZCSYCTZMS-UHFFFAOYSA-N 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 206010049752 Peau d'orange Diseases 0.000 description 1
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 1
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 1
- 229920002845 Poly(methacrylic acid) Polymers 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 108010039918 Polylysine Proteins 0.000 description 1
- 206010063493 Premature ageing Diseases 0.000 description 1
- 208000032038 Premature aging Diseases 0.000 description 1
- 108010050808 Procollagen Proteins 0.000 description 1
- 208000003251 Pruritus Diseases 0.000 description 1
- 238000001604 Rao's score test Methods 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 229920002125 Sokalan® Polymers 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- FDMBBCOBEAVDAO-UHFFFAOYSA-N Stovaine Chemical compound CN(C)CC(C)(CC)OC(=O)C1=CC=CC=C1 FDMBBCOBEAVDAO-UHFFFAOYSA-N 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- 206010042682 Swelling face Diseases 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 206010046543 Urinary incontinence Diseases 0.000 description 1
- FPIPGXGPPPQFEQ-BOOMUCAASA-N Vitamin A Natural products OC/C=C(/C)\C=C\C=C(\C)/C=C/C1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-BOOMUCAASA-N 0.000 description 1
- 229930003270 Vitamin B Natural products 0.000 description 1
- 229930003316 Vitamin D Natural products 0.000 description 1
- QYSXJUFSXHHAJI-XFEUOLMDSA-N Vitamin D3 Natural products C1(/[C@@H]2CC[C@@H]([C@]2(CCC1)C)[C@H](C)CCCC(C)C)=C/C=C1\C[C@@H](O)CCC1=C QYSXJUFSXHHAJI-XFEUOLMDSA-N 0.000 description 1
- 229930003427 Vitamin E Natural products 0.000 description 1
- 208000027418 Wounds and injury Diseases 0.000 description 1
- RFPVXZWXDPIKSD-UHFFFAOYSA-N [2-(diethylamino)-4-methylpentyl] 4-aminobenzoate;methanesulfonic acid Chemical compound CS(O)(=O)=O.CCN(CC)C(CC(C)C)COC(=O)C1=CC=C(N)C=C1 RFPVXZWXDPIKSD-UHFFFAOYSA-N 0.000 description 1
- 210000001015 abdomen Anatomy 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 239000008351 acetate buffer Substances 0.000 description 1
- 235000011054 acetic acid Nutrition 0.000 description 1
- 229960004308 acetylcysteine Drugs 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- IBVAQQYNSHJXBV-UHFFFAOYSA-N adipic acid dihydrazide Chemical compound NNC(=O)CCCCC(=O)NN IBVAQQYNSHJXBV-UHFFFAOYSA-N 0.000 description 1
- 210000001789 adipocyte Anatomy 0.000 description 1
- IAJILQKETJEXLJ-QTBDOELSSA-N aldehydo-D-glucuronic acid Chemical compound O=C[C@H](O)[C@@H](O)[C@H](O)[C@H](O)C(O)=O IAJILQKETJEXLJ-QTBDOELSSA-N 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- WQZGKKKJIJFFOK-PHYPRBDBSA-N alpha-D-galactose Chemical compound OC[C@H]1O[C@H](O)[C@H](O)[C@@H](O)[C@H]1O WQZGKKKJIJFFOK-PHYPRBDBSA-N 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 229950008211 ambucaine Drugs 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 229960000806 amylocaine Drugs 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 125000000129 anionic group Chemical group 0.000 description 1
- 239000000058 anti acne agent Substances 0.000 description 1
- 229940124340 antiacne agent Drugs 0.000 description 1
- 229940030225 antihemorrhagics Drugs 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 238000000149 argon plasma sintering Methods 0.000 description 1
- 235000019276 ascorbyl stearate Nutrition 0.000 description 1
- 230000003416 augmentation Effects 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 210000000270 basal cell Anatomy 0.000 description 1
- 229960000686 benzalkonium chloride Drugs 0.000 description 1
- 229960005274 benzocaine Drugs 0.000 description 1
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-FPRJBGLDSA-N beta-D-galactose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@H]1O WQZGKKKJIJFFOK-FPRJBGLDSA-N 0.000 description 1
- SQVRNKJHWKZAKO-UHFFFAOYSA-N beta-N-Acetyl-D-neuraminic acid Natural products CC(=O)NC1C(O)CC(O)(C(O)=O)OC1C(O)C(O)CO SQVRNKJHWKZAKO-UHFFFAOYSA-N 0.000 description 1
- 229950005028 betoxycaine Drugs 0.000 description 1
- CXYOBRKOFHQONJ-UHFFFAOYSA-N betoxycaine Chemical compound CCCCOC1=CC=C(C(=O)OCCOCCN(CC)CC)C=C1N CXYOBRKOFHQONJ-UHFFFAOYSA-N 0.000 description 1
- 230000000975 bioactive effect Effects 0.000 description 1
- 238000012925 biological evaluation Methods 0.000 description 1
- 210000000988 bone and bone Anatomy 0.000 description 1
- 230000008195 breast development Effects 0.000 description 1
- 208000030270 breast disease Diseases 0.000 description 1
- 239000007975 buffered saline Substances 0.000 description 1
- 238000009933 burial Methods 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 210000001217 buttock Anatomy 0.000 description 1
- 235000019282 butylated hydroxyanisole Nutrition 0.000 description 1
- 229940043253 butylated hydroxyanisole Drugs 0.000 description 1
- CZBZUDVBLSSABA-UHFFFAOYSA-N butylated hydroxyanisole Chemical compound COC1=CC=C(O)C(C(C)(C)C)=C1.COC1=CC=C(O)C=C1C(C)(C)C CZBZUDVBLSSABA-UHFFFAOYSA-N 0.000 description 1
- 235000010354 butylated hydroxytoluene Nutrition 0.000 description 1
- 229940095259 butylated hydroxytoluene Drugs 0.000 description 1
- 244000309466 calf Species 0.000 description 1
- 238000011088 calibration curve Methods 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 210000000845 cartilage Anatomy 0.000 description 1
- 229940105657 catalase Drugs 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 230000005779 cell damage Effects 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 210000000038 chest Anatomy 0.000 description 1
- 229960004926 chlorobutanol Drugs 0.000 description 1
- KXKPYJOVDUMHGS-OSRGNVMNSA-N chondroitin sulfate Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](OS(O)(=O)=O)[C@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](C(O)=O)O1 KXKPYJOVDUMHGS-OSRGNVMNSA-N 0.000 description 1
- 229960001747 cinchocaine Drugs 0.000 description 1
- 239000007979 citrate buffer Substances 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 239000003245 coal Substances 0.000 description 1
- 238000004737 colorimetric analysis Methods 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 230000006835 compression Effects 0.000 description 1
- 238000007906 compression Methods 0.000 description 1
- 230000008602 contraction Effects 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 238000012937 correction Methods 0.000 description 1
- 239000007822 coupling agent Substances 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 239000011243 crosslinked material Substances 0.000 description 1
- 230000001351 cycling effect Effects 0.000 description 1
- 238000013016 damping Methods 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- 150000004985 diamines Chemical class 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- GYZLOYUZLJXAJU-UHFFFAOYSA-N diglycidyl ether Chemical class C1OC1COCC1CO1 GYZLOYUZLJXAJU-UHFFFAOYSA-N 0.000 description 1
- 239000000539 dimer Substances 0.000 description 1
- 229960002228 diperodon Drugs 0.000 description 1
- AMQDHYXCJCIBQJ-YCWPWOODSA-L disodium;[(2r)-2-[(1s)-1,2-dihydroxyethyl]-3-oxido-5-oxo-2h-furan-4-yl] sulfate Chemical compound [Na+].[Na+].OC[C@H](O)[C@H]1OC(=O)C(OS([O-])(=O)=O)=C1[O-] AMQDHYXCJCIBQJ-YCWPWOODSA-L 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 230000005489 elastic deformation Effects 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 229940116977 epidermal growth factor Drugs 0.000 description 1
- 210000002615 epidermis Anatomy 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 210000002744 extracellular matrix Anatomy 0.000 description 1
- 238000001125 extrusion Methods 0.000 description 1
- 239000004744 fabric Substances 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 239000003527 fibrinolytic agent Substances 0.000 description 1
- 230000003890 fistula Effects 0.000 description 1
- 210000000245 forearm Anatomy 0.000 description 1
- 239000012458 free base Substances 0.000 description 1
- 229930182830 galactose Natural products 0.000 description 1
- WIGCFUFOHFEKBI-UHFFFAOYSA-N gamma-tocopherol Natural products CC(C)CCCC(C)CCCC(C)CCCC1CCC2C(C)C(O)C(C)C(C)C2O1 WIGCFUFOHFEKBI-UHFFFAOYSA-N 0.000 description 1
- 210000004392 genitalia Anatomy 0.000 description 1
- 229960002442 glucosamine Drugs 0.000 description 1
- 229940097043 glucuronic acid Drugs 0.000 description 1
- 235000011187 glycerol Nutrition 0.000 description 1
- 238000000227 grinding Methods 0.000 description 1
- 210000004209 hair Anatomy 0.000 description 1
- 210000003780 hair follicle Anatomy 0.000 description 1
- 210000003128 head Anatomy 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 239000002874 hemostatic agent Substances 0.000 description 1
- 229960005388 hexylcaine Drugs 0.000 description 1
- 208000002557 hidradenitis Diseases 0.000 description 1
- 229920001903 high density polyethylene Polymers 0.000 description 1
- 239000004700 high-density polyethylene Substances 0.000 description 1
- 239000003906 humectant Substances 0.000 description 1
- 229960002773 hyaluronidase Drugs 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 1
- DHCUQNSUUYMFGX-UHFFFAOYSA-N hydroxytetracaine Chemical compound CCCCNC1=CC=C(C(=O)OCCN(C)C)C(O)=C1 DHCUQNSUUYMFGX-UHFFFAOYSA-N 0.000 description 1
- 229950000638 hydroxytetracaine Drugs 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 210000004969 inflammatory cell Anatomy 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 238000009413 insulation Methods 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 230000001788 irregular Effects 0.000 description 1
- 239000002973 irritant agent Substances 0.000 description 1
- 239000007951 isotonicity adjuster Substances 0.000 description 1
- 210000002510 keratinocyte Anatomy 0.000 description 1
- 239000003410 keratolytic agent Substances 0.000 description 1
- 210000003127 knee Anatomy 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 210000001821 langerhans cell Anatomy 0.000 description 1
- 239000004816 latex Substances 0.000 description 1
- 229920000126 latex Polymers 0.000 description 1
- 229950003548 levoxadrol Drugs 0.000 description 1
- 235000019136 lipoic acid Nutrition 0.000 description 1
- 238000002690 local anesthesia Methods 0.000 description 1
- 150000004668 long chain fatty acids Chemical class 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 206010025135 lupus erythematosus Diseases 0.000 description 1
- 210000001365 lymphatic vessel Anatomy 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 159000000003 magnesium salts Chemical class 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 210000000412 mechanoreceptor Anatomy 0.000 description 1
- 108091008704 mechanoreceptors Proteins 0.000 description 1
- 210000002752 melanocyte Anatomy 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 210000000716 merkel cell Anatomy 0.000 description 1
- KPNBUPJZFJCCIQ-LURJTMIESA-N methyl L-lysinate Chemical compound COC(=O)[C@@H](N)CCCCN KPNBUPJZFJCCIQ-LURJTMIESA-N 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 230000003278 mimic effect Effects 0.000 description 1
- 230000000116 mitigating effect Effects 0.000 description 1
- 230000002297 mitogenic effect Effects 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- BZRYYBWNOUALTQ-HOTGVXAUSA-N myrtecaine Chemical compound CCN(CC)CCOCCC1=CC[C@@H]2C(C)(C)[C@H]1C2 BZRYYBWNOUALTQ-HOTGVXAUSA-N 0.000 description 1
- 229960000739 myrtecaine Drugs 0.000 description 1
- 229950006780 n-acetylglucosamine Drugs 0.000 description 1
- IYFWKMMMFIDAQJ-UHFFFAOYSA-N n-ethyl-n'-[6-(ethyliminomethylideneamino)hexyl]methanediimine Chemical compound CCN=C=NCCCCCCN=C=NCC IYFWKMMMFIDAQJ-UHFFFAOYSA-N 0.000 description 1
- 239000013642 negative control Substances 0.000 description 1
- 230000009707 neogenesis Effects 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 210000001640 nerve ending Anatomy 0.000 description 1
- 230000001537 neural effect Effects 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 230000003472 neutralizing effect Effects 0.000 description 1
- 229940053973 novocaine Drugs 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- HKOURKRGAFKVFP-UHFFFAOYSA-N octacaine Chemical compound CCN(CC)C(C)CC(=O)NC1=CC=CC=C1 HKOURKRGAFKVFP-UHFFFAOYSA-N 0.000 description 1
- 229950009333 octacaine Drugs 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 230000008520 organization Effects 0.000 description 1
- 229950006098 orthocaine Drugs 0.000 description 1
- 229960003502 oxybuprocaine Drugs 0.000 description 1
- CMHHMUWAYWTMGS-UHFFFAOYSA-N oxybuprocaine Chemical compound CCCCOC1=CC(C(=O)OCCN(CC)CC)=CC=C1N CMHHMUWAYWTMGS-UHFFFAOYSA-N 0.000 description 1
- 238000012856 packing Methods 0.000 description 1
- OWWVHQUOYSPNNE-UHFFFAOYSA-N parethoxycaine Chemical compound CCOC1=CC=C(C(=O)OCCN(CC)CC)C=C1 OWWVHQUOYSPNNE-UHFFFAOYSA-N 0.000 description 1
- 229960003899 parethoxycaine Drugs 0.000 description 1
- 239000006072 paste Substances 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 230000003285 pharmacodynamic effect Effects 0.000 description 1
- QXDAEKSDNVPFJG-UHFFFAOYSA-N phenacaine Chemical compound C1=CC(OCC)=CC=C1N\C(C)=N\C1=CC=C(OCC)C=C1 QXDAEKSDNVPFJG-UHFFFAOYSA-N 0.000 description 1
- 229950007049 phenacaine Drugs 0.000 description 1
- 229960003742 phenol Drugs 0.000 description 1
- 229940096826 phenylmercuric acetate Drugs 0.000 description 1
- PDTFCHSETJBPTR-UHFFFAOYSA-N phenylmercuric nitrate Chemical compound [O-][N+](=O)O[Hg]C1=CC=CC=C1 PDTFCHSETJBPTR-UHFFFAOYSA-N 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 230000019612 pigmentation Effects 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 229920000083 poly(allylamine) Polymers 0.000 description 1
- 229920002401 polyacrylamide Polymers 0.000 description 1
- 239000004584 polyacrylic acid Substances 0.000 description 1
- 229920000768 polyamine Polymers 0.000 description 1
- 229920000656 polylysine Polymers 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 229920001184 polypeptide Polymers 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 239000013641 positive control Substances 0.000 description 1
- 239000001103 potassium chloride Substances 0.000 description 1
- 235000011164 potassium chloride Nutrition 0.000 description 1
- 159000000001 potassium salts Chemical class 0.000 description 1
- 230000000750 progressive effect Effects 0.000 description 1
- STHAHFPLLHRRRO-UHFFFAOYSA-N propipocaine Chemical compound C1=CC(OCCC)=CC=C1C(=O)CCN1CCCCC1 STHAHFPLLHRRRO-UHFFFAOYSA-N 0.000 description 1
- 229950011219 propipocaine Drugs 0.000 description 1
- 125000002572 propoxy group Chemical group [*]OC([H])([H])C(C([H])([H])[H])([H])[H] 0.000 description 1
- 239000003586 protic polar solvent Substances 0.000 description 1
- 239000002516 radical scavenger Substances 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 238000007634 remodeling Methods 0.000 description 1
- 125000002523 retinol group Chemical group 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- CQRYARSYNCAZFO-UHFFFAOYSA-N salicyl alcohol Chemical compound OCC1=CC=CC=C1O CQRYARSYNCAZFO-UHFFFAOYSA-N 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 230000035807 sensation Effects 0.000 description 1
- 239000002356 single layer Substances 0.000 description 1
- 238000004513 sizing Methods 0.000 description 1
- 230000037075 skin appearance Effects 0.000 description 1
- 210000004927 skin cell Anatomy 0.000 description 1
- 230000037067 skin hydration Effects 0.000 description 1
- 239000002002 slurry Substances 0.000 description 1
- 230000000391 smoking effect Effects 0.000 description 1
- HRZFUMHJMZEROT-UHFFFAOYSA-L sodium disulfite Chemical compound [Na+].[Na+].[O-]S(=O)S([O-])(=O)=O HRZFUMHJMZEROT-UHFFFAOYSA-L 0.000 description 1
- 229940001584 sodium metabisulfite Drugs 0.000 description 1
- 235000010262 sodium metabisulphite Nutrition 0.000 description 1
- 159000000000 sodium salts Chemical class 0.000 description 1
- AKHNMLFCWUSKQB-UHFFFAOYSA-L sodium thiosulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=S AKHNMLFCWUSKQB-UHFFFAOYSA-L 0.000 description 1
- 229940001474 sodium thiosulfate Drugs 0.000 description 1
- 235000019345 sodium thiosulphate Nutrition 0.000 description 1
- PPASLZSBLFJQEF-RXSVEWSESA-M sodium-L-ascorbate Chemical compound [Na+].OC[C@H](O)[C@H]1OC(=O)C(O)=C1[O-] PPASLZSBLFJQEF-RXSVEWSESA-M 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 210000005070 sphincter Anatomy 0.000 description 1
- 238000013223 sprague-dawley female rat Methods 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 230000035882 stress Effects 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 230000036561 sun exposure Effects 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 229920001059 synthetic polymer Polymers 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- RTKIYNMVFMVABJ-UHFFFAOYSA-L thimerosal Chemical compound [Na+].CC[Hg]SC1=CC=CC=C1C([O-])=O RTKIYNMVFMVABJ-UHFFFAOYSA-L 0.000 description 1
- 229940033663 thimerosal Drugs 0.000 description 1
- 229960002663 thioctic acid Drugs 0.000 description 1
- 230000017423 tissue regeneration Effects 0.000 description 1
- 229950006609 tolycaine Drugs 0.000 description 1
- UDKICLZCJWQTLS-UHFFFAOYSA-N tolycaine Chemical compound CCN(CC)CC(=O)NC1=C(C)C=CC=C1C(=O)OC UDKICLZCJWQTLS-UHFFFAOYSA-N 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 239000012780 transparent material Substances 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 239000005526 vasoconstrictor agent Substances 0.000 description 1
- 229940124549 vasodilator Drugs 0.000 description 1
- 239000003071 vasodilator agent Substances 0.000 description 1
- 239000008154 viscoelastic solution Substances 0.000 description 1
- 235000019155 vitamin A Nutrition 0.000 description 1
- 239000011719 vitamin A Substances 0.000 description 1
- 239000011720 vitamin B Substances 0.000 description 1
- 235000019156 vitamin B Nutrition 0.000 description 1
- 235000019166 vitamin D Nutrition 0.000 description 1
- 239000011710 vitamin D Substances 0.000 description 1
- 150000003710 vitamin D derivatives Chemical class 0.000 description 1
- 235000019165 vitamin E Nutrition 0.000 description 1
- 239000011709 vitamin E Substances 0.000 description 1
- 229940046009 vitamin E Drugs 0.000 description 1
- 229940045997 vitamin a Drugs 0.000 description 1
- 229940046008 vitamin d Drugs 0.000 description 1
- 230000004584 weight gain Effects 0.000 description 1
- 235000019786 weight gain Nutrition 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 229960003434 xenysalate Drugs 0.000 description 1
- HLDCSYXMVXILQC-UHFFFAOYSA-N xenysalate Chemical compound CCN(CC)CCOC(=O)C1=CC=CC(C=2C=CC=CC=2)=C1O HLDCSYXMVXILQC-UHFFFAOYSA-N 0.000 description 1
- 229950006211 zolamine Drugs 0.000 description 1
- KYBJXENQEZJILU-UHFFFAOYSA-N zolamine Chemical compound C1=CC(OC)=CC=C1CN(CCN(C)C)C1=NC=CS1 KYBJXENQEZJILU-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/14—Macromolecular materials
- A61L27/20—Polysaccharides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/54—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound
- A61K47/545—Heterocyclic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K8/00—Cosmetics or similar toiletry preparations
- A61K8/18—Cosmetics or similar toiletry preparations characterised by the composition
- A61K8/30—Cosmetics or similar toiletry preparations characterised by the composition containing organic compounds
- A61K8/67—Vitamins
- A61K8/676—Ascorbic acid, i.e. vitamin C
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K8/00—Cosmetics or similar toiletry preparations
- A61K8/18—Cosmetics or similar toiletry preparations characterised by the composition
- A61K8/72—Cosmetics or similar toiletry preparations characterised by the composition containing organic macromolecular compounds
- A61K8/73—Polysaccharides
- A61K8/735—Mucopolysaccharides, e.g. hyaluronic acid; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L27/505—Stabilizers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L27/54—Biologically active materials, e.g. therapeutic substances
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61Q—SPECIFIC USE OF COSMETICS OR SIMILAR TOILETRY PREPARATIONS
- A61Q19/00—Preparations for care of the skin
- A61Q19/08—Anti-ageing preparations
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08B—POLYSACCHARIDES; DERIVATIVES THEREOF
- C08B37/00—Preparation of polysaccharides not provided for in groups C08B1/00 - C08B35/00; Derivatives thereof
- C08B37/006—Heteroglycans, i.e. polysaccharides having more than one sugar residue in the main chain in either alternating or less regular sequence; Gellans; Succinoglycans; Arabinogalactans; Tragacanth or gum tragacanth or traganth from Astragalus; Gum Karaya from Sterculia urens; Gum Ghatti from Anogeissus latifolia; Derivatives thereof
- C08B37/0063—Glycosaminoglycans or mucopolysaccharides, e.g. keratan sulfate; Derivatives thereof, e.g. fucoidan
- C08B37/0072—Hyaluronic acid, i.e. HA or hyaluronan; Derivatives thereof, e.g. crosslinked hyaluronic acid (hylan) or hyaluronates
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08J—WORKING-UP; GENERAL PROCESSES OF COMPOUNDING; AFTER-TREATMENT NOT COVERED BY SUBCLASSES C08B, C08C, C08F, C08G or C08H
- C08J3/00—Processes of treating or compounding macromolecular substances
- C08J3/24—Crosslinking, e.g. vulcanising, of macromolecules
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L5/00—Compositions of polysaccharides or of their derivatives not provided for in groups C08L1/00 or C08L3/00
- C08L5/08—Chitin; Chondroitin sulfate; Hyaluronic acid; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2800/00—Properties of cosmetic compositions or active ingredients thereof or formulation aids used therein and process related aspects
- A61K2800/80—Process related aspects concerning the preparation of the cosmetic composition or the storage or application thereof
- A61K2800/91—Injection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/40—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a specific therapeutic activity or mode of action
- A61L2300/402—Anaestetics, analgesics, e.g. lidocaine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/40—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a specific therapeutic activity or mode of action
- A61L2300/428—Vitamins, e.g. tocopherol, riboflavin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2400/00—Materials characterised by their function or physical properties
- A61L2400/06—Flowable or injectable implant compositions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2430/00—Materials or treatment for tissue regeneration
- A61L2430/34—Materials or treatment for tissue regeneration for soft tissue reconstruction
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08J—WORKING-UP; GENERAL PROCESSES OF COMPOUNDING; AFTER-TREATMENT NOT COVERED BY SUBCLASSES C08B, C08C, C08F, C08G or C08H
- C08J2305/00—Characterised by the use of polysaccharides or of their derivatives not provided for in groups C08J2301/00 or C08J2303/00
- C08J2305/08—Chitin; Chondroitin sulfate; Hyaluronic acid; Derivatives thereof
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08J—WORKING-UP; GENERAL PROCESSES OF COMPOUNDING; AFTER-TREATMENT NOT COVERED BY SUBCLASSES C08B, C08C, C08F, C08G or C08H
- C08J3/00—Processes of treating or compounding macromolecular substances
- C08J3/02—Making solutions, dispersions, lattices or gels by other methods than by solution, emulsion or suspension polymerisation techniques
- C08J3/03—Making solutions, dispersions, lattices or gels by other methods than by solution, emulsion or suspension polymerisation techniques in aqueous media
- C08J3/075—Macromolecular gels
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Dermatology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Polymers & Plastics (AREA)
- Organic Chemistry (AREA)
- Birds (AREA)
- Transplantation (AREA)
- Engineering & Computer Science (AREA)
- Oral & Maxillofacial Surgery (AREA)
- Molecular Biology (AREA)
- Gerontology & Geriatric Medicine (AREA)
- Biochemistry (AREA)
- Materials Engineering (AREA)
- Biomedical Technology (AREA)
- Pharmacology & Pharmacy (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Materials For Medical Uses (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Description
本出願は、2011年9月14日に出願された米国仮特許出願第61/534,780号に対する優先権およびその便益を主張し、また2011年6月3日に出願された米国仮特許出願第61/493,309号に対する優先権およびその便益を主張する2012年6月1日に出願された米国特許出願第13/486,754号の一部継続である、2012年8月23日に出願された米国特許出願第13/593,313号の一部継続であり、これらの出願の各々の開示全体は、この具体的な参照によりその全体が本明細書に組み込まれる。
*ゲルのパラメータ:体積 0.1cc、濃度 24mg/mLに基づく。(0.1×24×3%×1000)/(338*0.1)=2.13(mM)
**仮定:
AsAは一定の速度で放出される。
AsAの有効な濃度は0.05mMであり、2日間超、有効性を維持する。2.13*2/(0.05*30)=2.8(ヶ月)
400.6mgの低分子量ヒアルロン酸(LMW HA)を、シリンジ中の1802mgの1重量%NaOH中で約30分間水和した。800.7mgのAA2G、続いて713.7mgのBDDE、および1416.8mgの10%NaOHをバイアル中に入れた。上記溶液(pH12超)を50℃の水浴中で約20分間反応させ、その後水和HAに添加した。その添加後、その混合物を、2つのシリンジ間を往復させることにより約20回混合した。その混合ペーストをバイアル中に入れ、50℃の水浴中に約2.5時間入れた。223.5mgの12M HClを9.05gのPBS(pH7.4)に添加した。約2.5時間後、HA‐AA2Gゲルが形成された。そのゲルを切断して断片にし、HCl‐PBS溶液をそれに添加した。そのゲルを中和させ、環状振騰器上で一晩膨潤させた。そのゲルを、約60μmスクリーンを通してサイズ調整し、2つのシリンジ間を往復させることにより約20回混合した。そのゲルを15,000MWCO RC透析バッグ中に入れ、PBS緩衝液(pH7.4)中で透析した。透析を、PBS緩衝液を頻繁に交換しながら約185時間続けた。透析後、そのゲルをシリンジ中に入れ、4℃の冷蔵庫内で貯蔵した。
実施例1に記載されるゲルの重量を透析直前、および透析後に書き留めた。そのゲルが透析後に約1g/mLであったと想定した。透析を、1LのPBS中で8時間超につき、顕著なAA2Gが出てこなくなった点で止めた。そのAA2Gを、UV/Vis分光光度計(Nanodrop 2000C、ThermoScientific)を用いて260nmで測定した。AA2Gの較正曲線を、2%HA中の異なる濃度のAA2Gを用いて計算した(260nmでの吸収=1.4838[AA2G(mM)])。
実施例1に記載されるゲル中のAA2G結合度は、14.7モル%である。
振動平行プレートレオメータ(Anton Paar,Physica MCR 301)を、実施例1で得られたゲルの特性を測定するために使用した。使用されたプレートの直径は25mmであった。そのプレート間のギャップを1mmに設定した。各測定について、一定の歪みでの周波数掃引を最初に、その後、固定周波数での歪み掃引を行った。G’(貯蔵弾性係数)を1%の歪みでの歪み掃引曲線から得た。そのゲルについてのその値は、1450Paである。
本手順は、実施例1に記載されるものと類似した。結合度は、架橋剤対HAおよびAA2Gモル比を調整することにより修正される。ゲル特性を、実施例3に記載されるように測定した。詳細は、以下の通りである:
400.3mgのLMW HAを、シリンジ中の3002.0mgの1%NaOH中で約30分間水和した。800.5mgのAA2G、続いて264.3mgのBDDE、および1100.0mgの10%NaOHをバイアル中に入れた。上記溶液(pH12超)を50℃の水浴中で約20分間反応させ、その後水和HAに添加した。その添加後、その混合物を、2つのシリンジ間を往復させることにより約20回混合した。その混合ペーストをバイアル中に入れ、50℃の水浴中に約2.5時間入れた。104.2mgの12M HClを8.5128gのPBS(pH7.4)に添加した。約2.5時間後、HA‐AA2Gゲルが形成され、HCl‐PBS溶液をそれに添加した。そのゲルを中和させ、環状振騰器上で週末にかけて(約55時間)膨潤させた。そのゲルを、約60μmスクリーンを通してサイズ調整し、2つのシリンジ間を往復させることにより約20回混合した。そのゲルを15,000MWCO RC透析バッグ中に入れ、PBS緩衝液(pH7.4)中で透析した。透析を、PBS緩衝液を頻繁に交換しながら約114時間続けた。透析後、そのゲルをシリンジ中に入れ、4℃の冷蔵庫内で貯蔵した。結合度およびゲル流体力学的特性を、実施例2および3に記載される手順で測定する。結合度は5.3%である。ゲル貯蔵弾性係数は約300Paである。
200.4mgのLMW HAを、シリンジ中の2000mgの1%NaOH中で約30分間水和した。400mgのAA2G、続いて312.7mgのstar‐PEGエポキシド、および1026.5mgの10%NaOHをバイアル中に入れた。上記溶液を50℃の水浴中で約20分間反応させ、その後水和HAに添加した。その添加後、その混合物を、2つのシリンジ間を往復させることにより約20回混合した。その混合ペーストをバイアル中に入れ、50℃の水浴中に約2.5時間入れた。187.4mgの12M HClを3.034gのPBS(pH7.4)に添加した。約2.5時間後、HA‐AA2Gゲルが形成され、HCl‐PBS溶液をそれに添加した。そのゲルを中和させ、環状振騰器上で週末にかけて(約68時間)膨潤させた。そのゲルを、約60μmスクリーンを通してサイズ調整し、2つのシリンジ間を往復させることにより約20回混合した。そのゲルを15,000MWCO RC透析バッグ中に入れ、PBS緩衝液(pH7.4)中で透析した。透析を、PBS緩衝液を頻繁に交換しながら約95時間続けた。透析後、そのゲルをシリンジ中に入れ、4℃の冷蔵庫内で貯蔵した。結合度およびゲル流体力学的特性を、実施例2および3に記載される手順で測定する。結合度は29.4%である。ゲル貯蔵弾性係数は約235Paである。
200.3mgのLMW HAを、シリンジ中の2000mgの1%NaOH中で約30分間水和した。400.2mgのAA2G、続いて313.4mgのstar‐PEGエポキシド、および1022.6mgの10%NaOHをバイアル中に入れた。上記溶液を水和HAに添加した。その添加後、その混合物を、2つのシリンジ間を往復させることにより約20回混合した。その混合ペーストをバイアル中に入れ、50℃の水浴中に約2.5時間入れた。196.5mgの12M HClを3.016gのPBS(pH7.4)に添加した。約2.5時間後、HA‐AA2Gゲルが形成され、HCl‐PBS溶液をそれに添加した。そのゲルを中和させ、環状振騰器上で一晩(約24時間)膨潤させた。そのゲルを、約60μmスクリーンを通してサイズ調整し、2つのシリンジ間を往復させることにより約20回混合した。そのゲルを15,000MWCO RC透析バッグ中に入れ、PBS緩衝液(pH7.4)中で透析した。透析を、PBS緩衝液を頻繁に交換しながら約98.5時間続けた。透析後、そのゲルをシリンジ中に入れ、4℃の冷蔵庫内で貯蔵した。結合度およびゲル流体力学的特性を、実施例2および3に記載される手順で測定する。結合度は27.8%である。ゲル貯蔵弾性係数は約363Paである。
400.3mgのHMW HAを、シリンジ中の2501.3mgの4重量%NaOH中で約30分間水和した。1200mgのAA2G、続いて304.7mgのBDDE、および1178.6mgの16重量%NaOHをバイアル中に入れた。上記溶液(pH12超)を50℃の水浴中で約20分間反応させ、20ccのシリンジに移し、その後水和HAに添加した。その添加後、その混合物を2つのシリンジ間を往復させることにより約20回混合した。その混合ペーストを20ccバイアル中に入れ、50℃の水浴中に約2.5時間入れた。約2.5時間後、HA‐AA2Gゲルが形成された。その後、226.6mgの12M HClを8492.2mgの10倍PBS(pH7.4)に添加して、HCl‐PBS溶液を得、そのHCl‐PBS溶液を添加して、ゲルを中和させ、膨潤させた。そのゲルを環状振騰器上で48時間にわたり中和させ、膨潤させた。そのゲルを、約60μmスクリーンを通してサイズ調整し、2つのシリンジ間を往復させることにより約20回混合した。そのゲルを20,000MWCO CE透析バッグ中に入れ、PBS緩衝液(pH7.4)中で透析した。透析を、PBS緩衝液を頻繁に交換しながら約114時間続けた。透析後、そのゲルをシリンジ中に入れ、4℃の冷蔵庫内で貯蔵した。結合度およびゲル流体力学的特性を、実施例2および3に記載される手順で測定する。結合度は約10モル%である。ゲル貯蔵弾性係数は約240Paである。
398.2mgのLMW HAを、シリンジ中の1753.24mgの1重量%NaOH中で約40分間水和した。BDDE(311.7mg)を膨潤したHAに添加し、HAをさらなる80分間、膨潤させ続けた。膨潤したHA/BDDE混合物を50℃で20分間予め反応させた。
200.3mgのHMW HAを60ccのシリンジ中の10mLの水中で水和した。500mgのVitagenを0.5mLの水中に溶解させ、溶液をpH4.8まで中和した。197.7mgのEDCおよび149mgのNHSを6mLの水中で別に溶解させた。上記溶液(溶液およびEDC/NHS溶液)を、23.5mLの水を含有する別の60ccシリンジに添加する。その2つのシリンジを、2つのシリンジ間を往復させることにより20回混合する。その混合物を1つのシリンジ中で貯蔵し、37℃の浴中に4時間浸した。最後に、その溶液を、顕著なVitagenが観察されなくなるまで、PBS緩衝液(pH7.4)に対して透析した。結合度を、実施例3に記載される方法と類似の方法により決定した。結合度は約10モル%である。
200.4mgのLMW HAを、シリンジ中の1000mgのMES 5.2緩衝液中で約30分間水和する。292mgのAA2Pをバイアル中に入れ、続いて300mgのstar‐PEGアミンを添加する。上記溶液を室温で一晩反応させる。そのゲルをPBS緩衝液で水和し、PBS緩衝液に対して透析して、未反応のAA2Pを除去した。最終的なゲルを実施例2および3に記載されるように特徴付けて、結合度およびゲル流体力学的特性を決定した。結合度は約20モル%である。貯蔵弾性係数(G’)は約500Paである。
細線の出現を低減するための、AA2Gを有するHA/BDDE皮膚充填剤製品の製剤化
上記実施例に記載されるゲルのいずれかに対して、透析後、好適な量の遊離HAゲルをそのゲルに添加して、ゲルの粘着性および/または注入可能性の修正を改善し得る。例えば、均一な粘弾性ゲル(「遊離」HAゲル)を得るために、遊離HA繊維をリン酸緩衝液中で膨潤させる。(例えば、約1w/w%〜約5w/w%の遊離HAを有する組成物を得るために)この非架橋結合ゲルを、透析ステップ前に、実施例1で得られたHA/BDDE架橋結合ゲルに添加する。結果として生じるゲルを次いで、処理済み滅菌シリンジ中に満たし、滅菌のために十分な温度および圧で少なくとも約1分間オートクレーブにかける。オートクレーブ後、最終的なHA/AA2G製品を包装し、目尻または他の顔面領域における細線の出現を改善する表層注入のための皮膚充填剤として使用するために医師に配布する。
リドカインを含むHA‐AA2G皮膚充填剤の製剤化
実施例12の手順に従うが、透析ステップ後、かつ遊離HAゲル添加前に、リドカインクロル水和物(リドカインHCl)をその混合物に添加する。粉末形態の(リドカインHCl)を最初にWFI中で可溶化し、0.2μmフィルターを通してろ過し得る。希釈NaOH溶液を、わずかに塩基性のpH(例えば、約7.5〜約8のpH)に到達させるために、その粘着性HA/AA2Gゲルに添加する。そのリドカインHCl溶液を次いで、そのわずかに塩基性のゲルに添加して、最終的に所望される濃度、例えば、約0.3w/w%の濃度に到達させる。すると、HA/AA2G/リドカイン混合物の結果として生じるpHは、約7であり、HA濃度は、約24mg/gである。適切なブレンダー機構を備えた標準の反応器中で、適切な均一性を得るために機械的混合を行う。
HAヒドロゲルへのカルボキシル官能基を含有する添加剤の結合
レチノイン酸(トレチノインとしても知られる)、アダパレンス(adapalence)、およびアルファ‐リポ酸等の添加剤は、カルボキシル官能基(‐COOH)を含有する。これらの添加剤は、EDC化学反応を用いたエステル化によりHAヒドロゲルに結合される。本発明のある実施形態に従う結合についての実施例は、以下のように説明される:
HAヒドロゲルへのヒドロキシル官能基を含有する添加剤の結合
レチノール(トレチノインとしても知られる)、カタラーゼ、ジメチルアミノエタノール、およびg‐トコフェロール等の添加剤は、ヒドロキシル官能基(‐OH)を含有する。これらの添加剤は、EDC化学反応を用いたエステル化によりHAヒドロゲルに結合される。結合についての典型的な実施例は、以下のように説明される:
修飾後のHAヒドロゲルへのヒドロキシル官能基を含有する添加剤の結合
これは、2ステップのプロセスである。
HAヒドロゲルへの成長因子、ペプチド、またはエラスチンの結合
官能アミン基を含有する、上皮成長因子(EGF)、形質転換成長因子(TGF)、およびペプチド等の添加剤をHAに結合させて、有益な皮膚充填剤を形成し得る。これらの添加物は、アミド化化学反応によりHAに結合される。結合についての典型的な実施例は、以下のように説明される:
HAヒドロゲルへの成長因子、ペプチド、またはエラスチンの結合
ヒト脂肪組織由来幹細胞(hASC)に対するビタミンCおよびその誘導体の分裂促進効果を評価するために、hASCを、組織培養プラスチック上で、遊離型のビタミンC(アスコルビン酸)またはその誘導体(VitagenまたはAA2G)を補充したまたは補充しない完全MesenPro培地(Invitrogen,Carlsbad,CA)中で4日間培養した。増殖を、MTTアッセイによって、製造業者(ATCC,Manassas,VA)によって記載されるように評価した。4日後、アスコルビン酸の0.25、0.5、および1mMの濃度が、それぞれ、アスコルビン酸を欠いた対照を60%、80%、および96%上回って、増殖を向上させることが見出された(デヒドロゲナーゼ酵素による、黄色のテトラゾリウムMTTの、紫色のホルマザンへの変換の量によって測定(紫色のホルマザンは、洗剤によって可溶化する)。AA2Gの同じ濃度の使用は、それぞれ、対照を70%、60%、および50%を上回る増殖向上をもたらした。同様の結果がVitagenにより得られ、それぞれ、対照を70%、60%、および30%上回る増加を示した。要約すると、ビタミンCならびにその誘導体AA2GおよびVitagenは、成長因子含有培地の存在下で、細胞培養物中のhASC増殖を向上させる。
低減されたチンダル現象および他の利点を示す本発明のある特定の実施形態に従う、架橋結合されたビタミンCを有し、架橋剤として1,4−ブタンジオール(butaediol)ジグリシジルエーテル(BDDE)を用いる、架橋結合されたHAベースのゲルの調製が、下の実施例19および20に記載される。実施例19において、ビタミンC誘導体は、アスコルビン酸2−グルコシド(AA2G)であり、実施例20において、ビタミンC誘導体は、リン酸アスコルビル3‐アミノプロピル(Vitagen)である。これらのゲルは、最適な流体力学的特性、優れた注入可能性、および高いHA濃度(25mg/g)を有する。いかなる特定の操作理論にも拘束されることを望むものではないが、本発明者らによって、AA2GまたはVitagenのいずれかの存在下で、HAをBDDEと架橋結合することにより、ゲルの特性が大幅に変化し、そのゲルが、BDDEと架橋結合された市販のHAゲルと比べて、高い架橋結合密度、高いHA濃度、低い粘度、および低い押出力を有することが発見されている。AA2GまたはVitagenが架橋結合の間に存在するので、形成されたこのゲルは、ペンダント(pendent)基として、かつHA鎖を単独でまたはBDDEを介してのいずれかで橋渡しする架橋剤の両方として、HA鎖に連結されたこれらのアスコルビン酸誘導体を有する。ゲルの顕微鏡的構造は大幅に変化し、針が30ゲージもの細さであっても、非常に低い押出力を有するゲルをもたらす。さらに、そのゲルは、約3モル%〜約10モル%、または最大約15モル%のHAに結合されたビタミンCを有する。ゲルが注入されるとき、それらは、線維芽細胞またはホスホターゼ(phosphotase)から、α−グルコシダーゼ等の内因性酵素によって、活性ビタミンCを放出する。活性ビタミンCは、皮膚コラーゲン新生を誘発し得、ゲル分解を阻害するラジカルスカベンジャーとして作用し得る。
低減されたチンダル現象を伴うHA/AA2Gゲルの製剤化
シリンジ中の400.1mgのLMW HAおよび402.3mgのAA2Gの混合物を、1764.0mgの5重量%NaOH溶液を添加した後に約60分間水和した。別個のバイアル中に、800.8mgのAA2G、続いて1401.1mgの9.1重量%NaOH溶液、および252.6mgのBDDEを添加した。結果として生じた溶液(pH12超)を50℃の水浴中で約20分間反応させ、その後それを水和HAに移した。その添加後、その混合物を、2つのシリンジ間を往復させることにより約20回混合した。そのペーストを次いでバイアル中に移し、その後それを50℃の水浴中に約2.5時間配置した。架橋結合させた後、197.0mgの12M HClおよび9.18gの10倍PBS(pH7.4)を含有する溶液を添加して塩基を中和し、ゲルを環状振騰器上で72時間膨潤させた。ゲルを、約60μm細孔サイズのメッシュに押し通すことによってサイズ調整した。サイズ調整したゲルを、2つのシリンジ間を往復させることにより約20回混合し、その後それを、MWCO約20kDaのセルロースエステル透析バッグ中に移し、PBS緩衝液(pH7.4)に対して、緩衝液を毎日2回交換しながら5日間透析した。透析後、そのゲルを、1mL COCシリンジ中に分注し、5000RPMで5分間遠心分離して気泡を除去し、湿り蒸気で滅菌した。ゲルは、25mg/gの最終HA濃度を有し、AA2Gモル%が実施例2に記載されるように計算して約10モル%、G’が約80Paであった。他のゲルを同様の様態で作製し、このうちG’値が約60Pa〜約80Paであった。
低減されたチンダル現象を伴う、リドカインを有するHA/AA2Gの製剤化
実施例19のゲルに、ある量のリドカインを添加して、0.3ww%リドカインを有するリドカインゲルを含むHA/AA2Gを得た。リドカインの溶液を、リドカインHClをPBS緩衝液(pH約7.4)中に溶解させることによって調製した。リドカイン溶液のアリコートを、透析後であるが滅菌前に、実施例19のゲルに添加した。ゲルを次いで完全に混合して、0.3w/w%リドカイン濃度を有する均一化された混合物を得た。
低減されたチンダル現象を伴うHA/Vitagenゲルの製剤化
401.0mgのLMW HAを、シリンジ中の2355.0mgの1重量%NaOH溶液中で約45分間水和した。303.8mg BDDEを、水和されたHAに添加して、シリンジからシリンジにわたる混合によって10回混合した。混合物を50℃の水浴中で15分間予め反応させた。800.1mgのVitagenを、950.6mgの15重量%NaOH中に別に溶解させ、続いて510.1 Milli−Q水を添加した。Vitagen溶液を、シリンジからシリンジにわたる混合を使用して30回往復させて、予め加熱された水和HA/BDDE混合物と混合した。混合物を再び50℃の水浴中に配置し、反応がさらに2時間進行し、その後、148.1mgの12M HClおよび8523.1mgの10倍PBS(pH7.4)を含有する溶液を、クロスに添加した。HCl−PBS溶液を添加して、ゲルを中和し、膨潤させた。そのゲルを環状振騰器上で48時間にわたり、中和させ、膨潤させた。そのゲルを、約60μmスクリーンを通してサイズ調整し、2つのシリンジ間を往復させることにより約20回混合した。そのゲルを20,000MWCO CE透析バッグ中に入れ、PBS緩衝液(pH7.4)中で透析した。透析を、PBS緩衝液を頻繁に交換しながら約197時間続けた。透析後、そのゲルを1mL COCシリンジ中に移し、5000RPMで5分間遠心分離し、湿り蒸気で滅菌した。ゲルの最終HA濃度は、24mg/gであった。
低減されたチンダル現象および他の利点を示す本発明のある特定の実施形態に従う、架橋結合されたHAベースのゲルの調製が、下の実施例21および22に記載される。実施例21において、そのゲルは、EDC化学反応を介して作製され 架橋剤は、ヘキサメチレンジアミン(HMDA)を用い、実施例20においては、3−[3−(3−アミノプロポキシ)−2,2−ビス(3−アミノ−プロポキシメチル)−プロポキシ]−プロピルアミン(4アームのアミン−4 AA)である。架橋結合を、緩やかな条件下、例えば、室温で、および例えば、pH5.4で行う。反応条件を調節して、最適なゲル特性、優れた注入可能性、および高いHA濃度(約24mg/g)を有する、高度に網状のゲルを調製することができる。本発明者らによって、カップリング剤である、1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩(EDC)およびN−ヒドロキシコハク酸イミド(NHS)またはスルホニル−NHS(スルホ−NHS)と組み合わせて、中程度の量のHMDAまたは4 AAのいずれかを用いて、HAを非常に低い水和または反応濃度で架橋結合することが有利であり得ることが発見されている。ゲルは、相互に離れた架橋結合点を有することになり、よって、高い減衰力を有する高度に架橋結合された物質となる。対照的に、かかる低い水和または反応濃度でのHAのBDDEとの架橋結合は、架橋剤が比較的非効率的であるので実行不可能であり得る。
低減されたチンダル現象を伴うHA/HMDAゲルの製剤化
20.0gの100mM MES緩衝液(pH5.2)を、1000.0mgのLMW HAを含有するシリンジに添加した。HMDA溶液を、260.9mg HMDA.HClを2010.5mgの100mM MES緩衝液(pH5.2)中に溶解させ、2μLの1M NaOHを添加してpHを5.2にすることによって調製した。EDC溶液を、254.2mgのEDCを1188.4mg 100mM MES緩衝液(pH5.2)中に溶解させることによって調製し、別個のバイアル中で、44.3mgのNHSを、1341.8mgの100mM MES緩衝液(pH5.2)中に溶解させた。約1時間で、HAが完全に水和すると、790μLのHMDA溶液を、水和したHAに添加した。混合物を、10回のシリンジからシリンジにわたる混合によって均一化した。490μLのEDCおよび490μLのNHS溶液を次いで、均一化されたペーストに添加し、シリンジからシリンジにわたる混合によって再び10回混合した。混合物を次いでバイアルに移し、室温で5時間架橋結合させ、その後、17.9mLの1倍PBS緩衝液(pH7.4)を添加した。ゲルをローラー上で3日間膨潤させ、その後、それを60μm細孔サイズのメッシュに押し通した。サイズ調整したゲルを、MWCO 20kDaのセルロースエステル膜透析管類中に配置し、1倍PBSに対して、緩衝液を1日2回交換しながら4日間透析した。ゲルを、1mLCOCシリンジ中に分注し、5000RPMで5分間遠心分離し、湿り蒸気で滅菌した。ゲルの最終HA濃度は、25mg/gであった。
低減されたチンダル現象を伴うHA/4 AAゲルの製剤化
32.55gの100mM MES緩衝液pH5.2を、1000.4mgのLMW HAを含有するシリンジに添加した。4 AA溶液を、256.3mgの4 AAを1039.8mgの100mM MES緩衝液(pH5.2)中に溶解させ、380μLの6M HClを添加してpHを5.2にすることによって調製した。EDC溶液を、251.2mgのEDCを1013.8mgの100mM MES緩衝液(pH5.2)中に溶解させることによって調製し、別個のバイアル中で、74.7mgのNHSを、2020.0mgの100mM MES緩衝液(pH5.2)中に溶解させた。約1時間で、HAが完全に水和すると、260μLの4 AA溶液を、水和したHAに添加した。混合物を、10回のシリンジからシリンジにわたる混合によって均一化した。277μLのEDCおよび273μLのNHS溶液を次いで、均一化されたペーストに添加し、シリンジからシリンジにわたる混合によって再び10回混合した。混合物を次いでバイアルに移し、室温で5時間架橋結合させ、その後、6.4mLの10倍PBS緩衝液(pH7.4)を添加した。ゲルをローラー上で3日間膨潤させ、その後、それを60μm細孔サイズのメッシュに押し通した。サイズ調整したゲルを、MWCO 20kDaのセルロースエステル膜透析管類中に配置し、1倍PBSに対して、緩衝液を1日2回交換しながら4日間透析した。ゲルを、1mL COCシリンジ中に分注し、5000RPMで5分間遠心分離し、湿り蒸気で滅菌した。ゲルは、23mg/gの最終HA濃度を有した。
実施例19〜22のゲルの流体力学的特性の決定。
振動平行プレートレオメータである、Anton Paar Physica MCR 301を使用して、ゲルの流体力学的特性を測定した。25mmのプレート直径を1mmのギャップ高さで使用した。測定を25℃の一定の温度で行った。各測定は、2%の一定の歪みでの1〜10Hzの周波数掃引および周波数の対数的な増加、続いて5Hzの一定の周波数での1〜300%の歪み掃引と共に歪みの対数的な増加からなっていた。貯蔵弾性係数(G’)および粘性係数(G”)は、1%歪みでの歪み掃引から得た。
実施例19〜22のゲルの押出力測定値
ゲルを30ゲージ針に通して押し出すために必要とされる力を、Instron 5564およびBluehill 2ソフトウェアを使用して測定した。ゲルを1mL COCシリンジから、30G1/2 TSK針に通して押し出した。プランジャを100mm/分の速度で11.35mmにわたって押し、押出力を記録した。
実施例19〜22のゲルの生体適合性試験
ゲルの50μLボーラス注入を、Sprague Dawleyラットの背面の皮内に埋め込んだ。埋没物を、1週目に除去し、ヘマトキシリン・エオシン(H&E)染色、および単核性炎症細胞に対するマーカーであるCD68染色を用いる組織学によって分析した。CD68の3つの20倍画像を、染色の程度に基づいて0〜4でスコア化した。これらの値を次いで平均化して、試料スコアを得た。各ゲルから4つの試料を分析した。
実施例19〜22のゲル、ISO 10993−5の細胞傷害性試験。
ゲルの体外細胞傷害性試験を、NAMSAによって、Agarose Overlay Method of ISO 10993−5:biological Evaluation of Medical Devices−Part 5:Tests for In Vitro Cytotoxicityに従って行った。三重のウェルに、フィルターディスク上に配置した0.1mLの試験物品、ならびに0.9% NaCl溶液、陰性対照として1cm長の高密度ポリエチレン、および陽性対照としてラテックスの1×1cm2 部分を投薬した。各々を、L929マウス線維芽細胞の単層を直接覆っているアガロース表面上に配置した。5%CO2中、37℃で24時間インキュベートした後、培養物を、いずれの異常な細胞形態および細胞溶解について巨視的におよび微視的に検査した。試験物品を、試料の近接における溶解域に基づいて0〜4でスコア化した。試験物品は、いかなる細胞溶解または傷害性も引き起こす証拠を示さなかったため、試料1、3、および4からの試験物質を0としてスコア化した。
目視観察をさらに支持し、HA充填剤の比較性能分析を行うために、チンダル現象の定量分析を行うことが必要であるとされた。そのようなものとして、皮膚充填剤に特異的なチンダル現象に対する定量的技法は、文献において何ら存在しない。しかしながら、光散乱および光と皮膚との相互作用についての既存の科学的理解に基づいて、(a)比色分析、および(b)分光法に基づく2つの別々のアプローチを用いて、皮膚におけるチンダル現象を定量化した。これらの技法に基づいて、3つの別々の定量的パラメータ(下に概説される)を定義して、体内のチンダル現象を測定した。
ゲルのチンダル評価
ゲルを、リニアスレッディング技法を使用して、2月齢の無毛ラットの大腿部中に、27G1/2 TSK針に通して皮内注入した。ゲルを、臨床的な細線手技を模倣するために表層に埋め込んだ。チンダルについての試験を、ゲル埋没の48時間後に行った。チンダル試験を行う前に、ヘモグロビンの欠如に起因するチンダル現象の対比を改善するために、動物を安楽死させた。
組織学によるゲルの体内持続期間評価
本発明のゲルおよび市販のゲルの50μLボーラス注入を、Sprague Dawleyラットの背面の皮内に埋め込んだ。埋没物を、1週目に除去し、ヘマトキシリン・エオシン(H&E)染色を用いる組織学によって分析した。切片を厳密に注入部位において採取した。2つの切片を、各組織試料から切り取り、H&E染色切片を、縫合スコープを用いて縫合した。試料を次いでグループ化し、次のようにスコア化した;残っている物質の量に応じて、なし(0%)、低(25%)、中(50%)、および高(100%)。図15を参照されたい。
MRIによるゲルの体内持続期間評価
磁気共鳴画像法(MRI)研究を使用して、メスSprague−Dawleyラットにおける皮内注入後40週間の期間にわたる、本発明のゲルおよび市販のゲルの経時的な体積および表面積変化を評価した。ゲルを、1つの埋没当たり150μLの目標体積で注入した。埋没物は、肩の若干後方の2つの対側部位、膝から若干吻側の2つの対側部位、ならびに頭部および尾の中間点の2つの対側部位に位置した。MRI走査を、7 Tesla 70/30 Bruker Biospec MRI走査器上で行った。画像を、埋没の当日(0週目)、および埋没の12、24、40週後に収集した。ゲルの絶対体積対時間のプロットが、下の図16に示される。高持続性のゲルは、40週の埋没時点で高い絶対体積を有する。
目尻の線の治療において使用される本発明の組成物
40歳の痩せた女性が、目尻の領域に小じわを呈し、皮膚充填剤治療を要求する。30ゲージ針を使用して、医師は、本発明に従う0.6mLのHAベースのゲル(実施例19に記載されるもの等)を、リニアスレッディング技法を使用して彼女の眼の各々の下の細線中および涙の通り道領域において表層に導入する。ゲルは表層に導入されるが、青色の変色は何ら観察されず、患者は結果に満足する。
細線の出現の改善のための本発明の注入可能な組成物
ビタミンA、ビタミンB、ビタミンC、ビタミンD、ビタミンE、およびその誘導体等の添加剤を、単独でおよび組み合わせて、多様な実質的に光透過性であり、注入可能なHAベースのゲルを作製するような様態で、架橋結合されたヒアルロン酸ゲルに結合させる。HA成分は、本明細書の他の箇所で定義されるように、例えば、少なくとも90重量%であり、実質的に完全に低分子量のHA、または約100%低分子量のHAである。これらの添加剤は、任意の好適な手段を使用してHAヒドロゲルに結合される。結合されたゲルは、少なくとも約20mg/g、例えば、約23、約24mg/g、約25mg/g、最大約30mg/gのHA濃度を有し、細いゲージ針に通す注入に好適な、注入可能なpH中性の粘着性組成物を作製するように、サイズ調整され、プロセスされる。ゲルは、少なくとも約50PA、約60Pa、約70Pa、約80Pa、最大約100Paかつ約100Pa以下のG’値を有する。ゲルは、包装され、オートクレーブ、UV光、または他の好適な手段を使用して滅菌される。
Claims (34)
- 皮膚充填剤組成物であって、
架橋成分と架橋結合されたヒアルロン酸成分と、
L−アスコルビン酸2−グルコシド(AA2G)およびリン酸3−アミノプロピル−L−アスコルビルからなる群から選択される添加剤と、を含み、
前記ヒアルロン酸成分は、前記添加剤に化学的に結合され、
前記組成物は、最大200PaのG’値を有し、
前記組成物は、光透過性である、組成物。 - 前記ヒアルロン酸成分は、約3モル%〜約40モル%である結合度で、前記添加剤に化学的に結合される、請求項1に記載の組成物。
- 前記ヒアルロン酸成分は、約3モル%〜約10モル%である結合度で、前記添加剤に化学的に結合される、請求項2に記載の組成物。
- 前記架橋成分は、1,4‐ブタンジオールジグリシジルエーテル(BDDE)である、請求項1〜3のいずれかに記載の組成物。
- 麻酔剤をさらに含む、請求項1〜4のいずれかに記載の組成物。
- 麻酔剤がリドカインである、請求項5に記載の組成物。
- 約25Pa〜約150PaのG’値を有する、請求項1〜6のいずれかに記載の組成物。
- 約40Pa〜約100PaのG’値を有する、請求項1〜6のいずれかに記載の組成物。
- 約100Pa以下のG’値を有する、請求項1〜6のいずれかに記載の組成物。
- 約40Pa以上のG’値を有する、請求項1〜6のいずれかに記載の組成物。
- 患者の皮膚における細線を治療するための、請求項1〜10のいずれかに記載の組成物。
- 顔面の審美的外観を改善するための注入可能な皮膚充填剤組成物であって、
患者の皮膚領域に投与され、光透過性であり、
AA2Gおよびリン酸3−アミノプロピル−L−アスコルビルからなる群から選択されるビタミンC誘導体が共有結合された、架橋剤で架橋結合されたヒアルロン酸成分を含み、
均一化および中和されており、
最大200PaのG’値を有する、組成物。 - 前記ヒアルロン酸成分は、約3モル%〜約40モル%である結合度で、前記ビタミンC誘導体に共有結合される、請求項12に記載の組成物。
- 前記ヒアルロン酸成分は、約3モル%〜約10モル%である結合度で、前記ビタミンC誘導体に共有結合される、請求項13に記載の組成物。
- 約25Pa〜約150PaのG’値を有する、請求項12〜14のいずれかに記載の組成物。
- 患者の薄い皮膚領域における細線の出現を低減するための皮膚充填剤組成物であって、 架橋成分と架橋結合されたヒアルロン酸をベースとし、AA2Gおよびリン酸3−アミノプロピル−L−アスコルビルからなる群から選択されるビタミンC誘導体を含み、
前記ヒアルロン酸は、前記ビタミンC誘導体に化学的に結合され、
前記組成物は、最大200PaのG’値を有し、
前記組成物は、光透過性であり、
前記組成物は、前記患者に、約1mmを超えない深さで投与される、組成物。 - 約0.8mmを超えない深さで注入される、請求項16に記載の組成物。
- 約0.6mmを超えない深さで注入される、請求項16に記載の組成物。
- 約0.4mmを超えない深さで注入される、請求項16に記載の組成物。
- 約25Pa〜約150PaのG’値を有する、請求項16〜19のいずれかに記載の組成物。
- 皮膚充填剤組成物であって、
架橋成分と架橋結合されたヒアルロン酸成分と、
少なくとも約3モル%の結合度で、前記ヒアルロン酸成分に共有結合された、AA2Gおよびリン酸3−アミノプロピル−L−アスコルビルからなる群から選択されるビタミンC誘導体と、を含み、
前記組成物は、光透過性であり、約40Pa〜約100PaのG’値を有する、組成物。 - 約18mg/g〜約30mg/gのヒアルロン酸濃度を有する、請求項21に記載の組成物。
- 約12mg/g〜約30mg/gのヒアルロン酸濃度を有する、請求項21に記載の組成物。
- 前記結合度は、約10モル%である、請求項21〜23のいずれかに記載の組成物。
- 前記ヒアルロン酸は、少なくとも90%が低分子量HAである、請求項21〜24のいずれかに記載の組成物。
- 前記ヒアルロン酸成分は、低分子量HAである、請求項21〜25のいずれかに記載の組成物。
- 顔面における細線の出現を低減するための注入可能な組成物であって、前記組成物は、
1,4−ブタンジオールジグリシジルエーテル(BDDE)架橋結合低分子量ヒアルロン酸(HA)であって、約300Kダルトン〜約900Kダルトンの平均分子量を有する、HAと、
前記ヒアルロン酸に共有結合された、AA2Gおよびリン酸3−アミノプロピル−L−アスコルビルからなる群から選択されるビタミンC誘導体であって、結合度が、約10モル%である、ビタミンC誘導体と、を含み、
前記組成物は、約60Pa〜約80PaのG’値を有する、組成物。 - 前記HAは、約300Kダルトン〜約500Kダルトンの平均分子量を有する、請求項27に記載の組成物。
- 前記組成物は、約80PaのG’値を有する、請求項28に記載の組成物。
- 光透過性である、請求項27〜29のいずれかに記載の組成物。
- 約25mg/gのHA濃度を有する、請求項27〜30のいずれかに記載の組成物。
- 皮膚充填剤組成物であって、
架橋成分と架橋結合されたヒアルロン酸成分と、
AA2Gおよびリン酸3−アミノプロピル−L−アスコルビルからなる群から選択される添加剤と、を含み、
前記ヒアルロン酸成分は、前記添加剤に化学的に結合され、
前記組成物は、最大200PaのG’値を有し、
前記組成物は、光透過性であり、
前記組成物は、患者の皮膚領域中に投与されるとき、前記添加剤を含まないことを除いて実質的に同一である組成物と比べて、低減されたチンダル現象を示す、組成物。 - 架橋成分と架橋結合されたヒアルロン酸成分と、AA2Gおよびリン酸3−アミノプロピル−L−アスコルビルからなる群から選択される添加剤と、を含み、ここで、前記ヒアルロン酸成分は、前記添加剤に化学的に結合される、
光透過性の、患者の皮膚領域中に皮膚充填剤として投与されるとき、チンダル現象を低減するための組成物;
ここで、チンダル現象は、前記添加剤を含まないことを除いて実質的に同一である組成物と比べて、低減される。 - 架橋成分と架橋結合されたヒアルロン酸成分と、AA2Gおよびリン酸3−アミノプロピル−L−アスコルビルからなる群から選択される添加剤と、を含み、ここで、前記ヒアルロン酸成分は、前記添加剤に化学的に結合され、
最大200PaのG’値を有する、
光透過性の、患者の皮膚領域中に皮膚充填剤として投与されるとき、チンダル現象を低減するための組成物;
ここで、チンダル現象は、前記添加剤を含まないことを除いて実質的に同一である組成物と比べて、低減される。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161534780P | 2011-09-14 | 2011-09-14 | |
| US61/534,780 | 2011-09-14 | ||
| USPCT/US2012/052125 | 2012-08-23 | ||
| PCT/US2012/052125 WO2013028904A2 (en) | 2011-08-25 | 2012-08-23 | Dermal filler compositions including antioxidants |
| PCT/US2012/055211 WO2013040242A2 (en) | 2011-09-14 | 2012-09-13 | Dermal filler compositions for fine line treatment |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017075224A Division JP2017140433A (ja) | 2011-09-14 | 2017-04-05 | 酸化防止剤を含む皮膚充填剤組成物 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2014526342A JP2014526342A (ja) | 2014-10-06 |
| JP2014526342A5 JP2014526342A5 (ja) | 2015-11-05 |
| JP6125509B2 true JP6125509B2 (ja) | 2017-05-10 |
Family
ID=47883970
Family Applications (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014530798A Active JP6125509B2 (ja) | 2011-09-14 | 2012-09-13 | 酸化防止剤を含む皮膚充填剤組成物 |
| JP2017075224A Withdrawn JP2017140433A (ja) | 2011-09-14 | 2017-04-05 | 酸化防止剤を含む皮膚充填剤組成物 |
| JP2018219395A Withdrawn JP2019058692A (ja) | 2011-09-14 | 2018-11-22 | 酸化防止剤を含む皮膚充填剤組成物 |
| JP2021048584A Pending JP2021100603A (ja) | 2011-09-14 | 2021-03-23 | 酸化防止剤を含む皮膚充填剤組成物 |
Family Applications After (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017075224A Withdrawn JP2017140433A (ja) | 2011-09-14 | 2017-04-05 | 酸化防止剤を含む皮膚充填剤組成物 |
| JP2018219395A Withdrawn JP2019058692A (ja) | 2011-09-14 | 2018-11-22 | 酸化防止剤を含む皮膚充填剤組成物 |
| JP2021048584A Pending JP2021100603A (ja) | 2011-09-14 | 2021-03-23 | 酸化防止剤を含む皮膚充填剤組成物 |
Country Status (9)
| Country | Link |
|---|---|
| EP (1) | EP2755630A2 (ja) |
| JP (4) | JP6125509B2 (ja) |
| KR (4) | KR20200116168A (ja) |
| CN (2) | CN104105474B (ja) |
| AU (1) | AU2012308503B2 (ja) |
| CA (1) | CA2848833C (ja) |
| HK (1) | HK1198124A1 (ja) |
| RU (1) | RU2626513C2 (ja) |
| WO (1) | WO2013040242A2 (ja) |
Families Citing this family (30)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2861734B1 (fr) | 2003-04-10 | 2006-04-14 | Corneal Ind | Reticulation de polysaccharides de faible et forte masse moleculaire; preparation d'hydrogels monophasiques injectables; polysaccharides et hydrogels obtenus |
| EP2484387A1 (en) | 2011-02-03 | 2012-08-08 | Q-Med AB | Hyaluronic acid composition |
| US9408797B2 (en) | 2011-06-03 | 2016-08-09 | Allergan, Inc. | Dermal filler compositions for fine line treatment |
| US20130096081A1 (en) | 2011-06-03 | 2013-04-18 | Allergan, Inc. | Dermal filler compositions |
| US9393263B2 (en) | 2011-06-03 | 2016-07-19 | Allergan, Inc. | Dermal filler compositions including antioxidants |
| CN107412002A (zh) | 2011-06-03 | 2017-12-01 | 阿勒根公司 | 包括抗氧化剂的皮肤填充剂组合物 |
| CN104105474B (zh) * | 2011-09-14 | 2018-04-06 | 阿勒根公司 | 用于细纹治疗的真皮填充剂组合物 |
| DK2787959T3 (da) * | 2011-12-08 | 2020-09-21 | Allergan Ind Sas | Dermale fyldstofsammensætninger |
| US20140315828A1 (en) * | 2013-04-22 | 2014-10-23 | Allergan, Inc. | Cross-linked silk-hyaluronic acid compositions |
| US20160074519A1 (en) * | 2013-04-25 | 2016-03-17 | Aluron Biopharma Inc. | Crosslinked hyaluronic acid compositions |
| WO2016128783A1 (en) * | 2015-02-09 | 2016-08-18 | Allergan Industrie Sas | Compositions and methods for improving skin appearance |
| AU2016217792B2 (en) * | 2015-02-13 | 2020-07-02 | Allergan Industrie, Sas | Implants for sculpting, augmenting or correcting facial features such as the chin |
| US10988600B2 (en) * | 2016-06-23 | 2021-04-27 | Galderma Holding SA | Cyclodextrin-grafted cross-linked hyaluronic acid complexed with active drug substances and uses thereof |
| EP3503841A4 (en) | 2016-08-24 | 2020-04-22 | Allergan, Inc. | CO-CROSSLINKED HYALURONIC ACID-FIBROIN HYDROGELS FOR IMPROVING THE SUSTAINABILITY OF TISSUE GRAFTS AND FOR INCREASING SOFT TISSUES |
| US11389563B2 (en) | 2017-06-12 | 2022-07-19 | Advanced Aesthetic Technologies, Inc. | Dermal filler |
| UA127350C2 (uk) * | 2017-06-26 | 2023-07-26 | Іволвд Бай Нейчер, Інк. | Тканинний філер на основі шовку і гіалуронової кислоти |
| US20230190997A1 (en) | 2017-06-26 | 2023-06-22 | Evolved By Nature, Inc. | Silk-hyaluronic acid based tissue filers and methods of using the same |
| US20190021966A1 (en) * | 2017-07-19 | 2019-01-24 | Dentsply Sirona Inc. | Water-soluble hydrogel-based dental composition and methods of making and using same |
| CN111918640A (zh) * | 2017-12-29 | 2020-11-10 | 马特克斯拉比有限公司 | 具有透明质酸基的填充物的制备方法 |
| KR101967153B1 (ko) | 2018-04-04 | 2019-04-09 | 윤성준 | 주름과 피부 결손 및 위축성 흉터 개선을 위한 필러 배합 조성물 |
| MA52880A (fr) * | 2018-06-15 | 2021-09-22 | Croma Pharma Ges M B H | Composition d'hydrogel comprenant un polymère réticulé |
| IT201900006929A1 (it) * | 2019-05-16 | 2020-11-16 | Giuliani Spa | Kit per il trattamento estetico della pelle |
| CN110467689A (zh) * | 2019-09-09 | 2019-11-19 | 山东众山生物科技有限公司 | 一种透明质酸衍生物及其制备方法 |
| CN110907370A (zh) * | 2019-12-04 | 2020-03-24 | 桂林理工大学 | 一种普适性的超灵敏化学与生物比色传感方法 |
| US20230040919A1 (en) * | 2019-12-26 | 2023-02-09 | Allergan, Inc. | Crosslinked ha-collagen hydrogels as dermal fillers |
| CN111249172A (zh) * | 2020-01-15 | 2020-06-09 | 陈勇 | 一种美容注射凝胶及其制备方法 |
| CN118742576A (zh) | 2022-01-11 | 2024-10-01 | 维库有限公司 | 作为创新填充剂的新透明质酸衍生物 |
| WO2024055132A1 (es) * | 2022-09-12 | 2024-03-21 | Universidad De Talca | Método para la síntesis de un copolímero ramificado de ácido hialurónico y ácido poli(láctico-co-glicólico) |
| KR20240096331A (ko) | 2022-12-19 | 2024-06-26 | 주식회사 코루파마 | 히알루론산과 아가 또는 아가로오스 복합화 하이드로겔 제조방법, 이로부터 제조된 히알루론산과 아가 또는 아가로오스를 포함하는 하이드로겔 및 이를 포함하는 필러 조성물 |
| EP4450062A1 (en) * | 2023-04-20 | 2024-10-23 | Abiogen Pharma S.p.A. | Composition for the treatment of osteoarthrosis |
Family Cites Families (32)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6174999B1 (en) * | 1987-09-18 | 2001-01-16 | Genzyme Corporation | Water insoluble derivatives of polyanionic polysaccharides |
| KR100721752B1 (ko) * | 2000-01-24 | 2007-05-25 | 쿠라레 메디카루 가부시키가이샤 | 수팽윤성 고분자 겔 및 그 제조법 |
| IT1317091B1 (it) * | 2000-02-08 | 2003-05-26 | S F I R Societa Fondaria Ind R | Gel di acido ialuronico cross-linked con l-amminoacidi ol-amminoesteri bifunzionali. |
| FR2811996B1 (fr) | 2000-07-19 | 2003-08-08 | Corneal Ind | Reticulation de polysaccharide(s), preparation d'hydrogel(s) ; polysaccharide(s) et hydrogel(s) obtenus,leurs utilisations |
| AU2003303820A1 (en) * | 2003-01-31 | 2004-08-23 | Biosphere S.P.A. | Water soluble and biocompatible gels of hyaluronic acid cross-linked with bi-functional l-aminoacids or l-aminoesters |
| WO2004073759A1 (en) | 2003-02-19 | 2004-09-02 | Aventis Pharmaceuticals Holdings Inc. | Composition and method for intradermal soft tissue augmentation |
| FR2861734B1 (fr) | 2003-04-10 | 2006-04-14 | Corneal Ind | Reticulation de polysaccharides de faible et forte masse moleculaire; preparation d'hydrogels monophasiques injectables; polysaccharides et hydrogels obtenus |
| US8124120B2 (en) * | 2003-12-22 | 2012-02-28 | Anika Therapeutics, Inc. | Crosslinked hyaluronic acid compositions for tissue augmentation |
| CN100537606C (zh) * | 2003-12-30 | 2009-09-09 | 建新公司 | 源自交联的透明质酸和/或hylan的粘性凝胶、其制备和用途 |
| FR2865737B1 (fr) * | 2004-02-03 | 2006-03-31 | Anteis Sa | Gel reticule biocompatible |
| US20050281880A1 (en) * | 2004-05-20 | 2005-12-22 | Wei Wang | Methods for making injectable polymer hydrogels |
| FR2873379B1 (fr) * | 2004-07-23 | 2008-05-16 | Jerome Asius | Procede de preparation d'acide hyaluronique reticule, acide hyaluronique reticule susceptible d'etre obtenu par ledit procede, implant contenant ledit acide hyaluronique reticule, et son utilisation |
| FR2878444B1 (fr) | 2004-11-30 | 2008-04-25 | Corneal Ind Soc Par Actions Si | Solutions viscoelastiques renfermant du hyaluronate de sodiu et de l'hydroxypropylmethylcellulose, preparation et utilisations |
| KR20080067619A (ko) * | 2005-09-15 | 2008-07-21 | 유니버시티 오브 유타 리써치 파운데이션 | 고분자 조성물 및 이의 제조방법, 및 이의 용도 |
| CN101432311A (zh) * | 2006-02-28 | 2009-05-13 | 诺维信生物聚合物公司 | 透明质酸衍生物 |
| CN1837265A (zh) * | 2006-04-25 | 2006-09-27 | 江南大学 | 一种透明质酸-羧甲基纤维素复合改性的方法 |
| CN100417666C (zh) * | 2006-09-07 | 2008-09-10 | 重庆大学 | 赖氨酸-壳聚糖树脂及其制备方法 |
| FR2908415B1 (fr) * | 2006-11-10 | 2009-01-23 | Abr Dev Sarl | Acide hyaluronique reticule et son procede de preparation |
| FR2909560B1 (fr) * | 2006-12-06 | 2012-12-28 | Fabre Pierre Dermo Cosmetique | Gel d'acide hyaluronique pour injection intradermique |
| FR2918377B1 (fr) * | 2007-07-05 | 2010-10-08 | Estelle Piron | Gel co-reticule de polysaccharides |
| US8394782B2 (en) * | 2007-11-30 | 2013-03-12 | Allergan, Inc. | Polysaccharide gel formulation having increased longevity |
| JP2011507841A (ja) * | 2007-12-21 | 2011-03-10 | エンセコール アーベー | 活性物質を含む架橋したヒドロゲル |
| KR20090110090A (ko) * | 2008-04-17 | 2009-10-21 | 엘지전자 주식회사 | 초음파를 이용한 인듐 셀레나이드 나노화합물의 제조방법및 이를 포함하는 화합물 반도체 태양전지 |
| US8357795B2 (en) | 2008-08-04 | 2013-01-22 | Allergan, Inc. | Hyaluronic acid-based gels including lidocaine |
| CN101961344A (zh) * | 2009-07-23 | 2011-02-02 | 山东省生物药物研究院 | 药物组合物及其应用 |
| IT1395392B1 (it) * | 2009-08-27 | 2012-09-14 | Fidia Farmaceutici | Geli viscoelastici come nuovi filler |
| EP2504025A4 (en) * | 2009-11-23 | 2013-05-01 | Stephen F Olmstead | COMPOSITIONS AND METHODS USING SERRATIA PEPTIDASE FOR INHIBITING AND TREATING BIOFILMS ASSOCIATED WITH PARTICULAR SUFFERING |
| US20110171286A1 (en) * | 2010-01-13 | 2011-07-14 | Allergan, Inc. | Hyaluronic acid compositions for dermatological use |
| US20110172180A1 (en) * | 2010-01-13 | 2011-07-14 | Allergan Industrie. Sas | Heat stable hyaluronic acid compositions for dermatological use |
| US20110171311A1 (en) | 2010-01-13 | 2011-07-14 | Allergan Industrie, Sas | Stable hydrogel compositions including additives |
| CN107412002A (zh) * | 2011-06-03 | 2017-12-01 | 阿勒根公司 | 包括抗氧化剂的皮肤填充剂组合物 |
| CN104105474B (zh) * | 2011-09-14 | 2018-04-06 | 阿勒根公司 | 用于细纹治疗的真皮填充剂组合物 |
-
2012
- 2012-09-13 CN CN201280055657.7A patent/CN104105474B/zh not_active Expired - Fee Related
- 2012-09-13 RU RU2014113663A patent/RU2626513C2/ru active
- 2012-09-13 AU AU2012308503A patent/AU2012308503B2/en active Active
- 2012-09-13 EP EP12769798.5A patent/EP2755630A2/en not_active Withdrawn
- 2012-09-13 CA CA2848833A patent/CA2848833C/en active Active
- 2012-09-13 KR KR1020207027527A patent/KR20200116168A/ko not_active Application Discontinuation
- 2012-09-13 JP JP2014530798A patent/JP6125509B2/ja active Active
- 2012-09-13 KR KR1020217032224A patent/KR20210125119A/ko active IP Right Grant
- 2012-09-13 KR KR1020147009782A patent/KR102161861B1/ko active IP Right Grant
- 2012-09-13 CN CN201810249654.6A patent/CN108379112A/zh active Pending
- 2012-09-13 WO PCT/US2012/055211 patent/WO2013040242A2/en unknown
- 2012-09-13 KR KR1020227001920A patent/KR20220013588A/ko active Application Filing
-
2014
- 2014-11-17 HK HK14111615.6A patent/HK1198124A1/xx unknown
-
2017
- 2017-04-05 JP JP2017075224A patent/JP2017140433A/ja not_active Withdrawn
-
2018
- 2018-11-22 JP JP2018219395A patent/JP2019058692A/ja not_active Withdrawn
-
2021
- 2021-03-23 JP JP2021048584A patent/JP2021100603A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| RU2014113663A (ru) | 2015-10-20 |
| KR20200116168A (ko) | 2020-10-08 |
| HK1198124A1 (en) | 2015-03-13 |
| WO2013040242A2 (en) | 2013-03-21 |
| AU2012308503B2 (en) | 2015-08-13 |
| CA2848833C (en) | 2017-04-04 |
| KR20140096028A (ko) | 2014-08-04 |
| JP2019058692A (ja) | 2019-04-18 |
| CA2848833A1 (en) | 2013-03-21 |
| JP2021100603A (ja) | 2021-07-08 |
| KR20220013588A (ko) | 2022-02-04 |
| RU2626513C2 (ru) | 2017-07-28 |
| JP2017140433A (ja) | 2017-08-17 |
| JP2014526342A (ja) | 2014-10-06 |
| CN108379112A (zh) | 2018-08-10 |
| CN104105474B (zh) | 2018-04-06 |
| WO2013040242A3 (en) | 2014-03-13 |
| AU2012308503A1 (en) | 2014-04-03 |
| KR102161861B1 (ko) | 2020-10-26 |
| CN104105474A (zh) | 2014-10-15 |
| EP2755630A2 (en) | 2014-07-23 |
| KR20210125119A (ko) | 2021-10-15 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6995946B2 (ja) | 抗酸化物質を含む皮膚充填剤組成物 | |
| JP6125509B2 (ja) | 酸化防止剤を含む皮膚充填剤組成物 | |
| US20200353124A1 (en) | Dermal filler compositions for fine line treatment | |
| AU2021221920B2 (en) | Dermal filler compositions | |
| US11083684B2 (en) | Dermal filler compositions | |
| US20240342072A1 (en) | Dermal filler compositions | |
| AU2015255254B2 (en) | Dermal filler compositions for fine line treatment |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150911 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20150911 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20160614 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20160801 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20161031 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20161213 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20170307 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20170405 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6125509 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |