JP6072016B2 - デング熱を治療する方法 - Google Patents
デング熱を治療する方法 Download PDFInfo
- Publication number
- JP6072016B2 JP6072016B2 JP2014514062A JP2014514062A JP6072016B2 JP 6072016 B2 JP6072016 B2 JP 6072016B2 JP 2014514062 A JP2014514062 A JP 2014514062A JP 2014514062 A JP2014514062 A JP 2014514062A JP 6072016 B2 JP6072016 B2 JP 6072016B2
- Authority
- JP
- Japan
- Prior art keywords
- alkyl
- hydrogen
- aryl
- tetrahydro
- azido
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 206010012310 Dengue fever Diseases 0.000 title claims description 64
- 208000025729 dengue disease Diseases 0.000 title claims description 53
- 208000001490 Dengue Diseases 0.000 title claims description 48
- 125000000217 alkyl group Chemical group 0.000 claims description 107
- -1 —COR 1b Chemical group 0.000 claims description 86
- 150000001875 compounds Chemical class 0.000 claims description 83
- 229910052739 hydrogen Inorganic materials 0.000 claims description 59
- 239000001257 hydrogen Substances 0.000 claims description 59
- 125000003118 aryl group Chemical group 0.000 claims description 51
- 150000002431 hydrogen Chemical class 0.000 claims description 34
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 24
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 21
- 125000003545 alkoxy group Chemical group 0.000 claims description 20
- 150000003839 salts Chemical class 0.000 claims description 20
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims description 19
- 125000001424 substituent group Chemical group 0.000 claims description 19
- 239000003814 drug Substances 0.000 claims description 16
- 125000001624 naphthyl group Chemical group 0.000 claims description 16
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims description 16
- 229910052736 halogen Inorganic materials 0.000 claims description 15
- 238000002360 preparation method Methods 0.000 claims description 15
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 14
- 150000002367 halogens Chemical class 0.000 claims description 14
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 13
- 125000000171 (C1-C6) haloalkyl group Chemical group 0.000 claims description 12
- 125000001188 haloalkyl group Chemical group 0.000 claims description 10
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 10
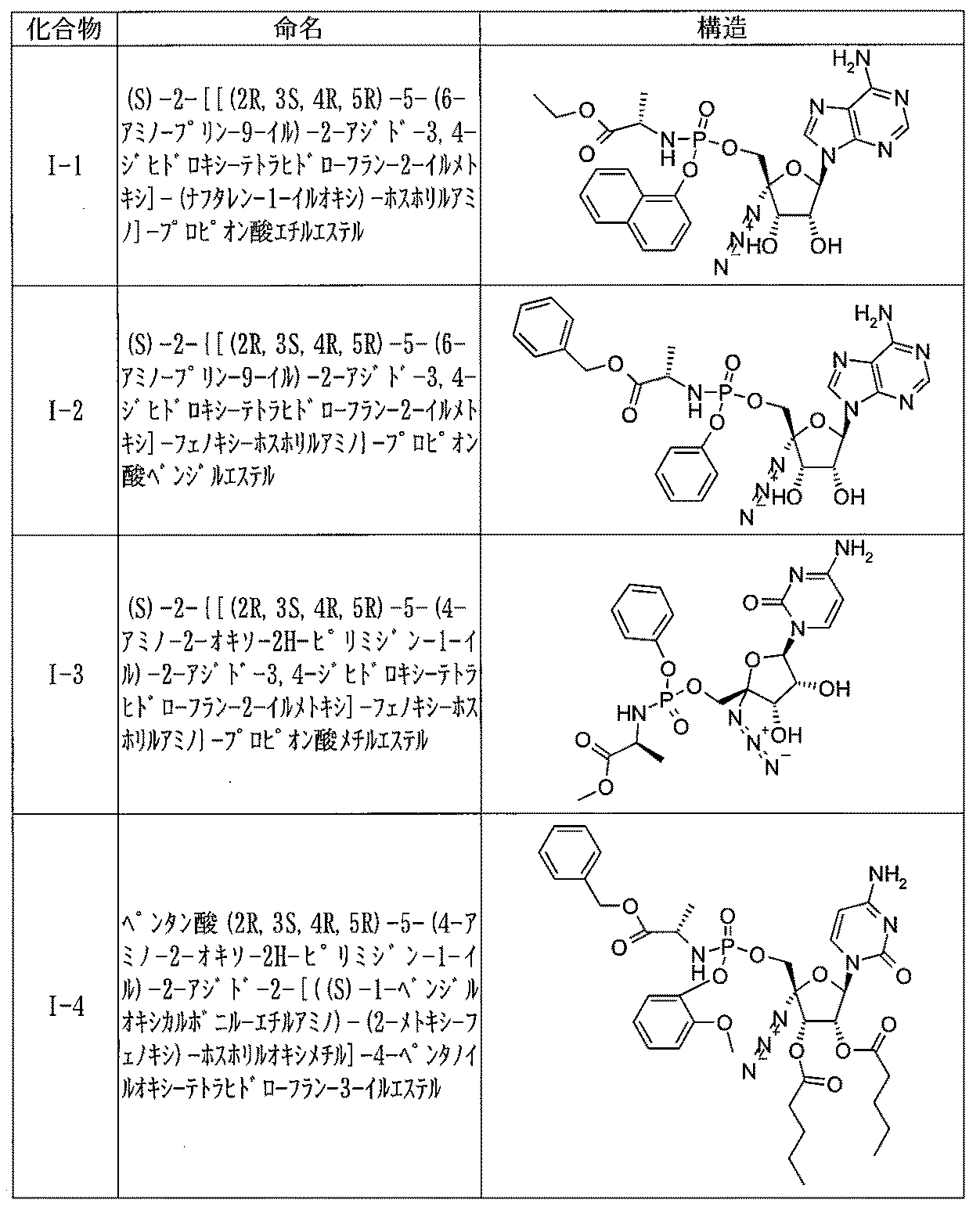
- VCDALMMJMVIYAS-PISJKROCSA-N N(=[N+]=[N-])[C@@]1(O[C@H]([C@@H]([C@@H]1O)O)N1C(NC(C=C1)=O)=O)COC1=C(C2=CC=CC=C2C=C1)OP(=O)=N[C@H](C(=O)O)CC1=CC=CC=C1 Chemical compound N(=[N+]=[N-])[C@@]1(O[C@H]([C@@H]([C@@H]1O)O)N1C(NC(C=C1)=O)=O)COC1=C(C2=CC=CC=C2C=C1)OP(=O)=N[C@H](C(=O)O)CC1=CC=CC=C1 VCDALMMJMVIYAS-PISJKROCSA-N 0.000 claims description 8
- 239000003443 antiviral agent Substances 0.000 claims description 8
- NQPDZGIKBAWPEJ-UHFFFAOYSA-N valeric acid Chemical compound CCCCC(O)=O NQPDZGIKBAWPEJ-UHFFFAOYSA-N 0.000 claims description 8
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 7
- 125000006577 C1-C6 hydroxyalkyl group Chemical group 0.000 claims description 6
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 claims description 6
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 claims description 6
- 125000004442 acylamino group Chemical group 0.000 claims description 6
- 238000000034 method Methods 0.000 description 29
- 239000000203 mixture Substances 0.000 description 26
- 208000009714 Severe Dengue Diseases 0.000 description 24
- 201000010099 disease Diseases 0.000 description 18
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 18
- 208000015181 infectious disease Diseases 0.000 description 16
- 239000004480 active ingredient Substances 0.000 description 15
- 210000004027 cell Anatomy 0.000 description 15
- 239000002777 nucleoside Substances 0.000 description 15
- 241000700605 Viruses Species 0.000 description 14
- 201000002950 dengue hemorrhagic fever Diseases 0.000 description 14
- 239000000243 solution Substances 0.000 description 12
- 239000000843 powder Substances 0.000 description 11
- 230000003612 virological effect Effects 0.000 description 11
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 10
- 125000004432 carbon atom Chemical group C* 0.000 description 10
- 201000009892 dengue shock syndrome Diseases 0.000 description 10
- 238000009472 formulation Methods 0.000 description 10
- 125000001072 heteroaryl group Chemical group 0.000 description 10
- 239000003826 tablet Substances 0.000 description 10
- 239000007787 solid Substances 0.000 description 9
- 229960005486 vaccine Drugs 0.000 description 9
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 8
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 8
- 241000725619 Dengue virus Species 0.000 description 8
- 239000002775 capsule Substances 0.000 description 8
- 239000000126 substance Substances 0.000 description 8
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 7
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 7
- 125000004429 atom Chemical group 0.000 description 7
- 239000002585 base Substances 0.000 description 7
- 239000002552 dosage form Substances 0.000 description 7
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 7
- 150000003833 nucleoside derivatives Chemical class 0.000 description 7
- 239000008194 pharmaceutical composition Substances 0.000 description 7
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 6
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 6
- SJRJJKPEHAURKC-UHFFFAOYSA-N N-Methylmorpholine Chemical compound CN1CCOCC1 SJRJJKPEHAURKC-UHFFFAOYSA-N 0.000 description 6
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 6
- 239000002253 acid Substances 0.000 description 6
- 125000002252 acyl group Chemical group 0.000 description 6
- 125000003710 aryl alkyl group Chemical group 0.000 description 6
- 238000003556 assay Methods 0.000 description 6
- 229910052799 carbon Inorganic materials 0.000 description 6
- 239000000839 emulsion Substances 0.000 description 6
- 125000002768 hydroxyalkyl group Chemical group 0.000 description 6
- 239000000463 material Substances 0.000 description 6
- 239000002904 solvent Substances 0.000 description 6
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 6
- 239000000725 suspension Substances 0.000 description 6
- 230000029812 viral genome replication Effects 0.000 description 6
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 6
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 5
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 5
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 5
- 235000001014 amino acid Nutrition 0.000 description 5
- 229940024606 amino acid Drugs 0.000 description 5
- 150000001413 amino acids Chemical class 0.000 description 5
- 230000015572 biosynthetic process Effects 0.000 description 5
- 238000006243 chemical reaction Methods 0.000 description 5
- 238000011161 development Methods 0.000 description 5
- 125000005843 halogen group Chemical group 0.000 description 5
- 230000004048 modification Effects 0.000 description 5
- 238000012986 modification Methods 0.000 description 5
- 229910052757 nitrogen Inorganic materials 0.000 description 5
- 239000000546 pharmaceutical excipient Substances 0.000 description 5
- 125000003884 phenylalkyl group Chemical group 0.000 description 5
- GQHTUMJGOHRCHB-UHFFFAOYSA-N 2,3,4,6,7,8,9,10-octahydropyrimido[1,2-a]azepine Chemical compound C1CCCCN2CCCN=C21 GQHTUMJGOHRCHB-UHFFFAOYSA-N 0.000 description 4
- HZNVUJQVZSTENZ-UHFFFAOYSA-N 2,3-dichloro-5,6-dicyano-1,4-benzoquinone Chemical compound ClC1=C(Cl)C(=O)C(C#N)=C(C#N)C1=O HZNVUJQVZSTENZ-UHFFFAOYSA-N 0.000 description 4
- NHQDETIJWKXCTC-UHFFFAOYSA-N 3-chloroperbenzoic acid Chemical compound OOC(=O)C1=CC=CC(Cl)=C1 NHQDETIJWKXCTC-UHFFFAOYSA-N 0.000 description 4
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 4
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 4
- GKQLYSROISKDLL-UHFFFAOYSA-N EEDQ Chemical compound C1=CC=C2N(C(=O)OCC)C(OCC)C=CC2=C1 GKQLYSROISKDLL-UHFFFAOYSA-N 0.000 description 4
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 4
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 4
- JRNVZBWKYDBUCA-UHFFFAOYSA-N N-chlorosuccinimide Chemical compound ClN1C(=O)CCC1=O JRNVZBWKYDBUCA-UHFFFAOYSA-N 0.000 description 4
- 108010076039 Polyproteins Proteins 0.000 description 4
- 101710172711 Structural protein Proteins 0.000 description 4
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 4
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 4
- 125000004453 alkoxycarbonyl group Chemical group 0.000 description 4
- 239000012298 atmosphere Substances 0.000 description 4
- 230000037396 body weight Effects 0.000 description 4
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 4
- 239000003153 chemical reaction reagent Substances 0.000 description 4
- 239000003795 chemical substances by application Substances 0.000 description 4
- 230000034994 death Effects 0.000 description 4
- 231100000517 death Toxicity 0.000 description 4
- CSJLBAMHHLJAAS-UHFFFAOYSA-N diethylaminosulfur trifluoride Chemical compound CCN(CC)S(F)(F)F CSJLBAMHHLJAAS-UHFFFAOYSA-N 0.000 description 4
- 150000002085 enols Chemical group 0.000 description 4
- 239000012091 fetal bovine serum Substances 0.000 description 4
- 125000004438 haloalkoxy group Chemical group 0.000 description 4
- 125000005842 heteroatom Chemical group 0.000 description 4
- 125000000623 heterocyclic group Chemical group 0.000 description 4
- 239000004615 ingredient Substances 0.000 description 4
- 238000002347 injection Methods 0.000 description 4
- 239000007924 injection Substances 0.000 description 4
- 125000000468 ketone group Chemical group 0.000 description 4
- IUYHWZFSGMZEOG-UHFFFAOYSA-M magnesium;propane;chloride Chemical compound [Mg+2].[Cl-].C[CH-]C IUYHWZFSGMZEOG-UHFFFAOYSA-M 0.000 description 4
- 125000003835 nucleoside group Chemical group 0.000 description 4
- 230000003287 optical effect Effects 0.000 description 4
- LEHBURLTIWGHEM-UHFFFAOYSA-N pyridinium chlorochromate Chemical compound [O-][Cr](Cl)(=O)=O.C1=CC=[NH+]C=C1 LEHBURLTIWGHEM-UHFFFAOYSA-N 0.000 description 4
- 125000006413 ring segment Chemical group 0.000 description 4
- 239000007921 spray Substances 0.000 description 4
- 239000003381 stabilizer Substances 0.000 description 4
- 239000007858 starting material Substances 0.000 description 4
- 238000007920 subcutaneous administration Methods 0.000 description 4
- 239000000829 suppository Substances 0.000 description 4
- 239000000375 suspending agent Substances 0.000 description 4
- 238000013268 sustained release Methods 0.000 description 4
- 239000012730 sustained-release form Substances 0.000 description 4
- 238000003786 synthesis reaction Methods 0.000 description 4
- FPGGTKZVZWFYPV-UHFFFAOYSA-M tetrabutylammonium fluoride Chemical compound [F-].CCCC[N+](CCCC)(CCCC)CCCC FPGGTKZVZWFYPV-UHFFFAOYSA-M 0.000 description 4
- 239000002562 thickening agent Substances 0.000 description 4
- BRBOLMMFGHVQNH-MLTZYSBQSA-N (2r,3s,4r,5r)-5-(6-aminopurin-9-yl)-2-azido-2-(hydroxymethyl)oxolane-3,4-diol Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@@](CO)(N=[N+]=[N-])[C@@H](O)[C@H]1O BRBOLMMFGHVQNH-MLTZYSBQSA-N 0.000 description 3
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 3
- FEJUGLKDZJDVFY-UHFFFAOYSA-N 9-borabicyclo(3.3.1)nonane Chemical compound C1CCC2CCCC1B2 FEJUGLKDZJDVFY-UHFFFAOYSA-N 0.000 description 3
- 244000215068 Acacia senegal Species 0.000 description 3
- 241000255925 Diptera Species 0.000 description 3
- 108010010803 Gelatin Proteins 0.000 description 3
- 229920000084 Gum arabic Polymers 0.000 description 3
- 208000032843 Hemorrhage Diseases 0.000 description 3
- OFOBLEOULBTSOW-UHFFFAOYSA-N Malonic acid Chemical compound OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 3
- 229910019142 PO4 Inorganic materials 0.000 description 3
- 229930182555 Penicillin Natural products 0.000 description 3
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 3
- 102000035195 Peptidases Human genes 0.000 description 3
- 108091005804 Peptidases Proteins 0.000 description 3
- 206010037660 Pyrexia Diseases 0.000 description 3
- 108020000999 Viral RNA Proteins 0.000 description 3
- 235000010489 acacia gum Nutrition 0.000 description 3
- 239000000205 acacia gum Substances 0.000 description 3
- 125000004390 alkyl sulfonyl group Chemical group 0.000 description 3
- 150000001408 amides Chemical class 0.000 description 3
- 125000003277 amino group Chemical group 0.000 description 3
- 125000002619 bicyclic group Chemical group 0.000 description 3
- 230000000740 bleeding effect Effects 0.000 description 3
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 description 3
- 229910002091 carbon monoxide Inorganic materials 0.000 description 3
- 239000000969 carrier Substances 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 239000003086 colorant Substances 0.000 description 3
- 239000006071 cream Substances 0.000 description 3
- 238000002425 crystallisation Methods 0.000 description 3
- 230000008025 crystallization Effects 0.000 description 3
- 125000000753 cycloalkyl group Chemical group 0.000 description 3
- 210000004443 dendritic cell Anatomy 0.000 description 3
- 230000001419 dependent effect Effects 0.000 description 3
- 239000003085 diluting agent Substances 0.000 description 3
- 239000002270 dispersing agent Substances 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- 239000003995 emulsifying agent Substances 0.000 description 3
- 239000000796 flavoring agent Substances 0.000 description 3
- 239000008273 gelatin Substances 0.000 description 3
- 229920000159 gelatin Polymers 0.000 description 3
- 235000019322 gelatine Nutrition 0.000 description 3
- 235000011852 gelatine desserts Nutrition 0.000 description 3
- 150000002430 hydrocarbons Chemical group 0.000 description 3
- 238000011534 incubation Methods 0.000 description 3
- 230000002401 inhibitory effect Effects 0.000 description 3
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 3
- 150000002576 ketones Chemical class 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- 239000012669 liquid formulation Substances 0.000 description 3
- 239000006210 lotion Substances 0.000 description 3
- 239000002609 medium Substances 0.000 description 3
- 238000002844 melting Methods 0.000 description 3
- 230000008018 melting Effects 0.000 description 3
- KDLHZDBZIXYQEI-UHFFFAOYSA-N palladium Substances [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 3
- 239000002245 particle Substances 0.000 description 3
- 229940049954 penicillin Drugs 0.000 description 3
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 3
- 239000010452 phosphate Substances 0.000 description 3
- 239000003755 preservative agent Substances 0.000 description 3
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 3
- 235000019833 protease Nutrition 0.000 description 3
- 125000006239 protecting group Chemical group 0.000 description 3
- 230000009467 reduction Effects 0.000 description 3
- 230000010076 replication Effects 0.000 description 3
- 229920006395 saturated elastomer Polymers 0.000 description 3
- 229960005322 streptomycin Drugs 0.000 description 3
- 238000006467 substitution reaction Methods 0.000 description 3
- DYHSDKLCOJIUFX-UHFFFAOYSA-N tert-butoxycarbonyl anhydride Chemical compound CC(C)(C)OC(=O)OC(=O)OC(C)(C)C DYHSDKLCOJIUFX-UHFFFAOYSA-N 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- 238000004809 thin layer chromatography Methods 0.000 description 3
- 239000003981 vehicle Substances 0.000 description 3
- CYPYTURSJDMMMP-WVCUSYJESA-N (1e,4e)-1,5-diphenylpenta-1,4-dien-3-one;palladium Chemical compound [Pd].[Pd].C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 CYPYTURSJDMMMP-WVCUSYJESA-N 0.000 description 2
- AXTGDCSMTYGJND-UHFFFAOYSA-N 1-dodecylazepan-2-one Chemical compound CCCCCCCCCCCCN1CCCCCC1=O AXTGDCSMTYGJND-UHFFFAOYSA-N 0.000 description 2
- 125000001637 1-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C(*)=C([H])C([H])=C([H])C2=C1[H] 0.000 description 2
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 2
- 108020004463 18S ribosomal RNA Proteins 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- JWUJQDFVADABEY-UHFFFAOYSA-N 2-methyltetrahydrofuran Chemical compound CC1CCCO1 JWUJQDFVADABEY-UHFFFAOYSA-N 0.000 description 2
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 2
- XMIIGOLPHOKFCH-UHFFFAOYSA-N 3-phenylpropionic acid Chemical compound OC(=O)CCC1=CC=CC=C1 XMIIGOLPHOKFCH-UHFFFAOYSA-N 0.000 description 2
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 2
- 241000416162 Astragalus gummifer Species 0.000 description 2
- JGLMVXWAHNTPRF-CMDGGOBGSA-N CCN1N=C(C)C=C1C(=O)NC1=NC2=CC(=CC(OC)=C2N1C\C=C\CN1C(NC(=O)C2=CC(C)=NN2CC)=NC2=CC(=CC(OCCCN3CCOCC3)=C12)C(N)=O)C(N)=O Chemical compound CCN1N=C(C)C=C1C(=O)NC1=NC2=CC(=CC(OC)=C2N1C\C=C\CN1C(NC(=O)C2=CC(C)=NN2CC)=NC2=CC(=CC(OCCCN3CCOCC3)=C12)C(N)=O)C(N)=O JGLMVXWAHNTPRF-CMDGGOBGSA-N 0.000 description 2
- 239000004215 Carbon black (E152) Substances 0.000 description 2
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 2
- RGHNJXZEOKUKBD-SQOUGZDYSA-N D-gluconic acid Chemical group OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)=O RGHNJXZEOKUKBD-SQOUGZDYSA-N 0.000 description 2
- 241000712471 Dhori virus Species 0.000 description 2
- 101710091045 Envelope protein Proteins 0.000 description 2
- 101710204837 Envelope small membrane protein Proteins 0.000 description 2
- 241000710781 Flaviviridae Species 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 2
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- AEMRFAOFKBGASW-UHFFFAOYSA-N Glycolic acid Chemical compound OCC(O)=O AEMRFAOFKBGASW-UHFFFAOYSA-N 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- 229930194542 Keto Natural products 0.000 description 2
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 2
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- 101710145006 Lysis protein Proteins 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 2
- 108060004795 Methyltransferase Proteins 0.000 description 2
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 2
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 2
- XYFCBTPGUUZFHI-UHFFFAOYSA-N Phosphine Chemical compound P XYFCBTPGUUZFHI-UHFFFAOYSA-N 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- 101710188315 Protein X Proteins 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 2
- LCTONWCANYUPML-UHFFFAOYSA-N Pyruvic acid Chemical compound CC(=O)C(O)=O LCTONWCANYUPML-UHFFFAOYSA-N 0.000 description 2
- IWUCXVSUMQZMFG-AFCXAGJDSA-N Ribavirin Chemical compound N1=C(C(=O)N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 IWUCXVSUMQZMFG-AFCXAGJDSA-N 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 229920002472 Starch Polymers 0.000 description 2
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 2
- 229930006000 Sucrose Natural products 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 102100021696 Syncytin-1 Human genes 0.000 description 2
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical compound C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 description 2
- 229920001615 Tragacanth Polymers 0.000 description 2
- DRTQHJPVMGBUCF-XVFCMESISA-N Uridine Chemical class O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C=C1 DRTQHJPVMGBUCF-XVFCMESISA-N 0.000 description 2
- 241000710886 West Nile virus Species 0.000 description 2
- 241000710772 Yellow fever virus Species 0.000 description 2
- IKHGUXGNUITLKF-XPULMUKRSA-N acetaldehyde Chemical compound [14CH]([14CH3])=O IKHGUXGNUITLKF-XPULMUKRSA-N 0.000 description 2
- DHKHKXVYLBGOIT-UHFFFAOYSA-N acetaldehyde Diethyl Acetal Natural products CCOC(C)OCC DHKHKXVYLBGOIT-UHFFFAOYSA-N 0.000 description 2
- 150000001241 acetals Chemical class 0.000 description 2
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 2
- OIRDTQYFTABQOQ-KQYNXXCUSA-N adenosine Chemical class C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O OIRDTQYFTABQOQ-KQYNXXCUSA-N 0.000 description 2
- 239000000443 aerosol Substances 0.000 description 2
- 125000000278 alkyl amino alkyl group Chemical group 0.000 description 2
- 125000003282 alkyl amino group Chemical group 0.000 description 2
- 125000003806 alkyl carbonyl amino group Chemical group 0.000 description 2
- 125000004448 alkyl carbonyl group Chemical group 0.000 description 2
- 125000004656 alkyl sulfonylamino group Chemical group 0.000 description 2
- 125000004414 alkyl thio group Chemical group 0.000 description 2
- 125000002947 alkylene group Chemical group 0.000 description 2
- 235000008206 alpha-amino acids Nutrition 0.000 description 2
- 229910052782 aluminium Inorganic materials 0.000 description 2
- 150000001409 amidines Chemical class 0.000 description 2
- 238000002832 anti-viral assay Methods 0.000 description 2
- 230000000840 anti-viral effect Effects 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 239000007900 aqueous suspension Substances 0.000 description 2
- 125000004658 aryl carbonyl amino group Chemical group 0.000 description 2
- 125000004657 aryl sulfonyl amino group Chemical group 0.000 description 2
- 125000004391 aryl sulfonyl group Chemical group 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- IOJUPLGTWVMSFF-UHFFFAOYSA-N benzothiazole Chemical group C1=CC=C2SC=NC2=C1 IOJUPLGTWVMSFF-UHFFFAOYSA-N 0.000 description 2
- MUALRAIOVNYAIW-UHFFFAOYSA-N binap Chemical group C1=CC=CC=C1P(C=1C(=C2C=CC=CC2=CC=1)C=1C2=CC=CC=C2C=CC=1P(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 MUALRAIOVNYAIW-UHFFFAOYSA-N 0.000 description 2
- PFKFTWBEEFSNDU-UHFFFAOYSA-N carbonyldiimidazole Chemical compound C1=CN=CN1C(=O)N1C=CN=C1 PFKFTWBEEFSNDU-UHFFFAOYSA-N 0.000 description 2
- 239000001768 carboxy methyl cellulose Substances 0.000 description 2
- 238000012054 celltiter-glo Methods 0.000 description 2
- 108091092328 cellular RNA Proteins 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- 238000004587 chromatography analysis Methods 0.000 description 2
- 229940110456 cocoa butter Drugs 0.000 description 2
- 235000019868 cocoa butter Nutrition 0.000 description 2
- 239000002299 complementary DNA Substances 0.000 description 2
- 229940126214 compound 3 Drugs 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 230000007123 defense Effects 0.000 description 2
- 238000010511 deprotection reaction Methods 0.000 description 2
- FAMRKDQNMBBFBR-BQYQJAHWSA-N diethyl azodicarboxylate Substances CCOC(=O)\N=N\C(=O)OCC FAMRKDQNMBBFBR-BQYQJAHWSA-N 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 2
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 2
- 230000000694 effects Effects 0.000 description 2
- 239000003480 eluent Substances 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 235000019439 ethyl acetate Nutrition 0.000 description 2
- FAMRKDQNMBBFBR-UHFFFAOYSA-N ethyl n-ethoxycarbonyliminocarbamate Chemical compound CCOC(=O)N=NC(=O)OCC FAMRKDQNMBBFBR-UHFFFAOYSA-N 0.000 description 2
- 239000012467 final product Substances 0.000 description 2
- 235000019634 flavors Nutrition 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 235000013922 glutamic acid Nutrition 0.000 description 2
- 239000004220 glutamic acid Substances 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 125000004404 heteroalkyl group Chemical group 0.000 description 2
- 125000000592 heterocycloalkyl group Chemical group 0.000 description 2
- 238000004128 high performance liquid chromatography Methods 0.000 description 2
- 229930195733 hydrocarbon Natural products 0.000 description 2
- RCBVKBFIWMOMHF-UHFFFAOYSA-L hydroxy-(hydroxy(dioxo)chromio)oxy-dioxochromium;pyridine Chemical compound C1=CC=NC=C1.C1=CC=NC=C1.O[Cr](=O)(=O)O[Cr](O)(=O)=O RCBVKBFIWMOMHF-UHFFFAOYSA-L 0.000 description 2
- 230000036039 immunity Effects 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 239000000543 intermediate Substances 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- SUMDYPCJJOFFON-UHFFFAOYSA-N isethionic acid Chemical compound OCCS(O)(=O)=O SUMDYPCJJOFFON-UHFFFAOYSA-N 0.000 description 2
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 239000000787 lecithin Substances 0.000 description 2
- 235000010445 lecithin Nutrition 0.000 description 2
- 229940067606 lecithin Drugs 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 2
- 239000007937 lozenge Substances 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- 229920000609 methyl cellulose Polymers 0.000 description 2
- 239000001923 methylcellulose Substances 0.000 description 2
- 235000010981 methylcellulose Nutrition 0.000 description 2
- 210000001616 monocyte Anatomy 0.000 description 2
- TXXHDPDFNKHHGW-UHFFFAOYSA-N muconic acid Chemical group OC(=O)C=CC=CC(O)=O TXXHDPDFNKHHGW-UHFFFAOYSA-N 0.000 description 2
- OKDQKPLMQBXTNH-UHFFFAOYSA-N n,n-dimethyl-2h-pyridin-1-amine Chemical compound CN(C)N1CC=CC=C1 OKDQKPLMQBXTNH-UHFFFAOYSA-N 0.000 description 2
- FUZZWVXGSFPDMH-UHFFFAOYSA-N n-hexanoic acid Natural products CCCCCC(O)=O FUZZWVXGSFPDMH-UHFFFAOYSA-N 0.000 description 2
- 210000003928 nasal cavity Anatomy 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 108020004707 nucleic acids Proteins 0.000 description 2
- 150000007523 nucleic acids Chemical class 0.000 description 2
- 102000039446 nucleic acids Human genes 0.000 description 2
- 239000002674 ointment Substances 0.000 description 2
- KJIFKLIQANRMOU-UHFFFAOYSA-N oxidanium;4-methylbenzenesulfonate Chemical compound O.CC1=CC=C(S(O)(=O)=O)C=C1 KJIFKLIQANRMOU-UHFFFAOYSA-N 0.000 description 2
- 229910052760 oxygen Inorganic materials 0.000 description 2
- 244000052769 pathogen Species 0.000 description 2
- 230000008506 pathogenesis Effects 0.000 description 2
- 125000000286 phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 description 2
- 150000008298 phosphoramidates Chemical class 0.000 description 2
- XHXFXVLFKHQFAL-UHFFFAOYSA-N phosphoryl trichloride Chemical compound ClP(Cl)(Cl)=O XHXFXVLFKHQFAL-UHFFFAOYSA-N 0.000 description 2
- 230000000704 physical effect Effects 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 229920006316 polyvinylpyrrolidine Polymers 0.000 description 2
- 239000002243 precursor Substances 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- VVWRJUBEIPHGQF-UHFFFAOYSA-N propan-2-yl n-propan-2-yloxycarbonyliminocarbamate Chemical compound CC(C)OC(=O)N=NC(=O)OC(C)C VVWRJUBEIPHGQF-UHFFFAOYSA-N 0.000 description 2
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 108090000623 proteins and genes Proteins 0.000 description 2
- 238000011002 quantification Methods 0.000 description 2
- 238000003753 real-time PCR Methods 0.000 description 2
- 238000011084 recovery Methods 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 229960000329 ribavirin Drugs 0.000 description 2
- HZCAHMRRMINHDJ-DBRKOABJSA-N ribavirin Natural products O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1N=CN=C1 HZCAHMRRMINHDJ-DBRKOABJSA-N 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical group OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 2
- 239000000523 sample Substances 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 230000035939 shock Effects 0.000 description 2
- 239000000741 silica gel Substances 0.000 description 2
- 229910002027 silica gel Inorganic materials 0.000 description 2
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 2
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 2
- DAEPDZWVDSPTHF-UHFFFAOYSA-M sodium pyruvate Chemical compound [Na+].CC(=O)C([O-])=O DAEPDZWVDSPTHF-UHFFFAOYSA-M 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 239000008107 starch Substances 0.000 description 2
- 235000019698 starch Nutrition 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- 239000005720 sucrose Substances 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 239000006188 syrup Substances 0.000 description 2
- 235000020357 syrup Nutrition 0.000 description 2
- 238000003419 tautomerization reaction Methods 0.000 description 2
- 125000001981 tert-butyldimethylsilyl group Chemical group [H]C([H])([H])[Si]([H])(C([H])([H])[H])[*]C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- 238000011200 topical administration Methods 0.000 description 2
- 235000010487 tragacanth Nutrition 0.000 description 2
- 239000000196 tragacanth Substances 0.000 description 2
- 229940116362 tragacanth Drugs 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 238000012546 transfer Methods 0.000 description 2
- 125000000026 trimethylsilyl group Chemical group [H]C([H])([H])[Si]([*])(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 239000008215 water for injection Substances 0.000 description 2
- 229940051021 yellow-fever virus Drugs 0.000 description 2
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 1
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 1
- 125000006272 (C3-C7) cycloalkyl group Chemical group 0.000 description 1
- MIOPJNTWMNEORI-GMSGAONNSA-N (S)-camphorsulfonic acid Chemical compound C1C[C@@]2(CS(O)(=O)=O)C(=O)C[C@@H]1C2(C)C MIOPJNTWMNEORI-GMSGAONNSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- WBYWAXJHAXSJNI-VOTSOKGWSA-M .beta-Phenylacrylic acid Natural products [O-]C(=O)\C=C\C1=CC=CC=C1 WBYWAXJHAXSJNI-VOTSOKGWSA-M 0.000 description 1
- ZORQXIQZAOLNGE-UHFFFAOYSA-N 1,1-difluorocyclohexane Chemical compound FC1(F)CCCCC1 ZORQXIQZAOLNGE-UHFFFAOYSA-N 0.000 description 1
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 1
- CSNIZNHTOVFARY-UHFFFAOYSA-N 1,2-benzothiazole Chemical group C1=CC=C2C=NSC2=C1 CSNIZNHTOVFARY-UHFFFAOYSA-N 0.000 description 1
- KTZQTRPPVKQPFO-UHFFFAOYSA-N 1,2-benzoxazole Chemical group C1=CC=C2C=NOC2=C1 KTZQTRPPVKQPFO-UHFFFAOYSA-N 0.000 description 1
- QFMZQPDHXULLKC-UHFFFAOYSA-N 1,2-bis(diphenylphosphino)ethane Chemical compound C=1C=CC=CC=1P(C=1C=CC=CC=1)CCP(C=1C=CC=CC=1)C1=CC=CC=C1 QFMZQPDHXULLKC-UHFFFAOYSA-N 0.000 description 1
- DDMOUSALMHHKOS-UHFFFAOYSA-N 1,2-dichloro-1,1,2,2-tetrafluoroethane Chemical compound FC(F)(Cl)C(F)(F)Cl DDMOUSALMHHKOS-UHFFFAOYSA-N 0.000 description 1
- ZWNWCROZSHWHSF-UHFFFAOYSA-N 1,3,4,6,7,8,9,9a-octahydropyrazino[2,1-c][1,4]oxazine Chemical compound C1COCC2CNCCN21 ZWNWCROZSHWHSF-UHFFFAOYSA-N 0.000 description 1
- BCMCBBGGLRIHSE-UHFFFAOYSA-N 1,3-benzoxazole Chemical group C1=CC=C2OC=NC2=C1 BCMCBBGGLRIHSE-UHFFFAOYSA-N 0.000 description 1
- SGUVLZREKBPKCE-UHFFFAOYSA-N 1,5-diazabicyclo[4.3.0]-non-5-ene Chemical compound C1CCN=C2CCCN21 SGUVLZREKBPKCE-UHFFFAOYSA-N 0.000 description 1
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimide Substances CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 1
- FHPJZSIIXUQGQE-JVZYCSMKSA-N 1-[(2r,3r,4s,5r)-5-azido-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]pyrimidine-2,4-dione Chemical compound O[C@@H]1[C@H](O)[C@](CO)(N=[N+]=[N-])O[C@H]1N1C(=O)NC(=O)C=C1 FHPJZSIIXUQGQE-JVZYCSMKSA-N 0.000 description 1
- UHDGCWIWMRVCDJ-UHFFFAOYSA-N 1-beta-D-Xylofuranosyl-NH-Cytosine Chemical class O=C1N=C(N)C=CN1C1C(O)C(O)C(CO)O1 UHDGCWIWMRVCDJ-UHFFFAOYSA-N 0.000 description 1
- AMMPLVWPWSYRDR-UHFFFAOYSA-N 1-methylbicyclo[2.2.2]oct-2-ene-4-carboxylic acid Chemical compound C1CC2(C(O)=O)CCC1(C)C=C2 AMMPLVWPWSYRDR-UHFFFAOYSA-N 0.000 description 1
- 101800001779 2'-O-methyltransferase Proteins 0.000 description 1
- YRAJNWYBUCUFBD-UHFFFAOYSA-N 2,2,6,6-tetramethylheptane-3,5-dione Chemical compound CC(C)(C)C(=O)CC(=O)C(C)(C)C YRAJNWYBUCUFBD-UHFFFAOYSA-N 0.000 description 1
- DJWDAKFSDBOQJK-UHFFFAOYSA-N 2,5-diazabicyclo[2.2.2]octane Chemical compound C1NC2CCC1NC2 DJWDAKFSDBOQJK-UHFFFAOYSA-N 0.000 description 1
- UDSAJFSYJMHNFI-UHFFFAOYSA-N 2,6-diazaspiro[3.3]heptane Chemical compound C1NCC11CNC1 UDSAJFSYJMHNFI-UHFFFAOYSA-N 0.000 description 1
- 125000000954 2-hydroxyethyl group Chemical group [H]C([*])([H])C([H])([H])O[H] 0.000 description 1
- UPHOPMSGKZNELG-UHFFFAOYSA-N 2-hydroxynaphthalene-1-carboxylic acid Chemical group C1=CC=C2C(C(=O)O)=C(O)C=CC2=C1 UPHOPMSGKZNELG-UHFFFAOYSA-N 0.000 description 1
- 108020005345 3' Untranslated Regions Proteins 0.000 description 1
- LKDJYZBKCVSODK-UHFFFAOYSA-N 3,8-diazabicyclo[3.2.1]octane Chemical compound C1NCC2CCC1N2 LKDJYZBKCVSODK-UHFFFAOYSA-N 0.000 description 1
- XLZYKTYMLBOINK-UHFFFAOYSA-N 3-(4-hydroxybenzoyl)benzoic acid Chemical compound OC(=O)C1=CC=CC(C(=O)C=2C=CC(O)=CC=2)=C1 XLZYKTYMLBOINK-UHFFFAOYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- ZRPLANDPDWYOMZ-UHFFFAOYSA-N 3-cyclopentylpropionic acid Chemical compound OC(=O)CCC1CCCC1 ZRPLANDPDWYOMZ-UHFFFAOYSA-N 0.000 description 1
- QOXOZONBQWIKDA-UHFFFAOYSA-N 3-hydroxypropyl Chemical group [CH2]CCO QOXOZONBQWIKDA-UHFFFAOYSA-N 0.000 description 1
- 125000006201 3-phenylpropyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- RJWBTWIBUIGANW-UHFFFAOYSA-N 4-chlorobenzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=C(Cl)C=C1 RJWBTWIBUIGANW-UHFFFAOYSA-N 0.000 description 1
- QJMYXHKGEGNLED-UHFFFAOYSA-N 5-(2-hydroxyethylamino)-1h-pyrimidine-2,4-dione Chemical compound OCCNC1=CNC(=O)NC1=O QJMYXHKGEGNLED-UHFFFAOYSA-N 0.000 description 1
- AMKGKYQBASDDJB-UHFFFAOYSA-N 9$l^{2}-borabicyclo[3.3.1]nonane Chemical compound C1CCC2CCCC1[B]2 AMKGKYQBASDDJB-UHFFFAOYSA-N 0.000 description 1
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 1
- 241000256118 Aedes aegypti Species 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 208000006820 Arthralgia Diseases 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- 208000008035 Back Pain Diseases 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- 239000002126 C01EB10 - Adenosine Chemical class 0.000 description 1
- QWOJMRHUQHTCJG-UHFFFAOYSA-N CC([CH2-])=O Chemical compound CC([CH2-])=O QWOJMRHUQHTCJG-UHFFFAOYSA-N 0.000 description 1
- WWZKQHOCKIZLMA-UHFFFAOYSA-N Caprylic acid Natural products CCCCCCCC(O)=O WWZKQHOCKIZLMA-UHFFFAOYSA-N 0.000 description 1
- WBYWAXJHAXSJNI-SREVYHEPSA-N Cinnamic acid Chemical compound OC(=O)\C=C/C1=CC=CC=C1 WBYWAXJHAXSJNI-SREVYHEPSA-N 0.000 description 1
- 206010009192 Circulatory collapse Diseases 0.000 description 1
- 208000003322 Coinfection Diseases 0.000 description 1
- UHDGCWIWMRVCDJ-PSQAKQOGSA-N Cytidine Chemical class O=C1N=C(N)C=CN1[C@@H]1[C@@H](O)[C@@H](O)[C@H](CO)O1 UHDGCWIWMRVCDJ-PSQAKQOGSA-N 0.000 description 1
- RGHNJXZEOKUKBD-UHFFFAOYSA-N D-gluconic acid Chemical group OCC(O)C(O)C(O)C(O)C(O)=O RGHNJXZEOKUKBD-UHFFFAOYSA-N 0.000 description 1
- 108020004414 DNA Proteins 0.000 description 1
- 108090000626 DNA-directed RNA polymerases Proteins 0.000 description 1
- 102000004163 DNA-directed RNA polymerases Human genes 0.000 description 1
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 1
- 239000004375 Dextrin Substances 0.000 description 1
- 229920001353 Dextrin Polymers 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 206010014596 Encephalitis Japanese B Diseases 0.000 description 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 1
- 208000015220 Febrile disease Diseases 0.000 description 1
- 238000005863 Friedel-Crafts acylation reaction Methods 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- NYHBQMYGNKIUIF-UUOKFMHZSA-N Guanosine Chemical class C1=NC=2C(=O)NC(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O NYHBQMYGNKIUIF-UUOKFMHZSA-N 0.000 description 1
- 239000007821 HATU Substances 0.000 description 1
- 229910004373 HOAc Inorganic materials 0.000 description 1
- 206010019233 Headaches Diseases 0.000 description 1
- 206010019695 Hepatic neoplasm Diseases 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000600434 Homo sapiens Putative uncharacterized protein encoded by MIR7-3HG Proteins 0.000 description 1
- 238000009015 Human TaqMan MicroRNA Assay kit Methods 0.000 description 1
- 206010020880 Hypertrophy Diseases 0.000 description 1
- 229930010555 Inosine Chemical class 0.000 description 1
- UGQMRVRMYYASKQ-KQYNXXCUSA-N Inosine Chemical class O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C2=NC=NC(O)=C2N=C1 UGQMRVRMYYASKQ-KQYNXXCUSA-N 0.000 description 1
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 1
- 201000005807 Japanese encephalitis Diseases 0.000 description 1
- 241000710842 Japanese encephalitis virus Species 0.000 description 1
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 1
- AHLPHDHHMVZTML-BYPYZUCNSA-N L-Ornithine Chemical compound NCCC[C@H](N)C(O)=O AHLPHDHHMVZTML-BYPYZUCNSA-N 0.000 description 1
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- 229930182816 L-glutamine Natural products 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 1
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 241000282560 Macaca mulatta Species 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 229920000881 Modified starch Polymers 0.000 description 1
- TXXHDPDFNKHHGW-CCAGOZQPSA-N Muconic acid Chemical group OC(=O)\C=C/C=C\C(O)=O TXXHDPDFNKHHGW-CCAGOZQPSA-N 0.000 description 1
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 1
- MKYBYDHXWVHEJW-UHFFFAOYSA-N N-[1-oxo-1-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)propan-2-yl]-2-[[3-(trifluoromethoxy)phenyl]methylamino]pyrimidine-5-carboxamide Chemical compound O=C(C(C)NC(=O)C=1C=NC(=NC=1)NCC1=CC(=CC=C1)OC(F)(F)F)N1CC2=C(CC1)NN=N2 MKYBYDHXWVHEJW-UHFFFAOYSA-N 0.000 description 1
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Chemical compound BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 1
- MBBZMMPHUWSWHV-BDVNFPICSA-N N-methylglucamine Chemical compound CNC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO MBBZMMPHUWSWHV-BDVNFPICSA-N 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- 108090001074 Nucleocapsid Proteins Proteins 0.000 description 1
- AHLPHDHHMVZTML-UHFFFAOYSA-N Orn-delta-NH2 Natural products NCCCC(N)C(O)=O AHLPHDHHMVZTML-UHFFFAOYSA-N 0.000 description 1
- UTJLXEIPEHZYQJ-UHFFFAOYSA-N Ornithine Natural products OC(=O)C(C)CCCN UTJLXEIPEHZYQJ-UHFFFAOYSA-N 0.000 description 1
- 108091036407 Polyadenylation Proteins 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- 102100037401 Putative uncharacterized protein encoded by MIR7-3HG Human genes 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- 239000012979 RPMI medium Substances 0.000 description 1
- 239000012980 RPMI-1640 medium Substances 0.000 description 1
- 206010037870 Rash morbilliform Diseases 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- 239000012317 TBTU Substances 0.000 description 1
- QYTDEUPAUMOIOP-UHFFFAOYSA-N TEMPO Chemical group CC1(C)CCCC(C)(C)N1[O] QYTDEUPAUMOIOP-UHFFFAOYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- 208000005485 Thrombocytosis Diseases 0.000 description 1
- GSEJCLTVZPLZKY-UHFFFAOYSA-N Triethanolamine Chemical compound OCCN(CCO)CCO GSEJCLTVZPLZKY-UHFFFAOYSA-N 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 1
- 208000028227 Viral hemorrhagic fever Diseases 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- 206010047700 Vomiting Diseases 0.000 description 1
- CIUQDSCDWFSTQR-UHFFFAOYSA-N [C]1=CC=CC=C1 Chemical compound [C]1=CC=CC=C1 CIUQDSCDWFSTQR-UHFFFAOYSA-N 0.000 description 1
- CLZISMQKJZCZDN-UHFFFAOYSA-N [benzotriazol-1-yloxy(dimethylamino)methylidene]-dimethylazanium Chemical compound C1=CC=C2N(OC(N(C)C)=[N+](C)C)N=NC2=C1 CLZISMQKJZCZDN-UHFFFAOYSA-N 0.000 description 1
- QQIRAVWVGBTHMJ-UHFFFAOYSA-N [dimethyl-(trimethylsilylamino)silyl]methane;lithium Chemical compound [Li].C[Si](C)(C)N[Si](C)(C)C QQIRAVWVGBTHMJ-UHFFFAOYSA-N 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 229960005305 adenosine Drugs 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 235000004279 alanine Nutrition 0.000 description 1
- 150000001299 aldehydes Chemical class 0.000 description 1
- 229910001413 alkali metal ion Inorganic materials 0.000 description 1
- 125000004183 alkoxy alkyl group Chemical group 0.000 description 1
- 125000004471 alkyl aminosulfonyl group Chemical group 0.000 description 1
- 125000005115 alkyl carbamoyl group Chemical group 0.000 description 1
- 125000004644 alkyl sulfinyl group Chemical group 0.000 description 1
- 125000005466 alkylenyl group Chemical group 0.000 description 1
- HMFHBZSHGGEWLO-AIHAYLRMSA-N alpha-D-ribose Chemical compound OC[C@H]1O[C@H](O)[C@H](O)[C@@H]1O HMFHBZSHGGEWLO-AIHAYLRMSA-N 0.000 description 1
- 150000001371 alpha-amino acids Chemical class 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 125000004103 aminoalkyl group Chemical group 0.000 description 1
- 208000007502 anemia Diseases 0.000 description 1
- 239000008365 aqueous carrier Substances 0.000 description 1
- 239000008135 aqueous vehicle Substances 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 235000021311 artificial sweeteners Nutrition 0.000 description 1
- 125000005100 aryl amino carbonyl group Chemical group 0.000 description 1
- 125000005141 aryl amino sulfonyl group Chemical group 0.000 description 1
- 125000005116 aryl carbamoyl group Chemical group 0.000 description 1
- 125000005129 aryl carbonyl group Chemical group 0.000 description 1
- 150000005840 aryl radicals Chemical class 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 125000002393 azetidinyl group Chemical group 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- 125000004618 benzofuryl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 description 1
- GONOPSZTUGRENK-UHFFFAOYSA-N benzyl(trichloro)silane Chemical compound Cl[Si](Cl)(Cl)CC1=CC=CC=C1 GONOPSZTUGRENK-UHFFFAOYSA-N 0.000 description 1
- 125000001584 benzyloxycarbonyl group Chemical group C(=O)(OCC1=CC=CC=C1)* 0.000 description 1
- DRTQHJPVMGBUCF-PSQAKQOGSA-N beta-L-uridine Natural products O[C@H]1[C@@H](O)[C@H](CO)O[C@@H]1N1C(=O)NC(=O)C=C1 DRTQHJPVMGBUCF-PSQAKQOGSA-N 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 229920002988 biodegradable polymer Polymers 0.000 description 1
- 239000004621 biodegradable polymer Substances 0.000 description 1
- 239000004305 biphenyl Substances 0.000 description 1
- 235000010290 biphenyl Nutrition 0.000 description 1
- AZWXAPCAJCYGIA-UHFFFAOYSA-N bis(2-methylpropyl)alumane Chemical compound CC(C)C[AlH]CC(C)C AZWXAPCAJCYGIA-UHFFFAOYSA-N 0.000 description 1
- SIPUZPBQZHNSDW-UHFFFAOYSA-N bis(2-methylpropyl)aluminum Chemical compound CC(C)C[Al]CC(C)C SIPUZPBQZHNSDW-UHFFFAOYSA-N 0.000 description 1
- 208000034158 bleeding Diseases 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 235000014121 butter Nutrition 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 238000010805 cDNA synthesis kit Methods 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 125000002837 carbocyclic group Chemical group 0.000 description 1
- 150000001721 carbon Chemical group 0.000 description 1
- 150000001722 carbon compounds Chemical class 0.000 description 1
- 239000001569 carbon dioxide Substances 0.000 description 1
- 229910002092 carbon dioxide Inorganic materials 0.000 description 1
- 229960004424 carbon dioxide Drugs 0.000 description 1
- 238000001460 carbon-13 nuclear magnetic resonance spectrum Methods 0.000 description 1
- 125000005587 carbonate group Chemical group 0.000 description 1
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 1
- 125000004181 carboxyalkyl group Chemical group 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- 230000005779 cell damage Effects 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 238000010568 chiral column chromatography Methods 0.000 description 1
- KYKAJFCTULSVSH-UHFFFAOYSA-N chloro(fluoro)methane Chemical compound F[C]Cl KYKAJFCTULSVSH-UHFFFAOYSA-N 0.000 description 1
- 235000013985 cinnamic acid Nutrition 0.000 description 1
- 229930016911 cinnamic acid Natural products 0.000 description 1
- 235000015165 citric acid Nutrition 0.000 description 1
- 238000002648 combination therapy Methods 0.000 description 1
- 239000000306 component Substances 0.000 description 1
- 238000013329 compounding Methods 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- UHDGCWIWMRVCDJ-ZAKLUEHWSA-N cytidine Chemical class O=C1N=C(N)C=CN1[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O1 UHDGCWIWMRVCDJ-ZAKLUEHWSA-N 0.000 description 1
- 231100000433 cytotoxic Toxicity 0.000 description 1
- 230000001472 cytotoxic effect Effects 0.000 description 1
- 230000007850 degeneration Effects 0.000 description 1
- 230000001934 delay Effects 0.000 description 1
- 230000000368 destabilizing effect Effects 0.000 description 1
- 229910052805 deuterium Inorganic materials 0.000 description 1
- 235000019425 dextrin Nutrition 0.000 description 1
- 125000004985 dialkyl amino alkyl group Chemical group 0.000 description 1
- 125000004663 dialkyl amino group Chemical group 0.000 description 1
- 125000005117 dialkylcarbamoyl group Chemical group 0.000 description 1
- 125000000664 diazo group Chemical group [N-]=[N+]=[*] 0.000 description 1
- 238000006193 diazotization reaction Methods 0.000 description 1
- WMKGGPCROCCUDY-PHEQNACWSA-N dibenzylideneacetone Chemical compound C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 WMKGGPCROCCUDY-PHEQNACWSA-N 0.000 description 1
- UMNKXPULIDJLSU-UHFFFAOYSA-N dichlorofluoromethane Chemical compound FC(Cl)Cl UMNKXPULIDJLSU-UHFFFAOYSA-N 0.000 description 1
- 229940099364 dichlorofluoromethane Drugs 0.000 description 1
- 229940087091 dichlorotetrafluoroethane Drugs 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 150000002009 diols Chemical group 0.000 description 1
- 230000006806 disease prevention Effects 0.000 description 1
- 238000004821 distillation Methods 0.000 description 1
- BOBUBHOXRCYKLI-UHFFFAOYSA-N ditert-butyl(cyclopenta-2,4-dien-1-yl)phosphane;iron(2+);(2,3,4,5-tetraphenylcyclopenta-1,4-dien-1-yl)benzene Chemical compound [Fe+2].CC(C)(C)P(C(C)(C)C)C1=CC=C[CH-]1.C1=CC=CC=C1C1=C(C=2C=CC=CC=2)[C-](C=2C=CC=CC=2)C(C=2C=CC=CC=2)=C1C1=CC=CC=C1 BOBUBHOXRCYKLI-UHFFFAOYSA-N 0.000 description 1
- MOTZDAYCYVMXPC-UHFFFAOYSA-N dodecyl hydrogen sulfate Chemical group CCCCCCCCCCCCOS(O)(=O)=O MOTZDAYCYVMXPC-UHFFFAOYSA-N 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 239000008298 dragée Substances 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- 239000000890 drug combination Substances 0.000 description 1
- 238000012377 drug delivery Methods 0.000 description 1
- 241001493065 dsRNA viruses Species 0.000 description 1
- 238000002330 electrospray ionisation mass spectrometry Methods 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 239000002702 enteric coating Substances 0.000 description 1
- 238000009505 enteric coating Methods 0.000 description 1
- 210000002615 epidermis Anatomy 0.000 description 1
- 230000032050 esterification Effects 0.000 description 1
- 238000005886 esterification reaction Methods 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- AFAXGSQYZLGZPG-UHFFFAOYSA-N ethanedisulfonic acid Chemical compound OS(=O)(=O)CCS(O)(=O)=O AFAXGSQYZLGZPG-UHFFFAOYSA-N 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 239000002360 explosive Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 239000006260 foam Substances 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 238000001640 fractional crystallisation Methods 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 235000011087 fumaric acid Nutrition 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- UHBYWPGGCSDKFX-VKHMYHEASA-N gamma-carboxy-L-glutamic acid Chemical compound OC(=O)[C@@H](N)CC(C(O)=O)C(O)=O UHBYWPGGCSDKFX-VKHMYHEASA-N 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 239000007903 gelatin capsule Substances 0.000 description 1
- 239000003349 gelling agent Substances 0.000 description 1
- 239000000174 gluconic acid Chemical group 0.000 description 1
- 235000012208 gluconic acid Nutrition 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 235000004554 glutamine Nutrition 0.000 description 1
- 235000011187 glycerol Nutrition 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 231100000869 headache Toxicity 0.000 description 1
- 230000002008 hemorrhagic effect Effects 0.000 description 1
- 125000003187 heptyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000004634 hexahydroazepinyl group Chemical group N1(CCCCCC1)* 0.000 description 1
- FFUAGWLWBBFQJT-UHFFFAOYSA-N hexamethyldisilazane Chemical compound C[Si](C)(C)N[Si](C)(C)C FFUAGWLWBBFQJT-UHFFFAOYSA-N 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 208000021760 high fever Diseases 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 235000014304 histidine Nutrition 0.000 description 1
- 239000008240 homogeneous mixture Substances 0.000 description 1
- 244000052637 human pathogen Species 0.000 description 1
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 1
- 125000004029 hydroxymethyl group Chemical group [H]OC([H])([H])* 0.000 description 1
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 1
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 1
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 1
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 1
- 125000002636 imidazolinyl group Chemical group 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 230000005934 immune activation Effects 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 230000002458 infectious effect Effects 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 229940102223 injectable solution Drugs 0.000 description 1
- 229960003786 inosine Drugs 0.000 description 1
- 239000013067 intermediate product Substances 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 1
- 229960000310 isoleucine Drugs 0.000 description 1
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 description 1
- CTAPFRYPJLPFDF-UHFFFAOYSA-N isoxazole Chemical compound C=1C=NOC=1 CTAPFRYPJLPFDF-UHFFFAOYSA-N 0.000 description 1
- 125000003965 isoxazolidinyl group Chemical group 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 210000001821 langerhans cell Anatomy 0.000 description 1
- YNESATAKKCNGOF-UHFFFAOYSA-N lithium bis(trimethylsilyl)amide Chemical compound [Li+].C[Si](C)(C)[N-][Si](C)(C)C YNESATAKKCNGOF-UHFFFAOYSA-N 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 208000014018 liver neoplasm Diseases 0.000 description 1
- 230000005923 long-lasting effect Effects 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 210000003712 lysosome Anatomy 0.000 description 1
- 230000001868 lysosomic effect Effects 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- ZLNQQNXFFQJAID-UHFFFAOYSA-L magnesium carbonate Chemical compound [Mg+2].[O-]C([O-])=O ZLNQQNXFFQJAID-UHFFFAOYSA-L 0.000 description 1
- 239000001095 magnesium carbonate Substances 0.000 description 1
- 229910000021 magnesium carbonate Inorganic materials 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 238000007726 management method Methods 0.000 description 1
- 229960002510 mandelic acid Drugs 0.000 description 1
- 238000001819 mass spectrum Methods 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 210000004779 membrane envelope Anatomy 0.000 description 1
- 229910021645 metal ion Inorganic materials 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- WBYWAXJHAXSJNI-UHFFFAOYSA-N methyl p-hydroxycinnamate Natural products OC(=O)C=CC1=CC=CC=C1 WBYWAXJHAXSJNI-UHFFFAOYSA-N 0.000 description 1
- 125000000325 methylidene group Chemical group [H]C([H])=* 0.000 description 1
- 125000004170 methylsulfonyl group Chemical group [H]C([H])([H])S(*)(=O)=O 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 238000006011 modification reaction Methods 0.000 description 1
- 235000019426 modified starch Nutrition 0.000 description 1
- 125000002950 monocyclic group Chemical group 0.000 description 1
- 125000002757 morpholinyl group Chemical group 0.000 description 1
- 238000010172 mouse model Methods 0.000 description 1
- 210000000214 mouth Anatomy 0.000 description 1
- 239000002324 mouth wash Substances 0.000 description 1
- 229940051866 mouthwash Drugs 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- KVBGVZZKJNLNJU-UHFFFAOYSA-N naphthalene-2-sulfonic acid Chemical compound C1=CC=CC2=CC(S(=O)(=O)O)=CC=C21 KVBGVZZKJNLNJU-UHFFFAOYSA-N 0.000 description 1
- 125000004593 naphthyridinyl group Chemical group N1=C(C=CC2=CC=CN=C12)* 0.000 description 1
- 229920003052 natural elastomer Polymers 0.000 description 1
- 229920001194 natural rubber Polymers 0.000 description 1
- 235000021096 natural sweeteners Nutrition 0.000 description 1
- 125000001971 neopentyl group Chemical group [H]C([*])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 230000003472 neutralizing effect Effects 0.000 description 1
- 238000006396 nitration reaction Methods 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 210000001331 nose Anatomy 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical group CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Chemical group CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- 125000002347 octyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 239000006186 oral dosage form Substances 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 150000002895 organic esters Chemical class 0.000 description 1
- 238000006053 organic reaction Methods 0.000 description 1
- 230000008520 organization Effects 0.000 description 1
- 229960003104 ornithine Drugs 0.000 description 1
- 125000000160 oxazolidinyl group Chemical group 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 125000003566 oxetanyl group Chemical group 0.000 description 1
- 239000007800 oxidant agent Substances 0.000 description 1
- 125000004043 oxo group Chemical group O=* 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- MUJIDPITZJWBSW-UHFFFAOYSA-N palladium(2+) Chemical compound [Pd+2] MUJIDPITZJWBSW-UHFFFAOYSA-N 0.000 description 1
- LXNAVEXFUKBNMK-UHFFFAOYSA-N palladium(II) acetate Substances [Pd].CC(O)=O.CC(O)=O LXNAVEXFUKBNMK-UHFFFAOYSA-N 0.000 description 1
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Chemical group OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 239000006072 paste Substances 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 239000001814 pectin Substances 0.000 description 1
- 235000010987 pectin Nutrition 0.000 description 1
- 229920001277 pectin Polymers 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- 239000003961 penetration enhancing agent Substances 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- 239000008024 pharmaceutical diluent Substances 0.000 description 1
- 229940124531 pharmaceutical excipient Drugs 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 230000003285 pharmacodynamic effect Effects 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 150000002989 phenols Chemical class 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- UYWQUFXKFGHYNT-UHFFFAOYSA-N phenylmethyl ester of formic acid Natural products O=COCC1=CC=CC=C1 UYWQUFXKFGHYNT-UHFFFAOYSA-N 0.000 description 1
- 229910000073 phosphorus hydride Inorganic materials 0.000 description 1
- 238000000053 physical method Methods 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- 125000003386 piperidinyl group Chemical group 0.000 description 1
- IUGYQRQAERSCNH-UHFFFAOYSA-N pivalic acid Chemical compound CC(C)(C)C(O)=O IUGYQRQAERSCNH-UHFFFAOYSA-N 0.000 description 1
- 229920000747 poly(lactic acid) Polymers 0.000 description 1
- 239000004626 polylactic acid Substances 0.000 description 1
- WSHYKIAQCMIPTB-UHFFFAOYSA-M potassium;2-oxo-3-(3-oxo-1-phenylbutyl)chromen-4-olate Chemical compound [K+].[O-]C=1C2=CC=CC=C2OC(=O)C=1C(CC(=O)C)C1=CC=CC=C1 WSHYKIAQCMIPTB-UHFFFAOYSA-M 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 150000003138 primary alcohols Chemical class 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 235000013930 proline Nutrition 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 239000003380 propellant Substances 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- 235000018102 proteins Nutrition 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 230000002797 proteolythic effect Effects 0.000 description 1
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 1
- 230000005180 public health Effects 0.000 description 1
- 150000003212 purines Chemical class 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 150000003230 pyrimidines Chemical class 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 229940107700 pyruvic acid Drugs 0.000 description 1
- 238000010791 quenching Methods 0.000 description 1
- 230000000171 quenching effect Effects 0.000 description 1
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 125000004621 quinuclidinyl group Chemical group N12C(CC(CC1)CC2)* 0.000 description 1
- 150000003254 radicals Chemical class 0.000 description 1
- 230000010837 receptor-mediated endocytosis Effects 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 210000002345 respiratory system Anatomy 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 229960004889 salicylic acid Drugs 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 150000003333 secondary alcohols Chemical class 0.000 description 1
- 238000013207 serial dilution Methods 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 206010040560 shock Diseases 0.000 description 1
- 229920002379 silicone rubber Polymers 0.000 description 1
- 239000004945 silicone rubber Substances 0.000 description 1
- 238000009097 single-agent therapy Methods 0.000 description 1
- 239000002002 slurry Substances 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 229940054269 sodium pyruvate Drugs 0.000 description 1
- 238000000935 solvent evaporation Methods 0.000 description 1
- 239000001593 sorbitan monooleate Substances 0.000 description 1
- 235000011069 sorbitan monooleate Nutrition 0.000 description 1
- 229940035049 sorbitan monooleate Drugs 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 230000003595 spectral effect Effects 0.000 description 1
- LBJQKYPPYSCCBH-UHFFFAOYSA-N spiro[3.3]heptane Chemical compound C1CCC21CCC2 LBJQKYPPYSCCBH-UHFFFAOYSA-N 0.000 description 1
- 239000008117 stearic acid Chemical group 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 230000000707 stereoselective effect Effects 0.000 description 1
- 208000012810 sudden onset of fever Diseases 0.000 description 1
- 125000000446 sulfanediyl group Chemical group *S* 0.000 description 1
- 229910052717 sulfur Inorganic materials 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 229920003051 synthetic elastomer Polymers 0.000 description 1
- 239000005061 synthetic rubber Substances 0.000 description 1
- 230000009897 systematic effect Effects 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 description 1
- 125000001412 tetrahydropyranyl group Chemical group 0.000 description 1
- 125000003507 tetrahydrothiofenyl group Chemical group 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- VLLMWSRANPNYQX-UHFFFAOYSA-N thiadiazole Chemical compound C1=CSN=N1.C1=CSN=N1 VLLMWSRANPNYQX-UHFFFAOYSA-N 0.000 description 1
- 125000001984 thiazolidinyl group Chemical group 0.000 description 1
- 230000008719 thickening Effects 0.000 description 1
- 125000003396 thiol group Chemical group [H]S* 0.000 description 1
- 125000004568 thiomorpholinyl group Chemical group 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 125000002088 tosyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1C([H])([H])[H])S(*)(=O)=O 0.000 description 1
- 230000037317 transdermal delivery Effects 0.000 description 1
- 238000013519 translation Methods 0.000 description 1
- CYRMSUTZVYGINF-UHFFFAOYSA-N trichlorofluoromethane Chemical compound FC(Cl)(Cl)Cl CYRMSUTZVYGINF-UHFFFAOYSA-N 0.000 description 1
- 229940029284 trichlorofluoromethane Drugs 0.000 description 1
- IMNIMPAHZVJRPE-UHFFFAOYSA-N triethylenediamine Chemical compound C1CN2CCN1CC2 IMNIMPAHZVJRPE-UHFFFAOYSA-N 0.000 description 1
- ITMCEJHCFYSIIV-UHFFFAOYSA-M triflate Chemical compound [O-]S(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-M 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- 229960000281 trometamol Drugs 0.000 description 1
- 210000004881 tumor cell Anatomy 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- DRTQHJPVMGBUCF-UHFFFAOYSA-N uracil arabinoside Natural products OC1C(O)C(CO)OC1N1C(=O)NC(=O)C=C1 DRTQHJPVMGBUCF-UHFFFAOYSA-N 0.000 description 1
- 229940045145 uridine Drugs 0.000 description 1
- 239000004474 valine Substances 0.000 description 1
- 230000008728 vascular permeability Effects 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 230000035899 viability Effects 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 230000007919 viral pathogenicity Effects 0.000 description 1
- 230000017613 viral reproduction Effects 0.000 description 1
- 210000001835 viscera Anatomy 0.000 description 1
- 239000011345 viscous material Substances 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H19/00—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof
- C07H19/02—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof sharing nitrogen
- C07H19/04—Heterocyclic radicals containing only nitrogen atoms as ring hetero atom
- C07H19/16—Purine radicals
- C07H19/20—Purine radicals with the saccharide radical esterified by phosphoric or polyphosphoric acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7052—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides
- A61K31/706—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom
- A61K31/7064—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines
- A61K31/7068—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines having oxo groups directly attached to the pyrimidine ring, e.g. cytidine, cytidylic acid
- A61K31/7072—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines having oxo groups directly attached to the pyrimidine ring, e.g. cytidine, cytidylic acid having two oxo groups directly attached to the pyrimidine ring, e.g. uridine, uridylic acid, thymidine, zidovudine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H19/00—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof
- C07H19/02—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof sharing nitrogen
- C07H19/04—Heterocyclic radicals containing only nitrogen atoms as ring hetero atom
- C07H19/06—Pyrimidine radicals
- C07H19/10—Pyrimidine radicals with the saccharide radical esterified by phosphoric or polyphosphoric acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H19/00—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof
- C07H19/02—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof sharing nitrogen
- C07H19/04—Heterocyclic radicals containing only nitrogen atoms as ring hetero atom
- C07H19/16—Purine radicals
- C07H19/20—Purine radicals with the saccharide radical esterified by phosphoric or polyphosphoric acids
- C07H19/207—Purine radicals with the saccharide radical esterified by phosphoric or polyphosphoric acids the phosphoric or polyphosphoric acids being esterified by a further hydroxylic compound, e.g. flavine adenine dinucleotide or nicotinamide-adenine dinucleotide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7052—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides
- A61K31/706—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom
- A61K31/7064—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines
- A61K31/7068—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines having oxo groups directly attached to the pyrimidine ring, e.g. cytidine, cytidylic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7052—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides
- A61K31/706—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom
- A61K31/7064—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines
- A61K31/7076—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines containing purines, e.g. adenosine, adenylic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7052—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides
- A61K31/706—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom
- A61K31/7064—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines
- A61K31/7076—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines containing purines, e.g. adenosine, adenylic acid
- A61K31/708—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines containing purines, e.g. adenosine, adenylic acid having oxo groups directly attached to the purine ring system, e.g. guanosine, guanylic acid
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Organic Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Biochemistry (AREA)
- Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Biotechnology (AREA)
- Virology (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Saccharide Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Indole Compounds (AREA)
Description
毎年、デングの局所的流行は、かなりの罹患率および死亡率、社会的混乱、ならびに入院および蚊の駆除の両方の点で、影響を受けた社会に実質的な経済的負担を引き起こす。デングは、世界保健機構(WHO)によって、最も重要な節足動物媒介性ウイルス性疾患と見なされており、毎年、世界でデング感染の5000万の症例があり、これには50万のDHF症例および24,000の死亡例が含まれる。WHOは、世界の人口の40パーセント(25億人)がDF、DHF、およびDSSに関するリスクを有すると概算している。デングはまた、NIAIDカテゴリーA病原体であり、そして生物テロ防御の観点において、海外の米軍に対する重大な脅威を代表する。デングは、キューバおよびベネズエラにおける大規模流行、ならびにテキサスおよびハワイにおける突発を含めて、過去25年間、重度の疾患の劇的な増加を伴い、北米に対して生じつつある脅威である。
ゲノムは、7つの非構造(NS)タンパク質遺伝子、ならびにヌクレオカプシドタンパク質(C)、膜会合タンパク質(M)、およびエンベロープタンパク質(E)をコードする3つの構造タンパク質遺伝子で構成される。非構造タンパク質は、ウイルスRNA複製、ウイルス組み立て、および疾患の炎症性構成要素に関与する。構造タンパク質は、主に、ウイルス粒子形成に関与する。前駆体ポリタンパク質は、細胞性プロテイナーゼによって切断されて、構造タンパク質を分離する一方、ウイルスがコードするプロテイナーゼがポリタンパク質の非構造領域を切断する。ゲノムは、キャップ化され、そして3’端にポリ(A)テールを持たないが、その代わりに、ゲノムRNAの安定性および複製に必要な安定ステム−ループ構造を有する。ウイルスは、Eタンパク質を通じて細胞受容体に結合し、そして受容体仲介性エンドサイトーシスの後、リソソームにおいて低pH融合を経る。
R1は、水素、C1−6ハロアルキル、またはアリールであり、ここで、前記アリールは、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6アルコキシ、ハロゲン、C1−6ハロアルキル、−N(R1a)2、C1−6アシルアミノ、−NHSO2C1−6アルキル、−SO2N(R1a)2、−SO2C1−6アルキル、−COR1b、ニトロおよびシアノからなる群より独立に選択される1〜3の置換基で場合によって置換された、フェニルまたはナフチルであり;
R1aは、独立に、水素またはC1−6アルキルであり;
R1bは、−OR1aまたは−N(R1a)2であり;
R2aおよびR2bは、(i)水素、C1−10アルキル、−(CH2)rN(R1a)2、C1−6ヒドロキシアルキル、−CH2SH、−(CH2)S(O)pMe、−(CH2)3NHC(=NH)NH2、(1H−インドル−3−イル)メチル、(1H−インドル−4−イル)メチル、−(CH2)mC(=O)R1b、アリールおよびアリールC1−3アルキルからなる群より独立に選択され、前記アリール基は、ヒドロキシル、C1−10アルキル、C1−6アルコキシ、ハロゲン、ニトロおよびシアノからなる群より選択される基で場合によって置換されるか;(ii)R2aは水素であり、そしてR2bおよびR4は、一緒に、(CH2)3であるか;(iii)R2aおよびR2bは、一緒に、(CH2)nであるか;または(iv)R2aおよびR2bは、どちらもC1−6アルキルであり;
R3は、水素、C1−10アルキル、C1−10ハロアルキル、アリールまたはアリール−C1−3アルキルであり、ここで、前記アリールはフェニルであり;
R4は、水素、C1−3アルキルであるか、またはR2bおよびR4は、一緒に、(CH2)3であり;
R6は、A、B、CまたはDであり、ここで、R8は水素またはC1−3アルキルであり;
R5およびR7は、水素、C(=O)C1−6アルキル、C(=O)R1bより独立に選択され;
mは、0〜3であり;
nは、4または5であり;
pは、0〜2であり;そして
rは、1〜6である]
のヌクレオシド化合物、または薬学的に許容されうるその塩の、デング熱(DF)を治療するための使用、および式Iの化合物または薬学的に許容されうるその塩を、治療が必要な患者に投与する工程を含む、デング熱を治療するための方法を提供する。
本明細書において、句(1つの(「a」または「an」))実体は、その実体の1またはそれより多くを指し;例えば、(1つの(「a」))化合物は、1またはそれより多くの化合物または少なくとも1つの化合物を指す。こうしたものとして、用語「1つの(「a」または「an」)」、「1またはそれより多くの(one or more)」、および「少なくとも1つの(at least one)」は、本明細書において、交換可能に使用可能である。
(明確な頂点で連結されるのとは対照的に)環系内に引かれた結合は、その結合が、適切な環原子のいずれに付着してもよいことを示す。
本明細書で用いる技術的用語および科学的用語は、別に定義しない限り、本発明が関連する技術分野の当業者に一般的に理解される意味を有する。本明細書において、当業者に知られる多様な方法論および材料に言及する。薬理学の一般的な原理を示す標準的な参考文献には、GoodmanおよびGilmanのThe Pharmacological Basis of Therapeutics, 第10版, McGraw Hill Companies Inc., ニューヨーク(2001)が含まれる。当業者に知られる任意の適切な材料および/または方法を、本発明の実施に利用してもよい。しかし、好ましい材料および方法を記載する。以下の説明および実施例に言及する材料、試薬等は、別に示さない限り、商業的供給源から得られうる。
用語「アルキル」は、本明細書において、1〜10の炭素原子を含有する、非分枝鎖または分枝鎖、飽和、一価炭化水素残基を示す。用語「より低次のアルキル」は、1〜6炭素原子を含有する、直鎖または分枝鎖炭化水素残基を示す。「C1−10アルキル」は、本明細書において、1〜10炭素で構成されるアルキルを指す。アルキル基の例には、限定されるわけではないが、より低次のアルキル基が含まれ、これにはメチル、エチル、プロピル、i−プロピル、n−ブチル、i−ブチル、t−ブチルまたはペンチル、イソペンチル、ネオペンチル、ヘキシル、ヘプチル、およびオクチルが含まれる。
用語「ハロアルコキシ」または「ハロ−より低次のアルコキシ」または「より低次のハロアルコキシ」は、1またはそれより多い炭素原子が、1またはそれより多いハロゲン原子で置換された、より低次のアルコキシ基を指す。
本出願は、式I:
R1は、水素、C1−6ハロアルキル、またはアリールであり、ここで、前記アリールは、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6アルコキシ、ハロゲン、C1−6ハロアルキル、−N(R1a)2、C1−6アシルアミノ、−NHSO2C1−6アルキル、−SO2N(R1a)2、−SO2C1−6アルキル、−COR1b、ニトロおよびシアノからなる群より独立に選択される1〜3の置換基で場合によって置換された、フェニルまたはナフチルであり;
R1aは、独立に、水素またはC1−6アルキルであり;
R1bは、−OR1aまたは−N(R1a)2であり;
R2aおよびR2bは、(i)水素、C1−10アルキル、−(CH2)rN(R1a)2、C1−6ヒドロキシアルキル、−CH2SH、−(CH2)S(O)pMe、−(CH2)3NHC(=NH)NH2、(1H−インドル−3−イル)メチル、(1H−インドル−4−イル)メチル、−(CH2)mC(=O)R1b、アリールおよびアリールC1−3アルキルからなる群より独立に選択され、前記アリール基は、ヒドロキシル、C1−10アルキル、C1−6アルコキシ、ハロゲン、ニトロおよびシアノからなる群より選択される基で場合によって置換されるか;(ii)R2aは水素であり、そしてR2bおよびR4は、一緒に、(CH2)3であるか;(iii)R2aおよびR2bは、一緒に、(CH2)nであるか;または(iv)R2aおよびR2bは、どちらもC1−6アルキルであり;
R3は、水素、C1−10アルキル、C1−10ハロアルキル、アリールまたはアリール−C1−3アルキルであり、ここで、前記アリールはフェニルであり;
R4は、水素、C1−3アルキルであるか、またはR2bおよびR4は、一緒に、(CH2)3であり;
R6は、A、B、CまたはDであり、ここで、R8は水素またはC1−3アルキルであり;
R5およびR7は、水素、C(=O)C1−6アルキル、C(=O)R1bより独立に選択され;
mは、0〜3であり;
nは、4または5であり;
pは、0〜2であり;そして
rは、1〜6である]
の化合物、または薬学的に許容されうるその塩を、治療が必要な患者に投与する工程を含む、デング熱を治療するための方法を提供する。
R1は、水素、C1−6ハロアルキル、またはアリールであり、ここで、前記アリールは、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6アルコキシ、ハロゲン、C1−6ハロアルキル、−N(R1a)2、C1−6アシルアミノ、−NHSO2C1−6アルキル、−SO2N(R1a)2、−SO2C1−6アルキル、−COR1b、ニトロおよびシアノからなる群より独立に選択される1〜3の置換基で場合によって置換された、フェニルまたはナフチルであり;
R1aは、独立に、水素またはC1−6アルキルであり;
R1bは、−OR1aまたは−N(R1a)2であり;
R2aおよびR2bは、(i)水素、C1−10アルキル、−(CH2)rN(R1a)2、C1−6ヒドロキシアルキル、−CH2SH、−(CH2)S(O)pMe、−(CH2)3NHC(=NH)NH2、(1H−インドル−3−イル)メチル、(1H−インドル−4−イル)メチル、−(CH2)mC(=O)R1b、アリールおよびアリールC1−3アルキルからなる群より独立に選択され、前記アリール基は、ヒドロキシル、C1−10アルキル、C1−6アルコキシ、ハロゲン、ニトロおよびシアノからなる群より選択される基で場合によって置換されるか;(ii)R2aは水素であり、そしてR2bおよびR4は、一緒に、(CH2)3であるか;(iii)R2aおよびR2bは、一緒に、(CH2)nであるか;または(iv)R2aおよびR2bは、どちらもC1−6アルキルであり;
R3は、水素、C1−10アルキル、C1−10ハロアルキル、アリールまたはアリール−C1−3アルキルであり、ここで、前記アリールはフェニルであり;
R4は、水素、C1−3アルキルであるか、またはR2bおよびR4は、一緒に、(CH2)3であり;
R5およびR7は、水素、C(=O)C1−6アルキル、C(=O)R1bより独立に選択され;
mは、0〜3であり;
nは、4または5であり;
pは、0〜2であり;そして
rは、1〜6である]
の化合物、または薬学的に許容されうるその塩を、治療が必要な患者に投与する工程を含む、デング熱を治療するための方法を提供する。
R1は、フェニル、ナフチル、またはo−メトキシフェニルであり;
R2aおよびR2bは、独立に、水素、メチル、またはベンジルであり;
R3は、メチル、エチル、またはベンジルであり;
R4はHであり;
R5およびR7は、どちらも、H、−C(=O)Et、または−C(=O)Buであり;そして
R8はHである;
上記方法を提供する。
R1は、フェニルまたはナフチルであり;
R2aは水素であり、そしてR2bはメチルであり;
R3は、エチルまたはベンジルであり;そして
R5およびR7は、どちらも、Hまたは−C(=O)Etである
上記方法を提供する。
R1はナフチルであり;
R2aは水素であり、そしてR2bはメチルであり;
R3はベンジルであり;そして
R5およびR7は、どちらもHである;
上記方法を提供する。
R1はナフチルであり;
R2aはHであり、そしてR2bはベンジルであり;
R3はエチルであり;
R4はHであり;
R5はHであり;
R6はAであり;
R7はHであり;そして
R8はHである;
上記方法のいずれかを提供する。
R1はナフチルであり;
R2aはHであり、そしてR2bはベンジルであり;
R3はベンジルであり;
R4はHであり;
R5はHであり;
R6はAであり;そして
R7はHである;
上記方法のいずれかを提供する。
R1はフェニルであり;
R2aはHであり、そしてR2bはメチルであり;
R3はベンジルであり;
R4はHであり;
R5はHであり;
R6はCであり;そして
R7はHである;
上記方法のいずれかを提供する。
(S)−2−[[(2R,3S,4R,5R)−5−(6−アミノ−プリン−9−イル)−2−アジド−3,4−ジヒドロキシ−テトラヒドロ−フラン−2−イルメトキシ]−(ナフタレン−1−イルオキシ)−ホスホリルアミノ]−プロピオン酸エチルエステル;
(S)−2−{[(2R,3S,4R,5R)−5−(6−アミノ−プリン−9−イル)−2−アジド−3,4−ジヒドロキシ−テトラヒドロ−フラン−2−イルメトキシ]−フェノキシ−ホスホリルアミノ}−プロピオン酸ベンジルエステル;
(S)−2−{[(2R,3S,4R,5R)−5−(4−アミノ−2−オキソ−2H−ピリミジン−1−イル)−2−アジド−3,4−ジヒドロキシ−テトラヒドロ−フラン−2−イルメトキシ]−フェノキシ−ホスホリルアミノ}−プロピオン酸メチルエステル;
ペンタン酸(2R,3S,4R,5R)−5−(4−アミノ−2−オキソ−2H−ピリミジン−1−イル)−2−アジド−2−[((S)−1−ベンジルオキシカルボニル−エチルアミノ)−(2−メトキシ−フェノキシ)−ホスホリルオキシメチル]−4−ペンタノイルオキシ−テトラヒドロ−フラン−3−イルエステル;
(S)−2−[[(2R,3S,4R,5R)−5−(4−アミノ−2−オキソ−2H−ピリミジン−1−イル)−2−アジド−3,4−ジヒドロキシ−テトラヒドロ−フラン−2−イルメトキシ]−(ナフタレン−1−イルオキシ)−ホスホリルアミノ]−プロピオン酸ベンジルエステル;
(S)−2−[[(2R,3S,4R,5R)−2−アジド−5−(2,4−ジオキソ−3,4−ジヒドロ−2H−ピリミジン−1−イル)−3,4−ジヒドロキシ−テトラヒドロ−フラン−2−イルメトキシ]−(ナフタレン−1−イルオキシ)−ホスホリルアミノ]−プロピオン酸ベンジルエステル;
(S)−2−[[(2R,3S,4R,5R)−2−アジド−5−(2,4−ジオキソ−3,4−ジヒドロ−2H−ピリミジン−1−イル)−3,4−ジヒドロキシ−テトラヒドロ−フラン−2−イルメトキシ]−(ナフタレン−1−イルオキシ)−ホスホリルアミノ]−ペンタンジオン酸ジエチルエステル;
(S)−2−{[(2R,3S,4R,5R)−2−アジド−5−(2,4−ジオキソ−3,4−ジヒドロ−2H−ピリミジン−1−イル)−3,4−ビス−プロピオニルオキシ−テトラヒドロ−フラン−2−イルメトキシ]−フェノキシ−ホスホリルアミノ}−プロピオン酸エチルエステル;
(S)−2−[[(2R,3S,4R,5R)−2−アジド−5−(2,4−ジオキソ−3,4−ジヒドロ−2H−ピリミジン−1−イル)−3,4−ジヒドロキシ−テトラヒドロ−フラン−2−イルメトキシ]−(ナフタレン−1−イルオキシ)−ホスホリルアミノ]−3−フェニル−プロピオン酸ベンジルエステル;および
(S)−2−[[(2R,3S,4R,5R)−2−アジド−5−(2,4−ジオキソ−3,4−ジヒドロ−2H−ピリミジン−1−イル)−3,4−ジヒドロキシ−テトラヒドロ−フラン−2−イルメトキシ]−(ナフタレン−1−イルオキシ)−ホスホリルアミノ]−3−フェニル−プロピオン酸エチルエステル;
からなる群より選択される化合物を、治療の必要がある患者に投与する工程を含む、デング熱を治療するための方法を提供する。
本出願は:
ペンタン酸(2R,3S,4R,5R)−5−(4−アミノ−2−オキソ−2H−ピリミジン−1−イル)−2−アジド−2−[((S)−1−ベンジルオキシカルボニル−エチルアミノ)−(2−メトキシ−フェノキシ)−ホスホリルオキシメチル]−4−ペンタノイルオキシ−テトラヒドロ−フラン−3−イルエステル;
(S)−2−[[(2R,3S,4R,5R)−2−アジド−5−(2,4−ジオキソ−3,4−ジヒドロ−2H−ピリミジン−1−イル)−3,4−ジヒドロキシ−テトラヒドロ−フラン−2−イルメトキシ]−(ナフタレン−1−イルオキシ)−ホスホリルアミノ]−ペンタンジオン酸ジエチルエステル;
(S)−2−{[(2R,3S,4R,5R)−2−アジド−5−(2,4−ジオキソ−3,4−ジヒドロ−2H−ピリミジン−1−イル)−3,4−ビス−プロピオニルオキシ−テトラヒドロ−フラン−2−イルメトキシ]−フェノキシ−ホスホリルアミノ}−プロピオン酸エチルエステル;
(S)−2−[[(2R,3S,4R,5R)−2−アジド−5−(2,4−ジオキソ−3,4−ジヒドロ−2H−ピリミジン−1−イル)−3,4−ジヒドロキシ−テトラヒドロ−フラン−2−イルメトキシ]−(ナフタレン−1−イルオキシ)−ホスホリルアミノ]−3−フェニル−プロピオン酸ベンジルエステル;および
(S)−2−[[(2R,3S,4R,5R)−2−アジド−5−(2,4−ジオキソ−3,4−ジヒドロ−2H−ピリミジン−1−イル)−3,4−ジヒドロキシ−テトラヒドロ−フラン−2−イルメトキシ]−(ナフタレン−1−イルオキシ)−ホスホリルアミノ]−3−フェニル−プロピオン酸エチルエステル;
からなる群より選択される、化合物を提供する。
デング熱の治療に有用な、本明細書に開示するような一般式Iの以下の代表的な化合物を、以下の表1に提供する。それに続く実施例および調製を提供して、当業者が本発明をより明らかに理解し、そして実施することを可能にする。これらが本発明の範囲を限定すると見なすべきではなく、単に例示でありそして代表であると見なすべきである。
表I
一般的なスキーム
本発明のホスホロアミデート化合物は、4’−アジドヌクレオシド4と、適切に置換されたホスホクロリデート化合物3を、強塩基の存在下で縮重することによって調製可能である(スキーム1)。本発明のヌクレオシドは、典型的には、場合によって置換されたピリミジン(R6=AまたはB)またはプリン(R6=CまたはD)を含有し、そしてR5およびR7の一方または両方は、水素またはアシルまたはカルバモイルまたはアルコキシカルボニルである。本発明の化合物を調製するのに用いる4’−サジド(sazido)ヌクレオシドの例は、4’−アジドアデノシンまたは4’−アジドウリジンであってもよく、これは限定を意図せず、そして本発明のヌクレオシドの範囲は請求項中に見出されうる。縮重は、保護されないヌクレオシドに対して実行可能であるし、あるいは、ヌクレオシドの2’,3’−ヒドロキシ基は、当該技術分野に知られるアセトニドまたは他のジオール保護基として保護可能である。縮重後のヌクレオシドの脱保護は、核酸化学反応のための標準的なプロトコルを利用して実行される。
用語「アミノ酸」は、本明細書において、天然存在αアミノカルボン酸、ならびにその光学異性体(エナンチオマーおよびジアステレオマー)、合成類似体および誘導体を指す。α−アミノ酸は、カルボキシル基、アミノ基、水素原子およびユニークな「側鎖」基に結合した炭素原子を含む。用語「天然存在アミノ酸」は、天然存在アミノ酸のL−異性体を意味する。天然存在アミノ酸は、グリシン、アラニン、バリン、ロイシン、イソロイシン、セリン、メチオニン、スレオニン、フェニルアラニン、チロシン、トリプトファン、システイン、プロリン、ヒスチジン、アスパラギン酸、アスパラギン、グルタミン酸、グルタミン、γ−カルボキシグルタミン酸、アルギニン、オルニチンおよびリジンである。天然存在アミノ酸の側鎖には:水素、メチル、イソ−プロピル、イソ−ブチル、sec−ブチル、−CH2OH、−CH(OH)CH3、−CH2SH、−CH2CH2SMe、−(CH2)pCOR、ここで、Rは、−OHまたは−NH2であり、そしてpは1または2である、−(CH2)q−NH2、ここで、qは3または4である、−(CH2)3−NHC(=NH)NH2、−CH2C6H5、−CH2−p−C6H4−OH、(3−インドリニル)メチレン、(4−イミダゾリル)メチレンが含まれる。
いくつかの経路を通じた投与のため、本発明の化合物の薬学的組成物を本例におけるように調製した。
経口投与のための組成物(B)
非経口配合物(D)
本発明の化合物を、非常に多様な経口投与投薬型およびキャリアー中で配合してもよい。経口投与は、錠剤、コーティング錠剤、ドラジェ、硬ゼラチンおよび軟ゼラチンカプセル、溶液、エマルジョン、シロップ、または懸濁物の形であってもよい。本発明の化合物は、他の投与経路の中でも、連続(静脈内ドリップ)局所非経口、筋内、静脈内、皮下、経皮(浸透増進剤を含んでもよい)、頬側、鼻、吸入および座薬投与を含む他の投与経路によって投与した際、有効である。好ましい投与方式は、一般的に、好適な毎日投薬措置を用いた経口であり、該投与は、苦痛の度合いおよび活性成分に対する患者の反応にしたがって、調節可能である。
適応症
本発明の化合物、ならびにその異性体型および薬学的に許容されうる塩は、デングウイルス感染を治療し、そして防止する際に有用である。
本出願は、式Iの化合物を投与する工程を含む、細胞におけるデングウイルスの複製を阻害するための方法を提供する。
一般的に用いられる略語には:アセチル(Ac)、アゾ−ビス−イソブチリルニトリル(AIBN)、気圧(Atm)、9−ボラビシクロ[3.3.1]ノナン(9−BBNまたはBBN)、2,2’−ビス(ジフェニルホスフィノ)−1,1’−ビナフチル(BINAP)、tert−ブトキシカルボニル(Boc)、ジ−tert−ブチルピロカーボネートまたはboc無水物(BOC2O)、ベンジル(Bn)、ブチル(Bu)、化学情報検索登録番号(CASRN)、ベンジルオキシカルボニル(CBZまたはZ)、カルボニルジイミダゾール(CDI)、1,4−ジアザビシクロ[2.2.2]オクタン(DABCO)、ジエチルアミノイオウトリフルオリド(DAST)、ジベンジリデンアセトン(dba)、1,5−ジアザビシクロ[4.3.0]ノン−5−エン(DBN)、1,8−ジアザビシクロ[5.4.0]ウンデク−7−エン(DBU)、N,N’−ジシクロヘキシルカルボジイミド(DCC)、1,2−ジクロロエタン(DCE)、ジクロロメタン(DCM)、2,3−ジクロロ−5,6−ジシアノ−1,4−ベンゾキノン(DDQ)、ジエチルアゾジカルボキシレート(DEAD)、ジ−イソ−プロピルアゾジカルボキシレート(DIAD)、ジ−イソ−ブチルアルミニウム水素化物(DIBALまたはDIBAL−H)、ジ−イソ−プロピルエチルアミン(DIPEA)、N,N−ジメチルアセトアミド(DMA)、4−N,N−ジメチルアミノピリジン(DMAP)、N,N−ジメチルホルムアミド(DMF)、ジメチルスルホキシド(DMSO)、1,1’−ビス−(ジフェニルホスフィノ)エタン(dppe)、1,1’−ビス−(ジフェニルホスフィノ)フェロセン(dppf)、1−(3−ジメチルアミノプロピル)−3−エチルカルボジイミド塩酸塩(EDCI)、2−エトキシ−1−エトキシカルボニル−1,2−ジヒドロキノリン(EEDQ)、エチル(Et)、酢酸エチル(EtOAc)、エタノール(EtOH)、2−エトキシ−2H−キノリン−1−カルボン酸エチルエステル(EEDQ)、ジエチルエーテル(Et2O)、エチルイソプロピルエーテル(EtOiPr)、O−(7−アザベンゾトリアゾール−1−イル)−N、N,N’N’−テトラメチルウロニウムヘキサフルオロホスフェート酢酸(HATU)、酢酸(HOAc)、1−N−ヒドロキシベンゾトリアゾール(HOBt)、高圧液体クロマトグラフィー(HPLC)、イソ−プロパノール(IPA)、塩化イソプロピルマグネシウム(iPrMgCl)、ヘキサメチルジシラザン(HMDS)、液体クロマトグラフィー質量分析(LCMS)、リチウムヘキサメチルジシラザン(LiHMDS)、メタ−クロロペルオキシ安息香酸(m−CPBA)、メタノール(MeOH)、融点(mp)、MeSO2−(メシルまたはMs)、メチル(Me)、アセトニトリル(MeCN)、m−クロロ過安息香酸(MCPBA)、質量スペクトル(ms)、メチルt−ブチルエーテル(MTBE)、メチルテトラヒドロフラン(MeTHF)、N−ブロモスクシンイミド(NBS)、n−ブチルリチウム(nBuLi)、N−カルボキシ無水物(NCA)、N−クロロスクシンイミド(NCS)、N−メチルモルホリン(NMM)、N−メチルピロリドン(NMP)、クロロクロム酸ピリジニウム(PCC)、ジクロロ−((ビス−ジフェニルホスフィノ)フェロセニル)パラジウム(II)(Pd(dppf)Cl2)、酢酸パラジウム(II)(Pd(OAc)2)、tris(ジベンジリデンアセトン)ジパラジウム(0)(Pd2(dba)3)、ジクロム酸ピリジニウム(PDC)、フェニル(Ph)、プロピル(Pr)、イソ−プロピル(i−Pr)、ポンド/平方インチ(psi)、ピリジン(pyr)、1,2,3,4,5−ペンタフェニル−1’−(ジ−tert−ブチルホスフィノ)フェロセン(Q−Phos)、室温(周囲温度、rtまたはRT)、sec−ブチルリチウム(sBuLi)、tert−ブチルジメチルシリルまたはt−BuMe2Si(TBDMS)、テトラ−n−ブチルアンモニウムフルオリド(TBAF)、トリエチルアミン(TEAまたはEt3N)、2,2,6,6−テトラメチルピペリジン1−オキシル(TEMPO)、トリフレートまたはCF3SO2−(Tf)、トリフルオロ酢酸(TFA)、1,1’−ビス−2,2,6,6−テトラメチルヘプタン−2,6−ジオン(TMHD)、O−ベンゾトリアゾル−1−イル−N,N,N’,N’−テトラメチルウロニウムテトラフルオロボレート(TBTU)、薄層クロマトグラフィー(TLC)、テトラヒドロフラン(THF)、トリメチルシリルまたはMe3Si(TMS)、p−トルエンスルホン酸一水和物(TsOHまたはpTsOH)、4−Me−C6H4SO2−またはトシル(Ts)、およびN−ウレタン−N−カルボキシ無水物(UNCA)が含まれる。接頭辞ノルマル(n)、イソ(i−)、二級(sec−)、三級(tert−)およびネオを含む慣用的な命名は、アルキル部分とともに用いる場合、その習慣的な意味を有する(J. RigaudyおよびD. P. Klesney, Nomenclature in Organic Chemistry, IUPAC 1979 Pergamon Press, Oxford.)。
本発明の化合物を、実施例セクションにおいて、以下に記載する例示的な合成反応に示す多様な方法によって、作製してもよい。米国特許7,608,599は、抗ウイルスヌクレオシドホスホロアミデートの調製を開示し、そして本明細書にその全体が援用される。
上昇法によって開発された、プレコーティングされたアルミニウム強化プレート(60F−54、0.2mm厚;E. Merck AG、ドイツ・ダルムシュタットによって供給)上で、TLCを行った。溶媒蒸発後、254nmのUVランプでの照射、または366nmの蛍光消光の観察によって、化合物を検出した。クロマトグラフィーカラムは、圧下、適切な溶出剤において、シリカゲル60A、40〜60μm、Phase Sep、英国をスラリーパックした。同じ溶出剤中の濃縮溶液として試料を適用するか、またはシリカゲル上にあらかじめ吸着させた。1Hおよび13C NMRスペクトルは、Bruker Advance DPX300分光系(それぞれ、300MHzおよび75MHz)上に記録し、そして重水素溶媒参照ピークに対して自動較正される。すべての13C NMRは、プロトン脱共役された。以下の略語をNMRシグナルの割り当てに用いる:s(一重項)、d(二重項)、t(三重項)、qu(四重項)、q(五重項)、m(多重項)、bs(ブロードシグナル)、dd(二重二重項)、dt(二重三重項)。低解像度質量スペクトルを、陰性または陽性モードのいずれかで、VG Platform II Fisons装置(大気圧イオン化、エレクトロスプレー質量分析)で行った。
調製例
実施例1
4’−アジドアデノシン5’−O−[フェニル(ベンジルオキシ−L−アラニニル)]ホスフェート
表題化合物(I−2)の調製は、McGuigan, Christopherらによって、Journal of Medicinal Chemistry (2007), 50(22), 5463−5470に開示されている。
HRMS(E/I) m/e 648.1696(MNa+)。正確な質量: C26H28N9O8NaPは、648.1696を要する。
4’−アジドアデノシン5’−O−[ナフタ−1−イル(ベンジルオキシ−L−フェニルアラニニル)ホスフェート]
表題化合物(I−9)を、McGuigan, Christopherらによって、Journal of Medicinal Chemistry (2007), 50(8), 1840−1849に記載される方法に類似の方式で調製した。
4’−アジドアデノシン5’−O−[ナフタ−1−イル(エチルオキシ−L−フェニルアラニニル)ホスフェート]
表題化合物(I−10)を、McGuigan, Christopherらによって、Journal of Medicinal Chemistry (2007), 50(8), 1840−1849に記載される方法に類似の方式で調製した。
Huh7細胞抗ウイルスアッセイ
ヒト肝腫瘍細胞株Huh−7(マインツ大学、ドイツ)を、フェノールレッドを含まないDMEM(Cellgro Mediatech、カタログ番号10−013−CV、4.5g/lグルコース、L−グルタミンおよびピルビン酸ナトリウムを含有する)中で培養した。培地にさらに、10%(v/v)FBS(ATLASカタログ番号F−0500−A、ロット番号850114A)および1%(v/v)ペニシリン/ストレプトマイシン(Cellgro Mediatech、#30−022−CI)を補充した。細胞を加湿5%CO2大気中、37℃で維持した。デングウイルスの4つの血清型の代表的な株、DENV−1(Th−Sman)、DENV−2(Th−36)、DENV−3(H−87)およびDENV−4(H−241)をすべて、ATCC(バージニア州マナサス)から得た。標準的プラークアッセイ法を用いて、BHK−21細胞上でウイルス力価を測定した。抗ウイルスアッセイにおけるヌクレオシドのEC50測定のため、Huh−7細胞を、10%FBSおよび1%ペニシリン/ストレプトマイシンを補充したMEM培地中、白色96ウェルプレート中にプレーティングした。24時間インキュベーションした後、細胞を0.5の感染効率(MOI)で2時間、37℃で感染させた。1%DMSOを補充した同じ培地中で、化合物の3倍希釈を10段階調製した。2時間の吸着期後、ウイルスを吸引して廃棄し、そして希釈化合物を4つのウェル各々に添加した。Huh−7細胞を上記のようにプレーティングし、そして同じ濃度範囲の化合物に曝露した。未処理細胞を対照として一緒に処理した。37℃で3日間インキュベーションした後、Cell−titer GloTM試薬(Promega、ウィスコンシン州マディソン)を各ウェルに添加し、そして5分間インキュベーションして用いて、細胞生存度を決定した。Thermo Luminoskanプレート読み取り装置(マサチューセッツ州ウォルサム)を用いて、プレートを分析した。
個人のドナー由来の凍結保存ヒト未成熟単球由来樹状細胞(iDC)を、Stemcell Technologies(カタログ番号PB−DC001F)から得た。iDCを計数し、そして10%(v/v)ウシ胎児血清(FBS)、1%(v/v)ペニシリン/ストレプトマイシン(InvitrogenTM)を含有するRPMI1640培地中、実験開始前に、90%加湿5%CO2大気中で、37℃で48時間、15,000細胞/ウェル(96ウェルプレート)の濃度でインキュベーションした。
表II
Claims (12)
- 式I:
R1は、水素、C1−6ハロアルキル、またはアリールであり、ここで、前記アリールは、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6アルコキシ、ハロゲン、C1−6ハロアルキル、−N(R1a)2、C1−6アシルアミノ、−NHSO2C1−6アルキル、−SO2N(R1a)2、−SO2C1−6アルキル、−COR1b、ニトロおよびシアノからなる群より独立に選択される1〜3の置換基で置換されていてもよい、フェニルまたはナフチルであり;
R1aは、独立に、水素またはC1−6アルキルであり;
R1bは、−OR1aまたは−N(R1a)2であり;
R2aおよびR2bは、(i)水素、C1−10アルキル、−(CH2)rN(R1a)2、C1−6ヒドロキシアルキル、−CH2SH、−(CH2)S(O)pMe、−(CH2)3NHC(=NH)NH2、(1H−インドル−3−イル)メチル、(1H−インドル−4−イル)メチル、−(CH2)mC(=O)R1b、アリールおよびアリールC1−3アルキルからなる群より独立に選択されるか、ここで、前記アリール基は、ヒドロキシル、C1−10アルキル、C1−6アルコキシ、ハロゲン、ニトロおよびシアノからなる群より選択される基で置換されていてもよい;(ii)R2aは水素であり、そしてR2bおよびR4は、一緒に、(CH2)3であるか;(iii)R2aおよびR2bは、一緒に、(CH2)nであるか;または(iv)R2aおよびR2bは、どちらもC1−6アルキルであり;
R3は、水素、C1−10アルキル、C1−10ハロアルキル、アリールまたはアリール−C1−3アルキルであり、ここで、前記アリールはフェニルであり;
R4は、水素、C1−3アルキルであるか、またはR2bおよびR4は、一緒に、(CH2)3であり;
R6は、式A、B、CまたはDであり、ここで、R8は水素またはC1−3アルキルであり;
R5およびR7は、水素、C(=O)C1−6アルキル、C(=O)R1bより独立に選択され;
mは、0〜3であり;
nは、4または5であり;
pは、0〜2であり;そして
rは、1〜6である]
の化合物、または薬学的に許容されうるその塩を含む、デング熱を治療するための医薬。 - デング熱を治療するための薬剤の調製のための、式I:
R1は、水素、C1−6ハロアルキル、またはアリールであり、ここで、前記アリールは、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6アルコキシ、ハロゲン、C1−6ハロアルキル、−N(R1a)2、C1−6アシルアミノ、−NHSO2C1−6アルキル、−SO2N(R1a)2、−SO2C1−6アルキル、−COR1b、ニトロおよびシアノからなる群より独立に選択される1〜3の置換基で置換されていてもよい、フェニルまたはナフチルであり;
R1aは、独立に、水素またはC1−6アルキルであり;
R1bは、−OR1aまたは−N(R1a)2であり;
R2aおよびR2bは、(i)水素、C1−10アルキル、−(CH2)rN(R1a)2、C1−6ヒドロキシアルキル、−CH2SH、−(CH2)S(O)pMe、−(CH2)3NHC(=NH)NH2、(1H−インドル−3−イル)メチル、(1H−インドル−4−イル)メチル、−(CH2)mC(=O)R1b、アリールおよびアリールC1−3アルキルからなる群より独立に選択されるか、ここで、前記アリール基は、ヒドロキシル、C1−10アルキル、C1−6アルコキシ、ハロゲン、ニトロおよびシアノからなる群より選択される基で置換されていてもよい;(ii)R2aは水素であり、そしてR2bおよびR4は、一緒に、(CH2)3であるか;(iii)R2aおよびR2bは、一緒に、(CH2)nであるか;または(iv)R2aおよびR2bは、どちらもC1−6アルキルであり;
R3は、水素、C1−10アルキル、C1−10ハロアルキル、アリールまたはアリール−C1−3アルキルであり、ここで、前記アリールはフェニルであり;
R4は、水素、C1−3アルキルであるか、またはR2bおよびR4は、一緒に、(CH2)3であり;
R6は、式A、B、CまたはDであり、ここで、R8は水素またはC1−3アルキルであり;
R5およびR7は、水素、C(=O)C1−6アルキル、C(=O)R1bより独立に選択され;
mは、0〜3であり;
nは、4または5であり;
pは、0〜2であり;そして
rは、1〜6である]
の化合物、または薬学的に許容されうるその塩の使用。 - 該化合物が、
式Ia:
R1は、水素、C1−6ハロアルキル、またはアリールであり、ここで、前記アリールは、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6アルコキシ、ハロゲン、C1−6ハロアルキル、−N(R1a)2、C1−6アシルアミノ、−NHSO2C1−6アルキル、−SO2N(R1a)2、−SO2C1−6アルキル、−COR1b、ニトロおよびシアノからなる群より独立に選択される1〜3の置換基で置換されていてもよい、フェニルまたはナフチルであり;
R1aは、独立に、水素またはC1−6アルキルであり;
R1bは、−OR1aまたは−N(R1a)2であり;
R2aおよびR2bは、(i)水素、C1−10アルキル、−(CH2)rN(R1a)2、C1−6ヒドロキシアルキル、−CH2SH、−(CH2)S(O)pMe、−(CH2)3NHC(=NH)NH2、(1H−インドル−3−イル)メチル、(1H−インドル−4−イル)メチル、−(CH2)mC(=O)R1b、アリールおよびアリールC1−3アルキルからなる群より独立に選択されるか、ここで、前記アリール基は、ヒドロキシル、C1−10アルキル、C1−6アルコキシ、ハロゲン、ニトロおよびシアノからなる群より選択される基で置換されていてもよい;(ii)R2aは水素であり、そしてR2bおよびR4は、一緒に、(CH2)3であるか;(iii)R2aおよびR2bは、一緒に、(CH2)nであるか;または(iv)R2aおよびR2bは、どちらもC1−6アルキルであり;
R3は、水素、C1−10アルキル、C1−10ハロアルキル、アリールまたはアリール−C1−3アルキルであり、ここで、前記アリールはフェニルであり;
R4は、水素、C1−3アルキルであるか、またはR2bおよびR4は、一緒に、(CH2)3であり;
R5およびR7は、水素、C(=O)C1−6アルキル、C(=O)R1bより独立に選択され;
R8は水素またはC1−3アルキルであり;
mは、0〜3であり;
nは、4または5であり;
pは、0〜2であり;そして
rは、1〜6である]
の化合物、または薬学的に許容されうるその塩である、請求項1記載の医薬。 - R1は、フェニル、ナフチル、またはo−メトキシフェニルであり;
R2aおよびR2bは、独立に、水素、メチル、またはベンジルであり;
R3は、メチル、エチル、またはベンジルであり;
R4はHであり;
R5およびR7は、どちらも、H、−C(=O)Et、または−C(=O)Buであり;そして
R8はHである;
請求項3記載の医薬。 - R1は、フェニルまたはナフチルであり;
R2aは水素であり、そしてR2bはメチルであり;
R3は、エチルまたはベンジルであり;そして
R5およびR7は、どちらも、Hまたは−C(=O)Etである;
請求項4記載の医薬。 - R1はナフチルであり;
R2aは水素であり、そしてR2bはメチルであり;
R3はベンジルであり;そして
R5およびR7は、どちらもHである;
請求項5記載の医薬。 - R1はナフチルであり;
R2aはHであり、そしてR2bはベンジルであり;
R3はエチルであり;そして
R5およびR7は、どちらもHである;
請求項4記載の医薬。 - R1はナフチルであり;
R2aはHであり、そしてR2bはベンジルであり;
R3はベンジルであり;そして
R5およびR7は、どちらもHである;
請求項4記載の医薬。 - R1はフェニルであり;
R2aはHであり、そしてR2bはメチルであり;
R3はベンジルであり;
R5はHであり;
R6は式Cであり;そして
R7はHである;
請求項1記載の医薬。 - 該化合物が、下記:
(S)−2−[[(2R,3S,4R,5R)−5−(6−アミノ−プリン−9−イル)−2−アジド−3,4−ジヒドロキシ−テトラヒドロ−フラン−2−イルメトキシ]−(ナフタレン−1−イルオキシ)−ホスホリルアミノ]−プロピオン酸エチルエステル;
(S)−2−{[(2R,3S,4R,5R)−5−(6−アミノ−プリン−9−イル)−2−アジド−3,4−ジヒドロキシ−テトラヒドロ−フラン−2−イルメトキシ]−フェノキシ−ホスホリルアミノ}−プロピオン酸ベンジルエステル;
(S)−2−{[(2R,3S,4R,5R)−5−(4−アミノ−2−オキソ−2H−ピリミジン−1−イル)−2−アジド−3,4−ジヒドロキシ−テトラヒドロ−フラン−2−イルメトキシ]−フェノキシ−ホスホリルアミノ}−プロピオン酸メチルエステル;
ペンタン酸(2R,3S,4R,5R)−5−(4−アミノ−2−オキソ−2H−ピリミジン−1−イル)−2−アジド−2−[((S)−1−ベンジルオキシカルボニル−エチルアミノ)−(2−メトキシ−フェノキシ)−ホスホリルオキシメチル]−4−ペンタノイルオキシ−テトラヒドロ−フラン−3−イルエステル;
(S)−2−[[(2R,3S,4R,5R)−5−(4−アミノ−2−オキソ−2H−ピリミジン−1−イル)−2−アジド−3,4−ジヒドロキシ−テトラヒドロ−フラン−2−イルメトキシ]−(ナフタレン−1−イルオキシ)−ホスホリルアミノ]−プロピオン酸ベンジルエステル;
(S)−2−[[(2R,3S,4R,5R)−2−アジド−5−(2,4−ジオキソ−3,4−ジヒドロ−2H−ピリミジン−1−イル)−3,4−ジヒドロキシ−テトラヒドロ−フラン−2−イルメトキシ]−(ナフタレン−1−イルオキシ)−ホスホリルアミノ]−プロピオン酸ベンジルエステル;
(S)−2−[[(2R,3S,4R,5R)−2−アジド−5−(2,4−ジオキソ−3,4−ジヒドロ−2H−ピリミジン−1−イル)−3,4−ジヒドロキシ−テトラヒドロ−フラン−2−イルメトキシ]−(ナフタレン−1−イルオキシ)−ホスホリルアミノ]−ペンタンジオン酸ジエチルエステル;
(S)−2−{[(2R,3S,4R,5R)−2−アジド−5−(2,4−ジオキソ−3,4−ジヒドロ−2H−ピリミジン−1−イル)−3,4−ビス−プロピオニルオキシ−テトラヒドロ−フラン−2−イルメトキシ]−フェノキシ−ホスホリルアミノ}−プロピオン酸エチルエステル;
(S)−2−[[(2R,3S,4R,5R)−2−アジド−5−(2,4−ジオキソ−3,4−ジヒドロ−2H−ピリミジン−1−イル)−3,4−ジヒドロキシ−テトラヒドロ−フラン−2−イルメトキシ]−(ナフタレン−1−イルオキシ)−ホスホリルアミノ]−3−フェニル−プロピオン酸ベンジルエステル;および
(S)−2−[[(2R,3S,4R,5R)−2−アジド−5−(2,4−ジオキソ−3,4−ジヒドロ−2H−ピリミジン−1−イル)−3,4−ジヒドロキシ−テトラヒドロ−フラン−2−イルメトキシ]−(ナフタレン−1−イルオキシ)−ホスホリルアミノ]−3−フェニル−プロピオン酸エチルエステル;
からなる群より選択される化合物である、請求項1記載の医薬。 - 少なくとも1種の他の抗ウイルス剤がさらに投与される、請求項1記載の医薬。
- ペンタン酸(2R,3S,4R,5R)−5−(4−アミノ−2−オキソ−2H−ピリミジン−1−イル)−2−アジド−2−[((S)−1−ベンジルオキシカルボニル−エチルアミノ)−(2−メトキシ−フェノキシ)−ホスホリルオキシメチル]−4−ペンタノイルオキシ−テトラヒドロ−フラン−3−イルエステル;
(S)−2−[[(2R,3S,4R,5R)−2−アジド−5−(2,4−ジオキソ−3,4−ジヒドロ−2H−ピリミジン−1−イル)−3,4−ジヒドロキシ−テトラヒドロ−フラン−2−イルメトキシ]−(ナフタレン−1−イルオキシ)−ホスホリルアミノ]−ペンタンジオン酸ジエチルエステル;
(S)−2−{[(2R,3S,4R,5R)−2−アジド−5−(2,4−ジオキソ−3,4−ジヒドロ−2H−ピリミジン−1−イル)−3,4−ビス−プロピオニルオキシ−テトラヒドロ−フラン−2−イルメトキシ]−フェノキシ−ホスホリルアミノ}−プロピオン酸エチルエステル;
(S)−2−[[(2R,3S,4R,5R)−2−アジド−5−(2,4−ジオキソ−3,4−ジヒドロ−2H−ピリミジン−1−イル)−3,4−ジヒドロキシ−テトラヒドロ−フラン−2−イルメトキシ]−(ナフタレン−1−イルオキシ)−ホスホリルアミノ]−3−フェニル−プロピオン酸ベンジルエステル;および
(S)−2−[[(2R,3S,4R,5R)−2−アジド−5−(2,4−ジオキソ−3,4−ジヒドロ−2H−ピリミジン−1−イル)−3,4−ジヒドロキシ−テトラヒドロ−フラン−2−イルメトキシ]−(ナフタレン−1−イルオキシ)−ホスホリルアミノ]−3−フェニル−プロピオン酸エチルエステル;
からなる群より選択される、化合物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161495472P | 2011-06-10 | 2011-06-10 | |
| US61/495,472 | 2011-06-10 | ||
| PCT/EP2012/060781 WO2012168348A1 (en) | 2011-06-10 | 2012-06-07 | Method of treating dengue fever |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2014519507A JP2014519507A (ja) | 2014-08-14 |
| JP2014519507A5 JP2014519507A5 (ja) | 2015-07-23 |
| JP6072016B2 true JP6072016B2 (ja) | 2017-02-01 |
Family
ID=46229500
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014514062A Expired - Fee Related JP6072016B2 (ja) | 2011-06-10 | 2012-06-07 | デング熱を治療する方法 |
Country Status (16)
| Country | Link |
|---|---|
| US (2) | US20130018011A1 (ja) |
| EP (1) | EP2717881A1 (ja) |
| JP (1) | JP6072016B2 (ja) |
| KR (1) | KR20140041706A (ja) |
| CN (1) | CN103608020B (ja) |
| CA (1) | CA2837242A1 (ja) |
| CL (1) | CL2013003487A1 (ja) |
| CO (1) | CO6811865A2 (ja) |
| CR (1) | CR20130610A (ja) |
| EC (1) | ECSP13013075A (ja) |
| MX (1) | MX2013014389A (ja) |
| MY (1) | MY173636A (ja) |
| PE (1) | PE20141263A1 (ja) |
| PH (1) | PH12013502424A1 (ja) |
| RU (1) | RU2605904C2 (ja) |
| WO (1) | WO2012168348A1 (ja) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20130018011A1 (en) * | 2011-06-10 | 2013-01-17 | Hassan Javanbakht | Method of treating dengue fever |
| WO2015158913A1 (en) * | 2014-04-17 | 2015-10-22 | Katholieke Universiteit Leuven | Novel antiviral and antitumoral compounds |
| AU2015320511B2 (en) * | 2014-09-26 | 2020-11-12 | Riboscience Llc | 4'-vinyl substituted nucleoside derivatives as inhibitors of Respiratory Syncytial Virus RNA replication |
| WO2016123905A1 (en) * | 2015-02-06 | 2016-08-11 | Ginkgo Pharma Co., Ltd. | Novel phosphoramidates for treatment of hcv infection |
| US20170232031A1 (en) * | 2016-02-16 | 2017-08-17 | Riboscience Llc | Inhibitors of Zika Virus |
| US20180098828A1 (en) | 2016-10-07 | 2018-04-12 | 3M Innovative Properties Company | Ceramic dental restorations made by additive manufacturing |
| CN115135383B (zh) | 2020-02-18 | 2024-06-11 | 吉利德科学公司 | 抗病毒化合物 |
| TWI883391B (zh) * | 2020-02-18 | 2025-05-11 | 美商基利科學股份有限公司 | 抗病毒化合物 |
| TWI775313B (zh) | 2020-02-18 | 2022-08-21 | 美商基利科學股份有限公司 | 抗病毒化合物 |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PL3521297T3 (pl) * | 2003-05-30 | 2022-04-04 | Gilead Pharmasset Llc | Zmodyfikowane fluorowane analogi nukleozydów |
| CN101287472B (zh) * | 2005-08-15 | 2011-10-12 | 弗·哈夫曼-拉罗切有限公司 | 抗病毒的4'-取代前核苷酸的氨基磷酸酯类化合物 |
| US7964580B2 (en) * | 2007-03-30 | 2011-06-21 | Pharmasset, Inc. | Nucleoside phosphoramidate prodrugs |
| EP2166016A1 (en) * | 2008-09-18 | 2010-03-24 | Centocor Ortho Biotech Products L.P. | Phosphoramidate Derivatives of Nucleosides |
| CL2009002207A1 (es) * | 2008-12-23 | 2011-02-18 | Gilead Pharmasset Llc | Compuestos derivados de 3-hidroxi-5-(9h-purin-9-il)tetrahidrofuran-2-il, inhibidor de la replicacion de arn viral dependiente de arn; composicion farmaceutica; uso para el tratamiento de hepatitis c. |
| EP2483288B1 (en) * | 2009-09-29 | 2016-11-16 | Janssen Products, L.P. | Phosphoramidate derivatives of nucleosides |
| CA2812962C (en) * | 2010-09-22 | 2020-03-31 | Alios Biopharma, Inc. | Azido nucleosides and nucleotide analogs |
| US20130018011A1 (en) * | 2011-06-10 | 2013-01-17 | Hassan Javanbakht | Method of treating dengue fever |
-
2012
- 2012-06-05 US US13/488,802 patent/US20130018011A1/en not_active Abandoned
- 2012-06-07 RU RU2013156939/04A patent/RU2605904C2/ru not_active IP Right Cessation
- 2012-06-07 WO PCT/EP2012/060781 patent/WO2012168348A1/en not_active Ceased
- 2012-06-07 CA CA2837242A patent/CA2837242A1/en not_active Abandoned
- 2012-06-07 MX MX2013014389A patent/MX2013014389A/es unknown
- 2012-06-07 EP EP12726438.0A patent/EP2717881A1/en not_active Withdrawn
- 2012-06-07 KR KR1020147000613A patent/KR20140041706A/ko not_active Ceased
- 2012-06-07 PE PE2013002781A patent/PE20141263A1/es active IP Right Grant
- 2012-06-07 PH PH1/2013/502424A patent/PH12013502424A1/en unknown
- 2012-06-07 JP JP2014514062A patent/JP6072016B2/ja not_active Expired - Fee Related
- 2012-06-07 CN CN201280029465.9A patent/CN103608020B/zh not_active Expired - Fee Related
- 2012-06-07 MY MYPI2013702389A patent/MY173636A/en unknown
-
2013
- 2013-11-21 CR CR20130610A patent/CR20130610A/es unknown
- 2013-11-29 CO CO13281371A patent/CO6811865A2/es unknown
- 2013-12-05 CL CL2013003487A patent/CL2013003487A1/es unknown
- 2013-12-10 EC ECSP13013075 patent/ECSP13013075A/es unknown
-
2015
- 2015-10-09 US US14/879,463 patent/US20160168186A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| PH12013502424A1 (en) | 2014-01-13 |
| CL2013003487A1 (es) | 2014-09-05 |
| MY173636A (en) | 2020-02-12 |
| CN103608020B (zh) | 2016-11-23 |
| EP2717881A1 (en) | 2014-04-16 |
| KR20140041706A (ko) | 2014-04-04 |
| MX2013014389A (es) | 2014-03-21 |
| CA2837242A1 (en) | 2012-12-13 |
| CN103608020A (zh) | 2014-02-26 |
| ECSP13013075A (es) | 2014-01-31 |
| RU2013156939A (ru) | 2015-07-20 |
| CO6811865A2 (es) | 2013-12-16 |
| WO2012168348A1 (en) | 2012-12-13 |
| JP2014519507A (ja) | 2014-08-14 |
| PE20141263A1 (es) | 2014-09-29 |
| US20160168186A1 (en) | 2016-06-16 |
| US20130018011A1 (en) | 2013-01-17 |
| RU2605904C2 (ru) | 2016-12-27 |
| CR20130610A (es) | 2014-02-18 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6072016B2 (ja) | デング熱を治療する方法 | |
| CA2727495C (en) | Nucleoside cyclicphosphates | |
| US20240238323A1 (en) | Modified nucleosides and nucleotides analogs as antiviral agents for corona and other viruses | |
| KR101384389B1 (ko) | 항-hcv 화합물로서의 4''-아지도-뉴클레오시드 | |
| JP2020534361A (ja) | 置換ヌクレオシド、ヌクレオチド、及びそのアナログ | |
| IL217228A (en) | Compounds of Type 2'-Deoxy-2'-Fluoro-2'-c-Methyluridine Nucleoside Phosphoramide Compounds | |
| CN115835907A (zh) | 用于靶向pd-l1的方法和组合物 | |
| JP2014515023A (ja) | 2’−置換ヌクレオシド誘導体およびウイルス疾患の処置のためのその使用方法 | |
| KR20040002854A (ko) | Rna 의존성 rna 바이러스 폴리머라제의억제제로서의 뉴클레오시드 유도체 | |
| AU2012242978A1 (en) | 2'-Cyano Substituted Nucleoside Derivatives and methods of use thereof for the treatment of viral diseases | |
| IL272953A (en) | Substituted nucleosides, nucleotides and analogs thereof | |
| WO2014082935A1 (en) | Cyclic nucleoside derivatives and uses thereof | |
| JP2011505351A (ja) | 抗ウイルスヌクレオシド化合物 | |
| AU2022415440A1 (en) | Methods and compositions for targeting pd-l1 | |
| CN112010916B (zh) | 核苷化合物的氨基磷酸酯衍生物及其用途 | |
| CN106883280A (zh) | 一种前药、其制备方法、药物组合物及其用途 | |
| US20170232031A1 (en) | Inhibitors of Zika Virus | |
| CN117769427A (zh) | 作为冠状病毒和其他病毒的抗病毒剂的修饰核苷和核苷酸类似物 | |
| HK1194998B (en) | The use of nucleoside compounds for the preparation of a medicament for the treatment of dengue fever | |
| HK1194998A (en) | The use of nucleoside compounds for the preparation of a medicament for the treatment of dengue fever | |
| AU2024261019A1 (en) | 4'-substituted nucleosides and nucleotides as antiviral agents | |
| CN105164115A (zh) | 用于治疗丙型肝炎的嘧啶化合物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20141024 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150605 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20150605 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20160408 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20160711 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20161130 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20161227 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6072016 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| LAPS | Cancellation because of no payment of annual fees |