JP5818804B2 - ヒトil−22raに対するヒト化抗体 - Google Patents
ヒトil−22raに対するヒト化抗体 Download PDFInfo
- Publication number
- JP5818804B2 JP5818804B2 JP2012539274A JP2012539274A JP5818804B2 JP 5818804 B2 JP5818804 B2 JP 5818804B2 JP 2012539274 A JP2012539274 A JP 2012539274A JP 2012539274 A JP2012539274 A JP 2012539274A JP 5818804 B2 JP5818804 B2 JP 5818804B2
- Authority
- JP
- Japan
- Prior art keywords
- humanized antibody
- antibody
- human
- seq
- amino acid
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 210000004027 cell Anatomy 0.000 claims description 75
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 53
- 238000000034 method Methods 0.000 claims description 23
- 102000040430 polynucleotide Human genes 0.000 claims description 22
- 108091033319 polynucleotide Proteins 0.000 claims description 22
- 239000002157 polynucleotide Substances 0.000 claims description 22
- 239000008194 pharmaceutical composition Substances 0.000 claims description 20
- 201000004681 Psoriasis Diseases 0.000 claims description 16
- 239000013598 vector Substances 0.000 claims description 15
- 206010012438 Dermatitis atopic Diseases 0.000 claims description 13
- 201000001263 Psoriatic Arthritis Diseases 0.000 claims description 13
- 208000036824 Psoriatic arthropathy Diseases 0.000 claims description 13
- 201000008937 atopic dermatitis Diseases 0.000 claims description 13
- 239000003814 drug Substances 0.000 claims description 9
- 210000004978 chinese hamster ovary cell Anatomy 0.000 claims description 7
- 239000013604 expression vector Substances 0.000 claims description 7
- 238000004519 manufacturing process Methods 0.000 claims description 6
- 238000012258 culturing Methods 0.000 claims description 3
- 238000002360 preparation method Methods 0.000 claims description 2
- 241000699666 Mus <mouse, genus> Species 0.000 description 79
- 108010074109 interleukin-22 Proteins 0.000 description 50
- 210000004602 germ cell Anatomy 0.000 description 35
- 102100030703 Interleukin-22 Human genes 0.000 description 34
- 102000005962 receptors Human genes 0.000 description 29
- 108020003175 receptors Proteins 0.000 description 29
- 108060003951 Immunoglobulin Proteins 0.000 description 27
- 102000018358 immunoglobulin Human genes 0.000 description 27
- 108090000623 proteins and genes Proteins 0.000 description 27
- 235000001014 amino acid Nutrition 0.000 description 20
- 230000003389 potentiating effect Effects 0.000 description 19
- 101710117290 Aldo-keto reductase family 1 member C4 Proteins 0.000 description 18
- 229940024606 amino acid Drugs 0.000 description 18
- 150000001413 amino acids Chemical class 0.000 description 18
- 238000003556 assay Methods 0.000 description 17
- 230000035772 mutation Effects 0.000 description 17
- 150000007523 nucleic acids Chemical class 0.000 description 17
- 102000039446 nucleic acids Human genes 0.000 description 16
- 108020004707 nucleic acids Proteins 0.000 description 16
- 230000000694 effects Effects 0.000 description 15
- 108020004414 DNA Proteins 0.000 description 13
- 101001010626 Homo sapiens Interleukin-22 Proteins 0.000 description 13
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 13
- 210000004754 hybrid cell Anatomy 0.000 description 13
- 241000699670 Mus sp. Species 0.000 description 11
- 102000004495 STAT3 Transcription Factor Human genes 0.000 description 11
- 108010017324 STAT3 Transcription Factor Proteins 0.000 description 11
- 238000001516 cell proliferation assay Methods 0.000 description 11
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 11
- 238000003566 phosphorylation assay Methods 0.000 description 11
- 108090000765 processed proteins & peptides Proteins 0.000 description 11
- 230000014509 gene expression Effects 0.000 description 10
- 102000004196 processed proteins & peptides Human genes 0.000 description 10
- 101001044887 Homo sapiens Interleukin-22 receptor subunit alpha-2 Proteins 0.000 description 9
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 9
- 125000000539 amino acid group Chemical group 0.000 description 9
- 239000000427 antigen Substances 0.000 description 9
- 102000036639 antigens Human genes 0.000 description 9
- 108091007433 antigens Proteins 0.000 description 9
- 229920001184 polypeptide Polymers 0.000 description 9
- 235000018102 proteins Nutrition 0.000 description 9
- 102000004169 proteins and genes Human genes 0.000 description 9
- 210000001519 tissue Anatomy 0.000 description 9
- IQFYYKKMVGJFEH-XLPZGREQSA-N Thymidine Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 IQFYYKKMVGJFEH-XLPZGREQSA-N 0.000 description 8
- 201000010099 disease Diseases 0.000 description 8
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 8
- 210000002510 keratinocyte Anatomy 0.000 description 8
- 230000003472 neutralizing effect Effects 0.000 description 8
- 229920001223 polyethylene glycol Polymers 0.000 description 8
- 238000013207 serial dilution Methods 0.000 description 8
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 7
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 description 7
- 102220519246 Conserved oligomeric Golgi complex subunit 3_D32E_mutation Human genes 0.000 description 7
- 102100020788 Interleukin-10 receptor subunit beta Human genes 0.000 description 7
- 101710199214 Interleukin-10 receptor subunit beta Proteins 0.000 description 7
- 102100022703 Interleukin-22 receptor subunit alpha-2 Human genes 0.000 description 7
- 239000002202 Polyethylene glycol Substances 0.000 description 7
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 7
- 230000006870 function Effects 0.000 description 7
- 102000043316 human IL22RA2 Human genes 0.000 description 7
- 238000005259 measurement Methods 0.000 description 7
- 229960001153 serine Drugs 0.000 description 7
- 235000004400 serine Nutrition 0.000 description 7
- 238000006467 substitution reaction Methods 0.000 description 7
- 239000003981 vehicle Substances 0.000 description 7
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 6
- 102000003814 Interleukin-10 Human genes 0.000 description 6
- 108090000174 Interleukin-10 Proteins 0.000 description 6
- 210000001744 T-lymphocyte Anatomy 0.000 description 6
- 230000004540 complement-dependent cytotoxicity Effects 0.000 description 6
- 235000018417 cysteine Nutrition 0.000 description 6
- 239000012634 fragment Substances 0.000 description 6
- 230000002829 reductive effect Effects 0.000 description 6
- 238000012360 testing method Methods 0.000 description 6
- 108020004635 Complementary DNA Proteins 0.000 description 5
- 238000002965 ELISA Methods 0.000 description 5
- 102100022723 Interleukin-22 receptor subunit alpha-1 Human genes 0.000 description 5
- 101710191556 Interleukin-22 receptor subunit alpha-2 Proteins 0.000 description 5
- 102000054727 Serum Amyloid A Human genes 0.000 description 5
- 108700028909 Serum Amyloid A Proteins 0.000 description 5
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 5
- 238000000423 cell based assay Methods 0.000 description 5
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 5
- 230000006240 deamidation Effects 0.000 description 5
- 239000012636 effector Substances 0.000 description 5
- 230000006320 pegylation Effects 0.000 description 5
- 230000000770 proinflammatory effect Effects 0.000 description 5
- 230000035755 proliferation Effects 0.000 description 5
- 230000009467 reduction Effects 0.000 description 5
- DWRXFEITVBNRMK-UHFFFAOYSA-N Beta-D-1-Arabinofuranosylthymine Natural products O=C1NC(=O)C(C)=CN1C1C(O)C(O)C(CO)O1 DWRXFEITVBNRMK-UHFFFAOYSA-N 0.000 description 4
- 102000004127 Cytokines Human genes 0.000 description 4
- 108090000695 Cytokines Proteins 0.000 description 4
- 102000053602 DNA Human genes 0.000 description 4
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 4
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 4
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 4
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 4
- 238000007792 addition Methods 0.000 description 4
- IQFYYKKMVGJFEH-UHFFFAOYSA-N beta-L-thymidine Natural products O=C1NC(=O)C(C)=CN1C1OC(CO)C(O)C1 IQFYYKKMVGJFEH-UHFFFAOYSA-N 0.000 description 4
- 238000010804 cDNA synthesis Methods 0.000 description 4
- 230000005754 cellular signaling Effects 0.000 description 4
- 230000008859 change Effects 0.000 description 4
- 239000002299 complementary DNA Substances 0.000 description 4
- 239000002131 composite material Substances 0.000 description 4
- 230000001419 dependent effect Effects 0.000 description 4
- 238000013461 design Methods 0.000 description 4
- 210000000987 immune system Anatomy 0.000 description 4
- 238000010348 incorporation Methods 0.000 description 4
- 108090000681 interleukin 20 Proteins 0.000 description 4
- 108090000237 interleukin-24 Proteins 0.000 description 4
- 239000006166 lysate Substances 0.000 description 4
- 239000000203 mixture Substances 0.000 description 4
- 230000003285 pharmacodynamic effect Effects 0.000 description 4
- 229920000642 polymer Polymers 0.000 description 4
- 230000008569 process Effects 0.000 description 4
- 238000003118 sandwich ELISA Methods 0.000 description 4
- 241000894007 species Species 0.000 description 4
- 229940104230 thymidine Drugs 0.000 description 4
- 229910052722 tritium Inorganic materials 0.000 description 4
- 239000004474 valine Substances 0.000 description 4
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 239000004471 Glycine Substances 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- 101001044883 Homo sapiens Interleukin-22 receptor subunit alpha-1 Proteins 0.000 description 3
- -1 IL22R1 Proteins 0.000 description 3
- 206010061218 Inflammation Diseases 0.000 description 3
- 102220565484 Killer cell immunoglobulin-like receptor 2DL2_D96E_mutation Human genes 0.000 description 3
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 3
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 3
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 3
- 239000004473 Threonine Substances 0.000 description 3
- 239000013543 active substance Substances 0.000 description 3
- 235000004279 alanine Nutrition 0.000 description 3
- 239000005557 antagonist Substances 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 230000000903 blocking effect Effects 0.000 description 3
- 208000037976 chronic inflammation Diseases 0.000 description 3
- 208000037893 chronic inflammatory disorder Diseases 0.000 description 3
- 238000010367 cloning Methods 0.000 description 3
- 230000002860 competitive effect Effects 0.000 description 3
- 230000009260 cross reactivity Effects 0.000 description 3
- 238000006731 degradation reaction Methods 0.000 description 3
- 238000000113 differential scanning calorimetry Methods 0.000 description 3
- 210000003527 eukaryotic cell Anatomy 0.000 description 3
- 238000005755 formation reaction Methods 0.000 description 3
- 230000007062 hydrolysis Effects 0.000 description 3
- 238000006460 hydrolysis reaction Methods 0.000 description 3
- 210000002865 immune cell Anatomy 0.000 description 3
- 238000001727 in vivo Methods 0.000 description 3
- 230000008595 infiltration Effects 0.000 description 3
- 238000001764 infiltration Methods 0.000 description 3
- 230000004054 inflammatory process Effects 0.000 description 3
- 230000003993 interaction Effects 0.000 description 3
- 229960000310 isoleucine Drugs 0.000 description 3
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 3
- 235000014705 isoleucine Nutrition 0.000 description 3
- 238000006317 isomerization reaction Methods 0.000 description 3
- 210000004962 mammalian cell Anatomy 0.000 description 3
- 230000001404 mediated effect Effects 0.000 description 3
- 238000010172 mouse model Methods 0.000 description 3
- 239000013642 negative control Substances 0.000 description 3
- 239000002773 nucleotide Substances 0.000 description 3
- 125000003729 nucleotide group Chemical group 0.000 description 3
- 210000001236 prokaryotic cell Anatomy 0.000 description 3
- 238000010188 recombinant method Methods 0.000 description 3
- 235000008521 threonine Nutrition 0.000 description 3
- 238000002054 transplantation Methods 0.000 description 3
- 229920003169 water-soluble polymer Polymers 0.000 description 3
- 206010002091 Anaesthesia Diseases 0.000 description 2
- 239000004475 Arginine Substances 0.000 description 2
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 2
- 241000701022 Cytomegalovirus Species 0.000 description 2
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 2
- 206010014025 Ear swelling Diseases 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- 101000935587 Homo sapiens Flavin reductase (NADPH) Proteins 0.000 description 2
- 101001033233 Homo sapiens Interleukin-10 Proteins 0.000 description 2
- 101001010591 Homo sapiens Interleukin-20 Proteins 0.000 description 2
- 101001044895 Homo sapiens Interleukin-20 receptor subunit beta Proteins 0.000 description 2
- 102000009786 Immunoglobulin Constant Regions Human genes 0.000 description 2
- 108010009817 Immunoglobulin Constant Regions Proteins 0.000 description 2
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 2
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 2
- 102100022705 Interleukin-20 receptor subunit beta Human genes 0.000 description 2
- PIWKPBJCKXDKJR-UHFFFAOYSA-N Isoflurane Chemical compound FC(F)OC(Cl)C(F)(F)F PIWKPBJCKXDKJR-UHFFFAOYSA-N 0.000 description 2
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 2
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 2
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 2
- 108091007491 NSP3 Papain-like protease domains Proteins 0.000 description 2
- 108091028043 Nucleic acid sequence Proteins 0.000 description 2
- 108091093037 Peptide nucleic acid Proteins 0.000 description 2
- 241000714474 Rous sarcoma virus Species 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 108010090804 Streptavidin Proteins 0.000 description 2
- 230000021736 acetylation Effects 0.000 description 2
- 238000006640 acetylation reaction Methods 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 125000003295 alanine group Chemical group N[C@@H](C)C(=O)* 0.000 description 2
- 230000037005 anaesthesia Effects 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 2
- 235000009582 asparagine Nutrition 0.000 description 2
- 229960001230 asparagine Drugs 0.000 description 2
- 230000004071 biological effect Effects 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- AIYUHDOJVYHVIT-UHFFFAOYSA-M caesium chloride Chemical compound [Cl-].[Cs+] AIYUHDOJVYHVIT-UHFFFAOYSA-M 0.000 description 2
- 230000015556 catabolic process Effects 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- 238000007385 chemical modification Methods 0.000 description 2
- 230000000295 complement effect Effects 0.000 description 2
- 150000001945 cysteines Chemical class 0.000 description 2
- 230000003013 cytotoxicity Effects 0.000 description 2
- 231100000135 cytotoxicity Toxicity 0.000 description 2
- 238000012217 deletion Methods 0.000 description 2
- 230000037430 deletion Effects 0.000 description 2
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 2
- 229960003957 dexamethasone Drugs 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 102000052620 human IL10 Human genes 0.000 description 2
- 230000028993 immune response Effects 0.000 description 2
- 230000002163 immunogen Effects 0.000 description 2
- 230000006698 induction Effects 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 108040006870 interleukin-10 receptor activity proteins Proteins 0.000 description 2
- 108040001834 interleukin-20 receptor activity proteins Proteins 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- 229960002725 isoflurane Drugs 0.000 description 2
- 238000012004 kinetic exclusion assay Methods 0.000 description 2
- 235000005772 leucine Nutrition 0.000 description 2
- 229960003136 leucine Drugs 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 210000004072 lung Anatomy 0.000 description 2
- 239000003550 marker Substances 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 230000003647 oxidation Effects 0.000 description 2
- 238000007254 oxidation reaction Methods 0.000 description 2
- 102000013415 peroxidase activity proteins Human genes 0.000 description 2
- 108040007629 peroxidase activity proteins Proteins 0.000 description 2
- 239000000546 pharmaceutical excipient Substances 0.000 description 2
- 239000013641 positive control Substances 0.000 description 2
- 230000008092 positive effect Effects 0.000 description 2
- 230000004481 post-translational protein modification Effects 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 230000001105 regulatory effect Effects 0.000 description 2
- 230000011664 signaling Effects 0.000 description 2
- 210000003491 skin Anatomy 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- 239000000243 solution Substances 0.000 description 2
- 239000003381 stabilizer Substances 0.000 description 2
- 238000007619 statistical method Methods 0.000 description 2
- 238000007920 subcutaneous administration Methods 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- 230000008719 thickening Effects 0.000 description 2
- 102000042287 type II cytokine receptor family Human genes 0.000 description 2
- 108091052254 type II cytokine receptor family Proteins 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 108010012236 Chemokines Proteins 0.000 description 1
- 102000019034 Chemokines Human genes 0.000 description 1
- 238000011537 Coomassie blue staining Methods 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- 201000004624 Dermatitis Diseases 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- 108091092584 GDNA Proteins 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- 101000690301 Homo sapiens Aldo-keto reductase family 1 member C4 Proteins 0.000 description 1
- 101001091242 Homo sapiens Immunoglobulin kappa joining 1 Proteins 0.000 description 1
- 101001116548 Homo sapiens Protein CBFA2T1 Proteins 0.000 description 1
- 241000701024 Human betaherpesvirus 5 Species 0.000 description 1
- 108010054016 IL-TIF IL-10-related T cell-derived inducible factor Proteins 0.000 description 1
- 102100026120 IgG receptor FcRn large subunit p51 Human genes 0.000 description 1
- 101710177940 IgG receptor FcRn large subunit p51 Proteins 0.000 description 1
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 1
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 1
- 108700005091 Immunoglobulin Genes Proteins 0.000 description 1
- 102000013463 Immunoglobulin Light Chains Human genes 0.000 description 1
- 108010065825 Immunoglobulin Light Chains Proteins 0.000 description 1
- 102000012745 Immunoglobulin Subunits Human genes 0.000 description 1
- 108010079585 Immunoglobulin Subunits Proteins 0.000 description 1
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 1
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 description 1
- 102100034892 Immunoglobulin kappa joining 1 Human genes 0.000 description 1
- 102100022706 Interleukin-20 receptor subunit alpha Human genes 0.000 description 1
- 101710174006 Interleukin-20 receptor subunit alpha Proteins 0.000 description 1
- 108090001005 Interleukin-6 Proteins 0.000 description 1
- 108090001007 Interleukin-8 Proteins 0.000 description 1
- 101150008942 J gene Proteins 0.000 description 1
- 102220565518 Killer cell immunoglobulin-like receptor 2DL2_D96N_mutation Human genes 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 241000282567 Macaca fascicularis Species 0.000 description 1
- 241000282560 Macaca mulatta Species 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 208000005141 Otitis Diseases 0.000 description 1
- 241000009328 Perro Species 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 1
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 1
- 102000007562 Serum Albumin Human genes 0.000 description 1
- 108010071390 Serum Albumin Proteins 0.000 description 1
- 108010003723 Single-Domain Antibodies Proteins 0.000 description 1
- 108010008038 Synthetic Vaccines Proteins 0.000 description 1
- 230000006044 T cell activation Effects 0.000 description 1
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 1
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 1
- 108700005077 Viral Genes Proteins 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 238000005917 acylation reaction Methods 0.000 description 1
- 229960002964 adalimumab Drugs 0.000 description 1
- 230000006978 adaptation Effects 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 238000005804 alkylation reaction Methods 0.000 description 1
- 230000009435 amidation Effects 0.000 description 1
- 238000007112 amidation reaction Methods 0.000 description 1
- 230000005875 antibody response Effects 0.000 description 1
- 230000010056 antibody-dependent cellular cytotoxicity Effects 0.000 description 1
- 230000000890 antigenic effect Effects 0.000 description 1
- 125000000637 arginyl group Chemical class N[C@@H](CCCNC(N)=N)C(=O)* 0.000 description 1
- 210000004507 artificial chromosome Anatomy 0.000 description 1
- 229920001718 aryloxy-PEG Polymers 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 230000002457 bidirectional effect Effects 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 238000012754 cardiac puncture Methods 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 230000003915 cell function Effects 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 239000013599 cloning vector Substances 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 230000016396 cytokine production Effects 0.000 description 1
- 102000003675 cytokine receptors Human genes 0.000 description 1
- 108010057085 cytokine receptors Proteins 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 238000001212 derivatisation Methods 0.000 description 1
- 238000012938 design process Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 230000003828 downregulation Effects 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- 238000012377 drug delivery Methods 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 230000003511 endothelial effect Effects 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 238000001415 gene therapy Methods 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 210000004907 gland Anatomy 0.000 description 1
- 229930195712 glutamate Natural products 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 235000004554 glutamine Nutrition 0.000 description 1
- 102000035122 glycosylated proteins Human genes 0.000 description 1
- 108091005608 glycosylated proteins Proteins 0.000 description 1
- 230000013595 glycosylation Effects 0.000 description 1
- 238000006206 glycosylation reaction Methods 0.000 description 1
- YQOKLYTXVFAUCW-UHFFFAOYSA-N guanidine;isothiocyanic acid Chemical compound N=C=S.NC(N)=N YQOKLYTXVFAUCW-UHFFFAOYSA-N 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 229920001519 homopolymer Polymers 0.000 description 1
- 102000054751 human RUNX1T1 Human genes 0.000 description 1
- 238000009396 hybridization Methods 0.000 description 1
- 230000003301 hydrolyzing effect Effects 0.000 description 1
- 206010020718 hyperplasia Diseases 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 230000016784 immunoglobulin production Effects 0.000 description 1
- 229940072221 immunoglobulins Drugs 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 239000000411 inducer Substances 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 239000012212 insulator Substances 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 108010027445 interleukin-22 receptor Proteins 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 125000000741 isoleucyl group Chemical group [H]N([H])C(C(C([H])([H])[H])C([H])([H])C([H])([H])[H])C(=O)O* 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 230000004807 localization Effects 0.000 description 1
- 239000008176 lyophilized powder Substances 0.000 description 1
- 229920001427 mPEG Polymers 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 241001515942 marmosets Species 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 229920005615 natural polymer Polymers 0.000 description 1
- 238000006386 neutralization reaction Methods 0.000 description 1
- 238000012856 packing Methods 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 239000008180 pharmaceutical surfactant Substances 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- 229960005190 phenylalanine Drugs 0.000 description 1
- 235000008729 phenylalanine Nutrition 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 239000013612 plasmid Substances 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 229920001451 polypropylene glycol Polymers 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 229940076372 protein antagonist Drugs 0.000 description 1
- 230000007026 protein scission Effects 0.000 description 1
- 230000002797 proteolythic effect Effects 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 230000001850 reproductive effect Effects 0.000 description 1
- 210000004994 reproductive system Anatomy 0.000 description 1
- 210000002345 respiratory system Anatomy 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 230000004043 responsiveness Effects 0.000 description 1
- 108091008146 restriction endonucleases Proteins 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 229920002477 rna polymer Polymers 0.000 description 1
- 102200048119 rs104894035 Human genes 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 238000013268 sustained release Methods 0.000 description 1
- 239000012730 sustained-release form Substances 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 229920001059 synthetic polymer Polymers 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 238000001890 transfection Methods 0.000 description 1
- 210000005253 yeast cell Anatomy 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2866—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for cytokines, lymphokines, interferons
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/567—Framework region [FR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Immunology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Genetics & Genomics (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Molecular Biology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biomedical Technology (AREA)
- Dermatology (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- General Engineering & Computer Science (AREA)
- Microbiology (AREA)
- Biotechnology (AREA)
- Rheumatology (AREA)
- Epidemiology (AREA)
- Physics & Mathematics (AREA)
- Mycology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Plant Pathology (AREA)
- Pulmonology (AREA)
- Physical Education & Sports Medicine (AREA)
- Peptides Or Proteins (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
Description
2005年10月21日に出願の国際特許出願第2006/047249号の実施例18に記載の5つの雑種細胞によって発現されたマウス抗ヒトIL-22RAモノクローナル抗体を、ヒト化工程の開始点として使用するものを選択するために比較した。選択に関して最も重要な判断基準は、ヒトIL-22RAに対する高親和性、マウスIL-22RAとの交差反応性、IL-22BPとの交差反応性の欠如及びヒトIL-22RA に対する拮抗薬活性の欠如であった。唯一1つの抗体が上記の全判断基準を満たし (データ未開示)、すなわちそれは、280.46.3.4 (ATCC特許寄託受託番号PTA-6284) と呼ばれる雑種細胞によって発現された抗体であって、マウス IgG1/カッパ抗体である。
A. フレームワーク配列のための相同ヒト生殖系列の選択
IMGT-GENEデーターベース (Giudicelli V. et al. 2005)を使用して、全体配列 (フレームワーク 及びCDR)がマウス280.46.3.4 VLと高いパーセント同一性を示すヒト生殖系列カッパ軽鎖可変ドメインを、アミノ酸配列の比較によって同定した。マウス280.46.3.4 VLは、ヒト免疫グロブリン生殖系列カッパ可変遺伝子4-1 (IGKV4-1)と最も相同であり、同一性82.2 %を示した(101個の内、83個のアミノ酸残基; 図1)。従って、配列番号27に記載のIGKV4-1を、CDR-移植のためのヒトフレームワークアクセプター配列として選択した。マウス 280.46.3.4 VHに関して、高いパーセント同一性のヒト生殖系列は、IMGT-GENEデーターベースを使用して同定されなかった。ヒト免疫グロブリン生殖系列重鎖可変遺伝子1-46 (IGHV1-46) ヒト生殖系列を、60.2%同一性 (98個の中、59個のアミノ酸残基)の最も高い相同性を有するものとして同定した。しかしながら、配列番号28に記載のIGHV3-66を、最も低い相同性 (50.0%同一性, 98個の中、49個のアミノ酸残基 ; 図2)を有するにもかかわらず、その配列は様々な重要なフレームワーク位置においてマウス280.46.3.4 VHの配列に近似し、従って良好な安定性を提供する可能性が高いので、ヒトフレームワークアクセプター配列として効率的に選択した。
B.1 軽鎖
ヒト化280.46.3.4 VLに関するデザインにおける次の工程は、マウス280.46.3.4 VL由来のCDRを、ヒト生殖系列IGKV4-1由来のフレームワーク領域 (FR)に結合することであった。マウスJ遺伝子の代わりに、免疫グロブリンカッパ結合1ヒト生殖系列遺伝子(IGKJ1)を使用した。配列番号29に記載の、再形成ヒト化280.46.3.4 VL (280.VK4-1-C) の第一のバージョンで、ヒトFRにおいて変化はなく、すなわち、FR中のマウス残基はいずれも構造上重要でないと思われた。IGKV4-1とヒト化280.46.3.4 VLの第一のバージョン(280.VK4-1-C)との配列比較を図3に示す。
ヒト化280.46.3.4 VHに関するデザイン工程における次の工程は、マウス280.46.3.4 VH由来のCDRをヒト生殖系列IGHV3-66由来のFRに結合することである。配列番号30に記載の、再形成ヒト化 280.46.3.4 VH の第一のバージョン (280.VH3-66.1) において、ヒトフレームワーク領域において12個の変化がもたらされた(図4)。ヒトFRにおける12個の変化は、27、28、29、30、48、49、67、69、70、71、73及び78位に存在した (表1中のナンバリングを参照されたい)。
第一列 (Kabat ナンバリング) は、Kabatの残基番号を供する(Kabat et al. 1991)。FR及びCDRは、重鎖可変ドメインのフレームワーク領域 (H-FR1, H-FR2, H-FR3, 及びH-FR4)及び4つのFRを分離する3つのCDRを有する相補性決定領域 (H-CDR1, H-CDR2, 及びH-CDR3) を同定する。第二列(Chothia ナンバリング)は、ChothiaのCDR定義の残基番号を供する (Al-Lazikani et al. 1997)。第三列 (マウス280.46.3.4 VH) は、マウス280.46.3.4の重鎖可変ドメインのアミノ酸配列を供する。第四列 (IGHV3-66)は、CDR-移植にヒトアクセプターフレームワークとして使用される、ヒト免疫グロブリン生殖系列重鎖可変遺伝子3-66 (受入番号IMGT X92218) のアミノ酸配列を供する。第五列(ヒト化 280.VH3-66-46) は、マウス280.46.3.4 VHの最終のヒト化バージョンのアミノ酸配列を供し、下線が付された残基は、ヒト生殖系列IGHV3-66と異なるアミノ酸を示す。
Kabat位置32の軽鎖CDR1 (L-CDR1)中に不対システインが存在し(表2におけるナンバリングを参照されたい)、それは280.VK4-1-C と対合した280.VH3-66-1を含むヒト化280.46.3.4 抗体の発現及び精製中に、高次の共有結合性凝集構造と結合されている(データ未開示)。
第一列 (Kabat & Chothiaナンバリング)は、Kabat (Kabat et al. 1991) 及びChothia (Al-Lazikani et al. 1997) の残基番号を供する。FR及びCDRは、軽鎖可変ドメインのフレームワーク領域(L-FR1, L-FR2, L-FR3, 及びL-FR4) 、及び4つのFRを分離する3つのCDRを有する相補性決定領域 (L-CDR1, L-CDR2, 及びL-CDR3) を同定する。第二列 (マウス 280.46.3.4 VL) は、マウス280.46.3.4の軽鎖可変ドメインのアミノ酸配列を供する。第三列(IGKV4-1)は、CDR-移植のためにヒトアクセプターフレームワークとして使用される、ヒト免疫グロブリン生殖系列カッパ可変遺伝子4-1 (受入番号IMGT Z00023) のアミノ酸配列を供する。第四列 (ヒト化280.VK4-1-TSY)は、マウス 280.46.3.4 VLの最終最適化ヒト化バージョンのアミノ酸配列を供し、下線が付された残基はヒト生殖系列IGKV4-1と異なるアミノ酸を示す。
1) ヒトHepG2ヘパトーマ細胞におけるSTAT3リン酸化アッセイ。HepG2ヒトヘパトーマ細胞株をATCC (American Type Culture Collection)から得て、24-ウェルプレート中で組換えヒトIL-22で刺激した。中和抗体の段階希釈をEC80のIL-22と混合し、20分間細胞に添加した。HepG2可溶化液をCell Signaling から購入したPathScan Phospho-STAT3 Sandwich ELISA Kit中で試験し、試験抗体のIC50 値を測定した。このHepG2アッセイにおいて、ヒト化抗体は、280.46.3.4 雑種細胞 (ATCC特許寄託番号PTA-6284) から精製された遊離システインを含むマウス親抗体より1.4倍効能が高いことが確認された。IC50 値は、それぞれ257.5 pM及び370.5 pMであった (図6)。
抗体を、例えば脱アミド、異性化、加水分解、ジスルフィドスクランブル、ベータ-除去、酸化及び付加物形成等の種々の化学修飾及び/又は分解反応に供することができる。分解の主要な加水分解機構は、特に直ちにグリシン又はセリンが続く、アスパラギンの脱アミドを含むことができる。L-CDR1におけるシステインのセリンによる置換は、脱アミド候補部位を構成するNSモチーフを作るため、除去されるべきである。このNSモチーフを破壊しようと、一連の変異体をコンストラクトした (データ未開示)。最良の全体変異はセリンからスレオニンへの変化であることが分かった。配列番号32に記載のこの変異軽鎖可変ドメイン (280.VK4-1-T)は、ヒト化280.46.3.4 VHのバージョン 4 (280.VH3-66-4; 以下を参照されたい) と対合し、細胞ベースのアッセイにおいて抑制効力に関して評価した。
1) HepG2アッセイにおいて、ヒト化抗体は、280.46.3.4 雑種細胞 (ATCC特許寄託番号PTA-6284) から精製されたマウス親抗体より1.8倍強力であることが分かった。IC50 値は、それぞれ183.2 及び333.0 pMであった (図10)。
2) ヒトIL-22受容体形質移入-BaF3安定株化細胞アッセイにおいて、ヒト化抗体は、280.46.3.4 雑種細胞 (ATCC特許寄託番号PTA-6284) から精製したマウス親抗体より1.75倍強力であることが分かった。IC50 値は、それぞれ334 及び587 pMであった (図11)。
3) マウスIL-22 受容体形質移入BaF3安定株化細胞アッセイにおいて、ヒト化抗体は、280.46.3.4雑種細胞 (ATCC 特許寄託番号PTA-6284) から精製したマウス親抗体より2.1倍強力であることが分かった。IC50 値は、それぞれ687及び1473 pMであった(図12)。
抗体は、例えば脱アミド、異性化、加水分解、ジスルフィドスクランブル、ベータ-除去、酸化及び付加物形成等の種々の化学修飾及び/又は分解反応に供することができる。分解の主要な加水分解性機構は、アスパラギン酸(Asp) 異性化を含むことができる。この問題を防止するために、H-CDR1におけるAsp32及びH-CDR3におけるAsp 96がそれぞれ280.VH3-66-4において変異された一組の変異体を作成した。続いてこれらの単一変異体を上記のヒト化軽鎖可変ドメイン280.VK4-1-Tと対合させ、生じるNiNTA精製Fab抗体フラグメントをビアコアによって親和性測定に関して試験した。H-CDR1の32位におけるAspからGluへの変異を含むVHを、バージョン18又は280.VH3-66-18と呼び、それは配列番号34に記載される。図13に示すヒトIL-22RAへの結合を測定するビアコア分析の結果は、親未変異D32 (280.VH3-66-4) と比較して、D32E変異はオン速度(on rate)を約2倍増大し、オフ速度(off rate)を約5倍低下したことを示す。一方、D96E変異は、負の影響を有し、約500倍まで親和性を低下した。変異体D32Eは、示差走査熱量測定 (DSC) によって分析する場合、親D32抗体より1度安定であるように見える (図14)。全体的に、D32E変異は最終重鎖ヒト化バージョン18 (280.VH3-66-18) の特性を非常に改善すると結論付けることができる。
A. 重鎖
親マウス280.46.3.4と比較して、一連の変異体はヒト化 280.46.3.4の親和性、効力及び安定性を増大したので、最終ヒト化バージョンのヒト化を増大しようとデザインした。当該目的は、マウス親起源の多くのフレームワーク残基を可能な限り、対応するヒト生殖系列IGHV3-66残基に変異することであった。この工程中、発明者は残基Ala 67及びLeu 69の、残基Phe及びIleそれぞれへの変異を成功することができた(表1)。彼らはまた、ヒト生殖系列IGHV3-66に存在するバリンの代わりに29位のイソロイシンの導入が、熱安定性に正の効果を有することを見出した (データ未開示)。Ile 29はヒト生殖系列 IGHV3-66 (val 29)のこの位置において通常見られる残基ではないという事実にもかかわらず、活性の損失のない安定性へのその正の効果のため、配列番号16に記載の最終ヒト化VHバージョン46 (280.VH3-66-46)においてそれを取り込むことに決定した。ヒト生殖系列IGHV3-66との、最終ヒト化VHバージョン、280.VH3-66-46の配列比較は、9個のマウスフレームワーク残基が保持されたことを示す(図16及び表1)。
ヒト化軽鎖において、全フレームワーク残基がヒトであるので、CDR残基を生殖系列化する(germlining)可能性を検討した。マウスCDR残基内の一連の変異体を、個々のCDR残基を等価な位置において見られるヒト生殖系列IGKV4-1残基に変異することによってコンストラクトした。変異体を示差走査熱量測定及びビアコアによって、熱安定性及び親和性それぞれに関してスクリーニングした。L-CDR3の92位におけるPhe (表2)は、ヒト生殖系列IGKV4-1のこの位置に存在するTyr残基と取り換えることができ、この時熱安定性は摂氏1度高くなり親和性の低下はないことが分かった。280.VK4-1-TSYと呼ばれるこの最適化ヒト化VL配列は、配列番号17に記載される。図17に示されるヒト生殖系列 IGKV4-1とのその配列比較は、それらの配列はたった5つの位置において異なるので、280.VK4-1-TSYがフレームワーク及びCDR残基を含む全生殖系列 IGKV4-1配列と非常に高い同一性有することを示す(図17及び表2)。
280.IGKV4-1-TSYと対合した280.VH3-66.46を含むヒト IgG1/カッパとして発現されたヒト化抗体の効力を、3つの異なる細胞アッセイにおいて評価した。
用語「280.346.TSY」とは、重鎖及び軽鎖定常領域に関係なく、280.IGKV4-1-TSYと対合した280.VH3-66.46を含む、抗ヒトIL-22RAヒト化抗体を示すために以下において使用される。
1) 正常ヒトケラチノサイトにおけるSTAT3リン酸化アッセイ。正常ヒトケラチノサイトをBiopredic International から得て、96-ウェルプレート中で組換えヒトIL-22で刺激した。中和抗体の段階希釈をEC80のIL-22と混合し、20分間細胞に添加した。ケラチノサイト可溶化液をCell Signalingから購入したPathScan Phospho-STAT3 Sandwich ELISA Kit中で試験し、試験抗体のIC50 値を測定した。この正常ヒトケラチノサイトアッセイにおいて、280.346.TSYは、280.46.3.4雑種細胞(ATCC特許寄託番号PTA-6284) から精製したマウス親抗体よりほぼ9倍強力であることが分かった。IC50 値は、それぞれ60.95及び541.9 pMであった(図18)。
280.346.TSY の効力を、2つの異なる細胞アッセイにおいて評価した:
1) HEPA1-6 細胞におけるSTAT3リン酸化アッセイ。HEPA1-6 マウスヘパトーマ株化細胞をDSMZ (German Collection of Microorganisms and Cell Cultures) から得て、96ウェルプレート中で組換えマウスIL-22で刺激した。中和抗体の段階希釈をEC80のIL-22と混合し、20分間細胞に添加した。ヒトIgG1を対照として使用した。HEPA1-6可溶化液をCell Signaling から購入したPathScan Phospho-STAT3 Sandwich ELISA Kit中で試験し、試験抗体のIC50 値を測定した。このHEPA1-6 細胞アッセイにおいて、280.346.TSYは、マウスIL-22の活性を抑制することが分かった。IC50 は、ナノモル濃度の範囲であった(2,1 nM; 図21)。
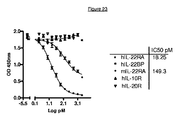
競合ELISAを使用して280.346.TSYの特異性及び結合親和性を測定した。マイクロタイタープレートをヒトIL-22RA-ECD (すなわち、IL-22RA-細胞外ドメイン) でコーティングした。ビオチン化280-346-TSY抗体を、競合物: ヒトインターロイキン22 受容体アルファ (hIL-22RA)、ヒトIL-22結合タンパク質 (hIL-22BP)、マウスIL-22受容体アルファ (mIL-22RA)、ヒトIL-10受容体アルファ (hIL-10R) 及びヒトIL-20受容体アルファ (hIL-20R) の存在下でプレートに添加した。プレート上にコーティングしたhIL-22RAへの結合を、ペルオキシダーゼ複合ストレプトアビジンの添加によって明らかにした。組換えヒト及びマウスIL-22RAに関する測定したIC50値は、それぞれ18.25 pM及び149.3 pMであった(図23)。モノクローナル抗体は、組換えヒトIL-22BP、IL-10R、及びIL-20Rと交差反応性を示さなかった。
280-346-TSYのKdを、ビアコア及びKinExA 装置の両方を使用して評価した。ヒト及び異なる種 (ラット, マウス, イヌ, アカゲザル, カニクイザル及びマーモセット)において見られる相同遺伝子配列のIL-22RA細胞外ドメイン (ECD)を、HEK-293細胞中で生成し、6 His tag を使用してNiNTA-精製した。280-346-TSY抗体は、試験したIL-22RAのヒト及びサル3種全てに対してナノモル以下の親和性を有する。それは、マウスに対してナノモル親和性を有し、ヒトへの親和性と比較して約100倍低い親和性であり、且つラットIL-22RAに対してマイクロモル親和性を有した (表3)。
280-346-TSYの薬力学活性を、オスBalb/cマウスにおいてIL-22-誘発血清アミロイドA上で測定した。異なる用量の280.346.TSYをマウスに皮下投与し、22時間後組換えマウスにIL-22を静脈内注射した。ビヒクル対照は、皮下にPBSを10 ml/kgで投与した。
280-346-TSYの薬力学活性を乾癬のマウスモデルにおいて測定した。メスC57BL/6マウスにおけるIL-23-誘発性耳肥厚への280-346-TSYの有効性を試験した。Zheng Y等記載のように(Nature 2007)、マウスに、全体積20μl中の500 ngの組換えヒト IL-23又はPBSを隔日に14日間注入した。異なる用量の280.346.TSYを、組換えIL-23の最初の投与前に第一の用量を、そしてその後隔日に皮下に投与した。ビヒクル対照として、皮下に10 ml/kgでPBSを投与する。デキサメタゾン(Dexa)を正の対照として使用した。9日目に抑制割合を算出し、これは耳介腫脹のピークに対応する。280-346-TSYは、ED50 値1.8 mg/kgを供する (図25)。
Claims (15)
- ヒトIL-22RAに結合するヒト化抗体であって、
a)それぞれ配列番号1、2及び3のアミノ酸配列から成るH-CDR1、H-CDR2、及びH-CDR3を含む重鎖可変ドメイン; 及び
b)それぞれ配列番号4、5及び6のアミノ酸配列から成る、又は、それぞれ配列番号4、5及び7のアミノ酸配列から成るL-CDR1、L-CDR2、及びL-CDR3を含む軽鎖可変ドメイン、
を含む、抗体。 - a) 重鎖可変ドメインが、それぞれ配列番号8、9、10及び11のアミノ酸配列から成るフレームワーク領域H-FR1、H-FR2、H-FR3及びH-FR4を含み、
b) 軽鎖可変ドメインが、それぞれ配列番号12、13、14、及び15のアミノ酸配列から成るフレームワーク領域L-FR1、L-FR2、L-FR3及びL-FR4を含む、
請求項1に記載のヒト化抗体。 - a) 重鎖可変ドメインが配列番号16のアミノ酸配列から成り、
b) 軽鎖可変ドメインが配列番号17のアミノ酸配列から成る、
請求項1又は2に記載のヒト化抗体。 - a) 配列番号18のアミノ酸配列から成る重鎖定常領域、及び
b) 配列番号19のアミノ酸配列から成る軽鎖定常ドメイン、
を含む、請求項1〜3のいずれか1項に記載のヒト化抗体。 - 配列番号20のアミノ酸配列を含む又は配列番号20のアミノ酸配列から成る重鎖、及び、配列番号21のアミノ酸配列を含む又は配列番号21のアミノ酸配列から成る軽鎖を含む、ヒトIL-22RAに結合する、ヒト化抗体。
- 請求項5に記載のヒト化抗体の重鎖及び軽鎖の双方をコードする、ポリヌクレオチド。
- a) 請求項5に記載のヒト化抗体の重鎖をコードするポリヌクレオチド、又は配列番号22を含む若しくは配列番号22から成る請求項5に記載のヒト化抗体の重鎖をコードするポリヌクレオチド、及びb) 請求項5に記載のヒト化抗体の軽鎖をコードするポリヌクレオチド、又は配列番号23を含む若しくは配列番号23から成る請求項5に記載のヒト化抗体の軽鎖をコードするポリヌクレオチド、を含む、発現ベクター。
- 請求項6に記載のポリヌクレオチドを含む、発現ベクター。
- 請求項7又は8に記載のベクターで形質転換された、宿主細胞。
- CHO細胞である、請求項9に記載の宿主細胞。
- 請求項1〜5のいずれか1項に記載のヒト化抗体を製造する方法であって、請求項9又は10に記載の宿主細胞を培養する工程、及び抗体を単離する工程を含む、方法。
- 請求項1〜5のいずれか1項に記載のヒト化抗体、又は請求項11に記載の方法に従って製造されたヒト化抗体を含む、医薬組成物。
- 医薬としての使用のための、請求項1〜5のいずれか1項に記載のヒト化抗体、又は請求項11に記載の方法に従って製造されたヒト化抗体。
- 乾癬、乾癬性関節炎又はアトピー性皮膚炎の治療における使用のための、請求項1〜5のいずれか1項に記載のヒト化抗体、又は請求項11に記載の方法に従って製造されたヒト化抗体。
- 乾癬、乾癬性関節炎又はアトピー性皮膚炎の治療用医薬の調製のための、請求項1〜5のいずれか1項に記載のヒト化抗体、又は請求項11に記載の方法に従って製造されヒト化抗体の使用。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP09176525.5 | 2009-11-19 | ||
| EP09176525 | 2009-11-19 | ||
| US26299809P | 2009-11-20 | 2009-11-20 | |
| US61/262,998 | 2009-11-20 | ||
| PCT/EP2010/067332 WO2011061119A1 (en) | 2009-11-19 | 2010-11-12 | Humanized antibodies against human il-22ra |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2013511267A JP2013511267A (ja) | 2013-04-04 |
| JP5818804B2 true JP5818804B2 (ja) | 2015-11-18 |
Family
ID=41565648
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2012539274A Expired - Fee Related JP5818804B2 (ja) | 2009-11-19 | 2010-11-12 | ヒトil−22raに対するヒト化抗体 |
Country Status (19)
| Country | Link |
|---|---|
| US (1) | US8545844B2 (ja) |
| EP (1) | EP2512511B1 (ja) |
| JP (1) | JP5818804B2 (ja) |
| KR (1) | KR20120098783A (ja) |
| CN (1) | CN102665759B (ja) |
| AU (1) | AU2010321047B2 (ja) |
| BR (1) | BR112012012003A2 (ja) |
| CA (1) | CA2778864C (ja) |
| EA (1) | EA021356B1 (ja) |
| EC (1) | ECSP12011980A (ja) |
| ES (1) | ES2531996T3 (ja) |
| IL (1) | IL219740A0 (ja) |
| IN (1) | IN2012DN03362A (ja) |
| MX (1) | MX2012005791A (ja) |
| NZ (1) | NZ599438A (ja) |
| PE (1) | PE20121560A1 (ja) |
| UA (1) | UA105405C2 (ja) |
| WO (1) | WO2011061119A1 (ja) |
| ZA (1) | ZA201202793B (ja) |
Families Citing this family (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BRPI0516975A (pt) * | 2004-10-22 | 2008-09-30 | Zymogenetics Inc | anticorpo ou seu fragmento de ligação a antìgeno, composição farmacêutica, imunoconjugado, hibridoma, anticorpo monoclonal, e, uso de um anticorpo ou seu fragmento de ligação a antìgeno |
| ES2670874T3 (es) | 2011-03-16 | 2018-06-01 | Argenx Bvba | Anticuerpos contra CD70 |
| KR20160042438A (ko) | 2013-08-12 | 2016-04-19 | 제넨테크, 인크. | 보체-연관 상태의 치료를 위한 조성물 및 방법 |
| US10179821B2 (en) * | 2014-05-01 | 2019-01-15 | Genentech, Inc. | Anti-factor D antibodies |
| US10391168B1 (en) | 2014-08-22 | 2019-08-27 | University Of Bern | Anti-CD70 combination therapy |
| WO2017075173A2 (en) | 2015-10-30 | 2017-05-04 | Genentech, Inc. | Anti-factor d antibodies and conjugates |
| US10654932B2 (en) * | 2015-10-30 | 2020-05-19 | Genentech, Inc. | Anti-factor D antibody variant conjugates and uses thereof |
| EP4292649A3 (en) | 2016-03-18 | 2024-02-21 | Staidson(Beijing) Biopharmaceuticals Co., Ltd. | Fusion protein comprising nerve growth factor and preparation method and use thereof |
| GB201612337D0 (en) | 2016-07-15 | 2016-08-31 | Argen-X N V | Ant-il-22r antibodies |
| US10781265B2 (en) * | 2017-05-24 | 2020-09-22 | Development Center For Biotechnology | Humanized antibodies against Globo H and uses thereof in cancer treatments |
| RU2019142330A (ru) | 2017-06-30 | 2021-07-30 | Займворкс, Инк. | Стабилизированные химерные fab |
| GB201800649D0 (en) | 2018-01-16 | 2018-02-28 | Argenx Bvba | CD70 Combination Therapy |
| WO2023232789A1 (en) * | 2022-06-03 | 2023-12-07 | Leo Pharma A/S | Liquid formulation of il-22r antibody |
| WO2024184333A1 (en) | 2023-03-08 | 2024-09-12 | Leo Pharma A/S | Il-22r antibody for use in treating atopic dermatitis |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5965704A (en) | 1997-08-05 | 1999-10-12 | Zymogenetics, Inc. | Class two cytokine receptor-11 |
| BRPI0516975A (pt) * | 2004-10-22 | 2008-09-30 | Zymogenetics Inc | anticorpo ou seu fragmento de ligação a antìgeno, composição farmacêutica, imunoconjugado, hibridoma, anticorpo monoclonal, e, uso de um anticorpo ou seu fragmento de ligação a antìgeno |
| TW200720439A (en) * | 2005-03-25 | 2007-06-01 | Glycart Biotechnology Ag | Antigen binding molecules directed to mcsp and having increased fc receptor binding affinity and effector function |
| NZ621483A (en) * | 2005-12-02 | 2015-10-30 | Genentech Inc | Compositions and methods for the treatment of diseases and disorders associated with cytokine signaling involving antibodies that bind to il-22 and il-22r |
-
2010
- 2010-11-12 IN IN3362DEN2012 patent/IN2012DN03362A/en unknown
- 2010-11-12 AU AU2010321047A patent/AU2010321047B2/en not_active Ceased
- 2010-11-12 KR KR1020127015390A patent/KR20120098783A/ko not_active Application Discontinuation
- 2010-11-12 CA CA2778864A patent/CA2778864C/en not_active Expired - Fee Related
- 2010-11-12 CN CN201080052724.0A patent/CN102665759B/zh not_active Expired - Fee Related
- 2010-11-12 US US13/510,068 patent/US8545844B2/en not_active Expired - Fee Related
- 2010-11-12 UA UAA201207335A patent/UA105405C2/ru unknown
- 2010-11-12 EA EA201290360A patent/EA021356B1/ru not_active IP Right Cessation
- 2010-11-12 MX MX2012005791A patent/MX2012005791A/es active IP Right Grant
- 2010-11-12 NZ NZ599438A patent/NZ599438A/en not_active IP Right Cessation
- 2010-11-12 BR BR112012012003A patent/BR112012012003A2/pt not_active IP Right Cessation
- 2010-11-12 EP EP10779768.0A patent/EP2512511B1/en active Active
- 2010-11-12 PE PE2012000669A patent/PE20121560A1/es not_active Application Discontinuation
- 2010-11-12 JP JP2012539274A patent/JP5818804B2/ja not_active Expired - Fee Related
- 2010-11-12 WO PCT/EP2010/067332 patent/WO2011061119A1/en active Application Filing
- 2010-11-12 ES ES10779768.0T patent/ES2531996T3/es active Active
-
2012
- 2012-04-17 ZA ZA2012/02793A patent/ZA201202793B/en unknown
- 2012-05-13 IL IL219740A patent/IL219740A0/en unknown
- 2012-06-18 EC ECSP12011980 patent/ECSP12011980A/es unknown
Also Published As
| Publication number | Publication date |
|---|---|
| JP2013511267A (ja) | 2013-04-04 |
| PE20121560A1 (es) | 2012-12-05 |
| MX2012005791A (es) | 2012-07-03 |
| IL219740A0 (en) | 2012-07-31 |
| CA2778864C (en) | 2017-06-27 |
| EP2512511A1 (en) | 2012-10-24 |
| UA105405C2 (ru) | 2014-05-12 |
| AU2010321047B2 (en) | 2016-06-09 |
| IN2012DN03362A (ja) | 2015-10-23 |
| US8545844B2 (en) | 2013-10-01 |
| CA2778864A1 (en) | 2011-05-26 |
| AU2010321047A1 (en) | 2012-05-24 |
| US20120230990A1 (en) | 2012-09-13 |
| NZ599438A (en) | 2013-12-20 |
| EA201290360A1 (ru) | 2012-11-30 |
| BR112012012003A2 (pt) | 2016-11-29 |
| EP2512511B1 (en) | 2015-01-07 |
| ZA201202793B (en) | 2013-06-26 |
| ECSP12011980A (es) | 2012-07-31 |
| EA021356B1 (ru) | 2015-05-29 |
| CN102665759B (zh) | 2015-09-30 |
| CN102665759A (zh) | 2012-09-12 |
| KR20120098783A (ko) | 2012-09-05 |
| ES2531996T3 (es) | 2015-03-23 |
| WO2011061119A1 (en) | 2011-05-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5818804B2 (ja) | ヒトil−22raに対するヒト化抗体 | |
| JP7100731B2 (ja) | ヒトil-4受容体に対する高親和性ヒト抗体 | |
| CN108699136B (zh) | 结合cd3和psma的异二聚抗体 | |
| CN103732621B (zh) | 抗神经生长因子抗体及其制备和使用方法 | |
| KR102278487B1 (ko) | Il-17a 접합체 및 이의 용도 | |
| KR101852915B1 (ko) | 과립구-대식세포 콜로니 자극 인자에 대한 항체 | |
| CN107522783B (zh) | 一种抗白介素17a的抗体、其制备方法和应用 | |
| JP7469292B2 (ja) | 抗btla抗体 | |
| KR20230009441A (ko) | 항-tigit 항체, 이의 제조 방법 및 용도 | |
| AU2016369307A1 (en) | Multi-specific antibody molecules having specificity for TNF-alpha, IL-17A and IL-17F | |
| IL262244B2 (en) | Antibodies against beta interferon and their use | |
| KR20210099027A (ko) | 항-cd40 항체, 이의 항원-결합 단편 및 약학적 용도 | |
| KR20230144596A (ko) | 항 cd112r 항체 및 그의 용도 | |
| US20140294815A1 (en) | Caninised tumour necrosis factor antibodies and methods of using the same | |
| KR20210121102A (ko) | 항-cd79b 항체, 이의 항원-결합 단편, 및 이의 약학적 용도 | |
| JPWO2020090892A1 (ja) | 抗ヒトFn14抗体 | |
| CN118284699A (zh) | 包含SIRPα突变体的融合蛋白 | |
| WO2022262828A1 (zh) | 抗il-36r抗体及其用途 | |
| WO2023093899A1 (zh) | 经修饰的蛋白或多肽 | |
| CN112513078B (zh) | 抗il-17a抗体及其用途 | |
| NZ621619B2 (en) | Caninised tumour necrosis factor antibodies and methods of using the same |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20131111 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20150127 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150427 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20150908 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20150929 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5818804 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |