JP5645666B2 - ハロゲン化フタロシアニン類の使用 - Google Patents
ハロゲン化フタロシアニン類の使用 Download PDFInfo
- Publication number
- JP5645666B2 JP5645666B2 JP2010531533A JP2010531533A JP5645666B2 JP 5645666 B2 JP5645666 B2 JP 5645666B2 JP 2010531533 A JP2010531533 A JP 2010531533A JP 2010531533 A JP2010531533 A JP 2010531533A JP 5645666 B2 JP5645666 B2 JP 5645666B2
- Authority
- JP
- Japan
- Prior art keywords
- phthalocyanine
- compound
- mixtures
- substituent
- solar cell
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 150000001875 compounds Chemical class 0.000 claims description 173
- 239000000463 material Substances 0.000 claims description 136
- 239000004065 semiconductor Substances 0.000 claims description 93
- 229910052725 zinc Inorganic materials 0.000 claims description 77
- 229910052802 copper Inorganic materials 0.000 claims description 58
- 229910052751 metal Inorganic materials 0.000 claims description 45
- 239000002184 metal Substances 0.000 claims description 45
- 239000000758 substrate Substances 0.000 claims description 41
- XMWRBQBLMFGWIX-UHFFFAOYSA-N C60 fullerene Chemical compound C12=C3C(C4=C56)=C7C8=C5C5=C9C%10=C6C6=C4C1=C1C4=C6C6=C%10C%10=C9C9=C%11C5=C8C5=C8C7=C3C3=C7C2=C1C1=C2C4=C6C4=C%10C6=C9C9=C%11C5=C5C8=C3C3=C7C1=C1C2=C4C6=C2C9=C5C3=C12 XMWRBQBLMFGWIX-UHFFFAOYSA-N 0.000 claims description 26
- 229910052736 halogen Inorganic materials 0.000 claims description 22
- 150000002367 halogens Chemical class 0.000 claims description 22
- 229910052739 hydrogen Inorganic materials 0.000 claims description 21
- 239000002019 doping agent Substances 0.000 claims description 19
- 239000001257 hydrogen Substances 0.000 claims description 18
- 229910003472 fullerene Inorganic materials 0.000 claims description 16
- 229910052801 chlorine Inorganic materials 0.000 claims description 15
- 229910052782 aluminium Inorganic materials 0.000 claims description 10
- CXZRDVVUVDYSCQ-UHFFFAOYSA-M pyronin B Chemical compound [Cl-].C1=CC(=[N+](CC)CC)C=C2OC3=CC(N(CC)CC)=CC=C3C=C21 CXZRDVVUVDYSCQ-UHFFFAOYSA-M 0.000 claims description 8
- 150000002738 metalloids Chemical group 0.000 claims description 7
- 229910052752 metalloid Inorganic materials 0.000 claims description 6
- PYWVYCXTNDRMGF-UHFFFAOYSA-N rhodamine B Chemical compound [Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=CC=C1C(O)=O PYWVYCXTNDRMGF-UHFFFAOYSA-N 0.000 claims description 5
- 125000004429 atom Chemical group 0.000 claims description 4
- 125000004435 hydrogen atom Chemical class [H]* 0.000 claims description 3
- VNWKTOKETHGBQD-UHFFFAOYSA-N methane Chemical compound C VNWKTOKETHGBQD-UHFFFAOYSA-N 0.000 claims 2
- 150000005309 metal halides Chemical group 0.000 claims 1
- 239000000203 mixture Substances 0.000 description 218
- IEQIEDJGQAUEQZ-UHFFFAOYSA-N phthalocyanine Chemical compound N1C(N=C2C3=CC=CC=C3C(N=C3C4=CC=CC=C4C(=N4)N3)=N2)=C(C=CC=C2)C2=C1N=C1C2=CC=CC=C2C4=N1 IEQIEDJGQAUEQZ-UHFFFAOYSA-N 0.000 description 137
- 239000010410 layer Substances 0.000 description 134
- 125000001153 fluoro group Chemical group F* 0.000 description 113
- AICOOMRHRUFYCM-ZRRPKQBOSA-N oxazine, 1 Chemical group C([C@@H]1[C@H](C(C[C@]2(C)[C@@H]([C@H](C)N(C)C)[C@H](O)C[C@]21C)=O)CC1=CC2)C[C@H]1[C@@]1(C)[C@H]2N=C(C(C)C)OC1 AICOOMRHRUFYCM-ZRRPKQBOSA-N 0.000 description 96
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 83
- 125000001309 chloro group Chemical group Cl* 0.000 description 80
- 239000011701 zinc Substances 0.000 description 79
- -1 R 18 Chemical compound 0.000 description 67
- 239000010949 copper Substances 0.000 description 64
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 51
- 239000000370 acceptor Substances 0.000 description 42
- 238000000746 purification Methods 0.000 description 35
- 125000005843 halogen group Chemical group 0.000 description 32
- 238000000034 method Methods 0.000 description 32
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 30
- 125000000217 alkyl group Chemical group 0.000 description 28
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 27
- LQNUZADURLCDLV-UHFFFAOYSA-N nitrobenzene Chemical compound [O-][N+](=O)C1=CC=CC=C1 LQNUZADURLCDLV-UHFFFAOYSA-N 0.000 description 26
- 239000000460 chlorine Substances 0.000 description 25
- 230000032258 transport Effects 0.000 description 25
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 24
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 24
- 238000000859 sublimation Methods 0.000 description 23
- 125000003118 aryl group Chemical group 0.000 description 22
- 229920001467 poly(styrenesulfonates) Polymers 0.000 description 22
- 230000008022 sublimation Effects 0.000 description 22
- XCJYREBRNVKWGJ-UHFFFAOYSA-N copper(II) phthalocyanine Chemical compound [Cu+2].C12=CC=CC=C2C(N=C2[N-]C(C3=CC=CC=C32)=N2)=NC1=NC([C]1C=CC=CC1=1)=NC=1N=C1[C]3C=CC=CC3=C2[N-]1 XCJYREBRNVKWGJ-UHFFFAOYSA-N 0.000 description 21
- STTGYIUESPWXOW-UHFFFAOYSA-N 2,9-dimethyl-4,7-diphenyl-1,10-phenanthroline Chemical compound C=12C=CC3=C(C=4C=CC=CC=4)C=C(C)N=C3C2=NC(C)=CC=1C1=CC=CC=C1 STTGYIUESPWXOW-UHFFFAOYSA-N 0.000 description 19
- 239000007787 solid Substances 0.000 description 19
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 17
- RBTKNAXYKSUFRK-UHFFFAOYSA-N heliogen blue Chemical compound [Cu].[N-]1C2=C(C=CC=C3)C3=C1N=C([N-]1)C3=CC=CC=C3C1=NC([N-]1)=C(C=CC=C3)C3=C1N=C([N-]1)C3=CC=CC=C3C1=N2 RBTKNAXYKSUFRK-UHFFFAOYSA-N 0.000 description 17
- 125000001424 substituent group Chemical group 0.000 description 17
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 16
- 239000012043 crude product Substances 0.000 description 16
- 229910052731 fluorine Inorganic materials 0.000 description 16
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 16
- QAOWNCQODCNURD-UHFFFAOYSA-N sulfuric acid group Chemical group S(O)(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 16
- 238000000151 deposition Methods 0.000 description 15
- 230000005669 field effect Effects 0.000 description 15
- 239000011135 tin Substances 0.000 description 15
- 230000008021 deposition Effects 0.000 description 14
- 239000000047 product Substances 0.000 description 14
- 125000003545 alkoxy group Chemical group 0.000 description 13
- 239000010931 gold Substances 0.000 description 13
- 238000004519 manufacturing process Methods 0.000 description 13
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical group N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 12
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 12
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 12
- 239000004202 carbamide Substances 0.000 description 12
- 239000011737 fluorine Substances 0.000 description 12
- 238000004770 highest occupied molecular orbital Methods 0.000 description 12
- 150000002739 metals Chemical class 0.000 description 12
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 12
- SAPTYURANIHAPE-UHFFFAOYSA-N 3-fluorobenzene-1,2-dicarbonitrile Chemical compound FC1=CC=CC(C#N)=C1C#N SAPTYURANIHAPE-UHFFFAOYSA-N 0.000 description 11
- 238000010521 absorption reaction Methods 0.000 description 11
- 238000006243 chemical reaction Methods 0.000 description 11
- 229920000642 polymer Polymers 0.000 description 11
- 239000002904 solvent Substances 0.000 description 11
- APUPEJJSWDHEBO-UHFFFAOYSA-P ammonium molybdate Chemical compound [NH4+].[NH4+].[O-][Mo]([O-])(=O)=O APUPEJJSWDHEBO-UHFFFAOYSA-P 0.000 description 10
- 239000011609 ammonium molybdate Substances 0.000 description 10
- 235000018660 ammonium molybdate Nutrition 0.000 description 10
- 229940010552 ammonium molybdate Drugs 0.000 description 10
- 125000004104 aryloxy group Chemical group 0.000 description 10
- 239000004020 conductor Substances 0.000 description 10
- 238000004768 lowest unoccupied molecular orbital Methods 0.000 description 10
- 229910052757 nitrogen Inorganic materials 0.000 description 10
- 229910052709 silver Inorganic materials 0.000 description 10
- ZCAPDAJQDNCVAE-UHFFFAOYSA-N 5,6,7,8,14,15,16,17,23,24,25,26,32,33,34,35-hexadecafluoro-2,11,20,29,37,38,39,40-octazanonacyclo[28.6.1.13,10.112,19.121,28.04,9.013,18.022,27.031,36]tetraconta-1,3,5,7,9,11,13(18),14,16,19,21(38),22(27),23,25,28,30(37),31(36),32,34-nonadecaene Chemical compound C12=C(F)C(F)=C(F)C(F)=C2C(N=C2NC(C3=C(F)C(F)=C(F)C(F)=C32)=N2)=NC1=NC([C]1C(F)=C(F)C(F)=C(F)C1=1)=NC=1N=C1[C]3C(F)=C(F)C(F)=C(F)C3=C2N1 ZCAPDAJQDNCVAE-UHFFFAOYSA-N 0.000 description 9
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 9
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 9
- 229920001609 Poly(3,4-ethylenedioxythiophene) Polymers 0.000 description 9
- 238000001704 evaporation Methods 0.000 description 9
- 230000008020 evaporation Effects 0.000 description 9
- 229910052737 gold Inorganic materials 0.000 description 9
- 230000001376 precipitating effect Effects 0.000 description 9
- 230000008569 process Effects 0.000 description 9
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 8
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 8
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 8
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 8
- 239000006096 absorbing agent Substances 0.000 description 8
- ZOIORXHNWRGPMV-UHFFFAOYSA-N acetic acid;zinc Chemical compound [Zn].CC(O)=O.CC(O)=O ZOIORXHNWRGPMV-UHFFFAOYSA-N 0.000 description 8
- 229910052786 argon Inorganic materials 0.000 description 8
- 125000000753 cycloalkyl group Chemical group 0.000 description 8
- 235000019253 formic acid Nutrition 0.000 description 8
- 230000005525 hole transport Effects 0.000 description 8
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 8
- PXHVJJICTQNCMI-UHFFFAOYSA-N nickel Substances [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 8
- 230000000737 periodic effect Effects 0.000 description 8
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 8
- 239000002243 precursor Substances 0.000 description 8
- 150000003751 zinc Chemical class 0.000 description 8
- 239000004246 zinc acetate Substances 0.000 description 8
- 238000001640 fractional crystallisation Methods 0.000 description 7
- 125000001072 heteroaryl group Chemical group 0.000 description 7
- 150000002431 hydrogen Chemical class 0.000 description 7
- 239000011159 matrix material Substances 0.000 description 7
- 238000005259 measurement Methods 0.000 description 7
- 238000013086 organic photovoltaic Methods 0.000 description 7
- 238000005215 recombination Methods 0.000 description 7
- 230000006798 recombination Effects 0.000 description 7
- 238000000926 separation method Methods 0.000 description 7
- 238000007740 vapor deposition Methods 0.000 description 7
- 229910021617 Indium monochloride Inorganic materials 0.000 description 6
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 6
- MWPLVEDNUUSJAV-UHFFFAOYSA-N anthracene Chemical class C1=CC=CC2=CC3=CC=CC=C3C=C21 MWPLVEDNUUSJAV-UHFFFAOYSA-N 0.000 description 6
- 239000011521 glass Substances 0.000 description 6
- 238000010438 heat treatment Methods 0.000 description 6
- 125000000592 heterocycloalkyl group Chemical group 0.000 description 6
- APHGZSBLRQFRCA-UHFFFAOYSA-M indium(1+);chloride Chemical group [In]Cl APHGZSBLRQFRCA-UHFFFAOYSA-M 0.000 description 6
- 239000012212 insulator Substances 0.000 description 6
- 229910052760 oxygen Inorganic materials 0.000 description 6
- 238000002360 preparation method Methods 0.000 description 6
- 239000011541 reaction mixture Substances 0.000 description 6
- 239000000243 solution Substances 0.000 description 6
- 239000010409 thin film Substances 0.000 description 6
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 5
- 150000007942 carboxylates Chemical class 0.000 description 5
- 239000003054 catalyst Substances 0.000 description 5
- 125000004093 cyano group Chemical group *C#N 0.000 description 5
- AMGQUBHHOARCQH-UHFFFAOYSA-N indium;oxotin Chemical compound [In].[Sn]=O AMGQUBHHOARCQH-UHFFFAOYSA-N 0.000 description 5
- 239000004973 liquid crystal related substance Substances 0.000 description 5
- 238000001840 matrix-assisted laser desorption--ionisation time-of-flight mass spectrometry Methods 0.000 description 5
- 239000011368 organic material Substances 0.000 description 5
- 238000005240 physical vapour deposition Methods 0.000 description 5
- 239000010453 quartz Substances 0.000 description 5
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N silicon dioxide Inorganic materials O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 5
- 239000010944 silver (metal) Substances 0.000 description 5
- QQEKYCCJLSRLEC-UHFFFAOYSA-N 4-fluorobenzene-1,2-dicarbonitrile Chemical compound FC1=CC=C(C#N)C(C#N)=C1 QQEKYCCJLSRLEC-UHFFFAOYSA-N 0.000 description 4
- 229920003026 Acene Polymers 0.000 description 4
- 239000004952 Polyamide Substances 0.000 description 4
- 229910004298 SiO 2 Inorganic materials 0.000 description 4
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 4
- 229910021529 ammonia Inorganic materials 0.000 description 4
- 230000000903 blocking effect Effects 0.000 description 4
- 230000000052 comparative effect Effects 0.000 description 4
- 239000002131 composite material Substances 0.000 description 4
- VPUGDVKSAQVFFS-UHFFFAOYSA-N coronene Chemical compound C1=C(C2=C34)C=CC3=CC=C(C=C3)C4=C4C3=CC=C(C=C3)C4=C2C3=C1 VPUGDVKSAQVFFS-UHFFFAOYSA-N 0.000 description 4
- 230000006870 function Effects 0.000 description 4
- 229910052738 indium Inorganic materials 0.000 description 4
- 229910052749 magnesium Inorganic materials 0.000 description 4
- 229910021645 metal ion Inorganic materials 0.000 description 4
- 125000001624 naphthyl group Chemical group 0.000 description 4
- 229910052697 platinum Inorganic materials 0.000 description 4
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Substances [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 4
- 229920002647 polyamide Polymers 0.000 description 4
- 238000007639 printing Methods 0.000 description 4
- 229910052710 silicon Inorganic materials 0.000 description 4
- 239000010703 silicon Substances 0.000 description 4
- 238000004528 spin coating Methods 0.000 description 4
- KNDUBEZZKOOYMJ-UHFFFAOYSA-N 4,5-difluorobenzene-1,2-dicarbonitrile Chemical compound FC1=CC(C#N)=C(C#N)C=C1F KNDUBEZZKOOYMJ-UHFFFAOYSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 3
- UJOBWOGCFQCDNV-UHFFFAOYSA-N Carbazole Natural products C1=CC=C2C3=CC=CC=C3NC2=C1 UJOBWOGCFQCDNV-UHFFFAOYSA-N 0.000 description 3
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 3
- 229910021591 Copper(I) chloride Inorganic materials 0.000 description 3
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- 239000004698 Polyethylene Substances 0.000 description 3
- 239000004743 Polypropylene Substances 0.000 description 3
- 239000004793 Polystyrene Substances 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- XLOMVQKBTHCTTD-UHFFFAOYSA-N Zinc monoxide Chemical compound [Zn]=O XLOMVQKBTHCTTD-UHFFFAOYSA-N 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- 238000000137 annealing Methods 0.000 description 3
- 238000009835 boiling Methods 0.000 description 3
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 3
- 229910052794 bromium Inorganic materials 0.000 description 3
- 229910052791 calcium Inorganic materials 0.000 description 3
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 3
- 229920001577 copolymer Polymers 0.000 description 3
- OXBLHERUFWYNTN-UHFFFAOYSA-M copper(I) chloride Chemical compound [Cu]Cl OXBLHERUFWYNTN-UHFFFAOYSA-M 0.000 description 3
- NWFNSTOSIVLCJA-UHFFFAOYSA-L copper;diacetate;hydrate Chemical compound O.[Cu+2].CC([O-])=O.CC([O-])=O NWFNSTOSIVLCJA-UHFFFAOYSA-L 0.000 description 3
- 239000013078 crystal Substances 0.000 description 3
- 238000002425 crystallisation Methods 0.000 description 3
- 230000008025 crystallization Effects 0.000 description 3
- 239000003989 dielectric material Substances 0.000 description 3
- 239000006185 dispersion Substances 0.000 description 3
- 230000005284 excitation Effects 0.000 description 3
- 238000001914 filtration Methods 0.000 description 3
- 229920002313 fluoropolymer Polymers 0.000 description 3
- 238000000260 fractional sublimation Methods 0.000 description 3
- 239000007789 gas Substances 0.000 description 3
- PQAXGPJSVFSKAI-UHFFFAOYSA-N hexadecachlorophthalocyanine Chemical compound C12=C(Cl)C(Cl)=C(Cl)C(Cl)=C2C(N=C2NC(C3=C(Cl)C(Cl)=C(Cl)C(Cl)=C32)=N2)=NC1=NC([C]1C(Cl)=C(Cl)C(Cl)=C(Cl)C1=1)=NC=1N=C1[C]3C(Cl)=C(Cl)C(Cl)=C(Cl)C3=C2N1 PQAXGPJSVFSKAI-UHFFFAOYSA-N 0.000 description 3
- 238000009413 insulation Methods 0.000 description 3
- 229910052742 iron Inorganic materials 0.000 description 3
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 3
- 229920000301 poly(3-hexylthiophene-2,5-diyl) polymer Polymers 0.000 description 3
- 229920000553 poly(phenylenevinylene) Polymers 0.000 description 3
- 229920000573 polyethylene Polymers 0.000 description 3
- 229920000098 polyolefin Polymers 0.000 description 3
- 229920001155 polypropylene Polymers 0.000 description 3
- 229920002223 polystyrene Polymers 0.000 description 3
- 229920000915 polyvinyl chloride Polymers 0.000 description 3
- 239000004800 polyvinyl chloride Substances 0.000 description 3
- 238000012545 processing Methods 0.000 description 3
- YYMBJDOZVAITBP-UHFFFAOYSA-N rubrene Chemical compound C1=CC=CC=C1C(C1=C(C=2C=CC=CC=2)C2=CC=CC=C2C(C=2C=CC=CC=2)=C11)=C(C=CC=C2)C2=C1C1=CC=CC=C1 YYMBJDOZVAITBP-UHFFFAOYSA-N 0.000 description 3
- 238000003756 stirring Methods 0.000 description 3
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 3
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 description 2
- 238000005160 1H NMR spectroscopy Methods 0.000 description 2
- GGNDPFHHUHTCIO-UHFFFAOYSA-N 1h-benzimidazole;perylene-3,4,9,10-tetracarboxylic acid Chemical compound C1=CC=C2NC=NC2=C1.C1=CC=C2NC=NC2=C1.C=12C3=CC=C(C(O)=O)C2=C(C(O)=O)C=CC=1C1=CC=C(C(O)=O)C2=C1C3=CC=C2C(=O)O GGNDPFHHUHTCIO-UHFFFAOYSA-N 0.000 description 2
- HZNVUJQVZSTENZ-UHFFFAOYSA-N 2,3-dichloro-5,6-dicyano-1,4-benzoquinone Chemical compound ClC1=C(Cl)C(=O)C(C#N)=C(C#N)C1=O HZNVUJQVZSTENZ-UHFFFAOYSA-N 0.000 description 2
- WXTMDXOMEHJXQO-UHFFFAOYSA-N 2,5-dihydroxybenzoic acid Chemical compound OC(=O)C1=CC(O)=CC=C1O WXTMDXOMEHJXQO-UHFFFAOYSA-N 0.000 description 2
- JESXATFQYMPTNL-UHFFFAOYSA-N 2-ethenylphenol Chemical compound OC1=CC=CC=C1C=C JESXATFQYMPTNL-UHFFFAOYSA-N 0.000 description 2
- SRIJSZQFAMLVQV-UHFFFAOYSA-N 4,5-dichlorobenzene-1,2-dicarbonitrile Chemical compound ClC1=CC(C#N)=C(C#N)C=C1Cl SRIJSZQFAMLVQV-UHFFFAOYSA-N 0.000 description 2
- 229910018072 Al 2 O 3 Inorganic materials 0.000 description 2
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 2
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N Aniline Chemical compound NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 description 2
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 2
- 229920001665 Poly-4-vinylphenol Polymers 0.000 description 2
- 239000004372 Polyvinyl alcohol Substances 0.000 description 2
- 229910052581 Si3N4 Inorganic materials 0.000 description 2
- PPBRXRYQALVLMV-UHFFFAOYSA-N Styrene Chemical compound C=CC1=CC=CC=C1 PPBRXRYQALVLMV-UHFFFAOYSA-N 0.000 description 2
- 229920004933 Terylene® Polymers 0.000 description 2
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 2
- 229910010413 TiO 2 Inorganic materials 0.000 description 2
- 150000001252 acrylic acid derivatives Chemical class 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 125000002723 alicyclic group Chemical group 0.000 description 2
- 229910045601 alloy Inorganic materials 0.000 description 2
- 239000000956 alloy Substances 0.000 description 2
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 2
- VSCWAEJMTAWNJL-UHFFFAOYSA-K aluminium trichloride Chemical compound Cl[Al](Cl)Cl VSCWAEJMTAWNJL-UHFFFAOYSA-K 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical group [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- UMIVXZPTRXBADB-UHFFFAOYSA-N benzocyclobutene Chemical compound C1=CC=C2CCC2=C1 UMIVXZPTRXBADB-UHFFFAOYSA-N 0.000 description 2
- WDEQGLDWZMIMJM-UHFFFAOYSA-N benzyl 4-hydroxy-2-(hydroxymethyl)pyrrolidine-1-carboxylate Chemical compound OCC1CC(O)CN1C(=O)OCC1=CC=CC=C1 WDEQGLDWZMIMJM-UHFFFAOYSA-N 0.000 description 2
- 239000012159 carrier gas Substances 0.000 description 2
- 238000005266 casting Methods 0.000 description 2
- 230000003197 catalytic effect Effects 0.000 description 2
- 239000000919 ceramic Substances 0.000 description 2
- MVPPADPHJFYWMZ-UHFFFAOYSA-N chlorobenzene Chemical compound ClC1=CC=CC=C1 MVPPADPHJFYWMZ-UHFFFAOYSA-N 0.000 description 2
- 230000000295 complement effect Effects 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 238000003618 dip coating Methods 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 125000005678 ethenylene group Chemical group [H]C([*:1])=C([H])[*:2] 0.000 description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 2
- 239000010408 film Substances 0.000 description 2
- 239000000706 filtrate Substances 0.000 description 2
- 239000004811 fluoropolymer Substances 0.000 description 2
- 239000011261 inert gas Substances 0.000 description 2
- 239000011229 interlayer Substances 0.000 description 2
- 238000000608 laser ablation Methods 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 229910001092 metal group alloy Inorganic materials 0.000 description 2
- 229920003240 metallophthalocyanine polymer Polymers 0.000 description 2
- 125000002950 monocyclic group Chemical group 0.000 description 2
- 239000002048 multi walled nanotube Substances 0.000 description 2
- 230000003287 optical effect Effects 0.000 description 2
- 125000001190 organyl group Chemical group 0.000 description 2
- 239000001301 oxygen Substances 0.000 description 2
- 238000005325 percolation Methods 0.000 description 2
- 125000002080 perylenyl group Chemical group C1(=CC=C2C=CC=C3C4=CC=CC5=CC=CC(C1=C23)=C45)* 0.000 description 2
- CSHWQDPOILHKBI-UHFFFAOYSA-N peryrene Natural products C1=CC(C2=CC=CC=3C2=C2C=CC=3)=C3C2=CC=CC3=C1 CSHWQDPOILHKBI-UHFFFAOYSA-N 0.000 description 2
- INAAIJLSXJJHOZ-UHFFFAOYSA-N pibenzimol Chemical compound C1CN(C)CCN1C1=CC=C(N=C(N2)C=3C=C4NC(=NC4=CC=3)C=3C=CC(O)=CC=3)C2=C1 INAAIJLSXJJHOZ-UHFFFAOYSA-N 0.000 description 2
- 229920000767 polyaniline Polymers 0.000 description 2
- 229920000728 polyester Polymers 0.000 description 2
- 239000005020 polyethylene terephthalate Substances 0.000 description 2
- 229920002098 polyfluorene Polymers 0.000 description 2
- 229920002635 polyurethane Polymers 0.000 description 2
- 239000004814 polyurethane Substances 0.000 description 2
- 229920002451 polyvinyl alcohol Polymers 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- 125000006413 ring segment Chemical group 0.000 description 2
- 229920006395 saturated elastomer Polymers 0.000 description 2
- HQVNEWCFYHHQES-UHFFFAOYSA-N silicon nitride Chemical compound N12[Si]34N5[Si]62N3[Si]51N64 HQVNEWCFYHHQES-UHFFFAOYSA-N 0.000 description 2
- 239000002109 single walled nanotube Substances 0.000 description 2
- 238000005507 spraying Methods 0.000 description 2
- 230000003068 static effect Effects 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 125000000547 substituted alkyl group Chemical group 0.000 description 2
- 125000005346 substituted cycloalkyl group Chemical group 0.000 description 2
- BDHFUVZGWQCTTF-UHFFFAOYSA-M sulfonate Chemical compound [O-]S(=O)=O BDHFUVZGWQCTTF-UHFFFAOYSA-M 0.000 description 2
- 125000001273 sulfonato group Chemical class [O-]S(*)(=O)=O 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 238000010345 tape casting Methods 0.000 description 2
- IFLREYGFSNHWGE-UHFFFAOYSA-N tetracene Chemical compound C1=CC=CC2=CC3=CC4=CC=CC=C4C=C3C=C21 IFLREYGFSNHWGE-UHFFFAOYSA-N 0.000 description 2
- PCCVSPMFGIFTHU-UHFFFAOYSA-N tetracyanoquinodimethane Chemical compound N#CC(C#N)=C1C=CC(=C(C#N)C#N)C=C1 PCCVSPMFGIFTHU-UHFFFAOYSA-N 0.000 description 2
- 150000003573 thiols Chemical class 0.000 description 2
- 229910052718 tin Inorganic materials 0.000 description 2
- JNELGWHKGNBSMD-UHFFFAOYSA-N xanthone Chemical compound C1=CC=C2C(=O)C3=CC=CC=C3OC2=C1 JNELGWHKGNBSMD-UHFFFAOYSA-N 0.000 description 2
- 239000008096 xylene Substances 0.000 description 2
- JIAARYAFYJHUJI-UHFFFAOYSA-L zinc dichloride Chemical compound [Cl-].[Cl-].[Zn+2] JIAARYAFYJHUJI-UHFFFAOYSA-L 0.000 description 2
- YLGQLQSDQXOIBI-UHFFFAOYSA-N (29h,31h-phthalocyaninato(2-)-n29,n30,n31,n32)platinum Chemical compound [Pt+2].[N-]1C(N=C2C3=CC=CC=C3C(N=C3C4=CC=CC=C4C(=N4)[N-]3)=N2)=C(C=CC=C2)C2=C1N=C1C2=CC=CC=C2C4=N1 YLGQLQSDQXOIBI-UHFFFAOYSA-N 0.000 description 1
- 125000004209 (C1-C8) alkyl group Chemical group 0.000 description 1
- 125000006552 (C3-C8) cycloalkyl group Chemical group 0.000 description 1
- 125000001399 1,2,3-triazolyl group Chemical group N1N=NC(=C1)* 0.000 description 1
- PBKONEOXTCPAFI-UHFFFAOYSA-N 1,2,4-trichlorobenzene Chemical compound ClC1=CC=C(Cl)C(Cl)=C1 PBKONEOXTCPAFI-UHFFFAOYSA-N 0.000 description 1
- ABFKYPFPQRDCGM-UHFFFAOYSA-N 14832-14-5 Chemical compound [Cu+2].[N-]1C(N=C2C3=C(Cl)C(Cl)=C(Cl)C(Cl)=C3C(N=C3C4=C(Cl)C(Cl)=C(Cl)C(Cl)=C4C(=N4)[N-]3)=N2)=C(C(Cl)=C(Cl)C(Cl)=C2Cl)C2=C1N=C1C2=C(Cl)C(Cl)=C(Cl)C(Cl)=C2C4=N1 ABFKYPFPQRDCGM-UHFFFAOYSA-N 0.000 description 1
- VOXZDWNPVJITMN-ZBRFXRBCSA-N 17β-estradiol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 VOXZDWNPVJITMN-ZBRFXRBCSA-N 0.000 description 1
- YBYIRNPNPLQARY-UHFFFAOYSA-N 1H-indene Natural products C1=CC=C2CC=CC2=C1 YBYIRNPNPLQARY-UHFFFAOYSA-N 0.000 description 1
- PDQRQJVPEFGVRK-UHFFFAOYSA-N 2,1,3-benzothiadiazole Chemical compound C1=CC=CC2=NSN=C21 PDQRQJVPEFGVRK-UHFFFAOYSA-N 0.000 description 1
- ATXGLSORWQBLBD-UHFFFAOYSA-N 2,3,6,7,10,11-hexa(undecoxy)triphenylene Chemical group C12=CC(OCCCCCCCCCCC)=C(OCCCCCCCCCCC)C=C2C2=CC(OCCCCCCCCCCC)=C(OCCCCCCCCCCC)C=C2C2=C1C=C(OCCCCCCCCCCC)C(OCCCCCCCCCCC)=C2 ATXGLSORWQBLBD-UHFFFAOYSA-N 0.000 description 1
- NPZFFXIUURRHIH-UHFFFAOYSA-N 2,3,6,7,10,11-hexakis(4-nonylphenyl)triphenylene Chemical group C1=CC(CCCCCCCCC)=CC=C1C1=CC(C2=CC(=C(C=3C=CC(CCCCCCCCC)=CC=3)C=C2C2=CC(=C(C=3C=CC(CCCCCCCCC)=CC=3)C=C22)C=3C=CC(CCCCCCCCC)=CC=3)C=3C=CC(CCCCCCCCC)=CC=3)=C2C=C1C1=CC=C(CCCCCCCCC)C=C1 NPZFFXIUURRHIH-UHFFFAOYSA-N 0.000 description 1
- XUGANSMMMYTZPV-UHFFFAOYSA-N 2,3,6,7,10,11-hexakis(hexylsulfanyl)triphenylene Chemical group C12=CC(SCCCCCC)=C(SCCCCCC)C=C2C2=CC(SCCCCCC)=C(SCCCCCC)C=C2C2=C1C=C(SCCCCCC)C(SCCCCCC)=C2 XUGANSMMMYTZPV-UHFFFAOYSA-N 0.000 description 1
- 125000005808 2,4,6-trimethoxyphenyl group Chemical group [H][#6]-1=[#6](-[#8]C([H])([H])[H])-[#6](-*)=[#6](-[#8]C([H])([H])[H])-[#6]([H])=[#6]-1-[#8]C([H])([H])[H] 0.000 description 1
- KLIDCXVFHGNTTM-UHFFFAOYSA-N 2,6-dimethoxyphenol Chemical group COC1=CC=CC(OC)=C1O KLIDCXVFHGNTTM-UHFFFAOYSA-N 0.000 description 1
- IIKSFQIOFHBWSO-UHFFFAOYSA-N 2,9-bis(2-phenylethyl)anthra(2,1,9-def:6,5,10-d'e'f')diisoquinoline-1,3,8,10(2h,9h)-tetrone Chemical compound O=C1C(C2=C34)=CC=C3C(C=35)=CC=C(C(N(CCC=6C=CC=CC=6)C6=O)=O)C5=C6C=CC=3C4=CC=C2C(=O)N1CCC1=CC=CC=C1 IIKSFQIOFHBWSO-UHFFFAOYSA-N 0.000 description 1
- HIXDQWDOVZUNNA-UHFFFAOYSA-N 2-(3,4-dimethoxyphenyl)-5-hydroxy-7-methoxychromen-4-one Chemical compound C=1C(OC)=CC(O)=C(C(C=2)=O)C=1OC=2C1=CC=C(OC)C(OC)=C1 HIXDQWDOVZUNNA-UHFFFAOYSA-N 0.000 description 1
- IXHWGNYCZPISET-UHFFFAOYSA-N 2-[4-(dicyanomethylidene)-2,3,5,6-tetrafluorocyclohexa-2,5-dien-1-ylidene]propanedinitrile Chemical compound FC1=C(F)C(=C(C#N)C#N)C(F)=C(F)C1=C(C#N)C#N IXHWGNYCZPISET-UHFFFAOYSA-N 0.000 description 1
- 125000004204 2-methoxyphenyl group Chemical group [H]C1=C([H])C(*)=C(OC([H])([H])[H])C([H])=C1[H] 0.000 description 1
- HONWGFNQCPRRFM-UHFFFAOYSA-N 2-n-(3-methylphenyl)-1-n,1-n,2-n-triphenylbenzene-1,2-diamine Chemical compound CC1=CC=CC(N(C=2C=CC=CC=2)C=2C(=CC=CC=2)N(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1 HONWGFNQCPRRFM-UHFFFAOYSA-N 0.000 description 1
- XDXWNHPWWKGTKO-UHFFFAOYSA-N 207739-72-8 Chemical compound C1=CC(OC)=CC=C1N(C=1C=C2C3(C4=CC(=CC=C4C2=CC=1)N(C=1C=CC(OC)=CC=1)C=1C=CC(OC)=CC=1)C1=CC(=CC=C1C1=CC=C(C=C13)N(C=1C=CC(OC)=CC=1)C=1C=CC(OC)=CC=1)N(C=1C=CC(OC)=CC=1)C=1C=CC(OC)=CC=1)C1=CC=C(OC)C=C1 XDXWNHPWWKGTKO-UHFFFAOYSA-N 0.000 description 1
- DDCBCMPRTJJARO-UHFFFAOYSA-N 3,6-bis(dicyanomethylidene)-2,5-difluorocyclohexa-1,4-diene-1,4-dicarbonitrile Chemical compound FC1=C(C#N)C(=C(C#N)C#N)C(F)=C(C#N)C1=C(C#N)C#N DDCBCMPRTJJARO-UHFFFAOYSA-N 0.000 description 1
- CWDGVDYEOTVHAZ-UHFFFAOYSA-N 3-(2-methoxy-5-octylphenyl)thiophene Chemical compound CCCCCCCCC1=CC=C(OC)C(C2=CSC=C2)=C1 CWDGVDYEOTVHAZ-UHFFFAOYSA-N 0.000 description 1
- YEWTUGLUENRXFN-UHFFFAOYSA-N 3-(4-octylphenyl)-2-thiophen-2-ylthiophene Chemical compound C1=CC(CCCCCCCC)=CC=C1C1=C(C=2SC=CC=2)SC=C1 YEWTUGLUENRXFN-UHFFFAOYSA-N 0.000 description 1
- VRQDSLZQWNGVEE-UHFFFAOYSA-N 3-[4-[2-(2-methoxyethoxy)ethoxy]phenyl]thiophene Chemical compound C1=CC(OCCOCCOC)=CC=C1C1=CSC=C1 VRQDSLZQWNGVEE-UHFFFAOYSA-N 0.000 description 1
- LZQGFZMYLYXXHI-UHFFFAOYSA-N 3-chlorobenzene-1,2-dicarbonitrile Chemical compound ClC1=CC=CC(C#N)=C1C#N LZQGFZMYLYXXHI-UHFFFAOYSA-N 0.000 description 1
- GZEFZLXJPGMRSP-UHFFFAOYSA-N 37,38,39,40-tetrazanonacyclo[28.6.1.13,10.112,19.121,28.04,9.013,18.022,27.031,36]tetraconta-1(37),2,4,6,8,10,12(39),13,15,17,19,21,23,25,27,29,31,33,35-nonadecaene Chemical compound c1ccc2c3cc4[nH]c(cc5nc(cc6[nH]c(cc(n3)c2c1)c1ccccc61)c1ccccc51)c1ccccc41 GZEFZLXJPGMRSP-UHFFFAOYSA-N 0.000 description 1
- UZVMVUUAAXJDIL-UHFFFAOYSA-N 37,38,39,40-tetrazanonacyclo[28.6.1.13,10.112,19.121,28.04,9.013,18.022,27.031,36]tetraconta-1(37),2,4,6,8,10,12(39),13,15,17,19,21,23,25,27,29,31,33,35-nonadecaene zinc Chemical compound [Zn].N1C(C=C2C3=CC=CC=C3C(C=C3C4=CC=CC=C4C(=C4)N3)=N2)=C(C=CC=C2)C2=C1C=C1C2=CC=CC=C2C4=N1 UZVMVUUAAXJDIL-UHFFFAOYSA-N 0.000 description 1
- DHDHJYNTEFLIHY-UHFFFAOYSA-N 4,7-diphenyl-1,10-phenanthroline Chemical compound C1=CC=CC=C1C1=CC=NC2=C1C=CC1=C(C=3C=CC=CC=3)C=CN=C21 DHDHJYNTEFLIHY-UHFFFAOYSA-N 0.000 description 1
- 125000004801 4-cyanophenyl group Chemical group [H]C1=C([H])C(C#N)=C([H])C([H])=C1* 0.000 description 1
- 125000004860 4-ethylphenyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000004861 4-isopropyl phenyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)C([H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000004172 4-methoxyphenyl group Chemical group [H]C1=C([H])C(OC([H])([H])[H])=C([H])C([H])=C1* 0.000 description 1
- DIVZFUBWFAOMCW-UHFFFAOYSA-N 4-n-(3-methylphenyl)-1-n,1-n-bis[4-(n-(3-methylphenyl)anilino)phenyl]-4-n-phenylbenzene-1,4-diamine Chemical compound CC1=CC=CC(N(C=2C=CC=CC=2)C=2C=CC(=CC=2)N(C=2C=CC(=CC=2)N(C=2C=CC=CC=2)C=2C=C(C)C=CC=2)C=2C=CC(=CC=2)N(C=2C=CC=CC=2)C=2C=C(C)C=CC=2)=C1 DIVZFUBWFAOMCW-UHFFFAOYSA-N 0.000 description 1
- GZKPUYJFADMBGO-UHFFFAOYSA-N 5,10,15,20-tetrapyridin-3-yl-21,23-dihydroporphyrin Chemical compound c1cc2nc1c(-c1cccnc1)c1ccc([nH]1)c(-c1cccnc1)c1ccc(n1)c(-c1cccnc1)c1ccc([nH]1)c2-c1cccnc1 GZKPUYJFADMBGO-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- PONZBUKBFVIXOD-UHFFFAOYSA-N 9,10-dicarbamoylperylene-3,4-dicarboxylic acid Chemical compound C=12C3=CC=C(C(O)=O)C2=C(C(O)=O)C=CC=1C1=CC=C(C(O)=N)C2=C1C3=CC=C2C(=N)O PONZBUKBFVIXOD-UHFFFAOYSA-N 0.000 description 1
- 239000005964 Acibenzolar-S-methyl Substances 0.000 description 1
- 229910001316 Ag alloy Inorganic materials 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 1
- KLHYPYAETJWSBK-UHFFFAOYSA-J Cl[Zn](Cl)(Cl)Cl Chemical compound Cl[Zn](Cl)(Cl)Cl KLHYPYAETJWSBK-UHFFFAOYSA-J 0.000 description 1
- 239000004985 Discotic Liquid Crystal Substance Substances 0.000 description 1
- GYHNNYVSQQEPJS-UHFFFAOYSA-N Gallium Chemical compound [Ga] GYHNNYVSQQEPJS-UHFFFAOYSA-N 0.000 description 1
- WLLGXSLBOPFWQV-UHFFFAOYSA-N MGK 264 Chemical compound C1=CC2CC1C1C2C(=O)N(CC(CC)CCCC)C1=O WLLGXSLBOPFWQV-UHFFFAOYSA-N 0.000 description 1
- 229910000861 Mg alloy Inorganic materials 0.000 description 1
- VEQPNABPJHWNSG-UHFFFAOYSA-N Nickel(2+) Chemical compound [Ni+2] VEQPNABPJHWNSG-UHFFFAOYSA-N 0.000 description 1
- CBENFWSGALASAD-UHFFFAOYSA-N Ozone Chemical compound [O-][O+]=O CBENFWSGALASAD-UHFFFAOYSA-N 0.000 description 1
- URLKBWYHVLBVBO-UHFFFAOYSA-N Para-Xylene Chemical group CC1=CC=C(C)C=C1 URLKBWYHVLBVBO-UHFFFAOYSA-N 0.000 description 1
- 229920000280 Poly(3-octylthiophene) Polymers 0.000 description 1
- 239000004642 Polyimide Substances 0.000 description 1
- 229920002367 Polyisobutene Polymers 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical group [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- XBDYBAVJXHJMNQ-UHFFFAOYSA-N Tetrahydroanthracene Natural products C1=CC=C2C=C(CCCC3)C3=CC2=C1 XBDYBAVJXHJMNQ-UHFFFAOYSA-N 0.000 description 1
- ATJFFYVFTNAWJD-UHFFFAOYSA-N Tin Chemical compound [Sn] ATJFFYVFTNAWJD-UHFFFAOYSA-N 0.000 description 1
- SLGBZMMZGDRARJ-UHFFFAOYSA-N Triphenylene Natural products C1=CC=C2C3=CC=CC=C3C3=CC=CC=C3C2=C1 SLGBZMMZGDRARJ-UHFFFAOYSA-N 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- PTFCDOFLOPIGGS-UHFFFAOYSA-N Zinc dication Chemical compound [Zn+2] PTFCDOFLOPIGGS-UHFFFAOYSA-N 0.000 description 1
- AJSHLDNBMHSJQZ-UHFFFAOYSA-N acetylene pyrido[2,3-b]pyrazine Chemical group C#C.N1=CC=NC2=CC=CN=C21 AJSHLDNBMHSJQZ-UHFFFAOYSA-N 0.000 description 1
- 125000000641 acridinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3C=C12)* 0.000 description 1
- 229920000109 alkoxy-substituted poly(p-phenylene vinylene) Polymers 0.000 description 1
- 125000004453 alkoxycarbonyl group Chemical group 0.000 description 1
- XYLMUPLGERFSHI-UHFFFAOYSA-N alpha-Methylstyrene Chemical compound CC(=C)C1=CC=CC=C1 XYLMUPLGERFSHI-UHFFFAOYSA-N 0.000 description 1
- 235000019270 ammonium chloride Nutrition 0.000 description 1
- YVBOZGOAVJZITM-UHFFFAOYSA-P ammonium phosphomolybdate Chemical compound [NH4+].[NH4+].[NH4+].[NH4+].[O-]P([O-])=O.[O-][Mo]([O-])(=O)=O YVBOZGOAVJZITM-UHFFFAOYSA-P 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 125000002178 anthracenyl group Chemical group C1(=CC=CC2=CC3=CC=CC=C3C=C12)* 0.000 description 1
- 150000001555 benzenes Chemical class 0.000 description 1
- 125000003354 benzotriazolyl group Chemical group N1N=NC2=C1C=CC=C2* 0.000 description 1
- PWLNAUNEAKQYLH-UHFFFAOYSA-N butyric acid octyl ester Natural products CCCCCCCCOC(=O)CCC PWLNAUNEAKQYLH-UHFFFAOYSA-N 0.000 description 1
- 239000003990 capacitor Substances 0.000 description 1
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 125000004432 carbon atom Chemical group C* 0.000 description 1
- 150000003857 carboxamides Chemical class 0.000 description 1
- 150000001732 carboxylic acid derivatives Chemical group 0.000 description 1
- 150000001733 carboxylic acid esters Chemical class 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000002800 charge carrier Substances 0.000 description 1
- PBAYDYUZOSNJGU-UHFFFAOYSA-N chelidonic acid Natural products OC(=O)C1=CC(=O)C=C(C(O)=O)O1 PBAYDYUZOSNJGU-UHFFFAOYSA-N 0.000 description 1
- 238000005660 chlorination reaction Methods 0.000 description 1
- 229960001701 chloroform Drugs 0.000 description 1
- 238000004140 cleaning Methods 0.000 description 1
- 238000010549 co-Evaporation Methods 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 229910017052 cobalt Inorganic materials 0.000 description 1
- 239000010941 cobalt Substances 0.000 description 1
- GUTLYIVDDKVIGB-UHFFFAOYSA-N cobalt atom Chemical compound [Co] GUTLYIVDDKVIGB-UHFFFAOYSA-N 0.000 description 1
- MPMSMUBQXQALQI-UHFFFAOYSA-N cobalt phthalocyanine Chemical compound [Co+2].C12=CC=CC=C2C(N=C2[N-]C(C3=CC=CC=C32)=N2)=NC1=NC([C]1C=CC=CC1=1)=NC=1N=C1[C]3C=CC=CC3=C2[N-]1 MPMSMUBQXQALQI-UHFFFAOYSA-N 0.000 description 1
- ILZSSCVGGYJLOG-UHFFFAOYSA-N cobaltocene Chemical compound [Co+2].C=1C=C[CH-]C=1.C=1C=C[CH-]C=1 ILZSSCVGGYJLOG-UHFFFAOYSA-N 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 229920001940 conductive polymer Polymers 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- DLKOGKBOBOTEFO-UHFFFAOYSA-N copper 37,38,39,40-tetrazanonacyclo[28.6.1.13,10.112,19.121,28.04,9.013,18.022,27.031,36]tetraconta-1(37),2,4,6,8,10,12(39),13,15,17,19,21,23,25,27,29,31,33,35-nonadecaene Chemical compound [Cu].N1C(C=C2C3=CC=CC=C3C(C=C3C4=CC=CC=C4C(=C4)N3)=N2)=C(C=CC=C2)C2=C1C=C1C2=CC=CC=C2C4=N1 DLKOGKBOBOTEFO-UHFFFAOYSA-N 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 239000008367 deionised water Substances 0.000 description 1
- 229910021641 deionized water Inorganic materials 0.000 description 1
- 238000004925 denaturation Methods 0.000 description 1
- 230000036425 denaturation Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- RAABOESOVLLHRU-UHFFFAOYSA-N diazene Chemical compound N=N RAABOESOVLLHRU-UHFFFAOYSA-N 0.000 description 1
- 229910000071 diazene Inorganic materials 0.000 description 1
- 125000000532 dioxanyl group Chemical group 0.000 description 1
- 238000010494 dissociation reaction Methods 0.000 description 1
- 230000005593 dissociations Effects 0.000 description 1
- HKNRNTYTYUWGLN-UHFFFAOYSA-N dithieno[3,2-a:2',3'-d]thiophene Chemical compound C1=CSC2=C1SC1=C2C=CS1 HKNRNTYTYUWGLN-UHFFFAOYSA-N 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 230000005670 electromagnetic radiation Effects 0.000 description 1
- 239000011532 electronic conductor Substances 0.000 description 1
- 239000003480 eluent Substances 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- RTZKZFJDLAIYFH-UHFFFAOYSA-N ether Substances CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 1
- 230000005281 excited state Effects 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 238000011049 filling Methods 0.000 description 1
- 239000012065 filter cake Substances 0.000 description 1
- 125000003983 fluorenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 description 1
- 229910052733 gallium Inorganic materials 0.000 description 1
- 229910021482 group 13 metal Inorganic materials 0.000 description 1
- 230000020169 heat generation Effects 0.000 description 1
- 229910052734 helium Inorganic materials 0.000 description 1
- 239000001307 helium Substances 0.000 description 1
- SWQJXJOGLNCZEY-UHFFFAOYSA-N helium atom Chemical compound [He] SWQJXJOGLNCZEY-UHFFFAOYSA-N 0.000 description 1
- 125000005842 heteroatom Chemical group 0.000 description 1
- QRRKXCPLJGPVHN-UHFFFAOYSA-N hexabenzocoronene Chemical compound C12C(C(=C34)C(=C56)C7=C89)=C%10C7=C7C%11=CC=CC7=C8C=CC=C9C5=CC=CC6=C3C=CC=C4C1=CC=CC2=C1C%10=C%11C=CC1 QRRKXCPLJGPVHN-UHFFFAOYSA-N 0.000 description 1
- 150000002483 hydrogen compounds Chemical class 0.000 description 1
- 125000002632 imidazolidinyl group Chemical group 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 150000003949 imides Chemical class 0.000 description 1
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 125000003454 indenyl group Chemical group C1(C=CC2=CC=CC=C12)* 0.000 description 1
- HRHKULZDDYWVBE-UHFFFAOYSA-N indium;oxozinc;tin Chemical compound [In].[Sn].[Zn]=O HRHKULZDDYWVBE-UHFFFAOYSA-N 0.000 description 1
- 125000001041 indolyl group Chemical group 0.000 description 1
- 229910003480 inorganic solid Inorganic materials 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 125000004628 isothiazolidinyl group Chemical group S1N(CCC1)* 0.000 description 1
- 125000003965 isoxazolidinyl group Chemical group 0.000 description 1
- 239000002346 layers by function Substances 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- 230000001795 light effect Effects 0.000 description 1
- 125000000040 m-tolyl group Chemical group [H]C1=C([H])C(*)=C([H])C(=C1[H])C([H])([H])[H] 0.000 description 1
- 229910052748 manganese Inorganic materials 0.000 description 1
- 239000000155 melt Substances 0.000 description 1
- 229910044991 metal oxide Inorganic materials 0.000 description 1
- 150000004706 metal oxides Chemical class 0.000 description 1
- 238000001465 metallisation Methods 0.000 description 1
- JIQNWFBLYKVZFY-UHFFFAOYSA-N methoxycyclohexatriene Chemical compound COC1=C[C]=CC=C1 JIQNWFBLYKVZFY-UHFFFAOYSA-N 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 238000000302 molecular modelling Methods 0.000 description 1
- 229910000476 molybdenum oxide Inorganic materials 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000003136 n-heptyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 150000002790 naphthalenes Chemical class 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 229910052755 nonmetal Inorganic materials 0.000 description 1
- 150000002843 nonmetals Chemical group 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 125000003261 o-tolyl group Chemical group [H]C1=C([H])C(*)=C(C([H])=C1[H])C([H])([H])[H] 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 230000005693 optoelectronics Effects 0.000 description 1
- 239000012044 organic layer Substances 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 125000000160 oxazolidinyl group Chemical group 0.000 description 1
- WYURNTSHIVDZCO-SVYQBANQSA-N oxolane-d8 Chemical compound [2H]C1([2H])OC([2H])([2H])C([2H])([2H])C1([2H])[2H] WYURNTSHIVDZCO-SVYQBANQSA-N 0.000 description 1
- PQQKPALAQIIWST-UHFFFAOYSA-N oxomolybdenum Chemical compound [Mo]=O PQQKPALAQIIWST-UHFFFAOYSA-N 0.000 description 1
- 125000001820 oxy group Chemical group [*:1]O[*:2] 0.000 description 1
- 238000006385 ozonation reaction Methods 0.000 description 1
- ATGUVEKSASEFFO-UHFFFAOYSA-N p-aminodiphenylamine Chemical compound C1=CC(N)=CC=C1NC1=CC=CC=C1 ATGUVEKSASEFFO-UHFFFAOYSA-N 0.000 description 1
- 125000001037 p-tolyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)C([H])([H])[H] 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- KDLHZDBZIXYQEI-UHFFFAOYSA-N palladium Substances [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 238000000059 patterning Methods 0.000 description 1
- FZYQHMHIALEGMG-MVOHYUIRSA-N pcbb Chemical compound CCCCOC(=O)CCCC1([C@]23C4=C5C=CC6=C7C=CC8=C9C=CC%10=C%11C=CC%12=C(C=C4)[C@]31C1=C3C4=C2C5=C6C=2C7=C8C5=C9C%10=C(C3=C5C4=2)C%11=C%121)C1=CC=CC=C1 FZYQHMHIALEGMG-MVOHYUIRSA-N 0.000 description 1
- BRVSNRNVRFLFLL-HQSVLGJOSA-N pcbo Chemical compound CCCCCCCCOC(=O)CCCC1([C@]23C4=C5C=CC6=C7C=CC8=C9C=CC%10=C%11C=CC%12=C(C=C4)[C@]31C1=C3C4=C2C5=C6C=2C7=C8C5=C9C%10=C(C3=C5C4=2)C%11=C%121)C1=CC=CC=C1 BRVSNRNVRFLFLL-HQSVLGJOSA-N 0.000 description 1
- SLIUAWYAILUBJU-UHFFFAOYSA-N pentacene Chemical compound C1=CC=CC2=CC3=CC4=CC5=CC=CC=C5C=C4C=C3C=C21 SLIUAWYAILUBJU-UHFFFAOYSA-N 0.000 description 1
- 150000002964 pentacenes Chemical class 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 125000001792 phenanthrenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3C=CC12)* 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- 125000003386 piperidinyl group Chemical group 0.000 description 1
- 230000010287 polarization Effects 0.000 description 1
- 229920000264 poly(3',7'-dimethyloctyloxy phenylene vinylene) Polymers 0.000 description 1
- 229920003227 poly(N-vinyl carbazole) Polymers 0.000 description 1
- 229920000058 polyacrylate Polymers 0.000 description 1
- 229920006122 polyamide resin Polymers 0.000 description 1
- 229920001088 polycarbazole Polymers 0.000 description 1
- 125000003367 polycyclic group Chemical group 0.000 description 1
- 229920000414 polyfuran Polymers 0.000 description 1
- 229920001721 polyimide Polymers 0.000 description 1
- 239000002861 polymer material Substances 0.000 description 1
- 229920000128 polypyrrole Polymers 0.000 description 1
- 229920000123 polythiophene Polymers 0.000 description 1
- 150000004032 porphyrins Chemical class 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 239000013014 purified material Substances 0.000 description 1
- 125000000561 purinyl group Chemical group N1=C(N=C2N=CNC2=C1)* 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000003072 pyrazolidinyl group Chemical group 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- 125000001725 pyrenyl group Chemical group 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- 125000004076 pyridyl group Chemical group 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- GGVMPKQSTZIOIU-UHFFFAOYSA-N quaterrylene Chemical group C12=C3C4=CC=C2C(C2=C56)=CC=C5C(C=57)=CC=CC7=CC=CC=5C6=CC=C2C1=CC=C3C1=CC=CC2=CC=CC4=C21 GGVMPKQSTZIOIU-UHFFFAOYSA-N 0.000 description 1
- 238000010791 quenching Methods 0.000 description 1
- 230000000171 quenching effect Effects 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 229940043267 rhodamine b Drugs 0.000 description 1
- DCKVNWZUADLDEH-UHFFFAOYSA-N sec-butyl acetate Chemical compound CCC(C)OC(C)=O DCKVNWZUADLDEH-UHFFFAOYSA-N 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 239000004332 silver Substances 0.000 description 1
- 238000000527 sonication Methods 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 125000003107 substituted aryl group Chemical group 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 125000000565 sulfonamide group Chemical group 0.000 description 1
- 125000002130 sulfonic acid ester group Chemical group 0.000 description 1
- 125000000542 sulfonic acid group Chemical group 0.000 description 1
- 239000011593 sulfur Chemical group 0.000 description 1
- 229910052717 sulfur Inorganic materials 0.000 description 1
- 229920002994 synthetic fiber Polymers 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000001935 tetracenyl group Chemical group C1(=CC=CC2=CC3=CC4=CC=CC=C4C=C3C=C12)* 0.000 description 1
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 description 1
- 125000001412 tetrahydropyranyl group Chemical group 0.000 description 1
- 125000003507 tetrahydrothiofenyl group Chemical group 0.000 description 1
- 238000002230 thermal chemical vapour deposition Methods 0.000 description 1
- 238000005979 thermal decomposition reaction Methods 0.000 description 1
- 238000002207 thermal evaporation Methods 0.000 description 1
- 125000001984 thiazolidinyl group Chemical group 0.000 description 1
- 125000001544 thienyl group Chemical group 0.000 description 1
- 125000005309 thioalkoxy group Chemical group 0.000 description 1
- 229930192474 thiophene Natural products 0.000 description 1
- XOLBLPGZBRYERU-UHFFFAOYSA-N tin dioxide Chemical compound O=[Sn]=O XOLBLPGZBRYERU-UHFFFAOYSA-N 0.000 description 1
- 229910001887 tin oxide Inorganic materials 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 125000005259 triarylamine group Chemical group 0.000 description 1
- 125000005580 triphenylene group Chemical group 0.000 description 1
- 125000005287 vanadyl group Chemical group 0.000 description 1
- 238000005019 vapor deposition process Methods 0.000 description 1
- 230000000007 visual effect Effects 0.000 description 1
- 229910052724 xenon Inorganic materials 0.000 description 1
- FHNFHKCVQCLJFQ-UHFFFAOYSA-N xenon atom Chemical compound [Xe] FHNFHKCVQCLJFQ-UHFFFAOYSA-N 0.000 description 1
- 239000011592 zinc chloride Substances 0.000 description 1
- 235000005074 zinc chloride Nutrition 0.000 description 1
- NWONKYPBYAMBJT-UHFFFAOYSA-L zinc sulfate Chemical compound [Zn+2].[O-]S([O-])(=O)=O NWONKYPBYAMBJT-UHFFFAOYSA-L 0.000 description 1
- 229960001763 zinc sulfate Drugs 0.000 description 1
- 229910000368 zinc sulfate Inorganic materials 0.000 description 1
- HRSADIZPZPRZEI-UHFFFAOYSA-L zinc;diacetate;hydrate Chemical compound O.[Zn+2].CC([O-])=O.CC([O-])=O HRSADIZPZPRZEI-UHFFFAOYSA-L 0.000 description 1
- 229910052726 zirconium Inorganic materials 0.000 description 1
Images
Classifications
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B82—NANOTECHNOLOGY
- B82Y—SPECIFIC USES OR APPLICATIONS OF NANOSTRUCTURES; MEASUREMENT OR ANALYSIS OF NANOSTRUCTURES; MANUFACTURE OR TREATMENT OF NANOSTRUCTURES
- B82Y10/00—Nanotechnology for information processing, storage or transmission, e.g. quantum computing or single electron logic
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/22—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains four or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B47/00—Porphines; Azaporphines
- C09B47/04—Phthalocyanines abbreviation: Pc
- C09B47/06—Preparation from carboxylic acids or derivatives thereof, e.g. anhydrides, amides, mononitriles, phthalimide, o-cyanobenzamide
- C09B47/067—Preparation from carboxylic acids or derivatives thereof, e.g. anhydrides, amides, mononitriles, phthalimide, o-cyanobenzamide from phthalodinitriles naphthalenedinitriles, aromatic dinitriles prepared in situ, hydrogenated phthalodinitrile
- C09B47/0671—Preparation from carboxylic acids or derivatives thereof, e.g. anhydrides, amides, mononitriles, phthalimide, o-cyanobenzamide from phthalodinitriles naphthalenedinitriles, aromatic dinitriles prepared in situ, hydrogenated phthalodinitrile having halogen atoms linked directly to the Pc skeleton
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K30/00—Organic devices sensitive to infrared radiation, light, electromagnetic radiation of shorter wavelength or corpuscular radiation
- H10K30/30—Organic devices sensitive to infrared radiation, light, electromagnetic radiation of shorter wavelength or corpuscular radiation comprising bulk heterojunctions, e.g. interpenetrating networks of donor and acceptor material domains
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/30—Coordination compounds
- H10K85/311—Phthalocyanine
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K30/00—Organic devices sensitive to infrared radiation, light, electromagnetic radiation of shorter wavelength or corpuscular radiation
- H10K30/20—Organic devices sensitive to infrared radiation, light, electromagnetic radiation of shorter wavelength or corpuscular radiation comprising organic-organic junctions, e.g. donor-acceptor junctions
- H10K30/211—Organic devices sensitive to infrared radiation, light, electromagnetic radiation of shorter wavelength or corpuscular radiation comprising organic-organic junctions, e.g. donor-acceptor junctions comprising multiple junctions, e.g. double heterojunctions
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K30/00—Organic devices sensitive to infrared radiation, light, electromagnetic radiation of shorter wavelength or corpuscular radiation
- H10K30/50—Photovoltaic [PV] devices
- H10K30/57—Photovoltaic [PV] devices comprising multiple junctions, e.g. tandem PV cells
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/10—Organic polymers or oligomers
- H10K85/111—Organic polymers or oligomers comprising aromatic, heteroaromatic, or aryl chains, e.g. polyaniline, polyphenylene or polyphenylene vinylene
- H10K85/113—Heteroaromatic compounds comprising sulfur or selene, e.g. polythiophene
- H10K85/1135—Polyethylene dioxythiophene [PEDOT]; Derivatives thereof
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/10—Organic polymers or oligomers
- H10K85/111—Organic polymers or oligomers comprising aromatic, heteroaromatic, or aryl chains, e.g. polyaniline, polyphenylene or polyphenylene vinylene
- H10K85/115—Polyfluorene; Derivatives thereof
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/20—Carbon compounds, e.g. carbon nanotubes or fullerenes
- H10K85/211—Fullerenes, e.g. C60
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/30—Coordination compounds
- H10K85/381—Metal complexes comprising a group IIB metal element, e.g. comprising cadmium, mercury or zinc
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E10/00—Energy generation through renewable energy sources
- Y02E10/50—Photovoltaic [PV] energy
- Y02E10/549—Organic PV cells
Description
1〜12個の、例えば1、2、3、4、5、6、7、8、9、10、11もしくは12個の基R1〜R16は、それぞれハロゲンであり、他のものはそれぞれ水素であり、かつ
式Ib中のMは、二価の金属、二価の金属原子含有基又は二価のメタロイド基である]の化合物を、電荷輸送材料及び/又は吸収体材料として用いる使用に関する。
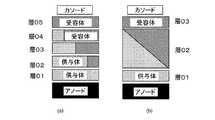
− 電子伝導特性を有する層(電子輸送層、ETL)
− 正孔伝導性材料を含む吸収する必要がない層(正孔輸送層、HTL)
− 励起子及び正孔をブロッキングする吸収する必要がない層(例えばEBL)
− 増幅層
が含まれる。
− 入射光に対して実質的に透過性の基板
− 第一の電極(前面電極、アノード)
− 正孔輸送層(HTL)
− バルクヘテロ接合の形の正孔伝導性材料と電子輸送材料との混合層
− 電子輸送層(ETL)
− 励起子ブロッキング層/電子輸送層
− 電極(背面電極、カソード)
を有する。
− 入射光に対して実質的に透過性の基板
− 第一の電極(前面電極、カソード)
− 励起子ブロッキング層/電子輸送層
− 電子輸送層(ETL)
− バルクヘテロ接合の形の正孔伝導性材料と電子輸送材料との混合層
− 正孔輸送層(HTL)
− 電極(背面電極、アノード)
を有する。
Rn1、Rn2、Rn3及びRn4基は、nが1〜4の場合に、それぞれ無関係に、水素、ハロゲンもしくはハロゲン以外の基であってよく、
Y1は、OもしくはNRaであり、その際、Raは、水素もしくはオルガニル基であり、
Y2は、OもしくはNRbであり、その際、Rbは、水素もしくはオルガニル基であり、
Z1、Z2、Z3及びZ4は、それぞれOである]のペリレン、テリレンもしくはクアテリレンであってよい。
ITO/
(0nm〜20nm)式Ia及び/又はIbの化合物/
(10nm〜80nm)C60:式Ia及び/又はIbの化合物を1:10〜10:1、好ましくは1:2〜2:1で
(10nm〜60nm)C60
(1nm〜10nm)BCP/
Ag
を有するバルクヘテロ接合型の太陽電池である。
使用される略語:
CuPc 銅フタロシアニン
CuPcF8 2,3,6,7,10,11,14,15−オクタフルオロ銅フタロシアニン
CuPcF4 テトラフルオロ銅フタロシアニン
CuPc−oF4 (オルト−テトラフルオロ)銅フタロシアニン
CuPc−mF4 (メタ−テトラフルオロ)銅フタロシアニン
CuPc−(o+m)F4 (オルト+メタ−テトラフルオロ)銅フタロシアニン
CuPcCl8 2,3,6,7,10,11,14,15−オクタクロロ銅フタロシアニン
ZnPc−oF4 (オルト−テトラフルオロ)亜鉛フタロシアニン
ZnPc−mF4 (メタ−テトラフルオロ)亜鉛フタロシアニン
C60 [60]フラーレン
PEDOT ポリ(3,4−エチレンジオキシチオフェン)
BCP バソクプロイン
BPE−PTCDI N,N′−ビス(2−フェニルエチル)ペリレン−3,4:9,10−ビス(ジカルボキシイミド)
Bphen 4,7−ジフェニル−1,10−フェナントロリン
PTCBI 3,4,9,10−ペリレンテトラカルボン酸ビスベンゾイミダゾール
PEDOT−PSS ポリ(3,4−エチレンジオキシチオフェン)−ポリ(スチレンスルホネート)
ITO インジウム酸化スズ
300mlのキシレン、5.0g(20ミリモル)のN,N′−ジメチルイミダゾリジノ−テトラメチルグアニジニウムクロリド及び58.1g(1000ミリモル)の無水KFの混合物を、50℃に加熱した。これに、19.7g(100ミリモル)の4,5−ジクロロフタロニトリルを添加し、該混合物を、120℃に13時間加熱した。該混合物を濾過し、そして溶剤を減圧下で除去した。粗製化合物を、カラムクロマトグラフィーによって1:1のトルエン/石油エーテルを溶出剤として使用して精製することで、11.96g(73%)の表題化合物が白色の物質として得られた。
100mlのニトロベンゼン、13.13g(80ミリモル)の4,5−ジフルオロフタロニトリル、2.18g(22ミリモル)のCuCl及び0.29g(2ミリモル)のMoO3の混合物を、アンモニア(1バール)の作用に供し、そして200℃に加熱した。該混合物を、前記温度でアンモニア下に2時間保持した。その後に、100mlのニトロベンゼンを添加し、そしてアンモニア流を止めた。該混合物をこの温度で更に3時間にわたり撹拌し、室温へと冷却させ、エタノールで洗浄し、そして減圧下で乾燥させた。10.88g(76%)の表題化合物が、青色の粉末として得られた。
分別結晶化a)
7.0gの粗生成物を、350gの98%硫酸中に溶解させた。該溶液を、50℃に加熱し、そして490gの50%硫酸を撹拌しつつ20時間以内で添加した。得られた70%硫酸の懸濁液を、更に16時間にわたり撹拌し、該懸濁液をゆっくりと室温にまで冷却させ、次いで濾過した。濾過ケークを50%硫酸で洗浄し、次いで水で洗浄することで、0.93g(13%)の表題化合物が得られた。
前記の結晶化を繰り返すことで、表題化合物が87%の収率で得られた。
前記の結晶化を繰り返すことで、表題化合物が74%の収率で得られた。
λmax(H2SO4)=255l/g cm(758nm)
3a)2,3,6,7,10,11,14,15−オクタクロロ銅フタロシアニンの製造
100mlのニトロベンゼン、10.1g(51ミリモル)の4,5−ジクロロフタロニトリル、1.39g(14ミリモル)のCuCl及び0.21g(1.5ミリモル)のMoO3の混合物を、1バールのアンモニアの作用に供した。次いで、該混合物を200℃に加熱し、そして該混合物をこの温度で3時間にわたり撹拌した。該混合物を濾過し、メタノールで洗浄し、そして減圧下で乾燥させた。9.83gの表題化合物が、青色の粉末として得られた。
λmax(H2SO4)=270l/g cm(801nm)
18.0gの粗生成物を、900gの98%硫酸中に溶解させ、そして1260gの50%硫酸で希釈した。該溶液を、50℃に加熱した。その手順をさらに2回繰り返すことで、15.3g(63%)の精製された材料が得られた。
λmax(H2SO4)=285L/g cm(760nm)
1.8gの実施例3bで得られた材料を、3領域型の勾配昇華装置中で40℃、250℃及び425℃で昇華させた。0.9gの表題化合物が受容された。
λmax(H2SO4)=282L/g cm(760nm)
以下の式:
2.92g(20ミリモル)の4−フルオロフタロニトリル、1.99g(10ミリモル)の酢酸銅一水和物、2.00g(33ミリモル)の尿素及び触媒量のモリブデン酸アンモニウムを25mlのニトロベンゼン中に入れた混合物を、160℃へと窒素下で5時間にわたり加熱した。次いで、該混合物を、室温へと冷却させ、トルエンで希釈し、そして濾過した。得られた粗生成物を、アセトン、水及びアセトニトリルで慎重に洗浄した。
更なる精製のために、0.383gの表題化合物を、室温、200℃及び390℃の温度勾配に供した。チューブの内部で、0.198gの表題化合物が得られた:
λmax(H2SO4)=780.5nm
以下の一般式:
4.38g(30ミリモル)の3−フルオロフタロニトリル、1.99g(10ミリモル)の酢酸銅一水和物、3.00g(50ミリモル)の尿素及び触媒量のモリブデン酸アンモニウムを25mlのニトロベンゼン中に入れた混合物を、160℃へと窒素下で7時間にわたり加熱した。次いで、該混合物を、室温へと冷却させ、トルエンで希釈し、そして濾過した。得られた粗生成物を、アセトン、水及びアセトニトリルで慎重に洗浄した。
引き続きの精製は、3領域型のファーネス炉内部で勾配昇華技術を使用して実施した。1.56gの材料を、425℃、250℃、そして室温の温度勾配に曝した。0.95gの生成物が、第一の領域中で回収された。
λmax(H2SO4)=819.0nm
以下の式:
5.84g(40ミリモル)の3−フルオロフタロニトリル、2.44g(13.3ミリモル)の酢酸亜鉛、4.00g(66.6ミリモル)の尿素及び0.08gのモリブデン酸アンモニウムを20mLのニトロベンゼン中に入れた混合物を、180℃へとアルゴン下で7時間にわたり加熱した。次いで、該混合物を室温に冷却し、そして濾過した。濾過後に得られた固体を、エタノールで徹底的に洗浄した。
5.0g(33.6ミリモル)の3−フルオロフタロニトリル、0.53g(8.1ミリモル)の亜鉛末、0.22g(1.2ミリモル)の酢酸亜鉛、0.16g(2.55ミリモル)の尿素及び0.031g(0.16ミリモル)のモリブデン酸アンモニウムを11mLの蒸留されたニトロベンゼン中に入れた混合物を100℃にアルゴン下で30分にわたり加熱し、引き続き190℃で約3時間にわたり加熱した。次いで、得られた固体を濾過し、メタノール、アセトン及びテトラヒドロフラン(THF)で洗浄することで、くすんだ青緑色の固体が得られた。粗生成物の更なる精製を、ギ酸及びメタノールを用いて実施することで、暗青色の固体が得られた。収量2.0g(36%)。
更なる精製のために、0.8gの表題化合物を、2×10-5ミリバール未満の真空中で、室温、250℃及び450℃の温度勾配に供した。チューブ内部に、0.48g(収率60%)の表題化合物が得られた:
更なる精製のために、1.55gの表題化合物を、2×10-5ミリバール未満の真空中で、室温、250℃及び350℃の温度勾配に供した。チューブ内部に、0.99g(収率64%)の表題化合物が得られた:
以下の式
以下の式:
以下の一般式:
1.62g(10ミリモル)の3−クロロフタロニトリル、0.60g(3.3ミリモル)の酢酸亜鉛、1.00g(16.7ミリモル)の尿素及び0.02gのモリブデン酸アンモニウムを10mLのニトロベンゼン中に入れた混合物を、185℃へとアルゴン下で7時間にわたり加熱した。次いで、該反応混合物を室温に冷却し、そして得られた固体を濾過し、エタノールで徹底的に洗浄した。
引き続きの精製は、3領域型のファーネス炉内部で勾配昇華技術を使用して実施した。1.21gの材料を、500℃、375℃、そして50℃の温度勾配に曝した。0.05gの生成物が、第一の領域中で回収された。
以下の式:
2.92g(20ミリモル)の3−フルオロフタロニトリル、0.93g(7ミリモル)の無水塩化アルミニウム、2g(33.3ミリモル)の尿素及び0.04gのモリブデン酸アンモニウムの混合物を、10mLのニトロベンゼン中に溶解させ、そして180℃でアルゴン下で18時間にわたり撹拌した。次いで、該反応混合物を、室温に冷却し、そしてアセトニトリルで希釈した。沈殿した青色の固体を濾過し、そしてエタノール及びアセトニトリルでよく洗浄した。粗生成物の更なる精製は、該固体をジメチルホルムアミド中に溶解させ、それをアセトニトリルを使用して沈殿させることによって実施した。得られた固体を濾過し、そして乾燥させることで、1.2g(37.3%)が精製後に得られた。MALDI−TOF質量:C32H12ClF4N8Alについて計算した質量=646、得られた質量=645.96(マトリクスなし);UV−vis:λmax(濃H2SO4)=833nm。
引き続きの精製は、3領域型のファーネス炉内部で勾配昇華技術を使用して実施した。1.02gの材料を、425℃、300℃、そして室温の温度勾配に曝した。0.11g(11%収率)の生成物が、第一の領域中で回収された。
太陽電池の構築
標準的な構成において、有機太陽電池を、透明な導電性のインジウム酸化スズ層(ITO)で被覆されているガラス基板上に作成する。接触特性を向上させるために、追加のPEDOTの層を、ITO電極と吸収体との間に適用してよい。引き続いての吸収体層は、電子供与体と電子受容体とからなり、その際、該材料の一方はハロゲン化されたフタロシアニンである。蒸着によって適用された対向電極は、金属、例えば銀もしくはアルミニウムである。
SC 短絡
Isc 短絡電流Isc、如何なる付加的な抵抗なくして2つの端子が接続された場合に太陽電池によって送達される
Jsc 短絡電流密度
OC 開路
Voc 開路電圧 − 無負荷状態/アンリット状態に存在する電圧
FF 充てん率
η 効率
変換:1サン=100mW/cm2
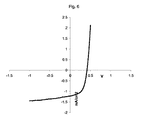
ピロニンBでドープされたCuPcF8及びCuPcを基礎とする太陽電池
ITOガラスは、Merckから購入した。ガラス基板を、沸騰したアセトン中での超音波によって清浄化した。
CuPc 23nm 0.1〜0.5nm/s
CuPcF8 34nm 0.1〜0.5nm/s
Ag 100nm 0.5nm/s
サイズ 7.3*10-4cm2
照度 0.85サン
Voc 410mV
Jsc 1.22mA/cm2
FF 56%
η 0.32%
結果を、図6に図示する。
ガラス基板上のインジウム酸化スズ(ITO)は、Merck Display Technologies Ltd社から購入した。ITO層の厚さは140±15nmであり、11.70Ω毎平方のシート抵抗を有していた。該ITOを、以下の手順により清浄化した。まず、該ITOを5%RB535デタージェント浴中で5分間にわたり清浄化し、脱イオン水中で5分間にわたりすすぎ、引き続き沸騰したアセトン中で5分間にわたり2回清浄化し、そしてイソプロパノール中で5分間にわたり2回清浄化した。清浄化は、該ITOを150℃のN−メチル−2−ピロリドン(NMP)中の超音波浴に5分間にわたり供することによって完了した。
PEDOT−PSS(H.C.Starcks Al4083)の堆積のために、ITO基板をスピンコート前にUVオゾン化した。50mW/cm2の出力を有するUVランプ(FHR Anlagenbau Gmbh)を使用した。UVオゾン化されたITOを、グローブボック中に入れて、PEDOT−PSSで被覆した。スピンコートは、UVオゾン化手順の後30分以内で実施した。PEDOT−PSSの分散液を、2500RPMで5秒間回転させ、6000RPMにまで25秒にわたり傾斜させ、引き続き窒素中100℃で20分にわたりアニーリングした。
ポリアミド樹脂(Supeico)は、トップ電極とボトム電極との間に絶縁のために適用できる。該サンプルを、硬化のために200℃で15分間置いた。
特に記載がなければ、キセノンランプ(16S−150V3モデル)を用いたSolar Light Co.Inc社製のAM1.5シミュレーター(この光源は実施例14でも使用した)。415nm未満のUV領域はフィルタリングされ、IV測定は、周囲条件で実施した。
太陽シミュレーター強度は、単結晶FZシリコン太陽電池(Frauhofer ISE)で校正する。
CuPc(BASF社から得られる、昇華精製によって1回精製)
C60(NeoTech Prodocut社から得られる、昇華精製によって1回精製)
BCP(Sensient Technology社から得られる、昇華精製によって1回精製)
Ag(Acros Organics社から得られる、入手したままで使用される)
CuPc−(o+m)F4(前記手順により記載される、昇華精製によって1回精製)
蒸発された層の厚さ(両者とも有機と金属)は、石英結晶モニター(QCM)でモニタリングした。ツーリング係数は、偏光解析測定で校正された。
温度は、坩堝の底部と直接接触させて熱電対で記録した。
C60 460±20℃
BCP 110±20℃
CuPc−mF4 400±20℃
CuPc−oF4 400±20℃
比較例12
<ITO/PEDOT−PSS/CuPc/C60/BCP/Ag>
ITOを、ITP製造で記載したように製造し、PEDOT−PSSは、PEDOT−PSS層堆積に記載したように製造した。絶縁層は、ボトム(PEDOT−PSS)及びトップ(Ag)の電極の間にサンプルの絶縁のための部分に塗布した。残りの蒸発(有機物及び金属)は、高真空チャンバ(p<10-7トル)中で実施した。
C60 40nm 0.1nm/秒
BCP 4nm 0.1nm/秒
Ag 100nm 0.1nm/秒
セルサイズ=0.01cm2
1サン強度(100mW/cm2)下で測定
Voc 520mV
Jsc 5.4mA/cm2
FF 50%
η 1.4%
Jsc及びηは、US2002189666号(S.Forrest他、2002年)で報告された最良値よりも低い。これは、異なる材料品質による可能性がある。更に、使用した光源は、UV光をフィルタアウトし、その際、C60は、大きな光子から電荷への変換(350〜400nm)を示す。
<ITO/PEDOT−PSS/CuPc−mF4/C60/BCP/Ag>
該太陽電池は、実施例12に記載のように構築した。実施例4bからのCuPc−mF4を使用した。セルサイズ及び測定条件は、実施例12での<ITO/PEDOT−PSS/CuPc/C60/BCP/Ag>での測定と同じであった。
Voc 740mV
Jsc 1.3mA/cm2
FF 31%
η 0.3%
<ITO/PEDOT−PSS/CuPc−oF4/C60/BCP/Ag>
該太陽電池は、実施例12に記載のように構築した。実施例5からの1回昇華されたCuPc−oF4を使用した。セルサイズ及び測定条件は、実施例12での<ITO/PEDOT−PSS/CuPc/C60/BCP/Ag>デバイスでの測定と同じであった。
Voc 660mV
Jsc 4.0mA/cm2
FF 37%
η 1.1%
<ITO/CuPc:C60(1:1)/C60/BCP/Ag>
ITOを、実施例12に記載されるように製造したが、PEDOT−PSS層は堆積させなかった。該デバイスは、PEDOT−PSSを有さずにもより良好な効率を示した。絶縁層は、ボトム(ITO)及びトップ(Ag)の電極の間にサンプルの絶縁のための部分に塗布した。残りの蒸発(有機物及び金属)は、高真空チャンバ(p<10-7トル)中で実施した。
CuPc:C60ヘテロ接合層は、同時蒸発によって堆積させる。2つの別個の石英結晶モニタを使用して、各有機源の速度をモニタリングした。2種の材料の間の混合比は、それぞれQCMによって測定された質量%を基礎とするものであった。
C60 2nm 0.1nm/秒
BCP 4nm 0.1nm/秒
Ag 100nm 0.1nm/秒
セルサイズ=0.01cm2
1サン強度(100mW/cm2)下で測定
Voc 480mV
Jsc 12.6mA/cm2
FF 38%
η 2.3%
Jsc及びηは、Applied Physics Letters 84,4218頁(Uchida他、2004年)で報告された最良の値より低い。これは、引用した参考文献と比較して、異なる材料品質及び/又は異なる厚さによるものである可能性がある。更に、使用した光源は、この実施例では、UV光をフィルタアウトし、その際、C60は、大きな光子から電荷への変換(350〜400nm)を示す。これは、全電流を低下させることがあり、ひいては電力変換効率ηを低下させることがあった。
<ITO/CuPc−oF4:C60(1:1)/C60/BCP/Ag>
CuPc−oF4は、実施例5bから製造した。比較例15のデバイスと同じ基板手順を採用し、そして同じデバイス構造を使用した。セルサイズ及び測定条件は、比較例15での<ITO/CuPc:C60(1:1)/C60/BCP/Ag>での測定と同じであった。
Jsc 1.1mA/cm2
FF 30%
η 0.15%
パターン形成されたITO基板は、Lehrstuhl fuer Bildschirmtechnik(シュトゥットガルト)から得た。ITO層の厚さは140nmであり、かつRMS(平均二乗粗さ)は<5nmであった。該基板は、有機堆積前に20分にわたりUVオゾン化した。PEDOT−PSSなどの追加の正孔輸送層は適用しなかった。
実施例11〜16と同じ手順を採用した。全ての測定は、1サン強度(100mW/cm2)下で実施した。
C60 Alfa Aeser/CreaPhys 昇華グレード 入手したままで使用
Bphen Sigma Aldrich 入手したままで使用
Ag Acros organics 入手したままで使用
2種類のセル(二重層及びバルクヘテロ接合(BHJ))を、高真空システム(<10-6ミリバール圧力)中で作成した。
実施例17
<ITO/ZnPc−mF4/C60/Bphen/Ag>
実施例7からのZnPc−mF4を使用した。
ZnPc−mF4 20nm
C60 40nm
Bphen 6nm
Ag 100nm
Voc 680mV
Jsc 2.3mA/cm2
FF 46%
η 0.7%
18a)
<ITO/ZnPc−oF4/C60/Bphen/Ag>
実施例6cからのZnPc−oF4(酢酸亜鉛前駆体、1回昇華)を使用した。
ZnPc−oF4 20nm
C60 40nm
Bphen 6nm
Ag 100nm
Voc 700mV
Jsc 5.64mA/cm2
FF 70%
η 2.76%
<ITO/ZnPc−oF4/C60/Bphen/Ag>
実施例6dからのZnPc−oF4(亜鉛末前駆体、1回昇華)を使用した。
ZnPc−oF4 40nm
C60 40nm
Bphen 6nm
Ag 100nm
Voc 700mV
Jsc 5.67mA/cm2
FF 63%
η 2.5%
CuPcの場合と同様に、フッ素化されたものにより、非置換のPCよりも高いVocが得られた。更に、オルト位を有する材料は、二重層セルにおいてはメタ位と比較してより良好な結果をもたらす。
<ITO/ZnPc−oCl4/C60/Bphen/Ag>
実施例9bからのZnPc−oCl4(1回昇華)を使用した。
ZnPc−oCl4 10nm
C60 40nm
Bphen 6nm
Ag 100nm
Voc 660mV
Jsc 4.23mA/cm2
FF 71%
η 2.0%
塩素化された銅フタロシアニンも、非置換の銅フタロシアニンよりも高いVocを示した。
<ITO/CuPc−(o+m)F4/C60/Bphen/Ag>
実施例8からのCuPc−(o+m)F4を使用した。
CuPc−(o+m)F4 15nm
C60 40nm
Bphen 6nm
Ag 100nm
Voc 740mV
Jsc 1.35mA/cm2
FF 39%
η 0.38%
実施例21
21a)
<ITO/ZnPc−oF4:C60(1:1)/C60/Bphen/Au>
実施例6cからのZnPc−oF4(酢酸亜鉛前駆体、1回昇華)を使用した。
ZnPc−oF4:C60 40nm
C60 20nm
Bphen 6nm
Au 80nm
Voc 660mV
Jsc 10.1mA/cm2
FF 50%
η 3.2%
<ITO/ZnPc−oF4:C60(1:1)/C60/Bphen/Ag>
実施例6cからのZnPc−oF4(酢酸亜鉛前駆体、1回昇華)を使用した。
ZnPc−oF4 30nm
C60 20nm
Bphen 6nm
Ag 100nm
Voc 640mV
Jsc 11.5mA/cm2
FF 50%
η 3.6%
<ITO/ZnPc−oF4:C60(1:1)/C60/Bphen/Ag>
実施例6dからのZnPc−oF4(亜鉛末前駆体、1回昇華)を使用した。
ZnPc−oF4:C60 40nm
C60 40nm
Bphen 6nm
Au 80nm
Voc 640mV
Jsc 11.5mA/cm2
FF 52%
η 3.8%
<ITO/ZnPc−oCl4:C60(1:1)/C60/Bphen/Au>
厚さ
ZnPc−oCl4 40nm
C60 20nm
Bphen 6nm
Ag 100nm
Voc 680mV
Jsc 10.3mA/cm2
FF 44%
η 3.1%
実施例23
<ITO/PEDOT−PSS/CuPc/CuPc−oF4/C60/BCP/Ag>
CuPc−oF4は、電荷抜き取りを促進するための中間層として使用した。
CuPc−oF4c 2nm 0.1nm/秒
C60 40nm 0.1nm/秒
BCP 4nm 0.1nm/秒
Ag 100nm 0.1nm/秒
Voc 560mV
Jsc 6.6mA/cm2
FF 54%
η 2.0%
Claims (16)
- Mが二価の金属である、請求項1に記載の使用。
- ハロゲンであるR1〜R16基が、全てFであるか、又は全てClである、請求項1又は2に記載の使用。
- 式Ib中のMが、CuもしくはZnである、請求項1に記載の使用。
- 式Ib中のMが二価のハロゲン化金属部、好ましくはAl(III)ClもしくはAl(III)Fである、請求項1に記載の使用。
- C60を電子受容体として使用する、請求項1から5までのいずれか1項に記載の使用。
- バルクヘテロ接合の形の供与体−受容体接合を有する有機太陽電池における、請求項1から6までのいずれか1項に記載の使用。
- フラット接合の形の供与体−受容体接合を有する有機太陽電池における、請求項1から7までのいずれか1項に記載の使用。
- 少なくとも1つのカソードと、少なくとも1つのアノードと、請求項1から5までのいずれか1項で定義される式Ia及び/又はIbの少なくとも1種の化合物、及び少なくとも1種のフラーレン及び/又はフラーレン誘導体を有する少なくとも1種の更なる半導体材料を組み合わせた光活性材料とを有する基板を含む有機太陽電池。
- 更なる半導体材料がC60を含む、請求項9に記載の有機太陽電池。
- 更なる半導体材料が、少なくとも1種のリレン、特に1,6,7,12−テトラクロロペリレン−3,4:9,10−テトラカルボキシイミドを含む、請求項9または10に記載の有機太陽電池。
- 式Ia及び/又はIbの化合物及び/又は更なる半導体材料が、少なくとも1種のドーパント、特にピロニンB、ローダミン、3,6−ジフルオロ−2,5,7,7,8,8−ヘキサシアノキノジメタン及びそれらの組み合わせから選択される少なくとも1種のドーパントと組み合わせて使用される、請求項9から11までのいずれか1項に記載の有機太陽電池。
- 有機太陽電池が、タンデム型太陽電池である、請求項9から12までのいずれか1項に記載の有機太陽電池。
- フラット接合の形の少なくとも1つの供与体−受容体接合を有する、請求項13に記載の有機太陽電池。
- バルクヘテロ接合の形の少なくとも1つの供与体−受容体接合を有する、請求項13に記載の有機太陽電池。
- 式Ia及び/又はIbの少なくとも1種の化合物と、少なくとも1種のフラーレンもしくはフラーレン誘導体、特にC60を含む、サブセルを含むタンデムセル型の、請求項9から15までのいずれか1項に記載の有機太陽電池。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US98417507P | 2007-10-31 | 2007-10-31 | |
| US60/984,175 | 2007-10-31 | ||
| PCT/EP2008/064796 WO2009056626A1 (en) | 2007-10-31 | 2008-10-31 | Use of halogenated phthalocyanines |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2011504292A JP2011504292A (ja) | 2011-02-03 |
| JP2011504292A5 JP2011504292A5 (ja) | 2011-12-22 |
| JP5645666B2 true JP5645666B2 (ja) | 2014-12-24 |
Family
ID=40089994
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010531533A Expired - Fee Related JP5645666B2 (ja) | 2007-10-31 | 2008-10-31 | ハロゲン化フタロシアニン類の使用 |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US8658290B2 (ja) |
| EP (1) | EP2212936A1 (ja) |
| JP (1) | JP5645666B2 (ja) |
| KR (1) | KR20100097662A (ja) |
| CN (1) | CN101842917B (ja) |
| AU (1) | AU2008320815B2 (ja) |
| WO (1) | WO2009056626A1 (ja) |
| ZA (1) | ZA201003792B (ja) |
Families Citing this family (45)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2011519350A (ja) * | 2008-03-19 | 2011-07-07 | ビーエーエスエフ ソシエタス・ヨーロピア | N,n’−ビス(フルオロフェニルアルキル)で置換されたペリレン−3,4:9,10−テトラカルボキシイミド、ならびにその製造および使用 |
| DE102008039337A1 (de) * | 2008-03-20 | 2009-09-24 | Siemens Aktiengesellschaft | Vorrichtung zum Besprühen, Verfahren dazu sowie organisches elektronisches Bauelement |
| KR20120081231A (ko) | 2008-05-16 | 2012-07-18 | 가부시키가이샤 한도오따이 에네루기 켄큐쇼 | 발광소자, 및 조명장치 |
| KR100981969B1 (ko) * | 2008-08-18 | 2010-09-13 | 삼성모바일디스플레이주식회사 | 유기 발광 소자 |
| JP5624987B2 (ja) * | 2008-09-09 | 2014-11-12 | テクニオン リサーチ アンド ディベロップメント ファウンデーションリミテッド | 有機半導体のための誘導体化されたフラーレン系ドーパント |
| KR20110074522A (ko) * | 2008-09-19 | 2011-06-30 | 바스프 에스이 | 유기 태양 전지에서의 디벤조테트라페닐페리플란텐의 용도 |
| US8847066B2 (en) * | 2009-05-19 | 2014-09-30 | Regents Of The University Of Minnesota | Graded organic photovoltaic device |
| AU2010252080A1 (en) * | 2009-05-26 | 2011-11-17 | Basf Se | Use of phthalocyanine compounds with aryl or hetaryl substituents in organic solar cells |
| DE102009051142B4 (de) * | 2009-06-05 | 2019-06-27 | Heliatek Gmbh | Photoaktives Bauelement mit invertierter Schichtfolge und Verfahren zu seiner Herstellung |
| GB0912041D0 (en) * | 2009-07-10 | 2009-08-19 | Cambridge Entpr Ltd | Optoelectronic devices |
| JP5469943B2 (ja) * | 2009-07-16 | 2014-04-16 | 出光興産株式会社 | 光電変換素子 |
| KR101087903B1 (ko) * | 2009-07-30 | 2011-11-30 | 한양대학교 산학협력단 | 양면 수광 유기태양전지 |
| WO2011101810A1 (en) * | 2010-02-19 | 2011-08-25 | Basf Se | Use of indanthrene compounds in organic photovoltaics |
| KR101097336B1 (ko) * | 2010-02-26 | 2011-12-23 | 삼성모바일디스플레이주식회사 | 전면발광형 유기 발광 소자 |
| EP2549559A4 (en) * | 2010-03-15 | 2014-12-03 | Oceans King Lighting Science | ORGANIC SOLAR CELL AND METHOD FOR MANUFACTURING THE SAME |
| JP2011208387A (ja) * | 2010-03-29 | 2011-10-20 | Miwa Lock Co Ltd | 可視光通信発電システム |
| WO2011127475A1 (en) * | 2010-04-09 | 2011-10-13 | The Arizona Board Of Regents On Behalf Of The University Of Arizona | Organic photovoltaic devices comprising solution- processed substituted metal-phthalocyanines and exhibiting near-ir photo-sensitivity |
| JP5598847B2 (ja) * | 2010-06-30 | 2014-10-01 | 独立行政法人産業技術総合研究所 | 光電変換素子及び太陽電池 |
| US8929054B2 (en) * | 2010-07-21 | 2015-01-06 | Cleanvolt Energy, Inc. | Use of organic and organometallic high dielectric constant material for improved energy storage devices and associated methods |
| KR101117127B1 (ko) * | 2010-08-06 | 2012-02-24 | 한국과학기술연구원 | 비정질 실리콘 태양전지와 유기 태양전지를 이용한 탠덤형 태양전지 |
| US20120060907A1 (en) * | 2010-09-13 | 2012-03-15 | University Of Central Florida | Photovoltaic cell structure and method including common cathode |
| US9029837B2 (en) * | 2010-10-12 | 2015-05-12 | The Regents Of The University Of Michigan | Photoactive devices including porphyrinoids with coordinating additives |
| JP5571525B2 (ja) * | 2010-10-20 | 2014-08-13 | ローム株式会社 | 有機薄膜太陽電池およびその製造方法 |
| US9012772B2 (en) | 2010-10-22 | 2015-04-21 | Xerox Corporation | Photovoltaic device |
| US8962994B2 (en) * | 2010-10-22 | 2015-02-24 | Xerox Corporation | Photovoltaic device |
| WO2012141347A1 (ko) * | 2011-04-12 | 2012-10-18 | 메디소스플러스 주식회사 | 유기 태양 전지의 광활성층의 제조방법 및 이를 이용한 유기 태양 전지 |
| WO2013020067A1 (en) * | 2011-08-03 | 2013-02-07 | Sun Chemical Corporation | Phthalocyanine synthesis |
| KR101942423B1 (ko) * | 2011-09-09 | 2019-04-12 | 삼성전자주식회사 | 광 다이오드 |
| CN102675349B (zh) * | 2012-05-03 | 2014-09-03 | 中国科学院化学研究所 | 并吡咯二酮-酞菁共轭衍生物及其制备方法与应用 |
| US9005357B2 (en) * | 2012-05-24 | 2015-04-14 | Agency For Science, Technology And Research | Method of preparing molybdenum oxide films |
| WO2014092830A2 (en) * | 2012-09-19 | 2014-06-19 | Northeastern University | Optoelectronic devices based on heterojunctions of single-walled carbon nanotubes and silicon |
| CN103346270A (zh) * | 2013-05-21 | 2013-10-09 | 京东方科技集团股份有限公司 | 一种有机电致发光器件及显示装置 |
| CN105722921A (zh) * | 2013-10-31 | 2016-06-29 | 沙特基础工业全球技术公司 | 用于制备轴向氟化酞菁的方法和它们在光伏应用中的用途 |
| DE102014114224A1 (de) * | 2014-09-30 | 2016-03-31 | Osram Oled Gmbh | Organisches elektronisches Bauteil, Verwendung eines Zinkkomplexes als p-Dotierungsmittel für organische elektronische Matrixmaterialien |
| CN104795510B (zh) * | 2014-12-11 | 2017-08-25 | 云南大学 | 基于俄歇电子注入的超低电压oled器件 |
| CN104530058B (zh) * | 2014-12-26 | 2016-09-14 | 天津大学 | 八氟取代酞菁的制备方法 |
| KR102376426B1 (ko) * | 2015-05-04 | 2022-03-22 | 삼성디스플레이 주식회사 | 녹색 컬러필터용 감광성 조성물 |
| US9882153B2 (en) * | 2015-06-25 | 2018-01-30 | International Business Machines Corporation | Organic monolayer passivation and silicon heterojunction photovoltaic devices using the same |
| KR102356696B1 (ko) | 2015-07-03 | 2022-01-26 | 삼성전자주식회사 | 유기 광전 소자 및 이미지 센서 |
| JP2016106437A (ja) * | 2016-03-17 | 2016-06-16 | 株式会社半導体エネルギー研究所 | 光電変換装置 |
| KR102012711B1 (ko) * | 2016-04-05 | 2019-08-21 | 한국화학연구원 | 높은 내열성을 가지는 페로브스카이트 태양전지 |
| CN108630812A (zh) * | 2017-03-17 | 2018-10-09 | 中国科学院宁波材料技术与工程研究所 | 罗丹明材料在有机太阳能电池中的应用 |
| KR102649294B1 (ko) * | 2018-02-06 | 2024-03-19 | 삼성전자주식회사 | 컬러 필터가 없는 유기 이미지 센서 |
| US11107860B2 (en) | 2018-02-06 | 2021-08-31 | Samsung Electronics Co., Ltd. | Organic image sensors without color filters |
| CN113135926A (zh) * | 2021-04-23 | 2021-07-20 | 昆明学院 | 新晶体结构酞菁铟纳米线及其制备方法 |
Family Cites Families (29)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES497058A0 (es) | 1979-11-22 | 1982-02-01 | Buehler Ag Geb | Instalacion de transporte para la descarga vertical de bar- cos y otros recipientes |
| JPH0716021B2 (ja) * | 1988-09-16 | 1995-02-22 | 松下電器産業株式会社 | 光起電力装置及びその製造方法 |
| JPH08199161A (ja) | 1995-01-26 | 1996-08-06 | Mitsubishi Chem Corp | 有機電界発光素子 |
| JPH10213912A (ja) * | 1997-01-30 | 1998-08-11 | Sharp Corp | 電子写真感光体 |
| US6051702A (en) | 1997-05-08 | 2000-04-18 | Rutgers, The University Of New Jersey | Organic dyes for photovoltaic cells and for photoconductive electrophotography systems |
| TW399338B (en) * | 1997-11-24 | 2000-07-21 | Lucent Technologies Inc | Method of making an organic thin film transistor and article made by the method |
| US20040067324A1 (en) * | 2002-09-13 | 2004-04-08 | Lazarev Pavel I | Organic photosensitive optoelectronic device |
| EP1731575A4 (en) * | 2004-03-04 | 2009-03-04 | Mitsubishi Chem Corp | PHTHALOCYANINE COMPOSITION AND EACH USING IT BZW. MAKING BZW. MACHINING PHOTO-LEADABLE MATERIAL, ELECTROPHOTOGRAPHIC PHOTO-RECEPTOR, CARTRIDGE FOR ELECTROPHOTOGRAPHIC PHOTO-RECEPTOR AND IMAGING APPARATUS |
| US8357849B2 (en) * | 2004-09-22 | 2013-01-22 | The Trustees Of Princeton University | Organic photosensitive devices |
| CN100466125C (zh) | 2005-04-18 | 2009-03-04 | 中国科学院长春应用化学研究所 | 含有有机异质结的电接触材料及其器件 |
| JP4802671B2 (ja) * | 2005-11-10 | 2011-10-26 | 凸版印刷株式会社 | 低分子有機薄膜を備える有機el素子 |
| DE102005053995A1 (de) | 2005-11-10 | 2007-05-24 | Basf Ag | Verwendung von Rylenderivaten als Photosensibilisatoren in Solarzellen |
| DE102005061997A1 (de) | 2005-12-23 | 2007-07-05 | Basf Ag | Naphthalintetracarbonsäurederivate und deren Verwendung |
| US7795145B2 (en) | 2006-02-15 | 2010-09-14 | Basf Aktiengesellschaft | Patterning crystalline compounds on surfaces |
| WO2007093643A1 (de) * | 2006-02-17 | 2007-08-23 | Basf Se | Fluorierte rylentetracarbonsäurederivate und deren verwendung |
| JP2007242836A (ja) * | 2006-03-08 | 2007-09-20 | Toppan Printing Co Ltd | 薄膜トランジスタおよびその製造方法 |
| US20070259475A1 (en) | 2006-05-04 | 2007-11-08 | Basf Aktiengesellschaft | Method for producing organic field-effect transistors |
| US20080090325A1 (en) | 2006-10-17 | 2008-04-17 | Basf Aktiengesellschaft | Method for producing organic field-effect transistors |
| WO2007128774A1 (en) | 2006-05-04 | 2007-11-15 | Basf Se | Method for producing organic field-effect transistors |
| US20070269924A1 (en) | 2006-05-18 | 2007-11-22 | Basf Aktiengesellschaft | Patterning nanowires on surfaces for fabricating nanoscale electronic devices |
| US8088922B2 (en) | 2006-05-30 | 2012-01-03 | Basf Aktiengesellschaft | Dibenzorylenetetracarboximides as infrared absorbers |
| US20080009092A1 (en) | 2006-07-06 | 2008-01-10 | Basf Aktiengesellschaft | Use of chlorinated copper phthalocyanines as air-stable n-channel organic semiconductors |
| US20080087878A1 (en) | 2006-10-17 | 2008-04-17 | Basf Akiengesellschaft | Use of perylene diimide derivatives as air-stable n-channel organic semiconductors |
| US20080054258A1 (en) | 2006-08-11 | 2008-03-06 | Basf Aktiengesellschaft | Use of perylene diimide derivatives as air-stable n-channel organic semiconductors |
| US20080035914A1 (en) | 2006-08-11 | 2008-02-14 | Basf Aktiengesellschaft | Use of perylene diimide derivatives as air-stable n-channel organic semiconductors |
| WO2008052981A1 (de) | 2006-11-02 | 2008-05-08 | Basf Se | Pentarylen- und hexarylentetracarbonsäurediimide und deren herstellung |
| EP2089390B1 (de) | 2006-11-02 | 2011-07-27 | Basf Se | Heptarylen-und octarylentetracarbonsäurediimide und deren herstellung |
| US20090078312A1 (en) | 2007-09-18 | 2009-03-26 | Basf Se | Verfahren zur herstellung von mit rylentetracarbonsaeurediimiden beschichteten substraten |
| JP2011519350A (ja) | 2008-03-19 | 2011-07-07 | ビーエーエスエフ ソシエタス・ヨーロピア | N,n’−ビス(フルオロフェニルアルキル)で置換されたペリレン−3,4:9,10−テトラカルボキシイミド、ならびにその製造および使用 |
-
2008
- 2008-10-31 KR KR1020107011885A patent/KR20100097662A/ko not_active Application Discontinuation
- 2008-10-31 WO PCT/EP2008/064796 patent/WO2009056626A1/en active Application Filing
- 2008-10-31 US US12/738,947 patent/US8658290B2/en not_active Expired - Fee Related
- 2008-10-31 CN CN200880114186.6A patent/CN101842917B/zh not_active Expired - Fee Related
- 2008-10-31 EP EP08844005A patent/EP2212936A1/en not_active Withdrawn
- 2008-10-31 JP JP2010531533A patent/JP5645666B2/ja not_active Expired - Fee Related
- 2008-10-31 AU AU2008320815A patent/AU2008320815B2/en not_active Ceased
-
2010
- 2010-05-27 ZA ZA2010/03792A patent/ZA201003792B/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| AU2008320815B2 (en) | 2014-07-03 |
| US8658290B2 (en) | 2014-02-25 |
| JP2011504292A (ja) | 2011-02-03 |
| KR20100097662A (ko) | 2010-09-03 |
| CN101842917A (zh) | 2010-09-22 |
| US20100207114A1 (en) | 2010-08-19 |
| CN101842917B (zh) | 2012-10-03 |
| WO2009056626A1 (en) | 2009-05-07 |
| ZA201003792B (en) | 2014-08-27 |
| EP2212936A1 (en) | 2010-08-04 |
| AU2008320815A1 (en) | 2009-05-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5645666B2 (ja) | ハロゲン化フタロシアニン類の使用 | |
| CN105659405B (zh) | 用于有机异质结太阳能电池的新型吸收剂 | |
| US8350035B2 (en) | Fluorinated rylenetetracarboxylic acid derivatives and use thereof | |
| KR101580338B1 (ko) | 할로겐-함유 페릴렌테트라카르복실산 유도체 및 이의 용도 | |
| US20120068123A1 (en) | Use of phthalocyanine compounds with aryl or hetaryl substituents in organic solar cells | |
| US20110168248A1 (en) | Use of dibenzotetraphenylperiflanthene in organic solar cells | |
| JP2012528101A5 (ja) | ||
| JP2012507169A (ja) | 有機太陽電池用および有機光検出器用の光活性層を形成するためのメロシアニン | |
| KR20130143540A (ko) | 유기 태양 전지에서 치환된 페릴렌의 용도 | |
| WO2014042091A1 (ja) | 共役系重合体、これを用いた電子供与性有機材料、光起電力素子用材料および光起電力素子 | |
| US20100171108A1 (en) | Use of n,n'-bis(1,1-dihydroperfluoro-c3-c5-alkyl)-perylene-3,4:9,10- tetracarboxylic diimides | |
| KR20130004907A (ko) | 유기 광전 변환 소자에서의 인단트렌 화합물의 용도 | |
| US9178171B2 (en) | Photovoltaic cell and method for manufacturing the same | |
| US20120234380A1 (en) | Terrylene compounds, preparation thereof and use thereof in organic solar cells | |
| Li et al. | Perylenes in Organic Photovoltaics | |
| Almeida et al. | Organic and Hybrid Solar Cells Based on Small Molecules | |
| Lim | Solution-Processable Solar Cell Technologies | |
| Zoombelt | pi-Conjugated polymers for photovoltaics | |
| WO2011138743A1 (en) | Use of pyromellitic diimides in organic electronics and organic photovoltaics | |
| WO2012123888A1 (en) | Terrylene compounds, preparation thereof and use thereof in organic solar cells |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20101228 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20111028 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20111028 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130701 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20130930 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20131007 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20131226 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20140310 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20140526 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20140602 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140909 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20141006 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20141104 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5645666 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| LAPS | Cancellation because of no payment of annual fees |