JP5503726B2 - 学習・記憶障害および運動障害などを伴う中枢神経変性疾患を改善する乾燥植物組織および植物組織抽出物ならびにこれらを含有する医薬品および食品 - Google Patents
学習・記憶障害および運動障害などを伴う中枢神経変性疾患を改善する乾燥植物組織および植物組織抽出物ならびにこれらを含有する医薬品および食品 Download PDFInfo
- Publication number
- JP5503726B2 JP5503726B2 JP2012501889A JP2012501889A JP5503726B2 JP 5503726 B2 JP5503726 B2 JP 5503726B2 JP 2012501889 A JP2012501889 A JP 2012501889A JP 2012501889 A JP2012501889 A JP 2012501889A JP 5503726 B2 JP5503726 B2 JP 5503726B2
- Authority
- JP
- Japan
- Prior art keywords
- extract
- plant tissue
- nobiletin
- tachibana
- peel
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 239000000284 extract Substances 0.000 title claims description 258
- 239000003814 drug Substances 0.000 title claims description 34
- 208000015122 neurodegenerative disease Diseases 0.000 title description 29
- 235000013305 food Nutrition 0.000 title description 18
- 208000020358 Learning disease Diseases 0.000 title description 6
- 208000026139 Memory disease Diseases 0.000 title description 6
- 201000003723 learning disability Diseases 0.000 title description 6
- 208000016285 Movement disease Diseases 0.000 title description 2
- OBIOZWXPDBWYHB-UHFFFAOYSA-N Nobiletin Natural products C1=CC(OC)=CC=C1C1=C(OC)C(=O)C2=C(OC)C(OC)=C(OC)C(OC)=C2O1 OBIOZWXPDBWYHB-UHFFFAOYSA-N 0.000 claims description 116
- MRIAQLRQZPPODS-UHFFFAOYSA-N nobiletin Chemical compound C1=C(OC)C(OC)=CC=C1C1=CC(=O)C2=C(OC)C(OC)=C(OC)C(OC)=C2O1 MRIAQLRQZPPODS-UHFFFAOYSA-N 0.000 claims description 116
- 241000196324 Embryophyta Species 0.000 claims description 101
- VYFYYTLLBUKUHU-UHFFFAOYSA-N dopamine Chemical compound NCCC1=CC=C(O)C(O)=C1 VYFYYTLLBUKUHU-UHFFFAOYSA-N 0.000 claims description 88
- 229960003638 dopamine Drugs 0.000 claims description 44
- 230000001737 promoting effect Effects 0.000 claims description 36
- 241000207199 Citrus Species 0.000 claims description 32
- 235000020971 citrus fruits Nutrition 0.000 claims description 28
- 239000000203 mixture Substances 0.000 claims description 28
- 230000015654 memory Effects 0.000 claims description 25
- 208000018737 Parkinson disease Diseases 0.000 claims description 23
- 230000001965 increasing effect Effects 0.000 claims description 22
- 230000015572 biosynthetic process Effects 0.000 claims description 20
- 239000004503 fine granule Substances 0.000 claims description 20
- 239000000243 solution Substances 0.000 claims description 18
- ULSUXBXHSYSGDT-UHFFFAOYSA-N tangeretin Chemical compound C1=CC(OC)=CC=C1C1=CC(=O)C2=C(OC)C(OC)=C(OC)C(OC)=C2O1 ULSUXBXHSYSGDT-UHFFFAOYSA-N 0.000 claims description 18
- 239000008187 granular material Substances 0.000 claims description 15
- 238000003786 synthesis reaction Methods 0.000 claims description 15
- 241000411851 herbal medicine Species 0.000 claims description 14
- 235000015110 jellies Nutrition 0.000 claims description 12
- 239000008274 jelly Substances 0.000 claims description 12
- 230000028327 secretion Effects 0.000 claims description 12
- 239000003826 tablet Substances 0.000 claims description 11
- 239000001100 (2S)-5,7-dihydroxy-2-(3-hydroxy-4-methoxyphenyl)chroman-4-one Substances 0.000 claims description 10
- QUQPHWDTPGMPEX-UHFFFAOYSA-N Hesperidine Natural products C1=C(O)C(OC)=CC=C1C1OC2=CC(OC3C(C(O)C(O)C(COC4C(C(O)C(O)C(C)O4)O)O3)O)=CC(O)=C2C(=O)C1 QUQPHWDTPGMPEX-UHFFFAOYSA-N 0.000 claims description 10
- QUQPHWDTPGMPEX-UTWYECKDSA-N aurantiamarin Natural products COc1ccc(cc1O)[C@H]1CC(=O)c2c(O)cc(O[C@@H]3O[C@H](CO[C@@H]4O[C@@H](C)[C@H](O)[C@@H](O)[C@H]4O)[C@@H](O)[C@H](O)[C@H]3O)cc2O1 QUQPHWDTPGMPEX-UTWYECKDSA-N 0.000 claims description 10
- APSNPMVGBGZYAJ-GLOOOPAXSA-N clematine Natural products COc1cc(ccc1O)[C@@H]2CC(=O)c3c(O)cc(O[C@@H]4O[C@H](CO[C@H]5O[C@@H](C)[C@H](O)[C@@H](O)[C@H]5O)[C@@H](O)[C@H](O)[C@H]4O)cc3O2 APSNPMVGBGZYAJ-GLOOOPAXSA-N 0.000 claims description 10
- VUYDGVRIQRPHFX-UHFFFAOYSA-N hesperidin Natural products COc1cc(ccc1O)C2CC(=O)c3c(O)cc(OC4OC(COC5OC(O)C(O)C(O)C5O)C(O)C(O)C4O)cc3O2 VUYDGVRIQRPHFX-UHFFFAOYSA-N 0.000 claims description 10
- QUQPHWDTPGMPEX-QJBIFVCTSA-N hesperidin Chemical compound C1=C(O)C(OC)=CC=C1[C@H]1OC2=CC(O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@@H](CO[C@H]4[C@@H]([C@H](O)[C@@H](O)[C@H](C)O4)O)O3)O)=CC(O)=C2C(=O)C1 QUQPHWDTPGMPEX-QJBIFVCTSA-N 0.000 claims description 10
- 229940025878 hesperidin Drugs 0.000 claims description 10
- ARGKVCXINMKCAZ-UHFFFAOYSA-N neohesperidine Natural products C1=C(O)C(OC)=CC=C1C1OC2=CC(OC3C(C(O)C(O)C(CO)O3)OC3C(C(O)C(O)C(C)O3)O)=CC(O)=C2C(=O)C1 ARGKVCXINMKCAZ-UHFFFAOYSA-N 0.000 claims description 10
- IECRXMSGDFIOEY-UHFFFAOYSA-N Tangeretin Natural products COC=1C(OC)=C(OC)C(OC)=C(C(C=2)=O)C=1OC=2C1=CC=C(O)C=C1 IECRXMSGDFIOEY-UHFFFAOYSA-N 0.000 claims description 9
- 239000002775 capsule Substances 0.000 claims description 9
- 239000000825 pharmaceutical preparation Substances 0.000 claims description 8
- 229940127557 pharmaceutical product Drugs 0.000 claims description 8
- 230000002708 enhancing effect Effects 0.000 claims description 7
- 238000002156 mixing Methods 0.000 claims description 6
- 239000000843 powder Substances 0.000 claims description 6
- 238000003809 water extraction Methods 0.000 claims description 6
- 239000004615 ingredient Substances 0.000 claims description 5
- 239000006188 syrup Substances 0.000 claims description 5
- 235000020357 syrup Nutrition 0.000 claims description 5
- 244000000626 Daucus carota Species 0.000 claims description 3
- 235000002767 Daucus carota Nutrition 0.000 claims description 3
- 235000006484 Paeonia officinalis Nutrition 0.000 claims description 3
- 235000006886 Zingiber officinale Nutrition 0.000 claims description 3
- 244000273928 Zingiber officinale Species 0.000 claims description 3
- 235000008397 ginger Nutrition 0.000 claims description 3
- 239000010440 gypsum Substances 0.000 claims description 3
- 229910052602 gypsum Inorganic materials 0.000 claims description 3
- 235000009292 Asparagus cochinchinensis Nutrition 0.000 claims description 2
- 244000248539 Asparagus cochinchinensis Species 0.000 claims description 2
- 240000008067 Cucumis sativus Species 0.000 claims description 2
- 235000010799 Cucumis sativus var sativus Nutrition 0.000 claims description 2
- 241000736199 Paeonia Species 0.000 claims description 2
- 240000008154 Piper betle Species 0.000 claims description 2
- 235000008180 Piper betle Nutrition 0.000 claims description 2
- 241000143060 Americamysis bahia Species 0.000 claims 1
- 240000005220 Bischofia javanica Species 0.000 claims 1
- 235000010893 Bischofia javanica Nutrition 0.000 claims 1
- 241000544061 Cuculus canorus Species 0.000 claims 1
- 241000222336 Ganoderma Species 0.000 claims 1
- 235000011201 Ginkgo Nutrition 0.000 claims 1
- 244000194101 Ginkgo biloba Species 0.000 claims 1
- 235000008100 Ginkgo biloba Nutrition 0.000 claims 1
- 240000000513 Santalum album Species 0.000 claims 1
- 235000008632 Santalum album Nutrition 0.000 claims 1
- 244000269722 Thea sinensis Species 0.000 claims 1
- 108010021724 tonin Proteins 0.000 claims 1
- 210000001519 tissue Anatomy 0.000 description 106
- 210000003491 skin Anatomy 0.000 description 104
- 238000012360 testing method Methods 0.000 description 76
- 230000000694 effects Effects 0.000 description 74
- 210000004027 cell Anatomy 0.000 description 65
- 230000002103 transcriptional effect Effects 0.000 description 48
- 108091000117 Tyrosine 3-Monooxygenase Proteins 0.000 description 46
- 102000048218 Tyrosine 3-monooxygenases Human genes 0.000 description 46
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 36
- 210000004295 hippocampal neuron Anatomy 0.000 description 32
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 27
- 238000000034 method Methods 0.000 description 26
- 230000004770 neurodegeneration Effects 0.000 description 26
- 238000004519 manufacturing process Methods 0.000 description 25
- 206010027175 memory impairment Diseases 0.000 description 25
- 208000024827 Alzheimer disease Diseases 0.000 description 20
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 20
- 239000007788 liquid Substances 0.000 description 19
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 18
- 230000001419 dependent effect Effects 0.000 description 17
- 230000026731 phosphorylation Effects 0.000 description 17
- 238000006366 phosphorylation reaction Methods 0.000 description 17
- 230000014759 maintenance of location Effects 0.000 description 16
- LBOJYSIDWZQNJS-CVEARBPZSA-N dizocilpine Chemical compound C12=CC=CC=C2[C@]2(C)C3=CC=CC=C3C[C@H]1N2 LBOJYSIDWZQNJS-CVEARBPZSA-N 0.000 description 15
- 230000005758 transcription activity Effects 0.000 description 15
- 230000009471 action Effects 0.000 description 14
- 239000000654 additive Substances 0.000 description 14
- 238000005119 centrifugation Methods 0.000 description 14
- 239000002609 medium Substances 0.000 description 14
- 238000000926 separation method Methods 0.000 description 14
- 102000007665 Extracellular Signal-Regulated MAP Kinases Human genes 0.000 description 13
- 108010007457 Extracellular Signal-Regulated MAP Kinases Proteins 0.000 description 13
- 230000000996 additive effect Effects 0.000 description 12
- 229940079593 drug Drugs 0.000 description 12
- 238000001914 filtration Methods 0.000 description 12
- 108090000623 proteins and genes Proteins 0.000 description 12
- 102000004169 proteins and genes Human genes 0.000 description 12
- 241001122767 Theaceae Species 0.000 description 11
- 230000006872 improvement Effects 0.000 description 11
- 239000007921 spray Substances 0.000 description 11
- 229940124597 therapeutic agent Drugs 0.000 description 11
- 238000001262 western blot Methods 0.000 description 11
- 239000006180 TBST buffer Substances 0.000 description 10
- 239000012141 concentrate Substances 0.000 description 10
- 235000008504 concentrate Nutrition 0.000 description 10
- 239000012488 sample solution Substances 0.000 description 10
- 235000012239 silicon dioxide Nutrition 0.000 description 10
- 241001672694 Citrus reticulata Species 0.000 description 9
- 102100027346 GTP cyclohydrolase 1 Human genes 0.000 description 9
- 241000700159 Rattus Species 0.000 description 9
- 235000019359 magnesium stearate Nutrition 0.000 description 9
- 230000007721 medicinal effect Effects 0.000 description 9
- 239000002245 particle Substances 0.000 description 9
- 239000000126 substance Substances 0.000 description 9
- 238000010998 test method Methods 0.000 description 9
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 8
- 102000005636 Cyclic AMP Response Element-Binding Protein Human genes 0.000 description 8
- 108010045171 Cyclic AMP Response Element-Binding Protein Proteins 0.000 description 8
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 8
- 239000000872 buffer Substances 0.000 description 8
- 239000000499 gel Substances 0.000 description 8
- 239000000377 silicon dioxide Substances 0.000 description 8
- 239000012086 standard solution Substances 0.000 description 8
- QUDAEJXIMBXKMG-UHFFFAOYSA-N 1-[2-[[2-[2-[[6-amino-2-[[2-[[2-amino-5-(diaminomethylideneamino)pentanoyl]amino]-5-(diaminomethylideneamino)pentanoyl]amino]hexanoyl]amino]propanoylamino]-3-hydroxypropanoyl]amino]acetyl]pyrrolidine-2-carboxylic acid Chemical compound NC(N)=NCCCC(N)C(=O)NC(CCCN=C(N)N)C(=O)NC(CCCCN)C(=O)NC(C)C(=O)NC(CO)C(=O)NCC(=O)N1CCCC1C(O)=O QUDAEJXIMBXKMG-UHFFFAOYSA-N 0.000 description 7
- OWEGMIWEEQEYGQ-UHFFFAOYSA-N 100676-05-9 Natural products OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OC2C(OC(O)C(O)C2O)CO)O1 OWEGMIWEEQEYGQ-UHFFFAOYSA-N 0.000 description 7
- 229920002261 Corn starch Polymers 0.000 description 7
- 102000019149 MAP kinase activity proteins Human genes 0.000 description 7
- 108040008097 MAP kinase activity proteins Proteins 0.000 description 7
- GUBGYTABKSRVRQ-PICCSMPSSA-N Maltose Natural products O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-PICCSMPSSA-N 0.000 description 7
- 239000008120 corn starch Substances 0.000 description 7
- 238000001035 drying Methods 0.000 description 7
- 230000011664 signaling Effects 0.000 description 7
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 7
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 6
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 6
- WMGSQTMJHBYJMQ-UHFFFAOYSA-N aluminum;magnesium;silicate Chemical compound [Mg+2].[Al+3].[O-][Si]([O-])([O-])[O-] WMGSQTMJHBYJMQ-UHFFFAOYSA-N 0.000 description 6
- 230000000903 blocking effect Effects 0.000 description 6
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 6
- 235000013399 edible fruits Nutrition 0.000 description 6
- 235000021552 granulated sugar Nutrition 0.000 description 6
- 238000002360 preparation method Methods 0.000 description 6
- 239000006228 supernatant Substances 0.000 description 6
- 208000024891 symptom Diseases 0.000 description 6
- 241000699666 Mus <mouse, genus> Species 0.000 description 5
- 241001093501 Rutaceae Species 0.000 description 5
- 230000000648 anti-parkinson Effects 0.000 description 5
- 239000000939 antiparkinson agent Substances 0.000 description 5
- 239000003795 chemical substances by application Substances 0.000 description 5
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 5
- 230000009266 disease activity Effects 0.000 description 5
- 229930003935 flavonoid Natural products 0.000 description 5
- 150000002215 flavonoids Chemical class 0.000 description 5
- 235000017173 flavonoids Nutrition 0.000 description 5
- 238000012812 general test Methods 0.000 description 5
- 239000001963 growth medium Substances 0.000 description 5
- 238000000338 in vitro Methods 0.000 description 5
- 238000001727 in vivo Methods 0.000 description 5
- 239000012528 membrane Substances 0.000 description 5
- -1 nariltin Chemical compound 0.000 description 5
- 238000001543 one-way ANOVA Methods 0.000 description 5
- 239000002953 phosphate buffered saline Substances 0.000 description 5
- 239000013612 plasmid Substances 0.000 description 5
- 239000000523 sample Substances 0.000 description 5
- 230000019491 signal transduction Effects 0.000 description 5
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 4
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 4
- 102000004190 Enzymes Human genes 0.000 description 4
- 108090000790 Enzymes Proteins 0.000 description 4
- 235000001453 Glycyrrhiza echinata Nutrition 0.000 description 4
- 235000006200 Glycyrrhiza glabra Nutrition 0.000 description 4
- 235000017382 Glycyrrhiza lepidota Nutrition 0.000 description 4
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 4
- 241000699670 Mus sp. Species 0.000 description 4
- HOKKHZGPKSLGJE-GSVOUGTGSA-N N-Methyl-D-aspartic acid Chemical compound CN[C@@H](C(O)=O)CC(O)=O HOKKHZGPKSLGJE-GSVOUGTGSA-N 0.000 description 4
- 239000002033 PVDF binder Substances 0.000 description 4
- VJHCJDRQFCCTHL-UHFFFAOYSA-N acetic acid 2,3,4,5,6-pentahydroxyhexanal Chemical compound CC(O)=O.OCC(O)C(O)C(O)C(O)C=O VJHCJDRQFCCTHL-UHFFFAOYSA-N 0.000 description 4
- 238000004458 analytical method Methods 0.000 description 4
- 230000007131 anti Alzheimer effect Effects 0.000 description 4
- 229960005070 ascorbic acid Drugs 0.000 description 4
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 4
- 229950008138 carmellose Drugs 0.000 description 4
- 239000011248 coating agent Substances 0.000 description 4
- 230000000052 comparative effect Effects 0.000 description 4
- 229940088598 enzyme Drugs 0.000 description 4
- 239000008101 lactose Substances 0.000 description 4
- 229940010454 licorice Drugs 0.000 description 4
- 230000007246 mechanism Effects 0.000 description 4
- 210000002569 neuron Anatomy 0.000 description 4
- 229920002981 polyvinylidene fluoride Polymers 0.000 description 4
- 230000008569 process Effects 0.000 description 4
- FNKQXYHWGSIFBK-RPDRRWSUSA-N sapropterin Chemical compound N1=C(N)NC(=O)C2=C1NC[C@H]([C@@H](O)[C@@H](O)C)N2 FNKQXYHWGSIFBK-RPDRRWSUSA-N 0.000 description 4
- 239000000741 silica gel Substances 0.000 description 4
- 229910002027 silica gel Inorganic materials 0.000 description 4
- 230000001629 suppression Effects 0.000 description 4
- 230000002195 synergetic effect Effects 0.000 description 4
- MRXDGVXSWIXTQL-HYHFHBMOSA-N (2s)-2-[[(1s)-1-(2-amino-1,4,5,6-tetrahydropyrimidin-6-yl)-2-[[(2s)-4-methyl-1-oxo-1-[[(2s)-1-oxo-3-phenylpropan-2-yl]amino]pentan-2-yl]amino]-2-oxoethyl]carbamoylamino]-3-phenylpropanoic acid Chemical compound C([C@H](NC(=O)N[C@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C=O)C1NC(N)=NCC1)C(O)=O)C1=CC=CC=C1 MRXDGVXSWIXTQL-HYHFHBMOSA-N 0.000 description 3
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 3
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 3
- WZFUQSJFWNHZHM-UHFFFAOYSA-N 2-[4-[2-(2,3-dihydro-1H-inden-2-ylamino)pyrimidin-5-yl]piperazin-1-yl]-1-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)ethanone Chemical compound C1C(CC2=CC=CC=C12)NC1=NC=C(C=N1)N1CCN(CC1)CC(=O)N1CC2=C(CC1)NN=N2 WZFUQSJFWNHZHM-UHFFFAOYSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 3
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 3
- OLVPQBGMUGIKIW-UHFFFAOYSA-N Chymostatin Natural products C=1C=CC=CC=1CC(C=O)NC(=O)C(C(C)CC)NC(=O)C(C1NC(N)=NCC1)NC(=O)NC(C(O)=O)CC1=CC=CC=C1 OLVPQBGMUGIKIW-UHFFFAOYSA-N 0.000 description 3
- 244000223760 Cinnamomum zeylanicum Species 0.000 description 3
- 241000238424 Crustacea Species 0.000 description 3
- 108020004414 DNA Proteins 0.000 description 3
- 235000011511 Diospyros Nutrition 0.000 description 3
- 244000236655 Diospyros kaki Species 0.000 description 3
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- 244000303040 Glycyrrhiza glabra Species 0.000 description 3
- 239000007995 HEPES buffer Substances 0.000 description 3
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 3
- 229930182816 L-glutamine Natural products 0.000 description 3
- GDBQQVLCIARPGH-UHFFFAOYSA-N Leupeptin Natural products CC(C)CC(NC(C)=O)C(=O)NC(CC(C)C)C(=O)NC(C=O)CCCN=C(N)N GDBQQVLCIARPGH-UHFFFAOYSA-N 0.000 description 3
- 239000005089 Luciferase Substances 0.000 description 3
- ZPHBZEQOLSRPAK-UHFFFAOYSA-N Phosphoramidon Natural products C=1NC2=CC=CC=C2C=1CC(C(O)=O)NC(=O)C(CC(C)C)NP(O)(=O)OC1OC(C)C(O)C(O)C1O ZPHBZEQOLSRPAK-UHFFFAOYSA-N 0.000 description 3
- 239000004373 Pullulan Substances 0.000 description 3
- 229920001218 Pullulan Polymers 0.000 description 3
- 229930006000 Sucrose Natural products 0.000 description 3
- 239000011668 ascorbic acid Substances 0.000 description 3
- 235000010323 ascorbic acid Nutrition 0.000 description 3
- 239000011575 calcium Substances 0.000 description 3
- 229910052791 calcium Inorganic materials 0.000 description 3
- 239000013592 cell lysate Substances 0.000 description 3
- 235000010980 cellulose Nutrition 0.000 description 3
- 239000001913 cellulose Substances 0.000 description 3
- 229920002678 cellulose Polymers 0.000 description 3
- 230000001684 chronic effect Effects 0.000 description 3
- 108010086192 chymostatin Proteins 0.000 description 3
- 235000017803 cinnamon Nutrition 0.000 description 3
- 235000020230 cinnamon extract Nutrition 0.000 description 3
- 238000000576 coating method Methods 0.000 description 3
- 239000005515 coenzyme Substances 0.000 description 3
- 210000004207 dermis Anatomy 0.000 description 3
- 235000014113 dietary fatty acids Nutrition 0.000 description 3
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 3
- 238000000605 extraction Methods 0.000 description 3
- 239000000194 fatty acid Substances 0.000 description 3
- 229930195729 fatty acid Natural products 0.000 description 3
- 239000012894 fetal calf serum Substances 0.000 description 3
- 230000001605 fetal effect Effects 0.000 description 3
- 230000006870 function Effects 0.000 description 3
- 230000000971 hippocampal effect Effects 0.000 description 3
- 235000012907 honey Nutrition 0.000 description 3
- 235000010445 lecithin Nutrition 0.000 description 3
- 239000000787 lecithin Substances 0.000 description 3
- 229940067606 lecithin Drugs 0.000 description 3
- GDBQQVLCIARPGH-ULQDDVLXSA-N leupeptin Chemical compound CC(C)C[C@H](NC(C)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@H](C=O)CCCN=C(N)N GDBQQVLCIARPGH-ULQDDVLXSA-N 0.000 description 3
- 108010052968 leupeptin Proteins 0.000 description 3
- QNDVLZJODHBUFM-WFXQOWMNSA-N okadaic acid Chemical compound C([C@H](O1)[C@H](C)/C=C/[C@H]2CC[C@@]3(CC[C@H]4O[C@@H](C([C@@H](O)[C@@H]4O3)=C)[C@@H](O)C[C@H](C)[C@@H]3[C@@H](CC[C@@]4(OCCCC4)O3)C)O2)C(C)=C[C@]21O[C@H](C[C@@](C)(O)C(O)=O)CC[C@H]2O QNDVLZJODHBUFM-WFXQOWMNSA-N 0.000 description 3
- VEFJHAYOIAAXEU-UHFFFAOYSA-N okadaic acid Natural products CC(CC(O)C1OC2CCC3(CCC(O3)C=CC(C)C4CC(=CC5(OC(CC(C)(O)C(=O)O)CCC5O)O4)C)OC2C(O)C1C)C6OC7(CCCCO7)CCC6C VEFJHAYOIAAXEU-UHFFFAOYSA-N 0.000 description 3
- 108010091212 pepstatin Proteins 0.000 description 3
- FAXGPCHRFPCXOO-LXTPJMTPSA-N pepstatin A Chemical compound OC(=O)C[C@H](O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)C[C@H](O)[C@H](CC(C)C)NC(=O)[C@H](C(C)C)NC(=O)[C@H](C(C)C)NC(=O)CC(C)C FAXGPCHRFPCXOO-LXTPJMTPSA-N 0.000 description 3
- 108010072906 phosphoramidon Proteins 0.000 description 3
- BWSDNRQVTFZQQD-AYVHNPTNSA-N phosphoramidon Chemical compound O([P@@](O)(=O)N[C@H](CC(C)C)C(=O)N[C@H](CC=1[C]2C=CC=CC2=NC=1)C(O)=O)[C@H]1O[C@@H](C)[C@H](O)[C@@H](O)[C@@H]1O BWSDNRQVTFZQQD-AYVHNPTNSA-N 0.000 description 3
- 239000002504 physiological saline solution Substances 0.000 description 3
- 229920003023 plastic Polymers 0.000 description 3
- 239000004033 plastic Substances 0.000 description 3
- 235000019423 pullulan Nutrition 0.000 description 3
- 238000011002 quantification Methods 0.000 description 3
- 238000003571 reporter gene assay Methods 0.000 description 3
- 235000020183 skimmed milk Nutrition 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 238000007619 statistical method Methods 0.000 description 3
- 239000005720 sucrose Substances 0.000 description 3
- 230000035897 transcription Effects 0.000 description 3
- 238000013518 transcription Methods 0.000 description 3
- IHIXIJGXTJIKRB-UHFFFAOYSA-N trisodium vanadate Chemical compound [Na+].[Na+].[Na+].[O-][V]([O-])([O-])=O IHIXIJGXTJIKRB-UHFFFAOYSA-N 0.000 description 3
- VZSRBBMJRBPUNF-UHFFFAOYSA-N 2-(2,3-dihydro-1H-inden-2-ylamino)-N-[3-oxo-3-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)propyl]pyrimidine-5-carboxamide Chemical compound C1C(CC2=CC=CC=C12)NC1=NC=C(C=N1)C(=O)NCCC(N1CC2=C(CC1)NN=N2)=O VZSRBBMJRBPUNF-UHFFFAOYSA-N 0.000 description 2
- MIDXCONKKJTLDX-UHFFFAOYSA-N 3,5-dimethylcyclopentane-1,2-dione Chemical compound CC1CC(C)C(=O)C1=O MIDXCONKKJTLDX-UHFFFAOYSA-N 0.000 description 2
- 108010011485 Aspartame Proteins 0.000 description 2
- 239000012583 B-27 Supplement Substances 0.000 description 2
- 235000002566 Capsicum Nutrition 0.000 description 2
- 241001140724 Citrus tachibana Species 0.000 description 2
- 241000555678 Citrus unshiu Species 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- 229920000161 Locust bean gum Polymers 0.000 description 2
- 108060001084 Luciferase Proteins 0.000 description 2
- 235000011430 Malus pumila Nutrition 0.000 description 2
- 235000015103 Malus silvestris Nutrition 0.000 description 2
- 241000269940 Pantodon buchholzi Species 0.000 description 2
- 241000255952 Papilio Species 0.000 description 2
- 239000006002 Pepper Substances 0.000 description 2
- 241000286209 Phasianidae Species 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- 235000016761 Piper aduncum Nutrition 0.000 description 2
- 235000017804 Piper guineense Nutrition 0.000 description 2
- 240000003889 Piper guineense Species 0.000 description 2
- 235000008184 Piper nigrum Nutrition 0.000 description 2
- 229920001213 Polysorbate 20 Polymers 0.000 description 2
- 241000242739 Renilla Species 0.000 description 2
- 241000238371 Sepiidae Species 0.000 description 2
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 2
- 229920002472 Starch Polymers 0.000 description 2
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 description 2
- 238000010162 Tukey test Methods 0.000 description 2
- TVXBFESIOXBWNM-UHFFFAOYSA-N Xylitol Natural products OCCC(O)C(O)C(O)CCO TVXBFESIOXBWNM-UHFFFAOYSA-N 0.000 description 2
- 239000010175 Yi-Gan San Substances 0.000 description 2
- YKTSYUJCYHOUJP-UHFFFAOYSA-N [O--].[Al+3].[Al+3].[O-][Si]([O-])([O-])[O-] Chemical compound [O--].[Al+3].[Al+3].[O-][Si]([O-])([O-])[O-] YKTSYUJCYHOUJP-UHFFFAOYSA-N 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 230000032683 aging Effects 0.000 description 2
- 230000003042 antagnostic effect Effects 0.000 description 2
- IAOZJIPTCAWIRG-QWRGUYRKSA-N aspartame Chemical compound OC(=O)C[C@H](N)C(=O)N[C@H](C(=O)OC)CC1=CC=CC=C1 IAOZJIPTCAWIRG-QWRGUYRKSA-N 0.000 description 2
- 239000000605 aspartame Substances 0.000 description 2
- 235000010357 aspartame Nutrition 0.000 description 2
- 229960003438 aspartame Drugs 0.000 description 2
- GUBGYTABKSRVRQ-QUYVBRFLSA-N beta-maltose Chemical compound OC[C@H]1O[C@H](O[C@H]2[C@H](O)[C@@H](O)[C@H](O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@@H]1O GUBGYTABKSRVRQ-QUYVBRFLSA-N 0.000 description 2
- 235000013736 caramel Nutrition 0.000 description 2
- 235000013869 carnauba wax Nutrition 0.000 description 2
- 239000004203 carnauba wax Substances 0.000 description 2
- 235000010418 carrageenan Nutrition 0.000 description 2
- 239000000679 carrageenan Substances 0.000 description 2
- 229920001525 carrageenan Polymers 0.000 description 2
- 229940113118 carrageenan Drugs 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 238000004113 cell culture Methods 0.000 description 2
- 239000008726 choto-san Substances 0.000 description 2
- 235000015165 citric acid Nutrition 0.000 description 2
- 238000007906 compression Methods 0.000 description 2
- 230000006835 compression Effects 0.000 description 2
- 238000012790 confirmation Methods 0.000 description 2
- 208000035475 disorder Diseases 0.000 description 2
- 239000004744 fabric Substances 0.000 description 2
- 239000000706 filtrate Substances 0.000 description 2
- 239000010419 fine particle Substances 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 238000007710 freezing Methods 0.000 description 2
- 230000008014 freezing Effects 0.000 description 2
- 235000013376 functional food Nutrition 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 239000003349 gelling agent Substances 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- 238000004128 high performance liquid chromatography Methods 0.000 description 2
- 239000001341 hydroxy propyl starch Substances 0.000 description 2
- 235000013828 hydroxypropyl starch Nutrition 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 238000007912 intraperitoneal administration Methods 0.000 description 2
- XMGQYMWWDOXHJM-UHFFFAOYSA-N limonene Chemical compound CC(=C)C1CCC(C)=CC1 XMGQYMWWDOXHJM-UHFFFAOYSA-N 0.000 description 2
- 230000033001 locomotion Effects 0.000 description 2
- 235000010420 locust bean gum Nutrition 0.000 description 2
- 239000000711 locust bean gum Substances 0.000 description 2
- 239000012139 lysis buffer Substances 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 230000007595 memory recall Effects 0.000 description 2
- HEBKCHPVOIAQTA-UHFFFAOYSA-N meso ribitol Natural products OCC(O)C(O)C(O)CO HEBKCHPVOIAQTA-UHFFFAOYSA-N 0.000 description 2
- 229920000609 methyl cellulose Polymers 0.000 description 2
- 235000010981 methylcellulose Nutrition 0.000 description 2
- 239000001923 methylcellulose Substances 0.000 description 2
- 238000010172 mouse model Methods 0.000 description 2
- 239000007968 orange flavor Substances 0.000 description 2
- 235000010987 pectin Nutrition 0.000 description 2
- 239000001814 pectin Substances 0.000 description 2
- 229920001277 pectin Polymers 0.000 description 2
- 239000008188 pellet Substances 0.000 description 2
- VLTRZXGMWDSKGL-UHFFFAOYSA-N perchloric acid Chemical compound OCl(=O)(=O)=O VLTRZXGMWDSKGL-UHFFFAOYSA-N 0.000 description 2
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 2
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 230000000750 progressive effect Effects 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 238000005070 sampling Methods 0.000 description 2
- RMAQACBXLXPBSY-UHFFFAOYSA-N silicic acid Chemical compound O[Si](O)(O)O RMAQACBXLXPBSY-UHFFFAOYSA-N 0.000 description 2
- 239000001509 sodium citrate Substances 0.000 description 2
- 239000008107 starch Substances 0.000 description 2
- 235000019698 starch Nutrition 0.000 description 2
- 229960005322 streptomycin Drugs 0.000 description 2
- 235000000346 sugar Nutrition 0.000 description 2
- 230000003956 synaptic plasticity Effects 0.000 description 2
- 239000000454 talc Substances 0.000 description 2
- 235000012222 talc Nutrition 0.000 description 2
- 229910052623 talc Inorganic materials 0.000 description 2
- OGIDPMRJRNCKJF-UHFFFAOYSA-N titanium oxide Inorganic materials [Ti]=O OGIDPMRJRNCKJF-UHFFFAOYSA-N 0.000 description 2
- HRXKRNGNAMMEHJ-UHFFFAOYSA-K trisodium citrate Chemical compound [Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O HRXKRNGNAMMEHJ-UHFFFAOYSA-K 0.000 description 2
- 235000019263 trisodium citrate Nutrition 0.000 description 2
- 229940038773 trisodium citrate Drugs 0.000 description 2
- 239000000811 xylitol Substances 0.000 description 2
- 235000010447 xylitol Nutrition 0.000 description 2
- HEBKCHPVOIAQTA-SCDXWVJYSA-N xylitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)CO HEBKCHPVOIAQTA-SCDXWVJYSA-N 0.000 description 2
- 229960002675 xylitol Drugs 0.000 description 2
- UHVMMEOXYDMDKI-JKYCWFKZSA-L zinc;1-(5-cyanopyridin-2-yl)-3-[(1s,2s)-2-(6-fluoro-2-hydroxy-3-propanoylphenyl)cyclopropyl]urea;diacetate Chemical compound [Zn+2].CC([O-])=O.CC([O-])=O.CCC(=O)C1=CC=C(F)C([C@H]2[C@H](C2)NC(=O)NC=2N=CC(=CC=2)C#N)=C1O UHVMMEOXYDMDKI-JKYCWFKZSA-L 0.000 description 2
- DGVVWUTYPXICAM-UHFFFAOYSA-N β‐Mercaptoethanol Chemical compound OCCS DGVVWUTYPXICAM-UHFFFAOYSA-N 0.000 description 2
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 description 1
- OHVLMTFVQDZYHP-UHFFFAOYSA-N 1-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)-2-[4-[2-[[3-(trifluoromethoxy)phenyl]methylamino]pyrimidin-5-yl]piperazin-1-yl]ethanone Chemical compound N1N=NC=2CN(CCC=21)C(CN1CCN(CC1)C=1C=NC(=NC=1)NCC1=CC(=CC=C1)OC(F)(F)F)=O OHVLMTFVQDZYHP-UHFFFAOYSA-N 0.000 description 1
- IHCCLXNEEPMSIO-UHFFFAOYSA-N 2-[4-[2-(2,3-dihydro-1H-inden-2-ylamino)pyrimidin-5-yl]piperidin-1-yl]-1-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)ethanone Chemical compound C1C(CC2=CC=CC=C12)NC1=NC=C(C=N1)C1CCN(CC1)CC(=O)N1CC2=C(CC1)NN=N2 IHCCLXNEEPMSIO-UHFFFAOYSA-N 0.000 description 1
- GKWLIQDHWRWNRS-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC(N)(CO)CO.OCCN1CCN(CCS(O)(=O)=O)CC1 GKWLIQDHWRWNRS-UHFFFAOYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 102000013455 Amyloid beta-Peptides Human genes 0.000 description 1
- 108010090849 Amyloid beta-Peptides Proteins 0.000 description 1
- 206010002091 Anaesthesia Diseases 0.000 description 1
- 235000017060 Arachis glabrata Nutrition 0.000 description 1
- 244000105624 Arachis hypogaea Species 0.000 description 1
- 235000010777 Arachis hypogaea Nutrition 0.000 description 1
- 235000018262 Arachis monticola Nutrition 0.000 description 1
- 244000080767 Areca catechu Species 0.000 description 1
- 229920001661 Chitosan Polymers 0.000 description 1
- 235000000604 Chrysanthemum parthenium Nutrition 0.000 description 1
- 235000007716 Citrus aurantium Nutrition 0.000 description 1
- 244000183685 Citrus aurantium Species 0.000 description 1
- 241000548268 Citrus deliciosa Species 0.000 description 1
- 241000951471 Citrus junos Species 0.000 description 1
- 235000005979 Citrus limon Nutrition 0.000 description 1
- 244000131522 Citrus pyriformis Species 0.000 description 1
- 241000675108 Citrus tangerina Species 0.000 description 1
- 241000271274 Cleopatra Species 0.000 description 1
- 241000254173 Coleoptera Species 0.000 description 1
- 239000005946 Cypermethrin Substances 0.000 description 1
- 206010012289 Dementia Diseases 0.000 description 1
- 239000004375 Dextrin Substances 0.000 description 1
- 229920001353 Dextrin Polymers 0.000 description 1
- 238000003718 Dual-Luciferase Reporter Assay System Methods 0.000 description 1
- 241000218671 Ephedra Species 0.000 description 1
- 241000283073 Equus caballus Species 0.000 description 1
- 102000036509 GTP Cyclohydrolase Human genes 0.000 description 1
- 108010023555 GTP Cyclohydrolase Proteins 0.000 description 1
- 108700039691 Genetic Promoter Regions Proteins 0.000 description 1
- 102000018899 Glutamate Receptors Human genes 0.000 description 1
- 108010027915 Glutamate Receptors Proteins 0.000 description 1
- 240000004670 Glycyrrhiza echinata Species 0.000 description 1
- 239000002211 L-ascorbic acid Substances 0.000 description 1
- 235000000069 L-ascorbic acid Nutrition 0.000 description 1
- 241000254158 Lampyridae Species 0.000 description 1
- 240000000599 Lentinula edodes Species 0.000 description 1
- 235000001715 Lentinula edodes Nutrition 0.000 description 1
- 240000007890 Leonurus cardiaca Species 0.000 description 1
- 235000000802 Leonurus cardiaca ssp. villosus Nutrition 0.000 description 1
- 235000014196 Magnolia kobus Nutrition 0.000 description 1
- 240000005378 Magnolia kobus Species 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- 235000015429 Mirabilis expansa Nutrition 0.000 description 1
- 244000294411 Mirabilis expansa Species 0.000 description 1
- 206010061296 Motor dysfunction Diseases 0.000 description 1
- 208000002740 Muscle Rigidity Diseases 0.000 description 1
- 102000004868 N-Methyl-D-Aspartate Receptors Human genes 0.000 description 1
- 108090001041 N-Methyl-D-Aspartate Receptors Proteins 0.000 description 1
- MKYBYDHXWVHEJW-UHFFFAOYSA-N N-[1-oxo-1-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)propan-2-yl]-2-[[3-(trifluoromethoxy)phenyl]methylamino]pyrimidine-5-carboxamide Chemical compound O=C(C(C)NC(=O)C=1C=NC(=NC=1)NCC1=CC(=CC=C1)OC(F)(F)F)N1CC2=C(CC1)NN=N2 MKYBYDHXWVHEJW-UHFFFAOYSA-N 0.000 description 1
- NIPNSKYNPDTRPC-UHFFFAOYSA-N N-[2-oxo-2-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)ethyl]-2-[[3-(trifluoromethoxy)phenyl]methylamino]pyrimidine-5-carboxamide Chemical compound O=C(CNC(=O)C=1C=NC(=NC=1)NCC1=CC(=CC=C1)OC(F)(F)F)N1CC2=C(CC1)NN=N2 NIPNSKYNPDTRPC-UHFFFAOYSA-N 0.000 description 1
- AFCARXCZXQIEQB-UHFFFAOYSA-N N-[3-oxo-3-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)propyl]-2-[[3-(trifluoromethoxy)phenyl]methylamino]pyrimidine-5-carboxamide Chemical compound O=C(CCNC(=O)C=1C=NC(=NC=1)NCC1=CC(=CC=C1)OC(F)(F)F)N1CC2=C(CC1)NN=N2 AFCARXCZXQIEQB-UHFFFAOYSA-N 0.000 description 1
- 208000012902 Nervous system disease Diseases 0.000 description 1
- 208000025966 Neurological disease Diseases 0.000 description 1
- 102000007999 Nuclear Proteins Human genes 0.000 description 1
- 108010089610 Nuclear Proteins Proteins 0.000 description 1
- 244000170916 Paeonia officinalis Species 0.000 description 1
- 108090000526 Papain Proteins 0.000 description 1
- 102000003992 Peroxidases Human genes 0.000 description 1
- 108010052090 Renilla Luciferases Proteins 0.000 description 1
- 108700008625 Reporter Genes Proteins 0.000 description 1
- 108091027981 Response element Proteins 0.000 description 1
- 238000003639 Student–Newman–Keuls (SNK) method Methods 0.000 description 1
- 101150076211 TH gene Proteins 0.000 description 1
- 206010044565 Tremor Diseases 0.000 description 1
- 241000863480 Vinca Species 0.000 description 1
- FKAWLXNLHHIHLA-YCBIHMBMSA-N [(2r,3r,5r,7r,8s,9s)-2-[(1s,3s,4s,5r,6r,7e,9e,11e,13z)-14-cyano-3,5-dihydroxy-1-methoxy-4,6,8,9,13-pentamethyltetradeca-7,9,11,13-tetraenyl]-9-[(e)-3-[2-[(2s)-4-[[(2s,3s,4s)-4-(dimethylamino)-2,3-dihydroxy-5-methoxypentanoyl]amino]butan-2-yl]-1,3-oxazol-4 Chemical compound O1C([C@@H](C)CCNC(=O)[C@@H](O)[C@@H](O)[C@H](COC)N(C)C)=NC(\C=C\C[C@H]2[C@H]([C@H](O)C[C@]3(O2)C([C@@H](OP(O)(O)=O)[C@@H]([C@H](C[C@H](O)[C@H](C)[C@H](O)[C@H](C)\C=C(/C)\C(\C)=C\C=C\C(\C)=C/C#N)OC)O3)(C)C)C)=C1 FKAWLXNLHHIHLA-YCBIHMBMSA-N 0.000 description 1
- 230000003187 abdominal effect Effects 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 230000037005 anaesthesia Effects 0.000 description 1
- 230000000954 anitussive effect Effects 0.000 description 1
- 239000005557 antagonist Substances 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 210000003323 beak Anatomy 0.000 description 1
- 235000013871 bee wax Nutrition 0.000 description 1
- 239000012166 beeswax Substances 0.000 description 1
- 230000003542 behavioural effect Effects 0.000 description 1
- 230000006696 biosynthetic metabolic pathway Effects 0.000 description 1
- 238000011088 calibration curve Methods 0.000 description 1
- 229930182747 calyculin Natural products 0.000 description 1
- 229940082483 carnauba wax Drugs 0.000 description 1
- 239000007765 cera alba Substances 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 229960004106 citric acid Drugs 0.000 description 1
- 208000010877 cognitive disease Diseases 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 230000003750 conditioning effect Effects 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- KAATUXNTWXVJKI-UHFFFAOYSA-N cypermethrin Chemical compound CC1(C)C(C=C(Cl)Cl)C1C(=O)OC(C#N)C1=CC=CC(OC=2C=CC=CC=2)=C1 KAATUXNTWXVJKI-UHFFFAOYSA-N 0.000 description 1
- 229960005424 cypermethrin Drugs 0.000 description 1
- 230000006735 deficit Effects 0.000 description 1
- 230000007850 degeneration Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 235000019425 dextrin Nutrition 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 230000006806 disease prevention Effects 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 229950004794 dizocilpine Drugs 0.000 description 1
- 210000004002 dopaminergic cell Anatomy 0.000 description 1
- 230000003291 dopaminomimetic effect Effects 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 230000000857 drug effect Effects 0.000 description 1
- 230000000074 effect on parkinson Effects 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 230000003028 elevating effect Effects 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 239000003172 expectorant agent Substances 0.000 description 1
- 230000003419 expectorant effect Effects 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 238000011049 filling Methods 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 235000019634 flavors Nutrition 0.000 description 1
- 239000003205 fragrance Substances 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 235000013402 health food Nutrition 0.000 description 1
- 210000001320 hippocampus Anatomy 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 1
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 1
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 1
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 230000001678 irradiating effect Effects 0.000 description 1
- 239000010985 leather Substances 0.000 description 1
- 238000001638 lipofection Methods 0.000 description 1
- 230000007787 long-term memory Effects 0.000 description 1
- 238000003670 luciferase enzyme activity assay Methods 0.000 description 1
- 230000003446 memory effect Effects 0.000 description 1
- 230000006386 memory function Effects 0.000 description 1
- 230000006993 memory improvement Effects 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 235000013536 miso Nutrition 0.000 description 1
- 239000011259 mixed solution Substances 0.000 description 1
- 238000000465 moulding Methods 0.000 description 1
- 239000003703 n methyl dextro aspartic acid receptor blocking agent Substances 0.000 description 1
- 210000001577 neostriatum Anatomy 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 210000000653 nervous system Anatomy 0.000 description 1
- 230000014511 neuron projection development Effects 0.000 description 1
- 235000016709 nutrition Nutrition 0.000 description 1
- 239000006186 oral dosage form Substances 0.000 description 1
- 230000008520 organization Effects 0.000 description 1
- 235000020232 peanut Nutrition 0.000 description 1
- 229950000964 pepstatin Drugs 0.000 description 1
- 108040007629 peroxidase activity proteins Proteins 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 238000005498 polishing Methods 0.000 description 1
- 229920000729 poly(L-lysine) polymer Polymers 0.000 description 1
- 229920002401 polyacrylamide Polymers 0.000 description 1
- 238000006116 polymerization reaction Methods 0.000 description 1
- 230000001144 postural effect Effects 0.000 description 1
- 230000035935 pregnancy Effects 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 230000011514 reflex Effects 0.000 description 1
- 238000009256 replacement therapy Methods 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 230000029058 respiratory gaseous exchange Effects 0.000 description 1
- 238000003757 reverse transcription PCR Methods 0.000 description 1
- 229960004617 sapropterin Drugs 0.000 description 1
- 235000015067 sauces Nutrition 0.000 description 1
- 238000004062 sedimentation Methods 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 229960001866 silicon dioxide Drugs 0.000 description 1
- 238000004513 sizing Methods 0.000 description 1
- 235000017557 sodium bicarbonate Nutrition 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- 238000012453 sprague-dawley rat model Methods 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 239000011550 stock solution Substances 0.000 description 1
- 210000000225 synapse Anatomy 0.000 description 1
- 238000001890 transfection Methods 0.000 description 1
- 238000007492 two-way ANOVA Methods 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 210000004291 uterus Anatomy 0.000 description 1
- 238000012795 verification Methods 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K36/00—Medicinal preparations of undetermined constitution containing material from algae, lichens, fungi or plants, or derivatives thereof, e.g. traditional herbal medicines
- A61K36/18—Magnoliophyta (angiosperms)
- A61K36/185—Magnoliopsida (dicotyledons)
- A61K36/75—Rutaceae (Rue family)
- A61K36/752—Citrus, e.g. lime, orange or lemon
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23L—FOODS, FOODSTUFFS, OR NON-ALCOHOLIC BEVERAGES, NOT COVERED BY SUBCLASSES A21D OR A23B-A23J; THEIR PREPARATION OR TREATMENT, e.g. COOKING, MODIFICATION OF NUTRITIVE QUALITIES, PHYSICAL TREATMENT; PRESERVATION OF FOODS OR FOODSTUFFS, IN GENERAL
- A23L33/00—Modifying nutritive qualities of foods; Dietetic products; Preparation or treatment thereof
- A23L33/10—Modifying nutritive qualities of foods; Dietetic products; Preparation or treatment thereof using additives
- A23L33/105—Plant extracts, their artificial duplicates or their derivatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/35—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom
- A61K31/352—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom condensed with carbocyclic rings, e.g. methantheline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7048—Compounds having saccharide radicals and heterocyclic rings having oxygen as a ring hetero atom, e.g. leucoglucosan, hesperidin, erythromycin, nystatin, digitoxin or digoxin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Description
(1)乾燥植物組織100重量%に対してノビレチンを0.4重量%以上含有する、中枢神経変性疾患の改善のための柑橘類の果皮の乾燥植物組織;
(2)乾燥植物組織100重量%に対してノビレチンを0.3重量%以上含有する、中枢神経変性疾患の改善のための柑橘類の葉の乾燥植物組織;
(3)ノビレチン/ナリルチンの含有重量比が1.0以上である、(1)または(2)のいずれか記載の乾燥植物組織;
(4)中枢神経変性疾患がアルツハイマー病および/またはパーキンソン病である、(1)または(2)のいずれか記載の乾燥植物組織;
(5)中枢神経変性疾患の改善がcAMP応答配列(CRE)依存的転写活性の増大、記憶の獲得、保持および想起能力の増強、チロシン・ヒドロキシラーゼ(TH)転写活性の促進、TH発現量の上昇、ドーパミン合成能の促進、またはドーパミン分泌の促進によりもたらされる、(1)または(2)のいずれか記載の乾燥植物組織;
(7)ノビレチン/ナリルチンの含有重量比が2.0以上である、(6)記載の植物組織抽出物;
(8)(1)または(2)のいずれか記載の乾燥植物組織から水抽出、好ましくは60〜100℃の水抽出により得られる、(6)記載の植物組織抽出物;
(9)中枢神経変性疾患がアルツハイマー病および/またはパーキンソン病である、(6)記載の植物組織抽出物;
(10)中枢神経変性疾患の改善がCRE依存的転写活性の増大、記憶の獲得、保持および想起能力の増強、TH転写活性の促進、TH発現量の上昇、ドーパミン合成能の促進、またはドーパミン分泌の促進によりもたらされる、(6)記載の植物組織抽出物;
(12)柑橘類がCitrus reticulata Blanco (Rutaceae)である、(6)記載の植物組織抽出物;
(13)柑橘類がタチバナ、好ましくはニホンタチバナである、(1)または(2)のいずれか記載の乾燥植物組織;
(14)柑橘類がタチバナ、好ましくはニホンタチバナである、(6)記載の植物組織抽出物;
(16)柑橘類がオオベニミカンである、(6)記載の植物組織抽出物;
(18)医薬品100重量%に対して、10〜100重量%の(1)もしくは(2)のいずれか記載の乾燥植物組織または10〜90重量%の(6)記載の植物組織抽出物を有効成分とする、パーキンソン病治療用医薬品;
(19)(1)または(2)のいずれか記載の乾燥植物組織と医薬的に許容される生薬成分とを1:5〜1:10の重量比率で配合して得られる配合物から水抽出、好ましくは60〜100℃の水抽出により得られる抽出物を有効成分とする、中枢神経変性疾患の治療用医薬品;
(20)食品100重量%に対して、10〜100重量%の(1)もしくは(2)のいずれか記載の乾燥植物組織または10〜90重量%の(6)記載の植物組織抽出物を含有する、中枢神経変性疾患の改善のための食品;
(21)中枢神経変性疾患がアルツハイマー病および/またはパーキンソン病である、(20)記載の食品;
(22)中枢神経変性疾患の改善が記憶の獲得、保持および想起能力の増強メカニズムによりもたらされる、(20)記載の食品;
(24)柑橘類の植物組織を50〜100℃にて1〜3時間加熱乾燥することにより得られ、歩留まりが20〜50%である、(4)記載の乾燥植物組織;
(25)植物組織抽出物100重量%に対してノビレチンを0.6〜3.0重量%含有し、かつ、ノビレチン/ナリルチンの含有重量比が2.0〜14.0である、(9)記載の植物組織抽出物;
(26)細粒剤、茶剤、煎剤、カプセル剤、錠剤、顆粒剤、ゼリー剤、散剤、液剤、シロップ剤またはエキス製剤の形態である、(19)記載の医薬品。
本発明の乾燥植物組織は、これに含まれる各成分の割合が上記範囲内であれば、いずれの植物に由来するものであっても、本発明の薬効、すなわち中枢神経変性疾患改善効果(抗アルツハイマー病活性、抗パーキンソン病活性など)、学習・記憶障害改善効果、リン酸化促進作用およびPKA/ERKシグナル伝達促進効果、CRE転写活性およびTH転写活性、TH発現量上昇作用、ドーパミン合成能促進作用、またはドーパミン分泌促進作用を示す。
本発明の植物組織抽出物は、これに含まれる各成分の割合が上記範囲内であれば、いずれの植物に由来するものであっても、本発明の薬効、すなわち中枢神経変性疾患改善効果(抗アルツハイマー病活性、抗パーキンソン病活性など)、学習・記憶障害改善効果、リン酸化促進作用およびPKA/ERKシグナル伝達促進効果、CRE転写活性およびTH転写活性、TH発現量上昇作用、ドーパミン合成能促進作用、またはドーパミン分泌促進作用を示す。
より詳細には、本発明の乾燥植物組織および植物組織抽出物は、植物組織の種類に応じて異なる活性を示してもよい。例えば、ドーパミンが関連する活性について、陳皮または陳皮エキスはドーパミン含量上昇活性を示し得、橘皮または橘皮エキスはドーパミン分泌促進活性を示し得る。
本実施例において、種々の柑橘類から採取した果皮および葉を陰干し、日干しまたは加熱乾燥することにより陳皮、橘皮、タチバナの葉およびオオベニミカンの果皮の乾燥体を製造した。加熱乾燥は、歩留まり(乾燥後質量/乾燥前質量の割合)が陳皮および橘皮について20〜50%、タチバナの葉について20〜50%、オオベニミカンの果皮について20〜50%となるまで行い、具体的には温度60℃にて2時間加熱乾燥した。
実施例1で得られた陳皮、橘皮、タチバナの葉またはオオベニミカンの果皮を細切りしたもの約10 gに純水400 mLを加えて加熱した(橘皮6については、細切りしたもの約20 gに純水1000 mLを加えて加熱した)。混合物が沸騰した後、100℃にて1時間かけて抽出した。次いで、ガーゼ(2枚)を通してろ過し、ろ液を凍結乾燥して植物組織抽出物を得た。植物組織抽出物の製造結果を以下の表1に示す。
実施例1および2で得られた乾燥植物組織および植物組織抽出物の含有成分を以下のようにして測定した。以下に、陳皮および陳皮エキスについての分析方法を示す。
ノビレチンおよびタンゲレチンの定量に用いた標準溶液を以下のように調製した。ノビレチン(和光純薬工業株式会社)をデシケーター(シリカゲル)で24時間以上乾燥した。乾燥ノビレチン約5 mgをメタノール/水混液(7:3)に溶解して100 mLとし、ノビレチン標準溶液とした。また、タンゲレチン(和光純薬工業株式会社)をデシケーター(シリカゲル)で24時間以上乾燥した。乾燥タンゲレチン約3 mgをメタノール/水混液(7:3)に溶解して100 mLとし、タンゲレチン標準溶液とした。
陳皮エキスの試料溶液として、陳皮エキス約0.3 gを50 mLの共栓遠心沈殿管に入れ、これにメタノール/水混液(7:3)50 mLを加えた。混合物に超音波を照射して(UT-305HS、シャープ株式会社)抽出を行った後、遠心分離した(KUBOTA KN-70、株式会社久保田製作所)。その後ろ過し、陳皮エキスの試料溶液とした。
検出器: 紫外吸光光度計(測定波長: 338 nm)
カラム: Mightysil RP-18 4.6 mm x 15 cm(関東化学株式会社)
移動相: 水/アセトニトリル混液(3:2)
流速: 1.0 mL/分(ノビレチンの保持時間を約10分とした)
カラム温度: 40℃
注入量: 10μL
ヘスペリジンおよびナリルチンの定量に用いた標準溶液を以下のように調製した。ヘスペリジン(和光純薬工業株式会社)をデシケーター(シリカゲル)で24時間以上乾燥した。乾燥ヘスペリジン約10 mgを50%メタノールに溶解して50 mLとし、ヘスペリジン標準溶液とした。また、ナリルチン(和光純薬工業株式会社)をデシケーター(シリカゲル)で24時間以上乾燥した。乾燥ナリルチン約10 mgを50%メタノールに溶解して500 mLとし、ナリルチン標準溶液とした。
陳皮エキスの試料溶液として、陳皮エキス約0.1 gを50 mLの共栓遠心沈殿管に入れ、これにメタノール/水混液(1:1)50 mLを加えた。混合物に超音波を照射して(UT-305HS、シャープ株式会社)抽出を行った後、遠心分離した(KUBOTA KN-70、株式会社久保田製作所)。その後ろ過し、陳皮エキスの試料溶液とした。
検出器: 紫外吸光光度計(測定波長: 285 nm)
カラム: L-column2 ODS 4.6 mm x 25 cm(化学物質評価研究機構)
移動相: 水/アセトニトリル/酢酸混液(40:10:1)
流速: 0.8 mL/分(ヘスペリジンの保持時間を約15分とした)
カラム温度: 30℃
注入量: 10μL
上記実施例で得られた陳皮エキスについて以下のインビトロおよびインビボ試験を行った。
以下の試験例1で用いた一般的試験手順は以下のとおりである。
(ラット胎仔初代海馬神経細胞の培養)
妊娠Sprague-Dawley(SD)ラットを12時間周期の明暗サイクルにて給餌・給水して飼育した。妊娠18日目のラット(E18)からエーテル深麻酔下にて腹部正中切開により無菌的に子宮を摘出した。実体顕微鏡下、氷冷リン酸緩衝生理食塩水(PBS)中にて胎仔の海馬を摘出し、パパイン酵素(SUMILON)で組織を分散させ、1000 rpmにて4分間遠心分離した後、上清を除去した。次いで、細胞ペレットを分散液(SUMILON)中にて分散させ、さらにピペッティングにより十分分散させた細胞に除去液(SUMILON)を加えて900 rpmにて5分間遠心分離した後、上清を除去した。
次に、ペレットをNeurobasal Medium(Neurobasal Medium 500 mL/フェノール・レッド不含, 50 x B27 Supplement 10 ml, 0.5 mM L-グルタミン, 0.005%ペニシリン-ストレプトマイシン)を用いて懸濁し、ポリ-L-リジンでコーティングした皿またはプレートに播種した。培養1日後に培地交換し、その後3〜4日おきに培地を半量交換し、10μM AraCを含有する培地中37℃にて5% CO2インキュベーター内で14日間培養した。
なお、薬物処置実験用試験培地は、10μM AraCを含有するNeurobasal Mediumを用いた。
ラット胎仔初代海馬神経細胞を35 mm皿に1×106細胞/皿にて播種し、成長培地中14日間5% CO2インキュベーターで培養した後、薬物を10分間処置した。
各細胞を薬物処置した後、氷冷したPBSで洗浄した。次いで、細胞可溶化液(1 mM EDTA, 1% SDS, 10 mM NaF, 10 nMカリキュリン, 320 nMオカダ酸, 1 mMオルトバナジウム酸ナトリウム, 1 mM p-APMSF, 10μg/mLペプスタチンA, 10μg/mLアンチパイン, 10μg/mLロイペプチン, 10μg/mLキモスタチン, 10μg/mLホスホラミドン, 10 mM HEPES, pH7.5)で回収した。その後すみやかに95℃にて5分間煮沸し、タンパク質を変性させた後、DNAを超音波破砕してSDS-PAGE用サンプルを調製した。
実験結果はワンウェイANOVA(Student-Newman-Keuls)を用いて評価した。有意水準を両側5%として検定し、p<0.05を有意とした。
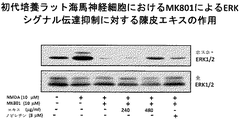
本試験例において、学習・記憶障害に対する本発明の陳皮エキスの作用を検討した。インビトロ試験において、陳皮エキスの海馬ニューロンにおける核内タンパク質CREBのリン酸化促進作用を検討し、初代培養海馬神経細胞におけるNMDA受容体遮断薬(MK801)によるPKA/ERKシグナル伝達抑制への陳皮エキスの影響を検討した。
なお、本明細書において用いるMK801は、グルタミン酸受容体のサブタイプの一つであるNMDA受容体の非選択的アンタゴニストであり、ジゾシルピン(dizocilpine)とも称される。
本試験例で用いた陳皮エキスは以下のように調製した。すなわち、インビトロ試験では、陳皮1からの陳皮エキス7.2 gを秤量し、50 ml遠心チューブに入れ、これにジメチルスルホキシド(DMSO)を加えて30 mLとした。その後、30分間超音波処理し、3000 rpmで10分間遠心分離し、上清を回収して陳皮エキスとして用いた。
種々の濃度の陳皮エキスによるCREBリン酸化に対する効果についてウェスタン・ブロット法を用いて検討した。1×106細胞/35-mmプラスチックシャーレの密度にて増殖させたE18ラット海馬神経細胞を14日間培養した。細胞を陳皮エキス(30, 60, 120, 240および480μg/ml)で10分間処理した。抗リン酸化CREB抗体を用いてウェスタン・ブロット法を行った。次いで、ブロットを剥ぎ取り、抗14-3-3-β抗体について再度試験し、等量のタンパク質が各レーンにて電気泳動されたことを確認した。
図2Aに示されるように、陳皮エキスは濃度依存的にCREBリン酸化を促進した。
種々の濃度の陳皮エキスによるPKA基質リン酸化に対する効果についてウェスタン・ブロット法を用いて検討した。1×106細胞/35-mmプラスチックシャーレの密度にて播種したE18ラット海馬神経細胞を14日間培養した。細胞を異なる濃度の陳皮エキスで10分間処理した。抗リン酸化PKA基質抗体を用いてウェスタン・ブロット法を行った。次いで、ブロットを剥ぎ取り、抗14-3-3-β抗体について再度試験し、等量のタンパク質が各レーンにて電気泳動されたことを確認した。
図2Bに示されるように、陳皮エキスは濃度依存的にPKA基質リン酸化を促進した。
種々の濃度の陳皮エキスまたはノビレチンのERK1/2リン酸化に対する効果についてウェスタン・ブロット法を用いて検討した(陳皮エキス60μg/ml中にノビレチン1μMを含有)。1×106細胞/35-mmプラスチックシャーレの密度にて増殖させたE18ラット海馬神経細胞を14日間培養した。細胞を陳皮エキス(30, 60, 120, 240および480μg/ml)またはノビレチン(4, 8および30μM)で10分間処理した。抗リン酸化ERK1/2抗体を用いてウェスタン・ブロット法を行った。次いで、ブロットを剥ぎ取り、抗ERK1/2抗体について再度試験し、等量のタンパク質が各レーンにて電気泳動されたことを確認した。
図2Cに示されるように、陳皮エキスは濃度依存的にERK1/2リン酸化を促進した。また、陳皮エキスはノビレチンと比較して、強い作用を示した。すなわち、ノビレチン4μMを含有する本発明の陳皮エキス240μg/mlのリン酸化促進効果は、ブロットの大きさによりノビレチン4μMの効果より強いことが示唆された。
初代培養ラット海馬神経細胞においてMK801によるPKA/ERKシグナル伝達抑制に及ぼす陳皮エキスの影響を検討した。初代培養ラット海馬神経細胞に、陳皮エキスまたはノビレチンを1時間前処置した後、MK801を30分間処置し、さらに15分間N-メチル-D-アスパラギン酸(NMDA)で処置した。抗リン酸化PKA基質抗体を用いてウェスタン・ブロット法を行った。次いで、ブロットを剥ぎ取り、抗14-3-3-β抗体について再度試験し、等量のタンパク質が各レーンにて電気泳動されたことを確認した(図2Dを参照のこと)。また、抗リン酸化ERK1/2抗体を用いてウェスタン・ブロット法を行った。次いで、ブロットを剥ぎ取り、抗ERK1/2抗体について再度試験し、等量のタンパク質が各レーンにて電気泳動されたことを確認した(図2Eを参照のこと)。
その結果、MK801はNMDAによるPKA/ERKシグナル伝達を抑制した。しかし、陳皮エキスは濃度依存的にMK801によるシグナル伝達抑制に対して拮抗作用を示し、陳皮エキス(陳皮エキス480μg/ml中にノビレチン8μMを含有)の作用はノビレチン8μMのものよりも強力であった。
上記試験例の結果から、シナプス形成および長期記憶の形成に深く関与することが知られている核内タンパク質であるCREB、さらにその上流にあるPKA基質およびERK1/2のリン酸化において、本発明の陳皮エキスは有意なリン酸化促進作用を有することが明らかとなった。本発明の陳皮エキスはまた、ERK1/2においてノビレチンよりも強いリン酸化促進作用を示した。
さらに、本発明の陳皮エキスは、MK801によるPKA/ERKシグナル伝達抑制に対して有意に拮抗作用を示し、その作用はノビレチンよりも強力であった。これにより本発明の陳皮エキスは、これに含まれるノビレチンとノビレチン以外の成分との相乗的作用を有することが示された。
本試験例において、本発明の陳皮エキスのCRE依存的転写活性作用を従来の陳皮エキスおよびノビレチンと比較した。
統計学的解析のために、レポータージーンアッセイ、RT-PCRで得られた結果はone-way ANOVA(Tukey)を用いて評価した。有意水準を両側5%として検定し、p<0.05を有意とした。
図2Fおよび2Gに示されるように、本試験例で用いた陳皮エキスにおけるノビレチン濃度は2.5μMであり、30μMノビレチンの12分の1の濃度であるにもかかわらず、そのCRE依存的転写活性は30μMノビレチンを超えるものであった。すなわち、多成分系の本発明の陳皮エキスでは、ノビレチン以外の成分の存在によりノビレチンのCRE依存的転写促進活性がノビレチン単体から想定される活性よりも顕著かつ相乗的に増大することが判明した。さらに、本発明の陳皮エキスは、従来の陳皮エキスよりも強いCRE依存的転写活性が認められたことから、学習・記憶障害改善作用を示し、より効果的にアルツハイマー病の認識機能を改善することが示された。
次に、インビボ試験において、MK801誘発性記憶障害モデルマウスを用いて、行動薬理学的に学習・記憶障害に対する本発明の陳皮エキスの作用を検討した。
本試験例で用いた陳皮エキスは以下のように調製した。すなわち、陳皮1からの陳皮エキス5.54 gを秤量し、50 ml遠心チューブに入れ、これに生理食塩水を加えて30 mLとした。その後、30分間超音波処理した。
マウスへの陳皮エキスの投与用量は、ノビレチン含量を基に調製した。ここで、ノビレチン含量は、予めノビレチン標準物質を用いたHPLC法の絶対検量線法により測定した。
恐怖付け学習試験において、マウスを透明なボックスに入れ、2分間自由に探索させた後、0.7 mA、2 sの電気刺激を与えた。これを3回繰り返して学習試行を行い、記憶の獲得および保持能力を評価した。24時間後に、マウスを再び透明なボックスに入れ、マウスのすくみ行動、すなわち呼吸以外のすべての動作が停止した状態を指標とした確認試行を行い、学習・記憶行動として5分間の測定により保持および想起能力を評価した。結果を図3Aに示す。
上記試験例1−1にて、陳皮エキスの経口投与をノビレチン(10, 50 mg/kg)の腹腔内投与に代えて比較試験を行った。結果を図3Bに示す。
上記試験例の結果から、インビボにおいても、本発明の陳皮エキスの慢性投与により学習・記憶障害を有意に改善することに加え、ノビレチンでは認められない記憶の獲得および保持能力を増強することが明らかとなった。
以上より、本発明の陳皮エキスは、シナプス可塑性促進作用およびPKA/ERK保護作用により、学習・記憶障害を改善し、さらに記憶の獲得能力を増強することが示された。すなわち、本発明の陳皮エキスは、ノビレチンよりもアルツハイマー病の中核症状である学習・記憶障害を改善し、特にノビレチンには認められない記憶の獲得および保持能力を増強および/または改善することが示された。
以下の試験例4で用いた一般的試験手順は以下のとおりである。
(PC12D細胞の培養)
ダルベッコ改変イーグル培地(DMEM)9.5 gをMilliQ水800 mLに溶解し、これにグルコース3.5 gを加えMilliQ水で1 Lにした。オートクレーブで滅菌したものを830 mLとり、10%炭酸水素ナトリウム水溶液17 mLおよび3% L-グルタミン水溶液16.5 mLを加えた。次いで、10%となるようにウマ血清(HS)、5%となるようにウシ胎仔血清(FCS)を加えて調製したものを成長培地とし、37℃にて5% CO2インキュベーター内で培養した。
試験培地は、2% HS, 1% FCSを含有するhDMEMを使用した。
PC12D細胞を48ウェルプレートに8×104細胞/ウェルで播種し、成長培地にて24時間培養した後、pRTHプラスミドを0.1μg/ウェル、ウミシイタケpRG-TKプラスミドを0.01μg/ウェルリポフェクションした。トランスフェクション19時間後に化合物を溶解した試験培地で培地交換した。24時間インキュベートした後、培地を吸引し、Passive Lysis Bufferにて回収した。
ホタルシイタケおよびウミシイタケルシフェラーゼはDual-Luciferase Reporter Assay System(Promega)を用い、ルミノメーターで測定した。
PC12D細胞を35 mm皿に0.67×106細胞/皿にて播種し、成長培地中2日間5% CO2インキュベーターで培養した後、薬物を24時間処置した。
各細胞を処置した後、氷冷したPBSで洗浄した。次いで、細胞可溶化液(1 mM EDTA, 1% SDS, 10 mM NaF, 10 nMカリキュリン, 320 nMオカダ酸, 1 mMオルトバナジウム酸ナトリウム, 1 mM p-APMSF, 10μg/mLペプスタチンA, 10μg/mLアンチパイン, 10μg/mLロイペプチン, 10μg/mLキモスタチン, 10μg/mLホスホラミドン, 10 mM HEPES, pH7.5)で回収した。その後すみやかに95℃にて5分間煮沸し、タンパク質を変性させた後、DNAを超音波破砕して遠心上清をSDS-PAGE用サンプルとして調製した。
実験結果はワンウェイANOVA(Bonferroni)を用いて評価した。有意水準を両側5%として検定し、p<0.05を有意とした。
本試験例において、本発明の陳皮エキスのパーキンソン病の症状改善作用として、ドーパミン生合成系への影響を指標にして検討した。具体的には、陳皮エキスによるチロシン・ヒドロキシラーゼ(TH)転写活性への影響についてドーパミン産生細胞であるPC12D細胞において、TH遺伝子プロモーター領域DNAレポータージーンを導入して、ルシフェラーゼ活性を測定して検討した。また、THタンパク質への影響を検討するために陳皮エキスで処置したPC12D細胞におけるTHタンパク質の発現をウェスタン・ブロット法で検討した。さらに、パーキンソン病モデルマウスにおいて黒質−線条体ドーパミン神経の変性による線条体でのドーパミン含有量の低下に対する陳皮エキスまたはノビレチンの薬効を検討するため、陳皮エキスまたはノビレチンの投与後にドーパミン含量を測定した。
8×104細胞/48ウェルプレートの密度にて増殖させたPC12D細胞を24時間培養した。細胞をルシフェラーゼレポーター構築体で19時間トランスフェクションし、次いで対照、陳皮1からの本発明の陳皮エキス(30, 60および120μg/ml)および従来の陳皮7のエキス(120μg/ml)またはノビレチン(2, 10および30μM)で24時間処理した。
図4Aに示されるように、PC12D細胞において、本発明の陳皮1のエキスは対照および従来の陳皮7のエキスと比較して、TH転写活性を顕著に上昇させた。また、ノビレチン換算2μMの陳皮1のエキス120μg/mlは、2μMおよび10μMのノビレチンよりも強力にTH転写活性を促進することが示された。
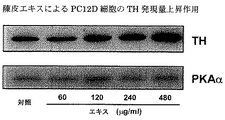
PC12D細胞において、THタンパク質の発現の促進作用を検討した。0.67×106細胞/皿の密度にて増殖させたPC12D細胞を48時間培養した。細胞を対照または陳皮1からの陳皮エキス(60, 120, 240および480μg/ml)で24時間処理した。抗THおよび抗PKAα抗体を用いてウェスタン・ブロット分析を行った。ブロットは、最初に抗TH抗体について調べた後、剥ぎ取り、抗PKAα抗体で再度試験して等量のタンパク質が各レーンにて電気泳動されたことを確認した。
図4Bに示されるように、PC12D細胞において、陳皮エキスはTHタンパク質の発現を濃度依存的に上昇させた。
THがドーパミン合成の律速酵素であり、PC12D細胞がドーパミン合成分泌細胞であることから、ドーパミンの上昇作用を検討した。
PC12D細胞を35 mm皿に1.0×106細胞/皿で播種し、増殖培地上5%CO2インキュベーター中にて24時間培養した後、陳皮1および陳皮7を添加した細胞培養液をさらに24時間培養した。その後、37℃に加温した低K+緩衝液(140 mM NaCl, 4.7 mM KCl, 1.2 mM KH2PO4, 2.5 mM CaCl2, 1.2 mM MgSO4, 11 mMグルコースおよび15 mM HEPES-Tris, pH7.4)にて細胞を洗浄し、最終濃度が0.4Nになるように過塩素酸溶液を加え、1分間超音波にて細胞を破砕した。得られた溶液を遠心分離し、電気化学検出器を用いた高速液体クロマトグラフィー法によりドーパミンを分離定量した。
図4Cに示されるように、本発明の陳皮1のエキスは対照および従来の陳皮7のエキスと比較して、24時間および48時間のいずれの処置においてもドーパミン含有量を増加させた。
上記試験例において、本発明の陳皮エキスはPC12D細胞にてTH転写活性、TH発現量およびドーパミン含量をいずれも濃度依存的に上昇させ、その作用は等濃度のノビレチンと比較して予想外かつ格別に強力であった。
すなわち、本発明の陳皮エキスは、ノビレチンより顕著にドーパミン合成促進活性を示すことが明らかとなった。従来の陳皮由来のエキスでは当該活性は認められていないことから、本発明の陳皮エキスは高含有量のノビレチンとノビレチン以外の他の成分との相乗効果によりドーパミン合成促進活性を示したと考えられる。以上により本発明の陳皮エキスは、パーキンソン病治療薬としての薬効が期待される。
実施例2で得られた橘皮3から本明細書記載の方法により抽出したエキスを用いて、海馬神経細胞におけるCRE転写活性を対照およびノビレチンと比較検討した。試験手順は試験例2と同様とした。結果を図5Aに示す。
なお、本試験例で用いた橘皮3エキス300μg/mLには、ノビレチンが約9.4μM含まれていた。
図5Aに示されるように、橘皮3のエキスは対照およびノビレチンと比較して、海馬神経細胞において顕著なCRE転写活性を示した。このことから、本発明の橘皮エキスは、アルツハイマー病治療薬としての薬効が期待される。
実施例2で得られた橘皮6から本明細書記載の方法により抽出したエキスを用いて、学習・記憶障害に対する本発明の橘皮エキスの作用を検討した。試験手順は試験例3と同様とした。結果を図5Bおよび図5Cに示す。
なお、橘皮エキス1.87 g/kgまたは3.73 g/kg(ノビレチン含量: それぞれ25 mg/kgまたは50 mg/kg)を1群ずつに、7日間連続的に経口投与した。
図5Bおよび図5Cに示されるように、本発明の橘皮エキスの慢性投与により学習・記憶障害を有意に改善することに加え、ノビレチンでは認められない記憶の獲得および保持能力を増強することが明らかとなった。
上記試験例の結果から、本発明の橘皮エキスは、アルツハイマー病治療薬としての薬効が期待される。
実施例2で得られた橘皮3から本明細書記載の方法により抽出したエキスを用いて、PC12D細胞におけるCRE転写活性を対照およびノビレチンと比較検討した。試験手順は試験例2と同様とした。結果を図5Dに示す。
なお、本試験例で用いた橘皮3エキス300μg/mLには、ノビレチンが約9.4μM含まれていた。
図5Dに示されるように、橘皮3のエキスは対照およびノビレチンと比較して、PC12D細胞において顕著なCRE転写活性を示した。
実施例2で得られた橘皮3から本明細書記載の方法により抽出したエキスを用いて、PC12D細胞におけるTH転写活性を対照およびノビレチンと比較検討した。試験手順は試験例4−1と同様とした。結果を図5Eに示す。
図5Eに示されるように、橘皮3のエキスは対照およびノビレチンと比較して、PC12D細胞において顕著なTH転写活性を示した。
PC12D細胞において、GCH I量上昇作用を検討した。GCH Iは、THに必須の補酵素テトラヒドロビオプテリン(BH4)の生合成における律速酵素である。
PC12D細胞は120 μg/mL濃度の橘皮エキス、陳皮エキスおよびDMSO(対照)で48時間処理後、PBSで洗浄し、細胞溶解液(1 mM EDTA, 1% SDS, 10 mM HEPES, 10 mM NaF, 1 mM p-APMSF, 1 mMオルトバナジウム酸ナトリウム, 10 nMカリキュリン(calyculin), 320 μMオカダ酸, 10 μg/mLペプスタチン(pepstatin), 10 μg/mLアンチパイン, 10 μg/mLロイペプチン, 10 μg/mLキモスタチン(chymostatin), 10 μg/mLホスホラミドン, 240 pMシペルメトリン)中で溶解した。その後5分間95℃で煮沸し、ソニケート後、10000 x gで10分間遠心を行い、上清を用いてSDS-PAGEを行った。10 μgサンプルをゲル濃度12.5%のゲルにアプライした。その後PVDFメンブレンに36Vで2時間転写を行い、メンブレンは5%スキムミルクで1時間ブロッキングした。その後GCH I抗体(ABBIOTEC、1000倍希釈)を用い、それぞれ4℃で一晩反応させ、洗浄後さらにペルオキシダーゼ標識抗ウサギ2次抗体(CST、2000倍希釈)と反応させ、ECL法でバンドを検出した。結果を陳皮エキスと比較して図5Fに示す。
なお、本試験例で用いた橘皮エキス120μg/mLにはノビレチンが約3.76μM含まれており、陳皮エキス120μg/mLにはノビレチンが約2.02μM含まれていた。
図5Fに示されるように、PC12D細胞において、橘皮エキスおよび陳皮エキスは対照に比べてGCH Iの発現量を有意に上昇させた。さらに、橘皮エキスは陳皮エキスに比べてもGCH Iの発現量を有意に上昇させた。
THの活性発現に必須な補酵素BH4は、ミカエリス定数が示す量より細胞内のBH4量が高くなると、THタンパク量が上昇して、THの酵素活性が増大し、ドーパミンの合成が促進される。
上記試験例の結果から、本発明の橘皮エキスは、GCH Iの発現量を有意に上昇させることから、THの活性発現に必須な補酵素BH4合成の律速酵素であるGCH I量を増加させることで、TH活性の増大を引き起こし、その結果として、ドーパミンの産生および分泌の促進が推測され、パーキンソン病治療薬としての薬効が期待される。
実施例2で得られたタチバナの葉1〜3から本明細書記載の方法により抽出したエキスを用いて、海馬神経細胞におけるCRE転写活性を対照およびノビレチンと比較検討した。試験手順は試験例2と同様とした。結果を図6Aに示す。
なお、本試験例で用いたタチバナの葉1由来エキス300μg/mLにはノビレチンが約4.9μM、タチバナの葉2由来エキス300μg/mLにはノビレチンが約8.5μM、タチバナの葉3由来エキス300μg/mLにはノビレチンが約6.9μM含まれていた。
図6Aに示されるように、タチバナの葉由来エキスは対照およびノビレチンと比較して、海馬神経細胞において顕著なCRE転写活性を示した。
実施例2で得られたタチバナの葉1〜3から本明細書記載の方法により抽出したエキスを用いて、PC12D細胞におけるCRE転写活性を対照およびノビレチンと比較検討した。試験手順は試験例2と同様とした。結果を図6Bに示す。
なお、本試験例で用いたタチバナの葉1由来エキス300μg/mLにはノビレチンが約4.9μM、タチバナの葉2由来エキス300μg/mLにはノビレチンが約8.5μM、タチバナの葉3由来エキス300μg/mLにはノビレチンが約6.9μM含まれていた。
図6Bに示されるように、タチバナの葉由来エキスは対照およびノビレチンと比較して、PC12D細胞において顕著なCRE転写活性を示した。
上記試験例の結果から、本発明のタチバナの葉由来エキスは、ノビレチン含有量から予測される活性を超えた顕著なCRE転写活性を示しており、アルツハイマー病治療薬およびパーキンソン病治療薬としての薬効が期待される。
実施例2で得られたオオベニミカン1から本明細書記載の方法により抽出したエキスを用いて、海馬神経細胞におけるCRE転写活性を対照およびノビレチンと比較検討した。試験手順は試験例2と同様とした。結果を図7Aに示す。
なお、本試験例で用いたオオベニミカン1果皮由来エキス100μg/mLにはノビレチンが約3.4μM、300μg/mLにはノビレチンが約10.1μM含まれていた。
図7Aに示されるように、オオベニミカン果皮由来エキスは対照およびノビレチンと比較して、海馬神経細胞において顕著なCRE転写活性を示した。
上記試験例の結果から、本発明のオオベニミカン果皮由来エキスは、ノビレチン含有量から予測される活性を超えた顕著なCRE転写活性を示しており、アルツハイマー病治療薬としての薬効が期待される。
実施例2で得られたオオベニミカン1から本明細書記載の方法により抽出したエキスを用いて、PC12D細胞におけるCRE転写活性を対照およびノビレチンと比較検討した。試験手順は試験例2と同様とした。結果を図7Bに示す。
なお、本試験例で用いたオオベニミカン果皮由来エキス100μg/mLにはノビレチンが約3.4μM含まれていた。
図7Bに示されるように、オオベニミカン果皮由来エキスは対照およびノビレチンと比較して、PC12D細胞において顕著なCRE転写活性を示した。
実施例2で得られたオオベニミカン1から本明細書記載の方法により抽出したエキスを用いて、PC12D細胞におけるTH転写活性を対照およびノビレチンと比較検討した。試験手順は試験例4−1と同様とした。結果を図7Cに示す。
なお、本試験例で用いたオオベニミカン果皮由来エキス100μg/mLにはノビレチンが約3.4μM含まれていた。
図7Cに示されるように、オオベニミカン果皮由来エキスは対照およびノビレチンと比較して、PC12D細胞において顕著なTH転写活性を示した。
上記試験例の結果から、本発明のオオベニミカン果皮由来エキスは、ノビレチン含有量から予測される活性を超えた顕著なCRE転写活性およびTH転写活性を示しており、パーキンソン病治療薬としての薬効が期待される。
以下の手順により、本発明の陳皮、橘皮またはタチバナの葉を含有する医薬品または食品を製造した。
陳皮3.0 g、トウキ3.0 g、チョウトウコウ3.0 g、センキュウ3.0 g、ビャクジュツ4.0 g、ブクリョウ4.0 g、サイコ2.0 g、カンゾウ1.5 gおよびハンゲ5.0 g(合計28.5 g)の比率で、合計量が200〜800 kgになるよう生薬を配合し、水2000〜8000 Lにて、60〜100℃、30〜180分間抽出(抽出缶)した。回転数1000〜5000 rpmでろ過(遠心分離機)して固液分離した後、8 kPa以下の減圧下で濃度約10〜40%まで濃縮(コイル回転型濃縮機)した。濃縮液を、回転数10000〜20000 rpm、給気温度130〜180℃、排気温度60〜120℃で噴霧乾燥(噴霧乾燥機)し、エキス製剤(抑肝散加陳皮半夏エキス)を得た。得られた抑肝散加陳皮半夏エキス6.1 gに対し、ステアリン酸マグネシウム、トウモロコシデンプン、乳糖、プルランおよびメタケイ酸アルミン酸マグネシウムからなる添加物2.9 gの比率で、合計量が50〜400 kgの範囲で配合し、4 rpm、20分間混合(容器回転型混合機)し、ロール圧490〜2500 Paで成型して整粒(乾式造粒装置)し、篩30号〜50号間にて粒子分級(カセットスクリーン)し、細粒剤Aを得た。
橘皮3.0 g、ビンロウジ4.0 g、コウボク3.0 g、ケイヒ3.0 g、ソヨウ1.5 g、カンゾウ1.0 g、ダイオウ1.0 g、ショウキョウ1.0 g、モッコウ1.0 g、ゴシュユ1.0 gおよびブクリョウ3.0 g(合計22.5 g)の比率で、合計量が200〜800 kgになるよう生薬を配合し、水2000〜8000 Lにて、60〜100℃、30〜180分間抽出(抽出缶)した。回転数1000〜5000 rpmでろ過(遠心分離機)して固液分離した後、8 kPa以下の減圧下で濃度約10〜40%まで濃縮(コイル回転型濃縮機)した。濃縮液を、回転数10000〜20000 rpm、給気温度130〜180℃、排気温度60〜120℃で噴霧乾燥(噴霧乾燥機)し、エキス製剤(九味檳榔湯エキス)を得た。得られた九味檳榔湯エキス3.7 gに対し、ステアリン酸マグネシウム、トウモロコシデンプン、乳糖、プルランおよびメタケイ酸アルミン酸マグネシウムからなる添加物2.3 gの比率で、合計量が50〜400 kgの範囲で配合し、4 rpm、20分間混合(容器回転型混合機)し、ロール圧490〜2500 Paで成型して整粒(乾式造粒装置)し、篩30号〜50号間にて粒子分級(カセットスクリーン)し、細粒剤Bを得た。
陳皮2.4 g、チョウトウコウ2.4 g、ハンゲ2.4 g、バクモンドウ2.4 g、ブクリョウ2.4 g、ニンジン1.6 g、ボウフウ1.6 g、キクカ1.6 g、カンゾウ0.8 g、ショウキョウ0.8 gおよびセッコウ4.0 g(合計22.4 g)の比率で、合計量が200〜800 kgになるよう生薬を配合し、水2000〜8000 Lにて、60〜100℃、30〜180分間抽出(抽出缶)した。回転数1000〜5000 rpmでろ過(遠心分離機)して固液分離した後、8 kPa以下の減圧下で濃度約10〜40%まで濃縮(コイル回転型濃縮機)した。濃縮液を、回転数10000〜20000 rpm、給気温度130〜180℃、排気温度60〜120℃で噴霧乾燥(噴霧乾燥機)し、エキス製剤(釣藤散エキス)を得た。得られた釣藤散エキス4.48 gに対し、含水二酸化ケイ素、ステアリン酸マグネシウムおよびトウモロコシデンプンからなる添加物1.52 gの比率で、合計量が50〜400 kgの範囲で配合し、4 rpm、20分間混合(容器回転型混合機)し、ロール圧490〜2500 Paで成型して整粒(乾式造粒装置)し、篩30号〜50号間にて粒子分級(カセットスクリーン)し、細粒剤Cを得た。
陳皮または橘皮を850〜4750μm角に切断し、切断した陳皮または橘皮3〜7 gを紙または布の袋に入れて茶剤とした。
得られた茶剤を成人1日あたり3回(1袋/回)で浸出して服用する。
陳皮または橘皮を回転数2000〜3500 rpm、目開き0.5〜3.0 mmで粗砕(粉砕機)し、さらに回転数5000〜8000 rpm、目開き150μmで粉砕(製粉機)し、生薬末とした。得られた陳皮または橘皮の生薬末10 gに対し、含水二酸化ケイ素、ステアリン酸マグネシウムおよびトウモロコシデンプンからなる添加物9.2 gの比率で、合計量が50〜400 kgの範囲で配合し、回転数4 rpm、20分間混合(容器回転型混合機)し、ロール圧490〜2500 Paで成型して整粒(乾式造粒装置)し、篩30号〜42号間にて粒子分級(カセットスクリーン)し、細粒剤Dを得た。
陳皮または橘皮10〜30 gを20倍量の水200〜600 mLで、100℃1時間煎じて水を半量にし、ろ過して煎剤とした。
得られた煎剤100〜300 mLには、陳皮または橘皮10〜30 gが含有されており、目安として煎剤100〜300 mLを成人1日あたり3回に分けて服用する。
陳皮または橘皮50 kgを水500〜2000 Lにて、60〜100℃、30〜180分間抽出(抽出缶)した。回転数1000〜2500 rpmでろ過(遠心分離機)して固液分離した後、8 kPa以下の減圧下で濃度約10〜40%まで濃縮(コイル回転型濃縮機)した。濃縮液を、回転数10000〜20000 rpm、給気温度130〜180℃、排気温度60〜120℃で噴霧乾燥(噴霧乾燥機)し、陳皮または橘皮のエキスを得た。得られたエキス7.2 gに対し、微粒二酸化ケイ素およびショ糖脂肪酸エステルからなる添加物1.8 gの比率で、合計量が50〜400 kgの範囲で配合し、回転数4 rpm、20分間混合(容器回転型混合機)し、ロール圧490〜2500 Paで成型して整粒(乾式造粒装置)し、篩30号〜42号間にて粒子分級(カセットスクリーン)し、細粒剤Eを得た。
陳皮または橘皮50 kgを水500〜2000 Lにて、60〜100℃、30〜180分間抽出(抽出缶)した。回転数1000〜2500 rpmでろ過(遠心分離機)して固液分離した後、8 kPa以下の減圧下で濃度約10〜40%まで濃縮(コイル回転型濃縮機)した。濃縮液を、回転数10000〜20000 rpm、給気温度130〜180℃、排気温度60〜120℃で噴霧乾燥(噴霧乾燥機)し、陳皮または橘皮のエキスを得た。得られたエキス10 gに対し、メタケイ酸アルミン酸マグネシウム、合成ケイ酸アルミニウム・ヒドロキシプロピルスターチ・結晶セルロース、トウモロコシデンプン、軽質無水ケイ酸、ステアリン酸マグネシウムおよびカルメロ−スカルシウムからなる添加物4.75 gの比率で、合計量が50〜400 kgの範囲で配合し、回転数4 rpm、20分間混合(容器回転型混合機)し、ロール圧490〜2500 Paで成型して整粒(乾式造粒装置)し、篩30号〜42号間にて粒子分級(カセットスクリーン)し、細粒を得た。この細粒400 mgを当分野にて通常用いられる市販のカプセルに充填(カプセル充填機)し、カプセル剤を得た。
陳皮または橘皮50 kgを水500〜2000 Lにて、60〜100℃、30〜180分間抽出(抽出缶)した。回転数1000〜2500 rpmでろ過(遠心分離機)して固液分離した後、8 kPa以下の減圧下で濃度約10〜40%まで濃縮(コイル回転型濃縮機)した。濃縮液を、回転数10000〜20000 rpm、給気温度130〜180℃、排気温度60〜120℃で噴霧乾燥(噴霧乾燥機)し、陳皮または橘皮のエキスを得た。得られたエキス10 gに対し、マルトース、乳糖、メタケイ酸アルミン酸マグネシウムおよびステアリン酸マグネシウムからなる添加物9.1 gの比率で、合計量が50〜400 kgの範囲で配合し、回転数4 rpm、20分間混合(容器回転型混合機)し、回転数20〜55 rpm、一次圧縮0.6 mm以上、二次圧縮0.4 mm以上で打錠(高速回転式打錠機)し、1錠350 mgの素錠を得た。ヒドロキシプロピルメチルセルロース、タルク、酸化チタンおよびカラメルからなるコーティング剤1.1 gを水/エタノール混液(3:7〜10:0)に溶解または懸濁し、排気温40〜55℃、流量200〜400 g/mL、回転数4〜6 rpmでコーティング(コーティング機)し、微量のカルナウバロウとサラシミツロウを用いて回転数1 rpm、排気温20〜30℃で艶出し(コーティング機)を行い、1錠370 mgのコート錠剤とした。
陳皮または橘皮50 kgを水500〜2000 Lにて、60〜100℃、30〜180分間抽出(抽出缶)した。回転数1000〜2500 rpmでろ過(遠心分離機)して固液分離した後、8 kPa以下の減圧下で濃度約10〜40%まで濃縮(コイル回転型濃縮機)した。濃縮液を、回転数10000〜20000 rpm、給気温度130〜180℃、排気温度60〜120℃で噴霧乾燥(噴霧乾燥機)し、陳皮または橘皮のエキスを得た。得られたエキス10 gに対し、トウモロコシデンプン、マルトース、含水二酸化ケイ素およびステアリン酸マグネシウムからなる添加物15 gの比率で、合計量が50〜400 kgの範囲で配合し、回転数4 rpm、20分間混合(容器回転型混合機)し、ロール圧490〜2500 Paで成型して整粒(乾式造粒装置)し、篩30号〜42号間にて粒子分級(カセットスクリーン)し、細粒剤Fを得た。
陳皮または橘皮50 kgを水500〜2000 Lにて、60〜100℃、30〜180分間抽出(抽出缶)した。回転数1000〜2500 rpmでろ過(遠心分離機)して固液分離した後、8 kPa以下の減圧下で濃度約10〜40%まで濃縮(コイル回転型濃縮機)した。濃縮液を、回転数10000〜20000 rpm、給気温度130〜180℃、排気温度60〜120℃で噴霧乾燥(噴霧乾燥機)し、陳皮または橘皮のエキスを得た。得られたエキス10 gに対し、カルメロースカルシウム、含水二酸化ケイ素、メタケイ酸アルミン酸マグネシウムおよびステアリン酸マグネシウムからなる添加物40 gの比率で、合計量が50〜400 kgの範囲で配合し、回転数4 rpm、20分間混合(容器回転型混合機)し、ロール圧490〜2500 Paで成型して整粒(乾式造粒装置)し、篩12号〜42号間にて粒子分級(カセットスクリーン)し、顆粒剤を得た。
陳皮または橘皮50 kgを水500〜2000 Lにて、60〜100℃、30〜180分間抽出(抽出缶)した。回転数1000〜2500 rpmでろ過(遠心分離機)して固液分離した後、8 kPa以下の減圧下で濃度約10〜40%まで濃縮(コイル回転型濃縮機)した。濃縮液を、回転数10000〜20000 rpm、給気温度130〜180℃、排気温度60〜120℃で噴霧乾燥(噴霧乾燥機)し、陳皮または橘皮のエキスを得た。得られたエキス10 gに対し、カラギナン、ローカストビーンガム、還元麦芽糖液糖、キシリトール、アップル香料、レシチンおよびクエン酸からなる添加物40 gの比率で、合計量が10〜30 kgの範囲で配合し、回転数50〜150 rpmで混合(混合攪拌機)し、等量の80℃以上の温水を攪拌しながら加え、15℃以下に冷却してゼリー剤とした。
陳皮または橘皮50 kgを水500〜2000 Lにて、60〜100℃、30〜180分間抽出(抽出缶)した。回転数1000〜2500 rpmでろ過(遠心分離機)して固液分離した後、8 kPa以下の減圧下で濃度約10〜40%まで濃縮(コイル回転型濃縮機)した。濃縮液を、回転数10000〜20000 rpm、給気温度130〜180℃、排気温度60〜120℃で噴霧乾燥(噴霧乾燥機)し、陳皮または橘皮のエキスを得た。得られたエキス3.6 gに対し、微粒二酸化ケイ素およびショ糖脂肪酸エステルからなる添加物0.9 gの比率で、合計量が50〜400 kgの範囲で配合し、回転数4 rpm、20分間混合(容器回転型混合機)し、ロール圧490〜2500 Paで成型して整粒(乾式造粒装置)し、篩30号〜42号間にて粒子分級(カセットスクリーン)し、細粒を得た。
陳皮または橘皮50 kgを水500〜2000 Lにて、60〜100℃、30〜180分間抽出(抽出缶)した。回転数1000〜2500 rpmでろ過(遠心分離機)して固液分離した後、8 kPa以下の減圧下で濃度約10〜40%まで濃縮(コイル回転型濃縮機)した。濃縮液を、回転数10000〜20000 rpm、給気温度130〜180℃、排気温度60〜120℃で噴霧乾燥(噴霧乾燥機)し、陳皮または橘皮のエキスを得た。得られたエキス10 gに対し、レシチン、還元麦芽糖水飴、アスパルテーム、アスコルビン酸、クエン酸三ナトリウム、ゲル化剤(FG-2266、新田ゼラチン株式会社)およびオレンジ香料からなる添加物15.9 gの比率で、合計量が50〜400 kgの範囲で配合し、回転数4 rpm、20分間混合(容器回転型混合機)してゼリーの素とした。
タチバナの葉を850〜4750μm角に切断し、切断したタチバナの葉3〜7 gを紙または布の袋に入れるか、またはそのままの状態で茶とした。
目安として、得られた茶を成人1日あたり3回〜5回(1袋または3〜7 g/回)にてお湯で淹れて摂取する。
陳皮または橘皮200 gおよび食塩2 gを十分に浸る程度の水に入れ、蓋をして15分間沸騰させた後、お湯を捨て、冷水にくぐらせた。グラニュー糖200 gおよび水100 mLを混ぜ合わせて沸騰させた混合溶液に、水分をきった前記陳皮または橘皮を入れ、時々混ぜながら皮に透明感が出てくるまで煮た。蓋をせず、ごく弱火で40〜50分間焦げ付かないように、時々混ぜながら煮詰めた。煮汁を除いて水分をよくきった後、熱いうちに取り出して、広げて乾かした。得られた皮にグラニュー糖20 gをまぶしてピールとした。
得られたピール21.1 gには、陳皮または橘皮10 gが含有されており、目安として成人1日あたりピール21.1〜42.2 gを摂取する。
陳皮または橘皮100 gに100 mLのお湯(100℃)をかけ、一晩容器に入れて蒸らし、ミキサーで粉砕した。1 Lの水を加え、強火で1時間30分煮込んだ。グラニュー糖25〜30 gを加え、中火で10〜15分間煮込んだ後、弱火にし、グラニュー糖25〜30 gを加えて溶解させた。さらに、グラニュー糖25〜30 gを加えて溶解させ、70℃以下まで冷却した後、ハチミツ60 g、ペクチン1.7 gおよびアスコルビン酸1.7 gを加え攪拌してジャムとした。
得られたジャム100 gには、陳皮または橘皮20 gが含有されており、目安として成人1日あたりジャム25〜50 gを摂取する。
タチバナの葉30 kgを水300 Lにて、60〜100℃、5〜30分間抽出(抽出缶)した。回転数1000〜2500 rpmでろ過(遠心分離機)して固液分離し、ろ液に0.2 g/Lのアスコルビン酸を添加し、茶とした。
得られた茶500 mLには、タチバナの葉5 gが含有されており、目安として成人1日あたり茶500 mLを摂取する。
Claims (7)
- 植物組織抽出物100重量%に対してノビレチンを0.6〜3.0重量%含有し、ナリルチンを0.4重量%以下含有し、タンゲレチンを0.1〜1.0重量%含有し、ヘスペリジンを1.8〜6.0重量%含有し、ノビレチン/ナリルチンの含有重量比が2.0〜14.0である柑橘類の植物組織抽出物を含有する、学習・記憶障害における記憶の獲得能力の増強またはパーキンソン病におけるドーパミン合成能の促進、ドーパミン含量の上昇もしくはドーパミン分泌の促進のための医薬品であって、
柑橘類がシトラス・レチクラータ・ブランコ(ルタシー)、タチバナまたはオオベニミカンである、医薬品。 - 柑橘類がタチバナまたはオオベニミカンである、請求項1記載の医薬品。
- 記憶の獲得能力の増強のための、請求項1または2のいずれか記載の医薬品。
- ドーパミン合成能の促進、ドーパミン含量の上昇またはドーパミン分泌の促進のための、請求項1または2のいずれか記載の医薬品。
- 柑橘類の植物組織抽出物が柑橘類の乾燥植物組織と医薬的に許容される生薬成分とを1:5〜1:10の重量比率で配合して得られる配合物から水抽出により得られる、請求項1〜4のいずれか記載の医薬品。
- 細粒剤、茶剤、煎剤、カプセル剤、錠剤、顆粒剤、ゼリー剤、散剤、液剤、シロップ剤またはエキス製剤の形態である、請求項1〜5のいずれか記載の医薬品。
- 生薬成分がイレイセン、ウヤク、エンゴサク、オウギ、オウゴン、オウバク、オンジ、カッコウ、カッコン、カンキョウ、カンゾウ、キキョウ、キクカ、キジツ、キョウニン、ケイヒ、コウカ、コウブシ、コウボク、ゴシツ、ゴシュユ、ゴミシ、サイコ、サンシシ、ジオウ、シャクヤク、ショウキョウ、ショウマ、シンキク、セッコウ、センキュウ、ゼンコ、ソウジュツ、ソボク、ソヨウ、ダイオウ、タイソウ、ダイフクヒ、タクシャ、チクジョ、チモ、チョウトウコウ、テンマ、テンモンドウ、トウキ、トウニン、ニンジン、バクガ、バクモンドウ、ハンゲ、ビャクシ、ビャクジュツ、ビンロウジ、ブクリョウ、ボウイ、ボウショウ、ボウフウ、ボタンピ、マオウ、モクツウ、モッコウ、ヤクモソウ、リュウタンおよびワキョウカツからなる群から選択される1以上の生薬成分である、請求項5記載の医薬品。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2012501889A JP5503726B2 (ja) | 2010-02-26 | 2011-02-25 | 学習・記憶障害および運動障害などを伴う中枢神経変性疾患を改善する乾燥植物組織および植物組織抽出物ならびにこれらを含有する医薬品および食品 |
Applications Claiming Priority (8)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2010042819 | 2010-02-26 | ||
| JP2010042819 | 2010-02-26 | ||
| JP2010126717 | 2010-06-02 | ||
| JP2010126717 | 2010-06-02 | ||
| JP2010270578 | 2010-12-03 | ||
| JP2010270578 | 2010-12-03 | ||
| PCT/JP2011/054358 WO2011105568A1 (ja) | 2010-02-26 | 2011-02-25 | 学習・記憶障害および運動障害などを伴う中枢神経変性疾患を改善する乾燥植物組織および植物組織抽出物ならびにこれらを含有する医薬品および食品 |
| JP2012501889A JP5503726B2 (ja) | 2010-02-26 | 2011-02-25 | 学習・記憶障害および運動障害などを伴う中枢神経変性疾患を改善する乾燥植物組織および植物組織抽出物ならびにこれらを含有する医薬品および食品 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014052426A Division JP5906267B2 (ja) | 2010-02-26 | 2014-03-14 | 学習・記憶障害および運動障害などを伴う中枢神経変性疾患を改善する乾燥植物組織および植物組織抽出物ならびにこれらを含有する医薬品および食品 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPWO2011105568A1 JPWO2011105568A1 (ja) | 2013-06-20 |
| JP5503726B2 true JP5503726B2 (ja) | 2014-05-28 |
Family
ID=44506965
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2012501889A Active JP5503726B2 (ja) | 2010-02-26 | 2011-02-25 | 学習・記憶障害および運動障害などを伴う中枢神経変性疾患を改善する乾燥植物組織および植物組織抽出物ならびにこれらを含有する医薬品および食品 |
| JP2014052426A Active JP5906267B2 (ja) | 2010-02-26 | 2014-03-14 | 学習・記憶障害および運動障害などを伴う中枢神経変性疾患を改善する乾燥植物組織および植物組織抽出物ならびにこれらを含有する医薬品および食品 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014052426A Active JP5906267B2 (ja) | 2010-02-26 | 2014-03-14 | 学習・記憶障害および運動障害などを伴う中枢神経変性疾患を改善する乾燥植物組織および植物組織抽出物ならびにこれらを含有する医薬品および食品 |
Country Status (4)
| Country | Link |
|---|---|
| JP (2) | JP5503726B2 (ja) |
| CN (1) | CN102883716B (ja) |
| HK (1) | HK1178792A1 (ja) |
| WO (1) | WO2011105568A1 (ja) |
Families Citing this family (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2013191236A1 (ja) * | 2012-06-21 | 2013-12-27 | 小太郎漢方製薬株式会社 | 中枢神経変性疾患の改善および/または治療用組成物 |
| CN103479743B (zh) * | 2013-01-28 | 2015-07-08 | 钱昌美 | 治疗老年痴呆的药物组合物及其制备方法 |
| JP6179891B2 (ja) * | 2013-05-29 | 2017-08-16 | 要 有持 | 生産方法、加工方法、加工品及び茶 |
| JP2015053939A (ja) * | 2013-09-10 | 2015-03-23 | 久子 松野 | みかんの果皮の加工食品 |
| JP5958658B2 (ja) * | 2014-06-26 | 2016-08-02 | 日本ゼオン株式会社 | 培養細胞内のerkまたはaktのリン酸化亢進方法、細胞の培養方法、およびリン酸化亢進剤 |
| JP2016056149A (ja) * | 2014-09-11 | 2016-04-21 | 日油株式会社 | 皮膚化粧料 |
| JPWO2016075960A1 (ja) * | 2014-11-12 | 2017-08-17 | 株式会社 沖縄リサーチセンター | 排尿障害を予防又は改善させる医薬組成物、排尿障害関連受容体に関する拮抗剤又はその医薬組成物又は拮抗剤を用いた排尿障害を予防又は改善させる方法 |
| JP6238089B1 (ja) * | 2016-06-01 | 2017-11-29 | 株式会社三協ホールディングス | 医薬組成物および食品 |
| JP6898628B2 (ja) * | 2016-06-15 | 2021-07-07 | 国立大学法人広島大学 | 神経変性疾患治療剤 |
| CN107648349A (zh) * | 2017-10-30 | 2018-02-02 | 江西中医药大学 | 代代花在制备改善睡眠障碍或改善记忆力减退或治疗阿尔茨海默病药物或保健食品中的应用 |
| WO2019102602A1 (ja) * | 2017-11-27 | 2019-05-31 | 康 大泉 | スクリーニング方法 |
| KR101894491B1 (ko) * | 2018-04-30 | 2018-09-04 | 주식회사 뉴트라팜텍 | 지각 초임계 추출물을 유효성분으로 함유하는 기억력 또는 인지 기능 개선용 조성물 |
| CN112402409A (zh) * | 2020-12-11 | 2021-02-26 | 江汉大学 | 橘皮素在制备抑制β分泌酶活性药物中的应用 |
| CN115886258A (zh) * | 2022-12-30 | 2023-04-04 | 上海交大昂立股份有限公司 | 一种改善生理性记忆力衰减的复合益生菌组合物 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2002053152A1 (en) * | 2001-01-08 | 2002-07-11 | Imperial College Of Science, Technology & Medicine | Composition containing flavonoids for treatment brain disorders |
| JP2008127325A (ja) * | 2006-11-20 | 2008-06-05 | Tokyoto Koreisha Kenkyu Fukushi Shinko Zaidan | リン酸化mbp産生促進剤 |
-
2011
- 2011-02-25 WO PCT/JP2011/054358 patent/WO2011105568A1/ja active Application Filing
- 2011-02-25 CN CN201180011122.5A patent/CN102883716B/zh active Active
- 2011-02-25 JP JP2012501889A patent/JP5503726B2/ja active Active
-
2013
- 2013-05-16 HK HK13105841.5A patent/HK1178792A1/xx unknown
-
2014
- 2014-03-14 JP JP2014052426A patent/JP5906267B2/ja active Active
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2002053152A1 (en) * | 2001-01-08 | 2002-07-11 | Imperial College Of Science, Technology & Medicine | Composition containing flavonoids for treatment brain disorders |
| JP2008127325A (ja) * | 2006-11-20 | 2008-06-05 | Tokyoto Koreisha Kenkyu Fukushi Shinko Zaidan | リン酸化mbp産生促進剤 |
Non-Patent Citations (10)
| Title |
|---|
| JPN6013056058; 山國徹 他: '臨床に必要な神経薬理・化学 陳皮成分nobiletin の抗アルツハイマー病作用' Clin Neurosci Vol.26,No.11, 2008, Page.1178-1179 * |
| JPN6013056059; 伊藤忠信: '現代社会におけるストレスと漢方の役割 抑肝散加陳皮半夏および柴胡加竜骨牡蛎湯の中枢機能調節に対する作' ProgMed Vol.17,No.4, 1997, Page.823-830 * |
| JPN6013056060; 坂井有美子 他: '独自ブランド創出のための機能性,芳香性に優れたカンキツ新品種の育成 2)機能性成分高含有系統の早期選抜方' 佐賀県果樹試験場業務年報 Vol.2006, 2006, Page.23-24 * |
| JPN6013056061; 前川哲男 他: '地域自生カンキツ「新姫」と「タチバナ」に含まれるフラボノイドの含量' 関東東海北陸農業研究成果情報 Vol.2003,No,2, 2004, pp.46-47 * |
| JPN6013056062; NAGASE Hiroyuki et al: 'Nobiletin and its related flavonoids withCRE-dependent transcription-stimulating and neuritegenicact' Biochem Biophys Res Commun Vol.337,No.4, 2005, age.1330-1336 * |
| JPN6013056063; DATLA Krishna P.et al: 'Short-Term Supplementation with PlantExtracts Rich in Flavonoids Protect Nigrostriatal DopaminergicN' J Am Coll Nutr Vol.26,No.4, 2007, Page.341-349 * |
| JPN6013056064; HWANG Sam-Long et al: 'Neuroprotective Effects of the CitrusFlavanones against H2O2-Induced Cytotoxicity in PC12 Cells' J. Agric Food Chem Vol.56,No.3, 2008, Page.859-864 * |
| JPN6013056065; XU G. H et al: 'Minerals, Phenolic Compounds, and AntioxidantCapacity of Citrus Peel Extract by Hot Water' J Food Sci Vol.73,No.1, 2008, pp.C11-C18 * |
| JPN6013056066; Kawaii,Satoru et al: 'Quantitative Study of Flavonoids in Leaves of Citrus Plants' Journal of Agricultural and Food Chemistry 48(9), 2000, pp.3865-3871 * |
| JPN6013056159; OSAKA Naoya et al: 'Protective effects of the extract fromAURANTII NOBILIS PERICARPIUM on NMDA receptor antagonistMK-801' J Pharmacol Sci Vol.106,No.Supplement 1, 2008, Page.176P * |
Also Published As
| Publication number | Publication date |
|---|---|
| JPWO2011105568A1 (ja) | 2013-06-20 |
| JP2014111664A (ja) | 2014-06-19 |
| WO2011105568A1 (ja) | 2011-09-01 |
| CN102883716B (zh) | 2014-05-07 |
| CN102883716A (zh) | 2013-01-16 |
| JP5906267B2 (ja) | 2016-04-20 |
| HK1178792A1 (en) | 2013-09-19 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5906267B2 (ja) | 学習・記憶障害および運動障害などを伴う中枢神経変性疾患を改善する乾燥植物組織および植物組織抽出物ならびにこれらを含有する医薬品および食品 | |
| EP2214681B1 (en) | Novel nutraceutical compositions containing steviol and uses thereof | |
| JP6033863B2 (ja) | 中枢神経変性疾患の改善および/または治療用組成物 | |
| CN108261547A (zh) | 用于调节代谢途径的组合物和方法 | |
| US20040247715A1 (en) | Water soluble extract from plant of solanum genus and the preparation process thereof, and pharmaceutical composition containing the water soluble extract | |
| US20210128664A1 (en) | Agent for Activating Astrocyte Glucose Metabolism | |
| Fernández et al. | Effect of boldo (Peumus boldus Molina) infusion on lipoperoxidation induced by cisplatin in mice liver | |
| JP2020172491A (ja) | エフェドリンアルカロイド除去麻黄エキスと、その製法及び用途 | |
| US11253566B2 (en) | Composition for ameliorating, or treating depression and anxiety disorder comprising Fraxinus rhynchophylla extract as effective ingredient | |
| Djamil et al. | Nanoemulsion of okra fruit extract as antidiabetic treatment | |
| CN108420890B (zh) | 一种具有降血脂作用的组合物及其制备方法 | |
| ES2883596T3 (es) | Composiciones para el tratamiento de trastornos relacionados con la edad | |
| Nafiu et al. | Ameliorative effect of Lecaniodiscus cupanioides (Sapindaceae) aqueous root extract in loperamide-induced constipated rats | |
| Dimpfel et al. | Zynamite®(Mangifera indica Leaf Extract) and Caffeine Act in a Synergistic Manner on Electrophysiological Parameters of Rat Central Nervous System | |
| DK2845624T3 (en) | Devil's mucoadhesive extracts (harpagophytum procumbens) and their applications | |
| WO2022262372A1 (zh) | 用于升高hdl-c的保健组合物 | |
| KR101509056B1 (ko) | 인삼 복합 생약 추출물, 진세노사이드 Rg2와 진세노사이드 F2를 포함하는 뇌기능 및 인지 기능 개선용 조성물 | |
| CN111246849A (zh) | 学习记忆能力增强组合物 | |
| EP2830641B1 (en) | New valerian extracts and uses thereof | |
| JP2018177748A (ja) | アストロサイトのグルコース代謝活性化剤 | |
| US9662367B2 (en) | Adaptogenic compositions and method for production thereof | |
| Iqbal et al. | Phytochemistry, Laxative, Prokinetic and Spasmolytic Verification of Withania somnifera (L.) Dunal Using In-Vitro, In-Vivo and In-Silico Approaches | |
| WO2017130638A1 (ja) | アストロサイトのグルコース代謝活性化剤 | |
| KR20210039298A (ko) | 석류 유래 세포외 소포체 및 이의 용도 | |
| CN114432309A (zh) | 一种提高烟酰胺磷酸核糖转移酶活性的方法及其组合物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20131112 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20131205 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20131212 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140207 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20140304 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20140314 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5503726 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |