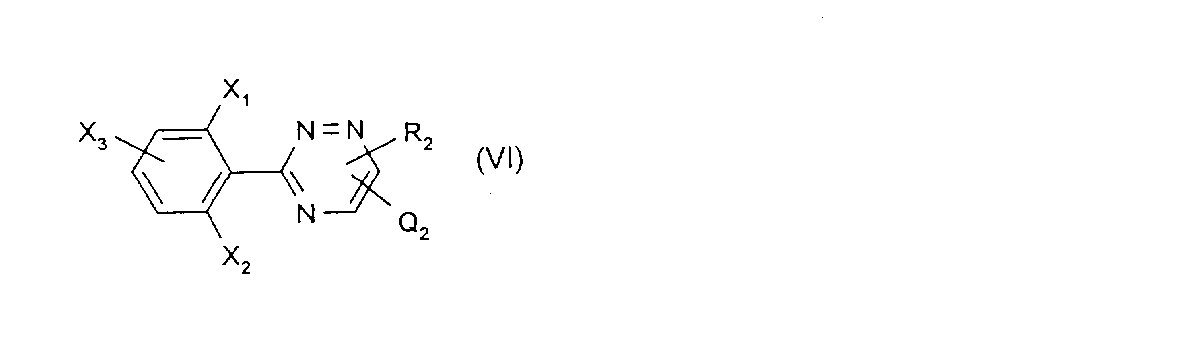JP4782289B2 - 農薬トリアジン誘導体 - Google Patents
農薬トリアジン誘導体 Download PDFInfo
- Publication number
- JP4782289B2 JP4782289B2 JP2000615599A JP2000615599A JP4782289B2 JP 4782289 B2 JP4782289 B2 JP 4782289B2 JP 2000615599 A JP2000615599 A JP 2000615599A JP 2000615599 A JP2000615599 A JP 2000615599A JP 4782289 B2 JP4782289 B2 JP 4782289B2
- Authority
- JP
- Japan
- Prior art keywords
- alkyl
- substituted
- formula
- compound
- halogen
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Classifications
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N57/00—Biocides, pest repellants or attractants, or plant growth regulators containing organic phosphorus compounds
- A01N57/18—Biocides, pest repellants or attractants, or plant growth regulators containing organic phosphorus compounds having phosphorus-to-carbon bonds
- A01N57/22—Biocides, pest repellants or attractants, or plant growth regulators containing organic phosphorus compounds having phosphorus-to-carbon bonds containing aromatic radicals
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N43/00—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds
- A01N43/64—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with three nitrogen atoms as the only ring hetero atoms
- A01N43/707—1,2,3- or 1,2,4-triazines; Hydrogenated 1,2,3- or 1,2,4-triazines
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D253/00—Heterocyclic compounds containing six-membered rings having three nitrogen atoms as the only ring hetero atoms, not provided for by group C07D251/00
- C07D253/02—Heterocyclic compounds containing six-membered rings having three nitrogen atoms as the only ring hetero atoms, not provided for by group C07D251/00 not condensed with other rings
- C07D253/06—1,2,4-Triazines
- C07D253/065—1,2,4-Triazines having three double bonds between ring members or between ring members and non-ring members
- C07D253/07—1,2,4-Triazines having three double bonds between ring members or between ring members and non-ring members with hetero atoms, or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
Landscapes
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Plant Pathology (AREA)
- Engineering & Computer Science (AREA)
- Dentistry (AREA)
- General Health & Medical Sciences (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Environmental Sciences (AREA)
- Pest Control & Pesticides (AREA)
- Agronomy & Crop Science (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
- Plural Heterocyclic Compounds (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Description
本発明は、以下の式:
【0002】
【化3】
【0003】
{式中、
R1 は、非置換又はモノ−〜ペンタ−置換アリール又は複素アリールであり、このアリール及び複素アリール環の置換基は、
OH、ハロゲン、CN,NO2 ,C1 −C6 アルキル、C3 −C8 シクロアルキル、場合により置換されたC3 −C8 シクロアルケニル、C1 −C6 アルキル−C3 −C8 シクロアルキル、C3 −C8 シクロアルキル−C1 −C6 アルキル、C1 −C6 ハロアルキル、C3 −C8 ハロシクロアルキル、C−C6 アルコキシ、C3 −C8 シクロアルコキシ、C1 −C6 ハロアルコキシ、C3 −C8 ハロシクロアルコキシ、C1 −C6 アルキルチオ、C3 −C8 シクロアルキルチオ、C1 −C6 ハロアルキルチオ、C3 −C8 ハロシクロアルキルチオ、C1 −C6 アルキルスルフィニル、C3 −C8 シクロアルキルスルフィニル、C1 −C6 ハロアルキルスルフィニル、C3 −C8 ハロシクロアルキルスルフィニル、C1 −C6 アルキルスルホニル、C3 −C8 シクロアルキルスルホニル、C1 −C6 ハロアルキルスルホニル、C3 −C8 ハロシクロアルキルスルホニル、場合により置換されたC2 −C8 アルケキル、場合により置換されたC2 −C8 アルキニル、C1 −C6 アルキルカルボニル、C1 −C6 アルキル−C(=NOR6 ),−P(=O)(OC1 −C6 アルキル)2 ,R7,
非置換又はモノ−〜ペンタ−置換フェニル、非置換又はモノ−〜ペンタ−置換複素アリール;ここで、上記フェニル及び複素アリール基の置換基は、OH、ハロゲン、CN,NO2 ,C1 −C6 アルキル、場合により置換されたC2 −C8 アルケニル、場合により置換されたC2 −C8 アルキニル、C3 −C8 シクロアルキル、場合により置換されたC3 −C8 シクロアルケニル、C1 −C6 ハロアルキル、C3 −C8 ハロシクロアルキル、C1 −C6 アルコキシ、C3 −C8 シクロアルコキシ、C1 −C6 ハロアルコキシ、C3 −C8 ハロシクロアルコキシ、C1 −C6 アルキルチオ、C3 −C8 シクロアルキルチオ、C1 −C6 ハロアルキルチオ、C3 −C8 ハロシクロアルキルチオ、C1 −C6 アルキルスルフィニル、C3 −C8 シクロアルキルスルフィニル、C1 −C6 ハロアルキルスルフィニル、C3 −C8 ハロシクロアルキルスルフィニル、C1 −C6 アルキルスルホニル、C3 −C8 シクロアルキルスルホニル、C1 −C6 ハロアルキルスルホニル、C3 −C8 ハロシクロアルキルスルホニル、C2 −C8 アルケニルであって非置換又は置換されたもの、C2 −C8 アルキニルであって非置換又は置換されたもの、C1 −C6 アルキルカルボニル、−CH(=NOR6 ),−C(C1 −C6 アルキル)(=NOR6 ),C1 −C6 アルキル−C(=NOR6 ),−CHO,−C(=O)−C1 −C6 アルキル、及びR7 から成る群から選ばれ;
非置換又はモノ−〜ペンタ−置換フェノキシ;
非置換又はモノ−〜ペンタ−置換フェニルチオ;
非置換又はモノ−〜ペンタ−置換フェニルアミノ;及び
非置換又はモノ−〜ペンタ−置換フェニル−(C1 −C6 アルキル)−アミノから成る群から選ばれ;
上記フェノキシ、フェニルチオ、フェニルアミノ、及びフェニル−(C1 −C6 アルキル)−アミノ基は、ハロゲン、CN,NO2 ,C1 −C6 アルキル、C3 −C8 シクロアルキル、C1 −C6 ハロアルキル、C3 −C8 ハロシクロアルキル、C1 −C6 アルコキシ、C1 −C6 ハロアルコキシ、C3 −C8 シクロアルコキシ、C1 −C6 アルキルチオ、C1 −C6 アルキルスルフィニル、C1 −C6 ハロアルキルスルフィニル、C1 −C6 アルキルスルホニル、C1 −C6 ハロアルキルスルホニル、C3 −C8 シクロアルキルチオ、C1 −C6 ハロアルキルチオ、及びC3 −C8 ハロシクロアルキルチオから成る群から選ばれ;
R2 は、H,OH、ハロゲン、CN,NO2 、場合により置換されたC1 −C6 アルキル、C1 −C6 アルコキシ、C1 −C6 アルコキシ−C1 −C6 アルキル、C1 −C6 アルキルチオ、C1 −C6 アルキルチオ−C1 −C6 アルキル、C3 −C8 シクロアルキル、C1 −C6 ハロアルキル、C3 −C8 ハロシクロアルキル、−NH−C1 −C6 −アルキル、SH又はCH2 −NO2 であり;
Aは、単結合、C1 −C12アルキレン、O,O(C1 −C12アルキレン)、S(O)n ,S(O)n (C1 −C12アルキレン)、C2 −C8 アルケニレン、C2 −C8 アルキニレン;NR3 又はNR3 (C1 −C12アルキレン)であり;
R3 は、H,C1 −C6 アルキル、C3 −C8 シクロアルキル、C1 −C6 ハロアルキル、C2 −C8 アルケニル、C2 −C8 アルキニル、アリール−C1 −C6 アルキル、(CH2 )p C(O)R4 又はC1 −C6 アルコキシ−C2 −C6 アルキルであり;
R4 はH,C1 −C6 アルキル、C3 −C8 シクロアルキル、C1 −C6 ハロアルキル、C1 −C6 アルコキシ、N(R5 )2 又はC1 −C6 アルコキシ−C2 −C6 アルキルであり;
R5 は、H,C1 −C6 アルキル、C3 −C8 シクロアルキル、C1 −C6 ハロアルキル又はアリール−C1 −C6 アルキルであり;
R6 は、H,C1 −C6 アルキル、C3 −C8 シクロアルキル又は−C(=O)−R5 であり;
R7 は、
【0004】
【化4】
【0005】
であり;
R8 とR9 は、互いに独立して、H又はC1 −C6 アルキルであり;
X1 は、R10であり;
X2 とX3 は、互いに独立してH又はR10であり;
R10は、ハロゲン、CN,NO2 ,C1 −C6 アルキル、C3 −C8 シクロアルキル、C1 −C6 ハロアルキル、C3 −C8 ハロシクロアルキル、C1 −C6 アルコキシ、C3 −C8 シクロアルコキシ、C1 −C6 ハロアルコキシ、C3 −C8 ハロシクロアルコキシ、C1 −C6 アルキルチオ、C3 −C8 シクロアルキルチオ、C1 −C6 ハロアルキルチオ又はC3 −C8 ハロシクロアルキルチオであり;
mは、1,2,3又は4であり;
nは、0,1又は2であり;そして
wは、0又はSである。
【0006】
但し、上記基A−R1 、およびX1 ,X2 、及びX3 により置換されたフェニル基は、上記トリアジン環上で互いに対してビシナル位にはなく、
さらに但し、X2 とX3 がHであり、Aが単結合であり、R1 がフェニル、2−フルオロフェニル、p−フルオロフェニル又は3−クロロフェニルであり、そしてR2 がH,Cl又はNHC2 −CH5 であるとき、X1 は、CH3 ,Cl又はFではなく;
かつ、3,6−ジ−(2−クロロフェニル)−5−ヒドロキシ−1,2,4−トリアジンではなく、かつ、3−(2−メチルフェニル)−6−(4−メチルフェニル)−5−トリフルオロメチル−1,2,4−トリアジンではない。}により表される化合物、並びに生理学的に許容され、そして農薬として許容されるその付加化合物、及び適宜E/Z異性体、E/Z異性体の混合物、及び互変異性体であって、各場合遊離形態又は塩形態にあるもの;上記化合物の製法及びそれらの使用、各場合において遊離形態又は農薬として許容される塩形態にある上記化合物からその活性成分が選ばれるところの農薬組成物、並びに上記組成物の製法及びそれらの使用に関する。
【0007】
式(I)の化合物であって、式中、R1 が、非置換又はモノ−〜ペンタ−置換アリール又は複素アリールであって、その置換基が、OH、ハロゲン、CN,NO2 ,C1 −C6 アルキル、C3 −C8 シクロアルキル、C1 −C6 アルキル−C3 −C8 シクロアルキル、C3 −C8 シクロアルキル−C1 −C6 アルキル、C1 −C6 ハロアルキル、C3 −C8 ハロシクロアルキル、C−C6 アルコキシ、C3 −C8 シクロアルコキシ、C1 −C6 ハロアルコキシ、C3 −C8 ハロシクロアルコキシ、C1 −C6 アルキルチオ、C3 −C8 シクロアルキルチオ、C1 −C6 ハロアルキルチオ、C3 −C8 ハロシクロアルキルチオ、C1 −C6 アルキルスルフィニル、C3 −C8 シクロアルキルスルフィニル、C1 −C6 ハロアルキルスルフィニル、C3 −C8 ハロシクロアルキルスルフィニル、C1 −C6 アルキルスルホニル、C3 −C8 シクロアルキルスルホニル、C1 −C6 ハロアルキルスルホニル、C3 −C8 ハロシクロアルキルスルホニル、C2 −C8 アルケキル、C2 −C8 アルキニル、C1 −C6 アルキルカルボニル、C1 −C6 アルキル−C(=NOR6 ),R7、から選ばれたもの;非置換又はモノ−〜ペンタ−置換フェニルであってその置換基が、OH、ハロゲン、CN,NO2 ,C1 −C6 アルキル、C3 −C8 シクロアルキル、C1 −C6 ハロアルキル、C3 −C8 ハロシクロアルキル、C1 −C6 アルコキシ、C3 −C8 シクロアルコキシ、C1 −C6 ハロアルコキシ、C3 −C8 ハロシクロアルコキシ、C1 −C6 アルキルチオ、C3 −C8 シクロアルキルチオ、C1 −C6 ハロアルキルチオ、C3 −C8 ハロシクロアルキルチオ、C1 −C6 アルキルスルフィニル、C3 −C8 シクロアルキルスルフィニル、C1 −C6 ハロアルキルスルフィニル、C3 −C8 ハロシクロアルキルスルフィニル、C1 −C6 アルキルスルホニル、C3 −C8 シクロアルキルスルホニル、C1 −C6 ハロアルキルスルホニル、C3 −C8 ハロシクロアルキルスルホニル、C2 −C8 アルケニル、C2 −C8 アルキニル、C1 −C6 アルキルカルボニル、C1 −C6 アルキル−C(=NOR6 )、及びR7から成る群から選ばれたもの;非置換又はモノ−〜ペンタ−置換フェノキシ;非置換又はモノ−〜ペンタ−置換フェニルチオ;非置換又はモノ−〜ペンタ−置換フェニルアミノ;及び非置換又はモノ−〜ペンタ−置換フェニル−(C1 −C6 アルキル)−アミノであってその置換基が、ハロゲン、CN,NO2 ,C1 −C6 アルキル、C3 −C8 シクロアルキル、C1 −C6 ハロアルキル、C3 −C8 ハロシクロアルキル、C1 −C6 アルコキシ、C3 −C8 シクロアルコキシ、C1 −C6 アルキルチオ、C3 −C8 シクロアルキルチオ、C1 −C6 ハロアルキルチオ、及びC3 −C8 ハロシクロアルキルチオから成る群から選ばれるものであり;
R2 が、H、ハロゲン、CN,NO2 、C1 −C6 アルキル、C3 −C8 シクロアルキル、C1 −C6 ハロアルキル、又はC3 −C8 ハロシクロアルキル、であり;
Aが、(CR11R12)p ,O(CR11R12)p ,S(O)n (CR11R12)p 、非置換又は置換C2 −C8 −アルケニレン、非置換又は置換C2 −C8 −アルキニレンであってその置換基が、R11とR12から成る群から選ばれたもの;又はNR3 (CH2 )p であり;
R3 が、H,C1 −C6 アルキル、C3 −C8 シクロアルキル、C1 −C6 ハロアルキル、C2 −C8 アルケニル、C2 −C8 アルキニル、アリール−C1 −C6 アルキル、(CH2 )p C(O)R4 又はC1 −C6 アルコキシ−C2 −C6 アルキルであり;
R4 はH,C1 −C6 アルキル、C3 −C8 シクロアルキル、C1 −C6 ハロアルキル、C1 −C6 アルコキシ、N(R5 )2 又はC1 −C6 アルコキシ−C2 −C6 アルキルであり;
R5 は、H,C1 −C6 アルキル、C3 −C8 シクロアルキル、C1 −C6 −ハロアルキル又はアリール−C1 −C6 アルキルであり;
R6 は、H,C1 −C6 アルキル又はC3 −C8 シクロアルキルであり;
R7 は、
【0008】
【化5】
【0009】
であり;
R8 とR9 は、互いに独立して、H又はC1 −C6 アルキルであり;
X1 は、R10であり;
X2 とX3 は、互いに独立してH又はR10であり;
R10は、ハロゲン、CN,NO2 ,C1 −C6 アルキル、C3 −C8 シクロアルキル、C1 −C6 ハロアルキル、C3 −C8 ハロシクロアルキル、C1 −C6 アルコキシ、C3 −C8 シクロアルコキシ、C1 −C6 ハロアルコキシ、C3 −C8 ハロシクロアルコキシ、C1 −C6 アルキルチオ、C3 −C8 シクロアルキルチオ、C1 −C6 ハロアルキルチオ又はC3 −C8 ハロシクロアルキルチオであり;
R11とR12は、互いに独立してH又はC1 −C6 −アルキルであり;
mは、1,2,3又は4であり;
nは、0,1又は2であり;
pは、0,1,2,3,4,5又は6であり;そして
Qは、0又はSであるものが好ましい。
【0010】
特定の1,2,4−トリアジン誘導体が、家畜動物(domestic animals)及び家畜(productive livestock)上の、及び有用な植物の農作物中の害虫(pests)の防除のための組成物中の活性成分として文献中に提案されている。上記の既知の化合物の生物学的特性は、害虫防除の分野において完全に満足いくものではない。このため、農薬特性を有するさらなる化合物を提供する必要があり、この課題は式(I)の化合物の提供により本発明に従って解決されるのである。
【0011】
式(I)の化合物は少なくとも3つの塩基性中心を含むので、式(I)の化合物は、塩の形態にあることができ、又は例えば、酸付加塩を形成することができる。後者は、例えば、強無機酸、例えば、鉱酸、例えば、硫酸、リン酸又はハロゲン化水素酸、強無機有機カルボン酸、例えば、非置換又は置換、例えば、ハロ置換、C1 −C4 アルカンカルボン酸、例えば、酢酸、飽和又は不飽和ジカルボン酸、例えば、シュウ酸、マロン酸、マレイン酸、フマル酸又はフタル酸、ヒドロキシカルボン酸、例えば、アスコルビン酸、乳酸、リンゴ酸、酒石酸又はクエン酸、又は安息香酸、又は有機スルホン酸、例えば、非置換又は置換、例えば、ハロ置換、C1 −C4 アルカン−又はアリール−スルホン酸、例えば、メタン−又はp−トルエン−スルホン酸と形成される。本明細書の全体にわたり、式(I)の遊離化合物又はそれらの塩への言及は、適宜及び好都合に、それぞれ、その対応の塩又は式(I)の遊離の化合物をも含むと理解されるべきである。遊離形態が好ましい。
【0012】
本明細書中に使用する一般用語は、別段の定めなき場合、以下の意味をもつ。
【0013】
別段の定めなき場合、炭素含有基及び化合物は、各々、1〜6(含む)、好ましくは1〜4(含む)、より特に1又は2の炭素原子を含む。
【0014】
アリールは、フェニル又はナフチルである。
【0015】
複素アリールは、特に、ピリジル、ピリミジル、s−トリアジニル、1,2,4−トリアジニル、チエニル、フラニル、ピリール、ピラゾールイル、イミダゾールイル、チアゾールイル、トリアゾールイル、オキサゾールイル、チアジアゾールイル、オキサジアゾールイル、ベンゾチエニル、ベンゾフラニル、ベンゾチアゾールイル、インドールイル又はインダゾールイルであって好ましくは、炭素原子を介して結合されているものであり;チアゾールイル、ベンゾフラニル、ベンゾチアゾールイル又はインドールイル、特にチアゾールイル又はインドールイルが好ましい。
【0016】
ハロゲンは、−基自体並びに他の基及び化合物、例えば、ハロアルキル、ハロアルコキシ、及びハロアルキルチオの構造要素の両者として−フッ素、塩素、臭素又はヨウ素、特にフッ素、塩素又は臭素、より特にフッ素又は塩素である。
【0017】
アルキルは、−基自体並びに他の基及び化合物、例えば、ハロアルキル、アルコキシ、及びアルキルチオの構造要素の両者として−各場合において、着目の基又は化合物内に含まれる炭素原子の数を十分に考慮して、直鎖、すなわち、メチル、エチル、プロピル、ブチル、ペンチル、ヘキシル、ヘプチル又はオクチル、又は分枝、例えば、イソプロピル、イソブチル、sec−ブチル、tert−ブチル、イソペンチル、ネオペンチル又はイソヘキシルである。
【0018】
シクロアルキルは、−基自体並びに他の基及び化合物、例えば;ハロシクロアルキル、シクロアルコキシ、及びシクロアルキルチオの構造要素の両者として、各場合において、着目の基又は化合物内に含まれる炭素原子の数を十分に考慮して、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル又はシクロオクチルである。
【0019】
アルケニルは、−基自体並びに他の基及び化合物の構造要素の両者として、着目の基又は化合物内に含まれる炭素原子及び共役1又は孤立した2重結合の数を十分に考慮して、直鎖、例えば、アリル、2−ブテニル、3−ペンテニル、1−ヘキセニル、1−ヘプテニル、1,3−ヘキサジエニル又は1,3−オクタジエニル、又は分枝、例えば、イソプロペニル、イソブテニル、イソプレニル、tert−ペンテニル、イソヘキセニル、イソヘプテニル又はイソオクテニルである。
【0020】
アルキニルは、−基自体並びに他の基及び化合物の構造要素の両者として、各場合において、着目の基又は化合物内に含まれる炭素原子、及び共役し又は孤立した2重結合の数を十分に考慮して、直鎖、例えば、プロパルギル、2−ブチニル、3−ペンチニル、1−ヘキシニル、1−ヘプチニル、3−ヘキセン−1−イニルは1,5−ペプタジエン−3−イニル、あるいは分枝、例えば、3−メチルブチ−1−イニル、4−エチルペンチ−1−イニル、4−メチル−ヘキシ−2−イニル又は2−メチルペチ−3−イニルである。
【0021】
アルキレン、アルケニレン、及びアルキニレンは、直鎖又は分枝橋員、特に、−CH2 −,−CH2 −CH2 −,−CH(CH3 )−,−CH(CH3 )CH2 −,−CH(CH3 )CH2 −CH2 −,−CH2 C(CH3 )2 −CH2 −,−CH=CH−,−CH2 −CH=CH−,−CH2 −CH=CH−CH2 −;−C≡C−、及び−CH2 C≡C−;より特に−CH2 −である。
【0022】
ハロ置換炭素含有基及び化合物、例えば、ハロアルキル、ハロアルコキシ、及びハロアルキルチオは、部分的にハロゲン化又はパーハロゲン化されることができ、ポリハロゲン化の場合のハロゲン置換基は同一であっても相違していてもよい。ハロアルキルの例は、−基自体並びに他の基及び化合物、例えば、ハロアルコキシ及びハロアルキルチオの構造要素の両者として、1〜3回、フッ素、塩素及び/又は臭素により置換されたメチル、例えば、CHF2 又はCF3 ;1〜5回、フッ素、塩素及び/又は臭素により置換されたエチル、例えば、CH2 CF3 ,CF2 CF3 ,CF2 CCl3 ,CF2 CHCl2 ,CF2 CHF2 ,CF2 CFCl2 ,CF2 CHBr2 ,CF2 CHClF,CF2 CHBrF又はCClFCHClF;1〜7回、フッ素、塩素及び/又は臭素により置換されたプロピル又はイソプロピル、例えば、CH2 CHBrCH2 Br,CF2 CHFCF3 ,CH2 CF2 CF3 又はCH(CF3 )2 ;1〜9回、フッ素、塩素及び/又は臭素により置換されたブチル又はその異性体、例えば、CF(CF3 )CHFCF3 又はCH2 (CF2 )2 CF3 ;1〜11回、フッ素、塩素及び/又は臭素により置換されたペンチル又はその異性体、例えば、CF(CF3 )(CHF)2 CF3 又はCH2 (CF2 )3 CF3 ;そして1〜13回、フッ素、塩素及び/又は臭素により置換されたヘキシル又はその異性体、例えば、(CH2 )4 CHBrCH2 Br,CF2 (CHF)4 CF3 ,CH2 (CF2 )4 CF3 又はC(CF3 )2 (CHF)2 CF3 である。
【0023】
場合により置換された基、例えば、C2 −C8 アルケニル、C2 −C8 アルキニル、C3 −C8 シクロアルケニル又はC1 −C6 アルキルは、好ましくは、OH,CN、ニトロ、ハロゲン、C1 −C6 −アルコキシ、C1 −C6 −ハロアルコキシ、C1 −C6 −アルキルチオ、C1 −C6 −ハロアルキルチオ、C1 −C6 −アルキルスルフィニル、C1 −C6 −ハロアルキルスルフィニル、C1 −C6 −アルキルスルホニル、C1 −C6 −ハロアルキルスルホニル、フェニル、ハロゲンフェニル、フェノキシ、NHR3 ,−C(=O)NH2 ,−C(=O)O−C1 −C6 −アルキル、及び−C(=O)−C1 −C6 −アルキルである。
【0024】
上述の但書を考慮して、本発明の範囲内の好ましい態様は、式中、
(1)R1 は、非置換又はモノ−〜トリ−置換アリール又は複素アリール環であり、その置換基は、OH、ハロゲン、CN,NO2 ,C1 −C4 アルキル、C3 −C6 シクロアルキル、場合により置換されたC5 −C6 シクロアルケニル、C1 −C4 ハロアルキル、C1 −C4 アルコキシ、C1 −C4 ハロアルコキシ、C1 −C4 アルキルチオ、C1 −C4 ハロアルキルチオ、C1 −C4 アルキルスルホニル、C1 −C4 ハロアルキルスルホニル、場合により置換されたC2 −C6 アルケニル、場合により置換されたC2 −C6 アルキニル、C1 −C4 アルキルカルボニル、非置換又はモノ−〜ペンタ−置換フェニルから成る群から選ばれ、その置換基は、OH、ハロゲン、CN,NO2 ,C1 −C4 アルキル、C3 −C6 シクロアルキル、C1 −C4 ハロアルキル、C1 −C4 アルコキシ、C1 −C4 ハロアルコキシ、C1 −C4 アルキルチオ、C1 −C4 ハロアルキルチオ、C1 −C4 アルキルスルホニル、C1 −C4 ハロアルキルスルホニル、C2 −C6 アルケニル、C2 −C6 アルキニル、及びC1 −C4 アルキルカルボニル、及び非置換又はモノ−〜ペンタ−置換フェノキシ又は非置換又はモノ−〜ペンタ−置換フェニルアミノから成る群から選ばれ、上記フェノキシ−及びフェニルアミノ基の置換基は、ハロゲン、CN,NO2 ,C1 −C4 アルキル、C3 −C6 シクロアルキル、C1 −C4 ハロアルキル、C1 −C4 アルコキシ、C1 −C4 ハロ−アルコキシ、C1 −C4 アルキルチオ、C1 −C4 アルキルスルフィニル、C1 −C4 アルキルスルホニル、C1 −C4 ハロアルキルスルフィニル、C1 −C4 ハロアルキルスルホニル、及びC1 −C4 ハロアルキルチオから成る群から選ばれ;
特にモノ−又はジ−置換フェニルであり、その置換基は、ハロゲン、CN,NO2 ,C1 −C2 アルキル、C1 −C2 ハロアルキル、C1 −C2 アルコキシ、C1 −C2 ハロアルコキシ、非置換又はモノ−又はジ−置換フェニル、上記フェニルの置換基はハロゲン、C1 −C2 アルキル、C1 −C2 ハロアルキル、C1 −C2 アルコキシ、C1 −C2 ハロアルコキシ、C1 −C2 アルキルチオ及びC1 −C2 ハロアルキルチオから成る群から選ばれ;及びフェノキシから成る群から選ばれ;
より特に、モノ−又はジ−置換フェニルであり、その置換基は、ハロゲン、メチル、ハロメチル、メトキシ、ハロメトキシ、非置換又はモノ−又はジ−置換フェニル、その置換基はハロゲン、メチル、ハロメチル、メトキシ、ハロメトキシ、メチルチオ及びハロメチルチオから成る群から選ばれ;及びフェノキシから成る群から選ばれ;
特にR1 は、フェニル環であり、これは、モノ−又はジ−置換フェニルであって好ましくはその4位にあるものによりモノ置換されており、上述のフェニル基の置換基は、ハロゲン、メチル、トリフルオロメチル、メトキシ、トリフルオロメトキシ、メチルチオ、及びトリフルオロメチルチオから成る群から選ばれ;
(2)R2 は、H、ハロゲン又はC1 −C4 アルキル、特にH又はC1 −C4 アルキル、より特にHであり;
(3)式(I)の化合物であって、式中、
Aが単結合、C1 −C4 アルキレン、O,OCH2 ,C2 −C4 アルケニレン、C2 −C4 アルキニレン又はNR3 、特に単結合、O,OCH2 ,C≡C,CH=CH又はNH、より特に単結合であり;
(4)R3 は、H,C1 −C6 アルキル又はC1 −C6 ハロアルキル、特にH又はC1 −C6 アルキル、より特にH又はC1 −C2 アルキル、特にHであり;
(5)X1 は、ハロゲン、C1 −C4 アルキル、C3 −C6 シクロアルキル、C1 −C4 ハロアルキル、C1 −C4 アルコキシ、C1 −C4 ハロアルコキシ、C1 −C4 アルキルチオ又はC1 −C4 ハロアルキルチオ;特にハロゲン、C1 −C2 アルキル、C1 −C2 ハロアルキル、C1 −C2 アルコキシ又はC1 −C2 ハロアルコキシ;より特にフッ素、塩素、メチル、トリフルオロメチル又はメトキシ、特にフッ素又は塩素、より特にフッ素であり;
(6)X2 は、H、ハロゲン、C1 −C4 アルキル、C3 −C6 シクロアルキル、C1 −C4 ハロアルキル、C1 −C4 アルコキシ、C1 −C4 ハロアルコキシ、C1 −C4 アルキルチオ又はC1 −C4 ハロアルキルチオ;特にH、ハロゲン、C1 −C2 アルキル、C1 −C2 ハロアルキル、C1 −C2 アルコキシ又はC1 −C2 ハロアルコキシ;より特にフッ素、塩素、メチル、トリフルオロメチル又はメトキシ、特にフッ素又は塩素、より特にフッ素であり;
(7)X3 は、H、ハロゲン、C1 −C4 アルキル、C3 −C6 シクロアルキル、C1 −C4 ハロアルキル、C1 −C4 アルコキシ、C1 −C4 ハロアルコキシ、C1 −C4 アルキルチオ又はC1 −C4 ハロアルキルチオ;特にH、ハロゲン、C1 −C2 アルキル、C1 −C2 ハロアルキル、C1 −C2 アルコキシ又はC1 −C2 ハロアルコキシ;より特にフッ素、塩素、メチル、トリフルオロメチル又はメトキシ、特にH、フッ素又は塩素、好ましくはHであり;
(8)X1 ,X2 ,及びX3 により置換されたフェニル基は、上記トリアジン環上の3位にあり;
(9)R1 は、非置換又はモノ−〜トリ−置換アリール又は複素アリール環であり、その置換基は、OH、ハロゲン、CN,NO2 ,C1 −C4 アルキル、C3 −C6 シクロアルキル、場合により置換されたC5 −C6 シクロアルケニル、C1 −C4 ハロアルキル、C1 −C4 アルコキシ、C1 −C4 ハロアルコキシ、C1 −C4 アルキルチオ、C1 −C4 ハロアルキルチオ、C1 −C4 アルキルスルホニル、C1 −C4 ハロアルキル−スルホニル、場合により置換されたC2 −C6 アルケニル、場合により置換されたC2 −C6 アルキニル、C1 −C4 アルキル−カルボニル、非置換又はモノ−〜ペンタ−置換フェニル、この置換基は、OH、ハロゲン、CN,NO2 ,C1 −C4 アルキル、C3 −C6 シクロアルキル、C1 −C4 ハロアルキル、C1 −C4 アルコキシ、C1 −C4 ハロアルコキシ、C1 −C4 アルキルチオ、C1 −C4 ハロアルキルチオ、C1 −C4 アルキル−スルホニル、C1 −C4 ハロアルキルスルホニル、C2 −C6 アルケニル、C2 −C6 アルキニル、及びC1 −C4 アルキルカルボニルから成る群から選ばれ、非置換又はモノ−〜ペンタ−置換フェノキシ、及び非置換又はモノ−〜ペンタ−置換フェニルアミノから成る群から選ばれ、その置換基は、ハロゲン、CN,NO2 ,C1 −C4 アルキル、C3 −C6 シクロアルキル、C1 −C4 ハロアルキル、C1 −C4 アルコキシ、C1 −C4 ハロアルコキシ、C1 −C4 アルキルチオ、C1 −C4 ハロアルキルチオ、C1 −C4 アルキルスルホニル、及びC1 −C4 ハロアルキルスルホニルから成る群から選ばれ;
R2 は、H、ハロゲン又はC1 −C4 アルキルであり;
Aは、単結合、C1 −C6 アルキレン、O(C1 −C6 アルキレン)、C2 −C4 アルケニレン、C2 −C4 アルキニレン又はNR3 であり;
R3 は、H,C1 −C6 アルキル又はC1 −C6 ハロアルキルであり;
X1 は、ハロゲン、C1 −C4 アルキル、C3 −C6 シクロアルキル、C1 −C4 ハロアルキル、C1 −C4 アルコキシ、C1 −C4 ハロアルコキシ、C1 −C4 アルキルチオ又はC1 −C4 ハロアルキルチオであり;
X2 とX3 は、互いに独立して、H、ハロゲン、C1 −C4 アルキル、C3 −C6 シクロアルキル、C1 −C4 ハロアルキル、C1 −C4 アルコキシ、C1 −C4 ハロアルコキシ、C1 −C4 アルキルチオ又はC1 −C4 ハロアルキルチオであり;そしてX1 ,X2 、及びX3 により置換されたフェニル基は、上記トリアジン環上の3位にあり;
(11)R1 は、モノ−又はジ−置換フェニルであり、その置換基は、ハロゲン、CN,NO2 ,C1 −C2 アルキル、C1 −C2 ハロアルキル、C1 −C2 アルコキシ、C1 −C2 ハロアルコキシ、非置換又はモノ−又はジ−置換フェニル、その置換基はハロゲン、C1 −C2 アルキル、C1 −C2 ハロアルキル、C1 −C2 アルコキシ、C1 −C2 ハロアルコキシ、C1 −C2 アルキルチオ、及びC1 −C2 ハロアルキルチオから成る群から選ばれ、及びフェノキシから成る群から選ばれ;
R2 は、H又はC1 −C4 アルキルであり;
Aは、単結合、O,OCH2 ,C≡C,CH=CH又はNHであり;
X1 は、ハロゲン、C1 −C2 アルキル、C1 −C2 ハロアルキル、C1 −C2 アルコキシ又はC1 −C2 ハロアルコキシであり;
X2 とX3 は、互いに独立して、H、ハロゲン、C1 −C2 アルキル、C1 −C2 ハロアルキル、C1 −C2 アルコキシ又はC1 −C2 ハロアルコキシであり;そしてX1 ,X2 、及びX3 により置換されたフェニル基は、上記トリアジン環上3位にあり;
(12)R1 は、モノ−又はジ−置換フェニル、その置換基は、ハロゲン、メチル、ハロメチル、メトキシ、ハロメトキシ、非置換又はモノ−又はジ−置換フェニル、その置換基はハロゲン、メチル、ハロメチル、メトキシ、ハロメトキシ、メチルチオ及びハロメチルチオから成る群から選ばれ;及びフェノキシから成る群から選ばれ;
R2 はHであり;
Aは、単結合であり;
X1 は、フッ素、塩素、メチル、トリフルオロメチル又はメトキシであり;
X2 とX3 は互いに独立して、H、フッ素、塩素、メチル、トリフルオロメチル又はメトキシであり;そして
X1 ,X2 、及びX3 により置換されたフェニル基は、上記トリアジン環上の3位にあり;
各場合において、その生理学的に許容される付加化合物を含み、
(13)式中、基A−R1 は、上記トリアジン環上の6位にある、
である式(I)の化合物である。
【0025】
本発明の範囲内では、表1〜6中に列記した式(I)の化合物が特に好ましく、そして合成実施例中に言及する式(I)の化合物がより特に好ましい。
【0026】
本発明は、各場合において、遊離形態又は塩形態にある、式(I)の化合物の製法であって、例えば、
a)式中、Aが単結合であり、そしてX1 ,X2 、及びX3 により置換されたフェニル基が上記トリアジン環上の6位にあるところの式(I)の化合物の製造のために、以下の式:
【0027】
【化6】
【0028】
{知られており、又は対応の知られた化合物と同様にして製造されることができ、そして式中、X1 ,X2 ,X3 、及びR2 は、式(I)のために定義したものと同じであり、そしてQは脱離基である。}により表される化合物を、2当量の以下の式:
【0029】
【化7】
【0030】
{知られており、又は対応の知られた化合物と同様にして製造されることができ、そして式中、R1 は、式(I)のために定義したものと同じである。}により表される化合物と、接合により触媒、好ましくは酢酸銀の存在下で、反応させ、又は
b)式中、Aが単結合であり、そしてX1 ,X2 、及びX3 により置換されたフェニル基が上記トリアジン環上の3位にあるところの式(I)の化合物の製造のために、2当量の以下の式:
【0031】
【化8】
【0032】
{知られており、又は対応の知られた化合物と同様にして製造されることができ、そして式中、X1 ,X2 、及びX3 は式(I)のために定義したものと同じである。}により表される化合物を、1当量の以下の式:
【0033】
【化9】
【0034】
{知られており、又は対応の知られた化合物と同様にして製造されることができ、そして式中、R1 とR2 は、式(I)のために定義したものと同じであり、そしてQ1 は脱離基である。}により表される化合物と、場合により触媒、好ましくは酢酸銀の存在下で反応させ、又は
c)式中、Aが単結合を除き、式(I)のために定義した意味をもつところの式(I)の化合物の製造のために、以下の式:
【0035】
【化10】
【0036】
{知られており、又は対応の知られた化合物と同様にして製造されることができ、そして式中、X1 ,X2 ,X3 、及びR2 は、式(I)のために定義したものと同じであり、そしてQ2 は脱離基である。}により表される化合物を、以下の式:
R1 −A−M (VII)
{知られており、又は対応の知られた化合物と同様にして製造されることができ、そして式中、R1 は、式(I)のために定義したものと同じであり、そしてAは、S(O),S(O)(C1 −C12アルキレン)、S(O)2 、及びS(O)2 (C1 −C12アルキレン)を除き、式(I)のために定義した意味をもち、そしてMは、水素、遷移金属又はアルカリ金属である。}により表される化合物と反応させ、そしてAがS又はS(C1 −C12アルキレン)であるとき、所望により、式中、AがS(O),S(O)(C1 −C12アルキレン)、S(O)2 、又はS(O)2 (C1 −C12アルキレン)であるところの式(I)の化合物の製造のために、場合により中間体単離後に、上記の得られた生成物を酸化し、又は
d)式中、Aが単結合であるところの式(I)の化合物の製造のために、以下の式:
【0037】
【化11】
【0038】
{知られており、又は対応の知られた化合物と同様にして製造されることができ、そして式中、X1 ,X2 ,X3 、及びR2 が式(I)のために定義したものと同じである。}により表される化合物を、酸化剤を用いて酸化し、そして得られた生成物を、場合により中間体単離後に、式(III)の化合物と反応させ、そして得られた生成物を、場合により中間体単離後に、アンモニウム塩、好ましくは酢酸アンモニウムと反応させ、又は
e)式中、X1 ,X2 、及びX3 により置換されたフェニル基が上記トリアジン環上の3位にあるところの式(I)の化合物の製造のために、以下の式:
【0039】
【化12】
【0040】
{知られており、又は対応の知られた化合物と同様にして製造されることができ、そして式中、R1 とR2 は式(I)のために定義したものと同じであり、そしてQ3 はO又はNOHである。}により表される化合物を、以下の式:
【0041】
【化13】
【0042】
{知られており、又は対応の知られた化合物と同様にして製造されることができ、そして式中、X1 ,X2 、及びX3 は式(I)のために定義したものと同じであり、そしてQ4 は、H又は除去されることができる保護基である。}により表される、遊離形態又は塩形態における化合物と反応させ、又は、
f)式中、AがC1 −C12アルキレン、C2 −C8 アルケニレン又はC2 −C8 アルキニレンであるところの式(I)の化合物の製造のために、知られており又は対応の知られた化合物と同様にして製造されることができ、そして式中、X1 ,X2 ,X3 、及びR2 が式(I)のために定義したものと同じであり、そしてQ2 は、C1 −C6 アルキル、好ましくはメチルであるところの式(IV)の化合物を、以下の式:
R1 −C1 −C10アルキル−CHO (XI)
{知られており、又は対応の知られた化合物と同様にして製造されることができ、そして式中、R1 が式(I)のために定義されたものと同じである。}により表される化合物と、場合により、強塩基触媒、好ましくはリチウム・ジエチルアミド又はブチルリチウムの存在下で、反応させ、そして得られた生成物を、場合により中間体単離後に、場合により強酸の存在下で、反応させ、そして所望により、式中、AがC1 −C12アルキレンであるところの式(I)の化合物の製造のために、水素化触媒の存在下で水素化を実施し、又は式中、AがC2 −C8 アルキニレンであるところの式(I)の化合物の製造のために、ハロゲンとの、そしてその後に、強塩基、好ましくはNaOHとの反応を行い;又は
g)式中、置換基Xにより置換されたフェニル環がその3位にあり、そしてAR1 が6位にあるところの式(I)の化合物の製造のために、以下の式:
【0043】
【化14】
【0044】
{知られており、又は対応の知られた化合物と同様にして製造されることができ、そして式中、X1 ,X2 、及びX3 が式(I)のために定義したものと同じであり、そしてWが、O又はSである。}により表される化合物、又はその塩を、以下の式:
【0045】
【化15】
【0046】
{知られており、又は対応の知られた化合物と同様にして製造されることができ、そして式中、A,R1 、及びR2 が式(I)のために定義したものと同じである。}により表される化合物と反応させ;
そして各場合において、所望により、式(I)の化合物であって、各場合において遊離形態又は塩形態にあり、上記方法に従って又は他の方法により得られうるものを、異なる式(I)の化合物に変換し、上記方法に従って得られうる異性体混合物に分割し、そして所望の異性体を単離し、そして/又は上記方法に従って得られうる遊離の式(I)の化合物を塩に変換し、又は上記方法に従って得られうる式(I)の化合物の塩をその遊離の式(I)の化合物又は異なる塩に変換する、
ことを含む前記方法にも関する。
【0047】
式(I)の化合物の塩に関して先に行った言及は、本明細書の全体にわたり言及する出発材料と同様に、それらの塩に関しても適用される。
【0048】
個々の反応ステップにおいては、上記反応体は、そのまますなわち、溶媒又は希釈剤を添加せずに、その溶融状態で、互いに反応することができる。しかしながら、一時的には、不活性溶媒又は希釈剤又はその混合物を添加することが有利である。
【0049】
変法a):
溶媒及び希釈剤の例は:芳香族、脂肪族、及び脂環式炭化水素及びハロゲン化炭化水素、例えば、ベンゼン、トルエン、キシレン、メシチレン、テトラリン(Tetralin)、クロロベンゼン、ジクロロベンゼン、ブロモベンゼン、石油エーテル、ヘキサン、シクロヘキサン、ジクロロメタン、トリクロロメタン、テトラクロロメタン、ジクロロエタン、トリクロロエテン、及びテトラクロロエテン;エーテル、例えば、ジエチル・エーテル、ジプロピル・エーテル、ジイソプロピル・エーテル、ジブチル・エーテル、tert−ブチル・メチル・エーテル、エチレン・グリコール・モノメチル・エーテル、エチレン・グリコール・モノエチル・エーテル、エチレン・グリコール・ジメチル・エーテル、ジメトキシジエチル・エーテル、テトラヒドロフラン、及びジオキサン;ケトン、例えば、アセトン、メチル・エチル・ケトン、及びメチル・イソブチル・ケトン;アルコール、例えば、メタノール、エタノール、プロパノール、イソプロパノール、ブタノール、エチレン・グリコール、及びグリセロール;アミド、例えば、N,N−ジメチルホルムアミド、N,N−ジエチルホルムアミド、N,N−ジメチルアセトアミド、N−メチル−ピロリドン、及びヘキサメチルリン酸トリアミド;ニトリル、例えば、アセトニトリル、及びプロピオニトリル;及びスルホキシド、例えば、ジメチル・スルホキシドを含む。
【0050】
好ましい遊離基は、ハロゲン、トシレート、メシレート、及びトリフレート、特にハロゲン、より特に塩素である。
【0051】
反応は、有利には、約0℃〜約+150℃の、好ましくは約20℃〜約+100℃の温度範囲内で行われる。
【0052】
変法a)の好ましい態様においては、式(II)の化合物を、約50℃〜約100℃、好ましくは約85℃において、エーテル、好ましくはエチレン・グリコール・ジメチル・エーテル中、触媒、好ましくは酢酸銀の存在下で、式(III)の化合物と反応させる。
【0053】
変法b):
溶媒及び希釈剤の例は、変法a)の下で与えられる。
【0054】
好ましい遊離基は、ハロゲン、トシレート、メシレート、及びトリフレート、特にハロゲン、より特に塩素である。
【0055】
反応は、有利には、約0℃〜約+150℃の、好ましくは約20℃〜約+100℃の温度範囲内で行われる。
【0056】
変法b)の好ましい態様においては、式(IV)の化合物を、約50℃〜約100℃、好ましくは約85℃において、エーテル、好ましくはエチレン・グリコール・ジメチル・エーテル中で、触媒、好ましくは酢酸銀の存在下で、式(V)の化合物と反応させる。
【0057】
変法c):
溶媒及び希釈剤の例は、変法a)の下に与えられる。
【0058】
好ましい遊離基は、OH、ハロゲン、トシレート、メシレート、及びトリフレート、特にハロゲン、より特に臭素及び塩素である。
【0059】
反応は、有利には、約0℃〜約+150℃の、好ましくは約20℃〜約+100℃の温度範囲内で行われる。
【0060】
変法c)の好ましい態様においては、式(IV)の化合物を、約0℃〜約100℃の、好ましくは約20℃において、不活性溶媒中、場合により、触媒としての塩基の存在下で、式(VII)の化合物と反応させる。
【0061】
変法d):
溶媒及び希釈剤の例は、変法a)の下に与えられる。
【0062】
好ましい酸化剤は、ハロゲン、より特に臭素である。
【0063】
反応を、有利には、約0℃〜約+120℃の、好ましくは約0℃〜約+80℃の温度範囲内で行う。
【0064】
変法d)の好ましい態様においては、式(VIII)の化合物を、約0℃〜約100℃、好ましくは約80℃において、極性溶媒、好ましくはDMSO/水中で、臭素を用いて酸化し、そして次に、得られたジケト化合物の中間体単離の後、約0℃〜約60℃、好ましくは約20℃において、極性溶媒、好ましくはアルコール中、式(III)の化合物と反応させ、そして次に、好ましくは中間体を単離せずに、約0℃〜約120℃、好ましくは約100℃で、極性溶媒、好ましくは氷酢酸中、酢酸アンモニウムを反応させる。
【0065】
変法e):
溶媒及び希釈剤の例は、変法a)の下に与えられる。
【0066】
好ましい保護基は、C1 −C6 アルコキシカルボニルである。
【0067】
反応を、有利には、約0℃〜約+150℃、好ましくは約0℃〜約+120℃の温度範囲内で、行う。
【0068】
変法e)の好ましい態様においては、式(IX)の化合物を、約0℃〜約100℃、好ましくは約20℃において、アルコール、好ましくはエタノール又はエタノール/水混合物中、場合により酸触媒、好ましくはギ酸の存在下、式(X)の化合物と反応させる。
【0069】
変法f):
溶媒及び希釈剤の例は、変法a)の下に与えられる。
【0070】
反応を、約−80℃〜約+150℃、好ましくは約0℃〜約+110℃の温度範囲内で、有利には、行う。
【0071】
変法f)の好ましい態様においては、式中、Q2 がメチルである化合物を、−80℃〜約0℃、好ましくは約−70℃において、非極性溶媒、好ましくはテトラヒドロフラン中、強塩基、好ましくは、n−ブチルリチウムの存在下、式(XI)のアルデヒドと反応させ、そして次に、好ましくは、中間体単離の後、約80℃〜約150℃、好ましくは上記溶媒の沸点において、非極性溶媒、好ましくはトルエン中で、強酸、好ましくはトルエンスルホン酸と反応させる。
【0072】
変法g):
溶媒及び希釈剤の例は変法a)の下に与えられ;アルコール、例えば、メタノール、エタノール、及びn−プロパノール、そしてまた、アミド、例えば、ジメチルホルムアミド及びジメチルアセトアミドが特に好適である。
【0073】
反応を、有利には、約室温〜使用する溶媒の沸点、好ましくは約60℃〜約+100℃の温度範囲内で、行う。
【0074】
変法g)の好ましい態様においては、式中、WがSである式(XII)の化合物を、約25℃〜約100℃、好ましくは約100℃において、アルコール、好ましくは、n−プロパノール中で、式(XIII)の化合物と反応させる。
【0075】
式(I)の化合物の塩は、それ自体知られたやり方で調製されることができる。例えば、式(I)の化合物の酸付加塩は、好適な酸又は好適なイオン交換試薬による処理により得られ、そして好適な塩基又は好適なイオン交換試薬による処理による塩基との塩である。
【0076】
式(I)の化合物の塩は、慣用のやり方で遊離の式(I)の化合物に変換されることができ;これらは、例えば、好適な塩基剤又は好適なイオン交換試薬による処理による、酸付加塩、及び例えば、好適な酸又は好適なイオン交換試薬による処理による塩基との塩である。
【0077】
式(I)の化合物の塩は、それ自体知られたやり方で、式(I)の化合物の他の塩に変換されることができ;酸付加塩は、例えば、形成する無機塩、例えば塩化銀がその中で不溶であり、そしてそれ故反応混合物から析出するところの好適な溶媒中での、酸の好適な金属塩、例えばナトリウム、バリウム又は銀塩による、例えば酢酸銀による、無機酸の塩、例えば、塩化水素塩の処理により、他の酸付加塩に変換されることができる。
【0078】
その手順及び反応条件に依存して、塩形成特性をもつ式(I)の化合物は、遊離形態又は塩形態において得られうる。
【0079】
式(I)の化合物は、溶媒和物、特にそれらの水和物の形態でも得られる。
【0080】
本発明は、出発化合物又はその方法のいずれかの段階における中間体として得られうる化合物を出発材料として使用し、そして残りのステップの全部又は一部を行い、又は出発材料を誘導体又は塩の形態で使用し、又は特にその反応条件下で形成させるような全ての方法に関する。
【0081】
本発明の方法においては、特に価値のあるものとして最初に述べた式(I)の化合物をもたらす出発材料及び中間体を使用することが好ましい。
【0082】
本発明は、特に製造実施例中に記載する方法に関する。
【0083】
本発明は、式(I)の化合物及びそれらの塩の製造のために本発明に従って使用される、各場合において、遊離形態又は塩形態における新規出発材料及び中間体、それらの使用、並びにそれらの製造方法にも関する。
【0084】
害虫防除の領域においては、本発明に係る式(I)の化合物は、低い割合の濃度においてさえ、ひじょうに有利な殺生物性スペクトルをもつ貴重な予防及び/又は治療活性を示すが、同時に温血動物、魚、及び植物により十分に許容される活性成分である。本発明に係る活性成分は、正常な感受性の動物害虫の全ての又は個々の発達段階に対して有効であるが、耐性の動物害虫、例えば、ダニ(Acarina)目の昆虫、及びそれを代表するものの全ての又は個々の発達段階に対しても有効である。本発明に係る活性成分の殺虫、殺卵、及び/又は殺ダニ作用は、それ自体直接的に、すなわち、直ちに又はある時機の後に、例えば、脱皮(moulting)の間に生じるそれら害虫の、又はそれらの卵の死亡率において、又は間接的に、例えば、低下した産卵、及び/又は孵化率において顕示され、良好な活性は、少なくとも50〜60%死亡率に対応する。
【0085】
上記動物害虫は、例えば、ヨーロッパ特許出願EP−A−736252中に言及されたものを含む。従って上記明細書中に列記する害虫は、本発明の主題に引用により含まれ;
ダニ目の代表例は、特に、
アカラス・シロ(Acarus siro)、アセリア・シェルドニ(Aceria sheldoni)、アキュラス・シュレヒテンダリ(Aculus schlechtendali)、アンブリオンマ種(Amblyomma spp.)、アグラス種(Agras spp.)、ブーフィラス種(Boophilus spp.)、ブレビパルパス種(Brevipalpus spp.)、ブリオビア・プラエティオサ(Bryobia praetiosa)、カリピトリメラス種(Calipitrimerus spp.)、コリオプテス種(Chorioptes)種、デルマニサス・ガリナエ(Dermanyssus gallinae)、エオテトラニカス・カルピニ(Eotetranychus carpini)、エリオフィエス種(Eriophyes spp.)、ヒアロンマ種(Hyalomma spp.)、イクソデス種(Ixodes spp.)、オリゴニカス・プラテンシス(Olygonychus pratensis)、オルニソドロス種(Ornithodoros spp.)、パノニカス種(Panonychus spp.)、フィロコプトルタ・オレイボラ(Phyllocoptruta oleivora)、ポリファゴタルソネムス・ラタス(Polyphagotarsonemus latus)、プソロプテス種(Psoroptes spp.)、リピセファラス種(Rhipicephalus spp.)、リゾグリファス種(Rhizoglyphus spp.)、サルコプテス種(Sarcoptes spp.)、タルソネムス種(Tarsonemus spp.)、及びテトラニクス種(Tetranychus spp.)である。
【0086】
本発明に係る化合物は、農業、園芸、及び林業における、特に植物上で、より特に有用植物、及び観葉植物上で、又は上記植物の部分、例えば、果実、花、葉、茎、根茎又は根上で生じる上述のタイプの害虫を、その後に生育する植物の部分をも上記害虫に対して未だ保護しながら、防除、すなわち、抑制又は破壊するために使用されることができる。
【0087】
標的作物は、天然作物、及び育種又は遺伝子工学的方法により修飾されている作物の両者を含み、特に、穀物、例えば小麦、大麦、ライ、オーツ、米、メイズ、及びモロコシ;ビート、例えばサトウダイコン及び飼料ビート;果実、例えばナシ状果、石果及び小果樹、例えばリンゴ、ナシ、プラム、桃、アーモンド、さくらんぼ、及びベリー、例えばいちご、ラズベリー及びブラック・ベリー;マメ科植物、例えばインゲン豆、レンズ豆、エンドウ豆、及び大豆;植物油、例えばアブラナ、からし、ケシ、オリーブ、ヒマワリ、ココナッツ、ヒマシ油植物、ココア豆、アメリカホドイモ;ウリ科植物、例えばカボチャ、キュウリ、及びメロン;繊維植物、例えば綿、フラックス、アサ、及びジュート;柑キツ類果実、例えばオレンジ、レモン、グレープフルーツ、及びマンダリン;野菜、例えばホウレンソウ、レタス、アスパラガス、キャベツ、ニンジン、玉ねぎ、トマト、ポテト、及びパプリカ;クスノキ科、例えばアボカド、シナモン、及びショウノウ;及びタバコ、ナッツ、コーヒー、ナス、サトウキビ、茶、コショウ、つる植物、ホップ、バナナ植物、天然ゴム植物、並びに観賞植物を含む。
【0088】
本発明に係る化合物は、綿、果実、柑キツ類、メイズ、大豆、ナタネ、及び野菜作物における、ダニ目の昆虫及びそれを代表するもの、特に植物破壊性摂食昆虫、例えば、アンソノマス・グランディス(Anthonomus grandis)、ディアブロティカ・バルテアタ(Diabrotica balteata)、ヘリオシス・ビレッセンス(Heliothis virescens)の幼虫、プルテラ・キシロステラ(Plutella xylostella)及びスポドプテラ・リトラリス(Spodoptera littoralis)の幼虫、及びハダニ(spider mites)、例えば、テトラニクス種(Tetranychus spp.)を防除するために特に好適である。
【0089】
本発明に係る化合物の使用のさらなる領域は、保存商品及び保存物の及び材料の保護であり、そしてまた、衛生区画、特に家畜動物、例えば、ウシ、ブタ、ヒツジ及びヤギ、家キン、例えば、雌鳥、七面鳥、及びガチョウ、それらの毛皮のために飼育される動物、例えばミンク、キツネ、チンチラ、ウサギその他、そしてまた、家畜動物及びペット、例えば、ネコ及びイヌ、そしてさらにヒトを含む温血動物を、上述のタイプの害虫に対して保護することにある。
【0090】
例えば、家畜動物及びペットにおけるノミの感染は、その動物の所有者にとっては問題であるが、それに対しては未だ満足いく解決策はない。ノミの複雑なライフサイクルに因って、ノミを防除する知られた方法のいずれも十分に満足いくものではない。なぜなら、特に、それらの知られた方法のほとんどが、その毛皮内の完全に成長したノミを防除することを主に目的としており、そして動物の毛皮内だけではなく、床、カーペット、動物の寝場所、イスの上、庭及びそのはびこった動物がそれに接触するところの他の場所の全ての内でも生きている、ノミのさまざまな若い段階を考慮していないからである。ノミの処理は、一般に費用がかかり、そして長い期間にわたり続けられなければならず、成功は、一般に、その処理が罹患動物、例えばイヌ又はネコだけではなくそれら罹患動物が頻繁に訪れる場所にも同時に適用されるときだけである。
【0091】
本発明に係る式(I)の化合物は、単独で又は他の殺生物剤とともに使用されることができる。例えば、その効果を高めるために、それらは、同一方向の作用をもつ農薬と併合されることができ、又はその作用スペクトルを広げるために、それらは、異なる方向の作用をもつ物質と併合されることができる。内部寄生生物、例えば蠕虫(worms)に対する作用スペクトルを広げることが望ましい場合、式(I)の化合物は、有利には、内部寄生生物特性をもつ物質と併合される。それらは、もちろん、抗バクテリア剤と併合して使用されることもできる。式(I)の化合物は“殺成虫剤(adulticides)”であるので、すなわち、それらは、特に、標的寄生生物の完全に生長した段階に対して有効であるので、上記寄生生物の若い段階に対してより有効である農薬の添加はひじょうに有利であることができる。なぜなら、この方法で、上記寄生生物集団のスペクトル全体が到達され、そしてさらに耐性の進展を回避に対する実質的な貢献があるからである。
【0092】
本発明に係る式(I)の化合物の良好な寄生生物活性は、上述の害虫の少なくとも50〜60%の死亡率に対応する。
【0093】
動物害虫に対する、本発明に係る化合物及びそれらを含む組成物の作用は、他の殺虫剤及び/又は殺ダニ剤の添加によりかなり広げられ、そして与えられた状況に適したものとなることができる。好適な添加物は、例えば、以下のクラスの活性成分を代表するものを含む:有機リン酸化合物、ニトロフェノール及び誘導体、ホルムアミジン、チオウレア、ベンゾイルウレア、カーバメート、ピレスロイド、ネオニコチノイド、塩素化炭化水素、及びバシルス・チューリンゲンシス(Bacillus thuringiensis)調製品。
【0094】
特に好適な混合パートナーは:アザメチフォス(Azamethiphos);クロルフェンビンフォス(Chlorfenvinphos);シペルメスリン(Cypermethrin),シペルメスリン高シス(Cypermethrin high−cis);シロマジン(Cyromazin);ジアフェンシウロン(Diafenthiuron);ジアジノン(Diazinon);ジクロルボス(Dichlorvos);ジクロトフォス(Dicrotophos);ジシクラニル(Dicyclanil);フェノキシカーブ(Fenoxycarb);フルアズロン(Fluazuron);フラチオカーブ(Furathiocarb);イサゾフォス(Isazofos);ジョドフェンフォス(Jodfenphos);キノプレン(Kinoprene);ルフェヌロン(Lufenuron);メタクリフォス(Methacriphos);メチダチオン(Methidathion);モノクロトフォス(Monocrotophos);フォスファミドン(Phosphamidon);プロフェノフォス(Profenofos);ジオフェノラン(Diofenolan);バチルス・チューリンゲンシス(Bacillus thuringiensis)株GC91又はNCTC11821から得られうる化合物;ピメトロジン(Pymetrozine);ブロモプロピレート(Bromopropylate);メトプレン(Methoprene);ジスルフトン(Disulfuton);キノルフォス(Quinalphos);タウ−フルバリネート(Tau−Fluvalinate);チオシクラム(Thiocyclam);チオメトン(Thiometon);アルジカーブ(Aldicarb);アジンフォス−メチル(Azinphos−methyl);ベンフラカーブ(Benfuracarb);ビフェンスリン(Bifenthrin);ブプロフェジン(Buprofezin);カルボフラン(Carbofuran);カルタップ(Cartap);クロルフルアズロン(Chlorfluazuron);クロルピリフォス(Chlorpyrifos);シフルスリン(Cyfluthrin);ラムダ−シハロスリン(Lambda−Cyhalothrin);アルファ−シペルメスリン(Alpha−cypermethrin);ゼータ−シペルメスリン(zeta−Cypermethrin);デルタメスリン(Deltamethrin);ジフルベンズロン(Diflubenzuron);エンドスルファン(Endosulfan);エチオフェンカーブ(Ethiofencarb);フェニトロシオン(Fenitrothion);フェノブカーブ(Fenobucarb);フェンバレレート(Fenvalerate);フォルモチオン(Formothion);メチオカーブ(Methiocarb);ヘプテノフォス(Heptenophos);イミダクロプリッド(Imidacloprid);イソプロカーブ(Isoprocarb);メタミドフォス(Methamidophos);メトミル(Methomyl);メビンフォス(Mevinphos);パラチオン(Parathion);パラチオン−メチル(Parathion−methyl);フォサロン(Phosalone);ピリミカーブ(Pirimicarb);プロポクサー(Propoxur);テフルベンズロン(Teflubenzuron);テルブフォス(Terbufos);トリアザメート(Triazamate);アバメクチン(Abamectin);フェノムカーブ(Fenobucarb);テブフェノジド(Tebufenozide);フィプロニル(Fipronil);ベータ−シフルスリン(beta−Cyfluthrin);シラフルオフェン(Silafluofen);フェンピアキシメート(Fenpyroximate);ピリダベン(Pyridaben);フェナザキン(Fenazaquin);ピリプロキシフェン(Pyriproxyfen);ピリミジフェン(Pyrimidifen);ニテンピラム(Nitenpyram);NI−25,アセタミプリッド(Acetamiprid);アベルメクチン(Avermectin)B1 アバメクチン(Abamectin);植物の殺虫活性抽出物;殺線虫活性成分含有調製物;バチルス・サブチリス(Bacillus subtilis)から得られうる化合物;殺虫活性真菌含有調製物;殺虫活性ウイルス含有調製物;AC 303 630;アセフェート(Acephate);アクリナスリン(Acrinathrin);アラニカーブ(Alanycarb);アルファメスリン(Alphamethrin);アミトラズ(Amitraz);AZ 60541;アジフォス(Azinphos)A;アジフォス(Azinphos)M;アゾシクロチン(Azocyclotin);ベンジオカーブ(Bendiocarb);ベンスルタップ(Bensultap);ベタシフルスリン(Betacyfluthrin);BPMC;ブロフェンプロックス(Brofenprox);ブロモフォス(Bromophos)A;ブフェンカーブ(Bufencarb);ブトカルボキシン(Butocarboxin);ブチルピリダベン(Butylpyridaben);カジュサフォス(Cadusafos);カルバリル(Carbaryl);カルボフェノチオン(Carbophenothion);クロエトカーブ(Chloethocarb);クロルエトキシフォス(Chlorethoxyfos);クロルメフォス(Chlormephos);シス−レス−メスリン(Cis−Res−methrin);クロシスリン(Clocythrin);クロフェンテジン(Clofentezin);シアノフォス(Cyanophos);シクロプロスリン(Cycloprothrin);シヘクサチン(Cyhexatin);デメトン(Demeton)M;デメトン(Demeton)S;デメトン(Demeton)−S−メチル(methyl);ジクロフェンチオン(Dichlofenthion);ジクリフォス(Dicliphos);ジエチオン(Diethion);ジメソート(Dimethoat);ジメチルビンフォス(Dimethylvinphos);ジオキサチオン(Dioxathion);エジフェンフォス(Edifenphos);エマメクチン(Emamectin);エスフェンバレラット(Esfenvalerat);エチオン(Ethion);エトフェンプロックス(Ethofenprox);エトプロフォス(Ethoprophos);エトリンフォス(Etrimphos);フェナミフォス(Fenamiphos);フェンブタチノキシド(Fenbutatinoxid);フェノチオカーブ(Fenothiocarb);フェンプロパスリン(Fenpropathrin);フェンピラッド(Fenpyrad);フェンチオン(Fenthion);フルアジナム(Fluazinam);フルシクロクスロン(Flucycloxuron);フルシトリナット(Flucythrinat);フルフェノクスロン(Flufenoxuron);フルフェンプロックス(Flufenprox);フェノフォス(Fonophos);フォスチアザット(Fosthiazat);フェブフェンプロックス(Fubfenprox);HCH;ヘキサフルムロン(Hexaflumuron);ヘキシチアゾックス(Hexythiazox);イプロベンフォス(Iprobenfos);イソフェンフォス(Isofenphos);イソキサチオン(Isoxathion);イベルメクチン(Ivermecthin);ラムダ(Lambda)−シハロスリン(cyhalothrin);マラチオン(Malathion);メカルバム(Mecarbam);メスルフェンフォス(Mesulfenphos);メタルデヒド(Metaldehyd);メトルカーブ(Metolcarb);ミルベメクチン(Milbemectin);モキシデクチン(Moxidectin);ナレド(Naled);NC 184;オメソート(Omethoat);オキサミル(Oxamyl);オキシデメソン(Oxydemethon)M;オキシデプロフォス(Oxydeprofos);ペルメスリン(Permethrin);フェンソート(Phenthoat);フォラット(Phorat);フォスメット(Phosmet);フォキシム(Phoxim);ピリミフォス(Pirimiphos)M;ピリミフォス(Pirimiphos)A;プロメカーブ(Promecarb);プロパフォス(Propaphos);プロチオフォス(Prothiofos);プロソート(Prothoat);ピラクロフォス(Pyrachlophos);ピラダ(Pyrada)−フェンチオン(phenthion);ピレスメトリン(Pyresmethrin);ピレスラム(Pyrethrum);RH 5992;サリチオン(Salithion);セブフォス(Sebufos);スルフォテップ(Sulfotep);スルプロフォス(Sulprofos);テブフェンピラッド(Tebufenpyrad);テブピリムフォス(Tebupirimphos);テフルスリン(Tefluthrin);テメフォス(Temephos);テルバム(Terbam);テトラコール(Tetrachlor)−ビンフォス(vinphos);チアクロプリッド(Thiacloprid);チアメソキサム(Thiamethoxam);チアフェノックス(Thiafenox);チオジカーブ(Thiodicarb);チオファノックス(Thiofanox);チオナジン(Thionazin);チューリンゲンシン(Thuringiensin);トラロメスリン(Tralomethrin);トリアセン(Triarthen);トリアゾフォス(Triazophos);トリアズロン(Triazuron);トリクロロフォン(Trichlorfon);トリフルムロン(Triflumuron);トリメタカーブ(Trimethacarb);バミドチオン(Vamidothion);キシリルカーブ(Xylylcarb);YI 5301/5302;ゼータメトリン(Zetamethrin);DPX−MP062;RH−2485;D 2341又はXMC(3,5−キシリル・メチルカーバメート(Xy−lyl Methylcarbamate)である。
【0095】
式(I)の化合物は、非修飾形態で、又は好ましくは、配合技術において慣用されるアジュバントとともに使用され、そしてそれ故、知られたやり方で、例えば、乳化性濃縮液、直接スプレーできる又は希釈することができる溶液、希釈エマルジョン、水和性粉末、可溶性粉末、ダスト、粒剤、そしてまた、ポリマー物質中でのカプセル化に、配合されることができる。
【0096】
式(I)の化合物(活性成分)、又はその活性成分と他の農薬活性成分、及び適宜、固体又は液体アジュバントとの併合物を含む、配合品、すなわち、組成物、調製物又は混合物は、知られたやり方で、例えば、その活性成分を伸展剤、例えば溶媒、固体担体、そして場合により表面活性化合物(界面活性剤)と均一混合し、そして/又はこれとともに粉砕することにより調製され、そして本発明は、これにも関する。
【0097】
本発明は、上記組成物の適用方法、すなわち、上述のタイプの害虫を防除し、例えば、意図された目的及び普及環境に従って選択される、スプレー、噴霧、ダスティング、コーティング、ドレッシング、スキャタリング、又は注ぎ(pouring)方法にも関し、そして上述のタイプの害虫を防除するための組成物の使用にも関する。典型的な濃度割合(rates of concentration)は、0.1〜1000ppm 、好ましくは0.1〜500ppm の活性成分である。1ヘクタール当りの適用割合(rates of application)は、一般的に、1〜2000gの活性成分/1ヘクタール、特に、10〜1000g/ha、好ましくは20〜600g/haである。
【0098】
植物保護の領域における好ましい適用方法は、植物の葉への適用(葉適用)であり、その適用頻度及び割合は、着目の害虫によるはびこりのリスクに依存する。しかしながら、活性成分は、液体配合品を用いて植物の場を浸漬することにより又は土壌中の活性成分を植物の場、例えば土壌中に、例えば粒剤の形態で取り込むことにより(土壌適用)、その根を通して(浸透作用)その植物に侵入することもできる。水田作物の場合には、このような粒剤は、水を張った水田に計量された量で適用されることができる。
【0099】
本発明の作物保護剤は、植物再生材料、例えば、種子、例えば、果実、塊茎又は穀粒、又は植物苗木を動物害虫から保護するためにも好適である。上記再生材料は、栽培開始前に上記組成物により処理されることができる。例えば、種子は、それらが種播きされる前にドレッシングされる。本発明の活性成分は、種子を液体組成物中に浸漬し又はそれらを固体組成物でコーティングすることにより、種子に適用されることもできる(コーティング)。上記組成物は、上記再生材料が栽培の場所に導入されるとき、例えば、種子が、種子鋤跡(seed furrow)内に播かれるときに、与えられることもできる。植物再生材料のための処理手順及びこのように処理された植物再生材料も、本発明の目的である。
【0100】
配合補助物質として、例えば、固体担体、溶媒、安定剤、“徐放性”補助物質、塗料、及び場合により表面活性物質(界面活性剤)が使用される。好適な担体及び補助物質は、植物保護組成物中で慣用される物質の全てを含む。本発明に従って使用される組成物中の、好適な補助物質、例えば、溶媒、固体担体、表面活性化合物、非イオン界面活性剤、カチオン界面活性剤、アニオン界面活性剤、及び他の補助物質は、例えば、EP−A−736252中に記載されたものを含み;それらは、引用により本発明の主題に含まれる。
【0101】
好適なアニオン界面活性剤は、いわゆる水溶性石けん、及び水溶性合成表面活性化合物の両者を含む。
【0102】
好適な石けんは、高級脂肪酸(C10−C22)のアルカリ金属塩、アルカリ土類金属塩又は非置換又は置換アンモニウム塩、例えば、オレイン酸又はステアリン酸の、又は例えばココナッツ油又はトール油から得られうる天然脂肪酸混合物のナトリウム又はカリウム塩である。界面活性剤として脂肪酸メチルタウリン塩も言及される。
【0103】
しかしながら、より頻繁に、いわゆる合成界面活性剤であってEP−A−736252中に言及されるもの、特に脂肪スルホネート、脂肪スルフェート、スルホネート・ベンズイミダゾール誘導体、及びアルキルアリールスルホネートが使用される。
【0104】
式(I)の化合物は、とりわけ、ノミ(fleas)に対する優れた活性によっても目立っており、成体ノミが速く殺されるだけではなく、間接的な経路(circuitous route)により、ノミの幼若段階をも殺す。ノミの卵から孵化したノミの幼虫は成体ノミの排泄物を実質的に摂食する。本発明に係る式(I)の化合物は成体ノミをひじょうに速く殺すので、必要な排泄物はなくなり、そして幼若段階は栄養媒体を奪われ、それらは成体段階に達する前に死滅する。
【0105】
それ故、本発明は、好ましくは、ヒト、家畜動物、生産家畜、及びペット上の寄生生物を防除する方法であって、少なくとも1の式(I)の化合物又はその生理学的に許容される塩を含む組成物の有効量が、温血動物に、全身的に、又は好ましくは、表在局所的に投与される、前記方法に関する。
【0106】
例えば、配合された形態にある上記活性成分を処理されるべき動物に外部又は内部から投与することによる、さまざまな投与形態をもつ本発明に係る式(I)の化合物により、長期間の作用が達成される。この場合における、“配合された”とは、例えば、粉末、錠剤又は粒剤の形態、リポソーム又はカプセル、エマルジョン、フォーム又はスプレーの形態、マイクロカプセル化された形態又は注ぎ(pour−on)又はスポット(spot−on)形態にあることを意味する。経口的に投与されることができる組合物の全てが、慣用の配合物質に加えて、その宿主動物が上記組成物を経口的・自発的に摂取することを促すさらなる添加物、例えば好適な匂い物質、及び香料を含むと理解される。
【0107】
経皮投与、例えば、皮下又は筋中注射によるもの又はインプラントの形態における貯蔵調製物としてのもの、及び表在局所的適用、例えば、注ぎ又はスポット形態は、それらが実施し易いために、本発明の好ましい主題を表す。さらなる投与モードは、経口投与であって、例えば錠剤の形態にあるものである。経皮及び表在局所的投与形態も特に重要であり、そして優れた結果を与える。
【0108】
表皮投与形態は、例えば、皮下、筋中、そしてさらに注射することができる形態の静脈内投与を含む。針をもつ慣用のシリンジに加えて、針のない高圧シリンジ、デバイスを使用することもできる。
【0109】
注ぎ及びスポット配合品は、表在局所的投与形態として特に好ましいが、スプレー、軟膏、溶液又は粉末の形態における投与も好都合である。
【0110】
好適な配合品の選択により、上記活性成分がその宿主動物の生きた組織に浸透し、そして/又はそれらの利用能を維持する能力を高めることができる。このことは、例えば、より溶けにくい活性成分であってその低い溶解度が溶解度を高めるための手段を必要とするようなものが使用されるとき、重要である。なぜなら、このような場合、動物の体液は、一度のほんの少量の活性成分を溶解することができるからである。
【0111】
さらに、活性成分の高遅延性放出を得るためには、本発明に係る式(I)の化合物は、上記活性成分が放出され、そして未成熟で排泄されることを物理的に防止し、そしてその活性成分の生物学的利用能を維持するマトリックス配合品中に存在することもできる。このようなマトリックス配合品は、例えば、筋中又は皮下で体内に注射され、そしてそこから上記活性成分が連続的に放出されるところの貯蔵庫の形態としてそこに残る。このようなマトリックス配合品は当業者に知られている。それらは、一般的にワックス様の、半固体物質、例えば、植物ワックス及びポリエチレングリコールであって高分子量をもつもの、又は固体ポリマー配合品、例えば、いわゆる微小球(microspheres)である。
【0112】
上記インプラントからの上記活性成分の放出速度、及びそれ故、上記インプラントが作用を示すところの時間期間は、上記インプラントがそれを用いて換算されているところの精度(上記インプラント中の活性成分の量)、上記インプラントの周囲の環境、及び上記インプラントがそれから作られているところのポリマー配合形態により、一般に決定される。
【0113】
動物飼料への獣医添加物の投与は、動物の健康の分野において周知である。上記活性成分が液体中に分散され、又は固体担体中に細かく分割された形態にあるところのいわゆるプレミックスをまず調製することが普通である。このプレミックスは、通常、食品中の望ましい最終濃度に依存して、プレミックス1kg当り約1〜800mgの化合物を含むことができる。
【0114】
本発明に係る式(I)の化合物は、食品の構成成分により加水分解されることができるので、それらは、プレミックスに添加される前に、保護マトリックス、例えば、ゼラチン中に配合されるべきである。
【0115】
従って、本発明は、加水分解に対して保護されている式(I)の化合物を、その食品とともにその宿主動物に投与することによる寄生生物の防除の局面にも関する。
【0116】
本発明に係る式(I)の化合物は、有利には、その宿主動物に基づき、0.01〜800mg/kg、好ましくは0.1〜200mg/kg、特に0.5〜30mg/kg、体重の投与量で、投与される。
【0117】
宿主動物に定常的に投与されることができる良好な投与量は、0.5〜100mg/kg、特に0.1〜40mg/kg、体重である。上記投与は、投与モード及び体重に依存して好適な間隔で行われる。
【0118】
合計投与量は、同一の活性成分に関して、動物の種間で、そしてまた動物の1の種内で変動しうる。なぜなら、それは、とりわけ、その宿主動物の体重、年齢、及び健康状態に依存するからである。
【0119】
本発明に従って使用されるとき、本発明に係る式(I)の化合物は、通常、純粋な形態ではなく、その活性成分に加えて、投与を助ける構成成分を含む組成物の形態で投与されるであろう。好適な構成成分は宿主動物により許容されるものである。もちろん、本発明に従って成体寄生生物を防除することとともに、ノミの幼若段階を防除するための慣用の方法を使用することもできるが、後者は不可欠なものではない。
【0120】
本発明に従って投与される上記組成物は、一般に、0.1〜99重量%の、特に0.1〜95重量%の、本発明に係る式(I)の化合物、及び99.9〜1重量%の、特に99.9〜5重量%の、固体又は液体の、生理学的に許容される担体を含み、0〜25重量%の、特に0.1〜25重量%の、非毒性分散剤を含む。
【0121】
商業品な製品は好ましくは濃縮剤として配合されるであろうが、エンド・ユーザーは、通常、希釈配合物を使用するであろう。
【0122】
このような配合品は、特別な効果を得るために、さらなる補助物質、例えば、安定剤、消泡材、粘度調節剤、バインダー、及び粘着剤、並びに他の活性成分を含むこともできる。
【0123】
経口、経皮、及び表在局所的投与のための獣医実務から知られている生理学的に許容される担体は、配合補助物質として使用されることができる。いくつかの例を以下に与える。
【0124】
好適な担体は、特に、増量剤、例えば、糖、例えば、ラクトース、サッカロース、マンニトール又はソルビトール、セルロース調製品及び/又はリン酸カルシウム、例えば、リン酸3カルシウム又はリン酸水素カルシウム、及びバインダー、例えば、デンプン・ペーストであって、例えば、メイズ、小麦、米、又はポテト・スターチを使用するもの、ゼラチン、トラガカント、メチルセルロース、及び/又は、所望により、崩壊剤、例えば、上述のデンプン、またカルボキシメチル・デンプン、架橋ポリビニルピロリドン、寒天、アルギン酸又はその塩、例えばアルギン酸ナトリウムである。
【0125】
アジュバントは、特に流動性改善剤及び潤滑剤、例えば、ケイ酸、タルク、ステアリン酸又はその塩、例えば、ステアリン酸マグネシウム又はカルシウム、及び/又はポリエチレン・グリコールである。糖衣錠コアは、好適な、場合により腸溶性の、コーティングが提供されることができ、とりわけ、アラビア・ガム、タルク、ポリビニルピロリドン、ポリエチレングリコール、及び/又は2酸化チタンを含むことができる濃縮された糖溶液、又は好適な有機溶媒又は溶媒混合物中のコーティング溶液が、又は腸溶コーティングの調製品のためには、好適なセルロース調製品、例えば、アセチルセルロース・フタレート又はヒドロキシプロピルメチルセルロース・フタレートの溶液が使用される。染料、香料又は顔料が、例えば識別目的のために又は活性成分の異なる量を示すために、錠剤又は糖衣コーティングに添加されることができる。
【0126】
他の経口投与することができる調製品は、ハード・ゼラチン・カプセル、そしてまた、ソフト・シールド・カプセルであって、ゼラチン及び可塑剤、例えば、グリセロール又はソルビトールから作られたものである。ハード・ゼラチン・カプセルは、粒状物の形態で、例えば、増量剤、例えば、ラクトース、バインダー、例えば、スターチ、及び/又は滑剤、例えば、タルク又はステアリン酸マグネシウム、及び、所望により、安定剤も混合されて、上記活性成分を含むことができる。ソフト・カプセル内では、上記活性成分は、好ましくは、好適な液体、例えば、脂肪油、パラフィン油又は液体ポリエチレン・グリコールであって、それに同じく安定剤が添加されることもできるものの中に溶解又は懸濁される。とりわけ、容易に、かんで飲む又はかまないで飲み込むことができるカプセルが好ましい。
【0127】
上記注ぎ(pour−on)又はスポット(spot−on)方法は、皮膚又は毛皮の局所的に限定された領域に、有利には、動物の首のうしろ又は背骨上に、式(I)の化合物を適用することを含む。これは、例えば、毛皮の比較的小さな領域に上記注ぎ又はスポット配合品を適用することにより行われ、そこから、上記活性成分は、動物の動きにより助けられる上記配合品のスプレッディング構成成分の結果としてほとんど自動的に上記毛皮の広い領域にわたり分布されるようになる。
【0128】
注ぎ及びスポット配合品は、有利には、皮膚の表面上で、及び宿主動物の毛皮内での速い分配を助け、そして一般にスプレッディング油といわれる担体を含む。例えば、油状溶液;アルコール性及びイソプロパノール溶液、例えば、2−オクチル・ドデカノール又はオレイル・アルコールの溶液;モノカルボン酸のエステル、例えば、イソプロピル・ミリステート、イソプロピル・パルミテート、ラウリン酸ショウ酸エステル、オレイン酸オレイル・エステル、オレイン酸デシル・エステル、ヘキシル・ラウレート、オレイル・オレエート、デシル・オレエート、鎖長C12−C18の飽和脂肪アルコールのカプロン酸エステル中の溶液;ジカルボン酸のエステル、例えば、ジブチル・フタレート、ジイソプロピル・イソフタレート、アジピン酸ジイソプロピル・エステル、ジ−n−ブチル・アジペートの溶液又は脂肪酸、例えばグリコールのエステルの溶液が好適である。医薬又は化粧品産業から知られた分散剤も存在することが有利でありうる。例は、ピロリジン−2−オン、N−アルキルピロリジン−2−オン、アセトン、ポリエチレン・グリコール並びにそのエーテル及びエステル、プロピレン・グリコール又は合成トリグリセリドである。
【0129】
上記油状溶液は、例えば、植物油、例えば、オリーブ油、アメリカホドイモ油、ゴマ油、松油、亜麻仁油、及びヒマシ油を含む。上記植物油は、エポキシ化形態で存在することもできる。パラフィン及びシリコーン油を使用することもできる。
【0130】
一般に、注ぎ又はスポット配合品は、1〜20重量%の式(I)の化合物、0.1〜50重量%の分散剤、及び45〜98.9重量%の溶媒を含むであろう。
【0131】
上記注ぎ又はスポット方法は、群れをなす動物、例えば、ウシ、ウマ、ヒツジ、及びブタであって、その動物の全てを経口的に又は注射を通じて処理することが難しく又は時間がかかるもののために特に有利に、使用されることができる。その単純さのために、上記方法は、もちろん、個々の家畜動物及びペットを含む他の全ての動物のために使用されることができ、そしてそれら動物の占有者にひじょうに人気がある。なぜなら、それはしばしば、獣外科医の専門的支援を伴わずに行われることができるからである。
【0132】
非経口及び経皮投与のために好適なものは、油状の注射溶液又は懸濁液であり、好適な親油性溶媒又は媒質、例えば、脂肪油、例えばゴマ油、合成脂肪酸エステル、例えば、オレイン酸エチル、又はトリグリセリド、または水性注射溶液又は懸濁液であって、粘度上昇物質、例えば、ナトリウム・カルボキシメチルセルロース、ソルビトール及び/又はデキストラン、及び、場合により、安定剤を含むものが使用される。
【0133】
本発明の調製品は、それ自体知られたやり方で、例えば、慣用の混合、顆粒化、調合(confectioning)、溶解又は凍結乾燥方法により、調製されうる。例えば、経口投与のための医薬調製品は、錠剤又は糖衣剤コアを形成するために、上記活性成分を、固体担体と併合し、場合により、得られた混合物を粉砕し、そして上記混合物又は顆粒を、所望により又は必要により、好適な賦形剤の添加後に、処理することにより、得られうる。
【0134】
以下の実施例は、本発明を単に説明するために役立ち、本発明を限定するものではない。
【0135】
好ましい配合品は特に以下の組成をもつ(全体を通して、パーセンテージは重量である):
乳化剤濃縮物:
活性成分 : 1〜90%、好ましくは5〜20%
表面活性剤: 1〜30%、好ましくは10〜20%
液体担体 : 5〜94%、好ましくは70〜85%
粉剤(ダスト):
活性成分 : 0.1〜10%、好ましくは0.1〜1%
固体担体 : 99.9〜90%、好ましくは99.9〜99%
懸濁濃縮液:
活性成分 : 5〜75%、好ましくは10〜50%
水 : 94〜24%、好ましくは88〜30%
表面活性剤: 1〜40%、好ましくは2〜30%
湿潤(水和)性粉末:
活性成分 : 0.5〜90%、好ましくは1〜80%
表面活性剤: 0.5〜20%、好ましくは1〜15%
固体担体 : 5〜95%、好ましくは15〜90%
顆粒:
活性成分 : 0.5〜30%、好ましくは3〜15%
固体担体 : 99.5〜70%、好ましくは97〜85%
注射溶液:
活性成分 : 0.1〜10%、好ましくは0.5〜5%
非イオン界面活性剤: 0.1〜30%、好ましくは0.5〜10%
エタノールとプロピレン
グリコールの混合物: 60〜99%、好ましくは85〜90%
注射懸濁液(水性又は油状):
活性成分 : 0.1〜20%、好ましくは1〜10%
非イオン界面活性剤: 0.1〜20%、好ましくは1〜10%
水又は植物油 : 60〜99%、好ましくは85〜95%
上記組成物は、特別な効果を得るために、さらなる成分、例えば、安定剤、例えば、植物油又はエポキシ化植物油(エポキシ化ココナッツ油、ナタネ油又は大豆油)、消泡剤、例えば、シリコーン油、保存料、粘度調節剤、バインダー及び粘着剤、並びに肥料又は他の活性成分を含むこともできる。
【0136】
以下の実施例は、上記の発明を説明するが、いかなる方法においてもその範囲を限定するものではない。温度は摂氏で与える。記号“h”は“時間”を表す。
1.合成実施例
実施例1.1:3−(4−ブロモフェニル)−6−(2,6−ジフルオロフェニル)−[1,2,4]トリアジン
a)40.6gの2,6−ジフルオロアセトフェノンを、120mlのクロロホルム中に入れ、そして0.1gの塩化アルミニウムを添加する。次に、0℃において、240mlのクロロホルム中の37gの臭素を滴下し、そして撹拌を0℃で1時間行う。次に反応混合物を室温まで加熱し、そしてロータリー・エバポレーターを用いて濃縮する。残渣をVigreuxカラム上で蒸留する。この方法で、9mbarにおいて101〜110℃の沸点をもつ2−ブロモ−1−(2,6−ジフルオロフェニル)−エタノンを得る。
【0137】
b)24.2gの4−ブロモ安息香酸ヒドラジドと9.17gの酢酸銀を290mlのジメトキシエタン中に入れる。茶色の懸濁液を60℃に加熱し、12.9gの2−ブロモ−1−(2,6−ジ−フルオロフェニル)−エタノンを添加し、そして次に、48時間、還流冷却しながら(約85℃)撹拌を行う。懸濁液を40℃に冷却し、そして濾過し、そして濾液をロータリー・エバポレーターを用いて濃縮する。粗生成物をフラッシュ・クロマトグラフィー(シリカ・ゲル;ジクロロメタン/n−ヘキサン1:1)により精製する。この方法で、167〜169℃の融点をもつ標題の化合物を得る。
【0138】
実施例1.2:6−(2,6−ジフルオロフェニル)−3−(4′−トリフルオロメトキシビフェニル−4−イル)−[1,2,4]トリアジン
244mgの3−(4−ブロモフェニル)−6−(2,6−ジフルオロフェニル)−[1,2,4]トリアジンを、1.8mlの1,2−ジメトキシエタン中に入れ、そして1.8mlの水中の、2.5mgのビス(トリフェニルホスフィン)パラジウム(II)クロライド、159mgの4−トリフルオロメトキシフェニル・ホウ酸、及び176mgの炭酸水素ナトリウムを順番に添加する。次に、反応混合物を5時間70℃で加熱する。室温まで冷却した後、懸濁液を1N水酸化ナトリウム溶液に注ぎ、そして酢酸エチルで抽出する。有機相を飽和塩化ナトリウム溶液で洗浄し、硫酸ナトリウム上で乾燥させ、濾過し、そして濃縮する。粗生成物を、最少量の熱酢酸エチル中に溶解し、清澄に濾過し、そして0℃で結晶化させる。この方法で、199〜202℃の融点をもつ標題の化合物を得る。
【0139】
実施例1.3:6−(4−ブロモフェニル)−3−(2,6−ジフルオロフェニル)−[1,2,4]トリアジン
a)窒素下で、3.15gのメチルチオ−2,6−ジフルオロベンズイミジニウム・ヨージドを30mlの無水メタノール中に溶解し、そして1.32gのtert−ブチル・カーバゼートを添加する。17時間室温で撹拌した後、反応混合物を、ロータリー・エバポレーターを用いて濃縮し、そして残渣を高真空下で乾燥させる。この方法で、N’−[(2,6−ジフルオロフェニル)−イミノメチル]−ヒドラジンカルボン酸tert−ブチル・エステルを、黄色っぽい泡の形態で得、これをさらに精製せずに反応させる。
【0140】
b)19.9gの4−ブロモアセトフェノンを、窒素下で150mlのメタノール中に入れ、そして14.7mlの亜硝酸イソペンチルを添加する。得られた溶液に、次に、17〜23℃において、メタノール中ナトリウム・メタノレートの5.4M溶液22.2mlを添加する。室温で70時間撹拌した後、オレンジ色の懸濁液を、ロータリー・エバポレーターを用いて濃縮する。300mlの水を残査に添加し、そして混合物を60mlの2N塩酸により酸性にする。得られた黄色の懸濁液を濾過し、そして水で洗浄する;濾過ケーキを酢酸エチル中に溶かし、そして水で洗浄する。有機相を飽和塩化ナトリウム溶液で洗浄し、硫酸ナトリウム上で乾燥させ、濾過し、そして濃縮する。粗生成物を、酢酸エチル/トルエンから結晶化する。この方法で、(4−ブロモフェニル)−オキソアセトアルデヒド・オキシムを無色粉末の形態で得る。
【0141】
c)1.5mlの氷酢酸中の、200mgのN’−[(2,6−ジフルオロフェニル)イミノメチル]−ヒドラジンカルボン酸tert−ブチル・エステル、114mgの(4−ブロモフェニル)−オキソアセトアルデヒド・オキシム、及び123mgの酢酸ナトリウムの混合物を、3時間で100℃に加熱する。室温まで冷却後、反応混合物を水に注ぎ、そして酢酸エチルで抽出する。有機相を、順番に、飽和炭酸水素ナトリウム溶液及び飽和塩化ナトリウム溶液で洗浄し、硫酸ナトリウム上で乾燥させ、濾過し、そして濃縮する。残渣をフラッシュ・クロマトグラフィー(ジクロロメタン中1%メタノール)により精製する。この方法で、180〜181℃の融点をもつ標題の化合物を得る。
【0142】
実施例1.4:3−(2,6−ジフルオロフェニル)−6−(4′トリフルオロメトキシビフェニル−4−イル)−[1,2,4]トリアジン
実施例1.2に示した手順と同様にして、6−(4−ブロモフェニル)−3−(2,6−ジ−フルオロフェニル)−[1,2,4]トリアジンを4−トリフルオロメトキシフェニル・ホウ酸をPd触媒カップリングすることにより、225〜230℃の融点をもつ標題の化合物を得る。
【0143】
実施例1.5:3−(4−ブロモフェニル)−5−(2,6−ジフルオロフェニル)−[1,2,4]トリアジン
a)5gの2,6−ジフルオロアセトフェノンを13.6mlのDMSO中に入れ、そして2.7mlの臭素(水中、8.8M)を滴下し、反応温度を室温から40℃まで上昇させる。臭素の添加が完了した後、混合物を30分間80℃に加熱する。室温まで冷却した後、反応混合物を100mlのジクロロメタンに注ぎ;撹拌しながら、硫酸ナトリウムと固体炭酸水素ナトリウムを上記溶液に添加し、濾過を行い、そして反応混合物を、ロータリー・エバポレーターを用いて濃縮する。粗生成物を、ジクロロメタンを用いたフラッシュ・クロマトグラフィーにかける。この方法で、(2,6−ジフルオロフェニル)−オキソアセトアルデヒドを無色の粘性油の形態で得る。
【0144】
b)2gの(2,6−ジフルオロフェニル)−オキソアセトアルデヒドを、室温で15mlのメタノール中に入れ、そして1.59gの4−ブロモフェニル・ヒドラジドを添加し、後者を完全に溶解させる。室温で2時間撹拌後、沈殿生成物を濾別し、そして次に少量の冷メタノールで洗浄する。この方法で、4−ブロモ安息香酸[2−(2,6−ジフルオロフェニル)−2−オキソエチリデン]ヒドラジドを得、そしてさらに精製せずに反応させる。
【0145】
c)1.85gの4−ブロモ安息香酸[2−(2,6−ジフルオロフェニル)−2−オキソエチリデン]ヒドラシドと0.77gの酢酸アンモニウムの混合物を、14時間100℃で15ml氷酢酸中で加熱する。室温まで冷却後、反応混合物を氷水に注ぎ、そして酢酸エチルで抽出し、そして有機相を飽和炭酸水素ナトリウム及び飽和塩化ナトリウム溶液で洗浄する。有機相を硫酸ナトリウム上で乾燥させた後、濾過及びロータリー・エバポレーター内での濃縮を行う。残渣をフラッシュ・クロマトグラフィー(5トルエン中5%酢酸エチル)により精製する。この方法で、標題の化合物を、黄色の結晶の形態で得る。
【0146】
実施例1.6:5−(2,6−ジフルオロフェニル)−3−(4′−トリフルオロメトキシビフェニル−4−イル)−[1,2,4]トリアジン
実施例1.2に示す手順と同様にして、159〜160℃の融点をもつ標題の化合物を、150mgの3−(4−ブロモフェニル)−5−(2,6−ジフルオロフェニル)−[1,2,4]トリアジンを、97mgの4−トリフルオロメトキシフェニル・ホウ酸とPd−触媒カップリングすることにより得る。
【0147】
実施例1.7:6−(4−クロロベンジルアミノ)−3−(2,6−ジフルオロフェニル)−[1,2,4]トリアジン
a)室温で、30gのN’−[(2,6−ジフルオロフェニル)−イミノ−メチル]−ヒドラジンカルボン酸tert−ブチル・エステルと23.8gのグリオキシル酸エチル・エステルを、4時間70℃で500mlのトルエン中で撹拌する。反応混合物を次に濃縮し、200mlのギ酸を添加し、そして室温で5時間撹拌を続ける。反応混合物を濃縮し、そして残渣を300mlエタノール中に溶かし、そして6時間還流下で沸騰させる。反応混合物を濃縮し、そして酢酸エチルから再結晶化させた後、219〜226℃の融点をもつ3−(2,6−ジフルオロフェニル)−[1,2,4]トリアジン−6(1H)−オンを得る。
【0148】
b)1gの3−(2,6−ジフルオロフェニル)−[1,2,4]トリアジン−6(1H)−オンを20mlのジオキサン中に入れ、そして室温で0.73gのPOCl3 を添加する。次に、5分間の期間内で、3mlのジオキサン中の0.48gのトリエチルアミンを滴下し、そして撹拌を30分間室温で行う。次に反応混合物を氷水中に注ぎ、そして酢酸エチルで抽出し、そして有機相を分液させ、そして濃縮する。この方法で、6−クロロ−3−(2,6−ジフルオロフェニル)−[1,2,4]トリアジンを黄色油の形態で得る。粗生成物を、さらに精製せずに反応させる。
【0149】
c)0.9gの6−クロロ−3−(2,6−ジフルオロフェニル)−[1,2,4]トリアジンを、10mlの塩化メチレン中に入れ、そして0.57gの4−クロロベンジルアミンと0.81gのトリエチルアミンを添加する。室温で2時間撹拌した後、反応混合物を水に注ぎ、そして塩化メチレンで抽出し;有機相を濃縮し、そして残渣をシリカ・ゲル上のカラム・クロマトグラフィーにより精製する。この方法で、200〜205℃の融点をもつ標題の化合物を得る。
【0150】
実施例1.8:6−(3−クロロフェノキシ)−3−(2,6−ジフルオロフェニル)−[1,2,4]トリアジン
325mgの6−クロロ−3−(2,6−ジフルオロフェニル)−[1,2,4]トリアジン(実施例1.7b参照)を、10mlのアセトニトリル中に入れ;230mgの3−クロロフェノールと190mgの炭酸カリウムを添加し、そして撹拌を室温で2時間行う。次に反応混合物を水に注ぎ、そして酢酸エチルで抽出し;その酢酸エチル相を濃縮し、そして粗生成物をフラッシュ・クロマトグラフィーにより精製する。この方法で、132〜137℃の融点をもつ標題の化合物を得る。
【0151】
実施例1.9:6−[2−(4−クロロフェニル)−ビニル]−3−(2,6−ジフルオロフェニル)−[1,2,4]トリアジン
a)1.89gのメチルグリオキサル(水中40%)を、30ml中の2.71gのN’−[(2,6−ジフルオロフェニル)−イミノメチル]−ヒドラジンカルボン酸tert−ブチル・エステルに添加し、そして撹拌を16時間室温で行う。次に反応混合物を濃縮し、そして残渣を20mlのギ酸中に溶かし、そして5時間室温で撹拌を続ける。反応混合物を蒸発により濃縮し;次に残渣を再び20mlのエタノール中に溶解し、2時間還流下で沸騰させ、次に濃縮し、そしてカラム・クロマトグラフィーにより精製する。この方法で、90〜93℃の融点をもつ3−(2,6−ジフルオロフェニル)−6−メチル−[1,2,4]トリアジンを得る。
【0152】
b)−20℃において、1.5mlのn−ブチルリチウム(ヘキサン中1.6M)を、6mlのテトラヒドロフラン中の202mgのジイソプロピル−アミンに添加する。15分後、反応混合物を、−50℃に冷却し、そして2mlのテトラヒドロフラン中の0.414gの3−(2,6−ジフルオロフェニル)−6−メチル−[1,2,4]トリアジンを滴下する。20分後、混合物を−70℃にまで冷却し、3mlテトラヒドロフラン中の0.281gの4−クロロベンズアルデヒドを滴下し、そして次に混合物を2時間−70℃で撹拌する。次に反応混合物を氷水中に注ぎ、そして酢酸エチルで抽出し;その有機相を濃縮し、そして残渣をフラッシュ・クロマトグラフィーにより精製する。この方法で、薄茶色の樹脂の形態で、1−(4−クロロフェニル)−2−[3−(2,6−ジフルオロフェニル)−[1,2,4]トリアジン−6−イル]−エタノールを得る。ジエチル・エーテル/ヘキサンから再結晶化した後、1−(4−クロロフェニル)−2−[3−(2,6−ジフルオロフェニル)−[1,2,4]トリアジン−6−イル]−エタノールを、98〜102℃の融点をもつベージュ色の結晶の形態で得る。
【0153】
c)10mlのトルエン中の140mgの1−(4−クロロフェニル)−2−[3−(2,6−ジフルオロフェニル)−[1,2,4]トリアジン−6−イル]−エタノールと10mgのP−トルエンスルホン酸を、2時間、水分離器を用いて還流下で沸騰させ;硫酸ナトリウムにより乾燥させ、そして蒸発により濃縮する。シクロヘキサンからその残渣を結晶化させた後、135〜140℃の融点をもつ標題の化合物を得る。
【0154】
上記の手順と同様にして、以下の表1〜6中に言及する物質を製造することもできる。数値はその融点に関し、そして℃で与えられる。
【0155】
【表1】
【0156】
【表2】
【0157】
【表3】
【0158】
【表4】
【0159】
【表5】
【0160】
【表6】
【0161】
【表7】
【0162】
【表8】
【0163】
【表9】
【0164】
【表10】
【0165】
【表11】
【0166】
【表12】
【0167】
【表13】
【0168】
【表14】
【0169】
【表15】
【0170】
【表16】
【0171】
【表17】
【0172】
【表18】
【0173】
【表19】
【0174】
【表20】
【0175】
【表21】
【0176】
【表22】
【0177】
【表23】
【0178】
【表24】
【0179】
【表25】
【0180】
【表26】
【0181】
【表27】
【0182】
【表28】
【0183】
【表29】
【0184】
【表30】
【0185】
【表31】
【0186】
【表32】
【0187】
【表33】
【0188】
【表34】
【0189】
【表35】
【0190】
【表36】
【0191】
【表37】
【0192】
【表38】
【0193】
【表39】
【0194】
【表40】
【0195】
【表41】
【0196】
【表42】
【0197】
【表43】
【0198】
【表44】
【0199】
【表45】
【0200】
【表46】
【0201】
【表47】
【0202】
【表48】
【0203】
【表49】
【0204】
表6.1: 式中、Rが4−Clであり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0205】
表6.2: 式中、Rが4−Fであり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0206】
表6.3: 式中、Rが4−CH3 であり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0207】
表6.4: 式中、Rが4−CF3 であり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0208】
表6.5: 式中、Rが3−CF3 であり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0209】
表6.6: 式中、Rが4−OCF3 であり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0210】
表6.7: 式中、Rが2−Clであり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0211】
表6.8: 式中、Rが3−Clであり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0212】
表6.9: 式中、Rが2−Fであり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0213】
表6.10: 式中、RがHであり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0214】
表6.11: 式中、Rが4−OCH3 であり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0215】
表6.12: 式中、Rが2,4−Cl2 であり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0216】
表6.13: 式中、Rが3,5−Cl2 であり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0217】
表6.14: 式中、Rが4−SCH3 であり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0218】
表6.15: 式中、Rが4−SCF3 であり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0219】
表6.16: 式中、Rが3−Cl,4Fであり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0220】
表6.17: 式中、Rが4−t−Butであり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0221】
表6.18: 式中、Rが3,4−Cl2 であり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0222】
表6.19: 式中、Rが4−Brであり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0223】
表6.20: 式中、Rが4−O(CH2 )5 CH3 であり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0224】
表6.21: 式中、Rが4−O(CH2 )2 CH3 であり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0225】
表6.22: 式中、Rが4−O(CH2 )3 CH3 であり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0226】
表6.23: 式中、Rが4−CH2 CH3 であり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0227】
表6.24: 式中、Rが4−(CH2 )5 CH3 であり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0228】
表6.25: 式中、Rが4−[4−フルオロフェニル]であり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0229】
表6.26: 式中、Rが4−[4−クロロフェニル]であり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0230】
表6.27: 式中、Rが4−(CH2 )2 CH3 であり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0231】
表6.28: 式中、Rが4−[4−メチルフェニル]であり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0232】
表6.29: 式中、Rが4−[4−OCF3 −フェニル]であり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0233】
表6.30: 式中、Rが4−[4−OCF3 −フェノキシ]であり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0234】
表6.31: 式中、Rが4−[4−CF3 −フェニル]であり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0235】
表6.32: 式中、Rが4−[4−CF3 −フェノキシ]であり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0236】
表6.33: 式中、Rが4−[2−Cl−4−CF3 −フェノキシ]であり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0237】
表6.34: 式中、Rが4−[4−クロロフェノキシ]であり、そして各場合における化合物について、置換基X1 ,X2 ,X3 、及びAの組合せが、表A中のA.1〜A.108行に対応する、一般式(Ia)の化合物。
【0238】
【表50】
【0239】
【表51】
【0240】
【表52】
【0241】
【表53】
【0242】
【表54】
【0243】
【表55】
【0244】
2.配合実施例
2.1乳化性濃縮物 a) b) c)
表1〜6の化合物 25% 40% 50%
カルシウム・ドデシルベンゼン 5% 8% 6%
スルホネート・ヒマシ油ポリエチレン
グリコール・エーテル
(36mol のエチレン・オキシド) 5% − −
トリブチルフェノール・ポリエチレン・
グリコール・エーテル
(30mol のエチレン・オキシド) − 12% 4%
クロロヘキサノン − 15% 20%
キシレン混合物 65% 25% 20%
いずれかの所望の濃度のエマルジョンを、水での希釈により上記濃縮物から調製することができる。
2.2乳化性濃縮物 a) b) c)
表1〜6の化合物 10% 8% 60%
オクチルフェノール・ポリエチレン・
グリコール・エーテル
(4〜5mol のエチレン・オキシド) 3% 3% 2%
カルシウム・ドデシルベンゼン
スルホネート 3% 4% 4%
ヒマシ油ポリエチレン・グリコール・
エーテル
(35mol のエチレンオキシド) 4% 5% 4%
シクロヘキサノン 30% 40% 15%
キシレン混合物 50% 40% 15%
いずれかの所望の濃度のエマルジョンを、水での希釈により上記濃縮物から調製することができる。
2.3懸濁濃縮物
表1〜6の化合物 40%
エチレン・グリコール 10%
ノニルフェノール・ポリエチレン・
グリコール・エーテル
(15mol のエチレン・オキシド) 6%
ナトリウム・リグノスルホネート 10%
カルボキシメチルセルロース 1%
37%水性ホルムアルデヒド溶液 0.2%
75%水性エマルジョンの形態に
おけるシリコーン油 0.8%
水 32%
細かく粉砕した活性成分を、上記アジュバントと直接混合して、懸濁濃縮物を得、これからいずれかの所望の濃度の懸濁液を、水による希釈により得ることができる。
2.4水中で分散可能な粉末混合物 a) b) c)
表1〜6の化合物 25% 50% 75%
ナトリウム・リグノスルホネート 5% 5% −
オレイン酸 3% − 5%
ナトリウム・ジイソブチルナフタレン
スルホネート − 6% 10%
オクチルフェノール・ポリエチレン・
グリコール・エーテル
(7〜8mol のエチレン・オキシド) − 2% −
高分散ケイ酸 5% 10% 10%
カオリン 62% 27% −
上記活性成分を、上記アジュバントと完全混合し、そしてその混合物を好適なミル内で微粉砕し、水により希釈することができる水和性粉末を得て所望の濃度の懸濁液を得る。
2.5ダスト a) b)
表1〜6の化合物 2% 5%
高分散ケイ酸 1% 5%
タルク 97% −
カオリン − 90%
直ぐに使用できるダストを、上記担体を上記活性成分とじかに混合し、そしてこの混合物を粉砕することにより得る。
2.6粒剤(granules) a) b)
表1〜6の化合物 5% 10%
カオリン 94% −
高分散ケイ酸 1% −
アタパルジット − 90%
上記活性成分を、塩化メチレン中に溶解し、そしてその溶液を担体上にスプレーし、そしてこの溶媒をその後、真空で蒸発させる。このような粒剤を動物飼料と混合することができる。
2.7粒剤
表1〜6の化合物 10%
ナトリウム・リグノスルホネート 2%
カルボキシメチルセルロース 1%
カオリン 87%
上記活性成分を、上記アジュバントと混合・粉砕し、そしてこの混合物を水で温められる。この混合物を押出し、そして次に気流中で乾燥させる。
2.8粒剤
表1〜6の化合物 3%
ポリエチレン・グリコール(MW200) 3%
カオリン 94%
(MW=分子量)
微粉砕された活性成分を、ミキサー内で、ポリエチレン・グリコールで湿らせたカオリンに均一に適用する。非発塵性コート粒剤を、このやり方で得る。
2.9錠剤
構成成分(1000錠剤当り):
表1〜6の化合物 25.0g
ラクトース 100.7g
小麦デンプン 7.5g
ポリエチレン・グリコール6000 5.0g
タルク 5.0g
ステアリン酸マグネシウム 1.8g
脱イオン水 適量
まず、固体成分の全てを、0.6mmメッシュ・サイズの節を通す。次に、活性成分、ラクトース、タルクとデンプンの半量をともに混合する。デンプンの残り半分を40mlの水に懸濁させ、そしてその懸濁液を、100mlの水中のポリエチレン・グリコールの沸騰溶液に添加する。得られたデンプン・ペーストを、メイン・バッチに添加し、そして混合物を、必要な場合、水を添加して粒状化する。この粒剤を35℃で一夜乾燥させ、1.2mmのメッシュ・サイズを通過させ、ステアリン酸マグネシウムと混合し、そして圧縮して、約6mmのメッシュサイズをもち、かつ、両側がくぼんだ錠剤を形成する。
2.10.注射配合品
A.油状媒体(遅延放出)
表1〜6の化合物 0.1〜1.0g
アメリカホドイモ油 100mlまで
表1〜6の化合物 0.1〜1.0g
ゴマ油 100mlまで
活性成分を、撹拌し、そして場合により緩やかに加熱しながら上記油の一部分中に溶解し、そして冷却後、溶液を所望の容量に調整し、そして好適な0.22mmの膜フィルターを通して滅菌濾過する。
B.水混和性溶媒(中程度の放出速度)
表1〜6の化合物 0.1〜1.0g
4−ヒドロキシメチル−1,3−ジオキソラン
(グリセロール・ホルマー) 40g
1,2−プロパンジオール 100mlまで
表1〜6の化合物 0.1〜1.0g
グリセロール・ジメチル・ケタール 40g
1,2−プロパンジオール 100mlまで
活性成分を、撹拌しながら上記溶媒の一部中に溶解させ、そしてその溶液を所望の容量に調整し、そして好適な0.22mm膜フィルターを通して滅菌濾過する。
水性溶解産物(速い放出)
表1〜6の化合物 0.1〜1.0g
ポリエトキシル化ヒマシ油
(40エチレン・オキシド単価) 10g
1,2−プロパンジオール 20g
ベンジル・アルコール 1g
注射器への水 100mlまで
表1〜6の化合物 0.1〜1.0g
ポリエトキシル化ソルビタン・モノオレエート
(20エチレン・オキシド単位) 8g
4−ヒドロキシメチル−1,3−ジオキソラン
(グリセロール・ホルマー) 20g
ベンジル・アルコール 1g
注射器への水 100mlまで
調製:活性成分を、上記溶媒と界面活性剤中に溶解し、そしてその溶液を、水により所望の容量に調整する。次に滅菌濾過を、0.22mmの多孔直径をもつ好適な膜を通して行う。
【0245】
上記水性系を、経口及び/又は脈管内投与のためにも好ましいやり方で使用することができる。
2.11.注ぎ(Pour on)
A.
表1〜6の化合物 10%
エポキシド化大豆油 5%
オレイル・アルコール 85%
B.
表1〜6の化合物 20%
ピリジン−2−オン 15%
イソプロピル・ミリステート 65%
上記組成物に、式(I)の化合物に対して中立的な挙動を示し、そして処理される宿主動物に対して有害な効果をもたないさらなる生物学的に活性な物質又は添加物、そしてまた無機塩又はビタミンを添加することもできる。
3.生物学的実施例
A.殺虫作用
3.1.アフィス・クラシボーラ(Aphis craccivora)に対する作用
エンドン豆の苗木にアフィス・クラシボーラをはびこらせ、その後に、100ppm の活性成分を含むスプレー混合物をスプレーし、そして次に、20℃においてインキュベートする。3及び6日後、集団におけるパーセンテージ低下(%活性)を、処理された植物上の死んだアブラムシの数を、処理されていない植物上のものと比較することにより測定する。
【0246】
表1〜6の化合物は、本テストにおいて良い活性を示す。
3.2.ディアブロティカ・バルテアタ(Diabrotica baltea ta)に対する作用
メイズの苗木に、100ppm の活性成分を含む水性エマルジョン・スプレー混合物をスプレーし、そのスプレー−コーティングが乾燥した後、第2段階にある10匹のディアブロティカ・パルテアタの幼虫を宿らせ、そして次にプラスチック容器内に入れる。6日後、集団におけるパーセンテージ低下(%活性)を、処理された植物上の死んだ幼虫の数と、処理されていない植物上のものと比較することにより測定する。
【0247】
表1〜6の化合物は、本テストにおいて良い活性を示す。例えば、特に化合物3.9,4.13,4,15、及び4.20は、上記害虫集団における80%超の減少をもたらす。
3.3.ヘリオシス・ビレッセンス(Heliothis virescens)に対する作用
若い大豆植物に、100ppm の活性成分を含む水性エマルジョン・スプレー混合物をスプレーし、そしてそのスプレー−コーティングを乾燥させた後、第1段階にある10匹のヘリオシス・ビレッセンスの毛虫を宿らせ、そして次にプラスチック容器内に入れる。6日後集団(数)及び摂食障害におけるパーセンテージ低下(%活性)を、処理された植物上の死んだ毛虫の数及び摂食障害を、処理されていない植物上のものと比較することにより測定する。
【0248】
表1〜6の化合物は、本テストにおいて良い活性を示す。例えば、特に、化合物3.12,3.13,3.15,3.20,3.21,3.107〜3.109、及び3.112は、害虫集団における80%超の減少をもたらす。
3.4.スポドプテラ・リトラリス(Spodoptera littoralis)に対する作用
若い大豆植物に、100ppm の活性成分を含む水性エマルジョン・スプレー混合物をスプレーし、そのスプレー−コーティングが乾燥した後、第3段階にある10匹のスポドプテラ・リトラリスの毛虫を宿らせ、そして次にプラスチック容器内に入れる。3日後、集団(数)におけるパーセンテージ低下及び摂食障害におけるパーセンテージ低下(%活性)を、処理された植物上の死んだ毛虫の数と摂食障害を、処理されていない植物上のものと比較することにより測定する。
【0249】
表1〜6の化合物は、本テストにおいて良い活性を示す。例えば、特に、化合物1.50,1.361,1.374,1.380,1.390,1.606,3.9,3.12〜3.16,3.20〜3.22,3.31,3.43,3.108,3.109,3.112,4.05,4.13,4.14,8.22、及び8.23は、上記害虫集団において80%超の減少をもたらす。
3.5.ニラパルバタ・ルゲンス(Nilaparvata lugens)に対する作用
米植物(rice plants)を、400ppm の活性成分を含む水性エマルジョン・スプレー混合物で処理する。そのスプレー−コーティングが乾燥した後、上記米植物に、第2及び第3段階にあるセミの幼虫を宿らせる。評価を21日後に行う。集団(数)におけるパーセンテージ低下(%活性)を、処理された植物上の生存セミの数を、処理されていない植物上のものと比較することにより測定する。
【0250】
表1〜6の化合物は、本テストにおいて良い活性を示す。
3.6.クロシドロミア・ビノタリス(Crocidolomia binotalis)に対する作用
若いキャベツ植物に、400ppm の活性成分を含む水性エマルジョン・スプレー混合物をスプレーする。そのスプレー−コーティングが乾燥した後、上記キャベツ植物に、第3段階にある10匹のクロシドロミア・ビノタリスの毛虫を宿らせ、そしてプラスチック容器内に入れる。評価を3日後に行う。集団(数)におけるパーセンテージ低下及び摂食障害におけるパーセンテージ低下(%活性)を、処理された植物上の死んだ毛虫の数と摂食障害を、処理されていない植物上のものと比較することにより測定する。
【0251】
表1〜6の化合物は、本テストにおいて良い活性を示す。
3.7.アンソノマス・グランディス(Anthonomus grandis)に対する作用
若い綿植物に、400ppm の活性成分を含む水性エマルジョン・スプレー混合物をスプレーする。そのスプレー−コーティングが乾燥した後、綿植物に、10匹のアンソノマス・グランディス成体を宿し、そしてプラスチック容器内に入れる。評価を3日後に行う。集団(数)におけるパーセンテージ低下、及び摂食障害におけるパーセンテージ低下(%活性)を、処理された植物上の死んだゾウムシの数と摂食障害を、処理されていない植物上のものと比較することにより測定する。
【0252】
表1〜6の化合物は、本テストにおいて良い活性を示す。
3.8.アオニジエラ・オーランチイ(Aonidiella aurantii)に対する作用
ポテト塊茎に、アオニジエラ・オーランチイのは行動物(crawlens)を宿らせる。約2週間後、上記ポテトを、400ppm の活性成分を含む水性エマルジョン又は懸濁スプレー混合物中に浸漬する。上記塊茎が乾燥したとき、それらをプラスチック容器内でインキュベートする。評価のために、10〜12週後、処理された集団の最初の次世代のは行動物の生存率を、処理されていない対照のものと比較する。
【0253】
表1〜6の化合物は、本テストにおいて良い活性を示す。
3.9.ベミシア・タバシ(Bemisia tabaci)に対する作用
ツルナシインゲン(Dwarf bean)植物を、ケージ・カゴ内に入れ、そしてそれにベミシア・タバシの成虫を宿す。産卵が生じた後、成虫の全てを取り出す。10日後、上記植物とその上にいる若虫(nymphs)に、400ppm の活性成分を含む水性エマルジョンスプレー混合物をスプレーする。さらに14日後、孵化した卵のパーセンテージを、処理されていない対照と比較して評価する。
【0254】
表1〜6の化合物は、本テストにおいて良い活性を示す。
B.殺ダニ作用
3.10.テトラニカス・ウルチカエ(Tetranychus urticae)に対する作用
若いインゲン豆植物に、テトラニカス・ウルチカエの混合集団を宿し、そして1日後、100ppm の活性成分を含む水性エマルジョン・スプレー混合物をスプレーし、そしてこれを25℃で6日間インキュベートし、そして次に評価する。集団(数)におけるパーセンテージ低下(%活性)を、処理された植物上の死んだ卵、幼虫、及び成虫の数を、処理されていない植物上のものと比較することにより測定する。
【0255】
表1〜6の化合物は、本テストにおいて良い活性を示す。例えば、特に化合物3.13,3.14,3.16,3.19〜3.22,4.13,4.30、及び4.33は、害虫集団における80%超の減少をもたらす。
3.11.パノニカス・ウルミ(Panonychus ulmi)(OP及びcarb.耐性)に対する作用
リンゴの苗木に、パノニカス・ウルミの生態雌を宿す。7日後、はびこった植物に、400ppm のテスト化合物を含む水性エマルジョン・スプレー混合物を、しずくが垂れるまでスプレーし、そして温室内で栽培する。評価を、14日後に行う。集団(数)におけるパーセンテージ低下(%活性)を、処理された植物上の死んだハダニ(spider mites)の数と、処理されていない植物上のものと比較することにより測定する。
【0256】
表1〜6の化合物は、本テストにおいて良い活性を示す。
C.殺内部寄生生物作用
3.12.注ぎ(pour−on)適用によるネコにおける成体ノミの防除
十分に成長したノミに対するテスト化合物の有効性を測定するために、各々2匹のネコである4群を使用する。各ネコに、100ネコ・ノミ[クテロセファリデス・フェリス(Ctenocephalides felis)(Bouche)]をはびこらせ、そしてこれを、体重1kg当り20mgの活性成分で処理する。この処理を、ネコの首のうしろ上の局所的に限定された領域に上記配合品を適用することにより行う。1群にノミをはびこらせたがプラセボ、すなわち、活性成分を含まない配合品だけで処理し、そして対照として役立たせた。他の群を、比較物質としてのニテンピラム(nitenpyram)で処理し;残りの2群を、テスト化合物で処理する。動物の毛皮からの生存ノミを櫛ですき、それをカウントし、そしてそのカウントされた数を、対照群及びニテンピラムにより処理された群におけるノミの数と比較することにより、各群において評価する。詳細な手順は以下のようなものである:各ネコに、0日目に処理直後に100匹のノミをはびこらせる。+1日目に、各動物を櫛ですき、生存ノミの数を測定し;次に生存ノミを、同一のネコ上に戻し、そして24時間後に、上記の櫛すき及び評価を繰り返す。上記の24時間後に未だ生存しているノミは、そのネコに戻さない。次に、上記手順を、+3日目、+7日目、+9日目、+14日目、+21日目、+28日目、+35日目、+42日目、及び+49日目に繰り返し、そしてこの方法で、有効性及び作用の継続時間を測定する。生存ノミが櫛ですかれて取り出される日には、約2.7mlの血液サンプルを各ネコから採取し−但し、対照群を除く−、そして活性成分の含有量を計測する。有効性を、以下の式に従って測定する:
【0257】
【数1】
【0258】
本発明に係る式(I)の化合物が、ニネンピラムに比較して優れた長期間の作用を達成していることが示される。
【0259】
イヌにおいては、上記テストは全く同様のやり方で進行する。同様の効果が、上記物質が注ぎ(pour−on)の形態ではなく、注射溶液の形態において投与されるときにも観察される。
3.13.皮下注射によるネコにおける成体ノミの防除
十分に成長したノミに対するテスト化合物の有効性を測定するために、生後1.5〜4年の各々2匹のネコである4群を使用する。各ネコに、100ネコ・ノミ[Ctenocephalides felis(Bouche)]をはびこらせ、そしてこれを、体重1kg当り20mgの活性成分で処理する。この処理を、左肩甲骨のうしろに活性成分の溶液を皮下注射することにより行う。1群をノミではびこらせたがプラセボ、すなわち活性成分を含まない配合品だけで処理し、そして対照として役立たせる。他の群を、比較物質としてニテンピラムで処理し;残りの2群をテスト化合物で処理する。評価を各場合において先の実施例と同様にして行う。
【0260】
皮下注射後、本発明に係る式(I)の化合物が、ニテンピラムと比較して優れた長期間の作用を達成することが示される。
【0261】
イヌを用いた同様のテストは、これに見合う結果を与える。
Claims (10)
- 以下の式:
R1 は、モノ−又はジ−置換されたフェニルであって、該置換基は、ハロゲン;C1 −C4 アルキル;C1 −C4 ハロアルキル;C1 −C4 アルコキシ;C3 −C6 シクロアルキル;−P(=O)(OC1 −C4 アルキル)2 ;非置換、又はシアノ、C1 −C4 アルキルスルホニル、フェノキシ、C1 −C4 アルコキシカルボニル、アミノカルボニル、フェニル−又はハロゲン−置換フェニルにより置換されたC2 −C6 アルケニル;非置換、又はヒドロキシ、C1 −C4 アルキルフェニル又はハロフェニルにより置換されたC2 −C6 アルキニル;シクロヘキセ−1−エン−1−イル;シクロヘキセ−1−エン−3−オン−1−イル;非置換、又はOH、ハロゲン、シアノ、C1 −C4 アルキル、C1 −C4 ハロアルキル、C1 −C4 アルコキシ、C1 −C4 ハロアルコキシ、C1 −C4 アルキルチオ、C1 −C4 ハロアルキルチオ、−CHO、−C(=O)−C1 −C4 アルキル、−CH(=NOR6)又は−C(C1 −C4 アルキル)(=NOR6)により置換されたフェニル;非置換、又はC1 −C4 アルキル若しくはC1 −C4 ハロアルキルにより置換されたフェニルアミノ;非置換、又はハロゲン、C1 −C4 アルキル、C1 −C4 ハロアルキル又はC1 −C4 ハロアルコキシにより置換されたフェノキシ;非置換、又はC1 −C4 ハロアルキルにより置換されたベンジルオキシ;又はフラニルであり;
あるいはR1は、ナフチル、フラニル、非置換又はハロゲン−置換チエニル、又は非置換若しくはフェニル−若しくはもC1 −C6 ハロアルキルフェニル−置換チアゾールであり;
R2 は、H、C1 −C4 アルキル、C1 −C4 アルキルチオ−C1 −C4 アルキル又はCH2 −NO2 であり;
R6 は、H、C1 −C4 アルキル又は−C(=O)−C1 −C4 アルキルであり;
Aは、単結合、O、C2 −C8 アルケニレン又はNH−CH2であり;
X1 は、ハロゲン又はC1 −C4 アルキルであり;
X2 とX3 は、互いに独立して、H、ハロゲン又はC1 −C4 アルキルであり;
但し、上記基A−R1 並びにX1 、X2 及びX3 により置換されたフェニル基は、上記トリアジン環上で互いに対してビシナル位にはなく、
さらに但し、X2 とX3 がHであり、Aが単結合であり、R1 がフェニル、2−フルオロフェニル、p−フルオロフェニル又は3−クロロフェニルであり、そしてR2 がHであるとき、X1 は、CH3 ではない。}で表される化合物。 - Aが、単結合である、式(I)を有する、請求項1に記載の化合物。
- X1 が、フッ素、塩素又はメチルである、式(I)を有する、請求項1又は2に記載の化合物。
- X2 とX3 が、互いに独立して、水素、フッ素、塩素又はメチルである、式(I)を有する、請求項1〜3のいずれか1項に記載の化合物。
- R1 が、モノ−又はジ−置換されたフェニルであり、ここで、該置換基は、ハロゲン、C1 −C2 アルキル、C1 −C2 ハロアルキル、C1 −C2 アルコキシ、非置換又はモノ−若しくはジ−置換フェニル(ここで、該フェニルの置換基は、ハロゲン、C1 −C2 アルキル、C1 −C2 ハロアルキル、C1 −C2 アルコキシ、C1 −C2 ハロアルコキシ、C1 −C2 アルキルチオ及びC1 −C2 ハロアルキルチオからなる群から選ばれる)、及びフェノキシからなる群から選ばれる、式(I)を有する、請求項1〜4のいずれか1項に記載の化合物。
- R1 が、モノ−又はジ−置換されたフェニルであり、ここで、該置換基は、ハロゲン、メチル、ハロメチル、メトキシ、ハロメトキシ、非置換又はモノ−若しくはジ−置換フェニル(ここで、該置換基は、ハロゲン、メチル、ハロメチル、メトキシ、ハロメトキシ、メチルチオ及びハロメチルチオからなる群から選ばれる)、及びフェノキシからなる群から選ばれる、式(I)を有する、請求項1〜5のいずれか1項に記載の化合物。
- R2 が、H又はC1 −C4 アルキルである、式(I)を有する、請求項1〜6のいずれか1項に記載の化合物。
- R1 が、モノ−〜ジ−置換されたフェニルであり、ここで、該置換基は、ハロゲン、メチル、ハロメチル、メトキシ、ハロメトキシ、非置換又はモノ−若しくはジ−置換フェニル(ここで、該置換基は、ハロゲン、メチル、ハロメチル、メトキシ、ハロメトキシ、メチルチオ及びハロメチルチオからなる群から選ばれる)、及びフェノキシからなる群から選ばれ;
R2 が、H又はC1 −C4 アルキルであり;
Aが、単結合であり;
X1 が、フッ素、塩素又はメチルであり;
X2 が、フッ素又は塩素であり;そして
X3 が、Hである、式(I)を有する、請求項1に記載の化合物。 - 活性成分として少なくとも1の請求項1〜8のいずれか1項に記載の式(I)の化合物、及び少なくとも1のアジュバントを含む、害虫(pest)防除用組成物。
- 害虫防除における、請求項1〜8のいずれか1項に記載の式(I)の化合物の使用。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CH83299 | 1999-05-04 | ||
| CH832/99 | 1999-05-04 | ||
| PCT/EP2000/003921 WO2000066568A1 (en) | 1999-05-04 | 2000-05-02 | Pesticidal triazine derivatives |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2002543191A JP2002543191A (ja) | 2002-12-17 |
| JP4782289B2 true JP4782289B2 (ja) | 2011-09-28 |
Family
ID=4196248
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2000615599A Expired - Fee Related JP4782289B2 (ja) | 1999-05-04 | 2000-05-02 | 農薬トリアジン誘導体 |
Country Status (23)
| Country | Link |
|---|---|
| US (1) | US6723720B2 (ja) |
| EP (1) | EP1175410B1 (ja) |
| JP (1) | JP4782289B2 (ja) |
| KR (1) | KR100746498B1 (ja) |
| CN (1) | CN1171880C (ja) |
| AT (1) | ATE312085T1 (ja) |
| AU (1) | AU762755B2 (ja) |
| BR (1) | BR0010294A (ja) |
| CA (1) | CA2368582C (ja) |
| CO (1) | CO5210943A1 (ja) |
| CZ (1) | CZ20013961A3 (ja) |
| DE (1) | DE60024610T2 (ja) |
| DK (1) | DK1175410T3 (ja) |
| ES (1) | ES2254165T3 (ja) |
| HU (1) | HUP0600529A2 (ja) |
| ID (1) | ID30390A (ja) |
| IL (2) | IL145543A0 (ja) |
| MX (1) | MXPA01011054A (ja) |
| PL (1) | PL351434A1 (ja) |
| RU (1) | RU2252217C2 (ja) |
| TW (1) | TWI250153B (ja) |
| WO (1) | WO2000066568A1 (ja) |
| ZA (1) | ZA200108943B (ja) |
Families Citing this family (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6969716B2 (en) * | 2003-02-07 | 2005-11-29 | Merck Sharp & Dohme Ltd. | 5-phenyl[1,2,4]triazines as ligands for GABA-A α2/α3 receptors for treating anxiety or depression |
| US20060047171A1 (en) * | 2003-12-22 | 2006-03-02 | Harold Meckler | Catalytic hydrogenation of nitriles to produce capsaicinoid derivatives and amine compounds, and methods for purifying and obtaining the polymorphs thereof |
| WO2005104846A1 (en) * | 2004-04-14 | 2005-11-10 | Fmc Corporation | Dispersible pesticidal compositions |
| US7834178B2 (en) * | 2006-03-01 | 2010-11-16 | Bristol-Myers Squibb Company | Triazine 11-beta hydroxysteroid dehydrogenase type 1 inhibitors |
| RU2329796C1 (ru) * | 2007-02-09 | 2008-07-27 | Общество с ограниченной ответственностью "Научно-внедренческий центр Агроветзащита" | Способ лечения и профилактики арахно-энтомозов млекопитающих животных и лекарственное средство для лечения и профилактики арахно-энтомозов млекопитающих животных |
| RU2340181C1 (ru) * | 2007-03-06 | 2008-12-10 | Александр Анатольевич Хахалин | Инсектоакарицидное средство "инсектал-плюс" |
| TW200904331A (en) * | 2007-06-15 | 2009-02-01 | Bayer Cropscience Sa | Pesticidal composition comprising a strigolactone derivative and an insecticide compound |
| UA108619C2 (xx) * | 2009-08-07 | 2015-05-25 | Пестицидні композиції | |
| CN102822150B (zh) | 2010-02-05 | 2014-12-03 | 赫普泰雅治疗有限公司 | 1,2,4-三嗪-4-胺衍生物 |
| KR101295228B1 (ko) * | 2011-01-05 | 2013-08-09 | 동부팜한농 주식회사 | 축사 및 양계 소독용 살충제 조성물 및 이의 제조방법 |
| CN102442960B (zh) * | 2011-09-30 | 2014-12-24 | 武汉工程大学 | 一种三聚氯氰衍生物及其制备方法和应用 |
| WO2013180194A1 (ja) * | 2012-05-30 | 2013-12-05 | 住友化学株式会社 | 縮合複素環化合物 |
| US10662157B2 (en) | 2016-04-06 | 2020-05-26 | Sumitomo Chemical Company, Limited | Heterocyclic compound |
| AU2017388691B2 (en) | 2016-12-27 | 2020-12-03 | Nihon Nohyaku Co., Ltd. | 4H-pyrrolopyridine compound or salt thereof, agricultural and horticultural insecticide comprising the compound or the salt, and method for using the insecticide |
| CN108586369B (zh) * | 2018-05-30 | 2021-08-17 | 中国科学院长春应用化学研究所 | 苯基三嗪化合物的制备方法及苯基吡啶化合物的制备方法 |
| CN114478417A (zh) * | 2022-02-18 | 2022-05-13 | 郑州萃智医药科技有限公司 | 5-对甲苯基-1,2,4-三嗪-3(2h)-酮的合成方法 |
| WO2024193699A1 (zh) * | 2023-03-23 | 2024-09-26 | 成都赜灵生物医药科技有限公司 | 三嗪类化合物及其用途 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5231085A (en) * | 1975-08-27 | 1977-03-09 | Bayer Ag | 33alkoxyybenzoo1*2*4**triazine preparation method thereof and uses as germicide and bactericide |
| JPS62169705A (ja) * | 1986-01-21 | 1987-07-25 | Rikagaku Kenkyusho | 植物病害防除剤 |
| JPH01132580A (ja) * | 1987-10-16 | 1989-05-25 | Ciba Geigy Ag | N−アミノ−1,2,4−トリアジノン、その製造方法及び有害生物防除におけるそれらの使用方法 |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SU598561A3 (ru) * | 1976-03-17 | 1978-03-15 | Эли Лилли Энд Компани (Фирма) | Способ получени производных 5,6-диарил-1,2,4-триазина и их солей |
| US4931487A (en) | 1988-03-04 | 1990-06-05 | Dow Chemical Company | Chain extenders for polyurethanes |
| JP2967997B2 (ja) * | 1989-06-09 | 1999-10-25 | 旭化成工業株式会社 | ポリアミドマルチフィラメントの製造方法 |
| FR2671551B1 (fr) | 1991-01-15 | 1993-03-12 | Adir | Nouveaux composes de structure aryl triazinique, leur procede de preparation et les compositions pharmaceutiques qui les contiennent. |
| GB2293380A (en) | 1994-09-22 | 1996-03-27 | Zeneca Ltd | Pesticidal heterocyclic and phenyl compounds |
| JP2000504016A (ja) | 1996-02-01 | 2000-04-04 | スミスクライン・ビーチャム・コーポレイション | エンドセリンレセプターアンタゴニスト |
| JPH10265464A (ja) | 1997-03-24 | 1998-10-06 | Sumitomo Pharmaceut Co Ltd | Ldl受容体遺伝子発現増強剤 |
| IT1300056B1 (it) * | 1998-04-17 | 2000-04-05 | Boehringer Ingelheim Italia | Eterocicli con anello a 6 termini difenil-sostituiti loro procedimento di preparazione e loro impiego come farmaci |
-
2000
- 2000-04-26 CO CO00030047A patent/CO5210943A1/es not_active Application Discontinuation
- 2000-05-02 DE DE60024610T patent/DE60024610T2/de not_active Expired - Fee Related
- 2000-05-02 MX MXPA01011054A patent/MXPA01011054A/es active IP Right Grant
- 2000-05-02 WO PCT/EP2000/003921 patent/WO2000066568A1/en not_active Ceased
- 2000-05-02 ES ES00922671T patent/ES2254165T3/es not_active Expired - Lifetime
- 2000-05-02 CZ CZ20013961A patent/CZ20013961A3/cs unknown
- 2000-05-02 HU HU0600529A patent/HUP0600529A2/hu unknown
- 2000-05-02 KR KR1020017014062A patent/KR100746498B1/ko not_active Expired - Fee Related
- 2000-05-02 PL PL00351434A patent/PL351434A1/xx not_active Application Discontinuation
- 2000-05-02 AT AT00922671T patent/ATE312085T1/de not_active IP Right Cessation
- 2000-05-02 JP JP2000615599A patent/JP4782289B2/ja not_active Expired - Fee Related
- 2000-05-02 IL IL14554300A patent/IL145543A0/xx active IP Right Grant
- 2000-05-02 DK DK00922671T patent/DK1175410T3/da active
- 2000-05-02 TW TW089108277A patent/TWI250153B/zh not_active IP Right Cessation
- 2000-05-02 ID IDW00200102331A patent/ID30390A/id unknown
- 2000-05-02 EP EP00922671A patent/EP1175410B1/en not_active Expired - Lifetime
- 2000-05-02 AU AU42986/00A patent/AU762755B2/en not_active Ceased
- 2000-05-02 RU RU2001132322/04A patent/RU2252217C2/ru active
- 2000-05-02 CN CNB008071047A patent/CN1171880C/zh not_active Expired - Fee Related
- 2000-05-02 BR BR0010294-6A patent/BR0010294A/pt not_active Application Discontinuation
- 2000-05-02 CA CA2368582A patent/CA2368582C/en not_active Expired - Fee Related
-
2001
- 2001-09-21 IL IL145543A patent/IL145543A/en unknown
- 2001-10-30 ZA ZA200108943A patent/ZA200108943B/en unknown
- 2001-12-05 US US10/006,954 patent/US6723720B2/en not_active Expired - Fee Related
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5231085A (en) * | 1975-08-27 | 1977-03-09 | Bayer Ag | 33alkoxyybenzoo1*2*4**triazine preparation method thereof and uses as germicide and bactericide |
| JPS62169705A (ja) * | 1986-01-21 | 1987-07-25 | Rikagaku Kenkyusho | 植物病害防除剤 |
| JPH01132580A (ja) * | 1987-10-16 | 1989-05-25 | Ciba Geigy Ag | N−アミノ−1,2,4−トリアジノン、その製造方法及び有害生物防除におけるそれらの使用方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| ZA200108943B (en) | 2002-06-25 |
| DK1175410T3 (da) | 2006-04-18 |
| KR100746498B1 (ko) | 2007-08-07 |
| WO2000066568A1 (en) | 2000-11-09 |
| CN1171880C (zh) | 2004-10-20 |
| CN1349514A (zh) | 2002-05-15 |
| CA2368582A1 (en) | 2000-11-09 |
| CA2368582C (en) | 2010-07-13 |
| PL351434A1 (en) | 2003-04-22 |
| RU2252217C2 (ru) | 2005-05-20 |
| HUP0600529A2 (en) | 2007-01-29 |
| ATE312085T1 (de) | 2005-12-15 |
| US20030036544A1 (en) | 2003-02-20 |
| EP1175410A1 (en) | 2002-01-30 |
| CO5210943A1 (es) | 2002-10-30 |
| MXPA01011054A (es) | 2002-06-04 |
| DE60024610D1 (de) | 2006-01-12 |
| CZ20013961A3 (cs) | 2002-02-13 |
| IL145543A (en) | 2007-03-08 |
| AU4298600A (en) | 2000-11-17 |
| ID30390A (id) | 2001-11-29 |
| IL145543A0 (en) | 2002-06-30 |
| ES2254165T3 (es) | 2006-06-16 |
| AU762755B2 (en) | 2003-07-03 |
| DE60024610T2 (de) | 2006-08-03 |
| EP1175410B1 (en) | 2005-12-07 |
| BR0010294A (pt) | 2002-02-13 |
| JP2002543191A (ja) | 2002-12-17 |
| TWI250153B (en) | 2006-03-01 |
| US6723720B2 (en) | 2004-04-20 |
| KR20020011406A (ko) | 2002-02-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4782289B2 (ja) | 農薬トリアジン誘導体 | |
| KR0124933B1 (ko) | 치환된 n-피리딜메틸-n'-시아노구아니딘 및 그의 제법 | |
| JP2009007372A (ja) | 病虫害防除剤特性を有するn−スルホニルアミノアセトニトリル | |
| KR20040068335A (ko) | 4”위치에 아미노설포닐옥시 치환체를 갖는 아버멕틴 b1유도체 | |
| JP2004521131A (ja) | 4”位に置換基をもち殺虫特性を有するアベルメクチンの塩類 | |
| JP4643024B2 (ja) | 農薬ピリミジン誘導体 | |
| WO2003004474A1 (en) | Pesticidally active aminoacetonitriles | |
| JP2003508519A (ja) | 農薬としてのテトラヒドロピリジン | |
| JP2003502413A (ja) | 農薬活性テトラジン誘導体 | |
| JP2004521130A (ja) | N−置換テトラヒドロピリヂン及びそれらの農薬としての使用 | |
| JP2009502834A (ja) | アミドニトリル化合物 | |
| JP2005517029A (ja) | (1−ベンジル−ピペリジン−4−イル)−ジフェニル−メタノールの誘導体と、その誘導体を利用した殺虫剤 | |
| JP2005517029A6 (ja) | (1−ベンジル−ピペリジン−4−イル)−ジフェニル−メタノールの誘導体と、その誘導体を利用した殺虫剤 | |
| JP2003507477A (ja) | トリフルオロメチルピリ(ミ)ジンの誘導体 | |
| JP2007519639A (ja) | 複素環アリル誘導体 | |
| CN118355017A (zh) | 用于防治无脊椎有害生物的双环化合物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20070404 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100824 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20101122 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20101130 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110207 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20110607 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20110707 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140715 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| R360 | Written notification for declining of transfer of rights |
Free format text: JAPANESE INTERMEDIATE CODE: R360 |
|
| R360 | Written notification for declining of transfer of rights |
Free format text: JAPANESE INTERMEDIATE CODE: R360 |
|
| R371 | Transfer withdrawn |
Free format text: JAPANESE INTERMEDIATE CODE: R371 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: R3D02 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |