JP4748855B2 - 中枢神経系の疾病の処置における使用のための単離されたストロマ細胞 - Google Patents
中枢神経系の疾病の処置における使用のための単離されたストロマ細胞 Download PDFInfo
- Publication number
- JP4748855B2 JP4748855B2 JP2000533087A JP2000533087A JP4748855B2 JP 4748855 B2 JP4748855 B2 JP 4748855B2 JP 2000533087 A JP2000533087 A JP 2000533087A JP 2000533087 A JP2000533087 A JP 2000533087A JP 4748855 B2 JP4748855 B2 JP 4748855B2
- Authority
- JP
- Japan
- Prior art keywords
- cells
- cell
- isolated
- disease
- nervous system
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/28—Bone marrow; Haematopoietic stem cells; Mesenchymal stem cells of any origin, e.g. adipose-derived stem cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/177—Receptors; Cell surface antigens; Cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
- A61K38/2264—Obesity-gene products, e.g. leptin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/43—Enzymes; Proenzymes; Derivatives thereof
- A61K38/44—Oxidoreductases (1)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/43—Enzymes; Proenzymes; Derivatives thereof
- A61K38/46—Hydrolases (3)
- A61K38/48—Hydrolases (3) acting on peptide bonds (3.4)
- A61K38/482—Serine endopeptidases (3.4.21)
- A61K38/4846—Factor VII (3.4.21.21); Factor IX (3.4.21.22); Factor Xa (3.4.21.6); Factor XI (3.4.21.27); Factor XII (3.4.21.38)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- C07K14/4701—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals not used
- C07K14/4702—Regulators; Modulating activity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/575—Hormones
- C07K14/61—Growth hormones [GH] (Somatotropin)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/745—Blood coagulation or fibrinolysis factors
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/78—Connective tissue peptides, e.g. collagen, elastin, laminin, fibronectin, vitronectin, cold insoluble globulin [CIG]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2839—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the integrin superfamily
- C07K16/2845—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the integrin superfamily against integrin beta2-subunit-containing molecules, e.g. CD11, CD18
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0618—Cells of the nervous system
- C12N5/0622—Glial cells, e.g. astrocytes, oligodendrocytes; Schwann cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0652—Cells of skeletal and connective tissues; Mesenchyme
- C12N5/0662—Stem cells
- C12N5/0663—Bone marrow mesenchymal stem cells (BM-MSC)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y114/00—Oxidoreductases acting on paired donors, with incorporation or reduction of molecular oxygen (1.14)
- C12Y114/16—Oxidoreductases acting on paired donors, with incorporation or reduction of molecular oxygen (1.14) with reduced pteridine as one donor, and incorporation of one atom of oxygen (1.14.16)
- C12Y114/16002—Tyrosine 3-monooxygenase (1.14.16.2)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y304/00—Hydrolases acting on peptide bonds, i.e. peptidases (3.4)
- C12Y304/21—Serine endopeptidases (3.4.21)
- C12Y304/21022—Coagulation factor IXa (3.4.21.22)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/10—Growth factors
- C12N2501/135—Platelet-derived growth factor [PDGF]
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2502/00—Coculture with; Conditioned medium produced by
- C12N2502/08—Coculture with; Conditioned medium produced by cells of the nervous system
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2502/00—Coculture with; Conditioned medium produced by
- C12N2502/13—Coculture with; Conditioned medium produced by connective tissue cells; generic mesenchyme cells, e.g. so-called "embryonic fibroblasts"
- C12N2502/1311—Osteocytes, osteoblasts, odontoblasts
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2506/00—Differentiation of animal cells from one lineage to another; Differentiation of pluripotent cells
- C12N2506/13—Differentiation of animal cells from one lineage to another; Differentiation of pluripotent cells from connective tissue cells, from mesenchymal cells
- C12N2506/1346—Differentiation of animal cells from one lineage to another; Differentiation of pluripotent cells from connective tissue cells, from mesenchymal cells from mesenchymal stem cells
- C12N2506/1353—Differentiation of animal cells from one lineage to another; Differentiation of pluripotent cells from connective tissue cells, from mesenchymal cells from mesenchymal stem cells from bone marrow mesenchymal stem cells (BM-MSC)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2799/00—Uses of viruses
- C12N2799/02—Uses of viruses as vector
- C12N2799/021—Uses of viruses as vector for the expression of a heterologous nucleic acid
- C12N2799/027—Uses of viruses as vector for the expression of a heterologous nucleic acid where the vector is derived from a retrovirus
Description
【発明の分野】
本発明は、単離されたストロマ細胞を用いる、中枢神経系と関係する疾病、疾患または病気を患っている哺乳類を処置する組成物及び方法に関する。
【0002】
【発明の背景】
外傷、腫瘍形成または遺伝的もしくは他の成分を起源として有する哺乳類における神経学的損傷は、該哺乳類において処置し、そして/または元に戻すことが非常に困難である。中枢神経系に対する神経学的損傷の一つの処置は神経移植である。この数十年にわたって、中枢神経系の発生、可塑性及び再生を探るために神経移植が用いられている(McKay、1997、Science 276:66-71)。また、罹病及び損傷を受けた神経組織の修復及び機能的回復をもたらすためにも神経移植が用いられている(Bjorklund、1993、Nature 362:414-415;Olson、1997、Nature Med、3:1329-1335;Spencer等、1992、N.Engl.J.Med.327:1541-1548;Freed等、1992、N.Engl.J.Med.327:1549-1555;Kordower等、1995、N.Engl.J.Med.332:1118-1124;Defer等、1996、Brain 119:41-50;Lopez-Lozano等、1997、Transp.Proc.29:977-980;Rosenstein、1995、Exp.Neurol.33:106;Turner等、1993、Neurosurg.33:1031-1037;Kang等、1993、J.Neurosci.13:5203-5211;Andersson等、1993、Int.J.Dev.Neurosci.11:555-568;Sanberg等、1997、Nature Med.3:1129-1132)。特に、パーキンソン病にかかっている一連のヒト患者がヒト胎児の6−9週齢の流産児から得られた中脳細胞の神経移植により処置されている(Spencer等、1992、N.Engl.J.Med.327:1541-1548;Freed等、1992、N.Engl.J.Med.327:1549-1555;Kordower等、1995、N.Engl.J.Med.332:1118-1124;Defer等、1996、Brain 119:41-50;Lopez-Lozano等、1997、Transp.Proc.29:977-980)。それらの患者の中には、ポジトロン−エミッショントモグラフィーを用いてフルオロドーパの取り込みにより評価した場合に、臨床症状及びドーパミンの合成の両方において著しい改善を示したものがいた(Spencer等、1992、N.Engl.J.Med.327:1541-1548;Freed等、1992、N.Engl.J.Med.327:1549-1555;Kordower等、1995、N.Engl.J.Med.332:1118-1124;Defer等、1996、Brain 119:41-50)。しかしながら、治療的用途のために胎児組織を得る方法は、重要な論理学的及び倫理的障壁を提示してきた(Rosenstein、1995、Exp.Neurol.33:106;Turner等、1993、Neurosurg.33:1031-1037)。また、明らかにドーパミン作動性ニューロンに対する不都合な免疫反応のために(Lopez-Lozano等、1997、Transp.Proc.29:977-980)、そして胎児組織は糖分解よりむしろ脂質代謝に主に依存しているので(Rosenstein、1995、Exp.Neurol.33:106)、ドーパミン作動性ニューロンの約5−10%のみが生存する。これらの理由のために、神経移植のために適当な繊維芽細胞(Kang等、1993、J.Neurosci.13:5203-5211)、胎児アストロサイト(Andersson等、1993、Int.J.Dev.Neurosci.11:555-568)及びセルトリ−細胞(Sanberg等、1997、Nature Med.3:1129-1132)のような代わりの細胞を開発する試みが行われている。
【0003】
移植により、例えば脳腫瘍、脳外傷、ハンチントン病、アルツハイマー病、パーキンソン病及び脊髄損傷のような中枢神経系の疾病、疾患または病気を処置するために、ドナー細胞は容易に利用でき、培養して迅速に増やすことができ、免疫学的に不活性であり、宿主脳組織において長期間の生存及び組込みが可能であり、そして外来遺伝子の安定なトランスフェクション及び長期間の発現が容易にできるべきである(Bjorklund、1993、Nature 362:414-415;Olson、1997、Nature Med.3:1329-1335)。現在、これらの規準を満たすドナー細胞は利用できない。
【0004】
造血幹細胞に加えて、骨髄は、骨芽細胞、軟骨細胞、脂肪細胞及び筋芽細胞のような非造血細胞の幹様前駆体を含有する(Owen等、1988、Cell and Molecular Biology of Vertebrate Hard Tissues中、Ciba Foundation Symposium 136、Chichester、UK、pp.42-60;Caplan、1991、J.Orthop.Res.9:641-650;Prockop、1997、Science 276:71-74)。骨髄の非造血前駆体は、コロニー形成単位繊維芽細胞、間充織幹細胞及び骨髄ストロマ細胞(MSC)と様々に呼ばれている。
【0005】
MSCは、骨髄細胞が哺乳類から取り出され、プラスチック皿に移された場合にそれらの付着特性を特徴とする間充織前駆細胞である(Friendenstein等、1976、Exp.Hemat.4:267-274)。約4時間以内に、MSCはプラスチックに付着し、従って、皿から非付着細胞を除くことにより単離することができる。プラスチックにしっかりと付着する骨髄細胞、すなわちMSCは詳細に研究されている(Castro-Malaspina等、1980、Blood 56:289-30125;Piersma等、1985、Exp.Hematol 13:237-243;Simmons等、1991、Blood 78:55-62;Beresford等、1992、J.Cell.Sci.102:341-351;Liesveld等、1989、Blood 73:1794-1800;Liesveld等、Exp.Hematol 19:63-70;Bennett等、1991、J.Cell.Sci.99:131-139)。「MSC」及び「ストロマ細胞」という用語は本明細書において互換可能に用いられる。
【0006】
ストロマ細胞は、インビボで骨髄内の微環境の発生に関与すると考えられる。単離した場合、ストロマ細胞は最初静止しているが、最終的に分裂し始め、従って、それらをインビトロで培養することができる。ストロマ細胞の増やした数を樹立し、維持することができる。適切な条件下で培養した場合に繊維芽細胞性脂肪細胞性及び骨原性細胞のコロニーを作製するためにストロマ細胞が用いられている。また、それらを軟骨細胞及び筋芽細胞に分化させることもできる。それらの付着細胞をヒドロコルチゾンまたは他の選択条件の存在下で培養する場合、前駆体または骨原性細胞に富んだ集団が得られる(Carter等、1992、Blood 79:356-364及びBienzle等、1994、Proc.Natl.Acad.Sci USA、91:350-354)。
【0007】
疾病の処置のためにストロマ細胞を使用するいくつかの例がある。例えば、欧州特許EP 0,381,490は、ストロマ細胞を用いる遺伝子治療を開示している。特に、血友病の処置方法が開示されている。インビボで選択組織中に移植した場合に繊維性組織、骨または軟骨を作るためにストロマ細胞が用いられている(Ohgushi等、1989、Acte.Orthop.Scand.60:334-339;Nakahara等、1992、J.Orthop.Res.9:465-476;Niedzwiedski等、1993、Biomaterials 14:115-121;及びWakitani等、1994、J.Bone & Surg.76A:579-592)。ある報告では、ストロマ細胞は多孔性セラミックを用いて皮下に(Ohgushi等、1989、Acta.Orthop.Scand.60:334-339)、拡散室中で腹腔内に(Nakahara等、1991、J.Orthop.Res.9:465-476)、外科的に引き起こした骨欠損中に経皮的に(Niedzwiedski等、1993、Biomaterials 14:115-121)移植するかまたは関節軟骨における外科的欠損を修復するためにコラーゲンゲル内に(Wakitani等、1994、J.Bone Surg.76A:579-592)移植した場合にインビボで骨または軟骨を生じるために用いられている。Piersma等(1983、Brit.J.Hematol.94:285-290)は、静脈内骨髄移植後に、造血ストロマを構成する繊維芽細胞コロニー形成細胞が宿主骨髄中に入り、とどまることを開示している。Stewart等(1993、Blood 81:2566-2571)は、最近、全骨髄細胞の非常に多量の繰り返された投与が、骨髄除去を受けていないマウス中に造血前駆体の長期間の移植をもたらすことを認めた。また、Bienzle等(1994、Proc.Natl.Acad.Sci.USA、91:350-354)は、骨髄除去なしにイヌにおいて造血細胞を永続的に移植するためにドナー細胞としてと長期間の骨髄培養物をうまく用いた。ある報告では、造血前駆体の培養物のための微環境を樹立する細胞として(Anklesaria、1987、Proc.Natl.Acad.Sci.USA 84:7681-7685)または造血幹細胞に富んだ集団の供給源として(Kiefer、1991、Blood 78(10):2577-2582)ストロマ細胞を用いた。
【0008】
中枢神経系の疾病、疾患及び病気の成功した処置の不足を考えれば、中枢神経系の疾病、疾患または病気に冒された患者を処置するさらなる方法が以前として必要である。本発明はこの必要性を満たし、そして先行類似技術の処置の欠陥を克服する。
【0009】
【発明の要約】
本発明は、中枢神経系の疾病、疾患または病気にかかっているヒト患者の処置方法を含む。該方法は、ヒトドナーから骨髄サンプルを得ること、該骨髄サンプルからストロマ細胞を単離すること及び該単離されたストロマ細胞を該ヒト患者の中枢神経系に投与することを含んでなり、その場合、該中枢神経系における該単離されたストロマ細胞の存在は該疾病、疾患または病気の処置をもたらす。
【0010】
一つの態様として、ヒトドナーが中枢神経系の疾病、疾患または病気を患っておらず、そしてヒトドナーが該患者と同一遺伝子型である。
【0011】
別の態様として、ヒトドナーが該ヒト患者である。
【0012】
別の態様として、中枢神経系の疾病、疾患または病気が遺伝病、腫瘍、外傷及び脳卒中よりなる群から選択される。
【0013】
別の態様として、疾病、疾患または病気が中枢神経系の組織または細胞に対する損傷である。
【0014】
さらに別の態様として、疾病、疾患または病気が脳腫瘍である。
【0015】
一つの態様として、中枢神経系に投与された単離されたストロマ細胞が該中枢神経系において存在または複製したままである。
【0016】
別の態様として、単離されたストロマ細胞を投与する前に、それらの細胞をインビトロで培養する。
【0017】
さらに別の態様として、単離されたストロマ細胞を投与する前に、治療的タンパク質をコードする単離された核酸で単離されたストロマ細胞をトランスフェクトし、その場合、該タンパク質がそれらの細胞において発現される場合に該タンパク質が該疾病、疾患または病気の処置をもたらすように働く。
【0018】
好ましくは、治療的タンパク質がサイトカイン、ケモカイン、ニューロトロフィン及び抗体並びにグリオーマ有毒タンパク質よりなる群から選択される。
【0019】
別の態様として、単離されたストロマ細胞を投与する前に、治療的タンパク質をコードする単離された核酸で単離されたストロマ細胞をトランスフェクトし、その場合、そのようなタンパク質がそれらの細胞により分泌される場合に該タンパク質が該疾病、疾患または病気の処置をもたらすように働く。
【0020】
一つの態様として、単離された核酸がプロモーター/調節配列に操作可能に連結される。
【0021】
別の態様として、治療的タンパク質がサイトカイン、ケモカイン、ニューロトロフィン、抗体及びグリオーマ有毒タンパク質よりなる群から選択される。
【0022】
本発明の方法における単離された核酸は、突然変異した、機能しないまたは不十分に発現される遺伝子の野生型コピーであってもよく、その場合、該単離された核酸がプロモーター/調節配列に操作可能に連結され、そして単離されたストロマ細胞において発現される。
【0023】
本発明のさらに別の態様として、ストロマ細胞を投与する前に、分化した細胞の実質的に均質な集団の存在下でまたは細胞分化の誘導物質の存在下で該ストロマ細胞を共培養することにより該細胞を前以て分化させ、それにより該単離されたストロマ細胞が分化し、そして分化した細胞または誘導物質で処理した細胞に特有の分化表現型の表現型特性を獲得する。
【0024】
別の態様として、単離されたストロマ細胞の投与前に、該細胞をインビトロで培養し、該細胞中に単離された核酸を導入し、そして該細胞を前以て分化させるという工程の少なくとも一つを実施する。
【0025】
さらなる態様として、単離されたストロマ細胞を免疫学的に分離する。
【0026】
また、本発明は、単離されたストロマ細胞の分化を導く方法も含む。該方法は、分化した細胞の実質的に均質な集団の存在下でまたは細胞分化の誘導物質の存在下で単離されたストロマ細胞を培養することを含んでなり、それにより該単離されたストロマ細胞が分化し、そして分化した細胞または誘導物質で処理した細胞に特有の分化表現型の表現型特性を獲得する。
【0027】
好ましくは、分化した細胞がアストロサイト、マクログリア細胞及びニューロンよりなる群から選択される。
【0028】
脳腫瘍が処置される場合、一つの態様として、脳腫瘍がグリオーマである。
【0029】
治療的タンパク質が用いられる場合、一つの態様として、治療的タンパク質がグリオーマ有毒タンパク質である。好ましくは、グリオーマ有毒タンパク質がFasリガンド、上皮増殖因子受容体(EGFR)及びCD3に対して導かれる二重特異性単鎖抗体または上皮増殖因子受容体(EGFR)に対して導かれる抗体である。
【0030】
細胞のトランスフェクションを実施するある種の態様として、該トランスフェクションをレトロウイルスベクターを用いて実施する。
【0031】
ある種の別の態様として、単離されたストロマ細胞の投与方法が、脳中に直接それらの細胞を移植することによる。
【0032】
さらに、別の態様として、中枢神経系に投与された単離されたストロマ細胞が該中枢神経系において約150日までの間存在または複製したままである。
【0033】
さらに別の態様として、単離されたストロマ細胞を中枢神経系に投与した後、中枢神経系に投与された該単離されたストロマ細胞の約0.1%がマクログリア細胞、アストロサイトまたはニューロンへの分化のマーカーを発現することができる。好ましくは、分化のマーカーがグリア繊維酸性タンパク質である。
【0034】
一つの態様として、中枢神経系の疾病がパーキンソン病である。
【0035】
別の態様として、治療的タンパク質が用いられる場合、治療的タンパク質が中枢神経系の疾病、疾患または病気において欠失しているかまたは生産されない神経伝達物質の生合成において必要とされる酵素である。好ましくは、該神経伝達物質がL-DOPAであり、該処置がパーキンソン病に見られる表現型の減少をもたらす。また好ましくは、パーキンソン病に見られる該表現型がパーキンソン病のラットモデルにおいてアポモルヒネにより誘導される回転である。さらに好ましくは、本発明の方法において用いられる単離されたストロマ細胞がL-DOPAを少なくとも約3日間合成し、分泌し続け、そして該L-DOPAがL-DOPAの代謝産物に転化される。
【0036】
本発明は、中枢神経系の疾病、疾患または病気に冒されている患者を処置するための組成物及び方法を含む。該組成物は、組換えDNA技術を用いて遺伝子的に改変してもしなくてもよい単離された骨髄細胞である。該方法は、ドナーから骨髄サンプルを得、その骨髄サンプルからストロマ細胞を単離し、そして単離されたストロマ細胞を患者の中枢神経系に直接投与するという工程を含んでなる。
定義
冠詞「一つ(a)」及び「一つ(an)」は、その冠詞の文法的対象の一つまたは一つより多く(すなわち、少なくとも一つ)をさすために本明細書において用いられる。例として、「一つの要素」は、一つの要素または一つより多くの要素を意味する。
【0037】
本明細書において用いられる場合、「中枢神経系」は哺乳類の脳及び/または脊髄を含むと解釈されるべきである。また、その用語はある場合において眼及び視神経を含んでもよい。
【0038】
本明細書において用いられる場合、「ストロマ細胞」、「コロニー形成繊維芽細胞」、「骨髄ストロマ細胞」、「付着細胞」及び「MSC」は互換可能に用いられ、そして骨細胞、軟骨細胞及び脂肪細胞の幹細胞様前駆体として働くことができ且つプラスチック皿に付着するそれらの能力により骨髄から単離することができる骨髄中の細胞の小画分をさすものとする。ストロマ細胞はあらゆる動物由来であってもよい。ある態様として、ストロマ細胞は霊長類、好ましくはヒト由来である。
【0039】
本明細書において用いられる場合、「付着細胞」という用語はストロマ細胞をさすものとする。
【0040】
「非付着細胞」という用語は、本明細書において用いられる場合、造血前駆細胞をさすものとする。
【0041】
本明細書において用いられる場合、「中枢神経系の疾病、疾患または病気」という用語は、例えば神経変性疾患または原発腫瘍形成のような、中枢神経系の細胞により発現される遺伝子における遺伝的突然変異により引き起こされ、その結果、そのような突然変異の影響の一つが中枢神経系の異常な構造及び/または機能により明示される疾病、疾患または病気をさすものとする。そのような遺伝的欠陥は、中枢神経系の細胞における突然変異した、機能しないまたは不十分に発現される遺伝子の結果であってもよい。また、その用語は、中枢神経系の細胞における遺伝的欠陥それ自体の結果ではなく、むしろ中枢神経系に由来しない細胞、例えば中枢神経系における転移性腫瘍形成による中枢神経系の浸潤の結果である中枢神経系における他の異常も包含すると解釈されるべきである。また、その用語は、中枢神経系の組織に対する直接損傷により引き起こされる中枢神経系に対する外傷も含むと解釈されるべきである。さらにその用語は、薬物及びアルコール中毒、鬱病、精神分裂病、セロトニン(seratonin)摂取またはアヘン類受容体を伴う疾病、薬物の代謝等のような、しかしそれらに限定されない行動障害を含むと解釈されるべきである。また、その用語は、脳卒中及び塞栓も含むと解釈されるべきである。
【0042】
本明細書において用いられる場合、「遺伝子欠損を特徴とする疾病、疾患または病気」は、欠損のある遺伝子及び/または不十分な遺伝子発現がその疾病、疾患または病気に原因的に関連している疾病、疾患及び病気をさすものとする。遺伝子欠損を特徴とするいくつかの周知の疾病、疾患及び病気のいずれかにかかっている個体を当業者は同定することができる。
【0043】
本明細書において用いられる場合、「分泌タンパク質をコードする遺伝子における欠損を特徴とする疾病、疾患または病気」は、欠損があるかまたは不十分に発現される遺伝子が、細胞から異常に分泌されるタンパク質をコードする遺伝子欠損を特徴とする疾病、疾患または病気をさすものとする。
【0044】
「異常な分泌」という用語は、正常な、すなわち野生型の欠損のないタンパク質と異なるようにタンパク質が細胞においてプロセシングされることを意味する。例えば、正常なタンパク質は特定の構造立体配置で細胞から分泌することができ;そのタンパク質が異なる立体配置で分泌される場合にこのタンパク質の異常な分泌が起こる可能性がある。さらなる例として、正常なタンパク質が通常は細胞から分泌される場合、そのタンパク質が細胞から分泌されないか、または正常なタンパク質の分泌の通常レベルから著しく異なる、すなわち、より高いかもしくはより低いレベルで細胞から分泌される場合にタンパク質の異常な分泌が起こる可能性がある。
【0045】
本明細書において用いられる場合、「有益なタンパク質で処置することができる疾病、疾患または病気」は、その疾病、疾患または病気の特徴である原因及び/または症状を緩和するか、減少するか、防ぐか、または緩和、減少もしく予防をもたらすタンパク質の存在により処置するかまたは予防することができる疾病、疾患または病気をさすものとする。有益なタンパク質で処置することができる疾病、疾患及び病気は、遺伝子欠損を特徴とする疾病、疾患及び病気並びに遺伝子欠損を特徴としないがそれにもかかわらずその疾病、疾患または病気の特徴である原因及び/または症状を緩和するか、減少するか、防ぐか、または緩和、減少もしく予防をもたらすタンパク質の存在により処置するかまたは予防することができるものを含む。
【0046】
本明細書において用いられる場合、「有益なタンパク質」及び「異種起源のタンパク質」は互換可能であり、そして遺伝子欠損を特徴とする疾病、疾患または病気の疾病または症状に原因的に関連している欠損遺伝子によりコードされるタンパク質及び/または不十分な遺伝子発現を補うことができるタンパク質をさすものとする。そのタンパク質の存在は、疾病、疾患または病気の特徴である原因及び/または症状を緩和するか、減少するか、防ぐか、または緩和、減少もしく予防をもたらす。
【0047】
本明細書において用いられる場合、「腫瘍により引き起こされる中枢神経系の組織または細胞の損傷」は、通常脳における、組織の新たな増殖が起こる中枢神経系の疾病、疾患または病気をさすものとし、そして制御できず且つ進行性である細胞の増殖を含む。増殖する細胞は、中枢神経組織由来であってもよく、またはそれ由来でなくてもよい。
【0048】
本明細書において用いられる場合、「免疫学的に分離された」、「免疫学的に防御された」、「免疫学的に中和された」、及び「レシピエントの免疫系から細胞を物理的に分離する方法」は、移植した細胞が体の免疫系にさらされないかまたはそれにより除去することができないように、移植した体からのその細胞の封入、閉じ込めまたは他の物理的分離をさすものとし、その結果、免疫学的に分離された細胞がレシピエントの免疫系から物理的に分離されるように投与される。免疫学的分離方法の例は、マイクロカプセル化、生体適合性マトリックス、拡散室、移植できるカートリッジ、膜組立を有する移植装置及び膜を有する他の容器のような周知の技術及び装置を含むが、それらに限定されない。移植装置内で体内で細胞を維持することによりそれらを免疫学的に分離することが好ましい。
【0049】
「単離された核酸」という用語は、天然に存在する状態でそれに隣接する配列から精製されている核酸配列またはセグメントまたはフラグメント、例えば、フラグメントに通常隣接する配列、例えば天然に存在するゲノム中でフラグメントに隣接する配列からとり出されているDNAフラグメントをさすと解釈されるべきである。また、その用語は、核酸に生来付随する他の成分、例えば、細胞中で生来それに付随するRNAまたはDNAまたはタンパク質から実質的に精製されている核酸にも当てはまる。
【0050】
本明細書において用いられる場合、「単離された核酸分子」は、古典的トランスフェクション(リン酸カルシウムもしくはDEAEデキストランによりもたらされるトランスフェクション)、電気穿孔、微量注入、リポソームによりもたらされる導入、化学薬品によりもたらされる導入、リガンドによりもたらされる導入または組換えウイルスベクター導入のような、しかしそれらに限定されない方法により細胞中に導入されるまでストロマ細胞において存在しないかまたはストロマ細胞において十分に高レベルのタンパク質として発現されないものであってもよい。
【0051】
本明細書において用いられる場合、「遺伝子構築物」は、ストロマ細胞におけるコーディング配列の発現のために十分な要素を有するプロモーター/調節配列に操作可能に連結された有益なタンパク質をコードするコーディング配列を含む単離された核酸分子をさすものとする。
【0052】
本明細書において用いられる場合、「プロモーター/調節配列」は、プロモーター/調節配列に操作可能に連結された遺伝子の特異的発現のために必要とされるDNA配列を意味する。ある場合には、この配列はコアプロモーター配列であってもよく、そしてある場合には、この配列はエンハンサー配列及び組織特異的またはそうでなければ誘導的もしくは構成的に遺伝子を発現させるために必要とされる他の調節要素を含んでもよい。
【0053】
2つの核酸配列を「操作可能に連結された」と記述することは、本明細書において用いられる場合、一本鎖または二本鎖核酸成分がそれら2つの核酸配列の各々を含んでなり、そしてそれら2つの核酸配列の少なくとも一方がもう一方に対して特性化される生理学的作用を及ぼすことができるように2つの配列が核酸成分内で配置されることを意味する。
【0054】
本明細書において用いられる場合、「異種起源の遺伝子」は遺伝子構築物のコーディング配列をさすものとする。
【0055】
「異種起源のタンパク質」は、本明細書において用いられる場合、異種起源の遺伝子によりコードされるものである。
【0056】
本明細書において用いられる場合、「組換え遺伝子物質」及び「組換え遺伝子」という用語は互換的に用いられ、そしてストロマ細胞中に導入されるゲノムDNA、cDNA、合成DNA及びRNA、mRNA並びにアンチセンスDNA及びRNAをさすものとする。組換え遺伝子物質は、異種起源の遺伝子物質であってもよく、または個体もしくは動物において通常見い出される遺伝子物質のさらに一つのコピーもしくは複数のコピーであってもよい。ヒト疾病疾患または病気を処置するための方法において製薬学的組成物の成分として細胞を用いる場合、それらの細胞を形質転換するために用いる組換え遺伝子物質は、個体を処置するため及び/または細胞をより容易に移植できるようにするために用いられる治療に役立つものとして選択されるタンパク質をコードすることができる。
【0057】
本明細書において用いられる場合、「トランスフェクトしたストロマ細胞」は、古典的トランスフェクション(リン酸カルシウムもしくはDEAEデキストランによりもたらされるトランスフェクション)、電気穿孔、微量注入、リポソームによりもたらされる導入、化学薬品によりもたらされる導入、リガンドによりもたらされる導入または組換えウイルスベクター導入のような、しかしそれらに限定されない細胞中に核酸分子を導入するために用いられるいずれかの技術を用いて遺伝子構築物が与えられているストロマ細胞をさすものとする。
【0058】
本明細書において用いられる場合、「前以て分化させた」という用語は、単離されたストロマ細胞が分化し、そして分化した細胞の表現型特性を獲得するように分化した細胞の実質的に均質な集団または分化した細胞の産物または細胞分化の誘導物質と共培養した単離されたストロマ細胞を意味すると解釈されるべきである。
【0059】
本明細書において用いられる場合、「表現型特性」という用語は、以下の特性:形態学的外観、特定のタンパク質の発現、染色パターン及び物質で染色される能力の少なくとも一つを意味すると解釈されるべきである。
【0060】
「分化した細胞の実質的に均質な集団」という語句は、本明細書において用いられる場合、細胞の少なくとも75%が同じ分化した表現型を示す細胞の集団を意味すると解釈されるべきである。
【0061】
「分化を導く」という語句は、本明細書において用いられる場合、分化した細胞の実質的に均質な集団の存在下、分化した細胞の産物の存在下または細胞分化の誘導物質の存在下で未分化の細胞を共培養することにより未分化の細胞において分化した表現型を誘導することを意味すると解釈されるべきである。
【0062】
本明細書において用いられる場合、「グリオーマ有毒タンパク質」は、グリオーマ細胞の増殖を阻止し、そして/または殺すことができるタンパク質を意味すると解釈されるべきである。
記述
本発明は、プラスチックへの付着により単離されかつ哺乳動物の脳に注入されるMSCが、植え付け、移動しそして中枢神経系の細胞に分化する一方で、他の細胞は前駆細胞としてとどまるか、もしくは中枢神経系の細胞に分化する娘細胞を産むという発明に基づく。この発見は、個体、すなわち哺乳動物、および好ましくは中枢神経系に関連する疾病、疾患もしくは病気に罹っているヒト患者に正常の適合された(matched)同一遺伝子系のドナーから得られたストロマ細胞を提供すること、もしくは、個体からストロマ細胞を単離すること、当該細胞を培養すること、そして、中枢神経系における欠陥と関連する疾病、疾患もしくは病気の原因である遺伝的欠損はなんでも修正するようにそれらを遺伝子的に改変することのいずれかによる、個体の成功裏の治療を見込む。
【0063】
本発明の好ましい一態様において、適合されたドナーもしくは同一個体から得られたストロマ細胞を、病気に罹っているおよび損傷を受けている神経細胞を増加させるもしくは置き換えるための、中枢神経系に伴う疾病、疾患もしくは病気に罹っている個体に投与する。ストロマ細胞は好ましくはヒトに投与される。ストロマ細胞は、さらに好ましくはヒトの脳に投与される。いくつかの態様において、細胞はヒト脳の線条体部分に投与される。ストロマ細胞の投与の正確な部位は、治療されるべき病変の部位、治療されている疾病の型、ヒトの年齢および疾病の重篤度などを包含するがしかしこれらに制限されないいずれかの数の要因に依存するであろう。投与の部位の決定は、こうした細胞の投与に精通した当業者の熟練内に十分ある。
【0064】
ヒトの中枢神経系へのストロマ細胞の投与の様式は、治療されている疾病の型、ヒトの年齢、当該ストロマ細胞が分化されるか否か、ストロマ細胞がその中に導入された異種DNAを有するかどうか、などを包含するいくつかの要因に依存して変動してよい。直接に脳組織中へのストロマ細胞の投与の一例が本明細書の実験の詳細の節に提供される。その実施例においては、細胞を、最初に、それを通って当該細胞がその後に脳組織中に進められる頭蓋の孔を創製することにより、哺乳動物の脳に導入する。細胞は、直接注入、シャントを使用すること、もしくは化合物の中枢神経系への導入に当該技術分野で使用されるいずれかの他の手段により導入してよい。
【0065】
ストロマ細胞が中枢神経系の疾病を治療するために哺乳動物、好ましくはヒトで使用されてよい、いくつかの方法が存在する。例えば、ストロマ細胞は、中枢神経系への導入後に分化する前駆細胞として、もしくは中枢神経系への導入前に神経細胞に分化されている細胞として、または単純に分化せずにそして遺伝子産物の運び屋としてはたらく細胞として使用してよい。どの状況でも、本明細書に提示されるデータが確立するとおり、当該細胞は中枢神経系の永続的定住体(resident)となる。これらの細胞は、従って、遺伝病、外傷もしくは他の傷害の結果として喪失されている中枢神経系中の細胞を置き換えることができる。加えて、中枢神経系への導入前に、ストロマ細胞は、サイトカイン、ニューロトロフィンなどのような分子を産生するように遺伝子的に工作されてよく、これらは中枢神経系中に既に存在する細胞に有益に影響することができる。例えば、その後中枢神経系に導入される遺伝子的に工作されたストロマ細胞は、いかなる中枢神経系の損傷も修復するため、そして/もしくは中枢神経系の腫瘍と闘うために使用することができる。
【0066】
本明細書に提示されるデータは、ラットアストロサイトとともに共培養されるヒトストロマ細胞が、早期アストロサイトのマーカー、神経膠線維酸性タンパク質について陽性になることを確立する。言い換えれば、所望の細胞型とのストロマ細胞の共培養によりストロマ細胞の分化を指図することが可能である。さらに、ヒトストロマ細胞を、本明細書に提示されるデータに従ってマクログリア細胞に転換することが可能である。従って、中枢神経組織へのそれらの導入の前に所望の表現型に進化するように単離されたストロマ細胞を前分化させることが、本明細書に提示されるデータに従って可能である。中枢神経系に導入される単離されたストロマ細胞が、脳組織もしくは脊髄組織中で、稀突起神経膠細胞、シュヴァン細胞、ニューロンおよびアストロサイトに分化し得ることが、さらに可能である。
【0067】
これらの考慮に基づき、中枢神経系に直接導入される単離されたストロマ細胞を使用して治療可能である疾病の型は多い。例えば、新生児および小児のあいだで、当該細胞は、テイ−サックス病および関連するザントホフ病、フルラー症候群および関連するムコ多糖症、ならびにクラッベ病を包含するがしかしこれらに制限されない中枢神経系の多数の遺伝病の治療に使用することができる。変動する程度まで、これらの疾病はまた脊髄および末梢神経でも病変を生じさせ、そしてそれらはまた非神経学的影響も有する。これらの疾病の非神経学的影響が骨髄移植により治療可能であることができる一方、中枢神経系の影響は骨髄移植にもかかわらず改善しない。本発明の方法は、従って、これらの型の疾病の中枢神経系の影響を取り扱うのに使用することができる。加えて、新生児および小児において、出生の間もしくは出生後の頭部外傷の治療は、ストロマ細胞をそれらの小児の中枢神経系に直接導入することにより治療可能である。小児における中枢神経系の腫瘍の形成もまた本発明の方法を使用して治療可能である。
【0068】
中枢神経系の成人疾病に関しては、単離されたストロマ細胞は、パーキンソン病、アルツハイマー病、脊髄の傷害、卒中、外傷、腫瘍、筋委縮性側索硬化症のような脊髄の変性性疾病、ハンチントン病および癲癇の治療に有用である。多発性硬化症の治療もまた可能であるかも知れない。
【0069】
脊髄の傷害の治療が本発明の方法を使用して可能である。脊髄の傷害のいくつかの従来技術の治療方法は、線維芽細胞を使用して動物で脊髄の病変の部位へニューロトロフィンを送達することを必要とする。この様式で送達されたニューロトロフィンは病変を低下させるか、もしくは別の方法で傷害を治療するようはたらく。しかしながら、ストロマ細胞と異なり、線維芽細胞は、病変の部位で線維症を引き起こす大量のコラーゲンを産生することを継続し、それによりこの治療の有益な効果を無効にする。従って、遺伝子的に工作されたストロマ細胞を使用する脊髄の病変へのニューロトロフィンの送達は従来技術の方法を上回る有意の利点を有する。なぜなら、ストロマ細胞は大量のコラーゲンを産生せず、そして従って線維症を引き起こさないことができるからである。
【0070】
本明細書に提示されるデータは、中枢神経系へのストロマ細胞の直接導入が中枢神経系の疾病の治療に有用であることを確立するとは言え、ある例においては、単離されたストロマ細胞はまた眼に関連する疾病もしくは傷害の治療にも有用であることができる。ストロマ細胞は、眼に直接注入される場合に、網膜色素上皮、すなわち網膜の後表面の内側を覆いそして眼の錐状体および杆状体の栄養細胞としてはたらくようである細胞に分化することができる。あるいは、単離されたストロマ細胞を、ストロマ細胞を眼の細胞とともに共培養することにより網膜色素上皮に前分化させることが可能であるかも知れない。幹細胞が眼の細胞を生じさせることは魚類で観察されている。魚の眼は魚の一生の間中成長することを継続する。その例では、網膜色素上皮および網膜の光感受性細胞の双方に分化する眼の前方端に幹細胞が存在する。単離されたストロマ細胞は、視神経の網膜色素上皮細胞の変性性疾病を包含する眼の多様な変性性疾病を治療するのに使用することができる。これらの疾病は、高齢者で中央の視覚喪失につながる未知の起源の過程である黄斑変性を包含するが、しかしこれらに制限されない。糖尿病もしくは動脈硬化から生じる盲目、すなわち網膜の血管供給(vascular supply)の病変の結果である眼の疾病もまた包含される。加えて、例えばレーバー先天性黒内障のような希な疾病もまた本発明の方法を使用して治療可能であるかも知れない。
【0071】
本発明のいくつかの局面において、中枢神経系に影響を与えかつ遺伝子欠損を特徴とする疾病、疾患もしくは病気に罹っている個体は、欠損のある(defective)もしくは不完全な(deficit)神経学的細胞を、正常な神経学的細胞の遺伝子を正しく発現する細胞で補充する、増加させる、そして/もしくは置き換えることにより治療することができる。個体に導入されるべきである細胞は、正常な適合されたドナーから得られたストロマ細胞由来であってよいか、もしくは、それらは治療されるべき個体から得られたストロマ細胞であってよい。当該細胞はまた、欠損を修正するように遺伝子的に改変されてもよい。しかし、これは、当該細胞が遺伝子的に改変され得る唯一の例でない。
【0072】
本発明の別の態様において、中枢神経系に影響を与えかつ遺伝子欠損を特徴とする疾病、疾患もしくは病気に罹っている個体は、欠損のある細胞を、正常遺伝子を正しく発現する細胞で補充する、増加させる、そして/もしくは置き換えることにより治療し得る。当該細胞は、正常な適合されたドナーから得られたストロマ細胞もしくは治療されるべき個体から得られたストロマ細胞由来であってよい。当該細胞はまた欠損を修正するように遺伝子的に改変されてもよい。
【0073】
中枢神経系に影響を与えかつ遺伝子欠損を特徴とする疾病、疾患もしくは病気の一例は脳腫瘍である。脳腫瘍に罹っている個体は、正常な適合されたドナーから得られたストロマ細胞を投与されてよく、このストロマ細胞は正常な脳細胞に分化し、これを、腫瘍細胞を有する個体の脳細胞を置き換えるもしくは補充するのに使用してよい。正常細胞は脳中の欠損のある細胞を補償することができる。
【0074】
代替の一態様においては、ストロマ細胞が脳腫瘍に罹っている個体から単離され、そして腫瘍細胞を殺すもしくはその複製を別の方法で停止させることが可能な遺伝子が、単離されたストロマ細胞中に挿入される。トランスフェクトされた細胞がその後個体に再導入される。腫瘍細胞の成長および/もしくは複製が停止され、そして/または腫瘍細胞のアポトーシスが誘発される。
【0075】
本発明の一局面において、中枢神経系の疾病、疾患もしくは病気に罹っている個体は、以下のとおり治療し得る。単離されたストロマ細胞が得られ、それらが増殖され(expanded)、そして個体に全身的に投与される。単離/増殖されたストロマ細胞のいくつかは正常な脳細胞に発達することができる。正常なストロマ細胞は欠損のあるストロマ細胞よりもより迅速に増殖し、そして増殖された若返らされた集団は、正常細胞のより大きい比率を反映することができる。従って、ストロマ細胞の増殖されかつ若返らされた集団での中枢神経系組織の再集団化(repopulation)は、正常な中枢神経系細胞の集団を提供するようにはたらき、これらは中枢神経系組織中の欠損の修正を助長する。また、ストロマ細胞は、中枢神経系へのストロマ細胞の投与前に、本明細書に提供されるプロトコルに従うことにより例えばアストロサイトに前分化されることができる。
【0076】
欠損のある細胞を、適合されたドナーからの修復された細胞もしくは正常細胞で置き換えることに加え、本発明の方法はまた、中枢神経系中に分泌される場合に有益な影響を有する所望のタンパク質の発現を助長するのにも使用してよい。すなわち、ストロマ細胞を単離し、所望のタンパク質をコードする遺伝子を供給し、そして個体の中枢神経系組織に導入してよい。個体の中枢神経系での所望のタンパク質の発現は、当該個体で治療効果を発揮する。本発明のこの局面は、その中で治療的タンパク質が個体に投与される遺伝子治療に関する。
【0077】
本発明のいくつかの局面に従えば、免疫学的に単離されたトランスフェクトされたストロマ細胞を、遺伝子欠損を特徴とする疾病、疾患もしくは病気、および/または遺伝子治療のアプローチで組換えタンパク質を使用して治療し得る疾病、疾患もしくは病気を治療するための細胞治療薬として使用してよい。とりわけ、有益なタンパク質をコードする異種遺伝子を含んで成る遺伝子構築物がストロマ細胞中に導入される。トランスフェクトされたストロマ細胞をその後、免疫学的に単離し、そして、当該タンパク質が発現されそして中枢神経系の組織、好ましくは脳中に当該細胞により分泌される場合に利益を得るであろう個体に埋込む。
【0078】
免疫学的に単離されたストロマ細胞は細胞治療薬組成物でとりわけ有用である。なぜなら、異種遺伝子を発現しそして異種タンパク質を産生するための適する宿主であることに加えて、ストロマ細胞は、それらが免疫学的に単離される場合に好都合に機能するからである。免疫学的に単離されたストロマ細胞は、直接の血管の血液供給(vascular blood supply)を欠く位置に埋込まれる場合に非常に高い生存率を有する。さらに、ストロマ細胞は容易にかつすぐに得ることができ、それらは培養物中で迅速に増殖し、それらを、免疫学的に単離された細胞治療薬のための有用な細胞の十分な供給の良好な供給源とする。
【0079】
本発明に従えば、異種タンパク質をコードするヌクレオチド配列を含んで成る遺伝子構築物がストロマ細胞中に導入される。すなわち、当該細胞は、その発現が個体に対する治療効果を有する遺伝子を導入するように遺伝子的に変えられる。本発明のいくつかの局面に従えば、治療されるべき同一個体もしくは別の個体、または非ヒトの動物から得られたストロマ細胞は、欠損のある遺伝子を置き換え、そして/もしくはその発現が個体に対する治療効果を有する遺伝子を導入するように遺伝子的に変えられてよい。
【0080】
さらに、本発明に従えば、ストロマ細胞は免疫学的に単離され得るトランスフェクトされた細胞を調製しそして異種の有益なタンパク質を発現してそれにより個体中で遺伝子欠損を修正しそして/もしくは治療的タンパク質を産生するための手段を提供するのに有用である。ストロマ細胞は、比較的容易に単離することができ、また、単離されたストロマ細胞は、利用可能な細胞の数を増大させるように培養することができる。ストロマ細胞は、トランスフェクトし得、免疫学的に単離し得、そして皮下の位置のような直接の血液供給を欠く位置に高程度の生存率を伴って埋込み得る。
【0081】
いくつかの態様においては、ストロマ細胞を、SV40ウイルス、レトロウイルス、アデノウイルスもしくは他の形質転換するウイルスを使用すること、または形質転換する特性を有するタンパク質を使用することによるように不死化してよい。本発明のいくつかの局面においては、疾病、疾患もしくは病気に罹っている個体は、不完全な遺伝子の正常な機能するコピーを包含する遺伝子構築物を含有する免疫学的に単離されたストロマ細胞を提供することにより欠損のあるもしくは不完全な遺伝子を補充する、増加させるそして/もしくは置き換えることにより治療することができる。本発明のこの局面は遺伝子治療に関し、その中で、個体は、それについてそれらが存在および/もしくは機能が不完全である遺伝子を提供される。細胞により提供される遺伝子は個体の欠損のある遺伝子を補償する。なぜなら、当該遺伝子が中枢神経系組織で発現される場合に、個体における疾病、疾患もしくは病気を緩和もしくは別の方法で治療するようはたらくタンパク質が産生されるからである。こうした遺伝子は、好ましくは分泌されるタンパク質をコードする。
【0082】
ストロマ細胞はトランスフェクトされ、そして個体の中枢神経系に「そうであるように」もしくは免疫学的に単離された形態で投与される。いくつかの態様において、ストロマ細胞は、それに対し治療されるべき個体が当該遺伝子の突然変異されないコピーの完全な非存在を欠点として持つ、または突然変異されない形態の当該タンパク質の非存在もしくは不十分な発現を欠点として持つ遺伝子でトランスフェクトされる。ストロマ細胞は、発現可能な形態の遺伝子の突然変異されないコピーでトランスフェクトされる。すなわち、トランスフェクトされた遺伝子によりコードされるタンパク質は、好ましくは分泌性タンパク質としてストロマ細胞により発現されることができる。
【0083】
欠損のある遺伝子を機能的遺伝子で置き換えることに加え、本発明はまた、生物学的に活性の治療もしくは予防効果を発揮する所望の分泌性タンパク質を発現するのにも使用してよい。こうしたタンパク質は、好ましくは当該細胞により分泌される。すなわち、ストロマ細胞が単離されることができ、所望のタンパク質をコードする遺伝子を供給されることができ、それらはその後、そうであるようにもしくは免疫学的に単離された形態で個体に投与されることができ、そして所望のタンパク質がその中で発現される。本発明のこの局面に従えば、単離されたストロマ細胞は、治療的遺伝子を個体に導入するための運び屋、ならびに細胞が個体に投与される場合はこうした遺伝子の宿主としてはたらく。
【0084】
こうした態様において、ストロマ細胞は、治療されるべき個体で発現される場合に治療効果を有するタンパク質をコードする遺伝子でトランスフェクトされる。反復される投与を必要としてよい個体に直接治療的タンパク質を投与することよりもむしろ、本発明は、治療的タンパク質を産生する細胞を個体に投与することにより継続的様式で当該個体に当該タンパク質を投与する手段を提供する。ストロマ細胞は、発現可能な形態でタンパク質をコードする遺伝子でトランスフェクトされる。すなわち、トランスフェクトされた遺伝子によりコードされるタンパク質は、好ましくは分泌性タンパク質としてストロマ細胞中で発現されることができる。従って、本発明は、中枢神経系の疾病、疾患もしくは病気の治療方法を包含し、ここで、あるタンパク質をコードする遺伝子でトランスフェクトされるストロマ細胞が当該個体に投与される。当該タンパク質が発現され、そして治療効果を有する。治療的タンパク質の例は、サイトカイン、ケモカイン、ニューロトロフィンなどを包含するがしかしこれらに制限されない。加えて、薬物およびアルコール嗜癖、薬物代謝に関与する遺伝子、分裂病、うつの治療に関与する遺伝子を包含する、アヘン剤レセプター、セロトニン取り込みなどを巻き込む疾患のようなしかしこれらに制限されない挙動的疾患に関与する遺伝子が、これらの疾病および疾患の治療のためのそれらのタンパク質産物の送達のため、本発明で使用されてよいことが企図される。
【0085】
遺伝子構築物がストロマ細胞中にトランスフェクトされる全部の場合で、異種遺伝子は、ストロマ細胞中での遺伝子の発現を達成するために必要とされる適切なプロモーター/調節配列に操作可能に連結される。こうしたプロモーター/調節配列は、構成的および誘導可能な、ならびに/もしくは組織特異的および分化特異的なプロモーターを包含するがしかしこれらに制限されない。構成的プロモーターは、サイトメガロウイルス前初期プロモーターおよびラウス肉腫ウイルスプロモーターを包含するがしかしこれらに制限されない。加えて、ハウスキーピング遺伝子の発現を調節するもののようなハウスキーピングプロモーターもまた使用してよい。他のプロモーターは、神経膠線維酸性タンパク質をコードする遺伝子のプロモーターのような、しかしこれらに制限されない、中枢神経系の細胞で優先的に発現されるものを包含する。加えて、遺伝子発現が誘導可能であるようなプロモーター/調節要素を選択してよい。例えば、テトラサイクリンで誘導可能なプロモーターを使用してよい(Freundlichら、1997、Meth.Enzymol.283:159−173)。
【0086】
遺伝子構築物は、好ましくは、当該ベクターが細胞中にトランスフェクトされる場合にコーディング配列が当該細胞により発現されるような必須のプロモーター/調節配列に操作可能に連結された異種タンパク質のコーディング配列を包含する発現ベクターとして提供される。当該コーディング配列は、当該細胞中での当該配列の発現に必要なプロモーター/調節要素に操作可能に連結される。当該タンパク質をコードするヌクレオチド配列は、cDNA、ゲノムDNA、合成DNAもしくはそれらのハイブリッド、またはmRNAのようなRNA分子であってよい。
【0087】
プロモーター/調節要素に操作可能に連結された有益なタンパク質をコードするヌクレオチド配列を包含する遺伝子構築物は、機能するエピソーム分子として細胞中に存在したままでよいか、もしくは、それは当該細胞の染色体DNA中に組込んでよい。遺伝物質が細胞に導入されることができ、そこでそれはプラスミドの形態の別個の遺伝物質としてとどまる。あるいは、宿主細胞の染色体中に組込む可能性がある直鎖DNAを細胞に導入してもよい。DNAを細胞中に導入する場合は、染色体中へのDNA組込みを促進する試薬を添加してよい。組込みを促進するのに有用であるDNA配列もまたそのDNA分子中に包含してよい。あるいは、RNAを細胞中に導入してよい。
【0088】
遺伝子発現に必要であるプロモーター/調節配列中の要素は:プロモーター、開始コドン、終止コドンおよびポリアデニル酸化シグナルを包含する。これらの要素が、ストロマ細胞、もしくは個体へのストロマ細胞の注入後に当該細胞から生じる細胞中で操作可能であることが必要である。さらに、これらの要素が、当該ヌクレオチド配列をストロマ細胞中で発現し得そして従って当該タンパク質を産生し得るようなあるタンパク質をコードするヌクレオチド配列に操作可能に連結されることが必要である。開始コドンおよび終止コドンは、一般に、タンパク質をコードするヌクレオチド配列の一部分であると考えられる。しかしながら、これらの要素がストロマ細胞もしくはストロマ細胞から生じる細胞中で機能性であることが必要である。同様に、使用されるプロモーターおよびポルアデニル酸化シグナルは、ストロマ細胞もしくはストロマ細胞から生じる細胞内で機能性でなくてはならない。
【0089】
本発明を実施するために有用なプロモーター/調節配列の例は、サイトメガロウイルスプロモーター、SV40のプロモーターおよび多くのレトロウイルスプロモーターのような、多くの細胞で活性であるプロモーター/調節配列を包含するがしかしこれらに制限されない。本発明を実施するために有用なプロモーター/調節配列の他の例は、組織特異的プロモーター/調節配列、すなわちいくつかの組織で機能するがしかし他ではしないプロモーター/調節配列:また、特異的なもしくは一般的なエンハンサー配列を伴うもしくは伴わないストロマ細胞中で通常発現される遺伝子のプロモーター/調節配列を包含するがしかしこれらに制限されない。いくつかの態様において、エンハンサー配列を伴いもしくは伴わずにストロマ細胞中で遺伝子を構成的に発現するプロモーター/調節配列が使用される。エンハンサー配列は、適切なもしくは所望の場合にいくつかの態様で提供される。
【0090】
本発明を実施するために有用なポリアデニル酸化シグナルの例は、ヒトコラーゲンIポリアデニル酸化シグナル、ヒトコラーゲンIIポリアデニル酸化シグナル、およびSV40ポリアデニル酸化シグナルを包含するがしかしこれらに制限されない。
【0091】
発現ベクター中の遺伝物質が発現されるために、プロモーター/調節要素が、当該タンパク質をコードするヌクレオチド配列に操作可能に連結されなければならない。タンパク質の産生を最大にするために、所望の細胞での遺伝子発現に十分適するプロモーター/調節配列を選択してよい。さらに、その細胞で最も効率的に転写されるコドンを選択することができる。当業者は、所望の細胞で機能性である発現ベクターとして組換え遺伝物質を製造し得る。
【0092】
プロモーター/調節要素を、当該タンパク質の組織特異的発現を助長するよう選択してよいこともまた企図される。従って、例えば、異種遺伝子が免疫学的に単離されたストロマ細胞が埋込まれる組織中で発現されることができるのみであるような、特異的なプロモーター/調節配列が提供されてよい。加えて、遺伝子発現が誘導可能であるようなプロモーター/調節要素を選択してよい。例えば、テトラサイクリンで誘導可能なプロモーターを使用してよい(Freundlichら、1997、Meth.Enzymol.283:159−173)。
【0093】
異種タンパク質は、好ましくは、ストロマ細胞中での異種タンパク質の輸送および分泌を指図するシグナル配列を包含する。シグナル配列は、一般に、細胞からの成熟タンパク質の分泌に際してプロセシングされそして除去される。
【0094】
細胞中の遺伝子欠損を修正する、当該遺伝物質が個体での遺伝子欠損を修正するように十分な量および/もしくは機能的状態で別の方法で存在しないタンパク質をコードする、そして/またはそれに関連する特定の疾病、疾患もしくは病気の治療もしくは予防において治療薬として有用であるタンパク質をコードする、いずれかの組換え遺伝物質を細胞に提供することに加え、こうした終止(termination)が望ましくなる場合は、こうした細胞を選択的に終止するための一手段を提供するために、遺伝物質を本発明で使用されるストロマ細胞中に導入してもまたよい。破壊に細胞の標的を定めるためのこうした手段を、別の方法で遺伝子的に改変されるべきであるストロマ細胞、ならびにそれに他の組換え遺伝物質が導入されるべきでないものに導入してよい。
【0095】
本発明に従えば、単離されたストロマ細胞は、それらを破壊に特別に影響を受けやすくする遺伝物質を供給される。例えば、ストロマ細胞は、細胞傷害性の作用物質で特異的に標的を定められ得るレセプターをコードする遺伝子を提供されてよい。選択的な細胞死を誘発させるのに使用し得る、発現可能な形態の遺伝子を細胞に導入し得る。こうした系では、当該遺伝子によりコードされるタンパク質を発現する細胞は、特定の条件下で、または特定の作用物質の存在もしくは非存在下で標的を定められた殺傷の影響を受けやすい。例えば、発現可能な形態のヘルペスウイルスのチミジンキナーゼ(ヘルペスtk)遺伝子を細胞中に導入し得、そして選択的な細胞死を誘発するのに使用し得る。ヘルペスtk遺伝子を包含する導入された遺伝物質が個体に導入される場合、ヘルペスtkが産生されることができる。埋込まれた細胞を殺すことが望ましいもしくは必要である場合は、薬物ガンシクロビルを個体に投与し得、これはヘルペスtkを産生するいかなる細胞の選択的殺傷も引き起こすことができる。従って、埋込まれた細胞の選択的破壊を見込む系を提供し得る。
【0096】
ストロマ細胞は、ドナーから骨髄細胞を取り出すこと、そしてその細胞を、プラスチック表面もしくは細胞が接触する他の適切な表面をもつ滅菌容器中に置くことにより得ることができる。ストロマ細胞は30分ないし約3日以内でプラスチック表面に付着することができる。最低30分、好ましくは約4時間後に、付着されない細胞を除去しそして廃棄してよい。付着された細胞はストロマ細胞であり、これは当初、非分割性である。しかしながら、約2〜4日後に、この細胞は増殖することを開始し、そして標準的細胞培養技術を使用してそれらの数を増大させるように培養し得る。
【0097】
好ましい態様に従えば、ストロマ細胞は、付加的な補充物を含むもしくは含まない2〜20%のウシ胎児血清を補充された培地もしくは血清を含まない培地中で培養される。単離されたストロマ細胞は、当業者に容易に利用可能な公知の技術を使用してトランスフェクトしてよい。外来遺伝子を、ある遺伝子によりコードされるタンパク質を発現する細胞中にその遺伝子構築物を導入するために使用される標準的方法を使用してストロマ細胞中に導入してよい。いくつかの態様において、細胞は、リン酸カルシウム沈殿トランスフェクション、DEAEデキストラントランスフェクション、電気穿孔法、微小注入法、リポソーム媒介性導入、化学物質媒介性導入、リガンド媒介性導入もしくは組換えウイルスベクター導入によりトランスフェクトされる。
【0098】
いくつかの態様において、組換えアデノウイルスベクターが、所望の配列を有するDNAをストロマ細胞中に導入するのに使用される。いくつかの態様において、組換えレトロウイルスベクターが、所望の配列を有するDNAをストロマ細胞中に導入するのに使用される。いくつかの態様においては、標準的なリン酸カルシウム、DEAEデキストランもしくは液体担体媒介性トランスフェクション技術を、分割する細胞に所望のDNAを組込むのに使用する。標準的な抗生物質耐性選択技術を、トランスフェクトされた細胞を同定かつ選択するのに使用し得る。いくつかの態様において、DNAは微小注入により細胞中に直接導入される。同様に、公知の電気穿孔もしくは微粒子衝撃技術を、単離されたストロマ細胞中に外来DNAを導入するのに使用し得る。第二の遺伝子が、通常、治療的遺伝子とコトランスフェクトされるか、もしくはそれに連結される。第二の遺伝子は、頻繁に、選択可能な抗生物質耐性遺伝子である。トランスフェクトされた細胞は、選択可能な遺伝子を取り込まない細胞を殺す抗生物質中で細胞を成長させることにより選択し得る。2種の遺伝子が連結されずそしてコトランスフェクトされる大部分の場合、抗生物質処理を生き延びる細胞は双方の遺伝子を含有かつ発現する。
【0099】
ストロマ細胞を単離した後、当該細胞は、単離に際して、もしくはインビトロ培養の期間の後にヒトに投与し得る。単離されたストロマ細胞は、単離に際して投与してよいか、もしくは、単離後約1時間以内に投与してよい。一般に、ストロマ細胞は、ドナーが大型でありかつレシピエントが幼児である状況では、単離に際して直ちに投与してよい。ストロマ細胞を投与前に培養することが好ましい。単離されたストロマ細胞は、1時間から1年を越えるまで培養し得る。いくつかの好ましい態様においては、単離されたストロマは、それらを非循環細胞から複製する細胞に転換させるのに十分な時間の期間の間、投与前に培養される。いくつかの態様において、単離されたストロマ細胞は、3〜30日、好ましくは5〜14日、より好ましくは7〜10日間培養される。他の態様においては、単離されたストロマ細胞は、4週ないし1年、好ましくは6週ないし10ヶ月、より好ましくは3〜6ヶ月間培養される。
【0100】
他の態様において、単離されたストロマ細胞は、それらが中枢神経系の投与の前にアストロサイトもしくは他の神経細胞に分化するように共培養される。
【0101】
細胞がトランスフェクトされるはずである場合、単離された非循環性のストロマ細胞が最初にトランスフェクトされ、そしてその後非循環細胞として投与されるか;単離された非循環性のストロマ細胞が最初にトランスフェクトされ、その後それらを非循環細胞から複製する細胞に転換するのに十分な時間の期間の間培養され、そしてその後投与されるか;単離された非循環性のストロマ細胞が、最初に、それらを非循環細胞から複製する細胞に転換するのに十分な時間の期間の間培養され、それらがその後トランスフェクトされ、そしてその後投与されるか;もしくは、単離された非循環性のストロマ細胞が、最初に、それらを非循環細胞から複製する細胞に転換するのに十分な時間の期間の間培養され、それらがその後トランスフェクトされ、それらがその後培養され、そしてその後ヒトに投与されるかのいずれかである。いくつかの態様において、ストロマ細胞が単離され、トランスフェクトされそして直ちにヒトに投与される。
【0102】
ストロマ細胞がトランスフェクションおよび/もしくは投与前に培養されることが好ましい。単離されたストロマ細胞は、トランスフェクション前に、3〜30日、いくつかの態様においては5〜14日、他の態様においては7〜10日間培養し得る。トランスフェクトされたストロマ細胞は、投与前に、3〜30日、いくつかの態様においては5〜14日、いくつかの態様においては7〜10日間培養し得る。単離されたストロマ細胞は、トランスフェクション前に、3から30日、いくつかの態様においては5〜14日、いくつかの態様においては7〜10日培養し得、そして、トランスフェクションに際して、投与前に、3〜30日、いくつかの態様においては5〜14日、いくつかの態様においては7〜10日間付加的に培養し得る。いくつかの態様において、単離されたストロマ細胞は、トランスフェクション前に、4週ないし1年、いくつかの態様においては6週ないし10ヶ月、いくつかの態様においては3〜6ヶ月間培養される。トランスフェクトされたストロマ細胞は、投与前に、4週ないし1年、いくつかの態様においては6週ないし10ヶ月、いくつかの態様においては3〜6ヶ月間培養し得る。いくつかの態様において、単離されたストロマ細胞は、トランスフェクション前に、4週ないし1年、いくつかの態様において6週ないし10ヶ月、いくつかの態様において3〜6ヶ月間培養され、そして、トランスフェクションに際して、投与前に、4週ないし1年、いくつかの態様において6週ないし10ヶ月、いくつかの態様において3〜6ヶ月間さらに培養される。
【0103】
ヒトへのストロマ細胞の投与のためには、単離されたストロマ細胞を培養皿から取り出し、生理的食塩水で洗浄し、ペレットに遠心分離し、そしてブドウ糖溶液に再懸濁し、これを患者に注入する。いくつかの態様において、骨髄除去が、導入される細胞のための骨中の空間を作成するために注入前に着手される。シクロスポリンのような作用物質により抑制される免疫応答もまた考慮しなければならない。骨髄除去は、治療されるべき個体をX線照射すること、シクロホスファミドのような薬物を投与すること、もしくはX線照射および薬物投与の組み合わせにより達成することができる。いくつかの態様において、骨髄除去は、例えば放射活性ストロンチウム、135サマリウムもしくは166ホルミウムのような転移骨細胞を殺すことが既知の放射性同位元素の投与により生じられる(Applebaumら、1992、Blood 80(6):1608−1613を参照されたい)。
【0104】
骨髄除去がストロマ細胞の投与に先行する場合は、ストロマ細胞の投与は、生存に必要な血液細胞前駆体を含んで成る非付着細胞の投与により付随されなければならない。こうした非付着細胞は、ストロマ細胞の単離において出発原料と同一の使用されるサンプルからたくわえかつ保存してよいか、もしくは、それらは異なるサンプル由来であり得る。いくつかの好ましい態様において、非付着細胞はレシピエント/患者により提供される。骨髄除去を生じさせる処置の前に、患者/レシピエントの骨髄のサンプルを得かつ保存する。サンプル全体を使用しよいか、もしくは、非付着細胞を単離しそして単離されたストロマ細胞とともに投与するのに使用してよい。ストロマ細胞の投与とともに投与される非付着細胞は、ストロマ細胞投与の前もしくは後に別個に投与してよいか、または、投与前に単離されたストロマ細胞と混合してよい。
【0105】
いくつかの態様において、単離されたストロマ細胞は、実験的実施例の節に本明細書に記述されるような直接注入により脳に投与される。他の態様において、単離されたストロマ細胞は、単純注入などにより中枢神経系、すなわち脊髄に投与される。
【0106】
100kgの人当たり約105と約1013個との間の細胞が注入あたりに投与される。いくつかの態様において、約1.5×106と約1.5×1012個との間の細胞が、100kgの人あたり静脈内に注入される。いくつかの態様において、約1×109と約5×1011個との間の細胞が、100kgの人あたり静脈内に注入される。いくつかの態様において、約4×109と約2×1011個との間の細胞が、100kgの人あたりに注入される。いくつかの態様において、約5×108個の細胞と約1×101個との間の細胞が、100kgの人あたりに注入される。
【0107】
いくつかの態様において、細胞の単回投与が提供される。いくつかの態様においては複数の投与が提供される。いくつかの態様において、複数の投与が3〜7連続日の経過にわたって提供される。いくつかの態様においては、3〜7投与が3〜7連続日の経過にわたって提供される。いくつかの態様においては、5投与が5連続日の経過にわたって提供される。
【0108】
いくつかの態様においては、100kgの人あたり約105と約1013個との間の細胞の単回投与が提供される。いくつかの態様においては、100kgの人あたり約1.5×108と約1.5×1012個との間の細胞の単回投与が提供される。いくつかの態様においては、100kgの人あたり約1×109と約5×1011個との間の細胞の単回投与が提供される。いくつかの態様においては、100kgの人あたり約5×1010個の細胞の単回投与が提供される。いくつかの態様においては、100kgの人あたり1×1010個の細胞の単回投与が提供される。
【0109】
いくつかの態様において、100kgの人あたり約105と約1013個との間の細胞の複数の投与が提供される。いくつかの態様において、100kgの人あたり約1.5×108と約1.5×1012個との間の細胞の複数の投与が提供される。いくつかの態様において、100kgの人あたり約1×109と約5×1011個との間の細胞の複数の投与が、3〜7連続日の経過にわたって提供される。いくつかの態様において、100kgの人あたり約4×109個の細胞の複数の投与が、3〜7連続日の経過にわたって提供される。いくつかの態様において、100kgの人あたり約2×1011個の細胞の複数の投与が、3〜7連続日の経過にわたって提供される。いくつかの態様において、約3.5×109個の細胞の5投与が5連続日の経過にわたって提供される。いくつかの態様において、約4×109個の細胞の5投与が5連続日の経過にわたって提供される。いくつかの態様において、約1.3×1011個の細胞の5投与が5連続日の経過にわたって提供される。いくつかの態様においては、約2×1011個の細胞の5投与が5連続日の経過にわたって提供される。
【0110】
拡散チャンバー中のストロマ細胞は、Benayahuら、1989、J.Cell Physiol.140:1−7;Mardonら、1987、Cell Tissue Res.250:157−165に記述される。遺伝子構築物をストロマ細胞に導入した後、当該細胞を、直ちに、もしくはインビトロ培養の期間の後に免疫学的に単離し得る。ストロマ細胞は、それらが免疫学的に単離された後に埋込まれ得る。ストロマ細胞は、容易に入手可能な出発原料および/もしくは装置を使用するいずれかの数の公知の方法を使用して免疫学的に単離してよい。ストロマ細胞は、例えば、米国特許第4,391,909号、米国特許第4,806,355号、米国特許第4,942,129号および米国特許第5,334,640号に開示されるものを包含する多くのこうした微小被包化プロトコルを使用して微小被包化してよい。
【0111】
ストロマ細胞は、拡散可能な膜を使用するチャンバー中で個体に投与してよいか、もしくは、それらをマイクロビーズ中に被包化してよい。別の態様において、ストロマ細胞は、アミコン インク(Amicon,Inc.)(マサチューセッツ州ビバリー)から入手可能なもののような中空ファイバー中に含有される。これらのファイバーは、例えば、透析のためのカートリッジを作成するのに使用される。一端部は、その細胞により作成されるタンパク質の投薬量が減少されるべきである場合には皮膚の下から引き出され得そして大きさが減少され得る。当該ファイバーの表面積は非常に大きい。さらに、ファイバー中の細胞は定期的に洗い流され得そして置き換えられ得る。中空ファイバーは、アミコン インク(Amicon,Inc.)の刊行物第323号の50〜51ページに記述される。
【0112】
同様に、生物適合性マトリックス中のトランスフェクトされたストロマ細胞の組込みは、免疫学的に単離された状態で細胞を維持しつつ個体への有益なタンパク質の分泌を助長する。生物適合性マトリックスの例は、例えば、米国特許第4,902,295号および米国特許第4,997,443号に開示される。いくつかの態様において、トランスフェクトされたストロマ細胞は、膜集成体である組織埋込み系内にそれらをすっぽり入れることにより免疫学的に単離される。すなわち、細胞は最低1個の多孔質膜を包含する容器中に維持される。膜集成体内の細胞が免疫学的に単離される一方、有益なタンパク質が当該膜を通過することにより個体に利用可能にされることができる。膜集成体である埋込み装置は、米国特許第5,314,471号および米国特許第5,344,454号に記述されるものを包含するがしかしこれらに制限されない。本発明の一態様に従い、2個の10リング集成体を含んで成る埋込み装置が提供される。各リング集成体は、1個の環状のプラスチックリングおよび環の領域を覆う0.3ミクロンのミリポア(millipore)膜を含んで成る。トランスフェクトされたストロマ細胞は、円周で相互に連結される2個のリング集成体の間に配置される。構築された埋込み装置は好ましくは皮下に埋込まれる。
【0113】
いくつかの好ましい埋込み装置で、約105ないし約1013個の細胞が提供される。免疫学的に単離される場合に投与されるべき細胞の好ましい範囲は、細胞が免疫学的に単離されない場合に本明細書に記述されるとおりである。免疫学的に単離された細胞は、硬膜下腔の脳室中もしくは脳および脊柱のクモ膜下腔中に埋込まれてよい。
【0114】
ストロマ細胞が免疫学的単離の前に培養されることが好ましい。ストロマ細胞は1時間から1年を越えてまで培養し得る。いくつかの好ましい態様において、ストロマ細胞は、それらを非循環細胞から複製する細胞に転換させるのに十分な時間の期間の間培養される。いくつかの態様において、ストロマ細胞は、3〜30日、好ましくは5〜14日、より好ましくは7〜10日間培養される。いくつかの態様において、ストロマ細胞は、4週ないし1年、好ましくは6週ないし10ヶ月、より好ましくは3〜6ヶ月間培養される。好ましい態様において、細胞は、最初にトランスフェクトされてそしてその後免疫学的に単離され、その後非循環細胞として埋込まれる、単離された非循環性のストロマ細胞;最初にトランスフェクトされ、その後非循環細胞から複製する細胞に転換するのに十分な時間の期間の間培養され、その後免疫学的に単離されそしてその後埋込まれる、単離された非循環性のストロマ細胞;最初に、非循環細胞から複製する細胞に転換するのに十分な時間の期間の間培養され、その後トランスフェクトされ、その後免疫学的に単離されそしてその後埋込まれる、単離された非循環性のストロマ細胞;もしくは、最初に非循環細胞から複製する細胞に転換するのに十分な時間の期間の間培養され、その後トランスフェクトされ、その後培養され、その後免疫学的に単離され、そしてその後埋込まれる、単離された非循環性のストロマ細胞のいずれかである。いくつかの態様において、ストロマ細胞は単離され、トランスフェクトされ、免疫学的に単離され、そして埋込まれる。ストロマ細胞は、トランスフェクションの前および後、免疫学的単離の前に培養されることが好ましい。単離されたストロマ細胞は、トランスフェクション前に、3から30日、いくつかの態様においては5〜14日、いくつかの態様においては7〜10日、培養し得る。トランスフェクトされたストロマ細胞は、投与前に、3から30日、いくつかの態様においては5〜14日、いくつかの態様においては7〜10日、培養し得る。単離されたストロマ細胞は、トランスフェクション前に、3から30日、いくつかの態様においては5〜14日、いくつかの態様においては7〜10日、培養し得、そして、トランスフェクションに際して、投与前に3〜30日、いくつかの態様においては5〜14日、いくつかの態様においては7〜10日間、付加的に培養し得る。いくつかの態様においては、単離されたストロマ細胞は、トランスフェクション前に、4週ないし1年、いくつかの態様においては6週ないし10ヶ月、いくつかの態様においては3〜6ヶ月間培養される。トランスフェクトされたストロマ細胞は、埋込み前に、4週ないし1年、いくつかの態様においては6週ないし10ヶ月、いくつかの態様においては3〜6ヶ月間培養し得る。
【0115】
本発明は、以下の実験的実施例への言及によりさらに記述されるであろう。これらの実施例は具体的説明のみの目的上提供され、そして、別の方法で明記されない限り制限することを意図されない。従って、本発明は決して以下の実施例に制限されるとして解釈されるべきでないが、しかし、むしろ、本明細書で提供される教示の結果として明らかとなるいかなるおよび全部の変形物も包含するように解釈されるべきである。
【0116】
【実施例】
実施例1:結合組織の前駆細胞としてのストロマ細胞
組織−特異的方法でコラーゲンI用のヒト微小−遺伝子(mini-gene)を発現するトランスジェニックマウス系統からの細胞を使用して、培養で増殖する骨髄からの前駆間充織細胞が照射されたマウス中への静脈注入後に骨および他の結合組織の長期前駆体として機能しうるかどうかを測定した。標識遺伝子は短縮されたプロα1(I)鎖の合成をもたらすプロコラーゲンIのヒトプロα1(I)鎖をコードする内部欠失した微小−遺伝子からなっていた(Khillan et al., 1991, J. Biol. Chem. 266:23373-23379; Pereira et al., 1983, J. Clin. Invest. 91:709-716; および Sokolov et al., 1993, Biochemistry 32: 9242-9249)。遺伝子を発現する細胞は、内因性マウス遺伝子に関連するヒト微小−遺伝子のコピー数が約100〜1でありそして内因性マウス遺伝子により発現されるmRNAに関連するヒト微小−遺伝子により発現されるmRNAの定常状態水準がマウス組織中で約0.5:1であるトランジェニックマウス系統から得られた。
【0117】
間充織前駆体に関して部分的に富んだ骨髄から得られたドナー細胞は標準的プロトコールを用いて製造された(Friedenstein et al., 1976, Exp Hemat. 4:267-274; Castro-Malaspina et al., 1980, Blood 56:289-301; Piersma et al., 1985, Exp. Hematol 13:237-243; Simmons et al., 1991, Blood 78:55-62; Beresford et al., 1992, J. Cell. Sci. 102:341-351; Liesveld et al., 1989, Blood 73:1794-1800; Liesveld et al., 1990, Exp. Hematol 19:63-70; Bennett et al., 1991, J. Cell. Scil 99:131-139)。要するに、トランジェニックマウスからの長骨の端部を切断し、そして10%ウシ胎児血清(アトランタ・バイオロジカルズ(Atlanta Biologicals))を含有するα−MEM(ミズーリ州、セントルイスのシグマ・ケミカル・カンパニー(Sigma Chemical Company))が充填された加圧注射器で骨髄を抽出した。約107個の核生成された細胞を10%ウシ胎児血清を含有する25mlのα−MEM中で175cm2のプラスチック培養フラスコ上で平板培養した。4時間後に、培地を交換することにより非付着細胞を廃棄した。2〜4個の繊維芽細胞−様細胞を含有するフォーカスが2〜3日間で現れ、そしてフォーカスは約1週間で近−集密的コロニーに成長した。トリプシン消化後の収量は1個のフラスコ当たり約107個の細胞であった。細胞のほとんどは繊維芽細胞−様細胞であったが、細胞を位相差顕微鏡下で検査した時に少数のマクロファージおよび脂肪細胞も見られた。
【0118】
約105個の培養された付着細胞を、付着細胞の初期単離用に使用したのと同じ条件下で175cm2フラスコ中で4時間にわたる正常マウスからの骨髄のインキュベーションにより得られた6×105個の非−付着細胞と混合した。0.2〜0.4mlのα−MEMおよび10%ウシ胎児血清中の約7×105個の細胞の混合物を各々のレシピエント(recipient)マウスの尾静脈の中に注射した。
【0119】
同一近交系FVB/N系統からの生後8週間のマウスを137Cu照射器(アトミック・エネルギー・オブ・カナダ・リミテッド(Atomic Energy of Canada, Ltd.)での照射によりドナー細胞を受容する準備をした。装置は116cG/分の投与速度を有し、平行な向かい合った光線配置を有していた。各々の動物は2回ずつ4時間間隔で9.0Gy(4.5Gy+4.5Gy)を受容した(O'Hara et al., 1991, Exp. Hemat. 19:878-881)。第2回目の照射から1〜2時間後に、標識をつけた付着細胞および正常な非−付着細胞の混合物を静脈内注射した。細胞注入を受けなかった対照の照射されたマウスは骨髄不全の10〜13日後に死亡した。
【0120】
ドナー細胞の運命を追跡するために、ヒトCOLIA1微小−遺伝子およびマウス内因性COLIA1遺伝子に対する2種のPCR検定法を開発した。2−プライマー検定法を用いると、ヒト対マウス遺伝子の比に関する値は10-4〜約10+1の範囲にわたり線状であり、従って、1個のレシピエント細胞当たり約10-6〜10-1個のドナー細胞を生じた。3−プライマー検定法を用いると、値は約10-3〜10+2の範囲にわたり線状であり、従って、1個のレシピエント細胞当たり約10-5〜1個のドナー細胞を生じた。
【0121】
照射されたマウスの1日後の検定は、骨髄、脾臓、骨、肺または脳内で痕跡量だけのドナー細胞を示した(表1)。7日後に、わずかに高い水準が見られた。30日および150日では、ドナー細胞の子孫は骨髄、脾臓、骨および肺内の細胞の2.0〜12%を占めた(表1)。150日では、それらは顕微鏡下で石灰化または繊維状組織を含まない切開された剣状突起軟骨中の細胞の1.5〜5.0%を占めた。平均値は1〜5カ月の間で減少を示すように見えたが、骨髄、脾臓、骨および肺に関する合計値における統計学的に意義のある減少はこれらの二つの期間の間ではなかった(表1)。照射されなかったマウスの検定は、同じ時点でドナー細胞の非常に低い水準しか示さなかった(<0.0001〜0.05%)。肺の組織切片のPCRインシトゥ検定は、ドナー細胞の子孫が胞および気管支の両方の柔組織の中に均一に分布されたことを示した。
【0122】
ドナー細胞の子孫が軟骨中に存在することを確認するために、軟骨細胞を剣状突起および関節軟骨からDMEM中の0.5mg/mlの細菌コラゲナーゼ(ミズーリ州、セントルイスのシグマ・ケミカル・カンパニー)を用いる37℃における一夜消化により単離した。PCR検定は、ドナー細胞の子孫が単離された軟骨細胞の2.5%を占めたことを示した。
【0123】
ドナー細胞が集団化する組織の中で機能的な間充織細胞になったかどうかを測定するために、レシピエントマウスから得られた組織をドナー細胞内に含有されるコラーゲンI用のヒト微小−遺伝子の発現に関してRT−PCRにより検定した。150日で検定された3匹のマウスでは、微小−遺伝子が骨で発現され、その中の組織は半分以上コラーゲンI中で蛋白質を合成した。骨の中での発現は、大腿骨から単離されそして1週間培養された骨細胞に対する同様な検定を用いて確認された。コラーゲンI用の微小−遺伝子の発現は骨髄、脾臓および肺ではより可変的であり、その中の組織のコラーゲンI合成速度は骨の中より低い。予期されたように、微小−遺伝子は軟骨中では発現されず、その中の組織の半分以上で蛋白質がコラーゲンII中で合成されるが、コラーゲンIの合成はない。コラーゲンI用の微小−遺伝子も、標識遺伝子を含有しており且つコラーゲンIIを合成するがコラーゲンIは合成しないレシピエントマウスから得られた軟骨細胞の培養物の中では発現されなかった。
【0124】
ここに表示された結果は、照射されたマウスへの静脈注射後に付着細胞の膨張した培養物が数種の結合組織を効果的に集団化することを示す。これらの結果はまた、細胞がコラーゲンI用の標識遺伝子を組織−特異的な方法で発現しそしてそれらが肺の間葉の柔組織中に拡散導入されるため、それらはこれらの組織の真の前駆細胞として機能することも示す。
実施例2:MSC類の単離および培養に関する条件
MSC類が増殖するが幹細胞−様の表現型を保有するようなMSC類の培養条件を試験した。表Iは、骨片を用いるMSC類の共培養が1週間後に得られた細胞数を増加させたことを立証するデータを与える。同時に、骨を用いる共培養は細胞中のアルカリ性ホスファターゼ(APase)水準を減少させ、それは細胞が骨芽細胞へ分化しなかったことを示唆する観察結果である。また、タルタレート(tartarate)−耐性の酸ホスファターゼ(TRAP)の水準における減少もあり、それは細胞が骨芽細胞へ分化しなかったことを示唆する観察結果である。MSC類の二次培養でも同様な効果が観察された。従って、これらの結果は骨片を用いるMSC類の共培養がMSC類の増殖のための改良された条件を与えることを示唆する。また、培養された骨片の培地がサイトカイン類および培養中のMSC類の増殖のための成長因子の重要な原料であるかもしれない。
【0125】
関連実験では、MSC類の二次培養物を長期間にわたり保つことができることが見いだされた。MSC類は培養中に4カ月以上にわたりトリプシン処理および再−平板培養により継代させることができる。細胞は定常期培養中に非常に安定である。一つの実験では、静置培養物は4カ月以上にわたり1週間に約1回の再−補給で生存したままであった。別の実験では、誤って細胞が1カ月にわたり再−補給なしでインキュベーター中に残された時にもそれらは生存したままであった。
レトロウイルスベクターを用いるMSC類の安定なトランスフェクション
MSC類の感染用ウイルスを得るために、LNCZレトロウイルスベクター(Miller et al., 1989, Bio Techniques 7:980-990)を改質して、サイトメガロウイルス(pCMV)用のプロモーターがlacZ遺伝子の発現を誘発させた(図1)。ベクターはアンフォトロピック(amphotropic)ネズミパッケージング細胞系統(PA317)のに安定にトランスフェクトされた。構成ウイルスプロデューサークローンがG418選択により単離され、そしてクローンから得られた上澄み液がMSC類の感染用に使用された。MSC類の一次培養物(生後3日)に3日間連続して最高力価を有するプロデューサー系統から得られた新しい上澄み液を感染させた。5日後の細胞の染色は、細胞の約15−20%が典型的にlacZ遺伝子を発現したことを示した。感染細胞の数種の培養物を選択下でG418(0.44μg/mlの活性濃度)を用いて50日間放置した。回収された細胞のほとんどはlacZ遺伝子を発現し続けた。LNCZの改質も、lacZ遺伝子の発現がCOLA1遺伝子のプロモーターおよびCOL2A1遺伝子(pCOL2A1)のプロモーターにより誘発されるように構成された。lacZ遺伝子の発現はMSC類の一次培養物中で2種の構造zzを用いて好結果を伴って得られた。
実施例3:安定にトランスフェクトされたMSC類中のhGH、因子 IX またはObを用いるヒト遺伝子の長期発現
MSC類をマウスから単離しそして引用することにより本発明の内容となる Pereira et al., 1995, Proc. Natl. Acad. Sci. USA 92:4857-4861 に記載された条件下で培養した。MSC類にレトロウイルスベクターを感染させるかまたは裸のDNAを用いてトランスフェクトして、ヒト成長ホルモン(hGH)、ヒト肥満蛋白質(Ob)、またはヒト因子IX用の遺伝子を発現するクローンを得た。lacZ遺伝子はレトロウイルスベクターを用いてマウスのMSC類中に好結果を伴って導入されているため、同一ベクターの変種が使用される。同時に、MSCは電気穿孔法(Andreason et al., 1988, Bio Techniques 6:650-660; Toneguzzo et al., 1986, Mol. Call. Biol. 6:703-706)、リポフェクタミンおよび核注射(Mercer et al., 1992, In: Antisense Strategies, Ann. IV. Y. Acad. Sci. Biol. 660:209-218)を用いて安定にトランスフェクトされて、より大きい内因性遺伝子を使用することができる。さらに、レトロウイルスベクターの潜在的な欠点の一部は別の導入法を用いて回避される。
【0126】
単離および培養の標準的条件を以下に記す:生後6〜10週間のFVB/Nマウスの脛骨および大腿骨から、骨の端部を切断しそして1〜2mlの氷冷α−MEMおよび10%ウシ胎児血清(FBS)を含有する注射器を用いて骨髄を押し出すことにより、全骨髄を得る。貯蔵した骨髄細胞を静かな振盪により分散させそして自動式カウンター(クールター(Courter)モデルZM)の中で計数する。25mlのα−MEMおよび10%FBS中の5×106〜5×107個の核が生成された細胞を75−cm2培養フラスコ上で平板培養する。4時間または3日後に、非−付着細胞を培地の交換により除去する。付着細胞を約4日毎の再補給で10〜12日間にわたり一次培養物として膨張させる。細胞を0.25%トリプシンをおよび1〜5mM EDTAを用いる5分間にわたる37℃での消化とその後の静かなこすりとりにより回収する。細胞を10%FBSを有するα−MEMで希釈しそして6−ウェル平板の中で9.5cm2当たり3×104〜1×105個の細胞密度で再平板培養する。これらの条件下で、細胞の倍化時間は19〜22時間である。二次培養物は約4日毎に再補給され、そして同一条件下でトリプシン処理および再平板培養により継代される。
遺伝子構成体の製造
レトロウイルスベクターLNCXがこの構成体として使用される。構成体中の使いやすいクローニング部位が改質された構成体であるpRSV−lacZ、pCMV−lacZ、pCOL1/lacZおよびpCOL2−lacZを製造するために使用される(図1)。pCOL1プロモーターは、ヒトCOL1A1遺伝子の476bpのプロモーター、第一エキソンおよび大部分の第一イントロンを含有する1.4kb断片である。このプロモーターはトランスジェニックマウスでは無プロモーター形態のCOL2A1遺伝子を高度に組織特異的および成長特異的方法で発現することが示されている(Sokolov et al., 1995, J. Biol. Chem. 270:9622-9629)。COL2A1プロモーターは、発現の組織−特異性を与える(Bradham et al., 1994, J. Cell Physiol. 158:61-68)ヒトCOL2A1遺伝子(Ala-Kokko et al., 1991, J. Biol. Chem. 266:14175-14178)からの1kb断片である。lacZ遺伝子はhGH遺伝子(ニコルス・ラボラトリーズ(Nichols Laboratories))、OB遺伝子(Considine et al., 1995, J. Clin. Invest. 95:2986-2988)またはヒト因子IX遺伝子(ジェネティック・セラピー・インコーポレーテッド(Genetic Therapy, Inc.)で置換される。
レトロウイルスベクターの使用
レトロウイルスベクタープロデューサー細胞系統
プロデューサー細胞系統を制定するために、アンフォトロフィック(amphotrophic)レトロウイルスベクターパッケージングネズミ細胞PA317を使用した。細胞を100mm皿の中でレトロウイルスベクターのpBR322領域中で切るScaIを用いる消化により線状にされた15μgのプラスミドDNAを用いる燐酸カルシウム沈澱工程(プロメガ(Promega))により20%集密度でトランスフェクトした。トランスフェクトから1日後に、G418(GIBCO/BRL))を培地に1mg/mlの活性濃度で加えた。ネオマイシン−耐性コロニーが随時7〜10日で現れそして機械リングを用いるクローニングにより単離された。クローンを膨張させそして個々のクローンを二重ウェルの直接染色によりlacZを発現する能力に関して試験した。陽性細胞により製造されるウイルスの力価は、6−ウェルマイクロリットル平板中で1個のウェル当たり3mlの培地を用いて且つ4μg/mlのポリブレンの存在下で20%集密度まで成長させたHT−1080ヒト腫瘍細胞に対する50μlの培地の1回の添加により検定された。力価は、lacZ遺伝子の発現に関して陽性に染色したHT−1080細胞の数を測定することにより検定された。典型的には、力価は1×105〜1×106であった。
マウスMSC類のレトロウイルス感染
マウスMSC類の一次培養物を上記の通りにして製造した。3日後に、非−付着骨髄細胞を廃棄しそして新しい培地を加えた。細胞に次にレトロウイルスを4μg/mlのポリブレンの存在下でウイルス製造の最高力価を有する安定にトランスフェクトされたプロデューサー細胞からの1/4量の新しい上澄み液培地の添加により感染させた。感染をさらに2回毎日繰り返した。細胞を次にlacZ発現のために直接染色するかまたはより大きい皿に分けそして選択下で0.4mg/mlのG418(活性濃度)で放置した。一次培養物の約15〜20%はlacZに関して陽性でありそしてG418選択に耐えた細胞のほとんどがlacZに関して陽性であった。
リポフェクタミントランスフェクション
MSC類の一次培養物を10%FBSを含有するα−MEMの中で10日間成長させた。トリプシン処理および軽いこすりとり後に、細胞を6−ウェル平板の中に1個のウェル当たり105個の密度で接種した。細胞を2日間成長させ、次にPBSで2回洗浄しそしてDNA−リポフェクタミン錯体を用いてインキュベートした。DNA−リポフェクタミン錯体は下記の通りにして製造された:6μlのリポフェクタミン(GIBCO/BRL)を200μlのα−MEM中の1μgのLNCZ DNAと混合し、室温で30分間インキュベートし、そして800マイクロリットルのα−MEM中にMSC類を含有する6−ウェル平板の1つのウェルに加えた。37℃における6時間のインキュベーション後に、DNA−リポフェクタミン錯体を10%FBSを含有する2mlのα−MEMで置換する。FBS−含有培地中の18時間のインキュベーション後に、細胞をlacZに関して染色するかまたはG418選択下に置く。陽性クローンが得られるが、明らかに細胞密度がG418選択後に低すぎるためにそれらはゆっくり成長した。この状況を回避するために、三種の方式を使用することができる:細胞をより高い密度で平板培養する;共培養細胞培養挿入物を生存クローン上に選択方法で早めに置きそして新しいMSC類または挿入物中の骨片を毎日の基準で入れて(表1参照)成長を刺激するのに必要な細胞因子を与える;G418を用いるその選択がトランスフェクトされなかった細胞の多くを殺した時に、lacZ遺伝子がチミジンキナーゼに関する選択的遺伝子で置換されているレトロウイルスLNCX(図1)の変種を感染させたMSC類を培養物に再接種する。従って、レトロウイルスで安定にトランスフェクトされたMSC類を使用して必要なサイトカイン類、成長因子、およびG418中の選択中にトランスフェクトされたMSC類の初期成長に必要な細胞相互作用を与える。レトロウイルスで感染した細胞をガングシクロビル(gangcyclovir)を用いる負の選択により次に除去してもよい。分配方法
核注射
核注射は一部の細胞をトランスフェクトする手段として非常に有効である。細胞を、微量注射用領域の輪郭を描く円で印がつけられた22×22mmカバースリップを含有する60−mm皿の中で平板培養した。細胞を0.1%CSを含有する培地の中で5日間インキュベートして、微量注射前の成長停止を誘発させた。これらの条件下で、細胞の8〜15%が5および6日の間の24時間にわたる連続的標識つけ中に[3H]チミジンを組み入れた。微量注射はエッペンドルフ(Eppendorf)微量注射器および市販のガラス毛管フェムトチップス(femtotips)を用いる微量操作器が装備されたザイス・アキシオベルト反転顕微鏡を用いて行われた。カバースリップの輪郭が描かれた領域内の全ての細胞(一般的には150−200)をDNAを有する核の中に10mMトリス緩衝液(pH7.6)中0.01−10μg/μlの範囲の濃度で微量注射した。注射された細胞を次に膨張させそして上記の通りにして検定した。
電気穿孔法
MSC類を0.25%トリプシンおよび1〜5mM EDTAで5分間にわたり室温で処理しそして次にこすりとりにより回収した。細胞を4,000×gでの10分間にわたる遠心により造粒し、そして次にペレットを氷冷PBS(pH7.4)の中に再懸濁させることにより2回洗浄する。MSC類を0.8ml当たり2×106個の細胞に再懸濁させそして電気穿孔キュベット(0.4cm隙間)の中に試料を分けた。細胞を氷上で10分間インキュベートし、DNAを懸濁液(5−50μg)に加え、そして細胞をさらに10分間冷却する。細胞懸濁液を次に市販の器具(バイオラド・ジーン・パルサー(BioRad Gene Pulser)、モデル1652076)を用いて外から加えられたDNAを保有する細胞の最高割合を与える経験的に決められたフィールド強度で電気穿孔する。MSC類に関する適切なフィールド強度を決めるために、0.25〜2.5kv/cmの範囲で滴定を行った。lacZ遺伝子(LNCZベクター)を導入しそして次に細胞を電気穿孔から48〜72時間後に染色することにより、電気穿孔効果を監視した。
検定
hGH
市販のキット(GIBCO/BRL)を有する酵素結合された免疫吸収剤検定法を用いて6−ウェルマイクロリットル平板中で成長させた細胞のクローンからの培地を検定することにより、hGH遺伝子の発現を監視する。この検定では、0.1mlの2×希釈剤緩衝液がマイクロリットル平板の1つのウェル当たり加えられる。5分後に、0.1mlの試験サンプルを加えそして平板を37℃で30分間インキュベートする。ウェルを5回洗浄しそして1つのウェル当たり0.2mlの一次抗体を加える。サンプルを37℃で30分間インキュベートし、そして5回洗浄する。次に0−フェニレンジアミン基質を含有する0.2mlの基質緩衝液を加える。サンプルを室温で30分間インキュベートしそして反応を0.1mlの2N硫酸の添加により停止させる。サンプルの吸収は490nmで評価される。
Ob蛋白質
細胞を細胞培地の蛋白質放射免疫検定法を用いてOB遺伝子の発現に関して検定する。ヒトOB蛋白質の一次抗体をウサギで、大腸菌発現システムで合成されそして均質となるまで精製された組み換え蛋白質に対して、成長させた。ヒト蛋白質はマウスに対して非常に同一性があり、従って、抗−ヒト抗体はマウス蛋白質と交差反応するはずである。そうしない場合には、短いマウスcDNA(619nt)が大腸菌内で発現され、蛋白質が精製されそして抗体が製造される。或いは、マウス配列を有する合成ペプチド類を購入しそしてこれらを使用して抗体を製造する。検定用には、組み換えヒトOb蛋白質にボルトンハンター(BoltonHunter)法により125ヨウ素で放射標識をつけ、その後にセファデックス(Sephadex)G−25を用いてゲル濾過精製する。得られた特異的活性は30μCi/μgであった。検定用のサンプル(0.2ml)を一次抗血清(1:2000希釈度)を用いて0.1%トリトン(Triton)X−100を含有するホスフェートで緩衝した食塩水の中で16時間にわたり4℃で0.4mlの合計量で予備インキュベートした。125I−Ob蛋白質(100μl中に担持された30,000cpm)を次に加えそしてインキュベーションをさらに24時間続けた。結合されたOb蛋白質(12±1%、非特異的結合1.4±0.1%)を0.1mlのヒツジ抗−ウサギIgG血清(カリフォルニア州、デービスのアンチボディーズ・インコーポレーテッド(Antibodies, Inc.)、0.1mlの正常なウサギ血清(GIBCO/BRL、メリーランド州、ガイセルスブルグ)、および0.1mlの10%ポリエチレングリコールの添加により免疫沈澱させた。管を15分間遠心し(2200rpm)、結合していない標識を傾斜しそしてペレット中の放射活性をパッカード(Packard)5000ガンマカウンター(イリノイ州、ダウネーズ・グロブ(Downers Grove))中で計数した。未知サンプル中のOb濃度をロッドバード(Rodbard)の非重量測定4パラメーター論理モデルを用いて計算した。この検定法の検出限度は0.39ng/mlである。検定中変動は12ng/mlでは11.6%であり、13.1ng/mlでは20.8%の変動であった。
ヒト因子 IX
市販のエリザ(ELISA)(アメリカン・バイオプロダクツ・カンパニー(American Bioproducts Company)を用いてhGH検定(上記)で使用されたものと同様な条件下で遺伝子コードつけ因子IXの発現を検定する。標準的曲線は1−50ng/ml-1でありそして感度の限度は1ng/ml-1であった。検定はマウス因子IXと交差反応しなかった。
実施例4:マウスに安定にトランスフェクトされたMSC類の全身注入による生理学的に重要な水準における3つの遺伝子の持続発現
ここに表示された実験は、培養されたMSC類が全身注入後に骨、軟骨および他の間充織組織の幹細胞−様前駆体として機能しうることを示した。従って、hGH、Ob蛋白質または因子IXを発現するMSC類を照射されたおよび照射されなかったマウスに注入して遺伝子の持続発現をインビボで評価する。
MSC類の注入
最初に、MSC類をマウスにここに記載された条件下で(生後3週間のマウス:300または700グレー(Gray)照射;腹腔内注射;1×106個のMSC;および2×108個の全骨髄細胞)。さらに、静脈注入を腹腔内と比較し、そして比較的低水準のX線照射が使用される。また、帝王切開により細胞を胚にも注入する。予備試験では、50μlの5×104ESを7個の13日目の胚の羊膜中に注射し、7個のうちの6個を生存幼体(pups)として移した。従って、MSC類のイントラウテリン注射は実行可能である。
成長曲線
hGHの有効なインビボ発現はマウスの成長速度を高めるはずでありそしてOb蛋白質の発現は飢餓を誘発するはずである。従って、処理されたマウスおよび対照同腹子の体重および寸法が監視される。
遺伝子発現に関する検定
MSC類、hGHおよび因子IXの注入から1週間、1カ月、3カ月、5カ月、10カ月、および20カ月後にマウスの後眼窩叢から血液を得る。hGHおよび因子IXはエリザにより検定され、そしてOb蛋白質は放射免疫検定法で検定される。さらに、ヒト因子IXにおける測定可能な増加がエリザで得られる場合には、Smith et al. (1993) Mature Genet. 5:397-402 に記載された工程で生物学的に活性なヒト因子IXを検定する。この工程では、ヒト因子IXを最初に微量滴定ウェルの中でモノクローン抗体であるBGIX1を用いて捕獲しそして次に因子XIaにより活性化する。活性因子IXは、因子VIIIと組み合わされて、因子XをXaに転化させる。因子Xaは色素産生(chromogenic)基質であるS2765を分裂させて黄色生成物を生ずる。BGIX1−コーテイングされたマイクロリットル平板および因子VIIIはエルカテック・インコーポレーテッド(Elcatech, Inc.)(ノースカロライナ州、ウィンストン−サレム)から購入した。因子XIaはエンザイム・リサーチ・ラブス・インコーポレーテッド(Enzyme Research Labs, Inc.)(イリノイ州、サウスベンド)から購入した。
【0127】
因子X、燐脂質溶液、S−2765、およびスロンビン抑制剤である1−2581はカビ・ファーマシア・ヘパー・インコーポレーテッド(Kabi Pharmacia Hepar, Inc.)(オハイオ州、フランクリン)から購入した。4種の緩衝液を製造した:A、50mMトリス(Tris)、150mM NaCl、1%BSA、pH7.5;B、150mMトリス、5mM CaCl2、10mg/mlゼラチン、pH7.6;C、50mMトリス、10mM CaCl2、pH7.5;D、50mMトリス、150mM NaCl、pH8.4。等量の下記の原料を混合することにより因子VIII/X反応混合物を新たに製造した:因子VIII、緩衝液A中5U/ml;因子X、緩衝液中1U/ml;1−2581緩衝液A中34μg/ml;CaCl2、水中25mM;および燐脂質。血漿サンプルを緩衝液Aの中で希釈しそして100μlを各々の微量滴定ウェルに加えた。平板を室温で90分間インキュベートしそして次に緩衝液Bで5回洗浄した。100μlの因子XIa(緩衝液C中2μg/ml)を各々のウェルに加えた。37℃における30分後に100μlのS2765(緩衝液D中0.5mM)を各々のウェルに加えそして平板を室温で10分間インキュベートし、その後に酢酸を10%の最終濃度まで加えることにより反応を停止させる。バイオ−ラド微量平板読み取り器を用いて405nmにおける吸収を測定した。ヒトの正常な貯蔵血漿の希釈で作成された標準曲線は3−25ng/mlから線状であった。この検定はマウス因子IXと交差反応しなかった。因子IXに関しては、250ng/mlすなわち正常値の5%の水準が一般的に治療用であると考えられそして100〜150ng/mlが有利であると考えられる。
実施例5:MSC類を皮下拡散室 (chamber) を中に入れることによる生理学的に重要な水準における遺伝子の持続発現
皮下拡散室の中に移植された細胞はヒト患者の治療で少なくとも2つの顕著な利点を有する:免疫応答が回避され、そしてマウス(Benayahu, 1989, J. Cell Physiol. 140:1-7)、ラット(Mardon et al., 1987, Cell Tissue Res. 250:157-165)またはウサギ(Friedenstein et al., 1987, Cell Tissue Kinet. 20:263-272)でカプセル中に移植された時には、明らかにそれらが血管新生を必要としない骨、繊維状組織または軟骨として残存するため(Benayahu et al., 1989, 上を見よ; Mardon, et al., 1987, 上を見よ; Owen et al., 1988, In: Cell and Molecular Biology of Invertebrate Hard Tissues, Wiley Chicester, CIBA Foundation Symposium, 136:42-60; Friedenstein et al., 1987, 上を見よ)、それらは少なくとも6週間生存する(Wakitani, 1994, J. Bone and J.T. Surgery 76A:579-592)。
室の製造
拡散室は市販の構成部品(ミリポア・コーポレーション(Millipore Corp.))から組み立てられそして上記のレポート(Benayahu et al., 1989, 上を見よ; Mardon, et al., 1987, 上を見よ)に記載されている。要するに、孔寸法を有する膜フィルターを2つのプラスチックリングの各々の一面にアクリロイド付着剤を用いて付着する。2つのリングを次に一緒に付着して室を形成し、寸法は9mmの内径および2mmの厚さ、約127mm3の容量である。104〜107個のMSC類を室の中に1つのリング内の孔を通して接種しそして孔を付着剤でコーテイングされた先が細くなったプラスチック栓で密封する。室をマウスに麻酔下で背中に皮下移植するかまたは腹腔内移植する。最初に、1つもしくはそれ以上の室を離乳したてのマウス(3週間)に挿入する。引き続き、室を生後1週間のマウスに挿入する。生後1週間のマウスでの実験用には、比較的小さい室をマイクロピペット用のプラスチックチップから切断された円形(5mm、内径)から製造する。
検定
室の移植から1週間、1カ月、3カ月、5カ月、10カ月および20カ月後に後眼窩叢から血液を得る。血漿を上記の通りにしてhGH、Ob蛋白質および因子IXに関して検定する。
実施例6:拡散チャンバー
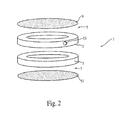
図2を参照すれば、拡散チャンバー(1)は、2つの端、第1の端(5)および第2の端(7)をもつチャンバーバレル(3)を備えていてもよい。バレルは、非毒性手段によって一緒に確保される1個以上のリングをからなっていてもよい。チャンバーは、各端にフィルター、第1のフィルター(9)および第2のフィルター(11)を固定される。フィルターは、ファクターがチャンバーと哺乳動物体の間を通過できるように、ファクター、例えばタンパク質にとって多孔性である。フィルター孔径は、約0.25μm以下、好ましくは約0.1μmであってもよい。フィルターは、プラスチック、テフロン、ポリエステルもしくは強くて柔軟であり、そして化学的処理を受け付けない、いかなる不活性材料から作成されてもよい。フィルターは、また、より緊密に密閉できるゴムのガスケットにより位置を確保されている。場合によっては、チャンバーのバレル部分は、キャップ(示されていない)によってカバーされている開口部(13)をもっていてもよい。キャップは、それ自体密閉性のゴムの形式にネジが切られていて、そして開口部に固定される。かくして、チャンバー内容物中への細胞の挿入は、キャップを取り除くことによって開口部に近づき、そして普通の針および注射器を用いて細胞を挿入することによって実施できる。チャンバーは、すべての物質、例えば限定されるものではないが、プラスチック、テフロン、ルーサイト、チタン、もしくは哺乳動物にとって無毒であり、良好に許容しうる、いかなる不活性材料から作成されてもよい。さらに、チャンバーは、滅菌に耐えられなければならない。
【0128】
チャンバーは、必ずしも限定されが次のように:例えば皮下もしくは腹腔内に移植できる。チャンバーは、移植後約24〜約30時間目に除去されてもよい。あるいはまた、再充填可能なチャンバーが使用されて、チャンバーが治療のために再使用され、そして治療後に空にされてもよい。
実施例7:ラットの脳中への単離MSCの直接投与
ドナーMSCおよびアストロサイトの調製
ヒトMSC(Owen et al.,1988,in Cell and Molecular Biology of Vertebrate Hard Tissues,Ciba Foundation Symposium 136,Chichester,UK,pp.42−60;Caplan,1991,J.Orthop.Res.9:641−650;Prockop,1997,Science 276:71−74;Pereira et al.,1995,Proc.Natl.Acad.Sci.92:4857−4861;Pereira et al.,1998,Proc.Natl.Acad.Sci.95:1142−1147)は、年齢19〜46才の正常な男子および女子ボランティアの腸骨稜から採取された吸引物から増殖された。吸引物を、α−MEM/10%FBSにより1:1希釈し、そして密度勾配(Ficoll−Paque Plus;1.077g/ml,Pharmacia,LKB Biotechnology Inc.,Piscataway,NJ)を通して1000Xgで30分間遠心した。上澄液および界面物を合わせた後、混合液を、α−MEM/10%FBSにより約40mlに希釈し、そして再び遠心した。核形成細胞、すなわちMSCが、α−MEM/10%FBS中、濃度1x107mlで懸濁され、そして細胞は、25cm2培養皿中に3X106/cm2でプレートされた。MSCを3日間培養し、そして非付着細胞を、培養物中の培地を交換することによって除去した。MSC培養が集密に達した後、MSCを、0.25%トリプシンおよび1mMEDTAによる37℃で3〜4分間のインキュベーションによってプレートからはがした。MSCを、1:2もしくは1:3希釈し、そしてMSC調製操作が3〜5継代繰り返された。第2の継代を開始する際に、血小板由来増殖因子(PDGF−AA;GIBCO/BRL,Grand Island,NY)5ng/mlを培地に添加した。
【0129】
ラットMSCの単離のために、8〜12週令のLewis/SsNHsd雌ラットから得られた脛骨および大腿骨が切開された(Harlan Sprauge Dawley,IN)。骨の末端を切断し、そして骨髄を、注射器と針を使用してDMEM(GIBCO/BRL,Grand Island,NY)5mlを用いて押し出した。全骨髄細胞100〜200X106個を、DMEM/10%FBSの175cm2組織培養フラスコにプレートした。24時間後、非付着細胞を、培地を交換することによって除去した。細胞が集密に増殖するように、培地は2〜3日毎に交換された。細胞は、0.25%トリプシンおよび1mMEDTA存在下のインキュベーションによって前のようにはがされ、それに続いて細胞は、3〜4回継代され、次いで使用まで凍結保存された。
【0130】
アストロサイトの1次培養物(Azizi,1996,Ann.Neurol.(前出)121:T236)は、アルビノSprague−Dawley成ラット(Harlan Sprague Dawley)の脳から得られた。マウスの頭部が断首された後、脳が、無菌条件下で取り出され、そして氷上の冷PBS中に浮かされた。脳脊髄膜および脳幹は除去され、そして廃棄された。前脳は、機械的に、組織小片に分解され、そして組織は、ジスパーゼ(dispase)(GIBCO/BRL,Grand Island,NY)2.4単位/ml存在下で37℃で30分間インキュベートされた。10分間隔で、組織は、大きい穴のピペットを通してそれらをフラッシュすることによって分解された。分解された組織を遠心し、そして上澄液を廃棄した。各脳からの残渣をα−MEM中に懸濁し、そして各α−MEM/10%FBS培地において、2個の175cm2培養フラスコにプレートした。48時間後、非付着細胞および細胞破片を、培地を交換することによって除去し、次いで、培養が集密に増殖するまで、約2週間、4日毎に培地を交換した。ゆるく付着した細胞を除去するためには、集密培養物を37℃で15分間、ジスパーゼ2.4単位/mlにより処理し、そして培養物を、ロータリーシェーカーにおいて120rpmで2時間振盪した。脱着した細胞を廃棄した。新鮮培地を、付着細胞に添加し、そして培養物を、24〜48時間再培養した。ゆるく付着した細胞を除去するためのジスパーゼ処理を、約1週間にわたって3回繰り返した。
【0131】
抗体染色では、細胞を、0.25%トリプシンとともに1〜3分間のインキュベーションによってプレートから剥がした。次いで、細胞を、チャンバースライドにおいて継代培養した。核を蛍光標識するために、MSCおよびアストロサイトを、移植前に、ビス−ベンズアミド(Sigma Chemical Company,St.Louis,MO)1μg/mlの存在下で24時間インキュベートした。移植1〜2時間前に、培養物を、無菌の緩衝生理食塩水で3回洗浄し、0.25%トリプシンとともに1〜3分間のインキュベーションによってプレートから剥がした。トリプシンは、20%血清含有培地の添加によって中和され、そして細胞が遠心によって単離された。細胞は、血清不含のα−MEM中に約10,000細胞/リットルのスラリーとして懸濁された。
【0132】
成Sprague−Dawleyアルビノラット(体重各200〜300g)が、密閉室内で酸素中3%ハロタンを用いて麻酔された。麻酔は、キシロジン6mg/kgおよびケタミン60mg/kgの混合物の筋肉内注射によって維持された。動物を、清潔な場所においてステロタキシック(sterotaxic)装置に移した。2〜5mm切開が、前頂側方2mmの頭皮に行われた。バーホールを、歯科用ドリルを用いて前頂側方3mmの位置の骨に行った。細胞懸濁液約10μlを、徐々に30分かけて、脳表面から深さ4〜5mmの線条体中に注射した。傷を断続的に外科縫合によって閉じ、そして動物を、キシロジン0.6mg/kgおよびケタミン6mg/kgによって処置した。5,14,30および72日間隔で、ラットをキシロジンおよびケタミンを用いる深い麻酔下の心臓内潅流によって犠牲にした。潅流は、氷冷リン酸緩衝化生理食塩水、続いて3%緩衝化パラホルムアルデヒド、次いで10%スクロースを用いて行われた。脳を取り出し、前脳をトリム(trim)し、そして脳の切片を含むサンプルを直ちに凍結した。
【0133】
移植細胞の免疫組織学
10ミクロン組織切片を、クリオスタットを用いて調製した。脳内の移植部位は、組織切片中の蛍光標識された細胞を顕微鏡的に同定することによって位置付けられた。凍結切片を、ゼラチン被覆されたスライドに付着させ、そして素早く5分間冷アセトンに浸漬し、そしてさらなる処理のために−20℃で保存した。チャンバースライド中の細胞は、アセトンで5分間固定された。免疫細胞化学試験は、室温で実施された。細胞および組織切片は、2%ヤギ血清および5%胎児ウシ血清を含有するブロッキング抗体により30分間処理された。コラーゲンおよびビメンチン(vimentin)の標識を必要とする実験では、細胞は、さらに、TritonX−100により30分間処理され、次いで、PBS中で洗浄された。1次抗体が、チャンバースライド中の細胞に1〜2時間適用された(表2)。これらの抗体は、組織切片の場合は、24時間適用された。使用された2次抗体は、FITCもしくはローダミンのいずれかにカップルされた種特異的IgGであった。
【0134】
蛍光標識された細胞は、肉眼的に見ることができ、そして蛍光顕微鏡を用いて写真撮影された。蛍光標識された核の数は、線条体の吻側から尾側限界まで切断された8〜10組織切片において数えられた。この操作は、各脳において、交互に切片が用いられた2個体で繰り返された。明瞭に標識された核のみが数えられた。死細胞および溶解細胞は、周辺組織に霞んだ色調を残し、そして明瞭な核染色はなかった。観察された数は、生存している移植細胞の数を評価するために、切片の総数に外挿された。
【0135】
ドナーMSCおよびアストロサイト前駆体
ヒト骨髄から得られるMSCは、プラスチックへのそれらの付着によって単離され、そして3〜5継代の間増殖された。図3に示されるように、PDGF−AAの添加は、細胞の増殖速度を増強した。したがって、PDGF−AAが、2〜5継代において細胞に添加されて、十分な数のヒトMSCが得られた。しかしながら、ラットMSCは、PDGF−AAの添加なしに十分に増殖した。また、アストロサイトも、プラスチック培養皿へのそれらの強固な付着によって単離された。アストロサイトは、約3週間の1次培養の後に収穫された。
【0136】
表2に示されるように、ヒトMSCは、フィブロネクチン、コラーゲンIおよびヒトHLA−ABCを強く染色した。ヒトMSCは、ビメンチンをかすかに染色し、そしてグリア繊維酸性タンパク質には陰性であり、一方、ラットアストロサイトは、両方に陽性であった。ラットアストロサイトは、フィブロネクチンをわずかに染色し、そしてコラーゲンIおよびヒトHLA−ABCには陰性であった。また、ラットアストロサイトは、フォンビルブラント因子およびガラクトセレブロシダーゼCには陰性であった。
【0137】
ヒトMSCは、これらの細胞が培養において継代されるにつれて、外観的に比較的均一になることが、既に記されている(Bruder et al.,1997,J.Cell Biochem.64:278−294)。しかしながら、本研究では、2つの別の集団が見られた。これらは、大きい平らな細胞の集団と比較的細長いまたはスピンドル型細胞の集団を含んだ(図4、パネルAおよびB)。ラットMSCでも、また、類似の形態をもつ2つの別の細胞集団が見られた(図4、パネルC)。ラット脳アストロサイトは、外観的により樹枝状であった。
【0138】
線条体における注射後の細胞の生存
MSCおよびアストロサイトが、ラット脳の線条体に最小の拡散圧を用いて注射された。5〜72日後に、ラットを殺し、そしてそれらの脳切片を得た。ヘマトキシリンおよびエオシンで染色された切片の試験により、ラットアストロサイトもしくはMSCのいずれの移植部位周辺にも有意な神経膠症がないことが示された(図5、パネルa)。蛍光標識された細胞は、容易に、脳切片において検出された。ラットアストロサイトは、先行技術において既に示されたように、容易に移植された(Andersson et al.,1993,Int.J.Dev.Neurosci.11:555−568;Azizi,1996,Ann.Neurol.(前出)121:T236;Zhou et al.,1992,J.Comp.Neurol.317:145−155)。類似の結果が、ラットMSC(図5,パネルf)およびヒトMSC(図5,パネルb−e)を用いて得られた。表3に示されるように、約20,000〜42,000細胞が、回収された脳において存在していた。注射された細胞数は、100,000〜120,000の範囲であったので、注入されたヒトMSCの約20%が5〜72日後に回収された。さらに、30〜72日目に回収された注入ヒトMSCの数では、減少が見られた。ラットMSCの場合は、33,000細胞もしくは約30%が、注入後14日目に回収された(図5f)。
【0139】
移植された細胞の移動
移植されたラットアストロサイトは、移植された神経幹細胞もしくは神経幹細胞の形質転換細胞系について見られる移動(McKay,1997,Science 276:66−71)と同じように、脳の層を通過して移動する(Andersson et al.,1993,Int.J.Dev.Neurosci.11:555−568;Zhou et al.,1992,J.Comp.Neurol.317:145−155)ことが、既に記述されている。本発明では、MSCが類似の様式で移動することを発見した。ドナー細胞は、反対側の皮質を含む、脳の多くの領域において見い出された(図6)。細胞は、それらが移動した部位に残存していた。もっとも濃い細胞濃度は、線条体中の吻尾側軸周囲および脳梁に沿って見い出された。大脳皮質中にはより少数の細胞しかなかった。標識細胞のクラスターは、検査された全時点における側頭葉域において一貫して観察された。72日目には、外にある皮質領域においてはより少数の細胞しか見いだされず、この観察は、30〜72日目の間の細胞数の明らかな減少と一致した(表3)。
【0140】
移植された細胞の免疫組織学
切片の免疫染色は、HLA−ABCに対する抗体が使用された場合、移植されたヒトMSCが、また、脳全般において検出される(図6)ということを例証した。ヒトMSCは、移植前に、コラーゲンIに対する抗体により染色されるけれども(図7,パネルa)、同じ抗体による染色が移植後には見られなかった。かくして、MSCは、脳組織へ組み込まれた後、I型コラーゲンの合成を止めた。フィブロネクチンに特異的な抗体による細胞の染色は、移植前に観察され(図7,パネルb)、そしてまた、移植後5日目には観察されなかった(図7,パネルc)。
【0141】
神経移植(neurotransplantation)実験の結果は、ラット脳中に注入されたヒトMSCが、ラットアストロサイトの移植、移動および生存と同様に、移植し、移動し、そして生存できることを確認した。ラットMSCは、ラットアストロサイトと類似の様式で挙動した。かくして、ラットおよびヒト細胞は、同じように挙動する。ここに提示されたデータは、プラスチック培養皿への付着特性によって、骨髄から単離された細胞の少なくとも1つのサブセットが、また、アストロサイトと同じ経路において関与できることを確認した。その結果は、したがって、MSCが、ヒトにおける種々の疾病の治療に関して、細胞および遺伝子両療法のための有用な運搬体(vehicle)であることを確立する。さらに、移植されたMSCが、コラーゲンI型の合成を止めるので、移植後に大量のコラーゲンを継続して生産することが知られ、したがって、移植部位において線維症を誘導する繊維芽細胞よりも、これらの細胞は、神経移植にとって一層適当である。
【0142】
MSCは、神経移植のための細胞としていくつかの利点を有する。特に、それらは、骨髄から容易に得ることができ、そして培養において拡大できる。また、患者自身のMSCが、治療のために使用でき、かくして宿主免疫および移植片対宿主病のいかなる随伴問題も回避できる。さらに、細胞は、ヒトにおける疾病の治療のために遺伝子工学的に改変されてもよい。
実施例8:MSCのアストロサイトとの同時培養;MSCのアストロサイトへの分化
濃度2X105細胞のヒトMSCが、濃度1X105細胞のラットアストロサイトとともに、MEMプラス30%FBS(Sigma Chemical Company,St.Louis,MO)からなる培地10ml中で同時培養された。ヒト細胞は、同時培養前にα−ヒトHLA−ABCにより蛍光標識された。同時培養5日後、ヒト細胞の約2%が、また、グリア繊維酸性タンパク質を陽性に染色した。グリア繊維酸性タンパク質は、初期アストロサイトに対するマーカーであるので、これらの結果は、ヒトMSCのフラクションが、ラットアストロサイトとの同時培養中にアストロサイトに分化したことを例証している。
【0143】
【表1】
【0144】
a 6週令マウスからの総骨髄細胞(20X106)が、各9.5cm2ウェルにおいて10%FCSおよびα−MEMの2ml中で培養された。非付着細胞が3日目に除去され、そして培養は、7日目まで新鮮培地中で継続された。APアーゼおよびTRAPがアッセイされた。
【0145】
b 細胞培養インサート(23mm;孔径3μm;Becton Dickinson)における骨片(大腿骨1/2および脛骨1/2)との同時培養。
【0146】
c Matrigelでコーティングされたインサートによるbと同じ。
【0147】
d 10日目の1次培養物が、0.25%トリプシンおよび1mMEDTAにより37℃で5分間脱着され、続いて静かに掻き取られた。1つのウェルからの細胞(2X105)が1:4希釈され、そして9.5cm2ウェルにおいて3日および6日目に培地を変えて7日間培養された。
【0148】
e APアーゼおよびTRAPは、全タンパク質1mg当たりであった。
【0149】
【表2】
【0150】
a アッセイされず
【0151】
【表3】
【0152】
a 2つの異なる観察による別の切片に関する総カウントが、20%未満で異なった。
実施例9:ラット脳へのヒトMSCの移植;マクログリア細胞へのMSCの分化
中枢神経系におけるニューロン細胞およびグリア細胞は、多能性脳室周囲(periventricular)前駆体から誘導される。骨髄ストロマ細胞は、骨芽細胞、軟骨細胞および筋管に分化できる骨髄由来の多能性細胞のサブセットであり、そして若干のグリア細胞もしくはそれらの前駆体の起源になることもできる。
【0153】
本実施例において提示されるデータは、ラット脳に移植されたヒト骨髄ストロマ細胞のフラクションが、アストロサイトマーカーグリア繊維酸性タンパク質(GFAP)を発現できることを例証する。ここに記述されるように、ヒト骨髄ストロマ細胞(hMSC)は、神経幹細胞と同じようにラット脳中に組み込まれ、そして移動することが分かった。
【0154】
発生の早期段階では、中枢神経系のニューロン細胞およびグリア細胞は、脳室周囲胚帯における多能性前駆体細胞から誘導される(McKay,1997,Science 276:66−71;Lundberg et al.,1997,Exp.Neurol.145:342−360)。グリアおよびニューロン(Gould et al.,1998,Proc.Natl.Acad.Sci.(USA)95:3168−3171;Kempermann et al.,1998,Nat Med 4:555−557)は、増殖およびターンオーバーを継続する。骨髄は、グリア発生の1つの起源であるかもしれない(Eglitis et al.,1997,Proc.Natl.Acad.Sci.(USA)94:4080−4085)。
【0155】
ヒト骨髄ストロマ細胞(hMSC)のラット脳中への直接移植の効果が、本明細書の他の場所に記述されている。hMSCは、プラスチックへのそれらの付着によって単離でき、そして骨芽細胞、脂肪細胞、軟骨細胞および筋管に分化できる骨髄における多能性細胞のサブセットである(Owen,1988,J.Cell Science(前出)10:63−76;Caplan,1991,J.Orthopaedic Res.9:641−650)。
【0156】
本実施例において示される実験の目的は、hMSCが、脳への移植のためのドナー細胞として使用できるか否か、そしてその結果、これらの細胞が、CNSへの遺伝子伝達のための運搬体として使用できるか否かを評価することである。さらなる目的は、これらの細胞の集団が、適当な環境および分化シグナルが与えられれば、脳細胞に発達できるか否かを決定することである。これらの実験は、神経系における再生および修復へのゴールを促進する意味を有する。
【0157】
神経移植は、このゴールを達成するため、そして個体発生および脳細胞の系統を研究するために、従来使用されてきた(McKay,1997,Science 276:66−71;Bjorklund,1993,Reseach Publications−Association for Reseach in Nervous & Mental Disease 71:361−374;Olson,1997,Nat Med 3:1329−1335;Bjorklund,1993,Nature 362:414−415)。神経および非神経両細胞が、移植のために使用されてきた。例えば、パーキンソン病では、ヒト胎児からの中脳細胞が、ヒトの治療のためにドーパミン作動組織の起源として使用された(Bjorklund,1993,Reseach Publications−Association for Reseach in Nervous & Mental Disease 71:361−374;Spencer et al.,1992,N.Engl.J.Med.327:1541−1548;Freed et al.,1992,N.Engl.J.Med.327:1549−1555;Kordower et al.,1997,J.Comp.Neurol.387:96−113)。多数の患者が、臨床症状および目標測定値、例えば位置−発光断層写真によるフルオロドーパ取り込みによってアッセイされるドーパミンの合成増加、の両方において有意な改善を示した(Spencer et al.,1992,N.Engl.J.Med.327:1541−1548;Freed et al.,1992,N.Engl.J.Med.327:1549−1555;Kordower et al.,1997,J.Comp.Neurol.387:96−113;Defer et al.,1996,Brain 119:41−50)。
【0158】
しかしながら、試験されたほとんどの細胞が、それらに関連する難題を有していた。例えば、それらは、ヒト胎児細胞として得ることの難しさであったり、またはそれらが、脳への注入後に組み込みおよび移動しなかった(Kang et al.,1993,J.Neurosc.13:5203−5211;Anderson et al.,1993,Int.J.Dev.Neurosc.11:555−568;Sanberg et al.,1997,Nat.Med.3:1129−1132;Isacson et al.,1997,Nat.Med.3:964−969)。さらに、移植された細胞の多くは、宿主において生存しない。例えば、ブタ胎児からの中脳神経細胞が、パーキンソン病に罹っている患者に神経移植された後、7カ月目には、ドナー細胞の約0.1%が生存しているだけであった(Isacson et al.、1997,Nat.Med.3:964−969)。
【0159】
本明細書の別の場所に記述される実験は、ラット脳への注入後、hMSCが、注射部位から数ミリメーター移動したことが分かったことを示した。本実施例に示される実験は、それらの観察を拡大し、そしてhMSCのフラクションが、ラット脳への注入後に、アストロサイト(GFAP)についてのマーカーを発現している細胞として回収できることを例証する。
ラットおよびヒトMSCの単離
本明細書の上に記述したように8から12週令のLewis/SsNHsdメスラット(Harlan−Sprague−Dawly)から脛骨および大腿骨を切り取ることを通して、ラットMSCを単離した。前記骨の末端部を切断した後、針とシリンジを用いて骨髄を5mlのDMEM(GIBCO/BRL、Grnad Island、NY)で抽出した。骨髄細胞全体(100−200X106)をDMEM/10%FBSに入っている175cm2の組織培養フラスコに塗布した。24時間後に前記培地を取り替えることで付着しなかった細胞を除去した。前記細胞が増殖して集密状態になることから前記培地を2から3日毎に取り替えた。前記細胞を0.25%のトリプシンおよび1mMのEDTAと一緒にインキュベーションすることで隆起させ(lifted)、3または4継代後、凍結貯蔵する。
【0160】
本明細書の上に記述したように、年令が19から46才の正常な男性および女性ボランティアの腸骨りょうから採取した吸引液からヒトMSCを増殖させた。核形成した細胞を密度勾配(Ficoll−Plaque Plus;1.077g/ml;Pharmacia LKB Biotechnology,Inc.、Piscataway、NJ)による遠心分離で単離し、α−MEM/10%FBSに入れて濃度が1x107/mlになるように懸濁させた後、25cm2の培地皿に3x106/cm2塗布した。3日後に付着しなかった細胞を除去した。この培養物が集密状態に到達した後、前記細胞を0.25%のトリプシンおよび1mMのEDTAと一緒に37℃で3から4分間インキュベーションすることで隆起させた。この細胞懸濁液を1:2または1:3に希釈した後、再び塗布した。この手順を3から5継代繰り返した。第二継代を用いて始めて、前記培地に血小板誘導成長因子αα(PDGF−AA;GIBCO/BRL、Grand Island、NY)を5ng/ml加えた。
抗体染色および蛍光標識
前記細胞を仕切り付きスライド内で継代培養した後、抗体染色を行った。移植を行う24時間前にhMSCを1−10μg/mlのビス−ベンズアミド(Sigma Chemical Co.、St Louis、MO)と一緒にインキュベートすることで核の蛍光標識を実施した。この培養物をラットの脳に注入する1−2時間前に、この培養物を無菌緩衝食塩水で3回洗浄して0.25%のトリプシンと一緒にインキュベーションを1−3分間行うことで隆起させた。血清が20%入っている培地を添加することでトリプシンを中和した後、細胞を遠心分離で単離した。この細胞を血清が入っていないα−MEMに入れて1μl当たり約10,000個の細胞が入っているスラリーとして懸濁させた。
ラットの脳へのhMSCの注入
酸素中3%のハロタンを用いて、成長したSprague−Dawly白皮症ラット(200から300g)に麻酔をかけ、キシロジンが6mg/kgでケタミンが60mg/kgの混合物を筋肉内注射することで保持した。次に、ラットを立体定位装置に入れ、そしてブレグマの横3mmの所にバーホール(burr hole)を開けた。脳の表面から4から5mmの深さの所に位置する線条の中に約10μlの前記細胞懸濁液を30分かけてゆっくりと注入することを通して、前記hMSCを投与した。その傷を割り込み外科縫合で閉じた後、この動物を0.2mg/kgのBuprenorphineで処置することで回復させた。前記ラットをキシロジンおよびケタミンで深い麻酔下に置きながら、氷で冷却した燐酸塩緩衝食塩水に続いて3%の緩衝パラホルムアルデヒドそして次に10%のスクロースを用いた心臓内潅流を前記ラットに受けさせることで、このラットをと殺した。脳を取り出し、前脳を削り取った後、このサンプルを直ちに凍結した。
ヒト細胞(hMSC)がラットの脳で生存することに関する評価
クリオスタット(cryostat)を用いて脳組織断片を10ミクロンの厚みで調製した。この組織断片内の蛍光標識細胞を顕微鏡で同定することを通して移植部位の位置を確かめた。凍結断片をゼラチン塗布スライドに付着させ、迅速に冷アセトンに5分間浸漬した後、さらなる処理および計数測定を行う目的で−20℃で貯蔵した。前記線条の吻側から尾側の範囲から切り取った8から10個の組織断片に存在する蛍光標識核の数を数えた。2人の試験者が断片を交互に用いることで前記手順を各脳に関して繰り返した。明瞭に標識されている核の数のみを数えた。死滅した細胞および破壊した細胞は、それを取り巻く組織内に青色がかった色が発生しそして核の染色が明確には起こらないことで特徴づけられた。植え込まれた生存細胞の数を推定する目的で、観察した数を断片の全数に外挿した。
細胞培養物の調製
前脳を機械的に分離させて小さい片にしそしてその結果として得た組織をジスペース(dispase)が2.4単位/mlでコラゲナーゼ(GIBCO/BRL、Grand Island、NY)が45単位/mlの混合物に入れて37℃で15分間インキュベートすることを通して、ラット脳細胞の培養物を調製した。大きな孔のピペットを用いたフラッシュ洗浄(flushing)を5分間隔で行うことで前記組織を分離させた。この分離させた組織を遠心分離にかけて、その上澄み液を廃棄した。各脳から得た残渣をα−MEMに入れて懸濁させた後、α−MEM/10%FBSに入っている2個の175cm2培養フラスコに塗布した。培地を48時間後に変えそして培養物が集密状態になるまで約2週間に渡って4日毎に培地を変えることで、付着しなかった細胞およびくずを除去した。緩く付着した細胞を除去する目的で、集密状態の培養物に2.4単位/mlのジスペースを用いた処理を37℃で15分間受けさせた後、傾斜回転振とう装置を6−7rpmで用いた振とうを2時間受けさせた。脱離した細胞を廃棄した後、付着している細胞に新鮮な培地を加えて培養物を再びインキュベートした。次に、この細胞をトリプシン(0.5%)で隆起させた後、計数測定および免疫細胞化学染色を行う目的で仕切り付きスライドに入れて継代培養した。細胞の全数および蛍光標識核を有する細胞の分率を血球計数器で数えた。
免疫組織化学染色
仕切り付きスライドに入れた細胞をアセトンで5分間固着させた。免疫細胞化学を室温で実施した。細胞にヤギ血清が1%とウシ胎児血清が1%入っている適切な阻止抗体を用いた処理を30分間受けさせた。一次抗体を仕切り付きスライドに1から2時間加えた。用いた二次抗体はFITCまたはローダミンのいずれかに結合する種特異的IgGsであった。結果として蛍光標識された細胞を目で確認しかつ蛍光顕微鏡を用いて写真を撮った。
結果
本明細書の上に記述したように、ラットおよびヒト両方のMSCは組織培養プラスチックにしっかりと付着することから、それらを全骨髄の吸引液から単離するのは容易であった(またCaplan、1991、J.Orthopaedic Res.9:641−650も参照)。図8に、ポリL−リシンを塗布したガラスカバースリップ上で培養したラットMSCを示す。この細胞はVimentinで非常に染まり、Nestinで中程度に染まり(細胞の40−60%)、そしてGFAPで若干染まり(細胞の1%)、神経S100蛋白質で若干染まりそしてp75神経成長因子レセプタ(p75NGFr)で若干染まった。同じ条件下で処理を受けさせたヒトMSCはVimentinに関して陽性であった。しかしながら、ヒトMSCの15サンプルを越えるサンプルを試験(約1x105細胞/サンプル)したが、GFAPに対する抗体で染まった細胞は全く確認されなかった。
【0161】
表4に、移植後の選択した日にラットの脳に存在する蛍光標識hMSCの数を示す。培養したhMSCにビス−ベンズアミドによる蛍光標識を付けて、成長したSprague−Dawly白皮症ラットの線条に約100,000個の細胞を10μlの緩衝液に入れてゆっくり注入した。5日間から120日間の範囲の選択した時間が経過した後、前記ラットをと殺して脳を取り出した。脳の断片を検査したが、本明細書の別の場所に記述した結果に一致して、細胞注入部位の回りに存在する白血球のグリオーシスの証拠も浸潤の証拠も全く確認されなかった。表4に、脳断片に存在する蛍光標識細胞の数を数えることで得た結果を含める。このデータは、5から30日後にヒト細胞の約30%が存在しておりそして120日後に約15%存在していることを示している。本明細書に記述するように、標識を付けた細胞が針の跡に沿って見られたが、この細胞はまた脳の複数の領域にも移行しており、そのような領域には、反対側皮質および側頭葉領域が含まれる。
【0162】
別の1組の実験において、hMSCを約100,000個注入して7から90日後にラットの脳を取り出し(表5)、注入部位を含む前脳をMEMと20%のFBS中で培養した。集密状態の一次培養物(図9a)を確立した後、前記細胞をトリプシンで隆起させ、血球計数器および位相差顕微鏡を用いて数を数えた(図9b)。血球計数器および蛍光顕微鏡を用いて蛍光標識核の数を数え(図9c)そして未標識細胞に対する蛍光標識細胞の比率を決定した。継代培養物をチャンバスライド(chamber slides)(DMEM中20%のFBS)に塗布した後、間接的な蛍光免疫細胞化学の目的で前記細胞を冷アセトンまたは3%パラホルムアルデヒドで固着させた。12個の脳から取り出した60個のサンプルを検査した。前記培養物に含まれるヒト細胞をHLA−ABCによる染色および核の蛍光標識の両方で同定した。
【0163】
前記実験の結果を表5に示す。これらの結果は、前記培養物に含まれる細胞の3から7%がヒト細胞であることを示している。前記培養物に含まれるヒト細胞の約1%(細胞全体の約0.1%)がGFAPに対する抗体で染まった。この比率は経時的に比較的一定のままであった。GFAP陽性細胞は上皮様の平らな星状細胞の形態を示した(図10)。このような培養条件下で処理を受けさせたヒトMSCはED−1、即ち小グリア細胞の表面に存在するマーカーに対する抗体で染まらず、従ってこれは小グリア細胞ではなかった(Wu他、1997、Neurosc.Res.28:67−75)。
【0164】
この実施例に示したデータは、hMSCをラットの脳に安定に移植することができることを実証するデータ(本明細書に記述した)を立証しかつ発展させるデータである。本実施例に示したデータは、hMSCは脳の環境下で生存しかつ移植後少なくとも150日に及んで多数検出可能であることを立証している。以前の研究は、組織をラットの脳に移植することで得られる結果はそのような組織がヒトの脳で示す挙動および生存の良好な指示であることを示唆していた(Zawada他、1998、Nat.Med.4;569−574)。移植後に脳が免疫反応の組織学的兆候を示すことも宿主動物が示す挙動が悪化することもなく前記細胞を多数安定に移植することができることは、hMSCをヒトの脳への移植で安全に用いることができると言った可能性を拡大するものである。
【0165】
このような結果は、また、本明細書に記述した培養条件は注入した細胞を選び出すか或は前記細胞を不均衡的に増殖させる条件であることも示唆している。星状細胞が豊富な培養物内で回収したヒト細胞の数(表5)の方がラットの脳に注入した比較的少ない数のhMSCから予測され得る数よりもずっと多かった(注入したhMSCは105個のみであったがラットの脳には2x107個を越える数の細胞が含まれている)ことから、そのように結論付けることができる。従って、この実施例で行った実験の結果は、ラットの脳に直接移植した少量のhMSCから星状細胞が生じ得ることの証拠を与えている。従って、脳の微細環境はMSC中の星状細胞族を選び出すか或はMSCの分化を誘発して星状細胞を生じさせると言った環境である。
【0166】
この実施例に示したデータは、ラットの脳に移植したヒト骨髄間質細胞の一部がGFAPを発現させ得ることを立証している。本明細書に記述するように、hMSCは、神経幹細胞に類似した様式でラットの脳に組み込まれかつ移行した。従って、このようなデータは、また、骨髄に由来する間質細胞は脳内で分化してマクログリア細胞(macroglial cell)を生じる能力を有することも立証している。
【0167】
このような特徴は、MSCが直接的な細胞治療で用いるに有用であるか或は数多くの中枢神経系病のエックスビボ(ex vivo)遺伝子治療用のベクターとして用いるに有用であることを示す他のデータ(本明細書に示した)を支持するものである。
【0168】
以前の報告は、特に発生の初期段階または創傷後に末梢血液の小食細胞が中枢神経系の小グリア細胞をもたらす能力を有することを示していた(Ling他、1993、GLIA 7:9−18;Bauer他、1996、Histoch.J.28:83−97;Rinner他、1995、GLIA 14:257−266)。本研究者らが用いた培養方法ではそのような細胞が排除されて星状細胞が選び出された可能性がある。成長した哺乳動物の脳のグリア集団におけるターンオーバー(turnover)はゆっくりではあるが明確に起こり得る(Rakic、1985、Science 227:1054−1056)が、星状細胞は成人の脳にとって内因性であると一般に仮定されていた。
実施例10:骨髄間質細胞を用いたグリオームの治療
悪性濃腫瘍は、米国において毎年約15,000人に影響を与えかつ患者の90%を2年以内に死亡させる破壊的な病気である(Levine他、1989、In Cancer:principles and practice of oncology、Davita他(編集)(Lippincoff、Philadelphia)、1557−1611頁;Azizi他、1998、J.Neurovirol.4:204−216;Chung他、1998、Surg.Oncol.Clin.N.Am.、7:589−602;Liang他、1998、Curr.Opin.Oncol.10:201−206)。従って、現在、改良治療法を開発する試みが数多く取られている。本明細書に記述したように、ヒトの骨髄から得られる細胞のサブセット(subset)[間葉腫幹細胞または骨髄間質細胞(hMSC)と呼ぶ]をラットの脳に植え付けることができることを示した。このhMSCをラットの脳に注入すると、これは取り込まれた後、神経幹細胞が移行する公知路に沿って移行する。ヒトMSCは如何なる免疫反応も炎症反応も引き起こさず、3カ月後、その細胞の約15%を脳内で回収した。また、宿主ラットの脳から調製した星状細胞豊富培養物を分析した結果、植え付けた少量のhMSCが分化を起こして初期星状細胞(early astrocytes)になって、これがグリアの原線維状酸性蛋白質を発現させることも示した。本明細書に記述したように、hMSCを骨髄から単離しそしてそれに遺伝工学処理を受けさせて外因性遺伝子を発現させるのは比較的容易なことから(また、Owen他、1988、In Cell nad Molecular Biology of Vertebrate Hard Tissues、Ciba Foundation Symposium 136、Chichester、UK、42−60頁;Caplan、1991、J.Orthop.Res.、9:641−650も参照)、それらは治療用遺伝子産物を脳に搬送するための魅力的な運搬手段であると見られる。
【0169】
本実施例に、hMSCを用いて腫瘍毒性(tumor−toxic)蛋白質を発現させることができそして次にそれをグリオームに注入することでそのような病気の効力のある治療を行うことができると言った可能性を試験する目的で細胞培養物中で実施した実験およびラットを用いて実施した実験の説明を含める。腫瘍毒性蛋白質を分泌する細胞を遺伝工学処理する目的で他の研究者が成功裏に用いた実験方策と本質的に同じ方策を本明細書でも用いた。そのようなプロトコルは本分野の技術者によく知られている。このような実験の主要な新規性は、脳に植え付けることができるプロデュサー細胞(producer cells)としてhMSCを用いること、従ってそれをグリオームに局所的搬送される腫瘍毒性蛋白質の長期源として働かせる点にある。
【0170】
この実施例では、hMSCを遺伝工学処理して下記の3種類の腫瘍毒性蛋白質の1つを発現させて分泌させる(図11):(a)ある種のグリア芽腫細胞を選択的に殺すことが最近示されたFasリガンド(FasL)(Weller他、1994、J.Clin.Invest.、94:954−964;Weller他、1995、Cancer Res.、55:2936−2944;Frei他、998、J.Neuro Immunol.、87:105−113;Weller他、1998、Brain Pathol.8:285−293;Nagata、1998、Intern.Med.、37:179−181;Suda他、1993、Cell、75:1169−1178;Li他、1998、Transpl.Proc.、30:943;Tanaka他、1997、J.Immunol.、158:2303−2309);(b)表皮成長因子レセプタ(EGFR)およびCD3の両方に特異的な二特異的単鎖抗体[このデザインは、抗EGFR抗体がその分泌された蛋白質をグリオーム細胞に向かわせそして抗CD3抗体が同じ分子のもう一方の末端部に活性化Tリンパ球を引き寄せてグリオーム細胞を死滅させると言った原理を基にしている。同様な二特異的単鎖抗体が数多くの癌に関して現在試験されている(Kufer他、1997、Cancer Immunol.Immunother、45:193−197;De Jonge他、1997、Cancer Immunol.Immunother、45:162−165;Bookman、1998、Semin.Oncol.25:381−396;Helfrich他、1998、Int.J.Cancer、76:232−239;Jost他、1996、Molec.Immunol.33:211−219;Wickham他、1997、J.Virol.71:7663−7669)];および(c)表皮成長因子レセプタ(EGFR)に対するマウス単鎖抗体[これは患者の約60%から得られる悪性グリオーム細胞に豊富に存在しそしてこれを前記マウス単鎖抗体に対する125I標識抗体と一緒に用いることでグリオーム細胞を死滅させることができる可能性がある(Snelling他、1995、Hybridoma 14:111−114;Faillot他、1996、Neurosurg.39:478−483;Stragliotto他、1996、Eur.J.Cancer、32A:636−640)]。このような実験のプロトコルは、EGFRに対する125I標識モノクローナル抗体を用いた臨床試行で現在使用されているプロトコルに類似したプロトコルをモデルにしたものである(Snelling他、1995、Hybridoma 14:111−114;Faillot他、1996、Neurosurg.39:478−483;Stragliotto他、1996、Eur.J.Cancer、32A:636−640)。
悪性グリオームの通常治療
悪性グリオームに関して現在行われている治療は、主に、外科切除に続く放射線治療から成る(Levine他、1989、In Cancer:principles and practice of oncology、Davita他(編集)(Lippincott、Philadelphia)、1557−1611頁;Azizi他、1998、J.Neurovirol.4:204−216;Chung他、1998、Surg.Oncol.Clin.N.Am.7:589−602;Liang他、1998、Curr.Opin.Oncol.、10:201−206)。高い段階のグリオームの場合にはしばしば前記治療を化学療法と組み合わせている。そのような治療プロトコルによって患者の寿命を数カ月伸ばすことは可能であるが、悪性グリオームの再発率は90%を越えており、かつ手術後の生活の質も劣っている。最近、放射線治療の技術が向上し、例えばハイパーフラクショネーション(hyper−fractionation)、放射線の品質の改良、正常な組織に危害を加えない立体定位治療、および放射線増感物質の添加などによって、いくらかではあるが結果が改善されてきている。数多くの化学療法剤が試験されてきているが、その結果はあまり良くなかった(Levine他、1989、In Cancer:principles and practice of oncology、Davita他(編集)(Lippincott、Philadelphia)、1557−1611頁;Azizi他、1998、J.Neurovirol.4:204−216;Chung他、1998、Surg.Oncol.Clin.N.Am.7:589−602;Liang他、1998、Curr.Opin.Oncol.、10:201−206)。
グリオーム治療用FasおよびFasL
最近、悪性疾患を治療するための分子標的および反応体としてFas(CD95/APO−1)およびFasL(CD95L)がかなりの注目を集めてきている(Trauth他、1989、Science 245:301−305;Nagata他、1995、Science 267:1449−1456)。Fasは、進歩してきているシトキンレセプタ系列の一員であり、そのような系列にはTNF−αおよびNGFのレセプタが含まれる。FasLはTNFに同族の細胞毒性シトキンであり、それは感受性標的細胞内でアポトーシス様細胞死滅(apoptotic cell death)を誘発する(Nagata他、1995、Science 267:1449−1456)。このFasL/Fas系はT細胞仲介細胞毒性、T細胞ホメオスタシスの調節および発生中の胸腺細胞選択に関係していると推定されている。膜結合FasLは細胞と細胞の接触によってそれの細胞毒性を及ぼし得るが、FasLのcDNAを移入させて可溶FasLを分泌させたCOS細胞の上澄み液にも有意な細胞毒性が確認されている(Rensing−Ehl他、1995、Eur.J.Immunol.25:2253−2258)。Fasに対する抗体はFasLレセプタを持つ細胞にアポトーシスを誘発する。前記抗体をnu/nuマウスに1回注入するとヒトB細胞腫瘍の迅速な後退が誘発された(Trauth他、1989、Science 245:301−305)。しかしながら、Fasに対する抗体を野生型マウスに投与すると肝臓内の細胞がアポトーシスを起こすことから致命的である(Ogasawara他、1993、Nature 364:806−809)。
【0171】
最近成されたいくつかの報告に、悪性グリオームの治療でFas/FasL系を利用することが提案された(Weller他、1994、J.Clin.Invest.94:954−964;Weller他、Cancer Res.55:2936−2944;Frei 1998、J.Neuroimmunol.87:105−113;Weller他、1998、Brain Pathol.8:285−293)。重要な発見は、正常な脳組織内にはFasが発現しないことであった(Weller他、1998、Brain Pathol.8:285−293;Gratas他、1997、Brain Pathol.7:863−869)。ただ1つの例外は内皮細胞であり、それらはインビトロにおいてFas抗体が誘発するアポトーシスに耐える(Weller他、1994、J.Clin.Invest.94:954−964)。それとは対照的に、FasおよびFasLは両方とも悪性グリオーム内に発現する(Weller他、1998、Brain Pathol.8:285−293)。理由は明らかではないが、FasとFasLの両方が同じグリオーム細胞内に存在しているとアポトーシスがもたらされない。しかしながら、FasのmRNAが全ての一次グリア芽腫内に検出されかつ二次グリア芽腫の約1/5に検出される。段階IからIVの星状細胞腫の系統的分析により、FasのmRNAのレベルと悪性腫瘍進行が相互に関係していることが示された(Weller他、1998、Brain Pathol.8:285−293)。Fas蛋白質の定量により、発現は主に大きな壊死領域を取り巻くグリオーム細胞内に観察されることが示された。
【0172】
このような観察を基にして、Fasに対する抗体および可溶FasLが培養物中のグリオームに関して試験された(Weller他、1994、J.Clin.Invest.94:954−964;Weller他、1995、Cancer Res.55:2936−2944;Frei 1998、J.Neuroimmunol.87:105−113;Weller他、1998、Brain Pathol.8:285−293)。両方ともアポトーシスをもたらしはしたが、FasLの方がFasに対する抗体よりも高い効果を示した。FasLは分析した19の腫瘍細胞系の全部にアポトーシスを誘発した(Frei他、1998、J.Neuroimmunol.87:105−113)。また、FasLが腫瘍コロニーの形成に対して示す長期の効果も、分析を受けさせた高い段階の8グリオームの全部に関して腫瘍コロニー増殖を90%を越える度合で抑制すると言った点で、より顕著であった(Frei他、1998、J.Neuroimmunol.87:105−113)。この著者は、彼らの結果を基にして、FasLをしょう内または腫瘍内投与することはFasを発現する悪性腫瘍細胞の治療にとって有望なアプローチであることを示唆した(Frei他、1998、J.Neuroimmunol.87:105−113)。
グリオームを治療するための二特異的scFv−抗−EGFRおよびscFv−抗−CD3
現在、数多くの悪性病の治療、例えば卵巣癌の治療(Bookman、1998、Semin.Oncol.25:381−396)または結腸直腸癌の治療(Kufer他、1997、Cancer Immunol.Immunother.45:193−197)で二特異的単鎖抗体(scFv)が探求されている。例えば、CD3とトランスフェリンレセプタの両方に特異的な二特異的scFvは、活性化マウス細胞毒性Tリンパ球がトランスフェリンレセプタ含有ヒト細胞を特異的に破壊するように再び導いた(redirected)(Jost他、1996、Molec.Immunol.33:211−219)。この二官能性反応体は数ng/mlの濃度で効果を示す(Jost他、1996、Molec.Immunol.33:211−219)。同様に、CD3と上皮細胞抗原の両方に特異的な二特異的scFvを調製して結腸直腸癌を治療することが行われた(Kufer他、1997、Cancer Immunol.Immunother.45:193−197)。また、腫瘍細胞に由来する膜結合IgMのイディオタイプとCD3の両方に特異的な二特異的抗体も調製された。そのような抗体はBCL1B細胞リンパ腫マウスの腫瘍をなくすことが示された(De Jonge他、1997、Cancer Immunol.Immunother.45:162−165)。加うるに、すい臓癌細胞に見られる抗原とCD3の両方に結合する二特異的scFvも調製された(EGP2;上皮糖蛋白質−2 C017−1A抗原、KSA)。その結果として得られた蛋白質はインビトロにおいて腫瘍破壊の仲介で効果を示した(Helfrich他、1998、Int.J.Cancer 76:232−239)。
【0173】
このような報告は、CD3とEGFRの両方に特異的なscFvを用いた方策の基礎を与えるものである。EGFRに対する二特異的抗体はグリオーム細胞を標的にする、と言うのは、EGFRは正常な脳組織には見られず、高い段階のグリオームの約半分に見られるからである(Snelling他、1995、Hybridoma 14:111−114;Faillot他、1996、Neurosurg.39:478−483;Stragliotto他、1996、Eur.J.Cancer 32A:636−640)。この二特異的scFvのもう一方の末端部は活性化CD8+Tリンパ球に結合してグリオーム細胞を死滅させるであろう(例えば図11の方策IIを参照)。このような方策を開発する時、T細胞が外傷後の中枢神経系に入り込み(Hirschberg他、1998、J.Neuroimmunol.89:88−96)そして複数の硬化症および髄膜炎を有する患者ばかりでなく正常な対照にも観察された(Vrethem他、1998、Acta Neurol.Scand.97:215−220)ことが以前に出版された出版物に示されていることを注目すべきである。従って、使用する二特異的抗体は細胞毒性T細胞をグリオームに補充すべきである。また、インターロイキン−2を活性化T細胞と一緒に投与することもある種の患者には有利であると思われた(Haynes他、1995、Cancer 75:840−852)。従って、このような方策が不利な影響をもたらす可能性はない。
グリオームを治療するためのEGFRに対する抗体
EGFRに対する抗体がグリオームの治療で広範に研究され、段階I(Faillot他、1996、Neurosurg.39:478−483;Stragliotto,G.他、1996、Eur.J.Cancer、32A:636−640)および段階II(Snelling他、1995、Hybridoma 14:111−114)の両方の臨床試行で用いられた。この治療の理論的解釈は、EGFRを静脈内投与した後にEGFRが数多くのグリオーム細胞に豊富に存在しかつEGFRに対する抗体がグリオーム内に集中することが観察されたことを基にしている。このような観察を基にして、EGFRに対する125I標識モノクローナル抗体が調製され、そしてそれがヒトグリオーム細胞内に存在することが示された。また、予備的段階II臨床試行も実施され(Snelling他、1995、Hybridoma 14:111−114)、この試行では、EGFRに対する125I標識モノクローナル抗体がグリア芽腫多形(multiforme)を伴う60人の患者に全身投与された。
【0174】
その結果、治療は比較的安全でありかつ一次グリア芽腫多形の管理にある程度の有利さを示し得ることが示された。しかしながら、そのような研究で全身投与された抗体が脳の中に入るのはそれの約1%のみであることは明らかである(Snelling他、1995、Hybridoma 14:111−114)。
【0175】
このような臨床試行が開始されてからEGFRの腫瘍特異的変異体が同定された(Hills他、1995、Int.J.Cancer 63:537−543;Wikstrand他、1995、Cancer Res.55:3140−3148;Wikstrand他、1997、Cancer Res.57:4130−4140;Okamoto他、1996、Br.J.Cancer 73:1366−1372;Wikstrand他、1998、J.Neurovirol.4:148−158;Schmidt他、1998、Int.J.Cancer 75:878−884;Reist他、1997、Nucl.Med.Biol.24:639−647)。この腫瘍特異的EGFR(EGFRvIIIと呼ばれる)は内部欠如(internal deletion)を有し、グリオームの約50%に存在する。4グループの研究者がEGFRvIIIに対するモノクローナル抗体を調製した(Hills他、1995、J.Cancer 63:537−543;Okamoto他、1996、Br.J.Cancer 73:1366−1372;Wikstrand他、1998、J.Neurovirol.4:148−158;Schmidt他、1998、Int.J.Cancer 75:878−884)。数多くのグリオーム細胞に見られるEGFRをより特異的に標的にするそのような抗体を用いた臨床的試行を開始することにかなりの興味が持たれている。このような実験は悪性グリオームのより有効で安全な治療を与える可能性がある。
【0176】
以下に示す実験によって本実施例に報告する研究の基礎を得た。
可溶Fasリガンドの分泌をもたらす試験細胞が成功裏に移入されることの立証
可溶形態のFasLをコード化して発現させる遺伝子を有する細胞を生じさせる目的でCOS細胞の移入を実施し、この細胞が可溶なFasLを分泌したことで、この移入は成功であった。図12は、可溶(端が切り取られた)FasLをコード化するcDNAを移入させたCOS細胞が可溶FasLを合成して分泌することを立証するウエスタンブロットアッセイの画像である。前記cDNAはプラスミドpSecTag2/Hygに含まれていた(Invitrogen、Carlsbad、CA;本明細書に示す遺伝子構造物のデザインおよび合成の実施例10を参照)。前記細胞にリポフェクタミンを用いた過渡的移入を受けさせて、Rensing−Ehl他が記述した如きウエスタンブロッティングによる定量を受けさせた(Rensing−Ehl他、1995、Eur.J.Immunol.25:2253−2258の図2を参照)。レーン1は、移入を受けさせて2日間インキュベートした細胞(2mlの培地中約5x105)から得た細胞溶解産物(14μgの蛋白質)を示している。レーン2:レーン1と同じであるが4日間のインキュベーション後である。レーン3:見せ掛け移入を受けさせ(mock transfected)て4日間インキュベートした細胞から得た細胞溶解産物。レーン4:移入を受けさせてインキュベーションを1日行った後の細胞から得た培地(18μl)(濃縮を受けさせていない)。レーン5:レーン4と同じであるが2日間のインキュベーション後である。レーン6:レーン4と同じであるが4日間のインキュベーション後である。レーン7:見せ掛け移入を受けさせて4日間インキュベートした細胞から得た培地。レーン4から7に含まれる拡散した白色の帯は、培地サンプルに含まれる大濃度のアルブミンであり、これがウエスタンブロットの背景を減少させている。
【0177】
この実験で得たデータから、試験細胞系(COS)に遺伝子が移入された結果として前記細胞系がFasリガンドの可溶変形を発現させて分泌し得ることは明らかである。
試験細胞が分泌したFasリガンドがFas含有細胞を殺す
脳組織に含まれるグリオーム細胞を殺す時に用いられるグリオーム毒性蛋白質がhMSC内に生じるようにhMSCに移入を受けさせることの可能性を立証する目的で下記の実験を実施した。この実験の結果を下記の如く図13に示す。図13a−dは、可溶FasLをコード化するcDNAを過渡的に発現させるCOS細胞から得た培地が293細胞(Fas+)の増殖を抑制しかつ殺すことを示す1組の顕微鏡写真の画像である。移入を受けさせて移入後48時間の時のCOS細胞から得た1mlの培地に加えて1mlの新鮮な培地を約5x105個の293細胞と一緒にインキュベートした。3日間のインキュベーションの時の293細胞を示す。この処理によって生存可能細胞が90%を越える度合で減少した。図13aに、見せ掛け移入を受けさせたCOS細胞から得た1mlの培地と一緒にインキュベートした対照の293細胞を示す。図13bに、可溶FasLを発現させるCOS細胞から得た1mlの培地と一緒にインキュベートした試験293細胞を示す。位相差倍率はx100であった。図13cおよび13dに、図13bと同じであるが倍率を高くしてx200にした時の培養物を示す。細胞の外観は、それらはアポトーシス性(apoptotic)であることを示唆している。
外因性遺伝子を発現させるマウスおよびヒトMSCの形質導入を成功裏に行うことができることの立証
マウスおよびヒトMSCが試験外因性遺伝子を発現するようにそれに遺伝工学処理を受けさせることができることを示す目的で、試験的遺伝子であるチロシン水酸化酵素を用いた実験を実施した。図14および15に、このような実験の結果を示し、これは、マウスおよびヒトMSCが試験外因性遺伝子であるチロシン水酸化酵素を発現するようにそれにレトロウイルスベクターを用いた遺伝工学処理を成功裏に受けさせることができることを立証している。図14は、試験遺伝子(チロシン水酸化酵素)を含有するレトロウイルス(pLNCX)を用いて形質導入を受けさせたラットMSCのウエスタンブロットの画像である。レトロウイルス形質導入の条件は本明細書の実施例10に記述する如き条件であった。細胞溶解産物およびチロシン水酸化酵素の抗体を用いてウエスタンブロットアッセイを実施した。レーン1:MWマーカー。レーン2−5:形質導入を受けさせたMSCの細胞溶解産物(5または10μgの蛋白質)。レーン6:形質導入を受けさせていないMSCの細胞溶解産物。レーン7:対照細胞(293)の細胞溶解産物。図15は、試験cDNA(チロシン水酸化酵素)を含有するレトロウイルスを用いて形質導入を受けさせたヒトMSCが産物(L−DOPA)を合成および分泌することを示すグラフである。前記細胞を必須補助因子である50μMのテトラヒドロプテリジンと一緒にインキュベートした後、前記培地内に生じたL−DOPAをHPLCで定量した。対照MSCから得た培地には全くL−DOPAが検出されなかった。
【0178】
図12および13に記述した実験で用いた可溶FASリガンド用プロモーターおよびcDNAを図14および15に記述した実験で用いたレトロウイルスに転移させることを通して、図11に記述するように、毒性蛋白質、例えばFasLまたは別のグリオーム毒性蛋白質などを分泌するMSCを生じさせることができる。本明細書の実施例10に記述するように、グリオーム毒性蛋白質を分泌するように遺伝工学処理を受けさせた前記MSCが培養状態のグリオーム細胞の増殖を抑制しかつ殺すと言った有効性を評価することができる。更に、本明細書の実施例10に記述するように、グリオーム毒性蛋白質を分泌するように遺伝工学処理を受けさせた前記MSCがラット内のグリオーム細胞の増殖を抑制しかつ殺すと言った有効性を評価することができる。
ラットの脳へのhMSCの植え付けおよび移行
本明細書の実施例9に報告するように、ヒト骨髄から得たhMSCをラットの脳に植え付けると、これは神経幹細胞の移行で知られる路に沿って移行する(図16)。より最近になって、星状細胞が豊富な培養物を宿主ラットの脳から調製した時に培養物に含まれる少量のヒト細胞を回収することができることを見い出した。更に、より少ない量のヒト細胞が初期星状細胞の形態を取っていてグリアの原線維状酸蛋白質、即ち初期星状細胞のマーカーを含有している(図10)。表4に示すように、骨髄移植を受けさせたラットから得た脳断片を評価した結果、120日後でもヒト細胞の15%が存在することが示された。ラットの脳から得た星状細胞豊富培養物の評価を行った結果、その培養物に含まれる細胞の約5%がヒト細胞であることが示された。この培養物に含まれるヒト細胞の約1%がグリアの原線維状酸性蛋白質の抗体で明確に染まる(表5)。この細胞のいずれもED−1に対する抗体で明確には染まらず、従って前記ヒト細胞は小グリア細胞ではなかった。
注入したMSCが新生児マウスの脳が成長している間に増殖
他の実験において、マウスの骨髄間質細胞(mMSC)をマウスから調製して、7日令の新生児マウスの脳に注入した。脳室の胚ゾーンに前記mMSCを約50,000個注入した。核に前以てビス−ベンズアミド(Sigma Chemical Co.、St.Louis、MO)による標識を付けておくことで供与体細胞の検出を行った。12日および45日後に供与体細胞を注入部位の所で回収したが、hMSCを用いたラット実験の場合と同様に、それらはまた脳の大きな領域に移行することも確認した(図16)。倍率をより高くすることで、前記細胞は線形隊列の状態でそれら自身が配列することを見ることができ、外包、脳梁、前交連、前面海馬交連内の白色物跡に沿って移行しかつ線条の繊維束に沿って移行すると見られる(図16および17)。それらはまた反対側半球の線条内にも見られた。本明細書に記述するように、脳の凍結断片に含まれる蛍光核の数を数えることで、12日後にと殺した1匹のマウスおよび45日後にと殺した別のマウスの脳に存在する細胞の数を推定した。表6に示すように、新生児マウスの脳が成長するにつれて供与体細胞の数が約40倍増加した。成熟したマウスの脳に含まれるDNA含有量を定量した結果、それに含まれる細胞の数は約108個であることが示された。従って、45日目の供与体細胞は脳の全細胞の約2%に相当していた。
【0179】
マウスの脳の分析により、腫瘍の形成の証拠は全く見られず、このマウスは如何なる神経学的兆候も腫瘍の症状も全く示さないことが立証された。従って、供与体細胞の増殖は成長するマウスの脳に含まれる内因性神経幹細胞の増殖と平行して起こる過程であると見られる。
Fas、FasLおよびEGFRのmRNAに関するhMSCのアッセイ
Fas、FasLまたはEGFRをコード化するmRNAをhMSCが含有するか否かを測定する目的で、hMSCから得た32P標識ポリA RNAをドットブロットアッセイで用いた。hMSC中にはFas、FasLまたはEGFRに特異的なmRNAを検出することができなかった(データは示していない)。このような結果を立証する目的で、mRNAに関するRT−PCRアッセイを実施した。図18に示す結果は、低いレベルではあるがFasLに特異的なmRNAが検出されはしたがFasに特異的なmRNAが存在する証拠は全く見られないことを示している。
ラットにおけるC6グリオームモデルで実施した実験
ラットの脳の片側に存在する大脳半球の白色物と灰色物の連結部の縁にC6ラットグリオーム細胞(約100,000)を注入した。2週間後、凍結断片を調製して、ヘミロトキシンおよびエオシンによる染色を受けさせた。図19に示すように、前記C6グリオーム細胞はラットの脳に成功裏に植え込まれた。図19は、グリオームの縁の輪郭がいかに鮮明であるかを示しておりかつ異様な核を有するグリオーム細胞が時折見られることを示している。
【0180】
グリオーマ細胞に対して毒性のタンパク質を発現及び分泌するためのhMSCsの遺伝子工学
これらの実験の全体の方法は以下のとおり略述することができる。
【0181】
(a)3つの異なる腫瘍毒性タンパク質の分泌された形態を発現するように設計されているレトロウイルスベクターを製造し(図11)、(b)レトロウイルスベクターを使用してhMSCsを感染させ、(c)安定に感染された(stably infected)hMSCsをスクリーニングして高レベルの組換え腫瘍毒性タンパク質を分泌するクローンを同定し、そして(d)高産生性クローンを骨芽細胞、軟骨細胞及び脂肪細胞に生体外で分化するそれらの能力をアッセイして、細胞がそれらの多分化性(pluripotentiality)を保持していることを確実にする。次いで該クローンを本明細書で述べた生体外及び生体内でのグリオーマ毒性(glioma toxocity)のアッセイに使用する。
【0182】
3つの異なるグリオーマ毒性タンパク質を例として使用する。各々を選ぶための根本理由は以下に説明する。
【0183】
グリオーマ毒性タンパク質としてのFasリガンド(FasL)
FasLは本発明で使用するのに好ましい遺伝子である。何故ならば、a)可溶性FasLは悪性グリオーマ細胞においてアポトーシスを誘発するが、CNSの正常細胞においては誘発しないことが示され(Weller et al.,1994,J.Clin.Invest.94:954−964; Weller et al.,1995,Cancer Res.55:2936−2944; Frei et al.,1998,J.Neuroimmunol.87:105−113; Weller et al.,1998,Brain Pathol.8:285−293)、(b)細胞毒性可溶性FasLがここにおいて遺伝子トランスフェクションされたCOS細胞により分泌され、従って、hMSCsは可溶性FasLを分泌する細胞を発生するための遺伝子工学的を受けやすいようであり、c)hMSCsは低いレベルのFasLmRNAを発現しそしてFasmRNAを発現しない(図18)。従って、hMSCsはより高いレベルのFasLを合成及び分泌するように一旦遺伝子工学的に操作されるとアポトーシスを受けないようであり、d)hMSCsを局所的に注入(infusion)及びエングラフトメント(engraftment)して可溶性FasLを分泌することに基づく治療は全身系毒性(systemic toxicity)を回避するが長期のタンパク質のソースを与えるからである。これらの実験は、hMSCsにおけるFasLの発現及びそれからのFasLの分泌が、単純ヘルペスチミジンキナーゼ(herpes simplex thymidine kinase)(Uckert,1998,Hum.Gene.Ther.9:855−865)のような自殺遺伝子の細胞中の存在又はテトラサイクリン感受性プロモーター(Steinmann et al.,1998,Arch.Vitrol.143:3548)のような条件プロモーター(conditional promotor)により調節されうる、その後の実験のための基礎も与える。
グリオーマ毒性遺伝子/タンパク質としてEGFR及びCD3の両方に対して特異的な二重特異性scFv
グリオーマ毒性遺伝子としてEGFR及びCD3にたいして特異的な二重特異性scFvは本発明における使用のための1つの好ましい構築物(construct)である。何故ならば、(a)それにより発現されたタンパク質は他の悪性疾患(malignancy)を処理するのに使用されておりそして有望な結果が得られ(Kufer et al., 1997,Cancer Immunol.Immunother.45:193−197;De Jonge et al.,1997,Cancer Immunol.Immunother..45:162−165; Bookman,Semin.Oncol.25:381−396; Helfrich et al.,1998,Int.J.Cancer 76:232−239; Jost et al.,1996,Molec.Immunol.33:211−219)、そして(b)この遺伝子の使用は末梢組織に適用可能であると同様にCNSに適用可能である。その理由はTリンパ球がCNSの病理学的変化中に増加した数でCNSに現れ(Hirschberg et al.,1998,J.Neuroimmunol.89:88−96)、そして更に活性化されたT細胞の注入(infusion)はいくらかの患者において有利であった(Haynes et al., Cancer 76:840−852)からである。この遺伝子は上記した如き自殺遺伝子又は誘導性プロモーターを使用して二重特異性scFvの産生を調節するために更に精製することができる(Uckert,1998,Hum.Gene.Ther.9:855−865; Steinmann et al.,1998,Arch.Virol.143:3548)。
【0184】
グリオーマ毒性遺伝子/タンパク質としてEGFRvIIIに対するscFv抗体
このグリオーマ毒性遺伝子も好ましい。何故ならば、a)この遺伝子の使用の潜在的な危険及び実行可能性についての多数の情報がEGFRに対して特異的な125I標識モノクローナル抗体を使用して最近のII期臨床実験(current phase II clinical trial)において既に得られており(Snelling et al.,1995,Hybridoma 14:111−114; Faillot et al.,1996,Neurosurg.39:478−483; Stragliotto,Eur.J.Cancer 32A:636−640)、b)エングラフテッドトランスフェクションされた(engrafted transfected)hMSCsを使用してEGFRに対するscFv抗体を分泌させ、続いて125I標識抗体をマウスscFvに投与するこの二段階方法は、最近使用されるEGFRに対するモノクローナル125I標識抗体より更に特異的な治療を与えるはずてあり、そしてc)このタンパク質の使用は、特異性がEGFRに対するマウスscFvの結合及びマウスscFvに対する125I標識抗体の結合の両方において達成されるので、EGFRvIIIに対する125I標識抗体の使用よりも更に特異的であるらしいからである。
【0185】
上記の外に、レトロウイルスベクターはそれらが導入される細胞において高いレベルの安定な遺伝子発現を再現可能に生じさせるので、レトロウイルスベクターを使用することができる。更に、多様なレトロウイルス構築物が商業的に入手可能であり、そしてhMSCsにおいて使用することができる。正常な志願者の腸骨稜(iliac crests)からの骨髄吸引液(marrow aspirates)及び器官ドナーの部検(autopsy)で得られた椎体(vertebral bodies)からの骨髄(marrow)を使用してhMSCsを単離を単離することができる。椎体からの骨髄も使用することができる。何故ならば、それらは多数のhMSCs(骨髄吸引液当たり108の代わりに約2×109/体(body))を与えるからである。また、ドナー椎体(donor−vertebral bodies)から得られたhMSCsが腸骨吸引液からのhMSCsとして脳においてエングラフトされる(engraft)ならば、それらは潜在的臨床実験のための好ましいソースであることができる。
【0186】
遺伝子構築物の設計及び合成
FasL構築物の場合に、プラスミド(pBL−KA15)におけるラットFasLcDNAはSuda et al.,(1933,Cell75:1169−1178)に記載されている。遺伝子の細胞外領域(ATG+nt371〜910;Suda et al.,1933,Cell75:1169−1178))をPCR増幅させ、そして配列をクローニングする。次いでcDNAを、Igκ鎖分泌シグナル、CMVプロモーター、myc tag、及びハイグロマイシン耐性遺伝子を含む分泌ベクター(pSecTag2/Hygro:Invitrogen,Carlsbad,CA)に移す。次いでフランキング遺伝子(flanking gene)を含む配列を標準レトロウイルスベクター(pLNCX:Clon Tech Inc,Palo Alto,CA)に移す。
【0187】
EGFRに対するscFvの場合に、レトロウイルスベクターpBabeNeo/scFv−225Sが記載されている(Jannot et al.,1996,Oncogene 13;275−282)。細胞からのタンパク質の分泌を改良するために、Jost et al.(Jost et al.,1994,J.Biol.Chem.269:26267−26273)により記載された如くしてグリコシル化部位を導入する。EGFRIに対するscFv抗体遺伝子をEGFRvIIIに対するscFvのための遺伝子で置き換える。何故ならば、それは本明細書で引用された参考文献に記載のとおりEGFRのグリオーマ腫瘍特異的バリアントであるからである。
【0188】
EGFR及びCD3の両方に対する二重特異性scFvは本明細書に引用された参考文献に記載されている。CD3及びFLAGエピトープ(Wickham et al.,1997,J.Viol.71:7663−7669)の両方に対するこの二重特異性scFvを、抗FLAGscFv配列を本発明で使用するためのレトロウイルスベクターpLNCX中のscFv抗EGFR又はscFv抗EGFRvIIIのための配列で置き換えることにより変成する(modified)。
【0189】
レトロウイルストランスフェクション
レトロウイルストランスフェクションのために標準プロトコルを使用する。条件は、マウスMSCsを安定にトランスフェクションするのに使用された条件に匹敵し、そして他の人がhMSCsを安定にトランスフェクションするのに使用沙汰条件に匹敵する(Gordon et al.,1997,Hum.Gene Ther.8:1385−1394;Chuah et al,1998,Hum.Gene Ther.9:353−365;Bulabois et al.,1998,J.Hematother.7:225−239)。ベクターを両種指向性ネズミパッケージング細胞系(amphotropic murine packaging cell line)に安定にトランスフェクションする(Retro−Pack;PT67;Clon Tech,Inc.Palo Alto,CA)。構成ウイルス産生体クローン(constitutive virus producer clones)をG418又はハイグロマイシンによる選択により単離し、ウイルス力価(virus titers)をNIH−3T3細胞上でアッセイする。高い力価のクローンの上清を使用してhMSCsを感染させる。一次培養物を引き続く三日感染させ、そして細胞を5〜14日間選択下に置いて、安定に発現するクローンを得る。
【0190】
組換え遺伝子発現を、プライマーにたいする既知の遺伝子配列を使用してRT−PCRアッセイにおいて最初にアッセイする。耐性細胞クローンから得られた細胞を含まない上清を(cell−free supernatant)をプールし、そしてアミコン(Amicon)撹拌装置を使用して45倍濃縮し、次いでLN−229及びC6グリオブラストーマ細胞の細胞毒性によりアッセイして(Frei et al.,1998,J.Neuroimmunol.87:105−113;Barth 1998,J.Neurooncol.36:91−102)、活性なFasLの分泌を評価する。scFv抗体を発現する細胞を評価するために、myc(インビトロゲン(Invitrogen))に対する特異的抗体の存在を濃縮媒体中において検出して、レトロウイルスベクターから発現されるmycエピトープを検出する。マウスscFvに対する抗血清をトランスフェクションされたhMSCsにより合成されたタンパク質を使用して製造し、そしてアッセイにおいて使用する。ウサギにおける抗血清を製造するのにhMSCsから得られた不十分なタンパク質の問題は、大腸菌(E.coli)における組換えタンパク質を製造することにより回避することができる。
【0191】
hMSCsの単離及び拡張
hMSCsの単離の方法は実施例9に上記したとおりである。この方法を3〜15回(passages)繰り返す。同様な条件を使用して、ヒトドナーからの椎体から得られたhMSCsを単離しそして増殖する(expand)。
【0192】
明らかにサンプリングの問題による腸骨稜の吸引液から得られたhMSCsのサンプルの培養物における寿命の変動がある。寿命は、コロニー形成単位(CFUs)を発生するための最初のサンプルの有効性と密接に関係しており、そしてCFUアッセイを使用して培養物における15までの倍加(doublings)を受けるであろうhMSCsのサンプルを同定することができる。CFUsを特徴付けるために、70〜90%集密性(confluency)に培養物において拡張されたhMSCsを37℃で5分間トリプシン−EDTA(GIBCO,Grand Island,NY)を使用して採取し、そして血球計を使用して計数した。ガラス製パストゥールピペットを頂部で炎に当ててその直径を減少させた。細胞を狭くなったピペットを通して数回吸って細胞の分離を確実にした。次いで細胞を完全媒体(α−MEM;GIBCO;20%ロット選択されたFCS)、1Xペニシリン−ストレプトマイシン(GIBCO)及び2mML−グルタミン(GIBCO)中で1:100に希釈した。約100〜200の細胞を100mm組織培養皿(Falcon,Becton Dickenson,Lincoln Park,NJ)で平板培養し、そして5%加湿CO2中で37℃で10〜14日間インキュベーションした。培地を吸引し、細胞を1×PBSで洗浄し、そしてメタノール中の5%クリスタルバイオレットで室温で10分間染色した。染料(stain)を細胞から吸引し、次いで細胞を蒸留水で2回洗浄した。可視コロニーを計数しそしてCFUsを平板培養された全体の細胞の百分率として計算した。
【0193】
分化/多分化能のアッセイ
下記の条件を使用してhMSCsの骨芽細胞への分化をアッセイした。hMSCsを完全培地において70〜90%集密性となるように培養した。培地を骨形成培地(osteogenic medium)(完全培地、10-8Mデキサメタゾン、0.2mMアスコルビン酸;Sigma Chemical Co.,St.Louis,MO)及び10mMβグリセロールリン酸(Sigma Chemical Co.,St.Louis,MO)で3日毎に置き換えた。鉱物の付着は通常2〜3週間後に観察された。培養物をPBSで洗浄しそして氷冷70%エタノールの溶液中に1時間固定してアリザリンレッド(AR−S)で染色し、そしてカルシウム鉱物含有率を定量した。培養物をMilli−Q精製水(Milli−Q purified water)で洗浄しそして回転させながら40mMアリザリンレッド−S、pH4.2(1ml/35mmプレート)で10分間染色した。次いで培養物を水で5回洗浄し、続いてPBSで15分間洗浄して(回転を伴って)、非特異的AR−S染色を減少させた。染色された培養物を撮影し、続いて10mMリン酸ナトリウム中の10%w/vセチルピリジニウムクロリド(CPC)、pH7.0を使用して室温で15分間定量的抽出処理した。これらのAR−S抽出物のアリクォートを10%CPC溶液中で10倍希釈し、AR−S濃度を分光光度計で562nmにおける吸光度測定により決定した。値を結合染料(Hoechst33258、Hoechst Marion Roussel,Kansas City,MO)によりアッセイされた全DNA含有率について正規化した。
【0194】
hMSCsの脂肪細胞への分化を下記の方法を使用して評価した。hMSCsを完全培地中で95%集密性となるように培養した。培地を0.5μMヒドロコルチゾン、125mMIBMX及び35mMインドメタシンを含有するMHIカクテルで3日毎に置き換えた。脂質小胞(lipid vacuoles)を含む細胞が2〜3週間後に観察された。脂肪の存在をオイルレッドO(Oil−red O)染色(Sigma Chemical Co.,St.Louis,MO)により検出した。細胞をPBSで洗浄しそして10%ホルマリン中に10分間固定し、そして新たなオイルレッドO溶液(3部のオイルレッドOストック[99%イソプロピルアルコール中の0.5%オイルレッドO]、2部の蒸留水、中で染色し、5分間混合し、そして10〜15分間フィルター滅菌した。プレートを水で3回洗浄した。1つ以上の脂肪細胞を含むコロニーの数及びコロニー当たり脂肪細胞の数(平均±S.D.)を計数した。
【0195】
グリオーマ細胞を殺すのに又はその寿命を制限するのに十分な所望の組換えタンパク質の分泌の十分なレベルがトランスフェクションされた細胞において観察されるかどうかに基づいて結果を評価する。
【0196】
培養物中の遺伝子工学的に処理されたhMSCsの有効性の試験
他の人々により広く使用されてきた標準プロトコルをこれらの実験で使用するが、培養物に潜在的腫瘍毒性試薬(potentially tumor toxic reagent)を加える代わりに、腫瘍毒性タンパク質を分泌するように工学的に処理されたhMSCsを加える。
【0197】
グリオーマ細胞ソース
β−ガラクトシダーゼ(lacZ)遺伝子が挿入されている及び挿入されていないラットC6グリオーマ細胞(Rat C6 glioma cells)及びヒトT98Gグリオーマ細胞(human T98G glioma cells)はアメリカン・タイプ・カルチャー・コレクション(American Type Culture Collection)(ATCC)から得られた。更に、確認された病理学的診断を有する13ヒトグリオブラストーマ多形腫瘍(human glioblastoma multiform tumors)の一次培養物を使用のために製造した。使用することができる追加のグリオーマ細胞系LN−18、LN−215、LN−229、LN−308、LN−319及びLN−405はWeller et al.,(1995,Cancer Res.55:2936−2944)に記載されている。
【0198】
腫瘍毒性(Tumor Toxicity)のアッセイ
Frei et al.(1998,J.Neuroimmunol.87:105−113)に記載の条件の如き標準アッセイ条件を使用する。1:10,000〜1:1の範囲のhMSCs対ヒトグリオーマ細胞の割合を使用する。hMSCsを殺すことはグリオーマを殺すことから区別される。これは前記したようにビス−ベンズアミド(Sigma Chemical Co.,St.Louis,MO)によるいずれかの細胞タイプの先の核標識(prior nuclear−labeling)による。scFv抗EGFRを分泌するhMSCsの効果を評価するために(図11の方法III)、より複雑なアッセイを使用することができる。scFv抗EGFRを分泌する細胞の効果を、マウスscFvに対する125I標識ウサギIgGを添加して及び添加しないで検査する。125I標識IgGは、細胞混合物のインキュベーションの開始の12又は48時間後に0.039〜20μCi/mlの濃度で加える(Reist et al.,1995,Cancer Res.55:4375−4382)。抗マウスscFvの細胞結合を、Reist et al.(Reist et al.,1995,Cancer Res..55:4375−4382)により述べられたようにFITCtag及び免疫蛍光顕微鏡検査法及び放射能標識を使用して評価する。scFv抗EGFRを分泌するhMSCsはアポトーシスについてはアッセイされない。何故ならば125Iは単独で染色体損傷を引き起こすからである。
【0199】
細胞毒性を評価するために(Frei et all.,1998,J.Neuroimmunol、87:105−113)、細胞混合物を、10%熱不活性化FSCを含有する0.5mlDMEM中のウエル当たり2×105細胞の密度で、24ウエルのプレート(Falcon)中に播種する。2日〜1週間インキュベーションの後、培地を捨て、そして残りの付着性生細胞(adherent viable cells)をクリスタルバイオレット(20%メタノール中の0.5%)0.3mlで15分間染色し、水道水(tap water)中で洗浄しそして空気乾燥する。細胞生存率(cell viability)を、0.3mlの0.05Mクエン酸ナトリウム/50%エタノール及び0.1ml溶液で染料を溶出することにより決定し、溶出された染料溶液を96ウエルのプレート(Falcon)のウエルに移し、そしてタイターテク・マルチスカン・プレート読み取り器(Titertek Multiskan plate reader)(Flow,Rockville,MD)を使用して染料の540nmにおける吸光度を測定する。生存率を対照培養物に対する生存している細胞の百分率として表し、死滅率(killing rate)は下記式:
%死滅=100%−%生存
を使用して計算される。
【0200】
軟質アガロース中の腫瘍コロニー形成に対する効果(コロニーのサイズ及び細胞死亡)を評価するために(Frei et all01998,J.Neuroimmunol.87:105−113)、24ウエル培養プレート(Falcon)の各ウエルを、0.7%の低ゲル化シープラークアガロース(low gelling seaplaque agarose)を含有する0.4mlの基部層(base layer)で被覆する。細胞混合物(6×105)を、20%FCS、2mMN−アセチル−L−グルタミン、1%非必須アミノ酸20μg/mlゲンタマイシン、0.3%低ゲル化シープラークアガロースを含有するDMEM1.5ml中に、同型ベース培養層(replicate base culture layers)の上で0.5mlを平板培養する前に、再懸濁させる。次いで培養プレートを冷蔵庫(4℃)に15分間移し、次いで室温に10分間移し、次いで37℃の培養物インキュベータ(culture incubator)に移した。試験された各腫瘍及びサンプルについて再現培養物(duplicate cultures)を調製した。4〜7週間のインキュベーションの後、コロニーをニュートラルレッドで染色しそして倒立顕微鏡を使用して計数する。30より多くの細胞を含むクローンをコロニーとして数え、そして30未満の細胞を含むクローンはクラスターとして数える。ニュートラルレッド取り込みも測定する。コロニーを染色する前に、アガロース培養物を0.1NHClで注意深く洗浄する。ニュートラルレッド溶液(3.3mg/ml:Sigma Chemical Co.,St.Louis,MO)を0.2NHCl中の0.1%で使用し、そしてコロニーを室温で15分間インキュベーションする。次いでコロニーを0.1NHClで注意深く2回洗浄し、そしてニュートラルレッド陽性コロニーを上記の如くして計数する。平板培養効率は、下記式 %平板培養効率=[成長コロニーの数/平板培養細胞の数]×100
を使用して計算する。
【0201】
細胞のアポトーシスも下記のとおりFrei et all.(1998,J.Neuroimmunol.87:105−113)の条件を使用して評価する。生体外腫瘍細胞における一本鎖及び二本鎖DNA中断(breaks)の検出を、製造会社の指示に従って現場の細胞死亡検出キット(Boehringer Manheim,Indianapolis,IN)を使用して行う。簡単に言うと、3×106細胞を25cm2フラスコ(Falcon)中で培養する。しかる後、浮遊細胞並びに付着細胞を円錐形50mlチューブ(Falcon)に移し、そして300Xgで5分間遠心分離によりPBS(pH7.4)中で洗浄する。ペレット化された細胞を、水平シェーカーにおいて室温で30分間、0.2mlのPBS緩衝2%ホルムアルデヒド溶液中で固定する。細胞をPBS中で洗浄し、次いでそれらを0.1mlのトリトン−X100(0.1%w/v)/クエン酸ナトリウム(0.1%、w/v)中で4℃で2分間インキュベーションすることにより透過性にする(permeabilized)。TUNEL反応(Boehringer Manheim,)を始める前に、細胞を2回洗浄する。TUNEL反応混合物(50μl)は、0.3ナノモル(nmol)FITC−12dTP、3ナノモルdATP、25単位のTdT及び塩化コバルトを含有する。陰性対照反応は塩化コバルトを省くことにより行われる。反応を37℃で1時間行い、そして2μlの0.5MEDTAの添加により中止する。細胞をPBS中で1回洗浄しそしてエピックス・プロフィル・アナライザー(Epics profile analyzer)を使用して分析する。
【0202】
サンプル処理の効果をスチューデントのt−検定により比較する。複合処理(composite treatment)をANOVAにより比較する。決定的パラメーターは、有意な効果を得るのに必要なhMSCs対グリオーマ細胞の割合である。
【0203】
疾患にたいするラットモデルにおける遺伝子工学的に処理されたhMSCsの有効性の試験
この節においては、他の人々により広く使用されている標準プロトコル(Barba et al.,1993,J.Neurosurg.79:729−735)を使用するが、様々の量の遺伝子工学的に処理されたhMSCsを、グリオーマ細胞がラットの脳に注入された後0〜14日の種々の時点で注入する点が変えられている。
【0204】
ラットモデル及びhMSCsの投与
本明細書で前記したのと本質的に同じプロトコルを使用して脳腫瘍を発生させる。成熟スプレーグ・ドーリー・アルビノラット(Adult Sprague Dawley albino rats)(200〜300g)を酸素中の3%ハロタンを使用して麻酔し、6mg/kgキシロジン及び60mg/kgケタミンの混合物の筋肉内注入により維持する。ラットを定位(stereotaxic)装置に入れ、そして2つのバーホール(burr holes)を、ブレグマ(bregma)に対して3mm側方に(lateral)及び2mm前方に(anterior)作る。グリオーマ細胞懸濁液約10μl(50,000〜75,000)を、大脳半球の白灰質及び白質接合部(grey and white matter junction)の縁(margin)に、30分間にわたり各部位にゆっくりと注入する(infused)。切開部(wound)を中断外科縫合糸(interrupted surgical sutures)で閉じ、そして動物を0.6mg/kgのキシロジン及び6mg/kgのケタミンで処理する。0〜14日後の範囲の時点で、遺伝子工学的に処理されたhMSCs10μl(10,000〜100,000細胞)を1つの部位に注入し、そして第2腫瘍部位への野生型hMSCsの同じ注入を行って対照として使用する。ラットを傾眠(lethalgy)及び不全麻痺(paresis)の神経学的症状について毎日検査する。ラットを14〜21日後に殺し、そのとき対照C6グリオーマは直径6〜10mmである。ラットをキシロジン及びケタミンで麻酔し、次いで氷冷リン酸緩衝液、続いて3%緩衝パラホルムアルデヒド及び10%スクロースを心臓内に(intracardially)灌流する(perfused)。脳を取り出し、前脳を刈り込み(trimmed)、そしてサンプルを直ちに冷凍する。
【0205】
アッセイ
グリオーマの減少又は処理において遺伝子工学的に処理されたhMSCsの有効性は、(a)腫瘍容積の立体学的分析、(b)ラットの長時間の生存、(c)脳の順次の切片(serial sections)における蛍光的に予備標識されたグリオーマ細胞又はhMSCsの計数及び(d)脳からの核の単離及び蛍光的に予備標識されたグリオーマ核の計数、により測定される。本発明で製造される組換えタンパク質は免疫組織学により検出することができる。
【0206】
腫瘍容積の評価
この評価は、前述のプロトコル(Barba et al.,1993,J.Neurosurg.79:729−735)を使用して行われる。ラットを殺しそして4%パラホルムアルデヒドで灌流する。個々の脳を採取し、4%パラホルムアルデヒド中に24時間置き、次いで4℃で30%スクロース中に飽和するまで保存する。脳を40μm切片(sections)を使用して順次に切断し(serially sectioned)、すべての第5の切片を取り付けそしてNissl染色で処理して腫瘍鑑定を助ける。腫瘍組織を有する染色された脳切片(every fifth serial 40μm section)を検査しそして腫瘍容積を立体学的に定量する。すべての第5の順次の40μm切片を検査することにより、脳の各100μm切片が腫瘍の存在について走査される。脳内の腫瘍の全容積は、校正されたドットマトリックスグリッドオーバーレイ(dot−matrix grid overlay)から腫瘍の上のグリッドドットを計数することにより顕微鏡により定量される。各ドットにより表される容積は、各ドットにより覆われた面積に各スライスにより表される脳の厚さを乗じた積として計算され、そして全腫瘍容積は個々の脳切片において測定された腫瘍容積の和として計算される。腫瘍容積はグラフの形態でプロットされ、そしてマン−ホイットニー(Mann−Whitney)のU検定ノンパラメトリック統計分析(U−test nonparametric statistican analysis)により比較される。
【0207】
長期間生存のアッセイ
これらの実験(Barba et al.,1993,J.Neurosurg.79:729−735)は、グリオーマ細胞が1つの部位のみに注入され、続いて遺伝子工学的に処理された又は野生型のhMSCsが同じ部位に注入されるラットを使用して行われる。ラットを90日にわたり評価する。動物を毎日観察し、死亡の日を記録し、そして腫瘍の存在を組織学的に証明する。結果を生存率曲線としてプロットする。
脳切片中のグリオーマ細胞およびhMSCの検出および特徴づけ
グリオーマ細胞もしくはhMSCのいずれかを、本明細書に既に記述されたとおり脳への注入前に1μg/mlのビスベンズアミドで24時間前標識する。ラットを殺し、そして上述されたとおり灌流する。脳をイソペンタン−ドライアイス中で凍結させ、そして10μmの切片を調製する。凍結された切片をゼラチン被覆されたスライドガラスに付着させ、そしてすばやく冷アセトン中に5分間浸積し、そしてさらなる処理のため−20℃で保存する。蛍光で標識された細胞を、蛍光顕微鏡を使用して可視化しそして写真撮影する。蛍光で標識された核の数を、線条体の頭側から尾側の限界までで切断された8〜10個の組織切片中で計数する。この処置を、交互の切片を使用する2名の研究者により各脳で反復する。明瞭に標識された核のみ計数する。死んだ細胞および溶解された細胞は周囲組織中に帯青色を残し、そして明瞭な核染色を残さない。観察された数を切片の総数に外挿して、生存する植え付けられた細胞の数を推定する。
【0208】
グリオーマ細胞もしくはhMSCのアッセイを確認するため、核を脳から単離する(Ausubel、1998、Current Protocols in Molecular Biology、1,4.10.6、John Wiley and Sons,Inc.)。標識されたグリオーマ細胞もしくは標識されたhMSCのいずれかの注入の後、脳を4℃で小片に切断し、そして氷冷ダウンス(Dounce)ホモジェナイザーに移す。組織および細胞を、B乳棒の5〜10回のひと突きで、もしくは、核が、位相差顕微鏡検査により測定されるように細胞質標識を含まないようにみえるまで破壊する。核を、清浄な50mlの円錐状のポリプロピレン遠沈管に移し、そして4mlのショ糖緩衝液IIを添加する(10mMトリス−HCl緩衝液、pH8.0中2Mショ糖、5mM酢酸マグネシウム、0.1mM EDTA、1mM DTT)。サンプルを穏やかにピペットで上下させることおよび反転により混合する。ショ糖緩衝液II(4.4ml)を、スウィンギングバスケット遠沈管(ポリアロマーSW 40.1チューブ)に添加し、核層をショ糖の緩衝材上に添加し、そしてチューブをショ糖緩衝液I(0.32Mショ糖、3mM CaCl2、2mM酢酸マグネシウム、0.1mM EDTAおよび1mM DTTおよび0.5%NP−40および10mMトリス−HCl緩衝液、pH8.0)で口のところまで満たす(topped off)。サンプルを、SW40.1ローター中4℃で30,000×gで45分間遠心分離する。核を含有するペレットを、1mlあたり約5×107個の核で0.2mlの氷冷グリセロール保存緩衝液に懸濁する。サンプルを液体窒素中−70℃で凍結させて保存する。アッセイのためには、核の融解された懸濁液を血球計算板中に置く。標識された核を、紫外顕微鏡を使用して計数し、そして全部の核を位相差顕微鏡検査を使用して計数する。
組換えタンパク質分泌についてのアッセイ
hMSCにより分泌されたグリオーマの毒性タンパク質を検出するため、脳を、それらをイソペンタン−ドライアイス(−22℃)中に置くことにより急激に凍結させ、薄片に切断し、そして切片を冷アセトン中で固定する。当該切片をその後、ヤギ抗ラットFasL(サンタ クルズ(Santa Cruz))もしくはヤギ抗マウスIgG(ジャクソン(Jackson))のような一次抗体で染色する。これらの抗体はジャクソン ラブス(Jackson Labs)(フィラデルフィア州チェスター)から得ることができる。二次抗体は適切なFITC標識された抗体(シグマ ケミカル カンパニー(Sigma Chemical Co.)、ミズーリ州セントルイス)である。
【0209】
実験を、より長い時間の期間の後に同一条件下で反復し得る。例えば、ラットを、これらの実験で有効であることが示された遺伝子を工作されたhMSCについて1ないし6ヶ月後に評価し得そして殺し得る。
【0210】
処理されたグリオーマおよび偽処理された対照グリオーマを同一ラットから一貫して比較する。全部のアッセイからのデータをスチューデントのt検定を使用して評価する。
【0211】
【表4】
【0212】
【表5】
【0213】
【表6】
【0214】
実施例11:骨髄ストロマ細胞は新生児のマウスの脳に注射した後、神経幹細胞として挙動する
幹細胞は自己再生し、そして多数の、しかし異なる細胞系譜に分化することができる子孫をつくる能力が特徴である。初期胚から派生した幹細胞はすべての体細胞型に分化することができるが(Evans and Kaufman,1981,Nature 292:154;Martin,1981,Proc.Natl.Acad.Sci.USA 78:7634;Pederson,1994,Repord,Fertil.Dev.6:543)、成体の組織に由来するものはそれらが存在する組織に特徴的な細胞系譜のみを生産すると考えられている。例えば骨髄に存在する造血幹細胞は、血液要素のみを生じる(Morrison,1994,Annu.Rev.Cell.Dev.Biol.11:35)。また幹細胞はそれらの分布が成体組織に限られ、そして骨髄、消化管、生殖巣、皮膚および脳に見いだされるだけである(Hall and Watt,1989,Development 106:619;Morrison et al.,1977,Cell 88:287)。後者の場合は、近づけないことがこのような幹細胞を中枢神経系疾患の処置に利用することを制限している。
【0215】
最近、幾つかの報告で、成体組織中の幹細胞の分化能力は系譜に限定されているという見解が調べられた(Tajbakhsh et al.,1994,Neuron 13:813;Bjornson et al.,1999,Science 283:534)。実際にそのような幹細胞が全能性であり、そしてそれらの分化能力が局所的なミクロ環境中の特異的な合図に比例する反応により現われるならば、別の皮膚起源に由来する幹細胞を使用して組織を再構成することが可能かもしれない。
【0216】
この実施例の実験は、新生児マウスの脳室下の芽細胞域(subventricular germinal zone:SVZ)に骨髄ストロマ細胞(MSC)を注射することにより、骨髄に由来する幹細胞が脳中の神経細胞の運命を選択できるかどうかを決定するために計画した。
均一な MSC 群を単離するための免疫抑制法
マウスMSCカルチャーをメスのFVB/N マウスの骨髄から樹立し(ジャクソン ラボズ(Jackson Labs)、バー ハーバー、メリーランド州)、そして7〜10日間培養した(Phinney et al.,1999,J.Cell.Biochem.72:570)。免疫細胞化学のためには、1-ウェル チャンバースライド(ファルコン:Falcon)で培養した細胞を、PBSで洗浄し、風乾し、氷冷アセトン中で2分間固定し、再度風乾し、そして次にギムザで染色するか、またはラット抗-マウスCD 16/CD32(ファミゲン:Pharmigem Fc ブロック)と、1:50希釈で30分間、次にビオチン化CD11b抗体(ファミゲン)と1:200希釈で、そして最後にFITC-結合抗-ビオチン抗体(ダコ:Dako)と1:100希釈でインキューベーションした。スライドはエチジウムブロマイドでカウンター染色した。
【0217】
あるいは細胞を0.25%トリプシンで室温にて5分間処理し、そして次に穏やかに掻き取り回収した。約2〜2.5×106細胞を4℃で60分間、ビオチン化抗-CD11b抗体(ファミゲン)に結合したアビジンを被覆した常磁性ビーズ(PGC)のスラリーとインキューベーションした。ビーズの終濃度は0.05mg/mlであり、そして抗体対ビーズの比率は、10μg/mgであった。ビーズに結合しない細胞を回収し、α−最小必須培地(MEM)で洗浄し、そして次に1−ウェルチャンバースライド上にまいた。48時間後、細胞を上記のように染色した。すべての写真はNikon Otpihot-2 顕微鏡で撮影した。
ビス - ベンズイミドを用いた mMSC の蛍光標識
7日間のマウスMSCカルチャーを10μg/mlのビス-ベンズイミド(シグマ:Sigma)と一緒に一晩インキューベーションし、そして次に免疫-抑制により単離したMSCを血球計算器で計数し、そして10,000細胞/μl濃度で無血清α-MEM中に再懸濁した。目印としてブレグマを使用して、全部5μlの約50,000個の細胞を5分間にわたりゆっくりと冷凍麻酔した4日齢のマウスのSVZにステロタクチック(sterotactic)デバイスで注射した。示した時点でマウスを屠殺し、4%パラホルムアルデヒドを潅流し、そして30%シュクロースでPBS中にて凍結保護した。脳を摘出し、そして4つの等しいサイズの皮質切片に大きく分割した。各切片をOCT化合物中に置き、凍結し、そして10μm厚に冷凍切開した。全部で3匹の動物を各時点で組織学的分析のために取った。MSC注射を受けた18匹以上の動物で、1匹だけが脳中にドナー細胞の移植を示さないことが分かった。
マウス前脳中のドナー細胞の量の計算
冠状の連続切片中で標識した核により覆われた領域を、最初に100×倍率で顕微鏡の網線を使用して算出した。この領域を次に400×倍の視野の領域により分割した。得られた数に、次に5つ毎の10μmの切片について400×倍で視野(n+5)あたりの同じ位相内の蛍光性の核の数を掛け算する。この方法に基づき、前脳中で予測されるドナー細胞の数は、各時点について1匹の動物の調査に従い、注射から3日後で100,000、12日後で600,000、そして45日後で2×106と等しかった。
8- ブロモ -2- デオキシウリジン (BrdU) での細胞標識
5日間成長させたMSCカルチャーに、5μM 8-ブロモ-2-デオキシウリジン(10%FBSを補充したα-MEM中)を用いて48時間パルスをかけ、PBSで数回洗浄し、そして上記のように免疫−抑制した。各時点で3匹の動物を組織額的分析に使用した。
mMSC の注射に由来する副作用の評価
最小反応性グリオーシスは、mMSC注射を受けた動物で明らかであったが、注射管の縁に限られた。このグリオーシスは塩水のみを注射された動物の模擬実験でも明らかであった。MSCを注射された動物は、注射から90日後まで明白な行動異常を示さず、これはこれまで確立された中で最も長い。さらに実験動物の兄妹交配では、MSC注射を受けたメスが成功裏に子孫を育てることができたことを確認した。
GFAP および BrdU の染色
マウスに4%パラホルムアルデヒドを潅流し、そしてパラフィン包埋のために処理した。BrdUのための免疫組織化学は、抗-BrdU抗体(ダコ社)を前述のように1:500希釈するが(Gage et al.,Proc.Natl.Acad.Sci.92:897)、ギ酸前処理は除いて行った。BrdU染色切片を、次にGFAPについて二重染色した。切片は10分間、0.25%トリプシンで処理し、続いて20%の正常ヤギ血清を用いて15分間のブロッキング工程で処理した。1:250希釈のウサギ抗-GFAP(ダコ社)を、次に室温で30分間適用した。1次抗体は、1:10希釈の金標識したヤギ抗-ウサギ免疫グロブリン、続いて30分間の銀増感により検出した(ポリサイエンス社:Polyscience Inc.)。
【0218】
MSCは拡張、再生および多くの間充織細胞系譜へ分化することができ(Owen,1988,J.Cell.Sci,Suppl.10:63;Aubin,1988 J.Cell.Biochem.Suppl.30:73)、すなわち幹細胞の基本的基準を満たす。典型的には、MSCはそれらのプラスチックへの付着により骨髄から単離される(Prockop,1977,Science 276:71)。我々はすでに、様々な同系交配マウス種からこの方法により得たマウスのMSCカルチャーが、細胞表面レセプターCD11bを発現する骨髄造血細胞により支配される異質な群を表すことを示した(Phinney et al.,1999,J.Cell.Biochem.72:570)。このような考察により、我々は(図20)に表すようなフィブロブラストイド−形MSCの均一な群を単離するために、免疫抑制に基づく信頼性のある方法の開発が可能となる。精製後、このような細胞はCD45との免疫反応性を示さず、この群に造血細胞が全く無いことを示している(データは示さず)。
【0219】
蛍光性DNA結合色素であるビス-ベンズイミドで標識した約50,000個のmMSCをマウスの脳に注射してから3日後、蛍光顕微鏡による凍結切片の直接的調査では、SVZ中に色素で標識したドナー細胞が明らかとなり、そして脳脊髄幹に沿って後および第3脳室に並び、臭球に吻側から伸びている。少数の細胞では、脳梁および脈絡叢に並んでいることも明らかであった。このような結果は、(図21A)に表す。時々ドナー細胞が対側性の半球にも見いだされた。注射に先立ち溶解した50,000のビス-ベンズイミド標識細胞を注射された動物に由来する凍結切片は、検出可能な蛍光性の核を含まず、これはビス-ベンズイミズがドナーから宿主細胞に受動的に輸送されないことを示した。
【0220】
注射から12日後に、ドナー細胞は+0.9ブレグマで注射管の近位に最も広く分布し、そして(図21a〜c)に示すように同側の線条に広がり、前交連から上の外包を通って帯状束皮質に広がった。多くのドナー細胞も、未だに側脳室および脈絡叢に並んでいることが明らかである。移植から45日後、ドナー細胞を(図21d)に示すように線条全体にまいた。注射部位から吻側に移動して、ドナー細胞は(図21a)に表すように外包を越えて語義感覚(sematosensory)皮質を通り、そしてクモ膜質に沿っていた。
【0221】
ドナー細胞は、(図21e)に表すように脳梁ならびに内部および腹側の海馬交連にも見られた。このように確立された白質管内で、ドナー細胞は(図22)に表すように平行で放射状に並び、それらの脳全体のスパシオテンポラル(spaciotemporal)な分布が単なる拡散というよりは秩序だった移動プロセスにより媒介されることを示した。色素で標識した細胞数の増加は、対側性半球でも明らかであった。蛍光性核の直接的計数に基づく予想では、ドナー細胞数は40倍以上に増えたことを示した。
【0222】
MSCの顕著な増殖はそれらのSVZから線条体および皮質性領域への移動と一緒に、神経膠細胞症の発生;SVZからのNSCによる前脳の出生後の集落形成、引き続きそれらのマクログリアへの分化(Levison et al.,1993,Development 119:611;Levison and Goldman,1993,Neuron 10:201;Zerlin et al.,1995,J.Neurosci,15:7238)を模倣した。したがってMSCは神経幹細胞の挙動の観点を模倣する。
【0223】
この事柄をさらに取り上げるために、このような実験を8-ブロモ-2-デオキシウリジン(BrdU)で標識した細胞を用いて繰り返した。注射から12日後に、BrdUで標識したドナー細胞は、(図23a〜c)に表すように脳室下域、線条体および同側半球の外包全体で明らかであり、この分布はビス−ベンズイミドで標識した細胞を用いて見られた分布と同様であった。
【0224】
二重標識では、グリア繊維酸性タンパク質(GFAP)発現がSVZ中のドナー細胞にはほとんど無いが、(図23d)に表すように線条体および海馬の分子層内のドナー細胞のサブセットでは強力に発現したことが明らかとなった。形態学およびそれらのニューロンとの関連に基づき、BrdUで標識した細胞も希突起膠細胞に分化するように思われた。このような結果は、骨髄に由来する細胞が脳中に移植され、そしてマクログリアを生じるというこれまでの知見(Eglitis and Mezey,1997,Proc.Natl.Acad.Sci.USA 95:4080;Azizi et al.,1998,Proc.Natl.Acad.Sci.USA 95:3908) を、マウスMSCが確立された経路に沿って移動し、そして新生児の前脳で行われている発育と一致する様式で神経細胞系譜に分化することを証明することにより広げた。
【0225】
ドナーに由来するアストロサイトおよび希突起膠細胞に加えて、BrdUで標識した細胞は(図24aおよびb)に表すようにカエハ島内、腹側の前脳皮質中のニューロンリッチ領域にもに凝集して見いだされ、MSCがニューロンにも分化することを示唆している。これを確認するために、出生後の神経発生の既知領域内でMSCの分布(Luskin,1993,Neuron 11:173;Lois and Alvarez-Buylla,1994,Science 264:1145;Jankovski and Sotelo,1996,J.Comp.Neurol.371:376;Altman,1972 J.Comp.Neurol.145:353;Hatten and Heintz,1995,Ann,Rev,Neurosci,18:385)を分析し、そしてBrdUで標識した細胞の有意な比率を(図24c〜f)に表すように臭球および小脳の両方に見い出した。後者の場合は、(図24eおよびf)に表すようにドナー細胞は特に第4脳室の上衣下腫、外部顆粒層(EGL)および内部顆粒層(IGL)に見いだされた。このような細胞のほとんどがGFAPを発現せず、したがってアストロサイトではなかった。それらの特異的な局在化および多さは、それらがこのような領域にまばらに集まっているミクログリアではないことを示している。むしろBrdUで標識した細胞のこの領域での顕著な分布パターンは、神経前駆物質(neuroprogenitor)について予想されるパターンに類似し、これは出生後に小脳が発育する間に中でクローン性の広がりを受け、そして続いてEGLからIGLへの移動し、これによりニューロンになる(Jacobson,1991,Developmental Neurobiology,Plenum Press New York;Zhang and Goldman,1996,Neuron,16:47)。これはまた、胚形成中に成熟し、そして出生後の脳内では有糸分裂性ではないIGLに隣接するperkinje細胞(Altman and Bayer,1978,J.Comp.Neurol.179:23;Altman and Bayer,1985,J.Comp.Neurol.231:42)がもっぱら宿主起源であるという知見とも合致する。
まとめ
まとめるとこれらのデータは、増殖、確立された経路に沿った移動、線条の、皮質性の、および小脳の領域内での非分裂的(non-disruptive)散在、ならびに神経細胞系譜への分化を含む正常な脳の発育の観点に参加することにより、マウスMSCがマウス脳内で神経幹細胞の挙動を模倣することを証明している。後者はmMSCが異なる皮膚起源の分化した子孫を生産できること;発育している新生児の脳のミクロ環境に暴露されることにより明らかになる能力も証明している。
【0226】
このMSCの挙動を弱めることができる脳内の1因子は、FGF2である。このポリペプチド増殖因子は発育している脳内の芽細胞域に発現し、ここでこの因子は両−能性ニューロン/アストログリア細胞前駆体ならびに多−能性NSCの増殖を誘導する(Caday et al.,1990:Brain Res.Develop.Brain Res.52:241;Grothe and Meisinger,1995,Neurosci.Lett.197:175;Hattori et al.,1997,Brain Res.Mol.Brain Res.47:262)。FGF2がMSCに有糸分裂促進的であり、しかもそれらのインビトロでの分化を防止するという事実は(Phinney et al.,1999,J.Cell.Biochem.72:570;Oliver et al.,1990,Growth Factors 3:231;Locklin et al.,1995,Clin,Orthop,Rel.Res.313:27)、このような細胞が脳内で劇的に広がる原因の一部かもしれない。NGFのような(Caneva et al.,1995,Blood Cell,Molecules & Disease 21:73)MSCがレセプターを発現するための他の神経向性事実(fact)も、重要な役割を果たし得る。
【0227】
脳内のMSCの非−分裂的な広い散在は、CNS疾患の細胞療法に重要な意味を有する。MSCは腸骨稜からの小容量のアスピレートから容易に単離でき、移植のための自家細胞の補充可能な供給源を提供する。さらにこのような細胞が神経細胞系譜に分化できる能力は、移植が機能的様式で行えることを示唆している。
実施例12:パーキンソン病のラットモデルを対象とした処置のために遺伝的に操作したラット MSC の使用
マウスおよびヒトのMSCのために、ラットMSC(rMSC)を本明細書にすでに記載したように(実施例10)遺伝的に操作してL-DOPAを分泌させた。簡単に説明すると、rMSCはチロシンヒドロキシラーゼ(TH)の遺伝子を含む1つのレトロウイルスで形質導入し、そして次にGTP-シクロヒドラーゼ(GC)の遺伝子を含む第2のレトロウイルスで形質導入した。GC遺伝子はチロシンヒドロキシラーゼの必須コファクターであるテトラヒドロプテリジンを提供する。約100,000個の形質導入した細胞を、本明細書ですでに記載したようにラットの脳に移植した。次に実験は移植したrMSCが6-ヒドロキシドパミンにより誘起されたパーキンソン病をもつラットの線条体に移植した後、L-DOPAを合成し、そして分泌し続けるかどうかを決定するために行った。
【0228】
ラットの脳に移植した後のL-DOPA生産レべルは、Sprague Dawleyを6-ヒドロキシドパミンにより損傷させたラットの線条体を微透析し、続いて上記の遺伝的に操作したrMSC(TH+GC+)を移植してから3日後にHPLC分析により評価した。透析物は30分毎に3時間、取り出した。これらの実験結果は、図25および26に記載する。図27に与えるデータは、L-DOPA生産の指標であるL-DOPAの代謝産物を示す。このような実験結果は、L-DOPAが、形質導入したrMSCを移植した後に処置したラットの脳内で、皮膚の繊維芽細胞またはアストロサイトのいずれかを使用した比較実験で他により得られたものに匹敵する以上のレベルで生産されたことを示している(Lundberg et al.,1996,Exp.Neurol.139:39-53;Bencrs et al.,1996,J.Neurosci.16:4449-4456;Leff et al.,1998,Exp.Neurol.151:249-264)。対照のラットの脳にはL-DOPAは検出されなかった。
【0229】
図25、26および27に与えるデータは、さらにラットの脳中で形質導入したrMSCにより合成されたL-DOPAが、L-DOPAおよびドパミンの両方の予想された代謝産物に転化されたことを示す。
【0230】
アポモルヒネが誘導する回転の減少である、パーキンソン病のラットモデルの1つの受け入れられた表現型も、形質導入したrMSCの移植後に6-ヒドロキシドパミンで損傷したラットで観察された。図28はこのような実験で得られたデータを含む。ラットは6-ヒドロキシドパミンを線条体に注入してパーキンソン病モデルを作出することにより調製した。回転はアポモルヒネ(0.05mg/kg,sc)の注射により誘導した。示した値はL-DOPA(TH+GC+)を合成するように形質導入したrMSCを注入した2〜5匹のラット、および細胞がテトラヒドロプテリジンを加えなければ培養中にL-DOPAを生産できなくされたチロシンヒドロキシラーゼ(TH)の遺伝子のみで形質導入したrMSCを注入した3匹の対照ラットから得た。グラフは約7日後に消えた回転に対する効果を示し、同時に図25に示す微透析実験ではどの時点でL-DOPAがもはや検出されなかったかを示す。
【0231】
同様の実験を、ニックDNAの電気穿孔法または自己不活性化レトロウイルスの使用により遺伝子操作したrMSCを使用して行い、中枢神経系に発現した遺伝子のシャットダウンを導かないrMSCを得た。これによりパーキンソン病の処置を長期化する方法を提供する。
【0232】
本明細書で引用した各特許、特許出願および公報は全部、引用により本明細書に編入する。
【0233】
本発明は具体的な態様に関して開示したが、他の態様および本発明の変更も本発明の精神および範囲から逸脱することなく当業者には考案され得る。前記の特許請求の範囲は、そのような態様および均等な変更物をすべて含むものとする。
【図面の簡単な説明】
【図1】 レトロウイルス構築物pCMV-lacZ、pCOL1-lacZ及びpCOL2-lacZの図である。遺伝子構築物のカセットは:LTR-Neo-プロモーター-LacZ-30LTRである。
【図2】 拡散室の図式説明である。
【図3】 MSCのヒトの増殖に対するPDGF-AAの影響を示すグラフである。以下の記号が示される:◆、コントロール;▲、2-5ng/ml PDGF;□、2-5ng/ml PDGF;■、2-5ng/ml PDGF。
【図4A−4F】 培養したMSC及びアストロサイトの形態学的特徴を示す一連の顕微鏡写真の像である。図4A及び4Bは平らな及び伸びた2種類のヒトMSCを示す。図4CはラットMSCを示す。図4Dは移植前のヒトMSCの蛍光標識した核を示す。図4E及び4Fはビメンチン及びグリア繊維酸性タンパク質に対する抗体を用いたアストロサイトの間接免疫蛍光染色を示す。
【図5A−5F】 成体ラットの線条体における骨髄ストロマ細胞の移植の部位を示す一連の顕微鏡写真の像である。図5Aは14日後のヒトMSCの移植の部位を示す。図5Bは図5Aにおいて示したものに隣接する切片を示し、ここでは、ヒトMSCをHLA-ABCに対する抗体で染色した。図5Cは図5Aにおけるものに隣接した切片を示し、ここでは、細胞をヒトMSCの核蛍光に関して調べた。図5Dは72日後のヒトMSCの移植の部位を示す。図5Eは30日後のヒトMSCの図5Dにおけるものと同じ移植部位を示す。図5Fは14日後のヒトMSCの移植の部位を示す。これらの細胞を核蛍光により調べた。
【図6A及び6B】 図6A及び6Bを含んでなる図6は、脳を通ったMSCの移動を示す、ラット前脳の一連の線画である。図は細胞注入後4、14、30及び72日で調べた脳からの合成画である。ヒトMSCの移植及び移動のパターンはラットアストロサイトのものに類似する。側頭皮質及び注入部位から最も遠い脳梁の領域に位置する中心から離れた細胞が最初に消失した。以下の記号が示される:●、ヒトMSC;○、ラットアストロサイト。
【図7A−7C】 コラーゲンI及びフィブロネクチンに対する抗体染色を示す一連の顕微鏡写真の像である。図7Aは移植前にコラーゲンIに対する抗体で染色されたヒトMSCを示す。図7Bはフィブロネクチンに対する抗体で染色されたヒトMSCを示す。図7CはヒトMSCの移植後5日目にフィブロネクチンに対して染色されたラット脳の切片を示す。
【図8A−8D】 培養したラットMSCの免疫染色を示す一連の顕微鏡写真の像である。図8Aは20xの倍率でビメンチンに対する間接免疫蛍光染色を示し(縮尺棒=0.1mm)、ここで、挿入物は20xの倍率の繊維芽細胞の陽性コントロールの像である。図8Bは40xの倍率でネスチンに対する間接免疫蛍光染色を示し、ここで、挿入物は同じ視野の相オーバーレイ(phase overlay)である(縮尺棒=0.1mm)。図8Cは40x倍率でGFAPに対する間接免疫蛍光染色を示し、ここで、挿入物は20xの倍率のアストロサイトの陽性コントロールの像である(縮尺棒=0.1mm)。図8Dは20xの倍率で相オーバーレイを有するS100に対する間接免疫蛍光染色を示す(縮尺棒=0.1mm)。
【図9A−9C】 HMSCの移植後のラット前脳の一次培養物の定量を示す一連の顕微鏡写真の像である。図9Aはラット前脳混合細胞培養物の非融合領域を示す。HMSCを内在性脳細胞から形態学的に識別できない。図9Bは位相差顕微鏡下で見た血球計算板中の採取した培養細胞を示す。図9Cは蛍光顕微鏡で視覚化した図9Bにおけるものと同じ細胞を示し、培養の30日前にラット脳中に移植したビス−ベンズアミド標識したhMSCを示す。
【図10A−10D】 ラット脳のアストロサイトに富んだ培養物からのヒト細胞の回収を示す一連の顕微鏡写真の像である。hMSCの移植後2週目にラット脳の培養物を調製した。サンプルを免疫細胞化学的に染色した。図10A−Dは、以下のように染色した培養した単離細胞を示す:図10AはGFAPに対する抗体(ウサギにおいて作製したヒトGFAPに対する、DAKO)での染色を示し;図10BはヒトHLA-ABCに対する抗体(マウスにおいて作製した、Pharmingen)での染色を示し;図10Cは二重標識抗体での染色を示し(倍率40x、縮尺棒25μm);そして図10Dは培養したラット脳細胞の異なる細胞における二重標識抗体での染色を示す。
【図11A、11B及び11C】 図11A、11B及び11Cを含んでなる図11は、腫瘍有毒タンパク質を分泌するようにhMSCを設計するために用いた方法の図式説明の3つ組である。
【図12】 可溶性(欠失した)FasLのcDNAでトランスフェクトしたCOS細胞による可溶性FasLの合成及び分泌を示すウェスタンブロットアッセイの像である。cDNA をプラスミドpSecTag2/Hyg内に含有した。細胞をリポフェクトアミンで一過性にトランスフェクトし、そしてRensing-Ehl等(1995、Eur.J.Immunol.25:2253-2258)により記述されたようにウェスタンブロッティングによりアッセイした。レーン1は2日間インキュベートしたトランスフェクトした細胞(2mlの培地中約5x105)から得られた細胞ライセート(14μgタンパク質)を示す。レーン2:4日のインキュベーション後のレーン1におけるものと同じもの。レーン3:4日間インキュベートしたモックトランスフェクトした細胞から得られた細胞ライセート。レーン4:1日間インキュベーション後にトランスフェクトした細胞からの濃縮していない培地(18μl)。レーン5:2日のインキュベーション後のレーン4と同じもの。レーン6:4日のインキュベーション後のレーン4と同じもの。レーン7:4日のインキュベーション後にモックトランスフェクトした細胞から得られた培地。備考:レーン4−7における拡散した白色バンドは、ウェスタンブロットのバックグラウンドを下げる培地のサンプル中の高濃度のアルブミンである。
【図13A−13D】 可溶性FasLをコードするcDNAを一過性発現するCOS細胞から得られた培地による293細胞(Fas+)の増殖の阻害及び殺すことを示す一連の顕微鏡写真の像である。トランスフェクション後48時間でトランスフェクトしたCOS細胞から得られた1mlの培地を加えた1mlの新しい培地と約5x105の293細胞をインキュベートした。インキュベーションの3日目の293細胞を示す。該処置は生細胞を90%以上減らした。図13AはモックトランスフェクトしたCOS細胞から得られた1mlの培地とインキュベートしたコントロール293細胞を示す。図13Bは可溶性FasLを発現するCOS細胞からの1mlの培地とインキュベートした試験293細胞を示す。位相差倍率はx100であった。図13C及び13Dはx200のより高倍率で図13Bと同じ培養物を示す。細胞の外観はそれらがアポトーシス的であることを示唆する。
【図14】 試験遺伝子(チロシンヒドロキシラーゼ)を含有するレトロウイルス(pLNCX)を形質導入したラットMSCのウェスタンブロットの像である。レトロウイルス形質導入の条件は実施例10で本明細書において記述したとおりであった。細胞ライセート及びチロシンヒドロキシラーゼに対する抗体を用いてウェスタンブロットアッセイを実施した。レーン1:MWマーカー。レーン2−5:形質導入したMSCの細胞ライセート(5または10μgタンパク質)。レーン6:形質導入していないMSC の細胞ライセート。レーン7:コントロール細胞(293)の細胞ライセート。
【図15】 試験 cDNA(チロシンヒドロキシラーゼ)を含有するレトロウイルスを形質導入したヒトMSCによる産物(L−DOPA)の合成及び分泌を示すグラフである。細胞を必須補因子50μMテトラヒドロプテリジンとインキュベートし、培地中に生産されるL-DOPAをHPLCによりアッセイした。コントロールMSCから得られた培地中でL-DOPAは検出されなかった。
【図16A−16F】 新生児マウスの脳中に注入した後のマウスMSCの移植を示す図の像及び一連の像である。図16Aは注入後12日で蛍光的に標識された核の分布を示す図である。図16Bは左側脳室に隣接した注入部位で蛍光的に標識された核を示す像である。図16Cはドナー細胞の新たに標識された核を計数するために用いたより高倍率での像である。12の連続切片を計数した。図16Dは45日で蛍光的に標識されたドナー細胞の分布の図である。図16Eは線条体の全体にわたる左側脳室に隣接する注入跡に沿ったドナー細胞の外観を示す像である。図16Fは、くも膜硬膜に沿って意味感覚野(sematosensory cortex)中に広がり、そして腹側(ventral)海馬交連中に移動するドナー細胞の検出を示す像である。
【図17A及び17B】 新生児脳中への注入後45日のドナーマウスMSCの移動をさらに示す一対の像の像である。それらの像は先に示したものより高倍率であり、そして細胞がそれら自体直線配置で整列し、外被膜(external capsule)、脳梁、前交連(AC)、腹側海馬交連(VHC)内の白質領域(white metered tracs)に沿って、そして線条体の繊維束に沿って移動しているように見えることを示す。
【図18】 hMSCにおけるFasLをコードするmRNAの低いレベル及びFasをコードする検出できるmRNAがないことを示すRT-PCRアッセイを示すゲルの像である。Kitagawa等(1998、Luekemia 12:486-492)により報告されたプライマーを用い、PCRは30サイクル間であった。レーン1:マーカー。レーン2:β−アクチンのコントロール。レーン3:FasLのアッセイ。レーン4:Fasのアッセイ。
【図19A及び19B】 ラット脳におけるC6-グリオーマ細胞の成功した移植を示す一対の像である。脳切片をH及びEで染色した。図19Aは移植した腫瘍と正常な大脳皮質組織(CTX)の間の境界を低倍率で示す。図19Bは、高倍率(40x)で、奇異核を有するグリオーマ細胞(矢印により示される)を示す。
【図20A−20D】 免疫枯渇前及び後のマウスMSC(mMSC)培養物を示す4つ組の像である。図20A及び20Cは、それぞれ、ギムザでまたはFITCを結合した抗CD11b抗体で染色し、DAPIで対比染色した免疫枯渇前の7日齢のmMSC培養物を示す。図20B及び20Dは、それぞれ、ギムザでまたはFITCを結合した抗CD11b抗体で染色し、DAPIで対比染色した免疫枯渇後の7日齢のmMSC培養物を示す。
【図21A−21E】 新生児マウス脳中へのマウスMSC移植の時間経過を示す図及び像である。図21Aは、注入後3日(黄色)、12日(赤色)及び45日(黒色)でビス−ベンズアミドで標識したMSCの散在を示す図である。ドナー細胞の分布が重なっていない脳の領域を各時点に対して小点で示す。図21Bは注入後12日でブレグマに約+0.9mmで側脳室に隣接するMSCを示す像である。倍率はx100であった。図21Cはx400のより高倍率で図21Bにおけるものと同じものを示す像である。図21Dは細胞の移植後45日でブレグマに-0.2mmで線条体及び外被膜の全体にわたって明らかなMSCを示す像である。倍率はx100であった。図21Eは、x100の倍率で腹側海馬交連及び脈絡叢に沿って並ぶドナー細胞を示す像である。(LV=側脳室;EC=外被膜;VHC=腹側海馬交連)。
【図22A及び22B】 注入後45日で確立した白質領域に沿ったMSCの配置を示す一対の像である。図22Aは、外被膜(EC)内で平行の放射状配置で向いたビス−ベンズアミド標識したMSCを示す。図22Bは、腹側海馬交連(VHC)内で平行の放射状配置で向いたビス−ベンズアミド標識したMSCを示す。図22A及び22Bはx400の倍率である。
【図23A−23D】 注入後12日で前脳においてBrdUで標識されたMSCの免疫組織化学配置を示す4つ組の像である。図23Aは、約+0.9ブレグマで、注入部位と同側の線条体及び側脳室の、ヘミロトキシン及びエオシン染色した、そして図23Bは抗-BrdU染色した連続切片を示す。倍率はx40である。図23Cはx400のより高倍率での図23Bにおける切片の顕微鏡写真の像であり、外被膜に沿って並ぶBrdU標識されたドナー細胞を示す。図23Dは、約-2.4ブレグマで海馬分子層におけるX1000倍率のグリア繊維酸性タンパク質(GFAP)に対する抗体で二重標識されたMSC由来のアストロサイト(矢印により示される)を示す。アストロサイトに分化していないドナー細胞を二重矢印により示す。
【図24A−24F】 前脳及び小脳の神経に富んだ領域において8−ブロモ−2−デオキシウリジン(BrdU)標識されたMSCを示す一連の像である。連続切片の図24Aにおいて示したヘミロトキシン及びエオシン(H&E)染色または図24Bにおいて示した抗-BrdU染色は、腹側前脳皮質中のカレジャ島(Islands of Calleja)(ICj)におけるドナー由来の細胞を示す。連続切片の図24Cにおいて示したH&E染色または図24Dにおいて示した抗-BrdU染色は、嗅球(OB)の上衣下(subependyma)におけるドナー由来の細胞を示す。連続切片の図24Eにおいて示したH&E染色または図24Fにおいて示した抗-BrdU染色は、小脳の外及び内顆粒層(EGL、IGL)におけるドナー由来の細胞を示す。倍率はx400であった。
【図25】 L-DOPAを分泌する遺伝子的に設計したラットMSCで処置したラットの脳において生産されるL-DOPAのレベルを示すグラフである。遺伝子的に設計したラットMSC(TH+GC+)の移植後3日のSprague Dawley6−ヒドロキシドーパミン損傷ラットの線条体においてミクロ透析(microdialysis)を実施した。約100,000S細胞を移植した。透析物(dialysate)を30分毎に3時間取った。移植前に、チロシンヒドロキシラーゼ(TH)の遺伝子を含有する一つのレトロウイルスで、次に、GTP−シクロヒドラーゼ(GC)の遺伝子を有する別のレトロウイルスでラットMSCに形質導入した。GC遺伝子は、チロシンヒドロキシラーゼの必須補因子のテトラヒドロプテリジンを与える。コントロールラットにおいてL-DOPAは検出されなかった。
【図26】 図25において示したミクロ透析実験からのサンプルにおいてHPLCにより検出されたL-DOPAのレベルを示すグラフである。図27において示されるように、3−O−メチルDOPA(3-O-MD)及びホモバニリン酸(HVA)は、DOPA代謝の改変経路から生じることができる。3,4−ジヒドロキシフェニル酢酸(DOPA-C)はドーパミンの代謝産物である。
【図27】 L-DOPAの代謝産物を示す図式説明である。
【図28】 パーキンソン病のラットモデルにおいてアポモルヒネにより誘導される回転の減少を示すグラフである。パーキンソン病モデルを作製するために線条体中への6―ヒドロキシドーパミンの注入によりラットを調製した。アポモルヒネの注入(0.05mg/kg、SC)により回転を誘導した。示した値は、L-DOPAを合成するように導入したrMSCを注入した2−5匹のラット(+GCTH)及びテトラヒドロプテリジンを添加せずに培養してL-DOPAを生産することができないように細胞をするチロシンヒドロキシラーゼの遺伝子のみを形質導入したrMSCを注入した3匹のコントロールラット(TH)からであり、。グラフは、約7日後に回転に対する効果が消失したことを示し、同時に、図25において示したミクロ透析によりL-DOPAはもはや検出されなかった。
Claims (37)
- 中枢神経系の疾病、疾患または病気にかかっているヒト患者の処置用の医療製剤であって、該疾病、疾患または病気が神経変性疾患、脳卒中または中枢神経系の組織または細胞に対する外傷であり、かつ、ヒトドナー由来の骨髄サンプルから単離されたストロマ細胞を有効成分として含んでなる、前記医療製剤。
- ヒトドナーが中枢神経系の疾病、疾患または病気を患っておらず、かつ、該ヒトドナーが該患者と同一遺伝子型(synergeneic)である、請求項1記載の医療製剤。
- ヒトドナーがヒト患者である、請求項1記載の医療製剤。
- 中枢神経系の疾病、疾患または病気が脳卒中である、請求項1記載の医療製剤。
- 疾病、疾患または病気が該中枢神経系の組織または細胞に対する損傷である、請求項1記載の医療製剤。
- 疾病、疾患または病気が神経変性疾患である、請求項1記載の医療製剤。
- 請求項1記載の医療製剤であって、単離されたストロマ細胞が該患者の中枢神経系に投与されるものであり、かつ、該単離されたストロマ細胞が該中枢神経系においてそのまま存在するかまたは複製するものである、前記医療製剤。
- 単離されたストロマ細胞をヒト患者に投与する前に、該細胞がインビトロで培養される、請求項1記載の医療製剤。
- 単離されたストロマ細胞をヒト患者に投与する前に、治療的タンパク質をコードする単離された核酸で該単離されたストロマ細胞がトランスフェクトされており、該タンパク質が該細胞において発現される場合に該タンパク質が該疾病、疾患または病気の処置をもたらすように働く、請求項1記載の医療製剤。
- 治療的タンパク質がサイトカイン、ケモカイン、ニューロトロフィン及び抗体よりなる群から選択される、請求項9記載の医療製剤。
- 単離されたストロマ細胞をヒト患者に投与する前に、治療的タンパク質をコードする単離された核酸で該単離されたストロマ細胞がトランスフェクトされており、そのようなタンパク質が該細胞により分泌される場合に該タンパク質が該疾病、疾患または病気の処置をもたらすように働く、請求項1記載の医療製剤。
- 単離された核酸がプロモーター/調節配列に操作可能に連結されている、請求項11記載の医療製剤。
- 治療的タンパク質がサイトカイン、ケモカイン、ニューロトロフィン及び抗体よりなる群から選択される、請求項11記載の医療製剤。
- 単離された核酸が突然変異した、機能しないまたは不十分に発現される遺伝子の野生型コピーであり、該単離された核酸がプロモーター/調節配列に操作可能に連結されており、そして該単離されたストロマ細胞において発現される、請求項9記載の医療製剤。
- 単離された核酸が突然変異した、機能しないまたは不十分に発現される遺伝子の野生型コピーであり、該単離された核酸がプロモーター/調節配列に操作可能に連結されており、そして該単離されたストロマ細胞から分泌されるタンパク質が生産されるために該ストロマ細胞において発現される、請求項11記載の医療製剤。
- ストロマ細胞をヒト患者に投与する前に、マクログリア細胞の実質的に均質な集団の存在下で該ストロマ細胞が共培養されることにより該細胞を前以て分化されており、それにより該単離されたストロマ細胞が分化され、そしてマクログリア細胞の表現型特性が獲得されている、請求項1記載の医療製剤。
- 単離されたストロマ細胞が免疫学的に分離されている、請求項1記載の医療製剤。
- 中枢神経系の腫瘍にかかっているヒト患者の処置用の医療組成物であって、ヒトドナー由来の骨髄サンプルから単離されたストロマ細胞を有効成分として含んでなり、かつ、該単離されたストロマ細胞がグリオーマ有毒タンパク質をコードする単離された核酸でトランスフェクトされている前記医療製剤、
- グリオーマ有毒タンパク質がFasリガンドである、請求項18記載の医療製剤。
- グリオーマ有毒タンパク質が上皮増殖因子受容体(EGFR)及びCD3に対して導かれる二重特異性単鎖抗体である、請求項18記載の医療製剤。
- グリオーマ有毒タンパク質が上皮増殖因子受容体(EGFR)に対して導かれる抗体である、請求項18記載の医療製剤。
- トランスフェクションがレトロウイルスベクターを用いて実施される、請求項11記載の医療製剤。
- 単離されたストロマ細胞が、脳中に直接移植されるものである、請求項9記載の医療製剤。
- 単離されたストロマ細胞が、脳中に直接移植されるものである、請求項11記載の医療製剤。
- 中枢神経系に投与された該単離されたストロマ細胞が該中枢神経系において約150日までの間存在したままかまたは複製される、請求項7記載の医療製剤。
- 単離されたストロマ細胞が中枢神経系に投与されるものであり、かつ、投与後に、中枢神経系に投与された該単離されたストロマ細胞の約0.1%がマクログリア細胞、アストロサイトまたはニューロンへの分化のマーカーを発現することができる、請求項1記載の医療製剤。
- 分化の該マーカーがグリア繊維酸性タンパク質である、請求項26記載の医療製剤。
- 中枢神経系の疾病がパーキンソン病である、請求項1記載の医療製剤。
- 治療的タンパク質が中枢神経系の疾病、疾患または病気において欠失しているかまたは生産されない神経伝達物質の生合成において必要とされる酵素である、請求項9記載の医療製剤。
- 治療的タンパク質が中枢神経系の疾病、疾患または病気において欠失しているかまたは生産されない神経伝達物質の生合成において必要とされる酵素である、請求項11記載の医療製剤。
- 神経伝達物質がL-DOPAである、請求項29記載の医療製剤。
- 神経伝達物質がL-DOPAである、請求項30記載の医療製剤。
- 処置がパーキンソン病に見られる表現型の減少をもたらす、請求項31記載の医療製剤。
- パーキンソン病に見られる表現型がパーキンソン病のラットモデルにおいてアポモルヒネにより誘導される回転である、請求項33記載の医療製剤。
- 単離されたストロマ細胞がL-DOPAを少なくとも約3日間合成し、分泌し続ける、請求項32記載の医療製剤。
- L-DOPAがL-DOPAの代謝産物に転化される、請求項32記載の医療製剤。
- 腫瘍がグリオーマである、請求項18記載の医療製剤。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US09/028,395 | 1998-02-24 | ||
| US09/028,395 US6653134B2 (en) | 1995-03-28 | 1998-02-24 | Isolated stromal cells for use in the treatment of diseases of the central nervous system |
| PCT/US1999/003897 WO1999043286A2 (en) | 1998-02-24 | 1999-02-24 | Isolated stromal cells for use in the treatment of diseases of the central nervous system |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010075872A Division JP2010209074A (ja) | 1998-02-24 | 2010-03-29 | 中枢神経系の疾病の処置における使用のための単離されたストロマ細胞 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2002504503A JP2002504503A (ja) | 2002-02-12 |
| JP2002504503A5 JP2002504503A5 (ja) | 2006-04-20 |
| JP4748855B2 true JP4748855B2 (ja) | 2011-08-17 |
Family
ID=21843237
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2000533087A Expired - Fee Related JP4748855B2 (ja) | 1998-02-24 | 1999-02-24 | 中枢神経系の疾病の処置における使用のための単離されたストロマ細胞 |
| JP2010075872A Pending JP2010209074A (ja) | 1998-02-24 | 2010-03-29 | 中枢神経系の疾病の処置における使用のための単離されたストロマ細胞 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010075872A Pending JP2010209074A (ja) | 1998-02-24 | 2010-03-29 | 中枢神経系の疾病の処置における使用のための単離されたストロマ細胞 |
Country Status (10)
| Country | Link |
|---|---|
| US (3) | US6653134B2 (ja) |
| EP (2) | EP1815862A1 (ja) |
| JP (2) | JP4748855B2 (ja) |
| AT (1) | ATE394110T1 (ja) |
| AU (1) | AU2782499A (ja) |
| CA (1) | CA2321883A1 (ja) |
| DE (1) | DE69938653D1 (ja) |
| ES (1) | ES2307332T3 (ja) |
| PT (1) | PT1059929E (ja) |
| WO (1) | WO1999043286A2 (ja) |
Families Citing this family (89)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6653134B2 (en) * | 1995-03-28 | 2003-11-25 | Cp Hahnemann University | Isolated stromal cells for use in the treatment of diseases of the central nervous system |
| US7022321B2 (en) | 1997-04-10 | 2006-04-04 | Eglitis Martin A | Use of marrow-derived glial progenitor cells as gene delivery vehicles into the central nervous system |
| ES2246085T3 (es) | 1998-05-07 | 2006-02-01 | University Of South Florida | Celulas de medula osea como fuente de neuronas util para reparar la medula espinal y el cerebro. |
| US7001746B1 (en) | 1999-01-29 | 2006-02-21 | Artecel Sciences, Inc. | Methods and compositions for the differentiation of human preadipocytes into adipocytes |
| US20030082152A1 (en) | 1999-03-10 | 2003-05-01 | Hedrick Marc H. | Adipose-derived stem cells and lattices |
| US8017112B2 (en) | 1999-05-14 | 2011-09-13 | Henry Ford Health System | Transplantation of bone marrow stromal cells for treatment of neurodegenerative diseases |
| DK1183035T3 (en) * | 1999-05-14 | 2015-03-09 | Ford Henry Health System | BONE MARROW TRANSPLANT TREATMENT stroke |
| US7927587B2 (en) * | 1999-08-05 | 2011-04-19 | Regents Of The University Of Minnesota | MAPC administration for the treatment of lysosomal storage disorders |
| US8609412B2 (en) * | 1999-08-05 | 2013-12-17 | Regents Of The University Of Minnesota | Mapc generation of lung tissue |
| US7015037B1 (en) * | 1999-08-05 | 2006-03-21 | Regents Of The University Of Minnesota | Multiponent adult stem cells and methods for isolation |
| US8252280B1 (en) | 1999-08-05 | 2012-08-28 | Regents Of The University Of Minnesota | MAPC generation of muscle |
| US10638734B2 (en) | 2004-01-05 | 2020-05-05 | Abt Holding Company | Multipotent adult stem cells, sources thereof, methods of obtaining and maintaining same, methods of differentiation thereof, methods of use thereof and cells derived thereof |
| ATE514772T1 (de) * | 1999-08-05 | 2011-07-15 | Abt Holding Co | Multipotente erwachsene stammzellen und verfahren zu deren isolierung |
| US8075881B2 (en) * | 1999-08-05 | 2011-12-13 | Regents Of The University Of Minnesota | Use of multipotent adult stem cells in treatment of myocardial infarction and congestive heart failure |
| US6555374B1 (en) | 1999-08-19 | 2003-04-29 | Artecel Sciences, Inc. | Multiple mesodermal lineage differentiation potentials for adipose tissue-derived stromal cells and uses thereof |
| AU3685401A (en) | 2000-02-11 | 2001-08-20 | Philadelphia Health | Differentiation of bone marrow cells into neuronal cells and uses therefor |
| US7582292B2 (en) * | 2000-02-26 | 2009-09-01 | Artecel, Inc. | Adipose tissue derived stromal cells for the treatment of neurological disorders |
| JP2003523767A (ja) | 2000-02-26 | 2003-08-12 | アーテイセル・サイエンスイーズ・インコーポレイテツド | 脂肪組織由来の間質細胞から生成した多能性幹細胞およびその用途 |
| JP2004500824A (ja) * | 2000-03-09 | 2004-01-15 | クリオ−セル インターナショナル インコーポレーティッド | 脳および脊髄の修復のための神経組織源としてのヒト臍帯血 |
| AU2001257030A1 (en) * | 2000-04-12 | 2001-10-30 | Children's Hospital Of Philadelphia | Therapeutic uses for mesenchymal stromal cells |
| US6673606B1 (en) | 2000-04-12 | 2004-01-06 | The Children's Hospital Of Philadelphia | Therapeutic uses for mesenchymal stromal cells |
| EP1302534A4 (en) | 2000-06-26 | 2004-06-16 | Renomedix Inst Inc | CELL FRACTIONS CONTAINING CELLS CAPABLE OF DIFFERENCING INTO NEURAL CELLS |
| WO2002034889A2 (en) * | 2000-10-24 | 2002-05-02 | Children's Hospital Of Philadelphia | Therapeutic uses for mesenchymal stromal cells |
| IL157332A0 (en) * | 2001-02-14 | 2004-02-19 | Multipotent adult stem cells, sources thereof, methods of obtaining and maintaining same, methods of differentiation thereof, methods of use thereof and cells derived thereof | |
| US20030003090A1 (en) | 2001-05-31 | 2003-01-02 | Prockop Darwin J. | Directed in vitro differentiation of marrow stromal cells into neural cell progenitors |
| DE10144326B4 (de) * | 2001-09-10 | 2005-09-22 | Siemens Ag | Verfahren und System zur Überwachung eines Reifenluftdrucks |
| US9969980B2 (en) * | 2001-09-21 | 2018-05-15 | Garnet Biotherapeutics | Cell populations which co-express CD49c and CD90 |
| US20050095228A1 (en) | 2001-12-07 | 2005-05-05 | Fraser John K. | Methods of using regenerative cells in the treatment of peripheral vascular disease and related disorders |
| US20050048035A1 (en) | 2001-12-07 | 2005-03-03 | Fraser John K. | Methods of using regenerative cells in the treatment of stroke and related diseases and disorders |
| US7771716B2 (en) | 2001-12-07 | 2010-08-10 | Cytori Therapeutics, Inc. | Methods of using regenerative cells in the treatment of musculoskeletal disorders |
| US9597395B2 (en) | 2001-12-07 | 2017-03-21 | Cytori Therapeutics, Inc. | Methods of using adipose tissue-derived cells in the treatment of cardiovascular conditions |
| CA2474141A1 (en) | 2002-01-14 | 2003-07-24 | The Board Of Trustees Of The University Of Illinois | Novel mammalian multipotent stem cells and compositions, methods of preparation and methods of administration thereof |
| US20060104962A1 (en) * | 2002-07-25 | 2006-05-18 | The Scripps Research Institute | Transfected hematopoietic stem cells and methods of treatment of neovascular eye diseases therewith |
| US9969977B2 (en) * | 2002-09-20 | 2018-05-15 | Garnet Biotherapeutics | Cell populations which co-express CD49c and CD90 |
| EP1795595A1 (en) | 2002-10-22 | 2007-06-13 | Eisai R&D Management Co., Ltd. | Gene specifically expressed in postmitotic dopaminergic neuron precursor cells |
| US20060228798A1 (en) * | 2002-11-27 | 2006-10-12 | Catherine Verfaillie | Homologous recombination in multipotent adult progenitor cells |
| US7485460B2 (en) | 2003-05-21 | 2009-02-03 | Tulane University Health Sciences Center | Enhanced growth of adult stem cells with Dkk-1 |
| US8426200B2 (en) * | 2003-07-02 | 2013-04-23 | Regents Of The University Of Minnesota | Neuronal differentiation of stem cells |
| US20050002904A1 (en) * | 2003-07-03 | 2005-01-06 | Wary Kishore K. | Uses of vascular endothelial growth factor and type I collagen inducible protein (VCIP) |
| AU2004296848A1 (en) | 2003-12-04 | 2005-06-23 | Regents Of The University Of Minnesota | Compositions and methods for the treatment of lysosomal storage disorders |
| EP2298862B1 (en) * | 2004-03-22 | 2017-08-30 | Mesoblast International Sàrl | Mesenchymal stem cells and uses therefor |
| AU2005233582B2 (en) | 2004-04-12 | 2009-01-29 | Sanbio, Inc. | Cells exhibiting neuronal progenitor cell characteristics |
| CN101027390B (zh) | 2004-07-22 | 2012-12-12 | 卫材R&D管理有限公司 | Lrp4/Corin多巴胺能神经元祖细胞标志物 |
| WO2006046583A1 (ja) * | 2004-10-26 | 2006-05-04 | Santen Pharmaceutical Co., Ltd. | 視細胞またはその機能を再生させるための材料 |
| WO2006056998A2 (en) * | 2004-11-29 | 2006-06-01 | Yeda Research And Development Co. Ltd. | Methods of cell therapy, neurogenesis and oligodendrogenesis |
| WO2006086639A1 (en) * | 2005-02-10 | 2006-08-17 | Regents Of The University Of Minnesota | Vascular/lymphatic endothelial cells |
| AU2005331559B2 (en) * | 2005-05-05 | 2012-04-19 | Regents Of The University Of Minnesota | Use of NK cell inhibition to facilitate persistence of engrafted MHC-I negative cells |
| US20080311084A1 (en) * | 2005-05-05 | 2008-12-18 | Verfaillie Catherine M | Mapc Engraftment in the Hematopoietic System |
| JP2006345726A (ja) * | 2005-06-14 | 2006-12-28 | Hamamatsu Univ School Of Medicine | 脳腫瘍治療用発現ベクター |
| ES2524996T3 (es) * | 2005-06-16 | 2014-12-16 | Ramot At Tel Aviv University Ltd. | Células aisladas y poblaciones que comprenden a las mismas para el tratamiento de enfermedades del SNC |
| WO2007117262A2 (en) * | 2005-07-29 | 2007-10-18 | Athersys, Inc. | Culture of non-embryonic cells at high cell density |
| WO2007021003A1 (ja) | 2005-08-18 | 2007-02-22 | Eisai R & D Management Co., Ltd. | ドーパミン産生ニューロン増殖前駆細胞マーカーNato3 |
| KR101022401B1 (ko) * | 2005-09-29 | 2011-03-15 | 아주대학교산학협력단 | 자살유전자를 발현하는 중간엽 줄기세포를 포함하는 암치료용 조성물 |
| JP2009511061A (ja) * | 2005-10-14 | 2009-03-19 | リージェンツ オブ ザ ユニバーシティ オブ ミネソタ | 膵臓表現型を有する細胞への非胚性幹細胞の分化 |
| US20080286249A1 (en) * | 2006-01-12 | 2008-11-20 | Varney Timothy R | Use of mesenchymal stem cells for treating genetic diseases and disorders |
| GB0600972D0 (en) * | 2006-01-18 | 2006-03-01 | Univ Leeds | Enrichment of cells |
| US20080038237A1 (en) * | 2006-02-28 | 2008-02-14 | Sapolsky Robert M | Trojan horse immunotherapy |
| US8198081B2 (en) | 2006-04-11 | 2012-06-12 | Eisai R&D Management Co., Ltd. | Dopaminergic neuron progenitor cell marker 187A5 |
| EP2023943A2 (en) * | 2006-04-28 | 2009-02-18 | Tulane University Health Sciences Center | Methods for treating diabetes |
| AP2010005103A0 (en) * | 2007-06-15 | 2010-02-28 | Garnet Biotherapeutics Inc | Treatment of diseases and disorders using self-renewing colony forming cells cultured and expanded in vitro |
| AU2009205886B2 (en) | 2008-01-18 | 2015-08-27 | Katholieke Universiteit Leuven | Stem cell aggregates and methods for making and using |
| EP2273988B1 (en) | 2008-04-18 | 2015-09-09 | Arizona Board Of Regents, A Body Corp. Of The State Of Arizona, Acting For And On Behalf Of The University Of Arizona | L-dopa for treating age-related macular degeneration |
| DK2620493T3 (da) | 2008-05-28 | 2019-07-01 | Univ Ramot | Mesenkymale stamceller til behandling af CNS-sygdomme |
| WO2010021993A1 (en) | 2008-08-19 | 2010-02-25 | Cytori Therapeutics, Inc. | Methods of using adipose tissue-derived cells in the treatment of the lymphatic system and malignant disease |
| US9057051B2 (en) | 2008-10-31 | 2015-06-16 | Katholieke Universiteit Leuven | Optimized methods for differentiation of cells into cells with hepatocyte progenitor phenotypes, cells produced by the methods, and methods of using the cells |
| CN102625829B (zh) * | 2009-07-21 | 2015-05-06 | Abt控股公司 | 干细胞用于减少白细胞外渗的用途 |
| US20110020292A1 (en) * | 2009-07-21 | 2011-01-27 | Abt Holding Company | Use of Stem Cells to Reduce Leukocyte Extravasation |
| US20110206647A1 (en) * | 2010-02-25 | 2011-08-25 | Abt Holding Company | Modulation of Angiogenesis |
| WO2011106476A1 (en) * | 2010-02-25 | 2011-09-01 | Abt Holding Company | Modulation of microglia activation |
| CA3128483A1 (en) | 2010-05-12 | 2011-11-17 | Abt Holding Company | Modulation of splenocytes in cell therapy |
| US9090878B2 (en) | 2010-06-17 | 2015-07-28 | Katholieke Universiteit Leuven | Methods for differentiating cells into hepatic stellate cells and hepatic sinusoidal endothelial cells, cells produced by the methods, and methods for using the cells |
| AU2011293440B2 (en) | 2010-08-24 | 2016-05-05 | Katholieke Universiteit Leuven | Non-static suspension culture of cell aggregates |
| WO2012048275A2 (en) | 2010-10-08 | 2012-04-12 | Caridianbct, Inc. | Configurable methods and systems of growing and harvesting cells in a hollow fiber bioreactor system |
| WO2012156968A2 (en) | 2011-05-19 | 2012-11-22 | Ariel - University Research And Development Company, Ltd. | Use of mesenchymal stem cells for the improvement of affective and cognitive function |
| US9453840B2 (en) | 2011-07-27 | 2016-09-27 | Kyoto University | Markers for dopaminergic neuron progenitor cells |
| CN107362357B (zh) | 2013-02-06 | 2021-04-27 | Nc医学研究公司 | 用于治疗神经变性的细胞疗法 |
| KR102161726B1 (ko) | 2013-04-12 | 2020-10-06 | 사베리오 라프란체스카 | 이식용 장기의 개선 |
| JP6633522B2 (ja) | 2013-11-16 | 2020-01-22 | テルモ ビーシーティー、インコーポレーテッド | バイオリアクターにおける細胞増殖 |
| WO2015148704A1 (en) | 2014-03-25 | 2015-10-01 | Terumo Bct, Inc. | Passive replacement of media |
| CN104161771A (zh) * | 2014-04-09 | 2014-11-26 | 大连医科大学 | 骨髓间充质干细胞来源的神经细胞作为治疗正己烷致周围性神经病的药物的应用 |
| JP6830059B2 (ja) | 2014-09-26 | 2021-02-17 | テルモ ビーシーティー、インコーポレーテッド | スケジュール化された細胞フィーディング |
| WO2017004592A1 (en) | 2015-07-02 | 2017-01-05 | Terumo Bct, Inc. | Cell growth with mechanical stimuli |
| SG11201806245TA (en) | 2016-01-21 | 2018-08-30 | Abt Holding Co | Stem cells for wound healing |
| WO2017205667A1 (en) | 2016-05-25 | 2017-11-30 | Terumo Bct, Inc. | Cell expansion |
| US11104874B2 (en) | 2016-06-07 | 2021-08-31 | Terumo Bct, Inc. | Coating a bioreactor |
| US11685883B2 (en) | 2016-06-07 | 2023-06-27 | Terumo Bct, Inc. | Methods and systems for coating a cell growth surface |
| US11629332B2 (en) | 2017-03-31 | 2023-04-18 | Terumo Bct, Inc. | Cell expansion |
| US11624046B2 (en) | 2017-03-31 | 2023-04-11 | Terumo Bct, Inc. | Cell expansion |
| US11464804B1 (en) | 2017-11-15 | 2022-10-11 | Enrico Stazzone | Intrathecal multifactorial infusion of heterogeneous autologous cell therapy |
Family Cites Families (43)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4391909A (en) | 1979-03-28 | 1983-07-05 | Damon Corporation | Microcapsules containing viable tissue cells |
| JPS6030654B2 (ja) * | 1980-12-31 | 1985-07-17 | 株式会社林原生物化学研究所 | ヒトコロニ−刺激因子の製造方法 |
| US4806355A (en) | 1983-06-06 | 1989-02-21 | Connaught Laboratories Limited | Microencapsulation of living tissue and cells |
| US4608199A (en) * | 1984-03-20 | 1986-08-26 | Arnold Caplan | Bone protein purification process |
| US4609551A (en) * | 1984-03-20 | 1986-09-02 | Arnold Caplan | Process of and material for stimulating growth of cartilage and bony tissue at anatomical sites |
| US4620327A (en) * | 1984-07-05 | 1986-11-04 | Caplan Arnold I | Process of adapting soluble bone protein for use in stimulating osteoinduction |
| US4666828A (en) * | 1984-08-15 | 1987-05-19 | The General Hospital Corporation | Test for Huntington's disease |
| US4683202A (en) * | 1985-03-28 | 1987-07-28 | Cetus Corporation | Process for amplifying nucleic acid sequences |
| US4801531A (en) * | 1985-04-17 | 1989-01-31 | Biotechnology Research Partners, Ltd. | Apo AI/CIII genomic polymorphisms predictive of atherosclerosis |
| US4678470A (en) * | 1985-05-29 | 1987-07-07 | American Hospital Supply Corporation | Bone-grafting material |
| US4902295A (en) | 1985-08-26 | 1990-02-20 | Hana Biologics, Inc. | Transplantable artificial tissue |
| US4997443A (en) | 1985-08-26 | 1991-03-05 | Hana Biologics, Inc. | Transplantable artificial tissue and process |
| US4942129A (en) | 1987-07-28 | 1990-07-17 | Queen's University At Kingston | Multiple membrane microencapsulation |
| US5283187A (en) * | 1987-11-17 | 1994-02-01 | Brown University Research Foundation | Cell culture-containing tubular capsule produced by co-extrusion |
| US4904259A (en) | 1988-04-29 | 1990-02-27 | Samuel Itay | Compositions and methods for repair of cartilage and bone |
| US5272057A (en) * | 1988-10-14 | 1993-12-21 | Georgetown University | Method of detecting a predisposition to cancer by the use of restriction fragment length polymorphism of the gene for human poly (ADP-ribose) polymerase |
| US5082670A (en) | 1988-12-15 | 1992-01-21 | The Regents Of The University Of California | Method of grafting genetically modified cells to treat defects, disease or damage or the central nervous system |
| ES2060942T3 (es) | 1989-02-02 | 1994-12-01 | Joel S Greenberger | Terapia genetica utilizando celulas estromicas. |
| US5192659A (en) * | 1989-08-25 | 1993-03-09 | Genetype Ag | Intron sequence analysis method for detection of adjacent and remote locus alleles as haplotypes |
| US5612211A (en) * | 1990-06-08 | 1997-03-18 | New York University | Stimulation, production and culturing of hematopoietic progenitor cells by fibroblast growth factors |
| US5344454A (en) | 1991-07-24 | 1994-09-06 | Baxter International Inc. | Closed porous chambers for implanting tissue in a host |
| US5314471A (en) | 1991-07-24 | 1994-05-24 | Baxter International Inc. | Tissue inplant systems and methods for sustaining viable high cell densities within a host |
| US5226914A (en) * | 1990-11-16 | 1993-07-13 | Caplan Arnold I | Method for treating connective tissue disorders |
| US5486359A (en) * | 1990-11-16 | 1996-01-23 | Osiris Therapeutics, Inc. | Human mesenchymal stem cells |
| US5197985A (en) * | 1990-11-16 | 1993-03-30 | Caplan Arnold I | Method for enhancing the implantation and differentiation of marrow-derived mesenchymal cells |
| US5750376A (en) * | 1991-07-08 | 1998-05-12 | Neurospheres Holdings Ltd. | In vitro growth and proliferation of genetically modified multipotent neural stem cells and their progeny |
| US5851832A (en) * | 1991-07-08 | 1998-12-22 | Neurospheres, Ltd. | In vitro growth and proliferation of multipotent neural stem cells and their progeny |
| US5334640A (en) | 1992-04-08 | 1994-08-02 | Clover Consolidated, Ltd. | Ionically covalently crosslinked and crosslinkable biocompatible encapsulation compositions and methods |
| JPH08509215A (ja) * | 1993-04-13 | 1996-10-01 | アメリカ合衆国 | 移植治療のための神経由来胎児セルラインの使用 |
| US5591625A (en) * | 1993-11-24 | 1997-01-07 | Case Western Reserve University | Transduced mesenchymal stem cells |
| US5571083A (en) * | 1994-02-18 | 1996-11-05 | Lemelson; Jerome H. | Method and system for cell transplantation |
| US5736396A (en) * | 1995-01-24 | 1998-04-07 | Case Western Reserve University | Lineage-directed induction of human mesenchymal stem cell differentiation |
| US6126936A (en) * | 1995-03-10 | 2000-10-03 | Biohybrid Technologies Llc | Microcapsules and composite microreactors for immunoisolation of cells |
| US6653134B2 (en) * | 1995-03-28 | 2003-11-25 | Cp Hahnemann University | Isolated stromal cells for use in the treatment of diseases of the central nervous system |
| US5716616A (en) * | 1995-03-28 | 1998-02-10 | Thomas Jefferson University | Isolated stromal cells for treating diseases, disorders or conditions characterized by bone defects |
| DK0871457T3 (da) * | 1995-03-28 | 2003-07-28 | Univ Jefferson | Isolerede stromaceller og fremgangsmåder til anvendelse heraf |
| US5842477A (en) * | 1996-02-21 | 1998-12-01 | Advanced Tissue Sciences, Inc. | Method for repairing cartilage |
| US6342479B1 (en) * | 1997-04-08 | 2002-01-29 | Societe De Counseils De Recherches Et D'applications Scientifiques, Sas | Prolonging survival of transplanted pancreatic cells |
| ES2246085T3 (es) * | 1998-05-07 | 2006-02-01 | University Of South Florida | Celulas de medula osea como fuente de neuronas util para reparar la medula espinal y el cerebro. |
| US20050169896A1 (en) * | 1999-05-14 | 2005-08-04 | Henry Ford Health System | Bone marrow transplantation for treatment of stroke |
| DK1183035T3 (en) * | 1999-05-14 | 2015-03-09 | Ford Henry Health System | BONE MARROW TRANSPLANT TREATMENT stroke |
| US8017112B2 (en) * | 1999-05-14 | 2011-09-13 | Henry Ford Health System | Transplantation of bone marrow stromal cells for treatment of neurodegenerative diseases |
| US20070264712A1 (en) * | 2006-01-10 | 2007-11-15 | Theradigm, Inc. | Expansion and differentiation of neural stem cells under low oxygen conditions |
-
1998
- 1998-02-24 US US09/028,395 patent/US6653134B2/en not_active Expired - Fee Related
-
1999
- 1999-02-24 AT AT99908377T patent/ATE394110T1/de active
- 1999-02-24 EP EP07008345A patent/EP1815862A1/en not_active Withdrawn
- 1999-02-24 EP EP99908377A patent/EP1059929B1/en not_active Expired - Lifetime
- 1999-02-24 AU AU27824/99A patent/AU2782499A/en not_active Abandoned
- 1999-02-24 DE DE69938653T patent/DE69938653D1/de not_active Expired - Lifetime
- 1999-02-24 CA CA002321883A patent/CA2321883A1/en not_active Abandoned
- 1999-02-24 JP JP2000533087A patent/JP4748855B2/ja not_active Expired - Fee Related
- 1999-02-24 WO PCT/US1999/003897 patent/WO1999043286A2/en active Application Filing
- 1999-02-24 PT PT99908377T patent/PT1059929E/pt unknown
- 1999-02-24 ES ES99908377T patent/ES2307332T3/es not_active Expired - Lifetime
-
2003
- 2003-06-27 US US10/608,997 patent/US20040091464A1/en not_active Abandoned
-
2009
- 2009-01-20 US US12/356,427 patent/US20090214492A1/en not_active Abandoned
-
2010
- 2010-03-29 JP JP2010075872A patent/JP2010209074A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| EP1059929A4 (en) | 2002-07-17 |
| US6653134B2 (en) | 2003-11-25 |
| ES2307332T3 (es) | 2008-11-16 |
| EP1059929B1 (en) | 2008-05-07 |
| EP1815862A1 (en) | 2007-08-08 |
| DE69938653D1 (de) | 2008-06-19 |
| AU2782499A (en) | 1999-09-15 |
| US20040091464A1 (en) | 2004-05-13 |
| WO1999043286A3 (en) | 1999-12-02 |
| US20090214492A1 (en) | 2009-08-27 |
| CA2321883A1 (en) | 1999-09-02 |
| WO1999043286A2 (en) | 1999-09-02 |
| US20030039639A1 (en) | 2003-02-27 |
| ATE394110T1 (de) | 2008-05-15 |
| JP2010209074A (ja) | 2010-09-24 |
| PT1059929E (pt) | 2008-10-14 |
| EP1059929A2 (en) | 2000-12-20 |
| JP2002504503A (ja) | 2002-02-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4748855B2 (ja) | 中枢神経系の疾病の処置における使用のための単離されたストロマ細胞 | |
| JP6545335B2 (ja) | 多能性胚様幹細胞、その組成物、方法および使用 | |
| Warf et al. | Evidence for the ventral origin of oligodendrocyte precursors in the rat spinal cord | |
| Roy et al. | Identification, isolation, and promoter-defined separation of mitotic oligodendrocyte progenitor cells from the adult human subcortical white matter | |
| Nishiyama et al. | NG2+ glial cells: a novel glial cell population in the adult brain | |
| Hartikka et al. | Development of septal cholinergic neurons in culture: plating density and glial cells modulate effects of NGF on survival, fiber growth, and expression of transmitter-specific enzymes | |
| US20040092011A1 (en) | Adipocytic differentiated adipose derived adult stem cells and uses thereof | |
| US20090035347A1 (en) | Isolated stromal cells and methods of using the same | |
| JP2008526762A (ja) | 組織再生および創傷治癒のための脂肪由来幹細胞 | |
| DE69637185T2 (de) | Isolierte Stromazellen und Methoden zu deren Verwendung | |
| US7297538B2 (en) | Encapsulated cell indicator system | |
| JP2003512333A (ja) | 脳における移植された前駆体細胞のインビボ増殖および移動を誘導するための方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20011122 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20060224 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20060224 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20090929 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20091229 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20091229 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100301 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100329 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20100329 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20100817 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20101217 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20110114 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20110419 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20110517 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140527 Year of fee payment: 3 |
|
| LAPS | Cancellation because of no payment of annual fees |