JP4170399B2 - ホスフェートによって鎖延長化された生分解性ポリマー、組成物、物品、並びにその製造及び使用方法 - Google Patents
ホスフェートによって鎖延長化された生分解性ポリマー、組成物、物品、並びにその製造及び使用方法 Download PDFInfo
- Publication number
- JP4170399B2 JP4170399B2 JP54194898A JP54194898A JP4170399B2 JP 4170399 B2 JP4170399 B2 JP 4170399B2 JP 54194898 A JP54194898 A JP 54194898A JP 54194898 A JP54194898 A JP 54194898A JP 4170399 B2 JP4170399 B2 JP 4170399B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- polymer
- formula
- agents
- branched
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 239000000203 mixture Substances 0.000 title claims abstract description 48
- 229920002988 biodegradable polymer Polymers 0.000 title claims abstract description 24
- 239000004621 biodegradable polymer Substances 0.000 title claims abstract description 24
- 238000000034 method Methods 0.000 title claims abstract description 20
- 229910019142 PO4 Inorganic materials 0.000 title description 4
- 235000021317 phosphate Nutrition 0.000 title description 4
- 150000003013 phosphoric acid derivatives Chemical class 0.000 title description 2
- 229920000642 polymer Polymers 0.000 claims abstract description 138
- -1 oxy- Chemical class 0.000 claims abstract description 48
- 125000004432 carbon atom Chemical group C* 0.000 claims abstract description 33
- 125000000217 alkyl group Chemical group 0.000 claims abstract description 28
- 125000001931 aliphatic group Chemical group 0.000 claims abstract description 27
- 125000003545 alkoxy group Chemical group 0.000 claims abstract description 26
- 125000000623 heterocyclic group Chemical group 0.000 claims abstract description 16
- 125000003118 aryl group Chemical group 0.000 claims abstract description 15
- 125000004104 aryloxy group Chemical group 0.000 claims abstract description 12
- 238000002513 implantation Methods 0.000 claims abstract description 7
- 238000002347 injection Methods 0.000 claims abstract description 6
- 239000007924 injection Substances 0.000 claims abstract description 6
- 230000008569 process Effects 0.000 claims abstract description 5
- 239000003814 drug Substances 0.000 claims description 41
- 239000004005 microsphere Substances 0.000 claims description 41
- 229940088623 biologically active substance Drugs 0.000 claims description 23
- 229940121363 anti-inflammatory agent Drugs 0.000 claims description 20
- 239000002260 anti-inflammatory agent Substances 0.000 claims description 20
- 239000002246 antineoplastic agent Substances 0.000 claims description 20
- 239000000463 material Substances 0.000 claims description 20
- 239000011159 matrix material Substances 0.000 claims description 20
- 229940034982 antineoplastic agent Drugs 0.000 claims description 19
- 125000002947 alkylene group Chemical group 0.000 claims description 18
- 238000006065 biodegradation reaction Methods 0.000 claims description 11
- 239000000178 monomer Substances 0.000 claims description 11
- 239000003242 anti bacterial agent Substances 0.000 claims description 10
- 125000004470 heterocyclooxy group Chemical group 0.000 claims description 10
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 10
- 239000000126 substance Substances 0.000 claims description 10
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 9
- 150000002391 heterocyclic compounds Chemical class 0.000 claims description 9
- 229940088710 antibiotic agent Drugs 0.000 claims description 8
- 239000003146 anticoagulant agent Substances 0.000 claims description 8
- 229940088597 hormone Drugs 0.000 claims description 8
- 239000005556 hormone Substances 0.000 claims description 8
- 239000007943 implant Substances 0.000 claims description 8
- 230000001225 therapeutic effect Effects 0.000 claims description 8
- 239000004599 antimicrobial Substances 0.000 claims description 7
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 7
- 229940127219 anticoagulant drug Drugs 0.000 claims description 6
- 230000003115 biocidal effect Effects 0.000 claims description 6
- 108010050904 Interferons Proteins 0.000 claims description 5
- 102000014150 Interferons Human genes 0.000 claims description 5
- 229930012538 Paclitaxel Natural products 0.000 claims description 5
- 239000003443 antiviral agent Substances 0.000 claims description 5
- 229940047124 interferons Drugs 0.000 claims description 5
- 229960001592 paclitaxel Drugs 0.000 claims description 5
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 5
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 claims description 5
- 102000004127 Cytokines Human genes 0.000 claims description 4
- 108090000695 Cytokines Proteins 0.000 claims description 4
- 239000003102 growth factor Substances 0.000 claims description 4
- 238000004519 manufacturing process Methods 0.000 claims description 4
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 claims description 4
- 239000002870 angiogenesis inducing agent Substances 0.000 claims description 3
- 230000001772 anti-angiogenic effect Effects 0.000 claims description 3
- 229910052794 bromium Inorganic materials 0.000 claims description 3
- 229910052801 chlorine Inorganic materials 0.000 claims description 3
- 239000004744 fabric Substances 0.000 claims description 3
- 150000004676 glycans Chemical class 0.000 claims description 3
- 229910052740 iodine Inorganic materials 0.000 claims description 3
- 229920001282 polysaccharide Polymers 0.000 claims description 3
- 239000005017 polysaccharide Substances 0.000 claims description 3
- 238000000576 coating method Methods 0.000 claims description 2
- 229940126585 therapeutic drug Drugs 0.000 claims description 2
- 208000020084 Bone disease Diseases 0.000 claims 1
- 230000002745 absorbent Effects 0.000 claims 1
- 239000002250 absorbent Substances 0.000 claims 1
- 229940121357 antivirals Drugs 0.000 claims 1
- 239000011248 coating agent Substances 0.000 claims 1
- 125000000592 heterocycloalkyl group Chemical group 0.000 claims 1
- 239000003356 suture material Substances 0.000 claims 1
- 239000013543 active substance Substances 0.000 abstract description 12
- 239000003795 chemical substances by application Substances 0.000 description 41
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 24
- 229940079593 drug Drugs 0.000 description 24
- 239000000243 solution Substances 0.000 description 24
- 229960005475 antiinfective agent Drugs 0.000 description 18
- 230000002924 anti-infective effect Effects 0.000 description 17
- 238000006243 chemical reaction Methods 0.000 description 17
- 239000002904 solvent Substances 0.000 description 16
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 15
- 210000003205 muscle Anatomy 0.000 description 15
- NNJVILVZKWQKPM-UHFFFAOYSA-N Lidocaine Chemical compound CCN(CC)CC(=O)NC1=C(C)C=CC=C1C NNJVILVZKWQKPM-UHFFFAOYSA-N 0.000 description 13
- 229960004194 lidocaine Drugs 0.000 description 13
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 12
- 125000001570 methylene group Chemical group [H]C([H])([*:1])[*:2] 0.000 description 12
- 238000006116 polymerization reaction Methods 0.000 description 12
- 239000000047 product Substances 0.000 description 12
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 12
- 239000003416 antiarrhythmic agent Substances 0.000 description 11
- 229940030600 antihypertensive agent Drugs 0.000 description 11
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 11
- 229940124597 therapeutic agent Drugs 0.000 description 11
- 210000001519 tissue Anatomy 0.000 description 11
- 238000001727 in vivo Methods 0.000 description 10
- 239000004372 Polyvinyl alcohol Substances 0.000 description 9
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 9
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 9
- 239000011149 active material Substances 0.000 description 9
- 239000000730 antalgic agent Substances 0.000 description 9
- 239000002220 antihypertensive agent Substances 0.000 description 9
- 210000004027 cell Anatomy 0.000 description 9
- 238000013270 controlled release Methods 0.000 description 9
- 108010006205 fluorescein isothiocyanate bovine serum albumin Proteins 0.000 description 9
- 229920002451 polyvinyl alcohol Polymers 0.000 description 9
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 8
- 229940035676 analgesics Drugs 0.000 description 8
- 239000002876 beta blocker Substances 0.000 description 8
- 229940097320 beta blocking agent Drugs 0.000 description 8
- 150000001875 compounds Chemical class 0.000 description 8
- 229920001577 copolymer Polymers 0.000 description 8
- 239000003246 corticosteroid Substances 0.000 description 8
- 206010002383 Angina Pectoris Diseases 0.000 description 7
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 7
- 239000002253 acid Substances 0.000 description 7
- 238000012377 drug delivery Methods 0.000 description 7
- 229960002949 fluorouracil Drugs 0.000 description 7
- 230000007062 hydrolysis Effects 0.000 description 7
- 238000006460 hydrolysis reaction Methods 0.000 description 7
- 238000002360 preparation method Methods 0.000 description 7
- 239000000523 sample Substances 0.000 description 7
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 6
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 6
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 6
- 102000004190 Enzymes Human genes 0.000 description 6
- 108090000790 Enzymes Proteins 0.000 description 6
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 6
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 6
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 6
- 239000000739 antihistaminic agent Substances 0.000 description 6
- 239000003699 antiulcer agent Substances 0.000 description 6
- 230000015572 biosynthetic process Effects 0.000 description 6
- 239000000701 coagulant Substances 0.000 description 6
- OROGSEYTTFOCAN-DNJOTXNNSA-N codeine Chemical compound C([C@H]1[C@H](N(CC[C@@]112)C)C3)=C[C@H](O)[C@@H]1OC1=C2C3=CC=C1OC OROGSEYTTFOCAN-DNJOTXNNSA-N 0.000 description 6
- 238000006731 degradation reaction Methods 0.000 description 6
- 239000002934 diuretic Substances 0.000 description 6
- 230000000694 effects Effects 0.000 description 6
- 229940088598 enzyme Drugs 0.000 description 6
- 230000002496 gastric effect Effects 0.000 description 6
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 6
- BQJCRHHNABKAKU-KBQPJGBKSA-N morphine Chemical compound O([C@H]1[C@H](C=C[C@H]23)O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O BQJCRHHNABKAKU-KBQPJGBKSA-N 0.000 description 6
- 229940127240 opiate Drugs 0.000 description 6
- 229910052698 phosphorus Inorganic materials 0.000 description 6
- 238000007086 side reaction Methods 0.000 description 6
- 239000000021 stimulant Substances 0.000 description 6
- 238000003756 stirring Methods 0.000 description 6
- METKIMKYRPQLGS-GFCCVEGCSA-N (R)-atenolol Chemical compound CC(C)NC[C@@H](O)COC1=CC=C(CC(N)=O)C=C1 METKIMKYRPQLGS-GFCCVEGCSA-N 0.000 description 5
- SVUOLADPCWQTTE-UHFFFAOYSA-N 1h-1,2-benzodiazepine Chemical compound N1N=CC=CC2=CC=CC=C12 SVUOLADPCWQTTE-UHFFFAOYSA-N 0.000 description 5
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 5
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 5
- YLQBMQCUIZJEEH-UHFFFAOYSA-N Furan Chemical compound C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 5
- 108060003951 Immunoglobulin Proteins 0.000 description 5
- 239000000370 acceptor Substances 0.000 description 5
- 230000000340 anti-metabolite Effects 0.000 description 5
- 239000001961 anticonvulsive agent Substances 0.000 description 5
- 239000000030 antiglaucoma agent Substances 0.000 description 5
- 229940125715 antihistaminic agent Drugs 0.000 description 5
- 239000003524 antilipemic agent Substances 0.000 description 5
- 229940100197 antimetabolite Drugs 0.000 description 5
- 239000002256 antimetabolite Substances 0.000 description 5
- 229960002274 atenolol Drugs 0.000 description 5
- 229940049706 benzodiazepine Drugs 0.000 description 5
- 229940124630 bronchodilator Drugs 0.000 description 5
- 230000015556 catabolic process Effects 0.000 description 5
- 230000008859 change Effects 0.000 description 5
- 150000002009 diols Chemical class 0.000 description 5
- 229940030606 diuretics Drugs 0.000 description 5
- 238000005538 encapsulation Methods 0.000 description 5
- 150000002148 esters Chemical group 0.000 description 5
- 238000010528 free radical solution polymerization reaction Methods 0.000 description 5
- 238000005227 gel permeation chromatography Methods 0.000 description 5
- 230000000147 hypnotic effect Effects 0.000 description 5
- 102000018358 immunoglobulin Human genes 0.000 description 5
- 239000003999 initiator Substances 0.000 description 5
- 210000005036 nerve Anatomy 0.000 description 5
- 231100000252 nontoxic Toxicity 0.000 description 5
- 230000003000 nontoxic effect Effects 0.000 description 5
- 239000003960 organic solvent Substances 0.000 description 5
- 230000001499 parasympathomimetic effect Effects 0.000 description 5
- 239000002953 phosphate buffered saline Substances 0.000 description 5
- 108090000765 processed proteins & peptides Proteins 0.000 description 5
- AQHHHDLHHXJYJD-UHFFFAOYSA-N propranolol Chemical compound C1=CC=C2C(OCC(O)CNC(C)C)=CC=CC2=C1 AQHHHDLHHXJYJD-UHFFFAOYSA-N 0.000 description 5
- 201000009032 substance abuse Diseases 0.000 description 5
- 230000002889 sympathetic effect Effects 0.000 description 5
- 238000003786 synthesis reaction Methods 0.000 description 5
- YBYIRNPNPLQARY-UHFFFAOYSA-N 1H-indene Chemical compound C1=CC=C2CC=CC2=C1 YBYIRNPNPLQARY-UHFFFAOYSA-N 0.000 description 4
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical class CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 4
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 4
- 239000005541 ACE inhibitor Substances 0.000 description 4
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 4
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 4
- ULGZDMOVFRHVEP-RWJQBGPGSA-N Erythromycin Chemical compound O([C@@H]1[C@@H](C)C(=O)O[C@@H]([C@@]([C@H](O)[C@@H](C)C(=O)[C@H](C)C[C@@](C)(O)[C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)O)[C@H]1C)(C)O)CC)[C@H]1C[C@@](C)(OC)[C@@H](O)[C@H](C)O1 ULGZDMOVFRHVEP-RWJQBGPGSA-N 0.000 description 4
- 102100039619 Granulocyte colony-stimulating factor Human genes 0.000 description 4
- 241001465754 Metazoa Species 0.000 description 4
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 4
- 229920000388 Polyphosphate Polymers 0.000 description 4
- RJKFOVLPORLFTN-LEKSSAKUSA-N Progesterone Chemical class C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H](C(=O)C)[C@@]1(C)CC2 RJKFOVLPORLFTN-LEKSSAKUSA-N 0.000 description 4
- 229930003270 Vitamin B Natural products 0.000 description 4
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 description 4
- 230000001800 adrenalinergic effect Effects 0.000 description 4
- 239000002160 alpha blocker Substances 0.000 description 4
- 229940044094 angiotensin-converting-enzyme inhibitor Drugs 0.000 description 4
- 230000000844 anti-bacterial effect Effects 0.000 description 4
- 230000003474 anti-emetic effect Effects 0.000 description 4
- 229940125681 anticonvulsant agent Drugs 0.000 description 4
- 239000002111 antiemetic agent Substances 0.000 description 4
- 229940125683 antiemetic agent Drugs 0.000 description 4
- 239000003434 antitussive agent Substances 0.000 description 4
- 239000002968 autonomic agent Substances 0.000 description 4
- 229940097217 cardiac glycoside Drugs 0.000 description 4
- 239000002368 cardiac glycoside Substances 0.000 description 4
- MYSWGUAQZAJSOK-UHFFFAOYSA-N ciprofloxacin Chemical compound C12=CC(N3CCNCC3)=C(F)C=C2C(=O)C(C(=O)O)=CN1C1CC1 MYSWGUAQZAJSOK-UHFFFAOYSA-N 0.000 description 4
- 229960003957 dexamethasone Drugs 0.000 description 4
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 4
- DCOPUUMXTXDBNB-UHFFFAOYSA-N diclofenac Chemical compound OC(=O)CC1=CC=CC=C1NC1=C(Cl)C=CC=C1Cl DCOPUUMXTXDBNB-UHFFFAOYSA-N 0.000 description 4
- 239000000839 emulsion Substances 0.000 description 4
- 239000003172 expectorant agent Substances 0.000 description 4
- IVLVTNPOHDFFCJ-UHFFFAOYSA-N fentanyl citrate Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.C=1C=CC=CC=1N(C(=O)CC)C(CC1)CCN1CCC1=CC=CC=C1 IVLVTNPOHDFFCJ-UHFFFAOYSA-N 0.000 description 4
- 239000003326 hypnotic agent Substances 0.000 description 4
- 239000003112 inhibitor Substances 0.000 description 4
- 230000002401 inhibitory effect Effects 0.000 description 4
- 239000003158 myorelaxant agent Substances 0.000 description 4
- 239000003921 oil Substances 0.000 description 4
- LPMXVESGRSUGHW-HBYQJFLCSA-N ouabain Chemical compound O[C@@H]1[C@H](O)[C@@H](O)[C@H](C)O[C@H]1O[C@@H]1C[C@@]2(O)CC[C@H]3[C@@]4(O)CC[C@H](C=5COC(=O)C=5)[C@@]4(C)C[C@@H](O)[C@@H]3[C@@]2(CO)[C@H](O)C1 LPMXVESGRSUGHW-HBYQJFLCSA-N 0.000 description 4
- 239000011574 phosphorus Substances 0.000 description 4
- 238000006068 polycondensation reaction Methods 0.000 description 4
- 239000001205 polyphosphate Substances 0.000 description 4
- 235000011176 polyphosphates Nutrition 0.000 description 4
- 102000004196 processed proteins & peptides Human genes 0.000 description 4
- 239000000583 progesterone congener Substances 0.000 description 4
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 4
- 230000000241 respiratory effect Effects 0.000 description 4
- 229960001860 salicylate Drugs 0.000 description 4
- YGSDEFSMJLZEOE-UHFFFAOYSA-M salicylate Chemical compound OC1=CC=CC=C1C([O-])=O YGSDEFSMJLZEOE-UHFFFAOYSA-M 0.000 description 4
- 229940125706 skeletal muscle relaxant agent Drugs 0.000 description 4
- 239000011780 sodium chloride Substances 0.000 description 4
- 229930002534 steroid glycoside Natural products 0.000 description 4
- 231100000736 substance abuse Toxicity 0.000 description 4
- 208000011117 substance-related disease Diseases 0.000 description 4
- 230000001732 thrombotic effect Effects 0.000 description 4
- 231100000331 toxic Toxicity 0.000 description 4
- 230000002588 toxic effect Effects 0.000 description 4
- 235000019156 vitamin B Nutrition 0.000 description 4
- 239000011720 vitamin B Substances 0.000 description 4
- 230000004580 weight loss Effects 0.000 description 4
- YZBOZNXACBQJHI-UHFFFAOYSA-N 1-dichlorophosphoryloxyethane Chemical compound CCOP(Cl)(Cl)=O YZBOZNXACBQJHI-UHFFFAOYSA-N 0.000 description 3
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- 108010058207 Anistreplase Proteins 0.000 description 3
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 3
- 241000283690 Bos taurus Species 0.000 description 3
- 229940127291 Calcium channel antagonist Drugs 0.000 description 3
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 description 3
- 108091006146 Channels Proteins 0.000 description 3
- 102000018233 Fibroblast Growth Factor Human genes 0.000 description 3
- 108050007372 Fibroblast Growth Factor Proteins 0.000 description 3
- AEMRFAOFKBGASW-UHFFFAOYSA-N Glycolic acid Polymers OCC(O)=O AEMRFAOFKBGASW-UHFFFAOYSA-N 0.000 description 3
- HEFNNWSXXWATRW-UHFFFAOYSA-N Ibuprofen Chemical compound CC(C)CC1=CC=C(C(C)C(O)=O)C=C1 HEFNNWSXXWATRW-UHFFFAOYSA-N 0.000 description 3
- 102000004877 Insulin Human genes 0.000 description 3
- 108090001061 Insulin Proteins 0.000 description 3
- 238000012696 Interfacial polycondensation Methods 0.000 description 3
- 102000006992 Interferon-alpha Human genes 0.000 description 3
- 108010047761 Interferon-alpha Proteins 0.000 description 3
- WTDRDQBEARUVNC-LURJTMIESA-N L-DOPA Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C(O)=C1 WTDRDQBEARUVNC-LURJTMIESA-N 0.000 description 3
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 3
- 229920002732 Polyanhydride Polymers 0.000 description 3
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 3
- PRXRUNOAOLTIEF-ADSICKODSA-N Sorbitan trioleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@@H](OC(=O)CCCCCCC\C=C/CCCCCCCC)[C@H]1OC[C@H](O)[C@H]1OC(=O)CCCCCCC\C=C/CCCCCCCC PRXRUNOAOLTIEF-ADSICKODSA-N 0.000 description 3
- 108010023197 Streptokinase Proteins 0.000 description 3
- 108090000373 Tissue Plasminogen Activator Proteins 0.000 description 3
- 102000003978 Tissue Plasminogen Activator Human genes 0.000 description 3
- 108090000435 Urokinase-type plasminogen activator Proteins 0.000 description 3
- 102000003990 Urokinase-type plasminogen activator Human genes 0.000 description 3
- 125000004419 alkynylene group Chemical group 0.000 description 3
- 229960003318 alteplase Drugs 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 229960000983 anistreplase Drugs 0.000 description 3
- 230000003178 anti-diabetic effect Effects 0.000 description 3
- 230000000840 anti-viral effect Effects 0.000 description 3
- 239000003173 antianemic agent Substances 0.000 description 3
- 239000000164 antipsychotic agent Substances 0.000 description 3
- 229940005529 antipsychotics Drugs 0.000 description 3
- 239000002249 anxiolytic agent Substances 0.000 description 3
- KBZOIRJILGZLEJ-LGYYRGKSSA-N argipressin Chemical compound C([C@H]1C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CSSC[C@@H](C(N[C@@H](CC=2C=CC(O)=CC=2)C(=O)N1)=O)N)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCN=C(N)N)C(=O)NCC(N)=O)C1=CC=CC=C1 KBZOIRJILGZLEJ-LGYYRGKSSA-N 0.000 description 3
- 229910052786 argon Inorganic materials 0.000 description 3
- 125000004429 atom Chemical group 0.000 description 3
- 229940125717 barbiturate Drugs 0.000 description 3
- 239000012620 biological material Substances 0.000 description 3
- 210000000988 bone and bone Anatomy 0.000 description 3
- OZVBMTJYIDMWIL-AYFBDAFISA-N bromocriptine Chemical compound C1=CC(C=2[C@H](N(C)C[C@@H](C=2)C(=O)N[C@]2(C(=O)N3[C@H](C(N4CCC[C@H]4[C@]3(O)O2)=O)CC(C)C)C(C)C)C2)=C3C2=C(Br)NC3=C1 OZVBMTJYIDMWIL-AYFBDAFISA-N 0.000 description 3
- 229960002802 bromocriptine Drugs 0.000 description 3
- 239000000168 bronchodilator agent Substances 0.000 description 3
- BBBFJLBPOGFECG-VJVYQDLKSA-N calcitonin Chemical compound N([C@H](C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N1[C@@H](CCC1)C(N)=O)C(C)C)C(=O)[C@@H]1CSSC[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N1 BBBFJLBPOGFECG-VJVYQDLKSA-N 0.000 description 3
- 239000000480 calcium channel blocker Substances 0.000 description 3
- 229960004126 codeine Drugs 0.000 description 3
- 229940124558 contraceptive agent Drugs 0.000 description 3
- 239000003433 contraceptive agent Substances 0.000 description 3
- 238000007796 conventional method Methods 0.000 description 3
- 239000008367 deionised water Substances 0.000 description 3
- 229910021641 deionized water Inorganic materials 0.000 description 3
- 229960001259 diclofenac Drugs 0.000 description 3
- 238000009792 diffusion process Methods 0.000 description 3
- 229940011871 estrogen Drugs 0.000 description 3
- 239000000262 estrogen Substances 0.000 description 3
- 238000001704 evaporation Methods 0.000 description 3
- 230000003419 expectorant effect Effects 0.000 description 3
- 238000000605 extraction Methods 0.000 description 3
- 229960002428 fentanyl Drugs 0.000 description 3
- 229940126864 fibroblast growth factor Drugs 0.000 description 3
- 238000009472 formulation Methods 0.000 description 3
- 230000012010 growth Effects 0.000 description 3
- 229910052736 halogen Inorganic materials 0.000 description 3
- 150000002367 halogens Chemical group 0.000 description 3
- OROGSEYTTFOCAN-UHFFFAOYSA-N hydrocodone Natural products C1C(N(CCC234)C)C2C=CC(O)C3OC2=C4C1=CC=C2OC OROGSEYTTFOCAN-UHFFFAOYSA-N 0.000 description 3
- 229960001680 ibuprofen Drugs 0.000 description 3
- 229940072221 immunoglobulins Drugs 0.000 description 3
- RKJUIXBNRJVNHR-UHFFFAOYSA-N indolenine Natural products C1=CC=C2CC=NC2=C1 RKJUIXBNRJVNHR-UHFFFAOYSA-N 0.000 description 3
- 229910052500 inorganic mineral Inorganic materials 0.000 description 3
- 229940125396 insulin Drugs 0.000 description 3
- 239000002869 intravenous anesthetic agent Substances 0.000 description 3
- 239000003589 local anesthetic agent Substances 0.000 description 3
- 229960005015 local anesthetics Drugs 0.000 description 3
- 239000003120 macrolide antibiotic agent Substances 0.000 description 3
- 229920002521 macromolecule Polymers 0.000 description 3
- 238000002844 melting Methods 0.000 description 3
- 230000008018 melting Effects 0.000 description 3
- 229960000485 methotrexate Drugs 0.000 description 3
- 235000010755 mineral Nutrition 0.000 description 3
- 239000011707 mineral Substances 0.000 description 3
- 238000002156 mixing Methods 0.000 description 3
- 229960005181 morphine Drugs 0.000 description 3
- 238000000465 moulding Methods 0.000 description 3
- DDHVILIIHBIMQU-YJGQQKNPSA-L mupirocin calcium hydrate Chemical compound O.O.[Ca+2].C[C@H](O)[C@H](C)[C@@H]1O[C@H]1C[C@@H]1[C@@H](O)[C@@H](O)[C@H](C\C(C)=C\C(=O)OCCCCCCCCC([O-])=O)OC1.C[C@H](O)[C@H](C)[C@@H]1O[C@H]1C[C@@H]1[C@@H](O)[C@@H](O)[C@H](C\C(C)=C\C(=O)OCCCCCCCCC([O-])=O)OC1 DDHVILIIHBIMQU-YJGQQKNPSA-L 0.000 description 3
- 239000000041 non-steroidal anti-inflammatory agent Substances 0.000 description 3
- 230000000399 orthopedic effect Effects 0.000 description 3
- 229920001606 poly(lactic acid-co-glycolic acid) Polymers 0.000 description 3
- 102000004169 proteins and genes Human genes 0.000 description 3
- 108090000623 proteins and genes Proteins 0.000 description 3
- 239000000376 reactant Substances 0.000 description 3
- 230000002829 reductive effect Effects 0.000 description 3
- 239000000932 sedative agent Substances 0.000 description 3
- 229920002545 silicone oil Polymers 0.000 description 3
- 238000000935 solvent evaporation Methods 0.000 description 3
- 229960005202 streptokinase Drugs 0.000 description 3
- 125000001424 substituent group Chemical group 0.000 description 3
- IMCGHZIGRANKHV-AJNGGQMLSA-N tert-butyl (3s,5s)-2-oxo-5-[(2s,4s)-5-oxo-4-propan-2-yloxolan-2-yl]-3-propan-2-ylpyrrolidine-1-carboxylate Chemical compound O1C(=O)[C@H](C(C)C)C[C@H]1[C@H]1N(C(=O)OC(C)(C)C)C(=O)[C@H](C(C)C)C1 IMCGHZIGRANKHV-AJNGGQMLSA-N 0.000 description 3
- 239000003859 topical antiinfective agent Substances 0.000 description 3
- 231100000419 toxicity Toxicity 0.000 description 3
- 230000001988 toxicity Effects 0.000 description 3
- 229960005356 urokinase Drugs 0.000 description 3
- 229940088594 vitamin Drugs 0.000 description 3
- 229930003231 vitamin Natural products 0.000 description 3
- 235000013343 vitamin Nutrition 0.000 description 3
- 239000011782 vitamin Substances 0.000 description 3
- 229960002555 zidovudine Drugs 0.000 description 3
- PAPBSGBWRJIAAV-UHFFFAOYSA-N ε-Caprolactone Chemical compound O=C1CCCCCO1 PAPBSGBWRJIAAV-UHFFFAOYSA-N 0.000 description 3
- WWYNJERNGUHSAO-XUDSTZEESA-N (+)-Norgestrel Chemical compound O=C1CC[C@@H]2[C@H]3CC[C@](CC)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=C1 WWYNJERNGUHSAO-XUDSTZEESA-N 0.000 description 2
- SNICXCGAKADSCV-JTQLQIEISA-N (-)-Nicotine Chemical compound CN1CCC[C@H]1C1=CC=CN=C1 SNICXCGAKADSCV-JTQLQIEISA-N 0.000 description 2
- KWGRBVOPPLSCSI-WPRPVWTQSA-N (-)-ephedrine Chemical compound CN[C@@H](C)[C@H](O)C1=CC=CC=C1 KWGRBVOPPLSCSI-WPRPVWTQSA-N 0.000 description 2
- HSINOMROUCMIEA-FGVHQWLLSA-N (2s,4r)-4-[(3r,5s,6r,7r,8s,9s,10s,13r,14s,17r)-6-ethyl-3,7-dihydroxy-10,13-dimethyl-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-17-yl]-2-methylpentanoic acid Chemical compound C([C@@]12C)C[C@@H](O)C[C@H]1[C@@H](CC)[C@@H](O)[C@@H]1[C@@H]2CC[C@]2(C)[C@@H]([C@H](C)C[C@H](C)C(O)=O)CC[C@H]21 HSINOMROUCMIEA-FGVHQWLLSA-N 0.000 description 2
- DIWRORZWFLOCLC-HNNXBMFYSA-N (3s)-7-chloro-5-(2-chlorophenyl)-3-hydroxy-1,3-dihydro-1,4-benzodiazepin-2-one Chemical compound N([C@H](C(NC1=CC=C(Cl)C=C11)=O)O)=C1C1=CC=CC=C1Cl DIWRORZWFLOCLC-HNNXBMFYSA-N 0.000 description 2
- TWBNMYSKRDRHAT-RCWTXCDDSA-N (S)-timolol hemihydrate Chemical compound O.CC(C)(C)NC[C@H](O)COC1=NSN=C1N1CCOCC1.CC(C)(C)NC[C@H](O)COC1=NSN=C1N1CCOCC1 TWBNMYSKRDRHAT-RCWTXCDDSA-N 0.000 description 2
- GVJHHUAWPYXKBD-UHFFFAOYSA-N (±)-α-Tocopherol Chemical compound OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 2
- RKDVKSZUMVYZHH-UHFFFAOYSA-N 1,4-dioxane-2,5-dione Chemical compound O=C1COC(=O)CO1 RKDVKSZUMVYZHH-UHFFFAOYSA-N 0.000 description 2
- 125000004825 2,2-dimethylpropylene group Chemical group [H]C([H])([H])C(C([H])([H])[H])(C([H])([H])[*:1])C([H])([H])[*:2] 0.000 description 2
- SGTNSNPWRIOYBX-UHFFFAOYSA-N 2-(3,4-dimethoxyphenyl)-5-{[2-(3,4-dimethoxyphenyl)ethyl](methyl)amino}-2-(propan-2-yl)pentanenitrile Chemical compound C1=C(OC)C(OC)=CC=C1CCN(C)CCCC(C#N)(C(C)C)C1=CC=C(OC)C(OC)=C1 SGTNSNPWRIOYBX-UHFFFAOYSA-N 0.000 description 2
- NGNBDVOYPDDBFK-UHFFFAOYSA-N 2-[2,4-di(pentan-2-yl)phenoxy]acetyl chloride Chemical compound CCCC(C)C1=CC=C(OCC(Cl)=O)C(C(C)CCC)=C1 NGNBDVOYPDDBFK-UHFFFAOYSA-N 0.000 description 2
- NSPMIYGKQJPBQR-UHFFFAOYSA-N 4H-1,2,4-triazole Chemical compound C=1N=CNN=1 NSPMIYGKQJPBQR-UHFFFAOYSA-N 0.000 description 2
- USSIQXCVUWKGNF-UHFFFAOYSA-N 6-(dimethylamino)-4,4-diphenylheptan-3-one Chemical compound C=1C=CC=CC=1C(CC(C)N(C)C)(C(=O)CC)C1=CC=CC=C1 USSIQXCVUWKGNF-UHFFFAOYSA-N 0.000 description 2
- UJOBWOGCFQCDNV-UHFFFAOYSA-N 9H-carbazole Chemical compound C1=CC=C2C3=CC=CC=C3NC2=C1 UJOBWOGCFQCDNV-UHFFFAOYSA-N 0.000 description 2
- RZVAJINKPMORJF-UHFFFAOYSA-N Acetaminophen Chemical compound CC(=O)NC1=CC=C(O)C=C1 RZVAJINKPMORJF-UHFFFAOYSA-N 0.000 description 2
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical group [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 2
- APKFDSVGJQXUKY-KKGHZKTASA-N Amphotericin-B Natural products O[C@H]1[C@@H](N)[C@H](O)[C@@H](C)O[C@H]1O[C@H]1C=CC=CC=CC=CC=CC=CC=C[C@H](C)[C@@H](O)[C@@H](C)[C@H](C)OC(=O)C[C@H](O)C[C@H](O)CC[C@@H](O)[C@H](O)C[C@H](O)C[C@](O)(C[C@H](O)[C@H]2C(O)=O)O[C@H]2C1 APKFDSVGJQXUKY-KKGHZKTASA-N 0.000 description 2
- 108010006654 Bleomycin Proteins 0.000 description 2
- 102000055006 Calcitonin Human genes 0.000 description 2
- 108060001064 Calcitonin Proteins 0.000 description 2
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 2
- JZUFKLXOESDKRF-UHFFFAOYSA-N Chlorothiazide Chemical compound C1=C(Cl)C(S(=O)(=O)N)=CC2=C1NCNS2(=O)=O JZUFKLXOESDKRF-UHFFFAOYSA-N 0.000 description 2
- 102100026735 Coagulation factor VIII Human genes 0.000 description 2
- 108010092160 Dactinomycin Proteins 0.000 description 2
- LTMHDMANZUZIPE-AMTYYWEZSA-N Digoxin Natural products O([C@H]1[C@H](C)O[C@H](O[C@@H]2C[C@@H]3[C@@](C)([C@@H]4[C@H]([C@]5(O)[C@](C)([C@H](O)C4)[C@H](C4=CC(=O)OC4)CC5)CC3)CC2)C[C@@H]1O)[C@H]1O[C@H](C)[C@@H](O[C@H]2O[C@@H](C)[C@H](O)[C@@H](O)C2)[C@@H](O)C1 LTMHDMANZUZIPE-AMTYYWEZSA-N 0.000 description 2
- LCGLNKUTAGEVQW-UHFFFAOYSA-N Dimethyl ether Chemical compound COC LCGLNKUTAGEVQW-UHFFFAOYSA-N 0.000 description 2
- JRWZLRBJNMZMFE-UHFFFAOYSA-N Dobutamine Chemical compound C=1C=C(O)C(O)=CC=1CCNC(C)CCC1=CC=C(O)C=C1 JRWZLRBJNMZMFE-UHFFFAOYSA-N 0.000 description 2
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 2
- UGJMXCAKCUNAIE-UHFFFAOYSA-N Gabapentin Chemical compound OC(=O)CC1(CN)CCCCC1 UGJMXCAKCUNAIE-UHFFFAOYSA-N 0.000 description 2
- 239000000579 Gonadotropin-Releasing Hormone Substances 0.000 description 2
- BLCLNMBMMGCOAS-URPVMXJPSA-N Goserelin Chemical compound C([C@@H](C(=O)N[C@H](COC(C)(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N1[C@@H](CCC1)C(=O)NNC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 BLCLNMBMMGCOAS-URPVMXJPSA-N 0.000 description 2
- 108010069236 Goserelin Proteins 0.000 description 2
- 108010017080 Granulocyte Colony-Stimulating Factor Proteins 0.000 description 2
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 2
- 239000000095 Growth Hormone-Releasing Hormone Substances 0.000 description 2
- 102000038461 Growth Hormone-Releasing Hormone Human genes 0.000 description 2
- 229940121710 HMGCoA reductase inhibitor Drugs 0.000 description 2
- 102000003745 Hepatocyte Growth Factor Human genes 0.000 description 2
- 108090000100 Hepatocyte Growth Factor Proteins 0.000 description 2
- RPTUSVTUFVMDQK-UHFFFAOYSA-N Hidralazin Chemical compound C1=CC=C2C(NN)=NN=CC2=C1 RPTUSVTUFVMDQK-UHFFFAOYSA-N 0.000 description 2
- 101000911390 Homo sapiens Coagulation factor VIII Proteins 0.000 description 2
- 102000002265 Human Growth Hormone Human genes 0.000 description 2
- 108010000521 Human Growth Hormone Proteins 0.000 description 2
- 239000000854 Human Growth Hormone Substances 0.000 description 2
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical compound C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 description 2
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- WTDRDQBEARUVNC-UHFFFAOYSA-N L-Dopa Natural products OC(=O)C(N)CC1=CC=C(O)C(O)=C1 WTDRDQBEARUVNC-UHFFFAOYSA-N 0.000 description 2
- MKXZASYAUGDDCJ-SZMVWBNQSA-N LSM-2525 Chemical compound C1CCC[C@H]2[C@@]3([H])N(C)CC[C@]21C1=CC(OC)=CC=C1C3 MKXZASYAUGDDCJ-SZMVWBNQSA-N 0.000 description 2
- 108010000817 Leuprolide Proteins 0.000 description 2
- ZFMITUMMTDLWHR-UHFFFAOYSA-N Minoxidil Chemical compound NC1=[N+]([O-])C(N)=CC(N2CCCCC2)=N1 ZFMITUMMTDLWHR-UHFFFAOYSA-N 0.000 description 2
- 229940123685 Monoamine oxidase inhibitor Drugs 0.000 description 2
- 208000021642 Muscular disease Diseases 0.000 description 2
- 208000006550 Mydriasis Diseases 0.000 description 2
- 201000009623 Myopathy Diseases 0.000 description 2
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 2
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 description 2
- 206010028980 Neoplasm Diseases 0.000 description 2
- 108010025020 Nerve Growth Factor Proteins 0.000 description 2
- 102000015336 Nerve Growth Factor Human genes 0.000 description 2
- 229920002292 Nylon 6 Polymers 0.000 description 2
- 229930182555 Penicillin Natural products 0.000 description 2
- DYWNLSQWJMTVGJ-KUSKTZOESA-N Phenylpropanolamine hydrochloride Chemical compound Cl.C[C@H](N)[C@H](O)C1=CC=CC=C1 DYWNLSQWJMTVGJ-KUSKTZOESA-N 0.000 description 2
- 108010047386 Pituitary Hormones Proteins 0.000 description 2
- 102000006877 Pituitary Hormones Human genes 0.000 description 2
- 239000004793 Polystyrene Substances 0.000 description 2
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 2
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 2
- KYQCOXFCLRTKLS-UHFFFAOYSA-N Pyrazine Chemical compound C1=CN=CC=N1 KYQCOXFCLRTKLS-UHFFFAOYSA-N 0.000 description 2
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 2
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 2
- 101710142969 Somatoliberin Proteins 0.000 description 2
- 101000857870 Squalus acanthias Gonadoliberin Proteins 0.000 description 2
- 208000005718 Stomach Neoplasms Diseases 0.000 description 2
- 239000000150 Sympathomimetic Substances 0.000 description 2
- NKANXQFJJICGDU-QPLCGJKRSA-N Tamoxifen Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 NKANXQFJJICGDU-QPLCGJKRSA-N 0.000 description 2
- GUGOEEXESWIERI-UHFFFAOYSA-N Terfenadine Chemical compound C1=CC(C(C)(C)C)=CC=C1C(O)CCCN1CCC(C(O)(C=2C=CC=CC=2)C=2C=CC=CC=2)CC1 GUGOEEXESWIERI-UHFFFAOYSA-N 0.000 description 2
- 239000004098 Tetracycline Substances 0.000 description 2
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 2
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 2
- SHGAZHPCJJPHSC-NWVFGJFESA-N Tretinoin Chemical compound OC(=O)/C=C(\C)/C=C/C=C(C)C=CC1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-NWVFGJFESA-N 0.000 description 2
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 2
- 229940122803 Vinca alkaloid Drugs 0.000 description 2
- 229930003316 Vitamin D Natural products 0.000 description 2
- QYSXJUFSXHHAJI-XFEUOLMDSA-N Vitamin D3 Natural products C1(/[C@@H]2CC[C@@H]([C@]2(CCC1)C)[C@H](C)CCCC(C)C)=C/C=C1\C[C@@H](O)CCC1=C QYSXJUFSXHHAJI-XFEUOLMDSA-N 0.000 description 2
- 210000000683 abdominal cavity Anatomy 0.000 description 2
- 230000003187 abdominal effect Effects 0.000 description 2
- KXKVLQRXCPHEJC-UHFFFAOYSA-N acetic acid trimethyl ester Natural products COC(C)=O KXKVLQRXCPHEJC-UHFFFAOYSA-N 0.000 description 2
- 229960001138 acetylsalicylic acid Drugs 0.000 description 2
- 229940121353 acid pump inhibitor Drugs 0.000 description 2
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 description 2
- 239000002568 adrenergic antihypertensivea Substances 0.000 description 2
- NDAUXUAQIAJITI-UHFFFAOYSA-N albuterol Chemical compound CC(C)(C)NCC(O)C1=CC=C(O)C(CO)=C1 NDAUXUAQIAJITI-UHFFFAOYSA-N 0.000 description 2
- 125000004450 alkenylene group Chemical group 0.000 description 2
- 229940100198 alkylating agent Drugs 0.000 description 2
- 239000002168 alkylating agent Substances 0.000 description 2
- 229940052294 amide local anesthetics Drugs 0.000 description 2
- 229940024606 amino acid Drugs 0.000 description 2
- 150000001413 amino acids Chemical class 0.000 description 2
- 125000003277 amino group Chemical group 0.000 description 2
- 229940126575 aminoglycoside Drugs 0.000 description 2
- 150000003927 aminopyridines Chemical class 0.000 description 2
- APKFDSVGJQXUKY-INPOYWNPSA-N amphotericin B Chemical compound O[C@H]1[C@@H](N)[C@H](O)[C@@H](C)O[C@H]1O[C@H]1/C=C/C=C/C=C/C=C/C=C/C=C/C=C/[C@H](C)[C@@H](O)[C@@H](C)[C@H](C)OC(=O)C[C@H](O)C[C@H](O)CC[C@@H](O)[C@H](O)C[C@H](O)C[C@](O)(C[C@H](O)[C@H]2C(O)=O)O[C@H]2C1 APKFDSVGJQXUKY-INPOYWNPSA-N 0.000 description 2
- 229960003942 amphotericin b Drugs 0.000 description 2
- 230000003444 anaesthetic effect Effects 0.000 description 2
- 239000003098 androgen Substances 0.000 description 2
- 229940069428 antacid Drugs 0.000 description 2
- 239000003159 antacid agent Substances 0.000 description 2
- 239000005557 antagonist Substances 0.000 description 2
- MWPLVEDNUUSJAV-UHFFFAOYSA-N anthracene Chemical compound C1=CC=CC2=CC3=CC=CC=C3C=C21 MWPLVEDNUUSJAV-UHFFFAOYSA-N 0.000 description 2
- 230000001078 anti-cholinergic effect Effects 0.000 description 2
- 230000003276 anti-hypertensive effect Effects 0.000 description 2
- 230000000078 anti-malarial effect Effects 0.000 description 2
- 230000001022 anti-muscarinic effect Effects 0.000 description 2
- 230000001754 anti-pyretic effect Effects 0.000 description 2
- 229940124344 antianaemic agent Drugs 0.000 description 2
- 239000000935 antidepressant agent Substances 0.000 description 2
- 229940005513 antidepressants Drugs 0.000 description 2
- 239000003793 antidiarrheal agent Substances 0.000 description 2
- 239000000729 antidote Substances 0.000 description 2
- 239000000427 antigen Substances 0.000 description 2
- 102000036639 antigens Human genes 0.000 description 2
- 108091007433 antigens Proteins 0.000 description 2
- 239000003430 antimalarial agent Substances 0.000 description 2
- 239000003926 antimycobacterial agent Substances 0.000 description 2
- 239000003101 antineoplastic hormone agonist and antagonist Substances 0.000 description 2
- 239000000939 antiparkinson agent Substances 0.000 description 2
- 239000002221 antipyretic Substances 0.000 description 2
- 239000003920 antivertigo agent Substances 0.000 description 2
- 230000000949 anxiolytic effect Effects 0.000 description 2
- 229940005530 anxiolytics Drugs 0.000 description 2
- 239000002830 appetite depressant Substances 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- KUCQYCKVKVOKAY-CTYIDZIISA-N atovaquone Chemical compound C1([C@H]2CC[C@@H](CC2)C2=C(C(C3=CC=CC=C3C2=O)=O)O)=CC=C(Cl)C=C1 KUCQYCKVKVOKAY-CTYIDZIISA-N 0.000 description 2
- WZPBZJONDBGPKJ-VEHQQRBSSA-N aztreonam Chemical compound O=C1N(S([O-])(=O)=O)[C@@H](C)[C@@H]1NC(=O)C(=N/OC(C)(C)C(O)=O)\C1=CSC([NH3+])=N1 WZPBZJONDBGPKJ-VEHQQRBSSA-N 0.000 description 2
- HNYOPLTXPVRDBG-UHFFFAOYSA-N barbituric acid Chemical compound O=C1CC(=O)NC(=O)N1 HNYOPLTXPVRDBG-UHFFFAOYSA-N 0.000 description 2
- BLFLLBZGZJTVJG-UHFFFAOYSA-N benzocaine Chemical compound CCOC(=O)C1=CC=C(N)C=C1 BLFLLBZGZJTVJG-UHFFFAOYSA-N 0.000 description 2
- 239000003782 beta lactam antibiotic agent Substances 0.000 description 2
- 229960002537 betamethasone Drugs 0.000 description 2
- UREBDLICKHMUKA-DVTGEIKXSA-N betamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-DVTGEIKXSA-N 0.000 description 2
- 239000003613 bile acid Substances 0.000 description 2
- 239000012867 bioactive agent Substances 0.000 description 2
- 230000000975 bioactive effect Effects 0.000 description 2
- 239000013060 biological fluid Substances 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- XUPYJHCZDLZNFP-UHFFFAOYSA-N butyl butanoate Chemical compound CCCCOC(=O)CCC XUPYJHCZDLZNFP-UHFFFAOYSA-N 0.000 description 2
- RYYVLZVUVIJVGH-UHFFFAOYSA-N caffeine Chemical compound CN1C(=O)N(C)C(=O)C2=C1N=CN2C RYYVLZVUVIJVGH-UHFFFAOYSA-N 0.000 description 2
- 229960004015 calcitonin Drugs 0.000 description 2
- 239000011575 calcium Substances 0.000 description 2
- 229910052791 calcium Inorganic materials 0.000 description 2
- 201000011510 cancer Diseases 0.000 description 2
- YAYRGNWWLMLWJE-UHFFFAOYSA-L carboplatin Chemical compound O=C1O[Pt](N)(N)OC(=O)C11CCC1 YAYRGNWWLMLWJE-UHFFFAOYSA-L 0.000 description 2
- 229960004562 carboplatin Drugs 0.000 description 2
- 239000002327 cardiovascular agent Substances 0.000 description 2
- 229940125692 cardiovascular agent Drugs 0.000 description 2
- 229960005243 carmustine Drugs 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 239000003054 catalyst Substances 0.000 description 2
- 239000002738 chelating agent Substances 0.000 description 2
- 230000001713 cholinergic effect Effects 0.000 description 2
- 239000000544 cholinesterase inhibitor Substances 0.000 description 2
- CCGSUNCLSOWKJO-UHFFFAOYSA-N cimetidine Chemical compound N#CNC(=N/C)\NCCSCC1=NC=N[C]1C CCGSUNCLSOWKJO-UHFFFAOYSA-N 0.000 description 2
- 229960001380 cimetidine Drugs 0.000 description 2
- 229960003405 ciprofloxacin Drugs 0.000 description 2
- 229960004316 cisplatin Drugs 0.000 description 2
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 2
- DGBIGWXXNGSACT-UHFFFAOYSA-N clonazepam Chemical compound C12=CC([N+](=O)[O-])=CC=C2NC(=O)CN=C1C1=CC=CC=C1Cl DGBIGWXXNGSACT-UHFFFAOYSA-N 0.000 description 2
- 229960003120 clonazepam Drugs 0.000 description 2
- 229960004022 clotrimazole Drugs 0.000 description 2
- VNFPBHJOKIVQEB-UHFFFAOYSA-N clotrimazole Chemical compound ClC1=CC=CC=C1C(N1C=NC=C1)(C=1C=CC=CC=1)C1=CC=CC=C1 VNFPBHJOKIVQEB-UHFFFAOYSA-N 0.000 description 2
- 210000002808 connective tissue Anatomy 0.000 description 2
- 238000004132 cross linking Methods 0.000 description 2
- RMRCNWBMXRMIRW-BYFNXCQMSA-M cyanocobalamin Chemical compound N#C[Co+]N([C@]1([H])[C@H](CC(N)=O)[C@]\2(CCC(=O)NC[C@H](C)OP(O)(=O)OC3[C@H]([C@H](O[C@@H]3CO)N3C4=CC(C)=C(C)C=C4N=C3)O)C)C/2=C(C)\C([C@H](C/2(C)C)CCC(N)=O)=N\C\2=C\C([C@H]([C@@]/2(CC(N)=O)C)CCC(N)=O)=N\C\2=C(C)/C2=N[C@]1(C)[C@@](C)(CC(N)=O)[C@@H]2CCC(N)=O RMRCNWBMXRMIRW-BYFNXCQMSA-M 0.000 description 2
- 229940127089 cytotoxic agent Drugs 0.000 description 2
- 231100000135 cytotoxicity Toxicity 0.000 description 2
- 230000003013 cytotoxicity Effects 0.000 description 2
- KWGRBVOPPLSCSI-UHFFFAOYSA-N d-ephedrine Natural products CNC(C)C(O)C1=CC=CC=C1 KWGRBVOPPLSCSI-UHFFFAOYSA-N 0.000 description 2
- 229960000640 dactinomycin Drugs 0.000 description 2
- 230000006378 damage Effects 0.000 description 2
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 2
- 229960000975 daunorubicin Drugs 0.000 description 2
- 239000000850 decongestant Substances 0.000 description 2
- 229960001985 dextromethorphan Drugs 0.000 description 2
- AAOVKJBEBIDNHE-UHFFFAOYSA-N diazepam Chemical compound N=1CC(=O)N(C)C2=CC=C(Cl)C=C2C=1C1=CC=CC=C1 AAOVKJBEBIDNHE-UHFFFAOYSA-N 0.000 description 2
- 229960003529 diazepam Drugs 0.000 description 2
- 229940124568 digestive agent Drugs 0.000 description 2
- LTMHDMANZUZIPE-PUGKRICDSA-N digoxin Chemical compound C1[C@H](O)[C@H](O)[C@@H](C)O[C@H]1O[C@@H]1[C@@H](C)O[C@@H](O[C@@H]2[C@H](O[C@@H](O[C@@H]3C[C@@H]4[C@]([C@@H]5[C@H]([C@]6(CC[C@@H]([C@@]6(C)[C@H](O)C5)C=5COC(=O)C=5)O)CC4)(C)CC3)C[C@@H]2O)C)C[C@@H]1O LTMHDMANZUZIPE-PUGKRICDSA-N 0.000 description 2
- 229960005156 digoxin Drugs 0.000 description 2
- LTMHDMANZUZIPE-UHFFFAOYSA-N digoxine Natural products C1C(O)C(O)C(C)OC1OC1C(C)OC(OC2C(OC(OC3CC4C(C5C(C6(CCC(C6(C)C(O)C5)C=5COC(=O)C=5)O)CC4)(C)CC3)CC2O)C)CC1O LTMHDMANZUZIPE-UHFFFAOYSA-N 0.000 description 2
- HSUGRBWQSSZJOP-RTWAWAEBSA-N diltiazem Chemical compound C1=CC(OC)=CC=C1[C@H]1[C@@H](OC(C)=O)C(=O)N(CCN(C)C)C2=CC=CC=C2S1 HSUGRBWQSSZJOP-RTWAWAEBSA-N 0.000 description 2
- 229960004166 diltiazem Drugs 0.000 description 2
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 2
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 2
- AUZONCFQVSMFAP-UHFFFAOYSA-N disulfiram Chemical compound CCN(CC)C(=S)SSC(=S)N(CC)CC AUZONCFQVSMFAP-UHFFFAOYSA-N 0.000 description 2
- 229940124567 diuretic antihypertensive agent Drugs 0.000 description 2
- 229960001089 dobutamine Drugs 0.000 description 2
- 229960003668 docetaxel Drugs 0.000 description 2
- VYFYYTLLBUKUHU-UHFFFAOYSA-N dopamine Chemical compound NCCC1=CC=C(O)C(O)=C1 VYFYYTLLBUKUHU-UHFFFAOYSA-N 0.000 description 2
- 239000003937 drug carrier Substances 0.000 description 2
- 238000005868 electrolysis reaction Methods 0.000 description 2
- JBKVHLHDHHXQEQ-UHFFFAOYSA-N epsilon-caprolactam Chemical compound O=C1CCCCCN1 JBKVHLHDHHXQEQ-UHFFFAOYSA-N 0.000 description 2
- 229960003133 ergot alkaloid Drugs 0.000 description 2
- 229960003276 erythromycin Drugs 0.000 description 2
- 125000005678 ethenylene group Chemical group [H]C([*:1])=C([H])[*:2] 0.000 description 2
- 125000000816 ethylene group Chemical group [H]C([H])([*:1])C([H])([H])[*:2] 0.000 description 2
- 230000008020 evaporation Effects 0.000 description 2
- 229960001596 famotidine Drugs 0.000 description 2
- XUFQPHANEAPEMJ-UHFFFAOYSA-N famotidine Chemical compound NC(N)=NC1=NC(CSCCC(N)=NS(N)(=O)=O)=CS1 XUFQPHANEAPEMJ-UHFFFAOYSA-N 0.000 description 2
- 239000003337 fertilizer Substances 0.000 description 2
- 238000011049 filling Methods 0.000 description 2
- ZZUFCTLCJUWOSV-UHFFFAOYSA-N furosemide Chemical compound C1=C(Cl)C(S(=O)(=O)N)=CC(C(O)=O)=C1NCC1=CC=CO1 ZZUFCTLCJUWOSV-UHFFFAOYSA-N 0.000 description 2
- 229960003883 furosemide Drugs 0.000 description 2
- 210000004211 gastric acid Anatomy 0.000 description 2
- 206010017758 gastric cancer Diseases 0.000 description 2
- 239000003193 general anesthetic agent Substances 0.000 description 2
- XLXSAKCOAKORKW-AQJXLSMYSA-N gonadorelin Chemical compound C([C@@H](C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)NCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 XLXSAKCOAKORKW-AQJXLSMYSA-N 0.000 description 2
- 229940035638 gonadotropin-releasing hormone Drugs 0.000 description 2
- 229960002913 goserelin Drugs 0.000 description 2
- 125000001475 halogen functional group Chemical group 0.000 description 2
- LNEPOXFFQSENCJ-UHFFFAOYSA-N haloperidol Chemical compound C1CC(O)(C=2C=CC(Cl)=CC=2)CCN1CCCC(=O)C1=CC=C(F)C=C1 LNEPOXFFQSENCJ-UHFFFAOYSA-N 0.000 description 2
- 229910001385 heavy metal Inorganic materials 0.000 description 2
- 229920006158 high molecular weight polymer Polymers 0.000 description 2
- JYGXADMDTFJGBT-VWUMJDOOSA-N hydrocortisone Chemical compound O=C1CC[C@]2(C)[C@H]3[C@@H](O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 JYGXADMDTFJGBT-VWUMJDOOSA-N 0.000 description 2
- WVLOADHCBXTIJK-YNHQPCIGSA-N hydromorphone Chemical compound O([C@H]1C(CC[C@H]23)=O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O WVLOADHCBXTIJK-YNHQPCIGSA-N 0.000 description 2
- 229960001410 hydromorphone Drugs 0.000 description 2
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 2
- 239000002471 hydroxymethylglutaryl coenzyme A reductase inhibitor Substances 0.000 description 2
- 239000000960 hypophysis hormone Substances 0.000 description 2
- 239000003018 immunosuppressive agent Substances 0.000 description 2
- 238000000338 in vitro Methods 0.000 description 2
- 230000002757 inflammatory effect Effects 0.000 description 2
- 239000003983 inhalation anesthetic agent Substances 0.000 description 2
- 239000004041 inotropic agent Substances 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- 239000003456 ion exchange resin Substances 0.000 description 2
- 229920003303 ion-exchange polymer Polymers 0.000 description 2
- 230000007794 irritation Effects 0.000 description 2
- AWJUIBRHMBBTKR-UHFFFAOYSA-N isoquinoline Chemical compound C1=NC=CC2=CC=CC=C21 AWJUIBRHMBBTKR-UHFFFAOYSA-N 0.000 description 2
- DKYWVDODHFEZIM-UHFFFAOYSA-N ketoprofen Chemical compound OC(=O)C(C)C1=CC=CC(C(=O)C=2C=CC=CC=2)=C1 DKYWVDODHFEZIM-UHFFFAOYSA-N 0.000 description 2
- 229960000991 ketoprofen Drugs 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- JJTUDXZGHPGLLC-UHFFFAOYSA-N lactide Chemical compound CC1OC(=O)C(C)OC1=O JJTUDXZGHPGLLC-UHFFFAOYSA-N 0.000 description 2
- 239000008141 laxative Substances 0.000 description 2
- 230000002475 laxative effect Effects 0.000 description 2
- GFIJNRVAKGFPGQ-LIJARHBVSA-N leuprolide Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CC=C(O)C=C1 GFIJNRVAKGFPGQ-LIJARHBVSA-N 0.000 description 2
- 229960004338 leuprorelin Drugs 0.000 description 2
- 229960004502 levodopa Drugs 0.000 description 2
- 229960004400 levonorgestrel Drugs 0.000 description 2
- 125000005647 linker group Chemical group 0.000 description 2
- 238000011068 loading method Methods 0.000 description 2
- 239000000773 local anti-infective agent Substances 0.000 description 2
- 229960004391 lorazepam Drugs 0.000 description 2
- 230000014759 maintenance of location Effects 0.000 description 2
- 229960001797 methadone Drugs 0.000 description 2
- TZIHFWKZFHZASV-UHFFFAOYSA-N methyl formate Chemical compound COC=O TZIHFWKZFHZASV-UHFFFAOYSA-N 0.000 description 2
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 2
- IUBSYMUCCVWXPE-UHFFFAOYSA-N metoprolol Chemical compound COCCC1=CC=C(OCC(O)CNC(C)C)C=C1 IUBSYMUCCVWXPE-UHFFFAOYSA-N 0.000 description 2
- 229960002237 metoprolol Drugs 0.000 description 2
- 229940029985 mineral supplement Drugs 0.000 description 2
- 235000020786 mineral supplement Nutrition 0.000 description 2
- 229960003632 minoxidil Drugs 0.000 description 2
- 230000003547 miosis Effects 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 239000002899 monoamine oxidase inhibitor Substances 0.000 description 2
- UZHSEJADLWPNLE-GRGSLBFTSA-N naloxone Chemical compound O=C([C@@H]1O2)CC[C@@]3(O)[C@H]4CC5=CC=C(O)C2=C5[C@@]13CCN4CC=C UZHSEJADLWPNLE-GRGSLBFTSA-N 0.000 description 2
- 229960004127 naloxone Drugs 0.000 description 2
- 229940053128 nerve growth factor Drugs 0.000 description 2
- 229960002715 nicotine Drugs 0.000 description 2
- SNICXCGAKADSCV-UHFFFAOYSA-N nicotine Natural products CN1CCCC1C1=CC=CN=C1 SNICXCGAKADSCV-UHFFFAOYSA-N 0.000 description 2
- HYIMSNHJOBLJNT-UHFFFAOYSA-N nifedipine Chemical compound COC(=O)C1=C(C)NC(C)=C(C(=O)OC)C1C1=CC=CC=C1[N+]([O-])=O HYIMSNHJOBLJNT-UHFFFAOYSA-N 0.000 description 2
- 229960001597 nifedipine Drugs 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 2
- OSTGTTZJOCZWJG-UHFFFAOYSA-N nitrosourea Chemical compound NC(=O)N=NO OSTGTTZJOCZWJG-UHFFFAOYSA-N 0.000 description 2
- 229940053934 norethindrone Drugs 0.000 description 2
- VIKNJXKGJWUCNN-XGXHKTLJSA-N norethisterone Chemical compound O=C1CC[C@@H]2[C@H]3CC[C@](C)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=C1 VIKNJXKGJWUCNN-XGXHKTLJSA-N 0.000 description 2
- 229960001180 norfloxacin Drugs 0.000 description 2
- OGJPXUAPXNRGGI-UHFFFAOYSA-N norfloxacin Chemical compound C1=C2N(CC)C=C(C(O)=O)C(=O)C2=CC(F)=C1N1CCNCC1 OGJPXUAPXNRGGI-UHFFFAOYSA-N 0.000 description 2
- 239000003401 opiate antagonist Substances 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- 125000001820 oxy group Chemical group [*:1]O[*:2] 0.000 description 2
- 230000000849 parathyroid Effects 0.000 description 2
- 229940049954 penicillin Drugs 0.000 description 2
- 239000000810 peripheral vasodilating agent Substances 0.000 description 2
- 229960002116 peripheral vasodilator Drugs 0.000 description 2
- 239000003208 petroleum Substances 0.000 description 2
- 239000003444 phase transfer catalyst Substances 0.000 description 2
- 229960002305 phenylpropanolamine hydrochloride Drugs 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 2
- 239000010452 phosphate Substances 0.000 description 2
- 125000004437 phosphorous atom Chemical group 0.000 description 2
- 229920000747 poly(lactic acid) Polymers 0.000 description 2
- 229920002463 poly(p-dioxanone) polymer Polymers 0.000 description 2
- 239000000622 polydioxanone Substances 0.000 description 2
- 229920001184 polypeptide Polymers 0.000 description 2
- 229920002223 polystyrene Polymers 0.000 description 2
- 239000011591 potassium Substances 0.000 description 2
- 229910052700 potassium Inorganic materials 0.000 description 2
- OXCMYAYHXIHQOA-UHFFFAOYSA-N potassium;[2-butyl-5-chloro-3-[[4-[2-(1,2,4-triaza-3-azanidacyclopenta-1,4-dien-5-yl)phenyl]phenyl]methyl]imidazol-4-yl]methanol Chemical compound [K+].CCCCC1=NC(Cl)=C(CO)N1CC1=CC=C(C=2C(=CC=CC=2)C2=N[N-]N=N2)C=C1 OXCMYAYHXIHQOA-UHFFFAOYSA-N 0.000 description 2
- IENZQIKPVFGBNW-UHFFFAOYSA-N prazosin Chemical compound N=1C(N)=C2C=C(OC)C(OC)=CC2=NC=1N(CC1)CCN1C(=O)C1=CC=CO1 IENZQIKPVFGBNW-UHFFFAOYSA-N 0.000 description 2
- 229960001289 prazosin Drugs 0.000 description 2
- 239000002244 precipitate Substances 0.000 description 2
- 238000001556 precipitation Methods 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 239000002325 prokinetic agent Substances 0.000 description 2
- 229960003712 propranolol Drugs 0.000 description 2
- YKYONYBAUNKHLG-UHFFFAOYSA-N propyl acetate Chemical compound CCCOC(C)=O YKYONYBAUNKHLG-UHFFFAOYSA-N 0.000 description 2
- 125000004805 propylene group Chemical group [H]C([H])([H])C([H])([*:1])C([H])([H])[*:2] 0.000 description 2
- 239000003368 psychostimulant agent Substances 0.000 description 2
- LOUPRKONTZGTKE-LHHVKLHASA-N quinidine Chemical compound C([C@H]([C@H](C1)C=C)C2)C[N@@]1[C@H]2[C@@H](O)C1=CC=NC2=CC=C(OC)C=C21 LOUPRKONTZGTKE-LHHVKLHASA-N 0.000 description 2
- LISFMEBWQUVKPJ-UHFFFAOYSA-N quinolin-2-ol Chemical compound C1=CC=C2NC(=O)C=CC2=C1 LISFMEBWQUVKPJ-UHFFFAOYSA-N 0.000 description 2
- 150000003254 radicals Chemical class 0.000 description 2
- 230000035484 reaction time Effects 0.000 description 2
- 230000008929 regeneration Effects 0.000 description 2
- 238000011069 regeneration method Methods 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- 229960002052 salbutamol Drugs 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 2
- 229940125723 sedative agent Drugs 0.000 description 2
- 229940124834 selective serotonin reuptake inhibitor Drugs 0.000 description 2
- 239000012896 selective serotonin reuptake inhibitor Substances 0.000 description 2
- RMLUKZWYIKEASN-UHFFFAOYSA-M sodium;2-amino-9-(2-hydroxyethoxymethyl)purin-6-olate Chemical compound [Na+].O=C1[N-]C(N)=NC2=C1N=CN2COCCO RMLUKZWYIKEASN-UHFFFAOYSA-M 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 201000011549 stomach cancer Diseases 0.000 description 2
- 238000003860 storage Methods 0.000 description 2
- 150000003512 tertiary amines Chemical class 0.000 description 2
- 229960002180 tetracycline Drugs 0.000 description 2
- 229930101283 tetracycline Natural products 0.000 description 2
- 235000019364 tetracycline Nutrition 0.000 description 2
- 229940072172 tetracycline antibiotic Drugs 0.000 description 2
- 150000003522 tetracyclines Chemical class 0.000 description 2
- ZFXYFBGIUFBOJW-UHFFFAOYSA-N theophylline Chemical compound O=C1N(C)C(=O)N(C)C2=C1NC=N2 ZFXYFBGIUFBOJW-UHFFFAOYSA-N 0.000 description 2
- 239000003451 thiazide diuretic agent Substances 0.000 description 2
- 210000001685 thyroid gland Anatomy 0.000 description 2
- 239000005495 thyroid hormone Substances 0.000 description 2
- 229940036555 thyroid hormone Drugs 0.000 description 2
- 229960004605 timolol Drugs 0.000 description 2
- 230000000699 topical effect Effects 0.000 description 2
- 229960001727 tretinoin Drugs 0.000 description 2
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 2
- 239000002996 urinary tract agent Substances 0.000 description 2
- 229960001722 verapamil Drugs 0.000 description 2
- 235000019166 vitamin D Nutrition 0.000 description 2
- 239000011710 vitamin D Substances 0.000 description 2
- 229940046008 vitamin d Drugs 0.000 description 2
- HBOMLICNUCNMMY-XLPZGREQSA-N zidovudine Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](N=[N+]=[N-])C1 HBOMLICNUCNMMY-XLPZGREQSA-N 0.000 description 2
- JIAARYAFYJHUJI-UHFFFAOYSA-L zinc dichloride Chemical compound [Cl-].[Cl-].[Zn+2] JIAARYAFYJHUJI-UHFFFAOYSA-L 0.000 description 2
- 239000002132 β-lactam antibiotic Substances 0.000 description 2
- 229940124586 β-lactam antibiotics Drugs 0.000 description 2
- QCHFTSOMWOSFHM-WPRPVWTQSA-N (+)-Pilocarpine Chemical compound C1OC(=O)[C@@H](CC)[C@H]1CC1=CN=CN1C QCHFTSOMWOSFHM-WPRPVWTQSA-N 0.000 description 1
- DNXHEGUUPJUMQT-UHFFFAOYSA-N (+)-estrone Natural products OC1=CC=C2C3CCC(C)(C(CC4)=O)C4C3CCC2=C1 DNXHEGUUPJUMQT-UHFFFAOYSA-N 0.000 description 1
- AKNNEGZIBPJZJG-MSOLQXFVSA-N (-)-noscapine Chemical compound CN1CCC2=CC=3OCOC=3C(OC)=C2[C@@H]1[C@@H]1C2=CC=C(OC)C(OC)=C2C(=O)O1 AKNNEGZIBPJZJG-MSOLQXFVSA-N 0.000 description 1
- DVPFXXZVXFSUTH-UHFFFAOYSA-N (2-oxocyclohexyl) acetate Chemical compound CC(=O)OC1CCCCC1=O DVPFXXZVXFSUTH-UHFFFAOYSA-N 0.000 description 1
- XMAYWYJOQHXEEK-OZXSUGGESA-N (2R,4S)-ketoconazole Chemical compound C1CN(C(=O)C)CCN1C(C=C1)=CC=C1OC[C@@H]1O[C@@](CN2C=NC=C2)(C=2C(=CC(Cl)=CC=2)Cl)OC1 XMAYWYJOQHXEEK-OZXSUGGESA-N 0.000 description 1
- VLPIATFUUWWMKC-SNVBAGLBSA-N (2r)-1-(2,6-dimethylphenoxy)propan-2-amine Chemical compound C[C@@H](N)COC1=C(C)C=CC=C1C VLPIATFUUWWMKC-SNVBAGLBSA-N 0.000 description 1
- RDEIXVOBVLKYNT-VQBXQJRRSA-N (2r,3r,4r,5r)-2-[(1s,2s,3r,4s,6r)-4,6-diamino-3-[(2r,3r,6s)-3-amino-6-(1-aminoethyl)oxan-2-yl]oxy-2-hydroxycyclohexyl]oxy-5-methyl-4-(methylamino)oxane-3,5-diol;(2r,3r,4r,5r)-2-[(1s,2s,3r,4s,6r)-4,6-diamino-3-[(2r,3r,6s)-3-amino-6-(aminomethyl)oxan-2-yl]o Chemical compound OS(O)(=O)=O.O1C[C@@](O)(C)[C@H](NC)[C@@H](O)[C@H]1O[C@@H]1[C@@H](O)[C@H](O[C@@H]2[C@@H](CC[C@@H](CN)O2)N)[C@@H](N)C[C@H]1N.O1C[C@@](O)(C)[C@H](NC)[C@@H](O)[C@H]1O[C@@H]1[C@@H](O)[C@H](O[C@@H]2[C@@H](CC[C@H](O2)C(C)N)N)[C@@H](N)C[C@H]1N.O1[C@H](C(C)NC)CC[C@@H](N)[C@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](NC)[C@@](C)(O)CO2)O)[C@H](N)C[C@@H]1N RDEIXVOBVLKYNT-VQBXQJRRSA-N 0.000 description 1
- YKFCISHFRZHKHY-NGQGLHOPSA-N (2s)-2-amino-3-(3,4-dihydroxyphenyl)-2-methylpropanoic acid;trihydrate Chemical compound O.O.O.OC(=O)[C@](N)(C)CC1=CC=C(O)C(O)=C1.OC(=O)[C@](N)(C)CC1=CC=C(O)C(O)=C1 YKFCISHFRZHKHY-NGQGLHOPSA-N 0.000 description 1
- FYGDTMLNYKFZSV-URKRLVJHSA-N (2s,3r,4s,5s,6r)-2-[(2r,4r,5r,6s)-4,5-dihydroxy-2-(hydroxymethyl)-6-[(2r,4r,5r,6s)-4,5,6-trihydroxy-2-(hydroxymethyl)oxan-3-yl]oxyoxan-3-yl]oxy-6-(hydroxymethyl)oxane-3,4,5-triol Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@H]1OC1[C@@H](CO)O[C@@H](OC2[C@H](O[C@H](O)[C@H](O)[C@H]2O)CO)[C@H](O)[C@H]1O FYGDTMLNYKFZSV-URKRLVJHSA-N 0.000 description 1
- LJRDOKAZOAKLDU-UDXJMMFXSA-N (2s,3s,4r,5r,6r)-5-amino-2-(aminomethyl)-6-[(2r,3s,4r,5s)-5-[(1r,2r,3s,5r,6s)-3,5-diamino-2-[(2s,3r,4r,5s,6r)-3-amino-4,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-6-hydroxycyclohexyl]oxy-4-hydroxy-2-(hydroxymethyl)oxolan-3-yl]oxyoxane-3,4-diol;sulfuric ac Chemical compound OS(O)(=O)=O.N[C@@H]1[C@@H](O)[C@H](O)[C@H](CN)O[C@@H]1O[C@H]1[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](N)C[C@@H](N)[C@@H]2O)O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)N)O[C@@H]1CO LJRDOKAZOAKLDU-UDXJMMFXSA-N 0.000 description 1
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 1
- DKSZLDSPXIWGFO-BLOJGBSASA-N (4r,4ar,7s,7ar,12bs)-9-methoxy-3-methyl-2,4,4a,7,7a,13-hexahydro-1h-4,12-methanobenzofuro[3,2-e]isoquinoline-7-ol;phosphoric acid;hydrate Chemical compound O.OP(O)(O)=O.OP(O)(O)=O.C([C@H]1[C@H](N(CC[C@@]112)C)C3)=C[C@H](O)[C@@H]1OC1=C2C3=CC=C1OC.C([C@H]1[C@H](N(CC[C@@]112)C)C3)=C[C@H](O)[C@@H]1OC1=C2C3=CC=C1OC DKSZLDSPXIWGFO-BLOJGBSASA-N 0.000 description 1
- BCXHDORHMMZBBZ-DORFAMGDSA-N (4r,4ar,7s,7ar,12bs)-9-methoxy-3-methyl-2,4,4a,7,7a,13-hexahydro-1h-4,12-methanobenzofuro[3,2-e]isoquinoline-7-ol;sulfuric acid Chemical compound OS(O)(=O)=O.C([C@H]1[C@H](N(CC[C@@]112)C)C3)=C[C@H](O)[C@@H]1OC1=C2C3=CC=C1OC.C([C@H]1[C@H](N(CC[C@@]112)C)C3)=C[C@H](O)[C@@H]1OC1=C2C3=CC=C1OC BCXHDORHMMZBBZ-DORFAMGDSA-N 0.000 description 1
- SGKRLCUYIXIAHR-AKNGSSGZSA-N (4s,4ar,5s,5ar,6r,12ar)-4-(dimethylamino)-1,5,10,11,12a-pentahydroxy-6-methyl-3,12-dioxo-4a,5,5a,6-tetrahydro-4h-tetracene-2-carboxamide Chemical compound C1=CC=C2[C@H](C)[C@@H]([C@H](O)[C@@H]3[C@](C(O)=C(C(N)=O)C(=O)[C@H]3N(C)C)(O)C3=O)C3=C(O)C2=C1O SGKRLCUYIXIAHR-AKNGSSGZSA-N 0.000 description 1
- FFTVPQUHLQBXQZ-KVUCHLLUSA-N (4s,4as,5ar,12ar)-4,7-bis(dimethylamino)-1,10,11,12a-tetrahydroxy-3,12-dioxo-4a,5,5a,6-tetrahydro-4h-tetracene-2-carboxamide Chemical compound C1C2=C(N(C)C)C=CC(O)=C2C(O)=C2[C@@H]1C[C@H]1[C@H](N(C)C)C(=O)C(C(N)=O)=C(O)[C@@]1(O)C2=O FFTVPQUHLQBXQZ-KVUCHLLUSA-N 0.000 description 1
- MINDHVHHQZYEEK-UHFFFAOYSA-N (E)-(2S,3R,4R,5S)-5-[(2S,3S,4S,5S)-2,3-epoxy-5-hydroxy-4-methylhexyl]tetrahydro-3,4-dihydroxy-(beta)-methyl-2H-pyran-2-crotonic acid ester with 9-hydroxynonanoic acid Natural products CC(O)C(C)C1OC1CC1C(O)C(O)C(CC(C)=CC(=O)OCCCCCCCCC(O)=O)OC1 MINDHVHHQZYEEK-UHFFFAOYSA-N 0.000 description 1
- UCTWMZQNUQWSLP-VIFPVBQESA-N (R)-adrenaline Chemical compound CNC[C@H](O)C1=CC=C(O)C(O)=C1 UCTWMZQNUQWSLP-VIFPVBQESA-N 0.000 description 1
- 229930182837 (R)-adrenaline Natural products 0.000 description 1
- WHTVZRBIWZFKQO-AWEZNQCLSA-N (S)-chloroquine Chemical compound ClC1=CC=C2C(N[C@@H](C)CCCN(CC)CC)=CC=NC2=C1 WHTVZRBIWZFKQO-AWEZNQCLSA-N 0.000 description 1
- JXYWFNAQESKDNC-BTJKTKAUSA-N (z)-4-hydroxy-4-oxobut-2-enoate;2-[(4-methoxyphenyl)methyl-pyridin-2-ylamino]ethyl-dimethylazanium Chemical compound OC(=O)\C=C/C(O)=O.C1=CC(OC)=CC=C1CN(CCN(C)C)C1=CC=CC=N1 JXYWFNAQESKDNC-BTJKTKAUSA-N 0.000 description 1
- SCYULBFZEHDVBN-UHFFFAOYSA-N 1,1-Dichloroethane Chemical compound CC(Cl)Cl SCYULBFZEHDVBN-UHFFFAOYSA-N 0.000 description 1
- JZTKNVMVUVSGJF-UHFFFAOYSA-N 1,2,3,5-oxatriazole Chemical compound C=1N=NON=1 JZTKNVMVUVSGJF-UHFFFAOYSA-N 0.000 description 1
- JYEUMXHLPRZUAT-UHFFFAOYSA-N 1,2,3-triazine Chemical compound C1=CN=NN=C1 JYEUMXHLPRZUAT-UHFFFAOYSA-N 0.000 description 1
- BBVIDBNAYOIXOE-UHFFFAOYSA-N 1,2,4-oxadiazole Chemical compound C=1N=CON=1 BBVIDBNAYOIXOE-UHFFFAOYSA-N 0.000 description 1
- FYADHXFMURLYQI-UHFFFAOYSA-N 1,2,4-triazine Chemical compound C1=CN=NC=N1 FYADHXFMURLYQI-UHFFFAOYSA-N 0.000 description 1
- WTPCCFHCHCMJIT-UHFFFAOYSA-N 1,2,5-oxathiazine Chemical compound O1SC=CN=C1 WTPCCFHCHCMJIT-UHFFFAOYSA-N 0.000 description 1
- PPYNEJLGBMVWMC-UHFFFAOYSA-N 1,2,6-oxathiazine Chemical compound O1SC=CC=N1 PPYNEJLGBMVWMC-UHFFFAOYSA-N 0.000 description 1
- NWUYHJFMYQTDRP-UHFFFAOYSA-N 1,2-bis(ethenyl)benzene;1-ethenyl-2-ethylbenzene;styrene Chemical compound C=CC1=CC=CC=C1.CCC1=CC=CC=C1C=C.C=CC1=CC=CC=C1C=C NWUYHJFMYQTDRP-UHFFFAOYSA-N 0.000 description 1
- OXVZEOYNXOZOFP-UHFFFAOYSA-N 1,2-dimethyl-3-propoxybenzene Chemical group CCCOC1=CC=CC(C)=C1C OXVZEOYNXOZOFP-UHFFFAOYSA-N 0.000 description 1
- VCZQYTJRWNRPHF-UHFFFAOYSA-N 1,2-dioxin Chemical compound O1OC=CC=C1 VCZQYTJRWNRPHF-UHFFFAOYSA-N 0.000 description 1
- FFJBRYXQVYFDEQ-UHFFFAOYSA-N 1,3,2-dioxazole Chemical compound N1OC=CO1 FFJBRYXQVYFDEQ-UHFFFAOYSA-N 0.000 description 1
- FKASFBLJDCHBNZ-UHFFFAOYSA-N 1,3,4-oxadiazole Chemical compound C1=NN=CO1 FKASFBLJDCHBNZ-UHFFFAOYSA-N 0.000 description 1
- JIHQDMXYYFUGFV-UHFFFAOYSA-N 1,3,5-triazine Chemical compound C1=NC=NC=N1 JIHQDMXYYFUGFV-UHFFFAOYSA-N 0.000 description 1
- BCMCBBGGLRIHSE-UHFFFAOYSA-N 1,3-benzoxazole Chemical compound C1=CC=C2OC=NC2=C1 BCMCBBGGLRIHSE-UHFFFAOYSA-N 0.000 description 1
- OHOXMCCFSFSRMD-UHFFFAOYSA-N 1,3-oxathiole Chemical compound C1OC=CS1 OHOXMCCFSFSRMD-UHFFFAOYSA-N 0.000 description 1
- ZWEGOVJVJZJDQJ-UHFFFAOYSA-N 1,4,2-dioxazole Chemical compound C1OC=NO1 ZWEGOVJVJZJDQJ-UHFFFAOYSA-N 0.000 description 1
- VMLKTERJLVWEJJ-UHFFFAOYSA-N 1,5-naphthyridine Chemical compound C1=CC=NC2=CC=CN=C21 VMLKTERJLVWEJJ-UHFFFAOYSA-N 0.000 description 1
- VSOSXKMEQPYESP-UHFFFAOYSA-N 1,6-naphthyridine Chemical compound C1=CN=CC2=CC=CN=C21 VSOSXKMEQPYESP-UHFFFAOYSA-N 0.000 description 1
- MXBVNILGVJVVMH-UHFFFAOYSA-N 1,7-naphthyridine Chemical compound C1=NC=CC2=CC=CN=C21 MXBVNILGVJVVMH-UHFFFAOYSA-N 0.000 description 1
- FLBAYUMRQUHISI-UHFFFAOYSA-N 1,8-naphthyridine Chemical compound N1=CC=CC2=CC=CN=C21 FLBAYUMRQUHISI-UHFFFAOYSA-N 0.000 description 1
- UBCHPRBFMUDMNC-UHFFFAOYSA-N 1-(1-adamantyl)ethanamine Chemical compound C1C(C2)CC3CC2CC1(C(N)C)C3 UBCHPRBFMUDMNC-UHFFFAOYSA-N 0.000 description 1
- ZGEGCLOFRBLKSE-UHFFFAOYSA-N 1-Heptene Chemical group CCCCCC=C ZGEGCLOFRBLKSE-UHFFFAOYSA-N 0.000 description 1
- XIJXHOVKJAXCGJ-XLPZGREQSA-N 1-[(2r,4s,5r)-4-hydroxy-5-(hydroxymethyl)oxolan-2-yl]-5-iodopyrimidin-2-one Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)N=CC(I)=C1 XIJXHOVKJAXCGJ-XLPZGREQSA-N 0.000 description 1
- BAVMXDNHWGQCSR-UHFFFAOYSA-N 1-[2-(2,3-dimethylphenyl)ethyl]-2,3-dimethylbenzene Chemical group CC1=CC=CC(CCC=2C(=C(C)C=CC=2)C)=C1C BAVMXDNHWGQCSR-UHFFFAOYSA-N 0.000 description 1
- FCEHBMOGCRZNNI-UHFFFAOYSA-N 1-benzothiophene Chemical compound C1=CC=C2SC=CC2=C1 FCEHBMOGCRZNNI-UHFFFAOYSA-N 0.000 description 1
- XVPUYZJFOYWSIY-UHFFFAOYSA-N 1-butoxy-2,3-dimethylbenzene Chemical group CCCCOC1=CC=CC(C)=C1C XVPUYZJFOYWSIY-UHFFFAOYSA-N 0.000 description 1
- AFFLGGQVNFXPEV-UHFFFAOYSA-N 1-decene Chemical group CCCCCCCCC=C AFFLGGQVNFXPEV-UHFFFAOYSA-N 0.000 description 1
- DSALCQNSJMUGOG-UHFFFAOYSA-N 1-dichlorophosphoryloxyhexane Chemical compound CCCCCCOP(Cl)(Cl)=O DSALCQNSJMUGOG-UHFFFAOYSA-N 0.000 description 1
- UHLXFCJOJNFYRI-UHFFFAOYSA-N 1-hexadecyl-2,3-dimethylbenzene Chemical group CCCCCCCCCCCCCCCCC1=CC=CC(C)=C1C UHLXFCJOJNFYRI-UHFFFAOYSA-N 0.000 description 1
- DVVGIUUJYPYENY-UHFFFAOYSA-N 1-methylpyridin-2-one Chemical compound CN1C=CC=CC1=O DVVGIUUJYPYENY-UHFFFAOYSA-N 0.000 description 1
- CFJMRBQWBDQYMK-UHFFFAOYSA-N 1-phenyl-1-cyclopentanecarboxylic acid 2-[2-(diethylamino)ethoxy]ethyl ester Chemical compound C=1C=CC=CC=1C1(C(=O)OCCOCCN(CC)CC)CCCC1 CFJMRBQWBDQYMK-UHFFFAOYSA-N 0.000 description 1
- WJFKNYWRSNBZNX-UHFFFAOYSA-N 10H-phenothiazine Chemical compound C1=CC=C2NC3=CC=CC=C3SC2=C1 WJFKNYWRSNBZNX-UHFFFAOYSA-N 0.000 description 1
- FUFLCEKSBBHCMO-UHFFFAOYSA-N 11-dehydrocorticosterone Natural products O=C1CCC2(C)C3C(=O)CC(C)(C(CC4)C(=O)CO)C4C3CCC2=C1 FUFLCEKSBBHCMO-UHFFFAOYSA-N 0.000 description 1
- FPIPGXGPPPQFEQ-UHFFFAOYSA-N 13-cis retinol Natural products OCC=C(C)C=CC=C(C)C=CC1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-UHFFFAOYSA-N 0.000 description 1
- VOXZDWNPVJITMN-ZBRFXRBCSA-N 17β-estradiol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 VOXZDWNPVJITMN-ZBRFXRBCSA-N 0.000 description 1
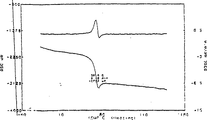
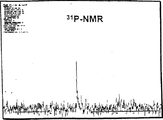
- 238000005160 1H NMR spectroscopy Methods 0.000 description 1
- QWENRTYMTSOGBR-UHFFFAOYSA-N 1H-1,2,3-Triazole Chemical compound C=1C=NNN=1 QWENRTYMTSOGBR-UHFFFAOYSA-N 0.000 description 1
- BAXOFTOLAUCFNW-UHFFFAOYSA-N 1H-indazole Chemical compound C1=CC=C2C=NNC2=C1 BAXOFTOLAUCFNW-UHFFFAOYSA-N 0.000 description 1
- ONOBXDPYDHTSBQ-UHFFFAOYSA-N 2,3,4,7-tetrahydro-1h-diazepine Chemical compound C1CC=CCNN1 ONOBXDPYDHTSBQ-UHFFFAOYSA-N 0.000 description 1
- WFXURHIXPXVPGM-UHFFFAOYSA-N 2,3-dihydroxybutanedioic acid;2-methyl-9-phenyl-1,3,4,9-tetrahydroindeno[2,1-c]pyridine Chemical compound OC(=O)C(O)C(O)C(O)=O.C1N(C)CCC(C2=CC=CC=C22)=C1C2C1=CC=CC=C1 WFXURHIXPXVPGM-UHFFFAOYSA-N 0.000 description 1
- SYOANZBNGDEJFH-UHFFFAOYSA-N 2,5-dihydro-1h-triazole Chemical compound C1NNN=C1 SYOANZBNGDEJFH-UHFFFAOYSA-N 0.000 description 1
- UXGVMFHEKMGWMA-UHFFFAOYSA-N 2-benzofuran Chemical compound C1=CC=CC2=COC=C21 UXGVMFHEKMGWMA-UHFFFAOYSA-N 0.000 description 1
- AZSNMRSAGSSBNP-UHFFFAOYSA-N 22,23-dihydroavermectin B1a Natural products C1CC(C)C(C(C)CC)OC21OC(CC=C(C)C(OC1OC(C)C(OC3OC(C)C(O)C(OC)C3)C(OC)C1)C(C)C=CC=C1C3(C(C(=O)O4)C=C(C)C(O)C3OC1)O)CC4C2 AZSNMRSAGSSBNP-UHFFFAOYSA-N 0.000 description 1
- BQTJMKIHKULPCZ-UHFFFAOYSA-N 2H-indene Chemical compound C1=CC=CC2=CCC=C21 BQTJMKIHKULPCZ-UHFFFAOYSA-N 0.000 description 1
- MGADZUXDNSDTHW-UHFFFAOYSA-N 2H-pyran Chemical compound C1OC=CC=C1 MGADZUXDNSDTHW-UHFFFAOYSA-N 0.000 description 1
- ZPSJGADGUYYRKE-UHFFFAOYSA-N 2H-pyran-2-one Chemical compound O=C1C=CC=CO1 ZPSJGADGUYYRKE-UHFFFAOYSA-N 0.000 description 1
- HPYLZSUEFFQHRS-UHFFFAOYSA-N 2h-1,2,4-oxadiazine Chemical compound N1OC=CN=C1 HPYLZSUEFFQHRS-UHFFFAOYSA-N 0.000 description 1
- PVTXJGJDOHYFOX-UHFFFAOYSA-N 2h-1,4-benzoxazine Chemical compound C1=CC=C2N=CCOC2=C1 PVTXJGJDOHYFOX-UHFFFAOYSA-N 0.000 description 1
- YHWMFDLNZGIJSD-UHFFFAOYSA-N 2h-1,4-oxazine Chemical compound C1OC=CN=C1 YHWMFDLNZGIJSD-UHFFFAOYSA-N 0.000 description 1
- GTYZDORKFFSTLS-UHFFFAOYSA-N 2h-3,1-benzoxazine Chemical compound C1=CC=CC2=NCOC=C21 GTYZDORKFFSTLS-UHFFFAOYSA-N 0.000 description 1
- BCHZICNRHXRCHY-UHFFFAOYSA-N 2h-oxazine Chemical compound N1OC=CC=C1 BCHZICNRHXRCHY-UHFFFAOYSA-N 0.000 description 1
- DNUJVGBNIXGTHC-UHFFFAOYSA-N 3,6-dihydro-2h-oxazine Chemical compound C1NOCC=C1 DNUJVGBNIXGTHC-UHFFFAOYSA-N 0.000 description 1
- WUIABRMSWOKTOF-OYALTWQYSA-O 3-[[2-[2-[2-[[(2s,3r)-2-[[(2s,3s,4r)-4-[[(2s,3r)-2-[[6-amino-2-[(1s)-3-amino-1-[[(2s)-2,3-diamino-3-oxopropyl]amino]-3-oxopropyl]-5-methylpyrimidine-4-carbonyl]amino]-3-[(2r,3s,4s,5s,6s)-3-[(2r,3s,4s,5r,6r)-4-carbamoyloxy-3,5-dihydroxy-6-(hydroxymethyl)ox Chemical compound OS(O)(=O)=O.N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C WUIABRMSWOKTOF-OYALTWQYSA-O 0.000 description 1
- JSDZSLGMRRSAHD-UHFFFAOYSA-N 3-methylbutan-2-ylcyclopropane Chemical compound CC(C)C(C)C1CC1 JSDZSLGMRRSAHD-UHFFFAOYSA-N 0.000 description 1
- UIAGMCDKSXEBJQ-IBGZPJMESA-N 3-o-(2-methoxyethyl) 5-o-propan-2-yl (4s)-2,6-dimethyl-4-(3-nitrophenyl)-1,4-dihydropyridine-3,5-dicarboxylate Chemical compound COCCOC(=O)C1=C(C)NC(C)=C(C(=O)OC(C)C)[C@H]1C1=CC=CC([N+]([O-])=O)=C1 UIAGMCDKSXEBJQ-IBGZPJMESA-N 0.000 description 1
- QLXDONQYFHWXFW-UHFFFAOYSA-N 3h-1,2,4-dioxazole Chemical compound C1OOC=N1 QLXDONQYFHWXFW-UHFFFAOYSA-N 0.000 description 1
- BWCDLEQTELFBAW-UHFFFAOYSA-N 3h-dioxazole Chemical compound N1OOC=C1 BWCDLEQTELFBAW-UHFFFAOYSA-N 0.000 description 1
- QCQCHGYLTSGIGX-GHXANHINSA-N 4-[[(3ar,5ar,5br,7ar,9s,11ar,11br,13as)-5a,5b,8,8,11a-pentamethyl-3a-[(5-methylpyridine-3-carbonyl)amino]-2-oxo-1-propan-2-yl-4,5,6,7,7a,9,10,11,11b,12,13,13a-dodecahydro-3h-cyclopenta[a]chrysen-9-yl]oxy]-2,2-dimethyl-4-oxobutanoic acid Chemical compound N([C@@]12CC[C@@]3(C)[C@]4(C)CC[C@H]5C(C)(C)[C@@H](OC(=O)CC(C)(C)C(O)=O)CC[C@]5(C)[C@H]4CC[C@@H]3C1=C(C(C2)=O)C(C)C)C(=O)C1=CN=CC(C)=C1 QCQCHGYLTSGIGX-GHXANHINSA-N 0.000 description 1
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 1
- JJTUDXZGHPGLLC-IMJSIDKUSA-N 4511-42-6 Chemical compound C[C@@H]1OC(=O)[C@H](C)OC1=O JJTUDXZGHPGLLC-IMJSIDKUSA-N 0.000 description 1
- UCZQXJKDCHCTAI-UHFFFAOYSA-N 4h-1,3-dioxine Chemical compound C1OCC=CO1 UCZQXJKDCHCTAI-UHFFFAOYSA-N 0.000 description 1
- BYVSMDBDTBXASR-UHFFFAOYSA-N 5,6-dihydro-4h-oxazine Chemical compound C1CON=CC1 BYVSMDBDTBXASR-UHFFFAOYSA-N 0.000 description 1
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 1
- SPBDXSGPUHCETR-JFUDTMANSA-N 8883yp2r6d Chemical compound O1[C@@H](C)[C@H](O)[C@@H](OC)C[C@@H]1O[C@@H]1[C@@H](OC)C[C@H](O[C@@H]2C(=C/C[C@@H]3C[C@@H](C[C@@]4(O[C@@H]([C@@H](C)CC4)C(C)C)O3)OC(=O)[C@@H]3C=C(C)[C@@H](O)[C@H]4OC\C([C@@]34O)=C/C=C/[C@@H]2C)/C)O[C@H]1C.C1C[C@H](C)[C@@H]([C@@H](C)CC)O[C@@]21O[C@H](C\C=C(C)\[C@@H](O[C@@H]1O[C@@H](C)[C@H](O[C@@H]3O[C@@H](C)[C@H](O)[C@@H](OC)C3)[C@@H](OC)C1)[C@@H](C)\C=C\C=C/1[C@]3([C@H](C(=O)O4)C=C(C)[C@@H](O)[C@H]3OC\1)O)C[C@H]4C2 SPBDXSGPUHCETR-JFUDTMANSA-N 0.000 description 1
- GSDSWSVVBLHKDQ-UHFFFAOYSA-N 9-fluoro-3-methyl-10-(4-methylpiperazin-1-yl)-7-oxo-2,3-dihydro-7H-[1,4]oxazino[2,3,4-ij]quinoline-6-carboxylic acid Chemical compound FC1=CC(C(C(C(O)=O)=C2)=O)=C3N2C(C)COC3=C1N1CCN(C)CC1 GSDSWSVVBLHKDQ-UHFFFAOYSA-N 0.000 description 1
- 206010063409 Acarodermatitis Diseases 0.000 description 1
- 206010002091 Anaesthesia Diseases 0.000 description 1
- 101710129690 Angiotensin-converting enzyme inhibitor Proteins 0.000 description 1
- WZPBZJONDBGPKJ-UHFFFAOYSA-N Antibiotic SQ 26917 Natural products O=C1N(S(O)(=O)=O)C(C)C1NC(=O)C(=NOC(C)(C)C(O)=O)C1=CSC(N)=N1 WZPBZJONDBGPKJ-UHFFFAOYSA-N 0.000 description 1
- 229930003347 Atropine Natural products 0.000 description 1
- 239000005528 B01AC05 - Ticlopidine Substances 0.000 description 1
- KPYSYYIEGFHWSV-UHFFFAOYSA-N Baclofen Chemical compound OC(=O)CC(CN)C1=CC=C(Cl)C=C1 KPYSYYIEGFHWSV-UHFFFAOYSA-N 0.000 description 1
- KYNSBQPICQTCGU-UHFFFAOYSA-N Benzopyrane Chemical compound C1=CC=C2C=CCOC2=C1 KYNSBQPICQTCGU-UHFFFAOYSA-N 0.000 description 1
- 229920002498 Beta-glucan Polymers 0.000 description 1
- 102000007350 Bone Morphogenetic Proteins Human genes 0.000 description 1
- 108010007726 Bone Morphogenetic Proteins Proteins 0.000 description 1
- 101710086378 Bradykinin-potentiating and C-type natriuretic peptides Proteins 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 229940122072 Carbonic anhydrase inhibitor Drugs 0.000 description 1
- 229930186147 Cephalosporin Natural products 0.000 description 1
- GHXZTYHSJHQHIJ-UHFFFAOYSA-N Chlorhexidine Chemical compound C=1C=C(Cl)C=CC=1NC(N)=NC(N)=NCCCCCCN=C(N)N=C(N)NC1=CC=C(Cl)C=C1 GHXZTYHSJHQHIJ-UHFFFAOYSA-N 0.000 description 1
- DBAKFASWICGISY-BTJKTKAUSA-N Chlorpheniramine maleate Chemical compound OC(=O)\C=C/C(O)=O.C=1C=CC=NC=1C(CCN(C)C)C1=CC=C(Cl)C=C1 DBAKFASWICGISY-BTJKTKAUSA-N 0.000 description 1
- 229940122041 Cholinesterase inhibitor Drugs 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- GJSURZIOUXUGAL-UHFFFAOYSA-N Clonidine Chemical compound ClC1=CC=CC(Cl)=C1NC1=NCCN1 GJSURZIOUXUGAL-UHFFFAOYSA-N 0.000 description 1
- 102000008186 Collagen Human genes 0.000 description 1
- 108010035532 Collagen Proteins 0.000 description 1
- MFYSYFVPBJMHGN-ZPOLXVRWSA-N Cortisone Chemical compound O=C1CC[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 MFYSYFVPBJMHGN-ZPOLXVRWSA-N 0.000 description 1
- MFYSYFVPBJMHGN-UHFFFAOYSA-N Cortisone Natural products O=C1CCC2(C)C3C(=O)CC(C)(C(CC4)(O)C(=O)CO)C4C3CCC2=C1 MFYSYFVPBJMHGN-UHFFFAOYSA-N 0.000 description 1
- ZZZCUOFIHGPKAK-UHFFFAOYSA-N D-erythro-ascorbic acid Natural products OCC1OC(=O)C(O)=C1O ZZZCUOFIHGPKAK-UHFFFAOYSA-N 0.000 description 1
- 108010000437 Deamino Arginine Vasopressin Proteins 0.000 description 1
- 102000016911 Deoxyribonucleases Human genes 0.000 description 1
- 108010053770 Deoxyribonucleases Proteins 0.000 description 1
- XIQVNETUBQGFHX-UHFFFAOYSA-N Ditropan Chemical compound C=1C=CC=CC=1C(O)(C(=O)OCC#CCN(CC)CC)C1CCCCC1 XIQVNETUBQGFHX-UHFFFAOYSA-N 0.000 description 1
- KBAUFVUYFNWQFM-UHFFFAOYSA-N Doxylamine succinate Chemical compound OC(=O)CCC(O)=O.C=1C=CC=NC=1C(C)(OCCN(C)C)C1=CC=CC=C1 KBAUFVUYFNWQFM-UHFFFAOYSA-N 0.000 description 1
- 108010061435 Enalapril Proteins 0.000 description 1
- XRHVZWWRFMCBAZ-UHFFFAOYSA-L Endothal-disodium Chemical compound [Na+].[Na+].C1CC2C(C([O-])=O)C(C(=O)[O-])C1O2 XRHVZWWRFMCBAZ-UHFFFAOYSA-L 0.000 description 1
- 102000003951 Erythropoietin Human genes 0.000 description 1
- 102100031939 Erythropoietin Human genes 0.000 description 1
- 108090000394 Erythropoietin Proteins 0.000 description 1
- UOACKFBJUYNSLK-XRKIENNPSA-N Estradiol Cypionate Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H](C4=CC=C(O)C=C4CC3)CC[C@@]21C)C(=O)CCC1CCCC1 UOACKFBJUYNSLK-XRKIENNPSA-N 0.000 description 1
- RSEPBGGWRJCQGY-RBRWEJTLSA-N Estradiol valerate Chemical compound C1CC2=CC(O)=CC=C2[C@@H]2[C@@H]1[C@@H]1CC[C@H](OC(=O)CCCC)[C@@]1(C)CC2 RSEPBGGWRJCQGY-RBRWEJTLSA-N 0.000 description 1
- DNXHEGUUPJUMQT-CBZIJGRNSA-N Estrone Chemical compound OC1=CC=C2[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CCC2=C1 DNXHEGUUPJUMQT-CBZIJGRNSA-N 0.000 description 1
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 1
- 239000005977 Ethylene Substances 0.000 description 1
- 108010029961 Filgrastim Proteins 0.000 description 1
- HEMJJKBWTPKOJG-UHFFFAOYSA-N Gemfibrozil Chemical compound CC1=CC=C(C)C(OCCCC(C)(C)C(O)=O)=C1 HEMJJKBWTPKOJG-UHFFFAOYSA-N 0.000 description 1
- CEAZRRDELHUEMR-URQXQFDESA-N Gentamicin Chemical compound O1[C@H](C(C)NC)CC[C@@H](N)[C@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](NC)[C@@](C)(O)CO2)O)[C@H](N)C[C@@H]1N CEAZRRDELHUEMR-URQXQFDESA-N 0.000 description 1
- 229930182566 Gentamicin Natural products 0.000 description 1
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 1
- 102000001554 Hemoglobins Human genes 0.000 description 1
- 108010054147 Hemoglobins Proteins 0.000 description 1
- 101000741445 Homo sapiens Calcitonin Proteins 0.000 description 1
- 241000713772 Human immunodeficiency virus 1 Species 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- RKUNBYITZUJHSG-UHFFFAOYSA-N Hyosciamin-hydrochlorid Natural products CN1C(C2)CCC1CC2OC(=O)C(CO)C1=CC=CC=C1 RKUNBYITZUJHSG-UHFFFAOYSA-N 0.000 description 1
- 206010051364 Hyperuricosuria Diseases 0.000 description 1
- 208000013016 Hypoglycemia Diseases 0.000 description 1
- 206010021118 Hypotonia Diseases 0.000 description 1
- 108010005716 Interferon beta-1a Proteins 0.000 description 1
- 108010063738 Interleukins Proteins 0.000 description 1
- 102000015696 Interleukins Human genes 0.000 description 1
- LPHGQDQBBGAPDZ-UHFFFAOYSA-N Isocaffeine Natural products CN1C(=O)N(C)C(=O)C2=C1N(C)C=N2 LPHGQDQBBGAPDZ-UHFFFAOYSA-N 0.000 description 1
- RRHGJUQNOFWUDK-UHFFFAOYSA-N Isoprene Chemical group CC(=C)C=C RRHGJUQNOFWUDK-UHFFFAOYSA-N 0.000 description 1
- SHGAZHPCJJPHSC-NUEINMDLSA-N Isotretinoin Chemical compound OC(=O)C=C(C)/C=C/C=C(C)C=CC1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-NUEINMDLSA-N 0.000 description 1
- UETNIIAIRMUTSM-UHFFFAOYSA-N Jacareubin Natural products CC1(C)OC2=CC3Oc4c(O)c(O)ccc4C(=O)C3C(=C2C=C1)O UETNIIAIRMUTSM-UHFFFAOYSA-N 0.000 description 1
- XUIIKFGFIJCVMT-LBPRGKRZSA-N L-thyroxine Chemical compound IC1=CC(C[C@H]([NH3+])C([O-])=O)=CC(I)=C1OC1=CC(I)=C(O)C(I)=C1 XUIIKFGFIJCVMT-LBPRGKRZSA-N 0.000 description 1
- 208000007914 Labor Pain Diseases 0.000 description 1
- 208000035945 Labour pain Diseases 0.000 description 1
- 108010062867 Lenograstim Proteins 0.000 description 1
- 108010073521 Luteinizing Hormone Proteins 0.000 description 1
- 102000009151 Luteinizing Hormone Human genes 0.000 description 1
- 231100000002 MTT assay Toxicity 0.000 description 1
- 238000000134 MTT assay Methods 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 241000270711 Malaclemys terrapin Species 0.000 description 1
- OCJYIGYOJCODJL-UHFFFAOYSA-N Meclizine Chemical compound CC1=CC=CC(CN2CCN(CC2)C(C=2C=CC=CC=2)C=2C=CC(Cl)=CC=2)=C1 OCJYIGYOJCODJL-UHFFFAOYSA-N 0.000 description 1
- 108010057021 Menotropins Proteins 0.000 description 1
- 229930192392 Mitomycin Natural products 0.000 description 1
- PCZOHLXUXFIOCF-UHFFFAOYSA-N Monacolin X Natural products C12C(OC(=O)C(C)CC)CC(C)C=C2C=CC(C)C1CCC1CC(O)CC(=O)O1 PCZOHLXUXFIOCF-UHFFFAOYSA-N 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- UQOFGTXDASPNLL-XHNCKOQMSA-N Muscarine Chemical compound C[C@@H]1O[C@H](C[N+](C)(C)C)C[C@H]1O UQOFGTXDASPNLL-XHNCKOQMSA-N 0.000 description 1
- 229940121948 Muscarinic receptor antagonist Drugs 0.000 description 1
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 1
- KEECCEWTUVWFCV-UHFFFAOYSA-N N-acetylprocainamide Chemical compound CCN(CC)CCNC(=O)C1=CC=C(NC(C)=O)C=C1 KEECCEWTUVWFCV-UHFFFAOYSA-N 0.000 description 1
- 238000005481 NMR spectroscopy Methods 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- 108010021717 Nafarelin Proteins 0.000 description 1
- CMWTZPSULFXXJA-UHFFFAOYSA-N Naproxen Natural products C1=C(C(C)C(O)=O)C=CC2=CC(OC)=CC=C21 CMWTZPSULFXXJA-UHFFFAOYSA-N 0.000 description 1
- 238000011887 Necropsy Methods 0.000 description 1
- 229930193140 Neomycin Natural products 0.000 description 1
- 239000000866 Neuromuscular Agent Substances 0.000 description 1
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical compound OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- MHABMANUFPZXEB-UHFFFAOYSA-N O-demethyl-aloesaponarin I Natural products O=C1C2=CC=CC(O)=C2C(=O)C2=C1C=C(O)C(C(O)=O)=C2C MHABMANUFPZXEB-UHFFFAOYSA-N 0.000 description 1
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical compound C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 description 1
- 102400000050 Oxytocin Human genes 0.000 description 1
- 101800000989 Oxytocin Proteins 0.000 description 1
- XNOPRXBHLZRZKH-UHFFFAOYSA-N Oxytocin Natural products N1C(=O)C(N)CSSCC(C(=O)N2C(CCC2)C(=O)NC(CC(C)C)C(=O)NCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(CCC(N)=O)NC(=O)C(C(C)CC)NC(=O)C1CC1=CC=C(O)C=C1 XNOPRXBHLZRZKH-UHFFFAOYSA-N 0.000 description 1
- 108010019160 Pancreatin Proteins 0.000 description 1
- 108010067035 Pancrelipase Proteins 0.000 description 1
- 229930195708 Penicillin V Natural products 0.000 description 1
- 208000004052 Peritoneal Panniculitis Diseases 0.000 description 1
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 description 1
- CXOFVDLJLONNDW-UHFFFAOYSA-N Phenytoin Chemical compound N1C(=O)NC(=O)C1(C=1C=CC=CC=1)C1=CC=CC=C1 CXOFVDLJLONNDW-UHFFFAOYSA-N 0.000 description 1
- 229920000504 Poly[(lactide-co-ethylene glycol)-co-ethyloxyphosphate] Polymers 0.000 description 1
- 229920002594 Polyethylene Glycol 8000 Polymers 0.000 description 1
- 229920000954 Polyglycolide Polymers 0.000 description 1
- 229920001710 Polyorthoester Polymers 0.000 description 1
- TUZYXOIXSAXUGO-UHFFFAOYSA-N Pravastatin Natural products C1=CC(C)C(CCC(O)CC(O)CC(O)=O)C2C(OC(=O)C(C)CC)CC(O)C=C21 TUZYXOIXSAXUGO-UHFFFAOYSA-N 0.000 description 1
- MWQCHHACWWAQLJ-UHFFFAOYSA-N Prazepam Chemical compound O=C1CN=C(C=2C=CC=CC=2)C2=CC(Cl)=CC=C2N1CC1CC1 MWQCHHACWWAQLJ-UHFFFAOYSA-N 0.000 description 1
- 208000003251 Pruritus Diseases 0.000 description 1
- 208000028017 Psychotic disease Diseases 0.000 description 1
- CVQUWLDCFXOXEN-UHFFFAOYSA-N Pyran-4-one Chemical compound O=C1C=COC=C1 CVQUWLDCFXOXEN-UHFFFAOYSA-N 0.000 description 1
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 1
- RVOLLAQWKVFTGE-UHFFFAOYSA-N Pyridostigmine Chemical compound CN(C)C(=O)OC1=CC=C[N+](C)=C1 RVOLLAQWKVFTGE-UHFFFAOYSA-N 0.000 description 1
- 102000006382 Ribonucleases Human genes 0.000 description 1
- 108010083644 Ribonucleases Proteins 0.000 description 1
- FTALBRSUTCGOEG-UHFFFAOYSA-N Riluzole Chemical compound C1=C(OC(F)(F)F)C=C2SC(N)=NC2=C1 FTALBRSUTCGOEG-UHFFFAOYSA-N 0.000 description 1
- QCHFTSOMWOSFHM-UHFFFAOYSA-N SJ000285536 Natural products C1OC(=O)C(CC)C1CC1=CN=CN1C QCHFTSOMWOSFHM-UHFFFAOYSA-N 0.000 description 1
- 241000447727 Scabies Species 0.000 description 1
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 1
- 102000005157 Somatostatin Human genes 0.000 description 1
- 108010056088 Somatostatin Proteins 0.000 description 1
- 239000004147 Sorbitan trioleate Substances 0.000 description 1
- 229940123317 Sulfonamide antibiotic Drugs 0.000 description 1
- 229940100389 Sulfonylurea Drugs 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- 102000019197 Superoxide Dismutase Human genes 0.000 description 1
- 108010012715 Superoxide dismutase Proteins 0.000 description 1
- 229920001963 Synthetic biodegradable polymer Polymers 0.000 description 1
- KKEYFWRCBNTPAC-UHFFFAOYSA-N Terephthalic acid Chemical compound OC(=O)C1=CC=C(C(O)=O)C=C1 KKEYFWRCBNTPAC-UHFFFAOYSA-N 0.000 description 1
- 241001122767 Theaceae Species 0.000 description 1
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical compound C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 description 1
- WKDDRNSBRWANNC-UHFFFAOYSA-N Thienamycin Natural products C1C(SCCN)=C(C(O)=O)N2C(=O)C(C(O)C)C21 WKDDRNSBRWANNC-UHFFFAOYSA-N 0.000 description 1
- 108010078233 Thymalfasin Proteins 0.000 description 1
- 102400000800 Thymosin alpha-1 Human genes 0.000 description 1
- 102000011923 Thyrotropin Human genes 0.000 description 1
- 108010061174 Thyrotropin Proteins 0.000 description 1
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 1
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 1
- FNYLWPVRPXGIIP-UHFFFAOYSA-N Triamterene Chemical compound NC1=NC2=NC(N)=NC(N)=C2N=C1C1=CC=CC=C1 FNYLWPVRPXGIIP-UHFFFAOYSA-N 0.000 description 1
- 229940123445 Tricyclic antidepressant Drugs 0.000 description 1
- HWHLPVGTWGOCJO-UHFFFAOYSA-N Trihexyphenidyl Chemical group C1CCCCC1C(C=1C=CC=CC=1)(O)CCN1CCCCC1 HWHLPVGTWGOCJO-UHFFFAOYSA-N 0.000 description 1
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 1
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 1
- 208000025865 Ulcer Diseases 0.000 description 1
- GXBMIBRIOWHPDT-UHFFFAOYSA-N Vasopressin Natural products N1C(=O)C(CC=2C=C(O)C=CC=2)NC(=O)C(N)CSSCC(C(=O)N2C(CCC2)C(=O)NC(CCCN=C(N)N)C(=O)NCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(CCC(N)=O)NC(=O)C1CC1=CC=CC=C1 GXBMIBRIOWHPDT-UHFFFAOYSA-N 0.000 description 1
- 108010004977 Vasopressins Proteins 0.000 description 1
- 102000002852 Vasopressins Human genes 0.000 description 1
- FPIPGXGPPPQFEQ-BOOMUCAASA-N Vitamin A Natural products OC/C=C(/C)\C=C\C=C(\C)/C=C/C1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-BOOMUCAASA-N 0.000 description 1
- 229930003268 Vitamin C Natural products 0.000 description 1
- 229930003427 Vitamin E Natural products 0.000 description 1
- 229930003448 Vitamin K Natural products 0.000 description 1
- 238000012084 abdominal surgery Methods 0.000 description 1
- 206010000210 abortion Diseases 0.000 description 1
- 231100000176 abortion Toxicity 0.000 description 1
- 229960004150 aciclovir Drugs 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 239000002535 acidifier Substances 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 210000000577 adipose tissue Anatomy 0.000 description 1
- 230000001919 adrenal effect Effects 0.000 description 1
- 239000000048 adrenergic agonist Substances 0.000 description 1
- 239000003463 adsorbent Substances 0.000 description 1
- 238000012382 advanced drug delivery Methods 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 108700025316 aldesleukin Proteins 0.000 description 1
- 150000001335 aliphatic alkanes Chemical class 0.000 description 1
- 229920003232 aliphatic polyester Polymers 0.000 description 1
- 229930013930 alkaloid Natural products 0.000 description 1
- 150000001336 alkenes Chemical class 0.000 description 1
- 150000001345 alkine derivatives Chemical class 0.000 description 1
- 125000002355 alkine group Chemical group 0.000 description 1
- 230000029936 alkylation Effects 0.000 description 1
- 238000005804 alkylation reaction Methods 0.000 description 1
- FPIPGXGPPPQFEQ-OVSJKPMPSA-N all-trans-retinol Chemical compound OC\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-OVSJKPMPSA-N 0.000 description 1
- AKNNEGZIBPJZJG-UHFFFAOYSA-N alpha-noscapine Natural products CN1CCC2=CC=3OCOC=3C(OC)=C2C1C1C2=CC=C(OC)C(OC)=C2C(=O)O1 AKNNEGZIBPJZJG-UHFFFAOYSA-N 0.000 description 1
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 1
- XSDQTOBWRPYKKA-UHFFFAOYSA-N amiloride Chemical compound NC(=N)NC(=O)C1=NC(Cl)=C(N)N=C1N XSDQTOBWRPYKKA-UHFFFAOYSA-N 0.000 description 1
- 229960002576 amiloride Drugs 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 239000002647 aminoglycoside antibiotic agent Substances 0.000 description 1
- IYIKLHRQXLHMJQ-UHFFFAOYSA-N amiodarone Chemical compound CCCCC=1OC2=CC=CC=C2C=1C(=O)C1=CC(I)=C(OCCN(CC)CC)C(I)=C1 IYIKLHRQXLHMJQ-UHFFFAOYSA-N 0.000 description 1
- 229960005260 amiodarone Drugs 0.000 description 1
- 235000019270 ammonium chloride Nutrition 0.000 description 1
- 229960002105 amrinone Drugs 0.000 description 1
- RNLQIBCLLYYYFJ-UHFFFAOYSA-N amrinone Chemical compound N1C(=O)C(N)=CC(C=2C=CN=CC=2)=C1 RNLQIBCLLYYYFJ-UHFFFAOYSA-N 0.000 description 1
- 229940124325 anabolic agent Drugs 0.000 description 1
- 239000003263 anabolic agent Substances 0.000 description 1
- 229940030486 androgens Drugs 0.000 description 1
- 208000007502 anemia Diseases 0.000 description 1
- 229940035674 anesthetics Drugs 0.000 description 1
- 150000001448 anilines Chemical class 0.000 description 1
- 239000011952 anionic catalyst Substances 0.000 description 1
- 230000000507 anthelmentic effect Effects 0.000 description 1
- 229940124339 anthelmintic agent Drugs 0.000 description 1
- 239000000921 anthelmintic agent Substances 0.000 description 1
- 125000002178 anthracenyl group Chemical group C1(=CC=CC2=CC3=CC=CC=C3C=C12)* 0.000 description 1
- 125000005427 anthranyl group Chemical group 0.000 description 1
- 230000001458 anti-acid effect Effects 0.000 description 1
- 230000002280 anti-androgenic effect Effects 0.000 description 1
- 230000001088 anti-asthma Effects 0.000 description 1
- 229940124599 anti-inflammatory drug Drugs 0.000 description 1
- 230000000845 anti-microbial effect Effects 0.000 description 1
- 230000001355 anti-mycobacterial effect Effects 0.000 description 1
- 239000000883 anti-obesity agent Substances 0.000 description 1
- 230000000798 anti-retroviral effect Effects 0.000 description 1
- 230000002421 anti-septic effect Effects 0.000 description 1
- 230000002365 anti-tubercular Effects 0.000 description 1
- 239000000051 antiandrogen Substances 0.000 description 1
- 229940030495 antiandrogen sex hormone and modulator of the genital system Drugs 0.000 description 1
- 239000000924 antiasthmatic agent Substances 0.000 description 1
- 229940052651 anticholinergic tertiary amines Drugs 0.000 description 1
- 239000003472 antidiabetic agent Substances 0.000 description 1
- 229940125714 antidiarrheal agent Drugs 0.000 description 1
- 229940075522 antidotes Drugs 0.000 description 1
- 230000000890 antigenic effect Effects 0.000 description 1
- 229960002708 antigout preparations Drugs 0.000 description 1
- 239000002282 antimigraine agent Substances 0.000 description 1
- 229940125684 antimigraine agent Drugs 0.000 description 1
- 229940125710 antiobesity agent Drugs 0.000 description 1
- 229940125688 antiparkinson agent Drugs 0.000 description 1
- 229940125716 antipyretic agent Drugs 0.000 description 1
- 229940124522 antiretrovirals Drugs 0.000 description 1
- 239000003903 antiretrovirus agent Substances 0.000 description 1
- 229960004676 antithrombotic agent Drugs 0.000 description 1
- 239000003200 antithyroid agent Substances 0.000 description 1
- 229940043671 antithyroid preparations Drugs 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 230000002763 arrhythmic effect Effects 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 229960003159 atovaquone Drugs 0.000 description 1
- RKUNBYITZUJHSG-SPUOUPEWSA-N atropine Chemical compound O([C@H]1C[C@H]2CC[C@@H](C1)N2C)C(=O)C(CO)C1=CC=CC=C1 RKUNBYITZUJHSG-SPUOUPEWSA-N 0.000 description 1
- 229960000396 atropine Drugs 0.000 description 1
- 210000003050 axon Anatomy 0.000 description 1
- XYOVOXDWRFGKEX-UHFFFAOYSA-N azepine Chemical compound N1C=CC=CC=C1 XYOVOXDWRFGKEX-UHFFFAOYSA-N 0.000 description 1
- 229960004099 azithromycin Drugs 0.000 description 1
- MQTOSJVFKKJCRP-BICOPXKESA-N azithromycin Chemical compound O([C@@H]1[C@@H](C)C(=O)O[C@@H]([C@@]([C@H](O)[C@@H](C)N(C)C[C@H](C)C[C@@](C)(O)[C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)O)[C@H]1C)(C)O)CC)[C@H]1C[C@@](C)(OC)[C@@H](O)[C@H](C)O1 MQTOSJVFKKJCRP-BICOPXKESA-N 0.000 description 1
- 229960003644 aztreonam Drugs 0.000 description 1
- 229960000794 baclofen Drugs 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 229940092705 beclomethasone Drugs 0.000 description 1
- NBMKJKDGKREAPL-DVTGEIKXSA-N beclomethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(Cl)[C@@H]1[C@@H]1C[C@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O NBMKJKDGKREAPL-DVTGEIKXSA-N 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- RFRXIWQYSOIBDI-UHFFFAOYSA-N benzarone Chemical compound CCC=1OC2=CC=CC=C2C=1C(=O)C1=CC=C(O)C=C1 RFRXIWQYSOIBDI-UHFFFAOYSA-N 0.000 description 1
- GIJXKZJWITVLHI-PMOLBWCYSA-N benzatropine Chemical compound O([C@H]1C[C@H]2CC[C@@H](C1)N2C)C(C=1C=CC=CC=1)C1=CC=CC=C1 GIJXKZJWITVLHI-PMOLBWCYSA-N 0.000 description 1
- 229960001081 benzatropine Drugs 0.000 description 1
- 229960005274 benzocaine Drugs 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000008512 biological response Effects 0.000 description 1
- 229960001561 bleomycin Drugs 0.000 description 1
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 1
- 229960004395 bleomycin sulfate Drugs 0.000 description 1
- 229920001400 block copolymer Polymers 0.000 description 1
- 239000002639 bone cement Substances 0.000 description 1
- 229940112869 bone morphogenetic protein Drugs 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- SXDBWCPKPHAZSM-UHFFFAOYSA-M bromate Inorganic materials [O-]Br(=O)=O SXDBWCPKPHAZSM-UHFFFAOYSA-M 0.000 description 1
- SXDBWCPKPHAZSM-UHFFFAOYSA-N bromic acid Chemical compound OBr(=O)=O SXDBWCPKPHAZSM-UHFFFAOYSA-N 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 239000004067 bulking agent Substances 0.000 description 1
- 229960001948 caffeine Drugs 0.000 description 1
- VJEONQKOZGKCAK-UHFFFAOYSA-N caffeine Natural products CN1C(=O)N(C)C(=O)C2=C1C=CN2C VJEONQKOZGKCAK-UHFFFAOYSA-N 0.000 description 1
- 229960003773 calcitonin (salmon synthetic) Drugs 0.000 description 1
- GMRQFYUYWCNGIN-NKMMMXOESA-N calcitriol Chemical compound C1(/[C@@H]2CC[C@@H]([C@]2(CCC1)C)[C@@H](CCCC(C)(C)O)C)=C\C=C1\C[C@@H](O)C[C@H](O)C1=C GMRQFYUYWCNGIN-NKMMMXOESA-N 0.000 description 1
- 235000020964 calcitriol Nutrition 0.000 description 1
- 239000011612 calcitriol Substances 0.000 description 1
- 229960005084 calcitriol Drugs 0.000 description 1
- 238000007707 calorimetry Methods 0.000 description 1
- 229960000830 captopril Drugs 0.000 description 1
- FAKRSMQSSFJEIM-RQJHMYQMSA-N captopril Chemical compound SC[C@@H](C)C(=O)N1CCC[C@H]1C(O)=O FAKRSMQSSFJEIM-RQJHMYQMSA-N 0.000 description 1
- 229960000623 carbamazepine Drugs 0.000 description 1
- FFGPTBGBLSHEPO-UHFFFAOYSA-N carbamazepine Chemical compound C1=CC2=CC=CC=C2N(C(=O)N)C2=CC=CC=C21 FFGPTBGBLSHEPO-UHFFFAOYSA-N 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 239000003489 carbonate dehydratase inhibitor Substances 0.000 description 1
- 150000001733 carboxylic acid esters Chemical class 0.000 description 1
- 239000011951 cationic catalyst Substances 0.000 description 1
- 125000002091 cationic group Chemical group 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 229940083181 centrally acting adntiadrenergic agent methyldopa Drugs 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 229940124587 cephalosporin Drugs 0.000 description 1
- 150000001780 cephalosporins Chemical class 0.000 description 1
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 150000005829 chemical entities Chemical class 0.000 description 1
- 210000000038 chest Anatomy 0.000 description 1
- 229960005091 chloramphenicol Drugs 0.000 description 1
- WIIZWVCIJKGZOK-RKDXNWHRSA-N chloramphenicol Chemical compound ClC(Cl)C(=O)N[C@H](CO)[C@H](O)C1=CC=C([N+]([O-])=O)C=C1 WIIZWVCIJKGZOK-RKDXNWHRSA-N 0.000 description 1
- 229960003260 chlorhexidine Drugs 0.000 description 1
- 229960003677 chloroquine Drugs 0.000 description 1
- WHTVZRBIWZFKQO-UHFFFAOYSA-N chloroquine Natural products ClC1=CC=C2C(NC(C)CCCN(CC)CC)=CC=NC2=C1 WHTVZRBIWZFKQO-UHFFFAOYSA-N 0.000 description 1
- 229940046978 chlorpheniramine maleate Drugs 0.000 description 1
- 239000000812 cholinergic antagonist Substances 0.000 description 1
- OTAFHZMPRISVEM-UHFFFAOYSA-N chromone Chemical compound C1=CC=C2C(=O)C=COC2=C1 OTAFHZMPRISVEM-UHFFFAOYSA-N 0.000 description 1
- LOUPRKONTZGTKE-UHFFFAOYSA-N cinchonine Natural products C1C(C(C2)C=C)CCN2C1C(O)C1=CC=NC2=CC=C(OC)C=C21 LOUPRKONTZGTKE-UHFFFAOYSA-N 0.000 description 1
- YNNUSGIPVFPVBX-NHCUHLMSSA-N clemastine Chemical compound CN1CCC[C@@H]1CCO[C@@](C)(C=1C=CC(Cl)=CC=1)C1=CC=CC=C1 YNNUSGIPVFPVBX-NHCUHLMSSA-N 0.000 description 1
- 229960002881 clemastine Drugs 0.000 description 1
- 229960002227 clindamycin Drugs 0.000 description 1
- KDLRVYVGXIQJDK-AWPVFWJPSA-N clindamycin Chemical compound CN1C[C@H](CCC)C[C@H]1C(=O)N[C@H]([C@H](C)Cl)[C@@H]1[C@H](O)[C@H](O)[C@@H](O)[C@@H](SC)O1 KDLRVYVGXIQJDK-AWPVFWJPSA-N 0.000 description 1
- KNHUKKLJHYUCFP-UHFFFAOYSA-N clofibrate Chemical compound CCOC(=O)C(C)(C)OC1=CC=C(Cl)C=C1 KNHUKKLJHYUCFP-UHFFFAOYSA-N 0.000 description 1
- GKIRPKYJQBWNGO-OCEACIFDSA-N clomifene Chemical compound C1=CC(OCCN(CC)CC)=CC=C1C(\C=1C=CC=CC=1)=C(\Cl)C1=CC=CC=C1 GKIRPKYJQBWNGO-OCEACIFDSA-N 0.000 description 1
- 229960003608 clomifene Drugs 0.000 description 1
- 229960002896 clonidine Drugs 0.000 description 1
- 229960004170 clozapine Drugs 0.000 description 1
- QZUDBNBUXVUHMW-UHFFFAOYSA-N clozapine Chemical compound C1CN(C)CCN1C1=NC2=CC(Cl)=CC=C2NC2=CC=CC=C12 QZUDBNBUXVUHMW-UHFFFAOYSA-N 0.000 description 1
- 229960004415 codeine phosphate Drugs 0.000 description 1
- 229960003871 codeine sulfate Drugs 0.000 description 1
- 229920001436 collagen Polymers 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 238000000748 compression moulding Methods 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 238000009833 condensation Methods 0.000 description 1
- 230000005494 condensation Effects 0.000 description 1
- 238000006482 condensation reaction Methods 0.000 description 1
- 229940035811 conjugated estrogen Drugs 0.000 description 1
- 239000000599 controlled substance Substances 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 238000007334 copolymerization reaction Methods 0.000 description 1
- 239000003218 coronary vasodilator agent Substances 0.000 description 1
- 229960004544 cortisone Drugs 0.000 description 1
- ZYGHJZDHTFUPRJ-UHFFFAOYSA-N coumarin Chemical compound C1=CC=C2OC(=O)C=CC2=C1 ZYGHJZDHTFUPRJ-UHFFFAOYSA-N 0.000 description 1
- 229960000956 coumarin Drugs 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 229920006037 cross link polymer Polymers 0.000 description 1
- 150000003983 crown ethers Chemical class 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 230000001186 cumulative effect Effects 0.000 description 1
- 229960002104 cyanocobalamin Drugs 0.000 description 1
- 235000000639 cyanocobalamin Nutrition 0.000 description 1
- 239000011666 cyanocobalamin Substances 0.000 description 1
- 150000001923 cyclic compounds Chemical class 0.000 description 1
- 150000001924 cycloalkanes Chemical class 0.000 description 1
- JURKNVYFZMSNLP-UHFFFAOYSA-N cyclobenzaprine Chemical compound C1=CC2=CC=CC=C2C(=CCCN(C)C)C2=CC=CC=C21 JURKNVYFZMSNLP-UHFFFAOYSA-N 0.000 description 1
- 229960003572 cyclobenzaprine Drugs 0.000 description 1
- 239000002254 cytotoxic agent Substances 0.000 description 1
- 231100000599 cytotoxic agent Toxicity 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 229940124581 decongestants Drugs 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 238000007033 dehydrochlorination reaction Methods 0.000 description 1
- 229940000033 dermatological agent Drugs 0.000 description 1
- 239000003241 dermatological agent Substances 0.000 description 1
- NFLWUMRGJYTJIN-NXBWRCJVSA-N desmopressin Chemical compound C([C@H]1C(=O)N[C@H](C(N[C@@H](CC(N)=O)C(=O)N[C@@H](CSSCCC(=O)N[C@@H](CC=2C=CC(O)=CC=2)C(=O)N1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)NCC(N)=O)=O)CCC(=O)N)C1=CC=CC=C1 NFLWUMRGJYTJIN-NXBWRCJVSA-N 0.000 description 1
- 229960004281 desmopressin Drugs 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 239000000032 diagnostic agent Substances 0.000 description 1
- 229940039227 diagnostic agent Drugs 0.000 description 1
- WVPKAWVFTPWPDB-UHFFFAOYSA-M dichlorophosphinate Chemical compound [O-]P(Cl)(Cl)=O WVPKAWVFTPWPDB-UHFFFAOYSA-M 0.000 description 1
- RGLYKWWBQGJZGM-ISLYRVAYSA-N diethylstilbestrol Chemical compound C=1C=C(O)C=CC=1C(/CC)=C(\CC)C1=CC=C(O)C=C1 RGLYKWWBQGJZGM-ISLYRVAYSA-N 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- CZHYKKAKFWLGJO-UHFFFAOYSA-N dimethyl phosphite Chemical compound COP([O-])OC CZHYKKAKFWLGJO-UHFFFAOYSA-N 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 239000012153 distilled water Substances 0.000 description 1
- 229960002563 disulfiram Drugs 0.000 description 1
- 230000001882 diuretic effect Effects 0.000 description 1
- 229960003638 dopamine Drugs 0.000 description 1
- 229960004679 doxorubicin Drugs 0.000 description 1
- 229960003722 doxycycline Drugs 0.000 description 1
- 229960005008 doxylamine succinate Drugs 0.000 description 1
- BNFRJXLZYUTIII-UHFFFAOYSA-N efaproxiral Chemical compound CC1=CC(C)=CC(NC(=O)CC=2C=CC(OC(C)(C)C(O)=O)=CC=2)=C1 BNFRJXLZYUTIII-UHFFFAOYSA-N 0.000 description 1
- 239000003792 electrolyte Substances 0.000 description 1
- 239000002895 emetic Substances 0.000 description 1
- GBXSMTUPTTWBMN-XIRDDKMYSA-N enalapril Chemical compound C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(O)=O)CC1=CC=CC=C1 GBXSMTUPTTWBMN-XIRDDKMYSA-N 0.000 description 1
- 229960000873 enalapril Drugs 0.000 description 1
- 229960002179 ephedrine Drugs 0.000 description 1
- 229960005139 epinephrine Drugs 0.000 description 1
- 230000010437 erythropoiesis Effects 0.000 description 1
- 229940105423 erythropoietin Drugs 0.000 description 1
- 229960005309 estradiol Drugs 0.000 description 1
- 229930182833 estradiol Natural products 0.000 description 1
- 229960005416 estradiol cypionate Drugs 0.000 description 1
- 229960004766 estradiol valerate Drugs 0.000 description 1
- 229960003399 estrone Drugs 0.000 description 1
- XJELOQYISYPGDX-UHFFFAOYSA-N ethenyl 2-chloroacetate Chemical compound ClCC(=O)OC=C XJELOQYISYPGDX-UHFFFAOYSA-N 0.000 description 1
- 125000005677 ethinylene group Chemical group [*:2]C#C[*:1] 0.000 description 1
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 description 1
- QPMJENKZJUFOON-PLNGDYQASA-N ethyl (z)-3-chloro-2-cyano-4,4,4-trifluorobut-2-enoate Chemical compound CCOC(=O)C(\C#N)=C(/Cl)C(F)(F)F QPMJENKZJUFOON-PLNGDYQASA-N 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 229940066493 expectorants Drugs 0.000 description 1
- 238000001125 extrusion Methods 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 239000000835 fiber Substances 0.000 description 1
- 229960004177 filgrastim Drugs 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 229960004884 fluconazole Drugs 0.000 description 1
- RFHAOTPXVQNOHP-UHFFFAOYSA-N fluconazole Chemical compound C1=NC=NN1CC(C=1C(=CC(F)=CC=1)F)(O)CN1C=NC=N1 RFHAOTPXVQNOHP-UHFFFAOYSA-N 0.000 description 1
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 1
- 238000012921 fluorescence analysis Methods 0.000 description 1
- 229960002390 flurbiprofen Drugs 0.000 description 1
- SYTBZMRGLBWNTM-UHFFFAOYSA-N flurbiprofen Chemical compound FC1=CC(C(C(O)=O)C)=CC=C1C1=CC=CC=C1 SYTBZMRGLBWNTM-UHFFFAOYSA-N 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 239000003205 fragrance Substances 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- JKFAIQOWCVVSKC-UHFFFAOYSA-N furazan Chemical compound C=1C=NON=1 JKFAIQOWCVVSKC-UHFFFAOYSA-N 0.000 description 1
- 229960002870 gabapentin Drugs 0.000 description 1
- 208000001130 gallstones Diseases 0.000 description 1
- 108010074605 gamma-Globulins Proteins 0.000 description 1
- WIGCFUFOHFEKBI-UHFFFAOYSA-N gamma-tocopherol Natural products CC(C)CCCC(C)CCCC(C)CCCC1CCC2C(C)C(O)C(C)C(C)C2O1 WIGCFUFOHFEKBI-UHFFFAOYSA-N 0.000 description 1
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 1
- 229960005277 gemcitabine Drugs 0.000 description 1
- 229960003627 gemfibrozil Drugs 0.000 description 1
- 229940005494 general anesthetics Drugs 0.000 description 1
- 229960002518 gentamicin Drugs 0.000 description 1
- 230000009477 glass transition Effects 0.000 description 1
- YMAWOPBAYDPSLA-UHFFFAOYSA-N glycine anhydride Natural products [NH3+]CC(=O)NCC([O-])=O YMAWOPBAYDPSLA-UHFFFAOYSA-N 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- 150000002344 gold compounds Chemical class 0.000 description 1
- 230000003394 haemopoietic effect Effects 0.000 description 1
- 229960003878 haloperidol Drugs 0.000 description 1
- 230000002439 hemostatic effect Effects 0.000 description 1
- 125000005842 heteroatom Chemical group 0.000 description 1
- WQPDUTSPKFMPDP-OUMQNGNKSA-N hirudin Chemical compound C([C@@H](C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1C=CC(OS(O)(=O)=O)=CC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CCCCN)NC(=O)[C@H]1N(CCC1)C(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)CNC(=O)[C@@H](NC(=O)[C@@H](NC(=O)[C@H]1NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCC(O)=O)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)CNC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@@H]2CSSC[C@@H](C(=O)N[C@@H](CCC(O)=O)C(=O)NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@H](C(=O)N[C@H](C(NCC(=O)N[C@@H](CCC(N)=O)C(=O)NCC(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCCN)C(=O)N2)=O)CSSC1)C(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]1NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)CNC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=2C=CC(O)=CC=2)NC(=O)[C@@H](NC(=O)[C@@H](N)C(C)C)C(C)C)[C@@H](C)O)CSSC1)C(C)C)[C@@H](C)O)[C@@H](C)O)C1=CC=CC=C1 WQPDUTSPKFMPDP-OUMQNGNKSA-N 0.000 description 1
- 239000000938 histamine H1 antagonist Substances 0.000 description 1
- 238000007489 histopathology method Methods 0.000 description 1
- 229940045644 human calcitonin Drugs 0.000 description 1
- 229960002474 hydralazine Drugs 0.000 description 1
- 229960002003 hydrochlorothiazide Drugs 0.000 description 1
- 229960000890 hydrocortisone Drugs 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- 125000004356 hydroxy functional group Chemical group O* 0.000 description 1
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 1
- 201000001421 hyperglycemia Diseases 0.000 description 1
- 206010020718 hyperplasia Diseases 0.000 description 1
- 230000002218 hypoglycaemic effect Effects 0.000 description 1
- ZSKVGTPCRGIANV-ZXFLCMHBSA-N imipenem Chemical compound C1C(SCC\N=C\N)=C(C(O)=O)N2C(=O)[C@H]([C@H](O)C)[C@H]21 ZSKVGTPCRGIANV-ZXFLCMHBSA-N 0.000 description 1
- 229960002182 imipenem Drugs 0.000 description 1
- 230000002163 immunogen Effects 0.000 description 1
- 239000002955 immunomodulating agent Substances 0.000 description 1
- 229940121354 immunomodulator Drugs 0.000 description 1
- 229960003444 immunosuppressant agent Drugs 0.000 description 1
- 229940125721 immunosuppressive agent Drugs 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- PZOUSPYUWWUPPK-UHFFFAOYSA-N indole Natural products CC1=CC=CC2=C1C=CN2 PZOUSPYUWWUPPK-UHFFFAOYSA-N 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 208000027866 inflammatory disease Diseases 0.000 description 1
- 230000028709 inflammatory response Effects 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 238000001746 injection moulding Methods 0.000 description 1
- 229960004461 interferon beta-1a Drugs 0.000 description 1
- 229940047122 interleukins Drugs 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- QRXWMOHMRWLFEY-UHFFFAOYSA-N isoniazide Chemical compound NNC(=O)C1=CC=NC=C1 QRXWMOHMRWLFEY-UHFFFAOYSA-N 0.000 description 1
- JMMWKPVZQRWMSS-UHFFFAOYSA-N isopropanol acetate Natural products CC(C)OC(C)=O JMMWKPVZQRWMSS-UHFFFAOYSA-N 0.000 description 1
- 229940011051 isopropyl acetate Drugs 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- ZLTPDFXIESTBQG-UHFFFAOYSA-N isothiazole Chemical compound C=1C=NSC=1 ZLTPDFXIESTBQG-UHFFFAOYSA-N 0.000 description 1
- 229960005280 isotretinoin Drugs 0.000 description 1
- GWYFCOCPABKNJV-UHFFFAOYSA-N isovaleric acid Chemical compound CC(C)CC(O)=O GWYFCOCPABKNJV-UHFFFAOYSA-N 0.000 description 1
- 229960002418 ivermectin Drugs 0.000 description 1
- 238000005304 joining Methods 0.000 description 1
- 229960004125 ketoconazole Drugs 0.000 description 1
- 230000002147 killing effect Effects 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- JCQLYHFGKNRPGE-FCVZTGTOSA-N lactulose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 JCQLYHFGKNRPGE-FCVZTGTOSA-N 0.000 description 1
- 229960000511 lactulose Drugs 0.000 description 1
- PFCRQPBOOFTZGQ-UHFFFAOYSA-N lactulose keto form Natural products OCC(=O)C(O)C(C(O)CO)OC1OC(CO)C(O)C(O)C1O PFCRQPBOOFTZGQ-UHFFFAOYSA-N 0.000 description 1
- 229960001848 lamotrigine Drugs 0.000 description 1
- PYZRQGJRPPTADH-UHFFFAOYSA-N lamotrigine Chemical compound NC1=NC(N)=NN=C1C1=CC=CC(Cl)=C1Cl PYZRQGJRPPTADH-UHFFFAOYSA-N 0.000 description 1
- 150000002605 large molecules Chemical class 0.000 description 1
- 229960002618 lenograstim Drugs 0.000 description 1
- 229950008325 levothyroxine Drugs 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 238000002690 local anesthesia Methods 0.000 description 1
- 239000002171 loop diuretic Substances 0.000 description 1
- PCZOHLXUXFIOCF-BXMDZJJMSA-N lovastatin Chemical compound C([C@H]1[C@@H](C)C=CC2=C[C@H](C)C[C@@H]([C@H]12)OC(=O)[C@@H](C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 PCZOHLXUXFIOCF-BXMDZJJMSA-N 0.000 description 1
- 229960004844 lovastatin Drugs 0.000 description 1
- QLJODMDSTUBWDW-UHFFFAOYSA-N lovastatin hydroxy acid Natural products C1=CC(C)C(CCC(O)CC(O)CC(O)=O)C2C(OC(=O)C(C)CC)CC(C)C=C21 QLJODMDSTUBWDW-UHFFFAOYSA-N 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 229940040129 luteinizing hormone Drugs 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- VTHJTEIRLNZDEV-UHFFFAOYSA-L magnesium dihydroxide Chemical compound [OH-].[OH-].[Mg+2] VTHJTEIRLNZDEV-UHFFFAOYSA-L 0.000 description 1
- 239000000347 magnesium hydroxide Substances 0.000 description 1
- 229910001862 magnesium hydroxide Inorganic materials 0.000 description 1
- 108010000594 mecasermin Proteins 0.000 description 1
- 229960001311 mecasermin Drugs 0.000 description 1
- HAWPXGHAZFHHAD-UHFFFAOYSA-N mechlorethamine Chemical class ClCCN(C)CCCl HAWPXGHAZFHHAD-UHFFFAOYSA-N 0.000 description 1
- 229960004961 mechlorethamine Drugs 0.000 description 1
- 229960001474 meclozine Drugs 0.000 description 1
- 229960004616 medroxyprogesterone Drugs 0.000 description 1
- FRQMUZJSZHZSGN-HBNHAYAOSA-N medroxyprogesterone Chemical compound C([C@@]12C)CC(=O)C=C1[C@@H](C)C[C@@H]1[C@@H]2CC[C@]2(C)[C@@](O)(C(C)=O)CC[C@H]21 FRQMUZJSZHZSGN-HBNHAYAOSA-N 0.000 description 1
- DASQOOZCTWOQPA-GXKRWWSZSA-L methotrexate disodium Chemical compound [Na+].[Na+].C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC([O-])=O)C([O-])=O)C=C1 DASQOOZCTWOQPA-GXKRWWSZSA-L 0.000 description 1
- AYLRODJJLADBOB-QMMMGPOBSA-N methyl (2s)-2,6-diisocyanatohexanoate Chemical compound COC(=O)[C@@H](N=C=O)CCCCN=C=O AYLRODJJLADBOB-QMMMGPOBSA-N 0.000 description 1
- JEENWEAPRWGXSG-UHFFFAOYSA-N methyl 2-oxocyclohexane-1-carboxylate Chemical compound COC(=O)C1CCCCC1=O JEENWEAPRWGXSG-UHFFFAOYSA-N 0.000 description 1
- TTWJBBZEZQICBI-UHFFFAOYSA-N metoclopramide Chemical compound CCN(CC)CCNC(=O)C1=CC(Cl)=C(N)C=C1OC TTWJBBZEZQICBI-UHFFFAOYSA-N 0.000 description 1
- 229960004503 metoclopramide Drugs 0.000 description 1
- 229960003404 mexiletine Drugs 0.000 description 1
- 229960004023 minocycline Drugs 0.000 description 1
- 229960004857 mitomycin Drugs 0.000 description 1
- 239000012046 mixed solvent Substances 0.000 description 1
- AARXZCZYLAFQQU-UHFFFAOYSA-N motexafin gadolinium Chemical compound [Gd].CC(O)=O.CC(O)=O.C1=C([N-]2)C(CC)=C(CC)C2=CC(C(=C2C)CCCO)=NC2=CN=C2C=C(OCCOCCOCCOC)C(OCCOCCOCCOC)=CC2=NC=C2C(C)=C(CCCO)C1=N2 AARXZCZYLAFQQU-UHFFFAOYSA-N 0.000 description 1
- 229940066491 mucolytics Drugs 0.000 description 1
- 210000004400 mucous membrane Anatomy 0.000 description 1
- 210000003097 mucus Anatomy 0.000 description 1
- 229960003128 mupirocin Drugs 0.000 description 1
- 229930187697 mupirocin Natural products 0.000 description 1
- 230000036640 muscle relaxation Effects 0.000 description 1
- 230000003387 muscular Effects 0.000 description 1
- 239000002637 mydriatic agent Substances 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- VWPOSFSPZNDTMJ-UCWKZMIHSA-N nadolol Chemical compound C1[C@@H](O)[C@@H](O)CC2=C1C=CC=C2OCC(O)CNC(C)(C)C VWPOSFSPZNDTMJ-UCWKZMIHSA-N 0.000 description 1
- 229960004255 nadolol Drugs 0.000 description 1
- RWHUEXWOYVBUCI-ITQXDASVSA-N nafarelin Chemical compound C([C@@H](C(=O)N[C@H](CC=1C=C2C=CC=CC2=CC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N1[C@@H](CCC1)C(=O)NCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 RWHUEXWOYVBUCI-ITQXDASVSA-N 0.000 description 1
- 229960002333 nafarelin Drugs 0.000 description 1
- 229960000515 nafcillin Drugs 0.000 description 1
- GPXLMGHLHQJAGZ-JTDSTZFVSA-N nafcillin Chemical compound C1=CC=CC2=C(C(=O)N[C@@H]3C(N4[C@H](C(C)(C)S[C@@H]43)C(O)=O)=O)C(OCC)=CC=C21 GPXLMGHLHQJAGZ-JTDSTZFVSA-N 0.000 description 1
- DQCKKXVULJGBQN-XFWGSAIBSA-N naltrexone Chemical compound N1([C@@H]2CC3=CC=C(C=4O[C@@H]5[C@](C3=4)([C@]2(CCC5=O)O)CC1)O)CC1CC1 DQCKKXVULJGBQN-XFWGSAIBSA-N 0.000 description 1
- 229960003086 naltrexone Drugs 0.000 description 1
- 229960002009 naproxen Drugs 0.000 description 1
- CMWTZPSULFXXJA-VIFPVBQESA-N naproxen Chemical compound C1=C([C@H](C)C(O)=O)C=CC2=CC(OC)=CC=C21 CMWTZPSULFXXJA-VIFPVBQESA-N 0.000 description 1
- 239000003887 narcotic antagonist Substances 0.000 description 1
- PLPRGLOFPNJOTN-UHFFFAOYSA-N narcotine Natural products COc1ccc2C(OC(=O)c2c1OC)C3Cc4c(CN3C)cc5OCOc5c4OC PLPRGLOFPNJOTN-UHFFFAOYSA-N 0.000 description 1
- 230000017074 necrotic cell death Effects 0.000 description 1
- 229960004927 neomycin Drugs 0.000 description 1
- 239000002547 new drug Substances 0.000 description 1
- 229960003512 nicotinic acid Drugs 0.000 description 1
- 235000001968 nicotinic acid Nutrition 0.000 description 1
- 239000011664 nicotinic acid Substances 0.000 description 1
- 229960000715 nimodipine Drugs 0.000 description 1
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 1
- SGXXNSQHWDMGGP-IZZDOVSWSA-N nizatidine Chemical compound [O-][N+](=O)\C=C(/NC)NCCSCC1=CSC(CN(C)C)=N1 SGXXNSQHWDMGGP-IZZDOVSWSA-N 0.000 description 1
- 229960004872 nizatidine Drugs 0.000 description 1
- 229960004708 noscapine Drugs 0.000 description 1
- 238000000655 nuclear magnetic resonance spectrum Methods 0.000 description 1
- 229960000988 nystatin Drugs 0.000 description 1
- VQOXZBDYSJBXMA-NQTDYLQESA-N nystatin A1 Chemical compound O[C@H]1[C@@H](N)[C@H](O)[C@@H](C)O[C@H]1O[C@H]1/C=C/C=C/C=C/C=C/CC/C=C/C=C/[C@H](C)[C@@H](O)[C@@H](C)[C@H](C)OC(=O)C[C@H](O)C[C@H](O)C[C@H](O)CC[C@@H](O)[C@H](O)C[C@](O)(C[C@H](O)[C@H]2C(O)=O)O[C@H]2C1 VQOXZBDYSJBXMA-NQTDYLQESA-N 0.000 description 1
- 229960001699 ofloxacin Drugs 0.000 description 1
- KVWDHTXUZHCGIO-UHFFFAOYSA-N olanzapine Chemical compound C1CN(C)CCN1C1=NC2=CC=CC=C2NC2=C1C=C(C)S2 KVWDHTXUZHCGIO-UHFFFAOYSA-N 0.000 description 1
- 229960005017 olanzapine Drugs 0.000 description 1
- SBQLYHNEIUGQKH-UHFFFAOYSA-N omeprazole Chemical compound N1=C2[CH]C(OC)=CC=C2N=C1S(=O)CC1=NC=C(C)C(OC)=C1C SBQLYHNEIUGQKH-UHFFFAOYSA-N 0.000 description 1
- 229960000381 omeprazole Drugs 0.000 description 1
- 229940023490 ophthalmic product Drugs 0.000 description 1
- 229940127234 oral contraceptive Drugs 0.000 description 1
- 239000003539 oral contraceptive agent Substances 0.000 description 1
- 239000002337 osmotic diuretic agent Substances 0.000 description 1
- 229960003552 other antineoplastic agent in atc Drugs 0.000 description 1
- 229960001019 oxacillin Drugs 0.000 description 1
- UWYHMGVUTGAWSP-JKIFEVAISA-N oxacillin Chemical compound N([C@@H]1C(N2[C@H](C(C)(C)S[C@@H]21)C(O)=O)=O)C(=O)C1=C(C)ON=C1C1=CC=CC=C1 UWYHMGVUTGAWSP-JKIFEVAISA-N 0.000 description 1
- WCPAKWJPBJAGKN-UHFFFAOYSA-N oxadiazole Chemical compound C1=CON=N1 WCPAKWJPBJAGKN-UHFFFAOYSA-N 0.000 description 1
- CQDAMYNQINDRQC-UHFFFAOYSA-N oxatriazole Chemical compound C1=NN=NO1 CQDAMYNQINDRQC-UHFFFAOYSA-N 0.000 description 1
- 229960004535 oxazepam Drugs 0.000 description 1
- ADIMAYPTOBDMTL-UHFFFAOYSA-N oxazepam Chemical compound C12=CC(Cl)=CC=C2NC(=O)C(O)N=C1C1=CC=CC=C1 ADIMAYPTOBDMTL-UHFFFAOYSA-N 0.000 description 1
- ATYBXHSAIOKLMG-UHFFFAOYSA-N oxepin Chemical compound O1C=CC=CC=C1 ATYBXHSAIOKLMG-UHFFFAOYSA-N 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 229960005434 oxybutynin Drugs 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- XNOPRXBHLZRZKH-DSZYJQQASA-N oxytocin Chemical compound C([C@H]1C(=O)N[C@H](C(N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CSSC[C@H](N)C(=O)N1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(C)C)C(=O)NCC(N)=O)=O)[C@@H](C)CC)C1=CC=C(O)C=C1 XNOPRXBHLZRZKH-DSZYJQQASA-N 0.000 description 1
- 229960001723 oxytocin Drugs 0.000 description 1
- 229940055695 pancreatin Drugs 0.000 description 1
- 229940045258 pancrelipase Drugs 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- 229960005489 paracetamol Drugs 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 230000032696 parturition Effects 0.000 description 1
- 229960001639 penicillamine Drugs 0.000 description 1
- 229940056360 penicillin g Drugs 0.000 description 1
- 229940056367 penicillin v Drugs 0.000 description 1
- 229960003436 pentoxyverine Drugs 0.000 description 1
- 230000035699 permeability Effects 0.000 description 1
- 239000008194 pharmaceutical composition Substances 0.000 description 1
- 125000001792 phenanthrenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3C=CC12)* 0.000 description 1
- 229960003956 phenindamine tartrate Drugs 0.000 description 1
- DDBREPKUVSBGFI-UHFFFAOYSA-N phenobarbital Chemical compound C=1C=CC=CC=1C1(CC)C(=O)NC(=O)NC1=O DDBREPKUVSBGFI-UHFFFAOYSA-N 0.000 description 1
- 229960002695 phenobarbital Drugs 0.000 description 1
- 229950000688 phenothiazine Drugs 0.000 description 1
- BPLBGHOLXOTWMN-MBNYWOFBSA-N phenoxymethylpenicillin Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)COC1=CC=CC=C1 BPLBGHOLXOTWMN-MBNYWOFBSA-N 0.000 description 1
- 229960003733 phenylephrine hydrochloride Drugs 0.000 description 1
- OCYSGIYOVXAGKQ-FVGYRXGTSA-N phenylephrine hydrochloride Chemical compound [H+].[Cl-].CNC[C@H](O)C1=CC=CC(O)=C1 OCYSGIYOVXAGKQ-FVGYRXGTSA-N 0.000 description 1
- 229960002036 phenytoin Drugs 0.000 description 1
- UEZVMMHDMIWARA-UHFFFAOYSA-M phosphonate Chemical compound [O-]P(=O)=O UEZVMMHDMIWARA-UHFFFAOYSA-M 0.000 description 1
- SHUZOJHMOBOZST-UHFFFAOYSA-N phylloquinone Natural products CC(C)CCCCC(C)CCC(C)CCCC(=CCC1=C(C)C(=O)c2ccccc2C1=O)C SHUZOJHMOBOZST-UHFFFAOYSA-N 0.000 description 1
- 230000036417 physical growth Effects 0.000 description 1
- 229960001416 pilocarpine Drugs 0.000 description 1
- BXRNXXXXHLBUKK-UHFFFAOYSA-N piperazine-2,5-dione Chemical compound O=C1CNC(=O)CN1 BXRNXXXXHLBUKK-UHFFFAOYSA-N 0.000 description 1
- 229940096701 plain lipid modifying drug hmg coa reductase inhibitors Drugs 0.000 description 1
- 229920001432 poly(L-lactide) Polymers 0.000 description 1
- 229920001308 poly(aminoacid) Polymers 0.000 description 1
- 229920006210 poly(glycolide-co-caprolactone) Polymers 0.000 description 1
- 229920001610 polycaprolactone Polymers 0.000 description 1
- 239000004632 polycaprolactone Substances 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 229920000166 polytrimethylene carbonate Polymers 0.000 description 1
- 229920002635 polyurethane Polymers 0.000 description 1
- 239000004814 polyurethane Substances 0.000 description 1
- 239000011148 porous material Substances 0.000 description 1
- 239000001103 potassium chloride Substances 0.000 description 1
- 235000011164 potassium chloride Nutrition 0.000 description 1
- TUZYXOIXSAXUGO-PZAWKZKUSA-N pravastatin Chemical compound C1=C[C@H](C)[C@H](CC[C@@H](O)C[C@@H](O)CC(O)=O)[C@H]2[C@@H](OC(=O)[C@@H](C)CC)C[C@H](O)C=C21 TUZYXOIXSAXUGO-PZAWKZKUSA-N 0.000 description 1
- 229960002965 pravastatin Drugs 0.000 description 1
- 229960004856 prazepam Drugs 0.000 description 1
- 229960005205 prednisolone Drugs 0.000 description 1
- OIGNJSKKLXVSLS-VWUMJDOOSA-N prednisolone Chemical compound O=C1C=C[C@]2(C)[C@H]3[C@@H](O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 OIGNJSKKLXVSLS-VWUMJDOOSA-N 0.000 description 1
- 229960004618 prednisone Drugs 0.000 description 1
- XOFYZVNMUHMLCC-ZPOLXVRWSA-N prednisone Chemical compound O=C1C=C[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 XOFYZVNMUHMLCC-ZPOLXVRWSA-N 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- DQMZLTXERSFNPB-UHFFFAOYSA-N primidone Chemical compound C=1C=CC=CC=1C1(CC)C(=O)NCNC1=O DQMZLTXERSFNPB-UHFFFAOYSA-N 0.000 description 1
- 229960002393 primidone Drugs 0.000 description 1
- DBABZHXKTCFAPX-UHFFFAOYSA-N probenecid Chemical compound CCCN(CCC)S(=O)(=O)C1=CC=C(C(O)=O)C=C1 DBABZHXKTCFAPX-UHFFFAOYSA-N 0.000 description 1
- 229960003081 probenecid Drugs 0.000 description 1
- FYPMFJGVHOHGLL-UHFFFAOYSA-N probucol Chemical compound C=1C(C(C)(C)C)=C(O)C(C(C)(C)C)=CC=1SC(C)(C)SC1=CC(C(C)(C)C)=C(O)C(C(C)(C)C)=C1 FYPMFJGVHOHGLL-UHFFFAOYSA-N 0.000 description 1
- 229960003912 probucol Drugs 0.000 description 1
- 229960000244 procainamide Drugs 0.000 description 1
- REQCZEXYDRLIBE-UHFFFAOYSA-N procainamide Chemical compound CCN(CC)CCNC(=O)C1=CC=C(N)C=C1 REQCZEXYDRLIBE-UHFFFAOYSA-N 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- 229960004919 procaine Drugs 0.000 description 1
- WIKYUJGCLQQFNW-UHFFFAOYSA-N prochlorperazine Chemical compound C1CN(C)CCN1CCCN1C2=CC(Cl)=CC=C2SC2=CC=CC=C21 WIKYUJGCLQQFNW-UHFFFAOYSA-N 0.000 description 1
- 229960003111 prochlorperazine Drugs 0.000 description 1
- 239000000186 progesterone Substances 0.000 description 1
- 229960003387 progesterone Drugs 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 125000006410 propenylene group Chemical group 0.000 description 1
- 229960003447 pseudoephedrine hydrochloride Drugs 0.000 description 1
- BALXUFOVQVENIU-KXNXZCPBSA-N pseudoephedrine hydrochloride Chemical compound [H+].[Cl-].CN[C@@H](C)[C@@H](O)C1=CC=CC=C1 BALXUFOVQVENIU-KXNXZCPBSA-N 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 125000000561 purinyl group Chemical group N1=C(N=C2N=CNC2=C1)* 0.000 description 1
- PBMFSQRYOILNGV-UHFFFAOYSA-N pyridazine Chemical compound C1=CC=NN=C1 PBMFSQRYOILNGV-UHFFFAOYSA-N 0.000 description 1
- 229960002290 pyridostigmine Drugs 0.000 description 1
- 229940018203 pyrilamine maleate Drugs 0.000 description 1
- WKSAUQYGYAYLPV-UHFFFAOYSA-N pyrimethamine Chemical compound CCC1=NC(N)=NC(N)=C1C1=CC=C(Cl)C=C1 WKSAUQYGYAYLPV-UHFFFAOYSA-N 0.000 description 1
- 229960000611 pyrimethamine Drugs 0.000 description 1
- 238000010791 quenching Methods 0.000 description 1
- 230000000171 quenching effect Effects 0.000 description 1
- JWVCLYRUEFBMGU-UHFFFAOYSA-N quinazoline Chemical compound N1=CN=CC2=CC=CC=C21 JWVCLYRUEFBMGU-UHFFFAOYSA-N 0.000 description 1
- 229960001404 quinidine Drugs 0.000 description 1
- 239000003306 quinoline derived antiinfective agent Substances 0.000 description 1
- 239000002534 radiation-sensitizing agent Substances 0.000 description 1
- VMXUWOKSQNHOCA-LCYFTJDESA-N ranitidine Chemical compound [O-][N+](=O)/C=C(/NC)NCCSCC1=CC=C(CN(C)C)O1 VMXUWOKSQNHOCA-LCYFTJDESA-N 0.000 description 1
- 229960000620 ranitidine Drugs 0.000 description 1
- GGWBHVILAJZWKJ-KJEVSKRMSA-N ranitidine hydrochloride Chemical compound [H+].[Cl-].[O-][N+](=O)\C=C(/NC)NCCSCC1=CC=C(CN(C)C)O1 GGWBHVILAJZWKJ-KJEVSKRMSA-N 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 238000005215 recombination Methods 0.000 description 1
- 230000006798 recombination Effects 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 239000013074 reference sample Substances 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 229960004181 riluzole Drugs 0.000 description 1
- 229960000888 rimantadine Drugs 0.000 description 1
- RAPZEAPATHNIPO-UHFFFAOYSA-N risperidone Chemical compound FC1=CC=C2C(C3CCN(CC3)CCC=3C(=O)N4CCCCC4=NC=3C)=NOC2=C1 RAPZEAPATHNIPO-UHFFFAOYSA-N 0.000 description 1
- 229960001534 risperidone Drugs 0.000 description 1
- 229960004889 salicylic acid Drugs 0.000 description 1
- 108010068072 salmon calcitonin Proteins 0.000 description 1
- 108010038379 sargramostim Proteins 0.000 description 1
- 229960002530 sargramostim Drugs 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 208000005687 scabies Diseases 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 230000001624 sedative effect Effects 0.000 description 1
- 229910052710 silicon Inorganic materials 0.000 description 1
- 239000010703 silicon Substances 0.000 description 1
- 210000002027 skeletal muscle Anatomy 0.000 description 1
- AUAGTGKMTMVIKN-UHFFFAOYSA-M sodium;2-(3-fluoro-4-phenylphenyl)propanoate Chemical compound [Na+].FC1=CC(C(C([O-])=O)C)=CC=C1C1=CC=CC=C1 AUAGTGKMTMVIKN-UHFFFAOYSA-M 0.000 description 1
- JJICLMJFIKGAAU-UHFFFAOYSA-M sodium;2-amino-9-(1,3-dihydroxypropan-2-yloxymethyl)purin-6-olate Chemical class [Na+].NC1=NC([O-])=C2N=CN(COC(CO)CO)C2=N1 JJICLMJFIKGAAU-UHFFFAOYSA-M 0.000 description 1
- NHXLMOGPVYXJNR-ATOGVRKGSA-N somatostatin Chemical compound C([C@H]1C(=O)N[C@H](C(N[C@@H](CO)C(=O)N[C@@H](CSSC[C@@H](C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@@H](CC=2C3=CC=CC=C3NC=2)C(=O)N[C@@H](CCCCN)C(=O)N[C@H](C(=O)N1)[C@@H](C)O)NC(=O)CNC(=O)[C@H](C)N)C(O)=O)=O)[C@H](O)C)C1=CC=CC=C1 NHXLMOGPVYXJNR-ATOGVRKGSA-N 0.000 description 1
- 229960000553 somatostatin Drugs 0.000 description 1
- 229960004532 somatropin Drugs 0.000 description 1
- 235000019337 sorbitan trioleate Nutrition 0.000 description 1
- 229960000391 sorbitan trioleate Drugs 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- LXMSZDCAJNLERA-ZHYRCANASA-N spironolactone Chemical compound C([C@@H]1[C@]2(C)CC[C@@H]3[C@@]4(C)CCC(=O)C=C4C[C@H]([C@@H]13)SC(=O)C)C[C@@]21CCC(=O)O1 LXMSZDCAJNLERA-ZHYRCANASA-N 0.000 description 1
- 229960002256 spironolactone Drugs 0.000 description 1
- 238000012453 sprague-dawley rat model Methods 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 238000000859 sublimation Methods 0.000 description 1
- 230000008022 sublimation Effects 0.000 description 1
- NCEXYHBECQHGNR-QZQOTICOSA-N sulfasalazine Chemical compound C1=C(O)C(C(=O)O)=CC(\N=N\C=2C=CC(=CC=2)S(=O)(=O)NC=2N=CC=CC=2)=C1 NCEXYHBECQHGNR-QZQOTICOSA-N 0.000 description 1
- 229960001940 sulfasalazine Drugs 0.000 description 1
- NCEXYHBECQHGNR-UHFFFAOYSA-N sulfasalazine Natural products C1=C(O)C(C(=O)O)=CC(N=NC=2C=CC(=CC=2)S(=O)(=O)NC=2N=CC=CC=2)=C1 NCEXYHBECQHGNR-UHFFFAOYSA-N 0.000 description 1
- 229940124530 sulfonamide Drugs 0.000 description 1
- 150000003456 sulfonamides Chemical class 0.000 description 1
- YROXIXLRRCOBKF-UHFFFAOYSA-N sulfonylurea Chemical class OC(=N)N=S(=O)=O YROXIXLRRCOBKF-UHFFFAOYSA-N 0.000 description 1
- 229910052717 sulfur Inorganic materials 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 230000009469 supplementation Effects 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 229940127230 sympathomimetic drug Drugs 0.000 description 1
- 230000001975 sympathomimetic effect Effects 0.000 description 1
- 229920001059 synthetic polymer Polymers 0.000 description 1
- YLJREFDVOIBQDA-UHFFFAOYSA-N tacrine Chemical compound C1=CC=C2C(N)=C(CCCC3)C3=NC2=C1 YLJREFDVOIBQDA-UHFFFAOYSA-N 0.000 description 1
- 229960001685 tacrine Drugs 0.000 description 1
- 229960001603 tamoxifen Drugs 0.000 description 1
- KKEYFWRCBNTPAC-UHFFFAOYSA-L terephthalate(2-) Chemical compound [O-]C(=O)C1=CC=C(C([O-])=O)C=C1 KKEYFWRCBNTPAC-UHFFFAOYSA-L 0.000 description 1
- 229960000351 terfenadine Drugs 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- ISXSCDLOGDJUNJ-UHFFFAOYSA-N tert-butyl prop-2-enoate Chemical compound CC(C)(C)OC(=O)C=C ISXSCDLOGDJUNJ-UHFFFAOYSA-N 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 239000004753 textile Substances 0.000 description 1
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 1
- 229960000278 theophylline Drugs 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- BISQTCXKVNCDDA-UHFFFAOYSA-N thiepine Chemical compound S1C=CC=CC=C1 BISQTCXKVNCDDA-UHFFFAOYSA-N 0.000 description 1
- 229930192474 thiophene Natural products 0.000 description 1
- 230000002537 thrombolytic effect Effects 0.000 description 1
- NZVYCXVTEHPMHE-ZSUJOUNUSA-N thymalfasin Chemical compound CC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O NZVYCXVTEHPMHE-ZSUJOUNUSA-N 0.000 description 1
- 229960004231 thymalfasin Drugs 0.000 description 1
- XUIIKFGFIJCVMT-UHFFFAOYSA-N thyroxine-binding globulin Natural products IC1=CC(CC([NH3+])C([O-])=O)=CC(I)=C1OC1=CC(I)=C(O)C(I)=C1 XUIIKFGFIJCVMT-UHFFFAOYSA-N 0.000 description 1
- PHWBOXQYWZNQIN-UHFFFAOYSA-N ticlopidine Chemical compound ClC1=CC=CC=C1CN1CC(C=CS2)=C2CC1 PHWBOXQYWZNQIN-UHFFFAOYSA-N 0.000 description 1
- 229960005001 ticlopidine Drugs 0.000 description 1
- 229960000707 tobramycin Drugs 0.000 description 1
- NLVFBUXFDBBNBW-PBSUHMDJSA-N tobramycin Chemical compound N[C@@H]1C[C@H](O)[C@@H](CN)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N NLVFBUXFDBBNBW-PBSUHMDJSA-N 0.000 description 1
- UCFGDBYHRUNTLO-QHCPKHFHSA-N topotecan Chemical compound C1=C(O)C(CN(C)C)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 UCFGDBYHRUNTLO-QHCPKHFHSA-N 0.000 description 1
- 229960000303 topotecan Drugs 0.000 description 1
- 238000002723 toxicity assay Methods 0.000 description 1
- 230000002110 toxicologic effect Effects 0.000 description 1
- 231100000027 toxicology Toxicity 0.000 description 1
- 229960001288 triamterene Drugs 0.000 description 1
- 239000003029 tricyclic antidepressant agent Substances 0.000 description 1
- 229960001032 trihexyphenidyl Drugs 0.000 description 1
- 125000003258 trimethylene group Chemical group [H]C([H])([*:2])C([H])([H])C([H])([H])[*:1] 0.000 description 1
- 231100000397 ulcer Toxicity 0.000 description 1
- 238000002604 ultrasonography Methods 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- VBEQCZHXXJYVRD-GACYYNSASA-N uroanthelone Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CS)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(C)C)[C@@H](C)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)CNC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C1=CC=C(O)C=C1 VBEQCZHXXJYVRD-GACYYNSASA-N 0.000 description 1
- 229960005486 vaccine Drugs 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 229940124549 vasodilator Drugs 0.000 description 1
- 239000003071 vasodilator agent Substances 0.000 description 1
- 229960003726 vasopressin Drugs 0.000 description 1
- 230000002861 ventricular Effects 0.000 description 1
- 229960003048 vinblastine Drugs 0.000 description 1
- KDQAABAKXDWYSZ-PNYVAJAMSA-N vinblastine sulfate Chemical compound OS(O)(=O)=O.C([C@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 KDQAABAKXDWYSZ-PNYVAJAMSA-N 0.000 description 1
- 229960004982 vinblastine sulfate Drugs 0.000 description 1
- JXLYSJRDGCGARV-XQKSVPLYSA-N vincaleukoblastine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 JXLYSJRDGCGARV-XQKSVPLYSA-N 0.000 description 1
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 1
- 229960004528 vincristine Drugs 0.000 description 1
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 1
- 210000001835 viscera Anatomy 0.000 description 1
- 235000019155 vitamin A Nutrition 0.000 description 1
- 239000011719 vitamin A Substances 0.000 description 1
- 235000019154 vitamin C Nutrition 0.000 description 1
- 239000011718 vitamin C Substances 0.000 description 1
- 150000003700 vitamin C derivatives Chemical class 0.000 description 1
- 150000003710 vitamin D derivatives Chemical class 0.000 description 1
- 235000019165 vitamin E Nutrition 0.000 description 1
- 229940046009 vitamin E Drugs 0.000 description 1
- 239000011709 vitamin E Substances 0.000 description 1
- 235000019168 vitamin K Nutrition 0.000 description 1
- 239000011712 vitamin K Substances 0.000 description 1
- 150000003721 vitamin K derivatives Chemical class 0.000 description 1
- 229940045997 vitamin a Drugs 0.000 description 1
- 229940046010 vitamin k Drugs 0.000 description 1
- 229960005080 warfarin Drugs 0.000 description 1
- PJVWKTKQMONHTI-UHFFFAOYSA-N warfarin Chemical compound OC=1C2=CC=CC=C2OC(=O)C=1C(CC(=O)C)C1=CC=CC=C1 PJVWKTKQMONHTI-UHFFFAOYSA-N 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 239000011592 zinc chloride Substances 0.000 description 1
- 235000005074 zinc chloride Nutrition 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G63/00—Macromolecular compounds obtained by reactions forming a carboxylic ester link in the main chain of the macromolecule
- C08G63/68—Polyesters containing atoms other than carbon, hydrogen and oxygen
- C08G63/692—Polyesters containing atoms other than carbon, hydrogen and oxygen containing phosphorus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
- A61K9/0024—Solid, semi-solid or solidifying implants, which are implanted or injected in body tissue
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1629—Organic macromolecular compounds
- A61K9/1641—Organic macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyethylene glycol, poloxamers
- A61K9/1647—Polyesters, e.g. poly(lactide-co-glycolide)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L17/00—Materials for surgical sutures or for ligaturing blood vessels ; Materials for prostheses or catheters
- A61L17/06—At least partially resorbable materials
- A61L17/10—At least partially resorbable materials containing macromolecular materials
- A61L17/12—Homopolymers or copolymers of glycolic acid or lactic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L26/00—Chemical aspects of, or use of materials for, wound dressings or bandages in liquid, gel or powder form
- A61L26/0009—Chemical aspects of, or use of materials for, wound dressings or bandages in liquid, gel or powder form containing macromolecular materials
- A61L26/0019—Chemical aspects of, or use of materials for, wound dressings or bandages in liquid, gel or powder form containing macromolecular materials obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/14—Macromolecular materials
- A61L27/18—Macromolecular materials obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G63/00—Macromolecular compounds obtained by reactions forming a carboxylic ester link in the main chain of the macromolecule
- C08G63/68—Polyesters containing atoms other than carbon, hydrogen and oxygen
- C08G63/692—Polyesters containing atoms other than carbon, hydrogen and oxygen containing phosphorus
- C08G63/6922—Polyesters containing atoms other than carbon, hydrogen and oxygen containing phosphorus derived from hydroxy carboxylic acids
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G63/00—Macromolecular compounds obtained by reactions forming a carboxylic ester link in the main chain of the macromolecule
- C08G63/91—Polymers modified by chemical after-treatment
- C08G63/912—Polymers modified by chemical after-treatment derived from hydroxycarboxylic acids
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L85/00—Compositions of macromolecular compounds obtained by reactions forming a linkage in the main chain of the macromolecule containing atoms other than silicon, sulfur, nitrogen, oxygen and carbon; Compositions of derivatives of such polymers
- C08L85/02—Compositions of macromolecular compounds obtained by reactions forming a linkage in the main chain of the macromolecule containing atoms other than silicon, sulfur, nitrogen, oxygen and carbon; Compositions of derivatives of such polymers containing phosphorus
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S623/00—Prosthesis, i.e. artificial body members, parts thereof, or aids and accessories therefor
- Y10S623/924—Material characteristic
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Epidemiology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Polymers & Plastics (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Dermatology (AREA)
- Pharmacology & Pharmacy (AREA)
- Materials Engineering (AREA)
- Surgery (AREA)
- Oral & Maxillofacial Surgery (AREA)
- Transplantation (AREA)
- Biomedical Technology (AREA)
- Vascular Medicine (AREA)
- General Chemical & Material Sciences (AREA)
- Neurosurgery (AREA)
- Medicinal Preparation (AREA)
- Biological Depolymerization Polymers (AREA)
- Polyesters Or Polycarbonates (AREA)
- Materials For Medical Uses (AREA)
- Compositions Of Macromolecular Compounds (AREA)
- Polyamides (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Polymers With Sulfur, Phosphorus Or Metals In The Main Chain (AREA)
Description
1.発明の分野
本発明は、生分解性ポリマー組成物、特にポリマーの主鎖にホスフェートとテレフタレートの両方のエステル結合を含み、インビボで無毒の残留物に分解されるそれらに関する。本発明のポリマーは、特に移植可能な医療器具や医薬導入システムに有用である。
2.従来技術の説明
生体適合性ポリマー材料は治療薬導入及び医薬移植器具への利用が拡大してきている。そのようなポリマーは生体適合性だけでなく、その治療上の価値が使い尽くされたときにこのポリマーを除去する必要性を排除する生分解性が望まれるときもある。
医薬導入の従来技術、例えば頻繁な定期的投薬は多くの場合理想的ではない。例えば毒性の高い薬の頻繁な従来の投薬は、投薬の際最初の薬レベルが高く、しばしば有毒に近いレベルになり、続いてそれらの治療値レベル以下にできる投薬間の低い薬レベルになる。しかし、薬の導入がコントロールされている場合には予測されたやり方で長期間コントロールされた放出によってより容易に治療に有効であるが有毒ではない薬のレベルに維持することができる。
もし、生分解性医療器具が薬の導入又は他のコントロールされたシステムとしての使用を意図しているのであれば、ポリマーキリヤーの使用は治療薬をコントロールされたやり方で局所的に導入する1つの有効な手段である。Langerら.,“Chemical and Physical Structures of Polymers as Carriers for Controlled Release of Bioactive Agents”,J.Macro.Science,Rev.Macro.Chem.Phys.,C23:1, 61−126(1983)参照。その結果、要求される薬の全量が少なくなり、有毒な副作用を最小限にすることができる。ポリマーは、治療薬を局所的に放出を維持させるキャリヤーとして使用されている。Leongら.,“Polymeric Controlled Drug Delivery”,Advanced Drug Delivery Reviews,1:199〜233(1987);Langer,“New Methods of Drug Delivery”,Science,249:1527〜33(1990);Chienら.,Novel Drug Delivery Systems(1982)参照。このような導入システムは治療効果の増進と全体としての毒性の減少の可能性を提供する。
非生分解性マトリックスでは、治療薬を放出するステップはこのマトリックスの内部への水の拡散、治療薬の溶解、及びこのマトリックスのチャンネルを通じてのこの治療薬の拡散放出からなる。その結果、溶解状態にある治療薬の平均滞留時間は、それが起こるであろうマトリックスのチャンネルの通過がもはや必要なくなる生分解性マトリックスよりも非生分解性マトリックスのほうが長くなる。多くの薬剤は半減期が短いので、治療薬はそれが放出される前に非生分解性マトリックスのなかで分解されあるいは不活性化されることがある。これは、多くの生物学的巨大分子や比較的小さいポリペプチドにとって特に重要である、何故ならこれらの分子は一般的に加水分解的に不安定であり、またポリマーマトリックスの透過率が低いので。実際のところ、非生分解マトリックスにおいては、多くの生体巨大分子が凝集あるいは沈殿してキャリヤーマトリックスの拡散放出に必要なチャンネルを塞いでしまう。
これらの問題は、拡散放出に加えてポリマーマトリックスの分解による治療薬のコントロールされた放出をもたらす生分解性マトリックスの使用によって緩和される。可能な生分解性材料として研究された合成ポリマーのクラスの例には、ポリエステル(Pittら.,Biodegradable Drug Delivery Systems Based on Aliphatic Polyesters:Application to contraceptives and Narcotic Antagonists”,Controlled Release of Bioactive Materials.19〜44(Richard Bakerらed.,1980);poly(amino acids)及びシュードポリアミノ酸(Pulapuraら.,“Trends in the Development of Bioresorbable Polymers for Medical Applications”,J.of Biomaterials Appl.,6:1, 216〜50(1992);ポリウレタン(Bruinら.,“Biodegradable Lysine Diisocyanate-based Poly(Glycolide-co-ε Caprolactone)-Urethane Network in Artificial Skin”,Biomaterials,11:4, 291〜95(1990);ポリオルトエステル(Hellerら.,“Release of Norethindrone from Poly(Ortho Esters)”,Polymer Engineering Sci.,21:11, 727〜31(1981);及びポリアンハイドライド(Leongら.,“Polyanhydrides for Controlled Release of Bioactive Agents”,Biomaterials 7:5, 364〜71(1986)が含まれる。医療用の移植材料として使用される生分解性物質の具体例には、ポリラクチド、ポリグリコライド、ポリジオキサノン、ポリ(ラクチド−コ−グリコライド)、ポリ(グリコライド−コ−ポリジオキサノン)、ポリアンハイドライド、ポリ(グリコライド−コ−トリメチレンカーボネート)、及びポリ(グリコライド−コ−カプロラクトン)がある。
ポリホスフェート、ポリホスホネート及びポリホスファイトと呼ばれるホスフェート結合を有するポリマーが知られている。Penczekら.,“Phosphorus-Containing Polymers”,Handbook of Polymer Synthesis,Part B,Chapter 17, 1077-1132(Hans R.Kricheldorf ed.,1992)参照。それぞれリン原子に結合されている異なる側鎖を有するこれらの三つのクラスの化合物のそれぞれの構造は次の通りである。
これらのポリマーの多用性は反応の多重性が知られているリン原子の多用性から来ている。その結合は3P軌道や各種の3S−3P混成軌道を含み、d軌道も受け入れられるのでspd混成軌道もまた可能である。こうして、これらのポリホスホエステルの物理化学的性質はRまたはR’基のどちらかを変えることによって容易に変えることができる。このポリマーの生分解性は基本的にこのポリマーの主鎖における生理学的に不安定なホスホエステル結合によるものである。主鎖や側鎖を操作することによって広範囲の生分解率を得ることができる。
Kadiyalaら“Poly(phosphoesters):Synthesis,Physicochemical Characerization and Biological Response”,Biomidical Applications of Synthetic Biodegradable Polymers,Chapter 3:33-57(Jeffrey O.Hollingers ed.,1995)。
ポリホスホエステルの付加的特徴は官能側基を利用しうることである。リンは5価になりうるので、薬の分子あるいは他の生物学的活性物質をこのポリマーに化学的に結合させることができる。たとえば、−o−カルボキシル基を持っている薬を加水分解可能なエステル結合を介してリンに結合させることができる。この主鎖におけるP−O−C基はポリマーのガラス転移温度も下げ、さらに重要なことに特性決定と処理に望ましい普通の有機溶剤への溶解性を与える。
Friedman,米国特許第3,4442,982号明細書は、エステル部として次の非対称基を有するポリホスホエステルポリマーを開示している。
Friedmanのポリマーは加水分解、熱、光に対して安定であると言及されている(Column 1,Lines 42-44 and Column 3,Lines 74-75)。
Starckら,カナダ特許第597,473号明細書は、ポリ(ホスホネート)およびリンの混入は得られるポリマーを不燃化させると言われていると開示している(Column 6,Lines 1-2)。Engelhardtら,米国特許第5,530,093号明細書は、ホスホエステルおよびエステル繰り返し単位と幅広い種類の重縮合構造を有する多数の繊維仕上げ組成物を開示している。StarckらおよびEngelhardtらのエステル部分は次のように配向している。
−O−CO−R3−CO−O−
こうして、生分解性材料の製造と他の生医学的適用に特に適する、本発明のポリ(ホスホエステル−コ−エステル)化合物のような材料の必要性が存在している。
発明の要約
本発明の生分解性ポリマーは、式IまたはIIに示される繰返しモノマー単位よりなる。
式中:
Xは−O−または−NR’−であり、このR’はHまたはアルキルであり、
M1およびM2はそれぞれ独立して(1)炭素原子数1〜20を有する分岐鎖または直鎖の脂肪族基または(2)炭素原子数1〜20を有する分岐鎖または直鎖のオキシ−、カルボキシ−またはアミノ−脂肪族基であって、これらのオキシ−、カルボキシ−またはアミノ−は水素原子がとれて二価になってもよく、
Yは−O−、−S−または−NR’−であり、
Lは炭素原子数1〜20を有する分岐鎖または直鎖の脂肪族基であり、
RはH、アルキル、アルコキシ、アリール、アリールオキシ、複素環式基またはヘテロシクロオキシであり、
x:yのモル比は約1であり、
n:(xまたはy)のモル比は約200:1と1:200の間であり、そして、
q:rのモル比は約1:99と99:1の間である。
別の態様においては、本発明は、次の組成よりなる生分解性ポリマー組成物よりなる。
(a) 少なくとも1つの生物学的に活性な物質と、
(b) 式IまたはIIで示される繰返しモノマー単位を有するポリマー
本発明のさらに別の態様においては、式IまたはIIの生分解性ポリマー又は前記のポリマー組成物よりなる、移植、注入あるいはその他の体内の全体もしくは一部に配置されるのに有用な物品よりなる。
さらに別の態様においては、本発明は次のステップよりなる生分解性ポリマーの製造方法をもくろんでいる。
(a) 式III、IVまたはV
式中、M1、M2およびXは上記に定義したとおりである。
を有する複素環式化合物と式
H−Y−L−Y−H
式中、YおよびLは上記に定義したとおりである。
を有する開始剤とを反応させて以下に示した式VIまたはVII
式中、X、M1、M2、Y、L、x、y、qおよびrは上記に定義したとおりである。
を有するプレポリマーを生成させ、
(b) さらに式VIまたはVIIの該プレポリマーを式VIII
「halo」はBr、ClまたはIであり、Rは上記に定義したとおりである。
を有するホスホロジハリデートを反応させて式IまたはIIの該ポリマーを生成させる。
本発明の別の態様においては、次のステップよりなる生物学的に活性な物質のコントロールされた放出をもたらす方法よりなる。
(a) この生物学的に活性な物質を式IまたはIIで示される繰り返しモノマー単位を有する生分解性ポリマーと組み合わせて混合物を形成させ、
(b) この混合物を固形成形品にし、そして、
(c) この固形品を少なくとも一部は生物学的液体に接触するように、予め選択された部位にインビボで移植あるいは注入する。
【図面の簡単な説明】
図1は本発明のポリマーについてグラフの形で表したGPC分析の結果を示す。
図2Aおよび図2Bは本発明の二つのポリマーの示差走差熱量計データを示す。
図3は溶媒蒸発法によって製造された本発明のポリマーの微小球の外見を示す。
図4Aおよび図4BはPBS中、37℃、8日間に亘って本発明の二つのポリマーから加工されたディスクの重量損失(4A)とMwの変化(4B)を示す。
図5は室温で1ヶ月間空気に晒された後の本発明の二つのポリマーのMwの変化を示す。
図6は本発明のポリマーP(LAEG-EOP)の1H-NMRスペクトルを示す。
図7は本発明のポリマーP(LAEG-EOP)の31P-NMRスペクトルを示す。
図8は本発明のポリマーの室温での貯蔵性を示す。
図9は本発明のポリマーP(LAEG-EOP)の微小球の細胞毒性を示す。
図10Aおよび図10Bは本発明の二つのポリマーから加工されたディスクのインビトロにおける重量損失(10A)とMwの変化(10B)を示す。
図11Aおよび図11Bは本発明の二つのポリマーから加工されたディスクのインビボにおける重量損失(11A)とMwの変化(11B)を示す。
図12は本発明のポリマーの生体適合性データを示す。
図13は本発明のポリマーの微小球の放出率に及ぼす成形方法の効果を示す。
図14は本発明のポリマーの微小球からのリドカインおよびシスプラティンの放出率を示す。
図15はFITS-BSAを含有する本発明のポリマーの微小球体の外見を示す。
図16は本発明のポリマーの微小球からのリドカイン放出率を示す。
図17は本発明のポリマーの微小球からのリドカイン放出率を示す。
発明の詳細な説明
本発明のポリマー
ここで使用されている“脂肪族”の用語は、直鎖、分岐あるいは環状のアルカン、アルケンあるいはアルキンを意味する。本発明のポリ(ホスホエステル−コ−エステル)ポリマーにおける好ましい脂肪族基は1から10個の炭素を有する直鎖又は分岐アルカンであり、好ましくは炭素原子が1から7個の直鎖アルキン基である。
ここで使用されている“アリール”の用語は、4n+2のπ電子を有する不飽和環状炭素化合物を意味する。
ここで使用されている“複素環式”の用語は環の1以上の原子が炭素以外、例えば窒素、酸素あるいは硫黄である、飽和又は不飽和の環式化合物を意味する。
本発明の生分解性ポリマーは式IまたはIIで示される繰返しモノマー単位からなる。
式中、Xは−O−または−NR’−であり、ここのR’はHまたはアルキルである。
Lは、重合、又はポリマーの生分解反応を阻害しない限り、炭素原子数1〜20を有する如何なる2価の分岐鎖または直鎖の脂肪族基であってもよい。具体的には、Lはメチレン、エチレン、1,2−ジメチルエチレン、n−プロピレン、イソプロピレン、2,2−ジメチル−プロピレン又はtert−ブチレン、n−ペンチレン、tert−ペンチレン、n−ヘキシレン、n−ヘプチレン等のアルキレン基;非阻害性置換基で置換されたアルキレン、例えばヒドロキシ、ハロゲンまたは窒素置換アルキレン;エテニレン、プロペニレン、2−(3−プロペニル)ドデシレン等のアルケニレン基;およびエテニレン、プロピニレン、1−(4−ブチニル)−3−メチルデシレンのようなアルキニレンであってもよい。
しかしながら、好ましくは、Lは独立して分岐鎖または直鎖のアルキレン基、より好ましくは、炭素原子数1〜7のアルキレン基である。なお一層好ましくは、Lはエチレン、メチル置換メチレン基、より好ましくは、エチレン基である。
式におけるM1およびM2はそれぞれ独立して(1)炭素原子数1〜20を有する分岐鎖または直鎖の脂肪族基または(2)炭素原子数1〜20を有する分岐鎖または直鎖のオキシ−、カルボキシ−またはアミノ−脂肪族基のいずれかであって、これらのオキシ−、カルボキシ−またはアミノ−は水素原子がとれて二価になってもよい。いずれの場合も、分岐鎖または直鎖の脂肪族基は重合、共重合またはポリマーの生分解反応を阻害しない、炭素原子数1〜20、好ましくは、炭素原子数1〜7を有する如何なる2価の脂肪族基部分であってもよい。具体的には、M1およびM2のいずれかが炭素原子数1〜20を有する分岐鎖または直鎖の脂肪族基であるときは、それは例えば、メチレン、エチレン、1−メチルエチレン、1,2−ジメチルエチレン、n−プロピレン、トリメチレン、イソプロピレン、2,2−ジメチル−プロピレン、tert−ブチレン、n−ペンチレン、tert−ペンチレン、n−ヘキシレン、n−ヘプチレン、n−オクチレン、n−ノニレン、n−デシレン、n−ウンデシレン等のアルキレン基;n−プロペニレン、2−ビニルプロピレン、n−ブテニレン、3−エチルブチレン、n−ペンテニレン、4−(3−プロペニル)ヘキシレン、n−オクテニレン、1−(4−ブテニル)−3−メチルデシレン、2−(3−プロペニル)ドデシレン、ヘキサデセニレン等のアルケニレン基;エチニレン、プロピニレン、3−(2−エチニル)ペンチレン、n−ヘキシニレン、2−(2−プロピニル)デシレン等のアルキニレン基;または非阻害性置換基、例えばヒドロキシ、ハロゲンまたは窒素基で置換されたアルキレン、アルケニレンまたはアルキニレン基、例えば例えば2−クロロ−n−デシレン、1−ヒドロキシ−3−エテニルブチレン、2−プロピル−6−ニトロ−10−ドデシニレン等であってもよい。M1またはM2が炭素原子数1〜20を有する分岐鎖または直鎖のオキシ脂肪族基であるときは、それは、例えば2価のアルコキシレン基、たとえばエトキシレン、2−メチルエトキシレン、プロポキシレン、ブトキシレン、ペントキシレン、ドデシルオキシレン、ヘキサデシルオキシレン等であってもよい。M1またはM2が分岐鎖または直鎖のオキシ脂肪族基であるときは、好ましくは、それは、式−O−(CH2)a−、式中aは1から7である、を有している。
M1またはM2が炭素原子数1〜20を有する分岐鎖または直鎖のオキシ脂肪族基であるときは、それはまた、例えばジオキシアルキレン基、例えばジオキシメチレン、ジオキシエチレン、1、3−ジオキシプロピレン、2−メトキシ−1、3−ジオキシプロピレン、1、3−ジオキシ−2−メチルプロピレン、ジオキシ−n−ペンチレン、ジオキシ−n−オクタデシレン、メトキシレン−メトキシレン、エトキシレン−メトキシレン、エトキシレン−エトキシレン、エトキシレン−1−プロポキシレン、ブトキシレン−n−プロポキシレン、ペンタデシルオキシレン等であってもよい。M1またはM2が分岐鎖または直鎖のジオキソ脂肪族基であるときは、好ましくは、それに式−O−(CH2)a−O−または−O−(CH2)a−O−(CH2)b−
式中、aおよびbのいずれも1から7である。
を有するものである。
M1またはM2のいずれかが炭素原子数1〜20を有する分岐鎖または直鎖カルボキシ脂肪族基であるときは、それは、例えば2価のカルボン酸エステル、例えばギ酸メチル、酢酸メチル、酢酸エチル、酢酸n−プロピル、酢酸イソプロピル、プロピオン酸アリル、アクリル酸t−ブチル、酪酸n−ブチル、クロロ酢酸ビニル、2−メトキシカルボニルシクロヘキサノン、2−アセトキシクロヘキサノン等の二価のラジカルであってもよい。MまたはM2が分岐鎖または直鎖カルボキシ脂肪族基であるときは、好ましくはそれは式
−O−CHR2−CO−CHR3−
式中、R2およびR3はそれぞれ独立してH、アルキル、アルコキシ、アリール、アリールオキシ、複素環式基またはヘテロシクロオキシである。
を有する。
M1またはM2のいずれかが炭素原子数1〜20を有する分岐鎖または直鎖アミノ脂肪族基であるときは、それは−CH2NH−、−(CH2)2N−、−CH2(C2H5)N−、−n−C4H9NH−、−t−C4H9NH−、−CH2(C3H7)N−、−C2H5(C3H7)N−、−CH2(C8H17)N−等の2価のアミンあってもよい。M1またはM2が分岐鎖または直鎖アミノ脂肪族基であるときは、好ましくはそれは式
−(CH2)aNR’−
式中、R’はHまたは低級アルキルである。
好ましくは、M1および/またはM2は式
−O−(CH2)a−
式中、aは1乃至7である。
を有するアルキレン基であり、最も好ましくは2価のエチレン基である。
特に好ましい態様では、M1およびM2の両方とも存在する。M1およびM2は同一の化学体でない。そして、M1およびM2はそれぞれn−ペンチレン、酢酸メチルの2価基である。
本発明のポリマーにおけるRは、H、アルキル、アルコキシ、アリール、アリールオキシ、複素環式基またはヘテロシクロオキシ残基である。有用なアルキルR’の例は、メチル、エチル、n−プロピル、i−プロピル、n−ブチル、tert−ブチル、−C8H17等の基;非阻害性置換基、例えばヒドロキシ、ハロゲン、アルコキシまたはニトロで置換されたアルキル;対応するアルコキシ基;そして生物学的に活性な物質と共役してペンダントの薬剤導入シムテムを形成するアルキルを包含する。
Rがアリール基または対応するアリールオキシ基であるときは、一般的に炭素原子数が約5から約14、好ましくは、炭素原子数が約5から12を含み、そして任意に互いに連合する1以上の環を含んでもよい。特に適当な芳香族基の例は、フェニル、フェノキシ、ナフチル、アントラセニル、フェナントレニル等を包含する。
Rが複素環式またはヘテロシクロキシである場合には、それは典型的には約5から14の環形成原子、好ましくは約5から12の環形成原子と、1以上の異種原子を含む。適する複素環式基の例には、フラン、チオフェン、ピロール、イソピロール、3−イソピロール、ピラゾール、2−イソイミダゾール、1,2,3−トリアゾール、1,2,4−トリアゾール、オキサゾール、チアゾール、イソチアゾール、1,2,3−オキサジアゾール、1,2,4−オキサジアゾール、1,2,5−オキサジアゾール、1,3,4−オキサジアゾール、1,2,3,4−オキサトリアゾール、1,2,3,5−オキサトリアゾール、1,2,3−ジオキサゾール、1,2,4−ジオキサゾール、1,3,2−ジオキサゾール、1,3,4−ジオキサゾール、1,2,5−オキサトリアゾール、1,3−オキサチオール、1,2−ピラン、1,4−ピラン、1,2−ピロン、1,4−ピロン、1,2−ジオキシン、1,3−ジオキシン、ピリジン、N−アルキルピリジニウム、ピリダジン、ピリミジン、ピラジン、1,3,5−トリアジン、1,2,4−トリアジン、1,2,3−トリアジン、1,2,4−オキサジン、1,3,2−オキサジン、1,3,5−オキサジン、1,4−オキサジン、o−イソオキサジン、p−イソオキサジン、1,2,5−オキサチアジン、1,2,6−オキサチアジン、1,4,2−オキサジアジン、1,3,5,2−オキサジアジン、アゼピン、オキセピン、チエピン、1,2,4−ジアゼピン、インデン、イソインデン、ベンゾフラン、イソベンゾフラン、チオナフテン、イソチオナフテン、インドール、インドレニン、2−イソベンザゾール、1,4−ピリンジン、ピランド[3,4−b]−ピロール、イソインダゾール、インドキサジン、ベンゾキサゾール、アンスラニル、1,2−ベンゾピラン、1,2−ベンゾピロン、1,4−ベンゾピロン、2,1−ベンゾピロン,2,3−ベンゾピロン、キノリン、イソキノリン、12,−ベンゾジアジン、1,3−ベンゾジアジン、ナフチリジン、ピリド[3,4−b]−ピリジン,ピリド[3,2−b]−ピリジン、ピリド[4,3−b]ピリジン、1,3,2−ベンゾキサジン、1,4,2−ベンゾキサジン、2,3,1−ベンゾキサジン、3,1,4−ベンゾキサジン、1,2−ベンズイソキサジン、1,4−ベンズイソキサジン、カルバゾール、キサントレン、エクリジン、プリン等が含まれる。好ましくは、Rが複素環式またはヘテロシクロキシの場合には、それがフラン、ピリジン、N−アルキルピリジン、1,2,3−及び1,2,4−トリアゾール、インデン、アントラセンおよびプリン環よりなる群から選ばれる。
特に好ましい態様においては、Rはアルキル基、アルコキシ基、フェニル基、フェノキシ基またはヘテロシクロオキシ基であり、特に好ましくは、1から7個の炭素原子を有するアルコキシ基である。最も好ましくは、Rはエトキシ基である。
n:(xまたはy)のモル比は、ポリマーに望まれる生分解可能性と放出性に大きく依存して変化するが、典型的には約1:200と200:1との間で変化する。好ましくは、x:yの比は約1:100から約100:1まで、最も好ましくは、約1:50から約50:1までである。
q:rのモル比は、ポリマーに望まれる生分解性と放出性に大きく依存して変化するが、典型的には約1:200と200:1との間で変化する。好ましくは、q:rの比は約1:150から約150:1まで、最も好ましくは、約1:99から約99:1までである。
x:yのモル比は、ポリマーに望まれる生分解性と放出性に大きく依存して変化するが、典型的には約1である。
生分解性ポリマーはインビボでの療法の間に分解しうるという点で非生分解性ポリマーとは異なっている。これは、一般的にはそのポリマーのモノマーのサブユニットまでの破壊を含んでいる。原理的には、ポリホスホエステルの究極の加水分解産物はホスフェート、アルコール及びジオールであり、それらの全ては無毒になりうるものである。この加水分解の中間のオリゴマー産物は異なる性質を持っているかも知れないが、移植や注入を意図している生分解性ポリマーの毒性は、例え明らかに見掛け上無害のモノマー構造物から合成されたとしても、一般的には1又はそれ以上のインビトロ毒性分析の後に決定される。
典型的な毒性検定は、次の方法でGT3TKB癌細胞のような生きている癌細胞を用いて実施される。
ポリマー試料の約100〜150mgを1M NaOH20mL中で37℃で1〜2日間つまり完全な分解が観察されるまで分解される。次いで、その溶液を1M HClで中和する。分解されたポリマー生成物の種々異なった濃度の約200μLを96ウエル組織培養板に置き、ヒト胃癌細胞(GT3TKB)を104/ウエル密度で接種する。分解されたポリマー生成物をGT3TKB細胞と共に48時間培養する。検定の結果を、相対成育%対組織培養ウエル中の分解ポリマー濃度としてプロットすることができる。
本発明の生分解性ポリマーは好ましくはそれ自身が生体適合性を有するのに充分に純粋であり、生分解の際に生体適合性を残している。“生体適合性”は生分解産物やポリマーが無毒であり、血管の多い組織に移植されあるいは注入されたときに最小限の組織への刺激をもたらすにすぎない。
本発明のポリマーは成形や処理を容易にするために1以上の一般の有機溶媒に溶けることが好ましい。一般の有機溶媒にはクロロホルム、ジクロロメタン、アセトン、酢酸エチル、DMAC、N−メチルピロリドン、ジメチルホルムアミドおよびジメチルスルホキシドなどの溶媒が含まれる。このポリマーは上記の溶媒の少なくとも1つに溶けることが好ましい。
ポリ(ホスホエステル−コ−エステル)ポリマーの合成
ポリホスフェートを製造する最も普通の一般反応は下記の式によるホスホロジクロリデートとジオールの間の脱塩酸反応である。
大部分のポリホスフェートは、適当に置換されたジクロライドとジオールとの縮合によっても得られる。
ポリホスフェートは、グリコールから二段縮合反応によって製造されている。グリコールと反応させるのに20%モル過剰量のジメチルホスファイトが使用され、次いで高温によってオリゴマー中のメトキシホスホニル末端基を除去する。
溶融重縮合の利点は溶媒と多量の他の添加剤の使用を避けて精製をより簡単にできることである。それはまた、適度に高分子量のポリマーを提供することができる。しかしながら、しばしばある程度厳密な条件が要求され、直鎖酸分解(もし水が存在していれば加水分解)をもたらす。もしポリマーの主鎖が高分子ラジカルの再結合が続いて起こる水素原子引抜きや酸化を受けやすい場合には、架橋反応のような望ましくない熱で引き起こされる副反応もまた起こりうる。これらの副反応を最少限にするために重合反応はまた溶液中で行なうことができる。
溶液重縮合反応はプレポリマーとリン成分の両方が共通の溶媒に溶けることが必要である。一般的には塩素化有機溶媒、例えばクロロホルム、ジクロロメタンあるいはジクロロエタン等が使用される。溶液重合は等モル量の反応体と化学量論量の酸受容体、通常はピリジンやトリエチルアミン等の第三アミンの存在下で行われなければならない。次いで、生成物は一般的には非溶媒による沈殿で溶液から分離され、当業者が知っている常法、例えば希HCIのような酸性水溶液洗浄などによって塩酸塩を除去することにより精製される。
反応時間は溶融重合より溶液重合のほうが長くなりやすい。しかしながら、全体としてより温和な反応条件を用いることができるので、副反応を最小限にすることができ、より敏感な官能基をポリマーに組み込むことができる。溶液重合法の欠点は高分子量の達成、例えば20,000より大きいMwにあまり適当でないことである。高分子量ポリマーを高い反応速度で得たいときには界面重縮合法を用いることができる。温和な条件によって副反応を最小限にすることができる。溶液法に本質的なジオールとジクロリデートの間の化学量論的な当量への高分子量の依存性もまた除かれる。しかしながら、酸クロライドの加水分解がアルカリ性水相で起こりうる。水に対していくらかの溶解度をもっている感受性ジクロリデートは一般的には重合よりむしろ加水分解される。クラウンエーテルや第三アンモニウムクロライドのような相移動触媒を、イオン化されたジオールを界面へ移動させて重縮合反応を容易にするために使用することができる。界面重縮合後のポリマーの収率と分子量は反応時間、モノマーのモル比率、混ざり合わない溶媒の容量比率、酸受容体の種類、及び相移動触媒の種類と濃度によって影響される。
本発明の好ましい態様においては、式IまたはIIの生分解性ポリマーは次のステップからなる方法によって製造される:
(a) 式III、IVまたはV
式中、M1、M2およびXは上記に定義したとおりである。
を有する複素環式化合物と式
H−Y−L−Y−H
式中、YおよびLは上記に定義したとおりである。
を有する開始剤とを反応させて以下に示した式VIまたはVII
式中、X、M1、M2、Y、L、x、y、qおよびrは上記に定義したとおりである。
を有するプレポリマーを生成させ、そして
(b) さらに式VIまたはVIIの該プレポリマーを式VIII
「halo」はBr、ClまたはIであり、Rは上記に定義したとおりである。
を有するホスホロジハリデートを反応させて式IまたはIIの該ポリマーを生成させる。
第1反応ステップ(a)の機能は、開始剤を使用して式III、IVまたはVの複素環式化合物の環を開環することである。有用な式III、IVまたはVの複素環式化合物の例は、カプロラクトン、カプロラクタム、グリシン無水物のようなアミノ酸無水物、シクロアルキレンカーボネート類、ジオキサノン類、グリコリド類、ラクチド類等が包含される。
本発明の化合物が式Iを有する場合は、M1を含む式IIIの複素環式化合物の一つだけを用いてステップ(a)における式VIのプレポリマーを製造してもよい。本発明の化合物が式IIを有する場合は、そのときはステップ(a)においてM1を含む式IIIの複素環式化合物とM2含む式IVの複素環式化合物とを組み合わせて使用してもよい。あるいは、本発明の化合物が式IIを有する場合は、M1およびM2の両方を含む式Vの複素環式化合物の一つをステップ(a)に使用することができる。
適当な開始剤の例は少なくとも2個の活性水素を含む幅広い種類の化合物
(H−Y−L−Y−H)
式中、Lは結合基で、上記に定義されており、Yは−O−、−S−、または−NR”、このR”は上記に定義されているとおりである、
が包含される。結合基Lは直鎖基、例えばアルキレンでよいが、これはまた1以上のさらなる活性水素を含む基で置換されていてもよい。例えば、Lはおのおのが−OH、−SH、または−NH2のような活性化された活性水素部位を生ずる、1以上の追加的なアルキル基で置換された直鎖アルキレン基であってもよい。この方法においては、分岐した活性水素開始剤を用いて種々の分岐したポリマーを製造して、得られるポリマーが所望とする性質を有するように設計することができる。しかしながら、分岐したポリマーを酸塩化物と反応させるときは、架橋したポリマーになって了う。
反応ステップ(a)は、使用する溶媒、反応体の副反応の形成しやすさ、および触媒の存在に応じて幅広い温度で行うことができる。しかしながら好ましくは、反応ステップ(a)は融解条件の約0から約+235℃までの温度で行われる。カチオン性またはアニオン性の触媒のいずれかを用いてある程度低い温度が可能であろう。
反応ステップ(a)に要求される時間もまた、用いられる反応の種類と所望とする分子量によって巾広く変えることができる。しかしながら、好ましくはこの反応ステップ(a)は約1時間から7日の間の期間に亘って行われる。
一方、この反応ステップ(a)は塊状でも、溶液でも、界面重縮合でも、あるいは他のいかなる好都合な重合方法でもよい。好ましくは、この反応ステップ(a)は融解条件下で行われる。
特に有用な式Vのプレポリマーの例は次のものが包含される。
(i) ポリカプロラクトンから得られたOH−末端プレポリマー
H-[-O(CH2)5-CO-]x-O-CH2-CH2-O-[-CO-(CH2)5-O-]y-H;
(ii) ポリカプロラクタム(ナイロン6)から得られたNH−末端プレポリマー
H-[-NH-(CH2)5-CO-]x-NH-CH2-CH2-NH-[-CO-(CH2)5-NH-]y-H;
(iii) ポリラクチドから得られたOH−末端プレポリマー
H-[-OCH(CH3)-CO-]x-O-CH2-CH2-O-[-CO-CH(CH3)-O-]y-H;
および
(iv) ポリトリメチレンカーボネートから得られたOH−末端プレポリマー
H-[-O(CH2)3-O-CO]x-O-CH2-CH2-O-[-CO-O-(CH2)3-O-]y-H
特に有用な式VIのプレポリマーの例は次のものが包含される。
(i) ラクチドおよびグリコリドから得られたOH−末端コポリマー
(ii) ラクチドおよびカプロラクトンから得られたOH−末端コポリマー
(iii) グリコリドカプロラクトンから得られたOH−末端コポリマー
ステップ(b)の重合反応の目的は、(i)ステップ(a)の結果製造されたプレポリマーと、(ii)連続するホスホリル化された単位からなるポリマーを生成させることにある。結果として得られるブロックコポリマーは、特にコントロールされた放出媒体として用いるのに適している微結晶構造を有している。
本発明の重合ステップ(b)は、通常ステップ(a)の温度よりもやや低い温度で行われるが、用いる重合反応の種類、1以上の触媒の存在、所望とする分子量および反応体の望まない副反応のしやすさによってやはり大きく変わりうる。融解条件が使用されるときは、温度は約0〜150℃から変わりうる。しかしながら、重合ステップ(b)が溶液重合反応で行われるときには、一般的に約−40と100℃との間の温度で行われる。典型的な溶媒にはメチレンクロライド、クロロホルムあるいは多種の不活性有機溶媒が含まれる。
ステップ(b)の重合に要求される時間もまた、所望とする物質の分子量と、一般的に、所望の完結の度合まで進行させる反応に使用される多かれ少なかれ厳密な条件の必要性によって巾広く変えることができる。しかしながら、一般的には、重合ステップ(b)は約30分から24時間の間で行われる。
特に、溶液重合反応が用いられるときには、酸受容体を重合ステップ(a)の間に存在させることが望ましい。特に適当なクラスの酸受容体は、第三級アミン、例えばピリジン、トリメチルアミン、トリエチルアミン、置換アニリンおよび置換アミノピリジンである。最も好ましい酸受容体は置換アミノピリジン、4−ジメチルアミノピリジン(“DMAP”)である。
式IおよびIIのポリマーは、沈殿、不混和性溶媒による抽出、蒸発、濾過、結晶化等の常法によって反応混合物から単離される。しかしながら、一般的には、式IおよびIIののポリマーは該ポリマーの非溶媒あるいは部分溶媒、例えばジメチルエーテルや石油エーテルの溶液を急冷することによって単離と精製の両方が行なわれる。
生分解性と放出性
式IおよびIIのポリマーは、生分解時のポリマーのホスホエステル結合の加水分解の作用として少なくとも1部がコントロールされた、インビボでの生物学的に活性な物質の放出速度によって通常特徴づけられる。尚、この放出される生物学的に活性な物質はリン側鎖R’に共役してペンダント医薬導入システムを形成させてもよい。さらに、他の因子もまた重要である。
生分解性ポリマーのインビボでの寿命はまたその分子量、結晶化度、生物学的な安定性及び架橋度によって変わる。一般的には、分子量が大きくなる程、結晶化度が高くなる程、そして生物学的な安定性が大きくなる程、生分解は遅くなる。
従って、側鎖の構造は生物学的に活性な物質からなる組成物の放出挙動に影響を及ぼす。例えば、リン側鎖をより親油性に、より疎水性にあるいは嵩ばった基へ変えることにより分解プロセスをスローダウンさせるであろうことが期待される。こうして、嵩ばった芳香族側鎖よりも小さな脂肪族基側鎖をもたせることによって、ポリマー組成物からの放出が通常速くなる。
ポリマー組成物
式IおよびIIのポリマーは、いずれも単独で用いることも、各種の有用な生分解性材料を形成する生物学的に活性な物質をさらに含む組成物として用いることもできる。例えば、式IおよびIIのポリマーをたとえ生物学的に活性な物質が存在していなくても、生体吸収性縫合剤、骨や結合組織の傷をなおす整形外科の器具や骨セメント、分解性あるいは非分解性織物用の積層物あるいは移植可能な器具用のコーティングの製造に使用することができる。
しかしながら、この生分解性ポリマー組成物は、
(a) 少なくとも1つの生物学的に活性な物質と
(b) X、M1、M2、Y、L、x、y、q、rおよびnが上記に定義された通りである式IまたはIIに示された繰返しモノマー単位を有するポリマー
の両方からなっているものが好ましい。
本発明の生物学的に活性な物質は組成物の目的によって巾広く変わる。この活性物質は単一物質あるいは、物質の組合せとして記載されていてもよい。この導入システムは、コントロールされた放出速度を有する導入システムをつくり出す水溶性の低い生物学的に活性な物質のほか水溶性の高いものも用いられるように設計されている。“生物学的に活性を有する物質”の用語は特に限定されるものではなく、薬物、ビタミン、ミナラル補給、病気の治療、予防、診断、療養又は緩和に使用される物質あるいは身体の構造や機能に影響を与える物質、あるいは予め定められた生理的な環境に置かれた後に生物学的活性になりあるいは活性が増加するプロ(前の)医薬を含む。
有用な生物学的に活性な物質の広いカテゴリーの限定されない例には次の拡大された治療のカテゴリーが含まれる。同化剤、制酸薬、抗喘息薬、抗コレステロール血症及び抗脂質薬、抗凝固剤、抗痙攣剤、抗下痢剤、抗吐剤、抗感染症剤、抗炎症剤、抗うつ剤、抗嘔吐剤、抗新生物剤、抗肥満症剤、解熱及び鎮痛剤、抗ケイレン剤、抗トロンボチック剤、抗尿酸血症剤、抗アンギナ剤、抗ヒスタミン剤、抗咳嗽剤、食欲抑制剤、生物学的製剤、脳拡張剤、冠状拡張剤、充血除去剤、利尿剤、診断剤、赤血球造血剤、去痰剤、胃腸鎮静剤、過血糖症剤、睡眠薬、低血糖症剤、イオン交換樹脂、緩下剤、ミネラル補給剤、粘液溶解剤、筋神経薬、血管拡張剤、精神療法剤、鎮静剤、興奮剤、甲状腺及び抗甲状腺剤、ウテリン弛緩剤、ビタミン、及びプロ医薬。
これまでの述べたカテゴリーから有用な生物学的に活性な物質の具体的な例は次のものを含む。
(a)抗新生物剤例えばアンドロゲンインヒビター、抗代謝産物、細胞毒性剤、及びイムノモジュレーター;(b)抗咳嗽剤例えばデキストロメトルファン、デキストロメトルファン臭素酸塩、ノスカピン、カルベタペンタンクエン酸塩及びクロルフェジアノール塩酸塩;(c)抗ヒスタミン剤例えばクロルフェニラミンマレイン酸塩、フェニンダミン酒石酸塩、ピリラミンマレイン酸塩、ドキシラミンコハク酸塩、及びフェニルトロキサミンクエン酸塩;(d)充血除去薬例えばフェニルエフェリン塩酸塩、フェニルプロパノールアミン塩酸塩、シュードエフェドリン塩酸塩、及びエフェドリン;(e)各種のアルカロイド例えばコデインリン酸塩、コデイン硫酸塩及びモルヒネ;(f)ミネラル補給剤例えば塩化カリウム、塩化亜鉛、炭酸カルシウム、酸化マグネシウム、並びにその他のアルカリ金属塩及びアルカリ土類金属塩;(g)イオン交換樹脂例えばコレストリルアミン;(h)抗不整脈剤例えばN−アセチルプロカインアミド;(i)解熱剤及び鎮痛剤例えばアセタミノフェン、アスピリン及びイブプロフェン;(j)食欲抑制剤例えばフェニルプロパノールアミン塩酸塩又はカフェイン;(k)去痰剤例えばガイフェネシン;(l)制酸剤例えば水酸化アルミニウム及び水酸化マグネシウム;(m)生化学製剤例えばペプチド、ポリペプチド、蛋白及びアミノ酸、ホルモン、インターフェロン又はサイトカイン、及び他の生物活性ペプチド性化合物、例えばhGH、tPA、カルシトニン、ANF、EPO及びインシュリン;並びに(n)抗感染症剤例えば抗菌剤、抗ウィルス剤、防腐剤及び抗生物質。
好ましくは、生物学的に活性な物質は多糖類、発育因子、ホルモン、抗脈管形成因子、インターフェロン又はサイトカイン及びプロ医薬からなる群より選ばれる。より詳しくは、有用な生物学的に活性な物質の限定されない例には次の治療のカテゴリーが含まれる。非ステロイド系抗炎症薬、阿片剤働筋及びサリチル酸塩のような鎮痛薬、H1−ブロッカーやH2−ブロッカーのような抗ヒスタミン剤、駆虫剤、抗無気症剤、抗生物質、アミノグリコシド抗生物質、抗菌抗生物質、セファロスポリン抗生物質、マクロライド抗生物質、各種のβ−ラクタム抗生物質、ペニシリン抗生物質、キノロン抗生物質、スルホナミド抗生物質、テトラサイクリン抗生物質、抗マイコバクテリア剤、抗マラリア性抗原生動物剤、抗ウイルス剤、抗レトロウイルス剤、疥癬剤及び尿の抗感染剤等の抗感染剤、アルキル化剤、窒素マスタードアルキル化剤、ニトロソウレアアルキル化剤、抗代謝物質、プリン類縁抗代謝物質、ピリミジン類縁抗代謝物質、ホルモン性抗新生物剤、天然抗新生物剤、抗生物質天然抗新生物剤及びビンカアルカロイド天然抗新生物剤などの抗新生物剤、抗コリン性剤、抗ムスカリン性抗コリン性剤、エルゴットアルカロイド、副交感神経刺激興奮剤、コリン性働筋副交感神経刺激興奮剤、コリンエステラーゼ阻害剤副交感神経刺激興奮剤、交感神経遮断剤、α−ブロッカー交感神経遮断剤、β−ブロッカー交感神経遮断剤、交感神経興奮剤及びアドレナリン性働筋交感神経興奮剤などの自律神経剤;心臓血管剤、例えば抗アンギナ剤、β−ブロッカー抗アンギナ剤、カルシウム−チャンネルブロッカー抗アンギナ剤、ニトレート抗アンギナ剤、抗不整脈剤、心臓グリコシド抗不整脈剤、クラスI抗不整脈剤、クラスII抗不整脈剤、クラスIII抗不整脈剤、クラスIV抗不整脈剤、抗高血圧剤、α−ブロッカー抗高血圧剤、アンギオテンシン転換酵素インヒビター(ACEインヒビター)抗高血圧剤、β−ブロッカー抗高血圧剤、カルシウムチャンネルブロッカー抗高血圧剤、中枢作用アドレナリン性抗高血圧剤、利尿剤抗高血圧剤、末梢血管拡張剤、抗高血圧剤、抗脂血症剤、胆汁酸隔離抗脂血症剤、HMG-CoAレダクターゼインヒビター抗脂血症剤、筋変力症剤、心臓グリコシド筋変力症剤、及びトロンボリティック剤;皮膚剤、例えば抗ヒスタミン剤、抗炎症剤、コルチコステロイド抗炎症剤、かゆみ止剤/局所麻酔薬、局所抗感染症剤、抗菌局所抗感染剤、抗ウイルス局所抗感染剤及び局所抗新生物剤;電解及び腎剤、例えば酸性化剤、アルカリ性化剤、利尿剤、カルボニックアンヒドラーゼインヒビター利尿剤、ループ利尿剤、浸透性利尿剤、カリウム回避利尿剤、チアジド利尿剤、電解質置換、及び尿酸尿剤;酵素、例えばパンクレアチン酵素及びトロンボリティック酵素;胃腸剤、例えば抗下痢剤、抗吐剤、胃腸用抗炎症剤、サリチル酸塩胃腸用抗炎症剤、抗酸抗潰瘍剤、胃酸ポンプインヒビター抗潰瘍剤、胃粘膜抗潰瘍剤、H2ブロッカー抗潰瘍剤、胆石症剤、消化薬、催吐剤、緩下剤及び軟便化剤、並びにプロカイネテック剤;一般の麻酔薬、例えば吸入麻酔薬、ハロゲン化吸入麻酔薬、静脈注射麻酔薬、バルビツール酸塩静脈注射麻酔薬、ベンゾジアゼピン静脈注射麻酔薬、及び阿片働筋静脈注射麻酔薬;血液剤、例えば抗貧血剤、造血剤抗貧血剤、凝固剤、抗凝固剤、止血凝固剤、血小板インヒビター凝固剤、トロンボリティック酵素凝固剤、及び血漿増量剤;ホルモン及びホルモン調節剤、例えば堕胎薬、副腎剤、コルチコステロイド副腎剤、アンドロゲン、抗アンドロゲン、抗糖尿病剤、スルホニルウレア抗糖尿病剤、抗低血糖症剤、経口避妊薬、プロゲスチン避妊薬、エストロゲン、受精剤、分娩促進剤、上皮小体剤、脳下垂体ホルモン、プロゲスチン、抗甲状腺剤、甲状腺ホルモン、及び陣痛剤;免疫生化学剤、例えばイムノグロブリン、免疫抑制剤、トキソイド、及びワクチン;局所麻酔薬、例えばアミド局所麻酔薬及びエステル局所麻酔薬;筋骨格剤、例えば抗痛風抗炎症剤、コルチコステロイド抗炎症剤、金化合物抗炎症剤、免疫抑制剤抗炎症剤、非ステロイド抗炎症剤(NSAIDs)、サリチル酸塩抗炎症剤、骨格筋弛緩剤、筋神経ブロッカー骨格筋弛緩剤、及び逆筋神経ブロッカー骨格筋弛緩剤;神経剤、例えば抗痙攣剤、バルビツール酸塩抗痙攣剤、ベンゾジアゼピン抗痙攣剤、抗片頭痛剤、抗パーキンソン病剤、抗めまい剤、阿片働筋剤、及び阿片拮抗剤、眼科薬、例えば抗緑内障剤、β−ブロッカー抗緑内障剤、縮瞳性抗緑内障剤、散瞳症剤、アドレナリン性働筋散瞳症剤、抗ムスカリン性散瞳症剤、眼科用麻酔薬、眼科用抗感染剤、眼科用アミノグリコシド抗感染症剤、眼科用マクロライド抗感染症剤、眼科用キノロン抗感染症剤、眼科用スルホナミド抗感染症剤、眼科用テトラサイクリン抗感染症剤、眼科用抗炎症剤、眼科用コルチコステロイド抗炎症剤、及び眼科用非ステロイド抗炎症剤(NSAIDs);精神病剤、例えば抗ウツ剤、複素環式抗ウツ剤、モノアミンオキシダーゼインヒビター(MAOIs)、選択性セロトニン再摂取阻害剤(SSRIs)、トリサイクリック抗ウツ剤、抗躁病剤、抗精神病剤、フェノチアジン抗精神病剤、不安除去剤、鎮静剤、及び催眠薬、バルビツール酸塩鎮痛剤と催眠剤、ベンゾジアゼピン不安除去剤、鎮痛剤と催眠剤、並びに精神刺激剤;呼吸剤、例えば抗咳嗽剤、気管支拡張剤、アドレナリン性働筋気管支拡張剤、抗ムスカリン性気管支拡張剤、去痰剤、粘液除去剤、呼吸器抗炎症剤、及び呼吸器コルチコステロイド抗炎症剤;毒物学製剤、例えば解毒薬、重金属拮抗質/キレート化剤、物質濫用剤、阻止物質濫用剤、中止物質濫用剤;ミネラル;並びにビタミン、例えばビタミンA、ビタミンB、ビタミンC、ビタミンD、ビタミンE、及びビタミンK。
上記のカテゴリーにおける有用な生物学的に活性な物質の好ましいクラスは、次のものを含む。
(1)非ステロイド性抗炎症薬(NSAIDs)、無痛覚薬、例えばジクロフェナック、イブプロフェン、ケトプロフェン、及びナプロキセン;(2)阿片働筋無痛覚薬、例えばコデイン、フェンタニル、ハイドロモルホン、及びモルフィネ;(3)サリチル酸塩無痛覚薬、例えばアスピリン(ASA)(腸溶性ASA);(4)H1ブロッカー抗ヒスタミン剤、例えばクレマスチン及びターフェナジン;(5)H2ブロッカー抗ヒスタミン剤、例えばシメチジン、ファモチジン、ニザジン、及びラニチジン;(6)抗感染症剤、例えばムピロシン;(7)抗無気性抗感染症剤、例えばクロラムフェニコール及びクリンダマイシン;(8)抗菌性抗生物質抗感染症剤、例えばアンホテリシンb、クロトリマゾール、フルコナゾール、及びケトコナゾール;(9)マクロライド抗物質抗感染症剤、例えばアジスロマイシン及びエリスロマイシン;(10)各種のβ−ラクタム抗生物質抗感染症剤、例えばアズトレオナム及びイミペネム;(11)ペニシリン抗生物質抗感染症剤、例えばナフシリン、オキサシリン、ペニシリンG、及びペニシリンV;(12)ノロン抗生物質抗感染症剤、例えばシプロフロキサシン及びノルフロキサシン;(13)テトラサイクリン抗生物質抗感染症剤、例えばドキシサイクリン、ミノサイクリン、及びテトラサイクリン;(14)抗結核性抗マイコバクテリア性抗感染症剤、例えばイソニアジド(INH)、及びリファムピン;(15)抗原生動物性抗感染症剤、例えばアトバクオン及びダプソン;(16)抗マラリヤ性抗原生動物抗感染症剤、例えばクロロキーネ及びピリメタミン;(17)抗レトロウイルス性抗感染症剤、例えばリトナビア及びジドブジン;(18)抗ウイルス性抗感染症剤、例えばアサイクロビア、ガンシクロビア、インターフェロンアルファ、及びリマンタジン;(19)アルキル化抗新生物剤、例えばカルボプラチン及びシスプラチン;(20)ニトロソウレアアルキル化抗新生物剤、例えばカルムスチン(BCNU);(21)抗代謝性抗新生物剤、例えばメトトレキセート;(22)ピリミジン類縁抗代謝性抗新生物剤、例えばフルオロウラシル(5−FU)及びゲムシタバイン;(23)ホルモン性抗新生物剤、例えばゴセレリン、ロイプロライド、及びタモキシフェン;(24)天然抗新生物剤、例えばアルデスロイキン、インターロイキン−2、ドセタキセル、エトポサイド(VP−16)、インターフェロンアルファ、パクリタキセル、及びトレチノイン(ATRA);(25)抗生物質天然抗新生物剤、例えばブレオマイシン、ダクチノマイシン、ダウノルビシン、ドキソルビシン、及びミトマイシン;(26)ビンカアルカロイド天然抗新生物剤、例えばビンブラスチン及びビンクリスチン;(27)自律神経剤、例えばニコチン;(28)抗コリン性自律神経剤、例えばベンズトロピン及びトリヘキシフェニジル;(29)抗ムスカリン性抗コリン性自律神経剤、例えばアトロピン及びオキシブチニン;(30)エルゴットアルカロイド自律神経剤、例えばブロモクリプチン;(31)コリン性働筋副交感神経刺激興奮剤、例えばピロカルピン;(32)コリンエステラーゼインヒビター副交感神経刺激興奮剤、例えばピリドスチグミン;(33)α−ブロッカー交感神経遮断剤、例えばプラゾシン;(34)β−ブロッカー交感神経遮断剤、例えばアテノロール;(35)アドレナリン性働筋、例えばアルブテロール及びドウブタミン;(36)心臓血管剤、例えばアスピリン(ASA)(腸溶性ASA);(37)β−ブロッカー抗アンギナ剤、例えばアテノロール及びプロプラノロール;(38)カルシウム−チャンネルブロッカー抗アンギナ剤、例えばニフェジピン及びベラパミル;(39)ニトレート抗アンギナ剤、例えばイソソルバイドジニトレート(ISDN);(40)心臓グリコシド抗不整脈剤、例えばジゴキシン;(41)クラスI抗不整脈剤、例えばリドカイン、メキシレチン、フェニトイン、プロカインアミド、及びキニジン;(42)クラスII抗不整脈剤、例えばアテノロール、メトプロロール、プロプラノロール、及びチモロール;(43)クラスIII抗不整脈剤、例えばアミオダロン;(44)クラスIV不整脈剤、例えばディルチアゼム及びベラパミル;(45)α−ブロッカー抗高血圧剤、例えばプラゾシン;(46)アンジオテンシン転換酵素インヒビター(ACEインヒビター、抗高血圧剤、例えばカプトプリル及びエナラプリル;(47)β−ブロッカー抗高血圧剤、例えばアテノロール、メトプロロール、ナドロール、及びプロパノロール;(48)カルシウム−チャンネルブロッカー抗高血圧剤、例えばディルチアゼム及びニフェジピン;(49)中枢作用アドレナリン性抗高血圧剤、例えばクロニジン及びメチルドーパ;(50)利尿薬抗高血圧剤、例えばアミロライド、フロセマイド、ハイドロクロロチアジド(HCTZ)、及びスピロノラクトン;(51)末梢血管拡張剤抗高血圧剤、例えばヒドララジン及びミノキシジル;(52)抗脂肪血症剤、例えばゲムフィブロジル及びプロブコル;(53)胆汁酸隔離抗脂肪血症剤、例えばコレスチラミン;(54)HMG-CoAレダクターゼインヒビター抗脂肪血症剤、例えばロバスタチン及びプラバスタチン;(55)筋変力症剤、例えばアムリノン、ドウブタミン、及びドーパミン;(56)心臓グリコシド筋変力症剤、例えばジゴキシン;(57)トロンボリティック剤、例えばアルテプラーゼ(TPA)、アニストレプラーゼ、ストレプトキナーゼ、及びウロキナーゼ;(58)皮膚科用薬剤、例えばコルチシン、イソトレチノイン、メトトレキセート、ミノキシジル、トレチノイン(ATRA);(59)皮膚科用コルチコステロイド抗炎症剤、例えばベタメタソン及びデキサメタゾン;(60)抗菌性局所抗感染症剤、例えばアムホテリシンB、クロトリマゾール、マイコナゾール、及びニスタチン;(61)抗ウイルス性局所抗感染症剤、例えばアサイクロビル;(62)局所抗新生物剤、例えばフルオロウラシル(5−FU);(63)電解及び腎剤、例えばラクチュロース;(64)ループ利尿剤、例えばフロセミド;(65)カリウム回避利尿剤、例えばトリアムテレン;(66)チアジド利尿剤、例えばハイドロクロロチアザイド(HCTZ);(67)尿酸尿症剤、例えばプロベネシド;(68)酵素例えばRNアーゼ及びDNアーゼ;(69)トロンボリティック酵素、例えばアルテプラーゼ、アニストレプラーゼ、ストレプトキナーゼ及びウロキナーゼ;(70)抗吐剤、例えばプロクロルペラジン;(71)サリチル酸性胃腸用抗炎症剤、例えばスルファサラジン;(72)胃酸ポンプインヒビター抗潰瘍剤、例えばオメプラゾール;(73)H2−ブラッカー抗潰瘍剤、例えばシメチジン、ファモチジン、ニザチジン、及びランチジン;(74)消化薬、例えばパンクレリパーゼ;(75)プロカイネティック剤、例えばエリスロマイシン;(76)阿片働筋静脈注射麻酔薬、例えばフェンタニル;(77)造血剤抗貧血剤、例えばエリスロポエチン、フィルグラスチム(G-CSF)、及びサルグラモスチム(GM-CSF);(78)凝固剤、例えば抗ヘモフィリック因子1−10(AHF 1-10);(79)抗凝固剤、例えばワルファリン;(80)トロンボリティック酵素凝固剤、例えばアルテプラーゼ、アニストレプラーゼ、ストレプトキナーゼ及びウロキナーゼ;(81)ホルモン及びホルモン調節剤、例えばブロモクリプチン;(82)堕胎薬、例えばメトトレキセート;(83)抗糖尿病剤例えばインシュリン;(84)経口避妊薬、例えばエストロゲン及びプロゲスチン;(85)プロゲスチン避妊薬、例えばレボノルゲストレル及びノルゲストレル;(86)エストロゲン例えば共役エストロゲン、ジエチルスチルベストロール(DES)、エストロゲン(エストラジオール、エストロン、及びエストロピペイト);(87)受精剤、例えばクロミフェン、ヒトコリオニックゴナダトロピン(HCG)、及びメノトロピンズ;(88)上皮小体剤例えばカルシトニン;(89)脳下垂体ホルモン、例えばデスモプレッシン、ゴセレリン、オキシトシン及びバソプレッシン(ADH);(90)プロゲスチン、例えばメドロキシプロゲステロン、ノルエチンドロン、及びプロゲステロン;(91)甲状腺ホルモン、例えばレボチロキシン;(92)免疫生化学剤、例えばインターフェローベーター−1b及びインターフェロンガンマ−1b;(93)イムノグロブリン、例えば免疫グロブリンIM、IMIG、IGIM及び免疫グロブリンIV、IVIG、IGIV、;(94)アミド局所麻酔薬、例えばリドカイン;(95)エステル局所麻酔薬、例えばベンゾカイン及びプロカイン;(96)筋骨格コルチコステロイド抗炎症剤、例えばベクロメタゾン、ベタメタゾン、コルチゾン、デキサメタゾン、ハイドロコルチゾン及びプレドニゾン;(97)筋骨格抗炎症免疫抑制剤、例えばアザチオプリン、サイクロホスファミド、及びメトトレキセート;(98)筋骨格非ステロイド抗炎症薬(NSAIDs)、例えばジクロフェナック、イブプロフェン、ケトプロフェン、ケトルラック、及びナプロキャン;(99)骨格筋弛緩剤、例えばバクロフェン、サイクロベンザプリン、及びジアザパム;(100)逆筋神経ブロッカー骨格筋弛緩剤、例えばピリドスチグマイン;(101)神経剤、例えばニモジピン、リルゾール、タクリン及びチクロピジン;(102)抗ケイレン剤、例えばカルバマゼピン、ガバペンチン、ラモトリギン、フェニトメン、及びバルプロイン酸;(103)バルビツール酸塩抗ケイレン剤、例えばフェノバルビタール及びプリミドン;(104)ベンゾジアゼピン抗ケイレン剤、例えばクロナゼパム、ジアゼパム及びロラゼパム;(105)抗パーキンソン病剤、例えばブロモクリプチン、レボドーパ、カルビドーパ、及びペルゴライド;(106)抗めまい剤、例えばメクリジン;(107)阿片働筋剤、例えばコデイン、フェンタニル、ハイドロモルホン、メタドン、及びモルヒネ;(108)阿片拮抗剤、例えばナロキソン:(109)β−ブロッカー抗緑内障剤、例えばチモロール;(110)縮瞳性抗緑内障剤、例えばプロカルピン;(111)眼科用アミノグリコシド抗感染症剤、例えばゲンタマイシン、ネオマイシン、及びトブラマイシン;(112)眼科用キノロン抗感染症剤、例えばシプロフロキサシン、ノルフロキサシン、及びオフロキサシン;(113)眼科用コルチコステロイド抗炎症剤、例えばデキサメタゾン及びプレドニソロン;(114)眼科用非ステロイド抗炎症剤(NSAIDs)、例えばジクロフェナック;(115)抗精神病剤、例えばクロザピン、ハロペリドール、及びリスペリドン;(116)ベンゾジアゼピン不安定除去剤、鎮痛剤と催眠薬、例えばクロナゼパム、ジアゼパム、ローラゼパム、オキサゼパム及びプラゼパム;(117)精神刺激剤、例えばメチルフェニデート及びペモリン;(118)抗咳嗽剤、例えばコデイン;(119)気管支拡張剤、例えばテオフィリン;(120)アドレナリン性働筋気管支拡張剤、例えばアルブテロール;(121)呼吸器コルチコステロイド炎症剤、例えばデキサメタゾン;(122)解毒剤、例えばアルマゼニル及びナロキソン;(123)重金属拮抗質/キレート化剤、例えばペニシラミン;(124)阻止物質濫用剤、例えばジスルフィラム、ナルトレキゾン、及びニコチン;(125)中止物質濫用剤、例えばブロモクリプチン;(126)ミネラル、例えば鉄、カルシウム、及びマグネシウム;(127)ビタミンB化合物、例えばシアノコバラミン(ビタミンB12)及びニアシン(ビタミンB3);(128)ビタミンC化合物、例えばアスコルビン酸;並びに(129)ビタミンD化合物、例えばカルシトリオール。
これまで述べてきたものに加えて、次のあまり一般的でない薬もまた使用できる。クロルヘキシジン;油中エストラジオールサイピオネート;油中エストラジオールバレレート;フルルビプロフェン;フルルビプロフェンナトリウム塩;イベルメクチン;レボドーパ;ナファレリン;及びソマトロピン。
さらに、次の新薬も使うことができる:
リコンビナントベータグルカン;牛イムノグロブリン濃縮物;牛スーパーオキシドジスムターゼ;フルオロウラシル、エピネフリン、及び牛コラーゲンからなる調剤;リコンビナントヒルジン(r−Hir)、HIV-1イムノゲン;ヒト抗−TAC抗体;リコンビナントヒト成長ホルモン(r-hGH);リコンビナントヒトヘモグロビン(r-Hb);リコンビナントヒトメカセルミン(r-IGF-1);リコンビナントインターフェロンベータ−1a;レノグラスチム(G-CSF);オランザピン;リコンビナント甲状腺刺激ホルモン(r-TSH)及びトポテカン。
さらにまた、次の静脈内の産物も使用しうる:
アサイクロビルナトリウム塩;アルデスロオイキン;アテノロール;ブレオマイシン硫酸塩、ヒトカルシトニン;サルモンカルシトニン;カルボプラチン;カルムスチン;ダクチノマイシン、ダウノルビシンHCL;ドウセタキセル;ドキソルビシン(HCL);エポエチンアルファ;エトポサイド(VP−16);フルオロウラシル(5−FU);ガンシクロビルナトリウム塩;ゲンタマイシン硫酸塩;インターフェロンアルファ;ロイプロライド酢酸塩;ナペリジンHCL;メタドンHCL;メトトレキセートナトリウム塩;パクリタキセル;ラニチジンHCL;ビンブラスチン硫酸塩;及びジドブジン(AZT)。
なおさらに次に記するペプチド、蛋白、他の大きい分子もまた使用することができる。例えば、突然変異体、類縁体を含むインタロイキン1から18;インターフェロンα、βおよびγ;黄体化ホルモン放出ホル(LHRH)及び類縁体、ゴナドトロピン放出ホルモン(GnRH)、形質転換成長因子−β(TGF−β)、繊維芽細胞成長因子(FGF)、潰瘍壊死因子α及びβ(TNF−α&β)、神経成長因子(NGF)、成長ホルモン放出因子(GHRF)、表皮成長因子(EGF)、繊維芽細胞成長因子相同因子(FGFHF)、肝細胞成長因子(HGF)、インシュリン成長因子(IGF)、侵入禁止因子ー2(IIF−2)、骨形成蛋白1−7(BMP1−7)、ソマトスタチン、チモシン−α−1、γ−グロブリン、スーパーオチシドジスムターゼ(SOD)、補体因子。
あるいはこの生物学的に活性な物質は放射線感受性体、例えばメトクロプラミド、センサミドヌはニューセンサミド(Oxigen製);プロフィロマイシン(Vion製);RSR13(Allos製);チミタク(Agouron製)、エタンダゾール又はイオベングアン(Nycomed製;ガドリニウムテキサフィリン(Pharmacyclics製);BuDR/Broxinek(NeoPharm製);IPdR(Sparta製);CR2412(Therapeutic製);LIX(Terrapin製)等であってもよい。特に好ましい態様において、この生物学的に活性な物質は治療薬又はプロ医薬、最も好ましくは、化学療法剤及び他の抗新生物剤、抗生物質、抗ウイルス剤、抗黴剤、抗炎症剤及び抗凝固剤からなる群より選ばれた医薬である。最も好ましくは、この生物学的に活性な物質はパクリタキセルである。
この生物学的に活性な物質は治療に有効な量が使用される。この生物学的に活性な物質の有効な量は、用いる物質によるけれども、約1%から約65%の生物学的に活性な物質の量がこの導入システムに容易に組み込まれ、コントロールされた放出を行なう。治療に効能のあるレベルに使用される量がより少なくてすむ生物学的に活性な物質もある。
薬剤として受け入れられるキャリヤーは広範囲の材料から調製することができる。特に限定されないが、そのような材料には希釈剤、結合剤及び接着剤、滑剤、崩壊剤、着色料、増量剤、芳香剤、甘味料、及びその他の各種の材料、例えば特定の医薬組成物をつくるためのバッファー及び吸着剤などが含まれる。
移植及び注入用に設計された導入システム
その最も簡単な形態は、生分解性治療剤導入システムはポリマーマトリックスに治療剤が分散されているものである。この治療剤は、一般的には、ポリマーマトリックスがインビボで体外へ排出される溶解性産物へ生分解されるに従って放出される。特に好ましい態様においては、移植、注入に使用され、あるいは体内に全部あるいは1部が配置される物品が本発明の生分解性テレフタレートポリマー組成物からなっている。この組成物の生物学的に活性な物質及び本発明のポリマーは物質なマトリックスを形成してもよく、あるいは生物学的に活性な物質がポリマーのなかに何らかの方法でカプセル化されていてもよい。例えば、生物学的に活性な物質がまず微小球のなかにカプセル化され、次に、少なくとも微小球構造体の1部が維持されるやり方でポリマーと組み合わせる。
あるいは、生物学的に活性な物質が、本発明のポリマーに溶解されるというよりはむしろ小さな液滴として分解されるのに充分な程ポリマーに対して不活性であってもよい。如何なる形でもよいが、この組成物の物質性にかかわりなく、生物学的に活性な物質のインビボでの放出速度が生分解の際にこのポリマーのホスホエステル結合の加水分解の機能として少なくとも1部がコントロールされたままであることが好ましい。
好ましい態様においては、本発明の物品は動物の体内への移植あるいは注入用につくられる。特に重要なことは、このような物品か血管の多い組織に移植されあるいは注入されたときに組織への刺激が最小限になるということである。
構造用医療器具として、本発明のポリマー組成物は、この組成物がインビボで無毒の残留物に分解するということに加えて、適用するのに充分な特定の化学的、物理的及び機械的な性質を有する物理的な形を提供する。典型的な構造用医療物品には、整形外科用固定器具のような移植材、心室の分流器、分解性織物用積層物、薬キャリヤー、生物吸収縫合材、火傷用包帯、他の移植器具に設けられる被覆材等が含まれる。
整形外科用物品には、本発明の組成物は負傷した骨や結合組織の修復に有用と思われる。例えば生分解性多孔性材料を骨成形蛋白に加えて、平らで大きな分節の欠損に有用な骨の分岐を形成させることができる。血管分岐への適用では、布の形の生分解性材料を組織の内方への生長の促進に使用することができる。本発明のポリマー組成物は、例えば腹部の外科での組織のゆ着を防止する仮のバリヤーとして使用することができる。
一方、神経再生物品では、生分解性支持マトリックスを細胞の接合や増殖を安易にするために使用することができる。このポリマー組成物を神経再生用のチューブに成形すれば、例えばこのチューブ状物品は機能回復の方向の軸索の伸長の幾何学的なガイドとして役立たせることもできる。
医薬導入器具としては、本発明のポリマー組成物は生物学的に活性な物質を隔離しうるポリマーマトリックスを提供し、この物質の予測できるコントロールされた導入を提供できる。このポリマーマトリックスは無毒な残留物に分解される。
生分解性医療用移植器具と薬導入産物はいくつかのやり方でつくることができる。このポリマーは溶融させて通常の押出成形や射出成形によって加工することができ、あるいはこれらの産物を適当な溶媒に溶解してその器具に成形し、続いて溶媒を蒸発や抽出で除去することによって作製することもできる。
一旦医療用移植物品が設置されると、それは少なくとも一部が生物学的液、例えば血液、内部臓器分泌物、粘膜、髄液等と接触状態にされなければならない。
実施例
[実施例1] ポリ(L−ラクチド−コ−エチルホスフェ−ト)[ポリ(LAEG-EOP)]の合成
(3S)−cis−3,6−ジメチル−1,4−ジオアン−2,5−ジオン(L−ラクチド)(アルドリッチ ケミカル会社から入手し、酢酸エチルを用いて再結晶、昇華、再び酢酸エチルを用いて再結晶した)20g(0.139モル)およびエチレングリコール(99.8%、無水、アルドリッチから入手)を乾燥アルゴンで満たされた250mLの丸底フラスコに入れた。フラスコを真空下に閉じ、140℃に加熱された炉に入れた。フラスコを時々振とうさせながらこの温度で48時間保持した。
次いで、フラスコを乾燥アルゴンで充満し、135℃に加熱した油浴中に入れた。アルゴン気流下、攪拌しながらエチルホスホロジクロリデート1.13gを添加した。1時間攪拌後、系に低真空(約20mmHg)をかけ、一夜放置した。仕上げ前の1時間、高真空をかけた。冷却後、ポリマーをクロロホルム200mLに溶解し、1リットルのエーテルに2回クエンチし僅かに灰色がかった白色沈殿とし、真空下に乾燥した。
得られたポリマーは、図6、図7に示すように目的とする生成物ポリ(L−ラクチド−コ−エチルホスフェート)[P(LAEG-EOP)]であることがNMR分光学によって確認した。
[実施例2] P(LAEG-EOP)の諸性質
(xまたはy)/n=10:1のP(LAEG-EOP)を実施例1において上述したように調製した。得られたポリ(ホスホエステルーコーエステル)ポリマーをポリスチレンを標準として用いてGPCによって分析し、得られたグラフは図7に示すように、Mw33,000、Mn4800と確定した。
粘度をクロロホルム(CH3Cl)中、40℃で測定し、0.315dL/gと測定した。ポリマーは酢酸エチル、アセトン、アセトニトリル、クロロホルム、ジクロロメタン、テトラヒドロフラン、N−メチルピドリドン、ジメチルホルムアミドおよびジメチルスルホキシドに可溶であった。ポリマーは脆いフィルムを形成し、Tgは図2A、図2Bに示すようにDSCによって51.5℃と測定された。
[実施例3] ポリ(L−ラクチド−コ−ヘキシルホスフェ−ト)[ポリ(LAEG-HOP)]の合成
EOP(エチルホスホロジクロリデート)の代わりにヘキシルホスホロジクロリデート(「HOP」)を用いた以外は、実施例1に記載された方法によって、次の構造を有する2番目のポリ(L−ラクチドーホスフェート)についても製造した。
[実施例4] P(LAEG-EOP)およびP(LAEG-HOP)の諸性質
実施例1のホスホエステルーコーエステル重合体、P(LAEG-EOP)および実施例3のポリマー、P(LAEG-HOP)の重量平均分子量(Mw)は図1に示したように、測定標準としてポリスチレンを用いてゲル透過クロマトグラフィ(GPC)によって先ず測定した。各サンプルを室温の大気に晒したまま周囲無保護貯蔵容量試験を行った。1ヶ月後、各ポリマーのMwを再度測定した。その結果(図5にプロットした)、P(LAEG-EOP)のMwは無保護周囲条件の1ヶ月後約1/3減少したが、P(LAEG-HOP)のMwはかなり一定に止まり、わずかな増加さえ示した。図8も参照。
次いで、各ポリマーから50℃、200MPa.の圧力で圧縮成型によって分解研究用のディスクを作成した。ディスクは直径4mm、厚さ1.5mm、重量40mgであった。分解研究はディスクを0.1MのPBS(pH7.4)4mL中、37℃に入れて行った。反復試料を8日迄異なった時点で取り除き、蒸留水で洗浄し、一夜真空下で乾燥した。試料を重量損失、分子量変化(GPC)について分析した。それらの結果を図4A、図4B、図10Aおよび図10Bに示す。P(LAEG-EOP)およびP(LAEG-HOP)のいずれのポリマーもは好都合な分解プロファイルを示した。
[実施例5] P(LAEG-EOP)のインビボ生体適合性
P(LAEG-EOP)、そして参考試料として生体適合性であると知られている乳酸とグリコール酸のコポリマー[「PLGA(RG755)」]から、それぞれポリマー薄片100mgを形成した。これらの薄片を麻酔をかけられた成育SPFスプラグードウレイ(Sprague-Dawley)系ラットの右肢筋肉層間に挿入した。所定時間に薄片を取り出した。そして周辺の組織は次の得点を用いて認定された病理学者によって組織病理学分析用に用意された。
組織病理学分析の結果を下記表8に示す。
図12についても参照。ホスホエステルコポリマーP(LAEG-EOP)はPLGA参考薄片によって示されたのと同様な許容生体適合性を有することが示された。
[実施例6] 微小球の調製
塩化メチレンを溶媒に用いる溶媒蒸発(二段乳化double emulsion)法によってP(LAEG-EOP)から微小球を調製した。その結果を図3に示す。
[実施例7] 理論上10%の充填レベルのFITC-BSAを含有するコポリマー微小球の調製
P(LAEG-EOP)100mgの塩化メチレン1mL溶液にFITC-BSA溶液100mL(水に溶解して100mg/mL)を添加し、氷の上で15秒間超音波によって乳化させた。得られた乳化液を直ちに5%NaClの1%ポリビニルアルコール(PVA)溶液の渦5mLに注ぎ、渦を1分間保持した。次いで、このように形成した乳化液を5%NaClの0.3%PVA溶液20mLに注ぎ、激しく攪拌させた。イソプロパノールの2%溶液25mLを添加し、その混合物を1時間攪拌し続けて完全な抽出を行った。得られた微小球を3000Xgの遠心分離によって集め、水で3回洗浄し、凍結乾燥した。
第2水層として5%NaCl溶液又は更にPEG8000を1%含む5%NaCl溶液を用いて異なった配合の微小球を作成した。混合物を一夜攪拌することによって溶媒を蒸発する溶媒蒸発によって微小球を形成させる他の技術を使用した。
[実施例8] カプセル化効率および充填レベルの評価
微小球を0.5%NaOHで一夜加水分解させた後、FITCを検定してFITC-BSAの充填レベルを測定した。FITC-BSAの量は、FITC-BSA一連の0.5N NaOH溶液を造ることによって描かれた標準曲線と比較した。微小球のカプセル化効率は、蛍光分析法によって溜まったFITC-BSA量を溶液中の初量と比較することによって測定した。カプセル化効率(%)および充填レベル(%)を下記表1に示す。
[実施例9] コポリマーの細胞毒性
P(LAEG-EOP)を含有する微小球を異なった濃度で96−ウエル組織培養板に添加した。次いで、人胃癌細胞(GT3TKB)を104細胞/ウエルの割合で接種した。そして、細胞をウエル中の微小球と共に37℃、48時間培養した。細胞増殖率をMTT検定法によって分析し、その結果を図9に示したように、相対成育%対組織培養ウエル中のコポリマー微小球濃度としてプロットした。
[実施例10] 成形方法の微小球からのFITC-BSA放出効果
本発明の重合体微小球50mgを、PBS10mLを入れたバイアル中に懸濁し、バイアルを培養器中で37℃、220rpm.の回転率で振とうさせた。上澄み液を種々の時点で取り、放出したFITC-BSAの量を492nm、分光光度計によって分析した。その結果を図13に示したように、微小球からのFITC-BSAの累積放出%対時間としてプロットした。
[実施例11] 非溶媒層としてポリビニルアルコールを用いてリドカインを含有するP(LAEG-EOP)微小球の調製
600mLビーカー中でPVA1.05gと脱イオン水210mLと合わせて脱イオン水溶液中のポリビニルアルコール(PVA)0.5%w/v溶液を調製した。その溶液を1時間攪拌し、濾過した。塩化メチレン7mL中にポリマー630mgとリドカイン70mgとを合わせ、渦によって混合してポリマー/薬剤溶液を調製した。PVA溶液をオーバーヘッドミキサーを用いて500rpm.で混合し、これにポリマー/薬剤溶液を滴下した。30分の混合後、冷脱イオン水200mLを攪拌しているPVA溶液に添加した。得られた混合物を全体で3.5時間攪拌した。形成した微小球を濾別、脱イオン水で洗浄し、一夜凍結乾燥した。
このようにしてリドカイン4.2%w/wを充填させた微小球を得た。約10mgの微小球を37℃、振とう機上のホスフェート緩衝食塩水(0.1M,pH7.4)に入れ、きちんとサンプリングした。その結果を図16に示したように、放出したリドカイン%対日数時間としてプロットした。
[実施例12] P(DAEG-EOP)の調製
ポリ(L−ラクチド−コ−エチルホスフェ−ト)のd,lラセミ混合物[「P(DAEG-EOP)」]を実施例1に記載したP(LAEG-EOP)と同様な方法で調製した。
[実施例13] 非溶媒層としてシリコン油を用いてリドカインを有するP(DAEG-EOP)微小球体の調製
「スパン−85」の商品名でアルドリッチから商業的に入手し得るソルビタンートリオレエート2%が、400mLビーカー中で「スパン−85」3mLとシリコン油150mLとを合わせ、500rpm.にセットしたオーバーヘッド攪拌機を用いて混合することによって調製された。上記実施例9で調製した重合体400mgおよびリドカイン100mgを塩化メチレン4.5mLに溶解してP(DAEG-EOP)ポリマー/薬剤溶液を調製した。得られたポリマー/薬剤溶液をシリコン油/スパン混合物に攪拌しながら滴下した。この混合物を1時間15分攪拌した。このようにして形成した微小球を濾別、石油エーテルで洗浄してシリコン油/スパン混合物を除去し、一夜凍結乾燥した。
このようにしてリドカイン7.6%w/wを充填した微小球を得た。約10mgの微小球を37℃、振とう機上のホスフェート緩衝食塩水(0.1M,pH7.4)に入れ、きちんとサンプリングした。その結果を図17に示したように、放出したリドカイン%対日数時間としてプロットした。
[実施例14] マウス腹腔におけるポリ(ホスホエステル)微小球の生物適合性
本発明の生分解性ポリ(ホスホエステル)微小球の生体適合性を次のとおり試験した。
凍結乾燥したポリ(L−ラクチド−コ−エチルホスフェ−ト)微小球30mg/mLの3試料を調製し、第1番目の試料は75ミクロンより大きい直径を有し、第2番目の試料は75〜125ミクロンの範囲内の直径を有し、そして第3番目の試料は125〜250ミクロンの範囲内の直径を有する。各試料を開始体重25gの雌マウス1グループ18匹に腹腔内注入した。各グループの動物を2,7,14日並びに1,2,3ヶ月に秤量、殺し、剖検した。剖検時に検出した障害は0は処置に対して何らの反応を示さず、4は処置に対して激しい反応を示すことを以て0から4の等級で等級をつけた。
炎症障害は腹腔表面あるいは脂肪組織内で微小球と連合しているところに限って観察され、異物単離およびカプセル化には適応した。中皮過形成と局部ないし多局部的に支持する腹膜脂肪織炎2〜7日目に観察されたが、大食細胞浸潤、炎症性巨大細胞の形成並びに後期の殺しでの微小球の繊維状カプセル化によって徐々に分解された。連合した炎症反応と共に微小球の肝臓および横隔膜への時折の付着も見られた。微小球に関連した障害は腹腔または胸器官内で見られなかった。研究期間に亘って検出された微小球は初期の殺しでは透明に見えたが、後期では体内では結晶性物質と発展した。体成育に何らの効果は観察されなかった。腹膜反応は微小球にじかに隣接している場所に限って観察されたが、主要な胸または腹腔器官にはっきりとした有害効果は全く伴わなかった。
本発明はこのように記されていることから、同様なことが種々の方法で変更し得よう。そのような変更は本発明の精神および範囲から逸脱したものと見做されるべきではなく、あらゆるそのような変更は次のクレームの範囲内に包含するものと意図している。
Claims (38)
- 1.式IまたはII
式中、
Xは−O−またはR’がHまたはアルキルである−NR’−であり、
M1およびM2はそれぞれ独立して(1)炭素原子数1〜20を有する分岐鎖または直鎖の脂肪族基または(2)炭素原子数1〜20を有する分岐鎖または直鎖のオキシ−、カルボキシ−またはアミノ−脂肪族基であって、これらのオキシ−、カルボキシ−またはアミノ−は水素原子がとれて二価になっていてもよく、
Yは−O−、−S−または−NR’−であり、
Lは炭素原子数1〜20を有する分岐鎖または直鎖の脂肪族基であり、
RはH、アルキル、アルコキシ、アリール、アリールオキシ、複素環式基またはヘテロシクロオキシであり、
x:yのモル比は1であり、
n:(xまたはy)のモル比は200:1と1:200の間であり、そして、
q:rのモル比は1:99と99:1の間である。
にて示される繰返しモノマー単位よりなる、生分解前および生分解時に生体適合性を有する生分解性ポリマー - Rがアルキル基、アルコキシ基、フェニル基、フェノキシ基またはヘテロシクロオキシ基である請求項1のポリマー
- Rが1から7の炭素原子数を有するアルコキシ基である請求項1のポリマー
- M1およびM2の各々が分岐鎖または直鎖のアルキレン基である請求項1のポリマー
- M1およびM2のうちの少なくとも一つが、式
−CHR2−CO−O−CHR3−
式中、R2およびR3はそれぞれ独立してH、アルキル、アルコキシ、アリール、アリールオキシ、複素環式基またはヘテロシクロオキシである。
を有する請求項1のポリマー - Xが−O−である請求項1のポリマー
- M1およびM2の各々がアルキレン基またはアルコキシレン基であり、Lがアルキレン基であり、Xが−O−であり、そしてRがアルコキシ基である請求項1のポリマー
- n:(xまたはy)のモル比が100:1と1:100の間にある請求項1のポリマー
- 式IまたはII
式中:
Xは−O−またはR’がHまたはアルキルである−NR’−であり、
M1およびM2はそれぞれ独立して(1)炭素原子数1〜20を有する分岐鎖または直鎖の脂肪族基または(2)炭素原子数1〜20を有する分岐鎖または直鎖のオキシ−、カルボキシ−またはアミノ−脂肪族基であって、これらのオキシ−、カルボキシ−またはアミノ−は水素原子がとれて二価になっていてもよく、
Yは−O−、−S−または−NR’−であり、
Lは炭素原子数1〜20を有する分岐鎖または直鎖の脂肪族基であり、
RはH、アルキル、アルコキシ、アリール、アリールオキシ、複素環式基またはヘテロシクロキシであり、
x:yのモル比は1であり、
n:(xまたはy)のモル比は200:1と1:200の間であり、そして、
q:rのモル比は1:99と99:1の間である。
にて示される繰返しモノマー単位よりなる、生分解前および生分解中、生体適合性を有する生分解ポリマーの製造方法であって、
(a) 式III、IVまたはV
式中、M1、M2およびXは上記に定義したとおりである。
を有する複素環式化合物のうちの少なくとも1種と、式
H−Y−L−Y−H
式中、YおよびLは上記に定義したとおりである。
を有する開始剤とを反応させて下記に示した式VIまたはVIIのプレポリマーを生成させ、
式中、X、M1、M2、Y、L、x、y、qおよびrは上記に定義したとおりである。
(b) さらに式VIまたはVIIの該プレポリマーを式VIII
「halo」はBr、ClまたはIであり、Rは上記に定義したとおりである。
を有するホスホロジハリデートを反応させて式IまたはIIの該ポリマーを生成させる工程かるなる前記生分解性ポリマーの製造方法 - M1およびM2の各々がアルキレン基またはアルコキシレン基であり、Lがアルキレン基であり、Xが−O−であり、そしてRがアルコキシ基である請求項9の方法
- 請求項1のポリマーからなる移植可能な器具用のコーティング材
- 次の成分からなる生分解性ポリマー組成物:
(a) 少なくとも一つの生物学的に活性な物質および
(b) 式IまたはII
式中、
Xは−O−またはR’がHまたはアルキルである−NR’−であり、
M1およびM2はそれぞれ独立して(1)炭素原子数1〜20を有する分岐鎖または直鎖の脂肪族基または(2)炭素原子数1〜20を有する分岐鎖または直鎖のオキシ−、カルボキシ−またはアミノ−脂肪族基であって、これらのオキシ−、カルボキシ−またはアミノ−は水素原子がとれて二価になっていてもよく、
Yは−O−、−S−または−NR’−であり、
Lは炭素原子数1〜20を有する分岐鎖または直鎖の脂肪族基であり、
RはH、アルキル、アルコキシ、アリール、アリールオキシ、複素環式基またはヘテロシクロキシであり、
x:yのモル比は1であり、
n:(xまたはy)のモル比は200:1と1:200の間であり、そして、
q:rのモル比は1:99と99:1の間である。
にて示される繰返しモノマー単位よりなる、生分解前および生分解時に生体適合性を有する生分解性ポリマー - Rがアルキル基、アルコキシ基、フェニル基、フェノキシ基またはヘテロシクロオキシ基である請求項12のポリマー組成物
- Rがアルコキシ基である請求項12のポリマー組成物
- M1およびM2のうちの少なくとも一つが、式
−CHR2−CO−O−CHR3−
式中、R2およびR3はそれぞれ独立してH、アルキル、
アルコキシ、アリール、アリールオキシ、複素環式基またはヘテロシクロオキシである。
を有する請求項12のポリマー組成物 - Xが−O−である請求項12のポリマー組成物
- M1およびM2は各々アルキレン基またはアルコキシレン基であり、Lがアルキレン基であり、Xが−O−であり、そしてRがアルコキシ基である請求項12のポリマー組成物
- n:(xまたはy)のモル比が100:1から1:100まである請求項12のポリマー組成物
- 生物学的に活性な物質が多糖類、発育因子、ホルモン、抗脈管形成因子、インターフェロン又はサイトカイン及びこれら物質のプロ医薬よりなる群から選ばれる請求項12のポリマー組成物
- 生物学的に活性な物質が治療薬またはプロ医薬である請求項12のポリマー組成物
- 該医薬が抗新生物剤、抗生物質、抗ウイルス剤、抗菌剤、抗炎症剤及び抗凝固剤からなる群より選ばれる請求項20のポリマー組成物
- 抗新生物剤がパクリタキセルである請求項21のポリマー組成物
- 該生物学的に活性な物質と該ポリマーは均一なマトリックスを形成している請求項12のポリマー組成物
- 移植、注入あるいは別の手段によって体内に全体的にまたは部分的に配置されるのに有用な物品であって、次の成分からなる生分解性ポリマー組成物からなる物品:
(a) 少なくとも一つの生物学的に活性な物質および
(b) 式IまたはII
式中、
Xは−O−またはR’がHまたはアルキルである−NR’−であり、
M1およびM2はそれぞれ独立して(1)炭素原子数1〜20を有する分岐鎖または直鎖の脂肪族基または(2)炭素原子数1〜20を有する分岐鎖または直鎖のオキシ−、カルボキシ−またはアミノ−脂肪族基であって、これらのオキシ−、カルボキシ−またはアミノ−は水素原子がとれて二価になっていてもよく、
Yは−O−、−S−または−NR’−であり、
Lは炭素原子数1〜20を有する分岐鎖または直鎖の脂肪族基であり、
RはH、アルキル、アルコキシ、アリール、アリールオキシ、複素環式基またはヘテロシクロオキシであり、
x:yのモル比は1であり、
n:(xまたはy)のモル比は200:1と1:200の間であり、そして、
q:rのモル比は1:99と99:1の間である。
にて示される繰返しモノマー単位よりなる、生分解前および生分解時に生体適合性を有する生分解性ポリマー - Rがアルキル基、アルコキシ基、フェニル基、フェノキシ基またはヘテロシクロキシ基である請求項24の物品
- Rがアルコキシ基である請求項24の物品
- M1およびM2のうちの少なくとも一つが、式
−CHR2−CO−O−CHR3−
式中、R2およびR3はそれぞれ独立してH、アルキル、アルコキシ、アリール、アリールオキシ、複素環式基またはヘテロシクロキシである。
を有する請求項24の物品 - Xが−O−である請求項24の物品
- M1およびM2は各々アルキレン基またはアルコキシレン基であり、Lがアルキレン基であり、Xが−O−であり、そしてRがアルコキシ基である請求項24の物品
- 生物学的に活性な物質が多糖類、発育因子、ホルモン、抗脈管形成因子、インターフェロンまたはサイトカイン及びこれらの物質のプロ医薬よりなる群から選ばれる請求項24の物品
- 生物学的に活性な物質が治療薬またはプロ医薬である請求項24の物品
- 該医薬が抗新生物剤、抗生物質、抗ウイルス剤、抗菌剤、抗炎症剤、抗凝固剤及びこれらの物質のプロ医薬からなる群より選ばれる請求項24の物品
- 抗新生物剤がパクリタキセルである請求項24の物品
- 該生物学的に活性な物質と該ポリマーは均一なマトリックスを形成している請求項24の物品
- 該生物学的に活性な物質が該ポリマー内でカプセル化されている請求項24の物品
- 該物品が微小球である請求項24項の物品
- 該物品が分解性織物の積層物に形成されている請求項24の物品
- 該物品が吸収性の縫合剤、骨障害の修復用材料または移植器具の被覆材に形成されている請求項24の物品
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US83221797A | 1997-04-03 | 1997-04-03 | |
| US08/832,217 | 1997-04-03 | ||
| PCT/US1998/006380 WO1998044020A1 (en) | 1997-04-03 | 1998-04-02 | Biodegradable polymers chain-extended by phosphates, compositions, articles and methods for making and using the same |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2001521561A JP2001521561A (ja) | 2001-11-06 |
| JP2001521561A5 JP2001521561A5 (ja) | 2005-11-24 |
| JP4170399B2 true JP4170399B2 (ja) | 2008-10-22 |
Family
ID=25261018
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP54194898A Expired - Fee Related JP4170399B2 (ja) | 1997-04-03 | 1998-04-02 | ホスフェートによって鎖延長化された生分解性ポリマー、組成物、物品、並びにその製造及び使用方法 |
Country Status (18)
| Country | Link |
|---|---|
| US (3) | US6166173A (ja) |
| EP (1) | EP0971969B1 (ja) |
| JP (1) | JP4170399B2 (ja) |
| KR (1) | KR20010006041A (ja) |
| CN (1) | CN1107687C (ja) |
| AT (1) | ATE271084T1 (ja) |
| AU (1) | AU742110B2 (ja) |
| BR (1) | BR9809390A (ja) |
| CA (1) | CA2285909C (ja) |
| DE (1) | DE69825040T2 (ja) |
| HK (1) | HK1027366A1 (ja) |
| HU (1) | HUP0001412A2 (ja) |
| IL (1) | IL132122A0 (ja) |
| NO (1) | NO994803L (ja) |
| NZ (1) | NZ500674A (ja) |
| RU (1) | RU2207350C2 (ja) |
| UA (1) | UA54505C2 (ja) |
| WO (1) | WO1998044020A1 (ja) |
Families Citing this family (72)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6495579B1 (en) | 1996-12-02 | 2002-12-17 | Angiotech Pharmaceuticals, Inc. | Method for treating multiple sclerosis |
| US6355705B1 (en) * | 1997-02-07 | 2002-03-12 | Queen's University At Kingston | Anaesthetic bone cement |
| US6713527B2 (en) | 1997-02-07 | 2004-03-30 | Queen's University At Kingston | Anaesthetic bone cement |
| UA54505C2 (uk) * | 1997-04-03 | 2003-03-17 | Гілфорд Фармасьютікалз Інк. | Полімери, що біологічно розкладаються, зшиті фосфатами, композиції, вироби і способи для їх виготовлення і використання |
| AU749644B2 (en) * | 1997-04-30 | 2002-06-27 | Guilford Pharmaceuticals Inc. | Biodegradable compositions comprising poly(cycloaliphatic phosphoester) compounds, articles, and methods for using the same |
| WO1999065531A1 (en) | 1998-06-18 | 1999-12-23 | Johns Hopkins University School Of Medicine | Polymers for delivery of nucleic acids |
| US6419709B1 (en) | 1998-10-02 | 2002-07-16 | Guilford Pharmaceuticals, Inc. | Biodegradable terephthalate polyester-poly(Phosphite) compositions, articles, and methods of using the same |
| US6350464B1 (en) | 1999-01-11 | 2002-02-26 | Guilford Pharmaceuticals, Inc. | Methods for treating ovarian cancer, poly (phosphoester) compositions, and biodegradable articles for same |
| US6348042B1 (en) * | 1999-02-02 | 2002-02-19 | W. Lee Warren, Jr. | Bioactive shunt |
| US6537585B1 (en) * | 1999-03-26 | 2003-03-25 | Guilford Pharmaceuticals, Inc. | Methods and compositions for treating solid tumors |
| US6461631B1 (en) | 1999-11-16 | 2002-10-08 | Atrix Laboratories, Inc. | Biodegradable polymer composition |
| AU2001247346A1 (en) * | 2000-03-10 | 2001-09-24 | Johns Hopkins University | Phosphate based biodegradable polymers |
| WO2002004544A2 (en) * | 2000-07-06 | 2002-01-17 | Guilford Pharmaceuticals | Polymers and polymerization processes |
| US20020041897A1 (en) * | 2000-07-07 | 2002-04-11 | Wenbin Dang | Compositions for sustained release of antineoplastic taxanes, and methods of making and using the same |
| WO2002005800A2 (en) * | 2000-07-17 | 2002-01-24 | Guilford Pharmaceuticals, Inc. | Compositions for sustained release of analgesic agents, and methods of making and using the same |
| US7666445B2 (en) * | 2000-10-20 | 2010-02-23 | The Trustees Of The University Of Pennsylvania | Polymer-based surgically implantable haloperidol delivery systems and methods for their production and use |
| US20020141966A1 (en) * | 2000-11-16 | 2002-10-03 | Wenbin Dang | Compositions for treatment of malignant effusions, and methods of making and using the same |
| US6527693B2 (en) | 2001-01-30 | 2003-03-04 | Implant Sciences Corporation | Methods and implants for providing radiation to a patient |
| US6590059B2 (en) | 2001-05-11 | 2003-07-08 | Ap Pharma, Inc. | Bioerodible polyorthoesters from dioxolane-based diketene acetals |
| US7417110B2 (en) * | 2001-05-14 | 2008-08-26 | Jun Wang | Biodegradable polyphosphoramidates for controlled release of bioactive substances |
| US7345138B2 (en) * | 2001-05-14 | 2008-03-18 | Johns Hopkins Singapore Pte Ltd. | Biodegradable polyphosphates for controlled release of bioactive substances |
| US20030134892A1 (en) * | 2001-07-19 | 2003-07-17 | Wenbin Dang | Compositions for treatment of head and neck cancers, and methods of making and using the same |
| AU2002354957A1 (en) * | 2001-07-19 | 2003-03-03 | Guilford Pharmaceuticals, Inc. | Biocompatible polymer containing composition for treatment of prostate cancers |
| AUPR951501A0 (en) * | 2001-12-14 | 2002-01-24 | Smart Drug Systems Inc | Modified sustained release pharmaceutical system |
| WO2003060799A2 (en) * | 2002-01-09 | 2003-07-24 | Guilford Pharmaceuticals, Inc. | Compositions for treatment of central nervous system neoplasms, and methods of making and using the same |
| US7479535B2 (en) * | 2002-02-25 | 2009-01-20 | Guilford Pharmaceuticals, Inc. | Phosphorous-containing compounds with polymeric chains, and methods of making and using the same |
| FR2839260B1 (fr) * | 2002-05-03 | 2005-02-25 | Inst Nat Sante Rech Med | Microparticules a base d'un materiau bicompatible et biodegradable, supportant des cellules et des substances biologiquement actives |
| US20050129776A1 (en) * | 2002-05-03 | 2005-06-16 | Inserm | Microparticles supporting cells and active substances |
| US20090004741A1 (en) * | 2002-05-14 | 2009-01-01 | Jun Wang | Biodegradable polyphosphoramidates for controlled release of bioactive substances |
| CN100341589C (zh) | 2002-05-24 | 2007-10-10 | 血管技术国际股份公司 | 用于涂覆医用植入物的组合物和方法 |
| US8313760B2 (en) | 2002-05-24 | 2012-11-20 | Angiotech International Ag | Compositions and methods for coating medical implants |
| US7041309B2 (en) * | 2002-06-13 | 2006-05-09 | Neuropro Technologies, Inc. | Spinal fusion using an HMG-CoA reductase inhibitor |
| SE0202619D0 (sv) * | 2002-09-05 | 2002-09-05 | Fredrik Nederberg | New Polymers and Applications |
| US20040197301A1 (en) * | 2003-02-18 | 2004-10-07 | Zhong Zhao | Hybrid polymers and methods of making the same |
| US20050209664A1 (en) * | 2003-11-20 | 2005-09-22 | Angiotech International Ag | Electrical devices and anti-scarring agents |
| AU2004293030A1 (en) * | 2003-11-20 | 2005-06-09 | Angiotech International Ag | Electrical devices and anti-scarring agents |
| US8329203B2 (en) * | 2004-01-12 | 2012-12-11 | The Trustees Of The University Of Pennsylvania | Drug-containing implants and methods of use thereof |
| EP1711124A4 (en) * | 2004-01-12 | 2011-06-01 | Univ Pennsylvania | LONG-TERM RELEASE PREPARATIONS AND METHODS OF USE THEREOF |
| US8221778B2 (en) | 2005-01-12 | 2012-07-17 | The Trustees Of The University Of Pennsylvania | Drug-containing implants and methods of use thereof |
| US8119153B2 (en) * | 2004-08-26 | 2012-02-21 | Boston Scientific Scimed, Inc. | Stents with drug eluting coatings |
| ATE421547T1 (de) * | 2004-12-22 | 2009-02-15 | California Inst Of Techn | Abbaubare polymere und herstellungsverfahren dafür |
| US7237497B2 (en) * | 2005-01-13 | 2007-07-03 | Card-Monroe Corp. | Replaceable hook modules |
| US7608612B2 (en) * | 2005-01-21 | 2009-10-27 | Richard H. Matthews | Radiosensitizer formulations and methods for use |
| AU2005100176A4 (en) * | 2005-03-01 | 2005-04-07 | Gym Tv Pty Ltd | Garbage bin clip |
| US7669732B2 (en) * | 2005-10-25 | 2010-03-02 | Imi Cornelius Inc. | Cup lid dispenser |
| EP1808380A1 (fr) * | 2006-01-13 | 2007-07-18 | Pepup S.A. | Récipient souple pour liquide et méthode pour sa fabrication |
| CN103122132B (zh) | 2006-07-20 | 2016-03-16 | 奥巴斯尼茨医学公司 | 用于医疗器械的可生物吸收聚合物组合物 |
| US20090169628A1 (en) * | 2006-10-17 | 2009-07-02 | Armark Authentication Technologies, Llc | Article and method for focused delivery of therapeutic and/or diagnostic materials |
| EP2073754A4 (en) | 2006-10-20 | 2012-09-26 | Orbusneich Medical Inc | BIOABSORBABLE POLYMER COMPOSITION AND MEDICAL DEVICE BACKGROUND |
| US7959942B2 (en) | 2006-10-20 | 2011-06-14 | Orbusneich Medical, Inc. | Bioabsorbable medical device with coating |
| JP2008138051A (ja) * | 2006-11-30 | 2008-06-19 | Terumo Corp | α−ヒドロキシ酸重合体組成物およびそれを用いた成形品の製造方法 |
| WO2008098220A1 (en) * | 2007-02-08 | 2008-08-14 | University Of Washington | Biocompatile amino acid anhydride polymers |
| US8133553B2 (en) | 2007-06-18 | 2012-03-13 | Zimmer, Inc. | Process for forming a ceramic layer |
| US8309521B2 (en) | 2007-06-19 | 2012-11-13 | Zimmer, Inc. | Spacer with a coating thereon for use with an implant device |
| CN101125916B (zh) * | 2007-06-26 | 2010-06-23 | 天大药业(珠海)有限公司 | 一种生物降解聚合物及其制备方法和应用 |
| US8608049B2 (en) | 2007-10-10 | 2013-12-17 | Zimmer, Inc. | Method for bonding a tantalum structure to a cobalt-alloy substrate |
| JP2009096720A (ja) * | 2007-10-12 | 2009-05-07 | Idemitsu Kosan Co Ltd | 生分解性液状エステル化合物 |
| WO2009088777A1 (en) * | 2007-12-31 | 2009-07-16 | Armark Authentication Technologies, Llc | Article and method for focused delivery of therapeutic and/or diagnostic materials |
| WO2009143236A1 (en) * | 2008-05-20 | 2009-11-26 | Albert Einstein Healthcare Network | Compositions and methods for the treatment of skeletal metastatic lesions and fractures |
| EP2305733A4 (en) * | 2008-07-24 | 2015-01-28 | Toyo Boseki | ALIPHATIC POLYESTER RESIN AND METHOD FOR THE PRODUCTION THEREOF |
| US20100078848A1 (en) * | 2008-09-29 | 2010-04-01 | Armark Authentication Technologies, Llc | Spinneret and method of spinning fiber |
| US20100291214A1 (en) * | 2008-12-23 | 2010-11-18 | Armark Authentication Technologies, Llc | Three-dimensional microfiber extrudate structure and process for forming three-dimensional microfiber extrudate structure |
| US9414864B2 (en) | 2009-04-15 | 2016-08-16 | Warsaw Orthopedic, Inc. | Anterior spinal plate with preformed drug-eluting device affixed thereto |
| US9078712B2 (en) | 2009-04-15 | 2015-07-14 | Warsaw Orthopedic, Inc. | Preformed drug-eluting device to be affixed to an anterior spinal plate |
| WO2010132763A1 (en) * | 2009-05-15 | 2010-11-18 | Armark Authentication Technologies, Llc | Fiber having non-uniform composition and method for making same |
| US9636109B2 (en) * | 2009-07-22 | 2017-05-02 | Wisconsin Alumni Research Foundation | Biologically active sutures for regenerative medicine |
| WO2015147923A1 (en) | 2010-03-03 | 2015-10-01 | Novabone Products, Llc | Kit for delivering bone grafting materials |
| US9144629B2 (en) | 2010-03-03 | 2015-09-29 | Novabone Products, Llc | Ionically crosslinked materials and methods for production |
| EP2542187B1 (en) | 2010-03-03 | 2019-11-20 | Novabone Products, LLC | Composition for the regeneration of bony defects |
| CN103371857A (zh) * | 2012-04-12 | 2013-10-30 | 北京汇福康医疗技术有限公司 | 复合型生物套管及其制备方法和应用 |
| US8907050B2 (en) * | 2012-05-11 | 2014-12-09 | University Of South Carolina | Polymeric additive for strength, deformability, and toughness enhancement of cemetitious materials and composites |
| US10066204B2 (en) | 2013-03-15 | 2018-09-04 | Wisconsin Alumni Research Foundation | Chemically labile peptide-presenting surfaces for cellular self-assembly |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3442982A (en) * | 1965-10-15 | 1969-05-06 | Weston Chemical Corp | Polyphosphites of 2,2-dimethyl-3-hydroxypropyl - 2 - dimethyl - 3-hydroxypropionate |
| US4746462A (en) * | 1985-02-21 | 1988-05-24 | Dainichiseika Color & Chemicals Mfg. Co., Ltd. | Phosphoric ester compound |
| US5194581A (en) * | 1989-03-09 | 1993-03-16 | Leong Kam W | Biodegradable poly(phosphoesters) |
| US5256765A (en) * | 1989-03-09 | 1993-10-26 | The Johns Hopkins University School Of Medicine | Biodegradable poly(phosphate esters) |
| DE4404365A1 (de) * | 1994-02-11 | 1995-08-17 | Cassella Ag | Phosphin- und phosphonsäuregruppenhaltige Polykondensate |
| JP3155013B2 (ja) | 1996-04-23 | 2001-04-09 | キナートン・リミテッド | 酸性ポリ乳酸ポリマー |
| UA54505C2 (uk) * | 1997-04-03 | 2003-03-17 | Гілфорд Фармасьютікалз Інк. | Полімери, що біологічно розкладаються, зшиті фосфатами, композиції, вироби і способи для їх виготовлення і використання |
| JP2002515939A (ja) | 1997-06-18 | 2002-05-28 | ギルフォード ファーマシュウティカルズ インコーポレイテッド | 高分子量ポリホスホエステルの2段溶液重合法 |
| US6028163A (en) | 1997-06-27 | 2000-02-22 | Guilford Pharmaceuticals Inc. | Solution polymerization of high molecular weight poly(phosphoesters) in toluene |
-
1998
- 1998-02-04 UA UA99105931A patent/UA54505C2/uk unknown
- 1998-04-02 CN CN98805196A patent/CN1107687C/zh not_active Expired - Fee Related
- 1998-04-02 JP JP54194898A patent/JP4170399B2/ja not_active Expired - Fee Related
- 1998-04-02 RU RU99123428/04A patent/RU2207350C2/ru not_active IP Right Cessation
- 1998-04-02 AU AU69449/98A patent/AU742110B2/en not_active Ceased
- 1998-04-02 KR KR1019997009119A patent/KR20010006041A/ko active IP Right Grant
- 1998-04-02 BR BR9809390-8A patent/BR9809390A/pt not_active Application Discontinuation
- 1998-04-02 IL IL13212298A patent/IL132122A0/xx unknown
- 1998-04-02 US US09/053,649 patent/US6166173A/en not_active Expired - Fee Related
- 1998-04-02 EP EP98915207A patent/EP0971969B1/en not_active Expired - Lifetime
- 1998-04-02 CA CA002285909A patent/CA2285909C/en not_active Expired - Fee Related
- 1998-04-02 NZ NZ500674A patent/NZ500674A/en not_active IP Right Cessation
- 1998-04-02 WO PCT/US1998/006380 patent/WO1998044020A1/en active IP Right Grant
- 1998-04-02 HU HU0001412A patent/HUP0001412A2/hu unknown
- 1998-04-02 AT AT98915207T patent/ATE271084T1/de not_active IP Right Cessation
- 1998-04-02 DE DE69825040T patent/DE69825040T2/de not_active Expired - Lifetime
-
1999
- 1999-10-01 NO NO994803A patent/NO994803L/no not_active Application Discontinuation
-
2000
- 2000-09-01 US US09/654,326 patent/US6376644B1/en not_active Expired - Lifetime
- 2000-10-10 HK HK00106411A patent/HK1027366A1/xx not_active IP Right Cessation
-
2002
- 2002-01-15 US US10/047,941 patent/US20020151617A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| NZ500674A (en) | 2002-02-01 |
| UA54505C2 (uk) | 2003-03-17 |
| CA2285909A1 (en) | 1998-10-08 |
| IL132122A0 (en) | 2001-03-19 |
| WO1998044020A1 (en) | 1998-10-08 |
| RU2207350C2 (ru) | 2003-06-27 |
| US6166173A (en) | 2000-12-26 |
| DE69825040D1 (de) | 2004-08-19 |
| JP2001521561A (ja) | 2001-11-06 |
| CN1256701A (zh) | 2000-06-14 |
| BR9809390A (pt) | 2000-06-13 |
| AU6944998A (en) | 1998-10-22 |
| CA2285909C (en) | 2008-07-29 |
| NO994803D0 (no) | 1999-10-01 |
| EP0971969B1 (en) | 2004-07-14 |
| HUP0001412A2 (hu) | 2000-08-28 |
| US6376644B1 (en) | 2002-04-23 |
| KR20010006041A (ko) | 2001-01-15 |
| ATE271084T1 (de) | 2004-07-15 |
| HK1027366A1 (en) | 2001-01-12 |
| NO994803L (no) | 1999-12-03 |
| AU742110B2 (en) | 2001-12-20 |
| DE69825040T2 (de) | 2005-09-08 |
| CN1107687C (zh) | 2003-05-07 |
| EP0971969A1 (en) | 2000-01-19 |
| US20020151617A1 (en) | 2002-10-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4170399B2 (ja) | ホスフェートによって鎖延長化された生分解性ポリマー、組成物、物品、並びにその製造及び使用方法 | |
| JP4496316B2 (ja) | 生分解性テレフタレートポリエステル−ポリホスフェートポリマー、組成物、物品、並びにその製造及び使用方法 | |
| US6485737B1 (en) | Biodegradable terephthalate polyester-poly (phosphonate) compositions, articles and methods of using the same | |
| JP2002500640A (ja) | ポリ脂環式ホスホエステル化合物よりなる生分解性組成物、物品、及びその使用方法 | |
| JP2011219483A (ja) | 固型腫瘍の治療方法及び組成物 | |
| JP2002508799A (ja) | トルエン中での高分子量ポリホスホエステルの溶液重合法 | |
| JP2002526396A (ja) | 生分解性テレフタレートポリエステル−ポリホスホネートとポリエステル−ポリホスファイトの組成物、物品、及びそれらの使用方法 | |
| AU779010B2 (en) | Biodegradable polymers chain-extended by phosphates, compositions, articles and methods for making and using the same | |
| MXPA99009126A (en) | Biodegradable polymers chain-extended by phosphates, compositions, articles and methods for making and using the same | |
| MXPA01003418A (en) | Biodegradable terephthalate polyester-poly(phosphonate) and polyester-poly(phosphite) compositions, articles, and methods of using them | |
| MXPA99009127A (en) | Biodegradable terephthalate polyester-poly(phosphate) polymers, compositions, articles, and methods for making and using the same | |
| MXPA99010107A (en) | Biodegradable compositions comprising poly(cycloaliphatic phosphoester) compounds, articles, and methods for using the same |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20050401 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20070327 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20070308 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20070627 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070703 |
|
| A524 | Written submission of copy of amendment under article 19 pct |
Free format text: JAPANESE INTERMEDIATE CODE: A524 Effective date: 20070703 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20070813 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20080722 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20080807 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110815 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110815 Year of fee payment: 3 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313115 Free format text: JAPANESE INTERMEDIATE CODE: R313117 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110815 Year of fee payment: 3 |
|
| R360 | Written notification for declining of transfer of rights |
Free format text: JAPANESE INTERMEDIATE CODE: R360 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110815 Year of fee payment: 3 |
|
| R370 | Written measure of declining of transfer procedure |
Free format text: JAPANESE INTERMEDIATE CODE: R370 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110815 Year of fee payment: 3 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313117 |
|
| S533 | Written request for registration of change of name |
Free format text: JAPANESE INTERMEDIATE CODE: R313533 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110815 Year of fee payment: 3 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110815 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120815 Year of fee payment: 4 |
|
| LAPS | Cancellation because of no payment of annual fees |