JP2020519645A - 脂肪組織由来幹細胞による多発性硬化症の治療 - Google Patents
脂肪組織由来幹細胞による多発性硬化症の治療 Download PDFInfo
- Publication number
- JP2020519645A JP2020519645A JP2019562579A JP2019562579A JP2020519645A JP 2020519645 A JP2020519645 A JP 2020519645A JP 2019562579 A JP2019562579 A JP 2019562579A JP 2019562579 A JP2019562579 A JP 2019562579A JP 2020519645 A JP2020519645 A JP 2020519645A
- Authority
- JP
- Japan
- Prior art keywords
- hadsc
- cells
- adipose tissue
- pellet
- tissue
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 210000000577 adipose tissue Anatomy 0.000 title claims abstract description 86
- 210000000130 stem cell Anatomy 0.000 title claims abstract description 41
- 201000006417 multiple sclerosis Diseases 0.000 title claims description 46
- 238000011282 treatment Methods 0.000 title claims description 24
- 238000000034 method Methods 0.000 claims abstract description 76
- 210000003169 central nervous system Anatomy 0.000 claims abstract description 28
- 210000004027 cell Anatomy 0.000 claims description 170
- 239000008188 pellet Substances 0.000 claims description 38
- 238000005119 centrifugation Methods 0.000 claims description 30
- 210000003743 erythrocyte Anatomy 0.000 claims description 26
- 210000001519 tissue Anatomy 0.000 claims description 26
- 239000000725 suspension Substances 0.000 claims description 25
- 239000002609 medium Substances 0.000 claims description 22
- 230000008014 freezing Effects 0.000 claims description 20
- 238000007710 freezing Methods 0.000 claims description 20
- 102100022464 5'-nucleotidase Human genes 0.000 claims description 18
- 101000678236 Homo sapiens 5'-nucleotidase Proteins 0.000 claims description 18
- 101000738771 Homo sapiens Receptor-type tyrosine-protein phosphatase C Proteins 0.000 claims description 18
- 101000800116 Homo sapiens Thy-1 membrane glycoprotein Proteins 0.000 claims description 18
- 102100037422 Receptor-type tyrosine-protein phosphatase C Human genes 0.000 claims description 18
- 102100033523 Thy-1 membrane glycoprotein Human genes 0.000 claims description 18
- 102100037241 Endoglin Human genes 0.000 claims description 17
- 101000881679 Homo sapiens Endoglin Proteins 0.000 claims description 17
- 230000003833 cell viability Effects 0.000 claims description 17
- 238000010257 thawing Methods 0.000 claims description 17
- 102100024222 B-lymphocyte antigen CD19 Human genes 0.000 claims description 16
- 102100032912 CD44 antigen Human genes 0.000 claims description 16
- 101000980825 Homo sapiens B-lymphocyte antigen CD19 Proteins 0.000 claims description 16
- 101000868273 Homo sapiens CD44 antigen Proteins 0.000 claims description 16
- 238000001914 filtration Methods 0.000 claims description 16
- 102000004190 Enzymes Human genes 0.000 claims description 15
- 108090000790 Enzymes Proteins 0.000 claims description 15
- 101001046686 Homo sapiens Integrin alpha-M Proteins 0.000 claims description 15
- 102100022338 Integrin alpha-M Human genes 0.000 claims description 15
- 229940088598 enzyme Drugs 0.000 claims description 15
- 230000000750 progressive effect Effects 0.000 claims description 15
- 210000004003 subcutaneous fat Anatomy 0.000 claims description 15
- 238000005406 washing Methods 0.000 claims description 15
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims description 14
- 102000006354 HLA-DR Antigens Human genes 0.000 claims description 14
- 108010058597 HLA-DR Antigens Proteins 0.000 claims description 14
- 238000000185 intracerebroventricular administration Methods 0.000 claims description 13
- 102100031573 Hematopoietic progenitor cell antigen CD34 Human genes 0.000 claims description 12
- 101000777663 Homo sapiens Hematopoietic progenitor cell antigen CD34 Proteins 0.000 claims description 12
- 206010063401 primary progressive multiple sclerosis Diseases 0.000 claims description 12
- 238000012258 culturing Methods 0.000 claims description 11
- 102000029816 Collagenase Human genes 0.000 claims description 10
- 108060005980 Collagenase Proteins 0.000 claims description 10
- 239000000872 buffer Substances 0.000 claims description 10
- 229960002424 collagenase Drugs 0.000 claims description 10
- 238000007913 intrathecal administration Methods 0.000 claims description 8
- 238000004113 cell culture Methods 0.000 claims description 7
- 239000001963 growth medium Substances 0.000 claims description 7
- 239000007788 liquid Substances 0.000 claims description 7
- 229910052757 nitrogen Inorganic materials 0.000 claims description 7
- 201000008628 secondary progressive multiple sclerosis Diseases 0.000 claims description 7
- 208000007118 chronic progressive multiple sclerosis Diseases 0.000 claims description 6
- 238000007914 intraventricular administration Methods 0.000 claims description 4
- 239000012808 vapor phase Substances 0.000 claims description 4
- 239000008004 cell lysis buffer Substances 0.000 claims description 3
- 108010007093 dispase Proteins 0.000 claims description 3
- 238000000926 separation method Methods 0.000 claims description 3
- 239000008194 pharmaceutical composition Substances 0.000 claims 1
- 241000894007 species Species 0.000 claims 1
- 230000008569 process Effects 0.000 abstract description 7
- 206010053395 Progressive multiple sclerosis Diseases 0.000 abstract description 5
- 238000010586 diagram Methods 0.000 abstract 1
- 239000000523 sample Substances 0.000 description 27
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 20
- 201000002491 encephalomyelitis Diseases 0.000 description 20
- 239000003814 drug Substances 0.000 description 19
- 210000002901 mesenchymal stem cell Anatomy 0.000 description 19
- 229940079593 drug Drugs 0.000 description 18
- 241001465754 Metazoa Species 0.000 description 16
- 201000010099 disease Diseases 0.000 description 16
- 238000002955 isolation Methods 0.000 description 14
- 238000004458 analytical method Methods 0.000 description 13
- 230000009089 cytolysis Effects 0.000 description 13
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 11
- 241000699670 Mus sp. Species 0.000 description 10
- 230000000694 effects Effects 0.000 description 10
- 239000012139 lysis buffer Substances 0.000 description 10
- 208000024891 symptom Diseases 0.000 description 10
- 239000003550 marker Substances 0.000 description 9
- 108010000123 Myelin-Oligodendrocyte Glycoprotein Proteins 0.000 description 8
- 102100023302 Myelin-oligodendrocyte glycoprotein Human genes 0.000 description 8
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 8
- 239000000203 mixture Substances 0.000 description 8
- 239000004033 plastic Substances 0.000 description 8
- 230000001464 adherent effect Effects 0.000 description 7
- 210000004556 brain Anatomy 0.000 description 7
- 238000002347 injection Methods 0.000 description 7
- 239000007924 injection Substances 0.000 description 7
- 238000007443 liposuction Methods 0.000 description 7
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 6
- 241000699666 Mus <mouse, genus> Species 0.000 description 6
- KKGQTZUTZRNORY-UHFFFAOYSA-N fingolimod Chemical compound CCCCCCCCC1=CC=C(CCC(N)(CO)CO)C=C1 KKGQTZUTZRNORY-UHFFFAOYSA-N 0.000 description 6
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 6
- 230000001684 chronic effect Effects 0.000 description 5
- 229960000556 fingolimod Drugs 0.000 description 5
- 238000004519 manufacturing process Methods 0.000 description 5
- 239000006228 supernatant Substances 0.000 description 5
- 230000001225 therapeutic effect Effects 0.000 description 5
- 238000012413 Fluorescence activated cell sorting analysis Methods 0.000 description 4
- 108010072051 Glatiramer Acetate Proteins 0.000 description 4
- 230000008901 benefit Effects 0.000 description 4
- 230000037396 body weight Effects 0.000 description 4
- 230000006037 cell lysis Effects 0.000 description 4
- 208000035475 disorder Diseases 0.000 description 4
- 231100000673 dose–response relationship Toxicity 0.000 description 4
- 238000002474 experimental method Methods 0.000 description 4
- 239000012737 fresh medium Substances 0.000 description 4
- 238000002649 immunization Methods 0.000 description 4
- 230000003053 immunization Effects 0.000 description 4
- 229960003444 immunosuppressant agent Drugs 0.000 description 4
- 239000003018 immunosuppressive agent Substances 0.000 description 4
- 230000004770 neurodegeneration Effects 0.000 description 4
- 239000000243 solution Substances 0.000 description 4
- 239000002904 solvent Substances 0.000 description 4
- 210000002536 stromal cell Anatomy 0.000 description 4
- 230000035899 viability Effects 0.000 description 4
- 208000023275 Autoimmune disease Diseases 0.000 description 3
- 238000011740 C57BL/6 mouse Methods 0.000 description 3
- 108090000695 Cytokines Proteins 0.000 description 3
- 102000004127 Cytokines Human genes 0.000 description 3
- 108010005716 Interferon beta-1a Proteins 0.000 description 3
- 208000007400 Relapsing-Remitting Multiple Sclerosis Diseases 0.000 description 3
- 239000013543 active substance Substances 0.000 description 3
- 229940047124 interferons Drugs 0.000 description 3
- 229960005027 natalizumab Drugs 0.000 description 3
- 208000015122 neurodegenerative disease Diseases 0.000 description 3
- 238000010899 nucleation Methods 0.000 description 3
- 238000012360 testing method Methods 0.000 description 3
- 238000002560 therapeutic procedure Methods 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 2
- 208000032116 Autoimmune Experimental Encephalomyelitis Diseases 0.000 description 2
- 206010061818 Disease progression Diseases 0.000 description 2
- 206010061218 Inflammation Diseases 0.000 description 2
- 108010005714 Interferon beta-1b Proteins 0.000 description 2
- 102100024616 Platelet endothelial cell adhesion molecule Human genes 0.000 description 2
- 208000006011 Stroke Diseases 0.000 description 2
- FHEAIOHRHQGZPC-KIWGSFCNSA-N acetic acid;(2s)-2-amino-3-(4-hydroxyphenyl)propanoic acid;(2s)-2-aminopentanedioic acid;(2s)-2-aminopropanoic acid;(2s)-2,6-diaminohexanoic acid Chemical compound CC(O)=O.C[C@H](N)C(O)=O.NCCCC[C@H](N)C(O)=O.OC(=O)[C@@H](N)CCC(O)=O.OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 FHEAIOHRHQGZPC-KIWGSFCNSA-N 0.000 description 2
- 230000002411 adverse Effects 0.000 description 2
- 230000000735 allogeneic effect Effects 0.000 description 2
- 230000001028 anti-proliverative effect Effects 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- 230000008499 blood brain barrier function Effects 0.000 description 2
- 210000001218 blood-brain barrier Anatomy 0.000 description 2
- 210000001185 bone marrow Anatomy 0.000 description 2
- 239000002458 cell surface marker Substances 0.000 description 2
- 230000002596 correlated effect Effects 0.000 description 2
- LDCRTTXIJACKKU-ONEGZZNKSA-N dimethyl fumarate Chemical compound COC(=O)\C=C\C(=O)OC LDCRTTXIJACKKU-ONEGZZNKSA-N 0.000 description 2
- 230000005750 disease progression Effects 0.000 description 2
- 238000001647 drug administration Methods 0.000 description 2
- 238000012377 drug delivery Methods 0.000 description 2
- 239000000839 emulsion Substances 0.000 description 2
- 208000012997 experimental autoimmune encephalomyelitis Diseases 0.000 description 2
- 238000013401 experimental design Methods 0.000 description 2
- 239000000706 filtrate Substances 0.000 description 2
- 230000006870 function Effects 0.000 description 2
- 229960003776 glatiramer acetate Drugs 0.000 description 2
- 239000003102 growth factor Substances 0.000 description 2
- 210000003958 hematopoietic stem cell Anatomy 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- 230000004054 inflammatory process Effects 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- 230000007774 longterm Effects 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- KKZJGLLVHKMTCM-UHFFFAOYSA-N mitoxantrone Chemical compound O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO KKZJGLLVHKMTCM-UHFFFAOYSA-N 0.000 description 2
- 229960001156 mitoxantrone Drugs 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 239000003900 neurotrophic factor Substances 0.000 description 2
- 230000036407 pain Effects 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 238000011084 recovery Methods 0.000 description 2
- 230000002829 reductive effect Effects 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 210000000278 spinal cord Anatomy 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- 150000003431 steroids Chemical class 0.000 description 2
- 238000003860 storage Methods 0.000 description 2
- 238000002054 transplantation Methods 0.000 description 2
- YLOCGHYTXIINAI-XKUOMLDTSA-N (2s)-2-amino-3-(4-hydroxyphenyl)propanoic acid;(2s)-2-aminopentanedioic acid;(2s)-2-aminopropanoic acid;(2s)-2,6-diaminohexanoic acid Chemical compound C[C@H](N)C(O)=O.NCCCC[C@H](N)C(O)=O.OC(=O)[C@@H](N)CCC(O)=O.OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 YLOCGHYTXIINAI-XKUOMLDTSA-N 0.000 description 1
- MGRVRXRGTBOSHW-UHFFFAOYSA-N (aminomethyl)phosphonic acid Chemical compound NCP(O)(O)=O MGRVRXRGTBOSHW-UHFFFAOYSA-N 0.000 description 1
- OZOMQRBLCMDCEG-CHHVJCJISA-N 1-[(z)-[5-(4-nitrophenyl)furan-2-yl]methylideneamino]imidazolidine-2,4-dione Chemical compound C1=CC([N+](=O)[O-])=CC=C1C(O1)=CC=C1\C=N/N1C(=O)NC(=O)C1 OZOMQRBLCMDCEG-CHHVJCJISA-N 0.000 description 1
- UQNAFPHGVPVTAL-UHFFFAOYSA-N 2,3-Dihydroxy-6-nitro-7-sulfamoyl-benzo(f)quinoxaline Chemical compound N1C(=O)C(=O)NC2=C1C=C([N+]([O-])=O)C1=C2C=CC=C1S(=O)(=O)N UQNAFPHGVPVTAL-UHFFFAOYSA-N 0.000 description 1
- MRVODVFESATPCI-UHFFFAOYSA-N 5-(4-aminophenyl)-7,8-dimethyl-9H-[1,3]dioxolo[4,5-h][2,3]benzodiazepine-8-carboxamide Chemical compound C12=CC=3OCOC=3C=C2CC(C(N)=O)(C)N(C)N=C1C1=CC=C(N)C=C1 MRVODVFESATPCI-UHFFFAOYSA-N 0.000 description 1
- VHRSUDSXCMQTMA-PJHHCJLFSA-N 6alpha-methylprednisolone Chemical compound C([C@@]12C)=CC(=O)C=C1[C@@H](C)C[C@@H]1[C@@H]2[C@@H](O)C[C@]2(C)[C@@](O)(C(=O)CO)CC[C@H]21 VHRSUDSXCMQTMA-PJHHCJLFSA-N 0.000 description 1
- 229940122065 Alpha4beta7 integrin antagonist Drugs 0.000 description 1
- KPYSYYIEGFHWSV-UHFFFAOYSA-N Baclofen Chemical compound OC(=O)CC(CN)C1=CC=C(Cl)C=C1 KPYSYYIEGFHWSV-UHFFFAOYSA-N 0.000 description 1
- 208000012639 Balance disease Diseases 0.000 description 1
- 229940124292 CD20 monoclonal antibody Drugs 0.000 description 1
- 229940122805 Cathepsin S inhibitor Drugs 0.000 description 1
- PTOAARAWEBMLNO-KVQBGUIXSA-N Cladribine Chemical compound C1=NC=2C(N)=NC(Cl)=NC=2N1[C@H]1C[C@H](O)[C@@H](CO)O1 PTOAARAWEBMLNO-KVQBGUIXSA-N 0.000 description 1
- GJSURZIOUXUGAL-UHFFFAOYSA-N Clonidine Chemical compound ClC1=CC=CC(Cl)=C1NC1=NCCN1 GJSURZIOUXUGAL-UHFFFAOYSA-N 0.000 description 1
- 208000028698 Cognitive impairment Diseases 0.000 description 1
- 239000000055 Corticotropin-Releasing Hormone Substances 0.000 description 1
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 1
- 208000019505 Deglutition disease Diseases 0.000 description 1
- 241001269524 Dura Species 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- LFBZZHVSGAHQPP-UHFFFAOYSA-N GYKI 52466 Chemical compound C12=CC=3OCOC=3C=C2CC(C)=NN=C1C1=CC=C(N)C=C1 LFBZZHVSGAHQPP-UHFFFAOYSA-N 0.000 description 1
- 206010017577 Gait disturbance Diseases 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 208000009329 Graft vs Host Disease Diseases 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 206010062016 Immunosuppression Diseases 0.000 description 1
- 108010008212 Integrin alpha4beta1 Proteins 0.000 description 1
- 102000006992 Interferon-alpha Human genes 0.000 description 1
- 108010047761 Interferon-alpha Proteins 0.000 description 1
- 108090000467 Interferon-beta Proteins 0.000 description 1
- 102000003996 Interferon-beta Human genes 0.000 description 1
- 108010050904 Interferons Proteins 0.000 description 1
- 102000014150 Interferons Human genes 0.000 description 1
- 108090000978 Interleukin-4 Proteins 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 208000026139 Memory disease Diseases 0.000 description 1
- 206010052904 Musculoskeletal stiffness Diseases 0.000 description 1
- 241001049988 Mycobacterium tuberculosis H37Ra Species 0.000 description 1
- 102000006386 Myelin Proteins Human genes 0.000 description 1
- 108010083674 Myelin Proteins Proteins 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 108010025020 Nerve Growth Factor Proteins 0.000 description 1
- 102000007072 Nerve Growth Factors Human genes 0.000 description 1
- 208000012902 Nervous system disease Diseases 0.000 description 1
- 208000025966 Neurological disease Diseases 0.000 description 1
- 206010060860 Neurological symptom Diseases 0.000 description 1
- BYPFEZZEUUWMEJ-UHFFFAOYSA-N Pentoxifylline Chemical compound O=C1N(CCCCC(=O)C)C(=O)N(C)C2=C1N(C)C=N2 BYPFEZZEUUWMEJ-UHFFFAOYSA-N 0.000 description 1
- 108010081690 Pertussis Toxin Proteins 0.000 description 1
- GMZVRMREEHBGGF-UHFFFAOYSA-N Piracetam Chemical compound NC(=O)CN1CCCC1=O GMZVRMREEHBGGF-UHFFFAOYSA-N 0.000 description 1
- 206010067063 Progressive relapsing multiple sclerosis Diseases 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- 238000000692 Student's t-test Methods 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- 208000030886 Traumatic Brain injury Diseases 0.000 description 1
- 108010000134 Vascular Cell Adhesion Molecule-1 Proteins 0.000 description 1
- 102100023543 Vascular cell adhesion protein 1 Human genes 0.000 description 1
- 206010047571 Visual impairment Diseases 0.000 description 1
- 210000001015 abdomen Anatomy 0.000 description 1
- 230000003187 abdominal effect Effects 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 230000006978 adaptation Effects 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 239000002487 adenosine deaminase inhibitor Substances 0.000 description 1
- 210000001789 adipocyte Anatomy 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 229960000548 alemtuzumab Drugs 0.000 description 1
- 235000019270 ammonium chloride Nutrition 0.000 description 1
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 description 1
- 238000000540 analysis of variance Methods 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 239000005557 antagonist Substances 0.000 description 1
- 230000002921 anti-spasmodic effect Effects 0.000 description 1
- 239000002246 antineoplastic agent Substances 0.000 description 1
- 229940124575 antispasmodic agent Drugs 0.000 description 1
- 210000000617 arm Anatomy 0.000 description 1
- 230000001363 autoimmune Effects 0.000 description 1
- 230000006470 autoimmune attack Effects 0.000 description 1
- 229940003504 avonex Drugs 0.000 description 1
- 210000003050 axon Anatomy 0.000 description 1
- 229960002170 azathioprine Drugs 0.000 description 1
- LMEKQMALGUDUQG-UHFFFAOYSA-N azathioprine Chemical compound CN1C=NC([N+]([O-])=O)=C1SC1=NC=NC2=C1NC=N2 LMEKQMALGUDUQG-UHFFFAOYSA-N 0.000 description 1
- 229960000794 baclofen Drugs 0.000 description 1
- 239000011324 bead Substances 0.000 description 1
- 239000002876 beta blocker Substances 0.000 description 1
- 229940097320 beta blocking agent Drugs 0.000 description 1
- 229940021459 betaseron Drugs 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 239000008366 buffered solution Substances 0.000 description 1
- 210000001217 buttock Anatomy 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 229930003827 cannabinoid Natural products 0.000 description 1
- 239000003557 cannabinoid Substances 0.000 description 1
- 229940065144 cannabinoids Drugs 0.000 description 1
- 229940082638 cardiac stimulant phosphodiesterase inhibitors Drugs 0.000 description 1
- 230000006727 cell loss Effects 0.000 description 1
- 238000002659 cell therapy Methods 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 229940044683 chemotherapy drug Drugs 0.000 description 1
- 210000001612 chondrocyte Anatomy 0.000 description 1
- 208000037976 chronic inflammation Diseases 0.000 description 1
- 208000037893 chronic inflammatory disorder Diseases 0.000 description 1
- 229960002436 cladribine Drugs 0.000 description 1
- 229960002896 clonidine Drugs 0.000 description 1
- 238000011278 co-treatment Methods 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 208000010877 cognitive disease Diseases 0.000 description 1
- 238000002648 combination therapy Methods 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 239000003636 conditioned culture medium Substances 0.000 description 1
- 229940038717 copaxone Drugs 0.000 description 1
- 239000003246 corticosteroid Substances 0.000 description 1
- 229960001334 corticosteroids Drugs 0.000 description 1
- IDLFZVILOHSSID-OVLDLUHVSA-N corticotropin Chemical compound C([C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(N)=O)C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)NC(=O)[C@@H](N)CO)C1=CC=C(O)C=C1 IDLFZVILOHSSID-OVLDLUHVSA-N 0.000 description 1
- 229960000258 corticotropin Drugs 0.000 description 1
- 229960004397 cyclophosphamide Drugs 0.000 description 1
- JJCFRYNCJDLXIK-UHFFFAOYSA-N cyproheptadine Chemical compound C1CN(C)CCC1=C1C2=CC=CC=C2C=CC2=CC=CC=C21 JJCFRYNCJDLXIK-UHFFFAOYSA-N 0.000 description 1
- 229960001140 cyproheptadine Drugs 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 229960001987 dantrolene Drugs 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000006735 deficit Effects 0.000 description 1
- 229960003957 dexamethasone Drugs 0.000 description 1
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 1
- AAOVKJBEBIDNHE-UHFFFAOYSA-N diazepam Chemical compound N=1CC(=O)N(C)C2=CC=C(Cl)C=C2C=1C1=CC=CC=C1 AAOVKJBEBIDNHE-UHFFFAOYSA-N 0.000 description 1
- 229960003529 diazepam Drugs 0.000 description 1
- 230000029087 digestion Effects 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 229960004419 dimethyl fumarate Drugs 0.000 description 1
- 238000011979 disease modifying therapy Methods 0.000 description 1
- 230000004064 dysfunction Effects 0.000 description 1
- 210000002889 endothelial cell Anatomy 0.000 description 1
- 230000006862 enzymatic digestion Effects 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 238000000556 factor analysis Methods 0.000 description 1
- 210000002950 fibroblast Anatomy 0.000 description 1
- 238000000684 flow cytometry Methods 0.000 description 1
- 239000012520 frozen sample Substances 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 229940042385 glatiramer Drugs 0.000 description 1
- 230000002518 glial effect Effects 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 239000003825 glutamate receptor antagonist Substances 0.000 description 1
- 208000024908 graft versus host disease Diseases 0.000 description 1
- 238000003306 harvesting Methods 0.000 description 1
- 210000001624 hip Anatomy 0.000 description 1
- 230000002519 immonomodulatory effect Effects 0.000 description 1
- 229940027941 immunoglobulin g Drugs 0.000 description 1
- 239000002955 immunomodulating agent Substances 0.000 description 1
- 229940121354 immunomodulator Drugs 0.000 description 1
- 230000001506 immunosuppresive effect Effects 0.000 description 1
- 230000001861 immunosuppressant effect Effects 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 229960004461 interferon beta-1a Drugs 0.000 description 1
- 229960003161 interferon beta-1b Drugs 0.000 description 1
- 229960001388 interferon-beta Drugs 0.000 description 1
- 238000007917 intracranial administration Methods 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- PYZRQGJRPPTADH-UHFFFAOYSA-N lamotrigine Chemical compound NC1=NC(N)=NN=C1C1=CC=CC(Cl)=C1Cl PYZRQGJRPPTADH-UHFFFAOYSA-N 0.000 description 1
- 229960001848 lamotrigine Drugs 0.000 description 1
- 210000002414 leg Anatomy 0.000 description 1
- 208000027906 leg weakness Diseases 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 229940124302 mTOR inhibitor Drugs 0.000 description 1
- 239000003628 mammalian target of rapamycin inhibitor Substances 0.000 description 1
- 238000007726 management method Methods 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 239000002906 medical waste Substances 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- YACKEPLHDIMKIO-UHFFFAOYSA-L methylphosphonate(2-) Chemical compound CP([O-])([O-])=O YACKEPLHDIMKIO-UHFFFAOYSA-L 0.000 description 1
- 229960004584 methylprednisolone Drugs 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 210000005012 myelin Anatomy 0.000 description 1
- 230000023105 myelination Effects 0.000 description 1
- 208000010125 myocardial infarction Diseases 0.000 description 1
- 210000003739 neck Anatomy 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 210000003061 neural cell Anatomy 0.000 description 1
- 230000009251 neurologic dysfunction Effects 0.000 description 1
- 208000015015 neurological dysfunction Diseases 0.000 description 1
- 210000002569 neuron Anatomy 0.000 description 1
- 230000000324 neuroprotective effect Effects 0.000 description 1
- 230000000508 neurotrophic effect Effects 0.000 description 1
- 229950005751 ocrelizumab Drugs 0.000 description 1
- QVYRGXJJSLMXQH-UHFFFAOYSA-N orphenadrine Chemical compound C=1C=CC=C(C)C=1C(OCCN(C)C)C1=CC=CC=C1 QVYRGXJJSLMXQH-UHFFFAOYSA-N 0.000 description 1
- 229960003941 orphenadrine Drugs 0.000 description 1
- 230000008723 osmotic stress Effects 0.000 description 1
- 210000000963 osteoblast Anatomy 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 229960001476 pentoxifylline Drugs 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- 239000002571 phosphodiesterase inhibitor Substances 0.000 description 1
- 229960004526 piracetam Drugs 0.000 description 1
- 210000001778 pluripotent stem cell Anatomy 0.000 description 1
- 230000002516 postimmunization Effects 0.000 description 1
- 229910000028 potassium bicarbonate Inorganic materials 0.000 description 1
- 235000015497 potassium bicarbonate Nutrition 0.000 description 1
- 239000011736 potassium bicarbonate Substances 0.000 description 1
- TYJJADVDDVDEDZ-UHFFFAOYSA-M potassium hydrogencarbonate Chemical compound [K+].OC([O-])=O TYJJADVDDVDEDZ-UHFFFAOYSA-M 0.000 description 1
- 229940086066 potassium hydrogencarbonate Drugs 0.000 description 1
- 229960004618 prednisone Drugs 0.000 description 1
- XOFYZVNMUHMLCC-ZPOLXVRWSA-N prednisone Chemical compound O=C1C=C[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 XOFYZVNMUHMLCC-ZPOLXVRWSA-N 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 208000037821 progressive disease Diseases 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 208000005069 pulmonary fibrosis Diseases 0.000 description 1
- 229940038850 rebif Drugs 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000008929 regeneration Effects 0.000 description 1
- 238000011069 regeneration method Methods 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- -1 rifluzole Chemical compound 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 238000002693 spinal anesthesia Methods 0.000 description 1
- 208000020431 spinal cord injury Diseases 0.000 description 1
- 238000013112 stability test Methods 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 238000009168 stem cell therapy Methods 0.000 description 1
- 238000009580 stem-cell therapy Methods 0.000 description 1
- 239000011550 stock solution Substances 0.000 description 1
- 210000002330 subarachnoid space Anatomy 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- 230000001839 systemic circulation Effects 0.000 description 1
- 229940121136 tecfidera Drugs 0.000 description 1
- 238000011285 therapeutic regimen Methods 0.000 description 1
- 229960000488 tizanidine Drugs 0.000 description 1
- XFYDIVBRZNQMJC-UHFFFAOYSA-N tizanidine Chemical compound ClC=1C=CC2=NSN=C2C=1NC1=NCCN1 XFYDIVBRZNQMJC-UHFFFAOYSA-N 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 230000009529 traumatic brain injury Effects 0.000 description 1
- 229940079023 tysabri Drugs 0.000 description 1
- 238000002604 ultrasonography Methods 0.000 description 1
- 210000000689 upper leg Anatomy 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 208000029257 vision disease Diseases 0.000 description 1
- 230000004393 visual impairment Effects 0.000 description 1
- 210000004885 white matter Anatomy 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/28—Bone marrow; Haematopoietic stem cells; Mesenchymal stem cells of any origin, e.g. adipose-derived stem cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0652—Cells of skeletal and connective tissues; Mesenchyme
- C12N5/0662—Stem cells
- C12N5/0667—Adipose-derived stem cells [ADSC]; Adipose stromal stem cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0085—Brain, e.g. brain implants; Spinal cord
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2523/00—Culture process characterised by temperature
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Chemical & Material Sciences (AREA)
- Biomedical Technology (AREA)
- General Health & Medical Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Developmental Biology & Embryology (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Organic Chemistry (AREA)
- Cell Biology (AREA)
- Biotechnology (AREA)
- Zoology (AREA)
- Neurology (AREA)
- Epidemiology (AREA)
- Immunology (AREA)
- Genetics & Genomics (AREA)
- Wood Science & Technology (AREA)
- Neurosurgery (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Physical Education & Sports Medicine (AREA)
- General Engineering & Computer Science (AREA)
- Hematology (AREA)
- Rheumatology (AREA)
- Virology (AREA)
- Biochemistry (AREA)
- Microbiology (AREA)
- Psychology (AREA)
- Dermatology (AREA)
- Hospice & Palliative Care (AREA)
- Psychiatry (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
Abstract
Description
(a)吸引脂肪組織を凍結するステップと、
(b)吸引脂肪組織を解凍し、組織分散酵素を用いて、又は機械的破砕により分散させるステップと、
(c)hADSCを含む細胞分画を遠心分離によってペレッティングし、任意にペレットを、細胞生存率を支持可能な懸濁培地で洗浄し、懸濁液を少なくとも1回の追加の遠心分離にかけるステップと、
(d)ステップ(c)で得られたペレットを、細胞生存率を支持可能な懸濁培地で再懸濁し、再懸濁されたペレット内の細胞集団からhADSCを選択するステップと、
(e)任意に、hADSCの選択の前に少なくとも1回濾過をおこなうステップと、
(f)任意に、hADSCを少なくとも3継代にわたって培養するステップと、
によってヒト皮下脂肪から得られたhADSCである。
(a)吸引脂肪組織を凍結するステップと、
(b)吸引脂肪組織を解凍し、組織分散酵素を用いて、又は機械的破砕により分散させるステップと、
(c)hADSCを含む細胞分画を遠心分離によってペレッティングし、任意にペレットを、細胞生存率を支持可能な懸濁培地で洗浄し、少なくとも1回の追加の遠心分離にかけるステップと、
(d)ステップ(c)で得られたペレットを緩衝液又は培養液で再懸濁し、少なくとも1回濾過をおこなうステップと、
(e)再懸濁されたペレット内の細胞集団からhADSCを選択するステップと、
(f)任意に、hADSCを少なくとも3継代にわたって培養するステップと、
(g)対象のCNSにhADSCを注入するステップと、
によってヒト皮下脂肪からhADSCを取得することを含む。
(a)吸引脂肪組織を凍結するステップと、
(b)吸引脂肪組織を解凍し、組織分散酵素を用いて、又は機械的破砕により分散させるステップと、
(c)hADSCを含む細胞分画を遠心分離によってペレッティングし、任意にペレットを、細胞生存率を支持可能な懸濁培地で洗浄し、懸濁液を少なくとも1回の追加の遠心分離にかけるステップと、
(d)ステップ(c)で得られたペレットを、細胞生存率を支持可能な懸濁培地で再懸濁し、少なくとも1回濾過をおこなうステップと、
(e)再懸濁されたペレット内の細胞集団からhADSCを選択するステップと、
(f)任意に、hADSCを対象への投与の前に少なくとも3継代にわたって培養するステップと、
から成る。
(a)吸引脂肪組織を凍結するステップと、
(b)吸引脂肪組織を解凍し、組織分散酵素を用いて、又は機械的破砕により分散させるステップと、
(c)hADSCを含む細胞分画を遠心分離によってペレッティングし、任意にペレットを、細胞生存率を支持可能な懸濁培地で洗浄し、懸濁液を少なくとも1回の追加の遠心分離にかけるステップと、
(d)ステップ(c)で得られたペレットを、細胞生存率を支持可能な懸濁培地で再懸濁し、少なくとも1回濾過をおこなうステップと、
(e)細胞培養容器への付着性によってhADSCを選択するステップと、
(f)任意に、対象への投与の前にhADSCを少なくとも3継代にわたって培養するステップと、
から成る。
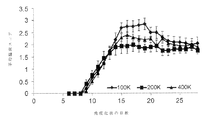
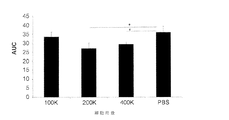
・生細胞数/ml
・死細胞数/ml
・サンプルごとの生細胞の総数
・生存率
・平均細胞サイズ(μm)
・生細胞数/ml
・死細胞数/ml
・サンプルごとの生細胞の総数
・生存率
・平均細胞サイズ(μm)
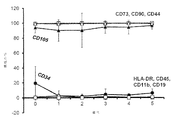
・MSC形態
・免疫表現型(FACS分析:CD90、CD73、CD45及びCD31)
・回収までの時間(日)
Claims (31)
- 非遺伝子組み換えのヒト脂肪組織由来幹細胞(hADSC)を、それを必要とする対象の中枢神経系(CNS)に投与することを含む、一次進行型多発性硬化症を治療する方法。
- 前記hADSCは、
(a)吸引脂肪組織を凍結するステップと、
(b)前記吸引脂肪組織を解凍し、組織分散酵素を用いて、又は機械的破砕により分散させるステップと、
(c)前記hADSCを含む細胞分画を遠心分離によってペレッティングし、任意に細胞生存率を支持可能な懸濁培地で前記ペレットを洗浄し、前記懸濁液を少なくとも1回の追加の遠心分離にかけるステップと、
(d)ステップ(c)で得られた前記ペレットを、細胞生存率を支持可能な懸濁培地で再懸濁し、再懸濁された前記ペレット内の細胞集団からhADSCを選択するステップと、
(e)任意に、前記hADSCの選択の前に少なくとも1回濾過をおこなうステップと、
(f)任意に、前記hADSCを少なくとも3継代にわたって培養するステップと、
によってヒト皮下脂肪から得られたhADSCである、
請求項1に記載の方法。 - 前記hADSCは、(i)吸引脂肪組織を凍結するステップと、(ii)前記吸引脂肪組織を解凍し、組織分散酵素を用いて、又は機械的破砕により分散させるステップと、(iii)前記hADSCを含む細胞分画を遠心分離によってペレッティングするステップと、(iv)前記ペレットを等張緩衝液又は培養液で洗浄し、追加の遠心分離にかけるステップと、(v)ステップ(iv)で得られた前記ペレットを等張緩衝液又は培養液で再懸濁し、少なくとも1回濾過をおこなうステップと、(vi)再懸濁された前記ペレット内の細胞集団からhADSCを選択するステップと、(vii)前記hADSCを少なくとも3継代にわたって培養するステップと、によってヒト皮下脂肪から得られたhADSCである、
請求項2に記載の方法。 - 遠心分離後に得られた前記hADSCを含む前記細胞分画は、赤血球溶解バッファーにさらされない、請求項2又は請求項3に記載の方法。
- 前記hADSCは、前記細胞培養容器への付着性によって選択される、請求項1〜4のいずれか一項に記載の方法。
- ヒト脂肪組織由来幹細胞(hADSC)を、それを必要とする対象の中枢神経系(CNS)に注入する方法であって、
(a)吸引脂肪組織を凍結するステップと、
(b)前記吸引脂肪組織を解凍し、組織分散酵素を用いて、又は機械的破砕により分散させるステップと、
(c)前記hADSCを含む細胞分画を遠心分離によってペレッティングし、任意に細胞生存率を支持可能な懸濁培地で前記ペレットを洗浄し、前記懸濁液を少なくとも1回の追加の遠心分離にかけるステップと、
(d)ステップ(c)で得られた前記ペレットを、細胞生存率を支持可能な懸濁培地で再懸濁し、少なくとも1回濾過をおこなうステップと、
(e)再懸濁された前記ペレット内の細胞集団からhADSCを選択するステップと、
(f)任意に、前記hADSCを少なくとも3継代にわたって培養するステップと、
(g)前記対象の前記CNSに前記hADSCを注入するステップと、
によってヒト皮下脂肪からhADSCを取得することを含む、方法。 - ヒト皮下脂肪からヒト脂肪組織由来幹細胞(hADSC)を、それを必要とする対象への投与のために取得する方法であって、
(a)吸引脂肪組織を凍結するステップと、
(b)前記吸引脂肪組織を解凍し、組織分散酵素を用いて、又は機械的破砕により分散させるステップと、
(c)前記hADSCを含む細胞分画を遠心分離によってペレッティングし、任意に前記ペレットを、細胞生存率を支持可能な懸濁培地で洗浄し、前記懸濁液を少なくとも1回の追加の遠心分離にかけるステップと、
(d)ステップ(c)で得られた前記ペレットを、細胞生存率を支持可能な懸濁培地で再懸濁し、少なくとも1回濾過をおこなうステップと、
(e)再懸濁された前記ペレット内の細胞集団からhADSCを選択するステップと、
(f)任意に、前記hADSCを前記対象への投与の前に少なくとも3継代にわたって培養するステップと、
を含む、方法。 - 前記hADSCは、組織培養容器への付着性によって選択される、請求項6又は請求項7に記載の方法。
- 前記対象は多発性硬化症(MS)を患っている、請求項6又は請求項7に記載の方法。
- 前記多発性硬化症は進行性MSである、請求項9に記載の方法。
- 前記進行性MSは二次進行型MSである、請求項10に記載の方法。
- 前記進行性MSは一次進行型MSである、請求項10に記載の方法。
- 前記凍結は−80℃で実施され、その後に気相液体窒素が続く、請求項2〜12のいずれか一項に記載の方法。
- 前記組織分散酵素は、コラゲナーゼ、ディスパーゼ又はそれらの組合わせから選択される、請求項2〜13のいずれか一項に記載の方法。
- 前記組織分散酵素はコラゲナーゼである、請求項14に記載の方法。
- 前記hADSCは、前記細胞の少なくとも95%によるCD44、CD73及びCD90の陽性発現と、前記細胞の少なくとも90%によるCD105の陽性発現と、前記細胞の少なくとも95%によるCD45、CD19、CD11b及びHLA−DRの陰性発現とによって特徴付けられる、
請求項1〜15のいずれか一項に記載の方法。 - 前記hADSCは、前記細胞の少なくとも98%によるCD44、CD73及びCD90の陽性発現と、前記細胞の少なくとも90%によるCD105の陽性発現と、前記細胞の少なくとも98%によるCD45、CD19、CD11b及びHLA−DRの陰性発現とによって特徴付けられる、
請求項16に記載の方法。 - 前記hADSCは更に、前記細胞の1〜10%によるCD34の陽性発現によって特徴付けられる、請求項16に記載の方法。
- 前記細胞の少なくとも50%は、CD105、CD73、CD44及びCD90に対して陽性であり、CD45、CD19、CD11b及びHLA−DRに対して陰性である、
請求項16に記載の方法。 - 前記hADSCは、投与の前に継代数3〜10まで培養されたhADSCである、請求項1〜19のいずれか一項に記載の方法。
- 前記hADSCは、投与の前に継代数3〜5まで培養されたhADSCである、請求項20に記載の方法。
- 前記hADSCは1回投与される、請求項1〜21のいずれか一項に記載の方法。
- 前記hADSCは複数回投与される、請求項1〜21のいずれか一項に記載の方法。
- 前記hADSCは2〜8ヶ月毎に1回投与される、請求項23に記載の方法。
- 前記hADSCは3〜12ヶ月毎に1回投与される、請求項23に記載の方法。
- 前記hADSCを投与することは髄腔内投与による、請求項1〜25のいずれか一項に記載の方法。
- 前記hADSCを投与することは室内又は脳室内(ICV)投与による、請求項1〜25のいずれか一項に記載の方法。
- 前記hADSCは自己由来である、請求項1〜27のいずれか一項に記載の方法。
- 前記hADSCは同種由来である、請求項1〜27のいずれか一項に記載の方法。
- 前記hADSCを投与することは、1回の投与につき約105〜3×108個の細胞を投与することを含む、請求項1〜29のいずれか一項に記載の方法。
- 中枢神経系(CNS)への投与による一次進行型多発性硬化症の治療における使用のための、非遺伝子組み換えのヒト脂肪組織由来幹細胞(hADSC)を含む、医薬組成物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201762506006P | 2017-05-15 | 2017-05-15 | |
| US62/506,006 | 2017-05-15 | ||
| PCT/IL2018/050523 WO2018211498A1 (en) | 2017-05-15 | 2018-05-14 | Treatment of multiple sclerosis with adipose-derived stem cells |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2020519645A true JP2020519645A (ja) | 2020-07-02 |
| JP2020519645A5 JP2020519645A5 (ja) | 2021-05-06 |
Family
ID=64274150
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019562579A Pending JP2020519645A (ja) | 2017-05-15 | 2018-05-14 | 脂肪組織由来幹細胞による多発性硬化症の治療 |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US11510946B2 (ja) |
| EP (1) | EP3624816A4 (ja) |
| JP (1) | JP2020519645A (ja) |
| CN (1) | CN110573170A (ja) |
| AU (1) | AU2018270396A1 (ja) |
| CA (1) | CA3062123A1 (ja) |
| IL (1) | IL269893B2 (ja) |
| WO (1) | WO2018211498A1 (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2020519658A (ja) * | 2017-05-15 | 2020-07-02 | ステム セル メディスン リミテッド | 長時間作用性グラチラマー及び脂肪由来幹細胞での多発性硬化症の治療 |
| US11510946B2 (en) | 2017-05-15 | 2022-11-29 | Stem Cell Medicine Ltd. | Treatment of multiple sclerosis with adipose-derived stem cells |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IL272145A (en) * | 2020-01-20 | 2021-07-29 | Stem Cell Medicine Ltd | Cosmetic preparations with protein concentrate from a conditioned growth medium of stem cells from adipose tissue |
| CN115624570A (zh) * | 2022-12-21 | 2023-01-20 | 北京瑷格干细胞科技有限公司 | 人脂肪间充质干细胞在制备治疗结缔组织疾病药物中的应用 |
| CN115624571A (zh) * | 2022-12-21 | 2023-01-20 | 北京瑷格干细胞科技有限公司 | 人脂肪间充质干细胞在制备治疗硬皮病药物中的应用 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015511221A (ja) * | 2012-01-31 | 2015-04-16 | ツェー・エス・エル・ベーリング・ゲー・エム・ベー・ハー | 神経炎症性障害の処置のための第xii因子阻害剤 |
| US20170065638A1 (en) * | 2014-02-10 | 2017-03-09 | Cytori Therapeutics, Inc. | Regenerative cell therapy for central nervous system (cns) disorders and ptsd |
Family Cites Families (38)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IL36670A (en) | 1971-04-21 | 1974-09-10 | Sela M | Therapeutic basic copolymers of amino acids |
| IL113812A (en) | 1994-05-24 | 2000-06-29 | Yeda Res & Dev | Copolymer-1 pharmaceutical compositions containing it and its use |
| US6214791B1 (en) | 1997-01-10 | 2001-04-10 | Yeda Research And Development Co. Ltd. | Treatment of multiple sclerosis through ingestion or inhalation of copolymer-1 |
| CN100360180C (zh) | 2000-01-20 | 2008-01-09 | 耶达研究及发展有限公司 | 共聚物1和相关肽和多肽及其处理过的t细胞在神经保护性治疗中的用途 |
| US8871241B2 (en) | 2002-05-07 | 2014-10-28 | Psivida Us, Inc. | Injectable sustained release delivery devices |
| ZA200505733B (en) | 2003-01-21 | 2006-10-25 | Yeda Res & Dev | COP 1 for treatment of inflammatory bowel diseases |
| US7429378B2 (en) | 2003-05-13 | 2008-09-30 | Depuy Spine, Inc. | Transdiscal administration of high affinity anti-MMP inhibitors |
| WO2006057003A2 (en) | 2004-11-29 | 2006-06-01 | Yeda Research And Development Co. Ltd. | Induction of neurogenesis and stem cell therapy in combination with copolymer 1 |
| US20060165667A1 (en) | 2004-12-03 | 2006-07-27 | Case Western Reserve University | Novel methods, compositions and devices for inducing neovascularization |
| JP4654015B2 (ja) | 2004-12-08 | 2011-03-16 | 京セラ株式会社 | カメラ装置 |
| US20070003528A1 (en) | 2005-06-29 | 2007-01-04 | Paul Consigny | Intracoronary device and method of use thereof |
| PE20070771A1 (es) | 2005-10-13 | 2007-08-11 | Anthrogenesis Corp | Inmunomodulacion mediante el uso de celulas madres de la placenta |
| EP1795588A1 (en) | 2005-12-07 | 2007-06-13 | Cellerix, S.L. | Use of adipose tissue derived mesenchymal stem cells for the treatment of graft versus host disease |
| WO2008024996A2 (en) | 2006-08-24 | 2008-02-28 | Johnstone Brian H | Production of neural protective and regenerative factors from stem cells and treatment of nervous system conditions therewith |
| DK2086332T3 (en) | 2006-11-03 | 2018-04-16 | Multiple Sclerosis Res Center Of New York | Bone marrow derived mesenchymal stem cells as a source of neural progenitors |
| US8703180B1 (en) | 2007-10-23 | 2014-04-22 | Abbott Cardiovascular Systems Inc. | Multiple growth factor compositions, methods of fabrication, and methods of treatment |
| AU2009227022B2 (en) * | 2008-03-19 | 2014-07-03 | Cryo-Save Ag | Improved cryopreservation of adipose tissue for the isolation of mesenchymal stem cells |
| US20090291061A1 (en) | 2008-05-21 | 2009-11-26 | Riordan Neil H | Stem cell therapy for blood vessel degeneration |
| DK2620493T3 (da) | 2008-05-28 | 2019-07-01 | Univ Ramot | Mesenkymale stamceller til behandling af CNS-sygdomme |
| WO2010014990A2 (en) | 2008-08-01 | 2010-02-04 | The Board Of Trustees Of The University Of Illinois | Method of promoting neurogenesis by modulating secretase activities |
| WO2010028051A2 (en) | 2008-09-03 | 2010-03-11 | Florida State University Research Foundation, Inc. | Substituted heterocyclic mercaptosulfonamide metalloprotease inhibitors |
| AU2009305532A1 (en) | 2008-10-17 | 2010-04-22 | Baxter Healthcare S.A. | Methods of obtaining cell populations from adipose tissue |
| JP5515319B2 (ja) | 2009-02-23 | 2014-06-11 | 富士レビオ株式会社 | 脂肪細胞への分化誘導培地及び方法 |
| NZ597975A (en) | 2009-07-09 | 2014-06-27 | Tigenix S A | Methods and compositions for use in cellular therapies |
| EP2482761A4 (en) | 2009-09-30 | 2014-03-19 | Brigham & Womens Hospital | TISSUE TRANSPLANT COMPOSITIONS AND METHOD FOR THEIR USE |
| PT3536333T (pt) | 2010-01-04 | 2022-11-11 | Mapi Pharma Ltd | Sistema de depósito compreendendo acetato de glatirâmero |
| US8377885B2 (en) | 2010-01-04 | 2013-02-19 | Mapi Pharma Ltd. | Depot systems comprising glatiramer or pharmacologically acceptable salt thereof |
| ES2663720T3 (es) | 2010-02-18 | 2018-04-16 | Osiris Therapeutics, Inc. | Métodos de fabricación de productos terapéuticos que comprenden dispersiones placentarias vitalizadas |
| WO2012143924A1 (en) | 2011-04-21 | 2012-10-26 | Mapi Pharma Ltd. | Random pentapolymer for treatment of autoimmune diseases |
| US20130034524A1 (en) | 2011-08-03 | 2013-02-07 | Siamak Agha-Mohammadi | Non-Enzymatic Method for Harvesting Adipose-Derived Stromal Cells and Adipose-Derived Stem Cells from Fat and Lipo-Aspirate |
| EP2744892B1 (en) | 2011-09-23 | 2019-03-20 | Cell Ideas Pty Ltd. | Therapeutics using adipose cells and cell secretions |
| CL2011002642A1 (es) | 2011-10-24 | 2012-04-09 | Univ Del Desarrollo | Uso de una composicion formada por un glucocorticoide y una tiazolinediona que sirve para inducir la diferenciacion adipogenica en celulas madres. |
| US20150030662A1 (en) | 2012-03-12 | 2015-01-29 | National University Of Singapore | Generation of Brown Adipose Tissue (BAT) from Mesenchymal Cells |
| CN104130975B (zh) * | 2013-05-03 | 2018-07-17 | 上海市东方医院 | 人源脂肪干细胞来源的神经元样细胞及其制备方法和应用 |
| TWI642781B (zh) * | 2014-02-06 | 2018-12-01 | 仲恩生醫科技股份有限公司 | 具優異細胞保護及免疫調節之quadri-正之基質細胞 |
| US20190046576A1 (en) | 2016-02-12 | 2019-02-14 | Cell Care Therapeutics | Adipose tissue derived mesenchymal stromal cell conditioned media and methods of making and using the same |
| EP3478300B1 (en) | 2016-06-30 | 2022-08-24 | Stem Cell Medicine Ltd. | Treatment of inflammatory bowel disease with long acting glatiramer and adipose-derived stem cells |
| EP3624816A4 (en) | 2017-05-15 | 2021-02-24 | Stem Cell Medicine Ltd. | TREATMENT OF MULTIPLE SCLEROSIS WITH ADAPTIVE STEM CELLS |
-
2018
- 2018-05-14 EP EP18801976.4A patent/EP3624816A4/en active Pending
- 2018-05-14 AU AU2018270396A patent/AU2018270396A1/en active Pending
- 2018-05-14 US US16/613,369 patent/US11510946B2/en active Active
- 2018-05-14 CN CN201880028213.1A patent/CN110573170A/zh active Pending
- 2018-05-14 CA CA3062123A patent/CA3062123A1/en active Pending
- 2018-05-14 WO PCT/IL2018/050523 patent/WO2018211498A1/en unknown
- 2018-05-14 IL IL269893A patent/IL269893B2/en unknown
- 2018-05-14 JP JP2019562579A patent/JP2020519645A/ja active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015511221A (ja) * | 2012-01-31 | 2015-04-16 | ツェー・エス・エル・ベーリング・ゲー・エム・ベー・ハー | 神経炎症性障害の処置のための第xii因子阻害剤 |
| US20170065638A1 (en) * | 2014-02-10 | 2017-03-09 | Cytori Therapeutics, Inc. | Regenerative cell therapy for central nervous system (cns) disorders and ptsd |
Non-Patent Citations (6)
| Title |
|---|
| MEDIATORS OF INFLAMMATION, 2016, VOL.2016, ARTICLE ID 5302120, JPN6021011511, ISSN: 0005065879 * |
| STEM CELLS INTERNATIONAL, 2015, VOL.2015, ARTICLE ID 146421, JPN6022009739, ISSN: 0005065880 * |
| WORLD J. STEM CELLS, 2014, VOL.6, NO.3, PP.312-321, JPN6022009737, ISSN: 0004727348 * |
| 中山 享之、加藤 栄史: "脂肪組織由来間葉系幹細胞を利用した細胞療法 −現状と展望−", 日本輸血細胞治療学会誌, vol. 59巻(2013)3号, JPN6022046305, 2013, JP, pages 450 - 456, ISSN: 0005065883 * |
| 吉良 潤一: "最新の多発性硬化症治療", 日本内科学会雑誌, vol. 105巻5号, JPN6022046303, 10 May 2016 (2016-05-10), JP, pages 894 - 904, ISSN: 0005065881 * |
| 風間 智彦: "間葉系幹細胞の基礎と臨床", 日大医学雑誌, vol. 75巻2号, JPN6022046304, 1 April 2016 (2016-04-01), JP, pages 61 - 66, ISSN: 0005065882 * |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2020519658A (ja) * | 2017-05-15 | 2020-07-02 | ステム セル メディスン リミテッド | 長時間作用性グラチラマー及び脂肪由来幹細胞での多発性硬化症の治療 |
| JP7000458B2 (ja) | 2017-05-15 | 2022-02-10 | ステム セル メディスン リミテッド | 長時間作用性グラチラマー及び脂肪由来幹細胞での多発性硬化症の治療 |
| US11413311B2 (en) | 2017-05-15 | 2022-08-16 | Mapi Pharma Ltd. | Treatment of multiple sclerosis with long acting glatiramer and adipose-derived stem cells |
| US11510946B2 (en) | 2017-05-15 | 2022-11-29 | Stem Cell Medicine Ltd. | Treatment of multiple sclerosis with adipose-derived stem cells |
Also Published As
| Publication number | Publication date |
|---|---|
| EP3624816A4 (en) | 2021-02-24 |
| IL269893B2 (en) | 2023-10-01 |
| CA3062123A1 (en) | 2018-11-22 |
| WO2018211498A1 (en) | 2018-11-22 |
| EP3624816A1 (en) | 2020-03-25 |
| IL269893A (ja) | 2019-11-28 |
| CN110573170A (zh) | 2019-12-13 |
| IL269893B1 (en) | 2023-06-01 |
| US11510946B2 (en) | 2022-11-29 |
| US20200188439A1 (en) | 2020-06-18 |
| AU2018270396A1 (en) | 2020-01-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2020519645A (ja) | 脂肪組織由来幹細胞による多発性硬化症の治療 | |
| JP7069011B2 (ja) | 間葉幹細胞由来のエクソソームおよびその使用 | |
| US20220054554A1 (en) | Scalable Production of Standardized Extracellular Vesicles, Extracellular Vesicle Preparations and Uses Thereof | |
| US20210169940A1 (en) | Methods of treating or preventing neurological diseases | |
| JP2015526065A (ja) | 超音波キャビテーションによる脂肪組織からの幹細胞の単離および使用方法 | |
| WO2015003623A1 (zh) | 治疗骨关节炎的组合物 | |
| US10596199B2 (en) | Methods of treating or preventing rheumatic disease | |
| US10293003B2 (en) | Multilineage-differentiating stress enduring (MUSE) cells for treatment of chronic kidney disease | |
| US20170106021A1 (en) | Compositions enriched for hox11+ stem cells and methods of preparing the same | |
| EP2931876B1 (en) | Treatment of diseases of endothelial dysfunction and inflammation | |
| JP7000458B2 (ja) | 長時間作用性グラチラマー及び脂肪由来幹細胞での多発性硬化症の治療 | |
| JP6250706B2 (ja) | 変形性関節症の予防または治療における異系間質血管層細胞および異系間葉前駆細胞の使用 | |
| JP2024509023A (ja) | 肝線維化および/または肝硬変の予防および治療における使用のための、脂肪組織由来再生細胞(ADRCs)を含む医薬組成物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210326 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20210326 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20220315 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220614 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20220615 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20221101 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230301 |
|
| C60 | Trial request (containing other claim documents, opposition documents) |
Free format text: JAPANESE INTERMEDIATE CODE: C60 Effective date: 20230301 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20230301 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20230323 |
|
| C21 | Notice of transfer of a case for reconsideration by examiners before appeal proceedings |
Free format text: JAPANESE INTERMEDIATE CODE: C21 Effective date: 20230328 |
|
| A912 | Re-examination (zenchi) completed and case transferred to appeal board |
Free format text: JAPANESE INTERMEDIATE CODE: A912 Effective date: 20230526 |