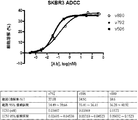
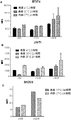
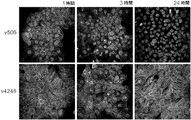
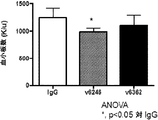
JP2016520586A - 二重特異性her2およびher3抗原結合性構築物 - Google Patents
二重特異性her2およびher3抗原結合性構築物 Download PDFInfo
- Publication number
- JP2016520586A JP2016520586A JP2016513093A JP2016513093A JP2016520586A JP 2016520586 A JP2016520586 A JP 2016520586A JP 2016513093 A JP2016513093 A JP 2016513093A JP 2016513093 A JP2016513093 A JP 2016513093A JP 2016520586 A JP2016520586 A JP 2016520586A
- Authority
- JP
- Japan
- Prior art keywords
- construct
- antigen binding
- her2
- polypeptide
- her3
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- 230000027455 binding Effects 0.000 title claims abstract description 370
- 239000000427 antigen Substances 0.000 title claims abstract description 298
- 108091007433 antigens Proteins 0.000 title claims abstract description 297
- 102000036639 antigens Human genes 0.000 title claims abstract description 297
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 title claims abstract description 100
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 title claims abstract description 99
- 102100029986 Receptor tyrosine-protein kinase erbB-3 Human genes 0.000 title claims abstract description 69
- 101710100969 Receptor tyrosine-protein kinase erbB-3 Proteins 0.000 title 1
- 108090000765 processed proteins & peptides Proteins 0.000 claims abstract description 273
- 102000004196 processed proteins & peptides Human genes 0.000 claims abstract description 251
- 229920001184 polypeptide Polymers 0.000 claims abstract description 244
- 101001010819 Homo sapiens Receptor tyrosine-protein kinase erbB-3 Proteins 0.000 claims abstract description 69
- 238000006471 dimerization reaction Methods 0.000 claims abstract description 5
- 210000004027 cell Anatomy 0.000 claims description 301
- 238000000034 method Methods 0.000 claims description 129
- 150000001413 amino acids Chemical class 0.000 claims description 106
- 108090000623 proteins and genes Proteins 0.000 claims description 90
- 206010028980 Neoplasm Diseases 0.000 claims description 81
- 102000004169 proteins and genes Human genes 0.000 claims description 80
- 230000004048 modification Effects 0.000 claims description 79
- 238000012986 modification Methods 0.000 claims description 79
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 64
- 102000040430 polynucleotide Human genes 0.000 claims description 57
- 108091033319 polynucleotide Proteins 0.000 claims description 57
- 239000002157 polynucleotide Substances 0.000 claims description 57
- 239000003814 drug Substances 0.000 claims description 55
- 150000007523 nucleic acids Chemical group 0.000 claims description 50
- 229940079593 drug Drugs 0.000 claims description 46
- 229960000575 trastuzumab Drugs 0.000 claims description 45
- 201000011510 cancer Diseases 0.000 claims description 44
- 230000014509 gene expression Effects 0.000 claims description 41
- 239000013598 vector Substances 0.000 claims description 40
- 241000282414 Homo sapiens Species 0.000 claims description 39
- 238000011282 treatment Methods 0.000 claims description 38
- 230000015572 biosynthetic process Effects 0.000 claims description 33
- 102400000058 Neuregulin-1 Human genes 0.000 claims description 32
- 208000026310 Breast neoplasm Diseases 0.000 claims description 30
- 206010006187 Breast cancer Diseases 0.000 claims description 29
- 230000010056 antibody-dependent cellular cytotoxicity Effects 0.000 claims description 25
- 230000035772 mutation Effects 0.000 claims description 22
- 241000124008 Mammalia Species 0.000 claims description 21
- 108090000556 Neuregulin-1 Proteins 0.000 claims description 20
- 239000000833 heterodimer Substances 0.000 claims description 17
- 239000008194 pharmaceutical composition Substances 0.000 claims description 17
- 150000001875 compounds Chemical class 0.000 claims description 16
- 239000000539 dimer Substances 0.000 claims description 15
- 239000013604 expression vector Substances 0.000 claims description 13
- 230000002401 inhibitory effect Effects 0.000 claims description 13
- WKPWGQKGSOKKOO-RSFHAFMBSA-N maytansine Chemical compound CO[C@@H]([C@@]1(O)C[C@](OC(=O)N1)([C@H]([C@@H]1O[C@@]1(C)[C@@H](OC(=O)[C@H](C)N(C)C(C)=O)CC(=O)N1C)C)[H])\C=C\C=C(C)\CC2=CC(OC)=C(Cl)C1=C2 WKPWGQKGSOKKOO-RSFHAFMBSA-N 0.000 claims description 13
- 229930126263 Maytansine Natural products 0.000 claims description 12
- 229940127089 cytotoxic agent Drugs 0.000 claims description 12
- 238000002844 melting Methods 0.000 claims description 12
- 230000008018 melting Effects 0.000 claims description 12
- 229960005558 mertansine Drugs 0.000 claims description 12
- 239000002246 antineoplastic agent Substances 0.000 claims description 11
- 230000012010 growth Effects 0.000 claims description 11
- 102000004190 Enzymes Human genes 0.000 claims description 10
- 108090000790 Enzymes Proteins 0.000 claims description 10
- 108010044540 auristatin Proteins 0.000 claims description 10
- 238000010494 dissociation reaction Methods 0.000 claims description 10
- 230000005593 dissociations Effects 0.000 claims description 10
- 229960002087 pertuzumab Drugs 0.000 claims description 9
- 239000013612 plasmid Substances 0.000 claims description 9
- 239000003053 toxin Substances 0.000 claims description 8
- 231100000765 toxin Toxicity 0.000 claims description 8
- 108700012359 toxins Proteins 0.000 claims description 8
- 210000004881 tumor cell Anatomy 0.000 claims description 8
- 239000003937 drug carrier Substances 0.000 claims description 7
- 150000002632 lipids Chemical class 0.000 claims description 7
- 230000002018 overexpression Effects 0.000 claims description 7
- 108091028043 Nucleic acid sequence Proteins 0.000 claims description 6
- 230000005907 cancer growth Effects 0.000 claims description 6
- 230000011664 signaling Effects 0.000 claims description 6
- 239000000872 buffer Substances 0.000 claims description 5
- 231100000433 cytotoxic Toxicity 0.000 claims description 5
- 230000001472 cytotoxic effect Effects 0.000 claims description 5
- 206010073071 hepatocellular carcinoma Diseases 0.000 claims description 5
- 230000001939 inductive effect Effects 0.000 claims description 5
- 206010009944 Colon cancer Diseases 0.000 claims description 4
- 241000699802 Cricetulus griseus Species 0.000 claims description 4
- 208000005718 Stomach Neoplasms Diseases 0.000 claims description 4
- NKANXQFJJICGDU-QPLCGJKRSA-N Tamoxifen Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 NKANXQFJJICGDU-QPLCGJKRSA-N 0.000 claims description 4
- 150000001720 carbohydrates Chemical class 0.000 claims description 4
- 238000000113 differential scanning calorimetry Methods 0.000 claims description 4
- 206010017758 gastric cancer Diseases 0.000 claims description 4
- 231100000844 hepatocellular carcinoma Toxicity 0.000 claims description 4
- 238000011068 loading method Methods 0.000 claims description 4
- 210000001672 ovary Anatomy 0.000 claims description 4
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 4
- 201000011549 stomach cancer Diseases 0.000 claims description 4
- 229940124597 therapeutic agent Drugs 0.000 claims description 4
- 229960001612 trastuzumab emtansine Drugs 0.000 claims description 4
- 239000002136 L01XE07 - Lapatinib Substances 0.000 claims description 3
- 206010033128 Ovarian cancer Diseases 0.000 claims description 3
- 206010061535 Ovarian neoplasm Diseases 0.000 claims description 3
- 229930195731 calicheamicin Natural products 0.000 claims description 3
- HXCHCVDVKSCDHU-LULTVBGHSA-N calicheamicin Chemical compound C1[C@H](OC)[C@@H](NCC)CO[C@H]1O[C@H]1[C@H](O[C@@H]2C\3=C(NC(=O)OC)C(=O)C[C@](C/3=C/CSSSC)(O)C#C\C=C/C#C2)O[C@H](C)[C@@H](NO[C@@H]2O[C@H](C)[C@@H](SC(=O)C=3C(=C(OC)C(O[C@H]4[C@@H]([C@H](OC)[C@@H](O)[C@H](C)O4)O)=C(I)C=3C)OC)[C@@H](O)C2)[C@@H]1O HXCHCVDVKSCDHU-LULTVBGHSA-N 0.000 claims description 3
- 239000002738 chelating agent Substances 0.000 claims description 3
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 claims description 3
- 229960004316 cisplatin Drugs 0.000 claims description 3
- 239000002299 complementary DNA Substances 0.000 claims description 3
- 230000001085 cytostatic effect Effects 0.000 claims description 3
- 239000007850 fluorescent dye Substances 0.000 claims description 3
- 239000003102 growth factor Substances 0.000 claims description 3
- 210000004408 hybridoma Anatomy 0.000 claims description 3
- 229940121354 immunomodulator Drugs 0.000 claims description 3
- 229960004891 lapatinib Drugs 0.000 claims description 3
- BCFGMOOMADDAQU-UHFFFAOYSA-N lapatinib Chemical compound O1C(CNCCS(=O)(=O)C)=CC=C1C1=CC=C(N=CN=C2NC=3C=C(Cl)C(OCC=4C=C(F)C=CC=4)=CC=3)C2=C1 BCFGMOOMADDAQU-UHFFFAOYSA-N 0.000 claims description 3
- 201000007270 liver cancer Diseases 0.000 claims description 3
- 208000014018 liver neoplasm Diseases 0.000 claims description 3
- 238000012423 maintenance Methods 0.000 claims description 3
- 230000035755 proliferation Effects 0.000 claims description 3
- 230000002285 radioactive effect Effects 0.000 claims description 3
- 238000003259 recombinant expression Methods 0.000 claims description 3
- 239000000758 substrate Substances 0.000 claims description 3
- 208000010507 Adenocarcinoma of Lung Diseases 0.000 claims description 2
- GAGWJHPBXLXJQN-UORFTKCHSA-N Capecitabine Chemical compound C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](C)O1 GAGWJHPBXLXJQN-UORFTKCHSA-N 0.000 claims description 2
- 208000001333 Colorectal Neoplasms Diseases 0.000 claims description 2
- 206010061902 Pancreatic neoplasm Diseases 0.000 claims description 2
- 206010060862 Prostate cancer Diseases 0.000 claims description 2
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims description 2
- 238000002512 chemotherapy Methods 0.000 claims description 2
- 239000000824 cytostatic agent Substances 0.000 claims description 2
- 239000000328 estrogen antagonist Substances 0.000 claims description 2
- 125000005842 heteroatom Chemical group 0.000 claims description 2
- 239000002955 immunomodulating agent Substances 0.000 claims description 2
- 230000002584 immunomodulator Effects 0.000 claims description 2
- 239000003112 inhibitor Substances 0.000 claims description 2
- 201000005249 lung adenocarcinoma Diseases 0.000 claims description 2
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 claims description 2
- 201000002528 pancreatic cancer Diseases 0.000 claims description 2
- 208000008443 pancreatic carcinoma Diseases 0.000 claims description 2
- 150000003384 small molecules Chemical class 0.000 claims description 2
- 239000003381 stabilizer Substances 0.000 claims description 2
- 230000004083 survival effect Effects 0.000 claims description 2
- 229960001603 tamoxifen Drugs 0.000 claims description 2
- 239000013603 viral vector Substances 0.000 claims description 2
- 102100035360 Cerebellar degeneration-related antigen 1 Human genes 0.000 claims 24
- 208000003721 Triple Negative Breast Neoplasms Diseases 0.000 claims 3
- 208000022679 triple-negative breast carcinoma Diseases 0.000 claims 3
- 239000005551 L01XE03 - Erlotinib Substances 0.000 claims 2
- 229960001433 erlotinib Drugs 0.000 claims 2
- AAKJLRGGTJKAMG-UHFFFAOYSA-N erlotinib Chemical compound C=12C=C(OCCOC)C(OCCOC)=CC2=NC=NC=1NC1=CC=CC(C#C)=C1 AAKJLRGGTJKAMG-UHFFFAOYSA-N 0.000 claims 2
- 231100000682 maximum tolerated dose Toxicity 0.000 claims 2
- 206010052747 Adenocarcinoma pancreas Diseases 0.000 claims 1
- GAGWJHPBXLXJQN-UHFFFAOYSA-N Capecitabine Natural products C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1C1C(O)C(O)C(C)O1 GAGWJHPBXLXJQN-UHFFFAOYSA-N 0.000 claims 1
- 206010052360 Colorectal adenocarcinoma Diseases 0.000 claims 1
- 101000945318 Homo sapiens Calponin-1 Proteins 0.000 claims 1
- 101000652736 Homo sapiens Transgelin Proteins 0.000 claims 1
- 239000005411 L01XE02 - Gefitinib Substances 0.000 claims 1
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims 1
- 208000035327 Oestrogen receptor positive breast cancer Diseases 0.000 claims 1
- 102100031013 Transgelin Human genes 0.000 claims 1
- 239000003963 antioxidant agent Substances 0.000 claims 1
- 230000003078 antioxidant effect Effects 0.000 claims 1
- 210000000481 breast Anatomy 0.000 claims 1
- 229960004117 capecitabine Drugs 0.000 claims 1
- 229960005395 cetuximab Drugs 0.000 claims 1
- 230000000447 dimerizing effect Effects 0.000 claims 1
- 102000015694 estrogen receptors Human genes 0.000 claims 1
- 108010038795 estrogen receptors Proteins 0.000 claims 1
- 201000007281 estrogen-receptor positive breast cancer Diseases 0.000 claims 1
- 201000006585 gastric adenocarcinoma Diseases 0.000 claims 1
- 229960002584 gefitinib Drugs 0.000 claims 1
- XGALLCVXEZPNRQ-UHFFFAOYSA-N gefitinib Chemical compound C=12C=C(OCCCN3CCOCC3)C(OC)=CC2=NC=NC=1NC1=CC=C(F)C(Cl)=C1 XGALLCVXEZPNRQ-UHFFFAOYSA-N 0.000 claims 1
- 238000003364 immunohistochemistry Methods 0.000 claims 1
- 239000007928 intraperitoneal injection Substances 0.000 claims 1
- 238000010253 intravenous injection Methods 0.000 claims 1
- 229940043355 kinase inhibitor Drugs 0.000 claims 1
- HPJKCIUCZWXJDR-UHFFFAOYSA-N letrozole Chemical compound C1=CC(C#N)=CC=C1C(N1N=CN=C1)C1=CC=C(C#N)C=C1 HPJKCIUCZWXJDR-UHFFFAOYSA-N 0.000 claims 1
- 229960003881 letrozole Drugs 0.000 claims 1
- 210000004185 liver Anatomy 0.000 claims 1
- 208000026535 luminal A breast carcinoma Diseases 0.000 claims 1
- 208000026534 luminal B breast carcinoma Diseases 0.000 claims 1
- 201000005202 lung cancer Diseases 0.000 claims 1
- 208000020816 lung neoplasm Diseases 0.000 claims 1
- 229940124302 mTOR inhibitor Drugs 0.000 claims 1
- 239000003628 mammalian target of rapamycin inhibitor Substances 0.000 claims 1
- 230000002611 ovarian Effects 0.000 claims 1
- 201000002094 pancreatic adenocarcinoma Diseases 0.000 claims 1
- 239000003757 phosphotransferase inhibitor Substances 0.000 claims 1
- 201000005825 prostate adenocarcinoma Diseases 0.000 claims 1
- 238000010254 subcutaneous injection Methods 0.000 claims 1
- 239000007929 subcutaneous injection Substances 0.000 claims 1
- 229940024606 amino acid Drugs 0.000 description 105
- 235000001014 amino acid Nutrition 0.000 description 105
- 235000018102 proteins Nutrition 0.000 description 75
- 125000005647 linker group Chemical group 0.000 description 71
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 65
- 102000039446 nucleic acids Human genes 0.000 description 42
- 108020004707 nucleic acids Proteins 0.000 description 42
- -1 β-alanine Ornithine Chemical class 0.000 description 35
- 239000000203 mixture Substances 0.000 description 33
- 125000003729 nucleotide group Chemical group 0.000 description 32
- 238000003556 assay Methods 0.000 description 31
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 30
- 239000002773 nucleotide Substances 0.000 description 30
- 230000000694 effects Effects 0.000 description 28
- 101000851181 Homo sapiens Epidermal growth factor receptor Proteins 0.000 description 27
- 239000003446 ligand Substances 0.000 description 26
- 108020004414 DNA Proteins 0.000 description 25
- 108010087819 Fc receptors Proteins 0.000 description 24
- 102000009109 Fc receptors Human genes 0.000 description 24
- 108060003951 Immunoglobulin Proteins 0.000 description 23
- 239000003153 chemical reaction reagent Substances 0.000 description 23
- 102000018358 immunoglobulin Human genes 0.000 description 23
- 102000005962 receptors Human genes 0.000 description 23
- 108020003175 receptors Proteins 0.000 description 23
- 239000000611 antibody drug conjugate Substances 0.000 description 21
- 229940049595 antibody-drug conjugate Drugs 0.000 description 21
- 230000001225 therapeutic effect Effects 0.000 description 20
- 230000006870 function Effects 0.000 description 19
- 102100024952 Protein CBFA2T1 Human genes 0.000 description 18
- 201000010099 disease Diseases 0.000 description 18
- 108010076504 Protein Sorting Signals Proteins 0.000 description 17
- 125000000539 amino acid group Chemical group 0.000 description 16
- 239000012634 fragment Substances 0.000 description 16
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 15
- 238000006243 chemical reaction Methods 0.000 description 15
- 239000012636 effector Substances 0.000 description 15
- 230000026731 phosphorylation Effects 0.000 description 15
- 238000006366 phosphorylation reaction Methods 0.000 description 15
- 102000001301 EGF receptor Human genes 0.000 description 14
- 235000014680 Saccharomyces cerevisiae Nutrition 0.000 description 14
- 239000000126 substance Substances 0.000 description 14
- 108060006698 EGF receptor Proteins 0.000 description 13
- 230000004913 activation Effects 0.000 description 13
- 238000004422 calculation algorithm Methods 0.000 description 13
- 238000000746 purification Methods 0.000 description 13
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 12
- 241001465754 Metazoa Species 0.000 description 12
- 230000021615 conjugation Effects 0.000 description 12
- 230000000875 corresponding effect Effects 0.000 description 12
- 208000035475 disorder Diseases 0.000 description 12
- 230000001404 mediated effect Effects 0.000 description 12
- 239000002609 medium Substances 0.000 description 12
- 108020004705 Codon Proteins 0.000 description 11
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 11
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 11
- 235000004554 glutamine Nutrition 0.000 description 11
- 230000003993 interaction Effects 0.000 description 11
- 125000001570 methylene group Chemical group [H]C([H])([*:1])[*:2] 0.000 description 11
- 230000000269 nucleophilic effect Effects 0.000 description 11
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 11
- 241000894006 Bacteria Species 0.000 description 10
- 241000196324 Embryophyta Species 0.000 description 10
- 238000004458 analytical method Methods 0.000 description 10
- 230000005764 inhibitory process Effects 0.000 description 10
- 238000004519 manufacturing process Methods 0.000 description 10
- ANZJBCHSOXCCRQ-FKUXLPTCSA-N mertansine Chemical compound CO[C@@H]([C@@]1(O)C[C@H](OC(=O)N1)[C@@H](C)[C@@H]1O[C@@]1(C)[C@@H](OC(=O)[C@H](C)N(C)C(=O)CCS)CC(=O)N1C)\C=C\C=C(C)\CC2=CC(OC)=C(Cl)C1=C2 ANZJBCHSOXCCRQ-FKUXLPTCSA-N 0.000 description 10
- 230000008569 process Effects 0.000 description 10
- 239000000047 product Substances 0.000 description 10
- 238000012360 testing method Methods 0.000 description 10
- 241000588724 Escherichia coli Species 0.000 description 9
- 102100026120 IgG receptor FcRn large subunit p51 Human genes 0.000 description 9
- 235000018417 cysteine Nutrition 0.000 description 9
- 229940088598 enzyme Drugs 0.000 description 9
- 239000000463 material Substances 0.000 description 9
- 238000012545 processing Methods 0.000 description 9
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 9
- 125000003396 thiol group Chemical group [H]S* 0.000 description 9
- 210000001519 tissue Anatomy 0.000 description 9
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 8
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 8
- 239000004472 Lysine Substances 0.000 description 8
- 239000004365 Protease Substances 0.000 description 8
- 239000002253 acid Substances 0.000 description 8
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 8
- 238000004113 cell culture Methods 0.000 description 8
- 230000000295 complement effect Effects 0.000 description 8
- 230000004540 complement-dependent cytotoxicity Effects 0.000 description 8
- 229940022353 herceptin Drugs 0.000 description 8
- 238000000338 in vitro Methods 0.000 description 8
- 238000001727 in vivo Methods 0.000 description 8
- 230000003834 intracellular effect Effects 0.000 description 8
- 230000004481 post-translational protein modification Effects 0.000 description 8
- 239000000243 solution Substances 0.000 description 8
- 238000001890 transfection Methods 0.000 description 8
- 238000013519 translation Methods 0.000 description 8
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 7
- 101710177940 IgG receptor FcRn large subunit p51 Proteins 0.000 description 7
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 7
- 125000003277 amino group Chemical group 0.000 description 7
- 210000004899 c-terminal region Anatomy 0.000 description 7
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 7
- 150000002148 esters Chemical class 0.000 description 7
- 238000009472 formulation Methods 0.000 description 7
- 238000009396 hybridization Methods 0.000 description 7
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 7
- 238000002347 injection Methods 0.000 description 7
- 239000007924 injection Substances 0.000 description 7
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 7
- 239000012528 membrane Substances 0.000 description 7
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 7
- 239000007787 solid Substances 0.000 description 7
- 238000010186 staining Methods 0.000 description 7
- 238000006467 substitution reaction Methods 0.000 description 7
- 150000003573 thiols Chemical class 0.000 description 7
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 7
- QWPXBEHQFHACTK-KZVYIGENSA-N (10e,12e)-86-chloro-12,14,4-trihydroxy-85,14-dimethoxy-33,2,7,10-tetramethyl-15,16-dihydro-14h-7-aza-1(6,4)-oxazina-3(2,3)-oxirana-8(1,3)-benzenacyclotetradecaphane-10,12-dien-6-one Chemical compound CN1C(=O)CC(O)C2(C)OC2C(C)C(OC(=O)N2)CC2(O)C(OC)\C=C\C=C(C)\CC2=CC(OC)=C(Cl)C1=C2 QWPXBEHQFHACTK-KZVYIGENSA-N 0.000 description 6
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 6
- 241000238631 Hexapoda Species 0.000 description 6
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 6
- 108091007491 NSP3 Papain-like protease domains Proteins 0.000 description 6
- 108091005804 Peptidases Proteins 0.000 description 6
- 206010035226 Plasma cell myeloma Diseases 0.000 description 6
- 230000021736 acetylation Effects 0.000 description 6
- 238000006640 acetylation reaction Methods 0.000 description 6
- 150000001299 aldehydes Chemical class 0.000 description 6
- 230000008901 benefit Effects 0.000 description 6
- UCMIRNVEIXFBKS-UHFFFAOYSA-N beta-alanine Chemical compound NCCC(O)=O UCMIRNVEIXFBKS-UHFFFAOYSA-N 0.000 description 6
- 230000004071 biological effect Effects 0.000 description 6
- 125000001246 bromo group Chemical group Br* 0.000 description 6
- 229910052799 carbon Inorganic materials 0.000 description 6
- 230000008859 change Effects 0.000 description 6
- 238000007385 chemical modification Methods 0.000 description 6
- 239000003795 chemical substances by application Substances 0.000 description 6
- 125000001309 chloro group Chemical group Cl* 0.000 description 6
- 230000001419 dependent effect Effects 0.000 description 6
- 102000052116 epidermal growth factor receptor activity proteins Human genes 0.000 description 6
- 108700015053 epidermal growth factor receptor activity proteins Proteins 0.000 description 6
- 238000010353 genetic engineering Methods 0.000 description 6
- 125000002346 iodo group Chemical group I* 0.000 description 6
- 210000004379 membrane Anatomy 0.000 description 6
- 239000000523 sample Substances 0.000 description 6
- 210000002966 serum Anatomy 0.000 description 6
- 241000894007 species Species 0.000 description 6
- 235000000346 sugar Nutrition 0.000 description 6
- 238000003786 synthesis reaction Methods 0.000 description 6
- 230000014616 translation Effects 0.000 description 6
- FUOOLUPWFVMBKG-UHFFFAOYSA-N 2-Aminoisobutyric acid Chemical compound CC(C)(N)C(O)=O FUOOLUPWFVMBKG-UHFFFAOYSA-N 0.000 description 5
- 102000000412 Annexin Human genes 0.000 description 5
- 108050008874 Annexin Proteins 0.000 description 5
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 5
- 150000008574 D-amino acids Chemical class 0.000 description 5
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 5
- 241000282412 Homo Species 0.000 description 5
- 108010073807 IgG Receptors Proteins 0.000 description 5
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 5
- 102100029204 Low affinity immunoglobulin gamma Fc region receptor II-a Human genes 0.000 description 5
- QWPXBEHQFHACTK-UHFFFAOYSA-N Maytansinol Natural products CN1C(=O)CC(O)C2(C)OC2C(C)C(OC(=O)N2)CC2(O)C(OC)C=CC=C(C)CC2=CC(OC)=C(Cl)C1=C2 QWPXBEHQFHACTK-UHFFFAOYSA-N 0.000 description 5
- 102000035195 Peptidases Human genes 0.000 description 5
- 102000007079 Peptide Fragments Human genes 0.000 description 5
- 108010033276 Peptide Fragments Proteins 0.000 description 5
- 241000235648 Pichia Species 0.000 description 5
- 241000700605 Viruses Species 0.000 description 5
- 238000007792 addition Methods 0.000 description 5
- 230000008484 agonism Effects 0.000 description 5
- 230000009435 amidation Effects 0.000 description 5
- 238000007112 amidation reaction Methods 0.000 description 5
- 238000003776 cleavage reaction Methods 0.000 description 5
- 239000000562 conjugate Substances 0.000 description 5
- 125000004122 cyclic group Chemical group 0.000 description 5
- 125000000151 cysteine group Chemical class N[C@@H](CS)C(=O)* 0.000 description 5
- 210000003527 eukaryotic cell Anatomy 0.000 description 5
- 108020001507 fusion proteins Proteins 0.000 description 5
- 102000037865 fusion proteins Human genes 0.000 description 5
- 230000013595 glycosylation Effects 0.000 description 5
- 238000006206 glycosylation reaction Methods 0.000 description 5
- 229940127121 immunoconjugate Drugs 0.000 description 5
- 229930182817 methionine Natural products 0.000 description 5
- 239000000178 monomer Substances 0.000 description 5
- 201000000050 myeloid neoplasm Diseases 0.000 description 5
- 230000003647 oxidation Effects 0.000 description 5
- 238000007254 oxidation reaction Methods 0.000 description 5
- 229920001223 polyethylene glycol Polymers 0.000 description 5
- 229920000642 polymer Polymers 0.000 description 5
- 230000001323 posttranslational effect Effects 0.000 description 5
- 230000002829 reductive effect Effects 0.000 description 5
- 230000007017 scission Effects 0.000 description 5
- 230000028327 secretion Effects 0.000 description 5
- 239000011780 sodium chloride Substances 0.000 description 5
- 238000013518 transcription Methods 0.000 description 5
- 230000035897 transcription Effects 0.000 description 5
- 230000009466 transformation Effects 0.000 description 5
- 125000001493 tyrosinyl group Chemical group [H]OC1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 5
- 102000009027 Albumins Human genes 0.000 description 4
- 108010088751 Albumins Proteins 0.000 description 4
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 4
- 108010021468 Fc gamma receptor IIA Proteins 0.000 description 4
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 4
- 101000871708 Homo sapiens Proheparin-binding EGF-like growth factor Proteins 0.000 description 4
- 102000009490 IgG Receptors Human genes 0.000 description 4
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 4
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 4
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 4
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 4
- 102000006496 Immunoglobulin Heavy Chains Human genes 0.000 description 4
- 108010019476 Immunoglobulin Heavy Chains Proteins 0.000 description 4
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 4
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 4
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 4
- 108700020796 Oncogene Proteins 0.000 description 4
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 4
- 108091000080 Phosphotransferase Proteins 0.000 description 4
- 239000002202 Polyethylene glycol Substances 0.000 description 4
- 102100033762 Proheparin-binding EGF-like growth factor Human genes 0.000 description 4
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 4
- 241000235070 Saccharomyces Species 0.000 description 4
- 235000004279 alanine Nutrition 0.000 description 4
- 229960002685 biotin Drugs 0.000 description 4
- 235000020958 biotin Nutrition 0.000 description 4
- 239000011616 biotin Substances 0.000 description 4
- 230000000903 blocking effect Effects 0.000 description 4
- 230000030833 cell death Effects 0.000 description 4
- 230000001413 cellular effect Effects 0.000 description 4
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 4
- 238000004587 chromatography analysis Methods 0.000 description 4
- 238000010276 construction Methods 0.000 description 4
- 238000013270 controlled release Methods 0.000 description 4
- XVOYSCVBGLVSOL-UHFFFAOYSA-N cysteic acid Chemical compound OC(=O)C(N)CS(O)(=O)=O XVOYSCVBGLVSOL-UHFFFAOYSA-N 0.000 description 4
- 239000002254 cytotoxic agent Substances 0.000 description 4
- 231100000599 cytotoxic agent Toxicity 0.000 description 4
- 230000007423 decrease Effects 0.000 description 4
- 238000012217 deletion Methods 0.000 description 4
- 230000037430 deletion Effects 0.000 description 4
- 238000001212 derivatisation Methods 0.000 description 4
- 238000013461 design Methods 0.000 description 4
- 238000004520 electroporation Methods 0.000 description 4
- 238000005516 engineering process Methods 0.000 description 4
- 238000002474 experimental method Methods 0.000 description 4
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 description 4
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 4
- 230000022244 formylation Effects 0.000 description 4
- 238000006170 formylation reaction Methods 0.000 description 4
- 239000001963 growth medium Substances 0.000 description 4
- 238000005734 heterodimerization reaction Methods 0.000 description 4
- 238000011534 incubation Methods 0.000 description 4
- 239000000543 intermediate Substances 0.000 description 4
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 4
- 239000002502 liposome Substances 0.000 description 4
- 210000004962 mammalian cell Anatomy 0.000 description 4
- 229960000485 methotrexate Drugs 0.000 description 4
- YOHYSYJDKVYCJI-UHFFFAOYSA-N n-[3-[[6-[3-(trifluoromethyl)anilino]pyrimidin-4-yl]amino]phenyl]cyclopropanecarboxamide Chemical compound FC(F)(F)C1=CC=CC(NC=2N=CN=C(NC=3C=C(NC(=O)C4CC4)C=CC=3)C=2)=C1 YOHYSYJDKVYCJI-UHFFFAOYSA-N 0.000 description 4
- 230000003472 neutralizing effect Effects 0.000 description 4
- 102000020233 phosphotransferase Human genes 0.000 description 4
- 238000002360 preparation method Methods 0.000 description 4
- 238000011321 prophylaxis Methods 0.000 description 4
- XJMOSONTPMZWPB-UHFFFAOYSA-M propidium iodide Chemical compound [I-].[I-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CCC[N+](C)(CC)CC)=C1C1=CC=CC=C1 XJMOSONTPMZWPB-UHFFFAOYSA-M 0.000 description 4
- 230000009467 reduction Effects 0.000 description 4
- 238000006722 reduction reaction Methods 0.000 description 4
- 230000001177 retroviral effect Effects 0.000 description 4
- 150000003839 salts Chemical class 0.000 description 4
- JQWHASGSAFIOCM-UHFFFAOYSA-M sodium periodate Chemical compound [Na+].[O-]I(=O)(=O)=O JQWHASGSAFIOCM-UHFFFAOYSA-M 0.000 description 4
- 229910052717 sulfur Inorganic materials 0.000 description 4
- WYWHKKSPHMUBEB-UHFFFAOYSA-N tioguanine Chemical compound N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 description 4
- 231100000331 toxic Toxicity 0.000 description 4
- 230000002588 toxic effect Effects 0.000 description 4
- 230000004614 tumor growth Effects 0.000 description 4
- 210000005253 yeast cell Anatomy 0.000 description 4
- WOWDZACBATWTAU-FEFUEGSOSA-N (2s)-2-[[(2s)-2-(dimethylamino)-3-methylbutanoyl]amino]-n-[(3r,4s,5s)-1-[(2s)-2-[(1r,2r)-3-[[(1s,2r)-1-hydroxy-1-phenylpropan-2-yl]amino]-1-methoxy-2-methyl-3-oxopropyl]pyrrolidin-1-yl]-3-methoxy-5-methyl-1-oxoheptan-4-yl]-n,3-dimethylbutanamide Chemical compound CC(C)[C@H](N(C)C)C(=O)N[C@@H](C(C)C)C(=O)N(C)[C@@H]([C@@H](C)CC)[C@H](OC)CC(=O)N1CCC[C@H]1[C@H](OC)[C@@H](C)C(=O)N[C@H](C)[C@@H](O)C1=CC=CC=C1 WOWDZACBATWTAU-FEFUEGSOSA-N 0.000 description 3
- BFSVOASYOCHEOV-UHFFFAOYSA-N 2-diethylaminoethanol Chemical compound CCN(CC)CCO BFSVOASYOCHEOV-UHFFFAOYSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 3
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 3
- 102000007299 Amphiregulin Human genes 0.000 description 3
- 108010033760 Amphiregulin Proteins 0.000 description 3
- 241000228212 Aspergillus Species 0.000 description 3
- 241000283690 Bos taurus Species 0.000 description 3
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 3
- 229920002307 Dextran Polymers 0.000 description 3
- 206010061818 Disease progression Diseases 0.000 description 3
- 101150029707 ERBB2 gene Proteins 0.000 description 3
- 101800000155 Epiregulin Proteins 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 3
- 241000233866 Fungi Species 0.000 description 3
- 101000917858 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-A Proteins 0.000 description 3
- 241000235649 Kluyveromyces Species 0.000 description 3
- 241000235058 Komagataella pastoris Species 0.000 description 3
- LRQKBLKVPFOOQJ-YFKPBYRVSA-N L-norleucine Chemical compound CCCC[C@H]([NH3+])C([O-])=O LRQKBLKVPFOOQJ-YFKPBYRVSA-N 0.000 description 3
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 3
- 102100029193 Low affinity immunoglobulin gamma Fc region receptor III-A Human genes 0.000 description 3
- PEEHTFAAVSWFBL-UHFFFAOYSA-N Maleimide Chemical compound O=C1NC(=O)C=C1 PEEHTFAAVSWFBL-UHFFFAOYSA-N 0.000 description 3
- 101710175625 Maltose/maltodextrin-binding periplasmic protein Proteins 0.000 description 3
- 241000699666 Mus <mouse, genus> Species 0.000 description 3
- 241000699670 Mus sp. Species 0.000 description 3
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 3
- 101800000675 Neuregulin-2 Proteins 0.000 description 3
- 101800000673 Neuregulin-3 Proteins 0.000 description 3
- 101800002641 Neuregulin-4 Proteins 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- 108090000526 Papain Proteins 0.000 description 3
- 206010057249 Phagocytosis Diseases 0.000 description 3
- 102100022668 Pro-neuregulin-2, membrane-bound isoform Human genes 0.000 description 3
- 102100022659 Pro-neuregulin-3, membrane-bound isoform Human genes 0.000 description 3
- 102100022658 Pro-neuregulin-4, membrane-bound isoform Human genes 0.000 description 3
- 102100025498 Proepiregulin Human genes 0.000 description 3
- 102100029981 Receptor tyrosine-protein kinase erbB-4 Human genes 0.000 description 3
- 101710100963 Receptor tyrosine-protein kinase erbB-4 Proteins 0.000 description 3
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 3
- 241000187747 Streptomyces Species 0.000 description 3
- FOCVUCIESVLUNU-UHFFFAOYSA-N Thiotepa Chemical compound C1CN1P(N1CC1)(=S)N1CC1 FOCVUCIESVLUNU-UHFFFAOYSA-N 0.000 description 3
- 102400001320 Transforming growth factor alpha Human genes 0.000 description 3
- 101800004564 Transforming growth factor alpha Proteins 0.000 description 3
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 3
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 3
- 102000004243 Tubulin Human genes 0.000 description 3
- 108090000704 Tubulin Proteins 0.000 description 3
- 150000007513 acids Chemical class 0.000 description 3
- 230000010933 acylation Effects 0.000 description 3
- 238000005917 acylation reaction Methods 0.000 description 3
- QWCKQJZIFLGMSD-UHFFFAOYSA-N alpha-aminobutyric acid Chemical compound CCC(N)C(O)=O QWCKQJZIFLGMSD-UHFFFAOYSA-N 0.000 description 3
- 150000001412 amines Chemical class 0.000 description 3
- 210000004102 animal cell Anatomy 0.000 description 3
- 230000006907 apoptotic process Effects 0.000 description 3
- 125000003118 aryl group Chemical group 0.000 description 3
- 230000001580 bacterial effect Effects 0.000 description 3
- 230000009286 beneficial effect Effects 0.000 description 3
- 238000006664 bond formation reaction Methods 0.000 description 3
- 239000001506 calcium phosphate Substances 0.000 description 3
- 229910000389 calcium phosphate Inorganic materials 0.000 description 3
- 235000011010 calcium phosphates Nutrition 0.000 description 3
- 235000014633 carbohydrates Nutrition 0.000 description 3
- 239000000969 carrier Substances 0.000 description 3
- 230000010261 cell growth Effects 0.000 description 3
- 230000004663 cell proliferation Effects 0.000 description 3
- 239000001913 cellulose Substances 0.000 description 3
- 229920002678 cellulose Polymers 0.000 description 3
- 238000005859 coupling reaction Methods 0.000 description 3
- 230000001086 cytosolic effect Effects 0.000 description 3
- 230000006378 damage Effects 0.000 description 3
- 230000017858 demethylation Effects 0.000 description 3
- 238000010520 demethylation reaction Methods 0.000 description 3
- 238000001514 detection method Methods 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 230000018109 developmental process Effects 0.000 description 3
- 230000005750 disease progression Effects 0.000 description 3
- 231100000673 dose–response relationship Toxicity 0.000 description 3
- 229960002949 fluorouracil Drugs 0.000 description 3
- 125000000524 functional group Chemical group 0.000 description 3
- 238000004128 high performance liquid chromatography Methods 0.000 description 3
- 239000000710 homodimer Substances 0.000 description 3
- 238000000099 in vitro assay Methods 0.000 description 3
- 238000001802 infusion Methods 0.000 description 3
- 239000004615 ingredient Substances 0.000 description 3
- 238000001990 intravenous administration Methods 0.000 description 3
- 150000002576 ketones Chemical class 0.000 description 3
- 125000005439 maleimidyl group Chemical group C1(C=CC(N1*)=O)=O 0.000 description 3
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 3
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 3
- 230000011987 methylation Effects 0.000 description 3
- 238000007069 methylation reaction Methods 0.000 description 3
- 238000000329 molecular dynamics simulation Methods 0.000 description 3
- 238000012856 packing Methods 0.000 description 3
- 229940055729 papain Drugs 0.000 description 3
- 235000019834 papain Nutrition 0.000 description 3
- 230000001575 pathological effect Effects 0.000 description 3
- 230000008782 phagocytosis Effects 0.000 description 3
- 229960005190 phenylalanine Drugs 0.000 description 3
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 3
- 210000001236 prokaryotic cell Anatomy 0.000 description 3
- 238000000159 protein binding assay Methods 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- 238000009738 saturating Methods 0.000 description 3
- 238000000926 separation method Methods 0.000 description 3
- 239000002356 single layer Substances 0.000 description 3
- 239000002904 solvent Substances 0.000 description 3
- 230000000638 stimulation Effects 0.000 description 3
- 208000024891 symptom Diseases 0.000 description 3
- 230000009885 systemic effect Effects 0.000 description 3
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 3
- 229960004295 valine Drugs 0.000 description 3
- 230000035899 viability Effects 0.000 description 3
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 2
- MFRNYXJJRJQHNW-DEMKXPNLSA-N (2s)-2-[[(2r,3r)-3-methoxy-3-[(2s)-1-[(3r,4s,5s)-3-methoxy-5-methyl-4-[methyl-[(2s)-3-methyl-2-[[(2s)-3-methyl-2-(methylamino)butanoyl]amino]butanoyl]amino]heptanoyl]pyrrolidin-2-yl]-2-methylpropanoyl]amino]-3-phenylpropanoic acid Chemical compound CN[C@@H](C(C)C)C(=O)N[C@@H](C(C)C)C(=O)N(C)[C@@H]([C@@H](C)CC)[C@H](OC)CC(=O)N1CCC[C@H]1[C@H](OC)[C@@H](C)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 MFRNYXJJRJQHNW-DEMKXPNLSA-N 0.000 description 2
- ALBODLTZUXKBGZ-JUUVMNCLSA-N (2s)-2-amino-3-phenylpropanoic acid;(2s)-2,6-diaminohexanoic acid Chemical compound NCCCC[C@H](N)C(O)=O.OC(=O)[C@@H](N)CC1=CC=CC=C1 ALBODLTZUXKBGZ-JUUVMNCLSA-N 0.000 description 2
- VYEWZWBILJHHCU-OMQUDAQFSA-N (e)-n-[(2s,3r,4r,5r,6r)-2-[(2r,3r,4s,5s,6s)-3-acetamido-5-amino-4-hydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-6-[2-[(2r,3s,4r,5r)-5-(2,4-dioxopyrimidin-1-yl)-3,4-dihydroxyoxolan-2-yl]-2-hydroxyethyl]-4,5-dihydroxyoxan-3-yl]-5-methylhex-2-enamide Chemical compound N1([C@@H]2O[C@@H]([C@H]([C@H]2O)O)C(O)C[C@@H]2[C@H](O)[C@H](O)[C@H]([C@@H](O2)O[C@@H]2[C@@H]([C@@H](O)[C@H](N)[C@@H](CO)O2)NC(C)=O)NC(=O)/C=C/CC(C)C)C=CC(=O)NC1=O VYEWZWBILJHHCU-OMQUDAQFSA-N 0.000 description 2
- XQUPVDVFXZDTLT-UHFFFAOYSA-N 1-[4-[[4-(2,5-dioxopyrrol-1-yl)phenyl]methyl]phenyl]pyrrole-2,5-dione Chemical compound O=C1C=CC(=O)N1C(C=C1)=CC=C1CC1=CC=C(N2C(C=CC2=O)=O)C=C1 XQUPVDVFXZDTLT-UHFFFAOYSA-N 0.000 description 2
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 2
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 2
- ODHCTXKNWHHXJC-VKHMYHEASA-N 5-oxo-L-proline Chemical compound OC(=O)[C@@H]1CCC(=O)N1 ODHCTXKNWHHXJC-VKHMYHEASA-N 0.000 description 2
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 2
- CJIJXIFQYOPWTF-UHFFFAOYSA-N 7-hydroxycoumarin Natural products O1C(=O)C=CC2=CC(O)=CC=C21 CJIJXIFQYOPWTF-UHFFFAOYSA-N 0.000 description 2
- 208000007934 ACTH-independent macronodular adrenal hyperplasia Diseases 0.000 description 2
- 230000005730 ADP ribosylation Effects 0.000 description 2
- 102000012440 Acetylcholinesterase Human genes 0.000 description 2
- 108010022752 Acetylcholinesterase Proteins 0.000 description 2
- 108010000239 Aequorin Proteins 0.000 description 2
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 2
- 239000004475 Arginine Substances 0.000 description 2
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 2
- 108090001008 Avidin Proteins 0.000 description 2
- NOWKCMXCCJGMRR-UHFFFAOYSA-N Aziridine Chemical compound C1CN1 NOWKCMXCCJGMRR-UHFFFAOYSA-N 0.000 description 2
- 102100026189 Beta-galactosidase Human genes 0.000 description 2
- 101800001382 Betacellulin Proteins 0.000 description 2
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 2
- 241000222120 Candida <Saccharomycetales> Species 0.000 description 2
- 201000009030 Carcinoma Diseases 0.000 description 2
- 102000000844 Cell Surface Receptors Human genes 0.000 description 2
- 108010001857 Cell Surface Receptors Proteins 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 2
- 108090000317 Chymotrypsin Proteins 0.000 description 2
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 2
- 108090000695 Cytokines Proteins 0.000 description 2
- 102000004127 Cytokines Human genes 0.000 description 2
- IGXWBGJHJZYPQS-SSDOTTSWSA-N D-Luciferin Chemical compound OC(=O)[C@H]1CSC(C=2SC3=CC=C(O)C=C3N=2)=N1 IGXWBGJHJZYPQS-SSDOTTSWSA-N 0.000 description 2
- 102000053602 DNA Human genes 0.000 description 2
- 108010092160 Dactinomycin Proteins 0.000 description 2
- XPDXVDYUQZHFPV-UHFFFAOYSA-N Dansyl Chloride Chemical compound C1=CC=C2C(N(C)C)=CC=CC2=C1S(Cl)(=O)=O XPDXVDYUQZHFPV-UHFFFAOYSA-N 0.000 description 2
- CYCGRDQQIOGCKX-UHFFFAOYSA-N Dehydro-luciferin Natural products OC(=O)C1=CSC(C=2SC3=CC(O)=CC=C3N=2)=N1 CYCGRDQQIOGCKX-UHFFFAOYSA-N 0.000 description 2
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 2
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 2
- 238000002965 ELISA Methods 0.000 description 2
- 241000283073 Equus caballus Species 0.000 description 2
- 241000206602 Eukaryota Species 0.000 description 2
- 108010021472 Fc gamma receptor IIB Proteins 0.000 description 2
- BJGNCJDXODQBOB-UHFFFAOYSA-N Fivefly Luciferin Natural products OC(=O)C1CSC(C=2SC3=CC(O)=CC=C3N=2)=N1 BJGNCJDXODQBOB-UHFFFAOYSA-N 0.000 description 2
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 2
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 2
- GYHNNYVSQQEPJS-UHFFFAOYSA-N Gallium Chemical compound [Ga] GYHNNYVSQQEPJS-UHFFFAOYSA-N 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 2
- 108010051815 Glutamyl endopeptidase Proteins 0.000 description 2
- 239000004471 Glycine Substances 0.000 description 2
- 241000205062 Halobacterium Species 0.000 description 2
- 244000286779 Hansenula anomala Species 0.000 description 2
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 2
- 108091006905 Human Serum Albumin Proteins 0.000 description 2
- 102000008100 Human Serum Albumin Human genes 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- 108700005091 Immunoglobulin Genes Proteins 0.000 description 2
- 244000285963 Kluyveromyces fragilis Species 0.000 description 2
- 241001138401 Kluyveromyces lactis Species 0.000 description 2
- AHLPHDHHMVZTML-BYPYZUCNSA-N L-Ornithine Chemical compound NCCC[C@H](N)C(O)=O AHLPHDHHMVZTML-BYPYZUCNSA-N 0.000 description 2
- 150000008575 L-amino acids Chemical class 0.000 description 2
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 2
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 2
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 2
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 2
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 2
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 2
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 2
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 2
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 2
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 2
- 102100029205 Low affinity immunoglobulin gamma Fc region receptor II-b Human genes 0.000 description 2
- 108060001084 Luciferase Proteins 0.000 description 2
- 239000005089 Luciferase Substances 0.000 description 2
- DDWFXDSYGUXRAY-UHFFFAOYSA-N Luciferin Natural products CCc1c(C)c(CC2NC(=O)C(=C2C=C)C)[nH]c1Cc3[nH]c4C(=C5/NC(CC(=O)O)C(C)C5CC(=O)O)CC(=O)c4c3C DDWFXDSYGUXRAY-UHFFFAOYSA-N 0.000 description 2
- 206010027476 Metastases Diseases 0.000 description 2
- 241001529936 Murinae Species 0.000 description 2
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 description 2
- 101800002648 Neuregulin-1 Proteins 0.000 description 2
- 241000221960 Neurospora Species 0.000 description 2
- 239000004677 Nylon Substances 0.000 description 2
- 241000320412 Ogataea angusta Species 0.000 description 2
- AHLPHDHHMVZTML-UHFFFAOYSA-N Orn-delta-NH2 Natural products NCCCC(N)C(O)=O AHLPHDHHMVZTML-UHFFFAOYSA-N 0.000 description 2
- UTJLXEIPEHZYQJ-UHFFFAOYSA-N Ornithine Natural products OC(=O)C(C)CCCN UTJLXEIPEHZYQJ-UHFFFAOYSA-N 0.000 description 2
- 108091093037 Peptide nucleic acid Proteins 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 108010004729 Phycoerythrin Proteins 0.000 description 2
- 239000004743 Polypropylene Substances 0.000 description 2
- 239000004793 Polystyrene Substances 0.000 description 2
- 102100029837 Probetacellulin Human genes 0.000 description 2
- 241000589516 Pseudomonas Species 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- 241000223252 Rhodotorula Species 0.000 description 2
- AUNGANRZJHBGPY-SCRDCRAPSA-N Riboflavin Chemical compound OC[C@@H](O)[C@@H](O)[C@@H](O)CN1C=2C=C(C)C(C)=CC=2N=C2C1=NC(=O)NC2=O AUNGANRZJHBGPY-SCRDCRAPSA-N 0.000 description 2
- 241000235346 Schizosaccharomyces Species 0.000 description 2
- 229920002684 Sepharose Polymers 0.000 description 2
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 2
- 241000228389 Sporidiobolus Species 0.000 description 2
- 229920002472 Starch Polymers 0.000 description 2
- 108010090804 Streptavidin Proteins 0.000 description 2
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 2
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 2
- 239000004473 Threonine Substances 0.000 description 2
- 108020004566 Transfer RNA Proteins 0.000 description 2
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 2
- 108090000631 Trypsin Proteins 0.000 description 2
- 102000004142 Trypsin Human genes 0.000 description 2
- YJQCOFNZVFGCAF-UHFFFAOYSA-N Tunicamycin II Natural products O1C(CC(O)C2C(C(O)C(O2)N2C(NC(=O)C=C2)=O)O)C(O)C(O)C(NC(=O)C=CCCCCCCCCC(C)C)C1OC1OC(CO)C(O)C(O)C1NC(C)=O YJQCOFNZVFGCAF-UHFFFAOYSA-N 0.000 description 2
- 108090000848 Ubiquitin Proteins 0.000 description 2
- 102400000757 Ubiquitin Human genes 0.000 description 2
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 2
- IEDXPSOJFSVCKU-HOKPPMCLSA-N [4-[[(2S)-5-(carbamoylamino)-2-[[(2S)-2-[6-(2,5-dioxopyrrolidin-1-yl)hexanoylamino]-3-methylbutanoyl]amino]pentanoyl]amino]phenyl]methyl N-[(2S)-1-[[(2S)-1-[[(3R,4S,5S)-1-[(2S)-2-[(1R,2R)-3-[[(1S,2R)-1-hydroxy-1-phenylpropan-2-yl]amino]-1-methoxy-2-methyl-3-oxopropyl]pyrrolidin-1-yl]-3-methoxy-5-methyl-1-oxoheptan-4-yl]-methylamino]-3-methyl-1-oxobutan-2-yl]amino]-3-methyl-1-oxobutan-2-yl]-N-methylcarbamate Chemical compound CC[C@H](C)[C@@H]([C@@H](CC(=O)N1CCC[C@H]1[C@H](OC)[C@@H](C)C(=O)N[C@H](C)[C@@H](O)c1ccccc1)OC)N(C)C(=O)[C@@H](NC(=O)[C@H](C(C)C)N(C)C(=O)OCc1ccc(NC(=O)[C@H](CCCNC(N)=O)NC(=O)[C@@H](NC(=O)CCCCCN2C(=O)CCC2=O)C(C)C)cc1)C(C)C IEDXPSOJFSVCKU-HOKPPMCLSA-N 0.000 description 2
- 229940022698 acetylcholinesterase Drugs 0.000 description 2
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 description 2
- 230000003213 activating effect Effects 0.000 description 2
- 230000001154 acute effect Effects 0.000 description 2
- 239000007801 affinity label Substances 0.000 description 2
- 230000009824 affinity maturation Effects 0.000 description 2
- 239000000556 agonist Substances 0.000 description 2
- 125000000217 alkyl group Chemical group 0.000 description 2
- 150000001350 alkyl halides Chemical class 0.000 description 2
- 230000006229 amino acid addition Effects 0.000 description 2
- 239000003708 ampul Substances 0.000 description 2
- 238000010171 animal model Methods 0.000 description 2
- 238000005571 anion exchange chromatography Methods 0.000 description 2
- 150000001450 anions Chemical class 0.000 description 2
- 230000000259 anti-tumor effect Effects 0.000 description 2
- 230000000890 antigenic effect Effects 0.000 description 2
- 230000001640 apoptogenic effect Effects 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 2
- 235000009697 arginine Nutrition 0.000 description 2
- 230000010516 arginylation Effects 0.000 description 2
- 235000009582 asparagine Nutrition 0.000 description 2
- 229960001230 asparagine Drugs 0.000 description 2
- 235000003704 aspartic acid Nutrition 0.000 description 2
- 125000004429 atom Chemical group 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 2
- 108010005774 beta-Galactosidase Proteins 0.000 description 2
- 229940000635 beta-alanine Drugs 0.000 description 2
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 2
- 239000012148 binding buffer Substances 0.000 description 2
- 230000017531 blood circulation Effects 0.000 description 2
- 210000004556 brain Anatomy 0.000 description 2
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 2
- 238000005277 cation exchange chromatography Methods 0.000 description 2
- 210000003169 central nervous system Anatomy 0.000 description 2
- 229940044683 chemotherapy drug Drugs 0.000 description 2
- 229960004630 chlorambucil Drugs 0.000 description 2
- JCKYGMPEJWAADB-UHFFFAOYSA-N chlorambucil Chemical compound OC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 JCKYGMPEJWAADB-UHFFFAOYSA-N 0.000 description 2
- 230000002759 chromosomal effect Effects 0.000 description 2
- 210000000349 chromosome Anatomy 0.000 description 2
- 229960002376 chymotrypsin Drugs 0.000 description 2
- 229960002173 citrulline Drugs 0.000 description 2
- 210000004748 cultured cell Anatomy 0.000 description 2
- ATDGTVJJHBUTRL-UHFFFAOYSA-N cyanogen bromide Chemical compound BrC#N ATDGTVJJHBUTRL-UHFFFAOYSA-N 0.000 description 2
- 229960004397 cyclophosphamide Drugs 0.000 description 2
- 230000009089 cytolysis Effects 0.000 description 2
- 230000003013 cytotoxicity Effects 0.000 description 2
- 231100000135 cytotoxicity Toxicity 0.000 description 2
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 2
- 238000000326 densiometry Methods 0.000 description 2
- 230000001627 detrimental effect Effects 0.000 description 2
- 230000029087 digestion Effects 0.000 description 2
- AFOSIXZFDONLBT-UHFFFAOYSA-N divinyl sulfone Chemical compound C=CS(=O)(=O)C=C AFOSIXZFDONLBT-UHFFFAOYSA-N 0.000 description 2
- 229960004679 doxorubicin Drugs 0.000 description 2
- 230000008030 elimination Effects 0.000 description 2
- 238000003379 elimination reaction Methods 0.000 description 2
- 238000005538 encapsulation Methods 0.000 description 2
- 239000003623 enhancer Substances 0.000 description 2
- 238000000855 fermentation Methods 0.000 description 2
- 230000004151 fermentation Effects 0.000 description 2
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 2
- 229910052731 fluorine Inorganic materials 0.000 description 2
- 239000011737 fluorine Substances 0.000 description 2
- OVBPIULPVIDEAO-LBPRGKRZSA-N folic acid Chemical compound C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-LBPRGKRZSA-N 0.000 description 2
- 235000019253 formic acid Nutrition 0.000 description 2
- 239000012737 fresh medium Substances 0.000 description 2
- 229910052733 gallium Inorganic materials 0.000 description 2
- BTCSSZJGUNDROE-UHFFFAOYSA-N gamma-aminobutyric acid Chemical compound NCCCC(O)=O BTCSSZJGUNDROE-UHFFFAOYSA-N 0.000 description 2
- 230000006251 gamma-carboxylation Effects 0.000 description 2
- 238000002523 gelfiltration Methods 0.000 description 2
- 239000011521 glass Substances 0.000 description 2
- 208000005017 glioblastoma Diseases 0.000 description 2
- 235000013922 glutamic acid Nutrition 0.000 description 2
- 239000004220 glutamic acid Substances 0.000 description 2
- 230000009422 growth inhibiting effect Effects 0.000 description 2
- 150000003278 haem Chemical group 0.000 description 2
- 150000004820 halides Chemical class 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 108010084091 heregulin beta1 Proteins 0.000 description 2
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 2
- 230000006801 homologous recombination Effects 0.000 description 2
- 238000002744 homologous recombination Methods 0.000 description 2
- 229920001519 homopolymer Polymers 0.000 description 2
- 102000051957 human ERBB2 Human genes 0.000 description 2
- 229910052739 hydrogen Inorganic materials 0.000 description 2
- 239000001257 hydrogen Substances 0.000 description 2
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 2
- 230000002209 hydrophobic effect Effects 0.000 description 2
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Chemical class O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 2
- 230000033444 hydroxylation Effects 0.000 description 2
- 238000005805 hydroxylation reaction Methods 0.000 description 2
- 229960001101 ifosfamide Drugs 0.000 description 2
- HOMGKSMUEGBAAB-UHFFFAOYSA-N ifosfamide Chemical compound ClCCNP1(=O)OCCCN1CCCl HOMGKSMUEGBAAB-UHFFFAOYSA-N 0.000 description 2
- 229940072221 immunoglobulins Drugs 0.000 description 2
- 229910052738 indium Inorganic materials 0.000 description 2
- APFVFJFRJDLVQX-UHFFFAOYSA-N indium atom Chemical compound [In] APFVFJFRJDLVQX-UHFFFAOYSA-N 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- 108091008042 inhibitory receptors Proteins 0.000 description 2
- 238000007914 intraventricular administration Methods 0.000 description 2
- 238000002955 isolation Methods 0.000 description 2
- 229960000310 isoleucine Drugs 0.000 description 2
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 2
- 210000003734 kidney Anatomy 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- HWYHZTIRURJOHG-UHFFFAOYSA-N luminol Chemical compound O=C1NNC(=O)C2=C1C(N)=CC=C2 HWYHZTIRURJOHG-UHFFFAOYSA-N 0.000 description 2
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 2
- 210000002540 macrophage Anatomy 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 230000036210 malignancy Effects 0.000 description 2
- 238000013507 mapping Methods 0.000 description 2
- 239000003550 marker Substances 0.000 description 2
- 229960004961 mechlorethamine Drugs 0.000 description 2
- HAWPXGHAZFHHAD-UHFFFAOYSA-N mechlorethamine Chemical class ClCCN(C)CCCl HAWPXGHAZFHHAD-UHFFFAOYSA-N 0.000 description 2
- 229960001428 mercaptopurine Drugs 0.000 description 2
- 229910021645 metal ion Inorganic materials 0.000 description 2
- 230000009401 metastasis Effects 0.000 description 2
- MYWUZJCMWCOHBA-VIFPVBQESA-N methamphetamine Chemical compound CN[C@@H](C)CC1=CC=CC=C1 MYWUZJCMWCOHBA-VIFPVBQESA-N 0.000 description 2
- 125000001360 methionine group Chemical group N[C@@H](CCSC)C(=O)* 0.000 description 2
- 239000011859 microparticle Substances 0.000 description 2
- 229960004857 mitomycin Drugs 0.000 description 2
- DNIAPMSPPWPWGF-UHFFFAOYSA-N monopropylene glycol Natural products CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 2
- ZTLGJPIZUOVDMT-UHFFFAOYSA-N n,n-dichlorotriazin-4-amine Chemical compound ClN(Cl)C1=CC=NN=N1 ZTLGJPIZUOVDMT-UHFFFAOYSA-N 0.000 description 2
- OWIUPIRUAQMTTK-UHFFFAOYSA-M n-aminocarbamate Chemical compound NNC([O-])=O OWIUPIRUAQMTTK-UHFFFAOYSA-M 0.000 description 2
- 108010068617 neonatal Fc receptor Proteins 0.000 description 2
- 210000004940 nucleus Anatomy 0.000 description 2
- 229920001778 nylon Polymers 0.000 description 2
- 229960003104 ornithine Drugs 0.000 description 2
- 150000002923 oximes Chemical class 0.000 description 2
- 238000004806 packaging method and process Methods 0.000 description 2
- 229910052763 palladium Inorganic materials 0.000 description 2
- 230000036961 partial effect Effects 0.000 description 2
- 230000006320 pegylation Effects 0.000 description 2
- 238000010647 peptide synthesis reaction Methods 0.000 description 2
- 210000001322 periplasm Anatomy 0.000 description 2
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 2
- 230000004962 physiological condition Effects 0.000 description 2
- 239000013600 plasmid vector Substances 0.000 description 2
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 2
- 229920002401 polyacrylamide Polymers 0.000 description 2
- 229920001155 polypropylene Polymers 0.000 description 2
- 229920002223 polystyrene Polymers 0.000 description 2
- 239000004800 polyvinyl chloride Substances 0.000 description 2
- 229920000915 polyvinyl chloride Polymers 0.000 description 2
- 239000002244 precipitate Substances 0.000 description 2
- 230000013823 prenylation Effects 0.000 description 2
- 230000002265 prevention Effects 0.000 description 2
- 238000004393 prognosis Methods 0.000 description 2
- 230000002062 proliferating effect Effects 0.000 description 2
- 230000000069 prophylactic effect Effects 0.000 description 2
- 230000002797 proteolythic effect Effects 0.000 description 2
- 230000006337 proteolytic cleavage Effects 0.000 description 2
- RXWNCPJZOCPEPQ-NVWDDTSBSA-N puromycin Chemical compound C1=CC(OC)=CC=C1C[C@H](N)C(=O)N[C@H]1[C@@H](O)[C@H](N2C3=NC=NC(=C3N=C2)N(C)C)O[C@@H]1CO RXWNCPJZOCPEPQ-NVWDDTSBSA-N 0.000 description 2
- 125000005030 pyridylthio group Chemical group N1=C(C=CC=C1)S* 0.000 description 2
- 229940043131 pyroglutamate Drugs 0.000 description 2
- 230000006340 racemization Effects 0.000 description 2
- 239000012857 radioactive material Substances 0.000 description 2
- 238000003156 radioimmunoprecipitation Methods 0.000 description 2
- 230000009257 reactivity Effects 0.000 description 2
- 230000001105 regulatory effect Effects 0.000 description 2
- 230000010076 replication Effects 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 108091008146 restriction endonucleases Proteins 0.000 description 2
- PYWVYCXTNDRMGF-UHFFFAOYSA-N rhodamine B Chemical compound [Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=CC=C1C(O)=O PYWVYCXTNDRMGF-UHFFFAOYSA-N 0.000 description 2
- 238000007363 ring formation reaction Methods 0.000 description 2
- FSYKKLYZXJSNPZ-UHFFFAOYSA-N sarcosine Chemical compound C[NH2+]CC([O-])=O FSYKKLYZXJSNPZ-UHFFFAOYSA-N 0.000 description 2
- 239000007790 solid phase Substances 0.000 description 2
- 230000009870 specific binding Effects 0.000 description 2
- 239000008107 starch Substances 0.000 description 2
- 235000019698 starch Nutrition 0.000 description 2
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 2
- PVYJZLYGTZKPJE-UHFFFAOYSA-N streptonigrin Chemical compound C=1C=C2C(=O)C(OC)=C(N)C(=O)C2=NC=1C(C=1N)=NC(C(O)=O)=C(C)C=1C1=CC=C(OC)C(OC)=C1O PVYJZLYGTZKPJE-UHFFFAOYSA-N 0.000 description 2
- 125000001424 substituent group Chemical group 0.000 description 2
- 230000019635 sulfation Effects 0.000 description 2
- 238000005670 sulfation reaction Methods 0.000 description 2
- 239000011593 sulfur Substances 0.000 description 2
- 239000006228 supernatant Substances 0.000 description 2
- 239000013589 supplement Substances 0.000 description 2
- 239000000829 suppository Substances 0.000 description 2
- 238000001356 surgical procedure Methods 0.000 description 2
- 238000013268 sustained release Methods 0.000 description 2
- 239000012730 sustained-release form Substances 0.000 description 2
- 238000010189 synthetic method Methods 0.000 description 2
- 229910052713 technetium Inorganic materials 0.000 description 2
- GKLVYJBZJHMRIY-UHFFFAOYSA-N technetium atom Chemical compound [Tc] GKLVYJBZJHMRIY-UHFFFAOYSA-N 0.000 description 2
- 229910052716 thallium Inorganic materials 0.000 description 2
- BKVIYDNLLOSFOA-UHFFFAOYSA-N thallium Chemical compound [Tl] BKVIYDNLLOSFOA-UHFFFAOYSA-N 0.000 description 2
- SRVJKTDHMYAMHA-WUXMJOGZSA-N thioacetazone Chemical compound CC(=O)NC1=CC=C(\C=N\NC(N)=S)C=C1 SRVJKTDHMYAMHA-WUXMJOGZSA-N 0.000 description 2
- 229960001196 thiotepa Drugs 0.000 description 2
- 229960003087 tioguanine Drugs 0.000 description 2
- 230000001988 toxicity Effects 0.000 description 2
- 231100000419 toxicity Toxicity 0.000 description 2
- 238000010361 transduction Methods 0.000 description 2
- 230000026683 transduction Effects 0.000 description 2
- 238000012546 transfer Methods 0.000 description 2
- 230000009261 transgenic effect Effects 0.000 description 2
- 230000001052 transient effect Effects 0.000 description 2
- 229910052722 tritium Inorganic materials 0.000 description 2
- 239000012588 trypsin Substances 0.000 description 2
- 229960001322 trypsin Drugs 0.000 description 2
- MEYZYGMYMLNUHJ-UHFFFAOYSA-N tunicamycin Natural products CC(C)CCCCCCCCCC=CC(=O)NC1C(O)C(O)C(CC(O)C2OC(C(O)C2O)N3C=CC(=O)NC3=O)OC1OC4OC(CO)C(O)C(O)C4NC(=O)C MEYZYGMYMLNUHJ-UHFFFAOYSA-N 0.000 description 2
- 238000010798 ubiquitination Methods 0.000 description 2
- 230000034512 ubiquitination Effects 0.000 description 2
- ORHBXUUXSCNDEV-UHFFFAOYSA-N umbelliferone Chemical compound C1=CC(=O)OC2=CC(O)=CC=C21 ORHBXUUXSCNDEV-UHFFFAOYSA-N 0.000 description 2
- HFTAFOQKODTIJY-UHFFFAOYSA-N umbelliferone Natural products Cc1cc2C=CC(=O)Oc2cc1OCC=CC(C)(C)O HFTAFOQKODTIJY-UHFFFAOYSA-N 0.000 description 2
- VBEQCZHXXJYVRD-GACYYNSASA-N uroanthelone Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CS)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(C)C)[C@@H](C)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)CNC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C1=CC=C(O)C=C1 VBEQCZHXXJYVRD-GACYYNSASA-N 0.000 description 2
- 239000004474 valine Substances 0.000 description 2
- JKHVDAUOODACDU-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 3-(2,5-dioxopyrrol-1-yl)propanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCN1C(=O)C=CC1=O JKHVDAUOODACDU-UHFFFAOYSA-N 0.000 description 1
- PVGATNRYUYNBHO-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 4-(2,5-dioxopyrrol-1-yl)butanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCCN1C(=O)C=CC1=O PVGATNRYUYNBHO-UHFFFAOYSA-N 0.000 description 1
- JSHOVKSMJRQOGY-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 4-(pyridin-2-yldisulfanyl)butanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCCSSC1=CC=CC=N1 JSHOVKSMJRQOGY-UHFFFAOYSA-N 0.000 description 1
- BQWBEDSJTMWJAE-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 4-[(2-iodoacetyl)amino]benzoate Chemical compound C1=CC(NC(=O)CI)=CC=C1C(=O)ON1C(=O)CCC1=O BQWBEDSJTMWJAE-UHFFFAOYSA-N 0.000 description 1
- PMJWDPGOWBRILU-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 4-[4-(2,5-dioxopyrrol-1-yl)phenyl]butanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCCC(C=C1)=CC=C1N1C(=O)C=CC1=O PMJWDPGOWBRILU-UHFFFAOYSA-N 0.000 description 1
- IADUWZMNTKHTIN-MLSWMBHTSA-N (2,5-dioxopyrrolidin-1-yl) 4-[[3-[3-[[(2S)-1-[[(1S,2R,3S,5S,6S,16E,18E,20R,21S)-11-chloro-21-hydroxy-12,20-dimethoxy-2,5,9,16-tetramethyl-8,23-dioxo-4,24-dioxa-9,22-diazatetracyclo[19.3.1.110,14.03,5]hexacosa-10,12,14(26),16,18-pentaen-6-yl]oxy]-1-oxopropan-2-yl]-methylamino]-3-oxopropyl]sulfanyl-2,5-dioxopyrrolidin-1-yl]methyl]cyclohexane-1-carboxylate Chemical compound CO[C@@H]1\C=C\C=C(C)\Cc2cc(OC)c(Cl)c(c2)N(C)C(=O)C[C@H](OC(=O)[C@H](C)N(C)C(=O)CCSC2CC(=O)N(CC3CCC(CC3)C(=O)ON3C(=O)CCC3=O)C2=O)[C@]2(C)O[C@H]2[C@H](C)[C@@H]2C[C@@]1(O)NC(=O)O2 IADUWZMNTKHTIN-MLSWMBHTSA-N 0.000 description 1
- VLARLSIGSPVYHX-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 6-(2,5-dioxopyrrol-1-yl)hexanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCCCCN1C(=O)C=CC1=O VLARLSIGSPVYHX-UHFFFAOYSA-N 0.000 description 1
- WCMOHMXWOOBVMZ-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 6-[3-(2,5-dioxopyrrol-1-yl)propanoylamino]hexanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCCCCNC(=O)CCN1C(=O)C=CC1=O WCMOHMXWOOBVMZ-UHFFFAOYSA-N 0.000 description 1
- IHVODYOQUSEYJJ-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 6-[[4-[(2,5-dioxopyrrol-1-yl)methyl]cyclohexanecarbonyl]amino]hexanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCCCCNC(=O)C(CC1)CCC1CN1C(=O)C=CC1=O IHVODYOQUSEYJJ-UHFFFAOYSA-N 0.000 description 1
- FDKWRPBBCBCIGA-REOHCLBHSA-N (2r)-2-azaniumyl-3-$l^{1}-selanylpropanoate Chemical compound [Se]C[C@H](N)C(O)=O FDKWRPBBCBCIGA-REOHCLBHSA-N 0.000 description 1
- WDQLRUYAYXDIFW-RWKIJVEZSA-N (2r,3r,4s,5r,6r)-4-[(2s,3r,4s,5r,6r)-3,5-dihydroxy-4-[(2r,3r,4s,5s,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-6-[[(2r,3r,4s,5s,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxymethyl]oxan-2-yl]oxy-6-(hydroxymethyl)oxane-2,3,5-triol Chemical compound O[C@@H]1[C@@H](CO)O[C@@H](O)[C@H](O)[C@H]1O[C@H]1[C@H](O)[C@@H](O[C@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)O)[C@H](O)[C@@H](CO[C@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)O)O1 WDQLRUYAYXDIFW-RWKIJVEZSA-N 0.000 description 1
- BVAUMRCGVHUWOZ-ZETCQYMHSA-N (2s)-2-(cyclohexylazaniumyl)propanoate Chemical compound OC(=O)[C@H](C)NC1CCCCC1 BVAUMRCGVHUWOZ-ZETCQYMHSA-N 0.000 description 1
- MRTPISKDZDHEQI-YFKPBYRVSA-N (2s)-2-(tert-butylamino)propanoic acid Chemical compound OC(=O)[C@H](C)NC(C)(C)C MRTPISKDZDHEQI-YFKPBYRVSA-N 0.000 description 1
- ORFNVPGICPYLJV-YTVPMEHESA-N (2s)-2-[[(2r,3r)-3-[(2s)-1-[(3r,4s,5s)-4-[[(2s)-2-[[(2s)-2-[6-(2,5-dioxopyrrol-1-yl)hexanoyl-methylamino]-3-methylbutanoyl]amino]-3-methylbutanoyl]-methylamino]-3-methoxy-5-methylheptanoyl]pyrrolidin-2-yl]-3-methoxy-2-methylpropanoyl]amino]-3-phenylpropan Chemical compound C([C@H](NC(=O)[C@H](C)[C@@H](OC)[C@@H]1CCCN1C(=O)C[C@H]([C@H]([C@@H](C)CC)N(C)C(=O)[C@@H](NC(=O)[C@H](C(C)C)N(C)C(=O)CCCCCN1C(C=CC1=O)=O)C(C)C)OC)C(O)=O)C1=CC=CC=C1 ORFNVPGICPYLJV-YTVPMEHESA-N 0.000 description 1
- AGGWFDNPHKLBBV-YUMQZZPRSA-N (2s)-2-[[(2s)-2-amino-3-methylbutanoyl]amino]-5-(carbamoylamino)pentanoic acid Chemical group CC(C)[C@H](N)C(=O)N[C@H](C(O)=O)CCCNC(N)=O AGGWFDNPHKLBBV-YUMQZZPRSA-N 0.000 description 1
- NPDBDJFLKKQMCM-SCSAIBSYSA-N (2s)-2-amino-3,3-dimethylbutanoic acid Chemical compound CC(C)(C)[C@H](N)C(O)=O NPDBDJFLKKQMCM-SCSAIBSYSA-N 0.000 description 1
- KQMBIBBJWXGSEI-ROLXFIACSA-N (2s)-2-amino-3-hydroxy-3-(1h-imidazol-5-yl)propanoic acid Chemical compound OC(=O)[C@@H](N)C(O)C1=CNC=N1 KQMBIBBJWXGSEI-ROLXFIACSA-N 0.000 description 1
- MSECZMWQBBVGEN-LURJTMIESA-N (2s)-2-azaniumyl-4-(1h-imidazol-5-yl)butanoate Chemical compound OC(=O)[C@@H](N)CCC1=CN=CN1 MSECZMWQBBVGEN-LURJTMIESA-N 0.000 description 1
- UYEGXSNFZXWSDV-BYPYZUCNSA-N (2s)-3-(2-amino-1h-imidazol-5-yl)-2-azaniumylpropanoate Chemical compound OC(=O)[C@@H](N)CC1=CNC(N)=N1 UYEGXSNFZXWSDV-BYPYZUCNSA-N 0.000 description 1
- BLUGYPPOFIHFJS-UUFHNPECSA-N (2s)-n-[(2s)-1-[[(3r,4s,5s)-3-methoxy-1-[(2s)-2-[(1r,2r)-1-methoxy-2-methyl-3-oxo-3-[[(1s)-2-phenyl-1-(1,3-thiazol-2-yl)ethyl]amino]propyl]pyrrolidin-1-yl]-5-methyl-1-oxoheptan-4-yl]-methylamino]-3-methyl-1-oxobutan-2-yl]-3-methyl-2-(methylamino)butanamid Chemical compound CN[C@@H](C(C)C)C(=O)N[C@@H](C(C)C)C(=O)N(C)[C@@H]([C@@H](C)CC)[C@H](OC)CC(=O)N1CCC[C@H]1[C@H](OC)[C@@H](C)C(=O)N[C@H](C=1SC=CN=1)CC1=CC=CC=C1 BLUGYPPOFIHFJS-UUFHNPECSA-N 0.000 description 1
- CGMTUJFWROPELF-YPAAEMCBSA-N (3E,5S)-5-[(2S)-butan-2-yl]-3-(1-hydroxyethylidene)pyrrolidine-2,4-dione Chemical compound CC[C@H](C)[C@@H]1NC(=O)\C(=C(/C)O)C1=O CGMTUJFWROPELF-YPAAEMCBSA-N 0.000 description 1
- LTDQGCFMTVHZKP-UHFFFAOYSA-N (4-bromophenyl)-(4,6-dimethoxy-3-methyl-1-benzofuran-2-yl)methanone Chemical compound O1C2=CC(OC)=CC(OC)=C2C(C)=C1C(=O)C1=CC=C(Br)C=C1 LTDQGCFMTVHZKP-UHFFFAOYSA-N 0.000 description 1
- NMWKYTGJWUAZPZ-WWHBDHEGSA-N (4S)-4-[[(4R,7S,10S,16S,19S,25S,28S,31R)-31-[[(2S)-2-[[(1R,6R,9S,12S,18S,21S,24S,27S,30S,33S,36S,39S,42R,47R,53S,56S,59S,62S,65S,68S,71S,76S,79S,85S)-47-[[(2S)-2-[[(2S)-4-amino-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-amino-3-methylbutanoyl]amino]-3-methylbutanoyl]amino]-3-hydroxypropanoyl]amino]-3-(1H-imidazol-4-yl)propanoyl]amino]-3-phenylpropanoyl]amino]-4-oxobutanoyl]amino]-3-carboxypropanoyl]amino]-18-(4-aminobutyl)-27,68-bis(3-amino-3-oxopropyl)-36,71,76-tribenzyl-39-(3-carbamimidamidopropyl)-24-(2-carboxyethyl)-21,56-bis(carboxymethyl)-65,85-bis[(1R)-1-hydroxyethyl]-59-(hydroxymethyl)-62,79-bis(1H-imidazol-4-ylmethyl)-9-methyl-33-(2-methylpropyl)-8,11,17,20,23,26,29,32,35,38,41,48,54,57,60,63,66,69,72,74,77,80,83,86-tetracosaoxo-30-propan-2-yl-3,4,44,45-tetrathia-7,10,16,19,22,25,28,31,34,37,40,49,55,58,61,64,67,70,73,75,78,81,84,87-tetracosazatetracyclo[40.31.14.012,16.049,53]heptaoctacontane-6-carbonyl]amino]-3-methylbutanoyl]amino]-7-(3-carbamimidamidopropyl)-25-(hydroxymethyl)-19-[(4-hydroxyphenyl)methyl]-28-(1H-imidazol-4-ylmethyl)-10-methyl-6,9,12,15,18,21,24,27,30-nonaoxo-16-propan-2-yl-1,2-dithia-5,8,11,14,17,20,23,26,29-nonazacyclodotriacontane-4-carbonyl]amino]-5-[[(2S)-1-[[(2S)-1-[[(2S)-3-carboxy-1-[[(2S)-1-[[(2S)-1-[[(1S)-1-carboxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-1-oxopropan-2-yl]amino]-1-oxopropan-2-yl]amino]-3-(1H-imidazol-4-yl)-1-oxopropan-2-yl]amino]-5-oxopentanoic acid Chemical compound CC(C)C[C@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](C)NC(=O)[C@H](Cc1c[nH]cn1)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H]1CSSC[C@H](NC(=O)[C@@H](NC(=O)[C@@H]2CSSC[C@@H]3NC(=O)[C@H](Cc4ccccc4)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](Cc4c[nH]cn4)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H]4CCCN4C(=O)[C@H](CSSC[C@H](NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](Cc4c[nH]cn4)NC(=O)[C@H](Cc4ccccc4)NC3=O)[C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](Cc3ccccc3)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N3CCC[C@H]3C(=O)N[C@@H](C)C(=O)N2)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](Cc2ccccc2)NC(=O)[C@H](Cc2c[nH]cn2)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@@H](N)C(C)C)C(C)C)[C@@H](C)O)C(C)C)C(=O)N[C@@H](Cc2c[nH]cn2)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](Cc2ccc(O)cc2)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1)C(=O)N[C@@H](C)C(O)=O NMWKYTGJWUAZPZ-WWHBDHEGSA-N 0.000 description 1
- XRBSKUSTLXISAB-XVVDYKMHSA-N (5r,6r,7r,8r)-8-hydroxy-7-(hydroxymethyl)-5-(3,4,5-trimethoxyphenyl)-5,6,7,8-tetrahydrobenzo[f][1,3]benzodioxole-6-carboxylic acid Chemical compound COC1=C(OC)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@H](O)[C@@H](CO)[C@@H]2C(O)=O)=C1 XRBSKUSTLXISAB-XVVDYKMHSA-N 0.000 description 1
- AESVUZLWRXEGEX-DKCAWCKPSA-N (7S,9R)-7-[(2S,4R,5R,6R)-4-amino-5-hydroxy-6-methyloxan-2-yl]oxy-6,9,11-trihydroxy-9-(2-hydroxyacetyl)-4-methoxy-8,10-dihydro-7H-tetracene-5,12-dione iron(3+) Chemical compound [Fe+3].COc1cccc2C(=O)c3c(O)c4C[C@@](O)(C[C@H](O[C@@H]5C[C@@H](N)[C@@H](O)[C@@H](C)O5)c4c(O)c3C(=O)c12)C(=O)CO AESVUZLWRXEGEX-DKCAWCKPSA-N 0.000 description 1
- FPVKHBSQESCIEP-UHFFFAOYSA-N (8S)-3-(2-deoxy-beta-D-erythro-pentofuranosyl)-3,6,7,8-tetrahydroimidazo[4,5-d][1,3]diazepin-8-ol Natural products C1C(O)C(CO)OC1N1C(NC=NCC2O)=C2N=C1 FPVKHBSQESCIEP-UHFFFAOYSA-N 0.000 description 1
- IEXUMDBQLIVNHZ-YOUGDJEHSA-N (8s,11r,13r,14s,17s)-11-[4-(dimethylamino)phenyl]-17-hydroxy-17-(3-hydroxypropyl)-13-methyl-1,2,6,7,8,11,12,14,15,16-decahydrocyclopenta[a]phenanthren-3-one Chemical compound C1=CC(N(C)C)=CC=C1[C@@H]1C2=C3CCC(=O)C=C3CC[C@H]2[C@H](CC[C@]2(O)CCCO)[C@@]2(C)C1 IEXUMDBQLIVNHZ-YOUGDJEHSA-N 0.000 description 1
- FDKXTQMXEQVLRF-ZHACJKMWSA-N (E)-dacarbazine Chemical compound CN(C)\N=N\c1[nH]cnc1C(N)=O FDKXTQMXEQVLRF-ZHACJKMWSA-N 0.000 description 1
- LKJPYSCBVHEWIU-KRWDZBQOSA-N (R)-bicalutamide Chemical compound C([C@@](O)(C)C(=O)NC=1C=C(C(C#N)=CC=1)C(F)(F)F)S(=O)(=O)C1=CC=C(F)C=C1 LKJPYSCBVHEWIU-KRWDZBQOSA-N 0.000 description 1
- AGNGYMCLFWQVGX-AGFFZDDWSA-N (e)-1-[(2s)-2-amino-2-carboxyethoxy]-2-diazonioethenolate Chemical compound OC(=O)[C@@H](N)CO\C([O-])=C\[N+]#N AGNGYMCLFWQVGX-AGFFZDDWSA-N 0.000 description 1
- 125000003088 (fluoren-9-ylmethoxy)carbonyl group Chemical group 0.000 description 1
- UKAUYVFTDYCKQA-UHFFFAOYSA-N -2-Amino-4-hydroxybutanoic acid Natural products OC(=O)C(N)CCO UKAUYVFTDYCKQA-UHFFFAOYSA-N 0.000 description 1
- SGVWDRVQIYUSRA-UHFFFAOYSA-N 1-[2-[2-(2,5-dioxopyrrol-1-yl)ethyldisulfanyl]ethyl]pyrrole-2,5-dione Chemical compound O=C1C=CC(=O)N1CCSSCCN1C(=O)C=CC1=O SGVWDRVQIYUSRA-UHFFFAOYSA-N 0.000 description 1
- DIYPCWKHSODVAP-UHFFFAOYSA-N 1-[3-(2,5-dioxopyrrol-1-yl)benzoyl]oxy-2,5-dioxopyrrolidine-3-sulfonic acid Chemical compound O=C1C(S(=O)(=O)O)CC(=O)N1OC(=O)C1=CC=CC(N2C(C=CC2=O)=O)=C1 DIYPCWKHSODVAP-UHFFFAOYSA-N 0.000 description 1
- FPKVOQKZMBDBKP-UHFFFAOYSA-N 1-[4-[(2,5-dioxopyrrol-1-yl)methyl]cyclohexanecarbonyl]oxy-2,5-dioxopyrrolidine-3-sulfonic acid Chemical group O=C1C(S(=O)(=O)O)CC(=O)N1OC(=O)C1CCC(CN2C(C=CC2=O)=O)CC1 FPKVOQKZMBDBKP-UHFFFAOYSA-N 0.000 description 1
- CULQNACJHGHAER-UHFFFAOYSA-N 1-[4-[(2-iodoacetyl)amino]benzoyl]oxy-2,5-dioxopyrrolidine-3-sulfonic acid Chemical compound O=C1C(S(=O)(=O)O)CC(=O)N1OC(=O)C1=CC=C(NC(=O)CI)C=C1 CULQNACJHGHAER-UHFFFAOYSA-N 0.000 description 1
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 description 1
- PRDFBSVERLRRMY-UHFFFAOYSA-N 2'-(4-ethoxyphenyl)-5-(4-methylpiperazin-1-yl)-2,5'-bibenzimidazole Chemical compound C1=CC(OCC)=CC=C1C1=NC2=CC=C(C=3NC4=CC(=CC=C4N=3)N3CCN(C)CC3)C=C2N1 PRDFBSVERLRRMY-UHFFFAOYSA-N 0.000 description 1
- VGONTNSXDCQUGY-RRKCRQDMSA-N 2'-deoxyinosine Chemical group C1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CNC2=O)=C2N=C1 VGONTNSXDCQUGY-RRKCRQDMSA-N 0.000 description 1
- BTOTXLJHDSNXMW-POYBYMJQSA-N 2,3-dideoxyuridine Chemical compound O1[C@H](CO)CC[C@@H]1N1C(=O)NC(=O)C=C1 BTOTXLJHDSNXMW-POYBYMJQSA-N 0.000 description 1
- OGNSCSPNOLGXSM-UHFFFAOYSA-N 2,4-diaminobutyric acid Chemical compound NCCC(N)C(O)=O OGNSCSPNOLGXSM-UHFFFAOYSA-N 0.000 description 1
- MIJDSYMOBYNHOT-UHFFFAOYSA-N 2-(ethylamino)ethanol Chemical compound CCNCCO MIJDSYMOBYNHOT-UHFFFAOYSA-N 0.000 description 1
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 1
- IOOMXAQUNPWDLL-UHFFFAOYSA-N 2-[6-(diethylamino)-3-(diethyliminiumyl)-3h-xanthen-9-yl]-5-sulfobenzene-1-sulfonate Chemical compound C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=C(S(O)(=O)=O)C=C1S([O-])(=O)=O IOOMXAQUNPWDLL-UHFFFAOYSA-N 0.000 description 1
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 1
- DJQYYYCQOZMCRC-UHFFFAOYSA-N 2-aminopropane-1,3-dithiol Chemical group SCC(N)CS DJQYYYCQOZMCRC-UHFFFAOYSA-N 0.000 description 1
- PBSPQZHJEDTHTL-UHFFFAOYSA-N 2-benzoylpentanoic acid Chemical compound CCCC(C(O)=O)C(=O)C1=CC=CC=C1 PBSPQZHJEDTHTL-UHFFFAOYSA-N 0.000 description 1
- JUIKUQOUMZUFQT-UHFFFAOYSA-N 2-bromoacetamide Chemical compound NC(=O)CBr JUIKUQOUMZUFQT-UHFFFAOYSA-N 0.000 description 1
- KGIGUEBEKRSTEW-UHFFFAOYSA-N 2-vinylpyridine Chemical compound C=CC1=CC=CC=N1 KGIGUEBEKRSTEW-UHFFFAOYSA-N 0.000 description 1
- NDMPLJNOPCLANR-UHFFFAOYSA-N 3,4-dihydroxy-15-(4-hydroxy-18-methoxycarbonyl-5,18-seco-ibogamin-18-yl)-16-methoxy-1-methyl-6,7-didehydro-aspidospermidine-3-carboxylic acid methyl ester Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 NDMPLJNOPCLANR-UHFFFAOYSA-N 0.000 description 1
- PWMYMKOUNYTVQN-UHFFFAOYSA-N 3-(8,8-diethyl-2-aza-8-germaspiro[4.5]decan-2-yl)-n,n-dimethylpropan-1-amine Chemical compound C1C[Ge](CC)(CC)CCC11CN(CCCN(C)C)CC1 PWMYMKOUNYTVQN-UHFFFAOYSA-N 0.000 description 1
- PBVAJRFEEOIAGW-UHFFFAOYSA-N 3-[bis(2-carboxyethyl)phosphanyl]propanoic acid;hydrochloride Chemical compound Cl.OC(=O)CCP(CCC(O)=O)CCC(O)=O PBVAJRFEEOIAGW-UHFFFAOYSA-N 0.000 description 1
- AOJJSUZBOXZQNB-VTZDEGQISA-N 4'-epidoxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-VTZDEGQISA-N 0.000 description 1
- DODQJNMQWMSYGS-QPLCGJKRSA-N 4-[(z)-1-[4-[2-(dimethylamino)ethoxy]phenyl]-1-phenylbut-1-en-2-yl]phenol Chemical compound C=1C=C(O)C=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 DODQJNMQWMSYGS-QPLCGJKRSA-N 0.000 description 1
- ZMRMMAOBSFSXLN-UHFFFAOYSA-N 4-[4-(2,5-dioxopyrrol-1-yl)phenyl]butanehydrazide Chemical compound C1=CC(CCCC(=O)NN)=CC=C1N1C(=O)C=CC1=O ZMRMMAOBSFSXLN-UHFFFAOYSA-N 0.000 description 1
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 1
- TVZGACDUOSZQKY-LBPRGKRZSA-N 4-aminofolic acid Chemical compound C1=NC2=NC(N)=NC(N)=C2N=C1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 TVZGACDUOSZQKY-LBPRGKRZSA-N 0.000 description 1
- IDPUKCWIGUEADI-UHFFFAOYSA-N 5-[bis(2-chloroethyl)amino]uracil Chemical compound ClCCN(CCCl)C1=CNC(=O)NC1=O IDPUKCWIGUEADI-UHFFFAOYSA-N 0.000 description 1
- NMUSYJAQQFHJEW-KVTDHHQDSA-N 5-azacytidine Chemical compound O=C1N=C(N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 NMUSYJAQQFHJEW-KVTDHHQDSA-N 0.000 description 1
- WYXSYVWAUAUWLD-SHUUEZRQSA-N 6-azauridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C=N1 WYXSYVWAUAUWLD-SHUUEZRQSA-N 0.000 description 1
- YCWQAMGASJSUIP-YFKPBYRVSA-N 6-diazo-5-oxo-L-norleucine Chemical compound OC(=O)[C@@H](N)CCC(=O)C=[N+]=[N-] YCWQAMGASJSUIP-YFKPBYRVSA-N 0.000 description 1
- 229960005538 6-diazo-5-oxo-L-norleucine Drugs 0.000 description 1
- VVIAGPKUTFNRDU-UHFFFAOYSA-N 6S-folinic acid Natural products C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 VVIAGPKUTFNRDU-UHFFFAOYSA-N 0.000 description 1
- ZGXJTSGNIOSYLO-UHFFFAOYSA-N 88755TAZ87 Chemical compound NCC(=O)CCC(O)=O ZGXJTSGNIOSYLO-UHFFFAOYSA-N 0.000 description 1
- HDZZVAMISRMYHH-UHFFFAOYSA-N 9beta-Ribofuranosyl-7-deazaadenin Natural products C1=CC=2C(N)=NC=NC=2N1C1OC(CO)C(O)C1O HDZZVAMISRMYHH-UHFFFAOYSA-N 0.000 description 1
- 241000186046 Actinomyces Species 0.000 description 1
- 241000567139 Aeropyrum pernix Species 0.000 description 1
- 108700028369 Alleles Proteins 0.000 description 1
- CEIZFXOZIQNICU-UHFFFAOYSA-N Alternaria alternata Crofton-weed toxin Natural products CCC(C)C1NC(=O)C(C(C)=O)=C1O CEIZFXOZIQNICU-UHFFFAOYSA-N 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 1
- 206010073128 Anaplastic oligodendroglioma Diseases 0.000 description 1
- DGBBXVWXOHSLTG-UHFFFAOYSA-N Ansamitocin P2 Natural products CC1C2OC2(C)C(OC(=O)CC)CC(=O)N(C)C(C(=C(OC)C=2)Cl)=CC=2CC(C)=CC=CC(OC)C2(O)NC(=O)OC1C2 DGBBXVWXOHSLTG-UHFFFAOYSA-N 0.000 description 1
- 101100067974 Arabidopsis thaliana POP2 gene Proteins 0.000 description 1
- 241000203069 Archaea Species 0.000 description 1
- 102100029361 Aromatase Human genes 0.000 description 1
- 108010078554 Aromatase Proteins 0.000 description 1
- 101100136076 Aspergillus oryzae (strain ATCC 42149 / RIB 40) pel1 gene Proteins 0.000 description 1
- 206010003571 Astrocytoma Diseases 0.000 description 1
- 241000271566 Aves Species 0.000 description 1
- 108091008875 B cell receptors Proteins 0.000 description 1
- 230000003844 B-cell-activation Effects 0.000 description 1
- 244000063299 Bacillus subtilis Species 0.000 description 1
- 235000014469 Bacillus subtilis Nutrition 0.000 description 1
- VGGGPCQERPFHOB-MCIONIFRSA-N Bestatin Chemical compound CC(C)C[C@H](C(O)=O)NC(=O)[C@@H](O)[C@H](N)CC1=CC=CC=C1 VGGGPCQERPFHOB-MCIONIFRSA-N 0.000 description 1
- 206010005003 Bladder cancer Diseases 0.000 description 1
- 108010006654 Bleomycin Proteins 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 1
- 102100036850 C-C motif chemokine 23 Human genes 0.000 description 1
- 206010006895 Cachexia Diseases 0.000 description 1
- 101100314454 Caenorhabditis elegans tra-1 gene Proteins 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 241000282465 Canis Species 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- AOCCBINRVIKJHY-UHFFFAOYSA-N Carmofur Chemical compound CCCCCCNC(=O)N1C=C(F)C(=O)NC1=O AOCCBINRVIKJHY-UHFFFAOYSA-N 0.000 description 1
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 description 1
- 241000700198 Cavia Species 0.000 description 1
- 241001619326 Cephalosporium Species 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 206010008342 Cervix carcinoma Diseases 0.000 description 1
- JWBOIMRXGHLCPP-UHFFFAOYSA-N Chloditan Chemical compound C=1C=CC=C(Cl)C=1C(C(Cl)Cl)C1=CC=C(Cl)C=C1 JWBOIMRXGHLCPP-UHFFFAOYSA-N 0.000 description 1
- MKQWTWSXVILIKJ-LXGUWJNJSA-N Chlorozotocin Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](C=O)NC(=O)N(N=O)CCCl MKQWTWSXVILIKJ-LXGUWJNJSA-N 0.000 description 1
- 241001508787 Citeromyces Species 0.000 description 1
- 108091026890 Coding region Proteins 0.000 description 1
- 208000035473 Communicable disease Diseases 0.000 description 1
- 102000000989 Complement System Proteins Human genes 0.000 description 1
- 108010069112 Complement System Proteins Proteins 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- 241000195493 Cryptophyta Species 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- FDKWRPBBCBCIGA-UWTATZPHSA-N D-Selenocysteine Natural products [Se]C[C@@H](N)C(O)=O FDKWRPBBCBCIGA-UWTATZPHSA-N 0.000 description 1
- 229920002271 DEAE-Sepharose Polymers 0.000 description 1
- 102000012410 DNA Ligases Human genes 0.000 description 1
- 108010061982 DNA Ligases Proteins 0.000 description 1
- 230000004544 DNA amplification Effects 0.000 description 1
- 108050009160 DNA polymerase 1 Proteins 0.000 description 1
- 239000003155 DNA primer Substances 0.000 description 1
- 108010014303 DNA-directed DNA polymerase Proteins 0.000 description 1
- 102000016928 DNA-directed DNA polymerase Human genes 0.000 description 1
- WEAHRLBPCANXCN-UHFFFAOYSA-N Daunomycin Natural products CCC1(O)CC(OC2CC(N)C(O)C(C)O2)c3cc4C(=O)c5c(OC)cccc5C(=O)c4c(O)c3C1 WEAHRLBPCANXCN-UHFFFAOYSA-N 0.000 description 1
- 206010011878 Deafness Diseases 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 102100024746 Dihydrofolate reductase Human genes 0.000 description 1
- 108010016626 Dipeptides Proteins 0.000 description 1
- 241000255581 Drosophila <fruit fly, genus> Species 0.000 description 1
- 102000012545 EGF-like domains Human genes 0.000 description 1
- 108050002150 EGF-like domains Proteins 0.000 description 1
- 206010014733 Endometrial cancer Diseases 0.000 description 1
- 206010014759 Endometrial neoplasm Diseases 0.000 description 1
- 108010042407 Endonucleases Proteins 0.000 description 1
- 102000004533 Endonucleases Human genes 0.000 description 1
- SAMRUMKYXPVKPA-VFKOLLTISA-N Enocitabine Chemical compound O=C1N=C(NC(=O)CCCCCCCCCCCCCCCCCCCCC)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 SAMRUMKYXPVKPA-VFKOLLTISA-N 0.000 description 1
- 101800003838 Epidermal growth factor Proteins 0.000 description 1
- HTIJFSOGRVMCQR-UHFFFAOYSA-N Epirubicin Natural products COc1cccc2C(=O)c3c(O)c4CC(O)(CC(OC5CC(N)C(=O)C(C)O5)c4c(O)c3C(=O)c12)C(=O)CO HTIJFSOGRVMCQR-UHFFFAOYSA-N 0.000 description 1
- OBMLHUPNRURLOK-XGRAFVIBSA-N Epitiostanol Chemical compound C1[C@@H]2S[C@@H]2C[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CC[C@H]21 OBMLHUPNRURLOK-XGRAFVIBSA-N 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 101000867232 Escherichia coli Heat-stable enterotoxin II Proteins 0.000 description 1
- 241000701533 Escherichia virus T4 Species 0.000 description 1
- JOYRKODLDBILNP-UHFFFAOYSA-N Ethyl urethane Chemical compound CCOC(N)=O JOYRKODLDBILNP-UHFFFAOYSA-N 0.000 description 1
- 108060002716 Exonuclease Proteins 0.000 description 1
- 241000282324 Felis Species 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- MPJKWIXIYCLVCU-UHFFFAOYSA-N Folinic acid Natural products NC1=NC2=C(N(C=O)C(CNc3ccc(cc3)C(=O)NC(CCC(=O)O)CC(=O)O)CN2)C(=O)N1 MPJKWIXIYCLVCU-UHFFFAOYSA-N 0.000 description 1
- 108010015133 Galactose oxidase Proteins 0.000 description 1
- 206010017993 Gastrointestinal neoplasms Diseases 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 241000193385 Geobacillus stearothermophilus Species 0.000 description 1
- 208000032612 Glial tumor Diseases 0.000 description 1
- 201000010915 Glioblastoma multiforme Diseases 0.000 description 1
- 206010018338 Glioma Diseases 0.000 description 1
- BLCLNMBMMGCOAS-URPVMXJPSA-N Goserelin Chemical compound C([C@@H](C(=O)N[C@H](COC(C)(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N1[C@@H](CCC1)C(=O)NNC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 BLCLNMBMMGCOAS-URPVMXJPSA-N 0.000 description 1
- 108010069236 Goserelin Proteins 0.000 description 1
- 244000041633 Grewia tenax Species 0.000 description 1
- 235000005612 Grewia tenax Nutrition 0.000 description 1
- 101150009006 HIS3 gene Proteins 0.000 description 1
- 241000204933 Haloferax volcanii Species 0.000 description 1
- 229920000209 Hexadimethrine bromide Polymers 0.000 description 1
- 102100026122 High affinity immunoglobulin gamma Fc receptor I Human genes 0.000 description 1
- 101000713081 Homo sapiens C-C motif chemokine 23 Proteins 0.000 description 1
- 101100118549 Homo sapiens EGFR gene Proteins 0.000 description 1
- 101000913074 Homo sapiens High affinity immunoglobulin gamma Fc receptor I Proteins 0.000 description 1
- 101001034652 Homo sapiens Insulin-like growth factor 1 receptor Proteins 0.000 description 1
- 101000917826 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor II-a Proteins 0.000 description 1
- 101000917824 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor II-b Proteins 0.000 description 1
- 241000223198 Humicola Species 0.000 description 1
- PMMYEEVYMWASQN-DMTCNVIQSA-N Hydroxyproline Chemical compound O[C@H]1CN[C@H](C(O)=O)C1 PMMYEEVYMWASQN-DMTCNVIQSA-N 0.000 description 1
- XDXDZDZNSLXDNA-TZNDIEGXSA-N Idarubicin Chemical compound C1[C@H](N)[C@H](O)[C@H](C)O[C@H]1O[C@@H]1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2C[C@@](O)(C(C)=O)C1 XDXDZDZNSLXDNA-TZNDIEGXSA-N 0.000 description 1
- XDXDZDZNSLXDNA-UHFFFAOYSA-N Idarubicin Natural products C1C(N)C(O)C(C)OC1OC1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2CC(O)(C(C)=O)C1 XDXDZDZNSLXDNA-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 102000009786 Immunoglobulin Constant Regions Human genes 0.000 description 1
- 108010009817 Immunoglobulin Constant Regions Proteins 0.000 description 1
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 1
- 102100039688 Insulin-like growth factor 1 receptor Human genes 0.000 description 1
- 208000008839 Kidney Neoplasms Diseases 0.000 description 1
- VHJLVAABSRFDPM-IMJSIDKUSA-N L-1,4-dithiothreitol Chemical compound SC[C@H](O)[C@@H](O)CS VHJLVAABSRFDPM-IMJSIDKUSA-N 0.000 description 1
- SNDPXSYFESPGGJ-BYPYZUCNSA-N L-2-aminopentanoic acid Chemical compound CCC[C@H](N)C(O)=O SNDPXSYFESPGGJ-BYPYZUCNSA-N 0.000 description 1
- FADYJNXDPBKVCA-UHFFFAOYSA-N L-Phenylalanyl-L-lysin Natural products NCCCCC(C(O)=O)NC(=O)C(N)CC1=CC=CC=C1 FADYJNXDPBKVCA-UHFFFAOYSA-N 0.000 description 1
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 1
- ZGUNAGUHMKGQNY-ZETCQYMHSA-N L-alpha-phenylglycine zwitterion Chemical compound OC(=O)[C@@H](N)C1=CC=CC=C1 ZGUNAGUHMKGQNY-ZETCQYMHSA-N 0.000 description 1
- RHGKLRLOHDJJDR-BYPYZUCNSA-N L-citrulline Chemical compound NC(=O)NCCC[C@H]([NH3+])C([O-])=O RHGKLRLOHDJJDR-BYPYZUCNSA-N 0.000 description 1
- 229930182816 L-glutamine Natural products 0.000 description 1
- XIGSAGMEBXLVJJ-YFKPBYRVSA-N L-homocitrulline Chemical compound NC(=O)NCCCC[C@H]([NH3+])C([O-])=O XIGSAGMEBXLVJJ-YFKPBYRVSA-N 0.000 description 1
- UKAUYVFTDYCKQA-VKHMYHEASA-N L-homoserine Chemical compound OC(=O)[C@@H](N)CCO UKAUYVFTDYCKQA-VKHMYHEASA-N 0.000 description 1
- QEFRNWWLZKMPFJ-ZXPFJRLXSA-N L-methionine (R)-S-oxide Chemical compound C[S@@](=O)CC[C@H]([NH3+])C([O-])=O QEFRNWWLZKMPFJ-ZXPFJRLXSA-N 0.000 description 1
- QEFRNWWLZKMPFJ-UHFFFAOYSA-N L-methionine sulphoxide Natural products CS(=O)CCC(N)C(O)=O QEFRNWWLZKMPFJ-UHFFFAOYSA-N 0.000 description 1
- SNDPXSYFESPGGJ-UHFFFAOYSA-N L-norVal-OH Natural products CCCC(N)C(O)=O SNDPXSYFESPGGJ-UHFFFAOYSA-N 0.000 description 1
- JLERVPBPJHKRBJ-UHFFFAOYSA-N LY 117018 Chemical compound C1=CC(O)=CC=C1C1=C(C(=O)C=2C=CC(OCCN3CCCC3)=CC=2)C2=CC=C(O)C=C2S1 JLERVPBPJHKRBJ-UHFFFAOYSA-N 0.000 description 1
- 108090001090 Lectins Proteins 0.000 description 1
- 102000004856 Lectins Human genes 0.000 description 1
- 241000270322 Lepidosauria Species 0.000 description 1
- 241000221479 Leucosporidium Species 0.000 description 1
- 108010000817 Leuprolide Proteins 0.000 description 1
- NNJVILVZKWQKPM-UHFFFAOYSA-N Lidocaine Chemical compound CCN(CC)CC(=O)NC1=C(C)C=CC=C1C NNJVILVZKWQKPM-UHFFFAOYSA-N 0.000 description 1
- GQYIWUVLTXOXAJ-UHFFFAOYSA-N Lomustine Chemical compound ClCCN(N=O)C(=O)NC1CCCCC1 GQYIWUVLTXOXAJ-UHFFFAOYSA-N 0.000 description 1
- 101710099301 Low affinity immunoglobulin gamma Fc region receptor III-A Proteins 0.000 description 1
- 206010025323 Lymphomas Diseases 0.000 description 1
- 102000043136 MAP kinase family Human genes 0.000 description 1
- 108091054455 MAP kinase family Proteins 0.000 description 1
- 239000012515 MabSelect SuRe Substances 0.000 description 1
- 108700018351 Major Histocompatibility Complex Proteins 0.000 description 1
- 101710141347 Major envelope glycoprotein Proteins 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 241000203407 Methanocaldococcus jannaschii Species 0.000 description 1
- 241000203353 Methanococcus Species 0.000 description 1
- 241001302042 Methanothermobacter thermautotrophicus Species 0.000 description 1
- 241000243190 Microsporidia Species 0.000 description 1
- 102000029749 Microtubule Human genes 0.000 description 1
- 108091022875 Microtubule Proteins 0.000 description 1
- 108020005196 Mitochondrial DNA Proteins 0.000 description 1
- 229930192392 Mitomycin Natural products 0.000 description 1
- ZOKXTWBITQBERF-UHFFFAOYSA-N Molybdenum Chemical compound [Mo] ZOKXTWBITQBERF-UHFFFAOYSA-N 0.000 description 1
- 241000235395 Mucor Species 0.000 description 1
- 208000034578 Multiple myelomas Diseases 0.000 description 1
- 108010085220 Multiprotein Complexes Proteins 0.000 description 1
- 102000007474 Multiprotein Complexes Human genes 0.000 description 1
- 102100025243 Myeloid cell surface antigen CD33 Human genes 0.000 description 1
- OVBPIULPVIDEAO-UHFFFAOYSA-N N-Pteroyl-L-glutaminsaeure Natural products C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-UHFFFAOYSA-N 0.000 description 1
- GXCLVBGFBYZDAG-UHFFFAOYSA-N N-[2-(1H-indol-3-yl)ethyl]-N-methylprop-2-en-1-amine Chemical compound CN(CCC1=CNC2=C1C=CC=C2)CC=C GXCLVBGFBYZDAG-UHFFFAOYSA-N 0.000 description 1
- RHGKLRLOHDJJDR-UHFFFAOYSA-N Ndelta-carbamoyl-DL-ornithine Natural products OC(=O)C(N)CCCNC(N)=O RHGKLRLOHDJJDR-UHFFFAOYSA-N 0.000 description 1
- 229930193140 Neomycin Natural products 0.000 description 1
- 102000048238 Neuregulin-1 Human genes 0.000 description 1
- 241000187654 Nocardia Species 0.000 description 1
- 108010079246 OMPA outer membrane proteins Proteins 0.000 description 1
- 201000010133 Oligodendroglioma Diseases 0.000 description 1
- 108091034117 Oligonucleotide Proteins 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 240000007594 Oryza sativa Species 0.000 description 1
- 235000007164 Oryza sativa Nutrition 0.000 description 1
- 239000002033 PVDF binder Substances 0.000 description 1
- 241000235652 Pachysolen Species 0.000 description 1
- 229930012538 Paclitaxel Natural products 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 229930182555 Penicillin Natural products 0.000 description 1
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 1
- KMSKQZKKOZQFFG-HSUXVGOQSA-N Pirarubicin Chemical compound O([C@H]1[C@@H](N)C[C@@H](O[C@H]1C)O[C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1CCCCO1 KMSKQZKKOZQFFG-HSUXVGOQSA-N 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 102100033237 Pro-epidermal growth factor Human genes 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 1
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 1
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 1
- 241000589517 Pseudomonas aeruginosa Species 0.000 description 1
- 101100084022 Pseudomonas aeruginosa (strain ATCC 15692 / DSM 22644 / CIP 104116 / JCM 14847 / LMG 12228 / 1C / PRS 101 / PAO1) lapA gene Proteins 0.000 description 1
- 241000589540 Pseudomonas fluorescens Species 0.000 description 1
- 241000589776 Pseudomonas putida Species 0.000 description 1
- 241000205156 Pyrococcus furiosus Species 0.000 description 1
- 241000522615 Pyrococcus horikoshii Species 0.000 description 1
- 239000012614 Q-Sepharose Substances 0.000 description 1
- AHHFEZNOXOZZQA-ZEBDFXRSSA-N Ranimustine Chemical compound CO[C@H]1O[C@H](CNC(=O)N(CCCl)N=O)[C@@H](O)[C@H](O)[C@H]1O AHHFEZNOXOZZQA-ZEBDFXRSSA-N 0.000 description 1
- 101100501691 Rattus norvegicus Erbb2 gene Proteins 0.000 description 1
- 101001010820 Rattus norvegicus Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 1
- 102000004278 Receptor Protein-Tyrosine Kinases Human genes 0.000 description 1
- 108090000873 Receptor Protein-Tyrosine Kinases Proteins 0.000 description 1
- 101710100968 Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 206010038389 Renal cancer Diseases 0.000 description 1
- PLXBWHJQWKZRKG-UHFFFAOYSA-N Resazurin Chemical compound C1=CC(=O)C=C2OC3=CC(O)=CC=C3[N+]([O-])=C21 PLXBWHJQWKZRKG-UHFFFAOYSA-N 0.000 description 1
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 1
- 101100394989 Rhodopseudomonas palustris (strain ATCC BAA-98 / CGA009) hisI gene Proteins 0.000 description 1
- 108091028664 Ribonucleotide Proteins 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 239000012722 SDS sample buffer Substances 0.000 description 1
- 101100123851 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) HER1 gene Proteins 0.000 description 1
- 241000235003 Saccharomycopsis Species 0.000 description 1
- 241000293869 Salmonella enterica subsp. enterica serovar Typhimurium Species 0.000 description 1
- 241000277331 Salmonidae Species 0.000 description 1
- 206010039491 Sarcoma Diseases 0.000 description 1
- 108010077895 Sarcosine Proteins 0.000 description 1
- 229920005654 Sephadex Polymers 0.000 description 1
- 239000012507 Sephadex™ Substances 0.000 description 1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 1
- 229920000519 Sizofiran Polymers 0.000 description 1
- 206010041067 Small cell lung cancer Diseases 0.000 description 1
- 241000256248 Spodoptera Species 0.000 description 1
- 108091081024 Start codon Proteins 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 208000002847 Surgical Wound Diseases 0.000 description 1
- PZBFGYYEXUXCOF-UHFFFAOYSA-N TCEP Chemical compound OC(=O)CCP(CCC(O)=O)CCC(O)=O PZBFGYYEXUXCOF-UHFFFAOYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 229940123237 Taxane Drugs 0.000 description 1
- CGMTUJFWROPELF-UHFFFAOYSA-N Tenuazonic acid Natural products CCC(C)C1NC(=O)C(=C(C)/O)C1=O CGMTUJFWROPELF-UHFFFAOYSA-N 0.000 description 1
- 239000004098 Tetracycline Substances 0.000 description 1
- 241000589499 Thermus thermophilus Species 0.000 description 1
- RYYWUUFWQRZTIU-UHFFFAOYSA-N Thiophosphoric acid Chemical class OP(O)(S)=O RYYWUUFWQRZTIU-UHFFFAOYSA-N 0.000 description 1
- 108010022394 Threonine synthase Proteins 0.000 description 1
- 208000024770 Thyroid neoplasm Diseases 0.000 description 1
- IWEQQRMGNVVKQW-OQKDUQJOSA-N Toremifene citrate Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.C1=CC(OCCN(C)C)=CC=C1C(\C=1C=CC=CC=1)=C(\CCCl)C1=CC=CC=C1 IWEQQRMGNVVKQW-OQKDUQJOSA-N 0.000 description 1
- 241000235006 Torulaspora Species 0.000 description 1
- 244000288561 Torulaspora delbrueckii Species 0.000 description 1
- 241000223259 Trichoderma Species 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- FYAMXEPQQLNQDM-UHFFFAOYSA-N Tris(1-aziridinyl)phosphine oxide Chemical compound C1CN1P(N1CC1)(=O)N1CC1 FYAMXEPQQLNQDM-UHFFFAOYSA-N 0.000 description 1
- GLNADSQYFUSGOU-GPTZEZBUSA-J Trypan blue Chemical compound [Na+].[Na+].[Na+].[Na+].C1=C(S([O-])(=O)=O)C=C2C=C(S([O-])(=O)=O)C(/N=N/C3=CC=C(C=C3C)C=3C=C(C(=CC=3)\N=N\C=3C(=CC4=CC(=CC(N)=C4C=3O)S([O-])(=O)=O)S([O-])(=O)=O)C)=C(O)C2=C1N GLNADSQYFUSGOU-GPTZEZBUSA-J 0.000 description 1
- 229940122429 Tubulin inhibitor Drugs 0.000 description 1
- 206010053613 Type IV hypersensitivity reaction Diseases 0.000 description 1
- VGQOVCHZGQWAOI-UHFFFAOYSA-N UNPD55612 Natural products N1C(O)C2CC(C=CC(N)=O)=CN2C(=O)C2=CC=C(C)C(O)=C12 VGQOVCHZGQWAOI-UHFFFAOYSA-N 0.000 description 1
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 1
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 1
- 208000002495 Uterine Neoplasms Diseases 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 1
- 241000235013 Yarrowia Species 0.000 description 1
- 241000235017 Zygosaccharomyces Species 0.000 description 1
- 241000235033 Zygosaccharomyces rouxii Species 0.000 description 1
- XZSRRNFBEIOBDA-CFNBKWCHSA-N [2-[(2s,4s)-4-[(2r,4s,5s,6s)-4-amino-5-hydroxy-6-methyloxan-2-yl]oxy-2,5,12-trihydroxy-7-methoxy-6,11-dioxo-3,4-dihydro-1h-tetracen-2-yl]-2-oxoethyl] 2,2-diethoxyacetate Chemical compound O([C@H]1C[C@](CC2=C(O)C=3C(=O)C4=CC=CC(OC)=C4C(=O)C=3C(O)=C21)(O)C(=O)COC(=O)C(OCC)OCC)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 XZSRRNFBEIOBDA-CFNBKWCHSA-N 0.000 description 1
- XMIJRFQYCUBWFZ-UHFFFAOYSA-N [2-[(dimethylamino)methyl]-1-ethylcyclohexyl] benzoate Chemical compound C=1C=CC=CC=1C(=O)OC1(CC)CCCCC1CN(C)C XMIJRFQYCUBWFZ-UHFFFAOYSA-N 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 235000011054 acetic acid Nutrition 0.000 description 1
- 229930188522 aclacinomycin Natural products 0.000 description 1
- USZYSDMBJDPRIF-SVEJIMAYSA-N aclacinomycin A Chemical compound O([C@H]1[C@@H](O)C[C@@H](O[C@H]1C)O[C@H]1[C@H](C[C@@H](O[C@H]1C)O[C@H]1C[C@]([C@@H](C2=CC=3C(=O)C4=CC=CC(O)=C4C(=O)C=3C(O)=C21)C(=O)OC)(O)CC)N(C)C)[C@H]1CCC(=O)[C@H](C)O1 USZYSDMBJDPRIF-SVEJIMAYSA-N 0.000 description 1
- 229960004176 aclarubicin Drugs 0.000 description 1
- 229930183665 actinomycin Natural products 0.000 description 1
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 150000001263 acyl chlorides Chemical class 0.000 description 1
- 125000004423 acyloxy group Chemical group 0.000 description 1
- 125000005042 acyloxymethyl group Chemical group 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 238000001042 affinity chromatography Methods 0.000 description 1
- 125000003172 aldehyde group Chemical group 0.000 description 1
- HAXFWIACAGNFHA-UHFFFAOYSA-N aldrithiol Chemical compound C=1C=CC=NC=1SSC1=CC=CC=N1 HAXFWIACAGNFHA-UHFFFAOYSA-N 0.000 description 1
- 125000004849 alkoxymethyl group Chemical group 0.000 description 1
- 229940045714 alkyl sulfonate alkylating agent Drugs 0.000 description 1
- 150000008052 alkyl sulfonates Chemical class 0.000 description 1
- 229940100198 alkylating agent Drugs 0.000 description 1
- 239000002168 alkylating agent Substances 0.000 description 1
- VREFGVBLTWBCJP-UHFFFAOYSA-N alprazolam Chemical compound C12=CC(Cl)=CC=C2N2C(C)=NN=C2CN=C1C1=CC=CC=C1 VREFGVBLTWBCJP-UHFFFAOYSA-N 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- 229960000473 altretamine Drugs 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 229960003437 aminoglutethimide Drugs 0.000 description 1
- ROBVIMPUHSLWNV-UHFFFAOYSA-N aminoglutethimide Chemical compound C=1C=C(N)C=CC=1C1(CC)CCC(=O)NC1=O ROBVIMPUHSLWNV-UHFFFAOYSA-N 0.000 description 1
- 229960002749 aminolevulinic acid Drugs 0.000 description 1
- 229960003896 aminopterin Drugs 0.000 description 1
- BFNBIHQBYMNNAN-UHFFFAOYSA-N ammonium sulfate Chemical compound N.N.OS(O)(=O)=O BFNBIHQBYMNNAN-UHFFFAOYSA-N 0.000 description 1
- 229910052921 ammonium sulfate Inorganic materials 0.000 description 1
- 238000012870 ammonium sulfate precipitation Methods 0.000 description 1
- 235000011130 ammonium sulphate Nutrition 0.000 description 1
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 1
- 229960000723 ampicillin Drugs 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 229960001220 amsacrine Drugs 0.000 description 1
- XCPGHVQEEXUHNC-UHFFFAOYSA-N amsacrine Chemical compound COC1=CC(NS(C)(=O)=O)=CC=C1NC1=C(C=CC=C2)C2=NC2=CC=CC=C12 XCPGHVQEEXUHNC-UHFFFAOYSA-N 0.000 description 1
- 230000003698 anagen phase Effects 0.000 description 1
- 239000012491 analyte Substances 0.000 description 1
- 206010002224 anaplastic astrocytoma Diseases 0.000 description 1
- 239000003098 androgen Substances 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- DGBBXVWXOHSLTG-UMDRASRXSA-N ansamitocin p 2 Chemical compound C([C@@H]([C@@]1(O[C@H]1[C@@H]1C)C)OC(=O)CC)C(=O)N(C)C(C(=C(OC)C=2)Cl)=CC=2C\C(C)=C\C=C\[C@@H](OC)[C@]2(O)NC(=O)O[C@H]1C2 DGBBXVWXOHSLTG-UMDRASRXSA-N 0.000 description 1
- VGQOVCHZGQWAOI-HYUHUPJXSA-N anthramycin Chemical compound N1[C@@H](O)[C@@H]2CC(\C=C\C(N)=O)=CN2C(=O)C2=CC=C(C)C(O)=C12 VGQOVCHZGQWAOI-HYUHUPJXSA-N 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000002280 anti-androgenic effect Effects 0.000 description 1
- 230000001093 anti-cancer Effects 0.000 description 1
- 229940046836 anti-estrogen Drugs 0.000 description 1
- 230000001833 anti-estrogenic effect Effects 0.000 description 1
- 230000000340 anti-metabolite Effects 0.000 description 1
- 230000000692 anti-sense effect Effects 0.000 description 1
- 239000000051 antiandrogen Substances 0.000 description 1
- 229940030495 antiandrogen sex hormone and modulator of the genital system Drugs 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 230000009830 antibody antigen interaction Effects 0.000 description 1
- 210000000612 antigen-presenting cell Anatomy 0.000 description 1
- 239000013059 antihormonal agent Substances 0.000 description 1
- 229940100197 antimetabolite Drugs 0.000 description 1
- 239000002256 antimetabolite Substances 0.000 description 1
- 229940045687 antimetabolites folic acid analogs Drugs 0.000 description 1
- 229940045719 antineoplastic alkylating agent nitrosoureas Drugs 0.000 description 1
- 239000012062 aqueous buffer Substances 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 210000001130 astrocyte Anatomy 0.000 description 1
- 230000003305 autocrine Effects 0.000 description 1
- 229960002756 azacitidine Drugs 0.000 description 1
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 1
- 229950011321 azaserine Drugs 0.000 description 1
- 239000002585 base Substances 0.000 description 1
- 229960000997 bicalutamide Drugs 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000000975 bioactive effect Effects 0.000 description 1
- 238000001574 biopsy Methods 0.000 description 1
- 229950008548 bisantrene Drugs 0.000 description 1
- 210000004952 blastocoel Anatomy 0.000 description 1
- 201000000053 blastoma Diseases 0.000 description 1
- 229960001561 bleomycin Drugs 0.000 description 1
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 238000009933 burial Methods 0.000 description 1
- 229960002092 busulfan Drugs 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 238000005251 capillar electrophoresis Methods 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 description 1
- 229960004562 carboplatin Drugs 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 150000001732 carboxylic acid derivatives Chemical group 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- 210000004413 cardiac myocyte Anatomy 0.000 description 1
- 229960003261 carmofur Drugs 0.000 description 1
- 229960005243 carmustine Drugs 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 238000000423 cell based assay Methods 0.000 description 1
- 238000010822 cell death assay Methods 0.000 description 1
- 230000032823 cell division Effects 0.000 description 1
- 239000013592 cell lysate Substances 0.000 description 1
- 230000006037 cell lysis Effects 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 230000015861 cell surface binding Effects 0.000 description 1
- 210000002230 centromere Anatomy 0.000 description 1
- 201000010881 cervical cancer Diseases 0.000 description 1
- 239000003638 chemical reducing agent Substances 0.000 description 1
- 229960001480 chlorozotocin Drugs 0.000 description 1
- ZYVSOIYQKUDENJ-WKSBCEQHSA-N chromomycin A3 Chemical compound O([C@@H]1C[C@@H](O[C@H](C)[C@@H]1OC(C)=O)OC=1C=C2C=C3C[C@H]([C@@H](C(=O)C3=C(O)C2=C(O)C=1C)O[C@@H]1O[C@H](C)[C@@H](O)[C@H](O[C@@H]2O[C@H](C)[C@@H](O)[C@H](O[C@@H]3O[C@@H](C)[C@H](OC(C)=O)[C@@](C)(O)C3)C2)C1)[C@H](OC)C(=O)[C@@H](O)[C@@H](C)O)[C@@H]1C[C@@H](O)[C@@H](OC)[C@@H](C)O1 ZYVSOIYQKUDENJ-WKSBCEQHSA-N 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 210000004081 cilia Anatomy 0.000 description 1
- 230000004087 circulation Effects 0.000 description 1
- 239000007979 citrate buffer Substances 0.000 description 1
- 235000013477 citrulline Nutrition 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 238000000749 co-immunoprecipitation Methods 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 238000002648 combination therapy Methods 0.000 description 1
- 230000024203 complement activation Effects 0.000 description 1
- 230000004154 complement system Effects 0.000 description 1
- 238000004590 computer program Methods 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 238000004624 confocal microscopy Methods 0.000 description 1
- 239000000599 controlled substance Substances 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 239000003431 cross linking reagent Substances 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 238000012258 culturing Methods 0.000 description 1
- 229960003901 dacarbazine Drugs 0.000 description 1
- 229960000640 dactinomycin Drugs 0.000 description 1
- 229960000975 daunorubicin Drugs 0.000 description 1
- 238000006298 dechlorination reaction Methods 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- 239000005549 deoxyribonucleoside Substances 0.000 description 1
- 239000005547 deoxyribonucleotide Substances 0.000 description 1
- 125000002637 deoxyribonucleotide group Chemical group 0.000 description 1
- 229950003913 detorubicin Drugs 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 239000000032 diagnostic agent Substances 0.000 description 1
- 229940039227 diagnostic agent Drugs 0.000 description 1
- WVYXNIXAMZOZFK-UHFFFAOYSA-N diaziquone Chemical compound O=C1C(NC(=O)OCC)=C(N2CC2)C(=O)C(NC(=O)OCC)=C1N1CC1 WVYXNIXAMZOZFK-UHFFFAOYSA-N 0.000 description 1
- 229950002389 diaziquone Drugs 0.000 description 1
- 238000001938 differential scanning calorimetry curve Methods 0.000 description 1
- 102000004419 dihydrofolate reductase Human genes 0.000 description 1
- 108020001096 dihydrofolate reductase Proteins 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 235000021186 dishes Nutrition 0.000 description 1
- 125000002228 disulfide group Chemical group 0.000 description 1
- 150000002019 disulfides Chemical class 0.000 description 1
- VHJLVAABSRFDPM-QWWZWVQMSA-N dithiothreitol Chemical compound SC[C@@H](O)[C@H](O)CS VHJLVAABSRFDPM-QWWZWVQMSA-N 0.000 description 1
- PMMYEEVYMWASQN-UHFFFAOYSA-N dl-hydroxyproline Natural products OC1C[NH2+]C(C([O-])=O)C1 PMMYEEVYMWASQN-UHFFFAOYSA-N 0.000 description 1
- 229960003668 docetaxel Drugs 0.000 description 1
- OFDNQWIFNXBECV-VFSYNPLYSA-N dolastatin 10 Chemical class CC(C)[C@H](N(C)C)C(=O)N[C@@H](C(C)C)C(=O)N(C)[C@@H]([C@@H](C)CC)[C@H](OC)CC(=O)N1CCC[C@H]1[C@H](OC)[C@@H](C)C(=O)N[C@H](C=1SC=CN=1)CC1=CC=CC=C1 OFDNQWIFNXBECV-VFSYNPLYSA-N 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 239000012154 double-distilled water Substances 0.000 description 1
- 230000003828 downregulation Effects 0.000 description 1
- 229940126534 drug product Drugs 0.000 description 1
- 230000004064 dysfunction Effects 0.000 description 1
- 230000008482 dysregulation Effects 0.000 description 1
- 101150097231 eg gene Proteins 0.000 description 1
- 230000009881 electrostatic interaction Effects 0.000 description 1
- 201000008184 embryoma Diseases 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 210000001163 endosome Anatomy 0.000 description 1
- 229950011487 enocitabine Drugs 0.000 description 1
- 229940116977 epidermal growth factor Drugs 0.000 description 1
- 229960001904 epirubicin Drugs 0.000 description 1
- 210000000981 epithelium Anatomy 0.000 description 1
- 229950002973 epitiostanol Drugs 0.000 description 1
- 108700020302 erbB-2 Genes Proteins 0.000 description 1
- ITSGNOIFAJAQHJ-BMFNZSJVSA-N esorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)C[C@H](C)O1 ITSGNOIFAJAQHJ-BMFNZSJVSA-N 0.000 description 1
- 229950002017 esorubicin Drugs 0.000 description 1
- FRPJXPJMRWBBIH-RBRWEJTLSA-N estramustine Chemical compound ClCCN(CCCl)C(=O)OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 FRPJXPJMRWBBIH-RBRWEJTLSA-N 0.000 description 1
- 229960001842 estramustine Drugs 0.000 description 1
- 238000012869 ethanol precipitation Methods 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 1
- 102000013165 exonuclease Human genes 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 229940043168 fareston Drugs 0.000 description 1
- 235000013861 fat-free Nutrition 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 229960004887 ferric hydroxide Drugs 0.000 description 1
- 239000012894 fetal calf serum Substances 0.000 description 1
- 210000003754 fetus Anatomy 0.000 description 1
- 239000000835 fiber Substances 0.000 description 1
- 230000004992 fission Effects 0.000 description 1
- 235000013312 flour Nutrition 0.000 description 1
- 238000000684 flow cytometry Methods 0.000 description 1
- 229960000961 floxuridine Drugs 0.000 description 1
- ODKNJVUHOIMIIZ-RRKCRQDMSA-N floxuridine Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(F)=C1 ODKNJVUHOIMIIZ-RRKCRQDMSA-N 0.000 description 1
- 229960000390 fludarabine Drugs 0.000 description 1
- GIUYCYHIANZCFB-FJFJXFQQSA-N fludarabine phosphate Chemical compound C1=NC=2C(N)=NC(F)=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@@H]1O GIUYCYHIANZCFB-FJFJXFQQSA-N 0.000 description 1
- MKXKFYHWDHIYRV-UHFFFAOYSA-N flutamide Chemical compound CC(C)C(=O)NC1=CC=C([N+]([O-])=O)C(C(F)(F)F)=C1 MKXKFYHWDHIYRV-UHFFFAOYSA-N 0.000 description 1
- 229960002074 flutamide Drugs 0.000 description 1
- 235000019152 folic acid Nutrition 0.000 description 1
- 239000011724 folic acid Substances 0.000 description 1
- 229960000304 folic acid Drugs 0.000 description 1
- 150000002224 folic acids Chemical class 0.000 description 1
- VVIAGPKUTFNRDU-ABLWVSNPSA-N folinic acid Chemical compound C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 VVIAGPKUTFNRDU-ABLWVSNPSA-N 0.000 description 1
- 235000008191 folinic acid Nutrition 0.000 description 1
- 239000011672 folinic acid Substances 0.000 description 1
- 230000005714 functional activity Effects 0.000 description 1
- 230000002538 fungal effect Effects 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- 229960003692 gamma aminobutyric acid Drugs 0.000 description 1
- ZXQYGBMAQZUVMI-GCMPRSNUSA-N gamma-cyhalothrin Chemical compound CC1(C)[C@@H](\C=C(/Cl)C(F)(F)F)[C@H]1C(=O)O[C@H](C#N)C1=CC=CC(OC=2C=CC=CC=2)=C1 ZXQYGBMAQZUVMI-GCMPRSNUSA-N 0.000 description 1
- 108010089491 gamma-heregulin Proteins 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 210000005095 gastrointestinal system Anatomy 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 229960005277 gemcitabine Drugs 0.000 description 1
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 230000000762 glandular Effects 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- YQEMORVAKMFKLG-UHFFFAOYSA-N glycerine monostearate Natural products CCCCCCCCCCCCCCCCCC(=O)OC(CO)CO YQEMORVAKMFKLG-UHFFFAOYSA-N 0.000 description 1
- SVUQHVRAGMNPLW-UHFFFAOYSA-N glycerol monostearate Natural products CCCCCCCCCCCCCCCCC(=O)OCC(O)CO SVUQHVRAGMNPLW-UHFFFAOYSA-N 0.000 description 1
- 229960002913 goserelin Drugs 0.000 description 1
- 239000011544 gradient gel Substances 0.000 description 1
- 230000009036 growth inhibition Effects 0.000 description 1
- 201000010536 head and neck cancer Diseases 0.000 description 1
- 208000014829 head and neck neoplasm Diseases 0.000 description 1
- 210000002443 helper t lymphocyte Anatomy 0.000 description 1
- 108010034429 heregulin alpha Proteins 0.000 description 1
- UUVWYPNAQBNQJQ-UHFFFAOYSA-N hexamethylmelamine Chemical compound CN(C)C1=NC(N(C)C)=NC(N(C)C)=N1 UUVWYPNAQBNQJQ-UHFFFAOYSA-N 0.000 description 1
- 230000003054 hormonal effect Effects 0.000 description 1
- 231100000508 hormonal effect Toxicity 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 238000001794 hormone therapy Methods 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 230000028996 humoral immune response Effects 0.000 description 1
- 229940042795 hydrazides for tuberculosis treatment Drugs 0.000 description 1
- 150000002429 hydrazines Chemical class 0.000 description 1
- 150000007857 hydrazones Chemical class 0.000 description 1
- 235000011167 hydrochloric acid Nutrition 0.000 description 1
- 150000002431 hydrogen Chemical class 0.000 description 1
- 238000004191 hydrophobic interaction chromatography Methods 0.000 description 1
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 1
- 229910052588 hydroxylapatite Inorganic materials 0.000 description 1
- CBOIHMRHGLHBPB-UHFFFAOYSA-N hydroxymethyl Chemical compound O[CH2] CBOIHMRHGLHBPB-UHFFFAOYSA-N 0.000 description 1
- 125000004029 hydroxymethyl group Chemical group [H]OC([H])([H])* 0.000 description 1
- 229960002591 hydroxyproline Drugs 0.000 description 1
- 210000003016 hypothalamus Anatomy 0.000 description 1
- 229960000908 idarubicin Drugs 0.000 description 1
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Substances C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 1
- 210000002865 immune cell Anatomy 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 239000012642 immune effector Substances 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 208000026278 immune system disease Diseases 0.000 description 1
- 238000003018 immunoassay Methods 0.000 description 1
- 238000003119 immunoblot Methods 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 238000009169 immunotherapy Methods 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- DBIGHPPNXATHOF-UHFFFAOYSA-N improsulfan Chemical compound CS(=O)(=O)OCCCNCCCOS(C)(=O)=O DBIGHPPNXATHOF-UHFFFAOYSA-N 0.000 description 1
- 229950008097 improsulfan Drugs 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000007901 in situ hybridization Methods 0.000 description 1
- 238000012606 in vitro cell culture Methods 0.000 description 1
- 238000010874 in vitro model Methods 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 239000000411 inducer Substances 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 210000004347 intestinal mucosa Anatomy 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- PGLTVOMIXTUURA-UHFFFAOYSA-N iodoacetamide Chemical compound NC(=O)CI PGLTVOMIXTUURA-UHFFFAOYSA-N 0.000 description 1
- 239000012948 isocyanate Substances 0.000 description 1
- 150000002513 isocyanates Chemical class 0.000 description 1
- 150000002540 isothiocyanates Chemical class 0.000 description 1
- 229960000318 kanamycin Drugs 0.000 description 1
- 229930027917 kanamycin Natural products 0.000 description 1
- SBUJHOSQTJFQJX-NOAMYHISSA-N kanamycin Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CN)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N SBUJHOSQTJFQJX-NOAMYHISSA-N 0.000 description 1
- 229930182823 kanamycin A Natural products 0.000 description 1
- 210000002510 keratinocyte Anatomy 0.000 description 1
- 150000004715 keto acids Chemical class 0.000 description 1
- 125000000468 ketone group Chemical group 0.000 description 1
- 201000010982 kidney cancer Diseases 0.000 description 1
- 210000003292 kidney cell Anatomy 0.000 description 1
- 238000011005 laboratory method Methods 0.000 description 1
- 150000002596 lactones Chemical class 0.000 description 1
- 239000010410 layer Substances 0.000 description 1
- 239000002523 lectin Substances 0.000 description 1
- 229960001691 leucovorin Drugs 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- GFIJNRVAKGFPGQ-LIJARHBVSA-N leuprolide Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CC=C(O)C=C1 GFIJNRVAKGFPGQ-LIJARHBVSA-N 0.000 description 1
- 229960004338 leuprorelin Drugs 0.000 description 1
- 229960004194 lidocaine Drugs 0.000 description 1
- 238000004811 liquid chromatography Methods 0.000 description 1
- 239000007791 liquid phase Substances 0.000 description 1
- 239000012280 lithium aluminium hydride Substances 0.000 description 1
- 244000144972 livestock Species 0.000 description 1
- 239000003589 local anesthetic agent Substances 0.000 description 1
- 230000004807 localization Effects 0.000 description 1
- 229960002247 lomustine Drugs 0.000 description 1
- 201000005243 lung squamous cell carcinoma Diseases 0.000 description 1
- 239000008176 lyophilized powder Substances 0.000 description 1
- 230000002132 lysosomal effect Effects 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- ZLNQQNXFFQJAID-UHFFFAOYSA-L magnesium carbonate Chemical compound [Mg+2].[O-]C([O-])=O ZLNQQNXFFQJAID-UHFFFAOYSA-L 0.000 description 1
- 239000001095 magnesium carbonate Substances 0.000 description 1
- 229910000021 magnesium carbonate Inorganic materials 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 230000003211 malignant effect Effects 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- MQXVYODZCMMZEM-ZYUZMQFOSA-N mannomustine Chemical compound ClCCNC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CNCCCl MQXVYODZCMMZEM-ZYUZMQFOSA-N 0.000 description 1
- 229950008612 mannomustine Drugs 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 230000008774 maternal effect Effects 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 230000010534 mechanism of action Effects 0.000 description 1
- 229960002868 mechlorethamine hydrochloride Drugs 0.000 description 1
- QZIQJVCYUQZDIR-UHFFFAOYSA-N mechlorethamine hydrochloride Chemical compound Cl.ClCCN(C)CCCl QZIQJVCYUQZDIR-UHFFFAOYSA-N 0.000 description 1
- 201000001441 melanoma Diseases 0.000 description 1
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 1
- 229960001924 melphalan Drugs 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- XMYQHJDBLRZMLW-UHFFFAOYSA-N methanolamine Chemical compound NCO XMYQHJDBLRZMLW-UHFFFAOYSA-N 0.000 description 1
- SXTAYKAGBXMACB-UHFFFAOYSA-N methionine S-imide-S-oxide Natural products CS(=N)(=O)CCC(N)C(O)=O SXTAYKAGBXMACB-UHFFFAOYSA-N 0.000 description 1
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 1
- 125000000250 methylamino group Chemical group [H]N(*)C([H])([H])[H] 0.000 description 1
- HPNSFSBZBAHARI-UHFFFAOYSA-N micophenolic acid Natural products OC1=C(CC=C(C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-UHFFFAOYSA-N 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 239000003094 microcapsule Substances 0.000 description 1
- 238000000520 microinjection Methods 0.000 description 1
- 210000004688 microtubule Anatomy 0.000 description 1
- 230000008880 microtubule cytoskeleton organization Effects 0.000 description 1
- 235000013336 milk Nutrition 0.000 description 1
- 239000008267 milk Substances 0.000 description 1
- 210000004080 milk Anatomy 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- 230000002297 mitogenic effect Effects 0.000 description 1
- 230000011278 mitosis Effects 0.000 description 1
- 229960000350 mitotane Drugs 0.000 description 1
- 229960001156 mitoxantrone Drugs 0.000 description 1
- KKZJGLLVHKMTCM-UHFFFAOYSA-N mitoxantrone Chemical compound O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO KKZJGLLVHKMTCM-UHFFFAOYSA-N 0.000 description 1
- 108091005601 modified peptides Proteins 0.000 description 1
- 238000001823 molecular biology technique Methods 0.000 description 1
- 229910052750 molybdenum Inorganic materials 0.000 description 1
- 239000011733 molybdenum Substances 0.000 description 1
- 210000001616 monocyte Anatomy 0.000 description 1
- FOYWNSCCNCUEPU-UHFFFAOYSA-N mopidamol Chemical compound C12=NC(N(CCO)CCO)=NC=C2N=C(N(CCO)CCO)N=C1N1CCCCC1 FOYWNSCCNCUEPU-UHFFFAOYSA-N 0.000 description 1
- 229950010718 mopidamol Drugs 0.000 description 1
- 210000002161 motor neuron Anatomy 0.000 description 1
- 238000010172 mouse model Methods 0.000 description 1
- 210000002200 mouth mucosa Anatomy 0.000 description 1
- 210000004877 mucosa Anatomy 0.000 description 1
- 229960000951 mycophenolic acid Drugs 0.000 description 1
- HPNSFSBZBAHARI-RUDMXATFSA-N mycophenolic acid Chemical compound OC1=C(C\C=C(/C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-RUDMXATFSA-N 0.000 description 1
- NJSMWLQOCQIOPE-OCHFTUDZSA-N n-[(e)-[10-[(e)-(4,5-dihydro-1h-imidazol-2-ylhydrazinylidene)methyl]anthracen-9-yl]methylideneamino]-4,5-dihydro-1h-imidazol-2-amine Chemical compound N1CCN=C1N\N=C\C(C1=CC=CC=C11)=C(C=CC=C2)C2=C1\C=N\NC1=NCCN1 NJSMWLQOCQIOPE-OCHFTUDZSA-N 0.000 description 1
- 239000006199 nebulizer Substances 0.000 description 1
- 229960004927 neomycin Drugs 0.000 description 1
- 210000004498 neuroglial cell Anatomy 0.000 description 1
- 210000002569 neuron Anatomy 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- 229960002653 nilutamide Drugs 0.000 description 1
- XWXYUMMDTVBTOU-UHFFFAOYSA-N nilutamide Chemical compound O=C1C(C)(C)NC(=O)N1C1=CC=C([N+]([O-])=O)C(C(F)(F)F)=C1 XWXYUMMDTVBTOU-UHFFFAOYSA-N 0.000 description 1
- 229960001420 nimustine Drugs 0.000 description 1
- VFEDRRNHLBGPNN-UHFFFAOYSA-N nimustine Chemical compound CC1=NC=C(CNC(=O)N(CCCl)N=O)C(N)=N1 VFEDRRNHLBGPNN-UHFFFAOYSA-N 0.000 description 1
- YMVWGSQGCWCDGW-UHFFFAOYSA-N nitracrine Chemical compound C1=CC([N+]([O-])=O)=C2C(NCCCN(C)C)=C(C=CC=C3)C3=NC2=C1 YMVWGSQGCWCDGW-UHFFFAOYSA-N 0.000 description 1
- 229950008607 nitracrine Drugs 0.000 description 1
- 208000002154 non-small cell lung carcinoma Diseases 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 238000007826 nucleic acid assay Methods 0.000 description 1
- 238000007899 nucleic acid hybridization Methods 0.000 description 1
- 239000012038 nucleophile Substances 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 210000004248 oligodendroglia Anatomy 0.000 description 1
- 229950011093 onapristone Drugs 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 239000006179 pH buffering agent Substances 0.000 description 1
- 229960001592 paclitaxel Drugs 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- 108010087558 pectate lyase Proteins 0.000 description 1
- 101150040383 pel2 gene Proteins 0.000 description 1
- 101150050446 pelB gene Proteins 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 229940049954 penicillin Drugs 0.000 description 1
- XYJRXVWERLGGKC-UHFFFAOYSA-D pentacalcium;hydroxide;triphosphate Chemical compound [OH-].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O XYJRXVWERLGGKC-UHFFFAOYSA-D 0.000 description 1
- 229960002340 pentostatin Drugs 0.000 description 1
- FPVKHBSQESCIEP-JQCXWYLXSA-N pentostatin Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CNC[C@H]2O)=C2N=C1 FPVKHBSQESCIEP-JQCXWYLXSA-N 0.000 description 1
- KHIWWQKSHDUIBK-UHFFFAOYSA-N periodic acid Chemical compound OI(=O)(=O)=O KHIWWQKSHDUIBK-UHFFFAOYSA-N 0.000 description 1
- 201000002628 peritoneum cancer Diseases 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 229940124531 pharmaceutical excipient Drugs 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 230000003285 pharmacodynamic effect Effects 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- 101150009573 phoA gene Proteins 0.000 description 1
- 229940080469 phosphocellulose Drugs 0.000 description 1
- 150000008298 phosphoramidates Chemical class 0.000 description 1
- 235000011007 phosphoric acid Nutrition 0.000 description 1
- 230000000865 phosphorylative effect Effects 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 229960001221 pirarubicin Drugs 0.000 description 1
- 210000002706 plastid Anatomy 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 150000003057 platinum Chemical class 0.000 description 1
- 238000002264 polyacrylamide gel electrophoresis Methods 0.000 description 1
- 238000003752 polymerase chain reaction Methods 0.000 description 1
- 238000006116 polymerization reaction Methods 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 229920002981 polyvinylidene fluoride Polymers 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 150000003141 primary amines Chemical group 0.000 description 1
- 239000013615 primer Substances 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- 229960004919 procaine Drugs 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- QQONPFPTGQHPMA-UHFFFAOYSA-N propylene Natural products CC=C QQONPFPTGQHPMA-UHFFFAOYSA-N 0.000 description 1
- 125000004805 propylene group Chemical group [H]C([H])([H])C([H])([*:1])C([H])([H])[*:2] 0.000 description 1
- 235000019833 protease Nutrition 0.000 description 1
- 235000019419 proteases Nutrition 0.000 description 1
- 230000026447 protein localization Effects 0.000 description 1
- 210000001938 protoplast Anatomy 0.000 description 1
- WOLQREOUPKZMEX-UHFFFAOYSA-N pteroyltriglutamic acid Chemical compound C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)NC(CCC(=O)NC(CCC(=O)NC(CCC(O)=O)C(O)=O)C(O)=O)C(O)=O)C=C1 WOLQREOUPKZMEX-UHFFFAOYSA-N 0.000 description 1
- 230000005180 public health Effects 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 150000003212 purines Chemical class 0.000 description 1
- 229950010131 puromycin Drugs 0.000 description 1
- 238000001959 radiotherapy Methods 0.000 description 1
- GZUITABIAKMVPG-UHFFFAOYSA-N raloxifene Chemical compound C1=CC(O)=CC=C1C1=C(C(=O)C=2C=CC(OCCN3CCCCC3)=CC=2)C2=CC=C(O)C=C2S1 GZUITABIAKMVPG-UHFFFAOYSA-N 0.000 description 1
- 229960004622 raloxifene Drugs 0.000 description 1
- 229960002185 ranimustine Drugs 0.000 description 1
- 230000010837 receptor-mediated endocytosis Effects 0.000 description 1
- 238000010188 recombinant method Methods 0.000 description 1
- 210000000664 rectum Anatomy 0.000 description 1
- 238000006268 reductive amination reaction Methods 0.000 description 1
- 238000006578 reductive coupling reaction Methods 0.000 description 1
- 230000011514 reflex Effects 0.000 description 1
- 230000013878 renal filtration Effects 0.000 description 1
- 230000003252 repetitive effect Effects 0.000 description 1
- 125000006853 reporter group Chemical group 0.000 description 1
- 238000004007 reversed phase HPLC Methods 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 239000002342 ribonucleoside Substances 0.000 description 1
- 239000002336 ribonucleotide Substances 0.000 description 1
- 125000002652 ribonucleotide group Chemical group 0.000 description 1
- 235000009566 rice Nutrition 0.000 description 1
- 229920002477 rna polymer Polymers 0.000 description 1
- CVHZOJJKTDOEJC-UHFFFAOYSA-N saccharin Chemical compound C1=CC=C2C(=O)NS(=O)(=O)C2=C1 CVHZOJJKTDOEJC-UHFFFAOYSA-N 0.000 description 1
- 210000003079 salivary gland Anatomy 0.000 description 1
- 229940043230 sarcosine Drugs 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 229940055619 selenocysteine Drugs 0.000 description 1
- ZKZBPNGNEQAJSX-UHFFFAOYSA-N selenocysteine Natural products [SeH]CC(N)C(O)=O ZKZBPNGNEQAJSX-UHFFFAOYSA-N 0.000 description 1
- 235000016491 selenocysteine Nutrition 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 230000001953 sensory effect Effects 0.000 description 1
- 238000012163 sequencing technique Methods 0.000 description 1
- 125000003607 serino group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C(O[H])([H])[H] 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 230000007781 signaling event Effects 0.000 description 1
- 229920000260 silastic Polymers 0.000 description 1
- 239000000741 silica gel Substances 0.000 description 1
- 229910002027 silica gel Inorganic materials 0.000 description 1
- 238000001542 size-exclusion chromatography Methods 0.000 description 1
- 229950001403 sizofiran Drugs 0.000 description 1
- 210000003491 skin Anatomy 0.000 description 1
- 208000000587 small cell lung carcinoma Diseases 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- RYYKJJJTJZKILX-UHFFFAOYSA-M sodium octadecanoate Chemical compound [Na+].CCCCCCCCCCCCCCCCCC([O-])=O RYYKJJJTJZKILX-UHFFFAOYSA-M 0.000 description 1
- MKNJJMHQBYVHRS-UHFFFAOYSA-M sodium;1-[11-(2,5-dioxopyrrol-1-yl)undecanoyloxy]-2,5-dioxopyrrolidine-3-sulfonate Chemical compound [Na+].O=C1C(S(=O)(=O)[O-])CC(=O)N1OC(=O)CCCCCCCCCCN1C(=O)C=CC1=O MKNJJMHQBYVHRS-UHFFFAOYSA-M 0.000 description 1
- ULARYIUTHAWJMU-UHFFFAOYSA-M sodium;1-[4-(2,5-dioxopyrrol-1-yl)butanoyloxy]-2,5-dioxopyrrolidine-3-sulfonate Chemical compound [Na+].O=C1C(S(=O)(=O)[O-])CC(=O)N1OC(=O)CCCN1C(=O)C=CC1=O ULARYIUTHAWJMU-UHFFFAOYSA-M 0.000 description 1
- VUFNRPJNRFOTGK-UHFFFAOYSA-M sodium;1-[4-[(2,5-dioxopyrrol-1-yl)methyl]cyclohexanecarbonyl]oxy-2,5-dioxopyrrolidine-3-sulfonate Chemical compound [Na+].O=C1C(S(=O)(=O)[O-])CC(=O)N1OC(=O)C1CCC(CN2C(C=CC2=O)=O)CC1 VUFNRPJNRFOTGK-UHFFFAOYSA-M 0.000 description 1
- 239000003549 soybean oil Substances 0.000 description 1
- 235000012424 soybean oil Nutrition 0.000 description 1
- 229950006315 spirogermanium Drugs 0.000 description 1
- 206010041823 squamous cell carcinoma Diseases 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 239000008227 sterile water for injection Substances 0.000 description 1
- 229960005322 streptomycin Drugs 0.000 description 1
- 229960001052 streptozocin Drugs 0.000 description 1
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- JJAHTWIKCUJRDK-UHFFFAOYSA-N succinimidyl 4-(N-maleimidomethyl)cyclohexane-1-carboxylate Chemical compound C1CC(CN2C(C=CC2=O)=O)CCC1C(=O)ON1C(=O)CCC1=O JJAHTWIKCUJRDK-UHFFFAOYSA-N 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 125000001273 sulfonato group Chemical group [O-]S(*)(=O)=O 0.000 description 1
- 125000000542 sulfonic acid group Chemical group 0.000 description 1
- 125000004434 sulfur atom Chemical group 0.000 description 1
- 230000020382 suppression by virus of host antigen processing and presentation of peptide antigen via MHC class I Effects 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 238000001308 synthesis method Methods 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 1
- RCINICONZNJXQF-XAZOAEDWSA-N taxol® Chemical compound O([C@@H]1[C@@]2(CC(C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3(C21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-XAZOAEDWSA-N 0.000 description 1
- 229940063683 taxotere Drugs 0.000 description 1
- 108010052178 teleocalcin Proteins 0.000 description 1
- NRUKOCRGYNPUPR-QBPJDGROSA-N teniposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@@H](OC[C@H]4O3)C=3SC=CC=3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 NRUKOCRGYNPUPR-QBPJDGROSA-N 0.000 description 1
- 229960001278 teniposide Drugs 0.000 description 1
- 229960002180 tetracycline Drugs 0.000 description 1
- 229930101283 tetracycline Natural products 0.000 description 1
- 235000019364 tetracycline Nutrition 0.000 description 1
- 150000003522 tetracyclines Chemical class 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- CNHYKKNIIGEXAY-UHFFFAOYSA-N thiolan-2-imine Chemical compound N=C1CCCS1 CNHYKKNIIGEXAY-UHFFFAOYSA-N 0.000 description 1
- 125000000341 threoninyl group Chemical group [H]OC([H])(C([H])([H])[H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 201000002510 thyroid cancer Diseases 0.000 description 1
- 230000025366 tissue development Effects 0.000 description 1
- YONPGGFAJWQGJC-UHFFFAOYSA-K titanium(iii) chloride Chemical compound Cl[Ti](Cl)Cl YONPGGFAJWQGJC-UHFFFAOYSA-K 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 229960005026 toremifene Drugs 0.000 description 1
- XFCLJVABOIYOMF-QPLCGJKRSA-N toremifene Chemical compound C1=CC(OCCN(C)C)=CC=C1C(\C=1C=CC=CC=1)=C(\CCCl)C1=CC=CC=C1 XFCLJVABOIYOMF-QPLCGJKRSA-N 0.000 description 1
- 238000002723 toxicity assay Methods 0.000 description 1
- FGMPLJWBKKVCDB-UHFFFAOYSA-N trans-L-hydroxy-proline Natural products ON1CCCC1C(O)=O FGMPLJWBKKVCDB-UHFFFAOYSA-N 0.000 description 1
- 230000005026 transcription initiation Effects 0.000 description 1
- 230000005030 transcription termination Effects 0.000 description 1
- 230000002463 transducing effect Effects 0.000 description 1
- 238000005809 transesterification reaction Methods 0.000 description 1
- 238000011830 transgenic mouse model Methods 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 230000014621 translational initiation Effects 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- 229950001353 tretamine Drugs 0.000 description 1
- IUCJMVBFZDHPDX-UHFFFAOYSA-N tretamine Chemical compound C1CN1C1=NC(N2CC2)=NC(N2CC2)=N1 IUCJMVBFZDHPDX-UHFFFAOYSA-N 0.000 description 1
- 150000003626 triacylglycerols Chemical class 0.000 description 1
- PYHOFAHZHOBVGV-UHFFFAOYSA-N triazane Chemical compound NNN PYHOFAHZHOBVGV-UHFFFAOYSA-N 0.000 description 1
- 229960001670 trilostane Drugs 0.000 description 1
- KVJXBPDAXMEYOA-CXANFOAXSA-N trilostane Chemical compound OC1=C(C#N)C[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CC[C@@]32O[C@@H]31 KVJXBPDAXMEYOA-CXANFOAXSA-N 0.000 description 1
- 229960000875 trofosfamide Drugs 0.000 description 1
- UMKFEPPTGMDVMI-UHFFFAOYSA-N trofosfamide Chemical compound ClCCN(CCCl)P1(=O)OCCCN1CCCl UMKFEPPTGMDVMI-UHFFFAOYSA-N 0.000 description 1
- HDZZVAMISRMYHH-LITAXDCLSA-N tubercidin Chemical compound C1=CC=2C(N)=NC=NC=2N1[C@@H]1O[C@@H](CO)[C@H](O)[C@H]1O HDZZVAMISRMYHH-LITAXDCLSA-N 0.000 description 1
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 description 1
- 229950009811 ubenimex Drugs 0.000 description 1
- 241000701447 unidentified baculovirus Species 0.000 description 1
- 241001515965 unidentified phage Species 0.000 description 1
- 241001430294 unidentified retrovirus Species 0.000 description 1
- 229960001055 uracil mustard Drugs 0.000 description 1
- 201000005112 urinary bladder cancer Diseases 0.000 description 1
- 206010046766 uterine cancer Diseases 0.000 description 1
- 235000013311 vegetables Nutrition 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 229960003048 vinblastine Drugs 0.000 description 1
- JXLYSJRDGCGARV-XQKSVPLYSA-N vincaleukoblastine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 JXLYSJRDGCGARV-XQKSVPLYSA-N 0.000 description 1
- 229960004528 vincristine Drugs 0.000 description 1
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 1
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 1
- 229960004355 vindesine Drugs 0.000 description 1
- UGGWPQSBPIFKDZ-KOTLKJBCSA-N vindesine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(N)=O)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1N=C1[C]2C=CC=C1 UGGWPQSBPIFKDZ-KOTLKJBCSA-N 0.000 description 1
- GBABOYUKABKIAF-GHYRFKGUSA-N vinorelbine Chemical compound C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC([C@]23[C@H]([C@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC GBABOYUKABKIAF-GHYRFKGUSA-N 0.000 description 1
- 229960002066 vinorelbine Drugs 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 230000000007 visual effect Effects 0.000 description 1
- 238000011179 visual inspection Methods 0.000 description 1
- 210000003905 vulva Anatomy 0.000 description 1
- 229920003169 water-soluble polymer Polymers 0.000 description 1
- 238000009736 wetting Methods 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 229940053867 xeloda Drugs 0.000 description 1
- 229910052724 xenon Inorganic materials 0.000 description 1
- FHNFHKCVQCLJFQ-UHFFFAOYSA-N xenon atom Chemical compound [Xe] FHNFHKCVQCLJFQ-UHFFFAOYSA-N 0.000 description 1
- 229960000641 zorubicin Drugs 0.000 description 1
- FBTUMDXHSRTGRV-ALTNURHMSA-N zorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(\C)=N\NC(=O)C=1C=CC=CC=1)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 FBTUMDXHSRTGRV-ALTNURHMSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/32—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against translation products of oncogenes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
- A61K47/68033—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates the drug being a maytansine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6871—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting an enzyme
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6875—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody being a hybrid immunoglobulin
- A61K47/6879—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody being a hybrid immunoglobulin the immunoglobulin having two or more different antigen-binding sites, e.g. bispecific or multispecific immunoglobulin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/08—Drugs for genital or sexual disorders; Contraceptives for gonadal disorders or for enhancing fertility, e.g. inducers of ovulation or of spermatogenesis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/40—Immunoglobulins specific features characterized by post-translational modification
- C07K2317/41—Glycosylation, sialylation, or fucosylation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
- C07K2317/526—CH3 domain
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/55—Fab or Fab'
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/64—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising a combination of variable region and constant region components
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
- C07K2317/732—Antibody-dependent cellular cytotoxicity [ADCC]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/77—Internalization into the cell
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/94—Stability, e.g. half-life, pH, temperature or enzyme-resistance
Abstract
Description
本出願は、2013年5月8日に出願された米国仮出願第61/821,197号の恩典を主張し、それはその全体が参照により本明細書に組み入れられる。
本出願は、EFS-Webを経由して提出される配列表を含み、かつそれとともに出願され、その全体が参照により本明細書に組み入れられる。2014年5月8日に作成された前記ASCIIコピーの名称は24689PCT_sequencelisting.txtであり、サイズは137,000バイトである。
本発明の分野は、例えばバイオセラピューティック(biotherapeutic)のために有用な、二重特異性HER2およびHER3抗原結合性構築物である。
ヒト上皮増殖因子受容体(HER、erbB)ファミリーはEGFR(HER1)、HER2(erbB2)、HER3(erbB3)およびHER4(erbB4)を含み、この受容体ファミリーの活性は正常組織の発生および維持を調節している。しかし、この受容体ファミリーの過剰発現および/またはその活性の異常調節はヒト腫瘍細胞の発生および増殖との関連が指摘されており、それ故にこのファミリーのメンバーは癌の治療用の治療用抗体の開発のための標的となってきている。例えば、トラスツズマブ(ハーセプチン(Herceptin)(商標))およびペルツズマブ(パージェタ(Perjeta)(商標))は、ハーセプテスト(Herceptest)(商標)による測定でHER2を高レベルで発現する乳癌(HER2 3+)の治療のために開発された抗HER2抗体であり、一方、トラスツズマブのメイタンシンコンジュゲートであるT-DM1(カドサイラ(Kadcycla)(商標))も、これらの型の乳癌の治療のために開発されている。
以下にさらに詳細に説明するように、本明細書に記載されるのは、二重特異性抗原結合性構築物、例えば二重特異性抗体である。二重特異性抗原結合性構築物は、HER2のECD4と結合する第1の抗原結合性ポリペプチド構築物、およびHER3のECDと特異的に結合する第2の抗原結合性ポリペプチド構築物を含む。抗原結合性構築物の一方はFc型をとり;もう一方はFab型をとる。二重特異性抗原結合性構築物は、二量体化のためのCH3ドメインをそれぞれが有する2つのFcポリペプチドを有するFcを含む。各Fcポリペプチドは、抗原結合性ポリペプチド構築物の1つのC末端と、リンカーを伴ってまたは伴わずに連結されている。単離された二重特異性抗原結合性構築物は、HER2およびHER3を発現する細胞において、2つの第1の抗原結合性ポリペプチド構築物または2つの第2の抗原結合性ポリペプチド構築物を含む参照二価単一特異性抗体と比較して、より大きな最大結合(Bmax)を呈する。
特許請求の範囲および明細書において用いられる用語は、別記しない限り、以下に明記される通りに定義される。
本明細書に開示されるのは、二重特異性抗原結合性構築物、例えば、HER2およびHER3の両方と選択的に結合する抗体である。
本明細書に記載の二重特異性抗原結合性構築物は、Fcを含む。Fcは、二量体化のためのCH3ドメインをそれぞれが有する2つのFcポリペプチドを含む。各FcポリペプチドのN末端は、抗原結合性ポリペプチド構築物の1つのC末端と、リンカーを伴ってまたは伴わずに連結されている。
いくつかの態様においては、二重特異性抗原結合性構築物を、エフェクター機能を改善するために改変することができる。そのような改変は当技術分野において公知であり、アフコシル化、ならびに、ADCCのための活性化受容体、主としてFCGR3aおよびFCGRbに対する抗体のFc部分の親和性、およびCDCのためのC1qに対する親和性の遺伝子操作が含まれる。1つの態様において、エフェクター機能は、CDC、ADCC、ADCP、およびサイトカイン分泌からなる群より選択される1つまたは複数の機能である。1つの特定の態様において、エフェクター機能はADCCである。
いくつかの態様において、二重特異性抗原結合性構築物は、FcγRの選択的結合を促進するための非対称性アミノ酸改変を有する変異型CH2ドメインを含む。いくつかの態様において、変異型CH2ドメインは、本明細書に記載の単離された一価抗体の分離および精製を可能にする。
1つの態様において、Fc領域は、新生児Fc受容体(FcRn)に対する結合親和性を示す。ある態様において、FcRn結合親和性はネイティブなIgG1 Fcのものと実質的に同程度である。いくつかの態様において、FcRnに対する実質的に同程度の結合は、本明細書に記載の構築物のFc領域が、FcRnに対するネイティブなIgG1 Fcドメインの結合親和性の約70%を上回る、またはいくつかの態様においては約80%を上回る、およびいくつかの特定の態様においては約90%を上回るものを示す場合に達成される。
ある態様において、本明細書に記載の構築物のFc領域は、ネイティブなIgG1 Fc領域と比較して、Fc受容体に対する結合親和性の低下、および/またはエフェクター機能の低下を示す。1つのそのような態様において、Fc領域は、ネイティブなIgG1 Fc領域と比較して、50%未満、代替的には20%未満、代替的には10%未満、およびいくつかの態様においては5%未満の、Fc受容体に対する結合親和性、ならびに/またはネイティブなIgG1 Fc領域と比較して、50%未満、代替的には20%未満、代替的には10%未満、およびいくつかの態様においては5%未満のエフェクター機能を示す。
本明細書に記載の二重特異性抗原結合性構築物は、本明細書に記載の2つの抗原結合性ポリペプチド構築物が、本明細書に記載のFcと機能的にカップリングされたものを含む。いくつかの局面において、Fcは、1つまたは複数のリンカーを伴ってまたは伴わずにカップリングされている。いくつかの局面において、Fcは抗原結合性ポリペプチド構築物と直接的にカップリングされている。いくつかの局面(ascpect)において、Fcは、1つまたは複数のリンカーによって抗原結合性ポリペプチド構築物とカップリングされている。
記載された二重特異性抗原結合性構築物は、HER2のECD4と特異的に結合する第1の抗原結合性ポリペプチド構築物、およびHER3のECDと特異的に結合する第2の抗原結合性ポリペプチド構築物を含む。一方の抗原結合性ポリペプチド構築物はFab型をとる;もう一方の抗原結合性ポリペプチド構築物はscFv型をとる。
いくつかの態様において、二重特異性抗原結合性構築物は、単鎖Fab型またはscFabにあるFabを含む。この型の説明は当業者には周知であり、例えば、国際特許公開公報第WO2014/018572号;US2010/0256338号;およびUS20110293613号に記載がある。これらの参考文献によるscFabの設計、発現および使用に関する説明は、参照により組み入れられる。
「解離定数(KD)」という用語は、本明細書で用いる場合、特定の抗原-抗体相互作用の解離速度を指すことを意図している。KDは、「オフ速度(koff)」とも呼ばれる解離の速度と、会合速度、または「オン速度(kon)」との比である。したがって、KDはkoff/konに等しく、モル濃度(M)として表現される。その結果、KDが小さいほど、結合の親和性は強くなる。このため、1mMのKDは、1nMのKDと比較して弱い結合親和性を示している。抗体に関するKD値は、当技術分野において十分に確立した方法を用いて決定することができる。抗体のKDを決定するための1つの方法は、典型的にはBiacore(登録商標)システムなどのバイオセンサーシステムを用いる表面プラズモン共鳴(SPR)を用いることによる。
本明細書に記載の二重特異性抗原結合性構築物は、これらの抗体が以下の有効性因子:a)二重特異性抗原結合性構築物が内部移行される能力、b)二重特異性抗原結合性構築物のBmaxの増大、およびc)二重特異性抗原結合性構築物のアゴニズム/部分的アゴニズムの度合い、の間で示すバランスに応じて、二重特異性溶解性(BSP-L)抗体および二重特異性内部移行性(BSP-I)抗体という2つのサブタイプに分類することができる。
本発明の単離された二重特異性抗原結合性構築物は、HER2およびHER3を発現する細胞において、2つの第1の抗原結合性ポリペプチド構築物(例えば、トラスツズマブ)または2つの第2の抗原結合性ポリペプチド構築物(例えば、H3)を含む参照二価単一特異性抗体と比較して、より大きな最大結合(Bmax)を呈する。いくつかの態様において、二重特異性抗原結合性構築物は、参照二価単一特異性抗体のBmaxの1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍または2.0倍であるBmaxを呈する。
本明細書に記載の二重特異性抗原結合性構築物は、少なくとも1つのポリペプチドを含む。本明細書に記載のポリペプチドをコードするポリヌクレオチドも同じく記載される。
また、宿主細胞におけるポリペプチドの発現を介して二重特異性抗原結合性構築物を生産する方法も本明細書に記載される。
ある態様において、記載される構築物は、酵母、細菌などの微生物、またはヒトもしくは動物細胞株からの分泌によって組換え分子として産生される。諸態様において、ポリペプチドは宿主細胞から分泌される。
、およびコンセンサスシグナル配列
が非限定的に含まれる。バキュロウイルス発現系とともに用いうる適したシグナル配列には、gp67シグナル配列(例えば、GenBankアクセッション番号AAA72759のアミノ酸1〜19)がある。
ある態様において、本明細書に記載の二重特異性抗原結合性構築物は、翻訳中または翻訳後に差異を伴って改変される。
ある態様において、二重特異性抗原結合性構築物は、薬物、例えば、毒素、化学療法薬、免疫調節薬、または放射性同位体とコンジュゲートされる。ADC(抗体薬物コンジュゲート)を調製するいくつかの方法が当技術分野において公知であり、例えば、米国特許第8,624,003(ポット法)、第8,163,888号(一段階)および第5,208,020号(二段階法)に記載されている。
ADCは、当業者に公知の有機化学反応、条件および試薬を用いて、いくつかの経路によって調製することができる:(1)抗体の求核基または求電子基と二価リンカー試薬との反応によって、共有結合を介して抗体-リンカー中間体Ab-Lを形成させ、その後に活性化薬物部分Dと反応させること;および(2)薬物部分の求核基または求電子基とリンカー試薬の反応によって、共有結合を介して薬物-リンカー中間体D-Lを形成させ、その後に抗体の求核基または求電子基と反応させること。コンジュゲーション方法(1)および(2)を、種々の抗体、薬物部分およびリンカーとともに使用することにより、本明細書に記載の抗体-薬物コンジュゲートを調製することができる。
薬物はリンカーによって抗体と連結させることができる。mAbに対するリンカーの結びつけは、例えば、表面リジンを通じて、酸化された糖質に対する還元性カップリング、および鎖間ジスルフィド結合を還元することによって自由になったシステイン残基を通じて、といった種々のやり方で実現することができる。ヒドラゾンベースの結合、ジスルフィドベースの結合およびペプチドベースの結合を含む、種々のADC連結システムが当技術分野において公知である。
薬物またはペイロードの例は、DM1(メイタンシン、N2'-デアセチル-N2'-(3-メルカプト-1-オキソプロピル)-またはN2'-デアセチル-N2'-(3-メルカプト-1-オキソプロピル)-メイタンシン)、mc-MMAD(6-マレイミドカプロイル-モノメチルオーリスタチン-DまたはN-メチル-L-バリル-N-[(1S,2R)-2-メトキシ-4-[(2S)-2-[(1R,2R)-1-メトキシ-2-メチル-3-オキソ-3-[[(1S)-2-フェニル-1-(2-チアゾリル)エチル]アミノ]プロピル]-1-ピロリジニル]-1-[(1S)-1-メチルプロピル]-4-オキソブチル]-N-メチル-(9Cl)-L-バリンアミド)、mc-MMAF(マレイミドカプロイル-モノメチルオーリスタチンFまたはN-[6-(2,5-ジヒドロ-2,5-ジオキソ-1H-ピロール-1-イル)-1-オキソヘキシル]-N-メチル-L-バリル-L-バリル-(3R,4S,5S)-3-メトキシ-5-メチル-4-(メチルアミノ)ヘプタノイル-(αR,βR,2S)-β-メトキシ-α-メチル-2-ピロリジンプロパノイル-L-フェニルアラニン)およびmc-Val-Cit-PABA-MMAE(6-マレイミドカプロイル-ValcCit-(p-アミノベンジルオキシカルボニル)-モノメチルオーリスタチンEまたはN-[[[4-[[N-[6-(2,5-ジヒドロ-2,5-ジオキソ-1H-ピロール-1-イル)-1-オキソヘキシル]-L-バリル-N5-(アミノカルボニル)-L-オルニチル]アミノ]フェニル]メトキシ]カルボニル]-N-メチル-L-バリル-N-[(1S,2R)-4-[(2S)-2-[(1R,2R)-3-[[(1R,2S)-2-ヒドロキシ-1-メチル-2-フェニルエチル]アミノ]-1-メトキシ-2-メチル-3-オキソプロピル]-1-ピロリジニル]-2-メトキシ-1-[(1S)-1-メチルプロピル]-4-オキソブチル]-N-メチル-L-バリンアミド)からなる群より選択される。DM1はチューブリン阻害薬メイタンシンの誘導体であり、一方、MMAD、MMAEおよびMMAFはオーリスタチン誘導体である。
いくつかの態様において、薬物はメイタンシノイドである。メイタンシン化合物は、マイクロチューブリンタンパク質であるチューブリンの重合阻害によって有糸分裂中の微小管の形成を阻害することによって、細胞増殖を阻害する(Remillard et al (1975) Science 189:1002-1005;米国特許第5,208,020号)。メイタンシンおよびメイタンシノイドは非常に細胞傷害性が強いが、癌治療におけるそれらの臨床用途は、それらの腫瘍選択性の低さに主に起因するそれらの重度の全身副作用によって大いに制限されている。メイタンシンを用いた臨床試験は、中枢神経系および胃腸系に対する重篤な副作用が原因で中止された(Issel et al (1978) Can. Treatment. Rev. 5: 199-207。
いくつかの態様において、薬物はオーリスタチン、例えばオーリスタチンE(当技術分野においてはドラスタチン-10の誘導体としても知られる)またはそれらの誘導体である。オーリスタチンは、例えば、アウリスタチンEとケト酸との間で形成されるエステルであってよい。例えば、アウリスタチンEは、パラアセチル安息香酸またはベンゾイル吉草酸と反応して、それぞれAEBおよびAEVBを生成することができる。他の典型的なアウリスタチンには、AFP、MMAF、およびMMAEが含まれる。例示的なアウリスタチンの合成および構造は、米国特許第6,884,869号、第7,098,308号、第7,256,257号、第7,423,116号、第7,498,298号および第7,745,394号に記載されており、これらはそれぞれその全体があらゆる目的で参照により本明細書に組み入れられる。
いくつかの態様において、二重特異性抗原結合性構築物は化学療法薬とコンジュゲートされる。その例には、シスプラチンおよびラパチニブが非限定的に含まれる。「化学療法薬」とは、癌の治療において有用な化合物のことである。
ある態様において、本明細書に記載の構築物は、本明細書においてさらに詳細に説明する1つまたは複数の生物活性を試験するためのアッセイに用いられる。構築物が特定のアッセイにおいて活性を示す場合、抗原結合性構築物によって構成される抗原結合性構築物は、その生物活性と関連のある疾患に関係している可能性がある。このため、この構築物は、その関連疾患の治療に利用される。
本明細書には、癌を治療するための医薬品の製造のための、本明細書に記載の抗原結合性構築物の使用が提供される。また、免疫系障害に対する医薬品の製造のための、本明細書に記載の抗原結合性構築物も提供される。ある態様においては、腫瘍の増殖を阻害するための医薬品の製造のための、本明細書に記載の抗原結合性構築物の使用がある。ある態様においては、腫瘍を縮小させるための医薬品の製造のための、本明細書に記載の抗原結合性構築物の使用がある。
また、抗原結合性構築物と薬学的に許容される担体とを含む薬学的組成物も含まれる。
本明細書に記載の二重特異性抗原結合性構築物は、対象、例えばヒトに投与することができる。
本明細書に記載の抗原結合性構築物または薬学的組成物は、ヒトに用いる前に、所望の治療的または予防処置的活性に関して、インビトロで、続いてインビボで試験される。例えば、化合物または薬学的組成物の治療的または予防処置的な有用性を実証するためのインビトロアッセイには、細胞株または患者組織試料に対する化合物の効果が含まれる。細胞株および/または組織試料に対する化合物または組成物の効果は、ロゼット形成アッセイおよび細胞溶解アッセイを非限定的に含む、当業者に公知の手法を利用して判定することができる。本発明によれば、特定の化合物の投与が適応となるか否かを判定するために用いうるインビトロアッセイには、患者組織試料を培養下で増殖させ、抗原結合性構築物に曝露させるかまたはそれを別の様式で投与した上で、組織試料に対するそのような抗原結合性構築物の効果を観察する、インビトロ細胞培養アッセイが含まれる。
McDonagh et al Mol Cancer Ther. 2012 Mar;11(3):582-93
Subik et al. (2010) Breast Cancer: Basic Clinical Research:4; 35-41
Anido et al Clin Cancer Res. 2003 Apr;9(4):1274-83
Neve et al Cancer Cell 2006 10:515-527
Dragowska et al BMC Cancer 2011 11:420
Prang et a. (2005) British Journal of Cancer Research:92; 342-349
いくつかの例示的な二重特異性抗原結合性構築物、例えば、抗原結合性構築物および対照を、以下に説明する通りに設計した。
実施例1に記載された構築物を、以下の通りにCHO細胞において発現させて精製した。清澄化培養培地をMabSelect SuRe(商標)(GE Healthcare)プロテインAカラムにロードし、10カラム体積のPBS緩衝液、pH 7.2で洗浄した。抗原結合性構築物を10カラム体積のクエン酸緩衝液、pH 3.6で溶出させ、抗体を含有するプール画分をTRIS、pH 11で中和した。図1は、プロテインA精製後の、一価抗体対照変異体878(図1A)および変異体879(図1B)、ならびにbsAb変異体880(図1C)に関するSDS-PAGE分析の結果を示している。この図に示された3つのゲルにおいて、レーン1は発現された全タンパク質を表し、レーン2はフロースルー画分を表し、レーン3は洗浄液、レーン4は精製された画分を表している。これらの結果は、一価対照抗体およびbsAb変異体880がCHO細胞において良好に発現されること、およびプロテインA精製後に約80%の純度に精製されることを示している。
bsAb変異体880の精製および収量を、上記の通りのプロテインA精製およびSEC精製後にLCMSによって試験した。
例示的なbsAbである変異体880の純度を、LCMSを標準的な条件下で用いて決定した。LC-MSへのローディングの前に、PNGasFによって抗体を脱グリコシル化した。液体クロマトグラフィーは、Agilent 1100 Series HPLCにて以下の条件下で実施した。
流速:分離ポストカラムでの1mL/分からMSへの100uL/分まで
溶媒:A=ddH2O中の0.1%ギ酸、B=65%アセトニトリル、25% THF、9.9% ddH2O、0.1%ギ酸
カラム:2.1×30mm PorosR2
カラム温度:80℃ ;溶媒も予熱
勾配:20% B(0〜3分)、20〜90% B(3〜6分)、90〜20% B(6〜7分)、20% B(7〜9分)
質量分析法(MS)を、引き続いて、次の条件下でLTQ-Orbitrap XL質量分析計にて実施した:
イオン化法:イオンマックスエレクトロスプレー
較正および調整方法:CsIの2mg/mL溶液を、10μL/分の流速で注入する。Orbitrapを、続いて、Automatic Tune機能を使用してm/z 2211で調整する(観測される全体的なCsIイオン範囲:1690〜2800)。
コーン電圧:40V
チューブレンズ:115V
FT分解能:7,500
スキャン範囲 m/z 400〜4000
スキャン遅延:1.5分
例示的なbsAbである変異体880が、HER2およびHER3という両方の標的と結合する能力を、以下の通りにBIO-RADによるProteOn(商標)XPR36システムを用いるSPR(表面プラズモン共鳴)によって判定した。緩衝液(10mM Hepes pH 6.8)中のHER-2を、アミンカップリングを通じて3000 RUとなるまでCM5チップに固定化した。抗HER2抗体を含有する抗体形式にあるFc変異体を300 RUとなるまでHER-2表面に固定化した。泳動緩衝液および界面活性剤をpH6.8に維持した。精製された分析物Her3をこの泳動緩衝液中に希釈し、20〜30μL/分の流速で2分間注入した後、さらに4分間かけて解離させた。20nMで開始する各抗体の5つの2倍希釈物を三重反復試験にて分析した。センサグラムを1:1 Langmuir結合モデルに全体的に適合させた。すべての実験は室温で行った。
例示的なbsAbである変異体880がHER2/3低発現性細胞株と結合する能力を、細胞株MALME-3Mにおけるフローサイトメトリーによって決定した。FACS分析は下記の通りに実施した。
例示的なbsAbである変異体880がHER2およびHER3受容体をさまざまな細胞密度で発現する細胞株と結合する能力を、細胞株SKOV-ATCCおよびMALME-3Mにおけるフローサイトメトリーによって決定した。表xxは、これらの細胞株におけるHER2およびHER3の相対発現レベルを特定している。FACS分析は、実施例4に記載した通りに行った。
例示的なbsAb変異体880がADCC媒介性細胞死滅を導く能力を、下記の方法に従って、ヒトトリプルネガティブ乳癌細胞株MDA-MB-231において評価した。
MDA-MB-231標的細胞を、800rpmで3分間の遠心処理によって採取した。細胞をアッセイ培地で1回洗浄して遠心処理を行い、ペレットよりも上にある培地を完全に除去した。細胞をアッセイ培地で穏やかに懸濁させて、単細胞溶液を作製した。細胞の数は4倍細胞ストック(50μlのアッセイ培地中に細胞10,000個)に調節した。続いて被験抗体を、上述した所望の濃度まで希釈した。
細胞溶解のパーセンテージを、以下の式に従って計算した。
細胞溶解率(%)=100*(実験データ-(E+T))/(最大放出-最小放出)。
データはGraphpad(v4.0)によって提示し、分析した。
例示的なbsAb変異体880がADCC媒介性細胞死滅を導く能力を、HER2低発現性MCF7細胞株において、実施例6に記載した方法に従って評価した。
いくつかのさらなる抗HER2-HER3二重特異性抗体(bsAb)および対照を設計して調製した。図10は、試験した抗HER2-HER3 bsAbおよび対照のDNA配列組成を列記しており、以下の表2は、被験抗体のエピトープおよび参照文献情報を提示している。
以下の通りに、実施例8に記載された抗HER2-HER3 bsAbおよび対照をクローニングし、50mL培養物において発現させて、精製した。抗体重鎖および軽鎖をコードする遺伝子を、ヒト/哺乳動物での発現のために最適化されたコドンを用いた遺伝子合成を介して構築した。最終的な遺伝子産物を哺乳動物発現ベクターpTT5(NRC-BRI、Canada)中にサブクローニングして、CHO細胞において発現させた(Durocher, Y., Perret, S. & Kamen, A. High-level and high-throughput recombinant protein production by transient transfection of suspension-growing CHO cells. Nucleic acids research 30, E9 (2002))。
例示的なbsAbであるv4248を、生産の拡張性および大規模製造性について評価するために、一過性CHO細胞培養物において最大25Lとして発現させた。抗体の発現および精製は上記の方法を用いて行った。
例示的なbsAbであるv4248を、一段階手順を用いて、抗体-薬物コンジュゲート(ADC)としてコンジュゲートさせた。
抗体変異体の安定性を融解温度に基づいて評価するために、示差走査熱量測定(DSC)を行った。
通常のbsAbおよびアフコシル化bsAbのFcγR結合能力を実証するために、いくつかのヒトFcγRに対する例示的な抗体の結合親和性を、Bio-RadによるProteOn(商標)XPR36システムを用いる表面プラズモン共鳴(SPR)によって測定した。
HER2およびHER3をさまざまなレベルで発現する種々のヒト腫瘍細胞株に対する、例示的なbsAbであるv4248の結合を、フローサイトメトリーによって評価し、親である単一特異性二価抗体対照であるv506と比較した。試験した細胞株であるBT-474、SKOV3、JIMT1、MDA-MB-231およびMCF7の起源および受容体発現レベルは表A1に記載されている。
標的抗原結合に対してコンジュゲーションの影響があるか否かを判定する目的で、bsADC v6362が細胞と結合する能力を評価した。実験は、実施例14に記載された通りに実施した。
下記の通りに、ヒト腫瘍細胞株SK-BR-3、JIMT1、SKOV3およびMDA-MB-231において、bsAb 4248および7186がADCCを媒介する能力を、単一特異性二価抗HER2対照抗体と比較して測定した。対照抗体ハーセプチン(商標)はRocheから購入した。
細胞溶解率(%)=100%×(OD試料-OD非特異)/(ODmax-ODmin)
例示的な抗HER2-HER3 bsAbが、HER2 3+ヒト乳癌細胞株BT-474の増殖を阻害する能力を、以下の通りに評価した。これらのbsAbがヘレグリンの増殖刺激効果を中和する能力を判定するために、外因性ヘレグリンの添加について試験した。
細胞増殖率(%)=100%×(RLU試料)/(RLU非処置)
種々の癌細胞株におけるbsAb取り込みのレベルを決定するために、内部移行アッセイを行った。抗体をヒト腫瘍細胞BT-474、JIMT1およびSKOV3とともにインキュベートすることによって誘導される標的受容体のアップレギュレーションまたはダウンレギュレーションと関係する可能性がある、細胞表面結合のレベルの変化についても評価した。
消光効率=QE=1-(Q4/U4)
初期表面受容体レベル=Si=U4
最終表面受容体レベル=Sf=(U37-Q37)/QE
抗体内部移行/蓄積=I=U37-Sf
標的受容体を発現するJIMT1細胞における例示的なbsAbの内部移行を描出し、標的腫瘍細胞内の抗体局在の詳細を明らかにするために、共焦点顕微鏡検査を行った。
bsADC v6362を用いるインビトロ増殖阻害アッセイを、癌細胞株SKOV3、JIMT1およびMDA-MB-231の死滅または増殖阻害におけるその効力および有効性を判定するために行った。実施例17に記載された増殖阻害アッセイに関するものと同じ様式で、細胞を処理し、細胞生存度測定を行った。
外因性増殖因子による刺激下で、ある種のヒト癌細胞はADCによる治療に対してより抵抗性になることがあり、これはインビトロでヘレグリンによって外因性に刺激したBT-474細胞でも同様である(Lewis Phillips et al, Clin Cancer Res 2014 20; 456)。HER2 3+ヒト乳癌細胞BT-474における例示的なbsADCであるv6362の増殖阻害特性を、増殖因子の存在下および非存在下において評価した。
例示的な抗HER2-HER3 bsAbおよびbsADCが、HER2 3+ヒト胃細胞株に対する外因性ヘレグリンによる増殖誘発を中和する能力を、以下の通りに評価した。
臨床的には、トラスツズマブ治療に伴って症例の2〜7%で心機能不全がみられる。心筋症のリスクは、治療を、単独でも心毒性があるドキソルビシンなどのアントラサイクリン化学療法と併用した場合に増大する。このため、同じくHER2を標的とするbsAbによって引き起こされる、より有害な恐れのある毒性作用を同定するために、心筋細胞に対する増殖阻害アッセイを行った。
このインビボ実験は、bsADCの腫瘍増殖阻害有効性を単一特異性抗体対照と比較して判定することを目的とした。トラスツズマブおよび化学療法に抵抗性のT226異種移植モデルを、炎症性表現型を有するHER23+、HER3+、HRG+、EGFR+原発性乳癌から導き出して、例示的な抗HER2-HER3 bsADCの抗腫瘍有効性を評価するために用いた。
このインビボ実験は、抗HER2抵抗性を獲得したモデルにおけるbsADCの腫瘍増殖阻害有効性を判定することを目的とした。トラスツズマブおよび化学療法に抵抗性のT226異種移植モデルを、炎症性表現型を有するHER23+、HER3+、HRG+、EGFR原発性乳癌から導き出して、例示的な抗HER2-HER3 bsADCの抗腫瘍有効性を評価するために用いた。
このインビボ実験は、bsADCの腫瘍増殖阻害有効性を、単一特異性抗体対照と比較して判定することを目的とした。トラスツズマブおよび化学療法に抵抗性のHBCx-13b異種移植モデルを、浸潤性乳管癌のHER23+、HER3+、HRG+転移性病変から導き出して、v6362の抗腫瘍有効性を評価するために用いた。
このインビボ実験は、bsADCの腫瘍増殖阻害有効性を、単一特異性抗体対照と比較して判定することを目的とした。トラスツズマブおよび化学療法に抵抗性のHBCx-5異種移植モデルを、悪液質を伴うHER23+、HER3+乳癌から導き出して、v6362の抗腫瘍有効性を評価するために用いた。
このインビボ実験は、v6246に対する抵抗性を獲得したモデルにおけるbsADCの腫瘍増殖阻害有効性を判定することを目的とした。トラスツズマブおよび化学療法に抵抗性のHBCx-13b異種移植モデルを、浸潤性乳管癌のHER23+、HER3+転移性病変から導き出して、v6362の抗腫瘍有効性を評価するために用いた。
このインビボ実験は、MDA-MB-231皮下腫瘍を保有する動物における血液循環中血小板数に対するv6362の効果を判定することを目的とした。
Claims (60)
- HER2(ヒト上皮増殖因子受容体2)の細胞外ドメイン4(ECD4)と一価でかつ特異的に結合する第1の抗原結合性ポリペプチド構築物;
HER3(ヒト上皮増殖因子受容体3)の細胞外ドメイン(ECD)と一価でかつ特異的に結合する第2の抗原結合性ポリペプチド構築物;
第1のCH3ドメインを含む第1のFcポリペプチドおよび第2のCH3ドメインを含む第2のFcポリペプチドを含み、第1のFcポリペプチドが第1の抗原結合性ポリペプチド構築物のC末端とリンカーを伴ってまたは伴わずに連結されており、第2のFcポリペプチドが第2の抗原結合性ポリペプチド構築物のC末端とリンカーを伴ってまたは伴わずに連結されている、Fc
を含む、単離された二重特異性抗原結合性構築物であって、
第1の抗原結合性ポリペプチド構築物がFab型でありかつ第2の抗原結合性ポリペプチド構築物がscFv型であるか、または第1の抗原結合性ポリペプチド構築物がscFv型でありかつ第2の抗原結合性ポリペプチド構築物がFab型であり、かつ
HER2およびHER3を発現する細胞において、2つの第1の抗原結合性ポリペプチド構築物または2つの第2の抗原結合性ポリペプチド構築物を含む参照二価単一特異性抗体と比較して、より大きな最大結合(Bmax)を呈する、単離された二重特異性抗原結合性構築物。 - v4248からなる、請求項1記載の単離された二重特異性抗原結合性構築物。
- i.第1の抗原結合性ポリペプチド構築物が、v4248のVH1を含む第1のVHおよびv4248のVL1を含む第1のVLを含むFab型であり;
ii.第2の抗原結合性ポリペプチド構築物が、v4248のVH2を含む第2のVHおよびv4248のVL2を含む第2のVLを含むscFv型をとる、請求項1記載の単離された二重特異性抗原結合性構築物。 - 第1の抗原結合性ポリペプチド構築物が、以下:
i.トラスツズマブの3つのVH CDR配列に対して少なくとも95%同一なアミノ酸配列を含む3つのCDR配列を含むポリペプチド構築物;
ii.トラスツズマブの3つのVH CDR配列に対して100%同一なアミノ酸配列を含む3つのCDR配列を含むポリペプチド構築物;
iii.トラスツズマブの3つのVL CDR配列に対して少なくとも95%同一なアミノ酸配列を含む3つのCDR配列を含むポリペプチド構築物;
iv.トラスツズマブの3つのVL CDR配列に対して100%同一なアミノ酸配列を含む3つのCDR配列を含むポリペプチド構築物;
v.トラスツズマブの6つのCDR配列に対して少なくとも95%同一なアミノ酸配列を含む6つのCDR配列を含むポリペプチド構築物;
vi.トラスツズマブの6つのCDR配列に対して100%同一なアミノ酸配列を含む6つのCDR配列を含むポリペプチド構築物;
vii.トラスツズマブのVH配列に対して少なくとも95%同一であるアミノ酸配列を含む第1のポリペプチドおよびトラスツズマブのVL配列に対して少なくとも95%同一であるアミノ酸配列を含む第2のポリペプチドを含むポリペプチド構築物;
viii.トラスツズマブのVH配列に対して100%同一であるアミノ酸配列を含む第1のポリペプチドおよびトラスツズマブのVL配列に対して100%同一であるアミノ酸配列を含む第2のポリペプチドを含むポリペプチド構築物;ならびに
ix.HER2の4D5エピトープと結合するポリペプチド;
x.HER2 ECD4に対するトラスツズマブの結合を50%またはそれを上回って遮断するポリペプチド構築物
から選択される、請求項1記載の単離された二重特異性抗原結合性構築物。 - 第2の抗原結合性ポリペプチド構築物が、以下:
i.H3の3つのVH CDR配列に対して少なくとも95%同一なアミノ酸配列を含む3つのCDR配列を含むポリペプチド構築物;
ii.H3の3つのVH CDR配列に対して100%同一なアミノ酸配列を含む3つのCDR配列を含むポリペプチド構築物;
iii.H3の3つのVL CDR配列に対して少なくとも95%同一なアミノ酸配列を含む3つのCDR配列を含むポリペプチド構築物;
iv.H3の3つのVL CDR配列に対して100%同一なアミノ酸配列を含む3つのCDR配列を含むポリペプチド構築物;
v.H3の6つのCDR配列に対して少なくとも95%同一なアミノ酸配列を含む6つのCDR配列を含むポリペプチド構築物;
vi.H3の6つのCDR配列に対して100%同一なアミノ酸配列を含む6つのCDR配列を含むポリペプチド構築物;
vii.H3のVH配列に対して少なくとも95%同一であるアミノ酸配列を含む第1のポリペプチドおよびH3のVL配列に対して少なくとも95%同一であるアミノ酸配列を含む第2のポリペプチドを含むポリペプチド構築物;
viii.H3のVH配列に対して少なくとも100%同一であるアミノ酸配列を含む第1のポリペプチドおよびH3のVL配列に対して少なくとも100%同一であるアミノ酸配列を含む第2のポリペプチドを含むポリペプチド構築物;
ix.HER3のECDに対する抗HER3 scFv H3の結合を50%またはそれを上回って遮断するポリペプチド構築物;ならびに
x.HER3のECDに対する結合をめぐってヘレグリンと競合するポリペプチド構築物
から選択される、請求項1または請求項4記載の単離された二重特異性抗原結合性構築物。 - 第1の抗原結合性ポリペプチド構築物がFab型をとって第2の抗原結合性ポリペプチド構築物がscFv型をとる、請求項1〜5のいずれか一項記載の単離された二重特異性抗原結合性構築物。
- 第1の抗原結合性ポリペプチド構築物がscFv型をとって第2の抗原結合性ポリペプチド構築物がFab型をとる、請求項1、4または5記載の単離された二重特異性抗原結合性構築物。
- 第1の抗原結合性ポリペプチド構築物がscFv型をとって第2の抗原結合性ポリペプチド構築物がFab型をとり、かつ第2の抗原結合性ポリペプチド構築物がλ定常軽鎖(CL)アミノ酸配列を含む、請求項1、4または5記載の単離された二重特異性抗原結合性構築物。
- 第1の抗原結合性ポリペプチド構築物がscFv型をとって第2の抗原結合性ポリペプチド構築物がFab型をとり、かつ第2の抗原結合性ポリペプチド構築物がκCLアミノ酸配列を含む、請求項1、4または5記載の単離された二重特異性抗原結合性構築物。
- scFv型をとる抗原結合性ポリペプチド構築物が、VH配列とVL配列との間へのジスルフィド結合の追加によって、またはscFvの表面疎水性を低下させることによって安定化されている、請求項1〜9のいずれか一項記載の単離された二重特異性抗原結合性構築物。
- Fcが、IgG1、IgG2、IgG3、IgG4、IgAおよびIgEを含む任意のクラス、またはIgG1、IgG2、IgG3もしくはIgG4を含むIgGサブクラスのいずれか、またはそれらの組み合わせであるFcに由来する、請求項1〜10のいずれか一項記載の単離された二重特異性抗原結合性構築物。
- 少なくとも1つのCH3ドメインが、野生型ホモ二量体Fcと同等の安定性を有するヘテロ二量体Fcの形成を促進する少なくとも1つのアミノ酸改変を含む、請求項1〜11のいずれか一項記載の単離された二重特異性抗原結合性構築物。
- ヘテロ二量体Fcの二量体化したCH3ドメインが、示差走査熱量測定(DSC)による測定で、約68、69、70、71、72、73、74、75、76、77、77.5、78、79、80、81、82、83、84もしくは85℃またはそれよりも高い融解温度(Tm)を有する、請求項12記載の単離された二重特異性抗原結合性構築物。
- 二量体Fcが、産生された場合に約75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98もしくは99%を上回る純度を有するヘテロ二量体形態である;またはFcが、発現された場合もしくは単細胞を介して発現された場合に約75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98もしくは99%を上回る純度を有するヘテロ二量体形態である、請求項12または13のいずれか一項記載の単離された二重特異性抗原結合性構築物。
- i.500nMもしくはそれ未満の解離定数(KD)でHER2と結合する;
ii.500nMもしくはそれ未満のKDでHER3と結合する;
iii.HER3をより低活性のコンフォメーションにする;
iv.活性HER2-HER3ヘテロ二量体シグナル伝達を50〜100%阻害する;
v.EGFR-HER3ヘテロ二量体シグナル伝達を少なくとも50%阻害する;
vi.HER3の、ヘレグリンにより刺激されるシグナル伝達を最大で100%遮断する;
vii.増殖因子の存在下もしくは非存在下における癌細胞の増殖を阻害する;
viii.ヘレグリンの存在下における癌細胞の増殖を阻害する;
ix.HER2および/もしくはHER3を発現する癌細胞による内部移行を受ける;
x.HER2およびHER3を共発現する癌細胞において、参照二価単一特異性抗体と比較して内部移行の増大を示す;
xi.参照抗体と比較して、HER2および/もしくはHER3を発現する癌細胞に対するADCCの増大を媒介する;
xii.HER2および/もしくはHER3を発現する乳癌細胞、卵巣癌細胞および胃癌細胞に対するADCCの増大を媒介する;
xiii.HER2高発現、中発現もしくは低発現細胞、トリプルネガティブ乳癌細胞、エストロゲン受容体陽性乳癌細胞、およびトラスツズマブ抵抗性乳癌細胞から選択される、HER2および/もしくはHER3を発現する乳癌細胞に対するADCCの増大を媒介する;
xiv.癌を引き起こすことが知られている突然変異を含む、HER2および/もしくはHER3を発現する癌細胞に対するADCCの増大を媒介する;ならびに/または
xv.FcγRIIIaF、FcγRIIIaV、FcγRIIaH、FcγRIIaR、FcγRIIbY、FcγRIA、およびC1qのうち1つもしくは複数と結合する、請求項1〜14のいずれか一項記載の単離された二重特異性抗原結合性構築物。 - アフコシル化されている、請求項1〜15のいずれか一項記載の単離された二重特異性抗原結合性構築物。
- 検出可能な標識または薬物とコンジュゲートされている、請求項1〜16のいずれか一項記載の単離された二重特異性抗原結合性構築物。
- 検出可能な標識が放射性化合物、蛍光性化合物、酵素、基質、エピトープタグまたは毒素である、請求項17記載の単離された二重特異性抗原結合性構築物。
- 薬物が毒素、化学療法剤、免疫調節薬、または放射性同位体である、請求項17記載の単離された二重特異性抗原結合性構築物。
- 薬物が、メイタンシン、オーリスタチン、カリケアマイシン、またはそれらの誘導体から選択される、請求項17記載の単離された二重特異性抗原結合性構築物。
- 薬物が、DM1およびDM4から選択されるメイタンシンである、請求項17記載の単離された二重特異性抗原結合性構築物。
- 毒素が、SMCCリンカー(DM1)またはSPDBリンカー(DM4)によって、単離された二重特異性抗原結合性構築物とコンジュゲートされている、請求項21記載の単離された二重特異性抗原結合性構築物。
- 薬物-抗体比(DAR)が1.0〜6.0または3.0〜5.0または3.5〜4.2である、請求項21〜22のいずれか一項記載の単離された二重特異性抗原結合性構築物。
- 請求項1〜23のいずれか一項記載の単離された二重特異性抗原結合性構築物と、薬学的担体とを含む、薬学的組成物。
- 担体が、緩衝剤、抗酸化剤、低分子量分子、薬物、タンパク質、アミノ酸、糖質、脂質、キレート剤、安定化剤、または賦形剤を含む、請求項25記載の薬学的組成物。
- HER2およびHER3を発現する癌細胞の増殖を阻害する方法であって、癌細胞を、請求項1〜23のいずれか一項記載の単離された二重特異性抗原結合性構築物の有効量と、癌細胞の増殖を阻害するのに十分な条件下で接触させる段階を含む、方法。
- 癌細胞が乳癌細胞である、請求項26記載の方法。
- 乳癌細胞が、HER2を3+で発現する乳癌細胞である、請求項27記載の方法。
- 免疫組織化学による測定で乳癌細胞がHER2および/もしくはHER3を高レベルで発現するか、またはHER2および/もしくはHER3の遺伝子が該癌細胞において増幅されている、請求項27記載の方法。
- 癌細胞における抗体依存性細胞性細胞傷害作用(ADCC)を誘導する方法であって、癌細胞を、請求項1〜23のいずれか一項記載の単離された二重特異性抗原結合性構築物の有効量と、癌細胞におけるADCCを誘導するのに十分な条件下で接触させる段階を含む、方法。
- 哺乳動物における、HER2およびHER3を発現する1つまたは複数の腫瘍細胞の増殖(growth)および/または増殖(proliferation)を阻害する方法であって、以下の段階を含む、方法:
請求項1〜23のいずれか一項記載の単離された二重特異性抗原結合性構築物または請求項24もしくは25記載の薬学的組成物の有効量を哺乳動物に投与する段階であって、それによって、哺乳動物における、HER2およびHER3を発現する1つまたは複数の腫瘍細胞の増殖(growth)および/または増殖(proliferation)を阻害する、段階。 - 哺乳動物における、HER2および/またはHER3の過剰発現によって特徴づけられる腫瘍を治療する方法であって、以下の段階を含む、方法:
請求項1〜23のいずれか一項記載の単離された二重特異性抗原結合性構築物または請求項24もしくは25記載の薬学的組成物の有効量を哺乳動物に投与する段階であって、それによって、哺乳動物における、HER2および/またはHER3の過剰発現によって特徴づけられる腫瘍を治療する、段階。 - 哺乳動物における、低レベルのHER2および/またはHER3を発現する腫瘍を治療する方法であって、以下の段階を含む、方法:
請求項1〜23のいずれか一項記載の単離された二重特異性抗原結合性構築物または請求項24もしくは25記載の薬学的組成物の有効量を哺乳動物に投与する段階であって、それによって、哺乳動物における、低レベルのHER2および/またはHER3を発現する腫瘍を治療する、段階。 - 哺乳動物における、HER2およびHER3を共発現する腫瘍を治療する方法であって、以下の段階を含む、方法:
請求項1〜23のいずれか一項記載の単離された二重特異性抗原結合性構築物または請求項24もしくは25記載の薬学的組成物の有効量を哺乳動物に投与する段階であって、それによって、哺乳動物における、HER2およびHER3を共発現する腫瘍を治療する、段階。 - 腫瘍が、乳癌、結腸直腸癌、肝癌、卵巣癌、膵癌、前立腺癌、胃癌、または肺癌腫瘍である、請求項31〜34のいずれか一項記載の方法。
- 腫瘍が乳癌腫瘍である、請求項31〜34のいずれか一項記載の方法。
- 乳癌が、基底細胞様乳癌、HER2リッチ(HER2-enriched)乳癌、ルミナルA乳癌、ルミナルB乳癌、または正常様トリプルネガティブ乳癌から選択されるトリプルネガティブ乳癌である、請求項36記載の方法。
- 腫瘍が、エストロゲン受容体陽性(ER+)BRCA関連乳癌、結腸直腸腺癌、肝臓の肝細胞癌、膵臓腺癌、前立腺腺癌、胃腺癌、または肺腺癌腫瘍である、請求項31〜34のいずれか一項記載の方法。
- 腫瘍が、トラスツズマブ、ペルツズマブ、トラスツズマブエムタンシン(T-DM1)、およびそれらの組み合わせから選択される抗HER2抗体治療に対して不応性または抵抗性である、請求項31〜38のいずれか一項記載の方法。
- 腫瘍が、抗HER3抗体、ラパチニブ、エルロチニブ、ゲフィニチブ、またはerbBファミリーシグナル伝達の他の小分子阻害薬に対して不応性または抵抗性である、請求項31〜38のいずれか一項記載の方法。
- 腫瘍が化学療法に対して不応性である、請求項31〜40のいずれか一項記載の方法。
- 腫瘍がHER2を1+、2+または3+のレベルで発現する、請求項31〜41のいずれか一項記載の方法。
- 哺乳動物がヒトまたは非ヒト霊長動物である、請求項31〜42のいずれか一項記載の方法。
- 腫瘍に対して細胞分裂抑制性であるかまたは腫瘍に対して細胞傷害性である、請求項31〜43のいずれか一項記載の方法。
- 哺乳動物の全生存期間を増加させる、請求項31〜44のいずれか一項記載の方法。
- 投与する段階が、静脈内注射、腹腔内注射、または皮下注射による、請求項31〜45のいずれか一項記載の方法。
- 投与する段階が、初回負荷量と、その後の間隔を置いたより少量の維持量を含む、請求項31〜46のいずれか一項記載の方法。
- 負荷量が最大で最大耐量(MTD)であり、維持量が最大で10mg/kgであって間隔が7日間程度の短さである(DM1の場合のみ)、請求項47記載の方法。
- 二重特異性抗原結合性構築物または薬学的組成物が他の治療剤と組み合わせて投与される、請求項31〜48のいずれか一項記載の方法。
- 他の治療剤が、ペルツズマブ、セツキシマブ、または有効量の抗エストロゲン薬(例えば、タモキシフェン、レトロゾール)、キナーゼ阻害薬(ラパチニブ、エルロチニブ)、mTOR阻害薬、もしくは化学療法剤(例えば、カペシタビンおよび/もしくはシスプラチン)から選択される、請求項49記載の方法。
- 請求項1〜15のいずれか一項記載の単離された二重特異性抗原結合性構築物を生産する方法であって、以下の段階を含む、方法:
二重特異性抗原結合性構築物を発現するのに適した条件下で宿主細胞を培養する段階であって、宿主細胞が請求項1〜15のいずれか一項記載の単離された二重特異性抗原結合性構築物をコードするポリヌクレオチドを含む、段階、および
二重特異性抗体構築物を精製する段階。 - 請求項1〜15のいずれか一項記載の単離された二重特異性抗原結合性構築物の少なくとも1つのポリペプチドをコードする少なくとも1つの核酸配列を含む、1つの単離されたポリヌクレオチドまたは単離されたポリヌクレオチドのセット。
- 1つのポリヌクレオチドまたはポリヌクレオチドのセットがcDNAである、請求項52記載の単離されたポリヌクレオチド。
- 請求項1〜15のいずれか一項記載の二重特異性抗原結合性構築物をコードする、1つの単離されたポリヌクレオチドまたは単離されたポリヌクレオチドのセット。
- 請求項52〜54のいずれか一項記載の1つのポリヌクレオチドまたはポリヌクレオチドのセットのうち、1つまたは複数を含む、1つのベクターまたはベクターのセット。
- プラスミド、ウイルスベクター、非エピソーム性哺乳動物ベクター、発現ベクターおよび組換え発現ベクターからなる群より選択される、請求項52〜54のいずれか一項記載の1つのポリヌクレオチドまたはポリヌクレオチドのセットのうち、1つまたは複数を含む、1つのベクターまたはベクターのセット。
- 請求項52〜54のいずれか一項記載の1つのポリヌクレオチドもしくはポリヌクレオチドのセット、または請求項55もしくは56記載の1つのベクターもしくはベクターのセットを含む、単離された細胞。
- ハイブリドーマ、チャイニーズハムスター卵巣(CHO)細胞、またはHEK293細胞である、請求項57記載の単離された細胞。
- 1つのポリヌクレオチド、ポリヌクレオチドのセット、1つのベクター、またはベクターのセットによって安定的にトランスフェクトされた、請求項57または58記載の単離された細胞。
- 細胞におけるHER2およびHER3の二量体化を阻害する方法であって、以下の段階を含む、方法:
細胞を請求項1〜23のいずれか一項記載の単離された二重特異性抗原結合性構築物の有効量と接触させる段階であって、それによって、細胞におけるHER2およびHER3の二量体化を阻害する、段階。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361821197P | 2013-05-08 | 2013-05-08 | |
| US61/821,197 | 2013-05-08 | ||
| PCT/US2014/037401 WO2014182970A1 (en) | 2013-05-08 | 2014-05-08 | Bispecific her2 and her3 antigen binding constructs |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2016520586A true JP2016520586A (ja) | 2016-07-14 |
| JP2016520586A5 JP2016520586A5 (ja) | 2017-06-15 |
Family
ID=51867759
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016513093A Withdrawn JP2016520586A (ja) | 2013-05-08 | 2014-05-08 | 二重特異性her2およびher3抗原結合性構築物 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US10239951B2 (ja) |
| EP (1) | EP2994164B1 (ja) |
| JP (1) | JP2016520586A (ja) |
| AU (1) | AU2014262566A1 (ja) |
| CA (1) | CA2910945A1 (ja) |
| WO (1) | WO2014182970A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2021523100A (ja) * | 2018-04-30 | 2021-09-02 | リジェネロン・ファーマシューティカルズ・インコーポレイテッドRegeneron Pharmaceuticals, Inc. | Her2及び/またはaplp2に結合する抗体及び二重特異性抗原結合分子、ならびにそれらのコンジュゲート及び使用 |
Families Citing this family (29)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DK2635607T3 (da) | 2010-11-05 | 2019-11-18 | Zymeworks Inc | Stabilt heterodimert antistofdesign med mutationer i fc-domænet |
| AU2012222833B2 (en) | 2011-03-03 | 2017-03-16 | Zymeworks Inc. | Multivalent heteromultimer scaffold design and constructs |
| CN109897103A (zh) | 2011-11-04 | 2019-06-18 | 酵活有限公司 | 在Fc结构域中具有突变的稳定异源二聚的抗体设计 |
| SG10201709018QA (en) | 2012-03-14 | 2017-11-29 | Regeneron Pharma | Multispecific antigen-binding molecules and uses thereof |
| US9499634B2 (en) | 2012-06-25 | 2016-11-22 | Zymeworks Inc. | Process and methods for efficient manufacturing of highly pure asymmetric antibodies in mammalian cells |
| WO2014012082A2 (en) | 2012-07-13 | 2014-01-16 | Zymeworks Inc. | Multivalent heteromultimer scaffold design an constructs |
| US9914785B2 (en) | 2012-11-28 | 2018-03-13 | Zymeworks Inc. | Engineered immunoglobulin heavy chain-light chain pairs and uses thereof |
| EP3470435B1 (en) | 2014-02-28 | 2020-08-05 | Merus N.V. | Antibody that binds erbb-2 and erbb-3 |
| DK3107938T3 (da) | 2014-05-28 | 2022-07-11 | Zymeworks Inc | Modificerede, antigenbindende polypeptidkonstrukter og anvendelser heraf |
| US11566082B2 (en) | 2014-11-17 | 2023-01-31 | Cytiva Bioprocess R&D Ab | Mutated immunoglobulin-binding polypeptides |
| EP3722318A1 (en) * | 2015-07-06 | 2020-10-14 | Regeneron Pharmaceuticals, Inc. | Multispecific antigen-binding molecules and uses thereof |
| JP2018524373A (ja) | 2015-07-15 | 2018-08-30 | ザイムワークス,インコーポレイテッド | 薬物がコンジュゲートされた二重特異性抗原結合コンストラクト |
| US11161915B2 (en) * | 2015-10-08 | 2021-11-02 | Zymeworks Inc. | Antigen-binding polypeptide constructs comprising kappa and lambda light chains and uses thereof |
| ES2865482T3 (es) | 2015-10-23 | 2021-10-15 | Merus Nv | Moléculas de unión que inhiben el crecimiento del cáncer |
| MA43416A (fr) | 2015-12-11 | 2018-10-17 | Regeneron Pharma | Méthodes pour ralentir ou empêcher la croissance de tumeurs résistantes au blocage de l'egfr et/ou d'erbb3 |
| WO2017102789A1 (en) * | 2015-12-17 | 2017-06-22 | F. Hoffmann-La Roche Ag | Combination therapy of anti-her3 antibodies and anti-her2 antibodies |
| US11352446B2 (en) | 2016-04-28 | 2022-06-07 | Regeneron Pharmaceuticals, Inc. | Methods of making multispecific antigen-binding molecules |
| CN109311949B (zh) | 2016-05-11 | 2022-09-16 | 思拓凡生物工艺研发有限公司 | 储存分离基质的方法 |
| US10730908B2 (en) | 2016-05-11 | 2020-08-04 | Ge Healthcare Bioprocess R&D Ab | Separation method |
| US10889615B2 (en) | 2016-05-11 | 2021-01-12 | Cytiva Bioprocess R&D Ab | Mutated immunoglobulin-binding polypeptides |
| US10703774B2 (en) | 2016-09-30 | 2020-07-07 | Ge Healthcare Bioprocess R&D Ab | Separation method |
| EP3455243B1 (en) | 2016-05-11 | 2021-03-24 | Cytiva BioProcess R&D AB | Separation matrix |
| US10654887B2 (en) | 2016-05-11 | 2020-05-19 | Ge Healthcare Bio-Process R&D Ab | Separation matrix |
| CN109311948B (zh) | 2016-05-11 | 2022-09-16 | 思拓凡生物工艺研发有限公司 | 清洁和/或消毒分离基质的方法 |
| MX2019011660A (es) | 2017-03-31 | 2019-11-18 | Merus Nv | Anticuerpos biespecificos que se unen al receptor 2 del factor de crecimiento humano (erbb-2) y receptor 3 del factor de crecimiento humano (erbb3) para usarse en el tratamiento de celulas que tienen un gen de fusion de neuregulina-1 (nrg1). |
| MX2020001432A (es) | 2017-08-09 | 2020-03-20 | Merus Nv | Anticuerpos que se unen al receptor del factor de crecimiento epidermico (egfr) y tirosina-proteina cinasa met (cmet). |
| JP2021515793A (ja) * | 2018-03-13 | 2021-06-24 | ザイムワークス,インコーポレイテッド | 抗her2バイパラトピック抗体−薬物コンジュゲート及び使用方法 |
| GB201913079D0 (en) * | 2019-09-11 | 2019-10-23 | Hummingbird Bioscience Holdings Pte Ltd | Treatment and prevention of cancer using her3 antigen-binding molecules |
| TW202304994A (zh) | 2021-04-02 | 2023-02-01 | 美商泰尼歐生物公司 | 促效性抗il-2r抗體及使用方法 |
Family Cites Families (88)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4179337A (en) | 1973-07-20 | 1979-12-18 | Davis Frank F | Non-immunogenic polypeptides |
| US4307016A (en) | 1978-03-24 | 1981-12-22 | Takeda Chemical Industries, Ltd. | Demethyl maytansinoids |
| US4256746A (en) | 1978-11-14 | 1981-03-17 | Takeda Chemical Industries | Dechloromaytansinoids, their pharmaceutical compositions and method of use |
| JPS55102583A (en) | 1979-01-31 | 1980-08-05 | Takeda Chem Ind Ltd | 20-acyloxy-20-demethylmaytansinoid compound |
| JPS55162791A (en) | 1979-06-05 | 1980-12-18 | Takeda Chem Ind Ltd | Antibiotic c-15003pnd and its preparation |
| JPS5645483A (en) | 1979-09-19 | 1981-04-25 | Takeda Chem Ind Ltd | C-15003phm and its preparation |
| JPS5645485A (en) | 1979-09-21 | 1981-04-25 | Takeda Chem Ind Ltd | Production of c-15003pnd |
| EP0028683A1 (en) | 1979-09-21 | 1981-05-20 | Takeda Chemical Industries, Ltd. | Antibiotic C-15003 PHO and production thereof |
| US4399216A (en) | 1980-02-25 | 1983-08-16 | The Trustees Of Columbia University | Processes for inserting DNA into eucaryotic cells and for producing proteinaceous materials |
| WO1982001188A1 (en) | 1980-10-08 | 1982-04-15 | Takeda Chemical Industries Ltd | 4,5-deoxymaytansinoide compounds and process for preparing same |
| US4450254A (en) | 1980-11-03 | 1984-05-22 | Standard Oil Company | Impact improvement of high nitrile resins |
| US4315929A (en) | 1981-01-27 | 1982-02-16 | The United States Of America As Represented By The Secretary Of Agriculture | Method of controlling the European corn borer with trewiasine |
| US4313946A (en) | 1981-01-27 | 1982-02-02 | The United States Of America As Represented By The Secretary Of Agriculture | Chemotherapeutically active maytansinoids from Trewia nudiflora |
| JPS57192389A (en) | 1981-05-20 | 1982-11-26 | Takeda Chem Ind Ltd | Novel maytansinoid |
| US4740461A (en) | 1983-12-27 | 1988-04-26 | Genetics Institute, Inc. | Vectors and methods for transformation of eucaryotic cells |
| US4683195A (en) | 1986-01-30 | 1987-07-28 | Cetus Corporation | Process for amplifying, detecting, and/or-cloning nucleic acid sequences |
| JP2532858B2 (ja) | 1985-04-01 | 1996-09-11 | セルテツク リミテツド | 形質転換したミエロ―マ細胞系 |
| US4980286A (en) | 1985-07-05 | 1990-12-25 | Whitehead Institute For Biomedical Research | In vivo introduction and expression of foreign genetic material in epithelial cells |
| US5576195A (en) | 1985-11-01 | 1996-11-19 | Xoma Corporation | Vectors with pectate lyase signal sequence |
| GB8601597D0 (en) | 1986-01-23 | 1986-02-26 | Wilson R H | Nucleotide sequences |
| GB8615701D0 (en) | 1986-06-27 | 1986-08-06 | Delta Biotechnology Ltd | Stable gene integration vector |
| US4959455A (en) | 1986-07-14 | 1990-09-25 | Genetics Institute, Inc. | Primate hematopoietic growth factors IL-3 and pharmaceutical compositions |
| GB8620926D0 (en) | 1986-08-29 | 1986-10-08 | Delta Biotechnology Ltd | Yeast promoter |
| US4912040A (en) | 1986-11-14 | 1990-03-27 | Genetics Institute, Inc. | Eucaryotic expression system |
| WO1989006692A1 (en) | 1988-01-12 | 1989-07-27 | Genentech, Inc. | Method of treating tumor cells by inhibiting growth factor receptor function |
| DK159088C (da) | 1988-04-06 | 1991-01-28 | Oce Helioprint As | Skanner til aftastning af en original |
| GB8809129D0 (en) | 1988-04-18 | 1988-05-18 | Celltech Ltd | Recombinant dna methods vectors and host cells |
| ATE135045T1 (de) | 1988-07-23 | 1996-03-15 | Delta Biotechnology Ltd | Sekretorische leader-sequenzen |
| GB8924021D0 (en) | 1989-10-25 | 1989-12-13 | Celltech Ltd | Recombinant dna method and vectors for the use therein |
| US5208020A (en) | 1989-10-25 | 1993-05-04 | Immunogen Inc. | Cytotoxic agents comprising maytansinoids and their therapeutic use |
| US5183884A (en) | 1989-12-01 | 1993-02-02 | United States Of America | Dna segment encoding a gene for a receptor related to the epidermal growth factor receptor |
| US5571894A (en) | 1991-02-05 | 1996-11-05 | Ciba-Geigy Corporation | Recombinant antibodies specific for a growth factor receptor |
| IL101943A0 (en) | 1991-05-24 | 1992-12-30 | Genentech Inc | Structure,production and use of heregulin |
| LU91067I2 (fr) | 1991-06-14 | 2004-04-02 | Genentech Inc | Trastuzumab et ses variantes et dérivés immuno chimiques y compris les immotoxines |
| US5362852A (en) | 1991-09-27 | 1994-11-08 | Pfizer Inc. | Modified peptide derivatives conjugated at 2-hydroxyethylamine moieties |
| US5587458A (en) | 1991-10-07 | 1996-12-24 | Aronex Pharmaceuticals, Inc. | Anti-erbB-2 antibodies, combinations thereof, and therapeutic and diagnostic uses thereof |
| US5641670A (en) | 1991-11-05 | 1997-06-24 | Transkaryotic Therapies, Inc. | Protein production and protein delivery |
| US6270989B1 (en) | 1991-11-05 | 2001-08-07 | Transkaryotic Therapies, Inc. | Protein production and delivery |
| ATE503496T1 (de) | 1992-02-06 | 2011-04-15 | Novartis Vaccines & Diagnostic | Biosynthetisches bindeprotein für tumormarker |
| AU4025193A (en) | 1992-04-08 | 1993-11-18 | Cetus Oncology Corporation | Humanized C-erbB-2 specific antibodies |
| TW402639B (en) | 1992-12-03 | 2000-08-21 | Transkaryotic Therapies Inc | Protein production and protein delivery |
| US6214345B1 (en) | 1993-05-14 | 2001-04-10 | Bristol-Myers Squibb Co. | Lysosomal enzyme-cleavable antitumor drug conjugates |
| EP0730646A1 (en) | 1993-11-23 | 1996-09-11 | Genentech, Inc. | PROTEIN TYROSINE KINASES NAMED Rse |
| US5731168A (en) | 1995-03-01 | 1998-03-24 | Genentech, Inc. | Method for making heteromultimeric polypeptides |
| US5968511A (en) | 1996-03-27 | 1999-10-19 | Genentech, Inc. | ErbB3 antibodies |
| US7951917B1 (en) | 1997-05-02 | 2011-05-31 | Genentech, Inc. | Method for making multispecific antibodies having heteromultimeric and common components |
| US6737056B1 (en) | 1999-01-15 | 2004-05-18 | Genentech, Inc. | Polypeptide variants with altered effector function |
| WO2001024763A2 (en) | 1999-10-01 | 2001-04-12 | Immunogen, Inc. | Compositions and methods for treating cancer using immunoconjugates and chemotherapeutic agents |
| AR030612A1 (es) | 2000-09-12 | 2003-08-27 | Smithkline Beecham Corp | Procedimiento e intermedios |
| US6884869B2 (en) | 2001-04-30 | 2005-04-26 | Seattle Genetics, Inc. | Pentapeptide compounds and uses related thereto |
| US7256257B2 (en) | 2001-04-30 | 2007-08-14 | Seattle Genetics, Inc. | Pentapeptide compounds and uses related thereto |
| US6441163B1 (en) | 2001-05-31 | 2002-08-27 | Immunogen, Inc. | Methods for preparation of cytotoxic conjugates of maytansinoids and cell binding agents |
| WO2003026577A2 (en) | 2001-09-24 | 2003-04-03 | Seattle Genetics, Inc. | P-amidobenzylethers in drug delivery agents |
| US7091186B2 (en) | 2001-09-24 | 2006-08-15 | Seattle Genetics, Inc. | p-Amidobenzylethers in drug delivery agents |
| ES2606840T3 (es) | 2001-10-10 | 2017-03-28 | Ratiopharm Gmbh | Remodelación y glicoconjugación de factor estimulante de colonias de granulocitos (G-CSF) |
| US20050123536A1 (en) | 2001-11-20 | 2005-06-09 | Che-Leung Law | Treatment of immunological disorders using anti-dc30 antibodies |
| US6716821B2 (en) | 2001-12-21 | 2004-04-06 | Immunogen Inc. | Cytotoxic agents bearing a reactive polyethylene glycol moiety, cytotoxic conjugates comprising polyethylene glycol linking groups, and methods of making and using the same |
| WO2003074679A2 (en) | 2002-03-01 | 2003-09-12 | Xencor | Antibody optimization |
| US7332580B2 (en) * | 2002-04-05 | 2008-02-19 | The Regents Of The University Of California | Bispecific single chain Fv antibody molecules and methods of use thereof |
| US7332585B2 (en) | 2002-04-05 | 2008-02-19 | The Regents Of The California University | Bispecific single chain Fv antibody molecules and methods of use thereof |
| AU2003224916B2 (en) * | 2002-04-10 | 2009-01-08 | Genentech, Inc. | Anti-HER2 antibody variants |
| CA2494104A1 (en) | 2002-07-31 | 2004-04-22 | Seattle Genetics, Inc. | Anti-cd20 antibody-drug conjugates for the treatment of cancer and immune disorders |
| AU2003259163B2 (en) | 2002-08-16 | 2008-07-03 | Immunogen, Inc. | Cross-linkers with high reactivity and solubility and their use in the preparation of conjugates for targeted delivery of small molecule drugs |
| US20090010920A1 (en) | 2003-03-03 | 2009-01-08 | Xencor, Inc. | Fc Variants Having Decreased Affinity for FcyRIIb |
| US8088387B2 (en) | 2003-10-10 | 2012-01-03 | Immunogen Inc. | Method of targeting specific cell populations using cell-binding agent maytansinoid conjugates linked via a non-cleavable linker, said conjugates, and methods of making said conjugates |
| US7276497B2 (en) | 2003-05-20 | 2007-10-02 | Immunogen Inc. | Cytotoxic agents comprising new maytansinoids |
| BR122018071808B8 (pt) | 2003-11-06 | 2020-06-30 | Seattle Genetics Inc | conjugado |
| BRPI0510883B8 (pt) | 2004-06-01 | 2021-05-25 | Genentech Inc | composto conjugado de droga e anticorpo, composição farmacêutica, método de fabricação de composto conjugado de droga e anticorpo e usos de uma formulação, de um conjugado de droga e anticorpo e um agente quimioterapêutico e de uma combinação |
| JP2008507520A (ja) | 2004-07-22 | 2008-03-13 | ジェネンテック・インコーポレーテッド | Her2抗体組成物 |
| WO2006031994A2 (en) | 2004-09-14 | 2006-03-23 | Xencor, Inc. | Monomeric immunoglobulin fc domains |
| AU2006283726C1 (en) * | 2005-08-24 | 2015-05-07 | Immunogen, Inc. | Process for preparing maytansinoid antibody conjugates |
| US8580263B2 (en) * | 2006-11-21 | 2013-11-12 | The Regents Of The University Of California | Anti-EGFR family antibodies, bispecific anti-EGFR family antibodies and methods of use thereof |
| EP3248617A3 (en) * | 2007-02-16 | 2018-02-21 | Merrimack Pharmaceuticals, Inc. | Antibodies against erbb3 and uses thereof |
| AU2008328785A1 (en) * | 2007-11-27 | 2009-06-04 | Ablynx N.V. | Method for obtaining polypeptide constructs comprising two or more single domain antibodies |
| CA2709847C (en) | 2008-01-07 | 2018-07-10 | Amgen Inc. | Method for making antibody fc-heterodimeric molecules using electrostatic steering effects |
| PL2288715T3 (pl) | 2008-04-11 | 2015-03-31 | Merrimack Pharmaceuticals Inc | Łączniki będące albuminą surowicy ludzkiej i ich koniugaty |
| CN102282168A (zh) | 2008-11-18 | 2011-12-14 | 梅里麦克制药股份有限公司 | 人血清白蛋白接头以及其结合物 |
| RU2598248C2 (ru) | 2009-04-02 | 2016-09-20 | Роше Гликарт Аг | Полиспецифичные антитела, включающие антитела полной длины и одноцепочечные фрагменты fab |
| CN104984360A (zh) | 2009-06-03 | 2015-10-21 | 伊缪诺金公司 | 轭合方法 |
| WO2011063348A1 (en) | 2009-11-23 | 2011-05-26 | Amgen Inc. | Monomeric antibody fc |
| AR080793A1 (es) | 2010-03-26 | 2012-05-09 | Roche Glycart Ag | Anticuerpos biespecificos |
| RU2012145183A (ru) | 2010-03-29 | 2014-05-10 | Займворкс, Инк. | Антитела с повышенной или пониженной эффекторной функцией |
| DK2635607T3 (da) | 2010-11-05 | 2019-11-18 | Zymeworks Inc | Stabilt heterodimert antistofdesign med mutationer i fc-domænet |
| CA2832387A1 (en) | 2011-04-20 | 2012-10-26 | Genmab A/S | Bispecifc antibodies against her2 |
| CN109897103A (zh) | 2011-11-04 | 2019-06-18 | 酵活有限公司 | 在Fc结构域中具有突变的稳定异源二聚的抗体设计 |
| US9499634B2 (en) | 2012-06-25 | 2016-11-22 | Zymeworks Inc. | Process and methods for efficient manufacturing of highly pure asymmetric antibodies in mammalian cells |
| WO2014018572A2 (en) | 2012-07-23 | 2014-01-30 | Zymeworks Inc. | Immunoglobulin constructs comprising selective pairing of the light and heavy chains |
| US9562110B2 (en) * | 2012-11-21 | 2017-02-07 | Wuhan Yzy Biopharma Co., Ltd. | Bispecific antibody |
-
2014
- 2014-05-08 CA CA2910945A patent/CA2910945A1/en not_active Abandoned
- 2014-05-08 WO PCT/US2014/037401 patent/WO2014182970A1/en active Application Filing
- 2014-05-08 JP JP2016513093A patent/JP2016520586A/ja not_active Withdrawn
- 2014-05-08 US US14/888,580 patent/US10239951B2/en not_active Expired - Fee Related
- 2014-05-08 EP EP14794897.0A patent/EP2994164B1/en active Active
- 2014-05-08 AU AU2014262566A patent/AU2014262566A1/en not_active Abandoned
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2021523100A (ja) * | 2018-04-30 | 2021-09-02 | リジェネロン・ファーマシューティカルズ・インコーポレイテッドRegeneron Pharmaceuticals, Inc. | Her2及び/またはaplp2に結合する抗体及び二重特異性抗原結合分子、ならびにそれらのコンジュゲート及び使用 |
| JP7328990B2 (ja) | 2018-04-30 | 2023-08-17 | リジェネロン・ファーマシューティカルズ・インコーポレイテッド | Her2及び/またはaplp2に結合する抗体及び二重特異性抗原結合分子、ならびにそれらのコンジュゲート及び使用 |
Also Published As
| Publication number | Publication date |
|---|---|
| EP2994164A4 (en) | 2017-01-04 |
| AU2014262566A1 (en) | 2015-11-12 |
| EP2994164A1 (en) | 2016-03-16 |
| CA2910945A1 (en) | 2014-11-13 |
| US10239951B2 (en) | 2019-03-26 |
| WO2014182970A1 (en) | 2014-11-13 |
| EP2994164B1 (en) | 2020-08-05 |
| US20160083480A1 (en) | 2016-03-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10239951B2 (en) | Bispecific HER2 and HER3 antigen binding constructs | |
| JP6727379B2 (ja) | Her2を標的とする二重特異性抗原結合性コンストラクト | |
| JP6849868B2 (ja) | シングルアーム一価抗体構築物およびその用途 | |
| US10273303B2 (en) | Monovalent antigen binding constructs targeting EGFR and/or HER2 and uses thereof | |
| JP6872482B2 (ja) | Her2を標的とする二重特異性抗原結合性構築物の使用方法 | |
| US20210269553A1 (en) | Methods using monovalent antigen binding constructs targeting her2 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170428 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20170428 |
|
| A761 | Written withdrawal of application |
Free format text: JAPANESE INTERMEDIATE CODE: A761 Effective date: 20180214 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20180221 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20180214 |