JP2015509943A - ウイルス侵入補助因子としてのtamレセプター - Google Patents
ウイルス侵入補助因子としてのtamレセプター Download PDFInfo
- Publication number
- JP2015509943A JP2015509943A JP2014558089A JP2014558089A JP2015509943A JP 2015509943 A JP2015509943 A JP 2015509943A JP 2014558089 A JP2014558089 A JP 2014558089A JP 2014558089 A JP2014558089 A JP 2014558089A JP 2015509943 A JP2015509943 A JP 2015509943A
- Authority
- JP
- Japan
- Prior art keywords
- inhibitor
- sequence
- axl
- receptor
- cells
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/7105—Natural ribonucleic acids, i.e. containing only riboses attached to adenine, guanine, cytosine or uracil and having 3'-5' phosphodiester links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/1703—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- A61K38/1709—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/177—Receptors; Cell surface antigens; Cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/36—Blood coagulation or fibrinolysis factors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/43—Enzymes; Proenzymes; Derivatives thereof
- A61K38/45—Transferases (2)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/745—Blood coagulation or fibrinolysis factors
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2863—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for growth factors, growth regulators
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
- C12N15/1138—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing against receptors or cell surface proteins
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/30—Non-immunoglobulin-derived peptide or protein having an immunoglobulin constant or Fc region, or a fragment thereof, attached thereto
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering N.A.
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2770/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses positive-sense
- C12N2770/00011—Details
- C12N2770/24011—Flaviviridae
- C12N2770/24111—Flavivirus, e.g. yellow fever virus, dengue, JEV
- C12N2770/24122—New viral proteins or individual genes, new structural or functional aspects of known viral proteins or genes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2770/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses positive-sense
- C12N2770/00011—Details
- C12N2770/36011—Togaviridae
- C12N2770/36111—Alphavirus, e.g. Sindbis virus, VEE, EEE, WEE, Semliki
- C12N2770/36122—New viral proteins or individual genes, new structural or functional aspects of known viral proteins or genes
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Abstract
本発明は、ウイルス侵入補助因子、特にホスファチジルセリン保有ウイルス感染、例えばフラビウイルス感染を予防または治療するためのホスファチジルセリンとTAMレセプターとの間の相互作用の阻害剤の使用に関する。
Description
発明の分野
本発明は、ウイルス感染を予防または治療するための、ホスファチジルセリンとTAMレセプターとの間の相互作用の阻害剤の使用に関する。
本発明は、ウイルス感染を予防または治療するための、ホスファチジルセリンとTAMレセプターとの間の相互作用の阻害剤の使用に関する。
発明の背景
ウイルス感染は、公衆衛生にとっての大きな脅威である。ウイルスによって引き起こされる生死に関わる疾患(例えば出血熱および脳炎)の出現および拡大は、まだ対処されていない従来の予防アプローチ(例えばワクチン)と共に、これらの致命的な病原体をターゲティングする新しい戦略を探究する必要性を浮き彫りにしている。
ウイルス感染は、公衆衛生にとっての大きな脅威である。ウイルスによって引き起こされる生死に関わる疾患(例えば出血熱および脳炎)の出現および拡大は、まだ対処されていない従来の予防アプローチ(例えばワクチン)と共に、これらの致命的な病原体をターゲティングする新しい戦略を探究する必要性を浮き彫りにしている。
例えばフラビウイルス属は、単一のプラス鎖RNAゲノムを収容している70種を超える小型エンベロープウイルスを包含している。デングウイルス(DV)、黄熱ウイルス(YFV)、およびウエストナイルウイルス(WNV)などのこの属のいくつかのメンバーは、出血熱および脳炎を含めた多様な医学的に関連するヒト疾患を引き起こす蚊媒介ヒト病原体である(Gould and Solomon, 2008, Lancet, 371:200-509; Gubler et al., 2007, Fields Virology, 5th Edition, 1153-1252)。抗原的に関係する4つの血清型(DV1〜DV4)によって引き起こされるデング病は、この数十年間の世界的な健康問題として出現し、最も医学的に関連するアルボウイルス疾患の一つである。年間5000万〜1億のデング症例が発生し、25億人を超える人々が感染のリスクに曝されていると推定されている。4つの血清型のどれによる感染も、軽い発熱から生死に関わるデング出血熱(DHF)およびデングショック症候群(DSS)にわたる疾患を引き起こす。ヒト病原体としてのDVの重要性および増え続ける発生率にかかわらず、現在のところDVに対して利用できる認可されたワクチンはなく、抗ウイルス薬の欠如が治療法の選択肢をひどく制限している。
デング病と闘うための今後の取り組みは、DVの生活環をよりよく理解することを必要とする。標的細胞内へのDVの侵入は、宿主の範囲、細胞親和性およびウイルスの病原性の主な決定因子であるので、予防的抗ウイルス戦略と同様に治療的抗ウイルス戦略のための有望な標的である。DVは、一次感染時に、ウイルス糖タンパク質(Eタンパク質)と細胞レセプターとの間の相互作用によって駆動される過程であるクラスリン媒介性エンドサイトーシスによって宿主細胞に侵入する。エンドソーム内で酸性環境がEタンパク質の不可逆的三量体化をトリガーし、それがウイルス膜と細胞膜との融合を招き、サイトゾル内にウイルスキャプシドおよびゲノムRNAを放出させる。現在までにウイルス侵入に至るDV−宿主相互作用の分子的基盤はあまり理解されておらず、DV細胞レセプター(一つまたは複数)の独自性に関してほとんど分かっていない。DVは広範囲の細胞型に感染することが分かっている。したがって、DVは標的細胞に応じて異なるレセプターを活用するか、または広く発現されている侵入分子を利用する可能性がある。初期の研究から、DVビリオンが細胞膜上のヘパラン硫酸プロテオグリカンに結合することによって宿主と最初の接触を行うことが示された。これらの分子は、Eタンパク質表面の正荷電した残基を認識する。そして、これらの分子は、標的細胞の表面にウイルスを集め、その後ウイルスが侵入因子と相互作用すると考えられている。熱ショックタンパク質70(HSP70)、HSP90、GRP78/Bip、リポ多糖レセプターCD14または37/67kDa高親和性ラミニンなどの数多くの細胞タンパク質が推定上のDV侵入レセプターとして提唱されている。しかし、ウイルス侵入に果たすそれらの機能はあまり特徴づけられていないままであり、生理学的関連性が不明である。現在までに唯一はっきりと特徴づけられた、DV侵入プログラムに能動的に関与する因子は、樹状細胞上に発現されるDC−SIGN、肝臓類洞内皮細胞上に発現されるL−SIGNおよびマクロファージ上に発現されるマンノースレセプター(MR)である。これらの分子はC型レクチンレセプターファミリーに属し、DVのEタンパク質上に発現した富マンノースN結合型グリカンと結合する。しかし、DVがDC−SIGN、MRまたはL−SIGNを発現しない細胞型に感染することは、他の関連侵入レセプター(一つまたは複数)が存在し、依然として特定されていないことを示している。
細胞表面レセプターとEタンパク質の相互作用によって媒介される古典的細胞侵入経路に加えて、体液および組織中に存在する可溶性成分がDV粒子と相互作用してウイルスの内部移行を増強しうるというのが妥当であるように思われる。この仮説を裏付けるものとして、最近の研究から、蚊細胞へのWNVの取り込みが分泌型のC型レクチンmosGTLC−1によって媒介されることが示された。この可溶性因子は高い親和性でWNV粒子と結合し、推定によると、WNV粒子をその細胞レセプターmosPTP−1に架橋することでウイルスの侵入を促進する。別の例は、ヒトアデノウイルス(HAdV)V5によって代表され、そのウイルスはヒト血液凝固因子X(FX)と相互作用する結果として、HAdV5ベクター粒子の大規模な肝臓取り込みを担う主要なパラメーターであるFX−HAdV5複合体の形成を招く。上述の情報に基づくと、DV侵入過程はおそらく以前に考えられていたよりも複雑である可能性がある。DVの付着および内部移行が、いくつかのレセプターと、可能性があることにはDVの細胞結合およびウイルス親和性に有利に働きうる体液中に循環する可溶性成分とを要する多段階過程であると仮定することが合理的である。
現在、DVは世界的な問題になり、110ヶ国よりも多い国で地方病である。したがって、DV感染の予防的処置または治療的処置の開発が必要とされる。
そのうえ、DVの内部移行機構を明らかにすることも、他のウイルス感染の処置を開発する道を開く可能性がある。
発明の説明
本発明者らは、DV感染がDVウイルスエンベロープ表面に存在するホスファチジルセリン(PtdSer)と宿主細胞表面に存在するTAMレセプターとの間の相互作用によって媒介されること、および当該相互作用を遮断することによって宿主細胞内へのDV侵入を阻害してDV感染を予防できることを見いだした。
本発明者らは、DV感染がDVウイルスエンベロープ表面に存在するホスファチジルセリン(PtdSer)と宿主細胞表面に存在するTAMレセプターとの間の相互作用によって媒介されること、および当該相互作用を遮断することによって宿主細胞内へのDV侵入を阻害してDV感染を予防できることを見いだした。
さらに本発明者らは、ホスファチジルセリン(PtdSer)とTAMレセプターとの間のこの相互作用が、黄熱ウイルス(YFN)およびウエストナイルウイルス(WNV)などの他のフラビウイルスによってだけでなく、例えばチクングニヤウイルスによっても利用されることを見いだし、これは、この相互作用が膜内にホスファチジルセリン(PtdSer)を組み入れているウイルスによって活用される一般メカニズムを表しうることを示している。
したがって本発明は、ウイルス感染、特にフラビウイルス感染などのホスファチジルセリン(PtdSer)保有ウイルス感染を予防または治療するための使用のための、ホスファチジルセリンとTAMレセプターとの間の相互作用の阻害剤に関し、ここで該阻害剤は、好ましくは(i)TAMレセプター阻害剤、(ii)Gas6阻害剤、および/または(iii)ホスファチジルセリン結合タンパク質である。好ましくは、該相互作用は間接相互作用である。「ホスファチジルセリン保有ウイルス感染」は、特に「フラビウイルス感染」を意味する。「フラビウイルス感染」は、デングウイルス(DV)、ウエストナイルウイルス、ダニ媒介脳炎ウイルス、セントルイス脳炎ウイルス、日本脳炎ウイルスまたは黄熱ウイルスの感染を意味する。好ましくは、該TAMレセプターはTYRO3、AXLまたはMERである。好ましくは、該TAMレセプター阻害剤は抗TAMレセプター抗体、アンチセンス核酸、模倣体または変異型TAMレセプターであり、より好ましくは、該TAMレセプター阻害剤はsiRNAである。好ましくは、該Gas6阻害剤は抗Gas6抗体、アンチセンス核酸、模倣体または変異型Gas6タンパク質である。好ましくは、該ホスファチジルセリン結合タンパク質は抗ホスファチジルセリン抗体またはアネキシン5である。
ホスファチジルセリンとTAMレセプターとの間の相互作用の阻害剤および追加的に少なくとも1種の他の抗ウイルス化合物を含む薬学的組成物も提供される。好ましくは、該少なくとも1種の他の抗ウイルス化合物は、ホスファチジルセリンとTIMレセプターとの間の相互作用の阻害剤である。
細胞へのウイルス、特にフラビウイルスなどのPtdSer保有ウイルスの侵入を阻害する方法における、ホスファチジルセリンとTAMレセプターとの間の相互作用の阻害剤の使用がさらに提供される。
ウイルス感染、特にフラビウイルス感染などのPtdSer保有ウイルス感染を予防または治療するための方法であって、それを必要とする個体に、ホスファチジルセリンとTAMレセプターとの間の相互作用の阻害剤の治療有効量を投与することを含む方法も提供される。
ウイルス感染、特にPtdSer保有ウイルス感染、特にフラビウイルス感染を予防または治療するための医薬を製造するための、ホスファチジルセリンとTAMレセプターとの間の相互作用の阻害剤の使用も提供される。
定義
「ホスファチジルセリン保有ウイルス感染」は、その膜にPtdSerを発現または組み入れているエンベロープウイルスの感染を意味する。感染前に、ウイルス膜上のPtdSerが宿主細胞のレセプターに曝される。PtdSerを保有するエンベロープウイルスの例には、非限定的にフラビウイルス(デングウイルス、ウエストナイルウイルス、黄熱ウイルスなど)、アルファウイルス(例えばチクングニヤウイルス)、フィロウイルス(例えばエボラウイルス)、ポックスウイルス(Poxivirus)(例えば牛痘ウイルス)およびアレナウイルス(例えばラッサウイルス)が含まれる。
「ホスファチジルセリン保有ウイルス感染」は、その膜にPtdSerを発現または組み入れているエンベロープウイルスの感染を意味する。感染前に、ウイルス膜上のPtdSerが宿主細胞のレセプターに曝される。PtdSerを保有するエンベロープウイルスの例には、非限定的にフラビウイルス(デングウイルス、ウエストナイルウイルス、黄熱ウイルスなど)、アルファウイルス(例えばチクングニヤウイルス)、フィロウイルス(例えばエボラウイルス)、ポックスウイルス(Poxivirus)(例えば牛痘ウイルス)およびアレナウイルス(例えばラッサウイルス)が含まれる。
「ホスファチジルセリン保有ウイルス感染」には、例えば「フラビウイルス感染」が含まれうる。「フラビウイルス感染」は、デングウイルス(DV)、ウエストナイルウイルス、ダニ媒介脳炎ウイルス、セントルイス脳炎ウイルス、日本脳炎ウイルスまたは黄熱ウイルスの感染を意味する(Sabin et al., 1952, A.B. Am. J. Trop. Med. Hyg. 1:30-50; Hammon et al., 1960, Trans. Assoc. Am. Physicians 73:140-155; Smithburn, 1940, Am. J. Trop. Med., 20:471-492; Monath and Heinz, 1996, Flaviviruses, Fields Virology, 3rd edition, p.961-1034; Gould and Solomon, 2008, Lancet, 371:500-509)。デングウイルスは、任意の血清型、すなわち血清型1、2、3または4でありうる。
「ホスファチジルセリンとTAMレセプターとの間の相互作用」は、好ましくはPtdSer保有ウイルスの表面に存在するホスファチジルセリンと宿主細胞の表面に存在するTAMレセプターとの間の間接相互作用を意味する。実際に、本発明者らは、ホスファチジルセリンとTAMレセプターとの間の相互作用が、例えばGas6タンパク質でありうる架橋分子によって媒介されること、およびこの間接相互作用が宿主細胞へのPtdSer保有ウイルスの感染または侵入を許すことを見いだした。
「阻害剤」は、ホスファチジルセリンとTAMレセプターとの間の相互作用を減少または消失させることができる薬剤を意味する。該阻害剤は、また、TAMレセプターおよび/またはGas6などの架橋分子の発現を減少または消失させることができる場合がある。本発明によると、該阻害剤は、例えば(i)TAMレセプター阻害剤、(ii)Gas6もしくは他の架橋分子の阻害剤、および/または(iii)ホスファチジルセリン結合タンパク質でありうる。
好ましくは、該阻害剤は、ホスファチジルセリンとTAMレセプターとの間の相互作用、ならびに/またはTAMレセプターおよび/もしくは架橋分子の発現を、少なくとも10、20、30、40%、より好ましくは少なくとも50、60、70%、最も好ましくは少なくとも75、80、85、90、95、96、97、98、99、または100%減少または消失させることができる。
本明細書におけるポリペプチドおよび核酸への言及には、本明細書において開示されたアミノ酸配列および核酸配列と該配列の変異体との両方が含まれる。
変異型タンパク質は、スプライス変異体、アレルおよびアイソフォームなどの天然変異体の場合があり、またはそれらは組み換え手段によって産生されうる。アミノ酸配列内の変異は、タンパク質のアミノ酸配列に変化を招く、タンパク質をコードする核酸配列への一つまたは複数のコドンの置換、欠失または挿入によって導入することができる。場合により、変異は、タンパク質中の1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20個またはそれよりも多いアミノ酸を任意の他のアミノ酸で置換することによる。追加的にまたは代替的に、変異は、タンパク質内に1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20個またはそれよりも多いアミノ酸を追加または欠失させることによる場合がある。
変異型核酸配列には、中または高ストリンジェンシー条件で配列番号1〜4、6、9、10、12、16〜18、21、23〜25、28、31、32、33〜36の配列に特異的にハイブリダイゼーションする能力がある配列が含まれる。ストリンジェントな条件または高ストリンジェンシー条件は:(1)洗浄に低イオン強度および高温、例えば0.015M塩化ナトリウム/0.0015Mクエン酸ナトリウム/0.1%ドデシル硫酸ナトリウムを50℃で採用する;(2)ハイブリダイゼーションの際にホルムアミドなどの変性剤、例えば0.1%ウシ血清アルブミン/0.1%フィコール/0.1%ポリビニルピロリドン/50mMリン酸ナトリウム緩衝液(pH6.5)を750mM塩化ナトリウム、75mMクエン酸ナトリウムと共に、50%(v/v)ホルムアミドを42℃で採用する;または(3)50%ホルムアミド、5×SSC(0.75M NaCl、0.075Mクエン酸ナトリウム)、50mMリン酸ナトリウム(pH6.8)、0.1%ピロリン酸ナトリウム、5×デンハート液、超音波処理サケ精子DNA(50μg/ml)、0.1%SDS、および10%硫酸デキストランを42℃で採用し、0.2×SSC(塩化ナトリウム/クエン酸ナトリウム)中、42℃でおよび50%ホルムアミド中55℃で洗浄し、続いてEDTA含有0.1×SSCから成る高ストリンジェンシー洗浄を55℃で行う条件によって特定することができる。中ストリンジェント条件は、Sambrook et al., Molecular Cloning: A Laboratory Manual, New York: Cold Spring Harbor Press, 1989によって記載されたように特定することができ、その条件は上記の条件よりもストリンジェントではない洗浄溶液およびハイブリダイゼーション条件(例えば温度、イオン強度および%SDS)の使用を含んでいる。中ストリンジェント条件の一例は、20%ホルムアミド、5×SSC(150mM NaCl、15mMクエン酸三ナトリウム)、50mMリン酸ナトリウム(pH7.6)、5×デンハート液、10%硫酸デキストラン、および20mg/ml変性剪断サケ精子DNAを含む溶液中37℃で一晩インキュベーションに続き、約37〜50℃の1×SSC中でフィルターを洗浄することである。
本明細書において開示されたタンパク質および変異型タンパク質のフラグメントもまた、本発明によって包含される。そのようなフラグメントは、例えば全長タンパク質に比べて、N末端もしくはC末端で切断されている場合があり、または内部残基を欠如している場合がある。ある種のフラグメントは、酵素活性に不可欠ではないアミノ酸残基を欠如している。好ましくは、該フラグメントは、少なくとも約10、20、30、40、50、60、70、80、90、100、110、120、150、250、300、350、400、450、500またはそれよりも多いアミノ酸長である。
本明細書において開示された核酸配列および変異体のフラグメントもまた、本発明によって包含される。そのようなフラグメントは、例えば全長核酸配列に比べて、3’もしくは5’末端で切断されている場合があり、または内部塩基を欠如している場合がある。好ましくは、該フラグメントは、少なくとも約10、20、30、40、50、60、70、80、90、100、110、120、150、250、300、350、400、450、500またはそれよりも多い塩基長である。
変異型タンパク質には、本明細書において開示されたポリペプチド配列と少なくとも約80%のアミノ酸配列同一性を有するタンパク質が含まれうる。好ましくは、変異型タンパク質は、本明細書において開示されたような全長ポリペプチド配列またはポリペプチド配列のフラグメントと少なくとも約50%、55%、60%、65%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%のアミノ酸配列同一性を有する。アミノ酸配列同一性は、いかなる保存的置換も配列同一性の一部として考慮せずに、最大の配列同一率(%)を達成するために配列をアライメントし、必要に応じてギャップを導入した後に、参照配列中のアミノ酸残基と同一な変異型配列中のアミノ酸残基のパーセンテージとして定義される。配列同一性は、変異型配列の全長、参照配列の全長、またはその両方にわたり決定することができる。
変異型核酸配列には、本明細書において開示された核酸配列と少なくとも約80%のアミノ酸配列同一性を有する核酸配列が含まれうる。好ましくは、変異型核酸配列は、本明細書において開示された全長核酸配列または核酸配列のフラグメントと少なくとも約50%、55%、60%、65%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%のアミノ酸配列同一性を有する。核酸配列同一性は、最大の配列同一率(%)を達成するために配列をアライメントし必要に応じてギャップを導入した後に、いかなる保存的置換も配列同一性の一部として考慮せずに参照配列中の核酸残基と同一な変異型配列中の核酸のパーセンテージとして定義される。配列同一性は、変異型配列の全長、参照配列の全長、またはその両方にわたり決定することができる。
本発明の問い合わせアミノ酸配列と少なくとも例えば95%「同一な」アミノ酸配列を有するポリペプチドは、対象ポリペプチドのアミノ酸配列が問い合わせ配列と同一であるが、但し、対象ポリペプチド配列が問い合わせアミノ酸配列のアミノ酸100個あたり最大5個のアミノ酸変化を含みうることを意味する。言い換えると、問い合わせアミノ酸配列と少なくとも95%同一なアミノ酸配列を有するポリペプチドを得るために、対象配列中のアミノ酸残基の最大5%(100個中5個)は挿入されている、欠失している、または別のアミノ酸によって置換されている場合がある。
本出願に関連して、同一パーセンテージはグローバルアライメント(すなわち2個の配列をそれらの全長にわたり比較する)を用いて計算される。2個以上の配列の同一性を比較するための方法は、当技術分野において周知である。2個の配列の全長を考慮する場合、それらの最適なアライメント(ギャップを含む)を見いだすために、例えばNeedleman-Wunschグローバルアライメントアルゴリズムを使用している「needle」プログラム(Needleman and Wunsch, 1970 J. Mol. Biol. 48:443-453)を使用することができる。needleプログラムは、例えばウェブサイトebi.ac.ukから入手することができる。本発明による同一パーセンテージは、好ましくはEMBOSS::needle(グローバル)プログラムを使用して、「ギャップオープン」パラメーター=10.0、「ギャップ伸長」パラメーター=0.5、およびBlosum62マトリックスで計算される。
参照配列に「少なくとも80%、85%、90%、95%、96%、97%、98%または99%同一な」アミノ酸配列から成るタンパク質は、参照配列に比べて欠失、挿入および/または置換などの突然変異を含みうる。置換の場合、参照配列と少なくとも80%、85%、90%、95%、96%、97%、98%または99%同一なアミノ酸配列から成るタンパク質は、参照配列と別の種から得られた相同配列に該当しうる。
アミノ酸置換は、保存的または非保存的でありうる。好ましくは、置換は保存的置換であり、保存的置換では、アミノ酸1個を類似の構造的および/または化学的性質を有する別のアミノ酸の代わりに置換する。置換は、好ましくは下表に示されるような保存的置換に該当する。
用語「抗体」は、免疫グロブリン分子および免疫グロブリン分子の免疫学的活性部分、すなわち抗原と免疫特異的に結合する抗原結合部位を含む分子を表す。このように、抗体という用語は、抗体分子全体だけでなく抗体フラグメントおよびヒト化抗体などの誘導体を含めた抗体変異体も包含する。天然抗体では、2本の重鎖がジスルフィド結合によって相互に結合し、各重鎖がジスルフィド結合によって軽鎖に結合している。軽鎖にはラムダ(λ)およびカッパ(κ)の2種類がある。抗体分子の機能的活性を決定する5種の主要重鎖クラス(またはアイソタイプ):IgM、IgD、IgG、IgAおよびIgEがある。各鎖は、別個の配列ドメインを含有する。軽鎖は、2個のドメイン、すなわち可変ドメイン(VL)および定常メイン(CL)を含む。重鎖は、4個のドメイン、すなわち可変ドメイン(VH)および3個の定常ドメイン(CH1、CH2およびCH3、まとめてCHと呼ばれる)を含む。軽鎖(VL)および重鎖(VH)の両方の可変領域は、抗原への結合認識および特異性を決定する。軽鎖(CL)および重鎖(CH)の定常領域ドメインは、抗体鎖の会合、分泌、経胎盤移動性、補体結合、およびFcレセプター(FcR)との結合などの重要な生物学的性質を付与する。Fvフラグメントは、免疫グロブリンのFabフラグメントのN末端部分であり、1本の軽鎖および1本の重鎖の可変部分から成る。抗体の特異性は、抗体結合部位と抗原決定基との間の構造相補性にある。抗体結合部位は、主に超可変領域または相補性決定領域(CDR)由来の残基から構成される。時に、非超可変領域またはフレームワーク領域(FR)由来の残基は、全体的なドメイン構造に、それ故に結合部位に影響する。相補性決定領域(CDR)は、一緒になってネイティブな免疫グロブリン結合部位の天然Fv領域の結合親和性および特異性を定義するアミノ酸配列を表す。免疫グロブリンの軽鎖および重鎖は、それぞれが各々L−CDR1、L−CDR2、L−CDR3およびH−CDR1、H−CDR2、H−CDR3と称される3個のCDRを有する。したがって、抗原結合部位は、重鎖V領域および軽鎖V領域のそれぞれ由来のCDRセットを含む6個のCDRを含む。
Kabatら(Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, Md., 1991)によって定義されたように、フレームワーク領域(FR)は、CDRの間に介在するアミノ酸配列を表し、すなわち単一種において異なる免疫グロブリンの間で相対的に保存されている、免疫グロブリン軽鎖および重鎖の可変領域の部分を表す。本明細書に使用される「ヒトフレームワーク領域」は、天然ヒト抗体のフレームワーク領域に実質的に(約85%以上、特に90%、95%、または100%)同一なフレームワーク領域である。
本明細書に使用される用語「モノクローナル抗体」または「mAb」は、特異的抗原に対する単一アミノ酸組成の抗体分子であって、単一クローンのB細胞またはハイブリドーマによって産生されうる抗体分子を表す。モノクローナル抗体は、また、リコンビナントの場合があり、すなわちタンパク質工学によって産生される場合がある。
用語「キメラ抗体」は、非ヒト動物から得られた抗体のVHドメインおよびVLドメインが、別の抗体、特にヒト抗体のCHドメインおよびCLドメインと結合したものを含む加工抗体を表す。非ヒト動物として、マウス、ラット、ハムスター、ウサギなどの任意の動物を使用することができる。キメラ抗体は、また、少なくとも2種の異なる抗原に対して特異性を有する多重特異性抗体を意味しうる。
用語「ヒト化抗体」は、フレームワーク領域または「相補性決定領域」(CDR)が改変されて、親免疫グロブリンのCDRと異なる特異性のドナー免疫グロブリン由来CDRを含むようになった抗体を表す。好ましい一態様では、「ヒト化抗体」を調製するために、マウスCDRがヒト抗体のフレームワーク領域に接ぎ合わされる。
「抗体フラグメント」は、インタクトな抗体の部分、好ましくはインタクトな抗体の抗原結合領域または可変領域を含む。抗体フラグメントの例には、Fv、Fab、F(ab’)2、Fab’、dsFv、scFv、sc(Fv)2、二重特異性抗体および抗体フラグメントから形成された多重特異性抗体が含まれる。
用語「Fab」は、分子量約50,000および抗原結合活性を有する抗体フラグメントであって、IgGをプロテアーゼであるパパインで処理することによって得られたフラグメントのうちH鎖のN末端側の約半分およびL鎖全体がジスルフィド結合を介して一緒に結合している抗体フラグメントを意味する。
用語「F(ab’)2」は、分子量約100,000および抗原結合活性を有する抗体フラグメントであって、IgGをプロテアーゼであるペプシンで処理することによって得られたフラグメントのうち、Fabよりもわずかに大きな抗体フラグメントがヒンジ領域のジスルフィド結合を経由して結合している抗体フラグメントを表す。
用語「Fab’」は、F(ab’)2のヒンジ領域のジスルフィド結合を切断することによって得られる、分子量約50,000および抗原結合活性を有する抗体フラグメントを表す。
単鎖Fv(「scFv」)ポリペプチドは、通常、ペプチドをコードするリンカーによって結合されたVHコード遺伝子およびVLコード遺伝子を含む遺伝子融合体から発現された共有結合型VH::VLヘテロ二量体である。本発明のヒトscFvフラグメントには、好ましくは遺伝子組換え技法を用いることによって適切なコンフォメーションに保持されたCDRが含まれる。「dsFv」はジスルフィド結合によって安定化されたVH::VLヘテロ二量体である。2価および多価抗体フラグメントは、1価scFvの会合によって自然に形成させることができ、または2価sc(Fv)2のようにペプチドリンカーによって1価scFvを結合させることによって発生させることができる。
用語「二重特異性抗体」は、2個の抗原結合部位を有する小型抗体フラグメントであって、重鎖可変ドメイン(VH)が軽鎖可変ドメイン(VL)に結合して同じポリペプチド鎖になったものを含む抗体フラグメント(VH−VL)を表す。同じ鎖上の2個のドメインの間で対形成させるには短すぎるリンカーを使用することによって、これらのドメインは別の鎖の相補的ドメインと対形成するよう強制され、2個の抗原結合部位を創出する。
「アンチセンス核酸」は、RNA−−RNAまたはRNA−DNAまたはRNA−PNA(タンパク質核酸; Egholm et al., 1993, Nature, 365: 566)相互作用により標的RNAに結合し、標的RNAの活性を変化させる非酵素的核酸分子を意味する(総説についてはStein and Cheng, 1993, Science, 261, 1004およびWoolfら、米国特許第5,849,902号を参照されたい)。典型的には、アンチセンス分子は、アンチセンス分子の単一連続配列に沿って標的配列と相補的である。しかし、ある態様では、アンチセンス分子は、基質分子がループもしくはヘアピンを形成するように基質に結合することができ、かつ/またはアンチセンス分子がループもしくはヘアピンを形成するように結合することができる。したがって、アンチセンス分子は、2、3、4、5、6、7、8、9、10もしくはそれよりも多い非連続基質配列に相補的な場合があり、またはアンチセンス分子の2、3、4、5、6、7、8、9、10もしくはそれよりも多い非連続配列部分が標的配列に相補的な場合があり、またはその両方である(例えばCrooke, 2000, Methods Enzymol., 313: 3-45参照)。加えて、アンチセンスDNAはDNA−RNA相互作用によりRNAをターゲティングすることによってRNase H(二本鎖の標的RNAを消化する)を活性化するために使用することができる。アンチセンスオリゴヌクレオチドは、標的RNAのRNAse H切断を活性化する能力がある1個または複数のRNAse H活性化領域を含みうる。
アンチセンス核酸は、導入されると、通常RNA干渉(RNAi)経路と呼ばれる細胞経路に入る。用語「RNA干渉」または「RNAi」は、遺伝子サイレンシングとも呼ばれるRNAの選択的細胞内分解を表す。RNAiには、低分子干渉RNA(siRNA)による翻訳抑制も含まれる。RNAiは、長二本鎖RNA(dsRNA)もしくはsiRNAの導入、または例えばプラスミドもしくは導入遺伝子からのsiRNAの細胞内産生により開始して、1つ以上の標的遺伝子の発現をサイレンシングすることができる。または、RNAiは細胞内で自然に生じ、外来RNA、例えばウイルスRNAを除去する。自然RNAiは、dicerが前駆dsRNAのフラグメント化を指揮し、分解メカニズムを他の同族RNA配列に向けることを介して進行する。
いくつかの態様では、アンチセンス核酸は、長二本鎖RNA(dsRNA)、マイクロRNA(miRNA)および/または低分子干渉RNA(siRNA)でありうる。
本明細書に使用される「長二本鎖RNA」または「dsRNA」は、ゲノムもしくは合成起源の、またはベクターの発現から得られた、改変または非改変のオリゴリボヌクレオチドまたはポリリボヌクレオチド、およびそのフラグメントまたは部分であって、部分二本鎖または完全二本鎖の場合があり、かつ平滑末端であるか、または5’および/もしくは3’オーバーハングを含む場合があり、また、二つ折りになって二本鎖領域が得られる1本鎖オリゴリボヌクレオチドを含むヘアピン形態でもありうるものを表す。いくつかの態様では、dsRNAは、150bpから3000bpに及ぶ、好ましくは250bpから2000bpに及ぶ、いっそうより好ましくは300bpから1000bpに及ぶ大きさを有する。いくつかの態様では、該dsRNAは、少なくとも150、160、170、180、190、200、210、220、230、240、250、260、270、280、290、300、310、320、330、340、350、400、450、500、550、600、650、700、750、800、850、900、950、1000、1500bpの大きさを有する。いくつかの態様では、該dsRNAは、最大で3000、2500、2000、1500、1000、950、900、850、800、750、700、650、600、550、500、450、400、350、300bpの大きさを有する。
「低分子干渉RNA」または「siRNA」は、関心がもたれる遺伝子にターゲティングされたRNA二本鎖のヌクレオチドである。RNA二本鎖は、RNA分子の2領域の間の相補的対形成によって形成される構造を表す。siRNAは、その二本鎖部分のヌクレオチド配列が、ターゲティングされた遺伝子のヌクレオチド配列と相補的であるような遺伝子にターゲティングされる。いくつかの態様では、siRNAの二本鎖長は、ヌクレオチド15個からヌクレオチド50個に及び、好ましくはヌクレオチド20個からヌクレオチド35個に及び、いっそうより好ましくはヌクレオチド21個からヌクレオチド29個に及ぶ。いくつかの態様では、二本鎖は、少なくとも15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、40、45、50ヌクレオチド長でありうる。いくつかの態様では、二本鎖は、最大で45、40、35、34、33、32、31、30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15ヌクレオチド長でありうる。siRNAのRNA二本鎖部分は、ヘアピン構造の部分でありうる。二本鎖部分に加えて、ヘアピン構造は、二本鎖を形成する二つの配列の間に位置するループ部分を含有しうる。ループは、様々な長さでありうる。いくつかの態様では、ループは5、6、7、8、9、10、11、12、または13ヌクレオチド長である。ヘアピン構造は、また、3または5オーバーハング部分を含有しうる。いくつかの態様では、オーバーハングは0、1、2、3、4、または5ヌクレオチド長の3’または5’オーバーハングである。
細胞および生物へのアンチセンス核酸の注入およびトランスフェクションが、主な送達方法である。しかし、一過性および安定トランスフェクションされた哺乳動物細胞においてアンチセンス核酸を連続的に発現させるために、発現ベクターも使用することができる。(例えば、Brummelkamp et al., 2002, Science, 296:550-553; Paddison et al., 2002, Genes & Dev, 16:948-958参照)。
アンチセンス核酸は、化学合成することができ、または例えばCaruthers et al., 1992, Methods in Enzymology, 211:3-19;国際PCT公報である国際公開公報第99/54459号; Brennan et al., 1998, Biotechnol Bioeng. 61:33-45、および米国特許第6,001,311号に記載されている当技術分野において公知のプロトコールを用いて、一本鎖DNA発現ベクターもしくはその同等物の使用により発現させることができる。非限定的な一例では、394 Applied Biosystems, Inc.合成装置で小規模合成を行う。または本発明のアンチセンス核酸分子を別々に合成し、合成後に、例えばライゲーションによって一緒につなぎ合わせることができる(国際PCT公報である国際公開公報第93/23569号、Bellon et al., 1997, Bioconjugate Chem, 8:204)。
本発明のアンチセンス核酸は、標的遺伝子、例えばTAMレセプターまたはGas6タンパク質の発現を少なくとも10、20、30、40%、より好ましくは少なくとも50、60、70%、最も好ましくは少なくとも75、80、85、90、95、96、97、98、99、100%低下させることができうる。
「変異型TAMレセプター」または「変異型Gas6タンパク質」または「変異型TIMレセプター」は、それぞれTAMレセプターまたはGas6タンパク質またはTIMレセプターと1個または数個のアミノ酸が異なるレセプターまたはタンパク質を意味する。例えば、該変異型TAMレセプターは、例えば突然変異E63R、E66RもしくはT847Rを保有する配列番号7もしくは8の配列のAXLレセプターのように、もはやGas6タンパク質と結合できない点で、または例えば突然変異K558Mを保有する配列番号7の配列のAXLレセプターもしくは突然変異K567Mを保有する配列番号8の配列のAXLレセプターのように、もはやそのキナーゼ活性を有することができない点で、TAMレセプターと異なりうる。例えば、該変異型Gas6タンパク質は、もはやホスファチジルセリンおよび/またはTAMレセプターに結合できない点でGas6タンパク質と異なりうる。例えば、該変異型Gas6タンパク質は、配列番号19の配列のGas6Δgla(rmGas6Δglaとも呼ばれる)でありうる。例えば、該変異型TIMレセプターは、もはやホスファチジルセリンに結合できない点で、またはもはやそのキナーゼ活性を有することができない点で、TIMレセプターと異なりうる。
用語「対象」、「個体」または「宿主」は、互換的に使用され、例えばヒトまたは非ヒト哺乳動物でありうる。例えば対象は、コウモリ;フェレット;ウサギ;ネコ科動物(ネコ);イヌ科動物(イヌ);霊長類(サル)、ウマ科動物(ウマ);男性、女性、子供を含めたヒトである。
ホスファチジルセリンとTAMレセプターとの間の相互作用の阻害剤
ホスファチジルセリンは、リン酸基がセリンアミノ酸と結合しているリン脂質であって、CAS番号8002−43−5で参照されるリン脂質である。
ホスファチジルセリンは、リン酸基がセリンアミノ酸と結合しているリン脂質であって、CAS番号8002−43−5で参照されるリン脂質である。
「TAMレセプター」は、Tyro3/Axl/Merファミリーのチロシンキナーゼレセプターを意味する。好ましい態様では、該TAMレセプターはTYRO−3、AXLまたはMERレセプターである。
好ましくは、TYRO−3レセプターは、
a)配列番号5の配列(NCBI参照配列NP_006284.2、2011年11月14日更新)、
b)配列番号6の配列の核酸(NCBI参照配列NM_006293.3、2012年1月14日更新)によってコードされる配列、
c)a)またはb)の配列と少なくとも80、85、90、95、96、97、98、99%同一な配列
を含む、またはそれから成る。
a)配列番号5の配列(NCBI参照配列NP_006284.2、2011年11月14日更新)、
b)配列番号6の配列の核酸(NCBI参照配列NM_006293.3、2012年1月14日更新)によってコードされる配列、
c)a)またはb)の配列と少なくとも80、85、90、95、96、97、98、99%同一な配列
を含む、またはそれから成る。
好ましくは、AXLレセプターは、
a)配列番号7の配列(NCBI参照配列NP_001690.2、2011年11月26日更新)、
b)配列番号8の配列(NCBI参照配列NP_068713.2、2011年11月26日更新)、
c)配列番号9の配列の核酸(NCBI参照配列NM_021913.3、2012年1月15日更新)によってコードされる配列、
d)配列番号10の配列の核酸(NCBI参照配列NM_001699.4、2012年1月15日更新)によってコードされる配列、
e)a)〜d)の配列と少なくとも80、85、90、95、96、97、98、99%同一な配列
を含む、またはそれから成る。
a)配列番号7の配列(NCBI参照配列NP_001690.2、2011年11月26日更新)、
b)配列番号8の配列(NCBI参照配列NP_068713.2、2011年11月26日更新)、
c)配列番号9の配列の核酸(NCBI参照配列NM_021913.3、2012年1月15日更新)によってコードされる配列、
d)配列番号10の配列の核酸(NCBI参照配列NM_001699.4、2012年1月15日更新)によってコードされる配列、
e)a)〜d)の配列と少なくとも80、85、90、95、96、97、98、99%同一な配列
を含む、またはそれから成る。
好ましくは、MERレセプターは、
a)配列番号11の配列(NCBI参照配列NP_006334.2、2011年12月24日更新)、
b)配列番号12の配列の核酸(NCBI参照配列NM_006343.2、2011年12月24日更新)によってコードされる配列、
c)a)またはb)の配列と少なくとも80、85、90、95、96、97、98、99%同一な配列
を含む、またはそれから成る。
a)配列番号11の配列(NCBI参照配列NP_006334.2、2011年12月24日更新)、
b)配列番号12の配列の核酸(NCBI参照配列NM_006343.2、2011年12月24日更新)によってコードされる配列、
c)a)またはb)の配列と少なくとも80、85、90、95、96、97、98、99%同一な配列
を含む、またはそれから成る。
Gas6タンパク質は、ホスファチジルセリンとTAMレセプターとの間の相互作用を媒介する架橋分子である。
好ましくは、Gas6タンパク質は、
a)配列番号13の配列(NCBI参照配列NP_000811.1、2011年12月24日更新)、
b)配列番号14の配列(NCBI参照配列NP_001137417.1、2011年12月24日更新)、
c)配列番号15の配列(NCBI参照配列NP_001137418.1、2011年12月24日更新)、
d)配列番号16の配列の核酸(NCBI参照配列NM_000820.2、2012年1月15日更新)によってコードされる配列、
e)配列番号17の配列の核酸(NCBI参照配列NM_001143945.1、2012年1月15日更新)によってコードされる配列、
f)配列番号18の配列の核酸(NCBI参照配列NM_001143946.1、2012年1月15日更新)によってコードされる配列、
g)a)〜f)の配列と少なくとも80、85、90、95、96、97、98、99%同一な配列
を含む、またはそれから成る。
a)配列番号13の配列(NCBI参照配列NP_000811.1、2011年12月24日更新)、
b)配列番号14の配列(NCBI参照配列NP_001137417.1、2011年12月24日更新)、
c)配列番号15の配列(NCBI参照配列NP_001137418.1、2011年12月24日更新)、
d)配列番号16の配列の核酸(NCBI参照配列NM_000820.2、2012年1月15日更新)によってコードされる配列、
e)配列番号17の配列の核酸(NCBI参照配列NM_001143945.1、2012年1月15日更新)によってコードされる配列、
f)配列番号18の配列の核酸(NCBI参照配列NM_001143946.1、2012年1月15日更新)によってコードされる配列、
g)a)〜f)の配列と少なくとも80、85、90、95、96、97、98、99%同一な配列
を含む、またはそれから成る。
いくつかの態様では、TAMレセプター阻害剤は、抗TAMレセプター抗体、アンチセンス核酸、模倣体または変異型TAMレセプターである。
好ましくは、該TAMレセプター阻害剤はアンチセンス核酸であり、より好ましくは、該TAMレセプター阻害剤はsiRNAである。該アンチセンス核酸は、配列番号5、7、8、もしくは11の配列のTAMレセプターまたは配列番号6、9、10、もしくは12の核酸によってコードされる配列のTAMレセプターの発現を阻害または減少させることができる配列を含むまたはそれから成りうる。該アンチセンス核酸は、TAMレセプターまたはそのフラグメントをコードする核酸、例えば配列番号6、9、10、または12の配列の核酸に相補的な配列を含むまたはそれから成りうる。一態様では、該siRNAは、配列番号1、2、3、または4の配列の少なくとも1種のsiRNAを含むまたはそれから成る。一態様では、該siRNAは、配列番号1、2、3、および4から成る群より選択される少なくとも2、3、または4種のsiRNAを含むまたはそれから成る。一態様では、該siRNAは、配列番号1、2、3、および4から成る群より選択される最大で4、3、または2種のsiRNAを含むまたはそれから成る。一態様では、該siRNAは、配列番号1、2、3、および4の配列の4種のsiRNAを含むまたはそれから成る。
好ましくは、該模倣体は、TAMレセプターの細胞外ドメインを含むまたはそれから成る。例えば、該模倣体は、配列番号7または配列番号8のアミノ酸26〜451番を含むまたはそれから成りうる。
いっそうより好ましくは、該模倣体は、可溶性形態のTAMレセプター細胞外ドメインを含むまたはそれから成る。例えば該模倣体は、配列番号5のアミノ酸41〜428番の配列、または配列番号7もしくは配列番号8のアミノ酸33〜440番の配列を含むまたはそれから成りうる。
好ましくは、該抗TAMレセプター抗体は、Gas6タンパク質へのTAMレセプターの結合部位に対する抗体である。好ましくは、該抗TAMレセプター抗体は、配列番号7または配列番号8の配列のアミノ酸63〜84番に対するものである。
いくつかの態様では、Gas6阻害剤は、抗Gas6抗体、アンチセンス核酸、模倣体または変異型Gas6タンパク質である。
好ましくは、該Gas6阻害剤はアンチセンス核酸であり、より好ましくは該Gas6阻害剤はsiRNAである。該アンチセンス核酸は、配列番号13、14、もしくは15の配列のGas6タンパク質または配列番号16、17、もしくは18の核酸によってコードされる配列のGas6タンパク質の発現を阻害または減少させることができる配列を含むまたはそれから成りうる。該アンチセンス核酸は、Gas6またはそのフラグメントをコードする核酸、例えば配列番号16、17、または18の配列の核酸に相補的な配列を含むまたはそれから成りうる。
好ましくは、該Gas6阻害剤は、配列番号19の配列の変異型Gas6タンパク質Gas6ΔGlaである。
好ましくは、該Gas−6模倣体は、配列番号13の残基53〜94番のアミノ酸配列を含むもしくはそれから成りうるホスファチジルセリン認識部位を含むもしくはそれから成り、または該模倣体は、配列番号13の残基298〜670番のアミノ酸配列を含むもしくはそれから成りうるレセプター結合部位を含むもしくはそれから成る。
好ましくは、該抗Gas6抗体は、TAMレセプターへのGas6タンパク質の結合部位に対する抗体である。好ましくは、該抗Gas6抗体は、配列番号13の配列のアミノ酸304〜312番、配列番号14の配列のアミノ酸31〜39番、または配列番号15の配列のアミノ酸5〜13番に対するものである。
ホスファチジルセリン結合タンパク質は、ホスファチジルセリンに結合することができるが、Gas6タンパク質に結合できないタンパク質でありうる。好ましくは、該ホスファチジルセリン結合タンパク質は、抗ホスファチジルセリン抗体またはアネキシンVである。
好ましくは、該抗ホスファチジルセリン抗体は、Gas6タンパク質へのホスファチジルセリンの結合部位に対する抗体である。例えば該抗体は、抗ホスファチジルセリン抗体クローン1H6(Upstate(登録商標))でありうる。
好ましくは、該アネキシンVタンパク質は、
a)配列番号20の配列(NCBI参照配列NP_001145.1、2012年2月1日更新)、
b)配列番号21の配列の核酸(NCBI参照配列NM_001154.3、2011年12月18日更新)によってコードされる配列、
c)a)またはb)の配列と少なくとも80、85、90、95、96、97、98、99%同一な配列
を含むまたはそれから成る。
a)配列番号20の配列(NCBI参照配列NP_001145.1、2012年2月1日更新)、
b)配列番号21の配列の核酸(NCBI参照配列NM_001154.3、2011年12月18日更新)によってコードされる配列、
c)a)またはb)の配列と少なくとも80、85、90、95、96、97、98、99%同一な配列
を含むまたはそれから成る。
抗ウイルス化合物
好ましい一態様では、本発明による阻害剤は、少なくとも1種の他の抗ウイルス化合物と組み合わせて、経時または同時のいずれかでの投与用である。
好ましい一態様では、本発明による阻害剤は、少なくとも1種の他の抗ウイルス化合物と組み合わせて、経時または同時のいずれかでの投与用である。
経時的投与は、異なる(それでもなお重複しうる)時間または時点で成分が投与されることを示す。同時投与は、成分が同時に投与されることを示す。
抗ウイルス化合物には、非限定的にノイラミニダーゼ阻害剤、ウイルス融合阻害剤、プロテアーゼ阻害剤、DNAポリメラーゼ阻害剤、シグナル伝達阻害剤、逆転写酵素阻害剤、インターフェロン、ヌクレオシドアナログ、インテグラーゼ阻害剤、チミジンキナーゼ阻害剤、ウイルス糖または糖タンパク質合成阻害剤、ウイルス構造タンパク質合成阻害剤、ウイルス付着および吸着阻害剤、ウイルス侵入阻害剤およびそれらの機能的アナログが含まれうる。
ノイラミニダーゼ阻害剤には、オセルタミビル、ザナミビルおよびペラミビルが含まれうる。ウイルス融合阻害剤には、シクロスポリン、マラビロク、エンフビルチド(enfuviritide)およびドコサノールが含まれうる。
プロテアーゼ阻害剤には、サキナビル、インジナビル、アンプレナビル、ネルフィナビル、リトナビル、チプラナビル、アタザナビル、ダルナビル、ザナミビルおよびオセルタミビルが含まれうる。
DNAポリメラーゼ阻害剤には、イドクスウリジン、ビダラビン、ホスホノ酢酸、トリフルリジン、アシクロビル、ホスカルネット(forscarnet)、ガンシクロビル、ペンシクロビル、シドクロビル(cidoclovir)、ファムシクロビル、バラシクロビルおよびバルガンシクロビルが含まれうる。
シグナル伝達阻害剤には、レスベラトロールおよびリバビリンが含まれる。ヌクレオシド逆転写酵素阻害剤(NRTI)には、ジドブジン(ZDV、AZT)、ラミブジン(3TC)、スタブジン(d4T)、ザルシタビン(ddC)、ジダノシン(2’,3’−ジデオキシイノシン、ddI)、アバカビル(ABC)、エミリビン(emirivine)(FTC)、テノホビル(TDF)、デラビルジン(delaviradine)(DLV)、フゼオン(T−20)、インジナビル(IDV)、ロピナビル(LPV)、アタザナビル、コンビビル(ZDV/3TC)、カレトラ(RTV/LPV)、アデホビルジピボキシルおよびトリジビル(ZDV/3TC/ABC)が含まれうる。非ヌクレオシド系逆転写酵素阻害剤(NNRTI)には、ネビラピン、デラビルジン、UC−781(チオカルボキサニリド)、ピリジノン、TIBO、カラノリドA、カプラビリンおよびエファビレンツが含まれうる。
ウイルス侵入阻害剤には、フゼオン(T−20)、NB−2、NB−64、T−649、T−1249、SCH−C、SCH−D、PRO140、TAK779、TAK−220、RANTESアナログ、AK602、UK−427,857、関連レセプターに対するモノクローナル抗体、シアノビリン−N、シクロデキストリン、カラゲナン(carregeenan)、硫酸化またはスルホン化ポリマー、マンデル酸縮合ポリマー、AMD−3100、およびその機能的アナログが含まれうる。
好ましくは、該少なくとも1種の他の抗ウイルス化合物は、ホスファチジルセリンとTIMレセプターとの間の相互作用の阻害剤である。
「TIMレセプター」は、TIM−1、TIM−3またはTIM−4レセプターを意味する。
いくつかの態様では、TIM−1レセプターは、
a)配列番号22の配列(GenBank番号AAH13325.1、2003年10月4日更新)、
b)配列番号23の核酸(NCBI参照配列NM_012206.2、2011年11月26日更新)によってコードされる配列、
c)配列番号24の核酸(NCBI参照配列NM_001099414.1、2011年11月26日更新)によってコードされる配列、
d)配列番号25の核酸(NCBI参照配列NM_001173393.1、2011年12月4日更新)によってコードされる配列、
e)a)〜d)の配列と少なくとも80、85、90、95、96、97、98、99%同一な配列
を含むまたはそれから成る。
a)配列番号22の配列(GenBank番号AAH13325.1、2003年10月4日更新)、
b)配列番号23の核酸(NCBI参照配列NM_012206.2、2011年11月26日更新)によってコードされる配列、
c)配列番号24の核酸(NCBI参照配列NM_001099414.1、2011年11月26日更新)によってコードされる配列、
d)配列番号25の核酸(NCBI参照配列NM_001173393.1、2011年12月4日更新)によってコードされる配列、
e)a)〜d)の配列と少なくとも80、85、90、95、96、97、98、99%同一な配列
を含むまたはそれから成る。
いくつかの態様では、TIM−3レセプターは、
a)配列番号26の配列(GenBank番号AAH20843.1、2003年9月16日更新)、
b)配列番号27の配列(GenBank番号AAH63431.1、2006年7月15日更新)、
c)配列番号28の核酸(NCBI参照配列NM_032782.4、2011年12月25日更新)によってコードされる配列、
d)a)〜c)の配列と少なくとも80、85、90、95、96、97、98、99%同一な配列
を含むまたはそれから成る。
a)配列番号26の配列(GenBank番号AAH20843.1、2003年9月16日更新)、
b)配列番号27の配列(GenBank番号AAH63431.1、2006年7月15日更新)、
c)配列番号28の核酸(NCBI参照配列NM_032782.4、2011年12月25日更新)によってコードされる配列、
d)a)〜c)の配列と少なくとも80、85、90、95、96、97、98、99%同一な配列
を含むまたはそれから成る。
いくつかの態様では、TIM−4レセプターは、
a)配列番号29の配列(NCBI参照配列NP_612388.2、2011年12月24日更新)、
b)配列番号30の配列(NCBI参照配列NP_001140198.1、2011年12月25日更新)、
c)配列番号31の核酸(NCBI参照配列NM_138379.2、2011年12月24日更新)によってコードされる配列、
d)配列番号32の核酸(NCBI参照配列NM_001146726.1、2011年12月25日更新)によってコードされる配列、
e)a)〜d)の配列と少なくとも80、85、90、95、96、97、98、99%同一な配列
を含むまたはそれから成る。
a)配列番号29の配列(NCBI参照配列NP_612388.2、2011年12月24日更新)、
b)配列番号30の配列(NCBI参照配列NP_001140198.1、2011年12月25日更新)、
c)配列番号31の核酸(NCBI参照配列NM_138379.2、2011年12月24日更新)によってコードされる配列、
d)配列番号32の核酸(NCBI参照配列NM_001146726.1、2011年12月25日更新)によってコードされる配列、
e)a)〜d)の配列と少なくとも80、85、90、95、96、97、98、99%同一な配列
を含むまたはそれから成る。
いくつかの態様では、該ホスファチジルセリンとTIMレセプターとの相互作用の阻害剤は、TIMレセプター阻害剤である。好ましくは、該TIMレセプター阻害剤は、抗TIMレセプター抗体、アンチセンス核酸、模倣体または変異型TIMレセプターである。好ましくは、該TIMレセプター阻害剤はアンチセンス核酸であり、より好ましくは該TIMレセプター阻害剤はsiRNAである。該アンチセンス核酸は、配列番号22、26、27、29、もしくは30の配列のTIMレセプターまたは配列番号23、24、25、28、31、もしくは32の核酸によってコードされる配列のTIMレセプターの発現を阻害または減少させることができる配列を含むまたはそれから成りうる。該アンチセンス核酸は、TIMレセプターをコードする核酸、例えば配列番号23、24、25、28、31、もしくは32の配列の核酸に相補的な配列を含むまたはそれから成りうる。一態様では、該TIMレセプター阻害剤は、配列番号33、34、35または36の配列の少なくとも1種のsiRNAを含むまたはそれから成る。一態様では、該siRNAは、配列番号33、34、35、および36からなる群より選択される少なくとも2、3、または4種のsiRNAを含むまたはそれから成る。一態様では、該siRNAは、配列番号33、34、35、および36から成る群より選択される最大で4、3、2、または1種のsiRNAを含むまたはそれから成る。一態様では、該siRNAは、配列番号33、34、35、および36の配列の4種のsiRNAを含むまたはそれから成る。
好ましくは、該抗TIMレセプター抗体は、Kondratowicz et al., 2011, PNAS, 108:8426-8431に記載されている抗TIM1レセプター抗体ARD5またはSonar et al., 2010, The Journal of Clinical investigation, 120: 2767-2781に記載されている抗TIM1抗体A6G2である。
好ましくは、該模倣体は、TIMレセプターの細胞外ドメインを含むまたはそれから成る。例えば該模倣体は、配列番号22のTIM−1についての残基21〜295番のアミノ酸配列を含むもしくはそれから成りうるか、該模倣体は、配列番号37のTIM−1についての残基21〜290番のアミノ酸配列を含むもしくはそれから成りうるか、または該模倣体は、配列番号29のTIM−4についての残基25〜314番のアミノ酸配列を含むもしくはそれから成りうる。
好ましくは、該抗TIMレセプター抗体は、ホスファチジルセリンへのTIMレセプターの結合部位に対する抗体である。好ましくは、該ホスファチジルセリンへのTIMレセプターの結合部位に対する抗体は、TIMレセプターの金属イオン依存性リガンド結合部位(MILIB)に対するものである。いっそうより好ましくは、該抗TIMレセプターは、配列番号22の配列のアミノ酸111〜115番、または配列番号29もしくは配列番号30の配列のアミノ酸119〜122番に対するものである。
細胞へのホスファチジルセリン保有ウイルスの侵入を阻害するための方法
本発明による阻害剤は、細胞へのPtdSer保有ウイルスの侵入を阻害する方法に使用することができる。
本発明による阻害剤は、細胞へのPtdSer保有ウイルスの侵入を阻害する方法に使用することができる。
該方法は、in vitroもしくはex vivo方法、または本明細書記載のPtdSer保有ウイルス感染の予防もしくは治療方法でありうる。
したがって、本発明は、細胞へのPtdSer保有ウイルスの侵入を阻害するためのin vitroまたはin vivo方法における、本明細書に定義される阻害剤の使用を提供する。細胞へのPtdSer保有ウイルスの侵入を阻害するためのin vitroまたはin vivo方法における使用のための本明細書に定義される阻害剤も提供される。
いくつかの態様では、該阻害剤は、本明細書上述に定義される少なくとも1種の他の抗ウイルス化合物と組み合わせた使用である。
該方法は、例えば該阻害剤に該細胞および/または該PtdSer保有ウイルスを曝露することを含みうる。方法がin vivo方法の場合、その方法は、該阻害剤を対象、好ましくはそれを必要とする患者に投与することを含みうる。
いくつかの態様では、該細胞は、樹状細胞、内皮細胞、星状膠細胞、肝細胞、ニューロン、クッパー細胞、および/またはマクロファージでありうる。
薬学的組成物
本発明による阻害剤は、単独で、または少なくとも1種の他の抗ウイルス化合物と組み合わせて、薬学的に許容されうる組成物に製剤化することができる。
本発明による阻害剤は、単独で、または少なくとも1種の他の抗ウイルス化合物と組み合わせて、薬学的に許容されうる組成物に製剤化することができる。
したがって本発明は、本発明による阻害剤および追加的に少なくとも1種の他の抗ウイルス化合物を含む薬学的組成物を提供する。
該少なくとも1種の他の抗ウイルス化合物は、上記に定義された化合物でありうる。
一態様では、該阻害剤は、配列番号1、2、3、および4の配列のsiRNAから成る群より選択される少なくとも1、2、3、もしくは4種、または最大で4、3、2、もしくは1種のsiRNA、ならびに/あるいは本明細書上述に定義されるアネキシンVを含むまたはそれから成り、少なくとも1種の他の抗ウイルス化合物は、配列番号33、34、35、および36の配列のsiRNAから成る群より選択される少なくとも1、2、3、もしくは4種、または最大で4、3、2、もしくは1種のsiRNAならびに/あるいは本明細書上述に定義される配列番号19の配列の変異型Gas6タンパク質Gas6Δglaを含むまたはそれから成る。一態様では、該阻害剤は、配列番号1、2、3、および4の配列の4種のsiRNAならびに/または本明細書上述に定義されるアネキシンVを含むまたはそれから成り、少なくとも1種の他の抗ウイルス化合物は、配列番号33、34、35、および36の配列の4種のsiRNAならびに/または本明細書上述に定義される配列番号19の配列の変異型Gas6タンパク質Gas6Δglaを含むまたはそれから成る。
本発明による薬学的組成物は、適切な薬学的単位投与剤形の形態で経口投与することができる。本発明の薬学的組成物は、錠剤、ゼラチン硬または軟カプセル、液剤、懸濁剤、ならびにリポゾームおよび成形ポリマーゲル剤などの他の徐放製剤が含まれる多数の剤形に調製することができる。
投薬様式および投与剤形は、所与の処置適用に望ましく有効な治療剤または組成物の性質に密接に関係する。適切な投薬剤形には、非限定的に、経口、静脈内、直腸、舌下、粘膜、経鼻、眼、皮下、筋肉内、経皮、脊髄、髄腔内、関節内、動脈内、クモ膜下、気管支、およびリンパ投与、ならびに活性成分の全身送達のための他の投薬剤形が含まれる。
本発明の薬学的組成物は、非限定的に、経皮(パッチ、ゲル、クリーム、軟膏またはイオン泳動による受動的);静脈内(ボーラス、注入);皮下(注入、デポー);経粘膜(バッカルおよび舌下、例えば口腔内分散錠(orodispersible tablet)、ウエファース、フィルム、および発泡製剤;結膜(点眼剤);直腸(坐剤、浣腸));または皮内(ボーラス、注入、デポー)を含めた当技術分野において公知の任意の方法により投与することができる。
経口液体薬学的組成物は、例えば、水性もしくは油性懸濁剤、液剤、乳剤、シロップ剤もしくはエリキシル剤の形態の場合があり、または使用前に水もしくは他の適切なビヒクルで構成するための乾燥製品として提示される場合がある。そのような液体薬学的組成物は、懸濁化剤、乳化剤、非水性ビヒクル(食用油が含まれうる)、または保存料などの通常の添加剤を含有しうる。
本発明の薬学的組成物は、また、非経口投与(例えば注射、例えばボーラス注射または連続注入による)用に製剤化される場合があり、アンプル、プレフィルドシリンジ、少量注入容器中の単位投与剤形で、または保存料を添加された多回容器に入れて提示される場合がある。薬学的組成物は、油性または水性ビヒクル中の懸濁剤、液剤、または乳剤などの形態を取る場合があり、懸濁化剤、安定化剤および/または分散剤などの製剤化剤(formulating agent)を含有しうる。または、本発明の薬学的組成物は、無菌固体の無菌的単離または溶液からの凍結乾燥によって得られた、使用前に適切なビヒクル、例えば無菌無発熱物質水で構成するための粉末形態でありうる。
直腸投与に適した、担体が固体の薬学的組成物は、最も好ましくは単位用量坐剤として提示される。適切な担体には、カカオ脂および当技術分野において一般に使用されている他の物質が含まれ、坐剤は、薬学的組成物を軟化または融解した担体(1種または複数)と混合し、続いて冷却し、型に入れて成形することによって好都合に形成することができる。
吸入による投与のために、本発明による薬学的組成物は、吹入器、ネブライザーもしくは加圧パック、またはエアロゾルスプレーを送達する他の好都合な手段から好都合に送達される。加圧パックは、ジクロロジフルオロメタン、トリクロロフルオロメタン、ジクロロテトラフルオロエタン、二酸化炭素または他の適切な気体などの適切な噴射剤を含みうる。加圧エアロゾルの場合、投薬単位は、定量を送達するためにバルブを提供することによって決定することができる。または、吸入または吹入による投与のために、本発明の薬学的組成物は、乾燥粉末組成物、例えば薬学的組成物と乳糖またはデンプンなどの適切な粉末基剤との粉末混合物の形態を取りうる。粉末組成物は、例えば、カプセルまたはカートリッジまたは例えば吸入器もしくは吹入器の助けを借りて粉末を投与することができるゼラチンもしくはブリスターパックに入れた単位投薬剤形で提示することができる。
鼻腔内投与のために、本発明の薬学的組成物は、プラスチックボトルアトマイザーなどの液体スプレーを介して投与することができる。これらのうちMistometerg(イソプロテレノール吸入器、Wintrop)およびMedihaler(登録商標)(イソプロテレノール吸入器、Riker)が典型的である。
アンチセンス核酸の投与のために、本発明の薬学的組成物は、リポゾーム、ミクロパーティクル、ミクロカプセル、脂質系担体システム内への被包が含まれる形態に調製することができる。本発明における使用に適する代替的な脂質系担体システムの非限定的な例には、ポリカチオンポリマー核酸複合体(例えば米国特許出願公開第20050222064号参照)、シクロデキストリンポリマー核酸複合体(例えば米国特許出願公開第20040087024号参照)、生分解性ポリ3アミノエステルポリマー核酸複合体(例えば米国特許出願公開第20040071654号参照)、pH感受性リポゾーム(例えば米国特許出願公開第20020192274号参照)、アニオン系リポゾーム(例えば米国特許出願公開第20030026831号参照)、カチオン系リポゾーム(例えば米国特許出願公開第20030229040号参照)、可逆マスクリポプレックス(reversibly masked lipoplex)(例えば米国特許出願公開20030180950号参照)、細胞型特異的リポゾーム(例えば米国特許出願公開20030198664号参照)、ポリマーマトリックス含有ミクロパーティクル(例えば米国特許出願公開20040142475号参照)、pH感受性リポプレックス(例えば米国特許出願公開20020192275号参照)、遊離可能な親水性ポリマーで誘導体化された脂質を含有するリポゾーム(例えば米国特許出願公開第20030031704号参照)、脂質に封入された核酸(例えばPCT特許公報である国際公開公報第03/057190号参照)、脂質に被包された核酸(例えば米国特許出願公開第20030129221号参照)、ポリカチオン系ステロール誘導体核酸複合体(例えば米国特許第6,756,054号参照)、他のリポソーム組成物(例えば米国特許出願公開第20030035829号参照)、他のミクロパーティクル組成物(例えば米国特許出願公開第20030157030号参照)、ポリプレックス(例えばPCT特許公報である国際公開公報第03/066069号参照)、エマルション組成物(例えば米国特許第6,747,014号参照)、縮合核酸複合体(例えば米国特許出願公開第20050123600号参照)、他のポリカチオン系核酸複合体(例えば米国特許出願公開第20030125281号参照)、ポリビニルエーテル核酸複合体(例えば米国特許出願公開第20040156909号参照)、多環状アミジニウム核酸複合体(例えば米国特許出願公開第20030220289号参照)、ナノカプセルおよびミクロカプセル組成物(例えばPCT特許公報である国際公開公報第02/096551号参照)、リポゾームとエマルションとの安定化混合物(例えばEP1304160参照)、ポルフィリン核酸複合体(例えば米国特許第6,620,805号参照)、脂質核酸複合体(例えば米国特許出願公開第20030203865号参照)、核酸ミクロエマルション(例えば米国特許出願公開第20050037086号参照)、カチオン脂質系組成物(例えば米国特許出願公開第20050234232号参照)が含まれる。当業者は、本発明の改変siRNAがネイキッドなsiRNA分子としても送達できることを認識している。
本発明の薬学的組成物は、また、着香料、着色料、抗菌剤、または保存料などの他の佐剤を含有する場合がある。
さらに、処置への使用に必要とされる薬学的組成物の量は、選択された治療剤だけでなく、投与経路、処置される状態の性質ならびに患者の年齢および状態に応じて変動し、最終的に主治医または臨床医の判断に任されることが、認識されている。
投与および処置方法
本発明は、また、本発明による阻害剤の治療有効量を投与することを含む、それを必要とする個体におけるPtdSer保有ウイルス感染を予防または治療するための方法に関する。
本発明は、また、本発明による阻害剤の治療有効量を投与することを含む、それを必要とする個体におけるPtdSer保有ウイルス感染を予防または治療するための方法に関する。
「治療」は治療的使用(すなわち所与の疾患を有する患者に対する)を意味し、「予防」は予防的使用(すなわち所与の疾患を発生しやすい個体に対する)を意味する。用語「治療」には、疾患の完全治癒に至る治療だけでなく、疾患の進行を減速する、および/または患者の生存期間を延長する治療も含まれる。
「有効量」は、所望の治療的または予防的結果を達成するために必要な薬用量および時間で有効な量を表す。
本発明の阻害剤の治療有効量は、病状、年齢、性別、および個体の体重、ならびにタンパク質が所望の治療的結果を誘起する能力などの要因に応じて変動しうる。治療有効量は、阻害剤の任意の毒性作用または有害作用に治療的有益効果が勝る量を包含する。治療有効量は、また、有益性、例えば臨床的有益性を付与するために十分な量を包含する。
本発明に関連して、「ホスファチジルセリン保有ウイルス感染を予防する」は、PtdSer保有ウイルスの感染または宿主細胞への侵入の予防を意味しうる。
本発明に関連して、「ホスファチジルセリン保有ウイルス感染を治療する」は、ホスファチジルセリン保有ウイルスの感染または宿主細胞への侵入を後退、軽減、または阻害することを意味しうる。
本発明に関連して、ホスファチジルセリン保有ウイルス感染は、少なくとも30、35、40、45、50、55、60、65、70、80、85、90、91、92、93、94、95、96、97、98、99、100%減少しうる。
いくつかの態様では、本発明の方法は、上記に定義される少なくとも1種の他の抗ウイルス化合物と組み合わせて上記に定義される阻害剤を経時または同時のいずれかでの投与することを含む。例えば、該少なくとも1種の他の抗ウイルス化合物は、本明細書上述に定義されるホスファチジルセリンとTIMレセプターとの間の相互作用の阻害剤である。
別の態様では、該方法は、本発明による薬学的組成物の投与を含む。
投与方法は全身方式でありうる。投薬様式および投与剤形は、所与の処置適用に望ましく有効な治療剤または組成物の性質に密接に関係する。適切な投与剤形および投薬経路には、非限定的に、経口、静脈内、直腸、舌下、粘膜、経鼻、眼、皮下、筋肉内、経皮、脊髄、髄腔内、関節内、動脈内、クモ膜下、気管支、およびリンパ投与、ならびに/または活性成分の全身送達のための他の投薬剤形および投与経路が含まれる。好ましい一態様では、投与剤形は非経口投与用である。
投与方法は、例えば少なくとも5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100日間でありうる。
用量範囲は、0.1mg/kg/日から100mg/kg/日の間でありうる。より好ましくは、用量範囲は0.5mg/kg/日から100mg/kg/日の間である。最も好ましくは、用量範囲は1mg/kg/日から80mg/kg/日の間である。最も好ましくは、用量範囲は5mg/kg/日から50mg/kg/日の間または10mg/kg/日から40mg/kg/日の間である。
いくつかの態様では、用量は、少なくとも0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.5、2、2.5、3、3.5、4、4.5、5、6、7、8、9、10、15、20、25、30、35、40、45、50mg/kg/日でありうる。いくつかの態様では、用量は最大で50、45、40、35、30、25、20、25、15、10、5、1、0.5、0.1mg/kg/日でありうる。
用量範囲は、また、10から10000UI/kg/日の間でありうる。より好ましくは、用量範囲は50から5000UI/kg/日の間または100から1000UI/kg/日の間である。
いくつかの態様では、用量は、少なくとも10、25、50、75、100、150、200、250、300、350、400、450、500、600、700、800、900、1000、1500、2000、2500、3000、3500、4000、4500、5000、5500、6000、6500、7000、7500、8000、8500、9000、9500、10000UI/kg/日でありうる。いくつかの態様では、用量は最大で10000、9500、9000、8500、8000、7500、7000、6500、6000、5500、5000、4500、4000、3500、3000、2500、2000、1500、1000、900、800、600、500、450、400、350、300、250、200、150、100UI/kg/日でありうる。
以下の図面および実施例を参照して、これから本発明をより詳細に説明する。本明細書に引用される全ての文献および特許文書は、本明細書によって参照により組み入れられる。
配列リスト
配列番号1にAXLに対するsiRNAの配列5’−ACAGCGAGAUUUAUGACUA−3’を示す。
配列番号2にAXLに対するsiRNAの配列5’−GGUACCGGCUGGCGUAUCA−3’を示す。
配列番号3にAXLに対するsiRNAの配列5’−GACGAAAUCCUCUAUGUCA−3’を示す。
配列番号4にAXLに対するsiRNAの配列5’−GAAGGAGACCCGUUAUGGA−3’を示す。
配列番号5にNCBI参照配列NP_006284.2で参照されるTYRO−3レセプターのアミノ酸配列を示す。
配列番号6にNCBI参照配列NM_006293.3で参照されるTYRO−3レセプターの核酸配列を示す。
配列番号7にNCBI参照配列NP_001690.2で参照されるAXLレセプターのアミノ酸配列を示す。
配列番号8にNCBI参照配列NP_068713.2で参照されるAXLレセプターのアミノ酸配列を示す。
配列番号9にNCBI参照配列NM_021913.3で参照されるAXLレセプターの核酸配列を示す。
配列番号10にNCBI参照配列NM_001699.4で参照されるAXLレセプターの核酸配列を示す。
配列番号11にNCBI参照配列NP_006334.2で参照されるMERレセプターのアミノ酸配列を示す。
配列番号12にNCBI参照配列NM_006343.2で参照されるMERレセプターの核酸配列を示す。
配列番号13にNCBI参照配列NP_000811.1で参照されるGas6タンパク質のアミノ酸配列を示す。
配列番号14にNCBI参照配列NP_001137417.1で参照されるGas6タンパク質のアミノ酸配列を示す。
配列番号15にNCBI参照配列NP_001137418.1で参照されるGas6タンパク質のアミノ酸配列を示す。
配列番号16にNCBI参照配列NM_000820.2で参照されるGas6タンパク質の核酸配列を示す。
配列番号17にNCBI参照配列NM_001143945.1で参照されるGas6タンパク質の核酸配列を示す。
配列番号18にNCBI参照配列NM_001143946.1で参照されるGas6タンパク質核酸配列を示す。
配列番号19に変異型Gas6ΔGlaタンパク質の配列を示す。
配列番号20にNCBI参照配列NP_001145.1で参照されるアネキシン5のアミノ酸配列を示す。
配列番号21にNCBI参照配列NM_001154.3で参照されるアネキシン5の核酸配列を示す。
配列番号22にGenBank番号AAH13325.1で参照されるTIM−1レセプターのアミノ酸配列を示す。
配列番号23にNCBI参照配列NM_012206.2で参照されるTIM−1レセプターの核酸配列を示す。
配列番号24にNCBI参照配列NM_001099414.1で参照されるTIM−1レセプターの核酸配列を示す。
配列番号25にNCBI参照配列NM_001173393.1で参照されるTIM−1レセプターの核酸配列を示す。
配列番号26にGenBank番号AAH20843.1で参照されるTIM−3レセプターのアミノ酸配列を示す。
配列番号27にGenBank番号AAH63431.1で参照されるTIM−3レセプターのアミノ酸配列を示す。
配列番号28にNCBI参照配列NM_032782.4で参照されるTIM−3レセプターの核酸配列を示す。
配列番号29にNCBI参照配列NP_612388.2で参照されるTIM−4レセプターのアミノ酸配列を示す。
配列番号30にNCBI参照配列NP_001140198.1で参照されるTIM−4レセプターのアミノ酸配列を示す。
配列番号31にNCBI参照配列NM_138379.2で参照されるTIM−4レセプターの核酸配列を示す。
配列番号32にNCBI参照配列NM_001146726.1で参照されるTIM−4レセプターの核酸配列を示す。
配列番号33にTIM−1に対するsiRNAの配列5’−AAACUCAACUGUUCCUACA−3’を示す。
配列番号34にTIM−1に対するsiRNAの配列5’−CGGAAGGACACACGCUAUA−3’を示す。
配列番号35にTIM−1に対するsiRNAの配列5’−GCAGAAACCCACCCUACGA−3’を示す。
配列番号36にTIM−1に対するsiRNAの配列5’−GGUCACGACUACUCCAAUU−3’を示す。
配列番号37にUniProt番号Q96D42で参照されるTIM−1レセプターのアミノ酸配列を示す。
配列番号1にAXLに対するsiRNAの配列5’−ACAGCGAGAUUUAUGACUA−3’を示す。
配列番号2にAXLに対するsiRNAの配列5’−GGUACCGGCUGGCGUAUCA−3’を示す。
配列番号3にAXLに対するsiRNAの配列5’−GACGAAAUCCUCUAUGUCA−3’を示す。
配列番号4にAXLに対するsiRNAの配列5’−GAAGGAGACCCGUUAUGGA−3’を示す。
配列番号5にNCBI参照配列NP_006284.2で参照されるTYRO−3レセプターのアミノ酸配列を示す。
配列番号6にNCBI参照配列NM_006293.3で参照されるTYRO−3レセプターの核酸配列を示す。
配列番号7にNCBI参照配列NP_001690.2で参照されるAXLレセプターのアミノ酸配列を示す。
配列番号8にNCBI参照配列NP_068713.2で参照されるAXLレセプターのアミノ酸配列を示す。
配列番号9にNCBI参照配列NM_021913.3で参照されるAXLレセプターの核酸配列を示す。
配列番号10にNCBI参照配列NM_001699.4で参照されるAXLレセプターの核酸配列を示す。
配列番号11にNCBI参照配列NP_006334.2で参照されるMERレセプターのアミノ酸配列を示す。
配列番号12にNCBI参照配列NM_006343.2で参照されるMERレセプターの核酸配列を示す。
配列番号13にNCBI参照配列NP_000811.1で参照されるGas6タンパク質のアミノ酸配列を示す。
配列番号14にNCBI参照配列NP_001137417.1で参照されるGas6タンパク質のアミノ酸配列を示す。
配列番号15にNCBI参照配列NP_001137418.1で参照されるGas6タンパク質のアミノ酸配列を示す。
配列番号16にNCBI参照配列NM_000820.2で参照されるGas6タンパク質の核酸配列を示す。
配列番号17にNCBI参照配列NM_001143945.1で参照されるGas6タンパク質の核酸配列を示す。
配列番号18にNCBI参照配列NM_001143946.1で参照されるGas6タンパク質核酸配列を示す。
配列番号19に変異型Gas6ΔGlaタンパク質の配列を示す。
配列番号20にNCBI参照配列NP_001145.1で参照されるアネキシン5のアミノ酸配列を示す。
配列番号21にNCBI参照配列NM_001154.3で参照されるアネキシン5の核酸配列を示す。
配列番号22にGenBank番号AAH13325.1で参照されるTIM−1レセプターのアミノ酸配列を示す。
配列番号23にNCBI参照配列NM_012206.2で参照されるTIM−1レセプターの核酸配列を示す。
配列番号24にNCBI参照配列NM_001099414.1で参照されるTIM−1レセプターの核酸配列を示す。
配列番号25にNCBI参照配列NM_001173393.1で参照されるTIM−1レセプターの核酸配列を示す。
配列番号26にGenBank番号AAH20843.1で参照されるTIM−3レセプターのアミノ酸配列を示す。
配列番号27にGenBank番号AAH63431.1で参照されるTIM−3レセプターのアミノ酸配列を示す。
配列番号28にNCBI参照配列NM_032782.4で参照されるTIM−3レセプターの核酸配列を示す。
配列番号29にNCBI参照配列NP_612388.2で参照されるTIM−4レセプターのアミノ酸配列を示す。
配列番号30にNCBI参照配列NP_001140198.1で参照されるTIM−4レセプターのアミノ酸配列を示す。
配列番号31にNCBI参照配列NM_138379.2で参照されるTIM−4レセプターの核酸配列を示す。
配列番号32にNCBI参照配列NM_001146726.1で参照されるTIM−4レセプターの核酸配列を示す。
配列番号33にTIM−1に対するsiRNAの配列5’−AAACUCAACUGUUCCUACA−3’を示す。
配列番号34にTIM−1に対するsiRNAの配列5’−CGGAAGGACACACGCUAUA−3’を示す。
配列番号35にTIM−1に対するsiRNAの配列5’−GCAGAAACCCACCCUACGA−3’を示す。
配列番号36にTIM−1に対するsiRNAの配列5’−GGUCACGACUACUCCAAUU−3’を示す。
配列番号37にUniProt番号Q96D42で参照されるTIM−1レセプターのアミノ酸配列を示す。
実施例
材料および方法
cDNAライブラリーのスクリーニング
cDNAの選別のために、バイオインフォマティクスアプローチに基づき、アレイ化された全長cDNAライブラリーから推定上の細胞レセプターをコードする1728種の遺伝子を選択した(Porcel et al., 2004, Genome Res, 14:463-471)。第1ラウンドについて、リポフェクタミンLTX(Life Technologies, Carlsbad, CA)を製造業者の説明書により使用して、個別のcDNA(1μg)8種のプール216個を293T細胞に一過性トランスフェクションした(24ウェルプレートの形式)。陽性対照として、等しい量のDC−SIGN cDNA希釈物(空のプラスミドの1/8)をトランスフェクションした。陰性対照として空のプラスミドを使用した。トランスフェクションの24時間後に、異所性発現したDC−SIGNの免疫染色によりトランスフェクション効率を評価した。次に、トランスフェクション後の293T細胞をDV2 JAM初代株(MOI=2)と共に48時間インキュベーションし、感染細胞のパーセントをフローサイトメトリーによって測定した。第2ラウンドでは、各陽性cDNAプールおよび対応する個別のcDNA8種(600ng)を293T細胞にトランスフェクションし、DV2 JAMを感染させて個別の陽性cDNAを特定した。
材料および方法
cDNAライブラリーのスクリーニング
cDNAの選別のために、バイオインフォマティクスアプローチに基づき、アレイ化された全長cDNAライブラリーから推定上の細胞レセプターをコードする1728種の遺伝子を選択した(Porcel et al., 2004, Genome Res, 14:463-471)。第1ラウンドについて、リポフェクタミンLTX(Life Technologies, Carlsbad, CA)を製造業者の説明書により使用して、個別のcDNA(1μg)8種のプール216個を293T細胞に一過性トランスフェクションした(24ウェルプレートの形式)。陽性対照として、等しい量のDC−SIGN cDNA希釈物(空のプラスミドの1/8)をトランスフェクションした。陰性対照として空のプラスミドを使用した。トランスフェクションの24時間後に、異所性発現したDC−SIGNの免疫染色によりトランスフェクション効率を評価した。次に、トランスフェクション後の293T細胞をDV2 JAM初代株(MOI=2)と共に48時間インキュベーションし、感染細胞のパーセントをフローサイトメトリーによって測定した。第2ラウンドでは、各陽性cDNAプールおよび対応する個別のcDNA8種(600ng)を293T細胞にトランスフェクションし、DV2 JAMを感染させて個別の陽性cDNAを特定した。
Elisa結合アッセイ
96ウェルMaxisorp NUNC-IMMUNOプレート(NUNC, Roskidle, Denmark)に二つ組でDVウイルス粒子(107FIU)を4℃で一晩被覆した。37℃のPBS CaCl2/MgCl2中に入れた2%のBSAで1時間ブロッキング後、0.05% Tweenおよび10mM CaCl2を補充したTBS中でウェルをrGas6タンパク質(2μg/ml)と共に37℃で1時間インキュベーションした。ウェルを徹底的に洗浄し、結合しているGas6タンパク質をヤギ抗Gas6ポリクローナルAbでラベルし、ホースラディッシュペルオキシダーゼ(HRP)コンジュゲーション型ロバ抗ヤギIgG抗体(Santa Cruz Biotechnology, Heidelberg, Germany)(1:2,000希釈)およびo−フェニレンジアミン二塩酸塩(OPD)(Thermo scientific)基質を用いて検出した。架橋実験のために、Fc−キメラタンパク質(2μg/ml)のインキュベーションの間にrGas6タンパク質(2μg/ml)を同時に添加した。ウェルを徹底的に洗浄し、結合しているFc−キメラを、ホースラディッシュペルオキシダーゼ(HRP)コンジュゲーション型ウサギ抗ヒトIgG抗体(Dako)(1:1,000希釈)およびOPDを用いて検出した。
96ウェルMaxisorp NUNC-IMMUNOプレート(NUNC, Roskidle, Denmark)に二つ組でDVウイルス粒子(107FIU)を4℃で一晩被覆した。37℃のPBS CaCl2/MgCl2中に入れた2%のBSAで1時間ブロッキング後、0.05% Tweenおよび10mM CaCl2を補充したTBS中でウェルをrGas6タンパク質(2μg/ml)と共に37℃で1時間インキュベーションした。ウェルを徹底的に洗浄し、結合しているGas6タンパク質をヤギ抗Gas6ポリクローナルAbでラベルし、ホースラディッシュペルオキシダーゼ(HRP)コンジュゲーション型ロバ抗ヤギIgG抗体(Santa Cruz Biotechnology, Heidelberg, Germany)(1:2,000希釈)およびo−フェニレンジアミン二塩酸塩(OPD)(Thermo scientific)基質を用いて検出した。架橋実験のために、Fc−キメラタンパク質(2μg/ml)のインキュベーションの間にrGas6タンパク質(2μg/ml)を同時に添加した。ウェルを徹底的に洗浄し、結合しているFc−キメラを、ホースラディッシュペルオキシダーゼ(HRP)コンジュゲーション型ウサギ抗ヒトIgG抗体(Dako)(1:1,000希釈)およびOPDを用いて検出した。
細胞結合アッセイ
1%BSAまたは5%FBSを含有する結合緩衝液(0.05% NaN3を補充したDMEM)中で、TYRO3、AXLおよびDC−SIGNを発現している293T細胞およびCHO745細胞(4×105個)を表示のMOIのDVと共に4℃で90分間インキュベーションした。293Tについて、細胞をヘパリン100Uと共に室温で30分間インキュベーションし、その後ウイルスと共にインキュベーションした。細胞を冷結合緩衝液で2回、冷無血清DMEM培地で1回洗浄し、PBS−PFA 2%中に入れて4℃で20分間固定した。細胞表面に吸収されたDV粒子を抗汎フラビウイルスエンベロープ抗体(4G2、5μg/ml)で染色し、前述のようにフローサイトメトリーによって分析した(Fernandez-Garcia et al., 2011, J Virol, 85:2980-2989)。結合増強・阻害アッセイでは、細胞をウイルスおよびrGas6(10μg/ml)と共に同時インキュベーションした。
1%BSAまたは5%FBSを含有する結合緩衝液(0.05% NaN3を補充したDMEM)中で、TYRO3、AXLおよびDC−SIGNを発現している293T細胞およびCHO745細胞(4×105個)を表示のMOIのDVと共に4℃で90分間インキュベーションした。293Tについて、細胞をヘパリン100Uと共に室温で30分間インキュベーションし、その後ウイルスと共にインキュベーションした。細胞を冷結合緩衝液で2回、冷無血清DMEM培地で1回洗浄し、PBS−PFA 2%中に入れて4℃で20分間固定した。細胞表面に吸収されたDV粒子を抗汎フラビウイルスエンベロープ抗体(4G2、5μg/ml)で染色し、前述のようにフローサイトメトリーによって分析した(Fernandez-Garcia et al., 2011, J Virol, 85:2980-2989)。結合増強・阻害アッセイでは、細胞をウイルスおよびrGas6(10μg/ml)と共に同時インキュベーションした。
ウイルスおよび細胞
限られた細胞継代をされた後の蚊(Aedes pseudoscutellaris)AP61細胞単層中でDV−1−TVP株、DV2−JAM株(Jamaica)、DV2−ニューギニアC株、DV2−16881株、DV3−PAH881株(Thailand)およびDV4−1086株を増殖させた。注目すべきことに、哺乳動物細胞中で産生されたDVは、昆虫細胞起源のウイルスと類似の結果を与えた。ウイルス力価はC6/36細胞を用いたフローサイトメトリー分析(FACS)によって評価し、FACS感染単位(FIU)として表現した。HEK 293T、A549、VERO、およびHuh7 5.1細胞(贈与:C.Rice, New York, USA)を、10%FBS、1%ペニシリン/ストレプトマイシンを補充したDMEM中で維持した。
限られた細胞継代をされた後の蚊(Aedes pseudoscutellaris)AP61細胞単層中でDV−1−TVP株、DV2−JAM株(Jamaica)、DV2−ニューギニアC株、DV2−16881株、DV3−PAH881株(Thailand)およびDV4−1086株を増殖させた。注目すべきことに、哺乳動物細胞中で産生されたDVは、昆虫細胞起源のウイルスと類似の結果を与えた。ウイルス力価はC6/36細胞を用いたフローサイトメトリー分析(FACS)によって評価し、FACS感染単位(FIU)として表現した。HEK 293T、A549、VERO、およびHuh7 5.1細胞(贈与:C.Rice, New York, USA)を、10%FBS、1%ペニシリン/ストレプトマイシンを補充したDMEM中で維持した。
上記の蚊(Aedes pseudoscutellaris)AP61細胞単層中でDV2−JAM(Jamaica)およびWNV(Israeli IS−98−STI株を増殖させた。YFV(YFV D17株)を成長させ、Vero細胞で力価決定した。HSV−1(F)を増殖させ、他に記載されたようにVero細胞で力価決定した(Taddeo et al. 2004)。チクングニヤ(CHIKV−21株)を昆虫細胞C6/36中で成長させた。
フローサイトメトリー分析
冷PBS中に入れた0.02% NaN3および5% FBSの存在下で、以下の従来プロトコールによりフローサイトメトリー分析を行った。感染アッセイのために、感染細胞を2%(v/v)パラホルムアルデヒド(PFA)加PBSで固定し、0.5%(w/v)サポニンで透過処理し、続いてDV prMを検出するマウス2H2 mAb(2μg/ml)または非構造タンパク質−1を検出するマウスNS1 mAb(1μg/ml)を用いて染色した。抗ICP4マウスmAb(クローン10F1、0.3μg/ml; Santa Cruz Biotechnology)を用いてHSV−1感染を検出した。WNV、YFVおよびチクングニヤ感染を抗タンパク質E抗体(4G2)およびE2エンベロープ糖タンパク質に対するマウスモノクローナル抗体(3E4)で検出した。45分後に、一次抗体をポリクローナルヤギ抗マウス免疫グロブリン/RPE(DakoCytomation)でラベルした。最後に、感染細胞のパーセンテージを、CellQuestソフトウェアを備えるLSR(Becton Dickinson)を用いるフローサイトメトリーによって評価した。FlowJoソフトウェア(Tree Star)を使用することによってデータを解析した。
冷PBS中に入れた0.02% NaN3および5% FBSの存在下で、以下の従来プロトコールによりフローサイトメトリー分析を行った。感染アッセイのために、感染細胞を2%(v/v)パラホルムアルデヒド(PFA)加PBSで固定し、0.5%(w/v)サポニンで透過処理し、続いてDV prMを検出するマウス2H2 mAb(2μg/ml)または非構造タンパク質−1を検出するマウスNS1 mAb(1μg/ml)を用いて染色した。抗ICP4マウスmAb(クローン10F1、0.3μg/ml; Santa Cruz Biotechnology)を用いてHSV−1感染を検出した。WNV、YFVおよびチクングニヤ感染を抗タンパク質E抗体(4G2)およびE2エンベロープ糖タンパク質に対するマウスモノクローナル抗体(3E4)で検出した。45分後に、一次抗体をポリクローナルヤギ抗マウス免疫グロブリン/RPE(DakoCytomation)でラベルした。最後に、感染細胞のパーセンテージを、CellQuestソフトウェアを備えるLSR(Becton Dickinson)を用いるフローサイトメトリーによって評価した。FlowJoソフトウェア(Tree Star)を使用することによってデータを解析した。
統計解析
グラフ表示、統計解析およびカーブフィッティングはPrism5ソフトウェア(GraphPad software, San Diego, CA)を使用して行った。特に述べない限り、全ての結果を3回の独立した実験の平均±標準偏差(SD)として示す。対応のある両側t検定を用いて、有意性について結果を検定した。
グラフ表示、統計解析およびカーブフィッティングはPrism5ソフトウェア(GraphPad software, San Diego, CA)を使用して行った。特に述べない限り、全ての結果を3回の独立した実験の平均±標準偏差(SD)として示す。対応のある両側t検定を用いて、有意性について結果を検定した。
結果
cDNA選別はDV2感染を増強する細胞表面レセプターとしてTYRO3およびAXLを特定する
新しいDV侵入レセプター(1種または複数)を特定しようとして、低感受性細胞系293TをDV2株JAMに感染可能にするヒト遺伝子についての機能獲得cDNA選別を実施した。このために、配列データベース(Swiss Prot、Uniprot、Human Protein Reference Database)と、約10000種のcDNAから成るアレイ化されたcDNAライブラリーから選択された、細胞膜レセプターをコードする1728種の全長cDNAを、CMVが駆動する発現ベクターpCMVSPORT6にクローニングしたものとを使用した。第1ラウンドのスクリーニングで、8種のcDNAのプール216個を293T細胞にトランスフェクションした。高い感染多重度(MOI)であってもわずかな感染細胞しか観察されなかったので、293Tは蚊由来DV初代株による感染に低感受性であることが以前に示されている。しかし、C型レクチンレセプターDC−SIGNをトランスフェクションされたこれらの細胞から感染性粒子が効率的に回収されたので、ウイルス複製段階、粒子集合段階または放出段階ではなくウイルス侵入段階で制限が起こることが示された。次に、トランスフェクション後の細胞を、蚊の中で成長したDV2 JAM粒子(MOI=2)で攻撃した。2日後に、DV prMタンパク質を認識する2H2 mAbを使用するFACSによって感染をスコア化した。293T細胞をprMタンパク質細胞内染色に陽性にしたcDNAのプールを第2ラウンドのスクリーニングに入れ、第2ラウンドのスクリーニングでは各プールを構成している単一のcDNAを個別に検査した。この選別の結果として、3種の主要タンパク質、すなわちDVの侵入を媒介することが以前から分かっているC型レクチンレセプターであるL−SIGN、TYRO3およびAXLを特定した。TYRO3およびAXLは、天然リガンドである成長停止特異的タンパク質6(Growth-arrest-specific 6)(Gas6)およびプロテインS(ProS)が結合すると活性化されるチロシンキナーゼ分子群であるTAM(TYRO3/AXL/MER)レセプターファミリーの2メンバーである。TAMレセプターは、細胞外ドメインリガンド結合ドメイン(2個の免疫グロブリン様リピートおよび2個のフィブロネクチンIII型リピートを含む)、1回膜貫通ドメイン、およびキナーゼ活性を担う細胞質ドメインを共有する。それらは広く発現され、細胞トランスフォーメーション、食作用、アポトーシス細胞体の浄化および自然免疫に関与する多様なシグナル伝達カスケードをレギュレーションする。興味深いことに、TAMレセプターファミリーの1メンバーであるAXLがエボラウイルスおよびワクシニアウイルス感染を容易にすることが見いだされた。
cDNA選別はDV2感染を増強する細胞表面レセプターとしてTYRO3およびAXLを特定する
新しいDV侵入レセプター(1種または複数)を特定しようとして、低感受性細胞系293TをDV2株JAMに感染可能にするヒト遺伝子についての機能獲得cDNA選別を実施した。このために、配列データベース(Swiss Prot、Uniprot、Human Protein Reference Database)と、約10000種のcDNAから成るアレイ化されたcDNAライブラリーから選択された、細胞膜レセプターをコードする1728種の全長cDNAを、CMVが駆動する発現ベクターpCMVSPORT6にクローニングしたものとを使用した。第1ラウンドのスクリーニングで、8種のcDNAのプール216個を293T細胞にトランスフェクションした。高い感染多重度(MOI)であってもわずかな感染細胞しか観察されなかったので、293Tは蚊由来DV初代株による感染に低感受性であることが以前に示されている。しかし、C型レクチンレセプターDC−SIGNをトランスフェクションされたこれらの細胞から感染性粒子が効率的に回収されたので、ウイルス複製段階、粒子集合段階または放出段階ではなくウイルス侵入段階で制限が起こることが示された。次に、トランスフェクション後の細胞を、蚊の中で成長したDV2 JAM粒子(MOI=2)で攻撃した。2日後に、DV prMタンパク質を認識する2H2 mAbを使用するFACSによって感染をスコア化した。293T細胞をprMタンパク質細胞内染色に陽性にしたcDNAのプールを第2ラウンドのスクリーニングに入れ、第2ラウンドのスクリーニングでは各プールを構成している単一のcDNAを個別に検査した。この選別の結果として、3種の主要タンパク質、すなわちDVの侵入を媒介することが以前から分かっているC型レクチンレセプターであるL−SIGN、TYRO3およびAXLを特定した。TYRO3およびAXLは、天然リガンドである成長停止特異的タンパク質6(Growth-arrest-specific 6)(Gas6)およびプロテインS(ProS)が結合すると活性化されるチロシンキナーゼ分子群であるTAM(TYRO3/AXL/MER)レセプターファミリーの2メンバーである。TAMレセプターは、細胞外ドメインリガンド結合ドメイン(2個の免疫グロブリン様リピートおよび2個のフィブロネクチンIII型リピートを含む)、1回膜貫通ドメイン、およびキナーゼ活性を担う細胞質ドメインを共有する。それらは広く発現され、細胞トランスフォーメーション、食作用、アポトーシス細胞体の浄化および自然免疫に関与する多様なシグナル伝達カスケードをレギュレーションする。興味深いことに、TAMレセプターファミリーの1メンバーであるAXLがエボラウイルスおよびワクシニアウイルス感染を容易にすることが見いだされた。
TYRO3およびAXLの異所性発現は標的細胞のDV1〜DV4感染を増強する
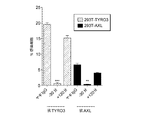
TAMレセプターファミリーの第3のメンバーであるMERでDV2 JAMの感染性の増強は検出されなかった。したがって、研究をTYRO3およびAXLに集中させた。次に、TYRO3を非常に低レベル発現し、AXLの発現を欠如している293T細胞に、ヒトTYRO3またはAXLをコードするレンチウイルスベクターをトランスダクションした。細胞を特異的mAbで染色し、高レベルの表面発現についてソーティングした。免疫蛍光研究から、293T−TYRO3細胞または293T−AXL細胞のDV2 JAM感染が、親293T細胞に比べてprMタンパク質の細胞内産生の顕著な増加を招いたことが示された。これに一致して、活動的複製時のみに産生されるDVの非構造タンパク質であるNS1の発現のFACS分析から、DV2 JAMで攻撃された293T−TYRO3細胞および293T−AXL細胞は増殖性感染することが実証された。異所性AXL発現または異所性TYRO3発現は、293T細胞のDV2感染をそれぞれ20倍および50倍に増強する。DV2 JAMで攻撃された細胞から回収された無細胞上清の力価決定から、TYRO3発現細胞およびAXL発現細胞が親対応物よりも大量の感染性ウイルス粒子を放出したことが示された(図1)。
TAMレセプターファミリーの第3のメンバーであるMERでDV2 JAMの感染性の増強は検出されなかった。したがって、研究をTYRO3およびAXLに集中させた。次に、TYRO3を非常に低レベル発現し、AXLの発現を欠如している293T細胞に、ヒトTYRO3またはAXLをコードするレンチウイルスベクターをトランスダクションした。細胞を特異的mAbで染色し、高レベルの表面発現についてソーティングした。免疫蛍光研究から、293T−TYRO3細胞または293T−AXL細胞のDV2 JAM感染が、親293T細胞に比べてprMタンパク質の細胞内産生の顕著な増加を招いたことが示された。これに一致して、活動的複製時のみに産生されるDVの非構造タンパク質であるNS1の発現のFACS分析から、DV2 JAMで攻撃された293T−TYRO3細胞および293T−AXL細胞は増殖性感染することが実証された。異所性AXL発現または異所性TYRO3発現は、293T細胞のDV2感染をそれぞれ20倍および50倍に増強する。DV2 JAMで攻撃された細胞から回収された無細胞上清の力価決定から、TYRO3発現細胞およびAXL発現細胞が親対応物よりも大量の感染性ウイルス粒子を放出したことが示された(図1)。
次に、TYRO3およびAXLが4種のDV血清型のいずれかによるヒト細胞の感染を容易にするかどうかを検査した。293T−TYRO3細胞、293T−AXL細胞および293T細胞にDV1〜DV4株のパネルを感染させた。48時間後に、細胞を2H2 mAbで染色し、FACSによって分析した。実験室適応株DV2 NGCまたは16881、および初代DV1、DV3およびDV4株による感染は、TYRO3またはAXLのいずれかによって有意に増強された(図2)。したがって、TYRO3およびAXLの異所性発現は、4種のDV血清型の感染を増強する。
次に、フラビウイルス属の他のメンバーであるWNVおよびYFV−17D、ならびにインフルエンザ(Flu)および水疱性口内炎ウイルスGタンパク質を担持するHIVシュードパーティクル(VSVpp)などの他のエンベロープウイルスを検査することによって、TYRO3およびAXLが媒介する感染性増強の特異性を調査した。TYRO3およびAXLは、WNV感染を強く増強し、より少ない程度にYFV−17D感染を増強した。対照的に、FluおよびVSVppではウイルス感染性の増強が起こらなかった(図3)。したがって、TYRO3およびAXLは異なる病原性フラビウイルスによって感染のために活用されている。
TAMレセプターの発現が他のヒト細胞系をDV感染に感受性にするかどうかを判定するために、TYRO3またはAXLを安定的に発現しているHeLa細胞を発生させた。親HeLa細胞はDV3粒子に低感受性であるが、TYRO3またはAXLの異所性発現後に効率的な感染が起こった(図4)。WNVで類似の結果が得られた(図4)。さらに、内因性AXLを発現するマクロファージ様系統であるCHME細胞へのTYRO3の付加はDV感染を強く増強する。したがって、少なくとも3種のヒト細胞系統へのTYRO3またはAXLの付加は、DV感染を増強する。
TAMレセプターのサイレンシングまたは阻害は許容性細胞におけるDV感染を減少させる
フローサイトメトリー実験から、DV感染に感受性のある広範囲のヒト細胞からAXLの発現が検出されたことが示された。AXLはA549細胞および初代ヒト星状膠細胞(in vivoでDVの重要な標的であると提唱されている)中に特に豊富である。対照的に、TYRO3は全ての被験細胞から検出可能に発現されているわけではなかった。次に、DVがA549細胞および初代ヒト星状膠細胞において内因性AXLを利用するかどうかを研究した。このために、フローサイトメトリーによって決定される内因性AXLの発現を、両細胞型においてsiRNAによってダウンレギュレーションした。AXLがサイレンシングされた細胞では、無関係のsiRNAを受け取った細胞に比べてDV3感染およびWNV感染に対する感受性が有意に低下した。フラビウイルスのpH依存性融合に必要な液胞ATPaseのサブユニットであるATP6V1B2のサイレンシングは、AXL siRNAと同じように効率的にDV3感染およびWNV感染を障害した(図5および6)。DV2 JAMで類似の結果が得られた。次に、AXLエクトドメインに対する抗体がDV感染を阻害する能力を研究した。抗AXL Abを用いた293T−AXL、A549または初代星状膠細胞の前処理は、DV3感染およびDV2感染を有意に阻害した一方で、対照Abは作用を有さなかった(図7)。同様に、抗TYRO3 Abは293T−TYRO3細胞のDV感染を阻害した(図8)。まとめると、これらの結果は、AXLの細胞表面発現が最適なDV感染に必要であることを示している。
フローサイトメトリー実験から、DV感染に感受性のある広範囲のヒト細胞からAXLの発現が検出されたことが示された。AXLはA549細胞および初代ヒト星状膠細胞(in vivoでDVの重要な標的であると提唱されている)中に特に豊富である。対照的に、TYRO3は全ての被験細胞から検出可能に発現されているわけではなかった。次に、DVがA549細胞および初代ヒト星状膠細胞において内因性AXLを利用するかどうかを研究した。このために、フローサイトメトリーによって決定される内因性AXLの発現を、両細胞型においてsiRNAによってダウンレギュレーションした。AXLがサイレンシングされた細胞では、無関係のsiRNAを受け取った細胞に比べてDV3感染およびWNV感染に対する感受性が有意に低下した。フラビウイルスのpH依存性融合に必要な液胞ATPaseのサブユニットであるATP6V1B2のサイレンシングは、AXL siRNAと同じように効率的にDV3感染およびWNV感染を障害した(図5および6)。DV2 JAMで類似の結果が得られた。次に、AXLエクトドメインに対する抗体がDV感染を阻害する能力を研究した。抗AXL Abを用いた293T−AXL、A549または初代星状膠細胞の前処理は、DV3感染およびDV2感染を有意に阻害した一方で、対照Abは作用を有さなかった(図7)。同様に、抗TYRO3 Abは293T−TYRO3細胞のDV感染を阻害した(図8)。まとめると、これらの結果は、AXLの細胞表面発現が最適なDV感染に必要であることを示している。
TYRO3レセプターおよびAXLレセプターはDVの内部移行を増強する
最初に、DVの生活環のどの段階でTYRO3およびAXLが作用するかを決定するために、抗TAM Abを様々な時点で添加したときに抗TAM AbがDV感染を阻害する能力を検討した(図8)。抗TYRO3 Abおよび抗AXL Abは、ウイルス攻撃の30分前にそれぞれ293T−TYRO3または293T−AXLと共にインキュベーションしたとき、DV感染を強く阻害した(図8)。Abは感染の2時間後に添加したときにその中和能を失った(図8)が、これは、TAMレセプターがDVの生活環の初期段階で作用することを示唆している。次に、TYRO3およびAXLがDVの内部移行を促進するかどうかを研究した。DV2 JAMでTYRO3発現細胞およびAXL発現細胞を37℃で4時間攻撃した。総RNAを抽出し、ウイルスRNAレベルをqPCRにより定量した(図9)。TAMレセプターは、293T細胞へのDV RNAの取り込みを強く増加させた(TYRO3およびAXLで、それぞれ30倍および10倍に増強)(図9)。第2のアプローチでは、細胞表面ヘパラン硫酸を欠如するCHO−745細胞内でTYRO3およびAXLを発現させた。TAM発現細胞、または対照としてのDC−SIGN CHO−745細胞をDV2 JAM粒子と共に4℃で1時間インキュベーションし、37℃で45分間に変えてエンドサイトーシスさせた。抗DV E mAbである4G2を使用する蛍光顕微鏡法によりウイルスの取り込みをモニターした。DC−SIGNと同様に、TYRO3またはAXLを発現している細胞中にDV Eタンパク質の強い細胞内蓄積を見いだした。したがって、TYRO3またはAXLが発現すると、DV粒子は標的細胞に効率的に内部移行される。これらの結果は、TAMレセプターであるTYRO3およびAXLがDVに対する新規な細胞侵入補助因子であることを示している。
最初に、DVの生活環のどの段階でTYRO3およびAXLが作用するかを決定するために、抗TAM Abを様々な時点で添加したときに抗TAM AbがDV感染を阻害する能力を検討した(図8)。抗TYRO3 Abおよび抗AXL Abは、ウイルス攻撃の30分前にそれぞれ293T−TYRO3または293T−AXLと共にインキュベーションしたとき、DV感染を強く阻害した(図8)。Abは感染の2時間後に添加したときにその中和能を失った(図8)が、これは、TAMレセプターがDVの生活環の初期段階で作用することを示唆している。次に、TYRO3およびAXLがDVの内部移行を促進するかどうかを研究した。DV2 JAMでTYRO3発現細胞およびAXL発現細胞を37℃で4時間攻撃した。総RNAを抽出し、ウイルスRNAレベルをqPCRにより定量した(図9)。TAMレセプターは、293T細胞へのDV RNAの取り込みを強く増加させた(TYRO3およびAXLで、それぞれ30倍および10倍に増強)(図9)。第2のアプローチでは、細胞表面ヘパラン硫酸を欠如するCHO−745細胞内でTYRO3およびAXLを発現させた。TAM発現細胞、または対照としてのDC−SIGN CHO−745細胞をDV2 JAM粒子と共に4℃で1時間インキュベーションし、37℃で45分間に変えてエンドサイトーシスさせた。抗DV E mAbである4G2を使用する蛍光顕微鏡法によりウイルスの取り込みをモニターした。DC−SIGNと同様に、TYRO3またはAXLを発現している細胞中にDV Eタンパク質の強い細胞内蓄積を見いだした。したがって、TYRO3またはAXLが発現すると、DV粒子は標的細胞に効率的に内部移行される。これらの結果は、TAMレセプターであるTYRO3およびAXLがDVに対する新規な細胞侵入補助因子であることを示している。
次に、TAM発現細胞へのDV侵入が機能的なクラスリン依存性エンドサイトーシス経路を必要とするかどうかを研究した。TYRO3またはAXLを発現しているHeLa細胞に、被覆ピット形成を促進する細胞因子であるクラスリン重鎖(CHC)をターゲティングするsiRNAをトランスフェクションした。WBおよび機能的アッセイによりサイレンシングを検証し、前記のようなトランスフェリンのクラスリン媒介性取り込みの阻害を実証した。CHCのサイレンシングは、TYRO3発現細胞およびAXL発現細胞のDV感染を強力に阻害した(図10)。陽性対照としてのATP6V1B2サイレンシングもDV感染を遮断した。まとめると、これらの結果からTAM媒介性のDV侵入増強がpH依存性であり、クラスリン経路を必要とすることが示された。
可溶性Gas6はDVエンベロープ上に発現されたPdtSerと相互作用し、ウイルス粒子をTYRO3およびAXLに架橋する
TYRO3およびAXLがDV侵入を増強するメカニズムを解明するために、可溶性キメラTYRO3−Fc分子および可溶性キメラAXL−Fc分子を用いて阻害感染アッセイを行った。親293T−TYRO3細胞および親293T−AXL細胞に、TYRO3−Fc分子、AXL−Fc分子または対照Fc分子と共に予備インキュベーションしたDV2 JAM粒子を感染させた(図11)。DV感染は可溶性TYRO3−Fcまたは可溶性AXL−Fcによって顕著に遮断されたが、これはDVビリオンがTAMレセプターに結合することを示唆している。しかし、可溶性TYRO3−Fcまたは可溶性AXL−Fcを使用するプルダウン実験では、インタクトなDV粒子からDV−Eタンパク質を免疫沈降することができなかった。これは、TYRO3またはAXLのエクトドメインがDVと直接には相互作用しないことを示している。TAMレセプターがDVとどのように結合するかをさらに研究するために、高レベル(約300nM)のTAMリガンドProSを含有するウシ胎児血清(FBS)の存在下または不在下でウイルス付着アッセイを行った。5%FBSの存在下または不在下で親293T細胞、TYRO3 293T細胞、AXL 293T細胞をDV粒子と共に4℃でインキュベーションした。細胞表面に結合しているDV粒子は、抗Eタンパク質4G2 mAbを使用するFACSによって検出した。TYRO3およびAXLへのウイルス結合の顕著な増加は、FBSの存在下でのみ検出された。TYRO3またはAXLがCHO745細胞上に発現しているとき、および様々なDV株を用いた場合に、類似の結果が得られた。FBSの存在下で、TAM陽性細胞へのDVの結合は特異的であった。というのは、抗TYRO3 Abまたは抗AXL Abによって結合が阻害されたからである。重要なことに、FBSの不在下で感染を行うと、DVに対するTAMの効果は打ち消された(図12)。FBS濃度を10%に増加させると、DC−SIGN発現細胞ではなく、TYRO3またはAXL発現細胞のDV感染が増強された(図12)。まとめると、これらのデータは、FBSの因子がTAMレセプターへのDVの結合を容易にしてウイルス侵入を増強しうることを示している。
TYRO3およびAXLがDV侵入を増強するメカニズムを解明するために、可溶性キメラTYRO3−Fc分子および可溶性キメラAXL−Fc分子を用いて阻害感染アッセイを行った。親293T−TYRO3細胞および親293T−AXL細胞に、TYRO3−Fc分子、AXL−Fc分子または対照Fc分子と共に予備インキュベーションしたDV2 JAM粒子を感染させた(図11)。DV感染は可溶性TYRO3−Fcまたは可溶性AXL−Fcによって顕著に遮断されたが、これはDVビリオンがTAMレセプターに結合することを示唆している。しかし、可溶性TYRO3−Fcまたは可溶性AXL−Fcを使用するプルダウン実験では、インタクトなDV粒子からDV−Eタンパク質を免疫沈降することができなかった。これは、TYRO3またはAXLのエクトドメインがDVと直接には相互作用しないことを示している。TAMレセプターがDVとどのように結合するかをさらに研究するために、高レベル(約300nM)のTAMリガンドProSを含有するウシ胎児血清(FBS)の存在下または不在下でウイルス付着アッセイを行った。5%FBSの存在下または不在下で親293T細胞、TYRO3 293T細胞、AXL 293T細胞をDV粒子と共に4℃でインキュベーションした。細胞表面に結合しているDV粒子は、抗Eタンパク質4G2 mAbを使用するFACSによって検出した。TYRO3およびAXLへのウイルス結合の顕著な増加は、FBSの存在下でのみ検出された。TYRO3またはAXLがCHO745細胞上に発現しているとき、および様々なDV株を用いた場合に、類似の結果が得られた。FBSの存在下で、TAM陽性細胞へのDVの結合は特異的であった。というのは、抗TYRO3 Abまたは抗AXL Abによって結合が阻害されたからである。重要なことに、FBSの不在下で感染を行うと、DVに対するTAMの効果は打ち消された(図12)。FBS濃度を10%に増加させると、DC−SIGN発現細胞ではなく、TYRO3またはAXL発現細胞のDV感染が増強された(図12)。まとめると、これらのデータは、FBSの因子がTAMレセプターへのDVの結合を容易にしてウイルス侵入を増強しうることを示している。
TAMレセプターへのDVの結合が全長マウスGas6(rmGas6)によってモデュレーションされるかどうかを研究した。モック対照ではなくmGas6と共にウイルス粒子を予備インキュベーションしたとき、TYRO3発現細胞およびAXL発現細胞へのDVの結合は、有意に増加した(図13)。これに一致して、全長rmGas6は、対照細胞ではなくTYRO3発現細胞およびAXL発現細胞のDV感染を強烈にブーストした(図14)。ヒト全長Gas−6を使用して類似の結果が得られた。これにより、DVと複合体を形成したGas6がTAMレセプターと相互作用してDVの侵入を増強することが強く示唆された。Gas6がDVビリオン上に発現されたPdtSerを認識するかどうかを知るために、ウェル上に被覆されたDVを様々なGas6分子と共にインキュベーションするELISAアッセイを行った(図15)。全長Gas6はDV粒子と効率的に結合した。対照的に、N末端Glaドメインを欠如することでPdtSerと結合できないGas6分子(rmGas6ΔGla)は、DV粒子と相互作用する能力が障害していた。
次に、DV粒子上に発現されたPdtSerがTAM陽性細胞の感染に必要かどうかを研究した。TYRO3細胞およびAXL細胞に、文書により十分に立証されたPdtSer結合タンパク質であるアネキシンV(ANX5)と共に予備インキュベーションされたDVを感染させた。ANX5はDC−SIGNを介したDV侵入に効果をもたない。対照的に、ANX5は、FBS中で培養されたTYRO3またはAXLを発現する293T細胞のDV感染を、おそらくPdtSerへのアクセスを遮断することによって有意に阻害した(図16)。まとめると、これらの結果からGas6がDV侵入を増強したことが示された。この分子は、DVビリオン上に露出したPdtSerをTAMレセプターTYRO3およびAXLに架橋することによって作用する。
DV粒子をTYRO3およびAXLに架橋することができないGas6分子の抗ウイルス活性
次に、全長mGas6およびGlaドメインを欠如する市販のGas6誘導体(rmGas6ΔGla)がTYRO3発現細胞およびAXL発現細胞のDV結合および感染をモデュレーションする能力を比較した。2種のGas6タンパク質がDVをTYRO3およびAXLに架橋する能力を検査した。ELISAプレート上に被覆されたDV粒子を、Gas6分子の存在下で可溶性TYRO3−Fc、可溶性AXL−Fcまたは対照としての無関係なFc分子と共にインキュベーションした。このアッセイでは、全長rmGas6はDV架橋活性を示したが、これはrmGas6ΔGlaおよび驚くことにrhGas6にはあてはまらなかった(図17)。対照として検査したGas6分子のどれもDC−SIGN−FcへのDVの結合をモデュレーションしなかった。FBSの存在下であっても全長rmGas6がDV感染を増強したことが観察された(図18)。これは、ほとんど全てが可溶性Axlエクトドメインと複合体を形成している非常に低血清濃度のGas6(0.2〜0.5nM)の結果に一致する。興味深いことに、TYRO3発現293T細胞またはAXL発現293T細胞をrmGas6ΔGlaで前処理するとDV2感染の増強が打ち消された(図18)。これらの結合実験から、rmGas6ΔGlaによるTAMレセプター媒介感染の阻害が、この分子がTAM発現CHO745細胞へのDV3の結合を遮断する能力と相関したことが示された(図19)。まとめると、これらの結果は、DVをTAMレセプターに付着させることができないGas6分子が抗ウイルス化合物として機能することを示している。
次に、全長mGas6およびGlaドメインを欠如する市販のGas6誘導体(rmGas6ΔGla)がTYRO3発現細胞およびAXL発現細胞のDV結合および感染をモデュレーションする能力を比較した。2種のGas6タンパク質がDVをTYRO3およびAXLに架橋する能力を検査した。ELISAプレート上に被覆されたDV粒子を、Gas6分子の存在下で可溶性TYRO3−Fc、可溶性AXL−Fcまたは対照としての無関係なFc分子と共にインキュベーションした。このアッセイでは、全長rmGas6はDV架橋活性を示したが、これはrmGas6ΔGlaおよび驚くことにrhGas6にはあてはまらなかった(図17)。対照として検査したGas6分子のどれもDC−SIGN−FcへのDVの結合をモデュレーションしなかった。FBSの存在下であっても全長rmGas6がDV感染を増強したことが観察された(図18)。これは、ほとんど全てが可溶性Axlエクトドメインと複合体を形成している非常に低血清濃度のGas6(0.2〜0.5nM)の結果に一致する。興味深いことに、TYRO3発現293T細胞またはAXL発現293T細胞をrmGas6ΔGlaで前処理するとDV2感染の増強が打ち消された(図18)。これらの結合実験から、rmGas6ΔGlaによるTAMレセプター媒介感染の阻害が、この分子がTAM発現CHO745細胞へのDV3の結合を遮断する能力と相関したことが示された(図19)。まとめると、これらの結果は、DVをTAMレセプターに付着させることができないGas6分子が抗ウイルス化合物として機能することを示している。
TIMレセプターおよびTAMレセプターは他のフラビウイルスによる感染を媒介する
TIMレセプターおよびTAMレセプターが他のウイルス種による感染を媒介するかどうかを判定するために、TIM−1発現細胞およびTIM−4発現細胞をDV2−Jamウエストナイルウイルス(WNV)、黄熱ウイルスワクチン株(YFV−17D)、および単純ヘルペスウイルス1型(HSV−1)で攻撃した。特異的抗体を使用するフローサイトメトリーによってウイルス感染を定量した(図21)。データは、TIM−1およびTIM−4がWNV感染を大きく増強し、YFV−17Dに対する感受性をわずかにアップレギュレーションしたが、HSV−1に効果をもたなかったことを示している。TYRO3発現細胞およびAXL発現細胞について類似の結果が得られた(図22)。まとめると、これらのデータは、PtdSerレセプターであるTIMおよびTAMが両方ともフラビウイルス感染を促進する細胞因子であることを示している。
TIMレセプターおよびTAMレセプターが他のウイルス種による感染を媒介するかどうかを判定するために、TIM−1発現細胞およびTIM−4発現細胞をDV2−Jamウエストナイルウイルス(WNV)、黄熱ウイルスワクチン株(YFV−17D)、および単純ヘルペスウイルス1型(HSV−1)で攻撃した。特異的抗体を使用するフローサイトメトリーによってウイルス感染を定量した(図21)。データは、TIM−1およびTIM−4がWNV感染を大きく増強し、YFV−17Dに対する感受性をわずかにアップレギュレーションしたが、HSV−1に効果をもたなかったことを示している。TYRO3発現細胞およびAXL発現細胞について類似の結果が得られた(図22)。まとめると、これらのデータは、PtdSerレセプターであるTIMおよびTAMが両方ともフラビウイルス感染を促進する細胞因子であることを示している。
TIMおよびTAMの異所性発現はチクングニヤによる感染を増強する
さらに、このメカニズムが、膜内にPtdSerを発現するまたは組み入れているウイルスによって活用される一般メカニズムを表すかどうかに関心がもたれた。親293T細胞、TIM−1発現293T細胞およびTIM−4発現293T細胞にチクングニヤ(Chick)を感染させた。48時間後にE2エンベロープ糖タンパク質に対するマウスモノクローナル抗体(3E4)を使用するフローサイトメトリーによって感染を定量した。結果(図23)は、TIM−1およびTIM−4がチクングニヤ感染を大きく増強することを示している。TYRO3発現細胞およびAXL発現細胞について類似の結果が得られたが、それらの異所性発現は同様にチクングニヤ感染を増強する(図24)。
さらに、このメカニズムが、膜内にPtdSerを発現するまたは組み入れているウイルスによって活用される一般メカニズムを表すかどうかに関心がもたれた。親293T細胞、TIM−1発現293T細胞およびTIM−4発現293T細胞にチクングニヤ(Chick)を感染させた。48時間後にE2エンベロープ糖タンパク質に対するマウスモノクローナル抗体(3E4)を使用するフローサイトメトリーによって感染を定量した。結果(図23)は、TIM−1およびTIM−4がチクングニヤ感染を大きく増強することを示している。TYRO3発現細胞およびAXL発現細胞について類似の結果が得られたが、それらの異所性発現は同様にチクングニヤ感染を増強する(図24)。
これらのデータは、TIMおよびTAMのウイルス感染助長が、膜にPtdSerを発現または組み入れているウイルスによって最適な感染のために活用される一般メカニズムを表すことを示している。
内因性TIM−1分子および内因性AXL分子はDV感染を媒介する
A549細胞系はTIM−1およびAXLの両方を発現する。DV2感染は、単独で投与された抗TIM−1 Abまたは抗AXL Abで部分的に減少するが、これら2種のAbの組み合わせは、HSV−1感染ではなくDV2感染(図25および26)、DV3感染(図27)を完全に阻害した。TIM−1およびAXLを発現しているVero細胞で類似の結果が得られた。これらの結果は、TIMレセプターおよびTAMレセプターが自然に協同してDV感染を促進すること、ならびにそれらのレセプターを内因性発現している細胞においてPtdSerが感染を媒介していることを示している。
A549細胞系はTIM−1およびAXLの両方を発現する。DV2感染は、単独で投与された抗TIM−1 Abまたは抗AXL Abで部分的に減少するが、これら2種のAbの組み合わせは、HSV−1感染ではなくDV2感染(図25および26)、DV3感染(図27)を完全に阻害した。TIM−1およびAXLを発現しているVero細胞で類似の結果が得られた。これらの結果は、TIMレセプターおよびTAMレセプターが自然に協同してDV感染を促進すること、ならびにそれらのレセプターを内因性発現している細胞においてPtdSerが感染を媒介していることを示している。
考察
本研究は、DV侵入のための分子メカニズムおよび細胞要件に重要な洞察を加えるものである。機能獲得cDNAスクリーニングを用いて、本発明者らは新規なDV侵入補助因子としてTYRO3およびAXLを特定した。TYROおよびAXLは、MERと共にTAMファミリーのレセプター型チロシンキナーゼ(RTK)を構成し、このファミリーは、興味をそそる過程の混合をレギュレーションし、アポトーシス細胞の食作用に不可欠である。TYRO3およびAXLは、DVビリオンを宿主細胞に架橋しウイルスの内部移行を増強する天然リガンドであるGas6およびProSを介してウイルスエンベロープ上に露出しているPdtSerを認識する。したがって、これらの結果は、DVが、アポトーシス細胞体の浄化に関与する宿主レセプターをその感染性侵入のために操ることを示しており、DVが、ヒト宿主において増殖性感染を確実に確立できるように複数の細胞レセプター系を活用することを示唆している。
本研究は、DV侵入のための分子メカニズムおよび細胞要件に重要な洞察を加えるものである。機能獲得cDNAスクリーニングを用いて、本発明者らは新規なDV侵入補助因子としてTYRO3およびAXLを特定した。TYROおよびAXLは、MERと共にTAMファミリーのレセプター型チロシンキナーゼ(RTK)を構成し、このファミリーは、興味をそそる過程の混合をレギュレーションし、アポトーシス細胞の食作用に不可欠である。TYRO3およびAXLは、DVビリオンを宿主細胞に架橋しウイルスの内部移行を増強する天然リガンドであるGas6およびProSを介してウイルスエンベロープ上に露出しているPdtSerを認識する。したがって、これらの結果は、DVが、アポトーシス細胞体の浄化に関与する宿主レセプターをその感染性侵入のために操ることを示しており、DVが、ヒト宿主において増殖性感染を確実に確立できるように複数の細胞レセプター系を活用することを示唆している。
本研究により、DV粒子がTAMレセプターと直接には相互作用しないことが実証された。それどころか、TYRO3発現細胞およびAXL発現細胞でのDV感染および吸収の増強は、血清の存在にほぼ完全に依存した。血清は、血漿中にそれぞれ0.25nMおよび350nMの生理学的濃度で存在するビタミンK依存性タンパク質Gas6および近縁の抗凝固因子プロテインSである2種のTAMレセプターリガンドを含有する。両方の分子は、アポトーシス細胞をTAMレセプターに架橋することを担っており、Gas6は、最近、AXLにより媒介されるレンチウイルスシュードタイプウイルスのトランスダクションを増強すると報告された。興味深いことに、FBS存在下のこれらの結果に類似して、Gas6は血清の不在下でTAM発現細胞でのDVの感染および吸収を増強した。それどころか、Glaドメインを欠如するGas6は、血清の存在下で感染およびTAMレセプターの結合を低下させた。これらの実験は、血清中に存在する成分が類似のメカニズムを利用し、Gas6と共通または重複するTAMレセプタードメインに結合することを示唆している。したがって、血清中に存在するGas6および/またはProSは、そのGlaドメインを介してウイルスに付着すると、同時にそのSHBGドメインを介してTAMレセプターに結合する可能性がある。本発明者らの観察から、フラビウイルスと細胞レセプターとの相互作用が架橋分子を必要としうるという新しい証拠が挙げられ、蚊細胞レセプターmosPTP−1へのWNVの間接結合に関する最近の研究が補強された。WNVの場合、可溶性C型レクチンmosGCTL−1はWNVエンベロープタンパク質をmosPTP−1に架橋し、続いて感染を容易にした。
いくつかの証拠は、観察されたFBSの効果が確かにGas6よりもProSによるものであると示唆している。第1に、Gas6の血漿中濃度は非常に低く、ほぼ全てのGas6が可溶性AXLエクトドメイン(sAXL)と複合体を形成している。一方、ProS濃度は非常に高く、ProSの60%だけがC4BP(C4b結合タンパク質)と複合体を形成している。第2に、Gas6はin vitroで3種のTAMレセプター全てに結合し(AXL≧TYRO3≫MER)、実際に図11〜16に認められるように、Gas6はTYRO3発現細胞およびAXL発現細胞へのDV結合を同様に増強した。対照的に、ProSはAXLよりもTYRO3に対して強力なin vitroリガンドであり、それは、FBSがTYRO3発現細胞への、そしてより低い程度にAXL発現細胞への、DVの結合を強く増強することに一致する。
Gas6およびプロテインSの架橋活性がGlaドメインとウイルス粒子との相互作用を示唆したので、本発明者らは、PtdSer残基がDVウイルスエンベロープ上に露出しているという仮説を立てた。実際に、本明細書記載のELISA実験から、Gas6のGlaドメインがウイルスと結合すること、およびウイルス粒子を結合タンパク質アネキシンVと共に予備インキュベーションすることにより血清の増強作用が競合的に消失することを明らかにした。興味深いことに、PtdSerはいくつかのエンベロープビリオン上に露出しているように見え、以前の刊行物から、アネキシンVがHIV−1、ワクシニアウイルス、CMV、HSV−1およびHSV−2に結合することが示された。DVは、DVの生活環に一致して、小胞体(ER)の内腔に出芽した間にPtdSerを獲得したと推定される。細胞膜およびERの2分子膜は、2葉から構成され、休止細胞ではPtdSerはそれらの内葉(inner leaflet)に局在し、豊富に存在する。サイトゾルから出芽する間に、ヌクレオカプシドはER膜の内向き陥入を誘導した。この過程の際に、ER膜の内葉およびERの内腔側にアンカーしたprM−Eヘテロ二量体は、エンベロープウイルスの未熟粒子表面に露出される。
DV侵入へのTYRO3およびAXLの関与は、ウイルス−リガンド複合体が結合するとこれらの分子がどのように感染を容易にするかについての興味深い問題を提起している。図20に示すように、DC−SIGNが媒介するDV侵入に類似するモデルにおいて、TYRO3タンパク質およびAXLタンパク質は、ウイルスエンベロープタンパク質とその一次レセプターとの相互作用を、例えば細胞表面ウイルス濃度を増加させることによって容易にすることができよう。さらに、TAMレセプターは非TAMレセプターとヘテロタイプな二量体化により物理的に結合することができるので、TYRO3およびAXLは真のレセプターをリクルートすることができると考えられる。この相互作用は、クラスリンが媒介するDVの内部移行を増強する下流のシグナル経路の活性化につながりうる。別の魅力のある仮説は、DV−TAMリガンド複合体の結合が、下流のエフェクターのレセプター活性化をトリガーしてウイルス感染を容易にすることができるというものである。この仮説は:(i)TAMレセプターへのGas6の結合が、多様な細胞依存性の生物学的結果を有するシグナル伝達カスケードをトリガーすること;(ii)細胞質尾部の欠失およびチロシンリン酸化を消失させるATP結合部位の突然変異(K567M)が、ZEBOV−GPのトランスダクションのAXL媒介性増強を減少させたという実証;(iii)ホスホリパーゼC経路の活性化がZEBOV−GPでシュードタイプにされたウイルスによるAXL依存性細胞トランスダクションに必要であることによって裏付けられている。したがって、下流の経路の活性化がTYRO3/AXL媒介性のDV感染増強に必要であると考えられる。
実際に、これらの下流経路の一つは、自然免疫の負のレギュレーションでありうる。最近、Gas6が、マクロファージおよび樹状細胞においてToll様レセプター(TLR)およびサイトカインレセプターによって誘導される炎症阻害剤としてのTAMレセプターの機能を活性化したと報告されている。炎症の際に、TLRおよびサイトカインシグナル伝達はAXL発現のアップレギュレーションを駆動し、それが炎症促進性INFAR/STAT1シグナル伝達経路を破壊してSOCS(suppressor of cytokine signaling)1およびSOCS3遺伝子の転写を誘導し、自然免疫および炎症の負のレギュレーションを行った。AXLへのGas6の結合はSOCS1 mRNAの発現が10倍に増加することを誘導し、TLR誘導性サイトカイン産生を阻害した。DV−TAMリガンド複合体がTAMレセプターのスーパーアゴニストとして作用することで、SOCS遺伝子発現およびその後のTLR阻害を刺激する強力なレセプター活性化を誘導することで、感染の初期段階を容易にしたと推定することができる。
DVがウイルスエンベロープ上に存在するPtdSer残基を介して血清成分によりアポトーシス小体として認識されることによって、細胞表面TYRO3およびAXLに結合する能力を有する複合体を形成するというモデルが予測されている。DVはアポトーシス小体を模倣することによって、TAMレセプターのアポトーシス浄化機能を打倒して感染を容易にする。
Claims (18)
- ウイルス感染を予防または治療するための使用のための、ホスファチジルセリンとTAMレセプターとの間の相互作用の阻害剤であって、該阻害剤が、
(i)TAMレセプター阻害剤、
(ii)Gas6阻害剤、および/または
(iii)ホスファチジルセリン結合タンパク質
である阻害剤。 - 前記TAMレセプターが、TYRO3、AXLまたはMERである、請求項1(i)記載の使用のための阻害剤。
- 前記TAMレセプター阻害剤が、抗TAMレセプター抗体、アンチセンス核酸、模倣体または変異型TAMレセプターである、請求項1(i)または2記載の使用のための阻害剤。
- 前記Gas6阻害剤が、抗Gas6抗体、アンチセンス核酸、模倣体または変異型Gas6タンパク質である、請求項1(ii)または2記載の使用のための阻害剤。
- 前記ホスファチジルセリン結合タンパク質が、抗ホスファチジルセリン抗体またはアネキシン5である、請求項1(iii)記載の使用のための阻害剤。
- 前記TAMレセプター阻害剤が、配列番号1、2、3、または4の配列のsiRNAである、請求項3記載の使用のための阻害剤。
- 前記Gas6阻害剤が、配列番号19の配列の変異型Gas6タンパク質Gas6ΔGlaである、請求項4記載の使用のための阻害剤。
- 前記ウイルスが、ホスファチジルセリン保有ウイルスである、請求項1記載の使用のための阻害剤。
- 前記ホスファチジルセリン保有ウイルスが、アルファウイルスまたはフラビウイルスである、請求項1〜8のいずれか一項記載の使用のための阻害剤。
- 前記アルファウイルスが、チクングニヤウイルスである、請求項9記載の使用のための阻害剤。
- 前記フラビウイルスが、ウエストナイルウイルス、黄熱ウイルスまたはデング熱ウイルスである、請求項9記載の使用のための阻害剤。
- 前記阻害剤が、少なくとも1種の他の抗ウイルス化合物と組み合わせて経時または同時のいずれかでの投与用である、請求項1〜8のいずれか一項記載の使用のための阻害剤。
- 前記他の抗ウイルス化合物が、ホスファチジルセリンとTIMレセプターとの相互作用の阻害剤である、請求項9記載の使用のための阻害剤。
- 前記阻害剤が、薬学的に許容されうる組成物に製剤化される、請求項1〜10のいずれか一項記載の使用のための阻害剤。
- 請求項1〜8のいずれか一項記載の阻害剤および追加的に少なくとも1種の他の抗ウイルス化合物を含む薬学的組成物。
- 前記少なくとも1種の抗ウイルス化合物が、ホスファチジルセリンとTIMレセプターとの相互作用の阻害剤である、請求項12記載の薬学的組成物。
- 細胞へのホスファチジルセリン保有ウイルス、特にフラビウイルスの侵入を阻害するin vitro方法における、請求項1〜8のいずれか一項記載の阻害剤の使用。
- ウイルス感染、特にPtdSer保有ウイルス感染、例えばフラビウイルス感染を予防または治療するための方法であって、それを必要とする個体に、ホスファチジルセリンとTAMレセプターとの間の相互作用の阻害剤の治療有効量を投与することを含む方法。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP12305192.2 | 2012-02-21 | ||
| EP12305192 | 2012-02-21 | ||
| EP12306283.8 | 2012-10-17 | ||
| EP12306283 | 2012-10-17 | ||
| PCT/EP2013/053388 WO2013124324A1 (en) | 2012-02-21 | 2013-02-20 | Tam receptors as virus entry cofactors |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2015509943A true JP2015509943A (ja) | 2015-04-02 |
Family
ID=47740970
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014558089A Pending JP2015509943A (ja) | 2012-02-21 | 2013-02-20 | ウイルス侵入補助因子としてのtamレセプター |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US20160015808A1 (ja) |
| EP (1) | EP2817328A1 (ja) |
| JP (1) | JP2015509943A (ja) |
| BR (1) | BR112014021065A8 (ja) |
| IN (1) | IN2014DN07022A (ja) |
| MX (1) | MX2014010015A (ja) |
| WO (1) | WO2013124324A1 (ja) |
Families Citing this family (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2011146313A1 (en) | 2010-05-19 | 2011-11-24 | The University Of North Carolina At Chapel Hill | Pyrazolopyrimidine compounds for the treatment of cancer |
| AU2012318896B2 (en) | 2011-10-03 | 2017-03-02 | The University Of North Carolina At Chapel Hill | Pyrrolopyrimidine compounds for the treatment of cancer |
| IN2014DN07023A (ja) | 2012-02-21 | 2015-04-10 | Inst Nat Sante Rech Med | |
| AU2013266438B2 (en) | 2012-05-22 | 2017-09-07 | The University Of North Carolina At Chapel Hill | Pyrimidine compounds for the treatment of cancer |
| EP2877211A4 (en) * | 2012-07-25 | 2016-02-10 | Salk Inst For Biological Studi | REGULATION OF THE INTERACTION BETWEEN TAM LIGANDS AND LIPID MEMBRANES CONTAINING PHOSPHATIDYLSERIN |
| WO2014062774A1 (en) | 2012-10-17 | 2014-04-24 | The University Of North Carolina At Chapel Hill | Pyrazolopyrimidine compounds for the treatment of cancer |
| EP2925752A4 (en) | 2012-11-27 | 2016-06-01 | Univ North Carolina | PYRIMIDINE COMPOUNDS FOR CANCER TREATMENT |
| EP3129379A4 (en) | 2014-04-11 | 2017-09-13 | The University of North Carolina at Chapel Hill | Mertk-specific pyrrolopyrimidine compounds |
| KR102632022B1 (ko) * | 2014-12-05 | 2024-01-31 | 후지필름 가부시키가이샤 | Tim 단백질 결합 담체, 당해 담체를 사용한 세포외막소포 및 바이러스의 취득 방법, 제거 방법, 검출 방법 그리고 당해 담체를 포함하는 키트 |
| US10709708B2 (en) | 2016-03-17 | 2020-07-14 | The University Of North Carolina At Chapel Hill | Method of treating cancer with a combination of MER tyrosine kinase inhibitor and an epidermal growth factor receptor (EGFR) inhibitor |
| AU2017297506A1 (en) | 2016-07-14 | 2019-02-21 | Bristol-Myers Squibb Company | Antibodies against TIM3 and uses thereof |
| EP3541391A4 (en) | 2016-11-17 | 2020-06-17 | The University of North Carolina at Chapel Hill | ALKYL-PYRROLOPYRIMIDINE ANALOG AND METHOD FOR THE PRODUCTION AND USE THEREOF |
| CN110237240A (zh) * | 2019-07-03 | 2019-09-17 | 上海市肺科医院 | 可溶性受体酪氨酸激酶sAxl在治疗结核病中的应用 |
Family Cites Families (36)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH08500481A (ja) | 1992-05-11 | 1996-01-23 | リボザイム・ファーマシューティカルズ・インコーポレーテッド | ウイルスの複製を阻害するための方法および薬剤 |
| US6620805B1 (en) | 1996-03-14 | 2003-09-16 | Yale University | Delivery of nucleic acids by porphyrins |
| EP0918790B1 (en) | 1996-05-24 | 2004-01-28 | Ic-Vec Limited | Polycationic sterol derivatives as transfection agents |
| US5849902A (en) | 1996-09-26 | 1998-12-15 | Oligos Etc. Inc. | Three component chimeric antisense oligonucleotides |
| US6001311A (en) | 1997-02-05 | 1999-12-14 | Protogene Laboratories, Inc. | Apparatus for diverse chemical synthesis using two-dimensional array |
| US20030229040A1 (en) | 1997-03-21 | 2003-12-11 | Georgetown University | Cationic liposomal delivery system and therapeutic use thereof |
| JP4656675B2 (ja) | 1997-05-14 | 2011-03-23 | ユニバーシティー オブ ブリティッシュ コロンビア | 脂質小胞への荷電した治療剤の高率封入 |
| WO1999001579A1 (en) | 1997-07-01 | 1999-01-14 | Isis Pharmaceuticals, Inc. | Compositions and methods for the delivery of oligonucleotides via the alimentary canal |
| US20030073640A1 (en) | 1997-07-23 | 2003-04-17 | Ribozyme Pharmaceuticals, Inc. | Novel compositions for the delivery of negatively charged molecules |
| JP2001510808A (ja) | 1997-07-24 | 2001-08-07 | イネックス ファーマシューティカルズ コーポレイション | 核酸触媒の供給のためのリポソーム組成物 |
| WO1999054459A2 (en) | 1998-04-20 | 1999-10-28 | Ribozyme Pharmaceuticals, Inc. | Nucleic acid molecules with novel chemical compositions capable of modulating gene expression |
| US7112337B2 (en) | 1999-04-23 | 2006-09-26 | Alza Corporation | Liposome composition for delivery of nucleic acid |
| US7098032B2 (en) | 2001-01-02 | 2006-08-29 | Mirus Bio Corporation | Compositions and methods for drug delivery using pH sensitive molecules |
| US20050037086A1 (en) | 1999-11-19 | 2005-02-17 | Zycos Inc., A Delaware Corporation | Continuous-flow method for preparing microparticles |
| AU6815901A (en) | 2000-06-02 | 2001-12-17 | Zycos Inc | Delivery systems for bioactive agents |
| US7427394B2 (en) | 2000-10-10 | 2008-09-23 | Massachusetts Institute Of Technology | Biodegradable poly(β-amino esters) and uses thereof |
| WO2002076427A2 (en) | 2001-03-26 | 2002-10-03 | Thomas Jefferson University | Ph sensitive liposomal drug delivery |
| EP1385479A4 (en) | 2001-03-26 | 2006-12-06 | Alza Corp | LIPOSOMIC COMPOSITION FOR IMPROVED INTRA-CELLULAR RELEASE OF A THERAPEUTIC AGENT |
| US20030026831A1 (en) | 2001-04-20 | 2003-02-06 | Aparna Lakkaraju | Anionic liposomes for delivery of bioactive agents |
| CA2445947A1 (en) | 2001-04-30 | 2002-11-07 | Targeted Genetics Corporation | Lipid-comprising drug delivery complexes and methods for their production |
| DE10127526A1 (de) | 2001-05-31 | 2002-12-12 | Novosom Ag | Verfahren zur Herstellung und Auflösung von Nano- und Mikrokapseln |
| US7101995B2 (en) | 2001-08-27 | 2006-09-05 | Mirus Bio Corporation | Compositions and processes using siRNA, amphipathic compounds and polycations |
| DE10152145A1 (de) | 2001-10-19 | 2003-05-22 | Novosom Ag | Stabilisierung von Liposomen und Emulsionen |
| AU2002368202B2 (en) | 2001-11-02 | 2008-06-05 | Insert Therapeutics, Inc | Methods and compositions for therapeutic use of RNA interference |
| WO2003057190A1 (en) | 2001-12-31 | 2003-07-17 | Elan Pharmaceuticals, Inc. | Efficient nucleic acid encapsulation into medium sized liposomes |
| WO2003066069A1 (en) | 2002-02-01 | 2003-08-14 | Intradigm Corporation | Polymers for delivering peptides and small molecules in vivo |
| US20050222064A1 (en) | 2002-02-20 | 2005-10-06 | Sirna Therapeutics, Inc. | Polycationic compositions for cellular delivery of polynucleotides |
| WO2003072637A1 (en) | 2002-02-22 | 2003-09-04 | Insert Therapeutics, Inc. | Carbohydrate-modified polymers, compositions and uses related thereto |
| US7037520B2 (en) | 2002-03-22 | 2006-05-02 | Baylor College Of Medicine | Reversible masking of liposomal complexes for targeted delivery |
| WO2003083443A2 (en) | 2002-03-29 | 2003-10-09 | University Of Florida | Lipid mediated screening of drug candidates for identification of active compounds |
| DE60328383D1 (de) | 2002-05-24 | 2009-08-27 | Mirus Bio Corp | Zusammensetzungen zur zuführung von nukleinsäuren an zellen |
| US7682626B2 (en) | 2003-02-07 | 2010-03-23 | Roche Madison Inc. | Polyvinylethers for delivery of polynucleotides to mammalian cells |
| EP2173342A2 (en) * | 2007-06-22 | 2010-04-14 | ETH Zurich | Antivirals |
| WO2010008411A1 (en) * | 2007-11-09 | 2010-01-21 | The Salk Institute For Biological Studies | Use of tam receptor inhibitors as immunoenhancers and tam activators as immunosuppressors |
| CN102256617B (zh) * | 2008-10-17 | 2015-04-08 | 伦敦健康科学中心研究公司 | 膜联蛋白及其治疗炎性病症的用途 |
| IN2014DN07023A (ja) | 2012-02-21 | 2015-04-10 | Inst Nat Sante Rech Med |
-
2013
- 2013-02-20 MX MX2014010015A patent/MX2014010015A/es unknown
- 2013-02-20 JP JP2014558089A patent/JP2015509943A/ja active Pending
- 2013-02-20 IN IN7022DEN2014 patent/IN2014DN07022A/en unknown
- 2013-02-20 EP EP13705182.7A patent/EP2817328A1/en not_active Withdrawn
- 2013-02-20 WO PCT/EP2013/053388 patent/WO2013124324A1/en active Application Filing
- 2013-02-20 BR BR112014021065A patent/BR112014021065A8/pt not_active IP Right Cessation
- 2013-02-20 US US14/379,914 patent/US20160015808A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| BR112014021065A2 (pt) | 2017-08-22 |
| MX2014010015A (es) | 2015-06-05 |
| BR112014021065A8 (pt) | 2018-04-24 |
| IN2014DN07022A (ja) | 2015-04-10 |
| EP2817328A1 (en) | 2014-12-31 |
| WO2013124324A1 (en) | 2013-08-29 |
| US20160015808A1 (en) | 2016-01-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2015509943A (ja) | ウイルス侵入補助因子としてのtamレセプター | |
| Mittler et al. | Hantavirus entry: Perspectives and recent advances | |
| JP2015513535A (ja) | ウイルス侵入補助因子としてのtimレセプター | |
| Cruz-Oliveira et al. | Receptors and routes of dengue virus entry into the host cells | |
| AU2009201478B2 (en) | The severe acute respiratory syndrome coronavirus | |
| WO2021170131A1 (zh) | 可溶性ace2和融合蛋白,及其应用 | |
| JP2019523647A (ja) | ジカ感染の予防および/または治療方法における使用のためのデング熱に対する中和抗体 | |
| Tang et al. | Small molecule inhibits respiratory syncytial virus entry and infection by blocking the interaction of the viral fusion protein with the cell membrane | |
| Pan et al. | Development of horse neutralizing immunoglobulin and immunoglobulin fragments against Junín virus | |
| WO2022096899A1 (en) | Viral spike proteins and fusion thereof | |
| JP5283106B2 (ja) | C型肝炎ウイルス阻害剤 | |
| CA3172421A1 (en) | Inhibitors of c5a for the treatment of corona virus infection | |
| CA2875391A1 (en) | Cd147 as receptor for pilus-mediated adhesion of meningococci to vascular endothelia | |
| US20170000849A1 (en) | Cd300a receptors as virus entry cofactors | |
| US20230312684A1 (en) | Neuropilin and angiotensin converting enzyme 2 fusion peptides for treating viral infections | |
| US11723968B2 (en) | Stabilized recombinant hantaviral spike proteins comprising mutations in Gc | |
| US20220168404A1 (en) | Methods and compositions for the treatment of coronavirus infection, including sars-cov-2 | |
| WO2017203436A2 (en) | Hanta virus gc fragments inhibiting the fusion of the virus with a cell | |
| TW202228765A (zh) | 重組ACE2-Fc融合分子以及製造與使用其的方法 | |
| Prado et al. | SINGLE-DOMAIN ANTIBODIES APPLIED AS ANTIVIRAL IMMUNOTHERAPEUTICS | |
| KR20230163512A (ko) | 고효능 폴리펩타이드-기반 단백질 억제를 위한 방법 및 조성물 | |
| Rinkenberger | Characterization of Host Factors Affecting Viral Entry | |
| WO2021216954A1 (en) | Compositions and methods for treating or preventing virus infection | |
| Chamberlain | Pathological Consequences Of Pdi Oxidoreductase Activity On Viral Protein Maturation | |
| WO2012107589A1 (en) | Methods and pharmaceutical compositions for the treatment and prevention of hcv infections |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20150312 |