JP2015513535A - ウイルス侵入補助因子としてのtimレセプター - Google Patents
ウイルス侵入補助因子としてのtimレセプター Download PDFInfo
- Publication number
- JP2015513535A JP2015513535A JP2014558090A JP2014558090A JP2015513535A JP 2015513535 A JP2015513535 A JP 2015513535A JP 2014558090 A JP2014558090 A JP 2014558090A JP 2014558090 A JP2014558090 A JP 2014558090A JP 2015513535 A JP2015513535 A JP 2015513535A
- Authority
- JP
- Japan
- Prior art keywords
- tim
- inhibitor
- receptor
- sequence
- phosphatidylserine
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/713—Double-stranded nucleic acids or oligonucleotides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/177—Receptors; Cell surface antigens; Cell surface determinants
- A61K38/1774—Immunoglobulin superfamily (e.g. CD2, CD4, CD8, ICAM molecules, B7 molecules, Fc-receptors, MHC-molecules)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39583—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials not provided for elsewhere, e.g. haptens, coenzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2863—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for growth factors, growth regulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/44—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material not provided for elsewhere, e.g. haptens, metals, DNA, RNA, amino acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
- C12N15/1138—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing against receptors or cell surface proteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
- A61K2039/507—Comprising a combination of two or more separate antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/30—Non-immunoglobulin-derived peptide or protein having an immunoglobulin constant or Fc region, or a fragment thereof, attached thereto
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/11—Antisense
- C12N2310/111—Antisense spanning the whole gene, or a large part of it
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering N.A.
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Abstract
Description
本発明は、ウイルス感染を予防または治療するための、ホスファチジルセリンとTIMレセプターとの間の相互作用の阻害剤の使用に関する。
ウイルス感染は、公衆衛生にとっての大きな脅威である。ウイルスによって引き起こされる生死に関わる疾患(例えば出血熱および脳炎)の出現および拡大は、まだ対処されていない従来の予防アプローチ(例えばワクチン)と共に、これらの致命的な病原体をターゲティングする新しい戦略を探究する必要性を浮き彫りにしている。
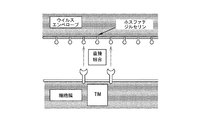
本発明者らは、DV感染がDVウイルスエンベロープ表面に存在するホスファチジルセリン(PtdSer)とホスト細胞表面に存在するTIMレセプターとの間の相互作用によって媒介されること、および当該相互作用を遮断することによってホスト細胞内へのDVの侵入を阻害してDV感染を予防することができることを見いだした。
「ホスファチジルセリン保有ウイルス感染」は、その膜にPtdSerを発現または組み入れているエンベロープウイルスの感染を意味する。感染前に、ウイルス膜上のPtdSerがホスト細胞のレセプターに曝される。PtdSerを保有するエンベロープウイルスの例には、非限定的にフラビウイルス(デングウイルス、ウエストナイルウイルス、黄熱ウイルスなど)、アルファウイルス(例えばチクングニヤウイルス)、フィロウイルス(例えばエボラウイルス)、ポックスウイルス(Poxivirus)(例えば牛痘ウイルス)およびアレナウイルス(例えばラッサウイルス)が含まれる。
ホスファチジルセリンは、リン酸基がセリンアミノ酸と結合しているリン脂質であって、CAS番号8002−43−5で参照されるリン脂質である。
a)配列番号5の配列(GenBank番号AAH13325.1、2003年10月4日更新)、
b)配列番号6の核酸(NCBI参照配列NM_012206.2、2011年11月26日更新)によってコードされる配列、
c)配列番号7の核酸(NCBI参照配列NM_001099414.1、2011年11月26日更新)によってコードされる配列、
d)配列番号8の核酸(NCBI参照配列NM_001173393.1、2011年12月4日更新)によってコードされる配列、
e)a)〜d)の配列と少なくとも80、85、90、95、96、97、98、99%同一な配列
を含むまたはそれから成る。
a)配列番号9の配列(GenBank番号AAH20843.1、2003年9月16日更新)、
b)配列番号10の配列(GenBank番号AAH63431.1、2006年7月15日更新)、
c)配列番号11の核酸(NCBI参照配列NM_032782.4、2011年12月25日更新)によってコードされる配列、
d)a)〜c)の配列と少なくとも80、85、90、95、96、97、98、99%同一な配列
を含むまたはそれから成る。
a)配列番号12の配列(NCBI参照配列NP_612388.2、2011年12月24日更新)、
b)配列番号13の配列(NCBI参照配列NP_001140198.1、2011年12月25日更新)、
c)配列番号14の核酸(NCBI参照配列NM_138379.2、2011年12月24日更新)によってコードされる配列、
d)配列番号15の核酸(NCBI参照配列NM_001146726.1、2011年12月25日更新)によってコードされる配列、
e)a)〜d)の配列と少なくとも80、85、90、95、96、97、98、99%同一な配列
を含むまたはそれから成る。
a)配列番号16の配列(NCBI参照配列NP_001145.1、2012年2月1日更新)、
b)配列番号17の配列の核酸(NCBI参照配列NM_001154.3、2011年12月18日更新)によってコードされる配列、
c)a)またはb)の配列と少なくとも80、85、90、95、96、97、98、99%同一な配列
を含むまたはそれから成る。
好ましい一態様では、本発明による阻害剤は、少なくとも1種の他の抗ウイルス化合物と組み合わせて連続的または同時のいずれかで投与するためのものである。
a)配列番号18の配列(NCBI参照配列NP_006284.2、2011年11月14日更新)、
b)配列番号19の配列の核酸(NCBI参照配列NM_006293.3、2012年1月14日更新)によってコードされる配列、
c)a)またはb)の配列と少なくとも80、85、90、95、96、97、98、99%同一な配列
を含むまたはそれから成る。
a)配列番号20の配列(NCBI参照配列NP_001690.2、2011年11月26日更新)、
b)配列番号21の配列(NCBI参照配列NP_068713.2、2011年11月26日更新)、
c)配列番号22の配列の核酸(NCBI参照配列NM_021913.3、2012年1月15日更新)によってコードされる配列、
d)配列番号23の配列の核酸(NCBI参照配列NM_001699.4、2012年1月15日更新)によってコードされる配列、
e)a)〜d)の配列と少なくとも80、85、90、95、96、97、98、99%同一な配列
を含むまたはそれから成る。
a)配列番号24の配列(NCBI参照配列NP_006334.2、2011年12月24日更新)、
b)配列番号25の配列の核酸(NCBI参照配列NM_006343.2、2011年12月24日更新)によってコードされる配列、
c)a)またはb)の配列と少なくとも80、85、90、95、96、97、98、99%同一な配列
を含むまたはそれから成る。
a)配列番号26の配列(NCBI参照配列NP_000811.1、2011年12月24日更新)、
b)配列番号27の配列(NCBI参照配列NP_001137417.1、2011年12月24日更新)、
c)配列番号28の配列(NCBI参照配列NP_001137418.1、2011年12月24日更新)、
d)配列番号29の配列の核酸(NCBI参照配列NM_000820.2、2012年1月15日更新)によってコードされる配列、
e)配列番号30の配列の核酸(NCBI参照配列NM_001143945.1、2012年1月15日更新)によってコードされる配列、
f)配列番号31の配列の核酸(NCBI参照配列NM_001143946.1、2012年1月15日更新)によってコードされる配列、
g)a)〜f)の配列と少なくとも80、85、90、95、96、97、98、99%同一な配列
を含むまたはそれから成る。
本発明による阻害剤は、細胞内へのPtdSer保有ウイルスの侵入を阻害する方法に使用することができる。
本発明による阻害剤は、単独で、または少なくとも1種の他の抗ウイルス化合物と組み合わせて、薬学的に許容されうる組成物に製剤化することができる。
本発明は、また、本発明による阻害剤の治療有効量を投与することを含む、それを必要とする個体におけるPtdSer保有ウイルス感染を予防または治療するための方法に関する。
配列番号1にTIM−1に対するsiRNAの配列5’−AAACUCAACUGUUCCUACA−3’を示す。
配列番号2にTIM−1に対するsiRNAの配列5’−CGGAAGGACACACGCUAUA−3’を示す。
配列番号3にTIM−1に対するsiRNAの配列5’−GCAGAAACCCACCCUACGA−3’を示す。
配列番号4にTIM−1に対するsiRNAの配列5’−GGUCACGACUACUCCAAUU−3’を示す。
配列番号5にGenBank番号AAH13325.1で参照されるTIM−1レセプターのアミノ酸配列を示す。
配列番号6にNCBI参照配列NM_012206.2で参照されるTIM−1レセプターの核酸配列を示す。
配列番号7にNCBI参照配列NM_001099414.1で参照されるTIM−1レセプターの核酸配列を示す。
配列番号8にNCBI参照配列NM_001173393.1で参照されるTIM−1レセプターの核酸配列を示す。
配列番号9にGenBank番号AAH20843.1で参照されるTIM−3レセプターのアミノ酸配列を示す。
配列番号10にGenBank番号AAH63431.1で参照されるTIM−3レセプターのアミノ酸配列を示す。
配列番号11にNCBI参照配列NM_032782.4で参照されるTIM−3レセプターの核酸配列を示す。
配列番号12にNCBI参照配列NP_612388.2で参照されるTIM−4レセプターのアミノ酸配列を示す。
配列番号13にNCBI参照配列NP_001140198.1で参照されるTIM−4レセプターのアミノ酸配列を示す。
配列番号14にNCBI参照配列NM_138379.2で参照されるTIM−4レセプターの核酸配列を示す。
配列番号15にNCBI参照配列NM_001146726.1で参照されるTIM−4レセプターの核酸配列を示す。
配列番号16にNCBI参照配列NP_001145.1で参照されるアネキシン5のアミノ酸配列を示す。
配列番号17にNCBI参照配列NM_001154.3で参照されるアネキシン5の核酸配列を示す。
配列番号18にNCBI参照配列NP_006284.2で参照されるTYRO−3レセプターのアミノ酸配列を示す。
配列番号19にNCBI参照配列NM_006293.3で参照されるTYRO−3レセプターの核酸配列を示す。
配列番号20にNCBI参照配列NP_001690.2で参照されるAXLレセプターのアミノ酸配列を示す。
配列番号21にNCBI参照配列NP_068713.2で参照されるAXLレセプターのアミノ酸配列を示す。
配列番号22にNCBI参照配列NM_021913.3で参照されるAXLレセプターの核酸配列を示す。
配列番号23にNCBI参照配列NM_001699.4で参照されるAXLレセプターの核酸配列を示す。
配列番号24にNCBI参照配列NP_006334.2で参照されるMERレセプターのアミノ酸配列を示す。
配列番号25にNCBI参照配列NM_006343.2で参照されるMERレセプターの核酸配列を示す。
配列番号26にNCBI参照配列NP_000811.1で参照されるGas6タンパク質のアミノ酸配列を示す。
配列番号27にNCBI参照配列NP_001137417.1で参照されるGas6タンパク質のアミノ酸配列を示す。
配列番号28にNCBI参照配列NP_001137418.1で参照されるGas6タンパク質のアミノ酸配列を示す。
配列番号29にNCBI参照配列NM_000820.2で参照されるGas6タンパク質の核酸配列を示す。
配列番号30にNCBI参照配列NM_001143945.1で参照されるGas6タンパク質の核酸配列を示す。
配列番号31にNCBI参照配列NM_001143946.1で参照されるGas6タンパク質の核酸配列を示す。
配列番号32にAXLに対するsiRNAの配列5’−ACAGCGAGAUUUAUGACUA−3’を示す。
配列番号33にAXLに対するsiRNAの配列5’−GGUACCGGCUGGCGUAUCA−3’を示す。
配列番号34にAXLに対するsiRNAの配列5’−GACGAAAUCCUCUAUGUCA−3’を示す。
配列番号35にAXLに対するsiRNAの配列5’−GAAGGAGACCCGUUAUGGA−3’を示す。
配列番号36に変異型Gas6ΔGlaタンパク質の配列を示す。
配列番号37にTYRO−3クローニング用の外部プライマーの配列を示す。
配列番号38にTYRO−3クローニング用の内部プライマーの配列を示す。
配列番号39にTYRO−3クローニング用の内部プライマーの配列を示す。
配列番号40にTYRO−3クローニング用の外部プライマーの配列を示す。
配列番号41にAXLクローニング用のプライマーの配列を示す。
配列番号42にAXLクローニング用のプライマーの配列を示す。
配列番号43にTIM−1エクトドメイン増幅用のプライマーの配列を示す。
配列番号44にTIM−1エクトドメイン増幅用のプライマーの配列を示す。
配列番号45にTIM−4エクトドメイン増幅用のプライマーの配列を示す。
配列番号46にTIM−4エクトドメイン増幅用のプライマーの配列を示す。
配列番号47にUniProt番号Q96D42で参照されるTIM−1レセプターのアミノ酸配列を示す。
材料および方法
cDNAライブラリースクリーニング
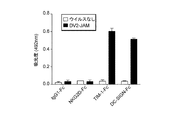
cDNAスクリーニングについて、アレイ化された全長cDNAライブラリー33からバイオインフォマティクスに基づいて推定上の細胞レセプターをコードする1728種の遺伝子を選択した。第1ラウンドのスクリーニングで、リポフェクタミンLTXを使用して8種のcDNAのプール216種を293T細胞にトランスフェクションした。次に、トランスフェクション後の293T細胞をDV2−JAM初代株(MOI=2)と共に48時間インキュベーションし、DV prMタンパク質を認識する2H2 mAbを使用するFACSによって感染をスコア化した。293T細胞をprMタンパク質の細胞内染色陽性にしたcDNAのプールを、第2ラウンドのスクリーニングに入れ、第2ラウンドのスクリーニングでは各プールを構成している単一のcDNAを個別に検査した。
限られた細胞継代をされた後、蚊(Aedes pseudoscutellaris)AP61細胞単層中でDV−1−TVP株、DV2−JAM株(Jamaica)、DV2−New Guinea C株、DV2−16881株、DV3−PAH881株(Thailand)およびDV4−1086株を増殖させた。注目すべきは、哺乳動物細胞において産生されたDVは、昆虫細胞起源のウイルスと類似の結果を与えた。ウイルス力価を、C6/36細胞を用いたフローサイトメトリー分析(FACS)によって評価し、FACS感染単位(FIU)として表現した。HEK 293T、A549、VERO、およびHuh7 5.1細胞(贈与:C.Rice, New York, USA)を、10%FBS、1%ペニシリン/ストレプトマイシンを補充したDMEM中で維持した。ヒト初代星状膠細胞および上皮細胞をLONZAから購入し、製造された条件に応じて培養した。
N末端Glaドメイン(rmGas6ΔGla)、リコンビナントヒトIgG1−Fc、TYRO3−Fc、AXL−Fc、DC−SIGN−Fc、TIM−3−FcおよびNKG2D−Fcを欠如するリコンビナントマウスGas6はR&D systems製であった。抗体は以下の通りであった:マウスモノクローナル(mAb)抗ヒトTIM−1(クローン219211)、抗ヒトTYRO3(クローン96201)、抗ヒトAXL(クローン108724)、IgG2bアイソタイプ(MAB004)、IgG1アイソタイプ(クローン11711)、抗ヒトDC−SIGN PEコンジュゲーション型(クローンクローン120507)、IgG2B PEコンジュゲーション型アイソタイプ(クローン133303)、ヤギポリクローナル(pAb)抗ヒトTIM−1(AF1750)、抗ヒトTIM−4(AF2929)、抗ヒトTyro3(AF859)、抗ヒトAXL(AF154)はR&D systems製であった。マウスモノクローナル抗ヒトホスファチジルセリン(1H6)は、Milliporeから購入した。ポリクローナルウサギ抗ヒトIgG−HRPはDakoCytomation製であり、ロバ抗ヤギIgG−HRPはSanta Cruz biotechnologies製であった。
Life TechnologiesおよびOrigeneから購入したcDNAから、それぞれTim−1遺伝子およびTim−4遺伝子のオープンリーディングフレーム(ORF)を増幅した。スクリーニングで特定されたcDNAクローンからTim−3のORFを増幅した。BamHIおよびXhoI制限部位を使用して全てのTIM ORFをpCDNA3.1およびpTRIPベクターにクローニングした。
従来のリン酸カルシウムトランスフェクションプロトコールにより、HIV gag−polをコードするプラスミドを有するpTRIP構築物および水疱性口内炎ウイルスエンベロープG(VSVg)タンパク質をコードするプラスミドを有するpTRIP構築物を293T細胞に同時トランスフェクションすることによってシュードウイルスを発生させた。2日後に上清を回収し、低速遠心分離により透明にし、超遠沈によりシュードパーティクルを濃縮した。ペレットをTNE緩衝液(トリス50mM、NaCl 100mMおよびEDTA 0.5mM)中に再懸濁し、小分けし、−80℃で保存した。293T細胞(1.5×105個)に所望のORFを保持するシュードウイルスをトランスダクションした。TIM−1、TIM−4、TYRO3およびAXLの高い細胞表面発現を有する細胞集団を、FACSDiva 6.1.2ソフトウェア(Becton Dickinson)を備えるBD FACSAria II(Becton Dickinson)でソーティングした。
ヒトIgG1 FcとTIM−1との融合タンパク質およびTIM−4との融合タンパク質を以下のように発生させた。TIM−1エクトドメイン(残基21〜290番)を、5’ATCGGAGATATCT GTA AAG GTT GGT GGA GAG GCA GGT CC(配列番号43)プライマーおよび3’TCTGGAAGATCTTCC TTT AGT GGT ATT GGC CGT CAG(配列番号44)プライマーを用いて増幅した。TIM−4エクトドメイン(残基25〜314番)を5’ATCGGAGATATCA GAG ACT GTT GTG ACG GAG GTT TTG GG(配列番号45)プライマーおよび3’TCTGGAAGATCTTTG GGA GAT GGG CAT TTC ATT CTTC (配列番号46)プライマーを用いて増幅した。EcoRVおよびBglII制限部位(最初および最後のTIMコドンは太字;制限エンドヌクレアーゼ部位に下線)を使用して両方のPCR産物をpFUSE−hIgG1−Fc2(Invivogen)にクローニングした。TIM−1−FcおよびTIM−4−Fc融合体発現ベクターを、10%FBSを補充したイソコフ改変ダルベッコ培地中の293T細胞にトランスフェクションし、トランスフェクション後はOPTIPRO−SFM(Life Technologies)中で培養した。両方の培地にP/SおよびL−グルタミンを補充した。トランスフェクションの4日後に、上清を回収し、遠心分離によって透明にし、Amicon 50K MWCO(Millipore)により濃縮した。TIM−FcをプロテインAカラムで精製し、30K MWCO PESフィルターユニット(Pierce)を通過させて濃縮/脱塩した。リン酸緩衝塩類溶液(PBS)(0.02%NaN3を補充)中にタンパク質を保存し、続いて−80℃で小分けした。280nmの吸光度を利用してタンパク質を定量し、SDS−PAGE条件で泳動した試料をクマシーブルー染色(R250)して還元条件でそれらの純度を評価した。
TIM−FcとDVとの間の直接相互作用を検出するために、最初に、10mM CaCl2を補充したトリス緩衝塩類溶液(TBS)中のFc融合タンパク質を、96ウェルMaxisorp NUNC-IMMUNOプレート(NUNC)上に4℃で一晩被覆した(二つ組、400ng/ウェル)。ウェルをTBS(10mM CaCl2を補充)で洗浄し、37℃のTBS(10mM CaCl2および2%BSAを補充)で2時間飽和させた。TBS(10mM CaCl2および0.05%Tweenを補充)で徹底的に洗浄した後、DV粒子(5×106FACS感染単位(FIU)/ウェル)を添加し、4℃で2時間インキュベーションした。結合した粒子は、ビオチン化4G2抗体(1μg/ml)およびホースラディッシュペルオキシダーゼ(HRP)コンジュゲーション型ストレプトアビジン(R&D systems)を用いて検出した。
TBS(10mM CaCl2を補充)に入れたFc−キメラタンパク質2μgと共にDV粒子(107FIU)を4℃で一晩インキュベーションした。BSA飽和プロテインGセファロースビーズ(GE Healthcare)を添加し、4℃で4時間インキュベーションした。ビーズをTBS(10mM CaCl2および0.05%Tweenを補充)で4回洗浄し、結合している物質を非還元条件の1×Laemmli緩衝液中で分離した。ニトロセルロース結合型Eエンベロープ糖タンパク質を、4G2 mAbおよびHRPコンジュゲーション型ウサギ抗マウスIgG抗体(Sigma-Aldrich)を用いて検出した。
TIM−1、TIM−4、TYRO3、AXLまたはDC−SIGNを発現している293T細胞(4×105個)を、2%BSAまたは5%FBSのいずれかを含有する結合緩衝液(DMEM、0.05%NaN3)中で表示のMOIのDVと共に4℃で90分間インキュベーションした。細胞をヘパリン100Uと共に室温で30分間インキュベーションし、その後ウイルスと共にインキュベーションした。細胞を冷結合緩衝液で2回、無血清冷DMEMで1回洗浄し、4℃のPBS−PFA 2%中で20分間固定した。細胞表面に吸収されたDV粒子を抗汎フラビウイルスエンベロープ4G2抗体(5μg/ml)で染色し、フローサイトメトリーにより分析した。架橋アッセイのために、細胞をウイルスおよびrGas6(10μg/ml)と共に同時にインキュベーションした。
冷PBS中の0.02%NaN3および5%FBSの存在下で、以下の従来プロトコールによってフローサイトメトリー分析を行った。感染アッセイのために、感染細胞を2%(v/v)パラホルムアルデヒド(PFA)加PBSで固定し、0.5%(w/v)サポニンで透過処理し、続いてDV prMを検出するマウス2H2 mAb(2μg/ml)または非構造タンパク質−1を検出するマウスNS1 mAb(1μg/ml)を用いて染色した。抗ICP4マウスmAb(クローン10F1、0.3μg/ml; Santa Cruz Biotechnology)を用いてHSV−1感染を検出した。WNV、YFVおよびチクングニヤ感染は、抗タンパク質E抗体(4G2)およびE2エンベロープ糖タンパク質に対するマウスモノクローナル抗体(3E4)で検出した。45分後に、一次抗体をポリクローナルヤギ抗マウス免疫グロブリン/RPE(DakoCytomation)でラベルした。最後に、感染細胞のパーセンテージを、CellQuestソフトウェアを備えるLSR(Becton Dickinson)を用いるフローサイトメトリーによって評価した。FlowJoソフトウェア(Tree Star)を使用することによってデータを解析した。
Lab-Tek II-CC2チャンバースライド(Nunc, Roskilde, Denmark)上で細胞を培養し、表示量のDV2−JAMと共に24または48時間インキュベーションした。インキュベーション後に、PBS−PFA 4%(v/v)で細胞を固定し、PBS中の0.05%(w/v)サポニンで透過処理し、PBS(0.1Mグリシンを補充)中で10分間インキュベーションし、続いてブロッキング緩衝液と共にインキュベーションしてから、DV prMタンパク質(2H2、5μg/ml)の免疫染色を行った。核染色のために4,6−ジアミジノ−2−フェニルインドール(DAPI)を含有するMoviol(Life Technologies)でスライドをマウントした。
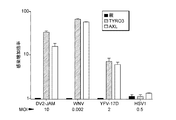
阻害実験のために、24ウェルプレート上に成長した細胞を、表示量の抗TIM抗体および/または抗TAM抗体を含有する培地と共に30分間インキュベーションしてから、感染させた。同一濃度の正常ヤギIgGをそれぞれの疑似対照として使用した。阻害剤の存在下でDVまたはHSVと共に3時間インキュベーション後に、培地を交換し、細胞を培地と共にインキュベーションした。感染を上記のようにFACSによって定量した。
リポフェクタミンRNAiMaxプロトコール(Life Technologies)を使用してA549細胞および初代星状膠細胞に終濃度10nMのsiRNAを一過性トランスフェクションした。48時間後、細胞を表示のMOIで感染させ、感染の24時間後にフローサイトメトリーによって感染細胞のパーセンテージを定量した。本研究に使用したsiRNAのプール(ON-TARGETplus SMARTpool)はDharmacon製であった:TIM−1(L019856−00)、AXL(L−003104−00)。非ターゲティング陰性対照(NT)を対照として使用した。
グラフ表示および統計解析はPrism5ソフトウェア(GraphPad Software)を使用して行った。特に述べない限り、結果は3回の独立した実験の平均±標準偏差(SD)として示す。対応のある両側t検定を用いて差の統計的有意性について検定した。
新しいDV侵入因子を特定するために、初代蚊由来DV2−JAM株に低感受性の293T細胞を感受性にする能力について1728種の細胞膜タンパク質をスクリーニングした。この選別からL−SIGNが特定され、このアプローチの妥当性が確認されたが、新規な潜在的DVレセプターとして、T細胞免疫グロブリンドメイン・ムチンドメイン(TIM)−3、TYRO3およびAXLも特定された。これらは、アポトーシス細胞の貪食を促進する「私を食べて」シグナルであるホスファチジルセリン(PtdSer)と直接(TIM)または間接(TAM)的に結合する二つの別個のファミリーの膜貫通レセプターに属する。次に、DV感染時のこれらのレセプターおよびPtdSerの役割を特徴づけた。
Claims (18)
- ウイルス感染を予防または治療するための使用のための、ホスファチジルセリンとTIMレセプターとの間の相互作用の阻害剤であって、
(i)TIMレセプター阻害剤、および/または
(iii)ホスファチジルセリン結合タンパク質
である阻害剤。 - TIMレセプターが、TIM−1、TIM−3またはTIM−4である、請求項1(i)記載の使用のための阻害剤。
- TIMレセプター阻害剤が、抗TIMレセプター抗体、アンチセンス核酸、模倣体または変異型TIMレセプターである、請求項1または2記載の使用のための阻害剤。
- ホスファチジルセリン結合タンパク質が、抗ホスファチジルセリン抗体またはアネキシン5である、請求項1または2記載の使用のための阻害剤。
- TIMレセプター阻害剤が、配列番号1、2、3、または4の配列のsiRNAである、請求項3記載の使用のための阻害剤。
- ウイルスがホスファチジルセリン保有ウイルスである、請求項1記載の使用のための阻害剤。
- ホスファチジルセリン保有ウイルスが、アルファウイルスまたはフラビウイルスである、請求項1〜6のいずれか一項記載の使用のための阻害剤。
- アルファウイルスがチクングニヤウイルスである、請求項7記載の使用のための阻害剤。
- フラビウイルスが、ウエストナイルウイルス、黄熱ウイルスまたはデング熱ウイルスである、請求項7記載の使用のための阻害剤。
- 前記阻害剤が、少なくとも1種の他の抗ウイルス化合物と組み合わせて連続的または同時のいずれかで投与するための、請求項1〜9のいずれか一項記載の使用のための阻害剤。
- 他の抗ウイルス化合物が、ホスファチジルセリンとTAMレセプターとの相互作用の阻害剤である、請求項10記載の使用のための阻害剤。
- ホスファチジルセリンとTAMレセプターとの相互作用の阻害剤が、
(i)TAMレセプター阻害剤、および/または
(ii)Gas6阻害剤
である、請求項11記載の使用のための阻害剤。 - 前記阻害剤が、薬学的に許容されうる組成物に製剤化される、請求項1〜12のいずれか一項記載の使用のための阻害剤。
- 請求項1〜9のいずれか一項記載の阻害剤および追加的に少なくとも1種の他の抗ウイルス化合物を含む薬学的組成物。
- 少なくとも1種の他の抗ウイルス化合物が、ホスファチジルセリンとTAMレセプターとの相互作用の阻害剤である、請求項14記載の薬学的組成物。
- ホスファチジルセリンとTAMレセプターとの相互作用の阻害剤が、
(i)TAMレセプター阻害剤、および/または
(ii)Gas6阻害剤
である、請求項15記載の薬学的組成物。 - 細胞内へのホスファチジルセリン保有ウイルス、特にフラビウイルスの侵入を阻害するin vitro方法における、請求項1〜9のいずれか一項記載の阻害剤の使用。
- ウイルス感染、特にフラビウイルス感染などのPtdSer保有ウイルス感染を予防または治療するための方法であって、それを必要とする個体に、ホスファチジルセリンとTIMレセプターとの間の相互作用の阻害剤の治療有効量を投与することを含む方法。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP12305193.0 | 2012-02-21 | ||
| EP12305193 | 2012-02-21 | ||
| EP12306281 | 2012-10-17 | ||
| EP12306281.2 | 2012-10-17 | ||
| PCT/EP2013/053391 WO2013124327A1 (en) | 2012-02-21 | 2013-02-20 | Tim receptors as virus entry cofactors |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2015513535A true JP2015513535A (ja) | 2015-05-14 |
| JP2015513535A5 JP2015513535A5 (ja) | 2016-03-10 |
Family
ID=47739275
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014558090A Pending JP2015513535A (ja) | 2012-02-21 | 2013-02-20 | ウイルス侵入補助因子としてのtimレセプター |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US20160017035A1 (ja) |
| EP (1) | EP2817327A1 (ja) |
| JP (1) | JP2015513535A (ja) |
| BR (1) | BR112014021068A8 (ja) |
| IN (1) | IN2014DN07023A (ja) |
| MX (1) | MX2014010016A (ja) |
| WO (1) | WO2013124327A1 (ja) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BR112014021065A8 (pt) | 2012-02-21 | 2018-04-24 | Centre Nat Rech Scient | receptores tam como cofatores de entrada do vírus |
| EP2931317A2 (en) * | 2012-12-13 | 2015-10-21 | Children's Medical Center Corporation | Compositions and methods for inhibiting viral entry |
| WO2015092035A1 (en) * | 2013-12-20 | 2015-06-25 | Institut National De La Sante Et De La Recherche Medicale (Inserm) | Cd300a receptors as virus entry cofactors |
| US20170239329A1 (en) * | 2014-10-15 | 2017-08-24 | Annexin Pharmaceuticals Ab | Therapeutic composition comprising annexin v |
| US10794899B2 (en) * | 2014-12-05 | 2020-10-06 | Fujifilm Wako Pure Chemical Corporation | Tim protein-bound carrier, methods for obtaining, removing and detecting extracellular membrane vesicles and viruses using said carrier, and kit including said carrier |
| MX2018014387A (es) | 2016-05-27 | 2019-03-14 | Agenus Inc | Anticuerpos anti proteina inmunoglobulina de linfocitos t y dominio de mucina 3 (tim-3) y métodos para usarlos. |
| JP7027401B2 (ja) | 2016-07-14 | 2022-03-01 | ブリストル-マイヤーズ スクイブ カンパニー | Tim3に対する抗体およびその使用 |
| WO2019191406A1 (en) * | 2018-03-29 | 2019-10-03 | H. Lee Moffitt Cancer Center And Research Institute Inc. | Chimeric tim-3 fusion protein |
| US11197910B1 (en) * | 2020-08-19 | 2021-12-14 | Vitruviae LLC | Fusion proteins for the diagnosis, prophylaxis and treatment of infectious diseases |
Family Cites Families (37)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1993023569A1 (en) | 1992-05-11 | 1993-11-25 | Ribozyme Pharmaceuticals, Inc. | Method and reagent for inhibiting viral replication |
| US6620805B1 (en) | 1996-03-14 | 2003-09-16 | Yale University | Delivery of nucleic acids by porphyrins |
| DE69727384T2 (de) | 1996-05-24 | 2004-11-04 | IC-VEC Ltd. | Polykatonische sterin-derivate zur transfektion |
| US5849902A (en) | 1996-09-26 | 1998-12-15 | Oligos Etc. Inc. | Three component chimeric antisense oligonucleotides |
| US6001311A (en) | 1997-02-05 | 1999-12-14 | Protogene Laboratories, Inc. | Apparatus for diverse chemical synthesis using two-dimensional array |
| US20030229040A1 (en) | 1997-03-21 | 2003-12-11 | Georgetown University | Cationic liposomal delivery system and therapeutic use thereof |
| DE69841002D1 (de) | 1997-05-14 | 2009-09-03 | Univ British Columbia | Hochwirksame verkapselung von nukleinsäuren in lipidvesikeln |
| AU731909B2 (en) | 1997-07-01 | 2001-04-05 | Isis Pharmaceuticals, Inc. | Compositions and methods for the delivery of oligonucleotides via the alimentary canal |
| US20030073640A1 (en) | 1997-07-23 | 2003-04-17 | Ribozyme Pharmaceuticals, Inc. | Novel compositions for the delivery of negatively charged molecules |
| CA2301166A1 (en) | 1997-07-24 | 1999-02-04 | Yuan-Peng Zhang | Liposomal compositions for the delivery of nucleic acid catalysts |
| JP2003525017A (ja) | 1998-04-20 | 2003-08-26 | リボザイム・ファーマシューティカルズ・インコーポレーテッド | 遺伝子発現を調節しうる新規な化学組成を有する核酸分子 |
| US7112337B2 (en) | 1999-04-23 | 2006-09-26 | Alza Corporation | Liposome composition for delivery of nucleic acid |
| US7098032B2 (en) | 2001-01-02 | 2006-08-29 | Mirus Bio Corporation | Compositions and methods for drug delivery using pH sensitive molecules |
| US20050037086A1 (en) | 1999-11-19 | 2005-02-17 | Zycos Inc., A Delaware Corporation | Continuous-flow method for preparing microparticles |
| EP1292285A4 (en) | 2000-06-02 | 2009-07-22 | Eisai Corp North America | SYSTEMS FOR DISPENSING BIOACTIVE AGENTS |
| US7427394B2 (en) | 2000-10-10 | 2008-09-23 | Massachusetts Institute Of Technology | Biodegradable poly(β-amino esters) and uses thereof |
| WO2002076427A2 (en) | 2001-03-26 | 2002-10-03 | Thomas Jefferson University | Ph sensitive liposomal drug delivery |
| WO2002076428A1 (en) | 2001-03-26 | 2002-10-03 | Alza Corporation | Liposome composition for improved intracellular delivery of a therapeutic agent |
| US20030026831A1 (en) | 2001-04-20 | 2003-02-06 | Aparna Lakkaraju | Anionic liposomes for delivery of bioactive agents |
| US20030203865A1 (en) | 2001-04-30 | 2003-10-30 | Pierrot Harvie | Lipid-comprising drug delivery complexes and methods for their production |
| DE10127526A1 (de) | 2001-05-31 | 2002-12-12 | Novosom Ag | Verfahren zur Herstellung und Auflösung von Nano- und Mikrokapseln |
| US7101995B2 (en) | 2001-08-27 | 2006-09-05 | Mirus Bio Corporation | Compositions and processes using siRNA, amphipathic compounds and polycations |
| DE10152145A1 (de) | 2001-10-19 | 2003-05-22 | Novosom Ag | Stabilisierung von Liposomen und Emulsionen |
| IL161733A0 (en) | 2001-11-02 | 2005-11-20 | Insert Therapeutics Inc | Methods and compositions for therapeutic use of rna interference |
| WO2003057190A1 (en) | 2001-12-31 | 2003-07-17 | Elan Pharmaceuticals, Inc. | Efficient nucleic acid encapsulation into medium sized liposomes |
| EP1480657A4 (en) | 2002-02-01 | 2006-07-05 | Intradigm Corp | POLYMERS FOR ADMINISTERING PEPTIDES AND SMALL MOLECULES IN VIVO / I |
| US20050222064A1 (en) | 2002-02-20 | 2005-10-06 | Sirna Therapeutics, Inc. | Polycationic compositions for cellular delivery of polynucleotides |
| AU2003239121A1 (en) | 2002-02-22 | 2003-09-09 | Insert Therapeutics, Inc. | Carbohydrate-modified polymers, compositions and uses related thereto |
| US7037520B2 (en) | 2002-03-22 | 2006-05-02 | Baylor College Of Medicine | Reversible masking of liposomal complexes for targeted delivery |
| US20030198664A1 (en) | 2002-03-29 | 2003-10-23 | Sullivan Sean Michael | Lipid mediated screening of drug candidates for identification of active compounds |
| DE60328383D1 (de) | 2002-05-24 | 2009-08-27 | Mirus Bio Corp | Zusammensetzungen zur zuführung von nukleinsäuren an zellen |
| US7682626B2 (en) | 2003-02-07 | 2010-03-23 | Roche Madison Inc. | Polyvinylethers for delivery of polynucleotides to mammalian cells |
| US20100272706A1 (en) | 2007-06-22 | 2010-10-28 | Jason Mercer | Antivirals |
| WO2009062112A2 (en) | 2007-11-09 | 2009-05-14 | The Salk Institute For Biological Studies | Use of tam receptor inhibitors as antimicrobials |
| CA2740557C (en) | 2008-10-17 | 2020-04-14 | London Health Sciences Centre Research Inc. | Annexin and its use to treat inflammatory disorders |
| JP2013532153A (ja) * | 2010-06-18 | 2013-08-15 | ザ ブリガム アンド ウィメンズ ホスピタル インコーポレイテッド | 慢性免疫病に対する免疫治療のためのtim−3およびpd−1に対する二重特異性抗体 |
| BR112014021065A8 (pt) | 2012-02-21 | 2018-04-24 | Centre Nat Rech Scient | receptores tam como cofatores de entrada do vírus |
-
2013
- 2013-02-20 WO PCT/EP2013/053391 patent/WO2013124327A1/en active Application Filing
- 2013-02-20 US US14/379,879 patent/US20160017035A1/en not_active Abandoned
- 2013-02-20 EP EP13704966.4A patent/EP2817327A1/en not_active Withdrawn
- 2013-02-20 BR BR112014021068A patent/BR112014021068A8/pt not_active IP Right Cessation
- 2013-02-20 MX MX2014010016A patent/MX2014010016A/es unknown
- 2013-02-20 IN IN7023DEN2014 patent/IN2014DN07023A/en unknown
- 2013-02-20 JP JP2014558090A patent/JP2015513535A/ja active Pending
Non-Patent Citations (3)
| Title |
|---|
| CELL HOST & MICROBE, vol. 9, JPN6016045121, 2011, pages 286 - 298, ISSN: 0003445895 * |
| NATURE MEDICINE, vol. 14, no. 12, JPN7016003582, 2008, pages 1357 - 1362, ISSN: 0003445896 * |
| PNAS, vol. 108, no. 20, JPN6016045119, 2011, pages 8426 - 8431, ISSN: 0003445894 * |
Also Published As
| Publication number | Publication date |
|---|---|
| BR112014021068A2 (pt) | 2017-08-22 |
| MX2014010016A (es) | 2015-06-05 |
| BR112014021068A8 (pt) | 2018-01-23 |
| US20160017035A1 (en) | 2016-01-21 |
| EP2817327A1 (en) | 2014-12-31 |
| WO2013124327A1 (en) | 2013-08-29 |
| IN2014DN07023A (ja) | 2015-04-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2015513535A (ja) | ウイルス侵入補助因子としてのtimレセプター | |
| JP2015509943A (ja) | ウイルス侵入補助因子としてのtamレセプター | |
| Mittler et al. | Hantavirus entry: Perspectives and recent advances | |
| CN115811986A (zh) | 冠状病毒疫苗 | |
| CN107847591B (zh) | 多价人免疫缺陷病毒抗原结合分子及其应用 | |
| JP2023513502A (ja) | コロナウイルスワクチン | |
| US20230129210A1 (en) | Binding proteins useful against ace2-targeted viruses | |
| AU2004230485A1 (en) | The severe acute respiratory syndrome coronavirus | |
| WO2021170131A1 (zh) | 可溶性ace2和融合蛋白,及其应用 | |
| CA3181108A1 (en) | Therapeutic antibodies with neutralizing activity against sars-cov-2 glycoprotein s | |
| KR20220111289A (ko) | 항-황열 바이러스 항체, 및 이의 생성 및 사용 방법 및 용도 | |
| US20200317753A1 (en) | Humanized Antibodies Against Enterovirus 71 | |
| WO2022096899A1 (en) | Viral spike proteins and fusion thereof | |
| JP2023528017A (ja) | 重症急性呼吸器症候群コロナウイルス2(sars-cov-2)ポリペプチドおよびワクチン目的でのその使用 | |
| Pan et al. | Development of horse neutralizing immunoglobulin and immunoglobulin fragments against Junín virus | |
| Gunnels et al. | Elucidating design principles for engineering cell‐derived vesicles to inhibit SARS‐CoV‐2 infection | |
| US20170000849A1 (en) | Cd300a receptors as virus entry cofactors | |
| Sauter et al. | Role of the capsid protein VP4 in the plasma-dependent enhancement of the Coxsackievirus B4E2-infection of human peripheral blood cells | |
| JP2023537546A (ja) | 組換えace2-fc融合分子、その製造方法及びその使用 | |
| TW202140571A (zh) | 重組ace2-fc融合分子以及製造及使用彼等之方法 | |
| WO2017203436A2 (en) | Hanta virus gc fragments inhibiting the fusion of the virus with a cell | |
| US20220168404A1 (en) | Methods and compositions for the treatment of coronavirus infection, including sars-cov-2 | |
| US11723968B2 (en) | Stabilized recombinant hantaviral spike proteins comprising mutations in Gc | |
| TW202228765A (zh) | 重組ACE2-Fc融合分子以及製造與使用其的方法 | |
| Prado et al. | SINGLE-DOMAIN ANTIBODIES APPLIED AS ANTIVIRAL IMMUNOTHERAPEUTICS |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20150312 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160120 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20160120 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20161129 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20170801 |