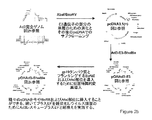
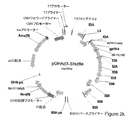
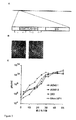
JP2012516682A - 非Ad5アデノウイルスベクター並びに前記に関連する方法および使用 - Google Patents
非Ad5アデノウイルスベクター並びに前記に関連する方法および使用 Download PDFInfo
- Publication number
- JP2012516682A JP2012516682A JP2011547047A JP2011547047A JP2012516682A JP 2012516682 A JP2012516682 A JP 2012516682A JP 2011547047 A JP2011547047 A JP 2011547047A JP 2011547047 A JP2011547047 A JP 2011547047A JP 2012516682 A JP2012516682 A JP 2012516682A
- Authority
- JP
- Japan
- Prior art keywords
- cancer
- cells
- tumor
- oncolytic
- virus
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 239000013598 vector Substances 0.000 title claims abstract description 105
- 238000000034 method Methods 0.000 title claims abstract description 37
- 206010028980 Neoplasm Diseases 0.000 claims abstract description 176
- 230000000174 oncolytic effect Effects 0.000 claims abstract description 62
- 201000011510 cancer Diseases 0.000 claims abstract description 55
- 241000598171 Human adenovirus sp. Species 0.000 claims abstract description 21
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 17
- 238000004519 manufacturing process Methods 0.000 claims abstract description 14
- 239000003814 drug Substances 0.000 claims abstract description 8
- 210000004027 cell Anatomy 0.000 claims description 171
- 108700019146 Transgenes Proteins 0.000 claims description 44
- 241000282414 Homo sapiens Species 0.000 claims description 41
- 241001465754 Metazoa Species 0.000 claims description 33
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 claims description 31
- 101000716693 Homo sapiens Sodium/iodide cotransporter Proteins 0.000 claims description 31
- 238000011282 treatment Methods 0.000 claims description 31
- 230000010076 replication Effects 0.000 claims description 29
- 230000014509 gene expression Effects 0.000 claims description 25
- 206010060862 Prostate cancer Diseases 0.000 claims description 18
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims description 18
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 claims description 16
- 239000013612 plasmid Substances 0.000 claims description 15
- 230000036961 partial effect Effects 0.000 claims description 13
- 206010009944 Colon cancer Diseases 0.000 claims description 10
- 238000012217 deletion Methods 0.000 claims description 10
- 230000037430 deletion Effects 0.000 claims description 10
- 108020004414 DNA Proteins 0.000 claims description 9
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 9
- 206010061902 Pancreatic neoplasm Diseases 0.000 claims description 9
- 201000005202 lung cancer Diseases 0.000 claims description 9
- 208000020816 lung neoplasm Diseases 0.000 claims description 9
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 claims description 9
- 201000002528 pancreatic cancer Diseases 0.000 claims description 9
- 208000008443 pancreatic carcinoma Diseases 0.000 claims description 9
- 108020004684 Internal Ribosome Entry Sites Proteins 0.000 claims description 8
- 230000000694 effects Effects 0.000 claims description 8
- 238000001990 intravenous administration Methods 0.000 claims description 7
- 206010006187 Breast cancer Diseases 0.000 claims description 6
- 208000026310 Breast neoplasm Diseases 0.000 claims description 6
- 108010029697 CD40 Ligand Proteins 0.000 claims description 6
- 102100032937 CD40 ligand Human genes 0.000 claims description 6
- 208000003445 Mouth Neoplasms Diseases 0.000 claims description 6
- 108010017842 Telomerase Proteins 0.000 claims description 6
- 230000006870 function Effects 0.000 claims description 6
- 230000002601 intratumoral effect Effects 0.000 claims description 6
- 230000003472 neutralizing effect Effects 0.000 claims description 6
- 208000001333 Colorectal Neoplasms Diseases 0.000 claims description 5
- 208000008839 Kidney Neoplasms Diseases 0.000 claims description 5
- 206010033128 Ovarian cancer Diseases 0.000 claims description 5
- 206010061535 Ovarian neoplasm Diseases 0.000 claims description 5
- 206010038389 Renal cancer Diseases 0.000 claims description 5
- 238000002512 chemotherapy Methods 0.000 claims description 5
- 201000010982 kidney cancer Diseases 0.000 claims description 5
- 238000001959 radiotherapy Methods 0.000 claims description 5
- 206010005949 Bone cancer Diseases 0.000 claims description 4
- 208000018084 Bone neoplasm Diseases 0.000 claims description 4
- 208000003174 Brain Neoplasms Diseases 0.000 claims description 4
- 208000005890 Neuroma Diseases 0.000 claims description 4
- 208000015634 Rectal Neoplasms Diseases 0.000 claims description 4
- 208000024770 Thyroid neoplasm Diseases 0.000 claims description 4
- 229940022399 cancer vaccine Drugs 0.000 claims description 4
- 238000009566 cancer vaccine Methods 0.000 claims description 4
- 208000006990 cholangiocarcinoma Diseases 0.000 claims description 4
- 208000029742 colonic neoplasm Diseases 0.000 claims description 4
- 201000000052 gastrinoma Diseases 0.000 claims description 4
- 201000007116 gestational trophoblastic neoplasm Diseases 0.000 claims description 4
- 208000014829 head and neck neoplasm Diseases 0.000 claims description 4
- 239000007928 intraperitoneal injection Substances 0.000 claims description 4
- 208000012987 lip and oral cavity carcinoma Diseases 0.000 claims description 4
- 201000007270 liver cancer Diseases 0.000 claims description 4
- 208000014018 liver neoplasm Diseases 0.000 claims description 4
- 201000001441 melanoma Diseases 0.000 claims description 4
- 206010038038 rectal cancer Diseases 0.000 claims description 4
- 201000001275 rectum cancer Diseases 0.000 claims description 4
- 201000002510 thyroid cancer Diseases 0.000 claims description 4
- 208000009458 Carcinoma in Situ Diseases 0.000 claims description 3
- 102000006992 Interferon-alpha Human genes 0.000 claims description 3
- 108010047761 Interferon-alpha Proteins 0.000 claims description 3
- 108090000467 Interferon-beta Proteins 0.000 claims description 3
- 102000003996 Interferon-beta Human genes 0.000 claims description 3
- 108010074328 Interferon-gamma Proteins 0.000 claims description 3
- 102000008070 Interferon-gamma Human genes 0.000 claims description 3
- 206010039491 Sarcoma Diseases 0.000 claims description 3
- 229960003130 interferon gamma Drugs 0.000 claims description 3
- 229960001388 interferon-beta Drugs 0.000 claims description 3
- 238000001361 intraarterial administration Methods 0.000 claims description 3
- 229960000575 trastuzumab Drugs 0.000 claims description 3
- 206010061424 Anal cancer Diseases 0.000 claims description 2
- 208000007860 Anus Neoplasms Diseases 0.000 claims description 2
- 206010004272 Benign hydatidiform mole Diseases 0.000 claims description 2
- 206010004593 Bile duct cancer Diseases 0.000 claims description 2
- 206010005003 Bladder cancer Diseases 0.000 claims description 2
- 206010008342 Cervix carcinoma Diseases 0.000 claims description 2
- 208000005243 Chondrosarcoma Diseases 0.000 claims description 2
- 208000006332 Choriocarcinoma Diseases 0.000 claims description 2
- 206010014733 Endometrial cancer Diseases 0.000 claims description 2
- 206010014759 Endometrial neoplasm Diseases 0.000 claims description 2
- 208000000461 Esophageal Neoplasms Diseases 0.000 claims description 2
- 208000006168 Ewing Sarcoma Diseases 0.000 claims description 2
- 201000008808 Fibrosarcoma Diseases 0.000 claims description 2
- 208000022072 Gallbladder Neoplasms Diseases 0.000 claims description 2
- 206010017993 Gastrointestinal neoplasms Diseases 0.000 claims description 2
- 206010067807 Gingival cancer Diseases 0.000 claims description 2
- 206010018404 Glucagonoma Diseases 0.000 claims description 2
- 208000017604 Hodgkin disease Diseases 0.000 claims description 2
- 208000010747 Hodgkins lymphoma Diseases 0.000 claims description 2
- 208000006937 Hydatidiform mole Diseases 0.000 claims description 2
- 208000005016 Intestinal Neoplasms Diseases 0.000 claims description 2
- 206010061523 Lip and/or oral cavity cancer Diseases 0.000 claims description 2
- 206010062038 Lip neoplasm Diseases 0.000 claims description 2
- 206010073059 Malignant neoplasm of unknown primary site Diseases 0.000 claims description 2
- 208000032271 Malignant tumor of penis Diseases 0.000 claims description 2
- 208000015021 Meningeal Neoplasms Diseases 0.000 claims description 2
- 206010027406 Mesothelioma Diseases 0.000 claims description 2
- 208000001894 Nasopharyngeal Neoplasms Diseases 0.000 claims description 2
- 206010061306 Nasopharyngeal cancer Diseases 0.000 claims description 2
- 206010029260 Neuroblastoma Diseases 0.000 claims description 2
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 claims description 2
- 208000010191 Osteitis Deformans Diseases 0.000 claims description 2
- 208000000035 Osteochondroma Diseases 0.000 claims description 2
- 208000027868 Paget disease Diseases 0.000 claims description 2
- 208000000821 Parathyroid Neoplasms Diseases 0.000 claims description 2
- 208000002471 Penile Neoplasms Diseases 0.000 claims description 2
- 206010034299 Penile cancer Diseases 0.000 claims description 2
- 208000009565 Pharyngeal Neoplasms Diseases 0.000 claims description 2
- 206010034811 Pharyngeal cancer Diseases 0.000 claims description 2
- 208000007913 Pituitary Neoplasms Diseases 0.000 claims description 2
- 206010036832 Prolactinoma Diseases 0.000 claims description 2
- 201000000582 Retinoblastoma Diseases 0.000 claims description 2
- 208000004337 Salivary Gland Neoplasms Diseases 0.000 claims description 2
- 206010061934 Salivary gland cancer Diseases 0.000 claims description 2
- 208000000453 Skin Neoplasms Diseases 0.000 claims description 2
- 208000021712 Soft tissue sarcoma Diseases 0.000 claims description 2
- 206010041329 Somatostatinoma Diseases 0.000 claims description 2
- 208000005718 Stomach Neoplasms Diseases 0.000 claims description 2
- 208000000389 T-cell leukemia Diseases 0.000 claims description 2
- 208000028530 T-cell lymphoblastic leukemia/lymphoma Diseases 0.000 claims description 2
- 206010042971 T-cell lymphoma Diseases 0.000 claims description 2
- 208000027585 T-cell non-Hodgkin lymphoma Diseases 0.000 claims description 2
- 208000024313 Testicular Neoplasms Diseases 0.000 claims description 2
- 206010057644 Testis cancer Diseases 0.000 claims description 2
- 206010043515 Throat cancer Diseases 0.000 claims description 2
- 208000000728 Thymus Neoplasms Diseases 0.000 claims description 2
- 206010062129 Tongue neoplasm Diseases 0.000 claims description 2
- 208000006842 Tonsillar Neoplasms Diseases 0.000 claims description 2
- 108060008682 Tumor Necrosis Factor Proteins 0.000 claims description 2
- 208000023915 Ureteral Neoplasms Diseases 0.000 claims description 2
- 206010046392 Ureteric cancer Diseases 0.000 claims description 2
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 claims description 2
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 claims description 2
- 208000002495 Uterine Neoplasms Diseases 0.000 claims description 2
- 206010047741 Vulval cancer Diseases 0.000 claims description 2
- 208000004354 Vulvar Neoplasms Diseases 0.000 claims description 2
- 208000008383 Wilms tumor Diseases 0.000 claims description 2
- 201000008629 Zollinger-Ellison syndrome Diseases 0.000 claims description 2
- 201000005188 adrenal gland cancer Diseases 0.000 claims description 2
- 208000024447 adrenal gland neoplasm Diseases 0.000 claims description 2
- 201000011165 anus cancer Diseases 0.000 claims description 2
- 208000026900 bile duct neoplasm Diseases 0.000 claims description 2
- 201000010881 cervical cancer Diseases 0.000 claims description 2
- 201000010918 connective tissue cancer Diseases 0.000 claims description 2
- 230000002124 endocrine Effects 0.000 claims description 2
- 201000004101 esophageal cancer Diseases 0.000 claims description 2
- 208000024519 eye neoplasm Diseases 0.000 claims description 2
- 201000010175 gallbladder cancer Diseases 0.000 claims description 2
- 206010017758 gastric cancer Diseases 0.000 claims description 2
- 208000015419 gastrin-producing neuroendocrine tumor Diseases 0.000 claims description 2
- 201000010235 heart cancer Diseases 0.000 claims description 2
- 208000024348 heart neoplasm Diseases 0.000 claims description 2
- 206010073071 hepatocellular carcinoma Diseases 0.000 claims description 2
- 231100000844 hepatocellular carcinoma Toxicity 0.000 claims description 2
- 206010022498 insulinoma Diseases 0.000 claims description 2
- 201000002313 intestinal cancer Diseases 0.000 claims description 2
- 238000007918 intramuscular administration Methods 0.000 claims description 2
- 201000006721 lip cancer Diseases 0.000 claims description 2
- 208000022006 malignant tumor of meninges Diseases 0.000 claims description 2
- 208000026037 malignant tumor of neck Diseases 0.000 claims description 2
- 208000026045 malignant tumor of parathyroid gland Diseases 0.000 claims description 2
- 208000027202 mammary Paget disease Diseases 0.000 claims description 2
- 206010027191 meningioma Diseases 0.000 claims description 2
- 201000005962 mycosis fungoides Diseases 0.000 claims description 2
- 201000008026 nephroblastoma Diseases 0.000 claims description 2
- 210000005036 nerve Anatomy 0.000 claims description 2
- 201000008106 ocular cancer Diseases 0.000 claims description 2
- 208000021255 pancreatic insulinoma Diseases 0.000 claims description 2
- 201000002628 peritoneum cancer Diseases 0.000 claims description 2
- 208000028591 pheochromocytoma Diseases 0.000 claims description 2
- 201000002511 pituitary cancer Diseases 0.000 claims description 2
- 201000003437 pleural cancer Diseases 0.000 claims description 2
- 208000030153 prolactin-producing pituitary gland adenoma Diseases 0.000 claims description 2
- 201000000849 skin cancer Diseases 0.000 claims description 2
- 201000002314 small intestine cancer Diseases 0.000 claims description 2
- 206010062261 spinal cord neoplasm Diseases 0.000 claims description 2
- 201000011549 stomach cancer Diseases 0.000 claims description 2
- 208000011580 syndromic disease Diseases 0.000 claims description 2
- 201000003120 testicular cancer Diseases 0.000 claims description 2
- 201000006134 tongue cancer Diseases 0.000 claims description 2
- 208000029387 trophoblastic neoplasm Diseases 0.000 claims description 2
- 201000005112 urinary bladder cancer Diseases 0.000 claims description 2
- 206010046766 uterine cancer Diseases 0.000 claims description 2
- 206010046885 vaginal cancer Diseases 0.000 claims description 2
- 208000013139 vaginal neoplasm Diseases 0.000 claims description 2
- 208000006542 von Hippel-Lindau disease Diseases 0.000 claims description 2
- 201000005102 vulva cancer Diseases 0.000 claims description 2
- 208000007766 Kaposi sarcoma Diseases 0.000 claims 1
- 210000004907 gland Anatomy 0.000 claims 1
- 210000003254 palate Anatomy 0.000 claims 1
- 201000009377 thymus cancer Diseases 0.000 claims 1
- 102000003390 tumor necrosis factor Human genes 0.000 claims 1
- 238000011275 oncology therapy Methods 0.000 abstract description 4
- 241000700605 Viruses Species 0.000 description 112
- 241000699670 Mus sp. Species 0.000 description 46
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 34
- 241000701161 unidentified adenovirus Species 0.000 description 33
- 108090000623 proteins and genes Proteins 0.000 description 31
- 238000002474 experimental method Methods 0.000 description 26
- 208000015181 infectious disease Diseases 0.000 description 25
- 210000004881 tumor cell Anatomy 0.000 description 23
- 230000003612 virological effect Effects 0.000 description 22
- 210000004369 blood Anatomy 0.000 description 18
- 239000008280 blood Substances 0.000 description 18
- 210000000056 organ Anatomy 0.000 description 18
- FVAUCKIRQBBSSJ-UHFFFAOYSA-M sodium iodide Chemical compound [Na+].[I-] FVAUCKIRQBBSSJ-UHFFFAOYSA-M 0.000 description 18
- 238000003556 assay Methods 0.000 description 17
- 238000001727 in vivo Methods 0.000 description 17
- 101000746373 Homo sapiens Granulocyte-macrophage colony-stimulating factor Proteins 0.000 description 16
- 230000022534 cell killing Effects 0.000 description 15
- 239000007924 injection Substances 0.000 description 15
- 238000002347 injection Methods 0.000 description 15
- 210000001519 tissue Anatomy 0.000 description 14
- 238000004458 analytical method Methods 0.000 description 13
- 238000000338 in vitro Methods 0.000 description 13
- 206010061218 Inflammation Diseases 0.000 description 12
- 230000004054 inflammatory process Effects 0.000 description 12
- 239000000047 product Substances 0.000 description 12
- 210000000234 capsid Anatomy 0.000 description 11
- 230000004048 modification Effects 0.000 description 11
- 238000012986 modification Methods 0.000 description 11
- 230000006378 damage Effects 0.000 description 10
- 238000001415 gene therapy Methods 0.000 description 10
- 230000001225 therapeutic effect Effects 0.000 description 10
- 230000004614 tumor growth Effects 0.000 description 10
- 230000029812 viral genome replication Effects 0.000 description 10
- 239000001963 growth medium Substances 0.000 description 9
- 238000003384 imaging method Methods 0.000 description 9
- 210000004185 liver Anatomy 0.000 description 9
- 238000003199 nucleic acid amplification method Methods 0.000 description 9
- 210000001685 thyroid gland Anatomy 0.000 description 9
- 231100000070 MTS assay Toxicity 0.000 description 8
- 238000000719 MTS assay Methods 0.000 description 8
- 241000699666 Mus <mouse, genus> Species 0.000 description 8
- 238000009825 accumulation Methods 0.000 description 8
- 230000003321 amplification Effects 0.000 description 8
- 239000000835 fiber Substances 0.000 description 8
- 238000005259 measurement Methods 0.000 description 8
- 230000011278 mitosis Effects 0.000 description 8
- 210000003240 portal vein Anatomy 0.000 description 8
- 108020003175 receptors Proteins 0.000 description 8
- 102000005962 receptors Human genes 0.000 description 8
- 241000699673 Mesocricetus auratus Species 0.000 description 7
- 238000013459 approach Methods 0.000 description 7
- 230000028993 immune response Effects 0.000 description 7
- 102000004169 proteins and genes Human genes 0.000 description 7
- 210000002966 serum Anatomy 0.000 description 7
- 238000002560 therapeutic procedure Methods 0.000 description 7
- 102000007469 Actins Human genes 0.000 description 6
- 108010085238 Actins Proteins 0.000 description 6
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 6
- 108060001084 Luciferase Proteins 0.000 description 6
- 239000005089 Luciferase Substances 0.000 description 6
- 206010028851 Necrosis Diseases 0.000 description 6
- 230000008901 benefit Effects 0.000 description 6
- 238000010367 cloning Methods 0.000 description 6
- 238000005516 engineering process Methods 0.000 description 6
- 210000003743 erythrocyte Anatomy 0.000 description 6
- 210000003494 hepatocyte Anatomy 0.000 description 6
- 230000017074 necrotic cell death Effects 0.000 description 6
- 239000002245 particle Substances 0.000 description 6
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 6
- 230000002285 radioactive effect Effects 0.000 description 6
- 230000002441 reversible effect Effects 0.000 description 6
- 235000009518 sodium iodide Nutrition 0.000 description 6
- 238000007920 subcutaneous administration Methods 0.000 description 6
- 230000004083 survival effect Effects 0.000 description 6
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 5
- 241000282412 Homo Species 0.000 description 5
- 108700026226 TATA Box Proteins 0.000 description 5
- 210000000612 antigen-presenting cell Anatomy 0.000 description 5
- 230000003833 cell viability Effects 0.000 description 5
- 239000003795 chemical substances by application Substances 0.000 description 5
- 230000009089 cytolysis Effects 0.000 description 5
- 230000002950 deficient Effects 0.000 description 5
- -1 doxyfluridine Chemical compound 0.000 description 5
- 239000012091 fetal bovine serum Substances 0.000 description 5
- 210000004072 lung Anatomy 0.000 description 5
- 230000001404 mediated effect Effects 0.000 description 5
- 206010061289 metastatic neoplasm Diseases 0.000 description 5
- 239000000203 mixture Substances 0.000 description 5
- 239000002773 nucleotide Substances 0.000 description 5
- 125000003729 nucleotide group Chemical group 0.000 description 5
- 239000013641 positive control Substances 0.000 description 5
- 238000012163 sequencing technique Methods 0.000 description 5
- 210000002784 stomach Anatomy 0.000 description 5
- 210000002700 urine Anatomy 0.000 description 5
- 210000003462 vein Anatomy 0.000 description 5
- SNBCLPGEMZEWLU-QXFUBDJGSA-N 2-chloro-n-[[(2r,3s,5r)-3-hydroxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methyl]acetamide Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CNC(=O)CCl)[C@@H](O)C1 SNBCLPGEMZEWLU-QXFUBDJGSA-N 0.000 description 4
- 108090000790 Enzymes Proteins 0.000 description 4
- 102000004190 Enzymes Human genes 0.000 description 4
- 241000193096 Human adenovirus B3 Species 0.000 description 4
- 238000011529 RT qPCR Methods 0.000 description 4
- 230000004913 activation Effects 0.000 description 4
- 230000001640 apoptogenic effect Effects 0.000 description 4
- 230000033228 biological regulation Effects 0.000 description 4
- 230000029087 digestion Effects 0.000 description 4
- 238000010790 dilution Methods 0.000 description 4
- 239000012895 dilution Substances 0.000 description 4
- 208000025887 endotheliitis Diseases 0.000 description 4
- 230000002458 infectious effect Effects 0.000 description 4
- 230000002147 killing effect Effects 0.000 description 4
- 231100001231 less toxic Toxicity 0.000 description 4
- 230000001394 metastastic effect Effects 0.000 description 4
- 230000003389 potentiating effect Effects 0.000 description 4
- 230000005855 radiation Effects 0.000 description 4
- 230000004044 response Effects 0.000 description 4
- 239000006228 supernatant Substances 0.000 description 4
- 230000002195 synergetic effect Effects 0.000 description 4
- 230000005909 tumor killing Effects 0.000 description 4
- 239000013603 viral vector Substances 0.000 description 4
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 3
- 201000009030 Carcinoma Diseases 0.000 description 3
- 102100021244 Integral membrane protein GPR180 Human genes 0.000 description 3
- 102100020870 La-related protein 6 Human genes 0.000 description 3
- 108050008265 La-related protein 6 Proteins 0.000 description 3
- 206010067125 Liver injury Diseases 0.000 description 3
- NTIZESTWPVYFNL-UHFFFAOYSA-N Methyl isobutyl ketone Chemical compound CC(C)CC(C)=O NTIZESTWPVYFNL-UHFFFAOYSA-N 0.000 description 3
- 108700019961 Neoplasm Genes Proteins 0.000 description 3
- 102000048850 Neoplasm Genes Human genes 0.000 description 3
- 108091028043 Nucleic acid sequence Proteins 0.000 description 3
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 3
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 3
- KYIKRXIYLAGAKQ-UHFFFAOYSA-N abcn Chemical compound C1CCCCC1(C#N)N=NC1(C#N)CCCCC1 KYIKRXIYLAGAKQ-UHFFFAOYSA-N 0.000 description 3
- 230000001154 acute effect Effects 0.000 description 3
- 231100000439 acute liver injury Toxicity 0.000 description 3
- 238000010171 animal model Methods 0.000 description 3
- 230000000259 anti-tumor effect Effects 0.000 description 3
- AIYUHDOJVYHVIT-UHFFFAOYSA-M caesium chloride Chemical compound [Cl-].[Cs+] AIYUHDOJVYHVIT-UHFFFAOYSA-M 0.000 description 3
- 238000004113 cell culture Methods 0.000 description 3
- 238000002648 combination therapy Methods 0.000 description 3
- 239000002299 complementary DNA Substances 0.000 description 3
- 108010030074 endodeoxyribonuclease MluI Proteins 0.000 description 3
- 210000002889 endothelial cell Anatomy 0.000 description 3
- 108010048367 enhanced green fluorescent protein Proteins 0.000 description 3
- 210000002950 fibroblast Anatomy 0.000 description 3
- 239000012634 fragment Substances 0.000 description 3
- 230000012010 growth Effects 0.000 description 3
- 230000006801 homologous recombination Effects 0.000 description 3
- 238000002744 homologous recombination Methods 0.000 description 3
- 208000018821 hormone-resistant prostate carcinoma Diseases 0.000 description 3
- 210000000987 immune system Anatomy 0.000 description 3
- 230000036039 immunity Effects 0.000 description 3
- 238000010348 incorporation Methods 0.000 description 3
- 238000007912 intraperitoneal administration Methods 0.000 description 3
- 210000004698 lymphocyte Anatomy 0.000 description 3
- 230000003211 malignant effect Effects 0.000 description 3
- 238000010172 mouse model Methods 0.000 description 3
- 239000013642 negative control Substances 0.000 description 3
- 238000011580 nude mouse model Methods 0.000 description 3
- 208000023958 prostate neoplasm Diseases 0.000 description 3
- 238000000746 purification Methods 0.000 description 3
- 230000006798 recombination Effects 0.000 description 3
- 238000005215 recombination Methods 0.000 description 3
- 230000001105 regulatory effect Effects 0.000 description 3
- 238000003757 reverse transcription PCR Methods 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 239000000243 solution Substances 0.000 description 3
- 210000000952 spleen Anatomy 0.000 description 3
- 238000010561 standard procedure Methods 0.000 description 3
- 210000000130 stem cell Anatomy 0.000 description 3
- 238000012360 testing method Methods 0.000 description 3
- 230000037455 tumor specific immune response Effects 0.000 description 3
- 210000003606 umbilical vein Anatomy 0.000 description 3
- 229960003048 vinblastine Drugs 0.000 description 3
- JXLYSJRDGCGARV-XQKSVPLYSA-N vincaleukoblastine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 JXLYSJRDGCGARV-XQKSVPLYSA-N 0.000 description 3
- 210000002845 virion Anatomy 0.000 description 3
- KJUGUADJHNHALS-UHFFFAOYSA-N 1H-tetrazole Chemical compound C=1N=NNN=1 KJUGUADJHNHALS-UHFFFAOYSA-N 0.000 description 2
- CXURGFRDGROIKG-UHFFFAOYSA-N 3,3-bis(chloromethyl)oxetane Chemical compound ClCC1(CCl)COC1 CXURGFRDGROIKG-UHFFFAOYSA-N 0.000 description 2
- 208000007788 Acute Liver Failure Diseases 0.000 description 2
- 206010000804 Acute hepatic failure Diseases 0.000 description 2
- 206010010741 Conjunctivitis Diseases 0.000 description 2
- IGXWBGJHJZYPQS-SSDOTTSWSA-N D-Luciferin Chemical compound OC(=O)[C@H]1CSC(C=2SC3=CC=C(O)C=C3N=2)=N1 IGXWBGJHJZYPQS-SSDOTTSWSA-N 0.000 description 2
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 2
- 101710145505 Fiber protein Proteins 0.000 description 2
- 241000699660 Mus musculus Species 0.000 description 2
- 238000011785 NMRI mouse Methods 0.000 description 2
- 108700026244 Open Reading Frames Proteins 0.000 description 2
- 238000011579 SCID mouse model Methods 0.000 description 2
- 238000011053 TCID50 method Methods 0.000 description 2
- 241000021375 Xenogenes Species 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 238000007792 addition Methods 0.000 description 2
- 230000011759 adipose tissue development Effects 0.000 description 2
- 208000037844 advanced solid tumor Diseases 0.000 description 2
- 230000005809 anti-tumor immunity Effects 0.000 description 2
- 230000003190 augmentative effect Effects 0.000 description 2
- 230000004071 biological effect Effects 0.000 description 2
- 230000029918 bioluminescence Effects 0.000 description 2
- 238000005415 bioluminescence Methods 0.000 description 2
- 210000000601 blood cell Anatomy 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 230000030833 cell death Effects 0.000 description 2
- 238000001516 cell proliferation assay Methods 0.000 description 2
- 238000011284 combination treatment Methods 0.000 description 2
- 238000010276 construction Methods 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 230000001186 cumulative effect Effects 0.000 description 2
- 230000000120 cytopathologic effect Effects 0.000 description 2
- 238000002784 cytotoxicity assay Methods 0.000 description 2
- 231100000263 cytotoxicity test Toxicity 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 238000004520 electroporation Methods 0.000 description 2
- 210000003527 eukaryotic cell Anatomy 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 230000035876 healing Effects 0.000 description 2
- 210000002216 heart Anatomy 0.000 description 2
- 230000001900 immune effect Effects 0.000 description 2
- 230000002163 immunogen Effects 0.000 description 2
- 230000006698 induction Effects 0.000 description 2
- 238000011081 inoculation Methods 0.000 description 2
- 238000003780 insertion Methods 0.000 description 2
- 230000037431 insertion Effects 0.000 description 2
- 238000010253 intravenous injection Methods 0.000 description 2
- 210000003734 kidney Anatomy 0.000 description 2
- 210000000265 leukocyte Anatomy 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 210000005228 liver tissue Anatomy 0.000 description 2
- 238000012423 maintenance Methods 0.000 description 2
- 230000014759 maintenance of location Effects 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 108020004999 messenger RNA Proteins 0.000 description 2
- 210000000822 natural killer cell Anatomy 0.000 description 2
- 210000004882 non-tumor cell Anatomy 0.000 description 2
- 150000007523 nucleic acids Chemical group 0.000 description 2
- 230000002611 ovarian Effects 0.000 description 2
- 230000035515 penetration Effects 0.000 description 2
- 230000010412 perfusion Effects 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 108090000765 processed proteins & peptides Proteins 0.000 description 2
- 230000002829 reductive effect Effects 0.000 description 2
- 230000003362 replicative effect Effects 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 230000009528 severe injury Effects 0.000 description 2
- 231100000161 signs of toxicity Toxicity 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 238000011301 standard therapy Methods 0.000 description 2
- 238000007619 statistical method Methods 0.000 description 2
- 230000007863 steatosis Effects 0.000 description 2
- 231100000240 steatosis hepatitis Toxicity 0.000 description 2
- 230000000638 stimulation Effects 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- 238000013518 transcription Methods 0.000 description 2
- 230000035897 transcription Effects 0.000 description 2
- 238000001890 transfection Methods 0.000 description 2
- 238000012546 transfer Methods 0.000 description 2
- 230000014616 translation Effects 0.000 description 2
- 230000032258 transport Effects 0.000 description 2
- 230000035899 viability Effects 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- 102000040650 (ribonucleotides)n+m Human genes 0.000 description 1
- VSNHCAURESNICA-NJFSPNSNSA-N 1-oxidanylurea Chemical compound N[14C](=O)NO VSNHCAURESNICA-NJFSPNSNSA-N 0.000 description 1
- AOJJSUZBOXZQNB-VTZDEGQISA-N 4'-epidoxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-VTZDEGQISA-N 0.000 description 1
- 125000000972 4,5-dimethylthiazol-2-yl group Chemical group [H]C([H])([H])C1=C(N=C(*)S1)C([H])([H])[H] 0.000 description 1
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 1
- NMUSYJAQQFHJEW-KVTDHHQDSA-N 5-azacytidine Chemical compound O=C1N=C(N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 NMUSYJAQQFHJEW-KVTDHHQDSA-N 0.000 description 1
- WYWHKKSPHMUBEB-UHFFFAOYSA-N 6-Mercaptoguanine Natural products N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 description 1
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 1
- 206010002091 Anaesthesia Diseases 0.000 description 1
- 108010006654 Bleomycin Proteins 0.000 description 1
- 102100031650 C-X-C chemokine receptor type 4 Human genes 0.000 description 1
- MHXGOZKBNSRFTK-UHFFFAOYSA-N CCN(C)C1(C2)S22C1CC2 Chemical compound CCN(C)C1(C2)S22C1CC2 MHXGOZKBNSRFTK-UHFFFAOYSA-N 0.000 description 1
- 101150071146 COX2 gene Proteins 0.000 description 1
- 101100114534 Caenorhabditis elegans ctc-2 gene Proteins 0.000 description 1
- GAGWJHPBXLXJQN-UORFTKCHSA-N Capecitabine Chemical compound C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](C)O1 GAGWJHPBXLXJQN-UORFTKCHSA-N 0.000 description 1
- GAGWJHPBXLXJQN-UHFFFAOYSA-N Capecitabine Natural products C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1C1C(O)C(O)C(C)O1 GAGWJHPBXLXJQN-UHFFFAOYSA-N 0.000 description 1
- 208000005623 Carcinogenesis Diseases 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 208000032544 Cicatrix Diseases 0.000 description 1
- 206010010144 Completed suicide Diseases 0.000 description 1
- 241000709687 Coxsackievirus Species 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 1
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- 230000004543 DNA replication Effects 0.000 description 1
- CYCGRDQQIOGCKX-UHFFFAOYSA-N Dehydro-luciferin Natural products OC(=O)C1=CSC(C=2SC3=CC(O)=CC=C3N=2)=N1 CYCGRDQQIOGCKX-UHFFFAOYSA-N 0.000 description 1
- 108010053770 Deoxyribonucleases Proteins 0.000 description 1
- 102000016911 Deoxyribonucleases Human genes 0.000 description 1
- 241000702421 Dependoparvovirus Species 0.000 description 1
- 241000255581 Drosophila <fruit fly, genus> Species 0.000 description 1
- 101710201734 E3 protein Proteins 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- HTIJFSOGRVMCQR-UHFFFAOYSA-N Epirubicin Natural products COc1cccc2C(=O)c3c(O)c4CC(O)(CC(OC5CC(N)C(=O)C(C)O5)c4c(O)c3C(=O)c12)C(=O)CO HTIJFSOGRVMCQR-UHFFFAOYSA-N 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- 238000001134 F-test Methods 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 102000003974 Fibroblast growth factor 2 Human genes 0.000 description 1
- 108090000379 Fibroblast growth factor 2 Proteins 0.000 description 1
- BJGNCJDXODQBOB-UHFFFAOYSA-N Fivefly Luciferin Natural products OC(=O)C1CSC(C=2SC3=CC(O)=CC=C3N=2)=N1 BJGNCJDXODQBOB-UHFFFAOYSA-N 0.000 description 1
- 238000011770 Fox Chase SCID mouse Methods 0.000 description 1
- 208000005577 Gastroenteritis Diseases 0.000 description 1
- 101100175482 Glycine max CG-3 gene Proteins 0.000 description 1
- 206010019851 Hepatotoxicity Diseases 0.000 description 1
- 101710094396 Hexon protein Proteins 0.000 description 1
- 101000922348 Homo sapiens C-X-C chemokine receptor type 4 Proteins 0.000 description 1
- 101000914324 Homo sapiens Carcinoembryonic antigen-related cell adhesion molecule 5 Proteins 0.000 description 1
- 101000914321 Homo sapiens Carcinoembryonic antigen-related cell adhesion molecule 7 Proteins 0.000 description 1
- 101000961414 Homo sapiens Membrane cofactor protein Proteins 0.000 description 1
- 101000617725 Homo sapiens Pregnancy-specific beta-1-glycoprotein 2 Proteins 0.000 description 1
- 101000701902 Homo sapiens Serpin B4 Proteins 0.000 description 1
- 206010021143 Hypoxia Diseases 0.000 description 1
- 101150032643 IVa2 gene Proteins 0.000 description 1
- XDXDZDZNSLXDNA-TZNDIEGXSA-N Idarubicin Chemical compound C1[C@H](N)[C@H](O)[C@H](C)O[C@H]1O[C@@H]1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2C[C@@](O)(C(C)=O)C1 XDXDZDZNSLXDNA-TZNDIEGXSA-N 0.000 description 1
- XDXDZDZNSLXDNA-UHFFFAOYSA-N Idarubicin Natural products C1C(N)C(O)C(C)OC1OC1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2CC(O)(C(C)=O)C1 XDXDZDZNSLXDNA-UHFFFAOYSA-N 0.000 description 1
- PIWKPBJCKXDKJR-UHFFFAOYSA-N Isoflurane Chemical compound FC(F)OC(Cl)C(F)(F)F PIWKPBJCKXDKJR-UHFFFAOYSA-N 0.000 description 1
- 101150008942 J gene Proteins 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- 239000005517 L01XE01 - Imatinib Substances 0.000 description 1
- 206010023774 Large cell lung cancer Diseases 0.000 description 1
- DDWFXDSYGUXRAY-UHFFFAOYSA-N Luciferin Natural products CCc1c(C)c(CC2NC(=O)C(=C2C=C)C)[nH]c1Cc3[nH]c4C(=C5/NC(CC(=O)O)C(C)C5CC(=O)O)CC(=O)c4c3C DDWFXDSYGUXRAY-UHFFFAOYSA-N 0.000 description 1
- 108700018351 Major Histocompatibility Complex Proteins 0.000 description 1
- 108010090054 Membrane Glycoproteins Proteins 0.000 description 1
- 102000012750 Membrane Glycoproteins Human genes 0.000 description 1
- 102100039373 Membrane cofactor protein Human genes 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- 102000016776 Midkine Human genes 0.000 description 1
- 108010092801 Midkine Proteins 0.000 description 1
- 241001529936 Murinae Species 0.000 description 1
- 101000713102 Mus musculus C-C motif chemokine 1 Proteins 0.000 description 1
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 description 1
- 238000011786 NMRI nude mouse Methods 0.000 description 1
- 206010028813 Nausea Diseases 0.000 description 1
- 206010067482 No adverse event Diseases 0.000 description 1
- 206010030155 Oesophageal carcinoma Diseases 0.000 description 1
- 108700020796 Oncogene Proteins 0.000 description 1
- 101150000187 PTGS2 gene Proteins 0.000 description 1
- 229930012538 Paclitaxel Natural products 0.000 description 1
- 101710173835 Penton protein Proteins 0.000 description 1
- 239000001888 Peptone Substances 0.000 description 1
- 108010080698 Peptones Proteins 0.000 description 1
- 241000009328 Perro Species 0.000 description 1
- 206010037660 Pyrexia Diseases 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 101000864964 Rattus norvegicus Septin-9 Proteins 0.000 description 1
- 208000035415 Reinfection Diseases 0.000 description 1
- 208000006265 Renal cell carcinoma Diseases 0.000 description 1
- 206010057190 Respiratory tract infections Diseases 0.000 description 1
- 102100030326 Serpin B4 Human genes 0.000 description 1
- 102100020886 Sodium/iodide cotransporter Human genes 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- BPEGJWRSRHCHSN-UHFFFAOYSA-N Temozolomide Chemical compound O=C1N(C)N=NC2=C(C(N)=O)N=CN21 BPEGJWRSRHCHSN-UHFFFAOYSA-N 0.000 description 1
- AUYYCJSJGJYCDS-LBPRGKRZSA-N Thyrolar Chemical class IC1=CC(C[C@H](N)C(O)=O)=CC(I)=C1OC1=CC=C(O)C(I)=C1 AUYYCJSJGJYCDS-LBPRGKRZSA-N 0.000 description 1
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 1
- 206010054094 Tumour necrosis Diseases 0.000 description 1
- 108020005202 Viral DNA Proteins 0.000 description 1
- 108010087302 Viral Structural Proteins Proteins 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 230000009056 active transport Effects 0.000 description 1
- 108010084938 adenovirus receptor Proteins 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- SHGAZHPCJJPHSC-YCNIQYBTSA-N all-trans-retinoic acid Chemical compound OC(=O)\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-YCNIQYBTSA-N 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- 230000037005 anaesthesia Effects 0.000 description 1
- 238000000540 analysis of variance Methods 0.000 description 1
- 239000003098 androgen Substances 0.000 description 1
- 210000004102 animal cell Anatomy 0.000 description 1
- 238000000137 annealing Methods 0.000 description 1
- 230000001772 anti-angiogenic effect Effects 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 239000002246 antineoplastic agent Substances 0.000 description 1
- 238000011888 autopsy Methods 0.000 description 1
- 229960002756 azacitidine Drugs 0.000 description 1
- LMEKQMALGUDUQG-UHFFFAOYSA-N azathioprine Chemical compound CN1C=NC([N+]([O-])=O)=C1SC1=NC=NC2=C1NC=N2 LMEKQMALGUDUQG-UHFFFAOYSA-N 0.000 description 1
- 229960002170 azathioprine Drugs 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 230000008827 biological function Effects 0.000 description 1
- 229960000074 biopharmaceutical Drugs 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 229960001561 bleomycin Drugs 0.000 description 1
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 210000000988 bone and bone Anatomy 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 230000036952 cancer formation Effects 0.000 description 1
- 239000012830 cancer therapeutic Substances 0.000 description 1
- 229960004117 capecitabine Drugs 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 229960004562 carboplatin Drugs 0.000 description 1
- 190000008236 carboplatin Chemical compound 0.000 description 1
- 231100000504 carcinogenesis Toxicity 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 230000022131 cell cycle Effects 0.000 description 1
- 230000006037 cell lysis Effects 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 230000002032 cellular defenses Effects 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 230000019522 cellular metabolic process Effects 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 229940044683 chemotherapy drug Drugs 0.000 description 1
- JCKYGMPEJWAADB-UHFFFAOYSA-N chlorambucil Chemical compound OC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 JCKYGMPEJWAADB-UHFFFAOYSA-N 0.000 description 1
- 229960004630 chlorambucil Drugs 0.000 description 1
- 108091006090 chromatin-associated proteins Proteins 0.000 description 1
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 1
- 229960004316 cisplatin Drugs 0.000 description 1
- 239000013599 cloning vector Substances 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 238000011443 conventional therapy Methods 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 239000012531 culture fluid Substances 0.000 description 1
- 229960004397 cyclophosphamide Drugs 0.000 description 1
- 229960000684 cytarabine Drugs 0.000 description 1
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 1
- 231100000135 cytotoxicity Toxicity 0.000 description 1
- 230000003013 cytotoxicity Effects 0.000 description 1
- 229960000975 daunorubicin Drugs 0.000 description 1
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000007123 defense Effects 0.000 description 1
- 230000008260 defense mechanism Effects 0.000 description 1
- 210000004443 dendritic cell Anatomy 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 1
- 229960003668 docetaxel Drugs 0.000 description 1
- 229960004679 doxorubicin Drugs 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- 101150097231 eg gene Proteins 0.000 description 1
- 238000000635 electron micrograph Methods 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 201000002491 encephalomyelitis Diseases 0.000 description 1
- 210000002472 endoplasmic reticulum Anatomy 0.000 description 1
- 210000001163 endosome Anatomy 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 229960001904 epirubicin Drugs 0.000 description 1
- 210000000981 epithelium Anatomy 0.000 description 1
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 1
- 229960005420 etoposide Drugs 0.000 description 1
- 206010016256 fatigue Diseases 0.000 description 1
- 230000001605 fetal effect Effects 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 230000004907 flux Effects 0.000 description 1
- 230000003325 follicular Effects 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 229960005277 gemcitabine Drugs 0.000 description 1
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 1
- 238000001476 gene delivery Methods 0.000 description 1
- 238000012239 gene modification Methods 0.000 description 1
- 230000008570 general process Effects 0.000 description 1
- 230000005017 genetic modification Effects 0.000 description 1
- 235000013617 genetically modified food Nutrition 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 208000006454 hepatitis Diseases 0.000 description 1
- 231100000304 hepatotoxicity Toxicity 0.000 description 1
- 230000007686 hepatotoxicity Effects 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 238000001794 hormone therapy Methods 0.000 description 1
- 230000005745 host immune response Effects 0.000 description 1
- 102000046157 human CSF2 Human genes 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 230000001146 hypoxic effect Effects 0.000 description 1
- 229960000908 idarubicin Drugs 0.000 description 1
- 229960002411 imatinib Drugs 0.000 description 1
- KTUFNOKKBVMGRW-UHFFFAOYSA-N imatinib Chemical compound C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 KTUFNOKKBVMGRW-UHFFFAOYSA-N 0.000 description 1
- 230000001024 immunotherapeutic effect Effects 0.000 description 1
- 238000009169 immunotherapy Methods 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 230000005917 in vivo anti-tumor Effects 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 239000000411 inducer Substances 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 102000006495 integrins Human genes 0.000 description 1
- 108010044426 integrins Proteins 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 229960002725 isoflurane Drugs 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 208000018191 liver inflammation Diseases 0.000 description 1
- 238000011551 log transformation method Methods 0.000 description 1
- 201000009546 lung large cell carcinoma Diseases 0.000 description 1
- 230000001926 lymphatic effect Effects 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 230000035800 maturation Effects 0.000 description 1
- HRLIOXLXPOHXTA-UHFFFAOYSA-N medetomidine Chemical compound C=1C=CC(C)=C(C)C=1C(C)C1=CN=C[N]1 HRLIOXLXPOHXTA-UHFFFAOYSA-N 0.000 description 1
- 229960002140 medetomidine Drugs 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 1
- 229960001428 mercaptopurine Drugs 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- 229960001156 mitoxantrone Drugs 0.000 description 1
- KKZJGLLVHKMTCM-UHFFFAOYSA-N mitoxantrone Chemical compound O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO KKZJGLLVHKMTCM-UHFFFAOYSA-N 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 210000000581 natural killer T-cell Anatomy 0.000 description 1
- 230000008693 nausea Effects 0.000 description 1
- 230000001613 neoplastic effect Effects 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 210000004940 nucleus Anatomy 0.000 description 1
- 244000309459 oncolytic virus Species 0.000 description 1
- 238000001543 one-way ANOVA Methods 0.000 description 1
- 230000008520 organization Effects 0.000 description 1
- DWAFYCQODLXJNR-BNTLRKBRSA-L oxaliplatin Chemical compound O1C(=O)C(=O)O[Pt]11N[C@@H]2CCCC[C@H]2N1 DWAFYCQODLXJNR-BNTLRKBRSA-L 0.000 description 1
- 229960001756 oxaliplatin Drugs 0.000 description 1
- 229960001592 paclitaxel Drugs 0.000 description 1
- 230000036407 pain Effects 0.000 description 1
- 201000001219 parotid gland cancer Diseases 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 229960005079 pemetrexed Drugs 0.000 description 1
- QOFFJEBXNKRSPX-ZDUSSCGKSA-N pemetrexed Chemical compound C1=N[C]2NC(N)=NC(=O)C2=C1CCC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 QOFFJEBXNKRSPX-ZDUSSCGKSA-N 0.000 description 1
- 235000019319 peptone Nutrition 0.000 description 1
- 210000003200 peritoneal cavity Anatomy 0.000 description 1
- 230000002688 persistence Effects 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 238000003752 polymerase chain reaction Methods 0.000 description 1
- 238000011176 pooling Methods 0.000 description 1
- 238000010149 post-hoc-test Methods 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 230000009145 protein modification Effects 0.000 description 1
- 238000001243 protein synthesis Methods 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 230000007115 recruitment Effects 0.000 description 1
- 230000003014 reinforcing effect Effects 0.000 description 1
- 208000023504 respiratory system disease Diseases 0.000 description 1
- 229930002330 retinoic acid Natural products 0.000 description 1
- 231100000241 scar Toxicity 0.000 description 1
- 230000037387 scars Effects 0.000 description 1
- 239000013605 shuttle vector Substances 0.000 description 1
- 239000002356 single layer Substances 0.000 description 1
- 108010013351 sodium-iodide symporter Proteins 0.000 description 1
- FVAUCKIRQBBSSJ-FXMLPJBTSA-M sodium;iodine-125(1-) Chemical compound [Na+].[125I-] FVAUCKIRQBBSSJ-FXMLPJBTSA-M 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 230000020382 suppression by virus of host antigen processing and presentation of peptide antigen via MHC class I Effects 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 230000008961 swelling Effects 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 1
- 108091035539 telomere Proteins 0.000 description 1
- 102000055501 telomere Human genes 0.000 description 1
- 210000003411 telomere Anatomy 0.000 description 1
- 229960004964 temozolomide Drugs 0.000 description 1
- NRUKOCRGYNPUPR-QBPJDGROSA-N teniposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@@H](OC[C@H]4O3)C=3SC=CC=3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 NRUKOCRGYNPUPR-QBPJDGROSA-N 0.000 description 1
- 229960001278 teniposide Drugs 0.000 description 1
- 239000005495 thyroid hormone Substances 0.000 description 1
- 229940036555 thyroid hormone Drugs 0.000 description 1
- 229960003087 tioguanine Drugs 0.000 description 1
- MNRILEROXIRVNJ-UHFFFAOYSA-N tioguanine Chemical compound N1C(N)=NC(=S)C2=NC=N[C]21 MNRILEROXIRVNJ-UHFFFAOYSA-N 0.000 description 1
- 238000004448 titration Methods 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 231100000820 toxicity test Toxicity 0.000 description 1
- 230000002110 toxicologic effect Effects 0.000 description 1
- 231100000027 toxicology Toxicity 0.000 description 1
- 231100000041 toxicology testing Toxicity 0.000 description 1
- 238000013519 translation Methods 0.000 description 1
- 230000014621 translational initiation Effects 0.000 description 1
- 230000001960 triggered effect Effects 0.000 description 1
- 241001430294 unidentified retrovirus Species 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 229960000653 valrubicin Drugs 0.000 description 1
- ZOCKGBMQLCSHFP-KQRAQHLDSA-N valrubicin Chemical compound O([C@H]1C[C@](CC2=C(O)C=3C(=O)C4=CC=CC(OC)=C4C(=O)C=3C(O)=C21)(O)C(=O)COC(=O)CCCC)[C@H]1C[C@H](NC(=O)C(F)(F)F)[C@H](O)[C@H](C)O1 ZOCKGBMQLCSHFP-KQRAQHLDSA-N 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
- C12N15/86—Viral vectors
- C12N15/861—Adenoviral vectors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/193—Colony stimulating factors [CSF]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/66—Microorganisms or materials therefrom
- A61K35/76—Viruses; Subviral particles; Bacteriophages
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/66—Microorganisms or materials therefrom
- A61K35/76—Viruses; Subviral particles; Bacteriophages
- A61K35/761—Adenovirus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/177—Receptors; Cell surface antigens; Cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
- C12N15/86—Viral vectors
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/10—Cells modified by introduction of foreign genetic material
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N7/00—Viruses; Bacteriophages; Compositions thereof; Preparation or purification thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2710/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA dsDNA viruses
- C12N2710/00011—Details
- C12N2710/10011—Adenoviridae
- C12N2710/10311—Mastadenovirus, e.g. human or simian adenoviruses
- C12N2710/10322—New viral proteins or individual genes, new structural or functional aspects of known viral proteins or genes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2710/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA dsDNA viruses
- C12N2710/00011—Details
- C12N2710/10011—Adenoviridae
- C12N2710/10311—Mastadenovirus, e.g. human or simian adenoviruses
- C12N2710/10332—Use of virus as therapeutic agent, other than vaccine, e.g. as cytolytic agent
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2710/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA dsDNA viruses
- C12N2710/00011—Details
- C12N2710/10011—Adenoviridae
- C12N2710/10311—Mastadenovirus, e.g. human or simian adenoviruses
- C12N2710/10341—Use of virus, viral particle or viral elements as a vector
- C12N2710/10343—Use of virus, viral particle or viral elements as a vector viral genome or elements thereof as genetic vector
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2710/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA dsDNA viruses
- C12N2710/00011—Details
- C12N2710/10011—Adenoviridae
- C12N2710/10311—Mastadenovirus, e.g. human or simian adenoviruses
- C12N2710/10341—Use of virus, viral particle or viral elements as a vector
- C12N2710/10345—Special targeting system for viral vectors
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2710/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA dsDNA viruses
- C12N2710/00011—Details
- C12N2710/10011—Adenoviridae
- C12N2710/10311—Mastadenovirus, e.g. human or simian adenoviruses
- C12N2710/10371—Demonstrated in vivo effect
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2830/00—Vector systems having a special element relevant for transcription
- C12N2830/008—Vector systems having a special element relevant for transcription cell type or tissue specific enhancer/promoter combination
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2830/00—Vector systems having a special element relevant for transcription
- C12N2830/60—Vector systems having a special element relevant for transcription from viruses
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2830/00—Vector systems having a special element relevant for transcription
- C12N2830/80—Vector systems having a special element relevant for transcription from vertebrates
- C12N2830/85—Vector systems having a special element relevant for transcription from vertebrates mammalian
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2840/00—Vectors comprising a special translation-regulating system
- C12N2840/20—Vectors comprising a special translation-regulating system translation of more than one cistron
- C12N2840/203—Vectors comprising a special translation-regulating system translation of more than one cistron having an IRES
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- General Health & Medical Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Zoology (AREA)
- Organic Chemistry (AREA)
- Medicinal Chemistry (AREA)
- Wood Science & Technology (AREA)
- Biotechnology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Biomedical Technology (AREA)
- General Engineering & Computer Science (AREA)
- Virology (AREA)
- Microbiology (AREA)
- Epidemiology (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Immunology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Gastroenterology & Hepatology (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Biophysics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Physics & Mathematics (AREA)
- Plant Pathology (AREA)
- Cell Biology (AREA)
- Mycology (AREA)
- Physical Education & Sports Medicine (AREA)
- Oncology (AREA)
- Rheumatology (AREA)
- Hematology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Abstract
本発明は医学の分野に関する。具体的には、本発明は癌療法に関する。より具体的には、本発明は、腫瘍溶解ヒトアデノウイルスベクター並びに前記ベクターを含む細胞および医薬組成物に関する。本発明はまた、対象者で癌を治療するための医薬の製造における前記ベクターの使用および対象者で癌を治療する方法に関する。さらにまた、本発明はアデノウイルスベクターを製造する方法に関する。
【選択図】 なし
【選択図】 なし
Description
本発明は医学の分野に関する。具体的には、本発明は癌療法に関する。より具体的には、本発明は、腫瘍溶解ヒトアデノウイルスベクター並びに前記ベクターを含む細胞および医薬組成物に関する。本発明はまた、対象者で癌を治療するための医薬の製造における前記ベクターの使用および対象者で癌を治療する方法に関する。さらにまた、本発明は、アデノウイルスベクターを製造する方法に関する。
癌は、外科手術、ホルモン療法、化学療法および/または放射線療法によって処置されえるが、多くの事例では、癌(しばしば進行期を特徴とする)は現在の治療方法では治癒させることはできない。したがって、癌細胞に照準を当てる新規なアプローチ(例えば遺伝子療法)が必要とされる。
ここ20年間、遺伝子移転技術は集中的に研究されてきた。癌の遺伝子療法の目的は、治療用遺伝子を腫瘍細胞に導入することである。標的細胞に導入されたこれらの治療用遺伝子は、例えば変異した遺伝子を修正するか、活動的な腫瘍遺伝子を抑制するか、または当該細胞にまた別の特性を生じさせることができる。適切な外因性治療用遺伝子には、免疫療法遺伝子、抗血管形成遺伝子、化学物質防御遺伝子および“自殺”遺伝子が含まれ(ただしこれらに限定されない)、それらは、改変ウイルスベクターまたは非ウイルス的方法(エレクトロポレーション、遺伝子銃およびポリマーコーティングを含む)を利用することにより細胞に導入できる。
最適なウイルスベクターの要件には、特異的標的細胞を見つけ出し、標的細胞内で当該ウイルスゲノムを発現させる効率的な能力が含まれる。さらにまた、最適なベクターは、標的組織または細胞で活性を維持しなければならない。これらすべてのウイルスベクターの特性がここ数十年の間に開発され、例えばレトロウイルス、アデノウイルスおよびアデノ関連ウイルスベクターが生物医薬として広範囲に研究されてきた。
ここ20年間、遺伝子移転技術は集中的に研究されてきた。癌の遺伝子療法の目的は、治療用遺伝子を腫瘍細胞に導入することである。標的細胞に導入されたこれらの治療用遺伝子は、例えば変異した遺伝子を修正するか、活動的な腫瘍遺伝子を抑制するか、または当該細胞にまた別の特性を生じさせることができる。適切な外因性治療用遺伝子には、免疫療法遺伝子、抗血管形成遺伝子、化学物質防御遺伝子および“自殺”遺伝子が含まれ(ただしこれらに限定されない)、それらは、改変ウイルスベクターまたは非ウイルス的方法(エレクトロポレーション、遺伝子銃およびポリマーコーティングを含む)を利用することにより細胞に導入できる。
最適なウイルスベクターの要件には、特異的標的細胞を見つけ出し、標的細胞内で当該ウイルスゲノムを発現させる効率的な能力が含まれる。さらにまた、最適なベクターは、標的組織または細胞で活性を維持しなければならない。これらすべてのウイルスベクターの特性がここ数十年の間に開発され、例えばレトロウイルス、アデノウイルスおよびアデノ関連ウイルスベクターが生物医薬として広範囲に研究されてきた。
腫瘍への穿通および抗腫瘍作用の局所増幅をさらに改善するために、選択的腫瘍溶解性因子、例えば条件付きで複製するアデノウイルスが構築された。腫瘍溶解アデノウイルスは癌の治療で有望なツールである。腫瘍細胞は、腫瘍細胞内での腫瘍溶解アデノウイルスの複製(効率的な腫瘍穿通および脈管再感染のために周辺腫瘍組織に数千のビリオンを放出する複製の終期)により当該ウイルスによって殺滅される。治療手段は、正常細胞と腫瘍細胞との間の分子的相違を利用する。腫瘍細胞はウイルスの複製を許容し、一方、正常細胞は、非腫瘍細胞での複製を妨げるウイルスゲノムの操作による変化のおかげでウイルス複製を免れる。最適な腫瘍溶解アデノウイルスは癌細胞にのみ感染して複製し、免疫学的応答がウイルスを中和する前に全癌細胞を殺滅するために十分に強力であろう。
組織特異的プロモーターの一定の欠失および付加はウイルスの選択性を高め、一方、トランスジーンの付加はこれら手段をより強力にしえる。実際、複製によって媒介される細胞殺滅に加えて、腫瘍溶解アデノウイルスはまた種々の治療用トランスジーンで補強することができる。このアプローチは、通常の遺伝子デリバリーの利点と複製能力を有する因子の潜在能力を合体させる。補強ウイルスの1つの目標は、ウイルス複製を許容する細胞に対する免疫反応の誘発である。免疫原性であってもウイルス複製だけでは有効な抗腫瘍免疫の誘発には通常十分ではない。治療免疫の誘発を強化するために、刺激性タンパク質(例えばサイトカイン)を用い、さらに樹状突起細胞に対し腫瘍抗原の引き合わせを促進することによってウイルスを補強することができる。免疫治療用遺伝子の腫瘍細胞への導入、さらにはまた当該タンパク質の翻訳は、免疫応答の活性化および腫瘍細胞の効率的な破壊をもたらす。
組織特異的プロモーターの一定の欠失および付加はウイルスの選択性を高め、一方、トランスジーンの付加はこれら手段をより強力にしえる。実際、複製によって媒介される細胞殺滅に加えて、腫瘍溶解アデノウイルスはまた種々の治療用トランスジーンで補強することができる。このアプローチは、通常の遺伝子デリバリーの利点と複製能力を有する因子の潜在能力を合体させる。補強ウイルスの1つの目標は、ウイルス複製を許容する細胞に対する免疫反応の誘発である。免疫原性であってもウイルス複製だけでは有効な抗腫瘍免疫の誘発には通常十分ではない。治療免疫の誘発を強化するために、刺激性タンパク質(例えばサイトカイン)を用い、さらに樹状突起細胞に対し腫瘍抗原の引き合わせを促進することによってウイルスを補強することができる。免疫治療用遺伝子の腫瘍細胞への導入、さらにはまた当該タンパク質の翻訳は、免疫応答の活性化および腫瘍細胞の効率的な破壊をもたらす。
アデノウイルスは中位のサイズで(90−100nm)エンベロープのない正二十面体ウイルスであり、タンパク質キャプシド中に約36キロベースの二重鎖線状DNAを有する。ウイルスキャプシドは線維構造物を有し、前記は標的細胞へのウイルスの接着に関与する。第一に、前記線維タンパク質のノブドメインは標的細胞のレセプター(例えばCD46またはコクサッキーウイルスアデノウイルスレセプター(CAR))と結合し、第二にウイルスはインテグリン分子と相互作用し、第三にウイルスはエンドサイトーシスにより標的細胞内に取り込まれる。次に、ウイルスゲノムはエンドソームから核内に移動し、標的細胞の複製機構もまたウイルスの目的のために利用される(WC Russell, 2000, J General Virol, 81:2753-2604)。
アデノウイルスは、初期(E1−E4)、中間(intermediate)(IXおよびIVa2)および後期遺伝子(L1−L5)を有し、これらは連続的順序で転写される。初期遺伝子生成物は、宿主細胞の防御メカニズム、細胞周期および細胞代謝に影響を及ぼす。中間および後期遺伝子は、新ビリオン生成のためのウイルス構造タンパク質をコードする(Wu and Nemerow, 2004, Trends Microbiol, 12:162-168;WC Russell, 2000, J General Virol, 81:2573-2604;C Volpers and S Kochanek, 2004, J Gene Med, 6 Suppl 1, S164-71;NA Kootstra and IM Verma, 2003, Annu Rev Pharmacol Toxicol 43:413-439)。
アデノウイルスは、初期(E1−E4)、中間(intermediate)(IXおよびIVa2)および後期遺伝子(L1−L5)を有し、これらは連続的順序で転写される。初期遺伝子生成物は、宿主細胞の防御メカニズム、細胞周期および細胞代謝に影響を及ぼす。中間および後期遺伝子は、新ビリオン生成のためのウイルス構造タンパク質をコードする(Wu and Nemerow, 2004, Trends Microbiol, 12:162-168;WC Russell, 2000, J General Virol, 81:2573-2604;C Volpers and S Kochanek, 2004, J Gene Med, 6 Suppl 1, S164-71;NA Kootstra and IM Verma, 2003, Annu Rev Pharmacol Toxicol 43:413-439)。
50を超える異なるアデノウイルス血清型がヒトで見出されている。血清型はA−Fの6つのサブグループに分類され、異なる血清型は異なる症状、すなわち呼吸器疾患、結膜炎および胃腸炎に関係することが判明している。それにもかかわらず、組換えアデノウイルスを利用するいずれの癌治療試験もサブグループCウイルス(ほとんど事例でAd5であった)を特色としている。それ以外は血清型5という環境でのキメラキャプシド血清型の利点もまた認識されている。キメラ血清型がAd5に対抗して存在する中和抗体(Nab)からの部分的逃避を可能にするからといって、ウイルスキャプシドの大半がなおAd5に由来するという事実はこの逃避を不完全なものにする(M. Sarkioja et al. 2008, Gene Ther 15:921-929)。
したがって完全に非Ad5の腫瘍溶解ウイルス(前記はAd5に対抗して存在するNabから逃避することができる)が希求される。これらのウイルスは、Ad5に対抗するNAbが既に存在する環境で特に有用である。このような状況は、自然感染の結果としてまたはAd5を土台とした腫瘍ウイルスによる処置に続いて生じる可能性がある。
現在のところ、遺伝子療法の関係で血清型3アデノウイルスに関する刊行物はほとんど存在しない。野生型Ad3はヒトで呼吸器感染および結膜炎を引き起こすことが判明している。完全なDNA配列は2005年に報告され、血清型5とは62.75%しか同一性をもたない。ゲノム構成は他のヒトアデノウイルスと同様であり、初期および遅延初期転写ユニット(後期および主要後期ユニットを含む)を有する(D Sirena et al. 2005, Virology 343:283-298)。数年前、野生型ウイルスが酸素正常状態下および低酸素状態下で調査された(BH Shen et al. 2006, Gene Ther 13:986-990)。最近、同じグループがColoAd1(複合Ad3/Ad11pキメラウイルス)を報告した(I Kuhn et al 2008, PLos ONE 3:e2409)。ColoAd1は、一連の血清型をプールし、続いてこのプールを血清型間での組換えを生じる条件下で継代することによって作製された。前記著者らはこの方法を“定方向進化”と呼んだ。続いてこれらの高度な多様性を有するウイルスプールを厳密な定方向選別下に置いて、強力なウイルスを作製しそれらを同定した。彼らの実験で、Ad3/Ad11Pキメラウイルスは、親の血清型または臨床的にもっとも進歩した腫瘍性Ad(ONYX-015)よりも2−3桁強力で選択性を有することがin vitroで見出された。これらの結果はin vivoおよびex vivo実験によってさらに支持された。しかしながら、ColoAd1は、その進化に利用できる手段が与えられたとしても、腫瘍選択性のための合理的な基礎をもたない。さらにまた、前記は1つの動物モデル(マウスにおける結腸癌異種移植を特色とする)でのみ研究されただけなので、in vivoにおけるその活性および安全性はほとんど知られていない。
したがって、非Ad5遺伝子療法の特異性の強化および十分な腫瘍殺滅能力とともにより効率的で正確な遺伝子移転が担保されねばならない。治療用ベクターの安全性の記録もまた優れていなければならない。本発明は、腫瘍溶解ヒト非Ad5ウイルスを利用することによって前述の特性を有する癌治療ツールを提供する。
したがって完全に非Ad5の腫瘍溶解ウイルス(前記はAd5に対抗して存在するNabから逃避することができる)が希求される。これらのウイルスは、Ad5に対抗するNAbが既に存在する環境で特に有用である。このような状況は、自然感染の結果としてまたはAd5を土台とした腫瘍ウイルスによる処置に続いて生じる可能性がある。
現在のところ、遺伝子療法の関係で血清型3アデノウイルスに関する刊行物はほとんど存在しない。野生型Ad3はヒトで呼吸器感染および結膜炎を引き起こすことが判明している。完全なDNA配列は2005年に報告され、血清型5とは62.75%しか同一性をもたない。ゲノム構成は他のヒトアデノウイルスと同様であり、初期および遅延初期転写ユニット(後期および主要後期ユニットを含む)を有する(D Sirena et al. 2005, Virology 343:283-298)。数年前、野生型ウイルスが酸素正常状態下および低酸素状態下で調査された(BH Shen et al. 2006, Gene Ther 13:986-990)。最近、同じグループがColoAd1(複合Ad3/Ad11pキメラウイルス)を報告した(I Kuhn et al 2008, PLos ONE 3:e2409)。ColoAd1は、一連の血清型をプールし、続いてこのプールを血清型間での組換えを生じる条件下で継代することによって作製された。前記著者らはこの方法を“定方向進化”と呼んだ。続いてこれらの高度な多様性を有するウイルスプールを厳密な定方向選別下に置いて、強力なウイルスを作製しそれらを同定した。彼らの実験で、Ad3/Ad11Pキメラウイルスは、親の血清型または臨床的にもっとも進歩した腫瘍性Ad(ONYX-015)よりも2−3桁強力で選択性を有することがin vitroで見出された。これらの結果はin vivoおよびex vivo実験によってさらに支持された。しかしながら、ColoAd1は、その進化に利用できる手段が与えられたとしても、腫瘍選択性のための合理的な基礎をもたない。さらにまた、前記は1つの動物モデル(マウスにおける結腸癌異種移植を特色とする)でのみ研究されただけなので、in vivoにおけるその活性および安全性はほとんど知られていない。
したがって、非Ad5遺伝子療法の特異性の強化および十分な腫瘍殺滅能力とともにより効率的で正確な遺伝子移転が担保されねばならない。治療用ベクターの安全性の記録もまた優れていなければならない。本発明は、腫瘍溶解ヒト非Ad5ウイルスを利用することによって前述の特性を有する癌治療ツールを提供する。
発明の簡単な説明
本発明の目的は、アデノウイルスの上述の特性を達成し、したがって従来の癌治療の問題を解決する新規な方法および手段を提供することである。より具体的には、本発明は、遺伝子療法のための新規な方法および手段を提供する。
本出願は、腫瘍溶解ヒトAd3ベクターの構築、並びに腫瘍細胞株および動物モデルにおけるそれらの使用について述べ、さらに腫瘍溶解アデノウイルス血清型5ベクターのウイルス療法における代替物を提供する。
本発明のベクターは、血清型3のみを土台とする最初の選択的腫瘍溶解性ヒトアデノウイルスである。本ベクターはまた、腫瘍特異的プロモーターによって制御される最初の非Ad5を土台とする腫瘍溶解アデノウイルスである。
本発明は完全に血清型3である腫瘍溶解ヒトアデノウイルスベクターに関する。
本発明はさらに本発明のアデノウイルスベクターを含む細胞に関する。
本発明はまた本発明のアデノウイルスベクターを含む医薬組成物に関する。
さらにまた、本発明は対象者で癌を治療する医薬の製造における本発明のアデノウイルスベクターの使用に関する。
さらにまた、本発明は対象者で癌を治療する方法に関し、前記方法は本発明のベクターまたは医薬組成物を対象者に投与する工程を含む。
さらにまた、本発明は以下の工程を含む本発明のアデノウイルスベクターを製造する方法に関する:
i)少なくとも部分的なAd3 DNAおよび場合によって1つまたはいくつかのプロモーターおよび/または場合によって1つまたはいくつかのトランスジーンを含むDNAベクターを提供する工程;および
ii)Ad3ゲノムの残りおよび場合によって1つまたはいくつかのプロモーターおよび/または場合によって1つまたはいくつかのトランスジーンを前記ベクターに挿入する工程。
本発明の目的は、アデノウイルスの上述の特性を達成し、したがって従来の癌治療の問題を解決する新規な方法および手段を提供することである。より具体的には、本発明は、遺伝子療法のための新規な方法および手段を提供する。
本出願は、腫瘍溶解ヒトAd3ベクターの構築、並びに腫瘍細胞株および動物モデルにおけるそれらの使用について述べ、さらに腫瘍溶解アデノウイルス血清型5ベクターのウイルス療法における代替物を提供する。
本発明のベクターは、血清型3のみを土台とする最初の選択的腫瘍溶解性ヒトアデノウイルスである。本ベクターはまた、腫瘍特異的プロモーターによって制御される最初の非Ad5を土台とする腫瘍溶解アデノウイルスである。
本発明は完全に血清型3である腫瘍溶解ヒトアデノウイルスベクターに関する。
本発明はさらに本発明のアデノウイルスベクターを含む細胞に関する。
本発明はまた本発明のアデノウイルスベクターを含む医薬組成物に関する。
さらにまた、本発明は対象者で癌を治療する医薬の製造における本発明のアデノウイルスベクターの使用に関する。
さらにまた、本発明は対象者で癌を治療する方法に関し、前記方法は本発明のベクターまたは医薬組成物を対象者に投与する工程を含む。
さらにまた、本発明は以下の工程を含む本発明のアデノウイルスベクターを製造する方法に関する:
i)少なくとも部分的なAd3 DNAおよび場合によって1つまたはいくつかのプロモーターおよび/または場合によって1つまたはいくつかのトランスジーンを含むDNAベクターを提供する工程;および
ii)Ad3ゲノムの残りおよび場合によって1つまたはいくつかのプロモーターおよび/または場合によって1つまたはいくつかのトランスジーンを前記ベクターに挿入する工程。
本発明は、従来のアプローチに対して難治性の癌を治療するツールを提供する。さらにまた、他の多くの治療と比較して本発明では治療に適切な腫瘍タイプに関する制限も極めて少ない。実際のところ、本発明を用いて全ての固形腫瘍を治療することができる。治療は、腫瘍内投与、空洞内投与、動脈内投与、静脈内投与および前記の組合せを用いることができる。
Ad3を土台とするウイルスは、Ad5ウイルスよりも容易に癌幹細胞型細胞に進入することができる。本発明のウイルスの有効性は腫瘍細胞株で示され、本ウイルスは、ヒト癌のいくつかのネズミモデルにおいてAd5またはAd5/3を土台とするコントロールと少なくとも同程度に強力であった。
問題の位置にベクターを輸送することができるだけでなく、本発明のベクターはまたトランスジーンの発現および持続性を担保することができる。非補強ウイルスの複製を許容する細胞に対する免疫反応は通常、腫瘍治療免疫の発達をもたらすほど強力ではない。この弱点を克服するために、本発明は抗腫瘍免疫の強力なインデューサー(例えばGM-CSF)で補強したウイルスを提供する。
本発明では、ヒトヨウ化ナトリウムシンポーター(hNIS)トランスジーンもまた放射性ヨウ化物の標的細胞への誘導で用いられる。前記手段は、ウイルスの腫瘍溶解作用および放射線誘発細胞死により腫瘍細胞の殺滅を可能にする。前記手段はまた、放射線と腫瘍溶解アデノウイルス複製との相乗作用を利用する。hNISをトランスジーンとして誘導することによって、放射性ヨウ化物を非甲状腺起源の癌の治療に用いることができる。hNISのまた別の有用な特徴はトランスジーンの発現の非侵襲性画像化であり、これによってウイルスの拡散および維持をモニターすることができる。
Ad3を土台とするウイルスは、Ad5ウイルスよりも容易に癌幹細胞型細胞に進入することができる。本発明のウイルスの有効性は腫瘍細胞株で示され、本ウイルスは、ヒト癌のいくつかのネズミモデルにおいてAd5またはAd5/3を土台とするコントロールと少なくとも同程度に強力であった。
問題の位置にベクターを輸送することができるだけでなく、本発明のベクターはまたトランスジーンの発現および持続性を担保することができる。非補強ウイルスの複製を許容する細胞に対する免疫反応は通常、腫瘍治療免疫の発達をもたらすほど強力ではない。この弱点を克服するために、本発明は抗腫瘍免疫の強力なインデューサー(例えばGM-CSF)で補強したウイルスを提供する。
本発明では、ヒトヨウ化ナトリウムシンポーター(hNIS)トランスジーンもまた放射性ヨウ化物の標的細胞への誘導で用いられる。前記手段は、ウイルスの腫瘍溶解作用および放射線誘発細胞死により腫瘍細胞の殺滅を可能にする。前記手段はまた、放射線と腫瘍溶解アデノウイルス複製との相乗作用を利用する。hNISをトランスジーンとして誘導することによって、放射性ヨウ化物を非甲状腺起源の癌の治療に用いることができる。hNISのまた別の有用な特徴はトランスジーンの発現の非侵襲性画像化であり、これによってウイルスの拡散および維持をモニターすることができる。
本発明はまた、通常の治療および他のアデノ関連療法に対する耐性に関する問題を解決する。本発明の極めて潜在的な対象群は、高い抗Ad5 Nab力価を有するかまたはAd5因子で以前に利用された患者群である。
さらにまた、本発明は、健常組織に毒性または損傷を与えない選択的治療のためのツールおよび方法を提供する。さらにまた、本発明の利点には他の療法と比較して緩和された異なる副作用が含まれえる。重要なことには、本アプローチは、他の多くの治療形態(化学療法及び放射線療法を含む)と相乗性を有し、したがって併用治療方針で用いることができる。
従来技術のアデノウイルスツールと比較して、本発明はより簡単でより有効であり、安価で毒性のないおよび/またはより安全な癌療法用ツールを提供する。さらにまた、ヘルパーウイルスを必要としない。
本発明の新規な生成物は癌療法における更なる改善を可能にする。
さらにまた、本発明は、健常組織に毒性または損傷を与えない選択的治療のためのツールおよび方法を提供する。さらにまた、本発明の利点には他の療法と比較して緩和された異なる副作用が含まれえる。重要なことには、本アプローチは、他の多くの治療形態(化学療法及び放射線療法を含む)と相乗性を有し、したがって併用治療方針で用いることができる。
従来技術のアデノウイルスツールと比較して、本発明はより簡単でより有効であり、安価で毒性のないおよび/またはより安全な癌療法用ツールを提供する。さらにまた、ヘルパーウイルスを必要としない。
本発明の新規な生成物は癌療法における更なる改善を可能にする。
発明の詳細な説明
アデノウイルスベクター:
本発明では、血清型3を土台とする腫瘍溶解アデノウイルスベクターを構築することができること、および前記ベクターは腫瘍の殺滅を可能にすることが示される。
Ad3では(他のアデノウイルスと同様に)、正二十面体キャプシドは、少なくとも3つの主要なタンパク質(ヘキソン、ペプトン土台および線維)とともにマイナータンパク質(例えばVI、VIII、IX、IIIaおよびIva2)から成る(WC Russell, J General Virol, 2000, 81:2573-2604;D Sirena et al. 2005, Virology 343:283-298)。
Sirenaら(2005, Virology 343:283-298)は、野生型Ad3の完全な配列を報告した(GeneBankアクセッション番号DQ086466)。Ad3ゲノムは、初期(E1−4)、中間(IXおよびIva2)並びに左および右の倒置末端リピート(それぞれLITRおよびRITR)によってフランキングされた主要後期ユニット(MLTU)領域(前記はDNA複製に必要な配列を含む)を含んでいる。
本発明のある実施態様では、完全に血清型3の腫瘍溶解ヒトアデノウイルスベクターは、E1、E2、E3、E4、中間および後期領域から成る群から選択される1つまたは2つ以上の領域を含む。本発明のある実施態様では、腫瘍溶解ヒトアデノウイルスベクターは以下の領域を含む:左ITR、E1、pIX、pIVa2、E2、VA1、VA2、後期領域、E3もしくは部分的E3、E4および右ITR。
前記領域はベクター内で任意の順序で存在できるが、本発明のある実施態様では、前記領域は5'から3'方向に連続的順序で存在する。オープンリーディングフレーム(ORF)は、同じDNA鎖または別個のDNA鎖に存在しえる。
アデノウイルスベクター:
本発明では、血清型3を土台とする腫瘍溶解アデノウイルスベクターを構築することができること、および前記ベクターは腫瘍の殺滅を可能にすることが示される。
Ad3では(他のアデノウイルスと同様に)、正二十面体キャプシドは、少なくとも3つの主要なタンパク質(ヘキソン、ペプトン土台および線維)とともにマイナータンパク質(例えばVI、VIII、IX、IIIaおよびIva2)から成る(WC Russell, J General Virol, 2000, 81:2573-2604;D Sirena et al. 2005, Virology 343:283-298)。
Sirenaら(2005, Virology 343:283-298)は、野生型Ad3の完全な配列を報告した(GeneBankアクセッション番号DQ086466)。Ad3ゲノムは、初期(E1−4)、中間(IXおよびIva2)並びに左および右の倒置末端リピート(それぞれLITRおよびRITR)によってフランキングされた主要後期ユニット(MLTU)領域(前記はDNA複製に必要な配列を含む)を含んでいる。
本発明のある実施態様では、完全に血清型3の腫瘍溶解ヒトアデノウイルスベクターは、E1、E2、E3、E4、中間および後期領域から成る群から選択される1つまたは2つ以上の領域を含む。本発明のある実施態様では、腫瘍溶解ヒトアデノウイルスベクターは以下の領域を含む:左ITR、E1、pIX、pIVa2、E2、VA1、VA2、後期領域、E3もしくは部分的E3、E4および右ITR。
前記領域はベクター内で任意の順序で存在できるが、本発明のある実施態様では、前記領域は5'から3'方向に連続的順序で存在する。オープンリーディングフレーム(ORF)は、同じDNA鎖または別個のDNA鎖に存在しえる。
本明細書で用いられるように、“アデノウイルス血清型3(Ad3)”という表現はヒトAd3のゲノムまたは部分的ゲノムを指し、前記は、Ad3起源のE1、pIX、pIVa2、E2、VA1、VA2、後期領域、E3もしくは部分的E3およびE4から成る群から選択される1つまたはいくつかの領域を含む。
本明細書で用いられるように、“部分的”領域という表現は、対応する野生型領域と比較して任意の部分を欠く領域を指す。“部分的E3”はgp19kを欠くE3領域を指す。
本明細書で用いられるように、“VA1”および“VA2”という表現は、ウイルス結合RNA1および2を指し、前記はアデノウイルスによって転写されるが翻訳されない。VA1およびVA2は細胞の防御メカニズムと戦う役割を有する。
内因性および外因性エレメントの挿入は標的細胞内でのベクターの作用を強化することができる。
外因性の組織特異的または腫瘍特異的プロモーターの使用はアデノウイルスベクターでは一般的であり、それらはまた本発明で利用することができる。例えば、プロモーター(hTERT、hTERTの変種、CEA、SLP、Cox-2、Midkine、E2F、E2Fの変種、CXCR4、SCCA2およびTTSが含まれるが、ただしこれらに限定されない)によってウイルスの複製を標的細胞に限定することができる。それらは通常はE1A領域を制御するために付加されるが、前記に加えてまたは前記の代わりに他の遺伝子(例えばE1BまたはE4)もまた調節することができる。
本明細書で用いられるように、“部分的”領域という表現は、対応する野生型領域と比較して任意の部分を欠く領域を指す。“部分的E3”はgp19kを欠くE3領域を指す。
本明細書で用いられるように、“VA1”および“VA2”という表現は、ウイルス結合RNA1および2を指し、前記はアデノウイルスによって転写されるが翻訳されない。VA1およびVA2は細胞の防御メカニズムと戦う役割を有する。
内因性および外因性エレメントの挿入は標的細胞内でのベクターの作用を強化することができる。
外因性の組織特異的または腫瘍特異的プロモーターの使用はアデノウイルスベクターでは一般的であり、それらはまた本発明で利用することができる。例えば、プロモーター(hTERT、hTERTの変種、CEA、SLP、Cox-2、Midkine、E2F、E2Fの変種、CXCR4、SCCA2およびTTSが含まれるが、ただしこれらに限定されない)によってウイルスの複製を標的細胞に限定することができる。それらは通常はE1A領域を制御するために付加されるが、前記に加えてまたは前記の代わりに他の遺伝子(例えばE1BまたはE4)もまた調節することができる。
本発明のある実施態様では、腫瘍溶解ヒトアデノウイルスはhTERTプロモーター下にAd3 E1A領域を含む。Ad3-hTERT-E1Aは、腫瘍特異的複製のために、E1A転写部位の上流にヒトテロメラーゼ触媒ドメインプロモーターを含む。
ここ数十年間でテロメアおよびテロメラーゼに関する研究が急速に進んだ。テロメラーゼ活性化はヒトの癌発生において決定的ステップであり、ほとんどのヒト腫瘍はテロメラーゼ活性を特徴とする。この特徴はhTERTプロモーターの活性と密接に連関している(hTERTプロモーターはほとんどのヒト腫瘍で活性を有すると示唆され、したがって有用な腫瘍特異的プロモーターの典型である)。本発明のある実施態様では、腫瘍溶解ヒトアデノウイルスベクターはテロメラーゼ活性を有する細胞でのみ複製することができる。
本発明のある実施態様では、腫瘍溶解アデノウイルスベクターは、複製活性化Ad3 E3プロモーター下にAd3 E3領域を含む。本発明のある具体的な実施態様では、E3プロモーター下でgp19k欠失E3領域に配置される。これによってトランスジーン発現は、ウイルスの複製およびその後のE3プロモーターの活性化を許容する腫瘍細胞に限定される。E3プロモーターは、当分野で公知の任意の外因性または内因性プロモーター、好ましくは内因性プロモーターでありえる。
外因性隔離因子、すなわち非特異的エンハンサー、左ITR、天然のE1Aプロモーターまたはクロマチンタンパク質に対抗する封鎖エレメントもまた組換えアデノウイルスベクターに含ませることができる。任意の追加成分または改変を場合によって用いることができるが、本発明のベクターに必須というわけではない。
ここ数十年間でテロメアおよびテロメラーゼに関する研究が急速に進んだ。テロメラーゼ活性化はヒトの癌発生において決定的ステップであり、ほとんどのヒト腫瘍はテロメラーゼ活性を特徴とする。この特徴はhTERTプロモーターの活性と密接に連関している(hTERTプロモーターはほとんどのヒト腫瘍で活性を有すると示唆され、したがって有用な腫瘍特異的プロモーターの典型である)。本発明のある実施態様では、腫瘍溶解ヒトアデノウイルスベクターはテロメラーゼ活性を有する細胞でのみ複製することができる。
本発明のある実施態様では、腫瘍溶解アデノウイルスベクターは、複製活性化Ad3 E3プロモーター下にAd3 E3領域を含む。本発明のある具体的な実施態様では、E3プロモーター下でgp19k欠失E3領域に配置される。これによってトランスジーン発現は、ウイルスの複製およびその後のE3プロモーターの活性化を許容する腫瘍細胞に限定される。E3プロモーターは、当分野で公知の任意の外因性または内因性プロモーター、好ましくは内因性プロモーターでありえる。
外因性隔離因子、すなわち非特異的エンハンサー、左ITR、天然のE1Aプロモーターまたはクロマチンタンパク質に対抗する封鎖エレメントもまた組換えアデノウイルスベクターに含ませることができる。任意の追加成分または改変を場合によって用いることができるが、本発明のベクターに必須というわけではない。
E3領域はin vitroのウイルス複製には必須ではないが、E3タンパク質は、宿主の免疫応答の調節、すなわち先天的および特異的免疫応答の両方の抑制に重要な役割を有する。本発明のベクターはE3内のgp19k領域に欠失を有することができる。gp19k遺伝子生成物は、小胞体中の主要組織適合複合体1(MHC1)分子と結合してこれを隔離し、細胞傷害性Tリンパ球による感染細胞の認識を妨げることが知られている。多くの腫瘍はMHC1を欠いているので、gp19kの欠失はウイルスの腫瘍選択性を高める(ウイルスは野生型ウイルスよりも迅速に正常細胞から除去されるが、腫瘍細胞では相違がない)。
本発明のある実施態様では、腫瘍溶解アデノウイルスベクターは1つまたは2つ以上のトランスジーンを含む。本発明のある実施態様では、トランスジーンは、hTERTプロモーター下でE1におよび/または複製活性化Ad3 E3プロモーター下でE3に配置される。本発明のある実施態様では、腫瘍溶解ヒトアデノウイルスベクターは、E3領域内の欠失gp19kの位置にトランスジーンを含む。
本発明のある実施態様では、腫瘍溶解アデノウイルスベクターはトランスジーンとE1A領域との間に内部リボソーム進入部位(IRES)を含む。IRESは、タンパク質合成においてメッセンジャーRNA配列の中央で翻訳開始を可能にするヌクレオチド配列を指す。本発明のある実施態様では、IRESは脳脊髄炎ウイルス(EMCV)に由来し、前記はClontechのベクター、pIRES2-DsRed2から得られる。本発明のある実施態様では、腫瘍溶解アデノウイルスベクターはhTERTプロモーター、トランスジーン、IRESおよびE1Aを含む。
本発明のある実施態様では、トランスジーンは、顆粒球-マクロファージコロニー刺激因子(GM-CSF)、ヒトヨウ化ナトリウムシンポーター(hNIS)、インターフェロンアルファ、インターフェロンベータ、インターフェロンガンマ、腫瘍壊死因子アルファ、CD40L、トラスツズマブおよび他のモノクローナル抗体から成る群から選択される
本発明のある実施態様では、腫瘍溶解アデノウイルスベクターは1つまたは2つ以上のトランスジーンを含む。本発明のある実施態様では、トランスジーンは、hTERTプロモーター下でE1におよび/または複製活性化Ad3 E3プロモーター下でE3に配置される。本発明のある実施態様では、腫瘍溶解ヒトアデノウイルスベクターは、E3領域内の欠失gp19kの位置にトランスジーンを含む。
本発明のある実施態様では、腫瘍溶解アデノウイルスベクターはトランスジーンとE1A領域との間に内部リボソーム進入部位(IRES)を含む。IRESは、タンパク質合成においてメッセンジャーRNA配列の中央で翻訳開始を可能にするヌクレオチド配列を指す。本発明のある実施態様では、IRESは脳脊髄炎ウイルス(EMCV)に由来し、前記はClontechのベクター、pIRES2-DsRed2から得られる。本発明のある実施態様では、腫瘍溶解アデノウイルスベクターはhTERTプロモーター、トランスジーン、IRESおよびE1Aを含む。
本発明のある実施態様では、トランスジーンは、顆粒球-マクロファージコロニー刺激因子(GM-CSF)、ヒトヨウ化ナトリウムシンポーター(hNIS)、インターフェロンアルファ、インターフェロンベータ、インターフェロンガンマ、腫瘍壊死因子アルファ、CD40L、トラスツズマブおよび他のモノクローナル抗体から成る群から選択される
GM-CSFは、種々のメカニズム(ナチュラルキラー(NK)細胞の動員および抗原提示細胞(APC)の刺激を含む)を介して作用することによって免疫応答に関与する。続いてAPCはT細胞を動員し活性化し腫瘍に向かわせる。GM-CSFをコードするヌクレオチド配列は任意の動物(例えばヒト、サル、ラット、マウス、ハムスター、イヌまたはネコ)に由来しえるが、好ましくはGM-CSFはヒトの配列によってコードされる。GM-CSFをコードするヌクレオチド配列は、GM-CSFの作用を改善するために改変してもよいが、改変しなくてもよい(すなわち野生型)。本発明の好ましい実施態様では、GM-CSFをコードする核酸配列は野生型である。
本発明のある実施態様では、腫瘍溶解ヒトアデノウイルスベクターはhNIS(配列番号:15)を含む(前記は放射性ヨウ化物を標的細胞へ誘導する)。ヨウ化ナトリウムシンポーター(hNIS)のトランスジーンとしての発現は、全身的に適用しえる放射性同位元素(例えば放射性ヨウ化物)を腫瘍へ誘導するための手段である。この手法は、ウイルスの腫瘍溶解作用によりさらに放射線照射誘発細胞死により腫瘍細胞の殺滅を可能にする。さらにこの手法は、放射線照射と腫瘍溶解アデノウイルス複製との間の相乗作用もまた利用する。hNISのさらに別の有用な特徴はトランスジーン発現の非侵襲性画像化であり、これによってウイルスの拡散および維持をモニターすることができる。
hNISは、主として甲状腺濾胞細胞で発現される必須の形質膜糖タンパク質である(O Dohan et al. 2003, Endocr Rev 24:48-77)。hNISの生物学的機能はヨウ化物の能動的輸送を媒介することである(ヨウ化物は甲状腺ホルモン生合成に必須の成分である)。hNISのこの輸送能力は、半世紀にわたって甲状腺癌の放射性ヨウ化物療法で用いられてきた(前記療法では、甲状腺由来の癌細胞を内部から放射線照射するために放射性ヨウ化物分子(131I)が用いられる)。
本発明のある実施態様では、腫瘍溶解ヒトアデノウイルスベクターはhNIS(配列番号:15)を含む(前記は放射性ヨウ化物を標的細胞へ誘導する)。ヨウ化ナトリウムシンポーター(hNIS)のトランスジーンとしての発現は、全身的に適用しえる放射性同位元素(例えば放射性ヨウ化物)を腫瘍へ誘導するための手段である。この手法は、ウイルスの腫瘍溶解作用によりさらに放射線照射誘発細胞死により腫瘍細胞の殺滅を可能にする。さらにこの手法は、放射線照射と腫瘍溶解アデノウイルス複製との間の相乗作用もまた利用する。hNISのさらに別の有用な特徴はトランスジーン発現の非侵襲性画像化であり、これによってウイルスの拡散および維持をモニターすることができる。
hNISは、主として甲状腺濾胞細胞で発現される必須の形質膜糖タンパク質である(O Dohan et al. 2003, Endocr Rev 24:48-77)。hNISの生物学的機能はヨウ化物の能動的輸送を媒介することである(ヨウ化物は甲状腺ホルモン生合成に必須の成分である)。hNISのこの輸送能力は、半世紀にわたって甲状腺癌の放射性ヨウ化物療法で用いられてきた(前記療法では、甲状腺由来の癌細胞を内部から放射線照射するために放射性ヨウ化物分子(131I)が用いられる)。
本発明では、例えばナチュラルキラー細胞、T細胞および/またはマクロファージを活性化することによって腫瘍細胞に対抗する患者の免疫系を誘発するために、トランスジーンとしてインターフェロンアルファ、インターフェロンベータ、インターフェロンガンマ、腫瘍壊死因子、CD40L、トラスツズマブおよび/または他のモノクローナル抗体もまた利用することができる。
本発明のベクターはまた、上記に述べたE3の部分的欠失並びにトランスジーンおよび/またはプロモーターの挿入以外の他の改変を含むことができる。
キャプシドの改変(すなわち当分野で公知のヘキソン、線維および/またはペントン土台タンパク質の改変、前記は腫瘍細胞へのウイルスのデリバリーを改善する)もまた本発明で利用できる。本明細書で用いられる“キャプシド”はウイルスのタンパク質の殻を指し、前記外皮にはヘキソン、線維およびペントン土台タンパク質が含まれる。改変は遺伝的改変でも物理的改変でもよく、前記改変には、リガンドの取り入れのための改変(リガンドは特異的な細胞レセプターを認識しおよび/または天然のレセプター結合を遮断する)、あるアデノウイルスベクターの線維またはノブドメインの他のアデノウイルスのノブによる置換(キメラ状態)のための改変、および特異的な分子(例えばFGF2)を付加するための改変が含まれるが、ただしこれらに限定されない。したがって、キャプシド改変には、小ペプチドモチーフ、ペプチド、キメラ状態または変異線維(例えばノブ、テールまたはシャフト部分)、ヘキソンおよび/またはペントン土台への取り入れが含まれるが、ただしこれらに限定されない。
本発明のベクターはまた、上記に述べたE3の部分的欠失並びにトランスジーンおよび/またはプロモーターの挿入以外の他の改変を含むことができる。
キャプシドの改変(すなわち当分野で公知のヘキソン、線維および/またはペントン土台タンパク質の改変、前記は腫瘍細胞へのウイルスのデリバリーを改善する)もまた本発明で利用できる。本明細書で用いられる“キャプシド”はウイルスのタンパク質の殻を指し、前記外皮にはヘキソン、線維およびペントン土台タンパク質が含まれる。改変は遺伝的改変でも物理的改変でもよく、前記改変には、リガンドの取り入れのための改変(リガンドは特異的な細胞レセプターを認識しおよび/または天然のレセプター結合を遮断する)、あるアデノウイルスベクターの線維またはノブドメインの他のアデノウイルスのノブによる置換(キメラ状態)のための改変、および特異的な分子(例えばFGF2)を付加するための改変が含まれるが、ただしこれらに限定されない。したがって、キャプシド改変には、小ペプチドモチーフ、ペプチド、キメラ状態または変異線維(例えばノブ、テールまたはシャフト部分)、ヘキソンおよび/またはペントン土台への取り入れが含まれるが、ただしこれらに限定されない。
ベクターを利用することによって標的(例えば細胞)でトランスジーンを発現させるために発現カセットが用いられる。本明細書で用いられるように、“発現カセット”という用語は、cDNAまたは遺伝子をコードするDNAベクターまたはヌクレオチド配列を含むその部分、および前記cDNAまたは遺伝子の発現を制御および/または調節するヌクレオチド配列を指す。類似のまたは異なる発現カセットを1つのベクターにまたはいくつかの異なるベクターに挿入することができる。本発明のAd3ベクターは1つまたはいくつかの発現カセットを含むことができる。しかしながら、ただ1つの発現カセットが適切である。本発明のある実施態様では、腫瘍溶解ヒトアデノウイルスベクターは少なくとも1つの発現カセットを含む。本発明の別の実施態様では、腫瘍溶解ヒトアデノウイルスベクターはただ1つの発現カセットを含む。
本発明のアデノウイルスベクターを含む細胞は、任意の細胞、例えば真核細胞、細菌細胞、動物細胞、ヒト細胞、マウス細胞などである。例えば、細胞はアデノウイルスベクターをin vitroまたはin vivoで製造するために用いることができる。または細胞は標的(例えば腫瘍細胞)でもよく、アデノウイルスベクターが前記に感染している。
本発明のアデノウイルスベクターを含む細胞は、任意の細胞、例えば真核細胞、細菌細胞、動物細胞、ヒト細胞、マウス細胞などである。例えば、細胞はアデノウイルスベクターをin vitroまたはin vivoで製造するために用いることができる。または細胞は標的(例えば腫瘍細胞)でもよく、アデノウイルスベクターが前記に感染している。
癌:
任意の癌または腫瘍(悪性および良性腫瘍とともに原発腫瘍および転移を含む)が遺伝子療法の標的となりえる。本発明の具体的な実施態様では、癌は任意の固形腫瘍である。本発明のある実施態様では、癌は以下から成る群から選択される:鼻咽頭癌、滑膜癌、肝細胞癌、腎癌、結合組織の癌、メラノーマ、肺癌、腸癌、結腸癌、直腸癌、結腸直腸癌、脳の癌、咽喉癌、口内癌、肝癌、骨の癌、膵臓癌、絨毛癌、ガストリノーマ、クロム親和性細胞腫、プロラクチノーマ、T細胞白血病/リンパ腫、神経腫、フォン・ヒッペル-リンダウ病、ゾリンジャー-エリソン症候群、副腎癌、肛門癌、胆管癌、膀胱癌、尿管癌、脳の癌、稀突起神経膠腫、神経芽細胞腫、髄膜腫、脊髄腫瘍、骨の癌、骨軟骨腫、軟骨肉腫、ユーイング肉腫、未知の原発癌、類癌、胃腸管の類癌、線維肉腫、胸部癌、パジェット病、子宮頸癌、結腸直腸癌、直腸癌、食道癌、胆嚢癌、頭部の癌、眼の癌、首の癌、腎臓癌、ウィルムス腫瘍、肝臓癌、カポジ肉腫、前立腺癌、肺癌、精巣癌、ホジキン病、非ホジキンリンパ腫、口内癌、皮膚癌、中皮腫、多発性メラノーマ、卵巣癌、内分泌系膵臓癌、グルカゴノーマ、膵臓癌、上皮小体癌、陰茎癌、下垂体癌、軟組織肉腫、網膜芽細胞腫、小腸癌、胃癌、胸腺癌、甲状腺癌、栄養膜の癌、胞状奇胎、子宮癌、子宮内膜癌、膣癌、外陰部癌、聴覚神経腫、菌状息肉腫、インスリノーマ、類癌症候群、ソマトスタチノーマ、歯肉癌、心臓の癌、口唇癌、髄膜癌、口の癌、神経の癌、口蓋癌、耳下腺癌、腹膜癌、咽頭癌、胸膜癌、唾液腺癌、舌癌および扁桃癌。
任意の癌または腫瘍(悪性および良性腫瘍とともに原発腫瘍および転移を含む)が遺伝子療法の標的となりえる。本発明の具体的な実施態様では、癌は任意の固形腫瘍である。本発明のある実施態様では、癌は以下から成る群から選択される:鼻咽頭癌、滑膜癌、肝細胞癌、腎癌、結合組織の癌、メラノーマ、肺癌、腸癌、結腸癌、直腸癌、結腸直腸癌、脳の癌、咽喉癌、口内癌、肝癌、骨の癌、膵臓癌、絨毛癌、ガストリノーマ、クロム親和性細胞腫、プロラクチノーマ、T細胞白血病/リンパ腫、神経腫、フォン・ヒッペル-リンダウ病、ゾリンジャー-エリソン症候群、副腎癌、肛門癌、胆管癌、膀胱癌、尿管癌、脳の癌、稀突起神経膠腫、神経芽細胞腫、髄膜腫、脊髄腫瘍、骨の癌、骨軟骨腫、軟骨肉腫、ユーイング肉腫、未知の原発癌、類癌、胃腸管の類癌、線維肉腫、胸部癌、パジェット病、子宮頸癌、結腸直腸癌、直腸癌、食道癌、胆嚢癌、頭部の癌、眼の癌、首の癌、腎臓癌、ウィルムス腫瘍、肝臓癌、カポジ肉腫、前立腺癌、肺癌、精巣癌、ホジキン病、非ホジキンリンパ腫、口内癌、皮膚癌、中皮腫、多発性メラノーマ、卵巣癌、内分泌系膵臓癌、グルカゴノーマ、膵臓癌、上皮小体癌、陰茎癌、下垂体癌、軟組織肉腫、網膜芽細胞腫、小腸癌、胃癌、胸腺癌、甲状腺癌、栄養膜の癌、胞状奇胎、子宮癌、子宮内膜癌、膣癌、外陰部癌、聴覚神経腫、菌状息肉腫、インスリノーマ、類癌症候群、ソマトスタチノーマ、歯肉癌、心臓の癌、口唇癌、髄膜癌、口の癌、神経の癌、口蓋癌、耳下腺癌、腹膜癌、咽頭癌、胸膜癌、唾液腺癌、舌癌および扁桃癌。
医薬組成物:
本発明の医薬組成物は少なくとも1つのタイプの本発明のベクターを含む。さらにまた、組成物は少なくとも2つ、3つまたは4つの本発明の異なるベクターを含むことができる。本発明のベクターに加えて、医薬組成物は、また任意の他のベクター、例えば他のアデノウイルスベクター、他の治療に有効な薬剤、任意の他の薬剤、例えば医薬的に許容できる担体、緩衝剤、賦形剤、アジュバント、防腐剤、充填剤、安定化剤または膨張剤、および/または対応する製品で通常的に見出される任意の成分を含むことができる。
医薬組成物は投与に適した任意の形態、例えば固体、半固体、または液体形態でありえる。処方は、溶液、乳液、懸濁液、錠剤、ペレットおよびカプセル(ただし前記に限定されない)から成る群から選択できる。
本発明のある実施態様では、腫瘍溶解アデノウイルスベクターまたは医薬組成物はin situ癌ワクチンとして機能する。本明細書で用いられる“in situ癌ワクチン”は、腫瘍細胞を殺滅しさらにまた腫瘍細胞に対する免疫応答を高める癌ワクチンを指す。ウイルスの複製は免疫系に対する極めて危険な信号であり(=TH1型応答に必要)、したがってAPCのGM-CSF媒介成熟および活性化並びにNK細胞の動員に対する強力な相乗刺激現象として機能する。腫瘍細胞溶解はまた腫瘍フラグメントおよびエピトープのAPCへの提示に役立ち、さらにまた相乗刺激は炎症によって引き起こされる。したがってエピトープ非依存性(すなわちHLA拘束性ではない)応答が、それぞれの腫瘍に対応して引き起こされ、したがってin situで生じる。腫瘍特異的免疫応答は、標的細胞とともに周辺細胞(例えば標的組織)で活性化される。
ベクターの有効用量は少なくとも、治療を要する対象者、腫瘍のタイプ、腫瘍の場所、腫瘍の時期により左右される。用量は、例えば約108ウイルス粒子(VP)から約1014 VP、好ましくは約5x109 VPから約1013 VP、より好ましくは約8x109 VPから約1012 VPで変動しえる。
医薬組成物は、当分野で公知の一般的な任意のプロセスによって製造することができる。例えば以下のいずれかのプロセスを用いることができる:バッチ、材料供給式バッチおよび灌流培養態様、カラムクロマトグラフィー精製、CsClグラディエント精製および低剪断力細胞保持装置(low-shear cell retention device)による灌流態様。
本発明の医薬組成物は少なくとも1つのタイプの本発明のベクターを含む。さらにまた、組成物は少なくとも2つ、3つまたは4つの本発明の異なるベクターを含むことができる。本発明のベクターに加えて、医薬組成物は、また任意の他のベクター、例えば他のアデノウイルスベクター、他の治療に有効な薬剤、任意の他の薬剤、例えば医薬的に許容できる担体、緩衝剤、賦形剤、アジュバント、防腐剤、充填剤、安定化剤または膨張剤、および/または対応する製品で通常的に見出される任意の成分を含むことができる。
医薬組成物は投与に適した任意の形態、例えば固体、半固体、または液体形態でありえる。処方は、溶液、乳液、懸濁液、錠剤、ペレットおよびカプセル(ただし前記に限定されない)から成る群から選択できる。
本発明のある実施態様では、腫瘍溶解アデノウイルスベクターまたは医薬組成物はin situ癌ワクチンとして機能する。本明細書で用いられる“in situ癌ワクチン”は、腫瘍細胞を殺滅しさらにまた腫瘍細胞に対する免疫応答を高める癌ワクチンを指す。ウイルスの複製は免疫系に対する極めて危険な信号であり(=TH1型応答に必要)、したがってAPCのGM-CSF媒介成熟および活性化並びにNK細胞の動員に対する強力な相乗刺激現象として機能する。腫瘍細胞溶解はまた腫瘍フラグメントおよびエピトープのAPCへの提示に役立ち、さらにまた相乗刺激は炎症によって引き起こされる。したがってエピトープ非依存性(すなわちHLA拘束性ではない)応答が、それぞれの腫瘍に対応して引き起こされ、したがってin situで生じる。腫瘍特異的免疫応答は、標的細胞とともに周辺細胞(例えば標的組織)で活性化される。
ベクターの有効用量は少なくとも、治療を要する対象者、腫瘍のタイプ、腫瘍の場所、腫瘍の時期により左右される。用量は、例えば約108ウイルス粒子(VP)から約1014 VP、好ましくは約5x109 VPから約1013 VP、より好ましくは約8x109 VPから約1012 VPで変動しえる。
医薬組成物は、当分野で公知の一般的な任意のプロセスによって製造することができる。例えば以下のいずれかのプロセスを用いることができる:バッチ、材料供給式バッチおよび灌流培養態様、カラムクロマトグラフィー精製、CsClグラディエント精製および低剪断力細胞保持装置(low-shear cell retention device)による灌流態様。
投与:
本発明のベクターまたは医薬組成物は、植物、動物およびヒトから成る群から選択される任意の真核細胞性対象生物に投与することができる。本発明の好ましい実施態様では、対象生物はヒトまたは動物である。動物はペット、家畜及び生産性動物から成る群から選択できる。
ほとんどの成人はもっとも広範囲に用いられているアデノウイルス血清型Ad5に暴露されているので、したがって免疫系はそれらに対して迅速に中和抗体(NAb)生成することができる。実際、抗Ad5 NAbの広がりは50%に達しえる。NAbはアデノウイルスキャプシドの多数の免疫原性タンパク質の大半に対して誘発されえることが示された。本発明のある実施態様では、対象者は大量の抗Ad5中和抗体を有する。本発明のある実施態様では、対象者は以前にAd5で処置されている。
通常的ないずれの方法もベクターまたは組成物の対象者への投与に用いることができる。投与経路は、組成物の処方または形態、疾患、腫瘍の場所、共存症および他の因子に左右される。本発明のある実施態様では、投与は、腫瘍内、筋肉内、動脈内、静脈内、胸膜内、嚢内、空洞内もしくは腹腔内注射、または経口投与により実施される。
本発明の腫瘍溶解ヒトアデノウイルスベクターのただ1回の投与が治療効果を有することがありえる。しかしながら、本発明のある実施態様では、腫瘍溶解アデノウイルスベクターまたは医薬組成物は治療期間中に数回投与される。腫瘍溶解ヒトアデノウイルスベクターまたは医薬組成物は、最初の2週間、4週間、毎月、または治療期間中に、例えば1回から10回投与することができる。本発明のある実施態様では、投与は、最初の2週間に3から7回、続いて4週間さらに続いて毎月同様に実施される。治療期間の長さは変動し、例えば2から12カ月またはそれより長く継続させることができる。
それにもかかわらず、進行した腫瘍塊の場合にただ1回の処置によって腫瘍を全滅させることはできない。したがって、ウイルスの再投与が有効性の増強のために要求されることは想像に難くない。全身的な再投与を制限する主要因子は当該ウイルスによって誘発される中和抗体(NAb)応答である。対象者で中和抗体を回避するために、本発明のベクターを治療間で変更することができる。
本発明のベクターまたは医薬組成物は、植物、動物およびヒトから成る群から選択される任意の真核細胞性対象生物に投与することができる。本発明の好ましい実施態様では、対象生物はヒトまたは動物である。動物はペット、家畜及び生産性動物から成る群から選択できる。
ほとんどの成人はもっとも広範囲に用いられているアデノウイルス血清型Ad5に暴露されているので、したがって免疫系はそれらに対して迅速に中和抗体(NAb)生成することができる。実際、抗Ad5 NAbの広がりは50%に達しえる。NAbはアデノウイルスキャプシドの多数の免疫原性タンパク質の大半に対して誘発されえることが示された。本発明のある実施態様では、対象者は大量の抗Ad5中和抗体を有する。本発明のある実施態様では、対象者は以前にAd5で処置されている。
通常的ないずれの方法もベクターまたは組成物の対象者への投与に用いることができる。投与経路は、組成物の処方または形態、疾患、腫瘍の場所、共存症および他の因子に左右される。本発明のある実施態様では、投与は、腫瘍内、筋肉内、動脈内、静脈内、胸膜内、嚢内、空洞内もしくは腹腔内注射、または経口投与により実施される。
本発明の腫瘍溶解ヒトアデノウイルスベクターのただ1回の投与が治療効果を有することがありえる。しかしながら、本発明のある実施態様では、腫瘍溶解アデノウイルスベクターまたは医薬組成物は治療期間中に数回投与される。腫瘍溶解ヒトアデノウイルスベクターまたは医薬組成物は、最初の2週間、4週間、毎月、または治療期間中に、例えば1回から10回投与することができる。本発明のある実施態様では、投与は、最初の2週間に3から7回、続いて4週間さらに続いて毎月同様に実施される。治療期間の長さは変動し、例えば2から12カ月またはそれより長く継続させることができる。
それにもかかわらず、進行した腫瘍塊の場合にただ1回の処置によって腫瘍を全滅させることはできない。したがって、ウイルスの再投与が有効性の増強のために要求されることは想像に難くない。全身的な再投与を制限する主要因子は当該ウイルスによって誘発される中和抗体(NAb)応答である。対象者で中和抗体を回避するために、本発明のベクターを治療間で変更することができる。
本発明の遺伝子療法は単独で有効であるが、他の任意の治療方法(例えば伝統的な治療方法)とアデノウイルス遺伝子療法との併用は、いずれか一方のみよりも有効でありえる。例えば、併用療法の各薬剤は腫瘍組織で独立して作用することができ、アデノウイルスベクターは化学療法または放射線療法に対して細胞を感受性にすることができ、および/または化学療法薬剤は、ウイルス複製レベルを強化するか、または標的細胞のレセプターの状態を有効にすることができる。併用療法の薬剤は同時にまたは連続して投与することができる。
本発明のある実施態様では、前記方法または使用はさらに対象者への併存放射線療法の実施を含む。本発明の別の実施態様では、前記方法または使用はさらに、併存化学療法の対象者への実施を含む。本明細書で用いられる“併存”は、本発明の遺伝子療法の前、後または同時に実施される治療方法を指す。併存療法のための期間は数分から数週間の間で変動しえる。好ましくは、併存療法は数時間持続する。
併用療法に適した薬剤には、全トランスレチン酸、アザシチジン、アザチオプリン、ブレオマイシン、カルボプラチン、カペシタビン、シスプラチン、クロラムブシル、シクロホスファミド、シタラビン、ダウノルビシン、ドセタキセル、ドキシフルリジン、ドキソルビシン、エピルビシン、エポシロン、エトポシド、フルオロウラシル、ジェムシタビン、ヒドロキシウレア、イダルビシン、イマチニブ、メクロレタミン、メルカプトプリン、メトトレキセート、ミトキサントロン、オキザリプラチン、パクリタキセル、ペメトレキセド、テモゾロミド、テニポシド、チオグアニン、バルルビシン、ビンブラスチン、ビンクリスチン、ビンデシンおよびベノレルビンが含まれるが、ただしこれらに限定されない。
アデノウイルスベクターを製造する方法には当分野で公知の任意の通常的な方法が含まれる。通常ではトランスジーンをシャトルプラスミドに挿入し、続いて前記シャトルプラスミドとウイルスゲノムの残りを含むプラスミド(“レスキュープラスミド”)との間で相同組換えを実施する。続いてこの新規なゲノムをプラスミドから切断し、ウイルス生成細胞にトランスフェクトする。或いはまた、プロデューサー細胞での組換えのためにレスキュープラスミドをこれら細胞に同時トランスフェクトしてもよい。
本発明のある実施態様では、アデノウイルスベクターにトランスジーンを配置するためにプラスミド構築物が用いられる。
本発明のある実施態様では、アデノウイルスベクターは細胞株で製造される。通常では真核細胞にアデノウイルスベクターをトランスフェクトし、その後ウイルス生成細胞を選別、増殖し、さらに試験する。本発明のウイルスベクターはまた動物または人間に投与する前に徹底的に精製することを必要とする。
本発明を以下の実施例によって例示する。これら実施例はいずれの態様においても制限を意図するものではない。
本発明のある実施態様では、前記方法または使用はさらに対象者への併存放射線療法の実施を含む。本発明の別の実施態様では、前記方法または使用はさらに、併存化学療法の対象者への実施を含む。本明細書で用いられる“併存”は、本発明の遺伝子療法の前、後または同時に実施される治療方法を指す。併存療法のための期間は数分から数週間の間で変動しえる。好ましくは、併存療法は数時間持続する。
併用療法に適した薬剤には、全トランスレチン酸、アザシチジン、アザチオプリン、ブレオマイシン、カルボプラチン、カペシタビン、シスプラチン、クロラムブシル、シクロホスファミド、シタラビン、ダウノルビシン、ドセタキセル、ドキシフルリジン、ドキソルビシン、エピルビシン、エポシロン、エトポシド、フルオロウラシル、ジェムシタビン、ヒドロキシウレア、イダルビシン、イマチニブ、メクロレタミン、メルカプトプリン、メトトレキセート、ミトキサントロン、オキザリプラチン、パクリタキセル、ペメトレキセド、テモゾロミド、テニポシド、チオグアニン、バルルビシン、ビンブラスチン、ビンクリスチン、ビンデシンおよびベノレルビンが含まれるが、ただしこれらに限定されない。
アデノウイルスベクターを製造する方法には当分野で公知の任意の通常的な方法が含まれる。通常ではトランスジーンをシャトルプラスミドに挿入し、続いて前記シャトルプラスミドとウイルスゲノムの残りを含むプラスミド(“レスキュープラスミド”)との間で相同組換えを実施する。続いてこの新規なゲノムをプラスミドから切断し、ウイルス生成細胞にトランスフェクトする。或いはまた、プロデューサー細胞での組換えのためにレスキュープラスミドをこれら細胞に同時トランスフェクトしてもよい。
本発明のある実施態様では、アデノウイルスベクターにトランスジーンを配置するためにプラスミド構築物が用いられる。
本発明のある実施態様では、アデノウイルスベクターは細胞株で製造される。通常では真核細胞にアデノウイルスベクターをトランスフェクトし、その後ウイルス生成細胞を選別、増殖し、さらに試験する。本発明のウイルスベクターはまた動物または人間に投与する前に徹底的に精製することを必要とする。
本発明を以下の実施例によって例示する。これら実施例はいずれの態様においても制限を意図するものではない。
細胞培養
293細胞はMicrobix(Tronto, Canada)から購入した。293-2v6-11細胞はポナステロン誘導性E4orf6領域を含んでいる(ES Mohammadi et al. 2004, Nucleic Acids Res, 32:2652-2659)。911-1c11細胞は1mg/mLのG418中で維持した(D Sirena et al. 2005, Virology 343:283-298)。SKOV3.ip1卵巣線癌細胞株はDr. Price(M.D. Anderson Cancer Center, Houston, TX)から入手した。ショウジョウバエルシフェリン発現卵巣線癌細胞株SKOV3-lucはDr. Negrin(Stanford Medical School, Stanford, CA)の好意により提供された。PC-3MM2(高度に転移性ホルモン耐性の前立腺癌サブライン)はIsajah J. Findler(MD Anderson Cancer Center, Houston, TX)の好意により寄贈された。LNM35/EGFP(高度にリンパ行性転移性のヒト大細胞肺癌サブライン)はTakashi Takahashi(The Honda Research Institute, Japan)から提供された。HUVECとして知られているヒト臍帯静脈内皮細胞はLonza(Basel, Switzerland)から購入した。以下の細胞株はATCC(Manassas, VA)から入手した:ACHN腎細胞癌、A549肺線癌、FHS173WEヒト線維芽細胞株、HTC116結腸直腸癌、CAMA-1乳房線癌、PANC-1膵臓類上皮癌。全ての細胞株は推奨条件下で培養した。
293細胞はMicrobix(Tronto, Canada)から購入した。293-2v6-11細胞はポナステロン誘導性E4orf6領域を含んでいる(ES Mohammadi et al. 2004, Nucleic Acids Res, 32:2652-2659)。911-1c11細胞は1mg/mLのG418中で維持した(D Sirena et al. 2005, Virology 343:283-298)。SKOV3.ip1卵巣線癌細胞株はDr. Price(M.D. Anderson Cancer Center, Houston, TX)から入手した。ショウジョウバエルシフェリン発現卵巣線癌細胞株SKOV3-lucはDr. Negrin(Stanford Medical School, Stanford, CA)の好意により提供された。PC-3MM2(高度に転移性ホルモン耐性の前立腺癌サブライン)はIsajah J. Findler(MD Anderson Cancer Center, Houston, TX)の好意により寄贈された。LNM35/EGFP(高度にリンパ行性転移性のヒト大細胞肺癌サブライン)はTakashi Takahashi(The Honda Research Institute, Japan)から提供された。HUVECとして知られているヒト臍帯静脈内皮細胞はLonza(Basel, Switzerland)から購入した。以下の細胞株はATCC(Manassas, VA)から入手した:ACHN腎細胞癌、A549肺線癌、FHS173WEヒト線維芽細胞株、HTC116結腸直腸癌、CAMA-1乳房線癌、PANC-1膵臓類上皮癌。全ての細胞株は推奨条件下で培養した。
Ad3-hTERT-E1の構築
Ad3-hTERT-E1のクローニングのために、Ad3-wtプラスミドpKSB2Ad3wt(D Sirena et al. 2005, Virology 343:283-298)で異なる3種のPCRを実施した(それらの2つは原型のTATA-ボックスをAd3wt配列から除去する目的であった)(図1−3)。第一のPCR生成物はTATAボックスまでのMluI消化部位をもつLITRを含んでいた(フォワードプライマー:5'-CAT GGT ACC CAA GTG TGT CGC TGT CGA GT-3'(配列番号:1)、リバースプライマー:5'-CAT GAT ATC AGC GAT CAG CTG ACA CCT AC-3'(配列番号:2);前部にKpnI部位を末端にEcoRV部位を付加)。第二のPCRはTATAボックスのすぐ後ろから開始しE1A領域の初めの半分まで続いた(フォワードプライマー:5'-CAT GAT ATC GTG CCA GCG AGA AGA GTT TT-3'(配列番号:3)、リバースプライマー:5'-CAT TCT AGA GCG AGC ACA ATA GTT TCA-3'(配列番号:4);前部にEcoRV部位を末端にXbaI部位を付加)。第三のPCRは、RITRを含むアデノウイルス3型の末端の1600bpを増幅した。それぞれに消化したTATAボックス周辺の最初の2つのPCR生成物を、KpnI/XbaI消化pUC19クローニングベクターでクローニングしてpGBAd3E1(TATAボックスを含みAd3配列の開始部が除かれている)が得られた。pBT255由来のhTERTプロモーターをKpnI/XhoIで消化して平滑末端を生成し、さらにpGBAd3E1のEcoRV消化によりE1領域の前部でクローニングしてpGBAd-3hTERT-E1を得た。
Ad3配列の末端をもつ第三のPCR生成物はNotI/平滑末端pShuttleでクローニングしてからHindIIIで消化し、その後HindIII消化pGBAd3-hTERT-E1でクローニングし、アデノウイルス3ゲノムの末端および改変開始部をもつシャトルベクターとしてpSGBAd3-hTERT-E1を得た。最後にpSGBAd3-hTERT-E1をXhoI/MscIで消化してプラスミドを得た。このプラスミドは、アデノウイルス3配列の改変開始部と保存末端との間が開放されてあり、MluIで消化されしたがって骨格が自由なpKSB2Ad3wtとの間で相同組換えが発生し、同じ耐性遺伝子によるバックグラウンドを低下させてAd3-hTERT-E1配列をもつプラスミド(pKGB-Ad3-hTERT-E1)を完成させる。
組換え体Ad3-hTERT-E1Aウイルスは、MluI消化pKGB-Ad3-hTERT-E1を911-1c11細胞にトランスフェクトすることによってレスキューした。最初の大きなAd3-hTERT-E1Aウイルスストックのその後の増幅は、293-2v6-11細胞での増幅、続いてA549細胞での2回目の増幅により実施した。増幅後、ウイルスを2度の塩化セシウムグラディエントで精製した。このストックはPCRによって血清型5が夾雑していないことを確認した(標準的な方法については以下を参照されたい:A. Kanerva et al. 2003, Mol Ther, 8:449-458)。続いて、E1Aの前部にhTERTプロモーターが存在することを確認した(図3b)。270bpバンドを得るために用いたプライマーは、5'-GGT TAT GCC AGG GTG GAG TA-3'フォワード(配列番号:5)および5'-AAG GTG AAG GGG CAG GAC-3'リバース(配列番号:6)であった。210bpバンドのために用いたプライマーは、5'-AGC CCC TCC CCT TCC TTT-3'フォワード(配列番号:7)および5'-CCC GGT CTC ACT GGA GAT AA-3'リバース(配列番号:8)であった。続いてPCRバンドをシークェンシングし、予想した配列を得た(配列番号:9および図10を参照されたい)。
最後にAd3-hTERT-E1Aを電子顕微鏡で観察した(図9参照)。
Ad3-hTERT-E1のクローニングのために、Ad3-wtプラスミドpKSB2Ad3wt(D Sirena et al. 2005, Virology 343:283-298)で異なる3種のPCRを実施した(それらの2つは原型のTATA-ボックスをAd3wt配列から除去する目的であった)(図1−3)。第一のPCR生成物はTATAボックスまでのMluI消化部位をもつLITRを含んでいた(フォワードプライマー:5'-CAT GGT ACC CAA GTG TGT CGC TGT CGA GT-3'(配列番号:1)、リバースプライマー:5'-CAT GAT ATC AGC GAT CAG CTG ACA CCT AC-3'(配列番号:2);前部にKpnI部位を末端にEcoRV部位を付加)。第二のPCRはTATAボックスのすぐ後ろから開始しE1A領域の初めの半分まで続いた(フォワードプライマー:5'-CAT GAT ATC GTG CCA GCG AGA AGA GTT TT-3'(配列番号:3)、リバースプライマー:5'-CAT TCT AGA GCG AGC ACA ATA GTT TCA-3'(配列番号:4);前部にEcoRV部位を末端にXbaI部位を付加)。第三のPCRは、RITRを含むアデノウイルス3型の末端の1600bpを増幅した。それぞれに消化したTATAボックス周辺の最初の2つのPCR生成物を、KpnI/XbaI消化pUC19クローニングベクターでクローニングしてpGBAd3E1(TATAボックスを含みAd3配列の開始部が除かれている)が得られた。pBT255由来のhTERTプロモーターをKpnI/XhoIで消化して平滑末端を生成し、さらにpGBAd3E1のEcoRV消化によりE1領域の前部でクローニングしてpGBAd-3hTERT-E1を得た。
Ad3配列の末端をもつ第三のPCR生成物はNotI/平滑末端pShuttleでクローニングしてからHindIIIで消化し、その後HindIII消化pGBAd3-hTERT-E1でクローニングし、アデノウイルス3ゲノムの末端および改変開始部をもつシャトルベクターとしてpSGBAd3-hTERT-E1を得た。最後にpSGBAd3-hTERT-E1をXhoI/MscIで消化してプラスミドを得た。このプラスミドは、アデノウイルス3配列の改変開始部と保存末端との間が開放されてあり、MluIで消化されしたがって骨格が自由なpKSB2Ad3wtとの間で相同組換えが発生し、同じ耐性遺伝子によるバックグラウンドを低下させてAd3-hTERT-E1配列をもつプラスミド(pKGB-Ad3-hTERT-E1)を完成させる。
組換え体Ad3-hTERT-E1Aウイルスは、MluI消化pKGB-Ad3-hTERT-E1を911-1c11細胞にトランスフェクトすることによってレスキューした。最初の大きなAd3-hTERT-E1Aウイルスストックのその後の増幅は、293-2v6-11細胞での増幅、続いてA549細胞での2回目の増幅により実施した。増幅後、ウイルスを2度の塩化セシウムグラディエントで精製した。このストックはPCRによって血清型5が夾雑していないことを確認した(標準的な方法については以下を参照されたい:A. Kanerva et al. 2003, Mol Ther, 8:449-458)。続いて、E1Aの前部にhTERTプロモーターが存在することを確認した(図3b)。270bpバンドを得るために用いたプライマーは、5'-GGT TAT GCC AGG GTG GAG TA-3'フォワード(配列番号:5)および5'-AAG GTG AAG GGG CAG GAC-3'リバース(配列番号:6)であった。210bpバンドのために用いたプライマーは、5'-AGC CCC TCC CCT TCC TTT-3'フォワード(配列番号:7)および5'-CCC GGT CTC ACT GGA GAT AA-3'リバース(配列番号:8)であった。続いてPCRバンドをシークェンシングし、予想した配列を得た(配列番号:9および図10を参照されたい)。
最後にAd3-hTERT-E1Aを電子顕微鏡で観察した(図9参照)。
累積感染アッセイ
Ad5を土台とするウイルスのために確立された方法論は、速度の遅いAd3野生型およびAd3-hTERT-E1Aの複製を明らかにするためには最適化の必要があった。機能的力価を概算するには通常の10日間細胞変性効果アッセイでは十分ではなく、したがってより動的な累積感染アッセイを開発した(図3c)。このアッセイでは力価がプラトーに達するまで細胞変性効果を進行させた。このアッセイはウイルスの実際の機能的力価を示した。
細胞を96ウェルプレートに10000細胞/ウェルで播種し、次の日、Ad3-hTERT-E1Aを10-5から10-12まで10倍希釈で稀釈しながらウェル列に感染させた。各希釈を10組ずつ用意した。感染はDMEM、2%FBS中で実施した。このプレートを顕微鏡で観察し、ウイルスのウェルを偽似ウェルと比較した。この観察からpfu/mLをTCID50と同様な方法で計算した(Adeasyマニュアル、Agilent Technologies, Inc. 2008)。培養液(DMEM、5%FBS)は4から7日毎に交換した。
in vitroではウイルスはよりゆっくりと最大力価に到達し、機能的感染アッセイには35日を要した。
Ad5を土台とするウイルスのために確立された方法論は、速度の遅いAd3野生型およびAd3-hTERT-E1Aの複製を明らかにするためには最適化の必要があった。機能的力価を概算するには通常の10日間細胞変性効果アッセイでは十分ではなく、したがってより動的な累積感染アッセイを開発した(図3c)。このアッセイでは力価がプラトーに達するまで細胞変性効果を進行させた。このアッセイはウイルスの実際の機能的力価を示した。
細胞を96ウェルプレートに10000細胞/ウェルで播種し、次の日、Ad3-hTERT-E1Aを10-5から10-12まで10倍希釈で稀釈しながらウェル列に感染させた。各希釈を10組ずつ用意した。感染はDMEM、2%FBS中で実施した。このプレートを顕微鏡で観察し、ウイルスのウェルを偽似ウェルと比較した。この観察からpfu/mLをTCID50と同様な方法で計算した(Adeasyマニュアル、Agilent Technologies, Inc. 2008)。培養液(DMEM、5%FBS)は4から7日毎に交換した。
in vitroではウイルスはよりゆっくりと最大力価に到達し、機能的感染アッセイには35日を要した。
in vitro細胞傷害アッセイ
細胞を96ウェルプレートに10000細胞/ウェルで播種した。次の日、細胞を3組ずつまたは4組ずつ0.1から100VP/ウェルでウイルスに感染させた。感染は2%ウシ胎児血清(FBS)中で実施した。このプレートを規則的に観察し、増殖培養液は3から5日毎に交換した。6から20日後に(各株につき最適なように)、細胞の生存率をMTSアッセイ(Cell Titer 96 Aqueous One Solution Cell Proliferation Assay, Promega)を用いて解析した。MTS解析は以下の日数で実施した:PC-3MM2は8日目、A549は17日目、HTC116は6日目、SKOV3.ip1は18日目、HUVECは11日目、FSH174WEは13日目、LNM-35/EGFPは10日目、CAMA-1は11日目、PANC-1は20日目さらにACHNは11日目。結果は図4A−Dに示されている。
細胞傷害アッセイでは、完全にAd3の両ウイルスは最終的に全ての癌細胞を死滅させたが、それらはAd5を土台とする腫瘍溶解因子(5/3血清型キメラを含む)よりも速度が遅いように思われた。非癌細胞では、Ad3-hTERT-E1Aは、コントロールウイルス(野生型Ad3を含む)よりも毒性が低かった。Ad3-hTERT-E1Aは、Ad3レセプターを欠く細胞を死滅させることはできなかった。
細胞を96ウェルプレートに10000細胞/ウェルで播種した。次の日、細胞を3組ずつまたは4組ずつ0.1から100VP/ウェルでウイルスに感染させた。感染は2%ウシ胎児血清(FBS)中で実施した。このプレートを規則的に観察し、増殖培養液は3から5日毎に交換した。6から20日後に(各株につき最適なように)、細胞の生存率をMTSアッセイ(Cell Titer 96 Aqueous One Solution Cell Proliferation Assay, Promega)を用いて解析した。MTS解析は以下の日数で実施した:PC-3MM2は8日目、A549は17日目、HTC116は6日目、SKOV3.ip1は18日目、HUVECは11日目、FSH174WEは13日目、LNM-35/EGFPは10日目、CAMA-1は11日目、PANC-1は20日目さらにACHNは11日目。結果は図4A−Dに示されている。
細胞傷害アッセイでは、完全にAd3の両ウイルスは最終的に全ての癌細胞を死滅させたが、それらはAd5を土台とする腫瘍溶解因子(5/3血清型キメラを含む)よりも速度が遅いように思われた。非癌細胞では、Ad3-hTERT-E1Aは、コントロールウイルス(野生型Ad3を含む)よりも毒性が低かった。Ad3-hTERT-E1Aは、Ad3レセプターを欠く細胞を死滅させることはできなかった。
癌細胞株に対するin vitroでのAd3-hTERT-E1Aの腫瘍溶解能力
癌細胞をin vitroで殺滅するAd3-hTERT-E1Aの能力を、異なる7つの腫瘍タイプを代表する単層細胞に感染させることによって解析した(図4A−Dおよび図7A−C)。全ての悪性細胞株でAd3-hTERT-E1Aは完全な腫瘍溶解を示し、一方、非複製Ad5/3luc1ウイルスは細胞殺滅を示さなかった(p<0.05)。しかしながら、ウイルスの増殖および力価測定の経験から予想したように、Ad3-hTERT-E1Aは血清型5よりも幾分速度が遅かった。
癌細胞をin vitroで殺滅するAd3-hTERT-E1Aの能力を、異なる7つの腫瘍タイプを代表する単層細胞に感染させることによって解析した(図4A−Dおよび図7A−C)。全ての悪性細胞株でAd3-hTERT-E1Aは完全な腫瘍溶解を示し、一方、非複製Ad5/3luc1ウイルスは細胞殺滅を示さなかった(p<0.05)。しかしながら、ウイルスの増殖および力価測定の経験から予想したように、Ad3-hTERT-E1Aは血清型5よりも幾分速度が遅かった。
Ad3-hTERT-E1Aの腫瘍選択性
腫瘍選択性を解析するために、HUVEC(ヒト臍帯静脈内皮細胞)およびFSH173WE(線維芽細胞)を同じウイルスに感染させ、細胞殺滅アッセイを実施した(図5)。低いウイルス濃度では細胞殺滅は認められず、高用量のAd3-hTERT-E1Aは、コントロールウイルスAd3wt、Ad5wt、Ad5/3-hTERT-E1A、Ad5/3-Δ24よりも毒性が低かった(0.1、1および10VP/細胞、P<0.05)。Ad5/3キメラを用いた以前の実験から、我々は、Ad5/3はLNM-35/EGFPに感染できず、したがってAd3レセプターを欠いている可能性があることに気付いていた(M Sarkioja et al. 2006, Cancer 107:1578-1588)。そのとおりに細胞殺滅はAd3-hTERT-E1AまたはAd3野生型では認められなかった。
腫瘍選択性を解析するために、HUVEC(ヒト臍帯静脈内皮細胞)およびFSH173WE(線維芽細胞)を同じウイルスに感染させ、細胞殺滅アッセイを実施した(図5)。低いウイルス濃度では細胞殺滅は認められず、高用量のAd3-hTERT-E1Aは、コントロールウイルスAd3wt、Ad5wt、Ad5/3-hTERT-E1A、Ad5/3-Δ24よりも毒性が低かった(0.1、1および10VP/細胞、P<0.05)。Ad5/3キメラを用いた以前の実験から、我々は、Ad5/3はLNM-35/EGFPに感染できず、したがってAd3レセプターを欠いている可能性があることに気付いていた(M Sarkioja et al. 2006, Cancer 107:1578-1588)。そのとおりに細胞殺滅はAd3-hTERT-E1AまたはAd3野生型では認められなかった。
動物実験
全ての動物実験はヘルシンキ大学(University of Helsinki)の実験動物委員会および南フィンランド州政府の承認を得た。マウスを頻繁に健康状態についてモニターし、痛みまたは抑うつの徴候がみためられた場合にはただちに安楽死させた。皮下モデルについては、雌のNMRIヌードマウス(Charles River, Germany)を用いた。それらは3−4週齢で発注し2週間隔離した。腹腔内モデルのために、雌のフォックスチェースSCIDマウス(Charles River, Germany)を用いた。それらは6−7週齢で発注し4カ月隔離した。
全ての動物実験はヘルシンキ大学(University of Helsinki)の実験動物委員会および南フィンランド州政府の承認を得た。マウスを頻繁に健康状態についてモニターし、痛みまたは抑うつの徴候がみためられた場合にはただちに安楽死させた。皮下モデルについては、雌のNMRIヌードマウス(Charles River, Germany)を用いた。それらは3−4週齢で発注し2週間隔離した。腹腔内モデルのために、雌のフォックスチェースSCIDマウス(Charles River, Germany)を用いた。それらは6−7週齢で発注し4カ月隔離した。
in vivoでの腫瘍溶解能力
我々は、PC-3MM2前立腺癌異種移植担癌マウスでAd3-hTERT-E1Aの有効性を試験した(図6A)。Ad3-hTERT-E1Aは、PBS注射と比較したとき腫瘍増殖を有意に低下させることができた(P=0.0035)。興味深いことに、ウイルスがin vitroで陽性コントロールよりも増殖が遅くてもin vivoでの有効性に差はなかった。Ad3-hTERT-E1Aは、Ad5およびAd5/3土台コントロールと少なくとも同程度にin vivoで腫瘍溶解性であった。A549異種移植片をもつマウス(図6B)では、Ad3-hTERT-E1A群は17日目以降もっとも小さな腫瘍を示したが、PBS群の急速な腫瘍増殖および17日目の当該群の終了のために、この実験は大きな統計能力を失った。Ad3-hTERT-E1AとPBSとを比較して17日目にはあいまいな差(P=0.051)を観察することができた。30日目には、Ad3-hTERT-E1Aは、Ad5/3-hTERT-E1Aよりも有意に(P=0.01)腫瘍増殖を低下させた(Ad5/3-hTERT-E1Aは極めて強力な腫瘍溶解アデノウイルスであることが知られている(GJ Bauerschmitz et al. 2008, Cancer Res 68:5533-5539))。
皮下腫瘍はヒトの癌の最適な代用物ではないかもしれない。したがって我々は続いて、ルシフェラーゼ発現SKOV3Luc細胞を用いて誘導される腹腔内播種性癌腫症を特徴とする正常位モデルを利用しようとした(図6C、D)。Ad3-hTERT-E1Aは、PBS処置マウスと比較してルシフェラーゼを有意に低下させた(p<0.0001)。複製能力を有する種々のウイルス間では有効性に差はなかった。Ad3-hTERT-E1Aは、マウスの生存中央値を34から46日に延長させ(PBS対Ad3-hTERT-E1A)、前記はKapkan-Meier生存解析で有意な差を生じた(p=0.01)。Ad3-hTERT-E1Aで処置した7匹のマウスの内1匹は実験の終わりまで(120日目)生存し、完治していた可能性がある。なぜならば、ルシフェラーゼ画像化では腫瘍の証拠は検出されず、その行動も正常であったからである。
我々は、PC-3MM2前立腺癌異種移植担癌マウスでAd3-hTERT-E1Aの有効性を試験した(図6A)。Ad3-hTERT-E1Aは、PBS注射と比較したとき腫瘍増殖を有意に低下させることができた(P=0.0035)。興味深いことに、ウイルスがin vitroで陽性コントロールよりも増殖が遅くてもin vivoでの有効性に差はなかった。Ad3-hTERT-E1Aは、Ad5およびAd5/3土台コントロールと少なくとも同程度にin vivoで腫瘍溶解性であった。A549異種移植片をもつマウス(図6B)では、Ad3-hTERT-E1A群は17日目以降もっとも小さな腫瘍を示したが、PBS群の急速な腫瘍増殖および17日目の当該群の終了のために、この実験は大きな統計能力を失った。Ad3-hTERT-E1AとPBSとを比較して17日目にはあいまいな差(P=0.051)を観察することができた。30日目には、Ad3-hTERT-E1Aは、Ad5/3-hTERT-E1Aよりも有意に(P=0.01)腫瘍増殖を低下させた(Ad5/3-hTERT-E1Aは極めて強力な腫瘍溶解アデノウイルスであることが知られている(GJ Bauerschmitz et al. 2008, Cancer Res 68:5533-5539))。
皮下腫瘍はヒトの癌の最適な代用物ではないかもしれない。したがって我々は続いて、ルシフェラーゼ発現SKOV3Luc細胞を用いて誘導される腹腔内播種性癌腫症を特徴とする正常位モデルを利用しようとした(図6C、D)。Ad3-hTERT-E1Aは、PBS処置マウスと比較してルシフェラーゼを有意に低下させた(p<0.0001)。複製能力を有する種々のウイルス間では有効性に差はなかった。Ad3-hTERT-E1Aは、マウスの生存中央値を34から46日に延長させ(PBS対Ad3-hTERT-E1A)、前記はKapkan-Meier生存解析で有意な差を生じた(p=0.01)。Ad3-hTERT-E1Aで処置した7匹のマウスの内1匹は実験の終わりまで(120日目)生存し、完治していた可能性がある。なぜならば、ルシフェラーゼ画像化では腫瘍の証拠は検出されず、その行動も正常であったからである。
皮下動物実験
マウスの両側腹部の皮下に2x106のPC-3MM2または5x106のA549細胞を注射した。それぞれ13日および11日後、腫瘍は測定可能なサイズに発育し、これらマウスの腫瘍内にPBS中の109VPまたはPBSのみを処置した。腫瘍当たりの注射体積は50μLであった。注射は1および2週間後に繰り返した。腫瘍を頻繁に測定し、体積はV=LxH2x0.52により算出した。最初の処置前の測定体積を100%とみなし、腫瘍増殖をこれと比較した。A549群に関しては、PBSで処置した腫瘍のいくつかは激しく増殖し、2週間半後にマウスを安楽死させねばならなかった。
マウスの両側腹部の皮下に2x106のPC-3MM2または5x106のA549細胞を注射した。それぞれ13日および11日後、腫瘍は測定可能なサイズに発育し、これらマウスの腫瘍内にPBS中の109VPまたはPBSのみを処置した。腫瘍当たりの注射体積は50μLであった。注射は1および2週間後に繰り返した。腫瘍を頻繁に測定し、体積はV=LxH2x0.52により算出した。最初の処置前の測定体積を100%とみなし、腫瘍増殖をこれと比較した。A549群に関しては、PBSで処置した腫瘍のいくつかは激しく増殖し、2週間半後にマウスを安楽死させねばならなかった。
腹腔内動物実験
腹腔内播種卵巣癌の正常位モデルは、300μLの純粋DMEM中の5x106のSKOV3-luc細胞をSCIDマウスの腹腔内に注射することによって作出した。3日後、マウス(n=7)を非侵襲的に画像化し、さらに各マウスにPBSまたはPBS中の109VPを腹腔内に注射することにより処置した。IVIS100(Xenogen, Alameda, CA, USA)を用いてマウスを3、7、14、21、28、35および42日目に画像化し、マウス中の腫瘍細胞数を概算した(図8)。バイオルミネセンスの画像化のために、150mg/kgのD-ルシフェリン(Promega, Madison, WI, USA)を腹腔内に注射し、10分後に露光時間10s、1f/stop、ビンニング(binning)中等度、フィルター開放により捕捉した。画像化の間はマウスをイソフルランガスで麻酔した。この画像を生体画像2.50(Xenogen)に重ねた。マウスの腹腔領域周辺の問題の領域(ROI)を抜き出すことによって、全流束(光子/s)を測定した。バックグラウンドは差し引いた。
腹腔内播種卵巣癌の正常位モデルは、300μLの純粋DMEM中の5x106のSKOV3-luc細胞をSCIDマウスの腹腔内に注射することによって作出した。3日後、マウス(n=7)を非侵襲的に画像化し、さらに各マウスにPBSまたはPBS中の109VPを腹腔内に注射することにより処置した。IVIS100(Xenogen, Alameda, CA, USA)を用いてマウスを3、7、14、21、28、35および42日目に画像化し、マウス中の腫瘍細胞数を概算した(図8)。バイオルミネセンスの画像化のために、150mg/kgのD-ルシフェリン(Promega, Madison, WI, USA)を腹腔内に注射し、10分後に露光時間10s、1f/stop、ビンニング(binning)中等度、フィルター開放により捕捉した。画像化の間はマウスをイソフルランガスで麻酔した。この画像を生体画像2.50(Xenogen)に重ねた。マウスの腹腔領域周辺の問題の領域(ROI)を抜き出すことによって、全流束(光子/s)を測定した。バックグラウンドは差し引いた。
マウスにおける毒物学
毒性実験(図18a−c)では、Ad3-hTERT-E1Aは、免疫適格ネズミモデルでAd5およびAd5/3コントロールウイルスよりも毒性が低いことが見出された。主要な全ての器官の組織学および基礎的血液値を解析した。8x1010VPを静脈内に投与して72時間後に、肝臓組織学にさらに肝酵素に有意な差が観察された。血清型3では、いくつかのマウスで軽度の肝臓炎症のみが非門脈系静脈近くに観察された。同じ時点および用量で、血清型5および5/3群は急性肝障害の徴候および肝臓酵素の上昇を示した。他の器官および血液値は毒性の徴候を示さなかった。血液サンプルのグラフおよび肝臓の組織図が添付されている(図18c)。以下は完全な組織病理学的報告である:PBS:5/5が正常、有糸分裂無し、炎症無し。Ad3wt:ほぼ正常、5/5のサンプルで有糸分裂、5/5で実質内の(非門脈)静脈付近に軽度の炎症。Ad3-hTERT-E1A:ほぼ正常、有糸分裂無し、実質内の(非門脈)静脈付近に不明確な炎症が3/5サンプルで観察された。Ad5wt:5/5:実質全体にわたって多量のアポトーシス肝細胞、中心静脈の内皮炎および損傷(門脈領域では内皮炎および損傷を見出すことができない)、中心周辺肝細胞の破壊は無し、脂肪変性、壊死、門脈領域内にリンパ球無し、急性肝損傷、実質全体に損傷。Ad5/3-hTERT-デルタgp19k:5/5:ほぼ正常、いくつかの点壊死(Ad5wtほど多くない)、いくつかのアポトーシス細胞、肝細胞の有糸分裂、実質の(小葉性)炎症、静脈周囲の炎症(Ad3と同様)。Ad5/3-Δ24:5/5:急性劇症肝不全、組織の50%が壊死、門脈領域付近でより強い損傷(ここでは全細胞が死滅)、脂肪生成はありえる、いくつかの有糸分裂。
毒性実験(図18a−c)では、Ad3-hTERT-E1Aは、免疫適格ネズミモデルでAd5およびAd5/3コントロールウイルスよりも毒性が低いことが見出された。主要な全ての器官の組織学および基礎的血液値を解析した。8x1010VPを静脈内に投与して72時間後に、肝臓組織学にさらに肝酵素に有意な差が観察された。血清型3では、いくつかのマウスで軽度の肝臓炎症のみが非門脈系静脈近くに観察された。同じ時点および用量で、血清型5および5/3群は急性肝障害の徴候および肝臓酵素の上昇を示した。他の器官および血液値は毒性の徴候を示さなかった。血液サンプルのグラフおよび肝臓の組織図が添付されている(図18c)。以下は完全な組織病理学的報告である:PBS:5/5が正常、有糸分裂無し、炎症無し。Ad3wt:ほぼ正常、5/5のサンプルで有糸分裂、5/5で実質内の(非門脈)静脈付近に軽度の炎症。Ad3-hTERT-E1A:ほぼ正常、有糸分裂無し、実質内の(非門脈)静脈付近に不明確な炎症が3/5サンプルで観察された。Ad5wt:5/5:実質全体にわたって多量のアポトーシス肝細胞、中心静脈の内皮炎および損傷(門脈領域では内皮炎および損傷を見出すことができない)、中心周辺肝細胞の破壊は無し、脂肪変性、壊死、門脈領域内にリンパ球無し、急性肝損傷、実質全体に損傷。Ad5/3-hTERT-デルタgp19k:5/5:ほぼ正常、いくつかの点壊死(Ad5wtほど多くない)、いくつかのアポトーシス細胞、肝細胞の有糸分裂、実質の(小葉性)炎症、静脈周囲の炎症(Ad3と同様)。Ad5/3-Δ24:5/5:急性劇症肝不全、組織の50%が壊死、門脈領域付近でより強い損傷(ここでは全細胞が死滅)、脂肪生成はありえる、いくつかの有糸分裂。
ヒト患者におけるウイルスの動態
これまでのところ、進行性固形腫瘍(標準的治療に対して難治性)を有する8人の患者をAd3-hTERT-E1Aで処置した。5x1010から5x1011までのウイルス粒子の用量では安全性は良好であり、用量の引き上げを継続させている。全体的に見て、全患者が1−2等級の副作用事象(典型的には発熱、吐き気および疲労感)を経験している。等級3以上の副作用事象はこれまでのところ観察されていない。完全な解析(有効性および免疫学的データを含む)は処理中である。
図19に示したように、最初の2人の患者から血液サンプルを採取した。パーコール(Percoll)グラディエントを用いて血液細胞を分離し、DNAを抽出した。サンプルはqPCRで解析した。患者1に関しては、ウイルスは血小板および末梢血単核細胞(PBMC)から1時間で除去されるようである。患者2に関しては、ウイルスの多くが、血液から急速に除去される前にPBMCおよび血漿に流れるように思われる。両方の患者で赤血球(RBC)からウイルスは検出されなかった。結果は、Ad3-hTERT-E1Aによる癌患者の処置は安全であり得ることを示唆している。患者1からはウイルスを含まない2つの尿サンプルが得られ、ウイルスは尿に排出されないことを示唆している。
これまでのところ、進行性固形腫瘍(標準的治療に対して難治性)を有する8人の患者をAd3-hTERT-E1Aで処置した。5x1010から5x1011までのウイルス粒子の用量では安全性は良好であり、用量の引き上げを継続させている。全体的に見て、全患者が1−2等級の副作用事象(典型的には発熱、吐き気および疲労感)を経験している。等級3以上の副作用事象はこれまでのところ観察されていない。完全な解析(有効性および免疫学的データを含む)は処理中である。
図19に示したように、最初の2人の患者から血液サンプルを採取した。パーコール(Percoll)グラディエントを用いて血液細胞を分離し、DNAを抽出した。サンプルはqPCRで解析した。患者1に関しては、ウイルスは血小板および末梢血単核細胞(PBMC)から1時間で除去されるようである。患者2に関しては、ウイルスの多くが、血液から急速に除去される前にPBMCおよび血漿に流れるように思われる。両方の患者で赤血球(RBC)からウイルスは検出されなかった。結果は、Ad3-hTERT-E1Aによる癌患者の処置は安全であり得ることを示唆している。患者1からはウイルスを含まない2つの尿サンプルが得られ、ウイルスは尿に排出されないことを示唆している。
統計解析
非母数Man-Whitney検定(ウィンドウはSPSS 15.0)を用い、2つの別個のサンプルをin vitroデータの全てについておよびin vivoのデータのいくつかについて比較した。PROC MIXED(SAS Ver. 9.1)による反復測定モデルを用い、腫瘍サイズの解析を実施した。メートル法で測定した腫瘍サイズおよびそのログ変換によりモデルを解析した。処置群の効果、日数並びに処置群および時間の相互作用をF検定によって評価した。モデルの曲率を時間の二次方程式によって検定した。予想される処置の期待値における比差の以前に計画した比較を経過時間で平均し、最終時点でt-統計によってコンピュータで計算した。A549実験については17および30日で、PC-3MM2については30日で比較し、時間で平均した。生存はログランク回帰を用いKaplan-Meier生存プロットで評価した(ウインドウはSPSS 15.0)。全ての解析について、両側を含む(two-sided)0.05未満のP値は統計的に有意であるとみなした。
非母数Man-Whitney検定(ウィンドウはSPSS 15.0)を用い、2つの別個のサンプルをin vitroデータの全てについておよびin vivoのデータのいくつかについて比較した。PROC MIXED(SAS Ver. 9.1)による反復測定モデルを用い、腫瘍サイズの解析を実施した。メートル法で測定した腫瘍サイズおよびそのログ変換によりモデルを解析した。処置群の効果、日数並びに処置群および時間の相互作用をF検定によって評価した。モデルの曲率を時間の二次方程式によって検定した。予想される処置の期待値における比差の以前に計画した比較を経過時間で平均し、最終時点でt-統計によってコンピュータで計算した。A549実験については17および30日で、PC-3MM2については30日で比較し、時間で平均した。生存はログランク回帰を用いKaplan-Meier生存プロットで評価した(ウインドウはSPSS 15.0)。全ての解析について、両側を含む(two-sided)0.05未満のP値は統計的に有意であるとみなした。
hNISおよび/またはGMCSFおよび/またはCD40Lを含むウイルス構築物
当分野で公知の方法を利用することによって、または上記実施例もしくは下記実施例の記載にしたがって、hNISおよび/またはGMCSFトランスジーンを本発明のAd3土台ベクターに付加した(この場合、本発明の非Ad5アデノウイルスベクター、例えばAd3-hTERT-E1AをAd5/3-Δ24骨格の代わりに用いることができる)(図1および2もまた参照されたい)。
I.hNISトランスジーン
材料と方法
細胞培養
アンドロゲン非依存性前立腺癌細胞株22Rv1、PC-3、DU-145および肺線癌細胞株A549はATCC(Manassas, VA)から購入した。PC-3MM2は、PC-3(Isajah J. Findler(MD Anderson Cancer Center, Houston, TX)の好意により寄贈された)の転移性ホルモン耐性のサブラインである。ヒト胎児腎上皮293細胞はMicrobix(Tronto, Canada)から購入した。細胞株911はDr. Alex van der Eb(University of Leiden, オランダ)から入手した。全ての細胞株は推奨条件下で培養した。
当分野で公知の方法を利用することによって、または上記実施例もしくは下記実施例の記載にしたがって、hNISおよび/またはGMCSFトランスジーンを本発明のAd3土台ベクターに付加した(この場合、本発明の非Ad5アデノウイルスベクター、例えばAd3-hTERT-E1AをAd5/3-Δ24骨格の代わりに用いることができる)(図1および2もまた参照されたい)。
I.hNISトランスジーン
材料と方法
細胞培養
アンドロゲン非依存性前立腺癌細胞株22Rv1、PC-3、DU-145および肺線癌細胞株A549はATCC(Manassas, VA)から購入した。PC-3MM2は、PC-3(Isajah J. Findler(MD Anderson Cancer Center, Houston, TX)の好意により寄贈された)の転移性ホルモン耐性のサブラインである。ヒト胎児腎上皮293細胞はMicrobix(Tronto, Canada)から購入した。細胞株911はDr. Alex van der Eb(University of Leiden, オランダ)から入手した。全ての細胞株は推奨条件下で培養した。
ウイルス構築物
Ad5/3-Δ24-hNISを作製するために、EcoRI消化し平滑端を生成したhNISフラグメント(pcDNA3-hNIS由来、Steve Russell(Mayo Clinic, Rochester, MN)の好意による)を、BsiWI-MfeI消化し平滑端を生成したpTHSN(A Kanerva et al. Gene Ther 12:87-94)に挿入してpTHSN-hNISを得た。コントロールウイルスAd5/3-Δ24-Δgp19Kを作製するために、BsiWI-MfeI消化し平滑端を生成したpTHSNを自己連結し、pTHSN-Δgp19Kを得た。pAd5/3-Δ24-hNISおよびpAd5/3-Δ24Δgp19Kを得るために、PmeI線状化pShuttle-Δ24(K Suzuki et al. 2002, Clin Cancer Res 8:3348-59)およびpAd5/3-E1-hNISまたはpAd5/3-E1-Δgp19KをBJ5183細胞にエレクトロポレーションにより導入した。
アデノウイルスプラスミドを線状化し、スーパーフェクト(Superfect)(Qiagen, Valencia, CA)を用いて製造業者の指示にしたがい911細胞にトランスフェクトした。アデノウイルスコロニーを採取し、ウイルスをA549細胞で増殖させ、さらに標準的技術を用いて精製した。Ad5/3-Δ24およびAd5/3luc1ウイルスは以前に構築した(A Kanerva et al. 2003, Mol Ther 8:449-58;A Kanerva et al. 2002, Clin Cancer Res 8:275-80)。ウイルス粒子(VP)は分光高度計およびTCID50アッセイによるプラーク形成ユニット(pfu)を用いて決定した。力価は以下のとおりであった:Ad5/3-Δ24-hNIS:1.1x1012VP/mL、9.0x1010pfu/mL;Ad5/3-Δ24-Δgp19K:1.5x1012VP/mL、2.8x1011pfu/mL;Ad5/3-Δ24:1.7x1012VP/mL;およびAd5/3luc1:6.9x1011VP/mL。
Ad5/3-Δ24-hNISを作製するために、EcoRI消化し平滑端を生成したhNISフラグメント(pcDNA3-hNIS由来、Steve Russell(Mayo Clinic, Rochester, MN)の好意による)を、BsiWI-MfeI消化し平滑端を生成したpTHSN(A Kanerva et al. Gene Ther 12:87-94)に挿入してpTHSN-hNISを得た。コントロールウイルスAd5/3-Δ24-Δgp19Kを作製するために、BsiWI-MfeI消化し平滑端を生成したpTHSNを自己連結し、pTHSN-Δgp19Kを得た。pAd5/3-Δ24-hNISおよびpAd5/3-Δ24Δgp19Kを得るために、PmeI線状化pShuttle-Δ24(K Suzuki et al. 2002, Clin Cancer Res 8:3348-59)およびpAd5/3-E1-hNISまたはpAd5/3-E1-Δgp19KをBJ5183細胞にエレクトロポレーションにより導入した。
アデノウイルスプラスミドを線状化し、スーパーフェクト(Superfect)(Qiagen, Valencia, CA)を用いて製造業者の指示にしたがい911細胞にトランスフェクトした。アデノウイルスコロニーを採取し、ウイルスをA549細胞で増殖させ、さらに標準的技術を用いて精製した。Ad5/3-Δ24およびAd5/3luc1ウイルスは以前に構築した(A Kanerva et al. 2003, Mol Ther 8:449-58;A Kanerva et al. 2002, Clin Cancer Res 8:275-80)。ウイルス粒子(VP)は分光高度計およびTCID50アッセイによるプラーク形成ユニット(pfu)を用いて決定した。力価は以下のとおりであった:Ad5/3-Δ24-hNIS:1.1x1012VP/mL、9.0x1010pfu/mL;Ad5/3-Δ24-Δgp19K:1.5x1012VP/mL、2.8x1011pfu/mL;Ad5/3-Δ24:1.7x1012VP/mL;およびAd5/3luc1:6.9x1011VP/mL。
RT-PCR
前立腺癌細胞にAd5/3-Δ24-hNISおよびAd5/3-Δ24-Δgp19K(10VP/細胞)を+37℃で2時間感染させた。感染後24時間後および48時間後に細胞を採集した。RNeasyキット(Qiagen)を用いて全RNAを単離し、さらにRT-PCRの前にDNaseで処理した。350ngの全RNAを各反応に用いた。増幅(35サイクル、+54℃でアニーリング)はOneStep RTPCRキット(Qiagen)を用い以下のプライマーにより実施した:hNIS特異的プライマー:フォワード5'-CTT CTG AAC TCG GTC CTC AC-3'(配列番号:10)、リバース5'-TCC AGA ATG TAT AGC GGC TC-3'(配列番号:11)およびβアクチン特異的プライマー:フォワード5'-CGA GGC CCA GAG CAA GAC A-3'(配列番号:12)、リバース5'-CAC AGC TTC TCC TTA ATG TCA CG-3'(配列番号:13)。hNISのためのPCR生成物およびβアクチンのためのPCR生成物はそれぞれ453bpおよび482bpであった。
前立腺癌細胞にAd5/3-Δ24-hNISおよびAd5/3-Δ24-Δgp19K(10VP/細胞)を+37℃で2時間感染させた。感染後24時間後および48時間後に細胞を採集した。RNeasyキット(Qiagen)を用いて全RNAを単離し、さらにRT-PCRの前にDNaseで処理した。350ngの全RNAを各反応に用いた。増幅(35サイクル、+54℃でアニーリング)はOneStep RTPCRキット(Qiagen)を用い以下のプライマーにより実施した:hNIS特異的プライマー:フォワード5'-CTT CTG AAC TCG GTC CTC AC-3'(配列番号:10)、リバース5'-TCC AGA ATG TAT AGC GGC TC-3'(配列番号:11)およびβアクチン特異的プライマー:フォワード5'-CGA GGC CCA GAG CAA GAC A-3'(配列番号:12)、リバース5'-CAC AGC TTC TCC TTA ATG TCA CG-3'(配列番号:13)。hNISのためのPCR生成物およびβアクチンのためのPCR生成物はそれぞれ453bpおよび482bpであった。
ヨウ化物の取り込み
前立腺癌細胞にAd5/3-Δ24-hNISおよびAd5/3-Δ24-Δgp19K(10VP/細胞)を+37℃で2時間感染させた。感染後24時間後および48時間後に細胞を1xPBSで洗浄し、7.4kBqのヨウ化ナトリウム[125I]NaI(MAP Medical Technologies Oy, Tikkakoski, フィンランド)とともにインキュベートした。細胞を1xPBSで2回洗浄し、続いて各サンプルについて300μLの細胞培養溶解試薬(Promega, Madison, WI)を用いて溶解させた。放射能をマルチチャネルアナライザーAtomlab 950(Biodex Medical System, Shirley, NY)と連結させたウェルカウンターを用いて定量した。
前立腺癌細胞にAd5/3-Δ24-hNISおよびAd5/3-Δ24-Δgp19K(10VP/細胞)を+37℃で2時間感染させた。感染後24時間後および48時間後に細胞を1xPBSで洗浄し、7.4kBqのヨウ化ナトリウム[125I]NaI(MAP Medical Technologies Oy, Tikkakoski, フィンランド)とともにインキュベートした。細胞を1xPBSで2回洗浄し、続いて各サンプルについて300μLの細胞培養溶解試薬(Promega, Madison, WI)を用いて溶解させた。放射能をマルチチャネルアナライザーAtomlab 950(Biodex Medical System, Shirley, NY)と連結させたウェルカウンターを用いて定量した。
細胞殺滅アッセイ
前立腺癌細胞にAd5/3-Δ24-hNIS、Ad5/3-Δ24-Δgp19K、Ad5/3-Δ24およびAd5/3luc1を0.01、0.1、1、10および100VP/細胞で感染させた。増殖培養液を2日毎に交換した。細胞生存率をPC-3MM2については感染後6日、DU-145については感染後7日および22Rv1細胞については感染後9日で決定した。
CellTiter96 Aqueous One Solution 細胞増殖アッセイ(Promega, Madison, WI)(3-(4,5-ジメチルチアゾール-2-イル)-5-(3-カルボキシ-メトキシフェニル)-2-(4-スルホフェニル)-2H-テトラゾリウム[MTS]アッセイとも称される)による感染後9日。
前立腺癌細胞にAd5/3-Δ24-hNIS、Ad5/3-Δ24-Δgp19K、Ad5/3-Δ24およびAd5/3luc1を0.01、0.1、1、10および100VP/細胞で感染させた。増殖培養液を2日毎に交換した。細胞生存率をPC-3MM2については感染後6日、DU-145については感染後7日および22Rv1細胞については感染後9日で決定した。
CellTiter96 Aqueous One Solution 細胞増殖アッセイ(Promega, Madison, WI)(3-(4,5-ジメチルチアゾール-2-イル)-5-(3-カルボキシ-メトキシフェニル)-2-(4-スルホフェニル)-2H-テトラゾリウム[MTS]アッセイとも称される)による感染後9日。
組織培養感染用量(TCID)アッセイ
細胞株サンプル:1mLの5%GM中に5x104前立腺癌細胞/ウェルを3ウェルずつ24ウェルプレートに播種し、一晩インキュベートし、Ad5/3-Δ24-hNIS(5VP/細胞)を+37℃で2時間感染させた。感染後8、24、48および72時間後に細胞および増殖培養液を採集して-80℃で凍結し、3回凍結融解した。TCID50のために、細胞を遠心し、上清を293細胞に添加した。
組織サンプル:Ad5/3-Δ24-hNISおよび131Iで処理したマウスから器官を収集し、秤量し、手動で均質化し、さらに800μLのDMEMで希釈した。それらを-80℃で3回凍結融解した。TCID50のために、組織サンプルを遠心し、上清を293細胞に添加した。
両方の実験のために、1044 293細胞を100μLの5%DMEM(96ウェルプレート)に播種し、一晩インキュベートし、上記実験の上清を用いて感染させた。10日後にCPEの発生を判定して力価を概算した。
細胞株サンプル:1mLの5%GM中に5x104前立腺癌細胞/ウェルを3ウェルずつ24ウェルプレートに播種し、一晩インキュベートし、Ad5/3-Δ24-hNIS(5VP/細胞)を+37℃で2時間感染させた。感染後8、24、48および72時間後に細胞および増殖培養液を採集して-80℃で凍結し、3回凍結融解した。TCID50のために、細胞を遠心し、上清を293細胞に添加した。
組織サンプル:Ad5/3-Δ24-hNISおよび131Iで処理したマウスから器官を収集し、秤量し、手動で均質化し、さらに800μLのDMEMで希釈した。それらを-80℃で3回凍結融解した。TCID50のために、組織サンプルを遠心し、上清を293細胞に添加した。
両方の実験のために、1044 293細胞を100μLの5%DMEM(96ウェルプレート)に播種し、一晩インキュベートし、上記実験の上清を用いて感染させた。10日後にCPEの発生を判定して力価を概算した。
in vivo実験
雄のNMRI/ヌードマウスをTaconic(Ejby, デンマーク)から購入した。メデトミジンケタミン-0.9%食塩水(1:2:7)麻酔下で、5x106のPC-3MM2細胞を8週齢のマウスの皮下に注射することによって腫瘍を発生させた。画像化実験では、3匹のマウスの腫瘍内に食塩水(上部左腫瘍)、5x106VPのAd5/3-Δ24-Δgp19K(上部右腫瘍)および7x108VPのAd5/3-Δ24-hNIS(下部右および左腫瘍)を腫瘍細胞接種後11および12日後に投与した。最後のウイルス注射の1日後に、マウスの静脈内に1.85MBqのヨウ化ナトリウム[123I]NaI(MAP Medical Technologies Oy, Tikkakoski, フィンランド)を投与し、ヨウ化物暴露後0.5、1、1.5、2、4および13時間後にガンマカメラToshiba7200A/UI(Toshiba, Tokyo, Japan)により画像化した。これより以降の解析は動物管理規制から許されなかった。ガンマエネルギーピーク159keVは20%ウインドウを用いて記録し、画像当たり150キロカウントを採集した。使用したマトリックスサイズは256x256x16であり、これはピクセルサイズを1.08mmx1.08mmにした。13時間で、種々の器官(心臓、肺臓、肝臓、脾臓、腎臓、甲状腺、胃、筋肉、血液および骨)および腫瘍を収集し、秤量し、マルチチャネルアナライザーAtomlab 950(Biodex Medical System, Shirley, NY)と連結させたウェルカウンターを用いて解析した。結果は、組織1グラム当たりの最初のヨウ化物線量のパーセンテージとして表される(ID%/g)。
治療実験のためには、担癌マウスを4つの群(6マウス/群、2腫瘍/マウス)(偽似、131I、Ad5/3-Δ24-hNISおよびAd5/3-Δ24-hNIS+131I)に任意抽出した。腫瘍細胞接種後6および7日後に、マウスの静脈内に増殖培養液または腫瘍当たり7x108VPのAd5/3-Δ24-hNISを投与した。最後のウイルス注射の1日後に、マウスの静脈内に50MBqの担体フリーのヨウ化ナトリウム([131I]NaI(MAP Medical Technologies Oy, Tikkakoski, フィンランド)を投与した。腫瘍サイズを2日毎に測定し、長さx幅2x0.5の式を用いて体積を計算した。腫瘍サイズのためにマウスを殺したときは、器官を収集し、秤量し、それらの放射能をガンマカウンター(Wizard3, PerkinElmer, Turku, フィンランド)で180秒間測定した。結果は、組織1グラム当たりの最初のヨウ化物線量のパーセンテージとして表される(ID%/g)。全身から放出される放射能は9、10、11、13、14、15および17日目に測定した。9−11日目に線量カリブレーター(CRC-120, Capintec, Inc., Ramsey, NJ)により、さらに11日後に鉛の測定チャンバーおよびヨウ化ナトリウムシンチレーションクリスタルを含むUniSpecチューブベースマルチチャネルアナライザーから成る全身測定装置(Canberra Industries, Inc., Meridien, CT)により測定を実施した。マウスを14日目に秤量し、実験を通して同じ重量を計算に用いた。
全ての実験で、動物管理規制の要請のために腫瘍サイズが任意の径で15mmに達したときマウスを殺した。in vivo治療薬実験は動物保護規制のために17日目に停止させなければならなかった。全ての動物実験はフィンランド実験動物委員会(national committee for animal experimentation in Finland, State Provincial Office of Southern Finland, Hameenlinna, Finland)によって承認された。
雄のNMRI/ヌードマウスをTaconic(Ejby, デンマーク)から購入した。メデトミジンケタミン-0.9%食塩水(1:2:7)麻酔下で、5x106のPC-3MM2細胞を8週齢のマウスの皮下に注射することによって腫瘍を発生させた。画像化実験では、3匹のマウスの腫瘍内に食塩水(上部左腫瘍)、5x106VPのAd5/3-Δ24-Δgp19K(上部右腫瘍)および7x108VPのAd5/3-Δ24-hNIS(下部右および左腫瘍)を腫瘍細胞接種後11および12日後に投与した。最後のウイルス注射の1日後に、マウスの静脈内に1.85MBqのヨウ化ナトリウム[123I]NaI(MAP Medical Technologies Oy, Tikkakoski, フィンランド)を投与し、ヨウ化物暴露後0.5、1、1.5、2、4および13時間後にガンマカメラToshiba7200A/UI(Toshiba, Tokyo, Japan)により画像化した。これより以降の解析は動物管理規制から許されなかった。ガンマエネルギーピーク159keVは20%ウインドウを用いて記録し、画像当たり150キロカウントを採集した。使用したマトリックスサイズは256x256x16であり、これはピクセルサイズを1.08mmx1.08mmにした。13時間で、種々の器官(心臓、肺臓、肝臓、脾臓、腎臓、甲状腺、胃、筋肉、血液および骨)および腫瘍を収集し、秤量し、マルチチャネルアナライザーAtomlab 950(Biodex Medical System, Shirley, NY)と連結させたウェルカウンターを用いて解析した。結果は、組織1グラム当たりの最初のヨウ化物線量のパーセンテージとして表される(ID%/g)。
治療実験のためには、担癌マウスを4つの群(6マウス/群、2腫瘍/マウス)(偽似、131I、Ad5/3-Δ24-hNISおよびAd5/3-Δ24-hNIS+131I)に任意抽出した。腫瘍細胞接種後6および7日後に、マウスの静脈内に増殖培養液または腫瘍当たり7x108VPのAd5/3-Δ24-hNISを投与した。最後のウイルス注射の1日後に、マウスの静脈内に50MBqの担体フリーのヨウ化ナトリウム([131I]NaI(MAP Medical Technologies Oy, Tikkakoski, フィンランド)を投与した。腫瘍サイズを2日毎に測定し、長さx幅2x0.5の式を用いて体積を計算した。腫瘍サイズのためにマウスを殺したときは、器官を収集し、秤量し、それらの放射能をガンマカウンター(Wizard3, PerkinElmer, Turku, フィンランド)で180秒間測定した。結果は、組織1グラム当たりの最初のヨウ化物線量のパーセンテージとして表される(ID%/g)。全身から放出される放射能は9、10、11、13、14、15および17日目に測定した。9−11日目に線量カリブレーター(CRC-120, Capintec, Inc., Ramsey, NJ)により、さらに11日後に鉛の測定チャンバーおよびヨウ化ナトリウムシンチレーションクリスタルを含むUniSpecチューブベースマルチチャネルアナライザーから成る全身測定装置(Canberra Industries, Inc., Meridien, CT)により測定を実施した。マウスを14日目に秤量し、実験を通して同じ重量を計算に用いた。
全ての実験で、動物管理規制の要請のために腫瘍サイズが任意の径で15mmに達したときマウスを殺した。in vivo治療薬実験は動物保護規制のために17日目に停止させなければならなかった。全ての動物実験はフィンランド実験動物委員会(national committee for animal experimentation in Finland, State Provincial Office of Southern Finland, Hameenlinna, Finland)によって承認された。
統計解析
ヨウ化物取り込みの解析は、Bonferroniのポストホック(post-hoc)検定を用い分散の一方向解析(one-way analysis of variance, ANOVA)によって実施した。実験群間における経過時間に対する腫瘍体積の解析は、PROC MIXED(SAS Ver.9.1, Cary, NC)による反復測定モデルを用いて実施した。腫瘍体積の測定は常態に対してログ変換した。予想される処置の期待値における比差の以前に計画した比較を経過時間および各時点でt-統計によって平均し、さらにTukey-Kramerモデルを調整に用いた。全ての解析について、両側を含む(two-sided)0.05未満のP値は統計的に有意であるとみなした。
ヨウ化物取り込みの解析は、Bonferroniのポストホック(post-hoc)検定を用い分散の一方向解析(one-way analysis of variance, ANOVA)によって実施した。実験群間における経過時間に対する腫瘍体積の解析は、PROC MIXED(SAS Ver.9.1, Cary, NC)による反復測定モデルを用いて実施した。腫瘍体積の測定は常態に対してログ変換した。予想される処置の期待値における比差の以前に計画した比較を経過時間および各時点でt-統計によって平均し、さらにTukey-Kramerモデルを調整に用いた。全ての解析について、両側を含む(two-sided)0.05未満のP値は統計的に有意であるとみなした。
結果
hNIS特異的mRNAがAd5/3-Δ24-hNIS感染前立腺癌細胞で検出される
Ad5線維シャフト内のAd3ノブ、E1A領域内の24bp欠失およびE3内に挿入されたhNISを含む新規なウイルスを構築した。このウイルスのトランスジーンの発現を判定するために、ホルモン耐性前立腺癌細胞株PC-3MM2、22Rv1、PC-3およびDU-145を、Ad5/3-Δ24-hNISまたはAd5/3-Δ24-Δgp19K(トランスジーンをもたない陽性コントロール)に感染させ、感染後24および48時間にRT-PCRで解析した。全てのAd5/3-Δ24-hNIS感染細胞株が、454bpサイズを有するhNIS特異的増幅生成物を特徴とし、hNISがウイルスゲノムから発現されることを示唆した。対照的に、Ad5/3-Δ24-Δgp19K感染細胞または細胞それ自体は増幅生成物を生じなかった。
hNIS特異的mRNAがAd5/3-Δ24-hNIS感染前立腺癌細胞で検出される
Ad5線維シャフト内のAd3ノブ、E1A領域内の24bp欠失およびE3内に挿入されたhNISを含む新規なウイルスを構築した。このウイルスのトランスジーンの発現を判定するために、ホルモン耐性前立腺癌細胞株PC-3MM2、22Rv1、PC-3およびDU-145を、Ad5/3-Δ24-hNISまたはAd5/3-Δ24-Δgp19K(トランスジーンをもたない陽性コントロール)に感染させ、感染後24および48時間にRT-PCRで解析した。全てのAd5/3-Δ24-hNIS感染細胞株が、454bpサイズを有するhNIS特異的増幅生成物を特徴とし、hNISがウイルスゲノムから発現されることを示唆した。対照的に、Ad5/3-Δ24-Δgp19K感染細胞または細胞それ自体は増幅生成物を生じなかった。
Ad5/3-Δ24-hNISは前立腺癌細胞への効率的なヨウ化物取り込みを媒介する
ウイルスから発現されたhNISの機能性を判定するために、前立腺癌細胞をAd5/3-Δ24-hNISまたはAd5/3-Δ24-Δgp19Kに感染させ、続いて125Iへの暴露およびヨウ化物蓄積の定量を実施した(図11)。非感染またはコントロールウイルス処置細胞と比較したとき、Ad5/3-Δ24-hNISは全ての実験細胞株で有意に高いヨウ化物取り込みをもたらした。偽似感染と比較したとき、Ad5/3-Δ24-hNISは、PC-3MM2および22Rv1細胞でそれぞれ2.5倍(p<0.001)および3倍(p<0.001)高いヨウ化物蓄積をもたらした。PC-3およびDU-145細胞では、偽似処置細胞と比較して、より控えめであるがなお有意に強化された蓄積が、それぞれ1.6倍(p<0.05)および1.3倍(p<0.001)高いレベルで観察された。Ad5/3-Δ24-Δgp19K処置はヨウ化物蓄積を生じず、ヨウ化物取り込みは、ウイルス感染または複製それ自体からではなくAd5/3-Δ24-hNISから発現されたhNISによって媒介されることを示唆した。
ウイルスから発現されたhNISの機能性を判定するために、前立腺癌細胞をAd5/3-Δ24-hNISまたはAd5/3-Δ24-Δgp19Kに感染させ、続いて125Iへの暴露およびヨウ化物蓄積の定量を実施した(図11)。非感染またはコントロールウイルス処置細胞と比較したとき、Ad5/3-Δ24-hNISは全ての実験細胞株で有意に高いヨウ化物取り込みをもたらした。偽似感染と比較したとき、Ad5/3-Δ24-hNISは、PC-3MM2および22Rv1細胞でそれぞれ2.5倍(p<0.001)および3倍(p<0.001)高いヨウ化物蓄積をもたらした。PC-3およびDU-145細胞では、偽似処置細胞と比較して、より控えめであるがなお有意に強化された蓄積が、それぞれ1.6倍(p<0.05)および1.3倍(p<0.001)高いレベルで観察された。Ad5/3-Δ24-Δgp19K処置はヨウ化物蓄積を生じず、ヨウ化物取り込みは、ウイルス感染または複製それ自体からではなくAd5/3-Δ24-hNISから発現されたhNISによって媒介されることを示唆した。
Ad5/3-Δ24-hNISは前立腺癌細胞内で複製し前記細胞の腫瘍溶解を引き起こす
前立腺癌細胞株にAd5/3-Δ24-hNIS、Ad5/3-Δ24-Δgp19K、Ad5/3-Δ24およびAd5/3luc1を感染させ、続いて感染後6日(PC3-MM2)、7日(PC3およびDU-145)または9日(22Rv1)に細胞生存率を決定した(図12)。Ad5/3-Δ24-hNISは、全ての被検前立腺癌細胞株で効率的な細胞殺滅を示した。もっとも迅速で効率的な腫瘍溶解はPC-3MM2細胞で観察され、この場合Ad5/3-Δ24-hNISの1VP/細胞を用いてほぼ完全な細胞殺滅が感染後6日で達成された。さらにまた、腫瘍溶解はAd5/3-Δ24-Δgp19Kで認められたもの類似していた。他の前立腺癌細胞株では、Ad5/3-Δ24-hNISの腫瘍溶解能力はAd5/3-Δ24-Δgp19Kよりもわずかに低かった。実際、E3に部分的な欠失を有するAd5/3-Δ24-Δgp19Kは、全ての被検細胞株で最高の腫瘍溶解能力を示した。より大きなゲノムサイズのAd5/3-Δ24-hNISは、Ad5/3-Δ24-Δgp19Kと比較して腫瘍溶解速度に大きな影響を与える可能性がある。hNISトランスジーンは約2.2kbであり、これは1kbpのΔgp19Kとともにゲノムサイズを105%以下に維持し、これはウイルスの機能性を維持するために重要であることを示唆した。Ad5/3-Δ24-hNISの複製性をPC-3および22Rv1細胞で判定し、TCID50アッセイは時間の関数として感染性粒子が増加することを示した。
前立腺癌細胞株にAd5/3-Δ24-hNIS、Ad5/3-Δ24-Δgp19K、Ad5/3-Δ24およびAd5/3luc1を感染させ、続いて感染後6日(PC3-MM2)、7日(PC3およびDU-145)または9日(22Rv1)に細胞生存率を決定した(図12)。Ad5/3-Δ24-hNISは、全ての被検前立腺癌細胞株で効率的な細胞殺滅を示した。もっとも迅速で効率的な腫瘍溶解はPC-3MM2細胞で観察され、この場合Ad5/3-Δ24-hNISの1VP/細胞を用いてほぼ完全な細胞殺滅が感染後6日で達成された。さらにまた、腫瘍溶解はAd5/3-Δ24-Δgp19Kで認められたもの類似していた。他の前立腺癌細胞株では、Ad5/3-Δ24-hNISの腫瘍溶解能力はAd5/3-Δ24-Δgp19Kよりもわずかに低かった。実際、E3に部分的な欠失を有するAd5/3-Δ24-Δgp19Kは、全ての被検細胞株で最高の腫瘍溶解能力を示した。より大きなゲノムサイズのAd5/3-Δ24-hNISは、Ad5/3-Δ24-Δgp19Kと比較して腫瘍溶解速度に大きな影響を与える可能性がある。hNISトランスジーンは約2.2kbであり、これは1kbpのΔgp19Kとともにゲノムサイズを105%以下に維持し、これはウイルスの機能性を維持するために重要であることを示唆した。Ad5/3-Δ24-hNISの複製性をPC-3および22Rv1細胞で判定し、TCID50アッセイは時間の関数として感染性粒子が増加することを示した。
Ad5/3-Δ24-hNISは前立腺癌腫瘍への放射性ヨウ化物の取り込みを媒介する
雄のヌード/NMRIマウスで皮下PC-3MM2腫瘍を作出した。下部腫瘍に2日連続して7x108VP/腫瘍のAd5/3-Δ24-hNISを、上部右腫瘍に同じ用量のAd5/3-Δ24-Δgp19Kを腫瘍内感染させた(図13AおよびB)。上部左腫瘍には偽似処置を施した。最後のウイルス注射の1日後に、マウス当たり1.85MBqの123Iを静脈内に投与し、123I注射後0.5から13時間ガンマカメラでマウスを画像化した。Ad5/3-Δ24-hNIS処置腫瘍へのある程度のヨウ化物蓄積が123I注射後0.5時間で既に観察された。ヨウ化物に暴露した後2時間で、強いヨウ化物蓄積がAd5/3-Δ24-hNIS処置腫瘍全体で観察されたが、コントロールウイルスまたは食塩水注射腫瘍はヨウ化物を取り込まなかった(図13A)。2時間後、ヨウ化物の蓄積はプラトーに達し、ヨウ化物注射後13時間の本実験最後の画像化時点まで比較的一定していた(図13B)。さらにまた、ヨウ化物は、甲状腺および胃にもこれらの器官の内因性NIS発現により高度に蓄積した。高度な胃への取り込みはマウスで典型的に観察されるが、ヒトではそうではない。患者では正常な甲状腺を放射性ヨウ化物から保護することは可能であろうが、このマウス実験では実施しなかった。放射性ヨウ化物の除去は尿を介して行われるので、膀胱のヨウ化物蓄積が観察された。
In vivoの123I分布を定量するために、画像化後に器官および腫瘍を収集し、それらの放射能含有量を決定した(図13C)。内因性hNIS発現のために、甲状腺および胃は注射線量の約30%を捕捉した。それにもかかわらず、Ad5/3-Δ24-hNIS処置腫瘍は全ヨウ化物線量の6%以上を蓄積した。このことは、腫瘍に存在する大量の感染性ウイルスと関係があり、一方、極めて微量が甲状腺および胃で観察された。腫瘍はウイルス注射後10日を過ぎて収集され、TCID50は感染性ウイルスを測定するので、高いTCID値はおそらくウイルスの複製を反映する。アデノウイルスは、細胞に進入するときキャプシドを失うので、したがってインプットウイルスはTCID50では検出できない。すなわち、TCID50は新規なビリオンの生産を必要とする。ヨウ化物の取り込みは、他の器官(偽似処置またはAd5/3-Δ24-Δgp19K処置腫瘍を含む)では低いままであった(最初の線量の1%未満)。
雄のヌード/NMRIマウスで皮下PC-3MM2腫瘍を作出した。下部腫瘍に2日連続して7x108VP/腫瘍のAd5/3-Δ24-hNISを、上部右腫瘍に同じ用量のAd5/3-Δ24-Δgp19Kを腫瘍内感染させた(図13AおよびB)。上部左腫瘍には偽似処置を施した。最後のウイルス注射の1日後に、マウス当たり1.85MBqの123Iを静脈内に投与し、123I注射後0.5から13時間ガンマカメラでマウスを画像化した。Ad5/3-Δ24-hNIS処置腫瘍へのある程度のヨウ化物蓄積が123I注射後0.5時間で既に観察された。ヨウ化物に暴露した後2時間で、強いヨウ化物蓄積がAd5/3-Δ24-hNIS処置腫瘍全体で観察されたが、コントロールウイルスまたは食塩水注射腫瘍はヨウ化物を取り込まなかった(図13A)。2時間後、ヨウ化物の蓄積はプラトーに達し、ヨウ化物注射後13時間の本実験最後の画像化時点まで比較的一定していた(図13B)。さらにまた、ヨウ化物は、甲状腺および胃にもこれらの器官の内因性NIS発現により高度に蓄積した。高度な胃への取り込みはマウスで典型的に観察されるが、ヒトではそうではない。患者では正常な甲状腺を放射性ヨウ化物から保護することは可能であろうが、このマウス実験では実施しなかった。放射性ヨウ化物の除去は尿を介して行われるので、膀胱のヨウ化物蓄積が観察された。
In vivoの123I分布を定量するために、画像化後に器官および腫瘍を収集し、それらの放射能含有量を決定した(図13C)。内因性hNIS発現のために、甲状腺および胃は注射線量の約30%を捕捉した。それにもかかわらず、Ad5/3-Δ24-hNIS処置腫瘍は全ヨウ化物線量の6%以上を蓄積した。このことは、腫瘍に存在する大量の感染性ウイルスと関係があり、一方、極めて微量が甲状腺および胃で観察された。腫瘍はウイルス注射後10日を過ぎて収集され、TCID50は感染性ウイルスを測定するので、高いTCID値はおそらくウイルスの複製を反映する。アデノウイルスは、細胞に進入するときキャプシドを失うので、したがってインプットウイルスはTCID50では検出できない。すなわち、TCID50は新規なビリオンの生産を必要とする。ヨウ化物の取り込みは、他の器官(偽似処置またはAd5/3-Δ24-Δgp19K処置腫瘍を含む)では低いままであった(最初の線量の1%未満)。
131 I併用Ad5/3-Δ24-hNISはin vivoで腫瘍増殖を阻害する
In vivoでのAd5/3-Δ24-hNISの有効性を判定するために、前立腺腫瘍をもつマウスを131IまたはAd5/3-Δ24-hNIS単独または前記の組合せで処置した(図14)。腫瘍を放射性ヨウ化物無しにAd5/3-Δ24-hNISで処置したとき、腫瘍の増殖速度は偽似群または131I単独群より有意に遅かった(両者についてp<0.05)。マウスにAd5/3-Δ24-hNISおよび 131Iの両方を投与したとき、腫瘍サイズは他のいずれの群よりも有意に小さかった(全てp<0.001)。調整ペア解析は、既に2日目にAd5/3-Δ24-hNIS+131Iとウイルス単独、131I単独または偽似処置との間で有意差を示した(全てp<0.05)。4、6および8日目におけるAd5/3-Δ24-hNIS+131Iとウイルス単独、131I単独または偽似処置との間の調整ペアp-値はいずれもまた0.001未満であった。動物保護規制のために、実験は17日目に終了させることが予め決められていたが、これらマウスのいくらかはなお良好な状態であった。
腫瘍サイズが任意の径で15mmに達したとき、マウスを殺し放射能の測定のために器官を収集した。放射能は時間の経過にしたがって減少し、もっとも高い放射能は甲状腺および胃、さらに短期的には心臓(おそらく循環による伝達による)で観察された。他の器官では、放射能は低いままであった。重要なことには、ウイルス注射はヨウ化物の生体内分布に影響を与えず、したがって本手法の安全性プロフィルは、甲状腺癌のための放射性ヨウ化物療法の安全性プロフィルと類似する。
In vivoでのAd5/3-Δ24-hNISの有効性を判定するために、前立腺腫瘍をもつマウスを131IまたはAd5/3-Δ24-hNIS単独または前記の組合せで処置した(図14)。腫瘍を放射性ヨウ化物無しにAd5/3-Δ24-hNISで処置したとき、腫瘍の増殖速度は偽似群または131I単独群より有意に遅かった(両者についてp<0.05)。マウスにAd5/3-Δ24-hNISおよび 131Iの両方を投与したとき、腫瘍サイズは他のいずれの群よりも有意に小さかった(全てp<0.001)。調整ペア解析は、既に2日目にAd5/3-Δ24-hNIS+131Iとウイルス単独、131I単独または偽似処置との間で有意差を示した(全てp<0.05)。4、6および8日目におけるAd5/3-Δ24-hNIS+131Iとウイルス単独、131I単独または偽似処置との間の調整ペアp-値はいずれもまた0.001未満であった。動物保護規制のために、実験は17日目に終了させることが予め決められていたが、これらマウスのいくらかはなお良好な状態であった。
腫瘍サイズが任意の径で15mmに達したとき、マウスを殺し放射能の測定のために器官を収集した。放射能は時間の経過にしたがって減少し、もっとも高い放射能は甲状腺および胃、さらに短期的には心臓(おそらく循環による伝達による)で観察された。他の器官では、放射能は低いままであった。重要なことには、ウイルス注射はヨウ化物の生体内分布に影響を与えず、したがって本手法の安全性プロフィルは、甲状腺癌のための放射性ヨウ化物療法の安全性プロフィルと類似する。
II.GM-CSFトランスジーン
3種のD24-GM-CSF型ウイルスのクローニング
−PCRによるhGM-CSFの増幅
−Sun/MunI部位の作出=>445bp(鋳型としてpORF-GM-CSF)
−PCR生成物およびpTHSNのSun/MunI消化
−粘着末端連結=>
−Pmel線状化pShuttle-D24+pTG3602=>pAd5-D24
−Ad5-D24-GM-CSF
相同組換え:SrfI線状化pAd5-D24+FspI線状化pTHSN-GM-CSF
=>pAd5-D24-GM-CSF
PacI線状化およびトランスフェクション=>Ad5-D24-GM-CSF
クローニングの全局面をPCRおよび多段制限消化により確認した。シャトルプラスミドpTHSN-GMCSFの配列を決定した。野生型E1が存在しないことはPCRにより確認した。E1領域、トランスジーンおよび線維は最終ウイルスの配列決定およびPCRによりチェックし、続いてこれらを製造のために無菌室に持ち込んだ。この目的のために、適切な緩衝溶液による一晩(ON)インキュベーションによりウイルスDNAを抽出し、さらにPCRの後で配列決定を実施し線維とともにGMCSF cDNAの完全性を分析した。ウイルス製造の全工程(トランスフェクションを含む)をA549細胞で実施し、以前に記載されたように野生型の組換えを避けた(A Kanerva et al. 2003, Mol Ther, 8:449-58;GJ Baeurschmitz et al. 2006, Mol Ther 14:164-74)。GM-CSFはE3プロモーター下にある(これによって複製と密接に連動したトランスジーンの発現(感染後約8時間で開始)が得られる)。E3は6.7K/gp19Kの欠失を除いて完全である。Ad5/3-D24-GM-CSFおよびAd5-RGD-D24-GM-CSFは同一の態様で構築したが、ただし血清型3由来のノブまたはAd5線維HIループ中のRGD-4Cのどちらかの特色を有するレスキュープラスミドを用いたことを除く。
3種のD24-GM-CSF型ウイルスのクローニング
−PCRによるhGM-CSFの増幅
−Sun/MunI部位の作出=>445bp(鋳型としてpORF-GM-CSF)
−PCR生成物およびpTHSNのSun/MunI消化
−粘着末端連結=>
−Pmel線状化pShuttle-D24+pTG3602=>pAd5-D24
−Ad5-D24-GM-CSF
相同組換え:SrfI線状化pAd5-D24+FspI線状化pTHSN-GM-CSF
=>pAd5-D24-GM-CSF
PacI線状化およびトランスフェクション=>Ad5-D24-GM-CSF
クローニングの全局面をPCRおよび多段制限消化により確認した。シャトルプラスミドpTHSN-GMCSFの配列を決定した。野生型E1が存在しないことはPCRにより確認した。E1領域、トランスジーンおよび線維は最終ウイルスの配列決定およびPCRによりチェックし、続いてこれらを製造のために無菌室に持ち込んだ。この目的のために、適切な緩衝溶液による一晩(ON)インキュベーションによりウイルスDNAを抽出し、さらにPCRの後で配列決定を実施し線維とともにGMCSF cDNAの完全性を分析した。ウイルス製造の全工程(トランスフェクションを含む)をA549細胞で実施し、以前に記載されたように野生型の組換えを避けた(A Kanerva et al. 2003, Mol Ther, 8:449-58;GJ Baeurschmitz et al. 2006, Mol Ther 14:164-74)。GM-CSFはE3プロモーター下にある(これによって複製と密接に連動したトランスジーンの発現(感染後約8時間で開始)が得られる)。E3は6.7K/gp19Kの欠失を除いて完全である。Ad5/3-D24-GM-CSFおよびAd5-RGD-D24-GM-CSFは同一の態様で構築したが、ただし血清型3由来のノブまたはAd5線維HIループ中のRGD-4Cのどちらかの特色を有するレスキュープラスミドを用いたことを除く。
D24-GM-CSF型ウイルスのin vitro解析
D24-GM-CSF型ウイルスのin vitro有効性を、MTS細胞殺滅アッセイを利用して肺癌細胞(A549)、乳癌幹細胞由来エクスプラント細胞(JIMT-1)および乳癌細胞(MDA-MB-436)で調べた。MTSアッセイは、癌遺伝子療法の細胞生存率を判定するために公表文献ではこれまでのところ標準的な方法である。Ad5Luc1は複製欠損ウイルスであり、陰性コントロールとして機能する。Ad5wtは野生型Ad5ウイルスであり(Ad300wt株)、陽性コントロールとして用いられる。Ad5-d24-E3は同遺伝子系の24bp欠失をE1に有するが、E3は無傷である。VPはウイルス粒子を指す。
要約すれば、Ad5-D24-GMCSFは陽性コントロールと類似する腫瘍溶解活性をin vitroで有し、したがってトランスジーン生成はウイルスの腫瘍溶解能力を損なわない(図15a−c)。同様なデータがAd5/3-D24-GM-CSFおよびAd5-RGD-D24-GM-CSFについても示された(図15d)。
Ad5D24-GMCSFがトランスジーンを発現することができるか否かを試験するために、A549細胞株に1000VP/細胞を感染させ、時間の経過にしたがって培養液を収集した。培養液中のGMCSFの濃度をFACSARRAYによって測定した(図16a)。前記の測定に加えて、我々はまた、ウイルス発現GMCSFがその生物学的活性を保持しているか否かを分析した。この目的のために、Ad5D24-GMCSFを以前に感染させたA549細胞から収集した培養液でTF1細胞株(その増殖および生存はヒトGMCSFに厳密に依存する)を処理した。TF1生存率をMTSアッセイによって時間の経過にしたがって判定した。本実験の結果は、ウイルス発現GMCSFは、そのような細胞株の増殖を刺激することができ、ヒト組換えGMCSF(Sigma)で処理した同じ細胞株との間で相違は認められないということであった(図16b)。
D24-GM-CSF型ウイルスのin vitro有効性を、MTS細胞殺滅アッセイを利用して肺癌細胞(A549)、乳癌幹細胞由来エクスプラント細胞(JIMT-1)および乳癌細胞(MDA-MB-436)で調べた。MTSアッセイは、癌遺伝子療法の細胞生存率を判定するために公表文献ではこれまでのところ標準的な方法である。Ad5Luc1は複製欠損ウイルスであり、陰性コントロールとして機能する。Ad5wtは野生型Ad5ウイルスであり(Ad300wt株)、陽性コントロールとして用いられる。Ad5-d24-E3は同遺伝子系の24bp欠失をE1に有するが、E3は無傷である。VPはウイルス粒子を指す。
要約すれば、Ad5-D24-GMCSFは陽性コントロールと類似する腫瘍溶解活性をin vitroで有し、したがってトランスジーン生成はウイルスの腫瘍溶解能力を損なわない(図15a−c)。同様なデータがAd5/3-D24-GM-CSFおよびAd5-RGD-D24-GM-CSFについても示された(図15d)。
Ad5D24-GMCSFがトランスジーンを発現することができるか否かを試験するために、A549細胞株に1000VP/細胞を感染させ、時間の経過にしたがって培養液を収集した。培養液中のGMCSFの濃度をFACSARRAYによって測定した(図16a)。前記の測定に加えて、我々はまた、ウイルス発現GMCSFがその生物学的活性を保持しているか否かを分析した。この目的のために、Ad5D24-GMCSFを以前に感染させたA549細胞から収集した培養液でTF1細胞株(その増殖および生存はヒトGMCSFに厳密に依存する)を処理した。TF1生存率をMTSアッセイによって時間の経過にしたがって判定した。本実験の結果は、ウイルス発現GMCSFは、そのような細胞株の増殖を刺激することができ、ヒト組換えGMCSF(Sigma)で処理した同じ細胞株との間で相違は認められないということであった(図16b)。
D24-GM-CSF型ウイルスの動物におけるin vivo解析
免疫適格性を有するシリアンハムスターでAd5-D24-GM-CSFのin vivo有効性を試験した(前記はヒトアデノウイルスの複製について半許容性である(マウスは非許容性である)(B Ying et al. 2009, Cancer Gene Ther, doi:10.1038/cgt.2009.6))。7x106 HapT1膵臓癌細胞を皮下に注射し、さらに0、2および3日目に、Ad5-D24-GM-CSFまたはAd5D24E3(GM-CSFを発現しない)の1x106 ウイルス粒子(VP)腫瘍内に注射した。偽似グループには同じ表示時期に同じ体積の増殖培養液を注射した。図17bは、Ad5-D24-GMCSFの腫瘍内注射はシリアンハムスターの血清中に高レベルのhGM-CSFを生じたことを示している。ヒトGM-CSFはシリアンハムスターで活性を有することが判明している(Cho, 2006, Exp Toxicl Pathol 57(4):321-8)。興味深いことに、偽似グループを除いて全動物が16日目まで腫瘍が存在しなかった(図17a)。さらに2週間腫瘍痕を詳しく検討して、腫瘍の再出現が生じえるか否かを判定した。しかしながら、32日目にこれらの動物で腫瘍の徴候は存在せず、実験の第一の部分を終了させ、偽似グループの動物を安楽死させた。この時点で、残りの処置動物をその上体の右側に同じ腫瘍の7x106 HapT1細胞で皮下注射によりチャレンジし、一方、左側に異なる腫瘍(1x106 HaK腫瘍)(前記に対して動物はナイーブである)でチャレンジした。時間の経過にしたがって腫瘍の増殖を測定し、図17c−dに示した。興味深いことに、以前にAd5D24GMCSFで処置された動物はHapT1腫瘍チャレンジを完全に拒絶したがHak腫瘍は正常に増殖し、一方、以前にAd5D24E3で処置した動物ではHapT1およびHaK腫瘍はそれぞれ無関係に増殖した(図17c−d)。
要約すれば、これらのデータは、免疫適格性を有する担癌動物でAd5-D24-GM-CSFは抗腫瘍活性を有し、さらに、前記は同じ腫瘍によるその後のチャレンジを拒絶しえる程度に腫瘍特異的免疫を誘引できることを示している。
免疫適格性を有するシリアンハムスターでAd5-D24-GM-CSFのin vivo有効性を試験した(前記はヒトアデノウイルスの複製について半許容性である(マウスは非許容性である)(B Ying et al. 2009, Cancer Gene Ther, doi:10.1038/cgt.2009.6))。7x106 HapT1膵臓癌細胞を皮下に注射し、さらに0、2および3日目に、Ad5-D24-GM-CSFまたはAd5D24E3(GM-CSFを発現しない)の1x106 ウイルス粒子(VP)腫瘍内に注射した。偽似グループには同じ表示時期に同じ体積の増殖培養液を注射した。図17bは、Ad5-D24-GMCSFの腫瘍内注射はシリアンハムスターの血清中に高レベルのhGM-CSFを生じたことを示している。ヒトGM-CSFはシリアンハムスターで活性を有することが判明している(Cho, 2006, Exp Toxicl Pathol 57(4):321-8)。興味深いことに、偽似グループを除いて全動物が16日目まで腫瘍が存在しなかった(図17a)。さらに2週間腫瘍痕を詳しく検討して、腫瘍の再出現が生じえるか否かを判定した。しかしながら、32日目にこれらの動物で腫瘍の徴候は存在せず、実験の第一の部分を終了させ、偽似グループの動物を安楽死させた。この時点で、残りの処置動物をその上体の右側に同じ腫瘍の7x106 HapT1細胞で皮下注射によりチャレンジし、一方、左側に異なる腫瘍(1x106 HaK腫瘍)(前記に対して動物はナイーブである)でチャレンジした。時間の経過にしたがって腫瘍の増殖を測定し、図17c−dに示した。興味深いことに、以前にAd5D24GMCSFで処置された動物はHapT1腫瘍チャレンジを完全に拒絶したがHak腫瘍は正常に増殖し、一方、以前にAd5D24E3で処置した動物ではHapT1およびHaK腫瘍はそれぞれ無関係に増殖した(図17c−d)。
要約すれば、これらのデータは、免疫適格性を有する担癌動物でAd5-D24-GM-CSFは抗腫瘍活性を有し、さらに、前記は同じ腫瘍によるその後のチャレンジを拒絶しえる程度に腫瘍特異的免疫を誘引できることを示している。
III.CD40Lトランスジーン
上記に記載した方法と同様な方法を用いて、Ad3-hTERT-CD40L-E1Aを構築し、マウスの生体内分布について解析した(図20a−b)。5x1010VPの静脈内投与の6時間後のネズミの生体内分布(図20a)は、血清型3のウイルスの多くはなお血液および血液が豊富な器官(例えば脾臓、肺臓および肝臓)にとどまることを示唆している。全ての主要な器官をqPCRにより解析した(図20b)。他の器官への進入は弱められることが判明した。このアッセイでは、血餅のβ-アクチンを血清数値のために用いた。血液区画内にβ-アクチンは存在しないので、血液数値は図20aで実施したように絶対値ともっとも良好に対応する。これらの結果は、Ad3ウイルスはRBCまたは血清と結合しないが、もっぱら血餅および血漿に存在することを示唆している。したがって、WBCおよび血小板は、マウスではAd3ウイルスのキャリアーでありえる。
上記に記載した方法と同様な方法を用いて、Ad3-hTERT-CD40L-E1Aを構築し、マウスの生体内分布について解析した(図20a−b)。5x1010VPの静脈内投与の6時間後のネズミの生体内分布(図20a)は、血清型3のウイルスの多くはなお血液および血液が豊富な器官(例えば脾臓、肺臓および肝臓)にとどまることを示唆している。全ての主要な器官をqPCRにより解析した(図20b)。他の器官への進入は弱められることが判明した。このアッセイでは、血餅のβ-アクチンを血清数値のために用いた。血液区画内にβ-アクチンは存在しないので、血液数値は図20aで実施したように絶対値ともっとも良好に対応する。これらの結果は、Ad3ウイルスはRBCまたは血清と結合しないが、もっぱら血餅および血漿に存在することを示唆している。したがって、WBCおよび血小板は、マウスではAd3ウイルスのキャリアーでありえる。
Claims (32)
- 完全に血清型3の腫瘍溶解ヒトアデノウイルスベクター。
- E1、E2、E3、E4、中間および後期領域から成る群から選択される1つまたは2つ以上の領域を含む、請求項1に記載の腫瘍溶解ヒトアデノウイルスベクター。
- 以下の領域:左ITR、E1、pIX、pIVa2、E2、VA1、VA2、後期領域、E3もしくは部分的E3、E4および右ITRを含む、請求項1または2に記載の腫瘍溶解ヒトアデノウイルスベクター。
- 前記領域が5'から3'方向に連続的順序で存在する、請求項1から3のいずれか1項に記載の腫瘍溶解ヒトアデノウイルスベクター。
- hTERTプロモーター下にAd3E1A領域を含む、請求項1から4のいずれか1項に記載の腫瘍溶解ヒトアデノウイルスベクター。
- 複製活性化Ad3 E3プロモーター下にAd3 E3領域を含む、請求項1から5のいずれか1項に記載の腫瘍溶解ヒトアデノウイルスベクター。
- 1つまたは2つ以上のトランスジーンを含む、請求項1から6のいずれか1項に記載の腫瘍溶解ヒトアデノウイルスベクター。
- 前記トランスジーンが、顆粒球-マクロファージコロニー刺激因子(GM-CSF)、ヒトヨウ化ナトリウムシンポーター(hNIS)、インターフェロンアルファ、インターフェロンベータ、インターフェロンガンマ、腫瘍壊死因子、CD40L、トラスツズマブおよび他のモノクローナル抗体から成る群から選択される、請求項7に記載の腫瘍溶解ヒトアデノウイルスベクター。
- 前記トランスジーンが、hTERTプロモーター下のE1および/または複製活性化Ad3 E3プロモーター下のE3に配置される、請求項7または8に記載の腫瘍溶解ヒトアデノウイルスベクター。
- 前記トランスジーンとE1A領域の間に内部リボソーム進入部位(IRES)を含む、請求項1から9のいずれか1項に記載の腫瘍溶解ヒトアデノウイルスベクター。
- hTERTプロモーター、トランスジーン、IRESおよびE1Aを含む、請求項1から10のいずれか1項に記載の腫瘍溶解ヒトアデノウイルスベクター。
- E3領域内の欠失gp19kの位置にトランスジーンを含む、請求項7から9のいずれか1項に記載の腫瘍溶解ヒトアデノウイルスベクター。
- 少なくとも1つの発現カセットを含む、請求項1から12のいずれか1項に記載の腫瘍溶解ヒトアデノウイルスベクター。
- ただ1つの発現カセットを含む、請求項1から13のいずれか1項に記載の腫瘍溶解ヒトアデノウイルスベクター。
- ベクターが、テロメラーゼ活性を有する細胞でのみ複製することができる、請求項1から14のいずれか1項に記載の腫瘍溶解ヒトアデノウイルスベクター。
- 放射性ヨウ化物を標的細胞に誘導するhNISを含む、請求項1から15のいずれか1項に記載の腫瘍溶解ヒトアデノウイルスベクター。
- 請求項1から16のいずれか1項に記載のアデノウイルスベクターを含む細胞。
- 請求項1から16のいずれか1項に記載のアデノウイルスベクターを含む医薬組成物。
- in situ癌ワクチンとして機能する、請求項1から18のいずれか1項に記載の腫瘍溶解ヒトアデノウイルスベクターまたは医薬組成物。
- 対象者で癌を治療するための医薬の製造における、請求項1から16のいずれか1項に記載のアデノウイルスベクターの使用。
- 対象者で癌を治療する方法であって、前記方法が、請求項1から16または18のいずれか1項に記載のベクターまたは医薬組成物を対象者に投与する工程を含む、前記癌の治療方法。
- 癌が以下から成る群から選択される、請求項20または21に記載の使用または方法:鼻咽頭癌、滑膜癌、肝細胞癌、腎癌、結合組織の癌、メラノーマ、肺癌、腸癌、結腸癌、直腸癌、結腸直腸癌、脳の癌、咽喉癌、口内癌、肝癌、骨の癌、膵臓癌、絨毛癌、ガストリノーマ、クロム親和性細胞腫、プロラクチノーマ、T細胞白血病/リンパ腫、神経腫、フォン・ヒッペル-リンダウ病、ゾリンジャー-エリソン症候群、副腎癌、肛門癌、胆管癌、膀胱癌、尿管癌、脳の癌、稀突起神経膠腫、神経芽細胞腫、髄膜腫、脊髄腫瘍、骨の癌、骨軟骨腫、軟骨肉腫、ユーイング肉腫、未知の原発癌、類癌、胃腸管の類癌、線維肉腫、胸部癌、パジェット病、子宮頸癌、結腸直腸癌、直腸癌、食道癌、胆嚢癌、頭部の癌、眼の癌、首の癌、腎臓癌、ウィルムス腫瘍、肝臓癌、カポジ肉腫、前立腺癌、肺癌、精巣癌、ホジキン病、非ホジキンリンパ腫、口内癌、皮膚癌、中皮腫、多発性メラノーマ、卵巣癌、内分泌系膵臓癌、グルカゴノーマ、膵臓癌、上皮小体癌、陰茎癌、下垂体癌、軟組織肉腫、網膜芽細胞腫、小腸癌、胃癌、胸腺癌、甲状腺癌、栄養膜の癌、胞状奇胎、子宮癌、子宮内膜癌、膣癌、外陰部癌、聴覚神経腫、菌状息肉腫、インスリノーマ、類癌症候群、ソマトスタチノーマ、歯肉癌、心臓の癌、口唇癌、髄膜癌、口の癌、神経の癌、口蓋癌、耳下腺癌、腹膜癌、咽頭癌、胸膜癌、唾液腺癌、舌癌および扁桃癌。
- 対象者がヒトまたは動物である、請求項20〜22のいずれか1項に記載の使用または方法。
- 投与が、腫瘍内、筋肉内、動脈内、静脈内、胸膜内、嚢内、腔内または腹膜内注射または経口投与により実施される、請求項20〜23のいずれか1項に記載の使用または方法。
- 腫瘍溶解ヒトアデノウイルスベクターまたは医薬組成物が治療期間中に数回投与される、請求項20〜24のいずれか1項に記載の使用または方法。
- 前記方法または使用がさらに対象者への放射線療法または放射性ヨウ化物の同時付与を含む、請求項20〜25のいずれか1項に記載の使用または方法。
- 前記方法または使用がさらに対象者への化学療法の同時付与を含む、請求項20〜26のいずれか1項に記載の使用または方法。
- 対象者が大量の抗Ad5中和抗体を有する、請求項20〜27のいずれか1項に記載の使用または方法。
- 対象者が以前にAd5で処置されている、請求項20〜28のいずれか1項に記載の使用または方法。
- 以下の工程を含む、請求項1〜16のいずれか1項に記載のアデノウイルスベクターを製造する方法:
i)少なくとも部分的なAd3 DNAおよび場合によって1つまたはいくつかのプロモーターおよび/または場合によって1つまたはいくつかのトランスジーンを含むDNAベクターを提供する工程;および
ii)Ad3ゲノムの残りおよび場合によって1つまたはいくつかのプロモーターおよび/または場合によって1つまたはいくつかのトランスジーンを前記ベクターに挿入する工程。 - プラスミド構築物がトランスジーンをアデノウイルスベクターへ配置するために用いられる、請求項30に記載の方法。
- 前記アデノウイルスベクターが細胞株で製造される、請求項30または31に記載の方法。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FI20090030A FI20090030A0 (fi) | 2009-02-02 | 2009-02-02 | Onkolyyttiset virukset |
| FI20090030 | 2009-02-02 | ||
| FI20095751 | 2009-07-02 | ||
| FI20095751A FI121574B (fi) | 2009-02-02 | 2009-07-02 | Ei-Ad5 adenovirusvektoreita ja niihin liittyviä menetelmiä ja käyttöjä |
| PCT/IB2010/050452 WO2010086838A2 (en) | 2009-02-02 | 2010-02-02 | Non-ad5 adenoviral vectors and methods and uses related thereto |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2012516682A true JP2012516682A (ja) | 2012-07-26 |
| JP2012516682A5 JP2012516682A5 (ja) | 2013-03-21 |
Family
ID=40404558
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011547047A Pending JP2012516682A (ja) | 2009-02-02 | 2010-02-02 | 非Ad5アデノウイルスベクター並びに前記に関連する方法および使用 |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US20120063995A1 (ja) |
| EP (1) | EP2391722B1 (ja) |
| JP (1) | JP2012516682A (ja) |
| KR (1) | KR20110110371A (ja) |
| CN (1) | CN102325887A (ja) |
| AU (1) | AU2010209334A1 (ja) |
| BR (1) | BRPI1008159A2 (ja) |
| CA (1) | CA2750770A1 (ja) |
| FI (2) | FI20090030A0 (ja) |
| RU (1) | RU2011136280A (ja) |
| SG (1) | SG173502A1 (ja) |
| WO (1) | WO2010086838A2 (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2016522805A (ja) * | 2013-04-18 | 2016-08-04 | ティーアイエルティー・バイオセラピューティクス・オーワイTILT Biotherapeutics Oy | 増強された養子細胞療法 |
| JP2021526842A (ja) * | 2018-06-19 | 2021-10-11 | エイチ リー モフィット キャンサー センター アンド リサーチ インスティテュート インコーポレイテッド | I型インターフェロン及びcd40−配位子を用いる腫瘍溶解性ウイルス又は抗原提示細胞媒介性癌治療 |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BR112013006669A2 (pt) * | 2010-09-24 | 2019-09-24 | Oncos Therapeutics Oy | vetores adenovirais oncolíticos e métodos e usos relacionados aos mesmos |
| CN104946602A (zh) * | 2015-06-11 | 2015-09-30 | 华中科技大学同济医学院附属同济医院 | 具有肿瘤组织靶向性和抑癌基因修复性的重组溶瘤腺病毒Ad5-P16及其应用 |
| LT3293201T (lt) * | 2016-09-12 | 2021-03-25 | Targovax Oy | Adenoviruso ir kontrolinio taško inhibitoriaus derinys vėžio gydymui |
| CN108261426B (zh) * | 2017-01-04 | 2019-04-05 | 杭州康万达医药科技有限公司 | 药物组合物及其在治疗肿瘤和/或癌症的药物中的应用 |
| CA3052086A1 (en) * | 2017-01-30 | 2018-08-02 | Epicentrx, Inc. | Tumor selective tata-box and caat-box mutants |
| WO2019191494A1 (en) * | 2018-03-28 | 2019-10-03 | Epicentrx, Inc. | Personalized cancer vaccines |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2005030261A1 (en) * | 2003-08-28 | 2005-04-07 | Cell Genesys, Inc. | Oncolytic adenoviral vectors encoding gm-csf |
| US20050214923A1 (en) * | 2004-03-25 | 2005-09-29 | Yu Dechao | Pan cancer oncolytic vectors and methods of use thereof |
| JP2007530004A (ja) * | 2003-07-18 | 2007-11-01 | オニックス ファーマシューティカルズ,インコーポレイティド | 疾患を処置するためのサブグループbアデノウイルスベクター |
-
2009
- 2009-02-02 FI FI20090030A patent/FI20090030A0/fi not_active Application Discontinuation
- 2009-07-02 FI FI20095751A patent/FI121574B/fi not_active IP Right Cessation
-
2010
- 2010-02-02 US US13/147,288 patent/US20120063995A1/en not_active Abandoned
- 2010-02-02 KR KR1020117020181A patent/KR20110110371A/ko not_active Application Discontinuation
- 2010-02-02 RU RU2011136280/10A patent/RU2011136280A/ru not_active Application Discontinuation
- 2010-02-02 AU AU2010209334A patent/AU2010209334A1/en not_active Abandoned
- 2010-02-02 BR BRPI1008159A patent/BRPI1008159A2/pt not_active IP Right Cessation
- 2010-02-02 SG SG2011055563A patent/SG173502A1/en unknown
- 2010-02-02 CN CN2010800087768A patent/CN102325887A/zh active Pending
- 2010-02-02 JP JP2011547047A patent/JP2012516682A/ja active Pending
- 2010-02-02 CA CA2750770A patent/CA2750770A1/en not_active Abandoned
- 2010-02-02 EP EP10704194.9A patent/EP2391722B1/en not_active Not-in-force
- 2010-02-02 WO PCT/IB2010/050452 patent/WO2010086838A2/en active Application Filing
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2007530004A (ja) * | 2003-07-18 | 2007-11-01 | オニックス ファーマシューティカルズ,インコーポレイティド | 疾患を処置するためのサブグループbアデノウイルスベクター |
| WO2005030261A1 (en) * | 2003-08-28 | 2005-04-07 | Cell Genesys, Inc. | Oncolytic adenoviral vectors encoding gm-csf |
| US20050214923A1 (en) * | 2004-03-25 | 2005-09-29 | Yu Dechao | Pan cancer oncolytic vectors and methods of use thereof |
Non-Patent Citations (5)
| Title |
|---|
| JPN5012014452; SHEN B: 'THE EFFECT OF HYPOXIA ON THE UPTAKE,REPLICATION AND LYTIC POTENTIAL OF GROUP B AND ADENOVIRUS TYPE 3' GENE THERAPY V13 N12, 200606 * |
| JPN5012014455; LEI N: 'AN ONCOLYTIC ADENOVIRUS EXPRESSING GRANULOCYTE MACROPHAGE COLONY-STIMULATING FACTOR SHOWS IMPROVED S' CANCER GENE THERAPY V16 N1, 20080801, P33-43 * |
| JPN5012014457; RAJECKI: 'BETAHCG EXPRESSING CRAD FOR PROSTATE CANCER' MOLECULAR THERAPY V13, 20060101, P S366-S367, ACADEMIC PRESS * |
| JPN5012014461; BARTON K N: 'POLYETHYLENE GLYCOL(MOLECULAR WEIGHT 400 DA)VEHICLE IMPROVES GENE EXPRESSION OF ADENOVIRUS MEDIATED' JOURNAL OF UROLOGY V175 N5, 20060501, P1921-1925, LIPPINCOTT WILLIAMS & WILKINS * |
| JPN6014022493; J. Virol., 2002, Vol.76, No.24, p.12775-12782 * |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2016522805A (ja) * | 2013-04-18 | 2016-08-04 | ティーアイエルティー・バイオセラピューティクス・オーワイTILT Biotherapeutics Oy | 増強された養子細胞療法 |
| JP2020011966A (ja) * | 2013-04-18 | 2020-01-23 | ティーアイエルティー・バイオセラピューティクス・オーワイTILT Biotherapeutics Oy | 増強された養子細胞療法 |
| US10647963B2 (en) | 2013-04-18 | 2020-05-12 | Tilt Biotherapeutics Oy | Enhanced adoptive cell therapy |
| JP2021526842A (ja) * | 2018-06-19 | 2021-10-11 | エイチ リー モフィット キャンサー センター アンド リサーチ インスティテュート インコーポレイテッド | I型インターフェロン及びcd40−配位子を用いる腫瘍溶解性ウイルス又は抗原提示細胞媒介性癌治療 |
| JP7420751B2 (ja) | 2018-06-19 | 2024-01-23 | エイチ リー モフィット キャンサー センター アンド リサーチ インスティテュート インコーポレイテッド | I型インターフェロン及びcd40-配位子を用いる腫瘍溶解性ウイルス又は抗原提示細胞媒介性癌治療 |
Also Published As
| Publication number | Publication date |
|---|---|
| BRPI1008159A2 (pt) | 2016-03-29 |
| FI20095751A (fi) | 2010-08-03 |
| WO2010086838A2 (en) | 2010-08-05 |
| EP2391722B1 (en) | 2014-06-11 |
| CA2750770A1 (en) | 2010-08-05 |
| SG173502A1 (en) | 2011-09-29 |
| US20120063995A1 (en) | 2012-03-15 |
| WO2010086838A3 (en) | 2010-11-25 |
| FI121574B (fi) | 2011-01-14 |
| KR20110110371A (ko) | 2011-10-06 |
| CN102325887A (zh) | 2012-01-18 |
| EP2391722A2 (en) | 2011-12-07 |
| FI20095751A0 (fi) | 2009-07-02 |
| FI20090030A0 (fi) | 2009-02-02 |
| AU2010209334A1 (en) | 2011-09-08 |
| RU2011136280A (ru) | 2013-03-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6639412B2 (ja) | アルブミン結合部分を含んでなるアデノウイルス | |
| US9410129B2 (en) | Recombinant serotype 5 (Ad5) adenoviral vectors | |
| EP2391722B1 (en) | Non-ad5 adenoviral vectors and methods and uses related thereto | |
| US10391183B2 (en) | Infectivity-enhanced conditionally-replicative adenovirus and uses thereof | |
| JP2012513209A (ja) | 腫瘍溶解アデノウイルスベクター並びに前記に関連する方法および使用 | |
| JP2014500004A (ja) | 抗ctla−4モノクローナル抗体をコードする腫瘍溶解性アデノウイルスベクター | |
| US20100166799A1 (en) | Adenoviral vectors and methods and uses related thereto | |
| JP7558808B2 (ja) | 組換えアデノウイルスおよびこれを含む幹細胞 | |
| EP1196616B1 (en) | Replication-competent anti-cancer vectors | |
| JP2004033186A (ja) | 腫瘍細胞において選択的に増殖する腫瘍融解ウイルス | |
| Gao et al. | RETRACTED: Selective Targeting of Checkpoint Kinase 1 in Tumor Cells with a Novel Potent Oncolytic Adenovirus | |
| Henderson et al. | Development of attenuated replication competent adenoviruses (ARCAs) for the treatment of prostate cancer | |
| TW202102677A (zh) | 經修飾腺病毒及含有其之醫藥 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A524 | Written submission of copy of amendment under article 19 pct |
Free format text: JAPANESE INTERMEDIATE CODE: A524 Effective date: 20130201 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20130201 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20140630 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20141203 |