JP2011517455A - C(10)エチルエステルおよびc(10)シクロプロピルエステル置換タキサン - Google Patents
C(10)エチルエステルおよびc(10)シクロプロピルエステル置換タキサン Download PDFInfo
- Publication number
- JP2011517455A JP2011517455A JP2011503034A JP2011503034A JP2011517455A JP 2011517455 A JP2011517455 A JP 2011517455A JP 2011503034 A JP2011503034 A JP 2011503034A JP 2011503034 A JP2011503034 A JP 2011503034A JP 2011517455 A JP2011517455 A JP 2011517455A
- Authority
- JP
- Japan
- Prior art keywords
- pharmaceutical composition
- taxane
- cancer
- tumor
- compound
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 229940123237 Taxane Drugs 0.000 title claims abstract description 66
- 125000004494 ethyl ester group Chemical group 0.000 title abstract description 3
- DKPFODGZWDEEBT-QFIAKTPHSA-N taxane Chemical class C([C@]1(C)CCC[C@@H](C)[C@H]1C1)C[C@H]2[C@H](C)CC[C@@H]1C2(C)C DKPFODGZWDEEBT-QFIAKTPHSA-N 0.000 claims abstract description 54
- 238000000034 method Methods 0.000 claims abstract description 49
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 47
- 239000003814 drug Substances 0.000 claims abstract description 28
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 claims description 185
- 206010028980 Neoplasm Diseases 0.000 claims description 129
- 239000000203 mixture Substances 0.000 claims description 76
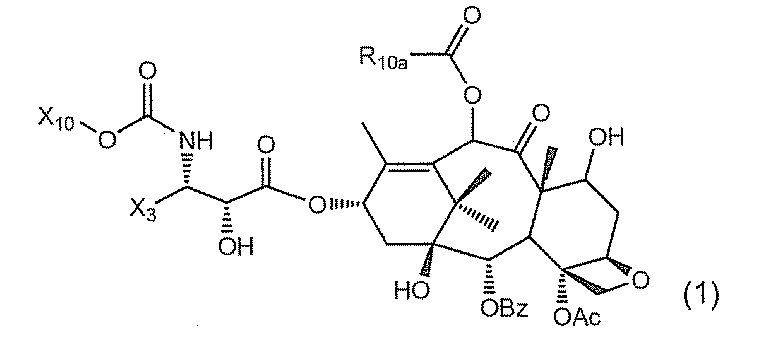
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 claims description 69
- 229960003668 docetaxel Drugs 0.000 claims description 68
- 239000000243 solution Substances 0.000 claims description 63
- 230000004614 tumor growth Effects 0.000 claims description 48
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 claims description 32
- 229930012538 Paclitaxel Natural products 0.000 claims description 31
- 229960001592 paclitaxel Drugs 0.000 claims description 31
- 239000008389 polyethoxylated castor oil Substances 0.000 claims description 26
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 claims description 25
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 claims description 25
- 229940079593 drug Drugs 0.000 claims description 25
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 claims description 24
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 23
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 23
- 239000000839 emulsion Substances 0.000 claims description 17
- 206010009944 Colon cancer Diseases 0.000 claims description 16
- 208000008839 Kidney Neoplasms Diseases 0.000 claims description 16
- 208000029742 colonic neoplasm Diseases 0.000 claims description 16
- 201000001441 melanoma Diseases 0.000 claims description 16
- 206010038389 Renal cancer Diseases 0.000 claims description 15
- 201000010982 kidney cancer Diseases 0.000 claims description 15
- 239000004094 surface-active agent Substances 0.000 claims description 15
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 14
- 201000005202 lung cancer Diseases 0.000 claims description 14
- 208000020816 lung neoplasm Diseases 0.000 claims description 14
- 210000004881 tumor cell Anatomy 0.000 claims description 14
- 125000001544 thienyl group Chemical group 0.000 claims description 13
- 125000000175 2-thienyl group Chemical group S1C([*])=C([H])C([H])=C1[H] 0.000 claims description 12
- 238000007911 parenteral administration Methods 0.000 claims description 12
- 206010027406 Mesothelioma Diseases 0.000 claims description 11
- 206010061535 Ovarian neoplasm Diseases 0.000 claims description 11
- 230000036457 multidrug resistance Effects 0.000 claims description 11
- 206010033128 Ovarian cancer Diseases 0.000 claims description 10
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 claims description 10
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 claims description 10
- 229920000053 polysorbate 80 Polymers 0.000 claims description 10
- 239000003937 drug carrier Substances 0.000 claims description 9
- 229940068968 polysorbate 80 Drugs 0.000 claims description 9
- 206010061902 Pancreatic neoplasm Diseases 0.000 claims description 8
- 108010078791 Carrier Proteins Proteins 0.000 claims description 7
- 241000124008 Mammalia Species 0.000 claims description 7
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 claims description 6
- 208000030381 cutaneous melanoma Diseases 0.000 claims description 6
- 230000002401 inhibitory effect Effects 0.000 claims description 6
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 claims description 6
- 201000002528 pancreatic cancer Diseases 0.000 claims description 6
- 208000008443 pancreatic carcinoma Diseases 0.000 claims description 6
- 201000003708 skin melanoma Diseases 0.000 claims description 6
- 239000011780 sodium chloride Substances 0.000 claims description 6
- 102100022595 Broad substrate specificity ATP-binding cassette transporter ABCG2 Human genes 0.000 claims description 5
- 208000005017 glioblastoma Diseases 0.000 claims description 5
- 108010006533 ATP-Binding Cassette Transporters Proteins 0.000 claims description 4
- 102100033350 ATP-dependent translocase ABCB1 Human genes 0.000 claims description 4
- 239000012153 distilled water Substances 0.000 claims description 4
- 239000002960 lipid emulsion Substances 0.000 claims description 4
- 108090000623 proteins and genes Proteins 0.000 claims description 4
- 102000004169 proteins and genes Human genes 0.000 claims description 4
- 206010052747 Adenocarcinoma pancreas Diseases 0.000 claims description 3
- 206010006187 Breast cancer Diseases 0.000 claims description 3
- 208000026310 Breast neoplasm Diseases 0.000 claims description 3
- 101000823298 Homo sapiens Broad substrate specificity ATP-binding cassette transporter ABCG2 Proteins 0.000 claims description 3
- 108010047230 Member 1 Subfamily B ATP Binding Cassette Transporter Proteins 0.000 claims description 3
- 201000002094 pancreatic adenocarcinoma Diseases 0.000 claims description 3
- 201000009030 Carcinoma Diseases 0.000 claims description 2
- 101000956263 Homo sapiens Uncharacterized protein C19orf48 Proteins 0.000 claims description 2
- 102100038573 Uncharacterized protein C19orf48 Human genes 0.000 claims description 2
- 210000002919 epithelial cell Anatomy 0.000 claims description 2
- 102000043966 ABC-type transporter activity proteins Human genes 0.000 claims 2
- 230000001747 exhibiting effect Effects 0.000 claims 1
- 201000007270 liver cancer Diseases 0.000 claims 1
- 208000014018 liver neoplasm Diseases 0.000 claims 1
- 229940100688 oral solution Drugs 0.000 claims 1
- 238000011282 treatment Methods 0.000 abstract description 69
- 125000000468 ketone group Chemical group 0.000 abstract description 7
- SRQMASZDGSTJCU-UHFFFAOYSA-N cyclopentyloxycarbamic acid Chemical group OC(=O)NOC1CCCC1 SRQMASZDGSTJCU-UHFFFAOYSA-N 0.000 abstract description 2
- ZMVBSIYIZLVZRQ-UHFFFAOYSA-N butoxycarbamic acid Chemical compound CCCCONC(O)=O ZMVBSIYIZLVZRQ-UHFFFAOYSA-N 0.000 abstract 1
- 150000001875 compounds Chemical class 0.000 description 259
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 64
- -1 cyclopropylcarbonyloxy Chemical group 0.000 description 56
- 230000000259 anti-tumor effect Effects 0.000 description 50
- 241000700159 Rattus Species 0.000 description 45
- 241001465754 Metazoa Species 0.000 description 44
- 238000001990 intravenous administration Methods 0.000 description 40
- 239000003981 vehicle Substances 0.000 description 36
- 241000699670 Mus sp. Species 0.000 description 35
- 238000002347 injection Methods 0.000 description 34
- 239000007924 injection Substances 0.000 description 34
- 230000000694 effects Effects 0.000 description 33
- 238000009472 formulation Methods 0.000 description 30
- 238000012360 testing method Methods 0.000 description 30
- 241000699660 Mus musculus Species 0.000 description 29
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 29
- 238000011580 nude mouse model Methods 0.000 description 29
- 230000004580 weight loss Effects 0.000 description 26
- 229940125782 compound 2 Drugs 0.000 description 25
- 229920000136 polysorbate Polymers 0.000 description 23
- 238000007920 subcutaneous administration Methods 0.000 description 23
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 21
- 125000001424 substituent group Chemical group 0.000 description 20
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 19
- 210000004027 cell Anatomy 0.000 description 19
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 19
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 18
- 125000004432 carbon atom Chemical group C* 0.000 description 18
- 238000001727 in vivo Methods 0.000 description 18
- YWLXLRUDGLRYDR-ZHPRIASZSA-N 5beta,20-epoxy-1,7beta,10beta,13alpha-tetrahydroxy-9-oxotax-11-ene-2alpha,4alpha-diyl 4-acetate 2-benzoate Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](O)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 YWLXLRUDGLRYDR-ZHPRIASZSA-N 0.000 description 17
- 125000001183 hydrocarbyl group Chemical group 0.000 description 17
- 229910001868 water Inorganic materials 0.000 description 17
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 16
- 239000002904 solvent Substances 0.000 description 16
- 230000037396 body weight Effects 0.000 description 15
- 238000006243 chemical reaction Methods 0.000 description 15
- 229920001223 polyethylene glycol Chemical group 0.000 description 15
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 13
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 13
- 230000004044 response Effects 0.000 description 13
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 12
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 12
- 125000000217 alkyl group Chemical group 0.000 description 12
- 239000003795 chemical substances by application Substances 0.000 description 12
- 230000034994 death Effects 0.000 description 12
- 231100000517 death Toxicity 0.000 description 12
- 150000002148 esters Chemical class 0.000 description 12
- 239000000546 pharmaceutical excipient Substances 0.000 description 12
- 229940002612 prodrug Drugs 0.000 description 12
- 239000000651 prodrug Substances 0.000 description 12
- 150000003839 salts Chemical class 0.000 description 12
- 239000002202 Polyethylene glycol Chemical group 0.000 description 11
- 230000009467 reduction Effects 0.000 description 11
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 10
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 10
- 125000003118 aryl group Chemical group 0.000 description 10
- 230000003376 axonal effect Effects 0.000 description 10
- 230000007850 degeneration Effects 0.000 description 10
- 235000014113 dietary fatty acids Nutrition 0.000 description 10
- 229930195729 fatty acid Natural products 0.000 description 10
- 239000000194 fatty acid Substances 0.000 description 10
- 239000003921 oil Substances 0.000 description 10
- 235000019198 oils Nutrition 0.000 description 10
- 239000000047 product Substances 0.000 description 10
- 230000002829 reductive effect Effects 0.000 description 10
- 239000000126 substance Substances 0.000 description 10
- 150000003952 β-lactams Chemical class 0.000 description 10
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 9
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 9
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 9
- 125000000304 alkynyl group Chemical group 0.000 description 9
- DCFKHNIGBAHNSS-UHFFFAOYSA-N chloro(triethyl)silane Chemical compound CC[Si](Cl)(CC)CC DCFKHNIGBAHNSS-UHFFFAOYSA-N 0.000 description 9
- 239000001257 hydrogen Substances 0.000 description 9
- 229910052739 hydrogen Inorganic materials 0.000 description 9
- 125000006239 protecting group Chemical group 0.000 description 9
- 230000001988 toxicity Effects 0.000 description 9
- 231100000419 toxicity Toxicity 0.000 description 9
- 229920002685 Polyoxyl 35CastorOil Polymers 0.000 description 8
- 239000002253 acid Substances 0.000 description 8
- 125000002252 acyl group Chemical group 0.000 description 8
- 125000003342 alkenyl group Chemical group 0.000 description 8
- 150000001408 amides Chemical class 0.000 description 8
- 239000002246 antineoplastic agent Substances 0.000 description 8
- 239000002585 base Substances 0.000 description 8
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 8
- 201000011510 cancer Diseases 0.000 description 8
- QUANRIQJNFHVEU-UHFFFAOYSA-N oxirane;propane-1,2,3-triol Chemical compound C1CO1.OCC(O)CO QUANRIQJNFHVEU-UHFFFAOYSA-N 0.000 description 8
- 238000003756 stirring Methods 0.000 description 8
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical group [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 7
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 7
- 239000008121 dextrose Substances 0.000 description 7
- 239000002552 dosage form Substances 0.000 description 7
- 125000005842 heteroatom Chemical group 0.000 description 7
- 239000002502 liposome Substances 0.000 description 7
- YNESATAKKCNGOF-UHFFFAOYSA-N lithium bis(trimethylsilyl)amide Chemical compound [Li+].C[Si](C)(C)[N-][Si](C)(C)C YNESATAKKCNGOF-UHFFFAOYSA-N 0.000 description 7
- 229910052757 nitrogen Inorganic materials 0.000 description 7
- 239000013641 positive control Substances 0.000 description 7
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 6
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 6
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 6
- 241000699666 Mus <mouse, genus> Species 0.000 description 6
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 6
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 6
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 6
- 229920002472 Starch Polymers 0.000 description 6
- 125000003545 alkoxy group Chemical group 0.000 description 6
- 125000004429 atom Chemical group 0.000 description 6
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 description 6
- 239000012267 brine Substances 0.000 description 6
- 229910052799 carbon Inorganic materials 0.000 description 6
- 239000000969 carrier Substances 0.000 description 6
- 239000000463 material Substances 0.000 description 6
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 6
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 6
- 125000004434 sulfur atom Chemical group 0.000 description 6
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 6
- 0 CCCC(C)(C)CC(CC1)C1C(C1C(CC2)CC2C(C)(C)C(C)*)C1C(C)(C)C Chemical compound CCCC(C)(C)CC(CC1)C1C(C1C(CC2)CC2C(C)(C)C(C)*)C1C(C)(C)C 0.000 description 5
- 206010011906 Death Diseases 0.000 description 5
- 150000001241 acetals Chemical class 0.000 description 5
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 5
- 150000001412 amines Chemical class 0.000 description 5
- 239000004359 castor oil Substances 0.000 description 5
- 235000019438 castor oil Nutrition 0.000 description 5
- IJOOHPMOJXWVHK-UHFFFAOYSA-N chlorotrimethylsilane Chemical compound C[Si](C)(C)Cl IJOOHPMOJXWVHK-UHFFFAOYSA-N 0.000 description 5
- 239000013078 crystal Substances 0.000 description 5
- 125000004093 cyano group Chemical group *C#N 0.000 description 5
- 229940127089 cytotoxic agent Drugs 0.000 description 5
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 5
- ZEMPKEQAKRGZGQ-XOQCFJPHSA-N glycerol triricinoleate Natural products CCCCCC[C@@H](O)CC=CCCCCCCCC(=O)OC[C@@H](COC(=O)CCCCCCCC=CC[C@@H](O)CCCCCC)OC(=O)CCCCCCCC=CC[C@H](O)CCCCCC ZEMPKEQAKRGZGQ-XOQCFJPHSA-N 0.000 description 5
- 229910052736 halogen Inorganic materials 0.000 description 5
- 150000002367 halogens Chemical group 0.000 description 5
- 125000001072 heteroaryl group Chemical group 0.000 description 5
- 238000004128 high performance liquid chromatography Methods 0.000 description 5
- 150000002430 hydrocarbons Chemical class 0.000 description 5
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 5
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 5
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 5
- 239000000843 powder Substances 0.000 description 5
- 238000002360 preparation method Methods 0.000 description 5
- 239000011541 reaction mixture Substances 0.000 description 5
- 239000007787 solid Substances 0.000 description 5
- 235000012424 soybean oil Nutrition 0.000 description 5
- 239000003549 soybean oil Substances 0.000 description 5
- 235000000346 sugar Nutrition 0.000 description 5
- 230000004083 survival effect Effects 0.000 description 5
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 4
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 4
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 4
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 4
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 4
- 229930194542 Keto Natural products 0.000 description 4
- 229920002690 Polyoxyl 40 HydrogenatedCastorOil Polymers 0.000 description 4
- 235000019485 Safflower oil Nutrition 0.000 description 4
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical compound [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 description 4
- 235000021355 Stearic acid Nutrition 0.000 description 4
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 4
- 229930006000 Sucrose Natural products 0.000 description 4
- 238000002835 absorbance Methods 0.000 description 4
- DHKHKXVYLBGOIT-UHFFFAOYSA-N acetaldehyde Diethyl Acetal Natural products CCOC(C)OCC DHKHKXVYLBGOIT-UHFFFAOYSA-N 0.000 description 4
- 125000004423 acyloxy group Chemical group 0.000 description 4
- 230000002411 adverse Effects 0.000 description 4
- 125000001931 aliphatic group Chemical group 0.000 description 4
- SESFRYSPDFLNCH-UHFFFAOYSA-N benzyl benzoate Chemical compound C=1C=CC=CC=1C(=O)OCC1=CC=CC=C1 SESFRYSPDFLNCH-UHFFFAOYSA-N 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- 150000001721 carbon Chemical group 0.000 description 4
- 150000004665 fatty acids Chemical class 0.000 description 4
- 239000000706 filtrate Substances 0.000 description 4
- 235000011187 glycerol Nutrition 0.000 description 4
- BXWNKGSJHAJOGX-UHFFFAOYSA-N hexadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCO BXWNKGSJHAJOGX-UHFFFAOYSA-N 0.000 description 4
- 229930195733 hydrocarbon Natural products 0.000 description 4
- 239000007788 liquid Substances 0.000 description 4
- ZCSHNCUQKCANBX-UHFFFAOYSA-N lithium diisopropylamide Chemical compound [Li+].CC(C)[N-]C(C)C ZCSHNCUQKCANBX-UHFFFAOYSA-N 0.000 description 4
- 231100000682 maximum tolerated dose Toxicity 0.000 description 4
- 238000012544 monitoring process Methods 0.000 description 4
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 4
- GLDOVTGHNKAZLK-UHFFFAOYSA-N octadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCCCO GLDOVTGHNKAZLK-UHFFFAOYSA-N 0.000 description 4
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 4
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 4
- 229940049964 oleate Drugs 0.000 description 4
- 230000001766 physiological effect Effects 0.000 description 4
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 4
- 238000011084 recovery Methods 0.000 description 4
- 235000005713 safflower oil Nutrition 0.000 description 4
- 239000003813 safflower oil Substances 0.000 description 4
- 229920006395 saturated elastomer Polymers 0.000 description 4
- 239000000741 silica gel Substances 0.000 description 4
- 229910002027 silica gel Inorganic materials 0.000 description 4
- GEHJYWRUCIMESM-UHFFFAOYSA-L sodium sulfite Chemical compound [Na+].[Na+].[O-]S([O-])=O GEHJYWRUCIMESM-UHFFFAOYSA-L 0.000 description 4
- 235000010356 sorbitol Nutrition 0.000 description 4
- 239000000600 sorbitol Substances 0.000 description 4
- 235000019698 starch Nutrition 0.000 description 4
- 239000007858 starting material Substances 0.000 description 4
- 239000008117 stearic acid Substances 0.000 description 4
- 229960004274 stearic acid Drugs 0.000 description 4
- 239000005720 sucrose Substances 0.000 description 4
- 229910052717 sulfur Inorganic materials 0.000 description 4
- 239000003826 tablet Substances 0.000 description 4
- 239000000454 talc Substances 0.000 description 4
- 229910052623 talc Inorganic materials 0.000 description 4
- 229940033134 talc Drugs 0.000 description 4
- 235000012222 talc Nutrition 0.000 description 4
- 150000003573 thiols Chemical class 0.000 description 4
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 4
- 230000001052 transient effect Effects 0.000 description 4
- 230000003442 weekly effect Effects 0.000 description 4
- JIAARYAFYJHUJI-UHFFFAOYSA-L zinc dichloride Chemical compound [Cl-].[Cl-].[Zn+2] JIAARYAFYJHUJI-UHFFFAOYSA-L 0.000 description 4
- ULQISTXYYBZJSJ-UHFFFAOYSA-N 12-hydroxyoctadecanoic acid Chemical compound CCCCCCC(O)CCCCCCCCCCC(O)=O ULQISTXYYBZJSJ-UHFFFAOYSA-N 0.000 description 3
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 description 3
- YOWQWFMSQCOSBA-UHFFFAOYSA-N 2-methoxypropene Chemical compound COC(C)=C YOWQWFMSQCOSBA-UHFFFAOYSA-N 0.000 description 3
- 125000001541 3-thienyl group Chemical group S1C([H])=C([*])C([H])=C1[H] 0.000 description 3
- 244000215068 Acacia senegal Species 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 3
- 229920002261 Corn starch Polymers 0.000 description 3
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 3
- 208000012766 Growth delay Diseases 0.000 description 3
- 229920000084 Gum arabic Polymers 0.000 description 3
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 3
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 3
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 3
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 3
- 239000012980 RPMI-1640 medium Substances 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 235000010489 acacia gum Nutrition 0.000 description 3
- 239000000205 acacia gum Substances 0.000 description 3
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 3
- 150000004703 alkoxides Chemical class 0.000 description 3
- 125000002877 alkyl aryl group Chemical group 0.000 description 3
- MBMBGCFOFBJSGT-KUBAVDMBSA-N all-cis-docosa-4,7,10,13,16,19-hexaenoic acid Chemical compound CC\C=C/C\C=C/C\C=C/C\C=C/C\C=C/C\C=C/CCC(O)=O MBMBGCFOFBJSGT-KUBAVDMBSA-N 0.000 description 3
- DTOSIQBPPRVQHS-PDBXOOCHSA-N alpha-linolenic acid Chemical compound CC\C=C/C\C=C/C\C=C/CCCCCCCC(O)=O DTOSIQBPPRVQHS-PDBXOOCHSA-N 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 238000010171 animal model Methods 0.000 description 3
- 230000001093 anti-cancer Effects 0.000 description 3
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 3
- 125000004104 aryloxy group Chemical group 0.000 description 3
- 239000004305 biphenyl Substances 0.000 description 3
- 235000010290 biphenyl Nutrition 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 239000008120 corn starch Substances 0.000 description 3
- 239000012043 crude product Substances 0.000 description 3
- 125000004122 cyclic group Chemical group 0.000 description 3
- 125000000753 cycloalkyl group Chemical group 0.000 description 3
- ZOOSILUVXHVRJE-UHFFFAOYSA-N cyclopropanecarbonyl chloride Chemical compound ClC(=O)C1CC1 ZOOSILUVXHVRJE-UHFFFAOYSA-N 0.000 description 3
- 238000010511 deprotection reaction Methods 0.000 description 3
- 239000003085 diluting agent Substances 0.000 description 3
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 3
- 239000000945 filler Substances 0.000 description 3
- 239000012065 filter cake Substances 0.000 description 3
- 125000000623 heterocyclic group Chemical group 0.000 description 3
- FFUAGWLWBBFQJT-UHFFFAOYSA-N hexamethyldisilazane Chemical compound C[Si](C)(C)N[Si](C)(C)C FFUAGWLWBBFQJT-UHFFFAOYSA-N 0.000 description 3
- 230000001976 improved effect Effects 0.000 description 3
- 238000000338 in vitro Methods 0.000 description 3
- 239000000543 intermediate Substances 0.000 description 3
- 229940028435 intralipid Drugs 0.000 description 3
- 238000007913 intrathecal administration Methods 0.000 description 3
- 238000010253 intravenous injection Methods 0.000 description 3
- 210000003734 kidney Anatomy 0.000 description 3
- 239000008101 lactose Substances 0.000 description 3
- 210000004072 lung Anatomy 0.000 description 3
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- 230000007246 mechanism Effects 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 208000002154 non-small cell lung carcinoma Diseases 0.000 description 3
- YYZUSRORWSJGET-UHFFFAOYSA-N octanoic acid ethyl ester Natural products CCCCCCCC(=O)OCC YYZUSRORWSJGET-UHFFFAOYSA-N 0.000 description 3
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 3
- 238000005580 one pot reaction Methods 0.000 description 3
- 230000003287 optical effect Effects 0.000 description 3
- 239000012044 organic layer Substances 0.000 description 3
- 125000004430 oxygen atom Chemical group O* 0.000 description 3
- 230000036961 partial effect Effects 0.000 description 3
- 229920001592 potato starch Polymers 0.000 description 3
- 235000018102 proteins Nutrition 0.000 description 3
- 238000001953 recrystallisation Methods 0.000 description 3
- 238000003307 slaughter Methods 0.000 description 3
- 239000002002 slurry Substances 0.000 description 3
- 235000017557 sodium bicarbonate Nutrition 0.000 description 3
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 3
- 239000008107 starch Substances 0.000 description 3
- 150000008163 sugars Chemical class 0.000 description 3
- 239000000725 suspension Substances 0.000 description 3
- 238000003786 synthesis reaction Methods 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- 150000003568 thioethers Chemical class 0.000 description 3
- 231100000820 toxicity test Toxicity 0.000 description 3
- 150000003626 triacylglycerols Chemical class 0.000 description 3
- 125000000026 trimethylsilyl group Chemical group [H]C([H])([H])[Si]([*])(C([H])([H])[H])C([H])([H])[H] 0.000 description 3
- 238000003828 vacuum filtration Methods 0.000 description 3
- PUPZLCDOIYMWBV-UHFFFAOYSA-N (+/-)-1,3-Butanediol Chemical compound CC(O)CCO PUPZLCDOIYMWBV-UHFFFAOYSA-N 0.000 description 2
- JNYAEWCLZODPBN-JGWLITMVSA-N (2r,3r,4s)-2-[(1r)-1,2-dihydroxyethyl]oxolane-3,4-diol Chemical compound OC[C@@H](O)[C@H]1OC[C@H](O)[C@H]1O JNYAEWCLZODPBN-JGWLITMVSA-N 0.000 description 2
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 description 2
- GHOKWGTUZJEAQD-ZETCQYMHSA-N (D)-(+)-Pantothenic acid Chemical compound OCC(C)(C)[C@@H](O)C(=O)NCCC(O)=O GHOKWGTUZJEAQD-ZETCQYMHSA-N 0.000 description 2
- KBPLFHHGFOOTCA-UHFFFAOYSA-N 1-Octanol Chemical compound CCCCCCCCO KBPLFHHGFOOTCA-UHFFFAOYSA-N 0.000 description 2
- FGYADSCZTQOAFK-UHFFFAOYSA-N 1-methylbenzimidazole Chemical compound C1=CC=C2N(C)C=NC2=C1 FGYADSCZTQOAFK-UHFFFAOYSA-N 0.000 description 2
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 2
- SVTBMSDMJJWYQN-UHFFFAOYSA-N 2-methylpentane-2,4-diol Chemical compound CC(O)CC(C)(C)O SVTBMSDMJJWYQN-UHFFFAOYSA-N 0.000 description 2
- OVMSOCFBDVBLFW-VHLOTGQHSA-N 5beta,20-epoxy-1,7beta,13alpha-trihydroxy-9-oxotax-11-ene-2alpha,4alpha,10beta-triyl 4,10-diacetate 2-benzoate Chemical compound O([C@@H]1[C@@]2(C[C@H](O)C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)O)C(=O)C1=CC=CC=C1 OVMSOCFBDVBLFW-VHLOTGQHSA-N 0.000 description 2
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 2
- 101150069931 Abcg2 gene Proteins 0.000 description 2
- 229920001817 Agar Polymers 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- 208000003174 Brain Neoplasms Diseases 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 2
- 229910004664 Cerium(III) chloride Inorganic materials 0.000 description 2
- 206010052360 Colorectal adenocarcinoma Diseases 0.000 description 2
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 2
- SRBFZHDQGSBBOR-IOVATXLUSA-N D-xylopyranose Chemical compound O[C@@H]1COC(O)[C@H](O)[C@H]1O SRBFZHDQGSBBOR-IOVATXLUSA-N 0.000 description 2
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- 239000002841 Lewis acid Substances 0.000 description 2
- 231100000002 MTT assay Toxicity 0.000 description 2
- 238000000134 MTT assay Methods 0.000 description 2
- 229930195725 Mannitol Natural products 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- 108090001099 Multi drug resistance-associated proteins Proteins 0.000 description 2
- 102000004855 Multi drug resistance-associated proteins Human genes 0.000 description 2
- 101000946797 Mus musculus C-C motif chemokine 9 Proteins 0.000 description 2
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 2
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 2
- 101100255593 Neurospora crassa (strain ATCC 24698 / 74-OR23-1A / CBS 708.71 / DSM 1257 / FGSC 987) mrp-9 gene Proteins 0.000 description 2
- 206010029350 Neurotoxicity Diseases 0.000 description 2
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 2
- 235000019483 Peanut oil Nutrition 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 2
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 2
- 208000006265 Renal cell carcinoma Diseases 0.000 description 2
- 208000000453 Skin Neoplasms Diseases 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 2
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 description 2
- 206010044221 Toxic encephalopathy Diseases 0.000 description 2
- 229920001615 Tragacanth Polymers 0.000 description 2
- 239000001089 [(2R)-oxolan-2-yl]methanol Substances 0.000 description 2
- 229960000583 acetic acid Drugs 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- 230000010933 acylation Effects 0.000 description 2
- 238000005917 acylation reaction Methods 0.000 description 2
- 239000002671 adjuvant Substances 0.000 description 2
- 239000008272 agar Substances 0.000 description 2
- 235000010419 agar Nutrition 0.000 description 2
- 238000013019 agitation Methods 0.000 description 2
- 150000001298 alcohols Chemical class 0.000 description 2
- 235000010443 alginic acid Nutrition 0.000 description 2
- 239000000783 alginic acid Substances 0.000 description 2
- 229920000615 alginic acid Polymers 0.000 description 2
- 229960001126 alginic acid Drugs 0.000 description 2
- 150000004781 alginic acids Chemical class 0.000 description 2
- 150000001338 aliphatic hydrocarbons Chemical class 0.000 description 2
- 150000001447 alkali salts Chemical class 0.000 description 2
- 125000006350 alkyl thio alkyl group Chemical group 0.000 description 2
- 235000020661 alpha-linolenic acid Nutrition 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- PYMYPHUHKUWMLA-UHFFFAOYSA-N arabinose Natural products OCC(O)C(O)C(O)C=O PYMYPHUHKUWMLA-UHFFFAOYSA-N 0.000 description 2
- 238000011717 athymic nude mouse Methods 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical group [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- 238000011888 autopsy Methods 0.000 description 2
- 210000003050 axon Anatomy 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- QUKGYYKBILRGFE-UHFFFAOYSA-N benzyl acetate Chemical compound CC(=O)OCC1=CC=CC=C1 QUKGYYKBILRGFE-UHFFFAOYSA-N 0.000 description 2
- 229960002903 benzyl benzoate Drugs 0.000 description 2
- SRBFZHDQGSBBOR-UHFFFAOYSA-N beta-D-Pyranose-Lyxose Natural products OC1COC(O)C(O)C1O SRBFZHDQGSBBOR-UHFFFAOYSA-N 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 210000004556 brain Anatomy 0.000 description 2
- 210000000481 breast Anatomy 0.000 description 2
- 239000001506 calcium phosphate Substances 0.000 description 2
- 229910000389 calcium phosphate Inorganic materials 0.000 description 2
- 235000011010 calcium phosphates Nutrition 0.000 description 2
- 239000001768 carboxy methyl cellulose Substances 0.000 description 2
- 230000003197 catalytic effect Effects 0.000 description 2
- VYLVYHXQOHJDJL-UHFFFAOYSA-K cerium trichloride Chemical compound Cl[Ce](Cl)Cl VYLVYHXQOHJDJL-UHFFFAOYSA-K 0.000 description 2
- 229960000541 cetyl alcohol Drugs 0.000 description 2
- 238000002512 chemotherapy Methods 0.000 description 2
- 239000000460 chlorine Substances 0.000 description 2
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 2
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 2
- 210000001072 colon Anatomy 0.000 description 2
- 229940099112 cornstarch Drugs 0.000 description 2
- 238000010168 coupling process Methods 0.000 description 2
- 230000001472 cytotoxic effect Effects 0.000 description 2
- 231100000135 cytotoxicity Toxicity 0.000 description 2
- 230000003013 cytotoxicity Effects 0.000 description 2
- DIOQZVSQGTUSAI-UHFFFAOYSA-N decane Chemical compound CCCCCCCCCC DIOQZVSQGTUSAI-UHFFFAOYSA-N 0.000 description 2
- GHVNFZFCNZKVNT-UHFFFAOYSA-N decanoic acid Chemical compound CCCCCCCCCC(O)=O GHVNFZFCNZKVNT-UHFFFAOYSA-N 0.000 description 2
- 230000003111 delayed effect Effects 0.000 description 2
- 230000002939 deleterious effect Effects 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 208000035475 disorder Diseases 0.000 description 2
- 235000020669 docosahexaenoic acid Nutrition 0.000 description 2
- POULHZVOKOAJMA-UHFFFAOYSA-N dodecanoic acid Chemical compound CCCCCCCCCCCC(O)=O POULHZVOKOAJMA-UHFFFAOYSA-N 0.000 description 2
- ZQPPMHVWECSIRJ-MDZDMXLPSA-N elaidic acid Chemical compound CCCCCCCC\C=C\CCCCCCCC(O)=O ZQPPMHVWECSIRJ-MDZDMXLPSA-N 0.000 description 2
- 239000008151 electrolyte solution Substances 0.000 description 2
- 238000005886 esterification reaction Methods 0.000 description 2
- 150000002170 ethers Chemical class 0.000 description 2
- LZCLXQDLBQLTDK-UHFFFAOYSA-N ethyl 2-hydroxypropanoate Chemical compound CCOC(=O)C(C)O LZCLXQDLBQLTDK-UHFFFAOYSA-N 0.000 description 2
- MTZQAGJQAFMTAQ-UHFFFAOYSA-N ethyl benzoate Chemical compound CCOC(=O)C1=CC=CC=C1 MTZQAGJQAFMTAQ-UHFFFAOYSA-N 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 125000002541 furyl group Chemical group 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 229940014259 gelatin Drugs 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 230000014509 gene expression Effects 0.000 description 2
- 229940074076 glycerol formal Drugs 0.000 description 2
- 125000005843 halogen group Chemical group 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 150000002390 heteroarenes Chemical class 0.000 description 2
- IPCSVZSSVZVIGE-UHFFFAOYSA-N hexadecanoic acid Chemical compound CCCCCCCCCCCCCCCC(O)=O IPCSVZSSVZVIGE-UHFFFAOYSA-N 0.000 description 2
- ZSIAUFGUXNUGDI-UHFFFAOYSA-N hexan-1-ol Chemical compound CCCCCCO ZSIAUFGUXNUGDI-UHFFFAOYSA-N 0.000 description 2
- 150000002431 hydrogen Chemical class 0.000 description 2
- 125000001041 indolyl group Chemical group 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 238000001361 intraarterial administration Methods 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 238000007912 intraperitoneal administration Methods 0.000 description 2
- SUMDYPCJJOFFON-UHFFFAOYSA-N isethionic acid Chemical compound OCCS(O)(=O)=O SUMDYPCJJOFFON-UHFFFAOYSA-N 0.000 description 2
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 2
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 description 2
- 150000002576 ketones Chemical class 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 230000003902 lesion Effects 0.000 description 2
- 150000007517 lewis acids Chemical class 0.000 description 2
- 229960004488 linolenic acid Drugs 0.000 description 2
- 239000000944 linseed oil Substances 0.000 description 2
- 235000021388 linseed oil Nutrition 0.000 description 2
- 150000002632 lipids Chemical class 0.000 description 2
- 210000004185 liver Anatomy 0.000 description 2
- 231100000053 low toxicity Toxicity 0.000 description 2
- 239000007937 lozenge Substances 0.000 description 2
- RLSSMJSEOOYNOY-UHFFFAOYSA-N m-cresol Chemical compound CC1=CC=CC(O)=C1 RLSSMJSEOOYNOY-UHFFFAOYSA-N 0.000 description 2
- 238000003760 magnetic stirring Methods 0.000 description 2
- 239000000594 mannitol Substances 0.000 description 2
- 235000010355 mannitol Nutrition 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- 125000004184 methoxymethyl group Chemical group [H]C([H])([H])OC([H])([H])* 0.000 description 2
- 229920000609 methyl cellulose Polymers 0.000 description 2
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 2
- 239000001923 methylcellulose Substances 0.000 description 2
- 229960002900 methylcellulose Drugs 0.000 description 2
- 235000010981 methylcellulose Nutrition 0.000 description 2
- 150000007522 mineralic acids Chemical class 0.000 description 2
- 125000002950 monocyclic group Chemical group 0.000 description 2
- GOQYKNQRPGWPLP-UHFFFAOYSA-N n-heptadecyl alcohol Natural products CCCCCCCCCCCCCCCCCO GOQYKNQRPGWPLP-UHFFFAOYSA-N 0.000 description 2
- 125000001624 naphthyl group Chemical group 0.000 description 2
- 230000007135 neurotoxicity Effects 0.000 description 2
- 231100000228 neurotoxicity Toxicity 0.000 description 2
- 239000012299 nitrogen atmosphere Substances 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- WWZKQHOCKIZLMA-UHFFFAOYSA-N octanoic acid Chemical compound CCCCCCCC(O)=O WWZKQHOCKIZLMA-UHFFFAOYSA-N 0.000 description 2
- 150000007524 organic acids Chemical class 0.000 description 2
- 235000005985 organic acids Nutrition 0.000 description 2
- 210000001672 ovary Anatomy 0.000 description 2
- 125000002971 oxazolyl group Chemical group 0.000 description 2
- 229910052760 oxygen Inorganic materials 0.000 description 2
- 239000001301 oxygen Substances 0.000 description 2
- SECPZKHBENQXJG-FPLPWBNLSA-N palmitoleic acid Chemical compound CCCCCC\C=C/CCCCCCCC(O)=O SECPZKHBENQXJG-FPLPWBNLSA-N 0.000 description 2
- 210000000496 pancreas Anatomy 0.000 description 2
- 239000000312 peanut oil Substances 0.000 description 2
- 208000033808 peripheral neuropathy Diseases 0.000 description 2
- WVDDGKGOMKODPV-ZQBYOMGUSA-N phenyl(114C)methanol Chemical compound O[14CH2]C1=CC=CC=C1 WVDDGKGOMKODPV-ZQBYOMGUSA-N 0.000 description 2
- 229910052698 phosphorus Inorganic materials 0.000 description 2
- 239000011574 phosphorus Substances 0.000 description 2
- 239000002798 polar solvent Substances 0.000 description 2
- 229920001983 poloxamer Polymers 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 229940116317 potato starch Drugs 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- RZWZRACFZGVKFM-UHFFFAOYSA-N propanoyl chloride Chemical compound CCC(Cl)=O RZWZRACFZGVKFM-UHFFFAOYSA-N 0.000 description 2
- 125000004076 pyridyl group Chemical group 0.000 description 2
- HNJBEVLQSNELDL-UHFFFAOYSA-N pyrrolidin-2-one Chemical compound O=C1CCCN1 HNJBEVLQSNELDL-UHFFFAOYSA-N 0.000 description 2
- 125000000168 pyrrolyl group Chemical group 0.000 description 2
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 2
- 229940100486 rice starch Drugs 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 229910052938 sodium sulfate Inorganic materials 0.000 description 2
- 235000011152 sodium sulphate Nutrition 0.000 description 2
- 235000010265 sodium sulphite Nutrition 0.000 description 2
- 239000007909 solid dosage form Substances 0.000 description 2
- 238000012453 sprague-dawley rat model Methods 0.000 description 2
- PRAKJMSDJKAYCZ-UHFFFAOYSA-N squalane Chemical compound CC(C)CCCC(C)CCCC(C)CCCCC(C)CCCC(C)CCCC(C)C PRAKJMSDJKAYCZ-UHFFFAOYSA-N 0.000 description 2
- 229940012831 stearyl alcohol Drugs 0.000 description 2
- HXJUTPCZVOIRIF-UHFFFAOYSA-N sulfolane Chemical compound O=S1(=O)CCCC1 HXJUTPCZVOIRIF-UHFFFAOYSA-N 0.000 description 2
- 239000006188 syrup Substances 0.000 description 2
- 235000020357 syrup Nutrition 0.000 description 2
- RCINICONZNJXQF-XAZOAEDWSA-N taxol® Chemical compound O([C@@H]1[C@@]2(CC(C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3(C21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-XAZOAEDWSA-N 0.000 description 2
- 229940063683 taxotere Drugs 0.000 description 2
- BSYVTEYKTMYBMK-UHFFFAOYSA-N tetrahydrofurfuryl alcohol Chemical compound OCC1CCCO1 BSYVTEYKTMYBMK-UHFFFAOYSA-N 0.000 description 2
- ISXOBTBCNRIIQO-UHFFFAOYSA-N tetrahydrothiophene 1-oxide Chemical compound O=S1CCCC1 ISXOBTBCNRIIQO-UHFFFAOYSA-N 0.000 description 2
- WGTYBPLFGIVFAS-UHFFFAOYSA-M tetramethylammonium hydroxide Chemical compound [OH-].C[N+](C)(C)C WGTYBPLFGIVFAS-UHFFFAOYSA-M 0.000 description 2
- 231100001274 therapeutic index Toxicity 0.000 description 2
- 230000004797 therapeutic response Effects 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 238000002054 transplantation Methods 0.000 description 2
- URAYPUMNDPQOKB-UHFFFAOYSA-N triacetin Chemical compound CC(=O)OCC(OC(C)=O)COC(C)=O URAYPUMNDPQOKB-UHFFFAOYSA-N 0.000 description 2
- 125000004665 trialkylsilyl group Chemical group 0.000 description 2
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 2
- DCXXMTOCNZCJGO-UHFFFAOYSA-N tristearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(OC(=O)CCCCCCCCCCCCCCCCC)COC(=O)CCCCCCCCCCCCCCCCC DCXXMTOCNZCJGO-UHFFFAOYSA-N 0.000 description 2
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 description 2
- 229940100445 wheat starch Drugs 0.000 description 2
- 239000011592 zinc chloride Substances 0.000 description 2
- 235000005074 zinc chloride Nutrition 0.000 description 2
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 1
- FTLYMKDSHNWQKD-UHFFFAOYSA-N (2,4,5-trichlorophenyl)boronic acid Chemical compound OB(O)C1=CC(Cl)=C(Cl)C=C1Cl FTLYMKDSHNWQKD-UHFFFAOYSA-N 0.000 description 1
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 1
- WJTCHBVEUFDSIK-NWDGAFQWSA-N (2r,5s)-1-benzyl-2,5-dimethylpiperazine Chemical compound C[C@@H]1CN[C@@H](C)CN1CC1=CC=CC=C1 WJTCHBVEUFDSIK-NWDGAFQWSA-N 0.000 description 1
- MEJYDZQQVZJMPP-ULAWRXDQSA-N (3s,3ar,6r,6ar)-3,6-dimethoxy-2,3,3a,5,6,6a-hexahydrofuro[3,2-b]furan Chemical compound CO[C@H]1CO[C@@H]2[C@H](OC)CO[C@@H]21 MEJYDZQQVZJMPP-ULAWRXDQSA-N 0.000 description 1
- YUFFSWGQGVEMMI-JLNKQSITSA-N (7Z,10Z,13Z,16Z,19Z)-docosapentaenoic acid Chemical compound CC\C=C/C\C=C/C\C=C/C\C=C/C\C=C/CCCCCC(O)=O YUFFSWGQGVEMMI-JLNKQSITSA-N 0.000 description 1
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 1
- MIOPJNTWMNEORI-GMSGAONNSA-N (S)-camphorsulfonic acid Chemical compound C1C[C@@]2(CS(O)(=O)=O)C(=O)C[C@@H]1C2(C)C MIOPJNTWMNEORI-GMSGAONNSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- FCZGHPGTZRTDNN-UHFFFAOYSA-N 1,2-bis(trimethylsilyloxy)ethenoxy-trimethylsilane Chemical group C[Si](C)(C)OC=C(O[Si](C)(C)C)O[Si](C)(C)C FCZGHPGTZRTDNN-UHFFFAOYSA-N 0.000 description 1
- 229940058015 1,3-butylene glycol Drugs 0.000 description 1
- LDVVTQMJQSCDMK-UHFFFAOYSA-N 1,3-dihydroxypropan-2-yl formate Chemical compound OCC(CO)OC=O LDVVTQMJQSCDMK-UHFFFAOYSA-N 0.000 description 1
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 description 1
- JKAAHFHXTOGATB-KBPBESRZSA-N 1-o-tert-butyl 2-o-[(2s)-1-[(2-methylpropan-2-yl)oxycarbonyl]pyrrolidine-2-carbonyl] (2s)-pyrrolidine-1,2-dicarboxylate Chemical compound CC(C)(C)OC(=O)N1CCC[C@H]1C(=O)OC(=O)[C@H]1N(C(=O)OC(C)(C)C)CCC1 JKAAHFHXTOGATB-KBPBESRZSA-N 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- YWLXLRUDGLRYDR-SKXCCXORSA-N 10-dab iii Chemical compound O([C@H]1C2[C@@](C([C@H](O)C3=C(C)[C@@H](O)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 YWLXLRUDGLRYDR-SKXCCXORSA-N 0.000 description 1
- 125000003241 10-deacetylbaccatin III group Chemical group 0.000 description 1
- OWEGMIWEEQEYGQ-UHFFFAOYSA-N 100676-05-9 Natural products OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OC2C(OC(O)C(O)C2O)CO)O1 OWEGMIWEEQEYGQ-UHFFFAOYSA-N 0.000 description 1
- 229940114072 12-hydroxystearic acid Drugs 0.000 description 1
- ZEPAXLPHESYSJU-UHFFFAOYSA-N 2,3,4,5,6,7,8-heptahydroxyoctanal Chemical compound OCC(O)C(O)C(O)C(O)C(O)C(O)C=O ZEPAXLPHESYSJU-UHFFFAOYSA-N 0.000 description 1
- KMZHZAAOEWVPSE-UHFFFAOYSA-N 2,3-dihydroxypropyl acetate Chemical compound CC(=O)OCC(O)CO KMZHZAAOEWVPSE-UHFFFAOYSA-N 0.000 description 1
- CTPDSKVQLSDPLC-UHFFFAOYSA-N 2-(oxolan-2-ylmethoxy)ethanol Chemical compound OCCOCC1CCCO1 CTPDSKVQLSDPLC-UHFFFAOYSA-N 0.000 description 1
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 1
- LBLYYCQCTBFVLH-UHFFFAOYSA-N 2-Methylbenzenesulfonic acid Chemical compound CC1=CC=CC=C1S(O)(=O)=O LBLYYCQCTBFVLH-UHFFFAOYSA-N 0.000 description 1
- SPCKHVPPRJWQRZ-UHFFFAOYSA-N 2-benzhydryloxy-n,n-dimethylethanamine;2-hydroxypropane-1,2,3-tricarboxylic acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.C=1C=CC=CC=1C(OCCN(C)C)C1=CC=CC=C1 SPCKHVPPRJWQRZ-UHFFFAOYSA-N 0.000 description 1
- MSXVEPNJUHWQHW-UHFFFAOYSA-N 2-methylbutan-2-ol Chemical compound CCC(C)(C)O MSXVEPNJUHWQHW-UHFFFAOYSA-N 0.000 description 1
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 1
- AZKSAVLVSZKNRD-UHFFFAOYSA-M 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide Chemical compound [Br-].S1C(C)=C(C)N=C1[N+]1=NC(C=2C=CC=CC=2)=NN1C1=CC=CC=C1 AZKSAVLVSZKNRD-UHFFFAOYSA-M 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- ULGRIBRMHUOCDT-UHFFFAOYSA-N 4-(2,3-dihydroxypropoxy)-2,3-dihydroxy-4-oxobutanoic acid Chemical compound OCC(O)COC(=O)C(O)C(O)C(O)=O ULGRIBRMHUOCDT-UHFFFAOYSA-N 0.000 description 1
- HMNVFLLOGIZHSI-UHFFFAOYSA-N 4-(2,3-dihydroxypropoxy)-2-[2-(2,3-dihydroxypropoxy)-2-oxoethyl]-2-hydroxy-4-oxobutanoic acid Chemical compound OCC(O)COC(=O)CC(O)(C(O)=O)CC(=O)OCC(O)CO HMNVFLLOGIZHSI-UHFFFAOYSA-N 0.000 description 1
- HIQIXEFWDLTDED-UHFFFAOYSA-N 4-hydroxy-1-piperidin-4-ylpyrrolidin-2-one Chemical compound O=C1CC(O)CN1C1CCNCC1 HIQIXEFWDLTDED-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 1
- 208000030507 AIDS Diseases 0.000 description 1
- 102000005416 ATP-Binding Cassette Transporters Human genes 0.000 description 1
- 239000005995 Aluminium silicate Substances 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 241000416162 Astragalus gummifer Species 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-M Bicarbonate Chemical compound OC([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-M 0.000 description 1
- ZOXJGFHDIHLPTG-UHFFFAOYSA-N Boron Chemical compound [B] ZOXJGFHDIHLPTG-UHFFFAOYSA-N 0.000 description 1
- 241000167854 Bourreria succulenta Species 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- DPUOLQHDNGRHBS-UHFFFAOYSA-N Brassidinsaeure Natural products CCCCCCCCC=CCCCCCCCCCCCC(O)=O DPUOLQHDNGRHBS-UHFFFAOYSA-N 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- 102100037904 CD9 antigen Human genes 0.000 description 1
- 239000005632 Capric acid (CAS 334-48-5) Substances 0.000 description 1
- 239000005635 Caprylic acid (CAS 124-07-2) Substances 0.000 description 1
- 239000004215 Carbon black (E152) Substances 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- GHOKWGTUZJEAQD-UHFFFAOYSA-N Chick antidermatitis factor Natural products OCC(C)(C)C(O)C(=O)NCCC(O)=O GHOKWGTUZJEAQD-UHFFFAOYSA-N 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 229910021591 Copper(I) chloride Inorganic materials 0.000 description 1
- 229920002785 Croscarmellose sodium Polymers 0.000 description 1
- 235000019750 Crude protein Nutrition 0.000 description 1
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 1
- HMFHBZSHGGEWLO-SOOFDHNKSA-N D-ribofuranose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H]1O HMFHBZSHGGEWLO-SOOFDHNKSA-N 0.000 description 1
- ZAQJHHRNXZUBTE-NQXXGFSBSA-N D-ribulose Chemical compound OC[C@@H](O)[C@@H](O)C(=O)CO ZAQJHHRNXZUBTE-NQXXGFSBSA-N 0.000 description 1
- ZAQJHHRNXZUBTE-UHFFFAOYSA-N D-threo-2-Pentulose Natural products OCC(O)C(O)C(=O)CO ZAQJHHRNXZUBTE-UHFFFAOYSA-N 0.000 description 1
- ZAQJHHRNXZUBTE-WUJLRWPWSA-N D-xylulose Chemical compound OC[C@@H](O)[C@H](O)C(=O)CO ZAQJHHRNXZUBTE-WUJLRWPWSA-N 0.000 description 1
- XMSXQFUHVRWGNA-UHFFFAOYSA-N Decamethylcyclopentasiloxane Chemical compound C[Si]1(C)O[Si](C)(C)O[Si](C)(C)O[Si](C)(C)O[Si](C)(C)O1 XMSXQFUHVRWGNA-UHFFFAOYSA-N 0.000 description 1
- 102100037101 Deoxycytidylate deaminase Human genes 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 235000021294 Docosapentaenoic acid Nutrition 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- URXZXNYJPAJJOQ-UHFFFAOYSA-N Erucic acid Natural products CCCCCCC=CCCCCCCCCCCCC(O)=O URXZXNYJPAJJOQ-UHFFFAOYSA-N 0.000 description 1
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 1
- 239000005977 Ethylene Substances 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- 206010015548 Euthanasia Diseases 0.000 description 1
- 239000004606 Fillers/Extenders Substances 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- 229930091371 Fructose Natural products 0.000 description 1
- 239000005715 Fructose Substances 0.000 description 1
- RFSUNEUAIZKAJO-ARQDHWQXSA-N Fructose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-ARQDHWQXSA-N 0.000 description 1
- 230000037059 G2/M phase arrest Effects 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 239000004348 Glyceryl diacetate Substances 0.000 description 1
- 206010053759 Growth retardation Diseases 0.000 description 1
- 229920002907 Guar gum Polymers 0.000 description 1
- 101000656751 Haloarcula marismortui (strain ATCC 43049 / DSM 3752 / JCM 8966 / VKM B-1809) 30S ribosomal protein S24e Proteins 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000955042 Homo sapiens Deoxycytidylate deaminase Proteins 0.000 description 1
- SHBUUTHKGIVMJT-UHFFFAOYSA-N Hydroxystearate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OO SHBUUTHKGIVMJT-UHFFFAOYSA-N 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 208000007766 Kaposi sarcoma Diseases 0.000 description 1
- LKDRXBCSQODPBY-AMVSKUEXSA-N L-(-)-Sorbose Chemical compound OCC1(O)OC[C@H](O)[C@@H](O)[C@@H]1O LKDRXBCSQODPBY-AMVSKUEXSA-N 0.000 description 1
- AHLPHDHHMVZTML-BYPYZUCNSA-N L-Ornithine Chemical compound NCCC[C@H](N)C(O)=O AHLPHDHHMVZTML-BYPYZUCNSA-N 0.000 description 1
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- 239000005639 Lauric acid Substances 0.000 description 1
- 239000004367 Lipase Substances 0.000 description 1
- 102000004882 Lipase Human genes 0.000 description 1
- 108090001060 Lipase Proteins 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- GUBGYTABKSRVRQ-PICCSMPSSA-N Maltose Natural products O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-PICCSMPSSA-N 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- NTIZESTWPVYFNL-UHFFFAOYSA-N Methyl isobutyl ketone Chemical compound CC(C)CC(C)=O NTIZESTWPVYFNL-UHFFFAOYSA-N 0.000 description 1
- UIHCLUNTQKBZGK-UHFFFAOYSA-N Methyl isobutyl ketone Natural products CCC(C)C(C)=O UIHCLUNTQKBZGK-UHFFFAOYSA-N 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- VQENOYXMFIFHCY-UHFFFAOYSA-N Monoglyceride citrate Chemical compound OCC(O)COC(=O)CC(O)(C(O)=O)CC(O)=O VQENOYXMFIFHCY-UHFFFAOYSA-N 0.000 description 1
- WHNWPMSKXPGLAX-UHFFFAOYSA-N N-Vinyl-2-pyrrolidone Chemical compound C=CN1CCCC1=O WHNWPMSKXPGLAX-UHFFFAOYSA-N 0.000 description 1
- 206010029098 Neoplasm skin Diseases 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- 239000005642 Oleic acid Substances 0.000 description 1
- 108010038807 Oligopeptides Proteins 0.000 description 1
- 102000015636 Oligopeptides Human genes 0.000 description 1
- AHLPHDHHMVZTML-UHFFFAOYSA-N Orn-delta-NH2 Natural products NCCCC(N)C(O)=O AHLPHDHHMVZTML-UHFFFAOYSA-N 0.000 description 1
- UTJLXEIPEHZYQJ-UHFFFAOYSA-N Ornithine Natural products OC(=O)C(C)CCCN UTJLXEIPEHZYQJ-UHFFFAOYSA-N 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 235000019482 Palm oil Nutrition 0.000 description 1
- 235000021314 Palmitic acid Nutrition 0.000 description 1
- 235000021319 Palmitoleic acid Nutrition 0.000 description 1
- 206010034133 Pathogen resistance Diseases 0.000 description 1
- 241000283222 Physeter catodon Species 0.000 description 1
- 206010035603 Pleural mesothelioma Diseases 0.000 description 1
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 1
- 108010020346 Polyglutamic Acid Proteins 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 1
- 206010060862 Prostate cancer Diseases 0.000 description 1
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 1
- 108010029485 Protein Isoforms Proteins 0.000 description 1
- 102000001708 Protein Isoforms Human genes 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- 235000019484 Rapeseed oil Nutrition 0.000 description 1
- 241000220010 Rhode Species 0.000 description 1
- PYMYPHUHKUWMLA-LMVFSUKVSA-N Ribose Natural products OC[C@@H](O)[C@@H](O)[C@@H](O)C=O PYMYPHUHKUWMLA-LMVFSUKVSA-N 0.000 description 1
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 1
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- BCKXLBQYZLBQEK-KVVVOXFISA-M Sodium oleate Chemical compound [Na+].CCCCCCCC\C=C/CCCCCCCC([O-])=O BCKXLBQYZLBQEK-KVVVOXFISA-M 0.000 description 1
- 229920002125 Sokalan® Polymers 0.000 description 1
- HVUMOYIDDBPOLL-XWVZOOPGSA-N Sorbitan monostearate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC[C@@H](O)[C@H]1OC[C@H](O)[C@H]1O HVUMOYIDDBPOLL-XWVZOOPGSA-N 0.000 description 1
- 208000005718 Stomach Neoplasms Diseases 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- 229910021627 Tin(IV) chloride Inorganic materials 0.000 description 1
- AOBORMOPSGHCAX-UHFFFAOYSA-N Tocophersolan Chemical compound OCCOC(=O)CCC(=O)OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C AOBORMOPSGHCAX-UHFFFAOYSA-N 0.000 description 1
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 1
- GSEJCLTVZPLZKY-UHFFFAOYSA-N Triethanolamine Chemical compound OCCN(CCO)CCO GSEJCLTVZPLZKY-UHFFFAOYSA-N 0.000 description 1
- 102000004243 Tubulin Human genes 0.000 description 1
- 108090000704 Tubulin Proteins 0.000 description 1
- 239000004164 Wax ester Substances 0.000 description 1
- 240000008042 Zea mays Species 0.000 description 1
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 1
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 231100000230 acceptable toxicity Toxicity 0.000 description 1
- 150000001242 acetic acid derivatives Chemical class 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 239000003463 adsorbent Substances 0.000 description 1
- 238000012382 advanced drug delivery Methods 0.000 description 1
- 125000002723 alicyclic group Chemical group 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 125000004183 alkoxy alkyl group Chemical group 0.000 description 1
- 150000005215 alkyl ethers Chemical class 0.000 description 1
- 125000002947 alkylene group Chemical group 0.000 description 1
- 125000005529 alkyleneoxy group Chemical group 0.000 description 1
- JAZBEHYOTPTENJ-JLNKQSITSA-N all-cis-5,8,11,14,17-icosapentaenoic acid Chemical compound CC\C=C/C\C=C/C\C=C/C\C=C/C\C=C/CCCC(O)=O JAZBEHYOTPTENJ-JLNKQSITSA-N 0.000 description 1
- 230000000172 allergic effect Effects 0.000 description 1
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 1
- HMFHBZSHGGEWLO-UHFFFAOYSA-N alpha-D-Furanose-Ribose Natural products OCC1OC(O)C(O)C1O HMFHBZSHGGEWLO-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-PHYPRBDBSA-N alpha-D-galactose Chemical compound OC[C@H]1O[C@H](O)[C@H](O)[C@@H](O)[C@H]1O WQZGKKKJIJFFOK-PHYPRBDBSA-N 0.000 description 1
- SRBFZHDQGSBBOR-STGXQOJASA-N alpha-D-lyxopyranose Chemical compound O[C@@H]1CO[C@H](O)[C@@H](O)[C@H]1O SRBFZHDQGSBBOR-STGXQOJASA-N 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 235000012211 aluminium silicate Nutrition 0.000 description 1
- 125000003368 amide group Chemical group 0.000 description 1
- 235000001014 amino acid Nutrition 0.000 description 1
- 150000001413 amino acids Chemical group 0.000 description 1
- GOPDFXUMARJJEA-UHFFFAOYSA-N amino(nitro)azanide Chemical compound N[N-][N+]([O-])=O GOPDFXUMARJJEA-UHFFFAOYSA-N 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 238000000540 analysis of variance Methods 0.000 description 1
- 150000008064 anhydrides Chemical group 0.000 description 1
- 239000010775 animal oil Substances 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000003527 anti-angiogenesis Effects 0.000 description 1
- 230000001772 anti-angiogenic effect Effects 0.000 description 1
- 230000001028 anti-proliverative effect Effects 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- 230000009925 apoptotic mechanism Effects 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 239000010477 apricot oil Substances 0.000 description 1
- 239000003125 aqueous solvent Substances 0.000 description 1
- PYMYPHUHKUWMLA-WDCZJNDASA-N arabinose Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)C=O PYMYPHUHKUWMLA-WDCZJNDASA-N 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 229960003121 arginine Drugs 0.000 description 1
- 229910052785 arsenic Inorganic materials 0.000 description 1
- 150000008378 aryl ethers Chemical class 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 239000000305 astragalus gummifer gum Substances 0.000 description 1
- 208000010668 atopic eczema Diseases 0.000 description 1
- 150000008305 azaarenes Chemical class 0.000 description 1
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 1
- 229930014667 baccatin III Natural products 0.000 description 1
- OGBUMNBNEWYMNJ-UHFFFAOYSA-N batilol Chemical class CCCCCCCCCCCCCCCCCCOCC(O)CO OGBUMNBNEWYMNJ-UHFFFAOYSA-N 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- UPABQMWFWCMOFV-UHFFFAOYSA-N benethamine Chemical compound C=1C=CC=CC=1CNCCC1=CC=CC=C1 UPABQMWFWCMOFV-UHFFFAOYSA-N 0.000 description 1
- 239000000440 bentonite Substances 0.000 description 1
- 229910000278 bentonite Inorganic materials 0.000 description 1
- SVPXDRXYRYOSEX-UHFFFAOYSA-N bentoquatam Chemical compound O.O=[Si]=O.O=[Al]O[Al]=O SVPXDRXYRYOSEX-UHFFFAOYSA-N 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 229960004365 benzoic acid Drugs 0.000 description 1
- 229940007550 benzyl acetate Drugs 0.000 description 1
- GUBGYTABKSRVRQ-QUYVBRFLSA-N beta-maltose Chemical compound OC[C@H]1O[C@H](O[C@H]2[C@H](O)[C@@H](O)[C@H](O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@@H]1O GUBGYTABKSRVRQ-QUYVBRFLSA-N 0.000 description 1
- 125000002619 bicyclic group Chemical group 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 125000006267 biphenyl group Chemical group 0.000 description 1
- UBSLUAKFONPTMY-UHFFFAOYSA-N bis(2,3-dihydroxypropyl) 2,3-dihydroxybutanedioate Chemical compound OCC(O)COC(=O)C(O)C(O)C(=O)OCC(O)CO UBSLUAKFONPTMY-UHFFFAOYSA-N 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000001772 blood platelet Anatomy 0.000 description 1
- 229910052796 boron Inorganic materials 0.000 description 1
- MOOAHMCRPCTRLV-UHFFFAOYSA-N boron sodium Chemical compound [B].[Na] MOOAHMCRPCTRLV-UHFFFAOYSA-N 0.000 description 1
- 210000000133 brain stem Anatomy 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- 239000006172 buffering agent Substances 0.000 description 1
- 244000309464 bull Species 0.000 description 1
- 235000019437 butane-1,3-diol Nutrition 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 125000004369 butenyl group Chemical group C(=CCC)* 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000000480 butynyl group Chemical group [*]C#CC([H])([H])C([H])([H])[H] 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- 235000010216 calcium carbonate Nutrition 0.000 description 1
- BRPQOXSCLDDYGP-UHFFFAOYSA-N calcium oxide Chemical compound [O-2].[Ca+2] BRPQOXSCLDDYGP-UHFFFAOYSA-N 0.000 description 1
- 239000000292 calcium oxide Substances 0.000 description 1
- ODINCKMPIJJUCX-UHFFFAOYSA-N calcium oxide Inorganic materials [Ca]=O ODINCKMPIJJUCX-UHFFFAOYSA-N 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 208000035269 cancer or benign tumor Diseases 0.000 description 1
- 239000007894 caplet Substances 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 229910002091 carbon monoxide Inorganic materials 0.000 description 1
- 229960004562 carboplatin Drugs 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- 125000002057 carboxymethyl group Chemical group [H]OC(=O)C([H])([H])[*] 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 239000006285 cell suspension Substances 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 235000010980 cellulose Nutrition 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 239000003638 chemical reducing agent Substances 0.000 description 1
- 235000020426 cherry syrup Nutrition 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- FZFAMSAMCHXGEF-UHFFFAOYSA-N chloro formate Chemical compound ClOC=O FZFAMSAMCHXGEF-UHFFFAOYSA-N 0.000 description 1
- 229960004926 chlorobutanol Drugs 0.000 description 1
- VDANGULDQQJODZ-UHFFFAOYSA-N chloroprocaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1Cl VDANGULDQQJODZ-UHFFFAOYSA-N 0.000 description 1
- 229960002023 chloroprocaine Drugs 0.000 description 1
- 235000012000 cholesterol Nutrition 0.000 description 1
- OEYIOHPDSNJKLS-UHFFFAOYSA-N choline Chemical compound C[N+](C)(C)CCO OEYIOHPDSNJKLS-UHFFFAOYSA-N 0.000 description 1
- 229960001231 choline Drugs 0.000 description 1
- 229940114081 cinnamate Drugs 0.000 description 1
- SECPZKHBENQXJG-UHFFFAOYSA-N cis-palmitoleic acid Natural products CCCCCCC=CCCCCCCCC(O)=O SECPZKHBENQXJG-UHFFFAOYSA-N 0.000 description 1
- 239000004927 clay Substances 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 239000003240 coconut oil Substances 0.000 description 1
- 235000019864 coconut oil Nutrition 0.000 description 1
- 235000012716 cod liver oil Nutrition 0.000 description 1
- 239000003026 cod liver oil Substances 0.000 description 1
- 229940075614 colloidal silicon dioxide Drugs 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 239000007859 condensation product Substances 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- OXBLHERUFWYNTN-UHFFFAOYSA-M copper(I) chloride Chemical compound [Cu]Cl OXBLHERUFWYNTN-UHFFFAOYSA-M 0.000 description 1
- 235000005822 corn Nutrition 0.000 description 1
- 235000005687 corn oil Nutrition 0.000 description 1
- 239000002285 corn oil Substances 0.000 description 1
- 235000012343 cottonseed oil Nutrition 0.000 description 1
- 239000002385 cottonseed oil Substances 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 239000007819 coupling partner Substances 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 229960001681 croscarmellose sodium Drugs 0.000 description 1
- 229960000913 crospovidone Drugs 0.000 description 1
- 235000010947 crosslinked sodium carboxy methyl cellulose Nutrition 0.000 description 1
- 235000019784 crude fat Nutrition 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 229940045803 cuprous chloride Drugs 0.000 description 1
- 150000004292 cyclic ethers Chemical class 0.000 description 1
- ZKYCXEXMLXHNJY-UHFFFAOYSA-N cyclobutyloxycarbamic acid Chemical compound OC(=O)NOC1CCC1 ZKYCXEXMLXHNJY-UHFFFAOYSA-N 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 229940086555 cyclomethicone Drugs 0.000 description 1
- XCIXKGXIYUWCLL-UHFFFAOYSA-N cyclopentanol Chemical compound OC1CCCC1 XCIXKGXIYUWCLL-UHFFFAOYSA-N 0.000 description 1
- ZFQCRLNKHHXELH-UHFFFAOYSA-N cyclopentyl carbonochloridate Chemical compound ClC(=O)OC1CCCC1 ZFQCRLNKHHXELH-UHFFFAOYSA-N 0.000 description 1
- QLBKLJFKEUBMGH-UHFFFAOYSA-N cyclopentyl formate Chemical compound O=COC1CCCC1 QLBKLJFKEUBMGH-UHFFFAOYSA-N 0.000 description 1
- 230000003412 degenerative effect Effects 0.000 description 1
- 238000005828 desilylation reaction Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 1
- 229960003957 dexamethasone Drugs 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- 229940043237 diethanolamine Drugs 0.000 description 1
- HPNMFZURTQLUMO-UHFFFAOYSA-N diethylamine Chemical compound CCNCC HPNMFZURTQLUMO-UHFFFAOYSA-N 0.000 description 1
- MTHSVFCYNBDYFN-UHFFFAOYSA-N diethylene glycol Chemical compound OCCOCCO MTHSVFCYNBDYFN-UHFFFAOYSA-N 0.000 description 1
- XXJWXESWEXIICW-UHFFFAOYSA-N diethylene glycol monoethyl ether Chemical compound CCOCCOCCO XXJWXESWEXIICW-UHFFFAOYSA-N 0.000 description 1
- 229940075557 diethylene glycol monoethyl ether Drugs 0.000 description 1
- 229940105990 diglycerin Drugs 0.000 description 1
- GPLRAVKSCUXZTP-UHFFFAOYSA-N diglycerol Chemical compound OCC(O)COCC(O)CO GPLRAVKSCUXZTP-UHFFFAOYSA-N 0.000 description 1
- UGMCXQCYOVCMTB-UHFFFAOYSA-K dihydroxy(stearato)aluminium Chemical compound CCCCCCCCCCCCCCCCCC(=O)O[Al](O)O UGMCXQCYOVCMTB-UHFFFAOYSA-K 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 229960001760 dimethyl sulfoxide Drugs 0.000 description 1
- 150000004862 dioxolanes Chemical class 0.000 description 1
- 229960000520 diphenhydramine Drugs 0.000 description 1
- 230000008034 disappearance Effects 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 229940090949 docosahexaenoic acid Drugs 0.000 description 1
- LQZZUXJYWNFBMV-UHFFFAOYSA-N dodecan-1-ol Chemical compound CCCCCCCCCCCCO LQZZUXJYWNFBMV-UHFFFAOYSA-N 0.000 description 1
- SNRUBQQJIBEYMU-UHFFFAOYSA-N dodecane Chemical compound CCCCCCCCCCCC SNRUBQQJIBEYMU-UHFFFAOYSA-N 0.000 description 1
- 229960004679 doxorubicin Drugs 0.000 description 1
- 239000008298 dragée Substances 0.000 description 1
- 238000012377 drug delivery Methods 0.000 description 1
- 238000009510 drug design Methods 0.000 description 1
- 238000009509 drug development Methods 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- BOXVSFHSLKQLNZ-UHFFFAOYSA-K dysprosium(iii) chloride Chemical compound Cl[Dy](Cl)Cl BOXVSFHSLKQLNZ-UHFFFAOYSA-K 0.000 description 1
- 235000020673 eicosapentaenoic acid Nutrition 0.000 description 1
- 229960005135 eicosapentaenoic acid Drugs 0.000 description 1
- JAZBEHYOTPTENJ-UHFFFAOYSA-N eicosapentaenoic acid Natural products CCC=CCC=CCC=CCC=CCC=CCCCC(O)=O JAZBEHYOTPTENJ-UHFFFAOYSA-N 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- DPUOLQHDNGRHBS-KTKRTIGZSA-N erucic acid Chemical compound CCCCCCCC\C=C/CCCCCCCCCCCC(O)=O DPUOLQHDNGRHBS-KTKRTIGZSA-N 0.000 description 1
- 230000032050 esterification Effects 0.000 description 1
- BEFDCLMNVWHSGT-UHFFFAOYSA-N ethenylcyclopentane Chemical compound C=CC1CCCC1 BEFDCLMNVWHSGT-UHFFFAOYSA-N 0.000 description 1
- 229940116333 ethyl lactate Drugs 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 239000004403 ethyl p-hydroxybenzoate Substances 0.000 description 1
- 235000010228 ethyl p-hydroxybenzoate Nutrition 0.000 description 1
- 229940043351 ethyl-p-hydroxybenzoate Drugs 0.000 description 1
- 229940012017 ethylenediamine Drugs 0.000 description 1
- NUVBSKCKDOMJSU-UHFFFAOYSA-N ethylparaben Chemical compound CCOC(=O)C1=CC=C(O)C=C1 NUVBSKCKDOMJSU-UHFFFAOYSA-N 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- 238000001704 evaporation Methods 0.000 description 1
- 230000008020 evaporation Effects 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 239000004744 fabric Substances 0.000 description 1
- 150000002191 fatty alcohols Chemical class 0.000 description 1
- 231100000755 favorable toxicity profile Toxicity 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 239000012894 fetal calf serum Substances 0.000 description 1
- 239000000835 fiber Substances 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- 235000021323 fish oil Nutrition 0.000 description 1
- 238000003818 flash chromatography Methods 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 239000006260 foam Substances 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- CNUDBTRUORMMPA-UHFFFAOYSA-N formylthiophene Chemical compound O=CC1=CC=CS1 CNUDBTRUORMMPA-UHFFFAOYSA-N 0.000 description 1
- 239000012634 fragment Substances 0.000 description 1
- 238000007710 freezing Methods 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 229930182830 galactose Natural products 0.000 description 1
- 206010017758 gastric cancer Diseases 0.000 description 1
- 239000007897 gelcap Substances 0.000 description 1
- 229960005277 gemcitabine Drugs 0.000 description 1
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 125000005456 glyceride group Chemical group 0.000 description 1
- 150000002314 glycerols Chemical class 0.000 description 1
- 235000019443 glyceryl diacetate Nutrition 0.000 description 1
- 229940075507 glyceryl monostearate Drugs 0.000 description 1
- 239000001087 glyceryl triacetate Substances 0.000 description 1
- 235000013773 glyceryl triacetate Nutrition 0.000 description 1
- 125000003827 glycol group Chemical group 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- 150000002337 glycosamines Chemical class 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 235000010417 guar gum Nutrition 0.000 description 1
- 239000000665 guar gum Substances 0.000 description 1
- 229960002154 guar gum Drugs 0.000 description 1
- 150000004820 halides Chemical class 0.000 description 1
- 230000035876 healing Effects 0.000 description 1
- 150000002386 heptoses Chemical class 0.000 description 1
- 125000006038 hexenyl group Chemical group 0.000 description 1
- 150000002402 hexoses Chemical class 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 229940051250 hexylene glycol Drugs 0.000 description 1
- 125000005980 hexynyl group Chemical group 0.000 description 1
- 229960000443 hydrochloric acid Drugs 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 1
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 1
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 1
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 1
- 229940072106 hydroxystearate Drugs 0.000 description 1
- 238000005286 illumination Methods 0.000 description 1
- 238000002513 implantation Methods 0.000 description 1
- 125000003392 indanyl group Chemical group C1(CCC2=CC=CC=C12)* 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- 230000009545 invasion Effects 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- UWKQSNNFCGGAFS-XIFFEERXSA-N irinotecan Chemical compound C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 UWKQSNNFCGGAFS-XIFFEERXSA-N 0.000 description 1
- 229960004768 irinotecan Drugs 0.000 description 1
- 229940045996 isethionic acid Drugs 0.000 description 1
- 125000000555 isopropenyl group Chemical group [H]\C([H])=C(\*)C([H])([H])[H] 0.000 description 1
- 125000003253 isopropoxy group Chemical group [H]C([H])([H])C([H])(O*)C([H])([H])[H] 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- NLYAJNPCOHFWQQ-UHFFFAOYSA-N kaolin Chemical compound O.O.O=[Al]O[Si](=O)O[Si](=O)O[Al]=O NLYAJNPCOHFWQQ-UHFFFAOYSA-N 0.000 description 1
- 150000003951 lactams Chemical group 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 229960000448 lactic acid Drugs 0.000 description 1
- ICAKDTKJOYSXGC-UHFFFAOYSA-K lanthanum(iii) chloride Chemical compound Cl[La](Cl)Cl ICAKDTKJOYSXGC-UHFFFAOYSA-K 0.000 description 1
- 239000010410 layer Substances 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 231100001231 less toxic Toxicity 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 238000012417 linear regression Methods 0.000 description 1
- KQQKGWQCNNTQJW-UHFFFAOYSA-N linolenic acid Natural products CC=CCCC=CCC=CCCCCCCCC(O)=O KQQKGWQCNNTQJW-UHFFFAOYSA-N 0.000 description 1
- 235000019421 lipase Nutrition 0.000 description 1
- 239000008297 liquid dosage form Substances 0.000 description 1
- 239000012280 lithium aluminium hydride Substances 0.000 description 1
- 229910003002 lithium salt Inorganic materials 0.000 description 1
- 159000000002 lithium salts Chemical class 0.000 description 1
- 238000001325 log-rank test Methods 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 208000037841 lung tumor Diseases 0.000 description 1
- 210000004324 lymphatic system Anatomy 0.000 description 1
- 229960003646 lysine Drugs 0.000 description 1
- ZLNQQNXFFQJAID-UHFFFAOYSA-L magnesium carbonate Chemical compound [Mg+2].[O-]C([O-])=O ZLNQQNXFFQJAID-UHFFFAOYSA-L 0.000 description 1
- VTHJTEIRLNZDEV-UHFFFAOYSA-L magnesium dihydroxide Chemical compound [OH-].[OH-].[Mg+2] VTHJTEIRLNZDEV-UHFFFAOYSA-L 0.000 description 1
- 239000000347 magnesium hydroxide Substances 0.000 description 1
- 229910001862 magnesium hydroxide Inorganic materials 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 229940057948 magnesium stearate Drugs 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 229940098895 maleic acid Drugs 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 229940099690 malic acid Drugs 0.000 description 1
- 238000007726 management method Methods 0.000 description 1
- 229960002510 mandelic acid Drugs 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- 150000004706 metal oxides Chemical group 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- 230000001394 metastastic effect Effects 0.000 description 1
- 206010061289 metastatic neoplasm Diseases 0.000 description 1
- ORDVHOHCTUHXBX-UHFFFAOYSA-M methanesulfonate;1-methylpyridin-1-ium Chemical compound CS([O-])(=O)=O.C[N+]1=CC=CC=C1 ORDVHOHCTUHXBX-UHFFFAOYSA-M 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 230000011144 microtubule bundle formation Effects 0.000 description 1
- 230000029115 microtubule polymerization Effects 0.000 description 1
- 235000010755 mineral Nutrition 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- NJTGANWAUPEOAX-UHFFFAOYSA-N molport-023-220-454 Chemical compound OCC(O)CO.OCC(O)CO NJTGANWAUPEOAX-UHFFFAOYSA-N 0.000 description 1
- 239000001788 mono and diglycerides of fatty acids Substances 0.000 description 1
- CQDGTJPVBWZJAZ-UHFFFAOYSA-N monoethyl carbonate Chemical compound CCOC(O)=O CQDGTJPVBWZJAZ-UHFFFAOYSA-N 0.000 description 1
- 150000002772 monosaccharides Chemical class 0.000 description 1
- 239000012452 mother liquor Substances 0.000 description 1
- 108090000743 multidrug resistance protein 3 Proteins 0.000 description 1
- 102000004233 multidrug resistance protein 3 Human genes 0.000 description 1
- 108010066052 multidrug resistance-associated protein 1 Proteins 0.000 description 1
- 108010066416 multidrug resistance-associated protein 3 Proteins 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- WQEPLUUGTLDZJY-UHFFFAOYSA-N n-Pentadecanoic acid Natural products CCCCCCCCCCCCCCC(O)=O WQEPLUUGTLDZJY-UHFFFAOYSA-N 0.000 description 1
- JXTPJDDICSTXJX-UHFFFAOYSA-N n-Triacontane Natural products CCCCCCCCCCCCCCCCCCCCCCCCCCCCCC JXTPJDDICSTXJX-UHFFFAOYSA-N 0.000 description 1
- 229940094933 n-dodecane Drugs 0.000 description 1
- 239000006070 nanosuspension Substances 0.000 description 1
- 210000003928 nasal cavity Anatomy 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 239000002353 niosome Substances 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 125000004433 nitrogen atom Chemical group N* 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 238000013392 nude mouse xenograft model Methods 0.000 description 1
- 229960002446 octanoic acid Drugs 0.000 description 1
- 229940060184 oil ingredients Drugs 0.000 description 1
- 229920001542 oligosaccharide Polymers 0.000 description 1
- 150000002482 oligosaccharides Chemical class 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 235000020660 omega-3 fatty acid Nutrition 0.000 description 1
- 239000006186 oral dosage form Substances 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 125000001181 organosilyl group Chemical group [SiH3]* 0.000 description 1
- 229960003104 ornithine Drugs 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 230000002018 overexpression Effects 0.000 description 1
- 239000007800 oxidant agent Substances 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- 239000002540 palm oil Substances 0.000 description 1
- 125000000913 palmityl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- WLJNZVDCPSBLRP-UHFFFAOYSA-N pamoic acid Chemical compound C1=CC=C2C(CC=3C4=CC=CC=C4C=C(C=3O)C(=O)O)=C(O)C(C(O)=O)=CC2=C1 WLJNZVDCPSBLRP-UHFFFAOYSA-N 0.000 description 1
- 239000011713 pantothenic acid Substances 0.000 description 1
- 229940055726 pantothenic acid Drugs 0.000 description 1
- 235000019161 pantothenic acid Nutrition 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 239000006201 parenteral dosage form Substances 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- WBXPDJSOTKVWSJ-ZDUSSCGKSA-N pemetrexed Chemical compound C=1NC=2NC(N)=NC(=O)C=2C=1CCC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 WBXPDJSOTKVWSJ-ZDUSSCGKSA-N 0.000 description 1
- 229960005079 pemetrexed Drugs 0.000 description 1
- 150000002972 pentoses Chemical class 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 229940124531 pharmaceutical excipient Drugs 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 150000002989 phenols Chemical class 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- MWFYXZUYQFIMBC-UHFFFAOYSA-N phosphonooxymethyl hydrogen carbonate Chemical group OC(=O)OCOP(O)(O)=O MWFYXZUYQFIMBC-UHFFFAOYSA-N 0.000 description 1
- 125000005633 phthalidyl group Chemical group 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 239000000049 pigment Substances 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 229920000233 poly(alkylene oxides) Polymers 0.000 description 1
- 229920001515 polyalkylene glycol Polymers 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 229920002643 polyglutamic acid Polymers 0.000 description 1
- 229920001522 polyglycol ester Polymers 0.000 description 1
- 238000006116 polymerization reaction Methods 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 235000010483 polyoxyethylene sorbitan monopalmitate Nutrition 0.000 description 1
- 239000000249 polyoxyethylene sorbitan monopalmitate Substances 0.000 description 1
- 235000010989 polyoxyethylene sorbitan monostearate Nutrition 0.000 description 1
- 239000001818 polyoxyethylene sorbitan monostearate Substances 0.000 description 1
- 229920001451 polypropylene glycol Polymers 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 229920001296 polysiloxane Polymers 0.000 description 1
- 229950008882 polysorbate Drugs 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 235000013809 polyvinylpolypyrrolidone Nutrition 0.000 description 1
- 229920000523 polyvinylpolypyrrolidone Polymers 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- 229960004919 procaine Drugs 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 description 1
- 125000004368 propenyl group Chemical group C(=CC)* 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 125000001501 propionyl group Chemical group O=C([*])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000002568 propynyl group Chemical group [*]C#CC([H])([H])[H] 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 235000020440 raspberry syrup Nutrition 0.000 description 1
- 238000010992 reflux Methods 0.000 description 1
- 208000015347 renal cell adenocarcinoma Diseases 0.000 description 1
- 238000001226 reprecipitation Methods 0.000 description 1
- 238000001223 reverse osmosis Methods 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 229940085605 saccharin sodium Drugs 0.000 description 1
- 235000003441 saturated fatty acids Nutrition 0.000 description 1
- 150000004671 saturated fatty acids Chemical class 0.000 description 1
- 238000013207 serial dilution Methods 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 239000010686 shark liver oil Substances 0.000 description 1
- 229940069764 shark liver oil Drugs 0.000 description 1
- 229910052710 silicon Inorganic materials 0.000 description 1
- 239000010703 silicon Substances 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 125000003808 silyl group Chemical group [H][Si]([H])([H])[*] 0.000 description 1
- 238000009097 single-agent therapy Methods 0.000 description 1
- 210000003491 skin Anatomy 0.000 description 1
- 201000000849 skin cancer Diseases 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- 235000010413 sodium alginate Nutrition 0.000 description 1
- 239000000661 sodium alginate Substances 0.000 description 1
- 229940005550 sodium alginate Drugs 0.000 description 1
- 235000017550 sodium carbonate Nutrition 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 1
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 1
- HRZFUMHJMZEROT-UHFFFAOYSA-L sodium disulfite Chemical compound [Na+].[Na+].[O-]S(=O)S([O-])(=O)=O HRZFUMHJMZEROT-UHFFFAOYSA-L 0.000 description 1
- BTURAGWYSMTVOW-UHFFFAOYSA-M sodium dodecanoate Chemical compound [Na+].CCCCCCCCCCCC([O-])=O BTURAGWYSMTVOW-UHFFFAOYSA-M 0.000 description 1
- 239000012312 sodium hydride Substances 0.000 description 1
- 229910000104 sodium hydride Inorganic materials 0.000 description 1
- 229940082004 sodium laurate Drugs 0.000 description 1
- 229940001584 sodium metabisulfite Drugs 0.000 description 1
- 235000010262 sodium metabisulphite Nutrition 0.000 description 1
- 239000012265 solid product Substances 0.000 description 1
- 239000004334 sorbic acid Substances 0.000 description 1
- 235000010199 sorbic acid Nutrition 0.000 description 1
- 229940075582 sorbic acid Drugs 0.000 description 1
- 229940100515 sorbitan Drugs 0.000 description 1
- 235000011076 sorbitan monostearate Nutrition 0.000 description 1
- 239000001587 sorbitan monostearate Substances 0.000 description 1
- 229940035048 sorbitan monostearate Drugs 0.000 description 1
- 229940032094 squalane Drugs 0.000 description 1
- 229940038774 squalene oil Drugs 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 238000010972 statistical evaluation Methods 0.000 description 1
- 230000000707 stereoselective effect Effects 0.000 description 1
- 201000011549 stomach cancer Diseases 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- 150000003505 terpenes Chemical class 0.000 description 1
- 235000007586 terpenes Nutrition 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- TUNFSRHWOTWDNC-HKGQFRNVSA-N tetradecanoic acid Chemical compound CCCCCCCCCCCCC[14C](O)=O TUNFSRHWOTWDNC-HKGQFRNVSA-N 0.000 description 1
- 125000001412 tetrahydropyranyl group Chemical group 0.000 description 1
- OSBSFAARYOCBHB-UHFFFAOYSA-N tetrapropylammonium Chemical compound CCC[N+](CCC)(CCC)CCC OSBSFAARYOCBHB-UHFFFAOYSA-N 0.000 description 1
- 150000003538 tetroses Chemical class 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- RTKIYNMVFMVABJ-UHFFFAOYSA-L thimerosal Chemical compound [Na+].CC[Hg]SC1=CC=CC=C1C([O-])=O RTKIYNMVFMVABJ-UHFFFAOYSA-L 0.000 description 1
- 229940033663 thimerosal Drugs 0.000 description 1
- 125000005000 thioaryl group Chemical group 0.000 description 1
- HPGGPRDJHPYFRM-UHFFFAOYSA-J tin(iv) chloride Chemical compound Cl[Sn](Cl)(Cl)Cl HPGGPRDJHPYFRM-UHFFFAOYSA-J 0.000 description 1
- 239000003104 tissue culture media Substances 0.000 description 1
- 239000004408 titanium dioxide Substances 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 231100000440 toxicity profile Toxicity 0.000 description 1
- 231100000041 toxicology testing Toxicity 0.000 description 1
- 235000010487 tragacanth Nutrition 0.000 description 1
- 239000000196 tragacanth Substances 0.000 description 1
- 229940116362 tragacanth Drugs 0.000 description 1
- WBYWAXJHAXSJNI-VOTSOKGWSA-M trans-cinnamate Chemical group [O-]C(=O)\C=C\C1=CC=CC=C1 WBYWAXJHAXSJNI-VOTSOKGWSA-M 0.000 description 1
- 229960002622 triacetin Drugs 0.000 description 1
- UFTFJSFQGQCHQW-UHFFFAOYSA-N triformin Chemical compound O=COCC(OC=O)COC=O UFTFJSFQGQCHQW-UHFFFAOYSA-N 0.000 description 1
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 1
- 150000003641 trioses Chemical class 0.000 description 1
- UCPYLLCMEDAXFR-UHFFFAOYSA-N triphosgene Chemical compound ClC(Cl)(Cl)OC(=O)OC(Cl)(Cl)Cl UCPYLLCMEDAXFR-UHFFFAOYSA-N 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- 229960004418 trolamine Drugs 0.000 description 1
- 230000001875 tumorinhibitory effect Effects 0.000 description 1
- 235000021122 unsaturated fatty acids Nutrition 0.000 description 1
- 150000004670 unsaturated fatty acids Chemical class 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 1
- 229960004528 vincristine Drugs 0.000 description 1
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- NLVXSWCKKBEXTG-UHFFFAOYSA-N vinylsulfonic acid Chemical compound OS(=O)(=O)C=C NLVXSWCKKBEXTG-UHFFFAOYSA-N 0.000 description 1
- 235000019386 wax ester Nutrition 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 239000010698 whale oil Substances 0.000 description 1
- 238000012447 xenograft mouse model Methods 0.000 description 1
- CKLHRQNQYIJFFX-UHFFFAOYSA-K ytterbium(III) chloride Chemical compound [Cl-].[Cl-].[Cl-].[Yb+3] CKLHRQNQYIJFFX-UHFFFAOYSA-K 0.000 description 1
- UGZADUVQMDAIAO-UHFFFAOYSA-L zinc hydroxide Chemical compound [OH-].[OH-].[Zn+2] UGZADUVQMDAIAO-UHFFFAOYSA-L 0.000 description 1
- 229940007718 zinc hydroxide Drugs 0.000 description 1
- 229910021511 zinc hydroxide Inorganic materials 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D305/00—Heterocyclic compounds containing four-membered rings having one oxygen atom as the only ring hetero atoms
- C07D305/14—Heterocyclic compounds containing four-membered rings having one oxygen atom as the only ring hetero atoms condensed with carbocyclic rings or ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings
- C07D409/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Medicinal Preparation (AREA)
Abstract
C(10)にエチルエステルまたはシクロプロピルエステル置換基、C(9)にケト置換基、C(7)にヒドロキシ置換基、C(3')にチエニル置換基、そしてC(3')にシクロブチルオキシカルバメートまたはシクロペンチルオキシカルバメート置換基を持つタキサン、該タキサンを含有する医薬組成物、処置および投与の方法、ならびに該タキサンを含有する医薬の製造方法。
Description
本発明は抗腫瘍剤として有用な新規タキサンに関する。
テルペンのタキサンファミリーは、バッカチンIIIや、一般にTaxol(登録商標)とも呼ばれるパクリタキセルを含み、生物学分野でも化学分野でも、少なからぬ関心が寄せられてきた。パクリタキセル自体はがん化学療法剤として使用され、広範囲にわたる腫瘍阻害活性を有する。パクリタキセルは2'R,3'S立体配置を持ち、次の構造式で表される:
[式中、Acはアセチルであり、Bzはベンゾイルであり、Phはフェニルである]。
パクリタキセルとドセタキセルは有用な化学療法剤であるが、一定のがんタイプに対する限られた効力や、さまざまな用量で投与された時の患者に対する毒性など、その有効性には限界がある。さらに、一定の腫瘍はパクリタキセルおよび/またはドセタキセルに対して耐性を示している。したがって、低い毒性と、パクリタキセルおよび/またはドセタキセル耐性腫瘍および非耐性腫瘍に関して改善された効力とを持つ、さらなる化学療法剤が、今も必要とされている。
本開示の概要
したがって、本発明のさまざまな態様には、毒性に関して、そして抗腫瘍剤としての効力に関して、パクリタキセルおよびドセタキセルに引けを取らないタキサンの提供が含まれる。一般に、これらのタキサンは、C(10)にエチルエステルまたはシクロプロピルエステル置換基、C(9)にケト置換基、C(7)にヒドロキシ置換基、C(3')にチエニル置換基、そしてC(3')にシクロブチルオキシカルバメートまたはシクロペンチルオキシカルバメート置換基を持つ。
したがって、本発明のさまざまな態様には、毒性に関して、そして抗腫瘍剤としての効力に関して、パクリタキセルおよびドセタキセルに引けを取らないタキサンの提供が含まれる。一般に、これらのタキサンは、C(10)にエチルエステルまたはシクロプロピルエステル置換基、C(9)にケト置換基、C(7)にヒドロキシ置換基、C(3')にチエニル置換基、そしてC(3')にシクロブチルオキシカルバメートまたはシクロペンチルオキシカルバメート置換基を持つ。
したがって簡単に言うと、本発明は、タキサンそのもの、そのプロドラッグ、タキサン(およびそのプロドラッグ)と医薬上許容される担体とを含む医薬組成物、処置および投与の方法、ならびにタキサン(およびそのプロドラッグ)を含む医薬品の製造方法に関する。
ある特定態様において、本発明は、次に挙げる構造(1)を持つタキサンに関する:
[式中、R10aはエチルまたはシクロプロピルであり、X3はチエニルであり、X10はシクロブチルまたはシクロペンチルである]。
もう一つの特定態様において、本発明は、構造(1)のタキサンと少なくとも1つの医薬上許容される担体とを含む医薬組成物に関する。
もう一つの特定態様において、本発明は、哺乳動物における腫瘍成長を阻害する方法であって、構造(1)のタキサンと少なくとも1つの医薬上許容される担体とを含む医薬組成物の処置有効量をその哺乳動物に投与することを含む方法に関する。ある特定実施形態では、腫瘍が多剤耐性腫瘍である。
他の目的および特徴は、一部は明白であるだろうし、一部は以下に記載する。
他の目的および特徴は、一部は明白であるだろうし、一部は以下に記載する。
式(1)に関して上述したように、X3はチエニルである。したがって、例えば、X3は2-チエニルまたは3-チエニルであることができる。好ましい一実施形態では、X3が2-チエニルである。
これと共に、タキサンが式(1)で示される一定の実施形態では、R10aがエチルであり、X10がシクロブチルまたはシクロペンチルである。したがって例えば、R10aがエチルであり、X10がシクロブチルであるか、またはR10aがエチルであり、X10がシクロペンチルであることができる。タキサンが式(1)で示される別の実施形態では、R10aがシクロプロピルであり、X10がシクロブチルまたはシクロペンチルである。したがって例えば、R10aがシクロプロピルであり、X10がシクロブチルであるか、またはR10aがシクロプロピルであり、X10がシクロペンチルであることができる。これらの実施形態のそれぞれにおいて、X3はチエニル(例えば2-チエニルまたは3-チエニル)である。また、より好ましくは、これらの実施形態において、X3は2-チエニルである。
別の組み合わせでは、タキサンが式(1)で示される一定の実施形態において、R10aがエチルまたはシクロプロピルであり、X10がシクロブチルである。したがって例えば、R10aがエチルであり、X10がシクロブチルであるか、またはR10aがシクロプロピルであり、X10がシクロブチルであることができる。タキサンが式(1)で示される別の実施形態では、R10aがエチルまたはシクロプロピルであり、X10がシクロペンチルである。したがって例えば、R10aがエチルであり、X10がシクロペンチルであるか、またはR10aがシクロプロピルであり、X10がシクロペンチルであることができる。これらの実施形態において、X3はチエニル(例えば2-チエニルまたは3-チエニル)である。また、より好ましくは、これらの実施形態において、X3は2-チエニルである。
一般に、C(7)ヒドロキシ置換基およびC(10)シクロプロピルカルボニルオキシまたはエチルカルボニルオキシ置換基は、独立して、αまたはβ立体化学配置を持つことができる。したがって、タキサン化合物が化学構造(1)で示される場合、C(7)置換基とC(10)置換基がそれぞれα立体化学配置を持つか、C(7)置換基とC(10)置換基がそれぞれβ立体化学配置を持つか、C(7)置換基がβ立体化学配置を持ちC(10)置換基がα立体化学配置を持つか、またはC(7)置換基がα立体化学配置を持ちC(10)置換基がβ立体化学配置を持つことができる。したがって例えば、さまざまな実施形態において、タキサンは、これら化学構造部分の立体化学配置を示す以下の式の1つ以上で示されうる:
ある実施形態では、タキサンが式(1bb)で示され(すなわちC(7)置換基とC(10)置換基がどちらもβ立体化学配置を持つ)、式中、R10aはエチルまたはシクロプロピルであり、X3はチエニルであり、X10はシクロブチルまたはシクロペンチルである。より好ましくは、この実施形態において、X3は2-チエニルである。
上記表1に記載の組み合わせのそれぞれにおいて(すなわち化合物17932、18365、18926、19244について)、タキサンのX3置換基はチエニルである。より好ましくは、これらの組み合わせにおいて、X3は2-チエニルである。したがって例えば、好ましいタキサンのいくつかは、式(1A)、(1B)、(1C)、または(1D)の1つ以上で示される。
例えば、式(1A)、(1B)、(1C)、および(1D)で示されるタキサンのC(7)置換基とC(10)置換基がどちらもβ立体化学配置を持つ実施形態の場合、これらのタキサンは、それぞれ式(1AA)、(1BB)、(1CC)、または(1DD)で示される。
従来の化学療法剤を使った化学療法は、腫瘍細胞における多剤耐性(MDR)の発生(これにより、腫瘍細胞は構造的、機能的に無関係な種々の化合物に対する交差耐性を獲得する)によって、しばしば妨害される。一般的な形態の多剤耐性は、数ある機序のなかでもとりわけ、抗血管新生;薬物排出トランスポーター(すなわち薬物排出ポンプ)の過剰発現;チューブリンの薬物結合部位の後天性突然変異;チューブリンアイソフォームの発現差異;アポトーシス機序の変化;微小管の束化および重合(例えばG2/M停止およびアポトーシスにつながるもの);ならびに成長因子経路の活性化が原因であると考えられている。これらの(および他の)多剤耐性機序のそれぞれまたは2つ以上の寄与は依然として不明であるが、多剤耐性と薬物排出トランスポーター発現レベルは、さまざまな腫瘍タイプで関連づけられている。例えばDumontetら, J. Clin. Oncol. 17, 1061-1070 (1999);Gottesmanら, Nat. Rev. Cancer 2, 48-58 (2002)を参照されたい。
本発明の化合物は、パクリタキセルおよびドセタキセル耐性腫瘍を含む多剤耐性腫瘍に対して有効である。したがって、特定の態様において、本明細書に記載の化合物は、哺乳動物における腫瘍成長を阻害するための方法であって、腫瘍が多剤耐性腫瘍(すなわち多剤耐性を示す腫瘍細胞を含む腫瘍)である方法に使用することができる。これに加えて、またはこれに代えて、腫瘍は1つまたはそれ以上の従来の化学療法剤に対して耐性であってもよい。例えば腫瘍は、薬剤の中でも、カルボプラチン、ドセタキセル、ドキソルビシン、ゲムシタビン、イリノテカン、パクリタキセル、ペメトレキセド、およびビンクリスチンなどに対して耐性であってもよい。特定の一実施形態では、腫瘍がパクリタキセルに対して耐性であるか、ドセタキセルに対して耐性であるか、またはパクリタキセルとドセタキセルの両方に対して耐性である。
さまざまな実施形態において、例えば、多剤耐性腫瘍細胞は薬物排出トランスポーターを過剰発現させる。薬物排出トランスポーターのなかでも、ATP結合カセットトランスポーター、例えばP-糖タンパク質(P-gp)、MDR関連タンパク質(例えばMDR-1、MDR-2、MDR-3など)、乳がん耐性タンパク質(例えばBCRP1)および/または多剤耐性関連タンパク質(MRP)(例えばMRP-1、MRP-2、MRP-3、MRP-9など)の過剰発現が、腫瘍細胞における多剤耐性の媒介に関連づけられている。したがってある実施形態では、過剰発現される薬物排出トランスポーターがATP結合カセットトランスポーターである。より典型的には、この実施形態において、薬物排出トランスポーターがP-糖タンパク質、MDR関連タンパク質、乳がん耐性タンパク質、多剤耐性関連タンパク質、またはそれらの組み合わせである。これらの実施形態において、本化合物は、上皮細胞癌、例えば脳、乳房、大腸、腎臓、肝臓、肺(非小細胞肺癌を含む)、卵巣、膵臓、腎臓および皮膚腫瘍タイプを含む、多種多様な腫瘍タイプに対して有効であることができる。例えば、パクリタキセルやドセタキセルとは異なり、化合物17932、18365、18926、および19244は、MDR関連タンパク質(例えばMDR-1)を過剰発現させる腫瘍細胞、例えばDLD-1大腸癌細胞株および786-0腎臓癌細胞株などの成長を阻害するのに、極めて効果的である。もう一つの例として、化合物18926、18365、19244は、MRP-2およびBCRP1を過剰発現させる腫瘍細胞、例えばMSTO-211H中皮腫細胞の成長を阻害するのに(パクリタキセルおよびドセタキセルと比較して)極めて効果的である。もう一つの例として、化合物18926、18365、19244は、MRP-9を過剰発現させる腫瘍細胞、例えばA375メラノーマの成長を阻害するのに(パクリタキセルおよびドセタキセルと比較して)極めて効果的である。特定の一理論に束縛されるものではないが、パクリタキセルやドセタキセルなどの従来の化学療法剤と比較して、これらの改善された効果の根拠は、少なくとも一つには、化合物とこれらの薬物排出ポンプおよび他の薬物排出ポンプとの相互作用が減少しているためであると考えられる。
好都合なことに、また関与する機序がどうであれ、本明細書に記載する化合物は、パクリタキセルおよび/またはドセタキセル感受性および耐性腫瘍株を含む一定の腫瘍タイプに関し、従来使用されているタキサンよりも優れた形で、インビトロでもインビボでも、がんに対して効果的である。他の薬剤と組み合わせて使用するにせよ、そうでないにせよ、化合物17932、18365、18926、および/または19244を含む医薬組成物は、パクリタキセルおよびドセタキセル(それぞれTaxol(登録商標)およびTaxotere(登録商標))による処置の適応となるがんを処置するために使用することができる。驚いたことに、本化合物は、多種多様な腫瘍タイプ(例えば脳、大腸、肺、卵巣、膵臓、腎臓、および皮膚がんから派生したものを含む)に対してパクリタキセルおよび/またはドセタキセルの活性よりも数オーダー高い(例えば2倍、5倍、10倍、またはそれ以上の)活性を示す。限定するわけではないが、化合物17932、18365、18926、および/または19244を含む医薬組成物は、単独で、または組み合わせて、脳のがん、乳がん、大腸がん、肺がん(非小細胞肺がんを含む)、卵巣がん、膵がん、前立腺がん、AIDS関連カポジ肉腫、中皮腫、胃がん、および腎がんを処置するために使用することができる。本化合物は経口投与しても静脈内投与しても忍容性がかなり高く、単回投与または複数回投与で効果的であることができ、改善された毒性プロファイルを持つ。本発明の化合物は、非Cremophor(登録商標)賦形剤中でも有効である。
化合物17932、18365、18926、および/または19244は、パクリタキセルおよびドセタキセルに対して不応性/耐性であるものを含むいくつかのヒト腫瘍ヌードマウス異種移植モデルにおいて、著しく有効である。化合物17932、18365、18926、および/または19244は、静脈内経路および経口経路により、単回投与スケジュールまたは複数回投与スケジュールで、効果的に投与することができる。試験した異種移植モデルの大半において、本化合物は、経口投与として、4日毎または7日毎の複数回投与スケジュールで投与した場合に、パクリタキセルおよびドセタキセルより優れた効力を示す。化合物17932、18365、18926、および19244は、これらのマウス異種移植モデルにおいて幅広い治療係数を示す。体重減少によって示される最大耐容量を十分に下回る用量でも効力が維持される。本化合物は、異種移植モデルで観察される効力で示されるとおり、経口投与で優れたバイオアベイラビリティを示し、スプラーグ・ドーリーラットに経口投与および静脈内投与した場合に好ましい毒性プロファイルを示す。例えば本化合物は、パクリタキセルおよびドセタキセルと比較して、著しく低い神経毒性(例えば軸索変性によって測定されるもの)を持つ。複数回投与レジメンにおける優れた効力、低い毒性、幅広い治療係数により、臨床現場では、特にヒト試験で毎週投与する場合に、用量強度を増加させる機会が与えられる。例えば、本発明の化合物は(パクリタキセルおよびドセタキセルと同じように)3週間ごとのスケジュールで投与するか、1週間ごとのスケジュールで投与することができる。1週間ごとのスケジュールは、例えば、投与頻度(dosing density)の増加を可能にすることができ、特に経口投与の場合は、患者の利便性を改善することができる。そのような経口投与レジメンは、比較的低い用量を使って、1日単位で行うことができる。好都合なことに、これらおよび他の経口投与レジメンは、抗血管新生メトロノミック投与スケジュール(パクリタキセルおよびドセタキセルの場合、それらは経口投与ではあまり効果的でないため、この投与スケジュールは望ましくない)の一部として使用することができる。
本発明のタキサンは、β-ラクタムを、タキサン四環核とC(13)金属オキシド置換基とを持つアルコキシドで処理することで、C(13)にβ-アミドエステル置換基を持つ化合物を形成させ(この反応はHoltonの米国特許第5,466,834号(この文献は参照によりその全てが本明細書に組み込まれる)に詳述されている)、次にヒドロキシ保護基を除去することによって得ることができる。一般に、これらの方法で使用されるβ-ラクタムは、式(I):
[式中、P2はヒドロキシ保護基であり、X3はチエニル(例えば2-チエニル)であり、X5はシクロブチルオキシカルボニルまたはシクロペンチルオキシカルボニルである]
で示され、アルコキシドは式(II):
[式中、Mは金属またはアンモニウムであり、P7は水素またはヒドロキシ保護基であり、R10はシクロプロピルカルボニルオキシまたはプロピオニルオキシであり、Acはアセチルであり、Bzはベンゾイルである]
で示される。
で示され、アルコキシドは式(II):
で示される。
構造式(II)のアルコキシドは、C(7)ヒドロキシ基を選択的に保護してからC(10)ヒドロキシ基をエステル化し、次に金属アミドで処理することにより、10-デアセチルバッカチンIII(10-DAB)(またはその誘導体)から製造することができる。本発明の一態様では、10-DABのC(7)ヒドロキシ基を、例えばDenisら(J. Am. Chem. Soc, 1988, 110, 5917)(この文献は参照によりその全てが本明細書に組み込まれる)によって記述されているように、シリル基で選択的に保護する。
あるいは、例えばHoltonらの米国特許第7,288,665号(この文献は参照によりその全てが本明細書に組み込まれる)に記述されているように、タキサンのC(10)ヒドロキシ基を塩基の非存在下で選択的にアシル化することもできる。タキサンのC(10)ヒドロキシ基の選択的アシル化に使用することができるアシル化剤には、置換または無置換アルキルまたはアリール無水物がある。タキサンのC(10)ヒドロキシ基のアシル化は、多くのアシル化剤で、十分な速度で進行するだろうが、反応混合物にルイス酸を含めることによって反応速度を増加させうることが見いだされている。好ましいルイス酸には、塩化亜鉛、塩化第二スズ、三塩化セリウム、塩化第一銅、三塩化ランタン、三塩化ジスプロシウム、および三塩化イッテルビウムなどがある。アシル化剤が無水物である場合は、塩化亜鉛または三塩化セリウムが、特に好ましい。
好ましいワンポットプロトコールでは、C(7)ヒドロキシル基を保護するために10-DABのN,N-ジメチルホルムアミド溶液を2〜3当量の4-N,N-ジメチルアミノピリジンの存在下、化学量論量のシリル化剤で処理した後、アシル化剤(塩化プロピオニルまたは塩化シクロプロピルカルボニル)で処理することにより、C(10)ヒドロキシル基を周囲温度で選択的にアシル化した。このプロセスにより、製造時間が短縮され、溶媒要件が緩和される。例えばHoltonらの米国特許出願公開第2005/0228037号(この文献は参照によりその全てが本明細書に組み込まれる)を参照されたい。
C(7)置換基およびC(10)置換基に特定の立体化学配置を持つ化合物(例えば上記の化合物1aa、1bb、1ab、および1ba)は、これらの立体化学配置を持つ出発物質(例えば10-DAB)または中間体を使って製造できることは、理解されるだろう。例えば10-DABのC(7)-エピマーの製造が、Georgら, Journal of Organic Chemistry, 63, 8926-8934 (1998)(この文献は参照によりその全てが本明細書に組み込まれる)によって例示されている。例えば10-α10-DABの製造は、Appendinoら, Tetrahedron Letters 36, 18, 3233-3236 (1995)(この文献は参照によりその全てが本明細書に組み込まれる)によって例示されている。C(7)位の立体化学配置は、Chaudharyら, Journal of Organic Chemistry 58, 3798-3799 (1993)(この文献は参照によりその全てが本明細書に組み込まれる)に記載されているように、化合物(適当に置換された側鎖が結合しているもの)を塩基で処理することによって改変することができる。これに加えて、またはこれに代えて、Appendinoら(前掲)およびDattaら, Tetrahedron Letters 36, 12, 1985-1988 (1995)(この文献は参照によりその全てが本明細書に組み込まれる)によって例示される酸化-還元-エステル化シーケンスを使用し、次に挙げる反応スキーム(式中、X10、X3、およびR10aは式(1)に関して定義したとおりであり、PGはヒドロキシ保護基である)で、さまざまなC(10)α異性体を得ることができる:
上記の酸化-還元-エステル化シーケンスにおいて、C(10)ヒドロキシ基の典型的酸化剤は、過ルテニウム酸テトラプロピルアンモニウム(TPAP)であり、C(10)ケト基の典型的還元剤は水素化ホウ素ナトリウムである。C(7)ヒドロキシ基およびC(2')ヒドロキシ基にはさまざまな保護基を使用することができ、本明細書では項を改めてそのいくつかを説明する(例えばトリアルキルシリル)。
適当なβ-ラクタム(I)カップリングパートナーを合成するための好ましいワンポットプロトコールでは、光学的に純粋なβ-ラクタムのテトラヒドロフラン溶液を、そのヒドロキシ基を保護(P2)するために触媒量のp-トルエンスルホン酸の存在下、化学量論量の2-メトキシ-プロペンで処理した後、適当なクロロホルメート(シクロブチルまたはシクロペンチル)で処理することにより、周囲温度でX10置換基を導入した。例えばHoltonらの米国特許出願公開第2005/0228037号(この文献は参照によりその全てが本明細書に組み込まれる)を参照されたい。
β-ラクタム(I)出発物質を製造し分割するためのプロセスは、当技術分野では一般によく知られている。例えばβ-ラクタムは、Holtonの米国特許第5,430,160号(第9欄2〜25行)またはHoltonの米国特許第6,649,632号(第7欄45行〜第8欄60行)および米国特許出願公開第2006/0281914号(1頁の段落番号[0021]〜6頁の段落番号[0060](これらの各文献は参照によりその全てが本明細書に組み込まれる)に記述されているように製造することができる。その結果生じるβ-ラクタムのエナンチオマー混合物は、例えばPatelの米国特許第5,879,929号(第16欄1行〜第18欄27行)またはPatelの米国特許第5,567,614号に記述されているようなリパーゼまたは酵素を使って、またはHoltonの米国特許第6,548,293号(第3欄30〜61行)に記載されているような肝ホモジネートを使って、立体選択的加水分解を行うことにより(これらの各文献は参照によりその全てが本明細書に組み込まれる)、または米国特許出願公開第2006/0281918号(1頁の段落番号[0022]〜8頁の段落番号[0071])(この文献は参照によりその全てが本明細書に組み込まれる)に記述されているように、光学活性プロリンアシル化剤で処理した後、未反応のエナンチオマーまたはジアステレオマーの一方を選択的に回収することにより、分割することができる。例えば米国特許第6,649,632号には、β-ラクタムのC(4)位にフリル置換基を持つβ-ラクタムの製造が開示されている。当業者に明白な変更を加えることにより、これらの先行特許および特許出願に例示されているように、また下記実施例11でさらに開示するように、β-ラクタムC(4)位にチエニル置換基を持つβ-ラクタムを製造することができる。
本発明の化合物はその塩の形で提供することができる。通例、塩は医薬上許容される塩、すなわち医薬上許容される無毒性の酸(無機酸および有機酸を含む)から製造される塩でありうる。適切な無毒性酸には、アミンなどの塩基性残基に対して、無機酸および有機酸、例えば酢酸、ベンゼンスルホン酸、安息香酸、カンファースルホン酸、クエン酸、エテンスルホン酸、フマル酸、グルコン酸、グルタミン酸、臭化水素酸、塩化水素酸、イセチオン酸、乳酸、マレイン酸、リンゴ酸、マンデル酸、メタンスルホン酸、ムチン酸、硝酸、パモ酸、パントテン酸、リン酸、コハク酸、硫酸、バルバチン酸(barbaric acid)、p-トルエンスルホン酸などが含まれる。カルボン酸などの酸性残基のアルカリ塩または有機塩には、例えば次に挙げる塩基から誘導されるアルカリ塩およびアルカリ土類金属塩が含まれる:水素化ナトリウム、水酸化ナトリウム、水酸化カリウム、水酸化カルシウム、水酸化アルミニウム、水酸化リチウム、水酸化マグネシウム、水酸化亜鉛、アンモニア、トリメチルアンモニア、トリエチルアンモニア、エチレンジアミン、リジン、アルギニン、オルニチン、コリン、N,N"-ジベンジルエチレンジアミン、クロロプロカイン、ジエタノールアミン、プロカイン、n-ベンジルフェネチルアミン、ジエチルアミン、ピペラジン、トリス(ヒドロキシメチル)-アミノメタン、水酸化テトラメチルアンモニウムなど。本明細書に記載する組成物の医薬上許容される塩は、化合物を化学量論量の適当な塩基または酸と水中または有機溶媒中またはそれら二つの混合物中で反応させることによって製造することができ、一般的には、エーテル、酢酸エチル、エタノール、イソプロパノール、またはアセトニトリルなどの非水性溶媒が好ましい。適切な塩のリストが「Remington's Pharmaceutical Sciences」第17版(Mack Publishing Company、ペンシルベニア州イーストン、1985)の1418頁に掲載されており、この文献は参照によりその全てが本明細書に組み込まれる。
これに加えて、またはこれに代えて、本化合物はプロドラッグの形で提供することもできる。一般に、医薬上許容される誘導体またはプロドラッグは、レシピエントに投与されたときに、本発明の化合物またはその阻害活性代謝産物もしくは残基を直接的または間接的に与えることができる、本発明化合物の任意の医薬上許容される塩、エステル、エスエルの塩または他の誘導体である。特に好ましい誘導体またはプロドラッグは、その化合物を患者に投与した時に本発明化合物のバイオアベイラビリティを(例えば経口投与された化合物をより容易に血中に吸収させることによって)増加させるもの、または生物学的コンパートメント(例えば脳またはリンパ系)への親化合物の送達を親化合物と比較して強化するものである。医薬上許容されるプロドラッグには、次に挙げる基の1つ以上で誘導体化された本発明のタキサンが含まれるが、これらに限るわけではない:ホスフェート、ピバロイルオキシメチル、アセトキシメチル、フタリジル、インダニル、メトキシメチル、メチルピリジニウムメシレート、バイカーボネート、オニウム塩、ホスホノオキシメチルカーボネート、シンナメート、アミノ酸、ベンゾイル、アシル、チオアリール、ポリエチレングリコール系基(polyethylene glycol based)、エステル結合(ester linked)、ポリアルキレンオキシド、デキストラン、ポリビニルアルコール、糖質系ポリマー、オリゴペプチド、ポリグルタミン酸、ポリアミノ酸、2-ハロゲン化アザアレーンのオニウム塩、高極性アミノ糖など。本発明のタキサン分子中の、プロドラッグ形成に適した位置には、C(2')およびC(7)位があるが、これらに限るわけではない。さまざまな形態のプロドラッグが当技術分野ではよく知られている。そのようなプロドラッグ誘導体の例については、次に挙げる文献を参照されたい:(a)H. Bundgaard編「Design of Prodrugs」(Elsevier、1985)およびK. Widderら編「Methods in Enzymology」第42巻の309〜396頁(Acamedic Press、1985);(b)Krosgaard-LarsenおよびH. Bundgaard編「A Textbook of Drug Design and Development」の第5章、H. Bundgaard著「Design and Application of Prodrugs」、113〜191頁(1991);(c) H. Bundgaard, Advanced Drug Delivery Reviews, 8, 1 -38 (1992);(d)H. Bundgaardら, Journal of Pharmaceutical Sciences, 77, 285 (1988);および(e)N. Kakeyaら, Chem. Pharm. Bull., 32, 692 (1984)、これらの各文献は参照によりその全てが本明細書に組み込まれる。
本発明のタキサン類は、ヒトを含む哺乳動物において腫瘍増殖抑制に有用であり、好ましくは、抗腫瘍有効量の本発明化合物を少なくとも1つの薬学的または薬理学的に許容しうる担体と共に含む医薬組成物の形態で投与する。担体は、賦形剤、ビヒクル、補助剤、アジュバントまたは希釈剤としてもこの分野では知られているが、担体は、薬学的に不活性であり、好適なコンシステンシーまたは形状を組成物に付与し、そして抗腫瘍化合物の治療効力を損なわない任意の物質である。担体は、哺乳動物またはヒトに投与されたときに有害なアレルギー反応または他の望ましくない反応を生じさせない場合に「薬学的または薬理学的に許容しうる」。
本発明の抗腫瘍化合物を含有する医薬組成物は任意の従来の方法で調製することができる。適切な調製は、選択した投与経路に依存する。本発明の組成物は、標的組織に投与経路を介して達する限り、任意の投与経路のために調製することができる。好適な投与経路には、経口投与、非経口(例えば、静脈内、動脈内、皮下、直腸内、皮下、筋肉内、眼窩内、嚢内、髄腔内、腹腔内または胸骨内)投与、局所(例えば、鼻腔、経皮、眼内)投与、ぼうこう内投与、くも膜下投与、腸内投与、肺投与、リンパ管内投与、洞内投与、膣投与、経尿道投与、皮内投与、耳投与、乳房内投与、口内投与、正位投与、気管内投与、病巣内投与、経皮投与、内視鏡的投与、経粘膜投与、舌下投与および腸管投与が含まれるが、これらに限定されない。
本発明の組成物に使用する薬学的に許容しうる担体は当業者にはよく知られており、下記のような多数の要因に基づいて選択する:使用する特定の抗腫瘍化合物、ならびにその濃度、安定性および意図するバイオアベイラビリティー;組成物で処置する疾患、障害または状態;被投与体、その年齢、大きさおよび全身の健康状態;ならびに投与経路。好適な担体は当業者によって容易に決定される(例えば、J.G.Nairn、Remington's Pharmaceutical Science(A.Gennaro編)、Mack Publishing Co.、Easton、Pa.(1985年)、1492頁〜1517頁を参照のこと、その内容は参考として本明細書中に組み込まれる)。
本発明の組成物は、好ましくは、錠剤、分散性粉末剤、ピル剤、カプセル剤、ゲルキャップ剤、カプレット剤、ゲル剤、リポソーム剤、顆粒剤、溶液剤、懸濁剤、エマルジョン剤、シロップ剤、エリキシル剤、トローチ剤、糖衣剤、ロゼンジ剤、または経口投与し得る任意の他の投薬形態として調製する。本発明において有用な経口投薬形態を調製するための技術および組成物は下記の参考文献に記載されている:7 Modern Pharmaceutics、9章および10章(Banker & Rhodes編、1979年);Lieberman他、Pharmaceutical Dosage Forms: Tablets(1981年);Ansel、Introduction to Pharmaceutical Dosage Forms、第2版(1976年)。
経口投与される本発明の組成物は、有効な抗腫瘍量の本発明化合物を、薬学的に許容しうる担体内に含む。固体投薬形態に好適な担体には、糖、デンプンおよび他の従来の物質が含まれる。そのような従来の物質には、ラクトース、タルク、スクロース、ゼラチン、カルボキシルメチルセルロース、寒天、マンニトール、ソルビトール、リン酸カルシウム、炭酸カルシウム、炭酸ナトリウム、カオリン、アルギン酸、アラビアゴム、トウモロコシデンプン、ジャガイモデンプン、サッカリンナトリウム、炭酸マグネシウム、トラガカント、微結晶セルロース、コロイド状二酸化ケイ素、クロスカルメロースナトリウム、タルク、ステアリン酸マグネシウムおよびステアリン酸が含まれる。さらに、そのような固体投薬形態はコーティングなしでもよく、あるいは知られている技術でコーティングして、例えば、崩壊および吸収を遅らせることができる。
本発明の抗腫瘍化合物はまた、非経口投与するために好ましく調製することができ、例えば、静脈内経路、動脈内経路、皮下経路、直腸内経路、皮下経路、筋肉内経路、眼窩内経路、嚢内経路、髄腔内経路、腹腔内経路または胸骨内経路で注射するために調製しうる。非経口投与する本発明の組成物は、有効な抗腫瘍量の抗腫瘍化合物を薬学的に許容しうる担体内に含む。非経口投与に好適な投薬形態には、溶液剤、懸濁剤、分散剤、エマルジョン剤、または非経口投与され得る任意の他の投薬形態が含まれる。非経口投与形態を調製するための技術および組成物はこの分野で知られている。
経口的または非経口的に投与する液体の投薬形態を調製する際に使用する好適な担体には、非水性の薬学的に許容しうる極性溶媒、例えばオイル、アルコール、アミド、エステル、エーテル、ケトン、炭化水素およびこれらの混合物、ならびに水、生理食塩液、デキストロース溶液(例えばDW5)、電解質溶液または任意の他の水性の薬学的に受容可能な液体が含まれる。
好適な非水性の薬学的に許容しうる極性溶媒には、下記のものが含まれるが、それらに限定されない:アルコール(例えば、α-グリセロールホルマール、β-グリセロールホルマール、1,3-ブチレングリコール、2個〜30個の炭素原子を有する脂肪族アルコールまたは芳香族アルコール、例えば、メタノール、エタノール、プロパノール、イソプロパノール、ブタノール、t-ブタノール、ヘキサノール、オクタノール、アミレン水和物、ベンジルアルコール、グリセリン(グリセロール)、グリコール、へキシレングリコール、テトラヒドロフルフリルアルコール、ラウリルアルコール、セチルアルコールまたはステアリルアルコール、ポリアルキレングリコール(例えば、ポリプロピレングリコール、ポリエチレングリコール)などの脂肪アルコールの脂肪酸エステル、ソルビタン、スクロースおよびコレステロールなど);アミド(例えば、ジメチルアセトアミド(DMA)、ベンジルベンゾアートDMA、ジメチルホルムアミド、N-(β-ヒドロキシエチル)ラクトアミド、N,N-ジメチルアセトアミド アミド、2-ピロリジノン、1-メチル-2-ピロリジノン、またはポリビニルピロリドン);
エステル(例えば、1-メチル-2-ピロリジノン、2-ピロリジノン、アセタートエステル(モノアセチン、ジアセチンおよびトリアセチンなど)、脂肪族エステルまたは芳香族エステル、例えば、カプリル酸エチルまたはオクタン酸エチル、オレイン酸アルキル、安息香酸ベンジル、酢酸ベンジルなど、ジメチルスルホキシド(DMSO)、グリセリンのエステル(クエン酸モノグリセリル、クエン酸ジグリセリルまたはクエン酸トリグリセリル、あるいは酒石酸モノグリセリル、酒石酸ジグリセリルまたは酒石酸トリグリセリル)、安息香酸エチル、酢酸エチル、炭酸エチル、乳酸エチル、オレイン酸エチル、ソルビタンの脂肪酸エステル、脂肪酸由来のPEGエステル、グリセリルモノステアラート、グリセリドエステル(モノグリセリド、ジグリセリドまたはトリグリセリドなど)、ミリスチン酸イソプロピルなどの脂肪酸エステル、PEGヒドロキシオレアートおよびPEGヒドロキシステアラートなどの脂肪酸由来のPEGエステル、N-メチルピロリジノン、プルロニック60、ポリオキシエチレンソルビトールオレイン酸ポリエステル(ポリ(エトキシル化)30〜60ソルビトールポリ(オレアート)2〜4、ポリ(オキシエチレン)15〜20モノオレアートなど、ポリ(オキシエチレン)15〜20モノ12-ヒドロキシステアラート、およびポリ(オキシエチレン)15〜20モノレシノレアート、ポリオキシエチレンソルビタンエステル(ポリオキシエチレンソルビタンモノオレアート、ポリオキシエチレンソルビタンモノパルミタート、ポリオキシエチレンソルビタンモノラウラート、ポリオキシエチレンソルビタンモノステアラート、およびICI Americas社(Wilmington、DE)から得られるPolysorbate(登録商標)20、40、60または80など)、ポリビニルピロリドン、ポリオキシル40水素化ひまし油およびポリオキシエチル化ひまし油(例えば、Cremophor(登録商標)EL溶液またはCremophor(登録商標)RH40溶液)などのアルキレンオキシ修飾脂肪酸エステル、
サッカリド脂肪酸エステル(すなわち、単糖(例えば、リボース、リブロース、アラビノース、キシロース、リキソースおよびキシルロースなどのペントース、グルコース、フルクトース、ガラクトース、マンノースおよびソルボースなどのヘキソース、ならびにトリオース、テトロース、ヘプトースおよびオクトース)または二糖(例えば、スクロース、マルトース、ラクトースおよびトレハロース)またはオリゴ糖またはこれらの混合物とC4〜C22脂肪酸(例えば、カプリル酸、カプリン酸、ラウリン酸、ミリスチン酸、パルミチン酸およびステアリン酸などの飽和脂肪酸、ならびにパルミトレイン酸、オレイン酸、エライジン酸、エルカ酸およびリノレン酸などの不飽和脂肪酸)との縮合生成物)、またはステロイドエステル);2個〜30個の炭素原子を有するアルキルエーテル、アリールエーテルまたは環状エーテル(例えば、ジエチルエーテル、テトラヒドロフラン、ジメチルイソソルビド、ジエチレングリコールモノエチルエーテル);グリコフロール(テトラヒドロフルフリルアルコールポリエチレングリコールエーテル);3個〜30個の炭素原子を有するケトン(例えば、アセトン、メチルエチルケトン、メチルイソブチルケトン);4個〜30個の炭素原子を有する脂肪族炭化水素または環状脂肪族炭化水素または芳香族炭化水素(例えば、ベンゼン、シクロヘキサン、ジクロロメタン、ジオキソラン類、ヘキサン、n-デカン、n-ドデカン、n-ヘキサン、スルホラン、テトラメチレンスルホン、テトラメチレンスルホキシド、トルエン、ジメチルスルホキシド(DMSO)、またはテトラメチレンスルホキシド);
鉱物起源、植物起源、動物起源または合成起源のオイル(例えば、鉱油、例えば脂肪族炭化水素またはワックス型炭化水素、芳香族炭化水素、脂肪族系および芳香族系の混合炭化水素、および精製パラフィン油、植物油(亜麻仁油、きり油、紅花油、ダイズ油、ひまし油、綿実油、ラッカセイ油、ナタネ油、ココナッツ油、パーム油、オリーブ油、コーン油、トウモロコシ胚芽油、ゴマ油、杏仁油およびピーナツ油など)およびグリセリド(モノグリセリド、ジグリセリドまたはトリグリセリドなど)、動物油(魚油、海産油、マッコウ鯨油、タラ肝油、ハリバ油、スクアレン油、スクアラン油およびサメ肝油)、オレイック(oleic)油、およびポリオキシエチル化ひまし油);1個〜30個の炭素原子および必要に応じて1個以上のハロゲン置換基を有するハロゲン化アルキルまたはハロゲン化アリール;塩化メチレン;モノエタノールアミン;石油ベンジン;トロラミン;ω-3多不飽和脂肪酸(例えば、α-リノレン酸、エイコサペンタエン酸、ドコサペンタエン酸またはドコサヘキサエン酸);12-ヒドロキシステアリン酸およびポリエチレングリコールのポリグリコールエステル(BASF社(Ludwigshafen、ドイツ)から得られるSolutol(登録商標)HS-15);ポリオキシエチレングリセロール;ラウリン酸ナトリウム;オレイン酸ナトリウム;またはソルビタンモノオレアート。
本発明において使用される他の薬学的に許容しうる溶媒は当業者にはよく知られており、The Chemotherapy Source Book(Williams & Wilkens Publishing)、The Handbook of Pharmaceutical Excipients(American Pharmaceutical Association(Washington, D.C.)およびThe Pharmaceutical Society of Great Britain(London、英国)、1968年)、Modern Pharnmceutics(G. Banker他編、第3版)(Maecel Dekker, Inc.、New York、New York、1995年)、The Pharmacological Basis of Therapeutics(Goodman & Gilman、McGraw Hill Publishing)、Pharmaceutical Dosage Forms(H. Lieberman他編)(Maecel Dekker, Inc.、New York、New York、1980年)、Remington's Pharmaceutical Sciences(A. Gennaro編、第19版)(Mack Publishing、Easton、PA、1995年)、The United States Pharmacopeia 24、The National Formulary 19(National Publishing、Philadelphia、PA、2000年)、A.J. Spiegel他、Use of Nonaqueous Solvents in Parenteral Products、JOURNAL OF PHARMACEUTICAL SCIENCES、第52巻、第10号、917頁〜927頁(1963)において明らかにされている。
好適な溶媒には、抗腫瘍化合物を安定化させることが知られている溶媒が含まれ、トリグリセリドが多いオイル(例えば、紅花油、ダイズ油またはそれらの混合物)、およびアルキレンオキシ修飾脂肪酸エステル(ポリオキシル40水素化ひまし油およびポリオキシエチル化ひまし油(例えば、Cremophor EL(登録商標)溶液またはCremophor RH40(登録商標)溶液)など)などが含まれる。市販のトリグリセリドが多いオイルには、Intralipid(登録商標)乳化ダイズ油(Kabi-Pharmacia Inc.、Stockholm、スェーデン)、Nutralipid(登録商標)エマルジョン(McGaw、Irvine、California)、Liposyn(登録商標)II 20%エマルジョン(1mlの溶液あたり、100mgの紅花油、100mgのダイズ油、12mgの卵ホスファチドおよび25mgのグリセリンを含有する20%の脂肪エマルジョン溶液;Abbott Laboratories、Chicago、Illinois)、Liposyn(登録商標)III 20%エマルジョン(1mlの溶液あたり、100mgの紅花油、100mgのダイズ油、12mgの卵ホスファチドおよび25mgのグリセリンを含有する20%の脂肪エマルジョン溶液;Abbott Laboratories、Chicago、Illinois)、ドコサヘキサエノイル基を総脂肪酸含有量に基づいて25重量%〜100重量%のレベルで含有する天然または合成のグリセロール誘導体(Dhasco(登録商標)(Martek Biosciences Corp.(Columbia、MD)から得られる)、DHA Maguro(登録商標)(Daito Enterprises(Los Angeles、CA)から得られる)、Soyacal(登録商標)およびTravemulsion(登録商標)が含まれる。エタノールは、抗腫瘍化合物を溶解して、溶液およびエマルジョンなどを調製する際に使用する好ましい溶媒である。
さらなる補助成分を、製薬分野でよく知られている様々な目的で本発明の組成物に含ませることができる。このような成分の多くは、抗腫瘍化合物の投与部位での保持を向上する性質、組成物の安定性を保護する性質、pHを制御する性質、抗腫瘍化合物の医薬製剤への加工を容易にする性質などをもたらしうる。通例、これらの成分はそれぞれが、個々に、組成物全体の約15重量%未満で存在し、好ましくは約5重量%未満であり、より好ましくは組成物全体の約0.5重量%未満である。充填剤または希釈剤などのいくつかの成分は、製剤分野で知られているように組成物全体の90重量%までを構成することができる。
そのような添加剤には、タキサンの再沈殿を防止するための凍結防止剤、表面活性剤、湿潤化剤または乳化剤(例えば、レシチン、ポリソルベート-80、プルロニック60、ポリオキシエチレンステアラート、およびポリエトキシル化ひまし油)、保存剤(例えば、p-ヒドロキシ安息香酸エチル)、微生物防腐剤(例えば、ベンジルアルコール、フェノール、m-クレゾール、クロロブタノール、ソルビン酸、チメロサールおよびパラベン)、pH調節剤または緩衝化剤(例えば、酸、塩基、酢酸ナトリウム、ソルビタンモノステアラート)、浸透圧調節剤(例えば、グリセリン)、増粘剤(例えば、モノステアリン酸アルミニウム、ステアリン酸、セチルアルコール、ステアリルアルコール、グアーゴム、メチルセルロース、ヒドロキシプロピルセルロース、トリステアリン、セチルワックスエステル、ポリエチレングリコール)、着色剤、色素、流動補助剤、不揮発性シリコーン(例えば、シクロメチコーン)、クレイ(例えば、ベントナイト)、付着剤、増量剤、風味剤、甘味剤、吸着剤、充填剤(例えば、ラクトース、スクロース、マンニトールまたはソルビトールなどの糖、セルロースあるいはリン酸カルシウム)、
希釈剤(例えば、水、生理食塩水、電解質溶液)、結合剤(例えば、トウモロコシデンプン、コムギデンプン、米デンプンまたはジャガイモデンプンなどのデンプン、ゼラチン、トラガカントゴム、メチルセルロース、ヒドロキシプロピルメチルセルロース、ナトリウムカルボキシメチルセルロース、ポリビニルピロリドン、糖、ポリマー、アラビアゴム)、崩壊剤(例えば、トウモロコシデンプン、コムギデンプン、米デンプン、ジャガイモデンプンまたはカルボキシルメチルデンプンなどのデンプン、架橋ポリビニルピロリドン、寒天、アルギン酸またはアルギン酸ナトリウムなどのその塩、クロスカルメロースナトリウムまたはクロスポビドン)、滑沢剤(例えば、シリカ、タルク、ステアリン酸またはステアリン酸マグネシウムなどのその塩、あるいはポリエチレングリコール)、コーティング剤(例えば、アラビアゴムを含む濃縮糖溶液、タルク、ポリビニルピロリドン、カルボポールゲル、ポリエチレングリコールまたは二酸化チタン)、および酸化防止剤(例えば、メタ重亜硫酸ナトリウム、重亜硫酸ナトリウム、亜硫酸ナトリウム、デキストロース、フェノール類、およびチオフェノール類)が含まれる。
上記経路による投薬形態の投与は、例えば、患者の生理学的状態、投与目的が治療的または予防的であるかどうか、および医師に知られ、そして医師によって評価される他の要因に依存して連続的または間断的であり得る。
本発明の医薬組成物を投与するための投薬量および投薬計画は、癌処置において通常の技術を有する者であれば容易に決定し得る。抗腫瘍化合物の投薬量は、被投与体の年齢、性別、健康状態および体重、併用される処置の種類(併用される場合)、処置頻度、ならびに所望する効果の性質に依存しうると理解される。どのような投与様式の場合でも、送達される抗腫瘍化合物の実際の量、そして本明細書中に記載される好都合な効果を達成するために必要な投薬スケジュールは、部分的には、抗腫瘍化合物のバイオアベイラビリティー、処置する障害、所望の処置用量、および当業者に明かな他の要因のような要因にも依存しうる。動物(特にヒト)に投与する用量は、本発明の範囲において、妥当な期間にわたって動物において所望する治療的応答が達成されるのに十分でなければならない。好ましくは、抗腫瘍化合物の有効量は、経口的または別の経路で投与されたとしても、そのような経路で投与されたときに所望する治療的応答を生じさせうる任意の量である。
好ましくは、経口投与する組成物は、1つまたはそれ以上の経口製剤における単回用量が、患者体表面積1m2あたり少なくとも20mgの抗腫瘍化合物を含有するように、あるいは患者体表面積1m2あたり少なくとも50mg、100mg、150mg、200mg、300mg、400mgまたは500mgの抗腫瘍化合物を含有するように調製する。この場合、ヒトの平均体表面積は1.8m2である。好ましくは、経口投与する組成物の単回用量は、患者体表面積1m2あたり約20mg〜約600mgの抗腫瘍化合物を含有し、より好ましくは約25mg/m2〜約400mg/m2、さらにより好ましくは約40mg/m2〜約300mg/m2、より一層好ましくは約50mg/m2〜約200mg/m2、そしてより一層好ましくは約50mg/m2〜約100mg/m2の抗腫瘍化合物を含有する。好ましくは、非経口投与する組成物は、単回用量が、患者体表面積1m2あたり少なくとも20mgの抗腫瘍化合物を含有するように、あるいは患者体表面積1m2あたり少なくとも40mg、50mg、100mg、150mg、200mg、300mg、400mgまたは500mgの抗腫瘍化合物を含有するように調製する。好ましくは、1つまたはそれ以上の非経口製剤における単回用量は、患者体表面積1m2あたり約20mg〜約500mgの抗腫瘍化合物を含有し、より好ましくは約40mg/m2〜約400mg/m2、さらにより好ましくは約60mg/m2〜約350mg/m2、そしてさらにより好ましくは約50mg/m2〜約100mg/m2の抗腫瘍化合物を含有する。しかし、投薬量は、所望する治療的効果を達成するために必要に応じて調節し得る投薬スケジュールに依存して変化し得る。本明細書中に記載する有効用量範囲は、本発明を限定するものではなく、好ましい用量範囲を表していることに留意しなければならない。最も好ましい投薬量は、被投与体毎に調節し得、そして過度な実験を行うことなく当業者が決定しうる。
液体の医薬組成物における抗腫瘍化合物の濃度は、好ましくは組成物1mlあたり約0.001mg〜約20mgの間であり、より好ましくは組成物1mlあたり約0.01mg〜約10mgの間であり、より一層好ましくは約0.1mg/ml〜約7mg/mlの間であり、さらにより好ましくは約0.1mg/ml〜約5mg/mlの間である。1つの実施形態においては、該製剤中の化学構造(1)の抗腫瘍化合物の濃度が0.15〜4mg/mlである。抗腫瘍化合物は低い濃度で溶液に最も溶解し得るために、比較的低い濃度が一般には好ましい。経口投与用の固体医薬組成物における抗腫瘍化合物の濃度は、組成物の総重量に基づいて、好ましくは約5重量%〜約50重量%の間であり、より好ましくは約8重量%〜約40重量%の間であり、最も好ましくは約10重量%〜約30重量%の間である。
1つの実施形態において、経口投与用の溶液剤を調製するために、抗腫瘍化合物を溶解し得る任意の薬学的に許容しうる溶媒(例えば、エタノールまたはポリエチレングリコール)に抗腫瘍化合物を溶解して溶液とする。界面活性剤、例えばCremophor EL(登録商標)溶液、ポリソルベート80、Solutol(登録商標)HS 15、またはVitamin E TPGSである担体の適量を攪拌下に溶液に加え、患者に経口投与するための薬学的に許容しうる溶液を形成する。得られる組成物は、約15%までのエタノールおよび/または約15%までの界面活性剤(とりわけ、これらの濃度は約7〜15体積%のエタノールと、同体積の界面活性剤でありうる)、および75〜90体積%の範囲の蒸留水を含有しうる。矯味目的で、蒸留水の一部を、希釈したチェリーまたはラズベリーシロップで置き替えることができ、好ましくは約10〜30%をシロップとし、残部を水としうる。1つの実施形態において、この製剤中の化学構造(1)の抗腫瘍化合物の濃度は2〜4mg/mlである。所望する場合、経口製剤中である濃度で投与されたときに有害な生理学的作用を生じさせることが当分野で知られているエタノールを最少量で含むように、あるいはエタノールを含まないように、前記のような溶液剤を調製しうる。好ましい実施形態において、溶液剤は、エタノール約10%、ポリソルベート80(例えばTween(登録商標)80)、ポリエトキシル化ひまし油(例えばCremophor(登録商標))およびそれらの混合物から選択する界面活性剤約10%、並びに蒸留水約80%を含有する。
別の実施形態において、経口投与用の粉末剤または錠剤を調製するために、抗腫瘍化合物を溶解し得る任意の薬学的に許容しうる溶媒(例えば、エタノールまたはポリエチレングリコール)に抗腫瘍化合物を溶解して溶液とする。必要に応じ、溶液を減圧下に乾燥させて溶媒を蒸発させることができる。Cremophor EL(登録商標)溶液などのさらなる担体を乾燥前の溶液に加えることができる。得られた溶液を減圧下に乾燥し、ガラス状物とする。その後、ガラス状物を結合剤と混合し、粉末剤とする。粉末剤を、患者に経口投与する錠剤を調製するために、充填剤または他の従来の錠剤化剤と混合し、加工しうる。粉末剤を上記のような任意の液体担体に入れて、経口投与用の溶液、エマルジョン、懸濁剤などを調製してもよい。
非経口投与用のエマルジョン剤を調製するためには、抗腫瘍化合物を溶解し得る任意の薬学的に許容しうる溶媒(例えば、エタノールまたはポリエチレングリコール)に抗腫瘍化合物を溶解して溶液としうる。Liposyn(登録商標)II、Liposyn(登録商標)III、またはIntralipid(登録商標)エマルジョンなどのエマルジョンである担体の適量を攪拌下に溶液に加えて、患者に非経口投与する薬学的に許容しうるエマルジョンを調製する。得られる組成物は例えば、約10%までのエタノールおよび/または約90%を越える担体(とりわけ、この濃度は約5〜10体積%のエタノールと、約90〜95体積%の担体でありうる)を含有しうる。1つの実施形態において、この投与液剤中の化学構造(1)の抗腫瘍化合物の濃度は約1〜2mg/mlである。所望する場合、非経口製剤中である濃度で投与されたときに有害な生理学的作用を生じさせることが当分野で知られているエタノールまたはCremophor(登録商標)溶液を最少量で含むように、あるいはエタノールまたはCremophor(登録商標)溶液を含まないように、前記のようなエマルジョンを調製しうる。好ましい実施形態において、エマルジョンは、約5%のエタノール、および約95%の担体(例えばIntralipid(登録商標)20%、Liposyn(登録商標)II 20%、またはそれらの混合物)を含有する。この好ましい実施形態において、エマルジョンは、有害な生理学的作用を引き起こすことが知られている剤、例えばポリエトキシル化ひまし油(例えばCremophor(登録商標))およびポリソルベート80(例えばTween(登録商標)80)を含有しない。
非経口投与用の溶液剤を調製するために、抗腫瘍化合物を溶解し得る任意の薬学的に許容しうる溶媒(例えば、エタノールまたはポリエチレングリコール)に抗腫瘍化合物を溶解して溶液としうる。界面活性剤、例えばCremophor(登録商標)溶液、ポリソルベート80、またはSolutol(登録商標)HS15である担体の適量を攪拌下に溶液に加え、患者に非経口投与するための薬学的に許容しうる溶液を形成する。得られる組成物は例えば、約10%までのエタノールおよび/または約10%までの界面活性剤(とりわけ、この濃度は約5〜10体積%のエタノールと、同体積の界面活性剤でありうる)、および80〜90体積%の範囲の生理食塩液を含有しうる。所望する場合、非経口用製剤中である濃度で投与されたときに有害な生理学的作用を生じさせることが当分野で知られているエタノールまたはCremophor(登録商標)溶液を最少量で含むように、あるいはエタノールまたはCremophor(登録商標)溶液を含まないように、上記のような溶液剤を調製しうる。好ましい実施形態において、溶液剤は、エタノール約5%、ポリソルベート80(例えばTween(登録商標)80)またはポリエトキシル化ひまし油(例えばCremophor(登録商標))約5%、および生理食塩液(0.9%塩化ナトリウム)約90%を含有する。起こりうる副作用(例えば過敏性反応)を抑制または排除するために、この実施形態の投与を受ける患者には、好ましくはデキサメタゾン、ジフェンヒドラミンまたは該副作用を抑制もしくは排除することが当分野で知られている任意の他の剤で前処置する。
他の適当な非経口製剤は、リポソームを包含する。リポソームは通例、脂質化合物を含む両親媒性化合物の球形または楕円形のクラスターまたは凝集体で、通例1つまたはそれ以上の同心層、例えば単層または二層の形態である。リポソームはイオン性または非イオン性脂質から調製しうる。非イオン性脂質のリポソームは、ニオソームとも称される。リポソームに関する参考文献は下記のものを包含する:(a) Liposomes Second Edition: A Practical Approach, V. TorchillinおよびV. Weissig編, Oxford University Press, 2003; (b) M. Malmstein, Surfactants and Polymers in Drug Delivery, Marcel Dekker Inc., 2002; および(c) Mullerら, Emulsions and Nanosuspensions for the Formulation of Poorly Soluble Drugs, Medpharm Scientific Publishers, 1998。
所望する場合、経口投与または非経口投与用の上記エマルジョン剤または溶液剤は、この分野で知られているように、濃縮された形態で、IVバッグ、バイアルまたは他の従来の容器に入れることができ、そして使用前に許容しうるタキサン濃度が得られるように、生理食塩水などの任意の薬学的に許容しうる液体で希釈することができる。
略号および定義
本発明をより一層明確にすると共に、本発明を実施する当業者の指針となるように、以下に定義および方法を記載する。別段の注記がない限り、用語は当業者による従来の用法に従って理解されるものとする。
本発明をより一層明確にすると共に、本発明を実施する当業者の指針となるように、以下に定義および方法を記載する。別段の注記がない限り、用語は当業者による従来の用法に従って理解されるものとする。
立体異性体に関し、化合物のキラル炭素原子への置換基の結合について、式(1)(および本明細書に記載する他の式)で示される化合物における結合の、実線による指定は、それらの基がそのページの平面よりも下または上に存在しうることを示す。
本明細書に開示する化合物の異性体は、ラセミ体、ラセミ混合物、および個々のエナンチオマーまたはジアステレオマーを含めて、全て考えられる。
本明細書において単独でまたは別の基の一部として使用される用語「アセタール」および「ケタール」は、それぞれ次の式によって表される部分を意味する:
[式中、X1およびX2は、独立して、ヒドロカルビル、置換ヒドロカルビル、ヘテロシクロ、またはへテロアリールであり、X3はヒドロカルビルまたは置換ヒドロカルビルであって、各基名は当該用語に関して定義するとおりである。また波線は、別の部分または化合物への当該アセタール部分またはケタール部分の結合点を表す]。
本明細書において単独でまたは別の基の一部として使用される用語「アシル」は、有機カルボン酸の-COOH基からヒドロキシル基を除去することによって形成される部分、例えばX4C(O)-(式中、X4は、X1、X1O-、X1X2N-、またはX1S-であり、X1はヒドロカルビル、ヘテロ置換ヒドロカルビル、またはヘテロシクロであり、X2は水素、ヒドロカルビルまたは置換ヒドロカルビルである)を示す。典型的なアシル部分には、アセチル、プロピオニル、ベンゾイル、ピリジニルカルボニルなどがある。
本明細書において単独でまたは別の基の一部として使用される用語「アシルオキシ」は、酸素結合(-O-)を介して結合された上述のアシル基、例えばX4C(O)O-(式中、X4は用語「アシル」に関して定義したとおりである)を示す。
本明細書において単独でまたは別の基の一部として使用される用語「アルコキシ」は、-OX5基(式中、X5は用語「アルキル」に関して定義するとおりである)を示す。典型的なアルコキシ部分には、メトキシ、エトキシ、プロポキシ、または2-プロポキシ、n-、イソ-、またはt-ブトキシなどがある。
本明細書において単独でまたは別の基の一部として使用される用語「アルケノキシ」は-OX6基(式中、X6は用語「アルケニル」に関して定義するとおりである)を示す。典型的なアルケノキシ部分には、エテノキシ、プロペノキシ、ブテノキシ、ヘキセノキシなどがある。
本明細書において単独でまたは別の基の一部として使用される用語「アルキノキシ」は、-OX7基(式中、X7は用語「アルキニル」に関して定義するとおりである)を示す。典型的なアルキノキシ部分には、エチノキシ、プロピノキシ、ブチノキシ、ヘキシノキシ、などがある。
別段の表示がない限り、本明細書に記載するアルキル基は、好ましくは、主鎖中に1〜8個の炭素原子を含有し、最大20個の炭素原子を含む、低級アルキルである。それらは直鎖、分枝鎖または環状であることができ、メチル、エチル、プロピル、イソプロピル、ブチル、ヘキシルなどが、これに含まれる。
本明細書において単独でまたは別の基の一部として使用される用語「シクロアルキル」は、炭素原子数が3〜10の環状飽和一価架橋または非架橋炭化水素基を示す。典型的なシクロアルキル部分には、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、またはアダマンチルがある。さらに、場合によっては、1個または2個の環炭素原子を-CO-基で置き換えてもよい。
別段の表示がない限り、本明細書に記載するアルケニル基は、好ましくは、主鎖中に2〜8個の炭素原子を含有し、最大20個の炭素原子を含む、低級アルケニルである。それらは直鎖、分枝鎖または環状であることができ、エテニル、プロペニル、イソプロペニル、ブテニル、イソブテニル、ヘキセニルなどが、これに含まれる。
別段の表示がない限り、本明細書に記載するアルキニル基は、好ましくは、主鎖中に2〜8個の炭素原子を含有し、最大20個の炭素原子を含む、低級アルキニルである。それらは直鎖または分枝鎖であることができ、エチニル、プロピニル、ブチニル、イソブチニル、ヘキシニルなどが、これに含まれる。
本明細書において単独でまたは別の基の一部として使用される用語「アミン」または「アミノ」は、式-N(X8)(X9)の基(式中、X8およびX9は、独立して、水素、ヒドロカルビル、置換ヒドロカルビル、ヘテロアリール、またはヘテロシクロであるか、X8とX9が全体として、典型的には環内に3〜8個の原子を持つ、置換または無置換脂環式、アリール、または複素環式部分を形成する(各基名は当該用語に関して定義するとおりである))を表す。例えば「置換アミン」は、X8およびX9の少なくとも一方が水素以外である、式-N(X8)(X9)の基を指す。例えば「無置換アミン」は、X8およびX9がどちらも水素である、式-N(X8)(X9)の基を指す。
本明細書において単独でまたは別の基の一部として使用される用語「アミド(amido)」または「アミド(amide)」は、式-CON(X8)(X9)の基(式中、X8およびX9は用語「アミン」または「アミノ」に関して定義したとおりである)を表す。例えば「置換アミド」は、X8およびX9の少なくとも一方が水素以外である、式-CON(X8)(X9)の基を指す。例えば「無置換アミド」は、X8およびX9がどちらも水素である、式-CON(X8)(X9)の基を指す。
本明細書において単独でまたは別の基の一部として使用される用語「アリール」または「Ar」は、置換されていてもよい同素環式芳香族基、好ましくは環部分に6〜12個の炭素を含む単環式または二環式基、例えばフェニル、ビフェニル、ナフチル、置換フェニル、置換ビフェニルまたは置換ナフチルなどを示す。フェニルおよび置換フェニルは、より好ましいアリールである。
本明細書において単独でまたは別の基の一部として使用される用語「アルカリール」または「アルキルアリール」は、-(アリーレン)-X11基(式中、X11は用語「アルキル」に関して定義したとおりである)を示す。
本明細書において単独でまたは別の基の一部として使用される用語「シアノ」は、式-CNの基を示す。
別段の表示がない限り、本明細書において単独でまたは別の基の一部として使用される用語「エステル」は、式-COOX12の基(式中、X12はアルキルまたはアリールであり、各基名は当該用語に関して定義するとおりである)を示す。
本明細書において単独でまたは別の基の一部として使用される用語「エーテル」は、2つの炭素原子に結合した酸素原子を含有する化合物または部分を包含する。例えばエーテルには、アルコキシ基で置換されたアルキル、アルケニル、またはアルキニル基を指す「アルコキシアルキル」が含まれる。
本明細書で使用する用語「炭化水素」および「ヒドロカルビル」は、炭素および水素の元素だけからなる有機化合物または有機基を示す。これらの部分には、アルキル、アルケニル、アルキニル、およびアリール部分が含まれる。これらの部分には、他の脂肪族または環状炭化水素基で置換されたアルキル、アルケニル、アルキニル、およびアリール部分、例えばアルカリール、アルケンアリールおよびアルキンアリールなども含まれる。別段の表示がない限り、これらの部分は、好ましくは、1〜20個の炭素原子を含む。
本明細書において単独でまたは別の基の一部として使用される用語「ハライド」、「ハロゲン」または「ハロ」は、塩素、臭素、フッ素、およびヨウ素を指す。
用語「ヘテロ原子」は、炭素および水素以外の原子を意味するものとする。
用語「ヘテロ原子」は、炭素および水素以外の原子を意味するものとする。
本明細書において単独でまたは別の基の一部として使用される用語「複素芳香族」または「ヘテロアリール」は、少なくとも1つの環に少なくとも1つのヘテロ原子を持ち、好ましくは各環に5個または6個の原子を持つ、置換されていてもよい芳香族基を示す。複素芳香族基は、好ましくは、1個または2個の酸素原子、1個または2個の硫黄原子、および/または1個もしくは4個の窒素原子を環内に持ち、炭素原子またはヘテロ原子を介して分子の残りの部分に結合することができる。典型的な複素芳香族には、フリル、チエニル、ピリジル、オキサゾリル、ピロリル、インドリル、キノリニル、またはイソキノリニルなどがある。典型的な置換基には次に挙げる基の1つ以上がある:ヒドロカルビル、置換ヒドロカルビル、ケト(すなわち=O)、ヒドロキシ、保護ヒドロキシ、アシル、アシルオキシ、アルコキシ、アルケノキシ、アルキノキシ、アリールオキシ、ハロゲン、アミド、アミノ、ニトロ、シアノ、チオール、ケタール、アセタール、エステルおよびエーテル。
本明細書において単独でまたは別の基の一部として使用される用語「ヘテロシクロ」または「複素環式」は、少なくとも1つの環内に少なくとも1つのヘテロ原子を持ち、各環内に好ましくは5個または6個の原子を持つ、置換されていてもよい完全飽和または不飽和単環式または二環式芳香族または非芳香族基を示す。ヘテロシクロ基は、好ましくは、環内に1個または2個の酸素原子、1個または2個の硫黄原子、および/または1〜4個の窒素を持ち、炭素原子またはヘテロ原子を介して分子の残りの部分に結合することができる。典型的なヘテロシクロには、複素芳香族、例えばフリル、チエニル、ピリジル、オキサゾリル、ピロリル、インドリル、キノリニル、またはイソキノリニルなどがある。典型的な置換基には次に挙げる基の1つ以上がある:ヒドロカルビル、置換ヒドロカルビル、ケト、ヒドロキシ、保護ヒドロキシ、アシル、アシルオキシ、アルコキシ、アルケノキシ、アルキノキシ、アリールオキシ、ハロゲン、アミド、アミノ、ニトロ、シアノ、チオール、ケタール、アセタール、エステルおよびエーテル。
本明細書で使用する用語「ヒドロキシ保護基」は、遊離ヒドロキシル基を保護し(「保護ヒドロキシ」)、保護を要した反応の後で、その分子の残りの部分を損なわずに除去することができる基を示す。ヒドロキシル基用のさまざまな保護基とその合成は、T. W. GreeneおよびP. G. M. Wuts著「Protective Groups in Organic Synthesis」第3版(John Wiley and Sons、1999)に見いだすことができる。典型的なヒドロキシ保護基にはメトキシメチル、1-エトキシエチル、ベンジルオキシメチル、(β-トリメチルシリルエトキシ)メチル、テトラヒドロピラニル、2,2,2-トリクロロエトキシカルボニル、t-ブチル(ジフェニル)シリル、トリアルキルシリル、ジメチルフェニルシリル、トリクロロメトキシカルボニルおよび2,2,2-トリクロロエトキシメチルがある。
本明細書において単独でまたは別の基の一部として使用される用語「ヒドロキシ」は、式-OHの基を示す。
本明細書において単独でまたは別の基の一部として使用される用語「ケト」は、二重結合した酸素部分(すなわち=O)を示す。
本明細書において単独でまたは別の基の一部として使用される用語「ニトロ」は、式-NO2の基を示す。
本明細書にいう「置換ヒドロカルビル」部分は、炭素原子以外の少なくとも1つの原子で置換されたヒドロカルビル部分、例えば炭素鎖原子が窒素、酸素、ケイ素、リン、ホウ素、硫黄、またはハロゲン原子などのヘテロ原子で置換されている部分である。これらの置換基には、ハロゲン、ヘテロシクロ、アルコキシ、アルケノキシ、アルキノキシ、アリールオキシ、ヒドロキシ、保護ヒドロキシ、ケト、アシル、アシルオキシ、ニトロ、アミノ、アミド、ニトロ、シアノ、チオール、ケタール、アセタール、エステル、エーテル、およびチオエーテルがある。
本明細書において単独でまたは別の基の一部として使用される用語「チオエーテル」は、2つの異なる炭素原子またはヘテロ原子に結合した硫黄原子(すなわち-S-)を含有する化合物および部分を示し、2つの硫黄原子が互いに結合していて、そのそれぞれが炭素原子またはヘテロ原子にも結合しているもの(すなわちジチオエーテル(-S-S-))を含有する化合物および部分も包含する。チオエーテルの例には、アルキルチオアルキル、アルキルチオアルケニル、およびアルキルチオアルキニルがあるが、これらに限るわけではない。用語「アルキルチオアルキル」は、アルキル基に結合している硫黄原子に結合したアルキル、アルケニル、またはアルキニル基を持つ化合物を包含する。同様に用語「アルキルチオアルケニル」および「アルキルチオアルキニル」は、アルキニル基に共有結合している硫黄原子にアルキル、アルケニル、またはアルキニル基が結合している化合物または部分を指す。
本明細書において単独でまたは別の基の一部として使用される用語「チオール」は、式-SHの基を示す。
本明細書では、「Ac」はアセチルを意味し、「Bz」はベンゾイルを意味し、「TES」はトリエチルシリルを意味し、「TMS」はトリメチルシリルを意味し、「LAH」は水素化アルミニウムリチウムを意味し、「10-DAB」は10-デスアセチルバッカチンIIIを意味し、「THF」はテトラヒドロフランを意味し、「DMAP」は4-ジメチルアミノピリジンを意味し、「LHMDS」または「LiHMDS」はリチウムヘキサメチルジシラジドを意味し、「TESCl」はトリエチルシリルクロリドを意味し、「TMSCl」はトリメチルシリルクロリドを意味し、「DMF」はN,N-ジメチルホルムアミドを意味し、「MOP」は2-メトキシプロペンを意味し、「LDA」はリチウムジイソプロピルアミドを意味し、「-OSiEt3」は-O-トリエチルシリルを意味し、「-O-SiMe3」は-O-トリメチルシリルを意味し、「nBuLi」または「BuLi」はn-ブチルリチウムを意味し、「DME」はジメトキシエタンを意味し、「ACN」はアセトニトリルを意味し、「cPr」はシクロプロピルを意味し、「cPent」はシクロペンチルを意味し、「cPentO」はシクロペンチルオキシカルボニルを意味し、「cBoc」はシクロブトキシカルボニルを意味する。
本発明を詳細に説明したので、本願特許請求の範囲に定義する本発明の範囲から逸脱することなく、変更および改変が可能であることは明らかだろう。さらにまた、本明細書の実施例はいずれも限定を意図しない実施例として記載されることを理解すべきである。
10-DAB(10.00g、18.36mmol)を、無水DMFに、窒素下で磁気撹拌しながら、6.0mL/g(60.0mL)の割合で、3当量のDMAP(6.73g、55.09mmol)と一緒に溶解した。その透明な帯黄色溶液に、周囲温度(22〜25℃)で、1.05当量のクロロトリエチルシラン(2.91g、19.28mmol)を約15分かけて滴下した。1時間後、HNMR反応モニタリングにより、出発物質10-DABの約3%が未反応のまま残っていることが示された。3.8%のクロロトリエチルシランを調整量として加え、反応をほぼ完了させるために2時間撹拌したところ、約1%の出発物質が未反応のまま残った。この反応に1.05当量のシクロプロパンカルボニルクロリド(2.02g、19.28mmol)を周囲温度で約30分かけて加えた。18時間撹拌した後、HNMRモニタリングにより、約1.5%の7-TES-10-DABが未反応のまま残っていることが示された。2.6%のシクロプロパンカルボニルクロリドを調整量として加え、さらに2時間撹拌したところ、TLC(2:3 E:H)では、反応がほぼ完了していた。次に反応混合物を約800mLの氷冷水中に0℃で撹拌しながら注ぎ込んだ。1.0時間後、固形生成物を減圧濾過によって集めた。濾過ケーキを冷水で洗浄し、約400mLの酢酸エチルに溶解した。酢酸エチル溶液を分液漏斗に移し、水、飽和NaHCO3溶液およびブラインで洗浄し、Na2SO4で乾燥し、濾過し、濃縮することにより、15.4759gの粗生成物を得た。この粗製物を、3:2 E:Hを使って、短いシリカゲルのパッドで濾過した。濾液を濃縮することにより、13.5239gの生成物を91.9%のHPLC純度で得た。この生成物を還流下の酢酸エチル(8.0mL/g)に溶解し、次にヘキサン類(16mL/g)を加えた。結晶化した生成物のスラリーを室温まで冷却し、さらに0℃に冷却した。白色結晶生成物をブフナー漏斗で集め、氷冷酢酸エチル:ヘキサン類(1:4 E:H)で洗浄した。濾過ケーキを減圧乾燥してから、減圧下でオーブン乾燥(78℃および<0.1mmHg)することにより、10.34gの生成物(14.22mmol、77.46%)を97.4%のHPLC純度で得た。
実施例1の手法を使って、10.00gの10-DABをトリエチルクロロシランおよび塩化プロピオニルとDMAPの存在下で反応させることにより、7.94gの10-プロピオニル-7-TES-10-DAB(収率60.5%)を95.8%のHPLC純度で得た。
10-cPr-7-TES-10-DAB(209mg、0.287mmol)およびN-cPentO-(O-MOP)-SIT302(111mg、0.316mmol)の無水テトラヒドロフラン(8mL)溶液に、窒素下で磁気撹拌しながら、-45℃において、0.316mL(0.316mmol)のリチウムヘキサメチルジシラジドを投入し、4時間撹拌した。反応を1mLの炭酸水素ナトリウム水溶液でクエンチし、10mLの酢酸エチルで希釈した。その混合物を各10mLのH2O、炭酸水素ナトリウム、およびブラインで洗浄し、硫酸ナトリウムで乾燥した。溶媒を減圧下で除去し、その粗固形物をフラッシュクロマトグラフィーで精製することにより、250mgの2'-MOP-7-TES-17932(80.6%)を得た。
10-Pr-7-TES-10-DAB(7.72g、10.81mmol)およびN-cPentO-(O-MOP)-SIT302(4.59g、12.98mmol)の無水テトラヒドロフラン(70mL)溶液に、-45℃で、12.97mL(12.97mmol)のリチウムヘキサメチルジシラジドを投入し、1.5時間撹拌した。反応を15mLの炭酸水素ナトリウム水溶液でクエンチし、50mLのH2O、50mLの炭酸水素ナトリウムおよび50mLのブラインで洗浄した。有機層を70mLのヘプタンで希釈し、塩基処理したシリカゲルのプラグで濾過した。残留生成物を酢酸エチル/ヘプタンの1:1混合物200mLでプラグカラムからフラッシュした。溶媒を減圧除去することにより、15.08gの粗泡状物を得た。酢酸エチル/ヘプタン(1:1)からの結晶化により、9.6gの2'-MOP-7-TES-18926を白色固形物(83%)として得た。
10-シクロプロパンカルボキシル-7-TES-10-DAB(8.00g、11.00mmol)を、無水THFに、窒素下で磁気撹拌しながら、0.13M(84.7mL)の濃度で溶解した。その透明な溶液に、-45℃で、1.14当量の1.0Mリチウムビス(トリメチルシリル)アミド(2.10g、12.55mmol)/THF溶液を、約10〜15分かけて加えた。その溶液を-45℃で45分間撹拌した。この溶液に、-45℃で、1.14当量のN-cBoc-(O-MOP)-SIT302(4.26g、12.55mmol)の溶液を約5〜10分かけて加え、次に-5℃〜-10℃で撹拌した。TLC(2:3 E:H)分析によると、カップリングは約3時間で完了した。反応を15mLの飽和炭酸水素ナトリウム水溶液でクエンチし、150mLの酢酸エチル150mlで抽出し、50mLのブラインで洗浄し、硫酸ナトリウムで乾燥し、濾過した。濾液を濃縮することにより、14.76gの粗生成物を得た。この粗製物を、1:2.5 E:Hおよび1%トリエチルアミンを使ってプラグ濾過した。濾液を減圧下で濃縮することにより、11.65gの生成物を得た。さらに、IPA(5ml/g+1%トリエチルアミン)を使って生成物を再結晶し、減圧下(<0.1mmHg)で恒量になるまで乾燥して、10.51g(9.86mmol、89.60%)を得た。
実施例6:2'-MOP-7-TES-19244
上述のLHMDSカップリング法を使って、2'-MOP-7-TES-19244を、10-プロピオニル-7-TES-10-DABおよびN-cBoc-(O-MOP)-SIT302から製造した。
2'-MOP-7-TES-18926(9.6g、8.98mmol)のアセトニトリル(70mL)溶液に、25mLの0.2N HClを室温で加えた。24時間撹拌した後、反応を70mLの酢酸エチルで希釈し、各50mLのH2O、炭酸水素ナトリウム、およびブラインで洗浄した。有機層を、シリカゲルのパッドに通し、150mLの酢酸エチルでフラッシュした。溶媒を減圧下で除去し、粗生成物を酢酸エチル:ヘプタン(1:1)から結晶化することにより、6.09gの化合物18926(76.9%)を得た。
上述の脱保護法を使って、10.51g(9.86mmol)の2'-MOP-7-TES-18365を0.2M HCl/アセトニトリルで処理し、酢酸エチル:ヘプタン(5.8:11.7mL/g)からの再結晶後に、8.08gの化合物18365を97.09%のHPLC純度で得た。
上述の脱保護法を使って、10.61g(10.07mmol)の2'-MOP-7-TES-19244を0.2M HCl/アセトニトリルで処理し、酢酸エチル:ヘプタン(6.0:11.0mL/g)からの再結晶後に、5.70g(6.57mmol、65%)の化合物19244を、97.59%のHPLC純度で得た。
0℃の、ヘキサメチルジシラザン(HMDS、230mL、1.1mol)の無水ジメトキシエタン(100mL)溶液に、2.5M n-ブチルリチウム溶液(nBuLi、400mL、1.0mol)を、反応温度が40℃未満に維持されるように、20分かけて加えた。添加後、2-チオフェンカルボキサルデヒド(112.15g、1.0mol)を反応混合物に、反応温度が40℃未満に維持されるように、30分かけて加えた。添加が完了した後、混合物を0℃に冷却し、トリス(トリメチルシロキシ)エチレン(322g、1.1mol)を加え、出発エチレン物質の消失により反応が完了したと決定されるまで(48時間)、混合物を撹拌した。反応混合物をトリメチルシリルクロリド(TMSCl、108.16g、1.0当量)でクエンチし、ヘキサン類(500mL)で希釈した。リチウム塩を焼結濾過器で濾去した。濾液を濃縮することにより、固形物を得た。ヘキサン類(500mL)を加え、その混合物を0℃で45分間撹拌してから、ブフナー漏斗で収集した。濾過ケーキを冷ヘキサン類で洗浄することにより、粗製(214.5g)ラセミ中間体ビス-(トリメチルシリル)-SIT302のオフホワイト固形物を得た。
ビス-シリル化中間体を無水メタノール(500mL)にとり、2つのトリメチルシリル保護基を除去するために、周囲温度の20〜24℃において触媒量のトリメチルシリルクロリド(5.4g、0.05mol)で処理した。TLC(3:1 酢酸エチル:ヘキサン類)でモニターしたところ、脱シリル化は1時間で完了して、最終生成物(Rf約0.2)を与えた。反応混合物をトリエチルアミン(12.7mL)で塩基性にし、濃縮することにより、結晶性生成物のスラリーを得た。酢酸エチル(500mL)を加え、濃厚なスラリーになるまで40℃で濃縮した後、周囲温度(20〜24℃)に冷却した。結晶を減圧濾過によってブフナー漏斗で集め、冷酢酸エチルで洗浄し、恒量になるまで乾燥して、74.5g(44%)のラセミSIT302を得た。第2クロップの分離は試みなかった。
0〜5℃において窒素下で機械的に撹拌したアセトニトリル中のラセミSIT302(846g、5.0mol)およびN-Boc-プロリン無水物(1132g、2.75mol、Benoiton N. L.ら, Synthesis 1978, 928)の透明な無水溶液に、速度論的に制御されるエステル化が触媒されるように、N-メチルベンゾイミダゾール(6.6g、0.05mol)を加えた。0〜5℃で24時間の撹拌後に、TLC(3:1 E/H、CAM染色)とHNMRモニタリングにより、エステル対アルコール比が37:63であることが示された。1%のN-メチルベンゾイミダゾール(6.6g、0.05mol)を追加することで、さらに24時間の撹拌後に、この比を50:50に到達させた。混合物を周囲温度まで温め、溶媒を減圧下で除去した後、酢酸エチル(4L)を加えた。混合物をさらに濃縮して、約1.50Lの溶媒を除去した。混合物を20〜22℃の周囲温度で1時間放置してから、結晶を減圧濾過によって集め、冷酢酸エチルで洗浄した。結晶を、252g(収率60%)の恒量に達するまで乾燥して、99.4%の光学純度を得た。母液をさらに処理し、3%酢酸/水で洗浄し、体積が約1Lになるまで酢酸エチルを濃縮することにより、結晶の第2クロップ(99.1%の光学純度で52g)を得た。合わせた総収率は71.9%で、光学および化学純度は>99%だった。
-45℃のトリホスゲン(5.5g、18.54mmol)のトルエン(45.0mL)溶液に、ジイソプロピルエチルアミン(0.89mL、5.15mmol)を窒素雰囲気下で滴下した。その混合物にシクロペンタノール(4.72mL、51.5mmol)を滴下し、1時間撹拌した。シクロペンチルクロロホルメート形成の進行をNMRでモニターした。別のフラスコで、3.5g(20.68mmol)のSIT302を、窒素雰囲気下で100mLの無水テトラヒドロフランに溶解し、-10℃に冷却した。この溶液にp-トルエンスルホン酸(196mg、1.03mmol)を加え、次に2.37mL(24.81mmol)の2-メトキシプロペンを滴下した。10分後に、ワンポット反応の第1ステップが完了した。その溶液をトリエチルアミン(8.6mL、62.04mmol)およびDMAP(500mg、4.09mmol)で塩基性にし、0℃に温めた。反応に、シクロペンチルホルメートのトルエン溶液31.02mL(31.02mmol)を投入し、室温まで徐々に温めた。5時間撹拌した後、100mLのヘプタンを加え、その有機混合物を100mLのH2O、100mLの炭酸水素ナトリウム水溶液、および100mLのブラインで洗浄した。有機層をトリエチルアミン塩基処理したシリカゲルのパッドに通し、酢酸エチル/ヘプタンの1:1混合物200mLでフラッシュした。溶媒を蒸発させると結晶が形成されて、5.75gのN-cPentO-(O-MOP)-SIT302(78.8%)を得た。
実施例14:O-MOP-N-シクロブトキシカルボニル-SIT302
上述の手法を使って、N-cBoc-(O-MOP)-SIT302を、1%トリエチルアミンを含有するヘキサン類からの再結晶後に、69.45%の収率で得た。
実施例15:MTTアッセイを使った化合物18926、19244、17932および18365とパクリタキセルおよびドセタキセルとのインビトロ細胞毒活性の比較
細胞毒性およびIC50の決定
化合物18926、18365、17932、19244、パクリタキセル(PTX、1)およびドセタキセル(TXT、2)を、それらがAmerican Type Tissue Cultureから得られる次の細胞株:MALME-3(ヒト皮膚メラノーマ)、MSTO-211H(ヒト胸膜中皮腫)、HT29(ヒト大腸腺癌)、DLD-1(ヒト大腸腺癌)、PANC-1(ヒト膵腺癌)、A549(ヒト肺癌)、A375(ヒト皮膚メラノーマ)、786-0(ヒト腎細胞腺癌)、SK-MEL-28(ヒト皮膚メラノーマ)、およびNCI DCTD Tumor/Cell Line Repositoryから得られる次の細胞株:SNB-19(ヒト脳膠芽腫)、HOP-18(ヒト肺NSCLC)、OVCAR4(ヒト卵巣癌)およびOVCAR5(ヒト卵巣癌)、TK-10(腎細胞癌)の増殖に及ぼす作用について分析した。化合物17932はこれらの細胞株のうち4つで試験し、残りの化合物はこれらの細胞株の全てで試験した。全ての細胞株を、RPMI-1640組織培養培地(TCM、抗生物質および10%ウシ胎仔血清を添加したもの)で維持し、5%CO2を含有する湿潤空気中、37℃で培養した。試験化合物の抗増殖効果を評価するために、172μLの腫瘍細胞懸濁液(1.45×104細胞/ml)を96穴プレートの各ウェルに加え、細胞を付着させるために、空気中の5%CO2下、37℃で24時間インキュベートした。別の96穴プレートでTCM/DMSOでの2倍薬物希釈を3つ一組にして7回行い、腫瘍細胞を含むウェルに28μLを移した(最終体積200μL/0.1%DMSO)。プレートを72時間インキュベートし、細胞生存度を決定するために、5mg/mL MTT(3-[4,5-ジメチルチアゾル-2-イル]-2,5-ジフェニルテトラゾリウムブロミド)を含む50μLの温かいTCMを各ウェルに加え、37℃で1時間インキュベートした。プレートを処理し、得られた溶液の吸光度をプレートリーダーにより570nmで測定した。(ブランクウェルを差し引いた後で)試験ウェルの吸光度を薬物非含有ウェルの吸光度で割り、無処理培養物の吸光度を50%にする薬剤濃度(IC50)を、データの最良適合曲線の解析(GraphPad Prism version 4.00 for Windows)によって決定した。試験はTaxolog, Inc.(フロリダ州タラハシー)によって行われた。
細胞毒性およびIC50の決定
化合物18926、18365、17932、19244、パクリタキセル(PTX、1)およびドセタキセル(TXT、2)を、それらがAmerican Type Tissue Cultureから得られる次の細胞株:MALME-3(ヒト皮膚メラノーマ)、MSTO-211H(ヒト胸膜中皮腫)、HT29(ヒト大腸腺癌)、DLD-1(ヒト大腸腺癌)、PANC-1(ヒト膵腺癌)、A549(ヒト肺癌)、A375(ヒト皮膚メラノーマ)、786-0(ヒト腎細胞腺癌)、SK-MEL-28(ヒト皮膚メラノーマ)、およびNCI DCTD Tumor/Cell Line Repositoryから得られる次の細胞株:SNB-19(ヒト脳膠芽腫)、HOP-18(ヒト肺NSCLC)、OVCAR4(ヒト卵巣癌)およびOVCAR5(ヒト卵巣癌)、TK-10(腎細胞癌)の増殖に及ぼす作用について分析した。化合物17932はこれらの細胞株のうち4つで試験し、残りの化合物はこれらの細胞株の全てで試験した。全ての細胞株を、RPMI-1640組織培養培地(TCM、抗生物質および10%ウシ胎仔血清を添加したもの)で維持し、5%CO2を含有する湿潤空気中、37℃で培養した。試験化合物の抗増殖効果を評価するために、172μLの腫瘍細胞懸濁液(1.45×104細胞/ml)を96穴プレートの各ウェルに加え、細胞を付着させるために、空気中の5%CO2下、37℃で24時間インキュベートした。別の96穴プレートでTCM/DMSOでの2倍薬物希釈を3つ一組にして7回行い、腫瘍細胞を含むウェルに28μLを移した(最終体積200μL/0.1%DMSO)。プレートを72時間インキュベートし、細胞生存度を決定するために、5mg/mL MTT(3-[4,5-ジメチルチアゾル-2-イル]-2,5-ジフェニルテトラゾリウムブロミド)を含む50μLの温かいTCMを各ウェルに加え、37℃で1時間インキュベートした。プレートを処理し、得られた溶液の吸光度をプレートリーダーにより570nmで測定した。(ブランクウェルを差し引いた後で)試験ウェルの吸光度を薬物非含有ウェルの吸光度で割り、無処理培養物の吸光度を50%にする薬剤濃度(IC50)を、データの最良適合曲線の解析(GraphPad Prism version 4.00 for Windows)によって決定した。試験はTaxolog, Inc.(フロリダ州タラハシー)によって行われた。
実施例16:BxPC-3がん細胞株における化合物18365および19244とドセタキセル(TXT)とのインビトロ細胞毒性の比較
BxPC-3がん細胞株(供給元ATCC)と培養培地は、Oncodesign(フランス)が購入し、用意した。
BxPC-3がん細胞株(供給元ATCC)と培養培地は、Oncodesign(フランス)が購入し、用意した。
腫瘍細胞(1ウェルあたり5,000細胞)を96穴平底マイクロタイタープレート(Ref 167008、バッチ083310、Nunc、Dutscher、フランス・ブリュマト)にプレーティングし、37℃で24時間インキュベートしてから、10%FBSを含む100μlの薬物非含有RPMI1640培地中で処理した。腫瘍細胞株を10種類の濃度の試験物質およびTXT(1/2段階希釈によって40〜0.07nM)と共に72時間インキュベートした。実験を3回繰り返し、各アッセイは4つ一組にして行った。対照細胞は賦形剤のみで処理した。処理の最後に、細胞毒活性をMTTアッセイで評価した。これらの試験はOncodesign(フランス)で行われた。
実施例17:MX1ヒト腫瘍異種移植片を有するヌードマウスにおける化合物18926および18365のインビボ活性
この異種移植片試験はノースカロライナ州のPiedmont Research Center(PRC)で行われた。雌無胸腺ヌードマウス(nu/nu Harlan)は、試験の1日目(D1)に、7週齢で体重(BW)範囲は15.1〜24.6gだった。これらの動物には、水(逆浸透水、1ppm Cl)と、18.0%粗タンパク質、5.0%粗脂肪、および5.0%粗繊維からなるNIH31 Modified and Irradiated Lab Diet(登録商標)とを、自由に摂取させた。固定マイクロアイソレータ中、12時間の照明周期、21〜22℃(70〜72°F)および40〜60%の湿度で、照射ALPHA-dri(登録商標)bed-o-cobs(登録商標)実験動物用敷料上に、マウスを収容した。PRCは、拘束、飼育管理、外科手技、飼料および水分調節、ならびに獣医学的ケアに関して、実験動物の管理と使用に関する指針(Guide for Care and Use of Laboratory Animals)の勧告に厳密に従う。PRCにおける動物プログラムは、実験動物の管理と使用に関して認められている基準の遵守を保証する国際実験動物管理公認協会(AALAC International)による認証を受けている。
この異種移植片試験はノースカロライナ州のPiedmont Research Center(PRC)で行われた。雌無胸腺ヌードマウス(nu/nu Harlan)は、試験の1日目(D1)に、7週齢で体重(BW)範囲は15.1〜24.6gだった。これらの動物には、水(逆浸透水、1ppm Cl)と、18.0%粗タンパク質、5.0%粗脂肪、および5.0%粗繊維からなるNIH31 Modified and Irradiated Lab Diet(登録商標)とを、自由に摂取させた。固定マイクロアイソレータ中、12時間の照明周期、21〜22℃(70〜72°F)および40〜60%の湿度で、照射ALPHA-dri(登録商標)bed-o-cobs(登録商標)実験動物用敷料上に、マウスを収容した。PRCは、拘束、飼育管理、外科手技、飼料および水分調節、ならびに獣医学的ケアに関して、実験動物の管理と使用に関する指針(Guide for Care and Use of Laboratory Animals)の勧告に厳密に従う。PRCにおける動物プログラムは、実験動物の管理と使用に関して認められている基準の遵守を保証する国際実験動物管理公認協会(AALAC International)による認証を受けている。
腫瘍植え込み
この試験で利用されるヒトMX-1乳癌は、逐次移植により、無胸腺ヌードマウスで維持した。腫瘍片(1mm3)を各試験マウスの右わき腹の皮下に植え込んだ。腫瘍を週に2回モニターし、その後、平均体積が80〜120mm3に達したら毎日モニターした。試験のD1に、63〜144mm3の腫瘍サイズを持ち、群平均腫瘍サイズが約88mm3である処置群に、動物を分けた。腫瘍サイズ(単位:mm3)は次の式から算出した:
[式中、w=腫瘍の幅(mm)およびl=腫瘍の長さ(mm)である]。
腫瘍重量は1mgが腫瘍体積1mm3に相当すると仮定して見積もった。
この試験で利用されるヒトMX-1乳癌は、逐次移植により、無胸腺ヌードマウスで維持した。腫瘍片(1mm3)を各試験マウスの右わき腹の皮下に植え込んだ。腫瘍を週に2回モニターし、その後、平均体積が80〜120mm3に達したら毎日モニターした。試験のD1に、63〜144mm3の腫瘍サイズを持ち、群平均腫瘍サイズが約88mm3である処置群に、動物を分けた。腫瘍サイズ(単位:mm3)は次の式から算出した:
腫瘍重量は1mgが腫瘍体積1mm3に相当すると仮定して見積もった。
化合物18365および18926を、10%エタノール、10%Cremophor EL(登録商標)および80%の5%デキストロース水溶液中に調剤し、マウス20グラムあたり0.3mLの投与体積で、各マウスの体重に合わせて投与した。50%エタノールおよび50%Tween(登録商標)80にTXTを溶解して、6.67×溶液を調製し、それをD5Wで希釈して7.5%エタノールおよび7.5%Tween(登録商標)80および85%D5Wを含有する静脈内投与溶液とし、それをマウス20グラムあたり0.2mLの投与体積で、各マウスの体重に合わせて投与した。全ての薬物溶液を投与の日に新しく調製した。
処置
マウスを1群あたり5匹の群に分けた。静脈内(i.v.)処置をD1に1回施した(qd×1)。対照群1には賦形剤1を静脈内投与した。群9〜11には、それぞれ7.5、15、および30mg/kgの化合物18365を静脈内投与した。群12〜14には、それぞれ7.5、15、および30mg/kgの化合物18926を静脈内投与した。群25には25mg/kgの化合物2を静脈内投与した。
マウスを1群あたり5匹の群に分けた。静脈内(i.v.)処置をD1に1回施した(qd×1)。対照群1には賦形剤1を静脈内投与した。群9〜11には、それぞれ7.5、15、および30mg/kgの化合物18365を静脈内投与した。群12〜14には、それぞれ7.5、15、および30mg/kgの化合物18926を静脈内投与した。群25には25mg/kgの化合物2を静脈内投与した。
エンドポイント
各動物は、その新生物が所定のエンドポイントサイズ(1500mm3)に達するか、または試験の最後か、どちらか早い時点で、安楽死させた。各マウスについてエンドポイント到達時間(TTE)を次の式によって算出した。
[式中、TTEは日数で表され、エンドポイント体積はmm3の単位で表され、bは、対数変換腫瘍成長データセットの線形回帰によって得られる直線の切片であり、mはその直線の傾きである]。データセットは、試験エンドポイント体積を超えた最初の観察と、エンドポイント体積に到達する直前の3つの連続する観察とから構成される。算出されるTTEは、通常、腫瘍サイズを理由として動物を安楽死させる日よりも少ない。エンドポイントに到達しない動物には、試験最終日に相当するTTE値(61日)が割り当てられる。処置関連(TR)原因または非処置関連転移(NTRm)原因によって死亡したと分類される動物には、死亡の日に相当するTTE値が割り当てられる。非処置関連(NTR)原因によって死亡したと分類される動物は、TTE算出から除外される。処置効力は、対照群と比較した処置群のTTE中央値の増加と定義される腫瘍成長遅延(TGD):
TGD = T-C
を日数で表すか、対照群のTTE中央値に対する百分率で表したもの:
から決定した
[式中、
T=処置群のTTE中央値
C=対照群1のTTE中央値
である]。
各動物は、その新生物が所定のエンドポイントサイズ(1500mm3)に達するか、または試験の最後か、どちらか早い時点で、安楽死させた。各マウスについてエンドポイント到達時間(TTE)を次の式によって算出した。
TGD = T-C
を日数で表すか、対照群のTTE中央値に対する百分率で表したもの:
[式中、
T=処置群のTTE中央値
C=対照群1のTTE中央値
である]。
MTVおよび退縮応答の基準
処置効力を、この試験において最終日に残っている動物の腫瘍体積からも決定し、退縮応答の数からも決定した。MTV(n)は、腫瘍がエンドポイント体積に達しなかった残存動物の数nにおける、D61での腫瘍体積中央値と定義される。処置は動物中の腫瘍の部分的退縮(PR)または完全退縮(CR)を引き起こしうる。PRは、試験中の連続した3回の測定について腫瘍体積がそのD1体積の50%以下であり、それら3回の測定のうち1回以上が13.5mm3以上であったことを示す。CRは、試験中の連続した3回の測定について腫瘍体積が13.5mm3未満であったことを示す。試験終了時にCRを持つ動物はさらに無腫瘍生存例(TFS)と分類される。
処置効力を、この試験において最終日に残っている動物の腫瘍体積からも決定し、退縮応答の数からも決定した。MTV(n)は、腫瘍がエンドポイント体積に達しなかった残存動物の数nにおける、D61での腫瘍体積中央値と定義される。処置は動物中の腫瘍の部分的退縮(PR)または完全退縮(CR)を引き起こしうる。PRは、試験中の連続した3回の測定について腫瘍体積がそのD1体積の50%以下であり、それら3回の測定のうち1回以上が13.5mm3以上であったことを示す。CRは、試験中の連続した3回の測定について腫瘍体積が13.5mm3未満であったことを示す。試験終了時にCRを持つ動物はさらに無腫瘍生存例(TFS)と分類される。
毒性
動物の体重をD1〜D5は毎日測定し、その後は、試験が完了するまで週に2回測定した。有害薬物関連副作用の明白な徴候について、マウスを頻繁に調べた。最大耐用量(MTD)に関し、許容される毒性を、試験中に起こる20%未満の群平均BW減少、および10匹中1匹以下のTR死と定義した。死亡例は、それが臨床徴候および/または剖検により、処置副作用に起因すると証明されるか、投薬期間中または最後の投薬から10日以内に起こった、未知の原因によるものである場合に、TRと分類される。死亡例は、その死亡が処置副作用に関係することを示す証拠がない場合に、NTRと分類される。死亡例は、それが浸潤および/または転移による腫瘍播種の結果として起こった可能性があることを剖検が示す場合に、NTRmと分類される。対照群1には賦形剤1を静脈内投与し、TTE解析の対照として、また静脈内処置群の統計的評価のための一次対照として利用した。群1マウスのTTE中央値は32.1日だった。5匹全てのマウスにおける腫瘍が1500mm3エンドポイント体積まで成長した。したがってこの61日試験において可能な最大%TGDは90だった。結果の要約を以下に示す。
動物の体重をD1〜D5は毎日測定し、その後は、試験が完了するまで週に2回測定した。有害薬物関連副作用の明白な徴候について、マウスを頻繁に調べた。最大耐用量(MTD)に関し、許容される毒性を、試験中に起こる20%未満の群平均BW減少、および10匹中1匹以下のTR死と定義した。死亡例は、それが臨床徴候および/または剖検により、処置副作用に起因すると証明されるか、投薬期間中または最後の投薬から10日以内に起こった、未知の原因によるものである場合に、TRと分類される。死亡例は、その死亡が処置副作用に関係することを示す証拠がない場合に、NTRと分類される。死亡例は、それが浸潤および/または転移による腫瘍播種の結果として起こった可能性があることを剖検が示す場合に、NTRmと分類される。対照群1には賦形剤1を静脈内投与し、TTE解析の対照として、また静脈内処置群の統計的評価のための一次対照として利用した。群1マウスのTTE中央値は32.1日だった。5匹全てのマウスにおける腫瘍が1500mm3エンドポイント体積まで成長した。したがってこの61日試験において可能な最大%TGDは90だった。結果の要約を以下に示す。
15および30mg/kgの化合物18365(群10および11)は、D5に、それぞれ6.8%および16%の最大群平均BW減少を引き起こした。7.5、15、および30mg/kgの化合物18926(群12〜14)は、それぞれ7.6%(D3)、6.6%(D4)、および15.5%(D5)の最大群平均BW減少を引き起こした。賦形剤処置群1では全ての腫瘍が1500mm3エンドポイント体積に到達し、退縮した腫瘍はなかったことから、この腫瘍モデルは申し分なく機能した。したがって全ての生存例および退縮応答は薬物処置に起因すると考えることができた。最小有効用量は、統計的に有意な結果をもたらし、かつ少なくとも1例のD61生存例および/または少なくとも1例の退縮応答を生じた、最も低い用量と定義した。賦形剤1処置は32.1のTTE中央値をもたらした(群1)。群1のTTE中央値に基づき、この試験における最大%TGDは90ということになった。化合物18365は7.5mg/kgで有意でない活性を示した(群9)。化合物18365は15mg/kgでわずかに有効(minimally effective)であって(群10)、1例のPRおよび2例のTFSをもたらし、群平均BW減少は6.8%だった。30mg/kgレジメン(群11)は5例のTFSを生じ、群平均BW減少は16%だった。化合物18926は7.5mg/kgで有意でない活性を示した(群12)。活性はわずかに有効な15mg/kg用量で急激に増加し(群13)、これは4例のTFSを生じ、群平均BW減少は6.6%だった。30mg/kg処置(群14)は5例のTFSをもたらし、15.5%の平均BW減少を引き起こした。25mg/kg qd×1の化合物2は、1例の一過性CRおよび4例のTFSをもたらし、群平均体重減少は10.2%だった。この試験についての平均腫瘍成長を図1に示す。
実施例18:MX1ヒト腫瘍移植片を有するヌードマウスにおける化合物19244のインビボ活性
この試験は、先に述べたように、PRCで行われた。化合物19244を4日に1回のスケジュールで4回投与した。ドセタキセルは週に1回で3回投与した。試験のD1に、動物を、63〜144mm3の腫瘍サイズおよび約87mm3の群平均腫瘍サイズを持つ処置群に分けた。静脈内化合物19244は、7.5mg/kgで3例のTFSおよび2例の一過性CRを生じ、15mg/kgで5例のTFSを生じ、30mg/kgで4例のTFSおよび1例のPRを生じた。それぞれの最大群平均BW減少(D19に3.1%、7.6%、および18.9%)は、投薬量と共にほぼ倍増した。結果の要約を示す。
この試験は、先に述べたように、PRCで行われた。化合物19244を4日に1回のスケジュールで4回投与した。ドセタキセルは週に1回で3回投与した。試験のD1に、動物を、63〜144mm3の腫瘍サイズおよび約87mm3の群平均腫瘍サイズを持つ処置群に分けた。静脈内化合物19244は、7.5mg/kgで3例のTFSおよび2例の一過性CRを生じ、15mg/kgで5例のTFSを生じ、30mg/kgで4例のTFSおよび1例のPRを生じた。それぞれの最大群平均BW減少(D19に3.1%、7.6%、および18.9%)は、投薬量と共にほぼ倍増した。結果の要約を示す。
実施例19:MX1ヒト腫瘍移植片を有するヌードマウスにおける化合物19244のインビボ活性
この試験は、先に述べたように、PRCで行われた。化合物19244およびドセタキセルを1日1回のスケジュールで投与した。3匹の化合物2処置マウスがD60まで生き残り、3例の腫瘍が退縮した(1例の一過性CRおよび2例のTFS)。7.5および15mg/kgの化合物19244は、それぞれ約-3および83の%TGDをもたらし、活性は有意でなかった(ログランク検定)。これらの低用量では60日生存例または退縮は生じなかった。30mg/kgでは化合物19244が235の%TGDをもたらし、有意な活性を示した。2匹のマウスがD60まで生き残り、全ての腫瘍が退縮した(1例のPR、2例の一過性CR、および2例のTFS)。結果の要約を示す。
この試験は、先に述べたように、PRCで行われた。化合物19244およびドセタキセルを1日1回のスケジュールで投与した。3匹の化合物2処置マウスがD60まで生き残り、3例の腫瘍が退縮した(1例の一過性CRおよび2例のTFS)。7.5および15mg/kgの化合物19244は、それぞれ約-3および83の%TGDをもたらし、活性は有意でなかった(ログランク検定)。これらの低用量では60日生存例または退縮は生じなかった。30mg/kgでは化合物19244が235の%TGDをもたらし、有意な活性を示した。2匹のマウスがD60まで生き残り、全ての腫瘍が退縮した(1例のPR、2例の一過性CR、および2例のTFS)。結果の要約を示す。
実施例20:SKMESヒト腫瘍異種移植片を有するヌードマウスにおける化合物19244のインビボ活性
この試験は、先に述べたように、PRCで行われた。SKMESはヒト肺がん細胞株である。この試験では、化合物2および全ての薬剤を、静脈内単剤療法として、単回30mg/kg用量(qd×1)で投与した。5%エタノールおよび95%の20%Liposyn(登録商標)IIからなる賦形剤中に、試験薬剤を調剤した。対照マウスにはこの賦形剤をqd×1投与した。化合物2は、7.5%エタノール、7.5%Tween(登録商標)80、および85%D5W(5%デキストロース水溶液)からなる賦形剤中に調剤した。十分に定着した(約124mm3)皮下SKMES肺腫瘍を有するヌードマウス5匹ずつの群で、投与を1日目に開始した。腫瘍成長のエンドポイント体積を1,500mm3とした。試験は23日目に終了した。
この試験は、先に述べたように、PRCで行われた。SKMESはヒト肺がん細胞株である。この試験では、化合物2および全ての薬剤を、静脈内単剤療法として、単回30mg/kg用量(qd×1)で投与した。5%エタノールおよび95%の20%Liposyn(登録商標)IIからなる賦形剤中に、試験薬剤を調剤した。対照マウスにはこの賦形剤をqd×1投与した。化合物2は、7.5%エタノール、7.5%Tween(登録商標)80、および85%D5W(5%デキストロース水溶液)からなる賦形剤中に調剤した。十分に定着した(約124mm3)皮下SKMES肺腫瘍を有するヌードマウス5匹ずつの群で、投与を1日目に開始した。腫瘍成長のエンドポイント体積を1,500mm3とした。試験は23日目に終了した。
化合物19244は、このモデルでは単回投与で活性であり、1例の完全応答と1例のTFSをもたらした。
この試験についての平均腫瘍成長を図4に示す。
この試験についての平均腫瘍成長を図4に示す。
実施例21:SKMESヒト腫瘍異種移植片を有するヌードマウスにおける化合物19244のインビボ活性
PRCにおいて、化合物19244を、ヒトSKMES肺癌異種移植片に対する抗腫瘍活性について調べた。化合物19244を、5%エタノールおよび95%の20%Liposyn(登録商標)IIからなる賦形剤中、30mg/kgで、4日ごとに1日1回、4回にわたって(q4d×4)、静脈内(i.v.)投与した。対照マウスにはこの賦形剤をq4d×4投与した。陽性参照群には、7.5%エタノール、7.5%Tween(登録商標)80、および85%D5W(5%デキストロース水溶液)からなる賦形剤中の化合物2を、25mg/kgで、週に1回、3週間にわたって(q7d×3)投与した。投与は、進行した(upstaged)(約182mm3)皮下SKMES腫瘍を有するヌードマウス5匹ずつの群で、1日目に開始した。
PRCにおいて、化合物19244を、ヒトSKMES肺癌異種移植片に対する抗腫瘍活性について調べた。化合物19244を、5%エタノールおよび95%の20%Liposyn(登録商標)IIからなる賦形剤中、30mg/kgで、4日ごとに1日1回、4回にわたって(q4d×4)、静脈内(i.v.)投与した。対照マウスにはこの賦形剤をq4d×4投与した。陽性参照群には、7.5%エタノール、7.5%Tween(登録商標)80、および85%D5W(5%デキストロース水溶液)からなる賦形剤中の化合物2を、25mg/kgで、週に1回、3週間にわたって(q7d×3)投与した。投与は、進行した(upstaged)(約182mm3)皮下SKMES腫瘍を有するヌードマウス5匹ずつの群で、1日目に開始した。
化合物19244は、このモデルでは単回投与で活性であり、2例の部分的応答と3例のTFSをもたらした。
この試験についての平均腫瘍成長を図5に示す。
この試験についての平均腫瘍成長を図5に示す。
実施例22:HT29ヒト腫瘍異種移植片を有するヌードマウスにおける化合物19244のインビボ活性
PRCにおいて、化合物19244を、ヒトHT29大腸癌異種移植片に対する抗腫瘍活性について調べた。化合物19244を、5%エタノールおよび95%の20%Liposyn(登録商標)IIの賦形剤中、30mg/kgで、4日ごとに1日1回、4回にわたって(q4d×4)、静脈内(i.v.)投与した。対照マウスにはこの賦形剤をq4d×4投与した。各群のマウスは6匹だった。1つの陽性参照群には30mg/kgのパクリタキセルをq4d×4投与し、もう一つの陽性参照群には、25mg/kgの化合物2を、週に1回、3週間にわたって(q7d×3)投与した。パクリタキセルは、5%エタノール、5%Cremophor EL(登録商標)、および90%のデキストロース(5%)水溶液(D5W)中に調剤した。化合物2は、7.5%エタノール、7.5%Tween(登録商標)80、および85%D5W中に調剤した。投与は、進行した(約259mm3)皮下HT29腫瘍を有するヌードマウス6匹ずつの群で、1日目に開始した。腫瘍成長のエンドポイント体積は1,000mm3とした。試験継続期間は59日とした。パクリタキセルは比較的弱い活性を示し、忍容性の高い化合物2レジメンは、1例のLTTFSと4例のPR応答をもたらした。化合物19244は、より多くの退縮応答と低いMTVを与える点で化合物2をしのぎ、化合物19244は1例のLTTFSを含む6例の退縮応答をもたらした。この試験についての平均腫瘍成長を図6に示す。
PRCにおいて、化合物19244を、ヒトHT29大腸癌異種移植片に対する抗腫瘍活性について調べた。化合物19244を、5%エタノールおよび95%の20%Liposyn(登録商標)IIの賦形剤中、30mg/kgで、4日ごとに1日1回、4回にわたって(q4d×4)、静脈内(i.v.)投与した。対照マウスにはこの賦形剤をq4d×4投与した。各群のマウスは6匹だった。1つの陽性参照群には30mg/kgのパクリタキセルをq4d×4投与し、もう一つの陽性参照群には、25mg/kgの化合物2を、週に1回、3週間にわたって(q7d×3)投与した。パクリタキセルは、5%エタノール、5%Cremophor EL(登録商標)、および90%のデキストロース(5%)水溶液(D5W)中に調剤した。化合物2は、7.5%エタノール、7.5%Tween(登録商標)80、および85%D5W中に調剤した。投与は、進行した(約259mm3)皮下HT29腫瘍を有するヌードマウス6匹ずつの群で、1日目に開始した。腫瘍成長のエンドポイント体積は1,000mm3とした。試験継続期間は59日とした。パクリタキセルは比較的弱い活性を示し、忍容性の高い化合物2レジメンは、1例のLTTFSと4例のPR応答をもたらした。化合物19244は、より多くの退縮応答と低いMTVを与える点で化合物2をしのぎ、化合物19244は1例のLTTFSを含む6例の退縮応答をもたらした。この試験についての平均腫瘍成長を図6に示す。
実施例23:HT29ヒト腫瘍異種移植片を有するヌードマウスにおける化合物18365、18926、および17932のインビボ活性
この試験はPRCで行われた。各試験薬剤を、4日ごとに1日1回、4回にわたって(q4d×4)、20または25mg/kgで静脈内(i.v.)投与した。対照マウスには、試験薬剤賦形剤である5%エタノールおよび95%の20%Liposyn(登録商標)IIを、q4d×4スケジュールで投与した。陽性参照群には、7.5%エタノール、7.5%Tween(登録商標)80、および85%D5W(5%デキストロース水溶液)からなる賦形剤中、25mg/kgの化合物2を、週に1回、3週間にわたって(q7d×3)投与した。投与は、進行した(約260mm3)皮下HT29腫瘍を有するヌードマウス6匹ずつの群で、1日目に開始した。腫瘍成長のエンドポイント体積は1,000mm3とした。試験継続期間は61日とした。化合物2は210の%TGDをもたらし、1例のLTTFSと5例のPR応答をもたらした。試験の最終日(61日目)に残っている動物の腫瘍体積中央値と定義されるMTVは、5匹のマウスで196mm3であった。化合物2は14.4%の忍容できる群平均体重(BW)減少を引き起こした。2.化合物17932および化合物18926は、20mg/kgで、それぞれ78mm3および83mm3のMTVをもたらしたが、これは化合物2処置マウスの196mm3というMTVより低い。これらの試験薬剤はそれぞれ5例のPR応答を与え、治癒活性はなかった。25mg/kgの化合物18365は5例の61日生存例をもたらした。化合物18365は、この試験では最も大きい治癒活性を示し、2例のCRおよび4例のPR応答を、1例のTR死と共にもたらした。
この試験はPRCで行われた。各試験薬剤を、4日ごとに1日1回、4回にわたって(q4d×4)、20または25mg/kgで静脈内(i.v.)投与した。対照マウスには、試験薬剤賦形剤である5%エタノールおよび95%の20%Liposyn(登録商標)IIを、q4d×4スケジュールで投与した。陽性参照群には、7.5%エタノール、7.5%Tween(登録商標)80、および85%D5W(5%デキストロース水溶液)からなる賦形剤中、25mg/kgの化合物2を、週に1回、3週間にわたって(q7d×3)投与した。投与は、進行した(約260mm3)皮下HT29腫瘍を有するヌードマウス6匹ずつの群で、1日目に開始した。腫瘍成長のエンドポイント体積は1,000mm3とした。試験継続期間は61日とした。化合物2は210の%TGDをもたらし、1例のLTTFSと5例のPR応答をもたらした。試験の最終日(61日目)に残っている動物の腫瘍体積中央値と定義されるMTVは、5匹のマウスで196mm3であった。化合物2は14.4%の忍容できる群平均体重(BW)減少を引き起こした。2.化合物17932および化合物18926は、20mg/kgで、それぞれ78mm3および83mm3のMTVをもたらしたが、これは化合物2処置マウスの196mm3というMTVより低い。これらの試験薬剤はそれぞれ5例のPR応答を与え、治癒活性はなかった。25mg/kgの化合物18365は5例の61日生存例をもたらした。化合物18365は、この試験では最も大きい治癒活性を示し、2例のCRおよび4例のPR応答を、1例のTR死と共にもたらした。
実施例24:HT29ヒト腫瘍異種移植片を有するヌードマウスにおける化合物19244のインビボ活性
この試験はPRCで行われた。化合物19244を5%エタノールおよび95%Liposyn(登録商標)II(5%E 95%L-II)中に調剤し、30mg/kgで、4日ごとに1日1回、4回にわたって(q4d×4)、静脈内(i.v.)投与した。対照マウスには5%E 95%L-II賦形剤をq4d×4投与した。陽性参照群には、5%デキストロース水溶液中の7.5%エタノールおよび7.5%Tween(登録商標)80からなる賦形剤中、30mg/kgの化合物2による、週に1回、3週間の(q7d×3)静脈内治療を施した。投与は、進行した(約225mm3)皮下HT29腫瘍を有するヌードマウス6匹ずつの群で、1日目に開始した。腫瘍成長のエンドポイント体積は1,000mm3とした。化合物19244は172の%TGDをもたらし、5例の55日生存例をもたらした。化合物19244は0というMTVをもたらしたが、処置関連(TR)死が1例あったので、最大耐容量(MTD)を超えて投与された可能性がある。化合物19244は治癒活性に関して化合物2より優れていた。
この試験はPRCで行われた。化合物19244を5%エタノールおよび95%Liposyn(登録商標)II(5%E 95%L-II)中に調剤し、30mg/kgで、4日ごとに1日1回、4回にわたって(q4d×4)、静脈内(i.v.)投与した。対照マウスには5%E 95%L-II賦形剤をq4d×4投与した。陽性参照群には、5%デキストロース水溶液中の7.5%エタノールおよび7.5%Tween(登録商標)80からなる賦形剤中、30mg/kgの化合物2による、週に1回、3週間の(q7d×3)静脈内治療を施した。投与は、進行した(約225mm3)皮下HT29腫瘍を有するヌードマウス6匹ずつの群で、1日目に開始した。腫瘍成長のエンドポイント体積は1,000mm3とした。化合物19244は172の%TGDをもたらし、5例の55日生存例をもたらした。化合物19244は0というMTVをもたらしたが、処置関連(TR)死が1例あったので、最大耐容量(MTD)を超えて投与された可能性がある。化合物19244は治癒活性に関して化合物2より優れていた。
実施例25:HT29ヒト腫瘍異種移植片を有するヌードマウスにおける化合物19244および18365の経口および静脈内投与によるインビボ活性
この試験はPRCで行われた。化合物18365および化合物19244はどちらも、4日に1回のスケジュールで4回の投与により、HT29異種移植片腫瘍モデルにおいて経口および静脈内投与により活性を示す。経口試験用の製剤はエタノールおよびCremophor製剤とし、静脈内投与される化合物18365および化合物19244の製剤は5%エタノールおよび95%Liposyn II 20%とした。ドセタキセル(化合物2)製剤は前述のようにエタノールおよびTween(登録商標)80製剤とした。
この試験はPRCで行われた。化合物18365および化合物19244はどちらも、4日に1回のスケジュールで4回の投与により、HT29異種移植片腫瘍モデルにおいて経口および静脈内投与により活性を示す。経口試験用の製剤はエタノールおよびCremophor製剤とし、静脈内投与される化合物18365および化合物19244の製剤は5%エタノールおよび95%Liposyn II 20%とした。ドセタキセル(化合物2)製剤は前述のようにエタノールおよびTween(登録商標)80製剤とした。
実施例26:HT29ヒト腫瘍異種移植片を有するヌードマウスにおける化合物19244および18365の経口および静脈内投与によるインビボ活性
この試験はPRCで行われた。化合物18365および化合物19244はどちらも、4日に1回のスケジュールで4回の投与により、HT29異種移植片腫瘍モデルにおいて経口および静脈内投与により活性を示す。経口試験用の製剤はエタノールおよびCremophor製剤とし、静脈内投与される化合物18365および化合物19244の製剤は5%エタノールおよび95%Liposyn II 20%とした。ドセタキセル(化合物2)製剤は前述のようにエタノールおよびTween(登録商標)80製剤とした。
この試験はPRCで行われた。化合物18365および化合物19244はどちらも、4日に1回のスケジュールで4回の投与により、HT29異種移植片腫瘍モデルにおいて経口および静脈内投与により活性を示す。経口試験用の製剤はエタノールおよびCremophor製剤とし、静脈内投与される化合物18365および化合物19244の製剤は5%エタノールおよび95%Liposyn II 20%とした。ドセタキセル(化合物2)製剤は前述のようにエタノールおよびTween(登録商標)80製剤とした。
実施例27:A375ヒト腫瘍異種移植片を有するヌードマウスにおける化合物19244、18926、および18365の静脈内投与によるインビボ活性
Piedmont Research Center, LLCにおいて、化合物18926、18365、および19244を、ヒトA375メラノーマ異種移植片に対する抗腫瘍活性についてスクリーニングした。全ての試験薬剤を、5%エタノールおよび95%の20%Liposyn(登録商標)IIからなる賦形剤中、30mg/kgで、4日に1回、4回にわたって(q4d×4)、静脈内投与した。対照マウスには、この賦形剤をq4d×4レジメンで静脈内投与した。陽性対照群には、D5W中の7.5%エタノール、7.5%Tween(登録商標)80からなる賦形剤中の化合物2を、25mg/kgで、週に1回、3週間にわたって(qwk×3)投与した。処置は、定着した(約100mm3)皮下A375腫瘍を有するヌードマウス6匹ずつの群で、1日目に開始した。エンドポイントは2,000mm3の腫瘍体積とし、試験を56日目に終了した。効力を、腫瘍成長遅延ならびに部分退縮および完全退縮の数によって評価した。56日目まで持続するCRを持つ動物は、長期無腫瘍生存例(TFS)と分類した。賦形剤対照における腫瘍は全て進行性に成長して、29日目またはそれ以前に、18.1日の中央値で、エンドポイントに到達した。陽性対照である化合物2は、8.9日という有意な腫瘍成長遅延をもたらしたが、退縮は全くもたらさなかった。
Piedmont Research Center, LLCにおいて、化合物18926、18365、および19244を、ヒトA375メラノーマ異種移植片に対する抗腫瘍活性についてスクリーニングした。全ての試験薬剤を、5%エタノールおよび95%の20%Liposyn(登録商標)IIからなる賦形剤中、30mg/kgで、4日に1回、4回にわたって(q4d×4)、静脈内投与した。対照マウスには、この賦形剤をq4d×4レジメンで静脈内投与した。陽性対照群には、D5W中の7.5%エタノール、7.5%Tween(登録商標)80からなる賦形剤中の化合物2を、25mg/kgで、週に1回、3週間にわたって(qwk×3)投与した。処置は、定着した(約100mm3)皮下A375腫瘍を有するヌードマウス6匹ずつの群で、1日目に開始した。エンドポイントは2,000mm3の腫瘍体積とし、試験を56日目に終了した。効力を、腫瘍成長遅延ならびに部分退縮および完全退縮の数によって評価した。56日目まで持続するCRを持つ動物は、長期無腫瘍生存例(TFS)と分類した。賦形剤対照における腫瘍は全て進行性に成長して、29日目またはそれ以前に、18.1日の中央値で、エンドポイントに到達した。陽性対照である化合物2は、8.9日という有意な腫瘍成長遅延をもたらしたが、退縮は全くもたらさなかった。
実施例28:MSTO-211Hヒト腫瘍異種移植片を有するヌードマウスにおける化合物18926およびドセタキセルの静脈内投与によるインビボ活性
MSTO-211Hは耐性中皮腫がん細胞株である。Taxolog, Inc.(フロリダ州タラハシー)において、化合物18926およびドセタキセルを、ヌードマウス中のヒトMSTO-211H中皮腫異種移植片に対する抗腫瘍活性について調べた。化合物18926を、5%エタノールおよび95%の20%Liposyn(登録商標)IIからなる賦形剤中、25mg/kgで、4日に1回、4回にわたって(q4d×4)、静脈内投与した。対照マウスにはこの賦形剤をq4d×4レジメンで静脈内投与した。陽性対照群には、D5W中の7.5%エタノール、7.5%Tween(登録商標)80からなる賦形剤中の化合物2を、25mg/kgで、週に1回、3週間にわたって(qwk×3)投与した。処置は、定着した(約225mm3)皮下MSTO-211H腫瘍を有するヌードマウス6匹ずつの群で、1日目に開始した。試験を48日目に終了した。賦形剤対照における腫瘍は全て進行性に成長して、20日目またはそれ以前にエンドポイントに達した。陽性対照である化合物2は、退縮を一切もたらさなかった。化合物18926はこのモデルで非常に活性が高く、腫瘍最下点サイズは32mg(平均)で、222mgの初期腫瘍重量に対して85%の腫瘍退縮になった。どちらの化合物も大きな体重減少を示し、ドセタキセルでは31%の最大体重減少が、また化合物18926では24%の体重減少が見られた。
この試験についての平均腫瘍成長を図12に示す。
MSTO-211Hは耐性中皮腫がん細胞株である。Taxolog, Inc.(フロリダ州タラハシー)において、化合物18926およびドセタキセルを、ヌードマウス中のヒトMSTO-211H中皮腫異種移植片に対する抗腫瘍活性について調べた。化合物18926を、5%エタノールおよび95%の20%Liposyn(登録商標)IIからなる賦形剤中、25mg/kgで、4日に1回、4回にわたって(q4d×4)、静脈内投与した。対照マウスにはこの賦形剤をq4d×4レジメンで静脈内投与した。陽性対照群には、D5W中の7.5%エタノール、7.5%Tween(登録商標)80からなる賦形剤中の化合物2を、25mg/kgで、週に1回、3週間にわたって(qwk×3)投与した。処置は、定着した(約225mm3)皮下MSTO-211H腫瘍を有するヌードマウス6匹ずつの群で、1日目に開始した。試験を48日目に終了した。賦形剤対照における腫瘍は全て進行性に成長して、20日目またはそれ以前にエンドポイントに達した。陽性対照である化合物2は、退縮を一切もたらさなかった。化合物18926はこのモデルで非常に活性が高く、腫瘍最下点サイズは32mg(平均)で、222mgの初期腫瘍重量に対して85%の腫瘍退縮になった。どちらの化合物も大きな体重減少を示し、ドセタキセルでは31%の最大体重減少が、また化合物18926では24%の体重減少が見られた。
この試験についての平均腫瘍成長を図12に示す。
実施例29:MSTO-211Hヒト腫瘍異種移植片を有するヌードマウスにおける化合物19244およびドセタキセルの静脈内投与によるインビボ活性
Taxolog, Inc.(フロリダ州タラハシー)において、化合物19244およびドセタキセルを、ヌードマウス中のヒトMSTO-211H中皮腫異種移植片に対する抗腫瘍活性について調べた。化合物19244を、5%エタノールおよび95%の20%Liposyn(登録商標)IIからなる賦形剤中、30mg/kgで、4日に1回、4回にわたって(q4d×4)、静脈内投与した。対照マウスにはこの賦形剤をq4d×4レジメンで静脈内投与した。陽性対照群には、D5W中の7.5%エタノール、7.5%Tween(登録商標)80からなる賦形剤中の化合物2を、25mg/kgで、週に1回、3週間にわたって(qwk×3)投与した。処置は、定着した(約220mm3)皮下MSTO-211H腫瘍を有するヌードマウス6匹ずつの群で、1日目に開始した。試験を48日目に終了した。賦形剤対照における腫瘍は全て進行性に成長して、30日目またはそれ以前にエンドポイントに達した。陽性対照である化合物2は、退縮を一切もたらさなかった。化合物19244はこのモデルで非常に活性が高く、腫瘍最下点サイズは51mg(平均)で、220mgの初期腫瘍重量に対して77%の腫瘍退縮になった。どちらの化合物も大きな体重減少を示し、ドセタキセルでは24%の最大体重減少が、また化合物19244では21%の体重減少が見られた。
この試験についての平均腫瘍成長を図13に示す。
Taxolog, Inc.(フロリダ州タラハシー)において、化合物19244およびドセタキセルを、ヌードマウス中のヒトMSTO-211H中皮腫異種移植片に対する抗腫瘍活性について調べた。化合物19244を、5%エタノールおよび95%の20%Liposyn(登録商標)IIからなる賦形剤中、30mg/kgで、4日に1回、4回にわたって(q4d×4)、静脈内投与した。対照マウスにはこの賦形剤をq4d×4レジメンで静脈内投与した。陽性対照群には、D5W中の7.5%エタノール、7.5%Tween(登録商標)80からなる賦形剤中の化合物2を、25mg/kgで、週に1回、3週間にわたって(qwk×3)投与した。処置は、定着した(約220mm3)皮下MSTO-211H腫瘍を有するヌードマウス6匹ずつの群で、1日目に開始した。試験を48日目に終了した。賦形剤対照における腫瘍は全て進行性に成長して、30日目またはそれ以前にエンドポイントに達した。陽性対照である化合物2は、退縮を一切もたらさなかった。化合物19244はこのモデルで非常に活性が高く、腫瘍最下点サイズは51mg(平均)で、220mgの初期腫瘍重量に対して77%の腫瘍退縮になった。どちらの化合物も大きな体重減少を示し、ドセタキセルでは24%の最大体重減少が、また化合物19244では21%の体重減少が見られた。
この試験についての平均腫瘍成長を図13に示す。
実施例30:MSTO-211Hヒト腫瘍異種移植片を有するヌードマウスにおける化合物18926および18365の静脈内投与によるインビボ活性
Taxolog, Inc.(フロリダ州タラハシー)において、化合物18365および18926を、ヌードマウス中のヒトMSTO-211H中皮腫異種移植片に対する抗腫瘍活性について調べた。10%エタノール、10%Cremophor EL(登録商標)および80%のD5Wからなる賦形剤中、化合物18926を20mg/kgで、また化合物18365を25mg/kgの用量で、4日に1回、4回にわたって(q4d×4)、静脈内投与した。対照マウスにはこの賦形剤をq4d×4レジメンで静脈内投与した。陽性対照群には、D5W中の7.5%エタノール、7.5%Tween(登録商標)80からなる賦形剤中の化合物2を、25mg/kgで、週に1回、3週間にわたって(qwk×3)投与した。処置は、定着した(約220mm3)皮下MSTO-211H腫瘍を有するヌードマウス5匹ずつの群で、1日目に開始した。試験は継続中であり、まだ終わっていない。化合物18926および18365はどちらもこの試験で非常に活性が高く、どちらの化合物でも有意な退縮が見られている。どちらの化合物も体重減少を示し、化合物18926では16%の最大体重減少が、また化合物18365では18%の体重減少と1例のTRが見られた。
この試験についての平均腫瘍成長を図14に示す。
Taxolog, Inc.(フロリダ州タラハシー)において、化合物18365および18926を、ヌードマウス中のヒトMSTO-211H中皮腫異種移植片に対する抗腫瘍活性について調べた。10%エタノール、10%Cremophor EL(登録商標)および80%のD5Wからなる賦形剤中、化合物18926を20mg/kgで、また化合物18365を25mg/kgの用量で、4日に1回、4回にわたって(q4d×4)、静脈内投与した。対照マウスにはこの賦形剤をq4d×4レジメンで静脈内投与した。陽性対照群には、D5W中の7.5%エタノール、7.5%Tween(登録商標)80からなる賦形剤中の化合物2を、25mg/kgで、週に1回、3週間にわたって(qwk×3)投与した。処置は、定着した(約220mm3)皮下MSTO-211H腫瘍を有するヌードマウス5匹ずつの群で、1日目に開始した。試験は継続中であり、まだ終わっていない。化合物18926および18365はどちらもこの試験で非常に活性が高く、どちらの化合物でも有意な退縮が見られている。どちらの化合物も体重減少を示し、化合物18926では16%の最大体重減少が、また化合物18365では18%の体重減少と1例のTRが見られた。
この試験についての平均腫瘍成長を図14に示す。
実施例31:MSTO-211Hヒト腫瘍異種移植片を有するヌードマウスにおける化合物18926および18365ならびに他の抗がん化合物の静脈内投与によるインビボ活性
Taxolog, Inc.(フロリダ州タラハシー)において、化合物18365および18926を、他の抗がん化合物と共に、以下のプロトコールに従って、ヌードマウス中のヒトMSTO-211H中皮腫異種移植片に対する抗腫瘍活性について調べた。
Taxolog, Inc.(フロリダ州タラハシー)において、化合物18365および18926を、他の抗がん化合物と共に、以下のプロトコールに従って、ヌードマウス中のヒトMSTO-211H中皮腫異種移植片に対する抗腫瘍活性について調べた。
処置は、定着した(約185mm3)皮下MSTO-211H腫瘍を有するヌードマウス5匹ずつの群で、1日目に開始した。化合物18365はこの試験で非常に活性が高く、腫瘍退縮が見られた。化合物18926は、この試験において、この用量では毒性だった。
この試験についての平均腫瘍成長を図15に示す。
この試験についての平均腫瘍成長を図15に示す。
実施例32:BxPC-3ヒト膵腫瘍異種移植片を有するヌードラットにおける化合物18365、19244、およびドセタキセルの静脈内投与によるインビボ活性
Oncodesign(France)において、化合物18365および19244を、ヌードラット中のヒトBxPC-3ヒト膵臓異種移植モデルに対する抗腫瘍活性について調べた。
Oncodesign(France)において、化合物18365および19244を、ヌードラット中のヒトBxPC-3ヒト膵臓異種移植モデルに対する抗腫瘍活性について調べた。
方法:γ線源(7.0Gy、Co60、INRA、フランス・ディジョン)による全身照射の24時間後に、200μlのRPMI1640培地中の20×106個のBxPC-3細胞を、8匹の雌ヌードラットの右脇腹に皮下注射して、腫瘍材料を生じさせた。腫瘍サイズが約1,000mm3に達したら、レシピエント雌ヌードラットへの移植のために、腫瘍を外科的に切除した。全身照射(7.0Gy、Co60、INRA、フランス・ディジョン)の24時間後、D0に、新鮮なBxPC-3腫瘍片を52匹の雌ヌードラットの右脇腹の皮下に外科用プライヤーを使って植え込み(1片/ラット)、皮膚を縫合した。平均腫瘍体積が321.6±131.2mm3に達したD21に、抗腫瘍活性試験を開始した。処置を開始する前に、移植を受けた52匹中42匹の腫瘍保有ラットを6匹ずつの7群にランダムに割り当てた。各群の平均腫瘍体積は同等であり、他の群との間に統計的な差はなかった(分散分析)。
各処置の間に回復しない重篤な体重減少が観察されたので、元のQ7D×4処置スケジュールを、化合物および用量に合わせて調節した。5mg/kg/注射では、化合物18365およびTXTについて、4回の処置をD21、D28、D42およびD49に施し、化合物19244については、体重の回復が遅かったので、D21、D42およびD49に3回だけ注射を行った。7mg/kg/注射では、重篤な体重減少が起こったので、D21とD42に2回だけ処置を行った。
化合物18365
賦形剤処置群のラットでの腫瘍の平均倍加時間(DT)は10.9±6.0日だった。5mg/kg/注射の化合物18365で処置されたラットでの腫瘍の平均倍加時間は24.7±10.4日に増加したが、賦形剤群と比較して有意差はなかった。7mg/kg/注射で処置した時は、1匹しかDT評価に利用できなかったので、DT解析を行わなかった。賦形剤処置ラットに関して、1,000mm3の体積に達するまでの時間(T to V)は30.0±2.7日だった。5mg/kg/注射の化合物18365で処置した群に関する1,000mm3へのT to Vは、賦形剤処置群と比較して、統計的に有意(p=0.0007)に増加した(64.3±16.3日)。7mg/kg/注射で処置した場合は、十分な数の動物を利用できず(1匹だけ)、結論を下せなかった。
賦形剤処置群のラットでの腫瘍の平均倍加時間(DT)は10.9±6.0日だった。5mg/kg/注射の化合物18365で処置されたラットでの腫瘍の平均倍加時間は24.7±10.4日に増加したが、賦形剤群と比較して有意差はなかった。7mg/kg/注射で処置した時は、1匹しかDT評価に利用できなかったので、DT解析を行わなかった。賦形剤処置ラットに関して、1,000mm3の体積に達するまでの時間(T to V)は30.0±2.7日だった。5mg/kg/注射の化合物18365で処置した群に関する1,000mm3へのT to Vは、賦形剤処置群と比較して、統計的に有意(p=0.0007)に増加した(64.3±16.3日)。7mg/kg/注射で処置した場合は、十分な数の動物を利用できず(1匹だけ)、結論を下せなかった。
5mg/kg/注射の化合物18365は、D53に、11.0%の最良T/C%値をもたらした(n=5)。T/C%値はD33での42%より低かった。この群では、D81(最終屠殺時)に、2匹で、完全な腫瘍退縮が記録された。7mg/kg/注射の化合物18365は、D53に、13.2%の最良T/C%値をもたらした(n=3)。T/C%値はD33での42%より低かった。5および7mg/kg/注射の反復静脈内注射により、それぞれ合計4回(D21、D28、D42およびD49)および2回(D21およびD42)の投与で処置した場合の、化合物18365の著しい抗腫瘍活性が、皮下BxPC-3腫瘍を有するヌードラットのモデルで証明された。5mg/kg/注射では、化合物18365の反復静脈内処置が、皮下BxPC-3腫瘍を有するヌードラットによって、十分には忍容されなかった。重篤な体重減少が観察され、D33で(重要な閾値(significant threshold)に近い)-16.9±6.1%に達し、それが処置日を遅らせることになった。スケジュールQ7D×4をD21、D28、D42およびD49における処置に変更した。D35に、体重が回復しなかったために、ラットを1匹(ID3171)だけ屠殺した。
7mg/kg/注射では、化合物18365による反復静脈内処置が、皮下BxPC-3腫瘍を有するヌードラットによって忍容されなかった。1回目の処置後に、重篤で統計的に有意な体重減少が観察された(MBWC D21-D26は、7mg/kg/注射の化合物18365で処置した群および賦形剤で処置した群について、それぞれ-16.5±7.2および-2.0±4.8%だった。p<0.0001)。体重減少および体重を回復するのに要する時間が、処置の回数を減少させることになった。スケジュールQ7D×4をD21およびD42における2回だけの処置に変更した。2回目の処置も重篤な体重減少をもたらし、体重回復は1匹でしか観察されなかった。3匹のラットは死亡しているのが見つかり(D23、D27およびD49)、2匹は屠殺した(D53およびD70)。7mg/kg/注射の化合物18365で処置された6匹のうち1匹のラットだけが試験の終了時に生存していた。
化合物19244
5mg/kg/注射では、化合物19244による反復静脈内処置が、皮下BxPC-3腫瘍を有するヌードラットにより、十分に忍容された。1回目の注射後に重篤かつ統計的に有意な体重減少が観察された(MBWC D21-D26は、5mg/kg/注射の化合物19244で処置した群および賦形剤で処置した群について、それぞれ-15.9±5.6および-2.0±4.8%だった。p<0.0001)。体重の減少が処置回数を減少をさせ、処置日を遅らせることになった。スケジュールQ7D×4をD21、D42およびD49における処置に変更した。5mg/kg/注射の化合物19244で処置した場合、3匹のラットが死亡しているのが見つかった(D34、D49およびD55)。7mg/kg/注射では、化合物19244による反復静脈内処置が、皮下BxPC-3腫瘍を有するヌードラットにより、忍容されなかった。1回目の処置後に重篤で統計的に有意な体重減少が観察された(MBWC D21-D26は、7mg/kg/注射の化合物19244で処置した群および賦形剤で処置した群について、それぞれ-20.1±5.7および-2.0±4.8%だった。p<0.0001)。体重減少および体重を回復するのに要する時間が、処置の回数を減少させることになった。スケジュールQ7D×4をD21およびD42における2回だけの処置に変更した。3匹のラットは死亡しているのが見つかり(D27、D28およびD31)、1匹はD49に屠殺した。7mg/kg/注射の化合物19244で処置した6匹のラットのうち、試験の最後に生存していたのは、2匹だけであった。
5mg/kg/注射では、化合物19244による反復静脈内処置が、皮下BxPC-3腫瘍を有するヌードラットにより、十分に忍容された。1回目の注射後に重篤かつ統計的に有意な体重減少が観察された(MBWC D21-D26は、5mg/kg/注射の化合物19244で処置した群および賦形剤で処置した群について、それぞれ-15.9±5.6および-2.0±4.8%だった。p<0.0001)。体重の減少が処置回数を減少をさせ、処置日を遅らせることになった。スケジュールQ7D×4をD21、D42およびD49における処置に変更した。5mg/kg/注射の化合物19244で処置した場合、3匹のラットが死亡しているのが見つかった(D34、D49およびD55)。7mg/kg/注射では、化合物19244による反復静脈内処置が、皮下BxPC-3腫瘍を有するヌードラットにより、忍容されなかった。1回目の処置後に重篤で統計的に有意な体重減少が観察された(MBWC D21-D26は、7mg/kg/注射の化合物19244で処置した群および賦形剤で処置した群について、それぞれ-20.1±5.7および-2.0±4.8%だった。p<0.0001)。体重減少および体重を回復するのに要する時間が、処置の回数を減少させることになった。スケジュールQ7D×4をD21およびD42における2回だけの処置に変更した。3匹のラットは死亡しているのが見つかり(D27、D28およびD31)、1匹はD49に屠殺した。7mg/kg/注射の化合物19244で処置した6匹のラットのうち、試験の最後に生存していたのは、2匹だけであった。
5mg/kg/注射の化合物19244で処置したラットでの腫瘍の平均倍加時間は、19.3±6.5日に増加したが、賦形剤群(10.9±6.0日のDT)と比較して、その差は統計的に有意でなかった。7mg/kg/注射で処置した場合は、十分な数の動物を利用できず(1匹だけ)、結論を下せなかった。
5mg/kg/注射の化合物19244で処置した群では1,000mm3へのT to Vが、賦形剤処置群と比べて増加した(46.0±11.6日)が、その差は統計的に有意でなかった(p=0.0240)。7mg/kg/注射で処置した場合、十分な数の動物を利用できず(1匹だけ)、結論を下せなかった。
5mg/kg/注射の化合物19244は、D53に、27.7%の最良T/C%値をもたらした(n=4)。T/C%値はD33での42%より低かった。7mg/kg/注射の化合物18365は、D53に、8.9%の最良T/C%値をもたらした(n=2)。T/C%値はD33での42%より低かった。
5および7mg/kg/注射の反復静脈内注射により、それぞれ合計3回(D21、D42およびD49)および2回(D21およびD42)の投与で処置した場合、化合物19244の著しい抗腫瘍活性が、皮下BxPC-3腫瘍を有するヌードラットのモデルで証明された。
TXT
5mg/kg/注射では、TXTによる反復静脈内処置が、皮下BxPC-3腫瘍を有するヌードラットにより、十分には忍容されなかった。重篤な体重減少が観察され、D33で(重要な閾値に近い)-15.4±8.2%に達し、処置日を遅らせることになった。スケジュールQ7D×4をD21、D28、D42およびD49における処置に変更した。1匹のラットをD35に屠殺し、2匹はD58に死亡しているのが見つかった。
5mg/kg/注射では、TXTによる反復静脈内処置が、皮下BxPC-3腫瘍を有するヌードラットにより、十分には忍容されなかった。重篤な体重減少が観察され、D33で(重要な閾値に近い)-15.4±8.2%に達し、処置日を遅らせることになった。スケジュールQ7D×4をD21、D28、D42およびD49における処置に変更した。1匹のラットをD35に屠殺し、2匹はD58に死亡しているのが見つかった。
7mg/kg/注射では、TXTによる反復静脈内処置が、皮下BxPC-3腫瘍を有するヌードラットにより、忍容されなかった。1回目の処置後に重篤で統計的に有意な体重減少が観察された(MBWC D21-D26は、7mg/kg/注射のTXTで処置した群および賦形剤で処置した群について、それぞれ-16.3±7.0および-2.0±4.8%だった。p<0.0001)。体重減少および体重を回復するのに要する時間が、処置の回数を減少させることになった。スケジュールQ7D×4をD21およびD42における2回だけの処置に変更した。2匹のラットは死亡しているのが見つかり(D28およびD29)、2匹は屠殺した(D60およびD70)。7mg/kg/注射のTXTで処置した6匹のラットのうち、試験の最後に生存していたのは、2匹だけだった。
5mg/kg/注射のTXTで処置したラットでの腫瘍の平均倍加時間は、DT評価に利用できる動物がなかったため、算出することができなかった。7mg/kg/注射で処置した場合は、十分な数の動物を利用できず(2匹だけ)、結論を下せなかった。
5または7mg/kg/注射のTXTで処置した群では1,000mm3へのT to Vが、賦形剤処置群と比べて増加したが、評価には1匹または2匹しか利用できなかった。
5mg/kg/注射のTXTは、D60に、3.8%の最良T/C%値をもたらした(n=2)。T/C%値はD33での42%より低かった。この群では、D81(最終屠殺時)に、1匹で、完全な腫瘍退縮が記録された。7mg/kg/注射のTXTは、D56に、12.3%の最良T/C%値をもたらした。T/C%値はD33での42%より低かった。
5および7mg/kg/注射の反復静脈内注射により、それぞれ合計4回(D21、D28、D42およびD49)および2回(D21およびD42)の投与で処置した場合、TXTの著しい抗腫瘍活性が、皮下BxPC-3腫瘍を有するヌードラットのモデルで証明された。
ラット異種移植片試験から得られた結果の要約。
・毒性ラット異種移植片試験
-18365
・5mg/kg:16.9%の体重減少。1匹を体重減少により屠殺。
・7mg/kg:3匹が死亡していた。2匹を体重減少により屠殺。
-19244
・5mg/kg:3匹が死亡していた。
・7mg/kg:3匹が死亡していた。1匹を屠殺。
-ドセタキセル
・5mg/kg:2匹が死亡していた。1匹を屠殺。
・7mg/kg:2匹が死亡していた。2匹を屠殺。
・毒性ラット異種移植片試験
-18365
・5mg/kg:16.9%の体重減少。1匹を体重減少により屠殺。
・7mg/kg:3匹が死亡していた。2匹を体重減少により屠殺。
-19244
・5mg/kg:3匹が死亡していた。
・7mg/kg:3匹が死亡していた。1匹を屠殺。
-ドセタキセル
・5mg/kg:2匹が死亡していた。1匹を屠殺。
・7mg/kg:2匹が死亡していた。2匹を屠殺。
結論として、この異種移植片試験により、ドセタキセルと同じスケジュールおよび同じ用量で投与すると、化合物18365の方が、ヌードラットにおいて毒性が低く、忍容性が高いことが示された。図15に賦形剤対照群および化合物19244群について腫瘍成長を示す。図16に化合物18365群およびドセタキセル群について腫瘍成長を示す。
実施例33:ラットにおけるインビボ毒性評価
毒性を250〜300gのスプラーグ・ドーリーラットで評価した。静脈内投与に12mg/kgの用量を使って、1用量群につき3匹のラットを使用した。動物を観察し、4日目および10日目に臨床化学データを集めた。ラットを11日目に安楽死させ、安楽死時に、さらなる検査のために神経を切除して固定した。
毒性を250〜300gのスプラーグ・ドーリーラットで評価した。静脈内投与に12mg/kgの用量を使って、1用量群につき3匹のラットを使用した。動物を観察し、4日目および10日目に臨床化学データを集めた。ラットを11日目に安楽死させ、安楽死時に、さらなる検査のために神経を切除して固定した。
各ラットを後述のようにスコア化し、全てのパラメータを組み込んだ最終毒性スコアを割り当てる。死亡したラットには0というスコアを割り当てる。下記表18に、スコアへの各毒性パラメータの寄与の仕方に関する基準を記載する。ほとんどのパラメータは正の値を与え、可能な合計スコアは最大130になる。体重、白血球および血小板の減少については、回復を考慮する。パラメータが回復を示さない場合は、合計から-5を差し引く。合計スコアを13で割ることで、それを0から10までの尺度にする。神経毒性スコアの場合、-10は軸索変性病変が見られることを示し、0は病変がないことを示す。同じ方法で、週に1回、3週間にわたる投与レジメンを使った試験における毒性を測定した。この場合は、最後の投与の4日後に臨床化学データを得た。
ラット毒性試験e206では、5.9のスコアを示すドセタキセルを対照として、化合物19244が7.7のスコアを持っていた。12mg/kgの用量は72mg/m2に相当し、これは3週間に1回投与される場合のドセタキセルのヒト用量に似ている。化合物19244は、この試験において、ドセタキセルに似たスコアを持つだけでなく、軸索変性もドセタキセル対照より少なかった。これは、末梢ニューロパシーのリスクが低いという臨床現場における潜在的利益を示しうる。この試験では死亡例はなかった。先に述べたように、化合物19244はエタノールおよびLiposyn II 20%製剤中に調剤し、ドセタキセルはエタノールおよびTween(登録商標)80に基づく製剤中に調剤した。
ラット毒性試験e195では、化合物17932が8.1(7.3、7.7、および9.2の平均)のスコアを持っていた。これはドセタキセル既存対照より低い。また、化合物17932は軸索変性をほとんど示さなかった。化合物17932はエタノールおよびLiposyn II 20%製剤中に調剤した。
ラット毒性試験e196では、化合物18365が、ドセタキセル既存対照より低い7.7のスコアを持っていた。また、化合物18365は軸索変性を全く示さなかった。化合物18365はエタノールおよびLiposyn II 20%製剤中に調剤した。
ラット毒性試験e199では、6.4のスコアを示すドセタキセルを対照として、化合物18926が7.4のスコアを持っていた。化合物18926は、この試験において、ドセタキセルに似たスコアを持つだけでなく、化合物18926は軸索変性も示さなかった。これは、末梢ニューロパシーのリスクが低いという臨床現場における潜在的利益を示しうる。この試験では死亡例はなかった。先に述べたように、化合物18926はエタノールおよびLiposyn II 20%製剤中に調剤し、ドセタキセルはエタノールおよびTween(登録商標)80に基づく製剤中に調剤した。
e371単回投与試験では、化合物18365、18926、および19244をドセタキセルと比較した。化合物18365、18926、および19244はエタノール、Cremophor EL(登録商標)およびD5W製剤(10:10:80)中に調剤し、ドセタキセルはエタノール-Tween(登録商標)80に基づく製剤中に調剤した。化合物18365、18926、および19244はいずれも、ドセタキセルより少ない軸索変性を示すと共に、より高い(より安全な)ラット毒性スコアを示した。
e371反復投与試験では、化合物18365、18926、および19244をドセタキセルと比較した。化合物18365、18926、および19244はエタノール、Cremophor EL(登録商標)およびD5W製剤(10:10:80)中に調剤し、ドセタキセルはエタノール-Tween(登録商標)80に基づく製剤中に調剤した。化合物18365および18926はドセタキセルより少ない軸索変性を示し、化合物19244は、週に1回投与した場合、ドセタキセルに似ていた。単回投与試験と比較して、化合物18926は、週に1回投与した場合、ドセタキセルより低いスコアを示した。これは、臨床現場において、化合物18926は、週に1回のスケジュールより3週間に1回のスケジュールで使用した方が良いかもしれないことを示している。しかしこの試験では死亡例はなかった。
e346反復投与試験では、化合物17932、18365、18926、および19244をドセタキセルと比較した。化合物18365、18926、および19244はエタノール、Lyposyn II 20%製剤に基づく製剤(5:95)中に調剤し、ドセタキセルはエタノール、Tween(登録商標)80に基づく製剤中に調剤した。化合物18365、17932、および18926はいずれも、ドセタキセルよりはるかに少ない軸索変性を示した。化合物19244は、週に1回投与した場合、やはり多くの軸索変性を示したが、それでもドセタキセルよりは少なかった。単回投与試験と比較して、化合物18926は、週に1回投与した場合、ドセタキセルより低いスコアを示した。これは、臨床現場において、化合物18926は、週に1回のスケジュールより3週間に1回のスケジュールで使用した方が良いかもしれないことを示している。しかしこの試験では死亡例はなかった。
Claims (71)
- R10aがエチルであり、X10がシクロブチルまたはシクロペンチルである、請求項1に記載のタキサン。
- R10aがシクロプロピルであり、X10がシクロブチルまたはシクロペンチルである、請求項1に記載のタキサン。
- R10aがエチルまたはシクロプロピルであり、X10がシクロブチルである、請求項1に記載のタキサン。
- R10aがエチルまたはシクロプロピルであり、X10がシクロペンチルである、請求項1に記載のタキサン。
- X3が2-チエニルである、請求項1〜5のいずれかに記載タキサン。
- R10aがエチルであり、X10がシクロブチルまたはシクロペンチルである、請求項11に記載の医薬組成物。
- R10aがシクロプロピルであり、X10がシクロブチルまたはシクロペンチルである、請求項11に記載の医薬組成物。
- R10aがエチルまたはシクロプロピルであり、X10がシクロブチルである、請求項11に記載の医薬組成物。
- R10aがエチルまたはシクロプロピルであり、X10がシクロペンチルである、請求項11に記載の医薬組成物。
- X3が2-チエニルである、請求項11〜15のいずれかに記載の医薬組成物。
- タキサンの濃度が約0.01mg/mL〜10mg/mLである、請求項11に記載の医薬組成物。
- 組成物が経口投与用の単一投与単位形であり、その投与単位形が患者の体表面積1m2あたり少なくとも20mgのタキサンを含有する、請求項11に記載の医薬組成物。
- 投与単位形が患者の体表面積1m2あたり約25mg〜約400mgのタキサンを含有する、請求項22に記載の医薬組成物。
- 投与単位形が患者の体表面積1m2あたり約50mg〜約200mgのタキサンを含有する、請求項23に記載の医薬組成物。
- 組成物が非経口投与用の単一投与単位形であり、その投与単位形が患者の体表面積1m2あたり少なくとも20mgのタキサンを含有する、請求項11に記載の医薬組成物。
- 投与単位形が患者の体表面積1m2あたり約40mg〜約400mgのタキサンを含有する、請求項25に記載の医薬組成物。
- 投与単位形が患者の体表面積1m2あたり約60mg〜約350mgのタキサンを含有する、請求項26に記載の医薬組成物。
- 投与単位形が患者の体表面積1m2あたり約50mg〜約100mgのタキサンを含有する、請求項26に記載の医薬組成物。
- 約10%までのエタノールを含む、請求項11に記載の医薬組成物。
- 経口投与用である、請求項29に記載の医薬組成物。
- 経口溶液の形態である、請求項30に記載の医薬組成物。
- 少なくとも約90%の蒸留水を含む、請求項31に記載の医薬組成物。
- 約10%未満の界面活性剤を含む、請求項31に記載の医薬組成物。
- 界面活性剤が、ポリソルベート80、ポリエトキシル化ヒマシ油、またはそれらの組み合わせである、請求項33に記載の医薬組成物。
- 非経口投与用である、請求項29に記載の医薬組成物。
- エマルションの形態である、請求項35に記載の医薬組成物。
- エタノール溶液と脂肪エマルションとを混合することによって製造される、請求項36に記載の医薬組成物。
- 脂肪エマルションが約10〜約20%の脂肪を含有する、請求項37に記載の医薬組成物。
- 溶液である、請求項35に記載の医薬組成物。
- 少なくとも約85%の食塩液を含む、請求項39に記載の医薬組成物。
- 約10%未満の界面活性剤を含む、請求項40に記載の医薬組成物。
- 界面活性剤が、ポリソルベート80、ポリエトキシル化ヒマシ油、またはそれらの組み合わせである、請求項41に記載の医薬組成物。
- R10aがエチルであり、X10がシクロブチルまたはシクロペンチルである、請求項43に記載の方法。
- R10aがシクロプロピルであり、X10がシクロブチルまたはシクロペンチルである、請求項43に記載の方法。
- R10aがエチルまたはシクロプロピルであり、X10がシクロブチルである、請求項43に記載の方法。
- R10aがエチルまたはシクロプロピルであり、X10がシクロペンチルである、請求項43に記載の方法。
- X3が2-チエニルである、請求項43〜47のいずれかに記載の方法。
- 腫瘍が多剤耐性を示す腫瘍細胞を含む、請求項43〜52のいずれかに記載の方法。
- 多剤耐性腫瘍細胞が薬物排出トランスポーターを過剰発現させる、請求項53に記載の方法。
- 薬物排出トランスポーターがATP結合カセットトランスポーターである、請求項54に記載の方法。
- ATP結合カセットトランスポーターが、P-糖タンパク質、MDR関連タンパク質、乳がん耐性タンパク質、多剤耐性関連タンパク質、またはそれらの組み合わせである、請求項55に記載の方法。
- 腫瘍がパクリタキセルに対して耐性である、請求項43〜56のいずれかに記載の方法。
- 腫瘍がドセタキセルに対して耐性である、請求項43〜56のいずれかに記載の方法。
- 腫瘍が上皮細胞癌である、請求項43〜58のいずれかに記載の方法。
- 腫瘍が、脳膠芽腫、乳癌、大腸癌、腎臓癌、肝臓癌、肺癌、卵巣癌、膵臓癌、腎臓癌、または皮膚メラノーマである、請求項43〜59のいずれかに記載の方法。
- 腫瘍が、脳膠芽腫、大腸癌、肺癌、卵巣癌、膵臓癌、腎臓癌、または皮膚メラノーマである、請求項43〜59のいずれかに記載の方法。
- 腫瘍が、大腸癌、肺癌、膵臓癌、腎臓癌、または皮膚メラノーマである、請求項43〜59のいずれかに記載の方法。
- 腫瘍が、大腸癌、肺癌、腎臓癌、または皮膚メラノーマである、請求項43〜59のいずれかに記載の方法。
- 腫瘍が、SNB-19脳膠芽腫、HCT116大腸癌、HT-29大腸癌、DLD-1大腸癌、A549肺癌、HOP-18肺癌、MSTO-211H中皮腫、A375メラノーマ、MALME-3メラノーマ、SK-MEL-28メラノーマ、OVCAR4卵巣癌、OVCAR5卵巣癌、PANC-1膵腺癌、BxPC-3膵臓癌、786-0腎臓癌、またはTK-10腎臓癌である、請求項43〜59のいずれかに記載の方法。
- 腫瘍が、SNB-19脳膠芽腫、HCT116大腸癌、HT-29大腸癌、DLD-1大腸癌、A549肺癌、HOP-18肺癌、MSTO-211H中皮腫、A375メラノーマ、SK-MEL-28メラノーマ、OVCAR5卵巣癌、PANC-1膵腺癌、786-0腎臓癌、またはTK-10腎臓癌である、請求項43〜59のいずれかに記載の方法。
- 腫瘍が、DLD-1大腸癌、OVCAR5卵巣癌、A549肺癌、MSTO-211H中皮腫、A375メラノーマ、786-0腎臓癌、またはTK-10腎臓癌である、請求項43〜59のいずれかに記載の方法。
- 腫瘍が、DLD-1大腸癌、MSTO-211H中皮腫、A375メラノーマ、または786-0腎臓癌である、請求項43〜59のいずれかに記載の方法。
- 医薬組成物が経口投与される、請求項43〜59のいずれかに記載の方法。
- 医薬組成物が非経口投与される、請求項43〜59のいずれかに記載の方法。
- 医薬組成物が界面活性剤を含む、請求項43〜59のいずれかに記載の方法。
- 界面活性剤が、ポリソルベート80、ポリエトキシル化ヒマシ油、またはそれらの組み合わせである、請求項43〜59のいずれかに記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US4101708P | 2008-03-31 | 2008-03-31 | |
| US61/041,017 | 2008-03-31 | ||
| PCT/US2009/038119 WO2009145981A1 (en) | 2008-03-31 | 2009-03-24 | C(10) ethyl ester and c(10) cyclopropyl ester substituted taxanes |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2011517455A true JP2011517455A (ja) | 2011-06-09 |
| JP2011517455A5 JP2011517455A5 (ja) | 2012-05-17 |
Family
ID=41377463
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011503034A Pending JP2011517455A (ja) | 2008-03-31 | 2009-03-24 | C(10)エチルエステルおよびc(10)シクロプロピルエステル置換タキサン |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US8242166B2 (ja) |
| EP (1) | EP2276755A4 (ja) |
| JP (1) | JP2011517455A (ja) |
| CA (1) | CA2718567A1 (ja) |
| WO (1) | WO2009145981A1 (ja) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20100023862A (ko) * | 2007-06-22 | 2010-03-04 | 싸이도우스 엘엘씨. | 트윈 80을 함유하지 않은 도세탁셀의 용해 제제 |
| CA2716576A1 (en) | 2008-03-07 | 2009-09-11 | Nageswara R. Palepu | Fulvestrant formulations |
| US20110092579A1 (en) * | 2009-10-19 | 2011-04-21 | Scidose Llc | Solubilized formulation of docetaxel |
| US8912228B2 (en) | 2009-10-19 | 2014-12-16 | Scidose Llc | Docetaxel formulations with lipoic acid |
| US8476310B2 (en) | 2009-10-19 | 2013-07-02 | Scidose Llc | Docetaxel formulations with lipoic acid |
| US8541465B2 (en) * | 2009-10-19 | 2013-09-24 | Scidose, Llc | Docetaxel formulations with lipoic acid and/or dihydrolipoic acid |
| US7772274B1 (en) | 2009-10-19 | 2010-08-10 | Scidose, Llc | Docetaxel formulations with lipoic acid |
| US11179468B2 (en) | 2012-04-09 | 2021-11-23 | Eagle Pharmaceuticals, Inc. | Fulvestrant formulations |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH07503477A (ja) * | 1992-02-07 | 1995-04-13 | ローン−プーラン・ロレ・ソシエテ・アノニム | バッカチン3および10‐デアセチルバッカチン3の新規誘導体,それらの製造およびそれらを含有する医薬組成物 |
| WO1999014209A1 (en) * | 1997-09-17 | 1999-03-25 | Kabushiki Kaisha Yakult Honsha | New taxane derivatives |
| WO1999032473A1 (en) * | 1997-12-19 | 1999-07-01 | Kabushiki Kaisha Yakult Honsha | Taxane derivatives |
| JP2003521545A (ja) * | 2000-02-02 | 2003-07-15 | フロリダ・ステイト・ユニバーシティ・リサーチ・ファウンデイション・インコーポレイテッド | 改良された溶解性を有するタキサン製剤 |
| JP2003522172A (ja) * | 2000-02-02 | 2003-07-22 | フロリダ・ステイト・ユニバーシティ・リサーチ・ファウンデイション・インコーポレイテッド | 抗腫瘍剤としてのc10エステル置換タキサン |
Family Cites Families (63)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2601675B1 (fr) * | 1986-07-17 | 1988-09-23 | Rhone Poulenc Sante | Derives du taxol, leur preparation et les compositions pharmaceutiques qui les contiennent |
| US5175315A (en) * | 1989-05-31 | 1992-12-29 | Florida State University | Method for preparation of taxol using β-lactam |
| US5714512A (en) * | 1991-07-08 | 1998-02-03 | Rhone-Poulenc Rorer, S.A. | Compositions containing taxane derivatives |
| US5243045A (en) * | 1991-09-23 | 1993-09-07 | Florida State University | Certain alkoxy substituted taxanes and pharmaceutical compositions containing them |
| US5721268A (en) * | 1991-09-23 | 1998-02-24 | Florida State University | C7 taxane derivatives and pharmaceutical compositions containing them |
| US5274124A (en) * | 1991-09-23 | 1993-12-28 | Florida State University | Metal alkoxides |
| US5710287A (en) * | 1991-09-23 | 1998-01-20 | Florida State University | Taxanes having an amino substituted side-chain and pharmaceutical compositions containing them |
| SG46582A1 (en) * | 1991-09-23 | 1998-02-20 | Univ Florida State | 10-Desacetoxytaxol derivatives |
| US5250683A (en) * | 1991-09-23 | 1993-10-05 | Florida State University | Certain substituted taxanes and pharmaceutical compositions containing them |
| US5739362A (en) * | 1991-09-23 | 1998-04-14 | Florida State University | Taxanes having an alkoxy, alkenoxy or aryloxy substituted side-chain and pharmaceutical compositions containing them |
| US5714513A (en) * | 1991-09-23 | 1998-02-03 | Florida State University | C10 taxane derivatives and pharmaceutical compositions |
| KR100252493B1 (ko) | 1991-09-23 | 2000-05-01 | 플로리다 | 금속알콕시드 및 베타-락탐을 사용한 치환된 이소세린 에스테르의 제조방법 |
| US5430160A (en) * | 1991-09-23 | 1995-07-04 | Florida State University | Preparation of substituted isoserine esters using β-lactams and metal or ammonium alkoxides |
| US5283253A (en) * | 1991-09-23 | 1994-02-01 | Florida State University | Furyl or thienyl carbonyl substituted taxanes and pharmaceutical compositions containing them |
| US5227400A (en) * | 1991-09-23 | 1993-07-13 | Florida State University | Furyl and thienyl substituted taxanes and pharmaceutical compositions containing them |
| ES2230790T3 (es) * | 1992-01-15 | 2005-05-01 | E.R. SQUIBB & SONS, INC. | Procedimientos enzimaticos para la resolucion de mezclas enantiomericas de compuestos utiles como intermedios en la preparacion de taxanos. |
| US5272171A (en) | 1992-02-13 | 1993-12-21 | Bristol-Myers Squibb Company | Phosphonooxy and carbonate derivatives of taxol |
| US5200534A (en) | 1992-03-13 | 1993-04-06 | University Of Florida | Process for the preparation of taxol and 10-deacetyltaxol |
| FR2691460B1 (fr) | 1992-05-21 | 1994-07-22 | Rhone Poulenc Rorer Sa | Nouveaux derives du taxane, leur preparation et les compositions qui les contiennent. |
| US5254580A (en) * | 1993-01-19 | 1993-10-19 | Bristol-Myers Squibb Company | 7,8-cyclopropataxanes |
| CA2100808A1 (en) | 1992-10-01 | 1994-04-02 | Vittorio Farina | Deoxy paclitaxels |
| FR2696461B1 (fr) | 1992-10-05 | 1994-11-10 | Rhone Poulenc Rorer Sa | Nouveaux dérivés d'analogues du taxol, leur préparation et les compositions qui les contiennent. |
| CA2109861C (en) | 1992-12-04 | 1999-03-16 | Shu-Hui Chen | 6,7-modified paclitaxels |
| MX9307777A (es) | 1992-12-15 | 1994-07-29 | Upjohn Co | 7-HALO-Y 7ß, 8ß-METANO-TAXOLES, USO ANTINEOPLASTICO Y COMPOSICIONES FARMACEUTICAS QUE LOS CONTIENEN. |
| NO310238B1 (no) | 1992-12-24 | 2001-06-11 | Bristol Myers Squibb Co | Kjemiske forbindelser og farmasöytisk preparat samt anvendelse av slike preparater |
| FR2702212B1 (fr) | 1993-03-02 | 1995-04-07 | Rhone Poulenc Rorer Sa | Nouveaux taxoïdes, leur préparation et les compositions pharmaceutiques qui les contiennent. |
| US5703247A (en) * | 1993-03-11 | 1997-12-30 | Virginia Tech Intellectual Properties, Inc. | 2-Debenzoyl-2-acyl taxol derivatives and methods for making same |
| US5475011A (en) * | 1993-03-26 | 1995-12-12 | The Research Foundation Of State University Of New York | Anti-tumor compounds, pharmaceutical compositions, methods for preparation thereof and for treatment |
| IT1261667B (it) * | 1993-05-20 | 1996-05-29 | Tassano ad attivita' antitumorale. | |
| PT982301E (pt) * | 1993-06-11 | 2004-02-27 | Upjohn Co | Utilizacao antineoplasica de delta-6,7-taxois e composicoes farmaceuticas que oscontem |
| IL109926A (en) | 1993-06-15 | 2000-02-29 | Bristol Myers Squibb Co | Methods for the preparation of taxanes and microorganisms and enzymes utilized therein |
| TW397866B (en) * | 1993-07-14 | 2000-07-11 | Bristol Myers Squibb Co | Enzymatic processes for the resolution of enantiomeric mixtures of compounds useful as intermediates in the preparation of taxanes |
| JPH07177879A (ja) | 1993-07-27 | 1995-07-18 | Nippon Steel Corp | 微生物によるタキソール及びその類縁化合物の製造法 |
| CA2129288C (en) | 1993-08-17 | 2000-05-16 | Jerzy Golik | Phosphonooxymethyl esters of taxane derivatives |
| RO115875B1 (ro) * | 1994-07-26 | 2000-07-28 | Indena Spa | Derivati de taxan, procedeu pentru prepararea acestora, intermediar pentru prepararea acestora si compozitie farmaceutica care ii contine |
| AU4133096A (en) | 1994-10-28 | 1996-05-23 | Research Foundation Of The State University Of New York, The | Taxoid derivatives, their preparation and their use as antitumor agents |
| US6100411A (en) | 1994-10-28 | 2000-08-08 | The Research Foundation Of State University Of New York | Taxoid anti-tumor agents and pharmaceutical compositions thereof |
| EP0738265A1 (en) | 1994-11-04 | 1996-10-23 | PHARMACIA S.p.A. | Taxane derivatives |
| MA23823A1 (fr) | 1995-03-27 | 1996-10-01 | Aventis Pharma Sa | Nouveaux taxoides, leur preparation et les compositions qui les contiennent |
| FR2732342B1 (fr) * | 1995-04-03 | 1997-04-30 | Rhone Poulenc Rorer Sa | Nouveaux taxoides, leur preparation et les compositions pharmaceutiques qui les contiennent |
| FR2732968B1 (fr) * | 1995-04-14 | 1997-05-16 | Rhone Poulenc Rorer Sa | Nouveaux taxoides, leur preparation et les compositions pharmaceutiques qui les contiennent |
| US5780653A (en) * | 1995-06-07 | 1998-07-14 | Vivorx Pharmaceuticals, Inc. | Nitrophenyl, 10-deacetylated substituted taxol derivatives as dual functional cytotoxic/radiosensitizers |
| US5760251A (en) | 1995-08-11 | 1998-06-02 | Sepracor, Inc. | Taxol process and compounds |
| WO1997009979A1 (en) | 1995-09-13 | 1997-03-20 | Florida State University | Radiosensitizing taxanes and their pharmaceutical preparations |
| US5767297A (en) * | 1997-02-05 | 1998-06-16 | Ensuiko Sugar Refining Co., Ltd. | Taxoid derivative and method of producing thereof |
| EP0927175A4 (en) | 1996-05-06 | 2002-05-22 | Univ Florida State | 1-DEOXYBACCATIN III, 1-DEOXYTAXOL AND 1-DEOXYTAXOL ANALOG AND METHOD FOR THE PRODUCTION THEREOF |
| JP4172726B2 (ja) | 1996-05-22 | 2008-10-29 | ルイトポルド・ファーマシューティカルズ・インコーポレーテッド | シス―ドコサヘキサエン酸とドセタキセルとの共有複合体を含有する製剤 |
| US5795909A (en) | 1996-05-22 | 1998-08-18 | Neuromedica, Inc. | DHA-pharmaceutical agent conjugates of taxanes |
| US6576636B2 (en) * | 1996-05-22 | 2003-06-10 | Protarga, Inc. | Method of treating a liver disorder with fatty acid-antiviral agent conjugates |
| EP0930309A4 (en) | 1996-07-15 | 2001-09-26 | Yakult Honsha Kk | TAXAN DERIVATIVES AND MEDICINAL PRODUCTS CONTAINING THEM |
| US5811452A (en) * | 1997-01-08 | 1998-09-22 | The Research Foundation Of State University Of New York | Taxoid reversal agents for drug-resistance in cancer chemotherapy and pharmaceutical compositions thereof |
| US5912264A (en) * | 1997-03-03 | 1999-06-15 | Bristol-Myers Squibb Company | 6-halo-or nitrate-substituted paclitaxels |
| CA2206739C (en) | 1997-06-03 | 2006-10-10 | Ensuiko Sugar Refining Co., Ltd. | Taxoid derivative and method of producing thereof |
| US7288665B1 (en) | 1997-08-18 | 2007-10-30 | Florida State University | Process for selective derivatization of taxanes |
| US6156789A (en) * | 1998-03-17 | 2000-12-05 | Rhone-Poulenc Rorer S.A. | Method for treating abnormal cell proliferation in the brain |
| JP2003026673A (ja) | 1999-03-05 | 2003-01-29 | Asahi Kasei Corp | 骨形成促進剤 |
| IL145636A0 (en) * | 2000-02-02 | 2002-06-30 | Univ Florida State Res Found | C10 carbonate substituted taxanes as antitumor agents |
| GEP20043226B (en) * | 2000-02-02 | 2004-04-26 | Florida State Univ Research Foundation Us | C7 Carbonate Substituted Taxanes as Antitumor Agents, Pharmaceutical Compositions Containing the Same and Use Thereof as Agents to Inhibit Tumor Growth |
| HUP0200995A3 (en) | 2000-02-02 | 2005-02-28 | Univ Florida State Res Found | Taxane formulations having improved solubility |
| US6649632B2 (en) * | 2000-02-02 | 2003-11-18 | Fsu Research Foundation, Inc. | C10 ester substituted taxanes |
| IT1319168B1 (it) | 2000-03-17 | 2003-09-26 | Indena Spa | Derivati di condensazione ad attivita' antitumorale, loro metodo dipreparazione e formulazioni che li contengono. |
| JP2008530122A (ja) | 2005-02-14 | 2008-08-07 | フロリダ・ステイト・ユニバーシティ・リサーチ・ファウンデイション・インコーポレイテッド | C10シクロプロピルエステル置換タキサン組成物 |
| JP5571380B2 (ja) * | 2006-07-24 | 2014-08-13 | ルミナス バイオサイエンシズ,インコーポレイテッド | オストワルド熟成を減少させた水不溶性の医薬品物質の固体ナノ粒子処方物 |
-
2009
- 2009-03-24 JP JP2011503034A patent/JP2011517455A/ja active Pending
- 2009-03-24 CA CA2718567A patent/CA2718567A1/en not_active Abandoned
- 2009-03-24 WO PCT/US2009/038119 patent/WO2009145981A1/en not_active Ceased
- 2009-03-24 EP EP09755344A patent/EP2276755A4/en not_active Withdrawn
- 2009-03-24 US US12/409,884 patent/US8242166B2/en not_active Expired - Fee Related
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH07503477A (ja) * | 1992-02-07 | 1995-04-13 | ローン−プーラン・ロレ・ソシエテ・アノニム | バッカチン3および10‐デアセチルバッカチン3の新規誘導体,それらの製造およびそれらを含有する医薬組成物 |
| WO1999014209A1 (en) * | 1997-09-17 | 1999-03-25 | Kabushiki Kaisha Yakult Honsha | New taxane derivatives |
| WO1999032473A1 (en) * | 1997-12-19 | 1999-07-01 | Kabushiki Kaisha Yakult Honsha | Taxane derivatives |
| JP2003521545A (ja) * | 2000-02-02 | 2003-07-15 | フロリダ・ステイト・ユニバーシティ・リサーチ・ファウンデイション・インコーポレイテッド | 改良された溶解性を有するタキサン製剤 |
| JP2003522172A (ja) * | 2000-02-02 | 2003-07-22 | フロリダ・ステイト・ユニバーシティ・リサーチ・ファウンデイション・インコーポレイテッド | 抗腫瘍剤としてのc10エステル置換タキサン |
Non-Patent Citations (1)
| Title |
|---|
| JPN6013049957; SAMPATH,D. et al: Clinical Cancer Research Vol.12, No.11, 2006, p.3459-3469 * |
Also Published As
| Publication number | Publication date |
|---|---|
| EP2276755A4 (en) | 2011-05-04 |
| US8242166B2 (en) | 2012-08-14 |
| CA2718567A1 (en) | 2009-12-03 |
| EP2276755A1 (en) | 2011-01-26 |
| WO2009145981A1 (en) | 2009-12-03 |
| US20090318543A1 (en) | 2009-12-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2011517455A (ja) | C(10)エチルエステルおよびc(10)シクロプロピルエステル置換タキサン | |
| JP2003522167A (ja) | 抗腫瘍剤としてのc7エステル置換タキサン | |
| JP2003521514A (ja) | 抗腫瘍剤としてのc10ヘテロ置換アセテートタキサン | |
| KR20010111580A (ko) | 개선된 용해도를 갖는 탁산 제형물 | |
| CN1186340C (zh) | 用作抗肿瘤剂的c10碳酸酯取代的紫杉烷 | |
| HUP0102979A2 (hu) | Gyomor-nyelőcső reflux betegség kezelésére alkalmas, hatóanyagként (+)-norciszapridot tartalmazó gyógyászati készítmények | |
| JP2003055360A (ja) | C10エステル置換タキサン | |
| CN1362957A (zh) | 作为抗肿瘤剂的c7杂取代乙酸酯取代的紫杉烷 | |
| HK1047934A1 (zh) | 用作抗肿瘤剂的c7碳酸酯取代的紫杉烷 | |
| JP4879757B2 (ja) | C10シクロペンチルエステル置換タキサン | |
| JP2003522172A (ja) | 抗腫瘍剤としてのc10エステル置換タキサン | |
| JP2003522173A (ja) | 抗腫瘍剤としてのc10カルバモイルオキシ置換タキサン | |
| JP2003522168A (ja) | 抗腫瘍剤としてのc7カルバモイルオキシ置換タキサン | |
| US20110039921A1 (en) | Cephalomannine derivatives, their preparation, pharmaceutical composition and use thereof | |
| WO2007025031A2 (en) | Prodrugs of indanone and tetralone compounds | |
| JP2003055361A (ja) | C10カーボネート置換タキサン | |
| JP2003055373A (ja) | C7エステル置換タキサン | |
| TWI286552B (en) | C10 carbonate substituted taxanes | |
| JP2007527432A (ja) | C7ラクチルオキシ置換タキサン | |
| MXPA06008999A (en) | C10 cyclopentyl ester substituted taxanes | |
| HUP0103245A2 (hu) | C10 észter szubsztituált taxánok | |
| HK1053472B (en) | C10 carbonate substituted taxanes as antitumor agents |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120326 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20120326 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20131008 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20140401 |