JP2009525781A - 細胞をベースとする体外治療装置および送達システム - Google Patents
細胞をベースとする体外治療装置および送達システム Download PDFInfo
- Publication number
- JP2009525781A JP2009525781A JP2008553503A JP2008553503A JP2009525781A JP 2009525781 A JP2009525781 A JP 2009525781A JP 2008553503 A JP2008553503 A JP 2008553503A JP 2008553503 A JP2008553503 A JP 2008553503A JP 2009525781 A JP2009525781 A JP 2009525781A
- Authority
- JP
- Japan
- Prior art keywords
- tube
- capsule
- cell
- cells
- blood
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M5/00—Devices for bringing media into the body in a subcutaneous, intra-vascular or intramuscular way; Accessories therefor, e.g. filling or cleaning devices, arm-rests
- A61M5/14—Infusion devices, e.g. infusing by gravity; Blood infusion; Accessories therefor
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M1/00—Suction or pumping devices for medical purposes; Devices for carrying-off, for treatment of, or for carrying-over, body-liquids; Drainage systems
- A61M1/34—Filtering material out of the blood by passing it through a membrane, i.e. hemofiltration or diafiltration
- A61M1/3472—Filtering material out of the blood by passing it through a membrane, i.e. hemofiltration or diafiltration with treatment of the filtrate
- A61M1/3486—Biological, chemical treatment, e.g. chemical precipitation; treatment by absorbents
- A61M1/3489—Biological, chemical treatment, e.g. chemical precipitation; treatment by absorbents by biological cells, e.g. bioreactor
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M1/00—Suction or pumping devices for medical purposes; Devices for carrying-off, for treatment of, or for carrying-over, body-liquids; Drainage systems
- A61M1/36—Other treatment of blood in a by-pass of the natural circulatory system, e.g. temperature adaptation, irradiation ; Extra-corporeal blood circuits
- A61M1/3687—Chemical treatment
- A61M1/3689—Chemical treatment by biological cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M1/00—Suction or pumping devices for medical purposes; Devices for carrying-off, for treatment of, or for carrying-over, body-liquids; Drainage systems
- A61M1/36—Other treatment of blood in a by-pass of the natural circulatory system, e.g. temperature adaptation, irradiation ; Extra-corporeal blood circuits
- A61M1/3621—Extra-corporeal blood circuits
- A61M1/3653—Interfaces between patient blood circulation and extra-corporal blood circuit
- A61M1/3655—Arterio-venous shunts or fistulae
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M1/00—Suction or pumping devices for medical purposes; Devices for carrying-off, for treatment of, or for carrying-over, body-liquids; Drainage systems
- A61M1/36—Other treatment of blood in a by-pass of the natural circulatory system, e.g. temperature adaptation, irradiation ; Extra-corporeal blood circuits
- A61M1/3687—Chemical treatment
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M2202/00—Special media to be introduced, removed or treated
- A61M2202/09—Body tissue
Abstract
動的生理環境に応じて生細胞によって産生される生物活性分子を治療用に送達する方法を提供する、細胞をベースとする体外の治療装置および送達システムを開示する。例示的な設計を開示する。第1の例示的な実施形態では、本装置は長い中空繊維を含んでおり、該中空繊維の内部において、細胞層が、管腔の体積の内部または中空が充填された二重構造のチャンバの内部で培養される。別の例示的な実施形態では、本装置は、細胞が上で培養される培地を形成するオブラートまたは一連のオブラートを含む。オブラート(複数)は、その後、装置に挿入される。これらの装置は、体外での使用を意図されている。開示するのは、あらかじめ選択された分子、例えばホルモンを、哺乳動物の体循環内に送達するための装置である。本装置は、様々な細胞産物の構成要素も送達することができる。本装置は、血液用の体外管の内壁に固定することができる固定要素を備える。
Description
相互参照項
本願は、2006年2月2日に出願された、現在係属中の米国仮特許出願第60/764,357号の利益を主張する。
本願は、2006年2月2日に出願された、現在係属中の米国仮特許出願第60/764,357号の利益を主張する。
発明の分野
本発明は、治療用分子を体内に送達するための体外治療装置に関する。より詳細には、本発明は、生存細胞を収容する体外治療装置に関する。分子を体内に送達することができる1つの方法は、血液循環または他の体液を介する方法である。本装置が体外の血流中に導入されている際に、細胞が治療用分子を産生し、本装置を通って循環する血液または流体中に分泌する。
本発明は、治療用分子を体内に送達するための体外治療装置に関する。より詳細には、本発明は、生存細胞を収容する体外治療装置に関する。分子を体内に送達することができる1つの方法は、血液循環または他の体液を介する方法である。本装置が体外の血流中に導入されている際に、細胞が治療用分子を産生し、本装置を通って循環する血液または流体中に分泌する。
発明の背景
哺乳動物の体内に治療用分子を導入するのに役立つ薬物送達装置は、数多くの研究の対象とされてきた。一側面では、研究は、細胞代謝によって産生される分子を送達する装置の開発に向けられてきた。努力は、長期間患者の体内に留まることができる植え込み型の細胞をベースとする送達システムの製造にも向けられてきた。
哺乳動物の体内に治療用分子を導入するのに役立つ薬物送達装置は、数多くの研究の対象とされてきた。一側面では、研究は、細胞代謝によって産生される分子を送達する装置の開発に向けられてきた。努力は、長期間患者の体内に留まることができる植え込み型の細胞をベースとする送達システムの製造にも向けられてきた。
あらかじめ選択された分子、例えばホルモンを哺乳動物の体循環内に送達するための植え込み型装置については、その全内容が引用により本明細書に組み込まれる、特許文献1に記載されている。記載されている装置は、損傷のない血管の内壁に固定することができる植え込み型血液透過性要素と、固定された血液透過性要素によって血管内の所定の位置に保持されたカプセルとを備える。カプセルは、あらかじめ選択された分子を産生して該カプセルを通る血液中に分泌する生存細胞を封入している。本特許には、この装置をあらかじめ選択された血管に経皮的に導入する方法も記載されている。
細胞をベースとする体内の送達装置は、身体の内部、一般には身体の管腔(血管のような)にちょうど収まる大きさを有する必要があり、従って、サイズ縮小要件のため、一定のサイズ制限を有する。さらに、細胞をベースとする体内送達システムを設計する際に、装置を身体、例えば血管に取り付けるために用いられる固定具を、身体に外傷をもたらすことなく装置が固定されるように構成する必要がある。最終的に、植え込み型の装置は、特にそれらが長期間体内に置かれていた場合に、回収が困難となる可能性がある。
ブタまたはヒトの近位尿細管前駆細胞を利用するより大きい体外装置を用いた生体外実験では、尿細管補助装置(RAD)の輸送機能および代謝機能に差異があることが明らかになった。[非特許文献1〜3(参考文献4−6)]バイオ人工腎臓(BAK)の構成は、ろ過ユニット(通常の合成血液ろ過カートリッジ)の後に尿細管(RAD)ユニットが直列に続く構成となっている。尿細管ユニットは、管腔内限外ろ過液と毛細管外空間の血液の両方から代謝基質および増殖物質と共に酸素が尿細管細胞に送達されるため、生活能力を保持することができる。細胞の免疫保護は、中空繊維を越えての免疫グロブリンおよび免疫担当細胞の不可入性によって達成される。非自己細胞の拒絶反応は生じない。
大型動物での前臨床研究では、急性尿毒症のイヌの腎臓のろ過機能、輸送機能、代謝機能、および内分泌機能をBAKがうまく代替することが実証された。[非特許文献2(参考文献5)]さらに、急性尿毒症のイヌでの前臨床研究では、応力状態下でのRADの影響力も評価された。緊急に腎摘出を施された動物は、BAK内での細胞を利用した治療またはシャム対照RADを用いた治療の前に、内毒素(リポ多糖類)の静脈内注射またはある回数分の生存可能大腸菌の腹腔内投与を試みられた。[非特許文献4、5(参考文献7、8)]これらの実験では、細胞を利用したRADは、腎臓の代謝機能を代替し、シャム対照と比較して、より高い抗炎症性の血漿中濃度、血行動態のより良い安定性をもたらし、また大腸菌敗血症モデルでは、より長い生存期間をもたらした。敗血症性ショックにおけるBAKの役割をさらに評価するために、正常な腎臓機能を有するブタのモデルが大量の大腸菌の腹腔内投与を受けた。[非特許文献6(参考文献9)]すべての動物が、投与後2時間〜4時間以内に、オリゴ/尿閉を伴う急性尿細管壊死を発現し、RAD治療の結果、シャム対照と比較して、より良い心血管系機能、より低い前炎症性サイトカインの血漿中濃度、およびより長い生存期間がもたらされた。
これらの対症的前臨床実験は、ARFおよびMOFを有する集中治療室(ICU)患者の第I/II相臨床試験および第II相臨床試験におけるヒト細胞RAD試験の根拠であった。良好な第I/II相安全性試験[非特許文献7(参考文献10)]の結果は、この細胞療法による手法が患者の死亡率を変えるか否かを判断するための、12の臨床現場での、FDAに認可された、無作為抽出による、制御された非盲検第II相調査につながった。この第II相研究には58人の患者が含まれ、そのうちの40人は、RAD療法に対して無作為に抽出され、18人は、比較可能な人口統計データおよび疾病の重症度を有する対照群を構成した。初期結果は、第I/II相の結果と同様に説得力のあるものとなった。腎細胞療法は、28日後の死亡率を、従来の血液ろ過治療を受けた対照群における61%からRAD治療を受けた群における34%まで改善した。[非特許文献8、9(参考文献11、12)]この生存率の影響は、90日および180日の追跡期間(p<0.04)を通して続き、死亡の危険性を示すCox比例ハザード率は、従来の持続的腎代償療法群において観察されたそれの50%であった。腎細胞療法によるこの生存率の優位性は、ARFの様々な病因に対して観察され、臓器不全の数(1〜5+)または敗血症の存在とは無関係であった。随伴性の重度敗血症または敗血症性ショックを有する患者のサブセット解析では、細胞療法群および従来の療法群において、それぞれ、73%および67%の敗血症発生率が実証された。RAD療法は、従来の療法群における67%と比較対照され、敗血症を有する患者における34%の死亡率と関連付けられた。従って、これらの臨床結果は、これらの重篤な有病患者の生存率に重大な影響があることを示唆している。重度敗血症を有する患者に対する尿細管細胞療法の臨床利用では、2つの体外ポンプシステムを有するこの複雑な2カートリッジシステムの大部分がARFには必要とされないので、該2カートリッジシステムは必要ではなくなる。
米国特許第6,716,208号明細書
Humes HDら、Am J Kindney Dis 2002;39(5):1078−1087
Humes HDら、Nat Biotechnol 1999;17:451−455
Humes HDら、Kidney Int 1999;55:2502−2514
Fissell WHら、Blood Purif 2002;20:55−60
Fissell WHら、J Am Soc Nephrol 2003;14:454−461
Humes HDら、Crit Care Med 2003;31:2421−2428
Humes HDら、Kidney Int 2004;66:1578−1588
Tumlin Jら、J Am Soc Nephrol 2005;16:46A
Williams Wら、J Am Soc Nephrol 2006;17:49A
本発明は、細胞をベースとする体内送達システムの諸側面に対処するように設計された細胞をベースとする体外送達システムを提供する。さらに、本発明は、治療薬を哺乳動物の体内に導入し、あらかじめ選択された分子または細胞産物の組み合わせを血流中または体液中あるいは体腔内に直接分泌して先行技術の課題に対処するように設計された体外装置を提供する。本発明は、以下の説明からより明確に理解されよう。
さらに、小型化された細胞療法装置は、大規模な体外血液ポンプシステムを必要としない。さらに、即時利用に備えて臨床現場に保管することができる小型装置は、市販用製品として成功する必要がある。現在のRADは、37℃で中央製造施設に保管されており、37℃で臨床現場に出荷される必要があり、処置を遅延させ、治療費を増大させている。凍結保存し、臨床現場で貯蔵することができる細胞装置の開発は、装置を安全に市場にもたらすのに役立つことができる。
発明の概要
本発明は、哺乳動物の体内、例えば哺乳動物の循環系または体液中にあらかじめ選択された分子または細胞産物を送達するための体外治療装置を提供する。本発明の一実施形態は、侵襲的な外科的手技なくして分子を循環系または体腔に導入することを可能にする。ひとたび本装置が配備されれば、本装置は、血流または体液中に分子を直接送達する。さらに、本発明の装置は、一定の期間にわたってあらかじめ選択された分子または細胞産物を産生し、次いで血流または体液中に分泌するようになっている。本体外装置および方法は、侵襲的な植え込み手技の不利点なくして治療上有効な量の遺伝子産物、例えばホルモン、成長因子、抗凝血剤、免疫賦活剤、または同種のものを受容者の血流または体液中に直接送達するための容易かつ再生可能なシステムを提供する。
本発明は、哺乳動物の体内、例えば哺乳動物の循環系または体液中にあらかじめ選択された分子または細胞産物を送達するための体外治療装置を提供する。本発明の一実施形態は、侵襲的な外科的手技なくして分子を循環系または体腔に導入することを可能にする。ひとたび本装置が配備されれば、本装置は、血流または体液中に分子を直接送達する。さらに、本発明の装置は、一定の期間にわたってあらかじめ選択された分子または細胞産物を産生し、次いで血流または体液中に分泌するようになっている。本体外装置および方法は、侵襲的な植え込み手技の不利点なくして治療上有効な量の遺伝子産物、例えばホルモン、成長因子、抗凝血剤、免疫賦活剤、または同種のものを受容者の血流または体液中に直接送達するための容易かつ再生可能なシステムを提供する。
所定の期間にわたって哺乳動物の体内にあらかじめ選択された分子(複数)を投与する体外装置は、先行技術に勝る利点を提示する。体外装置は、植え込まれた装置を除去するのに要する努力と比べて、循環系から取り出すことが容易であるという利点を有する。従って、本発明は、一定の期間にわたって、あらかじめ選択された分子または細胞産物を哺乳動物の体循環内に送達するための体外装置を提供する。別の態様では、本発明は、あらかじめ選択された分子または細胞産物を体循環内に送達することができる装置を哺乳動物の血液循環内に非外科的に導入する方法を提供する。
一実施形態では、本装置は、あらかじめ選択された分子を産生して血流中に分泌する生存細胞を収容するカプセルを含む。この装置は、血液を体外で循環させるチューブの内側表面に該装置を固定する固定要素を含むことができる。
本明細書において使用する用語「体外循環路」は、哺乳動物の体内の循環系または体液区画に接続することができかつ自然(例えば心臓による)循環または人工(例えば機械ポンプによる)循環によって血液または流体をチューブまたは導管に流す、体外にあるあらゆるチューブまたは導管を包含する。本発明の体外装置は、体外循環路内に配置するように構成されている。
本明細書において使用する用語「固定要素」は、体外循環系の血液チューブまたは血液導管の管腔に挿入することができ、ひとたび挿入すれば、例えばフック、返し、またはステントによってチューブまたは導管の内側表面に固定することができるあらゆる構造物を包含する。例示的な実施形態では、固定要素は、血餅フィルタ型構造物とすることができる。本発明の実施に役立つ様々な血餅抗移動フィルタが当業界に知られている。目下好ましい固定要素は、「Greenfield(登録商標)大静脈フィルタ」として知られている抗移動フィルタである。有用なGreenfield(登録商標)大静脈フィルタについては、米国特許第4,817,600号および第5,059,205号に詳細に記載されており、その全開示内容が引用により本明細書に組み込まれる。
本明細書において使用する用語「カプセル」は、体外循環路に用いられるチューブまたは導管の管腔にちょうど収まる大きさを有しかつ血液または流体の流れを閉塞または妨害しないあらゆる中空の構造物を包含する。一実施形態では、カプセルは、固定要素(複数)によって体外血液回路内の所定の位置に保持されている。例えば、カプセルは、固定要素の上流に保持してもよく、あるいは、固定要素を固定要素の下流に配置し、例えば、固定要素からカプセルに向けて延びるフックまたはテザーによって所定の位置に保持してもよい。さらに、カプセルを円錐形またはV字様の形とし、カプセルを通り越して流れる血液の乱流を低減することができる。好ましい実施形態では、カプセルは、特定のサイズより小さい粒子(細胞を含む)は通過することができ、特定のサイズより大きい粒子は通過するのを防止されるように粒子をろ過することができる材料で形成されている。フィルタは、血液から限外ろ過液を形成して100,000分子量より大きい蛋白質の侵入を最小限に抑え、それにより、特に非自己細胞が免疫反応を活性化しないように、免疫グロブリンを細胞周辺の浴媒体から除外することができる。
カプセルは、半透性膜で作製された単一の中空繊維または中空繊維の束を含むことができる。半透膜フィルタは、あらかじめ選択された分子または細胞産物を通して拡散させるのに十分でありながらも細胞の通過を排除するのには十分に小さいサイズの孔を有するのが好ましい。孔は、中空繊維を通過する血流中に細胞によって産生されたあらかじめ選択された分子が直接拡散するのを許容し、同時に細胞が中空繊維の外へ出て体循環中に移動するのを防止するように設計されているのが好ましい。
種々のポリマーが、本発明の生体適合性半透膜を製造するのに役立つ。それらには、限定するものではないが、ポリアルギン酸塩、ポリ塩化ビニル、ポリフッ化ビニリデン、ポリウレタンイソシアネート、酢酸セルロース、二酢酸セルロース、三酢酸セルロース、硝酸セルロース、ポリスルホン、ポリスチレン、ポリウレタン、ポリビニルアルコール、ポリアクリロニトリル、ポリアミド、ポリメタクリル酸メチル、polytetafluoroethylene、およびポリエチレンオキシドが含まれる。さらに、有益な半透膜は、これらのポリマーを組み合わせたもので製造してもよい。
一実施形態では、カプセルの半透性中空繊維(複数)の内部に封入された生存細胞は、真核細胞であるのが好ましく、哺乳類細胞であるのが最も好ましい。本明細書に記載する装置は、あらかじめ選択された分子または他の細胞産物を自然に産生および分泌する細胞を備えることができるが、遺伝子操作された細胞、すなわちあらかじめ選択された分子をコード化した核酸を導入され、それを発現することができる細胞も同様に本発明の実施に用いることができることが企図される。
別の実施形態では、あらかじめ選択された分子は蛋白質とすることができ、ホルモン、例えばエリスロポエチンまたはインスリンであるのが最も好ましい。しかしながら、本装置は、生存細胞によって産生および分泌することができる何らかの分子を体循環中に送達するために用いることができることが企図される。単一のあらかじめ選択された分子を産生および分泌する単一細胞型を本発明に用いることができるが、複数のあらかじめ選択された分子を産生および分泌する特定の細胞型に属する細胞も同様に本発明の実施に用いることができることが分かる。同様に、各細胞型に属する細胞が異なるあらかじめ選択された分子を産生および分泌する複数の細胞型をカプセル内で組み合わせ、それによってあらかじめ選択された分子の望ましい組み合わせを循環中に送達する装置を製造することが企図される。
本装置の好ましい実施形態は、3つの構成を含む。各好ましい構成では、免疫反応を最小限に抑えるために、治療用細胞が単離されている。第1の構成では、装置は、カートリッジと、カートリッジに取り付けられたチューブの形態とすることができる細胞担持ユニットと、固定システムとからなる。治療用細胞はチューブの内部に配置されており、該細胞は、チューブの孔の大きさによって単離されている。第2の構成では、細胞担持ユニットは、カートリッジ内に配置された円盤の形状をとっている。円盤上の治療用細胞は、カートリッジ内に円盤を隔離し、かつ体外の血流または流体流内での細胞の自由な生理的交換を可能にしながら細胞が望ましくない要素にさらされるのを防止する孔をカートリッジ内に設けることによって、拒絶反応から保護されている。第3の構成は、上述の構成を組み合わせたものである。他の構成も可能である。
詳細な説明:
本発明は、哺乳動物の体内、例えば哺乳動物の体循環内に分子を送達するための体外装置を提供する。本発明の装置は、体外の血液導管内への導入用に適合されている。体外の血液導管への導入後、本装置は、あらかじめ選択された分子または細胞産物が本装置の外へ出て受容者の血流または体腔内に拡散するのを許容する。特定の局面では、本装置は、血液パラメータ、例えばエリトロポエチン産生細胞の場合には酸素圧に応じて許容する。また、インスリン産生細胞周辺の浴媒体中のグルコース濃度も、インスリンの産生を刺激することができる。
本発明は、哺乳動物の体内、例えば哺乳動物の体循環内に分子を送達するための体外装置を提供する。本発明の装置は、体外の血液導管内への導入用に適合されている。体外の血液導管への導入後、本装置は、あらかじめ選択された分子または細胞産物が本装置の外へ出て受容者の血流または体腔内に拡散するのを許容する。特定の局面では、本装置は、血液パラメータ、例えばエリトロポエチン産生細胞の場合には酸素圧に応じて許容する。また、インスリン産生細胞周辺の浴媒体中のグルコース濃度も、インスリンの産生を刺激することができる。
本発明の実施形態は、以下の利点のうちの少なくともいくつかを有する。本装置が体外にあるため、サイズ制限が少なく、また装置を植え込む場合よりも細胞担持ユニットのサイズを大きくすることができる。さらに、本装置は体内に植え込まれないため、固定システムを非外傷性となるように設計する必要がない。導管に沿って嵌合するカートリッジの実施形態は、固定システムを有しないことを企図するものである。本装置は血管に挿入することを意図されていないため、血流への本装置の導入がはるかに簡単である。
本装置は、細胞担持材を保持するカプセルを含む。細胞担持材上の細胞は、血液と細胞との間に障壁を生成する多孔質材料を用いて細胞を単離することによって、免疫反応の誘発を防止される。障壁は、細胞が血液と十分な生理的交換機能(例えば、維持栄養素および維持酸素の抽出)および細胞によって産生された代謝産物の送達機能を有することを可能にする。代謝産物は、患者の病態の結果として血流中に循環される可能性がある小さいメッセンジャー分子に応答するものであるかもしれない。また、代謝産生は、患者の血流にメッセンジャー分子を導入することによって刺激することができる。
本発明の装置の一実施形態は、体外血液回路の内壁に本装置を固定する固定システムを含む。固定システムは、血液回路内への送達中は輪郭が縮小された構成をとり、その後拡張して送達完了後の輪郭をとるようになっているアームを有することができ、それにより、アームSは、拡張して血液導管まで延びることができる。固定システムには、該固定システムのアーム上に配置されたフック、返し、またはステントを用いることができる。固定システムは、血液導管の壁への固定時に、該システムによって血管内の血液が本装置の内部および周辺を通って流れることを許容するように設計されている。
本装置は、上流を向いた、例えば円錐の形状を含んでおり、血液がカプセルを越えて流れる際の血液の乱流を最小限に抑える。一実施形態では、本装置は、あらかじめ選択された分子を産生および分泌する生存細胞を収容する半透性のハウジングを備える。生存細胞は、円盤のような平面上に配置することができる。別の実施形態では、細胞は、細胞の生理活動が行われることを可能にする多孔質チューブの内部に収容されており、該多孔質チューブから、あらかじめ選択された分子または細胞産物が血流または体液に流入することができる。チューブは、カプセルを越えて延びることができる。
ここで、説明のために提供するものであって、本発明の範囲を限定しようとするものではない本発明の実施形態を、添付の図面を参照してさらに詳細に説明する。図面を参照すると、図1に、本発明の一実施形態の実施に有用な装置10が概略的に示されている。図1では、装置10は、ノーズコーン12と、あらかじめ選択された分子を送達するための生存細胞を封入した半透膜で作製された中空繊維18からなる細胞担持ユニット16を固定するために用いられる本体14とを含む。この実施形態では、本装置のノーズコーンおよび本体は、中空繊維18からなる細胞担持ユニット16を支持している。
生存細胞は、繊維の内側表面に付着させることができる。細胞を内側表面に付着させるか否かは、装置に含まれる細胞の型によって決まることになる。例えば、一部の細胞型は、固体表面上で定着部に依存して増殖し、他の細胞型は、定着部依存性を有せず、浮遊状態で増殖する。しかしながら、細胞型の選択は、所望の用途に依存する。
図1の装置は、固定具22を含む適切な固定システム20によって体外血液回路に取り付けられている。2つの固定具22が示されているが、2つより多い、または2つより少ない固定具22を、適切な設計で用いることができる。固定具は、装置を体外導管(図8に示す)内にしっかりと保持するように構成されている。固定具は、送達に対しては格納して輪郭を縮小し、装置が導管上の適切な位置に配置されたときに、拡張して輪郭を展開することができる。ニチノールまたは他のバネ材料を含む様々な弾力性に富む、または弾性の生体適合性材料を用いることができる。
図2〜図4に、装置30がノーズコーン32と、内部に細胞担持ユニット36が取り付けられた本体34とを含む、本発明の別の実施形態を示す。この実施形態では、細胞担持ユニットは、生存細胞を収容するいくつかの半透膜円盤38を含む。用いられる円盤のサイズおよび数は、送達されるあらかじめ選択された分子の種類および量に応じて変えることができる。半透膜は、同一または異なるポリマー組成物によって画定することができることが企図される。固定具42を有する固定システム40は、図1に関連して説明した固定システムと同様に構築されており、それと同様の方法で動作する。
図3に、円盤38の詳細図を示す。円盤38は、直径が約1cmで、一実施形態では、細胞は、栄養素に対して細胞が血液または流体の成分にさらされ、かつ血液に対して細胞が所望の産物(複数)を送達することができるように膜と関連付けられている。好ましい実施形態では、膜は、生理物質の交換を増強するために、小柱構造を有する。一実施形態では、円盤は、小柱状で多孔質のコインに類似している。この構造が、種々の媒体成分の貫流および特により高い組織密度での上皮細胞の足場依存的増殖を可能にしている。
図4に、血液導管内の装置を示す。血流は、波線で示されている。大きい血液成分、例えばマクロファージおよび免疫グロブリンが円盤38上の細胞と望ましくない免疫反応を引き起こすのを排除するために、装置内にフィルタ44が備えられている。限外ろ過液とも呼ばれるろ過された物質46は、円盤38を横断して流れることができる。他の実施形態では、それらは、膜を通って流れることができる。限外ろ過液は、円盤上の細胞に維持栄養素を供給し、細胞の代謝の産物を運び去る。結果として生じる限外ろ過血液および代謝産物の流れは、波状破線48として概略的に示されている。任意選択的に、装置の下流出口にフィルタを用いてもよい。
図5〜図7に示す本発明の別の実施形態では、中空のチューブを構築し、多層構造を備えることができる。装置50は、大きい血液成分をろ過して取り除く多孔質ノーズコーン52と、一連の中空チューブ56の一端を保持する本体54とを含む。単一の中空チューブが、参照数字58で特定されている。
本体は、1断面を図7に示す中空チューブの中央にろ過された血液を分散させるマニホルド(図6に示す)を含む。望ましい流動力学をもたらすため、またはろ過されていない血液の流れがチューブに導入されるのを防止するために、中空チューブの遠位端を閉鎖することができる(図示せず)。従って、ろ過された血液の流路は、所望の構成に応じて、チューブを通るかまたは壁を通る流路とすることができる。いずれの場合にも、チューブの壁内の細胞が十分な維持栄養素を得ることができる必要がある。
図7に示すように、中空チューブ58は、ろ過された血液が流れる中央管腔62を含む。細胞64は、内壁66と外壁68との間に、チューブ状の培地(軸方向断面で示す)に沿って配置されており、細胞は、ろ過された血液または流体が細胞を横断して移動するように配置されている。このようにして、細胞は、望ましい細胞産物の産生を可能にする生命維持栄養素の供給を受ける。図に示す実施形態では、中空チューブ58の外壁は、細胞産物がチューブを通して送達されるのを許容するが、大きい粒子がチューブに入って細胞に接触するのは許容しない。内壁と外壁の両方が、そのようなろ過機能を有することができる。
もう一つの選択肢として、チューブの端部は閉鎖されておらず、ろ液は、細胞を浴することができ、また細胞に適切な量の栄養素が供給され、かつろ過されていない血液が細胞に向かって上流へ移動することができないように、十分な流速を有する。
固定システム
上に述べたように、本発明に用いることができる固定システムは、血餅をろ過するか、または血管ステントとなる装置を含む。有益な固定要素は、血流を閉塞または妨害することなく導管の管腔内に固定することができる能力を特徴とする。本発明の利点のうち1つは、血管を損傷することなく血管内に固定されるように体外装置固定システムを設計する必要がない点である。これによって、組織損傷に対する懸念が最小限に抑えられる。
上に述べたように、本発明に用いることができる固定システムは、血餅をろ過するか、または血管ステントとなる装置を含む。有益な固定要素は、血流を閉塞または妨害することなく導管の管腔内に固定することができる能力を特徴とする。本発明の利点のうち1つは、血管を損傷することなく血管内に固定されるように体外装置固定システムを設計する必要がない点である。これによって、組織損傷に対する懸念が最小限に抑えられる。
血餅フィルタは、生命を脅かすことになりかねない脈管構造内部の血餅の移動を防止するために、医療従事者によって日常的に用いられている。血餅フィルタは、一般に、血管の管腔内に植え込んで固定するように設計されている。植え込まれている際に、抗移動フィルタは、血管内の血液の通過を許容し、その一方で同時に血餅を捕捉する。血管へのフィルタ取り付けに役立つ装置および手法は、体外装置に応用することができる。もちろん、この装置は脈管構造内への導入を意図されていないため、固定具の設計は、それらの使用に対して要求される高レベルの精度を有する必要はない。
当業界でGreenfield(登録商標)フィルタと呼ばれ、マサチューセッツ州ナティック所在のMedi−Tech(登録商標)、Boston Scientific Corporationから入手可能な、米国特許第4,817,600号および第5,059,205号に記載されているフィルタは、本発明の実施に特によく適している。円錐形のGreenfield(登録商標)大静脈フィルタは、塞栓捕捉後の血管の開通性を保持しながら血餅の捕捉に対して最大の取り込み面積を提供するように設計されている。Greenfield(登録商標)大静脈フィルタの6本の脚間のスペーシングによって、3mmより大きい塞栓の捕捉が確保されている(「Haimovici’s Vascular Surgery Principles and Techniques,第3版」,コネチカット州ノーウォーク/カリフォルニア州San Mateos,Appleton & Langeに記載されたGreenfieldら著(1989年),「Venous Interruption」,第68章,pp.929−939)。従って、これらのフィルタは、直径が3mmより大きいカプセルを捕獲することができてもよい。本発明の別の実施形態では、この装置は、体外導管に挿入されたチューブに組み込まれている。この実施形態では、この装置がチューブの内部に固定されているため、固定具は不要である。
装置の設計
本発明の種々の実施形態の体外薬物送達装置は、あらかじめ選択された薬物または細胞産物を長期間にわたって送達することができてもよい。本装置は植え込まれるように設計されていないため、カプセルおよび薬物送達媒体のサイズを増大させることによって、より高い送達速度用にカプセルのサイズを拡大することができる。
本発明の種々の実施形態の体外薬物送達装置は、あらかじめ選択された薬物または細胞産物を長期間にわたって送達することができてもよい。本装置は植え込まれるように設計されていないため、カプセルおよび薬物送達媒体のサイズを増大させることによって、より高い送達速度用にカプセルのサイズを拡大することができる。
本装置は所定の期間にわたるあらかじめ選択された分子の送達を可能にするので、本装置の設計における別の重要な配慮事項は、本装置に封入された細胞の生活能力を保持する構成である。様々な要因、例えば、カプセル内の細胞への酸素および栄養素の供給、カプセル内の細胞からの老廃物の除去、カプセル内の細胞に向けられる宿主免疫反応の最小化、細胞の増殖活性、およびカプセルの中央に位置する細胞が圧迫壊死を起こしやすいか否かのすべてが細胞を収容するチューブ(複数)の設計および準備に影響を与える可能性があることが分かる。
十分な曝気に加え、生存可能な状態を保持するために、カプセルに封入された細胞が血液供給から十分な量の必須栄養素を獲得することが重要である。酸素の輸送は、ほぼ完全に拡散によって行われる。これは、細胞の生活能力を保持するにあたっての重要な側面である。ひとたび中空繊維の形状が酸素輸送に対して最適化されれば、その後中空繊維は、血流からカプセルの管腔内への十分な量の栄養素の拡散を本質的に許容することができることになる。同様に、そのような形状は、老廃物およびあらかじめ選択された分子を含む細胞代謝産物の中空繊維から血流中への拡散を許容するためにも企図される。
中空繊維は、細胞の老廃物およびあらかじめ選択された分子の中空繊維の外への流出を許容しながら中空繊維の管腔内への酸素および栄養素の拡散を許容する大きさの孔を有する半透膜で製造されるのが好ましい。さらに、孔は、細胞が孔を通過するのを排除するような大きさであるのが好ましい。従って、孔は、中空繊維の管腔から血流中への生存細胞の移動を防止し、それにより宿主の単一の位置に移植された細胞を保持し、必要となった場合または必要時におけるそれらの細胞のその後の除去を促進するように設計されている。孔は、宿主免疫細胞、例えばマクロファージおよびリンパ球の流入を防止するようにも設計されており、宿主免疫細胞は、もし中空繊維の管腔に入ることを許容されれば、中空繊維の管腔に封入された細胞の生活能力に悪影響を及ぼすおそれがある。従って、膜は、中空繊維の管腔に封入された細胞を免疫反応から防御する免疫特権環境を提供する。これは、移植された細胞が本質的に非自己細胞である場合に重要な配慮事項となるかもしれない。サイズ制限によって分子規模より長い自己細胞が用いられる場合、設計は、それに応じて修正されることになろう。
カプセルを備えるかまたはカプセル内に組み込む中空繊維は、限定するものではないが、ポリ塩化ビニル、ポリフッ化ビニリデン、ポリウレタンイソシアネート、ポリアルギン酸塩、酢酸セルロース、二酢酸セルロース、三酢酸セルロース、硝酸セルロース、ポリスルホン、ポリスチレン、ポリウレタン、ポリビニルアルコール、ポリアクリロニトリル、ポリアミド、ポリメタクリル酸メチル、ポリエチレンオキシド、ポリテトラフルオロエチレンまたはそれらの共重合体を含む生体適合性ポリマーで製造することができる。製造方法および商用サプライヤの名前を含む、現在入手可能な中空繊維の概要は、Radovich著(1995年),「Dialysis Membranes: Structure and Predictions」Contrib Nephrol.,Basel,Karger,113:11−24に記載されており、その開示内容全体が引用により本明細書に組み込まれる。さらに、ポリテトラフルオロエチレンポリマーの中空繊維が、アリゾナ州テンペ所在のImpra,Inc.またはアリゾナ州フラッグスタッフ所在のW.L. Gore and Associatesから市販されている。引用によりその内容が組み込まれる米国特許第6,716,208号には、本装置の構成要素の詳細が記載されている。
円盤
円盤は、細胞を上に配置することができる適切な材料となる。好ましい形態では、円盤は、細胞が媒体に向かって増殖することを可能にする小柱構造を有する。代替的に、細胞を膜の表面に配置してもよい。円盤の材料は、セラミック、炭素、および金属物質を含む様々な異なる種類の化合物からなることができる。一実施形態では、円盤は、ニオブでコーティングを施した炭素材で作製されている。
円盤は、細胞を上に配置することができる適切な材料となる。好ましい形態では、円盤は、細胞が媒体に向かって増殖することを可能にする小柱構造を有する。代替的に、細胞を膜の表面に配置してもよい。円盤の材料は、セラミック、炭素、および金属物質を含む様々な異なる種類の化合物からなることができる。一実施形態では、円盤は、ニオブでコーティングを施した炭素材で作製されている。
本装置の用途
細胞療法は、急性疾患および慢性疾患の治療に対する新たな手法として出現している。この治療的手法は、ほとんどの疾病過程は、単一の蛋白質の欠如によるのではなく、種々の細胞産物の複雑な相互作用の変化によって生じるという認識の高まりにその起源を有する。細胞療法は、細胞および組織の培養手法に依存して特定の細胞を増殖させ、様々な疾病状態において乱れるかまたは失われた重要な分化した過程を補うものである。最近の手法は、患者に細胞活性を送達する手段として、複雑な体外ポンプシステムおよび大きいバイオリアクタ装置を必要とする、細胞を中空繊維バイオリアクタ内に配置するかまたは膜をカプセルに封入する方法によって進展してきた。細胞療法によって治療可能となるかもしれない1つの臨床的障害は、全身性炎症反応症候群、すなわちSIRSである。これは、感染、膵炎、および心肺バイパスを含む種々の臨床的な傷害の壊滅的続発症であり、米国では、毎年4万人を越える生命が奪われている。SIRSの最も一般的な原因は、細菌誘導性の敗血症性ショックである。この症候群と関連する極めて高い死亡率は、ある程度、SIRSを有する患者の一部における致死率の高い全身性多臓器不全症候群(MOF)の発症に起因する。[参考文献1、2]
機会を提示する1つの分野は、敗血症性ショックにおいて重要な免疫学的調節の役割を果たす、尿細管細胞を収容する小型細胞療法装置の開発である。原型開発の成功は、細胞療法を体外ポンプシステムを有しない簡素な体外カセットで提供することを可能にし、それによってこの療法をより幅広い適応症、特に急性腎不全(ARF)確立前の初期重度敗血症症候群に拡大することへの重要なステップである。
細胞療法は、急性疾患および慢性疾患の治療に対する新たな手法として出現している。この治療的手法は、ほとんどの疾病過程は、単一の蛋白質の欠如によるのではなく、種々の細胞産物の複雑な相互作用の変化によって生じるという認識の高まりにその起源を有する。細胞療法は、細胞および組織の培養手法に依存して特定の細胞を増殖させ、様々な疾病状態において乱れるかまたは失われた重要な分化した過程を補うものである。最近の手法は、患者に細胞活性を送達する手段として、複雑な体外ポンプシステムおよび大きいバイオリアクタ装置を必要とする、細胞を中空繊維バイオリアクタ内に配置するかまたは膜をカプセルに封入する方法によって進展してきた。細胞療法によって治療可能となるかもしれない1つの臨床的障害は、全身性炎症反応症候群、すなわちSIRSである。これは、感染、膵炎、および心肺バイパスを含む種々の臨床的な傷害の壊滅的続発症であり、米国では、毎年4万人を越える生命が奪われている。SIRSの最も一般的な原因は、細菌誘導性の敗血症性ショックである。この症候群と関連する極めて高い死亡率は、ある程度、SIRSを有する患者の一部における致死率の高い全身性多臓器不全症候群(MOF)の発症に起因する。[参考文献1、2]
機会を提示する1つの分野は、敗血症性ショックにおいて重要な免疫学的調節の役割を果たす、尿細管細胞を収容する小型細胞療法装置の開発である。原型開発の成功は、細胞療法を体外ポンプシステムを有しない簡素な体外カセットで提供することを可能にし、それによってこの療法をより幅広い適応症、特に急性腎不全(ARF)確立前の初期重度敗血症症候群に拡大することへの重要なステップである。
成人の幹/前駆細胞から培養された約108の尿細管細胞を収容する標準的な血液ろ過カートリッジを繊維の内側表面に沿った融合性単層として用いる体外装置は、ヒト細胞を用いた製作に成功している。[参考文献4]この初期の細胞療法装置は、大きく(12×4−インチの円筒)、かつ血液および血漿の限外ろ過液を細胞含有装置に送達するための追加の体外ポンプ回路を必要とする。これらの要素は、ARFを有する患者の目下の人工透析に対する追加物として設計されていた。
提案された小型装置の創作成功は、「装着型人工臓器」を含む様々な他の細胞療法装置をもたらす可能性を有する。現在の細胞療法の手法は、神経変性障害(パーキンソン病、アルツハイマー病)、脊髄損傷、心臓病(うっ血性心不全、心筋梗塞)、膵臓病(糖尿病)、肝臓病(肝硬変、肝炎)、腎臓病(末期腎不全[ESRD]、ARF)、血液(鎌状赤血球貧血)、筋障害(筋ジストロフィー)、皮膚(熱傷)、および骨(関節炎、骨粗しょう症)に対する幹細胞の使用を対象としている。市場の観点からは、細胞をベースとする市場の価値は、2005年は265億ドル、2010年は560億ドル、2015年は960億ドルと推定されている。300を越える会社が細胞療法に関与している。腎細胞装置の使用に対する短期市場も非常に大きく、ARF(患者数100,000人、20億ドル市場)、ESRD(患者数400,000人、費用200億ドル)、および心腎症候群(患者数350,000人、費用250億ドル)を含む(米国のみ)。
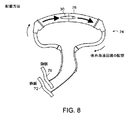
小型細胞療法装置の初期原型の構築法が図1および図8に図式化されている。注目すべきは、この動静脈カテーテル回路が該回路を通る血流用の血液ポンプを必要としない点である。
第1の原型の製作および生体外試験。評価対象の最初の原型は、図1のように描かれている。この原型は、中空繊維の内部に1.0×108の尿細管細胞を高密度増殖状態で収容するように製造されることになる。予備データは、30の中空繊維(250μm×長さ10cm)が生体外で十分な酸素投与および栄養供給を受けて高流動状態で1.0×108の細胞を保持することができることを示唆している。永久細胞系を用いた初期検査では、より簡素な中空繊維の原型が数週間にわたってこの程度の細胞密度を保持することができることが実証された。もしこれらの初期原型が細胞培養器内で3日〜5日にわたって細胞の生活能力を保持することができれば、それらは、ブタの敗血症性ショックモデルでの効力試験に使用できることになる。この実験は、尿細管細胞を高細胞密度で中空繊維装置内に配置および保持し、小型カセット内に十分な細胞を備えることができるという概念の重要な裏付けである。
冷凍保存能力を有する第2の原型の製作および生体外試験。第2の細胞療法装置の原型開発も図1に図式化されている。図2および図3に示すこの第2の装置は、細胞が上に付着して増殖する小柱構造を形成する一連の円盤を収容している。予備データは、ニオブでコーティングを施した新たな生体用炭素材料で作製された各円盤上で最大1.0×107の細胞を培養することができることを示唆している。血漿の限外ろ過液を生成するための半透膜としての機能を果たす10個の円盤を、カートリッジの内部に配置することができる。この速い限外ろ過液の流速により、免疫反応を防止しながら、生活能力、機能性、および効能を保持するための栄養素および酸素が円盤上の細胞に供給される。予備データは、円盤上の細胞は凍結保存することができ、解凍して体温まで温めるとすぐに付着力および生活能力を保持することができることも示唆している。従って、細胞療法装置の配送は、37℃の培養器内での保存よりはむしろ現地冷凍、および製造現場から臨床診療環境への迅速な輸送によってより容易となる。この原型での生体外実験によって3日〜5日にわたる細胞の生活能力の保持が実証されると、ブタモデルでの生体内試験を開始することができる。
本発明の種々の実施形態の体外装置は、図8に示す血液導管または流体導管と共に用いることができる。患者からの血液は、透析で用いることができる動静脈(AV)ラインに通すことができる。また、静脈ラインからveneousラインへの(VV)ラインも用いることができる。図に示すように、動脈70および静脈72は、血液を抽出して体外循環路74に血液を再導入するために用いることができる。種々の適切な接続を用いて導管の直径を増大させることができる。装置30は、最も大きい導管76に取り付けられた状態で示されている。ラインは、体液、例えば腹水を循環させることができる。腹水は、腹膜から採取され、次に、装置が所望の分子を該水に送達することができる体外に循環され、次いで腹膜に再導入される。
しかしながら、臨床的状況に基づく医師の判断によって、本装置を導入するための最適モードおよび本装置を固定するための最適位置をその都度決定すべきであることが分かる。そのような判断は、熟練した医師の専門的知識の範囲内にあると考えられる。
本発明の実施については、説明のためにのみ本明細書に提示するものであって、本発明を多少なりとも限定するものとみなすべきではない以下の例からより十分に理解されよう。
治療用送達システムに対して、2つの異なる装置設計が想定される。
1.細胞は、Nbコーティングを施した炭素をベースとする、円盤形の足場上で培養される(円盤システムの明細については3ページを参照されたい)。これらの細胞を播種された円盤は、培養液内で培養され、次いで凍結保存される。円盤は、凍結状態で臨床現場に出荷することができ、臨床現場で、細胞をベースとする治療に必要となるまで、円盤を凍結状態で保存することができる。治療の直前に、解凍した円盤を本装置のハウジング内に配置することができる。一回の治療当たりに用いる円盤の数(保持装置内に搭載される)は、必要な細胞の用量に応じて変えることができる。
2.生物基質の3−Dゲル中に再懸濁された細胞は、中空繊維バイオリアクタの管腔内に播種される。臨床現場への2つの配備方法が試験される。1)成熟培養細胞を搭載したバイオリアクタが必要に応じて最適出荷条件(未決定)下で出荷され、次いで臨床環境で用いられる。2)凍結保存された細胞のチューブおよび予混合された液体生物基質のチューブが臨床現場に送付される。これらは、必要となるまで保存することができる。臨床上の必要があり次第、細胞が解凍され、生物基質と混合され、次にバイオリアクタ内に注射器で挿入される。凍結保存されたチューブは、用量依存的治療に対して様々な細胞数を収容することができる。
細胞を播種したNbコーティングを施した炭素をベースとする、円盤形足場:
不死化腎細胞株(MDCK)を、Nbコーティングを施した炭素をベースとする円盤の方へ播種した。細胞播種に先立ち、コラーゲンI、コラーゲンIV、ラミニン、またはマトリゲルで円盤にコーティングを施した。播種密度は、106細胞/円盤であった。円盤を1週間スピナー培養液中に保持した。次いで、細胞を播種した円盤を冷凍保存し、液体窒素中に貯蔵し、次いで解凍し、解凍後2時間〜4時間の組織培養条件下で非撹拌状態の停止期間を置いた。次いで、円盤をスピナー培養瓶に戻し、解凍後24時間の細胞密度の測定を行った。乳酸産生を利用して、円盤上における細胞の増殖を測定した。凍結保存の前後における種々の生物基質コーティングを有する円盤上のMDCK細胞密度は、図9のグラフに描かれている。
細胞を播種したNbコーティングを施した炭素をベースとする、円盤形足場:
不死化腎細胞株(MDCK)を、Nbコーティングを施した炭素をベースとする円盤の方へ播種した。細胞播種に先立ち、コラーゲンI、コラーゲンIV、ラミニン、またはマトリゲルで円盤にコーティングを施した。播種密度は、106細胞/円盤であった。円盤を1週間スピナー培養液中に保持した。次いで、細胞を播種した円盤を冷凍保存し、液体窒素中に貯蔵し、次いで解凍し、解凍後2時間〜4時間の組織培養条件下で非撹拌状態の停止期間を置いた。次いで、円盤をスピナー培養瓶に戻し、解凍後24時間の細胞密度の測定を行った。乳酸産生を利用して、円盤上における細胞の増殖を測定した。凍結保存の前後における種々の生物基質コーティングを有する円盤上のMDCK細胞密度は、図9のグラフに描かれている。
初代細胞もNbコーティングを施した炭素をベースとする円盤上に保持することができるかどうか確認するために、初代ブタ近位尿細管細胞(PPTC)を、106細胞/円盤および107細胞/円盤で、種々の生物基質(基質なし、コラーゲンIV、ラミニン、またはマトリゲル)でコーティングを施した円盤上に播種した。細胞を播種した円盤は、現在、スピナー培養液中に保持されている。乳酸産生によって測定した円盤上の初代ブタ尿細管細胞の増殖速度は、図10および図11に描かれている。
生物基質の3−Dゲル中に再懸濁された細胞含有中空繊維バイオリアクタ:
1)ラミニン(100ug/mL)およびコラーゲンIV(100ug/mL)を補充したnutragen(コラーゲンI(3.12mg/mL)ゲルまたは2)マトリゲル中に再懸濁された不死化腎細胞株(MDCK)からの細胞を、2.06×107細胞/mLの密度のゲルで中空繊維バイオリアクタ内に播種した。細胞を挿入したバイオリアクタを8日間(マトリゲル)および13日間(nutragen)培養液中に保持し、細胞密度を乳酸産生によって評価した。結果は、図12に描かれている。BRECは、バイオ人工腎上皮細胞を指す。
生物基質の3−Dゲル中に再懸濁された細胞含有中空繊維バイオリアクタ:
1)ラミニン(100ug/mL)およびコラーゲンIV(100ug/mL)を補充したnutragen(コラーゲンI(3.12mg/mL)ゲルまたは2)マトリゲル中に再懸濁された不死化腎細胞株(MDCK)からの細胞を、2.06×107細胞/mLの密度のゲルで中空繊維バイオリアクタ内に播種した。細胞を挿入したバイオリアクタを8日間(マトリゲル)および13日間(nutragen)培養液中に保持し、細胞密度を乳酸産生によって評価した。結果は、図12に描かれている。BRECは、バイオ人工腎上皮細胞を指す。
他の実施形態および臨床上の目的
本発明は、その精神または本質的特徴から逸脱することなく他の特定の形態に具現することができる。従って、本発明の実施形態は、あらゆる点で、説明のためのものであり、限定的なものではないとみなすべきである。
本発明は、その精神または本質的特徴から逸脱することなく他の特定の形態に具現することができる。従って、本発明の実施形態は、あらゆる点で、説明のためのものであり、限定的なものではないとみなすべきである。
Claims (41)
- 細胞をベースとする体外治療装置であって、
(a)前記装置を体外チューブに取り付けることができる、前記チューブの内壁に取り付けられている際に前記チューブ内の血液の通過を許容する固定システムと、
(b)複数の孔を含む、中に生存細胞が配置されたカプセルと
を備え、前記カプセルは、前記チューブへの導入時は前記固定システムによって前記チューブの内部に保持され、前記孔は、中に配置された前記細胞の生活能力を保持するために栄養素が前記カプセルに入ることを許容する、
装置。 - 前記カプセルは、半透膜によって画定されている、請求項1に記載の装置。
- 前記半透膜は、ポリフッ化ビニリデン、ポリ塩化ビニル、ポリウレタン、ポリアルギン酸塩、ポリスチレン、ポリウレタン、ポリビニルアルコール、ポリアクリロニトリル、ポリアミド、ポリメタクリル酸メチル、ポリエチレンオキシド、ポリテトラフルオロエチレン、イソシアネート、酢酸セルロース、二酢酸セルロース、三酢酸セルロース、硝酸セルロース、ポリスルホン、およびそれらの混合物からなる群から選択される材料から構成される、請求項2に記載の装置。
- 前記生存細胞は、複数のフィラメント上に配置されている、請求項1に記載の装置。
- 前記フィラメントは金属である、請求項4に記載の装置。
- 前記孔は、抗体の通過を防止するような大きさを有する、請求項1に記載の装置。
- 前記細胞は、少なくとも1つの円盤上に配置されている、請求項1に記載の装置。
- 前記細胞は真核細胞である、請求項1に記載の装置。
- 前記細胞は哺乳類細胞である、請求項8に記載の装置。
- 前記カプセルは、前記固定システムを前記チューブから着脱させることによって前記チューブから分離されるようになっている、請求項1に記載の装置。
- 前記カプセルは、少なくとも1本の中空繊維を含む、請求項1に記載の装置。
- 前記孔は、150kD未満の溶質の通過を許容する、請求項1に記載の装置。
- 前記装置は、人工血液ポンプを用いることなく治療上有効な量の分子を供給するように構成されている、請求項1に記載の装置。
- 細胞をベースとする体外治療装置であって、
(a)血液用の導管を提供するように適合された体外チューブの内壁に固定可能な、チューブの前記内壁への固定時に血液の循環を許容する取り付けシステムと、
(b)複数の孔を画定する、中に生存細胞が配置されたカプセルと
を備え、前記カプセルは、前記取り付けシステムによって前記チューブの内部に保持され、前記孔は、中に配置された前記細胞の生活能力を保持するために栄養素が前記カプセルに入ることを許容する、
装置。 - 前記カプセルは、半透膜によって画定されている、請求項14に記載の装置。
- 前記半透膜は、ポリフッ化ビニリデン、ポリ塩化ビニル、ポリウレタン、ポリアルギン酸塩、ポリスチレン、ポリウレタン、ポリビニルアルコール、ポリアクリロニトリル、ポリアミド、ポリメタクリル酸メチル、ポリエチレンオキシド、ポリテトラフルオロエチレン、イソシアネート、酢酸セルロース、二酢酸セルロース、三酢酸セルロース、硝酸セルロース、ポリスルホン、およびそれらの混合物からなる群から選択される材料を備える、請求項15に記載の装置。
- 前記孔は、細胞の生活能力に悪影響を及ぼす前記血液中の物質を排除するような大きさを有する、請求項14に記載の装置。
- 前記孔は、抗体の通過を防止するような大きさを有する、請求項17に記載の装置。
- 前記細胞は真核細胞である、請求項14に記載の装置。
- 前記細胞は哺乳類細胞である、請求項19に記載の装置。
- 前記固定具は金属である、請求項14に記載の装置。
- 前記カプセルは、前記チューブへの導入時、前記取り付けシステムの上流に保持されている、請求項14に記載の装置。
- 前記カプセルは、少なくとも1つの円盤を含む、請求項14に記載の装置。
- 前記孔は、150kD未満の溶質の通過を許容する、請求項14に記載の装置。
- 前記細胞は、遺伝子操作された細胞である、請求項14に記載の装置。
- 細胞をベースとする体外治療装置を哺乳動物の循環系に導入する方法であって、前記方法は、
(a)体液用の導管を提供するように適合された体外チューブの内壁に、チューブの前記内壁への固定時に前記体液の循環を許容する取り付けシステムを固定するステップと、
(b)複数の孔を画定する、中に生存細胞が配置されたカプセルを挿入するステップと
を含み、前記カプセルは、前記取り付けシステムによって前記チューブの内部に保持され、前記孔は、中に配置された前記細胞の生活能力を保持するために栄養素が前記カプセルに入ることを許容する、
方法。 - ステップ(a)において、前記取り付けシステムは、カテーテルによって前記チューブに導入される、請求項26に記載の方法。
- ステップ(b)において、前記カプセルは、カテーテルによって前記チューブに導入される、請求項26に記載の方法。
- 前記生存細胞は、少なくとも1つの円盤上に配置されている、請求項26に記載の方法。
- 前記装置は、人口体液ポンプを用いることなく前記導管内に治療量の分子を送達するために用いられる、請求項26に記載の方法。
- 前記導管は、腹膜に取り付けられ、腹水は前記導管を通過する、請求項26に記載の方法。
- 細胞をベースとする体外治療装置であって、
(a)体液用の導管を提供するように適合された体外チューブの内壁に固定可能な、チューブの前記内壁への固定時に前記体液の循環を許容する取り付けシステムと、
(b)複数の孔を画定する、中に生存細胞が配置されたカプセルと
を備え、前記カプセルは、前記チューブへの導入時は前記取り付けシステムによって前記チューブの内部に保持され、前記孔は、中に配置された前記細胞の生活能力を保持するために栄養素が前記カプセルに入ることを許容する、
装置。 - 前記カプセルは、半透膜によって画定されている、請求項32に記載の装置。
- 前記半透膜は、ポリフッ化ビニリデン、ポリ塩化ビニル、ポリウレタン、ポリアルギン酸塩、ポリスチレン、ポリウレタン、ポリビニルアルコール、ポリアクリロニトリル、ポリアミド、ポリメタクリル酸メチル、ポリエチレンオキシド、ポリテトラフルオロエチレン、イソシアネート、酢酸セルロース、二酢酸セルロース、三酢酸セルロース、硝酸セルロース、ポリスルホン、およびそれらの混合物からなる群から選択される材料を備える、請求項33に記載の装置。
- 前記孔は、抗体の通過を防止するような大きさを有する、請求項34に記載の装置。
- 前記チューブは、腹膜に接続されるようになっており、前記体液は、腹水を含む、請求項32に記載の装置。
- 前記チューブは、血管に接続されるようになっており、前記体液は、血液を含む、請求項32に記載の装置。
- 前記取り付けシステムは、前記チューブから分離可能である、請求項32に記載の装置。
- 前記カプセルは、前記チューブへの導入時、前記取り付けシステムの上流に保持されている、請求項32に記載の装置。
- 前記カプセルは、少なくとも1つの円盤を含む、請求項32に記載の装置。
- 前記孔は、150kD未満の溶質の通過を許容する、請求項32に記載の装置。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US76435706P | 2006-02-02 | 2006-02-02 | |
| PCT/US2007/061468 WO2007092735A2 (en) | 2006-02-02 | 2007-02-01 | An extracorporeal cell-based therapeutic device and delivery system |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2009525781A true JP2009525781A (ja) | 2009-07-16 |
| JP2009525781A5 JP2009525781A5 (ja) | 2010-03-25 |
Family
ID=38345876
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008553503A Withdrawn JP2009525781A (ja) | 2006-02-02 | 2007-02-01 | 細胞をベースとする体外治療装置および送達システム |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US8048419B2 (ja) |
| EP (1) | EP1989144A4 (ja) |
| JP (1) | JP2009525781A (ja) |
| AU (1) | AU2007212110A1 (ja) |
| CA (1) | CA2637686A1 (ja) |
| WO (1) | WO2007092735A2 (ja) |
Families Citing this family (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009525781A (ja) | 2006-02-02 | 2009-07-16 | イノベーティブ バイオ セラピーズ | 細胞をベースとする体外治療装置および送達システム |
| US20070298497A1 (en) * | 2006-06-26 | 2007-12-27 | Gambro Bct, Inc. | Method of Culturing Mesenchymal Stem Cells |
| CA2728215A1 (en) | 2008-06-18 | 2010-06-24 | Innovative Biotherapies, Inc. | Methods for enhanced propagation of cells |
| EP2323725A4 (en) * | 2008-08-15 | 2014-01-29 | Innovative Biotherapies Inc | THERAPEUTIC DEVICE BASED ON EXTRACORPOREAL CELLS AND ADMINISTRATION SYSTEM |
| EP2177603A1 (en) | 2008-09-25 | 2010-04-21 | Gambro Lundia AB | Device for renal cell expansion |
| EP2168668A1 (en) | 2008-09-25 | 2010-03-31 | Gambro Lundia AB | Membrane for cell expansion |
| ATE545440T1 (de) | 2008-09-25 | 2012-03-15 | Gambro Lundia Ab | Hybride biologische künstliche niere |
| EP2168666A1 (en) | 2008-09-25 | 2010-03-31 | Gambro Lundia AB | Irradiated membrane for cell expansion |
| US8454547B2 (en) * | 2009-02-25 | 2013-06-04 | The Invention Science Fund I, Llc | Device, system, and method for controllably reducing inflammatory mediators in a subject |
| EP2412798A1 (en) | 2010-07-27 | 2012-02-01 | Gambro Lundia AB | Biomimetic membrane for cell expansion |
| EP2627369B1 (en) | 2010-10-15 | 2022-01-12 | SeaStar Medical, Inc. | Cytopheresic cartridge and use thereof |
| JP2015503418A (ja) | 2012-01-09 | 2015-02-02 | エイチ. デビッド ヒュームズ | 心筋機能を向上させるためのカートリッジおよび方法 |
| US9101707B2 (en) | 2012-04-27 | 2015-08-11 | Gregory Zeltser | Implantable bioartificial perfusion system |
| EP3509653A4 (en) | 2016-09-06 | 2020-04-29 | President and Fellows of Harvard College | LIVING DEVICE FOR REPLACING ORGANS OR SPECIFIC ORGAN FUNCTIONS, METHODS AND USES THEREOF |
Family Cites Families (168)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3313289A (en) | 1964-06-23 | 1967-04-11 | Frank A Kapral | Implant chamber |
| US3943936A (en) | 1970-09-21 | 1976-03-16 | Rasor Associates, Inc. | Self powered pacers and stimulators |
| US3952747A (en) | 1974-03-28 | 1976-04-27 | Kimmell Jr Garman O | Filter and filter insertion instrument |
| US4309776A (en) | 1980-05-13 | 1982-01-12 | Ramon Berguer | Intravascular implantation device and method of using the same |
| US4393133A (en) | 1980-06-12 | 1983-07-12 | The Wistar Institute Of Anatomy And Biology | Human hepatoma derived cell line, process for preparation thereof, and uses therefor |
| US4332893A (en) | 1980-06-13 | 1982-06-01 | Rosenberg Ralph A | Process for the production of an insulin-producing cell line of pancreatic beta cells |
| US4865585A (en) | 1981-07-13 | 1989-09-12 | Alza Corporation | Method of administering drug by using cell comprising drug |
| US4511353A (en) | 1981-07-13 | 1985-04-16 | Alza Corporation | Intravenous system for delivering a beneficial agent |
| US4985017A (en) | 1981-07-13 | 1991-01-15 | Alza Corporation | Parenteral therapeutical system comprising drug cell |
| US4378016A (en) | 1981-07-15 | 1983-03-29 | Biotek, Inc. | Artificial endocrine gland containing hormone-producing cells |
| US4402694A (en) * | 1981-07-16 | 1983-09-06 | Biotek, Inc. | Body cavity access device containing a hormone source |
| US4586922A (en) | 1981-10-09 | 1986-05-06 | Alza Corporation | Intravenous system for delivering a beneficial agent |
| SE445884B (sv) | 1982-04-30 | 1986-07-28 | Medinvent Sa | Anordning for implantation av en rorformig protes |
| US4479796A (en) | 1982-11-15 | 1984-10-30 | Medtronic, Inc. | Self-regenerating drug administration device |
| US4494531A (en) | 1982-12-06 | 1985-01-22 | Cook, Incorporated | Expandable blood clot filter |
| US4503569A (en) | 1983-03-03 | 1985-03-12 | Dotter Charles T | Transluminally placed expandable graft prosthesis |
| CA1237600A (en) | 1983-05-31 | 1988-06-07 | Tatsuhei Kondo | Non-contact controlled micropump |
| US4777049A (en) | 1983-12-01 | 1988-10-11 | Alza Corporation | Constant release system with pulsed release |
| US5104399A (en) | 1986-12-10 | 1992-04-14 | Endovascular Technologies, Inc. | Artificial graft and implantation method |
| DE3400874C1 (de) | 1984-01-12 | 1985-02-07 | Karl Dr. 6301 Pohlheim Aigner | Doppellumiger Katheter fuer eine Vorrichtung zur in-vivo-Reinigung von Blut |
| GB8422876D0 (en) | 1984-09-11 | 1984-10-17 | Secr Defence | Silicon implant devices |
| DE3447202A1 (de) | 1984-12-22 | 1986-07-10 | CYTOMED Medizintechnik GmbH, 8750 Aschaffenburg | Implantierbarer, intravasaler katheter fuer die dauermedikation von pharmaka |
| US4685918A (en) | 1985-02-01 | 1987-08-11 | Merck & Co., Inc. | Lipid osmotic pump |
| US4820626A (en) | 1985-06-06 | 1989-04-11 | Thomas Jefferson University | Method of treating a synthetic or naturally occuring surface with microvascular endothelial cells, and the treated surface itself |
| SE447061B (sv) | 1985-06-10 | 1986-10-27 | Medinvent Sa | Inforingsanordning, spec for implantering i en levande organism |
| CA1259915A (en) | 1985-10-09 | 1989-09-26 | Sailen S. Mookerjea | Means to reduce plasma cholesterol |
| GB2181650B (en) * | 1985-10-18 | 1989-09-13 | Blagoveshchensk G Med Inst | Aortic cannula |
| US4877864A (en) | 1987-03-26 | 1989-10-31 | Genetics Institute, Inc. | Osteoinductive factors |
| US4793348A (en) | 1986-11-15 | 1988-12-27 | Palmaz Julio C | Balloon expandable vena cava filter to prevent migration of lower extremity venous clots into the pulmonary circulation |
| FR2606641B1 (fr) | 1986-11-17 | 1991-07-12 | Promed | Dispositif filtrant pour caillots sanguins |
| US5026365A (en) | 1987-04-29 | 1991-06-25 | The University Of Massachusetts | Method and apparatus for therapeutically treating immunological disorders and disease states |
| JPH0723854Y2 (ja) * | 1987-04-30 | 1995-05-31 | 沖電気工業株式会社 | キーボードの照明素子用ホルダ |
| US4817600A (en) * | 1987-05-22 | 1989-04-04 | Medi-Tech, Inc. | Implantable filter |
| US4911717A (en) | 1987-06-18 | 1990-03-27 | Gaskill Iii Harold V | Intravasular artificial organ |
| US4878913A (en) | 1987-09-04 | 1989-11-07 | Pfizer Hospital Products Group, Inc. | Devices for neural signal transmission |
| US5232696A (en) | 1987-09-25 | 1993-08-03 | Massachusetts Institute Of Technology | Reduction of low density lipoproteins in biological fluids |
| US5035891A (en) | 1987-10-05 | 1991-07-30 | Syntex (U.S.A.) Inc. | Controlled release subcutaneous implant |
| US5133732A (en) | 1987-10-19 | 1992-07-28 | Medtronic, Inc. | Intravascular stent |
| US5487739A (en) | 1987-11-17 | 1996-01-30 | Brown University Research Foundation | Implantable therapy systems and methods |
| US5182111A (en) | 1987-11-17 | 1993-01-26 | Boston University Research Foundation | In vivo delivery of active factors by co-cultured cell implants |
| US4892538A (en) | 1987-11-17 | 1990-01-09 | Brown University Research Foundation | In vivo delivery of neurotransmitters by implanted, encapsulated cells |
| US4871352A (en) | 1987-12-07 | 1989-10-03 | Controlled Release Technologies, Inc. | Self-regulated therapeutic agent delivery system and method |
| US5200181A (en) | 1988-01-11 | 1993-04-06 | Massachusetts Institute Of Technology | Oral bilirubin therapy |
| US4938742A (en) | 1988-02-04 | 1990-07-03 | Smits Johannes G | Piezoelectric micropump with microvalves |
| US4936823A (en) | 1988-05-04 | 1990-06-26 | Triangle Research And Development Corp. | Transendoscopic implant capsule |
| US4832055A (en) | 1988-07-08 | 1989-05-23 | Palestrant Aubrey M | Mechanically locking blood clot filter |
| US5152743A (en) | 1988-08-05 | 1992-10-06 | Healthdyne, Inc. | Apparatus and method for selective separation of blood cholesterol |
| US5164186A (en) | 1988-10-13 | 1992-11-17 | Kabushikigaisha Ars Japan | Drug-releaser |
| US4994069A (en) | 1988-11-02 | 1991-02-19 | Target Therapeutics | Vaso-occlusion coil and method |
| US5152777A (en) | 1989-01-25 | 1992-10-06 | Uresil Corporation | Device and method for providing protection from emboli and preventing occulsion of blood vessels |
| US4969871A (en) | 1989-02-15 | 1990-11-13 | Alza Corporation | Intravenous system for delivering a beneficial agent |
| US5059205A (en) * | 1989-09-07 | 1991-10-22 | Boston Scientific Corporation | Percutaneous anti-migration vena cava filter |
| DE3941873A1 (de) | 1989-12-19 | 1991-06-20 | Jakob Dr Bodziony | Hohlfaser mit der beschichtung von zellen, die mehrjaehrige implantation in arterien und venen ermoeglichen |
| US5178864A (en) | 1990-08-14 | 1993-01-12 | Mit | Lipoprotein removal by soluble enzymes |
| US5314471A (en) | 1991-07-24 | 1994-05-24 | Baxter International Inc. | Tissue inplant systems and methods for sustaining viable high cell densities within a host |
| US5053008A (en) | 1990-11-21 | 1991-10-01 | Sandeep Bajaj | Intracardiac catheter |
| US5147379A (en) | 1990-11-26 | 1992-09-15 | Louisiana State University And Agricultural And Mechanical College | Insertion instrument for vena cava filter |
| US5360790A (en) * | 1990-12-11 | 1994-11-01 | The Regents Of The University Of Michigan | Method and formulations for the therapy of acute renal failure |
| US5391164A (en) | 1991-05-03 | 1995-02-21 | Giampapa; Vincent C. | Subcutaneous implantable multiple-agent delivery system |
| US5350398A (en) | 1991-05-13 | 1994-09-27 | Dusan Pavcnik | Self-expanding filter for percutaneous insertion |
| US5415630A (en) | 1991-07-17 | 1995-05-16 | Gory; Pierre | Method for removably implanting a blood filter in a vein of the human body |
| US5649906A (en) | 1991-07-17 | 1997-07-22 | Gory; Pierre | Method for implanting a removable medical apparatus in a human body |
| US5478807A (en) | 1991-08-19 | 1995-12-26 | Genentech, Inc. | Use of relaxin in the treatment of bradycardia |
| US5411550A (en) | 1991-09-16 | 1995-05-02 | Atrium Medical Corporation | Implantable prosthetic device for the delivery of a bioactive material |
| FR2683449A1 (fr) | 1991-11-08 | 1993-05-14 | Cardon Alain | Endoprothese pour implantation transluminale. |
| US6410320B1 (en) | 1992-03-02 | 2002-06-25 | The University Of Michigan | Method and compositions for isolation and growth of kidney tubule stem cells, in vitro kidney tubulogenesis and ex vivo construction of renal tubules |
| US6060270A (en) | 1992-03-02 | 2000-05-09 | The University Of Michigan | Methods and compositions for isolation and growth of kidney tubule stem cells, in vitro kidney tubulogenesis and ex vivo construction of renal tubules |
| US5429938A (en) | 1992-03-02 | 1995-07-04 | University Of Michigan | Methods and compositions for isolation and growth of kidney tubule stem cells, in vitro kidney tubulogenesis and ex vivo construction of renal tubules |
| US5549674A (en) | 1992-03-02 | 1996-08-27 | The Regents Of The University Of Michigan | Methods and compositions of a bioartificial kidney suitable for use in vivo or ex vivo |
| US6059825A (en) | 1992-03-05 | 2000-05-09 | Angiodynamics, Inc. | Clot filter |
| US5282861A (en) * | 1992-03-11 | 1994-02-01 | Ultramet | Open cell tantalum structures for cancellous bone implants and cell and tissue receptors |
| US5282823A (en) | 1992-03-19 | 1994-02-01 | Medtronic, Inc. | Intravascular radially expandable stent |
| US5260068A (en) | 1992-05-04 | 1993-11-09 | Anda Sr Pharmaceuticals Inc. | Multiparticulate pulsatile drug delivery system |
| US5383928A (en) | 1992-06-10 | 1995-01-24 | Emory University | Stent sheath for local drug delivery |
| US5304120A (en) | 1992-07-01 | 1994-04-19 | Btx Inc. | Electroporation method and apparatus for insertion of drugs and genes into endothelial cells |
| US5756291A (en) | 1992-08-21 | 1998-05-26 | Gilead Sciences, Inc. | Aptamers specific for biomolecules and methods of making |
| DE4331358A1 (de) | 1992-10-12 | 1994-04-14 | Braun Melsungen Ag | Verfahren zur quantitativen selektiven Entfernung oder präparativen Gewinnung von Tumor-Nekrose-Faktor (TNF) oder/und Lipopolysacchariden (LPS) aus wäßrigen Flüssigkeiten |
| FR2697995B1 (fr) | 1992-11-19 | 1994-12-30 | Celsa Lg | Dispositif amovible de filtration sanguine, à rigidité variable, implantable dans le corps d'un patient et autorisant l'injection d'un produit traitant. |
| EP0604022A1 (en) | 1992-12-22 | 1994-06-29 | Advanced Cardiovascular Systems, Inc. | Multilayered biodegradable stent and method for its manufacture |
| FR2699809B1 (fr) | 1992-12-28 | 1995-02-17 | Celsa Lg | Dispositif pouvant constituer sélectivement un filtre sanguin temporaire. |
| US5368555A (en) | 1992-12-29 | 1994-11-29 | Hepatix, Inc. | Organ support system |
| US5419760A (en) | 1993-01-08 | 1995-05-30 | Pdt Systems, Inc. | Medicament dispensing stent for prevention of restenosis of a blood vessel |
| US5429634A (en) | 1993-09-09 | 1995-07-04 | Pdt Systems | Biogenic implant for drug delivery and method |
| US5370691A (en) | 1993-01-26 | 1994-12-06 | Target Therapeutics, Inc. | Intravascular inflatable stent |
| JP3662263B2 (ja) | 1993-02-15 | 2005-06-22 | 株式会社半導体エネルギー研究所 | 半導体装置の作製方法 |
| US5368588A (en) | 1993-02-26 | 1994-11-29 | Bettinger; David S. | Parenteral fluid medication reservoir pump |
| WO1994025584A1 (en) | 1993-04-28 | 1994-11-10 | Johns Hopkins University School Of Medicine | Chronic endothelial cell culture under flow |
| GB9311784D0 (en) | 1993-06-08 | 1993-07-28 | Univ Alberta | Vascular bioartificial organ |
| EP0658205B1 (en) | 1993-06-25 | 2000-03-15 | Smithkline Beecham Plc | Lipoprotein associated phospholipase a2, inhibitors thereof and use of the same in diagnosis and therapy |
| WO1995001138A1 (en) | 1993-07-02 | 1995-01-12 | Materials Evolution And Development Usa, Inc. | Implantable system for cell growth control |
| EP0746236B1 (en) | 1993-10-01 | 2003-08-20 | Boston Scientific Corporation | Improved vena cava filter |
| WO1995010989A1 (en) | 1993-10-19 | 1995-04-27 | Scimed Life Systems, Inc. | Intravascular stent pump |
| US6001123A (en) | 1994-04-01 | 1999-12-14 | Gore Enterprise Holdings Inc. | Folding self-expandable intravascular stent-graft |
| US5947893A (en) | 1994-04-27 | 1999-09-07 | Board Of Regents, The University Of Texas System | Method of making a porous prothesis with biodegradable coatings |
| US5810767A (en) | 1994-05-11 | 1998-09-22 | Localmed, Inc. | Method and apparatus for pressurized intraluminal drug delivery |
| DE9409484U1 (de) | 1994-06-11 | 1994-08-04 | Naderlinger Eduard | Vena-cava Thromben-Filter |
| US5681278A (en) | 1994-06-23 | 1997-10-28 | Cormedics Corp. | Coronary vasculature treatment method |
| US5591230A (en) | 1994-09-07 | 1997-01-07 | Global Therapeutics, Inc. | Radially expandable stent |
| AU699821B2 (en) | 1994-10-17 | 1998-12-17 | Kabushikikaisha Igaki Iryo Sekkei | Stent for liberating drug |
| US5788468A (en) | 1994-11-03 | 1998-08-04 | Memstek Products, Llc | Microfabricated fluidic devices |
| US6472200B1 (en) * | 1999-07-23 | 2002-10-29 | Yissum Research Development Company Of The Hebrew University Of Jerusalem | Device and method for performing a biological modification of a fluid |
| US5696087A (en) | 1994-12-01 | 1997-12-09 | Oklahoma Medical Research Foundation | Method and compositions for reducing cholesterol absorption |
| US6099864A (en) | 1994-12-02 | 2000-08-08 | The United States Of America As Represented By The Administrator Of The National Aeronautics And Space Administration | In situ activation of microcapsules |
| US5961923A (en) | 1995-04-25 | 1999-10-05 | Irori | Matrices with memories and uses thereof |
| DE19549420A1 (de) | 1995-04-27 | 1997-09-18 | Braun Melsungen Ag | Verfahren zur simultanen extrakorporalen Elimination von Tumor-Nekrose Faktor alpha (TNF alpha) und bakteriellen Lipopolysacchariden (LPS) aus Vollblut oder/und Blutplasma |
| US6027516A (en) | 1995-05-04 | 2000-02-22 | The United States Of America As Represented By The Department Of Health And Human Services | Highly elastic, adjustable helical coil stent |
| US5788673A (en) | 1995-06-05 | 1998-08-04 | Atrion Medical Products, Inc. | Drug infusion system |
| US5704910A (en) | 1995-06-05 | 1998-01-06 | Nephros Therapeutics, Inc. | Implantable device and use therefor |
| US5609629A (en) | 1995-06-07 | 1997-03-11 | Med Institute, Inc. | Coated implantable medical device |
| CA2178541C (en) | 1995-06-07 | 2009-11-24 | Neal E. Fearnot | Implantable medical device |
| US5713853A (en) | 1995-06-07 | 1998-02-03 | Interventional Innovations Corporation | Methods for treating thrombosis |
| DE19521642C2 (de) | 1995-06-14 | 2000-11-09 | Aesculap Ag & Co Kg | Implantat, seine Verwendung in der Chirurgie und Verfahren zu seiner Herstellung |
| US6283951B1 (en) | 1996-10-11 | 2001-09-04 | Transvascular, Inc. | Systems and methods for delivering drugs to selected locations within the body |
| US5702717A (en) | 1995-10-25 | 1997-12-30 | Macromed, Inc. | Thermosensitive biodegradable polymers based on poly(ether-ester)block copolymers |
| FR2744924B1 (fr) | 1996-02-21 | 1998-04-24 | Franchi Pierre | Dispositif generateur/regulateur de pression pour pompe d'assistance cardiaque implantable du type a ballonnet de contrepression |
| US5713949A (en) | 1996-08-06 | 1998-02-03 | Jayaraman; Swaminathan | Microporous covered stents and method of coating |
| US5800421A (en) | 1996-06-12 | 1998-09-01 | Lemelson; Jerome H. | Medical devices using electrosensitive gels |
| US5834449A (en) | 1996-06-13 | 1998-11-10 | The Research Foundation Of State University Of New York | Treatment of aortic and vascular aneurysms with tetracycline compounds |
| US5797898A (en) | 1996-07-02 | 1998-08-25 | Massachusetts Institute Of Technology | Microchip drug delivery devices |
| US5797887A (en) | 1996-08-27 | 1998-08-25 | Novovasc Llc | Medical device with a surface adapted for exposure to a blood stream which is coated with a polymer containing a nitrosyl-containing organo-metallic compound which releases nitric oxide from the coating to mediate platelet aggregation |
| US6150164A (en) | 1996-09-30 | 2000-11-21 | The Regents Of The University Of Michigan | Methods and compositions of a bioartificial kidney suitable for use in vivo or ex vivo |
| US5902336A (en) | 1996-10-15 | 1999-05-11 | Mirimedical, Inc. | Implantable device and method for removing fluids from the blood of a patient method for implanting such a device and method for treating a patient experiencing renal failure |
| US6056734A (en) | 1997-02-07 | 2000-05-02 | Sarcos Lc | Method for automatic dosing of drugs |
| US6022333A (en) | 1997-05-01 | 2000-02-08 | S.L.I.M. Tech, Ltd. | Method and system for removing materials from lymphatic and other fluids |
| US5891154A (en) | 1997-05-06 | 1999-04-06 | Advanced Cardiovascular System, Inc. | Passive perfusion stent delivery system |
| US5911734A (en) | 1997-05-08 | 1999-06-15 | Embol-X, Inc. | Percutaneous catheter and guidewire having filter and medical device deployment capabilities |
| US6106454A (en) | 1997-06-17 | 2000-08-22 | Medtronic, Inc. | Medical device for delivering localized radiation |
| JP3502534B2 (ja) | 1997-06-19 | 2004-03-02 | 株式会社リコー | マグネットロールの製造方法 |
| US5899935A (en) | 1997-08-04 | 1999-05-04 | Schneider (Usa) Inc. | Balloon expandable braided stent with restraint |
| US5855892A (en) | 1997-09-19 | 1999-01-05 | Potter; Susan M. | Method for decreasing LDL-cholesterol concentration and increasing HDL-cholesterol concentration in the blood to reduce the risk of atherosclerosis and vascular disease |
| US6440734B1 (en) | 1998-09-25 | 2002-08-27 | Cytomatrix, Llc | Methods and devices for the long-term culture of hematopoietic progenitor cells |
| US6030414A (en) | 1997-11-13 | 2000-02-29 | Taheri; Syde A. | Variable stent and method for treatment of arterial disease |
| US6099495A (en) | 1998-04-30 | 2000-08-08 | Medtronic, Inc. | Implantable electrical transducer powered from capacitive storage energy source |
| US6132458A (en) | 1998-05-15 | 2000-10-17 | American Medical Systems, Inc. | Method and device for loading a stent |
| US6129757A (en) | 1998-05-18 | 2000-10-10 | Scimed Life Systems | Implantable members for receiving therapeutically useful compositions |
| US6071035A (en) | 1998-06-01 | 2000-06-06 | Hubbell Incorporated | Interchangeable tool coupling assembly having spring-based locking sleeve |
| US6036725A (en) | 1998-06-10 | 2000-03-14 | General Science And Technology | Expandable endovascular support device |
| US6136011A (en) | 1998-07-14 | 2000-10-24 | Advanced Cardiovascular Systems, Inc. | Stent delivery system and method of use |
| US6093199A (en) | 1998-08-05 | 2000-07-25 | Endovascular Technologies, Inc. | Intra-luminal device for treatment of body cavities and lumens and method of use |
| US6290728B1 (en) | 1998-09-10 | 2001-09-18 | Percardia, Inc. | Designs for left ventricular conduit |
| US6548299B1 (en) | 1999-11-12 | 2003-04-15 | Mark J. Pykett | Lymphoid tissue-specific cell production from hematopoietic progenitor cells in three-dimensional devices |
| US6113608A (en) | 1998-11-20 | 2000-09-05 | Scimed Life Systems, Inc. | Stent delivery device |
| US6080178A (en) | 1999-04-20 | 2000-06-27 | Meglin; Allen J. | Vena cava filter |
| ATE345827T1 (de) * | 1999-04-23 | 2006-12-15 | Renamed Biolog Inc | Extrakorporaler kreislauf |
| US6585756B1 (en) | 1999-05-14 | 2003-07-01 | Ernst P. Strecker | Implantable lumen prosthesis |
| AU4017501A (en) * | 1999-09-24 | 2001-04-24 | Cell Science Therapeutics, Inc. | Cell culture spinner flasks |
| CA2392006C (en) | 1999-11-17 | 2011-03-15 | Microchips, Inc. | Microfabricated devices for the delivery of molecules into a carrier fluid |
| US6242248B1 (en) * | 2000-02-08 | 2001-06-05 | Cedars-Sinai Medical Center | Bioreactor and related method |
| US6561320B2 (en) * | 2000-08-08 | 2003-05-13 | Ju-Young Yi | Automatically operated antiskid apparatus for automobile tires |
| CA2430554A1 (en) | 2000-12-01 | 2002-07-25 | Nephros Therapeutics, Inc. | Intravascular blood conditioning device and use thereof |
| EP1341476A2 (en) | 2000-12-01 | 2003-09-10 | Nephros Therapeutics, Inc. | Intrasvascular drug delivery device and use therefor |
| DE10061704A1 (de) * | 2000-12-12 | 2002-06-20 | Hans Joerg Bauer | Verfahren und Vorrichtung zur Herstellung von biologischem Gewebe in einer Wachstumskammer |
| US6653131B2 (en) * | 2001-08-30 | 2003-11-25 | The Regents Of The University Of Michigan | Method of treating systemic inflammatory response syndrome |
| US7332330B2 (en) * | 2001-09-11 | 2008-02-19 | Renamed Biologics, Inc. | Device for maintaining vascularization near an implant |
| US7442546B2 (en) * | 2002-03-15 | 2008-10-28 | The Regents Of The University Of Michigan | Method of modulating inflammatory response |
| AU2003233677A1 (en) * | 2002-05-24 | 2003-12-12 | Cytomatrix, Llc | Cytokine-free growth and maintenance of progenitor cells |
| US20080063652A1 (en) * | 2004-03-29 | 2008-03-13 | Cytomatrix, Llc | Methods for Production of Regulatory T Cells and Uses Thereof |
| US7704714B2 (en) * | 2004-07-26 | 2010-04-27 | Agency For Science, Technology & Research | Encapsulation of cells in biologic compatible scaffolds by coacervation of charged polymers |
| US20060286078A1 (en) * | 2005-06-15 | 2006-12-21 | Humes H D | Methods of treating cardiorenal syndrome and hepatorenal syndrome |
| US7776592B2 (en) | 2005-08-31 | 2010-08-17 | Stc.Unm | Human renal stem cells |
| US20070065642A1 (en) * | 2005-09-21 | 2007-03-22 | Venkateswara Gupta | Device and method for thermoforming a part |
| JP2009525781A (ja) | 2006-02-02 | 2009-07-16 | イノベーティブ バイオ セラピーズ | 細胞をベースとする体外治療装置および送達システム |
| US20090081296A1 (en) * | 2006-02-02 | 2009-03-26 | Humes H David | Extracorporeal cell-based therapeutic device and delivery system |
| ES2432395T3 (es) | 2006-10-12 | 2013-12-03 | Ethicon, Inc. | Células derivadas de riñon y metodo de uso en la reparación y regeneración tisular |
| NZ583591A (en) | 2007-08-31 | 2012-11-30 | Cytopherx Inc | Selective cytopheresis devices and related methods thereof |
| US20090130756A1 (en) * | 2007-11-20 | 2009-05-21 | Pioneer Surgical Orthobiologics,Inc. | Cryopreservation of cells using cross-linked bioactive hydrogel matrix particles |
| CA2728215A1 (en) | 2008-06-18 | 2010-06-24 | Innovative Biotherapies, Inc. | Methods for enhanced propagation of cells |
| EP2323725A4 (en) | 2008-08-15 | 2014-01-29 | Innovative Biotherapies Inc | THERAPEUTIC DEVICE BASED ON EXTRACORPOREAL CELLS AND ADMINISTRATION SYSTEM |
-
2007
- 2007-02-01 JP JP2008553503A patent/JP2009525781A/ja not_active Withdrawn
- 2007-02-01 AU AU2007212110A patent/AU2007212110A1/en not_active Abandoned
- 2007-02-01 US US11/670,123 patent/US8048419B2/en active Active
- 2007-02-01 CA CA002637686A patent/CA2637686A1/en not_active Abandoned
- 2007-02-01 WO PCT/US2007/061468 patent/WO2007092735A2/en active Application Filing
- 2007-02-01 EP EP07763504.3A patent/EP1989144A4/en not_active Withdrawn
Also Published As
| Publication number | Publication date |
|---|---|
| EP1989144A4 (en) | 2014-01-29 |
| CA2637686A1 (en) | 2007-08-16 |
| WO2007092735A2 (en) | 2007-08-16 |
| US8048419B2 (en) | 2011-11-01 |
| WO2007092735A3 (en) | 2008-12-31 |
| EP1989144A2 (en) | 2008-11-12 |
| US20070269489A1 (en) | 2007-11-22 |
| AU2007212110A1 (en) | 2007-08-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2009525781A (ja) | 細胞をベースとする体外治療装置および送達システム | |
| JP3878672B2 (ja) | 体循環への予め選択された分子の放出器具 | |
| US20020090389A1 (en) | Intravascular blood conditioning device and use thereof | |
| JP4751018B2 (ja) | インプラント近傍の血管形成を維持するためのデバイス及び方法 | |
| US5324518A (en) | Implantable structure for containing substances for delivery to a body | |
| Flendrig et al. | Semipermeable hollow fiber membranes in hepatocyte bioreactors: a prerequisite for a successful bioartificial liver? | |
| JPH04507051A (ja) | 人口膵臓灌流装置 | |
| US11666691B2 (en) | Bioartificial ultrafiltration device and methods related thereto | |
| US20090081296A1 (en) | Extracorporeal cell-based therapeutic device and delivery system | |
| Colton et al. | Development of novel semipermeable tubular membranes for a hybrid artificial pancreas | |
| Eibl et al. | Bioreactors for bioartificial organs | |
| WO2024036199A2 (en) | Endovascular biologic stent | |
| io ar tificial Liver | Bioreactors: zyxwvutsrqponm | |
| JP2004275718A (ja) | バイオ人工膵臓用モジュール及びバイオ人工膵臓 | |
| Wang | Progress in bioartificial pancreas | |
| Maki et al. | Vascular Devices |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100201 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20100201 |
|
| A072 | Dismissal of procedure [no reply to invitation to correct request for examination] |
Free format text: JAPANESE INTERMEDIATE CODE: A073 Effective date: 20110609 |
|
| A300 | Application deemed to be withdrawn because no request for examination was validly filed |
Free format text: JAPANESE INTERMEDIATE CODE: A300 Effective date: 20110705 |