JP3878672B2 - 体循環への予め選択された分子の放出器具 - Google Patents
体循環への予め選択された分子の放出器具 Download PDFInfo
- Publication number
- JP3878672B2 JP3878672B2 JP50109697A JP50109697A JP3878672B2 JP 3878672 B2 JP3878672 B2 JP 3878672B2 JP 50109697 A JP50109697 A JP 50109697A JP 50109697 A JP50109697 A JP 50109697A JP 3878672 B2 JP3878672 B2 JP 3878672B2
- Authority
- JP
- Japan
- Prior art keywords
- blood
- cells
- capsule
- cell
- blood vessel
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 230000001839 systemic circulation Effects 0.000 title claims abstract description 20
- 239000002775 capsule Substances 0.000 claims abstract description 114
- 210000004369 blood Anatomy 0.000 claims abstract description 91
- 239000008280 blood Substances 0.000 claims abstract description 91
- 210000004204 blood vessel Anatomy 0.000 claims abstract description 70
- 229940088597 hormone Drugs 0.000 claims abstract description 10
- 239000005556 hormone Substances 0.000 claims abstract description 10
- 210000004027 cell Anatomy 0.000 claims description 276
- 239000012510 hollow fiber Substances 0.000 claims description 144
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 claims description 90
- 229910052760 oxygen Inorganic materials 0.000 claims description 49
- 239000001301 oxygen Substances 0.000 claims description 49
- 102000004877 Insulin Human genes 0.000 claims description 48
- 108090001061 Insulin Proteins 0.000 claims description 48
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 claims description 48
- 229940125396 insulin Drugs 0.000 claims description 45
- 239000012528 membrane Substances 0.000 claims description 31
- 108090000623 proteins and genes Proteins 0.000 claims description 30
- 208000007536 Thrombosis Diseases 0.000 claims description 27
- 239000011148 porous material Substances 0.000 claims description 24
- 238000013508 migration Methods 0.000 claims description 21
- 239000000835 fiber Substances 0.000 claims description 15
- 102000004169 proteins and genes Human genes 0.000 claims description 15
- 230000004044 response Effects 0.000 claims description 14
- 238000011144 upstream manufacturing Methods 0.000 claims description 13
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 claims description 12
- 230000003833 cell viability Effects 0.000 claims description 12
- 239000008103 glucose Substances 0.000 claims description 12
- 230000035899 viability Effects 0.000 claims description 12
- 230000017531 blood circulation Effects 0.000 claims description 8
- 210000004962 mammalian cell Anatomy 0.000 claims description 8
- 229920002492 poly(sulfone) Polymers 0.000 claims description 8
- 210000003527 eukaryotic cell Anatomy 0.000 claims description 7
- -1 polyfucavinylidene Polymers 0.000 claims description 7
- 229920002301 cellulose acetate Polymers 0.000 claims description 6
- 229920002635 polyurethane Polymers 0.000 claims description 6
- 239000004814 polyurethane Substances 0.000 claims description 6
- 239000000203 mixture Substances 0.000 claims description 5
- 239000002253 acid Substances 0.000 claims description 4
- 239000004810 polytetrafluoroethylene Substances 0.000 claims description 4
- 229920001343 polytetrafluoroethylene Polymers 0.000 claims description 4
- 229920001747 Cellulose diacetate Polymers 0.000 claims description 3
- 239000000020 Nitrocellulose Substances 0.000 claims description 3
- 229920003171 Poly (ethylene oxide) Polymers 0.000 claims description 3
- 239000004952 Polyamide Substances 0.000 claims description 3
- 239000004793 Polystyrene Substances 0.000 claims description 3
- 239000004372 Polyvinyl alcohol Substances 0.000 claims description 3
- FJWGYAHXMCUOOM-QHOUIDNNSA-N [(2s,3r,4s,5r,6r)-2-[(2r,3r,4s,5r,6s)-4,5-dinitrooxy-2-(nitrooxymethyl)-6-[(2r,3r,4s,5r,6s)-4,5,6-trinitrooxy-2-(nitrooxymethyl)oxan-3-yl]oxyoxan-3-yl]oxy-3,5-dinitrooxy-6-(nitrooxymethyl)oxan-4-yl] nitrate Chemical compound O([C@@H]1O[C@@H]([C@H]([C@H](O[N+]([O-])=O)[C@H]1O[N+]([O-])=O)O[C@H]1[C@@H]([C@@H](O[N+]([O-])=O)[C@H](O[N+]([O-])=O)[C@@H](CO[N+]([O-])=O)O1)O[N+]([O-])=O)CO[N+](=O)[O-])[C@@H]1[C@@H](CO[N+]([O-])=O)O[C@@H](O[N+]([O-])=O)[C@H](O[N+]([O-])=O)[C@H]1O[N+]([O-])=O FJWGYAHXMCUOOM-QHOUIDNNSA-N 0.000 claims description 3
- 239000012948 isocyanate Substances 0.000 claims description 3
- 150000002513 isocyanates Chemical class 0.000 claims description 3
- 229910052751 metal Inorganic materials 0.000 claims description 3
- 239000002184 metal Substances 0.000 claims description 3
- 229920001220 nitrocellulos Polymers 0.000 claims description 3
- 229920003229 poly(methyl methacrylate) Polymers 0.000 claims description 3
- 229920002239 polyacrylonitrile Polymers 0.000 claims description 3
- 229920002647 polyamide Polymers 0.000 claims description 3
- 239000004926 polymethyl methacrylate Substances 0.000 claims description 3
- 229920002223 polystyrene Polymers 0.000 claims description 3
- 229920002451 polyvinyl alcohol Polymers 0.000 claims description 3
- 229920000915 polyvinyl chloride Polymers 0.000 claims description 3
- 239000004800 polyvinyl chloride Substances 0.000 claims description 3
- 229920002284 Cellulose triacetate Polymers 0.000 claims description 2
- NNLVGZFZQQXQNW-ADJNRHBOSA-N [(2r,3r,4s,5r,6s)-4,5-diacetyloxy-3-[(2s,3r,4s,5r,6r)-3,4,5-triacetyloxy-6-(acetyloxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6s)-4,5,6-triacetyloxy-2-(acetyloxymethyl)oxan-3-yl]oxyoxan-2-yl]methyl acetate Chemical compound O([C@@H]1O[C@@H]([C@H]([C@H](OC(C)=O)[C@H]1OC(C)=O)O[C@H]1[C@@H]([C@@H](OC(C)=O)[C@H](OC(C)=O)[C@@H](COC(C)=O)O1)OC(C)=O)COC(=O)C)[C@@H]1[C@@H](COC(C)=O)O[C@@H](OC(C)=O)[C@H](OC(C)=O)[C@H]1OC(C)=O NNLVGZFZQQXQNW-ADJNRHBOSA-N 0.000 claims description 2
- 230000001627 detrimental effect Effects 0.000 claims description 2
- 239000000463 material Substances 0.000 claims description 2
- 230000035764 nutrition Effects 0.000 claims 1
- 235000016709 nutrition Nutrition 0.000 claims 1
- 230000035699 permeability Effects 0.000 claims 1
- 230000000717 retained effect Effects 0.000 claims 1
- 239000000126 substance Substances 0.000 claims 1
- 238000000034 method Methods 0.000 abstract description 52
- 241000124008 Mammalia Species 0.000 abstract description 14
- 241001465754 Metazoa Species 0.000 description 30
- 238000004519 manufacturing process Methods 0.000 description 25
- 239000002609 medium Substances 0.000 description 22
- 241000282472 Canis lupus familiaris Species 0.000 description 16
- 102000003951 Erythropoietin Human genes 0.000 description 16
- 108090000394 Erythropoietin Proteins 0.000 description 16
- 229940105423 erythropoietin Drugs 0.000 description 16
- OXCMYAYHXIHQOA-UHFFFAOYSA-N potassium;[2-butyl-5-chloro-3-[[4-[2-(1,2,4-triaza-3-azanidacyclopenta-1,4-dien-5-yl)phenyl]phenyl]methyl]imidazol-4-yl]methanol Chemical compound [K+].CCCCC1=NC(Cl)=C(CO)N1CC1=CC=C(C=2C(=CC=CC=2)C2=N[N-]N=N2)C=C1 OXCMYAYHXIHQOA-UHFFFAOYSA-N 0.000 description 16
- 102000009123 Fibrin Human genes 0.000 description 15
- 108010073385 Fibrin Proteins 0.000 description 15
- BWGVNKXGVNDBDI-UHFFFAOYSA-N Fibrin monomer Chemical compound CNC(=O)CNC(=O)CN BWGVNKXGVNDBDI-UHFFFAOYSA-N 0.000 description 15
- 230000002950 deficient Effects 0.000 description 15
- 229950003499 fibrin Drugs 0.000 description 15
- 238000002474 experimental method Methods 0.000 description 14
- 238000002513 implantation Methods 0.000 description 14
- 239000013598 vector Substances 0.000 description 13
- 230000014509 gene expression Effects 0.000 description 12
- 210000004153 islets of langerhan Anatomy 0.000 description 12
- 210000001631 vena cava inferior Anatomy 0.000 description 12
- 230000001413 cellular effect Effects 0.000 description 11
- 238000003780 insertion Methods 0.000 description 11
- 230000037431 insertion Effects 0.000 description 11
- 235000015097 nutrients Nutrition 0.000 description 11
- 238000002054 transplantation Methods 0.000 description 11
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 10
- 108020004414 DNA Proteins 0.000 description 10
- 238000009792 diffusion process Methods 0.000 description 10
- 239000002753 trypsin inhibitor Substances 0.000 description 10
- 230000015572 biosynthetic process Effects 0.000 description 9
- 229940079593 drug Drugs 0.000 description 9
- 239000003814 drug Substances 0.000 description 9
- 108010054218 Factor VIII Proteins 0.000 description 8
- 102000001690 Factor VIII Human genes 0.000 description 8
- 229960000301 factor viii Drugs 0.000 description 8
- 210000003191 femoral vein Anatomy 0.000 description 8
- 238000001990 intravenous administration Methods 0.000 description 8
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 8
- 101710081722 Antitrypsin Proteins 0.000 description 7
- 208000007502 anemia Diseases 0.000 description 7
- 230000001475 anti-trypsic effect Effects 0.000 description 7
- 206010012601 diabetes mellitus Diseases 0.000 description 7
- 108020004999 messenger RNA Proteins 0.000 description 7
- 210000003462 vein Anatomy 0.000 description 7
- 102100022641 Coagulation factor IX Human genes 0.000 description 6
- 108010076282 Factor IX Proteins 0.000 description 6
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 6
- 108010007267 Hirudins Proteins 0.000 description 6
- 238000004113 cell culture Methods 0.000 description 6
- 238000013461 design Methods 0.000 description 6
- 210000002889 endothelial cell Anatomy 0.000 description 6
- 229960004222 factor ix Drugs 0.000 description 6
- 229960002897 heparin Drugs 0.000 description 6
- 229920000669 heparin Polymers 0.000 description 6
- WQPDUTSPKFMPDP-OUMQNGNKSA-N hirudin Chemical compound C([C@@H](C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1C=CC(OS(O)(=O)=O)=CC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CCCCN)NC(=O)[C@H]1N(CCC1)C(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)CNC(=O)[C@@H](NC(=O)[C@@H](NC(=O)[C@H]1NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCC(O)=O)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)CNC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@@H]2CSSC[C@@H](C(=O)N[C@@H](CCC(O)=O)C(=O)NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@H](C(=O)N[C@H](C(NCC(=O)N[C@@H](CCC(N)=O)C(=O)NCC(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCCN)C(=O)N2)=O)CSSC1)C(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]1NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)CNC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=2C=CC(O)=CC=2)NC(=O)[C@@H](NC(=O)[C@@H](N)C(C)C)C(C)C)[C@@H](C)O)CSSC1)C(C)C)[C@@H](C)O)[C@@H](C)O)C1=CC=CC=C1 WQPDUTSPKFMPDP-OUMQNGNKSA-N 0.000 description 6
- 210000001519 tissue Anatomy 0.000 description 6
- 102000007625 Hirudins Human genes 0.000 description 5
- 108091028043 Nucleic acid sequence Proteins 0.000 description 5
- 229910002092 carbon dioxide Inorganic materials 0.000 description 5
- 239000001569 carbon dioxide Substances 0.000 description 5
- 201000010099 disease Diseases 0.000 description 5
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 5
- 238000005516 engineering process Methods 0.000 description 5
- 210000003743 erythrocyte Anatomy 0.000 description 5
- 229940006607 hirudin Drugs 0.000 description 5
- 238000007901 in situ hybridization Methods 0.000 description 5
- 238000001727 in vivo Methods 0.000 description 5
- 238000002347 injection Methods 0.000 description 5
- 239000007924 injection Substances 0.000 description 5
- 210000003098 myoblast Anatomy 0.000 description 5
- 150000007523 nucleic acids Chemical class 0.000 description 5
- 229920000642 polymer Polymers 0.000 description 5
- 230000001177 retroviral effect Effects 0.000 description 5
- 208000024891 symptom Diseases 0.000 description 5
- 230000014616 translation Effects 0.000 description 5
- 230000002792 vascular Effects 0.000 description 5
- 206010002091 Anaesthesia Diseases 0.000 description 4
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 4
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 4
- 206010021143 Hypoxia Diseases 0.000 description 4
- YQEZLKZALYSWHR-UHFFFAOYSA-N Ketamine Chemical compound C=1C=CC=C(Cl)C=1C1(NC)CCCCC1=O YQEZLKZALYSWHR-UHFFFAOYSA-N 0.000 description 4
- 241000699666 Mus <mouse, genus> Species 0.000 description 4
- 239000012980 RPMI-1640 medium Substances 0.000 description 4
- 108020004511 Recombinant DNA Proteins 0.000 description 4
- RTAQQCXQSZGOHL-UHFFFAOYSA-N Titanium Chemical compound [Ti] RTAQQCXQSZGOHL-UHFFFAOYSA-N 0.000 description 4
- 230000037005 anaesthesia Effects 0.000 description 4
- 239000003146 anticoagulant agent Substances 0.000 description 4
- 229940127219 anticoagulant drug Drugs 0.000 description 4
- 239000012620 biological material Substances 0.000 description 4
- 239000002299 complementary DNA Substances 0.000 description 4
- 239000012894 fetal calf serum Substances 0.000 description 4
- 210000002950 fibroblast Anatomy 0.000 description 4
- 238000002594 fluoroscopy Methods 0.000 description 4
- 238000005534 hematocrit Methods 0.000 description 4
- 230000000984 immunochemical effect Effects 0.000 description 4
- 210000004731 jugular vein Anatomy 0.000 description 4
- 229960003299 ketamine Drugs 0.000 description 4
- 239000003550 marker Substances 0.000 description 4
- 108020004707 nucleic acids Proteins 0.000 description 4
- 102000039446 nucleic acids Human genes 0.000 description 4
- 210000000496 pancreas Anatomy 0.000 description 4
- 230000001575 pathological effect Effects 0.000 description 4
- 229910052697 platinum Inorganic materials 0.000 description 4
- 238000003752 polymerase chain reaction Methods 0.000 description 4
- 230000003248 secreting effect Effects 0.000 description 4
- 230000028327 secretion Effects 0.000 description 4
- 241000894007 species Species 0.000 description 4
- 238000001356 surgical procedure Methods 0.000 description 4
- 239000010936 titanium Substances 0.000 description 4
- 229910052719 titanium Inorganic materials 0.000 description 4
- 241000282465 Canis Species 0.000 description 3
- 241000282693 Cercopithecidae Species 0.000 description 3
- 102000008186 Collagen Human genes 0.000 description 3
- 108010035532 Collagen Proteins 0.000 description 3
- 102000029816 Collagenase Human genes 0.000 description 3
- 108060005980 Collagenase Proteins 0.000 description 3
- 102000004127 Cytokines Human genes 0.000 description 3
- 108090000695 Cytokines Proteins 0.000 description 3
- 241000700605 Viruses Species 0.000 description 3
- 230000036770 blood supply Effects 0.000 description 3
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 3
- 208000020832 chronic kidney disease Diseases 0.000 description 3
- 230000004087 circulation Effects 0.000 description 3
- 229920001436 collagen Polymers 0.000 description 3
- 229960002424 collagenase Drugs 0.000 description 3
- 238000012258 culturing Methods 0.000 description 3
- 208000036654 deficiency anemia Diseases 0.000 description 3
- 230000008021 deposition Effects 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 230000007368 endocrine function Effects 0.000 description 3
- 208000007345 glycogen storage disease Diseases 0.000 description 3
- 230000012010 growth Effects 0.000 description 3
- 210000003494 hepatocyte Anatomy 0.000 description 3
- 238000002657 hormone replacement therapy Methods 0.000 description 3
- 210000004185 liver Anatomy 0.000 description 3
- 210000004698 lymphocyte Anatomy 0.000 description 3
- 230000007246 mechanism Effects 0.000 description 3
- 239000002207 metabolite Substances 0.000 description 3
- 230000007170 pathology Effects 0.000 description 3
- 210000003240 portal vein Anatomy 0.000 description 3
- 238000012216 screening Methods 0.000 description 3
- 238000001890 transfection Methods 0.000 description 3
- 230000032258 transport Effects 0.000 description 3
- 206010003226 Arteriovenous fistula Diseases 0.000 description 2
- 241000283690 Bos taurus Species 0.000 description 2
- 230000004544 DNA amplification Effects 0.000 description 2
- 108700028146 Genetic Enhancer Elements Proteins 0.000 description 2
- 229920002527 Glycogen Polymers 0.000 description 2
- 208000031220 Hemophilia Diseases 0.000 description 2
- 208000009292 Hemophilia A Diseases 0.000 description 2
- 241000238631 Hexapoda Species 0.000 description 2
- 101000987586 Homo sapiens Eosinophil peroxidase Proteins 0.000 description 2
- 101000920686 Homo sapiens Erythropoietin Proteins 0.000 description 2
- 241001529936 Murinae Species 0.000 description 2
- 206010028980 Neoplasm Diseases 0.000 description 2
- 229920002873 Polyethylenimine Polymers 0.000 description 2
- 108010076504 Protein Sorting Signals Proteins 0.000 description 2
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 description 2
- 239000013543 active substance Substances 0.000 description 2
- 239000000853 adhesive Substances 0.000 description 2
- 230000001070 adhesive effect Effects 0.000 description 2
- 230000000735 allogeneic effect Effects 0.000 description 2
- 210000004102 animal cell Anatomy 0.000 description 2
- 238000010171 animal model Methods 0.000 description 2
- 239000004019 antithrombin Substances 0.000 description 2
- 210000001367 artery Anatomy 0.000 description 2
- 239000012298 atmosphere Substances 0.000 description 2
- 210000000227 basophil cell of anterior lobe of hypophysis Anatomy 0.000 description 2
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 2
- 238000012832 cell culture technique Methods 0.000 description 2
- 230000004069 differentiation Effects 0.000 description 2
- 238000009826 distribution Methods 0.000 description 2
- VYFYYTLLBUKUHU-UHFFFAOYSA-N dopamine Chemical compound NCCC1=CC=C(O)C(O)=C1 VYFYYTLLBUKUHU-UHFFFAOYSA-N 0.000 description 2
- 208000028208 end stage renal disease Diseases 0.000 description 2
- 201000000523 end stage renal failure Diseases 0.000 description 2
- 230000029142 excretion Effects 0.000 description 2
- 210000003608 fece Anatomy 0.000 description 2
- 238000010353 genetic engineering Methods 0.000 description 2
- 229940096919 glycogen Drugs 0.000 description 2
- 230000013632 homeostatic process Effects 0.000 description 2
- 230000005745 host immune response Effects 0.000 description 2
- 102000044890 human EPO Human genes 0.000 description 2
- 230000001146 hypoxic effect Effects 0.000 description 2
- 230000028993 immune response Effects 0.000 description 2
- 239000007943 implant Substances 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- 210000003734 kidney Anatomy 0.000 description 2
- 210000002540 macrophage Anatomy 0.000 description 2
- 230000002503 metabolic effect Effects 0.000 description 2
- 238000012978 minimally invasive surgical procedure Methods 0.000 description 2
- 210000003205 muscle Anatomy 0.000 description 2
- 230000017074 necrotic cell death Effects 0.000 description 2
- 230000001338 necrotic effect Effects 0.000 description 2
- 230000014508 negative regulation of coagulation Effects 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 108090000765 processed proteins & peptides Proteins 0.000 description 2
- 210000001236 prokaryotic cell Anatomy 0.000 description 2
- 210000002796 renal vein Anatomy 0.000 description 2
- 108091008146 restriction endonucleases Proteins 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- 238000013518 transcription Methods 0.000 description 2
- 230000035897 transcription Effects 0.000 description 2
- 238000013519 translation Methods 0.000 description 2
- 241001430294 unidentified retrovirus Species 0.000 description 2
- 210000005166 vasculature Anatomy 0.000 description 2
- 210000002620 vena cava superior Anatomy 0.000 description 2
- 108020003589 5' Untranslated Regions Proteins 0.000 description 1
- 101710169336 5'-deoxyadenosine deaminase Proteins 0.000 description 1
- 102000055025 Adenosine deaminases Human genes 0.000 description 1
- 206010003162 Arterial injury Diseases 0.000 description 1
- 208000023275 Autoimmune disease Diseases 0.000 description 1
- 241000271566 Aves Species 0.000 description 1
- 210000002237 B-cell of pancreatic islet Anatomy 0.000 description 1
- 244000063299 Bacillus subtilis Species 0.000 description 1
- 235000014469 Bacillus subtilis Nutrition 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 201000009030 Carcinoma Diseases 0.000 description 1
- 241000819038 Chichester Species 0.000 description 1
- 208000017667 Chronic Disease Diseases 0.000 description 1
- 102000004266 Collagen Type IV Human genes 0.000 description 1
- 108010042086 Collagen Type IV Proteins 0.000 description 1
- 108091035707 Consensus sequence Proteins 0.000 description 1
- NBSCHQHZLSJFNQ-GASJEMHNSA-N D-Glucose 6-phosphate Chemical compound OC1O[C@H](COP(O)(O)=O)[C@@H](O)[C@H](O)[C@H]1O NBSCHQHZLSJFNQ-GASJEMHNSA-N 0.000 description 1
- 102000012410 DNA Ligases Human genes 0.000 description 1
- 108010061982 DNA Ligases Proteins 0.000 description 1
- 244000000626 Daucus carota Species 0.000 description 1
- 206010012289 Dementia Diseases 0.000 description 1
- 206010014561 Emphysema Diseases 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 241000283073 Equus caballus Species 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- 208000024720 Fabry Disease Diseases 0.000 description 1
- 241000282324 Felis Species 0.000 description 1
- 206010072104 Fructose intolerance Diseases 0.000 description 1
- 102000001390 Fructose-Bisphosphate Aldolase Human genes 0.000 description 1
- 108010068561 Fructose-Bisphosphate Aldolase Proteins 0.000 description 1
- 208000027472 Galactosemias Diseases 0.000 description 1
- IAJILQKETJEXLJ-UHFFFAOYSA-N Galacturonsaeure Natural products O=CC(O)C(O)C(O)C(O)C(O)=O IAJILQKETJEXLJ-UHFFFAOYSA-N 0.000 description 1
- VFRROHXSMXFLSN-UHFFFAOYSA-N Glc6P Natural products OP(=O)(O)OCC(O)C(O)C(O)C(O)C=O VFRROHXSMXFLSN-UHFFFAOYSA-N 0.000 description 1
- 102000004547 Glucosylceramidase Human genes 0.000 description 1
- 108010017544 Glucosylceramidase Proteins 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 239000012981 Hank's balanced salt solution Substances 0.000 description 1
- 206010019878 Hereditary fructose intolerance Diseases 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 240000007049 Juglans regia Species 0.000 description 1
- 235000009496 Juglans regia Nutrition 0.000 description 1
- AEMOLEFTQBMNLQ-HNFCZKTMSA-N L-idopyranuronic acid Chemical compound OC1O[C@@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O AEMOLEFTQBMNLQ-HNFCZKTMSA-N 0.000 description 1
- 208000002678 Mucopolysaccharidoses Diseases 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- 241000772415 Neovison vison Species 0.000 description 1
- 208000014060 Niemann-Pick disease Diseases 0.000 description 1
- IOVCWXUNBOPUCH-UHFFFAOYSA-M Nitrite anion Chemical compound [O-]N=O IOVCWXUNBOPUCH-UHFFFAOYSA-M 0.000 description 1
- 108091034117 Oligonucleotide Proteins 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 238000012408 PCR amplification Methods 0.000 description 1
- 239000002033 PVDF binder Substances 0.000 description 1
- 208000018737 Parkinson disease Diseases 0.000 description 1
- 208000037581 Persistent Infection Diseases 0.000 description 1
- 108010069013 Phenylalanine Hydroxylase Proteins 0.000 description 1
- 102100038223 Phenylalanine-4-hydroxylase Human genes 0.000 description 1
- 201000011252 Phenylketonuria Diseases 0.000 description 1
- 102000009097 Phosphorylases Human genes 0.000 description 1
- 108010073135 Phosphorylases Proteins 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- 241000097929 Porphyria Species 0.000 description 1
- 208000010642 Porphyrias Diseases 0.000 description 1
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 1
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- 108010023197 Streptokinase Proteins 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 102000005262 Sulfatase Human genes 0.000 description 1
- 102000016540 Tyrosine aminotransferases Human genes 0.000 description 1
- 108010042606 Tyrosine transaminase Proteins 0.000 description 1
- 108010058532 UTP-hexose-1-phosphate uridylyltransferase Proteins 0.000 description 1
- 102000006321 UTP-hexose-1-phosphate uridylyltransferase Human genes 0.000 description 1
- 108090000435 Urokinase-type plasminogen activator Proteins 0.000 description 1
- 102000003990 Urokinase-type plasminogen activator Human genes 0.000 description 1
- 208000027276 Von Willebrand disease Diseases 0.000 description 1
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 1
- 210000000683 abdominal cavity Anatomy 0.000 description 1
- 239000012190 activator Substances 0.000 description 1
- 238000005273 aeration Methods 0.000 description 1
- 102000005840 alpha-Galactosidase Human genes 0.000 description 1
- 108010030291 alpha-Galactosidase Proteins 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000003466 anti-cipated effect Effects 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 239000002506 anticoagulant protein Substances 0.000 description 1
- 210000002376 aorta thoracic Anatomy 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 210000002565 arteriole Anatomy 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 230000003190 augmentative effect Effects 0.000 description 1
- 210000003719 b-lymphocyte Anatomy 0.000 description 1
- 238000005452 bending Methods 0.000 description 1
- 229920000249 biocompatible polymer Polymers 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 235000005770 birds nest Nutrition 0.000 description 1
- 230000023555 blood coagulation Effects 0.000 description 1
- 229940098773 bovine serum albumin Drugs 0.000 description 1
- 238000010804 cDNA synthesis Methods 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 239000006143 cell culture medium Substances 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 208000022831 chronic renal failure syndrome Diseases 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 230000001461 cytolytic effect Effects 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 238000000432 density-gradient centrifugation Methods 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000000502 dialysis Methods 0.000 description 1
- 238000007599 discharging Methods 0.000 description 1
- 229960003638 dopamine Drugs 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 210000002615 epidermis Anatomy 0.000 description 1
- 230000025215 erythrocyte homeostasis Effects 0.000 description 1
- 235000020774 essential nutrients Nutrition 0.000 description 1
- 239000013604 expression vector Substances 0.000 description 1
- 230000001605 fetal effect Effects 0.000 description 1
- 210000003953 foreskin Anatomy 0.000 description 1
- 239000012737 fresh medium Substances 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 238000001476 gene delivery Methods 0.000 description 1
- 238000001415 gene therapy Methods 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 210000002165 glioblast Anatomy 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 239000002565 heparin fraction Substances 0.000 description 1
- 210000002989 hepatic vein Anatomy 0.000 description 1
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 238000009396 hybridization Methods 0.000 description 1
- 208000018875 hypoxemia Diseases 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 210000002865 immune cell Anatomy 0.000 description 1
- 208000003669 immune deficiency disease Diseases 0.000 description 1
- 230000008105 immune reaction Effects 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 238000003018 immunoassay Methods 0.000 description 1
- 238000003365 immunocytochemistry Methods 0.000 description 1
- 239000002955 immunomodulating agent Substances 0.000 description 1
- 229940121354 immunomodulator Drugs 0.000 description 1
- 230000002134 immunopathologic effect Effects 0.000 description 1
- 208000033065 inborn errors of immunity Diseases 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 230000004941 influx Effects 0.000 description 1
- 230000003914 insulin secretion Effects 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 210000003292 kidney cell Anatomy 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 230000033001 locomotion Effects 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 238000007726 management method Methods 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 238000010172 mouse model Methods 0.000 description 1
- 206010028093 mucopolysaccharidosis Diseases 0.000 description 1
- 201000000050 myeloid neoplasm Diseases 0.000 description 1
- HLXZNVUGXRDIFK-UHFFFAOYSA-N nickel titanium Chemical compound [Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni] HLXZNVUGXRDIFK-UHFFFAOYSA-N 0.000 description 1
- 229910001000 nickel titanium Inorganic materials 0.000 description 1
- 238000010899 nucleation Methods 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 238000012261 overproduction Methods 0.000 description 1
- 210000004923 pancreatic tissue Anatomy 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 239000000813 peptide hormone Substances 0.000 description 1
- 230000010412 perfusion Effects 0.000 description 1
- 230000003836 peripheral circulation Effects 0.000 description 1
- 239000013612 plasmid Substances 0.000 description 1
- 229940012957 plasmin Drugs 0.000 description 1
- 229920002981 polyvinylidene fluoride Polymers 0.000 description 1
- 230000004481 post-translational protein modification Effects 0.000 description 1
- 208000028529 primary immunodeficiency disease Diseases 0.000 description 1
- 230000002062 proliferating effect Effects 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 230000020978 protein processing Effects 0.000 description 1
- 230000004088 pulmonary circulation Effects 0.000 description 1
- 210000004879 pulmonary tissue Anatomy 0.000 description 1
- 238000003127 radioimmunoassay Methods 0.000 description 1
- 230000008707 rearrangement Effects 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 238000009256 replacement therapy Methods 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 206010039073 rheumatoid arthritis Diseases 0.000 description 1
- 238000013341 scale-up Methods 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 210000001082 somatic cell Anatomy 0.000 description 1
- 238000009331 sowing Methods 0.000 description 1
- 239000010902 straw Substances 0.000 description 1
- 229960005202 streptokinase Drugs 0.000 description 1
- 108060007951 sulfatase Proteins 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 239000003104 tissue culture media Substances 0.000 description 1
- 230000005026 transcription initiation Effects 0.000 description 1
- 230000005030 transcription termination Effects 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 230000001228 trophic effect Effects 0.000 description 1
- 210000003606 umbilical vein Anatomy 0.000 description 1
- 241001515965 unidentified phage Species 0.000 description 1
- 229960005356 urokinase Drugs 0.000 description 1
- 238000009423 ventilation Methods 0.000 description 1
- 210000000264 venule Anatomy 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 108010047303 von Willebrand Factor Proteins 0.000 description 1
- 208000012137 von Willebrand disease (hereditary or acquired) Diseases 0.000 description 1
- 235000020234 walnut Nutrition 0.000 description 1
- 239000002699 waste material Substances 0.000 description 1
- 235000005765 wild carrot Nutrition 0.000 description 1
- 210000005253 yeast cell Anatomy 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
- A61K9/0024—Solid, semi-solid or solidifying implants, which are implanted or injected in body tissue
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/01—Filters implantable into blood vessels
- A61F2/0105—Open ended, i.e. legs gathered only at one side
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/02—Prostheses implantable into the body
- A61F2/022—Artificial gland structures using bioreactors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M31/00—Devices for introducing or retaining media, e.g. remedies, in cavities of the body
- A61M31/002—Devices for releasing a drug at a continuous and controlled rate for a prolonged period of time
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/01—Filters implantable into blood vessels
- A61F2002/016—Filters implantable into blood vessels made from wire-like elements
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2230/00—Geometry of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof
- A61F2230/0002—Two-dimensional shapes, e.g. cross-sections
- A61F2230/0028—Shapes in the form of latin or greek characters
- A61F2230/005—Rosette-shaped, e.g. star-shaped
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2230/00—Geometry of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof
- A61F2230/0063—Three-dimensional shapes
- A61F2230/0067—Three-dimensional shapes conical
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
Landscapes
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Biomedical Technology (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Transplantation (AREA)
- Heart & Thoracic Surgery (AREA)
- Vascular Medicine (AREA)
- Medicinal Chemistry (AREA)
- Oral & Maxillofacial Surgery (AREA)
- Chemical & Material Sciences (AREA)
- Cardiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Anesthesiology (AREA)
- Hematology (AREA)
- Neurosurgery (AREA)
- Dermatology (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Electrotherapy Devices (AREA)
- Threshing Machine Elements (AREA)
- External Artificial Organs (AREA)
Description
本発明は体循環へ予め選択された分子を放出する移植可能な器具に関する。より詳細には、本発明は生細胞を含有する移植可能な器具に関する。本器具を血管に移植すると細胞は予め選択された分子を産生し、器具を通じて血液循環にそれを分泌する。
発明の背景
哺乳動物の予め選択され部位への薬剤放出器具の開発は進行中である。現在までに、各種の外科的移植可能な薬剤放出器具が開発されてきているが、以下にそれらについて述べる。
米国特許第4、378、016号には、例えばホルモンのような活性因子を、例えば哺乳動物の腹腔等のような予め選択された部位に放出する外科的に移植可能な器具について説明されている。その器具は哺乳動物のなかに移植するための液体浸透性膜のサックおよび、一端がサックの開口部と接続され、他端が哺乳動物の体の外側に残るように設計された非浸透性の中空管から構成される。管は膜性のサックへの接近通路を提供し、サックが哺乳動物に外科的に移植された後で細胞含有包が管を通ってサックに導入される。細胞含有包をサックに挿入するとき、細胞は活性因子を産生し、引き続き受容者の周辺の組織、若しくは器官に拡散することができる。
米国特許第5、182、111号には、哺乳動物の、例えば、組織若しくは器官のような予め選択された部位に活性因子を放出する外科的に移植可能な器具にてついて説明されている。その器具は、特定の活性因子を産生する少なくとも1細胞型、及び増強因子を産生する第2細胞型を含有する半透膜から構成される。第2細胞型により産生される増強因子は、引き続き、第一細胞型が活性因子を産生するのを誘導する。
米国特許第4、479、796号には、予め選択された薬剤を直接血流に注入するための外科的に移植可能な分与器について説明されている。簡単には、分与器は、血管に外科的に結合されている。分与器は置換可能なカートリッジ、例えば微生物のような細胞を包含し、それがカートリッジを通して血流に薬剤を産生、及び分泌する。
米国特許第4、309、776号には、血管壁に外科的移植をするための移植細胞を含有するチェンバーを有する血管内薬剤放出器具について説明されている。その器具は移植細胞から産生されるホルモンをチェンバーから血流へ拡散させる多孔壁から構成される。しかしながら、哺乳動物に非外科的に、若しくは侵襲を最小限に抑えた外科的操作により移植され、一度移植されると予め選択された分子を直接哺乳動物の血管内に分泌する器具を作ることが望ましい。さらに、移植されたときに、長期間哺乳動物に予め選択された分子を投与し、また必要に応じていつでも簡単に取り除くことができる器具を作ることが望ましい。従って、本発明の目的は、長期間、予め選択された分子を哺乳動物の体循環に放出する、容易に移植可能な器具を提供することにある。他の目的は、体循環に予め選択された分子を放出するための哺乳動物の血管内に器具を非外科的に移植する方法を提供する。
本発明のこれらや他の目的、及び特徴については以下の明細書、図面及び請求項から、より明確に理解される。
発明の要約
本発明は哺乳動物の体循環に予め選択された分子を放出する移植可能な器具を提供する。本発明の器具は、非侵襲的に、若しくは最小限に侵襲を抑えた外科的操作により移植することができ、一度移植されると、予め選択された分子を直接血流に放出する。さらに、本発明の器具は、目的の場所で予め選択された分子を産生し、その後、長期間、血流に分泌するように適応される。本発明の器具と方法は治療的に効果のある量の、例えば、ホルモン、成長因子、抗凝固物質、免疫調整物質、サイトカインのような、遺伝子産物を受容者の血流に、直接放出する容易な再現性のよい系を提供する。本発明の器具は、各種の用途があるが、特に、ホルモン置換治療に適している。
最も広義にみて、器具は血液浸透素子からなり、血管の内部表面に固定するように適応される。血液浸透性素子は、本明細書で開示されるように、血管の内部表面に固定されるときに、素子は血管の血がそれを通る様に設計されている。器具は、さらに、血管内に配置されている素子と接触することにより、あるべき場所に配置され、維持されているカプセルからなる。カプセルは、予め選択される分子を産生し、血流に分泌する生細胞を含有する。
本明細書で使用される用語“体循環”は哺乳動物の全ての組織に血流を提供する、肺循環により潅流される肺組織を除く、いずれの血管も、即ち、動脈、細動脈、細静脈、静脈を包含するものと理解される。体循環は、大循環、若しくは抹消循環としてもこの分野では引用される。
本明細書で使用される用語“血液浸透性素子”とは一度挿入されると血管の内部表面に、例えば、鈎やかえしにより固定することができる体循環の血管の管腔に挿入する全ての構造を意味するものと理解される。血管の内部表面に固定されたとき、素子が血管を通る血流を閉塞したり、妨げないような特徴をさらに有する素子である。
好ましい実施の態様としては、血液浸透性素子は、血液凝固抗移動フィルターのような血栓抗移動フィルターである。本発明の実施に使用できる抗移動フィルターが当業者には知られている。現在のところ好ましい血液浸透性の素子としては”GreenfieldTM vena cava filter”として知られている抗移動フィルターである。有用なGreenfieldTM vena cava filterは米国特許第4、817、600号及び第5、059、205に詳細に開示されている。
本明細書で使用される用語”カプセル”とは、血管の管腔内にはまるような大きさの中空構造で、一度血管に導入されると血管を通る血液を閉塞しないし、妨げもしないようなものを意味するものと理解される。カプセルは血液浸透性素子により、血管内のあるべきところに保持される。例えば、カプセルが血液浸透性素子を通ることができないような大きさの時には、カプセルは血液浸透性素子の上流に保持される。また、カプセルは血液浸透性素子の下流であってもよく、血液浸透性素子からカプセルまでつなげる、例えば、鈎や、かえし、のような接続手段であるべきところに保持することができる。さらに、カプセルは楔のような形のもので、楔の狭い方の端が素子を通るが、大きな方の端は素子と接触し素子の中をカプセルが通過するのを妨げるようなものであってもよい。
カプセルは半透膜からできた単一の中空繊維、若しくは一束の中空繊維のいずれかよりなる。半透膜は好ましくは予め選択された分子が、それを通って拡散するのに十分な大きさで、しかしながら、細胞がそれを通過しないような小さな孔を有する。孔は、好ましくは、細胞により産生された、予め選択された分子が中空繊維を通る血流に直接拡散するようになっていて、しかしながら、細胞が中空繊維から体循環へ移動していかないように設計されているのが好ましい。より詳細には、孔は、好ましくは、リンパ球や細胞、特にマクロファージやリンパ球により産生される、例えば、蛋白質、特に抗体や細胞溶解因子、のような薬剤、それらは血流から中空繊維に孔を通るなら、そこに包含されている生細胞を損傷してしまうが、を血流より排除するが、分子量が約150キロダルトン以下の溶質がそれを通るような大きさに作られる。もし予め選択された分子の分子量が150キロダルトン以上であれば、カプセルは予め選択された分子がカプセルから血流に拡散できるような大きさの孔を持つべきである。しかしながら、分子量150キロダルトン以上の予め選択された分子を産生し、分泌するのに有用な生細胞は、好ましくは、カプセル内に包含されている細胞に対する宿主免疫反応(体液性、及び/若しくは細胞性)を最小限にするため本来自己由来のものがよい事に注意すべきである。
本発明の生体適合性の半透膜を作るのに有用なポリマーは、限定されるものではないが、ポリ塩化ビニル、ポリフッカビニリデン、ポリウレタンイソシアネート、ポリアルギン酸、酢酸セルロース、二酢酸セルロース、トリアセチルセルロース、硝酸セルロース、ポリスルフォン、ポリスチレン、ポリウレタン、ポリビニルアルコール、、ポリアクリロニトリル、ポリアミド、ポリメチルメタクリレート、ポリエチレンオキサイド、ポリテトラフルオロエイレン等が挙げられる。さらに、有用な半透膜はそのようなポリマーの組み合わせから作ることができることも意図されている。
他の好ましい実施の態様には、カプセルの半透性中空繊維内に包含されている生細胞が、好ましくは真核細胞で、さらに好ましくは哺乳動物の細胞である。本発明で開示される器具は、もともと、予め選択された分子を産生し、分泌する細胞からなるが、遺伝子操作された細胞、即ち、予め選択された分子をコードする核酸でトランスフェクトされ、それを発現できる細胞も本発明の実施に有用であることも意図されている。
さらに他の実施の態様では、予め選択された分子とは、好ましくは、蛋白質、さらに好ましくは、例えば、エリスリポイチンやインスリンのようなホルモンがよい。しかしながら、本器具は生細胞から産生され、分泌されるいかなる分子も体循環に放出するのに使用することができることも意図されている。単一の予め選択された分子を産生し、分泌する単一細胞型が本発明で使用することができるが、複数の予め選択された分子様のものを産生し、分泌する特定の細胞型に属する細胞を本発明の実施に使用することができる事も理解される。同様に、複数の細胞型を、そこでは各細胞型に属する細胞が異なる、予め選択された分子を産生し、分泌するが、循環系へ、好ましい組み合わせの予め選択された分子を放出する器具を作るのにカプセルに配合することができる。
ある応用では、例えば、ホルモン置換治療の間に、外部刺激に反応して、予め選択された分子を産生する細胞を用いるのが好ましい。そのような制御された細胞を含有する器具は、従って、予め選択された分子の過剰生産を防ぐような必要性が生じたときに予め選択された分子を産生するが、分子によるが受容者にとっては有害であることもある。しかしながら、他の応用の間、例えば、因子VIII欠損血友病の因子VIII、因子IX欠損血友病の因子IX、α1ー抗トリプシン欠損気腫のα1ー抗トリプシンの置換治療の間、これらの予め選択された分子を組成的に産生する細胞が器具の中空繊維に包含されていることも意図されている。
ある型の貧血、例えば、末期腎臓病に起因するエリスロポイチン欠損貧血は十分な量の赤血球の産生を誘導するのに十分な量のエリスロポイチンを産生する宿主の不全の結果である。この病気の結果、患者の赤血球の量が減少し、それにより血液の酸素運搬能を低下させる。一つの好ましい実施の態様は、従って、本発明は受容者の血液の低下した酸素運搬能に反応して、エリスロポイチンを産生するエリスロポイチン産生細胞を含有する器具を提供する。本発明は、細胞の内分泌機能を効果的に認識できるように、本発明はエリスロポイチン産生細胞を血液に暴露するようにしている。従って、本発明の移植可能なエリスロポイチン産生、及び分泌器具はエリスロポイチン欠損貧血の治療に有用であることも意図されている。
さらに、例えば真性糖尿病のような、ある型の糖尿病は血流を循環しているグルコースのレベルを調整するのに十分な量のインスリンを産生する宿主の不全の結果である。他の好ましい実施の態様では、本発明は血液のグルコースのレベルに反応してインスリンを産生するインスリン産生細胞を含有する器具を提供する。従って、本発明の移植可能なインスリン産生及び分泌器具はインスリン依存性糖尿病の治療に有用であることも意図されている。
他の局面では、本発明は体循環へ予め選択された分子を放出する器具を哺乳動物の血管に経皮的に導入する方法を提供する。方法は以下のステップからなる:(a)生の血管の内部壁に、血液浸透性の素子を固定し、それが固定されたときそれを通って血液をその血管にいれ;(b)固定された素子の上流に予め選択された分子を産生及び分泌する生細胞を含有するカプセルを導入し;そして(c)カプセルを素子と接触させる。
この方法では、血液浸透性素子はカテーテルにより血管に導入される。さらに、カプセルは同様に、同じ若しくは異なるカテーテルで血管に導入することができる。そのような操作の間、血液浸透性素子及び/若しくはカプセルはカテーテルで哺乳動物の大腿静脈、若しくは頚静脈に導入され、例えば下大静脈、上大静脈、門脈、若しくは腎静脈のような生体の静脈に固定することができ、または例えば外科的に発生させた動静脈瘻から派生した静脈のような人工的な静脈に固定することができる。器具の導入及び固定の適当な部位の選択は当業者の技術の範囲内であることは意図されている。
【図面の簡単な説明】
本発明は添付する図面によりさらに詳しく説明されるが限定されるものではない:
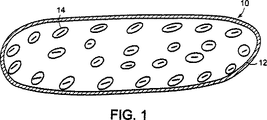
図1は本発明の実施に有用な第一細胞型含有カプセルの概要断面図である。
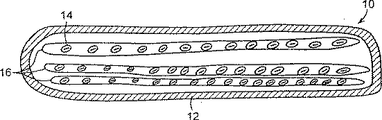
図2は本発明の実施に有用な第二細胞型含有カプセルの概要断面図である。
図3は本発明の好ましい血液浸透性素子を描いた図である。
図4は図3の素子の平面図である。
図5は生の血管に配置された本発明の器具の概要横断図である。
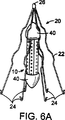
図6AからEまでは本発明の器具の好ましい実施の態様を示した図である。
図には、それぞれの図の文字のように相当する部分が示されている。
発明の詳細な説明
最も一般的な応用は、本発明は哺乳動物の体循環に予め選択された分子を放出する移植可能な器具を提供する。本発明の器具は血管へ、好ましくはカテーテルを用いて直接移植するのに適している。移植後、器具は予め選択された分子を器具から受容者の血流に拡散し、ある局面では、例えば、エリスロポイチン産生細胞の場合は酸素張力のような血液のパラメーターに反応する。
器具は受容者に移植されたときに相互に作用し合う2成分から構成される。第一成分は血液浸透性素子で、好ましくは篭様フィラメント構造で、生の血管の管腔に挿入されるような大きさのものである。所望の位置に導入されると、素子は血管の内壁のあるべきところに、一般的には素子に設けられた鈎や、かえし、などで固定される。血液浸透性の素子は、血管の内壁に固定されたとき、血管の血液がその素子を通過するように設計される。第二成分は血管の管腔に挿入されるような大きさのカプセルである。カプセルは、予め選択された分子を産生及び分泌する生細胞を含有する半透膜性の入れ物である。カプセルは血管の素子の上流に挿入される。挿入されると、カプセルは血管の中を血流に沿ってそれが固定された素子に到達するまで移動し、そこでカプセルは素子に捕捉され連動する。予め選択された分子はカプセル内に包含されている細胞により産生され、分泌されるが、細胞から分泌した後は、カプセルからカプセルを通る血液に拡散していく。予め選択された分子は血流にはいると、宿主の血管系全体に早く拡散していく。器具は正しく操作することにより血管を閉塞させない、即ち、移植された器具は血液が血管を通過するのを妨げることはない。
本発明の器具を、添付した図面を参照いてより詳細に説明するが、添付した図面は説明のためのものであって本発明の範囲を限定するものではない。図1及び2は本発明の実施に有用なカプセル10の概要図である。図1には、カプセル10が生細胞14を封入する半透膜12でできている単一中空繊維からなっている。図2には、カプセル10が生細胞14を封入する複数の半透膜中空繊維16を含有する半透膜12からなっている。半透膜12及び16は同じかまたは異なるポリマー組成物で特定できることが意図されている。そのような膜を製造するための方法や材料は以下に説明するように当業者には既知のものである。生細胞14は繊維の内部表面に付着してもよいし、しなくてもよいが、この特徴は器具に含まれる細胞の型に依存する。例えば、ある細胞型のものは固体表面に固定的に増殖し、一方他の型の細胞は非固定的に、懸濁液中で増殖する。しかしながら、細胞の型の選択は目的とする応用に依存する。
図3及び4は本発明の実施に有用な好ましい血液浸透性素子20を示している。素子20は頭部6及びそこから伸びている複数の弾力性のある脚22(代表的に金属)からなる。頭部に遠位の脚の端は標的血管の内壁に固定するように外側の方へ向いている鈎あるいはかえし24を有している。この設計に基づくそのような各種の素子は当業者には既知であるが、以下により詳細に説明する。しかしながら、例えば本明細書で開示される鳥の巣フィルターのような他の設計に基づく他の血液浸透性素子もまた本発明の実施に使用することができる。
図5は、本発明の移植可能な器具の好ましい設計配置を示す。血液浸透性素子20は生の血管の内壁32に固定される。放射状に拡がっている脚22を有する素子20の頭部26は鈎24の下流若しくは近位の血管に配置される。外側の方へ向いている脚22は、血流の方向(矢印で示されている)に素子が移動するのを防ぐように、血管30の壁に鈎24を固定させるために、バネの張力でかたよらせ、蝙蝠傘のように放射状に拡がっている。素子20の上流には生細胞含有のカプセル10がある。カプセルはカプセルに包含された細胞が生存するのに必要な酸素、グルコース、及び/若しくは他の栄養素が血流からカプセルの腔へ拡散でき、かつ、細胞の代謝物、例えば予め選択された分子や他の排泄物などがカプセルの腔から血流へ拡散できるような半透膜でできている。
図6は本発明の実施に有用と確信する各種の形態である。図6Aは末端キャップ40により一緒に保持されている一束の中空繊維からなる単一カプセル10を示す。単一カプセルは単一血液浸透性素子20の中に配置されている。鈎若しくはかえし24が血管の内壁に埋め込まれていると、カプセル10は血液浸透性素子20と接触する血液浸透性素子の上流の血管内の所定の場所に保持されている。図6Bに示されている器具の形体は、二つのカプセル10が一つの血液浸透性素子の中にあって、接触していることを除けば、本質的に図6Aと同じである。図6Cは血液浸透性素子の中で、かつ、接触して保持されている単一カプセル10を示す。血液浸透性素子20と接触しているカプセル10の部分は、生体適合性のあるゲル、例えば自己由来の凝血塊、の中に配置され、血液浸透性素子20によるカプセル10の捕捉が最適化されている。図6Dは血液浸透性素子20により所定の場所に保持されている二つのカプセル10を示す。カプセル10は鈎若しくはつなぎ鎖60により血液浸透性素子20と接触している。血液浸透性素子20の、かえし24が血管の内壁に埋め込まれていると、カプセル10は血液浸透性素子の下流に配置される。図6Eは二つの血液浸透性素子20によって所定の場所に保持されている二つのカプセルを示す。この型の形態は予め選択された分子の好ましい量を産生するのに多数の細胞が必要なときに特に有用であって、従って、多数の生細胞を収容する長いカプセルが必要となる。
血液浸透性素子
上述の如く、本発明の実施に有用な血液浸透性素子の技術は十分ある。有用な血液浸透性素子は血液を通る血流を閉塞したり、妨げることなく、血管の管腔内に固定できる能力により特徴づけられる。
本発明の実施に有用な血液浸透性素子は栓塞、若しくは血液凝固塊抗移動フィルターとして市販品として入手でき市場にでている。これらの抗移動フィルターは脈管構造内での命を脅かしうる血液凝固塊の移動を防ぐのに臨床医により通常使用されている。血液凝固塊抗移動フィルターは一般的には血管の管腔に移植され、固定されるよう設計されている。移植されると、抗移動フィルターは、血管内の血液が通過し、一方では同時に血液凝固塊を捕捉しながら通過するようになっている。
本発明の実施に有用な各種の血液凝固塊抗移動フィルターは当業者には公知で市販品として入手できる。例えば、米国特許第4、817、600号、及び第5、059、205号に開示されている現在の好ましい血液凝固塊抗移動フィルターでメリーランド州、ウオタータウン、Medi.Tech,Boston Scientific Corporationから入手できるGreenfieldTMフィルターは本発明の実施に特によく適している。円錐型GreenfieldTM静脈フィルターは血栓を捕捉した後血管の開通性を維持しながら血液凝固塊を捕捉する最大の包含面積を提供するよう設計されている。例えば、円錐の幾何学は、横断面積が64%に減少するまではその深さの80%まで充填されるようになっており、フィルターの深さの少なくとも80%はフィルターの表裏で著しい圧力勾配がないように充填することができる。Greenfield静脈フィルターの6脚の配置は3mm以上の血栓の捕捉を確実にする(Greenfield等(1989)”Venous Interruption”68章、929ー939頁、”Haimovici’s Vascular Surgery Principles and Techniques,第3版”Appleton and Lange、Norわlk,コネクチカット/サンマテオ、カリフォルニア)。従って、フィルターは直径3mm以上のカプセルを捕捉することができる。
本発明の実施に有用な他の血液凝固塊抗移動フィルターは、例えば米国特許第4、781、177号;第4、494、531号;第4、793、348号;第5、152、777号;第5、350、398号;及び第5、383、887号に開示されており、これらは参照することにより本明細書に援用する。また、Greenfield(1991)、”Vascular Suregery、A Comprehensive Review”、Moore.編、W.B.Saunders Co.,フィラデルフィア、ロンドン、トロント、モントリオール、シドニー、東京、669ー679頁等に開示されている他の血液凝固塊抗移動フィルターには、Nitinolフィルター、Guntherフィルター、Vanatechフィルター、Amplatzフィルター、及び鳥の巣フィルターなどが同様に本発明の実施に有用である。血液凝固塊抗移動フィルター固有の性質のために、即ち血管の管腔内に導入し、固定する仕様、さらに、血管に固定されると、フィルターは血管の血液をそのなかを通過させ、本発明の血液浸透性素子として望ましいものになる。しかしながら、本明細書で開示されている以外で、上述した特徴を有するが血液浸透性素子もまた、本発明の実施に有用である。
カプセル設計
本発明の移植できる薬剤放出器具は長期間、好ましくは数カ月から数年間予め選択された薬剤を放出することができる。しかしながら、消費された細胞カプセル、即ち、カプセルの中の実質的な分画の細胞が、もう既に活きていないか、あるいは予め選択された分子をもはや分泌しない状態になっているカプセルは、受容者から回収し、予め選択された分子を産生し分泌する新鮮な細胞を含有する新しいカプセルと取り替えることができることも意図されている。
カプセルは単一中空繊維(図1に示されるように)、若しくは複数の中空繊維(図2に示されている)のいずれかからなる。繊維の数は過度の実験無しで決定できる一組の変数に依存する。例えば一つの変数は器具に取り込まれた細胞の生産性にある。第一細胞型の方が第二細胞型より予め選択された分子をより多く産生する場合は、予め選択された分子を同じ量産生するためには、第一型の細胞はより少ない数でよいことが理解でされる。他の変数は、受容者に所望の治療効果を生じるのに必要な予め選択された分子の量;細胞の栄養要求性;移植後細胞が生存し続ける時間;細胞が生存性を失わずに増殖する密度等が含まれる。これらの変数を一度確立すると、細胞型及び中空繊維幾何学の賢明な選択により実務家は適当な細胞型を宿主で生存し、長期間、所望の予め選択された分子を産生するように選択することができる。
器具は長期間、予め選択された分子を放出するので、従って、重要なことは、宿主への移植後に器具に包含される細胞の生存性を維持するカプセルの開発を考えることである。例えば、カプセルの中の細胞への酸素や栄養の供給;カプセルの中の細胞からの排泄物の除去;カプセルの中の細胞に対する宿主の免疫反応の最小化;細胞の増殖活性;カプセルの中心にある細胞が圧力で壊死するかどうかなどの、1、若しくはそれ以上の因子が細胞含有カプセルの設計及び調製に影響するこが理解される。
酸素の輸送が、移植された細胞の生存性と機能を律する因子になるので、中空繊維の幾何学は、適切な酸素供給を維持するように注意して選択されなければならない。血管の管腔からカプセルに包含された細胞への酸素の輸送は、殆ど例外なく拡散によるものである。血流、若しくは血液供給から締め出された細胞の生存性を維持するために、細胞は好ましくは血液供給から約500μmの臨界的な拡散距離、より好ましくは約300μmに位置するのがよいと研究結果は示している。例えば、哺乳動物の胸大動脈の溶解酸素のレベルを酸素電極で直接測定すると、動脈壁の溶解酸素のレベルは血液管腔から約300μmのところで25mHgの最下点に近づくことがわかった(Buerk等(1982)Am.J.Physiol.243:H948−H958)。最適通気条件を確実にするために、細胞含有中空繊維は好ましくは約1000μm(1.0mm)、さらに好ましくは約500μm(0.5mm)以下の内部直径を有する。代謝活性が低く、従って酸素要求量も低い、例えば筋芽細胞のような細胞は約500μmを超える内部直径を有する中空繊維でも生存しているが、高代謝活性を示す細胞型は好ましくは約200μmの内部直径を揺する中空繊維に包含されるのがよい。予め選択された細胞型の最適カプセル直径は以下に説明されるような方法で過度の実験無しで決定することができる。
適当な通気に加えて、包含された細胞が生存するために十分な量の必須栄養素を血液供給から得ることが重要である。酸素拡散は細胞生存性を維持するのに最も重要で、従って、中空繊維の幾何学が酸素輸送に最適化されると、中空繊維は本質的に血流からカプセルの管腔に適当な量の栄養素を拡散できる。同様に、そのような幾何学は中空繊維から血流へ排泄物や予め選択された分子などの細胞代謝物の拡散をもできるようにすることが意図されている。
中空繊維は、好ましくは、一方では細胞排泄物や予め選択された分子を中空繊維から排出しながら、酸素や栄養素の中空繊維の管腔への拡散が可能な大きさの孔を有する半透膜から作成される。さらに、孔は、好ましくは、細胞がそれを通過しないような大きさのものである。従って、孔は生細胞が中空繊維の管腔から血流へ移動するのを防ぐように設計されており、それにより、必要になれば除去しやすいように移植細胞を宿主の単一の部位に維持する。孔は、また、例えばマクロファージやリンパ球のような宿主免疫細胞の流入を防ぐよう設計されている。もしそれらが中空繊維の管腔にはいるようにされていると、そこに包含されている生存細胞に有害であるからである。膜は、従って、そこに包含されている細胞を免疫反応から守るために、免疫を免除する環境を提供する。
さらに、孔は予め選択された分子が出ていくことができるのに十分な大きさのものであるが、分子量が150キロダルトンより大きな、例えば抗体やサイトカインのような分子を排除できるものが好ましいことも意図されている。宿主の抗体やサイトカインの除去は器具を宿主へ移植した後生存細胞の寿命を延ばすことも意図されている。排除する孔の大きさを好ましいものを用いた結果、中空繊維は分子量が150キロダルトンより小さい予め選択された分子の排出を許容できるように適用されることを意図されている。孔の大きさはカプセルに包含されている細胞が自己の細胞でないときには重要な考慮事項である。従って、予め選択された分子が、例えば約330キロダルトンの分子量を有する因子VIIIのような150キロダルトンを越える分子量を持っていた場合、中空繊維内に包含されている細胞は本来自原性で自己由来のものである事が理解できる。自原性、若しくは自己由来の細胞は他の起源からの細胞より、より弱い免疫反応を誘導し、その結果生存性や寿命をたかめることが意図されている。しかしながら、もし予め選択された分子が、例えば因子IX(約56キロダルトン)、α1アンチトリプシン(約52キロダルトンやエリスロポイチン(約36キロダルトン)のような、150キロダルトンより小さい分子量の場合、自原性若しくは自己由来の細胞が好ましいが、いずれの型の細胞も中空繊維内に包含させてもよいことが予測される。
カプセルを構成しまたはカプセルの内に混入される中空繊維は限定されるものではないが、ポリ塩化ビニル、ポリフッ化ビニリデン、ポリウレタンイソシアネート、ポリアルギネート、酢酸セルロース、ポリアルギン酸、二酢酸セルロース、三酢酸セルロース、硝酸セルロース、ポリスルフォン、ポリスチレン、ポリウレタン、ポリビニルアルコール、ポリアクリロニトリル、ポリアミド、ポリメチルメタクリレート、ポリエチレンオキサイド、ポリテトラフルオロエチレン、若しくはそれらのコポリマーを含む生体適合性ポリマーから作成することができる。その製造方法お呼び市販者の名前を含む、現在入手可能な中空繊維の概要には、Radovich(1995)”透析膜:構造及び予測”Contrib.Nephrol.Basel Karger、113:11ー24に示されている。これは参照することにより本発明細書に援用する。さらに、有益なポリテトラフルオロエチレンポリマー中空繊維はImpra、Inc.,Tempe,AZ、若しくはW.L.Gore & Associates、Flagstaff,AZ.から市販されている。
血流のなかで所望のレベルの予め選択された分子を産生するように十分な細胞が単一の中空繊維に移植できるとすると、本発明のカプセルは好ましくは単一中空繊維(例えば、図1)を含む。別のものとして、もし必要な数の細胞が単一の中空繊維に取り込むことができない場合、適当な数の細胞を一束の中空繊維に包含する事ができ、その一束の中空繊維はさらに第二のマクロ細孔の多孔性の外膜のなかにカプセル化することができる(例えば図2)。多孔性の外膜は、好ましくは、栄養素や細胞代謝物が細胞含有中空繊維の中へ及び外へ拡散するのに影響しないような孔を特徴とする。外膜の目的は、一束の中空繊維を一緒に保持し、酸素や栄養素の中空繊維への拡散または排泄物、即ち、二酸化炭素や予め選択された分子の中空繊維外への拡散を制限しないようにすることである。そのような形態で、通常、束の中空繊維は血液浸透性素子のカプセルにより包含できるように十分な外部直径を有する。さらに、一束の中空繊維はエンドキャップで一緒に保持することができる(例えば、図6Aのエンドキャップ40)。別のものとしては、中空繊維は例えば意図された受容者から抽出された血液から調製される自己由来の血液凝固塊のような生体適合性のゲルの中に入れることができ、それにより、血液浸透性素子により捕捉される栓を作ることができる(例えば、図6Cの栓50)。さらに、カプセルが血液浸透性素子により捕捉されるには小さすぎる場合は、鈎やかえしにより血液浸透性素子と接触させ続けることができる(例えば図6Dのかえし60)。各血液浸透素子及びカプセルにとって最適の形態は当業者により、過度な実験無しで決定することができる。
カプセルの中の細胞の生存性と性能は、カプセル及び/若しくは中空繊維の血液との接触表面上へのフィブリン、及び/若しくは血小板沈着、若しくはその周辺での血栓形成により昂進することができる。カプセル及び/若しくは中空繊維の血液との接触表面上へのフィブリン、及び/若しくは血小板沈着、若しくはその周辺での血栓形成はより大きな酸素拡散距離を生じ、それにより細胞の生存性を制限するさらに付加的な境界層を作ることが意図されている。この問題は膜の血液適合性で改善される。
この点に関しては、体循環に置かれた生物素材の血液適合性を改善する多くの方法が開発されてきた。最も、広範囲に渡って開発された方法としては、生物素材の表面に局所的な抗凝固活性を持たせるために生物素材にヘパリンを混合することが含まれる。例えば、Duraflo II ヘパリン膜(Bentley Labs.Baxter Healthcare Corporation,Irvine California)は少なくとも数日間は有効である膜表面に塗布されたヘパリン層からなる。例えば、Hsu(1991)Perfusion6:209−219;Tong等(1992)ASAIO Journal 38:M702−M706.別のものとして、ポリエチレンイミンのポリマーコーティングを生物素材の表面に沈着したり、イオン的に結合したりすることができる。例えば、ヘパリンの亜硝酸分解で調製されたヘパリン分画をPEIへヘパリンを末端接着法により化学的に共有結合させることができる(Larm等(1983)Biomat.,Med.Dev.,Art Organsll(2&3):161−173,Larsson等(1987)Ann N.Y.Acad.,Sci.516:102−115)。この方法で数カ月間有効な生物素材表面での抗凝固活性を提供できることが示された(Larson等(上述))。カプセル若しくは中空繊維の血液との接触表面のヘパリン化はフィブリン、血小板沈着及び/若しくは血栓形成を最小にすることができる。
生存性細胞
本発明の実施に各種の型の細胞を使用することができることが意図されている。細胞は好ましくは真核細胞、さらに好ましくは哺乳動物の細胞がよい。最も好ましくは、移植細胞は本来自原性のもの、即ち移植細胞は予定の受容者由来のものがよい。上述の如く、本発明の細胞は半透膜の中で免疫反応が起こらないような環境のなかに包含することができるので、例えば、予め選択された分子が150キロダルトンより小さい分子量を有する場合には、同種異系の細胞、即ち予定された受容者と同種であるが他の個体由来の細胞、若しくは外因性の細胞、即ち予定された受容者の種とは違う種由来の細胞を本発明の実施に用いることができる。
器具に取り込まれた細胞は、好ましくは、予め選択された分子を産生し分泌する、単離された細胞、樹立された細胞若しくは細胞株がよい。そのような細胞若しくは細胞株は、通常、当業者には公知の標準的な細胞培養及びスクリーニング方法で単離される。そのような従来の培養及びスクリーニング方法についての概観は、例えば、”組織培養、方法及び応用”(1973)Kruse & Paterson編、アカデミックプレス、ニューヨーク、サンフランシスコ、ロンドン;”動物細胞の培養、基礎技術マニュアル”第二版(1987)Freshney編、ウィリー・リス、ニューヨーク、チチェスター、ブリスベーン、トロント、シンガポール;”細胞生物学、実験ハンドブック”(1994)Ceis編、アカデミックプレス;そして”動物細胞増殖制御”(1985)Boyton & Leffeert編、アカデミックプレスが含まれ、その開示は参照することにより本明細書に援用される。
問題の細胞または細胞株は移植に先立って、受容者から単離され標準的な細胞培養方法で増やされのが好ましいが、予定の受容者とは異なる同種の個体から単離することができる。有用な細胞または細胞株は他の種、即ちブタ、ネズミ、ウマ、ウシ、サル、イヌ、ネコ起源から単離することができる。例えば、ドーパミンを産生し、分泌する、単離されたブタ胎児の腹側中脳細胞ヒト脳組織にパーキンソン病に関連する徴候を軽減するのに移植されているた(Lindwall等(1990)Science 575−577)
細胞は、好ましくは、環境条件によりきまる若しくは反応して予め選択された分子を産生し分泌する。実務家の細胞、若しくは細胞株の賢明な選択により各種の病気を治療する移植可能な薬剤放出器具を作ることができる。しかしながら、細胞型は治療すべき病気や徴候に依存することは理解される。例えば、エリスロポイチン欠損貧血症の治療に適切な器具を作るために、エリスロポイチン産生細胞を本発明の器具に取り込むことができる。エリスロポイチンを産生するいずれの細胞も使用できるが、最適の細胞型はその環境、即ち血流中の溶解酸素のレベルに反応してエリスロポイチンを産生し、分泌することが考えられる。例えば、溶解酸素の変数に反応してエリスロポイチンを産生し分泌する細胞が単離され、特徴づけられてきた。例えば米国特許第4、393、133号やGoldberg等(1987)Proc.Natl.Acad.Sci.USA.84:7927ー7976を参照。従って、血液の酸素運搬能2反応してエリスロポイチンを産生し、分泌するいずれの細胞、若しくは細胞株の取り込みは本発明の実施に有用である。同様に、インスリン産生細胞を含有している器具はインスリン依存性糖尿病の治療に用いることができる。そのような器具の中の、有用性を有する細胞は、受容者と同種の健康な個体、若しくは他種の、即ちブタ、ウシ、ウマ、サル等の哺乳動物起源の健康なものから単離されるのが好ましい。インスリン産生細胞とインスリン産生(ランゲルハンス)島や分散したB細胞を単離し、スクリーニング四、培養する方法は当業者に公知で徹底的に議論されている。例えば、Lacy等(1976)、Diabetes 25;585ー594;Wollheim等(1990)Methods in Enzymology 192;188−223;Wollheim等(1990)Methods in Enzymology 192:223ー235を参照。
問題の分子を産生し、分泌する天然に存在する細胞、若しくは細胞株の使用に加えて、従来の組換DNA技術により注文作りされた細胞を所望の予め選択された分子若しくはそのような組み合わせを産生し、分泌するように工学的に作ることができる。問題の予め選択された分子をコードする拡散を、操作し、増幅し、組み換える方法は当業者に既知であり、従って、詳細は本明細書には記載しない。予め選択された遺伝子を同定し、単離する方法もまたよく理解されており、本特許、及び他の文献に説明されている。
簡単に説明すると、問題の予め選択された分子をコードするDNAの産生は、種々の制限酵素を用いる公知の技術によって達成することができる。これらの技術には、DNA特異配列切断しブラント端と接着端を作る各種の制限酵素、DNAリガーゼ、DNAブラント端に接着端を酵素的に付加する事ができる技術、短い、若しくは中間の長さのオリゴヌクレオチドの組み合わせによる合成DNAの構築、cDNA合成技術、ライブラリーから適当な核酸配列を増幅するポリマラーゼ連鎖反応(PCR)技術がある。発現を達成するのに使用される細菌、哺乳動物、若しくは二三の昆虫からの各種のプロモーター配列及び他の制御DNA配列及び各種の宿主細胞もまたよく知られており入手できる。従来のトランスフェクション技術や、等しく、DNAをクローニング及びサブクローニングする従来の技術は本発明の実施に有用であり熟練した当業者には公知のものである。プラスミドや動物ウイルスを含むウイルスやバクテリオファージなどの各種のベクターを用いることができる。ベクターは、うまくトランスフェクトされた細胞に、1ファミリーのクローンがベクターの組換DNAをうまく取り込んだことを同定するのに使用できる検出可能な表現型を与える各種のマーカー遺伝子を利用する。
問題の分子をコードするDNAを得る一つの方法は、例えば、本明細書で参考文献として引用しているSambrook等編(1989)”Molecular Cloning”Coldspring Harbor Laboratories Press、NYに説明されているようなコロニーハイブリダイゼーション操作及び/または例えば,Innis等(1990)”PCR Protocols,A guide to methods and applications”Academic Pressに説明されているPCR増幅技術により核酸のライブラリーから単離することができる。これらの開示は参照することにより本明細書に援用する。問題の分子をコードする核酸が単離されたなら、発現ベクターに組み込んで蛋白質発現のための適当な宿主細胞にトランスフェクトする。有用な前核細胞としては、限定するわけではないが、大腸菌と枯草菌がある。有用な真核細胞としては、限定するわけではないが、酵母細胞、昆虫細胞、骨髄腫細胞、繊維芽細胞3T3、サル腎臓若しくはCOS細胞、チャイニーズハムスター卵巣細胞(CHO)、ミンク肺表皮細胞、ヒト包皮繊維芽細胞、ヒトグリア芽細胞、悪性上皮腫細胞がある。
ベクターには、さらに転写プロモーター、終止配列、エンハンサー配列、好ましいリボソーム結合部位配列、好ましいmRNAリーダー配列、好ましい蛋白質プロセッシング配列、好ましい蛋白質分泌のためのシグナル配列などを含む組換蛋白質の正しい発現を促進する各種の配列も含まれる。問題の遺伝子をコードするDNA配列は、阻害しうる配列を除去したり、望ましくない第2構造形成を最小限にするよう操作することができる。
工学的に作られた遺伝子の真核細胞での発現にはトランスフェクトし易く、外来DNAを安定に再配列しないようにすることができ、有効な転写、翻訳、翻訳後の修飾及び蛋白質の分泌に必要な細胞性成分を有する細胞及び細胞株が必要である。さらに、問題の遺伝子を運ぶ適切なベクターも必要である。哺乳動物の細胞にトランスフェクトするためのDNAベクターの設計は適当な転写開始、終止、及びエンハンサー配列及びKozakコンセンサス配列のような翻訳効率を昂進する配列などを含む本明細書で開示されている問題の遺伝子の発現を促進する適当な配列が含まれる。好ましいDNAベクターはマーカー遺伝子と問題の遺伝子のコピー数を増幅する手段を含有する。有用な細胞、蛋白質発現プロモーター配列、マーカー遺伝子、遺伝子増幅方法を含む哺乳動物細胞での外来蛋白質の生産技術に関する詳細な解説はBending(1988)Genetic Engineerring 7:91ー127に開示されている。
予め選択された分子の哺乳動物細胞発現に用いられる各種の細胞、細胞株およびDNA配列は当業者によく特徴づけられ、容易に入手できる。他のプロモーター、選択可能なマーカー遺伝子増幅法、及び細胞は本発明の蛋白質を発現させるのに用いることができる。トランスフェクション及び発現プロトコールは当業者によく開示され、当業者の通常の技術力を有するひとに理解される。哺乳動物細胞発現系での外来遺伝子の組換生産に使用される各ステップの各種技術的局面の更なる詳細については、例えば、F.M.Ausubel等、編、”Current Protocls in Molecular Biology”、JohnWiley & Sons、New York(1989)等の多くの当業者のテキストや実験マニュアルに見つけることができる。
例えば、有用な因子VIII産生細胞は従来の組換DNA及び細胞培養技術を用いて調製し、貧血症Aの治療に用いることができる。例えば、研究者は齧歯類及びヒトの細胞(プライマリー細胞及び樹立した細胞株)で因子VIIIのcDNAを移動させるMFGレトロウイルスベクター系を開発した。その細胞は高レベルの因子VIII生産を示し、因子VIII分泌細胞を免疫欠損マウスに移動させ血漿中に著しいレベルの因子VIIIを産生する。例えば、本明細書で参考文献として開示されているDwarki等(1995)Proc.Natl.Acad.Sci.USA.92:1023ー1027を参照。同様に、因子IX産生細胞は調製でき、貧血症Bの治療に使用できる。研究者らはレトロウイルスベクターをヒト、若しくはイヌ因子IXcDNAを培養マウスプライマリー筋芽細胞、イヌ筋芽細胞及び樹立マウス筋芽細胞株に導入するのに使用した。全てのケースで、結果的に安定にトランスフェクトした細胞は培養で、生物学的に活性な因子IXを産生し、検出可能な量を分化の前では培地に、分化の後では筋管に分泌した。Roman等(1992)Somatic Cell and Molecular Genetics 18:247ー248;Yao等(1992)Proc.Natl.Acad.Sci.USA 89:3357−3361;Yao等(1994)Gene Therapy 1:99ー107を参照。
さらにα1−抗トリプシン産生細胞を調製し、気腫の治療にしよすることができる。例えば、レトロウイルスベクターは、それにより、ヒトα1−抗トリプシンを産生し分泌するマウス繊維芽細胞のクローン化集団を作るために、ヒトα1−抗トリプシンcDNAをマウス繊維芽細胞のゲノムに挿入するのに使用される。例えば,Garver等(1987)Science 237:762ー764を参照。同様に実験動物の肝臓から取り出した肝細胞をα1ー抗トリプシンDNA含有レトロウイルスベクターでトランスフェクトし修飾する。結果としてできた肝細胞は受容者の門脈循環に注入すると検出可能なα1−抗トリプシンを1カ月まで産生し、分泌する。例えば,Crystel(1992)Am.J.Med.92(Suppl 6A)6A 445−6A 525;及びKan等(1992)Proc.Natl.Acad.Sci.USA 89:89ー93を参照。
さらに、組換エリスロポイチン産生細胞は調製され、エリスロポイチン欠損貧血の治療に使用できる。例えば、1.34キロベースのヒトエリスロポイチンcDNAを運搬する筋芽細胞クローンは高レベルのヒトエリスロポイチンを産生し、分泌する。そして、マウスモデルに移したときに、少なくとも12週間ヘマトクリット値を増加させるのに有効であった。Hamamori等(1995)J.Clin.Invest.95:1808ー1813を参照。この開示は参照することにより本明細書に援用する。
さらに、以下のようなことが意図されている、即ち、アルドラーゼBを発現及び分泌することができる細胞を遺伝的果糖不耐症の治療に使用することができる;グルコースー6ーリン酸産生細胞はタイプI糖原病の治療に使用することができる;酸αーグリコシダーゼ産生細胞はタイプII糖原病の治療に使用することができる;アミロー1、6ーグリコシダーゼ産生細胞はタイプIII糖原病の治療に有用である;筋フォスフォリラーゼはタイプIV糖原病の治療に有用である;ガラクトースー1ーリン酸・ウリジル・トランスフェラーゼ産生細胞はガラクトース血症の治療に有用である;フェニルアラニンヒドロキシラーゼはフェニルケトン尿症の治療に有用である;チロシンアミノトランスフェラーゼ産生細胞はチロシン血症の治療に有用である;アデノシンデアミナーゼ産生細胞は併発免疫欠損病の治療に有用である;フォルボリノーゲン・デアミナーゼ及びUROデカルボキシラーゼ産生細胞はポルフィリン症の治療に有用である;αイズロニダーゼ及びイズロン酸スルファターゼ産生細胞はムコ多糖症に有用である;スフィンゴミエリニダーゼ産生細胞はニーマンピック病の治療に有効である;グルコセレブロシダーゼ産生細胞はゴーシャー症候の治療に有用である;αーガラクトシダーゼ産生細胞はファブリー病の治療に有用である。フォン・ウィリブランド因子産生細胞はフォン・ウイリブランド病の治療に有用である;抗トロンビン産生細胞は抗トロンビン欠損症の治療に有用である。上述の全ての細胞及び細胞型は従来の組換DNA技術及び同様に従来の細胞培養技術を用いて調製することができる。上述の例はいずれにしても限定するものではなく、特定の状況と関連する徴候を軽減するのに有用な予め選択された分子を産生し、分泌するいずれの細胞、若しくは細胞株も一度単離され調製されれば本発明に実施に使用することができる。
予め選択された分子の発現のための終わりから2番目の発現媒体は真核細胞、哺乳動物起源のものが最も好ましい。真核細胞は外部刺激に反応して予め選択された分子を産生し、分泌する制御された細胞の開発にはより適切である。しかしながら、例えば、制御メカニズムが不要で予め選択された分子が継続的に生産されるような、特定の状況下では、工学的に作られた前核細胞も本発明の実施に有用である。
例えば、ポリスルフォン中空繊維を使用している間のように、特定の状況下では、器具上に、若しくはその周辺に血栓の形成、若しくは捕捉は器具周辺の血液の流れ及び/若しくは、中空繊維へ、または中空繊維からの栄養素、若しくは代謝物の拡散に影響を与える。これらの状況下では、例えば、組織プラスミン活性化因子、ストレプトキナーゼ、ウロキナーゼ、ヒルジン等のような抗凝固物質を産生し、分泌する細胞型は中空繊維の中に包含されることが意図されている。従って、当業者は、他の治療蛋白質に加えてそれ自身、若しくは一緒に抗凝固物質を産生する細胞を含有する器具を作ることができる。
例として、抗凝固蛋白質ヒルジンをコードする遺伝子を従来の遺伝子運搬技術で導入することができる。内皮細胞による局所的なヒルジン産生は血管部位に血栓ができるのを防ぐのに、特に魅力的である。研究により、ヒルジンはin vivoで有効な抗凝固物質であり、動脈損傷に続いて起こる実験動物モデルの血栓形成についてはヘパリンより優れている(Haskel等(1991)Circulation 83:1048−1056;Heras等(1990)Circulation 82:1476−1484)。例えば、ヒルジンをコードしている遺伝子は標準的なPCRプロトコルで単離し、例えばpMFG Moloneyマウス白血病腫瘍ウイルス(Dranoff等(1988)Proc.Natl.Acad.Sci.USA 90:3539ー3542)のフォン・ウイルブランド因子(vWF)のシグナル配列をコードする核酸配列の下流のようなレトロウイルスベクターに結合することができる。ベクターは、次に、φークリップ、両栄養性の複製欠損の組換レトロウイルスに導入される(Danos等(1988)Proc.Natl.Acad.Sci.USA 85:6460ー6464)。内皮細胞、即ちウサギ内皮細胞若しくはヒト臍静脈内皮細胞、を組換レトロウイルスで感染させ、ヒルジン遺伝子を内皮細胞のゲノムに運搬する結果となる。感染した内皮細胞は次に継続的に組み換えヒルジン遺伝子産物を産生し、分泌する。
カプセルの調製
予め選択された分子を産生し、分泌する適当な細胞及び細胞株が一度単離され、調製されると、細胞及び細胞株はその後カプセルを作るのに使用される中空繊維で培養される。細胞を中空繊維に導入し、細胞をそこで培養する好ましい方法は、市販のバイオリアクターによることができる。市販で入手できるバイオリアクターの製造者のリストは、“Genetic Engineering News”2月1日、1995年に示されている。本発明の実施に有用な好ましいバイオリアクターは、カリフォルニア州Setec.LivemoreからのTricetricTM及びMabMaxTMバイオリアクター,マサチューセッツ州ミルフォードのUnisyn TechnologiesからのCell−PharmTM,Micro MouseTM、メリーランド州、ジャーマンタウン、Cellco,Inc.からのCellmaxTMQuad及びマサチューセッツ州ビバリー、Amicon,Inc.,W.R.Grace & Co.,からのVitafiberII中空繊維細胞培養システムなどがある。
一般的に、細胞培養培地で予め選択された分子を産生し、分泌する細胞の懸濁液をバイオリアクターの中に細胞含有培地をバイオリアクターの中空繊維に注入することにより播種する。このステップで中空繊維の中に細胞が捕捉されることになる。その後、細胞を製造指針に従って特定の細胞型の最適培養条件下で培養する。
得られた中空繊維は、次に、単一中空繊維、若しくは一束の中空繊維として血液浸透性素子と一緒に受容者の血管に移植することができる。移植の方法は以下に説明されている。
器具の移植
本発明の器具は好ましくは宿主の血管に非外科的に、若しくは侵襲性を最小限にした外科的方法で挿入される。より詳細には、本発明の器具は血管へ血液凝固塊抗移動フィルターを移植するときに開発された各種のカテーテルを基礎にした器具により導入される。
例えば、米国特許第5、147、379号及び第3、952、747号及び国際特許出願番号PCT/US92/08366号には受容者の血管に血液凝固塊抗移動フィルターを移植するためのカテーテルを基礎にした器具と方法について開示されている。一般的には、カテーテルを基礎にしたフィルター挿入器具は血液凝固塊抗移動フィルターを折りたたんだコンパクトな状態で支えるキャリア;射出メカニズムは通常予め選択された部位にフィルターを射出するためのキャリアの中に配置され;予め選択された位置に血管に沿ってキャリアを進めるキャリアに長い、フレキシブルなチューブからなる。血管の中の好ましい位置に一度導入されると、フィルターはキャリアから射出される。自動的に開き移植されるフィルターを用いると、フィルターは簡単にキャリアから射出され、そこで血管壁にそれ自身を固定する。しかしながら、マニュアルで開き、固定するフィルターを用いると、挿入器具は、そのような開き、固定するステップを効果的にするための付加的な手段を含む。しかしながら、熟練した実務家であれば、フィルターの製造会社により推薦されているフィルター挿入器具や方法を使用して市販で入手できる血液凝固塊抗移動フィルターを挿入する事も意図されている。
例えば、好ましい実施の態様では、本発明の器具は、米国特許第4、817、600号及び第5、059、205号に開示されているもののような、Boston Scientific Corp.,ウオタータウン、マサチューセッツ州の,Medi−techTMから市販で入手でき、Greenfield大静脈フィルターとして知られているフィルター素子からなる。Greenfieldフィルターは導入カテーテルに予め装填されたものが購入できる。従って、フィルターと一緒に提供されるMediーtechの「使用説明書」に従って、米国特許第4、817、600号及び第5、059、205号に開示されているようなフィルター素子を外科医が移植するのを意図されている。従って,Mediーtechの「使用説明書」は以下に説明する。
簡単にいうと、フィルターは、一般的には、経皮的穿刺により内部頚静脈、若しくは大腿静脈を通じて挿入される。経皮的挿入の間に、従来の大静脈造影の後、頚静脈、若しくは大腿静脈のいずれかが針で穿刺され、導線がその針を通して血管に挿入される。その後、シースと拡張器を合体したものを導線を通じて静脈に、シースの端が移植部位を越えるまで挿入する。シースをそこに保持しながら、シースを後ろに放して、拡張器と導線を除去する。シースはフィルターを保持しているキャリアを含有している導入カテーテルの挿入を許容する通路としての役割りを果たす。導入カテーテルを挿入する間に起こるかも知れないシース内での血栓形成を防ぐために滅菌ヘパリン化食塩水でシースを洗浄する。導入カテーテルはフィルターキャリアカプセルの先端が移植部位の隣に来るまでシースの中へ進ませるが、その端を越えてはいけない。その後、シースはキャリアカプセルが完全に暴露されるまで導入カテーテルの上に後退させる。そして、フィルターを押し手メカニズムで、キャリアカプセルから押し出す。そこではフィルターの脚が外側にはねていて、フィルターをそれによりあるべきところに固定している血管の内壁にかみ合っている。一度フィルターが血管に射出され、固定されると、生細胞を同様に含有している1以上のカプセルが同じカテーテル経由で固定されているフィルターの上流の位置の血管に導入される。その後、導入カテーテルがシースを通じて血管から除去される。導入カテーテルが除去されると、シースも除去され、穿刺部位をホメオスタシスが達成されるまで圧迫する。
しかしながら、体循環の中の器具の好ましい移植場所は器具を用いる目的に依存する。例えば、ある場合には、器具を大腿静脈、若しくは頚静脈を通して導入し、下大静脈、上大静脈、門静脈、若しくは腎静脈等のような生体内の静脈の中に血液浸透性器具を固定するのが望ましいことが意図されている。また別のものとして、本発明の器具は外科的に開発された動静脈フィステルから開発された静脈のような人工静脈に固定することもできる。
しかしながら、もし器具がホルモン置換治療に使用されるものであれば、外科医は予め選択された分子を産生する本来の部位の下流の位置に器具を移植する事を選択する。例えば、α1ー抗トリプシンは一般的には肝実質細胞で産生される;従って、本発明のα1ー抗トリプシン産生器具を例えば肝静脈のような肝臓の下流に導入し固定するのが望ましい。さらには、上述の如く、インスリンは膵臓β細胞で産生される;従って、本発明のインスリン産生器具を膵臓の下流の門静脈に固定するのが望ましい。
しかしながら、臨床状況を基礎にして、外科医はケース毎に、器具を導入する最適モード及び器具を固定する最適位置を決定することができる。そのような判断は熟練した当業者の技術範囲と考えられる。
本発明の実施について、以下の実施例からさらに詳しく理解できるであろう。これらは単なる例示であっていずれにしても発明を限定するものではない。
実施例1.エリスロポイチン産生細胞の培養での増殖
エリスロポイチンは腎臓の特別の細胞で産生され、それらの特別の細胞への酸素供給が落ちたときに循環系へ放出されるホルモンである。赤血球量の低下による低酸素血症条件下では、組織への酸素供給の低下が起こる。次に、溶解酸素量の低下が特別の腎臓細胞のエリスロポイチン産生増加を誘導し、それにより、赤血球の産生増加を促進する。正常な血液中の酸素状態か赤血球の増加により正常な酸素供給に戻ると、エリスロポイチンの昂進していた産生が抑制され、本来のフィードバック回路は閉じる。エリスロポイチンは赤血球量のホメオスターシスに必須であるが、例えば、慢性腎不全、リウマチ関節炎、自己免疫疾患、慢性感染症、ヒト免疫不全症候群及び癌等の多くの慢性病で欠損している。
エリスロポイチンは165のアミノ酸の鎖長を有するペプチドからなる36キロダルトンの糖蛋白質である(Miyake等(1977)J.Biol.Chem.252:5558−5564)。エリスロポイチンの遺伝子がクローン化され、チャイニーズハムスター卵巣細胞にトランスフェクトされ、活性エリスロポイチンを産生するよう発現された(Lin等(1985)Proc.Natl.Acad.Sci.USA 82:7580ー7585)。研究者達は、Hep G2と呼ばれるヒトヘパトーマ由来の細胞株を単離し、引き続き、培地の酸素張力の変化に対応してエリスロポイチンを産生分泌することが分かった(Goldberg等(1987)Proc.Natl.Acad.Sci.USA 84:7972ー7976)。Hep G2細胞株は前に引用している米国特許第4、393、133号に説明されており、American Type Culture Collection(ATCC)ロックビル、メリーランド州を通して、問い合わせ番号ATCCHB8065で入手できる。
酸素欠乏を示すために、エリスロポイチン産生Hep G2細胞を細胞培養皿に播種し10%ウシ胎児血清加RPMI1640培地で37℃の温度で5%炭酸ガスの湿潤な雰囲気で増殖した。培養3〜5日後、培地に溶解している酸素のレベルを酸素供給の酸素含量を変えて調節した。酸素十分な基礎的な条件下で、空気供給の組成は約21%酸素、5%炭酸ガス、及び74%の窒素であった。酸素欠乏条件下の空気供給の組成は約1ー2%酸素、5%炭酸ガス、93ー94%窒素であった。
3日間インキュベーションの後、エリスロポイチンの産生はR&Dシステム社からのQuantikineTMIVDTMエリスロポイチンイムノアッセーキットを利用して、酸素十分、及び酸素欠乏条件下で測定された。アッセーは製造元の指示に従って行われた。
酸素十分な条件下では、Hep G2細胞は、24時間で、約20mUのエリスロポイチン/106細胞を産生した。酸素欠乏条件下では、枝りす路歩チン産生レベルは同じ時間で妬く100−200mU/106細胞まで増加した。
実施例2.中空繊維でのエリスロポイチン産生細胞の増殖
例えば末期腎臓病患者のような、エリスロポイチン欠乏貧血患者は1週間に約10、000単位の組換ヒトエリスロポイチンを必要とする(”Proceedings from ESRD Patient Management:Strategies for Meeitng the Clinical and Economic Challenges”、Nissenson編(1993)Am.J.Kid.Diseases 22(1)補)。従って、平均的な患者は一日約1000単位のエリスロポイチンを必要とすると推定されている。さらに、刺激された条件では、Hep G2は24時間にわたって200ミリ単位/106細胞産生すると仮定すると、約109の細胞がそのような患者では適当なヘマトクリット値を維持するのに十分エリスロポイチンを産生することができると推定される。
本発明の細胞は中空繊維で供給されるので、本実験の目的はエリスロポイチン産生細胞が中空繊維の中で細胞生存性、及びエリスロポイチン産生を落とさずに増殖することができることを示すことにある。
エリスロポイチン産生Hep G2細胞(約4.5 x 107/ml)を中空繊維、特にポリスルフォン中空繊維(W.R.Grace and Assosiates)及び酢酸セルロース(Cellco,Inc.)、それらは分子量50キロダルトンカットオフで内部直径が210、350、若しくは510μmのものであるが、そこに播種された。中空繊維は以前にラミニン若しくはコラーゲンタイプIVでライン化されていた。これらの実験で使用される膜は分子量が50キロダルトンより低い溶質が中空繊維から、及び培地へ通過できるような孔の大きさを有している。従って、孔の大きさはエリスロポイチン(36キロダルトン)が中空繊維から周辺の培地へ拡散することができ、一方、同時にHep G2細胞が中空繊維から移動するのを防いでいる。播種後、中空繊維を10%ウシ胎児血清加RPMI1640培地に入れて、細胞を2〜3週間37℃良酸素条件下(21%酸素)で増殖した。
培養2〜3週間後、培地に分泌したエリスロポイチン量は実施例1で説明してあるように分析された。さらに、中空繊維は培地から取り除かれ中空繊維に細胞壊死があるかどうかと、中空繊維の微小環境内に組換エリスロポイチンをコードする細胞性mRNAの分布を調べる病理学的検査のために固定した。細胞の病理は標準的な病理学的技術を用いて分析され、エリスロポイチンの細胞性mRNAは標準的なin situハイブリダイゼーションで調べられた(“In Situ Hybridization Histochemistry”(1990)Chesslet,ed., CRC Press,Boca Raton,Ann Arbor,Boston)。
内部直径が210μmの中空繊維の中で増殖したHep G2細胞は、酸素核酸の臨界的距離が、細胞が培地から十分な酸素と栄養素をとれるのに十分小さかったので、明らかに生存性を維持していた。しかしながら、直径が350μmの繊維で増殖したHep G2細胞は中空繊維の中心で壊死がみられた。従って、中空繊維の中間の細胞は、あまりにも密度が高く、周辺の培地から十分な栄養素と酸素を得ることができなかったことは明らかである。内部直径が510μmの中空繊維で増殖したHep G2細胞は壊死はしていなかったが、中空繊維の内壁に付着していた細胞層は約150μmの厚さであった。この距離は十分な栄養素と酸素がHep G2細胞の生存性を維持するために拡散することができる距離と相関することが分かる。従って、内部直径が510μmの中空繊維は、酸素と栄養素のレベルが限界になるまで細胞が増殖することができるので、Hep G2細胞含有器具の開発には有用である。
実施例3.中空繊維でのHep G2細胞のエリスロポイチン産生の酸素制御
この実験の目的はエリスロポイチン遺伝子発現と蛋白質産生を中空繊維周辺の培地の酸素張力により制御することができることを示すためである。この実験はエリスロポイチン産生速度が培地に溶解している酸素の濃度とともに以下に変化していくかを測定するために単一、若しくは束の中空繊維を用いて行うことができる。
直径の異なる単一、若しくは束の中空繊維、例えば210μm,若しくは510μmのコラーゲン処理してあるポリスルフォン中空繊維(Fresenius,USA、ウオルナットクリーク、カリフォルニア州、製で約50キロダルトンの分子量をカットオフする)にHep G2細胞を播種し、実施例2で決定されたような最適条件下で増殖させる。細胞がコンフルエントになった後、周辺の増殖培地の酸素濃度は空気供給の酸素濃度を変えるとにより調整された。空気供給の組成は21%、5%、3%、2%、若しくは1%の酸素濃度により調整される。24時間後に、培地に分泌されたヒトエリスロポイチンの量を実施例1に開示されている方法を用いて測定する。
各中空繊維の細胞は細胞生存性が周辺培地内の低酸素条件下で維持され得るかどうかを測定するために細胞生存性を分析される。さらに、中空繊維の中心の細胞が固定され、中心のまわりのエリスロポイチンmRNAレベルが実施例2で用いられている標準的なin situハイブリダイゼーションで測定される。
実施例4.エリスロポイチン産生細胞の生体内移植
この実験の目的はHep G2細胞含有中空繊維の動物の体循環への移植の後にHep G2細胞の生存性を測定することにある。
実験用イヌをケタミンで麻酔する。麻酔されている間に、米国特許第5、059、205号に開示されているようにX線透視誘導装置によりチタニウムGreenfieldTM大静脈フィルターを大腿静脈にカテーテルで導入する。フィルターを下大静脈のなかに、X線透視で決定された正しい配置にしてフィルターを挿入器具から射出する。一度放出されると、フィルターの脚の鈎がフィルターを大静脈壁に固定する。
実施例3で見つけられた最適条件に従って調製されるHep G2細胞含有中空繊維が、固定されたGreenfield大静脈フィルターの上流に静脈内に移植するために調製される。中空繊維は宿主動物から除去された血液から作られるフィブリン血液凝固塊のなかに入れることにより射出用に調製される。さらに、従来の放射線不透過性のプラチナ標識を繊維の適切な位置を確認し、動物を殺した後に繊維を回収するのに役立つように中空繊維の中にいれる。その後、フィブリン凝固塊含有中空繊維を固定されたGreenfieldTM大静脈フィルターの上流に静脈内カテーテルを通して投与する。フィブリン凝固塊含有中空繊維は下大静脈のあるべきところにフィルターにより捕捉され維持される。
それから、フィルター挿入器具は動物から除去され、動物は麻酔から回復する。動物は次に移植後時間間隔を変えながら観察される。術後約2週間から約6カ月までの間に、動物が殺され中空繊維が細胞生存性のために回収される。さらに、中空繊維のいろいろな微小環境でのエリスロポイチンmRNAの量を実施例1で開示されている方法を用いてin situハイブリダイゼーションにより測定される。
カプセル内の移植された細胞は生存性を維持し、検出可能なレベルのエリスロポイチンの細胞性mRNAが移植細胞内で産生されることが予測できる。
実施例5.エリスロポイチン産生細胞のエリスロポイチン欠損貧血症の動物への移植
この実験の目的は生存性を有するHep G2細胞を含有する本発明の器具が動物への移植の後にエリスロポイチン欠損貧血症と関連する徴候を軽減するかどうかを測定するためである。
実験用イヌ(1及び2/3腎臓摘出イヌ)をケタミンで麻酔する。麻酔されている間に、X線透視誘導装置によりチタンGreenfieldTM大静脈フィルターをカテーテルにより大腿静脈経由で下大静脈に挿入する。フィルターが下大静脈内にX線透視により決定された正しい配置にされると、フィルターを挿入器具から射出し下大静脈壁に固定する。
それから、実施例4で見つけられた最適条件に従って調製されたHep G2細胞含有中空繊維が固定されたGreenfieldTM大静脈フィルターの上流に静脈内移植のために調製される。中空繊維は宿主動物から除去された血液から作られるフィブリン血液凝固塊のなかに入れることにより射出用に調製される。さらに、従来の放射線不透過性のプラチナ標識を繊維の適切な位置を確認し、動物を殺した後に繊維を回収するのに役立つように中空繊維の中にいれる。その後、フィブリン凝固塊含有中空繊維を固定されたGreenfield大静脈フィルターの上流に静脈内カテーテルを通して投与する。フィブリン凝固塊含有中空繊維は下大静脈の所定の場所でフィルターにより捕捉され維持される。
それから、フィルター挿入器具は動物から除去され、動物は麻酔から回復する。その後、ヘマトクリット及びエリスロポイチンの値を移植後時間間隔を変えながら観察される。術後約2週間から約6カ月までの間に、動物が殺され中空繊維が細胞生存性のために回収される。さらに、中空繊維のいろいろな微小環境でのエリスロポイチンmRNAの量を実施例1で開示されている方法を用いてin situハイブリダイゼーションにより測定される。細胞を含有しない器具を腎臓摘出イヌに移植したものと、細胞含有器具を正常なイヌに移植した対照実験が行われる。
本発明のエリスロポイチン産生器具を移植された腎臓摘出イヌは、細胞を含有しない器具で処置された腎臓摘出イヌと比較して、エリスロポイチン、及びヘマトクリット値が上昇し、ホメオスタシスの維持を示した。さらに、腎臓摘出していないイヌより腎臓摘出したイヌへ移植した細胞の方がエリスロポイチンの細胞性mRNAレベルが高くなるであろうことが意図されている。
実施例6.インスリン産生細胞の単離及び培養
インスリンはジスルフィド結合で結合している2本のペプチド鎖からなる5.8キロダルトンのペプチドホルモンである。インスリンは血流の中を循環しているグルコースのレベルに反応して、膵臓にある特別の細胞(ランゲルハンス島のβ細胞)により産生される。グルコースの高いレベルに反応して、インスリンは肝臓や筋肉内でグリコーゲン合成が促進されることにより産生される。哺乳動物が正常血糖を維持するのに十分な量のインスリンを産生できないと、糖尿病の状態になり、現在までのところ、外部で調製したインスリンの非経口投与により調整されてきている。
ランゲルハンス島及びβ細胞を単離し、培養する方法については、完全に文献に記載されている。例えば、Lacy等(1976)Diabetes25:484−493;Wollheim等(1990)Methods inEnzymology 192:188ー223;Wollheim等(1990)Methods in Enzymology 192:223ー235などを参照。
例えば、コラゲナーゼを基礎にした方法では、コラーゲンで予め処理された膵臓組織を供与側の哺乳動物から摘除する。コラゲナーゼ処理後、ランゲルハンス島を約400μmのメッシュの孔を有するフィルターを通し、細胞を通った細片をHanks−HEPESーウシ血清アルブミン緩衝液を含有している試験管に収穫する。それから、その細片をHistopaque1077含有グラージェントで密度勾配遠心分離で他の細胞から分離する。島は収穫されHank’s−HEPESーBSA含有の細胞培養皿に移される。再懸濁時に解剖用顕微鏡の助けを借りて、島をシリコン化されたパスツールピペットでつまみ上げ,Hanks溶液を含有する遠心管に移す。島を遠心分離で収穫し抗生物質、及び10%ウシ胎児血清加RPMI1640組織培養培地に再懸濁し、5%炭酸ガス含有する雰囲気下で、37℃でインキュベートする。
5日間のインキュベーションの後、培地へのインスリン分泌のレベルをSigma Chemical Co.,セントルイス、ミズリー州、より供給されたシグマ製品番号I8510の使用のためのラジオイムノアッセー操作法”Sigma Immuno−file”を用いて測定する。
実施例7.中空繊維の中でのインスリン産生細胞の増殖
島細胞を膵臓に移植したイヌを用いて、約2x105の島細胞が20kgのイヌの内分泌機能を維持することを決定した。キロ当たり104の島細胞を仮定すると、50kgのヒトは内分泌機能を維持するのに約105の島細胞が必要だろうことが推定できる。内部直径が250μmの中空繊維が本発明の器具に使用され、さらに、直径200μmの島の細片が単離されたと仮定すると、約250の島が5cmの中空繊維に挿入されることができることが推定される。従って、1000ものそのような繊維は約2.5x105の島を含有する器具となるであろう。
本発明の細胞は中空繊維に入れて供給されるので、この実験の目的は、インスリン産生島細胞が中空繊維の中で細胞生存性やインスリン産生を落とすことなく増殖できるかどうかを測定するためにある。
実施例6で単離された約200の島細胞が中空繊維、特に、分子量50キロダルトンのカットオフで内部直径が210、350、若しくは510μmのポリスルフォン中空繊維や酢酸セルロースがよいが、に播種される。この実験に使用される膜は分子量が50キロダルトン以下の溶質を通過させ従ってインスリンはそれを通り、同時に、中空繊維からの島の移動を防いでいる孔の大きさを有する。210μmの中空繊維に導入できるよう十分小さい島を産生するために、コラゲナーゼ処理により作られた島は約190μmの孔の大きさを有するフィルターで濾過されることは留意すべきである。播種後、中空繊維は10%ウシ胎児血清加RPMI1640培地に置かれ、2〜3週間、37℃で増殖させる。
培養2〜3週間後、培地中に分泌されるインスリンの量を実施例6に記載されているように分析する。さらに、中空繊維を培地から取り除き中空繊維の中での生存性、及び中空繊維の各微小環境での細胞性インスリン蛋白質のレベルの分布を測定する病理学的検査のために固定する。島の病理は標準的な病理学的な方法を用いて分析され、細胞性インスリン蛋白質のレベルは標準的な免疫病理学的な操作で測定できる(例えば、”Immunocytochemistry、Practical Applications in Pathology and Biology”Polak & Van Noorden編(1983)Wright PSG,ブリストル、ロンドン、ボストン、及び”Immunochemical Methods in Cell and Molecular Biology”Mayer & Walker、編(1983)Academic Press、ロンドン、サンディエゴ、ニューヨーク、ボストン、シドニー、東京、トロント、などを参照)。
中空繊維に包含された島細胞は生存性を維持し検出可能なレベルのインスリンを産生することが意図されている。
実施例8.中空繊維の島によるインスリン産生のグルコース制御
この実験の目的は、インスリン産生が中空繊維の周辺の培地のグルコースのレベルによって制御できることを示すものである。この実験は単一、若しくは束の中空繊維を用いて、インスリン産生速度が培地のグルコースレベルに関連して変化するのを測定するために行われる。
例えば210μm,若しくは510μm(コラーゲン処理されたポリスルフォン中空繊維(W.R.Grace & Associates)及び酢酸セルロース中空繊維(Cellco,Inc.)のように直径の異なる、分子量約20〜50キロダルトンカットオフ)の単一、若しくは束の中空繊維に島を播種し、実施例7で決定された最適条件下で増殖させる。培養7日後、培地をグルコース濃度が約100と約500mg/dlになるようグルコースを加えた新しい培地で置換した。24時間後培地に分泌したインスリンの量を実施例6で開示されている方法を利用して測定する。
各中空繊維の島は細胞生存性がin vivo条件と類似しているところで維持されているかどうかを測定するために細胞依存性を分析する。さらに、中空繊維の中心部の細胞は固定され、中心部のインスリン蛋白質レベルを実施例7で開示されているように標準的な免疫化学的方法により測定される。
このような実験を利用して、細胞の生存性やインスリンの産生をどれだけの島が導入できるのか、どのくらいの中空繊維が所望のインスリンを産生する本発明の器具に用いられなければならないのかを測定することができることは予測できる。単一でも束の中空繊維構成物でもスケールアップが島のグルコース依存性インスリン産生に影響するかどうか測定するために試験される。
実施例9.生体内でのインスリン産生細胞の移植
この実験の目的はそのような細胞を含有する中空繊維を動物の体循環に移植した後、島細胞の生存性を測定することにある。
実験用イヌをケタミンで麻酔する。麻酔されている間に、米国特許第5、059、205号に開示されているようにX線透視誘導装置によりチタニウムGreenfieldTM大静脈フィルターを大腿静脈にカテーテルで導入する。フィルターを下大静脈のなかに、X線透視で決定された正しい配置にしてフィルターを挿入器具から射出する。一度放出されると、フィルターの脚の鈎がフィルターを大静脈壁に固定する。
実施例8で見つけられた最適条件に従って調製される島細胞含有中空繊維が、固定されたGreenfieldTM大静脈フィルターに静脈内投与及び移植するために調製される。中空繊維は宿主動物から除去された血液から作られるフィブリン血液凝固塊のなかに入れることにより射出用に調製される。さらに、従来の放射線不透過性のプラチナ標識を繊維の適切な位置を確認し、動物を殺した後に繊維を回収するのに役立つように中空繊維の中にいれる。その後、フィブリン凝固塊含有中空繊維を固定されたGreenfield大静脈フィルターの上流に静脈内カテーテルを通して投与する。フィブリン凝固塊含有中空繊維は下大静脈のあるべきところにフィルターにより捕捉され維持される。
それから、フィルター挿入器具は動物から除去され、動物は麻酔から回復する。動物は次に移植後時間間隔を変えながら観察される。術後約2週間から約6カ月までの間に、動物が殺され中空繊維が細胞生存性のために回収される。さらに、中空繊維の中でのいろいろな微小環境でのインスリン蛋白質産生のレベルが免疫化学的方法で分析される。
カプセルに包含されている移植された島細胞は生存性を維持し、移植細胞内で検出可能なレベルの細胞性インスリン産生があることが予測される。
実施例10.インスリン欠損性糖尿病の動物でのインスリン産生細胞の移植
この実験の目的は生存島細胞を含有する本発明の器具が、動物へ移植された後、インスリン欠損性真性糖尿病と関連する徴候を軽減するかどうかを測定することである。
実験用イヌ(膵臓摘出されている)をケタミンで麻酔する。麻酔されている間に、米国特許第5、059、205号に開示されているようにX線透視誘導装置によりチタニウムGreenfield大静脈フィルターを大腿静脈にカテーテルで導入する。フィルターを下大静脈のなかに、X線透視で決定された正しい配置にしてフィルターを挿入器具から射出する。一度放出されると、フィルターの脚の鈎がフィルターを大静脈壁に固定する。
実施例9で見つけられた最適条件に従って調製される島細胞含有中空繊維が固定されたGreenfield大静脈フィルターに静脈内投与及び移植するために調製される。中空繊維は宿主動物から除去された血液から作られるフィブリン血液凝固塊のなかに入れることにより射出用に調製される。さらに、従来の放射線不透過性のプラチナ標識を繊維の適切な位置を確認し、動物を殺した後に繊維を回収するのに役立つように中空繊維の中にいれる。その後、フィブリン凝固塊含有中空繊維を固定されたGreenfield大静脈フィルターの上流に静脈内カテーテルを通して投与する。フィブリン凝固塊含有中空繊維は下大静脈のあるべきところにフィルターにより捕捉され維持される。
それから、フィルター挿入器具は動物から除去され、動物は麻酔から回復する。動物は次に移植後、時間間隔を変えながら観察される。術後2週間から6カ月までの間に、動物が殺され中空繊維が細胞生存性のために回収される。さらに、中空繊維の中でのいろいろな微小環境でのインスリン蛋白質産生のレベルが免疫化学的方法で分析される。対象の膵臓摘出イヌはインスリン産生細胞を器具から除去した以外は全く同じように処置された。
インスリン産生器具を移植した実験用イヌは正常血糖を維持し適当な血漿インスリンレベルを維持することが予測される。しかしながら、インスリン産生細胞を有しない器具を移植した対照のイヌは正常血糖値を示さず、適当な血漿インスリンレベルも有しない。
他の実施の態様
本発明はその真意、もしくは本質的な特性から離れることなく他の特定の形態でも実施できる。本実施例は従って全ての面で例示的であり限定的ではなく本発明の範囲は、前述の開示よりむしろ添付したクレームにより示されクレームの均等の意味及び範囲内の全ての変化は従って本発明に包含されるものと意図されている。
他の実施の態様は以下のクレームの範囲内にある。
Claims (44)
- 予め選択された分子を体循環に放出する移植可能な器具で、器具は以下のものの組み合わせからなる:
(a)血管の内壁に固定可能な血液浸透性素子で、該血液浸透性素子は(i)ひとつの金属フィラメントまたは(ii)複数のフィラメントを含み、血管の内壁に固定されると、血管の血液がそこを通過することができる;及び
(b)予め選択された分子を産生し分泌する生細胞をその中に配置しているカプセルで、そのカプセルは血管内に導入されると、血液浸透性素子により血管内に保持され、カプセルに配置された細胞は予め選択された分子を産生し、カプセルを通して血液に分泌する。 - 血液浸透性素子が血栓抗移動フィルターである請求項1記載の器具。
- カプセルが血液浸透性素子の上流に配置されている請求項1記載の器具。
- カプセルが少なくともひとつの中空繊維を含む請求項1記載の器具。
- 中空繊維が半透膜でできている請求項4記載の器具。
- 半透膜が、予め選択された分子がそれを通って通過するのに十分な大きさであり、かつ、細胞がそれを通って通過するには十分な大きさでない孔を保有する請求項5記載の器具。
- 半透膜が150キロダルトン以下の溶質を通過させ得る孔を保有する請求項5記載の器具。
- 孔が細胞生存性に有害な血液中の物質を排除する大きさである請求項6または7記載の器具。
- 孔が抗体が通過しないような大きさである請求項8記載の器具。
- 半透膜がポリ塩化ビニル、ポリフッカビニリデン、ポリウレタンイソシアネート、ポリアルギン酸、酢酸セルロース、二酢酸セルロース、三酢酸セルロース、硝酸セルロース、ポリスルフォン、ポリスチレン、ポリウレタン、ポリビニルアルコール、ポリアクリロニトリル、ポリアミド、ポリメチルメタクリレート、ポリエチレンオキサイド、ポリテトラフルオロエチレン及びそれらの混合物からなる群から選択される素材からなる請求項5記載の器具。
- 細胞が真核細胞である請求項1記載の器具。
- 細胞が哺乳動物の細胞である請求項11記載の器具。
- 細胞が遺伝子工学的に作られたものである請求項1記載の器具。
- 予め選択された分子が蛋白質である請求項1記載の器具。
- 蛋白質がホルモンである請求項14記載の器具。
- ホルモンがエリスロポイチンである15記載の器具。
- ホルモンがインスリンである請求項15記載の器具。
- 細胞が複数の予め選択された分子を産生する請求項1記載の器具。
- 細胞が血液中の刺激に反応して予め選択された分子を産生する請求項1記載の器具。
- 細胞が予め選択された分子を継続して産生する請求項1記載の器具。
- 細胞が刺激に反応してエリスロポイチンを産生する請求項1記載の器具。
- 細胞が血液の低下した酸素運搬能に反応してエリスロポイチンを産生する請求項21記載の器具。
- 細胞が刺激に反応してインスリンを産生する請求項1記載の器具。
- 細胞が血液のグルコースレベルに反応してインスリンを産生する請求項23記載の器具。
- 血管の内壁に固定された(i)ひとつの金属フィラメントまたは(ii)複数のフィラメントを含む血液浸透性素子によって、血管内に保持されて使用されるカプセルで、そのカプセルは以下のものからなる:
繊維の外に拡散できる予め選択された分子を産生し分泌する細胞を含有する選択的透過性を有する複数の中空繊維で、その繊維は予め選択された分子がそれを通って通過するのに十分な大きさであり、かつ、細胞がそれを通って通過するには十分な大きさでない孔を保有し、その繊維は、血管に沿って動くことができ、かつ血管の血流を維持するような大きさの束を形成するよう接続されている。 - 中空繊維が少なくとも末端キャップで束ねられている請求項25記載のカプセル。
- 中空繊維が半透膜でできている請求項25記載のカプセル。
- 中空繊維が約1000μm以下の内部直径を有する請求項25記載のカプセル。
- 中空繊維が約500μm以下の内部直径を有する請求項25記載のカプセル。
- 細胞が真核細胞である請求項25記載のカプセル。
- 細胞が哺乳動物の細胞である請求項30記載のカプセル。
- 予め選択された分子が蛋白質である請求項25記載のカプセル。
- 蛋白質がホルモンである請求項32記載のカプセル。
- 蛋白質がインスリンである請求項33記載のカプセル。
- 蛋白質がエリスロポイチンである請求項33記載のカプセル。
- カプセルが血栓抗移動フィルターで捕捉される大きさの請求項25記載のカプセル。
- 以下のものの組み合わせからなる移植可能な器具:
(a)血管の内壁に固定可能なひとつのフィラメントを含む血液浸透性素子で、血管の内壁に固定されると、血管の血液がそこを通過することができる;及び
(b)複数の孔とカプセルの中に配置された、予め選択された分子を生産し分泌する生細胞を保有するカプセルで、その孔は、カプセルに配置された細胞の生存能力を維持するための栄養物がカプセルに入ることができ、そのカプセルは血管内に導入されると、血液浸透性素子により血管内に保持される。 - 血液浸透性素子が血栓抗移動フィルターである請求項37記載の器具。
- 血液浸透性素子が血管の内壁に固定可能な複数のフィラメントを含む請求項37記載の器具。
- 血液浸透性素子がヘッドとそこから伸長する血管の内壁に固定可能な複数の脚(legs)をもつ請求項37記載の器具。
- フィラメントが金属性である請求項37記載の器具。
- カプセルが半透膜でできている請求項37記載の器具。
- 体循環に生細胞を導入するのに使用するための、請求項1〜42のいずれか一つに記載の器具またはカプセル。
- 予め選択された分子を体循環に配達するのに使用するための、請求項1〜43のいずれか一つに記載の器具またはカプセル。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US08/461,042 US5704910A (en) | 1995-06-05 | 1995-06-05 | Implantable device and use therefor |
| US08/461,042 | 1995-06-05 | ||
| PCT/US1996/008524 WO1996039098A1 (en) | 1995-06-05 | 1996-06-04 | A device for delivering a preselected molecule into the system circulation |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPH11506954A JPH11506954A (ja) | 1999-06-22 |
| JP3878672B2 true JP3878672B2 (ja) | 2007-02-07 |
Family
ID=23830999
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP50109697A Expired - Fee Related JP3878672B2 (ja) | 1995-06-05 | 1996-06-04 | 体循環への予め選択された分子の放出器具 |
Country Status (8)
| Country | Link |
|---|---|
| US (5) | US5704910A (ja) |
| EP (2) | EP0831752B1 (ja) |
| JP (1) | JP3878672B2 (ja) |
| AT (1) | ATE274869T1 (ja) |
| AU (1) | AU716897B2 (ja) |
| CA (1) | CA2222613C (ja) |
| DE (1) | DE69633278T2 (ja) |
| WO (1) | WO1996039098A1 (ja) |
Families Citing this family (198)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5704910A (en) * | 1995-06-05 | 1998-01-06 | Nephros Therapeutics, Inc. | Implantable device and use therefor |
| US7694683B2 (en) * | 1996-12-18 | 2010-04-13 | Conceptus, Inc. | Methods and devices for occluding body lumens and/or for delivering therapeutic agents |
| US6547787B1 (en) | 1997-03-13 | 2003-04-15 | Biocardia, Inc. | Drug delivery catheters that attach to tissue and methods for their use |
| US6416510B1 (en) * | 1997-03-13 | 2002-07-09 | Biocardia, Inc. | Drug delivery catheters that attach to tissue and methods for their use |
| US6409674B1 (en) * | 1998-09-24 | 2002-06-25 | Data Sciences International, Inc. | Implantable sensor with wireless communication |
| US20020188207A1 (en) * | 1998-01-08 | 2002-12-12 | Jacob Richter | Anchor for sensor implanted in a bodily lumen |
| US6206914B1 (en) * | 1998-04-30 | 2001-03-27 | Medtronic, Inc. | Implantable system with drug-eluting cells for on-demand local drug delivery |
| US6102887A (en) | 1998-08-11 | 2000-08-15 | Biocardia, Inc. | Catheter drug delivery system and method for use |
| AU764686B2 (en) * | 1998-08-28 | 2003-08-28 | Duke University | Adenoviruses deleted in the IVa2, 100K, polymerase and/or preterminal protein sequences |
| US7314477B1 (en) | 1998-09-25 | 2008-01-01 | C.R. Bard Inc. | Removable embolus blood clot filter and filter delivery unit |
| US7044134B2 (en) | 1999-11-08 | 2006-05-16 | Ev3 Sunnyvale, Inc | Method of implanting a device in the left atrial appendage |
| US7128073B1 (en) | 1998-11-06 | 2006-10-31 | Ev3 Endovascular, Inc. | Method and device for left atrial appendage occlusion |
| US8016852B2 (en) * | 1998-11-10 | 2011-09-13 | Stryker Corporation | Bioactive components for incorporation with vaso-occlusive members |
| US6187024B1 (en) | 1998-11-10 | 2001-02-13 | Target Therapeutics, Inc. | Bioactive coating for vaso-occlusive devices |
| US6713293B1 (en) * | 1999-02-08 | 2004-03-30 | Friedrich Grummt | Encapsulated cells containing an amplified expression vector as a drug delivery device |
| US6080178A (en) * | 1999-04-20 | 2000-06-27 | Meglin; Allen J. | Vena cava filter |
| US6436120B1 (en) | 1999-04-20 | 2002-08-20 | Allen J. Meglin | Vena cava filter |
| ATE316980T1 (de) * | 1999-07-21 | 2006-02-15 | Univ Southern California | Fusions-polypeptide zur gewebegeneration und wundheilung zur gezielten matrixanwendung |
| US6770468B1 (en) | 1999-09-14 | 2004-08-03 | Genzyme Glycobiology Research Institute, Inc. | Phosphodiester-α-GlcNAcase of the lysosomal targeting pathway |
| US6642038B1 (en) | 1999-09-14 | 2003-11-04 | Genzyme Glycobiology Research Institute, Inc. | GlcNAc phosphotransferase of the lysosomal targeting pathway |
| US6994092B2 (en) * | 1999-11-08 | 2006-02-07 | Ev3 Sunnyvale, Inc. | Device for containing embolic material in the LAA having a plurality of tissue retention structures |
| US6217600B1 (en) | 2000-01-26 | 2001-04-17 | Scimed Life Systems, Inc. | Thrombus filter with break-away anchor members |
| US6342063B1 (en) | 2000-01-26 | 2002-01-29 | Scimed Life Systems, Inc. | Device and method for selectively removing a thrombus filter |
| US6478776B1 (en) | 2000-04-05 | 2002-11-12 | Biocardia, Inc. | Implant delivery catheter system and methods for its use |
| US6740331B1 (en) * | 2000-08-25 | 2004-05-25 | Global Gene Therapies, Inc. | Apparatus for the delivery of drugs or gene therapy into a patient's vasculature and methods of use |
| US7651696B2 (en) * | 2000-08-25 | 2010-01-26 | Nexeon Medical Systems, Inc. | Implantable device for treating disease states and methods of using same |
| AU2002241538A1 (en) * | 2000-12-01 | 2002-07-24 | Nephros Therapeutics, Inc. | Intrasvascular drug delivery device and use therefor |
| EP1341475A1 (en) * | 2000-12-01 | 2003-09-10 | Nephros Therapeutics, Inc. | Intravascular blood conditioning device and use thereof |
| US6867183B2 (en) * | 2001-02-15 | 2005-03-15 | Nobex Corporation | Pharmaceutical compositions of insulin drug-oligomer conjugates and methods of treating diseases therewith |
| US7060675B2 (en) * | 2001-02-15 | 2006-06-13 | Nobex Corporation | Methods of treating diabetes mellitus |
| US20040191246A1 (en) | 2003-02-26 | 2004-09-30 | Connelly Patrick R. | Process for in vivo treatment of specific biological targets in bodily fluid |
| US7629309B2 (en) | 2002-05-29 | 2009-12-08 | Zystor Therapeutics, Inc. | Targeted therapeutic proteins |
| EP1974752B1 (en) | 2001-04-30 | 2012-09-26 | BioMarin Pharmaceutical Inc. | Subcellular targeting of therapeutic proteins |
| US7560424B2 (en) | 2001-04-30 | 2009-07-14 | Zystor Therapeutics, Inc. | Targeted therapeutic proteins |
| US20040005309A1 (en) * | 2002-05-29 | 2004-01-08 | Symbiontics, Inc. | Targeted therapeutic proteins |
| US6828297B2 (en) * | 2001-06-04 | 2004-12-07 | Nobex Corporation | Mixtures of insulin drug-oligomer conjugates comprising polyalkylene glycol, uses thereof, and methods of making same |
| US7144381B2 (en) | 2001-06-20 | 2006-12-05 | The Regents Of The University Of California | Hemodialysis system and method |
| EP1281767A3 (en) | 2001-07-31 | 2003-05-28 | Aladar A. Szalay | Light emitting microorganisms and cells for diagnosis and therapy of tumors |
| WO2003011200A2 (en) | 2001-08-01 | 2003-02-13 | Pascal Mock | Intrauterine device, method of making such a device and method for putting active elements within the uterine cavity |
| US7196059B2 (en) * | 2001-09-07 | 2007-03-27 | Biocon Limited | Pharmaceutical compositions of insulin drug-oligomer conjugates and methods of treating diseases therewith |
| US20030050648A1 (en) | 2001-09-11 | 2003-03-13 | Spiration, Inc. | Removable lung reduction devices, systems, and methods |
| US20030073961A1 (en) * | 2001-09-28 | 2003-04-17 | Happ Dorrie M. | Medical device containing light-protected therapeutic agent and a method for fabricating thereof |
| US20030072761A1 (en) * | 2001-10-16 | 2003-04-17 | Lebowitz Jonathan | Methods and compositions for targeting proteins across the blood brain barrier |
| US6592594B2 (en) | 2001-10-25 | 2003-07-15 | Spiration, Inc. | Bronchial obstruction device deployment system and method |
| US20060292206A1 (en) | 2001-11-26 | 2006-12-28 | Kim Steven W | Devices and methods for treatment of vascular aneurysms |
| US6905856B2 (en) * | 2001-12-21 | 2005-06-14 | Genzyme Glycobiology Research Institute, Inc. | Soluble GlcNAc phosphotransferase |
| US6800472B2 (en) * | 2001-12-21 | 2004-10-05 | Genzyme Glycobiology Research Institute, Inc. | Expression of lysosomal hydrolase in cells expressing pro-N-acetylglucosamine-1-phosphodiester α-N-acetyl glucosimanidase |
| US20030124652A1 (en) * | 2001-12-21 | 2003-07-03 | Novazyme Pharmaceuticals, Inc. | Methods of producing high mannose glycoproteins in complex carbohydrate deficient cells |
| US9204956B2 (en) | 2002-02-20 | 2015-12-08 | C. R. Bard, Inc. | IVC filter with translating hooks |
| US6929637B2 (en) * | 2002-02-21 | 2005-08-16 | Spiration, Inc. | Device and method for intra-bronchial provision of a therapeutic agent |
| US7442546B2 (en) | 2002-03-15 | 2008-10-28 | The Regents Of The University Of Michigan | Method of modulating inflammatory response |
| US20030181922A1 (en) | 2002-03-20 | 2003-09-25 | Spiration, Inc. | Removable anchored lung volume reduction devices and methods |
| US20030216769A1 (en) | 2002-05-17 | 2003-11-20 | Dillard David H. | Removable anchored lung volume reduction devices and methods |
| US20030195385A1 (en) * | 2002-04-16 | 2003-10-16 | Spiration, Inc. | Removable anchored lung volume reduction devices and methods |
| US7695427B2 (en) * | 2002-04-26 | 2010-04-13 | Torax Medical, Inc. | Methods and apparatus for treating body tissue sphincters and the like |
| US20050197715A1 (en) * | 2002-04-26 | 2005-09-08 | Torax Medical, Inc. | Methods and apparatus for implanting devices into non-sterile body lumens or organs |
| EP1369491A1 (en) * | 2002-06-05 | 2003-12-10 | Aladar A. Szalay | Light emitting microorganisms and cells for diagnosis and therapy of diseases associated with wounded or inflamed tissue |
| US20030228261A1 (en) * | 2002-06-05 | 2003-12-11 | Aladar Szalay | Light emitting microorganisms and cells for diagnosis and therapy of diseases associated with wounded or inflamed tissue |
| US7217426B1 (en) | 2002-06-21 | 2007-05-15 | Advanced Cardiovascular Systems, Inc. | Coatings containing polycationic peptides for cardiovascular therapy |
| US7303575B2 (en) * | 2002-08-01 | 2007-12-04 | Lumen Biomedical, Inc. | Embolism protection devices |
| AU2003267164A1 (en) * | 2002-09-12 | 2004-04-30 | Cook Incorporated | Retrievable filter |
| US7481821B2 (en) | 2002-11-12 | 2009-01-27 | Thomas J. Fogarty | Embolization device and a method of using the same |
| US7025791B2 (en) | 2002-12-02 | 2006-04-11 | Gi Dynamics, Inc. | Bariatric sleeve |
| AU2003297534A1 (en) * | 2002-12-24 | 2004-07-22 | Ovion, Inc. | Contraceptive device and delivery system |
| US7166458B2 (en) * | 2003-01-07 | 2007-01-23 | Bio Tex, Inc. | Assay and method for analyte sensing by detecting efficiency of radiation conversion |
| US20040260382A1 (en) * | 2003-02-12 | 2004-12-23 | Fogarty Thomas J. | Intravascular implants and methods of using the same |
| US7100616B2 (en) | 2003-04-08 | 2006-09-05 | Spiration, Inc. | Bronchoscopic lung volume reduction method |
| US8791171B2 (en) * | 2003-05-01 | 2014-07-29 | Abbott Cardiovascular Systems Inc. | Biodegradable coatings for implantable medical devices |
| US7082336B2 (en) * | 2003-06-04 | 2006-07-25 | Synecor, Llc | Implantable intravascular device for defibrillation and/or pacing |
| US8239045B2 (en) * | 2003-06-04 | 2012-08-07 | Synecor Llc | Device and method for retaining a medical device within a vessel |
| US7617007B2 (en) * | 2003-06-04 | 2009-11-10 | Synecor Llc | Method and apparatus for retaining medical implants within body vessels |
| US20050234431A1 (en) * | 2004-02-10 | 2005-10-20 | Williams Michael S | Intravascular delivery system for therapeutic agents |
| AU2004251673B2 (en) * | 2003-06-04 | 2010-01-28 | Synecor Llc | Intravascular electrophysiological system and methods |
| BRPI0411526A (pt) | 2003-06-18 | 2006-08-01 | Genelux Corp | vìrus de vaccinia e outros microrganismos recombinates modificados e usos dos mesmos |
| US8048042B2 (en) * | 2003-07-22 | 2011-11-01 | Medtronic Vascular, Inc. | Medical articles incorporating surface capillary fiber |
| US7879062B2 (en) * | 2003-07-22 | 2011-02-01 | Lumen Biomedical, Inc. | Fiber based embolism protection device |
| US7662143B2 (en) * | 2003-07-29 | 2010-02-16 | Boston Scientific Scimed, Inc. | Apparatus and method for treating intravascular disease |
| US7896898B2 (en) * | 2003-07-30 | 2011-03-01 | Boston Scientific Scimed, Inc. | Self-centering blood clot filter |
| US7533671B2 (en) | 2003-08-08 | 2009-05-19 | Spiration, Inc. | Bronchoscopic repair of air leaks in a lung |
| US7056286B2 (en) * | 2003-11-12 | 2006-06-06 | Adrian Ravenscroft | Medical device anchor and delivery system |
| US7747335B2 (en) * | 2003-12-12 | 2010-06-29 | Synecor Llc | Implantable medical device having pre-implant exoskeleton |
| US7704266B2 (en) | 2004-01-22 | 2010-04-27 | Rex Medical, L.P. | Vein filter |
| US7976562B2 (en) | 2004-01-22 | 2011-07-12 | Rex Medical, L.P. | Method of removing a vein filter |
| US9510929B2 (en) | 2004-01-22 | 2016-12-06 | Argon Medical Devices, Inc. | Vein filter |
| US8162972B2 (en) | 2004-01-22 | 2012-04-24 | Rex Medical, Lp | Vein filter |
| US20050244400A1 (en) * | 2004-02-10 | 2005-11-03 | Zystor Therapeutics, Inc. | Acid alpha-glucosidase and fragments thereof |
| US8764729B2 (en) * | 2004-04-21 | 2014-07-01 | Acclarent, Inc. | Frontal sinus spacer |
| CA2580313C (en) * | 2004-07-19 | 2016-03-15 | Biocon Limited | Insulin-oligomer conjugates, formulations and uses thereof |
| US7704267B2 (en) | 2004-08-04 | 2010-04-27 | C. R. Bard, Inc. | Non-entangling vena cava filter |
| US7244443B2 (en) | 2004-08-31 | 2007-07-17 | Advanced Cardiovascular Systems, Inc. | Polymers of fluorinated monomers and hydrophilic monomers |
| AU2005290052B2 (en) * | 2004-09-27 | 2011-06-02 | Rex Medical, L.P. | Vein filter |
| CN101072580B (zh) | 2004-10-06 | 2012-08-22 | 农业生物技术有限公司 | 抗体制备方法 |
| WO2006042114A1 (en) | 2004-10-06 | 2006-04-20 | Cook, Inc. | Emboli capturing device having a coil and method for capturing emboli |
| US20060079927A1 (en) * | 2004-10-08 | 2006-04-13 | Medtronic Vascular, Inc., A Delaware Corporation | Detachable joint catheter and method |
| EP1809374A4 (en) * | 2004-10-12 | 2008-09-10 | Closed Loop Therapies Ltd | IMPLANTABLE METHODS AND DEVICES FOR TREATING SUPRAVENTRICULAR ARRHYTHMIAS |
| US7794473B2 (en) * | 2004-11-12 | 2010-09-14 | C.R. Bard, Inc. | Filter delivery system |
| US8267954B2 (en) * | 2005-02-04 | 2012-09-18 | C. R. Bard, Inc. | Vascular filter with sensing capability |
| US8169892B2 (en) * | 2005-02-08 | 2012-05-01 | Nokia Corporation | HARQ failure indication over IUB-interface |
| US8945169B2 (en) | 2005-03-15 | 2015-02-03 | Cook Medical Technologies Llc | Embolic protection device |
| US8221446B2 (en) | 2005-03-15 | 2012-07-17 | Cook Medical Technologies | Embolic protection device |
| US8574259B2 (en) * | 2005-05-10 | 2013-11-05 | Lifescreen Sciences Llc | Intravascular filter with drug reservoir |
| CA2946470C (en) | 2005-05-12 | 2019-02-19 | C.R. Bard Inc. | Removable embolus blood clot filter |
| US12115057B2 (en) | 2005-05-12 | 2024-10-15 | C.R. Bard, Inc. | Tubular filter |
| US8109962B2 (en) | 2005-06-20 | 2012-02-07 | Cook Medical Technologies Llc | Retrievable device having a reticulation portion with staggered struts |
| US7850708B2 (en) | 2005-06-20 | 2010-12-14 | Cook Incorporated | Embolic protection device having a reticulated body with staggered struts |
| US7771452B2 (en) | 2005-07-12 | 2010-08-10 | Cook Incorporated | Embolic protection device with a filter bag that disengages from a basket |
| US7766934B2 (en) | 2005-07-12 | 2010-08-03 | Cook Incorporated | Embolic protection device with an integral basket and bag |
| US8187298B2 (en) | 2005-08-04 | 2012-05-29 | Cook Medical Technologies Llc | Embolic protection device having inflatable frame |
| US8062327B2 (en) | 2005-08-09 | 2011-11-22 | C. R. Bard, Inc. | Embolus blood clot filter and delivery system |
| US7972359B2 (en) * | 2005-09-16 | 2011-07-05 | Atritech, Inc. | Intracardiac cage and method of delivering same |
| US8377092B2 (en) | 2005-09-16 | 2013-02-19 | Cook Medical Technologies Llc | Embolic protection device |
| US8632562B2 (en) | 2005-10-03 | 2014-01-21 | Cook Medical Technologies Llc | Embolic protection device |
| US8182508B2 (en) | 2005-10-04 | 2012-05-22 | Cook Medical Technologies Llc | Embolic protection device |
| US8252017B2 (en) | 2005-10-18 | 2012-08-28 | Cook Medical Technologies Llc | Invertible filter for embolic protection |
| US8216269B2 (en) | 2005-11-02 | 2012-07-10 | Cook Medical Technologies Llc | Embolic protection device having reduced profile |
| US8152831B2 (en) | 2005-11-17 | 2012-04-10 | Cook Medical Technologies Llc | Foam embolic protection device |
| CA2630217C (en) | 2005-11-18 | 2016-10-11 | C.R. Bard, Inc. | Vena cava filter with filament |
| US20070135826A1 (en) * | 2005-12-01 | 2007-06-14 | Steve Zaver | Method and apparatus for delivering an implant without bias to a left atrial appendage |
| US8278094B2 (en) | 2005-12-14 | 2012-10-02 | The Invention Science Fund I, Llc | Bone semi-permeable device |
| US8734823B2 (en) * | 2005-12-14 | 2014-05-27 | The Invention Science Fund I, Llc | Device including altered microorganisms, and methods and systems of use |
| US8682619B2 (en) * | 2005-12-14 | 2014-03-25 | The Invention Science Fund I, Llc | Device including altered microorganisms, and methods and systems of use |
| US20090081296A1 (en) * | 2006-02-02 | 2009-03-26 | Humes H David | Extracorporeal cell-based therapeutic device and delivery system |
| US8048419B2 (en) | 2006-02-02 | 2011-11-01 | Innovative Biotherapies, Inc. | Extracorporeal cell-based therapeutic device and delivery system |
| US8235047B2 (en) * | 2006-03-30 | 2012-08-07 | Conceptus, Inc. | Methods and devices for deployment into a lumen |
| US7691151B2 (en) | 2006-03-31 | 2010-04-06 | Spiration, Inc. | Articulable Anchor |
| US10188496B2 (en) | 2006-05-02 | 2019-01-29 | C. R. Bard, Inc. | Vena cava filter formed from a sheet |
| US20070265655A1 (en) * | 2006-05-09 | 2007-11-15 | Boston Scientific Scimed, Inc. | Embolic protection filter with enhanced stability within a vessel |
| US20080090765A1 (en) * | 2006-05-25 | 2008-04-17 | The Trustees Of Columbia University In The City Of New York | Compositions for modulating growth of embryonic and adult kidney tissue and uses for treating kidney damage |
| CA2655158A1 (en) | 2006-06-05 | 2007-12-13 | C.R. Bard Inc. | Embolus blood clot filter utilizable with a single delivery system or a single retrieval system in one of a femoral or jugular access |
| US20080097377A1 (en) * | 2006-06-13 | 2008-04-24 | The Florida International University Board Of Trustees | Temperature-controlled catheter system and method |
| US9028859B2 (en) | 2006-07-07 | 2015-05-12 | Advanced Cardiovascular Systems, Inc. | Phase-separated block copolymer coatings for implantable medical devices |
| TW200819540A (en) | 2006-07-11 | 2008-05-01 | Genelux Corp | Methods and compositions for detection of microorganisms and cells and treatment of diseases and disorders |
| US10076401B2 (en) | 2006-08-29 | 2018-09-18 | Argon Medical Devices, Inc. | Vein filter |
| US20080071307A1 (en) | 2006-09-19 | 2008-03-20 | Cook Incorporated | Apparatus and methods for in situ embolic protection |
| EP2099523A2 (en) * | 2006-11-13 | 2009-09-16 | ZyStor Therapeutics , Inc. | Methods for treating pompe disease |
| EP2108342B1 (en) * | 2006-12-07 | 2010-07-07 | Mallinckrodt Inc. | Medical devices for localized drug delivery |
| US20080215072A1 (en) * | 2007-02-15 | 2008-09-04 | Graham Kelly | Methods and apparatus for utilization of barbed sutures in human tissue including a method for eliminating or improving blood flow in veins |
| US9901434B2 (en) | 2007-02-27 | 2018-02-27 | Cook Medical Technologies Llc | Embolic protection device including a Z-stent waist band |
| US8795351B2 (en) | 2007-04-13 | 2014-08-05 | C.R. Bard, Inc. | Migration resistant embolic filter |
| US8007470B2 (en) | 2007-07-10 | 2011-08-30 | Cook Medical Technologies Llc | Minimally invasive medical device and method for delivery of therapeutic or diagnostic agents into a vessel wall |
| WO2009015341A1 (en) * | 2007-07-25 | 2009-01-29 | Mick Radio-Nuclear Instruments, Inc. | Seed anchor |
| US9138307B2 (en) | 2007-09-14 | 2015-09-22 | Cook Medical Technologies Llc | Expandable device for treatment of a stricture in a body vessel |
| US8419748B2 (en) | 2007-09-14 | 2013-04-16 | Cook Medical Technologies Llc | Helical thrombus removal device |
| US8252018B2 (en) | 2007-09-14 | 2012-08-28 | Cook Medical Technologies Llc | Helical embolic protection device |
| US8043301B2 (en) | 2007-10-12 | 2011-10-25 | Spiration, Inc. | Valve loader method, system, and apparatus |
| EP2194933B1 (en) | 2007-10-12 | 2016-05-04 | Spiration, Inc. | Valve loader method, system, and apparatus |
| CN101939023B (zh) * | 2007-10-16 | 2016-08-03 | 百康有限公司 | 可经口给药的固体药物组合物及其方法 |
| RU2464048C2 (ru) | 2008-04-17 | 2012-10-20 | Аллерган, Инк. | Имплантируемый порт доступа и система его крепления |
| US9023063B2 (en) | 2008-04-17 | 2015-05-05 | Apollo Endosurgery, Inc. | Implantable access port device having a safety cap |
| AU2009244148B2 (en) * | 2008-05-07 | 2014-10-09 | Biomarin Pharmaceutical Inc. | Lysosomal targeting peptides and uses thereof |
| DE102008002397A1 (de) | 2008-06-12 | 2009-12-17 | Biotronik Vi Patent Ag | Implantierbare Vorrichtung |
| WO2010071692A2 (en) * | 2008-06-18 | 2010-06-24 | Innovative Biotherapies, Inc. | Methods for enhanced propagation of cells |
| US8388644B2 (en) | 2008-12-29 | 2013-03-05 | Cook Medical Technologies Llc | Embolic protection device and method of use |
| US8715732B2 (en) * | 2009-01-05 | 2014-05-06 | Cornell University | Nucleic acid hydrogel via rolling circle amplification |
| WO2010115187A1 (en) * | 2009-04-03 | 2010-10-07 | Duke University | Methods of making cell sheets, tissue sheets and tissue engineered blood vessels |
| CN106039547A (zh) | 2009-05-15 | 2016-10-26 | 因特尔赛克特耳鼻喉公司 | 可展开装置及其使用方法 |
| US20100305688A1 (en) * | 2009-05-26 | 2010-12-02 | Mallinckrodt Inc. | Medical Devices for Localized Drug Delivery |
| US8785168B2 (en) | 2009-06-17 | 2014-07-22 | Biomarin Pharmaceutical Inc. | Formulations for lysosomal enzymes |
| MX2012001288A (es) | 2009-07-29 | 2012-06-19 | Bard Inc C R | Filtro tubular. |
| EP2464247B1 (en) | 2009-08-10 | 2018-05-30 | McCord, Darlene | Nutritional supplements |
| US8715158B2 (en) | 2009-08-26 | 2014-05-06 | Apollo Endosurgery, Inc. | Implantable bottom exit port |
| US8506532B2 (en) | 2009-08-26 | 2013-08-13 | Allergan, Inc. | System including access port and applicator tool |
| US8708979B2 (en) | 2009-08-26 | 2014-04-29 | Apollo Endosurgery, Inc. | Implantable coupling device |
| US10092427B2 (en) * | 2009-11-04 | 2018-10-09 | Confluent Medical Technologies, Inc. | Alternating circumferential bridge stent design and methods for use thereof |
| US8882728B2 (en) | 2010-02-10 | 2014-11-11 | Apollo Endosurgery, Inc. | Implantable injection port |
| WO2011112822A2 (en) * | 2010-03-10 | 2011-09-15 | University Of Florida Research Foundation. Inc. | Implantable therapeutic device and methods of making |
| US8992415B2 (en) | 2010-04-30 | 2015-03-31 | Apollo Endosurgery, Inc. | Implantable device to protect tubing from puncture |
| US20110270025A1 (en) | 2010-04-30 | 2011-11-03 | Allergan, Inc. | Remotely powered remotely adjustable gastric band system |
| US20110270021A1 (en) | 2010-04-30 | 2011-11-03 | Allergan, Inc. | Electronically enhanced access port for a fluid filled implant |
| US20120041258A1 (en) | 2010-08-16 | 2012-02-16 | Allergan, Inc. | Implantable access port system |
| US20120065460A1 (en) | 2010-09-14 | 2012-03-15 | Greg Nitka | Implantable access port system |
| EP2624791B1 (en) * | 2010-10-08 | 2017-06-21 | Confluent Medical Technologies, Inc. | Alternating circumferential bridge stent design |
| WO2012094251A2 (en) * | 2011-01-04 | 2012-07-12 | Massachusetts Institute Of Technology | Device and method for sampling bodily fluid for medical analytes in ultra low concentrations |
| US8821373B2 (en) | 2011-05-10 | 2014-09-02 | Apollo Endosurgery, Inc. | Directionless (orientation independent) needle injection port |
| US8795241B2 (en) | 2011-05-13 | 2014-08-05 | Spiration, Inc. | Deployment catheter |
| US20130030369A1 (en) * | 2011-07-27 | 2013-01-31 | Vascular Solutions, Inc. | Vascular introducer including expandable passage member |
| US8801597B2 (en) | 2011-08-25 | 2014-08-12 | Apollo Endosurgery, Inc. | Implantable access port with mesh attachment rivets |
| US9199069B2 (en) | 2011-10-20 | 2015-12-01 | Apollo Endosurgery, Inc. | Implantable injection port |
| US8858421B2 (en) | 2011-11-15 | 2014-10-14 | Apollo Endosurgery, Inc. | Interior needle stick guard stems for tubes |
| US9089395B2 (en) | 2011-11-16 | 2015-07-28 | Appolo Endosurgery, Inc. | Pre-loaded septum for use with an access port |
| AU2013204200B2 (en) | 2012-10-11 | 2016-10-20 | Brandeis University | Treatment of amyotrophic lateral sclerosis |
| US9414752B2 (en) | 2012-11-09 | 2016-08-16 | Elwha Llc | Embolism deflector |
| US10406332B2 (en) | 2013-03-14 | 2019-09-10 | Intersect Ent, Inc. | Systems, devices, and method for treating a sinus condition |
| EP2813234A1 (en) * | 2013-06-11 | 2014-12-17 | Erytech Pharma | Composition of erythrocytes encapsulating phenylalanine hydroxylase and therapeutic use thereof |
| EP3273949A4 (en) | 2015-03-23 | 2018-12-12 | The Regents of The University of California | Thin film cell encapsulation devices |
| US9867974B2 (en) * | 2015-06-01 | 2018-01-16 | Wisconsin Alumni Research Foundation | Microfluidic device for multiplexed point source administration of compounds |
| CN110831520B (zh) | 2017-04-27 | 2022-11-15 | 波士顿科学国际有限公司 | 具有织物保持倒钩的闭塞医疗装置 |
| US20210290821A1 (en) * | 2018-07-27 | 2021-09-23 | Washington University | Cell-embedded vascular graft for transplantation |
| DE102018006061A1 (de) * | 2018-08-01 | 2020-02-06 | Universität Duisburg-Essen | Implantat |
| US11596533B2 (en) | 2018-08-21 | 2023-03-07 | Boston Scientific Scimed, Inc. | Projecting member with barb for cardiovascular devices |
| US11944314B2 (en) | 2019-07-17 | 2024-04-02 | Boston Scientific Scimed, Inc. | Left atrial appendage implant with continuous covering |
| WO2021041831A1 (en) | 2019-08-30 | 2021-03-04 | Boston Scientific Scimed, Inc. | Left atrial appendage implant with sealing disk |
| AU2020352623A1 (en) | 2019-09-27 | 2022-05-12 | Isla Technologies, Inc. | Bioartificial pancreas |
| EP4125634A1 (en) | 2020-03-24 | 2023-02-08 | Boston Scientific Scimed Inc. | Medical system for treating a left atrial appendage |
| FR3124695B1 (fr) * | 2021-06-30 | 2023-06-30 | Univ Grenoble Alpes | Matrice de réception de cellules pancréatiques et dispositif amélioré de pancréas artificiel |
| WO2024036199A2 (en) * | 2022-08-09 | 2024-02-15 | The General Hospital Corporation | Endovascular biologic stent |
| WO2024079662A1 (en) | 2022-10-11 | 2024-04-18 | Meiragtx Uk Ii Limited | Upf1 expression constructs |
| WO2024079530A2 (en) | 2022-10-11 | 2024-04-18 | Meiragtx Uk Ii Limited | Nucleic acid regulatory elements for gene expression in the muscle and methods of use |
Family Cites Families (49)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3313289A (en) * | 1964-06-23 | 1967-04-11 | Frank A Kapral | Implant chamber |
| US3952747A (en) * | 1974-03-28 | 1976-04-27 | Kimmell Jr Garman O | Filter and filter insertion instrument |
| US4309776A (en) * | 1980-05-13 | 1982-01-12 | Ramon Berguer | Intravascular implantation device and method of using the same |
| US4393133A (en) * | 1980-06-12 | 1983-07-12 | The Wistar Institute Of Anatomy And Biology | Human hepatoma derived cell line, process for preparation thereof, and uses therefor |
| US4378016A (en) * | 1981-07-15 | 1983-03-29 | Biotek, Inc. | Artificial endocrine gland containing hormone-producing cells |
| US4586922A (en) * | 1981-10-09 | 1986-05-06 | Alza Corporation | Intravenous system for delivering a beneficial agent |
| US4479796A (en) * | 1982-11-15 | 1984-10-30 | Medtronic, Inc. | Self-regenerating drug administration device |
| US4494531A (en) * | 1982-12-06 | 1985-01-22 | Cook, Incorporated | Expandable blood clot filter |
| US5104399A (en) * | 1986-12-10 | 1992-04-14 | Endovascular Technologies, Inc. | Artificial graft and implantation method |
| GB8422876D0 (en) * | 1984-09-11 | 1984-10-17 | Secr Defence | Silicon implant devices |
| DE3447202A1 (de) * | 1984-12-22 | 1986-07-10 | CYTOMED Medizintechnik GmbH, 8750 Aschaffenburg | Implantierbarer, intravasaler katheter fuer die dauermedikation von pharmaka |
| SE447061B (sv) * | 1985-06-10 | 1986-10-27 | Medinvent Sa | Inforingsanordning, spec for implantering i en levande organism |
| US4793348A (en) * | 1986-11-15 | 1988-12-27 | Palmaz Julio C | Balloon expandable vena cava filter to prevent migration of lower extremity venous clots into the pulmonary circulation |
| FR2606641B1 (fr) * | 1986-11-17 | 1991-07-12 | Promed | Dispositif filtrant pour caillots sanguins |
| US5026365A (en) * | 1987-04-29 | 1991-06-25 | The University Of Massachusetts | Method and apparatus for therapeutically treating immunological disorders and disease states |
| US4817600A (en) * | 1987-05-22 | 1989-04-04 | Medi-Tech, Inc. | Implantable filter |
| US4911717A (en) * | 1987-06-18 | 1990-03-27 | Gaskill Iii Harold V | Intravasular artificial organ |
| US5182111A (en) * | 1987-11-17 | 1993-01-26 | Boston University Research Foundation | In vivo delivery of active factors by co-cultured cell implants |
| US5487739A (en) * | 1987-11-17 | 1996-01-30 | Brown University Research Foundation | Implantable therapy systems and methods |
| US4892538A (en) * | 1987-11-17 | 1990-01-09 | Brown University Research Foundation | In vivo delivery of neurotransmitters by implanted, encapsulated cells |
| US4936823A (en) * | 1988-05-04 | 1990-06-26 | Triangle Research And Development Corp. | Transendoscopic implant capsule |
| US4832055A (en) * | 1988-07-08 | 1989-05-23 | Palestrant Aubrey M | Mechanically locking blood clot filter |
| US5152743A (en) | 1988-08-05 | 1992-10-06 | Healthdyne, Inc. | Apparatus and method for selective separation of blood cholesterol |
| US5164186A (en) * | 1988-10-13 | 1992-11-17 | Kabushikigaisha Ars Japan | Drug-releaser |
| US4994069A (en) * | 1988-11-02 | 1991-02-19 | Target Therapeutics | Vaso-occlusion coil and method |
| JPH04507041A (ja) * | 1988-12-13 | 1992-12-10 | アメリカ合衆国 | 遺伝工学により修飾された内皮細胞およびその利用方法 |
| US5152777A (en) * | 1989-01-25 | 1992-10-06 | Uresil Corporation | Device and method for providing protection from emboli and preventing occulsion of blood vessels |
| US5059205A (en) * | 1989-09-07 | 1991-10-22 | Boston Scientific Corporation | Percutaneous anti-migration vena cava filter |
| DE3941873A1 (de) * | 1989-12-19 | 1991-06-20 | Jakob Dr Bodziony | Hohlfaser mit der beschichtung von zellen, die mehrjaehrige implantation in arterien und venen ermoeglichen |
| US5314471A (en) * | 1991-07-24 | 1994-05-24 | Baxter International Inc. | Tissue inplant systems and methods for sustaining viable high cell densities within a host |
| US5053008A (en) * | 1990-11-21 | 1991-10-01 | Sandeep Bajaj | Intracardiac catheter |
| US5147379A (en) * | 1990-11-26 | 1992-09-15 | Louisiana State University And Agricultural And Mechanical College | Insertion instrument for vena cava filter |
| WO1992015676A1 (en) * | 1991-03-08 | 1992-09-17 | The Salk Institute For Biological Studies | Somatic cell gene therapy |
| US5391164A (en) * | 1991-05-03 | 1995-02-21 | Giampapa; Vincent C. | Subcutaneous implantable multiple-agent delivery system |
| US5350398A (en) * | 1991-05-13 | 1994-09-27 | Dusan Pavcnik | Self-expanding filter for percutaneous insertion |
| WO1993006878A1 (en) * | 1991-10-11 | 1993-04-15 | Boston Scientific Corporation | Catheter introducer sheath assembly |
| FR2683449A1 (fr) * | 1991-11-08 | 1993-05-14 | Cardon Alain | Endoprothese pour implantation transluminale. |
| US5304120A (en) * | 1992-07-01 | 1994-04-19 | Btx Inc. | Electroporation method and apparatus for insertion of drugs and genes into endothelial cells |
| FR2697995B1 (fr) * | 1992-11-19 | 1994-12-30 | Celsa Lg | Dispositif amovible de filtration sanguine, à rigidité variable, implantable dans le corps d'un patient et autorisant l'injection d'un produit traitant. |
| EP0604022A1 (en) * | 1992-12-22 | 1994-06-29 | Advanced Cardiovascular Systems, Inc. | Multilayered biodegradable stent and method for its manufacture |
| FR2699809B1 (fr) * | 1992-12-28 | 1995-02-17 | Celsa Lg | Dispositif pouvant constituer sélectivement un filtre sanguin temporaire. |
| WO1994015583A1 (en) * | 1993-01-08 | 1994-07-21 | Pdt Systems, Inc. | Medicament dispensing stents |
| US5645829A (en) * | 1993-06-18 | 1997-07-08 | Beth Israel Hospital Association | Mesothelial cell gene therapy |
| US5961923A (en) | 1995-04-25 | 1999-10-05 | Irori | Matrices with memories and uses thereof |
| US5704910A (en) * | 1995-06-05 | 1998-01-06 | Nephros Therapeutics, Inc. | Implantable device and use therefor |
| US6283951B1 (en) | 1996-10-11 | 2001-09-04 | Transvascular, Inc. | Systems and methods for delivering drugs to selected locations within the body |
| US5902336A (en) | 1996-10-15 | 1999-05-11 | Mirimedical, Inc. | Implantable device and method for removing fluids from the blood of a patient method for implanting such a device and method for treating a patient experiencing renal failure |
| US6022333A (en) | 1997-05-01 | 2000-02-08 | S.L.I.M. Tech, Ltd. | Method and system for removing materials from lymphatic and other fluids |
| EP1341475A1 (en) | 2000-12-01 | 2003-09-10 | Nephros Therapeutics, Inc. | Intravascular blood conditioning device and use thereof |
-
1995
- 1995-06-05 US US08/461,042 patent/US5704910A/en not_active Expired - Lifetime
-
1996
- 1996-06-04 AU AU59740/96A patent/AU716897B2/en not_active Ceased
- 1996-06-04 EP EP96917047A patent/EP0831752B1/en not_active Expired - Lifetime
- 1996-06-04 WO PCT/US1996/008524 patent/WO1996039098A1/en active IP Right Grant
- 1996-06-04 EP EP04020374A patent/EP1486182A3/en not_active Withdrawn
- 1996-06-04 DE DE69633278T patent/DE69633278T2/de not_active Expired - Fee Related
- 1996-06-04 AT AT96917047T patent/ATE274869T1/de not_active IP Right Cessation
- 1996-06-04 JP JP50109697A patent/JP3878672B2/ja not_active Expired - Fee Related
- 1996-06-04 CA CA002222613A patent/CA2222613C/en not_active Expired - Fee Related
-
1997
- 1997-08-20 US US08/915,033 patent/US5911704A/en not_active Expired - Lifetime
-
2000
- 2000-08-31 US US09/651,709 patent/US6572605B1/en not_active Expired - Fee Related
- 2000-12-12 US US09/735,209 patent/US6716208B2/en not_active Expired - Fee Related
-
2003
- 2003-12-19 US US10/741,421 patent/US20050019370A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| AU716897B2 (en) | 2000-03-09 |
| CA2222613C (en) | 2001-08-07 |
| CA2222613A1 (en) | 1996-12-12 |
| US5704910A (en) | 1998-01-06 |
| JPH11506954A (ja) | 1999-06-22 |
| US5911704A (en) | 1999-06-15 |
| EP0831752A1 (en) | 1998-04-01 |
| DE69633278T2 (de) | 2006-08-17 |
| US20010001817A1 (en) | 2001-05-24 |
| US6716208B2 (en) | 2004-04-06 |
| AU5974096A (en) | 1996-12-24 |
| DE69633278D1 (de) | 2004-10-07 |
| WO1996039098A1 (en) | 1996-12-12 |
| ATE274869T1 (de) | 2004-09-15 |
| EP0831752B1 (en) | 2004-09-01 |
| US20050019370A1 (en) | 2005-01-27 |
| EP1486182A3 (en) | 2006-03-15 |
| EP1486182A2 (en) | 2004-12-15 |
| US6572605B1 (en) | 2003-06-03 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP3878672B2 (ja) | 体循環への予め選択された分子の放出器具 | |
| RU2177503C2 (ru) | Макрогранула с секреторными клетками, способ ее получения и способ лечения заболеваний, вызванных нарушением функционирования секреторных клеток | |
| US20020090389A1 (en) | Intravascular blood conditioning device and use thereof | |
| US8048419B2 (en) | Extracorporeal cell-based therapeutic device and delivery system | |
| EP1235536B1 (en) | MEDICAL DEVICE comprising a synthetic surface having nucleic acid for in vivo induction of its endothelialisation | |
| US5324518A (en) | Implantable structure for containing substances for delivery to a body | |
| ES2699690T3 (es) | Dispositivos prevascularizados y métodos relacionados | |
| JP2738881B2 (ja) | 神経治療システム | |
| US7044965B1 (en) | Therapeutic cellular stent | |
| US5916554A (en) | Use of pouch for implantation of living cells | |
| US20090105811A1 (en) | Intravascular Devices for Cell-Based Therapies | |
| WO2005089671A1 (en) | Implantable intravascular delivery device | |
| US20030180264A1 (en) | Devices and methods for delivery of a bioactive compound to an organism | |
| WO1993023013A1 (en) | Extravascular system for infusion of soluble substances |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20050726 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20051012 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20051128 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20060123 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20060523 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20060815 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20061010 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20061106 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| LAPS | Cancellation because of no payment of annual fees |