JP2005291952A - 生体関連物質固定用粒子およびマイクロアレイ - Google Patents
生体関連物質固定用粒子およびマイクロアレイ Download PDFInfo
- Publication number
- JP2005291952A JP2005291952A JP2004108168A JP2004108168A JP2005291952A JP 2005291952 A JP2005291952 A JP 2005291952A JP 2004108168 A JP2004108168 A JP 2004108168A JP 2004108168 A JP2004108168 A JP 2004108168A JP 2005291952 A JP2005291952 A JP 2005291952A
- Authority
- JP
- Japan
- Prior art keywords
- group
- biological substance
- fixing
- substrate
- particle
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- 239000002245 particle Substances 0.000 title claims abstract description 72
- 239000000126 substance Substances 0.000 title claims abstract description 68
- 238000002493 microarray Methods 0.000 title claims abstract description 35
- 229910052751 metal Inorganic materials 0.000 claims abstract description 33
- 239000002184 metal Substances 0.000 claims abstract description 33
- 125000003396 thiol group Chemical group [H]S* 0.000 claims abstract description 27
- 125000000524 functional group Chemical group 0.000 claims abstract description 15
- 239000000758 substrate Substances 0.000 claims description 71
- 239000012620 biological material Substances 0.000 claims description 16
- 239000007850 fluorescent dye Substances 0.000 claims description 16
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 claims description 16
- 239000010931 gold Substances 0.000 claims description 16
- 229910052737 gold Inorganic materials 0.000 claims description 16
- 230000003100 immobilizing effect Effects 0.000 claims description 12
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 10
- 125000003277 amino group Chemical group 0.000 claims description 7
- 229910052709 silver Inorganic materials 0.000 claims description 5
- 239000004332 silver Substances 0.000 claims description 5
- NGNBDVOYPDDBFK-UHFFFAOYSA-N 2-[2,4-di(pentan-2-yl)phenoxy]acetyl chloride Chemical group CCCC(C)C1=CC=C(OCC(Cl)=O)C(C(C)CCC)=C1 NGNBDVOYPDDBFK-UHFFFAOYSA-N 0.000 claims description 4
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 claims description 4
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 claims description 4
- 125000003172 aldehyde group Chemical group 0.000 claims description 4
- 229910052802 copper Inorganic materials 0.000 claims description 4
- 239000010949 copper Substances 0.000 claims description 4
- 125000003055 glycidyl group Chemical group C(C1CO1)* 0.000 claims description 4
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 4
- 125000000542 sulfonic acid group Chemical group 0.000 claims description 4
- 125000005424 tosyloxy group Chemical group S(=O)(=O)(C1=CC=C(C)C=C1)O* 0.000 claims description 4
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical group OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 claims description 3
- 239000000523 sample Substances 0.000 abstract description 20
- 239000000463 material Substances 0.000 abstract description 6
- 238000003556 assay Methods 0.000 abstract description 5
- 230000035945 sensitivity Effects 0.000 abstract description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 36
- 108020004414 DNA Proteins 0.000 description 27
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 27
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 20
- 239000010419 fine particle Substances 0.000 description 20
- 238000000034 method Methods 0.000 description 20
- 239000000243 solution Substances 0.000 description 18
- 239000003298 DNA probe Substances 0.000 description 14
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 14
- 108091034117 Oligonucleotide Proteins 0.000 description 13
- 239000007864 aqueous solution Substances 0.000 description 13
- 238000000018 DNA microarray Methods 0.000 description 12
- 229920002120 photoresistant polymer Polymers 0.000 description 11
- 239000011780 sodium chloride Substances 0.000 description 10
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 9
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 9
- 238000006243 chemical reaction Methods 0.000 description 9
- 238000004519 manufacturing process Methods 0.000 description 9
- 108090000623 proteins and genes Proteins 0.000 description 9
- 108020003215 DNA Probes Proteins 0.000 description 8
- PPBRXRYQALVLMV-UHFFFAOYSA-N Styrene Chemical compound C=CC1=CC=CC=C1 PPBRXRYQALVLMV-UHFFFAOYSA-N 0.000 description 8
- -1 hydrazide group Chemical group 0.000 description 8
- 239000011859 microparticle Substances 0.000 description 7
- OZAIFHULBGXAKX-UHFFFAOYSA-N 2-(2-cyanopropan-2-yldiazenyl)-2-methylpropanenitrile Chemical compound N#CC(C)(C)N=NC(C)(C)C#N OZAIFHULBGXAKX-UHFFFAOYSA-N 0.000 description 6
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 6
- RTAQQCXQSZGOHL-UHFFFAOYSA-N Titanium Chemical compound [Ti] RTAQQCXQSZGOHL-UHFFFAOYSA-N 0.000 description 6
- 239000007853 buffer solution Substances 0.000 description 6
- 239000000975 dye Substances 0.000 description 6
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 description 6
- 239000010703 silicon Substances 0.000 description 6
- 229910052710 silicon Inorganic materials 0.000 description 6
- 229920001909 styrene-acrylic polymer Polymers 0.000 description 6
- 239000000725 suspension Substances 0.000 description 6
- 239000010936 titanium Substances 0.000 description 6
- 229910052719 titanium Inorganic materials 0.000 description 6
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 6
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 5
- 230000000295 complement effect Effects 0.000 description 5
- 238000005259 measurement Methods 0.000 description 5
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 4
- 238000004458 analytical method Methods 0.000 description 4
- 229920001577 copolymer Polymers 0.000 description 4
- 238000002156 mixing Methods 0.000 description 4
- 239000000203 mixture Substances 0.000 description 4
- 229920005989 resin Polymers 0.000 description 4
- 239000011347 resin Substances 0.000 description 4
- ICAIBQMAPBDMDH-UHFFFAOYSA-N 2-(3,5-dimethyl-1h-pyrrol-2-yl)-4-(3,5-dimethylpyrrol-2-ylidene)-3-hydroxycyclobut-2-en-1-one Chemical compound CC1=CC(C)=NC1=C1C(=O)C(C2=C(C=C(C)N2)C)=C1O ICAIBQMAPBDMDH-UHFFFAOYSA-N 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 3
- 239000003638 chemical reducing agent Substances 0.000 description 3
- 238000001816 cooling Methods 0.000 description 3
- 230000007062 hydrolysis Effects 0.000 description 3
- 238000006460 hydrolysis reaction Methods 0.000 description 3
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 3
- 239000012046 mixed solvent Substances 0.000 description 3
- SHOMMGQAMRXRRK-UHFFFAOYSA-N C1C2CCCC1C2 Chemical compound C1C2CCCC1C2 SHOMMGQAMRXRRK-UHFFFAOYSA-N 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- 239000004793 Polystyrene Substances 0.000 description 2
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 2
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 2
- 238000000576 coating method Methods 0.000 description 2
- VHJLVAABSRFDPM-QWWZWVQMSA-N dithiothreitol Chemical compound SC[C@@H](O)[C@H](O)CS VHJLVAABSRFDPM-QWWZWVQMSA-N 0.000 description 2
- 239000012634 fragment Substances 0.000 description 2
- 230000014509 gene expression Effects 0.000 description 2
- 239000011521 glass Substances 0.000 description 2
- 239000011259 mixed solution Substances 0.000 description 2
- 229920003986 novolac Polymers 0.000 description 2
- 239000002773 nucleotide Substances 0.000 description 2
- 125000003729 nucleotide group Chemical group 0.000 description 2
- 239000001048 orange dye Substances 0.000 description 2
- 229920002223 polystyrene Polymers 0.000 description 2
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 2
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 2
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 2
- 125000006239 protecting group Chemical group 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 238000010186 staining Methods 0.000 description 2
- 238000004381 surface treatment Methods 0.000 description 2
- 230000002194 synthesizing effect Effects 0.000 description 2
- 238000009210 therapy by ultrasound Methods 0.000 description 2
- 238000007740 vapor deposition Methods 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- WEERVPDNCOGWJF-UHFFFAOYSA-N 1,4-bis(ethenyl)benzene Chemical compound C=CC1=CC=C(C=C)C=C1 WEERVPDNCOGWJF-UHFFFAOYSA-N 0.000 description 1
- 239000004925 Acrylic resin Substances 0.000 description 1
- 229920000178 Acrylic resin Polymers 0.000 description 1
- 239000004953 Aliphatic polyamide Substances 0.000 description 1
- LPCWKMYWISGVSK-UHFFFAOYSA-N C(C1)C2CCCC1C2 Chemical compound C(C1)C2CCCC1C2 LPCWKMYWISGVSK-UHFFFAOYSA-N 0.000 description 1
- JAPMJSVZDUYFKL-UHFFFAOYSA-N C1C2C1CCC2 Chemical compound C1C2C1CCC2 JAPMJSVZDUYFKL-UHFFFAOYSA-N 0.000 description 1
- XDTMQSROBMDMFD-UHFFFAOYSA-N C1CCCCC1 Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 1
- 108020004635 Complementary DNA Proteins 0.000 description 1
- CERQOIWHTDAKMF-UHFFFAOYSA-N Methacrylic acid Chemical compound CC(=C)C(O)=O CERQOIWHTDAKMF-UHFFFAOYSA-N 0.000 description 1
- 239000005062 Polybutadiene Substances 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- 229920001328 Polyvinylidene chloride Polymers 0.000 description 1
- UCKMPCXJQFINFW-UHFFFAOYSA-N Sulphide Chemical compound [S-2] UCKMPCXJQFINFW-UHFFFAOYSA-N 0.000 description 1
- SRUCYNCHUFMZIT-UHFFFAOYSA-N acetyl prop-2-enoate Chemical compound CC(=O)OC(=O)C=C SRUCYNCHUFMZIT-UHFFFAOYSA-N 0.000 description 1
- XECAHXYUAAWDEL-UHFFFAOYSA-N acrylonitrile butadiene styrene Chemical compound C=CC=C.C=CC#N.C=CC1=CC=CC=C1 XECAHXYUAAWDEL-UHFFFAOYSA-N 0.000 description 1
- 239000004676 acrylonitrile butadiene styrene Substances 0.000 description 1
- 229920000122 acrylonitrile butadiene styrene Polymers 0.000 description 1
- 229920001893 acrylonitrile styrene Polymers 0.000 description 1
- 229920003231 aliphatic polyamide Polymers 0.000 description 1
- 125000003368 amide group Chemical group 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- KVNRLNFWIYMESJ-UHFFFAOYSA-N butyronitrile Chemical compound CCCC#N KVNRLNFWIYMESJ-UHFFFAOYSA-N 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 239000000919 ceramic Substances 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 229940114081 cinnamate Drugs 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 238000010511 deprotection reaction Methods 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 239000004205 dimethyl polysiloxane Substances 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 229920001971 elastomer Polymers 0.000 description 1
- 238000010894 electron beam technology Methods 0.000 description 1
- 125000004185 ester group Chemical group 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 238000002523 gelfiltration Methods 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 238000009396 hybridization Methods 0.000 description 1
- 125000000468 ketone group Chemical group 0.000 description 1
- 150000002576 ketones Chemical class 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 239000012299 nitrogen atmosphere Substances 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 150000007523 nucleic acids Chemical class 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 125000002467 phosphate group Chemical group [H]OP(=O)(O[H])O[*] 0.000 description 1
- 238000000206 photolithography Methods 0.000 description 1
- 238000007747 plating Methods 0.000 description 1
- 229920000435 poly(dimethylsiloxane) Polymers 0.000 description 1
- 229920000779 poly(divinylbenzene) Polymers 0.000 description 1
- 229920003229 poly(methyl methacrylate) Polymers 0.000 description 1
- 229920002239 polyacrylonitrile Polymers 0.000 description 1
- 229920002857 polybutadiene Polymers 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 229920001195 polyisoprene Polymers 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 238000006116 polymerization reaction Methods 0.000 description 1
- 239000004926 polymethyl methacrylate Substances 0.000 description 1
- 229920002635 polyurethane Polymers 0.000 description 1
- 239000004814 polyurethane Substances 0.000 description 1
- 229920002689 polyvinyl acetate Polymers 0.000 description 1
- 239000011118 polyvinyl acetate Substances 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 229920000915 polyvinyl chloride Polymers 0.000 description 1
- 239000004800 polyvinyl chloride Substances 0.000 description 1
- 239000005033 polyvinylidene chloride Substances 0.000 description 1
- 229920002717 polyvinylpyridine Polymers 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- SCUZVMOVTVSBLE-UHFFFAOYSA-N prop-2-enenitrile;styrene Chemical compound C=CC#N.C=CC1=CC=CC=C1 SCUZVMOVTVSBLE-UHFFFAOYSA-N 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 239000005060 rubber Substances 0.000 description 1
- 239000004065 semiconductor Substances 0.000 description 1
- 238000010532 solid phase synthesis reaction Methods 0.000 description 1
- 238000004544 sputter deposition Methods 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- WBYWAXJHAXSJNI-VOTSOKGWSA-M trans-cinnamate Chemical compound [O-]C(=O)\C=C\C1=CC=CC=C1 WBYWAXJHAXSJNI-VOTSOKGWSA-M 0.000 description 1
- XSQUKJJJFZCRTK-UHFFFAOYSA-N urea group Chemical group NC(=O)N XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 1
- JOYRKODLDBILNP-UHFFFAOYSA-N urethane group Chemical group NC(=O)OCC JOYRKODLDBILNP-UHFFFAOYSA-N 0.000 description 1
Images
Landscapes
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
Abstract
【課題】DNAプローブ等の生体関連物質を基板に高密度に固定化することができ、感度の高いマイクロアレイアッセイを可能とする生体関連物質固定用粒子およびこのような粒子を用いたマイクロアレイを提供する。
【解決手段】生体関連物質を固定し、かつ、この固定した生体関連物質を基板に固定するために用いられる生体関連物質固定用粒子であって、粒子状基材の表面にチオール基と生体関連物質を導入可能な官能基とを有する生体関連物質固定用粒子であり、また、このような生体関連物質固定用粒子2と、表面にチオール基と化学的に結合する金属の層3を設けてなる基板1とを有し、生体関連物質固定用粒子2は、基板1の金属層3上に、それ自身が有するチオール基と金属との化学的結合によって固定されているマイクロアレイである。
【選択図】図1
【解決手段】生体関連物質を固定し、かつ、この固定した生体関連物質を基板に固定するために用いられる生体関連物質固定用粒子であって、粒子状基材の表面にチオール基と生体関連物質を導入可能な官能基とを有する生体関連物質固定用粒子であり、また、このような生体関連物質固定用粒子2と、表面にチオール基と化学的に結合する金属の層3を設けてなる基板1とを有し、生体関連物質固定用粒子2は、基板1の金属層3上に、それ自身が有するチオール基と金属との化学的結合によって固定されているマイクロアレイである。
【選択図】図1
Description
本発明は、DNA等の生体関連物質を固定するために用いられる生体関連物質固定用粒子およびこのような粒子を基板に固定させたマイクロアレイに関する。
ゲノムプロジェクトの進歩に伴って、大量の遺伝子情報を一度に処理、解析する必要性が高まり、このようなニーズを満たすための1つの有力な手段として、DNAマイクロアレイまたはDNAチップ(以下、DNAマイクロアレイと称する。)が開発され、実用化されている。
DNAマイクロアレイは、多数のcDNA、DNA断片、オリゴヌクレオチド等(以下、DNAプローブと称する。)をガラス基板またはシリコン基板上に固定したものであり、このDNAマイクロアレイに固定されたDNAプローブとこれに相補的なDNA断片試料とのハイブリダイゼーションを利用することにより、試料に含まれるDNAの状態を定量的または定性的に解析するものである。
DNAマイクロアレイを製造するには、基板表面に多数のDNAプローブを高密度かつ安定に整列させ固定することが必要であり、その作製方法としては、従来から、基板上でオリゴヌクレオチドを合成する方法と、予め調製したDNAプローブを基板上に固定する2つの方法が一般に用いられている。
前者の基板上で合成を行う方法は、基板表面に反応性保護基を有する化学リンカーを導入し、半導体製造で用いるフォトリソグラフィーの技術を用いて脱保護した後、固相合成の手法により保護基を有するヌクレオチドと反応させ、これを繰り返すことによって直接オリゴヌクレオチドを合成していく方法である(例えば、特許文献1参照。)。
また、後者の予め調製したDNAプローブを基板上に固定する方法には、基板表面がプラスの電荷を有するように表面処理を行い、DNAプローブのもつ電荷を利用して担体表面に静電結合させる方法(例えば、特許文献2参照。)と、合成オリゴヌクレオチドに反応活性基を導入する一方、基板にも反応性基を有するように表面処理を行い、オリゴヌクレオチドを基板表面に共有結合させる方法(例えば、特許文献3参照。)とが知られている。
それぞれ一長一短があり、前者では、人工的に合成されたオリゴヌクレオチドが基板表面に共有結合で固定されるため、再現性に優れた測定を行うことができる利点があり、一方、後者では、前者に比べ再現性等に課題を残すものの、スポット用のDNAプローブが用意できれば比較的低コストで製造することができ、また、使用者がカスタマイズを容易に行うことができるという利点を有する。
米国特許第5424186号明細書
特開2002−71686号公報
特開2002−60671号公報
ところで、前述したように、DNAマイクロアレイにおいては、多くのDNAプローブを基板にいかに高密度にかつ安定に固定させるかが非常に重要である。高密度にかつ安定に固定させることにより、測定感度を高め、信頼性の高い解析が可能となる。しかしながら、上述した従来の技術はいずれも、基本的に平らな基板に直接DNAプローブを固定するものであるため、高密度化には限度があった。このため、DNAプローブを基板により高密度に固定化しうる技術が要望されている。
本発明はこのような要望に応えるためになされたもので、DNAプローブ等の生体関連物質を基板により高密度に固定化することができ、より感度の高いマイクロアレイアッセイを可能とする生体関連物質固定用粒子およびこのような粒子を用いたマイクロアレイを提供することを目的とする。
本発明者は、上記の目的を達成するため鋭意研究を重ねた結果、DNAプローブ等の生体関連物質を粒子に固定し、この粒子を基板に固定することにより、基板におけるDNAプローブ等の生体関連物質の固定面積を実質的に増大させることができ、これにより従来に比べより高密度な固定化が可能になることを見出し、本発明を完成するに至った。
すなわち、本願の請求項1に記載の発明の生体関連物質固定用粒子は、生体関連物質を固定し、かつ、この固定した生体関連物質を基板に固定するために用いられる生体関連物質固定用粒子であって、粒子状基材の表面にチオール基と生体関連物質を導入可能な官能基とを有することを特徴とするものである。
請求項2に記載の発明は、請求項1記載の生体関連物質固定用粒子において、前記生体関連物質を導入可能な官能基が、カルボキシル基、スルホン酸基、リン酸基、水酸基、グリシジル基、アミノ基、アルデヒド基、トシルオキシ基および酸クロライド基からなる群より選ばれること特徴とするものである。
請求項3に記載の発明は、請求項1または2記載の生体関連物質固定用粒子において、識別のための蛍光色素をさらに含有していることを特徴とするものである。
また、本願の請求項4に記載の発明のマイクロアレイは、請求項1乃至3のいずれか1項記載の生体関連物質固定用粒子と、表面にチオール基と化学的に結合する金属の層を設けてなる基板とを有し、前記生体関連物質固定用粒子は、前記基板の金属層上に、それ自身が有するチオール基と前記金属との化学的結合によって固定されていることを特徴とするものである。
請求項5に記載の発明は、請求項4記載のマイクロアレイにおいて、前記金属層は金、銀および銅の群から選ばれる金属からなることを特徴とするものである。
請求項6に記載の発明は、請求項4または5記載のマイクロアレイにおいて、前記金属層は所定のパターン形状に設けられていることを特徴とするものである。
請求項7に記載の発明は、請求項4乃至6のいずれか1項記載のマイクロアレイにおいて、前記生体関連物質固定用粒子に生体関連物質が固定されていることを特徴とするものである。
本発明の生体関連物質固定用粒子およびマイクロアレイによれば、DNAプローブ等の生体関連物質を基板により高密度に固定化することができ、より感度の高いマイクロアレイアッセイが可能となる。しかも、製造にあたって特殊な装置を必要としないため、製造コストが従来に比べ大きく増大することもない。また、解析にあたっても特殊な測定装置を用いる必要がなく、簡易的かつ経済的な測定が可能である。
以下、本発明を詳細に説明する。
本発明において、生体関連物質としては、核酸(DNAおよびRNA)、アミノ酸、ペプチド、たんぱく質、抗体等が挙げられる。これらの生体関連物質には、次述する生体関連物質固定用粒子が有する官能基と結合可能な官能基が導入されていてもよい。
本発明の生体関連物質固定用粒子は、粒子状基材の表面にチオール基(−SH)と生体関連物質を導入可能な官能基を有するものである。
生体関連物質を導入可能な官能基は、上記のような生体関連物質が結合することができる官能基であれば特に限定されるものではなく、例えば、カルボキシル基、スルホン酸基、リン酸基、水酸基、グリシジル基、アミノ基、ウレタン基、アミド基、ヒドラジド基、ウレア基、アルデヒド基、ケトン基、トシルオキシ基、酸クロライド基、エステル基等が挙げられる。これらの官能基のなかでも、結合の強さ、導入の容易さ等の観点から、カルボキシル基、スルホン酸基、リン酸基、水酸基、グリシジル基、アミノ基、アルデヒド基、トシルオキシ基、酸クロライド基が好ましい。
また、粒子状基材としては、アクリル系樹脂、ポリスチレン、アクリル酸−スチレン共重合体、メタクリル酸−スチレン共重合体、アクリロニトリル−スチレン共重合体、アクリロニトリル−ブタジエン−スチレン共重合体、ポリビニルピロリドン、ポリ塩化ビニル、ポリ塩化ビニリデン、脂肪族ポリアミド、ポリエチレン、ポリプロピレン、エチレン−プロピレン共重合体、ポリビニルアルコール、ポリ酢酸ビニル、ポリアクリロニトリル、ポリアクロレイン、ポリブタジエン、ポリウレタン、ポリイソプレン、ポリジビニルベンゼン、ポリビニルピリジン、ポリジメチルシロキサン等の樹脂を主体とする微粒子が挙げられる。これらのなかでも、ポリスチレン、メタクリル酸−スチレン共重合体のようなスチレンと(メタ)アクリル酸(エステル)との共重合体が好ましい。これらの微粒子には、必要に応じて、識別のための蛍光色素が内包されていてもよい。このような蛍光色素としては、1,3−ビス[(1,3−ジヒドロ−1,3,3−トリメチル−2H−インドール−2−イリデン)メチル]−2,4−ジヒドロキシ−シクロブテンジイリウムおよびその塩、2−(3,5−ジメチルピロール−2−イル)−4−(3,5−ジメチル−2H−ピロール−2−イリデン)−3−ヒドロキシ−2−シクロブテン−1−オン、3,6−ジアミノ−2,5−ピラジンカルボニトリル等が例示される。これらの蛍光色素は1種を単独で使用してもよく、2種以上を適宜混合して使用してもよい。
本発明の生体関連物質固定用粒子を得るには、例えば、上記のような微粒子を製造する際に、重合成分としてチオール基および生体関連物質を導入可能な官能基を有するものを用いるようにすればよい。なお、このようにして得られた生体関連物質固定用粒子は、すぐに使用しない場合には、チオール基の酸化を防止するため、ジチオトレイトール(DTT)のような還元剤を含有する溶液中に保存しておき、使用直前に、還元剤を除去するようにする。還元剤は、ゲルろ過法や酢酸エチル等の有機溶媒に溶解する方法等により除去することができる。
本発明の生体関連物質固定用粒子の粒径は、用途に応じて適宜選択することができるが、通常、0.1μm〜100μmの範囲である。
次に、このような生体関連物質固定用粒子を用いたマイクロアレイについて説明する。
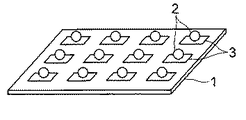
すなわち、図1は本発明のマイクロアレイの第1の実施形態を模式的に示した斜視図である。
図1に示すように、このマイクロアレイは、基板1と、この基板1上に固定された多数の前記した生体関連物質固定用粒子2とから構成されている。基板1の表面にはチオール基と化学的に結合(配位結合)する金属、例えば金、銀、銅等からなる層3が所定のパターンで設けられており、生体関連物質固定用粒子2は、この金属層3上に、それ自身が有するチオール基と前記金属とが配位結合することによって固定されている。
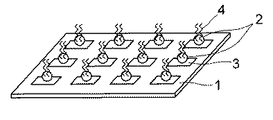
なお、この例は、測定用の生体関連物質を適宜結合させる操作を行うことで、使用者がカスタマイズできる構成をとっているが、図2に示すように、すぐに測定を行うことができるように、予め所定の生体関連物質4を生体関連物質固定用粒子2に固定させた構成としてもよい。生体関連物質4は、生体関連物質固定用粒子2表面の生体関連物質を導入可能な官能基に結合し、固定される。
基板1の材料としては、シリコン、ガラス、樹脂、セラミック等、従来よりマイクロアレイ用基板の材料として使用されているものを用いることができる。
金属層3の金属の種類としては、上述したように、金、銀、銅等が挙げられるが、結合強さの観点から、なかでも金および銀が好ましい。金属層3は、蒸着法、めっき法、スパッタ法、印刷法等により形成することができ、その層厚は、平均厚さとして0.5μm〜1μmの範囲が適当である。
このように構成されるマイクロアレイは、例えば次のように製造することができる。
すなわち、図3は、上記マイクロアレイの製造工程の一例を示す図である。
図3において、まず、基板1上にフォトレジストを塗布し乾燥させてフォトレジスト膜5を形成した後、このフォトレジスト膜5をフォトマスク6を介して露光し(図3(a))、現像して、所定のパターンを形成する(図3(b))。フォトレジストには、例えば、ポリメチルメタクリレート系、ノボラック樹脂系、環化ゴム系、けい皮酸ポリマー系、ポリメチルイソプロペニルケトン系等の各種ポジ型およびネガ型のフォトレジストを使用することができる。
図3において、まず、基板1上にフォトレジストを塗布し乾燥させてフォトレジスト膜5を形成した後、このフォトレジスト膜5をフォトマスク6を介して露光し(図3(a))、現像して、所定のパターンを形成する(図3(b))。フォトレジストには、例えば、ポリメチルメタクリレート系、ノボラック樹脂系、環化ゴム系、けい皮酸ポリマー系、ポリメチルイソプロペニルケトン系等の各種ポジ型およびネガ型のフォトレジストを使用することができる。
次いで、これらの上にチタンからなる被膜7およびチオール基と配位結合する金属として例えば金からなる被膜8を順に蒸着法などにより形成する(図3(c))。続いて、フォトマスク6を、その上に形成されたそれぞれチタンおよび金等からなる被膜7、8とともに剥離し、さらに、フォトレジスト膜5も除去する。この結果、表面に所定パターンの金等からなる層3が形成された基板1が得られる(図3(d))。
この後、上記基板1を、生体関連物質固定用粒子2を分散させた4℃〜100℃程度の緩衝液中に5分乃至24時間程度浸漬することによって(図3(e))、生体関連物質固定用粒子2のチオール基と金とが配位結合し、生体関連物質固定用粒子2が金属層3上に固定され、上記構成のマイクロアレイが作製される。
生体関連物質4は、生体関連物質固定用粒子2の表面に設けられた官能基と生体関連物質が含有するもしくは導入された官能基を反応させ結合させることにより、生体関連物質固定用粒子2に固定することができる。例えば、生体関連物質4としてオリゴヌクレオチドを、表面にカルボキシル基を有する生体関連物質固定用粒子2に固定する場合、オリゴヌクレオチド末端にはアミノ基を導入しておき、これらの基を反応させて塩を形成させたり、あるいは縮合剤を共存させることによりアミド結合を形成させたりすることにより、オリゴヌクレオチドを生体関連物質固定用粒子2上に固定することができる。
なお、図2に示すマイクロアレイの場合には、生体関連物質固定用粒子2を基板1に固定する前に生体関連物質4を予め固定しておいてもよい。
本実施形態のマイクロアレイにおいては、基板1上に生体関連物質固定用粒子2を介して生体関連物質4が固定されるため、生体関連物質4を高密度に固定化することができる。したがって、感度の高いマイクロアレイアッセイが可能となる。しかも、生体関連物質固定用粒子2の基板1への固定は、生体関連物質固定用粒子2表面に設けたチオール基と基板1表面に設けた金属層3の金属との配位結合によってなされるため、作製にあたって特殊な装置を必要とせず、簡便かつ低コストで作製することができる。さらに、遺伝子発現等の解析に使用する場合、従来より知られる方法で行うことができ、特殊な装置を使用する必要もない。
次に、本発明の他の実施形態について説明する。
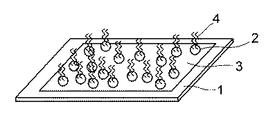
図4は、本発明のマイクロアレイの第2の実施形態にかかる斜視図であり、図1に共通する部分には同一符号を付し、重複する説明を省略する。
本実施形態のマイクロアレイは、第1の実施形態において、生体関連物質固定用粒子2として、識別のための蛍光色素を内包したものを用いるとともに、基材1上のほぼ全面に金属層3を設けたものであり、生体関連物質固定用粒子2は金属層2上にランダムに固定されている。蛍光色素が内包された生体関連物質固定用粒子2は、それ自身で識別可能であるため、第1の実施形態のように金属層3をパターンニングして、生体関連物質固定用粒子2を所定の位置に配置せずとも、それぞれに固定されている生体関連物質4を特定し、解析することができる。
本実施形態のマイクロアレイにおいては、第1の実施形態の場合と同様、基板1上に生体関連物質固定用粒子2を介して生体関連物質4が固定されるため、生体関連物質4を高密度に固定化することができ、感度の高いマイクロアレイアッセイが可能となる、また、生体関連物質固定用粒子2の基板1への固定は、生体関連物質固定用粒子2表面に設けたチオール基と基板1表面に設けた金属層3の金属との配位結合によってなされるため、作製にあたって特殊な装置を必要とせず、簡便かつ低コストで作製することができる。さらに、遺伝子発現等の解析に使用する場合、従来より知られる方法で行うことができ、特殊な装置を使用する必要もない。そのうえ、金属層3をパターンニングする必要がないため、第1の実施形態のマイクロアレイに比べ、より簡単に製造することができる。
なお、本実施形態において、金属層3は基板1上のほぼ全面に設けられているが、所要の生体関連物質固定用粒子2を固定することができれば特にこのような例に限定されるものではなく、例えば網目状やドット状等であってもよい。
また、使用にあたって、生体関連物質固定用粒子2に生体関連物質4を予め固定しておくだけでなく、緩衝液に生体関連物質固定用粒子2を懸濁した状態で、予め固定した生体関連物質4と解析対象の生体関連物質とを反応させた後、基板1上に固定化するようにしてもよい。このような手法を用いることにより、解析対象の生体関連物質との反応を促進し、反応効率を高めることができる。
次に本発明の具体的な実施例を記載するが、本発明はこれらの実施例に限定されるものでないことはいうまでもない。
実施例1
窒素雰囲気下、ジメルカプトジフェニルスルフィド10.7g(43mmol)、p−ジビニルベンゼン5.57g(43mmol)、2,2′−アゾビスイソブチロニトリル0.13g(0.79mmol)およびポリビニルピロリドン1.71gを、テトラヒドロフラン51mlおよびメタノール34mlの混合溶媒に溶解し、60℃で12時間反応させた。反応終了後、分散液を室温まで降温し、遠心分離によって微粒子を分離した。この分離した微粒子をメタノールで洗浄し、平均粒径4μmの生体関連物質固定用粒子を得た。
窒素雰囲気下、ジメルカプトジフェニルスルフィド10.7g(43mmol)、p−ジビニルベンゼン5.57g(43mmol)、2,2′−アゾビスイソブチロニトリル0.13g(0.79mmol)およびポリビニルピロリドン1.71gを、テトラヒドロフラン51mlおよびメタノール34mlの混合溶媒に溶解し、60℃で12時間反応させた。反応終了後、分散液を室温まで降温し、遠心分離によって微粒子を分離した。この分離した微粒子をメタノールで洗浄し、平均粒径4μmの生体関連物質固定用粒子を得た。
また、シリコン基板(50mm×90mm×0.6mm)上にビーム径3μmの電子ビームを用いて正方格子(5μm×5μm)を描画し、その上にチタンおよび金を順にそれぞれ30nm厚および500nm厚に蒸着した。
この基板を、上記生体関連物質固定用粒子を濃度が1wt%となるように分散させた緩衝液(ドデシル硫酸ナトリウム水溶液)中に80℃で約1時間浸漬して、生体関連物質固定用粒子を基板上に固定させた。固定量は約600万個であった。
次いで、末端にアミノ基を導入したプローブDNAを、0.15M塩化ナトリウムおよび15mMクエン酸水溶液に、その濃度が0.5mg/mlとなるように溶解した溶液に、上記の生体関連物質固定用粒子を固定した基板を浸漬して、75℃で1時間インキュベートし、さらに、0.1%ドデシル硫酸ナトリウム水溶液、純水およびエタノールに順に浸漬した後、室温で乾燥して、DNAマイクロアレイを作製した。
得られたDNAマイクロアレイ上に、ターゲットDNAとしてその配列が先に固定したプローブDNAに相補的な配列を有し、蛍光色素(フルオレセイン)で標識したオリゴヌクレオチドを0.15M塩化ナトリウムおよび15mMクエン酸水溶液に、その濃度が200ng/mlとなるように溶解した溶液をスポットし、45℃で約24時間インキュベートした。その後、0.15M塩化ナトリウムおよび15mMクエン酸水溶液で洗浄し、乾燥させた。基板上の蛍光強度を蛍光スキャニング装置で計測したところ、蛍光が確認され、ハイブリダイズ体が得られたことが確認された。
実施例2
パラ位にチオール基を導入し、このチオール基をアセチル基で保護したスチレン26.7g(0.17mol)およびアクリル酸アセチル4.58g(0.04mol)をトルエンに溶解した後、2,2′−アゾビスイソブチロニトリル0.45g(2.74mmol)を加え、70℃で10時間反応させた。反応終了後、反応液を室温まで降温し、メタノールを60ml加えた後、水酸化ナトリウムを加えて加水分解を行い、チオール基とカルボキシル基を有するスチレン−アクリル共重合体を得た。
パラ位にチオール基を導入し、このチオール基をアセチル基で保護したスチレン26.7g(0.17mol)およびアクリル酸アセチル4.58g(0.04mol)をトルエンに溶解した後、2,2′−アゾビスイソブチロニトリル0.45g(2.74mmol)を加え、70℃で10時間反応させた。反応終了後、反応液を室温まで降温し、メタノールを60ml加えた後、水酸化ナトリウムを加えて加水分解を行い、チオール基とカルボキシル基を有するスチレン−アクリル共重合体を得た。
上記スチレン−アクリル共重合体100重量部を熱ロールにより120℃〜180℃で加熱混練した。冷却後、ハンマーミルで粗粉砕し、さらにジェットミルを用いて微粉砕し、分級して、平均粒径10μmの生体関連物質固定用粒子を得た。
また、シリコン基板(50mm×90mm×0.6mm)上に、図3に示した方法で、正方格子(12μm×12μm)が縦横に配列された形状の金からなるパターンを形成した。すなわち、まず、基板1上にフォトレジストとしてノボラック樹脂を塗布し乾燥させて2μm厚のフォトレジスト膜5を形成した後、このフォトレジスト膜5をフォトマスク6を介して露光し現像した。次いで、これらの上にチタンおよび金を順にそれぞれ50nm厚および500nm厚に蒸着した。続いて、フォトマスク6を、その上に形成されたそれぞれチタンおよび金からなる被膜とともに剥離し、さらに、フォトレジスト膜5を除去した。
この基板を、上記生体関連物質固定用粒子を濃度が1wt%となるように分散させた緩衝液中に80℃で約1時間浸漬して、生体関連物質固定用粒子を基板上に固定させた。固定量は約180万個であった。
次いで、末端にアミノ基を導入したプローブDNAを、0.15M塩化ナトリウムおよび15mMクエン酸水溶液に、その濃度が0.5mg/mlとなるように溶解した溶液に、上記の生体関連物質固定用粒子を固定した基板を浸漬して、75℃で1時間インキュベートし、さらに、0.1%ドデシル硫酸ナトリウム水溶液、純水およびエタノールに順に浸漬した後、室温で乾燥して、DNAマイクロアレイを作製した。
得られたDNAマイクロアレイ上に、ターゲットDNAとしてその配列が先に固定したプローブDNAに相補的な配列を有し、蛍光色素(フルオレセイン)で標識したオリゴヌクレオチドを0.15M塩化ナトリウムおよび15mMクエン酸水溶液に、その濃度が200ng/mlとなるように溶解した溶液をスポットし、45℃で約24時間インキュベートした。その後、0.15M塩化ナトリウムおよび15mMクエン酸水溶液で洗浄し、乾燥させた。基板上の蛍光強度を蛍光スキャニング装置で計測したところ、蛍光が確認され、ハイブリダイズ体が得られたことが確認された。
実施例3
パラ位にチオール基を導入し、このチオール基をアセチル基で保護したスチレン23.2g(0.15mol)およびメタクリル酸2−(ジメチルアミノ)エチルエステル7.01g(0.04mol)をトルエン160mlに溶解した後、2,2′−アゾビスイソブチロニトリル0.39g(2.38mmol)を加え、70℃で10時間反応させた。反応終了後、反応液を室温まで降温し、メタノールを53ml加えた後、水酸化ナトリウムを加えて加水分解を行い、チオール基とカルボキシル基を有するスチレン−アクリル共重合体を得た。
パラ位にチオール基を導入し、このチオール基をアセチル基で保護したスチレン23.2g(0.15mol)およびメタクリル酸2−(ジメチルアミノ)エチルエステル7.01g(0.04mol)をトルエン160mlに溶解した後、2,2′−アゾビスイソブチロニトリル0.39g(2.38mmol)を加え、70℃で10時間反応させた。反応終了後、反応液を室温まで降温し、メタノールを53ml加えた後、水酸化ナトリウムを加えて加水分解を行い、チオール基とカルボキシル基を有するスチレン−アクリル共重合体を得た。
上記スチレン−アクリル共重合体100重量部を熱ロールにより120℃〜180℃で加熱混練した。冷却後、ハンマーミルで粗粉砕し、さらにジェットミルを用いて微粉砕し、分級して、平均粒径10μmの微粒子を得た。
また、赤蛍光染料1,3−ビス[(1,3−ジヒドロ−1,3,3−トリメチル−2H−インドール−2−イリデン)メチル]−2,4−ジヒドロキシシクロブテンジイリウムと、オレンジ染料2−(3,5−ジメチルピロール−2−イル)−4−(3,5−ジメチル−2H−ピロール−2−イリデン)−3−ヒドロキシ−2−シクロブテン−1−オンとを異なる比率でクロロホルムとエタノールの混合溶媒(混合比 2:3)に溶解して、2種の染料の混合比の異なる64種の混合染料液を調製した。
これらの各混合染料液0.6mlに上記微粒子60mgをそれぞれ懸濁させ、2時間の超音波処理を行った。処理後、各懸濁液から微粒子を分離し、1.2mlのメタノールに懸濁させた後、さらに超音波処理およびメタノール洗浄を行い、64個(種)の微粒子ライブラリー(同種の蛍光染料を異なる比率で配合したもの)を作成した。
得られた64個の微粒子ライブラリーをそれぞれ緩衝液に濃度が1wt%となるように懸濁させた後、これらの各懸濁液に、末端にカルボキシル基を導入したプローブDNAを、0.15M塩化ナトリウムおよび15mMクエン酸水溶液に、その濃度が0.5mg/mlとなるように溶解した溶液を混合して、75℃で1時間インキュベートし、微粒子にプローブDNAを導入した。この後、微粒子を分離し、0.1%ドデシル硫酸ナトリウム水溶液、純水およびエタノールに順に浸漬した後、純水に濃度が1wt%となるように懸濁させた。なお、64個の微粒子ライブラリーのうちの1つに、目的遺伝子検出のためのプローブDNAを導入し、その他には目的遺伝子を有さないプローブDNAを導入した。
次いで、これらのプローブDNAを導入した64個の微粒子ライブラリーを含む懸濁液を混合し、この混合液中に、実施例2の場合と同様にして、シリコン基板(50mm×90mm×0.6mm)上に、正方格子(12μm×12μm)が縦横に配列された形状の金からなるパターンを形成した基板を、80℃で約1時間浸漬して、プローブDNAを導入した微粒子を基板上に固定させた。
この後、上記基板上に、ターゲットDNAとしてその配列が先に固定した目的遺伝子検出のためのプローブDNAに相補的な配列を有し、蛍光色素(フルオレセイン)で標識したオリゴヌクレオチドを0.15M塩化ナトリウムおよび15mMクエン酸水溶液に、その濃度が200ng/mlとなるように溶解した溶液をスポットし、45℃で約24時間インキュベートした。その後、0.15M塩化ナトリウムおよび15mMクエン酸水溶液で洗浄し、乾燥させた。基板上の蛍光強度を蛍光スキャニング装置で計測したところ、フルオロセイン蛍光が確認され、ハイブリダイズ体が得られたことが確認された。また、微粒子の染色蛍光によって目的遺伝子が確認された。
実施例4
パラ位にチオール基を導入し、このチオール基をアセチル基で保護したスチレン23.2g(0.15mol)およびメタクリル酸2−(ジメチルアミノ)エチルエステル7.01g(0.04mol)をトルエン160mlに溶解した後、2,2′−アゾビスイソブチロニトリル0.39g(2.38mmol)を加え、70℃で10時間反応させた。反応終了後、反応液を室温まで降温し、メタノールを53ml加えた後、水酸化ナトリウムを加えて加水分解を行い、チオール基とカルボキシル基を有するスチレン−アクリル共重合体を得た。
パラ位にチオール基を導入し、このチオール基をアセチル基で保護したスチレン23.2g(0.15mol)およびメタクリル酸2−(ジメチルアミノ)エチルエステル7.01g(0.04mol)をトルエン160mlに溶解した後、2,2′−アゾビスイソブチロニトリル0.39g(2.38mmol)を加え、70℃で10時間反応させた。反応終了後、反応液を室温まで降温し、メタノールを53ml加えた後、水酸化ナトリウムを加えて加水分解を行い、チオール基とカルボキシル基を有するスチレン−アクリル共重合体を得た。
上記スチレン−アクリル共重合体100重量部を熱ロールにより120℃〜180℃で加熱混練した。冷却後、ハンマーミルで粗粉砕し、さらにジェットミルを用いて微粉砕し、分級して、平均粒径10μmの微粒子を得た。
また、赤蛍光染料1,3−ビス[(1,3−ジヒドロ−1,3,3−トリメチル−2H−インドール−2−イリデン)メチル]−2,4−ジヒドロキシシクロブテンジイリウムと、オレンジ染料2−(3,5−ジメチルピロール−2−イル)−4−(3,5−ジメチル−2H−ピロール−2−イリデン)−3−ヒドロキシ−2−シクロブテン−1−オンと、黄緑蛍光染料3,6−ジアミノ−2,5−ピラジンカルボニトリルとを、異なる比率でクロロホルムとエタノールの混合溶媒(混合比 2:3)に溶解して、3種の染料の混合比の異なる128種の混合染料液を調製した。
これらの各混合染料液0.6mlに上記微粒子60mgをそれぞれ懸濁させ、2時間の超音波処理を行った。処理後、各懸濁液から微粒子を分離し、1.2mlのメタノールに懸濁させた後、さらに超音波処理およびメタノール洗浄を行い、128個(種)の微粒子ライブラリー(同種の蛍光染料を異なる比率で配合したもの)を作成した。
得られた128個の微粒子ライブラリーをそれぞれ緩衝液に濃度が1wt%となるように懸濁させた後、これらの各懸濁液に、末端にカルボキシル基を導入したプローブDNAを、0.15M塩化ナトリウムおよび15mMクエン酸水溶液に、その濃度が0.5mg/mlとなるように溶解した溶液を混合して、75℃で1時間インキュベートし、微粒子にプローブDNAを導入した。この後、微粒子を分離し、0.1%ドデシル硫酸ナトリウム水溶液、純水およびエタノールに順に浸漬した後、純水に濃度が1wt%となるように懸濁させた。なお、128個の微粒子ライブラリーのうちの1つに、目的遺伝子検出のためのプローブDNAを導入し、その他には目的遺伝子を有さないプローブDNAを導入した。
次いで、これらのプローブDNAを導入した128個の微粒子ライブラリーを含む懸濁液を混合し、この混合液中に、実施例2の場合と同様にして、シリコン基板(50mm×90mm×0.6mm)上に、正方格子(12μm×12μm)が縦横に配列された形状の金からなるパターンを形成した基板を、80℃で約1時間浸漬して、プローブDNAを導入した微粒子を基板上に固定させた。
この後、上記基板上に、ターゲットDNAとしてその配列が先に固定した目的遺伝子検出のためのプローブDNAに相補的な配列を有し、蛍光色素(フルオレセイン)で標識したオリゴヌクレオチドを0.15M塩化ナトリウムおよび15mMクエン酸水溶液に、その濃度が200ng/mlとなるように溶解した溶液をスポットし、45℃で約24時間インキュベートした。その後、0.15M塩化ナトリウムおよび15mMクエン酸水溶液で洗浄し、乾燥させた。基板上の蛍光強度を蛍光スキャニング装置で計測したところ、フルオロセイン蛍光が確認され、ハイブリダイズ体が得られたことが確認された。また、微粒子の染色蛍光によって目的遺伝子が確認された。
1…基板、2…生体関連物質固定用粒子、3…金属層、4…生体関連物質、5…フォトレジスト膜、6…フォトマスク、7…チタン被膜、8…金被膜
Claims (7)
- 生体関連物質を固定し、かつ、この固定した生体関連物質を基板に固定するために用いられる生体関連物質固定用粒子であって、
粒子状基材の表面にチオール基と生体関連物質を導入可能な官能基とを有することを特徴とする生体関連物質固定用粒子。 - 前記生体関連物質を導入可能な官能基が、カルボキシル基、スルホン酸基、リン酸基、水酸基、グリシジル基、アミノ基、アルデヒド基、トシルオキシ基および酸クロライド基からなる群より選ばれること特徴とする請求項1記載の生体関連物質固定用粒子。
- 識別のための蛍光色素をさらに含有していることを特徴とする請求項1または2記載の生体関連物質固定用粒子。
- 請求項1乃至3のいずれか1項記載の生体関連物質固定用粒子と、表面にチオール基と化学的に結合する金属の層を設けてなる基板とを有し、前記生体関連物質固定用粒子は、前記基板の金属層上に、それ自身が有するチオール基と前記金属との化学的結合によって固定されていることを特徴とするマイクロアレイ。
- 前記金属層は金、銀および銅の群から選ばれる金属からなることを特徴とする請求項4記載のマイクロアレイ。
- 前記金属層は所定のパターン形状に設けられていることを特徴とする請求項4または5記載のマイクロアレイ。
- 前記生体関連物質固定用粒子に生体関連物質が固定されていることを特徴とする請求項4乃至6のいずれか1項記載のマイクロアレイ。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004108168A JP2005291952A (ja) | 2004-03-31 | 2004-03-31 | 生体関連物質固定用粒子およびマイクロアレイ |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004108168A JP2005291952A (ja) | 2004-03-31 | 2004-03-31 | 生体関連物質固定用粒子およびマイクロアレイ |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2005291952A true JP2005291952A (ja) | 2005-10-20 |
Family
ID=35325037
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004108168A Withdrawn JP2005291952A (ja) | 2004-03-31 | 2004-03-31 | 生体関連物質固定用粒子およびマイクロアレイ |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP2005291952A (ja) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR100891095B1 (ko) * | 2007-02-13 | 2009-03-31 | 삼성전자주식회사 | 마이크로 어레이 및 그 제조 방법 |
| KR100891096B1 (ko) * | 2007-02-13 | 2009-03-31 | 삼성전자주식회사 | 올리고머 프로브 어레이 및 이의 제조 방법 |
| JP2010243454A (ja) * | 2009-04-10 | 2010-10-28 | Hitachi High-Technologies Corp | 核酸分析デバイス、及び核酸分析装置 |
| JP2012191874A (ja) * | 2011-03-15 | 2012-10-11 | Hitachi High-Technologies Corp | 核酸分析デバイス、及び核酸分析装置 |
-
2004
- 2004-03-31 JP JP2004108168A patent/JP2005291952A/ja not_active Withdrawn
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR100891095B1 (ko) * | 2007-02-13 | 2009-03-31 | 삼성전자주식회사 | 마이크로 어레이 및 그 제조 방법 |
| KR100891096B1 (ko) * | 2007-02-13 | 2009-03-31 | 삼성전자주식회사 | 올리고머 프로브 어레이 및 이의 제조 방법 |
| JP2010243454A (ja) * | 2009-04-10 | 2010-10-28 | Hitachi High-Technologies Corp | 核酸分析デバイス、及び核酸分析装置 |
| JP2012191874A (ja) * | 2011-03-15 | 2012-10-11 | Hitachi High-Technologies Corp | 核酸分析デバイス、及び核酸分析装置 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4420020B2 (ja) | 溶液を攪拌する方法 | |
| JP4146239B2 (ja) | オリゴヌクレオチド修飾粒子をベースとするバイオバーコード | |
| US9993794B2 (en) | Single molecule loading methods and compositions | |
| ES2538038T3 (es) | Análisis multiplexado de muestras de ensayo | |
| CN103842821A (zh) | 生物分子分析方法及生物分子分析装置 | |
| WO2009109809A2 (en) | Atomic force microscope as an analyzing tool for biochip | |
| WO2010087121A1 (ja) | 核酸分析デバイス、及び核酸分析装置 | |
| JP2003523185A (ja) | 強磁性流体に基づくアレイ | |
| JP2001108683A (ja) | Dna断片固定固相担体、dna断片の固定方法および核酸断片の検出方法 | |
| JP2002176977A (ja) | プローブ分子が固定された検出具の処理方法及び水性処理液 | |
| JPWO2013011611A1 (ja) | 核酸分析方法及び核酸分析装置 | |
| JP5214941B2 (ja) | 単一プローブ分子素子及び単一プローブ分子素子の製造方法 | |
| JP2001128683A (ja) | Dna断片の固定方法、dnaチップおよび核酸断片の検出方法 | |
| JP2005291952A (ja) | 生体関連物質固定用粒子およびマイクロアレイ | |
| JP5309092B2 (ja) | 核酸分析用デバイス,核酸分析装置、及び核酸分析用デバイスの製造方法 | |
| JP2005502366A (ja) | 読み取り、検出、定量方法、前記方法で使用するハイブリッドまたは複合体およびそれを使用するバイオチップ | |
| EP1258731B1 (en) | Reactive solid support for DNA fragment detection | |
| JP2003329685A (ja) | プローブ分子が固定された検出具の処理方法及び水性処理液 | |
| JP2005291951A (ja) | 高分子微粒子の固定方法 | |
| JP3342695B2 (ja) | 反応性固相担体及びdna断片検出用具 | |
| JP3568197B2 (ja) | 反応性固相担体及びdna断片検出用具 | |
| JP3857075B2 (ja) | 反応性固相担体及びdna断片検出用具 | |
| JP3975042B2 (ja) | 固相担体表面へのdna断片の固定方法及びdnaチップ | |
| EP1256805B1 (en) | Biological material chip | |
| JP2001128697A (ja) | Dna断片固定固相担体、dna断片の固定方法および核酸断片の検出方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A300 | Withdrawal of application because of no request for examination |
Free format text: JAPANESE INTERMEDIATE CODE: A300 Effective date: 20070605 |