JP2004536282A - 胃がん患者の血清中の、血中を循環するエプスタイン・バーウイルスdna - Google Patents
胃がん患者の血清中の、血中を循環するエプスタイン・バーウイルスdna Download PDFInfo
- Publication number
- JP2004536282A JP2004536282A JP2002561083A JP2002561083A JP2004536282A JP 2004536282 A JP2004536282 A JP 2004536282A JP 2002561083 A JP2002561083 A JP 2002561083A JP 2002561083 A JP2002561083 A JP 2002561083A JP 2004536282 A JP2004536282 A JP 2004536282A
- Authority
- JP
- Japan
- Prior art keywords
- patient
- ebv
- dna
- ebv dna
- present
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6883—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material
- C12Q1/6886—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material for cancer
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/70—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving virus or bacteriophage
- C12Q1/701—Specific hybridization probes
- C12Q1/705—Specific hybridization probes for herpetoviridae, e.g. herpes simplex, varicella zoster
Landscapes
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Immunology (AREA)
- Zoology (AREA)
- Engineering & Computer Science (AREA)
- Wood Science & Technology (AREA)
- Genetics & Genomics (AREA)
- Analytical Chemistry (AREA)
- Biophysics (AREA)
- Pathology (AREA)
- Microbiology (AREA)
- Biotechnology (AREA)
- Physics & Mathematics (AREA)
- Biochemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Virology (AREA)
- Oncology (AREA)
- Hospice & Palliative Care (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Saccharide Compounds (AREA)
Abstract
Description
【0001】
本発明は、エプスタイン・バーウイルスが患者の血液由来の細胞を含まない液体に見出されることがあり、そのようなウイルスが見出されかつその患者が胃炎であるときは、その患者は胃炎から胃がんへと進行しやすい傾向を有する、という発見に関する。
【背景技術】
【0002】
がん由来のDNAが様々な腫瘍のがん細胞から放出されうることが知られている(アンカーら(Anker et al.)、Cancer Metastasis Rev.第18巻、65−73ページ、1999年)。例としては、すい臓がん由来のがん遺伝子突然変異体(アンカーら(Anker et al.)、Gastroenterology、第112巻、4−1120ページ、1997年)、肺がんにおけるマイクロサテライトの変化(チェンら(Chen et al.)、Nature Medicine、第2巻、3−1035ページ、1996年)、および肝臓がん由来のエピジェネティックな変化(ウォンら(Wong et al.)、Cancer Res.第59巻、3ページ、1999年)などがある。さらに、ウイルス感染と関連があるとして知られている多くのがんの血液循環中にウイルスDNAが見出されている。例としては、上咽頭がん(マチラングラら(Mutirangura et al.)、Clin Cancer Res.第4巻、665−9ページ、1998年;ローら(Lo et al.)、Cancer Res.第59巻、1188−91ページ、1999年)およびある種のリンパ腫(レイら(Lei et al.)、Br J Haematol.第111巻、239−46ページ、2000年;ガラガーら(Gallagher et al.)、Int J Cancer .第84巻、442−8ページ、1999年;ドルーエら(Drouet et al.)、J Med Virol.第57巻、383−9ページ、1999年)からのエプスタイン・バーウイルス(EBV)DNA、ならびに頭部および頚部がんからのヒトパピローマウイルスDNA(カポネら(Capone et al.)、Clin Cancer Res.第6巻、4171−5ページ、2000年)などがある。
【0003】
近年、がん患者の血漿および血清中のがん由来DNAの存在に非常に注目が集まっている(チェン、エックス キューら(Chen,X.Q.et al.)Nat.Med.第2巻、1033−1035ページ、1996年;ノウロツ、エイチら(Nawroz,H.et al.)、Nat.Med.第2巻、1035−1037ページ、1996年)。ウイルスに関連のあるがんについては、患者の血漿および血清中に細胞から離れた腫瘍関連ウイルスDNAが検出されている(マチラングラ、エーら(Mutirangura,A.et al.)、Cancer Res.第4巻、665−669ページ、1998年;ロー、ワイ エム ディーら(Lo,Y.M.D.et al.)、Clin.Cancer Res.第59巻、1188−1191ページ、1999年;カポネ、アール ビーら(Capone,R.B.et al.)、Clin Cancer Res.第6巻、4171−4175ページ、2000年)。多くのタイプの悪性腫瘍に関連付けられてきた1つの重要なウイルスはエプスタイン・バーウイルス(EBV)である(コーエン、ジェイ アイ(Cohen,J.I.)、N.Engl.J.Med.第343巻、481−492ページ、2000年)。エプスタイン・バーウイルス(EBV)は、ヒト集団の大多数に感染するヒトヘルペスウイルスである。EBVは通常唾液を介して感染し、Bリンパ球に潜伏感染を成立させ、宿主の生存している間はそこに存続する。これについては、上咽頭がん(NPC)(マチラングラ、エーら(Mutirangura,A.et al.)、Cancer Res.第4巻、665−669ページ、1998年;ロー、ワイ エム ディーら(Lo,Y.M.D.et al.)、Clin.Cancer Res.第59巻、1188−1191ページ、1999年)およびある種のリンパ腫(レイ、ケイ アイら(Lei,K.I.et al.)、Br.J.Haematol.第111巻、239−246ページ、2000年;ドルーエ、イーら(Drouet,E.et al.)、J.Med.Virol.第57巻、383−389ページ、1999年;ガラガー、エーら(Gallagher,A.et al.)、Int.J.Cancer.第84巻、442−8ページ、1999年)の患者の血漿および血清中に、血中を循環している(血中循環)EBV DNAが検出されている。
【0004】
EBV感染が胃がんの一部と関係があるという報告もされている(シバタ、ディーら(Shibata,D.et al.)、Am.J.Pathol.第140巻、769−774ページ、1992年)。香港では、胃がん症例の約10%についてEBV感染との関連が見出されている(イェン、エス ティーら(Yuen,S.T.et al.)、Am.J.Surg.Pathol.第18巻、1158−1163ページ、1994年)。
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明は、胃がん患者の血清中のEBV DNAを検出し、そのようにして検出されたEBV DNAの量を臨床上の診断または予後の判断に関連付ける方法を提供する。
【課題を解決するための手段】
【0006】
第1の態様では、本発明は、患者の胃がんを診断し、検出し、モニターし、予後を判断する方法を特徴とする。該方法は胃がん患者の血清もしくは血漿中に存在するエプスタイン・バーウイルスDNA(EBV DNA)の量を検出または測定することを特徴とする。従って、本発明は臨床医学において広範な適用性を有する。
【0007】
本発明の方法を、乳がんをはじめとする、頭部および頚部以外のリンパ系悪性腫瘍を診断し、検出し、モニターし、予後を判断するために適用することも可能である。これらの新生物は、胃がん同様にEBV感染と関連付けられている。
【0008】
本発明の方法を、胃炎を診断し、検出し、モニターし、予後を判断するために適用することも可能である。EBV DNAは、胃炎をはじめとする、新生物ではない胃の疾患の患者の血漿および血清中に検出されうる。次には、胃炎は胃がんと関連付けられている。本発明は、胃がんの可能性があるかまたは胃がんと診断された患者、およびEBVの核酸を含まないかまたはEBVを含むがん細胞をさらに含む。
【0009】
本発明の方法は、通常(1)患者から血液試料を採取するステップと、(2)血液試料からDNAを抽出するステップと、(3)血液試料中に存在する血中循環EBV DNAの量を測定するステップと、(4)血液試料中に存在する血中循環EBV DNAの量を対照と比較するステップとからなる。当然のことであるが、本発明の方法を、患者から血液試料を採取するという作業ステップを伴わず、以前患者から採取された血液試料(またはそのような血液試料から得た液体画分もしくはDNA)について実施することも可能である。
【0010】
血液試料は、細胞を含まない液体試料であることが好ましい。細胞を含まないという語は、該試料が、凝血させて残りの液体から細胞を分離することにより細胞を取り出した血清、または凝血を阻害して液体画分を遠心分離することにより細胞を取り出したもの(血漿)のいずれかを意味する。EBV DNAは液体画分に関して測定される。EBVが細胞を含まない試料の液体中に見出される場合、該感染が活動性であり感染細胞がEBVを放出しているものと考えられる。
【0011】
第2の態様では、本発明は患者の血清または血漿中のEBV DNAを検出するのに適した試薬を備えた診断用キットを特徴とする。本発明のキットは、患者から血液試料を採取するための1つ以上のデバイスと、血液試料からEBV DNAを分離するための手段と、血液試料中に存在するEBV DNAの量を定量するための手段とをさらに備えても良い。そのようなキットは、胃がんおよび胃炎を診断し、検出し、モニターし、予後を判断するために使用可能である。
【発明を実施するための最良の形態】
【0012】
本発明は、患者の胃がんを診断し、検出し、モニターし、予後を判断する方法を特徴とする。該方法は胃がん患者の血清中に存在するEBV DNAの量を検出または測定することを特徴とする。本発明の方法は臨床医学において広範な適用性を有する。胃がんは、日本を含む多くの地理的地域において比較的高い罹患率で存在している。一部の胃がんはEBV感染と関連があることが知られている(シバタら(Shibata et al.)、Am J Pathol.第140巻、769−74ページ、1992年)。本発明の非侵襲的血液検査は、臨床上の大きな進歩を示すものである。
【0013】
胃炎または消化不良は、胃粘膜の炎症である。胃炎とは、胃粘膜に炎症性の変化をもたらすが、その臨床上の特徴、組織学的特性、および発症機構が異なる一群の関連する障害である。炎症は、慢性の場合、胃腺がんへの進行の指標として知られている。
【0014】
胃炎には急性も慢性もあり得る。過剰なアルコールを飲んだ後、食べ過ぎた後、香辛料の効いた食物を食べた後、または喫煙の後に胃炎を患う人々がいる。また別の人々は、非ステロイド系抗炎症薬(NSAIDs)の長期使用または大腸菌、サルモネラ菌、もしくはヘリコバクター・ピロリなどの細菌への感染の後に胃炎を発症する。時により、大手術、外傷、火傷、または重篤な感染の後に胃炎が発症することもある。悪性貧血、自己免疫不全、および慢性の胆汁逆流などのある種の疾患も同様に胃炎の原因となり得る。臨床上、最も共通する症状は胃の不調または痛みである。おくび、腹部膨満、悪心、嘔吐、または胃部の満腹感もしくは灼熱感が患者により報告されている。胃の内面から出血している場合、血液は嘔吐物や大便中にも存在しうる。
【0015】
胃炎は、胃内視鏡、生検、貧血についての血液検査、および便潜血検査などの1つ以上の医学的検査によって診断される。便潜血検査は、胃炎の兆候である、便の中の血液の存在をチェックする。
【0016】
胃炎はEBV感染者に関連するとされているが、胃がんへの進行の増大とは関連付けられていない。胃がんに対する感受性が増大している胃炎患者を特定することが、本発明の目的である。本発明のアッセイは、医師が大きなリスクに直面している患者に注目することを可能にし、より積極的な抗胃炎治療とより高頻度の内視鏡的評価とを用いることにより、患者に利益をもたらすであろう。
【0017】
臨床的には、血中循環EBV DNAを、上咽頭がん(ロー、ワイ エム ディーら(Lo,Y.M.D.et al.)、Clin.Cancer Res.第59巻、1188−1191ページ、1999年;ロー、ワイ エム ディーら(Lo,Y.M.D.et al.)、Cancer Res.第59巻、5452−5455ページ、1999年)やある種のリンパ腫(レイ、ケイ アイら(Lei,K.I.et al.)、Br.J.Haematol.第111巻、239−246ページ、2000年;ドルーエ、イーら(Drouet,E.et al.)、J.Med.Virol.第57巻、383−389ページ、1999年;ガラガー、エーら(Gallagher,A.et al.)、Int.J.Cancer.第84巻、442−448ページ、1999年)について実現されたのと同様に、EBER陽性の腫瘍を有する胃がん患者の診断およびモニタリングに適用する。最近示された、上咽頭がんにおける血中循環EBV DNAの予後上の重要性(ロー、ワイ エム ディーら(Lo,Y.M.D.et al.)、Cancer Res.第60巻、6878−6881ページ)は、EBV DNAの測定が胃がんに関して予後上の重要性を有することを示唆するものである。
【0018】
本発明の方法は、いずれもEBVと関連のあるがんである、頭部および頚部以外のリンパ系悪性腫瘍を検出し、モニターし、予後を判断するために適用することも可能である。これらの新生物は、ある種の肝臓がん(スガワラら(Sugawara et al.)、Virology、第256巻、196−202ページ、1999年)と同様に、EBV感染とも関連付けられている(ボネットら(Bonnet et al.)、J Natl Cancer Inst.第91巻、1376−81ページ、1999年)。
【0019】
本発明の方法は、胃炎を検出し、モニターし、予後を判断するために適用することも可能である。EBV DNAは、胃炎のような新生物でない胃疾患において検出されうる。あるタイプの胃炎はEBV感染と関連があることが知られている(ヤナイら(Yanai et al.)、J Clin Gastroenterol.第29巻、39−43ページ、1999年)。あるタイプの胃炎は、患者が腸上皮化生になりやすく、ひいては胃がんにかかりやすくなる素因である(ヨシムラら(Yoshimura et al.)、J Clin Pathol.第53巻、532−6ページ、2000年)。
【0020】
日本国のヤナイ(Yanai)による20人の患者についての唯一の研究において、ある割合の胃炎患者およびその患者の胃上皮にEBVが存在することが見出されたが、その2つの間の関連は立証されていない。ドイツ国のフンガーマン(Hungermann)による、242人を超える慢性胃炎(軽いものから重篤なものまで)の患者についての最近の研究から、これらの患者においてEBV感染は非常に低い罹患率であることが示され、胃上皮細胞のEBV感染は胃がん形成において重要ではないと結論付けられた。
【0021】
本発明は、胃上皮組織のEBV感染を簡単な血液検査によって特定しうるという発見を含むものである。以前は、リンパ系組織および他の非上皮組織へのEBV感染だけが同様の方法により検出可能であった。上皮細胞がEBV感染に抵抗性であることはよく知られているので、本発明は、第1にEBVに感染した胃炎患者を特定し、次いで第2にそれらの患者がその後胃がんに対する感受性を増すという可能性について研究するという全く新しい概念と機会とを示すものである。本発明のアッセイは、医師が大きなリスクに直面している患者に注目することを可能にし、より積極的な抗胃炎治療または抗ウイルス治療とより高頻度の内視鏡的評価とを用いることにより、患者に利益をもたらすであろう。
【0022】
本発明の別の目的は、がんの原因になりうるEBVに感染するリスクの高い患者に向けられている。そのような患者には、上咽頭がんの原因となるEBVに非常に感染しやすいことが証明されている、H2,BW46およびB17タイプのHLA抗原を有する患者が含まれる。ヒト免疫不全症ウイルス(HIV)のような疾患のため免疫不全の患者、または臓器移植後に免疫抑制剤を投与されている患者のような他の患者も感染リスクが高い。本発明は、腫瘍細胞内にEBV DNAを有する胃がんの症例を簡単に検出可能であることを示す。さらに、腫瘍細胞内にEBV DNAがない胃がんの場合でも、すぐ近くの上皮にEBVに感染したリンパ球または他の細胞がありさえすれば検出可能である。全体として、腫瘍のEBV DNAが陽性または陰性のいずれかの胃がん患者の約35%が本発明により検出された。この新しい概念は、EBV感染の直接または間接のいずれかの結果として別の種類のがんになるリスクの高い患者をモニターするときに大きな助けとなるであろう。本発明に基づき、リンパ腫のほかに胃がんを調査の必要な疾患のリストに加えることが可能である。
【0023】
固形組織をEBV DNAについて調べる場合、生検標本をパラフィンに包埋し5μm厚の切片に切断する。DNAをQIAamp(登録商標)Tissue Kit(キアゲン(Qiagen))を用いて製造業者推奨のプロトコールにより抽出する。50μlの最終溶出量をDNAの試験に使用する。
【0024】
従来のDNA増幅法またはシグナル増幅法のいずれもEBV DNAの検出に使用可能である。大抵の場合、標的配列を当技術分野でよく知られた数種の核酸増幅手順のうちのいずれかを用いて増幅することが望ましい。具体的には、核酸増幅は、増幅しようとする核酸配列に相補的な配列を含む核酸のアンプリコン(コピー)を酵素的に合成することである。当技術分野で用いられている核酸増幅手順の例には、ポリメラーゼ連鎖反応(PCR)、鎖置換増幅(SDA)、リガーゼ連鎖反応(LCR)、および転写増幅(TAA)がある。核酸増幅は、試料中に存在する標的配列の量が非常に少ない場合に特に有用である。試料中の目的の生物またはウイルスの核酸をより確実に検出するためにアッセイ開始時に必要とされる標的配列がより少なくてすむので、標的配列を増幅し、合成されたアンプリコンを検出することによりアッセイの感度を大きく向上させることが可能である。
【0025】
核酸増幅法は文献に十分な記載がある。例えばPCR増幅は、米国特許第4,683,195号、第4,683,202号および第4,800,159号、ならびにMethods in Enzymology、第155巻、335−350ページ、1987年に、マリスら(Mullis et al.)により記載されている。SDAの例は、ウォーカー(Walker)、PCR Methods and Applications、第3巻、25−30ページ、1993年、ウォーカーら(Walker et al.)、Nucleic Acids Res.、第20巻、1691−1996ページ、1992年、およびProc.Natl.Acad.Sci.、第89巻、392−396ページ、1991年に見出すことができる。LCRは米国特許第5,427,930号および第5,686,272号に記載されている。そして種々のTAA方式は、バーグら(Burg et al.)の米国特許第5,437,990号;カシアンら(Kacian et al.)の米国特許第5,399,491号および第5,554,516号;ならびにギンゲラスら(Gingeras et al.)の国際出願番号PCT/US87/01966および国際公開番号第88/01302号、国際出願番号PCT/US88/02108および国際公開番号第88/10315号などの刊行物に示されている。
【0026】
リアルタイム定量PCRはEBV DNAをモニターするのに好ましい手段であり、蛍光標識を用いるPCR反応の進行を継続的、光学的にモニターすることに基づいている(ハイデら(Heide et al.)、Genome Res.第6巻、986−694ページ、1996年およびローら(Lo et al.)、Am J.Hum.Genet.第62巻、768−775ページ、1998年)。このシステムでは、従来のPCRで用いる2種の増幅プライマーに加えて、二重に標識された蛍光ハイブリダイゼーションプローブも用いられる(リバークら(Livak,et al.)、PCR Methods Appl.、4357−362ページ、1995年)。一方の蛍光色素がレポーターの役割を果たし(FAM)、その発光スペクトルが第2の蛍光色素(TAMRA)により消光される。PCRの伸長段階の間は、TaqDNAポリメラーゼ(9)の5’から3’方向のエキソヌクレアーゼ活性によりレポーターがプローブから離れ、よってレポーターが消光体から離れ、その結果518nmの蛍光発光が増大する。
【0027】
本発明の方法は、一般に(1)患者から血液試料を採取するステップと、(2)血液試料からDNAを抽出するステップと、(3)血液試料中に存在する血中循環EBV DNAの量を測定するステップと、(4)血液試料中に存在する血中循環EBV DNAの量を対照と比較するステップとからなる。血液試料を遠心分離にかけ、液体画分を採取し、液体画分についてEBV DNAを測定することが好ましい。
【0028】
当業者は、当技術分野で知られた多くの手段により血液試料からDNAを抽出しうることを理解するであろう。1つの好ましい手段は、QIAamp(登録商標)Blood Kitを用いることである。同様に、血中循環EBV DNAの量を多くの既知または新規なプロトコールのうちの1つを用いて測定することも可能である。リアルタイムPCR増幅システムを含むプロトコールが特に好ましい。そのようにして検出されたEBV DNAレベルを対照と比較するための標準的な手順は、得られた値の有意性を統計的に評価するべく容易に考案可能である。
【0029】
当業者は、臨床上の進行と試料中に存在する血中循環EBV DNA量との関係に基づく適切な診断基準を容易に作製することができる。しかしながら、胃がん患者においては一般に血清1mlあたり少なくとも約200コピー、より好ましくは少なくとも約500コピー、さらにより好ましくは少なくとも約1000コピーのEBV DNAが存在する。上記の血清1mlあたり500コピーのEBV DNAという境界点は、検査の時点でがんであり、がん細胞内部にEBV DNAを含むことが示されている場合にのみ適用する。EBV陽性リンパ球の浸潤のみを伴いがん細胞内部にはEBV DNAを含まない胃がんの患者については、コピー数のレベルはより低い。このように血清1mlあたりのEBV DNAのコピー数がより低いレベルであることは、胃炎のみを有する患者の特性でもある。
【0030】
EBV DNAのコピー数を長期間測定し、疾患の進行または緩解に関連付けることも可能である。従って、本発明は胃がん、胃炎および他の特定のがんの診断とその後のモニタリングとを可能にする非侵襲的な方法を提供する。500コピーの境界点は検査の時点ですでにがんである場合にのみ適用されることに注意すべきである。上記のようなリンパ球の浸潤を伴う患者では、コピー数のレベルはより低い。
【0031】
第2の態様では、本発明は患者の血清または血漿中のEBV DNAを検出するのに適した試薬を備えた診断用キットを特徴とする。本発明のキットは、患者から血液試料を採取するための1つ以上のデバイスと、血液試料からEBV DNAを分離するための手段と、血液試料中に存在するEBV DNAの量を定量するための手段とをさらに備えても良い。そのようなキットは、胃がん、胃炎、および他のある種の頭部および頚部以外のリンパ系悪性腫瘍を診断し、検出し、モニターし、予後を判断するために使用可能である。
【0032】
本明細書中に記載の全ての刊行物及び特許出願は、各個別の刊行物または特許出願が引用により組み込まれるべく特に個別に表示されてはいても、引用により本願に組み込まれる。
【0033】
上述の発明は明確な理解のために図面および例示を用いてある程度詳細に記述されているが、請求項の趣旨または範囲を逸脱することなくある種の変更形態および修正形態を上記発明に加えることが可能であることは、本発明の教示に照らせば当業者には直ちに明白であろう。
(実施例)
以下の実施例は例示のためだけに提供するものであり、限定を目的とするものではない。当業者は、本質的に同様の結果をもたらすために変更または修正可能な、種々の重要性の低いパラメータを容易に認識するであろう。
(実施例1)
(材料と方法)
51人の胃がん患者を、香港所在のプリンス・オブ・ウェールズ病院からインフォームドコンセントを実施して募集した。腫瘍の外科的切除の前に血液試料を採取した。手術後、腫瘍の切片をEBER(EBV遺伝子でコードされる小RNA)のin situハイブリダイゼーション分析に供した。胃炎で、がん腫の徴候のない30人の人、および健康そうな197人の対照被験者からも血液試料を採取した。
【0034】
(血漿試料からのDNA抽出) 各被験者から、血漿単離用のEDTAチューブ内へ末梢血(5ml)を採取することができる。血液試料を1600×gで遠心分離し、血漿をEDTA入りチューブから注意深く取り出して何も入っていないポリプロピレンチューブ内へ移す。次の処理までの間、試料を−20℃に保存する。血漿試料由来のDNAを、QIAamp(登録商標)Blood Kit(キアゲン(Qiagen)、ドイツ国ヒルデン所在)を用いて製造業者推奨の血液および体液用プロトコールにより抽出する(2)。血漿試料(130−800μl/カラム)をDNA抽出に使用する。正確な量を、標的DNAの濃度の算出用に記録する。抽出カラムから得た最終的な溶出量50μlを使用する。
【0035】
血中循環EBV DNAの濃度を、EBVゲノムのBamHI−W断片の領域についてのリアルタイム定量PCRシステム(ロー、ワイ エム ディーら(Lo,Y.M.D.et al.)、Cancer Res.第59巻、1188−1191ページ、1999年)を用いて測定した。リアルタイム定量PCRの原理および反応の準備手順についてはすでに記載されている(ロー、ワイ エム ディーら(Lo,Y.M.D.et al.)、Cancer Res.第59巻、1188−1191ページ、1999年)。ABI Prism(登録商標)7700 Sequence Detectorを用いてデータを収集し、アプライドバイオシステムズ社(Applied Biosystems)により開発されたSequence Detection Systemソフトウェア(バージョン1.6.3)を用いて解析した。結果を血清1mlあたりのEBVゲノムのコピー数として表した。
【0036】
全ての血清DNA試料を同様にグロビン遺伝子についてのリアルタイム定量PCR分析(ロー、ワイ エム ディーら(Lo,Y.M.D.et al.)、Cancer Res.第59巻、1188−1191ページ、1999年)に供し、この分析により全ての被験試料について陽性のシグナルを得たが、これは抽出DNAの品質が良いことを示すものである。全ての分析について水を用いた多数の陰性ブランクを含めた。
【0037】
より具体的には、EBV DNA検出のために2種のリアルタイム定量PCRシステムを構築した:(a)一方はBamHI−W領域について;(b)他方はEBNA−I領域(ベーアら(Baer et al.)、Nature、第310巻、207−211ページ、1984年)についてである。BamHI−Wシステムは、増幅プライマー(配列番号1)W−44F(5’−CCCAACACTCCACCACACC−3’)および(配列番号2)W−119R(5’−TCTTAGGAGCTGTCCGAGGG−3’)と、二重に標識された蛍光プローブ(配列番号3)W−67T(5’−(FAM)CACACACTACACACACCCACCCGTCTC(TAMRA)−3’)とから成る。EBNA−Iシステムは、増幅プライマー(配列番号4)EBNA−1162F(5’−TCATCATCATCCGGGTCTCC−3’)および(配列番号5)EBNA−1229R(5’−CCTACAGGGTGGAAAAATGGC−3’)と、二重に標識された蛍光プローブ(配列番号6)EBNA−1186T[5’−(FAM)CGCAGGCCCCCTCCAGGTAGAA(TAMRA)−3’]とから成る。蛍光プローブには、PCRの際にプローブが伸長するのを防ぐために3’側をブロックするリン酸基を含めた。プライマー/プローブの組合せは、Primer Expressソフトウェア(パーキンエルマー社(Perkin−Elmer Corp.)、カリフォルニア州フォレスターシティ所在)を用いて設計した。EBVゲノムの配列データはGenBank配列データベースから入手した(アクセス番号V01555)。β−グロビン遺伝子についてのリアルタイム定量PCRは、ローら(Lo,et al.)、Am J.Hum Genet、第62巻、768−775ページ、1998年)にすでに記載されているようなプライマーとプローブから成り、血漿DNAの増幅能についての対照として使用した。
【0038】
蛍光PCR反応を、TaqMan(登録商標)PCR Core Reagent Kit(パーキンエルマー社(Perkin−Elmer Corp.))中に提供されている構成要素(蛍光プローブと増幅プライマーを除く)を用いて反応容量50μl中に準備する。蛍光プローブはパーキンエルマーアプライドバイオシステムズ(Perkin−Elmer Applied Biosystems)によるカスタム合成である。PCRプライマーはライフテクノロジーズ社(Life Technologies,Inc.、メリーランド州ゲイサーズバーグ(Gaithersburg)所在)により合成された。各反応には、5μlの10×緩衝液A;300nMの各増幅プライマー;25nM(EBVプローブ用)または100nM(β−グロビンプローブ用)の対応する蛍光プローブ;4MM MgCl2;各200μmのdATP、dCTP、およびdGTP;400μMのdUTP;1.25ユニットのAmpliTaq Gold(登録商標);ならびに0.5ユニットのAmpErase(登録商標)ウラシルN−グリコシラーゼを含めた。
【0039】
DNA増幅を、パーキンエルマーアプライドバイオシステムズ(Perkin−Elmer Applied Biosystems)の7700 Sequence Detectorにおいて96ウェル反応用プレート方式で実施する。各試料を2連で分析する。全ての分析について水を用いた多数の陰性ブランクを含めた。
【0040】
EBV陽性の細胞株Namalwa(American Type Culture Collection CRL−1432;クラインら(Klein et al.)、Int J.Cancer、第10巻、44−57ページ、1972年を参照のこと)から抽出したDNAを標準として使用し、検量線を並行して各分析につき2連で作製する。Namalwaは、細胞あたり2つ組み込まれたウイルスゲノムを含む二倍体細胞である。二倍体細胞あたり6.6pg DNAの換算係数をコピー数算出に使用した(サイキら(Saiki et al.)、Science、第239巻、487−491ページ、1988年)。血中を循環している細胞外EBV DNAの濃度を、血漿1mlあたりのEBVゲノムのコピー数として表した。
【0041】
EBV BamHI−WおよびEBNA−IのPCRシステムに同じ熱プロファイルを使用した。熱サイクリングは、ウラシルN−グリコシラーゼを作用させるために50℃で2分間のインキュベーションを最初に実施し、次に95℃で10分間の初期変性ステップとし、次いで95℃で15秒間および56℃で1分間の反応を40サイクル実施した。
【0042】
次に、7700 Sequence Detectorにより収集されマッキントッシュ(Macintosh)コンピュータ(アップルコンピュータ(Apple Computer)、カリフォルニア州クパチーノ(Cupertino)所在)に保存された増幅データを、パーキンエルマーアプライドバイオシステムズにより開発されたSequence Detection Systemソフトウェアを用いて解析する。各2連データの平均定量値を用いてさらに濃度を算出する。EBV DNAまたはβ−グロビン遺伝子の血漿中濃度(コピー/mlで表す)を次の式を用いて算出する。
C=Q×(VDNA/VPCR)×(1/Vext)
式中、Cは血漿中の対象物の濃度(コピー/ml)を表し、QはPCRにおいてSequence Detectorにより測定された対象物の定量値(コピー数)を表し、VDNAは抽出後に得られたDNAの総容量(通常キアゲン(Qiagen)抽出1回あたり50μl)を表し、VPCRはPCRに使用されたDNAの容量(通常5μl)を表し、Vextは抽出された血漿/血清の容量(通常0.13−0.80ml)を表す。
【0043】
腫瘍細胞中のEBVの存在を、すでに記載されているとおりに(ホイ ピー ケーら(Hui,P.K.et al.)、Hum.Pathol.、第25巻、947−952ページ、1994年)、EBERに対するフルオレセイン結合オリゴヌクレオチドプローブ(ノボカストラ(Novocastra)、英国所在)を用いたパラフィン包埋組織切片のin situハイブリダイゼーションにより評価した。
(結果)
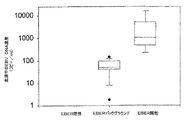
総数51人の胃がん患者を募集した。この集団中、5例の胃がんはEBER陽性であった(図1A)。14例については、腫瘍細胞はEBER陰性であったが、部分的にEBER陽性の浸潤リンパ球が認められた(図1B)。これらの14例を「バックグラウンド」の陽性を示すものとして分類した。図2は、上記3つの患者群間の血中循環EBV DNAのレベルの差異を示す。血清中のEBV DNAはEBER陽性の症例のすべてにおいて検出された(血清中EBV DNA濃度の中央値:1063コピー/mL;四分位範囲:485−5141コピー/mL)。陰性の32例のいずれにおいても血清中EBV DNAは検出されなかった(図2)。「バックグラウンド」のEBER陽性を示す14例のうち13例(93%)が検出可能な血清中EBV DNAを有していた。これらの症例の血清中EBV DNA濃度の中間の中央値は50コピー/mL(四分位範囲:42−98コピー/mL)であった。これら3群の間の差異は統計的に有意である(p<0.001、クラスカル・ウォリス(Kruskal−Wallis)の検定)。多重比較(対比較)分析により、EBER陽性群とEBER陰性群との間の有意差(p<0.05、ダン(Dunn)の方法)およびEBERバックグラウンド群とEBER陰性群との間の有意差(p<0.05、ダン(Dunn)の方法)が示されている。
【0044】
EBV DNAは、胃炎の試料30例のうち7例(23%)および健康な対照197例のうち7例(3.6%)の血清中に検出可能であった。これら2群間の血清中EBV DNAが陽性である症例の割合は有意に異なっている(カイ二乗検定、p=0.028)。検出可能な血中循環EBV DNAを有する症例であっても、実際の血清中EBV DNAの濃度は一般にEBER陽性の胃がんの症例における濃度よりも低い。
【0045】
「バックグラウンド」のEBER陽性を示す胃がんの症例、胃炎の症例、および対照被験者における検出可能な血清中EBV DNAを症例間で比較した。これら3群の血清中EBV DNA濃度は図3にプロットされている。これら3群の間に血中循環EBV DNAレベルの統計的有意差はない(クラスカル・ウォリス(Kruskal−Wallis)の検定、p=0.296)。
(考察)
上記のデータは、細胞外のEBV DNAを一部の胃がん患者から採取した血清試料中に検出することができることを示す。さらに、上記データは血清中EBV DNAを検出可能であることと、腫瘍のEBERの状態との間の興味深い相関を示している。このように、EBER陽性の胃がん症例は高レベルな血清中EBV DNAと関連があり;「バックグラウンド」のEBER陽性を示す胃がん症例は中間レベルの血清中EBV DNAと関連があり;EBER陰性の症例には血清中EBV DNAは認められなかった。これらの知見は、血漿および血清ががんをモニターするための材料の非侵襲的供給源になることをさらに示している(アンカー ピーら(Anker,P.et al.)、Cancer Metastasis Rev.第18巻、65−73ページ、1999年)。
【0046】
臨床的には、血中循環EBV DNAを、NPC(ロー、ワイ エム ディーら(Lo,Y.M.D.et al.)、Cancer Res.第59巻、1188−1191ページ、1999年;ロー、ワイ エム ディーら(Lo,Y.M.D.et al.)、Cancer Res.第59巻、5452−5455ページ、1999年)やある種のリンパ腫(レイ、ケイ アイら(Lei,K.I.et al.)、Br.J.Haematol.第111巻、239−246ページ、2000年;ドルーエ、イーら(Drouet,E.et al.)、J.Med.Virol.第57巻、383−389ページ、1999年;ガラガー、エーら(Gallagher,A.et al.)、Int.J.Cancer.第84巻、442−448ページ、1999年)について実現されたのと同様にEBER陽性の腫瘍を有する一部の胃がん患者の診断およびモニタリングに適用可能である。最近、上咽頭がんの予後における血中循環EBV DNAの重要性が示された。このデータ(ロー、ワイ エム ディーら(Lo,Y.M.D.et al.)、Cancer Res.第60巻、6878−6881ページ)は、EBV DNAの測定も胃がんの予後の判定に重要であることを示すものである。
【0047】
「バックグラウンド」のEBER陽性を示す胃がんにおける血中循環EBV DNAの検出は興味深い。腫瘍組織に浸潤しているEBER陽性のリンパ球が、これらの症例において検出可能な低いレベルの血清中EBV DNAの由来である可能性がある。仮にそれが正しいとすると、さらなる研究によりこれらのEBER陽性のリンパ球によるEBVの放出メカニズムが解明されるかもしれない。可能性のあるメカニズムには、DNAの積極的な放出(ロジャース ジェイ シーら(Rogers,J.C.et al.)、Proc.Natl.Acad.Sci.USA、第69巻、1685−1689、1972年)および上記細胞の一部における溶菌性のEBV感染の活性化が含まれる。
【0048】
血中循環EBV DNAとEBER陽性の浸潤リンパ球との間の関連は、低いレベルの血中循環EBV DNAが新生物を伴わない炎症状態においても認められることを示唆する。実際に、血中循環EBV DNAは胃炎患者にも存在する。対照としては、血清中EBV DNAは健康そうな対照の人々の3.6%にも検出された。健康そうな被験者において低いレベルの血中循環EBV DNAが存在するということは他の研究によって報告されている(ロー、ワイ エム ディーら(Lo,Y.M.D.et al.)、Cancer Res.第59巻、1188−1191ページ、1999年;ショーテラスク ケイら(Shotelersuk,K.et al.)、Clin.Cancer Res.、第6巻、1046−1051ページ、2000年)。検出可能な血清中EBV DNAを伴う胃炎の症例および健康な対照例において、ウイルスDNAの濃度は「バックグラウンド」のEBER陽性を示す胃がんの症例における濃度と非常に似通っている(図3)。この知見は、「バックグラウンドの」EBER陽性を示す胃がんについて上記に仮定したように、血中循環EBV DNAが胃炎および健康な対照例においてもEBER陽性リンパ球により放出されるということを示唆している。血中循環EBV DNAのレベルについては、検出可能な血清中EBV DNAを伴う上記27症例のうち26例が500コピー/ml未満であった。これに対して、EBER陽性の胃がん5例のうち4例(80%)、および、以前の研究(ロー、ワイ エム ディーら(Lo,Y.M.D.et al.)、Cancer Res.第59巻、1188−1191ページ、1999年)では上咽頭がん57例のうち48例(84%)が、500コピー/mlを上回る血中循環EBV DNAレベルを有していた。この解析から、血漿/血清のEBV DNA濃度500コピー/mlは特に明確にこれらのがん患者を特定するための実用的な診断上の境界点となりうることが示唆される。大規模な臨床研究により近々にこの境界値の精度がさらに高まることが期待される。
【0049】
健康そうな人々の血中に低いレベルの血中循環EBV DNAが存在することの長期的な意義は依然として不明である。何より、今後の研究は、これらの人々がEBV関連疾患を発症するリスクが大きいかもしれないという可能性について取り組むべきである。この問題は重大な公衆衛生上の問題かつ生物学的に重要な問題である。
【0050】
生物学的には、EBER陽性の胃がん患者における血中循環EBV DNAの検出は、血漿中の腫瘍由来DNAのクリアランス速度に関する重要な情報を提供する可能性がある。腫瘍由来DNAのクリアランスの速度論に関するこれまでの研究は放射線療法(ロー、ワイ エム ディーら(Lo,Y.M.D.et al.)、Cancer Res.第60巻、2351−2355ページ、2000年)および化学療法(レイ ケイ アイら(Lei,K.I.et al.)、Br.J.Haematol.第111巻、239−246ページ、2000年)を受けている患者について実施されているので、クリアランス速度は依然としてほとんど解明されていない問題となっている。上記のこれまでの研究から明らかにされた速度論的パラメータは、(a)治療法に起因する腫瘍細胞の死、および(b)血漿からの腫瘍由来DNAのクリアランスを合わせたものを指す。胃がんはほとんどが外科的切除により治療されるので、この新しいモデル系により、一時点すなわち手術時にがんを除去した後の腫瘍由来DNAのクリアランスに関する情報が提供されうる。そのような情報は、母親の血漿における胎児のDNAのクリアランスについてすでに為されているように(ロー、ワイ エム ディーら(Lo,Y.M.D.et al.)、Am.J.Hum.Genet.、第64巻、218−224ページ、1999年)、in vivoにおける血漿中DNAのクリアランスの解明を推進するであろう。
【0051】
本明細書中のデータは、血中循環EBV DNAが、EBVに関連のある他の多くのがんのタイプにおいても有用であることも示唆している。そのようながんの例には、乳がん(ボネット エムら(Bonnet,M.et al.)、J.Natl.Cancer Inst.第91巻、1376−1381ページ、1999年)および肝細胞がん(スガワラ ワイら(Sugawara,Y.et al.)、Virology、第256巻、196−202ページ、1999年)が含まれる。一部の腫瘍のタイプとEBVとの関連については議論のあるところであるので、そのような腫瘍を有する患者の血漿からEBV DNAを検出可能であるということは、上記の問題を解決するのに貢献する可能性がある。
【図面の簡単な説明】
【0052】
【図1A】EBV遺伝子でコードされる小RNA(EBER)陽性の腫瘍細胞を含む胃腺がんを示す図。EBERのin situハイブリダイゼーションで、×200拡大である。
【図1B】部分的にEBER陽性の腫瘍浸潤リンパ球を含む胃腺がんを示す図。腫瘍細胞は陰性である。EBERのin situハイブリダイゼーションで、×400拡大である。
【図2】3つの患者群間の血中循環EBV DNAのレベルの差異を示す図。血清中のEBV DNAはEBER陽性の症例のすべてにおいて検出された(血清中EBV DNA濃度の中央値:1063コピー/mL;四分位範囲:485−5141コピー/mL)。陰性の32例のいずれにおいても血清中EBV DNAは検出されなかった。「バックグラウンド」のEBER陽性を示す14例のうち13例(93%)が検出可能な血清中EBV DNAを有していた。これらの症例の血清中EBV DNA濃度の中間の中央値は50コピー/mL(四分位範囲:42−98コピー/mL)であった。
【図3】「バックグラウンド」のEBER陽性を示す胃がんの症例、胃炎の症例、および対照被験者における検出可能な血清中EBV DNAの症例間の比較を示す図。これら3群の血清中EBV DNAの濃度を示す。これら3群の間に血中循環EBV DNAレベルの統計的有意差はない(クラスカル・ウォリス(Kruskal−Wallis)の検定、p=0.296)。
Claims (22)
- (a)胃炎を患っている患者から細胞を含まない血液由来の液体試料を採取すること、および
(b)前記液体についてエプスタイン・バーウイルスが存在するか存在しないかをアッセイすることと、ウイルスの存在が、該患者が胃がんに進行しつつある可能性の増大の指標であることと、
により、胃炎を患っている患者が胃がんに進行しつつある可能性の増大を判断する方法。 - (1)患者から血液試料を採取するステップと、
(2)前記血液試料から液体画分を採取するステップと、
(3)前記液体画分からDNAを抽出するステップと、
(4)前記液体画分中に存在する血中循環EBV DNAの量を測定するステップと
からなる請求項1に記載の方法。 - (5)前記液体画分中に存在する血中循環EBV DNAの量を対照と比較するステップ
からさらになる請求項2に記載の方法。 - 液体画分1ミリリットルあたり少なくとも約500コピーのEBV DNAが存在する請求項1に記載の方法。
- 液体画分1ミリリットルあたり少なくとも1コピーのEBV DNAが存在する請求項1に記載の方法。
- 血液は血漿試料である請求項1に記載の方法。
- アッセイは核酸プローブを用いたEBVウイルス核酸のハイブリダイゼーションを含む請求項1に記載の方法。
- アッセイはポリメラーゼ連鎖反応に基づくアッセイである請求項1に記載の方法。
- 患者は慢性胃炎と診断されている請求項1に記載の方法。
- 患者は胃がんであると診断可能であり、がん細胞はEBV核酸を含まない請求項1に記載の方法。
- 患者は胃がんであると診断可能であり、がん細胞がEBV核酸を含んでいる請求項1に記載の方法。
- 患者の血清または血漿中に存在するEBV DNAを検出するステップからなる、患者における頭部および頚部以外の悪性腫瘍、もしくはリンパ系悪性腫瘍を診断し、検出し、モニターし、または予後を判断する方法。
- (1)患者から血液試料を採取するステップと、
(2)前記血液試料から液体画分を採取するステップと、
(3)前記液体画分からDNAを抽出するステップと、
(4)前記液体画分中に存在する血中循環EBV DNAの量を測定するステップと
からなる請求項12に記載の方法。 - (5)前記液体画分中に存在する血中循環EBV DNAの量を対照と比較するステップ
からさらになる請求項13に記載の方法。 - 患者の血清または血漿中に存在するEBV DNAを検出するステップからなる、患者の胃炎を診断し、検出し、モニターし、または予後を判断する方法。
- (1)患者から血液試料を採取するステップと、
(2)前記血液試料から液体画分を採取するステップと、
(3)前記液体画分からDNAを抽出するステップと、
(4)前記液体画分中に存在する血中循環EBV DNAの量を測定するステップと
からなる請求項15に記載の方法。 - (5)前記血液試料中に存在する血中循環EBV DNAの量を対照と比較するステップ
からさらになる請求項16に記載の方法。 - 胃炎を患っている患者が胃がんに進行しつつある可能性の増大を判断するためのキットであって、単一のキット製品中に
(a)患っている患者の血液中のエプスタイン・バーウイルスを検出するための核酸、および
(b)エプスタイン・バーウイルスが存在するか存在しないかを判断するための核酸の使用に関する指示書、およびウイルスが血液中に存在する場合の患者が胃がんに進行しつつある可能性の増大についての説明書
を備えたキット。 - 血清または血漿中のEBV DNAを検出するのに適した試薬を備えた、患者の血清または血漿中のEBV DNAを検出するための診断用キット。
- 患者から血液試料を採取するためのデバイスを備えた請求項19に記載の診断用キット。
- 血液試料からEBV DNAを分離するための手段を備えた請求項19に記載の診断用キット。
- 血液試料中に存在するEBV DNAの量を定量するための手段を備えた請求項19に記載の診断用キット。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US26556801P | 2001-01-31 | 2001-01-31 | |
| PCT/GB2002/000411 WO2002061148A2 (en) | 2001-01-31 | 2002-01-30 | Circulating epstein-barr virus dna in the serum of patients with gastric carcinoma |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2004536282A true JP2004536282A (ja) | 2004-12-02 |
Family
ID=23010993
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2002561083A Pending JP2004536282A (ja) | 2001-01-31 | 2002-01-30 | 胃がん患者の血清中の、血中を循環するエプスタイン・バーウイルスdna |
Country Status (7)
| Country | Link |
|---|---|
| US (2) | US6753137B2 (ja) |
| EP (1) | EP1356124B1 (ja) |
| JP (1) | JP2004536282A (ja) |
| CN (1) | CN1272448C (ja) |
| AT (1) | ATE352641T1 (ja) |
| DE (1) | DE60217823D1 (ja) |
| WO (1) | WO2002061148A2 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2022541331A (ja) * | 2019-07-25 | 2022-09-22 | エフ.ホフマン-ラ ロシュ アーゲー | エプスタイン・バーウイルス(ebv)を検出するための組成物および方法 |
Families Citing this family (33)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20030228575A1 (en) * | 2001-01-31 | 2003-12-11 | Yuk Ming Dennis Lo | Combination of circulating epstein-barr virus (EBV) DNA in the serum or plasma of patients and a method to assess EBV subtypes for the prediction and detection of epstein-barr virus associated cancers |
| ATE346170T1 (de) * | 2003-10-29 | 2006-12-15 | Maurice Stroun | Verfahren zur diagnose von krebs |
| JP4182227B2 (ja) * | 2005-09-09 | 2008-11-19 | 国立大学法人 岡山大学 | ウイルス潜伏感染の検査方法および検査用キット |
| TWI335354B (en) * | 2006-09-27 | 2011-01-01 | Univ Hong Kong Chinese | Methods for the detection of the degree of the methylation of a target dna and kits |
| US7842482B2 (en) * | 2007-02-26 | 2010-11-30 | The Chinese University Of Hong Kong | Methods and kits for diagnosis, prognosis or monitoring of Epstein-Barr virus (EBV)-associated cancer |
| KR20190030779A (ko) | 2008-01-18 | 2019-03-22 | 프레지던트 앤드 펠로우즈 오브 하바드 칼리지 | 체액 내에서 질병 또는 병태의 시그너쳐의 검출 방법 |
| DK2496720T3 (da) | 2009-11-06 | 2020-09-28 | Univ Leland Stanford Junior | Ikke-invasiv diagnose af transplantatafstødning i organ-transplanterede patienter |
| WO2012012694A2 (en) | 2010-07-23 | 2012-01-26 | President And Fellows Of Harvard College | Methods of detecting autoimmune or immune-related diseases or conditions |
| BR112013001752A2 (pt) | 2010-07-23 | 2016-05-31 | Harvard College | método de detectar doenças ou condições usando células fagocídicas |
| WO2012012717A1 (en) | 2010-07-23 | 2012-01-26 | President And Fellows Of Harvard College | Methods of detecting prenatal or pregnancy-related diseases or conditions |
| MX382244B (es) | 2010-07-23 | 2025-03-13 | Harvard College | Metodos para detectar firmas de enfermedad o condiciones en fluidos corporales |
| CA2849771A1 (en) * | 2011-09-22 | 2013-03-28 | ImmuMetrix, LLC | Compositions and methods for analyzing heterogeneous samples |
| EP2965077B1 (en) | 2013-03-09 | 2022-07-13 | Harry Stylli | Methods of detecting cancer |
| EP4513187A3 (en) | 2013-03-09 | 2025-05-21 | Immunis.AI, Inc. | Methods of detecting prostate cancer |
| CA2905517C (en) | 2013-03-15 | 2024-11-12 | Lineage Biosciences, Inc. | METHODS AND COMPOSITIONS FOR LABELING AND ANALYZING SAMPLES |
| JP7451070B2 (ja) | 2013-11-07 | 2024-03-18 | ザ ボード オブ トラスティーズ オブ ザ レランド スタンフォード ジュニア ユニバーシティー | ヒトミクロビオームおよびその成分の分析のための無細胞核酸 |
| CN103642945B (zh) * | 2013-12-30 | 2019-01-08 | 上海星耀医学科技发展有限公司 | 一种含内参照的高灵敏Epstein-Barr病毒荧光定量PCR试剂盒 |
| US10626464B2 (en) | 2014-09-11 | 2020-04-21 | Cell Mdx, Llc | Methods of detecting prostate cancer |
| CN104604799B (zh) * | 2015-02-05 | 2017-11-21 | 南华大学 | 一种鉴定eb病毒对淋巴瘤的诱发性的方法 |
| AU2016264102A1 (en) | 2015-05-18 | 2017-12-21 | Karius, Inc. | Compositions and methods for enriching populations of nucleic acids |
| KR102326769B1 (ko) | 2016-03-25 | 2021-11-17 | 카리우스, 인코포레이티드 | 합성 핵산 스파이크-인 |
| CA3059370C (en) | 2017-04-12 | 2022-05-10 | Karius, Inc. | Methods for concurrent analysis of dna and rna in mixed samples |
| RU2659134C1 (ru) * | 2017-09-20 | 2018-06-28 | Федеральное государственное бюджетное образовательное учреждение высшего образования "Смоленский государственный медицинский университет" министерства здравоохранения Российской Федерации | Способ оценки степени тяжести течения хронического эрозивного гастрита, ассоциированного с helicobacter pylori и вирусом эпшейн-барр |
| JP7239973B2 (ja) * | 2017-12-19 | 2023-03-15 | 国立大学法人山口大学 | 前癌病変又は癌の有無の予測を補助する方法 |
| WO2019178157A1 (en) | 2018-03-16 | 2019-09-19 | Karius, Inc. | Sample series to differentiate target nucleic acids from contaminant nucleic acids |
| US11512357B2 (en) | 2018-06-01 | 2022-11-29 | University of Pittsburgh—of the Commonwealth System of Higher Education | Gamma herpesvirus circular RNA |
| EP3830302B1 (en) * | 2018-08-01 | 2022-10-05 | Gen-Probe Incorporated | Compositions and methods for detecting nucleic acids of epstein-barr virus |
| CN109022619A (zh) * | 2018-08-27 | 2018-12-18 | 郑州安图生物工程股份有限公司 | 一种用于检测人类疱疹病毒4型的试剂盒 |
| CA3118990A1 (en) | 2018-11-21 | 2020-05-28 | Karius, Inc. | Direct-to-library methods, systems, and compositions |
| US20220373548A1 (en) * | 2019-10-24 | 2022-11-24 | Arizona Board Of Regents On Behalf Of Arizona State University | Novel antibodies for detecting epstein barr virus-positive gastric cancer |
| US11211147B2 (en) | 2020-02-18 | 2021-12-28 | Tempus Labs, Inc. | Estimation of circulating tumor fraction using off-target reads of targeted-panel sequencing |
| US11211144B2 (en) | 2020-02-18 | 2021-12-28 | Tempus Labs, Inc. | Methods and systems for refining copy number variation in a liquid biopsy assay |
| US11475981B2 (en) | 2020-02-18 | 2022-10-18 | Tempus Labs, Inc. | Methods and systems for dynamic variant thresholding in a liquid biopsy assay |
-
2002
- 2002-01-25 US US10/057,579 patent/US6753137B2/en not_active Expired - Lifetime
- 2002-01-30 CN CNB028042530A patent/CN1272448C/zh not_active Expired - Fee Related
- 2002-01-30 AT AT02710132T patent/ATE352641T1/de not_active IP Right Cessation
- 2002-01-30 WO PCT/GB2002/000411 patent/WO2002061148A2/en not_active Ceased
- 2002-01-30 EP EP02710132A patent/EP1356124B1/en not_active Expired - Lifetime
- 2002-01-30 DE DE60217823T patent/DE60217823D1/de not_active Expired - Fee Related
- 2002-01-30 JP JP2002561083A patent/JP2004536282A/ja active Pending
-
2003
- 2003-06-03 US US10/455,042 patent/US20040005551A1/en not_active Abandoned
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2022541331A (ja) * | 2019-07-25 | 2022-09-22 | エフ.ホフマン-ラ ロシュ アーゲー | エプスタイン・バーウイルス(ebv)を検出するための組成物および方法 |
| JP7649285B2 (ja) | 2019-07-25 | 2025-03-19 | エフ. ホフマン-ラ ロシュ アーゲー | エプスタイン・バーウイルス(ebv)を検出するための組成物および方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2002061148A3 (en) | 2003-05-15 |
| ATE352641T1 (de) | 2007-02-15 |
| WO2002061148A2 (en) | 2002-08-08 |
| US20040005551A1 (en) | 2004-01-08 |
| DE60217823D1 (de) | 2007-03-15 |
| HK1061048A1 (en) | 2004-09-03 |
| EP1356124B1 (en) | 2007-01-24 |
| US20020192642A1 (en) | 2002-12-19 |
| CN1272448C (zh) | 2006-08-30 |
| CN1489634A (zh) | 2004-04-14 |
| US6753137B2 (en) | 2004-06-22 |
| EP1356124A2 (en) | 2003-10-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2004536282A (ja) | 胃がん患者の血清中の、血中を循環するエプスタイン・バーウイルスdna | |
| JP6897970B2 (ja) | 大腸腫瘍の有無を検査する方法 | |
| US11767565B2 (en) | Use of detection reagent for detecting methylation of genes associated with colorectal cancer, and kit | |
| WO2006047482A2 (en) | Method for determining the diagnosis, malignant potential, and biologic behavior of pancreatic cysts using cyst aspirate | |
| CN102947468B (zh) | 大肠肿瘤的检测方法 | |
| US20020004206A1 (en) | Methods of screening for disease | |
| JP2021523730A (ja) | 腫瘍マーカー、メチル化検出試薬、キット及びその使用 | |
| US20080286784A1 (en) | Method for Detection of DNA Methyltransferase RNA in Plasma and Serum | |
| CN114107498B (zh) | 结直肠癌血液检测标记物及其应用 | |
| JP2021524750A (ja) | 腫瘍マーカー、メチル化検出試薬、キット及びその使用 | |
| WO2010032797A1 (ja) | 乳癌の転移の判定方法及び血清の評価方法 | |
| CN113322318B (zh) | Linc00485作为分子标志物在制备用于诊断和/或预后肝细胞癌的产品中的应用 | |
| JP7299765B2 (ja) | マイクロrna測定方法およびキット | |
| WO2001053535A2 (en) | Method of detecting neoplastic, hyperplastic, cytologically dysplastic and/or premalignant cellular growth or proliferation | |
| CN115786503B (zh) | 胃癌早期筛查的dna甲基化标志物组合及试剂盒 | |
| CN113186294A (zh) | 一种用于检测卵巢癌相关基因甲基化的核酸组合物、试剂盒和检测方法 | |
| JP2004151003A (ja) | Muc1およびケラチン19の検査方法 | |
| US20100159464A1 (en) | Method for Detection of DNA Methyltransferase RNA in Plasma and Serum | |
| CN115961048B (zh) | 一种基因甲基化检测引物组合、试剂及其应用 | |
| CN113637774B (zh) | 一种ddPCR检测包虫病的扩增引物及其构建方法、应用 | |
| CN114196755B (zh) | 用于诊断受试者宫颈病变的组合物及用途 | |
| CN114250302B (zh) | 用于宫颈上皮内瘤变检测的组合物、试剂盒及用途 | |
| HK1061048B (en) | Circulating epstein-barr virus dna in the serum of patients with gastric carcinoma | |
| WO2024204603A1 (ja) | 膀胱癌のバイオマーカー | |
| CN117187388A (zh) | Grik2基因作为标志物在制备肺癌检测试剂盒中的应用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20041126 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20050311 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20050311 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20050311 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20071127 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20080227 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20080305 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20080722 |