ES2941702T3 - Composiciones de moldeo de grado óptico que tienen una estabilidad térmica aumentada - Google Patents
Composiciones de moldeo de grado óptico que tienen una estabilidad térmica aumentada Download PDFInfo
- Publication number
- ES2941702T3 ES2941702T3 ES21733149T ES21733149T ES2941702T3 ES 2941702 T3 ES2941702 T3 ES 2941702T3 ES 21733149 T ES21733149 T ES 21733149T ES 21733149 T ES21733149 T ES 21733149T ES 2941702 T3 ES2941702 T3 ES 2941702T3
- Authority
- ES
- Spain
- Prior art keywords
- copolymer
- formula
- mol
- compound represented
- polymerization
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F220/00—Copolymers of compounds having one or more unsaturated aliphatic radicals, each having only one carbon-to-carbon double bond, and only one being terminated by only one carboxyl radical or a salt, anhydride ester, amide, imide or nitrile thereof
- C08F220/02—Monocarboxylic acids having less than ten carbon atoms; Derivatives thereof
- C08F220/10—Esters
- C08F220/12—Esters of monohydric alcohols or phenols
- C08F220/14—Methyl esters, e.g. methyl (meth)acrylate
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F222/00—Copolymers of compounds having one or more unsaturated aliphatic radicals, each having only one carbon-to-carbon double bond, and at least one being terminated by a carboxyl radical and containing at least one other carboxyl radical in the molecule; Salts, anhydrides, esters, amides, imides, or nitriles thereof
- C08F222/04—Anhydrides, e.g. cyclic anhydrides
- C08F222/06—Maleic anhydride
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F232/00—Copolymers of cyclic compounds containing no unsaturated aliphatic radicals in a side chain, and having one or more carbon-to-carbon double bonds in a carbocyclic ring system
- C08F232/08—Copolymers of cyclic compounds containing no unsaturated aliphatic radicals in a side chain, and having one or more carbon-to-carbon double bonds in a carbocyclic ring system having condensed rings
-
- G—PHYSICS
- G02—OPTICS
- G02B—OPTICAL ELEMENTS, SYSTEMS OR APPARATUS
- G02B1/00—Optical elements characterised by the material of which they are made; Optical coatings for optical elements
- G02B1/04—Optical elements characterised by the material of which they are made; Optical coatings for optical elements made of organic materials, e.g. plastics
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicinal Chemistry (AREA)
- Polymers & Plastics (AREA)
- Organic Chemistry (AREA)
- Physics & Mathematics (AREA)
- General Physics & Mathematics (AREA)
- Optics & Photonics (AREA)
- Addition Polymer Or Copolymer, Post-Treatments, Or Chemical Modifications (AREA)
- Compositions Of Macromolecular Compounds (AREA)
- Polymerisation Methods In General (AREA)
Abstract
La presente invención se refiere a un copolímero que tiene mayor resistencia al calor, alta transparencia y bajos valores de turbidez. La invención se refiere además a composiciones de moldeo que comprenden este copolímero ya un procedimiento para la fabricación de este copolímero. Las composiciones de moldeo de la presente invención son muy adecuadas para la fabricación de elementos ópticos utilizados en varios dispositivos ópticos que incluyen óptica primaria, óptica secundaria, óptica terciaria así como guías de luz. (Traducción automática con Google Translate, sin valor legal)
Description
DESCRIPCIÓN
Composiciones de moldeo de grado óptico que tienen una estabilidad térmica aumentada
Campo técnico
La presente invención se refiere a un copolímero que tiene mayor resistencia al calor, alta transparencia, y bajos valores de turbidez. La invención se refiere además a composiciones de moldeo que contienen este copolímero, y a un procedimiento para la fabricación de este copolímero.
Las composiciones de moldeo de la presente invención son muy adecuadas para la fabricación de elementos ópticos usados en diversos dispositivos ópticos, incluyendo óptica primaria, óptica secundaria, óptica terciaria, así como guías de luz.
Técnica anterior
Los copolímeros que comprenden unidades repetitivas derivadas del metacrilato de metilo (en lo sucesivo MMA), que, por simplicidad, se denominan a menudo polimetacrilato de metilo (en lo sucesivo PMMA), suelen ser materiales transparentes que tienen una alta resistencia a la intemperie, en particular, una alta resistencia a la radiación solar UV. Si se desea, la resistencia a la intemperie del PMMA se puede aumentar aún más mediante la adición de absorbentes, estabilizadores e inhibidores de UV. Por lo tanto, PMMA se usa comúnmente en aplicaciones en las que se requiere alta transparencia, baja turbidez y alta resistencia a la intemperie.
También existe una demanda creciente de polímeros con una resistencia al calor particularmente alta para aplicaciones ópticas. Estas aplicaciones incluyen por ejemplo fuentes de luz para uso en interiores y exteriores que comprenden LED de alta potencia, en los que dichos polímeros se usan como guías de luz, lentes ópticas, etc. Para aumentar el rendimiento lumínico de los l Ed , los elementos ópticos se colocan muy cerca del LED. La temperatura de funcionamiento de la superficie del LED, especialmente de los denominados LED blancos de alta potencia, a menudo supera los 100°C o, a veces, incluso los 130°C. En consecuencia, es importante que los materiales para estas aplicaciones tengan una alta transparencia y valores de turbidez particularmente bajos, así como una alta estabilidad térmica. Además, los materiales deben tener una alta estabilidad a la intemperie y no mostrar sustancialmente signos de amarilleamiento tras una exposición prolongada a la radiación solar.
La solicitud de patente EP 0113105 A1 describe un copolímero de anhídrido de ácido maleico (en lo sucesivo MAH), a-metilestireno y MMA. Aunque este material tiene excelentes propiedades ópticas y buena estabilidad térmica, sólo tiene una estabilidad moderada a la intemperie, y se vuelve quebradizo tras una exposición prolongada a la radiación solar debido al grupo aromático en el a-metilestireno.
Estos inconvenientes se superan parcialmente con una composición de moldeo descrita en el documento EP 1742 997 que comprende PMMA y un terpolímero de MAH, estireno y MMA. Sin embargo, la estabilidad térmica y la temperatura de transición vítrea de esta composición de moldeo aún no son suficientemente altas para aplicaciones que emplean LED potentes de alta potencia. Además, debido a la presencia de unidades repetitivas derivadas del estireno, la resistencia a la intemperie de esta composición de moldeo es menor que la del PMMA usado comúnmente. Además, los copolímeros con bloques de construcción que comprenden unidades repetitivas derivadas de MAH en combinación con compuestos vinilaromáticos a menudo tienen una compatibilidad limitada con PMMA. En consecuencia, pueden tener lugar separaciones de fase no deseadas, acompañadas de un aumento significativo de la turbidez.
El documento US 2014/000801 A1 describe un copolímero que se puede obtener haciendo reaccionar un monómero basado en (met)acrilato de alquilo, metacrilato de bencilo, y un monómero de ácido (met)acrílico, usando un método de polimerización en masa continua. También se ha dado a conocer que el copolímero tiene una alta estabilidad térmica. Sin embargo, si el contenido de unidades repetitivas derivadas del ácido (met)acrílico en el copolímero es demasiado alto, el copolímero tiende a sufrir un grado indeseablemente alto de absorción de agua, y su procesamiento termoplástico mediante moldeo por inyección se vuelve difícil debido a la alta adherencia al molde de inyección. Además, debido a la presencia de unidades repetitivas derivadas del metacrilato de bencilo, el material tiene una resistencia a la intemperie limitada, en particular, a temperaturas de funcionamiento elevadas.
La solicitud de patente JP H4-63810 A describe copolímeros obtenibles por polimerización de una mezcla de MMA, MAH y 2-norborneno (en lo sucesivo 2-NB). El documento establece que estos copolímeros tienen una temperatura de transición vítrea más alta que el PMMA común. Los copolímeros del documento JP H4-63810 A se prepararon por lotes en ampollas y, tras una polimerización sólo parcial, los copolímeros se aislaron y analizaron por precipitación en metanol. Aparte de una breve indicación de que los copolímeros obtenidos eran transparentes, no se proporciona información con respecto a sus propiedades ópticas, tal como el índice de amarilleamiento, la turbidez, o la tasa de volumen de fusión (MVR). El contenido informado de MAH en los copolímeros de los Ejemplos 1 -3 del documento JP H4-6381 0 A fue 21% en moles y más en el polímero precipitado.
El documento FR 2699540 A1 describe copolímeros transparentes de monómeros de vinilo a), por ejemplo estireno, cloruro de vinilo o (met)acrilato de metilo, monómeros de norborneno b), y monómeros de maleimida c), así como artículos moldeados producidos a partir de ellos. Por ejemplo, se describe un copolímero, que se obtiene por polimerización en disolución por radicales libres de una mezcla que comprende 79% en moles de metacrilato de metilo (MMA), 5% en moles de norborneno (NB) y 16% en moles de N-ciclohexil maleimida (NCHMI).
En términos generales, es bien conocido en el estado de la técnica que el 2-NB no puede copolimerizarse con MMA mediante polimerización por radicales libres (véase p.ej. "Palladium(ll)-catalysed polymerization of 5-norbornene-2-carboxylic acid esters and norbornene", Dissertation by B. Heinz, Marburg 1998). Además, se sabe que MAH puede copolimerizarse con MMA mediante polimerización por radicales libres con baja actividad (véase p.ej. B.C. Trivedi, B.M. Culbertson Maleic anhydride, Plenum Press, 1982). También se ha dado a conocer que 2-NB puede copolimerizarse radicalmente con MAH (véase p.ej. "Fundamental Aspects of Norbornene-Maleic-Anhydride Co and Terpolymers for 193 nm Lithography: Polymerization Chemistry and Polymer Properties", Hiroshi Ito et al., Journal of Photopolymer Science and Technology, 2000, p. 559-589). Sin embargo, los métodos para la preparación de copolímeros que comprenden MMA, 2-NB y MAH no se han investigado en detalle, ni desarrollado hasta ahora.
Objeto de la presente invención
Teniendo en cuenta las deficiencias descritas anteriormente, era un objeto de la presente invención proporcionar un copolímero que tuviera excelentes propiedades ópticas, en particular una baja turbidez, en combinación con una alta estabilidad térmica. Estas propiedades permitirían el uso del polímero con fuentes de luz que tengan altas temperaturas de funcionamiento en su superficie, por ejemplo LED blancos de alta potencia. Además, el polímero debe ser adecuado para un uso a largo plazo tras la exposición a la luz UV y/o temperaturas elevadas, y tener una baja absorción de agua y una excelente resistencia a la intemperie, en particular, una alta estabilidad frente a la radiación solar.
Otra meta de la presente invención era proporcionar un método para fabricar tal copolímero a escala industrial de manera eficiente.
Sumario de la invención
La presente invención se basa en un hallazgo sorprendente de que un copolímero, tal como se define en la reivindicación 1, que comprende de 47,0 a 99,8% en moles de unidades repetitivas derivadas de metacrilato de metilo, de 0,1 a 20,0% en moles de unidades repetitivas derivadas del compuesto representado por la fórmula (I)
en la que X está representado por un átomo de oxígeno o N-R1, siendo el sustituyente R1 un átomo de hidrógeno o un grupo hidrocarbonado que tiene de 1 a 12 átomos de carbono;
de 0,1 a 18,0% en moles de unidades repetitivas derivadas del compuesto representado por la fórmula (II)
en la que los sustituyentes R2, R3 y R4 pueden estar representados independientemente por un átomo de hidrógeno, un grupo hidrocarbonado que tiene de 1 a 12 átomos de carbono, un grupo carboxílico, -C(O)-alquilo de C1-12, -C(O)-cicloalquilo de C1-12, -C(O)-O-alquilo de C1-12 o -C(O)-O-cicloalquilo de C1-12; y
en la que R3 y R4 pueden estar representados independientemente por un grupo hidroxi o formar juntos un resto cíclico; y
de 0,0 a 15,0% en moles de unidades repetitivas derivadas de un comonómero opcional copolimerizable mediante radicales con metacrilato de metilo y/o el compuesto representado por la fórmula (I) y/o la fórmula
(II), siendo el comonómero opcional preferiblemente un (met)acrilato de alquilo, un ácido metacrílico, un (met)acrilonitrilo o un monómero de vinilo aromático
tiene la combinación deseada de propiedades ventajosas. Este copolímero tiene una turbidez baja y una estabilidad térmica sorprendentemente alta, incluso en ausencia de estabilizadores térmicos, y por lo tanto puede usarse para aplicaciones ópticas a temperaturas elevadas. Además, el copolímero tiene una excelente estabilidad a largo plazo en exteriores, y no muestra signos de amarilleamiento, incluso después de un uso prolongado en exteriores.
Estos resultados son sorprendentes porque la polaridad de las unidades repetitivas derivadas de los compuestos de fórmula (II), tal como 2-NB, difiere significativamente de las de las unidades repetitivas derivadas de los compuestos de fórmula (I), tal como MAH. Las unidades repetitivas derivadas de los compuestos de fórmula (II) son sustancialmente no polares, mientras que las unidades repetitivas derivadas de los compuestos de fórmula (I) son polares debido a la presencia de un grupo anhídrido o un grupo imida. Además, se esperaba que durante la copolimerización de un compuesto de fórmula (I) con un compuesto de fórmula (II) se formaran dominios con mayor rigidez. Por lo tanto, en base a su conocimiento general común, la persona experta normalmente esperaría p.ej. que los copolímeros de MMA, MAH y 2-NB tuvieran un aspecto turbio, i.e., una alta turbidez óptica. La expresión “turbidez óptica", como se usa aquí, se refiere a un valor medido según la norma ASTM D1003 - 13 en una probeta de 3,0 mm de grosor.
Según la presente invención, el peso molecular medio ponderal Mw del copolímero es de 40.000 a 300.000 g/mol, más preferiblemente de 50.000 a 200.000 g/mol. El peso molecular medio numérico Mn del copolímero es preferiblemente de 20.000 a 150.000 g/mol, más preferiblemente de 25.000 a 100.000 g/mol. La determinación de Mw y Mn se puede realizar p. ej. por medio de cromatografía de permeación en gel (GPC), por ejemplo usando PMMA como patrón de calibración, y tetrahidrofurano (THF) con 0,2% en volumen de ácido trifluoroacético (TFA) como eluyente. Como alternativa al uso de un patrón de calibración, también se puede emplear un detector de dispersión para copolímeros que tengan un Mw de más de 100.000 g/mol (véase H. F. Mark et al., Encyclopaedia of Polymer Science and Engineering, 2a. Edición, Vol. 10, página 1 y sig., J. Wiley, 1989). Las columnas GPC apropiadas se pueden seleccionar fácilmente por un experto, por ejemplo columnas HPS. Tales columnas están disponibles comercialmente, por ejemplo, en PSS Standards Service GmbH (Mainz, Alemania) como columnas de la serie PSS SDV. Como se apreciará fácilmente, también se puede emplear una combinación de varias columnas de GPC.
Descripción detallada de la invención
Sorprendentemente, el inventor encontró que el índice de turbidez del copolímero de la presente invención se puede reducir adicionalmente, si el copolímero comprende preferiblemente
de 55,0 a 98,7% en moles, preferiblemente 59 a 98,7% en moles, de unidades repetitivas derivadas de metacrilato de metilo;
de 1,0 a 18,0% en moles de unidades repetitivas derivadas del compuesto representado por la fórmula (I), de 0,3 a 15,0% en moles de unidades repetitivas derivadas del compuesto representado por la fórmula (II); y
de 0,0 a 12,0% en moles, preferiblemente 0,0 a 8,0% en moles, de unidades repetitivas derivadas de un comonómero opcional.
Además, demostró ser aún más ventajoso en términos de propiedades ópticas escoger un copolímero que comprende
de 65,0 a 93,0% en moles, preferiblemente 67,0 a 93,0% en moles, de unidades repetitivas derivadas de metacrilato de metilo;
de 5,0 a 16,0% en moles de unidades repetitivas derivadas del compuesto representado por la fórmula (I), de 2,0 a 12,0% en moles de unidades repetitivas derivadas del compuesto representado por la fórmula (II); y
de 0,0 a 7,0% en moles, preferiblemente 0,0 a 5,0% en moles, de unidades repetitivas derivadas de un comonómero opcional.
La turbidez óptica del copolímero de la presente invención también se puede reducir mediante un ajuste cuidadoso de la relación del contenido de unidades repetitivas derivadas del compuesto representado por la fórmula (I) y el contenido de unidades repetitivas derivadas del compuesto representado por la fórmula Estos contenidos se ajustan para obedecer la siguiente relación:
0.3 * P| < P|| < 0.9 * p|
en la que pI es el contenido de unidades repetitivas derivadas del compuesto representado por la fórmula (I), en % en moles, en el copolímero; y
en la que pii es el contenido de unidades repetitivas derivadas del compuesto representado por la fórmula (II), en % en moles, en el copolímero.
Además, se podrían obtener copolímeros con valores de turbidez particularmente bajos ajustando pI y pn para que sean
preferiblemente
0.5 * P| < P|| < 0.8 * p|
En este contexto, el inventor descubrió que dado que los compuestos representados por la fórmula (II), tal como 2-NB, generalmente pueden sufrir copolimerización por radicales con compuestos representados por la fórmula (I), tal como MAH, pero no con MMA, una relación molar pn / pI de más de 0,9 da como resultado segmentos relativamente largos que consisten en alternar unidades repetitivas derivadas del compuesto representado por la fórmula (I) y unidades repetitivas derivadas del compuesto representado por la fórmula (II). Si el peso molecular Mw del copolímero es mayor que 300.000 g/mol, o en un contenido de unidades repetitivas derivadas de un compuesto representado por la fórmula (I) de más de 20,0% en moles, es de esperar que estos dominios de cadena larga tengan una miscibilidad reducida con el componente acrílico del copolímero. Este fenómeno parece ser responsable del aumento de los valores de turbidez a relaciones molares de pn / pI de más de 0,9, en particular si el contenido de las unidades repetitivas derivadas del compuesto representado por la fórmula (II) está por encima de 18,0% en moles.
Otro aspecto de la presente invención se refiere a una composición de moldeo que comprende el copolímero de la presente invención y, opcionalmente, al menos un aditivo seleccionado de absorbentes de UV, estabilizadores de UV, antioxidantes, colorantes, mejoradores de la fluidez, agentes antiestáticos, lubricantes y ayudas para el desmoldeo, partículas dispersantes de la luz, ayudas para mejorar los arañazos, etc.
La composición de moldeo de la presente invención tiene una excelente transparencia y un aspecto transparente, sustancialmente no turbio. En particular, la turbidez de la composición de moldeo, medida a 23°C en una probeta moldeada por inyección que tiene un grosor de 3,0 mm según la norma ASTM D1003 (2013), normalmente es menor que 5%, preferiblemente menor que 3%, más preferiblemente menor que 2%, de forma especialmente preferible menor que 1%.
Además, la composición de moldeo sin aditivos de color o pigmentos colorantes muestra preferiblemente una transmitancia de luz, Td65, según DIN 5033 - 7 (2014), en el intervalo de 85% a 93%, más preferiblemente en el intervalo de 87% a 92%, medida a 23°C en una probeta moldeada por inyección que tiene un grosor de 3,0 mm.
El índice de amarilleamiento de la composición de moldeo sin aditivos colorantes ni pigmentos colorantes, determinable según DIN 6167 (1980) (iluminante D65, 10° en grosor de capa de 3,0 mm), debe ser preferiblemente menor que 7, preferiblemente menor que 5, medido a 23°C en una probeta moldeada por inyección que tiene un grosor de 3,0 mm, en ausencia de colorantes o pigmentos añadidos.
La temperatura de reblandecimiento Vicat de la composición de moldeo según ISO 306-B50 (2014) es ventajosamente al menos 90°C, preferiblemente al menos 100°C, más preferiblemente al menos 110°C.
El alargamiento a la rotura nominal de la composición de moldeo sin modificador de impacto, según ISO 527 (2012), debe ser preferiblemente al menos 2,0%, particularmente de forma preferible 3,0% o mayor.
El módulo de elasticidad de la composición de moldeo según ISO 527 (2012) es ventajosamente mayor que 3000 MPa, preferiblemente mayor que 3500 MPa, si no está presente modificador de impacto.
Debido a sus ventajosas propiedades reológicas, la composición de moldeo de la presente invención es muy adecuada para la fabricación de elementos ópticos mediante moldeo por inyección. La composición de la presente invención normalmente tiene un índice de flujo volumétrico de fusión MVR medido según ISO 1133 (2012) a 230°C y 3,8 kg, mayor que 0,2 cm3 / 10 min, preferiblemente mayor que 0,4 cm3 / 10 min, lo más preferible, en el intervalo de 0,6 cm3 / 10 min a 15,0 cm3 / 10 min.
Los monómeros que forman unidades repetitivas del copolímero de la presente invención se describirán a continuación con mayor detalle:
Compuesto de fórmula (I)
El copolímero de la presente invención comprende de 0,1 a 20,0% en moles, preferiblemente de 1,0 a 18,0% en moles, más preferiblemente de 5,0 a 16,0% en moles, de unidades repetitivas derivadas del compuesto representado por la fórmula (I)
X en la fórmula (I) puede ser un átomo de oxígeno o N-R1, siendo el sustituyente R1 un átomo de hidrógeno o un grupo hidrocarbonado que tiene de 1 a 12 átomos de carbono.
La expresión “grupo hidrocarbonado”, como se usa en la presente solicitud, abarca grupos alquilo, cicloalquilo, arilo, aralquilo, alquilarilo. Estos grupos pueden estar ramificados o no ramificados. Además, estos grupos pueden tener uno o varios sustituyentes. Los sustituyentes son, por ejemplo, grupos alquilo lineales y ramificados que tienen 1 a 6 átomos de carbono, por ejemplo metilo, etilo, propilo, butilo, pentilo, 2-metilbutilo o hexilo; grupos cicloalquilo, por ejemplo ciclopentilo y ciclohexilo; grupos aromáticos, tal como fenilo o naftilo. El uso del sustituyente R1, que es un grupo alquilo o cicloalquilo, mostró ser particularmente ventajoso en términos de estabilidad a la intemperie del copolímero resultante.
Los grupos alquilo preferidos incluyen grupo metilo, etilo, propilo, isopropilo, 1 -butilo, 2-butilo, 2-metilpropilo, terc-butilo, pentilo, 2-metilbutilo, 1,1 -dimetilpropilo, hexilo, heptilo, octilo, 1,1,3,3-tetrametilbutilo, nonilo, 1-decilo, 2-decilo, undecilo y dodecilo. Los grupos cicloalquilo preferidos incluyen ciclopropilo, ciclobutilo, ciclopentilo, ciclohexilo, cicloheptilo y el grupo ciclooctilo, cada uno de los cuales puede estar opcionalmente sustituido con uno o varios grupos alquilo ramificados o no ramificados. Los grupos aromáticos preferidos según la invención pueden derivar de fenilo, naftilo y bifenilo, cada uno de los cuales también puede estar opcionalmente sustituido con uno o varios grupos alquilo ramificados o no ramificados.
Aunque la elección del compuesto de fórmula (I) no está particularmente limitada, un compuesto seleccionado de MAH, maleimida, metilmaleimida, W-fenilmaleimida y W-ciclohexilmaleimida, conduce a copolímeros que tienen propiedades particularmente ventajosas. En particular, el uso de MAH y W-ciclohexilmaleimida como compuesto de fórmula (I) son los más preferibles.
Compuesto de fórmula (II)
El copolímero de la presente invención comprende de 0,1 a 18,0% en moles, preferiblemente de 0,3 a 15,0% en moles, más preferiblemente de 2,0 a 12,0% en moles, de unidades repetitivas derivadas del compuesto representado por la fórmula (II):
Los sustituyentes R2, R3 y R4 pueden estar representados independientemente por un átomo de hidrógeno, un grupo hidrocarbonado que tiene de 1 a 12 átomos de carbono, un grupo carboxílico, -C(O)-alquilo de C1-12, -C(O)-cicloalquilo de C1-12, -C(O)-O-alquilo de C1-12 o -C(O)-O-cicloalquilo de C1-12. Además, R3 y R4 pueden estar representados independientemente por un grupo hidroxi, o formar juntos un resto cíclico.
El significado de las expresiones “grupo hidrocarbonado’’, “alquiló’ y “cicloalquilo’’ es el mismo como se definió anteriormente para el sustituyente R1. Cada uno de los sustituyentes R3 y R4 puede estar independientemente configurado exo o endo. Los sustituyentes R3 y R4 también pueden estar configurados cis o trans uno respecto del otro.
La elección del compuesto de fórmula (II) no está particularmente limitada, siempre que pueda sufrir una polimerización por radicales con MMA y/o el compuesto de fórmula (I). Por ejemplo, el compuesto de fórmula (II) se puede seleccionar de anhídrido metil-5-norborneno-2,3-dicarboxílico, 2-norborneno (2-NB), anhídrido 5-norborneno-2,3-dicarboxílico, ácido 5-norborneno-2-carboxílico, ácido 5-norborneno-2,3-dicarboxílico, 5-norborneno-2-carboxilato de 2-hidroxietilo, 5-norborneno-2-carboxilato de terc-butilo, 2-acetil-5-norborneno, éster metílico del ácido 5-norborneno-2-carboxílico,
5-norborneno-2-carboxilato de etilo, W-(2-etilhexil)-5-norborneno-2,3-dicarboximida, 5-norbornen-2-ol, imida W-hidroxi-5-norborneno-2,3-dicarboxílica, 5-norborneno-2-carboxamida, y 5-norborneno-2,3-dicarboxilato de dimetilo. En particular, el uso de 2-NB mostró producir copolímeros con excelentes propiedades ópticas y alta estabilidad térmica.
Comonómeros opcionales
Además de las unidades repetidas derivadas de MMA, el compuesto de fórmula (I) y el compuesto de fórmula (II), el copolímero de la presente invención puede comprender de 0,0 a 15,0% en moles, preferiblemente de 0,0 a 12,0% en moles, más preferiblemente de 0,0 a 7,0% en moles de unidades repetitivas derivadas de un comonómero opcional copolimerizable por radicales con MMA y/o el compuesto representado por la fórmula (I) y/o la fórmula (II). La naturaleza del comonómero opcional no está particularmente limitada, y los monómeros tales como, p. ej., (met)acrilato de alquilo, ácido metacrílico, (met)acrilonitrilo, o un monómero de vinilo aromático demostraron ser los más adecuados para este fin.
La expresión “(met)acrilatos de alquilo’’, como se usa aquí, puede representar un solo (met)acrilato de alquilo o una mezcla de diferentes (met)acrilatos de alquilo. La expresión “(met)acrilato", como se usa aquí, se refiere no sólo a los metacrilatos, p. ej. metacrilato de metilo, metacrilato de etilo, etc., sino también a acrilatos, p. ej. acrilato de metilo, acrilato de etilo, etc., y también a mezclas de los mismos.
Para los fines de la presente invención, se da preferencia a (met)acrilatos de alquilo de C1-C18, ventajosamente (met)acrilatos de alquilo de C1-C10, en particular (met)acrilatos de alquilo de C1-C4. Los metacrilatos de alquilo más preferidos incluyen metacrilato de metilo (MMA), metacrilato de etilo, metacrilato de propilo, metacrilato de isopropilo, metacrilato de n-butilo, metacrilato de isobutilo, metacrilato de terc-butilo, metacrilato de n-pentilo, metacrilato de nhexilo, metacrilato de n-heptilo, metacrilato de n-octilo, metacrilato de n-isooctilo, y metacrilato de n-etilhexilo, metacrilato de n-nonilo, metacrilato de n-decilo, así como metacrilatos de cicloalquilo, por ejemplo metacrilato de ciclohexilo, metacrilato de isobornilo o metacrilato de etilciclohexilo. Los acrilatos de alquilo preferidos incluyen acrilato de metilo, acrilato de etilo, acrilato de propilo, acrilato de isopropilo, acrilato de n-butilo, acrilato de isobutilo, acrilato de terc-butilo, acrilato de n-pentilo, acrilato de n-hexilo, acrilato de n-heptilo, acrilato de n-octilo, acrilato de isooctilo, acrilato de n-nonilo, acrilato de n-decilo, y acrilato de n-etilhexilo, así como acrilatos de cicloalquilo, por ejemplo acrilato de ciclohexilo, acrilato de isobornilo o acrilato de etilciclohexilo.
Los ejemplos de monómeros vinílicos aromáticos adecuados incluyen estireno; mono- o polialquilestirenos tales como o-metilestireno, m-metilestireno, p-metilestireno, o,p-dimetilestireno, o-etilestireno, m-etilestireno y p-etilestireno; derivados de estireno que contienen grupos funcionales, tales como metoxiestireno, etoxiestireno, ácido vinilbenzoico, vinilbenzoato de metilo, acetato de vinilbencilo, hidroxiestireno, o-cloroestireno, p-cloroestireno y divinilbenceno; 3-fenilpropileno, 4-fenilbuteno y D-metilestireno. Entre estos, se prefiere principalmente el estireno.
El uso de un acrilato de alquilo seleccionado de acrilato de metilo, acrilato de etilo, acrilato de butilo, acrilato de hexilo, acrilato de isobornilo, acrilato de etilhexilo, acrilato de vinilo y ácido acrílico, como comonómero opcional, conduce incluso a un aumento adicional de la estabilidad térmica del copolímero. Además, también se pueden usar como comonómero opcional ácido metacrílico, metacrilato de isobornilo, metacrilato de norbornilo, metacrilato de terc-butilo y alfametilestireno. En términos de un equilibrio óptimo de propiedades ópticas y alta estabilidad térmica, el comonómero opcional se selecciona preferiblemente de un monómero tal como acrilato de metilo o acrilato de etilo.
Si se desea una mejora adicional de la fluidez y/o una absorción de agua particularmente baja del copolímero de la invención, también se pueden emplear como comonómero opcional estireno o metacrilatos tales como metacrilato de butilo, metacrilato de etilhexilo, o metacrilatos alifáticos de ésteres de ácidos grasos, tales como metacrilato de octilo, metacrilato de dodecilo, metacrilato de estearilo, metacrilato palmítico y otros metacrilatos alifáticos de C12-C24.
Preparación del copolímero
Otro aspecto de la presente invención se refiere a un procedimiento para la fabricación de un copolímero como se describe anteriormente, comprendiendo el procedimiento
(a) una etapa de polimerización, en la que una mezcla de monómeros que comprende MMA, un compuesto de fórmula (I), un compuesto de fórmula (II) y, opcionalmente, un comonómero opcional, sufre copolimerización por radicales.
Etapa de polimerización
La copolimerización por radicales de mezclas de monómeros que comprenden MMA es bien conocido per se en la técnica anterior. La etapa de polimerización (a) puede emplear un método en el que la polimerización se realiza en un estado que contiene dicha mezcla de monómeros, un iniciador de polimerización y, opcionalmente, un agente de transferencia de cadena, y que no contiene sustancialmente un disolvente (método de polimerización en masa). Alternativamente, un disolvente capaz de disolver el copolímero puede estar presente o se puede añadir durante la
polimerización (método de polimerización en disolución). La polimerización también se puede realizar en un medio disperso en el que los monómeros se dispersan en agua o en una mezcla acuosa.
Si se emplea un método de polimerización en disolución, el disolvente usado en la etapa (a) no está especialmente limitado, siempre que sea capaz de disolver el copolímero a la temperatura de polimerización como se describe anteriormente, y no interfiera con el procedimiento de polimerización, excepto alguna pequeña transferencia de cadena. Se pueden usar uno o más disolventes seleccionados de hidrocarburos aromáticos, cetonas, éteres, ésteres, amidas y alcoholes. Los ejemplos de un disolvente que se puede usar incluyen, pero no se limitan a, disolventes orgánicos conocidos públicamente, tales como acetona, metiletilcetona, metil-n-butilcetona, metilisobutilcetona, etilisobutilcetona, tetrahidrofurano, dioxano, dimetilformamida, dietilformamida, dimetilacetamida, dietilacetamida, W-metilpirrolidona, metanol, etanol, isopropanol, etilenglicol, propilenglicol, 2-metoxi-2-propanol y tetraglima. En particular, se prefieren los disolventes seleccionados de tolueno, acetato de butilo, acetato de etilo, xileno, dimetilfurano o mezclas de los mismos. Sorprendentemente, el uso de tolueno o acetato de butilo como disolventes en la etapa (a) mostró que proporcionaba copolímeros que tenían una transmitancia óptica particularmente alta y una turbidez baja.
Si la etapa (a) se realiza en un disolvente, el contenido de disolvente en la mezcla de reacción oscila típicamente entre 3,0% en peso y 60% en peso, más preferiblemente entre 5,0% en peso y 45% en peso, basado en el peso total de la mezcla de reacción.
Se prefiere además que la concentración de oxígeno molecular del aire disuelto (O2) de la mezcla de reacción en la etapa de polimerización (a) se controle para que sea 70 ppm o menos, de modo que el copolímero resultante tenga un índice de turbidez y amarilleamiento particularmente bajos. Para inhibir adicionalmente la coloración, la concentración de oxígeno disuelto es preferiblemente menor que 10 ppm. La concentración de oxígeno disuelto se puede medir con un medidor de oxígeno disuelto (por ejemplo, DO Meter B-505 como un sensor de oxígeno galvánico producido por lijima Denshi Kogyo K.K.).
Durante una preparación por lotes, los métodos para mantener la concentración de oxígeno disuelto por debajo de 10 ppm incluyen hacer pasar un gas inerte, tal como nitrógeno, argón o helio a través de la alimentación de monómeros y disolvente de un reactor, del recipiente de polimerización, burbujear un gas inerte directamente en la mezcla de reacción, llevar a cabo, una o dos veces o más, la operación de llenado a presión del recipiente de polimerización con un gas inerte antes de iniciar la polimerización y liberar posteriormente la presión, desairear el interior de un recipiente de polimerización sellado antes de suministrar la alimentación de monómero y llenar posteriormente con un gas inerte, y hacer pasar un gas inerte a través del recipiente de polimerización. En un reactor de funcionamiento continuo, los monómeros y los disolventes de la alimentación deben tener una concentración de oxígeno molecular disuelto por debajo de 10 ppm. Esto se puede lograr haciendo pasar un gas inerte, tal como nitrógeno, argón o helio, a través de la alimentación de monómeros y disolvente de un reactor.
La elección de un reactor para uso en la etapa de polimerización (a) no está particularmente limitada. Los monómeros se pueden añadir al reactor como una mezcla o como alimentaciones separadas. Se encontró que se puede obtener un copolímero con una turbidez particularmente baja cuando la alimentación total de monómeros en la etapa de polimerización (a) tiene típicamente la siguiente composición, basada en la cantidad total de componentes polimerizables:
de 28,0 a 99,7% en moles de metacrilato de metilo
de 0,0 a 15,0% en moles de un comonómero opcional copolimerizable por radicales con metacrilato de metilo y/o el compuesto representado por la fórmula (I) y/o (II).
La expresión “alimentación total de monómeros", como se usa aquí, se refiere a las cantidades totales de monómeros añadidos durante la etapa de polimerización (a).
Más preferiblemente, la alimentación total de monómeros en la etapa de polimerización (a) tiene la siguiente composición:
de 36,0 a 98,0% en moles de metacrilato de metilo
de 0,0 a 10,0% en moles de un comonómero opcional copolimerizable por radicales con metacrilato de metilo y/o el compuesto representado por la fórmula (I) y/o (II),
en el que es particularmente ventajoso el uso de la siguiente alimentación total de monómeros en la etapa de polimerización (a):
de 42,0 a 95,0% en moles de metacrilato de metilo
de 3,0 a 19,0% en moles del compuesto representado por la fórmula (I)
de 2,0 a 31,0% en moles del compuesto representado por la fórmula (II); y
de 0,0 a 8,0% en moles de un comonómero opcional copolimerizable por radicales con metacrilato de metilo y/o el compuesto representado por la fórmula (I) y/o (II).
Sorprendentemente, se ha encontrado además que la turbidez óptica del copolímero de la presente invención se puede reducir aún más mediante un ajuste cuidadoso de la relación del compuesto representado por la fórmula (I) y el compuesto representado por la fórmula (II) en la alimentación total de monómeros durante la etapa de polimerización (a). En tal realización, estos contenidos se ajustan para obedecer la siguiente relación:
0.3 * rri| < rri|| < 2.0 * m|
en la que mI es el contenido del compuesto representado por la fórmula (I), en % en moles, basado en la cantidad total de componentes polimerizables, en la alimentación de monómero; y
mu, es el contenido del compuesto representado por la fórmula (II), en % en moles, basado en la cantidad total de componentes polimerizables, en la alimentación de monómero.
Además, se pueden obtener copolímeros con valores de turbidez particularmente bajos ajustando los contenidos del compuesto representado por la fórmula (I) y la fórmula (II) mI y mu en la alimentación de monómero para que sea
preferiblemente
0.6 * m| < iff|| < 1.8 * m|
Generalmente, la absorción de agua del copolímero resultante tiende a disminuir con el aumento del contenido del compuesto de fórmula (II), tal como 2-NB, en la mezcla de reacción, debido a que esto conduce a una mayor incorporación de unidades repetitivas derivadas del compuesto de fórmula (II) en el copolímero.
La etapa de polimerización (a) se puede llevar a cabo en un reactor discontinuo (por lotes) o un tipo de reactor semicontinuo, en el que durante la etapa de polimerización (a) se alimenta opcionalmente iniciador, si está presente, disolvente, monómero, o una combinación de cualquiera de ellos. Alternativamente, la etapa de polimerización (a) se puede llevar a cabo en un procedimiento de polimerización continuo, como en reactores de tanque agitado (CSTR), en un reactor tubular, o una combinación de los mismos, en amasadoras, o en reactores de anillo de disco.
En algunas realizaciones, la mezcla de reacción polimérica procedente de la salida del primer CSTR se puede suministrar sucesivamente de forma continua a un segundo y/o tercer dispositivo de reacción, por ejemplo otro CSTR o un reactor tubular, a fin de aumentar la conversión. El término “conversión”, como se usa en la presente solicitud, se refiere a una relación ponderal promedio del copolímero formado en la etapa de polimerización (a) a la alimentación total de monómero.
Un reactor discontinuo (por lotes), un reactor semi-discontinuo y el CSTR pueden equiparse con cualquier tipo de elementos mezcladores para homogeneizar la mezcla de reacción en el reactor. Estos reactores también se denominan retromezclados en la bibliografía (Octave Levenspiel, Chemical Reaction Engineering 3S ed Wiley 1998). En otra realización, el reactor discontinuo (por lotes) no contiene elementos mezcladores. La etapa de polimerización puede tener lugar además en lámina colada. Si la polimerización se lleva a cabo en una dispersión o suspensión acuosa, es particularmente ventajoso si el monómero representado por la Fórmula I es W-maleinimida sustituida, es decir, X en la Fórmula I es un grupo N-R1.
El diseño del reactor discontinuo (por lotes), reactor semicontinuo y CSTR no está particularmente limitado. Ejemplos típicos de los mismos son recipientes con agitadores instalados en los que el eje del agitador porta los elementos mezcladores como paletas, palas, ancla o elementos mezcladores helicoidales. El recipiente de polimerización contiene opcionalmente una camisa calentada o enfriada, en la que circula aceite caliente, agua o vapor de agua, para calentar o enfriar la mezcla de reacción durante la polimerización. Otra forma eficaz de eliminar el calor es enfriar la mezcla de reacción alimentando los monómeros y/o el disolvente que tienen una temperatura menor que la
temperatura de polimerización. Alternativamente, la eliminación del calor de polimerización se puede realizar mediante el enfriamiento por ebullición de la mezcla de reacción.
La etapa de polimerización (a) también se puede llevar a cabo en un reactor tubular continuo. Un reactor tubular continuo contiene al menos un puerto de entrada para la mezcla de reacción de monómero o prepolímero, y al menos un puerto de salida para la mezcla de reacción polimérica. El reactor tubular también puede ser un reactor de haz tubular en el que la polimerización se lleva a cabo, por ejemplo, en uno o más tubos dispuestos en paralelo. Un reactor tubular alternativo también puede ser un intercambiador de calor de placas. A diferencia de un CSTR, un reactor tubular no contiene una mezcla de reacción bien mezclada u homogeneizada en todo el volumen de reacción. Un reactor tubular típico como se define en la bibliografía (Octave Levenspiel, Chemical Reaction Engineering 3S ed Wiley 1998) contiene gradientes de concentración a gran escala entre el área del puerto de entrada y el área del puerto de salida. El reactor tubular puede contener opcionalmente elementos mezcladores estáticos o un agitador para homogeneizar la mezcla de reacción en dirección radial. Los ejemplos de elementos mezcladores estáticos incluyen mezcladores tubulares Sulzer de tipo SMX y tipo SMR, mezcladores estáticos Kenics, mezcladores tubulares Toray, etc. Alternativamente, el reactor tubular puede no contener ningún elemento mezclador. La eliminación del calor de polimerización del reactor tubular se puede realizar opcionalmente mediante una camisa llena de agua o aceite caliente. Alternativamente, la eliminación del calor de polimerización se puede realizar mediante el enfriamiento por ebullición de la mezcla de reacción.
Un experto puede ajustar fácilmente la tasa de conversión adaptando el tiempo medio de residencia de la mezcla de reacción en el reactor, la temperatura de polimerización, la reactividad del iniciador usado, y la cantidad de iniciador y la concentración de monómero en la alimentación del reactor. Por ejemplo, si se usa un CSTR, el tiempo de residencia medio se selecciona preferiblemente en el intervalo de 10 minutos a 7 horas, más preferiblemente de 20 minutos a 6 horas, por ejemplo de 30 minutos a 4 horas. Si el tiempo de residencia medio es inferior a 10 minutos, se hace necesario aumentar la cantidad de iniciador de polimerización por radicales, lo que dificulta el control de la reacción de polimerización. Los tiempos de residencia medios superiores a 7 horas son generalmente desventajosos en términos de productividad y rentabilidad.
El recipiente de polimerización usado como CSTR en la etapa (a) no está particularmente limitado, siempre que la mezcla de reacción durante la etapa de polimerización (a) esté suficientemente mezclada. Para minimizar adicionalmente la formación de segmentos relativamente largos que consisten en unidades repetitivas alternas derivadas del compuesto representado por la fórmula (I) y las unidades repetitivas derivadas del compuesto representado por la fórmula (II), que parecen ser responsables de la formación de turbidez en el copolímero resultante, se prefiere que las relaciones de alimentación de MMA, del compuesto de fórmula (I) y del compuesto de fórmula (II) se ajusten de tal manera que en cualquier momento la mezcla de reacción en el recipiente de polimerización tenga la siguiente composición, basada en las cantidades totales de MMA, de compuesto representado por la fórmula (I), de compuesto representado por la fórmula (II) y de comonómero opcional:
de 28,0 a 99,7% en moles de metacrilato de metilo
de 0,1 a 22,0% en moles del compuesto representado por la fórmula (I)
de 0,2 a 35,0% en moles del compuesto representado por la fórmula (II); y
de 0,0 a 15,0% en moles de un comonómero opcional copolimerizable por radicales con metacrilato de metilo y/o el compuesto representado por la fórmula (I) y/o (II).
Más preferiblemente, las relaciones de alimentación de MMA, del compuesto de fórmula (I) y del compuesto de fórmula (I I) se pueden ajustar de tal manera que en cualquier momento la mezcla de reacción en el recipiente de polimerización obedezca la siguiente relación, en % en moles, basado en las cantidades totales de MMA, de compuesto representado por la fórmula (I), de compuesto representado por la fórmula (II) y de comonómero opcional:
0.3 * m| < rri|| < 2.0 * m|
preferiblemente
0.5 * m| < m|| < 1.9 * m|
más preferiblemente
0.6 * m| < m|| < 1.8 * m|
En general, se puede usar un solo recipiente de polimerización (reactor) en la etapa (a), o se pueden usar dos o más reactores en combinación. Si se emplean varios reactores, pueden operarse en paralelo o conectarse secuencialmente.
La temperatura de polimerización durante la etapa de polimerización (a) se mantiene ventajosamente en un intervalo de 60°C a 200°C, más preferiblemente de 70°C a 180°C, particularmente preferido de 80°C a 160°C, para evitar un aumento excesivo de la viscosidad de la mezcla de reacción en el reactor.
En una realización adicional, la etapa de polimerización (a) se puede llevar a cabo en un reactor tubular. Tanto la polimerización en masa como la polimerización en disolución se pueden llevar a cabo de forma continua en un reactor tubular con o sin elementos mezcladores. Se prefiere que la conversión a la salida del reactor tubular se mantenga en un intervalo de 50 a 98% en peso, basado en el peso total de los monómeros añadidos a la mezcla de reacción. Con una conversión por debajo del 50% en peso, el procedimiento se vuelve desventajoso desde el punto de vista económico. Por otro lado, la conversión no debe exceder el 98% en peso, ya que aumenta innecesariamente el tiempo de residencia medio en el reactor tubular. Un intervalo aún más preferido es de 55 a 96% en peso, y un intervalo más preferido es de 60 a 94% en peso, en particular si el reactor tubular funciona en combinación con otro reactor y es el reactor de polimerización final empleado en la etapa de polimerización (a).
Ventajosamente, el tiempo de residencia medio de la mezcla de reacción en el reactor tubular se mantiene en un intervalo de 0,5 a 8 horas. Si el tiempo de residencia medio es inferior a 0,5 horas, la conversión sigue siendo baja. Por otro lado, el tiempo de residencia medio en un reactor tubular no debe exceder las 9 horas, por motivos de productividad.
Como método para añadir un iniciador de polimerización por radicales usado en el reactor tubular, se prefiere un método de añadir el iniciador de polimerización por radicales junto con la alimentación de los monómeros y/o del disolvente al reactor tubular. Igualmente preferido es un método de mezclar preliminarmente el iniciador de polimerización por radicales en un mezclador estático dispuesto en serie a la entrada del reactor tubular, y hacer pasar la mezcla a través de dicho reactor tubular. Además, es posible y ventajoso añadir al menos algunos de los monómeros y/o el disolvente y/o el mismo tipo de iniciador o uno diferente, aguas abajo a lo largo del reactor tubular, para garantizar un control aún mejor de la conversión durante la etapa de polimerización (a) y de la composición del copolímero formado.
Además, para un ajuste mejorado del aumento de temperatura de la mezcla de reacción, se prefiere añadir el iniciador de polimerización por radicales en un lugar inmediatamente antes de la entrada de la mezcla de reacción del reactor tubular, y en uno o más lugares dentro del reactor. Esto permite que la polimerización proceda de manera más efectiva.
El contenido de polímero en la mezcla de reacción en un reactor tubular normalmente se puede mantener en un intervalo de 50 a 98% en peso, más preferiblemente de 60 a 96% en peso, aún más preferiblemente de 60 a 94% en peso, para asegurar una polimerización eficiente.
En aún otra realización, la etapa de polimerización (a) se puede llevar a cabo en un reactor de bucle tubular. La mezcla de reacción circula en un bucle de tubo, rodeada por una camisa para enfriar o calentar, y hay un flujo continuo de material de partida que entra y producto que sale. El contenido de polímero en la mezcla de reacción en un reactor de bucle tubular normalmente se puede mantener en un intervalo de 30 a 80% en peso, más preferiblemente de 40 a 70% en peso. El tiempo de residencia medio de la mezcla de reacción en el reactor de bucle tubular se mantiene normalmente en un intervalo de 0,15 a 3 horas. Cuando se usa un reactor tubular para llevar a cabo una polimerización adicional, se prefiere que la temperatura de la mezcla de reacción del reactor tubular sea de 60°C a 250°C.
En aún otra realización, la etapa de polimerización (a) se puede llevar a cabo en un reactor semicontinuo con alimentación opcional de monómero y/o disolvente y/o iniciador y/o agente de transferencia de cadena. El tiempo de polimerización no está limitado, y debe escogerse en función de la reactividad del monómero. Un intervalo preferido del tiempo de polimerización es de 1 hora a 24 horas. Un intervalo preferido del tiempo de semidesintegración de los iniciadores es de 10 segundos a 20 horas.
Es ventajoso usar un iniciador de polimerización por radicales con un tiempo de semidesintegración de 0,1 a 90 minutos en un lote o en un CSTR a la temperatura de polimerización. Un intervalo más preferido es de 1 a 60 minutos, y el intervalo más preferido es de 2 a 40 minutos. Si el tiempo de semidesintegración es inferior a 0,1 minutos, dado que el iniciador de polimerización por radicales se descompone antes de que se disperse uniformemente en el reactor de polimerización, la eficiencia (eficiencia de iniciación) del iniciador de polimerización por radicales disminuye. Si se aumenta la cantidad del iniciador de polimerización por radicales, disminuye la estabilidad térmica del copolímero resultante. Por otro lado, si el tiempo de semidesintegración es superior a 90 minutos en el CSTR, se pueden formar grumos de polímero (incrustaciones) en el recipiente de polimerización, lo que dificulta el funcionamiento estable de la polimerización. Además, la concentración de iniciador en el CSTR se acumula cuando el tiempo de semidesintegración es alto, lo que a veces puede conducir a situaciones inseguras, ya que la polimerización y el calor de polimerización generado difícilmente se pueden controlar. Eso puede conducir a un descontrol de la temperatura de polimerización en el CSTR.
En la realización cuando la polimerización se llevar a cabo en un reactor tubular, es ventajoso usar un reactor de polimerización por radicales con un tiempo de semidesintegración de 1,0 minutos a 10 horas a la temperatura de polimerización. Es ventajoso alimentar el reactor tubular con una mezcla polimérica de monómero procedente de otro
reactor tubular o de un CSTR, y llevar a cabo allí sólo la polimerización final. En esta realización, un tiempo de semidesintegración alto del iniciador es menos crítico que en un CSTR, ya que la concentración de monómero en el reactor tubular es típicamente menor que en el CSTR.
Se puede usar un iniciador de polimerización por radicales, o también se pueden usar dos o más como una mezcla. En el caso de que se usen dos o más iniciadores de polimerización por radicales en el reactor tubular, se prefiere usar iniciadores de polimerización por radicales diferentes en una temperatura de semidesintegración de 10 horas de 5°C o más. Esto permite que la etapa de polimerización (a) proceda de manera más eficiente.
El iniciador de polimerización por radicales se puede seleccionar, por ejemplo, de peróxidos orgánicos tales como peroxi-3,5,5-trimetilhexanoato de ferc-butilo, peroxilaurato de ferc-butilo, peroxi isopropil monocarbonato de ferc-butilo, peroxi isopropil monocarbonato de ferc-hexilo, peroxi acetato de ferc-butilo, 1,1-bis(ferc-butil peroxi)-3,3,5-trimetilciclohexano, 1,1-bis(ferc-butil peroxi)ciclohexano, peroxi 2-etilhexanoato de ferc-butilo, peroxi isobutirato de ferc-butilo, peroxi 2-etilhexanoato de ferc-hexilo, peróxido de di-ferc-butilo, 2,5-dimetil-2,5-bis(ferc-butil peroxi)hexano, peróxido de lauroílo, peróxido de benzoílo, peroxi neodecanoato de ferc-butilo, peroxi pivalato de ferc-butilo, peroxi-2-etilhexanoato de ferc-butilo, peroxibenzoato de ferc-butilo, y peróxido de dicumilo, compuestos azo tales como 2-(carbamoilazo)-isobutironitrilo, 1,1 ’-azobis(1 -ciclohexanocarbonitrilo), 2,2’-azobisisobutironitrilo, 2,2’-azobis(2-metilbutironitrilo), 2,2’-azobisisobutirato de dimetilo, 2,2’-azobis(2,4,4-trimetilpentano), 2,2’-azobis(2-metilpropano), 2,2’-azobis-4-metoxi-2,4-dimetilvaleronitrilo, y 2,2’-azobis-2,4-dimetilvaleronitrilo, y similares.
La cantidad del iniciador de polimerización por radicales usado en la etapa de polimerización (a) se ajusta dependiendo de la temperatura de polimerización, el tiempo de polimerización (tiempo de retención medio) y la tasa de conversión deseada. Se prefiere que la cantidad sea de 0,001 a 2,0% en peso, en base al peso total de la mezcla de reacción en la etapa de polimerización (a). Un intervalo más preferido es de 0,01 a 2,0% en peso, e incluso un intervalo más preferido es de 0,01 a 1,0% en peso.
Con el fin de controlar el peso molecular del copolímero, a menudo es ventajoso añadir de 0,001 a 2,0% en peso, más preferiblemente de 0,005 a 2,0% en peso, e incluso más preferiblemente de 0,01 a 1,0% en peso, basado en el peso total de la mezcla de reacción en la etapa de polimerización (a), de un agente de transferencia de cadena. Tales agentes de transferencia de cadena adecuados per se son bien conocidos en la técnica anterior, y se pueden seleccionar, por ejemplo, de un alquil mercaptano, tetracloruro de carbono, tetrabromuro de carbono, dimetilacetamida, etc. Los ejemplos de un alquil mercaptano usado en la etapa de polimerización (a) incluyen, entre otros, noctilmercaptano, ferc-dodecil mercaptano, n-dodecil mercaptano, n-tetradecil mercaptano, n-octadecil mercaptano, etc. Entre ellos, se pueden usar ventajosamente n-octil mercaptano, n-dodecil mercaptano y n-mercaptopropionato de metilo.
Si la polimerización tiene lugar en un reactor por lotes discontinuo, como una polimerización en suspensión o en una lámina colada, el copolímero obtenido puede tener una dispersión de la distribución de pesos moleculares (peso molecular medio ponderal Mw dividido entre el peso molecular medio numérico Mn) de 1,5 a 6,0. En una realización más preferida, el copolímero obtenido puede tener una distribución de pesos moleculares en un intervalo de 1,5 a 4,5. Si la etapa de polimerización (a) tiene lugar en un reactor semidiscontinuo discontinuo con adición de iniciador y/o agente de transferencia de cadena y/o monómeros y/o disolventes, o en un reactor CSTR y/o tubular, el copolímero obtenido puede tener una dispersión de la distribución de pesos moleculares (peso molecular medio ponderal Mw/peso molecular medio numérico Mn) de 1,5 a 5,0. En una realización más preferida, el copolímero obtenido puede tener una distribución de pesos moleculares en un intervalo de 1,5 a 4. Para obtener un copolímero con fluidez mejorada, el copolímero obtenido puede consistir en dos o más picos de peso molecular separados o fusionados en una GPC. La dispersión de la distribución de pesos moleculares (peso molecular medio ponderal Mw/peso molecular medio numérico Mn) es en este caso 2,0 a 8.
En una realización de la presente invención, la etapa de polimerización (a) se lleva a cabo en un Reactor de Tanque Agitado Continuo (CSTR), y la composición y la temperatura de la mezcla de reacción pueden mantenerse sustancialmente homogéneas por medio de un agitador adecuado instalado en el recipiente de polimerización. Normalmente se usa un reactor de tipo CSTR equipado con un agitador, en el que dicho agitador tiene palas agitadoras capaces de mantener la disolución mezclada sustancialmente por completo en el recipiente.
Las formas de las palas agitadoras pueden ser las de las palas agitadoras conocidas públicamente. Por ejemplo, para este fin se pueden usar palas helicoidales dobles, palas de paleta, palas de turbina, palas de hélice, palas Brumagin, palas multietapa, palas de anclaje, palas de mezcla máxima, palas de charco, palas MIG, palas de zona completa, y palas Logborn producidas por Kobelco Eco-Solutions Co., Ltd., y similares. Sobre todo, las palas de cinta helicoidales dobles son particularmente preferidas debido a su alta eficiencia de agitación. Además, para mejorar el efecto de agitación, se prefiere instalar deflectores en el recipiente de polimerización.
Además, dado que la reacción de polimerización y la agitación generan calor, la temperatura de polimerización normalmente se controla mediante eliminación de calor o calentando. La temperatura se puede controlar mediante métodos tal como el uso de una camisa o la circulación de un medio de calentamiento para la transferencia de calor, la eliminación del calor o el calentamiento, o el suministro de una mezcla de monómeros enfriada o calentada, etc.
En una realización preferida, la disolución de copolímero obtenida en un CSTR se suministra sucesivamente de forma continua a un reactor tubular para llevar a cabo una polimerización adicional. Esto reduce la cantidad de componentes volátiles que deben eliminarse en una etapa posterior, lo que hace que todo el procedimiento sea aún más rentable. Además, y aún más importante, esta combinación de dos reactores permite incluso una mejora adicional de las propiedades ópticas del copolímero resultante, en particular una reducción adicional del índice de turbidez y de amarilleamiento debido a una mejor composición y control de conversión del copolímero. Finalmente, dado que la tasa de conversión en el CSTR se puede mantener relativamente baja, la temperatura de polimerización en el CSTR se puede mantener baja. Esto conduce adicionalmente a un aumento de la temperatura de estabilidad térmica y de la temperatura Vicat del copolímero resultante.
El método para suministrar la disolución de copolímero obtenida en el CSTR a un segundo reactor, por ejemplo un segundo CSTR, un reactor tubular, o un reactor de bucle tubular, no está especialmente limitado. Por ejemplo, la operación de extraer la mezcla de reacción del primer CSTR al segundo reactor se puede realizar usando una bomba. Como bomba de alimentación de líquido, se puede usar adecuadamente una bomba de engranajes conocida públicamente. Si la mezcla de reacción es extraída por una bomba, la mezcla de reacción puede alimentarse de manera estable al segundo reactor, y la presión en el segundo reactor, que opcionalmente tiene porciones de estructura de mezclamiento estática instaladas en sucesión, puede elevarse por encima de la presión de vapor de la mezcla de reacción. Como posibilidad adicional, la mezcla de reacción se puede transferir desde el CSTR a un segundo reactor por medio de la diferencia de presión entre los reactores.
Es necesario que la caída de presión en el reactor tubular sea lo suficientemente baja como para que la presión de entrada al reactor tubular, restada por la caída de presión, dé un valor superior a la presión de vapor de la mezcla de reacción a la salida del reactor tubular.
Además, es posible que a medida que aumenta la temperatura de la mezcla de reacción por la generación de calor de polimerización, la temperatura de la pared interna que aumenta secuencialmente desde la entrada de la mezcla de reacción se ajuste en una o más regiones de temperatura en el reactor tubular. Esto permite que la conversión se eleve de manera efectiva mientras se inhibe la descomposición repentina del iniciador de polimerización por radicales. Alternativamente, la temperatura de la mezcla de reacción se puede mantener sustancialmente constante en todo el reactor tubular.
Además, cuando la polimerización se lleva a cabo adicionalmente en el reactor tubular, se prefiere añadir uno o más iniciadores de polimerización por radicales con un tiempo de semidesintegración de 0,1 a 8 horas a la temperatura de reacción del reactor tubular. Un intervalo más preferido es 1 a 7 horas. No se prefiere que el tiempo de semidesintegración de los iniciadores de polimerización por radicales sea superior a 8 horas, ya que la presencia de residuos de iniciador sin reaccionar puede resultar problemática durante la etapa de desvolatilización. Por otro lado, no se prefiere que el tiempo de semidesintegración sea demasiado corto, debido a que el iniciador de polimerización por radicales se descompondrá rápidamente, no permitiendo que la conversión aumente lo suficiente. Como consecuencia, se produciría un copolímero con poca estabilidad térmica. Por lo tanto, se prefiere usar un iniciador de polimerización por radicales con un tiempo de semidesintegración de 0,1 horas o más.
En una realización, un reactor tubular que tiene opcionalmente elementos mezcladores está dispuesto aguas abajo de un CSTR. En el CSTR, una polimerización continua se lleva a cabo mientras la conversión de monómero se mantiene entre 20 y 70% en peso, en base a la alimentación total de monómero en el CSTR, para producir continuamente la disolución de copolímero (primera subetapa de polimerización), y en sucesión, la mezcla de reacción obtenida se extrae continuamente mediante una bomba (subetapa de alimentación de la disolución) o, alternativamente, se alimenta bajo presión al reactor tubular. Además, en sucesión, en el reactor tubular, mientras se hace pasar la mezcla de reacción se añaden un iniciador de polimerización por radicales, monómeros adicionales o disolvente, para asegurar que la conversión de copolímero de todos los monómeros alimentados al CSTR y al reactor tubular de la presente invención en la disolución de copolímero sea 50 a 98% en peso a la salida del reactor tubular (segunda subetapa de polimerización). En este método de producción, se prefiere que la conversión de copolímero de la mezcla de reacción obtenida en la primera subetapa de polimerización se controle típicamente en un intervalo de 20 a 70% en peso, más preferiblemente de 30 a 65% en peso.
La conversión total en la etapa de polimerización (a) es normalmente al menos 40%, más preferiblemente al menos 45%. La conversión inferior al 40% es desventajosa por razones económicas. Por otra parte, tampoco se prefiere que la conversión final sea superior al 98%, ya que el tiempo de polimerización se hace demasiado largo por razones económicas. Un intervalo preferido es 40 a 96%, y un intervalo más preferido es 45 a 94%. El término “conversión", como se usa aquí, se refiere a una relación en peso promedio del copolímero formado en la etapa de polimerización (a) a la alimentación total de monómeros.
Etapa de desvolatilización
De acuerdo con la presente invención, la disolución de copolímero obtenida en la etapa de polimerización (a) se puede suministrar opcionalmente de forma continua a una etapa de calentamiento de la disolución de copolímero a una temperatura de 100°C a 300°C (etapa de calentamiento (b)).
Posteriormente, el material se puede suministrar a un aparato de desvolatilización en la etapa de desvolatilización subsiguiente, para separar y eliminar los monómeros sin reaccionar o la mezcla que consiste en los monómeros sin reaccionar y, si está presente, el disolvente (etapa de desvolatilización (c)).
La temperatura de la disolución de copolímero o la temperatura de fusión del copolímero en la etapa de desvolatilización es normalmente menor que 300°C, más preferiblemente de 150°C a 300°C, incluso más preferiblemente de 170°C a 280°C. La presión preferida en la última zona de desvolatilización de la etapa de desvolatilización es una presión absoluta, típicamente por debajo de 500 mbar, más preferiblemente por debajo de 200 mbar. El límite inferior de la presión absoluta en la etapa de desvolatilización no está limitado, pero por razones técnicas normalmente es al menos 10 mbar o mayor. Si la presión en la etapa de desvolatilización es mayor que 500 mbar, incluso si la desvolatilización se realiza en dicho intervalo de temperatura, los monómeros no reactivos, o la mezcla que consiste en los monómeros no reactivos y el disolvente de polimerización, no pueden separarse o eliminarse de manera eficiente. Esto es desventajoso en términos de estabilidad térmica, propiedades mecánicas y ópticas del copolímero resultante.
Como aparato para realizar dicha desvolatilización, se puede usar una extrusora de un solo tornillo o de dos tornillos, una cámara flash, una amasadora desgasificadota, o una combinación de las mismas. Una realización es un aparato que tiene un recipiente cilíndrico y un agitador que tiene múltiples elementos de agitación unidos a un eje giratorio, y tiene al menos uno o más orificios de ventilación en la parte superior de la parte cilíndrica, un puerto de suministro para suministrar la disolución de copolímero en un extremo de la porción cilíndrica, y un puerto de descarga para extraer el copolímero después de completar la desvolatilización en el otro extremo. El número de ejes giratorios no está limitado, pero normalmente es 1 a 5, preferiblemente 1 o 2, y es más preferido un aparato que tenga dos ejes giratorios. En particular, se prefiere una extrusora continua ventilada de uno o dos tornillos (aparato de amasado, y aparato de amasado por fusión de tipo discontinuo), y se pueden mencionar aquí una extrusora de un solo tornillo, extrusora de doble tornillo, extrusora de amasado continuo combinado de doble tornillo/un tornillo, y extrusora de triple tornillo respectivamente con tornillo o tornillos de tipo “Unimelt”, y máquina amasadora de tipo continuo o por lotes. Sobre todo, se puede usar preferiblemente una extrusora ventilada de uno o dos tornillos, o un reactor continuo de doble tornillo con múltiples paletas de placas elípticas y/o de tipo lentes convexas.
Además, la etapa de desvolatilización en el procedimiento de producción de esta invención puede emplear un método de usar dos o más aparatos de desvolatilización dispuestos en serie, para llevar a cabo la desvolatilización, y esto es ventajoso ya que se puede disminuir aún más el componente volátil restante en el copolímero obtenido después de la desvolatilización.
Composición de moldeo
Otro aspecto de la presente invención se refiere a una composición de moldeo que comprende un copolímero como el descrito anteriormente. La composición de moldeo puede contener al menos un aditivo polimérico común, siempre que este último no afecte negativamente a las propiedades ópticas del copolímero de la presente invención. Diversos aditivos poliméricos son bien conocidos por un experto, e incluyen, entre otros, absorbentes de UV, estabilizadores de UV, estabilizadores de la luz, antioxidantes, colorantes, mejoradores de fluidez, retardantes de la llama, lubricantes y auxiliares de desmoldeo, partículas dispersantes, etc. La estabilidad térmica de la composición de moldeo resultante no debe verse afectada excesivamente por estos aditivos.
Los absorbentes de UV y los estabilizadores de UV y los estabilizadores de la luz para uso en la presente invención son bien conocidos y se describen en detalle a modo de ejemplo en Hans Zweifel, Plastics Additives Handbook, Hanser Verlag, 5.a edición, 2001, pág. 141 y sig. Se entiende que los estabilizadores de UV incluyen estabilizadores de UV y depuradores de radicales libres. Los depuradores de radicales libres son, por ejemplo, fenoles estéricamente impedidos como, sin restricciones, 3-[3,5-di-terc-butil-4-hidroxifenil]propionato] de octadecilo, tetraquis[3-[3,5-di-tercbutil-4-hidroxifenil]propionato de pentaeritritol. Los absorbentes de UV pueden derivar, por ejemplo, del grupo de las benzofenonas sustituidas, ésteres salicílicos, ésteres cinámicos, oxanilidas, benzoxazinonas, hidroxifenilbenzotriazoles, benzotriazoles, triazinas, o bencilidenmalonato. El contenido total de los absorbentes de UV en la composición de moldeo oscila típicamente de 0,01% en peso a 1,0% en peso, especialmente de 0,01% en peso a 0,5% en peso, en particular de 0,02% en peso a 0,2% en peso, basado en el peso de la composición de moldeo.
Los absorbentes de UV pueden estar presentes en la composición de moldeo como compuestos de bajo peso molecular. Sin embargo, los grupos absorbentes de UV en las moléculas de polímero matriz también se pueden enlazar covalentemente después de la copolimerización con compuestos absorbentes de UV polimerizables, tales como, por ejemplo, derivados acrílicos, metacrílicos o alílicos de derivados de benzofenona o de derivados de benzotriazol. Como apreciará fácilmente un experto, también se pueden emplear mezclas de absorbentes UV químicamente diferentes, por ejemplo benzotriazoles en combinación con triazinas.
Los representantes más conocidos de los estabilizadores de UV/depuradores de radicales libres se proporcionan por el grupo de hidroxifenil benzotriazol o aminas estéricamente impedidas (estabilizador de la luz de tipo amina impedida, HALS). Los ejemplos de depuradores de radicales libres/estabilizadores de UV adecuados incluyen, entre otros, fenoles estéricamente impedidos y aminas estéricamente impedidas, que se conocen con el nombre de HALS ((estabilizador de la luz de tipo amina impedida). El grupo de tetrametilpiperidina presente en los compuestos HALS es responsable del efecto estabilizante de los mismos. Esta clase de compuestos puede no estar sustituido o estar sustituido con grupos alquilo o acilo en el nitrógeno de piperidina. Las aminas estéricamente impedidas no absorben en el intervalo UV. Ejemplos de hidroxifenil benzotriazol son 2-(2H-benzotriazol-2-il)-p-cresol, vendido como Tinuvin® P o Drometrizol. Atrapan los radicales libres formados, lo que nuevamente los absorbentes de UV son incapaces de hacer. Los depuradores de radicales libres/estabilizadores de UV se usan en las composiciones según la invención en cantidades de 0,01% en peso a 1,5% en peso, especialmente en cantidades de 0,02% en peso a 1,0% en peso, en particular, en cantidades de 0,02% en peso a 0,5% en peso, basado en el peso de la composición de moldeo. También es posible una combinación de estabilizadores/absorbentes de UV, estabilizadores de la luz, y antioxidantes.
Los lubricantes y agentes de desmoldeo que pueden reducir o evitar por completo la posible adherencia de la composición de moldeo al molde de inyección son importantes para el procedimiento de moldeo por inyección, y también se pueden emplear. Por ejemplo, pueden estar presentes como auxiliares, lubricantes, seleccionados del grupo que consiste en ácidos grasos saturados, ésteres o sales inorgánicas que tienen menos de C20, preferiblemente C16 a C18, átomos de carbono, o en alcoholes grasos saturados que tienen menos de C20, preferiblemente C16 a C18, átomos de carbono. Por ejemplo, ácido esteárico, alcohol estearílico, ácido palmítico, alcohol palmítico, ácido láurico, ácido láctico, monoestearato de glicerol, pentaeritrol, y mezclas industriales de ácido esteárico y palmítico. También son adecuados n-hexadecanol, n-octadecanol, y mezclas industriales de n-hexadecanol y n-octadecano, y monoestearato de glicerol. Un lubricante o agente de desmoldeo particularmente preferido es alcohol estearílico. Los lubricantes se usan típicamente en cantidades de no más del 1,0% en peso, por ejemplo 0,05% en peso a 0,25% en peso, basado en el peso de la composición de moldeo.
La composición de moldeo de la presente invención se puede procesar termoplásticamente mediante un método común, tal como moldeo por inyección y extrusión en condiciones de procesamiento habituales para obtener un artículo moldeado. El moldeo por inyección de la composición se puede llevar a cabo de manera conocida a temperaturas en el intervalo de 220°C a 280°C (temperatura de fusión) y una temperatura de moldeo preferiblemente de 602C a 120°C. La extrusión se lleva a cabo preferiblemente a una temperatura de 220°C a 280°C.
Debido a su alta estabilidad térmica y baja turbidez, la composición de moldeo y el artículo moldeado fabricado a partir de ella son muy adecuados para aplicaciones ópticas tales como iluminación y acristalamiento. Tales aplicaciones incluyen guías de luz, lentes y acristalamientos (por ejemplo, cubiertas de vidrio para luces de vehículos de motor, es decir, faros o luces traseras; cubiertas para luces de automóviles; otras aplicaciones de iluminación variadas para iluminación interior y/o exterior de edificios que tienen que satisfacer altas demandas, particularmente con respecto al vandalismo, estabilidad térmica y buena procesabilidad).
La composición de moldeo de la invención también se puede usar ventajosamente en pantallas para dispositivos de comunicación, especialmente PDA, teléfonos móviles, preferiblemente teléfonos inteligentes; tabletas; dispositivos de televisión; electrodomésticos de cocina y otros dispositivos electrónicos.
Los siguientes ejemplos ilustran la invención con mayor detalle. Sin embargo, no se pretende que la presente invención se limite a estos ejemplos.
Ejemplos
Análisis
Condiciones de medida de GPC
Eluyente: THF (grado HPLC) 0,2% en volumen de TFA Caudal: 1 ml / min
Volumen inyectado: 100 □!
Detección: RI HPS
Concentración de la disolución de muestra: 2 g/l
Patrón: PMMA
Propiedades del producto
Se prepararon probetas de 3,0 mm de grosor mediante moldeo por inyección a 250°C, y posteriormente se almacenaron durante 72 h a 23°C y una humedad relativa del 50% antes de las medidas.
La turbidez se determinó usando un turbidímetro BYK Gardner Hazegard-plus según ASTM D 1003 (1997).
La transmisión óptica se midió usando un espectrofotómetro Varian Cary 5000 según ISO 13468-2 (2006).
La temperatura de reblandecimiento Vicat VST ISO 306-B50 (2014) se midió usando probetas de 3,0 mm de grosor que se almacenaron durante 16 h a 105°C antes de las medidas.
El índice de fluidez (MVR) se determinó según ISO 1133 (2011) a 230°C bajo una carga de 3,8 kg.
Composición del producto
La composición de los copolímeros se determinó usando espectros de RMN 1H, registrados en un espectrómetro de RMN de 400 MHz de Bruker. El contenido de unidades repetitivas derivadas del anhídrido maleico (MAH) en los copolímeros se determinó por titulación.
El contenido de monómero residual de MMA y 2-norborneno se determinó mediante cromatografía de gases (GC) de espacio de cabeza. Para la determinación del contenido de monómero residual de MAH, los gránulos de copolímero se disolvieron en THF, el polímero se precipitó con MeOH, y la disolución de THF filtrada se analizó entonces mediante HPLC.
Materiales de partida
Se usaron los siguientes materiales de partida:
metacrilato de metilo (MMA), pureza > 99,6% de Rohm GmbH, Darmstadt, Alemania, acrilato de metilo (MA), pureza > 99% de Sigma Aldrich, St. Louis, Estados Unidos, anhídrido maleico (MAH), pureza > 99% de Sigma Aldrich, St. Louis, Estados Unidos, ciclohexil maleimida (CHMI) de Nippon Shokubai, Japón
2-norborneno (2-NB), pureza > 99,9% de Topas Advanced Polymers GmbH, Frankfurt, Alemania n-dodecilmercaptano (DDM), pureza del 98% de Dr. Spiess Chemische Fabrik GmbH, Kleinkarlbach, Alemania
peroxi-2-etilhexanoato de ferc-butilo (TBPEH), perneodecanoato de ferc-butilo (TBPND) y per-3,5,5-trimetilhexanoato de ferc-butilo (TBPIN), pureza > 98% de Pergan Hilfsstoffe für industrielle Prozesse GmbH, Bocholt, Alemania
tolueno, pureza del 99,8% de Brenntag AG, Essen, Alemania
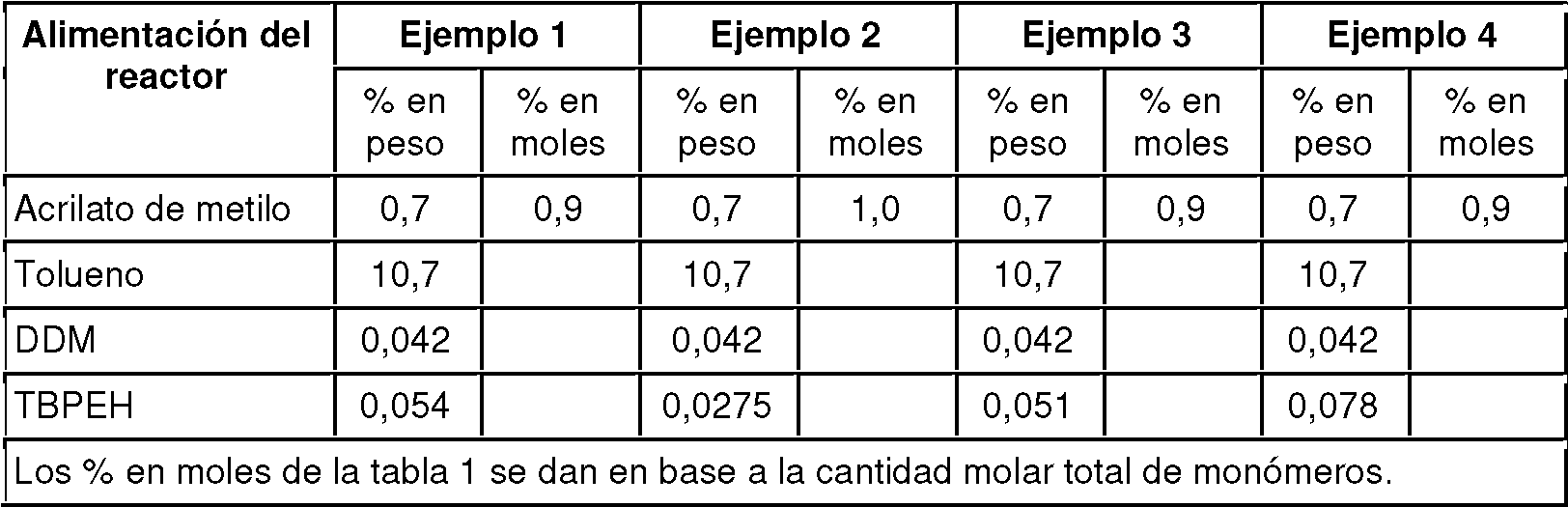
Ejemplos 1-4 (inventivo)
Los ejemplos 1-4 se llevaron a cabo en un CSTR. El CSTR era un recipiente de acero inoxidable agitado, con un volumen de reacción de 2,4 litros. CSTR generalmente permite obtener productos que tienen una distribución relativamente estrecha de longitudes de cadena polimérica. Esto simplifica la investigación de la relación entre la composición del polímero y las propiedades ópticas.
La temperatura de polimerización se monitorizó continuamente usando un termopar, y se mantuvo constante durante la polimerización calentando la camisa del reactor con aceite circulante. La temperatura de polimerización fue 140°C. Se usó n-dodecilmercaptano (DDM) como agente de transferencia de cadena, y se empleó peroxi-2-etilhexanoato de ferc-butilo (TBPEH) como iniciador de radicales. Las composiciones de la alimentación del reactor se especifican en la Tabla 1.
Tabla 1. Composición de la alimentación del reactor en los Ejemplos 1 -4
Para asegurar una operación de estado estable, los reactores se operaron durante alrededor de 6 horas antes de que se tomaran muestras de material.
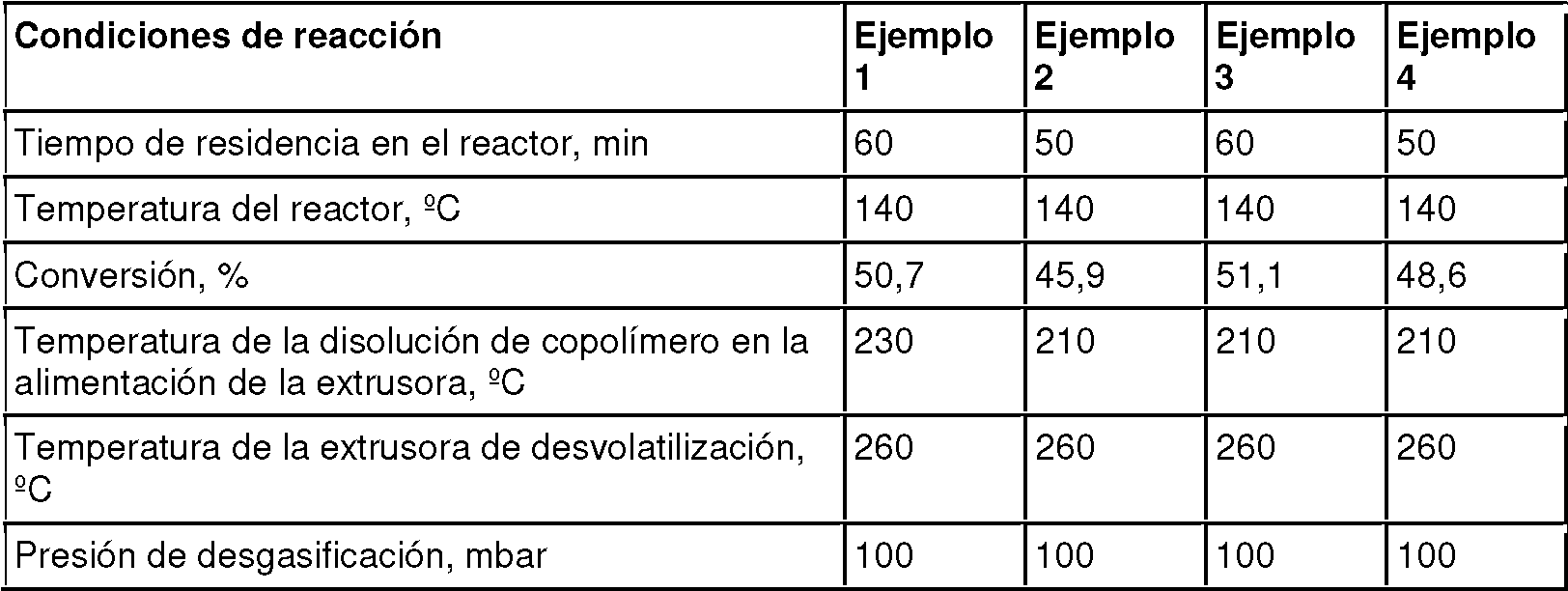
La salida continua de la disolución de copolímero del CSTR se calentó a 210°C en un intercambiador de calor aguas abajo del reactor, y después se desvolatilizó y peletizó en una extrusora de un solo tornillo con un diámetro de tornillo de 15 mm bajo una presión absoluta de 100 mbar.
Las condiciones de operación en los Ejemplos 1-4 se resumen en la Tabla 2.
Tabla 2. Condiciones de operación en los Ejemplos 1-4
Los peletes obtenidos se moldearon por inyección a 250°C en plaquetas de 3 mm de grosor para investigar las propiedades ópticas y la temperatura de reblandecimiento Vicat B50, °C según ISO 306. Para todas las demás pruebas, los peletes se usaron directamente.
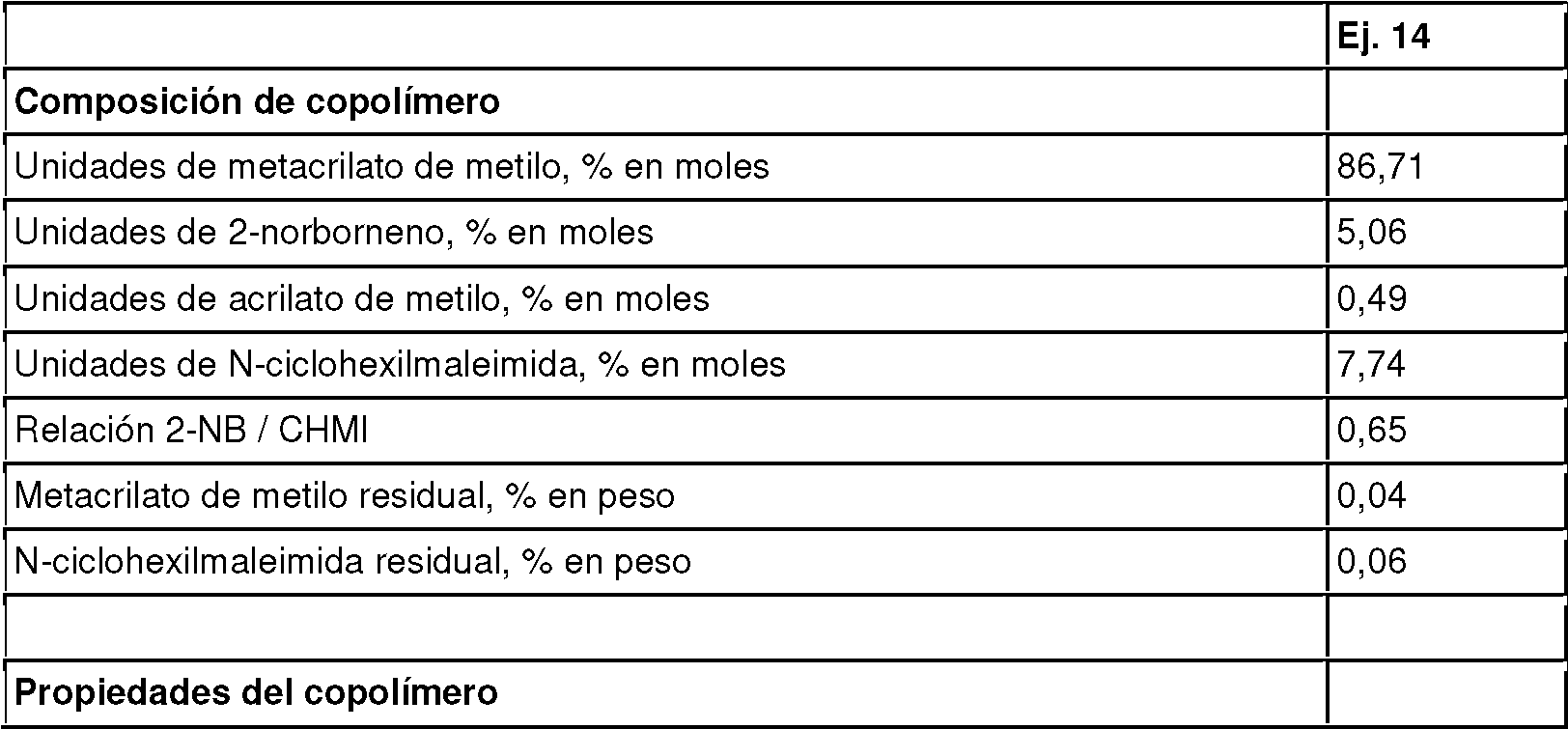
Las propiedades y composición de los copolímeros obtenidos se resumen en la Tabla 3.
Tabla 3. Composición y propiedades de los copolímeros obtenidos en los Ejemplos 1-4
Los copolímeros obtenidos en los Ejemplos 1-4 son materiales transparentes, y tienen una turbidez óptica tan baja como del 0,58% al 0,83%. Sin embargo, como puede observarse en la Tabla 3, la turbidez óptica tiende a aumentar con el aumento de la relación molar de 2-NB a MAH, y también con el aumento del peso molecular del copolímero.
Todos los copolímeros de los Ejemplos 1-4 tienen una turbidez baja y una temperatura Vicat alta, y por lo tanto son muy adecuados para su uso en elementos ópticos que pueden funcionar a temperaturas altas.
Ejemplos 5-7 (inventivo) y Ejemplo 8 (comparativo)
En los Ejemplos 5-8, las polimerizaciones se llevaron a cabo en un reactor discontinuo equipado con alimentaciones de monómero e iniciador. El reactor discontinuo era un reactor de vidrio agitado con una capacidad de 5 litros. La temperatura de polimerización se monitorizó continuamente usando un termopar, y se mantuvo constante durante la polimerización calentando la camisa del reactor con aceite circulante.
Se utilizó dodecilmercaptano (DDM) como agente de transferencia de cadena, y se empleó peroxi-2-etilhexanoato de ferc-butilo (TBPEH) como iniciador de radicales.
Al comienzo de la reacción, los monómeros y el disolvente se colocaron en el reactor, y la polimerización se inició añadiendo una pequeña cantidad del iniciador. Para evitar que la viscosidad de la mezcla de reacción se hiciera demasiado alta con el aumento de la conversión, se dosificó continuamente tolueno durante la polimerización. Dado que el tiempo de semidesintegración del iniciador es alrededor de 40 minutos a la temperatura de reacción de 95°C, se suministró continuamente más TBPEH a la mezcla de reacción en la alimentación de tolueno. Además, en los Ejemplos 5-7, también se suministró continuamente MMA a la mezcla de reacción con la alimentación de tolueno. La Tabla 5 proporciona una lista completa de los materiales de partida empleados al comienzo de las reacciones y en las alimentaciones, y la Tabla 4 resume las condiciones de operación.
Tabla 4. Condiciones de operación en los Ejemplos 5-8
Posteriormente, las disoluciones de copolímero obtenidas se desvolatilizaron y se peletizaron en una extrusora de un solo tornillo con un diámetro de tornillo de 15 mm bajo una presión absoluta de 100 mbar, como se describe en los Ejemplos 1-4.
00
mI
_
(
o
/)
Q .
E<D
llT
w
o
£0Z)
•co
o03
c0)
E
(D
(D
CD
> S
O
Oo( 0 ü )
~ < o D
O
Q .
c
O
Q _
(D
(O/)
~o 03
_0)
Q .
E
a)
T033
t (QD .
T
0
3
)
- <D
(HD
Tabla 6. Cantidades totales de materiales de partida empleados en los Ejemplos 5-8
Los % en moles de la tabla 6 se dan en base a la cantidad molar total de monómeros.
Los peletes obtenidos se moldearon por inyección a 250°C en plaquetas de 3 mm de grosor para la investigación de las propiedades ópticas y Vicat. Para todas las demás pruebas, los peletes se usaron directamente.
Las propiedades y composición de los copolímeros obtenidos se resumen en la Tabla 7.
Tabla 7. Composición y propiedades de los copolímeros obtenidos en los Ejemplos 5-8
Los copolímeros obtenidos en los Ejemplos 5-7 eran materiales transparentes, y el copolímero del Ejemplo 8 (comparativo) tenía un aspecto ligeramente turbio debido a un alto contenido de MAH (20% en moles). Los materiales que tienen una turbidez tan alta sólo se pueden usar para piezas ópticas relativamente delgadas. Un intento de usarlo en piezas más gruesas, tales como lentes, provocaría pérdidas significativas debido a la dispersión de la luz. Esta
dispersión de luz no deseada puede ser visualizada, por ejemplo, irradiando el componente con luz LED de alta potencia.
En contraste con el copolímero del Ejemplo 8 (comparativo), los copolímeros de los Ejemplos 5-7 tienen una turbidez baja y una temperatura Vicat alta, y por lo tanto son muy adecuados para uso en elementos ópticos que pueden operar a altas temperaturas.
Ejemplo 9
El ejemplo 9 se llevó a cabo en un reactor CSTR conectado secuencialmente con un reactor tubular. El CSTR era un recipiente de acero inoxidable agitado, con un volumen de reacción de 7,3 litros. El reactor tubular subsiguiente era un tubo de acero inoxidable de 32,8 mm de diámetro interior y 15 m de longitud, con una camisa exterior de aceite térmico para enfriar y calentar la mezcla de reacción. El reactor tubular se equipó con elementos mezcladores estáticos de tipo SMXL® de Sulzer Ltd. Winterthur Suiza.
La mezcla de reacción se alimentó en parte al CSTR y en parte al comienzo del reactor tubular, en el que la salida del CSTR también se alimentó al reactor tubular.
La salida de la disolución de copolímero del reactor tubular se calentó en un postcalentador a 200°C, y se alimentó a una extrusora de doble tornillo de 15 mm, en la que la disolución de copolímero se desvolatilizó y se peletizó a 100 mbar para eliminar los monómeros no convertidos y el tolueno.
La temperatura del reactor del CSTR fue 115°C, y la temperatura de la disolución de copolímero en el reactor tubular fue 120°C.
El polímero resultante se investigó como se describe anteriormente.
Para el control del procedimiento del CSTR, se tomaron muestras de la salida de la disolución de copolímero del CSTR, las cuales se secaron bien durante 16 horas a 120°C a 20 mbar para obtener el polímero puro. La conversión de monómero en el CSTR fue 63%, definida como la cantidad de polímero seco en la muestra del CSTR con respecto a la alimentación de los monómeros totales en la muestra del CSTR. Se supuso que el tolueno no participó en un grado apreciable en la polimerización, de manera que la fracción ponderal de tolueno en la muestra del CSTR era la misma que en la alimentación total del CSTR. La conversión de monómero en el reactor tubular fue 81,4%.
Se usó dodecilmercaptano (DDM) como agente de transferencia de cadena, y perneodecanoato de ferc-butilo (TBPND) y per-3,5,5-trimetilhexanoato de ferc-butilo (TBPIN) como iniciadores de radicales. Las composiciones de las alimentaciones del reactor se especifican en la Tabla 8.
Tabla 8: Composición de la alimentación del reactor
Los % en moles de la tabla 8 se dan en base a la cantidad molar total de monómeros.
Los peletes obtenidos se moldearon por inyección a 250°C en placas de 3 mm de grosor para la investigación de las propiedades ópticas y Vicat. Para todas las demás pruebas, los peletes se usaron directamente.
Tabla 9. Composición y propiedades de los copolímeros obtenidos en el Ejemplo 9
El copolímero del Ejemplo 9 tiene una turbidez baja y una temperatura Vicat alta, y por lo tanto es muy adecuado para uso en elementos ópticos que pueden funcionar a temperaturas altas.
Ejemplos 10-13 (comparativo)
Los ejemplos 1-4 de la solicitud de patente JP H4-63810A se reprodujeron según los procedimientos descritos en el documento JP H4-63810A.
Todas las disoluciones de polímero obtenidas en los Ejemplos 10-13 eran turbias y blancas. El procesamiento posterior de los copolímeros no fue necesario debido a que los copolímeros ya precipitaron de la disolución de copolímero en las ampollas. La insolubilidad de estos copolímeros es generalmente problemática en una producción a gran escala.
Dado que 2-NB no se copolimeriza radicalmente con MMA, el aumento de la relación 2-NB a MAH da como resultado dominios más largos que consisten en secuencias alternas de unidades repetitivas derivadas de 2-NB y unidades repetitivas derivadas de MAH. Esta parece ser la razón del aspecto lechoso de los copolímeros en los Ejemplos 10 13.
Además, con pesos moleculares altos del polímero, o proporciones altas de anhídrido maleico en el copolímero de PMMA, es de esperar que estos dominios rígidos de cadena larga tengan una solubilidad reducida en el copolímero de PMMA. Este parece ser el caso en el Ejemplo 13. Aunque el copolímero tiene un bajo contenido de ácido maleico de sólo 8% en moles, su peso molecular es tan alto como 729.000 g/mol. Como consecuencia, el copolímero turbio precipita de la mezcla de reacción.
Ejemplo 14 (inventivo)
El ejemplo 14 se llevó a cabo en un reactor discontinuo equipado con alimentaciones de monómero e iniciador de forma idéntica a los ejemplos 5-8 en lugar de usar una composición de monómero como se describe en las tablas 10 y 11 a continuación, que comprende N-ciclohexilmaleimida (CHMI) en lugar de anhídrido maleico. Las condiciones de reacción son idénticas a las del ejemplo 5 (véase la tabla 4 más arriba), con una conversión de monómero del 94%.
Tabla 10 Materiales de partida empleados al principio de la reacción y en la alimentación en el Ejemplo 14
Tabla 11. Cantidades totales de materiales de partida empleados en el Ejemplo 14
Las disoluciones de copolímero obtenidas se procesaron como se describe en los ejemplos 5-8, y el copolímero obtenido se analizó como se describe anteriormente. Los resultados de la prueba se resumen en la tabla 12 a continuación.
Tabla 12. Composición y propiedades de los copolímeros obtenidos en el Ejemplo 14
Ejemplo 15 - Prueba de almacenamiento de calor de LED
El copolímero según el ejemplo 6, así como un material de policarbonato (PC) comparativo, se evaluaron en la prueba de almacenamiento de calor de LED.
El material de policarbonato (PC) era un policarbonato comercialmente disponible para aplicaciones LED, que tenía una temperatura de reblandecimiento Vicat (B50) de 146°C.
Los materiales poliméricos se moldearon por inyección en placas redondas de 8 mm x 45 mm. Se cortaron barras de 40 mm de longitud y 8 mm x 11 mm de sección transversal a partir de las placas redondas moldeadas por inyección. Las barras se almacenaron a 110°C (para el ejemplo 6) o 120°C (para material de policarbonato) en una pequeña abertura redonda de 10 mm x 10 mm en un bloque de metal calentado. Una muestra se almacenó durante varios días sin iluminación LED, mientras que una muestra tenía en un extremo un LED blanco (Osram OSTAR LE UW U1A401), que iluminaba la sección transversal con 0,1 W/cm.2 a 5 mm de distancia de la barra. Todo el bloque de metal tiene un grosor de 100 mm, con una abertura redonda que atraviesa de lado a lado. Parte de la longitud de la abertura se llena con la barra procedente de la placa redonda de 45 mm x 8 mm. En diversos momentos, se tomaron muestras del bloque calentado, y se midieron la transmitancia y el índice de amarilleamiento.
Los resultados se resumen en la tabla 13. Los valores de A muestran la diferencia del valor respectivo al final del procedimiento de prueba (3504 h o 4521 h) y al comienzo (0 h), por ejemplo AT = T (3504 h) - T (0 h).
Tabla 13. Resultados de la prueba de almacenamiento de calor de LED.
Para el material inventivo según el ejemplo 6, no se observó un aumento significativo en YI (acrón. inglés = índice de amarilleamiento) y transmitancia durante 3500 horas sin luz LED. Se observó una ligera disminución de YI en las primeras 500 h (sin luz LED), que es típica y se ve a menudo en los polímeros de poli(metacrilato de metilo). Se observó una disminución más significativa de YI para el material inventivo con luz LED, debido al efecto de blanqueo de la luz.
El YI del material de comparación de policarbonato disminuyó ligeramente en las primeras 300 horas con luz LED, pero se observó una inclinación significativa de YI después de alrededor de 600 h, y al final de la prueba después de alrededor de 4500 h con luz LED y sin luz LED. La transmitancia disminuye sin luz LED.
La muestra de policarbonato se analizó a 1202C, que es 26 K por debajo de la temperatura Vicat del material. El polímero inventivo (ejemplo 6) se probó a una temperatura más baja de 110°C; sin embargo, esta temperatura de ensayo está más cerca de la temperatura Vicat, es decir, solo 14 K por debajo de la temperatura Vicat respectiva del copolímero según el ejemplo 6. Como consecuencia, incluso si la temperatura de ensayo es diferente, se demuestra que el copolímero de la invención muestra una estabilidad térmica y una estabilidad térmica a la luz significativamente mejores en comparación con el material de policarbonato basado en el área de temperatura respectiva, proporcionando suficiente estabilidad dimensional.
Claims (15)
1. Un copolímero, que comprende
de 47,0 a 99,8% en moles de unidades repetitivas derivadas de metacrilato de metilo, de 0,1 a 20,0% en moles de unidades repetitivas derivadas del compuesto representado por la fórmula (II)
en la que X está representado por un átomo de oxígeno o N-R1, siendo el sustituyente R1 un átomo de hidrógeno o un grupo hidrocarbonado que tiene de 1 a 12 átomos de carbono;
de 0,1 a 18,0% en moles de unidades repetitivas derivadas del compuesto representado por la fórmula (II)
en la que los sustituyentes R2, R3 y R4 pueden estar representados independientemente por un átomo de hidrógeno, un grupo hidrocarbonado que tiene de 1 a 12 átomos de carbono, un grupo carboxílico, -C(O)-alquilo de C1-12, -C(O)-cicloalquilo de C1-12, -C(O)-O-alquilo de C1-12 o -C(O)-O-cicloalquilo de C1-12; y en la que R3 y R4 pueden estar representados independientemente por un grupo hidroxi o formar juntos un resto cíclico; y
de 0,0 a 15,0% en moles de unidades repetitivas derivadas de un comonómero opcional copolimerizable mediante radicales con metacrilato de metilo y/o el compuesto representado por la fórmula (I) y/o la fórmula (II), siendo el comonómero opcional preferiblemente un (met)acrilato de alquilo, un ácido metacrílico, un (met)acrilonitrilo o un monómero de vinilo aromático;
en el que el peso molecular medio ponderal Mw del copolímero, determinado por GPC, es de 40.000 a 300.000 g/mol y en el que el contenido de unidades repetitivas derivadas del compuesto representado por la fórmula (II) pn, en % en moles, en el copolímero, se describe mediante la siguiente relación:
en la que pI es el contenido de unidades repetitivas derivadas del compuesto representado por la fórmula (I), en % en moles, en el copolímero.
2. Copolímero según la reivindicación 1, en el que
el compuesto representado por la Fórmula (I) es anhídrido de ácido maleico, y
el compuesto representado por la Fórmula (II) es 2-norborneno.
3. Copolímero según cualquiera de las reivindicaciones 1 a 2, en el que el comonómero opcional es acrilato de metilo o acrilato de etilo.
4. Copolímero según cualquiera de las reivindicaciones 1 a 43, en el que la temperatura de reblandecimiento Vicat según ISO 306-B50 (2014) es ventajosamente al menos 90°C, preferiblemente al menos 100°C, más preferiblemente al menos 110°C.
5. Un procedimiento para la fabricación de un copolímero según cualquiera de las reivindicaciones 1 a 4, que comprende
(a) una etapa de polimerización, en la que una mezcla de monómeros que comprende MMA, un compuesto de fórmula (I), un compuesto de fórmula (II) y, opcionalmente, un comonómero opcional, sufre copolimerización por radicales para formar una disolución de copolímero, una dispersión de copolímero o una suspensión de copolímero.
6. Procedimiento según la reivindicación 65, en el que la etapa de copolimerización (a) se lleva a cabo en presencia de un disolvente seleccionado preferiblemente de tolueno, acetato de butilo, acetato de etilo, xileno, dimetilfurano, metiletilcetona, o una mezcla de cualquiera de ellos.
7. Procedimiento según la reivindicación 5 o 6, en el que la alimentación total de monómeros en la etapa de polimerización (a) tiene la siguiente composición, en base a la cantidad total de componentes polimerizables: de 28,0 a 99,7% en moles de metacrilato de metilo
de 0,1 a 22,0% en moles del compuesto representado por la fórmula (I)
de 0,2 a 35,0% en moles del compuesto representado por la fórmula (II); y
de 0,0 a 15,0% en moles de un comonómero opcional copolimerizable por radicales con metacrilato de metilo y/o el compuesto representado por la fórmula (I) y/o (II).
8. Procedimiento según cualquiera de las reivindicaciones 5 a 7, en el que el contenido del compuesto representado por la fórmula (II) mn, en % en moles, en la alimentación total de monómeros en la etapa de polimerización (a), se describe mediante la siguiente relación:
en la que mI es el contenido del compuesto representado por la fórmula (I), en % en moles, en la mezcla de monómeros.
9. Procedimiento según cualquiera de las reivindicaciones 5 a 8, en el que la etapa de polimerización (a) se lleva a cabo en un reactor de tanque agitado que funciona de forma discontinua o continua, un reactor tubular de funcionamiento continuo, un reactor de bucle que funciona de forma continua o discontinua, o una combinación de cualquiera de ellos, y en el que si se emplean varios reactores, se hacen funcionar en paralelo o se conectan secuencialmente.
10. Procedimiento según cualquiera de las reivindicaciones 5 a 9, en el que la etapa de polimerización (a) se lleva a cabo en al menos un reactor de tanque agitado que funciona de forma continua conectado secuencialmente con un reactor tubular, en el que el reactor tubular está ubicado aguas abajo del reactor de tanque agitado.
11. Procedimiento según cualquiera de las reivindicaciones 5 a 10, en el que la conversión en la etapa de polimerización (a) es al menos 40%, preferiblemente al menos 45%.
12. Procedimiento según cualquiera de las reivindicaciones 5 a 11, en el que a la etapa de polimerización (a) le sigue (b) una etapa de calentamiento de la disolución de copolímero obtenida en la etapa de polimerización (a), hasta una temperatura de 100°C a 300°C y
(c) una etapa de eliminación de componentes volátiles en un aparato de desgasificación.
13. Composición de moldeo que comprende un copolímero según cualquiera de las reivindicaciones 1 a 4 y al menos un aditivo seleccionado de absorbentes de UV, estabilizadores de UV, antioxidantes, colorantes, mejoradores de la fluidez, auxiliares de la dispersión, lubricantes, auxiliares de desmoldeo, o una combinación de cualquiera de ellos.
14. Artículo moldeado obtenible a partir de una composición de moldeo según la reivindicación 13 mediante un procedimiento seleccionado de moldeo por inyección y extrusión.
15. Uso de un artículo moldeado según la reivindicación 14 como elemento óptico, cubierta de lámpara, preferiblemente para sistemas de iluminación de habitaciones o equipos de iluminación de automóviles, molduras de pilares de color negro, componente electrónico.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP20182498 | 2020-06-26 | ||
| PCT/EP2021/067061 WO2021259965A1 (en) | 2020-06-26 | 2021-06-23 | Optical grade moulding compositions having increased thermal stability |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2941702T3 true ES2941702T3 (es) | 2023-05-24 |
Family
ID=71527570
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES21733149T Active ES2941702T3 (es) | 2020-06-26 | 2021-06-23 | Composiciones de moldeo de grado óptico que tienen una estabilidad térmica aumentada |
Country Status (16)
| Country | Link |
|---|---|
| US (1) | US20230303740A1 (es) |
| EP (1) | EP4041785B1 (es) |
| JP (1) | JP7788410B2 (es) |
| KR (1) | KR20230029861A (es) |
| CN (1) | CN115734974B (es) |
| BR (1) | BR112022026438A2 (es) |
| CA (1) | CA3184075A1 (es) |
| ES (1) | ES2941702T3 (es) |
| HU (1) | HUE061367T2 (es) |
| MX (1) | MX2022015882A (es) |
| MY (1) | MY206459A (es) |
| PL (1) | PL4041785T3 (es) |
| SA (1) | SA522441819B1 (es) |
| SI (1) | SI4041785T1 (es) |
| TW (1) | TW202200642A (es) |
| WO (1) | WO2021259965A1 (es) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2025061516A1 (en) | 2023-09-20 | 2025-03-27 | Röhm Gmbh | Copolymer based on methyl methacrylate and optical grade moulding composition comprising it |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4558098A (en) | 1982-12-28 | 1985-12-10 | Mitsubishi Rayon Co., Ltd. | Methacrylic resin composition |
| JPH0463810A (ja) * | 1990-07-03 | 1992-02-28 | Kuraray Co Ltd | アクリル―ノルボルネン系共重合体およびその製造法 |
| FR2699540B1 (fr) | 1992-12-23 | 1995-02-24 | Atochem Elf Sa | Polymère thermoplastique transparent ayant une température de transition vitreuse élevée et une stabilité thermique améliorée. |
| JPH07242711A (ja) * | 1994-03-04 | 1995-09-19 | Kuraray Co Ltd | メタクリル酸メチル共重合体 |
| DE102004022540A1 (de) | 2004-05-05 | 2005-12-08 | Röhm GmbH & Co. KG | Formmasse für Formkörper mit hoher Witterungsbeständigkeit |
| KR100880519B1 (ko) * | 2006-04-07 | 2009-01-28 | 주식회사 엘지화학 | 올레핀-아크릴레이트-말레산 무수물-노보넨 4원 공중합체및 상기 중합체의 제조 방법 |
| CN102112506B (zh) * | 2008-07-31 | 2013-08-21 | 旭化成化学株式会社 | 热塑性丙烯酸树脂及其成型体 |
| CN101691414B (zh) * | 2009-06-15 | 2012-06-13 | 宁波工程学院 | 用于降冰片烯与马来酸酐、丙烯酸酯三元共聚的催化剂及其制备方法以及三元共聚方法 |
| JP2011026563A (ja) * | 2009-06-22 | 2011-02-10 | Asahi Kasei Chemicals Corp | 耐熱アクリル系樹脂組成物、及びその成形体 |
| DE102009046197A1 (de) * | 2009-10-30 | 2011-05-05 | Evonik Röhm Gmbh | Homopolymere und Copolymere der Hydroxyisobuttersäure(ester)(meth)acrylate |
| KR101409208B1 (ko) | 2011-04-13 | 2014-06-20 | 주식회사 엘지화학 | 연속괴상중합법에 의한 광학 필름용 수지 조성물의 제조 방법, 이를 이용한 광학 필름의 제조 방법 및 편광판 제조 방법 |
| JP5822225B2 (ja) * | 2011-08-30 | 2015-11-24 | 株式会社クラレ | 炭化水素系共重合体およびその製造方法、並びに成形体 |
| KR101344873B1 (ko) * | 2011-10-17 | 2013-12-30 | 이근수 | 공중합체 조성물, 이로부터 얻어진 내열성 수지 및 그 제조 방법 |
| JP7129181B2 (ja) * | 2017-03-17 | 2022-09-01 | 旭化成株式会社 | ヘッドマウントディスプレイ用部材 |
-
2021
- 2021-06-09 TW TW110121027A patent/TW202200642A/zh unknown
- 2021-06-23 CN CN202180045431.8A patent/CN115734974B/zh active Active
- 2021-06-23 EP EP21733149.5A patent/EP4041785B1/en active Active
- 2021-06-23 SI SI202130034T patent/SI4041785T1/sl unknown
- 2021-06-23 BR BR112022026438A patent/BR112022026438A2/pt unknown
- 2021-06-23 KR KR1020237002649A patent/KR20230029861A/ko active Pending
- 2021-06-23 US US18/002,974 patent/US20230303740A1/en active Pending
- 2021-06-23 JP JP2022580147A patent/JP7788410B2/ja active Active
- 2021-06-23 CA CA3184075A patent/CA3184075A1/en active Pending
- 2021-06-23 HU HUE21733149A patent/HUE061367T2/hu unknown
- 2021-06-23 PL PL21733149.5T patent/PL4041785T3/pl unknown
- 2021-06-23 ES ES21733149T patent/ES2941702T3/es active Active
- 2021-06-23 MY MYPI2022007349A patent/MY206459A/en unknown
- 2021-06-23 WO PCT/EP2021/067061 patent/WO2021259965A1/en not_active Ceased
- 2021-06-23 MX MX2022015882A patent/MX2022015882A/es unknown
-
2022
- 2022-12-21 SA SA522441819A patent/SA522441819B1/ar unknown
Also Published As
| Publication number | Publication date |
|---|---|
| EP4041785A1 (en) | 2022-08-17 |
| EP4041785B1 (en) | 2023-01-25 |
| MX2022015882A (es) | 2023-01-24 |
| MY206459A (en) | 2024-12-18 |
| KR20230029861A (ko) | 2023-03-03 |
| CN115734974A (zh) | 2023-03-03 |
| CN115734974B (zh) | 2024-05-28 |
| JP7788410B2 (ja) | 2025-12-18 |
| US20230303740A1 (en) | 2023-09-28 |
| PL4041785T3 (pl) | 2023-04-24 |
| TW202200642A (zh) | 2022-01-01 |
| SI4041785T1 (sl) | 2023-05-31 |
| BR112022026438A2 (pt) | 2023-01-31 |
| WO2021259965A1 (en) | 2021-12-30 |
| HUE061367T2 (hu) | 2023-06-28 |
| CA3184075A1 (en) | 2021-12-30 |
| SA522441819B1 (ar) | 2024-06-09 |
| JP2023536219A (ja) | 2023-08-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN108350125B (zh) | 甲基丙烯酸系树脂、甲基丙烯酸系树脂组合物、膜、制造方法 | |
| EP3438142B1 (en) | Methacrylic resin composition and molded body | |
| CN112154185B (zh) | 甲基丙烯酸系树脂组合物和成型体 | |
| JP2023080157A (ja) | メタクリル系樹脂、メタクリル系樹脂組成物、フィルム | |
| JP2018009141A (ja) | メタクリル系樹脂及びその製造方法、成形体、光学部品又は自動車部品 | |
| ES2941702T3 (es) | Composiciones de moldeo de grado óptico que tienen una estabilidad térmica aumentada | |
| EP4038112B1 (en) | Optical grade moulding compositions having increased heat resistance | |
| WO2025061516A1 (en) | Copolymer based on methyl methacrylate and optical grade moulding composition comprising it | |
| JP2006249220A (ja) | 硬化性組成物、高耐熱透明樹脂および光学部材 | |
| WO2021117903A1 (ja) | メタクリル系共重合体およびそれの製造に適した製造方法 | |
| JPH05247145A (ja) | 共重合体の製造法 | |
| JP2018188569A (ja) | アクリル系ブロック共重合体、樹脂組成物、フィルム | |
| JP2025023813A (ja) | 板状成形品の製造方法 |