EP1527115B1 - Polyaldimin enthaltende polyurethanzusammensetzung - Google Patents
Polyaldimin enthaltende polyurethanzusammensetzung Download PDFInfo
- Publication number
- EP1527115B1 EP1527115B1 EP03766269A EP03766269A EP1527115B1 EP 1527115 B1 EP1527115 B1 EP 1527115B1 EP 03766269 A EP03766269 A EP 03766269A EP 03766269 A EP03766269 A EP 03766269A EP 1527115 B1 EP1527115 B1 EP 1527115B1
- Authority
- EP
- European Patent Office
- Prior art keywords
- composition
- aldehyde
- acid
- polyaldimine
- polyol
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 239000000203 mixture Substances 0.000 title claims abstract description 107
- 239000004814 polyurethane Substances 0.000 title abstract description 52
- 229920002635 polyurethane Polymers 0.000 title description 43
- 229920000768 polyamine Polymers 0.000 claims abstract description 53
- 229920005862 polyol Polymers 0.000 claims abstract description 45
- 150000003077 polyols Chemical class 0.000 claims abstract description 45
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims abstract description 36
- 125000001931 aliphatic group Chemical group 0.000 claims abstract description 28
- IQPQWNKOIGAROB-UHFFFAOYSA-N isocyanate group Chemical group [N-]=C=O IQPQWNKOIGAROB-UHFFFAOYSA-N 0.000 claims abstract description 25
- 238000000034 method Methods 0.000 claims abstract description 18
- 239000005056 polyisocyanate Substances 0.000 claims abstract description 15
- 229920001228 polyisocyanate Polymers 0.000 claims abstract description 15
- 125000003277 amino group Chemical group 0.000 claims abstract description 10
- 125000003118 aryl group Chemical group 0.000 claims abstract description 8
- 150000001299 aldehydes Chemical class 0.000 claims description 54
- 229920001730 Moisture cure polyurethane Polymers 0.000 claims description 44
- AMIMRNSIRUDHCM-UHFFFAOYSA-N Isopropylaldehyde Chemical compound CC(C)C=O AMIMRNSIRUDHCM-UHFFFAOYSA-N 0.000 claims description 24
- -1 polyoxypropylene Polymers 0.000 claims description 19
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 16
- 150000001412 amines Chemical class 0.000 claims description 15
- POULHZVOKOAJMA-UHFFFAOYSA-N dodecanoic acid Chemical compound CCCCCCCCCCCC(O)=O POULHZVOKOAJMA-UHFFFAOYSA-N 0.000 claims description 14
- 239000002904 solvent Substances 0.000 claims description 12
- NIMLQBUJDJZYEJ-UHFFFAOYSA-N isophorone diisocyanate Chemical compound CC1(C)CC(N=C=O)CC(C)(CN=C=O)C1 NIMLQBUJDJZYEJ-UHFFFAOYSA-N 0.000 claims description 11
- 150000001735 carboxylic acids Chemical class 0.000 claims description 10
- 238000000576 coating method Methods 0.000 claims description 10
- 239000005058 Isophorone diisocyanate Substances 0.000 claims description 9
- 125000004432 carbon atom Chemical group C* 0.000 claims description 9
- CXMXRPHRNRROMY-UHFFFAOYSA-N sebacic acid Chemical compound OC(=O)CCCCCCCCC(O)=O CXMXRPHRNRROMY-UHFFFAOYSA-N 0.000 claims description 9
- JZUHIOJYCPIVLQ-UHFFFAOYSA-N 2-methylpentane-1,5-diamine Chemical compound NCC(C)CCCN JZUHIOJYCPIVLQ-UHFFFAOYSA-N 0.000 claims description 8
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 claims description 8
- 239000000853 adhesive Substances 0.000 claims description 8
- 230000001070 adhesive effect Effects 0.000 claims description 8
- 239000011248 coating agent Substances 0.000 claims description 8
- CNPURSDMOWDNOQ-UHFFFAOYSA-N 4-methoxy-7h-pyrrolo[2,3-d]pyrimidin-2-amine Chemical compound COC1=NC(N)=NC2=C1C=CN2 CNPURSDMOWDNOQ-UHFFFAOYSA-N 0.000 claims description 7
- 239000005639 Lauric acid Substances 0.000 claims description 7
- 229930040373 Paraformaldehyde Natural products 0.000 claims description 7
- NAQMVNRVTILPCV-UHFFFAOYSA-N hexane-1,6-diamine Chemical compound NCCCCCCN NAQMVNRVTILPCV-UHFFFAOYSA-N 0.000 claims description 7
- WSFSSNUMVMOOMR-NJFSPNSNSA-N methanone Chemical compound O=[14CH2] WSFSSNUMVMOOMR-NJFSPNSNSA-N 0.000 claims description 7
- 229920002866 paraformaldehyde Polymers 0.000 claims description 7
- 229920001451 polypropylene glycol Polymers 0.000 claims description 7
- FTZILAQGHINQQR-UHFFFAOYSA-N 2-Methylpentanal Chemical compound CCCC(C)C=O FTZILAQGHINQQR-UHFFFAOYSA-N 0.000 claims description 6
- JJMOMMLADQPZNY-UHFFFAOYSA-N 3-hydroxy-2,2-dimethylpropanal Chemical compound OCC(C)(C)C=O JJMOMMLADQPZNY-UHFFFAOYSA-N 0.000 claims description 6
- WNLRTRBMVRJNCN-UHFFFAOYSA-N adipic acid Chemical compound OC(=O)CCCCC(O)=O WNLRTRBMVRJNCN-UHFFFAOYSA-N 0.000 claims description 6
- 125000000217 alkyl group Chemical group 0.000 claims description 6
- 125000005842 heteroatom Chemical group 0.000 claims description 6
- 239000000565 sealant Substances 0.000 claims description 6
- 238000007789 sealing Methods 0.000 claims description 6
- RNLHGQLZWXBQNY-UHFFFAOYSA-N 3-(aminomethyl)-3,5,5-trimethylcyclohexan-1-amine Chemical compound CC1(C)CC(N)CC(C)(CN)C1 RNLHGQLZWXBQNY-UHFFFAOYSA-N 0.000 claims description 5
- 238000005886 esterification reaction Methods 0.000 claims description 5
- IPCSVZSSVZVIGE-UHFFFAOYSA-N hexadecanoic acid Chemical compound CCCCCCCCCCCCCCCC(O)=O IPCSVZSSVZVIGE-UHFFFAOYSA-N 0.000 claims description 5
- 238000011065 in-situ storage Methods 0.000 claims description 5
- BYGQBDHUGHBGMD-UHFFFAOYSA-N 2-methylbutanal Chemical compound CCC(C)C=O BYGQBDHUGHBGMD-UHFFFAOYSA-N 0.000 claims description 4
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 claims description 4
- 238000004519 manufacturing process Methods 0.000 claims description 4
- 239000001301 oxygen Substances 0.000 claims description 4
- 229910052760 oxygen Inorganic materials 0.000 claims description 4
- DPQHRXRAZHNGRU-UHFFFAOYSA-N 2,4,4-trimethylhexane-1,6-diamine Chemical compound NCC(C)CC(C)(C)CCN DPQHRXRAZHNGRU-UHFFFAOYSA-N 0.000 claims description 3
- FZZMTSNZRBFGGU-UHFFFAOYSA-N 2-chloro-7-fluoroquinazolin-4-amine Chemical compound FC1=CC=C2C(N)=NC(Cl)=NC2=C1 FZZMTSNZRBFGGU-UHFFFAOYSA-N 0.000 claims description 3
- HMJBXEZHJUYJQY-UHFFFAOYSA-N 4-(aminomethyl)octane-1,8-diamine Chemical compound NCCCCC(CN)CCCN HMJBXEZHJUYJQY-UHFFFAOYSA-N 0.000 claims description 3
- IGSBHTZEJMPDSZ-UHFFFAOYSA-N 4-[(4-amino-3-methylcyclohexyl)methyl]-2-methylcyclohexan-1-amine Chemical compound C1CC(N)C(C)CC1CC1CC(C)C(N)CC1 IGSBHTZEJMPDSZ-UHFFFAOYSA-N 0.000 claims description 3
- DZIHTWJGPDVSGE-UHFFFAOYSA-N 4-[(4-aminocyclohexyl)methyl]cyclohexan-1-amine Chemical compound C1CC(N)CCC1CC1CCC(N)CC1 DZIHTWJGPDVSGE-UHFFFAOYSA-N 0.000 claims description 3
- 235000021355 Stearic acid Nutrition 0.000 claims description 3
- OXIKYYJDTWKERT-UHFFFAOYSA-N [4-(aminomethyl)cyclohexyl]methanamine Chemical compound NCC1CCC(CN)CC1 OXIKYYJDTWKERT-UHFFFAOYSA-N 0.000 claims description 3
- ISKQADXMHQSTHK-UHFFFAOYSA-N [4-(aminomethyl)phenyl]methanamine Chemical compound NCC1=CC=C(CN)C=C1 ISKQADXMHQSTHK-UHFFFAOYSA-N 0.000 claims description 3
- 125000004429 atom Chemical group 0.000 claims description 3
- VKIRRGRTJUUZHS-UHFFFAOYSA-N cyclohexane-1,4-diamine Chemical compound NC1CCC(N)CC1 VKIRRGRTJUUZHS-UHFFFAOYSA-N 0.000 claims description 3
- WQEPLUUGTLDZJY-UHFFFAOYSA-N n-Pentadecanoic acid Natural products CCCCCCCCCCCCCCC(O)=O WQEPLUUGTLDZJY-UHFFFAOYSA-N 0.000 claims description 3
- BDJRBEYXGGNYIS-UHFFFAOYSA-N nonanedioic acid Chemical compound OC(=O)CCCCCCCC(O)=O BDJRBEYXGGNYIS-UHFFFAOYSA-N 0.000 claims description 3
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 claims description 3
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 claims description 3
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 claims description 3
- 239000008117 stearic acid Substances 0.000 claims description 3
- 239000001893 (2R)-2-methylbutanal Substances 0.000 claims description 2
- OYHQOLUKZRVURQ-NTGFUMLPSA-N (9Z,12Z)-9,10,12,13-tetratritiooctadeca-9,12-dienoic acid Chemical compound C(CCCCCCC\C(=C(/C\C(=C(/CCCCC)\[3H])\[3H])\[3H])\[3H])(=O)O OYHQOLUKZRVURQ-NTGFUMLPSA-N 0.000 claims description 2
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 claims description 2
- HLLGFGBLKOIZOM-UHFFFAOYSA-N 2,2-diphenylacetaldehyde Chemical compound C=1C=CC=CC=1C(C=O)C1=CC=CC=C1 HLLGFGBLKOIZOM-UHFFFAOYSA-N 0.000 claims description 2
- UNNGUFMVYQJGTD-UHFFFAOYSA-N 2-Ethylbutanal Chemical compound CCC(CC)C=O UNNGUFMVYQJGTD-UHFFFAOYSA-N 0.000 claims description 2
- HEPHYCJJLAUKSB-UHFFFAOYSA-N 2-methyl-3-phenylpropanal Chemical compound O=CC(C)CC1=CC=CC=C1 HEPHYCJJLAUKSB-UHFFFAOYSA-N 0.000 claims description 2
- IQVAERDLDAZARL-UHFFFAOYSA-N 2-phenylpropanal Chemical compound O=CC(C)C1=CC=CC=C1 IQVAERDLDAZARL-UHFFFAOYSA-N 0.000 claims description 2
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 claims description 2
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 claims description 2
- 239000009261 D 400 Substances 0.000 claims description 2
- 239000005642 Oleic acid Substances 0.000 claims description 2
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 claims description 2
- 235000021314 Palmitic acid Nutrition 0.000 claims description 2
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 claims description 2
- 239000001361 adipic acid Substances 0.000 claims description 2
- 235000011037 adipic acid Nutrition 0.000 claims description 2
- DTOSIQBPPRVQHS-PDBXOOCHSA-N alpha-linolenic acid Chemical compound CC\C=C/C\C=C/C\C=C/CCCCCCCC(O)=O DTOSIQBPPRVQHS-PDBXOOCHSA-N 0.000 claims description 2
- 235000020661 alpha-linolenic acid Nutrition 0.000 claims description 2
- 125000003710 aryl alkyl group Chemical group 0.000 claims description 2
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 claims description 2
- 125000002837 carbocyclic group Chemical group 0.000 claims description 2
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 2
- DCFDVJPDXYGCOK-UHFFFAOYSA-N cyclohex-3-ene-1-carbaldehyde Chemical compound O=CC1CCC=CC1 DCFDVJPDXYGCOK-UHFFFAOYSA-N 0.000 claims description 2
- KVFDZFBHBWTVID-UHFFFAOYSA-N cyclohexane-carboxaldehyde Natural products O=CC1CCCCC1 KVFDZFBHBWTVID-UHFFFAOYSA-N 0.000 claims description 2
- VELDYOPRLMJFIK-UHFFFAOYSA-N cyclopentanecarbaldehyde Chemical compound O=CC1CCCC1 VELDYOPRLMJFIK-UHFFFAOYSA-N 0.000 claims description 2
- 125000000623 heterocyclic group Chemical group 0.000 claims description 2
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 claims description 2
- 229960004488 linolenic acid Drugs 0.000 claims description 2
- KQQKGWQCNNTQJW-UHFFFAOYSA-N linolenic acid Natural products CC=CCCC=CCC=CCCCCCCCC(O)=O KQQKGWQCNNTQJW-UHFFFAOYSA-N 0.000 claims description 2
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 2
- TUNFSRHWOTWDNC-HKGQFRNVSA-N tetradecanoic acid Chemical compound CCCCCCCCCCCCC[14C](O)=O TUNFSRHWOTWDNC-HKGQFRNVSA-N 0.000 claims description 2
- LGYNIFWIKSEESD-UHFFFAOYSA-N 2-ethylhexanal Chemical compound CCCCC(CC)C=O LGYNIFWIKSEESD-UHFFFAOYSA-N 0.000 claims 1
- 238000004026 adhesive bonding Methods 0.000 claims 1
- 238000006555 catalytic reaction Methods 0.000 claims 1
- 125000005442 diisocyanate group Chemical group 0.000 claims 1
- 125000001183 hydrocarbyl group Chemical group 0.000 claims 1
- 125000000879 imine group Chemical group 0.000 claims 1
- 235000021313 oleic acid Nutrition 0.000 claims 1
- LPSXSORODABQKT-UHFFFAOYSA-N tetrahydrodicyclopentadiene Chemical compound C1C2CCC1C1C2CCC1 LPSXSORODABQKT-UHFFFAOYSA-N 0.000 claims 1
- 150000004705 aldimines Chemical group 0.000 abstract description 18
- 238000002360 preparation method Methods 0.000 abstract description 17
- 239000007787 solid Substances 0.000 abstract description 3
- 125000002485 formyl group Chemical class [H]C(*)=O 0.000 abstract 3
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 abstract 1
- 239000012876 carrier material Substances 0.000 abstract 1
- 235000019645 odor Nutrition 0.000 description 34
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 21
- 238000003860 storage Methods 0.000 description 21
- 238000001723 curing Methods 0.000 description 17
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 15
- 239000007795 chemical reaction product Substances 0.000 description 14
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 13
- 238000006243 chemical reaction Methods 0.000 description 12
- 239000000126 substance Substances 0.000 description 12
- MTHSVFCYNBDYFN-UHFFFAOYSA-N diethylene glycol Chemical compound OCCOCCO MTHSVFCYNBDYFN-UHFFFAOYSA-N 0.000 description 11
- 230000009257 reactivity Effects 0.000 description 11
- UPMLOUAZCHDJJD-UHFFFAOYSA-N 4,4'-Diphenylmethane Diisocyanate Chemical compound C1=CC(N=C=O)=CC=C1CC1=CC=C(N=C=O)C=C1 UPMLOUAZCHDJJD-UHFFFAOYSA-N 0.000 description 10
- 230000015572 biosynthetic process Effects 0.000 description 10
- 230000007062 hydrolysis Effects 0.000 description 10
- 238000006460 hydrolysis reaction Methods 0.000 description 10
- 239000007788 liquid Substances 0.000 description 10
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 9
- IISBACLAFKSPIT-UHFFFAOYSA-N bisphenol A Chemical compound C=1C=C(O)C=CC=1C(C)(C)C1=CC=C(O)C=C1 IISBACLAFKSPIT-UHFFFAOYSA-N 0.000 description 8
- 239000012948 isocyanate Substances 0.000 description 8
- 150000002513 isocyanates Chemical class 0.000 description 8
- 239000000047 product Substances 0.000 description 8
- 239000011541 reaction mixture Substances 0.000 description 8
- 239000003039 volatile agent Substances 0.000 description 8
- 239000003795 chemical substances by application Substances 0.000 description 7
- 230000000052 comparative effect Effects 0.000 description 7
- 150000001875 compounds Chemical class 0.000 description 7
- 238000013008 moisture curing Methods 0.000 description 7
- 238000003756 stirring Methods 0.000 description 7
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- 239000003054 catalyst Substances 0.000 description 6
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N Aniline Chemical compound NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 description 5
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 5
- ZJCCRDAZUWHFQH-UHFFFAOYSA-N Trimethylolpropane Chemical compound CCC(CO)(CO)CO ZJCCRDAZUWHFQH-UHFFFAOYSA-N 0.000 description 5
- FDLQZKYLHJJBHD-UHFFFAOYSA-N [3-(aminomethyl)phenyl]methanamine Chemical compound NCC1=CC=CC(CN)=C1 FDLQZKYLHJJBHD-UHFFFAOYSA-N 0.000 description 5
- 150000001298 alcohols Chemical class 0.000 description 5
- 150000002148 esters Chemical class 0.000 description 5
- 235000011187 glycerol Nutrition 0.000 description 5
- OHLKMGYGBHFODF-UHFFFAOYSA-N 1,4-bis(isocyanatomethyl)benzene Chemical compound O=C=NCC1=CC=C(CN=C=O)C=C1 OHLKMGYGBHFODF-UHFFFAOYSA-N 0.000 description 4
- WPYMKLBDIGXBTP-UHFFFAOYSA-N Benzoic acid Natural products OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 4
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 4
- IAYPIBMASNFSPL-UHFFFAOYSA-N Ethylene oxide Chemical compound C1CO1 IAYPIBMASNFSPL-UHFFFAOYSA-N 0.000 description 4
- 239000005057 Hexamethylene diisocyanate Substances 0.000 description 4
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 4
- 239000002253 acid Substances 0.000 description 4
- 150000007513 acids Chemical class 0.000 description 4
- 150000008064 anhydrides Chemical class 0.000 description 4
- 235000014113 dietary fatty acids Nutrition 0.000 description 4
- 239000000194 fatty acid Substances 0.000 description 4
- 229930195729 fatty acid Natural products 0.000 description 4
- 230000002209 hydrophobic effect Effects 0.000 description 4
- 239000000463 material Substances 0.000 description 4
- 230000009965 odorless effect Effects 0.000 description 4
- 238000010992 reflux Methods 0.000 description 4
- 239000000758 substrate Substances 0.000 description 4
- 239000003981 vehicle Substances 0.000 description 4
- LCZVSXRMYJUNFX-UHFFFAOYSA-N 2-[2-(2-hydroxypropoxy)propoxy]propan-1-ol Chemical class CC(O)COC(C)COC(C)CO LCZVSXRMYJUNFX-UHFFFAOYSA-N 0.000 description 3
- PNEYBMLMFCGWSK-UHFFFAOYSA-N Alumina Chemical compound [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 3
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 3
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 3
- 239000005977 Ethylene Substances 0.000 description 3
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 3
- YIMQCDZDWXUDCA-UHFFFAOYSA-N [4-(hydroxymethyl)cyclohexyl]methanol Chemical compound OCC1CCC(CO)CC1 YIMQCDZDWXUDCA-UHFFFAOYSA-N 0.000 description 3
- 150000003934 aromatic aldehydes Chemical class 0.000 description 3
- WERYXYBDKMZEQL-UHFFFAOYSA-N butane-1,4-diol Chemical compound OCCCCO WERYXYBDKMZEQL-UHFFFAOYSA-N 0.000 description 3
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 3
- 239000000470 constituent Substances 0.000 description 3
- 238000001816 cooling Methods 0.000 description 3
- 230000008021 deposition Effects 0.000 description 3
- 230000032050 esterification Effects 0.000 description 3
- 150000004665 fatty acids Chemical class 0.000 description 3
- RRAMGCGOFNQTLD-UHFFFAOYSA-N hexamethylene diisocyanate Chemical compound O=C=NCCCCCCN=C=O RRAMGCGOFNQTLD-UHFFFAOYSA-N 0.000 description 3
- 230000003301 hydrolyzing effect Effects 0.000 description 3
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 3
- 150000004668 long chain fatty acids Chemical class 0.000 description 3
- SLCVBVWXLSEKPL-UHFFFAOYSA-N neopentyl glycol Chemical compound OCC(C)(C)CO SLCVBVWXLSEKPL-UHFFFAOYSA-N 0.000 description 3
- 239000012299 nitrogen atmosphere Substances 0.000 description 3
- 239000003921 oil Substances 0.000 description 3
- 235000019198 oils Nutrition 0.000 description 3
- 239000004014 plasticizer Substances 0.000 description 3
- 229920005906 polyester polyol Polymers 0.000 description 3
- YPFDHNVEDLHUCE-UHFFFAOYSA-N propane-1,3-diol Chemical compound OCCCO YPFDHNVEDLHUCE-UHFFFAOYSA-N 0.000 description 3
- 150000005846 sugar alcohols Polymers 0.000 description 3
- ZIBGPFATKBEMQZ-UHFFFAOYSA-N triethylene glycol Chemical compound OCCOCCOCCO ZIBGPFATKBEMQZ-UHFFFAOYSA-N 0.000 description 3
- QXJQHYBHAIHNGG-UHFFFAOYSA-N trimethylolethane Chemical compound OCC(C)(CO)CO QXJQHYBHAIHNGG-UHFFFAOYSA-N 0.000 description 3
- DNIAPMSPPWPWGF-VKHMYHEASA-N (+)-propylene glycol Chemical compound C[C@H](O)CO DNIAPMSPPWPWGF-VKHMYHEASA-N 0.000 description 2
- APOPEBBNNFTQET-UHFFFAOYSA-N (2,2-dimethyl-3-oxopropyl) 2-methylpropanoate Chemical compound CC(C)C(=O)OCC(C)(C)C=O APOPEBBNNFTQET-UHFFFAOYSA-N 0.000 description 2
- AZYRZNIYJDKRHO-UHFFFAOYSA-N 1,3-bis(2-isocyanatopropan-2-yl)benzene Chemical compound O=C=NC(C)(C)C1=CC=CC(C(C)(C)N=C=O)=C1 AZYRZNIYJDKRHO-UHFFFAOYSA-N 0.000 description 2
- ROHUXHMNZLHBSF-UHFFFAOYSA-N 1,4-bis(isocyanatomethyl)cyclohexane Chemical compound O=C=NCC1CCC(CN=C=O)CC1 ROHUXHMNZLHBSF-UHFFFAOYSA-N 0.000 description 2
- LGLNTUFPPXPHKF-UHFFFAOYSA-N 1,4-diisocyanato-2,3,5,6-tetramethylbenzene Chemical compound CC1=C(C)C(N=C=O)=C(C)C(C)=C1N=C=O LGLNTUFPPXPHKF-UHFFFAOYSA-N 0.000 description 2
- ALQLPWJFHRMHIU-UHFFFAOYSA-N 1,4-diisocyanatobenzene Chemical compound O=C=NC1=CC=C(N=C=O)C=C1 ALQLPWJFHRMHIU-UHFFFAOYSA-N 0.000 description 2
- PQXKWPLDPFFDJP-UHFFFAOYSA-N 2,3-dimethyloxirane Chemical compound CC1OC1C PQXKWPLDPFFDJP-UHFFFAOYSA-N 0.000 description 2
- MZEGJNMYXWIQFF-UHFFFAOYSA-N 2,5-diisocyanato-1,1,3-trimethylcyclohexane Chemical compound CC1CC(N=C=O)CC(C)(C)C1N=C=O MZEGJNMYXWIQFF-UHFFFAOYSA-N 0.000 description 2
- ICSNLGPSRYBMBD-UHFFFAOYSA-N 2-aminopyridine Chemical compound NC1=CC=CC=N1 ICSNLGPSRYBMBD-UHFFFAOYSA-N 0.000 description 2
- WJIOHMVWGVGWJW-UHFFFAOYSA-N 3-methyl-n-[4-[(3-methylpyrazole-1-carbonyl)amino]butyl]pyrazole-1-carboxamide Chemical compound N1=C(C)C=CN1C(=O)NCCCCNC(=O)N1N=C(C)C=C1 WJIOHMVWGVGWJW-UHFFFAOYSA-N 0.000 description 2
- ODINCKMPIJJUCX-UHFFFAOYSA-N Calcium oxide Chemical compound [Ca]=O ODINCKMPIJJUCX-UHFFFAOYSA-N 0.000 description 2
- XFXPMWWXUTWYJX-UHFFFAOYSA-N Cyanide Chemical compound N#[C-] XFXPMWWXUTWYJX-UHFFFAOYSA-N 0.000 description 2
- MQIUGAXCHLFZKX-UHFFFAOYSA-N Di-n-octyl phthalate Chemical compound CCCCCCCCOC(=O)C1=CC=CC=C1C(=O)OCCCCCCCC MQIUGAXCHLFZKX-UHFFFAOYSA-N 0.000 description 2
- ZNZYKNKBJPZETN-WELNAUFTSA-N Dialdehyde 11678 Chemical compound N1C2=CC=CC=C2C2=C1[C@H](C[C@H](/C(=C/O)C(=O)OC)[C@@H](C=C)C=O)NCC2 ZNZYKNKBJPZETN-WELNAUFTSA-N 0.000 description 2
- ZVFDTKUVRCTHQE-UHFFFAOYSA-N Diisodecyl phthalate Chemical compound CC(C)CCCCCCCOC(=O)C1=CC=CC=C1C(=O)OCCCCCCCC(C)C ZVFDTKUVRCTHQE-UHFFFAOYSA-N 0.000 description 2
- 235000001950 Elaeis guineensis Nutrition 0.000 description 2
- 240000003133 Elaeis guineensis Species 0.000 description 2
- OFOBLEOULBTSOW-UHFFFAOYSA-N Malonic acid Chemical compound OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 2
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 2
- ALQSHHUCVQOPAS-UHFFFAOYSA-N Pentane-1,5-diol Chemical compound OCCCCCO ALQSHHUCVQOPAS-UHFFFAOYSA-N 0.000 description 2
- YGYAWVDWMABLBF-UHFFFAOYSA-N Phosgene Chemical compound ClC(Cl)=O YGYAWVDWMABLBF-UHFFFAOYSA-N 0.000 description 2
- DUFKCOQISQKSAV-UHFFFAOYSA-N Polypropylene glycol (m w 1,200-3,000) Chemical class CC(O)COC(C)CO DUFKCOQISQKSAV-UHFFFAOYSA-N 0.000 description 2
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 2
- GOOHAUXETOMSMM-UHFFFAOYSA-N Propylene oxide Chemical compound CC1CO1 GOOHAUXETOMSMM-UHFFFAOYSA-N 0.000 description 2
- 239000002318 adhesion promoter Substances 0.000 description 2
- YZXBAPSDXZZRGB-DOFZRALJSA-N arachidonic acid Chemical compound CCCCC\C=C/C\C=C/C\C=C/C\C=C/CCCC(O)=O YZXBAPSDXZZRGB-DOFZRALJSA-N 0.000 description 2
- 235000012216 bentonite Nutrition 0.000 description 2
- HIFVAOIJYDXIJG-UHFFFAOYSA-N benzylbenzene;isocyanic acid Chemical compound N=C=O.N=C=O.C=1C=CC=CC=1CC1=CC=CC=C1 HIFVAOIJYDXIJG-UHFFFAOYSA-N 0.000 description 2
- 230000005587 bubbling Effects 0.000 description 2
- CDQSJQSWAWPGKG-UHFFFAOYSA-N butane-1,1-diol Chemical class CCCC(O)O CDQSJQSWAWPGKG-UHFFFAOYSA-N 0.000 description 2
- VHRGRCVQAFMJIZ-UHFFFAOYSA-N cadaverine Chemical compound NCCCCCN VHRGRCVQAFMJIZ-UHFFFAOYSA-N 0.000 description 2
- 235000010216 calcium carbonate Nutrition 0.000 description 2
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 2
- 125000002843 carboxylic acid group Chemical group 0.000 description 2
- 238000006482 condensation reaction Methods 0.000 description 2
- QSAWQNUELGIYBC-UHFFFAOYSA-N cyclohexane-1,2-dicarboxylic acid Chemical compound OC(=O)C1CCCCC1C(O)=O QSAWQNUELGIYBC-UHFFFAOYSA-N 0.000 description 2
- DIOQZVSQGTUSAI-UHFFFAOYSA-N decane Chemical compound CCCCCCCCCC DIOQZVSQGTUSAI-UHFFFAOYSA-N 0.000 description 2
- 150000001991 dicarboxylic acids Chemical class 0.000 description 2
- 239000007789 gas Substances 0.000 description 2
- KEMQGTRYUADPNZ-UHFFFAOYSA-N heptadecanoic acid Chemical compound CCCCCCCCCCCCCCCCC(O)=O KEMQGTRYUADPNZ-UHFFFAOYSA-N 0.000 description 2
- MHIBEGOZTWERHF-UHFFFAOYSA-N heptane-1,1-diol Chemical class CCCCCCC(O)O MHIBEGOZTWERHF-UHFFFAOYSA-N 0.000 description 2
- ACCCMOQWYVYDOT-UHFFFAOYSA-N hexane-1,1-diol Chemical class CCCCCC(O)O ACCCMOQWYVYDOT-UHFFFAOYSA-N 0.000 description 2
- XXMIOPMDWAUFGU-UHFFFAOYSA-N hexane-1,6-diol Chemical compound OCCCCCCO XXMIOPMDWAUFGU-UHFFFAOYSA-N 0.000 description 2
- VKOBVWXKNCXXDE-UHFFFAOYSA-N icosanoic acid Chemical compound CCCCCCCCCCCCCCCCCCCC(O)=O VKOBVWXKNCXXDE-UHFFFAOYSA-N 0.000 description 2
- BUZRAOJSFRKWPD-UHFFFAOYSA-N isocyanatosilane Chemical compound [SiH3]N=C=O BUZRAOJSFRKWPD-UHFFFAOYSA-N 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- ISYWECDDZWTKFF-UHFFFAOYSA-N nonadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCCC(O)=O ISYWECDDZWTKFF-UHFFFAOYSA-N 0.000 description 2
- SECPZKHBENQXJG-FPLPWBNLSA-N palmitoleic acid Chemical compound CCCCCC\C=C/CCCCCCCC(O)=O SECPZKHBENQXJG-FPLPWBNLSA-N 0.000 description 2
- UWJJYHHHVWZFEP-UHFFFAOYSA-N pentane-1,1-diol Chemical class CCCCC(O)O UWJJYHHHVWZFEP-UHFFFAOYSA-N 0.000 description 2
- WLJVNTCWHIRURA-UHFFFAOYSA-N pimelic acid Chemical compound OC(=O)CCCCCC(O)=O WLJVNTCWHIRURA-UHFFFAOYSA-N 0.000 description 2
- 229920002857 polybutadiene Polymers 0.000 description 2
- 229920001083 polybutene Polymers 0.000 description 2
- 229920000573 polyethylene Polymers 0.000 description 2
- 229920000166 polytrimethylene carbonate Polymers 0.000 description 2
- 239000002987 primer (paints) Substances 0.000 description 2
- 239000011253 protective coating Substances 0.000 description 2
- KIDHWZJUCRJVML-UHFFFAOYSA-N putrescine Chemical compound NCCCCN KIDHWZJUCRJVML-UHFFFAOYSA-N 0.000 description 2
- 239000002994 raw material Substances 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 2
- FZHAPNGMFPVSLP-UHFFFAOYSA-N silanamine Chemical compound [SiH3]N FZHAPNGMFPVSLP-UHFFFAOYSA-N 0.000 description 2
- TYFQFVWCELRYAO-UHFFFAOYSA-N suberic acid Chemical compound OC(=O)CCCCCCC(O)=O TYFQFVWCELRYAO-UHFFFAOYSA-N 0.000 description 2
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 2
- RUELTTOHQODFPA-UHFFFAOYSA-N toluene 2,6-diisocyanate Chemical compound CC1=C(N=C=O)C=CC=C1N=C=O RUELTTOHQODFPA-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- SZHOJFHSIKHZHA-UHFFFAOYSA-N tridecanoic acid Chemical compound CCCCCCCCCCCCC(O)=O SZHOJFHSIKHZHA-UHFFFAOYSA-N 0.000 description 2
- XFNJVJPLKCPIBV-UHFFFAOYSA-N trimethylenediamine Chemical compound NCCCN XFNJVJPLKCPIBV-UHFFFAOYSA-N 0.000 description 2
- GRXOWOKLKIZFNP-UHFFFAOYSA-N undecane-1,1-diol Chemical class CCCCCCCCCCC(O)O GRXOWOKLKIZFNP-UHFFFAOYSA-N 0.000 description 2
- UKRDPEFKFJNXQM-UHFFFAOYSA-N vinylsilane Chemical compound [SiH3]C=C UKRDPEFKFJNXQM-UHFFFAOYSA-N 0.000 description 2
- QUOFXLPUVMTLLD-UHFFFAOYSA-N (2-formyl-2-methylpentyl) dodecanoate Chemical compound CCCCCCCCCCCC(=O)OCC(C)(C=O)CCC QUOFXLPUVMTLLD-UHFFFAOYSA-N 0.000 description 1
- MUTGBJKUEZFXGO-OLQVQODUSA-N (3as,7ar)-3a,4,5,6,7,7a-hexahydro-2-benzofuran-1,3-dione Chemical compound C1CCC[C@@H]2C(=O)OC(=O)[C@@H]21 MUTGBJKUEZFXGO-OLQVQODUSA-N 0.000 description 1
- CUXYLFPMQMFGPL-WPOADVJFSA-N (9Z,11E,13E)-octadeca-9,11,13-trienoic acid Chemical compound CCCC\C=C\C=C\C=C/CCCCCCCC(O)=O CUXYLFPMQMFGPL-WPOADVJFSA-N 0.000 description 1
- DNIAPMSPPWPWGF-GSVOUGTGSA-N (R)-(-)-Propylene glycol Chemical compound C[C@@H](O)CO DNIAPMSPPWPWGF-GSVOUGTGSA-N 0.000 description 1
- OPCJOXGBLDJWRM-UHFFFAOYSA-N 1,2-diamino-2-methylpropane Chemical compound CC(C)(N)CN OPCJOXGBLDJWRM-UHFFFAOYSA-N 0.000 description 1
- BGJSXRVXTHVRSN-UHFFFAOYSA-N 1,3,5-trioxane Chemical compound C1OCOCO1 BGJSXRVXTHVRSN-UHFFFAOYSA-N 0.000 description 1
- RTTZISZSHSCFRH-UHFFFAOYSA-N 1,3-bis(isocyanatomethyl)benzene Chemical compound O=C=NCC1=CC=CC(CN=C=O)=C1 RTTZISZSHSCFRH-UHFFFAOYSA-N 0.000 description 1
- PXGZQGDTEZPERC-UHFFFAOYSA-N 1,4-cyclohexanedicarboxylic acid Chemical compound OC(=O)C1CCC(C(O)=O)CC1 PXGZQGDTEZPERC-UHFFFAOYSA-N 0.000 description 1
- 229940008841 1,6-hexamethylene diisocyanate Drugs 0.000 description 1
- PWGJDPKCLMLPJW-UHFFFAOYSA-N 1,8-diaminooctane Chemical compound NCCCCCCCCN PWGJDPKCLMLPJW-UHFFFAOYSA-N 0.000 description 1
- SMNOVRZDAZZQTI-UHFFFAOYSA-N 1-[dibutyl(dodecanoyl)stannyl]dodecan-1-one Chemical compound CCCCCCCCCCCC(=O)[Sn](CCCC)(CCCC)C(=O)CCCCCCCCCCC SMNOVRZDAZZQTI-UHFFFAOYSA-N 0.000 description 1
- RTBFRGCFXZNCOE-UHFFFAOYSA-N 1-methylsulfonylpiperidin-4-one Chemical compound CS(=O)(=O)N1CCC(=O)CC1 RTBFRGCFXZNCOE-UHFFFAOYSA-N 0.000 description 1
- RNFJDJUURJAICM-UHFFFAOYSA-N 2,2,4,4,6,6-hexaphenoxy-1,3,5-triaza-2$l^{5},4$l^{5},6$l^{5}-triphosphacyclohexa-1,3,5-triene Chemical compound N=1P(OC=2C=CC=CC=2)(OC=2C=CC=CC=2)=NP(OC=2C=CC=CC=2)(OC=2C=CC=CC=2)=NP=1(OC=1C=CC=CC=1)OC1=CC=CC=C1 RNFJDJUURJAICM-UHFFFAOYSA-N 0.000 description 1
- VGKUQBORKKSJMG-UHFFFAOYSA-N 2,2,6-trimethylcyclohexane-1,4-diamine Chemical compound CC1CC(N)CC(C)(C)C1N VGKUQBORKKSJMG-UHFFFAOYSA-N 0.000 description 1
- DDHUNHGZUHZNKB-UHFFFAOYSA-N 2,2-dimethylpropane-1,3-diamine Chemical compound NCC(C)(C)CN DDHUNHGZUHZNKB-UHFFFAOYSA-N 0.000 description 1
- BPRJQFIHEGORJE-UHFFFAOYSA-N 2-(1-hydroxypropan-2-yloxy)propan-1-ol 1-(2-hydroxypropoxy)propan-2-ol Chemical compound CC(O)COCC(C)O.CC(CO)OC(C)CO BPRJQFIHEGORJE-UHFFFAOYSA-N 0.000 description 1
- GXVUZYLYWKWJIM-UHFFFAOYSA-N 2-(2-aminoethoxy)ethanamine Chemical compound NCCOCCN GXVUZYLYWKWJIM-UHFFFAOYSA-N 0.000 description 1
- HJZZQNLKBWJYPD-UHFFFAOYSA-N 2-[2-[2-(carboxymethoxy)ethoxy]ethoxy]acetic acid Chemical compound OC(=O)COCCOCCOCC(O)=O HJZZQNLKBWJYPD-UHFFFAOYSA-N 0.000 description 1
- WMRCTEPOPAZMMN-UHFFFAOYSA-N 2-undecylpropanedioic acid Chemical compound CCCCCCCCCCCC(C(O)=O)C(O)=O WMRCTEPOPAZMMN-UHFFFAOYSA-N 0.000 description 1
- POTQBGGWSWSMCX-UHFFFAOYSA-N 3-[2-(3-aminopropoxy)ethoxy]propan-1-amine Chemical compound NCCCOCCOCCCN POTQBGGWSWSMCX-UHFFFAOYSA-N 0.000 description 1
- ANOPCGQVRXJHHD-UHFFFAOYSA-N 3-[3-(3-aminopropyl)-2,4,8,10-tetraoxaspiro[5.5]undecan-9-yl]propan-1-amine Chemical compound C1OC(CCCN)OCC21COC(CCCN)OC2 ANOPCGQVRXJHHD-UHFFFAOYSA-N 0.000 description 1
- YOOSAIJKYCBPFW-UHFFFAOYSA-N 3-[4-(3-aminopropoxy)butoxy]propan-1-amine Chemical compound NCCCOCCCCOCCCN YOOSAIJKYCBPFW-UHFFFAOYSA-N 0.000 description 1
- WTKWFNIIIXNTDO-UHFFFAOYSA-N 3-isocyanato-5-methyl-2-(trifluoromethyl)furan Chemical compound CC1=CC(N=C=O)=C(C(F)(F)F)O1 WTKWFNIIIXNTDO-UHFFFAOYSA-N 0.000 description 1
- MRLGCTNJRREZHZ-UHFFFAOYSA-N 3-phenoxybenzaldehyde Chemical compound O=CC1=CC=CC(OC=2C=CC=CC=2)=C1 MRLGCTNJRREZHZ-UHFFFAOYSA-N 0.000 description 1
- JHCBFGGESJQAIQ-UHFFFAOYSA-N 4-[(4-amino-3,5-dimethylcyclohexyl)methyl]-2,6-dimethylcyclohexan-1-amine Chemical compound C1C(C)C(N)C(C)CC1CC1CC(C)C(N)C(C)C1 JHCBFGGESJQAIQ-UHFFFAOYSA-N 0.000 description 1
- HCJLTNJVGXHKTN-UHFFFAOYSA-N 4-[(4-amino-3-ethylcyclohexyl)methyl]-2-ethylcyclohexan-1-amine Chemical compound C1CC(N)C(CC)CC1CC1CC(CC)C(N)CC1 HCJLTNJVGXHKTN-UHFFFAOYSA-N 0.000 description 1
- VLJQDHDVZJXNQL-UHFFFAOYSA-N 4-methyl-n-(oxomethylidene)benzenesulfonamide Chemical compound CC1=CC=C(S(=O)(=O)N=C=O)C=C1 VLJQDHDVZJXNQL-UHFFFAOYSA-N 0.000 description 1
- QTKDDPSHNLZGRO-UHFFFAOYSA-N 4-methylcyclohexane-1,3-diamine Chemical compound CC1CCC(N)CC1N QTKDDPSHNLZGRO-UHFFFAOYSA-N 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-M Bisulfite Chemical compound OS([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-M 0.000 description 1
- DPUOLQHDNGRHBS-UHFFFAOYSA-N Brassidinsaeure Natural products CCCCCCCCC=CCCCCCCCCCCCC(O)=O DPUOLQHDNGRHBS-UHFFFAOYSA-N 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- NEHDRDVHPTWWFG-UHFFFAOYSA-N Dioctyl hexanedioate Chemical compound CCCCCCCCOC(=O)CCCCC(=O)OCCCCCCCC NEHDRDVHPTWWFG-UHFFFAOYSA-N 0.000 description 1
- URXZXNYJPAJJOQ-UHFFFAOYSA-N Erucic acid Natural products CCCCCCC=CCCCCCCCCCCCC(O)=O URXZXNYJPAJJOQ-UHFFFAOYSA-N 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- 241001295925 Gegenes Species 0.000 description 1
- 206010019233 Headaches Diseases 0.000 description 1
- RLAHWVDQYNDAGG-UHFFFAOYSA-N Methanetriol Chemical class OC(O)O RLAHWVDQYNDAGG-UHFFFAOYSA-N 0.000 description 1
- AFCARXCZXQIEQB-UHFFFAOYSA-N N-[3-oxo-3-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)propyl]-2-[[3-(trifluoromethoxy)phenyl]methylamino]pyrimidine-5-carboxamide Chemical compound O=C(CCNC(=O)C=1C=NC(=NC=1)NCC1=CC(=CC=C1)OC(F)(F)F)N1CC2=C(CC1)NN=N2 AFCARXCZXQIEQB-UHFFFAOYSA-N 0.000 description 1
- 206010028813 Nausea Diseases 0.000 description 1
- 235000021319 Palmitoleic acid Nutrition 0.000 description 1
- LGRFSURHDFAFJT-UHFFFAOYSA-N Phthalic anhydride Natural products C1=CC=C2C(=O)OC(=O)C2=C1 LGRFSURHDFAFJT-UHFFFAOYSA-N 0.000 description 1
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 1
- 239000004952 Polyamide Substances 0.000 description 1
- 239000005062 Polybutadiene Substances 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 239000004721 Polyphenylene oxide Substances 0.000 description 1
- 235000019484 Rapeseed oil Nutrition 0.000 description 1
- BLRPTPMANUNPDV-UHFFFAOYSA-N Silane Chemical compound [SiH4] BLRPTPMANUNPDV-UHFFFAOYSA-N 0.000 description 1
- 235000019486 Sunflower oil Nutrition 0.000 description 1
- DPNYVVLIXCRDQZ-UHFFFAOYSA-N [5-(aminomethyl)-2-bicyclo[2.2.1]heptanyl]methanamine [6-(aminomethyl)-2-bicyclo[2.2.1]heptanyl]methanamine Chemical compound NCC1CC2CC1CC2CN.NCC1CC2CC(CN)C1C2 DPNYVVLIXCRDQZ-UHFFFAOYSA-N 0.000 description 1
- UKLDJPRMSDWDSL-UHFFFAOYSA-L [dibutyl(dodecanoyloxy)stannyl] dodecanoate Chemical compound CCCCCCCCCCCC(=O)O[Sn](CCCC)(CCCC)OC(=O)CCCCCCCCCCC UKLDJPRMSDWDSL-UHFFFAOYSA-L 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- WNLRTRBMVRJNCN-UHFFFAOYSA-L adipate(2-) Chemical compound [O-]C(=O)CCCCC([O-])=O WNLRTRBMVRJNCN-UHFFFAOYSA-L 0.000 description 1
- 150000001279 adipic acids Chemical class 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 125000003172 aldehyde group Chemical group 0.000 description 1
- 238000006668 aldol addition reaction Methods 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 125000005233 alkylalcohol group Chemical group 0.000 description 1
- 229960005363 aluminium oxide Drugs 0.000 description 1
- 235000012211 aluminium silicate Nutrition 0.000 description 1
- 125000004202 aminomethyl group Chemical group [H]N([H])C([H])([H])* 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- JFCQEDHGNNZCLN-UHFFFAOYSA-N anhydrous glutaric acid Natural products OC(=O)CCCC(O)=O JFCQEDHGNNZCLN-UHFFFAOYSA-N 0.000 description 1
- 239000011952 anionic catalyst Substances 0.000 description 1
- 229940114079 arachidonic acid Drugs 0.000 description 1
- 235000021342 arachidonic acid Nutrition 0.000 description 1
- 150000004982 aromatic amines Chemical class 0.000 description 1
- 239000000440 bentonite Substances 0.000 description 1
- 229910000278 bentonite Inorganic materials 0.000 description 1
- SVPXDRXYRYOSEX-UHFFFAOYSA-N bentoquatam Chemical compound O.O=[Si]=O.O=[Al]O[Al]=O SVPXDRXYRYOSEX-UHFFFAOYSA-N 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- BJQHLKABXJIVAM-UHFFFAOYSA-N bis(2-ethylhexyl) phthalate Chemical compound CCCCC(CC)COC(=O)C1=CC=CC=C1C(=O)OCC(CC)CCCC BJQHLKABXJIVAM-UHFFFAOYSA-N 0.000 description 1
- ZFMQKOWCDKKBIF-UHFFFAOYSA-N bis(3,5-difluorophenyl)phosphane Chemical compound FC1=CC(F)=CC(PC=2C=C(F)C=C(F)C=2)=C1 ZFMQKOWCDKKBIF-UHFFFAOYSA-N 0.000 description 1
- 239000007767 bonding agent Substances 0.000 description 1
- 230000001680 brushing effect Effects 0.000 description 1
- JHIWVOJDXOSYLW-UHFFFAOYSA-N butyl 2,2-difluorocyclopropane-1-carboxylate Chemical compound CCCCOC(=O)C1CC1(F)F JHIWVOJDXOSYLW-UHFFFAOYSA-N 0.000 description 1
- 229960003563 calcium carbonate Drugs 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- BRPQOXSCLDDYGP-UHFFFAOYSA-N calcium oxide Chemical compound [O-2].[Ca+2] BRPQOXSCLDDYGP-UHFFFAOYSA-N 0.000 description 1
- 239000000292 calcium oxide Substances 0.000 description 1
- 150000004649 carbonic acid derivatives Chemical class 0.000 description 1
- 150000001244 carboxylic acid anhydrides Chemical class 0.000 description 1
- SECPZKHBENQXJG-UHFFFAOYSA-N cis-palmitoleic acid Natural products CCCCCCC=CCCCCCCCC(O)=O SECPZKHBENQXJG-UHFFFAOYSA-N 0.000 description 1
- 239000003240 coconut oil Substances 0.000 description 1
- 235000019864 coconut oil Nutrition 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- XBZSBBLNHFMTEB-UHFFFAOYSA-N cyclohexane-1,3-dicarboxylic acid Chemical compound OC(=O)C1CCCC(C(O)=O)C1 XBZSBBLNHFMTEB-UHFFFAOYSA-N 0.000 description 1
- YQLZOAVZWJBZSY-UHFFFAOYSA-N decane-1,10-diamine Chemical compound NCCCCCCCCCCN YQLZOAVZWJBZSY-UHFFFAOYSA-N 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000006735 deficit Effects 0.000 description 1
- 239000002274 desiccant Substances 0.000 description 1
- 230000006866 deterioration Effects 0.000 description 1
- 150000004985 diamines Chemical class 0.000 description 1
- AYOHIQLKSOJJQH-UHFFFAOYSA-N dibutyltin Chemical compound CCCC[Sn]CCCC AYOHIQLKSOJJQH-UHFFFAOYSA-N 0.000 description 1
- 239000012975 dibutyltin dilaurate Substances 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- 150000002009 diols Chemical class 0.000 description 1
- SZXQTJUDPRGNJN-UHFFFAOYSA-N dipropylene glycol Chemical compound OCCCOCCCO SZXQTJUDPRGNJN-UHFFFAOYSA-N 0.000 description 1
- QFTYSVGGYOXFRQ-UHFFFAOYSA-N dodecane-1,12-diamine Chemical compound NCCCCCCCCCCCCN QFTYSVGGYOXFRQ-UHFFFAOYSA-N 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- DPUOLQHDNGRHBS-KTKRTIGZSA-N erucic acid Chemical compound CCCCCCCC\C=C/CCCCCCCCCCCC(O)=O DPUOLQHDNGRHBS-KTKRTIGZSA-N 0.000 description 1
- 125000001033 ether group Chemical group 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 150000002191 fatty alcohols Chemical class 0.000 description 1
- 239000000835 fiber Substances 0.000 description 1
- 239000003063 flame retardant Substances 0.000 description 1
- 238000009408 flooring Methods 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 230000002538 fungal effect Effects 0.000 description 1
- 239000000417 fungicide Substances 0.000 description 1
- 238000000227 grinding Methods 0.000 description 1
- 238000009499 grossing Methods 0.000 description 1
- 231100000869 headache Toxicity 0.000 description 1
- 150000002374 hemiaminals Chemical class 0.000 description 1
- PWSKHLMYTZNYKO-UHFFFAOYSA-N heptane-1,7-diamine Chemical compound NCCCCCCCN PWSKHLMYTZNYKO-UHFFFAOYSA-N 0.000 description 1
- 150000002430 hydrocarbons Chemical group 0.000 description 1
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 1
- 238000007654 immersion Methods 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 239000011256 inorganic filler Substances 0.000 description 1
- 239000000543 intermediate Substances 0.000 description 1
- YAQXGBBDJYBXKL-UHFFFAOYSA-N iron(2+);1,10-phenanthroline;dicyanide Chemical compound [Fe+2].N#[C-].N#[C-].C1=CN=C2C3=NC=CC=C3C=CC2=C1.C1=CN=C2C3=NC=CC=C3C=CC2=C1 YAQXGBBDJYBXKL-UHFFFAOYSA-N 0.000 description 1
- QQVIHTHCMHWDBS-UHFFFAOYSA-N isophthalic acid Chemical compound OC(=O)C1=CC=CC(C(O)=O)=C1 QQVIHTHCMHWDBS-UHFFFAOYSA-N 0.000 description 1
- 150000002596 lactones Chemical class 0.000 description 1
- OYHQOLUKZRVURQ-HZJYTTRNSA-N linoleic acid group Chemical group C(CCCCCCC\C=C/C\C=C/CCCCC)(=O)O OYHQOLUKZRVURQ-HZJYTTRNSA-N 0.000 description 1
- 125000005481 linolenic acid group Chemical group 0.000 description 1
- 239000000944 linseed oil Substances 0.000 description 1
- 235000021388 linseed oil Nutrition 0.000 description 1
- 230000005923 long-lasting effect Effects 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 239000002808 molecular sieve Substances 0.000 description 1
- KMBPCQSCMCEPMU-UHFFFAOYSA-N n'-(3-aminopropyl)-n'-methylpropane-1,3-diamine Chemical compound NCCCN(C)CCCN KMBPCQSCMCEPMU-UHFFFAOYSA-N 0.000 description 1
- ITZPOSYADVYECJ-UHFFFAOYSA-N n'-cyclohexylpropane-1,3-diamine Chemical compound NCCCNC1CCCCC1 ITZPOSYADVYECJ-UHFFFAOYSA-N 0.000 description 1
- TVIDDXQYHWJXFK-UHFFFAOYSA-N n-Dodecanedioic acid Natural products OC(=O)CCCCCCCCCCC(O)=O TVIDDXQYHWJXFK-UHFFFAOYSA-N 0.000 description 1
- 230000008693 nausea Effects 0.000 description 1
- 231100000989 no adverse effect Toxicity 0.000 description 1
- SXJVFQLYZSNZBT-UHFFFAOYSA-N nonane-1,9-diamine Chemical compound NCCCCCCCCCN SXJVFQLYZSNZBT-UHFFFAOYSA-N 0.000 description 1
- 235000014593 oils and fats Nutrition 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 239000012766 organic filler Substances 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 238000010422 painting Methods 0.000 description 1
- 239000003346 palm kernel oil Substances 0.000 description 1
- 239000002540 palm oil Substances 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- WXZMFSXDPGVJKK-UHFFFAOYSA-N pentaerythritol Chemical compound OCC(CO)(CO)CO WXZMFSXDPGVJKK-UHFFFAOYSA-N 0.000 description 1
- WTSXICLFTPPDTL-UHFFFAOYSA-N pentane-1,3-diamine Chemical compound CCC(N)CCN WTSXICLFTPPDTL-UHFFFAOYSA-N 0.000 description 1
- 125000005498 phthalate group Chemical class 0.000 description 1
- XNGIFLGASWRNHJ-UHFFFAOYSA-L phthalate(2-) Chemical compound [O-]C(=O)C1=CC=CC=C1C([O-])=O XNGIFLGASWRNHJ-UHFFFAOYSA-L 0.000 description 1
- 239000000049 pigment Substances 0.000 description 1
- 229920000058 polyacrylate Polymers 0.000 description 1
- 229920002647 polyamide Polymers 0.000 description 1
- 239000004417 polycarbonate Substances 0.000 description 1
- 229920000515 polycarbonate Polymers 0.000 description 1
- 229920000570 polyether Polymers 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 238000006116 polymerization reaction Methods 0.000 description 1
- 229920000193 polymethacrylate Polymers 0.000 description 1
- 239000004810 polytetrafluoroethylene Substances 0.000 description 1
- 229920001343 polytetrafluoroethylene Polymers 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 150000003141 primary amines Chemical class 0.000 description 1
- 235000013772 propylene glycol Nutrition 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 230000000241 respiratory effect Effects 0.000 description 1
- 239000006254 rheological additive Substances 0.000 description 1
- 229960004889 salicylic acid Drugs 0.000 description 1
- 238000005488 sandblasting Methods 0.000 description 1
- 238000007127 saponification reaction Methods 0.000 description 1
- 229940116351 sebacate Drugs 0.000 description 1
- CXMXRPHRNRROMY-UHFFFAOYSA-L sebacate(2-) Chemical compound [O-]C(=O)CCCCCCCCC([O-])=O CXMXRPHRNRROMY-UHFFFAOYSA-L 0.000 description 1
- 150000003330 sebacic acids Chemical class 0.000 description 1
- 230000008786 sensory perception of smell Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 229910000077 silane Inorganic materials 0.000 description 1
- 150000004756 silanes Chemical class 0.000 description 1
- 125000005624 silicic acid group Chemical class 0.000 description 1
- 235000012239 silicon dioxide Nutrition 0.000 description 1
- URGAHOPLAPQHLN-UHFFFAOYSA-N sodium aluminosilicate Chemical compound [Na+].[Al+3].[O-][Si]([O-])=O.[O-][Si]([O-])=O URGAHOPLAPQHLN-UHFFFAOYSA-N 0.000 description 1
- RYYKJJJTJZKILX-UHFFFAOYSA-M sodium octadecanoate Chemical class [Na+].CCCCCCCCCCCCCCCCCC([O-])=O RYYKJJJTJZKILX-UHFFFAOYSA-M 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 238000005507 spraying Methods 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 230000003068 static effect Effects 0.000 description 1
- 150000003444 succinic acids Chemical class 0.000 description 1
- 150000003459 sulfonic acid esters Chemical class 0.000 description 1
- 239000002600 sunflower oil Substances 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 238000010998 test method Methods 0.000 description 1
- HQHCYKULIHKCEB-UHFFFAOYSA-N tetradecanedioic acid Natural products OC(=O)CCCCCCCCCCCCC(O)=O HQHCYKULIHKCEB-UHFFFAOYSA-N 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 150000004072 triols Chemical class 0.000 description 1
- KLNPWTHGTVSSEU-UHFFFAOYSA-N undecane-1,11-diamine Chemical compound NCCCCCCCCCCCN KLNPWTHGTVSSEU-UHFFFAOYSA-N 0.000 description 1
- 150000003672 ureas Chemical class 0.000 description 1
- 238000009423 ventilation Methods 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 239000001993 wax Substances 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09J—ADHESIVES; NON-MECHANICAL ASPECTS OF ADHESIVE PROCESSES IN GENERAL; ADHESIVE PROCESSES NOT PROVIDED FOR ELSEWHERE; USE OF MATERIALS AS ADHESIVES
- C09J175/00—Adhesives based on polyureas or polyurethanes; Adhesives based on derivatives of such polymers
- C09J175/02—Polyureas
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G18/00—Polymeric products of isocyanates or isothiocyanates
- C08G18/06—Polymeric products of isocyanates or isothiocyanates with compounds having active hydrogen
- C08G18/08—Processes
- C08G18/0804—Manufacture of polymers containing ionic or ionogenic groups
- C08G18/0819—Manufacture of polymers containing ionic or ionogenic groups containing anionic or anionogenic groups
- C08G18/0823—Manufacture of polymers containing ionic or ionogenic groups containing anionic or anionogenic groups containing carboxylate salt groups or groups forming them
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G18/00—Polymeric products of isocyanates or isothiocyanates
- C08G18/06—Polymeric products of isocyanates or isothiocyanates with compounds having active hydrogen
- C08G18/08—Processes
- C08G18/10—Prepolymer processes involving reaction of isocyanates or isothiocyanates with compounds having active hydrogen in a first reaction step
- C08G18/12—Prepolymer processes involving reaction of isocyanates or isothiocyanates with compounds having active hydrogen in a first reaction step using two or more compounds having active hydrogen in the first polymerisation step
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G18/00—Polymeric products of isocyanates or isothiocyanates
- C08G18/06—Polymeric products of isocyanates or isothiocyanates with compounds having active hydrogen
- C08G18/28—Polymeric products of isocyanates or isothiocyanates with compounds having active hydrogen characterised by the compounds used containing active hydrogen
- C08G18/2805—Compounds having only one group containing active hydrogen
- C08G18/285—Nitrogen containing compounds
- C08G18/2865—Compounds having only one primary or secondary amino group; Ammonia
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G18/00—Polymeric products of isocyanates or isothiocyanates
- C08G18/06—Polymeric products of isocyanates or isothiocyanates with compounds having active hydrogen
- C08G18/28—Polymeric products of isocyanates or isothiocyanates with compounds having active hydrogen characterised by the compounds used containing active hydrogen
- C08G18/40—High-molecular-weight compounds
- C08G18/48—Polyethers
- C08G18/4833—Polyethers containing oxyethylene units
- C08G18/4837—Polyethers containing oxyethylene units and other oxyalkylene units
- C08G18/4841—Polyethers containing oxyethylene units and other oxyalkylene units containing oxyethylene end groups
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G18/00—Polymeric products of isocyanates or isothiocyanates
- C08G18/06—Polymeric products of isocyanates or isothiocyanates with compounds having active hydrogen
- C08G18/28—Polymeric products of isocyanates or isothiocyanates with compounds having active hydrogen characterised by the compounds used containing active hydrogen
- C08G18/40—High-molecular-weight compounds
- C08G18/48—Polyethers
- C08G18/4866—Polyethers having a low unsaturation value
Definitions
- the invention relates to polyurethane compositions comprising at least one polyurethane prepolymer and at least one polyaldimine, which cure without any unpleasant odor.
- the polyaldimine used for this purpose is obtainable from a polyamine having aliphatic primary amino groups (also referred to in the text as "aliphatic polyamine”) and a specific aldehyde.
- Polyurethanes are used, inter alia, as one-component, moisture-curing, elastic sealants, adhesives and coatings. They usually contain an isocyanate group-containing polyurethane prepolymer prepared from polyols and polyisocyanates, which is then mixed with other components and stored until use in the absence of moisture. These known systems have the disadvantage that the resulting in the reaction of isocyanate groups with water CO 2 gas can lead to bubbles in the cured product.
- Isocyanate group-containing polyurethane prepolymers and polyaldimines can be formulated one-component products with good mechanical properties, which are sufficiently stable in storage and cure rapidly on contact with water or moisture from the air.
- the polyaldimines hydrolyze with water to the corresponding aldehydes and polyamines, whereupon the latter with the isocyanate groups of the polyurethane prepolymer react and cure without the release of CO 2 and thus without the formation of bubbles.
- Polyaldimines of aliphatic polyamines and their use as curing agents for polyurethanes are well known. They are described for example in US 3,932,357 ,
- polyaldimines of relatively volatile aldehydes are used, which are known to have a particularly intense odor. In their applications, therefore, a good ventilation or respiratory protection is required, especially if additional organic solvents are used.
- a good ventilation or respiratory protection is required, especially if additional organic solvents are used.
- the smell of the liberated in the hydrolysis of the polyaldimines aldehyde is particularly disturbing because it persists over a longer period remains.
- odor-sensitive applications In other, so-called odor-sensitive applications, however, such odor pollution is generally not tolerated. Particularly sensitive to smell are applications in closed rooms, such as For example, the sealing of joints in the interior of buildings or the bonding of components in the interior of vehicles. Odorlessness is an indispensable condition here, even during and shortly after the application of a product.
- strict standards are generally imposed on volatiles that escape from, for example, an adhesive.
- corresponding limit values for the volatiles escaping from an adhesive the so-called "fogging” are specified (measuring method: see, for example, DIN 75201).
- US 4,469,831 describes a moisture-curing, one-component polyurethane composition containing 2,2-dimethyl-3- (isobutyroxy) -propanaldimine aliphatic polyamines.
- This composition has a good storage stability, a high curing rate and allegedly little odor.
- the use of the polyaldimines described causes a long-lasting, pungent smell, which is intolerable for odor-sensitive applications.
- US 4,853,454 describes inter alia a similar moisture-curing, substituted 2,2-Dimethylpropanaldimine aliphatic polyamines containing one-component polyurethane composition.
- the released in the hydrolysis of polyaldimines described aldehydes should lead to allegedly very low odor compositions due to their high vapor pressure.
- unpleasant odors that are perceptible for a long time also occur here, which makes these substances unsuitable for odor-sensitive applications.
- US 4,720,535 describes moisture-curing one-component polyurethane compositions containing substituted 2,2-dimethylpropanaldimines of aromatic polyamines.
- the use of the polyaldimines described is unsuitable due to the aromatic polyamines used.
- aromatic polyamines are generally much more toxic than aliphatic, and on the other hand polyaldimines are more aromatic Polyamines as a curing agent much less reactive than those of aliphatic polyamines, both in terms of the hydrolysis of the aldimine and usually also with respect to the reaction of the amino groups with the isocyanate groups of the polyurethane prepolymer.
- most of the aldehydes described also cause a noticeable to strong odor.
- a suitable composition must be easy to prepare from commercially available raw materials, have sufficient storage stability and harden quickly enough after application. The released in the hydrolysis of the polyaldimine aldehyde must not cause any offensive odor and have no adverse effect on the cured polyurethane composition.
- composition comprising at least one polyurethane prepolymer having isocyanate end groups and at least one polyaldimine which is obtainable from at least one polyamine having aliphatic primary amino groups and at least one aldehyde according to the formula specified below.
- the preparation of the aldehydes used for the polyaldimines is based on readily available, inexpensive raw materials and is surprisingly simple by the esterification of low-volatility carboxylic acids, such as long-chain fatty acids, with ⁇ -hydroxyaldehydes, in particular 3-hydroxypivalaldehyde.
- the aldehydes thus obtained are solid or liquid at room temperature, depending on the carboxylic acid used. They can then be reacted with polyamines directly to the corresponding polyaldimines.
- the required reaction steps can all be carried out without the use of solvents, whereby no solvent residues enter the composition, where they could cause a disturbing smell and fogging. Since the carboxylic acids used in the preparation of the aldehydes themselves are low in odor, traces thereof likewise do not cause a disturbing odor, which makes a complicated purification of the polyaldimines superfluous before use.
- polyaldimines have a sufficiently high reactivity as curing agents for polyurethanes is surprising and not obvious to the person skilled in the art.
- One skilled in the art would expect that due to their hydrophobic structure they are poorly accessible to the water required for the hydrolysis of the aldimine groups, and therefore their hydrolysis is slow and incomplete.
- the described polyaldimines react quickly and completely upon contact with moisture in the polyurethane composition. Their reactivity is comparable to that of substantially less hydrophobic polyaldimines, such as those in US 4,469,831 are described.
- novel polyurethane compositions have excellent storage stability. They harden quickly on contact with moisture, without causing a disturbing smell. The released aldehyde remains in the cured polyurethane composition where it does not adversely affect its properties. On the contrary, its hydrophobicity leads to a quite desirable increase in the hydrolytic stability of the cured polyurethane composition.
- the present invention relates to compositions comprising at least one polyurethane prepolymer A with isocyanate end groups, which is prepared from at least one polyisocyanate and at least one polyol, and at least one polyaldimine B , which is obtainable from at least one polyamine C having aliphatic primary amino groups and at least one aldehyde D.
- compositions as adhesive, sealant, coating or coating is described. Furthermore, methods for bonding, sealing or coating are provided. Finally, articles are described whose surface has been at least partially contacted with such a composition.
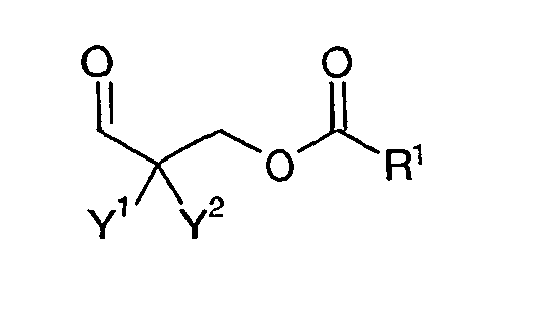
- the present invention relates to compositions comprising at least one polyurethane prepolymer A with isocyanate end groups, which is prepared from at least one polyisocyanate and at least one polyol, and at least one polyaldimine B , which is obtainable from at least one polyamine C having aliphatic primary amino groups and at least one aldehyde D with the Formula (I): where Y 1 and Y 2, on the one hand, independently of one another, represent an alkyl, aryl or arylalkyl group which may optionally be substituted in each case, may each contain heteroatoms and may optionally each contain unsaturated moieties.
- Y 1 and Y 2 may be bonded together to form a carbocyclic or heterocyclic ring having a ring size between 5 and 8, preferably 6, atoms, and optionally one or two monounsaturated bonds.
- the radical R 1 is either a linear or branched alkyl chain having 11 to 30 carbon atoms, optionally containing at least one heteroatom, in particular having at least one ether oxygen, or a mono- or polyunsaturated linear or branched hydrocarbon chain having 11 to 30 C. Atoms, or a radical of the formula (II) or (III).
- R 2 is a linear or branched or cyclic alkylene chain having 2 to 16 carbon atoms, optionally with at least one heteroatom, in particular with at least one ether oxygen, or for a single or polyunsaturated linear or branched or cyclic hydrocarbon chain having 2 to 16 carbon atoms
- R 3 is a linear or branched alkyl chain having 1 to 8 carbon atoms.
- Y 1 and Y 2 have the meaning already mentioned, and the dashed lines in the formulas denote the joints.
- poly in “polyaldimine”, “polyol”, “polyisocyanate”, “polyamine” is meant molecules which formally contain two or more of the respective functional groups.
- polyamines having aliphatic primary amino groups in the present document always denotes compounds which formally contain two or more NH 2 groups which are bonded to an aliphatic, cycloaliphatic or arylaliphatic radical. They differ from the aromatic amines in which the amino groups are bonded directly to an aromatic radical, such as in aniline or 2-aminopyridine.
- the polyurethane prepolymer A is prepared from at least one polyisocyanate and at least one polyol. This reaction can be carried out by reacting the polyol and the polyisocyanate with customary processes, for example at from 50 to 100 ° C., if appropriate with concomitant use of suitable catalysts, the polyisocyanate being metered in such a way that its isocyanate groups are proportionate to the hydroxyl groups of the polyol in stoichiometric excess are present.
- the excess of polyisocyanate is chosen so that in the resulting polyurethane prepolymer A after the reaction of all hydroxyl groups of the polyol, a content of free isocyanate groups of 0.1 to 15% by weight, preferably 0.5 to 5% by weight, based on the total polyurethane prepolymer A remains.
- the polyurethane prepolymer A can be prepared with the concomitant use of solvents or plasticizers, wherein the solvents or plasticizers used contain no isocyanate-reactive groups.
- These stated polyols have an average molecular weight of 250 to 30,000 g / mol and an average OH functionality in the range of 1.6 to 3.
- low molecular weight dihydric or polyhydric alcohols such as 1,2-ethanediol, 1,2- and 1,3-propanediol, neopentyl glycol, diethylene glycol, triethylene glycol, the isomeric dipropylene glycols and tripropylene glycols, the isomeric butanediols, pentanediols, hexanediols , Heptanediols, octanediols, nonanediols, decanediols, undecanediols, 1,3- and 1,4-cyclohexanedimethanol, hydrogenated bisphenol A, dimeric fatty alcohols, 1,1,1-trimethylolethane, 1,1,1-trimethylolpropane, glycerol, pentaerythritol, sugar alcohols and other higher alcohols, low molecular weight dihydric or polyhydric
- the polyaldimine B can be prepared from at least one polyamine C having aliphatic primary amino groups and at least one aldehyde D by a condensation reaction with elimination of water. Such condensation reactions are well known and described, for example in Houben-Weyl, "Methods of Organic Chemistry", Vol. XI / 2, page 73 ff.
- the aldehyde D is here in relation to the primary amino groups of the polyamine C stoichiometric or in stoichiometric excess used.
- Suitable polyamines C having aliphatic primary amino groups for the preparation of the polyaldimine B are the polyamines known in polyurethane chemistry, such as are used, inter alia, for two-component polyurethanes.
- Aliphatic polyamines such as ethylenediamine, 1,2- and 1,3-propanediamine, 2-methyl-1,2-propanediamine, 2,2-dimethyl-1,3-propanediamine, 1,3- and 1,4-butanediamine, 1,3- and 1,5-pentanediamine, 1,6-hexanediamine, 2,2,4- and 2,4,4-trimethylhexamethylenediamine and mixtures thereof, 1,7-heptanediamine, 1,8 -Octandiamin, 4-Aminomethyl-1,8-octanediamine, 1,9-nonanediamine, 1,10-decanediamine, 1,11-undecanediamine, 1,12-dodecanediamine, methyl bis (3-aminopropy
- Preferred polyamines are 1,6-hexamethylenediamine, MPMD, DAMP, 2,2,4- and 2,4,4-trimethylhexamethylenediamine, 4-aminomethyl-1,8-octanediamine, IPDA, 1,3- and 1,4-xylylenediamine , 1,3- and 1,4-bis (aminomethyl) cyclohexane, bis (4-aminocyclohexyl) methane, bis (4-amino-3-methylcyclohexyl) methane, 3 (4), 8 (9 ) -bis- (aminomethyl) tricyclo [5.2.1.0 2,6] decane, 1,2-, 1,3- and 1,4-diaminocyclohexane, polyoxyalkylene-polyamines having theoretically two or three amino groups, especially Jeffamine ® EDR 148, Jeffamine ® D-230, Jeffamine ® D-400 and Jeffamine ® T-403, as well as in particular mixtures of two or more of
- At least one aldehyde D is used having the formula (I):
- aldehyde D is based on a ⁇ -hydroxyaldehyde according to formula (IV), which, for example, from formaldehyde (or paraformaldehyde or oligomeric forms of formaldehyde, such as 1,3,5-trioxane) and an aldehyde according to formula (V) in a crossed aldol addition, optionally in situ.
- formula (IV) formaldehyde (or paraformaldehyde or oligomeric forms of formaldehyde, such as 1,3,5-trioxane) and an aldehyde according to formula (V) in a crossed aldol addition, optionally in situ.
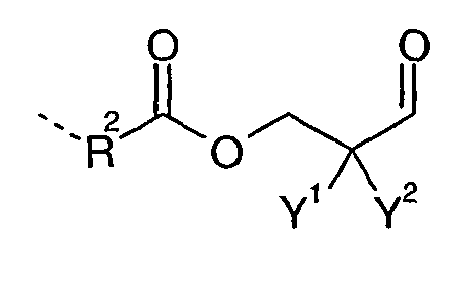
- the ⁇ -hydroxyaldehyde according to formula (IV) is reacted with a carboxylic acid to give the corresponding ester, namely either with a long-chain fatty acid R 1 -COOH to the corresponding fatty acid ester; and / or with a Dicarbonklaremonoalkylester HOOC-R 2 -COOR 3 to aldehyde D with the radical of formula (III); and / or with a dicarboxylic acid HOOC-R 2 -COOH to aldehyde D , in this case a dialdehyde, with the radical of formula (II).
- the formulas (II) and (III) and R 1 , R 2 and R 3 have the meaning already described.
- This esterification can be carried out by known methods without the use of solvents, described for example in US Pat Houben-Weyl, "Methods of Organic Chemistry", Vol. VIII, pages 516-528 ,
- a mixture of the aldehydes D is obtained with the radicals of formula (11) and of formula (III), for example, when first a part of the carboxylic acid groups with the ⁇ -hydroxyaldehyde according to formula (IV) is esterified, and then the remaining carboxylic acid groups are esterified with an alkyl alcohol (R 3 -OH).
- R 3 -OH alkyl alcohol
- Preferred aldehydes of formula (V) for reacting with formaldehyde to form ⁇ -hydroxyaldehydes of formula (IV) are the following: isobutyraldehyde, 2-methylbutyraldehyde, 2-ethylbutyraldehyde, 2-methylvaleraldehyde, 2-ethylcaproic aldehyde, cyclopentanecarboxaldehyde, cyclohexanecarboxaldehyde, 1,2, 3,6-tetrahydrobenzaldehyde, 2-methyl-3-phenylpropionaldehyde, 2-phenylpropionaldehyde and diphenylacetaldehyde. Particularly preferred is isobutyraldehyde.
- Preferred ⁇ -hydroxyaldehydes of the formula (IV) are the products of the reaction of formaldehyde with the aldehydes of the formula (V) mentioned above as being preferred. Particularly preferred is 3-hydroxypivalaldehyde.
- Examples of suitable carboxylic acids for esterification with the ⁇ -hydroxyaldehydes of the formula (IV) are: lauric acid, tridecanoic acid, myristic acid, pentadecanoic acid, palmitic acid, margaric acid, stearic acid, nonadecanoic acid, arachidic acid, palmitoleic acid, oleic acid, erucic acid, linoleic acid, linolenic acid, elaeostearic acid , Arachidonic acid, succinic acid, glutaric acid, adipic acid, pimelic acid, suberic acid, sebacic acid, 1,12-dodecanedioic acid, maleic acid, fumaric acid, hexahydrophthalic acid, hexahydroisophthalic acid, hexahydroterephthalic acid, 3,6,9-trioxaundecanedioic acid and similar derivatives of polyethylene glycol, dehydrated
- polyaldimines of the formula (VI) and (VII) are formed, where n is 2, 3 or 4 and Q is the residue of a polyamine C with aliphatic primary amino groups after removal of all primary amino groups; and wherein m is an integer from 0 to 10 and Q is the same or different in the same molecule and is intended to represent the residue of a polyamine C having aliphatic primary amino groups after removal of all primary amino groups.
- the radicals Y 1 , Y 2 , R 1 and R 2 in the formulas (VI) and (VII) have the meaning already described.
- a dialdehyde D with the radical according to formula (II) is used for the preparation of a polyaldimine B , this is advantageously used either in a mixture with a monoaldehyde D , in such a proportion that for the polyaldimine of formula (VII) for m, values in the range of 1 to 10 are obtained on average; or it is metered so that an excess of aldehyde groups relative to the amino groups in the preparation of the polyaldimine B is present, wherein the aldehyde excess is chosen so that for the polyaldimine of formula (VII) for m also in the mean values in Range from 1 to 10 can be obtained. On both Species is obtained a mixture of oligomeric polyaldimines with a good manageable viscosity.
- polyaldimine B it is also possible to use mixtures of different polyaldimines, in particular also mixtures of different polyaldimines prepared with the aid of various polyamines C having primary aliphatic amino groups reacted with different or identical aldehydes D , in particular also mixtures of polyaldimines prepared using polyamines having a different number of primary aliphatic amino groups, ie different values for n.
- a catalyst for the hydrolysis of the polyaldimine may be added, for example, an organic carboxylic acid such as benzoic or salicylic acid, an organic carboxylic anhydride such as phthalic anhydride or hexahydrophthalic anhydride, a silyl ester of organic carboxylic acids, an organic sulfonic acid such as p-toluenesulfonic acid, or other organic or inorganic acid. or mixtures of the aforementioned acids.
- the described polyurethane compositions are prepared and stored with the exclusion of moisture.
- the compositions are storage stable, that is, they can be stored in a suitable package or assembly, such as a keg, bag, or cartridge, for several months to a year or longer before use, without losing their utility.
- the polyurethane compositions come into contact with moisture, whereupon the polyaldimines B hydrolyze to aldehydes D and polyamines C and the polyamines C react with the isocyanate-containing polyurethane prepolymer A and thus cure it.
- Either the water needed for the reaction can come from the air (humidity), or the polyurethane composition can be contacted with a water-containing component, for example by painting, for example with a smoothing agent, by spraying or by immersion, or it can Polyrethanzusammen Austria a water-containing component may be added, for example in the form of a water-containing paste, which can be mixed, for example via a static mixer.
- the polyaldimine B is used in deficit, ie the ratio of the aldimine groups to the isocyanate groups is chosen to be substoichiometric, then the excess isocyanate groups react with water present.
- reaction of the isocyanate-containing polyurethane prepolymer A with the hydrolyzing polyaldimine B need not necessarily take place via the polyamine C.
- reactions with intermediates of the hydrolysis of the polyaldimine B to the polyamine C are possible.
- the hydrolyzing polyaldimine B in the form of a hemiaminal reacts directly with the polyurethane prepolymer A containing isocyanate groups.
- the polyurethane composition cures.
- the described polyurethane composition is characterized in the cured state by excellent mechanical properties. It has high strains and high tensile strengths, elastic moduli, which can be adjusted by varying the components used, such as polyols, polyisocyanates and polyamines in a wide range to the needs of each application.
- the aldehydes D which are split off by polyaldimine B during its hydrolysis, are characterized in that they remain in the cured polyurethane composition due to their high vapor pressure, and that they do not cause any disturbing odor.
- the hydrophobic fatty acid residue causes less water absorption of the cured polyurethane composition, which increases the resistance of the polyurethane material to hydrolysis.
- a hydrophobic fatty acid radical provides long-term water contact a good protection against the washing out of the aldehydes D from the cured polyurethane composition.
- the presence of these aldehydes in the cured polyurethane composition causes no deterioration in the light stability of the polyurethane material, as observed in the presence of low volatility aromatic aldehydes.
- the polyurethane composition described is suitable as a sealant of all kinds, for example for sealing joints in construction, as an adhesive for the bonding of various substrates, for example for bonding components in the manufacture of automobiles, rail vehicles, ships or other industrial goods, and as a coating or Covering for various articles or variable surfaces.
- odor-sensitive applications such as the sealing of joints in the interior of buildings and the bonding of components in the interior of vehicles.
- Protective coatings, sealants, protective coatings and primer coatings are preferred as coatings.
- Floor coverings are to be mentioned as preferred among the coverings.
- Such liners are made by typically pouring and leveling a reactive composition onto the substrate where it cures to a floor covering.
- Such flooring is used for offices, living areas, hospitals, schools, warehouses, parking garages and other private or industrial applications. These applications are extensive, which can lead to occupational hygiene problems and / or odor nuisance even in outdoor applications.
- a large part of the floor coverings is applied indoors. Therefore, the smell of floor coverings is generally a big problem.
- the polyurethane composition is at least partially contacted with the surface of any substrate. Preference is given to a uniform contact in the form of a sealant or adhesive, a coating or a coating, in the areas which require a connection in the form of a bond or seal for use or their background should be covered. It may well be necessary for the substrate or the article to be contacted to undergo a physical and / or chemical pretreatment prior to contacting, for example by grinding, sandblasting, brushing or the like, or by treatment with cleaners, solvents, adhesion promoters, Adhesive solutions or primers, or the application of a bonding agent or a sealer.
- Acclaim ® 12200 (Bayer): Linear polypropylene oxide polyol with theoretical OH functionality 2, average molecular weight about 12,000, OH number about 11 mg KOH / g, degree of unsaturation about 0.005 mEq / g.
- Caradol ® MD34-02 (Shell): ethylene oxide-terminated Nonlinear Polypropylenoxidpolyethylenoxid polyol with a theoretical OH functionality of 3, an average molecular weight about 4900, OH number about 35 mg KOH / g, degree of unsaturation about 0:08 mEq / g.
- the viscosity was measured at 20 ° C. on a cone-plate viscometer from Haake (PK100 / VT-500).
- Skinning time time to tack-free, tack-free time was determined at 23 ° C and 50% relative humidity.
- Bubble formation was judged qualitatively from the amount of bubbles which occurred during curing (at 23 ° C and 50% RH) of the films used for the mechanical tests (layer thickness 2 mm).
- the odor was evaluated on the poured films by nose-smelling 10 cm apart, a first time on the composition applied immediately before, and a second time 7 days later on the composition cured at 23 ° C and 50% relative humidity.
- the reaction mixture was cooled, and from a dropping funnel 48.6 g Jeffamine ® D-230 were added. Thereafter, the volatiles were completely distilled off.
- the resulting reaction product which was liquid at room temperature, had an aldimine content, determined as the amine content, of 2.17 mmol NH 2 / g and a viscosity at 20 ° C. of 700 mPa ⁇ s.
- polyaldimine PA1 42.8 g formaldehyde (37% in water, methanol-free), 38.0 g of isobutyraldehyde, 150.0 g of stearic acid and 1.0 g of 4-toluenesulphonic acid, with the separation of around 37 mL implemented water and the reaction mixture thus obtained with 57.0 g of Jeffamine ® D -230 offset. After removal of the volatiles, a reaction product which was cream-solid at room temperature and had an aldimine content, determined as the amine content, of 1.93 mmol NH 2 / g was obtained.
- thermometer and water separator (Dean Stark) were weighed 11.0 g of paraformaldehyde, 40.0 g of 2-methylvaleraldehyde, 64.0 g of lauric acid and 0.5 g of 4-toluenesulfonic acid and placed under a nitrogen atmosphere. The mixture was heated in an oil bath with vigorous stirring to 100 ° C until the reflux rate had decreased significantly. Then the reflux cooling was turned off, the bath temperature was raised to 130 ° C, whereupon water began to separate. After 30 minutes, the bath temperature was increased to 170 ° C and the apparatus was evacuated in a water-jet vacuum for 90 minutes.
- polyaldimine PA1 As described for polyaldimine PA1, 60.2 g of formaldehyde (37% in water, methanol-free), 53.5 g of isobutyraldehyde, 100.0 g of sebacic acid and 1.0 g of 4-toluenesulfonic acid were reacted with deposition of about 52 mL of water.
- the reaction mixture obtained was cooled, treated with 19.0 g of n-butanol, stirred for 30 minutes and reheated, whereupon water again began to precipitate. After one hour, the bath temperature was increased to 170 ° C and the apparatus evacuated in a water jet vacuum until nothing left. A total of about 57 mL (52 mL + 5 mL) distillate collected in the separator.
- reaction mixture was cooled and treated with 72.0 g of Jeffamine ® D-230. After removal of the volatile constituents, a reaction product which was liquid at room temperature and had an aldimine content, determined as the amine content, of 2.49 mmol NH 2 / g and a viscosity at 20 ° C. of 6,700 mPa ⁇ s was obtained.
- polyaldimine PA1 As described for polyaldimine PA1, 40.5 g of formaldehyde (37% in water, methanol-free), 36.0 g of isobutyraldehyde, 100.0 g of lauric acid and 1.0 g of 4-toluenesulfonic acid were reacted with deposition of 35 mL of water and the resulting reaction mixture was admixed with 26.0 g of MXDA. After removal of the volatile constituents, a reaction product which was liquid at room temperature and had an aldimine content, determined as the amine content, of 2.33 mmol NH 2 / g was obtained.
- polyaldimine PA1 As described for polyaldimine PA1, 22.3 g of paraformaldehyde, 53.5 g of isobutyraldehyde, 49.5 g of lauric acid, 50.0 g of sebacic acid and 1.0 g of 4-toluenesulfonic acid were reacted with deposition of just 14 mL of water, and 33.0 g of MPMD were added to the resulting reaction mixture. After removal of the volatile constituents, a reaction product which was liquid at room temperature and had an aldimine content, determined as the amine content, of 3.05 mmol NH 2 / g and a viscosity at 20 ° C. of 13,000 mPa ⁇ s was obtained.
- the resulting reaction product which was liquid at room temperature, had an aldimine content, determined as the amine content, of 2.19 mmol NH 2 / g and a viscosity at 20 ° C. of 700 mPa ⁇ s.
- the polyurethane prepolymers and polyaldimines indicated in Table 1 were homogeneously mixed in the NH 2 / NCO ratio (ie equivalent aldimine groups per equivalent isocyanate groups of the polyurethane prepolymer) of 0.5 / 1.0.
- the mixture was treated with benzoic acid (200 mg / 100 g polyurethane prepolymer), mixed again homogeneously and immediately filled into airtight tubes and stored for 15 hours at 60 ° C. Then a part of the mixture was poured into a PTFE-coated sheet (film thickness about 2 mm), cured for 7 days at 23 ° C and 50% relative humidity and then measured the mechanical properties of the through-hardened film.
- Table 3 ⁇ / b> example 11 12 13 comparison polyurethane PP3 PP3 PP3 polyaldimine PA7 PA5 PA9 Viscosity before storage (Pa ⁇ s) 31 38 40 Viscosity after storage (Pa ⁇ s) 37 44 44 Skin formation time (min.) 100 85 80 blistering none none none none none none none none none none none none None None none none none None None None none none none None None None none none none None Tensile strength (MPa) 6.2 7.6 7.5 Elongation at break (%) 860 900 700 Modulus 0.5-5% (MPa) 1.7 5.0 2.4 Odor when applied none none strongly Smell after 7 days none none strongly
- Example 14 (according to the invention) and Example 15 (comparison)
- the polyurethane prepolymers and polyaldimines used and the results of the tests are listed in Table 4.
- Example 14 is stable on storage, has a good reactivity (skinning time) and hardens without bubbles. It does not give off any unpleasant odor either during application or later. That after US 4,469,831 Formulated Comparative Example 15 is equivalent in terms of storage stability, reactivity and bubbling; however, there is a noticeable, disturbing odor during and after curing.
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicinal Chemistry (AREA)
- Polymers & Plastics (AREA)
- Engineering & Computer Science (AREA)
- Manufacturing & Machinery (AREA)
- Polyurethanes Or Polyureas (AREA)
- Sealing Material Composition (AREA)
- Paints Or Removers (AREA)
- Compositions Of Macromolecular Compounds (AREA)
- Adhesives Or Adhesive Processes (AREA)
- Packaging Of Annular Or Rod-Shaped Articles, Wearing Apparel, Cassettes, Or The Like (AREA)
Description
- Die Erfindung betrifft Polyurethanzusammensetzungen, umfassend mindestens ein Polyurethanprepolymer und mindestens ein Polyaldimin, die ohne störenden Geruch aushärten. Das hierfür eingesetzte Polyaldimin ist erhältlich aus einem Polyamin mit aliphatischen primären Aminogruppen (im weiteren Text vielfach auch als "aliphatisches Polyamin" bezeichnet) und einem speziellen Aldehyd.
- Polyurethane werden eingesetzt unter anderem als einkomponentige, feuchtigkeitshärtende, elastische Dichtstoffe, Klebstoffe und Beschichtungen. Üblicherweise enthalten sie ein isocyanatgruppenhaltiges Polyurethanprepolymer, hergestellt aus Polyolen und Polyisocyanaten, das anschliessend mit weiteren Komponenten vermengt und bis zum Gebrauch unter Ausschluss von Feuchtigkeit aufbewahrt wird. Diese an sich bekannten Systeme weisen den Nachteil auf, dass das bei der Reaktion der Isocyanatgruppen mit Wasser entstehende CO2-Gas zu Blasen im ausgehärteten Produkt führen kann.
- Polyaldimine sind in der Polyurethanchemie als Härter bekannte Verbindungen, beschrieben beispielsweise bei
US 3,420,800 undUS 3,567,692 . Als Polyaldimine werden Moleküle bezeichnet, welche zwei oder mehr Aldimingruppen R-CH=N-R' aufweisen. Aus isocyanatgruppenhaltigen Polyurethanprepolymeren und Polyaldiminen lassen sich einkomponentige Produkte mit guten mechanischen Gebrauchseigenschaften formulieren, die ausreichend lagerstabil sind und bei Kontakt mit Wasser oder Feuchtigkeit aus der Luft rasch aushärten. Dabei hydrolysieren die Polyaldimine mit Wasser zu den entsprechenden Aldehyden und Polyaminen, worauf letztere mit den Isocyanatgruppen des Polyurethanprepolymers reagieren und dieses ohne die Freisetzung von CO2 und somit ohne die Bildung von Blasen aushärten. - Polyaldimine aliphatischer Polyamine und ihre Anwendung als Härter für Polyurethane sind bestens bekannt. Sie werden beispielsweise beschrieben in
US 3,932,357 . - Üblicherweise werden Polyaldimine von relativ flüchtigen Aldehyden verwendet, die bekanntlich einen besonders intensiven Geruch aufweisen. Bei ihrer Anwendungen ist deshalb eine gute Lüftung oder ein Atemschutz erforderlich, insbesondere wenn zusätzlich organische Lösemittel eingesetzt werden. Für Anwendungen, in welchen mit vorwiegend lösemittelfreien und hochviskosen Produkten in dicken Schichten gearbeitet wird, wie das beispielsweise bei elastischen Abdichtungen und Verklebungen der Fall ist, ist der Geruch des bei der Hydrolyse der Polyaldimine freigesetzten Aldehyds speziell störend, da er über einen längeren Zeitraum bestehen bleibt. Dies ergibt sich daraus, dass einerseits die vollständige Aushärtung einer in dicker Schicht applizierten feuchtigkeitshärtenden Polyurethanzusammensetzung relativ lange dauert, weil die Diffusion des zur Härtung nötigen Wassers durch das bereits ausgehärtete Material hindurch nach innen zunehmend langsamer wird; und dass andererseits der bei der Härtungsreaktion freigesetzte Aldehyd immer langsamer durch die dicker werdenden Schichten des ausgehärteten Materials nach aussen diffundiert. Die durch das Entweichen des Aldehyds nach der Härtung des Produkts verursachte Geruchsbelastung wird für gewisse Anwendungen, wie beispielsweise im Aussenbereich von Gebäuden, zum Teil toleriert. Weil aber der intensive Aldehyd-Geruch zu Kopfschmerzen und Übelkeit führen kann, besteht auch in diesen Anwendungsbereichen zunehmend der Wunsch nach geruchsfreien Systemen. Dem Fachmann ist klar, dass der Begriff "geruchsfrei" schwierig zu definieren ist. Er soll hier und im gesamten Dokument als "von menschlichen Individuen mit dem Geruchssinn nicht oder nur geringfügig wahrnehmbar (riechbar)" zu verstehen sein.
- In anderen, sogenannten geruchssensiblen Anwendungen hingegen werden solche Geruchsbelastungen grundsätzlich nicht toleriert. Besonders geruchssensibel sind Anwendungen in geschlossenen Räumen, wie beispielsweise das Abdichten von Fugen im Innern von Gebäuden oder das Verkleben von Bauteilen im Innenraum von Fahrzeugen. Die Geruchsfreiheit ist hier eine unerlässliche Bedingung, und zwar auch während und kurz nach der Applikation eines Produkts. Bei Anwendungen im Innenraum von Fahrzeugen werden bezüglich flüchtigen Substanzen, die aus beispielsweise einem Klebstoff entweichen, generell strenge Massstäbe angelegt. So sind in der Automobilindustrie entsprechende Grenzwerte für die aus einem Klebstoff entweichenden flüchtigen Anteile, das sogenannte "Fogging", festgelegt (Messmethode: siehe z.B. DIN 75201).
- Es gab bisher verschiedene Versuche, den Geruch von Aldiminhaltigen Systemen zu reduzieren.
-
US 4,469,831 beschreibt eine feuchtigkeitshärtende, 2,2-Dimethyl-3-(isobutyroxy)-propanaldimine aliphatischer Polyamine enthaltende einkomponentige Polyurethanzusammensetzung. Diese Zusammensetzung weist eine gute Lagerstabilität, eine hohe Aushärtungsgeschwindigkeit und angeblich wenig Geruch auf. Der Einsatz der beschriebenen Polyaldimine verursacht jedoch einen lange anhaltenden, stechenden Geruch, welcher für geruchssensible Anwendungen nicht tolerierbar ist. -
US 4,853,454 beschreibt unter anderem eine ähnliche feuchtigkeitshärtende, substituierte 2,2-Dimethylpropanaldimine aliphatischer Polyamine enthaltende einkomponentige Polyurethanzusammensetzung. Die bei der Hydrolyse der beschriebenen Polyaldimine freigesetzten Aldehyde sollen aufgrund ihres hohen Dampfdruckes zu angeblich sehr geruchsarmen Zusammensetzungen führen. Beim Einsatz der beschriebenen Polyaldimine treten aber auch hier unangenehme, über lange Zeit wahrnehmbare Gerüche auf, was diese Substanzen für geruchssensible Anwendungen ungeeignet macht. -
US 4,720,535 beschreibt feuchtigkeitshärtende, substituierte 2,2-Dimethylpropanaldimine aromatischer Polyamine enthaltende einkomponentige Polyurethanzusammensetzungen. Der Einsatz der beschriebenen Polyaldimine ist aufgrund der verwendeten aromatischen Polyamine ungeeignet. Einerseits sind aromatische Polyamine im allgemeinen deutlich toxischer als aliphatische, und andererseits sind Polyaldimine aromatischer Polyamine als Härter deutlich weniger reaktiv als solche von aliphatischen Polyaminen, sowohl in Bezug auf die Hydrolyse der Aldimingruppen als meist auch in Bezug auf die Reaktion der Aminogruppen mit den Isocyanatgruppen des Polyurethanprepolymers. Zudem verursachen die meisten der beschriebenen Aldehyde ebenfalls einen deutlich wahrnehmbaren bis starken Geruch. -
US 6,136,942 beschreibt eine einkomponentige, 3-Phenyloxybenzaldimine aliphatischer Polyamine oder ähnliche Verbindungen enthaltende Polyurethanzusammensetzung, die geruchsarm aushärten soll. Der Geruch der beim Einsatz dieser Polyaldimine freigesetzten aromatischen Aldehyde ist jedoch deutlich wahrnehmbar und für geruchssensible Anwendungen ebenfalls nicht tolerierbar. Zudem kann sich die Anwesenheit von 3-Phenyloxybenzaldehyd und ähnlicher aromatischer Aldehyde störend auf die Lichtstabilität der ausgehärteten Polyurethanzusammensetzung auswirken. - Mit dem Stand der Technik ist es bisher nicht möglich, die Vorteile von feuchtigkeitshärtenden, Polyaldimine aliphatischer Polyamine enthaltenden einkomponentigen Polyurethanzusammensetzungen, wie keine Blasenbildung bei der Aushärtung, hohe Aushärtungsgeschwindigkeit und gute mechanische Eigenschaften nach der Aushärtung, für geruchssensible Anwendungen zu nutzen.
- Aufgabe der vorliegenden Erfindung war es, feuchtigkeitshärtende einkomponentige Polyurethanzusammensetzungen bereitzustellen, die als Härter mindestens ein Polyaldimin aliphatischer Polyamine enthalten, ohne störenden Geruch aushärten und sich damit unter anderem für geruchssensible Anwendungen eignen, wie beispielsweise das Abdichten von Fugen im Innern von Gebäuden oder das Verkleben von Bauteilen im Innenraum von Fahrzeugen. Eine geeignete Zusammensetzung muss einerseits aus kommerziell zugänglichen Rohstoffen einfach herstellbar sein, eine ausreichende Lagerstabilität aufweisen und nach der Applikation schnell genug aushärten. Der bei der Hydrolyse des Polyaldimins freigesetzte Aldehyd darf keinen störenden Geruch verursachen und keine nachteiligen Auswirkungen auf die ausgehärtete Polyurethanzusammensetzung haben.
- Überraschenderweise wurde gefunden, dass die vorher genannten Bedingungen bestens erfüllt werden mit einer Zusammensetzung umfassend mindestens ein Polyurethanprepolymer mit Isocyanatendgruppen und mindestens ein Polyaldimin, welches aus mindestens einem Polyamin mit aliphatischen primären Aminogruppen und mindestens einem Aldehyd gemäss der später spezifizierten Formel erhältlich ist.
- Die Herstellung der für die Polyaldimine verwendeten Aldehyde geht aus von leicht zugänglichen, kostengünstigen Rohstoffen und gelingt überraschend einfach durch die Veresterung von schwerflüchtigen Carbonsäuren, beispielsweise langkettigen Fettsäuren, mit β-Hydroxyaldehyden, insbesondere 3-Hydroxypivalaldehyd. Die so erhaltenen Aldehyde sind bei Raumtemperatur je nach der verwendeten Carbonsäure fest oder flüssig. Sie können anschliessend mit Polyaminen direkt zu den entsprechenden Polyaldiminen umgesetzt werden. Die erforderlichen Reaktionsschritte lassen sich alle ohne die Verwendung von Lösemitteln durchführen, wodurch keine Lösemittel-Rückstände in die Zusammensetzung gelangen, wo sie einen störenden Geruch und Fogging verursachen könnten. Da die bei der Herstellung der Aldehyde eingesetzten Carbonsäuren selber geruchsarm sind, verursachen Spuren davon ebenfalls keinen störenden Geruch, was eine aufwändige Reinigung der Polyaldimine vor der Verwendung überflüssig macht.
- Überraschend und für den Fachmann nicht naheliegend ist die Tatsache, dass solche Polyaldimine eine genügend hohe Reaktivität als Härter für Polyurethane aufweisen. Der Fachmann würde erwarten, dass sie aufgrund ihrer hydrophoben Struktur für das für die Hydrolyse der Aldimingruppen erforderliche Wasser schlecht zugänglich sind, und dass deren Hydrolyse deshalb nur langsam und unvollständig abläuft. Wider Erwarten reagieren die beschriebenen Polyaldimine bei Kontakt mit Feuchtigkeit in der Polyurethanzusammensetzung jedoch schnell und vollständig. Ihre Reaktivität ist vergleichbar mit jener von wesentlich weniger hydrophoben Polyaldiminen, wie sie beispielsweise in
US 4,469,831 beschrieben sind. - Die erfindungsgemässen Polyurethanzusammensetzungen weisen eine hervorragende Lagerstabilität auf. Sie härten bei Kontakt mit Feuchtigkeit sehr schnell aus, ohne dass ein störender Geruch entsteht. Der freigesetzte Aldehyd verbleibt in der ausgehärteten Polyurethanzusammensetzung, wo er keine nachteiligen Auswirkungen auf deren Eigenschaften hat. Seine Hydrophobie führt im Gegenteil zu einem durchaus erwünschten Anstieg der Hydrolysestabilität der ausgehärteten Polyurethanzusammensetzung.
- Die vorliegende Erfindung betrifft Zusammensetzungen umfassend mindestens ein Polyurethanprepolymer A mit Isocyanatendgruppen, welches aus mindestens einem Polyisocyanat und mindestens einem Polyol hergestellt wird, und mindestens ein Polyaldimin B, welches erhältlich ist aus mindestens einem Polyamin C mit aliphatischen primären Aminogruppen und mindestens einem Aldehyd D.
- Weiterhin offenbart ist die Herstellung dieser Zusammensetzungen, sowie die Herstellung des Polyaldimins.
- Zusätzlich wird die Verwendung dieser Zusammensetzungen als Klebstoff, Dichtstoff, Beschichtung oder Belag beschrieben. Des weiteren zur Verfügung gestellt werden Verfahren zum Verkleben, Abdichten oder Beschichten. Schliesslich werden Artikel beschrieben, deren Oberfläche zumindest partiell mit einer solchen Zusammensetzung kontaktiert worden ist.
- Die vorliegende Erfindung betrifft Zusammensetzungen umfassend mindestens ein Polyurethanprepolymer A mit Isocyanatendgruppen, welches aus mindestens einem Polyisocyanat und mindestens einem Polyol hergestellt wird, und mindestens ein Polyaldimin B, welches erhältlich ist aus mindestens einem Polyamin C mit aliphatischen primären Aminogruppen und mindestens einem Aldehyd D mit der Formel (I):
- Andererseits können Y1 und Y2 miteinander zu einem carbocyclischen oder heterocyclischen Ring verbunden sein, welcher eine Ringgrösse zwischen 5 und 8, bevorzugt 6, Atomen, und gegebenenfalls eine oder zwei einfach ungesättige Bindungen aufweist.
- Der Rest R1 steht entweder für eine lineare oder verzweigte Alkylkette mit 11 bis 30 C-Atomen, gegebenenfalls mit mindestens einem Heteroatom, insbesondere mit mindestens einem Ether-Sauerstoff, oder für eine einfach oder mehrfach ungesättigte lineare oder verzweigte Kohlenwasserstoffkette mit 11 bis 30 C-Atomen, oder für einen Rest der Formel (II) oder (III).
- In den Formeln (II) und/oder (III) stehen R2 für eine lineare oder verzweigte oder cyclische Alkylenkette mit 2 bis 16 C-Atomen, gegebenenfalls mit mindestens einem Heteroatom, insbesondere mit mindestens einem Ether-Sauerstoff, oder für eine einfach oder mehrfach ungesättigte lineare oder verzweigte oder cyclische Kohlenwasserstoffkette mit 2 bis 16 C-Atomen, und R3 für eine lineare oder verzweigte Alkylkette mit 1 bis 8 C-Atomen. Y1 und Y2 weisen die bereits genannte Bedeutung auf, und die gestrichelten Linien in den Formeln bezeichnen die Verbindungsstellen.
- Unter "Poly" in "Polyaldimin", "Polyol", "Polyisocyanat", "Polyamin" werden Moleküle verstanden, die formal zwei oder mehr der jeweiligen funktionellen Gruppen enthalten.
- Der Begriff "Polyamine mit aliphatischen primären Aminogruppen" bezeichnet im vorliegenden Dokument stets Verbindungen, die formal zwei oder mehr NH2-Gruppen enthalten, die an einen aliphatischen, cycloaliphatischen oder arylaliphatischen Rest gebunden sind. Sie unterscheiden sich damit von den aromatischen Aminen, in welchen die Aminogruppen direkt an einen aromatischen Rest gebunden sind, wie beispielsweise in Anilin oder 2-Aminopyridin.
- Das Polyurethanprepolymer A wird aus mindestens einem Polyisocyanat und mindestens einem Polyol hergestellt. Diese Umsetzung kann dadurch erfolgen, dass das Polyol und das Polyisocyanat mit üblichen Verfahren, beispielsweise bei Temperaturen von 50 bis 100°C, gegebenenfalls unter Mitverwendung geeigneter Katalysatoren, zur Reaktion gebracht werden, wobei das Polyisocyanat so dosiert ist, dass dessen Isocyanatgruppen im Verhältnis zu den Hydroxylgruppen des Polyols im stöchiometrischen Überschuss vorhanden sind. Der Überschuss an Polyisocyanat wird so gewählt, dass im resultierenden Polyurethanprepolymer A nach der Umsetzung aller Hydroxylgruppen des Polyols ein Gehalt an freien Isocyanatgruppen von 0.1 bis 15 Gewichts-%, bevorzugt 0.5 bis 5 Gewichts-%, bezogen auf das gesamte Polyurethanprepolymer A, verbleibt. Gegebenenfalls kann das Polyurethanprepolymer A unter Mitverwendung von Lösemitteln oder Weichmachern hergestellt werden, wobei die verwendeten Lösemittel oder Weichmacher keine gegenüber Isocyanaten reaktive Gruppen enthalten.
- Als Polyole für die Herstellung des Polyurethanprepolymers A können beispielsweise die folgenden handelsüblichen Polyole oder beliebige Mischungen davon eingesetzt werden:
- Polyoxyalkylenpolyole, auch Polyetherpolyole genannt, welche Polymerisationsprodukte von Ethylenoxid, 1,2-Propylenoxid, 1,2- oder 2,3-Butylenoxid, Tetrahydrofuran oder Mischungen davon sind, eventuell polymerisiert mit Hilfe eines Startermoleküls mit zwei oder mehreren aktiven Wasserstoffatomen wie beispielsweise Wasser, Ammoniak oder Verbindungen mit mehreren OH- oder NH-Gruppen wie beispielsweise 1,2-Ethandiol, 1,2-und 1,3-Propandiol, Neopentylglykol, Diethylenglykol, Triethylenglykol, die isomeren Dipropylenglykole und Tripropylenglykole, die isomeren Butandiole, Pentandiole, Hexandiole, Heptandiole, Octandiole, Nonandiole, Decandiole, Undecandiole, 1,3- und 1,4-Cyclohexandimethanol, Bisphenol A, hydriertes Bisphenol A, 1,1,1-Trimethylolethan, 1,1,1-Trimethylolpropan, Glycerin, Anilin sowie Mischungen der vorgenannten Verbindungen. Eingesetzt werden können sowohl Polyoxyalkylenpolyole, die einen niedrigen Ungesättigtheitsgrad aufweisen (gemessen nach ASTM D-2849-69 und angegeben in Milliequivalent Ungesättigtheit pro Gramm Polyol (mEq/g)), hergestellt beispielsweise mit Hilfe von sogenannten Double Metal Cyanide Complex Katalysatoren (DMC-Katalysatoren), als auch Polyoxyalkylenpolyole mit einem höheren Ungesättigtheitsgrad, hergestellt beispielsweise mit Hilfe von anionischen Katalysatoren wie NaOH, KOH oder Alkalialkoholaten.
Besonders geeignet sind Polyoxyalkylendiole oder Polyoxyalkylentriole, insbesondere Polyoxypropylendiole oder Polyoxypropylentriole.
Speziell geeignet sind Polyoxyalkylendiole oder Polyoxyalkylentriole mit einem Ungesättigtheitsgrad tiefer als 0.02 mEq/g und mit einem Molekulargewicht im Bereich von 1'000 bis 30'000 g/mol, sowie Polyoxypropylendiole und -triole mit einem Molekulargewicht von 400 bis 8'000 g/mol. Unter "Molekulargewicht" oder "Molgewicht" versteht man im vorliegenden Dokument stets das Molekulargewichtsmittel Mn.
Ebenfalls besonders geeignet sind sogenannte "EO-endcapped" (ethylene oxide-endcapped) Polyoxypropylendiole oder -triole. Letztere sind spezielle Polyoxypropylenpolyoxyethylenpolyole, die beispielsweise dadurch erhalten werden, dass reine Polyoxypropylenpolyole nach Abschluss der Polypropoxylierung mit Ethylenoxid alkoxyliert werden und dadurch primäre Hydroxylgruppen aufweisen. - Hydroxyfunktionelle Polybutadiene.
- Polyesterpolyole, hergestellt beispielsweise aus zwei- bis dreiwertigen Alkoholen wie beispielsweise 1,2-Ethandiol, Diethylenglykol, 1,2-Propandiol, Dipropylenglykol, 1,4-Butandiol, 1,5-Pentandiol, 1,6-Hexandiol, Neopentylglykol, Glycerin, 1,1,1-Trimethylolpropan oder Mischungen der vorgenannten Alkohole mit organischen Dicarbonsäuren oder deren Anhydride oder Ester wie beispielsweise Bernsteinsäure, Glutarsäure, Adipinsäure, Korksäure, Sebacinsäure, Dodecandicarbonsäure, Maleinsäure, Fumarsäure, Phthalsäure, Isophthalsäure, Terephthalsäure und Hexahydrophthalsäure oder Mischungen der vorgenannten Säuren, sowie Polyesterpolyole aus Lactonen wie beispielsweise ε-Caprotacton.
- Polycarbonatpolyole, wie sie durch Umsetzung beispielsweise der oben genannten - zum Aufbau der Polyesterpolyole eingesetzten - Alkohole mit Dialkylcarbonaten, Diarylcarbonaten oder Phosgen zugänglich sind,
- Polyacrylat- und Polymethacrylatpolyole.
- Diese genannten Polyole weisen ein mittleres Molekulargewicht von 250 bis 30'000 g/mol und eine mittlere OH-Funktionalität im Bereich von 1.6 bis 3 auf.
- Zusätzlich zu diesen genannten Polyolen können niedrigmolekulare zwei- oder mehrwertige Alkohole wie beispielsweise 1,2-Ethandiol, 1,2- und 1,3-Propandiol, Neopentylglykol, Diethylenglykol, Triethylenglykol, die isomeren Dipropylenglykole und Tripropylenglykole, die isomeren Butandiole, Pentandiole, Hexandiole, Heptandiole, Octandiole, Nonandiole, Decandiole, Undecandiole, 1,3- und 1,4-Cyclohexandimethanol, hydriertes Bisphenol A, dimere Fettalkohole, 1,1,1-Trimethylolethan, 1,1,1-Trimethylolpropan, Glycerin, Pentaerythrit, Zuckeralkohole und andere höherwertige Alkohole, niedrigmolekulare Alkoxylierungsprodukte der vorgenannten zwei- und mehrwertigen Alkohole sowie Mischungen der vorgenannten Alkohole bei der Herstellung des Polyurethanprepolymers A mitverwendet werden.
- Für die Herstellung des Polyurethanprepolymers A werden handelsübliche Polyisocyanate verwendet. Als Beispiele seien die folgenden, in der Polyurethanchemie bestens bekannten Polyisocyanate erwähnt:
- 2,4- und 2,6-Toluylendiisocyanat (TDI) und beliebige Gemische dieser Isomeren, 4,4'-Diphenylmethandiisocyanat (MDI), die stellungsisomeren Diphenylmethandiisocyanate, 1,3- und 1,4-Phenylendiisocyanat, 2,3,5,6-Tetramethyl-1,4-diisocyanatobenzol, 1,6-Hexamethylendiisocyanat (HDI), 2-Methylpentamethylen-1,5-diisocyanat, 2,2,4- und 2,4,4-Trimethyl-1,6-hexamethylendüsocyanat (TMDI), 1,12-Dodecamethylendiisocyanat, Cyclohexan-1,3- und -1,4-diisocyanat und beliebige Gemische dieser Isomeren, 1-Isocyanato-3,3,5-trimethyl-5-isocyanatomethyl-cyclohexan (=Isophorondiisocyanat oder IPDI), Perhydro-2,4'- und -4,4'-diphenylmethandiisocyanat (HMDI), 1,4-Diisocyanato-2,2,6-trimethylcyclohexan (TMCDI), m- und p-Xylylendiisocyanat (XDI), 1,3- und 1,4-Tetramethylxylylendiisocyanat (TMXDI), 1,3-und 1,4-Bis-(isocyanatomethyl)-cyclohexan, sowie Oligomere und Polymere der vorgenannten Isocyanate, sowie beliebige Mischungen der vorgenannten Isocyanate. Besonders bevorzugt sind MDI, TDI, HDI und IPDI.
- Das Polyaldimin B ist herstellbar aus mindestens einem Polyamin C mit aliphatischen primären Aminogruppen und mindestens einem Aldehyd D durch eine Kondensationsreaktion unter Abspaltung von Wasser. Solche Kondensationsreaktionen sind bestens bekannt und beschrieben, beispielsweise in Houben-Weyl, "Methoden der organischen Chemie", Vol. XI/2, Seite 73 ff. Der Aldehyd D wird hierbei in Bezug auf die primären Aminogruppen des Polyamins C stöchiometrisch oder in stöchiometrischem Überschuss eingesetzt.
- Als Polyamine C mit aliphatischen primären Aminogruppen zur Herstellung des Polyaldimins B kommen die in der Polyurethanchemie bekannten Polyamine in Frage, wie sie unter anderem für zweikomponentige Polyurethane verwendet werden. Als Beispiele seien die folgenden erwähnt: Aliphatische Polyamine wie Ethylendiamin, 1,2- und 1,3-Propandiamin, 2-Methyl-1,2-propandiamin, 2,2-Dimethyl-1,3-propandiamin, 1,3- und 1,4-Butandiamin, 1,3- und 1,5-Pentandiamin, 1,6-Hexandiamin, 2,2,4- und 2,4,4-Trimethylhexamethylendiamin und Mischungen davon, 1,7-Heptandiamin, 1,8-Octandiamin, 4-Aminomethyl-1,8-octandiamin, 1,9-Nonandiamin, 1,10-Decandiamin, 1,11-Undecandiamin, 1,12-Dodecandiamin, Methyl-bis-(3-aminopropyl)amin, 1,5-Diamino-2-methylpentan (MPMD), 1,3-Diaminopentan (DAMP), 2,5-Dimethyl-1,6-hexamethylendiamin, cycloaliphatische Polyamine wie 1,2- ,1,3- und 1,4-Diaminocyclohexan, Bis-(4-aminocyclohexyl)-methan, Bis-(4-amino-3-methylcyclohexyl)-methan, Bis-(4-amino-3-ethylcyclohexyl)-methan, Bis-(4-amino-3,5-dimethylcyclohexyl)-methan, 1-Amino-3-aminomethyl-3,5,5-trimethylcyclohexan (= Isophorondiamin oder IPDA), 2- und 4-Methyl-1,3-diaminocyclohexan und Mischungen davon, 1,3- und 1,4-Bis-(aminomethyl)cyclohexan, 1-Cyclohexylamino-3-aminopropan, 2,5(2,6)-Bis-(aminomethyl)-bicyclo[2.2.1]heptan (NBDA, hergestellt von Mitsui Chemicals), 3(4),8(9)-Bis-(aminomethyl)-tricyclo[5.2.102,6]decan, 1,4-Diamino-2,2,6-trimethylcyclohexan (TMCDA), 3,9-Bis-(3-aminopropyl)-2,4,8,10-tetraoxaspiro-[5.5]undecan, 1,3- und 1,4-Xylylendiamin, Ethergruppen-haltige aliphatische Polyamine wie Bis-(2-aminoethyl)ether, 4,7-Dioxadecan-1,10-diamin, 4,9-Dioxadodecan-1,12-diamin und höhere Oligomere davon, Polyoxyalkylen-Polyamine mit theoretisch zwei oder drei Aminogruppen, erhältlich beispielsweise unter dem Namen Jeffamine® (hergestellt von Huntsman Chemicals), sowie Mischungen der vorgenannten Polyamine.
- Bevorzugte Polyamine sind 1,6-Hexamethylendiamin, MPMD, DAMP, 2,2,4- und 2,4,4-Trimethylhexamethylendiamin, 4-Aminomethyl-1,8-octandiamin, IPDA, 1,3- und 1,4-Xylylendiamin, 1,3- und 1,4-Bis-(aminomethyl)-cyclohexan, Bis-(4-aminocyclohexyl)-methan, Bis-(4-amino-3-methyfcyclohexyl)-methan, 3(4),8(9)-Bis-(aminomethyl)-tricyclo[5.2.1.02,6]decan, 1,2-, 1,3-und 1,4-Diaminocyclohexan, Polyoxyalkylen-Polyamine mit theoretisch zwei oder drei Aminogruppen, insbesondere Jeffamine® EDR-148, Jeffamine® D-230, Jeffamine® D-400 und Jeffamine® T-403, sowie insbesondere Mischungen von zwei oder mehr der vorgenannten Polyamine.
-
- In einer bevorzugten Herstellmethode des Aldehyds D wird ausgegangen von einem β-Hydroxyaldehyd gemäss Formel (IV), welcher beispielsweise aus Formaldehyd (oder Paraformaldehyd oder oligomeren Formen von Formaldehyd, wie 1,3,5-Trioxan) und einem Aldehyd gemäss Formel (V) in einer gekreuzten Aldol-Addition, gegebenenfalls in situ, hergestellt werden kann.
- Y1 und Y2 in den Formeln (IV) und (V) haben die bereits beschriebene Bedeutung.
- Der β-Hydroxyaldehyd gemäss Formel (IV) wird mit einer Carbonsäure zum entsprechenden Ester umgesetzt, nämlich entweder mit einer langkettigen Fettsäure R1-COOH zum entsprechenden Fettsäureester; und / oder mit einem Dicarbonsäuremonoalkylester HOOC-R2-COOR3 zum Aldehyd D mit dem Rest nach Formel (III); und / oder mit einer Dicarbonsäure HOOC-R2-COOH zum Aldehyd D, in diesem Falle ein Dialdehyd, mit dem Rest nach Formel (II). Die Formeln (II) und (III) und R1, R2 und R3 haben dabei die bereits beschriebene Bedeutung. Diese Veresterung kann ohne die Verwendung von Lösemitteln nach bekannten Methoden erfolgen, beschrieben beispielsweise in Houben-Weyl, "Methoden der organischen Chemie", Vol. VIII, Seiten 516 - 528.
- Im Fall der Verwendung von Dicarbonsäuren wird ein Gemisch aus den Aldehyden D mit den Resten nach Formel (11) und nach Formel (III) erhalten, wenn beispielsweise zuerst ein Teil der Carbonsäuregruppen mit dem β-Hydroxyaldehyd nach Formel (IV) verestert wird, und anschliessend die restlichen Carbonsäuregruppen mit einem Alkylalkohol (R3-OH) verestert werden. Ein solches Gemisch kann zur Herstellung des Polyaldimins B direkt weiterverwendet werden.
- Bevorzugte Aldehyde nach Formel (V) zur Umsetzung mit Formaldehyd zu β-Hydroxyaldehyden nach Formel (IV) sind die folgenden: Isobutyraldehyd, 2-Methylbutyraldehyd, 2-Ethylbutyraldehyd, 2-Methylvaleraldehyd, 2-Ethylcapronaldehyd, Cyclopentancarboxaldehyd, Cyclohexancarboxaldehyd, 1,2,3,6-Tetrahydrobenzaldehyd, 2-Methyl-3-phenylpropionaldehyd, 2-Phenylpropionaldehyd und Diphenylacetaldehyd. Besonders bevorzugt ist Isobutyraldehyd.
- Bevorzugte β-Hydroxyaldehyde nach Formel (IV) sind die Produkte aus der Umsetzung von Formaldehyd mit den vorgängig als bevorzugt genannten Aldehyden nach Formel (V). Besonders bevorzugt ist 3-Hydroxypivalaldehyd.
- Als geeignete Carbonsäuren zur Veresterung mit den β-Hydroxyaldehyden nach Formel (IV) seien beispielsweise die folgenden erwähnt: Laurinsäure, Tridecansäure, Myristinsäure, Pentadecansäure, Palmitinsäure, Margarinsäure, Stearinsäure, Nonadecansäure, Arachinsäure, Palmitoleinsäure, Ölsäure, Erucasäure, Linolsäure, Linolensäure, Elaeostearinsäure, Arachidonsäure, Bernsteinsäure, Glutarsäure, Adipinsäure, Pimelinsäure, Korksäure, Azelainsäure, Sebacinsäure, 1,12-Dodecandisäure, Maleinsäure, Fumarsäure, Hexahydrophthalsäure, Hexahydroisophthalsäure, Hexahydroterephthalsäure, 3,6,9-Trioxaundecandisäure und ähnliche Derivate von Polyethylenglykol, dehydrierte Ricinolsäuren, sowie Fettsäuren aus der technischen Verseifung von natürlichen Ölen und Fetten wie beispielsweise Rapsöl, Sonnenblumenöl, Leinöl, Ölbaumöl, Kokosnussöl, Ölpalmkernöl und Ölpalmöl.
- Bevorzugt sind Laurinsäure, Myristinsäure, Palmitinsäure, Stearinsäure, Ölsäure, Linolsäure, Linolensäure, Bernsteinsäure, Adipinsäure, Azelainsäure und Sebacinsäure und technische Gemische von Fettsäuren, welche diese Säuren enthalten.
- Durch die Umsetzung mindestens eines Polyamins C mit aliphatischen primären Aminogruppen mit mindestens einem Aldehyd D entstehen beispielsweise Polyaldimine der schematischen Formeln (VI) und (VII),
- Wird ein Dialdehyd D mit dem Rest nach Formel (II) für die Herstellung eines Polyaldimins B verwendet, so wird dieser vorteilhaft entweder in einer Mischung mit einem Monoaldehyd D eingesetzt, und zwar in einem solchen Mengenverhältnis, dass für das Polyaldimin aus Formel (VII) für m im Mittel Werte im Bereich von 1 bis 10 erhalten werden; oder er wird so dosiert, dass ein Überschuss an Aldehydgruppen im Verhältnis zu den Aminogruppen bei der Herstellung des Polyaldimins B vorhanden ist, wobei der Aldehyd-Überschuss so gewählt wird, dass für das Polyaldimin aus Formel (VII) für m ebenfalls im Mittel Werte im Bereich von 1 bis 10 erhalten werden. Auf beide Arten wird ein Gemisch oligomerer Polyaldimine mit einer gut handhabbaren Viskosität erhalten.
- Als Polyaldimin B können auch Mischungen verschiedener Polyaldimine verwendet werden, insbesondere auch Mischungen verschiedener Polyaldimine hergestellt mit Hilfe von verschiedenen Polyaminen C mit primären aliphatischen Aminogruppen, umgesetzt mit verschiedenen oder gleichen Aldehyden D, insbesondere auch Mischungen von Polyaldiminen hergestellt mit Hilfe von Polyaminen mit unterschiedlicher Anzahl primärer aliphatischer Aminogruppen, d.h. verschiedener Werte für n.
- Das Polyurethanprepolymer A und das Polyaldimin B werden miteinander vermengt, wobei das Polyaldimin B in einer Menge von 0.1 bis 1.1 Equivalenten Aldimingruppen pro Equivalent Isocyanatgruppen des Polyurethanprepolymers A dosiert wird. Zusätzlich kann ein Katalysator für die Hydrolyse des Polyaldimins zugegeben werden, beispielsweise eine organische Carbonsäure wie Benzoesäure oder Salicylsäure, ein organisches Carbonsäureanhydrid wie Phthalsäureanhydrid oder Hexahydrophthalsäureanhydrid, ein Silylester organischer Carbonsäuren, eine organische Sulfonsäure wie p-Toluolsulfonsäure, oder eine andere organische oder anorganische Säure, oder Mischungen der vorgenannten Säuren.
- Als zusätzliche Komponenten in den beschriebenen Polyurethanzusammensetzungen können unter anderem folgende, in der Polyurethanindustrie wohlbekannte Hilfs- und Zusatzmittel vorhanden sein:
- Weichmacher, beispielsweise Ester organischer Carbonsäuren oder deren Anhydride, Phthalate, wie beispielsweise Dioctylphthalat oder Diisodecylphthalat, Adipate, wie zum Beispiel Dioctyladipat, Sebacate, organische Phosphor- und Sulfonsäureester, Polybutene und andere, mit Isocyanaten nicht reagierende Verbindungen; Lösemittel; anorganische und organische Füllstoffe, wie zum Beispiel gemahlene oder gefällte Calciumcarbonate, welche gegebenenfalls mit Stearaten beschichtet sind, Russe, Kaoline, Aluminiumoxide, Kieselsäuren und PVC-Pulver; Fasern, beispielsweise aus Polyethylen; Pigmente; Katalysatoren wie beispielsweise Organozinnverbindungen wie Dibutylzinndilaurat, Dibutylzinndiacetylacetonat, oder andere, in der Polyurethanchemie übliche Katalysatoren für die Reaktion der Isocyanatgruppen; Rheologie-Modifizierer wie beispielsweise Verdickungsmittel, zum Beispiel Harnstoffverbindungen, Polyamidwachse, Bentonite oder pyrogene Kieselsäuren; Haftvermittler, insbesondere Silane wie Epoxysilane, Vinylsilane, Isocyanatosilane und mit Aldehyden zu Aldiminosilanen umgesetzte Aminosilane; Trocknungsmittel wie beispielsweise p-Tosylisocyanat und andere reaktive Isocyanate, Orthoameisensäureester, Calciumoxid oder Molekularsiebe; Stabilisatoren gegen Wärme, Licht- und UV-Strahlung; flammhemmende Substanzen; oberflächenaktive Substanzen wie beispielsweise Netzmittel, Verlaufsmittel, Entlüftungsmittel oder Entschäumer; Fungizide oder das Pilzwachstum hemmende Substanzen; sowie weitere, in der Polyurethanindustrie üblicherweise eingesetzte Substanzen.
- Die beschriebenen Polyurethanzusammensetzungen werden hergestellt und aufbewahrt unter Ausschluss von Feuchtigkeit. Die Zusammensetzungen sind lagerstabil, d.h. sie können in einer geeigneten Verpackung oder Anordnung, wie beispielsweise in einem Fass, einem Beutel oder einer Kartusche, vor ihrer Anwendung während mehreren Monaten bis zu einem Jahr und länger aufbewahrt werden, ohne dass sie ihre Anwendbarkeit verlieren. Bei der Applikation kommen die Polyurethanzusammensetzungen in Kontakt mit Feuchtigkeit, worauf die Polyaldimine B zu Aldehyden D und Polyaminen C hydrolysieren und die Polyamine C mit dem isocyanatgruppenhaltigen Polyurethanprepolymer A reagieren und dieses somit aushärten. Entweder kann das für die Reaktion benötigte Wasser aus der Luft stammen (Luftfeuchtigkeit), oder die Polyurethanzusammensetzung kann mit einer Wasser enthaltenden Komponente in Kontakt gebracht werden, zum Beispiel durch Bestreichen, beispielsweise mit einem Abglättmittel, durch Besprühen oder mittels Eintauchverfahren, oder es kann der Polyrethanzusammensetzung eine Wasser enthaltende Komponente zugesetzt werden, zum Beispiel in Form einer wasserhaltigen Paste, die beispielsweise über einen Statikmischer eingemischt werden kann.
- Wird das Polyaldimin B im Unterschuss eingesetzt, d.h. das Verhältnis der Aldimingruppen zu den Isocyanatgruppen unterstöchiometrisch gewählt, so reagieren die überschüssigen Isocyanatgruppen mit vorhandenem Wasser.
- Die Reaktion des isocyanatgruppenhaltigen Polyurethanprepolymers A mit dem hydrolysierenden Polyaldimin B muss dabei nicht notwendigerweise über das Polyamin C erfolgen. Selbstverständlich sind auch Reaktionen mit Zwischenstufen der Hydrolyse des Polyaldimins B zum Polyamin C möglich. Beispielsweise ist es denkbar, dass das hydrolysierende Polyaldimin B in der Form eines Halbaminals direkt mit dem isocyanatgruppenhaltigen Polyurethanprepolymer A reagiert.
- Als Folge der oben beschriebenen Reaktionen härtet die Polyurethanzusammensetzung aus.
- Die beschriebene Polyurethanzusammensetzung zeichnet sich im ausgehärteten Zustand durch hervorragende mechanische Eigenschaften aus. Sie verfügt über hohe Dehnungen und hohe Zugfestigkeiten, bei Elastizitätsmodulen, welche sich durch Variation der eingesetzten Komponenten wie beispielsweise der Polyole, Polyisocyanate und Polyamine in einem weiten Bereich an die Bedürfnisse der jeweiligen Applikation angepasst einstellen lassen.
- Die Aldehyde D, welche von Polyaldimin B bei dessen Hydrolyse abgespalten werden, zeichnen sich dadurch aus, dass sie aufgrund ihres hohen Dampfdruckes in der ausgehärteten Polyurethanzusammensetzung verbleiben, und dass sie dabei keinerlei störenden Geruch verursachen. Im Fall der Verwendung von langkettigen Fettsäuren bewirkt der hydrophobe Fettsäurerest eine geringere Wasseraufnahme der ausgehärteten Polyurethanzusammensetzung, was die Beständigkeit des Polyurethanmaterials gegenüber Hydrolyse erhöht. Zudem bietet ein hydrophober Fettsäurerest bei längerdauerndem Wasserkontakt einen guten Schutz gegen das Auswaschen der Aldehyde D aus der ausgehärteten Polyurethanzusammensetzung. Die Anwesenheit dieser Aldehyde in der ausgehärteten Polyurethanzusammensetzung bewirkt keine Verschlechterung der Lichtstabilität des Polyurethanmaterials, wie dies bei der Anwesenheit schwerflüchtiger aromatischer Aldehyde beobachtet wird.
- Die beschriebene Polyurethanzusammensetzung ist geeignet als Dichtstoff aller Art, beispielsweise zum Abdichten von Fugen im Bau, als Klebstoff für das Verkleben von diversen Substraten, beispielsweise zum Verkleben von Bauteilen bei der Herstellung von Automobilen, Schienenfahrzeugen, Schiffen oder anderen industriellen Gütern, sowie als Beschichtung oder Belag für diverse Artikel beziehungsweise variable Untergründe.
- Besonders geeignet ist sie für geruchssensible Anwendungen, wie beispielsweise das Abdichten von Fugen im Innern von Gebäuden und das Verkleben von Bauteilen im Innenraum von Fahrzeugen. Als Beschichtungen bevorzugt sind Schutzanstriche, Versiegelungen, Schutzbeschichtungen und Primer-Beschichtungen. Unter den Belägen sind besonders Bodenbeläge als bevorzugt zu nennen. Solche Beläge werden hergestellt, indem typischerweise eine reaktive Zusammensetzung auf den Untergrund gegossen und egalisiert wird, wo sie zu einem Bodenbelag aushärtet. Beispielsweise werden solche Bodenbeläge für Büros, Wohnbereiche, Spitäler, Schulen, Lagerhallen, Parkgaragen und andere private oder industrielle Anwendungen verwendet. Diese Anwendungen sind grossflächig, was selbst bei Anwendungen im Aussenbereich zu arbeitshygienischen Schwierigkeiten und / oder Geruchsbelästigungen führen kann. Weiterhin wird ein Grossteil der Fussbodenbeläge im Innenbereich appliziert. Deshalb stellt der Geruch bei Bodenbelägen generell ein grosses Problem dar.
- Die Polyurethanzusammensetzung wird mit der Oberfläche eines beliebigen Untergrundes zumindest partiell kontaktiert. Bevorzugt ist eine gleichmässige Kontaktierung in Form eines Dicht- oder Klebstoffes, einer Beschichtung oder eines Belages, und zwar in den Bereichen, welche für den Einsatz eine Verbindung in Form einer Verklebung oder Dichtung benötigen oder aber deren Untergrund abgedeckt sein soll. Es kann durchaus nötig sein, dass der Untergrund bzw. der zu kontaktierende Artikel im Vorfeld des Kontaktierens einer physikalischen und / oder chemischen Vorbehandlung unterzogen werden muss, beispielsweise durch Schleifen, Sandstrahlen, Bürsten oder dergleichen, oder durch Behandeln mit Reinigern, Lösemitteln, Haftvermittlern, Haftvermittlerlösungen oder Primern, oder dem Aufbringen einer Haftbrücke oder eines Sealers.
- Alle Prozent-Angaben beziehen sich, wo nicht anders angegeben, auf Gewichts-Prozente.
-
- alpha, omega-Polyoxypropylendiamin (Jeffamine® D-230, Huntsman): Totaler Gehalt primärer Amine ≥ 97%; Amin-Gehalt = 8.22 mmol NH2/g.
- 1,3-Xylylendiamin (MXDA; Mitsubishi Gas Chemical): Gehalt MXDA ≥ 99%; Amin-Gehalt = 14.56 mmol NH2/g.
- 1,6-Hexamethylendiamin (HDA): Gehalt HDA ≥ 99.0%; Amin-Gehalt = 17.21 mmol NH2/g.
- 1,5-Diamino-2-methylpentan (MPMD; DuPont): Gehalt MPMD ≥ 98.5%; Amin-Gehalt = 17.11 mmol NH2/g.
- Acclaim® 4200 N (Bayer): Lineares Polypropylenoxid-Polyol mit theoretischer OH-Funktionalität 2, mittlerem Molekulargewicht ca. 4000, OH-Zahl ca. 28 mg KOH/g, Ungesättigtheitsgrad ca. 0.005 mEq/g.
- Acclaim® 12200 (Bayer): Lineares Polypropylenoxid-Polyol mit theoretischer OH-Funktionalität 2, mittlerem Molekulargewicht ca. 12000, OH-Zahl ca. 11 mg KOH/g, Ungesättigtheitsgrad ca. 0.005 mEq/g.
- Caradol® MD34-02 (Shell): Nichtlineares Polypropylenoxidpolyethylenoxid-Polyol, Ethylenoxid-terminiert, mit theoretischer OH-Funktionalität 3, mittlerem Molekulargewicht ca. 4900, OH-Zahl ca. 35 mg KOH/g, Ungesättigtheitsgrad ca. 0.08 mEq/g.
- Die Viskosität wurde bei 20 °C auf einem Kegel-Platten-Viskosimeter der Fa. Haake (PK100 / VT-500) gemessen.
- Die Hautbildungszeit (Zeit bis zur Klebefreiheit, "tack-free time") wurde bestimmt bei 23 °C und 50% relativer Luftfeuchtigkeit.
- Zugfestigkeit, Bruchdehnung und E-Modul bei 0.5-5% Dehnung wurden bestimmt an während 7 Tagen bei 23 °C und 50% relativer Luftfeuchtigkeit ausgehärteten Filmen nach DIN EN 53504 (Zuggeschwindigkeit: 200 mm/min).
- Die Blasenbildung wurde qualitativ beurteilt anhand der Menge der Blasen, die während der Aushärtung (bei 23 °C und 50% relativer Luftfeuchtigkeit) der für die mechanischen Prüfungen verwendeten Filme (Schichtdicke 2 mm) auftraten.
- Der Geruch wurde an den ausgegossenen Filmen beurteilt durch Riechen mit der Nase im Abstand von 10 cm, ein erstes Mal an der unmittelbar zuvor applizierten Zusammensetzung, und ein zweites Mal 7 Tage danach an der bei 23 °C und 50% relativer Luftfeuchtigkeit ausgehärteten Zusammensetzung.
- 259 g Polyol Acclaim® 4200 N, 517 g Polyol Caradol® MD34-02, 124 g 4,4`-Methylendiphenyldiisocyanat (MDI; Desmodur® 44 MC L, Bayer) und 100 g Diisodecylphthalat wurden nach bekanntem Verfahren bei 80 °C zu einem NCO-terminierten Polyurethanprepolymeren umgesetzt. Das Reaktionsprodukt hatte einen titrimetrisch bestimmten Gehalt an freien Isocyanat-Gruppen von 2.30%, bezogen auf das Polyurethanprepolymer, und eine Viskosität bei 20 °C von 56 Pa·s.
- 845 g Polyol Acclaim® 4200 N und 115 g 4,4'-Methylendiphenyldiisocyanat (MDI; Desmodur® 44 MC L, Bayer) wurden nach bekanntem Verfahren bei 80 °C zu einem NCO-terminierten Polyurethanprepolymeren umgesetzt. Das Reaktionsprodukt hatte einen titrimetrisch bestimmten Gehalt an freien Isocyanat-Gruppen von 1.96% und eine Viskosität bei 20 °C von 37 Pa·s.
- 937 g Polyol Acclaim® 4200 N, 57 g Tripropylenglykol und 285 g 4,4'-Methylendiphenyldiisocyanat (MDI; Desmodur® 44 MC L, Bayer) wurden nach bekanntem Verfahren bei 80 °C zu einem NCO-terminierten Polyurethanprepolymeren umgesetzt. Das Reaktionsprodukt hatte einen titrimetrisch bestimmten Gehalt an freien Isocyanat-Gruppen von 3.76% und eine Viskosität bei 20 °C von 58 Pa·s.
- 1515 g Polyol Acclaim® 12200 und 82 g Isophorondiisocyanat (IPDI; Vestanat® IPDI, Degussa) wurden nach bekanntem Verfahren bei 100 °C zu einem NCO-terminierten Polyurethanprepolymeren umgesetzt. Das Reaktionsprodukt hatte einen titrimetrisch bestimmten Gehalt an freien Isocyanat-Gruppen von 0.93% und eine Viskosität bei 20 °C von 45 Pa·s.
- In einen Rundkolben mit Rückflusskühler und Wasserabscheider (Dean Stark) wurden 40.5 g Formaldehyd (37% in Wasser, methanolfrei), 36.0 g Isobutyraldehyd, 100.0 g Laurinsäure und 1.0 g 4-Toluolsulfonsäure eingewogen und unter Stickstoffatmosphäre gestellt. Die Mischung wurde im Ölbad unter kräftigem Rühren erwärmt, worauf sich Wasser abzuscheiden begann. Nach vier Stunden wurde die Badtemperatur auf 170 °C erhöht und die Apparatur im Wasserstrahlvakuum evakuiert, bis sich nichts mehr abschied. Es sammelten sich insgesamt rund 35 mL Destillat im Abscheider. Das Reaktionsgemisch wurde abgekühlt, und aus einem Eintropftrichter wurden 48.6 g Jeffamine® D-230 zugegeben. Danach wurden die flüchtigen Bestandteile vollständig abdestilliert. Das so erhaltene, bei Raumtemperatur flüssige Reaktionsprodukt wies einen Aldimin-Gehalt, bestimmt als Amin-Gehalt, von 2.17 mmol NH2/g und eine Viskosität bei 20°C von 700 mPa·s auf.
- Wie für Polyaldimin PA1 beschrieben wurden 42.8 g Formaldehyd (37% in Wasser, methanolfrei), 38.0 g Isobutyraldehyd, 150.0 g Stearinsäure und 1.0 g 4-Toluolsulfonsäure unter Abscheidung von rund 37 mL Wasser umgesetzt und das dabei erhaltene Reaktionsgemisch mit 57.0 g Jeffamine® D-230 versetzt. Nach Entfernen der flüchtigen Bestandteile erhielt man ein bei Raumtemperatur cremefestes Reaktionsprodukt, das einen Aldimin-Gehalt, bestimmt als Amin-Gehalt, von 1.93 mmol NH2/g aufwies.
- In einen Rundkolben mit Rückflusskühler, Thermometer und Wasserabscheider (Dean Stark) wurden 11.0 g Paraformaldehyd, 40.0 g 2-Methylvaleraldehyd, 64.0 g Laurinsäure und 0.5 g 4-Toluolsulfonsäure eingewogen und unter Stickstoffatmosphäre gestellt. Die Mischung wurde im Ölbad unter kräftigem Rühren auf 100 °C erwärmt, bis die Rückflussgeschwindigkeit merklich abgenommen hatte. Darauf wurde die Rückflusskühlung ausgeschaltet, die Badtemperatur auf 130°C erhöht, worauf sich Wasser abzuscheiden begann. Nach 30 Minuten wurde die Badtemperatur auf 170 °C erhöht und die Apparatur im Wasserstrahlvakuum während 90 Minuten evakuiert. Es sammelten sich insgesamt rund 14 mL Destillat im Abscheider. Das Reaktionsgemisch wurde daraufhin im Hochvakuum rektifiziert. Zu 30.0 g des so erhaltenen Aldehyds (2-Methyl-2-propyl-3-oxo-propyl-laurat) wurden anschliessend aus einem Eintropftrichter 7.6 g HDA zugegeben. Nach Entfernen der flüchtigen Bestandteile bei 80 °C im Wasserstrahlvakuum erhielt man ein farbloses, bei Raumtemperatur flüssiges Reaktionsprodukt, das völlig geruchsfrei war und einen Aldimin-Gehalt, bestimmt als Amin-Gehalt, von 2.72 mmol NH2/g aufwies.
IR: 2955, 2922, 2852, 1737 (C=O), 1667 (C=N), 1466, 1419, 1376, 1343, 1233, 1162, 1112, 1070, 1021, 1008, 939, 885, 863, 740, 722. - Wie für Polyaldimin PA1 beschrieben wurden 60.2 g Formaldehyd (37% in Wasser, methanolfrei), 53.5 g Isobutyraldehyd, 100.0 g Sebacinsäure und 1.0 g 4-Toluolsulfonsäure unter Abscheidung von rund 52 mL Wasser umgesetzt. Das dabei erhaltene Reaktionsgemisch wurde abgekühlt, mit 19.0 g n-Butanol versetzt, 30 Minuten gerührt und wieder erwärmt, worauf sich erneut Wasser abzuscheiden begann. Nach einer Stunde wurde die Badtemperatur auf 170 °C erhöht und die Apparatur im Wasserstrahlvakuum evakuiert, bis sich nichts mehr abschied. Es sammelten sich insgesamt rund 57 mL (52 mL + 5 mL) Destillat im Abscheider. Das Reaktionsgemisch wurde abgekühlt und mit 72.0 g Jeffamine® D-230 versetzt. Nach Entfernen der flüchtigen Bestandteile erhielt man ein bei Raumtemperatur flüssiges Reaktionsprodukt, das einen Aldimin-Gehalt, bestimmt als Amin-Gehalt, von 2.49 mmol NH2/g und eine Viskosität bei 20 °C von 6'700 mPa·s aufwies.
- Wie für Polyaldimin PA1 beschrieben wurden 40.5 g Formaldehyd (37% in Wasser, methanolfrei), 36.0 g Isobutyraldehyd, 100.0 g Laurinsäure und 1.0 g 4-Toluolsulfonsäure unter Abscheidung von 35 mL Wasser umgesetzt und das dabei erhaltene Reaktionsgemisch mit 26.0 g MXDA versetzt. Nach Entfernen der flüchtigen Bestandteile erhielt man ein bei Raumtemperatur flüssiges Reaktionsprodukt, das einen Aldimin-Gehalt, bestimmt als Amin-Gehalt, von 2.33 mmol NH2/g aufwies.
- Wie für Polyaldimin PA1 beschrieben wurden 22.3 g Paraformaldehyd, 53.5 g Isobutyraldehyd, 49.5 g Laurinsäure, 50.0 g Sebacinsäure und 1.0 g 4-Toluolsulfonsäure unter Abscheidung von knapp 14 mL Wasser umgesetzt und das dabei erhaltene Reaktionsgemisch mit 33.0 g MPMD versetzt. Nach Entfernen der flüchtigen Bestandteile erhielt man ein bei Raumtemperatur flüssiges Reaktionsprodukt, das einen Aldimin-Gehalt, bestimmt als Amin-Gehalt, von 3.05 mmol NH2/g und eine Viskosität bei 20 °C von 13'000 mPa·s aufwies.
- In einen Rundkolben mit Thermometer und Wasserabscheider (Dean Stark) wurden 51.0 g 3-Hydroxypivalaldehyd (dimere Form), 100.0 g Laurinsäure und 1.0 g 4-Toluolsulfonsäure eingewogen und unter Stickstoffatmosphäre gestellt. Die Mischung wurde im Ölbad unter kräftigem Rühren erwärmt, worauf sich Wasser abzuscheiden begann. Nach vier Stunden wurde die Badtemperatur auf 170 °C erhöht und die Apparatur im Wasserstrahlvakuum evakuiert, bis sich nichts mehr abschied. Es sammelten sich insgesamt gut 9 mL Destillat im Abscheider. Das Reaktionsgemisch wurde abgekühlt, und aus einem Eintropftrichter wurden 48.6 g Jeffamine® D-230 zugegeben. Danach wurden die flüchtigen Bestandteile vollständig abdestilliert. Das so erhaltene, bei Raumtemperatur flüssige Reaktionsprodukt wies einen Aldimin-Gehalt, bestimmt als Amin-Gehalt, von 2.19 mmol NH2/g und eine Viskosität bei 20 °C von 700 mPa·s auf.
- In einem Rundkolben wurden 100.0 g Jeffamine® D-230 vorgelegt. Unter guter Kühlung und kräftigem Rühren wurden aus einem Eintropftrichter 75.0 g Isobutyraldehyd zugegeben. Nach 12 Stunden Rühren wurden die flüchtigen Bestandteile abdestilliert. Das so erhaltene, bei Raumtemperatur flüssige Reaktionsprodukt wies einen Aldimin-Gehalt, bestimmt als Amin-Gehalt, von 5.66 mmol NH2/g auf.
- In einem Rundkolben wurden 62.0 g Jeffamine® D-230 vorgelegt. Unter guter Kühlung und kräftigem Rühren wurden aus einem Eintropftrichter 89.5 g 2,2-Dimethyl-3-isobutyroxy-propanal zugegeben. Nach 10 Minuten Rühren wurden die flüchtigen Bestandteile abdestilliert. Das so erhaltene, bei Raumtemperatur flüssige Reaktionsprodukt wies einen Aldimin-Gehalt, bestimmt als Amin-Gehalt, von 3.58 mmol NH2/g auf.
- Wie für Polyaldimin PA9 beschrieben wurden 45.0 g MXDA mit 115.0 g 2,2-Dimethyl-3-isobutyroxy-propanal umgesetzt. Das so erhaltene, bei Raumtemperatur flüssige Reaktionsprodukt wies einen Aldimin-Gehalt, bestimmt als Amin-Gehalt, von 4.43 mmol NH2/g auf.
- Die in Tabelle 1 angegebenen Polyurethanprepolymere und Polyaldimine wurden im NH2/NCO-Verhältnis (d.h. Equivalente Aldimingruppen pro Equivalente Isocyanatgruppen des Polyurethanprepolymers) von 0.5/1.0 homogen gemischt. Die Mischung wurde mit Benzoesäure (200 mg/100 g Polyurethanprepolymer) versetzt, erneut homogen gemischt und sofort in luftdichte Tuben abgefüllt und diese während 15 Stunden bei 60 °C gelagert. Dann wurde ein Teil der Mischung in ein mit PTFE beschichtetes Blech gegossen (Filmdicke ca. 2 mm), während 7 Tagen bei 23 °C und 50% relativer Luftfeuchtigkeit ausgehärtet und anschliessend die mechanischen Eigenschaften des durchgehärteten Films gemessen. Mit dem verbleibenden Tubeninhalt wurde die Lagerstabilität bestimmt durch Messung der Viskosität vor und nach Lagerung während 7 Tagen bei 60 °C. Die Ergebnisse der Prüfungen sind in Tabelle 1 aufgeführt.
Tabelle 1 Beispiel 1 2 3 4 5 Ref.* 6 Ref.* 7 Ref.* Polyurethanprepolymer PP1 PP1 PP1 PP1 PP1 PP1 PP1 Polyaldimin PA1 PA2 PA3 PA4 PA8 PA9 - Viskosität vor Lagerung (Pa·s) 50 66 55 70 120 48 56 Viskosität nach Lagerung (Pa·s) 59 79 58 81 - (geliert) 58 61 Hautbildungszeit (Min.) 35 38 32 45 25 29 >600 Blasenbildung keine keine keine keine keine keine Sehr stark Zugfestigkeit (MPa) 1.3 1.2 2.0 1.1 1.2 1.2 n.m. Bruchdehnung (%) 150 160 160 130 140 150 n.m. E-Modul 0.5-5% (MPa) 1.7 1.5 9.0 1.7 2.1 2.0 n.m. Geruch bei Applikation keiner keiner keiner keiner sehr stark stark keiner Geruch nach 7 Tagen keiner keiner keiner keiner schwach stark keiner (n.m. = nicht messbar) *Ref. = Vergleich - Die Ergebnisse zeigen, dass die erfindungsgemässen Zusammensetzungen der Beispiele 1-4 lagerstabil sind, eine gute Reaktivität (Hautbildungszeit) aufweisen und blasenfrei aushärten. Sie geben dabei weder bei der Applikation noch später einen störenden Geruch ab und verfügen im ausgehärteten Zustand über gute mechanische Eigenschaften. Das nach dem Stand der Technik formulierte Vergleichsbeispiel 5 ist nicht lagerstabil und weist einen starken Geruch auf. Das nach
US 4,469,831 formulierte Vergleichsbeispiel 6 ist in Bezug auf Lagerstabilität, Reaktivität, Blasenbildung sowie den mechanischen Eigenschaften den Beispielen 1-4 ebenbürtig; allerdings gibt es schon während dem Aushärten und auch noch lange danach einen deutlich wahrnehmbaren, störenden Geruch ab. Das ganz ohne Polyaldimin formulierte Vergleichsbeispiel 7 schliesslich ist wohl geruchsfrei, zeigt aber eine ungenügende Reaktivität (langsame Hautbildungszeit) und eine starke Tendenz zur Blasenbildung. - Gleich wie in Beispiel 1 beschrieben wurden Zusammensetzungen aus verschiedenen Polyurethanprepolymeren und Polyaldiminen hergestellt und geprüft (verwendetes NH2/NCO-Verhältnis = 0.7/1.0).
- Die dabei eingesetzten Polyurethanprepolymere und Polyaldimine sowie die Ergebnisse der Prüfungen sind in der Tabelle 2 aufgeführt.
Tabelle 2 Beispiel 8 9 10 Vergleich Polyurethanprepolymer PP2 PP2 PP2 Polyaldimin PA5 PA6 PA10 Viskosität vor Lagerung (Pa·s) 32 36 34 Viskosität nach Lagerung (Pa·s) 37 43 38 Hautbildungszeit (Min.) 40 50 40 Blasenbildung keine keine keine Zugfestigkeit (MPa) 9.1 3.0* 7.5 Bruchdehnung(%) 1300 >1300 1300 E-Modul 0.5-5% (MPa) 3.6 0.8 4.5 Geruch bei Applikation keiner keiner stark Geruch nach 7 Tagen keiner keiner stark * Wert bei max. Dehnung (1300%) - Die Ergebnisse zeigen, dass die erfindungsgemässen Zusammensetzungen der Beispiele 8-9 lagerstabil sind, eine gute Reaktivität (Hautbildungszeit) aufweisen und blasenfrei aushärten. Sie geben dabei weder bei der Applikation noch später einen störenden Geruch ab und verfügen im ausgehärteten Zustand über gute mechanische Eigenschaften. Letztere hängen stark vom verwendeten Polyaldimin (bzw. dem diesem zugrundeliegenden Polyamin) ab, wie die Unterschiede zwischen den beiden Beispielen deutlich zeigen. Das nach
US 4,469,831 formulierte Vergleichsbeispiel 10 ist in Bezug auf Lagerstabilität, Reaktivität, Blasenbildung sowie den mechanischen Eigenschaften ebenbürtig; allerdings gibt es schon während dem Aushärten und auch noch lange danach einen deutlich wahrnehmbaren, störenden Geruch ab. - Gleich wie in Beispiel 1 beschrieben wurden Zusammensetzungen aus verschiedenen Polyurethanprepolymeren und Polyaldiminen hergestellt und geprüft (verwendetes NH2/NCO-Verhältnis = 0.5/1.0).
Tabelle 3 Beispiel 11 12 13 Vergleich Polyurethanprepolymer PP3 PP3 PP3 Polyaldimin PA7 PA5 PA9 Viskosität vor Lagerung (Pa·s) 31 38 40 Viskosität nach Lagerung (Pa·s) 37 44 44 Hautbildungszeit (Min.) 100 85 80 Blasenbildung keine keine keine Zugfestigkeit (MPa) 6.2 7.6 7.5 Bruchdehnung (%) 860 900 700 E-Modul 0.5-5% (MPa) 1.7 5.0 2.4 Geruch bei Applikation keiner keiner stark Geruch nach 7 Tagen keiner keiner stark - Die dabei eingesetzten Polyurethanprepolymere und Polyaldimine sowie die Ergebnisse der Prüfungen sind in der Tabelle 3 aufgeführt.
- Die Ergebnisse zeigen, dass die erfindungsgemässen Zusammensetzungen der Beispiele 11-12 lagerstabil sind, eine gute Reaktivität (Hautbildungszeit) aufweisen und blasenfrei aushärten. Sie geben dabei weder bei der Applikation noch später einen störenden Geruch ab und verfügen im ausgehärteten Zustand über gute mechanische Eigenschaften. Letztere variieren mit dem verwendeten Polyaldimin (bzw. dem diesem zugrundeliegenden Polyamin), was bei einem Vergleich der Prüfwerte für die beiden Beispiele deutlich wird. Das nach
US 4,469,831 formulierte Vergleichsbeispiel 13 ist in Bezug auf Lagerstabilität, Reaktivität, Blasenbildung sowie den mechanischen Eigenschaften ebenbürtig; allerdings gibt es schon während dem Aushärten und auch noch lange danach einen deutlich wahrnehmbaren, störenden Geruch ab. - Gleich wie in Beispiel 1 beschrieben wurden Zusammensetzungen aus verschiedenen Polyurethanprepolymeren und Polyaidiminen hergestellt und geprüft (verwendetes NH2/NCO-Verhältnis = 0.9/1.0). Die dabei eingesetzten Polyurethanprepolymere und Polyaldimine sowie die Ergebnisse der Prüfungen sind in der Tabelle 4 aufgeführt.
Tabelle 4 Beispiel 14 15 Vergleich Polyurethanprepolymer PP4 PP4 Polyaldimin PA4 PA10 Viskosität vor Lagerung (Pa·s) 37 38 Viskosität nach Lagerung (Pa·s) 42 41 Hautbildungszeit (Min.) 240 220 Blasenbildung keine keine Geruch nach Applikation keiner stark Geruch nach 7 Tagen keiner stark - Die Ergebnisse zeigen, dass die erfindungsgemässen Zusammensetzung des Beispiels 14 lagerstabil ist, eine gute Reaktivität (Hautbildungszeit) aufweist und blasenfrei aushärtet. Sie gibt dabei weder bei der Applikation noch später einen störenden Geruch ab. Das nach
US 4,469,831 formulierte Vergleichsbeispiel 15 ist in Bezug auf Lagerstabilität, Reaktivität und Blasenbildung ebenbürtig; allerdings gibt es während und nach dem Aushärten einen deutlich wahrnehmbaren, störenden Geruch ab.
Claims (26)
- Zusammensetzung umfassendmindestens ein Polyurethanprepolymer A mit Isocyanatendgruppen, hergestellt aus mindestens einem Polyisocyanat und mindestens einem Polyol;
undmindestens ein Polyaldimin B, welches erhältlich ist ausmindestens einem Polyamin C mit aliphatischen primären Aminogruppen
und
mindestens einem Aldehyd D der Formelwobei Y1 und Y2 entweder
unabhängig voneinander für eine Alkyl-, Aryl oder Arylalkylgruppe stehen, welche gegebenenfalls jeweils substituiert sein können, gegebenenfalls jeweils Heteroatome enthalten können und gegebenenfalls jeweils ungesättigte Anteile enthalten können,oder Y1 und Y2
miteinander zu einem carbocyclischen oder heterocyclischen Ring verbunden sind, welcher eine Ringgrösse zwischen 5 und 8, bevorzugt 6, Atomen, und gegebenenfalls eine oder zwei einfach ungesättige Bindungen aufweist;
undR1 entweder
für eine lineare oder verzweigte Alkylkette mit 11 bis 30 C-Atomen, gegebenenfalls mit mindestens einem Heteroatom, insbesondere mit mindestens einem Ether-Sauerstoff, oder für eine einfach oder mehrfach ungesättigte lineare oder verzweigte Kohlenwasserstoffkette mit 11 bis 30 C-Atomen steht;
oder für
oder für - Zusammensetzung gemäss Anspruch 1, dadurch gekennzeichnet, dass das Polyurethanprepolymer A einen Gehalt an freien Isocyanatgruppen von 0.1 bis 15 Gewichts-%, bevorzugt 0.5 - 5 Gewichts-%, bezogen auf das gesamte Polyurethanprepolymer, aufweist.
- Zusammensetzung gemäss Anspruch 1 oder 2, dadurch gekennzeichnet, dass das Polyisocyanat für die Herstellung des Polyurethanprepolymers A ein Diisocyanat ist, insbesondere ausgewählt aus der Gruppe von MDI, TDI, HDI und IPDI.
- Zusammensetzung gemäss einem der vorhergehenden Ansprüche, dadurch gekennzeichnet, dass das Polyol für die Herstellung des Polyurethanprepolymers A eine mittlere OH-Funktionalität von 1.6 bis 3 aufweist.
- Zusammensetzung gemäss Anspruch 4, dadurch gekennzeichnet, dass das Polyol ein Polyoxyalkylenpolyol ist, insbesondere mit einem Ungesättigtheitsgrad <0.02 mEq/g und einem Molekulargewicht Mn von 1'000 - 30'000 g/mol.
- Zusammensetzung gemäss Anspruch 5, dadurch gekennzeichnet, dass das Polyol ein mittels DMC-Katalyse hergestelltes Polyol ist.
- Zusammensetzung gemäss Anspruch 4, dadurch gekennzeichnet, dass das Polyol ein Polyoxyalkylenpolyol ist, insbesondere mit einem Molekulargewicht Mn von 400 - 8'000 g/mol.
- Zusammensetzung gemäss einem der Ansprüche 4 - 7, dadurch gekennzeichnet, dass das Polyol ein Polyoxypropylenpolyol oder ein EO-endcapped Polyoxypropylenpolyol ist.
- Zusammensetzung gemäss einem der vorhergehenden Ansprüche, dadurch gekennzeichnet, dass für die Herstellung des Polyaldimins B der Aldehyd D stöchiometrisch oder im stöchiometrischen Überschuss in Bezug auf die primären Aminogruppen des Polyamins C eingesetzt wird.
- Zusammensetzung gemäss einem der vorhergehenden Ansprüche, dadurch gekennzeichnet, dass das Polyurethanprepolymer A und das Polyaldimin B im Verhältnis von 0.1 - 1.1 Equivalent Aldimingruppen pro Equivalent Isocyanatgruppen vorliegen.
- Zusammensetzung gemäss einem der vorhergehenden Ansprüche, dadurch gekennzeichnet, dass das Polyamin C mit aliphatischen primären Aminogruppen ausgewählt ist aus der Gruppe bestehend aus 1,6-Hexamethylendiamin, MPMD, DAMP, 2,2,4- und 2,4,4-Trimethylhexamethylendiamin, 4-Aminomethyl-1,8-octandiamin, IPDA, 1,3- und 1,4-Xylylendiamin, 1,3- und 1,4-Bis-(aminomethyl)cyclohexan, Bis-(4-aminocyclohexyl)-methan, Bis-(4-amino-3-methylcyclohexyl)-methan, 3(4),8(9)-Bis-(aminomethyl)-tricyclo[5.2.1.02,6]decan, 1,2-, 1,3- und 1,4-Diaminocyclohexan, Polyoxyalkylen-Polyamine mit theoretisch zwei oder drei Aminogruppen, insbesondere Jeffamine® EDR-148, Jeffamine® D-230, Jeffamine® D-400 und Jeffamine® T-403, sowie insbesondere Mischungen von zwei oder mehr der vorgenannten Polyamine.
- Zusammensetzung gemäss einem der vorhergehenden Ansprüche, dadurch gekennzeichnet, dass der für die Herstellung des Polyaldimins B verwendete Aldehyd D durch eine Veresterungsreaktion eines β-Hydroxyaldehyds mit einer Carbonsäure erhältlich ist, insbesondere ohne Verwendung eines Lösemittels, wobei der β-Hydroxyaldehyd, gegebenenfalls in situ, aus Formaldehyd, beziehungsweise Paraformaldehyd oder einer oligomeren Form von Formaldehyd, und einem zweiten Aldehyd hergestellt wird, wobei dieser zweite Aldehyd ausgewählt ist aus der Gruppe umfassend Isobutyraldehyd, 2-Methylbutyraldehyd, 2-Ethylbutyraldehyd, 2-Methylvaleraldehyd, 2-Ethylcapronaldehyd, Cyclopentancarboxaldehyd, Cyclohexancarboxaldehyd, 1,2,3,6-Tetrahydrobenzaldehyd, 2-Methyl-3-phenylpropionaldehyd, 2-Phenylpropionaldehyd, Diphenylacetaldehyd, bevorzugt Isobutyraldehyd.
- Zusammensetzung gemäss einem der vorhergehenden Ansprüche, dadurch gekennzeichnet, dass der für die Herstellung des Polyaldimins B verwendete Aldehyd D durch eine Veresterungsreaktion von 3-Hydroxypivalaldehyd, welcher gegebenenfalls in situ aus Formaldehyd, beziehungsweise Paraformaldehyd, und Isobutyraldehyd hergestellt wird, mit einer Carbonsäure, insbesondere ohne Verwendung eines Lösemittels, erhältlich ist.
- Zusammensetzung gemäss Anspruch 13, dadurch gekennzeichnet, dass die für die Herstellung des Aldehyds D verwendete Carbonsäure ausgewählt ist aus der Gruppe umfassend Laurinsäure, Myristinsäure, Palmitinsäure, Stearinsäure, Ölsäure, Linolsäure, Linolensäure, Bernsteinsäure, Adipinsäure, Azelainsäure und Sebacinsäure.
- Zusammensetzung gemäss einem der vorhergehenden Ansprüche, dadurch gekennzeichnet, dass Y1 = Y2 = Methyl darstellt.
- Verfahren zur Herstellung der Zusammensetzung gemäss einem der Ansprüche 1 - 15, umfassend einen Schritt der Herstellung eines Polyaldimins durch Umsetzung eines Aldehyds mit einem Amin.
- Verfahren zur Herstellung der Zusammensetzung gemäss Anspruch 16, umfassend zusätzlich einen Schritt der Herstellung eines Aldehyds D aus einer Carbonsäure und einem β-Hydroxyaldehyd, insbesondere ohne Verwendung eines Lösemittels, wobei der β-Hydroxyaldehyd, gegebenenfalls in situ, aus Formaldehyd, beziehungsweise Paraformaldehyd oder einer oligomeren Form von Formaldehyd, und einem zweiten Aldehyd hergestellt wird.
- Verfahren zur Herstellung der Zusammensetzung gemäss Anspruch 16, umfassend zusätzlich einen Schritt der Herstellung eines Aldehyds D aus einer Carbonsäure und 3-Hydoxypivalaldehyd und Isobutyraldehyd, insbesondere ohne Verwendung eines Lösemittels, wobei 3-Hydroxypivalaldehyd, gegebenenfalls in situ, aus Formaldehyd, beziehungsweise Paraformaldehyd, hergestellt wird.
- Verwendung der Zusammensetzung gemäss einem der Ansprüche 1 15 als Klebstoff, Dichtstoff, Beschichtung oder Belag.
- Anordnung, dadurch gekennzeichnet, dass sie eine Zusammensetzung nach einem der Ansprüche 1-15 enthält.
- Artikel, dessen Oberfläche zumindest partiell mit einer Zusammensetzung gemäss einem der Ansprüche 1-15 kontaktiert worden ist.
- Verfahren zum Verkleben, dadurch gekennzeichnet, dass es einen Schritt des Kontaktierens mit einer Zusammensetzung gemäss einem der Ansprüche 1-15 umfasst.
- Verfahren zum Abdichten, dadurch gekennzeichnet, dass es einen Schritt des Kontaktierens mit einer Zusammensetzung gemäss einem der Ansprüche 1 - 15 umfasst.
- Verfahren zum Beschichten, dadurch gekennzeichnet, dass es einen Schritt des Kontaktierens mit einer Zusammensetzung gemäss einem der Ansprüche 1-15 umfasst.
- Verfahren gemäss einem der Ansprüche 22 - 24, dadurch gekennzeichnet, dass es einen zusätzlichen Schritt des Aushärtens an der Luft umfasst.
- Verfahren gemäss einem der Ansprüche 22 - 25, dadurch gekennzeichnet, dass es zusätzlich einen Schritt des Kontaktierens mit einer wasserhaltigen Komponente oder eine Beimischung derselben umfasst.
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| ES03766269T ES2304532T3 (es) | 2002-07-26 | 2003-07-23 | Composicion de poliuretano con contenido en polialdimina. |
| EP03766269A EP1527115B1 (de) | 2002-07-26 | 2003-07-23 | Polyaldimin enthaltende polyurethanzusammensetzung |
| SI200331245T SI1527115T1 (sl) | 2002-07-26 | 2003-07-23 | Poliuretanski sestavki, ki vsebujejo polialdimin |
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP02016755A EP1384735A1 (de) | 2002-07-26 | 2002-07-26 | Polyaldimin enthaltende Polyurethanzusammensetzung |
| EP02016755 | 2002-07-26 | ||
| EP03766269A EP1527115B1 (de) | 2002-07-26 | 2003-07-23 | Polyaldimin enthaltende polyurethanzusammensetzung |
| PCT/EP2003/008083 WO2004013200A1 (de) | 2002-07-26 | 2003-07-23 | Polyaldimin enthaltende polyurethanzusammensetzung |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| EP1527115A1 EP1527115A1 (de) | 2005-05-04 |
| EP1527115B1 true EP1527115B1 (de) | 2008-04-23 |
Family
ID=29797194
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP02016755A Withdrawn EP1384735A1 (de) | 2002-01-18 | 2002-07-26 | Polyaldimin enthaltende Polyurethanzusammensetzung |
| EP03766269A Expired - Lifetime EP1527115B1 (de) | 2002-07-26 | 2003-07-23 | Polyaldimin enthaltende polyurethanzusammensetzung |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP02016755A Withdrawn EP1384735A1 (de) | 2002-01-18 | 2002-07-26 | Polyaldimin enthaltende Polyurethanzusammensetzung |
Country Status (16)
| Country | Link |
|---|---|
| US (2) | US20060122352A1 (de) |
| EP (2) | EP1384735A1 (de) |
| JP (1) | JP4242834B2 (de) |
| CN (1) | CN1284812C (de) |
| AT (1) | ATE393178T1 (de) |
| AU (2) | AU2003251462A1 (de) |
| BR (1) | BR0312965B1 (de) |
| CA (1) | CA2493600A1 (de) |
| DE (1) | DE50309700D1 (de) |
| DK (1) | DK1527115T3 (de) |
| ES (1) | ES2304532T3 (de) |
| NO (1) | NO20050974L (de) |
| PT (1) | PT1527115E (de) |
| RU (1) | RU2291162C2 (de) |
| SI (1) | SI1527115T1 (de) |
| WO (1) | WO2004013200A1 (de) |
Families Citing this family (45)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4317760B2 (ja) * | 2002-01-18 | 2009-08-19 | シーカ・テクノロジー・アーゲー | 高い初期強度を有する2液型ポリウレタン組成物 |
| FR2850973B1 (fr) * | 2003-02-12 | 2007-04-20 | Weber A | Produit bi-composant |
| US8735526B2 (en) * | 2005-09-15 | 2014-05-27 | The United States Of America, As Represented By The Secretary Of The Navy | Polyenureas and method of making the same |
| EP1770107A1 (de) * | 2005-09-30 | 2007-04-04 | Sika Technology AG | Feuchtigkeitshärtende Polyurethanzusammensetzung |
| EP1772447A1 (de) * | 2005-09-30 | 2007-04-11 | Sika Technology AG | Aldimine mit aktivem Wasserstoff aufweisenden Reaktivgruppen sowie deren Verwendung |
| KR20080071132A (ko) * | 2005-09-30 | 2008-08-01 | 시카 테크놀러지 아게 | 알디민 함유 화합물 |
| EP1834971A1 (de) * | 2006-03-13 | 2007-09-19 | Sika Technology AG | Feuchtigkeitshärtende Polyurethanzusammensetzung mit gutem Tieftemperaturverhalten |
| EP1876196A1 (de) * | 2006-06-30 | 2008-01-09 | Sika Technology AG | VOC-freie oder VOC-arme Polyurethanbeschichtung |
| EP1918314A1 (de) * | 2006-10-31 | 2008-05-07 | Sika Technology AG | Polyurethanzusammensetzung mit guter Anfangsfestigkeit |
| ATE434653T1 (de) * | 2006-11-17 | 2009-07-15 | Sika Technology Ag | Polyaldimin enthaltende feuchtigkeitshärtende heissschmelzklebstoff-zusammensetzung |
| EP1967510A1 (de) | 2007-03-06 | 2008-09-10 | Sika Technology AG | Dialdimin, Dialdimin enthaltende Emulsion, sowie zweikomponentige Polyurethanzusammensetzung und deren Verwendungen |
| EP1975186A1 (de) | 2007-03-27 | 2008-10-01 | Sika Technology AG | Isocyanat- und Aldiminogruppen aufweisende Zusammensetzung mit niedrigem Isocyanat-Monomergehalt |
| EP1975189A1 (de) * | 2007-03-27 | 2008-10-01 | Sika Technology AG | Polyurethanzusammensetzung enthaltend asymmetrisches Dialdimin |
| EP1975188A1 (de) * | 2007-03-27 | 2008-10-01 | Sika Technology AG | Cycloaliphatische Polyurethanzusammensetzung enthaltend cycloaliphatische Dialdimine |
| EP1975190A1 (de) * | 2007-03-28 | 2008-10-01 | Sika Technology AG | Aldimine mit aktivem Wasserstoff aufweisenden Reaktivgruppen |
| EP1990387B1 (de) | 2007-05-11 | 2010-07-21 | Sika Technology AG | Über Polyurethan-Heissschmelzklebstoff verbundene Schichtbundkörper sowie Verfahren zum Verkleben von Weichmacher enthaltenden Kunststoffen |
| EP2030965A1 (de) * | 2007-08-31 | 2009-03-04 | Sika Technology AG | Hydroxylgruppen aufweisende Aldehyde |
| BRPI0820511A2 (pt) | 2007-11-13 | 2015-06-16 | Sika Technology Ag | Dialdimina aromática líquida à temperatura ambiente, composição endurecível compreendendo a mesma, uso de uma composição endurecível, processo para colar um substrato s1 com um substrato s2 e um artigo colado |
| ES2695030T3 (es) * | 2007-12-18 | 2018-12-28 | Sika Technology Ag | Composición multi-componente para el relleno y/o la compactación de grietas, zonas defectuosas y cavidades en estructuras o formaciones de suelo y rocosas |
| EP2072551A1 (de) | 2007-12-21 | 2009-06-24 | Sika Technology AG | Aldimin enthaltende Primerzusammensetzung |
| EP2128103A1 (de) | 2008-05-28 | 2009-12-02 | Sika Technology AG | Aromatisches Sekundäres Aminosilan enthaltende Haftvermittlerzusammensetzung |
| EP2128210B1 (de) | 2008-05-28 | 2013-09-04 | Sika Technology AG | Epoxidharz enthaltende Haftvermittlerzusammensetzung |
| BRPI0915393A2 (pt) * | 2008-06-24 | 2015-11-03 | Mi Llc | métodos de atraso de cura de elastômeros curáveis sensíveis à umidade |
| EP2189500A1 (de) | 2008-11-21 | 2010-05-26 | Sika Technology AG | Epoxid/(Meth)acrylat Zusammensetzung |
| EP2313463A2 (de) | 2008-07-17 | 2011-04-27 | Sika Technology AG | Epoxid/(meth)acrylat zusammensetzung |
| EP2189505A1 (de) | 2008-11-21 | 2010-05-26 | Sika Technology AG | Stabilisierung von (Meth)acrylatbasierenden Zusammensetzungen durch spezifische tertiäre Amine |
| ATE509972T1 (de) * | 2008-10-31 | 2011-06-15 | Sika Technology Ag | Organomethoxysilan enthaltende polyurethanzusammensetzung mit anisotropen materialeigenschaften |
| ES2358719T3 (es) * | 2008-10-31 | 2011-05-13 | Sika Technology Ag | Composición de poliuretano que contiene alfa-silano con propiedades de material anisótropas. |
| EP2236534A1 (de) * | 2009-03-31 | 2010-10-06 | Sika Technology AG | Zweistufig aushärtende Zusammensetzung enthaltend ein oberflächendesaktiviertes Polyisocyanat |
| JP5864567B2 (ja) | 2010-07-13 | 2016-02-17 | バイエル・インテレクチュアル・プロパティ・ゲゼルシャフト・ミット・ベシュレンクテル・ハフツングBayer Intellectual Property GmbH | 僅かに変性されたプレポリマーおよびその使用 |
| US8758862B2 (en) * | 2012-06-26 | 2014-06-24 | Prc Desoto International, Inc. | Coating compositions with an isocyanate-functional prepolymer derived from a tricyclodecane polyol, methods for their use, and related coated substrates |
| EP2948490B1 (de) | 2013-01-22 | 2020-01-15 | Sika Technology AG | Flüssig aufgetragene wasserdichte membran für dächer mit zwei verschiedenen aldiminen |
| RU2678836C2 (ru) * | 2013-01-22 | 2019-02-04 | Сикэ Текнолоджи Аг | Наносимая в жидком виде гидроизоляционная мембрана для кровли, содержащая триальдимин |
| US20150353797A1 (en) * | 2013-01-22 | 2015-12-10 | Sika Technology Ag | Liquid-applied waterproofing membrane for roofs |
| KR20210022156A (ko) | 2013-01-22 | 2021-03-02 | 시카 테크놀러지 아게 | 장쇄 알디민을 포함하는 지붕을 위한 액체 도포된 방수막 |
| JP6348913B2 (ja) * | 2013-01-22 | 2018-06-27 | シーカ・テクノロジー・アーゲー | オキサゾリジン及びアルジミンを含む液体塗布防水膜 |
| EP2966103A1 (de) | 2014-07-09 | 2016-01-13 | Sika Technology AG | Flüssig aufgetragene wasserdichte Membran für Dächer |
| US10711161B2 (en) | 2014-10-23 | 2020-07-14 | Sika Technology Ag | Adhesive system with highly reactive pretreatment agent |
| US11214706B2 (en) | 2015-12-21 | 2022-01-04 | Sika Technology Ag | Polyurethane composition with low plasticiser migration |
| CN110753711B (zh) * | 2017-06-19 | 2022-04-05 | Sika技术股份公司 | 胺的封闭剂,潜在固化剂和聚氨酯组合物 |
| US11535694B2 (en) * | 2017-06-19 | 2022-12-27 | Sika Technology Ag | Latent curing agent and curable polyurethane composition |
| US12252637B2 (en) | 2018-12-11 | 2025-03-18 | Sanyo Chemical Industries, Ltd. | Two-pack curable urethane adhesive |
| CA3136198A1 (en) | 2019-05-17 | 2020-11-26 | Sika Technology Ag | Process for producing 2,2-dialkyl-3-acyloxypropanals |
| WO2025017071A1 (en) | 2023-07-18 | 2025-01-23 | Basf Se | New latent hardeners and pu compositions containing them |
| CN119529653A (zh) * | 2024-12-05 | 2025-02-28 | 哈尔滨工程大学 | 一种席夫碱改性硅烷/聚氨酯防污涂层及其制备方法和应用 |
Family Cites Families (26)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3567692A (en) * | 1963-02-04 | 1971-03-02 | Ici Ltd | Polymeric materials produced by interacting polyisocyanate and water in the presence of polyaldimine or polyketimine |
| GB1064841A (en) * | 1963-02-04 | 1967-04-12 | Ici Ltd | Manufacture of polymers containing biuret and urea groups |
| RO55309A (de) * | 1968-04-24 | 1973-07-20 | ||
| DE1814832B2 (de) * | 1968-12-14 | 1979-02-08 | Bayer Ag, 5090 Leverkusen | Verfahren zur Herstellung von Hydroxymethyl-Gruppen aufweisenden Ketiminen |
| DE2325824A1 (de) * | 1973-05-22 | 1974-12-19 | Veba Chemie Ag | Polyurethan-zweikomponentenlacke |
| DE3306373A1 (de) * | 1983-02-24 | 1984-08-30 | Basf Ag, 6700 Ludwigshafen | Feuchtigkeitshaertendes, lagerstabiles einkomponenten-polyurethansystem |
| US4469831A (en) * | 1981-08-26 | 1984-09-04 | Basf Aktiengesellschaft | Moisture-curing, storage stable, single-component polyurethane systems |
| DE3607996A1 (de) * | 1986-03-11 | 1987-09-17 | Basf Ag | Feuchtigkeitshaertende, lagerstabile einkomponenten-polyurethansysteme und deren verwendung |
| DE3624924A1 (de) * | 1986-07-23 | 1988-01-28 | Basf Ag | Feuchtigkeitshaertende, lagerstabile einkomponenten-polyurethansysteme und deren verwendung |
| GB8705801D0 (en) * | 1987-03-11 | 1987-04-15 | Ici Plc | Injection moulding compositions |
| DE3710963A1 (de) * | 1987-04-01 | 1988-10-20 | Bayer Ag | Unter dem einfluss von feuchtigkeit haertbare bindemittelkombinationen, ein verfahren zu ihrer herstellung und ihre verwendung |
| GB8807684D0 (en) * | 1988-03-31 | 1988-05-05 | Ici Plc | Internal mould release composition |
| US5104930A (en) * | 1990-02-27 | 1992-04-14 | Raychem Corporation | Polyurea gel compositions and articles therefrom |
| US5087661A (en) * | 1990-07-20 | 1992-02-11 | Mitsui Toatsu Chemicals, Inc. | Moisture curable polyurethane composition comprising polyaldimine |
| US5116931A (en) * | 1990-09-28 | 1992-05-26 | Olin Corporation | Thermoset polyurethane elastomers and polyurea elastomers made using high functionality, low unsaturation level polyols prepared with double metal cyanide catalysts |
| US5466771A (en) * | 1993-12-21 | 1995-11-14 | Bayer Corporation | Coating compositions based on aldimines and polyisocyanates containing allophanate groups |
| JPH07216044A (ja) * | 1994-01-26 | 1995-08-15 | Mitsui Toatsu Chem Inc | アルジミンを含有するイソシアネート組成物の硬化方法 |
| DK0678544T4 (da) * | 1994-04-15 | 2004-08-02 | Sika Ag | Tokomponentklæbemasse, -tætningsmasse eller -belægningsmasse og anvendelse deraf |
| US5516873A (en) * | 1994-07-11 | 1996-05-14 | Bayer Corporation | Polyisocyanate/polyamine mixtures and their use for the production of polyurea coatings |
| US5489704A (en) * | 1994-08-29 | 1996-02-06 | Bayer Corporation | Polyisocyanate/polyamine mixtures and their use for the production of polyurea coatings |
| US5708118A (en) * | 1996-10-11 | 1998-01-13 | Arco Chemical Technology, L.P. | Spandex elastomers |
| ATE274006T1 (de) * | 1998-04-02 | 2004-09-15 | Sika Schweiz Ag | Latente aminogruppen und isocyanatgruppen aufweisende polyurethan-prepolymere, verfahren zu deren herstellung sowie deren verwendung |
| IL129583A (en) * | 1999-04-25 | 2005-05-17 | Kenneth I Sawyer | Diesters of oligobutyleneglycol and amidine benzoic acid and their use for preparation of moisture-curable, storage-stable, one-part polyurethane/urea compositions |
| EP1329469A1 (de) * | 2002-01-18 | 2003-07-23 | Sika Schweiz AG | Polyurethanzusammensetzung |
| EP1384709A1 (de) * | 2002-07-26 | 2004-01-28 | Sika Technology AG | Polyaldimine |
| JP4317760B2 (ja) * | 2002-01-18 | 2009-08-19 | シーカ・テクノロジー・アーゲー | 高い初期強度を有する2液型ポリウレタン組成物 |
-
2002
- 2002-07-26 EP EP02016755A patent/EP1384735A1/de not_active Withdrawn
-
2003
- 2003-07-23 CA CA002493600A patent/CA2493600A1/en not_active Abandoned
- 2003-07-23 US US10/522,412 patent/US20060122352A1/en not_active Abandoned
- 2003-07-23 SI SI200331245T patent/SI1527115T1/sl unknown
- 2003-07-23 WO PCT/EP2003/008083 patent/WO2004013200A1/de not_active Ceased
- 2003-07-23 PT PT03766269T patent/PT1527115E/pt unknown
- 2003-07-23 DE DE50309700T patent/DE50309700D1/de not_active Expired - Lifetime
- 2003-07-23 AU AU2003251462A patent/AU2003251462A1/en not_active Abandoned
- 2003-07-23 CN CNB038204762A patent/CN1284812C/zh not_active Expired - Lifetime
- 2003-07-23 AT AT03766269T patent/ATE393178T1/de not_active IP Right Cessation
- 2003-07-23 RU RU2005105296/04A patent/RU2291162C2/ru active
- 2003-07-23 EP EP03766269A patent/EP1527115B1/de not_active Expired - Lifetime
- 2003-07-23 DK DK03766269T patent/DK1527115T3/da active
- 2003-07-23 BR BRPI0312965-9A patent/BR0312965B1/pt active IP Right Grant
- 2003-07-23 JP JP2004525291A patent/JP4242834B2/ja not_active Expired - Lifetime
- 2003-07-23 ES ES03766269T patent/ES2304532T3/es not_active Expired - Lifetime
-
2005
- 2005-02-23 NO NO20050974A patent/NO20050974L/no not_active Application Discontinuation
-
2007
- 2007-12-17 US US12/000,763 patent/US20080114146A1/en not_active Abandoned
-
2009
- 2009-09-21 AU AU2009217414A patent/AU2009217414A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| RU2005105296A (ru) | 2005-07-20 |
| PT1527115E (pt) | 2008-07-30 |
| WO2004013200A1 (de) | 2004-02-12 |
| DE50309700D1 (de) | 2008-06-05 |
| BR0312965A (pt) | 2005-06-14 |
| AU2003251462A1 (en) | 2004-02-23 |
| EP1384735A1 (de) | 2004-01-28 |
| DK1527115T3 (da) | 2008-08-18 |
| ES2304532T3 (es) | 2008-10-16 |
| CN1678653A (zh) | 2005-10-05 |
| CN1284812C (zh) | 2006-11-15 |
| NO20050974L (no) | 2005-02-23 |
| RU2291162C2 (ru) | 2007-01-10 |
| JP4242834B2 (ja) | 2009-03-25 |
| ATE393178T1 (de) | 2008-05-15 |
| AU2009217414A1 (en) | 2009-10-08 |
| SI1527115T1 (sl) | 2008-08-31 |
| CA2493600A1 (en) | 2004-02-12 |
| BR0312965B1 (pt) | 2012-12-25 |
| US20060122352A1 (en) | 2006-06-08 |
| EP1527115A1 (de) | 2005-05-04 |
| US20080114146A1 (en) | 2008-05-15 |
| JP2005533916A (ja) | 2005-11-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP1527115B1 (de) | Polyaldimin enthaltende polyurethanzusammensetzung | |
| EP1678230B1 (de) | Zweikomponentige polyurethanzusammensetzung mit hoher frühfestigkeit | |
| EP1470173B1 (de) | Zweikomponentige polyurethanzusammensetzung mit hoher fr hfe stigkeit | |
| EP1527044B1 (de) | Polyaldimine | |
| EP1937741B1 (de) | Feuchtigkeitshärtende polyurethanzusammensetzungen enthaltend aldimin-haltige verbindungen | |
| EP2189485B1 (de) | Alpha-Silan enthaltende Polyurethanzusammensetzung mit anisotropen Materialeigenschaften | |
| EP1470172B1 (de) | Polyurethanzusammensetzung | |
| EP2021391B1 (de) | Zweikomponentige polyurethanzusammensetzung mit hoher frühfestigkeit | |
| EP2189484B1 (de) | Organomethoxysilan enthaltende Polyurethanzusammensetzung mit anisotropen Materialeigenschaften | |
| EP2139936B1 (de) | Polyurethanzusammensetzung enthaltend asymmetrisches dialdimin | |
| EP2132245B1 (de) | Isocyanat- und aldiminogruppen aufweisende zusammensetzung mit niedrigem isocyanat-monomergehalt | |
| EP1996635B1 (de) | Feuchtigkeitshärtende polyurethanzusammensetzung mit gutem tieftemperaturverhalten | |
| EP2220034B1 (de) | Aromatische aldimine und aldimin enthaltende polyurethanzusammensetzungen | |
| EP1544204A1 (de) | Aldiminoalkylsilane |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PUAI | Public reference made under article 153(3) epc to a published international application that has entered the european phase |
Free format text: ORIGINAL CODE: 0009012 |
|
| 17P | Request for examination filed |
Effective date: 20050228 |
|
| AK | Designated contracting states |
Kind code of ref document: A1 Designated state(s): AT BE BG CH CY CZ DE DK EE ES FI FR GB GR HU IE IT LI LU MC NL PT RO SE SI SK TR |
|
| AX | Request for extension of the european patent |
Extension state: AL LT LV MK |
|
| DAX | Request for extension of the european patent (deleted) | ||
| GRAP | Despatch of communication of intention to grant a patent |
Free format text: ORIGINAL CODE: EPIDOSNIGR1 |
|
| GRAS | Grant fee paid |
Free format text: ORIGINAL CODE: EPIDOSNIGR3 |
|
| GRAA | (expected) grant |
Free format text: ORIGINAL CODE: 0009210 |
|
| AK | Designated contracting states |
Kind code of ref document: B1 Designated state(s): AT BE BG CH CY CZ DE DK EE ES FI FR GB GR HU IE IT LI LU MC NL PT RO SE SI SK TR |
|
| REG | Reference to a national code |
Ref country code: GB Ref legal event code: FG4D Free format text: NOT ENGLISH |
|
| REG | Reference to a national code |
Ref country code: CH Ref legal event code: EP |
|
| REF | Corresponds to: |
Ref document number: 50309700 Country of ref document: DE Date of ref document: 20080605 Kind code of ref document: P |
|
| REG | Reference to a national code |
Ref country code: IE Ref legal event code: FG4D Free format text: LANGUAGE OF EP DOCUMENT: GERMAN |
|
| REG | Reference to a national code |
Ref country code: RO Ref legal event code: EPE |
|
| REG | Reference to a national code |
Ref country code: PT Ref legal event code: SC4A Free format text: AVAILABILITY OF NATIONAL TRANSLATION Effective date: 20080721 |
|
| REG | Reference to a national code |
Ref country code: SE Ref legal event code: TRGR |
|
| REG | Reference to a national code |
Ref country code: DK Ref legal event code: T3 |
|
| REG | Reference to a national code |
Ref country code: GR Ref legal event code: EP Ref document number: 20080401745 Country of ref document: GR |
|
| REG | Reference to a national code |
Ref country code: ES Ref legal event code: FG2A Ref document number: 2304532 Country of ref document: ES Kind code of ref document: T3 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: BG Payment date: 20080725 Year of fee payment: 6 Ref country code: EE Payment date: 20080723 Year of fee payment: 6 Ref country code: LU Payment date: 20080804 Year of fee payment: 6 Ref country code: PT Payment date: 20080808 Year of fee payment: 6 Ref country code: SI Payment date: 20080723 Year of fee payment: 6 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: AT Payment date: 20080721 Year of fee payment: 6 Ref country code: CZ Payment date: 20080721 Year of fee payment: 6 Ref country code: FI Payment date: 20080730 Year of fee payment: 6 Ref country code: IE Payment date: 20080725 Year of fee payment: 6 Ref country code: RO Payment date: 20080716 Year of fee payment: 6 Ref country code: SK Payment date: 20080722 Year of fee payment: 6 |
|
| REG | Reference to a national code |
Ref country code: HU Ref legal event code: AG4A Ref document number: E003716 Country of ref document: HU |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: TR Payment date: 20080721 Year of fee payment: 6 |
|
| ET | Fr: translation filed | ||
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: BE Payment date: 20080818 Year of fee payment: 6 |
|
| PLBE | No opposition filed within time limit |
Free format text: ORIGINAL CODE: 0009261 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: NO OPPOSITION FILED WITHIN TIME LIMIT |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: MC Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20080731 |
|
| 26N | No opposition filed |
Effective date: 20090126 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: GR Payment date: 20080729 Year of fee payment: 6 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: CY Payment date: 20080804 Year of fee payment: 6 |
|
| BERE | Be: lapsed |
Owner name: SIKA TECHNOLOGY A.G. Effective date: 20090731 |
|
| REG | Reference to a national code |
Ref country code: PT Ref legal event code: MM4A Free format text: LAPSE DUE TO NON-PAYMENT OF FEES Effective date: 20100125 |
|
| REG | Reference to a national code |
Ref country code: SK Ref legal event code: MM4A Ref document number: E 3903 Country of ref document: SK Effective date: 20090723 |
|
| REG | Reference to a national code |
Ref country code: EE Ref legal event code: MM4A Ref document number: E002169 Country of ref document: EE Effective date: 20090731 |
|
| REG | Reference to a national code |
Ref country code: IE Ref legal event code: MM4A |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: PT Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20100125 Ref country code: CZ Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20090723 Ref country code: EE Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20090731 Ref country code: FI Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20090723 Ref country code: RO Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20090723 |
|
| REG | Reference to a national code |
Ref country code: SI Ref legal event code: KO00 Effective date: 20100301 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: CY Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20090723 Ref country code: SI Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20090724 Ref country code: SK Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20090723 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: BE Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20090731 Ref country code: AT Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20090723 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: IE Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20090723 Ref country code: BG Free format text: FAILURE TO ELECT DOMICILE IN THE NATIONAL COUNTRY Effective date: 20100131 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: GR Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20100204 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: LU Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20090723 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: DK Payment date: 20110725 Year of fee payment: 9 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: IT Payment date: 20120727 Year of fee payment: 10 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: TR Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20090723 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: HU Payment date: 20121003 Year of fee payment: 10 |
|
| REG | Reference to a national code |
Ref country code: DK Ref legal event code: EBP Effective date: 20130731 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: HU Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20130724 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: IT Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20130723 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: DK Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20130731 |
|
| REG | Reference to a national code |
Ref country code: FR Ref legal event code: PLFP Year of fee payment: 14 |
|
| REG | Reference to a national code |
Ref country code: FR Ref legal event code: PLFP Year of fee payment: 15 |
|
| REG | Reference to a national code |
Ref country code: FR Ref legal event code: PLFP Year of fee payment: 16 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: NL Payment date: 20210622 Year of fee payment: 19 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: SE Payment date: 20210623 Year of fee payment: 19 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: CH Payment date: 20210728 Year of fee payment: 19 Ref country code: ES Payment date: 20210802 Year of fee payment: 19 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: GB Payment date: 20220621 Year of fee payment: 20 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: FR Payment date: 20220621 Year of fee payment: 20 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: DE Payment date: 20220621 Year of fee payment: 20 |
|
| REG | Reference to a national code |
Ref country code: CH Ref legal event code: PL Ref country code: SE Ref legal event code: EUG |
|
| REG | Reference to a national code |
Ref country code: NL Ref legal event code: MM Effective date: 20220801 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: SE Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20220724 Ref country code: LI Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20220731 Ref country code: CH Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20220731 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: NL Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20220801 |
|
| REG | Reference to a national code |
Ref country code: DE Ref legal event code: R071 Ref document number: 50309700 Country of ref document: DE |
|
| REG | Reference to a national code |
Ref country code: GB Ref legal event code: PE20 Expiry date: 20230722 |
|
| REG | Reference to a national code |
Ref country code: ES Ref legal event code: FD2A Effective date: 20230831 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: GB Free format text: LAPSE BECAUSE OF EXPIRATION OF PROTECTION Effective date: 20230722 Ref country code: ES Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20220724 |