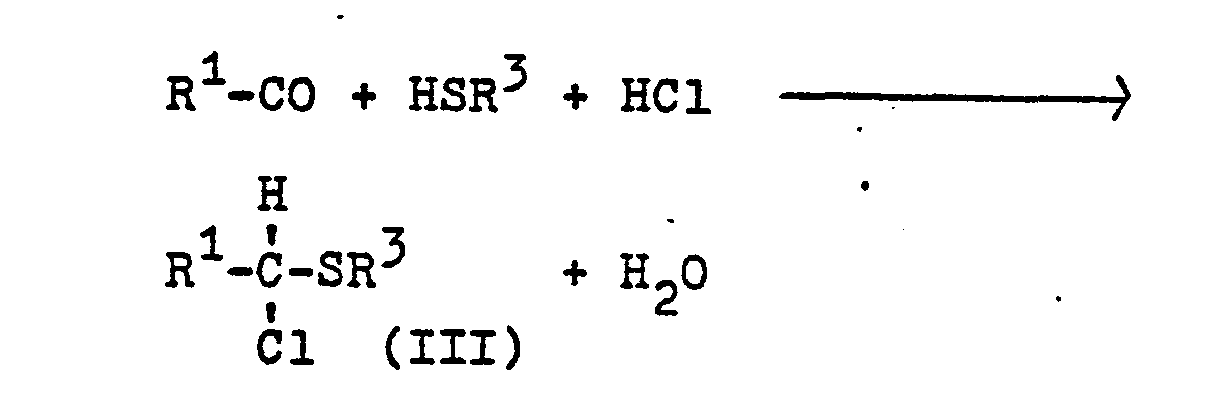EP0000752A2 - Alpha-azolysulfide, -sulfoxide und -sulfone, deren Salze und Metallkomplexe, Verfahren zu ihrer Herstellung, sowie sie enthaltende Mittel zur Pilzbekämpfung - Google Patents
Alpha-azolysulfide, -sulfoxide und -sulfone, deren Salze und Metallkomplexe, Verfahren zu ihrer Herstellung, sowie sie enthaltende Mittel zur Pilzbekämpfung Download PDFInfo
- Publication number
- EP0000752A2 EP0000752A2 EP7878100538A EP78100538A EP0000752A2 EP 0000752 A2 EP0000752 A2 EP 0000752A2 EP 7878100538 A EP7878100538 A EP 7878100538A EP 78100538 A EP78100538 A EP 78100538A EP 0000752 A2 EP0000752 A2 EP 0000752A2
- Authority
- EP
- European Patent Office
- Prior art keywords
- sulfide
- triazol
- chlorophenyl
- methyl
- alkyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 150000003839 salts Chemical class 0.000 title claims abstract description 21
- 229910052751 metal Chemical class 0.000 title claims abstract description 20
- 239000002184 metal Chemical class 0.000 title claims abstract description 20
- 238000000034 method Methods 0.000 title claims description 6
- 238000004519 manufacturing process Methods 0.000 title description 3
- 125000001174 sulfone group Chemical group 0.000 title 1
- -1 tetrazol-2-yl Chemical group 0.000 claims abstract description 52
- 125000000217 alkyl group Chemical group 0.000 claims abstract description 27
- 229910052739 hydrogen Inorganic materials 0.000 claims abstract description 19
- 239000001257 hydrogen Substances 0.000 claims abstract description 19
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims abstract description 13
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims abstract description 13
- 125000003626 1,2,4-triazol-1-yl group Chemical group [*]N1N=C([H])N=C1[H] 0.000 claims abstract description 12
- 125000001401 1,2,4-triazol-4-yl group Chemical group N=1N=C([H])N([*])C=1[H] 0.000 claims abstract description 10
- 125000004523 tetrazol-1-yl group Chemical group N1(N=NN=C1)* 0.000 claims abstract description 10
- 125000003342 alkenyl group Chemical group 0.000 claims abstract description 9
- 125000004453 alkoxycarbonyl group Chemical group 0.000 claims abstract description 9
- 125000003710 aryl alkyl group Chemical group 0.000 claims abstract description 9
- 150000002431 hydrogen Chemical class 0.000 claims abstract description 9
- 125000002962 imidazol-1-yl group Chemical group [*]N1C([H])=NC([H])=C1[H] 0.000 claims abstract description 9
- 125000004353 pyrazol-1-yl group Chemical group [H]C1=NN(*)C([H])=C1[H] 0.000 claims abstract description 9
- 125000000304 alkynyl group Chemical group 0.000 claims abstract description 8
- 125000003107 substituted aryl group Chemical group 0.000 claims abstract description 8
- UCKMPCXJQFINFW-UHFFFAOYSA-N Sulphide Chemical compound [S-2] UCKMPCXJQFINFW-UHFFFAOYSA-N 0.000 claims description 18
- 125000003854 p-chlorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1Cl 0.000 claims description 14
- 241000233866 Fungi Species 0.000 claims description 10
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 9
- 239000003085 diluting agent Substances 0.000 claims description 8
- 239000007787 solid Substances 0.000 claims description 6
- 239000007800 oxidant agent Substances 0.000 claims description 5
- 238000002360 preparation method Methods 0.000 claims description 5
- 239000003795 chemical substances by application Substances 0.000 claims description 4
- 150000003851 azoles Chemical class 0.000 claims description 2
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 claims 3
- YJESWPGXHOCGSX-UHFFFAOYSA-N 1-[(2-chlorophenyl)-(2-phenylethylsulfanyl)methyl]-1,2,4-triazole Chemical compound ClC1=CC=CC=C1C(N1N=CN=C1)SCCC1=CC=CC=C1 YJESWPGXHOCGSX-UHFFFAOYSA-N 0.000 claims 2
- GYQXOZDDGHVRRD-UHFFFAOYSA-N 1-[(2-chlorophenyl)-(4-chlorophenyl)-[(2-chlorophenyl)-(4-chlorophenyl)-imidazol-1-ylmethyl]sulfanylmethyl]imidazole Chemical compound ClC1=CC=C(C=C1)C(N1C=NC=C1)(C1=C(C=CC=C1)Cl)SC(C1=CC=C(C=C1)Cl)(C1=C(C=CC=C1)Cl)N1C=NC=C1 GYQXOZDDGHVRRD-UHFFFAOYSA-N 0.000 claims 2
- LTQTYGZBSHTEOY-UHFFFAOYSA-N 1-[(4-chlorophenyl)-[(4-chlorophenyl)-(4-fluorophenyl)-(1,2,4-triazol-1-yl)methyl]sulfanyl-(4-fluorophenyl)methyl]-1,2,4-triazole Chemical compound C1=CC(F)=CC=C1C(N1N=CN=C1)(C=1C=CC(Cl)=CC=1)SC(N1N=CN=C1)(C=1C=CC(Cl)=CC=1)C1=CC=C(F)C=C1 LTQTYGZBSHTEOY-UHFFFAOYSA-N 0.000 claims 2
- FZYUNQGQYLISSU-UHFFFAOYSA-N 1-[(4-chlorophenyl)-[(4-chlorophenyl)-(4-fluorophenyl)-imidazol-1-ylmethyl]sulfanyl-(4-fluorophenyl)methyl]imidazole Chemical compound ClC1=CC=C(C=C1)C(N1C=NC=C1)(C1=CC=C(C=C1)F)SC(C1=CC=C(C=C1)Cl)(C1=CC=C(C=C1)F)N1C=NC=C1 FZYUNQGQYLISSU-UHFFFAOYSA-N 0.000 claims 2
- QPBLIGOQKFYLSN-UHFFFAOYSA-N 1-[1-(4-chlorophenyl)-1-[1-(4-chlorophenyl)-3,3-dimethyl-1-(1,2,4-triazol-1-yl)butyl]sulfanyl-3,3-dimethylbutyl]-1,2,4-triazole Chemical compound C=1C=C(Cl)C=CC=1C(N1N=CN=C1)(CC(C)(C)C)SC(CC(C)(C)C)(N1N=CN=C1)C1=CC=C(Cl)C=C1 QPBLIGOQKFYLSN-UHFFFAOYSA-N 0.000 claims 2
- HNZWXBKYSRPZCK-UHFFFAOYSA-N ClC1=CC=C(C=C1)C(C(CCCC)CC)(N1N=CN=C1)SC(C(CCCC)CC)(C1=CC=C(C=C1)Cl)N1N=CN=C1 Chemical compound ClC1=CC=C(C=C1)C(C(CCCC)CC)(N1N=CN=C1)SC(C(CCCC)CC)(C1=CC=C(C=C1)Cl)N1N=CN=C1 HNZWXBKYSRPZCK-UHFFFAOYSA-N 0.000 claims 2
- 239000007788 liquid Substances 0.000 claims 2
- RDRKSIJTXUGVRZ-UHFFFAOYSA-N 1-[(4-chlorophenyl)-[(4-chlorophenyl)-imidazol-1-yl-phenylmethyl]sulfanyl-phenylmethyl]imidazole Chemical compound C1=CC(Cl)=CC=C1C(N1C=NC=C1)(C=1C=CC=CC=1)SC(N1C=NC=C1)(C=1C=CC(Cl)=CC=1)C1=CC=CC=C1 RDRKSIJTXUGVRZ-UHFFFAOYSA-N 0.000 claims 1
- GWRCBLYRCURFGA-UHFFFAOYSA-N 1-[1-(4-chlorophenyl)-1-[1-(4-chlorophenyl)-1-imidazol-1-yl-3,3-dimethylbutyl]sulfanyl-3,3-dimethylbutyl]imidazole Chemical compound C=1C=C(Cl)C=CC=1C(N1C=NC=C1)(CC(C)(C)C)SC(CC(C)(C)C)(N1C=NC=C1)C1=CC=C(Cl)C=C1 GWRCBLYRCURFGA-UHFFFAOYSA-N 0.000 claims 1
- PDZBUJITHSIDTD-UHFFFAOYSA-N 1-[[bis(4-chlorophenyl)-imidazol-1-ylmethyl]sulfanyl-bis(4-chlorophenyl)methyl]imidazole Chemical compound ClC1=CC=C(C=C1)C(N1C=NC=C1)(C1=CC=C(C=C1)Cl)SC(C1=CC=C(C=C1)Cl)(C1=CC=C(C=C1)Cl)N1C=NC=C1 PDZBUJITHSIDTD-UHFFFAOYSA-N 0.000 claims 1
- 125000004198 2-fluorophenyl group Chemical group [H]C1=C([H])C(F)=C(*)C([H])=C1[H] 0.000 claims 1
- 239000002689 soil Substances 0.000 claims 1
- 150000003462 sulfoxides Chemical class 0.000 abstract description 6
- 150000003457 sulfones Chemical class 0.000 abstract description 4
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 54
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 42
- 239000000203 mixture Substances 0.000 description 30
- 239000000243 solution Substances 0.000 description 29
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 27
- 150000001875 compounds Chemical class 0.000 description 25
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 24
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 15
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 15
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 15
- 239000004480 active ingredient Substances 0.000 description 15
- 239000013078 crystal Substances 0.000 description 13
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 12
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 12
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 10
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Substances C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 10
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 9
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 9
- 238000005160 1H NMR spectroscopy Methods 0.000 description 8
- ZAFNJMIOTHYJRJ-UHFFFAOYSA-N Diisopropyl ether Chemical compound CC(C)OC(C)C ZAFNJMIOTHYJRJ-UHFFFAOYSA-N 0.000 description 8
- 241000196324 Embryophyta Species 0.000 description 8
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 8
- 238000002844 melting Methods 0.000 description 8
- 230000008018 melting Effects 0.000 description 8
- 229910052757 nitrogen Inorganic materials 0.000 description 8
- 239000012074 organic phase Substances 0.000 description 8
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 7
- 239000000706 filtrate Substances 0.000 description 7
- 239000002904 solvent Substances 0.000 description 7
- 238000003756 stirring Methods 0.000 description 7
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 6
- 241000221785 Erysiphales Species 0.000 description 6
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 6
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 6
- 241000209140 Triticum Species 0.000 description 6
- 235000021307 Triticum Nutrition 0.000 description 6
- 239000006185 dispersion Substances 0.000 description 6
- 239000000417 fungicide Substances 0.000 description 6
- JEIPFZHSYJVQDO-UHFFFAOYSA-N iron(III) oxide Inorganic materials O=[Fe]O[Fe]=O JEIPFZHSYJVQDO-UHFFFAOYSA-N 0.000 description 6
- 229910000027 potassium carbonate Inorganic materials 0.000 description 6
- 238000010992 reflux Methods 0.000 description 6
- 238000005406 washing Methods 0.000 description 6
- NHQDETIJWKXCTC-UHFFFAOYSA-N 3-chloroperbenzoic acid Chemical compound OOC(=O)C1=CC=CC(Cl)=C1 NHQDETIJWKXCTC-UHFFFAOYSA-N 0.000 description 5
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 5
- IAYPIBMASNFSPL-UHFFFAOYSA-N Ethylene oxide Chemical compound C1CO1 IAYPIBMASNFSPL-UHFFFAOYSA-N 0.000 description 5
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 5
- 239000003995 emulsifying agent Substances 0.000 description 5
- 239000000284 extract Substances 0.000 description 5
- 239000003921 oil Substances 0.000 description 5
- 239000000741 silica gel Substances 0.000 description 5
- 229910002027 silica gel Inorganic materials 0.000 description 5
- NSPMIYGKQJPBQR-UHFFFAOYSA-N 4H-1,2,4-triazole Chemical compound C=1N=CNN=1 NSPMIYGKQJPBQR-UHFFFAOYSA-N 0.000 description 4
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 4
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 4
- 240000005979 Hordeum vulgare Species 0.000 description 4
- 235000007340 Hordeum vulgare Nutrition 0.000 description 4
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 4
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 4
- 238000005481 NMR spectroscopy Methods 0.000 description 4
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 4
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 4
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 4
- ATJFFYVFTNAWJD-UHFFFAOYSA-N Tin Chemical compound [Sn] ATJFFYVFTNAWJD-UHFFFAOYSA-N 0.000 description 4
- 238000006243 chemical reaction Methods 0.000 description 4
- ORTQZVOHEJQUHG-UHFFFAOYSA-L copper(II) chloride Chemical compound Cl[Cu]Cl ORTQZVOHEJQUHG-UHFFFAOYSA-L 0.000 description 4
- 239000000839 emulsion Substances 0.000 description 4
- 230000000855 fungicidal effect Effects 0.000 description 4
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 4
- 229910052759 nickel Inorganic materials 0.000 description 4
- 125000003261 o-tolyl group Chemical group [H]C1=C([H])C(*)=C(C([H])=C1[H])C([H])([H])[H] 0.000 description 4
- 239000000843 powder Substances 0.000 description 4
- 159000000000 sodium salts Chemical class 0.000 description 4
- 229910052938 sodium sulfate Inorganic materials 0.000 description 4
- 235000011152 sodium sulphate Nutrition 0.000 description 4
- 238000005507 spraying Methods 0.000 description 4
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 4
- 150000003568 thioethers Chemical class 0.000 description 4
- 229910052718 tin Inorganic materials 0.000 description 4
- 229910052725 zinc Inorganic materials 0.000 description 4
- 239000011701 zinc Substances 0.000 description 4
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- 241001480061 Blumeria graminis Species 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- JRNVZBWKYDBUCA-UHFFFAOYSA-N N-chlorosuccinimide Chemical compound ClN1C(=O)CCC1=O JRNVZBWKYDBUCA-UHFFFAOYSA-N 0.000 description 3
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 3
- 150000001450 anions Chemical class 0.000 description 3
- 239000002585 base Substances 0.000 description 3
- 239000004359 castor oil Substances 0.000 description 3
- 235000019438 castor oil Nutrition 0.000 description 3
- 125000004218 chloromethyl group Chemical group [H]C([H])(Cl)* 0.000 description 3
- 229910017052 cobalt Inorganic materials 0.000 description 3
- 239000010941 cobalt Substances 0.000 description 3
- GUTLYIVDDKVIGB-UHFFFAOYSA-N cobalt atom Chemical compound [Co] GUTLYIVDDKVIGB-UHFFFAOYSA-N 0.000 description 3
- 239000000470 constituent Substances 0.000 description 3
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 3
- 238000009472 formulation Methods 0.000 description 3
- ZEMPKEQAKRGZGQ-XOQCFJPHSA-N glycerol triricinoleate Natural products CCCCCC[C@@H](O)CC=CCCCCCCCC(=O)OC[C@@H](COC(=O)CCCCCCCC=CC[C@@H](O)CCCCCC)OC(=O)CCCCCCCC=CC[C@H](O)CCCCCC ZEMPKEQAKRGZGQ-XOQCFJPHSA-N 0.000 description 3
- 229910052742 iron Inorganic materials 0.000 description 3
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 3
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 3
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 3
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 3
- 230000003647 oxidation Effects 0.000 description 3
- 238000007254 oxidation reaction Methods 0.000 description 3
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 3
- 235000017557 sodium bicarbonate Nutrition 0.000 description 3
- 239000000725 suspension Substances 0.000 description 3
- 238000004809 thin layer chromatography Methods 0.000 description 3
- 239000011135 tin Substances 0.000 description 3
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 2
- BUTDHMPBEDTZQT-UHFFFAOYSA-N 1-[tert-butylsulfanyl-(2,4-dichlorophenyl)methyl]-1,2,4-triazole Chemical compound C1=NC=NN1C(SC(C)(C)C)C1=CC=C(Cl)C=C1Cl BUTDHMPBEDTZQT-UHFFFAOYSA-N 0.000 description 2
- 125000004201 2,4-dichlorophenyl group Chemical group [H]C1=C([H])C(*)=C(Cl)C([H])=C1Cl 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- WBIQQQGBSDOWNP-UHFFFAOYSA-N 2-dodecylbenzenesulfonic acid Chemical compound CCCCCCCCCCCCC1=CC=CC=C1S(O)(=O)=O WBIQQQGBSDOWNP-UHFFFAOYSA-N 0.000 description 2
- 125000004189 3,4-dichlorophenyl group Chemical group [H]C1=C([H])C(Cl)=C(Cl)C([H])=C1* 0.000 description 2
- YPJZCDIIIPXONL-UHFFFAOYSA-N 5-[tert-butylsulfinyl-(4-chlorophenyl)methyl]-1h-1,2,4-triazole Chemical compound C=1C=C(Cl)C=CC=1C(S(=O)C(C)(C)C)C1=NC=NN1 YPJZCDIIIPXONL-UHFFFAOYSA-N 0.000 description 2
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 2
- 240000007154 Coffea arabica Species 0.000 description 2
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 2
- 229910021592 Copper(II) chloride Inorganic materials 0.000 description 2
- 240000008067 Cucumis sativus Species 0.000 description 2
- 235000009849 Cucumis sativus Nutrition 0.000 description 2
- 240000009088 Fragaria x ananassa Species 0.000 description 2
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 2
- 238000005684 Liebig rearrangement reaction Methods 0.000 description 2
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 2
- 229910002651 NO3 Inorganic materials 0.000 description 2
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 2
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 2
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 2
- KFSLWBXXFJQRDL-UHFFFAOYSA-N Peracetic acid Chemical compound CC(=O)OO KFSLWBXXFJQRDL-UHFFFAOYSA-N 0.000 description 2
- 244000046052 Phaseolus vulgaris Species 0.000 description 2
- 235000010627 Phaseolus vulgaris Nutrition 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- 240000000111 Saccharum officinarum Species 0.000 description 2
- 235000007201 Saccharum officinarum Nutrition 0.000 description 2
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 2
- 229920001807 Urea-formaldehyde Polymers 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- 235000012211 aluminium silicate Nutrition 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 229910021529 ammonia Inorganic materials 0.000 description 2
- 238000009835 boiling Methods 0.000 description 2
- 159000000007 calcium salts Chemical class 0.000 description 2
- CSNJTIWCTNEOSW-UHFFFAOYSA-N carbamothioylsulfanyl carbamodithioate Chemical compound NC(=S)SSC(N)=S CSNJTIWCTNEOSW-UHFFFAOYSA-N 0.000 description 2
- 229910052799 carbon Inorganic materials 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 235000013339 cereals Nutrition 0.000 description 2
- NEHMKBQYUWJMIP-UHFFFAOYSA-N chloromethane Chemical compound ClC NEHMKBQYUWJMIP-UHFFFAOYSA-N 0.000 description 2
- 235000016213 coffee Nutrition 0.000 description 2
- 235000013353 coffee beverage Nutrition 0.000 description 2
- 229940125904 compound 1 Drugs 0.000 description 2
- 229940126214 compound 3 Drugs 0.000 description 2
- 229910052802 copper Inorganic materials 0.000 description 2
- 239000010949 copper Substances 0.000 description 2
- 238000002425 crystallisation Methods 0.000 description 2
- 230000008025 crystallization Effects 0.000 description 2
- JHIVVAPYMSGYDF-UHFFFAOYSA-N cyclohexanone Chemical compound O=C1CCCCC1 JHIVVAPYMSGYDF-UHFFFAOYSA-N 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 239000002270 dispersing agent Substances 0.000 description 2
- 239000012990 dithiocarbamate Substances 0.000 description 2
- 229940060296 dodecylbenzenesulfonic acid Drugs 0.000 description 2
- 238000001035 drying Methods 0.000 description 2
- 238000000605 extraction Methods 0.000 description 2
- 150000002191 fatty alcohols Chemical class 0.000 description 2
- 239000008187 granular material Substances 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 2
- 229910000041 hydrogen chloride Inorganic materials 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- ZXEKIIBDNHEJCQ-UHFFFAOYSA-N isobutanol Chemical compound CC(C)CO ZXEKIIBDNHEJCQ-UHFFFAOYSA-N 0.000 description 2
- WPBNNNQJVZRUHP-UHFFFAOYSA-L manganese(2+);methyl n-[[2-(methoxycarbonylcarbamothioylamino)phenyl]carbamothioyl]carbamate;n-[2-(sulfidocarbothioylamino)ethyl]carbamodithioate Chemical compound [Mn+2].[S-]C(=S)NCCNC([S-])=S.COC(=O)NC(=S)NC1=CC=CC=C1NC(=S)NC(=O)OC WPBNNNQJVZRUHP-UHFFFAOYSA-L 0.000 description 2
- 150000002739 metals Chemical class 0.000 description 2
- 125000001160 methoxycarbonyl group Chemical group [H]C([H])([H])OC(*)=O 0.000 description 2
- 239000002480 mineral oil Substances 0.000 description 2
- 235000010446 mineral oil Nutrition 0.000 description 2
- 125000003136 n-heptyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 239000003960 organic solvent Substances 0.000 description 2
- 125000000636 p-nitrophenyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)[N+]([O-])=O 0.000 description 2
- 239000006072 paste Substances 0.000 description 2
- 239000012312 sodium hydride Substances 0.000 description 2
- 229910000104 sodium hydride Inorganic materials 0.000 description 2
- GEHJYWRUCIMESM-UHFFFAOYSA-L sodium sulfite Chemical compound [Na+].[Na+].[O-]S([O-])=O GEHJYWRUCIMESM-UHFFFAOYSA-L 0.000 description 2
- 235000021012 strawberries Nutrition 0.000 description 2
- 229910052717 sulfur Inorganic materials 0.000 description 2
- 238000012360 testing method Methods 0.000 description 2
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 2
- 239000008096 xylene Substances 0.000 description 2
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 1
- VGJLTQKULDFCMM-UHFFFAOYSA-N 1-[1-[1,2-bis(2,4-dichlorophenyl)-1-(1,2,4-triazol-1-yl)ethyl]sulfanyl-1,2-bis(2,4-dichlorophenyl)ethyl]-1,2,4-triazole Chemical compound ClC1=CC(Cl)=CC=C1CC(N1N=CN=C1)(C=1C(=CC(Cl)=CC=1)Cl)SC(N1N=CN=C1)(C=1C(=CC(Cl)=CC=1)Cl)CC1=CC=C(Cl)C=C1Cl VGJLTQKULDFCMM-UHFFFAOYSA-N 0.000 description 1
- QXNNVFZIJHERRC-UHFFFAOYSA-N 1-[tert-butylsulfanyl(chloro)methyl]-2,4-dichlorobenzene Chemical compound CC(C)(C)SC(Cl)C1=CC=C(Cl)C=C1Cl QXNNVFZIJHERRC-UHFFFAOYSA-N 0.000 description 1
- URJADUQFXYQUGQ-UHFFFAOYSA-N 1-[tert-butylsulfanyl-(4-chlorophenyl)methyl]-1,2,4-triazole Chemical compound C1=NC=NN1C(SC(C)(C)C)C1=CC=C(Cl)C=C1 URJADUQFXYQUGQ-UHFFFAOYSA-N 0.000 description 1
- YIKWKLYQRFRGPM-UHFFFAOYSA-N 1-dodecylguanidine acetate Chemical compound CC(O)=O.CCCCCCCCCCCCN=C(N)N YIKWKLYQRFRGPM-UHFFFAOYSA-N 0.000 description 1
- KBLAMUYRMZPYLS-UHFFFAOYSA-N 2,3-bis(2-methylpropyl)naphthalene-1-sulfonic acid Chemical compound C1=CC=C2C(S(O)(=O)=O)=C(CC(C)C)C(CC(C)C)=CC2=C1 KBLAMUYRMZPYLS-UHFFFAOYSA-N 0.000 description 1
- SVPKNMBRVBMTLB-UHFFFAOYSA-N 2,3-dichloronaphthalene-1,4-dione Chemical compound C1=CC=C2C(=O)C(Cl)=C(Cl)C(=O)C2=C1 SVPKNMBRVBMTLB-UHFFFAOYSA-N 0.000 description 1
- LIBKURLVAUYWKV-UHFFFAOYSA-N 2,4-dichloro-1-(chloromethylsulfanylmethyl)benzene Chemical compound ClCSCC1=CC=C(Cl)C=C1Cl LIBKURLVAUYWKV-UHFFFAOYSA-N 0.000 description 1
- XEPBBUCQCXXTGR-UHFFFAOYSA-N 2,5-dimethyl-n-phenylfuran-3-carboxamide Chemical compound O1C(C)=CC(C(=O)NC=2C=CC=CC=2)=C1C XEPBBUCQCXXTGR-UHFFFAOYSA-N 0.000 description 1
- YTOPFCCWCSOHFV-UHFFFAOYSA-N 2,6-dimethyl-4-tridecylmorpholine Chemical compound CCCCCCCCCCCCCN1CC(C)OC(C)C1 YTOPFCCWCSOHFV-UHFFFAOYSA-N 0.000 description 1
- NFAOATPOYUWEHM-UHFFFAOYSA-N 2-(6-methylheptyl)phenol Chemical compound CC(C)CCCCCC1=CC=CC=C1O NFAOATPOYUWEHM-UHFFFAOYSA-N 0.000 description 1
- UPTVJAJPBGIRLZ-UHFFFAOYSA-N 2-(trichloromethylsulfanyl)-3a,4,5,7a-tetrahydroisoindole-1,3-dione Chemical compound C1CC=CC2C(=O)N(SC(Cl)(Cl)Cl)C(=O)C21 UPTVJAJPBGIRLZ-UHFFFAOYSA-N 0.000 description 1
- QRNATDQRFAUDKF-UHFFFAOYSA-N 2-carbamothioylsulfanylethyl carbamodithioate Chemical compound NC(=S)SCCSC(N)=S QRNATDQRFAUDKF-UHFFFAOYSA-N 0.000 description 1
- QSZOMCLHJKGKED-UHFFFAOYSA-N 2-carbamothioylsulfanylpropyl carbamodithioate Chemical compound NC(=S)SC(C)CSC(N)=S QSZOMCLHJKGKED-UHFFFAOYSA-N 0.000 description 1
- 125000004182 2-chlorophenyl group Chemical group [H]C1=C([H])C(Cl)=C(*)C([H])=C1[H] 0.000 description 1
- IQUPABOKLQSFBK-UHFFFAOYSA-N 2-nitrophenol Chemical class OC1=CC=CC=C1[N+]([O-])=O IQUPABOKLQSFBK-UHFFFAOYSA-N 0.000 description 1
- 125000000094 2-phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- 125000001494 2-propynyl group Chemical group [H]C#CC([H])([H])* 0.000 description 1
- ZRDUSMYWDRPZRM-UHFFFAOYSA-N 2-sec-butyl-4,6-dinitrophenyl 3-methylbut-2-enoate Chemical group CCC(C)C1=CC([N+]([O-])=O)=CC([N+]([O-])=O)=C1OC(=O)C=C(C)C ZRDUSMYWDRPZRM-UHFFFAOYSA-N 0.000 description 1
- QUFMWWCQUFBERM-UHFFFAOYSA-N 2-tert-butylsulfanyl-1,3-dichloro-4-(chloromethyl)benzene Chemical compound ClCC=1C(=C(C(=CC=1)Cl)SC(C)(C)C)Cl QUFMWWCQUFBERM-UHFFFAOYSA-N 0.000 description 1
- 125000006512 3,4-dichlorobenzyl group Chemical group [H]C1=C(Cl)C(Cl)=C([H])C(=C1[H])C([H])([H])* 0.000 description 1
- FOGYNLXERPKEGN-UHFFFAOYSA-N 3-(2-hydroxy-3-methoxyphenyl)-2-[2-methoxy-4-(3-sulfopropyl)phenoxy]propane-1-sulfonic acid Chemical compound COC1=CC=CC(CC(CS(O)(=O)=O)OC=2C(=CC(CCCS(O)(=O)=O)=CC=2)OC)=C1O FOGYNLXERPKEGN-UHFFFAOYSA-N 0.000 description 1
- YNJSNEKCXVFDKW-UHFFFAOYSA-N 3-(5-amino-1h-indol-3-yl)-2-azaniumylpropanoate Chemical compound C1=C(N)C=C2C(CC(N)C(O)=O)=CNC2=C1 YNJSNEKCXVFDKW-UHFFFAOYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- BUQNPHOBMVKITJ-UHFFFAOYSA-N 3-chlorobenzenecarboperoxoic acid;dichloromethane Chemical compound ClCCl.OOC(=O)C1=CC=CC(Cl)=C1 BUQNPHOBMVKITJ-UHFFFAOYSA-N 0.000 description 1
- 125000006495 3-trifluoromethyl benzyl group Chemical group [H]C1=C([H])C(=C([H])C(=C1[H])C([H])([H])*)C(F)(F)F 0.000 description 1
- CDIJOYCNNFLOAX-UHFFFAOYSA-N 4-(trichloromethylsulfanyl)isoindole-1,3-dione Chemical compound ClC(Cl)(Cl)SC1=CC=CC2=C1C(=O)NC2=O CDIJOYCNNFLOAX-UHFFFAOYSA-N 0.000 description 1
- OOTHTARUZHONSW-UHFFFAOYSA-N 4-[(2-chlorophenyl)hydrazinylidene]-3-methyl-1,2-oxazol-5-one Chemical compound CC1=NOC(=O)C1=NNC1=CC=CC=C1Cl OOTHTARUZHONSW-UHFFFAOYSA-N 0.000 description 1
- 125000006281 4-bromobenzyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1Br)C([H])([H])* 0.000 description 1
- 125000004800 4-bromophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1Br 0.000 description 1
- 125000006283 4-chlorobenzyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1Cl)C([H])([H])* 0.000 description 1
- 125000004801 4-cyanophenyl group Chemical group [H]C1=C([H])C(C#N)=C([H])C([H])=C1* 0.000 description 1
- 125000001255 4-fluorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1F 0.000 description 1
- 125000004172 4-methoxyphenyl group Chemical group [H]C1=C([H])C(OC([H])([H])[H])=C([H])C([H])=C1* 0.000 description 1
- 125000004199 4-trifluoromethylphenyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)C(F)(F)F 0.000 description 1
- MXGKKZZFPCDENK-UHFFFAOYSA-N 5-[2-(2,4-dichlorophenyl)-1-[2-(2,4-dichlorophenyl)-1-(1H-1,2,4-triazol-5-yl)ethyl]sulfanylethyl]-1H-1,2,4-triazole Chemical compound ClC1=C(CC(C2=NNC=N2)SC(CC2=C(C=C(C=C2)Cl)Cl)C2=NNC=N2)C=CC(=C1)Cl MXGKKZZFPCDENK-UHFFFAOYSA-N 0.000 description 1
- CHYMQLYOKFCNDL-UHFFFAOYSA-N 5-[tert-butylsulfanyl-(2,6-dichlorophenyl)methyl]-1H-pyrazole Chemical compound ClC=1C=CC=C(Cl)C=1C(SC(C)(C)C)C1=CC=NN1 CHYMQLYOKFCNDL-UHFFFAOYSA-N 0.000 description 1
- RVGUGOATHLSTGV-UHFFFAOYSA-N 5-[tert-butylsulfanyl-(4-chlorophenyl)methyl]-1h-1,2,4-triazole Chemical compound C=1C=C(Cl)C=CC=1C(SC(C)(C)C)C1=NC=NN1 RVGUGOATHLSTGV-UHFFFAOYSA-N 0.000 description 1
- 239000005725 8-Hydroxyquinoline Substances 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 239000005995 Aluminium silicate Substances 0.000 description 1
- 241000235349 Ascomycota Species 0.000 description 1
- 235000007319 Avena orientalis Nutrition 0.000 description 1
- 244000075850 Avena orientalis Species 0.000 description 1
- 241000221198 Basidiomycota Species 0.000 description 1
- 239000005739 Bordeaux mixture Substances 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- REEFSLKDEDEWAO-UHFFFAOYSA-N Chloraniformethan Chemical compound ClC1=CC=C(NC(NC=O)C(Cl)(Cl)Cl)C=C1Cl REEFSLKDEDEWAO-UHFFFAOYSA-N 0.000 description 1
- IBKVWWFUDFWBTB-UHFFFAOYSA-N Cl.CC1=C(C=CC=C1)C(N1C=NC=C1)SC(C)(C)C Chemical compound Cl.CC1=C(C=CC=C1)C(N1C=NC=C1)SC(C)(C)C IBKVWWFUDFWBTB-UHFFFAOYSA-N 0.000 description 1
- IIUZTXTZRGLYTI-UHFFFAOYSA-N Dihydrogriseofulvin Natural products COC1CC(=O)CC(C)C11C(=O)C(C(OC)=CC(OC)=C2Cl)=C2O1 IIUZTXTZRGLYTI-UHFFFAOYSA-N 0.000 description 1
- HDWLUGYOLUHEMN-UHFFFAOYSA-N Dinobuton Chemical group CCC(C)C1=CC([N+]([O-])=O)=CC([N+]([O-])=O)=C1OC(=O)OC(C)C HDWLUGYOLUHEMN-UHFFFAOYSA-N 0.000 description 1
- 241000510928 Erysiphe necator Species 0.000 description 1
- BDAGIHXWWSANSR-UHFFFAOYSA-M Formate Chemical compound [O-]C=O BDAGIHXWWSANSR-UHFFFAOYSA-M 0.000 description 1
- 241001295925 Gegenes Species 0.000 description 1
- DYMNZCGFRHLNMT-UHFFFAOYSA-N Glyodin Chemical compound CC(O)=O.CCCCCCCCCCCCCCCCCC1=NCCN1 DYMNZCGFRHLNMT-UHFFFAOYSA-N 0.000 description 1
- UXWOXTQWVMFRSE-UHFFFAOYSA-N Griseoviridin Natural products O=C1OC(C)CC=C(C(NCC=CC=CC(O)CC(O)C2)=O)SCC1NC(=O)C1=COC2=N1 UXWOXTQWVMFRSE-UHFFFAOYSA-N 0.000 description 1
- 241001181532 Hemileia vastatrix Species 0.000 description 1
- 235000011430 Malus pumila Nutrition 0.000 description 1
- 244000070406 Malus silvestris Species 0.000 description 1
- 235000015103 Malus silvestris Nutrition 0.000 description 1
- MZNCVTCEYXDDIS-UHFFFAOYSA-N Mebenil Chemical compound CC1=CC=CC=C1C(=O)NC1=CC=CC=C1 MZNCVTCEYXDDIS-UHFFFAOYSA-N 0.000 description 1
- 208000031888 Mycoses Diseases 0.000 description 1
- DDUHZTYCFQRHIY-UHFFFAOYSA-N Negwer: 6874 Natural products COC1=CC(=O)CC(C)C11C(=O)C(C(OC)=CC(OC)=C2Cl)=C2O1 DDUHZTYCFQRHIY-UHFFFAOYSA-N 0.000 description 1
- 0 O=C1C=CC*1Cl Chemical compound O=C1C=CC*1Cl 0.000 description 1
- 240000007594 Oryza sativa Species 0.000 description 1
- 235000007164 Oryza sativa Nutrition 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 239000005662 Paraffin oil Substances 0.000 description 1
- 231100000674 Phytotoxicity Toxicity 0.000 description 1
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 239000004743 Polypropylene Substances 0.000 description 1
- 241000221300 Puccinia Species 0.000 description 1
- 241001123569 Puccinia recondita Species 0.000 description 1
- 241000221535 Pucciniales Species 0.000 description 1
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 1
- 241000209056 Secale Species 0.000 description 1
- 235000007238 Secale cereale Nutrition 0.000 description 1
- 241000226724 Sporisorium scitamineum Species 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-N Sulfurous acid Chemical compound OS(O)=O LSNNMFCWUKXFEE-UHFFFAOYSA-N 0.000 description 1
- BABJTMNVJXLAEX-UHFFFAOYSA-N Triamiphos Chemical compound N1=C(N)N(P(=O)(N(C)C)N(C)C)N=C1C1=CC=CC=C1 BABJTMNVJXLAEX-UHFFFAOYSA-N 0.000 description 1
- 241000221577 Uromyces appendiculatus Species 0.000 description 1
- 241000544594 Uromyces viciae-fabae Species 0.000 description 1
- 240000006365 Vitis vinifera Species 0.000 description 1
- 235000014787 Vitis vinifera Nutrition 0.000 description 1
- 240000008042 Zea mays Species 0.000 description 1
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 1
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 1
- XBRCHRPDMJSYMU-UHFFFAOYSA-N [Na].N1=NC=CC=C1.CN(C1=CC=CC=C1)C Chemical compound [Na].N1=NC=CC=C1.CN(C1=CC=CC=C1)C XBRCHRPDMJSYMU-UHFFFAOYSA-N 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 125000006193 alkinyl group Chemical group 0.000 description 1
- 150000008055 alkyl aryl sulfonates Chemical class 0.000 description 1
- 229940045714 alkyl sulfonate alkylating agent Drugs 0.000 description 1
- 150000008052 alkyl sulfonates Chemical class 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- JDXKTOBMLZLCSB-UHFFFAOYSA-N anilinothiourea Chemical compound NC(=S)NNC1=CC=CC=C1 JDXKTOBMLZLCSB-UHFFFAOYSA-N 0.000 description 1
- 125000000129 anionic group Chemical group 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 239000002969 artificial stone Substances 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- LJOZMWRYMKECFF-UHFFFAOYSA-N benodanil Chemical compound IC1=CC=CC=C1C(=O)NC1=CC=CC=C1 LJOZMWRYMKECFF-UHFFFAOYSA-N 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- NBNTWDUNCHRWMT-UHFFFAOYSA-N bis(4-chlorophenyl)-pyridin-3-ylmethanol Chemical compound C=1C=C(Cl)C=CC=1C(C=1C=NC=CC=1)(O)C1=CC=C(Cl)C=C1 NBNTWDUNCHRWMT-UHFFFAOYSA-N 0.000 description 1
- 235000013532 brandy Nutrition 0.000 description 1
- 150000001649 bromium compounds Chemical class 0.000 description 1
- TWFZGCMQGLPBSX-UHFFFAOYSA-N carbendazim Chemical compound C1=CC=C2NC(NC(=O)OC)=NC2=C1 TWFZGCMQGLPBSX-UHFFFAOYSA-N 0.000 description 1
- 150000001721 carbon Chemical group 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 238000005660 chlorination reaction Methods 0.000 description 1
- KRIFIIWBVJKVST-UHFFFAOYSA-N chloro(chloromethylsulfanyl)methane Chemical compound ClCSCCl KRIFIIWBVJKVST-UHFFFAOYSA-N 0.000 description 1
- 150000008422 chlorobenzenes Chemical class 0.000 description 1
- PFIADAMVCJPXSF-UHFFFAOYSA-N chloroneb Chemical compound COC1=CC(Cl)=C(OC)C=C1Cl PFIADAMVCJPXSF-UHFFFAOYSA-N 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 229940125782 compound 2 Drugs 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 150000001879 copper Chemical class 0.000 description 1
- 235000005822 corn Nutrition 0.000 description 1
- 244000038559 crop plants Species 0.000 description 1
- HPXRVTGHNJAIIH-UHFFFAOYSA-N cyclohexanol Chemical compound OC1CCCCC1 HPXRVTGHNJAIIH-UHFFFAOYSA-N 0.000 description 1
- 150000004683 dihydrates Chemical class 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- CJHXCRMKMMBYJQ-UHFFFAOYSA-N dimethirimol Chemical compound CCCCC1=C(C)NC(N(C)C)=NC1=O CJHXCRMKMMBYJQ-UHFFFAOYSA-N 0.000 description 1
- POLCUAVZOMRGSN-UHFFFAOYSA-N dipropyl ether Chemical compound CCCOCCC POLCUAVZOMRGSN-UHFFFAOYSA-N 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 1
- 150000004659 dithiocarbamates Chemical class 0.000 description 1
- YRIUSKIDOIARQF-UHFFFAOYSA-N dodecyl benzenesulfonate Chemical class CCCCCCCCCCCCOS(=O)(=O)C1=CC=CC=C1 YRIUSKIDOIARQF-UHFFFAOYSA-N 0.000 description 1
- GJPICBWGIJYLCB-UHFFFAOYSA-N dodecyl phenylmethanesulfonate Chemical compound CCCCCCCCCCCCOS(=O)(=O)CC1=CC=CC=C1 GJPICBWGIJYLCB-UHFFFAOYSA-N 0.000 description 1
- JMXKCYUTURMERF-UHFFFAOYSA-N dodemorph Chemical compound C1C(C)OC(C)CN1C1CCCCCCCCCCC1 JMXKCYUTURMERF-UHFFFAOYSA-N 0.000 description 1
- 239000000428 dust Substances 0.000 description 1
- 238000010410 dusting Methods 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 239000003480 eluent Substances 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 239000003337 fertilizer Substances 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 125000002485 formyl group Chemical class [H]C(*)=O 0.000 description 1
- 239000012458 free base Substances 0.000 description 1
- 230000002464 fungitoxic effect Effects 0.000 description 1
- 229960002867 griseofulvin Drugs 0.000 description 1
- DDUHZTYCFQRHIY-RBHXEPJQSA-N griseofulvin Chemical compound COC1=CC(=O)C[C@@H](C)[C@@]11C(=O)C(C(OC)=CC(OC)=C2Cl)=C2O1 DDUHZTYCFQRHIY-RBHXEPJQSA-N 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 239000003630 growth substance Substances 0.000 description 1
- 239000004009 herbicide Substances 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- CKAPSXZOOQJIBF-UHFFFAOYSA-N hexachlorobenzene Chemical compound ClC1=C(Cl)C(Cl)=C(Cl)C(Cl)=C1Cl CKAPSXZOOQJIBF-UHFFFAOYSA-N 0.000 description 1
- 238000003898 horticulture Methods 0.000 description 1
- 150000003840 hydrochlorides Chemical class 0.000 description 1
- 150000002460 imidazoles Chemical class 0.000 description 1
- 150000002484 inorganic compounds Chemical class 0.000 description 1
- 229910010272 inorganic material Inorganic materials 0.000 description 1
- 239000002917 insecticide Substances 0.000 description 1
- 229940079865 intestinal antiinfectives imidazole derivative Drugs 0.000 description 1
- NLYAJNPCOHFWQQ-UHFFFAOYSA-N kaolin Chemical compound O.O.O=[Al]O[Si](=O)O[Si](=O)O[Al]=O NLYAJNPCOHFWQQ-UHFFFAOYSA-N 0.000 description 1
- 229920005610 lignin Polymers 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 229940050176 methyl chloride Drugs 0.000 description 1
- HAMGRBXTJNITHG-UHFFFAOYSA-N methyl isocyanate Chemical compound CN=C=O HAMGRBXTJNITHG-UHFFFAOYSA-N 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- OYRIKLVYHTWHCZ-UHFFFAOYSA-N n-cyclohexyl-2,5-dimethylfuran-3-carboxamide Chemical compound O1C(C)=CC(C(=O)NC2CCCCC2)=C1C OYRIKLVYHTWHCZ-UHFFFAOYSA-N 0.000 description 1
- 150000002823 nitrates Chemical class 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid group Chemical group C(CCCCCCC\C=C/CCCCCCCC)(=O)O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 150000003891 oxalate salts Chemical class 0.000 description 1
- AMEKQAFGQBKLKX-UHFFFAOYSA-N oxycarboxin Chemical compound O=S1(=O)CCOC(C)=C1C(=O)NC1=CC=CC=C1 AMEKQAFGQBKLKX-UHFFFAOYSA-N 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 229960003540 oxyquinoline Drugs 0.000 description 1
- 125000001037 p-tolyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)C([H])([H])[H] 0.000 description 1
- LKPLKUMXSAEKID-UHFFFAOYSA-N pentachloronitrobenzene Chemical compound [O-][N+](=O)C1=C(Cl)C(Cl)=C(Cl)C(Cl)=C1Cl LKPLKUMXSAEKID-UHFFFAOYSA-N 0.000 description 1
- 230000000737 periodic effect Effects 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- 235000021317 phosphate Nutrition 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 230000003032 phytopathogenic effect Effects 0.000 description 1
- 238000005554 pickling Methods 0.000 description 1
- KNCYXPMJDCCGSJ-UHFFFAOYSA-N piperidine-2,6-dione Chemical compound O=C1CCCC(=O)N1 KNCYXPMJDCCGSJ-UHFFFAOYSA-N 0.000 description 1
- 230000008635 plant growth Effects 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 229920000151 polyglycol Polymers 0.000 description 1
- 239000010695 polyglycol Substances 0.000 description 1
- 229920001155 polypropylene Polymers 0.000 description 1
- 239000012286 potassium permanganate Substances 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 239000001294 propane Substances 0.000 description 1
- 239000011814 protection agent Substances 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- FGVVTMRZYROCTH-UHFFFAOYSA-N pyridine-2-thiol N-oxide Chemical compound [O-][N+]1=CC=CC=C1S FGVVTMRZYROCTH-UHFFFAOYSA-N 0.000 description 1
- MCJGNVYPOGVAJF-UHFFFAOYSA-N quinolin-8-ol Chemical compound C1=CN=C2C(O)=CC=CC2=C1 MCJGNVYPOGVAJF-UHFFFAOYSA-N 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 235000009566 rice Nutrition 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 150000004760 silicates Chemical class 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 235000010265 sodium sulphite Nutrition 0.000 description 1
- NVMNEWNGLGACBB-UHFFFAOYSA-N sodium;1,2-diaza-4-azanidacyclopenta-2,5-diene Chemical compound [Na+].C=1N=C[N-]N=1 NVMNEWNGLGACBB-UHFFFAOYSA-N 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 239000004575 stone Substances 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- BDHFUVZGWQCTTF-UHFFFAOYSA-M sulfonate Chemical compound [O-]S(=O)=O BDHFUVZGWQCTTF-UHFFFAOYSA-M 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- 125000004434 sulfur atom Chemical group 0.000 description 1
- 150000003467 sulfuric acid derivatives Chemical class 0.000 description 1
- 239000001117 sulphuric acid Substances 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 150000003536 tetrazoles Chemical class 0.000 description 1
- 150000003573 thiols Chemical class 0.000 description 1
- YFNCATAIYKQPOO-UHFFFAOYSA-N thiophanate Chemical compound CCOC(=O)NC(=S)NC1=CC=CC=C1NC(=S)NC(=O)OCC YFNCATAIYKQPOO-UHFFFAOYSA-N 0.000 description 1
- QGHREAKMXXNCOA-UHFFFAOYSA-N thiophanate-methyl Chemical compound COC(=O)NC(=S)NC1=CC=CC=C1NC(=S)NC(=O)OC QGHREAKMXXNCOA-UHFFFAOYSA-N 0.000 description 1
- ILERPRJWJPJZDN-UHFFFAOYSA-N thioquinox Chemical compound C1=CC=C2N=C(SC(=S)S3)C3=NC2=C1 ILERPRJWJPJZDN-UHFFFAOYSA-N 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 150000003852 triazoles Chemical class 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- 239000002699 waste material Substances 0.000 description 1
- MAZZTUAWFTWGKB-UHFFFAOYSA-L zinc ethane-1,2-diamine manganese(2+) dicarbamodithioate Chemical compound [Mn+2].[Zn+2].NCCN.NC([S-])=S.NC([S-])=S MAZZTUAWFTWGKB-UHFFFAOYSA-L 0.000 description 1
- DUBNHZYBDBBJHD-UHFFFAOYSA-L ziram Chemical compound [Zn+2].CN(C)C([S-])=S.CN(C)C([S-])=S DUBNHZYBDBBJHD-UHFFFAOYSA-L 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D257/00—Heterocyclic compounds containing rings having four nitrogen atoms as the only ring hetero atoms
- C07D257/02—Heterocyclic compounds containing rings having four nitrogen atoms as the only ring hetero atoms not condensed with other rings
- C07D257/04—Five-membered rings
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N43/00—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds
- A01N43/48—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with two nitrogen atoms as the only ring hetero atoms
- A01N43/50—1,3-Diazoles; Hydrogenated 1,3-diazoles
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N43/00—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds
- A01N43/48—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with two nitrogen atoms as the only ring hetero atoms
- A01N43/58—1,2-Diazines; Hydrogenated 1,2-diazines
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N43/00—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds
- A01N43/64—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with three nitrogen atoms as the only ring hetero atoms
- A01N43/647—Triazoles; Hydrogenated triazoles
- A01N43/653—1,2,4-Triazoles; Hydrogenated 1,2,4-triazoles
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N43/00—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds
- A01N43/713—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with four or more nitrogen atoms as the only ring hetero atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D231/00—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings
- C07D231/02—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings
- C07D231/10—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D231/12—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/54—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members
- C07D233/56—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with only hydrogen atoms or radicals containing only hydrogen and carbon atoms, attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D249/00—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms
- C07D249/02—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms not condensed with other rings
- C07D249/08—1,2,4-Triazoles; Hydrogenated 1,2,4-triazoles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F1/00—Compounds containing elements of Groups 1 or 11 of the Periodic Table
- C07F1/005—Compounds containing elements of Groups 1 or 11 of the Periodic Table without C-Metal linkages
Definitions
- the present invention relates to new valuable ⁇ -azolyl sulfides and their derivatives, ⁇ -azolyl sulfoxides and ⁇ -azolyl sulfones and their salts and metal complexes, processes for their preparation and their use as fungicides.
- imidazole derivatives for example 1- [2,4-dichlorophenyl-ß-allylethyl ether-imidazole (DT-OS 20 63 857), show good fungicidal activity. The effect is not always satisfactory at low application rates and application concentrations. In addition, the fungitoxic effect is often associated with a high level of phytotoxicity, so that the crops are also damaged in the concentrations required for combating rust fungi. For these reasons, they are not always suitable for use as crop protection agents for combating fungi and not for all types of plants.
- R 2 means, for example, hydrogen, methyl, n-propyl.
- R 3 meant, for example, methyl, ethyl, n-propyl, isopropyl, n-butyl, t-butyl, n-pentyl, n-hexyl, allyl, propargyl, phenyl, 4-methoxyphenyl, 4-tolyl, 4-chlorophenyl, 3, 4-dichlorophenyl, 2,4-dichlorophenyl, 2,3,6-trichlorophenyl, benzyl, 3-trifluoromethylbenzyl, 4-chlorobenzyl, 4-bromobenzyl, 3,4-dichlorobenzyl, 2,4-dichlorobenzyl, 2,3,6- Trichlorobenzyl, 2-phenylethyl.
- salts are the hydrochlorides, bromides, sulfates, nitrates, phosphates, oxalates or dodecylbenzenesulfonates.
- the effectiveness of the salts is due to the cation, so that the choice of the anion is arbitrary.
- optionally C o implement 5-4 equivalents of the respective azole with the addition of 0.5 to 4 equivalents of a base at temperatures of about 0 to 200 ° C, preferably +20 to + 160 ° C in homogeneous or inhomogeneous phase.
- diluents e.g. Methanol, ethanol, isopropanol, n-butanol, diethyl ether, tetrahydrofuran, dioxane, acetone, acetonitrile, dimethylformamide, dimethyl sulfoxide, chloroform, methylene chloride or toluene can be used.
- bases e.g. organic amines such as triethylamine, pyridine or inorganic compounds, e.g. Potassium carbonate or sodium hydroxide can be used.
- Potassium permanganate, hydrogen peroxide or percarboxylic acids such as peracetic acid, perbenzoic acid or 3-chloroperbenzoic acid can be used as the oxidizing agent.
- diluents e.g. Water, acetic acid, methanol, acetone, chloroform or methylene chloride can be used.
- the metal complexes of the formula II are obtained if ⁇ -azolyl sulfides or their derivatives of the formula I with metal salts of the formula in which Me, X and k have the meaning given above and a denotes 0, 1, 2, 3 and 4, in the presence of a solvent.
- Me preferably stands for metals of subgroups I, II and IV to VIII of the Periodic Table of the Elements and for metals of main groups II and IV, in particular for copper, zinc, tin, manganese, iron, cobalt or nickel.
- the metal salts of the formula IV are generally known, easily accessible compounds.
- All water-miscible solvents can be used to prepare the metal complexes of the formula II. These preferably include methanol, ethanol, isopropanol, acetone, tetrahydrofuran and dioxane. It is generally carried out at temperatures between 0 and 100 ° C, preferably between 10 and 35 ° C.
- the asymmetric sulfur atom adjacent to the asymmetric carbon gives rise to diastereomer mixtures which are customary, e.g. can be separated into the individual components by crystallization or chromatography.
- separation of the enantiomers or diastereomers is normally not required for use as fungicides or as an agent for regulating plant growth.
- the colorless, insoluble residue of the hexane extractions consists of 27 g (12%) 2,4-dichlorobenzyl - [(2 ', 4'-dichlorophenyl) - (1,2,4-triazol-4-yl) methyl] sulfide vcm mp 132-133 ° C.
- the new ⁇ -azolyl sulfides, ⁇ -azolyl sulfoxides and ⁇ -azolyl sulfones and their salts show a considerably broader fungicidal activity and superior plant tolerance than the known 1- [2,4-dichlorophenyl- ⁇ -allylethyl ether] imidazole.
- the new active ingredients can also be in the form of their salts, e.g. Hydrochloride, oxalate or nitrate can be used.
- the fungicidal agents according to the invention are of great interest in fungal diseases on various crop plants, e.g. near Ustilago scitaminea (sugar cane brandy) Hemileia vastatrix (coffee rust) Uromyces fabae or appendiculatus (bean grate) Puccinia species - (grain rust) Erysiphe graminis (powdery mildew) Botrytia cinerea on vine, strawberries, Uncinula necator, Sphaerotheaceauculaceae, pheumoraceae erucumera, cucumbers, pods
- crops to mean, in particular, wheat, rye, barley, oats, rice, corn, apple trees, cucumbers, beans, coffee, sugar cane, grapevines, strawberries and ornamental plants in horticulture.
- the active compounds according to the invention are systemically active.
- the systemic effectiveness of these agents is of particular interest in connection with the control of internal plant diseases, e.g. Grain rust, powdery mildew.
- the agents according to the invention can simultaneously suppress the growth of two or more of the said fungi and have a high plant tolerance.
- the application rates required to control the phytopathogenic fungi are between 0.05 and 2 kg of active ingredient / ha of crop area.
- the active compounds according to the invention can be converted into the customary formulations, such as solutions, emulsions, suspensions, powders, pastes and granules. These are made in a known manner, e.g. by mixing the active ingredient with solvents and / or carriers, optionally using emulsifiers and dispersants, and if water is used as the diluent, other organic solvents can also be used as auxiliary solvents.
- solvents such as aromatics (e.g. xylene, benzene), chlorinated armates (e.g. chlorobenzenes), paraffins (e.g. petroleum fractions), alcohols (e.g.
- ⁇ ⁇
- Carriers such as natural stone powder (e.g. kaolins, clays, talc, chalk) and synthetic stone powder (e.g. highly disperse silica, silicates); Emulsifiers such as non-ionic and anionic emulsifiers (e.g. polyoxyethylene fatty alcohol ether, alkyl sulfonates and aryl sulfonates) and dispersants such as lignin, leachate and methyl cellulose.
- Carriers such as natural stone powder (e.g. kaolins, clays, talc, chalk) and synthetic stone powder (e.g. highly disperse silica, silicates)
- Emulsifiers such as non-ionic and anionic emulsifiers (e.g. polyoxyethylene fatty alcohol ether, alkyl sulfonates and aryl sulfonates) and dispersants such as lignin, leachate and methyl cellulose.
- the formulations generally contain between 0.1 and 95 percent by weight of active compound, preferably between 0.5 and 90%.
- the formulations or the ready-to-use preparations produced therefrom, such as solutions, emulsions, suspensions, powders, pastes or granules, are used in a known manner, for example by spraying, atomizing, dusting, scattering, pickling or pouring.
- compositions according to the invention can also be present together with other active compounds, for example herbicides, insecticides, growth regulators and fungicides, or else mixed with fertilizers.
- Fungicides which can be combined with the novel compounds, for example, dithiocarbamates and their derivatives, such as iron, zinc dimethyldithiocarbamate, Manganäthylenbisdithiocarbamat, manganese zinc ethylenediamine bisdithiocarbamate, Zinurathylenbisdithiocarbamat, Tetramethylthiuramidsulfide, ammonia complex of zinc (N, N- ethylene bis-dithiocarbamate) and N, N'-polyethylene bis (thiocarbamoyl) disulfide, zinc (N, N'-propylene bis-dithiocarbamate), ammonia complex of tin (N, N'-propylene) bis-dithiocarbamate) and N, N'-polypropylene
- Nitrophenol derivative such as dinitro- (1-methylheptyl) phenylcrotoriate, 2-sec-butyl-4,6-dinitrophenyl-3,3-dimethylacrylate, 2-sec-butyl-4,6-dinitrophenyl-isopropyl carbonate; heterocyclic structures, such as N-trichloromethylthio-tetrahydrophthalimide, N-trichloromethylthio-phthalimide, 2-heptadecyl-2-imidazoline acetate, 2 4-bichloro-6- (o-chloroanilino) -s-triazine, O, O-diethyl-phthalimidophonimophone , 5-amino-1- (bis- (dimethylamino) phosphinyl) -3-phenyl-1,2,4-triazole, 5-ethoxy-3-trichloromethyl-1,2,4-thiadiazole 2,3-dicyano-1 , 4-dithia
- Leaves of potted wheat seedlings of the "Jubilar” variety are artificially infected with spores of the wheat brown rust (Puccinia recondita) 24 hours before spraying and placed in a steam-saturated chamber at 20 to 25 ° C.
- the plants are then sprayed with aqueous emulsions of 80% (weight percent) active ingredient and 20% emulsifier. After the spray coating has dried on, the test plants are placed in the greenhouse Temperatures between 20 and 22 ° C and 75 to 80% relative humidity. After 10 days, the extent of the rust fungus development is determined.
- 20 parts by weight of compound 2 are dissolved in a mixture consisting of 80 parts by weight of xylene, 10 parts by weight of the adduct of 8 to 10 moles of ethylene oxide and 1 mole of oleic acid-N-monoethanolamide, 5 parts by weight of calcium salt of dodecylbenzenesulfonic acid and 5 parts by weight of the adduct of 40 moles of ethylene oxide of 1 mole of castor oil.
- aqueous dispersion which is 0.02% by weight. contains the active substance.
- active ingredient 2 20 parts by weight of active ingredient 2 are mixed well with 3 parts by weight of the sodium salt of diisobutylnaphthalene- ⁇ -sulfonic acid, 17 parts by weight of the sodium salt of lignosulfonic acid from a sulfite waste liquor and 60 parts by weight of powdered silica gel and ground in a hammer mill.
- a spray liquor is obtained which contains 0.1% by weight of the active ingredient.
- active ingredient 1 40 parts by weight of active ingredient 1 are intimately mixed with 10 parts of sodium salt of a phenolsulfonic acid-urea-formaldehyde condensate, 2 parts of silica gel and 48 parts of water. A stable aqueous dispersion is obtained. By Dilution with 100,000 parts by weight of water gives an aqueous dispersion which contains 0.04% by weight of active ingredient.
- active ingredient 2 20 parts are intimately mixed with 2 parts of calcium salt of dodecylbenzenesulfonic acid, 8 parts of fatty alcohol polyglycol ether, 2 parts of sodium salt of a phenolsulfonic acid-urea-formaldehyde condensate and 68 parts of a paraffinic mineral oil.
- a stable oily dispersion is obtained
Landscapes
- Organic Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Plant Pathology (AREA)
- Engineering & Computer Science (AREA)
- Dentistry (AREA)
- General Health & Medical Sciences (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Environmental Sciences (AREA)
- Pest Control & Pesticides (AREA)
- Agronomy & Crop Science (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
- Plural Heterocyclic Compounds (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
Description
- Die vorliegende Erfindung betrifft neue wertvolle α-Azolylsulfide und deren Derivate, α-Azolyl-sulfoxide und α-Azolyl-sulfone sowie deren Salze und Metallkomplexe, Verfahren zu ihrer Herstellung sowie ihre Verwendung als Fungizide.
- Es ist bekannt, daß Imidazol-Derivate, zum Beispiel das 1-[2,4-Dichlorphenyl-ß-allyläthylätherl-imidazol (DT-OS 20 63 857) eine gute fungizide Wirksamkeit zeigt. Die Wirkung ist bei niedrigen Aufwandmengen und Anwendungskonzentrationen nicht immer befriedigend. Darüber hinaus ist die fungitoxische Wirkung oft mit einer hohen Phytotoxizität verbunden, so daß in den für die Bekämpfung von Rostpilzen notwendigen Konzentrationen auch die Kulturpflanzen geschädigt werden. Aus diesen Gründen sind sie für den Gebrauch als Pflanzenschutzmittel zur Bekämpfung von Pilzen nicht immer und nicht bei allen Pflanzenarten geeignet.
-
- R Wasserstoff, Alkyl, Alkoxycarbonyl oder gegebenenfalls substituiertes Aryl
- R 2 Wasserstoff oder Alkyl
- R3 Alkyl, Alkenyl, Alkinyl, gegebenenfalls substituiertes Phenyl oder gegebenenfalls substituiertes Aralkyl
- Az Imidazol-1-yl, Pyrazol-1-yl, 1,2,4-Triazol-1-yl, 1,2,4--Triazol-4-yl, Tetrazol-1-yl oder Tetrazol-2-yl und
- n 0, 1 oder 2 bedeuten und deren Salze und Metallkomplexe gut wirksam gegen Schadpilze, insbesondere aus der Klasse der Ascomyceten und Basidiomyceten sind.
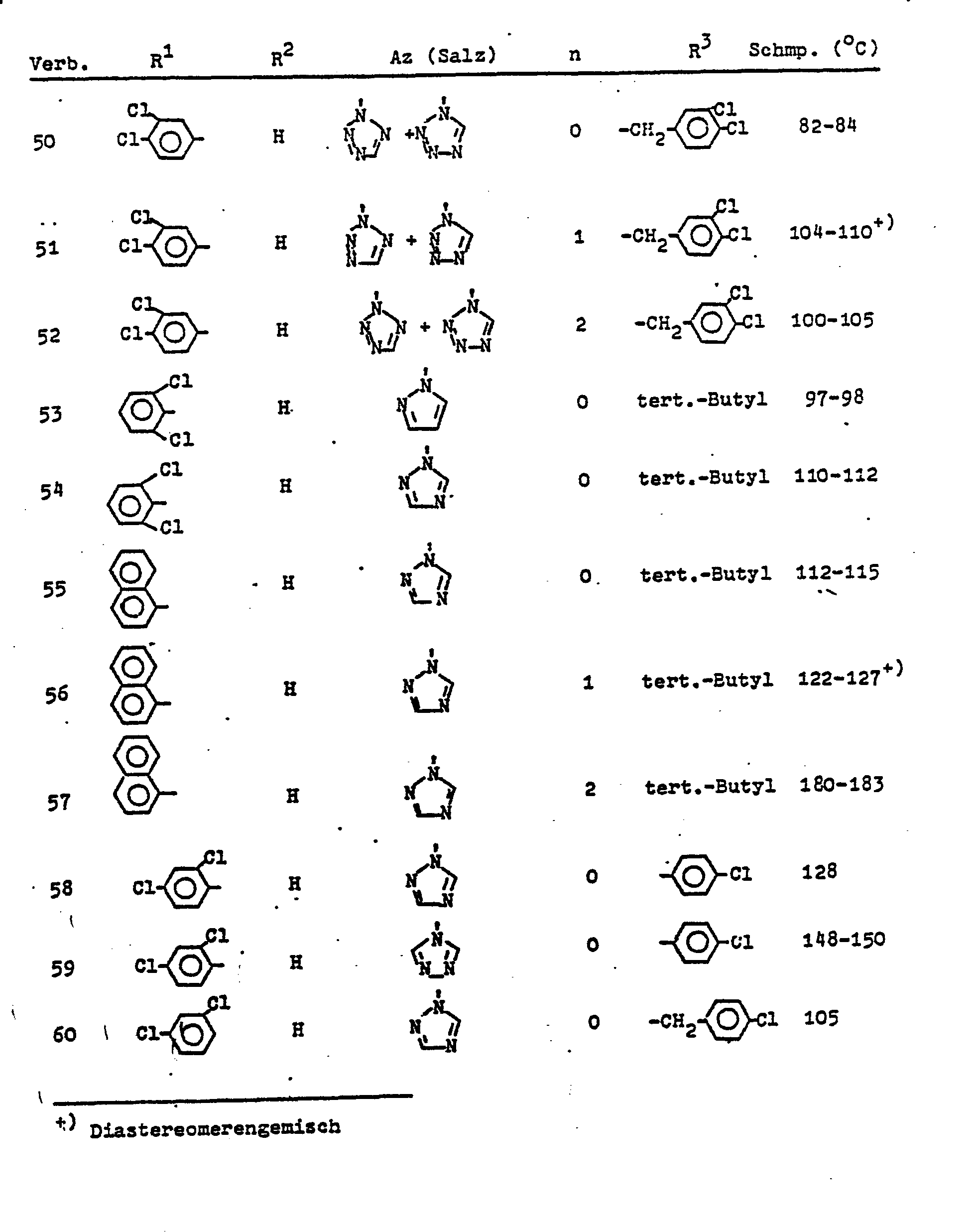
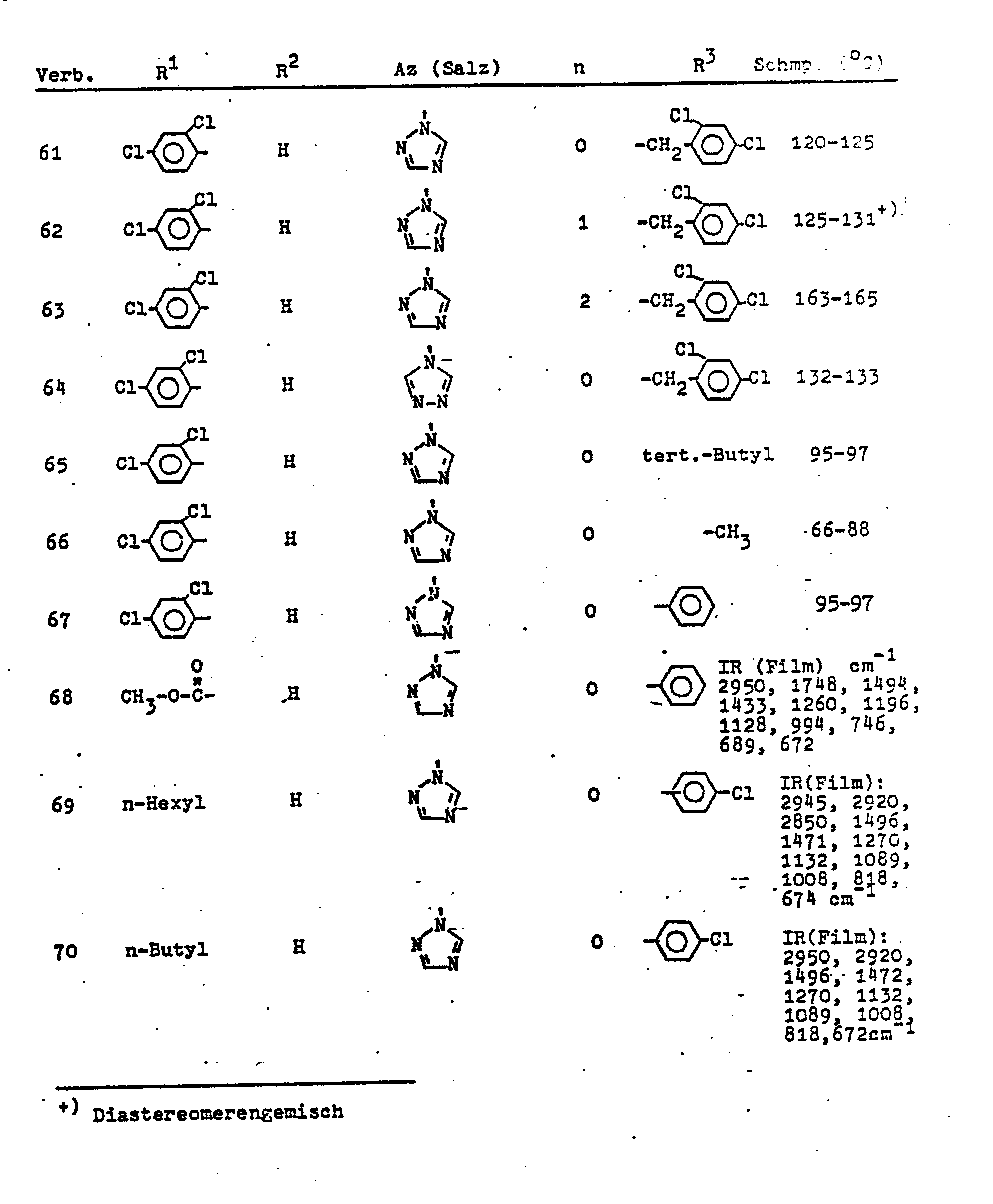
- R1 bedeutete beispielsweise Wasserstoff, Methyl, Ethyl, n-Propyl, Isopropyl, n-Butyl, n-Pentyl, n-Hexyl, n-Heptyl(3), Methoxycarbonyl, Phenyl, 4-Nitrophenyl, 4-Bromphenyl, 4-Cyanphenyl, 2-Methylphenyl, 4-t-Butylphenyl, 3-Trifluormethylphenyl, 4-Trifluormethylphenyl, 4-Fluorphenyl, 2-Chlorphenyl, 4-Chlorphenyl, 2,4-Dichlorphenyl, 2,6-Dichlorphenyl, 3,4-Dichlorphenyl, -Naphthyl.
- R2 bedeutet beispielsweise Wasserstoff, Methyl, n-Propyl. R3 bedeutete beispielsweise Methyl, Ethyl, n-Propyl, Isopropyl, n-Butyl, t-Butyl, n-Pentyl, n-Hexyl, Allyl, Propargyl, Phenyl, 4-Methoxyphenyl, 4-Tolyl, 4-Chlorphenyl, 3,4-Dichlorphenyl, 2,4-Dichlorphenyl, 2,3,6-Trichlorphenyl, Benzyl, 3-Trifluormethylbenzyl, 4-Chlorbenzyl, 4-Brombenzyl, 3,4-Dichlorbenzyl, 2,4-Dichlorbenzyl, 2,3,6-Trichlorbenzyl, 2-Phenylethyl.
- Salze sind beispielsweise die Hydrochloride, Bromide, Sulfate, Nitrate, Phosphate, Oxalate oder Dodecylbenzolsulfonate. Die Wirksamkeit der Salze geht auf das Kation zurück, so daß die Wahl des Anions beliebig ist.
-
- R1, R2, R3, Az und n die oben angegebene Bedeutung haben und Me ein Metall, z.B. Kupfer, Zink, Zinn, Mangan, Eisen, Cobalt oder Nickel bedeutet
- X das Anion einer anorganischen Säure bedeutete, z.B. Salzsäure, Schwefelsäure, Phosphorsäure, Bromwasserstoffsäure
- m und k 1, 2, 3 oder 4 bedeuten.
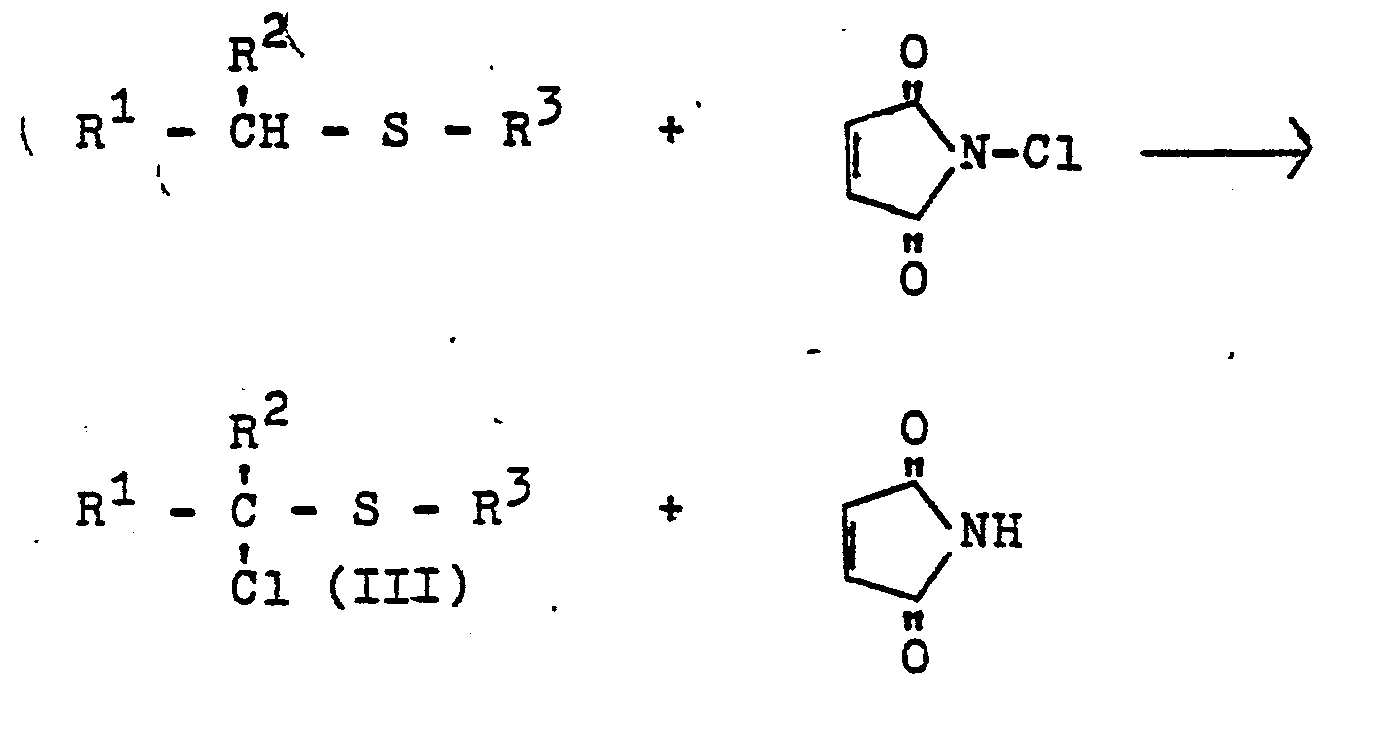
- Weiterhin wurde gefunden, daß man ä-Azolylsulfide der Formel I (mit n = 0) erhält, wenn man d-Chlorsulfide der Formel
- Zur Herstellung der α-Azolylsulfide der Formel I (n = 0) ist es zweckmäßig, die α-Chlorsulfide der Formel III ohne Verdünnungsmittel oder in Gegenwart eines Verdünnungsmittels mit etwa 0,5 bis 2 Äquivalenten eines Alkalisalzes des jeweiligen Azols oder mit etwa 0,5 bis 4 Äquivalenten des jeweiligen Azols, gegebenenfalls unter Zusatz von 0,5 bis 4 Äquivalenten einer Base bei Temperaturen von etwa 0 bis 200°C, vorzugsweise +20oC bis +160°C in homogener oder inhomogener Phase umzusetzen.
- Als Verdünnungsmittel können z.B. Methanol, Äthanol, Isopropanol, n-Butanol, Diäthyläther, Tetrahydrofuran, Dioxan, Aceton, Acetonitril, Dimethylformamid, Dimethylsulfoxid, Chloroform, Methylenchlroid oder Toluol verwendet werden. Als Basen können z.B. organische Amine wie Triäthylamin, Pyridin oder anorganische Verbindungen, z.B. Kaliumcarbonat oder Natriumhydroxid verwendet werden.
- Die als Ausgangsstoffe verwendeten α-Chlorsulfide III sind z.T. aus der Literatur bekannt oder können nach literaturbekannten Verfahren hergestellt werden, z.B.
- a) durch Chlorierung von Sulfiden mit N-Chlorsuccinimid (siehe z.B., B.L. Tuleen und T.B. Stephens, J. Org. Chem. 34, 31 (1969)) nach dem Schema
- b) durch Umsetzung von Aldehyden mit Thiolen in Gegenwart von Chlorwasserstoff (siehe z.B. H. Böhme, H. Fischer und R. Frank, Liebigs Ann. Chem. 563, 54 (1949)) nach dem Schema
- Zur Herstellung der α-Azolylsulfoxide der Formel I (n = 1) setzt man die α-Azolylsulfide gegebenenfalls in Gegenwart eines Verdünnungsmittels mit etwa einem Äquivalent eines geeigneten Oxidationsmittels bei Temperaturen zwischen etwa -30 und +100°C um. Die α-Azolylsulfone (Formel I, n = 2) erhält man in ähnlicher Weise bei der Oxidation der α-Azolylsulfide (I, n = 0) mit mindestens zwei Äquivalenten eines geeigneten Oxidationsmittels oder bei der Oxidation der α-Azolylsulfoxide (I, n = 1) mit mindestens einem Äquivalent eines Oxidationsmittels.
- Als Oxidationsmittel können beispielsweise Kaliumpermanganat, Wasserstoffperoxid oder Percarbonsäuren wie Peressigsäure, Perbenzoesäure oder 3-Chlorperbenzoesäure verwendet werden. Als Verdünnungsmittel können z.B. Wasser, Essigsäure, Methanol, Aceton, Chloroform oder Methylenchlorid verwendet werden. Ein bevorzugtes Verfahren zur Herstellung der Sulfoxide (I, n = 1) ist die Umsetzung der Sulfide (I, n = 0) mit einem Äquivalent 3-Chlorperbenzoesäure in Methylenchlorid bei 0 bis 25°C. Ein bevorzugtes Verfahren zur Herstellung der Sulfone ist die Umsetzung der Sulfide (I, n = 0) mit zwei Äquivalenten 3-Chlorperbenzoesäure in Methylenchlorid bei 15 bis 41°C.
- Die Verbindungen der Formel I (n = 0, 1, 2) sind in vielen organischen Lösungsmitteln, z.B. in Essigester, Aceton, Äthanol, Methylenchlorid, Chloroform, Dimethylsulfoxid, Dimethylformamid und N-Methylpyrrolidon leicht lösliche Substanzen. Die α-Azolylsulfide (I = 0) sind darüber hinaus auch in Toluol gut löslich.
- Sie lassen sich mit Säuren in ihre Salze, z.B. Hydrochloride, Sulfate, Nitrate, Oxalate, Formiate, Acetate oder Dodecylbenzylsulfonate überführen.
- Ferner wurde gefunden, daß man die Metall-Komplexe der Formel II erhält, wenn man α-Azolylsulfide bzw. deren Derivate der Formel I mit Metallsalzen der Formel
- Die Metallsalze der Formel IV sind allgemein bekannte, leicht (zugängliche Verbindungen.
- Für die Herstellung der Metall-Komplexe der Formel II kommen'alle mit Wasser mischbaren Lösungsmittel in Frage. Hierzu gehören vorzugsweise Methanol, Äthanol, Isopropanol, Aceton, Tetrahydrofuran und Dioxan. Dabei arbeitet man im allgemeinen bei Temperaturen zwischen 0 und 100°C, vorzugsweise zwischen 10 und 35°C.
- Die Sulfide (I, n = 0) und Sullfone (I, n = 2) enthalten jeweils ein Asymmetrisches Kohlenstoffatom und fallen demgemäß als Enantiomerengemische an, die in die optisch aktiven Verbindungen getrennt werden können. Im Falle der Sulfoxide I. (n = 1) treten durch das dem Asymmetrischen Kohlenstoff benachbarte Asymmetrische Schwefelatom Diastereomerengemische auf, die in üblicher Weise, z.B. durch Kristallisation oder Chromatographie in die einzkelnen Komponenten getrennt werden können. Für die Anwendung als Fungizide oder als Mittel zur Regulierung des Pflanzenwachstums ist jedoch eine Trennung der Enantiomeren oder Diastereomeren normalerweise nicht erforderlich.
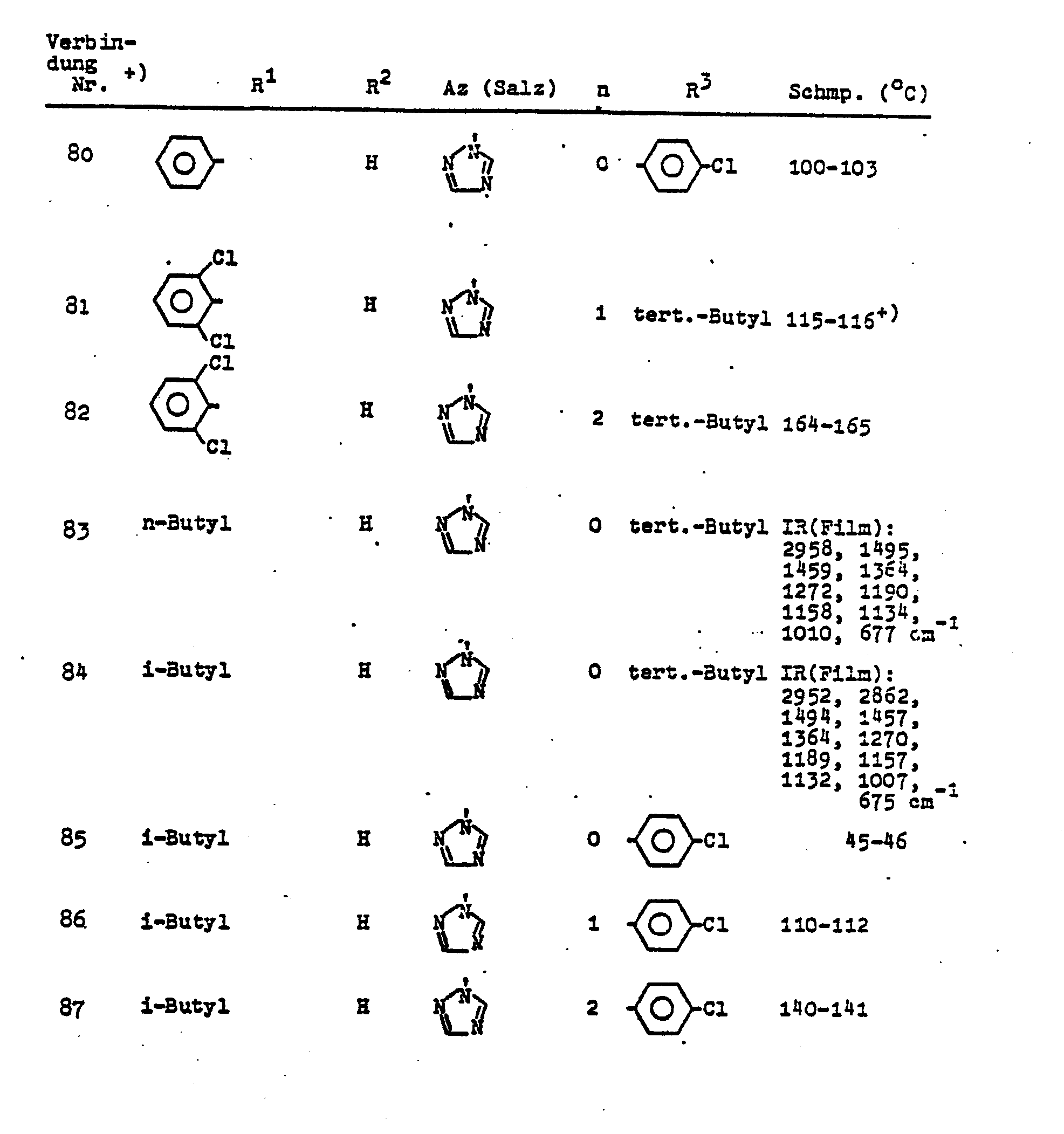
- tert.-Butyl-[(2,4-dichlorphenyl)-1,2,4-triazol-1-yl-methyl] -sulfid (Verbindung Nr. 65).
- Zur Lösung von 22,1 g 1,2,4-Triazol in 500 ml wasserfreiem Aceton gibt man 60,5 g tert.-Butyl-[(2,4-dichlorphenyl)-chlormethyl]-sulfid. Nach Zugabe von 44,2 g feingepulvertem Kaliumcarbonat erhitzt man die Mischung unter Rühren sieben Stunden am Rückfluß. Danach filtriert man die unlöslichen Bestandteile ab, engt das Filtrat im Vakuum zur Trockene ein und versetzt den Rückstand mit 300 ml Wasser. Man extrahiert die wäßrige Phase 3 mal mit je 200 ml Methylenchlorid, wäscht die vereinigten Extrakte mit 200 ml Wasser, trocknet sie und engt im Vakuum ein. Nach Zugabe von 100 ml Diisopropyläther gewinnt man aus dem Rückstand 35,6 g (53%) farblose Kristalle vom Schmp. 95 bis 97°C.
- 1 H-NMR (100 MHz, CDCl3): δ = 1,3 (s, 9H), 6,95 (s, 1H), 7,0-7,4 (m. 3H, ABX), 8,0 (s, 1H), 8,8 ppm (s, 1H).
- Bis-<tert.-butyl-[(2,4-dichlorphenyl)-1,2,4-triazol-1-yl--methyl]-sulfid>-kupfer-(II)-chlorid Zur Lösung von 9,5 g tert.-Butyl-[(2,4-dichlorphenyl)-1,2,4-triazol-1-yl-methyl]-sulfid in 100 ml Äthanol tropft man 15 ml einer molaren äthanolischen Lösung von Kupfer-(II)-chlorid-dihydrat. Aus dieser tiefblauen Lösung isoliert man nach zweitägigem Stehen bei 0°C 9,8 g blaue Kristalle, die mit Äthanol und Äther gewaschen werden. Schmp. 130°C.
- Zur Suspension von 13,0 g Natriumhydrid in 100 ml Dimethylformamid tropft man unter Rühren eine Lösung von 43,5 g Triazol in 200 ml Dimethylformamid. Nach Beendigung . der Wasserstoffentwicklung tropft man zu der auf Raumtemperatur abgekühlten Mischung 97,0 g 1-Pentyl-[1-chlorpentyl--(1)]-sulfid hinzu, wobei sich das Gemisch erwärmt. Anschließend rührt man noch acht Stunden bei 80°C. Die Reaktionsmischung wird sodann im Vakuum eingeengt, mit 500 ml Wasser versetzt und 5 mal mit Methylenchlorid extrahiert. Die vereinigten und eingeengten Extrakte chromatographiert man an Kieselgel (5 x 70 cm) zunächst unter Verwendung von Methylenchlorid als Laufmittel. Nach Durchlauf der ersten bräunlichen Zone werden steigende Mengen Aceton zugesetzt (bis 10% Aceton). Als zweite Zone isoliert man so 15,0 g Produkt als Blaßgelbes Öl. IR (Film): 2955, 2925, 2860, 1496, 1460, 1271, 1190, 1133, 1008, 677 cm-1.
- 1H-NMR (270 MHz, CDCl3): δ= 0,9 ("tr", 6H), 1,3 (m, 8H), 1,5 (m, 2H), 2,1 (m, 2H), 2,4 (m, 2H), 5,4 (tr, 1H), 8,0 (s, 1H), 8,4 ppm (s, 1H).
- Zur Lösung von 10,0 g 85-prozentiger 3-Chlorperbenzoesäure in 140 ml Methylchlorid tropft man unter Rühren und Eiskühlung eine Lösung von 6,0 g 2-Pentyl-[1-(1,2,4-triazol-1-yl)-pentyl-(1)]-sulfid. Nach Abklingen der anfänglichen Erwärmang rührt man noch 2 Tage bei 25°C. Die Mischung wird dann nit Natriumcarbonatlösung, Natriumsulfitlösung und Wasser gewaschen und die organische`Phase getrocknet. Nach dem Einengen bleibt ein hellgelbes Öl, aus kdem beim Anreiben mit Di sopropyläther 3,5 g farblose Kristalle vom Schmp. 69 bis 71°C gewonnen werden.
- NMR (CDCl3, 100 MHz): δ = 0,9 (m, 6H), 1,4 (m, 8H), 1,8 (m, 2H), 2,5 (m, 2H), 2,8 ('dd", 2H), 5,4 (dd, 1H), 8,1 (s, 1H), ,5 ppm (s, 1H).
- Zur Lösung von 1,6 g Imidazol in 300 ml Aceton tropft man unter Rührer. 82 g tert.-Butyl-[2-methylphenyl)-chlormethyl] -sulfid. Nach Zugbe von 88 g feingepulvertem Kaliumcarbonat erhitzt man Studen am Rückfluß. Danach wird von den ungelösten lestan leilen abfiltriert und das Filtrat eingeengt. Der mit 300 ml Wasser versetzte Rückstand wird mit 3 x 200 ml ethylenchlorid extrahiert. Aus den vereinigten organischen Phasen bleiben nach Waschen mit Wasser, Trock- nen und Einegen 69 g eines bräunlichen öls zurück, die in 1 1 Diisoproyläther gelöst werden. Durch tropfenweise Zugabe von 90 il einer 2,85-molaren Lösung von Chlorwasserstoff in Diispropyläther unter Rühren fallen aus dieser Lösung blaßgelbe Kristalle des Hydrochlorids, die aus Aceton umkristalliisert werden, an. Man erhält so 51 g farbloses tert.-Butyl-[(2-methylphenyl)-imidazol--1-yl-methyl]-sulfidhydrochlorid vom Schmp. 168 bis 170°C (Verbindung Nr. 110).'
- Nach Übergießen des Hydrochlorids mit einer wäßrigen Lösung von 25 g Natriumhydrogencarbonat extrahiert man die freie Base mit 3 x 200 ml Äther. Nach dem Trocknen und Einengen fällt sie als blaßgelbes öl (27 g) an, das allmählich durchkristallisiert (Fp. 93-95°).
- 1H-NMR (60 MHz, CDCl3): δ = 1,3 (s, 9H), 2,4 (s, 3H), 6,25 (s, 1H), 6,7-7,1 (m, 6H), 7,65 ppom (dd, 1H).
- Die Mischung von 60,7 g 4-Chlorphenyl-(chlormethyl-(4'--chlorphenyl))-sulfid, 27,2 g Imidazol und 55,4 g Kaliumcarbonat in 400 ml Aceton wird unter Rühren 5 Stunden am Rückfluß erhitzt. Danach wird filtriert, das Filtrat zur Trockene eingeengt und mit 500 ml Wasser versetzt. Man extrahiert diese Mischung 3 mal mit je 200 ml Methylenchlorid. Die vereinigtern Extrakte werden über Natriumsulfat getrocknet. Aus der im Vakuum zur Trockene eingeengten Lösung werden nach Anreiben mit Diisopropyläther 26 g (38 %) farblose Kristalle vom Schmp. 88°C isoliert.
- 1H-NMR (60 MHz, CDCl3): δ = 6,3 (s. 1H, 6,9-7,4 (m, 10H), 7,5 (br. s, 1H).
- Zur Lösung von 193 g tert.-Butyl-(chlormethyl-(2,6-dichlorphenyl))-sulfid und 44 g Pyrazol in 1 1 Toluol tropft man 66 g Triäthylamin und erhitzt nach Abklingen der schwach exothermen Reaktion noch 1 Stunde am Rückfluß. Man filtriert vom Ungelösten ab, engt das Filtrat ein und versetzt den Rückstand mit 500 ml Wasser. Nach Extraktion mit 3 mal 200 ml Methylenchlorid erhält man beim Einengen der vereinigten Extrakte einen festen Rückstand, der nach dem Waschen mit Diisopropyläther 117 g (57 %) farblose Kristalle vom Schmp. 97-98°C ergibt.
- 1H-NMR (60 MHz, CDCl3): δ = 1,4 ppm (s, 9H), 6,2 ("tr.", 1H), 7,0-7,3 (m, 3H), 7,4 ("d", 1H), 8,2 ("d", 2H).
- Eine Mischung von 60,4 g Chlormethyl-(2,4-dichlorbenzyl)-sulfid, 35 g 1,2,4-Triazol und 69 g gepulvertem Kaliumcarbonat in 300 ml wasserfreiem Aceton wird 10 Stunden unter Rückfluß zum Sieden erhitzt. Danach filtriert man die unlöslichen Bestandteile ab, engt das Filtrat im Vakuum zur Trockene ein und versetzt den Rückstand mit 300 ml Wasser. Dann wird 3 mal mit je 200 ml Methylenchlorid extrahiert, die vereinigten Extrakte getrocknet und im Vakuum eingeengt. Aus dem zurückbleibenden braunen Öl werden durch Kristallisation aus Diisopropyläther/Methanol bei -60°C 39,8 g (58 %) farblose Kristalle vom Schmp. 68-70°C gewonnen.
- 1H-NMR (60 MHz, CDCl3:d= 3,8 (s. 2H), 5,0 (s. 2H), 7,0-7,5 (m, 3H), 7,9 (s, 1H), 8,2 (s, 1H).
- 2,4-Dichlorbenzyl-(2',4'-dichlorphenyl-1,2,4-triazol-1-yl--methyl)-sulfid (Verbindung Nr. 61) und 2,4-Dichlorbenzyl-[(2',4'-dichlorphenyl-(1,2,4-triazol-4-yl)-methyl]-sulfid (Verbindung Nr. 64)
- Eine Mischung von 200 g 2,4-Dichlorbenzyl-[(2',4'-dichlorphenyl)-chlormethyl] -sulfid, 145 g 1,2,4-Triazol und 138 g gepuklvertem Kaliumcarbonat in 2 1 wasserfreiem Aceton wird unter kräftigem Rühren 9 Stunden am Rückfluß erhitzt. Danach werden die festen Bestandteile durch Filtration entfernt, das Filtrat im Vakuum zur Trockene eingeengt und der ölige Rückstand nach Zusatz von 500 ml Wasser fünfmal mit je 200 ml Methylenchlorid extrahiert. Die vereinigten organischen Phasen werden über Natriumsulfat getrocknet und dann im Vakuum zur Trockene eingeengt. Beim Anreiben des Rückstandes mit Diisopropyläther erhält man 157 g farblose Kristalle, die die isomeren Triazolylverbindungen im Verhältnis 8:2 enthalten.
- Dieses Gemisch wird mehrfach mit heißem Hexan extrahiert. Aus den vereinigten Hexanlösungen erhält man beim Abziehen des Lösungsmittels im Vakuum 122 g (65 %), 2,4-Dichlorbenzyl-[(2',4'-dichlorphenyl)-1,2,4-triazol-1-yl--methyl] -sulfid in Form farbloser Kristalle vom Schmp. 120-125°C.
- 1H-NMR (220 MHz, CDCl3): δ = 3,9 ppm (breites s, 2H), 6,65 (s, 1H), 7,0-7,5 (m, 6H), 8,0 (s. 1H), 8,6 (s. 1H).
- Der farblose, unlösliche Rückstand der Hexanextraktionen besteht aus 27 g (12 %) 2,4-Dichlorbenzyl-[(2',4'-dichlorphenyl)-(1,2,4-triazol-4-yl)-methyl]-sulfid vcm Schmp. 132-133°C.
- 1H-NMR (220 MHz, CDCl3): δ = 3,9 ppm (s, 2H), 6,5 (s, 1H), 7,0-7,5 (m, 6H), 8,45 (s,.2H).
- Zu einer Lösung von 78 g tert.-Butyl-[(4-chlorphenyl)-chlormethyl -sulfid in 175 ml trockenem Dimethylformamid (DMF) tropft man unter Rühren 350 ml einer molaren Lösung 1,2,4-Triazolylnatrium in DMF (hergestellt.aus 0,35 Mol Natriumhydrid und 0,35 Mol 1,2,4-Triazol in 350 ml DMF). Nach Abklingen der schwach exothermen Reaktion rührt man noch 4 Stunden bei 80°C nach. Der Ansatz wird in 1 1 Wasser gegössen und mit 3 mal 200 ml Methylenchlorid extrahiert. Die vereinigten organischen Phasen werden mit Wasser gewaschen, über Natriumsulfat getrocknet und im Vakuum eingedampft. Der Rückstand bildet beim Verreiben mit 150 ml Diisopropyläther 40,0 g (46 %) farblose Kristalle vom Schmp. 95°C.
- 1H NMR (60 MHz, CDCl3): δ = 1,3 ppm (s, 9H), 6,6 (s, 1H), 7,2 (AA'BB', 4H), 8,0 (s, 1H), 8,7 (s, 1H).
- Zur Lösung von 9,7 g tert.-Butyl-[(4-chlorphenyl)-1,2,4-tri- azolylmethyl]-sulfid in 20 ml Methylenchlorid tropft man unter Eiskühlung eine Lösung von 7,1 g 85-prozentiger 3-Chlorperbenzoesäure in 70 ml Methylenchlorid. Man rührt noch 2 Stunden bei 0°C nachk bis laut Dünnschichtchromatogramm (Si02, Methylenchlorid/Aceton 7:3) kein Sulfid (RF = 0,57) mehr vorhanden ist und nur noch die beiden diastereomeren Sulfoxide erkennbar sind (RF = 0,38 und 0,20). Die Lösung wird sodann bis zur Beendigung der C02-Entwicklung mit wäßriger Natriumhydrogencarbonatlösung gewaschen. Nach dem Waschen der organischen Phase mit Wasser wird diese getrocknet, eingeengt und der feste Rückstand lmit wenig Äther gewaschen. Man erhält 7,0 g (67 %) farblose Kristalle vom Schmp. 125-128°C.
- 1H-NMR (220 MHz, CDCl3): δ = 1,10 und 1,15 (zwei s, zus. 9H), 6,18 und 6,24 (zwei s, zus. 1H), 7,3-7,7 (m, 4H), 8,01 und 8,07 (zwei s, zus. 1H), 8,41 und 8,51 (zwei s, zus. 1H).
- Zur Lösung von 10,7 g tert.-Butyl-[(4-chlorphenyl)-1,2,4 -triazolylmethyl]-sulfoxid in 50 ml Methylenchlorid tropft man bei 20°C eine Lösung von 7,3 g 85-Prozentiger 3-Chlorperbenzoesäure in 100 ml Methylenchlorid zu. Nach dem Ergebnis der Dünnschichfchromatographie (DC) wird das weniger polare Sulfoxid schneller oxidiert; erst durch längeres Nachrühren bei Raumtemperatur wird auch das stärker polare Sulfoxid oxidiert. Nach 18 Stunden ist nach DC (Si02, Methylenchlorid/Aceton 7:3) die Umsetzung beendet. Das Sulfon (RF = 0,46) wird durch Waschen der Lösung mit Natriumhydrogencarbonatlösung und Wasser, Trocknen und Einengen der organischen Phase.isoliert. Nach dem Waschen des Rückstandes der organischen Phase isoliert. Nach dem Waschen des Rückstandes mit Diisopropyläther erhält man 8,7 g (77 %) farblose Kristalle vom Schmp. 150°C.
- 1H-NMR (220 MHz, CDCl3): δ = 1,3 ppm (s, 9H), 6,75 (s, 1H), 7,5 (AA'BB', 4H), 8,03 (s, 1H), 8,84 (s, 1H).
- 4-Chlorphenyl-[(4'-chlorphenyl)-(tetrazol-1-yl)-methyl] -sulfid und 4-Chlorphenyl-[(4'-chlorphenyl)-(tetrazol-2-yl) -methyl]-sulfid (Verbindung Nr. 15)
- Zu einer Mischung von 26,1 g Tetrazol und 102 g 4-Chlorphenyl-[(4'-chlorphenyl)-chlormethyl]-sulfid in 3,5 1 Toluol tropft man bei Raumtemperatur 37,4 g Triäthylamin unter Rühren zu. Die Mischung wird danach 4 Stunden am Rückfluß erhitzt. Man filtriert vom Unlöslichen ab, wäscht das Filtrat mit Wasser und trocknet die organische Phase über Natriumsulfat. Nach Abziehen des Lösungsmittels im Vakuum bleibt ein fester Rückstand, aus dem nach Zusatz von 50 ml Diisopropyläther 74,7 g (67 %) gelbstichige Kristalle vom Schmp. 104-1060C isoliert werden.
- 1H-NMR (60 MHz, CDCl3):δ= 6,7-7,6 ppm (m, 9H), 8,4 und 8,9 (zwei s, zus. 2H).
-
- Die neuen α-Azolylsulfide, α-Azolyl-sulfoxide und α-Azolyl--sulfone und ihre Salze zeigen eine erheblich breitere fungizide Wirkung und eine überlegene Pflanzenverträglichkeit als das bekannte 1-[2,4-Dichlorphenyl-β-allyläthyläthe] -imidazol. Die neuen Wirkstoffe können auch in Form ihrer Salze, z.B. Hydrochloride, Oxalate oder Nitrate verwendet werden.
- Von großem Interesse sind die erfindungsgemäßen fungiziden Mittel bei Pilzerkrankungen an verschiedenen Kulturpflanzen, z.B. bei Ustilago scitaminea (Zuckerrohrbrand) Hemileia vastatrix (Kaffeerost) Uromyces fabae bzw. appendiculatus (Bohnenrost) Puccinia Arten - (Getreiderost) Erysiphe graminis (Getreidemehltau) Botrytia cinerea an Rebe, Erdbeeren, Uncinula necator, Sphaerotheca fuliginea, Erysiphe cichoracearum, Podosphaera leucotricha.
- Unter Kulturpflanzen verstehen wir in diesem.Zusammenhang insbesondere Weizen, Roggen, Gerste, Hafer, Reis, Mais, Apfelbaum, Gurken, Bohnen, Kaffee, Zuckerrohr, Weinrebe, Erdbeeren sowie Zierpflanzen im Gartenbau.
- Die erfindungsgemäßen Wirkstoffe sind systemisch wirksam. Die systemische Wirksamkeit dieser Mittel ist von besonderem Interesse im Zusammenhang mit der Bekämpfung von inneren Pflanzenkrankheiten, z.B. Getreiderost, Getreidemehltau.
- Die erfindüngsgemäßen Mittel können gleichzeitig das Wachstum von zwei oder mehr der genannten Pilze unterdrücken und besitzen eine hohe Pflanzenverträglichkeit. Die zur Bekämpfung der phytopathogenen Pilze erforderlichen Aufwandmengen liegen zwischen 0,05 und 2 kg Wirkstoff/ha Kulturfläche.
- Die erfindungsgemäßen Wirkstoffe können in die üblichen Formulierungen übergeführt werden, wie Lösungen, Emulsionen, Suspensionen, Pulver, Pasten und Granulate. Diese werden in bekannter Weise hergestellt, z.B. durch Vermischen des Wirkstoffes mit Lösungsmitteln und/oder Trägerstoffen, gegebenenfalls unter Verwendung von Emulgiermitteln und Dispergiermitteln, wobei im Falle der Benutzung von Wasser als Verdünnungsmittel auch andere organische Lösungsmittel als Hilfslösungsmittel verwendet werden können. Als Hilfsstoffe kommen dafür im wesentlichen in Frage: Lösungsmittel, wie Aromaten (z.B. Xylol, Benzol), chlorierte Armaten (z.B. Chlorbenzole), Paraffine (z.B. Erdölfraktionen), Alkohole (z.B. Methanol, Butanol), Amine (z.B..Äthanolamin, Dimethylformamid) und Wasser; Trägerstoffe wie natürliche Gesteinsmehle (z.B. Kaoline, Tonerden, Talkum, Kreide) und synthetische Gesteinsmehle (z.B. hochdisperse Kieselsäure, Silikate); Emulgiermittel, wie nichtionögene und anionische Emulgatoren (z.B. Polyoxyäthylen-Fettalkohol-Äther, Alkylsulfonate und Arylsulfonate) und Dispergiermittel, wie Lignin, Sulfitablaugen und Methylcellulose.
- Die Formulierungen enthalten im allgemeinen zwischen 0,1 und 95 Gewichtsprozent Wirkstoff, vorzugsweise zwischen 0,5 und 90 %. Die Formulierungen bzw. die daraus hergestellten gebrauchsfertigen Zubereitungen, wie Lösungen, Emulsionen, Suspensionen, Pulver, Pasten oder Granulate, werden in bekannter Weise angewendet, beispielsweise durch Versprühen, Vernebeln, Verstäuben, Verstreuen, Beizen oder Gießen.
- Die erfindungsgemäßen Mittel können in diesen Anwendungsformen auch zusammen mit anderen Wirkstoffen vorliegen, z.B. Herbiziden, Insektiziden, Wachstumsregulatoren und Fungiziden oder auch mit Düngemitteln vermischt werden. Fungizide, die mit den erfindungsgemäßen Verbindungen kombiniert werden können, sind beispielsweise Dithiocarbamate und deren Derivate, wie Ferridimethyldithiocarbamat, Zinkdimethyldithiocarbamat, Manganäthylenbisdithiocarbamat, Mangan-Zink-äthylendiamin-bis-dithiocarbamat, Zinkäthylenbisdithiocarbamat, Tetramethylthiuramidsulfide, Ammoniak-Komplex von Zink-(N,N-äthylen-bis-dithiocarbamat) und N,N'-Polyäthylen-bis-(thiocarbamoyl)-disulfid, Zink-(N,N'-Propylen-bis-dithiocarbamat), Ammoniak-Komplex von Zinn-(N,N'-propylen-bis-dithiocarbamat) und N,N'-Pölypropylen-bis-(thiocarbamoyl)-disulfid. Nitrophenolderivat, wie Dinitro-(1-methylheptyl)-phenylcrotoriat, 2-sec-Butyl-4,6-dinitrophenyl-3,3-dimethylacrylat, 2-sec-Butyl-4,6-dinitrophenyl-isopropylcarbonat; heterocyclische Struktren, wie N-Trichlormethylthio-tetrahydrophthalimid, N-Trichlormcthylthio-phthalimid, 2-Heptadecyl-2-imidazolin-acetat, 2 4-bichlor-6-(o-chloranilino)-s-triazin, O,O-Diäthyl-phthalimidophonothioat, 5-Amino-1-(bis-(dimethylamino)-phosphinyl)-3-phenyl-1,2,4 -triazol, 5-Äthoxy-3-trichlormethyl-1,2,4-thiadiazol 2,3-Dicyano-1,4-dithiaanthrachinon, 2-Thio-1,3-dithio-(4,5-b)-chinoxalin, 1-Butylcarbamoyl)-2-benzimidazol-carbaminsäuremethylester, 2-Methoxycarbonylamino-benzimidazol, 2-Rhodanmethylthio-benzthiazol, 4-(2-Chlorphenylhydrazono)-3-methyl-5-isoxazolon, Pyridin-2-thiol-1-oxid, 8-Hydroxychinolin bzw. dessen Kupfersalz, 2,3-Dihydro-5-carboxanilido-6-methyl-1,4-oxathiin-4,4-dioxid, 2,3-Dihydro-5-carboxanilido-6-methyl-1,4-oxathiin, 2-(Furyl-(2))-benzimidazol, Piperazin-1,4-diyl-bis-1-(2,2,2-trichlor-äthyl)-formamid, 2-Thiazolyl-(4))-benzimidazol, 5-Butyl-2-dimethylamino-4-hydroxy-6-methyl-pyrimidin, Bis-(p-chlorphenyl)-3-pyridinmethanol, 1,2-Bis-(3-äthoxycarbonyl-2-thioureido)-benzol, 1,2-Bis-(3-methoxycarbonyl-2-thioureido)-benzol, und verschiedene Fungizide, wie Dodecylguanidinacetat, 3-(2-(3,5-Dimethyl-2-oxycyclehexyl)-2-hydroxyäthyl)-glutar- imid, Hexachlorbenzol, N-Dichlorfluormethylthio-N',N'-dimethyl-N-phenyl-schwefel- säurediamid, 2,5-Dimethyl-furan-3-carbonsäureanilid, 2,5-Dimethylfuran-3-carbonsäure-cyclohexylamid, 2-Methyl-benzoesäure-anilid, 2-Jod-benzoesäure-anilid, . 1-(3,4-Dichloranilino)-1-formylamino-2,2,2-trichloräthan, 2,6-Dimethyl-N-tridecyl-morpholin bzw. dessen Salze, 2,6-Dimethyl-N-cyclododecyl-morpholin bzw. dessen Salze, 2,3-Dichlor-1,4-naphthochinon, 1,4-Dichlor-2,5-dimethoxybenzol, p-Dimethylaminobenzol-diazinatriumsulfonat, 1-Chlor-2-nitrol-propan, Polychlornitrobenzole, wie Pentachlornitrobenzol, Methylisocyanat, fungizide Antibiotika, wie Griseofulvin oder Kausgamycin, Tetrafluordichloraceton, 1-Phenylthiosemicarbazid, Bordeauxmischung, nickelhaltige Verbindungen und Schwefel.
-
- Blätter von in Töpfen gewachsenen Gerstenkeimlingen der Sorte "Firlbecks Union" werden mit wäßrigen Emulsionen aus 80 % (Gew.%) Wirkstoff und 20 % Emulgiermittel besprüht und ,nach dem Antrocknen des Spritzbelages mit Oidien (Sporen) des Gerstenmehltaus (Erysiphe graminis var. hordei) bestäubt. Die Versuchspflanzen werden anschließend im Gewächshaus bei Temperaturen zwischen 20 und 22°C und 75 bis 80 % relativer Luftfeuchtigkeit aufgestellt. Nach 10 Tagen wird das Ausmaß der Mehltaupilzentwicklung ermittelt.
-
-
- Blätter von in Töpfen gewachsenen Weizenkeimlingen der Sorte "Jubilar" werden 24 Stunden vor der Spritzung künstlich mit Sporen des Weizenbraunrostes (Puccinia recondita) infiziert und bei 20 bsi 25°C in einer wasserdampfgesättigten Kammer aufgestellt. Danach werden die Pflanzen mit wäßrigen Emulsionen aus 80% (Gewichtsprozent) Wirkstoff und 20% Emulgiermittel besprüht. Nach dem Antrocknen des Spritzbelages werden die Versuchspflanzen im Gewächshaus bei Temperaturen zwischen 20 und 22°C und 75 bis 80% relativer Luftfeuchtigkeit aufgestellt. Nach 10 Tagen wird das Ausmaß der Rostpilzentwicklung ermittelt.
- Man vermischt 90 Gewichtsteile der Verbindung 1 mit 10 Gewichtsteilen N-Methyl-α-pyrrolidon und erhätl eine Lösung, die zur Anwendung in Form kleinster Tropfen geeignet ist.
- 20 Gewichtsteile der Verbindung 2 werden in einer Mischung gelöst, die aus 80 Gewichtsteilen Xylol, 10 Gewichtsteilen des Anlagerungsproduktes von 8 bis 10 Mol Äthylenoxid an 1 Mol ölsäure-N-monoäthanolamid, 5 Gewichtsteilen Calciumsalz der Dodecylbenzolsulfonsäure und 5 Gewichtsteilen des Anlagerungsproduktes von 40 Mol Äthylenoxid an 1 Mol Ricinusöl besteht. Durch Ausgießen und feines Verteilen der Lösung in 100 000 Gewichtsteilen Wasser erhält man eine wäßrige Dispersion, die 0,02 Gewichtsprozent. des Wirkstoffs enthält.
- 20 Gewichtsteile der Verbindung 3 werden in einer Mischung gelöst, die aus 40 Gewichtsteilen Cyclohexanon, 30 Gewichtsteilen Isobutanol, 20 Gewichtsteilen des Anlagerungsproduktes von 7 Mol Äthylenoxid an 1 Mol Isooctylphenol und 10 Gewichtsteilen des Anlagerungsproduktes von 40 Mol Äthylenoxid an 1 Mol Ricinusöl besteht. Durch Eingießen und feines Verteilen der Lösung in 100 000 Gewichtsteilen Wasser erhält man eine wäßrige Dispersion, die 0,02 Gewichtsprozent des Wirkstoffs enthält.
- 20 Gewichtsteile der Verbindung 1 werden in einer Mischung gelöst, die aus 25 Gewichtsteilen Cyclohexanol, 65 Gewichtsteilen einer Mineralölfraktion vom Siedepunkt 210 bis 280°C und 10 Gewichtsteilen des Anlagerungsproduktes von 40 Mol Äthylenoxid an 1 Mol Ricinusöl besteht. Durch Eingießen und feines Verteilen der Lösung in 100 000 Gewichtsteilen Wasser erhält man eine wäßrige Dispersion, die 0,02 Gewichtsprozent des Wirkstoffs enthält.
- 20 Gewichtsteile des Wirkstoffs 2 werden mit 3 Gewichtsteilen des Natriumsalzes der Düsobutylnaphthalin-α-sulfonsäure, 17 Gewichtsteilen des Natriumsalzes einer Ligninsulfonsäure aus einer Sulfit-Ablauge und 60 Gewichtsteilen pulverförmigem Kieselsäuregel gut vermischt und in einer Hammermühle vermahlen. Durch feines Verteilen der Mischung in 20 000 Gewichtsteilen Wasser erhält man eine Spritzbrühe, die 0,1 Gewichtsprozent des Wirkstoffs enthält.
- 3 Gewichtsteile der Verbindung 3 werden mit 97 Gewichtsteilen feinteiligem Kaolin innig vermischt. Man erhält auf diese Weise ein Stäubemittel, das 3 Gewichtsprozent des Wirkstoffs enthält.
- 30 Gewichtsteile der Verbindung 4 werden mit einer Mischung aus 92 Gewichtsteilen pulverförmigem Kieselsäuregel und 8 Gewichtsteilen Paraffinöl, das auf die Oberfläche dieses. Kieselsäuregels gesprüht wurde, innig vermischt. Man erhält auf diese Weise eine Aufbereitung des Wirkstoffs mit guter Haftfähigkeit.
- 40 Gewichtsteile des Wirkstoffs 1 werden mit 10 Teilen Natriumsalz eines Phenolsulfonsäure-harnstoff-formaldehyd-Kondensats, 2 Teilen Kieselgel und 48 Teilen Wasser innig vermischt. Man erhält eine stabile wäßrige Dispersion. Durch Verdünnen mit 100 000 Gewichtsteilen Wasser erhält man eine wäßrige Dispersion, die 0,04 Gewichtsprozent Wirkstoff enthält.
- 20 Teile des Wirkstoffs 2 werden mit 2 Teilen Calciumsalz der Dodecylbenzolsulfonsäure, 8 Teilen Fettalkohol-polyglykoläther, 2 Teilen Natriumsalz eines Phenolsulfonsäure-harnstoff-formaldehyd-Kondensats und 68 Teilen eines paraffinischen Mineralöls innig'vermischt. Man erhält eine stabile ölige Dispersion
Claims (8)
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE19772735314 DE2735314A1 (de) | 1977-08-05 | 1977-08-05 | Alpha-azolylsulfide und deren derivate |
| DE2735314 | 1977-08-05 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| EP0000752A2 true EP0000752A2 (de) | 1979-02-21 |
| EP0000752A3 EP0000752A3 (en) | 1979-04-04 |
| EP0000752B1 EP0000752B1 (de) | 1981-01-14 |
Family
ID=6015701
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP78100538A Expired EP0000752B1 (de) | 1977-08-05 | 1978-07-28 | Alpha-azolysulfide, -sulfoxide und -sulfone, deren Salze und Metallkomplexe, Verfahren zu ihrer Herstellung, sowie sie enthaltende Mittel zur Pilzbekämpfung |
Country Status (14)
| Country | Link |
|---|---|
| EP (1) | EP0000752B1 (de) |
| JP (1) | JPS5430174A (de) |
| AT (1) | AT360279B (de) |
| CA (1) | CA1112647A (de) |
| CS (1) | CS200238B2 (de) |
| DD (1) | DD137525A5 (de) |
| DE (2) | DE2735314A1 (de) |
| DK (1) | DK145597C (de) |
| FI (1) | FI64360C (de) |
| HU (1) | HU180205B (de) |
| IL (1) | IL55241A (de) |
| IT (1) | IT1107959B (de) |
| PL (1) | PL107615B1 (de) |
| SU (1) | SU795436A3 (de) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0101288A3 (de) * | 1982-08-13 | 1984-07-25 | The Dow Chemical Company | Aryl(aryloxy- und arylthio)azolmethane, ihre Herstellung und Verwendung |
| EP0061835B1 (de) * | 1981-03-18 | 1989-02-01 | Imperial Chemical Industries Plc | Triazolverbindungen, Verfahren zu deren Herstellung, deren Anwendung als Pflanzenfungizide und deren fungizide Zusammensetzungen |
| WO2003055850A1 (en) * | 2001-12-27 | 2003-07-10 | Daiichi Pharmaceutical Co., Ltd. | β-AMYLOID PROTEIN PRODUCTION/SECRETION INHIBITORS |
| US7932271B2 (en) | 2003-06-30 | 2011-04-26 | Daiichi Pharmaceutical Co., Ltd. | Heterocyclic methyl sulfone derivative |
Families Citing this family (23)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE2821829A1 (de) * | 1978-05-19 | 1979-11-22 | Basf Ag | Mittel zur regulierung des pflanzenwachstums |
| DE3100260A1 (de) * | 1981-01-08 | 1982-08-05 | Basf Ag, 6700 Ludwigshafen | Substituierte azolyl-glykolsulfonate, diese enthaltende fungizide und verfahren zu ihrer herstellung |
| ATE30322T1 (de) * | 1982-04-01 | 1987-11-15 | Schering Agrochemicals Ltd | Heterocyclische pilztoetende und wachstumsregulierende verbindungen und diese enthaltende zusammensetzungen. |
| US4517194A (en) * | 1982-06-25 | 1985-05-14 | Ciba-Geigy Corporation | Azolylmandelic acid derivatives and use thereof for controlling microorganisms |
| US4701207A (en) * | 1982-08-13 | 1987-10-20 | The Dow Chemical Company | Phenyl (phenoxy or phenylthio) azolomethanes |
| US4717732A (en) * | 1982-08-13 | 1988-01-05 | The Dow Chemical Company | Aryl(aryloxy or arylthio)azolomethanes and their use as pesticides |
| US4636514A (en) * | 1982-08-13 | 1987-01-13 | The Dow Chemical Company | Aryl(aryloxy or arylthio)azolomethanes |
| US4731372A (en) * | 1982-08-13 | 1988-03-15 | The Dow Chemical Company | Aryl(aryloxy or arylthio) azolomethanes, and their use as pesticides |
| US4728657A (en) * | 1982-08-13 | 1988-03-01 | The Dow Chemical Company | Aryl(aryloxy or arylthio)azolomethanes |
| US4716174A (en) * | 1982-08-13 | 1987-12-29 | The Dow Chemical Company | Aryl(aryloxy or arylthio)azolomethanes and their use as pesticides |
| US4717733A (en) * | 1982-08-13 | 1988-01-05 | The Dow Chemical Company | Aryl(aryloxy or arylthio)azolomethanes and their use as pesticides |
| US4720502A (en) * | 1982-08-13 | 1988-01-19 | The Dow Chemical Company | Aryl(aryloxy or arylthio)azolomethanes and their use as pesticides |
| US4701463A (en) * | 1982-08-13 | 1987-10-20 | The Dow Chemical Company | Pyridyl (pyridyloxy or pyriolylthio) azolomethanes |
| US4717734A (en) * | 1982-08-13 | 1988-01-05 | The Dow Chemical Company | Aryl(aryloxy or arylthio)azolomethanes and their use as pesticides |
| US4505919A (en) * | 1982-10-09 | 1985-03-19 | Pfizer Inc. | Antifungal S-arylmethyl- and S-heterocyclylmethyl ethers of 2-aryl-3-mercapto-1-(1H-1,2,4-triazol-1-yl) propan-2-ols |
| GB8326210D0 (en) * | 1983-09-30 | 1983-11-02 | Fbc Ltd | Azole compounds |
| PH23251A (en) * | 1985-03-18 | 1989-06-16 | Sds Biotech Corp | Propionate derivative and nonmedical fungicide containing the same |
| US4749713A (en) * | 1986-03-07 | 1988-06-07 | Ciba-Geigy Corporation | Alpha-heterocycle substituted tolunitriles |
| US4978672A (en) * | 1986-03-07 | 1990-12-18 | Ciba-Geigy Corporation | Alpha-heterocyclc substituted tolunitriles |
| US4937250A (en) * | 1988-03-07 | 1990-06-26 | Ciba-Geigy Corporation | Alpha-heterocycle substituted tolunitriles |
| FR2677983B1 (fr) * | 1991-06-24 | 1995-03-03 | Oreal | Composes alkylthiopoly(ethylimidazolium), procede de preparation et leur utilisation comme agents biocides. |
| GB0108592D0 (en) * | 2001-04-05 | 2001-05-23 | Merck Sharp & Dohme | Therapeutic agents |
| US7314875B2 (en) * | 2004-04-13 | 2008-01-01 | Cephalon, Inc. | Tricyclic aromatic and bis-phenyl sulfinyl derivatives |
-
1977
- 1977-08-05 DE DE19772735314 patent/DE2735314A1/de active Pending
-
1978
- 1978-07-28 EP EP78100538A patent/EP0000752B1/de not_active Expired
- 1978-07-28 IL IL55241A patent/IL55241A/xx unknown
- 1978-07-28 DE DE7878100538T patent/DE2860325D1/de not_active Expired
- 1978-07-31 CA CA308,484A patent/CA1112647A/en not_active Expired
- 1978-08-01 IT IT50557/78A patent/IT1107959B/it active
- 1978-08-02 DD DD20708978A patent/DD137525A5/de unknown
- 1978-08-02 CS CS785091A patent/CS200238B2/cs unknown
- 1978-08-03 SU SU782646293A patent/SU795436A3/ru active
- 1978-08-03 PL PL1978208828A patent/PL107615B1/pl unknown
- 1978-08-04 FI FI782403A patent/FI64360C/fi not_active IP Right Cessation
- 1978-08-04 AT AT568678A patent/AT360279B/de active
- 1978-08-04 HU HU78BA3683A patent/HU180205B/hu unknown
- 1978-08-04 JP JP9469478A patent/JPS5430174A/ja active Pending
- 1978-08-04 DK DK345678A patent/DK145597C/da active
Non-Patent Citations (1)
| Title |
|---|
| Keine Entgegenhaltungen * |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0061835B1 (de) * | 1981-03-18 | 1989-02-01 | Imperial Chemical Industries Plc | Triazolverbindungen, Verfahren zu deren Herstellung, deren Anwendung als Pflanzenfungizide und deren fungizide Zusammensetzungen |
| EP0101288A3 (de) * | 1982-08-13 | 1984-07-25 | The Dow Chemical Company | Aryl(aryloxy- und arylthio)azolmethane, ihre Herstellung und Verwendung |
| WO2003055850A1 (en) * | 2001-12-27 | 2003-07-10 | Daiichi Pharmaceutical Co., Ltd. | β-AMYLOID PROTEIN PRODUCTION/SECRETION INHIBITORS |
| US7399775B2 (en) | 2001-12-27 | 2008-07-15 | Daiichi Pharmaceutical Co., Ltd. | β-amyloid protein production/secretion inhibitor |
| US7932271B2 (en) | 2003-06-30 | 2011-04-26 | Daiichi Pharmaceutical Co., Ltd. | Heterocyclic methyl sulfone derivative |
Also Published As
| Publication number | Publication date |
|---|---|
| DE2860325D1 (en) | 1981-03-12 |
| DK345678A (da) | 1979-02-06 |
| JPS5430174A (en) | 1979-03-06 |
| DE2735314A1 (de) | 1979-02-22 |
| FI782403A7 (fi) | 1979-02-06 |
| IL55241A0 (en) | 1978-09-29 |
| PL107615B1 (pl) | 1980-02-29 |
| DD137525A5 (de) | 1979-09-12 |
| DK145597B (da) | 1982-12-20 |
| CS200238B2 (en) | 1980-08-29 |
| IT1107959B (it) | 1985-12-02 |
| PL208828A1 (pl) | 1979-05-21 |
| DK145597C (da) | 1983-08-15 |
| IL55241A (en) | 1982-01-31 |
| ATA568678A (de) | 1980-05-15 |
| HU180205B (en) | 1983-02-28 |
| FI64360B (fi) | 1983-07-29 |
| EP0000752A3 (en) | 1979-04-04 |
| CA1112647A (en) | 1981-11-17 |
| EP0000752B1 (de) | 1981-01-14 |
| IT7850557A0 (it) | 1978-08-01 |
| AT360279B (de) | 1980-12-29 |
| SU795436A3 (ru) | 1981-01-07 |
| FI64360C (fi) | 1983-11-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP0000752B1 (de) | Alpha-azolysulfide, -sulfoxide und -sulfone, deren Salze und Metallkomplexe, Verfahren zu ihrer Herstellung, sowie sie enthaltende Mittel zur Pilzbekämpfung | |
| EP0021345B1 (de) | Alpha-Azolylglykolderivate, ihre Herstellung, sie enthaltende pflanzenwachstumsregulierende Mittel und ihre Verwendung | |
| EP0054865B1 (de) | Substituierte 1-Azolyl-butan-2-one, Verfahren zu ihrer Herstellung und ihre Verwendung als Fungizide sowie als Zwischenprodukte | |
| DE2723942A1 (de) | Azolyl-acetophenonoximaether | |
| EP0192055A2 (de) | Hydroxyalkinyl-azolyl-Derivate, Verfahren zu ihrer Herstellung sowie ihre Verwendung als Fungizide | |
| EP0104549B1 (de) | Azolylbutanole | |
| DE3311702A1 (de) | Fungizide mittel, verfahren zu ihrer herstellung und deren verwendung | |
| CH635481A5 (de) | Fungizides mittel. | |
| EP0025882A1 (de) | N-phenylpropylsubstituierte Azole, Verfahren zu ihrer Herstellung und diese enthaltende Fungizide | |
| DE2634511A1 (de) | Beta-azolylketone | |
| EP0021327A1 (de) | Neue beta-Triazolylether, ihre Herstellung, sie enthaltende Fungizide, Verfahren zur Bekämpfung von Fungi und zur Herstellung von Fungiziden | |
| EP0000112B1 (de) | Triazolsubstituierte Schwefelverbindungen, Verfahren zu ihrer Herstellung sowie ihre Verwendung als Fungizide | |
| EP0047405A2 (de) | Azolylalkyl-Derivate, Verfahren zu ihrer Herstellung und ihre Verwendung als Fungizide | |
| EP0129186B1 (de) | Azolderivate | |
| EP0028363A1 (de) | Entriazole, ihre Herstellung, ihre Verwendung zur Bekämpfung von Fungi und Mittel dafür | |
| EP0010270A1 (de) | Neue alpha-Azolyl-alpha-phenylessigsäurederivate, ihre Herstellung, sie enthaltende Fungizide, Verfahren zur Bekämpfung von Fungi und zur Herstellung von Fungiziden | |
| EP0057365A2 (de) | Vinylazole, Verfahren zu ihrer Herstellung und ihre Verwendung bei der Bekämpfung von Pilzen | |
| EP0082400B1 (de) | Fungizide alpha-Azolylglykole | |
| EP0056089B1 (de) | Azolylalkyl-2,3-dihydrobenzofurane, diese enthaltende Fungizide und Verfahren zu ihrer Herstellung | |
| EP0033501A2 (de) | Beta-Imidazolylalkohole, Verfahren zu ihrer Herstellung, diese enthaltende Fungizide und Verfahren zur Bekämpfung von Pilzen mit ihnen | |
| EP0001571B1 (de) | Phenylazophenyloxy-triazolylverbindungen und Fungizide, die diese Verbindungen enthalten | |
| EP0069289B1 (de) | Azolderivate, Verfahren zu ihrer Herstellung und diese enthaltende Fungizide | |
| EP0057864A2 (de) | 2-Azolylmethyl-1,3-dioxolan- und -dioxan-Derivate, Verfahren zu ihrer Herstellung und ihre Verwendung als Fungizide | |
| EP0073331B1 (de) | 5-Aryloxy-5-azolyl-3,3-dimethyl-1-penten-4-one und -ole, Verfahren zu ihrer Herstellung sowie ihre Verwendung als Fungizide | |
| EP0071095A1 (de) | Phenylketenacetale und diese enthaltende Fungizide |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PUAI | Public reference made under article 153(3) epc to a published international application that has entered the european phase |
Free format text: ORIGINAL CODE: 0009012 |
|
| PUAL | Search report despatched |
Free format text: ORIGINAL CODE: 0009013 |
|
| AK | Designated contracting states |
Designated state(s): BE CH DE FR GB LU NL SE |
|
| AK | Designated contracting states |
Designated state(s): BE CH DE FR GB LU NL SE |
|
| 17P | Request for examination filed | ||
| GRAA | (expected) grant |
Free format text: ORIGINAL CODE: 0009210 |
|
| AK | Designated contracting states |
Designated state(s): BE CH DE FR GB LU NL SE |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: CH Effective date: 19810114 |
|
| REF | Corresponds to: |
Ref document number: 2860325 Country of ref document: DE Date of ref document: 19810312 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: LU Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19810731 |
|
| KL | Correction list |
Free format text: 81/01 |
|
| REG | Reference to a national code |
Ref country code: CH Ref legal event code: PL |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: LU Payment date: 19830628 Year of fee payment: 6 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: DE Payment date: 19840622 Year of fee payment: 7 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: FR Payment date: 19840625 Year of fee payment: 7 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: SE Payment date: 19840630 Year of fee payment: 7 Ref country code: BE Payment date: 19840630 Year of fee payment: 7 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: NL Payment date: 19870731 Year of fee payment: 10 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: GB Effective date: 19880728 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: SE Effective date: 19880729 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: BE Effective date: 19880731 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: DE Effective date: 19880901 |
|
| BERE | Be: lapsed |
Owner name: BASF A.G. Effective date: 19880731 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: NL Effective date: 19890201 |
|
| NLV4 | Nl: lapsed or anulled due to non-payment of the annual fee | ||
| GBPC | Gb: european patent ceased through non-payment of renewal fee | ||
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: FR Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19890331 |
|
| REG | Reference to a national code |
Ref country code: FR Ref legal event code: ST |
|
| EUG | Se: european patent has lapsed |
Ref document number: 78100538.4 Effective date: 19890510 |
|
| PLBE | No opposition filed within time limit |
Free format text: ORIGINAL CODE: 0009261 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: NO OPPOSITION FILED WITHIN TIME LIMIT |