-
1. GEBIET
DER ERFINDUNG
-
Es wird angenommen, dass die legal
und weitläufig
verfügbaren
Säuresalze
von sympathomimetischen Aminen, wie den Dekongestanzien Pseudoephedrinhydrochlorid,
Pseudoephedrinsulfat, Ephedrinhydrochlorid und Phenylpropanolaminhydrochlorid,
bei der chemischen Synthese von illegalen Arzneistoffen bzw. Drogen,
wie Methamphetamin, Amphetamin, Methcathinon und Cathinon, verwendet
werden. Diese Erfindung macht durch die Einarbeitung von einer oder
mehreren Vergällungsstoffverbindungen
kommerziell verfügbare „frei verkäufliche" („over the
counter") („OTC") Medikamente, die
sympathomimetische Aminsalze enthalten, als Ausgangsmaterialien
zur Herstellung von illegalen Drogen viel weniger geeignet. Der/Die
Vergällungsstoff(e)
zeigt/zeigen chemische oder physikalische Eigenschaften, die die
Isolierung des reinen sympathomimetischen Aminsalzes aus einem Produkt,
das eine Kombination des/der Vergällungsstoffs/e und des sympathomimetischen
Aminsalzes enthält,
schwierig oder im Wesentlichen unmöglich machen. Weil die Isolierung von
reinem sympathomimetischem Aminsalz unausführbar gemacht wird, werden
Versuche zum Anwenden von in dieser Erfindung vorgeschlagenen Zusammensetzungen
als eine Quelle für
Ausgangsmaterial zur Synthese von illegalen Drogen ein verfälschtes
Produkt bei Einbußen
in der Ausbeute ergeben.
-
In einer bevorzugten Ausführungsform
bezieht sich der Begriff „Vergällungsstoff" auf eine Verbindung, deren
Trennung von sympathomimetischen Aminsalzen schwierig oder im Wesentlichen
unmöglich
ist, sodass die Synthese von illegalen Drogen aus den erfindungsgemäßen Zusammensetzungen
unausführbar
gemacht wird und/oder illegale Drogen in einer verfälsch ten
Form erzeugt. In einer weiteren bevorzugten Ausführungsform bezieht sich der
Begriff „Vergällungsstoff" auf Materialien,
die physikalisch bei der Extraktion der sympathomimetischen Aminsalze
aus den pharmazeutischen Produkten stören (das heißt, die
Viskosität
der pharmazeutischen Produkte in Lösung emulgiert und/oder verändert),
sodass die Reinigung der sympathomimetischen Aminsalze aus den pharmazeutischen
Produkten nicht ausführbar
gemacht wird. Der Vergällungsstoff ist
aufgrund seines Vorliegens in OTC-Medikamenten selbstverständlich für Säuger pharmakologisch
und biologisch verträglich.
-
2. HINTERGRUND DER ERFINDUNG
-
2.1. SYMPATHOMIMETISCHE
PHARMAZEUTIKA
-
Sympathomimetische Verbindungen üben, wie
der Name impliziert, biologische Wirkungen, ähnlich jenen, die durch Aktivierung
des sympathetischen Nervensystems erzeugt werden, aus. Beispielsweise
wirkt die pharmazeutische Verbindung Pseudoephedrin durch Veranlassen
der adrenergen Nervenendigungen, Norepinephrin freizusetzen, wodurch α- und β-Norepinephrin-Rezeptoren,
insbesondere in Blutgefäßen des
oberen Atmungstrakts, stimuliert werden, als ein indirektes sympathomimetisches
Mittel. Dies wiederum führt
zu Vasokonstriktion und Schrumpfung von geschwollenen Geweben in
den Nebenhöhlen
und Nasalgängen.
-
2.2. DAS PROBLEM VON ILLEGALER
UMWANDLUNG
-
Methamphetamin ist eine starke und
zerstörerische
Droge, die illegal auf der Straße
als „Crack", „Meth" und „Speed" vertrieben wird.
Illegale Verwendung von Methamphetamin wird immer üblicher.
Allein in Kalifornien haben die Krankenhäuser eine mehr als 300-prozentige
Erhöhung
von Notaufnahmen von Methamphetamin-Missbrauch in den letzten zehn
Jahren zu verzeichnen.
-
Eines der wirksamsten Ausgangsmaterialien
bei der Synthese von Methamphetamin ist Ephedrin, das strenger Regu lierung
bzw. Gesetzgebung unterliegt und deshalb schwierig zu erhalten ist.
Zunehmend wird Pseudoephedrin, ein Enantiomer von Ephedrin, bei
der Herstellung von Methamphetaminen verwendet. Pseudoephedrin kann
aus einem Pseudoephedrinsalz, wie Pseudoephedrinhydrochlorid, erhalten
werden, welches ein üblicher
Bestandteil von frei verkäuflichen
(„OTC")-Medikamenten ist.
-
Pseudoephedrinhydrochlorid kann aus
OTC-Medikamenten durch Suspendieren/Auflösen der kommerziellen Produkte
in Wasser isoliert werden. Die erhaltene Aufschlämmung/Lösung wird filtriert und dann
mit Base behandelt, um das Aminsalz, Pseudoephedrinhydrochlorid,
zu neutralisieren, wodurch die freie Base von Pseudoephedrin erzeugt
wird. Die freie Base, die begrenzte Wasserlöslichkeit aufweist, wird dann
in ein mit Wasser nicht mischbares Lösungsmittel, wie Ether, extrahiert.
Die Extraktion dient als ein Reinigungsschritt. Ansäuerung zum
Erzeugen des Aminhydrochlorids, gefolgt von Extraktion in Wasser,
ist normalerweise hinreichend, um geeignetes reines Pseudoephedrinhydrochlorid
herzustellen.
-
Es wäre natürlich von großem Vorteil,
die Umwandlung von sympathomimetischen Aminverbindungen, unter Halten
der OTC-Verfügbarkeit,
zu verhindern oder davon abzuhalten.
-
WO 94/28870 offenbart eine kaubare
Erkältungs/Nebenhöhlenzubereitung,
umfassend ein bitter schmeckendes Gemisch eines Dekongestanz, wie
Pseudoephedrin, und eines Antihistamins, wie Diphenhydramin und/oder
Chlorpheniraminmaleat, welches ohne bitteren, metallischen Geschmack
oder unangenehmes Mundgefühl
durch Adsorbieren des aktiven Arzneistoffgemisches auf einem Siliziumdioxidträger hergestellt wird.
Eine tatsächliche
Multisymptomlinderungsformulierung wird durch die wahlweise Zugabe
eines Antitussivums, wie Dextromethorphanhydrobromid, und/oder Analgetikums,
wie Meclofenaminsäure,
Aspirin oder Ibuprofen, hergestellt.
-
3. KURZDARSTELLUNG
DER ERFINDUNG
-
Die vorliegende Erfindung ist auf
die Zugabe von einem oder mehreren pharmazeutisch und biologisch verträglichen
Vergällungsstoffen
zu sympathomimetischen Aminsalz-enthaltenden pharmazeutischen Produkten
gerichtet, um diese Produkte als Ausgangsmaterialien für die Herstellung
von illegalen Drogen weniger geeignet zu machen.
-
Der/Die Vergällungsstoff(e) zeigt/zeigen
chemische oder physikalische Eigenschaften, die die Isolierung des
reinen sympathomimetischen Aminsalzes aus einem Produkt, das eine
Kombination des/der Vergällungsstoffs/e
und des sympathomimetischen Aminsalzes enthält, schwierig oder im Wesentlichen
unmöglich machen.
Weil die Isolierung von reinem sympathomimetischem Aminsalz unmöglich gemacht
wird, werden Versuche zum Anwenden von in dieser Erfindung vorgeschlagenen
Zusammensetzungen als eine Quelle für Ausgangsmaterial zur Synthese
von illegalen Drogen ein verfälschtes
Produkt mit Einbußen
in der Ausbeute ergeben.
-
In einer bevorzugten Ausführungsform
bezieht sich der Begriff „Vergällungsstoff" auf eine Verbindung, deren
Trennung von sympathomimetischen Aminsalzen schwierig oder im Wesentlichen
unmöglich
ist, sodass die Synthese von illegalen Drogen aus den erfindungsgemäßen Zusammensetzungen
unausführbar
gemacht wird und/oder illegale Drogen in einer verfälschten
Form erzeugt. In einer weiteren bevorzugten Ausführungsform bezieht sich der
Begriff „Vergällungsstoff" auf Materialien,
die physikalisch bei der Extraktion der sympathomimetischen Aminsalze
aus den pharmazeutischen Produkten stören (das heißt, emulgiert
und/oder verändert
die Viskosität
der pharmazeutischen Produkte in Lösung), sodass die Reinigung
der sympathomimetischen Aminsalze aus den pharmazeutischen Produkten
nicht ausführbar
gemacht wird. Der Vergällungsstoff ist
aufgrund seines Vorliegens in OTC-Medikamenten selbstverständlich für Säuger pharmakologisch
und biologisch verträglich.
-
Die vorliegende Erfindung ist auf
Vergällungsstoffenthaltende
sympathomimetische Aminprodukte und Verfahren für deren Herstellung gerichtet.
Die Vergällungsstoff-enthaltenden
sympathomimetischen Aminprodukte werden für bekannte Indikationen, die
durch sympathomimetische Amine behandelt werden, angewendet.
-
4. BESCHREIBUNG DER ERFINDUNG
IM EINZELNEN
-
Zur einfacheren Beschreibung und
nicht zur Begrenzung wird die Beschreibung der Erfindung im Einzelnen
in die nachstehenden Unterabschnitte: i) Vergällungsstoff, ii) sympathomimetische
Amine und iii) Zusammensetzungen geteilt.
-
4.1. VERGÄLLUNGSSTOFF
-
Wie hierin verwendet, bezieht sich
der Begriff „Vergällungsstoff" auf eine Verbindung,
die (i) eine physikalische Eigenschaft aufweist, die ihre Trennung
von einem sympathomimetischen Amin schwierig oder im Wesentlichen
undurchführbar
macht, und/oder (ii) eine chemische Eigenschaft, die mit illegaler
sympathomimetischer, auf Amin basierender Arzneistoffsynthese in
Wechselwirkung tritt.
-
Verschiedene Löslichkeit in unterschiedlichen
Lösungsmitteln
ist eine physikalische Eigenschaft, die die Trennung eines Vergällungsstoffs
aus einem sympathomimetischen Amin verkompliziert oder ausschließen kann.
Beispielsweise umfasst die Isolierung von sympathomimetischen Aminen
aus OTC-Zubereitungen im Allgemeinen die Schritte von (i) Auflösen der
OTC-Zubereitung in wässeriger
Lösung;
(ii) Filtrieren; (iii) Zugeben von Base, unter Herstellung der in
Wasser relativ unlöslichen,
hydrophoben freien Basenform des sympathomimetischen Amins; (iv)
Filtrieren der ausgefällten
freien Base; (v) Extrahieren der verbleibenden freien Base in lipophiles
Lösungsmittel;
(vi) Verdampfen des Lösungsmittels;
und (vii) Auflösen
der freien Base in Säure,
um das Säuresalz
des sympathomimetischen Amins zu regenerieren. Ein Vergällungsstoff
mit ähnlicher Löslichkeit
würde während jedem
die ser Schritte schwierig oder unmöglich von dem sympathomimetischen Amin
zu trennen sein. In Abhängigkeit
von der chemischen Struktur des Vergällungsstoffs, kann sie durch
die Zugabe von Base oder Säure
oder durch Einwirkung von wässerigen
oder lipophilen Lösungsmitteln
wesentlich verändert
werden oder nicht. Erwünscht
ist, dass bei jedem Schritt des Reinigungsverfahrens die Löslichkeit
des Vergällungsstoffs
(in welcher Form auch immer) mit jener des sympathomimetischen Amins
vergleichbar ist. Die Löslichkeit
kann mit Hilfe von Löslichkeitskonstanten
der einzelnen Lösungsmittel,
siehe beispielsweise angeführt
in (The Handbook of Chemistry and Physics, 77. Ausgabe, Copyright
1996), quantifiziert werden. In besonderen nicht begrenzten Ausführungsformen
kann die Löslichkeitskonstante
für den
Vergällungsstoff
bei jedem Schritt des Reinigungsverfahrens in der Löslichkeitskonstante
des sympathomimetischen Amins um + 50 Prozent oder weniger, vorzugsweise
+ 30 Prozent oder weniger, bevorzugter + 20 Prozent oder weniger,
und noch bevorzugter + 10 Prozent oder weniger, variieren. Diese
Variationen können
sich von Schritt zu Schritt des Reinigungsverfahrens unterscheiden.
-
Alternativ kann der Vergällungsstoff
physikalische Eigenschaften aufweisen, die sich von jenen des sympathomimetischen
Amin unterscheiden, jedoch trotzdem die Reinigung des sympathomimetischen
Amins erschweren. Beispielsweise kann der Vergällungsstoff eine Substanz sein,
die in wässeriger
Lösung
schlecht löslich
ist, sodass Zusammensetzungen, umfassend sowohl Vergällungsstoff
als auch sympathomimetisches Amin, schwierig aufzulösen sind
(beispielsweise Vergällungsstoff – beschichtete
Teilchen, umfassend sympathomimetisches Amin, und sympathomimetisches
Amin, eingebettet in eine Vergällungsstoffmatrix).
-
In weiteren erfindungsgemäßen Ausführungsformen
kann ein Vergällungsstoff
ein oder mehrere chemische Eigenschaften aufweisen, die bei der
illegalen Drogensynthese stören.
Solche Störung
kann auftreten bei einem Schritt oder bei verschiedenen Schritten
von entweder der Reinigung des sympatho mimetischen Amins oder seiner
Umwandlung in eine illegale Droge. Die Begriffe „Stören" und „Störung" beziehen sich auf eine Behinderung
der Reinigung und/oder eines Umwandlungsverfahrens im Ergebnis einer
chemischen Reaktion, die den Vergällungsstoff beinhaltet. Beispielsweise
kann chemische Reaktion des Vergällungsstoffs eine
Produktverbindung erzeugen, die nichttoxisch ist, die jedoch einen
unangenehmen Geschmack, Geruch, emetischen Effekt, usw., aufweisen
kann. Alternativ kann das Vorliegen von Vergällungsstoff Reaktanten, die für das sympathomimetische
Amin einzusetzen sind, im Übermaß erfordern,
wodurch sich die Wirksamkeit der Reinigung und/oder Umwandlung vermindert.
-
Die Menge des zusammen mit dem sympathomimetischen
Aminsalz extrahiertem Vergällungsstoff kann
analytisch bewertet werden. Wenn das Extraktionsverfahren jenes
ist, das üblicherweise
durch die bekannten „meth
cooks" ausgewählt wird
(das heißt,
freie Base von sympathomimetischem Amin, extrahiert aus Wasser in
ein mit Wasser nicht mischbares Lösungsmittel (Secrets of Methamphetamine
Manufacture, Vierte Ausgabe, 1996)), kann die Menge an freie Base-Vergällungs-stoff
von Lösungsmittelextrakten
zusammen mit dem sympathomimetischen Amin größer als 50% der Anfangsmenge
des Vergällungsstoffs
sein; bevorzugter kann die extrahierte Menge an Vergällungsstoff
etwa 60% bis etwa 100% der Anfangsmenge an Vergällungsstoff sein, und besonders
bevorzugt kann die extrahierte Menge an Vergällungsstoff etwa 90% bis etwa
100% der Anfangsmenge des Vergällungsstoffs
sein. Es kann erwartet werden, dass die Menge an zusammen mit den
sympathomimetischen Aminsalzen extrahiertem Vergällungsstoff in Abhängigkeit
von dem besonderen angewendeten Extraktionsverfahren variiert.
-
In Abhängigkeit von dem angewendeten
Extraktionsverfahren kann das Ausmaß, zu dem die Vergällungsstoffe
die Leichtigkeit und Wirksamkeit der Wiedergewinnung der sympathomimetischen
Aminsalze aus sympathomimetischen Aminenthaltenden Formulierungen
beeinflussen, quantifiziert wer den. Wenn das Extraktionsverfahren
jenes, beschrieben von Uncle Fester in „The Secrets of Methamphetamine
Manufacture", Vierte
Ausgabe, Seiten 158–159,
ist, ist nach einigen Stunden die Ausbeute an sympathomimetischem
Aminsalz aus der Formulierung nicht mehr als etwa 70% der Gesamtmenge
an sympathomimetischem Aminsalz in der Formulierung. In einer bevorzugten
Ausführungsform
der vorliegenden Erfindung ist die Ausbeute nicht mehr als 50%,
und in einer bevorzugteren Ausführungsform
der vorliegenden Erfindung ist die Ausbeute nicht mehr als etwa
30%, und in einer besonders bevorzugten Ausführungsform ist die Ausbeute
nicht mehr als etwa 10%.
-
Nicht-begrenzende Beispiele von Vergällungsstoffen,
die gemäß der Erfindung
verwendet werden können,
werden nachstehend angeführt.
-
4.1.1. AMINVERBINDUNGEN
-
In einer ersten Reihe von nicht-begrenzenden
Ausführungsformen
können
die Säuresalze
der Aminverbindungen, die als im Wesentlichen in Wasser lösliche,
hydrophile Säuresalze
und im Wesentlichen in Wasser unlösliche, hydrophobe freie Basen
vorliegen, als erfindungsgemäßer Vergällungsstoff
verwendet werden. Diese Aminverbindungen zeigen physikalische und
chemische Eigenschaften, die den sympathomimetischen Aminsalzen ähnlich sind.
-
Während
bevorzugt Aminverbindungs-Vergällungsstoffe
hierin offenbart werden, sollte es selbstverständlich sein, dass beliebige
Aminverbindung, die als ein im Wesentlichen in Wasser lösliches
hydrophiles Säuresalz
und als eine im Wesentlichen in Wasser unlösliche, hydrophile freie Base
vorliegen, als ein Vergällungsstoff
verwendet werden können.
Solche Amin-enthaltenden Vergällungsstoffverbindungen
können
asymmetrische Zentren aufweisen und als Racemate, racemische Gemische,
einzelne Diastereomeren oder Enantiomeren vorliegen, wobei alle
isomeren Formen in die vorliegende Erfindung eingeschlossen sind.
-
In nicht-begrenzenden Ausführungsformen
der vorliegenden Erfindung ist die Löslichkeit von Aminverbindungs-Vergällungsstoff
und seiner freien Base etwa die gleiche wie die Löslichkeit
des sympathomimetischen Aminsalzes bzw. seiner freien Base. Der
Vergällungsstoff
und seine freie Base wird ähnliche
Löslichkeit in
Wasser und lipophilem Lösungsmittel,
bezogen auf sympathomimetische Amine, aufweisen; wobei der Vergällungsstoff
vorzugsweise in Wasser löslich
und in einem lipophilen Lösungsmittel
praktisch unlöslich
ist und seine freie Base in Wasser schlecht löslich ist und in einem lipophilen
Lösungsmittel
frei löslich
ist.
-
Ein bevorzugtes Amin, das die vorangehenden
Kriterien erfüllt,
ist ein Säureadditionssalz
von Chinin (beispielsweise Chininmonohydrochlorid oder Chininbisulfat).
Chinin ist als ein Salz sehr wasserlöslich und ist als eine freie
Base in Wasser nahezu unlöslich.
Die freie Base ist jedoch in einer breiten Vielzahl von organischen
Lösungsmitteln
sehr löslich.
Weiterhin hat Chinin verschiedene funktionelle Gruppen, die unter
den Reduktionsbedingungen, die normalerweise verwendet werden, um
die illegale Droge aus Pseudoephedrinhydrochlorid oder Phenylpropanolaminhydrochlorid
herzustellen, reaktiv sind. Diese zusätzlichen Nebenreaktionen machen
das allgemeine Reaktionsgemisch viel komplizierter und machen es
schwieriger, das Produkt zu reinigen. Chinin wird auch in der Amerikanischen
Liste „Generally
Regarded as Safe" („G. R.
A. S.") angeführt und
kann deshalb für
Säuger
als pharmakologisch und biologisch verträglich betrachtet werden.
-
In anderen, nicht-begrenzenden Ausführungsformen
der vorliegenden Erfindung ist der Aminverbindungs-Vergällungsstoff
ein Säuresalz
einer Verbindung mit der Strukturformel I:
worin R
1,
R
2, R
3, R
4 und R
5 ausgewählt sind
aus dem Nachstehenden: Wasserstoff, substituiertem oder unsubstituiertem
C
1-12-Alkyl, substituiertem oder unsubstituiertem
C
1-12-Alkoxy,
Hydroxyl, Halogen, substituiertem oder unsubstituiertem Aryl und
substituiertem oder unsubstituiertem Heterocyclus; R
3 und
R
4 können
auch -CH
2-S-Y sein, worin Y Wasserstoff;
substituiertes oder unsubstituiertes C
1-12-Alkyl,
substituiertes oder unsubstituiertes C
1-12-Alkoxy,
Hydroxyl, Halogen, substituiertes oder unsubstituiertes Aryl und
substituierter oder unsubstituierter Heterocyclus darstellt. X kann
Sauerstoff, Schwefel oder Stickstoff-R
6 sein,
worin R
6 das Gleiche wie R
1 ist.
N ist eine ganze Zahl von null bis fünf. Ungeachtet dem Vorangehenden
können
R
1 und R
2 nicht Halogen
sein, R
3 und R
4 können nicht
Phenyl sein und R
5 kann nicht Wasserstoff
oder Halogen sein. Wenn jede Variable (beispielsweise Aryl, Heterocyclus,
R
1, R
2, R
3, usw.) mehr als einmal in einem Bestandteil
oder in jeder Formel dieser Erfindung vorkommt, ist seine Definition
bei jedem Vorkommen unabhängig
von seiner Definition bei jedem anderen Vorkommen. Auch Kombinationen
von Substituenten und/oder Variablen sind zulässig, nur, wenn solche Kombinationen
stabile Verbindungen ergeben. Ausgenommen wo angeführt, ist,
wenn „Akyl" hier verwendet wird,
beabsichtigt, sowohl verzweigt- als auch nicht verzweigtkettige,
gesättigte
oder ungesättigte
aliphatische Kohlenwasserstoffgruppen mit der ausgewiesenen Anzahl
an Kohlenstoffatomen einzuschließen; „Alkoxy" gibt eine Alkylgruppe der ausgewiesenen
Anzahl an Kohlenstoffatomen, die an eine Sauerstoffbrücke gebunden
sind, wieder. „Halogen" oder „Halo", wie hierin verwendet,
bedeutet Fluor-, Chlor-, Brom- und Jod oder Jod-. Wie hierin verwendet,
mit angeführten
Ausnahmen, soll „Aryl" jeden stabilen monocyclischen,
bicyclischen oder tricyclischen Kohlenstoffring mit bis zu 7 Mitgliedern
in jedem Ring bedeuten, worin mindestens ein Ring aromatisch ist.
Der Begriff Heterocyclus oder heterocyclisch, wie hierin verwendet, ausgenommen,
wo angeführt,
gibt einen stabilen, 5- bis 7-gliedrigen
monocyclischen oder stabilen, 8- bis 11-gliedrigen bicyclischen,
heterocyclischen Ring wieder, der entweder gesättigt oder ungesättigt ist,
und der Kohlenstoffatome und ein bis drei Heteroatome, ausgewählt aus
der Gruppe, bestehend aus Stickstoff, Sauerstoff und Schwefel, umfasst,
worin die Stickstoff- und Schwefelheteroatome gegebenenfalls oxidiert
sein können
und das Stickstoffheteroatom gegebenenfalls quaternisiert sein kann,
und einschließlich
jede bicyclische Gruppe, in der jeder der vorstehend definierten
heterocyclischen Ringe an einen Benzolring kondensiert ist. Der
heterocyclische Ring kann an jedes Heteroatom oder Kohlenstoffatom
gebunden sein, das die Erzeugung einer stabilen Struktur ergibt.
-
Bevorzugte Aminverbindungs-Vergällungsstoffe,
die Säuresalze
von Verbindungen der Strukturformel I darstellen, sind Salze von
Aminosäureamiden.
Aminosäureester
und Aminosäureamide
sind dem Fachmann gut bekannt. Bevorzugte Beispiele dieser Vergällungsstoffe
schließen
Salze von Cysteinethylester, Glycin-t-butylester, Leucinamid, Methioninethylester,
Methylcystein, Methylmethionin, Prolinbenzylester, Serinethylester,
Tryptophanmethylester und Ethylglycin ein, sind jedoch nicht darauf
begrenzt.
-
Weitere Vergällungsstoffe, die für die vorliegende
Erfindung geeignet sind, schließen
in Wasser lösliche
Vitamine, einschließlich,
jedoch nicht begrenzt auf Vitamin-B-1 (Thiaminhydrochlorid), Vitamin-B-6
(Pyridoxinhydrochlorid), und Salze von Vitamin-K5 ein.
-
4.1.2. GERUCH-ERZEUGENDER
VERGÄLLUNGSSTOFF
-
In einer zweiten Reihe von nicht-begrenzenden
Ausführungsformen
können
die gemäß der Erfindung verwendeten
Vergällungsstoffe
Verbindungen sein, die während
der Reinigung und/oder Umwandlung von sympathomimetischen Aminen
bei der illegalen Drogensynthese schlecht riechend werden. Der Geruch
ist vorzugsweise unangenehm und stechend. Der Geruch kann während der
Herstellung von illegalen Drogen freigesetzt werden und dabei ein
solches Präparat
ungenießbar
machen und/oder als ein erkennbares Signal für die Gesetzeshüter dienen,
dass illegale Drogen an einem bestimmten Ort hergestellt werden.
Illegale, aus Ausgangsmaterialien, die Gerucherzeugenden Vergällungsstoff
umfassen, hergestellte Drogen können
selbst einen ungenießbaren
Geruch und/oder Geschmack beibehalten. Jedoch erzeugen solche Vergällungsstoffe nicht
den unangenehmen Geschmack oder Geruch, wenn die Produkte, die den
Vergällungsstoff
umfassen, in der legal beabsichtigten Weise verwendet werden.
-
In bestimmten, nicht-begrenzenden
Ausführungsformen
der Erfindung kann der Geruch-erzeugende Vergällungsstoff Schwefel enthalten,
sodass während
der Reinigung/Umwandlung ein schwefelartiger Geruch erzeugt werden
kann. Beispiele für
solche Schwefel-enthaltenden, Geruch-erzeugenden Vergällungsstoffe schließen Magnesiumsulfat,
Natriumsulfat, die Säuresalze
von Schwefel-enthaltenden Aminosäuren,
wie Methionin-HCl,
Ethylcystein-HCl, Ethylmethionin-HCl, Methylcystein-HCl und Methylmethionin-HCl,
ein. Wenn solche Schwefelenthaltenden Verbindungen illegalen Reaktionsbedingungen
unterzogen werden, werden schlecht riechender Schwefelwasserstoff,
Mercaptane mit niedrigem Molekulargewicht und/oder Schwefeldioxid
erzeugt.
-
In anderen, nicht-begrenzenden Ausführungsformen
der Erfindung kann der Geruch-erzeugende Vergällungsstoff Stickstoff enthalten.
Beispiele für
solche Stickstoffenthaltenden, Geruch-erzeugenden Vergällungsstoffe
schließen
Ammoniumchlorid, Ammoniumsulfat, Mono-, Di- und Trialkylaminhydrochloride,
Succinamid und Glutarsäurediamid
ein. Wenn solche stickstoff-enthaltenden Verbindungen illegalen
Reaktionsbedingungen unterzogen werden, können schlecht riechendes Ammoniak,
Amine mit niedrigem Molekulargewicht und Diamine mit niedrigem Molekulargewicht,
wie Putrescin und Cadaverin, hergestellt werden. Die vorangehenden
Stickstoff-enthaltenden Vergällungsstoffe
können
ihren unangenehmen Geruch während
der alkalischen Extraktions- und Isolierungsschritte aus dem Umwandlungsverfahren
entwickeln.
-
4.1.3. GUMMIS UND/ODER
VISKOSITÄTS-MODIFIZIERUNGSMITTEL
-
In einer dritten Reihe von nicht-begrenzenden
Ausführungsformen
können
die gemäß der Erfindung verwendeten
Vergällungsstoffe
Verbindungen sein, die Gummis und/oder Viskositäts-Modifizierungsmittel sind.
In einer besonderen Reihe von Ausführungsformen umfasst der Vergällungsstoff
ein oder mehrere Gummi und Viskositäts-Modifizierungsmittel.
-
Die Gummis und Viskositäts-Modifizierungsmittel,
die in der vorliegenden Erfindung angewendet werden, sind jene,
die (i) gute Wasserlöslichkeit
und/oder Quellvermögen;
und (ii) schlechte organische Lösungsmittellöslichkeit,
um deren bevorzugte Extraktion zu verhindern, besitzen. Gummis und
Viskositäts-Modifizierungsmittel
sind dem Fachmann bekannt, jedoch ist in einem speziellen, nicht-begrenzenden
Beispiel das verwendete Material eine Polyethylenoxidverbindung,
die sehr gute Löslichkeit
in Wasser und sehr schlechte Löslichkeit
in lipophilem Lösungsmittel
aufweist und die in Wasser ein schlammiges, Schleim-ähnliches
Gel bildet. Polyethylenoxidverbindungen mit einem Molekulargewicht
von etwa 2 000 000 sind besonders bevorzugt (beispielsweise Polyox
N-60K, Union Carbide).
Andere nicht-begrenzende Beispiele von Gummis und/oder Viskositäts-Modifizierungsmitteln
schließen
Xanthangummi, Guargummi und Alkylcellulosen, wie Hydroxypropylcellulose,
Hydroxypropylmethylcellulose und Hydroxyethylcellulose, ein.
-
In einer besonderen Reihe von Ausführungsformen
kann eine Kombination von Vergällungsstoffen verwendet
werden, die ein oder mehrere Gummi/Viskositäts-Modifizierungsmittel und
ein oder mehrere oberflächenaktive
Stoffe umfasst. Ohne auf eine Theorie festgelegt zu werden, erhöht die Kombination
von oberflächenaktivem
Stoff und dem Gummi/Viskositäts-Modifizierungsmittel
die Hydratationsgeschwindigkeit des Gummi/Viskositäts-Modifizierungsmittels
und Versuche zum Extrahieren in organische Lösungsmittel ergeben Emulgierung.
Wie das Gummi/Viskositäts-Modifizierungs-mittel
hat der oberflächenaktive
Stoff sehr gute Löslichkeit
in Wasser und sehr schlechte lipophile Lösungsmittellöslichkeit.
Oberflächenaktive
Stoffe sind für
den Fachmann bekannt und können
nichtionisch, kationisch, anionisch, Seifen, Vorstufen von Seifen
und amphotere oberflächenaktive
Stoffe sein. In einem speziellen, nicht-begrenzenden Beispiel ist
der oberflächenaktive Stoff
(a) ein Poly(oxypropylen)-Poly(oxyethy-len)-Copolymer, das ein nichtionisches oberflächenaktive Stoff/Emulgator/Gelierungsmittel
mit sehr guter Löslichkeit
in Wasser darstellt und das ein Gel in Wasser bildet (beispielsweise
Pluronic F127 (BASF)), hat eine schlechte Löslichkeit in lipophilen Lösungsmitteln
mit erhöhten
Anteilen von Ethylenoxidsubstitution); und/oder (b) Natriumlaurylsulfat,
ein anionisches Tensid/Netzmittel mit einer sehr guten Wasserlöslichkeit
und sehr schlechten lipophilen Lösungsmittellöslichkeit,
welches sowohl die Geschwindigkeit als auch das Ausmaß der Hydratation
von Gummi/Viskositäts-Modifizierungsmittel
und einigen oberflächenaktiven
Stoffen beschleunigt.
-
Insbesondere kann in einer Reihe
von Ausführungsformen
eine Kombination von Vergällungsstoffen verwendet
werden, die ein oder mehrere Gummi/Viskositäts-Modifizierungsmittel, ein
oder mehrere oberflächenaktive
Stoffe und ein oder mehrere Emulgatoren umfasst, wobei die Kombination
davon während
Reinigungsverfahren von sympathomimetischem Amin schwieriger zu
trennen ist als jedes von solchen verwendeten Vergällungsstoffen
allein.
-
Beispielsweise kann eine Kombination
von zwei nicht-ionischen
oberflächenaktiven
Stoffen/Emulgatoren/ Verdickungsmitteln und einem ionischen oberflächenaktiven
Stoff/ Emulgator/Netzmittel (jedes davon wird getrennt als ein Vergällungsstoff
betrachtet) verwendet werden. In einem speziellen, nicht-begrenzenden Beispiel
sind die in Kombination verwendeten Materialien (a) eine Polyethylenoxidverbindung;
(b) ein Poly(oxypropylen)-Poly(oxyethylen)-Copo-lymer; und (c) Natriumlaurylsulfat.
-
Die Menge an zu den erfindungsgemäßen Zusammensetzungen
zugegebenen Gummis und/oder Viskositäts-Modifizierungsmitteln ist
jene Menge, die für
eine vergällende
Wirkung ausreicht. In Abhängigkeit
von der Formulierung ist die Menge an Gummis und/oder Viskositäts-Modifizierungsmitteln
jene Menge, die für eine
vergällende
Wirkung auf die Zusammensetzung ausreicht, jedoch unwirksam, um „gesteuerte
oder verzögerte
Freisetzung", wie
diese Begriffe im Allgemeinen für
den Fachmann verständlich
sind, bereitzustellen. Durch einen anderen Weg ausgewiesen, ist
die Menge der Gummis und/oder Viskositäts-Modifizierungsmittel jene
Menge, die ausreichend ist, um eine vergällende Wirkung auf die Zusammensetzung
zu haben, ohne Eingehen von Kompromissen mit der sofortigen Art
der Freisetzung von oder Bioverfügbarkeit
oder Dosierungshäufigkeit,
die mit frei verkäuflichen
sympathomimetischen Aminenthaltenden Zusammensetzungen verbunden
ist.
-
Solche Kombinationen von Vergällungsstoffen,
die physikalisch mit sympathomimetischer Aminreinigung in Wechselwirkung
treten, eröffnen
die nachstehenden Vorteile. Zuerst ist die Schwierigkeit des Isolierens von
sympathomimetischem Amin aus solchen Vergällungsstoff-enthaltenden Produkten
stark erhöht.
Darüber hinaus
ist die Menge an Lösungsmitteln
und die benötigte
Zeit zum Erreichen von hinreichender Reinigung von sympathomimetischen
Aminen erhöht.
Weiterhin senkt das Vergällungsstoffgemisch
die Ausbeute an pro Reaktion erzeugtem sympathomimetischem Amin.
Jedes der vorangehenden Merkmale macht die illegale Drogensynthese
aus erfindungsgemäßen Produkten
in der Regel aufgrund schlechter Wirksamkeit, hoher Kosten und erhöhter Aufklärungsgefahr
unausführbar.
-
4.1.4. EINGEKAPSELTE GUMMIS
UND/ODER VISKOSITÄTS-MODIFIZIERUNGSMITTEL
-
In einer vierten Reihe von nicht-begrenzenden
Ausführungsformen
können
die erfindungsgemäß verwendeten
Vergällungsstoffe
Verbindungen sein, die in Gummis und/oder Viskositäts-Modifizierungsmitteln
eingekapselt sind. In einer be sonderen Reihe von Ausführungsformen
umfasst der Vergällungsstoff
mehr als ein eingekapseltes Gummi und/oder Viskositäts-Modifizierungsmittel.
-
Obwohl nicht berücksichtigt ist, durch eine
Theorie gebunden zu sein, ermöglicht
die Kombination des Einkapselungsmaterials und des Gummis und/oder
Viskositäts-Modifizierungsmittel
das Vorliegen von hohen Mengen Gummi und/oder Viskositäts-Modifi-zierungsmittel
in Vergällungsstoff-enthaltenden
Formulierungen. Wie in dem vorangehenden Abschnitt ausgewiesen,
wirken Gummis und/oder Viskositäts-Modifizierungsmittel als
Vergällungsstoff
in sympathomimetischen Amin-enthaltenden Formulierungen. Leider
kann das Vorliegen von hohen Mengen Gummis und/oder Viskositäts-Modifizierungsmitteln
in den Formulierungen mit der Auflösung der sympathomimetischen
Amine in den Formulierungen in ihrer normal beabsichtigten und gesteuerten Verwendung
in Wechselwirkung treten. Es ist möglich, dass frei verkäufliche
Arzneimittel, die hohe Mengen Gummis und/oder Viskositäts-Modifizierungsmittel
enthalten, bei USP-Auflösungstests
durchfallen und Bedenken bei den Behörden aufwerfen.
-
Es wurde jedoch gefunden, dass höhere Mengen
Gummis und/oder Viskositäts-Modifizierungsmittel in
sympathomimetischen Amin-enthaltenden Formulierungen vorliegen können, wenn
die Vergällungsstoffe
in Material eingekapselt sind, das entweder in unpolaren organischen
Stoffen löslich
ist und in wässerigen
Lösungen
unlöslich
ist, oder hydrophobe Materialien, die eine mittlere niedrige Schmelztemperatur
(das heißt zwischen
etwa 50°C
und etwa 90°C)
aufweisen. D. h., es würden
die Gummis und/oder Viskositäts-Modifizierungsmittel
frei vorliegen, um als Vergällungsstoff
zu wirken, wenn die sympathomimetischen Amin-enthaltenden Formulierungen
bei illegalen Vorgängen
missbraucht werden, jedoch relativ unverfügbar sein, um bei Auflösung und/oder
Bioverfügbarkeit
zu stören,
wenn die Formulierungen in ihrer normal beabsichtigten und gesteuerten
Verwendung angewendet werden. Das Konzept kann am besten durch die
nachstehenden nicht-begrenzenden Beispiele erläutert werden.
-
Während
vieler illegaler Vorgänge
werden sympathomimetische Amin-enthaltende Formulierungen durch
ein vorangehendes Vollsaugen bzw. Einweichen in einem unpolaren
organischen Stoff, wie Toluol, behandelt, welches jegliche Gummis
und/ oder Viskositäts-Modifizierungsmittel
in den Formulierungen entfernen kann. Es wird vorgeschlagen, den
Vergällungsstoff,
wie Polyethylenoxid, in einem Material, das in Toluol löslich und
in Wasser unlöslich
ist, einzukapseln. Wenn das Produkt bei seiner normal beabsichtigten
und gesteuerten Verwendung (das heißt, keine Exposition von unpolaren
organischen Stoffen im menschlichen Körper) verwendet wird, wird
der Vergällungsstoff
eingekapselt verbleiben und es gibt wenig oder keine Wechselwirkung mit
Auflösung
und/oder Bioverfügbarkeit.
Wenn das Produkt missbraucht wird (das heißt, illegale Drogenverarbeitung),
wird Toluol das Einkapselungsmaterial extrahieren und das Polyethylenoxid
freisetzen, um Reinigung des sympathomimetischen Amins aus der Formulierung
extrem schwierig zu machen.
-
In einem weiteren Beispiel kann ins
Auge gefasst werden, dass illegale Drogenhersteller die vergällende Wirkung
von Gummis und/oder Viskositäts-Modifizierungsmitteln
durch die Verwendung von erhöhten Temperaturen
minimieren könnten.
Die Filtrierbarkeit der Materialien aus der Lösung kann häufig durch Erhitzen der Lösung zum
Vermindern der Viskosität
verbessert werden. Wenn Gummis und/oder Viskositäts-Modifizierungsmittel in
moderat niedrig schmelzenden, hydrophoben Materialien eingekapselt
sind, um ihre Wechselwirkung unter Auflösung zu minimieren, und zu
einer Formulierung gegeben werden, die bereits eine vergällende Menge
an Gummi und/oder Viskositäts-Modifizierungsmittel
enthält,
um Filtration von einer wässerigen
Lösung
undurchführbar
zu machen, würde
dies die Möglichkeit
der Anwendung der Heizstrategie zur Verbesserung der Filtrierbarkeit
beseitigen. Da die Lösung
erhitzt wird, würde
als Ergebnis der heißeren
Lösung weiteres
Gummi und/oder Viskositäts-Modifizierungsmittel
freigesetzt werden, unter Kompensieren von jeglicher Verbesserung
der Filtrierbarkeit. Das Konzept würde einen höheren Anteil an Gummi und/oder
Viskositäts-Modifizierungsmittel
erlauben, welcher zu den sympathomimetischen Amin-enthaltenden Formulierungen zugegeben
wird, ohne jede Wirkung auf die Auflösung oder Bioverfügbarkeit
des Arzneimittelwirkstoffs. Es würde
die Durchführbarkeit
der Umgehung des Viskosität-modifizierenden
Vergällungssystems
unter Anwendung von Wärme
zum Verbessern der Filtrierbarkeit der wässerigen Drogen-enthaltenden
Lösung
verhindern oder vermindern.
-
Solche Kombinationen von eingekapselten
Vergällungsstoffen,
die physikalisch bei der Reinigung von sympathomimetischem Amin
stören,
bieten die nachstehenden Vorteile. Zuerst wird die Schwierigkeit
des Isolierens von sympathomimetischem Amin aus solchen Vergällungsstoff-enthaltenden
Produkten stark erhöht. Darüber hinaus
wird die zum Erreichen von hinreichender Reinigung von sympathomimetischen
Aminen benötigte
Menge an Lösungsmitteln
und Zeit erhöht.
Weiterhin senkt das Vergällungsstoffgemisch
die Ausbeute an pro Reaktion erzeugtem sympathomimetischem Amin.
Jedes der vorangehenden. Merkmale macht in der Regel die illegale
Drogensynthese aus erfindungsgemäßen Produkten
aufgrund der schlechten Wirksamkeit, hohen Kosten und gestiegener
Entdeckungsgefahr undurchführbar.
-
Die Gummis und Viskositäts-Modifizierungsmittel,
die in der vorliegenden Erfindung angewendet werden, sind jene,
die (i) gute Wasserlöslichkeit
und/oder Quellbarkeit; und (ii) schlechte organische Lösungsmittellöslichkeit,
um deren bevorzugte Extraktion zu verhindern, besitzen. Gummis und
Viskositäts-Modifizierungsmittel
sind dem Fachmann bekannt, jedoch ist in einem speziellen, nicht-begrenzenden
Beispiel das verwendete Material eine Polyethylenoxidverbindung,
die sehr gute Löslichkeit
in Wasser und sehr schlechte Löslichkeit
in lipophilem Lösungsmittel
aufweist und die ein schlammiges, Schleim-ähnliches Gel in Wasser bildet, Polyethylen oxidverbindungen
mit einem Molekulargewicht von etwa 2 000 000 sind besonders bevorzugt
(beispielsweise Polyox N-60K,
Union Carbide). Andere nicht-begrenzende Beispiele von Gummis und/oder
Viskositäts-Modifizierungsmitteln
schließen
Xanthangummi, Guargummi und Alkylcellulosen, wie Hydroxypropylcellulose,
Hydroxypropylmethylcellulose und Hydroxyethylcellulose, ein.
-
In einer besonderen Reihe von Ausführungsformen
kann eine Kombination von Vergällungsstoffen verwendet
werden, die ein oder mehrere Gummi/Viskositäts-Modifizierungsmittel und
ein oder mehrere oberflächenaktive
Stoffe umfasst. Ohne an eine Theorie gebunden sein zu wollen, erhöht die Kombination
von oberflächenaktivem
Stoff und/oder Gummi/Viskositäts-Modifizierungsmittel
die Hydratationsgeschwindigkeit des Gummi/Viskositäts-Modifizierungsmittels,
und Versuche, in organische Lösungsmittel
zu extrahieren, ergeben eine Emulsion, Wie das Gummi/Viskositäts-Modifizierungsmittel
hat der oberflächenaktive
Stoff sehr gute Löslichkeit
in Wasser und sehr schlechte lipophile Lösungsmittellöslichkeit.
Oberflächenaktive
Stoffe sind dem Fachmann bekannt und können nichtionisch, kationisch,
anionisch, Seifen, Vorstufen von Seifen und amphotere oberflächenaktive
Stoffe sein. In einem speziellen, nicht-begrenzen-den Beispiel ist
der oberflächenaktive
Stoff (a) ein Poly(oxypropylen)-Poly-(oxyethylen)-Copolymer, das ein
nichtionisches Tensid/Emul-gator/Gelierungsmittel mit sehr guter
Löslichkeit
in Wasser ist und das ein Gel in Wasser bildet (beispielsweise Pluronic
F127 (BASF)), eine schlechte Löslichkeit
in lipophilen Lösungsmitteln
bei erhöhten
Anteilen von Ethylenoxidsubstitution) hat; und/oder (b) Natriumlaurylsulfat,
ein anionischer oberflächenaktiver Stoff/Netzmittel
mit sehr guter Löslichkeit
in Wasser und sehr schlechter lipophiler Lösungsmittellöslichkeit, welches
sowohl die Geschwindigkeit als auch das Ausmaß der Hydratation von Gummi/Viskositäts-Modifizierungsmittel
und einigen oberflächenaktiven
Stoffen beschleunigt.
-
In einer besonderen Reihe von Ausführungsformen
kann eine Kombination von Vergällungsstoffen verwendet
werden, die ein oder mehrere Gummi/Viskositäts-Modifizierungsmittel, ein
oder mehrere oberflächenaktiven
Stoffe und ein oder mehrere Emulgatoren umfasst, wobei die Kombination
davon während
der Reinigungsverfahren von sympathomimetischem Amin schwieriger
zu trennen ist als jedes von solchen verwendeten Vergällungsstoffen
allein.
-
Beispielsweise kann eine Kombination
von zwei nicht-ionischen
oberflächenaktiven
Stoffen/Emulgatoren/Verdickungsmitteln und einem ionischen oberflächenaktiven
Stoff/Emulgator/Netzmittel (jedes davon wird getrennt als ein Vergällungsstoff
betrachtet) verwendet werden. In einem speziellen, nicht-begrenzenden Beispiel
sind die in Kombination verwendeten Materialien (a) eine Polyethylenoxidverbindung;
(b) ein Poly(oxypropylen)-Poly(oxyethylen)-Copo-lymer; und (c) Natriumlaurylsulfat.
-
Das in der vorliegenden Erfindung
angewendete eingekapselnde Material ist jenes, welches in unpolaren
organischen Stoffen, wie Toluol, sehr löslich ist und in Wasser und/oder
einem hydrophoben Material, das niedrig schmelzend ist (das heißt zwischen
etwa 50°C
und etwa 90°C),
unlöslich
ist. Einkapselnde Materialien sind dem Fachmann bekannt, jedoch
schließt
in speziellen, nicht-begrenzenden Beispielen das verwendete einkapselnde
Material Fettsäuren,
natürliche
wachse, synthetische Wachse und dergleichen und Gemische davon ein.
-
Fettsäuren werden im Allgemeinen
in dem nachstehenden Abschnitt definiert. Besonders bevorzugte Fettsäuren schließen hydriertes
Palmöl,
hydriertes Rizinusöl,
hydriertes Baumwollsamenöl,
Stearinsäure,
Palmitinsäure
und Gemische davon ein.
-
Wachse sind niedrig schmelzende organische
Gemische oder Verbindungen mit einem hohen Molekulargewicht, sind
bei Raumtemperatur fest und sind im Allgemeinen ähnlich in der Zusammensetzung
von Fetten und Ölen,
ausgenommen jene Wachse, die keine Glyceride enthalten. Wachse können Kohlenwasserstoffe
oder Ester von Fettsäuren
und Alkoholen sein. In der vorliegenden Erfindung verwendbare Wachse schließen natürliche Wachse,
wie tierische Wachse, Pflanzenwachse und Erdölwachse (das heißt Paraffinwachs,
Spermacetiwachs, Carnaubawachs, Japanwachs, Bayberrywachs, Flachswachs,
Bienenwachs, chinesisches Wachs, Schellackwachs, Lanolinwachs, Zuckerrohrwachs,
Candelillawachs, mikrokristallines Wachs, Petrolatumwachs, Carbowachs
und dergleichen und Gemische davon) ein.
-
Die Menge zum Einkapseln des Gummis
und/oder Viskositäts-Modifizierungsmittels
verwendeten Einkapselungsmaterials ist jene Menge, die wirksam ist,
um die Freisetzung von dem Gummi und/oder Viskositäts-Modifizierungsmittels
während
der normalen menschlichen Verdauung der Vergällungsstoff-enthaltenden Formulierungen
aufzuhalten oder zu verhindern, aber dennoch die Entfernung des
Gummis und/oder Viskositäts-Modifizierungsmittels
aus den Formulierungen während
des Missbrauchs erlaubt (das heißt, eine unpolare Vorvollsaugphase
des normalen heimlichen Verfahrens zur Herstellung illegaler Drogen
aus sympathomimetischen Aminen oder durch Erhöhen der Temperaturen zum Kreislaufführen eines
Viskosität-modifizierenden Vergällungsstoffsystems).
In einer Ausführungsform
sollte das Einkapselungsmaterial ein Material sein, das das Gummi
und/oder Viskositäts-Modifizierungsmittel
beschichten kann und in wesentlichen Mengen aus dem Gummi und/oder
Viskositäts-Modifizierungsmittel
in einer Formulierung durch einen unpolaren organischen Stoff, das
heißt,
etwa 30 bis etwa 40 Minuten bei einer Toluol-Vorvollsaugung, extrahiert
wird.
-
4.1.5. EINGEKAPSELTE LÖSUNGSMITTEL-LÖSLICHE SEIFENVORSTU-FEN/OBERFLÄCHENAKTIVE STOFFE
-
In einer fünften Reihe von nicht-begrenzenden
Ausführungsformen
können
die erfindungsgemäß verwendeten
Vergällungsstoffe
Verbindungen sein, die Seifenvorstufen und/oder oberflächenaktive
Stoffe einkapseln, die in unpolaren organischen Lösungsmitteln
löslich
sind, einschließlich,
jedoch nicht beschränkt
auf eingekapselte Fettsäuren.
In einer besonderen Reihe von Ausführungsformen umfasst der Vergällungsstoff
mehr als eine eingekapselte Lösungsmittel-lösliche Seifenvorstufe/oberflächenaktive
Stoff.
-
Obwohl nicht auf eine Theorie festgelegt
zu sein, werden die Kombination des Einkapselungsmaterials und der
Lösungsmittel-löslichen
Seifenvorstufe und/oder oberflächenaktive
Stoff die Extraktion der Seifenvorstufe und/oder oberflächenaktiven
Stoffs aus den sympathomimetischen Aminenthaltenden Formulierungen verhindern
oder verzögern,
wenn die Formulierungen zu einem Vorvollsaugen eines unpolaren organischen Stoffes,
wie Toluol, während
des normalen heimlichen Verfahrens zur Herstellung von illegalen
Drogen aus sympathomimetischen Amin-enthaltenden Formulierungen
behandelt werden. Seifenvorstufen und oberflächenaktive Stoffe selbst wirken
als Vergällungsstoff,
sind jedoch anfällig
für Extraktion
durch ein vorangehendes Vorvollsaugen mit einem unpolaren organischen
Stoff. Wenn die Seifenvorstufen und oberflächenaktiven Stoffe in ein Material
eingekapselt werden, das in unpolaren Lösungsmitteln schlecht löslich ist,
aber in Wasser löslich
ist, werden sie in den sympathomimetischen Amin-enthaltenden Formulierungen
während
der Lösungsmittelwäsche verbleiben.
Später,
wenn die Formulierungen in Wasser aufgeschlämmt werden, wird das eingekapselte
Material gelöst
und die Seifenvorstufen und/oder oberflächenaktive Stoffe werden zum
physikalischen Stören
bei der Reinigung des sympathomimetischen Amins freigesetzt.
-
In einem bevorzugten, nicht-begrenzenden
Beispiel der vorliegenden Erfindung sind Seifenvorstufen Fettsäuren, wie
jene, die in unpolaren organischen Stoffen, wie Toluol, löslich sind.
Fettsäuren
sind Carbonsäuren,
abgeleitet von oder enthalten in einem tierischen oder pflanzlichen
Fett oder Öl.
Fettsäuren
sind aus einer Kette von Alkylgruppen, enthaltend 4 bis 22 Kohlenstoffatome,
zusammengesetzt und zeichnen sich durch eine endständige Carbonsäuregruppe
aus.
-
In der vorliegenden Erfindung verwendbare
Fettsäuren
sind ausgewählt
aus der Gruppe, bestehend aus Decensäure, Docosansäure, Stearinsäure, Palmitinsäure, Laurinsäure, Myristinsäure, Ölsäure und
dergleichen und Gemischen davon. Die bevorzugten Fettsäuren sind
ausgewählt
aus der Gruppe, bestehend aus Stearinsäure, Palmitinsäure, Ölsäure und
Gemischen davon. Die besonders bevorzugte Fettsäure ist Stearinsäure.
-
In einem bevorzugten, nicht-begrenzenden
Beispiel der vorliegenden Erfindung wirken Ester von Fettsäuren oder
Fettalkoholen als oberflächenaktive
Stoffe, die in unpolaren organischen Stoffen, wie Toluol, löslich sind.
Ester von Fettsäure
mit etwa 10 bis etwa 31 Kohlenstoffatomen und Fettalkohole mit etwa
12 bis etwa 31 Kohlenstoffatomen, Ester mit einem Kohlenstoffatomgehalt
von etwa 24 bis etwa 62 Kohlenstoffatomen, sind besonders bevorzugt.
-
Beispiele für Fettsäureester schließen Monoglycerylester,
Diglycerylester oder Triglycerylester (Glyceride), welcher ein Ester
ist, gebildet aus einer Fettsäure
mit etwa 10 bis etwa 31 Kohlenstoffatomen, und Glycerin, worin eine
oder mehrere der Hydroxylgruppen von Glycerin mit einer Fettsäure substituiert
ist, ein. Beispiele für
verwendbare Glyceride sind Glycerylmonostearat, Glyceryldistearat,
Glyceryltristearat, Glyceryldipalmitat, Glyceryltripalmitat, Glycerylmonopalmitat,
Glyceryldilaurat, Glyceryltrilaurat, Glycerylmonolaurat, Glyceryldidocosanoat,
Glyceryltridocosanoat, Glycerylmonodocosanoat, Glycerylmonocaproat,
Glyceryldicaproat, Glyceryltricaproat, Glycerylmonomyristat, Glyceryldimyristat,
Glyceryltrimyristat, Glycerylmonodecenoat, Glyceryldidecenoat, Glyceryltridecenoat
und dergleichen und Gemische davon. Die bevorzugten Glyceride sind
ausgewählt
aus der Gruppe, bestehend aus Glycerylmonostearat, Glyceryldistearat,
Glyceryltristearat und Gemischen davon.
-
In einer bevorzugten Ausführungsform
ist die lösungsmittellösliche Seifenvorstufe
und/oder der oberflächenaktive
Stoff ausgewählt
aus der Gruppe, bestehend aus Stearinsäure, Glycerinmonooleat und
Glycerinmonostearat. Besonders bevor zugt ist die lösungsmittellösliche Seifenvorstufe
und/oder das Tensid Stearinsäure.
-
Das in der vorliegenden Erfindung
angewendete Einkapselungsmaterial ist jenes, das in unpolaren organischen
Stoffen, wie Toluol, schlecht löslich
und in Wasser löslich
ist. Einkapselungsmaterialien sind dem Fachmann bekannt, jedoch
in einem speziellen, nicht-begrenzenden Beispiel ist das verwendete
Einkapselungsmaterial Maltodextrin, Dextrin, Acacia und Alkylcellulosen,
wie Hydroxypropylmethylcellulose, Hydroxypropylcellulose und Hydroxyethylcellulose.
-
Die Menge an zum Einkapseln der lösungsmittellöslichen
Seifenvorstufen und/oder der oberflächenaktive Stoffen verwendeten
Einkapselungsmaterials ist jene Menge, die wirksam ist, um die Entfernung
der Seifenvorstufen und oberflächenaktive
Stoffe aus den Formulierungen während
einer unpolaren vorvollsaugphase des normalen heimlichen Verfahrens
zur Herstellung von illegalen Drogen aus sympathomimetischen Aminen
zu verzögern
oder zu verhindern. Im Allgemeinen sollte das Einkapselungsmaterial
ein Material sein, das die seifenvorstufen und oberflächenaktive
Stoffe beschichten kann und die Extraktion einer wesentlichen Menge
der Seifenvorstufen und oberflächenaktive
Stoffe aus einer Formulierung durch einen unpolaren organischen
Stoff; das heißt
etwa 30 bis etwa 40 Minuten bei einer Toluol-Vorvollsaugung, verhindert.
-
Die eingekapselten Vergällungsstoffe,
die physikalisch mit der sympathomimetischen Aminreinigung stören, bieten
die nachstehenden Vorteile. Zuerst wird die Schwierigkeit des Isolierens
des sympathomimetischen Amins aus solchen Vergällungsstoff enthaltenden Produkten
stark erhöht.
Außerdem
werden die zum Erreichen von hinreichender Reinigung von sympathomimetischen
Aminen benötigten
Lösungsmittelmengen und
benötigte
Zeit erhöht.
Weiterhin senkt das Vergällungsstoffgemisch
die Ausbeute an pro Reaktion hergestelltem sympathomimetischem Amin.
Jeder der vorangehenden Faktoren macht die Ausführung illegaler Drogensynthese
aus erfindungsgemäßen Produkten
in der Regel aufgrund schlechter Wirksamkeit, hoher Kosten und gestiegener
Entdeckungsgefahr undurchführbar.
-
4.2. SYMPATHOMIMETISCHE
AMINE
-
Sympathomimetische Amine sind jene
Verbindungen, die Vasokonstriktion in dem vaskulären Bett der Nasenschleimhaut
verursachen, was ein Schrumpfen der angeschwollenen Schleimmembranen
ergibt und somit Entwässerung
fördert
und Nasenluftstrom verbessert. In einer bevorzugten Ausführungsform
der vorliegenden Erfindung sind die sympathomimetischen Amine der
vorliegenden Erfindung jene mit der Strukturformel II:
worin R
7,
R
8, R
9, R
10, R
11, R
12 und R
13 ausgewählt sind
aus dem Nachstehenden: Wasserstoff, substituiertem oder unsubstituiertem
C
1-12-Alkyl, substituiertem oder unsubstituiertem
C
1-12-Alkoxy, Hydroxy und Halogen. Ungeachtet
des Vorangehenden sind R
11 und R
12 nicht Halogene. Wie hierin verwendet,
kann der Begriff „sympathomimetisches
Amin" sich auf ein
pharmazeutisch verträgliches
Säureadditionssalz
einer Verbindung beziehen, das asymmetrische Zentren aufweisen kann
und als Racemate, racemische Gemische, einzelne Diastereomeren oder
Enantiomeren, mit allen isomeren Formen, die in die vorliegende
Erfindung eingeschlossen sind, vorkommen.
-
In einer besonders bevorzugten Ausführungsform
der vorliegenden Erfindung werden die sympathomimetischen Amine
kommerziell als nasale Dekongestanzien verwendet. Spezielle Beispiele
der Säuresalze von
syμpathomimetischen
Amindekongestanzien werden üblicherweise
in OTC-Arzneimitteln gefunden, die einschließen: Phenylephrinhydrochlorid,
Phenylpropanolaminhydrochlorid, Pseudoephedrinhydrochlorid, Pseudoephedrinsulfat
und Ephedrinhydrochlorid.
-
Beispiele für illegale Drogen, die aus
sympathomimetischen Aminen umgewandelt werden, schließen ein,
sind jedoch nicht begrenzt auf Methamphetamin, Amphetamin, Methcathinon
und Cathinan. Die Umwandlung von illegalen Drogen aus sympathomimetisches
Amin enthaltenden Aminen ist dem Fachmann bekannt und tritt durch
eine Vielzahl von Oxidations- und Reduktionsreaktionen auf.
-
4.3. ZUSAMMENSETZUNGEN
-
Die Menge an Vergällungsstoff(n) und sympathomimetischen
Aminsalzen in einer beliebigen Zusammensetzung der vorliegenden
Erfindung ist in einem Verhältnis
von etwa 100 : 1 bis etwa 1 : 100, vorzugsweise etwa 10 : 1 bis
etwa 1 : 10. Bevorzugter ist die Menge an Vergällungsstoff(n) und sympathomimetischen
Aminsalzen in einer beliebigen Zusammensetzung der vorliegenden
Erfindung in einem Verhältnis
von etwa 3 : 1 bis etwa 1 : 3. Besonders bevorzugt ist die Menge
an Vergällungsstoff(n)
und sympathomimetischen Aminsalzen in jeder Zusammensetzung der
vorliegenden Erfindung in einem Verhältnis von etwa 2 : 1 bis etwa
1 : 2.
-
Allgemein kann die Gesamtmenge an
Vergällungsstoff(n)
in einer Einheitsdosiszubereitung von etwa 0,1 mg bis etwa 750 mg
gemäß der besonderen
Verabreichung und der Stärke
des sympathomimetischen Aminsalzes variiert oder eingestellt werden.
wenn Pseudoephedrinhydrochlorid das sympathomimetische Aminsalz
darstellt, liegt die Konzentration des/der Vergällungsstoffs/e in einem Bereich
von etwa 0,3 mg bis etwa 300 mg, besonders bevorzugt in einem Bereich
von etwa 10 mg bis etwa 90 mg und am meisten bevorzugt in einem
Bereich von etwa 15 mg bis etwa 60 mg. Wenn Phenylpropanolaminhydrochlorid
das sympathomimetische Aminsalz ist, ist die Konzentration des/
der Vergällungsstoffs/e
im Bereich von etwa 7,5 mg bis etwa 750 mg, bevorzugter im Bereich
von etwa 25 mg bis etwa 225 mg besonders bevorzugt im Bereich von etwa
37,5 mg bis etwa 75 mg.
-
Die vorliegende Erfindung ist auch
auf Verfahren zum Herstellen der Vergällungsstoff/sympathomimetischen
Aminsalzkombinationen gerichtet. Die Kombinationen werden durch
Zugeben einer wirksamen Menge von mindestens einem Vergällungsstoff
zu einer sympathomimetisches Aminsalz enthaltenden pharmazeutischen
Zusammensetzung hergestellt. Der/Die Vergällungsstoff/e kann/können einzeln
oder als ein Gemisch zu der pharmazeutischen Zusammensetzung gegeben
werden. Die vorliegende Erfindung ist auch auf Produkte, die durch
solche Herstellungsverfahren hergestellt werden, gerichtet.
-
Die pharmazeutischen Zusammensetzungen,
umfassend den/die Vergällungsstoff(e)
und das/die sympathomimetische/n Aminsalz(e) (und, falls erwünscht, andere
pharmazeutische Wirkstoffe, in einem innigen Gemisch mit einem pharmazeutischen
Träger),
können
gemäß herkömmlicher
pharmazeutischer Anmischungstechniken hergestellt werden. Die Zusammensetzungen
können
eine breite Vielzahl von Formen, in Abhängigkeit von der Herstellungsform,
die zur Verabreichung gewünscht
ist, beispielsweise intravenös,
oral oder parenteral, annehmen. Die erfindungsgemäßen Zusammensetzungen
können
beispielsweise die Form von Tabletten, Kapseln, Granulaten, Pulvern
oder Pastillen, oder flüssigen
Zubereitungen, wie Lösungen
und nichtwässerigen
Suspensionen, annehmen.
-
Die Zusammensetzungen können unter
Verwendung herkömmlicher
Träger
oder Exzipienten und gut etablierter Techniken formuliert werden.
Ohne darauf beschränkt
zu sein, schließen
solche herkömmlichen Träger oder
Exzipienten Verdünnungsmittel,
Bindemittel und Klebstoffe (beispielsweise Cellulosederivate und Acrylderivate),
Gleitmittel (beispielsweise Magnesium- oder Calciumstearat und Pflanzenöle, Polyethylenglycole,
Talkum, Natriumlaurylsulfat, Polyoxylethylenmonostearat), Sprengmittel,
Färbemittel,
Geschmacksmittel, Konservierungsmittel, Süßungsmittel und Mischmaterialien,
wie Puffer und Absorptionsmittel (einige von ihnen würden als
Vergällungsstoffe
angesehen werden), um eine besondere Zusammensetzung herzustellen,
ein.
-
Nichtwässerige Suspensionen können durch
Dispergieren der Vergällungsstoff/sympathomimetisches Amin-Zusammensetzungen
in einem geeigneten nichtwässerigen
Träger,
gegebenenfalls mit der Zugabe von geeigneten Viskosität-verstärkendem(n)
Mittel(n) (beispielsweise hydrierten essbaren Fetten, Aluminiumstearat,
usw.), erhalten werden. Geeignete nichtwässerige Träger schließen beispielsweise Mandelöl, Erdnussöl, Sojabohnenöl oder fraktionierte
Pflanzenöle,
wie fraktioniertes Kokosnussöl,
ein. Konservierungsstoff e) (beispielsweise Methyl-, Ethyl-, Propyl-
oder Butylhydroxybenzoate, Natriumbenzoat oder Sorbinsäure, usw.)
können,
wie geeignet, eingeschlossen sein.
-
Eine breite Vielzahl von Arzneimitteln
kann weiterhin in den erfindungsgemäßen Vergällungsstoff/sympathomimetisches
Amin-Kombinationen vorliegen. Die Arzneistoffe können aus einer breiten Vielzahl
von Drogen bzw. Arzneistoffen und deren Säureadditionssalzen ausgewählt werden.
Geeignete Kategorien der Arzneistoffe, die angewendet werden können, können breit
variieren. Erläuternde
Kategorien und spezielle Beispiele schließen ein, a) Antitussiva, wie
Dextromethorphan, Dextromethorphanhydrobromid, Noscapin, Carbetapentancitrat
und Chlophedianolhydrochlorid; b) Antihistaminika, wie Chlorpheniraminmaleat,
Phenindamintartrat, Pyrilaminmaleat, Doxylaminsuccinat, Phenyltoloxamincitrat,
Diphenhydraminhydrochlorid, Promethazin und Triprolidin; c) antiasthmatische
Arzneimittel, J2-Adrenergika, beispielsweise Salbutamol (Albuterol),
Terbutalin, Carbuterol, Broxaterol, Aminophyllin, Theophyllin; d)
Analgetika, wie Acetaminophen; und e) nicht-steroide antientzündliche Arzneimittel (NSAID),
wie Acetylsalicylsäure,
Indomethacin, Acemethacin, Sulindac, Piroxicam, Ibuprofen, Naproxen,
Ketoprofen.
-
Beliebige Kombinationen, Zusammensetzungen
oder Produkte, die hierin beschrieben wurden, werden für bekannte
Indikationen, behandelt durch sympathomimetische Amine, verwendet.
-
Die nachstehenden nicht-begrenzenden
Beispiele erläutern
die von den Erfindern bevorzugten Verfahren zur Herstellung der
vergällten
ein sympathomimetisches Aminsalz enthaltenden Zusammensetzungen der
Erfindung.
-
BEISPIELE
-
BEISPIEL 1
-
Pharmazeutische Tabletten wurden
gemäß gut bekannter
Formulierungsverfahren hergestellt. Die Tabletten enthielten Pseudoephedrinhydrochlorid
und Chininhydrochlorid in Verhältnissen
von 30 : 25 und 30 : 12,5.
-
-
- A. man kombiniert Materialien 1–6.
- B. man gibt Material 7 und 8 zu einer kleinen Menge der Charge
und mischt (Schmiermittelgemisch).
- C. Gebe Schmiermittelgemisch zu der Charge und mische gut.
-
-
- A. man kombiniert Materialien 1–6.
- B. man gibt Material 7 und 8 zu einer kleinen Menge der Charge
und mischt (Schmiermittelgemisch).
- C. Gebe Schmiermittelgemisch zu der Charge und mische gut.
-
BEISPIEL 2
-
Eine Extraktionsuntersuchung wurde
ausgeführt,
um die Trennbarkeit von Pseudoephedrinhydrochlorid und Chininhydrochlorid
von den gemäß Beispiel
1 hergestellten Tabletten zu bestimmen. Die Untersuchung wurde durchgeführt, um
die Eignung unter Verwendung von Chininhydrochlorid als ein Vergällungsstoff
für Pseudoephedrinhydrochlorid
zu bewerten. Es wurde aus der Untersuchung geschlussfolgert, dass
Isolierung von reinem Pseudoephedrinhydrochlorid aus einem Chininhydrochlorid/Pseudoephedrinhydrochlorid-Kombinationsprodukt
nicht unter Verwendung von herkömmlichen
Extraktionstechniken, welche organische Lösungsmittel, wie Ether, verwenden,
ausgeführt
werden kann.
-
VERSUCH
-
Zwei Mengen der Tabletten von Beispiel
1, enthaltend Pseudoephedrinhydrochlorid und Chininhydrochlorid
in Verhältnissen
30 : 25 und 30 : 12,5, wurden dem Bestimmen der Trennbarkeit der
zwei Komponenten voneinander unterzogen.
-
Das nachstehende Extraktionsverfahren
wurde für
jede Menge der Tabletten ausgeführt.
-
Die Probe wurde zuerst in Wasser
gelöst
und die unlöslichen
Exzipienten wurden absetzen lassen. Der Pseudoephedrinhydrochlorid-
und Chininhydrochloridgehalt in dieser Lösung wurden durch HPLC bestimmt.
Eine aliquote Menge Überstandsflüssigkeit
wurde dann zu einem Scheidetrichter überführt, Natriumhydroxidlösung wurde
zugegeben und die Lösung
wurde geschüttelt.
Ein Niederschlag wurde gebildet und die Lösung wurde trübe, was
auf die Bildung von Pseudoephedrin-freier Base hinweist. Als ein
Reinigungsschritt wurden zwei Extraktionen mit Ethylether ausgeführt, um
Pseudo ephedrin-freie Base und Chinin in die Etherphase zu extrahieren.
Schließlich
wurde eine aliquote Menge der Etherphase mit zwei Portionen 1,0
N Hydrochlorid zur Neubildung der Hydrochloridsalze extrahiert.
Die Hydrochloridextrakte wurden dann durch HPLC getestet, um die
relative Wirksamkeit des Extraktionsverfahrens zu bestimmen. Eine
Peak-Reinheitsbestimmung von Pseudoephedrinhydrochlorid- und Chininhydrochloridpeaks
in Chromatogrammen, vor und nach Extraktionsproben, zeigten die
Peaks als rein.
-
-
Chininhydrochlorid wurde als ein
Gemisch von Chininhydrochlorid und Dihydrochininhydrochlorid gemessen.
Der Prozentsatz an Dihydrochinin in Chininhydrochlorid wurde als < 5% durch Flächenprozent
gefunden.
-
BEISPIEL 3
-
Dies ist eine Formulierung für Tabletten,
vergällt
durch ein Gummi/Tensidsystem, das dann Zucker-beschichtet wird.
-
-
Verfahren:
- A.
Man vereinigt 1–6
in einem PK-Mischer.
- B. Man mischt 15 Minuten
- C. Abziehen von 2 kg des Pulvergemisches aus dem Mischer.
- D. Man vereinigt 7 und 8 Gewicht/ ungefähr 2 kg von C.
- E. Man mischt 5 Minuten.
-
BEISPIEL 4
-
Dies ist eine Formulierung für Tabletten,
die durch ein Gummi/Tensidsystem vergällt sind.
-
-
Verfahren:
- A
Man mische Materialien 1–11
in einem PK-Mischer für
15 Minuten.
- B Man gebe Material 12 zu ungefähr 200 g gemischtem A.
- C Gebe C zu dem gemischten Material und mische 5 Minuten.
- D Material Nr. 13, hergestellt als eine 10%ige Lösung in
desionisiertem Wasser.
- E Kerntabletten, sprühbeschichtet
mit D.
- F Beschichtete Tabletten, poliert man Gewicht/ Nr. 14.
-
BEISPIEL 5
-
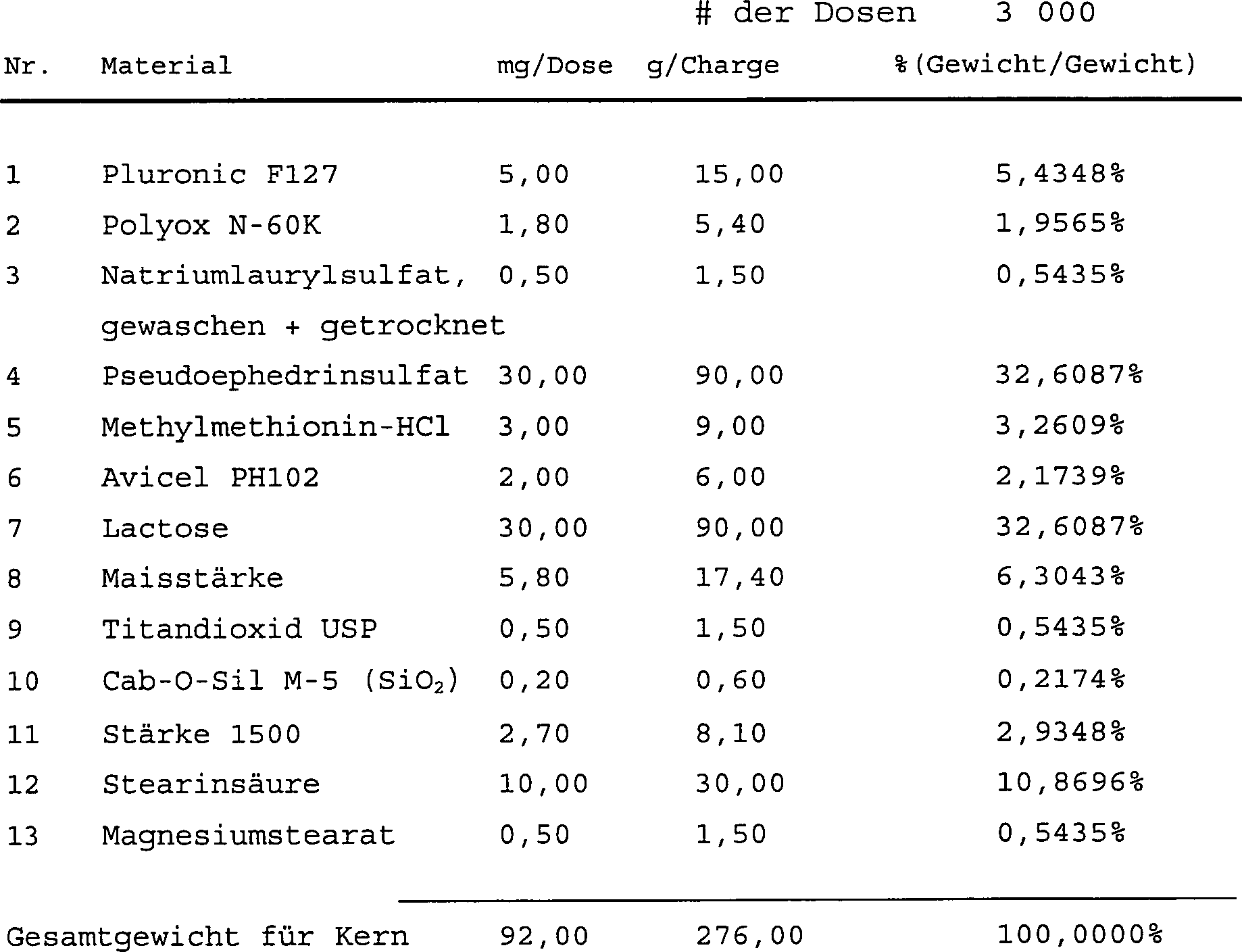
Dies ist eine Formulierung für Kerntabletten,
vergällt
durch ein Gummi/Tensidsystem.
-
-
Verfahren:
- A
Man vereinige 1, 2, 3, 6, 9, 10 und 11. Mische, Sieb 30 Mesh.
- B Man vereinige 5 und B. Mische.
- C Zu C gebe man 4, mische, gebe 7 zu, mische. Sieb 30 Mesh.
- D Gebe B zu C.
- E Sieb 30 Mesh.
- F Vereinige 12 und 13. Sieb 30 Mesh.
- G Gebe F zu der Charge und mische.
Tablettengewicht 92
mg/Tablette.
-
BEISPIEL 6
-
Dies ist eine Formulierung für Kerntabletten,
die durch Methylmethionin-HCl vergällt sind.
-
-
Verfahren:
- A
Man mische Materialien 1–8
in einem PK-Mischer für
15 Minuten.
- B Man gebe Material 9 zu ungefähr 100 g gemischtem A.
- C Man gebe B zu dem gemischten Material und mische für 5 Minuten.
Tablettengewicht
92 mg/Tablette
-
BEISPIEL 7
-
Dies ist eine Formulierung für Kerntabletten,
die durch Methylmethionin-HCl vergällt sind.
-
-
Verfahren:
- A
Man mische Materialien 1–9
in einem PK-Mischer für
15 Minuten.
- B Man gebe Material 10 zu ungefähr 100 g gemischtem A.
- C Man gebe B zu dem gemischten Material und mische für 5 Minuten.
-
BEISPIEL
8
Zweck: Herstellung von eingekapseltem Polyethylenoxid
-
Man schmelze Nr. 1, gebe Nr. 2 hinzu
und kühle
auf Raumtemperatur. Vermahle zu einer Teilchengröße, die mit anderen Materialien
in der Endformulierung kompatibel sind.
-
BEISPIEL
9
Zweck: Herstellung von eingekapseltem Xanthangummi
-
Man schmelze Nr. 1, gebe Nr. 2 hinzu
und kühle
auf Raumtemperatur. Vermahle zu einer Teilchengröße, die mit anderen Materialien
in der Endformulierung kompatibel sind.
-
BEISPIEL
10
Zweck: Herstellung von eingekapselter Hydroxypropylmethylcellulose
-
Man schmelze Nr. 1, gebe Nr. 2 hinzu
und kühle
auf Raumtemperatur. Vermahle zu einer Teilchengröße, die mit anderen Materialien
in der Endformulierung kompatibel sind.
-
BEISPIEL
11
Zweck: Herstellung von eingekapseltem Guargummi
-
Man schmelze Nr. 1, gebe Nr. 2 hinzu
und kühle
auf Raumtemperatur. Vermahle zu einer Teilchengröße, die mit anderen Materialien
in der Endformulierung kompatibel sind.
-
BEISPIEL
12
Zweck: Herstellung von eingekapselter Hydroxyethylcellulose
-
Man schmelze Nr. 1, gebe Nr. 2 hinzu
und kühle
auf Raumtemperatur. Vermahle zu einer Teilchengröße, die mit anderen Materialien
in der Endformulierung kompatibel sind.
-
BEISPIEL 13
-
Unter Verwendung des von Uncle Fester
mitgeteilten Verfahrens, in „The
Secrets of Methamphetamine Manufacture", wurden Extraktionen von verschiedenen
Pseudoephedrin-HCl-enthaltenden
Produkten durchgeführt.
Extrahiert wurden SUDA- FED-Tabletten,
SUDAFED-Tabletten Gewicht/Vergällungsstoff,
ein Gemisch von generischen PSE-Tabletten, und das gleiche Gemisch
von PSE-Tabletten Gewicht/Vergällungsstoff. Das
verwendete Vergällungsstoffsystem
war aus 2 mg Polyethylenoxid (Polyox), 5 mg Poloxamer (Carbopol) und
0,5 mg Natriumlaurylsulfat (SLS) zusammengesetzt.
| SUDAFED-Tabletten | A
89% |
| SUDAFED
Gewicht/ Vergällungsstoff | B
0% (Gewinnung nicht praktikabel) |
| Generische
Tabletten | E
98% |
| Generisches
Gewicht/ Vergällungsstoff | F
0% (Gewinnung nicht praktikabel) |
-
ZUSAMMENFASSUNG
-
Eine Reihe von Extraktionsversuchen
wurde durchgeführt,
um das Ausmaß zu
bestimmen, in dem das Vergällungsstoffsystem
die Leichtigkeit und Wirksamkeit der Gewinnung von Pseudoephedrin
(PSE) aus fertigen Produkten beeinflusst.
-
Unter Verwendung des von Uncle Fester
in „The
Secrets of Methamphetamine Manufacture", Vierte Ausgabe, Seiten 158–9, beschriebenen
Verfahrens wurden fünf
Produkte, jeweils enthaltend 30 mg Pseudoephedrin-HCl (PSE-HCl)
pro Tablette, bewertet. Die Produkte waren:
SUDAFED 30 mg Tabletten
SUDAFED
30 mg Tabletten Gewicht/Vergällungsstoff
Generische
30 mg Tabletten
Generische 30 mg Tabletten
Gewicht/Vergällungsstoff
(zugegeben
zu den vermahlenen Tabletten)
-
Es war nicht möglich, die zwei Produkte, die
das Vergällungssystem
enthielten, zu filtrieren. Unter Verwendung des Verfahrens von „Uncle
Fester" wurde kein
PSE aus den vergällten
Produkten gewonnen. Es kann möglich
sein, das PSE aus diesen Formulierungen zu isolieren, jedoch würde es beträcht liche
Zeitaufwand und Erfahrung erfordern. Mengen an PSE waren aus den
drei Produkten ohne das Vergällungsstoffsystem
extrahierbar. Das Material war ungefähr 95% rein, ohne weitere Reinigung.
Die zwei Produkte mit PSE-HCl als einzigen Wirkstoff
ergaben nahezu vollständige
Wiedergewinnung. Die SUDAFED 30 mg Tabletten erzeugten 89% als reines
PSE und die generischen 30 mg Tabletten ergaben 98% als reines PSE.
-
Das Vergällungsstoffsystem war beim
Verhindern der Isalierung von PSE aus den Tabletten wirksam.
-
Materialien:
-
Die generischen 30 mg Tabletten Gewicht/Vergällungsstoff
waren die vermahlenen generischen 30 mg Tabletten, zu denen das
Vergällungsstoffgemisch
während
der anfänglichen
Toluolextraktion gegeben wurde.
-
-
Das Toluol war Reagenzqualität. Die 20%ige
Natriumhydroxidlösung
wurde mit desionisiertem Wasser und Natriumhydroxid NF hergestellt.
Das gesamte Wasser war desionisiert.
-
Ausrüstung:
-
Alle Extraktionen wurden unter Verwendung
von Magnetstabrührern
gerührt.
Vakuumfiltrationen wurden unter Verwendung des „Hausvakuums" bei 22–25 mmHg
durchgeführt.
Die Filtrationen wurden mit entweder Whatman Nr.1 Filterpa pier oder
Mr. Coffee-Kaffeefiltern durchgeführt. Die Vakuumfiltertrichter
waren entweder 7,5 cm oder 11 cm Durchmesser Coors Porzellantrichter.
Die flüssig/flüssig-Toluolextraktionen
wurden mit einem 500-ml-Scheidetrichter ausgeführt und Toluol wurde an einem
Büchi-011-Rotationsverdampfer
unter Verwendung von „Hausvakuum" und einem 80°C-Wasserbad
verdampft.
-
Verfahren:
-
- 1. Die Tabletten wurden in einem Mörser vermahlen
und durch ein 20-Mesh-Sieb gesiebt.
- 2. Die vermahlenen Tabletten wurden in 300 ml Toluol aufgeschlämmt und
eine (1) Stunde gerührt.
Dieser Schritt wurde zum Trocknen und Entfernen des Gummivergällungsstoffsystems
durchgeführt.
- 3. Die Aufschlämmung
wird Vakuum-filtriert. Der Filterkuchen wird mit weiteren 100 ml
Toluol gewaschen und luftgetrocknet. Die Toluollösung wird verworfen.
- 4. Der Filterkuchen wird zu 175 ml Wasser bei Raumtemperatur
gegeben, 1 Stunde gerührt
und dann Vakuumfiltriert.
- 5. Der Filterkuchen wird mit weiteren 50 ml Wasser gewaschen.
Die Filtrate werden vereinigt.
- 6. Das vereinigte Filtrat wird mit 20%iger NaOH-Lösung zu
einem pH > 12 neutralisiert
und für
eine (1) Stunde gerührt.
- 7. Die Charge wird Vakuum-filtriert, um die ausgefällte freie
Base von Pseudoephedrin zu entfernen. Die feste freie Base wird
mit 50 ml Wasser gewaschen und luftgetrocknet. Die Filtrate und
die Waschlauge werden vereinigt und mit 2 × 100 ml Volumen Toluol extrahiert.
Das Toluol wird zur Trockne eingedampft und die erhaltene freie
Base zu jener zugegeben, die durch Filtration erhalten wurde.
- 8. Die theoretische Ausbeute ist 12,29 g der freien Base von
Pseudoephedrin.
-
Ergebnisse:
-
A: SUDAFED 30 MG TABLETTEN
-
Die Toluolextraktion der vermahlenen
Tabletten filtrierte sehr schnell (< 30 Sekunden). Die wässerige Aufschlämmung der
vermahlenen Tabletten war nur etwas viskos; wahrscheinlich aufgrund
des Zuckers und wird ohne Schwierigkeit abfiltriert. Nach Spülen wurde
der Filterkuchen sehr leicht rosafarben und das Filtrat tiefrot.
Nach Zugabe von Natriumhydroxid wurde eine wesentliche Menge Flockulierungsmittelmaterial
gebildet. Dieses feste Material, die freie Base von Pseudoephedrin,
wurde durch Vakuumfiltration leicht gesammelt und luftgetrocknet.
Der Feststoff hatte eine leicht rosafarbene Färbung. 10,56 g Feststoffe wurden
gewonnen. Toluolextraktion, gefolgt von Verdampfung, führte zu
weiteren 0,9 g Feststoff. Gesamtausbeute ist 11,468 g Rohmaterial.
Analytische Chemieanalyse zeigte das Material als 96,3 PSE. Tatsächliche
Ausbeute an PSE ist 11,04 g PSE oder 90% der Theorie.
-
B: SUDAFED 30 MG TABLETTEN
GEWICHT/VERGÄLLUNGSSTOFF
-
Die Toluolextraktion der vermahlenen
Tabletten filtrierte sehr schnell (< 30 Sekunden). Die wässerige Aufschlämmung der
vermahlenen Tabletten war viskos und sehr schlammig. Dies geschah
aufgrund von sowohl dem Zucker als auch dem Polyox. Es gab keine
wesentliche Sedimentation, auch nach Stehen für 24 Stunden. Die Aufschlämmung war
weder in dem 7,5-cm-Trichter mit Papier Nr. 1, noch in dem 11-cm-Trichter mit den
Mr. Coffee-Filtern filtrierbar. Nachdem die Aufschlämmung zuerst
in dem Trichter angeordnet wurde, wurde eine kleine Menge Wasser
durchgeleitet. Innerhalb 10 Minuten war die Fließgeschwindigkeit auf weniger
als ein Tropfen pro 15 Sekunden herunter und verlangsamte. Kein
Filter erzeugte mehr als 20 ml Filtrat vor dem Verlangsamen bis
zu einem nahen Ende. Die Filtration und somit leichte Isolierung
der freien Base ist aus dieser Formulierung nicht durchführbar.
-
E: GENERISCHE 30 MG TABLETTEN
-
Die Toluolextraktion der vermahlenen
Tabletten filtrierte sehr schnell (< 30 Sekunden). Die wässerige Aufschlämmung der
vermahlenen Tabletten filtrierte ohne Schwierigkeit. Nach Spülen war
der Filterkuchen etwas rosafarben und das Filtrat tiefrot. Nach
der Zugabe von Natriumhydroxid wurde eine wesentliche Menge an Flockulierungsmittelmaterial
gebildet. Dieses feste Material, die freie Base, wurde durch Vakuumfiltration leicht
gesammelt und luftgetrocknet. Der Feststoff hatte eine leicht rosafarbene
Färbung.
10,04 g an Feststoff wurde gewonnen. Toluolextraktion, gefolgt von
Verdampfung, führte
zu weiteren 02,7 g Feststoff. Die Ausbeute ist 12,74 g Rohmaterial.
Chemische Analyse zeigte das Material mit 94,75% PSE. Tatsächliche
Ausbeute an PSE ist 12,07 g PSE oder 98% der Theorie.
-
F: GENERISCHE 30 MG TABLETTEN
GEWICHT/VERGÄLLUNGSSTOFF
-
Die Toluolextraktion der vermahlenen
Tabletten filtrierte sehr schnell (< 30 Sekunden). Die wässerige Aufschlämmung der
vermahlenen Tabletten war viskos und sehr schlammig. Dies geschah
aufgrund des Polyox. Es gab eine leichte Sedimentation nach Stehen
für 24
Stunden. Das abgesetzte Material scheint Dicalciumphosphat zu sein.
Die Aufschlämmung
war weder mit dem 7,5-cm-Trichter mit Papier Nr. 1 noch dem 11-cm-Trichter
mit den Mr. Coffee-Filtern filtrierbar. Nachdem die Aufschlämmung zuerst
in den Trichter angeordnet wurde, gelangte eine kleine Wassermenge
hindurch. Innerhalb 10 Minuten war die Fließgeschwindigkeit herunter auf
weniger als ein Tropfen pro 15 Sekunden und verlangsamte. Keiner
der Filter erzeugte mehr als 20 ml Filtrat vor dem Verlangsamen
bis zu einem nahen Ende. Die Filtration und somit leichte Isolierung der
freien Base ist aus dieser Formulierung nicht durchführbar.
-