-
Technisches Gebiet
-
Die
vorliegende Erfindung betrifft allgemein den Nachweis und die Behandlung
von Chlamydieninfektion. Insbesondere betrifft die Erfindung Zusammensetzungen,
die Polypeptide enthalten, umfassend ein Chlamydia-Antigen, und
die Verwendung solcher Polypeptide für die Serodiagnose und Behandlung
von Chlamydiainfektion.
-
Hintergrund der Erfindung
-
Chlamydien
sind intrazelluläre
bakterielle Pathogene, die für
eine große
Vielzahl von wichtigen menschlichen und tierischen Infektionen verantwortlich
sind. Chlamydia trachomatis ist einer der häufigsten Gründe für sexuell übertragene Erkrankungen und
kann zu Pelvic Inflammatory Disease (PID) führen, welche in Eileiter-Obstruktion
und Infertilität
resultiert. Chlamydia trachomatis kann auch eine Rolle bei männlicher
Infertilität
spielen. 1990 wurden die Kosten für die Behandlung von PID in
den USA auf 4 Milliarden Dollar geschätzt. Trachom aufgrund von okulärer Infektion
mit Chlamydia trachomatis ist die Hauptursache für verhinderbare Blindheit weltweit.
Chlamydia pneumonia ist eine Hauptursache für akute Atemwegsinfektionen
bei Menschen und man glaubt auch, dass es eine Rolle bei der Pathogenese
von Artherosklerose und insbesondere koronarer Herzerkrankung spielt.
Von Individuen mit einem hohen Antikörpertiter gegen Chlamydia pneumonia
wurde gezeigt, dass es doppelt so wahrscheinlich ist, dass sie an
einer koronaren Herzerkrankung leiden wie seronegative Individuen.
Chlamydieninfektionen stellen so ein signifikantes Gesundheitsproblem
sowohl in den USA wie auch weltweit dar.
-
Die
Datenbank-EMBL-Zugangsnummer AE 001333 (22. Juli 1998) durch Stephens
et al. offenbart Chlamydia trachomatis Sektion 60 von 87 des kompletten
Genoms.
-
Chlamydien-Infektion
ist oft asymptomatisch. Zum Beispiel kann zu dem Zeitpunkt, an dem
eine Frau medizinische Aufmerksamkeit für PID sucht, bereits ein irreversibler
Schaden aufgetreten sein, der zur Infertilität führt. Daher verbleibt so ein
Bedarf auf dem Fachgebiet für
verbesserte Impfstoffe und pharmazeutische Zusammensetzungen für die Verhinderung
und Behandlung von Chlamydiainfektionen. Die vorliegende Erfindung
befriedigt diesen Bedarf und stellt weiter andere verwandte Vorteile
bereit.
-
Zusammenfassung der Erfindung
-
Die
vorliegende Erfindung stellt Zusammensetzungen für die Diagnose und Therapie
von Chlamydiainfektion bereit. Bei einem Aspekt stellt die vorliegende
Erfindung eine Zusammensetzung bereit, umfassend:
- (a)
ein Polypeptid, umfassend:
- (i) die Aminoshuresequenz mit den Resten 8 bis 660 von SEQ ID
Nr. 139 oder eine Variante davon mit einer mindestens 90%igen Sequenzidentität dazu,
bestimmt durch Vergleich der zwei optimal ausgerichteten Sequenzen über ein
Vergleichsfenster der Reste 8 bis 660 von SEQ ID Nr. 139;
oder
- (ii) einen immunogenen Teil der Aminosäurereste 8 bis 660 von SEQ
ID Nr. 139, der mindestens 15 Aminosäuren lang ist;
oder
- (b) ein Polynukleotid, codierend das Polypeptid gemäß (a);
zur
Verwendung bei der Diagnose, Behandlung oder Prävention einer Chlamydiainfektion.
-
Bestimmte
Teile und andere Varianten sind immunogen, so dass die Fähigkeit
der Variante, mit antigen-spezifischen Antiseren zu reagieren, im
Wesentlichen nicht vermindert wird.
-
Bei
einem anderen Aspekt stellt die vorliegende Erfindung Zusammensetzungen
bereit, umfassend ein Fusionsprotein, umfassend ein Polypeptid,
umfassend:
- (i) die Aminosäuresequenz mit den Resten 8
bis 660 von SEQ ID Nr. 139 oder eine Variante davon mit einer mindestens
90%igen Sequenzidentität
dazu, bestimmt durch Vergleich der zwei optimal ausgerichteten Sequenzen über ein
Vergleichsfenster der Reste 8 bis 660 von SEQ ID Nr. 139;
oder
- (ii) einen immunogenen Teil der Aminosäurereste 8 bis 660 von SEQ
ID Nr. 139, der mindestens 15 Aminosäuren lang ist;
für die Verwendung
bei der Diagnose, Behandlung oder Prävention von Chlamydiainfektion.
-
In
anderen Aspekten stellt die vorliegende Erfindung pharmazeutische
Zusammensetzungen bereit, die eine Zusammensetzung umfassen, umfassend:
- (a) ein Polypeptid, umfassend:
- (i) die Aminosäuresequenz
mit den Resten 8 bis 660 von SEQ ID Nr. 139 oder eine Variante davon
mit einer mindestens 90%igen Sequenzidentität dazu, bestimmt durch Vergleich
der zwei optimal ausgerichteten Sequenzen über ein Vergleichsfenster der
Reste 8 bis 660 von SEQ ID Nr. 139;
oder
- (ii) einen immunogenen Teil der Aminosäurereste 8 bis 660 von SEQ
ID Nr. 139, der mindestens 15 Aminosäuren lang ist;
oder
- (b) ein Polynucleotid, das das Polypeptid von (a) codiert und
einen physiologisch akzeptablen Träger.
-
Die
Erfindung stellt auch Impfstoffe für prophylaktische und therapeutische
Zwecke bereit, umfassend eine Zusammensetzung, umfassend:
- (a) ein Polypeptid, umfassend:
- (i) die Aminosäuresequenz
mit den Resten 8 bis 660 von SEQ ID Nr. 139 oder eine Variante davon
mit einer mindestens 90%igen Sequenzidentität dazu, bestimmt durch Vergleich
der zwei optimal ausgerichteten Sequenzen über ein Vergleichsfenster der
Reste 8 bis 660 von SEQ ID Nr. 139;
oder
- (ii) einen immunogenen Teil der Aminosäurereste 8 bis 660 von SEQ
ID Nr. 139, der mindestens 15 Aminosäuren lang ist; oder
- (b) ein Polynucleotid, das das Polypeptid von (a) codiert, und
ein Immunstimulans, z. B. ein Adjuvans.
-
Auch
bereitgestellt wird die Verwendung von:
- (a)
einem Polypeptid, umfassend:
- (i) die Aminosäuresequenz
mit den Resten 8 bis 660 von SEQ ID Nr. 139 oder eine Variante davon
mit einer mindestens 90%igen Sequenzidentität dazu, bestimmt durch Vergleich
der zwei optimal ausgerichteten Sequenzen über ein Vergleichsfenster der
Reste 8 bis 660 von SEQ ID Nr. 139;
oder
- (ii) einen immunogenen Teil der Aminosäurereste 8 bis 660 von SEQ
ID Nr. 139, der mindestens 15 Aminosäuren lang ist;
oder
- (b) einem Polynucleotid, das das Polypeptid von (a) codiert;
bei
der Herstellung eines Medikamentes für die Behandlung oder Prävention
von Chlamydiainfektion, bei dem Nachweis von Chlamydiainfektion
bei einem Patienten und bei der Herstellung eines Diagnosekits für den Nachweis
von Chlamydiainfektion bei einem Patienten.
-
Sequenzidentifikatoren
-
SEQ
ID Nr. 1 stellt eine DNA-Sequenz dar, identifiziert für Klon E4-A2-39
(CT10 positiv), das 1.311 bp ist und den gesamten OLR für CT460
(SWIB) und einen partiellen OLR für CT461 (yael) enthält.
-
SEQ
ID Nr. 2 stellt eine DNA-Sequenz für Klon E2-B10-52 (CT10 positiv)
dar, die 1.516 bp Insert aufweist, das partielle OLRs für die Gene
CT827 (nrdA-Ribonucleosidreduktase große Kette) und CT828 (ndrB-Ribonucleosidreduktase
kleine Kette) enthält.
Diese Gene wurden in einem Ct L2-Bibliothek-Screening nicht identifiziert.
-
SEQ
ID Nr. 3 stellt eine DNA-Sequenz für Klon E1-B1-80 (CT10 positiv)
(2.397 bp) dar, die partielle OLRs für verschiedene Gene, CT812
(pmpD), CT015 (phoH ATPase), CT016 (hypothetisches Protein) und pGpl-D
(C. trachomatis Plasmidgen) enthält.
-
SEQ
ID Nr. 4 stellt eine DNA-Sequenz für Klon E4-F9-4 (CT10, CL8,
CT1, CT5, CT13 und CHH037 positiv) dar, die ein 1.094 bp Insert
enthält,
das einen partiellen OLR für
das Gen CT316 (L7/L12 ribosomales Protein) wie auch einen partiellen
OLR für
Gen CT315 (RNA-Polymerase beta) aufweist.
-
SEQ
ID Nr. 5 stellt eine DNA-Sequenz für Klon E2-H6-40 (CT3 positiv)
dar, die ein 2.129 pb Insert aufweist, das den gesamten OLR für das Gen
CT288 und sehr kleine Fragmente der Gene CT287 und CT298 enthält. Die
Gene in diesem Klon wurden nicht bei dem Screening mit einer Ct
L2-Bibliothek identifiziert.
-
SEQ
ID Nr. 6 stellt eine DNA-Sequenz für Klon E5-D4-2 (CT3, CT10,
CT1, CT5, CT12 und CHH038 positiv) dar, die ein 1.828 bp Insert
aufweist, das einen partiellen OLR für Gen CT378 (pgi), kompletten
OLR für
Gen CT377 (ltuA) und einen kompletten OLR für das Gen CT376 (Malatdehydrogenase)
enthält.
Zusätzlich identifizierten
die Patientenlinien CT10, CT1, CT5, CT12 und CHH037 ebenfalls diesem
Klon.
-
SEQ
ID Nr. 7 stellt eine DNA-Sequenz für Klon E6-C1-31 (CT3 positiv)
dar, die ein 861 b Insert aufweist, das einen partiellen OLR für Gen CT858
enthält.
-
SEQ
ID Nr. 8 stellt eine DNA-Sequenz für Klon E9-E11-76 (CT3 postitiv)
dar, die ein 763 pb Insert enthält,
das eine Amino-terminale
Region des Gens für
CT798 (Glycogensynthase) ist. Dieses Gen wurde in einem vorherigen
Screening mit einer Ct L2-Bibliothek nicht identifiziert.
-
SEQ
ID Nr. 9 stellt eine DNA-Sequenz für Klon E2-A9-26 (CT1 positiv)
dar, die einen Teil des Gens für OLR-3,
das auf dem Plasmid in Chlamydia trachomatis gefunden wird, enthält.
-
SEQ
ID Nr. 10 stellt eine DNA-Sequenz für Klon E2-G8-94 (CT1 positiv)
dar, die das Carboxy-terminale Ende von Lpda-Gen wie auch einen
partiellen OLR für
CT556 aufweist.
-
SEQ
ID Nr. 11 stellt eine DNA-Sequenz für Klon E1-H1-14 (CT1 positiv)
dar, die ein 1.474 pb Insert aufweist, welches den Amiono-terminalen
Teil eines Lpda-OLRs auf dem komplementären Strang enthält.
-
SEQ
ID Nr. 12 stellt eine DNA-Sequenz für Klon E1-A5-53 (CT1 positiv)
dar, die ein 2.017 bp Insert enthält, das einen Amino-terminalen
Teil des OLRs für
dnaK-Gen auf den komplementären
Strang, einen partiellen OLR für
das grpE-Gen (CT395) und einen partiellen OLR für CT166 enthält.
-
SEQ
ID Nr. 13 stellt eine DNA-Sequenz für Klon E3-A1-50 (positiv auf
der CT1-Linie) dar, die 1.199 bp ist und einen Carboxy-terminalen
Teil des OLRs für
CT622 enthält.
-
SEQ
ID Nr. 14 stellt eine DNA-Sequenz für Klon E3-E2-22 dar, die 877
bp aufweist, enthaltend einen kompletten OLR für CT610 auf dem komplementären Strang
und diese wurde auf den CT3- wie auch CT10-Linien positiv war.
-
SEQ
ID Nr. 15 stellt eine DNA-Sequenz für Klon E5-E2-10 (CT10 positiv)
dar, die 427 bp ist und einen partiellen OLR für das hauptsächliche äußere Membranprotein
omp 1 enthält.
-
SEQ
ID Nr. 16 stellt die DNA-Sequenz für Klon E2-D5-89 (516 bp) dar,
die ein CT10-postives Klon ist, das einen partiellen OLR für pmpD-Gen
(CT812) enthält.
-
SEQ
ID Nr. 17 stellt die DNA-Sequenz für Klon E4-G9-75 (CT10 positiv)
dar, die 723 pb ist und einen partiellen OLR für die Amino-terminale Region
des pmpH-Gens (CT872) enthält.
-
SEQ
ID Nr. 18 stellt die DNA-Sequenz für Klon E3-F2-35 (CT10, CT3,
CT11 und CT13 positives 1.377 pb Insert) dar, die einen partiellen
OLR für
das tRNA-Trp(CT322)-Gen und einen kompletten OLR für das Gen secE
(CT321) enthält.
-
SEQ
ID Nr. 19 stellt die DNA-Sequenz für Klon E5-A11-8 (CT10 positiv
1.736 bp) dar, die den vollständigen
OLR für
groES (CT111) und einen Hauptanteil des OLRs für groEL (CT110) enthält.
-
SEQ
ID Nr. 20 stellt die DNA-Sequenz für Klon E7-H11-61 (CT3 positiv
1.735 bp) dar, die partielle Inserts für fliA (CT061), tyrS (CT062),
TSA (CT603) und ein hypothetisches Protein (CT602) aufweist.
-
SEQ
ID Nr. 21 stellt eine DNA-Sequenz für Klon E6-C8-95 dar, die ein
731 bp Insert enthält,
das unter Verwendung der Donor-Linien CT3-, CT1- und CT12-Linie
identifiziert wurde.
-
Dieses
Insert weist eine Carboxy-terminale Hälfte für das Gen für den 60 kDa OLR auf.
-
SEQ
ID Nr. 22 stellt die DNA-Sequenz für Klon E4-D2-79 (CT3 positiv)
dar, die ein 1.181 bp Insert enthält, das ein partieller OlR
für das
nrdA-Gen ist. Der OLR für
dieses Gen wurde auch von Klon E2-B10-52 (CT10 positiv) identifiziert.
-
SEQ
ID Nr. 23 stellt die DNA-Sequenz für Klon E1-F9-79 (167 bp; CT11
positiv) dar, die einen partiellen OLR für das Gen CT133 auf dem komplementären Strang
enthält.
CT133 wird als eine rRNA-Methylase vorhergesagt.
-
SEQ
ID Nr. 24 stellt die DNA-Sequenz für Klon E2-G12-52 (1.265 bp;
CT11 positiv) dar, die einen partiellen OLR für clpB, eine Protease ATPase,
enthält.
-
SEQ
ID Nr. 25 stellt die DNA-Sequenz für Klon E4-H3-56 (463 bp Insert;
CT1 positiv) dar, die einen partiellen OLR für das TSA-Gen (CT603) auf dem
komplementären
Strang enthält.
-
SEQ
ID Nr. 26 stellt die DNA-Sequenz für Klon E5-E9-3 (CT1 positiv)
dar, die ein 636 bp Insert enthält, das
partiell den OLR für
dnaK-ähnliches
Gen codiert. Ein Teil dieser Sequenz wurde auch in Klon E1-A5-53 identifiziert.
-
SEQ
ID Nr. 27 stellt die Serovar E-DNA-Sequenz von CT875 in voller Länge dar.
-
SEQ
ID Nr. 28 stellt die Serovar E-DNA-Sequenz von CT622 in voller Länge dar.
-
SEQ
ID Nr. 29 stellt die DNA-Sequenz für Klon E3-B4-18 (CT1 positiv)
dar, die 1.224 pb Insert enthält, das
4 OLRs enthält.
Der vollständige
OLR für
CT772 und die partiellen OLRs von CT771, CT191 und CT190.
-
SEQ
ID Nr. 30 stellt die DNA-Sequenz für den Klon E9-E10-51 (CT10
positiv) dar, die ein 883 bp Insert enthält, das zwei partielle OLRs,
CT680 und CT679, enthält.
-
SEQ
ID Nr. 31 stellt die DNA-Sequenz für den Klon E9-D5-8 (CT10, CT1,
CT4 und CT11 positiv) dar, die ein 393 bp Insert enthält, das
den partiellen OLR für
CT680 enthält.
-
SEQ
ID Nr. 32 stellt die DNA-Sequenz für den Klon E7-B1-16 (CT10,
CT3, CT5, CT11, CT13 und CHH037 positiv) dar, die ein 2.577 bp Insert
enthält,
das drei OLRs, zwei vollständige
OLRs für
CT694 und CT695 und den dritten, der den N-terminalen Teil von CT969
enthält,
enthält.
-
SEQ
ID Nr. 33 stellt die DNA-Sequenz für den Klon E9-G2-93 (CT10 positiv)
dar, die ein 554 bp Insert enthält,
das einen partiellen OLR für
CT178 enthält.
-
SEQ
ID Nr. 34 stellt die DNA-Sequenz für den Klon E5-A8-85 (CT1 positiv)
dar, die ein 1.433 bp Insert enthält, das zwei partielle OLRs
für CT875
und CT001 enthält.
-
SEQ
ID Nr. 35 stellt die DNA-Sequenz für den Klon E10-C6-45 (CT3 positiv)
dar, die ein 196 bp Insert enthält,
das einen partiellen OLR für
CT827 enthält.
-
SEQ
ID Nr. 36 stellt die DNA-Sequenz für den Klon E7-H11-10 (CT3 positiv)
dar, die ein 1.990 bp Insert enthält, das die partiellen ORLs
für CT610
und CT613 und den vollständigen
OLRs von CT611 und CT612 enthält.
-
SEQ
ID Nr. 37 stellt die DNA-Sequenz für den Klon E2-F7-11 (CT3 und
CT10 positiv) dar, die ein 2.093 bp Insert enthält. Es enthält eine große Region von CT609, einen
vollständigen
OLR für
CT610 und einen vollständigen
OLR für
CT611.
-
SEQ
ID Nr. 38 stellt die DNA-Sequenz für den Klon E3-A3-31 (CT1 positiv)
dar, die ein 1.834 bp Insert enthält, das eine große Region
von CT622 enthält.
-
SEQ
ID Nr. 39 stellt die DNA-Sequenz für den Klon E1-G9-23 (CT3 positiv)
dar, die ein 1.180 bp Insert enthält, das fast den gesamten OLR
für CT798
enthält.
-
SEQ
ID Nr. 40 stellt die DNA-Sequenz für den Klon E4-D6-21 (CT3 positiv)
dar, die ein 1.297 bp Insert enthält, das die partiellen OLRs
für CT329
und CT327 und den kompletten OLR von CT328 enthält.
-
SEQ
ID Nr. 41 stellt die DNA-Sequenz für den Klon E3-F3-18 (CT1 positiv)
dar, die ein 1.141 bp Insert enthält, das den partiellen OLR
von CT871 enthält.
-
SEQ
ID Nr. 42 stellt die DNA-Sequenz für den Klon E10-B2-57 (CT10
positiv) dar, die ein 822 bp Insert enthält, das den kompletten OLR
von CT066 enthält.
-
SEQ
ID Nr. 43 stellt die DNA-Sequenz für den Klon E3-F3-7 (CT1 positiv)
dar, die ein 1.643 bp Insert enthält, das die partiellen OLRs
von CT869 und CT870 enthält.
-
SEQ
ID Nr. 44 stellt die DNA-Sequenz für den Klon E10-H8-1 (CT3 und
CT10 positiv) dar, die ein 1.862 bp Insert enthält, das die partiellen OLRs
von CT871 und CT 872 enthält.
-
SEQ
ID Nr. 45 stellt die DNA-Sequenz für den Klon E3-D10-46 (CT1,
CT3, CT4, CT11 und CT12 positiv) dar, die ein 1.666 bp Insert enthält, das
die partiellen OLRs für
CT770 und CT773 und die vollständigen OLRs
für CT771
und CT722 enthält.
-
SEQ
ID Nr. 46 stellt die DNA-Sequenz für den Klon E2-D8-19 (CT1 positiv)
dar, die ein 2.010 bp Insert enthält, das die partiellen OLRs,
OLR3 und OLR6, und die vollständigen
OLRs, OLR4 und OLR5, enthält.
-
SEQ
ID Nr. 47 stellt die DNA-Sequenz für den Klon E4-C3-40 (CT10 positiv)
dar, die ein 2.044 bp Insert enthält, das den partiellen OLR
für CT827
und einen vollständigen
OLR für
CT828 enthält.
-
SEQ
ID Nr. 48 stellt die DNA-Sequenz für den Klon E3-H6-10 (CT12 positiv)
dar, die ein 3.743 bp Insert enthält, das die partiellen OLRs
für CT223
und CT229 und die vollständigen
OLRs für
CT224, CT225, CT226, CT227 und CT228 enthält.
-
SEQ
ID Nr. 80 stellt die Serovar D DNA-Sequenz des Chlamydia trachomatis-Gens
CT872 in voller Länge
dar.
-
SEQ
ID Nr. 81 stellt die Serovar D DNA-Sequenz des Chlamydia trachomatis-Gens
CT828 in voller Länge
dar.
-
SEQ
ID Nr. 82 stellt die Serovar D DNA-Sequenz des Chlamydia trachomatis-Gens
CT827 in voller Länge
dar.
-
SEQ
ID Nr. 83 stellt die Serovar D DNA-Sequenz des Chlamydia trachomatis-Gens
CT812 in voller Länge
dar.
-
SEQ
ID Nr. 84 stellt die Serovar D DNA-Sequenz des Chlamydia trachomatis-Gens
CT798 in voller Länge
dar.
-
SEQ
ID Nr. 85 stellt die Serovar D DNA-Sequenz des Chlamydia trachomatis-Gens
CT681 (MompF) in voller Länge
dar.
-
SEQ
ID Nr. 86 stellt die Serovar D DNA-Sequenz des Chlamydia trachomatis-Gens
CT603 in voller Länge
dar.
-
SEQ
ID Nr. 87 stellt die Serovar D DNA-Sequenz des Chlamydia trachomatis-Gens
CT460 in voller Länge
dar.
-
SEQ
ID Nr. 88 stellt die Serovar D DNA-Sequenz des Chlamydia trachomatis-Gens
CT322 in voller Länge
dar.
-
SEQ
ID Nr. 89 stellt die Serovar D DNA-Sequenz des Chlamydia trachomatis-Gens
CT321 in voller Länge
dar.
-
SEQ
ID Nr. 90 stellt die Serovar D DNA-Sequenz des Chlamydia trachomatis-Gens
CT289 in voller Länge
dar.
-
SEQ
ID Nr. 91 stellt die Serovar D DNA-Sequenz des Chlamydia trachomatis-Gens
CT288 in voller Länge
dar.
-
SEQ
ID Nr. 92 stellt die Serovar D DNA-Sequenz des Chlamydia trachomatis-Gens
CT287 in voller Länge
dar.
-
SEQ
ID Nr. 93 stellt die Serovar D DNA-Sequenz des Chlamydia trachomatis-Gens
CT133 in voller Länge
dar.
-
SEQ
ID Nr. 94 stellt die Serovar D DNA-Sequenz des Chlamydia trachomatis-Gens
CT113 in voller Länge
dar.
-
SEQ
ID Nr. 95 stellt die Serovar D Aminosäuresequenz des Chlamydia trachomatis-Gens
CT872 in voller Länge
dar.
-
SEQ
ID Nr. 96 stellt die Serovar D Aminosäuresequenz des Chlamydia trachomatis-Gens
CT828 in voller Länge
dar.
-
SEQ
ID Nr. 97 stellt die Serovar D Aminosäuresequenz des Chlamydia trachomatis-Gens
CT827 in voller Länge
dar.
-
SEQ
ID Nr. 98 stellt die Serovar D Aminosäuresequenz des Chlamydia trachomatis-Gens
CT812 in voller Länge
dar.
-
SEQ
ID Nr. 99 stellt die Serovar D Aminosäuresequenz des Chlamydia trachomatis-Gens
CT798 in voller Länge
dar.
-
SEQ
ID Nr. 100 stellt die Serovar D Aminosäuresequenz des Chlamydia trachomatis-Gens
CT681 in voller Länge
dar.
-
SEQ
ID Nr. 101 stellt die Serovar D Aminosäuresequenz des Chlamydia trachomatis-Gens
CT603 in voller Länge
dar.
-
SEQ
ID Nr. 102 stellt die Serovar D Aminosäuresequenz des Chlamydia trachomatis-Gens
CT460 in voller Länge
dar.
-
SEQ
ID Nr. 103 stellt die Serovar D Aminosäuresequenz des Chlamydia trachomatis-Gens
CT322 in voller Länge
dar.
-
SEQ
ID Nr. 104 stellt die Serovar D Aminosäuresequenz des Chlamydia trachomatis-Gens
CT321 in voller Länge
dar.
-
SEQ
ID Nr. 105 stellt die Serovar D Aminosäuresequenz des Chlamydia trachomatis-Gens
CT289 in voller Länge
dar.
-
SEQ
ID Nr. 106 stellt die Serovar D Aminosäuresequenz des Chlamydia trachomatis-Gens
CT288 in voller Länge
dar.
-
SEQ
ID Nr. 107 stellt die Serovar D Aminosäuresequenz des Chlamydia trachomatis-Gens
CT287 in voller Länge
dar.
-
SEQ
ID Nr. 108 stellt die Serovar D Aminosäuresequenz des Chlamydia trachomatis-Gens
CT133 in voller Länge
dar.
-
SEQ
ID Nr. 109 stellt die Serovar D Aminosäuresequenz des Chlamydia trachomatis-Gens
CT113 in voller Länge
dar.
-
SEQ
ID Nr. 114 stellt die DNA-Sequenz für den Klon E7-B12-65 (CHH037
positiv) dar, die ein 1.179 bp Insert enthält, das den vollständigen OLR
für 376
enthält.
-
SEQ
ID Nr. 115 stellt die DNA-Sequenz für den Klon E4-H9-83 (CHH037
positiv) dar, die den partiellen OLR für das Hitzeschock-Protein GroEL
(CT110) enthält.
-
SEQ
ID Nr. 116 stellt die DNA-Sequenz für den Klon E9-B10-52 (CHH037
positiv) dar, die den partiellen OLR für das Gen yscC (CT674) enthält.
-
SEQ
ID Nr. 117 stellt die DNA-Sequenz für den Klon E7-A7-79 (CHH037
positiv) dar, die den vollständigen
OLR für
das histonähnliche
Entwicklungsgen hctA (CT743) und einen partiellen OLR für das rRNA-Methyltransferasegen
ygcA (CT742) enthält.
-
SEQ
ID Nr. 118 stellt die DNA-Sequenz für den Klon E2-D11-18 (CHH037
positiv) dar, die den partiellen OLR für hctA (CT743) enthält.
-
SEQ
ID Nr. 119 stellt die DNA-Sequenz für das Chlamydia trachomatis
Servovar E hypothetische Protein CT694 dar.
-
SEQ
ID Nr. 120 stellt die DNA-Sequenz für das Chlamydia trachomatis
Servovar E hypothetische Protein CT695 dar.
-
SEQ
ID Nr. 121 stellt die DNA-Sequenz für das Chlamydia trachomatis
Servovar E L/1 ribosomale Protein dar.
-
SEQ
ID Nr. 122 stellt die Aminosäuresequenz
für das
Chlamydia trachomatis Servovar E hypothetische Protein CT694 dar.
-
SEQ
ID Nr. 123 stellt die Aminosäuresequenz
für das
Chlamydia trachomatis Servovar E hypothetische Protein CT695 dar.
-
SEQ
ID Nr. 124 stellt die Aminosäuresequenz
für das
Chlamydia trachomatis Servovar E L/1 ribosomale Protein dar.
-
SEQ
ID Nr. 125 stellt die DNA-Sequenz für den Klon E9-A6-15 (CT3 positiv)
dar, die den partiellen OLR für
das pmpB-Gen (CT413) enthält.
-
SEQ
ID Nr. 126 stellt die DNA-Sequenz für den Klon E3-D10-87 (CT1 positiv)
dar, die die partiellen OLRr für
die hypothetischen Gene CT388 und CT389 enthält.
-
SEQ
ID Nr. 127 stellt die DNA-Sequenz für den Klon E9-D6-43 (CT3 positiv)
dar, die den partiellen OLRs für
das CT858 enthält.
-
SEQ
ID Nr. 128 stellt die DNA-Sequenz für den Klon E3-D10-4 (CT1 positiv)
dar, die den partiellen OLR für
pGP3-D und OLR, der auf dem Plasmid pGHL1 codiert wird, enthält.
-
SEQ
ID Nr. 129 stellt die DNA-Sequenz für den Klon E3-G8-7 (CT1 positiv)
dar, die die partiellen OLRs für
das CT557 (LpdA) und CT558 (LipA) enhält.
-
SEQ
ID Nr. 130 stellt die DNA-Sequenz für den Klon E3-F11-32 (CT1 positiv)
dar, die den partiellen OLR für
pmpD (CT812) enthält.
-
SEQ
ID Nr. 131 stellt die DNA-Sequenz für den Klon E2-F8-5 (CT12 positiv)
dar, die den vollständigen OLR
für den
15 kDa OLR (CT442) und einen partiellen OLR für den 60 kDA OLR (CT443) enthält.
-
SEQ
ID Nr. 132 stellt die DNA-Sequenz für den Klon E2-G4-39 (CT12 positiv)
dar, die den partiellen OLR für
den 60 kDa OLR (CT443) enthält.
-
SEQ
ID Nr. 133 stellt die DNA-Sequenz für den Klon E9-D1-16 (CT10 positiv)
dar, die den partiellen OLR pmpH (CT872) enthält.
-
SEQ
ID Nr. 134 stellt die DNA-Sequenz für den Klon E3-F3-6 (CT1 positiv)
dar, die die partiellen OLRs für
die Gene accB (CT123) L1 ribosomal (CT125) und S9 ribosomal (CT126)
enthält.
-
SEQ
ID Nr. 135 stellt die DNA-Sequenz für den Klon E2-D4-70 (CT12 positiv)
dar, die den partiellen OLR für
das pmpC-Gen (CT414) enthält.
-
SEQ
ID Nr. 136 stellt die DNA-Sequenz für den Klon E5-A1-79 (CT1 positiv)
dar, die den partiellen OLR für
ydhO (CT127), einen vollständigen
OLR für
S9 ribosomales Gen (CT126), einen vollständigen OLR für das L1
ribosomale Gen (CT125) und einen partiellen OLR für accC (CT124)
enthält.
-
SEQ
ID Nr. 137 stellt die DNA-Sequenz für den Klon E1-F7-16 (CT12,
CT3 und CT11 positiv) dar, die den partiellen OLR für das ftsH-Gen
(CT841) und den gesamten OLR für
das pnp-Gen (CT842) enthält.
-
SEQ
ID Nr. 138 stellt die DNA-Sequenz für den Klon E1-D8-62 (CT12 positiv)
dar, die die partiellen OLRs für
das ftsH-Gen (CT841) und für
das pnp-Gen (CT842) enthält.
-
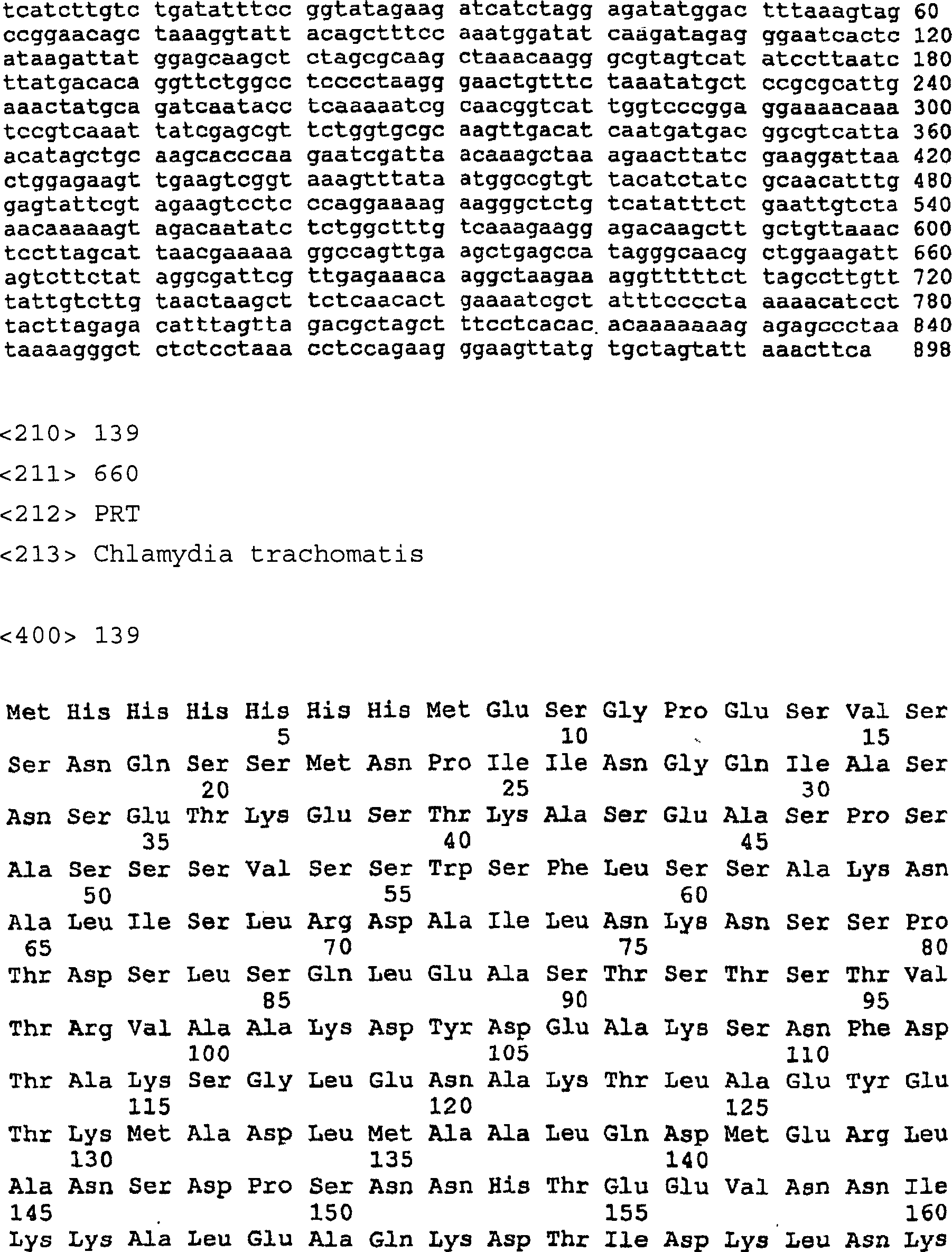
SEQ
ID Nr. 139 stellt die Aminosäuresequenz
für das
Serovar E Protein CT622 dar.
-
SEQ
ID Nr. 140 stellt die Aminosäuresequenz
für das
Serovar E Protein CT875 dar.
-
Beschreibung der veranschaulichenden
Ausführungsarten
-
Wie
oben erwähnt
wurde, richtet sich die vorliegende Erfindung im Allgemeinen auf
Zusammensetzungen für
die Diagnose und Behandlung von Chlamydiainfektion. Bei einem Aspekt
beinhalten die Zusammensetzungen der vorliegenden Erfindung Polypeptide,
die (i) die Aminosäuresequenz
der Reste 8 bis 660 von SEQ ID Nr. 139 oder eine Variante davon
mit einer mindestens 90%igen Sequenzidentität dazu, wie durch Vergleich
der zwei optimal ausgerichteten Sequenzen über ein Vergleichsfenster der
Reste 8 bis 660 von SEQ ID Nr. 139 bestimmt wurde; oder (ii) einen
immunogenen Teil der Aminosäurereste
8 bis 660 von SEQ ID Nr. 139, der mindestens 15 Aminosäuren lang
ist, umfassen.
-
Polynucleotidzusammensetzungen
-
Wie
hier verwendet, bezeichnen die Begriffe „DNA-Segment" und „Polynucleotid" ein DNA-Molekül, das frei
von gesamter genomischer DNA einer speziellen Art isoliert wurde.
Daher bezieht sich eine DNA-Segment, das ein Polypeptid codiert,
auf ein DNA-Segment, das ein oder mehrere Codierungssequenzen enthält, aber
dennoch im Wesentlichen von der gesamt-genomischen DNA der Art, von der das
DNA-Segment erhalten wurde, wegisoliert oder frei gereinigt wurde.
Mit eingeschlossen in die Begriffe „DNA-Segment" und „Polynucleotid" sind DNA-Segmente
und kleinere Fragmente solcher Segmente und auch rekombinante Vektoren, einschließlich z.
B. Plasmide, Cosmide, Phagemide, Phagen, Viren und dergleichen.
-
Es
wird von den Fachleuten auf dem Gebiet verstanden werden, dass DNA-Segmente
mit Nutzen bei dieser Erfindung genomische Sequenzen, extragenomische
und Plasmid-codierte Sequenzen und kleinere gentechnisch hergestellte
Gensegmente, die Proteine, Polypeptide, Peptide und dergleichen
exprimieren oder adaptiert sein können, um sie zu exprimieren,
beinhalten. Solche Segmente können
natürlich
isoliert oder synthetisch durch Menschenhand modifiziert sein.
-
„Isoliert", wie es hier verwendet
wird, bedeutet, dass ein Polynucleotid im Wesentlichen von anderen Codierungssequenzen
entfernt vorliegt, und dass das DNA-Segment nicht große Teile
von nicht verwandter codierender DNA, wie große chromosomale Fragmente oder
andere funktionelle Gene oder Polypeptid-codierende Regionen, enthält. Dies
bezieht sich natürlich
auf das DNA-Segment, wie es ursprünglich isoliert wurde, und schließt nicht
Gene oder Codierungsregionen aus, die später zu dem Segment durch Menschenhand
hinzugefügt
wurden.
-
Wie
es von dem bewanderten Fachmann erkannt werden wird, können die
Polynucleotide einzelsträngig
(Codierungs- oder Gegensinn) oder doppelsträngig sein und sie können DNA
(genomisch, cDNA oder synthetisch) oder RNA-Moleküle sein.
RNA-Moleküle
beinhalten HnRNA-Moleküle,
die Introns enthalten und zu einem DNA-Molekül auf eine eins-zu-eins-Weise
korrespondieren, und mRNA-Moleküle,
die keine Introns enthalten. Zusätzliche
Codierungs- oder Nicht-Codierungssequenzen
können,
aber müssen
nicht, innerhalb eines Polynucleotids von Nutzen bei der vorliegenden
Erfindung vorliegen und ein Polynucleotid kann, aber muss nicht,
an andere Moleküle
und/oder Trägermaterialien
gebunden sein.
-
Polynucleotide
können
eine native Chlamydia-Sequenz umfassen oder können eine Variante oder ein biologisches
oder antigenes funktionelles Äquivalent
einer solchen Sequenz umfassen. Polynucleotidvarianten können ein
oder mehrere Substitutionen, Additionen, Deletionen und/oder Insertionen
enthalten, wie weiter unten beschrieben wird, vorzugsweise solcher
Art, dass die Immunogenität
des codierten Polypeptids relativ zu einem nativen Chlamydia-Protein
nicht verringert wird. Der Effekt auf die Immunogenität des codierten
Polypeptids kann im Allgemeinen beurteilt werden, wie hier beschrieben
wird. Der Begriff „Varianten" umfasst auch homologe
Gene von xenogenem Ursprung.
-
Wenn
Polynucleotid- oder Polypeptidsequenzen verglichen werden, merkt
man, dass zwei Sequenzen „identisch" sind, wenn die Sequenz
der Nucleotide oder Aminosäure
in den zwei Sequenzen die gleiche ist, wenn sie für maximale
Korrespondenz ausgerichtet werden, wie unten beschrieben wird. Vergleiche
zwischen zwei Sequenzen werden typischerweise durch Vergleich der
Sequenzen über
ein Vergleichsfenster durchgeführt,
um lokale Bereiche der Sequenzähnlichkeit
zu identifizieren und zu vergleichen. Ein „Vergleichsfenster" bezieht sich auf
ein Segment von mindestens ungefähr
20 fortlaufenden Positionen, gewöhnlich
30 bis ungefähr
75, 40 bis ungefähr
50, wobei eine Sequenz zu einer Referenzsequenz mit der gleichen
Anzahl von fortlaufenden Positionen verglichen wird, nachdem die
zwei Sequenzen optimal ausgerichtet wurden.
-
Die
optimale Ausrichtung von Sequenzen für den Vergleich kann unter
Verwendung des Megalign-Programms in der Lasergene Suite of Bioinformatics
Software (DNASTAR, Inc., Madison, WI) unter Verwendung von vorgegebenen
Parametern durchgeführt
werden. Dieses Programm verkörpert
verschiedene Ausrichtungsschemata, die in den folgenden Quellenangaben
beschrieben werden: Dayhoff, M. O. (1978) A model of evolutionary
change in Proteins – Matrices
for detecting distant relationships. In Dayhoff, M. O. (Hrsg.) Atlas
of Protein Sequence and Structure, National Biomedical Research
Foundation, Washington CD Bd. 5, Anh. 3, S. 345–358; Hein J. (1990) Unified
Approach to Alignment and Phylogenes, S. 626–645, Methods in Enzymology, Bd.
183, Academic Press, Inc., San Diego, CA; Higgins, D. G. and Sharp,
P. M. (1989) CABIOS 5: 151–153; Myers,
E. W. and Muller W. (1988) CABIOS 4: 11–17; Robinson, E. D. (1971)
Comb. Theor. 11: 105; Santou, N. Nes, M. (1987) Mol. Biol. Evol.
4: 406–425;
Sneath, P. H. A. und Sokal, R. R. (1973) Numerical Taxonomy – the Principles
and Practice of Numerical Taxonomy, Freeman Press, San Francisco,
CA; Wilbur, W. J. and Lipman, D. J. (1983) Proc. Natl. Acad., Sci.
USA 80: 726–730.
-
Alternativ
kann die optimale Ausrichtung von Sequenzen zum Vergleich durch
den lokalen Identitätsalgorithmus
von Smith und Waterman (1981) Add. APL. Math 2: 482, durch den Identitäts-Ausrichtungsalgorithmus
von Needleman und Wunsch (1970) J. Mol. Biol. 48: 443, durch die
Suche nach Ähnlichkeitsverfahren von
Pearson und Lipman (1988) Proc. Natl. Acad. Sci. USA 85: 2444, durch
computerisierte Implementationen dieser Algorithmen (GAP, BESTFIT,
BLAST; FASIA und TFASTA in der Wisconsin Genetics Software Package, Genetics
Computer Group (GCG), 575 Science Dr., Madison, WI) oder durch Betrachtung
durchgeführt
werden.
-
Ein
bevorzugtes Beispiel für
Algorithmen, die für
die Bestimmung von Prozent Sequenzidentität und Sequenzähnlichkeit
geeignet sind, sind die BLAST und BLAST 2.0 Algorithmen, die in
Altschul et al. (1977) Nucl. Acids Res. 25: 3389–3402 bzw. Altschul et al.
(1990) J. Mol. Biol. 215: 403–410
beschrieben werden. BLAST und BLAST 2.0 können zum Beispiel mit den Parametern,
die hier beschrieben werden, verwendet werden, um Prozent Sequenzidentität für die Polynucleotide
und Polypeptide von Nutzen bei der Erfindung zu bestimmen. Die Software
für die
Durchführung
von BLAST-Analysen
ist öffentlich
durch das National Center for Biotechnology Information erhältlich.
Bei einem veranschaulichenden Beispiel können kumulative Punktzahlen
für Nucleotidsequenzen
unter Verwendung der Parameter M (Belohnungspunktzahl für ein Paar
von passenden Resten; immer > 0)
und N (Strafpunktzahl für
nicht passende Reste; immer < 0)
berechnet werden. Für
Aminosäuresequenzen
kann eine Bewertungsmatrix verwendet werden, um die kumulative Punktzahl
zu berechnen. Die Ausweitung der Worttreffer in jeder Richtung wird
aufgehalten, wenn: die kumulative Ausrichtungspunktzahl um mehr
als die Menge X von dem maximal erreichten Wert abfällt; die
kumulative Punktzahl aufgrund der Anhäufung von ein oder mehreren
negativ bewerteten Restausrichtungen 0 oder weniger erreicht; oder
das Ende von einer Sequenz erreicht wird. Die BLAST-Algorithmus-Parameter
W, T und X bestimmen die Sensitivität und die Geschwindigkeit der
Ausrichtung. Das BLASTN-Programm (für Nucleotidsequenzen) verwendet
als Voreinstellungen eine Wortlänge
(W) von 11 und Erwartung (E) von 10 und die BLOSUM62-Bewertungsmatrix
(siehe Henikoff and Henikoff (1989) Proc. Natl. Acad. Sci. USA 89: 10915)
Ausrichtungen, (B) von 50, Erwartung (E) von 10, M = 5, N = –4 und einen
Vergleich beider Stränge.
-
Vorzugsweise
wird der „Prozentsatz
an Sequenzidentität" durch Vergleich
von zwei optimal ausgerichteten Sequenzen über ein Vergleichsfenster von
mindestens 20 Positionen bestimmt, wobei der Teil der Polynucleotid-
oder Polypeptidsequenz in dem Vergleichsfenster Additionen oder
Deletionen (sprich Lücken)
von 20% oder weniger, normalerweise 5 bis 15% oder 10 bis 12% im
Vergleich mit den Referenzsequenzen (die keine Additionen oder Deletionen
umfassen) für
die optimale Ausrichtung der zwei Sequenzen umfassen können. Der
Prozentsatz wird durch Bestimmung der Anzahl von Positionen, an
denen die identischen Nucleinsäurebasen
oder Aminosäurereste
in beiden Sequenzen auftreten, um die Anzahl von passenden Positionen zu
ergeben, Division der Anzahl von passenden Positionen durch die
Gesamtanzahl von Positionen in der Referenzsequenz (sprich der Fenstergröße) und
Multiplikation der Ergebnisse mit 100, um den Prozentsatz an Sequenzidentität zu ergeben,
berechnet.
-
Demnach
verwendet die vorliegende Erfindung Polynucleotid- und Polypeptidsequenzen
mit substantieller Identität
zu den Sequenzen, die hier offenbart werden, sprich diejenigen,
die eine mindestens 90%ige, 95%ige, 96%ige, 97%ige, 98%ige oder
99%ige oder höhere
Sequenzidentität
im Vergleich mit einer Polynucleotid- oder Polypeptidsequenz von
Nutzen bei dieser Erfindung umfassen, wobei die Verfahren verwendet werden,
die hier beschrieben werden (z. B. BLAST-Analyse unter Verwendung
von Standardparametern, wie unten beschrieben wird). Ein Fachmann
auf diesem Gebiet wird erkennen, dass diese Werte geeignet eingestellt
werden können,
um korrespondierende Identität
von Proteinen, die durch zwei Nucleotidsequenzen kodiert werden,
durch Berücksichtigung
von Codon-Degeneration, Aminosäure-Ähnlichkeit, Leserahmen-Positionierung
und dergleichen zu bestimmen.
-
Bei
zusätzlichen
Ausführungsarten
verwendet die vorliegende Erfindung isolierte Polynucleotide und Polypeptide,
die verschiedene Längen
von fortlaufenden Strecken von Sequenz umfassen, die identisch oder komplementär zu einer
oder mehreren der Sequenzen, die hier offenbart werden, sind. Zum
Beispiel werden durch diese Erfindung Polynucleotide bereitgestellt,
die mindestens 50, 75, 100, 150, 200, 300, 400, 500 oder 1.000 oder
mehr fortlaufende Nucleotide von einer oder mehreren der Sequenzen,
die hier offenbart werden, wie auch alle mittleren Längen, die
dazwischen liegen, umfassen. Es wird einfach verstanden werden,
dass „mittlere
Längen" in diesem Zusammenhang
irgendeine Länge
zwischen den aufgeführten
Werten bedeuten, wie 50, 51, 52, 53 etc.; 100, 101, 102, 103 etc.;
150, 151, 152, 153 etc.; einschließlich aller ganzen Zahlen von 200–500; 500–1.000 und
dergleichen.
-
Die
Polynucleotide von Nutzen bei der vorliegenden Erfindung oder Fragmente
davon, unabhängig von
der Länge
der codierenden Sequenz selbst, können mit anderen DNA-Sequenzen,
wie Promotoren, Polyadenylierungssignalen, zusätzlichen Restriktionsenzymorten,
multiplen Klonierungsorten oder Codierungssegmenten und dergleichen
verbunden werden, so dass ihre Gesamtlänge beträchtlich varriieren kann. Es wird
daher überlegt,
dass ein Nucleinsäurefragment
von fast jeder Länge
verwendet werden kann, wobei die Gesamtlänge vorzugsweise durch die
Einfachheit der Herstellung und Verwendung bei dem beabsichtigten
rekombinanten DNA-Protokoll limitiert ist. Zum Beispiel werden veranschaulichende
DNA-Segmente mit Gesamtlänge
von ungefähr
10.000, ungefähr
5.000, ungefähr
3.000, ungefähr
2.000, ungefähr
1.000, ungefähr 500,
ungefähr
200, ungefähr
100, ungefähr
50 Basenpaaren in Länge
und dergleichen (einschließlich
allen mittleren Längen)
als nützlich
bei vielen Anwendungen dieser Erfindung überlegt.
-
Kleine
Polynucleotidsegmente oder Fragmente können einfach durch z. B. direktes
Synthetisieren des Fragmentes durch chemische Mittel, wie es gewöhnlich unter
Verwendung eines automatisierten Oligonucleotid-Synthetisierers
ausgeübt
wird, hergestellt werden. Fragmente können auch durch Anwendung von
Nucleinsäure-Reproduktionstechnologien,
wie der PCR
TM-Technologie von
U.S. Patent 4,683,202 , durch Einführung ausgewählter Sequenzen
in rekombinante Vektoren für
rekombinante Produktion und durch rekombinante DNA-Techniken, die
im Allgemeinen denjenigen mit Bewanderung auf dem Gebiet der Molekularbiologie
bekannt sind, erhalten werden.
-
Polynucleotid-Identifizierung
und -Charakterisierung
-
Polynucleotide
können
durch irgendeine einer Vielzahl von gut eingeführten Techniken identifziert, hergestellt
und/oder manipuliert werden. Zum Beispiel kann ein Polynucleotid
durch Screening eines Mikroarrays von cDNAs auf Chlamydia-Expression identifiziert
werden. Solche Screenings können
z. B. unter Verwendung eines Synteni Microarrays (Palo Alto, CA)
gemäß den Anweisungen
des Herstellers (und im Wesentlichen wie durch Schena et al., Proc.
Natl. Acad. Sci. USA 93: 10614–10619,
1996 und Heller et al., Proc. Natl. Acad. Sci. USA 94: 2150–2155, 1997
beschrieben wird) durchgeführt
werden. Alternativ können
Polynucleotide aus cDNA amplifiziert werden, die aus Zellen hergestellt
wurde, die die Proteine, die hier beschrieben werden, exprimieren.
Solche Polynucleotide können über Polymerase-Kettenreaktion
(PCR) amplifiziert werden. Für
diesen Ansatz können
Sequenzspezifische Primer, basierend auf den Sequenzen, die hier
bereitgestellt werden, designed werden, und sie können erworben
oder synthetisiert werden.
-
Ein
amplifizierter Teil eines Polynucleotids von Nutzen bei der vorliegenden
Erfindung kann verwendet werden, um ein Gen in vollständiger Länge von
einer geeigneten Bibliothek (z. B. Chlamydia-cDNA-Bibliothek) unter
Verwendung von gut bekannten Techniken zu isolieren. Bei solchen
Techniken wird eine Bibliothek (cDNA oder genomisch) unter Verwendung
von einer oder mehreren Polynucleotidsonden oder Primern, die für die Amplifizierung
geeignet sind, gescreent. Vorzugsweise wird eine Bibliothek so größenselektiert,
dass sie größere Moleküle beinhaltet.
Random-primed Bibliotheken können
auch für
die Identifizierung von 5'-
und Stromaufwärts-Regionen
von Genen bevorzugt werden. Genomische Bibliotheken werden für den Erhalt
von Introns und verlängerten
5'-Sequenzen bevorzugt.
-
Für Hybridierunstechniken
kann eine partielle Sequenz unter Verwendung von gut bekannten Techniken
markiert werden (z. B. durch Nick-Translation oder Endmarkierung
mit 32P). Eine bakterielle oder Bakteriophagen-Bibliothek
wird dann im Allgemeinen durch Hybridisierungsfilter, die denaturierte
bakterielle Kolonien (oder Rasen, die Phagen-Plaques enthalten)
enthalten, mit der markierten Sonde gescreent (siehe Sambrook et
al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor
Laboratories, Cold Spring Harbor, NY, 1989). Hybridisierende Kolonien
oder Plaques werden ausgewählt
und expandiert und die DNA wird für die weitere Analyse isoliert.
cDNA-Klone können
analysiert werden, um die Menge von zusätzlicher Sequenz durch z. B.
PCR unter Verwendung eines Primers für die partielle Sequenz und
eines Primers für
den Vektor bestimmt werden. Restriktionskarten und partielle Sequenzen
können
erzeugt werden, um einen oder mehrere überlappende Klone zu identifizieren.
Die vollständige
Sequenz kann unter Verwendung von Standardtechniken bestimmt werden,
die die Erzeugung einer Reihe von Deletionsklonen involvieren können. Die
resultierenden überlappenden
Sequenzen können
dann zu einer einzelnen fortlaufenden Sequenz zusammengefügt werden.
Ein cDNA-Moleküls
vollständiger
Länge kann
durch Verbindung von geeigneten Fragmenten unter Verwendung von
gut bekannten Techniken erzeugt werden.
-
Alternativ
gibt es zahlreiche Amplifikationstechniken für den Erhalt einer Codierungssequenz
in voller Länge
aus einer partiellen cDNA-Sequenz. Bei solchen Techniken wird die
Amplifikation im Allgemeinen über PCR
durchgeführt.
Es kann irgendeines einer Vielzahl von kommerziell erhältlichen
Kits verwendet werden, um den Amplifikationsschritt durchzuführen. Primer
können
z. B. unter Verwendung von Software, die auf dem Fachgebiet gut
bekannt ist, designed werden. Primer sind vorzugsweise 22–30 Nucleotide
lang, weisen einen GC-Gehalt von mindestens 50% auf und binden sich
an die Zielsequenz bei Temperaturen von ungefähr 68°C bis 72°C. Die amplifizierte Region
kann wie oben beschrieben sequenziert und überlappende Sequenzen können zu
einer fortlaufenden Sequenz zusammengefügt werden.
-
Eine
solche Amplifikationstechnik ist inverse PCR (siehe Triglia et al.,
Nucl. Acids Res. 16: 8186, 1988), die Restriktionsenzyme verwendet,
um ein Fragment in der bekannten Region des Gens zu erzeugen. Das
Fragment wird dann durch intramolekulare Ligation zirkularisiert
und auf eine Matrize für
PCR mit divergenten Primern, die aus der bekannten Region stammen,
verwendet. Bei einem alternativen Ansatz können Sequenzen, die zu einer
partiellen Sequenz benachbart liegen, durch Amplifikation mit einem
Primer zu einer Linkersequenz und einem Primer, der für eine bekannte
Region spezifisch ist, gewonnen werden. Die amplifizierten Sequenzen
werden typischerweise einer zweiten Runde der Amplifikation mit
demselben Linker-Primer und einem zweiten Primer, der für die bekannte
Region spezifisch ist, unterworfen. Eine Variation von dieser Vorgehensweise,
die zwei Primer verwendet, die die Extension in verschiedene Richtungen
von der bekannten Sequenz initiieren, wird in
WO 96/38591 beschrieben. Eine andere
solche Technik ist als eine „schnelle
Amplifikation von cDNA-Enden" oder
RACE bekannt. Diese Technik involviert die Verwendung eines inneren
Primers und eines äußeren Primers,
der mit einer polyA-Region oder Vektorsequenz hybridisiert, um Sequenzen zu
identifizieren, die 5' und
3' einer bekannten
Sequenz liegen. Zusätzliche
Techniken beinhalten Capture-PCR (Lagerstrom et al., PCR Methods
Applic. 1: 111–19,
1991) und Walking-PCR (Parker et al., Nucl. Acids. Res. 19: 3055–60, 1991).
Andere Verfahren, die Amplifikation verwenden, können auch verwendet werden,
um eine cDNA-Sequenz in voller Länge
zu erhalten.
-
Unter
bestimmten Umständen
ist es möglich,
eine cDNA-Sequenz voller Länge
durch Analyse von Sequenzen, die in einer Expressed Sequenz Tag(EST)-Datenbank,
wie derjenigen, die von GenBank erhältlich ist, bereitgestellt
werden, zu erhalten. Die Suche nach überlappenden ESTs kann im Allgemeinen
unter Verwendung von gut bekannten Programmen (z. B. NCBI BALST-Suchen)
durchgeführt
werden und solche ESTs können
verwendet werden, um eine fortlaufende Sequenz vollständiger Länge zu erzeugen.
DNA-Sequenzen vollständiger
Länge können auch
durch Analyse von Genomfragmenten erhalten werden.
-
Polynucleotidexpression in
Wirtszellen
-
Polynucleotidsequenzen
oder Fragmente davon, die Polypeptide von Nutzen bei der Erfindung
kodieren, oder Fusionsproteine oder funktionelle Äquivalente
davon, können
in rekombinanten DNA-Molekülen
verwendet werden, um die Expression eines Polypeptids in geeigneten
Wirtszellen zu lenken. Aufgrund der innewohnenden Degeneration des
genetischen Codes können
andere DNA-Sequenzen, die im Wesentlichen dieselbe oder eine funktionell äquivalente
Aminosäuresequenz
codieren, hergestellt werden, und diese Sequenzen können verwendet
werden, um ein gegebenes Polypeptid zu klonieren und zu exprimieren.
-
Es
wird von Fachleuten auf dem Gebiet verstanden werden, dass es in
einigen Fällen
vorteilhaft sein kann, Polypeptid codierende Nucleotidsequenzen,
die nicht natürlich
auftretende Codons besitzen, herzustellen. Zum Beispiel können Codons,
die von einem bestimmten prokaryoten oder eukaryoten Wirt bevorzugt
werden, ausgewählt
werden, um die Rate an Proteinexpression zu steigern oder ein rekombinantes
RNA-Transkript mit erwünschten
Eigenschaften, wie einer Halbwertszeit, die länger ist, als diejenige eines
Transkriptes, das aus der natürlich
auftretenden Sequenz erzeugt wurde, herzustellen.
-
Darüber hinaus
können
die Polynucleotidsequenzen von Nutzen bei der vorliegenden Erfindung
unter Verwendung von Verfahren, die auf dem Fachgebiet gut bekannt
sind, gentechnisch verändert
werden, um Polypeptid-codierende Sequenzen aus einer Vielzahl von
Gründen
zu verändern,
einschließlich,
aber nicht beschränkt
auf Änderungen,
die die Klonierung, die Weiterverarbeitung und/oder Expression des
Genproduktes modifizieren. Zum Beispiel kann DNA-Neukombination durch zufällige Fragmentierung
und PCR-Neuzusammenbau
von Genfragmenten und synthetischen Oligonucleotiden verwendet werden,
um die Nucleotidsequenzen gentechnisch zu verändern. Zusätzlich kann ortsgerichtete
Mutagenese verwendet werden, um neue Restriktionsorte einzuführen, Glycosilierungsmuster
zu verändern,
Kodon-Präferenz zu ändern, Splicevarianten herzustellen
oder Mutationen einzuführen
usw.
-
Bei
einer anderen Ausführungsart
der Erfindung können
natürliche,
modifizierte oder rekombinante Nucleinsäuresequenzen an eine heterologe
Sequenz ligiert werden, um ein Fusionsprotein zu codieren. Ein Fusionsprotein
kann auch gentechnisch hergestellt werden, um einen Spaltungsort
zu entfalten, der zwischen der Polypeptid codierenden Sequenz und
der heterologen Proteinsequenz liegt, so dass das Polypeptid gespalten
und von dem heterologen Rest weg gereinigt werden kann.
-
Sequenzen,
die ein erwünschtes
Polypeptid codieren, können
im Ganzen oder teilweise unter Verwendung von chemischen Verfahren,
die auf dem Fachgebiet gut bekannt sind (siehe Caruthers, M. H.
et al. (1980) Nucl. Acids Res. Symp. Ser. 215–223, Horn, T. et al. (1980)
Nucl. Acids Res. Symp. Ser. 225–232),
synthetisiert werden. Alternativ kann das Protein selbst unter Verwendung
von chemischen Verfahren hergestellt werden, um die Aminosäuresequenz
eines Polypeptids oder eines Teils davon zu synthetisieren. Zum
Beispiel kann Peptidsynthese unter Verwendung von verschiedenen
Festphasen-Techniken
(Roberge, J. Y. et al. (1995) Science 269: 202–204) durchgeführt werden
und automatisierte Synthese kann z. B. unter Verwendung des ABI431A
Peptidsynthetisierers (Perkin Elmer, Palo Alto, CA) erreicht werden.
-
Ein
neu synthetisiertes Peptid kann im Wesentlichen durch präparative
Hochleistungs-Flüssig-Chromatographie
(z. B. Creighton, Tl. (1983) Proteins, Structures and Molecular
Principles, SH Freeman and Co., New York, N. Y.) oder andere vergleichbare
Techniken, die auf dem Fachgebiet erhältlich sind, gereinigt werden.
Die Zusammensetzung der synthetischen Peptide kann durch Aminosäureanalyse
oder Sequenzierung (z. B. das Edman Abbau-Verfahren) bestätigt werden.
Zusätzlich
kann die Aminosäuresequenz
eines Polypeptids oder irgendeines Teiles davon unter Verwendung
von direkter Synthese verändert
und/oder Verwendung von chemischen Verfahren mit Sequenzen von anderen
Proteinen oder irgendeinem Teil davon kombiniert werden, um ein
variantes Polypeptid herzustellen.
-
Um
ein erwünschtes
Polypeptid zu exprimieren, können
die Nucleotidsequenzen, die das Polypeptid codieren, oder funktionelle Äquivalente,
in einen geeigneten Expressionsvektor, sprich einen Vektor, der
die notwendigen Elemente für
die Transkription und Translation der inserierten Codierungssequenz
enthält,
inseriert werden. Es können
Verfahren, die denjenigen mit Bewanderung auf dem Fachgebiet gut
bekannt sind, verwendet werden, um Expressionsvektoren zu konstruieren,
die Sequenzen, die ein Polypeptid von Interesse codieren, und geeignete
Transkriptions- und Translations-Kontrollelemente enthalten.
-
Diese
Verfahren beinhalten in vitro rekombinante DNA-Techniken, synthetische Techniken und
in vivo genetische Rekombination. Solche Techniken werden in Sambrook,
J. et al (1989) Molecular Cloning, A Laboratory Manual, Cold Spring
Harbor Press, Plainview, N. Y., und Ausubel, F. M. et al. (1989)
Current Protocols in Molecular Biology, John Wiley & Sons, New York,
N. Y., beschrieben.
-
Es
kann eine Vielzahl von Epressionsvektor/Wirtssystemen verwendet
werden, um Polynucleotidsequenzen zu enthalten und zu exprimieren.
Diese beinhalten, sind aber nicht limitiert auf, Mikroorganismen,
wie Bakterien, die mit rekombinanten Bakteriophagen, Plasmid, oder
Cosmid-DNA-Expressionsvektoren transformiert wurden; Hefen, die
mit Hefe-Expressionsvektoren transformiert wurden; Insektenzellsysteme,
die mit Virus-Expressionsvektoren
(z. B. Baculovirus) infiziert wurden; Pflanzenzellsysteme, die mit
Virus-Expressionsvektoren (z. B. Blumenkohl-Mosaikvirus, CaMV; Tabak-Mosaikvirus,
TMV) oder mit bakteriellen Expressionsvektoren (z. B. Ti- oder pBR322-Plasmiden) transformiert
wurden oder Tierzellsysteme.
-
Die „Kontrollelemente" oder „regulatorischen
Sequenzen", die
in einem Expressionsvektor vorliegen, sind diejenigen nicht translatierten
Regionen der Vektorverstärker,
Promotoren, 5' und
3' untranslatierten
Regionen, die mit Wirts-zellulären
Proteinen in Wechselwirkung treten, um Transkription und Translation
auszuführen.
Solche Elemente können
in ihrer Stärke
und Spezifität
variieren. Abhängig
von dem Vektorsystem und dem Wirt, der verwendet wird, kann jedwede
Anzahl von geeigneten Transkriptions- und Translationselementen,
einschließlich
konstitutiven und induzierbaren Promotoren, verwendet werden. Wenn
in bakteriellen Systemen kloniert wird, können z. B. induzierbare Promotoren,
wie der Hybrid lacZ-Promotor von dem pBluescript Phagemid (Stratagene,
La Jolla, Calif.) oder PSPORT1-Plasmid (Gibco BRL, Gaithersburg,
MD) und dergleichen verwendet werden. In Säugerzellsystemen werden im
Allgemeinen Promotoren für
Säugergene
oder von Säugerviren
bevorzugt. Wenn es notwendig ist, eine Zelllinie zu erzeugen, die
zahlreiche Kopien der Sequenz, die ein Polypeptid codiert, enthält, können Vektoren,
die auf SV40 oder EBV basieren, vorteilhaft mit einem geeigneten
selektierbaren Marker verwendet werden.
-
In
Bakteriensystemen kann eine Anzahl von Expressionsvektoren abhängig von
der Verwendung, die für
das exprimierte Polypeptid vorgesehen ist, ausgewählt werden.
Wenn große
Mengen benötigt
werden, können
z. B. Vektoren verwendet werden, die hochgradige Expresssion von
Fusionsproteinen, die einfach gereinigt werden können, lenken. Solche Vektoren
beinhalten, sind aber nicht begrenzt auf die multifunktionellen
E. coli Klonierungs- und Expressionsvektoren, wie Bluescript (Stratagene),
in denen die Sequenz, die das Polypeptid von Interesse codiert,
in den Vektor im Rahmen mit Sequenzen für das Amino-terminale Met und
die darauf folgenden 7 Reste von beta-Galactosidase ligiert ist,
so dass ein Hybridprotein hergestellt wird; pIN-Vektoren (Van Heeke, G. und S. M. Schuster
(1989), J. Biol. Chem. 264: 5503–5509) und dergleichen. Es können auch
pGEX-Vektoren (Promega,
Madison, Wis.) verwendet werden, um fremde Polypeptide wie Fusionsproteine
mit Glutathion-S-Transferase (GST) zu exprimieren. Im Allgemeinen
sind solche Fusionsproteine löslich
und können
einfach aus lysierten Zellen durch Adsorption an Glutathion-Agarosekügelchen,
gefolgt von Elution in der Gegenwart von freiem Glutathion gereinigt
werden. Proteine, die in solchen Systemen hergestellt werden, können so
entwickelt werden, dass sie Heparin-, Thrombin- oder Faktor-XA-Protease
Spaltungsorte enthalten, so dass das geklonte Polypeptid von Interesse
aus dem GST-Rest nach eigenem Willen freigesetzt werden kann. Bei
der Hefe, Saccharomyces cerevisiae, kann eine Anzahl von Vektoren,
die konstitutive oder induzierbare Promotoren, wie alpha-Faktor,
Alkoholoxidase und PGH enthalten, verwendet werden. Für Überblicke
siehe Ausubel et al. (supra) und Grant et al. (1987) Methods Enzymol.
153: 516–544.
-
In
Fällen,
bei denen Pflanzen-Expressionsvektoren verwendet werden, kann die
Expression von Sequenzen, die Polypeptide codieren, durch irgendeinen
einer Anzahl von Promotoren getrieben werden. Zum Beispiel können virale
Promotoren, wie die 35S- und 19S-Promotoren von CaMV, allein oder
in Kombination mit der Omega-Leader-Sequenz von TMV (Takamatsu,
N. (1987) EMBO J. 6: 307–311)
verwendet werden. Alternativ können
Pflanzen-Promotoren, wie die kleine Untereinheit von RUBISCO, oder
Hitzeschock-Promotoren verwendet werden (Coruzzi, G. et al. (1984)
EMBO J. 3: 1671–1680;
Broglie, R. et al. (1984) Science 224: 838–843; und Winter, J. et al.
(1991) Results Probl. Cell Differ. 17: 85–105). Diese Konstrukte können in
Pflanzenzellen durch direkte DNA-Transformation
oder pathogen vermittelte Transfektion eingeführt werden. Solche Techniken
werden in einer Anzahl von allgemein erhältlichen Überblicken beschrieben (siehe
z. B. Hobbs, S. oder Murry, L. E. in McGraw Hill Yearbook of Science
and Technology (1992) McGraw Hill, New York, N. Y.; S. 191–196).
-
Es
kann auch ein Insektensystem verwendet werden, um ein Polypeptid
von Interesse zu exprimieren. In einem solchen System wird z. B.
Autographa californica nukleäres
Polyhedrosis-Virus (AcNPV) als ein Vektor verwendet, um fremde Gene
in Spodoptera frugiperda-Zellen oder in Trichoplusia-Larven zu exprimieren. Die
Sequenzen, die die Polypeptide codieren, können in eine nicht essentielle
Region des Virus, wie das Polyhedrin-Gen, kloniert und unter die
Kontrolle des Polyhedrin-Promotors gestellt werden. Die erfolgreiche
Insertion der Polypeptid codierenden Sequenz wird das Polyhedrin-Gen
inaktiv machen und rekombinanten Virus, dem an Hüllprotein fehlt, produzieren.
Die rekombinanten Viren können
dann verwendet werden, um z. B. S. frugiperda-Zellen oder Trichoplusia-Larven
zu infizieren, in denen das Polypeptid von Interesse exprimiert werden
kann (Engelhard, E. K. et al. (1994) Proc. Natl. Acad. Sci. 91:
3224–3227).
-
Bei
Säuger-Wirtszellen
ist allgemein eine Anzahl von viral basierten Expressionssystemen
erhältlich. In
Fällen,
bei denen ein Adenovirus als ein Expressionsvektor verwendet wird,
können
z. B. Sequenzen, die ein Polypeptid von Interesse kodieren, in einen
Adenovirus-Transkriptions-/Translationskomplex,
der aus dem späten
Promotor und der dreiteiligen Leadersequenz besteht, ligiert werden.
Insertion in eine nicht essentielle E1- oder E3-Region des Virusgenoms
kann verwendet werden, um ein lebensfähiges Virus zu erhalten, das
in der Lage ist, das Polypeptid in infizierten Wirtszellen zu exprimieren
(Logan, J. und Shenk, T. (1984) Proc. Natl. Acad. Set 81: 3655–3659).
Zusätzlich
können
Transkriptionsverstärker,
wie der Rous-Sarcom-Virus(RSV)-Verstärker, verwendet
werden, um die Expression in Säuger-Wirtszellen
zu steigern.
-
Es
können
auch spezifische Startsignale verwendet werden, um eine effizientere
Translation von Sequenzen, die ein Polypeptid von Interesse codieren,
zu erreichen. Solche Signale beinhalten das ATG-Startkodon und benachbarte
Sequenzen. In Fällen,
in denen Sequenzen, die das Polypeptid, sein Startkodon und Stromaufwärts-Sequenzen
codieren, in den geeigneten Expressionsvektor inseriert werden,
könnten
keine zusätzlichen
Transkriptions- oder Translations-Kontrollsignale benötigt werden. In den Fällen jedoch,
in denen nur die Codierungssequenz oder ein Teil davon inseriert
wird, sollten exogene Translations-Kontrollsignale, einschließlich dem
ATG-Startkodon, bereitgestellt werden. Darüber hinaus sollte das Startkodon
in dem korrekten Leserahmen vorliegen, um die Translation des gesamten
Inserts zu sichern. Exogene Translationselemente und Startkodons
können
aus verschiedenen Ursprüngen,
sowohl natürlich
wie auch synthetisch, stammen. Die Effizienz der Expression kann durch
Einschluss von Verstärkern,
die für
das spezielle Zellsystem, das verwendet wird, geeignet sind, wie
diejenigen, die in der Literatur beschrieben werden (Scharf, D.
et al. (1994) Results Probl. Cell Differ. 20: 125–162), gesteigert
werden.
-
Zusätzlich kann
ein Wirtszell-Stamm wegen seiner Fähigkeit, die Expression der
inserierten Sequenzen zu modulieren oder das exprimierte Protein
auf die erwünschte
Weise weiter zu verarbeiten, ausgewählt werden. Solche Modifikationen
des Polypeptids beinhalten, sind aber nicht beschränkt auf,
Acetylierung, Carboxylierung, Glycosilierung, Phosphorylierung,
Lipidierung und Acylierung. Posttranslationelle Weiterverarbeitung,
die eine „Präpro"-Form des Proteins
spaltet, kann auch verwendet werden, um die korrekte Insertion,
Faltung und/oder Funktion zu erleichtern. Verschiedene Wirtszellen,
wie CHO, HeLa, MDCK, HEK293 und WI38, die eine spezifische zelluläre Maschinerie
und charakteristische Mechanismen für solche posttranslationellen Aktivitäten aufweisen,
können
ausgewählt
werden, um die korrekte Modifikation und Weiterverarbeitung des fremden
Proteins zu sichern.
-
Für lang dauernde,
ertragreiche Produktion von rekombinanten Proteinen wird stabile
Expression im Allgemeinen bevorzugt. Zum Beispiel können Zelllinien,
die ein Polynucleotid von Interesse stabil exprimieren, unter Verwendung
von Expressionsvektoren, die virale Replikationsursprünge und/oder
endogene Expressionselemente enthalten können, und eines selektierbaren
Markergens auf dem gleichen oder einem anderen Vektor transformiert
werden. Nach der Einführung
des Vektors lässt
man die Zellen für
ein bis zwei Tage in einem angereicherten Medium wachsen, bevor
sie auf selektives Medium übertragen
werden. Der Zweck des selektierbaren Markers ist es, Resistenz gegenüber Selektion
zu verleihen und seine Gegenwart erlaubt das Wachstum und die Erholung
von Zellen, die die eingeführten
Sequenzen erfolgreich exprimieren. Resistente Klone von stabil transformierten
Zellen können
unter Verwendung von Gewebekulturtechniken, die für den Zelltyp
geeignet sind, vermehrt werden.
-
Jede
Anzahl von Selektionssystemen kann verwendet werden, um transformierte
Zelllinien zu gewinnen. Diese beinhalten, sind aber nicht begrenzt
auf Herpes-simplex-Virus-Thymidinkinase- (Wigler, M. et al. (1977)
Cell 11: 223–32)
und Adeninphosphoribosyltransferase(Lowy, I. et al. (1990) Cell
22: 817–23)-Gene,
die in tk.sup.- bzw. aprt.sup.-Zellen verwendet werden können. Auch
kann Antimetabolit-, Antibiotika- oder Herbizidresistenz als die
Basis für
die Selektion verwendet werden; zum Beispiel dhfr, das Resistenz
gegenüber
Methotrexat verleiht (Wigler, M et al. (1980) Proc. Natl. Acad.
Set 77: 3567–70);
npt, das Resistenz gegenüber Aminoglysosiden,
Neomycin und G-418 verleiht (Colbere-Garapin, F. et al. (1981) J. Mol. Biol.
150: 1–14)
und als oder pat, die Resistenz gegenüber Chlorsulfuron bzw. Phosphinotricinacetyltransferase
verleihen (Murry, supra). Es wurden zusätzlich selektierbare Gene beschrieben,
z. B. trpB, welches Zellen ermöglicht,
Indol anstelle von Tryptophan zu verwerten, oder hisD, welches Zellen
ermöglicht,
Histinol anstelle von Histidin zu verwerten (Hartman, S. C. und
R. C. Mulligan (1988) Proc. Natl. Acad. Sci. 85: 8047–51). In
letzter Zeit hat die Verwendung von sichtbaren Markern Popularität mit solchen
Markern wie Anthocyaninen, beta-Glucuronidase und
seinem Substrat GUS und Luciferase und seinem Substrat Luciferin
gewonnen, welche breit angewendet werden, nicht nur um Transformanden
zu identifizieren, sondern auch, um die Menge an transienter oder
stabiler Proteinexpression, die einem spezifischen Vektorsystem
zuzuschreiben ist, zu quantifizieren (Rhodes, C. A. et al. (1995)
Methods Mol. Biol. 55: 121–131).
-
Obwohl
die Gegenwart/Abwesenheit von Markergenexpression nahelegt, dass
das Gen von Interesse auch vorliegt, könnte es nötig sein, seine Gegenwart und
Expression zu bestätigen.
-
Wenn
die Sequenz, die ein Polypeptid codiert, in eine Markergensequenz
inseriert wird, können
z. B. rekombinante Zellen, die Sequenzen enthalten, durch die Abwesenheit
von Markergenfunktion identifiziert werden. Alternativ kann ein
Markergen in Tandem mit einer Polypeptid-codierenden Sequenz unter
die Kontrolle eines einzelnen Promotors gestellt werden. Die Expression
des Markergens in Antwort auf die Induktion oder Selektion weist
normalerweise auch auf die Expression des Tandemgens hin.
-
Alternativ
können
Wirtszellen, die eine erwünschte
Polynucleotidsequenz enthalten und exprimieren, durch eine Vielzahl
von Verfahren, die demjenigen mit Bewanderung auf dem Fachgebiet
bekannt sind, identifiziert werden. Diese Verfahren beinhalten,
sind aber nicht begrenzt auf, DNA-DNA- oder DNA-RNA-Hybridisierungen und Protein-Bioassay-
oder Immunassay-Techniken, die Membran, Lösungs- oder Chipbasierte Technologien
für den
Nachweis und/oder die Quantifizierung von Nucleinsäure oder
Protein beinhalten.
-
Es
sind eine Vielzahl von Protokollen für den Nachweis und die Messung
der Expression von Polynucleotid-codierten Produkten unter Verwendung
von entweder polyklonalen oder monoklonalen Antikörpern, die für das Produkt
spezifisch sind, auf dem Fachgebiet bekannt. Beispiele beinhalten
Enzyme-linked Immunosorbent Assay (ELISA), Radioimmunoassay (RIA)
und Fluoreszenz-aktivierte Zellsortierung (FACS). Ein zweiseitiger,
monoklonal basierter Immunoassay, der monoklonale Antikörper verwendet,
die gegen zwei nicht interferierende Epitope auf einem gegebenen
Polypeptid reagieren, kann für
einige Anwendungen bevorzugt werden, aber ein kompetitiver Bindungsassay
kann auch verwendet werden. Diese und andere Assays werden unter
anderen in Hampton, R. et al. (1990; Serological Methods, a Laboratory
Manual, APS Press, St. Paul. Minn.) und Maddox, D. E. et al. (1983;
J. Exp. Med. 158: 1211–1216)
beschrieben.
-
Eine
große
Bandbreite an Markern und Konjugationstechniken sind denjenigen,
die auf dem Fachgebiet bewandert sind, bekannt und können in
verschiedenen Nucleinsäure-
und Amionsäure-Assays
verwendet werden. Mittel zur Herstellung von markierten Hybridisierungs-
oder PCR-Sonden zum Nachweis von Sequenzen, die mit Polynucleotiden
verwandt sind, beinhalten Oligolabeling, Nicktranslation und Endmarkierung
oder PCR-Amplifikation unter Verwendung eines markierten Nucleotids.
Alternativ können
die Sequenzen oder irgendwelche Teile davon in einen Vektor für die Produktion
einer mRNA-Sonde
kloniert werden. Solche Vektoren sind auf dem Fachgebiet bekannt,
sind kommerziell erhältlich
und können
verwendet werden, um RNA-Sonden in vitro durch Zugabe einer geeigneten
RNA-Polymerase, wie T7, T3 oder SP6, und markierten Nucleotiden
zu synthetisieren. Diese Verfahren können unter Verwendung einer
Vielzahl von kommerziell erhältlichen
Kits durchgeführt
werden. Geeignete Reportermoleküle
oder Marker, die verwendet werden können, beinhalten Radionuclide,
Enzyme, fluoreszierende, chemilumineszente oder chromogene Wirkstoffe,
wie auch Substrate, Cofaktoren, Inhibitoren, magnetische Teilchen
und dergleichen.
-
Wirtszellen,
die mit einer Polynucleotidsequenz von Interesse transformiert werden,
können
unter Bedingungen, die für
die Expression und Gewinnung des Proteins aus der Zellkultur geeignet
sind, kultiviert werden. Das Protein, das durch eine rekombinante
Zelle hergestellt wird, kann sezerniert oder intrazellulär behalten
werden, abhängig
von der Sequenz und/oder dem Vektor, die/der verwendet wird. Wie
von denjenigen mit Bewanderung auf dem Fachgebiet verstanden werden
wird, können
Expressionsvektoren, die Polynucleotide enthalten, so entwickelt
werden, dass sie Signalsequenzen enthalten, die die Sezernierung
des codierten Polypeptids durch eine prokaryote oder eukaryote Zellmembran
steuern. Andere rekombinante Konstruktionen können verwendet werden, um Sequenzen,
die ein Polypeptid von Interesse kodieren, mit Nucleotidsequenzen,
die eine Polypeptiddomäne
codieren, die die Reinigung von löslichen Proteinen erleichtern
wird, zu verbinden. Solche die Reinigung erleichternden Domänen beinhalten,
sind aber nicht begrenzt auf, Metallchelat-bildende Peptide, wie Histidme-Tryptophan-Module,
die die Reinigung auf immobilisierten Metallen ermöglichen,
Protein-A-Domänen, die
die Reinigung auf immobilisierten Immunglobulin ermöglichen
und die Domäne,
die in dem FLAGS Extensions-/Affinitätsreinigungssystem (Immunex
Corp., Seattle, Wash.) verwendet wird. Der Einschluss von spaltbaren
Linkersequenzen, wie diejenigen, die für Faktor XA oder Enterokinase
(Invitrogen, San Diego, Calif.) spezifisch sind, zwischen der Reinigungsdomäne und dem
codierten Polypeptid kann verwendet werden, um die Reinigung zu
erleichtern. Ein solcher Expressionsvektor sorgt für die Expression
eines Fusionsproteins, das ein Polypeptid von Interesse und eine
Nucleinsäure,
die 6 Histidinreste, die einem Thioredoxin oder einem Enterokinase-Spaltungsort
vorangehen, codiert, enthält.
Die Histidinreste erleichtern die Reinigung auf IMIAC (immobilisierte
Metallionen-Affinitäts-Chromatographie),
wie in Porath, J. et al. (1992, Prot. Exp. Purif. 3: 263–281) beschrieben
wird, während
der Enterokinase-Spaltungsort ein Mittel zur Reinigung des erwünschten
Polypeptids aus dem Fusionsprotein bereitstellt. Eine Diskussion
der Vektoren, die Fusionsproteine enthalten, wird in Kroll, D. J.
et al. (1993; DNA Cell Biol. 12: 441–453) bereitgestellt.
-
Zusätzlich zu
den rekombinanten Produktionsverfahren können Polypeptide und Fragemente
davon durch direkte Peptidsynthese unter Verwendung von Festphasetechniken
(Merrifield J. (1963) J. Am. Chem. Soc. 85: 2149–2154) hergestellt werden.
Proteinsynthese kann unter Verwendung von manuellen Techniken oder
durch Automatisierung durchgeführt
werden. Automatisierte Synthese kann z. B. unter Verwendung eines Applied
Biosystems 431A Peptid-Synthetisierers (Perkin Elmer) erreicht werden.
Alternativ können
verschiedene Fragmente chemisch getrennt und zusammen unter Verwendung
von chemischen Verfahren, um ein Molekül vollständiger Länge herzustellen, synthetisiert
werden.
-
Ortsgerichtete Mutagenese
-
Ortsgerichtete
Mutagenese ist eine Technik, die bei der Herstellung von individuellen
Peptiden oder biologisch funktionellen äquivalenten Polypeptiden durch
spezifische Mutagenese der darunter liegenden Polynucleotide, die
sie codieren, nützlich
ist. Die Technik, denjenigen mit Bewanderung auf dem Fachgebiet
gut bekannt, stellt weiter eine einfache Möglichkeit bereit, Sequenzvarianten,
z. B. solche, die ein oder mehrere der vorangehenden Überlegungen
beinhalten, durch Einführung
von ein oder mehreren Nucleotidsequenzänderungen in die DNA herzustellen
und zu testen. Ortsgerichtete Mutagenese ermöglicht die Herstellung von Mutanten
durch die Verwendung von spezifischen Oligonucleotidsequenzen, die
die DNA-Sequenz der erwünschten
Mutation codieren, wie auch eine ausreichende Anzahl von benachbarten
Nucleotiden, um eine Primersequenz von ausreichender Größe und Sequenzkomplexität bereitzustellen,
um einen stabilen Doppelstrang auf beiden Seiten der Deletionsverbindung,
die überbrückt wird,
zu bilden. Mutationen können
in einer ausgewählten
Polynucleotidsequenz angewendet werden, um die Eigenschaften des
Polynucleotids selbst und/oder die Eigenschaften, die Aktivität, die Zusammensetzung,
Stabilität
oder primäre
Sequenz des codierten Polypeptids zu verbessern, zu ändern, zu
verringern, zu modifizieren oder anderweitig zu verändern.
-
Die
Techniken der ortsgerichteten Mutagenese sind auf dem Fachgebiet
gut bekannt und werden breit angewendet, um Varianten von sowohl
Polypeptiden wie auch Polynucleotiden zu erzeugen. Zum Beispiel
wird ortsgerichtete Mutagenese oft verwendet, um einen spezifischen
Anteil eines DNA-Moleküls
zu verändern.
Es wird ein Primer, der typischerweise ungefähr 14 bis ungefähr 25 Nucleotide
oder so ähnlich
in der Länge umfasst,
verwendet, wobei ungefähr
5 bis ungefähr
10 Reste auf beiden Seiten der Verbindungsstelle der Sequenz verändert werden.
-
Wie
es demjenigen mit Bewanderung auf dem Fachgebiet bewusst sein wird,
haben ortsgerichtete Mutagenesetechniken oft einen Phagenvektor
verwendet, der sowohl in einer einzelsträngigen wie auch doppelsträngigen Form
vorliegt. Typische Vektoren, die bei ortsgerichteter Mutagenese
nützlich
sind, beinhalten Vektoren, wie den M13 Phagen. Diese Phagen sind
einfach kommerziell erhältlich
und ihre Verwendung ist allgemein denjenigen mit Bewanderung auf
dem Fachgebiet gut bekannt. Doppelsträngige Plasmide werden auch
routinemäßig bei
der ortsgerichteten Mutagenese, die den Schritt des Transfers des
Gens von Interesse von einem Plasmid auf einen Phagen eliminiert,
verwendet.
-
Im
Allgemeinen wird die ortsgerichtete Mutagenese, die sich hiermit
in Übereinstimmung
befindet, durchgeführt,
indem zuerst ein einzelsträngiger
Vektor erhalten oder zwei Stränge
eines doppelsträngigen Vektors,
der innerhalb seiner Sequenz eine DNA-Sequenz, die das erwünschte Peptid
codiert, beinhaltet, außereinander
geschmolzen werden. Ein Oligonucleotidprimer, der die erwünschte mutierte
Sequenz trägt,
wird hergestellt, im Allgemeinen synthetisch. Dieser Primer wird
dann mit dem einsträngigen
Vektor verbunden und DNA-polymerisierenden Enzymen, wie E. coli-Polymerase
I Klenow Fragment, ausgesetzt, um die Synthese des Mutations-tragenden Stranges
zu vervollständigen.
So wird ein Hetero-Doppelstrang
gebildet, worin ein Strang die ursprüngliche nicht mutierte Sequenz
codiert und der zweite Strang die erwünschte Mutation trägt. Dieser
Hetero-Doppelstrang-Vektor wird dann verwendet, um geeignete Zellen,
wie E. coli-Zellen, zu transformieren und Klone werden ausgewählt, die
rekombinante Vektoren beinhalten, die die mutierte Sequenzanordnung
tragen.
-
Die
Herstellung von Sequenzvarianten der selektiertes Peptid-codierenden DNA-Segmente
unter Verwendung von ortsgerichteter Mutagenese stellt ein Mittel
zur Herstellung von potentiell nützlichen
Arten dar und soll nicht limitierend gemeint sein, da es andere
Wege gibt, auf denen Sequenzvarianten von Peptiden und der DNA-Sequenzen,
die sie codieren, erhalten werden können. Zum Beispiel können rekombinante
Vektoren, die die erwünschte
Peptidsequenz codieren, mit mutagenen Wirkstoffen, wie Hydroxylamin,
behandelt werden, um Sequenzvarianten zu erhalten. Spezifische Details
bezüglich
dieser Verfahren und Protokolle werden in den Lehren von Maloy et
al., 1994; Segal, 1976; Prokop und Bajpai, 1991; Kuby, 1994; und
Maniatis et al., 1982, gefunden.
-
Wie
hier verwendet, bezieht sich der Begriff „Oligonucleotid gerichtetes
Mutageneseverfahren" auf Matrizen-abhängige Prozesse
und Vektor-vermittelte Vermehrung, die zu einer Steigerung in der
Konzentration eines spezifischen Nucleinsäuremoleküls relativ zu seiner anfänglichen
Konzentration oder zu einer Steigerung in der Konzentration eines
nachweisbaren Signals, wie Amplifikation, führen. Wie hier verwendet, soll der
Begriff „Oligonucleotid
gerichtetes Mutageneseverfahren" sich
auf einen Prozess beziehen, der die matrizenabhängige Extension eines Primermoleküls involviert.
Der Begriff matrizenabhängiger
Prozess bezieht sich auf Nucleinsäuresynthese eines RNA- oder
DNA-Moleküls,
worin die Sequenz des neu synthetisierten Stranges von Nucleinsäure durch
die gut bekannten Regeln der komplementären Basenpaarung diktiert wird
(siehe z. B. Watson, 1987). Typischerweise involvieren Vektor-vermittelte
Methodiken die Einführung
des Nucleinsäurefragments
in einen DNA- oder RNA-Vektor,
die klonale Amplifikation des Vektors und die Gewinnung des amplizierten
Nucleinsäurefragments.
Beispiele für
solche Methodiken werden durch
U.S.
Patent Nr. 4,237,224 bereitgestellt.
-
Polynucleotid-Amplifikationstechniken
-
Eine
Anzahl von Matrizen-abhängigen
Prozessen sind erhältlich,
um die Zielsequenzen von Interesse, die in einer Probe vorliegen,
zu amplifizieren. Eines der am Besten bekannten Amplifikationsverfahren
ist die Polymerase-Kettenreaktion
(PCR
TM), die detailliert in den
U.S. Patenten Nr. 4,683,195 ,
4,683,202 und
4,800,159 beschrieben wird. Kurz gefasst
werden bei der PCR
TM zwei Primersequenzen
hergestellt, die komplementär
zu Regionen auf gegenüberliegenden
komplementären
Strängen
der Zielsequenz sind. Es wird ein Überschuss an Desoxynucleotidtriphosphaten
zu der Reaktionsmischung zusammen mit einer DNA-Polymerase (z. B.
Taq-Polymerase) zugegeben. Wenn die Zielsequenz in einer Probe vorliegt,
werden die Primer an das Ziel binden, und die Polymerase wird die
Primer dazu veranlassen, entlang der Zielsequenz durch Addition von
Nucleotiden verlängert
zu werden. Durch Erhöhung
und Senkung der Temperatur der Reaktionsmischung werden die verlängerten
Primer von dem Ziel dissoziiert, um Reaktionsprodukte zu bilden, überschüssige Primer
werden an das Ziel und an das Reaktionsprodukt binden und der Prozess
wird wiederholt. Vorzugsweise wird Reverse Transkription und PCR
TM-Amplifikations-Verfahren durchgeführt, um
die Menge an mRNA, die amplifiziert wurde, zu quantifizieren. Polymerase-Kettenreaktions-Methodiken
sind auf dem Fachgebiet gut bekannt.
-
Ein
anderes Verfahren für
die Amplifikation ist die Ligase-Kettenreaktion
(bezeichnet als LCR), offenbart in der
Europäischen Patentanmeldung
Veröffentlichungs-Nr.
320,308 . Bei der LCR werden zwei komplementäre Sondenpaare
hergestellt und in der Gegenwart der Zielsequenz wird jedes Paar
an die gegenüberliegenden
komplementären
Stränge
des Ziel binden, so dass sie aneinander stoßen. In der Gegenwart eine
Ligase werden die zwei Sondenpaare sich verbinden, um eine einzelne
Einheit zu bilden. Durch Temperaturzyklen, wie in PCR
TM,
dissoziieren gebundene ligierte Einheiten von dem Ziel und dienen
als „Zielsequenzen" für die Ligation
von überschüssigen Sondenpaaren.
U.S. Patent Nr. 4,883,750 beschreibt
ein alternatives Verfahren der Amplifikation für die Bindung von Sondenpaaren
an eine Zielsequenz, die der LCR ähnlich ist.
-
Qbeta-Replikase,
beschrieben in PCT Internationale Patentanmeldung Veröffentlichungs-Nr. PCT/US87/00880
kann als noch ein anderes Amplifikationsverfahren bei der vorliegenden
Erfindung verwendet werden. Bei diesem Verfahren wird eine replikative
Sequenz von RNA, die eine Region aufweist, die zu der eines Ziels
komplementär
ist, zu einer Probe in der Gegenwart einer RNA-Polymerase zugegeben.
Die Polymerase wird die replikative Sequenz kopieren, die dann nachgewiesen
werden kann.
-
Ein
isothermales Amplifikationsverfahren, bei dem Restriktionsendonucleasen
und Ligasen verwendet werden, um die Amplifikation von Zielmolekülen, die
Nucleotid 5'[α-thio]Triphosphate
in einem Strang eines Restriktionsortes (Walker et al., 1992) enthalten,
zu erreichen, kann auch bei der Amplifikation von Nucleinsäuren nützlich sein.
-
Strand
Displacement Amplification (SDA) ist ein anderes Verfahren der Durchführung von
isothermaler Amplifikation von Nucleinsäuren, die multiple Runden von
Strangverdrängung
und Synthese, sprich Nick-Translation, involviert. Ein ähnliches
Verfahren, genannt Reparatur-Kettenreaktion (RCR), ist ein anderes Verfahren
der Amplifikation, das nützlich
sein könnte,
und es involviert Annealing von verschiedenen Sonden durch eine
Region hindurch, auf die mit der Amplifikation gezielt wird, gefolgt
von einer Reparaturreaktion, bei der nur zwei der vier Basen vorliegen.
Die anderen zwei Basen können
als biotinylierte Derivate zum einfachen Nachweis zugefügt werden.
Ein ähnlicher
Ansatz wird in SDA verwendet.
-
Sequenzen
können
auch unter Verwendung einer zyklischen Sondenreaktion (CPR) nachgewiesen werden.
Bei der CPR werden eine Sonde mit einer 3'- und einer 5'-Sequenz von Nicht-Ziel-DNA und eine innere
oder „mittlere" Sequenz der Zielprotein-spezifischen RNA
mit DNA hybridisiert, die in einer Probe vorliegt. Bei der Hybridisierung
wird die Reaktion mit RNaseH behandelt und die Produkte der Sonde
werden als unterschiedliche Produkte durch Erzeugung eines Signals,
das nach dem Verdau freigesetzt wird, identifiziert. Die ursprüngliche
Matrize wird mit einer anderen zu zyklierenden Sonde verbunden und
die Reaktion wird wiederholt. So involviert CPR die Amplifikation
eines Signals, das durch Hybridisierung einer Sonde mit einer Zielgen-spezifischen
exprimierten Nucleinsäure
erzeugt wird.
-
Noch
andere Amplifikationsverfahren, die in der
Großbritannien
Patent-Veröffentlichungs-Nr.
2 202 328 und in PCT Internationale Patentanmeldungs-Veröffentlichungs-Nr.
PCT/US89/01025 beschrieben werden, können verwendet werden. Bei
der ersteren Anmeldung werden „modifizierte" Primer in einer
PCR-ähnlichen,
Matrizen- und Enzym-abhängigen
Synthese verwendet. Die Primer können
durch Markierung mit einem Capture-Rest (z. B. Biotin) und/oder
einen Nachweisrest (z. B. Enzym) modifiziert werden. Bei der letzteren Anmeldung
wird ein Überschuss
an markierten Sonden zu einer Probe zugegeben. In der Gegenwart
der Zielsequenz bindet die Sonde und wird katalytisch gespalten.
Nach der Spaltung wird die Zielsequenz intakt freigesetzt, um durch
einen Überschuss
Sonde gebunden zu werden. Die Spaltung der markierten Sonde signalisiert
die Gegenwart der Zielsequenz.
-
Andere
Nucleinsäure-Amplifikationsverfahren
beinhalten Transkriptions-basierte Amplifikationssysteme (TAS) (Kwoh
et al., 1989; PCT Internationale Patent-Veröffentlichungs-Nr.
WO 88/10315 ), einschließlich Nucleinsäuresequenz-basierter
Amplifikation (NASBA) und 3SR. Bei der NASBA können die Nucleinsäuren für die Amplifikation
durch Standard- Phenol/Chloroform-Extraktion,
Hitzedenaturierung einer Probe, Behandlung mit Lysepuffer und Minisein-Säulen für die Isolierung
von DNA und RNA oder Guanidinum-Chloridextraktion von RNA hergestellt
werden. Diese Amplifikationstechniken involvieren Annealing eines
Primers, der Sequenzen aufweist, die für die Zielsequenz spezifisch
sind. Nach der Polymerisation werden DNA/RNA-Hybride mit RNaseH
verdaut, während
doppelsträngige
DNA-Moleküle
erneut Hitze-denaturiert werden. In jedem Fall wird die einzelsträngige DNA
durch Zugabe von sekundärem,
zielspezifischem Primer, gefolgt von Polymerisation vollständig doppelsträngig gemacht.
Die doppelsträngigen
DNA-Moleküle
werden dann multipel durch eine Polyermase, wie T7 oder SP6, transkribiert.
Bei einer isothermalen zyklischen Reaktion werden die RNAs revers zur
DNA transkribiert und erneut mit einer Polymerase, wie T7 oder SP6
transkribiert. Die resultierenden Produkte, ob gekürzt oder
vollständig,
weisen auf zielspezifische Sequenzen hin.
-
Die
Europäische Patentanmeldung Veröffentlichungs-Nummer
329,822 offenbart einen Nucleinsäure-Amplifikationsprozess,
der die zyklische Synthetisierung von Einzelstrang-RNA („ssRNA"), ssDNA und doppelsträngiger DNA
(dsDNA) involviert, der verwendet werden kann. Die ssRNA ist eine
erste Matrize für
ein erstes Primer-Oligonucleotid, das durch reverse Transkriptase
(RNA-abhängige
DNA-Polymerase) verlängert wird.
Die RNA wird dann von dem resultierenden DNA:RNA-Doppelstrang durch
die Wirkung von Ribonuclease H (RNase H, eine RNase, die für RNA in
einem Doppelstrang mit entweder DNA oder RNA spezifisch ist) entfernt.
Die resultierende ssDNA ist eine zweite Matrize für einen
zweiten Primer, die auch die Sequenzen eines RNA-Polymerasepromotors
(veranschaulicht durch T7-RNA-Polymerase) 5' zu seiner Homologie zu seiner Matrize
beinhaltet. Dieser Primer wird dann durch DNA-Polymerase (veranschaulicht durch das
große „Klenow"-Fragment von E.
coli DNA-Polymerase I) verlängert,
was zu einem doppelsträngigen
DNA(„dsDNA")-Molekül führt, welches
eine Sequenz, die identisch zu derjenigen der ursprünglichen
RNA ist, zwischen den Primern und zusätzlich an einem Ende eine Promotorsequenz
aufweist. Diese Promotorsequenz kann durch die passende RNA-Polymerase
verwendet werden, um viele RNA-Kopien
der DNA herzustellen. Diese Kopien können dann erneut in den Zyklus
eintreten, was zu einer sehr schnellen Amplifikation führt. Bei
geeigneter Auswahl von Enzymen kann diese Amplifikation isothermal
ohne Zugabe von Enzymen bei jedem Zyklus durchgeführt werden.
Wegen der zyklischen Natur dieses Prozesses kann die Ausgangssequenz
so ausgewählt
werden, dass sie in der Form von entweder DNA oder RNA vorliegt.
-
PCT
Internationale Patentanmeldung Veröffentlichungs-Nummer
WO 89/06700 offenbart ein
Nucleinsäuresequenz-Amplifikations-Schema, basierend
auf der Hybridisierung einer Promotor-/Primer-Sequenz mit einer Ziel-Einzelstrang-DNA
(„ssDNA"), gefolgt von der
Transkription von vielen RNA-Kopien der Sequenz. Dieses Schema ist
nicht zyklisch; sprich neue Matrizen werden nicht aus den resultierenden
RNA-Transkripten hergestellt. Andere Amplifikationsverfahren beinhalten „RACE" (Frohman, 1990)
und „einseitige
PCR” (Ohara, 1989),
die den Fachleuten auf dem Gebiet gut bekannt sind.
-
Verfahren,
die auf der Ligation von zwei (oder mehr) Oligonucleotiden in der
Gegenwart von Nucleinsäure
mit der Sequenz des resultierenden „Di-Oligonucleotids" basieren, wodurch
das Di-Oligonucleotid amplifiziert wird (Wu und Dean, 1996), können auch
bei der Amplifikation von DNA-Sequenzen verwendet werden.
-
Biologisch funktionelle Äquivalente
-
Modifikation
und Änderungen
können
in der Struktur der Polynucleotide und Polypeptide durchgeführt werden
und man kann dennoch ein funktionelles Molekül erhalten, das ein Polypeptid
mit erwünschten
Eigenschaften codiert. Wie oben erwähnt, ist es oft erwünscht, ein
oder mehrere Mutationen in eine spezifische Polynucleotidsequenz
einzuführen.
Unter bestimmten Umständen
wird die resultierende codierte Polypeptidsequenz durch diese Mutation
verändert
oder in anderen Fällen
bleibt die Sequenz des Polypeptids durch ein oder mehrere Mutationen
in dem codierenden Polynucleotid unverändert.
-
Wenn
es erwünscht
ist, die Aminosäuresequenz
eines Polypeptids zu verändern,
um ein Äquivalent oder
sogar ein verbessertes, zweite Generationsmolekül zu erzeugen, können die
Aminosäureänderungen durch Änderung
von einem oder mehreren der Codons der codierenden DNA-Sequenz gemäß der Tabelle
1 erreicht werden.
-
Zum
Beispiel können
bestimmte Aminosäuren
durch andere Aminosäuren
in einer Proteinstruktur substituiert werden, ohne dass ein merklicher
Verlust an interaktiver Bindungskapazität mit Strukturen, wie zum Beispiel
Antigen-Bindungsregionen
von Antikörpern
oder Bindungsorten auf Substratmolekülen auftritt. Da es die interaktive
Kapazität
und Natur eines Proteins ist, die die biologische funktionelle Aktivität des Proteins
definieren, können
bestimmte Aminosäuresequenz-Substitutionen
in einer Proteinsequenz und natürlich
ihrer zugrunde liegenden DNA-Codierungssequenz
durchgeführt
werden, und man erhält
dennoch ein Protein mit ähnlichen
Eigenschaften. Es wird daher durch die Erfinder überlegt, dass verschiedene Änderungen
in den Peptidsequenzen der offenbarten Zusammensetzungen oder korrespondierenden
DNA-Sequenzen, die die Peptide codieren, durchgeführt werden
können,
ohne dass ein merklicher Verlust in ihrer biologischen Nützlichkeit
oder Aktivität
auftritt. Tabelle
1
-
Wenn
man solche Änderungen
durchführt,
muss der hydropathische Index von Aminosäuren berücksichtigt werden. Die Wichtigkeit
des hydropathischen Aminosäureindex
bei der Verleihung von interaktiver biologischer Funktion an ein
Protein wird allgemein auf dem Fachgebiet verstanden (Kyte und Doolittle,
1982). Es ist akzeptiert, dass der relative hydropathische Charakter
der Aminosäure
zu der sekundären
Struktur des resultierenden Proteins beiträgt, was wiederum die Wechselwirkung
des Proteins mit anderen Molekülen,
z. B. Enzymen, Substraten, Rezeptoren, DNA, Antikörpern, Antigenen
und dergleichen definiert. Jede Aminosäure wurde auf der Basis ihrer
Hydrophobien und Ladungscharakteristiken ein hydropathischer Index
zugeschrieben (Kyte und Doolittle, 1982). Diese Werte sind: Isoleucin
(+4,5); Valin (+4,2); Leucin (+3,8); Phenylalanin (+2,8); Cystein/Cystin
(+2,5); Methionin (+1,9); Alanin (+1,8); Glycin (–0,4); Threonin
(–0,7);
Serin (–0,8);
Tryptophan (–0,9);
Tyrosin (–1,3);
Prolin (–1,6);
Histidin (–3,2);
Glutamat (–3,5);
Glutamin (–3,5);
Aspartat (–3,5); Asparagin
(–3,5);
Lysin (–3,9)
und Arginin (–4,5).
-
Es
ist auf dem Fachgebiet bekannt, dass bestimmte Aminosäuren durch
andere Aminosäuren
mit einem ähnlichen
hydropathischen Index oder Score substituiert werden können und
dennoch zu einem Protein mit einer ähnlichen biologischen Aktivität führen, sprich
man erhält
dennoch ein biologisch funktionell äquivalentes Protein. Bei der
Durchführung
solcher Änderungen
ist die Substitution von Aminosäuren,
deren hydropathische Indizes innerhalb von ±2 liegen, bevorzugt, diejenigen
innerhalb von ±1
werden besonders bevorzugt und diejenigen innerhalb +0,5 werden
sogar noch mehr speziell bevorzugt. Es wird auf dem Fachgebiet auch
verstanden, dass die Substitution von ähnlichen Aminosäuren effektiv
auf der Basis von Hydrophilie durchgeführt werden kann.
U.S. Patent 4,554,101 stellt fest,
dass die größte lokale
durchschnittliche Hydrophilie eines Proteins, wie sie durch die
Hydrophilie seiner benachbarten Aminosäuren bestimmt wird, mit einer biologischen
Eigenschaft des Proteins korreliert.
-
Wie
in
U.S. Patent 4,554,101 ausführlich dargestellt
wird, wurden die folgenden Hydrophilie-Werte den Aminosäureresten
zugewiesen: Arginin (+3,0); Lysin (+3,0); Aspartat (+3,0 +1); Glutamat
(+3,0 ±1);
Serin (+0,3); Asparagin (+0,2); Glutamin (+0,2); Glycin (0); Threonin
(–04);
Prolin (–0,5 ±1); Alanin
(–0,5);
Histidin (–0,5);
Cystein (–1,0);
Methionin (–1,3);
Valin (–1,5);
Leucin (–1,8);
Isoleucin (–1,8);
Tyrosin (–2,3);
Phenylalanin (–2,5);
Tryptophan (–3,4).
Es wird verstanden, dass eine Aminosäure durch eine andere mit ähnlichen
Hydrophiliewert substituiert werden kann und man dennoch ein biologisches Äquivalent,
und insbesondere ein immunologisch äquivalentes Protein erhält. Bei
solchen Änderungen
wird die Substitution von Aminosäuren,
deren Hydrophiliewerte innerhalb von +2 liegen, bevorzugt, diejenigen
innerhalb von ±1
werden besonders bevorzugt und diejenigen innerhalb von ±0,5 werden
noch mehr besonders bevorzugt.
-
Wie
unten umrissen wird, basiert man daher Aminosäuresubstitutionen allgemein
auf der relativen Ähnlichkeit
der Aminosäure-Seitenketten-Substituenten,
z. B. ihre Hydrophobie, Hydrophilie, Ladung, Größe und dergleichen. Beispielhafte
Substitutionen, die verschiedene der vorangehenden Charakteristiken
berücksichtigen,
sind denjenigen mit Bewanderung auf dem Fachgebiet gut bekannt und
beinhalten: Arginin und Lysin; Glutamat und Aspartat; Serin und
Threonin; Glutamin und Asparagin und Valin, Leucin und Isoleucin.
-
Zusätzlich kann
jedes Polynucleotid weiter modifiziert werden, um die Stabilität in vivo
zu steigern. Mögliche
Modifikationen beinhalten, sind aber nicht begrenzt auf die Addition
von Flankierungssequenzen an den 5'- und/oder 3'-Enden; die Verwendung von Phosphorothioat
oder 2' O-Methyl
anstelle von Phosphodiesterase-Verbindungen in dem Gerüst und/oder
den Einschluss von nicht traditionellen Basen, wie Inosin, Queosin
und Wybutosin, wie auch Acetyl-Methyl-, Thio- und andere modifizierte Formen von
Adenin, Cytidin, Guanin, Thymin und Uridin.
-
In vivo-Polynucleotid-Abgabetechniken
-
Genetische
Konstrukte, die ein oder mehrere der Polynucleotide umfassen, werden
in Zellen in vivo eingeführt.
Dies kann unter Verwendung von irgendeinem einer Vielzahl von gut
bekannten Ansätzen
erreicht werden, von denen mehrere unten zu dem Zweck der Veranschaulichung
umrissen werden.
-
1. Adenovirus
-
Eines
der bevorzugten Verfahren für
die in vivo-Abgabe von ein oder mehr Nucleinsäuresequenzen involviert die
Verwendung eines Adenovirus-Expressionsvektors. „Adenovirus-Expressionsvektor" soll bedeuten, dass
diejenigen Konstrukte mit eingeschlossen sind, die genug Adenovirus-Sequenzen
enthalten, um (a) das Packen des Konstruktes zu unterstützen und
(b) ein Polynucleotid zu exprimieren, das darin in einer Sinn- oder
Gegensinn-Orientierung geklont wurde. In dem Zusammenhang mit einem
Gegensinn-Konstrukt erfordert die Expression natürlich nicht, dass das Genprodukt
synthetisiert wird.
-
Der
Expressionsvektor umfasst eine gentechnisch behandelte Form eines
Adenovirus. Das Wissen um die genetische Organisierung von Adenovirus,
eines 36 kb, linearen, doppelsträngigen
DNA-Virus, erlaubt die Substitution von großen Stücken von adenoviraler DNA durch
fremde Sequenzen bis zu 7 kb (Grunhaus und Horwitz, 1992). Im Gegensatz
zu Retrovirus führt
die adenovirale Infektion von Wirtszellen nicht zu einer chromosomalen
Integration, da die adenovirale DNA auf eine episomale Weise ohne
mögliche
Genotoxizität replizieren
kann. Auch sind Adenoviren strukturell stabil und keine Genomumordnung
wurde nach extensiver Amplifikation nachgewiesen. Adenovirus kann
nahezu alle Epithelialzellen unabhängig von ihrem Zellzyklus-Stadium
infizieren. Soweit scheint adenovirale Infektion nur mit milder
Erkrankung, wie akuter Atemwegserkrankung beim Menschen, verbunden
zu sein.
-
Adenovirus
ist besonders für
die Verwendung als ein Gentransfer-Vektor wegen seines mittelgroßen Genoms,
der Leichtigkeit der Manipulation, dem hohen Titer, dem breiten
Zielzellbereich und der hohen Infektiosität geeignet. Beide Enden des
Virusgenoms enthalten 100–200
Baenpaar-invertierte Wiederholungen (ITRs), die cis-Elemente sind,
die für
die virale DNA-Replikation und Packung notwendig sind. Die frühen (E) und
späten
(L)-Regionen des Genoms enthalten verschiedene Transkriptionseinheiten,
die durch den Beginn der viralen DNA-Replikation getrennt werden.
Die E1-Region (E1A und E1B) codiert Proteine, die für die Regulierung
der Transkription des Virusgenoms und einiger zellulärer Gene
verantwortlich sind. Die Expression der E2-Region (E2A und E2B)
führt zu
der Synthese der Proteine für
die virale DNA-Replikation. Diese Proteine sind in die DNA-Replikation,
späte Gen-Expression
und den Wirtszell-Shut-off involviert (Renan, 1990). Die Produkte
der späten
Gene, einschließlich
der Mehrheit der viralen Capsidproteine, werden nur nach signifikanter
Verarbeitung eines einzelnen primären Transkriptes, das von dem
hauptsächlichen
späten
Promotor (MLP) stammt, exprimiert. Der MLP (lokalisiert bei 16.8
m. u.) ist während
der späten
Phase der Infektion besonders effizient und alle mRNAs, die von
diesem Promotor stammen, besitzen eine 5' dreiteilige Leader(TPL)-Sequenz, welche
sie zu bevorzugten mRNAs für
die Translation macht.
-
In
einem laufenden System wird rekombinanter Adenovirus aus homologer
Rekombination zwischen Shuttle-Vektor und Provirus-Vektor erzeugt. Aufgrund
der möglichen
Rekombination zwischen zwei proviralen Vektoren, kann Wildtyp-Adenovirus
aus diesem Prozess erzeugt werden. Es ist daher wichtig, einen einzelnen Klon
von Virus aus einem individuellen Plaque zu isolieren und seine
Genomstruktur zu untersuchen.
-
Die
Erzeugung und Vermehrung der aktuellen Adenovirus-Vektoren, die Replikations-defizient
sind, hängen
von einer einzelnen Helfer-Zelllinie, bezeichnet 293, ab, die aus
menschlichen embryonalen Nierenzellen durch Ad5-DNA-Fragmente transformiert
wurde und konstitutiv E1-Proteine exprimiert (Graham et al., 1977).
Da die E3-Region für
das Adenovirus-Genom
entbehrlich ist (Jones und Shenk, 1978), tragen die aktuellen Adenovirus-Vektoren
mit der Hilfe von 293-Zellen fremde DNA entweder in die E1, die
D3 oder beide Regionen (Graham und Prevec, 1991). In der Natur kann
Adenovirus ungefähr
105% des Wildtyp-Genoms packen (Ghosh-Choudhury et al., 1987), wobei
Kapazität
für ungefähr 2 extra
kb DNA bereitgestellt wird. Verbunden mit den ungefähr 5,5 kb
DNA, die in den E1- und E3-Regionen ersetzbar sind, liegt die maximale
Kapazität des
aktuellen Adenovirus-Vektors unter 7,5 kb oder bei ungefähr 15% der
gesamten Länge
des Vektors. Mehr als 80% des Adenovirus viralen Genoms verbleibt
in dem Vektorgerüst
und ist die Quelle der vektorbedingten Cytotoxizität. Auch
ist die Replikationsdefizienz des E1 deletierten Virus inkomplett.
Zum Beispiel wurde ein Verlust an viraler Genexpression bei den
aktuell erhältlichen
Vektoren bei hohen Mengen an Infektion (MOI) beobachtet (Mulligan,
1993).
-
Helfer-Zelllinien
können
von menschlichen Zellen, wie menschlichen embryonalen Nierenzellen,
Muskelzellen, hämatopoetischen
Zellen oder anderen menschlichen embryonalen, mesenchymalen oder
epithelialen Zellen stammen. Alternativ können die Helferzellen von den
Zellen anderer Säugerarten
stammen, die menschliches Adenovirus zulassen. Solche Zellen beinhalten
z. B. Verozellen oder andere Affenembryonalen, mesenchymalen oder
epithelialen Zellen. Wie oben angegeben wurde, ist die aktuell bevorzugte
Helfer-Zelllinie 293.
-
Kürzlich offenbarte
Racher et al. (1995) verbesserte Verfahren für die Kultivierung von 293
Zellen und die Vermehrung von Adenovirus. In einem Format werden
natürliche
Zell-Aggregate durch Impfung von individuellen Zellen in 1 Liter
silikonisierte Spinner-Flasks (rechne, Cambridge, UK), die 100–200 ml
Medium enthalten, gezüchtet.
Nach Rühren
mit 40 UpM wird die Zell-Lebensfähigkeit
mit Tryptanblau geschätzt.
In einem anderen Format werden Fibra-Cel-Mikroträger (Bibby Sterlin, Stone,
UK) (5 g/l) wie folgt verwendet. Ein Zell-Inokulat, in 5 ml Medium
resuspendiert, wird zu dem Träger
(50 ml) in einem 250 ml Erlenmeyer-Kolben zugegeben und mit gelegentlicher
Bewegung für
1 bis 4 Stunden stehen gelassen. Das Medium wird dann durch 50 ml
frisches Medium ersetzt und Schütteln
begonnen. Für
die Virusproduktion lässt
man Zellen bis zu ungefähr
8%iger Konfluenz wachsen, nach dieser Zeit wird das Medium ersetzt
(auf 25% des endgültigen
Volumens) und Adenovirus mit einer MOI von 0,05 zugegeben. Die Kulturen
werden über
Nacht stehen gelassen, wonach das Volumen auf 100% gesteigert und
Schütteln
für 72
Stunden wiederaufgenommen wird.
-
Abgesehen
von der Anforderung, dass der Adenovirus-Vektor replikationsdefizient,
oder zumindest bedingt defizient sein soll, glaubt man nicht, dass
die Natur des Adenovirus-Vektors für die erfolgreiche Ausübung der
Erfindung essentiell ist. Das Adenovirus kann irgendeiner der 42
verschiedenen bekannten Serotypen oder Untergruppen A–F sein.
Adenovirus Typ 5 der Untergruppe C ist das bevorzugte Ausgangsmaterial, um
einen bedingt replikationsdefizienten Adenovirus-Vektor für die Verwendung
bei der vorliegenden Erfindung zu erhalten, da Adenovirus Typ 5
ein menschliches Adenovirus ist, über das eine große Menge
an biochemischer und genetischer Information bekannt ist und es
wurde historisch für
die meisten Konstruktionen, die Adenovirus als einen Vektor verwenden,
verwendet.
-
Wie
oben angegeben wurde, ist der typische Vektor replikationsdefizient
und wird keine Adenovirus-E1-Region aufweisen. So wird es am bequemsten
sein, das Polynucleotid, das das Gen von Interesse kodiert, an der
Position einzuführen,
von der die D1-codierenden Sequenzen entfernt wurden. Die Position
der Insertion des Konstruktes innerhalb der Adenovirus-Sequenzen
ist jedoch für
die Erfindung nicht entscheidend. Das Polynucleotid, das das Gen
von Interesse codiert, kann auch anstelle der deletierten E3-Region
in E3-Ersatzvektoren
inseriert werden, wie durch Karlsson et al. (1986) beschrieben wird,
oder in der E4-Region, wo eine Helfer-Zelllinie oder Helfervirus
den E4-Defekt ergänzt.
-
Adenovirus
ist einfach zu züchten
und zu manipulieren und zeigt in vitro und in vivo eine große Wirtsbandbreite.
Diese Gruppe von Viren kann in hohen Titern, z. B. 109–1011 Plaque bildenden Einheiten pro ml erhalten
werden, und sie sind hoch infektiös. Der Lebenslauf des Adenovirus
macht nicht die Integration in das Wirtszellgenom erforderlich.
Die fremden Gene, die von den Adenovirus-Vektoren geliefert werden,
sind episomal und weisen daher eine niedrige Genotoxizität gegenüber Wirtszellen
auf. Es wurde über
keine Nebenwirkungen in Studien der Impfung mit Wildtyp-Adenovirus
berichtet (Couch et al., 1963; Top et al., 1971), was ihre Sicherheit
und ihr therapeutisches Potential als in vivo-Gentransfer-Vektoren zeigt.
-
Adenovirus-Vektoren
wurden in eukaryoter Genexpression (Levrero et al., 1991; Gomez-Foix
et al., 1992) und Impfstoffentwicklung (Grunhaus und Horwitz, 1992;
Graham und Prevec, 1992) verwendet. Kürzlich legten Tierstudien nahe,
dass rekombinantes Adenovirus für
die Gentherapie verwendet werden können (Stratford-Perricaudet
und Perricaudet, 1991; Stratford-Perricaudet et al., 1990; Rich
et al., 1993). Studien zur Verabreichung von rekombinantem Adenovirus
an verschiedene Gewebe beinhalten Trachea-Instillierung (Rosenfeld
et al., 1991; Rosenfeld et al., 1992), Muskelinjektion (Ragot et
al., 1993), periphere intravenöse
Injektion (Herz und Gerard, 1993) und sterntaktische Impfung in
das Gehirn (Le Gal La Salle et al., 1993).
-
2. Retroviren
-
Die
Retroviren sind eine Gruppe von einsträngigen RNA-Viren, die durch
ihre Fähigkeit
charakterisiert werden, ihre RNA zu doppelsträngiger DNA in infizierten Zellen
durch einen Prozess der reversen Transkription zu konvertieren (Coffin, 1990).
Die resultierende DNA integriert sich dann stabil in zelluläre Chromosome als
ein Provirus und lenkt die Synthese von viralen Proteinen. Die Integration
führt zu
der Retention der viralen Gensequenzen in der Empfängerzelle
und ihren Nachkommen. Das retrovirale Genom enthält drei Gene, gag, pol und
env, die die Capsidproteine, Polymeraseenzym bzw. Hüllkomponenten
codieren. Eine Sequenz, die stromaufwärts von dem gag-Gen gefunden
wird, enthält
ein Signal für
die Verpackung des Genoms in Virione. Zwei lange terminale Wiederholungs(LTR)-Sequenzen
liegen an den 5'-
und 3'-Enden des
viralen Genoms vor. Diese enthalten starke Promotor- und Verstärkersequenzen
und sie sind auch für
die Integration in das Wirtszellgenom erforderlich (Coffin, 1990).
-
Um
einen retroviralen Vektor herzustellen, wird eine Nucleinsäure, die
ein oder mehrere Oligonucleotid- oder Polynucleotidsequenzen von
Interesse codiert, in das virale Genom anstelle von bestimmten viralen Sequenzen
inseriert, um ein Virus herzustellen, das replikationsdefizient
ist. Um Virione herzustellen, wird eine Verpackungs-Zelllinie, die
die gag-, pol- und env-Gene enthält,
aber ohne die LTR und Verpackungskomponenten, konstruiert (Mann
et al., 1983). Wenn ein rekombinantes Plasmid, das eine cDNA zusammen
mit den retroviralen LTR und Verpackungssequenzen enthält, in diese
Zelllinie (z. B. durch Calciumphosphatpräzipitation) eingeführt wird,
ermöglicht
es die Verpackungssequenz dem RNA-Transkript des rekombinanten Plasmids
in viralen Partikel verpackt zu werden, die dann in das Kulturmedium
sezerniert werden (Nicolas und Rubenstein, 1988; Temin, 1986; Mann
et al., 1983). Das Medium, das die rekombinanten Retroviren enthält, wird dann
gesammelt, optional konzentriert und für den Gentransfer verwendet.
Retrovirale Vektoren sind in der Lage, eine große Bandbreite an Zelltypen
zu infizieren. Die Integration und stabile Expression erfordert
jedoch die Teilung von Wirtszellen (Paskind et al., 1975).
-
Ein
neuer Ansatz, entwickelt um spezifische Zielrichtung von Retrovirus-Vektoren
zu ermöglichen, wurde
kürzlich
basierend auf der chemischen Modifikation eines Retrovirus durch
die chemische Addition von Lactoseresten zu der viralen Hülle entwickelt.
Diese Modifikation könnte
die spezifische Infektion von Hepatozyten über Sialoglycoproteinrezeptoren
erlauben.
-
Ein
unterschiedlicher Ansatz für
die Zielrichtung von rekombinanten Retroviren wurde entwickelt,
bei dem biotinylierte Antikörper
gegen retrovirales Hüllprotein
und gegen einen spezifischen Zellrezeptor verwendet wurden. Die
Antikörper
wurden über
die Biotinkomponenten unter Verwendung von Streptavidin (Roux et al.,
1989) gekoppelt. Unter Verwendung von Antikörpern gegen Haupt-Histokompatibilitätskomplexe-Klasse-I- und
Klasse-II-Antigene zeigten sie die Infektion einer Vielzahl von
menschlichen Zellen, die diese Oberflächen-Antigene mit einem ecotropen
Virus in vitro trugen (Roux et al., 1989).
-
3. Adeno-assoziierte Viren
-
AAV
(Ridgeway, 1988; Hermonat und Muzycska, 1984) ist ein Parovirus,
entdeckt als eine Kontamination von adenoviralen Vorräten. Es
ist ein ubiquitäres
Virus (Antikörper
liegen in 85% der menschlichen U.S.-Bevölkerung vor), das nicht mit
irgendeiner Erkrankung in Verbindung gebracht wurde. Es wird auch
als ein Dependovirus klassifiziert, da seine Replikation von der
Gegenwart eines Helfervirus, wie eines Adenovirus, abhängig ist.
Es wurden fünf
Serotypen isoliert, von denen AAV-2 der am besten Charakterisierte
ist. AAV besitzt eine einsträngige
lineare DNA, die in Capsidproteine VP1, VP2 und VP3 eingekapselt
ist, um ein icosahedrales Virion von 20 bis 24 nm im Durchmesser
zu bilden (Muzyczka und McLaughlin, 1988).
-
Die
AAV-DNA ist ungefähr
4,7 Kilobasen lang. Sie enthält
zwei offene Leserahmen und wird durch zwei ITRs flankiert. Es gibt
zwei Hauptgene in dem AAV-Genom: rep und cap. Das rep-Gen codiert
Proteine, die für die
viralen Replikationen verantwortlich sind, währen cap Capsidprotein VP 1–3 kodiert.
Jedes ITR bildet eine T-förmige
Haarnadelstruktur. Diese terminalen Wiederholungen sind die einzigen
essentiellen cis-Komponenten
des AAV für
chromosomale Integration. Daher kann der AAV als ein Vektor verwendet
werden, wenn alle viralen Codierungssequenzen entfernt und durch
die Kassette von Genen für
die Abgabe ersetzt wurden. Es wurden drei virale Promotoren identifiziert
und p5, p19 und p40, gemäß ihrer
Kartenposition genannt. Die Transkription von p5 und p19 führt zu der
Produktion von rep-Proteinen und die Transkription von p40 stellt
die Capsidproteine her (Hermonat und Muzyczka, 1984).
-
Es
gibt verschiedene Faktoren, die Forscher dazu veranlassten, die
Möglichkeit
der Verwendung von rAAV als ein Expressionsvektor zu studieren,
eine davon ist, dass die Erfordernisse für die Abgabe eines Gens, um
in das Wirtschromosom integriert zu werden, erstaunlich gering sind.
Es ist notwendig, die 145 bp ITRs zu haben, die nur 6% des AAV-Genoms
ausmachen. Dies lässt
Raum in dem Vektor, um eine 4,5 kb DNA-Insertion zusammenzufügen. Während diese
Tragekapazität
das AAV davon abhalten kann, große Gene abzugeben, ist sie
reichlich für
die Abgabe der Gegensinn-Konstrukte
geeignet.
-
AAV
ist auch eine gute Wahl als Abgabevehikel aufgrund seiner Sicherheit.
Es gibt einen relativ komplizierten Rettungsmechanismus: nicht nur
vom Wildtyp-Adenovirus, sondern auch von AAV-Genen wird gefordert,
dass sie rAAV mobilisieren. Entsprechend ist AAV nicht pathogen
und nicht mit irgendeiner Erkrankung assoziiert. Die Entfernung
von viralen Codierungssequenzen minimiert Immunreaktionen gegen virale
Genexpression und daher ruft rAAV keine inflammatorische Reaktion
hervor.
-
4. Andere virale Vektoren
als Expressionskonstrukte
-
Andere
virale Vektoren können
als Expressionskonstrukte in der vorliegenden Erfindung für die Abgabe
von Oligonucleotid- oder
Polynucleotidsequenzen an eine Wirtszelle verwendet werden. Vektoren,
die von Viren wie dem Vaccinia-Virus (Ridgeway, 1988; Coupar et
al., 1988), Lentiviren, Polioviren und Herpesviren stammen, können verwendet
werden. Sie bieten verschiedene attraktive Merkmale für verschiedene
Säugerzellen
(Friedmann, 1989; Ridgeway, 1988; Coupar et al., 1988; Horwich et
al., 1990).
-
Mit
der kürzlichen
Erkennung von defizienten Hepatitis B-Viren wurde neue Einsicht in das Struktur-Funktionsverhältnis von
verschiedenen viralen Sequenzen gewonnen. In vitro-Studien zeigten,
dass das Virus die Fähigkeit
zur Helfer-abhängigen Verpackung
und reversen Transkription trotz der Deletion von bis zu 80% seines
Genoms behielt (Horwich et al., 1990). Dies legte nahe, dass große Teile
des Genoms durch fremdes genetisches Material ersetzt werden könnten. Der
Hepatotropismus und die Persistenz (Integration) waren besonders
attraktive Eigenschaften für
auf die Leber gerichteten Gentransfer. Chang et al. (1991) führte das Chloramphenicolacetyltransferase(CAT)-Gen
in Enten-Hepatitis
B-Virusgenom anstelle der Polymerase-, Oberflächen-, und Präoberflächen-Codierungssequenzen
ein. Es wurde mit Wildtyp-Virus in einer Geflügelhepatom-Zelllinie cotransfiziert.
Es wurden Kulturmedien, die hohe Titer des rekombinanten Virus enthielten,
verwendet, um primäre
Entenküken-Hepatocyten
zu infizieren. Stabile CAT-Genexpression
wurde für
mindestens 24 Tage nach der Transfektion nachgewiesen (Chang et
al., 1991).
-
5. Nicht-virale Vektoren
-
Um
die Expression von Oligonucleotid- oder Polynucleotidsequenzen hervorzurufen,
muss das Expressionskonstrukt in eine Zelle abgegeben werden. Diese
Abgabe kann in vitro erreicht werden, wie in Laborverfahren für die Transformierung
von Zelllinien, oder in vivo oder ex vivo, wie bei der Behandlung
von bestimmten Erkrankungszuständen.
Wie oben beschrieben wurde, ist ein bevorzugter Mechanismus für die Abgabe über virale
Infektion, wo das Expressionskonstrukt in einen infektiösen viralen
Partikel verkapselt wird.
-
Nachdem
das Expressionskonstrukt einmal in die Zelle abgegeben wurde, kann
die Nucleinsäure,
die die erwünschten
Oligonucleotid- oder Polynucleotidsequenzen codiert, positioniert
und an verschiedenen Orten exprimiert werden. Die Nucleinsäure, die
das Konstrukt codiert, kann stabil in das Genom der Zelle integriert
werden. Diese Integration kann an dem spezifischen Ort und der spezifischen
Orientierung über
homologe Rekombination (Genersatz) erfolgen oder es kann in einer
zufälligen,
unspezifischen Lokalisierung integriert werden (Genzuwachs). Die
Nucleinsäure
kann in der Zelle als ein getrenntes, episomales Segment von DNA
stabil erhalten werden. Solche Nucleinsäuresegmente oder „Episome" codieren ausreichend
Sequenzen, um den Erhalt und die Replikation unabhängig von
oder in Synchronisierung mit dem Wirtszellzyklus zu erlauben. Wie
das Expressionskonstrukt an einer Zelle abgegeben wird und wo in
der Zelle die Nucleinsäure
verbleibt, hängt
von dem Typ des Expressionskonstruktes, das verwendet wird, ab.
-
Das
Expressionskonstrukt, das ein oder mehrere Oligonucleotid- oder
Polynucleotidsequenzen umfasst, kann einfach aus nackter rekombinanter
DNA oder Plasmiden bestehen. Der Transfer des Konstruktes kann durch
irgendeines der Verfahren, die oben erwähnt wurden, die physikalisch
oder chemisch die Zellmembran durchlässig machen, durchgeführt werden.
Dies ist besonders anwendbar für
den Transfer in vitro, aber kann für in vivo-Gebrauch ebenfalls
angewendet werden. Dubensky et al. (1984) injizierten erfolgreich
Polyomavirus-DNA in der Form von Calciumphosphat-Präzipitaten
in Leber und Milz von erwachsenen und neugeborenen Mäusen, wobei
die aktive virale Replikation und akute Infektion gezeigt wurde.
Benvenisty und Reshef (1986) zeigten auch, dass direkte intraperitoneale
Injektion von Calciumphosphat-präzipierten
Plasmiden zu der Expression der transfizierten Gene führt. Man
stellt sich vor, dass DNA, die ein Gen von Interesse codiert, auch
auf eine ähnliche
Weise in vivo transferiert werden und das Genprodukt exprimieren
kann.
-
Ein
anderes Verfahren des Transfers eines nackten DNA-Expressionskonstruktes
in Zellen kann Partikelbeschuss involvieren. Dieses Verfahren hängt von
der Fähigkeit
ab, DNA-beschichtete Mikroprojektile auf eine hohe Geschwindigkeit
zu beschleunigen, was es ihnen erlaubt, die Zellmembranen zu durchdringen
und in die Zellen einzutreten, ohne sie zu töten (Klein et al., 1987). Es
wurden verschiedene Geräte
für die
Beschleunigung kleiner Partikel entwickelt. Ein solches Gerät hängt von
einer Hochspannungsentladung ab, um einen elektrischen Strom zu
erzeugen, welcher wiederum die Motivkraft bereitstellt (Yang et
al., 1990). Die verwendeten Mikroprojektile bestanden aus biologisch
inerten Substanzen, wie Wolfram oder Goldkügelchen.
-
Ausgewählte Organe,
einschließlich
dem Leber-, Haut- und Muskelgewebe von Ratten und Mäusen, wurden
in vivo beschossen (Yang et al., 1990; Zelenin et al., 1991). Dies
kann die operative Freilegung des Gewebes oder der Zellen erforderlich
machen, um irgendwelches störende
Gewebe zwischen der Kanone und dem Zielorgan zu eliminieren, sprich
ex vivo-Behandlung. Wieder kann DNA, die ein bestimmtes Gen codiert, über dieses
Verfahren abgegeben werden und dennoch inkorporiert werden.
-
Polypeptidzusammensetzungen
und Verwendungen
-
Die
vorliegende Erfindung stellt in anderen Aspekten Polypeptidzusammensetzungen
für die
Verwendung bei der Diagnose, Behandlung oder Prävention von Chlamydiainfektion
bereit. Allgemein wird ein Polypeptid ein isoliertes Polypeptid
(oder ein Epitop, eine Variante oder ein aktiviertes Fragment davon)
sein, das von einer Säugerart
stammt. Entsprechend wird eine Polypeptidzusammensetzung der vorliegenden
Erfindung so verstanden, dass sie ein oder mehrere Polypeptide umfasst,
die in der Lage sind, Antikörper
hervorzurufen, die immunologisch reaktiv mit einem Polypeptid sind,
umfassend:
- (i) die Aminosäuresequenz mit den Resten 8
bis 660 von SEQ ID Nr. 139 oder eine Variante davon mit einer mindestens
90%igen Sequenzidentität
dazu, bestimmt durch Vergleich der zwei optimal ausgerichteten Sequenzen über ein
Vergleichsfenster der Reste 8 bis 660 von SEQ ID Nr. 139;
oder
- (ii) einen immunogenen Teil der Aminosäurereste 8 bis 660 von SEQ
ID Nr. 139, der mindestens 15 Aminosäuren lang ist.
-
Wie
hier verwendet, beinhaltet ein aktives Fragment eines Polypeptids
die Gesamtheit oder einen Teil eines Polypeptids, das durch konventionelle
Techniken, z. B. Mutagenese, oder durch Addition, Deletion oder Substition
modifiziert wurde, wobei aber das aktive Fragment im Wesentlichen
dieselbe Strukturfunktion, Antigenität etc. wie ein Polypeptid,
das hier beschrieben wird, zeigt.
-
In
bestimmten veranschaulichenden Ausführungsarten werden die Polypeptide
von Nutzen in der Erfindung mindestens einen immunogenen Teil eines
Chlamydiaproteins oder eine Variante davon umfassen, wie hier beschrieben
wird. Proteine, die Chlamydia-Proteine sind, reagieren im Allgemeinen
nachweisbar in einem Immunassay (wie einem ELISA) mit Antiseren
von einem Patienten mit einer Chlamydiainfektion. Polypeptide, wie
hier beschrieben wird, sind mindestens 15 Aminosäuren lang. Zusätzliche
Sequenzen, die von dem nativen Protein stammen, und/oder heterologe
Sequenzen können
vorliegen und solche Sequenzen können
(aber müssen
nicht) weitere immunogene oder antigene Eigenschaften besitzen.
-
Ein „immunogener
Anteil", wie er
hier verwendet wird, ist ein Anteil eines Proteins, der durch einen B-Zell-
und/oder T-Zell-Oberflächen-Antigenrezeptor
erkannt wird (sprich spezifisch gebunden wird). Solche immunogenen
Anteile umfassen vorzugsweise mindestens 20 Aminosäurereste
eines Chlamydia-Proteins oder einer Variante davon. Bestimmte bevorzugte
immunogene Anteile beinhalten Peptide, in denen eine N-terminale
Leadersequenz und/oder Transmembrandomäne deletiert wurden. Andere
bevorzugte immunogene Anteile können
eine kleine N- und/oder C-terminale Deletion (z. B. 1–30 Aminosäuren, vorzugsweise 5–15 Aminosäuren), relativ
zu dem reifen Protein enthalten.
-
Immunogene
Anteile können
allgemein unter Verwendung von gut bekannten Techniken, wie denjenigen,
die in Paul, Fundamental Immunology, 3. Ausg., 243–247 (Rauen
Press, 1993) und Quellenangaben, die darin zitiert werden, zusammengefasst
werden, identifiziert werden. Solche Techniken beinhalten das Screening
von Polypeptiden auf die Fähigkeit,
mit einigen spezifischen Antikörpern,
Antiseren und/oder T-Zelllinien oder Klonen zu reagieren. Wie hier
verwendet, sind Antiseren und Antikörper „Antigen-spezifisch", wenn sie spezifisch
an ein Antigen binden (sprich sie reagieren mit dem Protein in einem
ELISA oder einem anderen Immunassay und sie reagieren nicht nachweisbar
mit nicht verwandten Proteinen). Solche Antiseren und Antikörper können wie
hier beschrieben und unter Verwendung von gut bekannten Techniken
hergestellt werden. Ein immunogener Anteil eines nativen Chlamydia-Proteins ist ein
Anteil, der mit solchen Antiseren und/oder T-Zellen mit einem Spiegel
reagiert, der nicht wesentlich geringer ist als die Reaktivität des Polypeptids
in vollständiger
Länge (z.
B. in einem ELISA und/oder T-Zell-Reaktivitäts-Assay). Solche immunogenen
Anteile können
mit solchen Assays mit einem Spiegel reagieren, der ähnlich oder
größer ist
als die Reaktivität
des Polypeptids vollständiger
Länge.
Solche Screenings können
im Allgemeinen unter Verwendung von Verfahren, die dem Fachmann
auf dem Gebiet gut bekannt sind, durchgeführt werden, so wie diejenigen,
die in Harlow und Lane, Antibodies: A Laboratory Manual, Cold Spring
Harbor Laboratory, 1988, beschrieben werden. Zum Beispiel kann ein
Polypeptid auf einem festen Träger
immobilisiert und mit Patientenseren in Kontakt gebracht werden,
um die Bindung von Antikörpern
innerhalb der Seren an das immobilisierte Peptid zu ermöglichen.
Ungebundene Seren können
dann entfernt und gebundene Antikörper unter Verwendung von z.
B. 125I-markierten Protein A nachgewiesen
werden.
-
Wie
oben bemerkt wurde, kann eine Zusammensetzung eine Variante eines
nativen Chlamydia-Proteins umfassen. Eine Polypeptid-„Variante", wie hier verwendet,
ist ein Polypeptid, das sich von einem nativen Chlamydia-Protein
in einer oder mehreren Substitutionen, Deletionen, Additionen und/oder
Insertionen so unterscheidet, dass die Immunogenität des Polypeptids
im Wesentlichen nicht verringert wird. In anderen Worten kann die
Fähigkeit
einer Variante, mit Antigen-spezifischen Antiseren zu reagieren,
gesteigert oder unverändert
relativ zu dem nativen Protein sein, oder sie kann um weniger als
50%, und vorzugsweise weniger als 20% relativ zu dem nativen Protein
verringert sein. Solche Varianten können im Allgemeinen durch Modifizierung von
einer der obigen Polypeptidsequenzen und Evaluierung der Reaktivität des modifizierten
Polypeptids mit Antigenspezifischen Antikörpern oder Antiseren, wie hier
beschrieben wird, identifiziert werden. Bevorzugte Varianten beinhalten diejenigen,
in denen ein oder mehrere Anteile, wie eine N-terminale Leadersequenz
oder Transmembrandomäne,
entfernt wurden. Andere bevorzugte Varianten beinhalten Varianten,
in denen ein kleiner Anteil (z. B. 1–30 Aminosäuren, vorzugsweise 5–15 Aminosäuren) von
dem N- und/oder C-terminalen Ende
des reifen Proteins entfernt wurde.
-
Polypeptidvarianten,
die durch die vorliegende Erfindung mit eingeschlossen werden, beinhalten
diejenigen, die mindestens 90%ige, 91%ige, 92%ige, 93%ige, 94%ige,
95%ige, 96%ige, 97%ige, 98%ige oder 99%ige oder mehr Identität (bestimmt
wie oben beschrieben) zu der Aminosäuresequenz der Reste 8 bis
660 der SEQ ID Nr. 139 zeigen.
-
Vorzugsweise
enthält
eine Variante konservative Substitutionen. Eine „konservative Substitution" ist eine, bei der
eine Aminosäure
durch eine andere Aminosäure
substituiert wird, die ähnliche
Eigenschaften aufweist, so dass ein Fachmann auf dem Gebiet der
Peptidchemie erwarten wird, dass die sekundäre Struktur und die hydropathische
Natur des Polypeptids im Wesentlichen unverändert bleibt. Aminosäuresubstitutionen können allgemein
auf der Basis von Ähnlichkeit
in Polarität,
Ladung, Löslichkeit,
Hydrophobie, Hydrophilie und/oder der amphipathischen Natur der
Reste durchgeführt
werden. Zum Beispiel beinhalten negativ geladene Aminosäuren Asparagin-
und Glutaminsäure;
positiv geladene Aminosäuren
beinhalten Lysin und Arginin und Aminosäuren mit ungeladenen polaren
Kopfgruppen mit ähnlichen
Hydrophiliewerten beinhalten Leucin, Isoleucin und Valin; Glycin
und Alanin; Asparagin und Glutamin und Serin, Threonin, Phenylalanin
und Tyrosin. Andere Gruppen von Aminosäuren, die konservative Änderungen
darstellen können,
beinhalten: (1) ala, pro, gly, glu, asp, gln, asn, ser, thr; (2)
cys, ser, tyr, thr; (3) val, ilc, leu, met, ala, phe; (4) lys, arg,
his; und (5) phe, tyr, trp, his. Eine Variante kann auch oder alternativ
nicht konservative Änderungen
enthalten. In einer bevorzugten Ausführungsart unterscheiden sich variante
Polypeptide von einer nativen Sequenz durch Substition, Deletion
oder Addition von fünf
Aminosäuren
oder weniger. Varianten können
auch (oder alternativ) durch z. B. Deletion oder Addition von Aminosäuren, die
minimalen Einfluss auf die Immunogenität, sekundäre Struktur und hydropathische
Natur des Polypeptids aufweisen, modifiziert werden.
-
Wie
oben angemerkt wurde, können
Polypeptide eine Signal(oder Leader)-Sequenz an dem N-terminalen
Ende des Proteins umfassen, die cotranslational oder posttranslational
den Transfer des Proteins lenkt. Das Polypeptid kann auch mit einem
Linker oder einer anderen Sequenz zur Erleichterung der Synthese,
Reinigung oder Identifizierung des Polypeptids (z. B. Poly-His)
oder um die Bindung des Polypeptids an einen festen Träger zu steigern,
konjugiert sein. Zum Beispiel kann ein Polypeptid an eine Immunglobulin-Fc-Region konjugiert
sein.
-
Polypeptide
können
unter Verwendung von irgendeiner einer Vielfalt von gut bekannten
Techniken hergestellt werden. Rekombinante Polypeptide, die durch
DNA-Sequenzen codiert werden, wie oben beschrieben wurde, können einfach
aus den DNA-Sequenzen unter Verwendung von irgendeinem aus einer
Vielfalt von Expressionsvektoren, die denjenigen mit normaler Bewanderung
auf dem Fachgebiet bekannt sind, hergestellt werden. Die Expression
kann in irgendeiner geeigneten Wirtszelle, die mit einem Expressionsvektor, der
ein DNA-Molekül enthält, das
ein rekombinantes Polypeptid codiert, transformiert oder transfiziert
wurde, erreicht werden. Geeignete Wirtszellen beinhalten Prokaryoten,
Hefe und höhere
eukaryote Zellen, wie Säugerzellen
und Pflanzenzellen. Vorzugsweise sind die verwendeten Wirtszellen
E. coli, Hefe oder eine Säugerzelllinie,
wie COS oder CHO. Überstände von
geeigneten Wirt-/Vektorsystemen, die rekombinantes Protein oder
Polypeptid in die Kulturmedien sezernieren, können zuerst unter Verwendung
eines kommerziell erhältlichen Filters
konzentriert werden. Nach der Konzentration kann das Konzentrat
auf eine geeignete Reinigungsmatrix, wie eine Affinitätsmatrix
oder ein Ionenaustauschharz, aufgebracht werden. Schließlich können ein
oder mehrere Reverse-Phase HPLC-Schritte durchgeführt werden,
um ein rekombinantes Polypeptid weiter zu reinigen.
-
Anteile
und andere Varianten mit weniger als ungefähr 100 Aminosäuren und
im Allgemeinen weniger als ungefähr
50 Aminosäuren
können
auch durch synthetische Mittel, unter Verwendung von Techniken,
die denjenigen mit normaler Bewanderung auf dem Fachgebiet gut bekannt
sind, erzeugt werden. Zum Beispiel können solche Polypeptide unter
Verwendung von irgendeiner der kommerziell erhältlichen Festphasen-Techniken,
wie dem Merrifield Festphasen-Syntheseverfahren,
wo Aminosäuren
sequentiell zu einer wachsenden Aminosäurekette zugegeben werden,
synthetisiert werden. Siehe Merrifield, J. Am. Chem. Soc. 85: 2149–2146, 1963.
Die Ausrüstung
für automatisierte
Synthese von Polypeptiden ist kommerziell von Lieferanten wie Perkin
Elmer/Applied BioSystems Division (Foster City, CA) erhältlich und
kann gemäß den Anweisungen
des Herstellers bedient werden.
-
Innerhalb
bestimmter spezifischer Ausführungsarten
kann ein Polypeptid ein Fusionsprotein sein, das multiple Polypeptide
umfasst, wie hier beschrieben wird, oder dass mindestens ein Polypeptid,
wie hier beschrieben wird, und eine nicht verwandte Sequenz, wie
ein bekanntes Chlamydia-Protein, umfasst. Ein Fusionspartner kann
z. B. dabei helfen, T-Helfer-Epitope
(einen immunologischen Fusionspartner) bereitzustellen, vorzugsweise
T-Helfer-Epitope, die durch Menschen erkannt werden, oder kann dabei
helfen, das Protein in höheren
Erträgen
als das native rekombinante Protein zu exprimieren (ein Expressionsverstärker). Bestimmte bevorzugte
Fusionspartner sind sowohl immunologische wie auch Expressions-steigernde
Fusionspartner. Andere Fusionspartner können so ausgewählt werden,
dass sie die Löslichkeit
des Proteins steigern oder es dem Protein ermöglichen, auf gewünschte intrazelluläre Kompartimente
gerichtet zu werden. Noch weitere Fusionspartner beinhalten Affinitätsmarker,
die die Reinigung des Proteins erleichtern.
-
Fusionsproteine
können
im Allgemeinen unter Verwendung von Standardtechniken, einschließlich chemischer
Konjugation, hergestellt werden. Vorzugsweise wird ein Fusionsprotein
als ein rekombinantes Protein exprimiert, was die Herstellung von
gesteigerten Spiegeln relativ zu einem nicht fusionierten Protein
in einem Expressionssystem ermöglicht.
Kurz gefasst können
DNA-Sequenzen, die die Polypeptidkomponenten codieren, getrennt
zusammengefügt
und in einen geeigneten Expressionsvektor ligiert werden. Das 3'-Ende der DNA-Sequenz, die eine
Polypeptidkomponente codiert, wird mit oder ohne einen Peptidlinker
an das 5'-Ende einer
DNA-Sequenz, die eine zweite Polypeptidkomponente codiert, ligiert,
so dass die Leserahmen der Sequenzen sich in Phase befinden. Dies
erlaubt die Translation in ein einziges Fusionsprotein, das die
biologische Aktivität
beider Bestandteil-Polypeptide behält.
-
Es
kann eine Peptidlinker-Sequenz verwendet werden, um die erste und
zweite Polypeptidkomponente durch eine Distanz zu trennen, die ausreicht,
um sicherzustellen, dass sich jedes Polypeptid in seine sekundären und
tertiären
Strukturen faltet. Solch eine Peptidlinker-Sequenz wird in das Fusionsprotein
unter Verwendung von Standardtechniken, die auf dem Fachgebiet gut
bekannt sind, inkorporiert. Geeignete Peptidlinker-Sequenzen können basierend
auf den folgenden Faktoren ausgewählt werden: (1) ihrer Fähigkeit,
eine flexible ausgedehnte Konformation anzunehmen; (2) ihrer Fähigkeit,
eine sekundäre
Struktur anzunehmen, die mit funktionellen Epitopen auf den ersten
und zweiten Polypeptiden in Wechselwirkung treten könnte, und
(3) dem Mangel an hydrophoben oder geladenen Resten, die mit Polypeptid-funktionellen
Epitopen reagieren könnten.
Bevorzugte Peptidlinker-Sequenzen enthalten Gly-, Asn- und Ser-Reste.
Andere fast neutrale Aminosäuren,
wie Thr und Ala, können
auch in der Linkersequenz verwendet werden. Aminosäuresequenzen,
die nützlich
als Linker verwendet werden können,
beinhalten diejenigen, die in Maratea et al., Gene 40: 39–46, 1985;
Murphy et al., Proc. Natl. Acad. Set USA 83: 8258–8262, 1986;
U.S. Patent Nr. 4,935,233 und
U.S. Patent Nr. 4,751,180 offenbart
werden. Die Linkersequenz kann im Allgemeinen von 1 bis ungefähr 50 Aminosäuren lang
sein. Linkersequenzen sind nicht erforderlich, wenn die ersten und
zweiten Polypeptide nicht essentielle N-terminale Aminosäureregionen
aufweisen, die verwendet werden können, um die funktionellen
Domänen
voneinander zu trennen und sterische Hinderung zu verhindern.
-
Die
ligierten DNA-Sequenzen sind operabel mit transkriptionellen oder
translationalen Regulationselementen verbunden. Die Regulationselemente,
die für
die Expression von DNA verantwortlich sind, sind nur 5' zu der DNA-Sequenz,
die die ersten Polypeptide codiert, lokalisiert. Ähnlich sind
Stopkodons, die erforderlich sind, um die Translation und Transkriptions-Terminations-Signale
zu beenden, nur 3' zu
der DNA-Sequenz, die das zweite Polypeptid codiert, vorhanden.
-
Es
werden auch Zusammensetzungen, die Fusionsproteine umfassen, für die Verwendung
gemäß der vorliegenden
Erfindung bereitgestellt. Solche Proteine umfassen ein Polypeptid,
umfassend:
- (i) Die Aminosäuresequenz der Reste 8 bis
660 von SEQ ID Nr. 139 oder eine Variante davon mit einer mindestens
90%igen Sequenzidentität
dazu, wie durch den Vergleich der zwei optimal ausgerichteten Sequenzen über ein
Vergleichsfenster der Reste 8 bis 660 von SEQ ID Nr. 139 bestimmt
wird;
oder
- (ii) einen immunogenen Teil der Aminosäurereste 8 bis 660 von SEQ
ID Nr. 139, der mindestens 15 Aminosäuren lang ist; zusammen mit
einem nicht verwandten immunogenen Protein. Vorzugsweise ist das
immunogene Protein in der Lage, eine Gedächtnisreaktion hervorzurufen.
Beispiele für
solche Proteine beinhalten Tetanus, Tuberkulose und Hepatitis-Proteine
(siehe z. B. Stoute et al., New Engl. J. Med., 336: 86–91, 1997).
-
In
bevorzugten Ausführungsarten
stammt ein immunologischer Fusionspartner von Protein D, einem Oberflächenprotein
des Gram-negativen Bakteriums Haemophilus influenza B (
WO 91/18926 ). Vorzugsweise umfasst
ein Protein-D-Derivat ungefähr
das erste Drittel des Proteins (z. B. die ersten N-terminalen 100–110 Aminosäuren) und
ein Protein-D-Derivat kann lipidiert sein. Innerhalb bestimmter
bevorzugter Ausführungsarten
werden die ersten 109 Reste eines Lipoprotein-D-Fusionspartners
auf dem N-Terminus mit eingeschlossen, um das Polypeptid mit zusätzlichen
exogenen T-Zell-Epitopen bereitzustellen und den Expressionsspiegel
in E. coli zu steigern (daher als ein Expressions-Steigerer wirkend).
Der Lipidschwanz stellt die optimale Präsentation des Antigens für Antigen-präsentierende
Zellen sicher. Andere Fusionspartner beinhalten das nicht strukturelle
Protein von Influenza-Virus, NS1 (Hämagglutinin). Typischerweise
werden die N-terminalen 81 Aminosäuren verwendet, obwohl unterschiedliche
Fragmente, die T-Helferepitopte beinhalten, verwendet werden können.
-
In
einer anderen Ausführungsart
ist der immunologische Fusionspartner das Protein, das als LYTA
bekannt ist, oder ein Teil davon (vorzugsweise ein C-terminaler
Teil). LYTA stammt von Streptococcus pneumoniae, welches eine N-Acetyl-N-alaninamidase synthetisiert,
die als Amidase-LYTA bekannt ist (codiert durch das LytA-Gen; Gene
43: 265–292,
1986). LYTA ist ein Autolysin, das spezifisch bestimmte Bindungen
in dem Peptidoglycan-Gerüst
abbaut. Die C-terminale Domäne
des LYTA-Proteins
ist für
die Affinität
zu dem Cholin oder zu einigen Cholin-Analoga, wie DEAE, verantwortlich.
Diese Eigenschaft wurde für
die Entwicklung von E. coli-C-LYTA exprimierenden Plasmiden, die
für die
Expression von Fusionsproteinen nützlich sind, ausgenutzt. Die
Reinigung von Hybridproteinen, die das C-LYTA-Fragment an dem Aminoende
enthalten, wurde beschrieben (siehe Biotechnology 10: 795–798, 1992).
In einer bevorzugten Ausführungsart
kann ein Wiederholungsanteil von LYTA in ein Fusionsprotein mit
eingeschlossen werden. Ein Wiederholungsanteil wird in der C-terminalen
Region, beginnend am Rest 178, gefunden. Ein besonders bevorzugter
Wiederholungsanteil beinhaltet die Reste 188–305.
-
Im
Allgemeinen sind Polypeptide (einschließlich Fusionsproteinen) und
Polynucleotide, wie hier beschrieben wird, isoliert. Ein „isoliertes" Polypeptid oder
Polynucleotid ist eines, das aus seiner ursprünglichen Umgebung entfernt
wurde. Zum Beispiel ist ein natürlich
auftretendes Protein isoliert, wenn es von einigen oder allen der
zusammen auftretenden Materialien in dem natürlichen System getrennt ist.
Vorzugsweise sind solche Polypeptide mindestens ungefähr 90% rein,
mehr vorzuziehen ungefähr
95% rein und am Besten mindestens ungefähr 99% rein. Ein Polypeptid
wird als isoliert betrachtet, wenn es z. B. in einen Vektor kloniert
ist, der nicht ein Teil der natürlichen
Umgebung ist.
-
Veranschaulichende therapeutische Zusammensetzungen
und Verwendungen
-
Ein
anderer Aspekt der vorliegenden Erfindung stellt ein oder mehrere
der obigen Polypeptide oder Fusionsproteine (oder Polynucleotide,
die solche Polypeptide oder Fusionsproteine codieren) für die Verwendung
bei der Induktion von schützender
Immunität
gegen Chlamydiainfektion in einem Patienten bereit. Wie hier verwendet,
bezieht sich ein „Patient" auf jedes warmblütige Tier,
vorzugsweise einen Menschen. Ein Patient kann von einer Erkrankung
betroffen sein, oder er kann von nachweisbarer Erkrankung und/oder
Infektion frei sein. In anderen Worten kann die schützende Immunität induziert
werden, um Chlamydiainfektion zu verhindern oder zu behandeln. Bei
diesem Aspekt liegt das Polypeptid, Fusionsprotein oder Polynucleotidmolekül im Allgemeinen
innerhalb einer pharmazeutischen Zusammensetzung oder einem Impfstoff
vor. Pharmazeutische Zusammensetzungen können ein oder mehrere Polypeptide
umfassen, von denen jedes ein oder mehrere der Sequenzen (i) der
Aminosäuresequenz
der Reste 8 bis 660 von SEQ ID Nr. 139 oder einer Variante davon
mit mindestens 90%iger Sequenzidentität dazu, wie durch Vergleich
der zwei optimal ausgerichteten Sequenz über ein Vergleichsfenster der
Reste 8 bis 660 der Sequenz von SEQ ID Nr. 139 bestimmt wird; oder (ii)
eines immunogenen Anteils der Aminosäurereste 8 bis 660 der Sequenz
von SEQ ID Nr. 139, der mindestens 15 Aminosäuren lang ist, und einen physiologisch
akzeptablen Träger
enthalten. Impfstoffe können
ein oder mehrere der Polypeptide umfassen, umfassend (i) die Aminosäuresequenz
der Reste 8 bis 660 von SEQ ID Nr. 139 oder eine Variante davon
mit mindestens 90%iger Sequenzidentität dazu, wie durch Vergleich
der zwei optimal ausgerichteten Sequenz über ein Vergleichsfenster der
Reste 8 bis 660 der Sequenz von SEQ ID Nr. 139 bestimmt wird; oder
(ii) einen immunogenen Anteil der Aminosäurereste 8 bis 660 der Sequenz
von SEQ ID Nr. 139, der mindestens 15 Aminosäuren lang ist; und ein Immunstimulans,
wie ein Adjuvans oder ein Ribosom (in welches das Polypeptid eingeschlossen
ist). Solche pharmazeutischen Zusammensetzungen und Impfstoffe können andere
Chlamydiaantigene enthalten, entweder in ein Kombinationspolypeptid
eingeschlossen oder in einem getrennten Polypeptid vorliegend.
-
Alternativ
kann ein Impfstoff Polynucleotide enthalten, die ein oder mehrere
Polypeptide oder Fusionsproteine codieren, wie oben beschrieben
wurde, so dass das Polypeptid in situ erzeugt wird. Bei solchen
Impfstoffen können
die Polynucleotide in irgendeinem einer Vielfalt von Ausgabesystemen,
die demjenigen mit normaler Bewanderung auf dem Gebiet bekannt sind,
vorliegen, einschließlich
Nucleinsäure-Expressionssystemen,
bakteriellen und viralen Expressionssystemen. Geeignete Nucleinsäure-Expressionssysteme
enthalten die notwendigen Polynucleotidsequenzen für die Expression
in dem Patienten (wie ein geeignetes Promotor- und Terminierungssignal).
Bakterielle Abgabesysteme involvieren die Verabreichung eines Bakteriums
(wie Bacillus-Calmette-Guerrin), das einen immunogenen Anteil des
Polypeptids auf seiner Zelloberfläche exprimiert. In einer bevorzugten
Ausführungsart
können
die Polynucleotide unter Verwendung eines viralen Expressionssystemes
(z. B. Vaccinia oder ein anderes Pockenvirus, Retrovirus oder Adenovirus)
eingeführt
werden, was die Verwendung eines nicht pathogenen (defekten) Virus
involviert. Techniken für
den Einschluss von Polynucleotiden in solche Expressionssysteme
sind denjenigen mit normaler Bewanderung auf dem Fachgebiet gut
bekannt. Die Polynucleotide können
als „nackte" Plasmidvektoren
verabreicht werden, wie z. B. in Ulmer et al., Science 259: 1745–1749, 1993
beschrieben und im Überblick
durch Cohen, Science 259: 1691–1692, 1993,
dargestellt wird. Techniken für
den Einschluss von DNA in solche Vektoren sind denjenigen mit normaler Bewanderung
auf dem Fachgebiet gut bekannt. Ein retroviraler Vektor kann zusätzlich ein
Gen für
einen selektierbaren Marker (um bei der Identifikation oder Selektion
von transduzierten Zellen zu helfen) und/oder ein zielgebendes Teil,
wie ein Gen, das einen Liganden für einen Rezeptor auf der spezifischen
Zielzelle codiert, transferieren, um den Vektor zielspezifisch zu
machen. Zielrichtung kann auch unter Verwendung eines Antikörpers unter
Verwendung von Verfahren, die denjenigen mit normaler Bewanderung
auf dem Fachgebiet bekannt sind, erreicht werden.
-
Andere
Formulierungen für
therapeutische Zwecke beinhalten colloidale Dispersionssysteme,
wie Makromolekülkomplexe,
Nanokapseln, Mikrosphären,
Kügelchen
und auf Lipid basierende Systeme, einschließlich Öl-in-Wasser-Emulsionen, Micellen,
gemischten Micellen und Liposomen. Ein bevorzugtes kolloidales System
für die
Verwendung als ein Abgabevehikel in vitro und in vivo ist ein Liposom
(sprich ein künstlicher Membranvesikel).
Die Aufnahme von nackten Polynucleotiden kann durch Einschluss der
Polynucleotide in und/oder auf bioabbaubare Kügelchen, die effizient in die
Zellen transportiert werden, gesteigert werden. Die Herstellung
und Verwendung solcher Systeme ist auf dem Fachgebiet gut bekannt.
-
Bei
einem verwandten Aspekt kann ein Polynucleotid-Impfstoff, wie oben
beschrieben, simultan mit oder sequenziell zu entweder einem Polypeptid
der vorliegenden Erfindung oder einem bekannten Chlamydia-Antigen
verabreicht werden. Zum Beispiel kann die Verabreichung von Polynucleotiden,
die ein Polypeptid codieren, entweder „nackt" oder in einem Abgabesystem, wie oben
beschrieben, von der Verabreichung eines Antigens gefolgt werden,
um den schützenden
Immuneffekt des Impfstoffes zu steigern.
-
Ein
Immunstimulans kann irgendeine Substanz sein, die eine Immunreaktion
auf ein exogenes Antigen steigert oder vervielfacht. Beispiele für Immunstimulanzien
beinhalten Adjuvanzien, bioabbaubare Mikrosphären (z. B. Polylactidgalactid)
und Liposome (in die die Verbindung eingeschlossen ist; siehe z.
B. Fullerton,
U.S. Patent Nr.
4,235,877 ). Die Impfstoffherstellung wird allgemein in
z. B. M. F. Powell und M. J. Newman, Hrsg., „Vaccine Design (the subunit
and adjuvant approach)",
Plenum Press (NY, 1995) beschrieben. Pharmazeutische Zusammensetzungen
und Impfstoffe innerhalb des Umfanges der vorliegenden Erfindung
können auch
andere Verbindungen enthalten, die biologisch aktiv oder inaktiv
sein können.
Zum Beispiel können
ein oder mehrere immunogene Anteile von anderen Chlamydia-Antigenen
vorliegen, entweder in ein Fusionspolypeptid eingeschlossen oder
als eine separate Verbindung innerhalb der Zusammensetzung oder
dem Impfstoff.
-
Eine
pharmazeutische Zusammsensetzung oder ein Impfstoff kann DNA enthalten,
die ein oder mehrere der Polypeptide codiert, wie oben beschrieben
wurde, so dass das Polypeptid in situ erzeugt wird. Wie oben bemerkt
wurde, kann die DNA innerhalb irgendeines von einer Vielzahl von
Abgabesystemen, die denjenigen mit normaler Bewanderung auf dem
Fachgebiet bekannt sind, vorliegen, einschließlich Nucleinsäure-Expressionssystemen,
bakteriellen und viralen Expressionssystemen. Zahlreiche Genabgabetechniken sind
auf dem Fachgebiet gut bekannt, wie diejenigen, die durch Rolland,
Crit. Rev. Therap. Drug Carrier Systems 15: 143–198, 1998, und Quellen, die
darin zitiert werden, beschrieben werden. Geeignete Nucleinsäure-Expressionssysteme
enthalten die notwendigen DNA-Sequenzen für die Expression in dem Patienten
(wie ein geeignetes Promotor- und Terminierungssignal). Bakterielle
Abgabesysteme involvieren die Verabreichung eines Bakteriums (wie
eines Bacillus-Calmette-Guerrin),
welches einen immunogenen Anteil des Polypeptids auf seiner Zelloberfläche exprimiert
oder ein solches Epitop sezerniert.
-
In
einer bevorzugten Ausführungsart
kann die DNA unter Verwendung eines viralen Expressionssystemes
(z. B. Vaccinia oder ein andere Pockenvirus, Retrovirus, Adenovirus,
Baculovirus, Togavirus, Bacteriophage und dergleichen) eingeführt werden,
was häufig
die Verwendung eines nicht pathogenen (defekten), Replikations-kompetenten
Virus involviert.
-
Viele
virale Expressionsvektoren stammen z. B. von Viren der Retroviridae-Familie.
Diese Familie beinhaltet die Maus-Leukämieviren,
die Maus-Brustkrebsviren, die menschlichen Foamy-Viren, Rous-Sarkomvirus
und die Immundefizienzviren, einschließlich menschlichen, von Affen
und Katzen stammenden. Überlegungen,
wenn retrovirale Expressionsvektoren designed werden, werden in
Comstock et al. (1997) diskutiert.
-
Es
wurden ausgezeichnete, auf Maus-Leukämievirus (MLV) basierende virale
Expressionsvektoren durch Kim et al. (1998) entwickelt. Bei der
Erzeugung der MLV-Vektoren fanden Kim et al. heraus, dass die gesamte
gag-Sequenz zusammen mit der direkt stromaufwärts liegenden Region ohne signifikante
Beeinflussung der viralen Verpackung oder Genexpression deletiert
werden konnte. Weiter wurde herausgefunden, dass fast die gesamte
U3-Region durch den unmittelbar frühen Promotor von menschlichen
Cytomegalievirus ohne schädliche
Effekte ersetzt werden konnte. Zusätzlich konnten MCR und innere
Ribosomen-Eintrittsorte (IRES) ohne Nebenwirkungen zugefügt werden.
Basierend auf ihren Beobachtungen entwarfen Kim et al. eine Reihe
von MLV-basierten Expressionsvektoren, die ein oder mehrere der
Merkmale, die oben beschrieben werden, umfassen.
-
Als
mehr über
das menschliche Foamy-Virus (HFV) gelernt wurde, wurden Eigenschaften
von HFV, die für
seine Verwendung als ein Expressionsvektor günstig sind, entdeckt. Diese
Eigenschaften beinhalten die Expression von pol durch Splicing und
Beginn der Translation an einem definierten Startkodon. Andere Aspekte
von HFV-viralen Expressionsvektoren werden in Bodem et al. (1997)
im Überblick
dargestellt.
-
Murakami
et al. (1997) beschreibt auf Rous-Sarcomvirus (RSV) basierende replikationskompetente Vogel-Retrovirus-Vektoren,
IR1 und IR2, um ein heterologes Gen in einem hohen Spiegel zu exprimieren.
In diesen Vektoren wurde der IRES, stammend von Encephalomyocarditis-Virus
(EMCV), zwischen das env-Gen und das heterologe Gen inseriert. Der
IR1-Vektor behält
den Splice-Akzeptorort, der stromabwärts des env-Gens vorliegt, während es
dem IR2-Vektor daran mangelt. Murakami et al. haben eine hochgradige
Expression von verschiedenen unterschiedlichen heterologen Genen
durch diese Vektoren gezeigt.
-
Kürzlich wurde
eine Anzahl von auf Lentivirus basierenden retroviralen Expressionsvektoren
entwickelt. Kafri et al. (1997) zeigten anhaltende Expression von
Genen, die direkt in die Leber und die Muskulatur durch einen menschlichen
Immundefizienz-Virus(HIV)-basierten Expressionsvektor abgegeben
wurden. Ein Vorteil des Systems ist die innewohnende Fähigkeit
von HIV, nicht teilende Zellen zu transduzieren. Da die Viren von
Kafri et al. pseudotypisiert mit vesikulärem Stomatitis Virus G Glycoprotein
(VSVG) sind, können
sie einen breiten Bereich von Gewebe und Zelltypen transduzieren.
-
Es
wurde eine große
Zahl von Adenovirus-basierten Expressionsvektoren entwickelt, vorrangig
aufgrund der Vorteile, die durch diese Vektoren bei Gentherapie-Anwendungen angeboten
werden. Adenovirus-Expressionsvektoren und Verfahren der Verwendung
solcher Vektoren sind das Thema einer Anzahl von Patenten in den
Vereinigten Staaten, einschließlich
United States Patent Nr. 5,698,202 ,
United States Patent Nr. 5,616,326 ,
United States Patent Nr. 5,585,362 und
United States Patent Nr. 5,518,913 .
-
Zusätzliche
adenovirale Konstrukte werden in Kathri et al. (1997) und Tomanin
et al. (1997) beschrieben. Kathri et al. beschreibt neue Rinder-Adenovirus-Expressionsvektoren
und ihre Fähigkeit,
nasale turbinale Zellen vom Rind und Kaninchen-Nierenzellen wie
auch eine Bandbreite von menschlichem Zelltyp, einschließlich Lungen
und Vorhaut-Fibroblasten,
wie auch Leber, Prostata, Brust, Kolon und retinale Linien, zu infizieren. Tomanin
et al. beschreiben adenovirale Expressionsvektoren, die das T7-RNA-Polymerasegen
enthalten. Wenn sie in Zellen eingeführt wurden, die ein heterologes
Gen, operabel gebunden an einen T7-Promotor, enthalten, waren die
Vektoren in der Lage, die Genexpression von dem T7-Promotor anzutreiben.
Die Autoren schlagen vor, dass dieses System nützlich für die Klonierung und Expression
von Genen, die zytotoxische Proteine codieren, sein könnte.
-
Pockenviren
werden breit für
die Expression von heterologen Genen in Säugerzellen verwendet. Über die
Jahre wurden die Vektoren verbessert, um eine hohe Expression des
heterologen Gens zu ermöglichen und
die Integration von multiplen heterologen Genen in ein einzelnes
Molekül
zu vereinfachen. In einer Anstrengung, zytopathische Effekte zu
verringern und die Sicherheit zu steigern, erfahren Vaccinia-Virusmutanten
und andere Pockenviren, die abortive Infektion in Säugerzellen
durchlaufen, besondere Aufmerksamkeit (Oertli et al., 1997). Die
Verwendung von Pockenviren als Expressionsvektoren wird in Carroll
und Moss (1997) im Überblick
dargestellt.
-
Togavirale
Expressionsvektoren, die alphavirale Expressionsvektoren beinhalten,
wurden verwendet, um die Struktur und Funktion von Proteinen zu
studieren und für
Proteinherstellungszwecke. Attraktive Merkmale von togaviralen Expressionsvektoren
sind schnelle und effiziente Genexpression, ein breiter Wirtsbereich und
RNA-Genome (Huang, 1996). Auch wurde von rekombinanten Impfstoffen,
basierend auf alphaviralen Expressionsvektoren, gezeigt, dass sie
eine starke humorale und zelluläre
Immunantwort mit gutem immunologischem Gedächtnis und schützenden
Effekten induzieren (Tubulekas et al., 1997). Alphavirale Expressionsvektoren
und ihre Verwendung werden z. B. in Lundstrom (1997) diskutiert.
-
In
einer Studie verwendeten Li und Garoff (1996) Semliki-Forest-Virus(SFV)-Expressionsvektoren,
um retrovirale Gene zu exprimieren und retrovirale Partikel in BHK-21-Zellen
zu produzieren. Die Partikel, die durch dieses Verfahren hergestellt
wurden, besaßen
Protease- und Reverse-Transkriptase-Aktivität und waren infektiös. Darüber hinaus
konnte kein Helfervirus in den Virusvorräten nachgewiesen werden. Daher
besitzt dieses System Merkmale, die attraktiv für seine Verwendung in Gentherapieprotokollen
sind.
-
Baculovirale
Expressionsvektoren wurden traditionell verwendet, um heterologe
Proteine in Insektenzellen zu exprimieren. Beispiele für Proteine
beinhalten Säuger-Chemokin-Rezeptoren
(Wang et al., 1997), Reporterproteine, wie grün fluoreszierendes Protein
(Wu et al., 1997) und FLAG Fusionsproteine (Wu et al., 1997; Koh
et al., 1997). Kürzliche
Fortschritte in der baculoviralen Expressionsvektor-Technologie,
einschließlich
ihrer Verwendung in Virion-Display-Vektoren und Expression in Säugerzellen,
werden durch Possee (1997) im Überblick
dargestellt. Andere Überblicke
zu baculoviralen Expressionsvektoren beinhalten Jones und Morikawa
(1996) und O'Reilly
(1997).
-
Andere
geeignete virale Expressionssysteme werden z. B. in Fisher-Hoch
et al., Proc. Natl. Acad. Sci. USA 86: 317–321, 1989; Flexner et al.,
Ann. N. Y. Acad. Sci. 569: 86–103,
1989; Flexner et al., Vaccine 8 : 17–21 ; 1990 ;
U.S. Patent Nr. 4,603,112 ,
4,769,330 und
5,017,487 ;
WO 89/01973 ;
U.S. Patent Nr. 4,777,127 ;
GB 2,200,651 ;
EP 0,345,242 ;
WO 91/02805 ; Berkner, Biotechniques
6: 616–627,
1988; Rosenfeld et al., Science 252: 431–434, 1991; Kolls et al., Proc.
Natl. Acad. Sci. USA 91: 215–219,
1994; Kass-Eisler et al., Proc. Natl. Acad. Sci. USA 90: 11498–11502,
1993; Guzman et al., Circulation 88: 2838–2848, 1993; und Guzman et
al., Cir. Res. 73: 1202–1207,
1993 offenbart. Techniken für
den Einschluss von DNA in solche Expressionssysteme sind denjenigen
mit normaler Bewanderung auf dem Fachgebiet gut bekannt. In anderen
Systemen kann die DNA als „nackte" DNA eingeführt werden,
wie z. B. in Ulmer et al., Science 259: 1745–1749, 1993 und durch Cohen,
Science 259: 1691–1692,
1993 im Überblick
dargestellt wird. Die Aufnahme von nackter DNA kann durch Beschichtung
der DNA auf bioabbaubare Kügelchen,
die effizient in die Zellen transportiert werden, gesteigert werden.
-
Es
wird offensichtlich sein, dass ein Impfstoff eine Polynucleotid-
und/oder eine Polypeptidkomponente, wie erwünscht, umfassen kann. Es wird
auch offensichtlich sein, dass ein Impfstoff pharmazeutisch akzeptable
Salze der Polynucleotide und/oder Polypeptide, die hier bereitgestellt
werden, enthalten kann. Solche Salze können aus pharmazeutisch akzeptablen,
nicht-toxischen Basen hergestellt werden, einschließlich organischen
Basen (z. B. Salze von primären,
sekundären
und tertiären
Aminen und basischen Aminosäuren) und
anorganischen Basen (z. B. Natrium, Kalium, Lithium, Ammonium, Alcium
und Magnesiumsalze). Während
jeder geeignete Träger,
der demjenigen mit normaler Bewanderung auf dem Fachgebiet bekannt
ist, in den pharmazeutischen Zusammensetzungen dieser Erfindung
verwendet werden kann, wird der Typ des Trägers abhängig von dem Modus der Verabreichung
variieren. Zusammensetzungen der vorliegenden Erfindung können für jede geeignete
Weise der Verabreichung formuliert sein, einschließlich z.
B. topische, orale, nasale, intravenöse, intracraniale, intraperitoneale,
subkutane oder intramuskuläre
Verabreichung. Für
parenterale Verabreichung, wie subkutane Injektion, umfasst der
Träger
vorzugsweise Wasser, Kochsalzlösung,
Alkohol, ein Fett, ein Wachs oder einen Puffer. Für die orale
Verabreichung kann jeder der obigen Träger oder ein fester Träger, wie
Mannitol, Lactose, Stärke,
Magnesiumstearat, Natriumsaccharin, Talk, Zellulose, Glucose, Saccharose
und Magnesiumcarbonat verwendet werden. Bioabbaubare Mikrosphären (z.
B. Polylactat, Polyglycolat) können
auch als Träger
für die
pharmazeutischen Zusammensetzungen dieser Erfindung verwendet werden.
Geeignete bioabbaubare Mikrosphären
werden z. B. in
U.S. Patent Nr.
4,897,268 und
5,075,109 offenbart.
-
Solche
Zusammensetzungen können
auch Puffer (z. B. neutral gepufferte Kochsalzlösung oder Phosphat-gepufferte
Kochsalzlösung),
Kohlenhydrate (z. B. Glucose, Mannose, Saccharose oder Dextrane),
Mannitol, Proteine, Polypeptide oder Aminosäuren, wie Glycin, Antioxidantien,
Bakteriostatika, Chelatbildner, wie EDTA oder Gluthation, Adjuvantien
(z. B. Aluminiumhydroxid), gelöste
Stoffe, die die Formulierung isoton, hypoton oder schwach hyperton
mit dem Blut eines Empfängers
machen, Suspensionsmittel, Verdickungsmittel und/oder Konservierungsstoffe
umfassen. Alternativ können
Zusammensetzungen der vorliegenden Erfindung als ein Lyophilisat
formuliert sein. Verbindungen können
auch in Liposome unter Verwendung bekannter Technologie eingeschlossen
werden.
-
Irgendeines
einer Vielfalt von Immunstimulantien kann bei den Impfstoffen dieser
Erfindung verwendet werden. Zum Beispiel kann ein Adjuvans mit eingeschlossen
werden. Die meisten Adjuvantien enthalten eine Substanz, die entworfen
wurde, um das Antigen vor schnellem Katabolismus zu schützen, wie
Aluminiumhydroxid oder Mineralöl,
und einen Stimulator, der Immunreaktion, wie Lipid A, Bortadella
Pertussis oder Mycobacterium tuberculosis abgeleitete Proteine.
Geeignete Adjuvantien sind z. B. als Freund's inkomplettes Adjuvans und komplettes
Adjuvans (Difco Laboratories, Detroit, MI); Merck Adjuvans 65 (Merck
and Company, Inc., Rahway, NJ); AS-2 (SmithKline Beecham, Philadelphia,
PA); Aluminiumsalze, wie Aluminiumhydroxidgel (Alum) oder Aluminiumphosphat;
Salze von Calcium, Eisen oder Zink; eine unlösliche Suspension von acyliertem
Tyrosin, acylierte Zucker; kationisch oder anionisch derivatisierte
Polysaccharide; Polyphosphazene; bioabbaubare Mikrosphären; Monophosphoryl-Lipid
A und Quil A erhältlich.
Cytokine, wie GM-CSF oder Interleukin-2, -7 oder -12, können auch
als Adjuvantien verwendet werden.
-
Innerhalb
der Impfstoffe, die hier bereitgestellt werden, unter ausgewählten Umständen, kann
die Adjuvans- Zusammensetzung
entwickelt werden, um eine Immunantwort vorrangig des Th1-Typs oder
Th2-Typs zu induzieren. Hohe Spiegel an Th1-Typ-Cytokinen (z. B.
IFN-γ, TFNα, IL-2 und
IL-12) tendieren dazu, die Induktion von Zell-vermittelten Immunantworten
auf ein verabreichtes Antigen zu favorisieren. Im Gegensatz dazu
tendieren hohe Spiegel an Th2-Typ-Cytokinen (z. B. IL-4, IL-5, IL-6
und IL-10) dazu, die Induktion von humoralen Immunantworten zu favorisieren.
Nach der Anwendung eines Impfstoffes, wie er hier bereitgestellt wird,
wird ein Patient eine Immunreaktion unterstützen, die Th1- und Th2-Typ-Antworten beinhaltet.
In einer bevorzugten Ausführungsart,
in der eine Reaktion vorrangig vom Th1-Typ ist, wird der Spiegel
an Th1-Cytokinen in einem größeren Ausmaß ansteigen
als der Spiegel von Th2-Typ-Cytokinen. Die Spiegel dieser Cytokine können einfach
unter Verwendung von Standard-Assays beurteilt werden. Für einen Überblick über die
Familien der Cytokine, siehe Mosmann und Coffman, Ann. Rev. Immunol.
7: 145–173,
1989.
-
Bevorzugte
Adjuvantien für
die Verwendung bei der Hervorrufung einer hauptsächlich Th1-Typ-Antwort beinhalten
z. B. eine Kombination aus Monophosphoryl-Lipid A, vorzugsweise
3-de-O-acyliertem Monophosphoryl-Lipid A (3D-MPL), zusammen mit
einem Aluminiumsalz. MPL-Adjuvantien sind von Corixa Corporation
(Seattle, WA; siehe
U.S. Patent
Nr. 4,436,727 ;
4,877,611 ;
4,866,034 und
4,912,094 ) erhältlich. CpG-enthaltende Oligonucleotide
(in denen das CpG-Dinucleotid unmethyliert ist) induzieren vorrangig
auch eine Th1-Antwort. Solche Oligonucleotide sind bekannt und werden
z. B. in
WO 96/02555 und
WO 99/33488 beschrieben.
Immunstimulierende DNA-Sequenzen werden auch z. B. durch Sato et
al., Science 273: 352, 1996, beschrieben. Ein anderes bevorzugtes
Adjuvans ist Saponin, vorzugsweise QS21 (Aquila Biopharmaceuticals Inc.,
Framingham, MA), das allein oder in Kombination mit anderen Adjuvantien
verwendet werden kann. Zum Beispiel involviert ein verbessertes
System die Kombination eines Monophosphoryl-Lipid A und Saponin- Derivats, wie die
Kombination von QS21 und 3D-MPL, wie in
WO 94/00153 beschrieben wird, oder
eine weniger reaktogene Zusammensetzung, worin das QS21 mit Cholesterin
gequencht wird, wie in
WO 96/33739 beschrieben
wird. Andere bevorzugte Formulierungen umfassen eine Öl-in-Wasser-Emulsion
und Tocoferol. Eine besonders stark wirkende Adjuvans-Formulierung involviert
QS21, 3D-MPL und Tocoferol in einer Öl-in-Wasser-Emulsion, wie in
WO 95/17210 beschrieben
wird. Andere bevorzugte Adjuvantien beinhalten Montanid ISA 720
(Seppic, Frankreich), SAF (Chiron, Californien, USA), ISCOMS (CSL),
MF-59 (Chiron), die SBAS-Reihe von Adjuvantien (z. B. SBAS-2 oder
SBAS-4, erhältlich
von SmithKline Beecham, Rixensart, Belgien), Detox (Corixa Corporation;
Seattle, WA), RC-529 (Corixa Corporation; Seattle, WA) und andere
Aminoalkylglucosaminid-4-phosphate (AGPs), wie diejenigen, die in
den anhängigen
U.S. Patentanmeldungen Seriennummern 08/853,826 und 09/074,720 beschrieben
werden.
-
Jeder
Impfstoff, der hier bereitgestellt wird, kann unter Verwendung von
gut bekannten Verfahren hergestellt werden, die zu einer Kombination
aus Antigen, Immunstimulans und einem geeigneten Träger oder Arzneiträger führen. Die
Zusammensetzungen, die hier beschrieben werden, können als
Teil einer Formulierung mit verzögerter
Freisetzung verabreicht werden (sprich einer Formulierung wie einer
Kapsel, Schwamm oder Gel (z. B. bestehend aus Polysacchariden),
was eine langsame Freisetzung der Verbindung nach der Verabreichung
bewirkt). Solche Formulierungen können allgemein unter Verwendung
von gut bekannten Technologien hergestellt werden (siehe z. B. Coombes
et al., Vaccine 14: 1429–1438,
1996) und z. B. durch orale, rektale oder subkutane Implantation
oder durch Implantation an dem erwünschten Zielort verabreicht
werden. Formulierungen mit verzögerter
Freisetzung können
ein Polypeptid, Polynucleotid oder Antikörper enthalten, der in einer
Trägermatrix
dispergiert und/oder in einem Reservoir enthalten ist, der von einer
Geschwindigkeits-kontrollierenden
Membran umgeben ist.
-
Träger für die Verwendung
in solchen Formulierungen sind biokompatibel und können auch
bioabbaubar sein; vorzugsweise stellt die Formulierung einen relativ
konstanten Spiegel an aktiver Bestandteilfreisetzung bereit. Solche
Träger
beinhalten Mikropartikel von Poly (Lactid-co-glycolid), wie auch
Polyacrylat, Latex, Stärke,
Zellulose und Dextran. Andere Träger
mit verzögerter
Freisetzung beinhalten supramolekulare Biovektoren, die einen nicht
flüssigen
hydrophilen Kern (sprich ein quervernetztes Polysaccharid oder Oligosaccharid)
und wahlweise eine externe Schicht, umfassend eine amphiphile Verbindung,
wie ein Phospholipid, umfassen (siehe z. B.
U.S. Patent Nr. 5,151,254 und PCT
Anmeldungen
WO 94/20078 ,
WO 94/23701 und
WO 96/06638 ). Die Menge
an aktiver Verbindung, die in einer Formulierung mit verzögerter Freisetzung
enthalten ist, hängt
von dem Ort der Implantation, der Geschwindigkeit und erwarteten
Dauer der Freisetzung und der Natur des Zustandes, der behandelt
oder verhindert werden soll, ab.
-
Jeder
aus einer Vielfalt von Abgabevehikeln kann innerhalb der pharmazeutischen
Zusammensetzungen und Impfstoffe verwendet werden, um die Produktion
einer Antigen-spezifischen
Immunreaktion, die auf Chlamydia-infizierte Zellen zielt, zu erleichtern.
-
Wege
und Frequenz der Verabreichung von pharmazeutischen Zusammensetzungen
und Impfstoffen, wie auch die Dosierung, wird von Individuum zu
Individuum variieren. Im Allgemeinen können die pharmazeutischen Zusammensetzungen
und Impfstoffe durch Injektion (sprich intrakutan, intramuskulär, intravenös oder subkutan),
intranasal (z. B. durch Aspiration) oder oral verabreicht werden.
Zwischen 1 und 3 Dosen können für einen
Zeitraum von 1–36
Wochen verabreicht werden. Vorzugsweise werden 3 Dosen in Abständen von 3–4 Monaten
verabreicht und Booster-Impfungen können danach periodisch gegeben
werden. Alternative Protokolle können
für einzelne
Patienten geeignet sein. Eine geeignete Dosis ist eine Menge an
Polypeptid oder DNA, die, wenn sie wie oben beschrieben verabreicht
wird, in der Lage ist, eine Immunreaktion in einem immunisierten
Patienten hervorzurufen, die ausreicht, um den Patienten vor Chlamydia-Infektion
für mindestens 1–2 Jahre
zu schützen.
Im Allgemeinen liegt die Menge an Polypeptid, die in einer Dosis
vorliegt (oder in situ durch die DNA in einer Dosis hergestellt
wird) in einem Bereich von 1 pg bis ungefähr 100 mg pro kg Wirt, typischerweise
von ungefähr
10 pg bis ungefähr
1 mg und vorzugsweise von ungefähr
100 pg bis ungefähr
1 μg. Geeignete
Dosierungsgrößen werden
mit der Größe des Patienten
variieren, aber werden typischerweise in dem Bereich von ungefähr 0,1 ml
bis ungefähr
5 ml liegen.
-
Während irgendein
geeigneter Träger,
der denjenigen mit normaler Bewanderung auf dem Fachgebiet bekannt
ist, in den pharmazeutischen Zusammensetzungen dieser Erfindung
verwendet werden kann, wird der Typ des Trägers, abhängig von dem Modus der Verabreichung,
variieren. Für
die parenterale Verabreichung, wie subkutane Injektion, umfasst
der Träger
vorzugsweise Wasser, Kochsalzlösung,
Alkohol, ein Fett, ein Wachs oder einen Puffer. Für die orale
Verabreichung kann jeder der obigen Träger oder ein fester Träger, wie Mannitol,
Lactose, Stärke,
Magnesiumstearat, Natriumsaccharin, Talk, Zellulose, Glucose, Saccharose
und Magnesiumcarbonat verwendet werden. Bioabbaubare Mikrosphären (z.
B. Polylactidgalactid) können
auch als Träger
für die
pharmazeutischen Zusammensetzungen dieser Erfindung verwendet werden.
Geeignete bioabbaubare Mikrosphären
werden z. B. in den
U.S. Patenten
Nr. 4,897,268 und
5,075,109 offenbart.
-
Im
Allgemeinen stellt ein geeignetes Dosierungs- und Behandlungsregime
die aktive Verbindung/die aktiven Verbindungen in einer Menge bereit,
die ausreicht, um einen therapeutischen und/oder prophylaktischen
Nutzen bereitzustellen. Eine solche Antwort kann durch Feststellung
eines verbesserten klinischen Outcomes bei behandelten Patienten
im Vergleich zu unbehandelten Patienten überwacht werden. Steigerungen bei
zuvor existierenden Immunantworten gegen ein Chlamydia-Protein korrelieren
im Allgemeinen mit einem verbesserten klinischen Outcome. Solche
Immunantworten können
im Allgemeinen unter Verwendung von Standard-Proliferationen, Cytotoxizität oder Cytokin-Assays
evaluiert werden, die unter Verwendung von Proben, die von einem
Patienten vor und nach der Behandlung erhalten werden, durchgeführt werden.
-
Nachweis und Diagnose
-
In
einem anderen Aspekt stellt die vorliegende Erfindung Verfahren
für die
Verwendung der Polypeptide, die oben beschrieben werden, für die Diagnose
von Chlamydia-Infektion bereit. Bei diesem Aspekt werden Verfahren
zum Nachweis von Chlamydia-Infektion in einer biologischen Probe
bereitgestellt, wobei eines oder mehrere der obigen Polypeptide
entweder allein oder in Kombination verwendet werden. Zur Klärung wird der
Begriff „Polypeptid" verwendet, wenn
spezifische Ausführungsarten
der erfinderischen diagnostischen Verfahren beschrieben werden.
Es wird jedoch für
jemanden mit Bewanderung auf dem Fachgebiet klar sein, dass die
Fusionsproteine der vorliegenden Erfindung auch in solchen Verfahren
verwendet werden können.
-
Wie
hier verwendet, ist eine „biologische
Probe" eine Antikörper enthaltende
Probe, die von einem Patienten erhalten wurde. Vorzugsweise ist
die Probe Vollblut, Sputum, Serum, Plasma, Speichel, Cerebrospinalflüssigkeit
oder Urin. Mehr vorzuziehen ist die Probe Blut, Serum oder Plasmaprobe,
die von einem Patienten erhalten werden. Die Polypeptide werden
in einem Assay verwendet, wie unten beschrieben wird, um die Gegenwart
oder Abwesenheit von Antikörpern
gegen das Polypeptid/die Polypeptide in der Probe zu bestimmen, relativ zu
einem vorbestimmten Cut-off-Wert. Die Gegenwart solcher Antikörper weist
auf die vorangehende Sensibilisierung gegen Chlamydia-Antigene hin,
was hinweisend auf Chlamydia-Infektionen
sein könnte.
-
In
Ausführungsarten,
in denen mehr als ein Polypeptid verwendet wird, sind die Polypeptide,
die verwendet werden, vorzugsweise komplementär (sprich ein Bestandteil-Polypeptid
wird die Infektion in Proben nachweisen, wo die Infektion durch
ein anderes Bestandteil-Polypeptid nicht nachgewiesen würde). Komplementäre Polypeptide
können
im Allgemeinen unter Verwendung von jedem Polypeptid einzeln identifziert
werden, um Serumproben, die von einer Reihe von Patienten, von denen
bekannt ist, dass sie mit Chlamydia infiziert sind, erhalten wurden,
zu beurteilen. Nach der Bestimmung, welche Proben Test-positiv (wie
unten beschrieben) mit jedem Polypeptid sind, können Kombinationen aus zwei
oder mehr Polypeptiden formuliert werden, die in der Lage sind,
Infektionen in den meisten oder allen der gestesteten Proben nachzuweisen.
-
Eine
Vielzahl von Assay-Formaten sind denjenigen mit normaler Bewanderung
auf dem Fachgebiet für
die Verwendung von ein oder mehr Polypeptiden, um Antikörper in
einer Probe nachzuweisen, bekannt. Siehe z. B. Harlow und Lane,
Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory,
1988. In einer bevorzugten Ausführungsart
involviert der Assay die Verwendung von Polypeptid, das auf einem
festen Träger immobilisiert
wurde, um an den Antikörper
aus der Probe zu binden und ihn zu entfernen. Der gebundene Antikörper kann
dann unter Verwendung eines Nachweisreagens, das eine Reportergruppe
enthält,
nachgewiesen werden. Geeignete Nachweisreagentien beinhalten Antikörper, die
an den Antikörper-/Polypeptidkomplex und
freies Polypeptid, das mit einer Reportergruppe markiert ist, binden
(z. B. in einem semi-kompetitiven Assay). Alternativ kann ein kompetitiver
Assay verwendet werden, in dem ein Antikörper, der an das Polypeptid bindet,
mit einer Reportergruppe markiert wird und man es ihm ermöglicht,
an das immobilisierte Antigen nach Inkubation des Antigens der Probe
zu binden. Das Ausmaß,
in dem Bestandteile der Probe die Bindung des markierten Antikörpers an
das Polypeptid inhibieren, weist auf die Reaktivität der Probe
in dem immobilisierten Polypeptid hin.
-
Der
feste Träger
kann irgendein festes Material sein, das denjenigen mit normaler
Bewanderung auf dem Fachgebiet bekannt ist, an das das Antigen angebracht
werden kann. Zum Beispiel kann der feste Träger eine Testvertiefung in
einer Mikrotiterplatte oder eine Nitrozellulose oder eine andere
geeignete Membran sein. Alternativ kann der Träger ein Kügelchen oder eine Scheibe sein,
so wie Glas, Fieberglas, Latex oder ein Kunststoffmaterial, wie
Polystyrol oder Polyvinylchlorid. Der Träger kann auch ein magnetisches
Teilchen oder ein fieberoptischer Sensor sein, wie diejenigen, die
z. B. in
U.S. Patent Nr. 5,359,681 offenbart
werden.
-
Die
Polypeptide können
an den festen Träger
unter Verwendung einer Vielfalt von Techniken, die demjenigen mit
normaler Bewanderung auf dem Fachgebiet bekannt sind, gebunden werden.
In dem Zusammenhang der vorliegenden Erfindung bezeichnet der Begriff „gebunden" die sowohl nicht
kovalente Assoziierung, wie Adsorption, wie auch die kovalente Anbringung
(die eine direkte Verbindung zwischen dem Antigen und den funktionellen
Gruppen auf dem Träger
sein kann oder eine Verbindung durch einen quervernetzenden Wirkstoff
sein kann). Die Bindung durch Adsorption an eine Vertiefung in einer
Mikrotiterplatte oder an eine Membran wird bevorzugt. In solchen
Fällen
kann die Adsorption durch In-Kontakt-Bringen des Polypetides in einem
geeigneten Puffer mit dem festen Träger für eine geeignete Zeitdauer
sein. Die Kontaktzeit variiert mit der Temperatur, aber liegt typischerweise
zwischen ungefähr
1 Stunde und 1 Tag. Im Allgemeinen reicht das In-Kontakt-Bringen einer Vertiefung
von einer Kunststoffmikrotiterplatte (wie Polystyrol oder Polyvinylchlorid) mit
einer Menge von Polypeptid in dem Bereich von 10 ng bis ungefähr 1 μg, und vorzugsweise
ungefähr
100 ng, aus, um eine adäquate
Menge an Antigen zu binden.
-
Kovalentes
Anbringen von Polypeptid an einen festen Träger kann im Allgemeinen durch
zuerst Reaktion des Trägers
mit einem bifunktionellen Reagens, der mit sowohl dem Träger wie
auch einer funktionellen Gruppe, wie einer Hydroxyl- oder Aminogruppe,
auf dem Polypeptid reagieren wird, erreicht. Zum Beispiel kann das
Polypeptid an Träger
mit einer geeigneten Polymerbeschichtung unter Verwendung von Benzochinon
oder durch Kondensation einer Aldehydgruppe auf den Träger mit
einem Amin und einem aktiven Wasserstoff auf dem Polypeptid gebunden
werden (siehe z. B. Pierce Immunotechnology Catalog and Handbook, 1991,
bei A12–A13).
-
Im
bestimmten Ausführungsarten
ist der Assay ein Enzyme Linked Immunosorbant Assay (ELISA). Dieser
Assay kann durchgeführt
werden, indem zuerst ein Polypeptid-Antigen, das auf einem festen
Träger, gewöhnlich der
Vertiefung einer Mikrotiterplatte, immobilisiert wurde, mit der
Probe in Kontakt gebracht wird, so dass die Antikörper gegen
das Polypeptid innerhalb der Probe in der Lage sind, an das immobilisierte
Polypeptid zu binden. Ungebundene Probe wird dann von dem immobilisierten
Polypeptid entfernt und ein Nachweisreagens, das in der Lage ist,
an den immobilisierten Antikörper-Polypeptidkomplex
zu binden, wird zugegeben. Die Menge an Nachweisreagens, die auf
dem festen Träger
gebunden bleibt, wird dann unter Verwendung eines Verfahrens, das
für das
spezifische Nachweisreagens geeignet ist, bestimmt.
-
Konkreter
werden, soweit das Polypeptid auf dem Träger immobilisiert wurde, wie
oben beschrieben wird, die verbleibendenen Proteinbindungsorte auf
dem Träger
typischerweise blockiert. Jedes geeignete Blockierungsmittel, das
demjenigen mit normaler Bewanderung auf dem Fachgebiet bekannt ist,
wie Rinderserumalbumin (BSA) oder Tween 20TM (Sigma
Chemical Co., St. Louis, MO) kann verwendet werden. Das immobilisierte
Polypeptid wird dann mit der Probe inkubiert und man lässt den
Antikörper
an das Antigen binden. Die Probe kann mit einem geeigneten Verdünnungsmittel,
wie Phosphat-gepufferter Kochsalzlösung (PBS) vor der Inkubation
verdünnt
werden. Im Allgemeinen ist eine geeignete Kontaktzeit (sprich Inkubationszeit)
der Zeitraum, der ausreicht, um die Gegenwart von Antikörpern in
einer HGE-infizierten
Probe nachzuweisen. Vorzugsweise reicht die Kontaktzeit aus, um
einen Grad an Bindung zu erreichen, der mindestens 95% von demjenigen
beträgt,
der im Gleichgewicht zwischen gebundenem und ungebundenem Antikörper erreicht
wird, zu erreichen. Diejenigen mit normaler Bewanderung auf dem
Fachgebiet werden erkennen, dass die Zeit, die notwendig ist, um
ein Gleichgewicht zu erreichen, einfach durch Assay des Grades an
Bindung, die über
einen Zeitraum auftritt, bestimmt werden kann. Bei Raumtemperatur
ist im Allgemeinen eine Inkubationszeit von ungefähr 30 Minuten
ausreichend.
-
Ungebundene
Probe kann dann durch Waschen des festen Trägers mit einem geeigneten Puffer,
wie PBS, enthaltend 0,1% Tween 20TM, entfernt
werden. Nachweisreagens kann dann zu dem festen Träger zugegeben
werden. Ein geeignetes Nachweisreagens ist jede Verbindung, die
an den immobilisierten Antikörper-Polypeptidkomplex
bindet, und die dann durch irgendeines einer Vielzahl von Mitteln,
die denjenigen in dem Fachgebiet bekannt sind, nachgewiesen werden
kann. Vorzugsweise enthält
das Nachweisreagens ein Bindemittel (wie z. B. Protein A, Protein
G, Immunglobulin, Lectin oder freies Antigen), konjugiert an eine
Reportergruppe. Bevorzugte Reportergruppen beinhalten Enzyme (wie
Meerrettichperoxidase), Substrate, Cofaktoren, Inhibitoren, Farbstoffe,
Radionuclide, lumineszierende Gruppen, fluoreszierende Gruppen und
Biotin. Die Konjugation von Bindemittel an Reportergruppe kann unter
Verwendung von Standardverfahren, die denjenigen mit normaler Bewanderung
auf dem Fachgebiet bekannt sind, erreicht werden. Häufige Bindungsmittel können auch
konjugiert an eine Vielzahl von Reportergruppen von vielen kommerziellen
Quellen erworben werden (z. B. Zymed Laboratories, San Francisco,
CA, und Pierce, Rockford, IL).
-
Das
Nachweisreagens wird dann mit dem immobilisierten Antikörper-Polypeptidkomplex
für eine
Zeitdauer, die ausreicht, um den gebundenen Antikörper nachzuweisen,
inkubiert. Eine geeignete Zeitdauer kann im Allgemeinen aus den
Anweisungen des Herstellers oder Assay des Grades an Bindung, der über einen
Zeitraum auftritt, bestimmt werden. Ungebundenes Nachweisreagens
wird dann entfernt und gebundenes Nachweisreagens wird unter Verwendung
der Reportergruppe nachgewiesen. Das Verfahren, das für den Nachweis der
Reportergruppe verwendet wird, hängt
von der Natur der Reportergruppe ab. Für radioaktive Gruppen sind im
Allgemeinen Szintillations-zählende
oder autoradiographische Verfahren geeignet. Spektroskopische Verfahren
können
verwendet werden, um Farbstoffe, lumineszierende Gruppen und fluoreszierende
Gruppen nachzuweisen. Biotin kann unter Verwendung von Avidin, gekoppelt
an eine verschiedene Reportergruppe (gewöhnlich eine radioaktive oder
fluoreszierende Gruppe oder ein Enzym) nachgewiesen werden. Enzymreportergruppen
können
im Allgemeinen durch die Zugabe von Substrat (im Allgemeinen für einen
spezifischen Zeitraum), gefolgt von spektroskopischer oder anderer
Analyse der Reaktionsprodukte, nachgewiesen werden.
-
Um
die Gegenwart oder Abwesenheit von Antichlamydia-Antikörpern in der Probe zu bestimmen,
wird im Allgemeinen das Signal, das von der Reportergruppe, die
auf dem festen Träger
gebunden bleibt, nachgewiesen wird, mit einem Signal, das zu einem
vorbestimmten Cut-off-Wert korrespondiert, verglichen. In einer bevorzugten
Ausführungsart
ist der Cut-off-Wert
das durchschnittliche mittlere Signal, das erhalten wird, wenn das
immobilisierte Antigen mit Proben von einem nicht infizierten Patienten
inkubiert wird. Im Allgemeinen wird eine Probe, die ein Signal erzeugt,
das drei Standardabweichungen oberhalb des vorbestimmten Cut-off-Wertes liegt, als
positiv für
Chlamydia-Infektion betrachtet. In einer alternativen bevorzugten
Ausführungsart
wird der Cut-off-Wert unter Verwendung einer Receive-Operator-Kurve,
gemäß dem Verfahren
von Sackett et al., Clinical Epidemiology: A Basic Science for Clinical
Medicine, Little Brown and Co., 1985, S. 106–107, bestimmt. Kurz gefasst,
kann in dieser Ausführungsart
der Cut-off-Wert aus einer Aufzeichnung von Paaren von wahren positiven
Raten (sprich Sensitivät)
und falsch positiven Raten (100% Spezifität), die zu jedem möglichen
Cut-off-Wert für
das diagnostische Testergebnis korrespondieren, bestimmt werden.
Der Cut-off-Wert
auf dem Diagramm, der am nächsten
zu der oberen linksseitigen Ecke ist (sprich der Wert, der das größte Gebiet umfasst),
ist der genaueste Cut-off-Wert und eine Probe, die ein Signal erzeugt,
das höher
ist als der Cut-off-Wert,
der durch dieses Verfahren bestimmt wird, kann als positiv betrachtet
werden. Alternativ kann der Cut-off-Wert entlang dem Diagramm nach
links verschoben werden, um die flasch positiven Raten zu minimieren,
oder nach rechts, um die falsch negativen Raten zu minimieren. Im
Allgemeinen wird eine Probe, die ein Signal erzeugt, das höher ist
als der Cut-off-Wert, der durch dieses Verfahren bestimmt wird,
als positiv für Chlamydia-Infektion
betrachtet.
-
Bei
einer verwandten Ausführungsart
wird der Assay in einem schnellen Durchfluss oder Striptest-Format
durchgeführt,
worin das Antigen auf eine Membran, wie Nitrozellulose, immobilisiert
wird. In dem Durchflusstest binden die Antikörper in der Probe an immobilisierte
Polypeptide, während
die Probe durch die Membran passiert. Ein Nachweisreagens (sprich
Protein-A kolloidales Gold) bindet dann an den Antikörper-Polypeptidkomplex,
während
die Lösung,
die das Nachweisreagens enthält,
durch die Membran fließt.
Der Nachweis von gebundenem Nachweisreagens kann dann durchgeführt werden,
wie oben beschrieben wurde. In dem Striptest-Format wird ein Ende
der Membran, an die Polypeptid gebunden ist, in eine Lösung getaucht, die
die Probe enthält.
Die Probe wandert entlang der Membran durch eine Region, die Nachweisreagens
enthält,
und zu dem Gebiet des immobilisiertes Peptids. Die Konzentration
an Nachweisreagens an dem Polypeptid weist auf die Gegenwart von
Anti-Chlamydia-Antikörpern in
der Probe hin. Typischerweise erzeugt die Konzentration von Nachweisreagens
an diesem Ort ein Muster, wie eine Linie, das einfach visuell gelesen
werden kann. Die Abwesenheit eines solchen Mustern weist auf ein
negatives Ergebnis hin. Im Allgemeinen wird die Menge an Polypeptid,
die auf der Membran immobilisiert wird, ausgewählt, um ein visuell erkennbares
Muster zu erzeugen, wenn die biologische Probe einen Spiegel an
Antikörpern
enthält,
der ausreichen würde,
um ein positives Signal in einem ELISA, wie oben diskutiert wurde,
zu erzeugen. Vorzugsweise liegt die Menge an Polypeptid, das auf
der Membran immobilisiert ist, in dem Bereich von ungefähr 25 ng
bis ungefähr
1 μg und mehr
vorzuziehen von ungefähr
50 ng bis ungefähr
500 ng. Solche Tests können
typischerweise mit einer sehr kleinen Menge (z. B. einem Tropfen)
Patientenserum oder Blut durchgeführt werden.
-
Natürlich gibt
es zahlreiche andere Assay-Protokolle, die für die Verwendung mit den Polypeptiden
der vorliegenden Erfindung geeignet sind. Die obigen Beschreibungen
sollen nur exemplarisch sein. Ein Beispiel für ein alternatives Assay-Protokoll, das nützlich bei
solchen Verfahren verwendet werden kann, ist ein Western-Blot, worin
die Proteine, die in einer biologischen Probe vorliegen, auf einem
Gel vor der Ausssetzung gegenüber
einem Bindemittel getrennt werden. Solche Techniken sind denjenigen
mit Bewanderung auf dem Fachgebiet gut bekannt.
-
Diagnostische
Reagentien der vorliegenden Erfindung können auch DNA-Sequenzen umfassen,
die ein oder mehrere der obigen Polypetide oder einen oder mehrere
Anteile davon kodieren. Zum Beispiel können mindestens zwei Oligonucleotidprimer
in einem auf einer Polymerase-Kettenreaktion (PCR) basierendem Assay,
um Chlamydia-spezifische cDNA, die aus einer biologischen Probe
stammt, zu amplifizieren, verwendet werden, worin mindestens einer
der Oligonucleotidprimer für
ein DNA-Molekül
spezifisch ist, das ein Polypeptid der vorliegenden Erfindung codiert.
Die Gegenwart der amplifizierten cDNA wird dann unter Verwendung von
Techniken, die auf dem Fachgebiet gut bekannt sind, wie Gel-Elektrophorese, nachgewiesen. Ähnlich können Oligonucleotidsonden,
die spezifisch für
ein DNA-Molekül,
das ein Polypeptid der vorliegenden Erfindung codiert, sind, in
einem Hybridisierungs-Assay verwendet werden, um die Gegenwart eines
erfinderischen Polypeptids in einer biologischen Probe nachzuweisen.
-
Die
folgenden Beispiele werden zur Illustration und keinesweges zur
Limitierung angeboten.
-
Beispiel 1
-
CD4 T-Zell-Expressionsklonierung für die Identifikation
von T-Zell-stimulierenden Antigenen von Chlamydia trachomatis Serovar
E
-
In
diesem Beispiel wurde eine CD4+ T-Zell-Expressions-Klonierungsstrategie
verwendet, um Chlamydia trachomatis-Antigene, erkannt durch Patienten, die
im Corixa Corporation's
Blutspendeprogramm aufgenommen sind, zu identifizieren. Eine genomische
Bibliothek von Chlamydia trachomatis Serovar E wurde konstruiert
und mit Chlamydia-spezifischen
T-Zell-Linien, die durch Stimulierung von PBMCs aus diesen Spendern erzeugt
wurden, gescreent. Spender CT1 ist ein 27 Jahre alter Mann, dessen
klinische Manifestation eine Non-Gonokokken-Urethritis war und dessen
Urin positiv auf Chlamydia durch Ligase-Kettenreaktion getestet wurde.
Spender CT3 ist ein 43-jähriger
alter Mann, der asymptomatisch und mit Serovar J infiziert ist.
Spender CT10 ist eine 24 Jahre alte Frau, die asymptomatisch ist
und gegenüber
Chlamydia durch ihren Partner exponiert war, aber keine Erkrankung
entwickelte. Spender CT11 ist eine 24 Jahre alte Frau mit multiplen
Infektionen (Serovar J, F und E).
-
Chlamydien-spezifische
T-Zell-Linien wurden von Spendern mit Chlamydia-Genitaltrakt-Infektion
oder Spendern, die gegenüber
Chlamydia exponiert waren, die keine Erkrankung entwickelten, erzeugt.
T-Zell-Linien von den Spendern CT-1, CT-3 und CT-10 wurden durch
Stimulierung von PBMCs mit retikulären Körpern von C. trachomatis Serovar
E erzeugt. T-Zell-Linien von Spender CT-11 wurden durch Stimulation
von PBMCs mit entweder retikulären
Körpern
oder Elementarkörpern
von C. trachomatis Serovar E erzeugt. Eine zufällig gescherte Genombibliothek
von C. trachomatis Serovar E wurde in lambda Zap II-Vektor konstruiert
und eine amplifizierte Bibliothek in Mikrotiterplatten mit 96 Vertiefungen
in einer Dichte von 25 Klonen pro Vertiefung ausplattiert. Die Bakterien
wurden induziert, um das rekombinante Protein in der Gegenwart von
2 mM IPTG für
2 Stunden zu exprimieren, dann pelletiert und in 200 μl RMPI/10%
FBS erneut suspendiert. 10 μl
der induzierten bakteriellen Suspension wurde auf Platten mit 96
Vertiefungen, die autologe Monozyten abgeleitete dendritische Zellen
enthielten, transferiert. Nach einer zweistündigen Inkubation wurden die
dendritischen Zellen gewaschen, um E. coli zu entfernen, und die
T-Zellen wurden zugegeben. Positive E. coli-Pools wurden durch Bestimmung
der IFN-gamma-Produktion
und Proliferation von T-Zellen in den Pools identifiziert. Die Anzahl
von Pools, die durch jede T-Zell-Linie
identifiziert wurden, ist wie folgt: CT1-Linie: 30/480 Pools; CT3-Linie: 91/960
Pools; CT10-Linie: 40/480 Pools; CT11-Linie: 51/480 Pools. Die unter
Verwendung dieses Ansatzes identifizierten Klone werden in SEQ ID
Nr. 1–14
dargelegt.
-
In
einem anderen Beispiel unter Verwendung von im Wesentlichen dem
gleichen Ansatz, der oben beschrieben wurde, identifizierten wir
12 zusätzliche
T-Zell-reaktive Klone aus Chlamydia trachomatis Serovar E Expressions-Screening.
Klon E5-E9-3 (CT1 positiv) enthält
ein 636 bp Insert, das partiell den OLR für dnaK-ähnliches Gen codiert. Ein Teil
dieser Sequenz wurde auch in Klon E1-A5-53 identifiziert. Klon E4-H3-56 (CTI positiv,
463 bp Insert) enthält
einen partiellen OLR für
das TSA-Gen (CT603) auf dem komplementären Strang. Das Insert für Klon E2-G12-52
(1.265 bp) wurde in der CT11-Linie
identifiziert. Es enthält
einen partiellen OLR für
cipB, eine Protease-ATPase. Ein anderer Klon, der mit der CT11-Linie
identifiziert wurde, E1-F9-79 (167 bp), enthält einen partiellen OLR für das Gen
CT133 auf dem komplementären
Strang. CT133 ist eine vorhergesagte rRNA-Methylase. Klon E4-D2-79 (CT3 positiv)
enthält
ein 1.181 pb Insert, das ein partieller OLR für nrdA-Gen ist. Der OLR für dieses
Gen wurde auch in Klon E2-B10-52 (CT10 positiv) identifiziert. Klon
E6-C8-95 enthält ein 731
pb Insert, das unter Verwendung der Spenderlinien CT3, CT1 und CT12
identifiziert wurde. Dieses Insert weist eine Carboxy-terminale
Hälfte
für das
Gen für
den 60 kDA OLR auf. Klon E7-H11-61 (Ct3 positiv – 1.135 bp) besitzt partielle
Inserts für
fliA (CT061), tyrS (CT062), TSA (CT603) und ein hypothetisches Protein
(CT602). Das Insert für
Klon E5-A11-8 (CT10 positiv – 1.736
pb) enthält
den kompletten OLR für
groES (CT111) und einen Hauptanteil für den OLR für groEL (CT110). Klon E3-F2-37
(CT10, CT3, CT11 und CT12 positiv – 1.377 bp Insert) enthält einen
partiellen OLR für
Gen tRNA-Trp (CT322) und einen vollständigen OLR für das Gen
secE (CT321). E4-G9-75 ist ein anderer CT10-Klon, der einen partiellen
OLR (723 pb Insert) für
die Amino-terminale Region des pmpH-Gens (CT872) enthält. Klon
E2-D5-89 (516 pb) ist auch ein CT10-positiver Klon, der einen partiellen
OLR für
pmpD-Gen (12) enthält.
Das Insert für
Klon ES-E2-10 (CT10 positiv) ist 427 pb und enthält einen partiellen OLR für das Haupt-äußere-Membran-Protein omp1.
-
Beispiel 2
-
Zusätzliche
CD4 T-Zell-Expressionsklonierung für die Identifikation von T-Zell-stimulierenden
Antigenen von Chlamydia trachomatis Serovar E
-
Es
wurden 20 Sequenzen aus einzelnen Klonen unter Verwendung eines
Chlamydia trachomatis Serovar E (Ct E) Bibliotheks-Expression-Screening-Verfahrens
isoliert. Beschreibungen, wie die Klone und Linien erzeugt wurden,
werden in Beispiel 1 bereitgestellt.
-
Von
Klon E5-A8-85 (identifiziert unter Verwendung der CT1-Patientenlinie) wurde
herausgefunden, dass er ein 1.433 bp Insert enthält. Dieses Insert enthält eine
große
Region der C-terminalen Hälfte
des CT875, eines Chlamydia trachomatis hypothetisch spezifischen
Gens, das in SEQ ID Nr. 34 offenbart wird. Ebenfalls in diesem Klon
liegt ein partiell offener Leserahmen (OLR) eines hypothetischen
Proteins CT001 vor, das auf dem komplementären Strang ist.
-
Von
dem Klon E9-G2-93 (identifiziert unter Verwendung der C10-Patientenlinie)
wurde gezeigt, dass er 554 pb Insert enthält, dessen Sequenz in SEQ ID
Nr. 33 offenbart wird. Diese Sequenz codiert einen partiellen OLR
für CT178,
ein hypothetisches CT-Protein.
-
Klon
E7-B1-16 (identifiziert unter Verwendung der Patientenlinien CT10,
CT3, CT5, CT11, CT13 und CHH037) besitzt ein 2.577 bp Insert, dessen
Sequenz in SEQ ID Nr. 32 offenbart wird. Von diesem Klon wurde herausgefunden,
dass er 3 OLRs enthält.
Der erste OLR enthält
fast den gesamten OLR für
CT694, ein Chlamydia trachomatis(CT)-spezifisches hyptothetisches
Protein. Der zweite OLR ist ein OLR in voller Länge für CT695, ein anderes hyptothetisches
CT-Protein. Der dritte OLR ist der N-terminale Anteil von CT696.
-
Klon
E9-D5-8 (identifiziert unter Verwendung der Patientenlinien CT10,
CT1, CT4 und CT11) enthält ein
393 bp Insert, das in SEQ ID Nr. 31 offenbart wird. Es wurde herausgefunden,
dass es einen partiellen OLR für
CT680, das S2 ribosomale Protein, codiert.
-
Klon
E9-E10-51 (identifiziert unter Verwendung der Patientenlinie CT10)
enthält
ein 883 bp Insert, dessen Sequenz in SEQ ID Nr. 30 offenbart wird.
Dieser Klon enthält
zwei partielle OLRs. Der erste von diesen ist die C-terminale Hälfte von
CT680, die einige Überlappung
mit dem Insert zeigen kann, das in Klon E9-D5-8 vorliegt. Der zweite
OLR ist der N-terminale partielle OLR für CT679, welches der Verlängerungsfaktor
TS ist.
-
Klon
E3-B4-18 (identifiziert unter Verwendung der CT1-Patientenlinie) enthält 1.224 pb Insert, dessen Sequenz
in SEQ ID Nr. 29 offenbart wird. Dieser Klon enthält vier
OLRs. An dem N-terminalen Ende des Klons befindet sich der komplette
OLR für
CT772, codierend für
anorganische Pyrophosphatase. Der zweite OLR ist ein kleiner Teil
des C-terminalen
Endes von CT771 auf dem komplementären Rahmen. Der dritte ist
ein OLR des hypothetischen Proteins, CT191, und der vierte ist ein
partieller OLR für
CT190, DNA-Gyrase-B.
-
Klon
E10-B2-57 (identifiziert unter Verwendung der CT10-Patientenlinie) enthält ein 822
pb Insert, dessen Sequenz in SEQ ID Nr. 42 offenbart wird. Dieser
Klon enthält
den kompletten OLR für
CT066, ein hypothetisches Protein auf dem komplementären Strang.
-
Klon
E3-F3-18 (identifiziert unter Verwendung der CT1-Patientenlinie) enthält 1.141 bp Insert, dessen Sequenz
in SEQ ID Nr. 41 offenbart wird. Es enthält einen partiellen OLR für pmpG (CT871)
im Rahmen mit dem β-gal-Gen.
-
Klon
E4-D6-21 (identifiziert unter Verwendung der CT3-Patientenlinie) enthält ein 1.297 bp Insert, dessen
Sequenz in SEQ ID Nr. 40 offenbart wird. Dieser Klon enthält einen
sehr kleinen Teil von xseA (CT329), den gesamten OLR für tpiS (CT328)
auf dem komplementären
Strang und einen partiellen Amino-terminalen OLR für trpC (CT327)
auf dem oberen Rahmen.
-
Klon
E1-G9-23 (identifiziert unter Verwendung der CT3-Patientenlinie) enthält ein 1.180 bp Insert, dessen
Sequenz in SEQ ID Nr. 39 offenbart wird. Dieses Klon enthält fast
den gesamtn OLR für
Glycogensynthase (CT798).
-
Klon
E3-A3-31 (identifiziert unter Verwendung der CT1-Patientenlinie) enthält ein 1.834 bp Insert, dessen
Sequenz in SEQ ID Nr. 38 offenbart wird. Dieser Klon enthält eine
große
Region des hypothetischen Gens CT622.
-
Klon
E2-F7-11 (identifiziert unter Verwendung sowohl der CT3- wie auch
der CT10-Patientenlinien) enthält
ein 2.093 bp Insert, dessen Sequenz in SEQ ID Nr. 37 offenbart wird.
Dieser Klon enthält
eine große Region
des rpoN-Gens (CT609) im Rahmen mit β-gal und den kompletten ORL
für das
hyptothetische Gen CT610 auf dem komplementären Strang. Zusätzlich enthält er auch
das carboxyterminale Ende von CT611, einem anderen hypothetischen
Gen.
-
Klon
E7-H11-10 (identifiziert unter Verwendung der CT3-Patientenlinie) enthält ein 1.990
bp Insert, dessen Sequenz in SEQ ID Nr. 36 offenbart wird. Dieser
Klon enthält
den Amino-terminalen partiellen ORL für CT610, einen vollständigen OLR
für CT611,
einen anderen vollständigen
OLR für
CT612 und einen Carboxy-terminalen Teil von CT613. Alle diese Gene
sind hypothetisch und alle liegen auf dem komplementären Strang
vor.
-
Klon
E10-C6-45 (identifiziert unter Verwendung der CT3-Patientenlinie) enthält ein 196
bp Insert, dessen Sequenz in SEQ ID Nr. 35 offenbart wird. Dieser
Klon enthält
einen partiellen OLR für
nrdA (CT827) im Rahmen mit β-gal.
Dieser Klon enthält
ein relativ kleines Insert und hat besonderen Nutzen bei der Bestimmung
des Epitops dieses Gens, das zu der Immunogenität von Serovar E beiträgt.
-
Klon
E3-H6-10 (identifiziert unter Verwendung der CT12-Patientenlinie) enthält ein 3.734
bp Insert, dessen Sequenz in SEQ ID Nr. 48 offenbart wird. Dieser
Klon enthält
OLRs für
eine Reihe von hypothetischen Proteinen. Er enthält die partiellen OLRs für CT223
und CT229 und die kompletten OLRs für CT224, CT225, CT226, CT227
und CT228.
-
Klon
E4-C3-40 (identifiziert unter Verwendung der CT10-Patientenlinie) enthält ein 2.044
bp Insert, dessen Sequenz in SEQ ID Nr. 47 offenbart wird. Dieser
Klon enthält
einen partiellen OLR für
nrdA (CT827) und den kompletten OLR für nrdB (CT828).
-
Klon
E2-D8-19 (identifiziert unter Verwendung der CT1-Patientenlinie) enthält ein 2.010 bp Insert, dessen
Sequenz in SEQ ID Nr. 46 offenbart wird. Dieser Klon enthält sowohl
den OLR für
das Chlamydia trachomatis-Plasmid wie auch partielle OLRs für OLR3 und
OLR6 und vollständige
OLRs für
OLR4 und OLR5.
-
Klon
E3-D10-46 (identifiziert unter Verwendung der Patientenlinien CT1,
CT3, CT4, CT11 und CT12) enthält
ein 1.666 bp Insert, dessen Sequenz in SEQ ID Nr. 45 offenbart wird.
Dieser Klon enthält
einen partiellen OLR für
CT770 (fab F), einen vollständigen
OLR für
CT771 (Hydrolase/Phosphatasehomolog), einen vollständigen OLR
für CT772
(ppa, anorganische Phosphatase) und einen partiellen OLR für CT773
(ldh, Leucin-Dehydrogenase).
-
Klon
E10-H8-1 (identifiziert unter Verwendung sowohl der CT3- wie auch
CT10-Patientenlinien) enthält
ein 1.862 bp Insert, dessen Sequenz in SEQ ID Nr. 44 offenbart wird.
Es enthält
die partiellen OLRs für CT871
(pmpG) wie auch CT872 (pmpH).
-
Klon
E3-F3-7 (identifiziert unter Verwendung der CT1-Patientenlinie) enthält ein 1.643 bp Insert, dessen
Sequenz in SEQ ID Nr. 43 offenbart wird. Es enhält die partiellen OLRs für sowohl
CT869 (pmpE) wie auch CT870 (pmpF).
-
Beispiel 3
-
Zusätzliche
CD4 T-Zell-Exprssionsklonierung für die Identifikation von T-Zell-stimulierenden
Antigenen von Chlamydia trachomatis Serovar E
-
Die
T-Zell-Linie CHH037 wurde aus einer 22 Jahre alten gesunden Frau,
die für
Chlamydia sero-negativ war, erzeugt. Diese Linie wurde verwendet,
um die Chlamydia trachomatis Serovar E Bibliothek zu screenen. 19
Klone wurden auf diesem Screening identifiziert, wie unten beschrieben
wird.
-
Klon
E7-B12-65 enthält
ein 1.179 bp Insert, dessen Sequenz in SEQ ID Nr. 114 offenbart
wird. Es enthält
den vollständigen
OLR des Gens für
Malatdehydrogenase (CT376) auf dem komplementären Strang.
-
Klon
E4-H9-83 enthält
ein 772 bp Insert, dessen Sequenz in SEQ ID Nr. 115 identifziert
wird. Es enthält den
partiellen OLR für
das Hitzeschock-Protein GroEL (CT110).
-
Klon
E9-B10-52 enthält
ein 487 bp Insert, dessen Sequenz in SEQ ID Nr. 116 identifziert
wird. Es enthält
einen partiellen OLR für
das Gen yscC (CT674), einem allgemeinen Sekretionsweg-Protein.
-
Klon
E7-A7-79 enthält
ein 1.014 bp Insert, dessen Sequenz in SEQ ID Nr. 117 offenbart
wird. Es enthält
den kompletten OLR für
das Histon-ähnliche
Entwicklungsgen, hctA (CT743) und einen partiellen ORL für das rRNA-Methyltransferasegen
ygcA (CT742).
-
Klon
E2-D11-18 enthält
ein 287 bp Insert, dessen Sequenz in SEQ ID Nr. 118 offenbart wird.
Es enthält den
partiellen OLR für
hctA (CT743).
-
Klon
E9-H6-15, identifiziert unter Verwendung der CT3-Linie, enthält ein 713
bp Insert, dessen Sequenz in SEQ ID Nr. 125 offenbart wird. Es enthält den partiellen
OLR für
das pmpB-Gen (CT
413).
-
Klon
E3-D10-87, identifiziert unter Verwendung der CT1-Linie, enthält ein 780
bp Insert, dessen Sequenz in SEQ ID Nr. 126 offenbart wird. Es enthält den partiellen
OLR für
CT388, ein hypothetisches Gen, auf dem komplementären Strang
und einen partiellen OLR für
CT389, ein anderes hypothetisches Protein.
-
Klon
E9-D6-43, identifiziert unter Verwendung der CT3-Linie, enthält ein 433
bp Insert, dessen Sequenz in SEQ ID Nr. 127 offenbart wird. Es enthält einen
partiellen OLR für
CT858.
-
Klon
E3-D10-4, identifiziert unter Verwendung der CT1-Linie, enthält ein 803
bp Insert, dessen Sequenz in SEQ ID Nr. 128 offenbart wird. Es enthält einen
partiellen OLR für
pGP3-D, einen OLR, der auf dem Plasmid pCHL1 codiert wird.
-
Klon
E3-G8-7, identifiziert unter Verwendung der CT1-Linie, enthält ein 842
bp Insert, dessen Sequenz in SEQ ID Nr. 129 offenbart wird. Es enthält partielle
OLRs für
CT557 (Leda) und CT558 (LipA).
-
Klon
E3-F11-32, identifiziert unter Verwendung der CT1-Linie, enthält ein 813
bp Insert, dessen Sequenz in SEQ ID Nr. 130 offenbart wird. Es enthält einen
partiellen OLR für
pmpD (CT812).
-
Klon
E2-F8-5, identifiziert unter Verwendung der CT12-Linie, enthält ein 1.947
bp Insert, dessen Sequenz in SEQ ID Nr. 131 offenbart wird. Es enthält einen
kompletten OLR für
den 15 kDa OLR (CT442) und einen partiellen OLR für den 60
kDa OLR (CT443).
-
Klon
E2-G4-39, identifiziert unter Verwendung der CT12-Linie, enthält ein 1.278
bp Insert, dessen Sequenz in SEQ ID Nr. 132 offenbart wird. Es enthält den partiellen
OLR für
den 60 kDa OLR (CT443).
-
Klon
E9-D1-16, identifiziert unter Verwendung der CT10-Linie, enthält ein 916
bp Insert, dessen Sequenz in SEQ ID Nr. 133 enthüllt wird. Es enthält den partiellen
OLR für
das pmpH (CT872).
-
Klon
E3-F3-6, identifiziert unter Verwendung der CT1-Linie, enthält ein 751
bp Insert, dessen Sequenz in SEQ ID Nr. 134 enthüllt wird. Es enthält die partiellen
OLRs, alle auf dem komplementären
Strang, für
die Gene accB (CT123), L13 ribosomal (CT125) und S9 ribosomal (CT126).
-
Klon
E2-D4-70, identifiziert unter Verwendung der CT12-Linie, enthält ein 410
bp Insert, dessen Sequenz in SEQ ID Nr. 135 offenbart wird. Es enthält den partiellen
OLR für
das pmpC-Gen (CT414).
-
Klon
E5-A1-79, identifiziert unter Verwendung der CT1-Linie, enthält ein 2.719
bp Insert, dessen Sequenz in SEQ ID Nr. 136 offenbart wird. Es enthält einen
partiellen OLR für
ydhO (CT127), einen vollständigen OLR
für S9
ribosomales Gen (CT126 auf dem komplementären Strang), einen vollständigen OLR
für das
L13 ribosomale Gen (CT125 auf dem komplementären Strang) und einen partiellen
OLR für
accC (CT124 auf dem komplementären
Strang).
-
Klon
E1-F7-16, identifiziert unter Verwendung der Linien CT12, CT3 und
CT11, enthält
ein 2.354 bp Insert, dessen Sequenz in SEQ ID Nr. 137 offenbart
wird. Es enthält
einen partiellen OLR für
das ftsH-Gen (CT841) und den gesamten OLR für das pnp-Gen (CT842) auf dem
komplementären
Strang.
-
Klon
E1-D8-62, identifiziert unter Verwendung der CT12-Linie, enthält ein 898
bp Insert, dessen Sequenz in SEQ ID Nr. 138 offenbart wird. Es enthält partielle
OLRs für
das ftsH-Gen (CT841) und für
das pnp-Gen (CT842).
-
Beispiel 4
-
Expression von Chlamydia trachomatis rekombinanten
Proteinen
-
Verschiedene
Chlamydia trachomatis Serovar E spezifische Gene wurden in pET17b
kloniert. Dieses Plasmid schließt
einen 6X Histidinmarker an dem N-Ende ein, um die Expression und
Reinigung von rekombinanten Proteinen zu ermöglichen.
-
Die
zwei rekombinanten Proteine voller Länge, CT622 und CT875, wurden
in E. coli exprimiert. Diese beiden Gene wurden unter Verwendung
von CtLGVII-Expressions-Screening identifiziert, aber die Serovar E-Homologe
wurden exprimiert. Die Primer, die verwendet wurden, um diese Gene
zu amplifizieren, basierten auf Serovar D-Sequenzen. Die Gene wurden
unter Verwendung von Serovar E genomischer DNA als der Matrize amplifziert.
Einmal amplifiziert, wurden die Fragmente in pET-17b mit einem N-terminalen
6X-His-Marker kloniert. Nach der Transformation des rekombinanten
Plasmids in XL-I-Blau-Zellen, wurde die DNA präpariert und die Klone vollständig sequenziert.
Die DNA wurde dann in die Expressionswirt BL21-pLysS-Zellen (Novagen)
für die
Herstellung der rekombinanten Proteine transformiert. Die Proteine
wurden mit IPTG induziert und auf Ni-NTA-Agarose unter Verwendung
von Standardverfahren gereinigt. Die DNA-Sequenzen für CTE622 und CTE875 werden
in SEQ ID Nr. 28 bzw. 27 offenbart und ihre Aminosäuresequenzen
werden in SEQ ID Nr. 139 bzw. 140 offenbart.
-
Fünf zusätzliche
Chlamydia trachomatis-Gene wurden geklont. Das Chlamydia trachomatis-spezifische
Protein CT694, das Protein CT695 und das L1-ribosomale Protein,
deren DNA-Sequenzen
in SEQ ID Nr. 119, 120 bzw. 121 offenbart werden.
-
Die
Proteinsequenzen dieser 6X Histidin-rekombinanten Proteine werden
in SEQ ID Nr. 122 (CT694), 123 (CT695) und 124 (L1-ribosomales Protein)
offenbart. Die Gene CT875 und CT622 von Serovar E wurden ebenfalls
unter Verwendung von pET17b als 6X-His-Fusionsproteine geklont.
Diese rekombinanten Proteine wurden exprimiert und gereinigt und
ihre Aminosäuresequenzen
werden in SEQ ID Nr. 140 bzw. 139 offenbart.
-
Beispiel 5
-
Rekombinante
Chlamydia-Antigene, die durch T-Zell-Linien erkannt werden.
-
Patienten-T-Zell-Linien
wurden aus den folgenden Spendern erzeugt:
CT1, CT2, CT3, CT4,
CT5, CT6, CT7, CT8, CT9, CT10, CT11, CT12, CT13, CT14, CT15 und
CT16. Eine Zusammenfassung ihrer Details wird in Tabelle II eingschlossen.
| Tabelle
II: C. trachomatis-Patienten |
| Patienten | Geschlecht | Alter | Klinische
Manifestation | Serovar | IgG-Titer | Multiple
Infektionen |
| CT1 | M | 27 | NGU | LCR | Negativ | Nein |
| CT2 | M | 24 | NGU | D | Negativ | E |
| CT3 | M | 43 | Asymptomatisch
Abgabe Eb Dx war HPV | J | Ct
1:512 Cp 1:1024 Cps 1:256 | Nein |
| CT4 | W | 25 | Asymptomatisch
Abgabe Eb | J | Ct
1:1024 | Y |
| CT5 | W | 27 | BV | LCR | Ct
1:256 Cp 1:256 | F/F |
| CT6 | M | 26 | Perinealer
Ausschlag, Ausfluss, Dysurie | G | Cp
1:1024 | N |
| CT7 | W | 29 | BV
Genitalulcus | E | Ct
1:512 Cp 1:1024 | N |
| CT8 | W | 24 | Nicht
bekannt | LCR | Nicht
getestet | NA |
| CT9 | M | 24 | Asymptomatisch | LCR | Ct
1:128 Cp 1:128 | N |
| CT10 | W | 20 | Milder
Juckreiz vulvär | Negativ | Negativ | 12/1/98 |
| CT11 | W | 21 | BV
abnormaler pap | J | Ct
1:512 | F/F/J/E/E PID
6/96 |
| CT12 | M | 20 | Asymptomatisch | LCR | Cp
1:512 | N |
| CT13 | W | 18 | BV,
Gonorrhoe, Ct vaginal | G | Ct
1:1024 | N |
| CT14 | M | 24 | NGU | LCR | Ct
1:256 Cp 1:256 | N |
| CT15 | W | 21 | Muco-purulente
Zervicitis | Kultur | Ct
1:256 Ct IgM | N |
| CT16 | M | 26 | Asymptomatisch/Kontakt | LCR | NA | N |
| CT8 | M | 38 | Keine
klinische Anamnese für
Erkrankung | Negativ | Negativ | Nein |
| NGU = Non-Gonokokken-Urethritis;
BV = Bakterielle Vaginose; CT = Chlamydiatrachomatis; Cp = Chlamydia
pneumoniae; Eb = Chlamydia Elementarkörper; HPV = menschliches Papillomvirus;
Dx = Diagnose; PID = Pelvic Inflammatory Disease; LCR = Ligase-Kettenreaktion. |
-
PBMC
wurden aus einer zweiten Reihe von Spendern gesammelt und T-Zell-Linien
wurden von einer Untergruppe von diesen erzeugt. Eine Zusammenfassung
der Details für
drei solcher T-Zell-Linien
wird in der Tabelle unten aufgeführt.
| Tabelle
III: Normale Spender |
| Spender | Geschlecht | Alter | CT-IgG-Titer | CP-IgG-Titer |
| CHH011 | W | 49 | 1:64 | 1:16 |
| CHH037 | W | 22 | 0 | 0 |
| CHH042 | W | 25 | 0 | 1:16 |
-
Spender
CHH011 ist eine gesunde 49 Jahre alte weibliche Spenderin, die für C. trachomatis
seronegativ ist. PBMC produzierten höhere Mengen an IFN-gamma in
Reaktion auf C. trachomatis-Elementarkörper im Vergleich zu C. pneumoniae-Elementarkörpern, was
auf eine C. trachomatis-spezifische Reaktion hinweist. Spender CHH037
ist eine 22 Jahre gesunde weibliche Spenderin, die für C. trachomatis
seronegativ ist.
-
PBMC
produzierten höhere
Mengen an IFN-gamma in Reaktion auf C. trachomatis-Elementarkörper im
Vergleich zu C. pneumoniae-Elementarkörpern, was
auf eine C. trachomatis-spezifische Reaktion hinweist. CHH042 ist
eine 25 Jahre alte gesunde weibliche Spenderin mit einem IgG-Titer
von 1:16 für
C. pneumoniae. PBMC produzierten höhere Mengen an IFN-gamma in
Reaktion auf C. trachomatis-Elementarkörper im Vergleich zu C. pneumoniae-Elementarkörpern, was
auf eine C. trachomatis-spezifische Reaktion hinweist.
-
Rekombinante
Proteine für
verschiedene Chlamydia-trachomatis-Gene wurden wie oben beschrieben erzeugt.
Sequenzen für
MOMP wurden von Serovar F abgeleitet. Die Gene CT875, CT622, pmp-B-2, pmpA und CT529
wurden von Serovar E und die Sequenzen für die Gene gro-EL, Swib, pmpD,
pmpG, TSA, CT610, pmpC, pmpE, S13, IpdA, pmpl und pmpH-C wurden
von LII abgeleitet.
-
Verschiedene
der Patienten- und Spenderlinien, die oben beschrieben wurden, wurden
gegen die rekombinanten Chlamydia-Proteine getestet. Tabelle IV fasst
die Ergebnisse der T-Zell-Reaktionen
auf die rekombinanten Chlamydia-Proteine zusammen.
| Tabelle
IV: Rekombinante Chlamydia-Antigene, die durch T-Zell-Linien erkannt
werden |
| Antigen | Serovar | Anzahl von
Treffern | CL 8 L2 | CT 10 E | CT 1
E | CT 3
E | CT 4 L2 | CT 5
E | CT 11 E | CT 12 E | CT 13 E | CHH-011 E | CHH-037 E |
| gro-EL (CT110) | L2 | 10 | - | + | + | + | + | + | + | + | + | + | + |
| MompF (CT681) | F | 10 | - | + | + | + | + | + | + | + | + | + | + |
| CT875 | E | 8 | - | + | + | - | + | + | + | + | + | - | + |
| SWIB (CT460) | L2 | 8 | + | + | - | + | - | + | - | + | + | + | + |
| pmpD (CT812) | L2 | 5 | - | + | + | + | + | - | - | + | + | - | - |
| pmpG (CT871) | L2 | 6 | - | + | + | - | + | + | nt | - | + | + | - |
| TSA (CT603) | L2 | 6 | - | - | + | + | + | + | - | - | + | - | + |
| CT622 | E | 3 | - | - | + | - | + | - | - | - | + | - | - |
| CT610 | L2 | 3 | - | + | - | + | - | - | - | + | - | - | - |
| pmpB-2 (CT413) | E | 3 | - | - | + | + | + | - | - | - | - | - | - |
| pmpC (CT414) | L2 | 4 | - | - | - | + | - | + | - | + | - | - | + |
| pmpE (CT869) | L2 | 3 | - | + | + | - | - | - | - | - | + | - | - |
| S13 (CT509) | L2 | 2 | + | - | - | - | + | - | - | - | - | - | - |
| IpdA (CT557) | L2 | 3 | - | - | + | + | - | - | - | - | - | + | - |
| pmpl (CT874) | L2 | 2 | - | - | + | - | - | - | - | - | - | + | - |
| pmpH-C (CT872) | L2 | 1 | - | - | - | - | - | - | - | + | - | - | - |
| pmpA (CT412) | E | 0 | - | - | - | - | - | - | - | - | - | - | - |
| CT529 | E | 0 | - | - | - | - | - | - | - | - | - | - | - |
-
Obwohl
die vorliegende Erfindung in einiger Ausführlichkeit mit Hilfe von Veranschaulichung
und Beispiel für
die Zwecke der Klarheit des Verständnisses beschrieben wurde,
können Änderungen
und Modifikationen durchgeführt
werden, ohne von dem Umfang der Erfindung abzuweichen, der nur durch
den Umfang der anhängigen
Ansprüche
limiert werden soll. SEQUENZPROTOKOLL