DE102005057250A1 - Wirkstoffe zur Steigerung der Stressabwehr in Pflanzen gegenüber abiotischem Stress und Methoden zu ihrer Auffindung - Google Patents
Wirkstoffe zur Steigerung der Stressabwehr in Pflanzen gegenüber abiotischem Stress und Methoden zu ihrer Auffindung Download PDFInfo
- Publication number
- DE102005057250A1 DE102005057250A1 DE102005057250A DE102005057250A DE102005057250A1 DE 102005057250 A1 DE102005057250 A1 DE 102005057250A1 DE 102005057250 A DE102005057250 A DE 102005057250A DE 102005057250 A DE102005057250 A DE 102005057250A DE 102005057250 A1 DE102005057250 A1 DE 102005057250A1
- Authority
- DE
- Germany
- Prior art keywords
- alkyl
- plants
- oder
- compounds
- stress
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
Classifications
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01H—NEW PLANTS OR NON-TRANSGENIC PROCESSES FOR OBTAINING THEM; PLANT REPRODUCTION BY TISSUE CULTURE TECHNIQUES
- A01H3/00—Processes for modifying phenotypes, e.g. symbiosis with bacteria
- A01H3/04—Processes for modifying phenotypes, e.g. symbiosis with bacteria by treatment with chemicals
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6888—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for detection or identification of organisms
- C12Q1/6895—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for detection or identification of organisms for plants, fungi or algae
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01H—NEW PLANTS OR NON-TRANSGENIC PROCESSES FOR OBTAINING THEM; PLANT REPRODUCTION BY TISSUE CULTURE TECHNIQUES
- A01H1/00—Processes for modifying genotypes ; Plants characterised by associated natural traits
- A01H1/02—Methods or apparatus for hybridisation; Artificial pollination ; Fertility
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01H—NEW PLANTS OR NON-TRANSGENIC PROCESSES FOR OBTAINING THEM; PLANT REPRODUCTION BY TISSUE CULTURE TECHNIQUES
- A01H1/00—Processes for modifying genotypes ; Plants characterised by associated natural traits
- A01H1/04—Processes of selection involving genotypic or phenotypic markers; Methods of using phenotypic markers for selection
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N25/00—Biocides, pest repellants or attractants, or plant growth regulators, characterised by their forms, or by their non-active ingredients or by their methods of application, e.g. seed treatment or sequential application; Substances for reducing the noxious effect of the active ingredients to organisms other than pests
- A01N25/32—Ingredients for reducing the noxious effect of the active substances to organisms other than pests, e.g. toxicity reducing compositions, self-destructing compositions
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N37/00—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom having three bonds to hetero atoms with at the most two bonds to halogen, e.g. carboxylic acids
- A01N37/18—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom having three bonds to hetero atoms with at the most two bonds to halogen, e.g. carboxylic acids containing the group —CO—N<, e.g. carboxylic acid amides or imides; Thio analogues thereof
- A01N37/28—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom having three bonds to hetero atoms with at the most two bonds to halogen, e.g. carboxylic acids containing the group —CO—N<, e.g. carboxylic acid amides or imides; Thio analogues thereof containing the group; Thio analogues thereof
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N41/00—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a sulfur atom bound to a hetero atom
- A01N41/02—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a sulfur atom bound to a hetero atom containing a sulfur-to-oxygen double bond
- A01N41/04—Sulfonic acids; Derivatives thereof
- A01N41/06—Sulfonic acid amides
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N43/00—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds
- A01N43/48—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with two nitrogen atoms as the only ring hetero atoms
- A01N43/56—1,2-Diazoles; Hydrogenated 1,2-diazoles
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N43/00—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds
- A01N43/72—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with nitrogen atoms and oxygen or sulfur atoms as ring hetero atoms
- A01N43/80—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with nitrogen atoms and oxygen or sulfur atoms as ring hetero atoms five-membered rings with one nitrogen atom and either one oxygen atom or one sulfur atom in positions 1,2
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N61/00—Biocides, pest repellants or attractants, or plant growth regulators containing substances of unknown or undetermined composition, e.g. substances characterised only by the mode of action
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/158—Expression markers
Landscapes
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Environmental Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Agronomy & Crop Science (AREA)
- Plant Pathology (AREA)
- Pest Control & Pesticides (AREA)
- Dentistry (AREA)
- Organic Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Analytical Chemistry (AREA)
- Biotechnology (AREA)
- Genetics & Genomics (AREA)
- Botany (AREA)
- Mycology (AREA)
- Biochemistry (AREA)
- General Engineering & Computer Science (AREA)
- Physics & Mathematics (AREA)
- Biophysics (AREA)
- Immunology (AREA)
- Microbiology (AREA)
- Molecular Biology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Developmental Biology & Embryology (AREA)
- Toxicology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Breeding Of Plants And Reproduction By Means Of Culturing (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Cultivation Of Plants (AREA)
- Investigating Or Analysing Biological Materials (AREA)
Abstract
Die Erfindung betrifft ein Verfahren zum Auffinden von Verbindungen, die die Toleranz von Pflanzen gegenüber auf diese Pflanze einwirkenden abiotischem Stressoren, wie beispielsweise Temperatur (wie Kälte, Frost oder Hitze), Wasser (wie Trockenheit, Dürre oder Anoxia), oder die chemische Belastung (wie Mangel oder Überschuss an Mineralsalzen, Schwermetallen, gasförmigen Noxen) durch Expressionssteigerung pflanzenendogener Proteine erhöhen, sowie die Verwendung dieser Verbindungen zur Erhöhung der Pflanzentoleranz gegenüber abiotischen Stressoren.
Description
- Die Erfindung betrifft ein Verfahren zum Auffinden von Verbindungen, die die Toleranz von Pflanzen gegenüber auf diese Pflanze einwirkenden abiotischem Stressoren, wie beispielsweise Temperatur (wie Kälte, Frost oder Hitze), Wasser (wie Trockenheit, Dürre oder Anoxia), oder die chemische Belastung (wie Mangel oder Überschuss an Mineralsalzen, Schwermetalle, gasförmige Noxen) durch Expressionssteigerung pflanzenendogener Proteine erhöhen, sowie die Verwendung dieser Verbindungen zur Erhöhung der Pflanzentoleranz gegenüber abiotischen Stressoren.
- Es ist bekannt, dass Pflanzen auf natürliche Stressbedingungen, wie beispielsweise Kälte, Hitze, Trockenheit, Verwundung, Pathogenbefall (Viren, Bakterien, Pilze, Insekten) etc. aber auch auf Herbizide mit spezifischen oder unspezifischen Abwehrmechanismen reagieren [Pflanzenbiochemie, S. 393–462, Spektrum Akademischer Verlag, Heidelberg, Berlin, Oxford, Hans W. Heldt, 1996.; Biochemistry and Molecular Biology of Plants, S. 1102–1203, American Society of Plant Physiologists, Rockville, Maryland, eds. Buchanan, Gruissem, Jones, 2000].
- In Pflanzen sind zahlreiche Proteine und die sie codierenden Gene bekannt, die an Abwehrreaktionen gegen abiotischen Stress (z.B. Kälte, Hitze, Trockenheit, Salz) beteiligt sind. Diese gehören teilweise zu Signaltransduktionsketten (z.B. Transkriptionsfaktoren, Kinasen, Phosphatasen) oder bewirken eine physiologische Antwort der Pflanzenzelle (z.B. Ionentransport, Entgiftung reaktiver Sauerstoff-Spezies). Zu den Signalkettengenen der abiotischen Stressreaktion gehören u.a. Transkriptionsfaktoren der Klassen DREB und CBF (Jaglo-Ottosen et al., 1998, Science 280: 104–106). An der Reaktion auf Salzstress sind Phosphatasen vom Typ ATPK und MP2C beteiligt. Ferner wird bei Salzstress häufig die Biosynthese von Osmolyten wie Prolin oder Sucrose aktiviert. Beteiligt sind hier z.B. die Sucrose-Synthase und Prolin-Transporter (Hasegawa et al., 2000, Annu Rev Plant Physiol Plant Mol Biol 51: 463–499). Die Stressabwehr der Pflanzen gegen Kälte und Trockenheit benutzt z.T. die gleichen molekularen Mechanismen. Bekannt ist die Akkumulation von sogenannten Late Embryogenesis Abundant Proteins (LEA-Proteine), zu denen als wichtige Klasse die Dehydrine gehören (Ingram and Bartels, 1996, Annu Rev Plant Physiol Plant Mol Biol 47: 277–403, Close, 1997, Physiol Plant 100: 291–296). Es handelt sich dabei um Chaperone, die Vesikel, Proteine und Membranstrukturen in gestressten Pflanzen stabilisieren (Bray, 1993, Plant Physiol 103: 1035–1040). Außerdem erfolgt häufig eine Induktion von Aldehyd-Deydrogenasen, welche die bei oxidativem Stress entstehenden reaktiven Sauerstoff-Spezies (ROS) entgiften (Kirch et al., 2005, Plant Mol Biol 57: 315–332). Heat Shock Faktoren (HSF) und Heat Shock Proteine (HSP) werden bei Hitzestress aktiviert und spielen hier als Chaperone eine ähnliche Rolle wie die Dehydrine bei Kälte- und Trockenstress (Yu et al., 2005, Mol Cells 19: 328–333).
- Die meisten der beschriebenen molekularen Mechanismen werden durch Induktion der Genexpression aktiviert. Dadurch ergibt sich die interessante Möglichkeit spezifische Stressantworten von Pflanzen mit Hilfe der Transkriptom-Analyse, z.B. durch Gene Expression Profiling (GEP) mit DNA Microarrays oder vergleichbaren Techniken zu charakterisieren (Rensink et al., 2005, Genome 48: 598–605, Cheong et al., 2002, Plant Physiology 129: 661–677). Auf diese Weise lassen sich spezifische Stress-reaktive Genexpressionsmuster erfassen und miteinander vergleichen.
- Es ist weiter bekannt, dass chemische Substanzen die Toleranz von Pflanzen gegen abiotischen Stress erhöhen können. Derartige Substanzen werden dabei entweder durch Saatgut-Beizung, durch Blattspritzung oder durch Bodenbehandung appliziert. So wird eine Erhöhung der abiotischen Stresstoleranz von Kulturpflanzen durch Behandlung mit Elicitoren der Systemic Acquired Resistance (SAR) oder Abscisinsäure-Derivaten beschrieben (Schading and Wei, WO-200028055, Abrams and Gusta, US-5201931, Churchill et al., 1998, Plant Growth Regul 25: 35–45).
- Auch bei Anwendung von Fungiziden, insbesondere aus der Gruppe der Strobilurine werden ähnliche Effekte beobachtet, die häufig auch mit einer Ertragssteigerung einhergehen (Draber et al., DE-3534948, Bartlett et al., 2002, Pest Manag Sci 60: 309).
- Desweiteren wurden Effekte von Wachstumsregulatoren auf die Stresstoleranz von Kulturpflanzen beschrieben (Morrison and Andrews, 1992, J Plant Growth Regul 11: 113–117, RD-259027). Bei osmotischem Stress ist eine Schutzwirkung durch Applikation von Osmolyten wie z.B. Glycinbetain oder deren biochemischen Vorstufen, z.B. Cholin-Derivate beobachtet worden (Chen et al., 2000, Plant Cell Environ 23: 609–618, Bergmann et al., DE-4103253). Auch die Wirkung von Antioxidantien wie z.B Naphtole und Xanthine zur Erhöhung der abiotischen Stresstoleranz in Pflanzen wurde bereits beschrieben (Bergmann et al., DD-277832, Bergmann et al., DD-277835). Die molekularen Ursachen der Anti-Stress-Wirkung dieser Substanzen sind jedoch weitgehend unbekannt.
- Somit ist bekannt, dass Pflanzen über mehrere endogene Reaktionsmechanismen verfügen, die eine wirksame Abwehr gegenüber verschiedensten Schadorganismen und/oder natürlichem abiotischen Stress bewirken können. Eine Voraussage darüber, welche Abwehrreaktionen gezielt durch Anwendung von Wirkstoffen hervorgerufen oder moduliert werden können, war bisher jedoch nicht bekannt.
- Es besteht somit ein Bedarf nach einer Methode zum gezielten Auffinden molekularer Aktivatoren pflanzenendogener Abwehrmechanismen gegenüber abiotischem Stress (wie beispielsweise Hitze, Kälte, Trockenheit, Salinität, sowie Säuren-/und Basenbelastung) wodurch neuartige Wirkstoffe aufgefunden, neue Eigenschaften bekannter, aber andersartig wirkender Wirkstoffe identifiziert, oder aber bereits bekannte Moleküle oder Leitstrukturen auf die Verwendung als Induktoren der pflanzenendogenen Abwehrmechanismen gegenüber abiotischen Stressoren optimiert werden können.
- Definitionen nachfolgend verwendeter Begriffe
- Der Begriff „Blast-Analysen" (Blast = Basic Local Alignment Search Tool)", wie hier verwendet, beschreibt die Verwendung geeigneter Computer-Programme zur Klassifikation und zum Auffinden potentiell homologer Sequenzen (Altschul et al., J. Mol. Biol. 1990, 215: 403–410), wobei ein Vergleich (Alignment) zwischen einer Suchsequenz (query sequence) und allen Sequenzen einer oder mehrerer Datenbanken unter Vorgabe einer gewünschten Übereinstimmung in Form eines „Signifkanz-Kriteriums" (scoring function), erfolgt (R. Rauhut, Bioinformatik, S 38–107, Verlag Wiley-VCH Verlag GmbH, Weinheim, 2001).
- Der Begriff „cDNA" (complementary DNA), wie hier verwendet, beschreibt einen DNA-Einzelstrang, der zu einer RNA komplementär, und der durch eine enzymatische reverse Transkription in vitro synthetisiert wird. Die cDNA kann entweder der gesamten RNA-Länge entsprechen, oder aber nur eine Teilsequenz der als Matrix dienenden RNA darstellen.
- Der Begriff „Cluster-Analyse", wie hier verwendet, bedeutet die Zusammenfassung der ermittelten Einzeldaten mittels eines hierfür entwickelten Computerprogramms, wobei Gruppen von Genen, die für Proteine mit ähnlicher Funktion kodieren, oder aber Gene mit ähnlichem Expressionsmuster zusammenfassend dargestellt werden. Hierdurch wird eine hierarchische Minimierung des komplexen Datenmusters erreicht, die in Form eines Dendrograms dargestellt werden kann. Die Cluster-Analyse ermöglicht die klassifizierende Bewertung der erhaltenen Datensätze, die deutlich über die bloße Akkumulierung beziehungsloser Daten hinausgeht.
- Unter den Begriffen „DNA-Chip" und „DNA-Microarray", die hier synonym verwendet werden, wird ein Träger bezeichnet dessen Grundmaterial beispielsweise aus Glas oder Nylon besteht, auf dessen Grundmaterial DNA-Fragmente fixiert sind, wobei die Aufbringung der DNA beispielsweise durch (a) ein photolithographisches Verfahren (DNA wird direkt auf dem Arrayträger synthetisiert), (b) ein Microspotting-Verfahren (extern synthetisierte Oligonukleotide oder PCR-Produkte werden auf den Träger appliziert und kovalent gebunden), oder (c) durch eine Microspraying-Verfahren (extern synthetisierte Oligonukleotide oder PCR-Produkte werden mit einem Tintenstrahldrucker berührungsfrei auf den Träger gesprüht) erfolgen kann (R. Rauhut, Bioinformatik, S 197–199, Verlag Wiley-VCH Verlag GmbH, Weinheim, 2001). Ein DNA-Chip, der genomische Sequenzen eines Organismus representiert, wird als „genomischer DNA-Chip" bezeichnet. Die Auswertung der mit Hilfe dieser DNA-Chips" erhaltenen Messwerte wird als „DNA-Chip-Analyse" bezeichnet.
- Der Begriff „DNA-Chip-Hybridisierung", wie hier verwendet, bedeutet die Paarung zweier einzelstränger, komplementärer Nukleinsäuremoleküle, wobei eines der basenpaarenden Molekülpartner als DNA (Desoxribonukleinsäure) auf dem DNA-Chip in bevorzugt kovalent gebundener Form lokalisiert ist, während der andere in Form der RNA (Ribonukleinsäure) oder der hierzu korrespondierenden cDNA (komplementäre DNA) in Lösung vorliegt. Die Hybridisierung der gebundenen und nicht gebundenen Nukleinsäuren erfolgt auf dem DNA-Chip in wässriger Pufferlösung, gegebenenfalls unter zusätzlich denaturierenden Bedingungen, wie beispielsweise in Gegenwart von Dimethylsulfoxid, bei Temperaturen von 30–60°C, bevorzugt 40–50°C, besonders bevorzugt bei 45°C für 10–20 Stunden, bevorzugt für 14–18 Stunden, besonders bevorzugt für 16 Stunden unter ständiger Bewegung. Die Hygbridisierungsbedingungen können konstant beispielsweise in einem Hybridisierungsofen realisiert werden. Standardmäßig werden in einem solchen Hybridisierungsofen Bewegungen von 60 rpm (rounds per minute, Umdrehungen pro Minute) realisiert.
- Die mit dem Begriff „EST-Sequenz" (Expressed Sequence Tag) bezeichnete Nukleinsäuresequenz, wie hier verwendet, bedeutet eine kurze Sequenz von 200–500 Basen oder Basenpaaren.
- Die synonym gebrauchten Begriffe „Expressionsmuster", „Induktionsmuster" bzw. „Expressionsprofil", wie hier verwendet, beschreiben die zeitlich differenzierte und/oder gewebespezifische Expression der pflanzlichen mRNA, wobei das Muster direkt durch die erzeugte Intensität des Hybridisierungssignals der aus der Pflanze erhaltenen RNA oder deren korrespondierender cDNA mit Hilfe der DNA-Chip-Technologie erhalten wird. Die gemessenen „Induktionswerte" ergeben sich durch direkte Verrechnung mit den korrespondierenden Signalen, die durch Verwendung eines synonymen Chips unter Hybridisierung mit einer nicht behandelten/gestressten Kontrollpflanze erhalten werden.
- Der Begriff „Expressionszustand" der durch das vorgenommene „Gene Expression Profiling" erhalten wird, wie hier verwendet, beschreibt die gesamte erfasste Transkriptionsaktivität zellulärer Gene, die mit Hilfe eines DNA-Chips gemessen wird.
- Der Begriff „Gesamt-RNA", wie hier verwendet, beschreibt die aufgrund des angewendeten Aufschlussverfahrens mögliche Repräsentanz verschiedener pflanzenendogener RNA-Gruppen, die in einer Pflanzenzelle vorliegen können, wie beispielsweise, cytoplasmatische rRNA (ribosomale RNA), cytoplasmatische tRNA (transfer RNA), cytoplasmatische mRNA (messenger RNA), sowie deren jeweilige nucleäre Vorläufer, ctRNA (chloroplastidäre RNA) und mtRNA (mitochondriale RNA), sie umfasst aber auch RNA-Moleküle, die von exogenen Organismen stammen können, wie beispielsweise von Viren, oder parasitierenden Bakterien und Pilzen.
- Der Begriff „Nutzpflanzen", wie hier verwendet, bezeichnet Kulturpflanzen, die als Pflanzen für die Gewinnung von Nahrungsmitteln, Futtermitteln oder für technische Zwecke eingesetzt werden.
- Der Begriff „Safener", wie hier verwendet, bezeichnet eine chemische Verbindung, die nicht pflanzenendogenen Ursprungs ist, und die die phytotoxischen Eigenschaften eines Pestizids gegenüber Nutzpflanzen aufhebt oder verringert, ohne dass die pestizide Wirkung gegenüber Schadorganismen, wie beispielsweise Unkräutern, Bakterien, Viren und Pilzen wesentlich vermindert wird.
- Safener, die neben ihrer eigentlich bekannten Funktion ebenfalls zur Erhöhung der Toleranz gegenüber abiotischen Stressoren beitragen, sind vorzugsweise ausgewählt aus der nachstehend definierten Gruppe, wobei die Auswahl je nach abiotischem Stressor unterschiedlich erfolgen kann, die Verwendung nur eines einzelnen Saferners oder aber mehrerer Safener aus der selben oder aus verschiedenen Gruppen erfolgen kann:
- a) Verbindungen der Formeln (I) bis (III), Indizes folgende Bedeutungen haben: n' ist eine natürliche Zahl von 0 bis 5, vorzugsweise 0 bis 3; T ist eine (C1 oder C2)-Alkandiylkette, die unsubstituiert oder mit einem oder zwei (C1-C4)Alkylresten oder mit [(C1-C3)-Alkoxy]-carbonyl substituiert ist; W ist ein unsubstituierter oder substituierter divalenter heterocyclischer Rest aus der Gruppe der teilungesättigten oder aromatischen Fünfring-Heterocyclen mit 1 bis 3 Heteroringatomen des Typs N oder O, wobei mindestens ein N-Atom und höchstens ein O-Atom im Ring enthalten ist, vorzugsweise ein Rest aus der Gruppe (W1) bis (W4), m' ist 0 oder 1; R17, R19 sind gleich oder verschieden Halogen, (C1-C4)Alkyl, (C1-C4)Alkoxy, Nitro oder (C1-C4)Haloalkyl; R18, R20 sind gleich oder verschieden OR24, SR24 oder NR24R25 oder ein gesättigter oder ungesättigter 3- bis 7-gliedriger Heterocyclus mit mindestens einem N-Atom und bis zu 3 Heteroatomen, vorzugsweise aus der Gruppe O und S, der über das N-Atom mit der Carbonylgruppe in (II) bzw. (III) verbunden ist und unsubstituiert oder durch Reste aus der Gruppe (C1-C4)Alkyl, (C1-C4)Alkoxy oder gegebenenfalls substituiertes Phenyl substituiert ist, vorzugsweise ein Rest der Formel OR24, NHR25 oder N(CH3)2, insbesondere der Formel OR24; R24 ist Wasserstoff oder ein unsubstituierter oder substituierter aliphatischer Kohlenwasserstoffrest, vorzugsweise mit insgesamt 1 bis 18 C-Atomen; R25 ist Wasserstoff, (C1-C6)Alkyl, (C1-C6)Alkoxy oder substituiertes oder unsubstituiertes Phenyl; RX ist H, (C1-C8)Alkyl, C1-C8(Haloalkyl), (C1-C4)Alkoxy(C1-C8)Alkyl, Cyano oder COOR26, worin R26 Wasserstoff, (C1-C8)Alkyl, (C1-C8)Haloalkyl, (C1-C4)Alkoxy(C1-C4)alkyl, (C1-C6)Hydroxyalkyl, (C3-C12)Cycloalkyl oder Tri-(C1-C4)-alkylsilyl ist; R27, R28, R29 sind gleich oder verschieden Wasserstoff, (C1-C8)Alkyl, (C1-C8)Haloalkyl, (C3-C12)Cycloalkyl oder substituiertes oder unsubstituiertes Phenyl; R21 ist (C1-C4)Alkyl, (C1-C4)Haloalkyl, (C2-C4)Alkenyl, (C2-C4)Haloalkenyl, (C3-C7)Cycloalkyl, vorzugsweise Dichlormethyl; R22, R23 ist gleich oder verschieden Wasserstoff, (C1-C4)Alkyl, (C2-C4)Alkenyl, (C2-C4)Alkinyl, (C1-C4)Haloalkyl, (C2-C4)Haloalkenyl, (C1-C4)Alkylcarbamoyl(C1-C4)alkyl, (C2-C4)Alkenylcarbamoyl-(C1-C4)alkyl, (C1-C4)Alkoxy-(C1-C4)alkyl, Dioxolanyl-(C1-C4)alkyl, Thiazolyl, Furyl, Furylalkyl, Thienyl, Piperidyl, substituiertes oder unsubstituiertes Phenyl, oder R22 und R23 bilden zusammen einen substituierten oder unsubstituierten heterocyclischen Ring, vorzugsweise einen Oxazolidin-, Thiazolidin-, Piperidin-, Morpholin-, Hexahydropyrimidin- oder Benzoxazinring;
- b) eine oder mehreren Verbindungen aus Gruppe: 1,8-Naphthalsäureanhydrid, Methyl-diphenylmethoxyacetat, 1-(2-Chlorbenzyl)-3-(1-methyl-1-phenylethyl)harnstoff (Cumyluron), O,O-Diethyl S-2-ethylthioethyl phosphordithioat (Disulfoton), 4-Chlorphenyl-methylcarbamat (Mephenate), O,O-Diethyl-O-phenylphosphorotioat (Dietholate), 4-Carboxy-3,4-dihydro-2H-1-benzopyran-4-essigsäure (CL-304415, CAS-Regno: 31541-57-8), Cyanomethoxyimino(phenyl)acetonitril (Cyometrinil), 1,3-Dioxolan-2-ylmethoxyimino(phenyl)acetonitril (Oxabetrinil), 4'-Chlor-2,2,2-trifluoracetophenon-O-1,3-dioxolan-2-ylmethyloxim (Fluxofenim), 4,6-Dichlor-2-phenylpyrimidin (Fenclorim), Benzyl-2-chlor-4-trifluormethyl-1,3-thiazol-5-carboxylat (Flurazole), 2-Dichlormethyl-2-methyl-1,3-dioxolan (MG-191), N-(4-Methylphenyl)-N'-(1-methyl-1-phenylethyl)harnstoff (Dymron), (2,4-Dichlorphenoxy)essigsäure (2,4-D), (4-Chlorphenoxy)essigsäure, (R,S)-2-(4-Chlor-o-tolyloxy)propionsäure (Mecoprop), 4-(2,4-Dichlorphenoxy)buttersäure (2,4-DB), (4-Chlor-o-tolyloxy)essigsäure (MCPA), 4-(4-Chlor-o-tolyloxy)buttersäure, 4-(4-Chlorphenoxy)buttersäure, 3,6-Dichlor-2-methoxybenzoesäure (Dicamba), 1-(Ethoxycarbonyl)ethyl 3,6-dichlor-2-methoxybenzoat (Lactidichlor) sowie deren Salze und Ester, vorzugsweise (C1-C8);
- c) N-Acylsulfonamide der Formel (IV) und ihre Salze, worin R30 Wasserstoff, einen Kohlenwasserstoffrest, einen Kohlenwasserstoffoxyrest, einen Kohlenwasserstoffthiorest oder einen Heterocyclylrest, der vorzugsweise über ein C-Atom gebunden ist, wobei jeder der letztgenannten 4 Reste unsubstituiert oder durch einen oder mehrere gleiche oder verschiedene Reste aus der Gruppe Halogen, Cyano, Nitro, Amino, Hydroxy, Carboxy, Formyl, Carbonamid, Sulfonamid und Reste der Formel -Za-Ra substituiert ist, wobei jeder Kohlenwasserstoffteil vorzugsweise 1 bis 20 C-Atome aufweist und ein C-haltiger Rest R30 inklusive Substituenten vorzugsweise 1 bis 30 C-Atome aufweist; R31 Wasserstoff oder (C1-C4)-Alkyl, vorzugsweise Wasserstoff, oder R30 und R31 zusammen mit der Gruppe der Formel -CO-N- den Rest eines 3- bis 8-gliedrigen gesättigten oder ungesättigten Rings; R32 gleich oder verschieden Halogen, Cyano, Nitro, Amino, Hydroxy, Carboxy, Formyl, CONH2, SO2NH2 oder einen Rest der Formel -Zb-Rb; R33 Wasserstoff oder (C1-C4)-Alkyl, vorzugsweise H; R34 gleich oder verschieden Halogen, Cyano, Nitro, Amino, Hydroxy, Carboxy, CHO, CONH2, SO2NH2 oder einen Rest der Formel -Zc-Rc; Ra einen Kohlenwasserstoffrest oder einen Heterocyclylrest, wobei jeder der beiden letztgenannten Reste unsubstituiert oder durch einen oder mehrere gleiche oder verschiedene Reste aus der Gruppe Halogen, Cyano, Nitro, Amino, Hydroxy, Mono- und Di-[(C1-C4)-alkyl]-amino substituiert ist, oder einen Alkylrest, in dem mehrere, vorzugsweise 2 oder 3, nicht benachbarte CH2-Gruppen jeweils durch ein Sauerstoffatom ersetzt sind; Rb, Rc gleich oder verschieden einen Kohlenwasserstoffrest oder einen Heterocyclylrest, wobei jeder der beiden letztgenannten Reste unsubstituiert oder durch einen oder mehrere gleiche oder verschiedene Reste aus der Gruppe Halogen, Cyano, Nitro, Amino, Hydroxy, Phosphoryl, Halogen(C1-C4)-alkoxy, Mono- und Di-((C1-C4)-alkyl]-amino substituiert ist, oder einen Alkylrest, in dem mehrere, vorzugsweise 2 oder 3, nicht benachbarte CH2-Gruppen jeweils durch ein Sauerstoffatom ersetzt sind; Za eine divalente Gruppe der Formel -O-, -S-, -CO-, -CS-, -CO-O-, -CO-S-, -O-CO-, -S-CO-, -SO-, -SO2-, -NR*-, -CO-NR*-, -NR*-CO-, -SO2-NR*- oder -NR*-SO2-, wobei die rechts angegebene Bindung der jeweiligen divalenten Gruppe die Bindung zum Rest Ra ist und wobei die R* in den letztgenannten 5 Resten unabhängig voneinander jeweils H, (C1-C4)-Alkyl oder Halo-(C1-C4)alkyl bedeuten; Zb, Zc unabhängig voneinander eine direkte Bindung oder eine divalente Gruppe der Formel -O-, -S-, -CO-, -CS-, -CO-O-, -CO-S-, -O-CO-, -S-CO-, -SO-, -SO2-, -NR*-, -SO2-NR*-, -NR*-SO2-, -CO-NR*- oder -NR*-CO-, wobei die rechts angegebene Bindung der jeweiligen divalenten Gruppe die Bindung zum Rest Rb bzw. Rc ist und wobei die R* in den letztgenannten 5 Resten unabhängig voneinander jeweils H, (C1-C4)-Alkyl oder Halo-(C1-C4)-alkyl bedeuten; n eine ganze Zahl von 0 bis 4, vorzugsweise 0, 1 oder 2, insbesondere 0 oder 1, und m eine ganze Zahl von 0 bis 5, vorzugsweise 0, 1, 2 oder 3, insbesondere 0, 1 oder 2; bedeuten;
- d) Acylsulfamoylbenzoesäureamide der allgemeinen Formel (V), gegebenenfalls auch in Salzform, worin X3 CH oder N; R35 Wasserstoff, Heterocyclyl oder einen Kohlenwasserstoffrest, wobei die beiden letztgenannten Reste gegebenenfalls durch einen oder mehrere, gleiche oder verschiedene Reste aus der Gruppe Halogen, Cyano, Nitro, Amino, Hydroxy, Carboxy, CHO, CONH2, SO2NH2 und Za-Ra substituiert sind; R36 Wasserstoff, Hydroxy, (C1-C6)-Alkyl, (C2-C6)-Alkenyl, (C2-C6)-Alkinyl, (C1-C6)-Alkoxy, (C2-C6)-Alkenyloxy, wobei die fünf letztgenannten Reste gegebenenfalls durch einen oder mehrere, gleiche oder verschiedene Reste aus der Gruppe Halogen, Hydroxy, (C1-C4)-Alkyl, (C1-C4)-Alkoxy und (C1-C4)-Alkylthio substituiert sind, oder R35 und R36 zusammen mit dem sie tragenden Stickstoffatom einen 3- bis 8-gliedrigen gesättigten oder ungesättigten Ring; R37 Halogen, Cyano, Nitro, Amino, Hydroxy, Carboxy, CHO, CONH2, SO2NH2 oder Zb-Rb; R38 Wasserstoff, (C1-C4)-Alkyl, (C2-C4)-Alkenyl oder (C2-C4)-Alkinyl; R39 Halogen, Cyano, Nitro, Amino, Hydroxy, Carboxy, Phosphoryl, CHO, CONH2, SO2NH2 oder Zc-Rc; Ra einen (C2-C20)-Alkylrest, dessen Kohlenstoffkette ein- oder mehrfach durch Sauerstoffatome unterbrochen ist, Heterocyclyl oder einen Kohlenwasserstoffrest, wobei die zwei letztgenannten Reste gegebenenfalls durch einen oder mehrere, gleiche oder verschiedene Reste aus der Gruppe Halogen, Cyano, Nitro, Amino, Hydroxy, Mono- und Di-[(C1-C4)-alkyl]-amino substituiert sind; Rb, Rc gleich oder verschieden einen (C2-C20)-Alkylrest, dessen Kohlenstoffkette ein- oder mehrfach durch Sauerstoffatome unterbrochen ist, Heterocyclyl oder einen Kohlenwasserstoffrest, wobei die zwei letztgenannten Reste gegebenenfalls durch einen oder mehrere, gleiche oder verschiedene Reste aus der Gruppe Halogen, Cyano, Nitro, Amino, Hydroxy, Phosphoryl, (C1-C4)-Haloalkoxy, Mono- und Di-[(C1-C4)-alkyl]-amino substituiert sind; Za eine divalente Einheit aus der Gruppe O, S, CO, CS, C(O)O, C(O)S, SO, SO2, NRd, C(O)NRd oder SO2NRd; Zb, Zc gleich oder verschieden eine direkte Bindung oder eine divalente Einheit aus der Gruppe O, S, CO, CS, C(O)O, C(O)S, SO, SO2, NRd, SO2NRd oder C(O)NRd; Rd Wasserstoff, (C1-C4)-Alkyl oder (C1-C4)-Haloalkyl; n eine ganze Zahl von 0 bis 4, und m für den Fall, dass X für CH steht, eine ganze Zahl von 0 bis 5, und für den Fall, dass X für N steht, eine ganze Zahl von 0 bis 4 bedeuten;
- e) Verbindungen von Typ der Acylsulfamoylbenzoesäureamide, z.B. der nachfolgenden Formel (VI), die z.B. bekannt sind aus WO 99/16744, z.B. solche worin R21 = Cyclo-Propyl und R22 = H ist (S3-1 = 4-Cyclopopylaminocarbonyl-N-(2 methoxybenzoyl)benzolsulfonamid), R21 = Cyclo-Propyl und R22 = 5-Cl ist (S3-2), R21 = Ethyl und R22 = H ist (S3-3), R21 = iso-Propyl und R22 = 5-Cl ist (S3-4) und R21 = iso-Propyl und R22 = H ist (S3-5);
- f) Verbindungen vom Typ der N-Acylsulfamoylphenylharnstoffe der Formel (VII), die z.B. bekannt sind aus der EP-A-365484, worin A für einen Rest aus der Gruppe Rα und Rβ unabhängig voneinander für Wasserstoff, C1-C8-Alkyl, C3-C8-Cycloalkyl, C3-C6 Alkenyl, C3-C6-Alkinyl, Rα und Rβ gemeinsam für eine C4-C6-Alkylenbrücke oder eine durch Sauerstoff, Schwefel, SO, SO2, NH oder -N(C1-C4-Alkyl)- unterbrochene C4-C6-Alkylenbrücke, Rγ für Wasserstoff oder C1-C4-Alkyl, Ra und Rb unabhängig voneinander für Wasserstoff, Halogen, Cyan, Nitro, Trifluormethyl, C1-C4-Alkyl, C1-C4-Alkoxy, C1-C4-Alkylthio, C1-C4-Alkylsulfinyl, C1-C4-Alkylsulfonyl, -COORj, -CONRkRm, -CORn, -SO2NRkRm oder -OSO2-C1-C4-Alkyl, oder Ra und Rb gemeinsam für eine C3-C4-Alkylenbrücke, die durch Halogen oder C1-C4-Alkyl substituiert sein kann, oder eine C3-C4-Alkenylenbrücke, die durch Halogen oder C1-C4-Alkyl substituiert sein kann, oder eine C4-Alkadienylenbrücke, die durch Halogen oder C1-C4-Alkyl substituiert sein kann, und Rg und Rh unabhängig voneinander für Wasserstoff, Halogen, C1-C4-Alkyl, Trifluormethyl, Methoxy, Methylthio oder -COORj stehen, wobei Rc Wasserstoff, Halogen, C1-C4-Alkyl oder Methoxy, Rd Wasserstoff, Halogen, Nitro, C1-C4-Alkyl, C1-C4-Alkoxy, C1-C4-Alkylthio, C1-C4-Alkylsulfinyl, C1-C4-Alkylsulfonyl, -COORj oder -CONRkRm, Re Wasserstoff, Halogen, C1-C4-Alkyl, -COORj, Trifluormethyl oder Methoxy, oder Rd nd Re gemeinsam für eine C3-C4-Alkylenbrücke, Rf Wasserstoff, Halogen oder C1-C4-Alkyl, RX und RY unabhängig voneinander Wasserstoff, Halogen, C1-C4-Alkyl, C1-C4-Alkoxy, C1-C4-Alkylthio, -COOR4, Trifluormethyl, Nitro oder Cyan, Rj, Rk und Rm unabhängig voneinander Wasserstoff oder C1-C4-Alkyl, Rk und Rm gemeinsam eine C4-C6-Alkylenbrücke oder eine durch Sauerstoff, NH oder -N(C1-C4-Alkyl)- unterbrochene C4-C6-Alkylenbrücke, und Rn C1-C4-Alkyl, Phenyl oder durch Halogen, C1-C4-Alkyl, Methoxy, Nitro oder Trifluormethyl substituiertes Phenyl bedeuten, bevorzugt 1-[4-(N-2-Methoxybenzoylsulfamoyl)phenyl]-3-methylharnstoff, 1-[4-(N-2-Methoxybenzoylsulfamoyl)phenyl]-3,3-dimethylharnstoff, 1-[4-(N-4,5-Dimethylbenzoylsulfamoyl)phenyl]-3-methylharnstoff, 1-[4-(N-Naphthoylsulfamoyl)phenyl]-3,3-dimethylharnstoff,
- g) Verbindungen vom Typ der Acylsulfamoylbenzoesäureamide der Formel (VIII), bekannt aus EP-A-1019368, gegebenenfalls auch in Salzform, worin R1 bedeutet Methyl, Methoxy oder Trifluormethoxy; R2 bedeutet Wasserstoff, Chlor oder Methyl; R3 bedeutet Wasserstoff, Ethyl oder Propargyl; R4 bedeutet Ethyl, Cyclopropyl, iso-Propyl oder Propargyl, oder R3 und R4 bilden gemeinsam die Gruppe (CH2)4, einschließlich der Stereoisomeren und der in der Landwirtschaft gebräuchlichen Salze.
- Die Verbindungen der Formel (I) sind z.B. aus EP-A-0 333 131 (ZA-89/1960), EP-A-0 269 806 (US-A-4,891,057), EP-A-0 346 620 (AU-A-89/34951), EP-A-0 174 562, EP-A-0 346 620 (WO-A-91/08 202), WO-A-91/07 874 oder WO-A 95/07 897 (ZA 94/7120) und der dort zitierten Literatur bekannt oder können nach oder analog den dort beschriebenen Verfahren hergestellt werden.
- Die Verbindungen der Formel (II) sind aus EP-A-0 086 750, EP-A-0 94349 (US-A-4,902,340), EP-A-0 191736 (US-A-4,881,966) und EP-A-0 492 366 und dort zitierter Literatur bekannt oder können nach oder analog den dort beschriebenen Verfahren hergestellt werden. Einige Verbindungen sind ferner in EP-A-0 582 198 und WO 2002/34048 beschrieben.
- Die Verbindungen der Formel (III) sind aus zahlreichen Patentanmeldungen bekannt, beispielsweise US-A-4,021,224 und US-A-4,021,229.
- Verbindungen der Gruppe (b) sind weiterhin aus CN-A-87/102 789, EP-A-365484 sowie aus "The Pesticide Manual", The British Crop Protection Council and the Royal Society of Chemistry, 11th edition, Farnham 1997, bekannt.
- Die Verbindungen der Gruppe (c) sind in der WO-A-97/45016, die der Gruppe (d) in der WO-A-99/16744, die der Gruppe B (e) in der EP-A-365484 und die der Gruppe (g) in EP-A-1019368 beschrieben.
- Die zitierten Schriften enthalten ausführliche Angaben zu Herstellungsverfahren und Ausgangsmaterialien und nennen bevorzugte Verbindungen. Auf diese Schriften wird ausdrücklich Bezug genommen, sie gelten durch Zitat als Bestandteil dieser Beschreibung.
- Bevorzugt sind als Safener bekannte Verbindungen der Formel (I) und/oder (II) bei denen die Symbole und Indizes folgende Bedeutungen haben:
R24 ist Wasserstoff, (C1-C18)-Alkyl, (C3-C12)-Cycloalkyl, (C2-C8)-Alkenyl und (C2-C18)Alkinyl, wobei die C-haltigen Gruppen durch einen oder mehrere, vorzugsweise bis zu drei, Reste R50 substituiert sein können;
R50 ist gleich oder verschieden Halogen, Hydroxy, (C1-C8)-Alkoxy, (C1-C8)Alkylthio, (C2-C8)Alkenylthio, (C2-C8)Alkinylthio, (C2-C8)Alkenyloxy, (C2-C8)Alkinyloxy, (C3-C7)Cycloalkyl, (C3-C7)Cycloalkoxy, Cyano, Mono- und Di-(C1-C4)-alkyl)-amino, Carboxy, (C1-C8)Alkoxycarbonyl, (C2-C8)Alkenyloxycarbonyl, (C1-C8)Alkylthiocarbonyl, (C2-C8)Alkinyloxycarbonyl, (C1-C8)Alkylcarbonyl, (C2-C8)Alkenylcarbonyl, (C2-C8)Alkinylcarbonyl, 1-(Hydroxyimino)-(C1-C6)-alkyl, 1-[(C1-C4)Alkylimino]-(C1-C4)-alkyl, 1-[(C1-C4)Alkoxyimino]-(C1-C6)-alkyl, (C1-C8)Alkylcarbonylamino, (C2-C8)Alkenylcarbonylamino, (C2-C8)Alkinylcarbonylamino, Aminocarbonyl, (C1-C8)Alkylaminocarbonyl, Di-C1-C6)-alkylaminocarbonyl, (C2-C6)Alkenylaminocarbonyl, (C2-C6)Alkinylaminocarbonyl, (C1-C8)Alkoxycarbonylamino, (C1-C8)Alkylaminocarbonylamino, (C1-C6)Alkylcarbonyloxy, das unsubstituiert oder durch R51 substituiert ist, (C2-C6)Alkenylcarbonyloxy, (C2-C6)Alkinylcarbonyloxy, (C1-C8)Alkylsulfonyl, Phenyl, Phenyl-(C1-C6)-alkoxy, Phenyl-(C1-C6)-alkoxycarbonyl, Phenoxy, Phenoxy-(C1-C6)-alkoxy, Phenoxy-(C1-C6)-alkoxycarbonyl, Phenylcarbonyloxy, Phenylcarbonylamino, Phenyl-(C1-C6)-alkylcarbonylamino, wobei die letztgenannten 9 Reste im Phenylring unsubstituiert oder ein- oder mehrfach, vorzugsweise bis zu dreifach durch Reste R52 substituiert sind; SiR'3, -O-SiR'3, R'3Si-(C1-C8)-alkoxy, -CO-O-NR'2, -O-N=CR'2, -N=CR'2, -O-NR'2, -NR'2, CH(OR')2, -O-(CH2)m -CH(OR')2, -CR'''(OR')2, -O-(CH2)mCR'''(OR'')2 oder durch R''O-CHR'''CHCOR''-(C1-C6)-alkoxy,
R51 ist gleich oder verschieden Halogen, Nitro, (C1-C4)Alkoxy und unsubstituiertes oder mit einem oder mehreren, vorzugsweise bis zu drei Resten R52 substituiertes Phenyl;
R52 ist gleich oder verschieden Halogen, (C1-C4)Alkyl, (C1-C4)Alkoxy, (C1-C4)Haloalkyl, (C1-C4)-Haloalkoxy oder Nitro;
R' ist gleich oder verschieden Wasserstoff, (C1-C4)Alkyl, unsubstituiertes oder durch einen oder mehrere, vorzugsweise bis zu drei, Reste R52 substituiertes Phenyl oder zwei Reste R' bilden zusammen eine (C2-C6)Alkandiylkette;
R'' ist gleich oder verschieden (C1-C4)Alkyl oder zwei Reste R'' bilden zusammen eine (C2-C6)Alkandiylkette;
R''' ist Wasserstoff oder (C1-C4)Alkyl;
m ist 0, 1, 2, 3, 4, 5 oder 6. - Besonders bevorzugt sind als Safener bekannte Verbindungen der Formel (I) und/oder (II), bei denen die Symbole und Indizes folgende Bedeutungen haben:
R24 ist Wasserstoff, (C1-C8)Alkyl oder (C3-C7)Cycloalkyl, wobei die vorstehenden C-haltigen Reste unsubstituiert sind oder ein- oder mehrfach durch Halogen oder ein- oder zweifach, vorzugsweise einfach, durch Reste R50 substituiert sind,
R50 ist gleich oder verschieden Hydroxy, (C1-C4)Alkoxy, Carboxy, (C1-C4)Alkoxycarbonyl, (C2-C6)Alkenyloxycarbonyl, (C2-C6)Alkinyloxycarbonyl, 1-(Hydroxyimino)-(C1-C4)-alkyl, 1-[(C1-C4)Alkylimino]-(C1-C4)-alkyl und 1-[(C1-C4)Alkoxyimino]-(C1-C4)-alkyl; -SiR'3, -O-N=CR'2, -N=CR'2, -NR'2, und -O-NR'2, worin R' gleich oder verschieden Wasserstoff, (C1-C4)Alkyl oder paarweise eine (C4-C5)Alkandiylkette bedeutet,
R27, R28, R29 sind gleich oder verschieden Wasserstoff, (C1-C8)Alkyl, (C1-C6)Haloalkyl, (C3-C7)Cycloalkyl oder Phenyl, das unsubstituiert oder durch einen oder mehrere der Reste aus der Gruppe Halogen, Cyano, Nitro, Amino, Mono- und Di-[(C1-C4)alkyl]-amino, (C1-C4)Alkyl, (C1-C4)Haloalkyl, (C1-C4)Alkoxy, (C1-C4)Haloalkoxy, (C1-C4)Alkylthio und (C1-C4)Alkylsulfonyl substituiert ist;
Rx ist Wasserstoff oder COOR24, worin R26 Wasserstoff, (C1-C8)Alkyl, (C1-C8)Haloalkyl, (C1-C4-Alkoxy)-(C1-C4)-alkyl, (C1-C6)Hydroxyalkyl, (C3-C7)Cycloalkyl oder Tri-(C1-C4)-alkylsilyl bedeutet,
R17, R19 sind gleich oder verschieden Halogen, Methyl, Ethyl, Methoxy, Ethoxy, (C1 oder C2)-Haloalkyl, vorzugsweise Wasserstoff, Halogen oder (C1 oder C2)-Haloalkyl. - Ganz besonders bevorzugt sind als Safener bekannte Verbindungen in welchen die Symbole und Indizes in Formel (I) folgende Bedeutungen haben:
R17 ist Halogen, Nitro oder (C1-C4)Haloalkyl;
n' ist 0, 1, 2 oder 3;
R18 ist ein Rest der Formel OR24,
R24 ist Wasserstoff, (C1-C8)Alkyl oder (C3-C7)Cycloalkyl, wobei die vorstehenden C-haltigen Reste unsubstituiert sind oder ein- oder mehrfach, vorzugsweise bis zu dreifach, durch gleiche oder verschiedene Halogen-Reste oder bis zu zweifach, vorzugsweise einfach, durch gleiche oder verschiedene Reste aus der Gruppe Hydroxy, (C1-C4)Alkoxy, (C1-C4)Alkoxycarbonyl, (C2-C6)Alkenyloxycarbonyl, (C2-C6)Alkinyloxycarbonyl, 1-(Hydroxyimino)-(C1-C4)-alkyl, 1-[(C1-C4)Alkylimino]-(C1-C4)-alkyl, 1-[(C1-C4)Alkoxyimino]-(C1-C4)-alkyl und Reste der Formeln -SiR'3, -O-N=R'2, -N=CR'2, -NR'2 und -O-NR'2 substituiert sind, wobei die Reste R' in den genannten Formeln gleich oder verschieden Wasserstoff, (C1-C4)Alkyl oder paarweise (C4 oder C5)Alkandiyl bedeuten;
R27, R28, R29 sind gleich oder verschieden Wasserstoff, (C1-C8)Alkyl, (C1-C6)Haloalkyl, (C3-C7)Cycloalkyl oder Phenyl, das unsubstituiert oder durch einen oder mehrere der Reste aus der Gruppe Halogen, (C1-C4)Alkyl, (C1-C4)Alkoxy, Nitro, (C1-C4)Haloalkyl und (C1-C4)Haloalkoxy substituiert ist, und
RX ist Wasserstoff oder COOR26, worin R26 Wasserstoff, (C1-C8)Alkyl, (C1-C8)Haloalkyl, (C1-C4)Alkoxy-(C1-C4)-alkyl, (C1-C6)Hydroxyalkyl, (C3-C7)Cycloalkyl oder Tri-(C1-C4)-alkylsilyl ist. - Ganz besonders bevorzugt sind auch als Safener bekannte Verbindungen der Formel (II), bei denen die Symbole und Indizes folgende Bedeutungen haben:
R19 ist Halogen oder (C1-C4)Haloalkyl;
n' ist 0, 1, 2 oder 3, wobei (R19)n, vorzugsweise 5-Cl ist;
R20 ist ein Rest der Formel OR24;
T ist CH2 oder CH(COO-(C1-C3-Alkyl)) und
R24 ist Wasserstoff, (C1-C8)Alkyl, (C1-C8)Haloalkyl oder (C1-C4)Alkoxy-(C1-C4)-alkyl, vorzugsweise Wasserstoff oder (C1-C8)Alkyl. - Insbesondere bevorzugt sind dabei als Safener bekannte Verbindungen der Formel (I) bei denen die Symbole und Indizes folgende Bedeutungen haben:
W ist (W1);
R17 ist Halogen oder (C1-C2)Haloalkyl;
n' ist 0, 1, 2 oder 3, wobei (R17)n' vorzugsweise 2,4-Cl2 ist;
R18 ist ein Rest der Formel OR24;
R24 ist Wasserstoff, (C1-C8)Alkyl, (C1-C4)Haloalkyl, (C1-C4)Hydroxyalkyl, (C3-C7)Cycloalkyl, (C1-C4)Alkoxy-(C1-C4)-alkyl oder Tri-(C1-C2)-alkylsilyl, vorzugsweise (C1-C4)Alkyl;
R27 ist Wasserstoff, (C1-C8)Alkyl, (C1-C8)Haloalkyl oder (C3-C7)Cycloalkyl, vorzugsweise Wasserstoff oder (C1-C4)Alkyl, und
Rx ist COOR26, worin R26 Wasserstoff, (C1-C8)Alkyl, (C1-C4)Haloalkyl, (C1-C4)Hydroxyalkyl, (C3-C7)Cycloalkyl, (C1-C4)Alkoxy-(C1-C4)-alkyl oder Tri-(C1-C2)-alkylsilyl, vorzugsweise Wasserstoff oder (C1-C4)Alkyl ist. - Insbesondere bevorzugt sind auch als Safener bekannte Verbindungen der Formel (I), worin die Symbole und Indizes folgende Bedeutungen haben:
W ist (W2);
R17 ist Halogen oder (C1-C2)Haloalkyl;
n' ist 0, 1, 2 oder 3, wobei (R17)n' vorzugsweise 2,4-Cl2 ist;
R18 ist ein Rest der Formel OR24;
R24 ist Wasserstoff, (C1-C8)Alkyl, (C1-C4)Haloalkyl, (C1-C4)Hydroxyalkyl, (C3-C7)Cycloalkyl, (C1-C4-Alkoxy)-C1-C4-alkyl oder Tri-(C1-C2)-alkyl-silyl, vorzugsweise (C1-C4)Alkyl, und
R27 ist Wasserstoff, (C1-C8)Alkyl, (C1-C4)Haloalkyl, (C3-C7)Cycloalkyl oder unsubstituiertes oder substituiertes Phenyl, vorzugsweise Wasserstoff, (C1-C4)Alkyl oder Phenyl, das unsubstituiert oder durch einen oder mehrere Reste aus der Gruppe Halogen, (C1-C4)Alkyl, (C1-C4)Haloalkyl, Nitro, Cyano oder (C1-C4)Alkoxy substituiert ist. - Insbesondere bevorzugt sind auch als Safener bekannte Verbindungen der Formel (I), worin die Symbole und Indizes folgende Bedeutungen haben:
W ist (W3);
R17 ist Halogen oder (C1-C2)Haloalkyl;
n' ist 0, 1, 2 oder 3, wobei (R17)n' vorzugsweise 2,4-Cl2 ist;
R18 ist ein Rest der Formel OR24;
R24 ist Wasserstoff, (C1-C8)Alkyl, (C1-C4)Haloalkyl, (C1-C4)Hydroxyalkyl, (C3-C7)Cycloalkyl, (C1-C4)Alkoxy-(C1-C4)-alkyl oder Tri-(C1-C2)-alkylsilyl, vorzugsweise (C1-C4)Alkyl, und
R28 ist (C1-C8)Alkyl oder (C1-C4)Haloalkyl, vorzugsweise C1-Haloalkyl. - Insbesondere bevorzugt sind auch als Safener bekannte Verbindungen der Formel (I), worin die Symbole und Indizes folgende Bedeutung haben:
W ist (W4);
R17 ist Halogen, Nitro, (C1-C4)Alkyl, (C1-C2)Haloalkyl, vorzugsweise CF3, oder (C1-C4)Alkoxy;
n' ist 0, 1, 2 oder 3;
m' ist 0 oder 1;
R18 ist ein Rest der Formel OR24;
R24 ist Wasserstoff, (C1-C4)Alkyl, Carboxy-(C1-C4)-alkyl, (C1-C4)Alkoxycarbonyl-(C1-C4)-alkyl, vorzugsweise (C1-C4)Alkoxy-CO-CH2-, (C1-C4)Alkoxy-CO-C(CH3)H-, HO-CO-CH2- oder HO-CO-C(CH3)H-, und
R29 ist Wasserstoff, (C1-C4)Alkyl, (C1-C4)Haloalkyl, (C3-C7)Cycloalkyl oder Phenyl, das unsubstituiert oder durch einen oder mehrere der Reste aus der Gruppe Halogen, (C1-C4)Alkyl, (C1-C4)Haloalkyl, Nitro, Cyano und (C1-C4)Alkoxy substituiert ist. - Folgende Gruppen von als Safener bekannte Verbindungen sind insbesondere als Wirkstoffe für die Erhöhung der Toleranz von Pflanzen gegenüber abiotischen Stressoren geeignet:
- a) Verbindungen vom Typ der Dichlorphenylpyrazolin-3-carbonsäure (d.h. der Formel (I), worin W = (W1) und (R17)n' = 2,4-Cl2), vorzugsweise Verbindungen wie 1-(2,4-Dichlorphenyl)-5-(ethoxycarbonyl)-5-methyl-2-pyrazolin-3-carbonsäureethylester (I-1, Mefenpyr-diethyl), Mefenpyr-dimethyl und Mefenpyr (I-0), und verwandte Verbindungen, wie sie in der WO-A 91/07874 beschrieben sind;
- b) Derivate der Dichlorphenylpyrazolcarbonsäure (d.h. der Formel (I), worin W = (W2) und (R17)n' = 2,4-Cl2 ist), vorzugsweise Verbindungen wie 1-(2,4-Dichlorphenyl)-5-methyl-pyrazol-3-carbonsäureethylester (I-2), 1-(2,4-Dichlorphenyl)-5-isopropyl-pyrazol-3-carbonsäureethylester (I-3), 1-(2,4-Dichlorphenyl)-5-(1,1-dimethyl-ethyl)pyrazol-3-carbonsäureethylester (I-4), 1-(2,4-Dichlorphenyl)-5-phenyl-pyrazol-3-carbonsäureethylester (I-5) und verwandte Verbindungen, wie sie in EP-A-0 333 131 und EP-A-0 269 806 beschrieben sind;
- c) Verbindungen vom Typ der Triazolcarbonsäuren (d.h. der Formel (I), worin W = (W3) und (R17)n' = 2,4-Cl2 ist), vorzugsweise Verbindungen wie Fenchlorazol-ethyl, d.h. 1-(2,4-Dichlorphenyl)-5-trichlormethyl-(1H)-1,2,4-triazol-3-carbonsäureethylester (I-6), und verwandte Verbindungen (siehe EP-A-0 174 562 und EP-A-0 346 620);
- d) Verbindungen vom Typ der 5-Benzyl- oder 5-Phenyl-2-isoxazolin-3-carbonsäure oder der 5,5-Diphenyl-2-isoxazolin-3-carbonsäure wie Isoxadifen (I-12), (worin W = (W4) ist), vorzugsweise Verbindungen wie 5-(2,4-Dichlorbenzyl)-2-isoxazolin-3-carbonsäureethylester (I-7) oder 5-Phenyl-2-isoxazolin-3-carbonsäureethylester (I-8) und verwandte Verbindungen, wie sie in WO-A-91/08202 beschrieben sind, oder der 5,5-Diphenyl-2-isoxazolin carbonsäureethylester (I-9, Isoxadifen-ethyl) oder -n-propylester (I-10) oder der 5-(4-Fluorphenyl)-5-phenyl-2-isoxazolin-3-carbonsäureethylester (I-11), wie sie in der WO-A-95/07897 beschrieben sind.
- e) Verbindungen vom Typ der 8-Chinolinoxyessigsäure, z.B. solche der Formel (II), worin (R19)n' = 5-Cl, R20 = OR24 und T = CH2 ist, vorzugsweise die Verbindungen (5-Chlor-8-chinolinoxy)essigsäure-(1-methylhexyl)-ester (II-1, Cloquintocetmexyl), (5-Chlor-8-chinolinoxy)essigsäure-(1,3-dimethyl-but-1-yl)-ester (II-2), (5-Chlor-8-chinolinoxy)essigsäure-4-allyl-oxy-butylester (II-3), (5-Chlor-8-chinolinoxy)essigsäure-1-allyloxy-prop-2-ylester (II-4), (5-Chlor-8-chinolinoxy)essigsäureethylester (II-5), (5-Chlor-8-chinolinoxy)essigsäuremethylester (II-6), (5-Chlor-8-chinolinoxy)essigsäureallylester (II-7), (5-Chlor-8-chinolinoxy)essigsäure-2-(2-propyliden-iminoxy)-1-ethylester (II-8), (5-Chlor-8-chinolinoxy)essigsäure-2-oxo-prop-1-ylester (II-9), (5-Chlor-8-chinolinoxy)essigsäure (II-10) und dessen Salze wie sie z.B. in der WO-A-2002/34048 beschrieben sind, und verwandte Verbindungen, wie sie in EP-A-0 860 750, EP-A-0 094 349 und EP-A-0 191 736 oder EP-A-0 492 366 beschrieben sind.
- f) Verbindungen vom Typ der (5-Chlor-8-chinolinoxy)-malonsäure, d.h. der Formel (II), worin (R19)n' = 5-Cl, R20 = OR24, T = -CH(COO-Alkyl)- ist, vorzugsweise die Verbindungen (5-Chlor-8-chinolinoxy)-malonsäurediethylester (II-11), (5-Chlor-8-chinolinoxy)-malonsäurediallylester, (5-Chlor-8-chinolinoxy)-malonsäure-methyl-ethylester und verwandte Verbindungen, wie sie in EP-A-0 582 198 beschrieben sind.
- g) Verbindungen vom Typ der Dichloracetamide, d.h. der Formel
(III), vorzugsweise:
N,N-Diallyl-2,2-dichloracetamid (Dichlormid
(III-1), aus US-A 4,137,070),
4-Dichloracetyl-3,4-dihydro-3-methyl-2H-1,4-benzoxazin
(IV-2, Benoxacor, aus
EP 0 149 974 ), N1,N2-Diallyl-N2-dichloracetylglycinamid (DKA-24 (III-3), aus HU 2143821), 4-Dichloracetyl-1-oxa-4-aza-spiro[4,5]decan (AD-67), 2,2-Dichlor-N-(1,3-dioxolan-2-ylmethyl)-N-(2-propenyl)acetamid (PPG-1292), 3-Dichloracetyl-2,2,5-trimethyloxazolidin (R-29148, III-4), 3-Dichloracetyl-2,2-dimethyl-5-phenyloxazolidin, 3-Dichloracetyl-2,2-dimethyl-5-(2-thienyl)oxazolidin, 3-Dichloracetyl-5-(2-furanyl)-2,2-dimethyloxazolidin (Furilazole (III-5), MON 13900), 1-Dichloracetyl-hexahydro-3,3,8a-trimethylpyrrolo[1,2-a]pyrimidin-6(2H)-on (Dicyclonon, BAS 145138), - h) Verbindungen der Gruppe (b), vorzugsweise 1,8-Naphthalsäureanhydrid (b-1), Methyl-diphenylmethoxyacetat (b-2), Cyanomethoxyimino(phenyl)acetonitril (Cyometrinil) (b-3), 1-(2-Chlorbenzyl)-3-(1-methyl-1-phenylethyl)harnstoff (Cumyluron) (b-4), O,O-Diethyl S-2-ethylthioethyl phosphordithioat (Disulfoton) (b-5), 4-Chlorphenyl-methylcarbamat (Mephenate) (b-6), O,O-Diethyl-O-phenylphosphorotioat (Dietholate) (b-7), 4-Carboxy-3,4-dihydro-2H-1-benzopyran-4-essigsäure (CL-304415, CAS-Regno: 31541-57-8) (b-8), 1,3-Dioxolan-2-ylmethoxyimino(phenyl)acetonitril (Oxabetrinil) (b-9), 4'-Chlor-2,2,2-trifluoracetophenon O-1,3-dioxolan-2-ylmethyloxim (Fluxofenim) (b-10), 4,6-Dichlor-2-phenylpyrimidin (Fenclorim) (b-11), Benzyl-2-chlor-4-trifluormethyl-1,3-thiazol-5-carboxylat (Flurazole) (b-12), 2-Dichlormethyl-2-methyl-1,3-dioxolan (MG-191) (b-13), N-(4-Methylphenyl)-N'-(1-methyl-1-phenylethyl)harnstoff (Dymron) (b-14), (2,4-Dichlorphenoxy)essigsäure (2,4-D), (4-Chlorphenoxy)essigsäure, (R,S)-2-(4-Chlor-o-tolyloxy)propionsäure (Mecoprop), 4-(2,4-Dichlorphenoxy)buttersäure (2,4-DB), (4-Chlor-o-tolyloxy)essigsäure (MCPA), 4-(4-Chlor-o-tolyloxy)buttersäure, 4-(4-Chlorphenoxy)buttersäure, 3,6-Dichlor-2-methoxybenzoesäure (Dicamba), 1-(Ethoxycarbonyl)ethyl 3,6-dichlor-2-methoxybenzoat (Lactidichlor) sowie deren Salze und Ester, vorzugsweise (C1-C8).
- Bevorzugt sind weiterhin als Safener bekannte Verbindungen der Formel (IV) oder deren Salze, worin
R30 Wasserstoff, (C1-C6)-Alkyl, (C3-C6)-Cycloalkyl, Furanyl oder Thienyl, wobei jeder der letztgenannten 4 Reste unsubstituiert oder durch einen oder mehrere Substituenten aus der Gruppe Halogen, (C1-C4)-Alkoxy, Halogen-(C1-C6)-alkoxy und (C1-C4)-Alkylthio und im Falle cyclischer Reste auch (C1-C4)-Alkyl und (C1-C4)-Haloalkyl substituiert ist,
R31 Wasserstoff,
R32 Halogen, Halogen-(C1-C4)-alkyl, Halogen-(C1-C4)-alkoxy, (C1-C4)-Alkyl, (C1-C4)-Alkoxy, (C1-C4)-Alkylsulfonyl, (C1-C4)-Alkoxycarbonyl oder (C1-C4)-Alkylcarbonyl,
vorzugsweise Halogen, (C1-C4)-Halogenalkyl, wie Trifluormethyl, (C1-C4)-Alkoxy, Halogen-(C1-C4)-alkoxy, (C1-C4)-Alkoxycarbonyl oder (C1-C4)-Alkylsulfonyl,
R33 Wasserstoff,
R34 Halogen, (C1-C4)-Alkyl, Halogen-(C1-C4)-alkyl, Halogen-(C1-C4)-alkoxy, (C3-C6)-Cycloalkyl, Phenyl, (C1-C4)-Alkoxy, Cyano, (C1-C4)-Alkylthio, (C1-C4)-Alkylsulfinyl, (C1-C4)-Alkylsulfonyl, (C1-C4)-Alkoxycarbonyl oder (C1-C4)-Alkylcarbonyl,
vorzugsweise Halogen, (C1-C4)-Alkyl, (C1-C4)-Halogenalkyl, wie Trifluormethyl, Halogen-(C1-C4)-alkoxy, (C1-C4)-Alkoxy oder (C1-C4)-Alkylthio,
n 0, 1 oder 2 und
m 1 oder 2 bedeuten. - Besonders bevorzugt sind als Safener bekannte Verbindungen der Formel (IV), worin
R30 = H3C-O-CH2-, R31 = R33 = H, R34 = 2-OMe ist (IV-1),
R30 = H3C-O-CH2-, R31 = R33 = H, R34 = 2-OMe-5-Cl ist (IV-2),
R30 = Cyclopropyl, R31 = R33 = H, R34 = 2-OMe ist (IV-3),
R30 = Cyclopropyl, R31 = R33 = H, R34 = 2-OMe-5-Cl ist (IV-4),
R30 = Cyclopropyl, R31 = R33 = H, R34 = 2-Me ist (IV-5),
R30 = tert. Butyl, R31 = R33 = H, R34 = 2-OMe ist (IV-6). - Weiterhin bevorzugt sind als Safener bekannte Verbindungen der Formel (V), in der X3 CH;
R35 Wasserstoff, (C1-C6)-Alkyl, (C3-C6)-Cycloalkyl, (C2-C6)-Alkenyl, (C5-C6)-Cycloalkenyl, Phenyl oder 3- bis 6-gliedriges Heterocyclyl mit bis zu drei Heteroatomen aus der Gruppe Stickstoff, Sauerstoff und Schwefel, wobei die sechs letztgenannten Reste gegebenenfalls durch einen oder mehrere, gleiche oder verschiedene Substituenten aus der Gruppe Halogen, (C1-C6)-Alkoxy, (C1-C6)-Haloalkoxy, (C1-C2)-Alkylsulfinyl, (C1-C2)-Alkylsulfonyl, (C3-C6)-Cycloalkyl, (C1-C4)-Alkoxycarbonyl, (C1-C4)-Alkylcarbonyl und Phenyl und im Falle cyclischer Reste auch (C1-C4)-Alkyl und (C1-C4)-Haloalkyl substituiert sind;
R36 Wasserstoff, (C1-C6)-Alkyl, (C2-C6)-Alkenyl, (C2-C6)-Alkinyl, wobei die drei letztgenannten Reste gegebenenfalls durch einen oder mehrere, gleiche oder verschiedene Substituenten aus der Gruppe Halogen, Hydroxy, (C1-C4)-Alkyl, (C1-C4)-Alkoxy und (C1-C4)-Alkylthio substituiert sind;
R37 Halogen, (C1-C4)-Haloalkyl, (C1-C4)-Haloalkoxy, Nitro, (C1-C4)-Alkyl, (C1-C4)-Alkoxy, (C1-C4)-Alkylsulfonyl, (C1-C4)-Alkoxycarbonyl oder (C1-C4)-Alkylcarbonyl;
R38 Wasserstoff;
R39 Halogen, Nitro, (C1-C4)-Alkyl, (C1-C4)-Haloalkyl, (C1-C4)-Haloalkoxy, (C3-C6)-Cycloalkyl, Phenyl, (C1-C4)-Alkoxy, Cyano, (C1-C4)-Alkylthio, (C1-C4)- Alkylsulfinyl, (C1-C4)-Alkylsulfonyl, (C1-C4)-Alkoxycarbonyl oder (C1-C4)-Alkylcarbonyl;
n 0, 1 oder 2 und
m 1 oder 2
bedeuten. - Bevorzugte als Safener bekannte Verbindungen der Formel (VI) sind (S3-1), (S3-2), (S3-3), (S3-4) und (S3-5).
- Bevorzugt sind auch Verbindungen der Formel (VII) sind
1-[4-(N-2-Methoxybenzoylsulfamoyl)phenyl]-3-methylharnstoff (VII-1),
1-[4-(N-2-Methoxybenzoylsulfamoyl)phenyl]-3,3-dimethylharnstoff (VII-2),
1-[4-(N-4,5-Dimethylbenzoylsulfamoyl)phenyl]-3-methylharnstoff (VII-3) und
1-[4-(N-Naphthoylsulfamoyl)phenyl]-3,3-dimethylharnstoff (VII-4). -
- Besonders bevorzugte Verbindungen zur Verwendung als Mittel zur Toleranzerhöhung bei Pflanzen gegenüber abiotischen Stressoren sind solche, die ausgewählt sind aus der Gruppe von als Safener bekannten Verbindungen bestehend aus den Verbindungen der Formeln I-1 (Mefenpyr-diethyl), I-9 (Isoxadifen-ethyl), II-1 (Chloquintocet-mexyl), b-11 (Fenclorim), b-14 (Dymron), und VIII-3 (4-Cyclopropylaminocarbonyl-N-(2-methoxybenzoyl)benzolsulfonamide, ganz besonders bevorzugt sind die Verbindungen I-1 und VIII-3).
- Die zuvor identifzierten/genannten unter Umständen bereits als Safener bekannten Verbindungen können auch in gentechnisch veränderten Pflanzen eingesetzt werden.
- Die gentechnisch veränderten (auch transgen genannt) Pflanzen zeichnen sich in der Regel durch besondere vorteilhafte Eigenschaften aus, beispielsweise durch Resistenzen gegenüber bestimmten Pestiziden, vor allem bestimmten Herbiziden, Resistenzen gegenüber Pflanzenkrankheiten oder Erregern von Pflanzenkrankheiten wie bestimmten Insekten oder Mikroorganismen wie Pilzen, Bakterien oder Viren. Andere besondere Eigenschaften betreffen z.B. das Erntegut hinsichtlich Menge, Qualität, Lagerfähigkeit, Zusammensetzung und spezieller Inhaltsstoffe. So sind transgene Pflanzen mit erhöhtem Stärkegehalt oder veränderter Qualität der Stärke oder solche mit anderer Fettsäurezusammensetzung des Ernteguts bekannt.
- Bevorzugt ist die Anwendung der identifizierten/genannten als Safener bekannten Verbindungen oder deren Salze in wirtschaftlich bedeutenden transgenen Kulturen von Nutz-und Zierpflanzen, z.B. von Getreide wie Weizen, Gerste, Roggen, Hafer, Hirse, Reis und Mais oder auch Kulturen von Zuckerrübe, Baumwolle, Soja, Raps, Kartoffel, Tomate, Erbse und anderen Gemüsesorten, besonders bevorzugt in Kulturen von Mais, Weizen, Gerste, Roggen, Hafer, Reis, Raps, Zuckerrübe und Soja, ganz besonders bevorzugt in Kulturen von Mais, Weizen, Reis, Raps, Zuckerrübe und Soja.
- Daneben können auch transgene Pflanzen mit mit Hilfe von DNA-Microarrays identifizierten Substanzen wie auch der bereits als Safener bekannten Moleküle behandelt werden, deren Toleranz gegenüber abiotischen Stressoren bereits durch gentechnische Maßnahmen erhöht worden ist, so dass eine synergistische Wirkung der endogen kodierten Toleranz und der exogen applizierten toleranzsteigernden Wirkung beobachtet wird.
- Herkömmliche Wege zur Herstellung neuer Pflanzen, die im Vergleich zu bisher vorkommenden Pflanzen modifizierte Eigenschaften aufweisen, bestehen beispielsweise in klassischen Züchtungsverfahren und der Erzeugung von Mutanten. Alternativ können neue Pflanzen mit veränderten Eigenschaften mit Hilfe gentechnischer Verfahren erzeugt werden (siehe z.B. EP-A-0221044, EP-A-0131624). Beschrieben wurden beispielsweise in mehreren Fällen
- – gentechnische Veränderungen von Kulturpflanzen zwecks Modifikation der in den Pflanzen synthetisierten Stärke (z.B. WO 92/11376, WO 92/14827, WO 91/19806),
- – transgene Kulturpflanzen, welche gegen bestimmte Herbizide vom Typ Glufosinate (vgl. z.B. EP-A-0242236, EP-A-242246) oder Glyphosate (WO 92/00377) oder der Sulfonylharnstoffe (EP-A-0257993, US-A-5013659) resistent sind,
- – transgene Kulturpflanzen, beispielsweise Baumwolle, mit der Fähigkeit Bacillus thuringiensis-Toxine (Bt-Toxine) zu produzieren, welche die Pflanzen gegen bestimmte Schädlinge resistent machen (EP-A-0142924, EP-A-0193259).
- – transgene Kulturpflanzen mit modifizierter Fettsäurezusammensetzung (WO 91/13972).
- Zahlreiche molekularbiologische Techniken, mit denen neue transgene Pflanzen mit veränderten Eigenschaften hergestellt werden können, sind im Prinzip bekannt; siehe z.B. Sambrook et al., 1989, Molecular Cloning, A Laboratory Manual, 2. Aufl. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY; oder Winnacker "Gene und Klone", VCH Weinheim 2. Auflage 1996 oder Christou, "Trends in Plant Science" 1 (1996) 423–431).
- Für derartige gentechnische Manipulationen können Nucleinsäuremoleküle in Plasmide eingebracht werden, die eine Mutagenese oder eine Sequenzveränderung durch Rekombination von DNA-Sequenzen erlauben. Mit Hilfe der obengenannten Standardverfahren können z.B. Basenaustausche vorgenommen, Teilsequenzen entfernt oder natürliche oder synthetische Sequenzen hinzugefügt werden. Für die Verbindung der DNA-Fragmente untereinander können an die Fragmente Adaptoren oder Linker angesetzt werden.
- Die Herstellung von Pflanzenzellen mit einer verringerten Aktivität eines Genprodukts kann beispielsweise erzielt werden durch die Expression mindestens einer entsprechenden antisense-RNA, einer sense-RNA zur Erzielung eines Cosuppressionseffektes oder die Expression mindestens eines entsprechend konstruierten Ribozyms, das spezifisch Transkripte des obengenannten Genprodukts spaltet.
- Hierzu können zum einen DNA-Moleküle verwendet werden, die die gesamte codierende Sequenz eines Genprodukts einschließlich eventuell vorhandener flankierender Sequenzen umfassen, als auch DNA-Moleküle, die nur Teile der codierenden Sequenz umfassen, wobei diese Teile lang genug sein müssen, um in den Zellen einen antisense-Effekt zu bewirken. Möglich ist auch die Verwendung von DNA-Sequenzen, die einen hohen Grad an Homologie zu den codiereden Sequenzen eines Genprodukts aufweisen, aber nicht vollkommen identisch sind.
- Bei der Expression von Nucleinsäuremolekülen in Pflanzen kann das synthetisierte Protein in jedem beliebigen Kompartiment der pflanzlichen Zelle lokalisiert sein. Um aber die Lokalisation in einem bestimmten Kompartiment zu erreichen, kann z.B. die codierende Region mit DNA-Sequenzen verknüpft werden, die die Lokalisierung in einem bestimmten Kompartiment gewährleisten. Derartige Sequenzen sind dem Fachmann bekannt (siehe beispielsweise Braun et al., EMBO J. 11 (1992), 3219–3227; Wolter et al., Proc. Natl. Acad. Sci. USA 85 (1988), 846–850; Sonnewald et al., Plant J. 1 (1991), 95–106).
- Die transgenen Pflanzenzellen können nach bekannten Techniken zu ganzen Pflanzen regeneriert werden. Bei den transgenen Pflanzen kann es sich prinzipiell um Pflanzen jeder beliebigen Pflanzenspezies handeln, d.h., sowohl monokotyle als auch dikotyle Pflanzen.
- So sind transgene Pflanzen erhältlich, die veränderte Eigenschaften durch Überexpression, Suppression oder Inhibierung homologer (= natürlicher) Gene oder Gensequenzen oder Expression heterologer (= fremder) Gene oder Gensequenzen aufweisen.
- Vorzugsweise können die mit Hilfe der DNA-Microarrays identifizierten oder aber als Safener bekannten Moleküle in transgenen Kulturen eingesetzt werden, welche gegen Herbizide aus der Gruppe der Sulfonylharnstoffe, Glufosinate-ammonium oder Glyphosate-isopropylammonium und analoge Wirkstoffe resistent sind und/oder auf der Basis gentechnischer Veränderung eine endogene Toleranz gegenüber abiotischen Stressoren aufweisen.
- Bei der Anwendung der erfindungsgemäßen Wirkstoffe in transgenen Kulturen treten neben den in anderen Kulturen zu beobachtenden Wirkungen gegenüber Schadpflanzen oftmals Wirkungen auf, die für die Applikation in der jeweiligen transgenen Kultur spezifisch sind, beispielsweise ein verändertes oder speziell erweitertes Unkrautspektrum, das bekämpft werden kann, veränderte Aufwandmengen, die für die Applikation eingesetzt werden können, vorzugsweise gute Kombinierbarkeit mit den Herbiziden, gegenüber denen die transgene Kultur resistent ist, sowie Beeinflussung von Wuchs und Ertrag der transgenen Kulturpflanzen.
- Gegenstand der Erfindung ist deshalb auch die Verwendung der mit DNA-Microarrays identifizierten Verbindungen bzw. von bereits als Safener bekannten Verbindungen zur Erhöhung der Toleranz gegenüber abiotischen Stressoren in transgenen Kulturpflanzen, bevorzugt mit dem Ziel der Ertragssteigerung.
- Gegenstand der vorliegenden Erfindung ist ein Verfahren zum Auffinden einer die Toleranz gegenüber abiotischen Stressoren bei Pflanzen erhöhenden Verbindung, wobei die Steigerung der Transkription bzw. Expression einzelner oder mehrerer, pflanzenendogener Gene wie beispielsweise Genen codierend für Proteine aus der Gruppe der Cytrochrom-Oxidasen, wie der Cytochromoxidase P450, Glycosyltransferasen, Uricasen, wie der Uricase II (E.C.17.3.3), Peptidasen, verschiedener Membranproteine, Amidohydrolasen, sowie verschiedener allgemeiner Stressproteine, als Indiz für die Induktion bewertet wird.
- Gegenstand der vorliegenden Erfindung ist im besonderen ein Verfahren zum Auffinden von Verbindungen, die die Transkription der für pflanzenendogene Enzyme der Stresstoleranz kodierenden Gene induzieren, dadurch gekennzeichnet, dass:
- a) Testpflanzen einem oder mehreren abiotischen Stressoren ausgesetzt werden,
- b) Kontrollpflanzen, unter ansonsten gleichen Bedingungen wie Testpflanzen unter a), zusätzlich mit einer zu testenden Verbindung in Kontakt gebracht werden, sei es in Form gebeizten Saatgutmaterials, oder der Besprühung zu einem bestimmten Entwicklungszeitpunkt oder durch Wurzelaufnahme,
- c) RNA aus den Test- und Kontrollpflanzen extrahiert wird,
- d) die RNA entweder direkt radioaktiv oder nicht radioaktiv markiert wird, oder aber die RNA unter gleichzeitiger enzymatischer Umschreibung in die korrespondierende cDNA radioaktiv oder nicht-radioaktiv markiert wird, oder aber die erhaltene, nicht markierte cDNA enzymatisch in eine korrespondierende radioaktive oder nicht-radioaktive markierte cRNA umgeschrieben wird,
- e) ein pflanzliche DNA-Sequenzen enthaltender DNA-Microarray mit den gemäß Schritt d) erhaltenen Substanzen hybridisiert wird,
- f) Expressionsprofile der Gene für die Expression der verschiedener Stressproteine vergleichend für die gemäß a) und b) getesteten Pflanzen erstellt werden,
- g) eine Quantifizierung der gemäß f) gemessenen Expressionsunterschiede erfolgt,
- h) eine abschließende Systematisierung der gemäß g) zugeordneten Expressionsprofile durch Cluster-Analyse erfolgt.
- Im Fall des zuvor genannten Schritts d) ist die enzymatische Umschreibung der erhaltenen cDNA in eine cRNA als bevorzugter Verfahrensschritt anzusehen, da hierdurch eine nochmalige Amplifikation der Hybridisierungsprobe erreicht werden kann. Ebenso bevorzugt ist die Markierung mittels nicht radioaktiver Nukleotide, besonders bevorzugt die Markierung mittels biotinyliertem UTP und/oder CTP, wobei der Nachweis im Anschluss an die erfolgte Hybridisierungsreaktion durch Bindung von Streptavidin-Phycoerythrin als Fluorophor and die biotinylierte cRNA erfolgt. Ein Nachweis der spezifischen Phycoerythrin-Fluoreszenz, die als Grundlage für die Quantifizierung der gemessenen Expressionsunterschiede dient, erfolgt im Anschluss an die Hybridisierung mit Hilfe eines Laser-Scanners.
- Bevorzugter Gegenstand der vorliegenden Erfindung ist ein Verfahren unter Einhalten der zuvor genannten Verfahrensabläufe a) – h), wobei im Fall der beabsichtigten Steigerung bei Hitzestress die Gene für die Expression der Cytrochrom-Oxidasen, wie der Cytochromoxidase P450, Glycosyltransferasen, Uricasen, wie der Uricase II (E.C.17.3.3), Peptidasen, verschiedener Membranproteine, Amidohydrolasen bei hitzegestressten und nicht hitzegestressten Pflanzen verglichen wird, bevorzugt der Gene die für die Expression der „N-carbamyl-L-amino acid Amidohydrolase" (Zm.11840.1.A1_at), der „Serine Carboxypeptidase (Zm.18994.2.A1_a_at), der Uricase II (E.C.1.7.3.3) und der Glycosyltransferase (Zm.12587.1.S1_s_at), ganz besonders bevorzugt der Gene für die Expression der „N-carbamyl-L-amino acid Amidohydrolase" (Zm.11840.1.A1_at) und der „Serine Carboxypeptidase (Zm.18994.2.A1_a_at) (Signatur gemäß Mais Genom-Array der Firma Affymetrix (Affymetrix Inc., 3380 Central Expressway, Santa Clara, CA, USA)) und wobei die Genexpression gegenüber einer hitzegestressten Kontrollpflanze bei Behandlung mit beispielsweise um den Faktor 1.5 oder mehr, vorzugsweise um den Faktor 1.5 bis 30, bevorzugt 1.5 bis 20, besonders bevorzugt 1.5 bis 10, ganz besonders bevorzugt 1.5 bis 5, erhöht ist, wobei die Steigerung der geänderten Expressionsprofile der einzelnen Gene unabhängig voneinander in den unterschiedlichen zuvor benannten Größenbereichen liegen kann.
- Ebenfalls bevorzugter Gegenstand der vorliegenden Erfindung ist ein Verfahren unter Einhalten der zuvor genannten Verfahrensabläufe a) – h), wobei im Fall der beabsichtigten Steigerung bei Trockenstress beispielsweise die Gene für die Expression des Late Embryogenesis Abundant Proteinen, wie den Dehydrinen, des Universal Stress Proteins (Zm.818.1.A1_at), Non-symbiotic hemoglobin (Zm.485.1.A1_at), des Proteins mit der Adressierung „Zm.818.2.A1_a_at" (Mais Genom-Array der Firma Affymetrix (Affymetrix Inc., 3380 Central Expressway, Santa Clara, CA, USA)) und des Proteins mit der Adressierung „Zm.18682.1.A1_s_at" (Mais Genom-Array der Firma Affymetrix (Affymetrix Inc., 3380 Central Expressway, Santa Clara, CA, USA)) bei durch Trockenheit gestressten und nicht Trockenheit gestressten Pflanzen verglichen wird, bevorzugt die Gene für die Expression des Universal Stress Proteins (Zm.818.1.A1_at), Non-symbiotic hemoglobin (Zm.485.1.A1_at), des Proteins mit der Adressierung „Zm.818.2.A1_a_at" (Signatur gemäß Mais Genom-Array der Firma Affymetrix (Affymetrix Inc., 3380 Central Expressway, Santa Clara, CA, USA)) und des Proteins mit der Adressierung „Zm.18682.1.A1_s_at" (Mais Genom-Array der Firma Affymetrix (Affymetrix Inc., 3380 Central Expressway, Santa Clara, CA, USA)) und wobei die Genexpression gegenüber einer durch Trockenheit gestressten Kontrollpflanze bei Behandlung mit beispielsweise um den Faktor 1.5 oder mehr, vorzugsweise um den Faktor 1.5 bis 30, bevorzugt 1.5 bis 20, besonders bevorzugt 1.5 bis 10, ganz besonders bevorzugt 1.5 bis 8, erhöht ist, wobei die Steigerung der geänderten Expressionsprofile der einzelnen Gene unabhängig voneinander in den unterschiedlichen zuvor benannten Größenbereichen liegen kann.
- Gegenstand der vorliegenden Erfindung ist weiter die Verwendung bestimmter DNA-Microarrays, die auf der Basis genetischer Informationen aus Pflanzen, bevorzugt genetischer Information aus Nutzpflanzen, besonders bevorzugt aus Nutzpflanzen wie beispielsweise aus Mais, Getreide, wie Weizen, Gerste, Roggen, Hafer, Reis und Soja, bevorzugt aus Mais, Weizen, Gerste, Roggen, Reis und Soja, besonders bevorzugt aus Gerste, Mais, Weizen, Reis und Soja, ganz besonders bevorzugt aus Mais, Weizen und Soja zur Auffindung von geänderten Genexpressionsmustern benutzt werden. Dabei werden die relativen Veränderungen der Genmuster für Gene verschiedener Stressproteine in mit den zu testenden Verbindungen behandelten Pflanzen im Vergleich zu unbehandelten Kontrollpflanzen unter ansonsten identischen Stressbedingungen betrachtet.
- Gegenstand der Erfindung ist außerdem die Verwendung der Promotoren der beschriebenen Indikatorgene in Verbindung mit speziellen Reportergenen (z.B. GUS, GFP, Luciferase etc) zum Auffinden von Substanzen mit positiver Wirkung auf die abiotische Stresstoleranz in Kulturpflanzen. Dabei werden transgene Testpflanzen erzeugt, welche die erwähnten Promoter-Reportergen-Konstrukte enthalten. Wirkstoffe welche die abiotische Stresstoleranz von Pflanzen nach dem beschriebenen Mechanismus erhöhen, induzieren die Expression des Reportergens und können mit Hilfe eines kolorimetrischen, fluorimetrischen oder sonstigen Assays identifiziet werden.
- Gegenstand der Erfindung ist weiterhin die Verwendung der beschriebenen Indikatorgene zur Steigerung der abiotischen Stresstoleranz in transgenen Kulturpflanzen. Dabei werden die Gene mit einem geeigneten Promoter, welcher die gewünschte Stärke und Spezifität besitzt fusioniert und die Konstrukte in monocotyle oder dicotyle Kulturpflanzen transformiert. Die erzeugten transgenen Pflanzen zeichnen sich durch eine erhöhte Toleranz gegen abiotischen Stress, z.B. Kälte, Hitze, Trockenheit etc. aus.
- Weiterer Gegenstand der vorliegenden Erfindung ist auch die Verwendung der Verbindungen die mit Hilfe des DNA-Microarrays unter Betrachtung der Expressionsprofile der Gene der identifiziert wurden und/oder bereits als Safener bekannter Verbindungen, die im Falle von abiotischen Stressbedingungen, wie beispielsweise gegenüber auf diese Pflanze einwirkenden abiotischem Stressoren, wie Temperatur (Kälte, Frost oder Hitze), Wasser (Trockenheit oder Dürre), oder die chemische Belastung (Mangel oder Überschuss an Mineralsalzen, Schwermetalle, gasförmige Noxen) positiv, d.h. expressionssteigernd hinsichtlich ihrer induktiven Wirkung auf einzelne oder mehren Gene der pflanzendogenen Abwehrmechanismen wirken, wie beispielsweise im Fall von Hitzestress auf Cytrochrom-Oxidasen, wie der Cytochromoxidase P450, auf Glycosyltransferasen, auf Uricasen, wie der Uricase II (E.C.17.3.3), auf Peptidasen, auf verschiedener Membranprotein, auf Amidohydrolasen und/oder verschiedene Stressproteine und/oder beispielsweise im Fall von Trockenstress positiv, d.h. expressionssteigernd hinsichtlich ihrer induktiven Wirkung auf einzelne oder mehrere Gene der universeller Stressproteine, Nonsymbiotic hemoglobin (Zm.485.1.A1_at), des Proteins mit der Adressierung „Zm.818.2.A1_a_at" (Mais Genom-Array der Firma Affymetrix (Affymetrix Inc., 3380 Central Expressway, Santa Clara, CA, USA)) und des Proteins mit der Adressierung „Zm.18682.1.A1_s_at" (Signatur gemäß Mais Genom-Array der Firma Affymetrix (Affymetrix Inc., 3380 Central Expressway, Santa Clara, CA, USA)) identifiziert wurden, als Wirkstoffe zur Steigerung der Stresstoleranz bei Nutzpflanzen.
- Gegenstand der Erfindung ist auch die Verwendung von mit Hilfe des DNA-Microarrays identifizierten Substanzen wie auch der bereits als Safener bekannten Moleküle zur Toleranzerhöhung gegenüber abiotischen Stressoren in verschiedenen Kulturpflanzen, wie Mais, Getreide, wie Weizen, Gerste, Roggen, Hafer, Reis und Soja, bevorzugt Mais, Weizen, Gerste, Roggen, Reis und Soja, besonders bevorzugt Mais, Weizen, Reis und Soja, ganz besonders bevorzugt Mais, Weizen und Soja.
- Gegenstand der vorliegenden Erfindung ist daher auch die Verwendung von Verbindungen, die mit Hilfe des DNA-Microarrays unter Betrachtung der Expressionsprofile der Gene identifiziert wurden und/oder bereits als Safener bekannter Verbindungen, die in Pflanzen, direkt oder indirekt, wie beispielsweise durch eine Signaltransduktionskette, zur Erhöhung der Toleranz gegenüber abiotischen Stressoren, wie beispielsweise Temperatur (wie Kälte, Frost oder Hitze), Wasser (wie Trockenheit, Dürre oder Anoxia), oder die chemische Belastung (wie Mangel oder Überschuss an Mineralsalzen. Schwermetallen, gasförmigen Noxen) beitragen, zur Ertragssteigerung, zur Verlängerung der der Vegetationsperiode, zur Ermöglichung einer früheren Aussaat, zur Steigerung der Qualität, oder zur Verwendung im Rahmen der Züchtung unter Verwendung ansonsten weniger vitaler Inzucht-Linien.
- Gegenstand der vorliegenden Erfindung ist daher auch ein Verfahren zur Ertragssteigerung in Nutzpflanzenkulturen, zur Verlängerung der der Vegetationsperiode, zur Ermöglichung einer früheren Aussaat, zur Steigerung der Qualität, oder zur Verwendung im Rahmen der Züchtung unter Verwendung ansonsten weniger vitaler Inzucht-Linien dadurch gekennzeichnet, dass die Nutzpflanzen durch Saatgut-Beizung, durch Blattspritzung oder durch Bodenapplikation mit einem oder mehreren Verbindungen, die mit Hilfe des DNA-Microarrays identifiziert wurden, und/oder bereits als Safener bekannten Verbindung behandelt werden.
- Bevorzugt sind hierbei solche Verbindungen, die in ihrer Verwendung als sogenannte Safener bereits im Pflanzenschutz bekannt sind, wie beispielsweise, Safener bekannten Verbindungen bestehend aus den Verbindungen der Formeln I-1 (Mefenpyr-diethyl), I-9 (Isoxadifen-ethyl), II-1 (Chloquintocet-mexyl), b-11 (Fenclorim), b-14 (Dymron), VIII-3 (4-Cyclopropylaminocarbonyl-N-(2-methoxybenzoyl)benzolsulfonamide), ganz besonders bevorzugt sind die Verbindungen I-1 und VIII-3 (4-Cyclopropylaminocarbonyl-N-(2-methoxybenzoyl) benzolsulfonamide)).
- Durch Applikation der zuvor genannten Verbindungen können Nutzpflanzen effektiv gegenüber den Auswirkungen abiotischer Stressoren geschützt werden, was sich z.B. auch in höheren Erträgen niederschlägt.
- Gegenstand der vorliegenden Erfindung ist daher auch ein Verfahren Erhöhung der Toleranz von Nutzpflanzen in Nutzpflanzenkulturen gegenüber abiotischen Stressoren durch Applikation der mit Hilfe des DNA-Microarrays unter Betrachtung der Expressionsprofile der Gene der identifizierten Verbindungen und/oder bereits als Safener bekannter Verbindungen.
- Die folgenden Beispiele beschreiben die Erfindung im einzelnen.
- Beispiel 1
- Nachweis der Wirkung von Safenern auf Pflanzen, die gezielten Trockenstressbedingungen ausgesetzt waren, durch Gene Expression Profiling (GEP):
- Abiotischer Stressor = Trockenstress
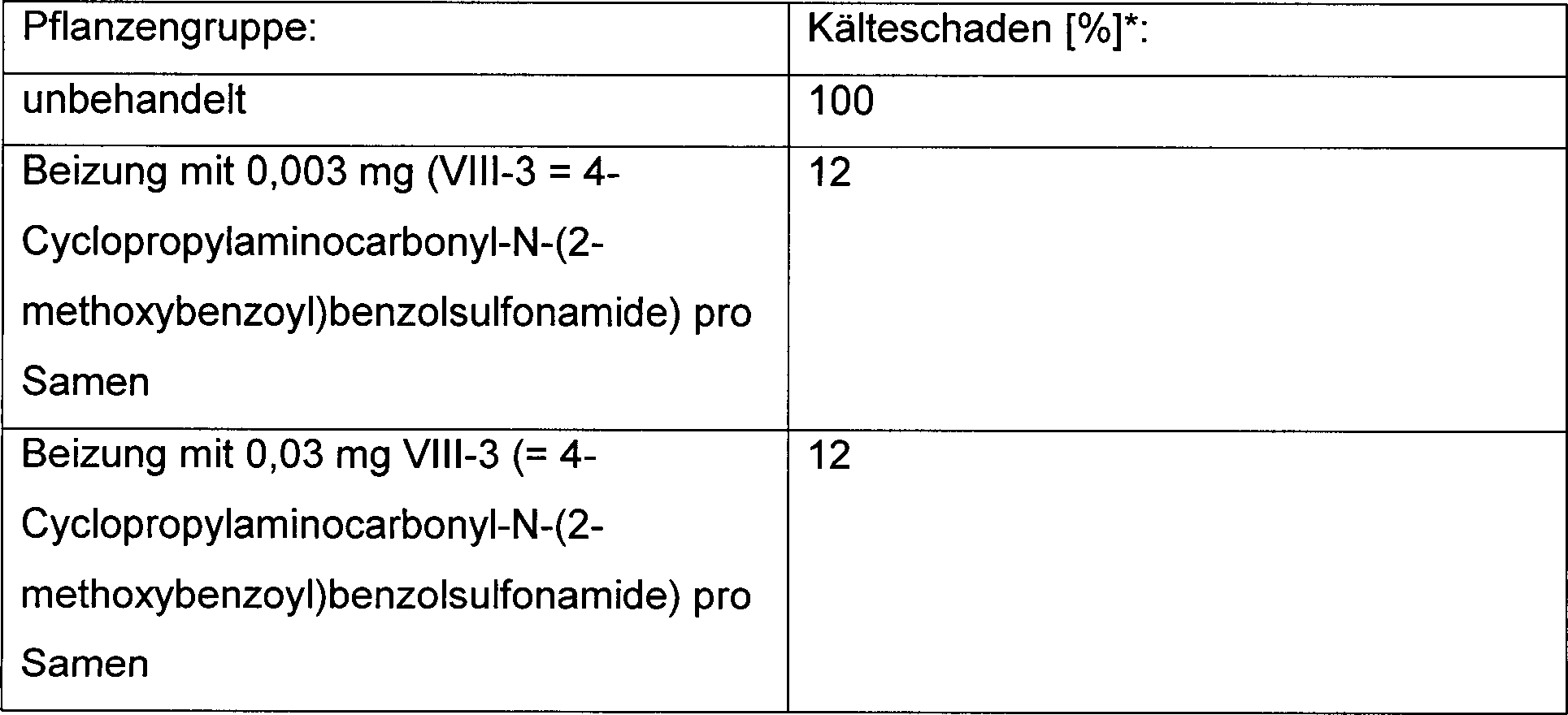
- Mais-Samen der Sorte Lorenzo wurden mit der Verbindung 4-Cyclopropylaminocarbonyl-N-(2-methoxybenzoyl)benzolsulfonamide gebeizt.
- Dazu wurden 10 g Samen mit 20 mg Wirkstoff gelöst in 2 ml Methylenchlorid unter leichtem Schütteln inkubiert, bis das Lösungsmittel abgedampft war (ca. 30 min.). Die Samen der Kontrollgruppe wurden lediglich mit Lösungsmittel gebeizt. Anschließend wurden die behandelten Samen in Töpfe mit Erde (Durchmesser: 10 cm, je 10 Samen pro Topf) ausgelegt und die Maiskeimlinge für 10 Tage in einer Klimakammer unter definierten Licht-, Feuchtigkeits- und Temperaturbedingungen [Weißlicht, Langtag (16 h hell, 8 h dunkel), 70 % Luftfeuchtigkeit, 24°C] angezogen. Es wurden je 2 × 10 Töpfe für die Kontrollgruppen und für den Trockenstress-Versuch verwendet. Während der Anzucht wurden die Pflanzen alle 2 Tage durch Anstauen von unten in einer Wanne für 20 min. bewässert. 10 Tage nach Auskeimen der Samen wurden die Maispflanzen dem Trockenstress ausgesetzt. Dazu wurden die Pflanzen der Kontrollgruppe 1 (ohne Wirkstoff-Beizung) und der Testgruppe (mit Wirkstoff-Beizung) nur noch alle 7 Tage wie oben beschrieben gewässert. Bei den Pflanzen der Kontrollgruppe 2 (ohne Wirkstoff-Beizung) und der Testgruppe 2 (mit Wirkstoff-Beizung) wurde das normale Bewässerungsschema beibehalten. Nach 3 Wochen Trockenstress-Bedingungen wurde der Versuch wie folgt ausgewertet. Die oberirdischen Pflanzenteile wurden abgeschnitten und über Nacht bei 50°C getrocknet. Am nächsten Tag wurde die Blattmasse pro Topf (Trockenmasse) in [g] bestimmt.
- Die Messwerte wurden über die jeweils 10 Töpfe der Pflanzengruppe gemittelt. Die in der Tab. 1 angegebenen Zahlenwerte sind Relativwerte in [%] bezogen auf die Messergebnisse der Kontrollgruppe 2 (ohne Wirkstoff-Beizung, normales Bewässerungsschema). Tabelle 1: Trockenstress-Versuch mit Maispflanzen ohne und mit Wirkstoff-Beizung
- S = Verbindung VIII-3 (= 4-Cyclopropylaminocarbonyl-N-(2-methoxybenzoyl) benzolsulfonamide),
- T = Trockenstress
- Die durchschnittliche Trockenmasse war bei Pflanzen aus ungebeizten und aus gebeizten Samen ohne Stressbedingungen gleich (Kontrollgruppe 2, Testgruppe 2).
- Die Pflanzen aus der Gruppe mit Beizung mit der Verbindung VIII-3 (= 4-Cyclopropylaminocarbonyl-N-(2-methoxybenzoyl)benzolsulfonamide) zeigten im Durchschnitt einen kompakteren Habitus als die Pflanzen der Kontrollgruppe, der sich aber nicht auf die Trockenmasse auswirkte. Unter Trockenstress war die durchschnittliche Blattmasse (Trockenmasse) der Safener-gebeizten Pflanzen gegenüber den ungebeizten Kontrollpflanzen jedoch signifikant erhöht (Kontrollgruppe 1, Testgruppe 1).
- Beispiel 2
- Abiotischer Stressor = Hitzestress
- Mais-Samen der Sorte Lorenzo wurden wie in Beispiel 1 mit der Verbindung 4-Cyclopropylaminocarbonyl-N-(2-methoxybenzoyl)benzolsulfonamide gebeizt bzw. nur mit Lösungsmittel ohne Wirkstoff behandelt. Die Anzucht der Keimlinge erfolgte für 10 Tage in der Klimakammer unter definierten Bedingungen ebenfalls wie in Beispiel 1 beschrieben. Für den Hitzestress-Versuch wurden 2 × 10 Töpfe mit Maispflanzen verwendet. Die Kontrollgruppe bestand aus ungebeizten Pflanzen (Lösungsmittel), die Testgruppe aus Safener-gebeizten Pflanzen.
- Zur Applizierung der Hitzestress-Bedingungen wurden beide Pflanzengruppen für 2 Tage in einen Klimaschrank bei 45°C, Weißlicht, Langtag (16 h hell, 8 h dunkel) und 70 % Luftfeuchtigkeit gestellt. Um eine Austrocknung durch die hohe Temperatur zu vermeiden, wurden die Pflanzen 1 × pro Tag durch Anstauen von unten in einer Wanne bewässert. Nach dem Hitzestress konnte beobachtet werden, dass – besonders in der Kontrollgruppe – die Sprosse vieler Pflanzen umgeknickt waren und die Blätter flach auf dem Boden lagen.
- Der Versuch wurde nach folgenden Kriterien quantitativ ausgewertet.
- Nach der Hitze-Behandlung wurden die umgeknickten Pflanzen ausgezählt und das Ergebnis pro Topf bewertet:
< 20 % der aufgelaufenen Pflanzen umgeknickt: schwache Schädigung O
20–50 % der aufgelaufenen Pflanzen umgeknickt: mittlere Schädigung
> 50 % der aufgelaufenen Pflanzen umgeknickt: starke Schädigung • - Anschließend wurden alle Pflanzen für 2 Wochen unter Standard-Bedingungen weiter kultiviert. Dann wurde der Längenzuwachs der Einzelpflanzen gemessen und die Überlebensrate der Pflanzen pro Topf bestimmt:
> 50 % Überlebensrate: schwache Schädigung O
20–50 % Überlebensrate: mittlere Schädigung
< 20 % Überlebensrate: starke Schädigung • - Die Ergebnisse der Versuchsauwertung sind in Tab.2 zusammengefasst.
- Die ungebeizten Kontrollpflanzen wurden durch den Hitzestress stark geschädigt. Auffallend waren insbesondere das Umknicken der Sprosse bei den meisten Pflanzen, sowie die geringe Überlebensrate. Die Safener-gebeizten Testpflanzen zeichneten sich besonders durch ein wesentlich besseres „Standing" aus. In der Endbonitur wurde zwar auch bei diesen Pflanzen die Schädigung durch den starken Hitzestress deutlich, die Überlebensrate war aber signifikant höher als in der Kontrollgruppe. Tabelle 2: Trockenstress-Versuch mit Maispflanzen ohne und mit Wirkstoff-Beizung
- S = Verbindung VIII-3 (= 4-Cyclopropylaminocarbonyl-N-(2-methoxybenzoyl)benzolsulfonamide),
- H = Hitzestress
- Beispiel 3
- Abiotischer Stressor = Kältestress (Gewächshaus)
- Mais-Samen der Sorte Lorenzo wurden in 10 cm Töpfen in Erde mit je 10 Samen pro Topf ausgesät. Alle Versuchsgruppen bestanden aus jeweils 4 Töpfen. Die ausgesäten Samen der Testgruppen 1 und 2 wurden im Vorauflauf mit 50 bzw. 100 [g a.i./ha] der Verbindung 4-Cyclopropylaminocarbonyl-N-(2-methoxybenzoyl) benzolsulfonamide gespritzt. Die Samen der Kontrollgruppe blieben unbehandelt. Die Pflanzen wurden unter kontrollierten Bedingungen in der Klimakammer [Weißlicht (Langtag: 16 h hell, 8 h dunkel), 22°C Tagestemperatur, 14°C Nachttemperatur, 60 % Luftfeuchtigkeit] angezogen.
- Nach der Keimung, wenn die Pflanzen eine Höhe von ca. 1 cm erreicht hatten, wurden 2 Töpfe aus jeder Gruppe für 6 h in einer anderen Klimakammer unter Kältestress-Bedingungen bei –2° C inkubiert. Anschließend wurden diese Pflanzen wieder zu den anderen in die erste Klimakammer gestellt.
- Nach weiteren 24 h unter Standard-Bedingungen wurde der Versuch ausgewertet. Es konnte beobachtet werden, dass der Kältestress Chlorosen an den Blattspitzen der Keimlinge der unbehandelten Kontrollgruppe hervorrief. Diese Symptome waren an den Safener-behandelten Pflanzen gar nicht oder nur sehr eingeschränkt zu beobachten.
- Alle Pflanzen der Testgruppen und der Kontrollgruppe, die ausschließlich unter Standard-Bedingungen ohne Kältestress gehalten wurden, zeigten keinerlei Schadsymptome.
- Zur quantitativen Auswertung des Versuchs wurden die Pflanzen mit Aufhellungen an den Blattspitzen ausgezählt. Die Gesamtzahl der Pflanzen pro Versuchsgruppe und Kältestress-Behandlung war 20 verteilt auf je 2 Töpfe.
- Die Ergebnisse der Versuchsauswertung sind in Tabelle 3 zusammengefasst.
- Tabelle 3: Kältestress-Versuch (Gewächshaus) mit Maispflanzen ohne und mit Wirkstoff-Behandlung mit der Verbindung VIII-3 (= 4-Cyclopropylaminocarbonyl-N-(2-methoxybenzoyl)benzolsulfonamide) im Vorauflauf. Alle Pflanzen waren Kältestress-Behandlung ausgesetzt. Die Gesamtzahl de Pflanzen pro Gruppe betrug 20.
- Die Ergebnisse zeigen, dass die Behandlung mit Wirkstoff-Behandlung mit der Verbindung VIII-3 (= 4-Cyclopropylaminocarbonyl-N-(2-methoxybenzoyl)benzolsulfonamide) die durch Kältestress entstehenden Schadsymptome deutlich reduzieren kann, bzw. in der höheren Dosierung das Auftreten dieser Symptome gänzlich verhindert.
- Beispiel 4
- Abiotischer Stressor = Kältestress (Freiland)
- Mais-Samen (Dent Corn) wurden mit 0,003 mg und 0,03 mg der Verbindung 4-Cyclopropylaminocarbonyl-N-(2-methoxybenzoyl)benzolsulfonamide pro g Samen gebeizt und auf je 34 m2 großen Testparzellen ausgesät. Eine Kontrollparzelle enthielt ungebeiztes Saatgut. Ca. 8 Tage nach Auflaufen der Saat waren die Keimlinge im Einblatt-Stadium und waren für 5 Tage den folgenden Temperatur-Bedingungen ausgesetzt:
- Nach dieser Kälteperiode wurden die Versuchsparzellen bonitiert. Dabei wurden alle Pflanzen einzeln bewertet und Pflanzen mit mindestens 20 % Kältesymptomen bezogen auf die gesamte Blattfläche (Verbrennungen und/oder Chlorosen) als geschädigt bewertet.
- Die Ergebnisse sind in der Tabelle 4 zusammengefasst. In der Kontrollparzelle ohne Safener-Beizung zeigten alle Pflanzen (100 %) die beschriebenen Kältesymptome. In den Testparzellen mit Safener-Beizung waren die Kälteschäden signifikant reduziert.
- Hier konnten nur noch bei ca. 12 % der Pflanzen Schadsymptome beobachtet werden. Die maximale Frostschutzwirkung wurde im Größenbereich der in der Tabelle angegebenen Wirkstoff-Beizungsmengen erzielt. Tabelle 4: Kältestress-Versuch (Freiland) mit Maispflanzen ohne und mit Wirkstoff-Beizung mit der Verbindung VIII-3 (= 4-Cyclopropylaminocarbonyl-N-(2-methoxybenzoyl) benzolsulfonamide)
- *: Anteil der Pflanzen mit Kälteschaden > 20 % bezogen auf die Gesamtzahl der Pflanzen in der Testparzelle
- Beispiel 5
- Charakterisierung von Genen, die von Safenern unter abiotischen Stressbedingungen induziert werden, durch Gene Expression Profiling (GEP):
- Mais-Samen der Sorte Lorenzo wurden wie in Beispiel 1 beschrieben mit der Verbindung VIII-3 (= 4-Cyclopropylaminocarbonyl-N-(2-methoxybenzoyl) benzolsulfonamide) bzw. mit Lösungsmittel gebeizt. Die Pflanzen wurden für 10 Tage in einer Klimakammer angezogen (Bedingungen: siehe Beispiel 1). Anschließend wurden die Pflanzen den folgenden Stress-Bedingungen ausgesetzt:
- (1) Hitzestress: 6 h bei 45°C
- (2) Trockenstress: 7 Tage ohne Bewässerung, 24°C
- Die Kontrollpflanzen der jeweiligen Experimentgruppe wurden unter den in Beispiel 1 beschriebenen Standard-Bedingungen (Temperatur, Bewässerung) gehalten.
- Nach der Stressbehandlung wurden die Blätter der gestressten Pflanzen sowie der ungestressten Kontrollpflanzen geerntet, in Flüssig-Stickstoff schockgefroren und bis zur Aufarbeitung bei –80°C gelagert. Alle Versuche wurden in Replikaten mit je 2 Töpfen durchgeführt.
- Die Herstellung der markierten RNA-Sonden für die DNA-Chip-Hybridisierung erfolgte nach den Protokollen (Expression Analysis, Technical Manual) der Firma Affymetrix (Affymetrix Inc., 3380 Central Expressway, Santa Clara, CA, USA). Aus je 500 mg der geernteten Blätter wurde zunächst Gesamt-RNA isoliert. Je 10 μg Gesamt-RNA wurden für die Erst- und Zweitstrang cDNA-Synthese verwendet. Die cDNA wurde mit T7-Polymerase amplifiziert und dabei gleichzeitig mit Biotin-UTP markiert. Je 20 μg dieser biotinylierten cDNA wurden für die Hybridiserung des Mais Genom-Arrays von der Firma Affymetrix eingesetzt. Dieser DNA-Microarray enthält DNA-Sequenzen, die in ihrer Gesamtheit 13339 Gene repräsentieren. Anschließend wurden die DNA-Microarrays in der Affymetrix Fluidics Station gewaschen, mit Streptavidin/Phycoerythrin (Molecular Probes, P/N S-866) gefärbt und mit dem zugehörigen Agilent Laser Scanner (Agilent Gene Array Scanner) gescannt. Die erhaltenen Fluoreszendaten wurden mit der Software Microarray Suite 5 von Affymetrix analysiert. Nach erfolgter Qualitätskontrolle wurden alle DNA-Chip-Analysen in einer Datenbank gespeichert. Zur Ermittlung von relativen Expressionswerten (Induktions-, Repressionsfaktoren) wurden die absoluten Expressionswerte der Gene aus den jeweiligen Stressexperimenten mit den Werten der jeweiligen Kontrollversuche (d.h., ohne abiotischen Stress und Beizung lediglich mit Lösungsmittel) verglichen und dabei die von der Affymetrix-Software vorgegebenen Signifikanz Kriterien zu Grunde gelegt. Die daraus erhaltenen je 4 Expressionswerte pro Gen wurden durch Medianberechnung gemittelt. Diese Mediane sind als Induktionsfaktoren in den Ergebnistabellen angegeben. Ähnlichkeitsvergleiche von Expressionsprofilen verschiedener Experimente und Cluster-Analysen wurden mit der Software „Genedata Expressionist" von Genedata (Genedata, Maulbeerstr. 46, CH-4016 Basel, Switzerland) durchgeführt.
- Bei der Analyse der Expressionsprofile wurde speziell nach Genen gesucht, die durch die Testsubstanzen nur in Verbindung mit abiotischem Stress induziert werden, nicht aber durch die Substanzen oder durch Stress alleine. Solche Gene können als Indikatoren für zusätzliche Anti-Stress-Wirkungen der Substanzen angesehen werden, die über die bereits bekannte Safener-Wirkung hinausgehen. Die Ergebnisse der Analysen sind in den folgenden Tabellen aufgeführt.
- Die Induktionsmuster der beschriebenen Indikatorgene erlauben das gezielte Auffinden von Wirkstoffen zur Steigerung der abiotischen Stresstoleranz in Kulturpflanzen.
- a) Unter Hitzestressbedingungen, d.h. die getesteten (mit 2mg a.i./g Samen 4-Cyclopropylaminocarbonyl-N-(2-methoxybenzoyl)benzolsulfonamide gebeizten) Maispflanzen wurden 7 Tage nach Keimung für 6 Stunden einer Temperatur von 45°C ausgesetzt.
-
- Der jeweiligen Probe Set No. entspricht:
Zm.11840.1.A1_at: Putative N-carbamyl-L-amino acid amidohydrolase Zm.4274.1.S1_at: Cytochrome P450 Zm.3040.1.S1_at Uricase II (E.C.1.7.3.3); Nodule specific uricase Zm12587.1.S1.s_at: Glycosyltransferase Zm18994.2.A1_a_at: Putative Serine Transferase Zm.13498.1.S1_at: Membrane Protein - Kondition A: Hitzestress (6 Stunden, 45°C)
- Kondition B: 4-Cyclopropylaminocarbonyl-N-(2-methoxybenzoyl)benzolsulfonamide (VIII-3) gebeizter Samen/KEIN Hitzestress
- Kondition C: 4-Cyclopropylaminocarbonyl-N-(2-methoxybenzoyl)benzolsulfonamide (VIII-3) gebeizter Samen + Hitzestress (6 Stunden, 45°C)
- Somit wurde selbst bei leichter Grundinduktion der analysierten Genaktivitäten in allen Fällen eine deutliche Steigerung der Genexpression beobachtet, die bei den hier genannten Genen im Bereich von 1.5 bis 2.35 liegt (Expression unter Kondition C/Expression unter Kondition A). Wurde die getestete Verbindung VIII-3 alleinig, d.h. ohne Hitzestress geprüft, so lagen die gemessenen Expressionslevel im Bereich des durch Hitzestress induzierten Bereichs, oder unterhalb oder leicht oberhalb des durch Hitzestress induzierten Bereichs.
- Die aus der Tabelle 5 abgeleiteten Induktionsmuster, die direkt durch die erhaltenen Expressionswerte dargestellt werden, zeigen charakteristische Induktionen durch Einwirkung der Verbindung 4-Cyclopropylaminocarbonyl-N-(2-methoxybenzoyl) benzolsulfonamide, wobei die Wirkung auf das Putative N-Carbamyl-L-Amino acid Amidohydrolase [Zm.11840.1.A1_at] und auf das Putative Serine Carboxypeptidase [Zm18994.2.A1-at] am stärksten ausgeprägt ist.
- b) Unter Trockenstressbedingungen, d.h. die getesteten (mit 2mg a.i./g Samen 4-Cyclopropylaminocarbonyl-N-(2-methoxybenzoyl)benzolsulfonamide gebeizten) Maispflanzen wurden 7 Tage nach Keimung für 7 Stunden einer Temperatur von 45°C ausgesetzt.
-
- Der jeweiligen Probe Set No. entspricht:
Zm.818.1.A1_at Universal Stress Protein Zm.3633.4.A1_at Wound Induced Protein (Fragment) Zm.18273.1.S1_at Regulatory Protein-Like Zm.13229.1.S1_at NBS-LRR Type Disease Resistance Protein O2 (Fragment) Zm.12035.1.A1_at Similar to AT3G10120 Zm.485.1.A1_at Non-Symbiotic Hemoglobin (HBT) (ZEAMP GLB1) Zm.818.2.A1_at Expressed Protein Zm.10097.1.A1_at Expressed Protein Zm.18682.1.A1_at Unknown Protein - Kondition A: Trockenstress (7 Tage, 24°C)
- Kondition B: 4-Cyclopropylaminocarbonyl-N-(2-methoxybenzoyl)benzolsulfonamide (VIII-3) gebeizter Samen/KEIN Trockenstress
- Kondition C: 4-Cyclopropylaminocarbonyl-N-(2-methoxybenzoyl)benzolsulfonamide (VIII-3) gebeizter Samen + Trockenstress (7 Tage, 24°C)
- Somit wurde selbst bei leichter Grundinduktion der analysierten Genaktivitäten in allen Fällen eine deutliche Steigerung der Genexpression beobachtet, die bei den hier genannten Genen im Bereich von 1.75 bis 8.0 liegt (Expression unter Kondition C/Expression unter Kondition A). Wurde die getestete Verbindung VIII-3 alleinig, d.h. ohne Trockenstress geprüft, so lagen die gemessenen Expressionslevel im Bereich des durch Trockenstress induzierten Bereichs, in einzelnen Fällen sogar unterhalb der Expression ungestresster Pflanzen (bei Werten < 1.0)
- Die aus der Tabelle 6 abgeleiteten Induktionsmuster, die direkt durch die erhaltenen Expressionswerte dargestellt werden, zeigen charakteristische Induktionen in Gegenwart der Verbindung 4-Cyclopropylaminocarbonyl-N-(2-methoxybenzoyl) benzolsulfonamide, wobei die Wirkung auf das Universal Stress Protein [Zm.818.1.A1_at] und Non-Symbiotic Hemoglobin (HBT) (ZEAMP GLB1) [Zm.485.1.A1_at] am stärksten ausgeprägt ist.
Claims (17)
- Verfahren zum Auffinden einer die Toleranz gegenüber abiotischen Stressoren bei Pflanzen erhöhenden Verbindung, wobei die Steigerung der Transkription bzw. Expression einzelner oder mehrerer, pflanzenendogener Gene, als Indiz für die Induktion bewertet wird.
- Verfahren gemäß Anspruch 1, wobei die pflanzenendogenen Gene ausgewählt sind aus der Gruppe von Genen codierend für Proteine aus der Gruppe der Cytrochrom-Oxidasen, Glycosyltransferasen, Uricasen, Peptidasen, verschiedener Membranproteine, Amidohydrolasen, Late Embryogenesis Abundant Proteinen, sowie verschiedener allgemeiner Stressproteine.
- Verfahren gemäß Anspruch 1 oder 2, dadurch gekennzeichnet, dass: a) Testpflanzen einem oder mehreren abiotischen Stressoren ausgesetzt werden, b) Kontrollpflanzen, unter ansonsten gleichen Bedingungen wie Testpflanzen unter a), zusätzlich mit einer zu testenden Verbindung in Kontakt gebracht werden, sei es in Form gebeizten Saatgutmaterials oder der Besprühung zu einem bestimmten Entwicklungszeitpunkt oder durch Wurzelaufnahme, c) RNA aus den Test- und Kontrollpflanzen extrahiert wird, d) die RNA entweder direkt radioaktiv oder nicht radioaktiv markiert wird, oder aber die RNA unter gleichzeitiger enzymatischer Umschreibung in die korrespondierende cDNA radioaktiv oder nicht-radioaktiv markiert wird, oder aber die erhaltene, nicht markierte cDNA enzymatisch in eine korrespondierende radioaktive oder nicht-radioaktive markierte cRNA umgeschrieben wird, e) ein pflanzliche DNA-Sequenzen enthaltender DNA-Microarray mit den gemäß Schritt d) erhaltenen Substanzen hybridisiert wird, f) Expressionsprofile der Gene für die Expression der verschiedener Stressproteine vergleichend für die gemäß a) und b) getesteten Pflanzen erstellt werden, g) eine Quantifizierung der gemäß f) gemessenen Expressionsunterschiede erfolgt, h) eine abschließende Systematisierung der gemäß g) zugeordneten Expressionsprofile durch Cluster-Analyse erfolgt.
- Verfahren gemäß Anspruch 3, wobei im Fall der beabsichtigten Steigerung der Toleranz bei Hitzestress die Expression der Gene der Cytrochrom-Oxidasen, wie der Cytochromoxidase P450, Glycosyltransferasen, Uricasen, Peptidasen, verschiedener Membranproteine, Amidohydrolasen bei hitzegestressten und nicht hitzegestressten Pflanzen verglichen wird
- Verfahren gemäß Anspruch 4, wobei die Expression der Gene, der N-carbamyl-L-amino acid Amidohydrolase, der Serine Carboxypeptidase, der Uricase II (E.C.1.7.3.3) und der Glycosyltransferase bei hitzegestressten und nicht hitzegestressten Pflanzen verglichen wird.
- Verfahren gemäß einem der Ansprüche 4 und 5, wobei das Expressionsprofil eines oder mehrerer der benannten Gene um den Faktor 1.5 bis 30, bevorzugt 1.5 bis 20, besonders bevorzugt 1.5 bis 10, ganz besonders bevorzugt 1.5 bis 5 erhöht ist.
- Verfahren gemäß Anspruch 3, wobei im Fall der beabsichtigten Steigerung der Toleranz bei Trockenstress die Expression der der Late Embryogenesis Abundant Proteine, des Universal Stress Proteins, des Non-symbiotic hemoglobin (Zm.485.1.A1_at), des Proteins mit der Adressierung „Zm.818.2.A1_a_at" (Signatur gemäß Mais Genom-Array der Firma Affymetrix) und des Proteins mit der Adressierung „Zm.18682.1.A1_s_at" (Signatur gemäß Mais Genom-Array der Firma Affymetrix) bei durch Trockenheit gestressten und nicht durch Trockenheit gestressten Pflanzen verglichen wird.
- Verfahren gemäß Anspruch 7, wobei die Expression der Gene des Universal Stress Proteins (Zm.818.1.A1_at), Non-symbiotic hemoglobin (Zm.485.1.A1_at), des Proteins mit der Adressierung „Zm.818.2.A1_a_at" (Signatur gemäß Affimetrix Mais Genom-Array) und des Proteins mit der Adressierung „Zm.18682.1.A1_s_at" (Signatur gemäß Mais Genom-Array der Firma Affymetrix) bei durch Trockenheit gestressten und nicht Trockenheit gestressten Pflanzen verglichen wird.
- Verfahren gemäß einem der Ansprüche 7 oder 8, wobei das Expressionsprofil eines oder mehrerer der benannten Gene um den Faktor 1.5 bis 30, bevorzugt 1.5 bis 20, besonders bevorzugt 1.5 bis 10, ganz besonders bevorzugt 1.5 bis 8 erhöht ist.
- Verwendung einer oder mehrerer mit Hilfe eines Verfahrens gemäß einem der Ansprüche 1 bis 9 identifizierten Verbindungen und/oder bereits als Safener bekannten Verbindungen, zur Erhöhung der Toleranz gegenüber abiotischen Stressoren zur Ertragssteigerung, zur Verlängerung der der Vegetationsperiode, zur Ermöglichung einer früheren Aussaat, zur Steigerung der Qualität, oder zur Verwendung im Rahmen der Züchtung unter Verwendung ansonsten weniger vitaler Inzucht-Linien.
- Verwendung von Verbindungen gemäß Anspruch 10, die in ihrer Verwendung als Safener bereits im Pflanzenschutz bekannt sind, ausgewählt aus der Gruppe bestehend aus Mefenpyr-diethyl, Isoxadifen-ethyl, Chloquintocetmexyl, Fenclorim, Dymron, und 4-Cyclopropylaminocarbonyl-N-(2-methoxybenzoyl)benzolsulfonamide.
- Verwendung von Verbindungen gemäß Anspruch 11, die in ihrer Verwendung als Safener bereits im Pflanzenschutz bekannt sind, ausgewählt aus der Gruppe bestehend aus Mefenpyr-diethyl und 4-Cyclopropylaminocarbonyl-N-(2-methoxybenzoyl)benzolsulfonamide.
- Verwendung von Verbindungen gemäß einem der Ansprüche 10 bis 12, zur Toleranzerhöhung gegenüber abiotischen Stressoren in den Kulturpflanzen Mais, Weizen, Gerste, Roggen, Hafer, Reis, Soja, Sonnenblume, Raps und Zuckerrübe.
- Verfahren zur Ertragssteigerung in Nutzpflanzenkulturen, dadurch gekennzeichnet, dass die Nutzpflanzen durch Saatgut-Beizung, durch Blattspritzung oder durch Bodenapplikation mit einem oder mehreren Verbindungen die nach einem Verfahren gemäß einem der Ansprüche 1 bis 9 identifiziert wurden und/oder bereits als Safener im Pflanzenschutz bekannten Verbindungen behandelt werden.
- Verfahren zur Verlängerung der Vegetationsperiode in Nutzpflanzenkulturen, dadurch gekennzeichnet, dass die Nutzpflanzen durch Saatgut-Beizung, durch Blattspritzung oder durch Bodenapplikation mit einem oder mehreren Verbindungen die nach einem Verfahren gemäß einem der Ansprüche 1 bis 9 identifiziert wurden und/oder bereits als Safener im Pflanzenschutz bekannten Verbindungen behandelt werden.
- Verfahren zur Ermöglichung einer früheren Aussaat in Nutzpflanzenkulturen, dadurch gekennzeichnet, dass die Nutzpflanzen durch Saatgut-Beizung, durch Blattspritzung oder durch Bodenapplikation mit einem oder mehreren Verbindungen die nach einem Verfahren gemäß einem der Ansprüche 1 bis 9 identifiziert wurden und/oder bereits als Safener im Pflanzenschutz bekannten Verbindungen behandelt werden.
- Verfahren zur Qualitätssteigerung in Nutzpflanzenkulturen, dadurch gekennzeichnet, dass die Nutzpflanzen durch Saatgut-Beizung, durch Blattspritzung oder durch Bodenapplikation mit einem oder mehreren Verbindungen die nach einem Verfahren gemäß einem der Ansprüche 1 bis 9 identifiziert wurden und/oder bereits als Safener im Pflanzenschutz bekannten Verbindungen behandelt werden.
Priority Applications (22)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE102005057250A DE102005057250A1 (de) | 2005-11-29 | 2005-11-29 | Wirkstoffe zur Steigerung der Stressabwehr in Pflanzen gegenüber abiotischem Stress und Methoden zu ihrer Auffindung |
| KR1020087011767A KR101362803B1 (ko) | 2005-11-29 | 2006-11-10 | 비생물적 스트레스와 관련한 식물의 방어를 증가시키는활성 성분 및 상기 활성 성분을 검출하는 방법 |
| CN200680044690.4A CN101316505B (zh) | 2005-11-29 | 2006-11-10 | 在植物中用于提高对非生物性应激的应激抵御的活性成分以及发现该活性成分的方法 |
| EA200801456A EA015077B1 (ru) | 2005-11-29 | 2006-11-10 | Активные ингредиенты для повышения защиты растений от стресса, вызванного абиотическими факторами, и способы их обнаружения |
| EP06818467A EP1956885A2 (de) | 2005-11-29 | 2006-11-10 | Wirkstoffe zur steigerung der stressabwehr in pflanzen gegenüber abiotischem stress und methoden zu ihrer auffindung |
| ES10175325T ES2383741T3 (es) | 2005-11-29 | 2006-11-10 | Utilización de antídotos para el aumento de la tolerancia de las plantas frente a agentes estresores abióticos |
| JP2008542623A JP5297810B2 (ja) | 2005-11-29 | 2006-11-10 | 非生物的ストレスに関する植物防御を向上させる有効成分およびその有効成分を検出するための方法 |
| CA2631353A CA2631353C (en) | 2005-11-29 | 2006-11-10 | 4-cyclopropylaminocarbonyl-n-(2-methoxybenzoyl)benzenesulfonamide for increasing the yield in crop plants in the presence of drought stress, heat stress, and/or cold stress |
| PCT/EP2006/010796 WO2007062737A2 (de) | 2005-11-29 | 2006-11-10 | Wirkstoffe zur steigerung der stressabwehr in pflanzen gegenüber abiotischem stress und methoden zu ihrer auffindung |
| AU2006319516A AU2006319516B2 (en) | 2005-11-29 | 2006-11-10 | Active ingredients for increasing a plant's defence in relation to abiotic stress, and methods for detecting said active ingredients |
| BRPI0619386-2A BRPI0619386B1 (pt) | 2005-11-29 | 2006-11-10 | Uso de compostos ativos e processo para aumentar produtividade em plantas de cultura pelo aumento da tolerância ao estresse abiótico |
| EA201100145A EA019372B9 (ru) | 2005-11-29 | 2006-11-10 | Активные ингредиенты для повышения защиты растений от стресса, вызванного абиотическими факторами, и способ их обнаружения |
| AT10175325T ATE550930T1 (de) | 2005-11-29 | 2006-11-10 | Wirkstoffe zur ertragssteigerung in pflanzen gegenüber trocken- und/oder hitzestress |
| EP10175325A EP2289310B1 (de) | 2005-11-29 | 2006-11-10 | Wirkstoffe zur Ertragssteigerung in Pflanzen gegenüber Trocken- und/oder Hitzestress |
| PL10175325T PL2289310T3 (pl) | 2005-11-29 | 2006-11-10 | Substancje czynne do zwiększania plonów u roślin wobec stresu suszy i/lub stresu cieplnego |
| US11/604,214 US20070124839A1 (en) | 2005-11-29 | 2006-11-27 | Active substances for increasing the stress defense in plants to abiotic stress, and methods of finding them |
| ARP060105214A AR057179A1 (es) | 2005-11-29 | 2006-11-27 | Principios activos para aumentar la resistencia al estres en plantas frente al estres abiotico y metodos para hallar los mismos |
| TW095143763A TW200738885A (en) | 2005-11-29 | 2006-11-27 | Active substances for increasing the stress defense in plants to abiotic stress, and methods of finding them |
| IL191646A IL191646A (en) | 2005-11-29 | 2008-05-22 | Active Ingredients to Raise Plant Protection in Relation to Abiotic Stress and Methods to Identify Those Active Ingredients |
| US12/826,788 US8901040B2 (en) | 2005-11-29 | 2010-06-30 | Active substances for increasing the stress defense in plants to abiotic stress, and methods of finding them |
| IL233573A IL233573A (en) | 2005-11-29 | 2014-07-09 | Active Ingredients to Raise Plant Protection in Relation to Abiotic Stress and Methods to Identify Those Active Ingredients |
| US14/453,022 US9920383B2 (en) | 2005-11-27 | 2014-08-06 | Active substances for increasing the stress defense in plants to abiotic stress, and methods of finding them |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE102005057250A DE102005057250A1 (de) | 2005-11-29 | 2005-11-29 | Wirkstoffe zur Steigerung der Stressabwehr in Pflanzen gegenüber abiotischem Stress und Methoden zu ihrer Auffindung |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| DE102005057250A1 true DE102005057250A1 (de) | 2007-06-06 |
Family
ID=37983293
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE102005057250A Withdrawn DE102005057250A1 (de) | 2005-11-27 | 2005-11-29 | Wirkstoffe zur Steigerung der Stressabwehr in Pflanzen gegenüber abiotischem Stress und Methoden zu ihrer Auffindung |
Country Status (17)
| Country | Link |
|---|---|
| US (3) | US20070124839A1 (de) |
| EP (2) | EP2289310B1 (de) |
| JP (1) | JP5297810B2 (de) |
| KR (1) | KR101362803B1 (de) |
| CN (1) | CN101316505B (de) |
| AR (1) | AR057179A1 (de) |
| AT (1) | ATE550930T1 (de) |
| AU (1) | AU2006319516B2 (de) |
| BR (1) | BRPI0619386B1 (de) |
| CA (1) | CA2631353C (de) |
| DE (1) | DE102005057250A1 (de) |
| EA (2) | EA015077B1 (de) |
| ES (1) | ES2383741T3 (de) |
| IL (2) | IL191646A (de) |
| PL (1) | PL2289310T3 (de) |
| TW (1) | TW200738885A (de) |
| WO (1) | WO2007062737A2 (de) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2013037958A1 (en) * | 2011-09-16 | 2013-03-21 | Bayer Intellectual Property Gmbh | Use of phenylpyrazolin-3-carboxylates for improving plant yield |
Families Citing this family (35)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7127678B2 (en) * | 2000-12-21 | 2006-10-24 | Microsoft Corporation | System and method to specify device specific user interface information in the firmware of a USB device |
| DE102005057250A1 (de) | 2005-11-29 | 2007-06-06 | Bayer Cropscience Gmbh | Wirkstoffe zur Steigerung der Stressabwehr in Pflanzen gegenüber abiotischem Stress und Methoden zu ihrer Auffindung |
| AU2007224576A1 (en) * | 2006-03-14 | 2007-09-20 | Basf Se | Method of inducing tolerance of plants against bacterioses |
| PE20090432A1 (es) * | 2007-06-29 | 2009-05-17 | Basf Se | Estrobilurinas para aumentar la resistencia de plantas al estres abiotico |
| US20100144524A1 (en) * | 2007-11-19 | 2010-06-10 | Hoobler Ray J | Systems and Methods for Applying Particle Films to Control Stress on Plant Tissues |
| EP2145537A1 (de) | 2008-07-09 | 2010-01-20 | Bayer CropScience AG | Pflanzenwachstumsregulator |
| EP2191716A1 (de) * | 2008-11-29 | 2010-06-02 | Bayer CropScience AG | Herbizid-Safener-Kombination |
| FR2940886B1 (fr) * | 2009-01-13 | 2012-08-24 | Procedes Roland Pigeon | Utilisation d'une composition minerale liquide pour ameliorer la reponse adaptative des plantes a un changement des conditions d'environnement |
| EP2255626A1 (de) * | 2009-05-27 | 2010-12-01 | Bayer CropScience AG | Verwendung von Succinat Dehydrogenase Inhibitoren zur Steigerung der Resistenz von Pflanzen oder Pflanzenteilen gegenüber abiotischem Stress |
| CA3022591C (en) | 2010-03-12 | 2020-04-28 | Monsanto Technology Llc | Plant health compositions comprising a water-soluble pesticide and a water-insoluble agrochemical |
| AR081242A1 (es) | 2010-04-28 | 2012-07-18 | Univ California | Receptores pyr/pyl modificados activados por ligandos ortogonales |
| FR2961826B1 (fr) * | 2010-06-24 | 2012-08-03 | Agronomique Inst Nat Rech | Dispositif pour determiner ou etudier l'etat de stimulation des defenses naturelles de plantes ou parties de plantes |
| EP2471363A1 (de) * | 2010-12-30 | 2012-07-04 | Bayer CropScience AG | Verwendung von Aryl-, Heteroaryl- und Benzylsulfonamidocarbonsäuren, -carbonsäureestern, -carbonsäureamiden und -carbonitrilen oder deren Salze zur Steigerung der Stresstoleranz in Pflanzen |
| AR087888A1 (es) * | 2011-09-14 | 2014-04-23 | Dow Agrosciences Llc | Plantas con caracteristicas relacionadas al estres y metodos para producirlas |
| BR112014006217B1 (pt) | 2011-09-16 | 2019-01-15 | Bayer Intellectual Property Gmbh | utilização de acilsulfonamidas para melhorar o rendimento de plantas,método para induzir respostas de regulação de crescimento em plantas úteis ou plantas de cultura e composição. |
| AU2012307322B2 (en) * | 2011-09-16 | 2016-07-14 | Bayer Intellectual Property Gmbh | Use of 5-phenyl- or 5-benzyl-2 isoxazoline-3 carboxylates for improving plant yield |
| WO2013050324A1 (de) | 2011-10-06 | 2013-04-11 | Bayer Intellectual Property Gmbh | Abiotischen pflanzenstress-reduzierende kombination enthaltend 4- phenylbuttersäure (4-pba) oder eines ihrer salze (komponente (a)) und eine oder mehrere ausgewählte weitere agronomisch wirksame verbindungen (komponente(n) (b) |
| EP2943065B1 (de) * | 2012-12-14 | 2017-06-21 | Vib Vzw | Agrochemische zusammensetzungen zur induktion der abiotischen stresstoleranz |
| WO2014135468A1 (en) * | 2013-03-05 | 2014-09-12 | Bayer Cropscience Ag | Use of acylsulfonamides for improving plant yield |
| BR112015021132B1 (pt) | 2013-03-05 | 2020-11-03 | Bayer Cropscience Aktiengesellschaft | uso de 1-metilhexil(5-cloro-8-quinolinóxi)acetato para induzir uma resposta de regulação de crescimento em plantas |
| AR095246A1 (es) | 2013-03-14 | 2015-09-30 | Univ California | Receptores pyr/pyl modificados activados por ligandos ortogonales |
| WO2014152496A1 (en) * | 2013-03-15 | 2014-09-25 | KamTec, LLC | Signaling compositions, methods, and systems for effecting plant growth and burndown, and enhancement of crops and herbicides |
| US8999890B2 (en) | 2013-03-15 | 2015-04-07 | KamTec, LLC | Signaling compositions, methods, and systems for effecting plant burndown and herbicide enhancement |
| US9464283B2 (en) | 2013-03-15 | 2016-10-11 | KamTec, LLC | Signaling compositions, methods, and systems for effecting plant growth and crop enhancement |
| DE102013012498A1 (de) | 2013-07-26 | 2015-01-29 | Skw Stickstoffwerke Piesteritz Gmbh | Verwendung von einfachen 1,2,4-Triazol-Derivaten als Mittel zur Verbesserung der Trockenstresstoleranz |
| DE102013012500A1 (de) | 2013-07-26 | 2015-01-29 | Skw Stickstoffwerke Piesteritz Gmbh | Verwendung von Phosphorsäureamiden als Mittel zur Verbesserung der Trockenstresstoleranz |
| DE102013021933A1 (de) | 2013-12-20 | 2015-06-25 | Skw Stickstoffwerke Piesteritz Gmbh | Verwendung von Pyrazol-Derivaten als Mittel zur Verbesserung der Trockenstresstoleranz |
| WO2017072013A1 (en) | 2015-10-27 | 2017-05-04 | Bayer Cropscience Aktiengesellschaft | Composition comprising a safener, a fungicide and metalaxyl |
| CN105255896B (zh) * | 2015-11-21 | 2019-01-11 | 长沙绿天生物技术有限公司 | 一种水稻基因启动子、表达盒、表达载体及其应用 |
| DE102016107338A1 (de) | 2016-04-20 | 2017-10-26 | Skw Stickstoffwerke Piesteritz Gmbh | Verwendung von Imidamid-Derivaten als Mittel zur Verbesserung der Trockenstresstoleranz |
| CN109790150A (zh) | 2016-08-11 | 2019-05-21 | 拜耳作物科学股份公司 | 取代的吡唑啉基衍生物、其制备方法及其作为除草剂和/或植物生长调节剂的用途 |
| WO2019025153A1 (de) * | 2017-07-31 | 2019-02-07 | Bayer Cropscience Aktiengesellschaft | Verwendung von substituierten n-sulfonyl-n'-aryldiaminoalkanen und n-sulfonyl-n'-heteroaryldiaminoalkanen oder deren salzen zur steigerung der stresstoleranz in pflanzen |
| CN107466848A (zh) * | 2017-10-17 | 2017-12-15 | 沧州市农林科学院 | 耐盐小麦叠氮化钠诱变培育方法 |
| PE20211477A1 (es) * | 2018-02-05 | 2021-08-05 | Crop Microclimate Man Inc | Metodos y composiciones para aumentar la tolerancia a estres abiotico en plantas |
| CN108660238A (zh) * | 2018-04-04 | 2018-10-16 | 山西省农业科学院生物技术研究中心 | 基于gbs技术的燕麦抗旱性相关snp分子标记及其应用 |
Family Cites Families (53)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4137070A (en) | 1971-04-16 | 1979-01-30 | Stauffer Chemical Company | Herbicide compositions |
| US4021224A (en) | 1971-12-09 | 1977-05-03 | Stauffer Chemical Company | Herbicide compositions |
| US4021229A (en) | 1972-09-05 | 1977-05-03 | Stauffer Chemical Company | Sulfonamide herbicide antidote compositions and method of use |
| MA19709A1 (fr) | 1982-02-17 | 1983-10-01 | Ciba Geigy Ag | Application de derives de quinoleine a la protection des plantes cultivees . |
| EP0094349B1 (de) | 1982-05-07 | 1994-04-06 | Ciba-Geigy Ag | Verwendung von Chinolinderivaten zum Schützen von Kulturpflanzen |
| JPS60500438A (ja) | 1983-01-17 | 1985-04-04 | モンサント カンパニ− | 植物細胞を形質転換するためのプラスミド |
| BR8404834A (pt) | 1983-09-26 | 1985-08-13 | Agrigenetics Res Ass | Metodo para modificar geneticamente uma celula vegetal |
| MX159669A (es) | 1983-12-12 | 1989-08-02 | Ciba Geigy Ag | Procedimiento para la preparacion de derivados de acilamida |
| DE3525205A1 (de) | 1984-09-11 | 1986-03-20 | Hoechst Ag, 6230 Frankfurt | Pflanzenschuetzende mittel auf basis von 1,2,4-triazolderivaten sowie neue derivate des 1,2,4-triazols |
| BR8600161A (pt) | 1985-01-18 | 1986-09-23 | Plant Genetic Systems Nv | Gene quimerico,vetores de plasmidio hibrido,intermediario,processo para controlar insetos em agricultura ou horticultura,composicao inseticida,processo para transformar celulas de plantas para expressar uma toxina de polipeptideo produzida por bacillus thuringiensis,planta,semente de planta,cultura de celulas e plasmidio |
| DE3680212D1 (de) | 1985-02-14 | 1991-08-22 | Ciba Geigy Ag | Verwendung von chinolinderivaten zum schuetzen von kulturpflanzen. |
| DE3534948A1 (de) | 1985-10-01 | 1987-04-09 | Bayer Ag | Fungizide und wachstumsregulatorische mittel |
| EP0221044B1 (de) | 1985-10-25 | 1992-09-02 | Monsanto Company | Pflanzenvektoren |
| EP0242236B2 (de) | 1986-03-11 | 1996-08-21 | Plant Genetic Systems N.V. | Durch Gentechnologie erhaltene und gegen Glutaminsynthetase-Inhibitoren resistente Pflanzenzellen |
| US5013659A (en) | 1987-07-27 | 1991-05-07 | E. I. Du Pont De Nemours And Company | Nucleic acid fragment encoding herbicide resistant plant acetolactate synthase |
| IL83348A (en) | 1986-08-26 | 1995-12-08 | Du Pont | Nucleic acid fragment encoding herbicide resistant plant acetolactate synthase |
| DE3633840A1 (de) | 1986-10-04 | 1988-04-14 | Hoechst Ag | Phenylpyrazolcarbonsaeurederivate, ihre herstellung und verwendung als pflanzenwachstumsregulatoren und safener |
| CN87102789A (zh) | 1987-04-13 | 1988-11-02 | 内蒙古粮食科研所 | 膨化人工乳加工工艺 |
| DE3808896A1 (de) | 1988-03-17 | 1989-09-28 | Hoechst Ag | Pflanzenschuetzende mittel auf basis von pyrazolcarbonsaeurederivaten |
| DE3817192A1 (de) | 1988-05-20 | 1989-11-30 | Hoechst Ag | 1,2,4-triazolderivate enthaltende pflanzenschuetzende mittel sowie neue derivate des 1,2,4-triazols |
| DE58903221D1 (en) | 1988-10-20 | 1993-02-18 | Ciba Geigy Ag | Sulfamoylphenylharnstoffe. |
| US5201931A (en) | 1988-12-01 | 1993-04-13 | Her Majesty The Queen In Right Of Canada, As Represented By The National Research Council Of Canada | Abscisic acid-related plant growth regulators - germination promoters |
| DD277832A1 (de) | 1988-12-13 | 1990-04-18 | Forschzent Bodenfruchtbarkeit | Mittel zur erhoehung der stresstoleranz von kulturpflanzen |
| DD277935A1 (de) | 1988-12-13 | 1990-04-18 | Karl Marx Stadt Tech Textil | Anordnung zur horizontalen verbindung von mauerwerksteilen mit unterschiedlicher waermedaemmung |
| DD277835A1 (de) | 1988-12-13 | 1990-04-18 | Forschzent Bodenfruchtbarkeit | Mittel zur erhoehung der stresstoleranz von kulturpflanzen |
| DE3939010A1 (de) | 1989-11-25 | 1991-05-29 | Hoechst Ag | Isoxazoline, verfahren zu ihrer herstellung und ihre verwendung als pflanzenschuetzende mittel |
| DE3939503A1 (de) | 1989-11-30 | 1991-06-06 | Hoechst Ag | Neue pyrazoline zum schutz von kulturpflanzen gegenueber herbiziden |
| JPH03234915A (ja) | 1990-02-07 | 1991-10-18 | Mabuchi Motor Co Ltd | 小型モータの軸受装置及びその製造方法 |
| EP0472722B1 (de) | 1990-03-16 | 2003-05-21 | Calgene LLC | Dnas, die für pflanzliche desaturasen kodieren und deren anwendungen |
| JP3325022B2 (ja) | 1990-06-18 | 2002-09-17 | モンサント カンパニー | 植物中の増加された澱粉含量 |
| ES2173077T3 (es) | 1990-06-25 | 2002-10-16 | Monsanto Technology Llc | Plantas que toleran glifosato. |
| DE59108636D1 (de) | 1990-12-21 | 1997-04-30 | Hoechst Schering Agrevo Gmbh | Neue 5-Chlorchinolin-8-oxyalkancarbonsäurederivate, Verfahren zu ihrer Herstellung und ihre Verwendung als Antidots von Herbiziden |
| SE467358B (sv) | 1990-12-21 | 1992-07-06 | Amylogene Hb | Genteknisk foeraendring av potatis foer bildning av staerkelse av amylopektintyp |
| DE4103253C2 (de) | 1991-02-04 | 2000-03-23 | Aua Agrar Und Umweltanalytik G | Mittel zur Erhöhung der Streßtoleranz von land- und forstwirtschaftlichen Kulturpflanzen |
| DE4104782B4 (de) | 1991-02-13 | 2006-05-11 | Bayer Cropscience Gmbh | Neue Plasmide, enthaltend DNA-Sequenzen, die Veränderungen der Karbohydratkonzentration und Karbohydratzusammensetzung in Pflanzen hervorrufen, sowie Pflanzen und Pflanzenzellen enthaltend dieses Plasmide |
| TW259690B (de) | 1992-08-01 | 1995-10-11 | Hoechst Ag | |
| DE4331448A1 (de) | 1993-09-16 | 1995-03-23 | Hoechst Schering Agrevo Gmbh | Substituierte Isoxazoline, Verfahren zu deren Herstellung, diese enthaltende Mittel und deren Verwendung als Safener |
| DE19621522A1 (de) | 1996-05-29 | 1997-12-04 | Hoechst Schering Agrevo Gmbh | Neue N-Acylsulfonamide, neue Mischungen aus Herbiziden und Antidots und deren Verwendung |
| GB9613753D0 (en) * | 1996-07-01 | 1996-09-04 | Broekaert Willem F | Plant protection method |
| US5961687A (en) * | 1996-07-26 | 1999-10-05 | University Of Maryland Eastern Shore | Method for treating plants |
| JPH10239954A (ja) | 1997-02-21 | 1998-09-11 | Canon Inc | 画像形成装置 |
| DE19742951A1 (de) | 1997-09-29 | 1999-04-15 | Hoechst Schering Agrevo Gmbh | Acylsulfamoylbenzoesäureamide, diese enthaltende nutzpflanzenschützende Mittel und Verfahren zu ihrer Herstellung |
| US6624139B1 (en) | 1998-11-05 | 2003-09-23 | Eden Bioscience Corporation | Hypersensitive response elicitor-induced stress resistance |
| EP1013767A1 (de) * | 1998-12-22 | 2000-06-28 | American Cyanamid Company | Verfahren zum Screenen von Agrochemikalien |
| AR031027A1 (es) | 2000-10-23 | 2003-09-03 | Syngenta Participations Ag | Composiciones agroquimicas |
| WO2002060256A1 (en) * | 2001-01-31 | 2002-08-08 | Bayer Cropscience Gmbh | Method of safening crops using isoxazoline carboxylates |
| DE10127328A1 (de) * | 2001-06-06 | 2002-12-19 | Bayer Cropscience Gmbh | Herbizide Mittel enthaltend Benzoylpyrazole und Safener |
| EP1382247A1 (de) * | 2002-07-18 | 2004-01-21 | Bayer CropScience GmbH | Kombinationen aus Cyclohexanedione Oxime-Herbiziden und Safenern |
| ATE514781T1 (de) * | 2003-04-15 | 2011-07-15 | Basf Plant Science Gmbh | Nukleinsäuresequenzen, die für proteine in zusammenhang mit abiotischer stressreaktion kodieren, sowie pflanzenzellen und pflanzen mit erhöhter umweltstressverträglichkeit |
| DE10337497A1 (de) * | 2003-08-14 | 2005-03-10 | Bayer Cropscience Ag | 4-Biphenylsubstituierte-Pyrazolidin-3,5-dion-Derivate |
| DE10354628A1 (de) * | 2003-11-22 | 2005-06-16 | Bayer Cropscience Ag | 2-Ethyl-4,6-dimethyl-phenyl-substituierte Tetramsäure-Derivate |
| UA93192C2 (ru) * | 2004-12-14 | 2011-01-25 | БАЕР КРОПСАЙЕНС ЭЛПи | Способ повышения урожайности растений кукурузы (варианты) |
| DE102005057250A1 (de) | 2005-11-29 | 2007-06-06 | Bayer Cropscience Gmbh | Wirkstoffe zur Steigerung der Stressabwehr in Pflanzen gegenüber abiotischem Stress und Methoden zu ihrer Auffindung |
-
2005
- 2005-11-29 DE DE102005057250A patent/DE102005057250A1/de not_active Withdrawn
-
2006
- 2006-11-10 WO PCT/EP2006/010796 patent/WO2007062737A2/de active Application Filing
- 2006-11-10 EP EP10175325A patent/EP2289310B1/de active Active
- 2006-11-10 EP EP06818467A patent/EP1956885A2/de not_active Withdrawn
- 2006-11-10 AU AU2006319516A patent/AU2006319516B2/en active Active
- 2006-11-10 EA EA200801456A patent/EA015077B1/ru not_active IP Right Cessation
- 2006-11-10 ES ES10175325T patent/ES2383741T3/es active Active
- 2006-11-10 CA CA2631353A patent/CA2631353C/en active Active
- 2006-11-10 PL PL10175325T patent/PL2289310T3/pl unknown
- 2006-11-10 CN CN200680044690.4A patent/CN101316505B/zh active Active
- 2006-11-10 AT AT10175325T patent/ATE550930T1/de active
- 2006-11-10 JP JP2008542623A patent/JP5297810B2/ja active Active
- 2006-11-10 EA EA201100145A patent/EA019372B9/ru not_active IP Right Cessation
- 2006-11-10 KR KR1020087011767A patent/KR101362803B1/ko active IP Right Grant
- 2006-11-10 BR BRPI0619386-2A patent/BRPI0619386B1/pt active IP Right Grant
- 2006-11-27 TW TW095143763A patent/TW200738885A/zh unknown
- 2006-11-27 AR ARP060105214A patent/AR057179A1/es not_active Application Discontinuation
- 2006-11-27 US US11/604,214 patent/US20070124839A1/en not_active Abandoned
-
2008
- 2008-05-22 IL IL191646A patent/IL191646A/en active IP Right Grant
-
2010
- 2010-06-30 US US12/826,788 patent/US8901040B2/en active Active
-
2014
- 2014-07-09 IL IL233573A patent/IL233573A/en active IP Right Grant
- 2014-08-06 US US14/453,022 patent/US9920383B2/en active Active
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2013037958A1 (en) * | 2011-09-16 | 2013-03-21 | Bayer Intellectual Property Gmbh | Use of phenylpyrazolin-3-carboxylates for improving plant yield |
| EA029005B1 (ru) * | 2011-09-16 | 2018-01-31 | Байер Интеллектчуал Проперти Гмбх | Применение фенилпиразолин-3-карбоксилатов для повышения урожайности растений |
| US10435372B2 (en) | 2011-09-16 | 2019-10-08 | Bayer Intellectual Property Gmbh | Use of phenylpyrazolin-3-carboxylates for improving plant yield |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP2289310B1 (de) | Wirkstoffe zur Ertragssteigerung in Pflanzen gegenüber Trocken- und/oder Hitzestress | |
| Cruz et al. | Damage of Spodoptera frugiperda (Smith) in different maize genotypes cultivated in soil under three levels of aluminium saturation | |
| US6413910B1 (en) | Composition comprising chitosan for enhancing resistance to plant diseases | |
| US20090018019A1 (en) | Increasing pathogen defence in plants | |
| DE102004035137A1 (de) | Wirkstoffe zur Steigerung der Pathogenabwehr in Pflanzen und Methoden zu ihrer Auffindung | |
| CN107549190A (zh) | 种子处理剂组合物及其应用 | |
| Gopinath et al. | Evaluation of metsulfuron-methyl and chlorimuron-ethyl for weed control in direct-seeded rice (Oryza sativa) | |
| CA2029877A1 (en) | Phytosanitary agent and its use | |
| MX2008006919A (en) | Active ingredients for increasing a plant's defence in relation to abiotic stress, and methods for detecting said active ingredients | |
| Uluışık et al. | Physiological and biochemical responses of 13 cultivars of triticale (x Triticosecale Wittmack) to Salt Stress | |
| Hooda et al. | Management of herbicide-resistant Little seed canary grass (Phalaris minor) by integrating malathion with post-emergence herbicides in wheat crop | |
| St John-Sweeting | Dispersal and genetic variability of Sonchus oleraceus L. in relation to its resistance to ALS-inhibiting herbicides. | |
| Chakravarty et al. | Impact of weather parameters on population build up and natural parasitization of pod fly, Melanagromyza obtusa (Malloch) on Pigeon pea | |
| Patel et al. | Incidence of aphid (Lipaphis erysimi Kalten) in mustard and their fluctuation with biotic and abiotic factors | |
| CN110150236A (zh) | 一种利用黑腹果蝇评价三唑类农药的生长发育毒性的方法 | |
| JP2021024832A (ja) | ジフェニル尿素化合物誘導体 | |
| Blodgett et al. | The status of spraying practices for the control of plant lice in apple orchards | |
| UA119920U (uk) | Н-пропіл 2-((4-аміно-5-(морфолінометил)-4h-1,2,4-триазол-3-іл)тіо)ацетату гідрохлорид, який виявляє протитуберкульозну дію | |
| WO2011078116A1 (ja) | 植物ストレス軽減剤およびそれを用いた植物ストレス軽減法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8127 | New person/name/address of the applicant |
Owner name: BAYER CROPSCIENCE AG, 40789 MONHEIM, DE |
|
| 8139 | Disposal/non-payment of the annual fee |