CN1578677A - 改良的治疗方案 - Google Patents
改良的治疗方案 Download PDFInfo
- Publication number
- CN1578677A CN1578677A CNA028214358A CN02821435A CN1578677A CN 1578677 A CN1578677 A CN 1578677A CN A028214358 A CNA028214358 A CN A028214358A CN 02821435 A CN02821435 A CN 02821435A CN 1578677 A CN1578677 A CN 1578677A
- Authority
- CN
- China
- Prior art keywords
- dox
- chemotherapeutics
- day
- hydox
- neutrophilic granulocyte
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/715—Polysaccharides, i.e. having more than five saccharide radicals attached to each other by glycosidic linkages; Derivatives thereof, e.g. ethers, esters
- A61K31/726—Glycosaminoglycans, i.e. mucopolysaccharides
- A61K31/728—Hyaluronic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/36—Polysaccharides; Derivatives thereof, e.g. gums, starch, alginate, dextrin, hyaluronic acid, chitosan, inulin, agar or pectin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Epidemiology (AREA)
- Dermatology (AREA)
- Inorganic Chemistry (AREA)
- Molecular Biology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
本发明涉及疾病的化学治疗领域,所述疾病如细胞增殖病变包括癌症。特别地,本发明涉及透明质酸(HA)在治疗中作为防护剂的应用。HA与化疗药物同时施用以便于将一个剂量的化疗药物延长施用于治疗对象。由于HA的防护作用,化疗药物的剂量可以充分高于一般可接受的有效剂量,否则,该剂量在治疗对象内可以导致无法接受的不良反应。
Description
技术领域
本发明涉及疾病的化学治疗领域,所述疾病如细胞增殖病变包括癌症。特别地,本发明涉及透明质酸(hyaluronan,HA)在治疗中作为防护剂的应用。将HA与化疗药物同时施用以便于将一个剂量的化疗药物延长施用于治疗对象。由于HA的防护作用,化疗药物的剂量可以充分高于一般可接受的有效剂量,否则,在治疗对象中可能会导致无法接受的不良反应。
背景技术
在本说明书中参考文献目录在说明书的最后列出。
在本说明书中对任何现有技术的引用不是也不应被认为是承认或提示这一现有技术在任一国家构成通用知识的一部分。
给动物包括人类造成痛苦的许多疾病是用化疗药物治疗的。例如,化疗药物在治疗肿瘤病变包括结缔组织或自身免疫疾病,代谢病变和皮肤疾病中具有重要意义,这些化疗药物中有一些是高效的(例如长春新碱和博来霉素)而且不引起任何毒不良反应如白细胞减少。
化疗药物的正确应用需要在选择化疗药物、确定剂量及着手治疗之前对疾病的自然病史及病理学非常熟悉。对每个对象必须谨慎评估,注意直接相关因素,这些因素可能会加强毒性,如明显或隐蔽的感染、出血恶病质、营养不良及严重的代谢紊乱。另外,某些主要器官如肝、肾和骨髓的功能状态非常重要。因此,选择合适的化疗药物及设计有效的治疗方案受治疗对象的表现的影响。令人失望的是,许多化学疗法由于在正常与恶性组织之间缺乏选择性而具有严重的不良反应。
有害的毒不良反应可包括心脏毒性、脱发、胃肠道毒性(包括恶心和呕吐)、神经毒性、肺部毒性、哮喘及骨髓抑制(包括中性粒细胞减少)。
与化疗相关的骨髓抑制至少部分显然是药物诱导的骨髓造血祖细胞(HPC)抑制的结果(Shimamura等,Exp.Hemato.16:681-685,1988)。随后中性粒细胞数降低导致继发感染发生,其严重性与中性粒细胞的持续时间和严重性直接相关(Bodey等,Ann.Intern.Med.64:328,1966)。由于继发感染,对患者撤销其化疗方案并代之以广谱抗生素治疗,导致细胞毒性治疗的潜在益处受限。然而,尽管使用了抗生素,但严重中性粒细胞减少的患者死于败血症的也非罕见(Pettengel等,Blood 80(6):430-436,1992)。
中性粒细胞减少症的水平一般依赖于骨髓的再生能力和/或使用的药物剂量。事实上,中性粒细胞减少症通常是决定减少给予患者的药物剂量的主要原因(Dotti等,Haematologica 80:142-145,1995)。由于药物剂量减少典型地伴随化疗效力或潜在效力丧失,因此不希望减少药物剂量。因此,需要确定治疗方案或者同时使用的制剂,其可以减轻与化疗相关的中性粒细胞减少症的迹象或严重性,从而避免减少药物剂量或者甚至使得可以使用高于化疗药物标准剂量的药物剂量。
在降低小鼠模型中骨髓抑制的一些早期研究中已经观测到,通过在开始注射5-氟尿嘧啶之后每日皮下注射人重组粒细胞集落刺激因子(rG-CSF),可以促进中性粒细胞减少症的恢复(Shimamura等,Blood 69:353-355,1987),更特别是在注射阿霉素之后(Shimamura等,1988,如前)。人rG-CSF通过刺激造血祖细胞增殖和分化而发挥这种作用(Cohen等,Proc.Natl.Acad.Sci.USA 84:2484-2488,1987)。最近,rG-CSF在进行细胞毒性化疗的患者中用作辅剂(adjunct),以增强中性粒细胞减少症的恢复(Sheridan等,Lancet 339:640-644,1992;Pettengell等,1992,如前;Anglin等,Leuk.Lymphoma 11:469-472,1993;Kotaka等,Int.J.Urol.6:61-67,1999)。然而,rG-CSF最好与重复循环的化疗组合应用,因为数目增加的造血祖细胞可能变得对细胞毒性药物高度敏感(Dotti等,1995,如前)。
需要揭示一些方案,其中可以使用高剂量的杀死癌细胞或靶细胞的化疗药物而无毒不良反应或降低毒不良反应的水平。
发明内容
在本说明书中,除非特别要求,术语“包含”是指包含一定的因子或整体或者因子或整体群,但不排除任何其它因子或整体或因子或整体群。
本发明部分基于这样的论断,即当治疗对象接受一般细胞毒性药物治疗时,透明质酸(HA)可用作一种防护剂。其中治疗对象可接受细胞毒性药物的情况包括治疗危及生命的疾病如癌症。在这些情况中,主要的治疗目标是达到恶性细胞衰退。然而,目前可利用的有效治疗剂特异性低下而非优选的,其施用最后导致治疗对象的许多正常细胞死亡。当不能足够迅速地作用于癌症使其衰退时,伴随的对正常细胞的有害作用也可以很高以至于治疗对象的状况恶化为必须减少或者终止治疗。这样对进行治疗的对象会会损失严重。
针对足够长时间地便于延长和提高化疗药物的治疗作用,一种可以调节停止治疗时机的制剂在治疗多种形式的癌症及其它疾病中具有明显益处。在治疗方案中包含HA的一些有益作用已经知晓一段时间了,而HA的防护作用迄今还未认识到。
因此,本发明的一方面提供了一种便于将一个剂量的化疗药物延长施用于治疗对象的方法,其中所述化疗药物的单一剂量比一般可接受的有效剂量可以最多高200%,和/或累积剂量比一般可接受的有效剂量可最多高600%,所述方法包括预先和/或同时施用有效量的HA。
在这个方案下,预先或同时施用HA具有减轻或者甚至消除对正常细胞的非希望的伴随的有害作用。由于患者的健康状态不受治疗剂的细胞毒性作用的负面影响,因此所述治疗剂能够以高出正常剂量施用且可以较长时期起作用。这样提高了针对非希望的恶性细胞而施用的药物的所需的细胞毒性作用产生成功治疗的机会。
因此,本发明的另一方面涉及一种延长用一个剂量的化疗药物治疗患者的方法,其中所述化疗药物的单一剂量比一般可接受的有效剂量可最多高200%,和/或累积剂量比一般可接受的有效剂量可最多高600%,所述方法包括预先施用有效量的HA和/或与所述化疗药物同时施用。
这种治疗方案的结果是消除了通常观测到的无法接受的严重不良反应。
由于HA是一种聚合物分子,因此其可以配制为包含各种分子量的分子。尽管较低分子量配方在本发明方法中也有效,但优选配方包含中等分子量的HA,范围在750,000-2,000,000Da。较高分子量的HA具有三级结构的优点,从而在低浓度其自身聚集形成三维网眼。该网眼呈现出可控制的孔隙度及分子大小特点,其使得多糖的容量结构域内的治疗分子与外部环境之间建立平衡。将HA三维结构“加载”于治疗分子中导致在病变部位控制释放治疗剂,继而克服了健康组织的非特异性定向。特别优选的分子量范围是750,000-1,000,000Da。
在一个优选的实施方案中,HA配方可与化疗药物同时或者在其之前施用于治疗对象。HA配方可以以本领域熟知的多种方式产生,包括注射溶液、粉末配方、片剂或胶囊,或者其它任何常规形式。
附图说明
图1A,1B和1C是阿霉素对用阿霉素和HyDox配方注射的小鼠周围血中性粒细胞的作用示意图。将11-13周的雄性F1小鼠注射上述阿霉素的组合,剂量分别为(A)6mg/kg,(B)9mg/kg及(C)12mg/kg。在静脉施用后第0天(基线),1、4、7、10和14天收集血样。如材料和方法章节所述分析样品的中性粒细胞数目。对每天的数据绘曲线图作为相对第0天中性粒细胞的平均百分比±SEM。(虚线:阿霉素;实线:HyDox;点线:HA)。实验数据可见于表1A和1C。
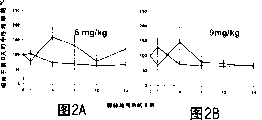
图2A,2B,2C,2D和2E是在先注射HA之后注射阿霉素的小鼠中阿霉素对周围血中性粒细胞的作用。将11-13周的雄性F1小鼠注射上述药物组合,阿霉素剂量分别为(A)6mg/kg,(B)9mg/kg,(C)12mg/kg,(D)16mg/kg及(E)24mg/kg。如前所述收集血样并分析中性粒细胞数目。对每天的数据绘曲线图作为第0天中性粒细胞的平均百分比±SEM。(虚线:阿霉素;实线:在注射阿霉素之前30分钟注射HA)。实验数据可见于表1A和1B。
图3是用阿霉素注射的小鼠的存活率示意图。在这项研究结束之前只有两个处理组有死亡情况。所述处理组是9mg/kg(实线)和24mg/kg(虚线)阿霉素处理组。所有其它小鼠,包括接受较低剂量阿霉素及与透明质酸组合的较高剂量阿霉素的那些小鼠,在研究结束时仍存活。
图4是在有或无HA的情况下逐步施用增加剂量的阿霉素观测到的中性粒细胞减少症最低点示意图。针对每个处理剂量,记录最低水平的中性粒细胞计数并绘图。中性粒细胞减少以每个单独的处理组在第0天测定值的百分比表示(实线=HyDox;间断线=Dox;点线=在Dox之前施用HA)。
图5A,5B,5C,5D和5E是在注射阿霉素及在此之前注射HA的小鼠中,阿霉素对代谢应激的作用的示意图。将雄性F1小鼠注射上述阿霉素组合物,剂量分别为(A)6mg/kg,(B)9mg/kg,(C)12mg/kg,(D)16mg/kg及(E)24mg/kg,每天记录其体重。数据表示体重下降或增加,以原始体重+/-SEM的平均百分比表示(虚线:阿霉素;实线:在阿霉素之前施用HA;点线:HA)。图中数据可见于表2A和2B。
图6A,6B和6C是HyDox配方对代谢应激的作用示意图。将雄性F1小鼠经静脉内分别注射(A)6mg/kg,(B)9mg/kg及(C)12mg/kg阿霉素,及于HyDox配方中等剂量的阿霉素。每天记录体重并以与图3所述相同方式绘图。数据代表平均值±SEM(虚线:阿霉素;实线:HyDox;点线:HA)。这些图的数据可见于表3。
图7是HA/Dox对心肌毒性作用示意图。
图8A和8B是示出在慢性暴露于(A)阿霉素和(B)透明质酸和阿霉素之后大鼠心肌细胞变化的电子显微镜照片。
图9A和9B是在注射HyDox的小鼠中,阿霉素对周围血中性粒细胞的作用示意图。将小鼠注射HyDox,阿霉素剂量分别为(A)12和(B)16mg/kg。结果通过交错6组的结果而确定,每4天均放血取样。在这种方式中,可以确定中性粒细胞含量每日测定值。在每个时间点的绘图数据表示平均中性粒细胞计数,以该组在第0天原始数据SEM的百分比表示(n=8)。实线:HyDOX;虚线:阿霉素;点线:HA)。
图10A和10B是HyDox配方对代谢应激和食物消耗的作用示意图。(A)将雄性F1小鼠经静脉内注射12和16mg/kg Dox及HyDox。每日记录体重,数据以与原始体重相比丧失或增加的百分比表示。每个数据点是8只小鼠SEM的平均值。(B)在相同的实验组中,每天监测食物消耗量,以每天每只小鼠摄入的平均食物量表示。数据点表示食物的平均量,其中小鼠数为6-8只。(虚线和●:阿霉素;实线和+:HyDox),A(点线)组:HA对照。
图11A,11B,11C和11D是示出在慢性暴露于阿霉素+/-透明质酸之后,大鼠心肌中变化的电子显微镜照片。大鼠每周注射一次阿霉素或者HyDox,为期12周。阿霉素的累积剂量为13mg/kg。记录得自只施用阿霉素(C)和施用HyDox(D)的样品中的肌细胞中含有的大的合生空泡(coalscent vacuoles)(实箭头所示)。肌细胞空泡化的严重程度在接受HyDox(D)的大鼠中明显较少。肌细胞空泡化在测试的对照组中最少:未处理组(A),透明质酸处理组(B)。
图12A,12B,12C和12D是示出在慢性暴露于阿霉素之后,心肌中肌原纤维束减少的电子显微镜照片。接受阿霉素(A)的大鼠展示较大程度的肌原纤维分解,这由肌原纤维的特征性平行方向丧失及Z带模糊所表示(点箭头所示)。在取自HyDox处理的大鼠的样品中没有这种丧失迹象,在此仍存在有序的肌原纤维阵列(B,虚线箭头所示)。线粒体剖面也出现扩大及也注意到线粒体嵴破坏。线粒体功能的严重破坏由髓磷脂(myelin)的出现而证明(A和B,实箭头所示)。这些观测在接受HyDox(B)的大鼠中不常见。在得自对照组的样品中,均含有完整的线粒体及有序的肌原纤维阵列,由Z带平行排列所证明(C和D:分别为透明质酸和未处理组)。
图13是示出空泡化的肌细胞百分率示意图,作为心肌病变的记录。将大鼠的心室瓣膜切片加工以进行传递电子分析并记录损伤程度。由于肌细胞的空泡化在所有受影响的细胞中均是恒定特征,因此这种特征用作评估损伤的有效方式。在任一个极薄的切片上,倘若可以估定完整的横断面,计数损伤细胞数(即空泡化的细胞),以及未受影响心肌细胞数。然后以百分比表示每个样品中损伤的细胞比例。数据代表平均值±SEM(8-10只动物)。HA=透明质酸;NT=未处理;*当与仅施用Dox的处理组相比时,p<0.001(t-检验)。
图14A,14B,14C和14D是示出在慢性暴露于阿霉素HA之后抗氧化剂水平的示意图。在慢性暴露于Dox和HyDox之后测定抗氧化剂过氧化氢酶(CAT)[A];谷胱甘肽过氧化物酶[C];过氧化物歧化酶(SOD)[D]的活性,及谷胱甘肽降低水平[B]。每条柱表示8-10只动物的平均测定值±SEM。在[B]中,已经除去肝脏数据并再作图(B:插入图),以便可见心GSH含量。*在处理组之间[A]及在HyDox和Dox之间[B],p<0.05(单因素方差分析)。
图15A是CMF/HA疗法对小鼠体重作用的示意图。预先施用或者与CMF同时施用HA导致体重有统计学意义地增加。示出了两个处理组。圆形=盐水;倒三角形=第1,2天施用HA;方形=第1,3天施用HA;菱形=在第1,2天施用CMF;三角形=在第1,2天施用CMF/HA;六边形=在第1,3天施用HA,随后施用CMF。进一步详细资料见表12。
图15B是CMF/H疗法对小鼠体重作用的线性衰减分析示意图。
图16是CMF/HA处理方案对小鼠平均存活率的作用示意图。同时施用HA消除毒性及导致存活期有统计学意义提高(p<0.05)。进一步的详细资料见表18。
图17是剂量应答曲线示意图,示出不同浓度的HA对不同浓度的Dox对H9C2分化的心肌细胞的细胞毒性的作用。
具体实施方式
根据本发明已经确定,在存在有效量的HA的情况下,可改善化疗药物对正常细胞的非所希望的和累积的细胞毒性作用。通常地,这种非所希望的细胞毒性最后导致需要停用该化疗药物或者至少降低治疗的水平或者持续时间。
然而,根据本发明的方法,HA可用于在化疗患者中避免非希望地减少施用剂量或时间。减轻或消除无法接受的严重不良反应,包括中性粒细胞减少、心脏毒性和胃肠道毒性(表现为恶心,呕吐及严重体重下降)。即通过预先和/或同时施用有效量的HA,化疗药物的剂量可以增加至一定水平,所述剂量如果在没有HA存在的情况下使用预期在治疗对象中导致无法接受的严重不良反应。
因此,本发明的一方面涉及一种方法,其便于将一个剂量的化疗药物延长施用于治疗对象,其中所述的剂量可以是单一剂量比一般可接受的有效剂量高200%,和/或累积剂量可高600%,所述方法包括预先和/或同时施用有效量的HA。
本领域技术人员可易于确定接受化疗的对象是否或者何时患有无法接受的不良反应,而且应该对治疗加以变化或进行改变。例如,接受细胞毒性化疗药物如5-氟尿嘧啶和/或阿霉素的化疗患者,在超过一段时间之后预期会出现无法接受的不良反应如中性粒细胞减少、心脏毒性和胃肠道毒性,根据本发明,执业医生可以不用减少化疗药物的剂量,而是通过预先或同时施用有效量的HA而保持或者增加化疗药物剂量。这种不良反应也可称为“无法接受的严重不良反应”。
“预先或者同时施用”是指在为患者施用化疗药物之前、在同一时间或者之后施用HA。在化疗药物之前施用HA之处,优选在施用化疗药物之前大约24小时至5分钟,更优选大约12小时至10分钟,更优选大约5小时至10分钟,最优选大约0.5小时施用HA。在化疗药物之后施用HA之处,优选在施用化疗药物之后大约0.05-2小时,更优选0.1-5小时,及最优选大约0.5小时施用HA。
优选地,施用的化疗药物选自由以下制剂组成的一组:亚硝基脲氮芥(BCNU)、苯丁酸氮芥(Leukeran)、顺铂(Platinol)、阿糖胞苷、阿霉素(Adriamycin)、氟尿嘧啶(5-FU)、氨甲蝶呤(Mexate)、环磷酰胺、CPT11、表鬼臼毒素吡喃葡糖苷、普卡霉素(plicamycin,Mithracin)及taxanes例如紫杉醇(paclitaxel)。
最优选地,所述化疗药物是阿霉素(Adriamycin)。阿霉素是一种蒽环类抗生素,而且是用于临床实践的一种最有效的抗肿瘤药物(Carter,J.Nat.Cancer Inst.55:1265-1274,1975)。其临床效力扩展至广泛的肿瘤病变,如固体肿瘤包括乳腺癌、肺癌和甲状腺癌;血液恶性病变如急性白血病和淋巴瘤及软组织和骨肉瘤及成神经细胞瘤。
在一般的治疗中,本领域技术人员能基于经验进行判断持续施用将导致无法接受的不良反应的临界点。超过该临界点继续施用胞毒剂在此称为“延长施用”该药物。
因此,本发明的另一方面提供了一种用化疗药物对治疗对象延长治疗的方法,所述化疗药物剂量比一般可接受的有效剂量最多高200%,所述方法包括预先施用有效量的HA和/或与所述化疗药物同时施用。
在此所用术语“治疗对象”是指任何动物,其患有需要用化疗药物治疗的疾病或病变。优选地,所述对象患有细胞增殖性病变(例如肿瘤病变)。本发明的治疗对象包括但非限于哺乳动物如人及其它灵长类动物,家畜(例如羊,马,牛,猪,驴),实验室实验动物(例如大鼠,兔,豚鼠)及宠物(例如狗和猫)。灵长类动物最优选人。
在治疗如患有肿瘤疾病的患者中,根据施用的药物,细胞毒性药物具有“一般接受的有效剂量”,主治医生熟知该剂量而且一般不愿意超出该剂量用药。这是因为如上所述经处方的细胞毒性药物随着时间累积而对正常细胞的有害作用必须减少或停止治疗,以防止这些无法接受的不良反应持续下去。针对不同的化疗药物,本领域技术人员意识到要确定一般接受的有效剂量。
然而根据本发明在化疗药物剂量中,可以施用单一剂量比一般接受的剂量可最多高200%和/或累积剂量可最多高600%的化疗药物。“最多高200%”是指包括并包含在大约5%至大约200%之间的任何整数或分数。优选范围是高大约20%至大约150%。在最优选的实施方案中,一般接受的剂量提高大约35%至大约100%。
因此,本发明的另一方面提供了一种治疗方法,所述方法包括为所述治疗对象施用一个剂量的化疗药物,所述剂量比导致临床无法接受的不良反应的剂量高,其中将有效量的HA预先施用和/或与所述化疗药物同时施用。
在此所用术语“有效量”是指HA的量,其有效减少化疗药物的不良反应,由此可以使用与一般接受的有效剂量相等或较高的化疗药物的剂量。
特异性的“有效量”明显随着一些因素而变化,如预先或同时使用的化疗药物的性质,患者的身体状况,治疗的哺乳动物类型,治疗时间,同时进行的治疗的性质(若有的话)。然而,通常HA的有效量为大约0.5mg-10mg/kg体重,优选在大约5mg-20mg/kg体重之间(大约0.3g-3g/人/天)。
作为聚合物分子,HA分子可具有各种分子量。HA配方因此可包含不同分子量的分子。几乎任何平均中等分子量的HA配方在本发明方法中均可有效。然而优选的配方具有较高而不是较低的分子量。优选分子量中等的在750,000-2,000,000的HA。较高分子量的HA具有形成三级结构的优势,从而在较低浓度其自身聚集形成三维网眼,其呈现可控制多孔性及分子大小的特性,能在多糖的容量结构域内的治疗分子与外部环境之间建立平衡。用治疗分子“装填”HA三维结构导致所述治疗剂在病变部位可控制释放,随之克服了对健康组织的非特异性定向。特别优选的分子量范围是750,000-1,000,000Da。
本发明的方法使得能持续或延长应用一个剂量或在其之上剂量的化疗药物,所述剂量如果在没有HA存在的情况下使用预期在治疗对象中导致无法接受的严重不良反应。所述剂量可以根据特殊的化疗药物的一致性及其它因素而变化。然而,例如本发明的方法允许使用剂量为≥60mg/m2,更优选≥80mg/m2及最优选≥100mg/m2的阿霉素。
所述化疗药物和/或HA可以口服、局部施用、非肠道施用、肿瘤内注射,或者在含有常规非毒性药物可接受的载体、佐剂和运载体的剂量单位配方中施用。在此所用术语“非肠道”包括皮下注射、气雾剂、静脉内注射、肌内注射、鞘内注射、颅内注射、舌下含服、经淋巴管施用、或者注入或灌注技术。
在此所用术语“药物可接受的载体”是一种药物可接受的溶剂、悬浮剂或运载体,以将所述化疗药物和/或HA输送至治疗对象。所述载体可以是液体或固体的,根据施用方式加以选择。
因此,用于本发明方法中的化疗药物和/或HA可以配制为例如局部、口服及非肠道施用药物配方。因此,所述化疗药物和/或HA可以作为片剂、水相或油相悬浮液、锭剂、糖锭、粉末、颗粒、乳状液、胶囊、糖浆或酏剂口服施用。口服配方可含有一或多种以下制剂:甜味剂、香料、色素和防腐剂。所述化疗药物和/或HA的片剂配方可含有与适于生产片剂的非毒性药物可接受的赋形剂混合的活性配料。这些赋形剂可例如是(1)惰性稀释剂,如碳酸钙、乳糖、磷酸钙或磷酸钠;(2)粒化和分解剂,如玉米淀粉或褐藻酸;(3)结合剂,如淀粉、凝胶或阿拉伯胶;(4)润滑剂,如硬脂酸镁、硬脂酸或滑石。这种片剂可以不包被或者通过已知方法包被,以延迟在胃肠道中分解和吸收,从而提供长期持续发挥作用。例如,可以应用延长时间的原料,如甘油单硬脂酸酯或甘油二硬脂酸酯。包被也可以使用美国专利No.4,256,108、4,160,452及4,265,874所述方法进行,形成渗透性治疗片剂以控制释放。
用于本发明方法中的所述化疗药物以及HA可以单独或一起长期通过体内应用,通过非肠道注射或者通过逐步灌注而施用。施用途径可以是静脉内、动脉内、腹腔内、肌内、皮下、腔内或经皮施用。非肠道施用的制品包括无菌的水或非水性溶液、悬浮液和乳状液。非水相溶剂例如是丙二醇、聚乙二醇、植物油如橄榄油,及可注射的有机酯如乙基油酸酯。水相载体包括水、乙醇/水溶液、乳状液或悬浮液,包括盐水和缓冲介质。非肠道运载体包括氯化钠溶液、Ringer′s葡萄糖、葡萄糖和氯化钠、乳化的Ringer′s静脉内运载体包括液体和营养补充物、电解质补充物(如基于Ringer′s葡萄糖的那些物质)等。也可以存在防腐剂及其它添加剂,例如抗微生物剂、抗氧化剂、螯合剂、生长因子和惰性气体等。
HA也可以以脂质体输送系统形式施用,如小单层脂质体、大单层脂质体和多单层脂质体。脂质体可以从各种磷脂中形成,如胆固醇、硬脂酰胺或卵磷脂。
可以设想在用化疗药物治疗患者细胞增殖性病变中可以使用本发明的方法。“细胞增殖性病变”是指细胞非正常生长,特别是异常生长,导致赘生物、肿瘤或癌症。细胞增殖性病变包括例如乳腺癌、肺癌、前列腺癌、肾癌、皮肤癌、神经组织癌、卵巢癌、子宫癌、肝癌、胰腺癌、上皮癌、头颈部组织癌、以及胃、肠、内分泌、外分泌、淋巴或造血系统癌症。
在用化疗药物治疗患者神经变性病变、激素不平衡等疾病中也可以使用本发明的方法。
本说明书中包括的任何文献、法案、材料、装置、论文等的揭示内容,只是根据本发明的上下文而提供的。这不应被认为是承认其中的任何或全部构成了在本申请的优先权日之前在澳大利亚或其他地区已经存在的与本发明领域相关的现有技术或通用知识的一部分。
本发明通过参考以下非限制性实施例得以进一步描述。然而应理解以下实施例只是例证了本发明而无限制本发明一般性之意。特别地,本发明是关于癌症而详细加以描述的,但应理解在此的发现非限于癌症的治疗。例如,HA可用于处理用于治疗其它病变的化疗药物的细胞毒性不良反应。
实施例1:细胞毒性的体内模型(I)
静脉内注射药物
抗癌药物阿霉素(Adriamycin),在此称为Dox,购自Asta Medical(NSW,Australia),注射器中含有2.5mL终浓度为2mg/mL阿霉素,或者盐酸阿霉素粉末,其在0.9%无菌氯化钠溶液中重配为终浓度2mg/mL。粉状透明质酸(HA),824,000kDa,购自Pearce Pharmaceuticals(Victoria,Australia),将其溶解于无菌水中至终浓度为10mg/mL,通过0.22μm滤膜过滤除菌,在4℃贮存直至使用。与阿霉素混合的透明质酸(后文称为HyDox)通过将适当体积的10mg/mL透明质酸与适当体积的0.5mg/mLDox混合达到希望的阿霉素剂量而制备。在该研究中HA的剂量为13.3mg/kg体重。研究的Dox的剂量为6、9、12、16和24mg/kg体重。
实验动物
在体内研究中使用的雄性F1小鼠(C57x CBA;11-13周龄),得自The Animal Central Division(Monash University,Victoria,Australia)。将小鼠随机分布于每个处理组中(6只/组),并使其适应2-3周之后开始进行研究。处理组分成“只有药物组”,其分别接受剂量为6、9、12、16和24 mg/kg的Dox在施用6、9、12、16和24mg/kg的Dox之前30分钟注射HA(13.3mg/kg)的处理组;及施用6、9和12mg/kg的HyDox的处理组。两个对照组分别接受静脉内注射的生理盐水、HA(13.3mg/g)。在开始处理之前,从每只实验动物中通过眶后窝放血收集血样(200μL),立即移至含有EDTA的试管中,轻轻摇动混合并贮存于冰上直至进行分析。在第0天进行此项工作,之后将小鼠通过尾静脉给予具有相应的对照物,药物或HA/药物组合的单一的大药丸静脉内注射剂。然后将小鼠通过前述方法在第1、4、7、10和14天继续放血。在Adiva 120 Differential Coulter计数仪(Bayer Diagnostics,USA)中分析所有血样的的白细胞成分。在研究期间,每天记录小鼠体重,食物摄取和一般活性水平。在第14天,通过颈椎脱位处死小鼠,取出心,肺,肝,脾,肾,胃,小肠和睾丸,立即在于磷酸盐缓冲盐水中的10%v/v福尔马林中固定。
一般毒性
在注射Dox之前30分钟以HyDox配方或者用13.3mg/kg体重HA预先敏化的形式接受dox的小鼠,在实验期间存活。只有在以较高药物剂量处理的Dox处理组中观测到小鼠死亡。在24mg/kg Dox组中,两只小鼠直至研究结束时仍存活,而在施用相同剂量dox之前30分钟接受HA的小鼠,在处理期间存活(见图3)。除了在9mg/kg Dox组中有一只小鼠在经静脉施用药物后第8天出乎意料地死亡之外,所有其它小鼠在直至研究结束时仍存活。
血液学测定
中性粒细胞减少症
在第0天所有组的平均中性粒细胞数为1.39×103个细胞/μL血液+0.60SD(最小值=0.54,最大值=3.34×103个细胞/μL血液)。为标准化数据以可以在处理组之间进行对比,实验数据以每个单独的小鼠的基线血样及随后在第1、4、7、10和14天血样测定值的百分比表示(其中第0天血样=100%)。
6mg/kg阿霉素及HyDox处理组
在该研究中Dox的最低剂量为6mg/kg,其等于在人体内应用30mg/m2。在两种药物组合中(HyDox或者在Dox之前施用HA),中性粒细胞竟然相反,当与“只施用Dox”处理组相对比时观测到周围血中性粒细胞增加(图1和2,标记6mg/kg的数据)。最大值为大约160%(见表1A,B和C),在第4天观测到。到第7天开始逐渐下降,但仍高于“只施用Dox”处理组,其中性粒细胞水平甚至到第14天仍未恢复到基线水平。
表1A:中性粒细胞减少的数据,以在第0天所有阿霉素剂量与药物组合:注射阿霉素的中性粒细胞减少的数据的百分比表示
| 处理组:只施用阿霉素 | |||||
| 天数 | 6mg/kgDox(n=12) | 9mg/kgDox(n=9) | 12mg/kgDox(n=10) | 16mg/kgDox(n=3) | 24mg/kgDox(n=5) |
| 0 | 100 | 100 | 100 | 100 | 100 |
| 1 | 102.4±9.3 | 128.1+32.7 | 91+12.5 | 59.1+2.5 | 199.5+42.5 |
| 4 | 73.7+15.9 | 72.4+12 | 44.1+6.9 | 8.2+1.5 | 6.7+3.6 |
| 7 | 69.4+20 | 68.5+10.6 | 71.1+10.3 | 85.9+4.7 | 58.9+14.7 |
| 10 | 65.6+9.6 | 67.10+6.2 | 104+13.2 | 58.5+8.7 | 262.7+56.6 |
| 14 | 68.3+9.6 | 71.4+7.7 | 65+4 | 43.1+4.6 | 233* |
*在实验的结束点,只残存两只小鼠,由于这些样品之一出乎意料地凝集,只对一个血液样品分析中性粒细胞含量。
表1B:在施用阿霉素之前30分钟注射透明质酸(13.3mg/Kg,824,000Da)的中性粒细胞减少数据
| 处理组:施用Dox前30分钟注射HA | |||||
| 天 | 6mg/kg Dox(n=5) | 9mg/kg Dox(n=6) | 12mg/kgDox(n=5) | 16mg/gDox(n=6) | 24mg/kgDox(n=5) |
| 0 | 100 | 100 | 100 | 100 | 100 |
| 1 | 78±11.4 | 68.70±17.3 | 44.7±8.5 | 102.8±24.8 | 189.4±40.4 |
| 4 | 159.4±33.9 | 146.2±52.3 | 69.1±7.6 | 41.1±8.9 | 10±5.8 |
| 7 | 131.4±36.1 | 81.3±19.9 | 61.4±8.2 | 96.2±19.6 | 56.3±13.7 |
| 10 | 79.8±20.2 | 75.5±11.9 | 90.2±23.4 | 86.5±18.9 | 424.6±65 |
| 14 | 119.4±23.8 | 68.3±9.8 | 67.6±7.5 | 67±10.1 | 501.2±105.5 |
表1C:HyDox配方及对照注射液的中性粒细胞减少数据
| 处理组: HyDox配方 | 对照组 | ||||
| 天 | 6mg/kgHyDox(n=6) | 9mg/kgHyDox(n=6) | 12mg/kgHyDox(n=5) | 透明质酸13.3mg/kg(n=6) | 盐水(400μL)(n=6) |
| 0 | 100 | 100 | 100 | 100 | 100 |
| 1 | 70±10.2 | 80±10.6 | 230.8±73.3 | 92.6±10.3 | 78.8±11.7 |
| 4 | 161±36 | 151.9±51.6 | 64.7±10.7 | 158±10.1 | 111±8.4 |
| 7 | 121.2±25.4 | 111.3±14.8 | 139.1±56.5 | 91.1±23.3 | 66.6±6 |
| 10 | 56.7±10.8 | 247.7±114.6 | 158.6±17.2 | 128.8±20.1 | 78.9±12.7 |
| 14 | 84.5±17.3 | 195.6±58.5 | 114.6±7.7 | 136.2±18.6 | 105.2±6.5 |
9mglkg阿霉素及HyDox处理组
9mg/kg的Dox等于在人体内施用45mg/m2,在HyDox配方及在Dox之前施用HA这两种情况中再一次观测到相似趋向(分别为图1和2)。然而在这两个处理组中,周围血中性粒细胞百分比略降低,但到第4天这些数值提高大约150%。在“只施用Dox”处理组中,在第4天观测到药物诱导的(最低值)中性粒细胞减少,为在第0天基线血样值的大约72%。随后在第7,10和14天测定结果表明在Dox之前施用HA的处理组中中性粒细胞的百分比返回到在只施用Dox的处理组中观测到的模式(图2,标记9mg/g的数据)。
12mg/kg阿霉素和HyDox处理组
当与在Dox之前施用HA处理组相比时,HA的抗中性粒细胞减少的保护作用在12mg/kg HyDox剂量(等于在人体内施用60mg/m2)的情况下甚至更明显(分别见图1和2)。只有在第4天,12mg/kg HyDox处理组的周围血中性粒细胞降低至平均水平的64%。之后,恢复并保持高于基线血样值的水平。在只施用Dox的处理组中再一次观测到最低水平的中性粒细胞减少(图1,标记12mg/kg的数据,黑线)。
16mg/kg和24mg/kg阿霉素及HyDox处理组
16mg/kg和24mg/kg Dox处理组不包括HyDox,因为难以获得其配方及注射入小鼠体内的体积受限。因此,在这些剂量只研究施用Dox及在Dox之前施用HA处理组。在第1天,施用16mg/kg Dox(等于在人体内施用80mg/m2剂量)处理组的中性粒细胞的水平为大约59%,而在施用药物之前施用HA的处理组中观测到该数值为103%(图2;标记16mg/kg的数据)。在第4天观测到中性粒细胞水平最低,在“只施用Dox”的处理组中最严重。在施用24mg/kg Dox剂量的处理组中,中性粒细胞减少的程度最严重,在有或无HA施用的情况下一样严重(图2;标记24mg/kg的数据)。
在所有处理组中,最低的中性粒细胞减少是剂量依赖性的,而且相等剂量的Dox与施用HyDox或者在Dox之前施用HA的处理组相比,在只接受Dox的处理组中最严重(见图4)。施用盐水对照注射液对中性粒细胞水平不具有任何值得考虑的作用,因此未作图。数据适于表1C。
完全意外的是得自HA对照组的结果,其在所有其它实验组中均注射相同剂量(13.3mg/kg)。在HA处理组中周围血中性粒细胞的百分比与在HyDox配方的6和9mg/kg剂量处理组的结果非常相似(图1),其中HA在施用药物之前30分钟施用(图2)。
其它血液学测定
除了测定中性粒细胞之外,还分析了红细胞、血红蛋白含量、红细胞压积、血小板及淋巴细胞百分比。这些参数的数据可见于表2-6。这些表中表示的数据均以与在注射药物之前第0天取血样的测定值的百分比表示。
表2:血红蛋白百分数
| 处理组 | ||||||
| 天 | 6mg/kgDox(n=12) | HA b/f6mg/kgDox(n=5) | 6mg/kgHyDOX(n=6) | 9mg/kgDox(n=9) | GA b/f9mg/kgDox(n=6) | 9mg/kgHyDox(n=6) |
| 0 | 100 | 100 | 100 | 100 | 100 | 100 |
| 1 | 83.9±1.90 | 82.3±2.40 | 84.7±1.80 | 85.8±2.10 | 80.8±4.50 | 78.8±6.90 |
| 4 | 67.3±2.10 | 66.5±3.10 | 69.0±1.10 | 68.20±3.80 | 70.1±5.50 | 67.7±1.80 |
| 7 | 57.0±1.30 | 77.4±2.10 | 79.7±2.70 | 45.7±4.60 | 76.0±7.10 | 59.6±1.10 |
| 10 | 81.4±1.14 | 91.2±1.30 | 95.7±2.50 | 70.7±3.10 | 91.7±2.20 | 98.3±1.80 |
| 14 | 100±1.30 | 104.7±1.70 | 103±3.00 | 98.5±1.50 | 102.6±3.50 | 85.4±2.10 |
| 天 | 12mg/kgDox(n=10) | HAb/f12mg/kgDox(n=5) | 12mg/kgHyDOX(n=5) | 16mg/kgDox(n=3) | HA b/f16mg/kgDox(n=6) | 24mg/kgDox(n=5) |
| 0 | 100 | 100 | 100 | 100 | 100 | 100 |
| 1 | 79.7±1.50 | 75.7±3.20 | 72.9±6.20 | ** | 86.5±4.0 | 826±1.60 |
| 4 | 60.3±2.30 | 58.8±2.60 | 62.2±2.10 | 74.10±2.40 | 74.2±4.20 | 68.9±3.20 |
| 7 | 47.7±1.90 | 59.5±1.80 | 63.80±13.0 | 51.4±4.60 | 52.8±3.50 | 63.2±6.70 |
| 10 | 70.1±4.20 | 93.1±0.80 | 52.4±5.00 | 64.3±3.40 | 80.7±3.80 | 42.2±3.40 |
| 14 | 90.6±1.30 | 93.10±2.20 | 93.0±2.20 | 86.0±3.60 | 101.2±4.0 | 79.3 |
| 天 | HAb/f24mg/kgDox(n=5) | HA(13.3mg/kg)(n=6) | 盐水(n=6) | |||
| 0 | 100 | 100 | 100 | |||
| 1 | 81.7±2.3 | 88.8±1.5 | 81.8±1.3 | |||
| 4 | 76.3±2.60 | 81.1±1.1 | 79.1±2.2 | |||
| 7 | 61.3±3.60 | 88.3±3.5 | 85.2±0.9 | |||
| 10 | 43.1±2.50 | 89.10±3.3 | 85.0±1.9 | |||
| 14 | 65.5±2.90 | 95.3±1.9 | 92.6±1.3 | |||
(b/f)=在阿霉素之前30分钟注射透明质酸
**=此处理组的样品在测定第1天读作“0”。
表3:红细胞压积
| 处理组 | ||||||
| 天 | 6mg/kgDox(n=12) | HAb/f6mg/kgDox(n=5) | 6mg/kgHyDOX(n=6) | 9mg/kgDox(n=9) | HA b/f9mg/kgDox(n=6) | 9mg/kg(n=6)HyDox |
| 0 | 100 | 100 | 100 | 100 | 100 | 100 |
| 1 | 95.5±11.50 | 180.1±91.20 | 82.6±1.40 | 93.4±6.90 | 43.2±14.20 | 96.4±6.40 |
| 4 | 75.3±8.80 | 275.6±128.30 | 54.8±9.30 | 90.2±9.80 | 132.7±66.60 | 82.30±5.80 |
| 7 | 70.1±8.80 | 204.7±107.0 | 74.5±5.10 | 74.9±10.10 | 163.2±84.70 | 75.0±4.80 |
| 10 | 103.7±10.60 | 106.5±75.4 | 99.4±3.0 | 92.10±4.45 | 31.7±13.20 | l07.5±3.10 |
| 14 | 121.4±12.7 | 483.9±239.00 | 108.0±2.80 | 98.8 | 220.5±92.70 | 106.5±4.40 |
| 天 | 12mg/kgDox(n=10) | HA b/f12mg/kgDox(n=5) | 12mg/kgHyDOX(n=5) | 16mg/kgDox(n=3) | HA b/f16mg/kgDox(n=6) | 24mg/kgDox(n=5) |
| 0 | 100 | 100 | 100 | 100 | 100 | 100 |
| 1 | 94.8±1.50 | 92.3±7.20 | 77.8±5.60 | 110.7±21.5 | 102.8±24.80 | 80.4±2.50 |
| 4 | 52.9±1.80 | 68.6±5.40 | 54.0±2.50 | 88.0±17.7 | 41.10±8.90 | 34.6±8.0 |
| 7 | 50.5±4.30 | 73.1±5.40 | 46.6±3.30 | 25.20±3.20 | 96.2±19.60 | 59.2±4.80 |
| 10 | 74.2±5.10 | 96.0±6.70 | 50.9±5.80 | 90.7±16.70 | 86.5±18.90 | 37.5±3.20 |
| 14 | 60.0±6.40 | 59.2±7.30 | 84.0±3.40 | 107.8±18.90 | 67.0±10.10 | 85.7 |
| 天 | HA b/f2mg/kgDox(n=5) | HA(13.3mg/kg)n=6 | 盐水n=6 | |||
| 0 | 100 | 100 | 100 | |||
| 1 | 77.7±2.30 | 85.7±1.9 | 78.8±11.7 | |||
| 4 | 31.6±9.20 | 83.0±1.6 | 111±8.4 | |||
| 7 | 55.9±3.50 | 89.8±2.3 | 66.6±6 | |||
| 10 | 37.3±1.80 | 50.9±5.8 | 78.9±12.7 | |||
| 14 | 73.3±2.80 | 87.3±5.2 | 105.2±6.5 | |||
表4:血小板百分比
| 处理组 | ||||||
| 天 | 6mg/kgDox(n=12) | HA b/f6g/kgDox(n=5) | 6mg/kgHyDOX(n=6) | 9mg/kgDox(n=9) | HA b/f9mg/kgDox(n=6) | 9mg/kgHyDox(n=6) |
| 0 | 100 | 100 | 100 | 100 | 100 | 100 |
| 1 | 98.0±11.0 | 100.4±6.60 | 102.0±6.60 | 72.6±5.30 | 105.7±7.90 | 76.4±2.90 |
| 4 | 124.7±18.0 | 151.9±8.50 | 192.2±10.40 | 103.8±10.10 | 154.3±10.3 | 107.9±8.30 |
| 7 | 175.1±17.2 | 155.7±8.30 | 136.2±11.20 | 152.7±15.0 | 171.7±10.10 | 135.2±14.80 |
| 10 | 98.1±6.60 | 86.6±3.90 | 91.1±2.50 | 112.1±12.2 | 97.1±7.60 | 51.0±7.90 |
| 14 | 84.7±10.5 | 75.0±5.50 | 94.7±5.80 | 96.0±7.20 | 71.1±4.80 | 58.10±2.80 |
| 天 | 12ng/kgDox(n=10) | HA b/f12 mg/kgDox(n=5) | 12mg/kgHyDOX(n=5) | 16mg/kgDox(n=3) | HA b/f16mg/kgDox(n=6) | 24mg/kgDox(n=5) |
| 0 | 100 | 100 | 100 | 100 | 100 | 100 |
| 1 | 105.2±6.0 | 115.7±31.40 | 76.9±4.50 | 106.6±23.6 | 71.7±1.20 | 78.4±13.10 |
| 4 | 150.1±12.6 | 195.6±54.40 | 114.60±10.90 | 159.6±24.3 | 103.5±5.10 | 91.2±6.00 |
| 7 | 205.6±10.0 | 204.7±25.60 | 187.8±15.20 | 145.3±6.70 | 123.9±8.10 | 59.4±11.40 |
| 10 | 190.4±15.4 | 88.0±13.0 | 228.3±43.60 | 223.1±13.3 | 107.3±15.5 | 254.9±48.30 |
| 14 | 147.0±9.80 | 158.1±31.0 | 127.3±29.2 | 137.9±6.20 | 91.1±11.20 | 218.20 |
| 天 | HAb/f24mg/kgDox(n=5) | HA(13.3mg/kg)(n=6) | 盐水(n=6) | |||
| 0 | 100 | 100 | 100 | |||
| 1 | 86.8±9.10 | 100.7±10.2 | 104±1.9 | |||
| 4 | 81.8±12.80 | 135.6±8.6 | 123.4±9.8 | |||
| 7 | 58.30±4.80 | 138.9±14.5 | 125±9.4 | |||
| 10 | 324.5±32.5 | 112.2±11.6 | 134.2±12.6 | |||
| 14 | 222.5±18.40 | 110.6±10.4 | 94.7±19.9 | |||
表5:红细胞百分比
| 处理组 | ||||||
| 天 | 6mg/kgDox(n=12) | HAb/f6mg/kgDox(n=5) | 6mg/kgHyDOX(n=6) | 9mg/kgDox(n=9) | HA b/f9mg/kgDox(n=6) | 9mg/kgHyDox(n=6) |
| 0 | 100 | 100 | 100 | 100 | 100 | 100 |
| 1 | 124.6±17.4 | 78.0±11.40 | 85.8±1.10 | 98.6±7.20 | 44.0±13.20 | 102.7±6.90 |
| 4 | 89.5±10.30 | 159.4±33.90 | 58.5±3.30 | 98.5±10.90 | 134.7±60.3 | 90.7±6.40 |
| 7 | 80.20±10.10 | 131.4±36.10 | 67.5±4.50 | 80.4±13.10 | 136.2±61.2 | 77.1±5.0 |
| 10 | 106.3±144 | 79.8±20.20 | 88.4±2.40 | 92.90 | 26.4±8.90 | 102.4±12.40 |
| 14 | 128.8±17.0 | 119.4±23.8 | 96.1±2.10 | 103.50 | 185.1±69.6 | 104.3±6.10 |
| 天 | 12mg/kgDox(n=10) | HA b/f12mg/kgDox(n=5) | 12mg/kgHyDOX(n=5) | 16mg/kgDox(n=3) | HAb/f16mg/kgDox(n=6) | 24mg/kgDox(n=5) |
| 0 | 100 | 100 | 100 | 100 | 100 | 100 |
| 1 | 77.0±1.20 | 97.8±15.30 | 77.3±2.60 | 113.7±23.30 | 102.8±24.80 | 84.6±1.90 |
| 4 | 55.4±1.70 | 73.6±11.80 | 56.6±2.50 | 90.10±41.10 | 41.1±8.90 | 35.5±7.20 |
| 7 | 49.1±3.10 | 67.3±9.10 | 48.2±2.70 | 25.40±3.50 | 96.2±19.60 | 64.3±6.50 |
| 10 | 61.0±4.60 | 77.0±10.10 | 46.2±4.90 | 72.7±13.8 | 86.5±18.90 | 41.6±4.10 |
| 14 | 59.4±9.30 | 50.9±5.80 | 76.2±3.60 | 96.6±18.0 | 67.0±10.10 | 64.50 |
| 天 | HA b/b24mg/kgDox(n=5) | HA(13.3mg/kg)(n=6) | 盐水(n=6) | |||
| 0 | 100 | 100 | 100 | |||
| 1 | 81.6±2.90 | 83.4±2.1 | 80.5±2.0 | |||
| 4 | 32.10±9.20 | 73.4±1.5 | 72.4±1.8 | |||
| 7 | 61.9±3.90 | 77.2±1.9 | 76.8±2.8 | |||
| 10 | 41.4±2.30 | 44.0±4.9 | 42.6±2.8 | |||
| 14 | 59.9±2.10 | 76.3±5.1 | 78.9±4.1 | |||
表6:淋巴细胞百分比
| 处理组 | ||||||
| 天 | 6mg/kgDox(n=12) | HA b/f6mg/kgDox(n=5) | 6mg/kgHyDOX(n=6) | 9mg/kgDox(n=9) | HA b/f9mg/kgDox(n=6) | 9mg/kgHyDox(n=6) |
| 0 | 100 | 100 | 100 | 100 | 100 | 100 |
| 1 | 122.1±14.70 | 77.5±11.10 | 142.1±23.90 | 70.5±8.40 | 59.0±6.10 | 65.6±8.30 |
| 4 | 71.5±5.30 | 92.6±7.40 | 134.9±29.7 | 49.70±4.60 | 114.5±20.0 | 65.6±11.30 |
| 7 | 97.1±9.50 | 89.6±21.9 | 122.4±15.30 | 95.3±13.7 | 122.3±10.20 | 119.2±11.40 |
| 10 | 84.1±6.60 | 80.2±21.8 | 138.4±11.9 | 100.4±12.9 | 68.9±14.80 | 63.20±7.60 |
| 14 | 77.9±7.80 | 91.2±17.5 | 126.4±11.5 | 82.60±8.10 | 89.1±10.50 | 88.7±8.50 |
| 天 | 12mg/kgDox(n=10) | HAb/f12mg/kgDox(n=5) | 12mg/kgHyDOX(n=5) | 16mg/kgDox(n=3) | HAb/f16mg/kgDox(n=6) | 24mg/kgDox(n=5) |
| 0 | 100 | 100 | 100 | 100 | 100 | 100 |
| 1 | 36.8±5.10 | 38.2±3.50 | 41.0±9.60 | 119.1±16.0 | 144.1±18.0 | 48.1±6.80 |
| 4 | 39.18±6.60 | 47.7±4.90 | 57.5±11.70 | 35.3±10.70 | 69.6±13.40 | 17.0±3.30 |
| 7 | 59.7±6.80 | 68.2±4.90 | 86.3±14.40 | 64.5±4.80 | 99.6±13.70 | 32.4±6.40 |
| 10 | 85.5±5.80 | 52.4±5.80 | 183.7±46.4 | 111.7±11.50 | 108.2±4.70 | 66.8±17.4 |
| 14 | 51.2±5.40 | 60.4±2.00 | 74.5±13.90 | 71.4±12.10 | 90.7±27.4 | 112.2 |
| 天 | HA b/f24mg/kgDox(n=5) | HA(13.3mg/kg)n=6 | 盐水(n=6) | |||
| 0 | 100 | 100 | 100 | |||
| 1 | 60.1±11.90 | 101.2±6.7 | 78.8±11.7 | |||
| 4 | 199±6.70 | 168.4±11.8 | 111±8.4 | |||
| 7 | 43.3±8.10 | 90.9±9.6 | 66.6±6 | |||
| 10 | 110.5±16.10 | 108±13.4 | 78.9±12.7 | |||
| 14 | 120.9±13.20 | 119.1±17.5 | 105.2±6.5 | |||
在所有剂量中,当与相等Dox处理组相比时,在HyDox配方处理组中观测到较高百分比的周围血淋巴细胞(见表6)。HA对照注射液增加周围血淋巴细胞,在第4天观测到最大增加168%。血小板在24 mg/kg Dox处理组中增加,与在相等剂量中性粒细胞增加相关,也许表明内在组织损伤和感染。
代谢应激
每天监测所有处理组的体重下降情况。在研究结束时,数据以与初始体重的百分比表示并以此方式绘图。在注射HA和盐水注射液这两个对照组中,体重下降的百分比相似。因此,只对HA数据作图进行实验数据对比。所有实验组包括HA和盐水对照组的体重下降数据,均可见于表7A,7B和8。
表7A:6、9和24mg/kg剂量的阿霉素及在阿霉素之前注射HA的处理组体重下降数据。数据以与开始处理之前初始体重的百分比表示
| 处理组 | ||||||
| 天 | 6mg/kg Dox(n=6) | HA继以6mg/kgDox(n=5) | 9mg/kgDox(n=6) | HA继以9mg/kgDox(n=6) | 24mg/kgDox(n=4) | HA继以24mg/kgDox(n=5) |
| 0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 |
| 1 | -1.10±0.65 | -2.70±0.40 | -0.90±0.73 | -0.70±0.50 | -3.60±0.40 | -3.90±1.00 |
| 2 | -1.00±0.73 | -4.00±0.90 | -1.50±0.61 | -1.30±0.40 | -6.40±0.35 | -6.80±1.10 |
| 3 | -3.00±0.40 | -4.40±0.80 | -5.00±0.16 | -1.10±0.80 | -12.60±0.90 | -13.80±0.90 |
| 4 | -5.90±0.73 | -4.20±0.50 | -7.60±0.69 | -1.70±0.90 | -15.90±0.80 | -17.50±1.00 |
| 7 | -4.50±0.53 | -8.60±0.70 | -9.70±0.89 | -5.20±1.70 | -26.20±2.10 | -27.50±0.50 |
| 8 | -2.70±1.55 | -5.90±0.60 | -8.30±0.61 | -2.70±1.70 | -24.90±1.75 | -25.80±0.35 |
| 9 | -2.10±0.97 | -3.00±0.50 | -6.50±0.73 | -0.40±1.20 | -24.80±2.30 | -24.10±0.40 |
| 10 | -5.00±0.89 | -4.20±0.60 | -8.00±0.81 | -1.60±1.10 | -26.30±2.30 | -23.90±0.85 |
| 11 | -2.90±1.10 | -5.60±0.30 | -6.90±0.85 | -3.00±1.20 | -27.70±2.75 | -23.60±0.70 |
| 14 | -1.90±0.85 | -5.10±0.71 | -6.30±0.48 | -2.91±0.44 | -16.80±2.50 | -22.10±1.80 |
表7B:12和16mg/kg剂量的阿霉素及在阿霉素之前注射HA的处理组体重下降数据
| 天 | 12mg/kg Dox(n=4) | HA继以12mg/kg Dox(n=5) | 16mg/kg Dox(n=3) | HA继以16mg/kg Dox(n=6) |
| 0 | 0.0 | 0.0 | 0.0 | 0.0 |
| 1 | -1.90±0.75 | -2.1O±0.89 | -5.60±0.60 | -4.60±0.69 |
| 4 | -6.10±0.85 | -2.40±0.84 | -14.50±0.90 | -10.90±1.60 |
| 5 | -6.80±0.95 | -4.10±0.84 | -15.20±1.70 | -11.20±2.00 |
| 6 | -7.80±1.10 | -4.30±1.43 | -11.90±2.40 | -11.50±1.80 |
| 7 | -9.50±1.10 | -4.50±1.65 | -14.20±1.80 | -11.80±0.90 |
| 8 | -9.70±1.75 | -3.90±2.54 | -16.80±1.70 | -12.60±0.60 |
| 11 | -12.70±1.35 | -4.10±2.50 | -12.40±1.67 | -9.00±0.65 |
| 12 | -9.10±145 | -5.00±2.19 | -10.50±1.67 | -7.20±0.69 |
| 13 | -7.70±1.75 | -2.50±2.45 | -9.10±1.32 | -5.90±0.89 |
| 14 | -10.80±1.70 | 4.80±2.28 | -9.80±1.03 | -7.80±1.02 |
表8:6、9和12mg/kg剂量的HyDox注射液处理组的体重下降数据
| 处理组 | ||||||
| 天 | 6mg/kgDox(n=6) | 6mg/kgHyDox(n=6) | 9mg/kgDox(n=3) | 9mg/kgHyDox(n=6) | 12mg/kgDox(n=6) | 12mg/kgHyDox(n=5) |
| 0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 |
| 1 | -1.40±0.93 | 0.50±1.02 | -2.30±0.51 | -0.80±0.85 | -4.90±0.65 | -2.80±0.70 |
| 2 | -1.50±1.30 | 0.90±1.10 | -5.90±0.57 | -4.00±0.80 | ||
| 3 | -4.60±1.38 | 0.10±0.97 | -7.70±0.65 | -7.60±0.70 | ||
| 4 | -7.30±2.32 | 0.70±1.06 | -6.60±2.36 | 0.20±1.14 | -9.00±0.53 | -8.70±0.60 |
| 5 | -8.70±4.07 | -0.g0±1.42 | ||||
| 6 | -7.50±5.88 | -1.00±0.85 | ||||
| 7 | -4.50±2.12 | 0.90±1.06 | -8.30±4.67 | 1.60±1.91 | -11.50±1.14 | -9.80±0.90 |
| 8 | -1.40±1.95 | 3.50±1.26 | -7.10±6.50 | 5.20±2.08 | -12.20±1.10 | -10.80±1.10 |
| 9 | 2.30±2.04 | 7.10±1.42 | -11.10±1.26 | -9.70±0.70 | ||
| 10 | -0.70±1.75 | 5.10±1.38 | -12.70±1.30 | -10.70±0.90 | ||
| 11 | 1.50±1.30 | 6.40±1.42 | 0.20±0.63 | -2.50±1.87 | -13.50±1.74 | -11.00±0.60 |
| 12 | 0.40±0.23 | 6.20±2.69 | ||||
| 13 | 3.80±1.38 | 5.50±3.30 | ||||
| 14 | 0.60±1.47 | 5.50±1.30 | 3.10±1.32 | 0.90±2.77 | -11.80±1.63 | -10.80±0.70 |
| 对照组 | ||
| 天 | HA(13.3mg/kg)N=6 | 盐水N=6 |
| 0 | 0.0 | 0.0 |
| 1 | -2.5±1.5 | -3.2±0.48 |
| 2 | -3.0±1.4 | -1.9±0.97 |
| 3 | -3.2±1.3 | -4.10±1.02 |
| 4 | -4.0±1.2 | -5.10±1.95 |
| 7 | -4.8±1.0 | -4.0±0.94 |
| 8 | -5.7±1.1 | -4.7±1.14 |
| 9 | -4.8±1.5 | -4.1±1.22 |
| 10 | -7.1±1.3 | -5.9±1.26 |
| 11 | -6.6±1.2 | -4.4±1.34 |
| 14 | -4.6±1.3 | -2.9±0.89 |
小鼠体重的下降是剂量依赖性的:在24mg/kg剂量处理组中观测到最高程度的体重下降,其中在第7天几乎下降初始体重的25%(图5;标记24mg/kg的数据)。在较低剂量的6和9mg/kg dox中,在Dox之前施用HA的处理组的体重下降与HA对照组数据相似,在第8天在9mg/kg在Dox之前施用HA的处理组中,体重开始增长接近初始体重。9mg/kg只施用Dox的处理组体重下降最大,接近10%,而在Dox之前施用HA的处理组最多只下降5.7%(图5)。在施用12mg/kg Dox(等于在人体内施用60mg/m2)之前施用HA的处理组中,体重下降再一次与在对照组中观测到的结果相似,但当在只施用Dox的处理组中体重下降变得更明显,在第11天几乎下降初始体重的13%(图5)。
令人感兴趣地,当在HyDox配方中测试相等剂量时,体重下降情况与相应的只施用Dox的处理组相同(图6)。然而当检验较低剂量HyDox时,6和9mg/kg处理组体重不下降,到第7天实际上体重开始增长至初始体重之上。
以上数据表明在等于在人体施用30、45和60mg/m2剂量,HyDox及在Dox之前30分钟施用HA具有降低中性粒细胞减少的能力并实际上刺激中性粒细胞释放入血液循环中。根据目前的化疗方案一个有意义的发现,目前的化疗方案通常由于药物相关的中性粒细胞减少而妨碍治疗的完整性。
实施例2:心脏毒性的体内模型(I)
实验动物
成熟的雌性Wistar大鼠(10周龄)购自The Animal Central Division(Monash University,Victoria,Australia),随机分成6个实验组(每个处理组8只动物)。1-3组每周经静脉内注射接受:(1)只施用1.5mg/kg Dox;(2)在施用1.5mg/kg Dox之前30分钟施用HA;(3)施用1.5mg/kg HyDox。4-5组每周经静脉内注射分别接受相当体积的盐水和13.3mg/kg HA。6组不接受处理。
在开始研究之前,从每只大鼠经尾静脉放血收集血样(500μL)。将血样收集在1.5mL Capiject试管中并凝集最少30分钟。在此使其之后,将凝集块通过在3,500g离心2分钟沉淀,并将血清移至一个清洁的1.5mLEppendorf管中,立即贮存于-20℃直至进一步分析。在预先取血样之后,将每只实验动物注射各自的药物组合或者对照处理物,施用24小时之后将大鼠经尾部放血取血样并如上述处理血样。之后,将动物每周注射一次药物组合,共12周,在处理之后24小时收集血样。1,2和3组中动物接受的Dox累积剂量共为18mg/kg。
处理组织以进行分析
在最后一次注射一周后,将大鼠通过斩首处死并将内部器官在于磷酸盐缓冲盐水中的10%v/v福尔马林中固定。在组织固定之前,将肾、肝和骨骼肌及心的一部分迅速取出,置于冰上的试管中。将该组织立即使用或贮存于-80℃直至进行分析。将每个样品切成小片,在冰冻的含有1mM EDTA的0.25M蔗糖的两种变化形式中充分洗涤,然后在含有0.1mM EDTA的50mM磷酸钾缓冲液(pH7.8)中洗涤,之后记录组织“湿”重。然后将该组织再悬浮于2mL冰磷酸EDTA缓冲液中,使用Ultraturrax均质仪在5分钟以三次5秒脉冲在冰上均质。用磷酸盐EDTA缓冲液生产优良的悬浮液直至终体积为4mL,用于以下所述酶及GSH分析。
抗氧化剂酶及GSH分析
从4mL组织均浆中取1mL移至一个清洁的1.5mL Eppendorf管中并贮存于冰上。将另一1mL磷酸盐缓冲液加入3mL组织均浆中以产生终体积为4mL。针对酶分析,将粗均浆(4mL)在装备TLA100.2马达的Beckman TL-100超高速离心器中在4℃以100,000xg离心60分钟。在离心之后,将清澈的高速离心上清等份,贮存在-80℃直至直接测定谷胱甘肽过氧化物酶(GP),过氧化氢酶及过氧化物歧化酶(SOD)活性。
针对GSH分析,将0.25mL的25%w/v偏磷酸加入1mL的原始粗均浆中,彻底混合并在冰上温育15分钟。通过在4℃以10,000g离心10分钟沉淀蛋白质沉淀物。将清澈的上清移至一个清洁试管中并在-70℃贮存不超过3天,或者直接测定GSH水平。使用o-邻苯二醛通过荧光测定分析确定GSH的水平,如Cohn & Lyle(Anal.Biochem.14(3):434-440,1966)所述。
SOD活性通过McCord & Fridovich(J;Biol.Chem.244(22):6056-6063,1969)所述方法测定细胞色素C而确定。GP活性通过间接偶联分析估定(Paglia & Valentine,J.Lab.Clin.Med.70(1):158-169,1967)。过氧化氢酶活性通过Claiborne(Am.Rev.Respir.Dis.131(6):947-949,1985)所述方法在240nm在H2O2分解之后测定。
使用BCA蛋白质分析确定100,000g上清和10,000g上清的蛋白质浓度。
心肌钙蛋白-T(Troponin-T,cTnT)的血清水平
为量化Dox引起的心脏毒性程度,对在研究中收集的每个血清样品均测定cTnT的血清水平,使用得自Roche Diagnostics(Victoria,Australia)的针对心肌钙蛋白T的免疫分析进行测定。
通过电子显微镜分析心脏损害情况
在处死动物之后立即将心室内瓣膜的横切切片从心脏中切下,在于磷酸盐缓冲液中的2%戊二醛、2%多聚甲醛和4%葡萄糖中固定。随后进行标准后缓冲,锇酸化(osmication)及处理。用Philip电子显微镜检测样品,根据Billingham等(Can.Treat.Rep.62:865-872,1978)所述方法对心肌细胞中心肌损害的频率和严重程度分等级。简而言之,选择主要组成横断的心肌细胞的模块。记录损害情况,将心肌损害程度以与具有空泡的肌细胞的百分比表示。
图7示出HA/Dox对心脏毒性的作用。如该图所示,具有HA和Dox的配方或者在施用药物之前注射HA可以延迟心脏毒性的发生。得自对大鼠进行研究的血清肌钙蛋白T的数据在此阶段表现为HyDox具有延迟肌钙蛋白T释放的作用(在Dox的累积剂量为9mg/kg及HyDox在累积剂量12mg/kg,心脏毒性开始出现)。
图8A-8B示出在大鼠中HA和Dox对心脏毒性的作用。应注意在接受Dox的动物心脏中具有空泡的肌细胞与用HA和Dox处理的动物的无空泡的健康肌细胞相对。
实施例3:细胞毒性的体内模型(II)
实验动物
雄性F1小鼠(C57 x CBA,11-13周龄)得自The Animal Central Division(Monash University,Victoria,Australia)。针对每个处理剂量,使用共6组实验动物(每组8只小鼠)。每个处理组的数据通过交错6组的结果(单独计数的)而确定,每4天对每组取样以便可以确定每天的估定值。如上述对每组进行处理,之后使用药物。在此项研究中,收集血液并如前述实施例所述分析中性粒细胞含量。在结束时间点,将所有动物人道处死并将机体器官在于PBS中的10%v/v福尔马林中固定。
血液学测定
该研究针对于两种剂量的12mg/kg Dox和16mg/kg Dox,其分别等于在人体内施用60和80mg/m2剂量。再一次标准化数据以在处理组之间进行对比,中性粒细胞减少以与在第0天(施用药物之前)的中性粒细胞的百分比表示。
12mg/kg阿霉素和HyDox处理组
在12mg/kg剂量,观测到与实施例1中性粒细胞减少相似的趋向(图9,标记12mg/kg的数据)。尽管在施用HyDox之后24小时中性粒细胞含量下降为大约74%,但在第2和3天,周围血中性粒细胞分别平均增加267%和207%。尽管在只施用Dox处理组中观测到周围血中性粒细胞增加,其在第2天达到峰值,但其从未达到在HyDox处理组中获得的最大值。最低的中性粒细胞减少的发生和持续时间在这两组中一样严重:在第4天开始发生并持续2天,之后在第7天恢复正常水平。
16mg/kg阿霉素和HyDox处理组
在16mg/kg剂量的Dox处理组,不管测试的药物组合如何,观测到相似的中性粒细胞减少趋向(图9)。尽管有这种趋向,但在用HyDox配方处理的那些组中中性粒细胞减少的发生延迟一天(图9,标记16mg/kg的数据,实线),在第5天出现。最低的中性粒细胞减少在药物组合施用的两组中相等,但在用HyDox处理的那些组中只持续24小时,之后恢复至正常水平。相反,在用Dox处理的小鼠中,最低中性粒细胞减少持续48小时之上才恢复。随后周围血中性粒细胞下降及在第4天最低中性粒细胞减少在药物组合处理组之间相似,持续48小时之后恢复正常水平。
在用16mg/kg Dox处理的小鼠中,在任一药物组合中观测到相似的中性粒细胞减少趋向。这两组均表现出在静脉内施用药物后第2天周围血中性粒细胞增加,其先于中性粒细胞数下降。然而在接受16mg/kgHyDox的小鼠中,这种下降延迟24小时,但当与只接受Dox的小鼠相比时程度相等(图9)。
其它血液学测定
对红细胞,血红蛋白,血小板和淋巴细胞的示差结果进行分析,在当Dox以HyDox或单独施用时的作用未示出有任何不同。
代谢应激
体重下降以与初始体重的百分比表示。在用12mg/kg Dox或HyDox处理组中,体重下降情况在直至第4天均相等。然而到第5天,HyDox组开始增加体重及到第12天恢复至初始体重(图10A,标记12mg/kg的数据)。相反,用12mg/kg Dox处理的动物继续体重下降直至第6天,之后开始增加体重。在12mg/kg剂量组中,体重下降的最大百分比是12.9%及发生在第6天,而HyDox组只到第4天下降最多9.6%。只接受药物的小鼠从未再增加至其初始体重水平(图10A,标记12mg/kg的数据)。
在用16mg/kg Dox及HyDox配方处理的小鼠中,体重下降呈现相似趋向,这两组均再未恢复至其初始体重。这是令人感兴趣地的,然而尽管在这两组中体重下降情况相等,但只接受药物的小鼠在该研究期间平均消耗的食物更多一些(图10B,16mg/kg Dox)。这种作用在接受药物剂量为12mg/kg的HyDox组中更显而易见。当与只施用药物的处理组数据相比时,HyDox组更快速地增加体重,在研究期间仍消耗等量的食物(图10B,12mg/kg)。
实施例4:心脏毒性的体内模型(II)
用于静脉内注射的阿霉素及其它化学剂
阿霉素购自Asta Medical(NSW,Australia),盐酸阿霉素粉末在0.9%无菌氯化钠中重配至终浓度为2mg/mL。干贮的HA,824,000Da,购自Pearce Pharmaceuticals(Victoria,Australia),将其溶解于无菌水中至终浓度为10mg/mL,经0.22μm滤膜过滤除菌,并在4℃贮存直至使用。HyDox通过将计算体积的10mg/mL HA与计算体积的0.5mg/mL Dox混合达到希望的1.0mg/kg Dox剂量而制备。
在这项研究中使用的HA剂量为13.3mg/kg体重。谷胱甘肽,o-邻苯二醛、黄嘌呤、黄嘌呤氧化酶(得自脱脂乳,一级)、还原的III型NADPH购自Sigma Chemicals(St.Louis,MO)。过氧化氢酶、谷胱甘肽过氧化物酶和谷胱甘肽还原酶购自Roche Molecular Biochemicals(NSW,Australia)。所有其它试剂均是分析等级的。
实验动物
成熟的雌性自发高血压的大鼠(10周龄)购自The Baker MedicalResearch Institute(Melbourne,Australia),随机分成4个实验组(每组10只动物)。1和2组每周经静脉内注射接受:(1)只施用1.0mg/kg Dox(2)1.0mg/kg HyDox。3组每周经静脉内注射接受13.3mg/kg HA。4组不接受处理。每周为动物注射一次药物组合,共12周。在这两个处理组中接受的Dox累积剂量共13mg/kg。
为进行分析,组织处理及抗氧化剂酶和GSH的分析乳实施例2所述进行。通过发射电子显微镜分析心脏损害也如实施例2所述进行。
心肌病理学,超微结构研究
为产生一个诱导的慢性心脏毒性的模型,每周为大鼠经静脉注射施用1.0mg/kg Dox,以单独药物形式或者HyDox形式。给予实验组的Dox的累积剂量共为13mg/kg。然后使用电子显微镜确定在有或无HA存在情况下慢性暴露于Dox是否分别是心脏保护性的或心脏毒性的。为使处理组之间解剖学变化最小化,将左心室的外侧缘样品进行处理以进行EM分析。
电子显微镜检测表明累积剂量为13mg/kg的Dox在自发高血压大鼠模型中具有心脏毒性,而且与在相似对象进行的其它研究一致。特别地,Dox的心脏毒性主要表现为胞质空泡化、肌原纤维破坏及肌细胞的超微结构破坏。
在用Dox处理的大鼠中,心肌细胞空泡化当与得自接受HyDox的大鼠的显微图相比时发生的更频繁(分别为图11C和11D)。Dox还导致线粒体膨胀、线粒体嵴的破坏较小。然而,在接受只Dox的大鼠中严重程度较高。事实上,退化性线粒体变化与这些亚细胞器官的完全破坏相关及与髓磷脂的出现一致(图12A和12B,实箭头)。这些观测资料在接受HyDox的大鼠中出现的不频繁(图12B)。慢性暴露于Dox也导致有组织的肌原纤维阵列轻度破坏,包括肌原纤维裂解以及Z带未对准。再一次Dox心脏毒性的这些特征在只接受Dox的大鼠中更严重(图12A,星点箭头)。尽管肌原纤维裂解仍明显,但在用HyDox处理的大鼠中不太严重,而且有序的肌原纤维阵列仍显而易见(图12B,虚线箭头)。
在所有处理组中心肌细胞空泡化的严重程度示于图13。当与HyDox处理组对比时,Dox处理组中肌细胞空泡化几乎高2-3倍(p<0.05:在处理组之间t-检验)。
在慢性暴露于Dox HA之后抗氧化物水平
自由基清除酶的水平:在慢性暴露于Dox之后测定过氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶及还原型谷胱甘肽(GSH)的水平。为进行对照,对肝、肾和骨骼肌提取物中的抗氧化剂也进行测定。慢性暴露于Dox和HyDox对心、肝、肾和骨骼肌抗氧化剂能力的作用示于图14。
过氧化氢酶
当与Dox及两个对照组相比时,应答HyDox的心脏过氧化氢酶略增加。肝过氧化氢酶在应答Dox中明显增加,但是HyDox活性反映出从两个对照组中观测到的那些结果(图14A)。
还原型谷胱甘肽(GSH)
肝GSH的水平在接受HyDox大鼠中明显降低。然而,在Dox处理的大鼠中GSH水平相对于对照值保持不变(图14B)。在心脏水平观测到相似趋向,其中HyDox降低GSH含量而Dox处理产生与对照值相似的数值(图14B:插入除去的肝脏数据)。
谷胱甘肽过氧化物酶
当与得自对照组的数相比时,HyDox和Dox处理组相等地提高心脏谷胱甘肽过氧化物酶水平(图14C)。当与相应的对照数据相比时,两种药物组合均产生相似的肝,肾和骨骼肌谷胱甘肽过氧化物酶活性(图14C)。
过氧化物歧化酶(SOD)
当与未处理的对照组相比时,心脏SOD活性在处理组之间保持相对不变(图14D)。HA对照组明显降低这种酶的活性(图14D)。在两个处理组中均观测到肝和肾SOD的抑制,而骨骼肌SOD活性中等程度提高(图14D)。肝过氧化氢酶活性应答暴露于Dox而明显提高,但HyDox活性反映出从两个对照组中观测到的那些结果(图14A)。
心脏毒性是一个复杂因素,其限制Dox化疗的总累积剂量为500-550mg/m2。这些数据表明通过将Dox与HA组合(HyDox),心脏毒性的水平当与只使用药物相比时几乎降低3倍。因此,使用HyDox使得高效抗癌药物可以具有较高累积剂量,而通常无心脏毒性。完成治疗而无心脏毒性增加肿瘤应答的可能性及最终提高存活率。
实施例5:在具有进展性癌症的患者中,阿霉素+HA(HyDox)的I期临床试验
在具有进展性癌症的患者中进行I期研究,以确定同时施用HA和Dox是否影响Dox毒性。
这项研究中包含的合适标准如下:患者必须具有经组织学或细胞学证实的进展或转移的癌症。患者应未接受过化疗或者接受过不超过一个的化疗方案且未使用过的蒽环类。患者年龄在18-75岁之间,非卧床状态且具有足够的骨髓、肝和肾功能。
提供的治疗计划是在第一个化疗循环中,患者随机只接受Dox或者接受Dox+HA。在第二个循环中则相反应用。在随后的四个循环中,患者接受Dox+HA。这样使得每个患者在前两个循环中在毒性分析中作为其自身对照,降低了影响解释结果的患者内部可变性的可能性。
HyDox配方(作为灌注袋)如下制备:HA得自美国纽约GlycoMedResearch,使用10mg/ml原液,所述原液是将粉末状HA溶解于蒸馏水中并经过0.22μm滤膜过滤除菌而制备。Dox得自Asta Medica,以在含有250mg乳糖的50mg小瓶中的形式提供,在25ml的可注射的正常盐水中重配,持续旋动8-12分钟。可注射的氯化钠溶液得自澳大利亚悉尼BaxterHealthcare,以500ml灌注袋形式提供。制备可注射的HyDox以输送13.3mg/kg HA及30、45或60mg/m2Dox。
Dox±HA通过静脉内施用一小时以上而给予,三周一个疗程。在该I期研究中,Dox的初始剂量为30mg/m2及HA剂量为500mg/m2。在两个步骤中增加剂量以达到标准剂量60mg/m2。因此,初始剂量水平为30mg/m2,接下来为45mg/m2及再接下来为60mg/m2。
在每个剂量水平治疗4名患者。结果表明HA不增加任何已知的Dox毒性。在较高的剂量水平60mg/m2,减轻化疗后出现的恶心和呕吐现象,以及降低脱发及Dox诱导的中性粒细胞减少的程度,。中性粒细胞计数结果示于表9。患者的状况得以改善。未报道有其它毒性。
表9
| 病人1:A-S#1 | ||||||||||
| 疗程1: | 30mg/m2 | 疗程2: | 30mg/m2 | 疗程3: | 30mg/m2 | |||||
| HyDOX | DOX | DOX | ||||||||
| 时间(天) | 中性粒细胞X109/L | 相当于第1天中性粒细胞的% | 时间(天) | 中性粒细胞X109/L | 相当于第1天中性粒细胞的% | 时间(天) | 中性粒细胞X109/L | 相当于第1天中性粒细胞的% | ||
| 1 | 3.6 | 100 | 1 | 3.5 | 100 | 1 | 2.6 | 100 | ||
| 3 | 4.5 | 125 | 6 | 3.5 | 100 | 0 | ||||
| 6 | 5.7 | 158 | 8 | 3.8 | 109 | 0 | ||||
| 8 | 5 | 139 | 10 | 3.8 | 109 | 0 | ||||
| 10 | 5.1 | 142 | 13 | 2.9 | 83 | 0 | ||||
| 15 | 2.9 | 81 | 15 | 2 | 57 | 0 | ||||
| 17 | 2.3 | 64 | 20 | 2 | 57 | 0 | ||||
| 20 | 2.7 | 75 | 21 | 2.6 | 74 | |||||
| 21 | 3.5 | 97 | ||||||||
| 病人2:H-Y #2 | ||||||||||
| 疗程1: | 30mg/m2 | 疗程2: | 30mg/m2 | 疗程3: | 30mg/m2 | |||||
| DOX | HyDOX | DOX | ||||||||
| 时间(天) | 中性粒细胞X109/L | 相当于第1天中性粒细胞的% | 时间(天) | 中性粒细胞X109/L | 相当于第1天中性粒细胞的% | 时间(天) | 中性粒细胞X109/L | 相当于第1天中性粒细胞的% | ||
| 1 | 5 | 100 | 1 | 4.3 | 100 | 1 | 3 | 100 | ||
| 4 | 6 | 120 | 4 | 5.3 | 123 | 0 | ||||
| 8 | 6.6 | 132 | 8 | 6.4 | 149 | 0 | ||||
| 10 | 3.9 | 78 | 11 | 4 | 93 | 0 | ||||
| 15 | 2.7 | 54 | 12 | 4.2 | 98 | 0 | ||||
| 17 | 2 | 40 | 15 | 4.1 | 95 | 0 | ||||
| 21 | 4.3 | 86 | 17 | 2.3 | 53 | 0 | ||||
| 21 | 3 | 70 |
| 病人5:A-L#5 | |||||||||||
| 疗程1: | 30mg/m2 | 疗程2: | 30mg/m2 | 疗程3: | 30mg/m2 | ||||||
| DOX | HyDOX | DOX | |||||||||
| 时间(天) | 中性粒细胞X109/L | 相当于第1天中性粒细胞的% | 时间(天) | 中性粒细胞X109/L | 相当于第1天中性粒细胞的% | 时间(天) | 中性粒细胞X109/L | 相当于第1天中性粒细胞的% | |||
| 1 | 3.7 | 100 | 1 | 2.2 | 100 | 1 | 2.1 | 100 | |||
| 4 | 2.9 | 78 | 4 | 3.1 | 141 | ||||||
| 7 | 2.6 | 70 | 7 | 3.2 | 145 | ||||||
| 9 | 2.7 | 73 | 9 | 3.5 | 159 | ||||||
| 12 | 1.8 | 49 | 12 | 1.8 | 82 | ||||||
| 14 | 1.4 | 38 | 14 | 1.6 | 73 | ||||||
| 16 | 1.2 | 32 | 16 | 1.4 | 64 | ||||||
| 19 | 1.4 | 38 | 19 | 1 | 45 | ||||||
| 21 | 2.2 | 59 | 21 | 1.9 | 86 | ||||||
| 病人7:W-H#7 | |||||||||||
| 疗程1: | 45mg/m2 | 疗程2: | 45mg/m2 | 疗程3: | 45mg/m2 | ||||||
| DOX | HyDOX | DOX | |||||||||
| 时间(天) | 中性粒细胞X109/L | 相当于第1天中性粒细胞的% | 时间(天) | 中性粒细胞X109/L | 相当于第1天中性粒细胞的% | 时间(天) | 中性粒细胞X109/L | 相当于第1天中性粒细胞的% | |||
| 1 | 6.3 | 100 | 1 | 3.2 | 100 | 1 | 2.6 | 100 | |||
| 4 | 2.9 | 46 | 4 | 2.8 | 88 | ||||||
| 8 | 3.5 | 56 | 10 | 2.5 | 78 | ||||||
| 10 | 2.6 | 41 | 12 | 1.6 | 50 | ||||||
| 12 | 2.2 | 35 | 17 | 1.3 | 41 | ||||||
| 15 | 1.2 | 19 | 19 | 1.5 | 47 | ||||||
| 17 | 0.9 | 14 | |||||||||
| 19 | 1.3 | 21 | |||||||||
| 病人8:S-W#8 | |||||||||||
| 疗程1: | 45mg/m2 | 疗程2: | 45mg/m2 | 疗程3: | 45mg/m2 | ||||||
| HyDOX | DOX | ||||||||||
| 时间(天) | 中性粒细胞X109/L | 相当于第1天中性粒细胞的% | 时间(天) | 中性粒细胞X109/1 | 相当于第1天中性粒细胞的% | 时间(天) | 中性粒细胞X109/L | 相当于第1天中性粒细胞的% | |||
| 1 | 4 | 100 | 1 | 5.7 | 100 | 1 | #DIV/0! | ||||
| 4 | 7.3 | 183 | 4 | 4.8 | 84 | ||||||
| 8 | 4.9 | 123 | 8 | 4.1 | 85 | ||||||
| 10 | 2.2 | 55 | 10 | 1.6 | 39 | ||||||
| 12 | 1.1 | 28 | 12 | 1.3 | 81 | ||||||
| 17 | 1.9 | 48 | 15 | 0.8 | 62 | ||||||
| 19 | 3.1 | 78 | 0 | ||||||||
| #DIV/0! | |||||||||||
| 病人9:J-V#9 | |||||||||||
| 疗程1:HyDOX | 60mg/m2 | 疗程2: | 60mg/m2 | 疗程3: | 60mg/m2 | ||||||
| 时间(天) | 中性粒细胞X109/L | 相当于第1天中性粒细胞的% | 时间(天) | 中性粒细胞X109/L | 相当于第1天中性粒细胞的% | 时间(天) | 中性粒细胞X109/L | 相当于第1天中性粒细胞的% | |||
| 1 | 4.9 | 100 | 1 | 9.9 | 100 | 1 | #DIV/0! | ||||
| 4 | 6.2 | 127 | 4 | 13.8 | 139 | ||||||
| 8 | 5.6 | 114 | 7 | 14.7 | 107 | ||||||
| 10 | 2.2 | 45 | |||||||||
| L2 | 0.7 | 14 | |||||||||
| 15 | 0.8 | 16 | |||||||||
| 17 | 2.4 | 49 | |||||||||
| 19 | 5.5 | 112 | |||||||||
| 病人10:E-C#10 | |||||||||||
| 疗程1: | 60mg/m2 | 疗程2: | 60mg/m2 | 疗程3: | 60mg/m2 | ||||||
| DOX | HyDOX | ||||||||||
| 时间(天) | 中性粒细胞X109/L | 相当于第1天中性粒细胞的% | 时间(天) | 中性粒细胞X109/L | 相当于第1天中性粒细胞的% | 时间(天) | 中性粒细胞X109/L | 相当于第1天中性粒细胞的% | |||
| 1 | 7.6 | 100 | 1 | 4.5 | 100 | 1 | #DIV/0! | ||||
| 4 | 7.1 | 93 | 4 | 4 | 89 | ||||||
| 6 | 4.8 | 63 | 6 | 3.3 | 73 | ||||||
| 8 | 1.6 | 33 | |||||||||
| 10 | 0.3 | 4 | |||||||||
| 13 | 0.2 | 3 | |||||||||
| 17 | 1.5 | 20 | |||||||||
| 20 | 3.6 | 47 | |||||||||
| 病人11:H-T#11 | |||||||||||
| 疗程1: | 60mg/m2 | 疗程2: | 60mg/m2 | 疗程3: | 60mg/m2 | ||||||
| HyDOX | |||||||||||
| 时间(天) | 中性粒细胞X109/L | 相当于第1天中性粒细胞的% | 时间(天) | 中性粒细胞X109/L | 相当于第1天中性粒细胞的% | 时间(天) | 中性粒细胞X109/L | 相当于第1天中性粒细胞的% | |||
| 1 | 3 | 100 | 1 | 2.4 | 100 | 1 | #DIV/0! | ||||
| 4 | 2.1 | 70 | 4 | ||||||||
| 8 | 2 | 67 | 7 | ||||||||
| 10 | 1.5 | 50 | |||||||||
| 12 | 0.8 | 27 | |||||||||
| 15 | 0.5 | 17 | |||||||||
| 17 | 0.5 | 17 | |||||||||
| 19 | 0.9 | 30 | |||||||||
| 病人12:M-P#12 | ||||||||||
| 疗程1: | 60mg/m2 | 疗程2: | 60mg/m2 | 疗程3: | 60mg/m2 | |||||
| DOX | ||||||||||
| 时间(天) | 中性粒细胞X109/L | 相当于第1天中性粒细胞的% | 时间(天) | 中性粒细胞X109/L | 相当于第1天中性粒细胞的% | 时间(天) | 中性粒细胞X109/L | 相当于第1天中性粒细胞的% | ||
| 1 | 5.8 | 100 | 1 | #DIV/0! | ||||||
| 4 | 7.2 | 124 | ||||||||
| 7 | 5.5 | 95 | ||||||||
实施例6:在具有转移的结肠直肠癌患者中施用5-氟尿嘧啶和HA组合(Hyfive)的I期临床实验
在具有转移的结肠直肠癌患者中施用HA和5-氟尿嘧啶组合(Hyfive)进行相似的I期研究。合适的标准如实施例3所述,不同之处在于蒽环类不是反指征。治疗计划如实施例3所述。
HyDox配方(灌注袋形式)如下制备:HA和可注射的氯化钠溶液分别得自GlycoMed Research和Baxter Healthcare,如实施例3所示。Dox得自David Bull Laboratories,以含有500mg的5-氟尿嘧啶(5-FU)的10ml小瓶形式提供。
5-FU±HA通过静脉内施用一小时以上而给予,4周一个疗程。在这项研究中5-FU的初始剂量为450mg/m2/天,同时施用3天,每次施用5-FU时HA剂量为500mg/m2。在两个步骤中增加剂量以在每个疗程连续5天达到标准剂量为450mg/m2。因此,初始剂量水平为450mg/m2/天共3天,接下来450mg/m2共4天,最后450mg/m2/天共5天。
在每个剂量水平治疗4名患者。结果表明HA不增加任何已知5-FU毒性。在较高剂量水平表现为化疗后恶心和呕吐现象明显减轻,而且无中性粒细胞减少或胃肠道毒性。中性粒细胞计数结果示于表10。
表10
| 病人2-L-F(3天Tr) | ||||||||||
| 疗程1-5FU | 疗程2-HyFive | 疗程-HyFive | ||||||||
| 时间(天) | 中性数细胞计数 | 相当于第1天的% | 时间(天) | 中性粒细胞计数 | 相当于第1天的% | 时间(天) | 中性粒细胞计数 | 相当于第1天的% | ||
| 1 | 9.3 | 100 | 1 | 8.7 | 100 | 2 | 9.6 | |||
| 3 | 7.6 | 82 | 3 | 8.1 | 93 | |||||
| 7 | 8.4 | 90 | 7 | 8.1 | 93 | |||||
| 9 | 8.3 | 89 | 9 | 7.5 | 86 | |||||
| 11 | 6.8 | 73 | 11 | 7.2 | 83 | |||||
| 14 | 7 | 75 | 14 | 7.7 | 89 | |||||
| 16 | 7.3 | 78 | 16 | 10.8 | 124 | |||||
| 18 | 8.4 | 90 | 18 | 7.9 | 91 | |||||
| 21 | 8.2 | 88 | 21 | 7.9 | 91 | |||||
| 23 | 7.8 | 84 | 23 | 7.9 | 91 | |||||
| 25 | 8.7 | 94 | 25 | 8.4 | 97 | |||||
| 病人4-C-X(4天Tx) | ||||||||||
| 疗程1-HyFive | 疗程2-5FU | 疗程3-HyFive | ||||||||
| 时间(天) | 中性粒细胞计数 | 相当于第1天的% | 时间(天) | 中性粒细胞计数 | 相当于第1天的% | 时间(天) | 中性粒细胞计数 | 相当于第1天的% | ||
| 1 | 5.8 | 100 | 1 | 5.1 | 100 | 1 | 5.5 | |||
| 4 | 6.1 | 105 | 4 | 4.4 | 86 | |||||
| 8 | 10.2 | 176 | 5 | 4.4 | 86 | |||||
| 10 | 10.8 | 186 | 8 | 5 | 98 | |||||
| 15 | 14.3 | 247 | 10 | 10.3 | 202 | |||||
| 17 | 13.1 | 226 | 12 | 6.9 | 135 | |||||
| 19 | 12.2 | 210 | 15 | 6.7 | 131 | |||||
| 22 | 6 | 103 | 17 | 7.5 | 147 | |||||
| 24 | 5.8 | 100 | 19 | 6.5 | 127 | |||||
| 22 | 6.1 | 120 | ||||||||
| 24 | 7.9 | 155 | ||||||||
| 26 | 5.3 | 104 |
| 病人5-J-M(5天 1X) | ||||||||||
| 疗程1-5FU | 疗程2-HyFive | 疗程3-HyFive | ||||||||
| 时间(天) | 中性粒细胞计数 | 相当于第1天的% | 时间(天) | 中性粒细胞计数 | 相当于第1天的% | 时间(天) | 中性粒细胞计数 | 相当于第1天的% | ||
| 1 | 4.2 | 100 | 1 | 4 | 100 | 1 | 5.8 | |||
| 5 | 4.5 | 107 | 3 | 3.9 | 98 | |||||
| 10 | 4.1 | 98 | 7 | 4.8 | 120 | |||||
| 12 | 4.3 | 102 | 9 | 5.6 | 140 | |||||
| 15 | 3.7 | 88 | 11 | 7.1 | 178 | |||||
| 17 | 3.3 | 79 | 14 | 5.8 | 145 | |||||
| 19 | 4.3 | 102 | 16 | 5.6 | 140 | |||||
| 22 | 4.3 | 102 | 18 | 4.5 | 113 | |||||
| 24 | 4 | 95 | 21 | 5.2 | 130 | |||||
| 26 | 4.5 | 107 | 23 | 5.5 | 138 | |||||
| 25 | 5.7 | 143 | ||||||||
| 病人6-J-B(5天 Tx) | ||||||||||
| 疗程1-5FU | 疗程2-HyFive | 疗程3- | ||||||||
| 时间(天) | 中性粒细胞计数 | 相当于第1天的% | 时间(天) | 中性粒细胞计数 | 相当于第1天的% | 时间(天) | 中性粒细胞计数 | 相当于第1天的% | ||
| 1 | 5.3 | 100 | 1 | 4.5 | 100 | 1 | 6.1 | |||
| 3 | 4.3 | 81 | 3 | 4.9 | 109 | |||||
| 8 | 4.5 | 85 | 5 | 4.6 | 102 | |||||
| 10 | 6.6 | 125 | 8 | 7.5 | 167 | |||||
| 12 | 4.5 | 85 | 10 | 8.6 | 191 | |||||
| 15 | 4.2 | 79 | 12 | 5.8 | 129 | |||||
| 17 | 5.5 | 104 | 13 | 7 | 156 | |||||
| 19 | 5.3 | 100 | 19 | 6 | 133 | |||||
| 22 | 5.7 | 108 | 22 | 7 | 156 | |||||
| 24 | 5.4 | 102 | 24 | 5.5 | 122 | |||||
| 26 | 5 | 94 | 26 | 5.5 | 122 | |||||
| 病人7-V-D(5 天 Tx) | ||||||||||
| 疗程1-HvEive | 疗程2-5FU | 疗程3 | ||||||||
| 时间(天) | 中性粒细胞计数 | 相当于第1天的% | 时间(天) | 中性粒细胞计数 | 相当于第1天的% | 时间(天) | 中性粒细胞计数 | 相当于第1天的% | ||
| 1 | 2.7 | 100 | 1 | 3 | 100 | 1 | 3 | |||
| 3 | 3.2 | 119 | 3 | 2.3 | 77 | |||||
| 5 | 2.7 | 100 | 5 | 2.8 | 93 | |||||
| 8 | 3.3 | 122 | 8 | 3.2 | 107 | |||||
| 10 | 2.5 | 93 | 10 | 2.5 | 83 | |||||
| 12 | 2.6 | 96 | 15 | 2.7 | 90 | |||||
| 19 | 2.5 | 93 | 17 | 2.5 | 83 | |||||
| 22 | 2.4 | 89 | 19 | 3 | 100 | |||||
| 24 | 2.9 | 107 | 22 | 3.4 | 113 | |||||
| 26 | 2.9 | 107 | 24 | 3.1 | 103 | |||||
| 26 | 3.5 | 117 |
实施例7:细胞毒性的体内模型(III)
实施例5和6研究了HA/细胞毒性药物组合分别为期6个月和6周的作用,示出在氨甲蝶呤或5-FU中加入HA增强肿瘤应答,降低转移及降低胃肠道毒性。根据那些结果在治疗裸鼠中人乳腺癌异种移植物中研究HA对环磷酰胺、氨甲蝶呤和5-氟尿嘧啶(CMF)的效力的作用。研究以下效力参数:初始肿瘤体积;癌症转移及与体重相关的治疗毒性、器官病理学、血液学及存活力。
人乳腺癌细胞系
人乳腺癌细胞系MDA-MB-468(American Tissue Culture Collection,Rockville,USA)基于其表达CD44和RHAMM的HA受体情况而选择。将细胞在具有补加10%w/v胎牛血清和10μg/ml庆大霉素的LeibovitzL-15培养基(Sigma.St.Louis,USA)的175cm2培养瓶或700cm2滚动瓶中常规生长并亚培养为单层。为注射入小鼠中,将细胞生长为80%铺满,在0.05%胰蛋白酶/0.01%EDTA溶液中胰蛋白酶消化,通过在BeckmanTJ-6台式离心器(Beckman,Melbourne,Australia)中以400g离心10分钟洗涤两次,使用Model-ZM Coulter计数器(Coulter Electronics,England)计数,并以2×108个细胞/ml再悬浮于无血清的Leibovitz L-15培养基中。
小鼠肿瘤模型
将6-8周龄的无胸腺CBA/WEHI雌性裸鼠(Walter and Eliza HallResearch Institute,Melbourne,Australia)在特殊的无病原条件下维持,随意给予无菌食物和水。每只小鼠接受含有1×107个细胞/50-100μl的一种注射液。所述细胞使用26号针头注射入第一乳头下的乳腺脂肪层中(Lamszus et al.,Lab.Invest.76(3):339-353,1997)。每周通过测定三条垂直径向(d1d2d3)对肿瘤加以测定。肿瘤体积使用以下公式计算:
(1/6)π(d1d2d3)
在接种癌细胞后大约4-8周开始用CMF±HA进行处理。表11示出在开始处理时每个处理组的平均肿瘤体积大小。
表11
| 处理组 | 开始治疗时的肿瘤体积(mm3)平均值±SD | 肿瘤体积(mm3)相当于开始治疗时体重的%平均值±SD |
| 盐水第1&2天 | 39.98±13.8g | 0.20±0.07 |
| HA第1&2天 | 50.99±18.07 | 0.22±0.10 |
| HA第1&3天 | 28.65±20.90 | 0.14±0.11 |
| CMF第1&2天 | 44.51±26.92 | 0.23±0.13 |
| HA/CMF第1&2天 | 37.13±22.30 | 0.20±0.12 |
| HA第1&3天继而GMF第2&4天 | 35.31±942 | 0.20±0.05 |
动物维持和圈养
每个笼子里分配等数的小鼠。每个笼子里的动物数根据实验阶段在5-8只之间变化。所有动物均根据内部质量认证程序圈养在Monash大学动物饲养中心SPF设备中。
人乳腺癌异种移植物的确认:对乳腺癌上HA受体进行免疫组织化学检测
在诱导肿瘤后大约8周,将两只携带肿瘤的小鼠给予致死剂量的戊巴比妥钠。在杀死小鼠的3分钟内,经手术切除肿瘤并立即在10%v/v缓冲的福尔马林中固定12小时。将固定的肿瘤在70-100%v/v系列乙醇中脱水过夜,包埋于石蜡中。做成切片(2-4μm)并置于玻片上,脱蜡及置于水中。将玻片在PBS中洗涤3次×5分钟。异嗜性蛋白质通过用10%w/v胎牛血清温育10分钟而封闭,然后在PBS中漂洗。在室温(RT)应用检测抗体60分钟。RHAMM(Applied Bioligands Corporation,Manitoba,Canada),CD44H,CAE的抗血清或抗体及二抗购自Zymed(California,USA)。将玻片在PBS中洗涤3次×5分钟,内源过氧化物酶活性通过在于甲醇中的0.3%H2O2中沉浸20分钟而封闭。在进一步用PBS洗涤后,在RT应用过氧化物酶缀合的猪抗兔第二抗血清(Dako,California,USA),随后在PBS中洗涤3次×5分钟。根据厂商指导制备Sigma Fast DAB(3,3′-二氨基联苯胺(DAB),Sigma,St.Louis,USA)片剂,在RT应用DAB溶液5-10分钟。将玻片在自来水中洗涤10分钟,用苏木精复染、脱水并封固。
CMF/HA药物组合的制备及注射
根据小鼠体重单独生产环磷酰胺/氨甲蝶呤/5-氟尿嘧啶(CMF)注射液,以输送15mg/kg MTX/30mg/kg Cyclo及30mg/kg5-FU,相当于在人体内的施用剂量为:
15mg/kg MTX=565mg/m2人体剂量
30mg/kg Cyclo=1g/m2人体剂量
30mg/kg 5-FU=400mg/m2人体剂量。
将5-FU加入MTX中并将药物组合抽吸入1ml注射器中,然后将cyclo抽吸入各个注射器中而制备100μl注射液。
针对5-FU/HA,将一种无热源的HA原液(10mg/ml;modal mr8.5×105da)加入20mg/ml 5-FU原液的一部分中,旋动温育过夜至HA终浓度为12.5mg/kg小鼠体重,根据小鼠体重单独生产注射液,以在100μl注射液中输送30mg/kg 5-FU和12.5mg/kg HA。
HA/CMF注射液根据小鼠体重单独生产,以输送15mg/kg MTX/30mg/kg Cyclo/30mg/kg5-FU及12.5mg/kg HA,其相当于在人体内的剂量如上所述。
将MTX加入5-FU/HA中制备100μl药物组合注射液,然后将Cyclo抽吸入各个注射器中。
将小鼠随机分成以下治疗组:
盐水(第1天和第2天,7天/疗程)
12.5mg/kg HA 850kD(第1天和第2天,7天/疗程)
12.5mg/kg HA 850kD(第1天和第3天,7天/疗程)
CMF(第1天和第2天,7天/疗程)
12.5mg/kg HA 850kD/CMF(第1天和第2天,7天/疗程)
CMF(第2天和第4天,7天/疗程)
12.5mg/kg HA 850kD(在第1天和第3天);CMF(第2天和第4天,7天/疗程)。
通过尾静脉将治疗物数量上施用。将动物注射Cyclo,2分钟之后注射5-FU/MTX+HA。每天将动物称重并测定肿瘤体积。
肿瘤及机体器官的收集与处理
在实验结束时,当动物由于疾病进展的程度而进行安乐死或者在6周处理方案完成时,将动物通过腹腔内注射0.1ml戊巴比妥钠(60mg/ml)进行麻醉,收集血液,使用颈部脱位处死所述动物。
在处死小鼠之后,立即切下肿瘤,肝,心,脾,膀胱,左右肾,子宫,肺,胃,小肠,脑和淋巴结并称重,置于10%v/v福尔马林中。将组织固定16-24小时之后进行组织学处理。将固定的组织在逐步至100%的乙醇中脱水并包埋于石蜡中,将从中制备的2-4μm切片置于玻璃显微镜玻片上。用苏木精核染剂及伊红胞质染剂染色所述组织切片,突出了可表明处理毒性的任何病理学特征。
监测治疗过程的不良反应
胃肠(GI)道毒性
监测动物的胃肠道不适情况如腹泻,及更严重的毒性表现如体重下降。体重下降通过估定净重减去以1gx肿瘤体积(cm3)而计算的肿瘤重量而计算,如Shibamoto等,Br.J.Cancer 74(11):1709-1713,1996所述。为表明任何体重变化,将动物体重标准化为在治疗开始时的体重:
骨髓抑制
通过产生在小鼠韧性盐水中的1/50-1/2000稀释液并在血细胞计数仪上计数而确定红细胞,血小板和白细胞数。产生血液涂片并用Giemsa染色,从而使得能够相对量化中性粒细胞,淋巴细胞和红细胞的百分比。将血细胞亚群的总估定值与公布的小鼠血液数据对比。
治疗对器官重量的作用
为保证所述治疗不诱导器官萎缩或增大,在致死放血后取出器官并称重。每个器官的重量以占机体总净重的百分比计算,并与只用盐水的对照组器官重量相比。
全部群体存活时间
全部存活时间以在开始治疗后动物生活的时间(天或周)计算。
HA对CMF诱导的毒性的作用
胃肠道毒性:监测体重
每天监测以腹泻形式存在的胃肠道毒性,无一治疗组出现症状。除了肉眼所见的胃肠道毒性之外,在6周的研究期间还观测动物净重(不包括肿瘤)。当与所有其它治疗组相比时,预先或者与CMF同时施用HA引起体重明显增加(见表12和图15)。
表12:HA对CMF的胃肠道毒性的作用的统计学对比
| 处理组 | 体重(不包括肿瘤)变化的平均值(%)±SEM | 与HA/CMF处理组比较的统计学差异(t—检验) |
| HA/CMF第1和2天 | 8.74±1.93 | 不适用 |
| 盐水 | 0.09±1.87 | P=0.005 |
| HA第1和2天 | 2.47±1.05 | P=0.013 |
| HA第1和3天 | 2.78±1.28 | P=0.022 |
| HA第1和3天;CMF第2和4天 | 5.97±1.65 | 无显著性 |
| CMF第1和2天 | -15.51±4.15 | P<0.001 |
骨髓毒性:中性粒细胞减少
CMF治疗方案引起总循环白细胞(WBC)减少,随之表明骨髓毒性。预先或同时施用HA/CMF表现为克服了该毒性(见表13-15)。最受CMF影响的白细胞亚群是多形类型细胞,其中HA/CMF表现为引起数目增加,表明可能为循环血补充了中性粒细胞祖细胞。
表13:CMF/HA治疗对骨髓毒性的作用
| 处理 | 血细胞计数(平均值±SD) | ||||
| 红细胞×106/ul | 血小板×103/ul | 白细胞×103/ul | 中性/嗜酸性/嗜碱性粒细胞(%) | 淋巴/单核细胞(%) | |
| 盐水 | 8.71±0.43 | 1290±88 | 6.15±0.19 | 54±3 | 46±3 |
| HA/CMF第1和2天 | 8.99±0.07 | 1323±21 | 6.75±0.12 | 58±2 | 42±2 |
| HA第1和2天 | 8.99±0.13 | 1374±7 | 6.15±0.03 | 53±1 | 47±1 |
| HA第1和3天 | 8.78±0.25 | 1356±41 | 6.15±0.05 | 53±2 | 47±2 |
| HA第1和3天:CMF第2和4天 | 8.99±0.05 | 1335±38 | 6.54±0.17 | 56±2 | 44±2 |
| CMF第1和2天 | 8.90±0.17 | 1295±56 | 5.63±0.32 | 45±3 | 56±3 |
表14:与盐水治疗组的血细胞对比
| 细胞类型 | CMF | CMF/HA | HA 1,3 | HA 1,2 | HA 1,3继以CMF 2,4 | 结论 |
| 红细胞 | - | - | - | - | - | |
| 白细胞 | 下降8%p=0.003 | 升高9%p<0.001 | - | - | 升高6%p<0.001 | 加入HA克服了CMF组中WBC的减少 |
| 嗜酸细胞/中性粒细胞 | 下降13%p<0.001 | 升高8%p=0.007 | - | - | - | 同时施用HA增加多形细胞的数量 |
| 单核/淋巴细胞 | 升高20%p<0.001 | 下降10%p=0.007 | - | - | - | |
| 血小板 | - | - | - | 升高6%p=0.010 | - |
表15:与HA/CMF治疗组的血细胞对比
| 细胞类型 | 盐水 | CMF | HA 1,3 | HA 1,2 | HA 1,3继以CMF 2,4 | 结论 |
| 红细胞 | 无 | 无 | 无 | 无 | 无 | |
| 白细胞 | 下降9%p<0.001 | 下降17%p<0.001 | 下降9%p<0.001 | 下降9%p<0.001 | 下降3%p<0.001 | 加入HA克服了CMF组中WBC的减少 |
| 嗜酸细胞/中性粒细胞 | 下降9%p=0.007 | 下降24%p<0.001 | 下降9%p<0.001 | 下降9%p<0.001 | 下降7%p=0.050 | 同时施用HA增加多形细胞的数量 |
| 单核/淋巴细胞 | 升高25%p<0.001 | 升高10%p=0.007 | 升高11%p<0.001 | 升高12%p<0.001 | 升高9%p=0.050 | |
| 血小板 | 无 | 无 | 无 | 升高3%p<0.001 | 无 |
治疗对器官重量的作用
当与未治疗的对照组相比时,HA或在CMF中加入HA引起脾明显增大(表16);对脾进行的病理学检测未表明任何异常组织或细胞病理学改变。HA也表现为引起心脏重量减少;再一次对组织进行病理学评估未示出任何异常病理学改变。CMF治疗方案表现为产生子宫萎缩,通过同时施用HA得以充分克服。CMF还引起胃肠道增大。
表16:与盐水未治疗的对照组器官重量的对比
| 细胞类型 | CMF/HA | CMF | HA 1,3 | HA 1,2 | HA 1,3继以CMF 2,4 | 结论 |
| 脾脏 | 增大101%p<0.001 | 无 | 无 | 无 | 增大197%p=0.007 | 在CMF中加入HA引起脾脏增大 |
| 心脏 | 缩小14%p=0.013 | 无 | 缩小11%p=0.023 | 缩小16%p=0.029 | 缩小13%p=0.023 | 加入HA引起心脏重量轻度减小 |
| 肾脏 | 缩小10%p=0.001 | 无 | 缩小8%p=0.038 | 无 | 无 | 变化较小,但HA可能影响肾脏重量 |
| 子宫 | 缩小49%p=0.004 | 缩小102%p=0.001 | 无 | 无 | 缩小97%p=0.001 | CMF引起子宫缩小,而HA使得毒性降低53% |
| 脑 | 无 | 增大27%p=0.001 | 无 | 无 | 增大22%p=0.01 | CMF似乎引起脑轻度增大,其被同时施用HA而克服 |
| 肝脏 | 无 | 无 | 无 | 无 | 增大15%p=0.046 | |
| 膀胱 | 无 | 无 | 无 | 无 | 无 | |
| 消化道 | 增大28%p=0.002 | 增大27%p=0.002 | 无 | 无 | 增大19%p=0.001 | CMF似乎引起消化道增大 |
| 肺 | 无 | 增大26%p=0.020 | 无 | 无 | 无 | |
| 胃 | 增大66%p=0.006 | 增大49%p=0.005 | 无 | 缩小14%p=0.046 | 增大69%p=0.002 | 各处理组之间无显著差别 |
治疗对器官病理学改变的作用
对用CMF治疗的动物器官的病理学改变的评估示出肝脏表现出一些不利病理改变(表17)。在肝脏中,在CMF治疗组、CMF之后施用HA治疗组、盐水和HA治疗组中观测到局部坏死和炎症区域。在只接受药物的CMF治疗组或者动物用HA预处理的治疗组中观测到最大程度的局部坏死和炎症。加入HA完全抑制肝脏的坏死和炎症。
表17:对在肺和肝中观测到的不利病理学改变的治疗对比
| 器官 | 盐水 | CMF/HA | CMF | HA | HA1,3继以CMF2,4 |
| 肝脏 | 25%具有局部肝坏死/炎症区域 | 无不利病理学 | 87.5%具有局部肝坏死/炎症区域 | 25%具有局部肝坏死/炎症区域 | 87.5%具有局部肝坏死/炎症区域 |
| 肺 | 无不利病理学 | 无不利病理学 | 无不利病理学 | 12.5%具有水肿和巨噬细胞浸润 | 无不利病理学 |
治疗对存活力的作用
CMF治疗方案具有极大毒性:动物由于过度丧失体重而死亡。其它治疗组不产生毒性。同时施用HA/CMF完全消除治疗毒性,随后引起存活期明显增加(见表18和图16)。
表18:统计学对比HA/CMF对存活率的作用
| 治疗 | 存活时间(天数)平均值±SEM | 与CMF/HA治疗组相比的统计学显著差异(t-检验) |
| HA/CMF在第1天和第2天施用 | 42±0 | 不适用 |
| 盐水 | 42±0 | 无 |
| HA在第1天和第2天施用 | 42±0 | 无 |
| HA在第1天和第3天施用 | 42±0 | 无 |
| HA在第1天和第3天施用;CMF在第2天和第4天施用 | 42±0 | 无 |
| CMF在第1天和第2天施用 | 37.38±2.84 | P<0.05 |
前述结果表明预先或者与CMF同时施用HA改变治疗的毒性,同时保持抗肿瘤效力。
实施例8:在体外在H9C2大鼠胚胎心肌细胞中透明质酸对阿霉素细胞毒性的作用
将H9C2心肌细胞以50,000个细胞/ml/孔的密度铺板于具有10%w/vFCS的DMEM中,并在24孔铺板中放置过夜。24小时后,细胞在1%w/vFCS中生长4天后发生分化。4天后,将细胞在含有0μg/ml,0.0097μg/ml,0.0195μg/ml,0.03905μg/ml,0.0781μg/ml,0.1562μg/ml,0.3125μg/ml,0.625μg/ml,1.25μg/ml,2.5μg/ml和5μg/ml的Dox的生长培养基中温育48小时。每种Dox浓度在有或无HA的情况下一式四份进行。HA的分子量为824,000 kD,在存在Dox情况下应用于细胞的浓度为1μM,2.5μM,5μM,7.5μM和10μM。
在用Dox±HA温育48小时之后,将细胞用Hank′s洗涤,通过0.5ml胰蛋白酶/EDTA分离以产生同源单细胞悬浮液,并将细胞悬浮于15ml盐水中。将此15.5-ml细胞悬浮液使用Coulter计数器用于计数细胞数。每种浓度的Dox±HA的细胞计数以无药物/无HA对照读数的细胞计数的平均百分比表示。结果示于图17。
本领域技术人员知晓在此所述本发明除了特别描述的那些之外可以加以变化和修改。应意识到本发明包括所有这种变化和修改。本发明还包括在此说明书中单独或全体涉及的或指明的所有步骤、特点、组合物和化合物、及任两或多个所述步骤或特点的任何所有组合。
参考文献:
Aglietta,M.,Piacibello,W.,Sanavio,F.,Stacchini,A.,Apra,F.,Schena,M.,Mossetti,C.,Carnino F,Caligaris-Cappio,F & Gavosto F.Kinetics ofhuman hemopoietic cells after in vivo administration ofgranulocyte-macrophage colony-stimulating factor.J.Clin.Invest.83:551-557,1989.
Anglin,P.,Strauss,B.A.,& Brandwein,J.M.Prevention ofchemotherapy-induced neutropenia using G-CSF with VACOP-B,A casereport.Leuk.Lymphom.11:469-472,1993.
Billingham,M.E.,Mason,J.W.,Bristow,M.R.,and Daniels,J.R.Anthracycline cardiomyopathy monitored by morphologic changes.Can.Treat.Rep.62:865-872,1978.
Bodey,G.P.,Buckley,M.,Sathe,Y.S.,Freireich,E.J.Quantitativerelationships between circulating leukocytes and infection in patients withacute leukemia.Ann.Intern.Med.64:328-340,1966.
Carter,S.K.Adriamycin-a review.J.Nat.Cancer.Inst.55:1265-1274,1975.
Claiborne,R.A.and Dutt,A.K.Ioniazid-induced pure red cell aplasia.Am.Rev.Respir.Dis.131(6):947-949,1985.
Cohen,A.M.,Zsebo,K.M.,Inoue,H.,Hines,H.,Hines,D.,Boone,T.C.,Chazin,V.R.,Tsai,L.,Ritch,T.,and Souza,L.M.In vivo stimulation ofgranupoiesis by recombinant human,granulocyte colony-stimulating factor.Proc.Natl.Acad.Sci.84:2484-2488,1987.
Cohn,V. H.and Lyle,J.,Anal Biochem.14(3):434-404,1966.
Dotti,G.,Carlo-Stella,C.,Mangoni,L.,Cottafavi,L.,Caramatti,C.,Ahnici,C.,and</RTI>Rizzoli,V.Granulocyte colony-stimulating factor(G-CSF)prevents dose-limiting neutropenia in lymphoma patients receivingstandard dose chemotherapy.Haematologica 80:142-145,1995.
Grigg,A.,Begley,C.G.,Juttner,C.A.,Szer,J.,To L.B.,Maher,D.,McGrath,K.M.,Morstyn,G.,Fox,R.M and Sheridan W.P.Effect ofperipheral blood progenitor cells mobilized by filgrastim(G-CSF)on plateletrecovery after high-dose chemotherapy.BoneMarrow Transplant 11:23-29,1993.
Hryniuk,W.M,The importance of dose intensity in the outcome ofchemotherapy.In:Advances in Oncology:Hellman S,De Vita V,RosembergS,Eds.,Philadelphia:J.B.Lippincott:pp.1121-414,1988.
Kotake,T.,Usami.M.,Miki,T.,Togashi,M.,Akaza,H.,Kubota,Y.,&Matsumura Y.*Effect of recombinant human granulocyte colony stimulatingfactor(lenograstim)on chemotherapy induced neutropenia in patients withurothelial cancer.Int.J;Urol.6:61-67,1999.
Lamszus,K.,Jin,L.,Fuchs,A.,Shi,E.,Chowdhury,S.,Yao,Y.,Polverini,P.J.,Laterra.J.,Goldberg,I.D.and Rosen,E.M.Scatter factorstimulates tumor growth and tumor angiogenesis in human breast cancers inthe mammary fat pads of nude mice.Lab.Invest.76(3):39-353,1997.
Legras,S.,L vesque,J.P.,Charrad,R.,Morimoto,K.,Le Bousse,C.,Clay,D.,Jasmin C & Smadja-Joffe F.CD44-mediated adhesiveness ofhumanhematopoietic progenitors to HA is modulated by cytokines.Blood 89:1905-1914,1997.
L vesque,J.P.,Leavesley.,D.I.,Niutta,S.,Vadas,M.,& Simmons,P.J.Cytokines increase human haematopoietic cell adhesiVeness by activation ofvery late antigen(VLA)-4 andVLA-5 integrins.J.Exp.Med.181:1805-1815,1995.
Maher DW,Lieschke GJ,Green M,Bishop J,Stuart-HarrisR,Wolf M,Sheridan WP,Kefford RF,Cebon J,Olver I,et al.Filgrastim in patients withchemotherapy-induced febrile neutropenia.A double-blind,placebo-controlled trial.Ann.Intern.Med.121:492-501,1994.
Mavroudis,D.A.,Read,E.J.,Molldrem,J.,Raptis,A.,Plante,M.,Carter,C.S,Phang,S.,Dunbar,C.E.and Barrett,A.J.T cell-depletedgranulocyte colony-stimulating factor(G-CSF)modified allogenic bonemarrow transplantation for haematological malignancy improves graftCD34+cell content but is associated with delayed pancytopenia.BoneMarrow Transplant 21:431-440,1998.
McCord,J.M.and Fridovich.I.The utility of superoxide dismutase instudying free radical reactions.I.Radicals generated by the interaction ofsulfite,dimethyl sulfoxide,and oxygen.J.Biol.Chem.244(22):6056-6063,1969.
Paglia,D.E.and Valentine,W.N.Studies on the quantitative andqualitative characterization of erythrocyte glutathione peroxidase.J.Lab.Clin.Med.70(1):158-169,1967.
Pettengell,R.,Gurney,H.,Radford,J.A.,Deakin,D.P.,James,R.,Wilkinson,P.M.,Kane,K.,Bentley,J.,and Crowther,D.Granulocytecolony-stimulating factor to prevent dose- limiting neutropenia innon-Hodgkin′s lymphoma:a randomized controlled trial.Blood 80(6):430-436,1992.
Scott,J.E.,Cummings,C.,Brass,A.,aBd Chen,Y.Secondary andtertiary structures of HA in aqueous solution,investigated by rotaryshadowing-electron microseopy and computer simulation.Biochem.J:274:699-705,1991.
Shibamoto,Y.,Murata,R.,Miyauchi,S.,Hirohashi,M.,Takagi,T.,Sasai,K.,Shibata.T.,Oya,N.,and Takahashi,M.Combined effect of clinicallyrelevant doses of emitefur,a new 5-fluorouracil derivative,and radiation inmurine tumours.Br.J.Cancer 74(11):1709-1713,1996.
Shimamura,M.,Kobayashi,Y.,You,A.,Urabe,A.,Okabe,T.,Komatsu,Y.,Itoh,S.,and Takaku,F.Effect of human recombinant granulocytecolony-stimulating factor on hematopoietic injury in mice induced by5-fluorouracil.Blood69:353-355,1987.
Shimamura,M.,Takigawa,T.,Urabe,A.,Okabe,T.,Souza,L.M.andTakalcu,F.Synergistic effect of dolichyl phosphate and human recombinantgranulocyte colony-stimulating factor on recovery from neutropenia in micetreated with anti-cancer drugs.Exp.Hematol.16:681-685,1988.
Simmons,P.J.,Zannettino,A.,Gronthos,S.,Leavesley,D.Potentialadhesion mechanisms for localization of haematopoietic progenitors to bonemarrow stoma.Leuk.Lymphom.12:353-363,1994.
Sheridan,W.P.,Begley,C.G.,Juttner,C.A.,Szer,J.,To,L.B.,Maher,D.,McGrath,K.M.,Morstyn,G.,and Fox,R.M.Effect of peripheral-bloodprogenitor cells mobilized by filgrastin(G-CSF)on platelet recovery afterhigh-dose chemotherapy.Lancet 339:640-644,1992.
Watanabe,T.,Dave,B.,Heimann,D.G.,Lethaby,E.,Kissinger,A andTalmadge,J.E.GM-CSF mobilized peripheral blood CD34+cells differ fromsteady-state bone marrow CD34+ cells in adhesion molecule expression.BoneMarrow Transplant 19:1175-1981,1997.
Claims (20)
1、一种便于将一个剂量的化疗药物延长施用于治疗对象的方法,其中所述剂量高于一般可接受的有效剂量,所述方法包括预先和/或同时施用一有效量的HA。
2、权利要求1的方法,其中单一剂量可比一般可接受的有效剂量最多高200%,和/或累积剂量可比一般可接受的有效剂量最多高600%。
3、权利要求2的方法,其中化疗药物的剂量比一般可接受的有效剂量高大约10%至大约150%。
4、权利要求3的方法,其中化疗药物的剂量比一般可接受的有效剂量高大约35%至大约100%。
5、权利要求1至4中任一项的方法,其中HA与化疗药物同时施用。
6、权利要求1至4中任一项的方法,其中HA在施用化疗药物之前大约24小时至大约5分钟施用。
7、权利要求1至4中任一项的方法,其中HA在施用化疗药物之前大约12小时至大约10分钟施用。
8、权利要求1至4中任一项的方法,其中HA在施用化疗药物之前大约半小时施用。
9、权利要求1至8中任一项的方法,其中HA的有效量为大约0.5mg至20mg/kg体重/天。
10、权利要求1至8中任一项的方法,其中HA的有效量为大约5mg至10mg/kg体重/天。
11、一种以一个剂量的化疗药物对治疗对象进行延长的治疗的方法,其中化疗药物的单一剂量比一般可接受的有效剂量最多高200%且/或累积剂量比一般可接受的有效剂量最多高600%,所述方法包括预先施用有效量的HA和/或与所述化疗药物同时施用。
12、权利要求11的方法,其中化疗药物的剂量比一般可接受的有效剂量高大约10%至大约150%。
13、权利要求12的方法,其中化疗药物的剂量比一般可接受的有效剂量高大约35%至大约100%。
14、权利要求11至13中任一项的方法,其中HA与化疗药物同时施用。
15、权利要求11至13中任一项的方法,其中HA在施用化疗药物之前大约24小时至大约5分钟施用。
16、权利要求11至13中任一项的方法,其中HA在施用化疗药物之前大约12小时至大约10分钟施用。
17、权利要求11至13中任一项的方法,其中HA在施用化疗药物之前大约半小时施用。
18、权利要求11至17中任一项的方法,其中HA的有效量为大约0.5mg至20mg/kg体重/天。
19、权利要求11至17中任一项的方法,其中HA的有效量为大约5mg至10mg/kg体重/天。
20、HA在生产一种药物中的应用,所述药物在治疗恶性病变中预先施用或与化疗药物同时施用。
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| AUPR7302 | 2001-08-27 | ||
| AUPR7302A AUPR730201A0 (en) | 2001-08-27 | 2001-08-27 | Preventive treatment for toxic side-effects caused by chemotherapeutic agents |
| AUPR9504A AUPR950401A0 (en) | 2001-12-13 | 2001-12-13 | Methods for treatment |
| AUPR9504 | 2001-12-13 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN1578677A true CN1578677A (zh) | 2005-02-09 |
Family
ID=25646785
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNA028214358A Pending CN1578677A (zh) | 2001-08-27 | 2002-08-27 | 改良的治疗方案 |
Country Status (7)
| Country | Link |
|---|---|
| US (2) | US20050042303A1 (zh) |
| EP (1) | EP1427447A4 (zh) |
| JP (1) | JP2005505540A (zh) |
| CN (1) | CN1578677A (zh) |
| CA (1) | CA2458856C (zh) |
| MX (1) | MXPA04001828A (zh) |
| WO (1) | WO2003018062A1 (zh) |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE60036915T2 (de) | 1999-01-13 | 2008-08-07 | Alchemia Oncology Pty Ltd., Hawthorn | Verwendung von hyaluronan zur herstellung eines medikaments zur erhöhung der wirksamkeit von zytotoxischen arzneimitteln |
| US9066919B2 (en) | 2000-07-14 | 2015-06-30 | Alchemia Oncology Pty Limited | Hyaluronan as a chemo-sensitizer in the treatment of cancer |
| AUPQ879500A0 (en) | 2000-07-14 | 2000-08-10 | Meditech Research Limited | Hyaluronan as cytotoxic agent, drug presensitizer and chemo-sensitizer in the treatment of disease |
| CA2458856C (en) * | 2001-08-27 | 2011-02-15 | Meditech Research Limited | Improved therapeutic protocols |
| US8338648B2 (en) * | 2004-06-12 | 2012-12-25 | Signum Biosciences, Inc. | Topical compositions and methods for epithelial-related conditions |
| CA2616607C (en) * | 2005-07-27 | 2015-06-02 | Alchemia Oncology Pty Limited | Therapeutic protocols using hyaluronan |
| US8319625B2 (en) * | 2005-09-01 | 2012-11-27 | Simplexgrinnell Lp | Fire alarm textual notification related application |
| WO2007028196A1 (en) | 2005-09-07 | 2007-03-15 | Alchemia Oncology Pty Limited | Therapeutic compositions comprising hyaluronan and therapeutic antibodies as well as methods of treatment |
| WO2009033047A2 (en) * | 2007-09-07 | 2009-03-12 | University Of Chicago | Methods and compositions for treating diseases and conditions involving higher molecular weight hyaluronan |
| EP2832309B1 (en) | 2013-07-31 | 2018-03-07 | Biedermann Technologies GmbH & Co. KG | Implant for bones or vertebrae with self-constrained flexibility |
Family Cites Families (48)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US410452A (en) * | 1889-09-03 | Liam wiiarton | ||
| US4141973A (en) * | 1975-10-17 | 1979-02-27 | Biotrics, Inc. | Ultrapure hyaluronic acid and the use thereof |
| US4256108A (en) * | 1977-04-07 | 1981-03-17 | Alza Corporation | Microporous-semipermeable laminated osmotic system |
| US4160452A (en) * | 1977-04-07 | 1979-07-10 | Alza Corporation | Osmotic system having laminated wall comprising semipermeable lamina and microporous lamina |
| US4265874A (en) * | 1980-04-25 | 1981-05-05 | Alza Corporation | Method of delivering drug with aid of effervescent activity generated in environment of use |
| US4522811A (en) * | 1982-07-08 | 1985-06-11 | Syntex (U.S.A.) Inc. | Serial injection of muramyldipeptides and liposomes enhances the anti-infective activity of muramyldipeptides |
| US5166331A (en) * | 1983-10-10 | 1992-11-24 | Fidia, S.P.A. | Hyaluronics acid fractions, methods for the preparation thereof, and pharmaceutical compositions containing same |
| IT1229075B (it) * | 1985-04-05 | 1991-07-17 | Fidia Farmaceutici | Medicamenti per uso topico, ottenuti tramite l'impiego dell'acido ialuronico |
| US5532341A (en) * | 1985-03-28 | 1996-07-02 | Sloan-Kettering Institute For Cancer Research | Human pluripotent hematopoietic colony stimulating factor |
| US5202431A (en) * | 1985-07-08 | 1993-04-13 | Fidia, S.P.A. | Partial esters of hyaluronic acid |
| US4851521A (en) * | 1985-07-08 | 1989-07-25 | Fidia, S.P.A. | Esters of hyaluronic acid |
| US4665107A (en) * | 1986-03-21 | 1987-05-12 | Koh-I-Noor Rapidograph, Inc. | Pigment encapsulated latex aqueous colorant dispersions |
| IT1219587B (it) * | 1988-05-13 | 1990-05-18 | Fidia Farmaceutici | Polisaccaridi carbossiilici autoreticolati |
| US5128450A (en) * | 1989-06-30 | 1992-07-07 | Urdal David L | Nonglycosylated human interleukin-3 analog proteins |
| CA1340994C (en) * | 1989-09-21 | 2000-05-16 | Rudolf Edgar Dr. Falk | Treatment of conditions and disease |
| US5208020A (en) * | 1989-10-25 | 1993-05-04 | Immunogen Inc. | Cytotoxic agents comprising maytansinoids and their therapeutic use |
| US5095037B1 (en) * | 1989-12-21 | 1995-12-19 | Nissho Kk | Combined anti-inflammatory agent |
| US5733891A (en) * | 1990-10-18 | 1998-03-31 | Shiseido Co., Ltd. | Compound for medicinal ingredient and hyaluronic acid and process for producing the same |
| AU643141B2 (en) * | 1991-03-15 | 1993-11-04 | Amgen, Inc. | Pulmonary administration of granulocyte colony stimulating factor |
| EP0952855B1 (en) * | 1991-07-03 | 2005-07-27 | Meditech Research Limited | Use of hyaluronan in gene therapy |
| US5977088A (en) * | 1991-07-03 | 1999-11-02 | Hyal Pharmaceutical Corporation | Formulations containing hyaluronic acid |
| EP0563475B1 (en) * | 1992-03-25 | 2000-05-31 | Immunogen Inc | Cell binding agent conjugates of derivatives of CC-1065 |
| CA2089621A1 (en) * | 1993-02-16 | 1994-08-17 | Rudolf Edgar Falk | Formulations containing hyaluronic acid |
| US5847002A (en) * | 1993-04-16 | 1998-12-08 | Hyal Pharmaceutical Corporation | Compositions, for inhibition, control and regression of angiogenesis, containing hyaluronic acid and NSAID |
| US5744155A (en) * | 1993-08-13 | 1998-04-28 | Friedman; Doron | Bioadhesive emulsion preparations for enhanced drug delivery |
| ITPD940054A1 (it) * | 1994-03-23 | 1995-09-23 | Fidia Advanced Biopolymers Srl | Polisaccaridi solfatati |
| WO1997009998A2 (en) * | 1995-09-14 | 1997-03-20 | Bristol-Myers Squibb Company | Insulin-like growth factor binding protein 3 (igf-bp3) in treatment of p53-related tumors |
| US5968972A (en) * | 1995-10-26 | 1999-10-19 | Baker Norton Pharmaceuticals, Inc. | Method for increasing the oral bioactivity of pharmaceutical agents |
| AUPN814496A0 (en) * | 1996-02-19 | 1996-03-14 | Monash University | Dermal penetration enhancer |
| KR100236771B1 (ko) * | 1997-04-01 | 2000-02-01 | 성재갑 | 히아루론산을 이용한 약물의 서방성 미세입자 제형 |
| CA2175282A1 (en) * | 1996-04-29 | 1997-10-30 | Rudolf Edgar Falk | Use of forms of hyaluronic acid (ha) for the treatment of cancer |
| US5756537A (en) * | 1996-11-08 | 1998-05-26 | Parkash S. Gill, M.D., Inc. | Regime for paclitaxel in Kaposi's sarcoma patients |
| CA2247389C (en) * | 1996-12-27 | 2009-11-24 | Seikagaku Corporation | Agent for treatment of bladder troubles |
| DE69809892T2 (de) * | 1997-04-04 | 2003-08-28 | Fidia Advanced Biopolymers S.R.L., Brindisi | N-sulfatierte hyaluronsäureverbindungen, ihre derivate und verfahren zu ihrer herstellung |
| US6087350A (en) * | 1997-08-29 | 2000-07-11 | University Of Pittsburgh Of The Commonwealth System Of Higher Education | Use of pretreatment chemicals to enhance efficacy of cytotoxic agents |
| GB9727524D0 (en) * | 1997-12-31 | 1998-02-25 | Pharmacia & Upjohn Spa | Synergistic antitumor composition containing a biologically active ureido compound |
| US20020015724A1 (en) * | 1998-08-10 | 2002-02-07 | Chunlin Yang | Collagen type i and type iii hemostatic compositions for use as a vascular sealant and wound dressing |
| IT1303735B1 (it) * | 1998-11-11 | 2001-02-23 | Falorni Italia Farmaceutici S | Acidi ialuronici reticolati e loro usi medici. |
| DE60036915T2 (de) * | 1999-01-13 | 2008-08-07 | Alchemia Oncology Pty Ltd., Hawthorn | Verwendung von hyaluronan zur herstellung eines medikaments zur erhöhung der wirksamkeit von zytotoxischen arzneimitteln |
| ATE216998T1 (de) * | 1999-03-09 | 2002-05-15 | Sigma Tau Ind Farmaceuti | Camptothecin-derivate mit antitumor-wirkung |
| IT1306643B1 (it) * | 1999-04-08 | 2001-10-02 | Fidia Advanced Biopolymers Srl | Processo per la preparazione dei composti autoreticolati dell'acidoialuronico e dei suoi derivati ottenibili mediante la tecnica |
| US9066919B2 (en) * | 2000-07-14 | 2015-06-30 | Alchemia Oncology Pty Limited | Hyaluronan as a chemo-sensitizer in the treatment of cancer |
| AUPQ879500A0 (en) * | 2000-07-14 | 2000-08-10 | Meditech Research Limited | Hyaluronan as cytotoxic agent, drug presensitizer and chemo-sensitizer in the treatment of disease |
| ATE312076T1 (de) * | 2001-02-22 | 2005-12-15 | Anika Therapeutics Inc | Thiol-modifizierte hyaluronan-derivate |
| CA2458856C (en) * | 2001-08-27 | 2011-02-15 | Meditech Research Limited | Improved therapeutic protocols |
| WO2006047744A2 (en) * | 2004-10-26 | 2006-05-04 | Agennix Incorporated | Compositions of lactoferrin related peptides and uses thereof |
| CA2616607C (en) * | 2005-07-27 | 2015-06-02 | Alchemia Oncology Pty Limited | Therapeutic protocols using hyaluronan |
| WO2007028196A1 (en) * | 2005-09-07 | 2007-03-15 | Alchemia Oncology Pty Limited | Therapeutic compositions comprising hyaluronan and therapeutic antibodies as well as methods of treatment |
-
2002
- 2002-08-27 CA CA2458856A patent/CA2458856C/en not_active Expired - Fee Related
- 2002-08-27 JP JP2003522577A patent/JP2005505540A/ja active Pending
- 2002-08-27 CN CNA028214358A patent/CN1578677A/zh active Pending
- 2002-08-27 US US10/479,934 patent/US20050042303A1/en not_active Abandoned
- 2002-08-27 EP EP02759888A patent/EP1427447A4/en not_active Withdrawn
- 2002-08-27 WO PCT/AU2002/001160 patent/WO2003018062A1/en active IP Right Grant
- 2002-08-27 MX MXPA04001828A patent/MXPA04001828A/es not_active Application Discontinuation
-
2009
- 2009-06-11 US US12/482,870 patent/US20090306012A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| JP2005505540A (ja) | 2005-02-24 |
| EP1427447A4 (en) | 2007-05-23 |
| US20090306012A1 (en) | 2009-12-10 |
| US20050042303A1 (en) | 2005-02-24 |
| EP1427447A1 (en) | 2004-06-16 |
| WO2003018062A1 (en) | 2003-03-06 |
| CA2458856C (en) | 2011-02-15 |
| CA2458856A1 (en) | 2003-03-06 |
| MXPA04001828A (es) | 2005-03-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1729012A (zh) | 预防和治疗实体瘤的组合物和方法 | |
| CN1273146C (zh) | 用于治疗肿瘤的组合物 | |
| CN1879607A (zh) | 一种含水溶性药物的海藻酸钠微球血管栓塞剂和制备及应用 | |
| CN1127984C (zh) | 含抗肿瘤药物和羟肟酸衍生物且具有抗肿瘤增强活性和/或副作用降低的药物组合物 | |
| CN1388760A (zh) | 在疾病治疗中作为胞毒剂,药物预致敏剂和化学致敏剂的透明质酸 | |
| CN1816617A (zh) | 贮藏肿瘤细胞的方法 | |
| CN1564678A (zh) | 类脂化糖胺聚糖颗粒及其在诊断和治疗用药物和基因传递中的应用 | |
| CN1578677A (zh) | 改良的治疗方案 | |
| CN1668325A (zh) | 乳铁蛋白在治疗恶性肿瘤及其它过度增生性疾病中的用途 | |
| CN1771954A (zh) | 长春瑞滨脂质微球注射液及其制备方法 | |
| CN1336828A (zh) | 增强药物功效的组合物和方法 | |
| CN1867252A (zh) | 多糖与用于癌症治疗的化疗剂的共同给药 | |
| CN1809385A (zh) | 聚乙二醇化渥曼青霉素轭合物 | |
| JP2022518142A (ja) | がんの処置方法 | |
| CN1713905A (zh) | 用于治疗骨髓增生异常综合征的选择性细胞因子抑制药 | |
| CN1816338A (zh) | 罗可嘌呤用于治疗淋巴细胞白血病的用途 | |
| CN1172668C (zh) | 白屈菜红碱在制备药物中的应用 | |
| CN1711099A (zh) | 具有抗肿瘤和抗毒活性的提取物 | |
| JP2024128909A (ja) | アズブジンを含む免疫調節剤組成物 | |
| CN1212122C (zh) | 三七总皂苷脂质体及其制剂 | |
| CN1889943A (zh) | 协同抗癌组合物 | |
| CN1942189A (zh) | 5,10-亚甲基四氢叶酸在癌症治疗中的用途 | |
| WO2010101257A1 (ja) | 白血病の再発抑制剤 | |
| CN1960747A (zh) | 用于抑制血管生成的乳清蛋白 | |
| CN1861075A (zh) | 水溶性17-烯丙氨基-17-脱甲氧基格尔德霉素注射用药物组合物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C02 | Deemed withdrawal of patent application after publication (patent law 2001) | ||
| WD01 | Invention patent application deemed withdrawn after publication |