CN1525864A - 具有免疫增强特性的粘蛋白肽 - Google Patents
具有免疫增强特性的粘蛋白肽 Download PDFInfo
- Publication number
- CN1525864A CN1525864A CNA028077784A CN02807778A CN1525864A CN 1525864 A CN1525864 A CN 1525864A CN A028077784 A CNA028077784 A CN A028077784A CN 02807778 A CN02807778 A CN 02807778A CN 1525864 A CN1525864 A CN 1525864A
- Authority
- CN
- China
- Prior art keywords
- cell
- peptide
- tumor
- sec
- polypeptide
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 108090000765 processed proteins & peptides Proteins 0.000 title claims abstract description 122
- 108010063954 Mucins Proteins 0.000 title description 10
- 102000015728 Mucins Human genes 0.000 title description 10
- 230000002766 immunoenhancing effect Effects 0.000 title 1
- 102000004196 processed proteins & peptides Human genes 0.000 claims abstract description 41
- 229920001184 polypeptide Polymers 0.000 claims abstract description 25
- 238000000034 method Methods 0.000 claims abstract description 19
- 229960005486 vaccine Drugs 0.000 claims abstract description 13
- 238000011282 treatment Methods 0.000 claims abstract description 10
- 241000124008 Mammalia Species 0.000 claims abstract 4
- 206010028980 Neoplasm Diseases 0.000 claims description 86
- 101001133056 Homo sapiens Mucin-1 Proteins 0.000 claims description 67
- 102100034256 Mucin-1 Human genes 0.000 claims description 67
- 239000000427 antigen Substances 0.000 claims description 33
- 108091007433 antigens Proteins 0.000 claims description 33
- 102000036639 antigens Human genes 0.000 claims description 33
- 108090000623 proteins and genes Proteins 0.000 claims description 16
- 241001597008 Nomeidae Species 0.000 claims description 15
- 108020004707 nucleic acids Proteins 0.000 claims description 14
- 102000039446 nucleic acids Human genes 0.000 claims description 14
- 150000007523 nucleic acids Chemical class 0.000 claims description 14
- 239000008194 pharmaceutical composition Substances 0.000 claims description 14
- 235000018102 proteins Nutrition 0.000 claims description 13
- 102000004169 proteins and genes Human genes 0.000 claims description 13
- 201000011510 cancer Diseases 0.000 claims description 8
- 125000000539 amino acid group Chemical group 0.000 claims description 6
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 4
- 230000000890 antigenic effect Effects 0.000 claims description 3
- 230000000295 complement effect Effects 0.000 claims description 3
- 230000002708 enhancing effect Effects 0.000 claims description 3
- 108010072866 Prostate-Specific Antigen Proteins 0.000 claims description 2
- 102000007066 Prostate-Specific Antigen Human genes 0.000 claims description 2
- 201000001441 melanoma Diseases 0.000 claims description 2
- 125000003275 alpha amino acid group Chemical group 0.000 claims 2
- 108060003552 hemocyanin Proteins 0.000 claims 1
- 239000000203 mixture Substances 0.000 abstract description 20
- 230000028993 immune response Effects 0.000 abstract description 6
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 abstract description 3
- 230000002265 prevention Effects 0.000 abstract description 3
- 201000010099 disease Diseases 0.000 abstract description 2
- 102000014914 Carrier Proteins Human genes 0.000 abstract 1
- 108010078791 Carrier Proteins Proteins 0.000 abstract 1
- 101100346929 Homo sapiens MUC1 gene Proteins 0.000 abstract 1
- 208000035475 disorder Diseases 0.000 abstract 1
- 102000057860 human MUC1 Human genes 0.000 abstract 1
- 230000002163 immunogen Effects 0.000 abstract 1
- 210000004027 cell Anatomy 0.000 description 128
- 238000001890 transfection Methods 0.000 description 42
- 210000004881 tumor cell Anatomy 0.000 description 39
- 241000699670 Mus sp. Species 0.000 description 30
- 238000011725 BALB/c mouse Methods 0.000 description 27
- 230000000694 effects Effects 0.000 description 24
- 230000003248 secreting effect Effects 0.000 description 24
- 230000036039 immunity Effects 0.000 description 18
- 208000026310 Breast neoplasm Diseases 0.000 description 17
- 241001465754 Metazoa Species 0.000 description 17
- 150000001413 amino acids Chemical class 0.000 description 17
- 206010006187 Breast cancer Diseases 0.000 description 16
- 230000012010 growth Effects 0.000 description 16
- 235000001014 amino acid Nutrition 0.000 description 15
- 210000004988 splenocyte Anatomy 0.000 description 14
- 239000002671 adjuvant Substances 0.000 description 12
- 241000699666 Mus <mouse, genus> Species 0.000 description 11
- 230000004044 response Effects 0.000 description 11
- 230000004936 stimulating effect Effects 0.000 description 11
- 230000004614 tumor growth Effects 0.000 description 11
- NHBKXEKEPDILRR-UHFFFAOYSA-N 2,3-bis(butanoylsulfanyl)propyl butanoate Chemical compound CCCC(=O)OCC(SC(=O)CCC)CSC(=O)CCC NHBKXEKEPDILRR-UHFFFAOYSA-N 0.000 description 10
- 229930193140 Neomycin Natural products 0.000 description 10
- 230000003013 cytotoxicity Effects 0.000 description 10
- 231100000135 cytotoxicity Toxicity 0.000 description 10
- 229960004927 neomycin Drugs 0.000 description 10
- 238000012360 testing method Methods 0.000 description 10
- 108020004414 DNA Proteins 0.000 description 8
- 238000011081 inoculation Methods 0.000 description 8
- 238000002360 preparation method Methods 0.000 description 8
- 101000981253 Mus musculus GPI-linked NAD(P)(+)-arginine ADP-ribosyltransferase 1 Proteins 0.000 description 7
- 238000006243 chemical reaction Methods 0.000 description 7
- 230000008878 coupling Effects 0.000 description 7
- 238000010168 coupling process Methods 0.000 description 7
- 238000005859 coupling reaction Methods 0.000 description 7
- 239000012636 effector Substances 0.000 description 7
- 238000002474 experimental method Methods 0.000 description 7
- 230000002519 immonomodulatory effect Effects 0.000 description 7
- 238000002347 injection Methods 0.000 description 7
- 239000007924 injection Substances 0.000 description 7
- 239000000463 material Substances 0.000 description 7
- 230000001681 protective effect Effects 0.000 description 7
- 238000011160 research Methods 0.000 description 7
- 230000001472 cytotoxic effect Effects 0.000 description 6
- 238000001727 in vivo Methods 0.000 description 6
- 210000004698 lymphocyte Anatomy 0.000 description 6
- 244000005700 microbiome Species 0.000 description 6
- 238000011729 BALB/c nude mouse Methods 0.000 description 5
- DJZCTUVALDDONK-HQMSUKCRSA-N concanamycin A Chemical compound O1C(=O)\C(OC)=C\C(\C)=C\[C@@H](C)[C@@H](O)[C@@H](CC)[C@@H](O)[C@H](C)C\C(C)=C\C=C\[C@H](OC)[C@H]1[C@@H](C)[C@@H](O)[C@H](C)[C@]1(O)O[C@H](\C=C\C)[C@@H](C)[C@H](O[C@@H]2O[C@H](C)[C@@H](OC(N)=O)[C@H](O)C2)C1 DJZCTUVALDDONK-HQMSUKCRSA-N 0.000 description 5
- DJZCTUVALDDONK-UHFFFAOYSA-N concanamycin A Natural products O1C(=O)C(OC)=CC(C)=CC(C)C(O)C(CC)C(O)C(C)CC(C)=CC=CC(OC)C1C(C)C(O)C(C)C1(O)OC(C=CC)C(C)C(OC2OC(C)C(OC(N)=O)C(O)C2)C1 DJZCTUVALDDONK-UHFFFAOYSA-N 0.000 description 5
- 231100000433 cytotoxic Toxicity 0.000 description 5
- 229960001438 immunostimulant agent Drugs 0.000 description 5
- 239000003022 immunostimulating agent Substances 0.000 description 5
- 230000003308 immunostimulating effect Effects 0.000 description 5
- 208000008798 osteoma Diseases 0.000 description 5
- 108091033319 polynucleotide Proteins 0.000 description 5
- 102000040430 polynucleotide Human genes 0.000 description 5
- 239000002157 polynucleotide Substances 0.000 description 5
- 241000699660 Mus musculus Species 0.000 description 4
- 102000004503 Perforin Human genes 0.000 description 4
- 108010056995 Perforin Proteins 0.000 description 4
- KHGNFPUMBJSZSM-UHFFFAOYSA-N Perforine Natural products COC1=C2CCC(O)C(CCC(C)(C)O)(OC)C2=NC2=C1C=CO2 KHGNFPUMBJSZSM-UHFFFAOYSA-N 0.000 description 4
- 241000700605 Viruses Species 0.000 description 4
- 238000000338 in vitro Methods 0.000 description 4
- 230000005764 inhibitory process Effects 0.000 description 4
- 210000003360 nephrocyte Anatomy 0.000 description 4
- 238000011580 nude mouse model Methods 0.000 description 4
- 229930192851 perforin Natural products 0.000 description 4
- 108020004635 Complementary DNA Proteins 0.000 description 3
- 108090000790 Enzymes Proteins 0.000 description 3
- 102000004190 Enzymes Human genes 0.000 description 3
- 208000006265 Renal cell carcinoma Diseases 0.000 description 3
- 210000001744 T-lymphocyte Anatomy 0.000 description 3
- 230000000844 anti-bacterial effect Effects 0.000 description 3
- 238000003556 assay Methods 0.000 description 3
- 238000012512 characterization method Methods 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 239000013604 expression vector Substances 0.000 description 3
- 238000013467 fragmentation Methods 0.000 description 3
- 238000006062 fragmentation reaction Methods 0.000 description 3
- 239000001963 growth medium Substances 0.000 description 3
- 230000003053 immunization Effects 0.000 description 3
- 238000002649 immunization Methods 0.000 description 3
- 239000007943 implant Substances 0.000 description 3
- 208000020816 lung neoplasm Diseases 0.000 description 3
- 238000002156 mixing Methods 0.000 description 3
- 239000013612 plasmid Substances 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 230000004083 survival effect Effects 0.000 description 3
- 238000002255 vaccination Methods 0.000 description 3
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 2
- 241000271566 Aves Species 0.000 description 2
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 2
- 102000004127 Cytokines Human genes 0.000 description 2
- 108090000695 Cytokines Proteins 0.000 description 2
- 108010039471 Fas Ligand Protein Proteins 0.000 description 2
- 241000287828 Gallus gallus Species 0.000 description 2
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 2
- 101150114927 MUC1 gene Proteins 0.000 description 2
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 2
- 108010029485 Protein Isoforms Proteins 0.000 description 2
- 102000001708 Protein Isoforms Human genes 0.000 description 2
- 241000580858 Simian-Human immunodeficiency virus Species 0.000 description 2
- 102100031988 Tumor necrosis factor ligand superfamily member 6 Human genes 0.000 description 2
- 208000009956 adenocarcinoma Diseases 0.000 description 2
- 230000000735 allogeneic effect Effects 0.000 description 2
- 229940022399 cancer vaccine Drugs 0.000 description 2
- 239000011651 chromium Substances 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 230000001276 controlling effect Effects 0.000 description 2
- 210000000805 cytoplasm Anatomy 0.000 description 2
- 230000003111 delayed effect Effects 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 239000013613 expression plasmid Substances 0.000 description 2
- 239000012634 fragment Substances 0.000 description 2
- 230000007365 immunoregulation Effects 0.000 description 2
- 230000004957 immunoregulator effect Effects 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- 239000003112 inhibitor Substances 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- 108010045069 keyhole-limpet hemocyanin Proteins 0.000 description 2
- 238000002372 labelling Methods 0.000 description 2
- 201000005202 lung cancer Diseases 0.000 description 2
- 230000002101 lytic effect Effects 0.000 description 2
- FSQQTNAZHBEJLS-UPHRSURJSA-N maleamic acid Chemical compound NC(=O)\C=C/C(O)=O FSQQTNAZHBEJLS-UPHRSURJSA-N 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 239000002773 nucleotide Substances 0.000 description 2
- 125000003729 nucleotide group Chemical group 0.000 description 2
- 239000013641 positive control Substances 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 230000009257 reactivity Effects 0.000 description 2
- 230000003252 repetitive effect Effects 0.000 description 2
- 230000028327 secretion Effects 0.000 description 2
- DAEPDZWVDSPTHF-UHFFFAOYSA-M sodium pyruvate Chemical compound [Na+].CC(=O)C([O-])=O DAEPDZWVDSPTHF-UHFFFAOYSA-M 0.000 description 2
- 239000000243 solution Substances 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- YNZXLMPHTZVKJN-VBKCWIKWSA-N (3z,5e,7r,8r,9s,10s,11r,13e,15e,17s,18r)-18-[(2s,3r,4s)-4-[(2r,4r,5s,6r)-2,4-dihydroxy-5-methyl-6-[(e)-prop-1-enyl]oxan-2-yl]-3-hydroxypentan-2-yl]-9-ethyl-8,10-dihydroxy-3,17-dimethoxy-5,7,11,13-tetramethyl-1-oxacyclooctadeca-3,5,13,15-tetraen-2-one Chemical compound O1C(=O)\C(OC)=C\C(\C)=C\[C@@H](C)[C@@H](O)[C@@H](CC)[C@@H](O)[C@H](C)C\C(C)=C\C=C\[C@H](OC)[C@H]1[C@@H](C)[C@@H](O)[C@H](C)[C@]1(O)O[C@H](\C=C\C)[C@@H](C)[C@H](O)C1 YNZXLMPHTZVKJN-VBKCWIKWSA-N 0.000 description 1
- 241000251468 Actinopterygii Species 0.000 description 1
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 1
- 208000035143 Bacterial infection Diseases 0.000 description 1
- 208000003174 Brain Neoplasms Diseases 0.000 description 1
- 201000009030 Carcinoma Diseases 0.000 description 1
- 231100000023 Cell-mediated cytotoxicity Toxicity 0.000 description 1
- 206010057250 Cell-mediated cytotoxicity Diseases 0.000 description 1
- 102100025064 Cellular tumor antigen p53 Human genes 0.000 description 1
- 241001529572 Chaceon affinis Species 0.000 description 1
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 1
- 238000002965 ELISA Methods 0.000 description 1
- 241000244160 Echinococcus Species 0.000 description 1
- 201000009051 Embryonal Carcinoma Diseases 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- 102000005720 Glutathione transferase Human genes 0.000 description 1
- 108010070675 Glutathione transferase Proteins 0.000 description 1
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 1
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 1
- 241000711549 Hepacivirus C Species 0.000 description 1
- 208000005176 Hepatitis C Diseases 0.000 description 1
- 101000721661 Homo sapiens Cellular tumor antigen p53 Proteins 0.000 description 1
- 101000911390 Homo sapiens Coagulation factor VIII Proteins 0.000 description 1
- 241000714260 Human T-lymphotropic virus 1 Species 0.000 description 1
- 206010061598 Immunodeficiency Diseases 0.000 description 1
- 208000029462 Immunodeficiency disease Diseases 0.000 description 1
- 108010002350 Interleukin-2 Proteins 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- 229930182816 L-glutamine Natural products 0.000 description 1
- 239000012480 LAL reagent Substances 0.000 description 1
- 206010025323 Lymphomas Diseases 0.000 description 1
- 229930192392 Mitomycin Natural products 0.000 description 1
- 241000699729 Muridae Species 0.000 description 1
- 241000186362 Mycobacterium leprae Species 0.000 description 1
- 101100211688 Mycobacterium leprae (strain TN) ML0287 gene Proteins 0.000 description 1
- 108091034117 Oligonucleotide Proteins 0.000 description 1
- 241001631646 Papillomaviridae Species 0.000 description 1
- 229930182555 Penicillin Natural products 0.000 description 1
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 1
- 108010076504 Protein Sorting Signals Proteins 0.000 description 1
- 239000012980 RPMI-1640 medium Substances 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 206010039491 Sarcoma Diseases 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- 241000973887 Takayama Species 0.000 description 1
- 108020005038 Terminator Codon Proteins 0.000 description 1
- 241000209140 Triticum Species 0.000 description 1
- 235000021307 Triticum Nutrition 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 208000022362 bacterial infectious disease Diseases 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 210000003969 blast cell Anatomy 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- 230000000981 bystander Effects 0.000 description 1
- 238000009566 cancer vaccine Methods 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 230000020411 cell activation Effects 0.000 description 1
- 230000005890 cell-mediated cytotoxicity Effects 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 229910052804 chromium Inorganic materials 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 229930184793 concanamycin Natural products 0.000 description 1
- 239000012228 culture supernatant Substances 0.000 description 1
- 229960004397 cyclophosphamide Drugs 0.000 description 1
- FHIVAFMUCKRCQO-UHFFFAOYSA-N diazinon Chemical compound CCOP(=S)(OCC)OC1=CC(C)=NC(C(C)C)=N1 FHIVAFMUCKRCQO-UHFFFAOYSA-N 0.000 description 1
- 229960003983 diphtheria toxoid Drugs 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 239000002158 endotoxin Substances 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 239000003797 essential amino acid Substances 0.000 description 1
- 235000020776 essential amino acid Nutrition 0.000 description 1
- 150000002270 gangliosides Chemical class 0.000 description 1
- 238000003306 harvesting Methods 0.000 description 1
- 230000023597 hemostasis Effects 0.000 description 1
- 208000002672 hepatitis B Diseases 0.000 description 1
- 102000057593 human F8 Human genes 0.000 description 1
- 235000020256 human milk Nutrition 0.000 description 1
- 210000004251 human milk Anatomy 0.000 description 1
- 238000009396 hybridization Methods 0.000 description 1
- 210000002865 immune cell Anatomy 0.000 description 1
- 239000012642 immune effector Substances 0.000 description 1
- 230000007813 immunodeficiency Effects 0.000 description 1
- 229940121354 immunomodulator Drugs 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 230000001524 infective effect Effects 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 230000001665 lethal effect Effects 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 231100000053 low toxicity Toxicity 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 208000037841 lung tumor Diseases 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 230000013011 mating Effects 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 239000003226 mitogen Substances 0.000 description 1
- 229960004857 mitomycin Drugs 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 210000000822 natural killer cell Anatomy 0.000 description 1
- 230000017066 negative regulation of growth Effects 0.000 description 1
- 238000010606 normalization Methods 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 229940049954 penicillin Drugs 0.000 description 1
- 229940023041 peptide vaccine Drugs 0.000 description 1
- 239000002574 poison Substances 0.000 description 1
- 231100000614 poison Toxicity 0.000 description 1
- 230000008092 positive effect Effects 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 239000002423 protozoacide Substances 0.000 description 1
- 208000008128 pulmonary tuberculosis Diseases 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 238000010188 recombinant method Methods 0.000 description 1
- 229940047431 recombinate Drugs 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 230000008521 reorganization Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 238000004088 simulation Methods 0.000 description 1
- 229940054269 sodium pyruvate Drugs 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 238000003153 stable transfection Methods 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 238000012916 structural analysis Methods 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 229960000814 tetanus toxoid Drugs 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 231100000167 toxic agent Toxicity 0.000 description 1
- 239000003440 toxic substance Substances 0.000 description 1
- 238000013519 translation Methods 0.000 description 1
- 201000008827 tuberculosis Diseases 0.000 description 1
- 230000005748 tumor development Effects 0.000 description 1
- 239000012646 vaccine adjuvant Substances 0.000 description 1
- 229940124931 vaccine adjuvant Drugs 0.000 description 1
- 210000003934 vacuole Anatomy 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- C07K14/4701—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals not used
- C07K14/4727—Mucins, e.g. human intestinal mucin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001169—Tumor associated carbohydrates
- A61K39/00117—Mucins, e.g. MUC-1
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/39—Medicinal preparations containing antigens or antibodies characterised by the immunostimulating additives, e.g. chemical adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55516—Proteins; Peptides
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Immunology (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Organic Chemistry (AREA)
- Epidemiology (AREA)
- General Chemical & Material Sciences (AREA)
- Mycology (AREA)
- Microbiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Molecular Biology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Oncology (AREA)
- Engineering & Computer Science (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Gastroenterology & Hepatology (AREA)
- Genetics & Genomics (AREA)
- Zoology (AREA)
- Toxicology (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
Abstract
一种包含序列VSIGLSFPMLP(SEQ ID NO:1)的分离肽或多肽,其在人的分泌型MUCl中被发现,当被施用于哺乳动物时,能增强免疫应答,以及包含该肽的组合物,产生该肽的宿主细胞及使用方法。该肽或多肽可以与载体蛋白偶联并作为疫苗或免疫性组合物的一部分使用来预防或治疗疾病或机能紊乱。
Description
技术领域
本发明涉及具有免疫增强特性的粘蛋白肽(mucin peptide),包含该肽的药物组合物,以及治疗或预防癌症的方法。
背景技术
MUC1基因在正常的上皮细胞和多种人类癌症中被表达,在乳腺肿瘤中所表达的水平非常高(1)。这种基因的主要产物是一种多态型1跨膜分子,其包含有一个大的,多糖基化的细胞外区域,一个跨膜区和一个含72个氨基酸的细胞质尾巴(2)。
这种多态性主要来自于存在于细胞外区域的20个氨基酸串联重复单元的数目变化。已发现一种分泌型MUC1同种型(isoform)(MUC1/sec)(3),其包括内含子2的序列,并在内含子的中止密码子处永久性终止,因此可缺少跨膜区。
MUC1及其片段和衍生物已经被广泛地用于抗癌疫苗和癌症治疗的研究中。U.S.Pat.No.6,344,203公开了模拟MUC1的肽及将其结合到IB4植物血凝素和抗-Gal.alpha.(1,3)Gal抗体中,以用于癌症疫苗中。这些肽偶联到蛋白质载体,如破伤风类毒素,白喉类毒素或氧化的KLH上,用以刺激T细胞。
U.S.Pat.No.5,827,666公开了一种合成的MUC1肽,它包括MUC1的20-氨基酸串联的至少两个重复,其能够在没有糖基化的情况下,获得其天然结构。表明该合成肽可被用于包括抗原决定基的氨基酸序列的疫苗及其它物质中。U.S.Pat.No.5,989,552公开了一种MUC1多肽或其串联重复和氧化的甘露聚糖的偶联物被用于免疫治疗中。
U.S.Pat.No.6,080,725公开了皂甙类似物佐剂可与MUC1及其肽片段用于疫苗中,该MUC1及其肽片段作为肿瘤相关抗原。
公开的U.S.专利申请20020009759,200020012931,20020022235和20010051351中描述了MUC1被用作癌症细胞的决定簇或标记物。
在上述公开物中,MUC1及其片段和模拟物被用作或被认为是肿瘤相关抗原而被用于疫苗或免疫组合物中,或被用作诊断测试的标记物。
本发明的意料之外的发现是,一种不同的MUC1分泌的同种型具有佐剂的性质,并因此具有与抗原不同的免疫增强性质。
发明概述
一种含有氨基酸序列VSIGLSFPMLP(SEQ ID NO:1)的肽及其类似物和衍生物,表现出在体内的免疫调节活性。这样的肽和编码它们的核酸(如,RNA,DNA)可被用作佐剂来刺激或增强动物或人体内的免疫应答,可通过本领域已知的体液或细胞内的标准检测。例如,可使抗体的产生得到增强,可溶性免疫调节子(如,细胞因子)的分泌,抗原的呈递、效应细胞产生或发挥功能(如,细胞毒性),以及其它已知的免疫反应方法、或其结合来显示功效。尤其是,肽或核酸可被用作疫苗佐剂来增强体内免疫反应,以诱导体内和/或体外细胞因子的生成,作为一个或多个细胞亚群的促细胞分裂剂,或增强细胞毒性。本发明的一个目的就是提供一种新型的免疫调节和增强分子。
为了刺激或增强一种抗原特异性的免疫反应,该肽可与抗原(如,一种肿瘤抗原或一种来源于传染性物质,如细菌、病毒、原生动物、真菌、霉菌或酵母菌的抗原)一起混合到疫苗制剂中或被偶联到抗原上应用。核酸可以与抗原和/或编码抗原的表达载体一起整合至基因疫苗的制剂中;或一种编码VSIGLSFPMLP(SEQ ID NO:1)的核苷酸序列,或其类似物或衍生物也包含在与编码抗原的一个区域相接合的或与该区域显著不同的表达载体上。该疫苗制剂的成分还包含诸如其它佐剂和/或细胞因子。因此,组合物可被混合至细胞内的,无细胞的,分次或纯化的,重组的、基于蛋白质的、或“裸露的DNA”疫苗中。
可以治疗的肿瘤类型包括,但不限于,肉瘤和癌。例如,癌症如白血病、淋巴瘤、或脑癌都可以被治疗。通常,本发明可使任何基于抗体或其它的免疫治疗得以增强。
本发明提供了有效的和低毒的佐剂替代物来增强免疫应答。它是在能够满足医用或兽医治疗为目的的生物品的标准条件下制备的,并与用于治疗和预防的制剂是生物相容的。
本发明所用的术语“肽”“多肽”和“蛋白质”可以相互转变,每一种都指天然存在的氨基酸的序列。通常,“肽”是指少于20个氨基酸残基的序列,“多肽”是指20个或更多个氨基酸残基的序列,本发明所用的多肽也包括蛋白质。优选地,本发明的肽、多肽或蛋白质包含11至200个氨基酸残基,更优选为11至100个残基,再更优选为11至50个残基,最优选为11,12,13,14,15,16,17,18,19或20个残基。
如本发明所用,术语“分离”是指物质从其原始的环境中被取出(如,天然存在的物质从其自然环境中被取出)。这样的物质能作为载体的部分或作为一种组合物,或能在细胞内获得,如果上述载体、组合物或细胞不是物质的原始环境。
本发明的一个目的是提供一种被分离肽,多肽或蛋白质,它包含氨基酸序列VSIGLSFPMLP(SEQ ID NO:1),或其类似物或衍生物。本发明的肽具有免疫增强特性并能够用于药物组合物和疫苗中。
本发明使用的术语“类似物”是指具有相同或相似功能性质(即,产生免疫调节作用)的序列变体。这样的变体可以具有一个或几个(2-3)替代的氨基酸残基,优选为保守性替代,以使变体保持“母体化合物”的免疫调节特性。
本发明使用的“衍生物”是指一种肽、多肽或蛋白质,它包含添加了至少了一个附加基团而修饰的序列VSIGLSFPMLP(SEQ ID NO:1),并仍保持母体化合物的免疫调节能力的特性。在一个优选的实施例中,衍生物包括一个KLH分子,其上偶联了多拷贝的本发明的肽。该衍生物也可以是连接了本发明的肽、多肽、或蛋白质的抗原。衍生物的其他实例包括,但不限于,偶联了多拷贝的肽的OVA和BSA。该肽也可以纯品形式使用。本发明的肽、多肽或蛋白质可以以常规的化学合成或DNA重组技术的方法制备。例如,将编码多肽的DNA片段转化至宿主微生物中,然后从培养物中收集多肽。宿主微生物可以是,如细菌、酵母菌、病毒的载体或哺乳动物细胞,其中所述的DNA片段被整合到宿主微生物的基因组中,或被插入至合适的表达载体中通过宿主微生物复制。将DNA片段放置在由含有合适的转录和翻译信号的区域所控制的位置。多肽的制备采用本领域技术人员所熟悉的方法。
本发明的另一个目的是提供一种核酸,该核酸编码本发明的肽、多肽或蛋白质,或其衍生物或类似物。本发明的核酸可以重组地、合成地或通过任何本领域技术人员可获得的方法制备,并可以利用本领域已知的技术被克隆。在这个方面,本发明也包括一种包含本发明核酸的载体,和一种包括本发明核酸的宿主细胞。
本发明使用的术语“核酸”,“寡核苷酸”和“多核苷酸”包括RNA,DNA,或RAN/DNA杂交序列,并且它们在其中一个单链或双链上具有一个以上的核苷酸,这些术语可以相互转换使用。
本发明使用的术语“互补”或“其互补体”是指多核苷酸序列,其在整个互补区能形成与另一个特定的多核苷酸配对的Watson & Crick碱基。该术语用于仅根据其序列的多核苷酸对,而不是指任何特定条件下两个多核苷酸都能够结合的情况。
本发明还包括一种免疫性的药物组合物,其包括本发明的肽或多肽,或其类似物或衍生物,以及可药用的赋型剂或载体。在一个优选实施例中,药物组合物包括至少一种抗原,优选为肿瘤抗原。肿瘤抗原包括,如自体肿瘤细胞、同种异体肿瘤细胞、神经节糖苷、胚胎性癌抗原、前列腺特异性抗原、黑素瘤相关的抗原和p53以及其它本领域技术人员熟知的肿瘤抗原。其它可用于本发明的抗原包括病毒抗原,如来源于乳头状瘤病毒、B型和C型肝炎病毒、HIV和HTLV-1以及细菌及其它感染性微生物如M.Tuberculosis的抗原。
本发明还包括一种疫苗,和一种诱导或加强免疫应答的方法。在一个优选实施例中,疫苗包括一种本发明的免疫调节肽或多肽,或其类似物或衍生物,一种抗原、一种药学可接受的赋型剂或载体。在一个尤其优选的实施方案中,抗原为肿瘤抗原。
疫苗的制备方法是本领域技术人员所熟知的并被广泛描述在技术文献中(见,例如,Remington’s Pharmaceutical Sciences,17th ed.,Mack PublishingCo.,Easton,Pa.,USA)。
本发明的免疫性药物组合物或疫苗也可包括一种或多种附加的佐剂,如BCG,KLH,IL-2,GM-CSF和环磷酰胺(cytoxan),其可选择性地与本发明的免疫调节肽或多肽相连接。在一个优选实施例中,本发明的免疫调节肽与马来酰胺活化的KLH偶联。依据与肽结合的佐剂采用一些本领域已知的连接键。通常的形式有R-HNCO-X或R-HCNO-X,其中R=佐剂,X=肽。
本发明的又一个目的是提供一种预防或治疗疾病或失调的方法,其是通过施用安全且有效剂量的本发明的疫苗或药物组合物而进行的。本发明的药物组合物和疫苗的安全且有效的剂量可以通过本领域技术人员经适当的实验而确定。安全和有效的剂量被认为是在受试体使用该剂量可以产生有益的免疫应答效果,并且不会产生本领域技术人员不可接受的副作用的剂量。可以领会到,任何这样的副作用一定会与本发明的治疗疗效,可选择的治疗方法,和其它本领域技术人员熟悉的因素相抵消。在一个优选实施例中,本发明提供了一种预防或治疗肿瘤尤其是癌性瘤的方法。
附图说明
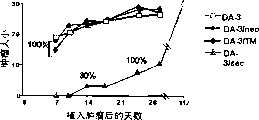
图1在注入106未转染的DA-3乳腺肿瘤细胞,或只用新霉素载体转染的DA-3细胞(DA-3/neo),或用跨膜MUC1同种型转染的DA-3细胞(DA-3/TM),或用分泌型MUC1同种型转染的DA-3细胞(DA-3/sec)后,纯系BALB/c小鼠的存活率。
图2未转染的DA-3乳腺肿瘤细胞或只用新霉素载体转染的DA-3细胞(DA-3/neo),或用跨膜MUC1同种型转染的DA-3细胞(DA-3/TM),或用分泌型MUC1同种型转染的DA-3细胞(DA-3/sec)的体外生长动力学特征。
图3注入106未转染的DA-3乳腺肿瘤细胞(DA-3/neo),或只用新霉素载体转染的DA-3细胞(DA-3/neo),或用跨膜MUC1同种型转染的DA-3细胞(DA-3/TM),或用分泌型MUC1同种型转染的DA-3细胞(DA-3/sec)后,BALB/c(nu+nu+)小鼠中的肿瘤生长。
图4接种106未转染的DA-3乳腺肿瘤细胞(DA-3/neo),或只用新霉素载体转染的DA-3细胞(DA-3/neo),或用跨膜MUC1同种型转染的DA-3细胞(DA-3/TM),或用分泌型MUC1同种型的三个单独的转染子转染的DA-3细胞(DA-3/sec)接种后,BALB/c裸鼠中的肿瘤生长。
图5用分泌型MUC1同种型转染的DA-3细胞(DA-3/sec)接种,对于跨膜MUC1同种型转染的DA-3细胞(DA-3/TM)和DA-3/sec细胞的混合物在BALB/c小鼠中生长的作用。
图6接种分泌型MUC1同种型转染的DA-3细胞(DA-3/sec)对于新霉素载体转染的DA-3细胞(DA-3/neo)和DA-3/sec细胞的混合物在BALB/c小鼠中生长的作用。
图7接种分泌型MUC1同种型转染的DA-3乳腺肿瘤细胞(DA-3/sec)对于RENCA肾细胞癌和DA-3/sec细胞的混合物在BALB/c小鼠中生长的作用。
图8接种分泌型MUC1同种型转染的DA-3乳腺肿瘤细胞(DA-3/sec)对于K7骨瘤细胞和DA-3/sec乳腺肿瘤细胞的混合物在BALB/c小鼠中生长的作用。
图9人跨膜MUC1(MUC1/TM)和人分泌MUC1(MUC1/sec)同种型的cDNAs示意图。
图10肽免疫。用分泌型的人MUC1同种型的独特的11个氨基酸肽与KLH的偶联物来接种,它对偶联独特肽的KLH与只用新霉素载体转染的DA-3细胞(DA-3/neo)或跨膜MUC1同种型(DA-3/TM)转染的DA-3细胞的混合物的生长作用。
图11A和11B用分泌型的人MUC1同种型的独特的氨基酸肽与KLH的偶联物来接种,对于偶联独特氨基酸肽的KLH和BALB/c小鼠中的RENCA肿瘤细胞(11A)或C57/BL6小鼠中Lewis肺癌细胞(11B)的混合物的生长作用。该图表明MUC1/sec肽的免疫接种效果不受菌株限制。
图12施用含有较低数量的可产生抗体的抗原细胞(DA-3/TM)和DA-3/sec细胞的混合物对于肿瘤生长的影响。该图显示了在没有接种疫苗时,较低数量的可产生抗体的抗原细胞能够产生有效的保护作用。
图13注射DA-3/sec的小鼠脾细胞对于DA-3肿瘤靶细胞的细胞毒活性。
图14穿孔素抑制剂concanamycin A对于DA-3/sec脾细胞的细胞毒性作用。该图显示了穿孔素通过活化的脾细胞介导DA-3/sec肿瘤细胞的溶解。
图15抗-Fas抗体作用于DA-3/sec活化的脾细胞相对于DA-3/sec靶体和阳性对照的细胞毒性效果。该图显示Fas/FasL在DA-3/sec的细胞毒性中不起作用。
图16体内注入DA-3/sec对抑制YAC-1靶体的典型NK活性的影响。该图显示了体内注入DA-3/sec导致更强的抑制YAC-1靶体的典型NK活性。
图17A和17B。MUC1/sec肽对于体外(17A)和体内(17B)含有的D1-DMBA-3肿瘤的免疫应答的影响。该图显示了MUC1/sec肽刺激了含有D1-DMBA-3肿瘤的免疫应答。
图18A和18B。含有和不含MUC1/sec肽的正常BALB/c肾细胞对于YAC-1(18A)和EL-4(18B)靶细胞的影响。该图显示了MUC1/sec肽活化正常的BALB/c肾细胞而杀死多种靶体。
图19A和19B。含有和不含MUC1/sec肽的不同种类小鼠的正常肾细胞对于DA-3/sec肿瘤细胞的溶解作用。该图显示了在MUC1/sec肽存在时,正常的肾细胞能杀死DA-3/sec肿瘤细胞。
发明详述
为了用一种确定的肿瘤抗原研究乳腺肿瘤的免疫应答,将跨膜MUC1同种型(DA-3/TM)、分泌型(DA-3/sec),或单独的新酶素载体(DA-3/neo)转染至DA-3细胞中,该细胞是导致转移损害以及BALB/c小鼠宿主死亡的乳腺肿瘤细胞系。MUC1分泌型的转染使DA-3细胞不能在纯系BALB/c小鼠中生长,但是能在BALB/c裸鼠中生长。用DA-3/sec细胞进行免疫接种可以激发对DA-3/TM或DA-3/neo细胞的免疫应答,而且抑制BALB/c的同源小鼠中的两种不相关的肿瘤。结果显示在分泌型MUC1同种型中存在一种独特的11个氨基酸的肽,其具有保护作用并可用作免疫增强分子。
材料和方法
小鼠和肿瘤。纯系BALB/c小鼠在University of Miami School of Medicine的实验室通过兄弟-姐妹交配的方法繁衍。BALB/c un+/nu+从Taconic Labs中购得。DA-3肿瘤细胞系是从BALB/c小鼠(4)同源的D1-DMBA-3体内的乳腺肿瘤中得到的。DA-3细胞在BALB/c小鼠体内产生肿瘤并引起肺部转移损伤。该细胞系在RPMI-1640培养基中培养,培养基还补充有5%FCS(胎牛血清)、100U青霉素、100μg/ml链霉素、5×10-5M 2-β-巯基乙醇(2-BME)、2mM L-谷胺酰胺、1%非必需氨基酸、1%必需氨基酸和1%丙酮酸钠(所有都来自GIBCO BRL,Gaithersburg,MD),并通过连续的传代延续。通过常规的鲎鱼阿米巴状细胞自溶(Limulus amebocyte lysate(Pyrogent R plus;Whittaker M.A.Bioproducts,Inc.,Walkersville,MD))方法测定这些细胞没有内毒素。
肽片段和抗体的制备。使用称为H23的单克隆抗体来检测MUC1/TM和MUC1/sec中都常见的串联重复序列。通过含有MUC1/sec的特定肽VSIGLSFMLP(SEQ ID NO:)与马来酰胺活化的钥孔虫戚血蓝蛋白(keyholelimpet hemocyanin,KLH)偶联来免疫鸡制得抗体1709(Aves Labs,Tigard,OR)。游离肽的浓度以及每分子KLH至少结合150个肽分子的偶联物被用于免疫中。免疫前IgY抗体是从免疫前的鸡蛋中制得的。
DA-3细胞的转染。表达MUC1同种型的稳定转染体是通过具有MUC1/TM或分泌型MUC1/sec cDNA的表达质粒与新霉素质粒(pSV2 neo)选择标记物共同转染至DA-3小鼠乳腺肿瘤细胞中而得到的。作为对照,用空质粒和选择耐受新霉素的质粒进行转染。
体内肿瘤的生长。清洗DA-3母细胞及新霉素对照和MUC1同种型转染的细胞,并计数,将106个细胞皮下注射(s.c.)至同源的BALB/c纯系小鼠或un+/nu+裸鼠中。每隔2-3天监控肿瘤的生长,当小鼠的肿瘤大小用标尺测量>10mm时,为肿瘤阳性。
疫苗免疫方案。用106个DA-3/sec肿瘤细胞的生理盐水溶液免疫BALB/c小鼠两次或三次,每次间隔两个星期。在最后一次免疫的两个星期后,用DA-3细胞对动物进行免疫激发,该DA-3细胞是未转染的或单独用新霉素载体转染或与MUC1跨膜同种型一起转染的细胞。在一些实验中,进行免疫激发的肿瘤是肾细胞瘤、RENCA或骨瘤K7。每次将106个肿瘤细胞与106个DA-3/sec细胞混合以激发免疫应答。
在其它研究中,存在于分泌型MUC1同种型中独特的11个氨基酸肽是由Aves Labs,Inc.(Tigard,OR)合成的,并偶联到KLH上。由于在每次合成中,肽和KLH的确切比率会不同,因而需要使制备规格化以使每次能以相同量施用。KLH肽作为疫苗时,间隔两个星期使用。第一次免疫BALB/c小鼠时,给予50μg肽和完全的福氏佐剂。两个星期后,给予25μg肽和不完全的福氏佐剂。两个星期后,用含有25μg肽且没有佐剂的106个DA-3c细胞或DA-3/neo细胞来激发小鼠产生免疫应答。
在所有的研究中,未免疫的小鼠给予和试验组相同的肿瘤激发,来作为对照。每两天或三天监控肿瘤生长并用标尺测量肿瘤大小。
实施例1
如材料和方法中所描述,将人MUC1的跨膜或分泌同种型转染至DA-3乳腺肿瘤细胞。用MUC1串联重复序列的特异性H23抗体对存在该序列的细胞进行染色以证明转染成功(5)。将得到的细胞系用于体内试验以确定在BALB/c小鼠中肿瘤的发生和时间。如表1所示,将DA-3,DA-3/neo和DA-3/TM乳腺肿瘤细胞植入小鼠中,可产生明显的肿瘤,肿瘤在7天和15天的大小基本相同,且所有动物都具有类似大小的肿瘤。
表1 BALB/c小鼠中肿瘤的发生和时间
| 肿瘤类型 | 肿瘤出现的天数 | ||||
| 7 | 15 | 25 | 37 | 12+月 | |
| DA-3 | 32/38 | 38/38 | |||
| DA-3/neo | 17/25 | 24/25 | 25/25 | ||
| DA-3/TM | 29/36 | 33/36 | 35/36 | 36/36 | |
| DA-3/sec | 0/70 | 0/70 | 1/70 | 1/70 | 1/70 |
令人惊异的是,用MUC1分泌型(DA-3/sec)转染的DA-3细胞不会导致肿瘤的发生。从图1可以明显的看出,这些动物甚至在植入该类细胞12个多月后仍没有肿瘤,而植入其它三种类型的DA-3细胞的动物都不能存活100天。应该指出的是,每次以高达1×107的浓度给小鼠植入DA-3/sec肿瘤细胞,都没有观察到肿瘤产生。
实施例2
这样结果的一个解释是转染过程选择性地减弱了DA-3/sec细胞的基本生长能力。为了检验这种可能,我们研究了DA-3肿瘤细胞的四种类型的体外生长特性。如图2所示,母细胞系和所有转染体的生长在体外都具有相似的动力学特征。事实上,DA-3/sec细胞似乎比其它细胞系繁殖得更好,显示了这些细胞体外生长能力并没有由于转染处理而被改变。
实施例3
为了确定DA-3/sec细胞在体内是否失去了产生肿瘤的能力,将四种DA-3细胞系都植入un+/nu+BALB/c小鼠中,测量肿瘤出现的几率和不同时间的肿瘤大小。图3显示了将DA-3,DA-3/neo,和DA-3/TM细胞植入BALB/c裸鼠7天后就导致产生明显的肿瘤,而且肿瘤的生长与在纯系BALB/c动物中生长的方式相似。与表1和图1的结果形成对比,DA-3/sec肿瘤细胞在14天时,使30%的裸鼠产生肿瘤,在25天时,使所有的动物都产生肿瘤。因此,在纯系BALB/c小鼠中植入DA-3/sec细胞而没有产生肿瘤,这似乎是免疫性原因而控制的结果。因为将这种肿瘤植入裸鼠中,尽管有些肿瘤出现的时间较晚,但它能导致100%的小鼠产生肿瘤。用带有分泌型MUC1的表达质粒分别转染其它两种DA-3肿瘤细胞,该肿瘤细胞重复了同样的结果。如表2所示,用MUC1/sec基因分别转染的那三种DA-3细胞都不能在纯系BALB/c小鼠中产生肿瘤。
表2不同的DA-3/sec转染体在BALB/c小鼠中产生肿瘤的几率
转染体 几率
DA-3/neo 6/6
DA-3/TM 6/6
DA-3/sec 0/6
DA-3/sec 11 0/14
DA-3/sec 22 0/11
图4显示了三种不同的DA-3/sec细胞转染体,即DA-3/sec,DA-3/secll,和DA-3/sec22,都能够在BALB/c裸鼠体内产生肿瘤,只是在免疫缺陷的小鼠中,其各自的生长动力学特征略有不同。有趣的是,当DA-3/sec肿瘤被植入至免疫纯系BALB/c小鼠中时,能够在BALB/c裸鼠中生长的DA-3/sec肿瘤却不生长了,但是当接种至其它BALB/c裸动物中时肿瘤仍然生长(数据没有显示)。这些实验结果提示了T细胞或至少是另一种非T细胞的效应细胞参与控制了用MUC1分泌型转染的肿瘤生长。
实施例4
我们评价了将DA-3/sec细胞植入BALB/c小鼠中是否能够提供对于其它表达MUC1的肿瘤细胞的保护作用。不表达粘蛋白的DA-3细胞(DA-3/neo)也包含在本研究中。在单独给予1×106的DA-3/TM细胞或DA-3/neo细胞,或与DA-3/sec细胞相混合进行免疫激发反应之前,实验组间隔1周接受两次或三次注射1×106的DA-3/sec细胞。作为对照,没有接种疫苗的动物用DA-3/neo或DA-3/TM细胞来激发免疫。接受两次未混合的DA-3/sec(106细胞)注射的动物,当仅用DA-3/TM细胞来激发免疫反应时,只是引起肿瘤出现的短时间的延迟,即13/22动物在两周时出现肿瘤,而对照组13/14动物在一周时出现肿瘤。在激发免疫应答之前接受了三次注射106DA-3/sec细胞的小鼠,与未接种的对照组相比,不仅异想不到地延迟了DA-3/TM细胞的生长,而且延迟了DA-3/neo细胞的生长。明显地,当用于激发的DA-3/TM肿瘤细胞在植入的时候就与DA-3/sec细胞混合(图5),与对照组相比,其不仅延迟了肿瘤出现的时间,而且产生了实质性保护,导致50%接种后的小鼠没有出现DA-3/TM肿瘤细胞的生长。此外,由于MUC1分子的识别,这种保护作用没有出现,因为在免疫接种DA-3/sec细胞并且用DA-3/neo和DA-3/sec乳腺肿瘤细胞混合物进行免疫激发的动物中能够看到类似的效果。
实施例5
除了在DA-3乳腺肿瘤的环境下的研究以外,本发明还进行了进一步的研究以确定接种DA-3/sec细胞是否能产生保护而不形成肿瘤。采用与BALB/c小鼠同源的两种不相关的肿瘤,即肾细胞瘤系RENCA,和骨瘤K7细胞系。图7显示了给BALB/c小鼠接种两次DA-3/sec细胞,随后用RENCA细胞和DA-3/sec细胞的混合物进行免疫激发,与未接种的对照组相比,其生长的肿瘤明显减小。因为未混合的RENCA细胞的生长并没有被减弱,因此在激发免疫应答时,加入DA-3/sec是必要的,这对于DA-3/TM和DA-3/neo细胞的试验也是同样。在采用k7骨瘤细胞的实验中可得相似的结果。如图8所示,植入K7和DA-3/sec混合物的小鼠中的80%未接种疫苗的小鼠,在免疫激发后的21天出现肿瘤。然而,接种两次106DA-3/sec乳腺肿瘤细胞的小鼠在免疫激发后延迟至40天才出现肿瘤,并能抑制肿瘤发展。确实,免疫激发后70天,少于50%的接种疫苗的小鼠具有肿瘤。
实施例6
关于分泌型MUC1可提供保护的原因,一种可能的线索可以从MUC1跨膜和分泌型同种型的结构分析中得到。图9是MUC1/TM和MUC1/sec同种型的cDNAs的示意图。CDNAs是从图左端5’末端开始描述的。串联重复排列由栅栏状(barred)区域描述,编码信号肽、跨膜区、和细胞质区的区域由SP,TM和CYT分别表示,两种类型具有相同的阴影。MUC1/sec同种型末端的氨基酸序列是VSIGLSFPMLP(3)。重要的是,对这11个氨基酸采用高度严格的BLASTP 1.4.11(6)分析,发现大约50%与人Ly49E配体相同,但不与任何已知的蛋白质序列相同。在较低严格度下,两种Echinococcus中的谷胱苷肽S-转移酶与分支杆菌属leprae的假设蛋白MLCB4.30以及两种植物种的EF hand蛋白有些相似。该肽的高度抗原性很可能由于其亲水性的原因。为了确定这种肽存在于分泌型MUC1同种型转染的DA-3细胞中,将针对独特的11个氨基酸肽的鸡IgY抗体偶联到KLH上。利用该试剂,用酶联法(ELISA)直接检测DA-3/sec培养物上清液中的肽。简单描述该方法,4℃下,将含有0.2-10.0μg蛋白质/ml的50μl涂覆缓冲液(coating buffer)或无血清培养物的组织培养上清液在培养板上放置过夜。加入封闭液在37℃放置1个小时,清洗培养板3次,将第一抗体孵育1个小时或过夜;清洗3次;如果需要,加入第二抗体,保持1个小时,清洗3次;加入显影溶液;孵育并读数。在所有测试中,用已知浓度的纯化的肽作阳性对照。所有测试的培养物对于该分子都呈阳性(数据未显示)。
实施例7
进行实验,来评价用这种肽接种可能产生的有益效果(图10)。无论佐剂是否存在,接受DA-3/TM或DA-3/neo细胞(106细胞)注射的对照小鼠都100%导致肿瘤生长。实验小鼠是在间隔8天接受具有佐剂的KLH-独特肽的偶联物两次注射。在第二次注射后的8天,用KLH结合肽和肿瘤细胞的混合物激发动物产生免疫应答。用肽和DA-3/TM细胞混合物激发免疫应答导致12只小鼠中有7只有肿瘤产生,还有一只在4个星期时产生肿瘤。用KLH结合肽和DA-3/neo细胞混合物激发接种后的小鼠产生免疫应答,能够对更多小鼠提供保护,只有40%的动物产生肿瘤,还有一只小鼠在一个月后才出现肿瘤。重要的是,存活的动物在用DA-3/TM或DA-3/neo细胞激发免疫应答后的6个月都没有肿瘤存在的迹象。
实施例8
在进一步的研究中,在其它两种肿瘤中评价接种肽疫苗的效果。从图11A可以看出,将RENCA细胞植入BALB/c小鼠时,只有很弱的保护作用并且使肿瘤的出现延后。重要的是,如图11B所示,将KLH与免疫增强肽的偶联物用于另一小鼠种(C57/BL6小鼠),并用攻击性很强的Lewis肺肿瘤进行免疫激发时,也观察到了保护作用。
实施例9
为了确定混合有DA-3/sec细胞的低数量的激发免疫应答细胞是否能够避免预先接种后者DA-3/sec细胞的必要性,其中该预先接种是为了抑制肿瘤生长,将5×105DA-3/TM细胞与等量的DA-3/sec细胞混合,注入小鼠中。如图12所示,在没有提前接种疫苗的情况下,这种治疗使60%小鼠的肿瘤生长得到了抑制。
实施例10
为了确定何种效应细胞参与抑制DA-3/sec肿瘤细胞生长,取两个星期前接种DA-3/sec肿瘤细胞的小鼠脾细胞,进行51Cr标记的细胞毒性测定。在丝裂霉素处理过的2×105-2×106个DA-3/sec细胞C(MMC)存在下,培养10×106个脾细胞5天。被DA-3/sec初次激活的脾细胞显示了很强的抑制DA-3/sec细胞的活性(图13)。被DA-3/sec初次激活的脾细胞对于DA-3/TM,DA-3/neo和DA-3靶体显示了低水平的抑制作用。这些结果显示了在DA-3/sec的刺激下,淋巴细胞在体外出现增长,且对DA-3/sec靶体具有有效的抑制功能。
实施例11
免疫系统的细胞具有多种杀伤机制,其包括Fas-Fas配体相互作用(7)和穿孔素-granzyme介导的杀伤(8)。被DA-3/sec初次激活的脾细胞用抗-Fas抗体或Concanamycin A(CMA)处理,CMA是一种液泡酸化抑制剂,其通过阻断H+ATP酶而阻滞穿孔素介导的杀伤(9)。CMA以剂量依赖方式有效地阻滞DA-3/sec靶体的杀伤(图14),然而当加入抗-Fas抗体时没有观察到细胞毒作用(图15)。上述结果表明Fas/FasL在DA-3/sec细胞的细胞毒性中不起作用,而是通过穿孔素-granzyme途径介导的。
实施例12
为了确定是否体内注入DA-3/sec细胞会导致更强的能抑制YAC-1靶细胞(一种典型的鼠科NK-靶细胞)的NK活性(10),在实验中,将正常的脾细胞与体内注入DA-3/sec细胞3-10天的脾细胞相比较,比较它们诱导溶解的能力。如图16所示,测试的3天前注射DA-3/sec细胞的BALB/c小鼠的脾细胞对YAC-1细胞的溶解活性水平比正常小鼠的略高一些。这种NK反应性被增强的现象在测试前10天就接种DA-3/sec细胞的小鼠中更明显。
实施例13
其它初步的研究提示了用人分泌型MUC1,而不是跨膜型转染的DA-3细胞,无论在体内还是体外,都会刺激效应细胞产生针对DA-3/sec细胞的反应。如上所述,在MUC1/sec蛋白的C-末端存在一独特的11个氨基酸肽,但在MUC1/TM蛋白质上没有该肽。根据这种肽制备了一种合成肽(称为“免疫增强肽”,或IEP),并用于免疫实验中,结果发现其具有抑制DA-3,DA-3/neo,DA-3/TM,K7骨瘤,RENCA和Lewis肺癌细胞的作用。我们研究了该肽对细胞毒反应的可能的效果。测试时,采用另一种肿瘤模型,即带有D1-DMBA-3乳腺肿瘤的小鼠。DA-3细胞系最初来自于这种肿瘤,该细胞在同源的BALB/c小鼠体内按常规方式在实验室传代。从图17可以看出,在正常小鼠的脾细胞或具有D1-DMBA-3肿瘤的小鼠脾细胞体外加入MUC1/sec独特的肽,5天后导致对DA-3/sec肿瘤靶体的显著细胞毒作用。重要的是,在接种疫苗的方案与上述方案类似的情况下,表现出明显的抑制D1-DMBA-3肿瘤生长的作用。在NK细胞中进行该肽刺激免疫细胞能力的测试。根据DA-3/sec肿瘤在裸鼠的最初生长阶段就被抑制的现象来选择测定方法,其提示了固有的免疫能力可能参与了抑制DA-3/sec的直接反应。因此,为了检测免疫增强肽(IEP)的免疫调节活性,BALB/c脾细胞用10μg IEP预处理30-45分钟,然后加入铬标记的YAC-1或EL-4靶体,进行如上所述的4-小时测试(11)。如图18所示,加入肽导致正常脾细胞抑制典型的鼠NK-靶细胞(YAC-1)的细胞毒水平的提高。而且,当将免疫增强肽注入对正常脾细胞的NK--型的细胞毒性不敏感的EL-4靶细胞后,该EL-4靶细胞易被这些效应器溶解。在其他的实验中,通过提前注入MUC1/sec独特的肽,我们也能够激活正常的BALB/c或C57BL(B6)小鼠中的脾效应细胞以杀伤DA-3/sec靶细胞(图19)。
实施例14
对于观察到的细胞毒性是由于肿瘤细胞上的独特11个氨基酸肽的直接毒性作用的结果是有争论的。为了检测这种可能性,我们将高水平的IEP加入到体外的几个肿瘤靶体中,培养4天后测定细胞的存活能力。如表3所示,用比体内细胞,或效应细胞介导的细胞毒性测定中所用的更高水平的肽进行处理,却没有导致对肿瘤细胞生长的抑制或对肿瘤细胞的杀伤作用。
表3 Sec肽对于体外肿瘤生长的作用
肿瘤细胞系 仅培养基 +KLH-Sec肽1
DA-3 3.7×106细胞2 3.5×106细胞
DA-3/neo 3.9×106细胞 4.0×106细胞
DA-3/TM 3.1×106细胞 3.0×106细胞
DA-3/sec 2.9×106细胞 3.1×106细胞
150μg/孔
2培养4天后的所有细胞
结论
本发明公开的数据表明用新型分泌型同种型MUC1基因(MUC1/sec)转染,能够预防BALB/C小鼠中已存在的进攻性强并可产生免疫力的肿瘤细胞系的生长。当将其用于接种方案中,能够以非特异性方式抑制同源肿瘤。存在于MUC1/sec分子中的一种独特的11个氨基酸肽与保护作用有关,当用于接种免疫的方案中时,它能有效抑制各种肿瘤细胞系。这些数据还提示了,由固有的和/或调节性免疫系统的效应器细胞产生的细胞毒性也与所观察的结果相关。由于该肽的作用不被限制于所指出的肿瘤类型或小鼠种类,它应该可以单独地和/或与其它免疫调节分子结合使用来抑制多种肿瘤。在注射了该肽的动物体内,没有检测到毒性反应。IEP的广谱作用使其不仅可用于抑制肿瘤,而且还可抑制病毒或细菌性疾病,如HIV,乙型肝炎和丙型肝炎,以及其它微生物引起的感染(如,肺结核),其中免疫应答的增强对受试体可能具有积极的作用。
在本发明描述的优选实施例中,为了描述清晰使用了特定的术语。然而,本发明并无意于使发明限制于所选择的特定术语。可以理解,每一个具体要素都包括可以相似方式操作以实现相似目的的所有技术的等效方式。
本发明详述部分举例说明并讨论的实施例只是希望给本领域技术人员提供发明人所知的最佳方式以实施和使用本发明,而不应该将其认为是对本发明范围的限制。根据本领域技术人员对于上述发明内容的理解,在没有背离本发明的情况下,本发明例举的实施例可以被修饰或改变,增加或删减要素。因此可以理解,在权利要求及其等效转换的范围内,本发明可以被实施而不只是作为具体的描述。
所有专利,公开的专利申请和其它公开的参考文献都在此作为引用文献。为了方便,将参考文献列在下面。
REFERENCES
1.Ceriani RL,Thompson KE,Peterson JA,and Abrahams S:Surfacedifferentiation antigens of human mammary epithelial cells carried on the humanmilk fat globule.Proc.Natl.Acad.Sci.(Wash)74:582-587,1977.
2.Lloyd KO,Burchell J,Kudryashou V,Yin BWt,and Taylor-Papadimitriou J:Comparison of O-linlced carbohydrate chains in MUC1 mucin from normal breastepithelial cell lines and breast carcinoma cell lines.J.Biol.Chem.271:3332533334,1996.
3.Smorodinsky N,Weiss M,Hartmann M-L,Baruch A,Harness E,YaakobovitzM,Keydar I,and Wreschner DH:Detection of a secreted MUC l/SEC protein byMUC1 isoform specific monoclonal antibodies.Biochem.Biophys.Res.Comm.228:115-121,1996.
4.Fu Y-X,Watson GA,Kasahara M,and Lopez DM:The role of tumor derivedcytokines on the immune system of mice bearing mammary adenocarcinomas.I.Induction of regulatory macrophages by in ViVo administration of rGM-CSF.J.Immunol.146:783-789,1991.
5.Keydar I,Chou CS,Hareuveni M,Tsarfaty I,Sahar E,Selzer G,Chaitchik S,and Hizi A:Production and characterization of monoclonal antibodies identifyingbreast tumor associated antigens.Proc.Natl.Acad.Sci.(Wash.),86:1362-1366,1989.
6.Altschul SF,Gish W,Miller W,Myers EW,and Lipman DJ:Basic localalignment search tool.J.Mol.Biol.215:403-410,1990.
7.Nagata S and Golstein P:The FAS death receptor.Science 267:1449-1456,1995.
8.Podack ER,Olsen KJ,Lowery DM,and Lichtenheld M:Structure and functionof perforin.Curr.Top.Microbiol.Immunol.140:11-17,1989.
9.Kataoka T,Shinohara N,Takayama H,Takaku K,Kondo S,Yonehara S,andNagai K:Concanamycin A,a powerful tool for characterization and estimation ofcontributions of perforin-anad Fas-based lytic pathways in cell-mediatedcytotoxicity.I.Immunol.156:3678-3686,1996.
10.Herberman RB,Nunn ME,and Lavrin DH:Natural cytotoxic reactiVity ofmouse lymphoid cells against syngeneic and allogeneic tumors.I.Distribution ofreactiVity and specificity.Int.J.Cancer 16:216-223,1975.
11.Paul R,Padmanabhan R,and Lopez DM:Characterization of the effector cellsmediating an″innocent bystander″cytotoxicity reaction induced by a syngeneicmammary adenocarcinoma in mice.Cancer Res.44:4480-4486,1984.
序列表
SEQUENCE LISTING
<110>迈阿密大学
<120>具有免疫增强特性的粘蛋白肽
<130>PC03938C
<150>US 60/280,137
<151>2001-04-02
<160>1
<170>PatentIn version 3.1
<210>1
<211>11
<212>PRT
<213>Homo sapiens
<400>1
Val Ser Ile Gly Leu Ser Phe Pro Met Leu Pro
1 5 10
Claims (20)
1.一种包含氨基酸序列VSIGLSFPMLP(SEQ ID NO:1)分离肽或多肽,或其类似物或衍生物,当所述肽或多肽施用至哺乳动物时,其具有增强对抗原的免疫反应的性质。
2.权利要求1所述的肽或多肽,其长度在11和200个氨基酸残基之间。
3.权利要求1所述的肽或多肽,其长度在11和20个氨基酸残基之间。
4.权利要求1所述的肽或多肽,它包含VSIGLSFPMLP(SEQ ID NO:1)。
5.权利要求1所述的衍生物,其包括至少一个含有氨基酸序列VSIGLSFPMLP(SEQ ID NO:1)的肽或多肽偶联至蛋白质载体上。
6.权利要求4所述的衍生物,其中载体是钥孔血蓝蛋白。
7.一种编码权利要求1的肽或多肽的核酸,或一种具有其互补序列的核酸。
8.一种药物组合物,它含有权利要求1的肽或多肽,或其类似物或衍生物,以及药用可接受的赋型剂或载体。
9.权利要求8所述的药物组合物,其还包括一种抗原。
10.权利要求9所述的药物组合物,其中所述抗原为一种肿瘤抗原。
11.权利要求10所述的药物组合物,其中所述抗原选自前列腺特异性抗原、黑素瘤有关的抗原和p53。
12.权利要求10所述的药物组合物,其中,所述肽为VSIGLSFPMLP(SEQ IDNO:1)。
13.一种载体,其包含权利要求7的核酸。
14.一种宿主细胞,其包含权利要求7的核酸。
15.权利要求14所述的宿主细胞,其包括编码MUC1/sec的核酸。
16.权利要求15所述的宿主细胞,其为DA-3细胞。
17.一种疫苗,其包括权利要求1的肽或多肽,或其类似物或衍生物,一种抗原,和一种药用可接受的赋型剂或载体。
18.一种治疗或预防哺乳动物癌症的方法,其包括给哺乳动物施用安全且有效剂量的权利要求8或9的药物组合物。
19.一种诱导或增强哺乳动物对抗原的免疫反应的方法,其包括给哺乳动物施用安全且有效剂量的权利要求8或9的药物组合物。
20.权利要求19所述的方法,其中,所述抗原也施用于哺乳动物。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US28013701P | 2001-04-02 | 2001-04-02 | |
| US60/280,137 | 2001-04-02 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN1525864A true CN1525864A (zh) | 2004-09-01 |
Family
ID=23071833
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNA028077784A Pending CN1525864A (zh) | 2001-04-02 | 2002-04-02 | 具有免疫增强特性的粘蛋白肽 |
Country Status (11)
| Country | Link |
|---|---|
| US (2) | US7285282B2 (zh) |
| EP (1) | EP1372691B1 (zh) |
| JP (2) | JP4223813B2 (zh) |
| KR (1) | KR20030092044A (zh) |
| CN (1) | CN1525864A (zh) |
| AT (1) | ATE376836T1 (zh) |
| BR (1) | BR0208771A (zh) |
| CA (1) | CA2443045A1 (zh) |
| DE (1) | DE60223232T2 (zh) |
| NZ (1) | NZ528234A (zh) |
| WO (1) | WO2002078607A2 (zh) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1301267C (zh) * | 2005-06-21 | 2007-02-21 | 中国人民解放军军事医学科学院附属医院 | Muc1粘蛋白的一个模拟表位肽及其编码dna与应用 |
| CN112574283A (zh) * | 2020-12-07 | 2021-03-30 | 湖北文理学院 | 一种人muc1特异性结合多肽及其提取方法 |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2651866C (en) * | 2006-05-11 | 2014-10-28 | Universiteit Gent | Sialoadhesin-related compositions and methods |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2668064B1 (fr) * | 1990-10-23 | 1994-12-16 | Transgene Sa | Composition pharmaceutique pour le traitement ou la prevention d'une tumeur maligne. |
-
2002
- 2002-04-02 NZ NZ528234A patent/NZ528234A/en unknown
- 2002-04-02 CN CNA028077784A patent/CN1525864A/zh active Pending
- 2002-04-02 AT AT02757916T patent/ATE376836T1/de not_active IP Right Cessation
- 2002-04-02 DE DE60223232T patent/DE60223232T2/de not_active Expired - Fee Related
- 2002-04-02 CA CA002443045A patent/CA2443045A1/en not_active Abandoned
- 2002-04-02 KR KR10-2003-7012901A patent/KR20030092044A/ko not_active Application Discontinuation
- 2002-04-02 WO PCT/US2002/010155 patent/WO2002078607A2/en active IP Right Grant
- 2002-04-02 EP EP02757916A patent/EP1372691B1/en not_active Expired - Lifetime
- 2002-04-02 BR BR0208771-5A patent/BR0208771A/pt not_active IP Right Cessation
- 2002-04-02 JP JP2002576876A patent/JP4223813B2/ja not_active Expired - Fee Related
- 2002-04-02 US US10/113,800 patent/US7285282B2/en not_active Expired - Fee Related
-
2004
- 2004-08-04 US US10/910,612 patent/US20050095675A1/en not_active Abandoned
-
2005
- 2005-04-05 JP JP2005109271A patent/JP2005247861A/ja not_active Withdrawn
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1301267C (zh) * | 2005-06-21 | 2007-02-21 | 中国人民解放军军事医学科学院附属医院 | Muc1粘蛋白的一个模拟表位肽及其编码dna与应用 |
| CN112574283A (zh) * | 2020-12-07 | 2021-03-30 | 湖北文理学院 | 一种人muc1特异性结合多肽及其提取方法 |
| CN112574283B (zh) * | 2020-12-07 | 2022-07-05 | 湖北文理学院 | 一种人muc1特异性结合多肽及其提取方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2005247861A (ja) | 2005-09-15 |
| JP2004532018A (ja) | 2004-10-21 |
| EP1372691A4 (en) | 2005-11-09 |
| DE60223232T2 (de) | 2008-08-14 |
| EP1372691B1 (en) | 2007-10-31 |
| WO2002078607A3 (en) | 2003-03-27 |
| US7285282B2 (en) | 2007-10-23 |
| KR20030092044A (ko) | 2003-12-03 |
| EP1372691A2 (en) | 2004-01-02 |
| ATE376836T1 (de) | 2007-11-15 |
| WO2002078607A2 (en) | 2002-10-10 |
| NZ528234A (en) | 2006-01-27 |
| BR0208771A (pt) | 2004-07-06 |
| US20050095675A1 (en) | 2005-05-05 |
| US20030166853A1 (en) | 2003-09-04 |
| JP4223813B2 (ja) | 2009-02-12 |
| DE60223232D1 (de) | 2007-12-13 |
| CA2443045A1 (en) | 2002-10-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1281625C (zh) | 经修饰的wt1肽 | |
| Rakhmilevich et al. | Gene gun-mediated IL-12 gene therapy induces antitumor effects in the absence of toxicity: a direct comparison with systemic IL-12 protein therapy | |
| CN1617742A (zh) | 使用肿瘤-衍生的树突细胞抑制因子拮抗剂和Toll类受体激动剂的组合治疗癌症的方法 | |
| CN1314916A (zh) | 基于癌抑制基因wt1的产物的癌抗原 | |
| CN102803487A (zh) | 癌抗原辅助肽 | |
| KR20130122902A (ko) | 종양 치료용 면역원성 조성물 및 방법 | |
| CN1300294A (zh) | β-淀粉样前体蛋白和泛素-B的移码突变体和它们的用途 | |
| CN1291755C (zh) | 增强低免疫原性抗原的免疫原性的药物组合物 | |
| WO2019101110A1 (zh) | 天花粉蛋白用于致敏和/激活树突状细胞中的应用 | |
| CN105658673A (zh) | 新型的具有4个连接的ctl表位的肽 | |
| CN1222619C (zh) | 增强对单纯疱疹病毒疫苗应答的疫苗及其制药应用 | |
| US20110280897A1 (en) | Polypeptides and uses thereof | |
| CN110167576A (zh) | 靶向成纤维细胞活化蛋白的优化的合成共有免疫原性组合物 | |
| CN1367686A (zh) | 新组合物 | |
| CN1525864A (zh) | 具有免疫增强特性的粘蛋白肽 | |
| CN105008399A (zh) | 新型的具有5个连接的ctl表位的肽 | |
| CN107106666A (zh) | 用于基于免疫的治疗的免疫原性mhcii类肽的鉴定 | |
| US5208022A (en) | Non-malignant cells coupled to adjuvants and their use in a method to induce anti-tumor immunity | |
| CN1921883A (zh) | 包含血管动蛋白或编码血管动蛋白的多核苷酸的疫苗及其在治疗血管生成相关紊乱中的用途 | |
| KR102567487B1 (ko) | Bi-1 단백질 발현 억제를 통한 세포 백신의 효능 증강 방법 | |
| CN112142824B (zh) | 具有诱导细胞毒性t淋巴细胞能力的多肽及其应用 | |
| CN1196786C (zh) | 抗移植排斥细胞及其用途 | |
| CN1288166C (zh) | 修饰的肿瘤抗原肽及其应用 | |
| TWI278320B (en) | A complex immunity gene medicine composition for inhibiting tumor cell | |
| CN1315960A (zh) | 来源于sart-1的肿瘤抗原肽 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C02 | Deemed withdrawal of patent application after publication (patent law 2001) | ||
| WD01 | Invention patent application deemed withdrawn after publication |