CN103096901A - 眼用组合物 - Google Patents
眼用组合物 Download PDFInfo
- Publication number
- CN103096901A CN103096901A CN2011800332340A CN201180033234A CN103096901A CN 103096901 A CN103096901 A CN 103096901A CN 2011800332340 A CN2011800332340 A CN 2011800332340A CN 201180033234 A CN201180033234 A CN 201180033234A CN 103096901 A CN103096901 A CN 103096901A
- Authority
- CN
- China
- Prior art keywords
- dorzolamide
- timolol
- ophthalmic composition
- test
- peg
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/74—Synthetic polymeric materials
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/38—Heterocyclic compounds having sulfur as a ring hetero atom
- A61K31/382—Heterocyclic compounds having sulfur as a ring hetero atom having six-membered rings, e.g. thioxanthenes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/135—Amines having aromatic rings, e.g. ketamine, nortriptyline
- A61K31/138—Aryloxyalkylamines, e.g. propranolol, tamoxifen, phenoxybenzamine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/433—Thidiazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/4704—2-Quinolinones, e.g. carbostyril
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
- A61K31/5377—1,4-Oxazines, e.g. morpholine not condensed and containing further heterocyclic rings, e.g. timolol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/54—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one sulfur as the ring hetero atoms, e.g. sulthiame
- A61K31/542—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one sulfur as the ring hetero atoms, e.g. sulthiame ortho- or peri-condensed with heterocyclic ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/34—Macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyesters, polyamino acids, polysiloxanes, polyphosphazines, copolymers of polyalkylene glycol or poloxamers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0048—Eye, e.g. artificial tears
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
- A61P27/06—Antiglaucoma agents or miotics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Abstract
本发明提供了一种包含超支化聚酯的眼用组合物。所述眼用组合物还可以包含碳酸酐酶抑制剂,其中所述超支化聚酯增加碳酸酐酶抑制剂的水溶解度,并增加活性剂的角膜渗透。所述眼用组合物还可以包含非离子表面活性剂(诸如PEG、聚山梨酯、HPMC或HEC)和β-阻滞剂(诸如卡替洛尔、左布诺洛尔、倍他洛尔、美替洛尔、噻吗洛尔或普萘洛尔)。所述眼用制剂中的超支化聚酯的浓度应当小于或等于4%(w/v)以便避免对人角膜细胞的任何细胞毒性效应和由此产生的眼刺激。
Description
技术领域
本发明涉及包含超支化聚合物的眼用组合物。本发明的超支化聚合物可以是药学上可接受的任意超支化聚合物,例如,具有聚乙烯亚胺、聚丙烯亚胺或聚酯的超支化聚合物。
背景技术
COSOPT®和TRUSOPT®是由Merck开发的可商业得到的局部眼用溶液,其用于治疗称作青光眼的眼病。在TRUSOPT®的情况下,活性成分仅是多佐胺。在COSOPT®的情况下,活性成分是多佐胺和噻吗洛尔(β阻滞剂)。多佐胺是一种碳酸酐酶(carbonic
anhydraze)抑制剂,在pH 4.0-5.5时具有40
mg/mL的水溶解度。它是白色至灰白色结晶性粉末,它可溶于水中,且微溶于甲醇和乙醇中。
但是,这些制剂含有2% (w/v)多佐胺,并在pH 5.65制备,这是由于多佐胺在生理pH的有限水溶解度。结果,由于低的pH,COSOPT®和TRUSOPT®制剂可以导致局部刺激。多佐胺具有6.35和8.5的2个pKa值,它们分别对应着质子化的仲胺基团和磺酰胺基团。多佐胺在pH6.4以下主要是它的亲水阳离子形式,在pH
8.5以上主要是它的亲水阴离子形式。
因而,多佐胺在具有6.4至8.5之间的pH的溶液中具有相对较低的水溶解度,这主要是因为多佐胺在该生理pH范围内的非离子性能。
AZOPT®(布林佐胺眼用混悬液)1%是一种布林佐胺无菌水性混悬液,其已经配制成在摇动以后可容易地悬浮和缓慢地沉降。AZOPT®由Alcon开发,且含有布林佐胺作为活性成分。所述制剂具有大约7.5的pH和300 mOsm/kg的重量克分子渗透压浓度(osmolality)。滴注它来降低具有开角型青光眼或眼内高压的患者的眼内压升高。布林佐胺的pKa值是5.9(胺)和8.4(主要是磺酰胺),这允许它根据pH而起酸或碱的作用(两性电解质)。它在pH5.9以下主要是它的亲水阳离子形式,在pH 8.4以上主要是它的亲水阴离子形式。显然,布林佐胺在生理pH会明显更少地质子化(<10%)。因而,布林佐胺在具有5.9至8.4之间的pH的溶液中具有相对较低的水溶解度,这主要是因为布林佐胺的在该pH范围内的非离子(亲脂)性能。
树枝状聚合物是这样的树样聚合物:基于它们的支化体系结构,其可以分类为2大类,即“完美分支的”(树状物(dendrimers))和“不完美分支的”(超支化聚合物或HP)。超支化聚合物是具有分支结构(通常围绕一个核心)的分子构造。不同于树状物,超支化聚合物的结构通常缺乏对称性,因为用于构建超支化聚合物的基础单元或单体可以具有不同的性质,且它们的分布是不均匀的。所述聚合物的分支可以具有不同的性质和长度。基础单元或单体的数目可以是不同的,这取决于不同的支化。尽管在不对称的同时,超支化聚合物可以具有:围绕一个核心的高度分支的结构;连续数代或数层的支化;一层末端链。超支化聚合物通常源自一种或多种单体ABx的缩聚作用,其中A和B是能够一起反应的反应基团,x是大于或等于2的整数。但是,其它制备方法也是可能的。超支化聚合物的特征在于它们的聚合度DP=l00-b,其中b是在B中的尚未与基团A反应的非末端官能团的百分比。因为所述缩合不是系统性的,聚合度小于100%。末端基团T可以与超支化聚合物反应,以得到在链末端上的特定官能度。
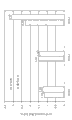
超支化聚合物主要通过它们的核心类型和它们的末端基团来鉴别。超支化聚合物的核心类型的实例是聚乙烯亚胺、聚丙烯亚胺、聚二醇、聚醚、聚酯等。具有聚酯核心的超支化聚合物可以称作超支化聚酯。超支化聚合物的末端或表面官能团的实例是胺、羟基、羧酸、脂肪酸、聚乙二醇(PEG)、聚酯等。参见美国专利6,432,423、美国专利7,097,856和美国专利公开2006/0204472,它们的内容通过引用并入本文。
显示了从
AB2
单体的聚合形成超支化聚合物的示意图。
与通过多步合成制备的“结构完美的”树状物相比,可以在一步反应中合成完美度稍微更低的超支化聚合物。因而,不同于树状物,可以快速地制备超支化聚合物,它们的制备不需要纯化步骤。结果,超支化聚合物明显不如树状物昂贵。因此,这使得超支化聚合物适用于大规模体内试验,并使得高度支化的聚合物成为药物递送(甚至诸如布洛芬等常见药物)的候选物(Kannan,
R.M. 等人, Biomedical Applications
of Nanotechnology, 2007, John Wiley & Sons Inc., 第105页)。
发明目的
本发明的一个目的是提供一种改进的眼用组合物,其具有改善的活性剂的水溶解度和角膜渗透。
发明内容
发明人已经研究了包含超支化聚合物的眼用组合物。发明人已经发现,超支化聚合物是具有高生物粘附力的粘膜粘着性聚合物,其提供带负电荷的角膜粘蛋白膜和阳离子超支化聚合物之间的强静电相互作用。
发明人已经发现,超支化聚合物会增加用于青光眼治疗的碳酸酐酶抑制剂(诸如多佐胺或布林佐胺)的水溶解度。另外,发明人已经发现,多佐胺或布林佐胺的水溶解度随着超支化聚合物浓度的增加而线性增加。此外,基于体外人角膜上皮细胞培养研究,发明人已经发现超支化聚合物,诸如具有羟基官能团的Bis-MPA超支化聚酯(第2代),可以没有细胞毒性或眼刺激地安全地使用至高达4%
(w/v)。另外,发明人已经发现,超支化聚合物会增加多佐胺和噻吗洛尔向完整角膜中的角膜渗透和分配,并增加多佐胺和噻吗洛尔向亲脂性角膜中的分配。
因此,本发明提供了:
(1)一种包含超支化聚合物的眼用组合物,其中所述超支化聚合物包含选自下述的末端官能团:胺基团、羟基、脂肪酸基团和聚乙二醇(PEG)。
(2)根据上述(1)的眼用组合物,所述眼用组合物另外包含碳酸酐酶抑制剂。
(3)根据上述(1)或(2)的眼用组合物,所述眼用组合物另外包含非离子表面活性剂。
(4)根据上述(1)的眼用组合物,其中所述超支化聚合物的平均分子量是在1,000至750,000道尔顿(Mw)范围内。
(5)根据上述(1)或(2)的眼用组合物,其中所述超支化聚合物包含选自下述的核心:聚乙烯亚胺、聚丙烯亚胺和聚酯。
(6)根据上述(1)的眼用组合物,其中pH是在3.0至8.0范围内。
(7)根据上述(1)的眼用组合物,其中所述超支化聚酯的浓度是在0.01%至5%
(w/v)范围内。
(8)根据上述(2)的眼用组合物,所述眼用组合物另外包含β-阻滞剂。
(9)根据上述(2)的眼用组合物,其中所述碳酸酐酶抑制剂选自:多佐胺、布林佐胺和乙酰唑胺。
(10)根据上述(3)的眼用组合物,其中所述非离子表面活性剂选自:PEG、聚山梨酯、羟丙基甲基纤维素(HPMC)和羟乙基纤维素(HEC)。
(11)根据上述(8)的眼用组合物,其中所述β-阻滞剂选自:卡替洛尔、左布诺洛尔、倍他洛尔、美替洛尔、噻吗洛尔和普萘洛尔。
(12)根据上述(5)的眼用组合物,其中所述超支化聚合物核心是聚酯,并且其中所述超支化聚合物包含作为末端官能团的羟基、脂肪酸基团和PEG。
(13)根据上述(12)的眼用组合物,其中所述超支化聚合物的平均分子量是在1,000至12,000道尔顿(Mw)范围内。
(14)根据上述(12)的眼用组合物,其中所述超支化聚合物的浓度是在0.001%至4%
(w/v)范围内。
(15)一种包含超支化聚酯、噻吗洛尔、多佐胺和聚山梨酯80的眼用组合物,其中所述超支化聚酯包含选自下述的末端官能团:聚酯羟基、脂肪酸基团和PEG。
(16)一种包含超支化聚酯、噻吗洛尔、布林佐胺和聚山梨酯80的眼用组合物,其中所述超支化聚酯包含选自下述的末端官能团:聚酯羟基、脂肪酸基团和PEG。
附图说明
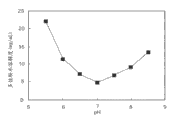
图1显示了多佐胺在0.1% (w/v)磷酸盐缓冲液中的pH-溶解度特性。
图2显示了超支化聚合物浓度对多佐胺在pH
5.65的0.1% (w/v)磷酸盐缓冲液中的水溶解度的依赖性。
图3显示了超支化聚合物浓度对多佐胺在pH 7的0.1% (w/v)磷酸盐缓冲液中的水溶解度的依赖性。
图4显示了PEG 8000和不同浓度的超支化聚合物(Lupasol®PS)的组合对多佐胺在pH 7的水溶解度的影响。
图5显示了作为在0.1% (w/v)磷酸盐缓冲液中的不同溶液在20℃时的剪切率的函数的粘度。
图6显示了在pH 7和80 s-1的剪切率时的生物粘附力。
图7显示了多佐胺在pH 5.65和pH 7时的最大水溶解度,在所有情况下,在有0.5% 噻吗洛尔存在下,向水溶液中加入添加剂。
图8显示了在pH 7时的最大多佐胺溶解度,其中在有0.5%噻吗洛尔存在下,使用不同的添加剂组合。
图9显示了标准的并排扩散池(side by side
diffusion cell)的示意图。
图10显示了就含有Lupasol®PS超支化聚合物的制剂而言,多佐胺穿过完整兔角膜的平均渗透特性(n=2)。
图11显示了就含有Lupasol®PS超支化聚合物的制剂而言,噻吗洛尔穿过完整兔角膜的平均渗透特性(n=2)。
图12显示了就含有Lupasol®PS超支化聚合物的制剂而言,在3小时以后,多佐胺和噻吗洛尔的总角膜渗透平均百分比。
图13显示了就含有Lupasol®PS超支化聚合物的制剂而言,多佐胺和噻吗洛尔的平均角膜渗透系数。
图14显示了就含有Lupasol®PS超支化聚合物的制剂而言,多佐胺和噻吗洛尔渗透穿过完整兔角膜的平均扩散系数。
图15显示了就含有Lupasol®PS超支化聚合物的制剂而言,多佐胺和噻吗洛尔渗透穿过完整兔角膜的平均分配系数。
图16显示了布林佐胺在具有不同pH值的10 mM磷酸盐缓冲液中的水溶解度。
图17显示了布林佐胺在pH 7时的最大水溶解度,其中在有和没有0.5% 噻吗洛尔存在下,向水溶液中加入添加剂。
图18显示了就含有Boltorn®H20超支化聚合物的制剂而言,多佐胺(n=2)穿过兔角膜的平均渗透特性。
图19显示了就含有Boltorn®H20超支化聚合物的制剂而言,噻吗洛尔(n=2)穿过兔角膜的平均渗透特性。
图20显示了就含有Boltorn®H20超支化聚合物的制剂而言,在2小时以后,多佐胺和噻吗洛尔的总角膜渗透平均百分比。
图21显示了就含有Boltorn®H20超支化聚合物的制剂而言,多佐胺和噻吗洛尔的平均角膜渗透系数。
图22显示了就含有Boltorn®H20超支化聚合物的制剂而言,多佐胺和噻吗洛尔渗透穿过完整兔角膜的平均扩散系数。
图23显示了就含有Boltorn®H20超支化聚合物的制剂而言,多佐胺和噻吗洛尔渗透穿过完整兔角膜的平均分配系数。
图24显示了布林佐胺在pH 7.4时的最大水溶解度,其中在有0.5% (w/v)噻吗洛尔存在下,向乳剂溶液中加入Boltorn®W3000(两亲的HP)。
图25显示了就含有Boltorn®W3000超支化聚合物的制剂而言,多佐胺(n=2)穿过完整兔角膜的平均渗透特性。
图26显示了就含有Boltorn®W3000超支化聚合物的制剂而言,噻吗洛尔穿过完整兔角膜的平均渗透特性(n=2)。
图27显示了就含有Boltorn®W3000超支化聚合物的制剂而言,在3小时以后,多佐胺和噻吗洛尔的总角膜渗透平均百分比。
图28显示了就含有Boltorn®W3000超支化聚合物的制剂而言,多佐胺和噻吗洛尔的平均角膜渗透系数。
图29显示了就含有Boltorn®W3000超支化聚合物的制剂而言,多佐胺和噻吗洛尔渗透穿过完整兔角膜的平均扩散系数。
图30显示了就含有Boltorn®W3000超支化聚合物的制剂而言,多佐胺和噻吗洛尔渗透穿过完整兔角膜的平均分配系数。
图31显示了布林佐胺在pH 7.4时的最大水溶解度,其中在有0.5% (w/v)噻吗洛尔存在下,加入第2 代Bis-MPA超支化聚酯或第3 代Bis-MPA超支化聚酯。
图32显示了不同浓度的超支化聚酯(羟基,第2和3代)和AZOPT®的体外人角膜上皮细胞生存力。
图33显示了不同浓度的Bis-MPA超支化聚酯的细胞毒性。
图34显示了多佐胺在pH 7.4时的溶解度和稳定性,其中在有0.5% (w/v)噻吗洛尔存在下,加入Bis-MPA超支化聚酯和非离子表面活性剂。
图35显示了多佐胺在pH 7.4时的最大水溶解度,其中在有0.5% (w/v)噻吗洛尔存在下,加入不同的添加剂。
图36显示了就含有Bis MPA超支化聚酯(第2代)的制剂而言,多佐胺的完整角膜渗透特性。
图37显示了就含有Bis MPA超支化聚酯(第2代)的制剂而言,噻吗洛尔的完整角膜渗透特性。
图38显示了就含有Bis MPA超支化聚酯(第2代)的制剂而言,在3小时以后,多佐胺和噻吗洛尔的总角膜渗透平均百分比。
图39显示了就含有Bis MPA超支化聚酯(第2代)的制剂而言,多佐胺和噻吗洛尔的渗透系数。
图40显示了就含有Bis MPA超支化聚酯(第2代)的制剂而言,多佐胺和噻吗洛尔的分配系数。
具体实施方式
本发明的组合物是用于治疗眼病症的可局部给药的治疗组合物。这样的眼病症包括:青光眼,以及眼睛疾病,诸如白内障、结膜炎、感染、炎症或视网膜病变。
下面提供了本发明的详细描述。
本发明包括一种含有超支化聚合物的眼用组合物。
根据本发明的超支化聚合物可以是药学上可接受的任意超支化聚合物,例如,具有聚乙烯亚胺、聚丙烯亚胺或聚酯核心的超支化聚合物。在本发明的眼用组合物中的超支化聚合物的分子量是在1,000至750,000道尔顿范围内,优选地在1,000至12,000道尔顿范围内。所述分子量是通过动态光散射测得的重量平均分子量。在本发明的眼用组合物中的超支化聚合物的浓度是在0.001%至10% (w/v)范围内,优选地在0.001%至5% (w/v)范围内,更优选地在0.001%至4% (w/v)范围内,更优选地在0.01%至4% (w/v)范围内,更优选地在0.01%至3% (w/v)范围内。
上面讨论的眼用组合物还可以包含碳酸酐酶抑制剂。碳酸酐酶抑制剂是一类抑制碳酸酐酶活性的药物,且已知可用作抗青光眼剂。可以存在于本发明的眼用组合物中的碳酸酐酶抑制剂的实例是:多佐胺、布林佐胺或乙酰唑胺。
上面讨论的眼用组合物还可以包含非离子表面活性剂。所述非离子表面活性剂可以是,已知为药学上可接受的添加剂的任意非离子表面活性剂,例如,聚山梨酯80、PEG 8000、HPMC或HEC。
本发明的眼用组合物有利地在调节至被常规地采用以用于向眼局部施用的pH范围以后使用,且通常在调节至pH
3-8、优选地pH 5-8以后使用。就pH调节而言,可以使用盐酸、醋酸、氢氧化钠等。
本发明的眼用组合物还可以包含β-阻滞剂。已知β-阻滞剂会降低眼内部的压力(眼内压),并因而用于降低青光眼患者的视神经损伤和视力丧失的风险。在本发明的眼用组合物中的β-阻滞剂可以是已知在眼用组合物中可接受的任意β-阻滞剂,诸如卡替洛尔、左布诺洛尔、倍他洛尔、美替洛尔、噻吗洛尔和普萘洛尔。
本发明的第一个具体实施方案是包含超支化聚合物、噻吗洛尔、多佐胺、PEG 8000和聚山梨酯80的眼用组合物。
这样的组合物优选地包含:约0.001%-10% (w/v)、最优选约1-5%
(w/v)的超支化聚合物,和0.05-1% (w/v)、最优选约0.5% (w/v)的噻吗洛尔,和约0.05-5%
(w/v)、最优选约0.5-2% (w/v)的多佐胺,和约0.05-5% (w/v)、最优选约0.5-4%
(w/v)的PEG 8000,和约0.05-5%
(w/v)、最优选约0.5-4% (w/v)的聚山梨酯80,且向每只受影响的眼睛每天施用1次或2次。
本发明的第二个具体实施方案是包含超支化聚合物、噻吗洛尔、布林佐胺、PEG 8000和聚山梨酯80的眼用组合物。
这样的组合物优选地包含:约0.001%-10% (w/v)、最优选约1-5%
(w/v)的超支化聚合物,和0.05-1% (w/v)、最优选约0.5% (w/v)的噻吗洛尔,和约0.05-5%
(w/v)、最优选约0.5-2% (w/v)的布林佐胺,和约0.05-5% (w/v)、最优选约0.5-4%
(w/v)的PEG 8000,和约0.05-5%
(w/v)、最优选约0.5-4% (w/v)的聚山梨酯80,且向每只受影响的眼睛每天施用1次或2次。
本发明的第三个具体实施方案是包含超支化聚酯、噻吗洛尔、多佐胺、PEG 8000和聚山梨酯80的眼用组合物。
这样的组合物优选地包含:约0.1%-10% (w/v)、最优选约1-5%
(w/v)的超支化聚酯,和0.05-1% (w/v)、最优选约0.5% (w/v)的噻吗洛尔,和约0.05-5%
(w/v)、最优选约0.5-2% (w/v)的多佐胺,和约0.05-5% (w/v)、最优选约0.5-4%
(w/v)的PEG 8000,和约0.05-5%
(w/v)、最优选约0.5-4% (w/v)的聚山梨酯80,且向每只受影响的眼睛每天施用1次或2次。
本发明的第四个具体实施方案是包含超支化聚酯、噻吗洛尔、布林佐胺、PEG 8000和PEG 8000的眼用组合物。
这样的组合物优选地包含:约0.1%-10% (w/v)、最优选约1-5%
(w/v)的超支化聚酯,和0.05-1% (w/v)、最优选约0.5% (w/v)的噻吗洛尔,和约0.05-5%
(w/v)、最优选约0.5-2% (w/v)的布林佐胺,和约0.05-5% (w/v)、最优选约0.5-4%
(w/v)的PEG 8000,和约0.05-5%
(w/v)、最优选约0.5-4% (w/v)的聚山梨酯80,且向每只受影响的眼睛每天施用1次或2次。
根据本发明的眼用组合物可以包含药理学上可接受的载体、赋形剂或稀释剂,它们本身是已知的,且可以通过用于制备眼用组合物的本身已知的方法来配制。本发明的眼用组合物可以以常规地用作眼用制剂,例如,滴眼剂、乳剂和眼用软膏剂的任意药物剂型的形式提供。
滴眼剂制剂可以是,例如,水性制剂,诸如作为澄清溶液的眼用溶液、眼用混悬剂、眼用乳剂,以及非水性制剂,诸如非水性的眼用溶液和非水性的眼用混悬剂。
眼用溶液制剂可以含有通常掺入的各种添加剂,诸如:缓冲剂(例如,磷酸盐缓冲剂、硼酸盐缓冲剂、柠檬酸盐缓冲剂、酒石酸盐缓冲剂、乙酸盐缓冲剂、氨基酸、醋酸钠、柠檬酸钠等等)、等渗剂(例如,糖类诸如山梨醇、葡萄糖和甘露醇,多元醇类诸如甘油、浓缩甘油、PEG和丙二醇,盐类诸如氯化钠)、防腐剂或消毒剂(例如,苯扎氯铵、苄索氯铵、对羟基苯甲酸酯类诸如对羟基苯甲酸甲酯或对羟基苯甲酸乙酯、苯甲醇、苯乙醇、山梨酸或它的盐、硫柳汞、三氯叔丁醇等等)、增溶助剂或稳定剂(例如,环糊精类和它们的衍生物、水溶性聚合物诸如聚乙烯吡咯烷酮、表面活性剂诸如泰洛沙泊、pH调节剂(例如,盐酸、醋酸、磷酸、氢氧化钠、氢氧化钾、氢氧化铵等等)、增稠剂(例如,HEC、羟丙基纤维素、甲基纤维素、HPMC、羧甲基纤维素和它们的盐)、螯合剂(例如,依地酸钠、柠檬酸钠、浓缩的磷酸钠)等等。
除了上面列出的添加剂以外,水性混悬剂形式的滴眼剂制剂还可以含有助悬剂(例如,聚乙烯吡咯烷酮、单硬脂酸甘油酯)和分散剂(例如,表面活性剂诸如泰洛沙泊,离子聚合物诸如海藻酸钠),由此确保所述滴眼剂制剂是进一步均匀的微粒和令人满意地分散的水性混悬液。
水性混悬剂形式的滴眼剂制剂优选地含有:作为缓冲剂的柠檬酸钠或醋酸钠、作为等渗剂的浓缩的甘油和/或丙二醇以及作为助悬剂的聚乙烯吡咯烷酮。一种优选的分散剂是表面活性剂和/或海藻酸钠。这样的表面活性剂优选地是泰洛沙泊。
本发明的眼用组合物可以施用给哺乳动物(例如,人、兔、狗、猫、牛、马、猴),所述哺乳动物正在或可能遭受眼科疾病,诸如青光眼。
尽管给药途径和剂量可以随受试者的症状、年龄和体重而变化,在本发明的眼用组合物中的活性剂的浓度是,当施用给成年人时,包含在水性滴眼剂制剂中的约0.001-5
(w/v)%、优选约0.01-3 (w/v)%,且优选地每天施用1-8次,单次剂量是1滴至数滴。
除非不利地影响预期的使用目的,本发明的眼用组合物可以含有下述的其它适当的药理学上有效的物质,或可以与所述物质一起使用:例如,甾体抗炎剂(地塞米松、泼尼松龙、氯替泼诺氟米龙(Loteprednolm
Fluorometholone)、氟轻松(Fluocinolone)等等)、非甾体抗炎剂(双氯芬酸钠、普拉洛芬、溴芬酸、酮咯酸氨丁三醇、奈帕芬胺、氟比洛芬钠等等)、抗过敏剂(曲尼司特、富马酸酮替芬、盐酸奥罗他定、色甘酸钠、吡嘧司特钾、奈多罗米钠等等)、抗组胺剂(盐酸依匹斯汀、盐酸氮卓斯汀、Azalastine
hydrochrilidem、盐酸苯海拉明等等)、青光眼治疗剂(盐酸毛果芸香碱、水杨酸毒扁豆碱、噻吗洛尔、乌诺前列酮异丙酯、拉坦前列素、盐酸倍他洛尔、阿可乐定、酒石酸溴莫尼定、卡米可林(Carbacol)、地匹福林、比马前列素、曲伏前列素、酒石酸溴莫尼定等等)、抗生素(阿奇霉素、硫酸庆大霉素、硫酸新霉素、妥布霉素、磺苄西林、头孢甲肟、红霉素、多粘菌素E、土霉素、多粘菌素B、氯霉素、小诺米星、地贝卡星、西索米星等等)、抗细菌剂(磺胺甲二唑、磺胺甲噁唑、氧氟沙星、诺氟沙星、盐酸洛美沙星、盐酸莫西沙星、依诺沙星、盐酸环丙沙星、西诺沙星、司帕沙星、甲苯磺酸托氟沙星、萘啶酸、吡哌酸三水合物、吡哌酸、氟罗沙星、左氧氟沙星、加替沙星等等)和抗病毒剂(碘苷、阿昔洛韦等等)和抗真菌剂(匹马菌素、氟康唑、咪康唑、两性霉素B、氟胞嘧啶、伊曲康唑等等)、抗VEGF抗体(哌加他尼(Pegaptanib)等等)。
可以如下生产本发明的眼用组合物:将活性剂(多种活性剂)、超支化聚合物和任选的非离子表面活性剂溶解或分散在溶液中,所述溶液适当地含有药学上可接受的添加剂,诸如等渗剂、缓冲剂、防腐剂、助悬剂、增稠剂、稳定剂、pH调节剂等等。
发明人特此将先前提交的美国申请第12/774,419号整体并入本文中作为参考。下述实验实施例进一步详细例证了本发明。这些实验实施例仅仅是示例性的,并且无意限制本发明的范围。
实验实施例1
多佐胺在含有不同浓度的超支化聚合物(HP)(Lupasol®G20、Lupasol®G
35、Lupasol®PS)和PEG的水溶液中的pH-溶解度特性。
方法
制备了盐酸多佐胺在pH 5.5、pH 6、pH 6.5、pH 7、pH 7、pH 8和pH 8.5的0.1% (w/v)磷酸盐缓冲溶液中的混悬液。还在含有不同浓度的不同HP和PEG(分子量为8000)的水溶液中制备了类似的混悬液。还尝试了聚山梨酯80和PEG 8000的组合。使用微-pH电极(Thermo Scientific)精确地测量pH。使用1 M NaOH或1 M HCl调节期望的pH。首先将所述混悬溶液在室温搅拌10 min(加热至60℃持续5分钟)。在使所述混悬液在室温平衡另外的30分钟以后,再将所述混悬溶液声处理10分钟,最后通过0.45µm注射器式滤器进行过滤。使用UPLC分析滤液的多佐胺浓度。如下进行多佐胺检测:梯度1% (v/v)三乙胺(TEA)水溶液:乙腈方法,在室温进行,流速为0.7 mL/min,在254 nm波长,注射体积10 μL,在BEH C18 1.7 μm、2.1x 50 mm柱上。制备校正曲线,以发现多佐胺浓度。使用的聚合物的性质列出在表1中。
表1:实验实施例1中的HP的性质。
| 聚合物名称 | 粘度(cP) | 分子量 | pKa | 固体含量(% w/v) |
| Lupasol®G 20 | 200-500 | 1300 | 7-10 | >98% |
| Lupasol®G 35 | 250-650 | 2000 | 7-10 | 48-52% |
| Lupasol®PS | 1000-2500 | 750,000 | 7-10 | 33% |
结果和讨论
图1表明多佐胺的水溶解度随着pH从5.65升高而降低,并在pH 7时达到底点。由于COSOPT®是在pH
5.65时配制,在有不同浓度的不同HP存在下,在pH
5.65定量多佐胺在0.1% (w/v)磷酸盐缓冲液中的溶解度。结果显示在图2中。随着HP浓度从0.1%(w/v)增加至1% (w/v),多佐胺在pH 5.65时的溶解度增加。类似地,在pH 7,如图3的条形图所示,随着HP浓度从0.1% (w/v)增加至4% (w/v),多佐胺溶解度线性地增加。
如图4所示,在pH 7时应用了不同浓度的PEG 8000和0.5%和1% (w/v)的HP(Lupasol®PS)的组合。从图4显而易见,通过使用约20%的PEG 8000和0.5%的Lupasol®PS,或者17%的PEG 8000和1%的Lupasol®PS,可以实现多佐胺在pH 7的磷酸盐缓冲液中的2% (w/v)溶解度(类似于COSOPT®)。
结论
发明人发现,多佐胺的水溶解度随着HP和PEG的浓度的增加而增加。在PEG的情况下,所述溶解度也随着PEG的分子量的增加而线性地增加。此外,聚山梨酯80有助于分散多佐胺分子,并抑制在有PEG存在下在水中的沉淀。
从这些结果可以得出结论,HP会显著地增加多佐胺的溶解度。另外,发现亲水的聚乙二醇是多佐胺溶解度增高剂。所述结果证实了在接近生理pH的pH值时使用超支化聚合物和PEG作为多佐胺溶解度增高添加剂的优点。
实验实施例2
用于在体外评估粘蛋白-超支化聚合物生物粘附键(bioadhesive
bond)强度的简单流变学方法。
采用简单的粘度测定方法来定量粘蛋白-聚合物生物粘附键强度。为了确定称作Lupasol®PS的可商业得到的HP的粘膜粘着性质,与市售产品COSOPT®相比,计算在pH 7时不同浓度的HP与猪胃粘蛋白的生物粘附力。使用猪胃粘蛋白作为模型粘蛋白。但是,由于所有粘蛋白似乎共有一般的物理性质、结构性质和流变学性质,据信猪胃粘蛋白是用于基本评价生物粘附材料的令人满意的模型。
方法
使用Brookfield Rotational L VDVE粘度计进行所有测量。使用具有代号18的纺锤体进行所有粘度测量。按照手册,使用1.32的因数(factor)将rpm转换成剪切率(s-1)。在pH 7的0.1% (w/v)磷酸盐缓冲液中制备15%
(w/v)的胃粘蛋白溶液。测量0.5% (w/v)和1%
(w/v)的Lupasol®PS在磷酸盐缓冲溶液中的各个粘度。还测量了15%粘蛋白在磷酸盐缓冲液中的粘度。在20℃以从2.6至80 s-1的不同剪切率D测量粘度(Hassan, E. 等人, Pharm Res. 5(1990)491)。使用不同浓度的Lupasol®PS、PEG,使用和不使用15% (w/v)胃粘蛋白,在pH 7的0.1% (w/v)磷酸盐缓冲液中制备5个各自10 mL的样品。
表2:测试样品的含量(% w/v)。
| 含量(% w/v) | #1 | #2 | #3 | #4 | #5 | #6 |
| Lupasol®PS | - | 0.5 | 0.5 | 1 | 1 | 1 |
| 胃粘蛋白 | 15 | - | 15 | - | 15 | 15 |
| PEG 8000 | - | - | - | - | - | 2 |
| 1M NaOH | 调节pH至7.0 | 调节pH至7.0 | 调节pH至7.0 | 调节pH至7.0 | 调节pH至7.0 | 调节pH至7.0 |
样品#7是原始的COSOPT®市售产品。在不同的剪切率测量在20℃的粘度。使用上面讨论的方程式(1)和(2)计算生物粘附力。
按照下述方程式(1)计算生物粘附力(F):
其中σ是每秒的剪切率,ηb是基于实验测量值,其按照下述方程式(2):
其中ηt是系统的粘度系数,并且ηm和ηp分别是粘蛋白和生物粘附聚合物(例如,HP和PEG 8000)各自的粘度系数。
为了使方程式(1)和(2)有效,ηt、ηm和ηp应当在相同的浓度、温度、时间和剪切率进行测量。生物粘附现象在在角膜前区域中取代的水性泪液的接触时间中起主导作用。
结果和讨论
如图5所示,与COSOPT®(样品#7)和粘蛋白(样品#1)相比,在磷酸盐缓冲液中的低浓度的HP具有相对较低的粘度。在高剪切率,HP(0.5%, 样品#2,和1%, 样品#4)的粘度相对接近于水。另外,在高剪切率,0.5% (w/v)和1%
(w/v)的HP之间的粘度差异是可忽略的。该结果清楚地暗示使用HP作为添加剂的优点,所述添加剂具有非常适合局部眼用溶液的流变学性质,因为向制剂中加入HP不会改变最终制剂的流变学性质。
基于在80 s-l的剪切率从图5可得到的数据定量生物粘附力。选择高剪切率,因为所述聚合物通常在高剪切率(接近100 s-1)表现出生物粘附性质。
如图6所示,低浓度(0.5% (w/v)和1% (w/v))的HP-粘蛋白系统的生物粘附键强度几乎超过COSOPT®-粘蛋白系统的2倍。2% (w/v) PEG的加入没有改变1% (w/v) HP-粘蛋白系统的生物粘附力,这暗示2%
PEG可能不会影响在pH 7时由HP造成的生物粘附力。总之,在图6中所示的结果指示,与在COSOPT®制剂中存在的聚合物相比,低浓度的HP的生物粘附强度是相对显著的。所述生物粘附现象可能非常有助于增加药物的眼睛生物利用度。
结论
综上所述,通过生物粘附的粘度测定评估方法产生的数据暗示,超支化聚合物是可以与眼睛粘蛋白强烈地相互作用的生物粘附添加剂材料。在粘蛋白和HP之间的这些生物粘附力最终会导致药物的眼睛生物利用度的增加。
实验实施例3
就含有HP(Lupasol®PS)和聚山梨酯80或PEG和聚山梨酯80的组合的新的制剂而言,在pH 5.65和pH 7时,多佐胺在有噻吗洛尔存在下的水溶解度。
方法
制备盐酸多佐胺和0.5% (w/v)噻吗洛尔在pH
5.65的柠檬酸盐缓冲溶液中的混悬液(对照样品)。还在含有2% (w/v)的HP(在pH 3的柠檬酸盐缓冲液中)的水溶液中制备类似的混悬液。加入HP以后,用1 M
NaOH将最终的pH调至5.65(样品1)。还尝试了根据表3的在pH 5.65时的不同分子量PEG和聚山梨酯80的组合。表3表明,所有不同的测试样品混悬液在10 mM柠檬酸盐缓冲液中制备。
表3:在pH 5.65在柠檬酸盐缓冲液中和在pH 7在磷酸盐缓冲液中制备的不同测试制剂。
| 含量(%v/w) | 对照样品 | 样品#1 | 样品#2 | 样品#3 | 样品#4 | 样品#5 | 样品#6 | 样品#7 | 样品#8 |
| 盐酸多佐胺 | >2.22 | >2.22 | >2.22 | >2.22 | >2.22 | >2.22 | >2.22 | >2.22 | >2.22 |
| 马来酸噻吗洛尔 | 0.683 | 0.683 | 0.683 | 0.683 | 0.683 | 0.683 | 0.683 | 0.683 | 0.683 |
| Lupasol®PS (MW=750k) | - | 2 | - | - | - | - | - | - | - |
| PEG 200 | - | - | 2 | - | - | - | - | - | - |
| PEG 400 | - | - | - | 2 | - | - | - | - | - |
| PEG 2000 | - | - | - | - | 2 | - | - | - | - |
| PEG 3350 | - | - | - | - | - | 2 | - | - | - |
| PEG 4000 | - | - | - | - | - | - | 2 | - | - |
| PEG 8000 | - | - | - | - | - | - | - | 2 | - |
| PEG 20000 | - | - | - | - | - | - | - | - | 2 |
| 聚山梨酯80 | - | - | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| 在10 mM柠檬酸盐或磷酸盐缓冲液中 | 调节pH至5.65/7 | 调节pH至5.65/7 | 调节pH至5.65/7 | 调节pH至5.65/7 | 调节pH至5.65/7 | 调节pH至5.65/7 | 调节pH至5.65/7 | 调节pH至5.65/7 | 调节pH至5.65/7 |
类似地,就要测试多佐胺在pH 7时在磷酸盐缓冲液(而不是柠檬酸盐缓冲液)中的溶解度的制剂而言,再在10 mM磷酸盐缓冲液中制备制剂(表3)。首先将混悬溶液在室温搅拌10 min(加热至60℃持续5分钟)。在使所述混悬液在室温平衡另外30分钟以后,再将所述悬浮溶液声处理10分钟,最后通过0.45µm注射器式滤器进行过滤。使用与实验实施例1相同条件的UPLC,分析滤液的多佐胺和噻吗洛尔浓度。
结果和讨论
在该实验中,发明人使用HP、PEG和聚山梨酯80作为溶解度增高剂添加剂。在pH 5.65和pH 7尝试了不同的组合。如图7所示,证实了在pH 5.65和pH 7时,在有噻吗洛尔存在下,与没有添加剂的对照样品相比,多佐胺的溶解度随着添加剂的加入而增加。在pH 5.65时,在所有情况下,多佐胺的溶解度大于2%,因此,在有噻吗洛尔存在下,HP或PEG与聚山梨酯80组合的加入增加了多佐胺的溶解度。
尽管市售的COSOPT®产品具有在pH
5.65时的2% (w/v)多佐胺,通过加入HP或PEG来增加在pH 5.65时的溶解度(超过2% (w/v)多佐胺溶解度)将不会通过增加剂量从而对药物的效力增强产生有用的促进。因而,在pH 7时的溶解度数据是更重要的,在此时,多佐胺在10 mM磷酸盐缓冲液中具有差的溶解度(小于0.5%
w/v溶解度)。还注意到,在加入添加剂的情况下,噻吗洛尔在制剂样品(各自精确地含有0.5%
w/v噻吗洛尔)中的溶解度在pH 5.65和pH 7时没有变化。因为COSOPT®是在pH
5.65配制的,通过在pH 5.65向制剂样品中加入不同浓度的不同HP定量了在有噻吗洛尔存在下的多佐胺溶解度。结果显示在图7中。如该条形图所示,在pH 5.65和pH 7,随着HP浓度从0.5% (w/v)增加至2%
(w/v),多佐胺溶解度线性地增加。但是,与pH 7相比,在pH 5.65时HP对多佐胺的溶解度增加的影响更显著。如图8所示,向HP中加入聚山梨酯80会增加多佐胺溶解度。
在pH 5.65时,在加入HP或PEG与聚山梨酯80的组合的情况下,多佐胺在有噻吗洛尔存在下的水溶解度的改善是显著的。在该情况下,聚山梨酯80有助于分散多佐胺分子,并抑制在有PEG存在下在水中的沉淀。在pH 7时,HP和聚山梨酯80的组合是用于增加多佐胺在有噻吗洛尔存在下的溶解度的最佳组合。从所述结果可以得出结论,在pH 7时,HP和聚山梨酯80会显著增加多佐胺在有噻吗洛尔存在下的溶解度。还证实亲水性PEG是多佐胺溶解度增高剂。此外,还证实低浓度的聚山梨酯80和PEG 8000的组合是用于增加多佐胺溶解度的非常有用的添加剂。总之,具有优化浓度的HP和聚山梨酯的在pH 7的制剂可以非常有用地增加眼睛生物利用度。
结论
所述结果清楚地指示在接近生理pH的pH值时使用HP和聚山梨酯80作为多佐胺溶解度增高添加剂的优点,所述优点更有助于约1% (w/v)多佐胺穿过角膜的渗透。还证实,聚山梨酯80是有效的乳化剂,其会抑制难溶的多佐胺在有HP存在下在pH 7时的沉淀。
实验实施例4
就含有HP(Lupasol®PS)和聚山梨酯80的新的局部制剂而言,多佐胺和噻吗洛尔的体外角膜渗透研究。
进行关于多佐胺和噻吗洛尔(COSOPT®的活性成分)的角膜渗透的体外实验,以研究在pH
5.65时与原始的市售局部制剂(仅有活性成分)相比,0.5% (w/v) HP的加入或0.5% (w/v) HP和1%
(w/v)聚山梨酯80的加入的影响。
材料和方法
实验方法
1. 制剂制备:在10 mM柠檬酸盐缓冲液中配制下述3种溶液,用于检查多佐胺和噻吗洛尔的体外角膜渗透,以及确定角膜水解效应。
通过0.45µm滤器式注射器过滤样品。通过UPLC分析确定两种样品的初始浓度。从实验数据得出下述推论:
a)仅HP(来自测试1和测试2数据对比)。
b)聚山梨酯80(测试2和测试3对比)对角膜渗透的重要性。
c)HP + 聚山梨酯80组合的重要性(来自测试1、测试2、测试3数据对比)。
2. 体外兔角膜渗透实验
表4:用于体外角膜渗透实验的受体溶液组合物。
3只雄性兔子(新西兰)重为3-4磅。兔龄为11-12周。在用过量的二氧化碳气体处死以后,立即摘出眼,用盐水洗涤,并分离角膜以用于渗透实验中。用新鲜制备的受体溶液(表4)冲洗每个角膜,以去除过量的污渍。以使角膜上皮表面面向供体隔室的方式,将6个完整的且新鲜的角膜固定在所有玻璃并排扩散池的有卡箍的供体和受体隔室之间。图9显示了在该实验中使用的简单扩散池的示意图。
可用于渗透的角膜面积是0.211 cm2。给受体隔室装入新鲜制备的pH
7.2的受体溶液(按照表4所述的组合物)。将样品#1的等分试样(5 mL)置于2个完整角膜上,并用玻璃盖玻片密封供体池的开口。在样品#1施用10分钟以后,将样品#2的等分试样(5 mL)施用在接下来的2个完整角膜上。再在10分钟以后,将样品#3等分试样(5 mL)施用在剩余的2个完整角膜上。在所有6种情况下,使用恒定搅拌,通过水套将受体流体(在每个受体池中,5 mL)保持在34℃的恒定温度。在10、20、40、60、80、100、120、140、160和180分钟的预定时间间隔,从受体溶液中取出200 μL样品。此后,将相同量的磷酸盐缓冲溶液加入到受体池中。通过UPLC测定药物浓度。
3. 分析
多佐胺和马来酸噻吗洛尔的检测条件是:梯度1% (v/v)三乙胺(TEA)水溶液:乙腈方法,在室温进行,流速为0.7 mL/min,在254
nm和298 nm波长,注射体积1 μL,在BEH C 18 1.7 μm、2.l x 50 mm柱上。
4. 角膜渗透参数计算
在实验结束时,在去离子水中浸泡以后,称量每个角膜(没有粘着的巩膜)。将湿角膜在烘箱中干燥过夜,并重新称重。从重量差计算出角膜水化(corneal
hydration)。将最终的药物渗透结果表示为累积渗透量(Q)。计算的参数如下:
i= 取样数目(1-10),浓度(t0)= 0
dQ/dt [ng/cm2/min]
累积量曲线的斜率
td
[min]
在时间轴上的截距
扩散系数(D)[cm2/秒]
h
[cm]
角膜厚度:0.04 [cm]
Cd
[ng/mL]
在供体溶液中的初始药物浓度。
结果和讨论
通过UPLC确定的多佐胺和噻吗洛尔的初始浓度在表5中给出。
表5:测试制剂的初始浓度。
| 样品 | 多佐胺(mg/mL) | 噻吗洛尔(mg/mL) |
| 测试1 | 23.02 | 4.70 |
| 测试2 | 21.48 | 4.51 |
| 测试3 | 22.21 | 4.72 |
基于角膜的净湿重和干重测量角膜水化。通常,正常哺乳动物的角膜的% (w/w)水化是在75-80%范围内。总之,所有测试样品的%水化没有显著变化,在所有情况下,它们是在期望的范围内。因而,HP或聚山梨酯80对角膜水化没有影响。
表6:角膜水化百分比计算。
| 样品 | 最终净湿重(g) | 最终净干重(g) | % (w/w)角膜水化 |
| 测试1 | 0.0107 | 0.0017 | 84.11 |
| 测试1 | 0.0112 | 0.0019 | 83.06 |
| 测试2 | 0.0123 | 0.0023 | 80.16 |
| 测试2 | 0.0133 | 0.0023 | 82.70 |
| 测试3 | 0.0150 | 0.0024 | 84.00 |
| 测试3 | 0.0053 | 0.0012 | 77.40 |
图10和11分别揭示了多佐胺和噻吗洛尔的角膜渗透特性。在34℃,仔细地检查了多佐胺和噻吗洛尔的透过分离的兔角膜的时间依赖性的渗透。与没有添加剂的对照样品相比,含有0.5%
(w/v) HP的测试制剂具有相对更高的渗透穿过角膜的多佐胺累积总量和在3小时以后渗透的总量。此外,聚山梨酯80连同HP一起加入会增加角膜渗透,与仅含有HP的制剂相比,渗透更多量的多佐胺。总之,0.5%
(w/v) HP和1% (w/v)聚山梨酯80的加入会使多佐胺和噻吗洛尔的角膜渗透速率增加约25-30%。也观察到噻吗洛尔的类似趋势(图11)。因而,HP和聚山梨酯80的组合会改善活性成分的角膜渗透。
图12显示了多佐胺和噻吗洛尔的总渗透百分比。显然,HP和聚山梨酯80的存在增加了渗透穿过角膜的活性成分(多佐胺和噻吗洛尔)的百分比。应当指出,所有测试制剂具有类似的多佐胺和噻吗洛尔初始浓度(小于10%变化)。因而,可容易地确定每种添加剂在类似的pH条件下的影响。在测试2和测试1的对比中,清楚地证实了使用HP作为添加剂的重要性。
图13显示了多佐胺和噻吗洛尔的角膜渗透系数。渗透系数与供体溶液中的药物初始浓度成反比。在多佐胺的情况下,测试2和测试3的渗透系数更高,这表明,与不含有HP的pH 5.65对照制剂(测试1)相比,在有0.5% HP存在下,多佐胺具有增加的角膜渗透速率。测试3具有比测试2相对更高的角膜渗透性,由此指示聚山梨酯80的影响。聚山梨酯80可能起粘度增高剂的作用,由此增加多佐胺和噻吗洛尔在角膜渗透方面的生物利用度。总之,来自图13的数据清楚地指示,与在pH 5.65的没有HP的对照测试1(类似于COSOPT®活性成分制剂)相比,分别含有HP和HP与聚山梨酯80的制剂测试2和3具有更高的噻吗洛尔和多佐胺渗透系数。
HP和聚山梨酯80的加入没有显著改变多佐胺和噻吗洛尔的扩散系数(其与延迟时间成反比)(参见图14)。因而,HP和聚山梨酯80对角膜表面没有任何影响。如果扩散系数已经显著增加或降低了,它将会指示角膜表面性质的变化。因为扩散系数是药物化合物的固有性质,它不应当随着添加剂的加入而变化。
HP会促进噻吗洛尔和多佐胺的包封,并因而增加噻吗洛尔向角膜上皮中的分配。该理论也得到图15中的数据的支持。与测试1相比,噻吗洛尔和多佐胺在角膜表面的分配系数在测试3中更高,这指示在有0.5% (w/v)高度官能化的HP存在下,噻吗洛尔和多佐胺向亲脂性角膜中的分配的改善。因而,在有HP存在下改善的渗透主要是因为改善的向上皮的分配。通过增加制剂溶液中的HP的浓度,可以进一步增加所述分配。HP会增加角膜渗透,主要是因为:a)分子包封在高度官能化的聚乙烯亚胺的分支结构内,b)药物分子和HP的离子官能胺基团之间的静电相互作用,和c)带电荷的HP的粘膜粘着性能。
0.5%
(w/v) HP和1% (w/v)聚山梨酯80的加入使多佐胺和噻吗洛尔的角膜渗透速率增加了约25-30%。HP的存在增加了在pH 5.65时多佐胺和噻吗洛尔向角膜中的分配。HP和聚山梨酯80的加入没有显著改变角膜扩散速率和角膜水化速率,这提示这些添加剂对角膜表面没有有害影响。在有HP存在下,多佐胺和噻吗洛尔的角膜渗透系数相对更高,这提示HP作为有效的药物载体添加剂的重要性。因而,发明人发现了与当前的市售产品相比具有增加的角膜渗透的新的制剂。通过增加HP的浓度可以进一步增加角膜渗透。
结论
与没有添加剂的对照制剂(COSOPT®活性成分制剂)相比,在有诸如HP等添加剂存在下,多佐胺和噻吗洛尔在pH
5.65时的累积渗透量相对更高。向制剂中加入0.5% (w/v) HP和1% (w/v)聚山梨酯80使多佐胺和噻吗洛尔的角膜渗透速率增加了约25-30%。在有HP存在下,活性成分向角膜上皮中的分配增加了。因而,HP和聚山梨酯80的组合可以非常有效地增加COSOPT®活性成分的眼睛生物利用度。
实验实施例5
在pH 7磷酸盐缓冲液中,布林佐胺在含有HP(Lupasol®PS)或HP和聚山梨酯80组合或PEG和聚山梨酯80组合的水溶液中的溶解度的增加。
在pH 7于10 mM磷酸盐缓冲液中研究了布林佐胺在有噻吗洛尔存在下的水溶解度。
方法
表7:在pH 7的磷酸盐缓冲液中制备的不同测试制剂
| 含量(%v/w) | 对照样品 | 样品#1 | 样品#2 | 样品#3 | 样品#4 | 样品#5 | 样品#6 | 样品#7 | 样品#8 |
| 布林佐胺 | 1 | >1 | >1 | >1 | >1 | >1 | >1 | >1 | >1 |
| Lupasol®PS(MW=750k) | - | 0.5 | 1 | 2 | 0.5 | 1 | 2 | - | - |
| PEG 400 | - | - | - | - | - | - | - | 2 | - |
| PEG 8000 | - | - | - | - | - | - | - | - | 2 |
| 聚山梨酯80 | - | - | - | - | 1 | 1 | 1 | 1 | 1 |
| 在10 mM柠檬酸盐或磷酸盐缓冲液中(加入1M NaOH) | 调节pH至7 | 调节pH至7 | 调节pH至7 | 调节pH至7 | 调节pH至7 | 调节pH至7 | 调节pH至7 | 调节pH至7 | 调节pH至7 |
制备了布林佐胺在磷酸盐缓冲液中的混悬液(含有1% (w/v)),作为对照样品。还在含有HP、PEG和聚山梨酯80的不同组合(按照上面的表7)的水溶液(10 mM磷酸盐缓冲液)中制备了含有过量布林佐胺(> 1% (w/v))的类似混悬液。用1 M NaOH将最终的pH调至7。首先将所述混悬溶液在室温搅拌10 min(加热至60℃持续5分钟)。在使混悬液在室温平衡另外30分钟以后,再将所述混悬溶液声处理10
min,最后通过0.45µm注射器式滤器进行过滤。使用与实验实施例1相同条件的UPLC分析滤液的布林佐胺浓度。
结果和讨论
图16显示了布林佐胺在不同pH值的10 mM磷酸盐缓冲液中的溶解度。显然,随着pH从4增加至7,布林佐胺的水溶解度下降。布林佐胺的溶解度在pH 7时最小,这与在pH 7时完全非离子性能相一致。因为布林佐胺的离子化百分比随着pH从8.4增加至10而增加,溶解度陡然增加,这与布林佐胺在该pH范围中的阴离子性质相一致。所述溶解度性质与多佐胺非常类似。因此,重要的是,开发出在pH 7.4附近(泪液的pH是7.44)具有增加的溶解度的亲脂性布林佐胺药物,以便增加布林佐胺的眼睛生物利用度和减少眼刺激现象。
在该研究中,发明人使用HP、PEG和聚山梨酯80作为溶解度增高剂添加剂。在pH 7尝试了不同组合。在图17中,显示了布林佐胺溶解度随着添加剂的加入而增加。
如图17所示,在两种情况下(有和没有噻吗洛尔),布林佐胺溶解度随着HP的浓度的增加而增加。在没有噻吗洛尔且有0.5% (w/v) HP和1% (w/v)聚山梨酯80存在下,布林佐胺溶解度是约11 mg/mL。与PEG
400相比,PEG 8000的加入似乎更能增加布林佐胺的溶解度。但是,对照溶液以及所有含有0.5%
(w/v)噻吗洛尔的具有添加剂的制剂的溶解度相对更低。因而,噻吗洛尔(其在pH 7时比布林佐胺相对更可溶于水中)通过它在局部制剂样品中的存在对布林佐胺的水溶解度产生影响。这些结果与关于称作多佐胺的另一种碳酸酐酶的结果(实验实施例1)非常类似。由高度可溶性的离子型噻吗洛尔导致的在pH 7时的溶解度下降可能是由于噻吗洛尔的加入造成的溶液离子强度的变化或盐析效应。尽管市售的AZARGA®产品具有在pH 7.4的布林佐胺10 mg/mL+噻吗洛尔5 mg/mL眼用混悬液,通过加入HP或PEG来增加在pH 7时的溶解度将会有助于药物的效力增强(通过使剂量增加至大于1%)。
向HP中加入聚山梨酯80会通过阻止沉淀而增加布林佐胺溶解度。聚山梨酯80可能起表面活性剂的作用,由此减少在有HP存在下相分离以后的布林佐胺聚集。在有0.5% (w/v)噻吗洛尔制剂存在下,在pH 7时,0.5% (w/v) HP和1%
(w/v)聚山梨酯的组合可以是非常有效的。
在pH 7时,在加入HP或PEG与聚山梨酯80的组合的情况下,布林佐胺在有噻吗洛尔存在下的水溶解度的改善是显著的。聚山梨酯80有助于分散布林佐胺分子,并抑制在有PEG存在下在水中的沉淀。就在有噻吗洛尔存在下增加布林佐胺在pH 7的溶解度而言,HP和聚山梨酯80的组合可以是良好的组合。从所述结果可以得出结论,HP和聚山梨酯80会显著增加疏水性布林佐胺在有噻吗洛尔存在下在pH 7时的溶解度。还证实亲水性PEG是布林佐胺溶解度增高剂。此外,还证实低浓度的聚山梨酯80和PEG
8000的组合就增加疏水性布林佐胺的溶解度而言是非常有用的添加剂。总之,具有优化的浓度的HP和聚山梨酯80的在pH 7的制剂可以非常有用地增加眼睛生物利用度。
结论
所述结果清楚地指示在接近生理pH的pH值时使用HP和聚山梨酯80作为疏水性布林佐胺溶解度增高添加剂的优点。还证实,聚山梨酯80是有效的乳化剂,其会抑制难溶性的布林佐胺在有HP存在下在pH 7时的沉淀。噻吗洛尔可能通过改变溶液的离子强度而影响布林佐胺溶解度。
实验实施例6
含有具有末端羟基的HP的多佐胺和噻吗洛尔的体外角膜渗透研究。
进行关于多佐胺和噻吗洛尔(COSOPT®的活性成分)的角膜渗透的体外实验,以研究与原始的市售局部制剂(仅活性成分)相比,具有羟基官能团的超支化聚酯的加入的影响。
新的制剂含有称作Boltorn®H20的可商业得到的HP。Boltorn®H20的一般定义是具有聚酯核心和16个末端羟基官能团的HP。它会增加在pH 7或pH 7.4配制的非离子型(亲脂性)多佐胺的溶解度。
具有羟基末端基团的超支化聚酯的一般结构。
在该实施例中使用的HP的性质在表8中列出。它具有16个伯羟基/分子。固体含量是100% (w/v)。
表8:在该实施例中使用的HP的性质。
| 聚合物名称 | 粘度(cP) | 分子量(道尔顿) | 多分散度 | pH | 分配系数 |
| Boltorn®H20 | 7 | 2100 | 1.3 | 2.5-4 | -0.2 log POW |
从含有最多2% (w/v) HP的新的制剂确定了多佐胺和噻吗洛尔的体外跨角膜渗透。还确定了HP的浓度对活性成分的影响。使用在pH 7.4的含有COSOPT®活性成分的标准溶液作为对照样品。
材料和方法
制剂制备
配制了在0.1% (w/v)磷酸盐缓冲液中的下述3种溶液(表9),用于检查多佐胺和噻吗洛尔的体外角膜渗透,以及用于确定角膜水解效应。
表9:测试制剂的组成。
| 含量(% w/v) | 对照样品#1 | 测试样品#2 | 测试样品#3 |
| 盐酸多佐胺 | 1 | 1 | 1 |
| 马来酸噻吗洛尔 | 0.683 | 0.683 | 0.683 |
| Boltorn®H20 | --- | 0.5 | 2 |
| 1M NaOH/ 1M HCl | 调节pH至7.4 | 调节pH至7.4 | 调节pH至7.4 |
| 外观 | 混悬液 | 混悬液 | 混悬液 |
首先,将10 mM磷酸盐缓冲液加入到固体活性成分的适当地称重的物料中,并彻底搅拌15分钟。其次,将有效体积的5% (w/v) HP混悬溶液加入到测试样品2和测试样品3中,以补足在表9中描述的精确浓度。
然后将3种测试溶液在室温搅拌10分钟(加热至60℃持续5分钟)。搅拌以后,将所述溶液声处理5分钟。除了对照溶液(对照样品#1)以外,含有HP的溶液在调节pH以前是白色浆状混悬液。在完全稀释所有活性成分和非活性成分以后,使用1 M NaOH或1 M HCl将pH调至7.4,并加入额外的缓冲液,以补足如表8所示的精确组成。在调节pH的情况下,在所有情况下形成混悬溶液,通过在室温搅拌另外的15小时或更久将其平衡。再次测量所有样品溶液的pH以确认最终的期望的pH。
这些混悬溶液直接地用作样品供体溶液,用于角膜渗透研究。为了确定溶解度,通过0.45µm注射器式滤器过滤混悬液。在用超纯水稀释(稀释因子= 1000)每个样品以后,使用UPLC分析滤液的多佐胺和噻吗洛尔浓度。还将体外角膜渗透特性结果与来自实验实施例4的含有活性成分的对照样品在pH 5.65得到的数据进行对比。
3只雄性兔子(新西兰)重为2-3 kg。在用过量的吸入异氟烷处死以后,立即摘出眼,并分离角膜以用于渗透实验。实验操作的细节描述在先前的实验实施例4中。
计算的参数按照在实验实施例4中所述进行计算,其中Cd
[ng/mL]是供体溶液中的活性药物成分的初始药物浓度(表10)。
结果和讨论
通过UPLC确定的多佐胺和噻吗洛尔的初始浓度在表10中给出。角膜水化百分比计算结果在表10中给出。
表10:测试制剂的初始浓度。
| 样品 | 多佐胺(mg/mL) | 噻吗洛尔(mg/mL) |
| 测试1 | 4.69 | 4.7 |
| 测试2 | 6.6 | 4.5 |
| 测试3 | 8.9 | 4.7 |
表11:角膜水化百分比计算结果。
| 样品 | 最终净湿重(g) | 最终净干重(g) | % (w/w)角膜水化 |
| 测试1 | 0.0104 | 0.0020 | 80.7 |
| 测试1 | 0.0124 | 0.0022 | 82.2 |
| 测试2 | 0.0117 | 0.0025 | 78.6 |
| 测试2 | 0.0126 | 0.0024 | 80.9 |
| 测试3 | 0.0146 | 0.0029 | 80.1 |
| 测试3 | 0.0113 | 0.0026 | 76.9 |
基于角膜的净湿重和干重测量角膜水化。通常,正常哺乳动物的角膜的%水化是在75-80%范围内。总之,所有测试样品的%水化没有显著变化,并且在所有情况下,它们是在期望的范围内。因而,HP对角膜水化没有影响。
图18和19分别揭示了多佐胺和噻吗洛尔的角膜渗透特性。还与测试样品1、2和3得到的渗透特性一起,绘制了来自实验实施例4的在pH 5.65时的对照样品渗透特性。在34℃,仔细地检查了多佐胺和噻吗洛尔的透过分离的兔角膜的时间依赖性的渗透。与没有添加剂的对照样品相比,含有0.5%
(w/v) HP(测试2)和2%
(w/v) HP(测试3)的测试制剂具有相对更高的渗透穿过角膜的多佐胺累积总量和在2小时以后渗透的总量。此外,从0.5% HP增加至2% HP的浓度,表现出两种活性成分的角膜渗透的增加。在pH 5.65时,在含有2%
(w/v) HP的制剂(实验3)中,活性成分的角膜渗透高于市售产品COSOPT®(在制剂中仅有活性成分)(参见图19和图20)。另外,含有2% (w/v) HP的制剂会在2小时以后提供显著增加的角膜渗透,具有更高的渗透速率(斜率的变化)。
总之,具有羟基官能团的HP的加入会随着HP的浓度的增加而显著地增加多佐胺和噻吗洛尔的角膜渗透速率。因而,与用于青光眼治疗的称作COSOPT®或TRUSOPT®或AZOPT®的市售产品相比,HP改善了活性成分的角膜渗透。
图20显示了在2小时以后的多佐胺和噻吗洛尔的总渗透百分比。显然,HP的存在增加了渗透穿过角膜的活性成分(多佐胺和噻吗洛尔)的百分比。应当指出,所有测试制剂具有不同的多佐胺初始浓度和类似的噻吗洛尔浓度(小于10%变化)。不同的多佐胺初始溶解度主要是因为HP导致的增加的溶解度。在测试2和测试3与测试1的对比中,从图20清楚可见使用HP作为添加剂的重要性。使用来自图19和20的直至2小时的斜率以便确定角膜渗透性、分配系数和扩散系数。
图21显示了多佐胺和噻吗洛尔的角膜渗透系数。渗透系数与供体溶液中的药物初始浓度成反比。在两种活性成分的情况下,测试2和测试3的渗透系数更高,这表明与不含有HP的对照制剂(测试1)相比,在有HP存在下,多佐胺具有增加的角膜渗透速率。测试3具有比测试2相对更高的角膜渗透性,由此指示增加HP浓度的影响。总之,来自图21的数据清楚地指示,与在pH 7.4的没有HP的对照测试1和在pH 5.65的COSOPT®对照制剂(类似于COSOPT®活性成分制剂)相比,含有HP的制剂测试2和3具有更高的噻吗洛尔和多佐胺的渗透系数。
HP的加入没有显著改变多佐胺和噻吗洛尔的扩散系数(其与延迟时间成反比)(参见图22)。因而,HP对角膜表面没有任何影响。如果扩散系数已经显著增加或降低了,它会指示角膜表面性质的变化。因为扩散系数是药物化合物的固有性质,它不应当随着添加剂的加入而变化。
HP会促进噻吗洛尔和多佐胺的包封,并因而增加噻吗洛尔和多佐胺向角膜上皮中的分配。该理论也得到图23中表明的数据的支持。与测试1相比,噻吗洛尔和多佐胺在角膜表面的分配系数在测试2和3中更高,这指示在有高度官能化的(羟基)HP存在下噻吗洛尔和多佐胺向亲脂性角膜中的分配的改善。因而,在有HP存在下改善的渗透主要是因为改善的向上皮的分配。通过使制剂溶液中的HP浓度从0.5%(w/v)增加至2% (w/v),可以进一步增加所述渗透。但是,增加HP浓度不会显著改变分配系数和渗透系数,因为这些参数将不会成物质的浓度的函数。
与没有添加剂的对照制剂相比,在有HP添加剂(诸如可商业得到的具有羟基官能团的Boltorn®H20)存在下,多佐胺和噻吗洛尔在pH 7.4的累积渗透量相对更高。制剂中的这样的HP的浓度的增加会显著增加多佐胺和噻吗洛尔的角膜渗透速率。在有HP存在下,多佐胺和噻吗洛尔的角膜渗透系数相对更高。在有HP存在下,活性成分向角膜上皮中的分配增加。因而,具有羟基官能团的HP可以非常有效地增加COSOPT®活性成分的眼睛生物利用度。
实验实施例7
研究了碳酸酐酶抑制剂(诸如多佐胺和布林佐胺)在有HP和噻吗洛尔存在下在pH 7.4在10 mM磷酸盐缓冲液中的水溶解度。使用了称作Boltorn®W3000的HP。该HP的末端官能团是PEG(亲水的)和不饱和的长链脂肪酸。在该实施例中使用的超支化聚酯的模型如下所示。
具有两亲性端基的超支化聚酯。
在该实验中使用的HP的性质如表12所述。所述HP具有50个伯羟基/分子,并且固体含量是55% (w/w)。
表12:在该研究中使用的HP的性质。
| 聚合物名称 | 粘度(mPa-s) | 分子量(道尔顿) | 多分散度 | pH | 酸值(mg KOH/g) |
| Boltorn®W3000 | 125 | 9000 | 1.3 | 3-5 | 10(最大值) |
表13显示了在pH 7.4的10 mM磷酸盐缓冲液中制备的不同的测试样品制剂。
表13:在pH7的磷酸盐缓冲液中制备的不同的测试制剂。
| 含量(%w/v) | 对照样品 | 样品#1 | 样品#2 | 样品#3 | 样品#4 | 样品#5 | 样品#6 |
| CAI | >1 | >1 | >1 | >1 | >1 | >1 | >1 |
| Boltorn®W 3000 | - | 0.1 | 0.5 | 1 | 2 | 5 | 2 |
| 马来酸噻吗洛尔 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 |
| HPMC | - | - | - | - | - | - | 0.5 |
| 在10 mM磷酸盐缓冲液中(加入1M NaOH) | 调节pH至7.4 | 调节pH至7.4 | 调节pH至7.4 | 调节pH至7.4 | 调节pH至7.4 | 调节pH至7.4 | 调节pH至7.4 |
如下制备乳剂:将水缓慢地分散在称量的量的蜡状的Boltorn®W3000中以制备5% (w/v)乳剂,并继续搅拌和在60-70℃加热至少30分钟,随后继续剧烈搅拌另外15小时,以在烧瓶中得到均匀的乳剂混合物。
将10 mM磷酸盐缓冲液加入到固体活性成分的适当地称重的物料中,并彻底搅拌15分钟。其次,将有效体积的5% (w/v) HP乳剂溶液适当地稀释以补足在表13中描述的精确浓度。然后将样品测试乳剂溶液在室温搅拌10分钟(加热至60℃持续5分钟)。搅拌以后,将所述乳剂溶液声处理5分钟。在完全乳化所有活性成分和非活性成分以后,使用1 M NaOH将pH调至7.4,并加入额外的缓冲液以补足表13中的精确组成。在调节pH的情况下,在室温搅拌另外15小时或更久以将乳剂溶液进一步平衡。再次测量所有样品乳剂溶液的pH,以确认最终的期望的pH
7.4。使用与实验实施例1相同条件的UPLC分析滤液的CAI浓度。
结果和讨论
在该实验中,使用两亲的自乳化的HP作为溶解度增高剂添加剂。在pH
7.4,尝试了不同浓度的HP。
在图24中,显示了布林佐胺和多佐胺的溶解度随着HP的浓度的增加而增加。在有0.5% (w/v)噻吗洛尔和5%
(w/v) HP存在下,多佐胺和布林佐胺的溶解度是约2% (w/v)的CAI。向2% (w/v) HP中加入HPMC没有增加溶解度。尽管市售的AZARGA®混悬液产品具有在pH 7.4的1% (w/v)布林佐胺,并且COSOPT®具有在pH
5.65的2% (w/v)多佐胺,通过加入HP来增加在pH 7.4时的溶解度将有助于药物的效力增强(通过使剂量增加至大于1%
(w/v))。因此,重要的是,开发出在pH 7.4附近(泪液的pH是7.4)具有增加的溶解度的布林佐胺或多佐胺以便增加CAI的眼睛生物利用度和减少眼刺激现象。
实验实施例8
含有具有两亲官能团的HP(Boltorn®W3000)的多佐胺和噻吗洛尔的体外角膜渗透研究。
进行关于多佐胺和噻吗洛尔(COSOPT®的活性成分)的角膜渗透的体外实验,以研究与原始的市售局部制剂(仅活性成分)相比,具有两亲官能团的HP的加入的影响。
新的局部制剂含有Boltorn®W3000(超支化聚酯),所述Boltorn®W3000具有作为亲水官能团的非离子PEG和作为疏水官能团的不饱和脂肪酸(可商业得到的),因而使它成为两亲的。通过在pH
7.41加入2% (w/v)的该HP,使多佐胺的溶解度从4.3 mg/mL增加至15
mg/mL。在该实验中,从含有最多2% (w/v) HP(其与COSOPT®相当)的新的制剂确定了多佐胺和噻吗洛尔的体外跨角膜渗透。还确定了HP的浓度对活性成分的影响。使用在pH 7.4的含有COSOPT®活性成分的标准溶液作为对照样品。
材料和方法
1. 制剂制备
配制了在0.1% (w/v)磷酸盐缓冲液中的下述3种溶液(表14),用于检查多佐胺和噻吗洛尔的体外角膜渗透,以及用于确定角膜水解效应。
表14:测试制剂的组成。
| 含量(% w/v) | 测试1 | 测试2 | 测试3 |
| 盐酸多佐胺 | 1.5 | 1.5 | 2.22 |
| 马来酸噻吗洛尔 | 0.638 | 0.683 | 0.683 |
| Boltorn®W3000 | - | 2 | - |
| 1 M NaOH/ 1 M HCl | 调节pH至7.4 | 调节pH至7.4 | 调节pH至5.65 |
| 外观 | 混悬液 | 乳液 | 澄清溶液 |
将10 mM磷酸盐缓冲液加入到固体活性成分的适当地称重的物料中,并彻底搅拌15分钟。其次,将有效体积的5% (w/v) HP混悬溶液加入到测试2中,以补足在表14中描述的精确浓度。然后将3种测试溶液在室温搅拌10分钟(加热至60℃持续5分钟)。搅拌以后,将所述溶液声处理5分钟。在完全稀释所有活性成分和非活性成分以后,使用1 M NaOH或1 M
HCl将pH调至7.4或5.65,并加入额外的缓冲液以补足表15中的精确组成。在调节pH的情况下,注意到外观如表14所示,并通过在室温搅拌另外15小时或更久将制剂进一步平衡。再次测量所有样品溶液的pH,以确认最终的期望的pH。这些制剂直接地用作样品供体溶液,用于角膜渗透研究。为了确定溶解度,通过0.45µm注射器式滤器过滤混悬液/乳液。在用超纯水稀释(稀释因子= 1000)每个样品以后,使用UPLC分析滤液的多佐胺和噻吗洛尔浓度。
2. 体外兔角膜渗透实验
在先前的实验实施例4中详细描述了要进行的实验操作和分析。计算的参数是在实验实施例4中所述的那些,其中Cd [ng/mL]是供体溶液中的活性药物成分的初始药物浓度(来自表15)。
结果和讨论
通过UPLC确定的多佐胺和噻吗洛尔的初始浓度在表15中给出。角膜水化百分比计算结果在表16中给出。
表15:测试制剂中的活性药物成分的溶解度。
| 样品 | 多佐胺(mg/mL) | 噻吗洛尔(mg/mL) |
| 测试1 | 4.6 | 4.7 |
| 测试2 | 15 | 4.7 |
| 测试3 | 20 | 4.7 |
表16:角膜水化百分比计算结果。
| 样品 | 最终净湿重(g) | 最终净干重(g) | % (w/w)角膜水化 |
| 测试1 | 0.0143 | 0.0028 | 80.41 |
| 测试1 | 0.0281 | 0.0044 | 84.34 |
| 测试2 | 0.0201 | 0.0035 | 82.59 |
| 测试2 | 0.151 | 0.0028 | 81.46 |
| 测试3 | 0.0265 | 0.0042 | 84.15 |
| 测试3 | 0.0257 | 0.0043 | 83.27 |
基于角膜的净湿重和干重测量角膜水化。通常,正常哺乳动物的角膜的%(w/w)水化是在75-80%范围内。测试1和3都高于80%。但是,分配和渗透系数的计算值没有差异,这提示更高的水化%不会产生任何角膜损伤。总之,所有测试样品的%水化没有显著变化,在所有情况下,它们是在期望的范围内。因而,HP似乎对角膜水化没有影响。
图25和26分别揭示了多佐胺和噻吗洛尔的角膜渗透特性。在34℃仔细地检查了多佐胺和噻吗洛尔的透过分离的兔角膜的时间依赖性的渗透。与没有添加剂的在pH
7.4的对照样品(测试1)相比,含有2%
(w/v) HP的测试制剂(测试2)具有相对更高的渗透穿过角膜的多佐胺累积总量和在2小时以后渗透的总量。测试2(新的制剂)的多佐胺的总渗透与测试3的多佐胺渗透特性相当。但是,应当指出,与在pH 5.65制备的市售产品相比,测试1对于患者而言可能更为舒适,因为它是在pH 7.4制备的。通过增加HP的浓度可以进一步增加渗透。
此外,不同于多佐胺,与具有类似水溶解度的测试1和3相比,测试2的噻吗洛尔渗透在有HP存在下显著增加(参见图26)。在pH 5.65时,在含有2% (w/v) HP的制剂(测试2)中,噻吗洛尔的角膜渗透几乎是市售产品COSOPT®(在制剂中仅活性成分)的2倍(参见图27)。该结果清楚地证实了使用HP作为多佐胺和噻吗洛尔的局部制剂的药物载体的重要性。
总之,具有两亲官能团的HP的加入会随着HP的浓度的增加而显著地增加多佐胺和噻吗洛尔的角膜渗透速率。因而,与用于青光眼治疗的称作COSOPT®或TRUSOPT®或AZOPT®的市售产品相比,具有两亲官能团的树枝状聚酯HP会改善活性成分的角膜渗透。
图27显示了在3小时以后的多佐胺和噻吗洛尔的总渗透百分比。显然,HP的存在增加了渗透穿过角膜的活性成分(多佐胺和噻吗洛尔)的百分比(参见测试2)。在pH 7.4制备的测试2具有稍微大于测试3(其在pH 5.65制备)的多佐胺总渗透%。应当指出,所有测试制剂具有不同的多佐胺初始浓度和类似的噻吗洛尔浓度。不同的多佐胺初始溶解度主要是因为HP导致的增加的溶解度。在测试2与测试3(pH 5.65)和测试1(pH 7.4)的对比中,图27证实了使用HP作为添加剂的重要性。使用来自图26和27的斜率以确定角膜渗透性、分配系数和扩散系数。
图28显示了多佐胺和噻吗洛尔的角膜渗透系数。渗透系数与供体溶液中的药物初始浓度成反比。在两种活性成分的情况下,与在pH
7.4和pH 5.65的对照样品相比,测试2的渗透系数更高,因而提示与不含有HP的对照制剂(测试1和3)相比,在有HP存在下,活性药物成分具有增加的角膜渗透速率。测试3具有比测试2相对更高的角膜渗透性,由此指示pH的影响。在生理pH的活性药物成分更有助于类似溶解度下的渗透。总之,来自图28的数据清楚地指示,与在pH
7.4的没有HP的测试1和在pH 5.65的COSOPT®对照制剂(类似于COSOPT®活性成分制剂)相比,含有HP的测试2的制剂具有更高的噻吗洛尔和多佐胺的渗透系数。
HP的加入没有显著改变多佐胺和噻吗洛尔的扩散系数(其与延迟时间成反比)(参见图29)。因而,HP对角膜表面没有任何影响。如果扩散系数已经显著增加或降低了,它会指示角膜表面性质的变化。因为扩散系数是药物化合物的固有性质,它不应当随着添加剂的加入而变化。
与测试1和3相比,噻吗洛尔和多佐胺在角膜表面的分配系数在测试2中更高,因而指示在有高度官能化的(两亲的)HP存在下,噻吗洛尔和多佐胺向亲脂性角膜中的分配的改善。因而,在有HP存在下改善的渗透主要是因为改善的向上皮的分配。通过使制剂溶液中的HP浓度从2% (w/v)增加至5% (w/v),可以进一步增加所述渗透。
在有HP添加剂(诸如可商业得到的具有两亲官能团的Boltorn®W3000(2% w/v))存在下,在pH 7.4时,多佐胺和噻吗洛尔的累积渗透量几乎是没有添加剂的在类似pH值的对照制剂的2倍。与在pH 5.65的市售产品相比,制剂中的这样的HP的浓度增加(大于2% (w/v))可以进一步显著增加多佐胺和噻吗洛尔的角膜渗透速率。所述新的局部制剂是在pH
7.4制备的,因而使它对患者而言更有益和更舒适。在有HP存在下,活性成分向角膜上皮中的分配增加。因而,具有两亲官能团的HP可以非常有效地增加COSOPT®活性成分的眼睛生物利用度。
实验实施例9
Bis-MPA聚酯超支化聚合物(BMPA-HP)或PEG和BMPA-HP的组合对碳酸酐酶抑制剂(CAI)的溶解度的增加。
研究了在有噻吗洛尔存在下,在pH 7.4时,官能化的超支化聚合物对CAI(诸如多佐胺和布林佐胺)在10 mM磷酸盐缓冲液中的水溶解度的影响。BMPA-HP的一般定义是具有二羟甲基丙酸(Bis-MPA)聚酯核心和末端羟基(OH)官能团的超支化聚合物。末端羟基官能团的数目取决于超支化聚酯的代(generation)。所述代由从核心至末端官能团的支化层数或支化程度来定义。例如,第2代BMPA超支化聚酯含有16个羟基,而第3代含有32个羟基。BMPA-HP的结构如下所示。
第
3
代超支化的
Bis-MPA
聚酯(第
3
代
BMPA-HP
)。
在该调查研究中使用的不同代的聚酯HP的性质在表17中列出。
表17:在该实验中使用的HP的性质。
| 聚合物名称 | 粘度(Pa-s) | 分子量(道尔顿) | 每个单体单元的羟基数 | pH |
| 第2代BMPA-HP | 0.007-0.25 | 1750 | 16 | 2.5-4 |
| 第3代BMPA-HP | 0.007-0.25 | 3600 | 32 | 2.5-4 |
材料和方法
表18显示了要在pH
7.4的10 mM磷酸盐缓冲液中制备的不同的测试样品乳液,对照溶液除外。
表18: 在pH 7.4的磷酸盐缓冲液中制备的不同测试制剂
| 含量(%w/v) | 对照样品 | 样品#1 | 样品#2 | 样品#3 | 样品#4 | 样品#5 | 样品#6 | 样品#7 |
| CAI | >1 | >1 | >1 | >1 | >1 | >1 | >1 | >1 |
| 第2代BMPA-HP | - | 0.1 | 0.5 | 1 | 2 | 5 | 2 | 2 |
| 马来酸噻吗洛尔 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 |
| PEG 8000 | - | - | - | - | - | - | 2 | 4 |
| 在10 mM磷酸盐缓冲液中(加入1M NaOH) | 调节pH至7.4 | 调节pH至7.4 | 调节pH至7.4 | 调节pH至7.4 | 调节pH至7.4 | 调节pH至7.4 | 调节pH至7.4 | 调节pH至7.4 |
| 含量(%w/v) | 样品#8 | 样品#9 | 样品#10 | 样品#11 | 样品#12 | 样品#13 | 样品#14 |
| CAI | >1 | >1 | >1 | >1 | >1 | >1 | >1 |
| 第3代BMPA-HP | 0.1 | 0.5 | 1 | 2 | 5 | 2 | 2 |
| 马来酸噻吗洛尔 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 |
| PEG 8000 | - | - | - | - | - | 2 | 4 |
| 在10 mM磷酸盐缓冲液中(加入1M NaOH) | 调节pH至7.4 | 调节pH至7.4 | 调节pH至7.4 | 调节pH至7.4 | 调节pH至7.4 | 调节pH至7.4 | 调节pH至7.4 |
将10 mM磷酸盐缓冲液加入到固体活性成分的适当地称重的物料中,并彻底搅拌15分钟。其次,将有效体积的5% (w/v) BMPA-HP溶液适当地稀释以补足在表18中描述的精确浓度。然后将样品测试溶液在室温搅拌10分钟(加热至60℃持续5分钟)。搅拌以后,将所述溶液声处理5分钟。在完全混悬所有活性成分和非活性成分以后,使用1 M NaOH将pH调至7.4,并加入额外的缓冲液以补足如表18所述的精确组成。在调节pH的情况下,通过在室温搅拌另外15小时或更久以进一步平衡混悬溶液。再次测量所有样品溶液的pH以确认为7.4的最终的期望的pH。使用与实验实施例1相同条件的UPLC分析滤液的CAI。
结果和讨论
在该实验中,使用第2代BMPA-HP或第3代BMPA-HP作为溶解度增高剂添加剂,并在pH 7.4测试了每种的不同浓度。重要的是,开发出在pH
7.4附近(泪液的pH是7.4)具有增加的溶解度的亲脂性布林佐胺或多佐胺药物以便增加CAI的眼睛生物利用度和减少眼刺激现象。在有0.5% 噻吗洛尔和5%第3代BMPA-HP存在下,多佐胺和布林佐胺的溶解度是大约1%
(w/v)的CAI。就类似浓度的用作所有样品的添加剂的第2代BMPA-HP而言,与第3代BMPA-HP相比,低级的第2代BMPA-HP使CAI的溶解度下降了小于10%。
当使用2% (w/v) PEG 8000和HP的组合时,CAI的溶解度急剧增加(是对照的4倍)。将2% (w/v) PEG 8000加入到2%
(w/v) BMPA-HP中会使CAI的溶解度几乎翻倍(参见图31)。
尽管市售的Azarga®混悬液产品具有在pH
7.4的1% 布林佐胺,并且COSOPT®具有在pH 5.65的2% (w/v)多佐胺,通过加入BMPA-HP来增加在pH 7.4时的溶解度将会有助于药物的效力增强(通过使剂量增加至大于1% (w/v))。
所述结果清楚地指示在接近生理pH的pH值时使用BMPA-HP作为疏水的CAI溶解度增高剂的优点。向含有BMPA-HP的溶液中加入PEG会进一步改善CAI的溶解度。
实验实施例10
确定Bis-MPA超支化聚酯的眼刺激的人角膜上皮(HCE)组织培养研究,和基于细胞的细胞毒性的眼睛研究的优化的样品施用时间。
方法和材料
在盐水磷酸盐缓冲液(AZOPT®除外)中,根据下表19制备样品,并使用0.2µm无菌的注射器式滤器除菌。使用0.02% BAK作为阳性对照。重建的人角膜上皮购自皮肤伦理学实验室(Skin
Ethics laboratory)(法国)。
表19:样品集合。
| 含量(%w/v) | 空白样品 | +媒介物对照 | -媒介物对照 | 样品#1 | 样品#2 | 样品#3 | 样品#4 | 样品#5 |
| 磷酸盐盐水(pH 7.4) | 一式三份 | - | - | - | - | - | - | - |
| 0.02% 苯扎氯铵i | - | 一式三份 | - | - | - | - | - | - |
| 3% Bis MPA第3代 | - | - | 一式三份 | - | - | - | - | - |
| 4% Bis MPA第3代 | - | - | - | 一式三份 | - | - | - | - |
| 2% Bis MPA第2代 | - | - | - | - | 一式三份 | - | - | - |
| 3% Bis MPA第2代 | - | - | - | - | - | 一式三份 | - | - |
| 5% Bis MPA第2代 | - | - | - | - | - | - | 一式三份 | - |
| Azopt® | - | - | - | - | - | - | 一式三份 |
细胞培养方法如下所述:
将上皮从琼脂糖转移至维持培养基6-孔板中
↓
组织预处理(conditioning):在37℃、5% CO2、≥95%湿度,至少2小时
↓
将组织转移至在24-孔板中的新鲜维持培养基中
↓
3个组织,每个具有30 μL /
30 mg测试物质
↓
在室温温育20 min或40
min
↓
用PBS冲洗
↓
将组织转移至新鲜维持培养基中
↓
在37℃、5% CO2、≥95%湿度温育16±1小时
↓
将组织转移至在培养基中的MTT溶液中(MTT温育)
↓
将组织温育3小时(37℃、5% CO2、≥95%)
↓
将插入物浸入异丙醇中(甲臜提取)
↓
提取甲臢最少2小时(在室温)
↓
将插入物穿孔(perforate),并均质化
↓
在570 nm在平板分光光度计(plate
spectrophotometer)中读取OD。
从相对于相应的阴性对照(100%生存力)的测试化学物处理过的培养物中的MTT转化百分比计算每种处理过的培养物的生存力百分比。
使用下述方程式:
生存力百分比= [单个OD化学物/平均OD阴性对照]x100。
HCE生存力分类预测模型:NI(生存力≥60%), I(生存力< 60%), 即,如果与阴性对照相比,测试产物得到的生存力百分比<
60%,那么将该产物分类为刺激物(根据体内分类法)。
结果和讨论
如图32所示,使用在上面在实验部分中描述的生存力百分比方程式计算不同样品(根据表19)的生存力百分比。生存力小于60%的样品被视为刺激物。所有样品的基于一式三份的细胞生存力的标准差小于7%。来自细胞毒性研究的结果揭示具有最多4% (w/v)的第3代BMPA-HP的眼用样品将会是非眼刺激物,具有大于60%的细胞生存力(参见图32)。来自图32的结果也揭示AZOPT®对角膜上皮细胞可以是细胞毒性的,就1小时的施用时间而言,具有小于50%的细胞生存力。含有5% (w/v)的第2代Bis-MPA的样品也造成眼刺激,具有小于60%的细胞生存力。
与来自先前研究的结果相组合,不同浓度的Bis-MPA商业的超支化聚酯的细胞毒性在图33中所揭示。从该图显而易见,就在眼用溶液中的相同浓度而言,由第2代BMPA-HP造成的上皮细胞损伤和由此造成的眼刺激小于由第3代BMPA-HP造成的眼刺激。已知的是,支化的程度或长度和因而产生的末端官能团的分子量和数目随着HP的代数的减小而减小。来自图33的结果指示细胞毒性随着代数的减小而下降可以主要是由于末端官能团与上皮细胞的延长的相互作用的减少。
结论
上皮细胞死亡率随着浓度剂量和代(摩尔质量和支化程度)的增加而增加。在AZOPT®市售产品的情况下,它造成具有小于50%细胞生存力的眼刺激,这可能是由于0.01%
(w/v)的BAK和1小时的暴露时间。
实验实施例11
含有BMPA-HP或非离子表面活性剂和BMPA-HP的组合的CAI的溶解度增加。
在有噻吗洛尔存在下,在pH 7.4,研究了多佐胺在10 mM磷酸盐缓冲液中的水溶解度和稳定性。
方法和材料
首先,将10 mM磷酸盐缓冲液加入到固体活性成分的适当地称重的物料中,并彻底搅拌15分钟。在完全溶解活性药物成分以后,将超支化的第2代BMPA-HP加入到溶液中。在HP溶解以后,按照需要的制剂浓度加入PEG
8000。然后将样品测试溶液在室温搅拌10分钟(加热至60℃持续5分钟)。搅拌以后,将所述溶液声处理20分钟。在完全溶解所有活性成分和非活性成分以后,使用1 M NaOH将pH调至7.4,并加入额外的缓冲液以补足如表20和21所示的精确组成。在调节pH的情况下,通过在室温搅拌另外15小时或更久以进一步平衡制剂。通过0.45
um注射器式滤器过滤样品。将聚山梨酯80加入到最终制剂中。在样品#3的情况下,在pH调节以后在60℃平衡制剂(24小时),然后加入聚山梨酯80。再次测量所有样品溶液的pH以确认最终的期望的7.4的pH。在25和60℃储存所有样品14天,并且在用超纯水稀释(稀释因子= 1000)每个样品以后使用UPLC分析滤液的多佐胺和噻吗洛尔。
结果和讨论
表20:样品在室温的多佐胺和噻吗洛尔含量、外观和pH。
表21:样品在60℃的多佐胺和噻吗洛尔含量、外观和pH。
在该研究中,将第2代BMPA-HP作为溶解度增高剂添加剂进行了研究。在pH 7.4尝试了与非离子表面活性剂(诸如PEG和聚山梨酯80)的不同组合。在样品制备以后,所有制剂在室温都是澄清溶液。在图34中,显示了在加入4% (w/v) HP和2%(w/v)
PEG的情况下,多佐胺的溶解度增加。如图34所示,从第1天直到2周,含有4% (w/v) HP和2%
(w/v) PEG的制剂的多佐胺浓度稳步下降。在2周以后,含有4%
(w/v) HP和2% (w/v) PEG的制剂变成混悬液。发明人发现,多佐胺浓度的下降速率随着1% (w/v)聚山梨酯80的加入而下降(样品#1)。在2周的时间段内,多佐胺浓度从9.6 mg/mL下降至8.4
mg/mL。
因而,更高浓度的聚山梨酯80会防止沉淀,并有助于稳定新的制剂。在2周的时段内,观察到所有制剂的pH的可忽略的变化(参见表20和表21)。在2周的时段内,噻吗洛尔浓度的变化是轻微的。尽管市售的AZARGA®混悬液产品具有在pH 7.4的1% (w/v)布林佐胺,并且COSOPT®具有在pH
5.65的2%多佐胺,通过加入HP和非离子表面活性剂来增加在pH 7.4时的溶解度将会有助于药物的效力增强(通过使剂量增加至大于等于1%
(w/v))。
结论
所述结果清楚地证实了在接近生理pH的pH值时使用与PEG 8000和聚山梨酯80相组合的第2代BMPA-HP作为CAI溶解度增高剂的优点。
实验实施例12
进行了基于在有噻吗洛尔存在下碳酸酐酶抑制剂(多佐胺和布林佐胺)在含有在磷酸盐缓冲液中的第2代超支化的Bis-MPA聚酯-16-羟基(第2代BMPA-HP)、PEG 8000和聚山梨酯80的不同组合的水溶液中的溶解度和稳定性来确定在pH 7.4的局部制剂的研究。
方法和材料
表22显示了要在pH
7.4的10 mM磷酸盐缓冲液中制备的所有不同的测试样品。
表22: 在pH 7.4的磷酸盐缓冲液中制备的不同测试制剂。
| 含量(%w/v) | 对照样品 | 样品#1 | 样品#2 | 样品#3 | 样品#4 | 样品#5 | 样品#6 |
| CAI | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| 噻吗洛尔 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 |
| 第2代BMPA-HP | - | 4 | 4 | 4 | - | - | - |
| PEG 8000 | - | 2 | - | 2 | 2 | 2 | - |
| 聚山梨酯80 | - | 4 | 4 | - | 4 | - | 4 |
| 1M NaOH/1 M HCl | 调节pH至7.4 | 调节pH至7.4 | 调节pH至7.4 | 调节pH至7.4 | 调节pH至7.4 | 调节pH至7.4 | 调节pH至7.4 |
首先,将10 mM磷酸盐缓冲液加入到固体活性成分的适当地称重的物料中,并彻底搅拌,直到活性药剂溶解。其次,将固体BMPA-HP粉末加入到样品制剂1、2和3中。在HP溶解以后,外观为澄清溶液。将适当质量的非离子表面活性剂(诸如PEG 8000)加入到所述制剂中,以补足按照上表22中所述的制剂内容物的精确浓度。然后将所有测试溶液在室温搅拌10分钟(加热至60℃持续5分钟)。搅拌以后,将所述溶液声处理5分钟。在完全溶解所有活性成分和非活性成分以后,使用1 M
NaOH或1 M HCl将pH调至7.4或5.65,并加入额外的缓冲液以补足根据表22样品组成的精确组成。在调节pH的情况下,形成测试溶液,通过在室温搅拌另外24小时或更久以将其平衡。就含有聚山梨酯80和超支化聚酯的样品(表2)而言,仅在60℃平衡最终制剂24小时以后加入聚山梨酯80。再次调节所有样品溶液的pH以确认最终的期望的pH。
在用超纯水稀释(稀释因子= 1000)每个样品以后,使用UPLC分析滤液的碳酸酐酶抑制剂、噻吗洛尔和HP浓度。使用从实验实施例1得到的CAI和噻吗洛尔检测的最佳条件。记录每种制剂在室温和60℃时1个月时段内的外观和pH。
结果和讨论
该研究使用具有羟基末端基团的HP、PEG和聚山梨酯80作为溶解度增高剂添加剂。在pH 7.4尝试了不同组合,以便基于以前的结果确定最佳制剂。图35表明,在有4%
(w/v) HP和2% (w/v) PEG或4% (w/v)聚山梨酯80存在下(样品1、2和3),多佐胺的溶解度显著增加。但是,在仅有PEG
8000(样品5)或仅聚山梨酯80(样品6)或它们的组合(样品4)存在下,多佐胺溶解度没有显著增加。因而,向制剂中加入超支化聚酯清楚地指示了其作为溶解度增高剂的优点。但是,与含有HP、聚山梨酯80和PEG 8000的制剂(样品1)相比,含有与聚山梨酯80相组合的具有羟基的HP的制剂(样品2)具有类似的溶解度。因而,可以避免PEG 8000的加入。总之,基于多佐胺和噻吗洛尔溶解度数据发现,样品2是最佳制剂。向HP中加入表面活性剂(诸如聚山梨酯80)也会通过防止包封在HP内的多佐胺的沉淀而增加多佐胺溶解度。
表23:样品在室温的多佐胺和噻吗洛尔含量、外观和pH。
表24:样品在60℃的多佐胺和噻吗洛尔含量、外观和pH。
表23和24显示了所有制剂样品在4周时段内的多佐胺和噻吗洛尔的稳定性测试结果。从所述表可见,样品#1和样品#2在1个月以后是相对稳定的且澄清的溶液。可以避免PEG在样品#1中的存在,因为没有PEG的样品#2产生了类似的结果。
结论
所述结果清楚地指示使用与表面活性剂(诸如聚山梨酯80和PEG 8000)相组合的具有羟基末端官能团的HP的优点。聚山梨酯80的表面活性剂性能非常有助于通过防止沉淀而增加CAI的溶解度。基于溶解度和1个月稳定性结果的良好制剂是含有在pH
7.4的磷酸盐缓冲液中的活性成分与仅4% (w/v)第2代BMPA-HP和4%聚山梨酯80的组合的制剂。
实验实施例13
含有Bis MPA超支化聚酯和聚山梨酯80的新的局部制剂的多佐胺和噻吗洛尔的体外角膜渗透研究。
方法和材料
配制了在0.1% (w/v)磷酸盐缓冲液中的下述3种溶液(表27),用于检查多佐胺和噻吗洛尔的体外角膜渗透,以及用于确定角膜水解效应。
表25:测试制剂的组成。
| 含量(% w/v) | 测试1 | 测试2 | 测试3 |
| 多佐胺 | 2 | 1 | 1 |
| 噻吗洛尔 | 0.5 | 0.5 | 0.5 |
| 第2代BMPA-HP | - | 4 | 4 |
| 聚山梨酯80 | - | 4 | 4 |
| 1M NaOH/ 1M HCl | 调节pH至5.65 | 调节pH至5.65 | 调节pH至7.4 |
| 外观 | 澄清 | 澄清 | 澄清 |
首先,将10 mM磷酸盐缓冲液加入到固体活性成分的适当地称重的物料中,并彻底搅拌15分钟。在样品编号2和3的情况下,按照表25中的组成,将第2代BMPA-HP粉末加入到溶液中。然后将3种测试溶液在室温搅拌10分钟(加热至60℃持续5分钟)。搅拌以后,将所述溶液声处理5分钟。在完全溶解所有活性成分和非活性成分以后,使用1 M NaOH或1 M
HCl将pH调至7.4或5.65,并加入额外的缓冲液以补足如上表样品组成所示的精确组成。在调节pH的情况下,形成测试溶液,就样品1和2而言,通过在室温搅拌另外24小时或更久以将测试溶液平衡。在样品号2和3中,在60℃进行平衡24小时。然后加入聚山梨酯80(4% (w/v)),随后再次调节pH。再次测量所有样品溶液的pH,以确认最终的期望的pH。
这些澄清溶液直接地用作样品供体溶液,用于角膜渗透研究。为了确定溶解度,通过0.45µm注射器式滤器过滤测试溶液。在用超纯水稀释(稀释因子= 1000)每个样品以后,使用UPLC分析滤液的多佐胺和噻吗洛尔浓度。使用的材料和设备的细节以及兔角膜研究操作在实验实施例4中给出。
结果和讨论
表26:测试样品中的活性成分的初始浓度
| 样品 | 多佐胺(mg/mL) | 噻吗洛尔(mg/mL) |
| 测试1 | 20.2 | 5.2 |
| 测试2 | 10.2 | 5.1 |
| 测试3 | 10.0 | 5.0 |
通过UPLC确定的多佐胺和噻吗洛尔的初始浓度在表26中给出。
表27:角膜水化百分比计算结果。
| 样品 | 最终净湿重(g) | 最终净干重(g) | %(w/v)角膜水化 |
| 测试1 | 0.0534 | 0.0534 | 80.42 |
| 测试2 | 0.0471 | 0.0471 | 82.59 |
| 测试3 | 0.0627 | 0.0550 | 84.15 |
| 测试1 | 0.0684 | 0.0420 | 84.34 |
| 测试2 | 0.0459 | 0.0365 | 81.46 |
| 测试3 | 0.0421 | 0.0370 | 83.27 |
基于角膜的净湿重和干重测量角膜水化。通常,正常哺乳动物的角膜的% (w/w)水化是在75-85%范围内。总之,所有测试样品的%水化没有显著变化,并且都是在期望的范围内,如表27所示。因而,HP或聚山梨酯80对角膜水化没有影响。
图36和图37分别揭示了多佐胺和噻吗洛尔的角膜渗透特性。在34℃,仔细地检查了多佐胺和噻吗洛尔的透过分离的兔角膜的时间依赖性的渗透。从图36可见,与在pH 5.65的相同制剂(测试2)相比,含有4% (w/v) HP和聚山梨酯80的在pH 7.4的测试制剂(测试3)具有相对更高的渗透穿过角膜的多佐胺累积总量和在3小时以后渗透的总量。显然,多佐胺渗透在pH
7.4增加,因为它的非离子性能非常有助于亲脂性的角膜上皮膜。测试3的多佐胺角膜渗透与在pH 5.65的没有添加剂的对照溶液(测试1)相当。应当指出,测试3含有1% (w/v)多佐胺,而测试1含有2% (w/v)多佐胺。尽管测试3含有测试1的一半多佐胺浓度,角膜渗透特性是类似的。与可以造成眼刺激的在pH 5.65的市售产品相比,测试3对患者而言可能是更舒适的,因为它是在pH
7.4制备的。来自图37的噻吗洛尔渗透特性提示,测试3具有比测试1(对照溶液)显著更高的角膜渗透。显然,与具有类似水溶解度的测试1相比,在pH 7.4时超支化聚酯和聚山梨酯80在测试3中的存在会增加噻吗洛尔渗透。总之,与市售产品相比增加的噻吗洛尔渗透和相当的多佐胺渗透是含有HP和聚山梨酯80的新的制剂的关键优点。从图38可见,测试3(新的制剂)在3小时以后的多佐胺和噻吗洛尔的总渗透百分比是测试1(市售产品活性成分)的至少2倍。显然,HP和聚山梨酯80的存在会增加渗透穿过角膜的活性成分(多佐胺和噻吗洛尔)的百分比。
使用来自图36和37的斜率以确定角膜渗透系数和分配系数。渗透系数与供体溶液中的药物初始浓度成反比。测试2的渗透系数(参见图39)和分配系数(参见图40)相对高于测试1。应当指出,测试1和测试2溶液都是在pH 5.65。结果提示了HP和聚山梨酯80的增加活性成分的分配和渗透的影响。由于pH效应,测试3的渗透系数和分配系数高于测试2。测试3制剂是在pH 7.4制备的,这更有助于非离子型多佐胺和噻吗洛尔的渗透。总之,结果清楚地证实了使用HP和聚山梨酯80作为多佐胺和噻吗洛尔的局部制剂的药物载体的重要性。
总之,来自图39的数据清楚地指示,与在pH 7.4的不含HP的测试1和在pH 5.65的COSOPT®对照制剂(类似于COSOPT®活性成分制剂)相比,含有HP和聚山梨酯80的制剂测试2具有更高的噻吗洛尔和多佐胺渗透系数。
HP和聚山梨酯80促进噻吗洛尔和多佐胺的包封,并从而增加噻吗洛尔向角膜上皮中的分配。该理论也得到图40中的数据的支持。与测试1和测试2相比,噻吗洛尔和多佐胺在角膜表面的分配系数在pH 7.4的测试3中更高,这指示,在有高度官能化的HP存在下,在pH
7.4而不是pH 5.65,噻吗洛尔和多佐胺向亲脂性角膜中的分配的改善。因而,在有HP存在下改善的渗透主要是因为改善的向上皮的分配。
结论
在pH 7.4,在有HP添加剂(诸如可商业得到的树枝状Bis-MPA HP)和聚山梨酯80存在下,在多佐胺的情况下活性药剂的累积渗透量几乎与市售产品相当,并且就噻吗洛尔渗透而言活性药剂的累积渗透量超过市售产品的2倍。该新的的局部制剂是在pH 7.4制备的,因而使它更有助于亲脂性上皮角膜渗透,并且对患者而言更舒适。因而,具有羟基末端基团的HP和聚山梨酯80可以非常有效地增加COSOPT®活性成分的眼睛生物利用度。
工业实用性
根据本发明,可以提供一种包含HP的眼用组合物,所述眼用组合物显示出增加的碳酸酐酶抑制剂(诸如多佐胺或布林佐胺)的水溶解度。所述眼用组合物还可以包含非离子表面活性剂和/或β-阻滞剂。本发明的眼用组合物导致增加的活性剂向角膜中的渗透。因此,与可得到的目前有关的眼用市售产品相比,可以增加含有碳酸酐酶抑制剂和β阻滞剂(活性成分)的局部眼用溶液的总眼睛生物利用度,并因此增加其治疗活性。呈现在本发明中的局部眼用组合物提供更有效的抗青光眼组合物,其可以通过增加眼睛生物利用度而提高患者的顺应性。
尽管上面已经详细地描述了本发明的一些实施方案,本领域普通技术人员可以对所示的具体实施方案做出各种改进和变化,而不实质上脱离本发明的新的教导和优点。这样的改进和变化被包括在所附权利要求书所述的本发明的精神和范围内。
Claims (18)
1. 一种包含超支化聚合物的眼用组合物,其中所述超支化聚合物包含选自下述的末端官能团:胺基团、羟基、脂肪酸基团和PEG。
2. 根据权利要求1所述的眼用组合物,所述眼用组合物另外包含碳酸酐酶抑制剂。
3. 根据权利要求1所述的眼用组合物,所述眼用组合物另外包含非离子表面活性剂。
4. 根据权利要求2所述的眼用组合物,所述眼用组合物另外包含非离子表面活性剂。
5. 根据权利要求1所述的眼用组合物,其中所述超支化聚合物的平均分子量是在1,000至750,000道尔顿(Mw)范围内。
6. 根据权利要求1或2所述的眼用组合物,其中所述超支化聚合物包含选自下述的核心:聚乙烯亚胺、聚丙烯亚胺和聚酯。
7. 根据权利要求1所述的眼用组合物,其中pH是在3.0至8.0范围内。
8. 根据权利要求1所述的眼用组合物,其中所述超支化聚合物的浓度是在0.01%至5% (w/v)范围内。
9. 根据权利要求2所述的眼用组合物,所述眼用组合物另外包含β-阻滞剂。
10. 根据权利要求2所述的眼用组合物,其中所述碳酸酐酶抑制剂选自:多佐胺、布林佐胺和乙酰唑胺。
11. 根据权利要求3所述的眼用组合物,其中所述非离子表面活性剂选自:PEG、聚山梨酯、羟丙基甲基纤维素和羟乙基纤维素。
12. 根据权利要求4所述的眼用组合物,其中所述非离子表面活性剂选自:PEG、聚山梨酯、羟丙基甲基纤维素和羟乙基纤维素。
13. 根据权利要求9所述的眼用组合物,其中所述β-阻滞剂选自:卡替洛尔、左布诺洛尔、倍他洛尔、美替洛尔、噻吗洛尔和普萘洛尔。
14. 根据权利要求6所述的眼用组合物,其中所述超支化聚合物核心是聚酯,并且其中所述超支化聚合物包含作为末端官能团的羟基、脂肪酸基团和PEG。
15. 根据权利要求14所述的眼用组合物,其中所述超支化聚合物的平均分子量是在1,000至12,000道尔顿(Mw)范围内。
16. 根据权利要求14所述的眼用组合物,其中所述超支化聚合物的浓度是在0.001至4% (w/v)范围内。
17. 一种包含超支化聚酯、噻吗洛尔、多佐胺和聚山梨酯80的眼用组合物,其中所述超支化聚酯包含选自下述的末端官能团:聚酯羟基、脂肪酸基团和PEG。
18. 一种包含超支化聚酯、噻吗洛尔、布林佐胺和聚山梨酯80的眼用组合物,其中所述超支化聚酯包含选自下述的末端官能团:聚酯羟基、脂肪酸基团和PEG。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US12/774,419 US8211450B2 (en) | 2010-05-05 | 2010-05-05 | Ophthalmic composition |
| US12/774,419 | 2010-05-05 | ||
| PCT/US2011/035147 WO2011140194A1 (en) | 2010-05-05 | 2011-05-04 | Ophthalmic composition |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN103096901A true CN103096901A (zh) | 2013-05-08 |
Family
ID=44902332
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN2011800332340A Pending CN103096901A (zh) | 2010-05-05 | 2011-05-04 | 眼用组合物 |
Country Status (8)
| Country | Link |
|---|---|
| US (2) | US8211450B2 (zh) |
| EP (1) | EP2566487A4 (zh) |
| JP (1) | JP2013528589A (zh) |
| KR (1) | KR20130121685A (zh) |
| CN (1) | CN103096901A (zh) |
| CA (1) | CA2797123A1 (zh) |
| MX (1) | MX2012012846A (zh) |
| WO (1) | WO2011140194A1 (zh) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103740831A (zh) * | 2014-01-13 | 2014-04-23 | 宁波海尔施基因科技有限公司 | 一种指导β-受体阻断药用药的引物组合物、多重基因检测试剂盒及其使用方法 |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2011283586B2 (en) * | 2010-07-29 | 2014-07-31 | Santen Pharmaceutical Co., Ltd. | Drug support body, and method for producing same |
| WO2013114397A2 (en) * | 2012-01-16 | 2013-08-08 | Biocon Limited | Pharmaceutically acceptable salt of brinzolamide and composition thereof |
| US9820991B2 (en) * | 2013-11-08 | 2017-11-21 | Sentiss Pharma Private Limited | Pharmaceutical composition comprising brinzolamide |
| JP6487452B2 (ja) * | 2014-01-24 | 2019-03-20 | センティス ファーマ プライベート リミテッド | ブリンゾラミドを含む医薬組成物 |
| CA3226491A1 (en) | 2014-05-16 | 2015-11-19 | Occidental Chemical Corporation | Method for making 1,1,3,3-tetrachloropropene |
| CN106535943A (zh) * | 2014-07-11 | 2017-03-22 | 富士胶片株式会社 | 眼科用水性组合物 |
| KR101773669B1 (ko) | 2015-07-30 | 2017-08-31 | 포항공과대학교 산학협력단 | 생체적합성 각막세포 전구체 분화방법 및 각막세포 전구체 조성물 |
| JP6050454B1 (ja) * | 2015-09-28 | 2016-12-21 | 参天製薬株式会社 | 水性医薬組成物 |
| JP6178028B1 (ja) * | 2016-03-14 | 2017-08-09 | 参天製薬株式会社 | ドルゾラミドとチモロールと界面活性剤を含有する医薬組成物 |
| NZ766141A (en) | 2017-12-15 | 2024-01-26 | Tarsus Pharmaceuticals Inc | Isoxazoline parasiticide formulations and methods for treating blepharitis |
| US20220265695A1 (en) | 2019-07-26 | 2022-08-25 | Proqr Therapeutics Ii B.V. | Opthalmic compositions comprising viscosifying polymers and nucleic acids |
| JPWO2023140357A1 (zh) * | 2022-01-21 | 2023-07-27 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20060204472A1 (en) * | 2003-02-13 | 2006-09-14 | Constantinos Paleos | Multifunctional dendrimers and hyperbranched polymers as drug and gene delivery systems |
| US20070048337A1 (en) * | 2005-08-24 | 2007-03-01 | Arthur Samuel D | Aldol-crosslinked polymeric hydrogel adhesives |
| US20080180803A1 (en) * | 2007-01-26 | 2008-07-31 | Seybert Kevin W | Optical elements comprising compatiblizing coatings and methods of making the same |
| US20100008993A1 (en) * | 2008-07-14 | 2010-01-14 | Proksch Joel W | Compositions and Methods for Increasing Bioavailability of Topical Ophthalmic Drugs |
Family Cites Families (33)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5136014A (en) * | 1990-06-22 | 1992-08-04 | E. I. Du Pont De Nemours And Company | Hyperbranched polyesters |
| SK282039B6 (sk) * | 1991-04-17 | 2001-10-08 | Merck & Co., Inc. | Oftalmický prípravok na liečenie očnej hypertenzie obsahujúci kombináciu inhibítora karboanhydrázy a beta-adrenergného antagonistu |
| US6316443B1 (en) * | 1994-08-04 | 2001-11-13 | Merck & Co., Inc. | Ophthalmic compositions comprising combinations of a carbonic anhydrase inhibitor and a β-adrenergic antagonist |
| DE19726186A1 (de) * | 1997-06-20 | 1998-12-24 | Boehringer Ingelheim Int | Komplexe für den Transport von Nukleinsäure in höhere eukaryotische Zellen |
| FR2772771B1 (fr) * | 1997-12-19 | 2000-01-28 | Oreal | Utilisation de polymeres hyperbranches et de dendrimeres comportant un groupement particulier, en tant qu'agent filmogene, les compositions filmogenes les comprenant et leur utilisation notamment en cosmetique ou en pharmacie |
| WO2000063409A1 (en) | 1999-04-21 | 2000-10-26 | Massachusetts Institute Of Technology | Endosomolytic agents and cell delivery systems |
| US7030097B1 (en) | 1999-07-14 | 2006-04-18 | Cornell Research Foundation, Inc. | Controlled nucleic acid delivery systems |
| SK282717B6 (sk) | 2000-03-10 | 2002-11-06 | �Stav Experiment�Lnej Farmakol�Gie Sav | Spôsob prípravy ultravysokomolekulových hyalurónanov |
| US7097856B2 (en) | 2000-09-29 | 2006-08-29 | The Regents Of The University Of California | Dendrimeric support or carrier macromolecule |
| CA2438193A1 (en) | 2001-02-26 | 2002-09-06 | Duke University | Novel dendritic polymers and their biomedical uses |
| JP2004529908A (ja) | 2001-03-08 | 2004-09-30 | ナイモックス ファーマシューティカル コーポレーション | 細胞の除去または破壊を必要とする、腫瘍および他の症状を治療するための神経糸タンパク質の使用方法 |
| FR2830450B1 (fr) | 2001-10-09 | 2004-02-06 | Univ Pasteur | Utilisation de dendrimeres dans une composition ophtalmique |
| TWI255224B (en) | 2002-01-09 | 2006-05-21 | Novartis Ag | Polymeric articles having a lubricious coating and method for making the same |
| GB0209022D0 (en) | 2002-04-19 | 2002-05-29 | Imp College Innovations Ltd | Compounds |
| WO2004060283A2 (en) | 2002-12-16 | 2004-07-22 | Nitromed, Inc. | Nitrosated and nitrosylated rapamycin compounds, compositions and methods of use |
| JP2005008614A (ja) | 2003-03-28 | 2005-01-13 | Nano Career Kk | 高分子ミセルを用いた眼科用ドラッグデリバリーシステム |
| US7109247B2 (en) | 2003-05-30 | 2006-09-19 | 3M Innovative Properties Company | Stabilized particle dispersions containing nanoparticles |
| US7189456B2 (en) | 2004-03-04 | 2007-03-13 | Transitions Optical, Inc. | Photochromic optical article |
| WO2006031358A2 (en) | 2004-08-13 | 2006-03-23 | Hyperbranch Medical Technology, Inc. | Dendritic polymers, crosslinked gels, and their uses as ophthalmic sealants and lenses |
| US20060057215A1 (en) * | 2004-09-15 | 2006-03-16 | Raiche Adrian T | Method for the production of nanoparticles and microparticles by ternary agent concentration and temperature alteration induced immiscibility |
| US7837986B2 (en) | 2004-12-01 | 2010-11-23 | E. I. Du Pont De Nemours And Company | Protein-based polymer tissue adhesives for medical use |
| EP2308460A1 (de) * | 2005-02-21 | 2011-04-13 | Basf Se | Wirkstoffzusammensetzung die wenigstens ein stickstoffatomhaltiges, hyperverzweigtes Polymer enthält |
| US20060257359A1 (en) | 2005-02-28 | 2006-11-16 | Cedric Francois | Modifying macrophage phenotype for treatment of disease |
| US7666331B2 (en) | 2005-08-31 | 2010-02-23 | Transitions Optical, Inc. | Photochromic article |
| EP1981512B1 (en) | 2006-01-20 | 2022-11-02 | Starpharma Pty Limited | Modified macromolecule |
| US20090012033A1 (en) | 2006-03-03 | 2009-01-08 | Demattei Cordell R | Delivery of Biologically Active Materials Using Core-Shell Tecto(Dendritic Polymers) |
| US20080031916A1 (en) * | 2006-04-24 | 2008-02-07 | Heather Sheardown | Dendrimer cross-linked collagen |
| WO2008027340A2 (en) * | 2006-08-30 | 2008-03-06 | Merck & Co., Inc. | Topical ophthalmic formulations |
| WO2008030591A2 (en) | 2006-09-08 | 2008-03-13 | Dendritic Nanotechnologies, Inc. | Peham dendrimers as excipients |
| BRPI0718696A2 (pt) * | 2006-11-09 | 2013-12-31 | Alcon Res Ltd | Matriz de polímero insolúvel em água para liberação de fármaco. |
| DK2214646T3 (da) * | 2007-10-05 | 2021-10-04 | Univ Wayne State | Dendrimers for sustained release of compounds |
| US8426492B2 (en) | 2007-11-14 | 2013-04-23 | Actamax Surgical Materials, Llc | Oxidized cationic polysaccharide-based polymer tissue adhesive for medical use |
| WO2010017184A2 (en) * | 2008-08-08 | 2010-02-11 | Virginia Commonwealth University | Dendrimer hydrogels |
-
2010
- 2010-05-05 US US12/774,419 patent/US8211450B2/en not_active Expired - Fee Related
-
2011
- 2011-05-04 CN CN2011800332340A patent/CN103096901A/zh active Pending
- 2011-05-04 KR KR1020127031915A patent/KR20130121685A/ko not_active Application Discontinuation
- 2011-05-04 US US13/695,930 patent/US20130053374A1/en not_active Abandoned
- 2011-05-04 MX MX2012012846A patent/MX2012012846A/es not_active Application Discontinuation
- 2011-05-04 CA CA2797123A patent/CA2797123A1/en not_active Abandoned
- 2011-05-04 EP EP20110778244 patent/EP2566487A4/en not_active Withdrawn
- 2011-05-04 WO PCT/US2011/035147 patent/WO2011140194A1/en active Application Filing
- 2011-05-04 JP JP2013509213A patent/JP2013528589A/ja active Pending
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20060204472A1 (en) * | 2003-02-13 | 2006-09-14 | Constantinos Paleos | Multifunctional dendrimers and hyperbranched polymers as drug and gene delivery systems |
| US20070048337A1 (en) * | 2005-08-24 | 2007-03-01 | Arthur Samuel D | Aldol-crosslinked polymeric hydrogel adhesives |
| US20080180803A1 (en) * | 2007-01-26 | 2008-07-31 | Seybert Kevin W | Optical elements comprising compatiblizing coatings and methods of making the same |
| US20100008993A1 (en) * | 2008-07-14 | 2010-01-14 | Proksch Joel W | Compositions and Methods for Increasing Bioavailability of Topical Ophthalmic Drugs |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103740831A (zh) * | 2014-01-13 | 2014-04-23 | 宁波海尔施基因科技有限公司 | 一种指导β-受体阻断药用药的引物组合物、多重基因检测试剂盒及其使用方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| MX2012012846A (es) | 2013-05-22 |
| US20130053374A1 (en) | 2013-02-28 |
| JP2013528589A (ja) | 2013-07-11 |
| US20110275617A1 (en) | 2011-11-10 |
| CA2797123A1 (en) | 2011-11-10 |
| US8211450B2 (en) | 2012-07-03 |
| EP2566487A4 (en) | 2014-06-18 |
| EP2566487A1 (en) | 2013-03-13 |
| WO2011140194A1 (en) | 2011-11-10 |
| KR20130121685A (ko) | 2013-11-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN103096901A (zh) | 眼用组合物 | |
| Gupta et al. | Cellulosic polymers for enhancing drug bioavailability in ocular drug delivery systems | |
| EP2136782B1 (en) | Ophthalmic oil-in-water emulsions containing prostaglandins | |
| Rathore | In situ gelling ophthalmic drug delivery system: an overview | |
| WO2010070664A1 (en) | Curcuminoids and its metabolites for the application in ocular diseases | |
| Wang et al. | Cyclodextrin-based ocular drug delivery systems: A comprehensive review | |
| Ricci et al. | Chitosan/sulfobutylether-β-cyclodextrin based nanoparticles coated with thiolated hyaluronic acid for indomethacin ophthalmic delivery | |
| ES2891344T3 (es) | Partículas de nanoresina cargadas con fármaco | |
| CN107613985A (zh) | 含有糖皮质激素的纳米微粒的水性悬浮液剂 | |
| EP3275429A1 (en) | Topical ophthalmic formulation of endothelin receptor antagonists | |
| Wu et al. | Cell penetrating peptide TAT-functionalized liposomes for efficient ophthalmic delivery of flurbiprofen: Penetration and its underlying mechanism, retention, anti-inflammation and biocompatibility | |
| Talaei et al. | Investigating the ocular toxicity potential and therapeutic efficiency of in situ gel nanoemulsion formulations of brinzolamide | |
| Gupta et al. | Formulation and evaluation of brinzolamide encapsulated niosomal in-situ gel for sustained reduction of IOP in rabbits | |
| Mohamed et al. | MA; Mekkawy, AI Chitosan Nanoparticles for Meloxicam Ocular Delivery: Development | |
| Li et al. | Optimization and characterization of low-molecular-weight chitosan-coated baicalin mPEG-PLGA nanoparticles for the treatment of cataract | |
| Wu et al. | Flurbiprofen loaded thermosensitive nanohydrogel for ophthalmic anti-inflammatory therapy | |
| CN105566100B (zh) | 一种苯乙烯酸类化合物,包含其的组合物及其应用 | |
| Swain et al. | Ocular delivery of felodipine for the management of intraocular pressure and inflammation: Effect of film plasticizer and in vitro in vivo evaluation | |
| EP2937076B1 (en) | Eye drops containing prostaglandin and tyloxapol | |
| Mehetre et al. | Rationalized approach for formulation and optimization of ebastine microemulsion using design expert for solubility enhancement | |
| Dewan et al. | Development, evaluation and recent progress of ocular in situ gelling drug delivery vehicle based on poloxamer 407 | |
| EP3150211A1 (en) | Therapeutic agent for keratoconjunctive disorder | |
| US20230093908A1 (en) | In-situ Gel Containing Cyclosporine Micelles as Sustained Ophthalmic Drug Delivery System | |
| Krtalić | Development of innovative in situ forming gels for topical ophthalmic delivery | |
| WO2023103835A1 (zh) | 一种酪氨酸激酶抑制剂眼用制剂及其制备方法和用途 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C02 | Deemed withdrawal of patent application after publication (patent law 2001) | ||
| WD01 | Invention patent application deemed withdrawn after publication |
Application publication date: 20130508 |