BR112018008250B1 - Sequência de meio filtrante, dispositivo filtrante e método de fabricação de um fluido biológico - Google Patents
Sequência de meio filtrante, dispositivo filtrante e método de fabricação de um fluido biológico Download PDFInfo
- Publication number
- BR112018008250B1 BR112018008250B1 BR112018008250-3A BR112018008250A BR112018008250B1 BR 112018008250 B1 BR112018008250 B1 BR 112018008250B1 BR 112018008250 A BR112018008250 A BR 112018008250A BR 112018008250 B1 BR112018008250 B1 BR 112018008250B1
- Authority
- BR
- Brazil
- Prior art keywords
- filter
- filter media
- media
- monomer
- sequence
- Prior art date
Links
Images
Classifications
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D69/00—Semi-permeable membranes for separation processes or apparatus characterised by their form, structure or properties; Manufacturing processes specially adapted therefor
- B01D69/10—Supported membranes; Membrane supports
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D63/00—Apparatus in general for separation processes using semi-permeable membranes
- B01D63/10—Spiral-wound membrane modules
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D63/00—Apparatus in general for separation processes using semi-permeable membranes
- B01D63/14—Pleat-type membrane modules
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D67/00—Processes specially adapted for manufacturing semi-permeable membranes for separation processes or apparatus
- B01D67/0081—After-treatment of organic or inorganic membranes
- B01D67/009—After-treatment of organic or inorganic membranes with wave-energy, particle-radiation or plasma
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D67/00—Processes specially adapted for manufacturing semi-permeable membranes for separation processes or apparatus
- B01D67/0081—After-treatment of organic or inorganic membranes
- B01D67/0093—Chemical modification
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D67/00—Processes specially adapted for manufacturing semi-permeable membranes for separation processes or apparatus
- B01D67/0081—After-treatment of organic or inorganic membranes
- B01D67/0093—Chemical modification
- B01D67/00931—Chemical modification by introduction of specific groups after membrane formation, e.g. by grafting
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D67/00—Processes specially adapted for manufacturing semi-permeable membranes for separation processes or apparatus
- B01D67/0081—After-treatment of organic or inorganic membranes
- B01D67/0093—Chemical modification
- B01D67/00933—Chemical modification by addition of a layer chemically bonded to the membrane
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D69/00—Semi-permeable membranes for separation processes or apparatus characterised by their form, structure or properties; Manufacturing processes specially adapted therefor
- B01D69/02—Semi-permeable membranes for separation processes or apparatus characterised by their form, structure or properties; Manufacturing processes specially adapted therefor characterised by their properties
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D69/00—Semi-permeable membranes for separation processes or apparatus characterised by their form, structure or properties; Manufacturing processes specially adapted therefor
- B01D69/10—Supported membranes; Membrane supports
- B01D69/107—Organic support material
- B01D69/1071—Woven, non-woven or net mesh
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D69/00—Semi-permeable membranes for separation processes or apparatus characterised by their form, structure or properties; Manufacturing processes specially adapted therefor
- B01D69/12—Composite membranes; Ultra-thin membranes
- B01D69/125—In situ manufacturing by polymerisation, polycondensation, cross-linking or chemical reaction
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D71/00—Semi-permeable membranes for separation processes or apparatus characterised by the material; Manufacturing processes specially adapted therefor
- B01D71/06—Organic material
- B01D71/40—Polymers of unsaturated acids or derivatives thereof, e.g. salts, amides, imides, nitriles, anhydrides, esters
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D71/00—Semi-permeable membranes for separation processes or apparatus characterised by the material; Manufacturing processes specially adapted therefor
- B01D71/06—Organic material
- B01D71/40—Polymers of unsaturated acids or derivatives thereof, e.g. salts, amides, imides, nitriles, anhydrides, esters
- B01D71/401—Polymers based on the polymerisation of acrylic acid, e.g. polyacrylate
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D71/00—Semi-permeable membranes for separation processes or apparatus characterised by the material; Manufacturing processes specially adapted therefor
- B01D71/06—Organic material
- B01D71/76—Macromolecular material not specifically provided for in a single one of groups B01D71/08 - B01D71/74
- B01D71/78—Graft polymers
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K1/00—General methods for the preparation of peptides, i.e. processes for the organic chemical preparation of peptides or proteins of any length
- C07K1/14—Extraction; Separation; Purification
- C07K1/34—Extraction; Separation; Purification by filtration, ultrafiltration or reverse osmosis
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D2323/00—Details relating to membrane preparation
- B01D2323/15—Use of additives
- B01D2323/16—Swelling agents
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D2323/00—Details relating to membrane preparation
- B01D2323/15—Use of additives
- B01D2323/218—Additive materials
- B01D2323/2182—Organic additives
- B01D2323/21827—Salts
- B01D2323/21828—Ammonium Salts
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D2323/00—Details relating to membrane preparation
- B01D2323/34—Use of radiation
- B01D2323/345—UV-treatment
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D2323/00—Details relating to membrane preparation
- B01D2323/38—Graft polymerization
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D2323/00—Details relating to membrane preparation
- B01D2323/38—Graft polymerization
- B01D2323/385—Graft polymerization involving radiation
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D2323/00—Details relating to membrane preparation
- B01D2323/42—Details of membrane preparation apparatus
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D2325/00—Details relating to properties of membranes
- B01D2325/16—Membrane materials having positively charged functional groups
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D2325/00—Details relating to properties of membranes
- B01D2325/42—Ion-exchange membranes
Abstract
SEQUÊNCIA DE MEIO FILTRANTE PARA PURIFICAÇÃO DE BIOMATERIAIS. A presente invenção refere-se a um meio filtrante que compreende: (i) um primeiro meio filtrante compreendendo um substrato não tecido de troca aniônica, sendo que o substrato não tecido de troca aniônica compreende uma pluralidade de grupos amônio quaternário; e (ii) um segundo meio filtrante compreendendo uma membrana microporosa funcionalizada, sendo que a membrana microporosa funcionalizada compreende uma pluralidade de grupos guanidila; sendo que o primeiro meio filtrante está posicionado a montante do segundo meio filtrante.
Description
[001]Uma sequência de meios filtrantes que compreende um não tecido fun- cionalizado e uma membrana porosa funcionalizada é descrita. A sequência de meios filtrantes é útil, por exemplo, na purificação de biomateriais.
[002]A fabricação em grande escala ou em quantidades comerciais de biomate- riais alvo terapeuticamente úteis, como proteínas, pode ser implementada por meio de cultivo de células que são manipuladas para produzir uma proteína desejada em biorre- atores sob condições controladas. A tecnologia usada consiste, por exemplo, na fermentação de micro-organismos que tenham sido alterados através de técnicas de DNA re- combinante ou a cultura de células de mamíferos que tenham sido alteradas através de técnicas de hibridoma. As células são suspensas em um caldo que contém os sais, açúcares, proteínas, e vários fatores necessários para suportar o crescimento de células específicas. O produto desejado pode ser secretado pelas células no caldo ou ficar retido dentro do corpo da célula. O caldo coletado é, então, processado para recuperar, purificar, e concentrar o produto desejado.
[003]A separação ou purificação destes biomateriais alvo a partir de uma mistura heterogênea provou ser uma tarefa formidável ao menos pelas seguintes razões: o produto desejado frequentemente representa uma pequena porcentagem do fluido de cultura de células totais, que compreende quantidades significativas de particulados e de contaminantes solúveis, e o fluido da cultura de células pode compreender altas concentrações de sal.
[004]Como resultado destes fatores, o processamento extensivo a jusante foi necessariamente usado para produzir grandes quantidades de produto purificado. Tal processamento a jusante inclui as muitas etapas de processamento que ocorrem após a produção de biomateriais alvo, incluindo, por exemplo, centrifugação, ruptura celular, peneiragem mecânica, microfiltração, troca iônica, filtração de fluxo cruzado, separação por afinidade, esterilização, purificação, e embalagem. O processamento a jusante representa um custo importante na produção de produtos bioprocessados.
[005]Vários artigos de filtração foram descritos para a purificação ou a separação de misturas de biomateriais alvo a partir de misturas fluidas. A publicação de patente US No 2011/0207196 (Koehler et al.) descreve uma camada de filtro de profundidade com uma camada inorgânica de hidróxido duplo para reter contaminantes, como DNA, enquanto as proteínas de processos biotecnológicos podem ser transmitidas através do mesmo. A patente US n° 5.567.615 (Degen et al.) descreve um método de separação por afinidade envolvendo filtração mecânica, tida como particularmente útil no isolamento de compostos biologicamente ativos. A publicação de patente US N° 2012/0252091 (Rasmussen et al.) descreve um substrato enxertado com um polímero que tem afinidade pela ligação a biomateriais com carga neutra ou negativa.
[006]Há uma necessidade por meios filtrantes que aumentem a eficiência de custo de isolamento e/ou a purificação de biomateriais a partir de amostras de fluido. Tal eficiência pode traduzir-se em maior rendimento, devido à redução de etapas de processo, maior rendimento de uma etapa única, e/ou melhor remoção de contaminantes, resultando em carga reduzida de impurezas nos dispositivos de purificação a jusante (como colunas de cromatografia ou filtros).
[007]Em um aspecto, é descrita uma sequência de meios filtrantes que compreende: (i) um primeiro meio filtrante compreendendo um substrato não tecido de troca aniônica, sendo que o substrato não tecido de troca aniônica compreende uma pluralidade de grupos amônio quaternário; e (ii) um segundo meio filtrante compreendendo uma membrana microporosa funcionalizada, sendo que a membrana microporosa funcionalizada compreende uma pluralidade de grupos guanidila; sendo que o primeiro meio filtrante está posicionado a montante do segundo meio filtrante.
[008]Em outro aspecto, é descrito um método de filtração de um fluido biológico que compreende: (a) fornecer o fluido biológico, em que o fluido biológico compreende um biomaterial alvo e contaminantes, e (b) colocar o fluido biológico em contato com uma sequência de meios filtrantes, sendo que a sequência de meios filtrantes compreende: (i) um primeiro meio filtrante compreendendo um substrato não tecido de troca aniônica, sendo que o substrato não tecido de troca aniônica compreende uma pluralidade de grupos amônio quaternário; e (ii) um segundo meio filtrante compreendendo uma membrana microporosa funcionali- zada, sendo que a membrana microporosa funcionalizada compreende uma pluralidade de grupos guanidila; sendo que o primeiro meio filtrante é posicionado a montante do segundo meio filtrante.
[009]O sumário acima não se destina a descrever cada modalidade. Os detalhes de uma ou mais modalidades da invenção são apresentados também na descrição a seguir. Outras características, objetivos e vantagens ficarão evidentes a partir da descrição e das reivindicações.
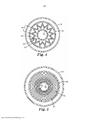
[010]A Figura 1 é uma vista em perspectiva de uma modalidade exemplifica- dora de uma sequência de meios filtrantes, de acordo com a presente revelação, formada em um artigo multicamadas que compreende uma pluralidade de pregas;
[011]A Figura 2 é uma vista em seção transversal de um dispositivo filtrante exemplificador fornecido em forma lenticular e que compreende uma sequência de meios filtrantes, de acordo com a presente revelação;
[012]A Figura 3 é uma vista em recorte parcial e em perspectiva de um dispositivo filtrante exemplificador fornecido na forma encapsulada e que compreende uma sequência de meios filtrantes, de acordo com a presente revelação;
[013]A Figura 4 é uma vista em seção transversal tomada em 4-4 da Figura 3 de um dispositivo filtrante exemplificador fornecido na forma encapsulada e que compreende um primeiro cilindro de meio pregueado compreendendo a sequência de meios filtrantes, de acordo com a presente revelação;
[014]A Figura 5 é uma vista em seção transversal tomada em 4-4 da Figura 3 de um dispositivo filtrante exemplificador fornecido na forma encapsulada e que compreende um núcleo no qual a sequência de meios filtrantes, de acordo com a presente revelação, é enrolada em espiral em torno do núcleo;
[015]A Figura 6 é um gráfico de pressão versus rendimento para o Exemplo 3 e os Exemplos Comparativos C6-C8; e
[016]A Figura 7 é uma imagem de um gel SDS-PAGE de Centrifugado de CHO 4 e o filtrado dos Exemplos 6 a 8 e do Exemplo Comparativo C11.
[017]Embora as figuras 1 a 5 identificadas acima apresentem várias modalidades da presente revelação, outras modalidades também são contempladas, conforme observado na discussão. Em todos os casos, esta revelação apresenta a descrição por meio de representação e não de limitações.
[018]Como usado aqui, o termo: “Alquila” significa um hidrocarboneto monovalente saturado, cíclico ou ací- clico, linear ou ramificado tendo de um a cerca de doze átomos de carbono, por exemplo, metila, etila, 1-propila, 2-propila, pentila, e similares. “Alquileno” significa um hidrocarboneto divalente saturado linear tendo de um a cerca de doze átomos de carbono ou um hidrocarboneto divalente saturado ramificado tendo de três a cerca de doze átomos de carbono, por exemplo, metileno, etileno, propileno, 2-metilpropileno, pentileno, hexileno, e similares. “Alquenila” significa um hidrocarboneto monovalente insaturado linear tendo de dois a cerca de doze átomos de carbono ou um hidrocarboneto insaturado ramificado tendo de três a cerca de doze átomos de carbono. “Alquenoíla” significa um grupo alquenila que compreende um grupo carbonila -C(=O)-). “Arila” significa um aromático monovalente, como fenila, naftila e similares. “Guanidila” significa um grupo funcional selecionado a partir de ao menos um dentre guanidina e biguanida. “Heteroarileno” refere-se a um grupo divalente que é aromático e heterocí- clico. Ou seja, o heteroarileno inclui ao menos um heteroátomo em um anel aromático que tem 5 ou 6 membros. Os heteroátomos adequados são tipicamente óxi, tio ou amino. O grupo pode ter um a cinco anéis que são conectados, fundidos ou uma combinação dos mesmos. Ao menos um anel é heteroaromático e qualquer outro anel pode ser aromático, não aromático, heterocíclico, carbocíclico, ou uma combinação dos mesmos. Em algumas modalidades, o heteroarileno tem até 5 anéis, até 4 anéis, até 3 anéis, até 2 anéis, ou um anel. Exemplos de grupos heteroarilenos incluem, mas não se limitam a, triazina-diila, piridina-diila, pirimidina-diila, piridazina- diila, e similares. “Hidrocarbila” é inclusivo de arila e alquila; “(Hetero)hidrocarbila” é inclusivo de grupos hidrocarbil alquila e arila e de grupos hetero-hidrocarbila, heteroalquila e heteroarila, o último compreendendo um ou mais heteroátomos catenários (em cadeia), como átomos de oxigênio ou nitrogênio. Hetero-hidrocarbila pode conter opcionalmente um ou mais grupos funcionais catenários (em cadeia) que incluem grupos funcionais éster, amida, ureia, uretano e carbonato. Exceto onde indicado em contrário, os grupos (hetero)hidrocarbila não poliméricos contêm tipicamente de 1 a 60 átomos de carbono. Alguns exemplos desses hetero-hidrocarbilas, conforme usado no presente documento, incluem, mas não se limitam a, metóxi, etóxi, propóxi, 4-difenilaminobutila, 2-(2'-fenoxietoxi)etila, 3,6-dioxa-heptila, 3,6-dioxa-hexil-6-fenila, além daqueles descritos para “alquila”, “heteroalquila”, “arila” e “heteroarila” acima. “um”, “uma”, “o” e “a” são usados de forma intercambiável e significam um ou mais. “e/ou” é usado para indicar que um ou ambos os casos apresentados podem ocorrer, por exemplo, A e/ou B inclui, (A e B) e (A ou B).
[019]Também na presente invenção, a menção de faixas com extremos inclui todos os números contidos dentro daquela faixa (por exemplo, de 1 a 10 inclui 1,4; 1,9; 2,33; 5,75; 9,98 etc.).
[020]Também na presente invenção, a menção a “pelo menos um” inclui todos os números de um a mais de um (por exemplo, pelo menos 2, pelo menos 4, pelo menos 6, pelo menos 8, pelo menos 10, pelo menos 25, pelo menos 50, pelo menos 100 etc.).
[021]A presente descrição fornece uma sequência de meios filtrantes que compreende dois substratos diferentes funcionalizados com ligantes funcionalizados diferentes. A sequência de meios filtrantes compreende ao menos dois meios funci- onalizados diferentes em uma ordem específica. Em uma modalidade, (i) um primeiro meio filtrante que compreende um substrato não tecido funcionalizado com grupos amônio quaternário está situado a montante de (ii) um segundo meio filtrante que compreende um substrato de membrana microporosa funcionalizado com grupos guanidila.
[022]O primeiro meio filtrante (i) é um substrato não tecido de troca aniônica que compreende grupos amônio quaternário.
[023]O substrato não tecido é uma manta não tecida que pode incluir mantas de não tecido produzidas por qualquer um dos processos comumente conhecidos para a produção de mantas de não tecido. Para uso na presente invenção, o termo “manta não tecida” refere-se a um tecido que tem uma estrutura de fibras ou filamentos individuais que são aleatória e/ou unidirecionalmente intercalados em uma configuração semelhante a uma esteira.
[024]Por exemplo, a manta não tecida fibrosa pode ser feita por cardação, produzida por deposição a ar (airlaid), produzida por deposição a úmido (wetlaid), hidroen- trelaçada, por fiação contínua, eletrofiação ou técnicas de fiação via fusão e sopro, como produzida por extrusão em blocos com giro de ar quente em alta velocidade (meltspun) ou produzida por extrusão em blocos com passagem de ar quente em alta velocidade (meltblown), ou combinações dos mesmos. Fibras de fiação contínua são tipicamente fibras de diâmetro pequeno que são formadas pela extrusão de polímero termoplástico fundido como filamentos a partir de uma pluralidade de capilares finos, geralmente circulares de uma fiandeira, com o diâmetro das fibras extrudadas sendo rapidamente reduzido. Fibras produzidas por sopro em fusão (meltblown) são tipicamente formadas pela extrusão de material termoplástico fundido, através de uma pluralidade de capilares de matriz finos, geralmente circulares, como fios ou filamentos fundidos a uma alta velocidade, geralmente em uma corrente de gás aquecido (por exemplo, ar) que atenua os filamentos do material termoplástico fundido para reduzir seu diâmetro. Consequentemente, as fibras produzidas por sopro fundido são levadas pela corrente de gás em alta velocidade e depositadas em uma superfície coletora para formar uma manta de fibras produzidas por sopro fundido distribuídas aleatoriamente. Qualquer uma das mantas de não tecido pode ser produzida a partir de um único tipo de fibra ou duas ou mais fibras que sejam diferentes quanto ao tipo de polímero termoplástico e/ou espessura.
[025]Fibras têxteis também podem estar presentes na manta. A presença de fibras têxteis fornece, em geral, uma manta mais aerada, menos densa que uma manta de apenas microfibras produzidas por sopro em fusão. De preferência, não mais do que cerca de 20 por cento, em peso, de fibras têxteis estão presentes, com mais preferência não mais do que cerca de 10 por cento, em peso. Essas mantas contendo fibras têxteis são apresentadas na patente US N° 4.118.531 (Hauser).
[026]O artigo não tecido pode, opcionalmente, compreender ainda uma ou mais camadas de talagarça. Por exemplo, uma ou ambas as superfícies principais podem opcionalmente compreender ainda uma camada de talagarça. A talagarça, que é tipicamente um reforço tecido ou não tecido produzido a partir de fibras, é incluída para oferecer força ao artigo não tecido. Os materiais de talagarça adequados incluem, mas não se limitam a, náilon, poliéster, fibra de vidro, polietileno, polipropileno e similares. A espessura média da talagarça pode variar. Tipicamente, a espessura média da talagarça fica na faixa de cerca de 25 a cerca de 100 micrômetros, de preferência, cerca de 25 a cerca de 50 micrômetros. A camada da talagarça pode, opcionalmente, ser ligada ao artigo não tecido. Uma variedade de materiais adesivos pode ser usada para ligar a talagarça ao material polimérico. Alternativamente, a talagarça pode ser ligada por calor ao não tecido.
[027]As microfibras do substrato não tecido têm tipicamente um diâmetro eficaz de fibra de ao menos 0,5, 1, 2, ou mesmo 4 micrômetros e de no máximo 15, 10, 8 ou mesmo 6 micrômetros, conforme calculado de acordo com o método citado em Davies, C. N., “The Separation of Airborne Dust and Particles,” Institution of Mechanical Engineers, London, Proceedings 1B, 1952. O substrato não tecido tem, de preferência, um peso base na faixa de ao menos 5, 10, 20 ou mesmo 50 g/m2; e de no máximo 800, 600, 400, 200 ou mesmo 100 g/m2. A resistência à tração mínima da manta de não tecido é cerca de 4,0 Newtons. É geralmente reconhecido que a resistência à tração de não tecidos é mais baixa na direção da máquina do que na direção transversal à manta devido aos melhores entrelaçamento e ligação da fibra na última.
[028]Detalhes adicionais sobre o método de fabricação de mantas não tecidas podem ser encontrados em Wente, Superfine Thermoplastic Fibers, 48 INDUS. Eng. Chem. 1342 (1956), ou em Wente et al., Manufacture Of Superfine Organic Fibers (Naval Research Laboratories Report No. 4364, 1954).
[029]A aeração da manta não tecida é medida por solidez, um parâmetro que define a fração de sólidos em um volume de manta. Os valores de solidez mais baixos são indicativos de maior aeração da manta. Substratos não tecidos úteis têm uma solidez menor que 20% e, de preferência, menor que 15%. A solidez é uma fração adimensional tipicamente representada por α: em que mf é a massa de fibra por área de superfície da amostra, e p é a densidade da fibra; e Lnão tecido é a espessura do não tecido. A solidez é usada na presente invenção para se referir ao próprio substrato não tecido e não para o não tecido funcionalizado. Quando um substrato não tecido contém misturas de dois ou mais tipos de fibras, os valores de solidez individual são determinados para cada tipo de fibra usando o mesmo Lnão tecido, e esses valores de solidez individuais são adicionados em conjunto para obter a solidez da manta, α.
[030]O substrato não tecido pode ser formado a partir de fibras ou filamentos feitos de qualquer material polimérico termoplástico adequado. Os materiais poliméri- cos adequados incluem, mas não se limitam a poliolefinas, poli(isoprenos), poli(buta- dienos), polímeros fluorados, polímeros clorados, poliamidas, poliimidas, poliéteres, poli(éter sulfonas), poli(sulfonas), poli(acetatos de vinila), copolímeros de acetato de vinila, como poli(etileno)-co-poli(álcool vinílico), poli(fosfazenos), poli(ésteres de vi- nila), poli(éteres de vinila), poli(alcoóis vinílicos) e poli(carbonatos).
[031]Poliolefinas adequadas incluem, mas não se limitam a, poli(etileno), poli(propileno), poli(1-buteno), copolímeros de etileno e propileno, copolímeros de alfa-olefina (como copolímeros de etileno ou prolileno com 1-buteno, 1-hexeno, 1-oc- teno, e 1-deceno), poli(etileno-co-1-buteno) e poli(etileno-co-1-buteno-co-1-hexeno).
[032]Os polímeros fluorados adequados incluem, mas não se limitam a, poli(fluoreto de vinila), poli(fluoreto de vinilideno), copolímeros de fluoreto de vinili- deno (como poli(fluoreto de vinilideno-co-hexafluorpropileno) e copolímeros de clo- rotrifluoroetileno (como poli(etileno-co-clorotrifluoroetileno).
[033]As poliamidas adequadas incluem, mas não se limitam a, poli(iminoadipoili- mino-hexametileno), poli(iminoadipoiliminodecametileno), e policaprolactama. As poliimi- das adequadas incluem poli(piromelitimida).
[034]As poli(sulfonas de éter) adequadas incluem, mas não se limitam a, poli(sulfonas de éter difenílico) e poli(óxido de sulfona de difenilsulfona-co-difenileno).
[035]Copolímeros adequados de acetato de vinila incluem, mas não se limitam a, poli(etileno-co-acetato de vinila) e tais copolímeros em que pelo menos alguns dos grupos acetato foram hidrolisados para obter vários poli(álcoois vinílicos), incluindo poli(etileno-álcool-co-vinílico)
[036]O substrato não tecido da presente revelação é tratado para compreender um grupo funcional amônio quaternário, isto é, -N+ R1R2R3 X-, em que X- é um grupo contraíon, frequentemente um haleto (por exemplo, Cl-), um sulfato, um fosfato, um nitrato, e similares. Em algumas modalidades, R1, R2, e R3 do grupo funcional de amônio são todos metila. Em outras modalidades, um dentre os grupos R1, R2, ou R3 é metila e os outros dois são um alquila tendo de 2 a 18, de 2 a 10, de 2 a 6 ou de 2 a 4 átomos de carbono. Em outras modalidades, dois dos grupos R1, R2, ou R3 são metila e o outro grupo é um alquila tendo de 2 a 18, de 2 a 10, de 2 a 6 ou de 2 a 4 átomos de carbono. Ainda em outras modalidades, ao menos dois dentre os grupos R1, R2, e R3 se combinam com o átomo de nitrogênio ao qual estão ligados para formar um grupo heterocíclico. O grupo heterocíclico inclui pelo menos um átomo de nitrogênio e pode conter outros hete- roátomos como oxigênio ou enxofre. Os grupos heterocíclicos exemplificadores incluem, mas não se limitam a, piperidinila e morfolinila. O grupo heterocíclico pode ser fundido a um anel adicional, como um benzeno, cicloexeno, ou cicloexano.
[037]O grupo amônio quaternário é covalentemente ligado ao substrato não tecido com o uso de técnicas conhecidas na técnica anterior. Tipicamente, o grupo amônio quaternário é enxertado através de um grupo de ligação diretamente no substrato não tecido ou no substrato não tecido que foi tratado com uma camada primer.
[038]Em uma modalidade, o substrato não tecido é enxertado com o uso de um sal de amônio quaternário de um monômero de aminoalquil(met)acriloíla, comoEm que Ri é hidrogênio ou metila, de preferência, metila; L é -O- ou -NH-; e Y é um alquileno (por exemplo, um alquileno tendo 2 a 10 átomos de carbono, de 2 a 6 ou de 2 a 4 átomos de carbono). R2, R3, e R4 são, independentemente, arila ou alquila, de preferência, alquila C1-C4; e X- é o contra-ânion.
[039]Os sais quaternários exemplificadores dos monômeros iônicos da Fórmula II incluem, mas não se limitam a, sais de (met)acrilamido alquil trimetil amônio (por exemplo, cloreto de 3-(met)acrilamido propil trimetil amônio e cloreto de 3-acri- lamidopropil trimetil amônio) e sais de (met)acril oxi alquil trimetil amômio (por exemplo, cloreto de 2-acrilóxi etil trimetil amônio, cloreto de 2-metacrilóxi etil trimetil amô- nio, cloreto de 3-metacrilóxi-2-hidróxi propil trimetil amônio, cloreto de 3-acrilóxi-2- hidróxi propil trimetil amônio e 2-acrilóxi etil trimetil amônio sulfato de metila).
[040]Tais monômeros que têm um grupo amônio quaternário de Fórmula I podem ser diretamente enxertados na superfície do substrato não tecido ou um mo- nômero de aminoalquil(met)acriloíla de enxertia, que tem um grupo amina primária, secundária ou terciária, pode ser enxertado e, subsequentemente, convertido em um grupo amônio quaternário por alquilação. Tal fabricação de não tecidos de troca aniônica é descrita na patente US n° 8.328.023. (Weiss et al.).
[041]Em uma modalidade, o polímero enxertado que tem grupos amônio quaternário derivados do monômero de Fórmula I compreende adicionalmente unidades derivadas de monômeros monofuncionais etilenicamente insaturados que têm um grupo poli(óxido de alquileno). As unidades monoméricas que têm um grupo poli(óxido de alquileno) têm a seguinte fórmula:Z-Q-(CH(R5)-CH2-O)m- R6, em que Z é uma porção etilenicamente insaturada polimerizável, R5 é um H ou um grupo alquila C1 a C4; Q é N(R5) ou O; e R6 é um H, um grupo alquila C1 a C4, grupo arila, ou suas combinações e m é de 2 a 100, de preferência, de 5 a 20. A porção etilenicamente insaturada útil, Z, do monômero pode incluir:em que R3 é H ou -CH3 e r = 1 a 10.
[042]Exemplos de monômeros poli(óxido de alquileno) monofuncionais adequados incluem (met)acrilato de poli(óxido de etileno), (met)acrilato de poli(óxido de propi- leno), (met)acrilato de poli(óxido de etileno-óxido de propileno) e combinações dos mesmos. Tais monômeros incluem, de preferência, um grupo final não reativo como hidrogênio, alcóxi (C1-C4), arilóxi (por exemplo, fenóxi), e alcarilóxi (C1-C4). Esses grupos podem ser lineares ou ramificados. Esses monômeros podem ser de uma ampla gama de pesos moleculares e estão disponíveis comercialmente junto a fontes como Sartomer Company, Exton, PA, EUA; Shinnakamura Chemical Co., Ltd., Tóquio, Japão; Aldrich, Milwaukee, WI, EUA; e Osaka Organic Chemical Ind., Ltd., Osaka, Japão.
[043]Em uma modalidade, os polímeros enxertados compreendendo o grupo amônio quaternário de Fórmula I são adicionalmente derivados de “monômeros hidro- fílicos”. Para uso na presente invenção, “monômeros hidrofílicos” são aqueles monômeros polimerizáveis que têm uma miscibilidade em água (água em monômero) de ao menos 1% em peso, de preferência, de ao menos 5% em peso sem alcançar um ponto de névoa, são exclusivos de monômero de poli(óxido de alquileno) e não contêm grupos funcionais ácidos ou grupos que poderiam retardar a polimerização com enxertia. Exemplos de monômeros hidrofílicos adequados incluem (met)acrilato de 2-hidróxi etila (HEMA), (met)acrilato de 2-hidróxi propila, (met)acrilato de 3-hidróxi propila, (met)acrilato de 2,3-diidróxi propila, (met)acrilato de 4-hidroxibutila, N-vinil ca- prolactama, N-vinil acetamida, N-vinil pirrolidona, acrilonitrila, acrilato de tetraidrofurfu- rila, acrilamida, acrilamida substituída por mono- ou di-N-alquila, metacrilato de glice- rol, e combinações dos mesmos. Monômeros polares preferenciais incluem (met)acri- lato de 2-hidróxi etila (HEMA), N-vinil pirrolidona, N-vinil acetamida, metilacrilamida, e misturas dos mesmos. Em uma modalidade, os polímeros enxertados contendo o grupo amônio quaternário de Fórmula I é um polímero derivado de monômero de ami- noalquil (met)acriloíla, monômero de poli(óxido de alquileno) e, opcionalmente, um segundo monômero hidrofílico. Em uma modalidade, o polímero enxertado é derivado de a 80 a 98%, em peso, de um monômero de aminoalquil (met)acriloíla; De 2 a 20%, em peso, de monômero de poli(óxido de alquileno); e de 0 a 10%, em peso, do monô- mero hidrofílico. Exemplos de monômeros de poli(óxido de alquileno) adequados incluem (met)acrilato de poli(óxido de etileno), (met)acrilato de poli(óxido de propileno), (met)acrilato de poli(óxido de etileno-óxido de propileno) e combinações dos mesmos. Mais informações sobre tal enxertia podem ser encontradas na patente US n° 8.328.023 (Weiss et al.).
[044]Em uma modalidade, os polímeros enxertados contendo o grupo amô- nio quaternário de Fórmula I são adicionalmente derivados de um monômero de amida, um monômero óxi e, opcionalmente, um monômero de poli(óxido de alqui- leno). Em uma modalidade, o polímero enxertado é derivado de 10 a 50 partes, em peso, de um grupo amônio quaternário compreendendo monômero; de 10 a 80 partes, em peso, de um monômero de amida; de 10 a 40 partes, em peso, de um monômero óxi; e de 0 a 30 partes, em peso, do monômero de poli(óxido de alqui- leno).
[045]O monômero de amida é um monômero hidrofílico que compreende (met)acrilamidas e N-vinil amidas das fórmulas gerais:em que R3 é -H ou alquila C1-C4; cada R8 é um H, um alquila ou um grupo arila, R9 e R10 são grupos alquila, ou podem ser tomados em conjunto para formar um anel de 5 ou 6 membros. Exemplos de monômeros de amida hidrofílicos adequados incluem N-vinilcaprolactama, N-vinilacetamida, N-vinilpirrolidona, acrilamida, acrila- mida mono- ou di-N-alquil-substituída, e suas combinações. Os monômeros polares preferenciais incluem N-vinilpirrolidona, N-vinilacetamida, metilacrilamida, e suas misturas. O monômero óxi inclui (met)acrilatos epóxi-funcionais e monoéter-funcionais e (met)acrilamidas e aqueles da fórmula geral: sendo que: R3 é -H ou alquila C1-C4; X1 é -NR3- ou -O-; e R1 é um grupo (hetero)hidrocar- bila epóxi-funcional ou éter-funcional. Mais particularmente, o grupo éter-funcional é um grupo alquileno-óxi alquila inferior. De preferência, o grupo R1 é baseado em um hidrocarboneto de cadeia linear, ramificado, cíclico ou policílico de 2 a 30 átomos de carbono tendo um grupo oxirano (epóxi) incluído. Com mais preferência, o grupo R8 contém de 3 a 10 átomos de carbono, como metacrilato de glicidila (GMA). Maiores informações referentes a tal enxerto podem ser encontradas na publicação de patente US n° 2015/0099413 (Berrigan et al.).
[046]A espessura média do primeiro meio filtrante é, de preferência, de ao menos 0,1, 0,25 ou mesmo 1 mm; e, no máximo, 5, 8 ou mesmo 10 mm.
[047]Em uma modalidade, o primeiro meio filtrante compreende ao menos 0,1, 0,2, 0,4, 0,8, 1, ou mesmo 5 mmol de grupos amônio quaternário por grama do primeiro meio filtrante.
[048]O segundo meio filtrante (ii) é um substrato de membrana microporosa funcionalizada com grupos guanidila.
[049]A membrana microporosa é um substrato polimérico poroso (como folha ou filme) compreendendo microporos com um tamanho de poro de fluxo médio, como o caracterizado pelo método de teste padrão ASTM N° F316-03, “Standard Test Methods for Pore Size Characteristics of Membrane Filters by Bubble Point and Mean Flow Pore Test,” menor que 5 micrômetros. Em uma modalidade, a membrana microporosa tem um tamanho de poro de fluxo médio de ao menos 0,1, 0,2, 0,5, 0,8, ou mesmo 1 micrômetro; e no máximo 5, 3, ou mesmo 2 micrômetros. O tamanho de poro desejado pode variar dependendo da aplicação. A membrana microporosa pode ter uma distribuição simétrica ou assimétrica (por exemplo, gradiente) de tamanho de poro na direção do fluxo de fluido.
[050]A membrana microporosa pode ser formada a partir de qualquer material polimérico termoplástico adequado. Os materiais poliméricos adequados incluem, mas não se limitam a, poliolefinas, poli(isoprenos), poli(butadienos), polímeros fluorados, polímeros clorados, poliamidas, poli-imidas, poliéteres, poli(éter sulfonas), poli(sulfonas), poli(acetatos de vinila), poliésteres como poli (ácido lático), co- polímeros de acetato de vinila, como poli(etileno)-co-poli(álcool vinílico), poli(fosfa- zenos), poli(éteres de vinila), poli(álcoois vinílicos) e poli(carbonatos).
[051]Poliolefinas adequadas incluem, mas não se limitam a, poli(etileno), poli(propileno), poli(1-buteno), copolímeros de etileno e propileno, copolímeros de alfa-olefina (como copolímeros de etileno ou prolileno com 1-buteno, 1-hexeno, 1-oc- teno, e 1-deceno), poli(etileno-co-1-buteno) e poli(etileno-co-1-buteno-co-1-hexeno).
[052]Os polímeros fluorados adequados incluem, mas não se limitam a, poli(fluoreto de vinila), poli(fluoreto de vinilideno), copolímeros de fluoreto de vinili- deno (como poli(fluoreto de vinilideno-co-hexafluorpropileno) e copolímeros de clo- rotrifluoroetileno (como poli(etileno-co-clorotrifluoroetileno).
[053]Os polímeros fluorados adequados incluem, mas não se limitam a, poli(imi- noadipoliliminohexametileno), poli(iminoadipoliliminodecametileno) e policaprolactama. As poliimidas adequadas incluem, mas não se limitam a, poli(piromellitimida).
[054]As poli(sulfonas de éter) adequadas incluem, mas não se limitam a, poli(sulfonas de éter difenílico) e poli(óxido de sulfona de difenilsulfona-co-difenileno).
[055]Copolímeros adequados de acetato de vinila incluem, mas não se limitam a, poli(etileno-co-acetato de vinila) e copolímeros em que pelo menos alguns dos grupos acetato foram hidrolisados para obter-se vários poli(alcoóis vinílicos).
[056]Em uma modalidade, a membrana microporosa é uma membrana de separação de fases induzida por solvente (SIPS). As membranas SIPS são frequentemente feitas pela preparação de uma solução homogênea de um polímero no primeiro (s) solvente (s), moldar por fusão a solução em um formato desejado, por exemplo, folha plana ou fibra oca, colocar a solução moldada por fusão em contato com um outro segundo solvente que é um não solvente para o polímero, mas um solvente para o primeiro solvente (isto é, o primeiro solvente é miscível com o segundo solvente, mas o polímero não é). A separação de fase é induzida por difusão do segundo solvente na solução de polímero fundido e difusão do primeiro solvente para fora da solução de polímero e para dentro do segundo solvente, precipitando, dessa forma, o polímero. A fase pobre em polímero é removida e o polímero submetido a secagem para produzir a estrutura porosa. A SIPS é também chamada de inversão de fases ou separação de fases induzida por difusão, ou separação de fases induzida por não solvente, sendo tais técnicas conhecidas comumente na técnica. Membranas microporosas SIPS são também descritas nas patentes US n°s. 6.056.529 (Meyering et al.), 6.267.916 (Meyering et al), 6.413.070 (Meye- ring et al.), 6.776.940 (Meyering et al.), 3.876.738 (Marinacchio et al.), 3.928.517 (Knight et al.), 4.707.265 (Knight et al.), e 5.458.782 (Hou et al.).
[057]Em uma modalidade, a membrana microporosa é uma membrana de separação de fases induzida por solvente (TIPS). As membranas TIPS frequentemente são preparadas através da formação de uma solução homogênea de um material termoplástico e um segundo material (como um diluente), e opcionalmente incluindo um agente de nucleação, através de mistura em temperaturas elevadas em um equipamento de composição de plástico, por exemplo, uma extrusora. A solução pode ser formada pela passagem através de uma placa de orifícios ou matriz de extrusão e, sob resfriamento, o material termoplástico cristaliza e a fase se separada do segundo material. Com frequência, o material termoplástico cristalizado é estirado. O segundo material é opcionalmente removido antes ou depois do estiramento, deixando uma estrutura polimérica porosa. As membranas microporosas TIPS são adicionalmente descritas na patente US n° US 4.529.256 (Shipman); 4.726.989 (Mrozinski); 4.867.881 (Kinzer); 5.120.594 (Mrozinski); 5.260.360 (Mrozinski); e 5.962.544 (Waller, Jr.). Algumas membranas TIPS de exemplo compreendem poli(fluoreto de vinilideno) (PVDF), poliolefinas como poli(etileno) ou poli(propileno), vinil contendo polímeros ou copolímeros, como copolímeros de etileno vinil álcool e butadieno contendo polímeros ou copolímeros, e polímeros ou copolímeros contendo acrilato. As membranas TIPS que compreendem PVDF são adicionalmente descritas na patente US n° 7.338.692) (Smith et al.).
[058]A membrana microporosa da presente invenção é tratada para compre-ender um grupo funcional guanidila. Tais grupos funcionais incluem grupos guani-dina de Fórmula II ou grupos biguanidina de Fórmula III:
em que R1, R2, R3, R4, R5, e R6 são independentemente selecionados de H ou hidrocarbila, de preferência, alquila C1-C12.
[059]O grupo funcional guanidila é covalentemente ligado ao substrato de membrana porosa com o uso de técnicas conhecidas na técnica. Tipicamente, o grupo funcional guanidila é enxertado através de um grupo de ligação diretamente no substrato de membrana porosa e em um substrato de membrana que foi tratado com uma ca- mada primer.
[060]Em uma modalidade, uma membrana porosa é tratada com grupos guani-dila derivados de unidades monoméricas ligante-funcionais de Fórmula Iva ou b:em que R1 é H ou alquila C1-C4; R2 é um grupo (hetero)hidrocarbila, opcionalmente contendo um éster, amida, uretano ou ureia, de preferência, um alquileno divalente tendo de 1 a 20 átomos de carbono; cada R3 é independentemente H ou hidrocarbila, de preferência, alquila C1-C12; R4 é H, alquila C1-C12 ou -N(R3)2; R5 é H ou hidrocarbila, de preferência, alquila C1-C12 ou arila; X1 é -O- ou -NR3-, o é 0 ou 1, e n é 1 ou 2.
[061]Tais monômeros contendo guanidila podem ser preparados por condensação de um composto de alquenila ou alquenoíla, tipicamente um haleto de (met)acriloíla, um isocianato de (met)acriloíla, ou uma alquenilazlactona, com um composto de Fórmulas Va ou Vb:em que R1 é H ou alquila C1-C4; R2 é um grupo (hetero)hidrocarbila, opcionalmente contendo um éster, amida, uretano ou ureia, de preferência, um alquileno divalente tendo de 1 a 20 átomos de carbono; cada R3 é independentemente H ou hidro- carbila, de preferência, alquila C1-C12; R4 é H, alquila C1-C12 ou -N(R3)2; e X1 é -O- ou -NR3-. Outros monômeros ligantes podem ser preparados por condensação de um monômero contendo carbonila, como acroleína, vinil metil cetona, diacetona acrila- mida ou metacrilato de acetoacetoxietila, opcionalmente na presença de um agente redutor com um composto de Fórmulas Va ou Vb.
[062]A publicação de patente US N° 2012/0252091 (Rasmussen et al.) descreve o tratamento de um substrato poroso com uma camada de polímero de poliamina reticulado que tem grupos polimerizáveis etilenicamente insaturados, e então o enxerto desta camada primer em um polímero derivado dos monômeros contendo guanidila acima citados. A publicação de patente US N° (2015/0136698 (Bothof et al.) ensina o enxerto de um substrato com monômeros contendo guanidila acima citados na presença de um fotoiniciador do tipo II. Um fotoiniciador do tipo II é um iniciador que, quando ativado por radiação actínica, forma radicais livres por abstração do hidrogênio de um segundo composto (doador H) para gerar a efetiva iniciação via radicais livres. Esses iniciadores são conhecidos na técnica.
[063]Em uma modalidade, a camada de polímero enxertado derivada do monô- mero contendo guanidila é um homopolímero de unidades de monômero de guanidila.
[064]Em uma modalidade, a camada de polímero enxertado derivada do monô- mero contendo guanidila é um copolímero de unidades de monômero de guanidila.
[065]Além do monômero contendo guanidila, em uma modalidade, a camada de polímero enxertado derivada do monômero contendo guanidila pode ser derivada de outros monômeros como monômeros multifuncionais de (met)acriloíla, incluindo monômeros de (met)acrilato e de (met) acrilamida. Exemplos de (met)acrilatos multifuncionais úteis incluem, mas não se limitam a, di(met)acrilatos, tri(met)acrilatos e tetra(met)acrilatos, como di(met)acrilato de etileno glicol, di(met)acrilato de 1,6-he- xanediol, di(met)acrilatos de poli(etilenoglicol), di(met)acrilato de polibutadieno, di(met)acrilatos de poliuretano e tri(met)acrilato de glicerina propoxilada, metileno bisacrilamida, etileno bisacrilamida, hexametileno bisacrilamida, diacriloilpiperazina e misturas dos mesmos. Em uma modalidade, a camada de polímero pode ser derivada de monômeros hidrofílicos que compreendem ao menos um grupo alquenila, de preferência, um grupo (met)acriloíla, e um grupo hidrofílico incluindo poli(oxial- quileno) e grupos iônicos, para fornecer capacidade hidrofílica ao substrato, ou para proporcionar maior seletividade ao substrato quando faz a ligação de biomateriais. Os grupos iônicos hidrofílicos podem ser neutros e/ou ter uma carga positiva. Em uma modalidade, um monômero de carga negativa pode ser incluído, contanto que seja adicionado em quantidades pequenas o suficiente para não interferir com a interação de ligação dos grupos guanidila.
[066]Em uma modalidade, o segundo meio filtrante compreende ao menos 0,01, 0,05, 0,1, ou mesmo 0,5 mmol; e, no máximo, 1, 1,5, ou mesmo 2 mmol de grupos guanidila por grama da membrana microporosa funcionalizada.
[067]Em uma modalidade, a espessura do segundo meio filtrante tem ao menos 5, 10, 20, 25 ou mesmo 50 micrômetros de espessura; e no máximo 800, 500, 200, ou mesmo 100 micrômetros de espessura.
[068]Conforme descrito na presente invenção, a combinação do primeiro e segundo meios filtrantes é usada como os meios filtrantes. Quando usado em uma aplicação de filtração, em uma modalidade, uma ou mais camadas do primeiro meio filtrante pode ser usada. Quando uma pluralidade de camadas do primeiro meio filtrante é usada, cada camada pode ter diâmetro eficaz de fibra, peso base, solidez, quantidade de amônio quaternário enxertado, resistência à tração e área superficiais iguais ou diferentes. Em algumas modalidades, cada camada subsequente do primeiro meio filtrante pode ter um menor diâmetro eficaz de fibra de modo que os contaminantes mais finos possam ficar retidos. Quando uma pluralidade do segundo meio filtrante é usada, cada camada pode ter uma distribuição simétrica ou assimétrica (por exemplo, gradiente) de tamanho de poro na direção de fluxo de fluido e as camadas podem ter tamanho de poro de fluxo médio, porosidade, quantidade de grupos guanidila enxertados, resistência à tração e área superficial iguais ou diferentes. Em algumas modalidades, cada camada subsequente do segundo meio filtrante pode ter tamanho eficaz de poro menor de modo que os contaminantes mais finos possam ficar retidos.
[069]O número de camadas do primeiro meio filtrante pode variar (ou ser otimizado) com base na matriz de amostra, e/ou no tipo e/ou quantidade de conta- minantes no fluido biológico. Por exemplo, o número de camadas do primeiro meio filtrante pode variar para otimizar a concentração de íons de amônio quaternário presentes, com base na quantidade de fragmentos de células e/ou DNA na amostra. O número de camadas do segundo meio filtrante pode variar para otimizar a concentração de grupos guanidila presentes com base na quantidade de proteína de célula hospedeira na amostra.
[070]Na presente revelação, o primeiro meio filtrante é colocado a montante da segunda membrana de filtração. Em uma modalidade, o segundo meio filtrante está a montante de uma etapa de captura de cromatografia, em que a biomolécula alvo é retida nos meios e então, subsequente e deliberadamente, é liberada dos meios para purificar e/ou concentrar a biomolécula alvo. Tais etapas de captura podem envolver uma coluna de cromatografia, como uma coluna de proteína A.
[071]Em uma modalidade, o primeiro e o segundo meios filtrantes estão contidos em compartimentos separados, em que o primeiro meio filtrante está a montante do segundo meio filtrante. Com mais preferência, o primeiro e o segundo meios filtrantes estão contidos no mesmo compartimento.
[072]Em algumas modalidades, uma membrana microporosa não funcionali- zada de exclusão de tamanho é disposta entre o primeiro e o segundo meios filtrantes. Uma membrana microporosa é definida acima. A membrana é não funcionalizada, o que significa que a membrana é substancialmente desprovida (isto é, menos de 10, 1 ou mesmo 0,1 μmol por grama de membrana de exclusão de tamanho não funciona- lizada) de grupos químicos funcionais de troca iônica. A membrana é uma membrana de exclusão de tamanho, o que significa que ela retém as partículas essencialmente por peneiragem mecânica. Quando incluída, a membrana de exclusão de tamanho não funcionalizada vantajosamente tem um tamanho de poro no ponto de bolha, medido de acordo com o método de teste ASTM No. F316-03, “Standard Test Methods for Pore Size Characteristics of Membrane Filters by Bubble Point and Mean Flow Pore Test,” menor do que o do segundo meio filtrante.
[073]Em uma modalidade, a membrana de exclusão de tamanho não funcio- nalizada compreende uma estrutura de poro assimétrica. Em uma modalidade, a membrana de exclusão de tamanho não funcionalizada compreende um gradiente ou morfologia de poro em zonas múltiplas, com o tamanho de poro diminuindo a partir da superfície a montante em direção à superfície a montante, para fornecer alta capacidade de carregamento de partículas. Tipos de membranas microporosas de exclusão de tamanho não funcionalizadas incluem aquelas descritas acima como substratos adequados para o segundo meio filtrante.
[074]Em algumas modalidades, a presente descrição apresenta um dispositivo filtrante que compreende um compartimento dotado de uma parede de topo, uma parede de fundo, uma parede lateral genericamente cilíndrica que se estende entre a parede de topo e a parede de fundo, um elemento filtrante disposto no interior do compartimento que compreende uma entrada e uma saída definindo uma trajetória de fluxo de líquidos ao longo do elemento filtrante. A trajetória de fluxo de líquidos tem uma porção a montante adjacente à entrada e uma porção a jusante adjacente à saída de modo que o fluido flui através do primeiro meio filtrante e, então, através do segundo meio filtrante até a saída.
[075]Em uma modalidade, o primeiro e o segundo meios filtrantes podem ser, cada um, individualmente, configurado como um disco plano ou lenticular. Em algumas modalidades, o primeiro e o segundo meios filtrantes podem ser, cada um, individualmente pregueados.
[076]De preferência, o primeiro e o segundo meios filtrantes estão situados em estreita proximidade, com mais preferência, o primeiro e o segundo meios filtrantes estão alojados no interior do mesmo compartimento do filtro. Em uma modalidade, o primeiro e o segundo meios filtrantes são configurados como um disco plano ou lenticular. Em algumas modalidades, o primeiro e o segundo meios filtrantes são pregueados juntos. Em uma modalidade, o segundo meio filtrante é enrolado em torno de um núcleo e o primeiro meio filtrante é enrolado ao redor do segundo meio filtrante. Alternativamente, o segundo meio filtrante é disposto sobre o primeiro meio filtrante para formar uma construção em múltiplas camadas, sendo que uma camada única da construção em múltiplas camadas é enrolada em torno da circunferência de um núcleo e ligada uma à outra e paralelas ao eixo geométrico do núcleo, sendo que o segundo meio filtrante está a jusante a partir do primeiro meio filtrante. Modalidades exemplificadoras são mostradas nas Figuras a seguir.
[077]A Figura 1 apresenta um meio filtrante exemplificador 10, de acordo com a presente descrição, que compreende um primeiro meio filtrante 1 (não tecido com grupos amônio quaternário) e um segundo meio filtrante 2 (membrana porosa com grupos guanidila). Uma camada não funcional opcional (não mostrada) como um filtro de tamanho de partícula, pode ser disposta entre o primeiro meio filtrante e o segundo meio filtrante. Conforme mostrado, o meio filtrante 10 compreende uma pluralidade de pregas 4. Em algumas modalidades, o meio filtrante pregueado 10 pode ser incorporado em um dispositivo filtrante. Os exemplos de configurações de pregueamento e de dispositivos filtrantes que compreendem meios pregueados pode ser encontrado, por exemplo, na patente US n° 6.521.011 (Sundet et al).
[078]A Figura 2 representa uma vista em seção transversal interna de um dispositivo filtrante exemplificador 200 de acordo com a presente descrição que compreende a sequência de meios filtrantes na forma de uma célula filtrante lenticular. A célula filtrante lenticular compreende duas seções de meios filtrantes semelhantes a disco, identificadas como sequência de meios filtrantes 20A e sequência de meios filtrantes 20B, entre as quais se encontra um volume interno 25. A sequência de meios filtrantes estende-se a partir da vedação externa 27 até a vedação interna 24 no núcleo central 26. Em conjunto, a sequência de meios filtrantes 20A e a sequência de meios filtrantes 20B são chamadas de embalagem de meio filtrante. Em algumas modalidades, a embalagem de meio filtrante pode ser uma extensão do tipo bolso do meio filtrante, por exemplo, dobrada sobre si mesma, sem necessidade de uma vedação externa. Quando o fluxo de fluido procede do exterior do dispositivo filtrante 200 para o interior 25, a superfície externa da sequência de meios filtrantes 20A e 20B (designada como 201 na Figura 2) é o lado sujo ou lado a montante da sequência de meios filtrantes 20A e 20B e a superfície interna da sequência de meios filtrantes 20A e 20B (designada como 202 na Figura 2) é o lado filtrado ou lado a jusante da sequência de meios filtrantes. Sob tais condições de fluxo de fluido, a primeira sequência de meios filtrantes 20A compreende o primeiro meio filtrante 21A e o segundo meio filtrante 22A, ao passo que a sequência de meios filtrantes 20B compreende o primeiro meio filtrante 21B e o segundo meio filtrante 22B. Uma camada não funcional opcional (não mostrada) como um filtro de tamanho de partícula, pode ser disposta entre o primeiro meio filtrante e o segundo meio filtrante.
[079]O núcleo central 26 tem uma pluralidade de passagens radiais 28 em seu interior, que fornecem comunicação fluida, em um modo radial, entre o interior 25 e a disposição da parte central 23. Um elemento separador 29 que, por exemplo, é composto de uma pluralidade de nervuras, se estende a partir da disposição da parte central 23 para o interior 25 entre as sequências de meios filtrantes 20A e 20B. O elemento separador 29 é um elemento não filtrante que facilita o fluxo de fluido a partir do interior 25 através das passagens radiais 28 até a disposição da parte central 23. Adicionalmente, o elemento separador 29 inibe a retração da sequência de meios filtrantes 20A e 20B para o interior 25, por exemplo, devido à pressão da sequência de meios filtrantes 20A e 20B quando o fluido é filtrado pela célula lenticular filtrante 200. Conforme representado na Figura 2, o elemento separador 29 tem um diâmetro externo menor que o diâmetro externo das sequências de meios filtrantes 20A e 20B. Em algumas modalidades, o elemento separador 29 pode ter um diâmetro externo igual a, ou ligeiramente maior que o diâmetro externo das sequências de meios filtrantes 20A e 20B, de modo que o elemento separador 29 é encapsulado dentro da vedação externa 27.
[080]Embora a Figura 2 seja descrita em uma operação na qual o fluxo de fluido procede do exterior da célula lenticular para o interior, a célula lenticular pode também ser operada na direção reversa, em que o fluxo de fluido procede de dentro para fora. Quando o fluxo de fluido está na direção acima descrita, a superfície 202 seria o lado sujo ou o lado a montante da sequência de meios filtrantes e a superfície 201 seria o lado filtrado ou o lado a jusante da sequência de meios filtrantes. Sob essas condições de fluxo de fluido, o primeiro meio filtrante estaria localizado no interior da célula lenticular e o segundo meio filtrante estaria localizado a jusante do primeiro meio filtrante.
[081]Exemplos células filtrantes lenticulares e métodos para sua preparação podem ser encontrados, por exemplo, na patentes US n°. 6.464.084 (Pulek); 6.939.466 (Pulek); 7.178.676 (Pulek et al.); e 6.712.966 (Pulek et al.); e nas publicações dos pedidos de patente n° 2011/0259812 (Marks et al.). As células filtrantes lenticulares podem ser usadas, por exemplo, juntamente com sistemas filtrantes descritos na publicação de patente US n° 2011/0297604 (Bryan et al.).
[082]A Figura 3 é um dispositivo filtrante exemplificador 300 compreendendo a cápsula filtrante 33. A sequência de meios filtrantes 30 é encapsulada na cápsula filtrante 33, que compreende a entrada de fluido 35 e a saída de fluido 36. A válvula de respiro 37 é usada para expelir ar do dispositivo filtrante, enquanto a válvula de drenagem 38 é usada para drenar o dispositivo filtrante após o uso. Conforme visto em corte na Figura 3, o dispositivo filtrante compreende um núcleo interno perfurado 34 que se estende coaxialmente ao longo da cápsula filtrante 33 conectando de maneira fluida a sequência de meios filtrantes 30 à saída de fluido 36. A sequência de meios filtrantes 30 é mostrada estendendo-se a partir da cápsula filtrante 33 para mostrar os elementos do dispositivo filtrante, no entanto em uso, a sequência de meios filtrantes está situada entre o núcleo interno perfurado 34 e a periferia externa perfurada 39, que pode ser vista nas Figuras 3 e 4. A entrada de fluido 35 está em comunicação fluida com a periferia externa perfurada 39. Em operação, o fluido entra na entrada de fluido 35, então sequencialmente passa através da periferia externa perfurada 39, da sequência de meios filtrantes 30, do núcleo interno perfurado 34, e então sai pela saída de fluido 36. A periferia externa perfurada 39 pode ser uma rede, gaiola perfurada, etc. usada para apoiar a sequência de meios filtrantes, especialmente em operações de refluxo. Dependendo da construção da sequência de meios filtrantes, o dispositivo filtrante pode não compreender uma periferia externa perfurada.
[083]Dois cilindros de meio filtrante diferentes para uso na cápsula filtrante 33 são mostrados nas Figuras 4 e 5.
[084]A Figura 4 representa uma vista em seção transversal de uma modalidade de um dispositivo filtrante, em que a cápsula de meio filtrante compreende uma sequência de meios filtrantes compreendendo uma pluralidade de pregas 44. A sequência de meios filtrantes 40 situada entre a periferia externa perfurada 39 e o núcleo interno perfurado 34, compreende o primeiro meio filtrante 41 e o segundo meio filtrante 42. O segundo meio filtrante 42 está posicionado a jusante do primeiro meio filtrante 41, onde o fluxo de fluido procede da periferia externa perfurada 39, se desloca através da sequência de meios filtrantes 40 e entra no núcleo interno perfurado 34. Um exemplo de um módulo de filtro compreendendo um cilindro de meio filtrante compreendendo uma pluralidade de pregas pode ser encontrado, por exemplo, na patente US n° 6.315.130 (Olsen).
[085]A Figura 5 representa uma vista em seção transversal de uma modalidade alternativa de um dispositivo filtrante, em que a cápsula de meio filtrante compreende uma sequência de meios filtrantes enrolada em espiral em torno do núcleo interno perfurado 34. A sequência de meios filtrantes 50 situada entre a periferia externa perfurada 39 e o núcleo interno perfurado 34, compreende o segundo meio filtrante 52 enrolado em espiral em torno do núcleo interno perfurado 34 e o primeiro meio filtrante 51 enrolado em espiral em torno do segundo meio filtrante 52. Conforme descrito, o fluido flui a partir da periferia externa perfurada 39, através da sequência de meios filtrantes 50 e, então, para dentro do núcleo interno perfurado 34. Em algumas modalidades, uma camada de drenagem pode ser adicionalmente fornecida para facilitar o fluxo de fluidos entre camadas adjacentes da sequência de meios filtrantes.
[086]Em uma modalidade, o primeiro e o segundo meios filtrantes são encapsulados com uma manta porosa para proporcionar apoio e ajudar no manuseio. Em aplicações de filtração, o primeiro e o segundo meios filtrantes podem ser dispostos verticalmente ou horizontalmente.
[087]A sequência de meios filtrantes da presente revelação pode ser usada na purificação e/ou isolamento de biomateriais alvo a partir de um fluido biológico. Em uma modalidade, a sequência de meios filtrantes da presente descrição pode ser usada na purificação e/ou isolamento de proteínas positivamente carregadas, com mais preferência, anticorpos monoclonais a partir de um fluido de colheita de um biorreator ou fermentador. Tipicamente, o fluido de colheita compreende, além dos anticorpos monoclonais, células inteiras e fragmentos de células insolúveis, e impurezas solúveis, incluindo impurezas de proteína, como proteínas de célula hospedeira, DNA, e cromatina em um meio de cultura.
[088]Os anticorpos monoclonais são uma das proteínas terapêuticas mais usadas na indústria farmacêutica. Avanços no desenvolvimento de linhagens de células e na otimização de processos de cultura celular têm permitido titulações de anticorpo mais altas, o que aumenta a densidade de cultura de células e estende o tempo de duração da cultura. Isto se traduz em níveis mais altos de impurezas relacionadas ao processo, como proteínas de célula hospedeira e DNA, lipídios, coloides e fragmentos de células. Estes níveis de impureza mais altos apresentam desafios para a recuperação, purificação, e/ou concentração do anticorpo monoclonal. Tipicamente, o processamento pós-colheita envolve a recuperação primária do anticorpo monoclonal, seguido pela captura do anticorpo monoclonal em uma coluna de cromatografia (como cromatografia de troca catiônica ou proteína A), seguido pela eluição (e concentração) do anticorpo monoclonal capturado a partir da coluna de cromatografia, o eluato e polimento do eluato.
[089]Cromatografia por afinidade de proteína A é preferencial para captura devido à interação altamente específica da proteína A com anticorpos monoclonais. Como as colunas de proteína A são relativamente caras, é importante reduzir as impurezas no caldo coletado antes da exposição à coluna de proteína A para otimizar sua vida útil. Além disso, algumas impurezas podem ser retidas pela coluna de proteína A e eluídas com o eluato de anticorpo monoclonal, resultando em polimento adicional e/ou mais agressivo do eluato.
[090]Fragmentos de células genericamente referem-se a componentes insolúveis de células lisadas (decompostas), incluindo lipídios de parede celular, lisosso- mas, vesículas e similares) e agregados proteináceos. Tipicamente, fragmentos de células são materiais maiores e de carga predominantemente negativa que podem obstruir os filtros. A turvação é uma maneira de medir a concentração dos fragmentos de células em um fluido, na qual quanto maior o valor de turbidez, maior o número de fragmentos de células presentes. Em uma modalidade, o fluido de colheita ou o fluido de cultura de células tem uma turbidez de ao menos 40, 60, 80 ou mesmo 100 NTU (unidade de turbidez nefelométrica) e de no máximo 500, 400, 200, ou mesmo 150 NTU. Após passar pelos meios filtrantes da presente invenção, a turbidez do filtrado é frequentemente menor que 15, 10, 5, ou mesmo 2 NTU.
[091]As proteínas indesejadas, como impurezas de proteína e proteínas de célula hospedeira, estão também tipicamente presentes no fluido de colheita. Em uma modalidade, o fluido de colheita ou o fluido de cultura de células tem uma concentração de proteína de célula hospedeira de ao menos 50.000; 100.000 ou mesmo 200.000 ng/ml e de no máximo 2.000.000; 1.000.000; ou mesmo 500.000 ng/ml. Essas proteínas solúveis são de natureza menor e precisam ser separadas dos anticorpos monoclonais.
[092]O DNA é uma sequência de nucleotídeos, que é o modelo para replica- ção da célula. Em uma modalidade, o fluido de colheita ou o fluido de cultura de células tem uma concentração de DNA de ao menos 105, 106, 107, 108, ou mesmo 109 picogramas/ml. Após passar pela sequência de meios filtrantes da presente invenção, o DNA do filtrado pode ser reduzido por um valor de redução logarítmica de 3 ou mais, muitas vezes uma redução logarítmica de 4 ou mais, e mesmo um valor de redução logarítmica de 8 ou mais.
[093]Para isolar e/ou purificar a biomicromolécula alvo, como o anticorpo monoclonal, cada um dos contaminantes precisa ser removido em níveis suficientes. Frequentemente, o meio de cultura compreende tampões, eletrólitos, e/ou açúcares, que podem afetar o desempenho do filtro. Em uma modalidade, o fluido de colheita ou o fluido de cultura de células tem uma condutividade de ao menos 10 milliSiemens/cm (mS/cm), ou mesmo 15 mS/cm, e no máximo não mais que 25 mS/cm ou mesmo 35 mS/cm. Em algumas modalidades, em que a sequência de meios filtrantes é usada no processo de purificação e/ou isolamento, o fluido de entrada (isto é, o fluido a ser filtrado) pode ter uma condutividade mais alta ou mais baixa, dependendo das etapas de processamento anteriores. Em uma modalidade, o fluido de entrada tem uma condutividade de ao menos 1 mS/cm, ou mesmo 0,5 mS/cm, e de ao menos não mais que 40 mS/cm ou mesmo 50 mS/cm. Às vezes, durante o isolamento/purificação tradicional de anticorpos monoclo- nais, a solução de processo é diluída para diminuir a concentração iônica, já que as elevadas concentrações de sal podem interferir com certas técnicas, como troca iônica.
[094]Descobriu-se, no presente pedido, que quando um substrato não tecido funcionalizado com um grupo amônio quaternário é colocado a montante de uma membrana microporosa funcionalizada com ligantes contendo grupos guanidina ou biguanida, um dispositivo filtrante pode ser adaptado para ter uma alta capacidade de purificação de fragmentos de células do fluido, alta capacidade para redução substancial de DNA do fluido, e um alto grau de redução de proteína de célula hospedeira, ao mesmo tempo em que também minimiza o número de etapas de processo.
[095]Quando usado na purificação de anticorpos monoclonais, o primeiro meio filtrante pode servir para remover células inteiras e fragmentos de células, e contaminan- tes solúveis como DNA e algumas proteínas de célula hospedeira. O segundo meio filtrante compreende grupos guanidila que podem ligar-se a contaminantes negativamente carregados, particularmente proteínas de célula hospedeira negativamente carregadas, permitindo a passagem de materiais positivamente carregados, como anticorpos mono- clonais (mAb).
[096]Em uma modalidade, a sequência de filtração da presente descrição pode ser usada para remover eficazmente fragmentos de células, DNA e proteína de célula hospedeira, na presença de altas concentrações de sal, permitindo a purificação e/ou isolamento de biomacromoléculas alvo, como mAb.
[097]Conforme será ilustrado nos Exemplos abaixo, descobriu-se que o emprego de uma construção de múltiplas camadas que compreende o primeiro meio filtrante a montante do segundo meio filtrante, surpreendentemente produz melhor rendimento em comparação com os filtros que compreendem somente grupos amônio quaternário ou grupos guanidila. Também se descobriu que a combinação destes dois meios filtrantes, em que o primeiro meio filtrante está a montante a partir do segundo meio filtrante, proporciona um rendimento melhorado e pode aumentar a vida útil da combinação de meio filtrante. O rendimento melhorado pode resultar não apenas do rendimento melhorado através dos meios filtrantes, mas também da remoção de uma ou mais etapas do processo de purificação ou isolamento de um material biológico, e/ou redução mais eficaz dos contaminantes para minimizar a exposição aos mesmos em processos a jusante, aumentando assim a vida útil do componente a jusante. Quando instalado no começo do processo de purificação de proteína, por exemplo, durante a clarificação inicial do fluido de cultura celular colhido, ou um centrifugado do mesmo, os meios filtrantes da presente invenção podem, também, servir para limitar o tempo de exposição da proteína alvo (por exemplo, mAb) aos contaminantes do fluido (por exemplo, enzimas protease), que podem degradar a qualidade da proteína alvo.
[098]Modalidades exemplificadoras da presente descrição incluem as seguintes modalidades não limitadoras.
[099]Modalidade 1. Sequência de meios filtrantes, caracterizada pelo fato de que compreende: (i) um primeiro meio filtrante compreendendo um substrato não tecido de troca aniônica, sendo que o substrato não tecido de troca aniônica compreende uma pluralidade de grupos amônio quaternário; e (ii) um segundo meio filtrante compreendendo uma membrana microporosa fun- cionalizada, sendo que a membrana microporosa funcionalizada compreende uma pluralidade de grupos guanidila; sendo que o primeiro meio filtrante está posicionado a montante do segundo meio filtrante.
[0100]Modalidade 2. Sequência de meios filtrantes da modalidade 1, em que o primeiro meio filtrante compreende ao menos 0,1 mmol de grupos amônio quaternário por grama do primeiro meio filtrante.
[0101]Modalidade 3. Sequência de meios filtrantes, de acordo com qualquer das modalidades anteriores, em que o segundo meio filtrante compreende ao menos 0,01 mmol de grupos guanidila por grama do segundo meio filtrante.
[0102]Modalidade 4. Sequência de meios filtrantes, de acordo com qualquer das modalidades anteriores, em que o substrato não tecido de troca aniônica tem um diâmetro eficaz de fibra de 1 a 6 micrômetros.
[0103]Modalidade 5. Sequência de meios filtrantes, de acordo com qualquer das modalidades anteriores, em que o segundo meio filtrante tem um tamanho de poro de fluxo médio de 0,1 a 5 micrômetros.
[0104]Modalidade 6. Sequência de meios filtrantes, de acordo com qualquer das modalidades anteriores, em que o primeiro meio filtrante compreende um polímero enxertado na superfície de um substrato não tecido, sendo que o polímero compreende unidades monoméricas interpolimerizadas de: (a) 80 a 98%, em peso, de um monômero de aminoalquil(meta)acriloíla; (b) 2 a 20%, em peso, de um monômero de poli(óxido de alquileno); e (c) 0 a 10%, em peso, de um segundo monômero hidrofílico.
[0105]Modalidade 7. Sequência de meios filtrantes, de acordo com qualquer das modalidades 1 a 6, em que o segundo meio filtrante compreende um polímero enxertado na superfície de um substrato não tecido, sendo que o polímero compreende unidades monoméricas interpolimerizadas de: a) ) 10 a 50%, em peso, de um monômero ligante contendo amônio quaternário; b) 10 a 80%, em peso, de um monômero de amida; (c) 10 a 40%, em peso, de um monômero óxi; e (d)0 a 30%, em peso, de um monômero de poli (óxido de alquileno).
[0106]Modalidade 8. Sequência de meios filtrantes, de acordo com qualquer das modalidades anteriores, em que a membrana microporosa funcionalizada compreende uma membrana TIPS.
[0107]Modalidade 9. Sequência de meios filtrantes, de acordo com qualquer das modalidades 1 a 8, em que a membrana microporosa funcionalizada compreende uma membrana SIPS.
[0108]Modalidade 10. Sequência de meios filtrantes, de acordo com qual- quer das modalidades anteriores, em que a membrana microporosa funcionalizada compreende um monômero de (met)acriloíla guanidila-funcional enxertado via radi-cais livres, em que o monômero de (met)acriloíla guanidila-funcional enxertado via radicais livres compreende ao menos um dentre: em que R1 é H ou alquila C1-C4; R2 é um grupo (hetero)hidrocarbila; cada R3 é, independentemente, H ou hidrocarbila; R4 é H, alquila C1-C12 ou -N(R3)2; R5 é H ou hidrocarbila; X1 é -O- ou -NR3-, o é 0 ou 1 e n é 1 ou 2.
[0109]Modalidade 11. Sequência de meios filtrantes, de acordo com a modalidade 10, em que o monômero de (met)acriloíla guanidila-funcional enxertado via radicais livres é enxertado em uma camada primer disposta sobre uma membrana microporosa, em que a camada primer compreende um polímero de poliamina reticulado tendo grupos polimerizáveis etilenicamente insaturados, em que o polímero de poliamina reticulado tendo grupos polimerizáveis etilenicamente insaturados é um produto de reação de: (a) um polímero de poliamina; (b) um agente de reticulação polifuncional para o polímero de poliamina; e (c) um monômero que tem um grupo funcional reativo de amina e um grupo polimerizável etilenicamente insaturado.
[0110]Modalidade 12. Sequência de meios filtrantes, de acordo com a modalidade 10 ou 11, em que o monômero de (met)acriloíla guanidila-funcional enxertado via radicais livres é enxertado em uma membrana microporosa na presença de um fotoiniciador do tipo II.
[0111]Modalidade 13. Sequência de meios filtrantes, de acordo com qualquer das modalidades anteriores, em que o primeiro meio filtrante é colocado em contato com o segundo meio filtrante.
[0112]Modalidade 14. Sequência de meios filtrantes, de acordo com qualquer das modalidades anteriores, compreendendo um artigo multicamadas, em que o artigo multicamadas compreende o primeiro meio filtrante e o segundo meio filtrante.
[0113]Modalidade 15. Sequência de meios filtrantes, de acordo com qualquer das modalidades anteriores, que compreende adicionalmente um meio filtrante não funcionalizado disposto entre o primeiro meio filtrante e o segundo meio filtrante.
[0114]Modalidade 16. Sequência de meios filtrantes, de acordo com a modalidade 15, em que o meio filtrante não funcionalizado é uma membrana de exclusão de tamanho microporosa não funcionalizada.
[0115]Modalidade 17. Sequência de meios filtrantes, de acordo com a modalidade 16, em que a membrana de exclusão de tamanho microporosa não funci- onalizada tem uma estrutura de poro assimétrica.
[0116]Modalidade 18. Sequência de meios filtrantes, de acordo com a modalidade 16, em que a membrana de exclusão de tamanho microporosa não funcionali- zada tem um tamanho de poro de fluxo médio menor que o segundo meio filtrante.
[0117]Modalidade 19. Dispositivo filtrante que compreender: uma entrada de fluido; uma saída de fluido; e um meio filtrante conectando de maneira fluida a entrada de fluido e a saída de fluido, sendo que o meio filtrante compreende (i) um primeiro meio filtrante compreendendo um substrato não tecido de troca aniônica, sendo que o substrato não tecido de troca aniônica compreende uma pluralidade de grupos amônio quaternário; e (ii) um segundo meio filtrante compreendendo uma membrana microporosa funci- onalizada, sendo que a membrana microporosa funcionalizada compreende uma pluralidade de grupos guanidila; e sendo que o primeiro meio filtrante está posicionado a montante do segundo meio filtrante, os meios filtrantes.
[0118]Modalidade 20. Dispositivo filtrante, de acordo com a modalidade 19, em que o meio filtrante é formado em um cilindro de meio filtrante que compreende uma pluralidade de pregas.
[0119]Modalidade 21. Dispositivo filtrante, de acordo com a modalidade 19, em que o segundo meio filtrante é enrolado em torno do núcleo e o primeiro meio filtrante é enrolado em torno do segundo meio filtrante.
[0120]Modalidade 22. Dispositivo filtrante, de acordo com a modalidade 19, em que o dispositivo filtrante adicionalmente compreende um elemento separador; uma vedação de borda; sendo que o elemento separador compreende um núcleo central em comunicação fluida com a entrada de fluido; um primeiro lado e um segundo lado; e sendo que o meio filtrante compreende adicionalmente um primeiro disco médio posicionado sobre o primeiro lado do elemento separador e que tem uma borda circunferencial externa e uma borda circunferencial interna; e um segundo disco médio posicionado sobre o segundo lado do elemento separador e que tem uma borda circunferencial externa e uma borda circunferencial interna; e sendo que as bordas circunferenciais externas do primeiro e do segundo discos de meio são conectadas através da vedação de borda e as bordas circunferenciais internas do primeiro e segundo discos de meio são conectadas a um núcleo central e sendo que o lado a montante do primeiro e segundo discos de meio compreende o primeiro meio filtrante.
[0121]Modalidade 23. Método de fabricação de um fluido biológico, sendo o método caracterizado pelo fato de que compreende: (a) fornecer o fluido biológico, sendo que o fluido biológico compreende uma bi- omolécula alvo e contaminantes, e (b) colocar o fluido biológico em contato com a sequência de meios filtrantes, de acordo com qualquer das modalidades anteriores, para obter um filtrado.
[0122]Modalidade 24. Método, de acordo com a modalidade 23, em que o fluido biológico tem uma condutividade de ao menos 10 mS/cm.
[0123]Modalidade 25. Método, de acordo com qualquer modalidade 23 ou 24, em que o fluido biológico tem uma turbidez de ao menos 40 NTU.
[0124]Modalidade 26. Método, de acordo com qualquer das modalidades 23 a 25, em que o fluido biológico tem uma concentração de proteína de célula hospedeira de 100.000 ng/ml a 2.000.000 ng/ml.
[0125]Modalidade 27. Método, de acordo com qualquer das modalidades 23 a 26, em que o fluido biológico tem uma concentração de DNA de ao menos 105 pg/ml.
[0126]Modalidade 28. Método, de acordo com qualquer das modalidades 23 a 27, em que o filtrado tem uma turbidez inferior a 15 NTU.
[0127]Modalidade 29. Método, de acordo com qualquer das modalidades 23 a 28, em que o fluido biológico tem uma primeira concentração de proteína de célula hospedeira e o filtrado tem uma segunda concentração de proteína de célula hospedeira, sendo que a segunda concentração de proteína de célula hospedeira é ao menos 50% menor que a primeira concentração de proteína de célula hospedeira.
[0128]Modalidade 30. Método, de acordo com qualquer das modalidades 23 a 29, em que o fluido biológico tem uma primeira concentração de DNA e o filtrado tem uma segunda concentração de DNA, sendo que a segunda concentração de DNA é ao menos 3 logs menor que a primeira concentração de DNA.
[0129]Modalidade 31. Método, de acordo com qualquer das modalidades 23 a 30, que compreende adicionalmente colocar o filtrado em contato com uma coluna de cromatografia funcionalizada com Proteína A.
[0130]Modalidade 32. Método, de acordo com qualquer das modalidades de 23 a 31, sendo que a biomolécula alvo é uma proteína.
[0131]Modalidade 33. O método, de acordo com a modalidade 32, em que a biomolécula alvo é uma proteína positivamente carregada.
[0132]Modalidade 34. Método, de acordo com a modalidade 33, em que a proteína positivamente carregada é um anticorpo monoclonal.
[0133]Exceto onde especificado em contrário, todas as partes, porcentagens, razões, etc., citadas nos exemplo e nas demais partes deste relatório descritivo são dadas em peso e todos os reagentes usados nos exemplos foram obtidos ou estão disponíveis junto a fornecedores para produtos químicos em geral como, por exemplo, a Sigma-Aldrich Company, Saint Louis, Missouri, EUA, ou podem ser sintetizados por métodos convencionais.
[0134]Estas abreviações são usadas nos exemplos a seguir: cm = centímetro; g = gramas; mL = mililitro; min = minutos; μL = microlitres; mmol = milimols; w = peso; pg = picogramas; kPa = quilopascais kV=quilovolts; kGy = quilogray; e °C = graus Celsius.
[0135]Cloreto de metacrilamido propil trimetil amônio (MAPTAC, 50% peso/peso de solução em água), metileno bisacrilamida (MBA), benzofenona, e metanol foram obtidos junto à Sigma-Aldrich.
[0136]Sal sódico de 4-(3-sulfopropilóxi)benzofenona (S-PB) pode ser preparado conforme descrito na patente japonesa n° 47040913, Teijin Ltd.
[0137]N-(3-dimetilaminopropil)metacrilamida (DMAPMA) e N-vinil pirrolidona (NVP) foram obtidos junto à TCI Americas, Inc, Portland, Oregon, EUA.
[0138]Metacrilato de isocianatometila - sulfato sódico de agmatina (IEM-Ag) pode ser preparado conforme descrito na publicação de patente US n° 2011-0033633.
[0139]Metacrilato de glicidila (GMA) foi obtido junto à Dow Chemical Corporation, Deer Park, Texas, EUA.
[0140]Substratos de membrana de náilon (n° 080ZN, membrana de náilon- 6,6 reforçada, tamanho de poro nominal 0,8 micrômetro) foram obtidos de 3M Purification, Inc., Meriden, CT, EUA.
[0141]Substratos de microfibra soprada de polipropileno (PP BMF) foram preparados por meio de um processo de fusão e sopro e tinham um diâmetro eficaz de fibra de 4,3 micrômetros, peso base de 90 gramas por metro quadrado, e 10% de solidez.
[0142]Para os não tecidos funcionais descritos a seguir, a porcentagem de massa de polímero funcional enxertado foi medida conforme exposto a seguir. Ao menos cinco discos de 47 mm de diâmetro foram cortados em matriz a partir de uma amostra de não tecido seco funcional. Os discos foram submetidos a secagem a um peso constante em uma balança analisadora de umidade (Mettler-Toledo MJ33 disponível junto à Mettler-Toledo, LLC, Columbus, Ohio, EUA) a 90°C, e o peso seco constante foi registrado mf. A massa de uma área igual de substrato PP BMF foi registrada como mi. A porcentagem de massa de polímero enxertado foi, então, calculada como
[0143]A porcentagem de massa de polímero funcional enxertado foi subse-quentemente usada para estimar o número de milimols de monômero enxertado no substrato não tecido, multiplicando-se a porcentagem de massa de polímero funcional pela massa total de uma amostra de área conhecida, multiplicando-se o resultado pela porcentagem de massa de monômero funcional ligante na solução para revestimento com respeito ao monômero total, e dividindo-se pelo peso molecular do monômero funcional ligante. A densidade de enxerto foi, então, normalizada mediante a divisão pela massa original do substrato não tecido e expressa como milimols de monômero enxertado por grama de substrato (mmol/g).
[0144]Substratos de membrana de náilon foram equilibrados por um período mínimo de 18 horas em uma câmara de baixa umidade (Sanpia Dry Keeper, Sanplatec Corporation, disponível junto à VWR International) a uma umidade relativa (UR) de 20 a 25 por cento (%), antes de serem enxertados. Os substratos foram removidos da câmara de baixa umidade, imediatamente pesados, e, então, submetidos a uma reação de enxertia via radical livre, conforme descrito abaixo para uma variedade de monômeros contendo grupos funcionais ligantes. Após um processo de lavagem e secagem, os substratos foram equilibrados novamente na câmara de baixa umidade por um período mínimo de 18 horas, foram removidos da câmara e novamente pesados imediatamente para obter uma medição de ganho de massa durante a reação de enxertia. O ganho de massa foi subsequentemente usado para estimar o número de milimols de monômero enxertado no substrato de membrana mediante a divisão do ganho de massa pelo peso molecular do monômero. A densidade de enxerto foi, então, normalizada mediante a divisão pela massa original do substrato de membrana e expressa como milimols de monômero enxertado por grama de substrato (mmol/g).
[0145]Os valores de pH e condutividade de fluidos de desafio foram caracterizadas com o uso de um medidor de pH e eletroquímico Beckman Coulter pHI 570 disponível junto à Beckman Coulter, Inc, Brea, Califórnia, EUA.
[0146]Em experimentos de filtração, a turbidez dos fluidos de desafio e dos fluidos processados foi medida com o uso de um turbidímetro (disponível sob a designação comercial de “ORION AQUAFAST AQ4500 TURBIDIMETER” junto à Thermofisher Scientific). O turbidímetro fornece valores de turbidez em unidades nefelométricas de turbi- dez (NTU).
[0147]A quantificação de HCP de CHO foi realizada com o uso de um ensaio imunossorvente ligado a enzima (ELISA - enzyme-linked immunosorbent assay) específico para HCP de CHO (Kit ELISA para HCP de CHO, 3G, obtido junto à Cygnus Technologies, Southport, NC, EUA). Antes da análise, as amostras foram diluídas com tampão (Tampão de diluição de amostra obtido junto à Cygnus Technologies) para obter uma concentração dentro da faixa da curva de calibração.
[0148]Uma % de redução de HCP é registrada, sendo ela a concentração de HCP determinada pela diferença da concentração de HCP no fluido de desafio (centrifugado de CHO) menos a concentração de HCP no filtrado dividida pela concentração de HCP no fluido de desafio (centrifugado de CHO) e relatada como uma porcentagem.
[0149]Alíquotas para eletroforese não nativa foram dissolvidas em um tampão de amostra de proteína pré-misturada (tampão de amostra Laemmli 2X disponível junto à Biorad Laboratories Inc., Hercules, CA, EUA) contendo beta-mercaptoetanol. As amostras foram executadas a 200 volts durante 30 minutos em um gel de Tris-glicina 12% pré- moldado (disponível sob a designação comercial de “CRITERION TGX PRECAST GEL”, junto à Biorad Laboratories Inc.) para separar as várias proteínas na alíquota. Concluída a eletroforese, o gel foi corado com o uso de um kit de coloração com prata ThermoFisher Scientific.
[0150]A quantificação de DNA de CHO foi realizada através da reação quantitativa em cadeia de polimerase (qPCR) usando um ensaio específico para DNA de CHO (disponível sob a designação comercial de “RESDNASEQ QUANTITATIVE CHO DNA KIT” junto à ThermoFisher Scientific, Waltham, MA, EUA). Antes da qPCR, o DNA foi isolado das amostras usando-se um kit de preparação (disponível sob a designação comercial “PREPSEQ RESIDUAL DNA SAMPLE PREPARATION KIT” junto à ThermoFisher Scientific) para evitar interferência de componentes de meio de cultura de células.
[0151]A redução de DNA é relatada como um LRV (valor de redução logarítmica), em que a concentração de DNA determinada no filtrado foi dividida pela concentração de DNA no fluido de desafio (centrifugado de CHO) e, então, o logaritmo base 10 do quociente foi considerado.
[0152]Uma membrana de amônio quaternário funcional (“Q-funcional”) 1 foi preparada da seguinte forma. Solução para revestimento: Uma solução para revestimento foi preparada misturando-se MAPTAC (3,532 gramas da solução 50% peso/peso de solução em água) e S-BP (250 microlitros de uma solução 0,05 g/ml em água deionizada), e então diluindo até um total de 20 gramas com água deioni- zada.
[0153]Preparação: Um substrato de membrana de náilon de 18 cm x 23 cm foi colocado sobre uma folha de filme de poliéster e a solução para revestimento foi pipetada sobre a superfície de topo do substrato. A solução para revestimento foi deixada embeber no substrato por cerca de 1 minuto, e então uma segunda folha de filme de poliéster foi colocada sobre o topo do substrato. Um peso cilíndrico de 2,28 kg foi rolado sobre o topo do sanduíche de três camadas resultante para remover o excesso de solução para revestimento. A enxertia iniciada com ultravioleta (UV) foi conduzida por irradiação do sanduíche com o uso de um suporte de UV (Classic Manufacturing, Inc., Oakdale, MN, EUA), equipado com 18 lâmpadas [Sylvania RG2 40W F40/350BL/ECO, 10 acima e 8 abaixo do substrato, 1,17 metros (46 polegadas) de comprimento, com espaçamento de 5,1 cm (2 polegadas) no centro], com um tempo de irradiação de 15 minutos. As folhas de poliéster foram removidas e o substrato funcionalizado resultante foi colocado em um frasco de polietileno de 1000 mL. O frasco foi preenchido com 0,9 por cento (%) de solução salina, vedado e sacudido por 30 minutos para retirar por lavagem qualquer monômero residual ou polímero não enxertado. A solução salina foi despejada e o substrato funcionalizado foi lavado por mais 30 minutos com uma solução salina sem uso prévio e, então, lavada por 30 minutos com água deionizada (2 vezes) e deixada secar.
[0154]A densidade de enxerto da membra funcional 1 foi de 0,53 mmol/g.
[0155]Uma membrana funcional de guanidila 2 (“G-funcional”) foi preparada da seguinte forma. Solução para revestimento: Uma solução para revestimento foi preparada misturando-se IEM-Ag (3,5 gramas), MBA (0,07 grama) e benzofenona (0,125 grama), e então diluindo-se até um total de 25 gramas com metanol. A mistura foi agitada por 30 minutos em então, filtrada. Um substrato de membrana de náilon foi, então, revestido com a solução para revestimento, irradiado, lavado e submetido a secagem, conforme descrito acima para a preparação da membrana 1. A densidade de enxerto da membrana funcional 2A foi de 0,51 mmol/g.
[0156]Uma membrana funcional de guanidila 2B (“G-funcional”) foi preparada seguindo o procedimento descrito no pedido de Patente US n° 2012/0252091, Exemplo 42.
[0157]Uma membrana funcional de amina terciária 3 (“T-funcional”) foi preparada da seguinte forma. Solução para revestimento: Uma solução para revestimento foi preparada misturando-se DMAPMA (0,851 grama) e S-BP (250 microlitros de uma solução 0,05 g/ml em água deionizada), e então, diluindo até um total de 20 gramas com água deionizada. Um substrato de membrana de náilon foi, então, revestido com a solução para revestimento, irradiado, lavado e submetido a secagem, conforme descrito acima para a preparação da membrana 1. A densidade de enxerto da membrana funcional 3 foi de 0,41 mmol/g.
[0158]Um não tecido de amônio quaternário funcional 1 (“Q-funcional”) foi preparado seguindo o procedimento descrito na patente US 2015/0099413. Solução para revestimento: Uma solução para revestimento foi preparada misturando-se solução aquosa de MAPTAC (50% peso/peso de solução em água), NVP, GMA, e água deionizada para preparar uma solução aquosa contendo 9%, em peso, de monômero de MAPTAC, 11%, em peso, de NVP, 6%, em peso, de GMA e 74%, em peso, de água. A solução para revestimento foi purgada de ar pela abertura repetida da tampa, e sacudindo-se a solução sob atmosfera de nitrogênio em uma caixa de luvas.
[0159]Preparação: Uma folha de substrato de BMF PP de 30 cm x 43 cm foi purgada de ar na caixa de luvas e inserida em uma bolsa plástica resselável que foi vedada. A bolsa vedada foi então removida da caixa de luvas e irradiada até um nível de dose de 40 kGy por passagem da mesma através de um feixe de elétrons Energy Sciences, Inc. ‘Electrocurtain’ CB-300 em uma operação de passagem única a uma velocidade da manta de aproximadamente 5,5 metros por minuto (18-19 pés por minuto) e uma tensão elétrica de aceleração de 300 kV. A bolsa vedada foi, então, devolvida à atmosfera de nitrogênio dentro da caixa de luvas. A bolsa foi aberta e uniformemente saturada com 110 gramas da solução para revestimento purgada com nitrogênio, e a bolsa foi novamente vedada após a maior parte do nitrogênio ter sido expelido. Durante essas etapas, o nível de oxigênio dentro da caixa de luvas foi em geral mantido abaixo de 40 partes por milhão (ppm). A amostra foi mantida plana na bolsa e saturada com solução para revestimento por cerca de 16 horas. O não tecido funcionalizado foi, então, removido, lavado, e submetido a secagem, conforme descrito na patente US 2015/0099413. A porcentagem de massa de polímero funcional enxertado foi de 62 por cento (%), correspondendo a uma densidade de enxerto de MAPTAC de 0,25 mmol/g de não tecido funcionalizado ou 0,66 mmol/g de substrato não tecido.
[0160]Um não tecido funcional de guanidila 2 (“G-funcional”) foi preparado da seguinte forma. Solução para revestimento: Uma solução para revestimento foi preparada contendo 9%, em peso, de IEM-Ag, 11%, em peso, de NVP, 6%, em peso, de GMA e 74%, em peso, de água deionizada.
[0161]Preparação: Um substrato BMF PP foi, então, revestido de modo inerte, irradiado, lavado, e submetido a secagem, conforme descrito anteriormente para a preparação do não tecido 1. A porcentagem em massa de polímero funcional enxertado foi de 69 por cento (%), correspondendo a uma densidade de enxerto de IEM-Ag de 0,16 mmol/g de não tecido funcionalizado ou 0,52 mmol/g de substrato não tecido.
[0162]Um não tecido funcional de amina terciária 3 (“T-funcional”) foi preparado da seguinte forma. Solução para revestimento: Uma solução de revestimento foi preparada contendo 9%, em peso, de DMAPMA, 11%, em peso, de NVP, 6%, em peso, de GMA e 74%, em peso, de água deionizada.
[0163]Preparação: Um substrato BMF PP foi, então, revestido de modo inerte, irradiado, lavado, e submetido a secagem, conforme descrito anteriormente para a preparação do não tecido 1. A porcentagem em massa de polímero funcional enxertado foi de 61 por cento (%), correspondendo a uma densidade de enxerto de DMAPMA de 0,32 mmol/g de não tecido funcionalizado ou 0,84 mmol/g de substrato não tecido.
[0164]Uma cultura de células de ovário de hamster chinês foi preparada com o uso de técnicas padrão de cultura celular. O fluido de colheita foi coletado, centrifugado, e, então, testado quanto à condutividade ou PH, turbidez, e concentração de HCP por ELISA. Várias culturas foram usadas nos experimentos da presente invenção e os perfis de cada uma são descritos abaixo.
[0165]Centrifugado de CHO 1: Uma cultura de células CHO foi coletada a uma densidade celular de 5x106 células/ml e uma viabilidade de aproximadamente 20%. O fluido de colheita foi centrifugado (centrífuga Jouan GR4.22 disponível junto à Thermofisher Scientific) por aproximadamente 4 minutos a 4000 rpm, produzindo um fluido de centrifugado com uma turbidez de 85,2 NTU, uma concentração de HCP de 169,596 nanogramas por mililitro (ng/ml) e uma condutividade de 11,8 mS/cm.
[0166]Centrifugado de CHO 2: A cultura de células CHO foi coletada a uma densidade celular de 1x108 células/ml, uma viabilidade de aproximadamente 60 e uma concentração de mAb de 0,5 mg/ml. O fluido de colheita foi centrifugado (centrífuga Jouan GR4.22 disponível junto à Yhermofisher Scientific) por aproximadamente 8 minutos a 4000 rpm, produzindo um fluido de centrifugado com uma turbi- dez de 83,4 NTU, uma concentração de HCP de 255,688 nanogramas por mililitro (ng/ml), uma concentração de DNA de 2,41x108 pg/ml, e uma condutividade de 16,9 mS/cm.
[0167]Centrifugado de CHO 3: A cultura de células CHO foi coletada a uma con-centração de células de aproximadamente 1x107 células/ml e uma viabilidade de aproxi-madamente 20%. O fluido foi centrifugado, produzindo um centrifugado com uma turbidez de 81,0 NTU, uma concentração de HCP de 259,840 nanogramas por mililitro (ng/ml), e um pH de 6,8.
[0168]Centrifugado de CHO 4: A cultura de células CHO foi coletada a uma con-centração de células de aproximadamente 1x107 células/ml e uma viabilidade de aproxi-madamente 20%. O fluido foi centrifugado, produzindo um centrifugado com uma turbidez de 87,5 NTU, uma concentração de HCP de 265,740 nanogramas por mililitro (ng/ml) e um pH de 6,8.
[0169]Fluidos de desafio para células CHO foram usados para realizar os testes de filtração em várias combinações de não tecido e meio filtrante de membrana, usando compartimentos acrílicos para filtro de 25 mm de diâmetro nominal. Discos de 25 mm do não tecido funcional e do meio filtrante de membrana funcional foram cortados em matriz a partir de amostras de meio filtrante submetidas a secagem conforme descrito acima. Para cada combinação de meio filtrante testada, seis discos de um meio filtrante de membrana funcional específico foram colocados em um compartimento de filtro acrílico. Quatro discos de um meio filtrante de não tecido funcional específico foram, então, colocados no topo do meio filtrante de membrana funcional no suporte. O compartimento acrílico foi, então, montado. O compartimento acrílico foi adaptado para fornecer uma vedação de borda em torno da periferia do meio, através de um anel de vedação, definindo uma área de filtração efetiva (EFA) de 2,84 centímetros quadrados (cm2), de tal modo que o fluido de desafio deveria fluir para dentro de uma entrada do compartimento, e então através de quatro camadas de meio não tecido funcional, e então através das seis camadas de meio de membrana funcional, e então para fora de uma saída do compartimento. Uma válvula de respiro posicionada próximo à entrada de fluido permitiu a ventilação do ar do compartimento antes do teste.
[0170]Desafios de filtração foram conduzidos com o uso de um sistema de filtração PENDOTECH, disponível junto à PendoTECH, Princeton, New Jersey, EUA. Um módulo de bomba automatizado proporcionou uma taxa de fluxo constante da solução de desafio ao compartimento de filtro. A queda de pressão no compartimento de filtro foi monitorada com o uso de um transdutor de pressão posicionado a montante da entrada do compartimento. A massa de fluido coletada na saída do compartimento de filtro foi monitorada usando um equilíbrio de massa. Em qualquer dado momento, a quantidade cumulativa de fluido processado através do compartimento de filtro foi caracterizada em unidades de litros de fluido processado por metro quadrado de EFA (L/m2).
[0171]Antes de cada teste de filtro, o compartimento de filtro foi primeiramente ventilado e purgado a uma taxa de fluxo de 3 cm3/min (3 ml/min) com 250 l/m2 de uma solução de cloreto de sódio 25 milimolares (mM) em água deionizada. O fluxo de alimentação foi, então, trocado pelo fluido de desafio de CHO e o teste de filtro foi iniciado, também a uma taxa de fluxo de 3 cm3/min (3 ml/min). Durante um teste de filtro, a queda de pressão aumentou à medida que a membrana era carregada com matéria particulada no fluido de desafio. O teste de filtro foi interrompido quando a pressão atingiu 172 kPa (25 PSI), e a quantidade cumulativa de fluido processado nesse momento foi registrada como o rendimento. As amostras de fluido de saída para cada teste de filtro foram coletadas em alíquotas individuais de aproximadamente 25 mililitros (88 l/m2), e a massa exata de cada uma foi medida e registrada. A turbidez de cada alíquota foi medida, e as alíquotas selecionadas foram testadas quanto à concentração de HCP e/ou DNA, conforme descrito acima. A turbidez média de saída para cada teste de filtro foi calculada como a média ponderada dos valores de turbidez de cada uma das alíquotas, ponderadas pelas massas de alíquota.
[0172]Fluidos de desafio para células CHO foram usados para realizar os testes de filtração em várias combinações de não tecido e meio filtrante de membrana, usando compartimentos para filtro de 47 mm de diâmetro nominal. Em cada experimento de desafio, foram construídos quatro trens de filtro, cada um com um compartimento de acrílico simples com 47 mm de diâmetro nominal ou dois desses compartimentos de filtro dispostos em série. Discos de 47 mm de diâmetro dos meios filtrantes foram cortados em matriz a partir de amostras de meios submetidas a secagem, conforme descrito acima. Discos de meio filtrante foram colocados dentro de compartimentos de filtro, em combinações específicas, conforme detalhado nos exemplos abaixo. Os compartimentos foram então montados. Cada compartimento de acrílico foi adaptado para fornecer uma vedação de borda em torno da periferia dos meios através de um anel de vedação, definindo uma área de filtração efetiva (EFA) de 13,85 centímetros quadrados (cm2). Uma válvula de respiro posicionada próximo à entrada de fluido permitiu a ventilação do ar do compartimento antes do teste.
[0173]Em trens de filtro nos quais um compartimento de filtro foi usado, o com-partimento de filtro foi disposto de tal modo que o fluido de desafio passou para dentro de uma entrada de fluido do compartimento, e, então, através do meio filtrante dentro do compartimento, e então para fora de um saída de fluido do compartimento. Em trens de filtro nos quais foram usados dois compartimentos de filtro, os compartimentos de filtro foram dispostos de tal modo fluido de desafio passou para dentro de uma entrada de fluido de um primeiro compartimento, e, então, através do meio filtrante dentro do primeiro compartimento, e então para fora de um saída de fluido do primeiro compartimento e, então, para dentro de uma entrada de fluido de um segundo compartimento, e então através do meio filtrante dentro do segundo compartimento, e então para fora de uma saída de fluido do segundo compartimento.
[0174]Desafios de filtração foram conduzidos usando um sistema de filtração e peneiramento de fluxo normal (3M Purification, Inc, Meriden, CT, EUA). Um módulo de bomba automatizado proporcionou uma taxa de fluxo constante da solução de desafio para cada trem de filtro. Um transdutor de pressão foi posicionado a montante de cada compartimento de filtro de cada trem de filtro, de modo que a queda de pressão através de cada compartimento do filtro pode ser monitorada. Em trens de filtro com duas séries de compartimentos de filtro, uma válvula de 3 vias de caixas foi instalada entre o primeiro compartimento de filtro e o segundo compartimento de filtro para permitir a coleta periódica de amostras daquela posição no trem de filtro por meio de uma seringa. A massa de fluido coletada na saída da última série de compartimento de filtro de cada trem de filtro foi monitorada com o uso de um equilíbrio de massa. Em qualquer dado momento, a quantidade cumulativa de fluido processado através do compartimento de filtro foi caracterizada em unidades de litros de fluido processado por metro quadrado de EFA (L/m2).
[0175]Antes de cada teste de filtro, o compartimento de filtro foi primeiramente ventilado e purgado a uma taxa de fluxo de 4 cm3/min (4 ml/min) com 250 l/m2 de uma solução de cloreto de sódio 35 milimolares (mM) em água deionizada. O fluxo de alimentação foi, então, trocado pelo fluido de desafio de CHO e o teste de filtro foi iniciado a uma taxa de fluxo de 3,7 cm3/min (3,7 ml/min). Durante um teste de filtro, a queda de pressão total no trem de filtro aumentou à medida que as membranas eram carregadas com matéria particulada no fluido de desafio. Cada teste de filtro foi interrompido quando a pressão total (em todos os suportes em série do trem de filtro) atingiu 172 kPa (25 psi), e a quantidade cumulativa de fluido processado nesse momento foi registrada como o rendimento.
[0176]Várias combinações de meios funcionais, conforme descrito na Tabela 1, foram testadas nos experimentos de desafio de filtração com o uso do método de compartimentos de filtro de 25 mm e usando o centrifugado de CHO 1. Os resultados de rendimento, turbidez de saída média e redução de HCP para os Exemplos 1-2 e Exemplos Comparativos C1-C5 são relatados na Tabela 1.Tabela 1
[0177]Presumindo que a membrana a montante causa impacto sobre o rendimento final dos meios filtrantes, os dados de rendimento da Tabela 1 foram consolidados e comparados para não tecido 1, não tecido 2 e não tecido 3. O rendimento médio quando se usou o não tecido 1 foi de 430 l/m2. O rendimento médio quando se usou o não tecido 2 foi de 390 l/m2. O rendimento para o não tecido 3 foi de 286 l/m2.
[0178]O experimento acima foi refeito usando a solução de desafio com uma concentração maior de HCP. Várias combinações de meios funcionais, conforme descrito na Tabela 2, foram testadas nos experimentos de desafio de filtração com o uso do método de compartimentos de filtro de 25 mm e usando o centrifugado 2 de CHO. Os resultados do rendimento, turbidez média de saída, % de redução de HCP, e valor de redução logarítmica (LRV) para redução de DNA no Exemplo 3 e Exemplos Comparativos C6 a C8 são relatados na Tabela 2 abaixo. Conforme mencionado acima, a queda de pressão através do compartimento de filtro foi monitorada durante a operação, como também a massa do fluido coletado, que pode ser calculada em rendimento (l/m2). A pressão na Figura 6 é mostrada como uma função do rendimento no Exemplo 3 e os Exemplos Comparativos C6-C8.Tabela 2
[0179]Vários meios foram testados em trens de filtro após os experimentos de desafio de filtração usando o método em compartimentos de filtro de 47 mm acima.
[0180]O Exemplo comparativo C9 continha apenas um compartimento de filtro, no qual foram instalados dois tipos de meios filtrantes de profundidade convencional (disponíveis sob as designações comerciais de “ZETA PLUS 60ZA” e “ZETA PLUS 90ZA” junto à 3M Co., St. Paul, MN, EUA, compostos de auxiliar de filtração inorgânico pré-extraído, celulose e ligante polimérico catiônico). O compartimento de filtro continha 1 camada de ZETA OLUS 60ZA a montante de 1 camada de ZETA PLUS 90ZA.
[0181]O Exemplo comparativo C10 continha dois compartimentos de filtro dispostos em série. O primeiro compartimento de filtro (a montante) continha quatro camadas de não tecido 1. O segundo compartimento de filtro continha uma membrana de exclusão de tamanho de náilon assimétrica não funcionalizada de 0,2 mícrons, que não foi funcionalizada. O trem de filtro simulou um filtro de clarificação sintético disponível comercialmente, projetado para a clarificação de culturas de células de mamífero, purificador híbrido 3M EMPHAZE AEX Hybrid Purifier, disponível junto à 3M Purification, Inc., Meriden, CT, EUA.
[0182]O Exemplo 4 continha dois compartimentos de filtro dispostos em série. O primeiro compartimento de filtro (a montante) continha quatro camadas de não tecido 1. O segundo compartimento continha uma membrana de exclusão de tamanho de náilon assimétrica não funcionalizada de 0,2 mícrons a montante de 2 camadas da membrana 2B.
[0183]O Exemplo 5 tinha a mesma configuração do Exemplo 4, exceto que 4 camadas da membrana 2B foram usadas em vez de 2.
[0184]Os quatro trens de filtro foram simultaneamente desafiados com o centrifugado 3 de CHO a uma taxa de fluxo de 3,7 cm3/min (3,7 ml/min). As amostras foram coletadas de cada trem de filtro, em cada uma de duas posições, para análise de HCP. A primeira posição (no caso de dois compartimentos) estava a jusante da saída do compartimento 1, mas a montante da entrada do compartimento 2. Isso permitiu o cálculo da redução de HCP obtida pelos meios no compartimento 1. A segunda posição estava a jusante da saída do compartimento 2. Isto permitiu o cálculo da redução cumulativa de HCP obtida pelos meios em ambos os compartimentos. As amostras foram coletadas de cada trem de filtro em dois pontos de rendimento de 145 l/m2 e 220 l/m2, permitindo a caracterização de redução de HCP obtida em uma parte anterior da operação e em uma parte posterior da operação, respectivamente. A redução de HCP em cada uma das posições e pontos de rendimento é mostrada na Tabela 3. É também mostrado na Tabela 3 abaixo o rendimento total e turbidez do filtrado acumulado para os Exemplos 4 e 5 e os Exemplos Comparativos C9 a 10.Tabela 3NA significa não aplicável
[0185]Vários meios foram testados em trens de filtro após os experimentos de desafio de filtração usando o método em compartimentos de filtro de 47 mm acima.
[0186]O Exemplo comparativo C11 continha somente um compartimento de filtro, no qual foram instaladas quatro camadas de não tecido 1 a montante de uma membrana de exclusão de tamanho de náilon assimétrica não funcionalizada de 0,2 mícron. O trem de filtro simulou um filtro de clarificação sintético disponível comercialmente, projetado para a clarificação de culturas de células de mamífero, purificador híbrido 3M EMPHAZE AEX Hybrid Purifier, disponível junto à 3M Purification, Inc., Meriden, CT, EUA.
[0187]Os Exemplos 6 a 8 continham dois compartimentos de filtro dispostos em série, o conteúdo do primeiro compartimento (a montante) sendo idêntico ao conteúdo do compartimento do exemplo comparativo C11. O segundo compartimento dos Exemplos 6 a 8 continham três, quatro e seis camadas, respectivamente, da membrana 2B.
[0188]Os quatro trens de filtro foram simultaneamente desafiados com o centrifugado 4 de CHO a uma taxa de fluxo de 3,7 cm3/min (3,7 ml/min). Quando a queda de pressão de cada um dos trens de filtro atingiu 172 kPa (25 psi), a quantidade cumulativa de fluido processado nesse momento foi registrada como o rendimento. A turbidez e a concentração de HCP do agregado total de filtrado acumulado para cada trem de filtro foram medidas. Isso permitiu o cálculo da redução de HCP obtida por cada trem do filtro ao longo de toda a operação. O rendimento, a turbidez total, e a redução de HCP para cada um dos trens de filtro são mostrados na Tabela 4.Tabela 4
[0189]Alíquotas de fluido de desafio do centrifugado 4 e de cada um dos agregados de filtrado dos Exemplos 6 a 8 e Exemplo Comparativo C11 foram analisadas através de SDS-PAGE. O gel resultante é mostrado na Figura 7.
[0190]Modificações e alterações previsíveis desta invenção estarão evidentes aos versados na técnica, sem que se afaste do escopo e do espírito desta invenção. A presente invenção não deve se restringir às modalidades que são apresentadas neste pedido para fins de ilustração. Na medida em que houver qualquer conflito ou discrepância entre o presente relatório descritivo e a revelação em qualquer documento incorporado a título de referência neste documento, este relatório descritivo prevalecerá.
Claims (12)
1. Sequência de meio filtrante, CARACTERIZADA pelo fato de que compreende: (iii) um primeiro meio filtrante que compreende um substrato não tecido de troca aniônica, em que o substrato não tecido de troca aniônica compreende uma pluralidade de grupos amônio quaternário; e (ii) um segundo meio filtrante que compreende uma membrana microporosa fun- cionalizada, em que a membrana microporosa funcionalizada compreende uma pluralidade de grupos guanidila; em que o primeiro meio filtrante está posicionado a montante do segundo meio filtrante.
2. Sequência de meio filtrante, de acordo com a reivindicação 1, CARACTERIZADA pelo fato de que que o primeiro meio filtrante compreende ao menos 0,1 mmol de grupos amônio quaternário por grama do primeiro meio filtrante.
3. Sequência de meio filtrante, de acordo com a reivindicação 1 ou 2, CARACTERIZADA pelo fato de que o segundo meio filtrante compreende ao menos 0,01 mmol de grupos guanidila por grama do segundo meio filtrante.
4. Sequência de meio filtrante, de acordo com qualquer uma das reivindicações 1 a 3, CARACTERIZADA pelo fato de que o primeiro meio filtrante compreende um polímero enxertado na superfície de um substrato não tecido, em que o polímero compreende unidades monoméricas interpolimerizadas de: (a) 80 a 98%, em peso, de um monômero de aminoalquil(meta)acriloíla; (b) 2 a 20%, em peso, de um monômero de poli(óxido de alquileno); e (c) 0 a 10%, em peso, de um segundo monômero hidrofílico.
5. Sequência de meio filtrante, de acordo com qualquer uma das reivindicações 1 a 4, CARACTERIZADA pelo fato de que o primeiro meio filtrante compreende um polímero enxertado na superfície de um substrato não tecido, em que o polímero compreende unidades monoméricas interpolimerizadas de: (a) 10 a 50%, em peso, de um monômero ligante contendo amônio quaternário; (b) 10 a 80%, em peso, de um monômero de amida; (c) 10 a 40%, em peso, de um monômero óxi; e (d) 0 a 30%, em peso, de um monômero de poli (óxido de alquileno).
6. Sequência de meio filtrante, de acordo com qualquer uma das reivindicações 1 a 5, CARACTERIZADA pelo fato de que a membrana microporosa funcionalizada compreende um monômero de (met)acriloíla guanidila-funcional enxertado via radicais livres, em que o monômero de (met)acriloíla guanidila-funcional compreende ao menos um den-tre: em que R1 é H ou alquila C1-C4; R2 é um grupo (hetero)hidrocarbila; cada R3 é, independentemente, H ou hidrocarbila; R4 é H, alquila C1-C12 ou -N(R3)2; R5 é H ou hidrocarbila; X1 é -O- ou -NR3-, o é 0 ou 1, e n é 1 ou 2.
7. Sequência de meio filtrante, de acordo com a reivindicação 6, CARACTERIZADA pelo fato de que o monômero de (met)acriloíla guanidila-funcio- nal enxertado via radicais livres é enxertado em uma camada primer disposta sobre uma membrana microporosa, em que a camada primer compreende um polímero de poliamina reticulado que tem grupos polimerizáveis etilenicamente insaturados, em que o polímero de poliamina reticulado que tem grupos polimerizáveis etilenicamente insaturados é um produto de reação de: (a) um polímero de poliamina; (b) um agente de reticulação polifuncional para o polímero de poliamina; e (c) um monômero que tem um grupo funcional reativo de amina e um grupo polimerizável etilenicamente insaturado.
8. Sequência de meio filtrante, de acordo com a reivindicação 6 ou 7, CARACTERIZADA pelo fato de que o monômero de (met)acriloíla guanidila-funcional enxertado via radicais livres é enxertado sobre uma membrana microporosa na presença de um fotoiniciador do tipo II.
9. Sequência de meio filtrante, de acordo com qualquer uma das reivindicações 1 a 8, CARACTERIZADA pelo fato de que compreende ainda um meio filtrante não fun- cionalizado disposto entre o primeiro meio filtrante e o segundo meio filtrante.
10. Dispositivo filtrante, CARACTERIZADO pelo fato de que compreende: uma entrada de fluido; uma saída de fluido; e meios filtrantes conectando de maneira fluida a entrada de fluido e a saída de fluido, em que os meios filtrantes compreendem (i) um primeiro meio filtrante compreendendo um substrato não tecido de troca aniônica, em que o substrato não tecido de troca aniônica compreende uma pluralidade de grupos amônio quaternário; e (ii) um segundo meio filtrante compreendendo uma membrana microporosa funci- onalizada, em que a membrana microporosa funcionalizada compreende uma pluralidade de grupos guanidila; e em que o primeiro meio filtrante está posicionado a montante do segundo meio filtrante, os meios filtrantes.
11. Método de fabricação de um fluido biológico, CARACTERIZADO pelo fato de que compreende: (a) fornecer o fluido biológico, em que o fluido biológico compreende uma biomo- lécula alvo e contaminantes, e (b) colocar o fluido biológico em contato com a sequência de meio filtrante, como definida em qualquer uma das reivindicações 1 a 9, para obter um filtrado.
12. Método, de acordo com a reivindicação 11, CARACTERIZADO pelo fato de que a biomolécula alvo é uma proteína.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562245403P | 2015-10-23 | 2015-10-23 | |
| US62/245,403 | 2015-10-23 | ||
| PCT/US2016/056326 WO2017069965A1 (en) | 2015-10-23 | 2016-10-11 | Filtration medium sequence for biomaterial purification |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| BR112018008250A2 BR112018008250A2 (pt) | 2018-10-23 |
| BR112018008250B1 true BR112018008250B1 (pt) | 2022-10-04 |
Family
ID=57218993
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| BR112018008250-3A BR112018008250B1 (pt) | 2015-10-23 | 2016-10-11 | Sequência de meio filtrante, dispositivo filtrante e método de fabricação de um fluido biológico |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US10722848B2 (pt) |
| EP (1) | EP3365095A1 (pt) |
| JP (1) | JP6924750B2 (pt) |
| CN (1) | CN108136338B (pt) |
| BR (1) | BR112018008250B1 (pt) |
| RU (1) | RU2698822C1 (pt) |
| WO (1) | WO2017069965A1 (pt) |
Families Citing this family (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10704021B2 (en) | 2012-03-15 | 2020-07-07 | Flodesign Sonics, Inc. | Acoustic perfusion devices |
| CA2935960C (en) | 2014-01-08 | 2023-01-10 | Bart Lipkens | Acoustophoresis device with dual acoustophoretic chamber |
| US11708572B2 (en) | 2015-04-29 | 2023-07-25 | Flodesign Sonics, Inc. | Acoustic cell separation techniques and processes |
| US11377651B2 (en) | 2016-10-19 | 2022-07-05 | Flodesign Sonics, Inc. | Cell therapy processes utilizing acoustophoresis |
| US11214789B2 (en) | 2016-05-03 | 2022-01-04 | Flodesign Sonics, Inc. | Concentration and washing of particles with acoustics |
| EP3725092A4 (en) | 2017-12-14 | 2021-09-22 | FloDesign Sonics, Inc. | DRIVE AND CONTROL UNIT FOR ACOUSTIC CONVERTER |
| US10737259B2 (en) * | 2018-08-31 | 2020-08-11 | Pall Corporation | Salt tolerant anion exchange medium |
| US11045773B2 (en) | 2018-08-31 | 2021-06-29 | Pall Corporation | Salt tolerant porous medium |
| JP2022510909A (ja) * | 2018-11-30 | 2022-01-28 | インテグリス・インコーポレーテッド | ペンダント親水性基を有する親水性フィルタ膜、ならびに関連する調製および使用の方法 |
| EP3899526B1 (en) | 2018-12-21 | 2024-05-01 | Solventum Intellectual Properties Company | Method for testing a chromatography device used for ion exchange |
| CN111471101A (zh) * | 2020-04-13 | 2020-07-31 | 国药集团武汉血液制品有限公司 | 一种去除人免疫球蛋白类制品中残留的IgA的方法 |
| KR20230039673A (ko) * | 2020-07-14 | 2023-03-21 | 도날드슨 컴파니, 인코포레이티드 | 탈기용 시스템 및 방법 |
| EP4255917A1 (en) | 2020-12-04 | 2023-10-11 | 3M Innovative Properties Company | A filtration unit and a method for biomaterial purification |
| WO2022136968A1 (en) * | 2020-12-23 | 2022-06-30 | 3M Innovative Properties Company | Method of separating a virus from a composition using copolymer-grafted nonwoven substrates |
| WO2023089412A1 (en) | 2021-11-19 | 2023-05-25 | 3M Innovative Properties Company | Method for biomaterial purification |
| WO2024038338A1 (en) * | 2022-08-15 | 2024-02-22 | Solventum Intellectual Properties Company | Functionalized porous substrates and their use for detecting analytes |
Family Cites Families (40)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS4740913Y1 (pt) | 1970-06-23 | 1972-12-11 | ||
| US3876738A (en) | 1973-07-18 | 1975-04-08 | Amf Inc | Process for producing microporous films and products |
| US3928517A (en) | 1973-12-26 | 1975-12-23 | Amf Inc | Quench bath regeneration system for microporous film production |
| CA1073648A (en) | 1976-08-02 | 1980-03-18 | Edward R. Hauser | Web of blended microfibers and crimped bulking fibers |
| DE3146913C2 (de) | 1981-11-26 | 1983-10-06 | C.A. Weidmueller Gmbh & Co, 4930 Detmold | Querverbinder |
| US4707265A (en) | 1981-12-18 | 1987-11-17 | Cuno Incorporated | Reinforced microporous membrane |
| US4726989A (en) | 1986-12-11 | 1988-02-23 | Minnesota Mining And Manufacturing | Microporous materials incorporating a nucleating agent and methods for making same |
| US4867881A (en) | 1987-09-14 | 1989-09-19 | Minnesota Minning And Manufacturing Company | Orientied microporous film |
| US5120594A (en) | 1989-11-20 | 1992-06-09 | Minnesota Mining And Manufacturing Company | Microporous polyolefin shaped articles with patterned surface areas of different porosity |
| US5260360A (en) | 1991-10-18 | 1993-11-09 | Minnesota Mining And Manufacturing Company | Oil, water and sweat repellent microporous membrane materials |
| US5522997A (en) | 1993-03-16 | 1996-06-04 | Cognis, Inc. | Process for the removal of toxic cyanide and heavy metal species from alkaline solutions |
| CA2127605A1 (en) | 1993-12-23 | 1995-06-24 | Peter J. Degen | Affinity separation method |
| US5458782A (en) | 1994-01-07 | 1995-10-17 | Cuno Incorporated | Hydrolytically stable nylon membrane |
| US5962544A (en) | 1995-12-07 | 1999-10-05 | 3M | Microporous materials of ethylene-vinyl alcohol copolymer and methods for making same |
| US6056529A (en) | 1998-02-11 | 2000-05-02 | Cuno, Inc. | Systems for producing a plurality of different microporous phase inversion membrane each having any one of a plurality of different pore sizes from a single master dope batch |
| US6413070B1 (en) | 1997-04-11 | 2002-07-02 | Cuno Incorporated | System for manufacturing reinforced three-zone microporous membrane |
| US6939466B2 (en) | 1998-08-17 | 2005-09-06 | Cuno Incorporated | Graded particle-size retention filter medium for fluid filtration unit with improved edge seal |
| DE69935257T2 (de) | 1998-08-17 | 2007-11-15 | 3M Innovative Properties Co., St. Paul | Randabdichtung für einen patronenfilter |
| US6712966B1 (en) | 1999-02-04 | 2004-03-30 | Cuno Incorporated | Graded particle-size retention filter medium for cell-type filter unit |
| BR0008591A (pt) | 1999-01-07 | 2002-10-08 | Cuno Inc | Elemento filtrante, unidade de cartucho e método de formação de um elemento filtrante |
| US6780327B1 (en) | 1999-02-25 | 2004-08-24 | Pall Corporation | Positively charged membrane |
| US6521011B1 (en) | 1999-07-15 | 2003-02-18 | 3M Innovative Properties Company | Self-supporting pleated filter and method of making same |
| RU2170136C1 (ru) * | 2000-06-06 | 2001-07-10 | Государственный научный центр Российской Федерации Физико-энергетический институт им. акад. А.И. Лейпунского | Многослойный фильтрующий материал для ультра- и микрофильтрации и способ его изготовления |
| ITTO20030039A1 (it) * | 2003-01-24 | 2004-07-25 | Fresenius Hemocare Italia Srl | Filtro per separare leucociti da sangue intero e/o da preparati derivati dal sangue, procedimento per la fabbricazione del filtro, dispositivo e utilizzazione. |
| US7338692B2 (en) | 2003-09-12 | 2008-03-04 | 3M Innovative Properties Company | Microporous PVDF films |
| JP5182793B2 (ja) * | 2007-10-12 | 2013-04-17 | 独立行政法人日本原子力研究開発機構 | 液体濾過用カートリッジフィルタ |
| JP2011523965A (ja) | 2008-05-30 | 2011-08-25 | スリーエム イノベイティブ プロパティズ カンパニー | リガンド官能化基材 |
| JP2011522090A (ja) | 2008-05-30 | 2011-07-28 | スリーエム イノベイティブ プロパティズ カンパニー | リガンド官能化基材の製造方法 |
| DE102008037678A1 (de) | 2008-08-14 | 2010-02-25 | Sartorius Stedim Biotech Gmbh | Tiefenfilterschicht mit anorganischem Schichtdoppelhydroxid |
| EP2342269B1 (en) | 2008-09-19 | 2019-11-13 | 3M Innovative Properties Co. | Ligand graft functionalized substrates |
| JP5667068B2 (ja) | 2008-11-04 | 2015-02-12 | スリーエム イノベイティブ プロパティズ カンパニー | 流体処理装置用相互連結具 |
| US10918985B2 (en) | 2008-11-04 | 2021-02-16 | 3M Innovative Properties Company | Filter element and seal therefor |
| WO2010074773A1 (en) * | 2008-12-23 | 2010-07-01 | 3M Innovative Properties Company | Functionalized nonwoven article |
| US20100210160A1 (en) | 2009-02-18 | 2010-08-19 | 3M Innovative Properties Company | Hydrophilic porous substrates |
| CN102803593A (zh) * | 2009-06-23 | 2012-11-28 | 3M创新有限公司 | 官能化非织造制品 |
| US9272246B2 (en) | 2011-03-28 | 2016-03-01 | 3M Innovative Properties Company | Ligand functional substrates |
| KR102043249B1 (ko) | 2012-04-24 | 2019-11-11 | 쓰리엠 이노베이티브 프로퍼티즈 캄파니 | 공중합체로 그래프팅된 부직 물품 |
| EP3326711B1 (en) * | 2012-06-05 | 2021-07-07 | 3M Innovative Properties Company | Graft copolymer functionalized article |
| CN104737018B (zh) | 2012-09-27 | 2017-06-30 | 3M创新有限公司 | 配体接枝基底 |
| AU2016243036B2 (en) * | 2015-04-03 | 2022-02-17 | Abbott Laboratories | Devices and methods for sample analysis |
-
2016
- 2016-10-11 US US15/755,584 patent/US10722848B2/en active Active
- 2016-10-11 CN CN201680061591.0A patent/CN108136338B/zh active Active
- 2016-10-11 JP JP2018520105A patent/JP6924750B2/ja active Active
- 2016-10-11 EP EP16788850.2A patent/EP3365095A1/en active Pending
- 2016-10-11 RU RU2018112487A patent/RU2698822C1/ru active
- 2016-10-11 WO PCT/US2016/056326 patent/WO2017069965A1/en active Application Filing
- 2016-10-11 BR BR112018008250-3A patent/BR112018008250B1/pt active IP Right Grant
Also Published As
| Publication number | Publication date |
|---|---|
| US10722848B2 (en) | 2020-07-28 |
| CN108136338B (zh) | 2021-09-03 |
| JP6924750B2 (ja) | 2021-08-25 |
| WO2017069965A1 (en) | 2017-04-27 |
| RU2698822C1 (ru) | 2019-08-30 |
| EP3365095A1 (en) | 2018-08-29 |
| CN108136338A (zh) | 2018-06-08 |
| BR112018008250A2 (pt) | 2018-10-23 |
| US20180257042A1 (en) | 2018-09-13 |
| JP2018538127A (ja) | 2018-12-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| BR112018008250B1 (pt) | Sequência de meio filtrante, dispositivo filtrante e método de fabricação de um fluido biológico | |
| CN103477227B (zh) | 配体官能化基底 | |
| CN102317523B (zh) | 官能化非织造制品 | |
| KR101808356B1 (ko) | 리간드 작용화된 중합체 | |
| EP2401065B1 (en) | Membrane with sulfonic groups for removing protein aggregates | |
| US7721898B2 (en) | Coating material for leukocyte removal filter and the filter | |
| JP6467409B2 (ja) | グアニジノ官能性モノマーを調製する方法 | |
| US8136676B2 (en) | Polymers useful as medical materials | |
| EA013385B1 (ru) | Устройство для удаления целевых агентов из образца и способ | |
| EP1814659A1 (en) | Polymers useful as medical materials | |
| JP2016503486A (ja) | リガンドグラフト化基材 | |
| JP7085533B2 (ja) | 官能化コポリマー及びその使用 | |
| JPH0949830A (ja) | 刺激応答型分離材料および分離精製方法 | |
| JP2019536736A (ja) | 生物学的溶液中の単量体タンパク質から凝集タンパク質を分離するための方法 | |
| WO2001066171A1 (fr) | Nouveau filtre pour leucopherese | |
| US20130284669A1 (en) | Negatively charged porous medium for removing protein aggregates | |
| Xiang et al. | Improved antifouling properties and blood compatibility of 3-methacryloxypropyl trimethoxysilane–based zwitterionic copolymer modified composite membranes via in situ post-crosslinking copolymerization | |
| US20240131450A1 (en) | Charged depth filter for therapeutic biotechnology manufacturing process | |
| CN116887899A (zh) | 用于治疗生物技术制造过程的带电深度过滤器 | |
| CN117177805A (zh) | 病毒过滤介质、制品和方法 | |
| WO2016149851A1 (zh) | 双离子电荷偏差型血球筛选用材料及从血液样品中移除白血球的方法 | |
| WO2023037178A1 (en) | Method of harvesting biologics | |
| WO2023089412A1 (en) | Method for biomaterial purification | |
| WO2024074906A1 (en) | Anion exchange separation article, methods of making, and methods of using | |
| CN116615434A (zh) | 用于生物材料纯化的过滤单元和方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| B06U | Preliminary requirement: requests with searches performed by other patent offices: procedure suspended [chapter 6.21 patent gazette] | ||
| B09A | Decision: intention to grant [chapter 9.1 patent gazette] | ||
| B16A | Patent or certificate of addition of invention granted [chapter 16.1 patent gazette] |
Free format text: PRAZO DE VALIDADE: 20 (VINTE) ANOS CONTADOS A PARTIR DE 11/10/2016, OBSERVADAS AS CONDICOES LEGAIS |