BR112016002646B1 - Dispositivo intravesical de entrega de fármaco - Google Patents
Dispositivo intravesical de entrega de fármaco Download PDFInfo
- Publication number
- BR112016002646B1 BR112016002646B1 BR112016002646-2A BR112016002646A BR112016002646B1 BR 112016002646 B1 BR112016002646 B1 BR 112016002646B1 BR 112016002646 A BR112016002646 A BR 112016002646A BR 112016002646 B1 BR112016002646 B1 BR 112016002646B1
- Authority
- BR
- Brazil
- Prior art keywords
- drug
- housing
- unit
- release
- reservoir
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2013—Organic compounds, e.g. phospholipids, fats
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/14—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L31/16—Biologically active materials, e.g. therapeutic substances
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M31/00—Devices for introducing or retaining media, e.g. remedies, in cavities of the body
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7052—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides
- A61K31/706—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom
- A61K31/7064—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines
- A61K31/7068—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines having oxo groups directly attached to the pyrimidine ring, e.g. cytidine, cytidylic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/10—Alcohols; Phenols; Salts thereof, e.g. glycerol; Polyethylene glycols [PEG]; Poloxamers; PEG/POE alkyl ethers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/12—Carboxylic acids; Salts or anhydrides thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/16—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing nitrogen, e.g. nitro-, nitroso-, azo-compounds, nitriles, cyanates
- A61K47/18—Amines; Amides; Ureas; Quaternary ammonium compounds; Amino acids; Oligopeptides having up to five amino acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0002—Galenical forms characterised by the drug release technique; Application systems commanded by energy
- A61K9/0004—Osmotic delivery systems; Sustained release driven by osmosis, thermal energy or gas
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0034—Urogenital system, e.g. vagina, uterus, cervix, penis, scrotum, urethra, bladder; Personal lubricants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/2027—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone, poly(meth)acrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/04—Macromolecular materials
- A61L31/048—Macromolecular materials obtained by reactions only involving carbon-to-carbon unsaturated bonds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/08—Materials for coatings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M31/00—Devices for introducing or retaining media, e.g. remedies, in cavities of the body
- A61M31/002—Devices for releasing a drug at a continuous and controlled rate for a prolonged period of time
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M31/00—Devices for introducing or retaining media, e.g. remedies, in cavities of the body
- A61M31/007—Injectors for solid bodies, e.g. suppositories
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/02—Drugs for disorders of the urinary system of urine or of the urinary tract, e.g. urine acidifiers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/10—Drugs for disorders of the urinary system of the bladder
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0087—Galenical forms not covered by A61K9/02 - A61K9/7023
- A61K9/0092—Hollow drug-filled fibres, tubes of the core-shell type, coated fibres, coated rods, microtubules or nanotubes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M2210/00—Anatomical parts of the body
- A61M2210/10—Trunk
- A61M2210/1078—Urinary tract
- A61M2210/1085—Bladder
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Engineering & Computer Science (AREA)
- Epidemiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Chemical & Material Sciences (AREA)
- Heart & Thoracic Surgery (AREA)
- Urology & Nephrology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Biomedical Technology (AREA)
- Vascular Medicine (AREA)
- Surgery (AREA)
- Molecular Biology (AREA)
- Anesthesiology (AREA)
- Hematology (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Gynecology & Obstetrics (AREA)
- Reproductive Health (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Nanotechnology (AREA)
- Biophysics (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Infusion, Injection, And Reservoir Apparatuses (AREA)
- Media Introduction/Drainage Providing Device (AREA)
- Medical Preparation Storing Or Oral Administration Devices (AREA)
- Materials For Medical Uses (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
DISPOSITIVOS E MÉTODOS DE ENTREGA DE FÁRMACOS DE MÚLTIPLAS UNIDADES. Trata-se de dispositivos de entrega de fármaco implantáveis que incluem um alojamento que define um reservatório, uma primeira unidade dentro do reservatório e uma segunda unidade dentro do reservatório. A primeira unidade contém um fármaco e a segunda unidade contém um agente funcional que facilita a liberação do fármaco. Os dispositivos de entrega de fármaco intravesical incluem uma porção de alojamento que contém uma formulação de fármaco e uma porção de alojamento que contém um excipiente, e são configurados para liberar o fármaco de acordo com um primeiro perfil de liberação e o excipiente de acordo com um segundo perfil de liberação. Os métodos incluem inserir qualquer um desses dispositivos em um paciente e liberar fármaco do dispositivo.
Description
[001] Esta revelação refere-se, de modo geral, à entrega controlada de fár- maco aos pacientes e, mais particularmente, se refere a dispositivos médicos para liberação controlada de fármaco, incluindo, porém sem limitação a, dispositivos ins-taláveis na bexiga urinária para liberação de fármaco na bexiga.
[002] Vários dispositivos de entrega de fármaco implantáveis são conhecidos na técnica. Por exemplo, a Publicação de Pedido de Patente n° U.S. 2007/0202151 por Lee et al. e Publicação de Pedido de Patente n° U.S. 2009/0149833 por Cima et al. descrevem dispositivos de entrega de fármaco para instalação minimamente invasiva e retenção em uma cavidade ou lúmen em um paciente, tal como a bexiga. Os dispositivos resistem à excreção, tal como em resposta às forças associadas à urinação. Por exemplo, os dispositivos podem incluir uma armação de retenção, que pode ser configurada em um perfil relativamente baixo para instalação no corpo, e uma vez implantada, pode assumir um perfil relativamente expandido para facilitar a retenção. Os dispositivos podem fornecer liberação controlada de fármaco durante um período estendido de maneira predefinida. Em algumas modalidades, os dispositivos incluem um tubo permeável à água que define um reservatório de fármaco para alojar um fármaco e pelo menos uma ranhura para liberar o fármaco. Bombeamento osmótico ou difusão pode ser o mecanismo dominante pelo qual o fármaco é liberado do reservatório. Fármacos altamente solúveis em água, tais como cloridrato de lidocaína, podem ser liberados por meio de pressão osmótica em taxas terapeuticamente úteis durante um período estendido. Em outras modalidades, o dispositivo pode ser configurado para liberar solubilidade inferior ou outros fármacos principalmente ou exclusivamente por meio de difusão.
[003] Seria desejável, no entanto, fornecer dispositivos e sistemas aprimorados de entrega de fármaco. Por exemplo, seria desejável fornecer dispositivos, sistemas, e métodos nos quais fármacos de solubilidade relativamente inferior podem ser liberados em taxas terapeuticamente úteis por um meio de pressão osmótica durante um período estendido. Também seria desejável fornecer dispositivos de entrega de fármaco implantáveis e sistemas com capacidade de entregar uma variedade de agentes ativos em um perfil de cinética de liberação selecionado e fornecer técnicas adicionais, estruturas, e/ou formulações para intensificar o controle de liberação de fármaco in vivo, por exemplo, por meio de um dispositivo instalado na bexiga.
[0004] Em um aspecto, é fornecido um dispositivo de entrega de fármaco implantável, que inclui um alojamento que define um reservatório, uma primeira unidade contida dentro do reservatório e uma segunda unidade contida dentro do reservatório em uma posição distinta da primeira unidade. A primeira unidade contém um fármaco e a segunda unidade contém um agente funcional que facilita a liberação in vivo do fármaco do alojamento.
[0005] Em outro aspecto, um dispositivo de entrega de fármaco intravesical é fornecido, incluindo uma primeira porção de alojamento carregada com uma formulação de fármaco que inclui um fármaco, e uma segunda porção de alojamento carregada com um excipiente. O dispositivo é configurado para liberar o fármaco de acordo com um primeiro perfil de liberação e é configurado para liberar o excipiente de acordo com um segundo perfil de liberação que difere do primeiro perfil de liberação.
[0006] Em ainda outro aspecto, é fornecido um método de administração de um fármaco a um paciente, incluindo inserir um dispositivo de entrega de fármaco conforme revelado no presente documento em um paciente, e liberar o fármaco do dispositivo inserido.
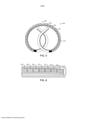
[0007] A Figura 1 é uma vista em corte transversal de uma modalidade de um dispositivo de entrega de fármaco de técnica anterior;
[0008] A Figura 2 é uma vista em corte transversal de uma modalidade de um dispositivo de entrega de fármaco de múltiplas unidades;
[0009] A Figura 3 é uma vista em corte transversal de outra modalidade de um dispositivo de entrega de fármaco de múltiplas unidades;
[0010] A Figura 4 é uma vista em corte transversal de outra modalidade de um dispositivo de entrega de fármaco de múltiplas unidades;
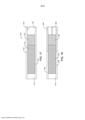
[0011] A Figura 5 é uma vista em corte transversal de uma modalidade de um dispositivo de entrega de fármaco de múltiplas unidades;
[0012] A Figura 6 é uma vista em perspectiva de uma porção do dispositivo de entrega de múltiplas unidades de fármaco da Figura 5.
[0013] A Figura 7 ilustra configurações exemplificadoras para dispositivos de entrega de fármaco que têm mais do que uma porção de alojamento de fármaco.
[0014] A Figura 8 é uma vista plana de uma modalidade de um dispositivo de entrega de fármaco que tem mais do que uma porção de alojamento de fármaco.
[0015] A Figura 9 é um gráfico que mostra a porcentagem de liberação de fármaco ao longo do tempo de um dispositivo de entrega de fármaco em único tablete e um dispositivo de entrega de fármaco em dois tabletes.
[0016] A Figura 10 é um gráfico que mostra a taxa de liberação de fármaco ao longo do tempo de um dispositivo de entrega de fármaco em único tablete e um dispositivo de entrega de fármaco em dois tabletes.
[0017] A Figura 11 é um gráfico que mostra a porcentagem de liberação de fármaco ao longo do tempo de um dispositivo de entrega de fármaco que tem um orifício perfurado por laser e um dispositivo de entrega de fármaco que tem um orifício espaçador.
[0018] A Figura 12 é um gráfico que mostra a taxa de liberação de fármaco ao longo do tempo de um dispositivo de entrega de fármaco que tem um orifício perfurado por laser e um dispositivo de entrega de fármaco que tem um orifício espaçador.
[0019] A Figura 13 é um gráfico que mostra a porcentagem de liberação de fármaco ao longo do tempo de um dispositivo de entrega de fármaco que contém um fármaco em pó e um tablete de agente osmótico, e um dispositivo de entrega de fármaco que contém um tablete de fármaco e um tablete de agente osmótico.
[0020] A Figura 14 é um gráfico que mostra a taxa de liberação de fármaco ao longo do tempo de um dispositivo de entrega de fármaco que contém um fármaco em pó e um tablete de agente osmótico, e um dispositivo de entrega de fármaco que contém um tablete de fármaco e um tablete de agente osmótico.
[0021] As Figuras 15A e 15B são vistas em perspectiva e em corte transversal, respectivamente, de uma modalidade do alojamento para um dispositivo de entrega de fármaco.
[0022] A Figura 16 é uma vista em corte transversal de uma modalidade de um dispositivo de entrega de fármaco no qual o reservatório inclui um modulador de canal de fluxo.
[0023] A Figura 17 é uma vista em corte transversal de uma modalidade de um dispositivo de entrega de fármaco de múltiplas unidades;
[0024] A Figura 18 é uma vista em corte transversal de uma modalidade de um dispositivo de entrega de fármaco de múltiplas unidades;
[0025] A Figura 19 é um gráfico que mostra a quantidade de fármaco liberado ao longo do tempo de dispositivos de entrega de fármaco que têm várias espessuras de parede e durômetro de alojamento.
[0026] A Figura 20 é um gráfico que mostra a quantidade de fármaco liberado ao longo do tempo de dispositivos de entrega de fármaco que têm várias espessuras de parede e durômetro de alojamento.
[0027] A Figura 21 é um gráfico que mostra a quantidade de fármaco liberado ao longo do tempo de dispositivos de entrega de fármaco que têm um revestimento de alojamento de vários comprimentos.
[0028] São fornecidos dispositivos que podem ser inseridos em uma cavidade de corpo ou lúmen de um paciente para o propósito de entregar fármaco de modo localizado ou regionalmente em torno de um lugar de implantação. Em uma modalidade, os dispositivos contêm unidades de fármaco e unidades separadas de um segundo agente que promove liberação de fármaco. Exemplos In vitro mostram aprimoramentos de perfis de liberação de fármaco tanto a curto prazo quanto a longo prazo em comparação a dispositivos comparáveis de única unidade. Ademais, esses dispositivos permitem vantajosamente a entrega de fármacos de baixa solubilidade aos pacientes por meio de dispositivos de liberação osmótica. Isso é especialmente útil para fármacos que são difíceis de reformular em formas mais altamente solúveis. Além disso, a liberação osmótica é geralmente preferencial para liberação à base de difusão quando a solubilidade de fármaco depende significativamente do pH dos meios de liberação e é desejável reduzir a dependência de pH da liberação de fármaco.
[0029] Para os propósitos da presente revelação, o termo "lugar de implantação" geralmente se refere a um lugar dentro do corpo de um paciente humano ou outro animal. O lugar de implantação pode ser qualquer lugar geniturinário, tal como a bexiga, uretra, ureteres, rins, próstata, vesículas seminais, duto ejaculatório, duto deferente, vagina, útero, trompas de falópio, ovários ou qualquer outro local dentro de um sistema urológico ou reprodutivo do corpo, entre outros locais. Em modalidades particulares, o lugar de implantação é a bexiga.
[0030] Em determinadas modalidades, os dispositivos são projetados para serem instalados através de orifícios naturais e lumens do corpo em procedimentos de instalação minimamente invasiva. Por exemplo, os dispositivos podem ter um formato de instalação adequado para instalação através de um lúmen natural do corpo. Os dispositivos também são projetados para serem retidos no corpo uma vez implantados, tal como alcançando-se um formato de retenção mediante a implantação ou por ancoramento dentro do corpo. Em modalidades particulares, os dispositivos podem ser instalados através da uretra na bexiga e pode superar as forças de urinação uma vez implantados para retenção na bexiga.
[0031] Uma vez implantados, os dispositivos podem liberar um ou mais fármacos durante um período estendido. O fármaco pode ser liberado por bombeamento osmótico através de uma abertura no dispositivo, difundindo-se através de uma superfície do dispositivo, difundindo-se a partir de uma abertura no dispositivo ou uma combinação dos mesmos. A liberação de fármaco pode ser contínua e de acordo com um perfil de liberação predefinido.
[0032] Em determinadas modalidades, os dispositivos são carregados com uma ou mais unidades de fármaco e uma ou mais unidades de agente funcional. Conforme usado no presente documento, o termo "agente funcional" se refere a agentes ou excipientes que facilitam liberação controlada in vivo de um fármaco do dispositivo. Por exemplo, agentes funcionais podem incluir agentes osmóticos, agentes de solubilização de fármaco, agentes de estabilização de fármaco, agentes de intensificação de permeação ou combinações dos mesmos. O agente funcional pode ser selecionado com base no(s) fármaco(s) a serem entregues do dispositivo. Por exemplo, o fármaco a ser entregue pode ser um fármaco de baixa solubilidade e o agente funcional pode incluir um agente osmótico para facilitar liberação osmótica in vivo do fármaco.
[0033] Conforme usado no presente documento, o termo "baixa solubilidade" se refere a um fármaco que tem uma solubilidade de cerca de 0,001 mg/ml a cerca de 10 mg/ml de água a 37 °C. conforme usado no presente documento, o termo "alta solubilidade" se refere a um fármaco que tem uma solubilidade acima de cerca de 10 mg/ml água a 37 °C. A solubilidade do fármaco pode ser afetada pelo menos em parte por sua forma. Por exemplo, um fármaco na forma de um sal solúvel em água pode ter uma alta solubilidade, enquanto o mesmo fármaco em forma básica pode ter uma baixa solubilidade.
[0034] Com dispositivos convencionais de entrega de fármaco, fármacos de alta solubilidade geralmente podem ser adequados para liberação de acordo com um gradiente de pressão osmótica induzida, enquanto fármacos de baixa solubilidade podem ser adequados para liberação por meio de difusão através da parede ou passagem no alojamento de fármaco. Os dispositivos revelados no presente documento têm capacidade de entregar uma variedade de fármacos por meio de vários modos de liberação e perfis de cinética de liberação, e para fornecer técnicas adicionais, estruturas, e/ou formulações para intensificar o controle de liberação de fármaco in vivo.
[0035] Independente de o fármaco selecionado ter uma alta ou baixa solubilidade, o mesmo deve entregue (isto é, liberado do dispositivo de entrega) em uma taxa terapeuticamente eficaz, o que pode exigir a adição de um ou mais agentes funcionais (por exemplo, um agente osmótico para aumentar o fluxo de água, agente de solubilização ou solubilidade, agente de ajuste de pH, ou agente de intensificação de estabilidade). Em geral, a combinação da solubilidade do fármaco selecionado na presença ou ausência de agentes funcionais, se houver, e fluxo de água osmótica determinará a taxa de liberação e duração, e tal combinação pode ser configurada para a taxa e duração a estar dentro de uma faixa terapeuticamente eficaz.
[0036] Os dispositivos e métodos revelados no presente documento construídos a partir daqueles descritos na Publicação de Pedido de Patente no U.S. 2010/0331770 por Lee et al, Publicação de Pedido de Patente no U.S. 2011/0152839 por Cima et al, e Publicação de Pedido de Patente no U.S. 2012/0203203 por Lee et al, que são incorporados a título de referência ao presente documento.
[0037] I. DISPOSITIVOS DE ENTREGA DE FÁRMACO IMPLANTÁVEIS
[0038] Modalidades de dispositivos de entrega de fármaco implantáveis reveladas no presente documento incluem, em geral, um alojamento que define um reservatório, e a primeira e a segunda unidades contidas dentro do reservatório. Por exemplo, o alojamento pode ser um tubo anular alongado e o reservatório pode ser o lúmen do tubo anular.
[0039] A(s) primeira(s) unidade(s) incluem um fármaco ou ingrediente farmaceuticamente ativo a ser entregue a um paciente, e a(s) segunda(s) unidade(s) inclui(incluem) um agente funcional que facilita a liberação in vivo do fármaco do alojamento. A primeira e a segunda unidades são localizadas em posições distintas dentro do reservatório. Ou seja, a primeira e a segunda unidades são distintas e separadas uma da outra. Por exemplo, a primeira e a segunda unidades podem ser tabletes sólidos que são posicionados de modo adjacente no reservatório.
[0040] Conforme mostrado na Figura 1, um dispositivo de entrega de fármaco convencional 100 inclui múltiplos tabletes idênticos 102 posicionados em um reservatório 104. (Para fins de clareza e facilidade de comparação com outras modalidades ilustradas, o dispositivo 100 é mostrado em um formato linear, que pode ser útil durante o processo de inserção do dispositivo no paciente.) Os tabletes 102 incluem o fármaco a ser entregue e, opcionalmente, um ou mais excipientes. Uma vez implantado, o dispositivo 100 libera o fármaco por bombeamento osmótico através de uma abertura 106 no dispositivo 100. No entanto, o modo de liberação e cinética do fármaco são limitados pela formulação de tablete, assim como pelas características dos materiais de construção do alojamento.
[0041] Uma modalidade da presente revelação é mostrada na Figura 2. O dispositivo de entrega de fármaco implantável 200 inclui um alojamento 208, que define um reservatório 204. Em contraste ao dispositivo 100, o dispositivo 200 inclui uma pluralidade de primeiras unidades 202, que incluem um fármaco, e uma pluralidade de segundas unidades 210, que incluem um agente funcional, que são contidos dentro do reservatório 204. A primeira e a segunda unidades 202, 210 são localizadas em posições distintas dentro do reservatório 204. Essa disposição pode ser particularmente vantajosa, conforme detalhado abaixo.
[0042] A estrutura de dispositivo, em combinação com as formulações de fármaco e agente funcional, pode ser projetada para liberar o fármaco e agente funcional por meio de osmose e/ou difusão.
[0043] A Figura 2 ilustra um dispositivo 200 que é configurado para operar como uma bomba osmótica. O dispositivo alojamento 208 inclui uma parede que é prontamente permeável à água, mas não ao fármaco a ser entregue, e um fármaco que não pode se difundir prontamente através da parede do alojamento 208. Ou seja, a porção permeável à água pode ser substancialmente impermeável ao fármaco em solução aquosa. A porção de parede permeável à água pode definir pelo menos parte do reservatório 204. Depois que o dispositivo é instalado em um paciente, a água (ou urina se na bexiga) permeia através da parede, entra no reservatório 204, e solubiliza a primeira e/ou a segunda unidades 202, 210. Alternativamente, ou em combinação com uma porção de parede permeável à água, o alojamento pode incluir pelo menos uma ranhura configurada para permitir que um fluido entre no reservatório in vivo. Por exemplo, o alojamento e/ou quaisquer porções de parede permeáveis à água podem ser silicone, um poliuretano termoplástico, de etileno-co-acetato de vinila (EVA), ou uma combinação dos mesmos.
[0044] Injeção de alguma porção de um fluido de solubilização no reservatório antes da implantação pode acelerar o processo de hidratação de tabletes ou formulações no mesmo se for necessário. Em uma modalidade, o dispositivo é configurado para receber pelo menos uma porção do fluido aquoso necessário para solubilizar o agente funcional e fármaco antes da implantação. Por exemplo, o fluido pode ser entregue ao dispositivo reservatório por meio de uma agulha e seringa. Em uma modalidade, uma porção do alojamento inclui um material de baixo durômetro adequado para penetração por uma agulha ou outro instrumento. Por exemplo, o alojamento pode incluir um espaçador coaxial que inclui uma porção de material de baixo durômetro circundada por uma porção de material de alto durômetro. Em outro exemplo, o alojamento pode incluir um recurso de vedação hermética unidirecional.
[0045] Seguindo a implantação, um gradiente de pressão osmótica se desenvolve entre o interior e o exterior do dispositivo alojamento 208, e uma vez que pressão suficiente é obtida, fármaco solubilizado é liberado do reservatório 204 através de pelo menos um orifício de liberação de fármaco 206, que está em comunicação fluida com o reservatório 204, em uma taxa controlada, acionada por pressão osmótica no reservatório 204. Tal modo de liberação pode ser denominado no presente documento como "liberação osmótica" ou "bombeamento osmótico."
[0046] Conforme mostrado na Figura 2, o orifício de liberação de fármaco 206 pode ser fornecido em um plugue de extremidade localizado em uma extremidade de alojamento tubular 208. Tais plugues de extremidade, também denominados como "orifícios de espaçador", são descritos em mais detalhes no Pedido PCT no PCT/US 14/20703, depositado em 5 de março 2014, que é incorporado ao presente documento a título de referência. A Figura 3 ilustra outra modalidade de um dispositivo osmótico 300, que inclui um orifício de liberação de fármaco 306 na parede lateral do alojamento 308, sendo que a ranhura é configurada para permitir que o fármaco solubilizado passe entre os mesmos.
[0047] Conforme mostrado na Figura 17, o dispositivo de entrega de fármaco 1700 pode incluir um plugue de restrição 1707 em uma extremidade do alojamento tubular 1708. Nessa modalidade, o plugue de restrição 1707 controla a liberação do fármaco pela formação transiente de um ou mais microcanais entre a porção elástica do alojamento 1708 e o plugue de restrição. Por exemplo, tabletes osmóticos 1710 e tabletes de fármaco 1702 podem ser contidos no reservatório 1704, que é ligado por uma extremidade vedada 1713 e o plugue de restrição 1707, que pode ser preso no lugar por adesivo 1709, que segura uma parte do plugue de restrição ao alojamento impedir a formação transiente de microcanais entre outra parte do plugue de restrição e alojamento (por exemplo, em uma área distante do adesivo). Tal plugue de restrição/microcanais são descritos em mais detalhes no Pedido PCT no PCT/US 14/28317, depositado em 14 de março de 2014, que é incorporado ao presente documento a título de referência.
[0048] Em determinadas modalidades, a primeira unidade, isto é, a unidade de fármaco, é localizada mais próxima ao orifício de liberação de fármaco, a porção de parede permeável a fármaco, ou plugue de restrição do que a segunda unidade, isto é, o agente funcional unidade. Essa disposição foi mostrada para ser particularmente vantajosa em termos de alcançar taxas terapeuticamente eficazes de liberação de fármaco para determinar fármacos, tal como fármacos de baixa solubilidade.
[0049] Quando a liberação osmótica é o modo de liberação de fármaco desejado, o agente funcional nas segundas unidades pode incluir um agente osmótico que facilita a liberação osmótica do fármaco. Por exemplo, o agente osmótico pode ter uma solubilidade maior do que o fármaco, de modo que o agente osmótico acelere a solubilização e/ou liberação subsequente do fármaco. Isso permite de modo benéfico a entrega de baixa solubilidade ou outros fármacos tipicamente somente entregue por meio de difusão, de dispositivos à base de entrega osmótica.
[0050] O dispositivo 200 pode exibir um período de indução enquanto um volume suficiente de agente funcional e/ou fármaco são solubilizados para alcançar o gradiente de pressão osmótica. Subsequentemente, o dispositivo 200 pode exibir uma taxa de liberação de ordem zero por um período estendido, seguida por uma taxa reduzida de liberação de ordem diferente de zero durante um período de queda. Uma taxa de entrega desejada pode ser alcançada controlando-se/selecionando-se vários parâmetros do dispositivo, incluindo, porém, sem limitação, a área de superfície e espessura da parede permeável à água; a permeabilidade à água do material usado para formar a parede; o formato, tamanho, número e colocação das ranhuras 206; e os perfis de dissolução do fármaco e do agente funcional.
[0051] Os dispositivos descritos no presente documento também podem ser configurados para liberar fármaco por meio de difusão, por si só ou em combinação com liberação osmótica. O dispositivo pode ser configurado para permitir que o fármaco solubilizado atravesse uma porção do alojamento ou uma ou mais ranhuras no mesmo.
[0052] Em determinadas modalidades, uma porção de parede permeável à água do alojamento também é permeável ao fármaco em solução aquosa, de modo que fármaco solubilizado seja liberado por meio da porção de parede, também denominada no presente documento como "difusão de passagem de parede". Depois que o dispositivo é implantado, a água ou urina se permeia através da parede, entra no reservatório, e solubiliza o agente funcional e/ou fármaco. O fármaco então se difunde diretamente através da parede em uma taxa controlada, devido a um gradiente de concentração de fármaco entre o interior e o exterior do dispositivo. Por exemplo, o alojamento e/ou quaisquer porções de parede permeáveis à água ou a fármaco pode ser silicone, um poliuretano termoplástico, de etileno-co-acetato de vinila (EVA), ou uma combinação dos mesmos.
[0053] Em determinadas modalidades, o alojamento não tem orifício de liberação e é configurado para liberar o fármaco através de pelo menos uma parede permeável a fármaco que liga o reservatório. Por exemplo, a parede permeável a fármaco pode incluir um disco estabilizado no lúmen de um tubo em uma extremidade do tubo ou próxima à mesma, opcionalmente ensanduichado entre uma arruela interna e uma arruela externa. As paredes permeáveis a fármaco são descritas em mais detalhes no Pedido de Patente no U.S. 14/216, 112, depositado em 17 de março de 2014, que é incorporado a título de referência ao presente documento. Em outras modalidades, a parede permeável a fármaco é parte de uma parede lateral de um alojamento tubular, ou parte de um plugue de extremidade localizado na extremidade de um alojamento tubular.
[0054] Alternativamente, ou em combinação com uma porção de parede permeável à água, o alojamento pode incluir pelo menos uma ranhura configurada para permitir que um fluido entre no reservatório in vivo. O alojamento também pode incluir uma ou mais ranhuras ou poros de passagem configurados para permitir que fármaco solubilizado atravesse o mesmo.
[0055] Conforme descrito acima, o dispositivo também pode ser configurado para receber pelo menos uma porção da água ou fluido necessários para solubilizar o agente funcional e fármaco antes da implantação, por exemplo, por meio de uma agulha e seringa.
[0056] O dispositivo pode exibir uma taxa de liberação de ordem zero por um período estendido, seguido por uma taxa reduzida de liberação de ordem diferente de zero durante um período de queda. A liberação de ordem zero pode começar de maneira relativamente rápida, à medida que o fármaco pode ser imediatamente disponível para se difundir através da parede de alojamento uma vez solubilizada. A taxa de entrega é afetada pela área de superfície e espessura da parede; pela permeabilidade à água e fármaco do material usado para formar a parede; pela carga ou tamanho de partícula do fármaco; e o perfil de dissolução do fármaco e agente funcional, dentre outros fatores. Em modalidades nas quais o fármaco é liberado por meio de uma ou mais ranhuras ou poros de passagem, um número ou combinação de ranhuras ou poros de passagem pode ser usado, o que também pode afetar a taxa geral de liberação atribuível à difusão.
[0057] Em determinadas modalidades, a primeira unidade e/ou a segunda unidade está na forma de um tablete sólido. Por exemplo, conforme mostrado na Figura 4, primeira unidade 402 está em forma de pó, enquanto as segundas unidades 410 estão na forma de tabletes sólidos. Em outras modalidades, conforme mostrado
[0058] Nas Figuras 2 e 3, tanto a primeira quanto a segunda unidade estão na forma de tabletes sólidos. Em determinadas modalidades, os tabletes sólidos são configurados como "mini-tabletes" conforme descrito no documento de patente no U.S. 8.343.516 por Daniel et al. Em modalidades, conforme mostrado na Figura 5, o dispositivo 500 contém uma pluralidade de primeiras unidades 502 em forma de tablete sólido e uma pluralidade de segundas unidades 510 em forma de tablete sólido.
[0059] Em determinadas modalidades, cada tablete de unidade de fármaco inclui uma fração em peso relativamente alto do fármaco e um relativamente fração em peso relativamente baixo de excipientes. Por exemplo, cada tablete de fármaco pode incluir mais do que 50% de fármaco em peso, o que permite o carregamento de um dispositivo relativamente pequeno com uma quantidade terapeuticamente eficaz de fármaco. A taxa de liberação de fármaco do dispositivo pode ser controlada de forma predominante pelas propriedades combinadas do agente funcional e alojamento de fármaco e pode ser alterada ajustando-se as características de alojamento, tal como sua espessura e permeabilidade, assim como a formulação de agente funcional.
[0060] O dispositivo implantável pode ser projetado para instalação em uma porção do corpo e retenção dentro da mesma, tal como a bexiga. O dispositivo pode ser flexível de modo que o dispositivo pode ser deformado para inserção, ainda uma vez implantado o dispositivo pode resistir à excreção em resposta às forças de urinação ou outras forças. Em uma modalidade, o dispositivo carregado com fármaco é flexível ou deformável apesar de ser carregado com a unidade de fármaco sólido e/ou tabletes de unidades de agente funcional, à medida que cada unidade de fármaco pode ser permitida a se mover em referência às unidades de fármaco adjacentes. Em particular, interstícios ou rupturas entre as unidades de fármaco individuais pode formar alívios que permitem deformação do dispositivo, enquanto permite que unidades individuais retenham sua forma sólida, conforme descrito na Publicação de Pedido de Patente no U.S. 2010/0331770 por Lee et al.
[0061] Algumas cargas sólidas de fármaco e/ou agente funcional são flexíveis em geral, incluindo unidades em pó 402, conforme mostrado na Figura 4, ou cargas formadas de tabletes sólidos individuais 602, 610 que podem se mover em referência uma à outra, conforme mostrado na Figura 6.
[0062] Conforme descrito acima, o dispositivo alojamento pode ser formado pelo menos parcialmente de um material permeável à água. Por exemplo, o alojamento pode ser formado de um material permeável à água que permite que a água se difunda no alojamento de fármaco ao longo de seu comprimento inteiro, uma porção do mesmo, ou em uma ou ambas as extremidades do dispositivo.
[0063] Em uma modalidade particular, o alojamento está na forma de um ou mais tubos anulares alongados em que o tubo anular inclui duas porções de parede, sendo que uma é permeável à água e a outra é impermeável à água. Uma modalidade do tubo anular é mostrada nas Figuras 15A e 15B. Aqui, o tubo anular 1500 inclui a porção de parede impermeável à água 1510 e a porção de parede permeável à água 1520. Mediante a inserção no paciente, a água permeia no lúmen 1530 através da porção de parede 1520, em que a mesma entraria em contato e solubilizaria as cargas de fármaco sólido e/ou agente funcional na mesma (não mostrada). Essa estrutura pode ser formada por coextrusão, por exemplo. As proporções relativas das duas porções de parede podem ser selecionadas, por exemplo, dependendo da taxa de (e desse modo, área de superfície disponível para) permeação à água e das propriedades mecânicas necessárias, por exemplo, para proporcionar ao dispositivo os valores de flexibilidade/durômetro necessárias para inserção transuretral e retenção de bexiga e tolerância, conforme descrito por exemplo, na Publicação de Pedido de Patente no U.S. 2011/0152839 por Cima et al.
[0064] Conforme mostrado na Figura 18, o dispositivo de entrega de fármaco 1800 pode incluir uma região de revestimento impermeável à água 1809 ao longo de pelo menos uma porção do alojamento tubular 1808. Ou seja, uma porção de parede impermeável à água pode ser formada revestindo-se o alojamento com um material impermeável à água. Por exemplo, tabletes osmóticos 1810 e tabletes de fármaco 1802 podem ser contidos no reservatório 1804, que é ligado por uma extremidade vedada 1813 e um plugue de orifício de liberação 1806. Mediante a inserção no paciente, água permeia no reservatório 1804 através de alojamento permeável à água 1808 (mas não através de região impermeável à água 1809), em que a mesma entra em contato e solubiliza as cargas de agente funcional e tablete de fármaco no mesmo. A região impermeável à água permite a solubilização controlada e liberação do fármaco. Em particular, um revestimento de alojamento pode ser útil para dispositivos de liberação osmótica em que o alojamento material é permeável ao fármaco.
[0065] Por exemplo, uma região de revestimento impermeável à água pode se estender ao longo de 4 cm a 11 cm do comprimento de alojamento, tal como 6,5 cm ao longo do comprimento de alojamento. Em determinadas modalidades, um alojamento tubular tem um diâmetro interno de 2,64 mm, e contém 6 a 11 cm de tabletes de agente funcional e 2 a 4,5 cm de tabletes de fármaco, enquanto tem uma região de revestimento impermeável que se estende de 4 cm a 11 cm do comprimento de alojamento. Por exemplo, um revestimento de parileno impermeável à água pode ser fornecido em um silicone ou outro alojamento.
[0066] Conforme mencionado acima, a parede do dispositivo alojamento pode ter uma ou mais passagens através de sua superfície, fornecendo um caminho para fluxo de água no reservatório e/ou fluxo de fármaco do mesmo. Em algumas modalidades, a parede pode ser porosa, significando que a parede pode ter um ou mais poros de passagem formada na mesma. Em outras modalidades, a parede pode estar na forma de uma ranhura definida formada completamente através da parede, tal como por perfuração, punção ou moldagem. A ranhura pode ter um formato circular ou outro formato. A ranhura pode ter uma parede lateral reta ou parede lateral afunilada que se estende através da parede.
[0067] Em algumas modalidades, a parede é feita de um material polimérico elástico biocompatível. O material pode ser não reabsorvível ou reabsorvível. Materiais não reabsorvíveis exemplificadores incluem polímeros sintéticos selecionados dentre poli(éteres), poli(acrilatos), poli(metacrilatos), poli(vinil pirolidonas), acetatos de (poli)vinila, poli(uretanos), celuloses, acetatos de celulose, poli(siloxanos), poli(etileno), poli(tetrafluoroetileno) e outro polímeros fluorados, e poli(siloxanos). Materiais reabsorvíveis exemplificadores, especialmente polímeros biodegradáveis ou bioerodíveis, incluem polímeros sintéticos selecionados dentre poli(amidas), poli(ésteres), amidas de (poli)éster, poli(anidros), poli(ortoésteres), polifosfazenos, pseudo poli(aminoácidos), sebacato de poli(glicerol), ácidos (poli)lácticos, ácidos (poli)lglicólicos, ácidos (poli)lático-co-glicólicos, poli(caprolactonas), poli(caprolactona) derivados de (PC), amidos de (poli)éster à base de amino álcool (PEA) e citrato de (poli)octano-diol (POC), e outros elastômeros biorreabsorvíveis curáveis. Polímeros à base de PC podem exigir agentes de reticulação adicionais tais como diisocianato de lisina ou 2,2-bis(e- caprolactona-4-il)propano para obter propriedades elastoméricas. Copolímeros, misturas, e combinações dos materiais acima também podem ser empregados.
[0068] Em determinadas modalidades, o alojamento pode ser formado de um material que é tanto permeável à água quanto flexível. Silicone é um material polimérico exemplificador que é flexível e pode atuar como uma membrana permeável à água quando formada como uma parede fina, com a permeabilidade determinada pelo menos em parte pela espessura de parede. Por exemplo, uma parede fina de silicone pode ter uma espessura na faixa de cerca de 100 μm a cerca de 1000 μm, embora outra espessura de parede possa ser usada. Além disso, uma parede fina de silicone pode ser permeável a alguns fármacos, dependendo, por exemplo, da porosidade da parede, do tamanho da molécula de fármaco, seu peso molecular, ou sua carga.
[0069] O tamanho do alojamento, que inclui a espessura da parede, pode ser selecionado com base no volume de formulações de fármaco e agente funcional a ser contido, a taxa desejada de entrega do fármaco do tubo, o lugar destinado de implantação do dispositivo dentro do corpo, a integridade mecânica desejada para o dispositivo, a taxa de liberação desejada ou permeabilidade à água e urina, o tempo de indução desejado antes do começo da liberação inicial, e o método desejado ou rota de inserção no corpo, dentre outros. A espessura de parede de tubo pode ser determinada com base nas propriedades mecânicas e permeabilidade à água do material de tubo, á medida que uma parede de tubo que é muito fina pode não ter integridade mecânica suficiente enquanto uma parede de tubo que é muito espessa pode experimentar um tempo de indução indesejavelmente longo para liberação de fármaco inicial do dispositivo e/ou pode não ter flexibilidade suficiente para permitir a entrega através de uma uretra ou outro lúmen de corpo estreito.
[0070] Por exemplo, o alojamento pode ser um tubo anular alongado que tem um diâmetro interno de cerca de 2 mm a cerca de 5 mm. A primeira e a segunda unidades podem ser tabletes sólidos que tem um diâmetro substancialmente igual ao diâmetro interno do tubo anular alongado. Um ou mais dentre os tabletes de primeira unidade podem preencher um comprimento de cerca de 1 cm a cerca de 3 cm do lúmen do tubo, e um ou mais dentre os tabletes de segunda unidade podem preencher um comprimento de cerca de 10 cm a cerca de 15 cm do lúmen do tubo. Em uma modalidade, a razão de volume da(s) primeira(s) unidade(s) para o volume da(s) segunda(s) unidade(s) é de cerca de 0,05 a cerca de 0,5. Outros comprimentos e razões das cargas de tablete são previstos.
[0071] Por exemplo, o alojamento pode ser um tubo anular alongado que tem a espessura de parede de 0,1 a 0,4 mm, tal como a espessura de parede de 0,2 mm. o alojamento material pode ser selecionado de modo que o alojamento tenha um durômetro de 25A a 80A, tal como 25A, 50A, 65A, 70A ou 80A.
[0072] Em determinadas modalidades, o dispositivo é elasticamente deformável entre um formato relativamente esticado adequado para inserção através da uretra de um paciente e na bexiga do paciente e um formato de retenção adequado para reter o dispositivo dentro da bexiga. Por exemplo, o dispositivo pode incluir um lúmen de armação de retenção que tem uma armação de retenção posicionada no mesmo. A armação de retenção pode ser feita de uma liga superelástica ou outro fio elástico, conforme descrito na Publicação de Pedido de Patente no U.S. 2010/0331770 por Lee et al, que é incorporado ao presente documento a título de referência.
[0073] Uma modalidade exemplificativa é mostrada na Figura 5, em que o dispositivo 500 inclui um alojamento 508 que aloja a primeira e a segunda unidades 502, 510, e uma armação de retenção 512. O alojamento de fármaco 508 é axialmente alinhado com a armação de retenção 512, e é formado de um material flexível, o que permite mover o dispositivo 500 entre o formato de retenção mostrado na Figura 5, e um formato de instalação esticada, tal como mostrado na Figura 3. O "formato de retenção" geralmente indica qualquer formato adequado para reter o dispositivo no local de implantação destinado, incluindo, porém, sem limitação, o formato similar a pretzel mostrado na Figura 5 que é adequado para reter o dispositivo na bexiga, enquanto o "formato de instalação" geralmente indica qualquer formato adequado para instalar o dispositivo de entrega de fármaco no corpo, que inclui o formato linear ou alongado mostrado na Figura 3 que é adequado para instalar o dispositivo através de um canal de trabalho de um instrumento instalável posicionado na uretra ou outro lúmen natural. Em uma modalidade, o dispositivo é configurado para assumir espontaneamente um formato que tem um par interconectado e sobreposto de bobinas, na ausência de uma carga compressiva, tal como causado sendo forcado em um formato de instalação e/ou através de um instrumento instalável.
[0074] Em determinadas modalidades, conforme mostrado na Figura 16, o reservatório 1604 do dispositivo 1600 inclui um canal modulador de fluxo 1642 posicionado entre a primeira e a segunda unidades 1602, 1610. Por exemplo, o canal modulador de fluxo pode ser uma passagem que tem um diâmetro menor do que o diâmetro do reservatório. O canal modulador de fluxo pode servir para limitar o fluxo entre canais (isto é, seções de reservatório), e desse modo retardar a liberação de fármaco do alojamento limitando-se a capacidade do agente funcional para entrar em contato com o fármaco. Em determinadas modalidades, o dispositivo pode incluir mais do que um canal modulador de fluxo para controle adicional da taxa de liberação de fármaco do dispositivo.
[0075] Em determinadas modalidades, um dispositivo de entrega de fármaco inclui uma primeira porção de alojamento carregada com uma formulação de fármaco, e uma segunda porção de alojamento carregada com um excipiente, e é configurado para liberar o fármaco de acordo com um primeiro perfil de liberação e é configurada para liberar o excipiente de acordo com um segundo perfil de liberação que difere do primeiro perfil de liberação. As porções de alojamento podem alcançar taxas de liberação diferentes tendo diferentes configurações, alojando-se diferentes formulações, ou empregando-se diferentes mecanismos de liberação, dentre outros ou combinações das mesmas. As porções de alojamento podem ser combinadas para alcançar um perfil de liberação de fármaco desejado. Por exemplo, o excipiente pode ser um agente funcional configurado para facilitar a liberação e/ou entrega do fármaco, tal como um agente de solubilização de fármaco, um fármaco agente de estabilização, ou um agente de intensificação de permeação. A formulação de fármaco e/ou o excipiente pode estar na forma de um ou mais tabletes.
[0076] Por exemplo, o dispositivo pode incluir porções de alojamento que exibem diferentes tempos de indução ou atraso antes do começo da liberação inicial, que liberam o fármaco e o excipiente em diferentes taxas ou de acordo com diferentes curvas de liberação após o começo da liberação, ou que liberam o fármaco e o excipiente por diferentes períodos antes que as cargas sejam substancialmente esgotadas, dentre outros ou combinações dos mesmos. As porções de alojamento díspares podem ser combinadas para alcançar um perfil de liberação desejado do dispositivo de entrega de fármaco como um todo, tal como um perfil de liberação que demonstra um tempo de atraso inicial relativamente curto e então demonstra liberação continuada em uma taxa relativamente constante durante um período estendido.
[0077] Por exemplo, o fármaco e o excipiente podem ser liberados por bombeamento osmótico ou difusão, conforme descrito acima, ou alguma combinação dos mesmos. Em determinadas modalidades, o fármaco é liberado da primeira porção de alojamento, através de uma ranhura na primeira porção de alojamento, principalmente por meio de pressão osmótica, e o excipiente é liberado da segunda porção de alojamento por difusão. Em outra modalidade, o fármaco é liberado da primeira porção de alojamento por difusão através de uma parede permeável a fármaco na primeira porção de alojamento, e o excipiente é liberado da segunda porção de alojamento, através de uma ranhura na segunda porção de alojamento, principalmente por meio de pressão osmótica.
[0078] Em modalidades particulares, o dispositivo de entrega de fármaco inclui pelo menos duas porções de alojamento distintas ou segregadas associadas a uma única porção de retenção. As porções de alojamento podem ser alojamentos de reservatórios separados, cada um associado à porção de retenção, ou as porções de alojamento podem ser áreas separadas dentro de um único alojamento que é associado à porção de retenção. A Figura 7 ilustra porções de alojamento exemplificadoras com alojamentos de reservatórios separados nos Exemplos A a C. A Figura 7 também ilustra porções de alojamento exemplificadoras que são áreas segregadas dentro de um único alojamento nos Exemplos D a F. A Figura 7 também ilustra porções de alojamento nos Exemplos G a I que poderia ter quaisquer configurações dependendo de materiais e construção.
[0079] A Figura 8 é uma vista plana de outra modalidade de um dispositivo de entrega de fármaco 800 que tem um alojamento que é dividido em múltiplas porções de alojamento segregadas. Três porções de alojamento 802, 804, e 806 são mostradas, embora qualquer número possa ser usado. Cada porção de alojamento é definida por uma porção da parede do alojamento e pelo menos uma estrutura de partição 808, que separa a porção de alojamento de uma porção de alojamento adjacente. A estrutura de partição 808 pode ser um plugue inserido no alojamento, tal como um cilindro, esfera, ou disco, dentre outros, que é preso no lugar devido a seu tamanho ou com um adesivo. A estrutura de partição 808 também pode ser uma porção do alojamento formada diretamente na mesma, tal como por moldagem. Por exemplo, as tramas mostradas nos Exemplos D a E da Figura 7 são estruturas de partição que segregam porções de alojamento ao longo do comprimento do dispositivo.
[0080] Um dispositivo com pelo menos duas porções de alojamento distintas pode ser adequado para liberação controlada de pelo menos uma carga de fármaco e pelo menos uma carga de excipiente ou agente funcional de um número correspondente de reservatórios. As duas porções distintas podem ter as mesmas configurações ou configurações diferentes, tal como ou qualquer combinação das configurações descritas acima em referência às Figuras 1 a 6. Configurações de dispositivos de entrega de fármaco que têm duas porções de fármaco distintas são adicionalmente descritas na Publicação de Pedido no U.S. 201 1/0060309 por Lee et al.
[0081] II. USO E APLICAÇÕES DE DISPOSITIVOS DE ENTREGA DE FÁRMACO IMPLANTÁVEIS
[0082] Os dispositivos de entrega de fármaco implantáveis descritos no presente documento podem ser usados em uma variedade de aplicações médicas, particularmente tratamentos terapêuticos e profiláticos para pacientes. Em determinadas modalidades, o dispositivo é configurado para entregar um fármaco tal como lidocaína, gemcitabina, docetaxel, carboplatina, cisplatina, oxaliplatina, tróspio, tolterodina ou mitomicina C.
[0083] Em algumas modalidades, os dispositivos fornecem alívio de dor ao paciente. Uma variedade de agentes anestésicos, agentes analgésicos, e combinações dos mesmos pode ser usada. Em modalidades, o dispositivo entrega um ou mais agentes anestésicos locais. O agente anestésico local pode ser um análogo de cocaína. Em modalidades particulares, o agente anestésico local é um aminoamida, um aminoéster ou combinações dos mesmos.
[0084] Exemplos representativos de aminoamidas ou anestésicos de classe de amida incluem articaína, bupivacaína, carticaína, cinchocaína, etidocaína, levobupivacaína, lidocaína, mepivacaína, prilocaína, ropivacaína e trimecaína. Exemplos representativos de aminoésteres ou anestésicos de classe de éster incluem amilocaína, benzocaína, butacaína, cloroprocaína, cocaína, ciclometicaína, dimetocaína, hexilcaína, larocaína, meprilcaína, metabutoxicaína, ortocaína, piperocaína, procaína, proparacaína, propoxicaína, proximetacaína, risocaína e tetracaína. Esses anestésicos locais tipicamente são bases fracas e podem ser formuladas como um sal, tal como um sal de cloridrato, para torna-los solúveis em água, embora os anestésicos também possam ser usados em base livre ou forma de hidrato. Outros anestésicos, tais como lontocaína, também podem ser usados. O fármaco também pode ser um composto de antimuscarínico que exibe um efeito anestésico, tal como oxibutinina ou propiverina. O fármaco também pode incluir outros fármacos descritos no presente documento, por si só ou em combinação com um agente anestésico local.
[0085] Em determinadas modalidades, o analgésico inclui um opioide. Exemplos representativos de agonistas de opioide incluem alfentanila, alilprodina, alfaprodina, anileridina, benzilmorfina, bezitramida, buprenorfina, butorfanol, clonitazeno, codeína, desomorfina, dextromoramida, dezocina, diampromida, diamorfona, diidrocodeína, diidromorfina, dimenoxadol, dimefeptanol, dimetiltiambuteno, butirato de dioxafetila, dipipanona, eptazocina, etoheptazina, etilmetiltiambuteno, etilmorfina, etonitazeno fentanila, heroína, hidrocodona, hidromorfona, hidroxipetidina, isometadona, cetobemidona, levorfanol, levophenacilmorfano, lofentanila, meperidina, meptazinol, metazocina, methadona, metopona, morfina, mirofina, nalbufina, narceína, nicomorfina, norlevorfanol, normetadona, nalorfina, normorfina, norpipanona, ópio, óxicodona, óximorfona, papavereto, pentazocina, fenadoxona, fenomorfano, fenazocina, fenoperidina, piminodina, piritramida, proeptazina, promedol, properidina, propiram, propoxifeno, sufentanila, tilidina, tramadol, sais farmaceuticamente aceitáveis dos mesmos, e misturas dos mesmos. Outros fármacos de opioide, tal como mu, kappa, delta, e opioide de nocicepção agonistas receptores, são contemplados.
[0086] Exemplos representativos de outros agentes aliviadores de dor adequados incluem tais agentes como álcool de salicila, fenazopiridina cloridrato de fenazopiridina, acetaminofeno, ácido acetilsalicílico, flufenisal, ibuprofeno, indoprofeno, indometacina e naproxeno.
[0087] Em modalidades, o dispositivo de entrega de fármaco é usado para tratar afecções inflamatórias tal como cistite intersticial, cistite química, cistite de radiação, cistite de hemorrágica induzida por radiação e quimioterapia, cistite de cetamina (ou síndrome de bexiga de cetamina), síndrome de bexiga dolorosa, prostatite, uretrite, dores pós cirúrgicas, e pedras nos rins. Exemplos não limitadores de fármacos específicos para essas afecções incluem lidocaína, agentes imunossupressivos (por exemplo, tacrolimo monoidratado, tacrolimo monoidratado lipossomal), glicosaminoglicanos (por exemplo, sulfato de condroitina, sulodexida), sódio de polissulfato de pentosano (PPS), sulfóxido de dimetila (DMSO), oxibutinina, mitomicina C, heparina, flavoxato, cetorolaco ou uma combinação dos mesmos. Para pedras nos rins, o(s) fármaco(s) pode(m) ser selecionados para tratar dor e/ou promover dissolução na pedra.
[0088] Em algumas modalidades, o dispositivo de entrega de fármaco é usado em associação com a colocação de um stent ureteral, tal como para tratar dor, urgência urinária ou frequência urinária resultante da colocação de stent ureteral. Exemplos não limitadores de fármacos específicos para tal tratamento incluem antimuscarínicos, α-bloqueadores, narcóticos, e fenazopiridina, dentre outros.
[0089] O dispositivo de entrega de fármaco pode ser usado, por exemplo, para tratar incontinência urinária, frequência, ou urgência, incluindo incontinência de estímulo e incontinência neurogênica, assim como trigonite. Fármacos que podem ser usados incluem agentes anticolinérgicos, agentes antispasmódicos, agentes antimuscarínicos, β-2 agonistas, alfa adrenérgicos, anticonvulsivos, inibidores de captação de norepinefrina, inibidores de captação de serotonina, bloqueadores de canal de cálcio, abridores de canal de potássio, e relaxantes musculares. Exemplos representativos de fármacos adequados para o tratamento de incontinência incluem oxibutinina, S-oxibutitina, emeprônio, verapamil, imipramina, flavoxato, atropina, propantelina, tolterodina, rociverina clenbuterol, darifenacina terodilina tróspio, hyoscimina propiverina, desmopressina vamicamida, brometo clidínio, dicilominaHC1, aminoálcool de glicopirolato éster, brometo de ipratrópio, brometo de mepenzolato, brometo de methscopolamina, hidrobromida de escopolamina, brometo de iotrópio, fumarato de fesoterodina, YM-46303 (Yamanouchi Co., Japão), lanperisona(Nippon Kayaku Co., Japão), inaperisona NS-21 (Nippon Shinyaku Orion, Formenti, Japão/Itália), NC-1800 (Nippon Chemiphar Co., Japão), ZD-6169 (Zeneca Co., Reino Unido), e iodeto de estilônio.
[0090] Em outras modalidades, o dispositivo de entrega de fármaco é usado para tratar câncer de trato urinário, tal como câncer de bexiga ou câncer de próstata. Fármacos que podem ser usados incluem agentes antiproliferativos, agentes citotóxicos, agentes químioterapêuticos ou uma combinação dos mesmos. Exemplos representativos de fármacos que podem ser adequados para o tratamento de câncer de trato urinário incluem vacina Bacillus Calmette-Guérin (BCG), docetaxel, oxaliplatina, carboplatina, cisplatina, doxorubicina, valrubicina, gemcitabina, complexo de DNA de parede celular micobacteriano (MCC), metotrexato, vinblastina, tiotepa, mitomicina, fluorouracila, leuprolide, dietilstilbestrol, estramustina, acetato de megestrol, cyproterona, flutamida, moduladores de receptor de estrogênio seletivo (isto é, um SERM, tal como tamoxifeno), toxinas de botulinum, inibidores de deacetilase de histona (por exemplo, ácido de hidroxâmico de suberoilanilida) e ciclofosfamida. O fármaco pode ser um biológico, e pode incluir um anticporpo monoclonal, um inibidor de TNF, um antileucina ou similares. O fármaco também pode ser um imunomodulator, tal como um agonista de TLR, incluindo imiquimode ou outro agonista de TLR7. O fármaco também pode ser um inibidor de quinase, tal como um inibidor de quinase de tirosina seletiva de (FGFR3) de receptor-3 de fator de crescimento de fibroblasto, um inibidor de fosfatidilinositol 3 quinase (PI3K), ou um inibidor de proteína quinase ativada por mitogênio (MAPK), dentre outros ou combinações dos mesmos. O tratamento de fármaco pode ser acoplado com uma radiação convencional ou terapia cirúrgica almejada ao tecido cancerígeno.
[0091] Em ainda outras modalidades, o dispositivo é usado para tratar infecções que envolvem a bexiga, a próstata, e a uretra. Antibióticos, agentes antibacterianos, antifúngicos, antiprotozoários, antissépticos, antivirais e outros anti-infecciosos podem ser administrados para tratamento de tais infecções. Exemplos representativos de fármacos para o tratamento de infecções incluem mitomicina, ciprofloxacina, norfloxacina, ofloxacina, metanamina, nitrofurantoina, ampicillina, amoxicillina, nafcillina, trimetoprima, sulfonamidas trimetoprimsulfametoxazol, eritromicina, doxiciclina, metronidazol, tetraciclina, canamicina, penicilinas, cefalosporinas e aminoglicosidas.
[0092] Em outras modalidades, o dispositivo é usado para tratar fibrose de um lugar geniturinário, tal como a bexiga ou útero. Exemplos representativos de fármacos for o tratamento de fibroides incluem pentoxfillina (análogo de xantina), antiTNF, agentes antiTGF, análogos de GnRH, progestinas exógenas, antiprogestinas, moduladores de receptor de estrogênio seletivo, danazol e NSAIDs.
[0093] O dispositivo de entrega de fármaco também pode ser usado para tratar bexiga neurogênica. Exemplos representativos de fármacos para o tratamento de bexiga neurogênica incluem analgésicos ou anestésicos, tal como lidocaína, bupivacaína, mepivacaína, prilocaína, articaína, e ropivacaína; anticolinérgicos; antimuscarínicos tal como oxibutinina ou propiverina; um vaniloide, tal como capsaicina ou resiniferatoxina; antimuscarínicos tais como aqueles que atuam no receptor de acetilcolina de M3 muscarínico (mAChRs); antiespasmódicos incluindo agonistas GABAB, tais como baclofeno; toxinas de botulinum; capsaicinas; antagonistas de alfa-adrenérgicas; anticonvulsivos; inibidores de recaptação de serotonina tais como amitriptilina; e antagonistas de fator de crescimento de nervo. Em várias modalidades, o fármaco pode ser aquele que atua em aferentes de bexiga ou aquele que atua na transmissão de colinérgico aferente, conforme descrito em Reitz et al, Spinal Cord 42:267-72 (2004).
[0094] Os fármacos para o tratamento de bexiga neurogênica podem ser categorizados em um dentre dois tipos gerais: aqueles para tratar bexiga neurogênica convulsiva e aqueles para tratar bexiga neurogênica flácida. Em modalidades, o fármaco é selecionado dentre aqueles conhecidos para o tratamento de incontinência devido à superatividade de detrusor neurológico e/ou detrusor de baixa conformidade. Exemplos incluem fármacos relaxantes de bexiga (por exemplo, oxibutinina (agente antimuscarínico com um atividade pronunciada de relaxante muscular e atividade anestésica local), propiverina, impratrópio, tiotrópio, tróspio, terodilina, tolterodina, propantelina, oxifenciclimina, flavoxato, e antidepressivos tricíclicos; fármacos para bloquear nervos que enervam a bexiga e uretra (por exemplo, vaniloides (capsaicina, resiniferatoxina), toxina de botulinum A); ou fármacos que modulam a força de contração de detrusor, reflexo de micção, dissinergia de esfíncter de detrusor (por exemplo, agonistas de GABAb (baclofeno), benzodiazapinas). Em outras modalidades, o fármaco é selecionado dentre aqueles conhecidos para o tratamento de incontinência devido à deficiência de esfíncter neurológico. Exemplos incluem agonistas alfa-adrenérgicos, estrogênios, agonistas beta-adrenérgicos, antidepressivos tricíclicos (imipramina, amitriptilina). Em ainda outras modalidades, o fármaco é selecionado dentre aqueles conhecidos por facilitar esvaziamento de bexiga (por exemplo, antagonistas alfa-adrenérgicos (fentolamina) ou colinérgicos). Em ainda outras modalidades, o fármaco é selecionado dentre fármacos anticolinérgicos (por exemplo, diciclomina), bloqueadores de canal de cálcio (por exemplo, verapamil) alcaloides de tropano (por exemplo, atropina, escopolamina), nociceptina/orfanina FQ, e betanecol (por exemplo, agonista de m3 muscarínico, éster de colina).
[0095] Em determinadas modalidades, agentes funcionais ou excipientes incluem agentes osmóticos, agentes de solubilização de fármaco, agentes de estabilização de fármaco, agentes de intensificação de permeação ou combinações dos mesmos. Em particular, os agentes funcionais ou excipientes podem ser adequados para facilitar a liberação in vivo ou entrega do fármaco ao lugar de implantação. Por exemplo, o fármaco pode ser um fármaco de baixa solubilidade e o agente funcional pode ser um agente osmótico, tal como ureia. Mediante solubilização, o agente osmótico pode facilitar a liberação do fármaco do alojamento por fluxo de fluido induzido por pressão osmótica. Outros exemplos de agentes funcionais e excipientes que podem ser usados incluem ciclodextrinas, glicerol, polietileno glicol, citratos, acetatos, fosfatos, ácido ascórbico, e sulfeto de sódio.
[0096] Em modalidades, a(s) primeira(s) unidade(s) contém uma alta porcentagem em peso de fármaco, e a(s) segunda(s) unidade(s) contém uma alta porcentagem em peso de agente funcional ou excipiente. Por exemplo, a primeira unidade pode conter pelo menos 50 por cento em peso fármaco, pelo menos 60 por cento em peso fármaco, pelo menos 75 por cento em peso fármaco, de cerca de 60 a cerca de 99 por cento em peso fármaco, ou de cerca de 75 a cerca de 95 por cento em peso fármaco. A segunda unidade pode conter pelo menos 80 por cento em peso de agente funcional, pelo menos 85 por cento em peso de agente funcional, pelo menos 90 por cento em peso de agente funcional, de cerca de 80 a cerca de 99 por cento em peso de agente funcional, ou de cerca de 85 a cerca de 95 por cento em peso de agente funcional. O restante das unidades pode incluir excipientes tal como lubrificantes farmacêuticos, agentes estabilizantes, ou agentes de ligação, por exemplo, lubrificantes com base em óleo, PEG ou PVP. Os excipientes também podem incluir um agente de atraso de liberação. Por exemplo, um agente de atraso de liberação poderia ser fornecido em uma porção das unidades de fármaco, em uma porção das unidades de agente funcional, ou em ambas para controle adicional de liberação do fármaco.
[0097] Em uma modalidade particular, a primeira unidade contém pelo menos 75 por cento em peso de gemcitabina HC1 e a segunda unidade contém pelo menos 85 por cento em peso de ureia. Por exemplo, a primeira unidade pode conter cerca de 80 por cento em peso de gemcitabina HC1, e a segunda unidade pode conter cerca de 90 por cento em peso de ureia.
[0098] Em uma modalidade, o alojamento é permeável à água, a primeira unidade inclui um primeiro tablete que contém um fármaco de baixa solubilidade, e a segunda unidade inclui um segundo tablete que contém um agente osmótico que facilita a liberação do fármaco do alojamento por pressão osmótica. Em uma modalidade, o fármaco é gemcitabina e o agente osmótico é ureia.
[0099] O dispositivo pode ser inserido em uma cavidade de corpo ou lúmen do paciente. Uma vez implantado, o dispositivo pode liberar um ou mais fármacos para o tratamento de uma ou mais afecções, tanto de modo localizado a um ou mais tecidos no lugar de instalação, regionalmente a outros tecidos distais do lugar de instalação ou ambos. A liberação pode ser controlada durante um período estendido. Em seguida, o dispositivo pode ser removido, reabsorvido, excretado ou uma combinação dos mesmos.
[0100] Em determinadas modalidades, o dispositivo é inserido em um paciente passando-se o dispositivo através de um instrumento instalável e liberando o dispositivo do instrumento instalável no corpo. O instrumento instalável pode ser qualquer dispositivo de lúmen adequado, tal como um cateter, um cateter uretral, um cistoscópio ou uma combinação dos mesmos, seja comercialmente disponível ou especialmente adaptado para instalar o presente dispositivo. Em modalidades particulares, o dispositivo é implantado na bexiga. O dispositivo é então retido na bexiga devido ao recurso de retenção, tal como assumindo-se um formato de retenção ou ancorando na bexiga.
[0101] O dispositivo pode ser instalado em um procedimento independente ou em conjunto com outro procedimento urológico ou outro procedimento ou cirurgia, tanto antes, durante, ou após o outro procedimento. O dispositivo pode liberar um ou mais fármacos que são entregues ao lugar e/ou tecidos regionais para terapia ou profilaxia, seja de modo peri-operativo, pós-operativo ou ambos.
[0102] Seguindo a instalação in vivo, o dispositivo libera o fármaco. Liberação pode ocorrer, conforme descrito acima, devido a um gradiente de pressão osmótica entre o interior e o exterior do dispositivo, sendo que o fármaco atravessa um ou mais orifícios ou poros de passagem no dispositivo sob a força de pressão osmótica. A liberação também pode ocorrer por difusão, na qual o fármaco atravessa um ou mais orifícios ou poros de passagem no dispositivo e/ou através de um fármaco- permeável parede do dispositivo, devido a um gradiente de concentração de fármaco entre o interior e o exterior do dispositivo. Combinações desses modos de liberação dentro de um único dispositivo são possíveis, e em algumas modalidades são preferenciais de modo a alcançar um perfil de liberação de fármaco geral não prontamente alcançável de qualquer modo individualmente.
[0103] Após a inserção do dispositivo no paciente, a água ou fluido corpóreo aquoso da implantação local pode entrar no dispositivo, tal como através de uma parede permeável a água ou uma passagem na parede do dispositivo, para solubilizar o agente funcional ou excipiente e o fármaco. Por exemplo, o agente funcional e fármaco pode ser solubilizado mediante o contato com urina em casos em que o dispositivo é implantado na bexiga. O agente funcional pode ser um agente de solubilização configurado para facilitar a solubilização do fármaco.
[0104] Em modalidades particulares, a liberação de pelo menos duas cargas úteis (isto é, uma carga útil de fármaco e uma carga útil de excipiente e/ou agente funcional ) pode ocorrer de acordo com perfis de liberação diferentes, o que inclui perfis que exibem diferentes começos iniciais de liberação, tal como liberação imediata ou retardada; perfis que exibem durações diferentes de liberação, tal como liberação rápida e estendida; e perfis que exibem taxas de liberação diferentes, tanto uma taxa de liberação de ordem zero ou de outro modo. A liberação contínua e estendida é, portanto, facilitada de acordo com um perfil desejado. Por exemplo, o dispositivo pode liberar uma carga útil de agente funcional relativamente rápido, e o dispositivo pode liberar uma carga útil de fármaco de forma mais contínua.
[0105] O dispositivo pode fornecer liberação estendida, contínua, intermitente ou periódica de uma quantidade desejada de fármaco por um período predeterminado, desejado. Em várias modalidades, o dispositivo pode entregar a dose desejada de fármaco durante um período estendido, tal como 12 horas, 24 horas, 5 dias, 7 dias, 10 dias, 14 dias, ou 20, 25, 30, 45, 60 ou 90 dias, ou mais. A taxa de entrega e dosagem do fármaco pode ser selecionada dependendo o fármaco que é entregue e a doença ou condição que é tratada. Em modalidades, o dispositivo é configurado para liberar uma quantidade terapeuticamente eficaz do fármaco durante um período de 1 dia a 30 dias, tal como de 2 dias a 30 dias, de 1 dia a 21 dias, de 1 dia a 14 dias, de 2 dias a 14 dias, ou de 5 dias a 7 dias, etc. Em certas modalidades, o fármaco é liberado do dispositivo em uma taxa de ordem zero durante um período de 1 dia a 30 dias, tal como de 2 dias a 14 dias, ou de 3 dias a 7 dias.
[0106] Subsequentemente, o dispositivo pode ser recuperado do corpo, tal como em casos em que o dispositivo é não reabsorvível ou precisa ser removido de outro modo. Os dispositivos de recuperação para esse propósito são conhecidos na técnica ou podem ser produzidos especificamente. O dispositivo também pode ser completamente ou parcialmente bioabsorvível, de modo que a recuperação é desnecessária, conforme tanto todo o dispositivo é reabsorvido ou o dispositivo degrada suficientemente para expulsão a partir da bexiga durante urinação, conforme descrito por exemplo, na Publicação de Pedido de Patente n° U.S. 2012/0089122 para Lee et al, que está incorporada no presente documento por referência. O dispositivo pode não ser recuperado ou reabsorvido até que algum do fármaco, ou preferencialmente a maior parte ou todo o fármaco, tenha sido liberado. Se necessário, um novo dispositivo carregado de fármaco pode subsequentemente ser implantado, durante o mesmo procedimento conforme a recuperação ou em um momento posterior.
[0107] Em uma modalidade, o dispositivo implantável, com uma carga útil de fármaco de peça única, é posicionado totalmente dentro da bexiga para fornecer entrega local, sustentada por pelo menos um fármaco localmente para uma bexiga em uma quantidade eficaz. Após o posicionamento in vivo do dispositivo, pelo menos uma porção da carga útil de fármaco é liberado do dispositivo substancialmente continuamente durante um período estendido, para o urotélio e possivelmente para tecidos próximos, em uma quantidade eficaz para fornecer tratamento ou aprimorar uma função de bexiga no paciente. Em uma modalidade preferencial, o dispositivo reside na bexiga que libera o fármaco por um período predeterminado, tal como duas semanas, três semanas, quatro semanas, um mês ou mais. Em tais casos, o dispositivo pode ser usado para tratar cistite intersticial, cistite química, cistite por radiação, cistite hemorrágica induzida por radiação e quimioterapia, cistite de cetamina (ou síndrome de bexiga de cetamina), dor pélvica, síndrome de bexiga hiperativa, câncer de bexiga, bexiga neurogênica, disfunção de esfíncter de bexiga neuropática ou não neuropática, infecção, dor pós-cirúrgica ou outras doenças, distúrbios, e condições tratados com fármacos entregues para uma bexiga. O dispositivo pode distribuir fármacos que aprimorem a função de bexiga, tal como capacidade de bexiga, conformidade, e/ou frequência de contrações desinibidas, que reduzem a dor e desconforto na bexiga ou em outras áreas próximas, ou que tiveram outros efeitos, ou combinações dos mesmos.
[0108] Em algumas modalidades, o dispositivo de entrega de fármaco é posicionado na bexiga de um paciente para entrega de fármaco regional a um ou mais lugares genitourinários próximos. O dispositivo pode liberar fármaco localmente para uma bexiga e regionalmente para outros locais próximos a uma bexiga. Um dispositivo posicionado em bexiga também pode entregar uma quantidade terapeuticamente eficaz de um ou mais fármacos para outros locais genitourinários dentro do corpo, tal como outras localizações dentro de sistemas urológicos ou reprodutivos do corpo, o que inclui um ou ambos os[ rins, a uretra, uma ou ambos os ureteres, o pênis, os testículos, uma ou ambas dentre as vesículas seminais, um ou ambos dentre os canais deferentes, um ou ambos dentre os dutos ejaculatórios, a próstata, a vagina, o útero, um ou ambos dentre os ovários, ou uma ou dentre as trompas de falópio, dentre outros ou combinações dos mesmos. Por exemplo, o dispositivo de entrega de fármaco intravesical pode ser usado no tratamento de pedras ou fibrose no rim, disfunção erétil, entre outras doenças, distúrbios e condições. Tal entrega pode fornecer uma alternativa para administração sistemática, que pode acarretar efeitos colaterais indesejáveis ou resultar em biodisponibilidade do fármaco.
[0109] A presente invenção pode ser adicionalmente compreendida com referência aos seguintes exemplos não limitativos: A menos que indicado de outro modo, todas as porcentagens são porcentagens de peso.
[0110] EXEMPLO 1: DISPOSITIVOS DE ÚNICA UNIDADE VERSUS DISPOSITIVOS DE MÚLTIPLAS UNIDADES
[0111] Os modelos de dispositivo de entrega de fármaco foram preparados com o uso de tubos de produção de silicone que tem um diâmetro interno de 2,64 mm.
[0112] Um dispositivo de única unidade foi preparado, de acordo com a modalidade de dispositivo mostrada na Figura 1. O tubo foi carregado com uma pluralidade de tabletes que contém 17,7 por cento de cloridrato gemcitabina (164 mg FBE), 73,6 por cento de ureia, 7,8 por cento de lubrificante farmacêutico à base óleo LUBRITAB® (disponível comercialmente junto à JRS PHARMA, Rosenberg, Alemanha), e 0,9 por cento de polivinilpirrolidona (PVP) K29-32 (disponível comercialmente como PLASDONE® da International Specialty Products, Nova Jersey). Os tabletes foram formados para ter um diâmetro substancialmente igual ao diâmetro interno do tubo, e foram carregados no tubo em uma disposição em série. Os tabletes preencheram um comprimento de 15,2 cm. O dispositivo incluiu um orifício de liberação do tipo espaçador com um comprimento de 5 mm.
[0113] Um dispositivo de múltiplas unidades também foi preparado, de acordo com a modalidade de dispositivo mostrada na Figura 2. O tubo foi carregado com uma pluralidade de tabletes de fármaco que contém 80,0 por cento de gemcitabina HCl, 13,3 por cento de ureia, 4,2 por cento PVP K29-32, e 2,5 por cento de poli(glicol etilênico) (PEG) 8000. Os tabletes de fármaco preencheram um comprimento de 2,8 cm e foram posicionados em série adjacentes a um orifício de liberação do tipo espaçador com um comprimento de 5 mm. O tubo também foi carregado com uma pluralidade de tabletes de agente funcional que contém 90,0 por cento de ureia e 10,0 por cento de Lubritab. Os tabletes de agente funcional preencheram um comprimento de 12,0 cm do tubo.
[0114] A formulação total do dispositivo de múltiplas unidades foi de 18,9 por cento de gemcitabina HCl, 71,8 por cento de ureia, 7,7 por cento de Lubritab, 1,0 de por cento PVP K29-32, e 0,6 por cento PEG 8000, que foi comparável à formulação total do dispositivo de única unidade. Em particular, o dispositivo de única unidade continha 164,0 mg de gemcitabina FBE, enquanto que o dispositivo de múltiplas unidades continha 163,8 mg de gemcitabina FBE.
[0115] Os perfis de liberação de fármaco in vitro foram medidos tanto para os dispositivos de única unidade e dispositivos de múltiplas unidades na água. As Figuras 9 e 10 mostram a porcentagem de liberação de fármaco e taxa de liberação (medidos em gemcitabina FBE mg por dia) versus tempo, respectivamente. De modo geral, o dispositivo de múltiplas unidades funcionou melhor do que o dispositivo de única unidade, liberando uma porcentagem maior do fármaco, e mantendo uma taxa mais alta de liberação do fármaco por um período mais longo. Conforme mostrado na Figura 9, o dispositivo de múltiplas unidades liberou mais que 90 por cento de sua carga útil de fármaco em um período de 7 dias, enquanto que o dispositivo de única unidade foi liberado menos do que 80 por cento de sua carga útil de fármaco no mesmo período. Conforme mostrado na Figura 10, o dispositivo de múltiplas unidades também tem um perfil de liberação "aplanador", no qual a taxa de liberação de fármaco estabilizou entre os dias 2 e 4. Um perfil plano é desejável para a liberação estendida do fármaco. Por exemplo, o dispositivo de múltiplas unidades funcionou muito melhor do que o dispositivo de única unidade em liberação estendida de fármaco, contínua por 5 a 7 dias.
[0116] EXEMPLO 2: ORIFÍCIOS DE LIBERAÇÃO DO TIPO PERFURADOS POR LASER VERSUS ORIFÍCIOS DE LIBERAÇÃO DO TIPO ESPAÇADOR EM DISPOSITIVOS DE MÚLTIPLAS UNIDADES
[0117] Um dispositivo de múltiplas unidades que tem um orifício de liberação do tipo espaçador foi preparado, de acordo com a modalidade de dispositivo mostrada na Figura 2. O orifício de liberação tinha um comprimento de 5 mm e um diâmetro interno de 0,3 mm. O orifício espaçador estava localizado em uma extremidade do tubo.
[0118] Um dispositivo de múltiplas unidades que tem um orifício de liberação perfurado a laser foi preparado, de acordo com a modalidade de dispositivo mostrada na Figura 3. O orifício de liberação tinha um diâmetro interno de 0,150 mm e estava localizado na parede de alojamento do dispositivo.
[0119] Cada tubo foi preenchido com uma pluralidade de tabletes de fármaco e uma pluralidade de tabletes de agente funcional. Os tabletes de agente funcional continham 90,0 por cento de ureia e 10,0 por cento de Lubritab, e preencheram um comprimento de tubo de 6,0 cm. Os tabletes de fármaco continham 80,0 por cento de gemcitabina HC1, 13,3 por cento de ureia, 4,2 por cento PVP K29-32, e 2,5 por cento de poli(glicol etilênico) (PEG) 8000, e preencheram um comprimento de tubo de 2,5 cm. O dispositivo perfurado por laser continha 141,6 de gemcitabina FBE mg, e o dispositivo de orifício espaçador continha 140,5 de gemcitabina FBE mg).
[0120] Conforme mostrado na Figura 3, no dispositivo de orifício perfurado por laser 300,3 cm de tabletes de agente funcional 310 foram localizados em cada lado de 2,5 cm de tabletes de fármaco 302, de modo que os tabletes de fármaco 302 estavam centralizados próximo ao orifício perfurado por laser 306. Conforme mostrado na Figura 2, no dispositivo de orifício espaçador 200, 2,5 cm dos tabletes de fármaco 202 estavam localizados adjacentes ao orifício espaçador 206, e 6,0 cm dos tabletes de agente funcional 210 estavam localizados adjacentes aos tabletes de fármaco 202.
[0121] Os perfis de liberação de fármaco in vitro foram medidos tanto para o orifício perfurado por laser quanto para os dispositivos de orifício espaçador na água. As Figuras 11 e 12 mostram a porcentagem de liberação de fármaco e taxa de liberação (medidos em FBE gemcitabina mg por dia) versus tempo, respectivamente. De modo geral, ambos os dispositivos exibiram perfis de liberação similares, liberando mais de cerca de 70 por cento da carga útil de fármaco por 7 dias em uma taxa substancialmente de ordem zero. Os perfis de taxa de liberação dos dispositivos também são similares, com uma região de platô em cerca de 20 mg FBE/dia de liberação entre os dias 1 a 4.
[0122] EXEMPLO 3: DISPOSITIVOS DE MÚLTIPLAS UNIDADES DE FÁRMACO EM PÓ VERSUS DE FÁRMACO EM TABLETE
[0123] Um dispositivo de múltiplas unidades que tem tabletes de fármaco e tabletes de agente funcional foi preparado, de acordo com a modalidade de dispositivo mostrada na Figura 2. Os tabletes de agente funcional continham 90,0 por cento de ureia e 10,0 por cento de Lubritab e preencheram um comprimento de tubo de 6,0 cm. Os tabletes de fármaco continham 80,0 por cento de gemcitabina HC1, 13,3 por cento de ureia, 4,2 por cento de PVP K29-32, e 2,5 por cento de poli(glicol etilênico) (PEG) 8000, e preencheram um comprimento de tubo de 1,5 cm. O dispositivo de fármaco em tablete continha 123,4 de gemcitabina FBE mg.
[0124] Um dispositivo de múltiplas unidades que tem tabletes de agente funcional e uma unidade de fármaco em pó foi preparado, de acordo com a modalidade de dispositivo mostrada na Figura 4. Os tabletes de agente funcional 410 continham 80 por cento de ureia e 20 por cento de Lubritab, e preenchiam um comprimento de tubo de 7,8 cm. A unidade de pó de fármaco 402 continha 80 por cento de gemcitabina HC1 e 20 por cento de pó de ureia, e preencheu um comprimento de tubo de 3,4 cm. O dispositivo de fármaco em pó continha 124,4 de gemcitabina FBE mg.
[0125] Cada dispositivo incluía um orifício de liberação do tipo espaçador que tem um diâmetro interno de 0,300 mm e um comprimento de 5,0 mm.
[0126] Os perfis de liberação de fármaco in vitro foram medidos tanto para o orifício perfurado por laser quanto para os dispositivos de orifício espaçador na água. As Figuras 13 e 14 mostram a porcentagem de liberação de fármaco e taxa de liberação (medidos em FBE gemcitabina mg por dia) versus tempo, respectivamente. De modo geral, ambos os dispositivos exibiram perfis de liberação similares, liberando mais de cerca de 85 por cento da carga útil de fármaco por 7 dias em uma taxa substancialmente de ordem zero. Os perfis de taxa de liberação dos dispositivos também são similares, com uma região de platô acima de 20 mg FBE/dia de liberação entre os dias 1 a 4.
[0127] Conforme pode ser visto a partir dos Exemplos acima, os dispositivos de entrega de fármaco de múltiplas unidades fornecem aprimoramentos tanto para os perfis de liberação de curto prazo quanto de longo prazo em comparação aos dispositivos de única unidade comparáveis. Esses dispositivos permitem vantajosamente liberação de fármaco estendida controlada, por exemplo, liberação de ordem zero durante 5 a 7 dias. Ademais, esses dispositivos fornecem um meio para entrega fármacos de baixa solubilidade aos pacientes por meio de dispositivos de liberação osmótica. Isso é especialmente útil para fármacos que são difíceis de reformular em formas mais altamente solúveis. Desse modo, esses dispositivos têm capacidade de entregar uma variedade de fármacos por meio de vários mecanismos de liberação e perfis de cinética de liberação, e fornecem controle intensificado de liberação de fármaco in vivo, por exemplo, de um dispositivo instalado na bexiga.
[0128] EXEMPLO 4: EFEITO DE ESPESSURA DE PAREDE E DURÔMETRO DE ALOJAMENTO DE TUBO DE SILICONE EM LIBERAÇÃO DE FÁRMACO DO DISPOSITIVO
[0129] Um dispositivo de múltiplas unidades que tem tabletes de fármaco e tabletes de agente funcional foi preparado, de acordo com a modalidade de dispositivo mostrada na Figura 17. Os tabletes de agente funcional foram tabletes osmóticos. A massa e comprimento de tablete osmótico foram de aproximadamente 400 mg e 6 cm, respectivamente, e a massa e comprimento de tablete de fármaco foram de aproximadamente 150 mg e 2 cm, respectivamente. A formulação de tablete de fármaco (gemcitabina) foi de 85,5 por cento de gemcitabina HC1, 5 por cento de ureia, 4,5 por cento de PVP K30, 2,5 por cento de neusilina, e 2,5 por cento de estearato de magnésio. A formulação de tablete osmótico foi de 90 por cento de ureia e 10 por cento de Lubritab. Todos os tabletes foram feitos pelo método de compactação direta de pó.
[0130] Quatro tipos diferentes de alojamentos tubulares de silicone extrudados foram usados nesse exemplo: 1) 2,64 mm de diâmetro interno, 0,13 mm de parede, durômetro de 65A Shore A (MED-4765, NuSil Technology LLC); 2) 2,64 mm de diâmetro interno, 0,1 mm de parede, durômetro 80A Shore A (MED-4780, NuSil Technology LLC); 3) 2,64 mm de diâmetro interno, 0,2 mm de parede, durômetro 50A Shore A (MED-4750, NuSil Technology LLC); e 4) 2,64 mm de diâmetro interno, 0,4 mm de parede, durômetro 25A Shore A (MED-4720, NuSil Technology LLC).
[0131] Em cada dispositivo, como na Figura 17, uma extremidade do tubo foi vedada por adesivo de silicone MED3-4213-1 (NuSil Technology LLC) e a outra extremidade incluiu um plugue de restrição feito de moldura de suporte de EVA (tubagem médica FBK), que compreende Elvax 760, copolímero de acetato de vinila de etileno (EVA). O EVA plugue tinha aproximadamente 2.74 mm de diâmetro externo e 5 mm de comprimento e um corte de 30 a 60 graus foi feito em uma extremidade do plugue. O espaço vazio criado pela superfície de corte e o tubo de silicone foi preenchido com adesivo de silicone, conforme mostrado na Figura 17, que serviu como um batente para evitar a desafixação do plugue quando pressão osmótica foi formada no tubo de silicone. A liberação In vitro foi realizada em água deionizada a 37°C e os resultados são mostrados na Figura 19. O tamanho de amostra para cada grupo foi de 2 e as barras de erro indicam desvio padrão (SD) ao redor do meio. Algumas barras de erro não são vistas se as mesmas forem menores do que os símbolos. Conforme usado na legenda, "O" se refere a tablete osmótico e "A" se refere ao ingrediente farmaceuticamente ativo, isto é, fármaco, tablete.
[0132] Em particular, a Figura 19 mostra a quantidade de fármaco liberado ao longo do tempo dos dispositivos que tem várias espessuras de parede e durômetro de alojamento. O desempenho de liberação de gemcitabina foi afetado pela espessura de parede e do durômetro do alojamento de tubo de silicone. Esses resultados indicam que o tamanho do alojamento, incluindo a espessura da parede e a dureza e flexibilidade do alojamento material, pode ser selecionada com base no volume de formulações de fármaco e agente funcional a ser contido assim como a taxa desejada de entrega do fármaco do tubo.
[0133] EXEMPLO 5: EFEITO DE ESPESSURA DE PAREDE E DURÔMETRO DE ALOJAMENTO DE TUBO DE SILICONE EM LIBERAÇÃO DE FÁRMACO DO DISPOSITIVO
[0134] Outro conjunto de experimentos foi realizado com o uso das configurações de dispositivo mostradas na Figura 17. Nesse exemplo, três diferentes alojamentos tubulares de silicone usados foram: 1) 2,64 mm de diâmetro interno, 0,2 mm de parede, durômetro 50A Shore A (MED-4750, NuSil Technology LLC); 2) 2,64 mm de diâmetro interno, 0,2 mm de parede, durômetro 70A Shore A (MED-4770, NuSil Technology LLC); e 3) 2,64 mm de diâmetro interno, 0,4 mm de parede, durômetro 25A Shore A (MED-4720, NuSil Technology LLC).
[0135] Os tabletes foram colocados próximos um ao outro no reservatório, como na Figura 17. A massa e comprimento de tablete osmótico foram de aproximadamente 700 mg e 11 cm, respectivamente, e a massa e comprimento de tablete de fármaco foram de aproximadamente 300 mg e 4,5 cm, respectivamente. A formulação de tablete de fármaco (gemcitabina) foi de 85,5 por cento de gemcitabina HC1, 5 por cento de ureia, 4,5 por cento de PVP K30, 2,5 por cento de neusilina, e 2,5 por cento de estearato de magnésio. A formulação de tablete osmótico foi de 90 por cento de ureia e 10 por cento de Lubritab. Todos os tabletes foram feitos pelo método de compactação direta de pó. A liberação In vitro foi realizada em água deionizada a 37°C e os resultados são mostrados na Figura 20. O tamanho de amostra para cada grupo foi 2, e as barras de erro indicam desvio padrão (SD) em torno do meio. Algumas barras de erro não são vistas se as mesmas forem menores do que os símbolos. Conforme usado na legenda, "O" se refere a tablete osmótico e "A" se refere ao ingrediente farmaceuticamente ativo, isto é, fármaco, tablete.
[0136] Em particular, a Figura 20 mostra a quantidade de fármaco liberado ao longo do tempo dos dispositivos que tem várias espessuras de parede e durômetro de alojamento. O desempenho de liberação de gemcitabina foi afetado pela espessura de parede e do durômetro do alojamento de tubo de silicone. Esses resultados indicam que o tamanho do alojamento, que inclui a espessura da parede, o comprimento, e a dureza e flexibilidade do alojamento material, pode ser selecionada com base no volume de formulações de fármaco e agente funcional a ser contido assim como a taxa desejada de entrega do fármaco do tubo.
[0137] EXEMPLO 6: EFEITO DE COMPRIMENTO DE REGIÃO DE REVESTIMENTO IMPERMEÁVEL DE ALOJAMENTO DE TUBO DE SILICONE NA LIBERAÇÃO DE FÁRMACO DE DISPOSITIVO
[0138] Um dispositivo de múltiplas unidades que tem tabletes de fármaco e tabletes de agente funcional foi preparado, de acordo com a modalidade de dispositivo mostrada na Figura 18. Diferente das configurações anteriores, parileno C (um revestimento impermeável à água) foi parcialmente revestido no tubo extrudado de silicone que tem um diâmetro interno de 2,64 mm, 0,2 mm de parede, e durômetro 50A Shore A (MED-4750, NuSil Technology LLC). Um orifício de 0,3 mm de diâmetro foi colocado em uma extremidade do tubo enquanto a outra extremidade foi vedada por adesivo de silicone MED3-4213-1. Três configurações diferentes do alojamento de tubo de silicone foram testadas: 1) massa/comprimento de tablete osmótico: 700 mg/11 cm, massa/comprimento de tablete de fármaco: 320 mg/4,5 cm, comprimento de região revestida com parileno: 6,5 cm; 2) massa/comprimento de tablete osmótico: 700 mg/11 cm, massa/comprimento de tablete de fármaco: 320 mg/4,5 cm, comprimento de região revestida com parileno: 11 cm; e 3) massa/comprimento de tablete osmótico: 400 mg/6 cm, massa/comprimento de tablete de fármaco: 150 mg/2 cm, comprimento de região revestida com parileno: 4 cm.
[0139] A liberação In vitro foi realizada em água deionizada a 37°C e os resultados são mostrados na Figura 21. O tamanho de amostra para cada grupo foi 2, e as barras de erro indicam desvio padrão (SD) em torno do meio. Algumas barras de erro não são vistas se as mesmas forem menores do que os símbolos. Conforme usado na legenda, "O" se refere a tablete osmótico e "A" se refere ao ingrediente farmaceuticamente ativo, isto é, fármaco, tablete.
[0140] Em particular, a Figura 21 mostra a quantidade de fármaco liberado ao longo do tempo a partir dos dispositivos que tem vários comprimentos de região de revestimento impermeável à água. O desempenho de liberação de gemcitabina foi afetado pelo comprimento de região revestida com parileno em relação aos comprimentos de regiões de tablete osmótico e de fármaco. Esses resultados indicam que o comprimento da região impermeável à água, podem ser selecionados com base no volume de formulações de fármaco e agente funcional a ser contido assim como a taxa desejada de entrega do fármaco do tubo. Ademais, pode ser útil um revestimento de alojamento em que o alojamento material for permeável a fármaco e liberação osmótica é desejada.
[0141] Publicações citadas no presente documento e os materiais para os quais as mesmas são citadas são especialmente incorporados a título de referência. Modificações e variações dos métodos e dispositivos descritos no presente documento serão obvias a aqueles versados na técnica a partir da descrição detalhada precedente. Tais modificações e variações são destinadas a estarem dentro do escopo das reivindicações em anexo.
Claims (28)
1. Dispositivo intravesical de entrega de fármaco, compreendendo: um alojamento que define um reservatório; caracterizado pelo fato de que compreende ainda: uma primeira unidade na forma de um tablete sólido contida dentro do reservatório em uma primeira posição, sendo que a primeira unidade compreende um fármaco; e uma segunda unidade na forma de um tablete sólido compreendendo um agente osmótico e contida dentro do reservatório em uma segunda posição distinta da primeira posição, as primeira e segunda posições estando em comunicação fluida entre si, em que a segunda unidade facilita a liberação in vivo do fármaco a partir do alojamento, e em que o dispositivo é elasticamente deformável entre uma forma relati-vamente endireitada adaptada para inserção através da uretra de um paciente e para dentro da bexiga do paciente e uma forma de retenção adaptada para reter o disposi-tivo no interior da bexiga.
2. Dispositivo, de acordo com a reivindicação 1, caracterizado pelo fato de que o alojamento compreende uma porção de parede permeável à água que define pelo menos parte do reservatório.
3. Dispositivo, de acordo com a reivindicação 2, caracterizado pelo fato de que ou a porção de parede permeável à água é impermeável ao fármaco em so-lução aquosa ou é permeável ao fármaco em solução aquosa.
4. Dispositivo, de acordo com a reivindicação 1, caracterizado pelo fato de que o alojamento compreende pelo menos uma ranhura configurada para permitir que um fluido entre no reservatório in vivo e/ou compreende pelo menos um orifício de liberação de fármaco, que está em comunicação fluida com o reservatório.
5. Dispositivo, de acordo com a reivindicação 1, caracterizado pelo fato de que o alojamento compreende um tubo anular alongado e o reservatório compre-ende o lúmen do tubo anular.
6. Dispositivo, de acordo com a reivindicação 5, caracterizado pelo fato de que um orifício de liberação de fármaco ou é fornecido em um plugue de extremi-dade localizado em uma extremidade do tubo ou em uma parede lateral do tubo.
7. Dispositivo, de acordo com a reivindicação 5, caracterizado pelo fato de que o alojamento não tem orifício de liberação e é configurado para liberar o fár- maco através de parede permeável a fármaco que liga o reservatório.
8. Dispositivo, de acordo com a reivindicação 7, caracterizado pelo fato de que a parede permeável a fármaco compreende um disco estabilizado no lúmen do tubo em uma extremidade do tubo ou próximo à mesma.
9. Dispositivo, de acordo com a reivindicação 7, caracterizado pelo fato de que a parede permeável a fármaco ou é parte de uma parede lateral do tubo ou parte de um plugue de extremidade localizado em uma extremidade do tubo.
10. Dispositivo, de acordo com qualquer uma das reivindicações 1 a 9, caracterizado pelo fato de que o fármaco é um fármaco de baixa solubilidade.
11. Dispositivo, de acordo com a reivindicação 1, caracterizado pelo fato de que o dispositivo é configurado para liberar uma quantidade terapeuticamente eficaz do fármaco durante um período de 2 dias a 30 dias.
12. Dispositivo, de acordo com a reivindicação 1, caracterizado pelo fato de que o alojamento compreende um tubo anular alongado, sendo que o tubo anular compreende uma porção de parede permeável à água e uma porção de parede impermeável à água.
13. Dispositivo, de acordo com a reivindicação 7, caracterizado pelo fato de que a primeira unidade é localizada mais próxima à parede permeável a fármaco do que a segunda unidade.
14. Dispositivo, de acordo com a reivindicação 1 ou 12, caracterizado pelo fato de que o alojamento tem um durômetro de 25A a 80A.
15. Dispositivo, de acordo com a reivindicação 1 ou 12, caracterizado pelo fato de que o alojamento compreende silicone, um poliuretano termoplástico, de etileno-co-acetato de vinila (EVA), ou uma combinação dos mesmos.
16. Dispositivo, de acordo com qualquer uma das reivindicações 1 a 15, caracterizado pelo fato de que o fármaco compreende lidocaína, gemcitabina, do-cetaxel, carboplatina, cisplatina, oxaliplatina, tróspio, tolterodina, ou mitomicina C.
17. Dispositivo, de acordo com a reivindicação 1, caracterizado pelo fato de que o fármaco compreende gemcitabina e o agente osmótico compreende ureia.
18. Dispositivo, de acordo com a reivindicação 17, caracterizado pelo fato de que a primeira unidade compreende pelo menos 75 por cento em peso de gemcitabina HCl e a segunda unidade compreende pelo menos 85 por cento em peso de ureia.
19. Dispositivo, de acordo com qualquer uma das reivindicações 1 a 18, caracterizado pelo fato de que compreende uma pluralidade das primeiras unidades e uma pluralidade das segundas unidades.
20. Dispositivo, de acordo com a reivindicação 1, caracterizado pelo fato de que: o alojamento compreende um tubo anular alongado permeável à água que tem um diâmetro interno de 2 a 5 mm, o tablete sólido da primeira unidade tem um diâmetro igual ao diâmetro interno do tubo anular alongado, sendo que os um ou mais tabletes sólidos da primeira unidade preenchem um comprimento de 1 cm a 3 cm do lúmen do tubo anular, e o tablete sólido da segunda unidade tem um diâmetro igual ao diâmetro interno do tubo anular alongado, sendo que os um ou mais tabletes sólidos da se-gunda unidade preenchem um comprimento de 10 cm a 15 cm do lúmen do tubo anular.
21. Dispositivo, de acordo com a reivindicação 1 ou 20, caracterizado pelo fato de que uma razão de volume da primeira unidade para volume da segunda unidade é de 0,05 a 0,5.
22. Dispositivo, de acordo com a reivindicação 1, caracterizado pelo fato de que o dispositivo é configurado para assumir espontaneamente um formato na ausência de uma carga compressiva, cujo formato compreende um par interconectado e sobreposto de bobinas.
23. Dispositivo, de acordo com a reivindicação 21 ou 22, caracterizado pelo fato de que o alojamento compreende, adicionalmente, um lúmen de armação de retenção e uma armação de retenção posicionada no lúmen de armação de retenção, em que a armação de retenção compreende uma liga superelástica ou outro fio elástico.
24. Dispositivo, de acordo com a reivindicação 1, caracterizado pelo fato de que: o alojamento é permeável à água, a primeira unidade compreende um fármaco de baixa solubilidade, e a segunda unidade compreende um agente osmótico que facilita a liberação do fármaco do alojamento por pressão osmótica.
25. Dispositivo, de acordo com a reivindicação 24, caracterizado pelo fato de que o fármaco compreende gemcitabina e o agente osmótico compreende ureia.
26. Dispositivo, de acordo com a reivindicação 1, caracterizado pelo fato de que o dispositivo é configurado, seguindo o posicionamento do dispositivo em um paciente, para permitir que água ou urina entre no reservatório e solubilizar as primeira e a segunda unidades.
27. Dispositivo, de acordo com a reivindicação 1, caracterizado pelo fato de que o agente osmótico está configurado para acelerar a solubilização do fármaco.
28. Dispositivo, de acordo com a reivindicação 1, caracterizado pelo fato de que o dispositivo é configurado para liberar o fármaco e o agente osmótico a partir do alojamento.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361867245P | 2013-08-19 | 2013-08-19 | |
| US61/867,245 | 2013-08-19 | ||
| US201361877610P | 2013-09-13 | 2013-09-13 | |
| US61/877,610 | 2013-09-13 | ||
| PCT/US2014/051672 WO2015026813A1 (en) | 2013-08-19 | 2014-08-19 | Multi-unit drug delivery devices and methods |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| BR112016002646A2 BR112016002646A2 (pt) | 2017-08-01 |
| BR112016002646B1 true BR112016002646B1 (pt) | 2022-01-25 |
Family
ID=51422208
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| BR112016002646-2A BR112016002646B1 (pt) | 2013-08-19 | 2014-08-19 | Dispositivo intravesical de entrega de fármaco |
Country Status (24)
| Country | Link |
|---|---|
| US (3) | US10729823B2 (pt) |
| EP (3) | EP3736015B1 (pt) |
| JP (4) | JP6486359B2 (pt) |
| KR (3) | KR102488491B1 (pt) |
| CN (3) | CN113413537A (pt) |
| AU (4) | AU2014309012B2 (pt) |
| BR (1) | BR112016002646B1 (pt) |
| CA (2) | CA2919215C (pt) |
| CY (1) | CY1123474T1 (pt) |
| DK (1) | DK3035991T3 (pt) |
| ES (2) | ES2817838T3 (pt) |
| HR (1) | HRP20201421T1 (pt) |
| HU (1) | HUE051336T2 (pt) |
| IL (3) | IL299897B2 (pt) |
| LT (1) | LT3035991T (pt) |
| MX (2) | MX2016001621A (pt) |
| PL (1) | PL3035991T3 (pt) |
| PT (1) | PT3035991T (pt) |
| RS (1) | RS60847B1 (pt) |
| RU (1) | RU2687596C2 (pt) |
| SG (2) | SG11201600856RA (pt) |
| SI (1) | SI3035991T1 (pt) |
| WO (1) | WO2015026813A1 (pt) |
| ZA (1) | ZA202205265B (pt) |
Families Citing this family (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BR112015003836A2 (pt) | 2012-08-31 | 2017-07-04 | Taris Biomedical Llc | sistemas e métodos para distribuição de drogas para tratamento de câncer de bexiga |
| KR102383496B1 (ko) | 2012-08-31 | 2022-04-08 | 타리스 바이오메디컬 엘엘씨 | 젬시타빈을 포함하는 전립선 질환의 치료를 위한 약물 전달 시스템과 방법 |
| EP2964310A1 (en) | 2013-03-05 | 2016-01-13 | TARIS Biomedical LLC | Drug delivery devices and methods for controlled drug release through device orifice |
| MX2015012250A (es) | 2013-03-15 | 2015-12-01 | Taris Biomedical Llc | Dispositivos de administracion de medicamentos y metodos para administracion de medicamentos. |
| US20150250717A1 (en) * | 2014-03-06 | 2015-09-10 | Taris Biomedical Llc | Drug delivery systems and methods for treatment of bladder cancer with gemcitabine |
| KR20170016853A (ko) | 2014-05-12 | 2017-02-14 | 타리스 바이오메디컬 엘엘씨 | 약물 전달 장치 및 방법 |
| KR102486216B1 (ko) | 2014-06-26 | 2023-01-09 | 타리스 바이오메디컬 엘엘씨 | 탄성 폴리머-약물 매트릭스 시스템을 포함하는 방광내 약물 전달 장치 및 방법 |
| US10010400B2 (en) | 2015-03-30 | 2018-07-03 | Taris Biomedical Llc | Devices and methods for local delivery of drug to upper urinary tract |
| WO2016172704A1 (en) * | 2015-04-23 | 2016-10-27 | Taris Biomedical Llc | Drug delivery devices with drug-permeable component and methods |
| US20180117219A1 (en) * | 2015-04-29 | 2018-05-03 | Northwestern University | 3d printing of biomedical implants |
| CN105056376A (zh) * | 2015-08-21 | 2015-11-18 | 崔尚品 | 一种治疗宫颈炎和宫颈hpv感染的医疗器械 |
| WO2017151983A1 (en) * | 2016-03-02 | 2017-09-08 | Taris Biomedical Llc | Osmotic drug delivery devices and methods of making osmotic drug delivery devices |
| MX2018013432A (es) | 2016-05-06 | 2019-08-12 | Taris Biomedical Llc | Metodo para tratar cancer urotelial del tracto inferior. |
| KR102564771B1 (ko) | 2017-02-01 | 2023-08-07 | 타리스 바이오메디컬 엘엘씨 | 약물 전달을 위한 생체내 약물 전달 장치 |
| WO2019023388A1 (en) | 2017-07-25 | 2019-01-31 | Taris Biomedical Llc | METHODS OF TREATING TUMOR METASTASIS |
| EP3706763A4 (en) | 2017-11-08 | 2021-08-11 | TARIS Biomedical LLC | METHODS OF TREATMENT AND MAINTENANCE THERAPY FOR BLADDER CANCER USING GEMCITABINE |
| US11464734B2 (en) | 2018-08-01 | 2022-10-11 | Taris Biomedical Llc | Methods of treating overactive bladder using trospium |
| JP2022505025A (ja) * | 2018-11-09 | 2022-01-14 | タリス バイオメディカル エルエルシー | 上部尿路への局所薬物送達のための薬物送達装置及びシステム |
| US20200383688A1 (en) * | 2019-06-04 | 2020-12-10 | Surefire Medical, Inc. | Atraumatic Occlusive System with Compartment for Measurement of Vascular Pressure Change |
| CN118715037A (zh) | 2021-12-21 | 2024-09-27 | 塔里斯生物医药公司 | 用于膀胱内装置的泌尿放置导管 |
| WO2024092159A1 (en) | 2022-10-28 | 2024-05-02 | Taris Biomedical Llc | Methods of treating bladder cancer with gemcitabine |
Family Cites Families (146)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3089815A (en) | 1951-10-11 | 1963-05-14 | Lieb Hans | Injectable pharmaceutical preparation, and a method of making same |
| US3854480A (en) | 1969-04-01 | 1974-12-17 | Alza Corp | Drug-delivery system |
| US3948254A (en) * | 1971-11-08 | 1976-04-06 | Alza Corporation | Novel drug delivery device |
| US4016251A (en) | 1972-08-17 | 1977-04-05 | Alza Corporation | Vaginal drug dispensing device |
| US3888975A (en) | 1972-12-27 | 1975-06-10 | Alza Corp | Erodible intrauterine device |
| US3916899A (en) * | 1973-04-25 | 1975-11-04 | Alza Corp | Osmotic dispensing device with maximum and minimum sizes for the passageway |
| US3901232A (en) | 1973-10-26 | 1975-08-26 | Alza Corp | Integrated device for administering beneficial drug at programmed rate |
| US3935860A (en) | 1974-08-21 | 1976-02-03 | Alza Corporation | Intrauterine device with restrictor for maintaining device in uterine cavity |
| US4111203A (en) * | 1976-11-22 | 1978-09-05 | Alza Corporation | Osmotic system with means for improving delivery kinetics of system |
| US4210139A (en) | 1979-01-17 | 1980-07-01 | Alza Corporation | Osmotic device with compartment for governing concentration of agent dispensed from device |
| US4235236A (en) | 1979-02-12 | 1980-11-25 | Alza Corporation | Device for dispensing drug by combined diffusional and osmotic operations |
| US4392848A (en) | 1979-06-25 | 1983-07-12 | The Procter & Gamble Company | Catheterization |
| US4309996A (en) | 1980-04-28 | 1982-01-12 | Alza Corporation | System with microporous releasing diffusor |
| US4326522A (en) | 1980-06-09 | 1982-04-27 | Pitman-Moore, Inc. | Mesh-covered bolus |
| AU538961B2 (en) | 1980-06-09 | 1984-09-06 | Alex Harvey Industries Limited | Intra-vaginal device |
| US4475916A (en) | 1982-03-18 | 1984-10-09 | Merck & Co., Inc. | Osmotic drug delivery system |
| US4629449A (en) | 1982-07-29 | 1986-12-16 | Alza Corporation | Vaginal dispenser for dispensing beneficial hormone |
| US5366738A (en) | 1982-07-29 | 1994-11-22 | Merck & Co., Inc. | Controlled release drug dispersion delivery device |
| US4578075A (en) | 1982-12-20 | 1986-03-25 | Alza Corporation | Delivery system housing a plurality of delivery devices |
| US4681583A (en) | 1982-12-20 | 1987-07-21 | Alza Corporation | System for dispersing drug in biological environment |
| US4655219A (en) | 1983-07-22 | 1987-04-07 | American Hospital Supply Corporation | Multicomponent flexible grasping device |
| DE3332156A1 (de) | 1983-09-06 | 1985-03-21 | Peter 6000 Frankfurt Prezelj | Nasenspange |
| GB8328916D0 (en) | 1983-10-28 | 1983-11-30 | Castex Prod | Pharmaceutical pellet |
| GB8403138D0 (en) | 1984-02-07 | 1984-03-14 | Graham N B | Sustained release of active ingredient |
| NZ207341A (en) | 1984-03-01 | 1988-02-29 | Harvey Alex Ind Ltd | Device containing chemical impregnants for insertion into a body cavity of an animal |
| US4968507A (en) | 1984-06-20 | 1990-11-06 | Merck & Co., Inc. | Controlled porosity osmotic pump |
| CH667209A5 (de) | 1985-07-02 | 1988-09-30 | Sulzer Ag | Medizinische depotsonde. |
| US5008112A (en) * | 1985-12-16 | 1991-04-16 | International Minerals & Chem. Corporation | Device for the extended delivery of diffusible agents |
| US4871542A (en) | 1987-04-30 | 1989-10-03 | Ferring Service Center, N.V. | Method and apparatus useful for delivering medicinal compositions into the bladder and urinary tract |
| US5340590A (en) * | 1987-06-25 | 1994-08-23 | Alza Corporation | Delivery system with bilayer osmotic engine |
| US5057318A (en) * | 1988-12-13 | 1991-10-15 | Alza Corporation | Delivery system for beneficial agent over a broad range of rates |
| US5545208A (en) | 1990-02-28 | 1996-08-13 | Medtronic, Inc. | Intralumenal drug eluting prosthesis |
| US5324280A (en) * | 1990-04-02 | 1994-06-28 | Alza Corporation | Osmotic dosage system for delivering a formulation comprising liquid carrier and drug |
| WO1993006792A1 (en) | 1991-10-04 | 1993-04-15 | Scimed Life Systems, Inc. | Biodegradable drug delivery vascular stent |
| WO1993006819A1 (en) | 1991-10-10 | 1993-04-15 | Alza Corporation | Osmotic drug delivery devices with hydrophobic wall materials |
| US5441550A (en) | 1992-03-26 | 1995-08-15 | The University Of Tennessee Research Corporation | Post-treatment of laminated nonwoven cellulosic fiber webs |
| US5499997A (en) | 1992-04-10 | 1996-03-19 | Sharpe Endosurgical Corporation | Endoscopic tenaculum surgical instrument |
| DE69329407T2 (de) | 1992-06-02 | 2001-05-03 | Bard Inc C R | Verfahren und Implantatvorrichtung für Langzeitwirkstoffabgabe |
| US5523092A (en) | 1993-04-14 | 1996-06-04 | Emory University | Device for local drug delivery and methods for using the same |
| US5516522A (en) | 1994-03-14 | 1996-05-14 | Board Of Supervisors Of Louisiana State University | Biodegradable porous device for long-term drug delivery with constant rate release and method of making the same |
| IL116433A (en) | 1994-12-19 | 2002-02-10 | Galen Chemicals Ltd | INTRAVAGINAL DRUG DELIVERY DEVICES FOR THE ADMINISTRATION OF 17β-OESTRADIOL PRECURSORS |
| US5817335A (en) * | 1995-05-26 | 1998-10-06 | Alza Corporation | Osmotic device with high drug loading and delayed activation of drug delivery |
| GB9522403D0 (en) | 1995-11-01 | 1996-01-03 | Hoechst Roussel Ltd | Intravaginal drug delivery device |
| PT877599E (pt) | 1996-02-02 | 2003-08-29 | Alza Corp | Administracao continua de leuprolido utilizando um sistema implantavel |
| US6171298B1 (en) | 1996-05-03 | 2001-01-09 | Situs Corporation | Intravesical infuser |
| GB9610862D0 (en) | 1996-05-23 | 1996-07-31 | Evans Brian K | Pharmaceutical products |
| US20070161967A1 (en) * | 1996-06-04 | 2007-07-12 | Vance Products Inc., Dba Cook Urological Inc. | Implantable medical device with pharmacologically active ingredient |
| US5869081A (en) | 1996-06-28 | 1999-02-09 | The Population Council | Progesterone vaginal ring for treatment of infertility |
| US5797898A (en) | 1996-07-02 | 1998-08-25 | Massachusetts Institute Of Technology | Microchip drug delivery devices |
| US5972372A (en) | 1996-07-31 | 1999-10-26 | The Population Council, Inc. | Intravaginal rings with insertable drug-containing core |
| US5868719A (en) | 1997-01-15 | 1999-02-09 | Boston Scientific Corporation | Drug delivery balloon catheter device |
| US5830230A (en) | 1997-03-07 | 1998-11-03 | Micro Therapeutics, Inc. | Method of intracranial vascular embolotherapy using self anchoring coils |
| KR20010006027A (ko) | 1997-04-03 | 2001-01-15 | 포인트 바이오메디칼 코퍼레이션 | 방광내 약물 송달 시스템 |
| IL123813A0 (en) | 1997-04-11 | 1998-10-30 | Akzo Nobel Nv | Drug delivery system for two or more active substances |
| IL132702A0 (en) | 1997-05-07 | 2001-03-19 | Galen Chemicals Ltd | Intravaginal drug delivery devices for the administration of testosterone and testosterone precursors |
| AU723217B2 (en) | 1997-05-28 | 2000-08-24 | Interag | Intra-vaginal device for pigs |
| US6197327B1 (en) | 1997-06-11 | 2001-03-06 | Umd, Inc. | Device and method for treatment of dysmenorrhea |
| US6039968A (en) | 1997-06-24 | 2000-03-21 | Hoechst Marion Roussel | Intravaginal drug delivery device |
| US6267761B1 (en) | 1997-09-09 | 2001-07-31 | Sherwood Services Ag | Apparatus and method for sealing and cutting tissue |
| AU734838B2 (en) | 1997-10-10 | 2001-06-21 | Vetoquinol Usa, Inc. | Drug delivery system |
| US6749617B1 (en) | 1997-11-04 | 2004-06-15 | Scimed Life Systems, Inc. | Catheter and implants for the delivery of therapeutic agents to tissues |
| DE69834213T2 (de) * | 1997-12-31 | 2007-01-25 | Alza Corp., Mountain View | Osmotisches Abgabesystem für ein nützliches Mittel |
| US6183461B1 (en) | 1998-03-11 | 2001-02-06 | Situs Corporation | Method for delivering a medication |
| US6482837B1 (en) | 1998-04-24 | 2002-11-19 | University Of Rochester | Antimuscarinic compounds and methods for treatment of bladder diseases |
| US6464999B1 (en) | 1998-06-17 | 2002-10-15 | Galt Incorporated | Bioadhesive medical devices |
| US6159143A (en) | 1998-06-17 | 2000-12-12 | Scimed Life Systems, Inc. | Method and device for delivery of therapeutic agents in conjunction with isotope seed placement |
| US6168801B1 (en) | 1998-09-09 | 2001-01-02 | Cardiac Pacemakers, Inc. | Controlled release drug delivery |
| WO2000040234A1 (en) | 1999-01-06 | 2000-07-13 | Richard Henry | Topical anesthesia of the urinary bladder |
| US6293923B1 (en) | 1999-03-15 | 2001-09-25 | Innoventions, Inc. | Intravesicular balloon |
| US6083933A (en) | 1999-04-19 | 2000-07-04 | Stellar International Inc. | Treatment of cystitis-like symptoms with chondroitin sulfate following administration of a challenge solution |
| US6139535A (en) | 1999-05-27 | 2000-10-31 | Situs Corporation | Method and apparatus for placement and activation of a medical device within a body cavity |
| ES2332869T3 (es) | 1999-11-17 | 2010-02-15 | Boston Scientific Limited | Dispositivos microfabricados para la entrega de moleculas en fluidos portadores. |
| ATE323470T1 (de) | 1999-12-10 | 2006-05-15 | Massachusetts Inst Technology | Mikrochip-arzneistoffverabreichungssysteme und herstellungsverfahren |
| US20050238733A1 (en) | 2000-01-05 | 2005-10-27 | Richard Henry | Topical anesthesia of the urinary bladder |
| US6753011B2 (en) | 2000-01-14 | 2004-06-22 | Osmotica Corp | Combined diffusion/osmotic pumping drug delivery system |
| US6379382B1 (en) | 2000-03-13 | 2002-04-30 | Jun Yang | Stent having cover with drug delivery capability |
| US6682473B1 (en) | 2000-04-14 | 2004-01-27 | Solace Therapeutics, Inc. | Devices and methods for attenuation of pressure waves in the body |
| US6988983B2 (en) | 2000-04-14 | 2006-01-24 | Solace Therapeutics, Inc. | Implantable self-inflating attenuation device |
| US7232421B1 (en) | 2000-05-12 | 2007-06-19 | C. R. Bard, Inc. | Agent delivery systems |
| US6730072B2 (en) | 2000-05-30 | 2004-05-04 | Massachusetts Institute Of Technology | Methods and devices for sealing microchip reservoir devices |
| US6398718B1 (en) | 2000-06-15 | 2002-06-04 | Innoventions, Inc. | Intravesicular device |
| GB0015617D0 (en) | 2000-06-26 | 2000-08-16 | Vectura Ltd | Improved preparations for dermal delivery of active substances |
| WO2002005800A2 (en) | 2000-07-17 | 2002-01-24 | Guilford Pharmaceuticals, Inc. | Compositions for sustained release of analgesic agents, and methods of making and using the same |
| AU2001286726B2 (en) | 2000-08-24 | 2007-03-22 | Sidney Lerner | Non-hormonal vaginal contraceptive |
| US6752829B2 (en) | 2001-01-30 | 2004-06-22 | Scimed Life Systems, Inc. | Stent with channel(s) for containing and delivering a biologically active material and method for manufacturing the same |
| DE10104369A1 (de) * | 2001-02-01 | 2002-08-08 | Boehringer Ingelheim Pharma | Verwendung von 2-Amino-(4-hydroxy-2-methansulfonamidophenyl)ethanol zur Behandlung der Harninkontinenz |
| CN1536986B (zh) | 2001-03-27 | 2012-07-04 | 沃纳奇尔科特(爱尔兰)有限公司 | 用于抗微生物剂给药的阴道内药物递送装置 |
| US6632217B2 (en) | 2001-04-19 | 2003-10-14 | Microsolutions, Inc. | Implantable osmotic pump |
| US6973718B2 (en) | 2001-05-30 | 2005-12-13 | Microchips, Inc. | Methods for conformal coating and sealing microchip reservoir devices |
| US6875208B2 (en) | 2001-05-31 | 2005-04-05 | Massachusetts Institute Of Technology | Microchip devices with improved reservoir opening |
| US7438701B2 (en) | 2001-07-26 | 2008-10-21 | Durect Corporation | Local concentration management system |
| AU2002341959A1 (en) | 2001-10-04 | 2003-04-14 | Case Western Reserve University | Drug delivery devices and methods |
| US7722894B2 (en) | 2001-10-22 | 2010-05-25 | Massachusetts Institute Of Technology | Biodegradable polymer |
| US7005138B2 (en) | 2001-12-21 | 2006-02-28 | Duramed Pharmaceuticals, Inc. | Method of systematically delivering SSRIs |
| US7473273B2 (en) | 2002-01-22 | 2009-01-06 | Medtronic Vascular, Inc. | Stent assembly with therapeutic agent exterior banding |
| US8685427B2 (en) | 2002-07-31 | 2014-04-01 | Boston Scientific Scimed, Inc. | Controlled drug delivery |
| GB2385273B (en) | 2002-02-13 | 2004-05-26 | Deborah Huang | Drug delivery device |
| US6899890B2 (en) | 2002-03-20 | 2005-05-31 | Kv Pharmaceutical Company | Bioadhesive drug delivery system |
| DE10247689A1 (de) | 2002-10-12 | 2004-04-22 | Martin Rahe | Implantat in der Harnblase |
| US7504387B2 (en) | 2002-10-16 | 2009-03-17 | Arthrodynamic Technologies, Animal Health Division, Inc. | Glycosaminoglycan composition and method for treatment and prevention of interstitial cystitis |
| EP1553899A4 (en) | 2002-10-22 | 2006-10-25 | METHOD AND SYSTEM FOR INTRAVASCULAR DELIVERY OF THERAPEUTIC AGENTS | |
| WO2004058105A2 (en) | 2002-12-16 | 2004-07-15 | The Regents Of The University Of Michigan | Assembly and planar structure for use therein which is expandable into a 3-d structure such as a stent and device for making the planar structure |
| ATE423584T1 (de) | 2002-12-23 | 2009-03-15 | Medtronic Inc | Systeme und methoden zum einstellen der dichte einer medizinischen lösung |
| JP2006521897A (ja) * | 2003-03-31 | 2006-09-28 | アルザ・コーポレーション | 内部圧力を放散する手段を備える浸透ポンプ |
| US20050228482A1 (en) | 2003-09-26 | 2005-10-13 | William Herzog | Stent covered by a layer having a layer opening |
| DE10359828A1 (de) * | 2003-12-12 | 2005-07-28 | Zoser B. Dr.Rer.Nat. Salama | CHP-Gemcitabin- Kombinationsmittel und ihre Verwendung als Antitumorwirkstoffe, insbesondere Antimetastasierungswirkstoffe |
| PT1708722E (pt) | 2004-01-28 | 2014-09-12 | Univ California | Nova terapia interstciial para o alívio imediato dos sintomas e terapia crónica na cistite intersticial |
| JP4680939B2 (ja) | 2004-02-10 | 2011-05-11 | シネコー・エルエルシー | 治療薬用脈管内送達システム |
| US7647112B2 (en) | 2004-02-11 | 2010-01-12 | Ethicon, Inc. | System and method for selectively stimulating different body parts |
| WO2005115245A1 (en) | 2004-05-28 | 2005-12-08 | Dynaventions Inc. | Intravesicular device |
| EP1861161A4 (en) | 2005-01-24 | 2012-05-16 | Neurosystec Corp | APPARATUS AND METHOD FOR DISPENSING THERAPEUTIC AND / OR OTHER AGENTS IN THE INTERNAL EAR AND OTHER FABRICS |
| EP1871310B1 (en) | 2005-04-20 | 2016-07-27 | Cook Medical Technologies LLC | Medical apparatus for rapid insertion |
| US7862552B2 (en) | 2005-05-09 | 2011-01-04 | Boston Scientific Scimed, Inc. | Medical devices for treating urological and uterine conditions |
| ES2400091T3 (es) * | 2005-08-11 | 2013-04-05 | Massachusetts Institute Of Technology | Dispositivo de suministro de fármacos intravesical y método |
| BRPI0706280A2 (pt) * | 2006-01-05 | 2011-03-22 | Lifecycle Pharma As | produto de comprimido carregável desintegrante, e, método para a preparação de um comprimido carregável desintegrante |
| US20070172508A1 (en) | 2006-01-26 | 2007-07-26 | Paul Zupkas | Transluminal drug delivery methods and devices |
| US20070172507A1 (en) | 2006-01-26 | 2007-07-26 | Paul Zupkas | Transluminal drug delivery methods and devices |
| WO2007109247A2 (en) | 2006-03-20 | 2007-09-27 | Duramed Pharmaceuticals, Inc. | Flexible, compressed intravaginal rings, methods of making and using the same, and apparatus for making the same |
| BRPI0709672B8 (pt) | 2006-03-31 | 2021-06-22 | 3088922 Inc | implante ocular insersível em um lúmen ocular e método de distribuição de um agente terapêutico a um olho |
| US7824383B2 (en) | 2006-06-16 | 2010-11-02 | Family Health International | Vaginal drug delivery system and method |
| WO2008038281A2 (en) | 2006-09-28 | 2008-04-03 | Medvision Inc. | Examination device |
| EP2089010A1 (en) | 2006-10-24 | 2009-08-19 | The John Hopkins University | Rapid release mini-tablets provide analgesia in laboratory animals |
| CA2687281A1 (en) | 2007-03-20 | 2008-09-25 | Boston Scientific Limited | Urological medical devices for release of prostatically beneficial therapeutic agents |
| EP3470055A1 (en) | 2007-06-26 | 2019-04-17 | Allergan Pharmaceuticals International Limited | Intravaginal drug delivery devices for the delivery of macromolecules and water-soluble drugs |
| WO2009029958A2 (en) | 2007-08-30 | 2009-03-05 | Sunstorm Research Corporation | Implantable delivery device |
| CN201179205Y (zh) * | 2007-11-28 | 2009-01-14 | 北京星昊医药股份有限公司 | 双氯芬酸钠双释胶囊片 |
| BRPI0820800B8 (pt) * | 2007-12-11 | 2021-06-22 | Massachusetts Inst Technology | dispositivo médico implantável para liberação controlada de droga |
| AU2009268934A1 (en) | 2008-06-16 | 2010-01-14 | Appian Labs, Llc | Composition and method of preparation of release systems for constant (zero-order) release of active agents |
| BRPI0917135A2 (pt) | 2008-08-09 | 2015-11-10 | Massachusetts Inst Technology | dispositivo médico para extensão e retenção em uma vesícula seminal, duto ejaculatório, próstata ou vaso deferente de um paciente, uso de um elastômero reabsorvível, e, dispositivo de bomba osmótica. |
| CA2792484C (en) * | 2009-03-12 | 2017-10-31 | Delpor, Inc. | Implantable device for long-term delivery of drugs |
| US10543166B2 (en) | 2009-06-26 | 2020-01-28 | Taris Biomedical Llc | Implantable drug delivery devices and methods of making the same |
| US9017312B2 (en) * | 2009-09-10 | 2015-04-28 | Taris Biomedical Llc | Implantable device for controlled drug delivery |
| US8167836B2 (en) * | 2009-12-08 | 2012-05-01 | Taris Biomedical, Inc. | Tissue expander configured for drug delivery |
| US8679094B2 (en) | 2009-12-17 | 2014-03-25 | Taris Biomedical, Inc. | Implantable device with intravesical tolerability and methods of treatment |
| US20110218488A1 (en) | 2010-03-05 | 2011-09-08 | Taris Biomedical, Inc. | Systems and Methods for Implanting Devices in the Bladder and Other Genitourinary Sites |
| WO2012048114A1 (en) * | 2010-10-06 | 2012-04-12 | Taris Biomedical, Inc. | Time-selective bioresorbable or collapsible drug delivery systems and methods |
| US9457176B2 (en) * | 2010-10-06 | 2016-10-04 | Taris Biomedical Llc | Implantable drug delivery device with bladder retention feature |
| EP2663300B1 (en) | 2011-01-10 | 2023-03-08 | TARIS Biomedical LLC | Lidocaine regimen for the use of sustained treatment of bladder pain and irritative voiding |
| EP2670398B1 (en) * | 2011-02-04 | 2017-06-07 | TARIS Biomedical LLC | Implantable device for controlled release of low solubility drug |
| TWI615155B (zh) * | 2011-11-01 | 2018-02-21 | 拜耳股份有限公司 | 滲透活性的陰道遞送系統 |
| KR102383496B1 (ko) | 2012-08-31 | 2022-04-08 | 타리스 바이오메디컬 엘엘씨 | 젬시타빈을 포함하는 전립선 질환의 치료를 위한 약물 전달 시스템과 방법 |
| AP2015008381A0 (en) * | 2012-11-02 | 2015-04-30 | Pfizer | Bruton's tyrosine kinase inhibitors |
| EP2964310A1 (en) | 2013-03-05 | 2016-01-13 | TARIS Biomedical LLC | Drug delivery devices and methods for controlled drug release through device orifice |
| MX2015012250A (es) | 2013-03-15 | 2015-12-01 | Taris Biomedical Llc | Dispositivos de administracion de medicamentos y metodos para administracion de medicamentos. |
| EP2968880A1 (en) | 2013-03-15 | 2016-01-20 | TARIS Biomedical LLC | Drug delivery devices with drug-permeable component and methods |
| US20150250717A1 (en) | 2014-03-06 | 2015-09-10 | Taris Biomedical Llc | Drug delivery systems and methods for treatment of bladder cancer with gemcitabine |
-
2014
- 2014-08-19 KR KR1020227011546A patent/KR102488491B1/ko active IP Right Grant
- 2014-08-19 SG SG11201600856RA patent/SG11201600856RA/en unknown
- 2014-08-19 CN CN202110670311.9A patent/CN113413537A/zh active Pending
- 2014-08-19 KR KR1020227011545A patent/KR102503010B1/ko active IP Right Grant
- 2014-08-19 PT PT147562243T patent/PT3035991T/pt unknown
- 2014-08-19 CN CN202110670327.XA patent/CN113413393A/zh active Pending
- 2014-08-19 US US14/913,185 patent/US10729823B2/en active Active
- 2014-08-19 ES ES14756224T patent/ES2817838T3/es active Active
- 2014-08-19 ES ES20174754T patent/ES2956840T3/es active Active
- 2014-08-19 MX MX2016001621A patent/MX2016001621A/es unknown
- 2014-08-19 SI SI201431662T patent/SI3035991T1/sl unknown
- 2014-08-19 BR BR112016002646-2A patent/BR112016002646B1/pt active IP Right Grant
- 2014-08-19 WO PCT/US2014/051672 patent/WO2015026813A1/en active Application Filing
- 2014-08-19 PL PL14756224T patent/PL3035991T3/pl unknown
- 2014-08-19 CA CA2919215A patent/CA2919215C/en active Active
- 2014-08-19 RU RU2016108968A patent/RU2687596C2/ru active
- 2014-08-19 CN CN201480044009.0A patent/CN105530987B/zh active Active
- 2014-08-19 CA CA3173027A patent/CA3173027A1/en active Pending
- 2014-08-19 HU HUE14756224A patent/HUE051336T2/hu unknown
- 2014-08-19 EP EP20174754.0A patent/EP3736015B1/en active Active
- 2014-08-19 EP EP14756224.3A patent/EP3035991B1/en active Active
- 2014-08-19 IL IL299897A patent/IL299897B2/en unknown
- 2014-08-19 RS RS20201108A patent/RS60847B1/sr unknown
- 2014-08-19 SG SG10202004675QA patent/SG10202004675QA/en unknown
- 2014-08-19 LT LTEP14756224.3T patent/LT3035991T/lt unknown
- 2014-08-19 AU AU2014309012A patent/AU2014309012B2/en active Active
- 2014-08-19 EP EP23181854.3A patent/EP4234036A3/en active Pending
- 2014-08-19 JP JP2016536377A patent/JP6486359B2/ja active Active
- 2014-08-19 DK DK14756224.3T patent/DK3035991T3/da active
- 2014-08-19 KR KR1020167006968A patent/KR102385603B1/ko active IP Right Grant
-
2016
- 2016-01-21 IL IL243714A patent/IL243714B/en active IP Right Grant
- 2016-02-05 MX MX2021012349A patent/MX2021012349A/es unknown
-
2019
- 2019-02-19 JP JP2019027903A patent/JP6743213B2/ja active Active
- 2019-05-14 AU AU2019203394A patent/AU2019203394B2/en active Active
-
2020
- 2020-07-23 US US16/936,554 patent/US20200353131A1/en active Pending
- 2020-07-29 JP JP2020128398A patent/JP2020182875A/ja active Pending
- 2020-08-03 US US16/983,212 patent/US20200360574A1/en active Pending
- 2020-09-07 HR HRP20201421TT patent/HRP20201421T1/hr unknown
- 2020-09-24 CY CY20201100907T patent/CY1123474T1/el unknown
-
2021
- 2021-04-04 IL IL282042A patent/IL282042B2/en unknown
- 2021-12-07 AU AU2021282405A patent/AU2021282405A1/en not_active Abandoned
-
2022
- 2022-05-12 ZA ZA2022/05265A patent/ZA202205265B/en unknown
- 2022-09-26 JP JP2022152556A patent/JP2022177236A/ja active Pending
-
2024
- 2024-06-21 AU AU2024204252A patent/AU2024204252A1/en active Pending
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20200360574A1 (en) | Multi-unit drug delivery devices and methods | |
| US11135161B2 (en) | Intravesical device for controlled drug delivery | |
| BR112015022433B1 (pt) | Dispositivo de liberação de droga intravesical | |
| US20160279399A1 (en) | Osmotic drug delivery devices, kits, and methods | |
| RU2791232C2 (ru) | Многоблочные устройства для доставки лекарственного средства и способы доставки лекарственного средства | |
| NZ716207B2 (en) | Multi-unit drug delivery devices and methods | |
| BR112015022427B1 (pt) | Dispositivo de liberação de droga |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| B07D | Technical examination (opinion) related to article 229 of industrial property law [chapter 7.4 patent gazette] | ||
| B07G | Grant request does not fulfill article 229-c lpi (prior consent of anvisa) [chapter 7.7 patent gazette] |
Free format text: NOTIFICACAO DE DEVOLUCAO DO PEDIDO POR NAO SE ENQUADRAR NO ART. 229-C DA LPI. |
|
| B06U | Preliminary requirement: requests with searches performed by other patent offices: procedure suspended [chapter 6.21 patent gazette] | ||
| B09A | Decision: intention to grant [chapter 9.1 patent gazette] | ||
| B16A | Patent or certificate of addition of invention granted [chapter 16.1 patent gazette] |
Free format text: PRAZO DE VALIDADE: 20 (VINTE) ANOS CONTADOS A PARTIR DE 19/08/2014, OBSERVADAS AS CONDICOES LEGAIS. |