BR112014028362B1 - Ácidos (3r, 4r, 5s)-5-guanidino-4-acetamido-3-(pentan-3-iloxi)cicloexeno-1-carboxílicos flúor substituídos, os seus ésteres, composição farmacêutica e uso da mesma - Google Patents
Ácidos (3r, 4r, 5s)-5-guanidino-4-acetamido-3-(pentan-3-iloxi)cicloexeno-1-carboxílicos flúor substituídos, os seus ésteres, composição farmacêutica e uso da mesma Download PDFInfo
- Publication number
- BR112014028362B1 BR112014028362B1 BR112014028362-1A BR112014028362A BR112014028362B1 BR 112014028362 B1 BR112014028362 B1 BR 112014028362B1 BR 112014028362 A BR112014028362 A BR 112014028362A BR 112014028362 B1 BR112014028362 B1 BR 112014028362B1
- Authority
- BR
- Brazil
- Prior art keywords
- pentan
- yloxy
- cyclohexene
- guanidino
- pharmaceutical composition
- Prior art date
Links
- 239000008194 pharmaceutical composition Substances 0.000 title claims abstract description 27
- 150000002148 esters Chemical class 0.000 title claims abstract description 8
- 125000001153 fluoro group Chemical group F* 0.000 title abstract description 3
- TXXPTEJSSVMAFL-YNEHKIRRSA-N (3r,4r,5s)-4-acetamido-5-(diaminomethylideneamino)-3-pentan-3-yloxycyclohexene-1-carboxylic acid Chemical class CCC(CC)O[C@@H]1C=C(C(O)=O)C[C@H](N=C(N)N)[C@H]1NC(C)=O TXXPTEJSSVMAFL-YNEHKIRRSA-N 0.000 title description 4
- 229910052731 fluorine Inorganic materials 0.000 title description 2
- 239000011737 fluorine Substances 0.000 title description 2
- 206010022000 influenza Diseases 0.000 claims abstract description 26
- 230000000694 effects Effects 0.000 claims abstract description 25
- 150000003839 salts Chemical class 0.000 claims abstract description 24
- 238000011282 treatment Methods 0.000 claims abstract description 15
- 238000011321 prophylaxis Methods 0.000 claims abstract description 8
- NMEZJSDUZQOPFE-UHFFFAOYSA-N Cyclohex-1-enecarboxylic acid Chemical class OC(=O)C1=CCCCC1 NMEZJSDUZQOPFE-UHFFFAOYSA-N 0.000 claims abstract description 7
- 229910052739 hydrogen Inorganic materials 0.000 claims abstract description 7
- 239000001257 hydrogen Substances 0.000 claims abstract description 7
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims abstract description 7
- 201000010099 disease Diseases 0.000 claims abstract description 5
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 5
- 150000001875 compounds Chemical class 0.000 claims description 45
- 108010006232 Neuraminidase Proteins 0.000 claims description 25
- 102000005348 Neuraminidase Human genes 0.000 claims description 24
- 241000712461 unidentified influenza virus Species 0.000 claims description 21
- 239000003814 drug Substances 0.000 claims description 18
- 229940079593 drug Drugs 0.000 claims description 11
- GPJMJWZFIQXUME-DMDPSCGWSA-N (3r,4r,5s)-5-(diaminomethylideneamino)-4-[(2-fluoroacetyl)amino]-3-pentan-3-yloxycyclohexene-1-carboxylic acid Chemical compound CCC(CC)O[C@@H]1C=C(C(O)=O)C[C@H](NC(N)=N)[C@H]1NC(=O)CF GPJMJWZFIQXUME-DMDPSCGWSA-N 0.000 claims description 10
- 206010035664 Pneumonia Diseases 0.000 claims description 8
- 239000003826 tablet Substances 0.000 claims description 6
- 239000007924 injection Substances 0.000 claims description 5
- 238000002347 injection Methods 0.000 claims description 5
- 239000002775 capsule Substances 0.000 claims description 4
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 4
- 238000004519 manufacturing process Methods 0.000 claims description 3
- XYCILMAXNRFKAO-OUCADQQQSA-N methyl (3r,4r,5s)-5-(diaminomethylideneamino)-4-[(2-fluoroacetyl)amino]-3-pentan-3-yloxycyclohexene-1-carboxylate Chemical compound CCC(CC)O[C@@H]1C=C(C(=O)OC)C[C@H](NC(N)=N)[C@H]1NC(=O)CF XYCILMAXNRFKAO-OUCADQQQSA-N 0.000 claims description 2
- 125000006273 (C1-C3) alkyl group Chemical group 0.000 claims 1
- 230000000840 anti-viral effect Effects 0.000 claims 1
- 239000002253 acid Substances 0.000 abstract description 16
- 238000000034 method Methods 0.000 abstract description 14
- 238000002360 preparation method Methods 0.000 abstract description 10
- 150000007513 acids Chemical class 0.000 abstract description 8
- 229940042406 direct acting antivirals neuraminidase inhibitors Drugs 0.000 abstract description 5
- 239000002911 sialidase inhibitor Substances 0.000 abstract description 5
- 125000006527 (C1-C5) alkyl group Chemical group 0.000 abstract description 2
- 125000006729 (C2-C5) alkenyl group Chemical group 0.000 abstract description 2
- 125000006730 (C2-C5) alkynyl group Chemical group 0.000 abstract description 2
- JNCMHMUGTWEVOZ-UHFFFAOYSA-N F[CH]F Chemical compound F[CH]F JNCMHMUGTWEVOZ-UHFFFAOYSA-N 0.000 abstract description 2
- 108010081348 HRT1 protein Hairy Proteins 0.000 abstract description 2
- 102100021881 Hairy/enhancer-of-split related with YRPW motif protein 1 Human genes 0.000 abstract description 2
- VUWZPRWSIVNGKG-UHFFFAOYSA-N fluoromethane Chemical compound F[CH2] VUWZPRWSIVNGKG-UHFFFAOYSA-N 0.000 abstract description 2
- 150000004677 hydrates Chemical class 0.000 abstract description 2
- 230000003612 virological effect Effects 0.000 abstract 1
- 241000700605 Viruses Species 0.000 description 35
- -1 cyano, hydroxy Chemical group 0.000 description 31
- 241001465754 Metazoa Species 0.000 description 26
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 16
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 15
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 15
- 239000000243 solution Substances 0.000 description 15
- 125000000217 alkyl group Chemical group 0.000 description 14
- NENPYTRHICXVCS-YNEHKIRRSA-N oseltamivir acid Chemical compound CCC(CC)O[C@@H]1C=C(C(O)=O)C[C@H](N)[C@H]1NC(C)=O NENPYTRHICXVCS-YNEHKIRRSA-N 0.000 description 13
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 12
- 239000000203 mixture Substances 0.000 description 12
- 239000002904 solvent Substances 0.000 description 11
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 10
- 125000000623 heterocyclic group Chemical group 0.000 description 10
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 9
- UIIMBOGNXHQVGW-UHFFFAOYSA-M sodium bicarbonate Substances [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 9
- 239000003795 chemical substances by application Substances 0.000 description 8
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 8
- 238000002474 experimental method Methods 0.000 description 7
- PGZUMBJQJWIWGJ-ONAKXNSWSA-N oseltamivir phosphate Chemical compound OP(O)(O)=O.CCOC(=O)C1=C[C@@H](OC(CC)CC)[C@H](NC(C)=O)[C@@H](N)C1 PGZUMBJQJWIWGJ-ONAKXNSWSA-N 0.000 description 7
- 229940061367 tamiflu Drugs 0.000 description 7
- 230000004580 weight loss Effects 0.000 description 7
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 6
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 6
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 6
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 6
- 239000004480 active ingredient Substances 0.000 description 6
- 208000015181 infectious disease Diseases 0.000 description 6
- ARAIBEBZBOPLMB-UFGQHTETSA-N zanamivir Chemical compound CC(=O)N[C@@H]1[C@@H](N=C(N)N)C=C(C(O)=O)O[C@H]1[C@H](O)[C@H](O)CO ARAIBEBZBOPLMB-UFGQHTETSA-N 0.000 description 6
- 229960001028 zanamivir Drugs 0.000 description 6
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 5
- 241000699670 Mus sp. Species 0.000 description 5
- 239000007832 Na2SO4 Substances 0.000 description 5
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 5
- 125000004453 alkoxycarbonyl group Chemical group 0.000 description 5
- 125000003118 aryl group Chemical group 0.000 description 5
- NMEZJSDUZQOPFE-UHFFFAOYSA-M cyclohexene-1-carboxylate Chemical compound [O-]C(=O)C1=CCCCC1 NMEZJSDUZQOPFE-UHFFFAOYSA-M 0.000 description 5
- 238000010790 dilution Methods 0.000 description 5
- 239000012895 dilution Substances 0.000 description 5
- 125000001072 heteroaryl group Chemical group 0.000 description 5
- 239000003921 oil Substances 0.000 description 5
- 235000019198 oils Nutrition 0.000 description 5
- 230000001717 pathogenic effect Effects 0.000 description 5
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 5
- 229910052938 sodium sulfate Inorganic materials 0.000 description 5
- 235000011152 sodium sulphate Nutrition 0.000 description 5
- 239000003981 vehicle Substances 0.000 description 5
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 5
- 238000005160 1H NMR spectroscopy Methods 0.000 description 4
- 125000003545 alkoxy group Chemical group 0.000 description 4
- 125000004104 aryloxy group Chemical group 0.000 description 4
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 4
- 125000000753 cycloalkyl group Chemical group 0.000 description 4
- 239000003085 diluting agent Substances 0.000 description 4
- 239000000945 filler Substances 0.000 description 4
- QEWYKACRFQMRMB-UHFFFAOYSA-N fluoroacetic acid Chemical compound OC(=O)CF QEWYKACRFQMRMB-UHFFFAOYSA-N 0.000 description 4
- 239000008187 granular material Substances 0.000 description 4
- 230000005764 inhibitory process Effects 0.000 description 4
- 239000000314 lubricant Substances 0.000 description 4
- 238000005259 measurement Methods 0.000 description 4
- 244000005700 microbiome Species 0.000 description 4
- 235000017557 sodium bicarbonate Nutrition 0.000 description 4
- 239000007858 starting material Substances 0.000 description 4
- 125000001424 substituent group Chemical group 0.000 description 4
- 230000001225 therapeutic effect Effects 0.000 description 4
- OWFXKXBBNLIZTO-HBNTYKKESA-N (3r,4r,5s)-5-(diaminomethylideneamino)-4-[(2,2-difluoroacetyl)amino]-3-pentan-3-yloxycyclohexene-1-carboxylic acid Chemical compound CCC(CC)O[C@@H]1C=C(C(O)=O)C[C@H](NC(N)=N)[C@H]1NC(=O)C(F)F OWFXKXBBNLIZTO-HBNTYKKESA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 241000272525 Anas platyrhynchos Species 0.000 description 3
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 3
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- 230000009471 action Effects 0.000 description 3
- 150000001338 aliphatic hydrocarbons Chemical group 0.000 description 3
- 125000003342 alkenyl group Chemical group 0.000 description 3
- 125000003302 alkenyloxy group Chemical group 0.000 description 3
- 125000004414 alkyl thio group Chemical group 0.000 description 3
- 125000000304 alkynyl group Chemical group 0.000 description 3
- 125000005133 alkynyloxy group Chemical group 0.000 description 3
- 125000003710 aryl alkyl group Chemical group 0.000 description 3
- 125000004432 carbon atom Chemical group C* 0.000 description 3
- 125000002057 carboxymethyl group Chemical group [H]OC(=O)C([H])([H])[*] 0.000 description 3
- 238000004113 cell culture Methods 0.000 description 3
- 125000004851 cyclopentylmethyl group Chemical group C1(CCCC1)C* 0.000 description 3
- 125000004186 cyclopropylmethyl group Chemical group [H]C([H])(*)C1([H])C([H])([H])C1([H])[H] 0.000 description 3
- 230000002354 daily effect Effects 0.000 description 3
- 239000007884 disintegrant Substances 0.000 description 3
- 125000004494 ethyl ester group Chemical group 0.000 description 3
- 239000000796 flavoring agent Substances 0.000 description 3
- 235000013355 food flavoring agent Nutrition 0.000 description 3
- 229910052736 halogen Inorganic materials 0.000 description 3
- 150000002367 halogens Chemical class 0.000 description 3
- 125000004475 heteroaralkyl group Chemical group 0.000 description 3
- 208000037797 influenza A Diseases 0.000 description 3
- 239000003112 inhibitor Substances 0.000 description 3
- 238000007918 intramuscular administration Methods 0.000 description 3
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 3
- 239000008101 lactose Substances 0.000 description 3
- 229910052751 metal Inorganic materials 0.000 description 3
- 239000002184 metal Substances 0.000 description 3
- 238000010172 mouse model Methods 0.000 description 3
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 3
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 3
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 3
- 239000002547 new drug Substances 0.000 description 3
- 125000004433 nitrogen atom Chemical group N* 0.000 description 3
- VSZGPKBBMSAYNT-RRFJBIMHSA-N oseltamivir Chemical compound CCOC(=O)C1=C[C@@H](OC(CC)CC)[C@H](NC(C)=O)[C@@H](N)C1 VSZGPKBBMSAYNT-RRFJBIMHSA-N 0.000 description 3
- 125000003538 pentan-3-yl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])[H] 0.000 description 3
- 239000000843 powder Substances 0.000 description 3
- 239000003381 stabilizer Substances 0.000 description 3
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 3
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 3
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- 206010002091 Anaesthesia Diseases 0.000 description 2
- BVKZGUZCCUSVTD-UHFFFAOYSA-M Bicarbonate Chemical compound OC([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-M 0.000 description 2
- UJHWBSAMMMFGKC-BFHYXJOUSA-N CCC(CC)O[C@@H]1C=C(C(O)=O)C[C@H](NC(=O)OC(C)(C)C)[C@H]1N Chemical compound CCC(CC)O[C@@H]1C=C(C(O)=O)C[C@H](NC(=O)OC(C)(C)C)[C@H]1N UJHWBSAMMMFGKC-BFHYXJOUSA-N 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- ROSDSFDQCJNGOL-UHFFFAOYSA-N Dimethylamine Chemical compound CNC ROSDSFDQCJNGOL-UHFFFAOYSA-N 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- 241000283086 Equidae Species 0.000 description 2
- QUSNBJAOOMFDIB-UHFFFAOYSA-N Ethylamine Chemical compound CCN QUSNBJAOOMFDIB-UHFFFAOYSA-N 0.000 description 2
- 241000287828 Gallus gallus Species 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- 240000006240 Linum usitatissimum Species 0.000 description 2
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 2
- BAVYZALUXZFZLV-UHFFFAOYSA-N Methylamine Chemical compound NC BAVYZALUXZFZLV-UHFFFAOYSA-N 0.000 description 2
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 2
- 241000283216 Phocidae Species 0.000 description 2
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 229920002472 Starch Polymers 0.000 description 2
- 241000282887 Suidae Species 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 150000001413 amino acids Chemical class 0.000 description 2
- 230000037005 anaesthesia Effects 0.000 description 2
- 239000003242 anti bacterial agent Substances 0.000 description 2
- 239000004599 antimicrobial Substances 0.000 description 2
- 125000004659 aryl alkyl thio group Chemical group 0.000 description 2
- 125000005161 aryl oxy carbonyl group Chemical group 0.000 description 2
- WGQKYBSKWIADBV-UHFFFAOYSA-N benzylamine Chemical compound NCC1=CC=CC=C1 WGQKYBSKWIADBV-UHFFFAOYSA-N 0.000 description 2
- 239000011449 brick Substances 0.000 description 2
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 2
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 2
- 229960004926 chlorobutanol Drugs 0.000 description 2
- 229940125782 compound 2 Drugs 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- PBWZKZYHONABLN-UHFFFAOYSA-N difluoroacetic acid Chemical compound OC(=O)C(F)F PBWZKZYHONABLN-UHFFFAOYSA-N 0.000 description 2
- 239000003937 drug carrier Substances 0.000 description 2
- 229940088679 drug related substance Drugs 0.000 description 2
- UZPOINGXOKIYHV-YNEHKIRRSA-N ethyl (3r,4r,5s)-5-amino-4-[(2,2-difluoroacetyl)amino]-3-pentan-3-yloxycyclohexene-1-carboxylate Chemical compound CCOC(=O)C1=C[C@@H](OC(CC)CC)[C@H](NC(=O)C(F)F)[C@@H](N)C1 UZPOINGXOKIYHV-YNEHKIRRSA-N 0.000 description 2
- 125000005368 heteroarylthio group Chemical group 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- 229910052744 lithium Inorganic materials 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 229940098779 methanesulfonic acid Drugs 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 229960002194 oseltamivir phosphate Drugs 0.000 description 2
- 230000007918 pathogenicity Effects 0.000 description 2
- 230000000144 pharmacologic effect Effects 0.000 description 2
- 230000002035 prolonged effect Effects 0.000 description 2
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 239000011541 reaction mixture Substances 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 239000008107 starch Substances 0.000 description 2
- 235000019698 starch Nutrition 0.000 description 2
- 239000012089 stop solution Substances 0.000 description 2
- 238000007920 subcutaneous administration Methods 0.000 description 2
- 239000000375 suspending agent Substances 0.000 description 2
- 239000000454 talc Substances 0.000 description 2
- 229910052623 talc Inorganic materials 0.000 description 2
- 235000012222 talc Nutrition 0.000 description 2
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 2
- 230000009385 viral infection Effects 0.000 description 2
- 230000004584 weight gain Effects 0.000 description 2
- 235000019786 weight gain Nutrition 0.000 description 2
- RGHNJXZEOKUKBD-NRXMZTRTSA-N (2r,3r,4r,5s)-2,3,4,5,6-pentahydroxyhexanoic acid Chemical compound OC[C@H](O)[C@@H](O)[C@@H](O)[C@@H](O)C(O)=O RGHNJXZEOKUKBD-NRXMZTRTSA-N 0.000 description 1
- LGZDNNKBOUUMMY-GVDBMIGSSA-N (3r,4r,5s)-5-[bis[(2-methylpropan-2-yl)oxycarbonylamino]methylideneamino]-4-[(2,2-difluoroacetyl)amino]-3-pentan-3-yloxycyclohexene-1-carboxylic acid Chemical compound CCC(CC)O[C@@H]1C=C(C(O)=O)C[C@H](N\C(NC(=O)OC(C)(C)C)=N\C(=O)OC(C)(C)C)[C@H]1NC(=O)C(F)F LGZDNNKBOUUMMY-GVDBMIGSSA-N 0.000 description 1
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 1
- WNWHHMBRJJOGFJ-UHFFFAOYSA-N 16-methylheptadecan-1-ol Chemical class CC(C)CCCCCCCCCCCCCCCO WNWHHMBRJJOGFJ-UHFFFAOYSA-N 0.000 description 1
- FVRSZMVPDSCPKI-BFHYXJOUSA-N 2-methoxyethyl (3R,4R,5S)-5-(diaminomethylideneamino)-4-[(2,2-difluoroacetyl)amino]-3-pentan-3-yloxycyclohexene-1-carboxylate Chemical compound CCC(CC)O[C@@H]1C=C(C(=O)OCCOC)C[C@H](NC(N)=N)[C@H]1NC(=O)C(F)F FVRSZMVPDSCPKI-BFHYXJOUSA-N 0.000 description 1
- XTONPQGOHYYPIW-IPMKNSEASA-N 2-phenylethyl (3R,4R,5S)-5-(diaminomethylideneamino)-4-[(2,2-difluoroacetyl)amino]-3-pentan-3-yloxycyclohexene-1-carboxylate Chemical compound C1[C@H](NC(N)=N)[C@@H](NC(=O)C(F)F)[C@H](OC(CC)CC)C=C1C(=O)OCCC1=CC=CC=C1 XTONPQGOHYYPIW-IPMKNSEASA-N 0.000 description 1
- RKDVTFPQBQPESD-RCCFBDPRSA-N 2-pyridin-3-ylethyl (3R,4R,5S)-5-(diaminomethylideneamino)-4-[(2,2-difluoroacetyl)amino]-3-pentan-3-yloxycyclohexene-1-carboxylate Chemical compound C1[C@H](NC(N)=N)[C@@H](NC(=O)C(F)F)[C@H](OC(CC)CC)C=C1C(=O)OCCC1=CC=CN=C1 RKDVTFPQBQPESD-RCCFBDPRSA-N 0.000 description 1
- 229920001817 Agar Polymers 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 241000416162 Astragalus gummifer Species 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- BWLUMTFWVZZZND-UHFFFAOYSA-N Dibenzylamine Chemical compound C=1C=CC=CC=1CNCC1=CC=CC=C1 BWLUMTFWVZZZND-UHFFFAOYSA-N 0.000 description 1
- XBPCUCUWBYBCDP-UHFFFAOYSA-N Dicyclohexylamine Chemical compound C1CCCCC1NC1CCCCC1 XBPCUCUWBYBCDP-UHFFFAOYSA-N 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 241000206672 Gelidium Species 0.000 description 1
- 229930186217 Glycolipid Natural products 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 102000005744 Glycoside Hydrolases Human genes 0.000 description 1
- 108010031186 Glycoside Hydrolases Proteins 0.000 description 1
- 206010069767 H1N1 influenza Diseases 0.000 description 1
- 239000004705 High-molecular-weight polyethylene Substances 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical class Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 1
- 102000004157 Hydrolases Human genes 0.000 description 1
- 108090000604 Hydrolases Proteins 0.000 description 1
- 241000712431 Influenza A virus Species 0.000 description 1
- 241001500351 Influenzavirus A Species 0.000 description 1
- 102000004877 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- AHLPHDHHMVZTML-BYPYZUCNSA-N L-Ornithine Chemical compound NCCC[C@H](N)C(O)=O AHLPHDHHMVZTML-BYPYZUCNSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 241000701076 Macacine alphaherpesvirus 1 Species 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- HTLZVHNRZJPSMI-UHFFFAOYSA-N N-ethylpiperidine Chemical compound CCN1CCCCC1 HTLZVHNRZJPSMI-UHFFFAOYSA-N 0.000 description 1
- AHLPHDHHMVZTML-UHFFFAOYSA-N Orn-delta-NH2 Natural products NCCCC(N)C(O)=O AHLPHDHHMVZTML-UHFFFAOYSA-N 0.000 description 1
- UTJLXEIPEHZYQJ-UHFFFAOYSA-N Ornithine Natural products OC(=O)C(C)CCCN UTJLXEIPEHZYQJ-UHFFFAOYSA-N 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-N Propionic acid Chemical class CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 1
- 102100028755 Sialidase-2 Human genes 0.000 description 1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 1
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- 238000002441 X-ray diffraction Methods 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 239000008351 acetate buffer Substances 0.000 description 1
- 150000001242 acetic acid derivatives Chemical class 0.000 description 1
- 239000008186 active pharmaceutical agent Substances 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 235000010419 agar Nutrition 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 125000004390 alkyl sulfonyl group Chemical group 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- AZDRQVAHHNSJOQ-UHFFFAOYSA-N alumane Chemical class [AlH3] AZDRQVAHHNSJOQ-UHFFFAOYSA-N 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 230000002421 anti-septic effect Effects 0.000 description 1
- 239000003429 antifungal agent Substances 0.000 description 1
- 229940121375 antifungal agent Drugs 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 125000003435 aroyl group Chemical group 0.000 description 1
- 125000004391 aryl sulfonyl group Chemical group 0.000 description 1
- 239000012752 auxiliary agent Substances 0.000 description 1
- 206010064097 avian influenza Diseases 0.000 description 1
- 229910052788 barium Inorganic materials 0.000 description 1
- DSAJWYNOEDNPEQ-UHFFFAOYSA-N barium atom Chemical compound [Ba] DSAJWYNOEDNPEQ-UHFFFAOYSA-N 0.000 description 1
- 239000000440 bentonite Substances 0.000 description 1
- 235000012216 bentonite Nutrition 0.000 description 1
- 229910000278 bentonite Inorganic materials 0.000 description 1
- SVPXDRXYRYOSEX-UHFFFAOYSA-N bentoquatam Chemical compound O.O=[Si]=O.O=[Al]O[Al]=O SVPXDRXYRYOSEX-UHFFFAOYSA-N 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical class OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 150000001558 benzoic acid derivatives Chemical class 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-M bisulphate group Chemical group S([O-])(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-M 0.000 description 1
- 150000001642 boronic acid derivatives Chemical class 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- AXCZMVOFGPJBDE-UHFFFAOYSA-L calcium dihydroxide Chemical compound [OH-].[OH-].[Ca+2] AXCZMVOFGPJBDE-UHFFFAOYSA-L 0.000 description 1
- 239000000920 calcium hydroxide Substances 0.000 description 1
- 229910001861 calcium hydroxide Inorganic materials 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 230000000973 chemotherapeutic effect Effects 0.000 description 1
- 235000015218 chewing gum Nutrition 0.000 description 1
- 150000001860 citric acid derivatives Chemical class 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- IZWMNOZOUHVGSU-GVDBMIGSSA-N cyclohexyl (3R,4R,5S)-5-(diaminomethylideneamino)-4-[(2,2-difluoroacetyl)amino]-3-pentan-3-yloxycyclohexene-1-carboxylate Chemical compound N(C(=N)N)[C@@H]1[C@H]([C@@H](C=C(C1)C(=O)OC1CCCCC1)OC(CC)CC)NC(C(F)F)=O IZWMNOZOUHVGSU-GVDBMIGSSA-N 0.000 description 1
- HPNMFZURTQLUMO-UHFFFAOYSA-N diethylamine Chemical compound CCNCC HPNMFZURTQLUMO-UHFFFAOYSA-N 0.000 description 1
- POULHZVOKOAJMA-UHFFFAOYSA-N dodecanoic acid Chemical class CCCCCCCCCCCC(O)=O POULHZVOKOAJMA-UHFFFAOYSA-N 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 238000009510 drug design Methods 0.000 description 1
- 239000003480 eluent Substances 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-N ethanesulfonic acid Chemical class CCS(O)(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-N 0.000 description 1
- BEFDCLMNVWHSGT-UHFFFAOYSA-N ethenylcyclopentane Chemical compound C=CC1CCCC1 BEFDCLMNVWHSGT-UHFFFAOYSA-N 0.000 description 1
- CXUXGUWICULPMW-ARFHVFGLSA-N ethyl (3R,4R,5S)-4-[(2,2-difluoroacetyl)amino]-5-[(2-methylpropan-2-yl)oxycarbonylamino]-3-pentan-3-yloxycyclohexene-1-carboxylate Chemical compound CCOC(=O)C1=C[C@@H](OC(CC)CC)[C@H](NC(=O)C(F)F)[C@H](C1)NC(=O)OC(C)(C)C CXUXGUWICULPMW-ARFHVFGLSA-N 0.000 description 1
- JHOLUQMNQBVDCF-LUHWTZLKSA-N ethyl (3R,4R,5S)-5-(diaminomethylideneamino)-4-[(2,2-difluoroacetyl)amino]-3-pentan-3-yloxycyclohexene-1-carboxylate methanesulfonic acid Chemical compound CS(O)(=O)=O.CCOC(=O)C1=C[C@@H](OC(CC)CC)[C@H](NC(=O)C(F)F)[C@@H](NC(N)=N)C1 JHOLUQMNQBVDCF-LUHWTZLKSA-N 0.000 description 1
- HDKVSEUEUWKMFS-UHFFFAOYSA-N ethyl cyclohexene-1-carboxylate Chemical compound CCOC(=O)C1=CCCCC1 HDKVSEUEUWKMFS-UHFFFAOYSA-N 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- 230000003203 everyday effect Effects 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- VZCYOOQTPOCHFL-OWOJBTEDSA-L fumarate(2-) Chemical class [O-]C(=O)\C=C\C([O-])=O VZCYOOQTPOCHFL-OWOJBTEDSA-L 0.000 description 1
- 239000000417 fungicide Substances 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 239000007903 gelatin capsule Substances 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 244000144993 groups of animals Species 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 239000003906 humectant Substances 0.000 description 1
- 150000003840 hydrochlorides Chemical class 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 208000037798 influenza B Diseases 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 150000007529 inorganic bases Chemical class 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 239000007951 isotonicity adjuster Substances 0.000 description 1
- 150000003903 lactic acid esters Chemical class 0.000 description 1
- 231100000518 lethal Toxicity 0.000 description 1
- 230000001665 lethal effect Effects 0.000 description 1
- 231100000053 low toxicity Toxicity 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- VTHJTEIRLNZDEV-UHFFFAOYSA-L magnesium dihydroxide Chemical compound [OH-].[OH-].[Mg+2] VTHJTEIRLNZDEV-UHFFFAOYSA-L 0.000 description 1
- 239000000347 magnesium hydroxide Substances 0.000 description 1
- 229910001862 magnesium hydroxide Inorganic materials 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 150000002688 maleic acid derivatives Chemical class 0.000 description 1
- 150000002690 malonic acid derivatives Chemical class 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 238000002483 medication Methods 0.000 description 1
- LWJROJCJINYWOX-UHFFFAOYSA-L mercury dichloride Chemical compound Cl[Hg]Cl LWJROJCJINYWOX-UHFFFAOYSA-L 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-M methanesulfonate group Chemical class CS(=O)(=O)[O-] AFVFQIVMOAPDHO-UHFFFAOYSA-M 0.000 description 1
- 244000000010 microbial pathogen Species 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 235000010755 mineral Nutrition 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 125000004370 n-butenyl group Chemical group [H]\C([H])=C(/[H])C([H])([H])C([H])([H])* 0.000 description 1
- 150000002823 nitrates Chemical class 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- OIPZNTLJVJGRCI-UHFFFAOYSA-M octadecanoyloxyaluminum;dihydrate Chemical compound O.O.CCCCCCCCCCCCCCCCCC(=O)O[Al] OIPZNTLJVJGRCI-UHFFFAOYSA-M 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 229920001542 oligosaccharide Polymers 0.000 description 1
- 150000002482 oligosaccharides Chemical class 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 150000002895 organic esters Chemical class 0.000 description 1
- 229960003104 ornithine Drugs 0.000 description 1
- 229960003752 oseltamivir Drugs 0.000 description 1
- 150000003901 oxalic acid esters Chemical class 0.000 description 1
- AICOOMRHRUFYCM-ZRRPKQBOSA-N oxazine, 1 Chemical compound C([C@@H]1[C@H](C(C[C@]2(C)[C@@H]([C@H](C)N(C)C)[C@H](O)C[C@]21C)=O)CC1=CC2)C[C@H]1[C@@]1(C)[C@H]2N=C(C(C)C)OC1 AICOOMRHRUFYCM-ZRRPKQBOSA-N 0.000 description 1
- 150000002942 palmitic acid derivatives Chemical class 0.000 description 1
- 244000052769 pathogen Species 0.000 description 1
- 239000008024 pharmaceutical diluent Substances 0.000 description 1
- 235000021317 phosphate Nutrition 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 239000011736 potassium bicarbonate Substances 0.000 description 1
- 229910000028 potassium bicarbonate Inorganic materials 0.000 description 1
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Substances [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 1
- 229910000027 potassium carbonate Inorganic materials 0.000 description 1
- 159000000001 potassium salts Chemical class 0.000 description 1
- ANBFRLKBEIFNQU-UHFFFAOYSA-M potassium;octadecanoate Chemical class [K+].CCCCCCCCCCCCCCCCCC([O-])=O ANBFRLKBEIFNQU-UHFFFAOYSA-M 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 125000004368 propenyl group Chemical group C(=CC)* 0.000 description 1
- 125000002568 propynyl group Chemical group [*]C#CC([H])([H])[H] 0.000 description 1
- 239000011535 reaction buffer Substances 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 210000001533 respiratory mucosa Anatomy 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 150000003902 salicylic acid esters Chemical class 0.000 description 1
- 150000004760 silicates Chemical class 0.000 description 1
- CDBYLPFSWZWCQE-UHFFFAOYSA-L sodium carbonate Substances [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- 239000012312 sodium hydride Substances 0.000 description 1
- 229910000104 sodium hydride Inorganic materials 0.000 description 1
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 1
- 230000003381 solubilizing effect Effects 0.000 description 1
- 239000004334 sorbic acid Substances 0.000 description 1
- 229940075582 sorbic acid Drugs 0.000 description 1
- 235000010199 sorbic acid Nutrition 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 150000003900 succinic acid esters Chemical class 0.000 description 1
- 150000005846 sugar alcohols Polymers 0.000 description 1
- IIACRCGMVDHOTQ-UHFFFAOYSA-N sulfamic acid Chemical class NS(O)(=O)=O IIACRCGMVDHOTQ-UHFFFAOYSA-N 0.000 description 1
- 150000003467 sulfuric acid derivatives Chemical class 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 201000010740 swine influenza Diseases 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 150000003899 tartaric acid esters Chemical class 0.000 description 1
- GCMMHBRAPKXXJF-UHFFFAOYSA-N tert-butyl n-carbamothioyl-n-[(2-methylpropan-2-yl)oxycarbonyl]carbamate Chemical compound CC(C)(C)OC(=O)N(C(N)=S)C(=O)OC(C)(C)C GCMMHBRAPKXXJF-UHFFFAOYSA-N 0.000 description 1
- 150000005622 tetraalkylammonium hydroxides Chemical class 0.000 description 1
- CBXCPBUEXACCNR-UHFFFAOYSA-N tetraethylammonium Chemical compound CC[N+](CC)(CC)CC CBXCPBUEXACCNR-UHFFFAOYSA-N 0.000 description 1
- QEMXHQIAXOOASZ-UHFFFAOYSA-N tetramethylammonium Chemical compound C[N+](C)(C)C QEMXHQIAXOOASZ-UHFFFAOYSA-N 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical class CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 1
- 239000000196 tragacanth Substances 0.000 description 1
- 235000010487 tragacanth Nutrition 0.000 description 1
- 229940116362 tragacanth Drugs 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 210000002845 virion Anatomy 0.000 description 1
- 239000008215 water for injection Substances 0.000 description 1
- 238000005303 weighing Methods 0.000 description 1
- 239000013585 weight reducing agent Substances 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
- UGZADUVQMDAIAO-UHFFFAOYSA-L zinc hydroxide Chemical compound [OH-].[OH-].[Zn+2] UGZADUVQMDAIAO-UHFFFAOYSA-L 0.000 description 1
- 229940007718 zinc hydroxide Drugs 0.000 description 1
- 229910021511 zinc hydroxide Inorganic materials 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C279/00—Derivatives of guanidine, i.e. compounds containing the group, the singly-bound nitrogen atoms not being part of nitro or nitroso groups
- C07C279/16—Derivatives of guanidine, i.e. compounds containing the group, the singly-bound nitrogen atoms not being part of nitro or nitroso groups having nitrogen atoms of guanidine groups bound to carbon atoms of rings other than six-membered aromatic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/16—Antivirals for RNA viruses for influenza or rhinoviruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/12—Systems containing only non-condensed rings with a six-membered ring
- C07C2601/16—Systems containing only non-condensed rings with a six-membered ring the ring being unsaturated
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Virology (AREA)
- Animal Behavior & Ethology (AREA)
- Pulmonology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Communicable Diseases (AREA)
- Molecular Biology (AREA)
- Oncology (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
ÁCIDOS (3R, 4R, 5S)-5-GUANIDINO-4-ACETAMIDO-3-(PENTAN-3- ILOXI)CICLOEXENO-1-CARBOXÍLICOS FLÚOR SUBSTITUÍDOS, OS SEUS ÉSTERES, COMPONENTE ATIVO, COMPOSIÇÃO FARMACÊUTICA, MÉTODO E USO DOS MESMOS. A presente invenção se refere a nova atividade de inibidores de neuraminidase e ao uso dos mesmos para a profilaxia e o tratamento de infecções por influenza, ou seja, a ácidos 4-acetamido-5-guan idino-3-(pentan-3- iloxi)ciclohexeno-1- carboxílico fluoro substituídos, os seus ésteres de fórmula geral 1, os sais e/ou os hidratos farmaceuticamente aceitáveis dos mesmos, em que R representa hidrogênio, alquila C1-C5, alqu enila C2-C5 ou alquinila C2-C5 opcionalmente substituída; Rf representa CH2F ou CHF2. São propostos uma composição farmacêutica, um método para a sua preparação, assim como método para a profilaxia e o tratamento de doenças virais.
Description
[001]A presente invenção se refere a novos compostos - ácidos (3R, 4R, 5S)-5-guanidino-4-acetamido-3-(pentan-3-iloxi)cicloexeno-1-carboxílicos flúorsubstituídos e os seus ésteres inibidores de atividade de neuraminidase.
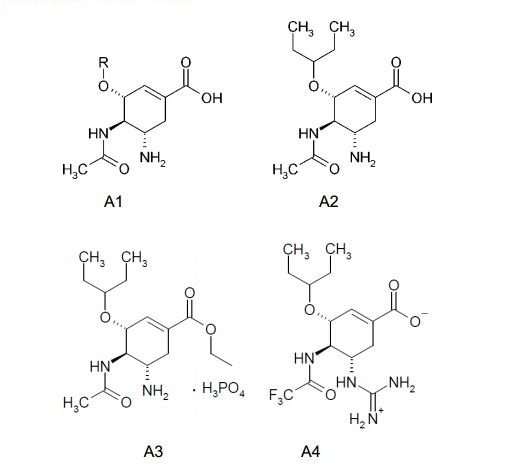
[002]Muitos micro-organismos que compreendem neuraminidase são patogênicos a seres humanos e animais tais como frango, cavalos, porcos e focas. Os referidos micro-organismos patogênicos incluem o vírus da influenza. Neuraminidase está associada com a patogenicidade do vírus da influenza.
[003]Em relação a isso novos ácidos (3R, 4R, 5S)-5-guanidino-4-acetamido- 3-(pentan-3-iloxi)cicloexeno-1-carboxílicos flúor substituídos e os seus ésteres são de grande preocupação como substâncias de fármaco para medicamentos pretendidos para a profilaxia e o tratamento da influenza. Os inibidores de neuraminidase conhecidos são os ácidos (3R, 4R, 5S)-4-acetamido-5-amino-3- alquiloxi- cicloexeno-1-carboxílicos A1, dos referidos, o mais ativo dos mesmos é o ácido (3R, 4R, 5S)-4-acetamido-5-amino-3-(pentan-3-iloxi)cicloexeno-1-carboxílico A2, o qual, como foi mostrado por dados de difração de raio X por seu complexo com neuraminidase do vírus da influenza, é efetivamente ligado ao o centro ativo da enzima (Oseltamivir Carboxilato) [C. U. Kim, W. Lew, M. A. Williams, et al. J. Am. Chem. Soc. 1997, 119, 681 - 690.].
[004]Éster etílico do ácido Oseltamivir carboxílico A3, conhecido como Oseltamivir Fosfato ou Tamiflu (Oseltamivir Fosfato, Tamiflu) [J. C. Rohloff, K. M. Kent, M. J. Postich, et al. J. Org. Chem. 1998, 63, 4545.], é um precursor medicinal do Oseltamivir carboxilato A2.
[005]É também conhecido o ácido (3R, 4R, 5S)-5-guanidino-4- trifluoroacetamido-3-(pentan-3-iloxi)cicloexeno-1-carboxílico A4, que exibe atividade em direção de neuraminidase do vírus da influenza H5N1 [Q.-S. Du, R.-B. Huang, Y.-T. Wei, Z.-W. Pa, L.-Q. Du, K.-C. Chou. Fragment-Based Quantitative Structure- Activiti Relationship (FB-QSAR) for Fragment-Based Drug Design. J. Comput. Chem. 2008, 30(2), 295-304].
[006]O ácido (2R, 3R, 4S)-3-Acetamido-4-guanidino-2-((1R, 2R)-1,2,3- trihidroxipropil)-3,4-dihidro-2if-piran-6-carboxílico (zanamivir) é conhecido por ser ativo contra neuraminidases dos vírus da influenza A e B, e também neuraminidase do vírus da influenza H1N1 [J. M. Woods, R. C. Betell, J. A. Coatos, et al. O ácido 4- Guanidino-2,4-dideoxi-2,3-dehidro-N-acetilneurâmico é um inibidor altamente eficaz não só da sialidase (neuraminidase) mas também do desenvolvimento de uma grande gama do vírus de influenza A e B em vitro. Antimicrob Agentes Chemoutro. 1993, 377, 1473 - 1479].
[007]Pesquisando por medicamentos altamente eficazes anti-influenza, dentre outras coisas que exibem maior atividade em direção do vírus resistentes da influenza, ainda permanece uma das maiores tendências no desenvolvimento de novos remédios farmacológicos para o tratamento da influenza. Nesse contexto, a configuração de novos ingredientes, composições farmacêuticas e medicamentos anti-influenza, assim como métodos para a preparação dos mesmos e o seu uso é de atual interesse.
[008]No contexto da presente invenção, os termos são em geral definidos como a seguir:
[009]"Alquenila" quer dizer uma cadeia de hidrocarboneto retilínea ou ramificada alifática, que compreendem 2-7 átomos de carbono e incluindo pelo menos uma ligação dupla carbono-carbono. Ramificado quer dizer que uma cadeia retilínea alquenila contém um ou mais grupos alquila inferiores, tais como metila, etila ou propila. Grupo alquila pode ter um ou mais substituintes, por exemplo, halogênio, alqueniloxi, cicloalquila, ciano, hidroxi, alcoxi, carboxi, alquiniloxi, aralcoxi, ariloxi, ariloxicarbonila, alquiltio, heteroaralquiloxi, heterociclila, heterociclilalquiloxi, alcoxicarbonila, aralcoxicarbonila, heteroaralquiloxicarbonila ou RkaRk+1aN-, RkaRk+1aNC(=0)-, RkaRk+1aNSO2-, onde Rka e Rk+1a independentemente um do outro representa "substituinte de grupo amino" os significados dos quais são definidos na presente seção, tais como hidrogênio, alquila, arila, aralquila, heteroaralquila, heterociclila ou heteroarila, ou Rka e Rk+1a juntos com o átomo de nitrogênio os mesmos são fixados para formar através de Rka e Rk+1a heterociclila ou heterociclenila de 4-7 membros. Os grupos alquila preferidos são metila, trifluorometila, ciclopropilmetila, ciclopentilmetila, etila, n-propila, iso-propila, n-butila, terc-butila, n-pentila, 3-pentila, metoxietila, carboximetila, metoxicarbonilmetila, benziloxicarbonilmetila e piridilmetiloxicarbonilmetila. Os grupos alquenila preferidos são etenila, propenila, n-butenila, iso-butenila, 3-metilbut-2-enila, n-pentenila e cicloexilbutenila.
[010]"Alquila" quer dizer uma cadeia de hidrocarboneto alifática retilínea ou ramificada com 1-12 átomos de carbono. Ramificado quer dizer a cadeia alquila com pelo menos um ou mais substituintes de "alquila inferior". Grupo alquila pode ter um ou mais substituintes de mesma estrutura ou estrutura diferente ("substituinte alquila") incluindo halogênio, alqueniloxi, cicloalquila, arila, heteroarila, heterociclila, aroila, ciano, hidroxi, alcoxi, carboxi, alquiniloxi, aralcoxi, ariloxi, ariloxicarbonila, alquiltio, heteroariltio, aralquiltio, arilsulfonila, alquilsulfonilheteroaralquiloxi, heteroarilcicloalquenila anelada, heteroarilcicloalquila anelada, heteroarilheterociclenila anelada, heteroarilheterociclila anelada, arilcicloalquenila anelada, arilcicloalquila anelada, arilheterociclenila anelada, arilheterociclila anelada, alcoxicarbonila, aralcoxicarbonila, heteroaralquiloxicarbonila ou RkaRk+1aN-, RkaRk+1aNC(=0)-, RkaRk+1aNC(=S)-, RkaRk+1aNSO2-, onde Rka e Rk+1a independentemente um do outro representa "substituinte de grupo amino" os significados dos quais são definidos na presente seção, por exemplo, hidrogênio, alquila, arila, aralquila, heteroaralquila, heterociclila ou heteroarila, ou Rka e Rk+1a juntos com o N-átomo, os mesmos são fixados para formar através de Rka e Rk+1a heterociclila ou heterociclenila de 4-7 membros. Os grupos alquila preferidos são metila, trifluorometila, ciclopropilmetila, ciclopentilmetila, etila, n-propila, iso-propila, n-butila, terc-butila, n-pentila, 3-pentila, metoxietila, carboximetila, metoxicarbonilmetila, etoxicarbonilmetila, benziloxicarbonilmetila e piridilmetiloxicarbonilmetila. Os "alquila substituintes" preferidos são cicloalquila, arila, heteroarila, heterociclila, hidroxi, alcoxi, alcoxicarbonila, aralcoxi, ariloxi, alquiltio, heteroariltio, aralquiltio, alquilsulfonila, arilsulfonila, alcoxicarbonila, aralcoxicarbonila, heteroaralquiloxicarbonila ou RkaRk+1aN-, RkaRk+1aNC(=O)-, arilheterociclenila anelada e arilheterociclila anelada.
[011]"Alquinila" quer dizer uma cadeia de hidrocarboneto alifática retilínea ou ramificada com 2-12 átomos de carbono e incluindo pelo menos uma ligação tripla carbono-carbono. Ramificado quer dizer que cadeia retilínea de alquinila contém pelo menos um ou mais grupos alquila inferiores, tais como metila, etila ou propila. Grupo alquila pode ter um ou mais substituintes, por exemplo, halogênio, alqueniloxi, cicloalquila, ciano, hidroxi, alcoxi, alquiniloxi, aralcoxi, ariloxi, ariloxicarbonila, alquiltio, heteroaralquiloxi, heterociclila, heterociclilalquiloxi, alcoxicarbonila, aralcoxicarbonila, heteroaralquiloxicarbonila ou RkaRk+1aN-, RkaRk+1aNC(=O)-, RkaRk+1aNSO2-, onde Rka e Rk+1a independentemente um do outro representa "amino grupo substituintes", os significados dos quais são definidos na presente seção, tais como hidrogênio, alquila, arila, aralquila, heteroaralquila, heterociclila ou heteroarila, ou Rka e Rk+1a juntos com o N-átomo os mesmos são fixados para formar através de Rka e Rk+1a heterociclila ou heterociclenila de 4-7 membros. Os grupos alquila preferidos são metila, trifluorometila, ciclopropilmetila, ciclopentilmetila, etila, n-propila, iso-propila, n-butila, terc-butila, n-pentila, 3-pentila, metoxietila, carboximetila, metoxicarbonilmetila, benziloxicarbonilmetila e piridilmetiloxicarbonilmetila. Os grupos alquinila preferidos são etinila, propinila, n- butinila, iso-butinila, 3-metilbut-2-inila, n-pentinila, bute-1,3-diinila e hexa-1,3,5-triinila.
[012]"Hidrato" quer dizer composições estequiométricas ou não estequiométricas de compostos ou dos seus sais com água.
[013]"Componente ativo" (fármaco-substância) quer dizer um composto fisiologicamente ativo de origem sintética ou de outra origem (biotecnológica, vegetal, animal, micróbio e assim por diante) que exibe atividade farmacológica que é um ingrediente ativo de composição farmacêutica empregado na produção e preparação de medicamentos.
[014]"Medicamento" - é um composto (ou uma mistura de compostos como uma composição farmacêutica) na forma de tabletes, cápsulas, injeções, unguentos, e outras formas prontas pretendidas para a restauração, aprimoramento ou modificação das funções fisiológicas em seres humanos e animais, e para o tratamento e profilaxia de doenças, para diagnósticos, anestesia, contracepção, cosmetologia e outros.
[015]"Neuraminidase" (sialidase, acilneuraminile hidrolase e EC 3.2.1.18) é uma enzima comum para animais e para um número de micro-organismos. A mesma representa glicohidrolase que cliva as ligações glicosídicas dos ácidos neurâmicos em glicoproteínass, glicolipídeos e oligossacarídeos. Muitos dos microorganismos que compreendem neuraminidase, são patogênicos a seres humanos e animais tais como frango, cavalos, porcos e focas. Os referidos organismos patogênicos incluem vírus da influenza. Neuraminidase é associada com a patogenicidade do vírus da influenza. Presumivelmente a mesma contribui para a elução de vírions recentemente sintetizados a partir de células infectadas e ao movimento do vírus (em virtude da sua atividade de hidrolase) através da túnica mucosa respiratória.
[016]"Composição farmacêutica" quer dizer uma composição que compreende um composto de fórmula geral I e pelo menos um dos componentes selecionados a partir do grupo que consiste de elementos farmaceuticamente aceitáveis e farmacologicamente compatíveis tais como cargas, solventes, diluentes, veículos, agentes auxiliares, de distribuição e excipientes, agentes de envio, tais como conservantes, estabilizantes, cargas, desintegrantes, umectantes, emulsificantes, agentes de suspensão, espessantes, adoçantes, agentes flavorizantes, agentes aromatizantes, agentes antibacterianos, fungicidas, lubrificantes, e controladores de envio prolongado, a escolha e as proporções adequadas dos quais depende do tipo e da via de administração e da dosagem. Exemplos de agentes de suspensão adequados são álcool de isoestearila etoxilado, polioxieteno, sorbitol e éter de sorbitol, celulose microcristalina, metahidróxido de alumínio, bentonita, agar-agar e tragacanto e as suas misturas também. Proteção contra a ação de micro-organismos pode ser proporcionada por vários agentes antibacterianos e antifúngicos, tais como, por exemplo, parabenos, clorobutanola, ácido sórbico, e compostos similares. A composição pode também compreender agentes isotônicos, tais como, por exemplo, açúcar, cloreto de sódio, e compostos similares. A ação prolongada da composição pode ser alcançada por agentes que diminuem a absorção de ingrediente ativo, por exemplo, monostearato de alumínio e gelatina. Exemplos de veículos, solventes, diluentes e agentes de envio adequados incluem água, etanol, poliálcoois e as suas misturas, óleos naturais (tais como óleo de oliva) e ésteres orgânicos injetáveis (tais como oleato de etila). Exemplos de cargas são lactose, açúcar do leite, citrato de sódio, carbonato de cálcio, fosfato de cálcio e semelhante. Exemplos de desintegrantes e distribuidores são amido, ácido algínico, os seus sais, e silicatos. Exemplos de lubrificantes adequados são estearato de magnésio, lauril sulfato de sódio, talco e polietileno glicol de alto peso molecular. A composição farmacêutica para a administração peroral, sublingual, transdermal, intramuscular, intravenosa, subcutânea, local ou retal de ingrediente ativo, isoladamente ou em combinação com outro composto ativo, pode ser administrada a seres humanos e animais em uma forma de administração padrão, ou em uma mistura com veículos farmacêuticos tradicionais. Formas de administração padrão adequadas incluem as formas perorais tais como tabletes, cápsulas de gelatina, pílulas, pós, grânulos, gomas de mascar e soluções e suspensões perorais; formas de administração sublingual e transbucal; aerossóis; implantes; formas locais, transdérmicas, subcutânea, intramuscular, intravenosa, intranasal ou intraocular e as formas de administração retais.
[017]"Sais farmaceuticamente aceitáveis" querem dizer os sais relativamente não tóxicos seja orgânico e inorgânico de ácidos e bases descritos na presente invenção. Os referidos sais podem ser preparados em situ nos processos de síntese, isolamento ou purificação dos compostos ou os mesmos podem ser preparados especialmente. Em particular, os sais de bases podem ser preparados a partir de uma base purificada do composto descrito e ácido orgânico ou mineral adequados. Exemplos de sais preparados desse modo incluem hidrocloretos, hidrobrometos, sulfatos, bisulfatos, fosfatos, nitratos, acetatos, oxalatos, valeriatos, oleatos, palmitatos, stearatos, lauratos, boratos, benzoatos, lactatos, p-toluenesulfonatos, citratos, maleatos, fumaratos, succinatos, tartratos, metano sulfonatos, malonatos, salicilatos, propionatos, etano sulfonatos, benzeno sulfonatos, sulfamatos e semelhante (A descrição detalhada das referidas propriedades dos sais é dada em: Berge S.M., et al., "Pharmaceutical Salts " J.Pharm.Sci., 1977, 66: 1-19). Os sais dos ácidos descritos podem também ser preparados pela reação de ácidos purificados especialmente com bases adequadas; ademais, os sais de metal e sais de amina podem ser sintetizados também. Os sais de metal são os sais de sódio, potássio, cálcio, bário, zinco, magnésio, lítio e alumínio; os sais de sódio e potássio sendo os preferidos. Bases inorgânicas adequadas a partir das quais os sais de metal podem ser preparados são hidróxido de sódio, carbonato, bicarbonato e hidreto; hidróxido de potássio, carbonato e bicarbonato; hidróxido de lítio, hidróxido de cálcio, hidróxido de magnésio, hidróxido de zinco. Bases orgânicas adequadas para a preparação dos sais de ácido descritos são as aminas e amino ácidos de base de resistência suficiente para produzir um sal estável que é adequado para uso de fim médico (em particular, os mesmos devem ser de baixa toxicidade). As referidas aminas incluem amônia, metilamina, dimetilamina, trimetilamina, etilamina, dietilamina, trietilamina, benzilamina, dibenzilamina, dicicloexilamina, piperazina, etilpiperidina, tris(hidroximetil)aminometano e semelhante. Além disso, os sais podem ser preparados usando algum hidróxido de tetraalquilamônia, tais como holina, tetrametilamônia, tetraetilamônia, e semelhante. Lisina, ornitina e arginina podem ser usadas como os aminoácidos altamente básicos.
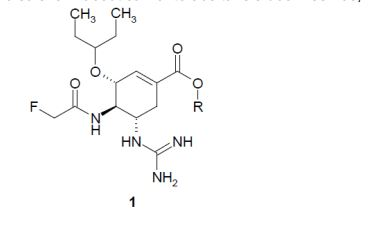
[018]Os autores observaram novos inibidores de neuraminidase que representam os desconhecidos anteriormente ácidos (3R, 4R, 5S)-4-acetamido-5- guanidino-3-(pentan-3-iloxi)cicloexeno-1-carboxílico e os seus ésteres de fórmula geral 1 e sais farmaceuticamente aceitáveis e/ou os hidratos dos mesmos, em que:R representa hidrogênio, opcionalmente substituída alquila C1-C5, alquenila C2-C5 ou alquinila C2-C5; Rf representa CH2F ou CHF2.
[019]Em comparação com a eficácia de Oseltamivir carboxilato A2 os novos compostos de fórmula geral 1, como os autores observaram inesperadamente, são inibidores muito mais eficientes de neuraminidase de algumas outras cepas de influenza por fator de 5-259 (Tabela 1).
[020]Tabela 1. Atividade de anti-neuraminidase do ácido (3R, 4R, 5S)-5- guanidino-4-fluoroacetamido-3-(pentan-3-iloxi)cicloexeno-1-carboxílico 1.1 eOseltamivir carboxilato A2 em um painel de cepas do vírus da influenza.
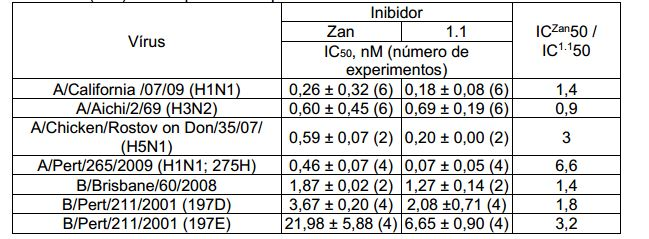
[021] Os novos compostos da fórmula geral, conforme os autores observaram, acabaram sendo inibidores mais eficazes de neuraminidase do vírus da influenza, em comparação com o Zanamivir (Zan) conhecido (Tabela 2).
[022]Tabela 2. Atividade de anti-neuraminidase de ácido (3R, 4R, 5S)-5- guanidino-4-fluoroacetamido-3-(pentan-3-iloxi)cicloexeno-1-carboxílico 1.1 eZanamivir (Zan) em um painel de cepas do vírus da influenza.
[023]Finalmente, os autores observaram que a comparação não só com Oseltamivir carboxilato mas também com Zanamivir os novos compostos são mais eficazes em cultura de células MDCK em direção do vírus das cepas de influenza Ia/Califórnia/07/09 (H1N1) e cepas altamente patogênicas Ia/pato/MN/1525/81 (H5N1) (Tabela 3). Em particular, o ácido (3R, 4R, 5S)-5-guanidino-4- fluoroacetamido-3-(pentan-3-iloxi)cicloexeno-1-carboxílico 1.1 é mais ativo do que o Oseltamivir carboxilato (A2) por um fator de 13 e Zanamivir (Zan) por um fator de 20 em direção da cepa Ia/Califórnia/07/09 (H1N1), e em direção da cepa altamente patogênica Ia/pato/MN/1525/81(H5N1) a sua atividade é maior do que aquela de Oseltamivir carboxilato e Zanamivir (Zan) em 24 e 16 vezes, respectivamente.
[024]O ácido (3R, 4R, 5S)-5-Guanidino-4-(2-trifluoroacetamido)-3-(pentan-3- iloxi)cicloexeno-1-carboxílico A4 mostrou atividade de neuraminidase em direção do vírus A/Califórnia/04/09 IC5o = 80 nM, e em direção do vírus A/Vladivostok/16/09 - IC50 > 1000 nM. O ácido (3R, 4R, 5S)-5-guanidino-4-fluoroacetamido-3-(pentan-3- iloxi)cicloexeno-1-carboxílico 1.1 anteriormente desconhecido tem atividade de neuraminidase em direção do vírus A/Califórnia/04/09 de 400 vezes maior do que a atividade de A4, e em direção do vírus A/Vladivostok/16/09 - os novos ácidos 1.1 têm IC50 = 4 nM, ou seja, os mesmos são mais ativos do que o seu análogo conhecido 4-(2-trifluoroacetamido) por um fator de 250. O ácido (3R, 4R, 5S)-5- Guanidino-4-(2-difluoroacetamido)-3-(pentan-3-iloxi)cicloexeno-1-carboxílico 1.4 é também mais ativo do que o seu análogo A4: a sua atividade de neuraminidase em direção do vírus A/Califórnia/04/09 corresponde a IC50 = 0.3 nM, (ou seja, é 2.7 vezes mais ativo do que A2 e 267 vezes mais ativo do que A4 ); em direção do vírus A/Vladivostok/16/09 - os novos ácidos 1.4 exibem uma IC50 = 7 nM (em outro palavras, é mais ativo do que A2 por um fator de 118 e por um fator de 140 do que A4).
[025]Tabela 3. Atividade específica do ácido (3R, 4R, 5S)-5-guanidino-4- fluoroacetamido-3-(pentan-3-iloxi)cicloexeno-1-carboxílico 1.1 em cultura celular MDCK em direção do vírus das cepas Ia/Califórnia/07/09 (H1N1) e da cepa altamente patogênica Ia/pato/MN/1525/81 (H5N1) em comparação com Oseltamivir carboxilato (A2) e Zanamivir (Zan).
[026]De acordo com a presente invenção os compostos preferidos são os compostos de fórmula geral 1, em que R representa hidrogênio, metila ou etila.
[027]De acordo com a presente invenção os compostos mais preferidos de fórmula geral 1 são: ácido (3R, 4R, 5S)-5-guanidino-4-fluoroacetamido-3-(pentan-3- iloxi)cicloexeno-1-caboxílico 1.1 e os seus ésteres de metila 1.2 e de etila 1.3; o ácido (3R, 4R, 5S)-5-guanidino-4-difluoroacetamido-3-(pentan-3-iloxi)cicloexeno-1- carboxílico 1.4 e os seus ésteres de metila 1.5 e de etila 1.6.
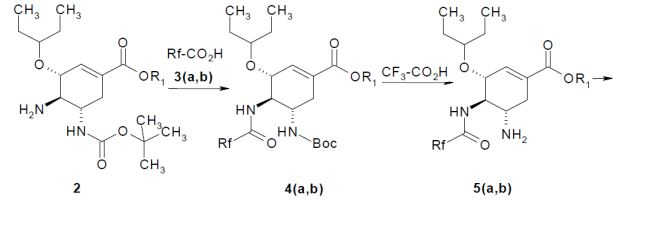
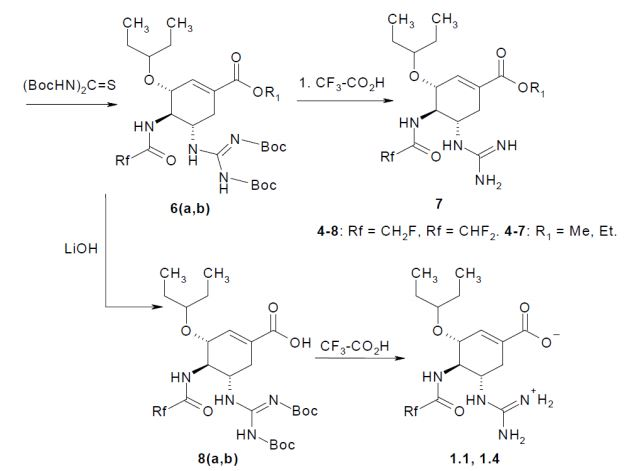
[028]Os inibidores de neuraminidases dos vírus da influenza de fórmulageral 1 podem ser preparados iniciando a partir de 4-amino-5-(terc- butoxicarbonilamino)-3-(pentan-3-iloxi)cicloexeno-1-carboxilato de alquila de fórmulageral 2 de acordo com o esquema mostrado abaixo:
[029]Os novos inibidores de neuraminidases dos vírus da influenza que representam os anteriormente desconhecidos ácidos (3R, 4R, 5S)-4-(2- fluoroacetamido)- e ácidos (3R, 4R, 5S)-4-(2,2-difluoroacetamido)-5-guanidino-3- (pentan-3-iloxi)cicloexeno-1-carboxílico e os seus ésteres de fórmula geral 1 e sais farmaceuticamente aceitáveis dos mesmos também mostrou alta atividade antiinfluenza em modelos de animais do vírus da influenza pneumonia.
[030]A atividade anti-neuraminidase dos compostos descritos foi determinada de acordo com o método descrito em [Who Collaborating Centre for Reference & Research on Influenza, Australia, Standard Operating Procedure WHO - 025. Reviewed by: Aeron Hurt, Senior Scientist Review Date: 13/3/2009].
[031]De acordo com a presente invenção os novos compostos de fórmula geral 1 representam um componente ativo para a preparação de composições farmacêuticas e formas de dosagem finais para a profilaxia e o tratamento de influenza em animais de sangue quente e em seres humanos.
[032]O objetivo da presente invenção é uma composição farmacêutica que compreende como componente ativo os compostos de fórmula geral 1 ou os sais farmaceuticamente aceitáveis dos mesmos em uma quantidade terapeuticamente eficaz.
[033]As composições farmacêuticas podem incluir excipientes farmaceuticamente aceitáveis. Excipientes farmaceuticamente aceitáveis quer dizer aplicado na esfera dos diluentes, auxiliares agentes e/ou veículos farmacêuticos. De acordo com a presente invenção a composição farmacêutica junta com um composto de fórmula geral 1 ou sal e/ou hidrato farmaceuticamente aceitável dos mesmos pode envolver outros componentes ativos incluindo os com atividade antiinfluenza, desde que os mesmos não causem efeitos indesejáveis.
[034]Se necessário, de acordo com a presente invenção a composição farmacêutica pode ser usada na prática clínica em várias formas preparadas perla mistura das referidas composições com veículos farmacêuticos tradicionais.
[035]De acordo com a presente invenção os veículos usados em composições farmacêuticas representam os veículos que são usados na esfera de produtos farmacêuticos para a preparação das formas comumente usadas: agentes de ligação, agentes lubrificantes, desintegrantes, solventes, diluentes, estabilizantes, agentes de suspensão, agentes incolores, aromatizantes de sabor são usados para as formas perorais; agentes antissépticos, solubilizantes, estabilizantes são usados em formas para injeções; materiais de base, diluentes, agentes lubrificantes, agentes antissépticos são usados em formas locais.
[036]O objetivo da presente invenção é um método para a preparação da composição farmacêutica ao se misturar a quantidade terapeuticamente eficaz de pelo menos um componente ativo de fórmula geral 1 ou do seu sal farmaceuticamente aceitável com uma carga inerte e/ou solvente.
[037]O objetivo da presente invenção é também um medicamento que exibe atividade anti-influenza na forma de tabletes, cápsulas ou injeções dispostas em uma embalagem farmaceuticamente aceitável e pretendida para a profilaxia e tratamento de influenza em seres humanos e animais de sangue quente e que compreendem uma quantidade terapeuticamente eficaz dos novos componentes ativos de fórmula geral 1 ou uma composição farmacêutica que compreendem os novos componentes ativos de fórmula geral 1.
[038]O objetivo da presente invenção é também kits terapêuticos para o tratamento de influenza incluindo como um dos componentes os novos medicamentos ou as novas composições farmacêuticas que compreendem como um componente ativo, pelo menos um composto de fórmula geral 1 ou sal e/ou hidrato farmaceuticamente aceitável dos mesmos.
[039]De acordo com a presente invenção, junto com os novos medicamentos o kit terapêutico para o tratamento influenza pode incluir outros medicamentos conhecidos pretendidos para o tratamento de influenza ou medicamentos que reforçam o sistema imune do paciente.
[040]De acordo com a presente invenção o método para a profilaxia e tratamento de influenza em seres humanos e animais consiste na administração dos novos medicamentos, a nova composição farmacêutica ou do novo kit terapêutico a um paciente.
[041]Os medicamentos descritos podem ser administrados por via peroral ou por via parenteral (por exemplo, intravenosa, subcutânea, intraperitoneal ou local) ou por meio de inalador. A dose clínica de um componente ativo de fórmula geral 1 pode ser corrida dependendo de: eficiência terapêutica e da biodisponibilidade dos ingredientes ativos no organismo do paciente, do coeficiente de sua troca e de sua remoção a partir do organismo, e da idade, do gênero, e da gravidade dos sintomas do paciente. Assim, a ingesta diária para adultos normalmente é de 10~500 mg, preferivelmente 50~300 mg. Embora a preparação de um medicamento como uma unidade de dosagem a partir da composição farmacêutica a dose eficaz acima deve ser levada em consideração, ou seja, cada unidade de dosagem do medicamento deve conter 10~500 mg, preferivelmente - 50 ~ 300 mg. Seguindo as instruções do médico ou farmacêutico, os medicamentos podem ser tomados diversas vezes em períodos de tempo especificados (preferivelmente, a partir de uma a seis vezes).
[042]O objetivo da presente invenção é também um método para a inibição da atividade de neuraminidase em vivo, incluindo neuraminidase do vírus da influenza, que compreende o estágio de contato da neuraminidase com um composto de fórmula geral 1.
[043]Abaixo a presente invenção é descrita por meio de exemplos específicos que ilustram, mas não limitam o âmbito da presente invenção.
[044]Exemplo 1. Preparação de (3R, 4R, 5S)-4-(2,2-difluoroacetamido)-5- guanidino-3-(pentan-3-iloxi)cicloexeno-1-carboxilato mesilato de etila 1.6.CH3SO3H. ácido 2,2-Difluoroacético 3b (0,624 g, 0,0065 mol, 1.2 eq) foi adicionado gota a gota a uma solução de (3R, 4R, 5S)-4-amino-5-(terc-butoxicarbonilamino)-3-(pentan-3- iloxi)cicloexeno-1-carboxilato de etila (2 g, 0,0054 mol, 1 eq.), 1H- benzo[d][1,2,3]tnazol-1-ol (0,867 g, 0,0065 mol, 1.2 eq.), A1-((etilimino)metileno)- A2,A2-dimetiletano-1,2-diamina hidrocloreto (1,239 g, 0,0065 mol, 1.2 eq.) e diisopropiletilamina (2,212 g, 0,0178 mol, 3,3 eq.) em THF (20 mL). A mistura de reação foi agitada a temperatura ambiente por 4 h. Então solventes foram evaporados em vácuo, o óleo residual foi dissolvido em acetato de etila, lavado com 5% de solução de NaHCO3, seco sobre Na2SO4, filtrado e evaporado em vácuo. Rendimento de (3R, 4R, 5S)-5-(terc-butoxicarbonilamino)-4-(2,2-difluoroacetamido)- 3-(pentan-3-iloxi)cicloexeno-1-carboxilato de etila 4b é 89% (2,15 g). LCMS (M+H): encontrado 449; calculado 448.51. O produto preparado 4b (2,15 g, 0,0048 mol) foi dissolvido em 10% de solução de ácido trifluoroacético em cloreto de metileno (20 ml) e agitada a temperatura ambiente por 12 h. Então os solventes foram evaporados em vácuo, o óleo residual foi dissolvido em acetato de etila, lavado com 5% de solução de NaHCO3, seco sobre Na2SO4, filtrado e evaporado em vácuo. Rendimento do produto é 96% (1,605 g). A purificação adicional foi realizada por meio de coluna de cromatografia com acetato de etila/THF como eluente, ou por recristalização do produto a partir de hexano. Foi proporcionado (3R, 4R, 5S)-5- amino-4-(2,2-difluoroacetamido)-3-(pentan-3-iloxi)cicloexeno-1-carboxilato de etila 5b, que foi dissolvido em cloreto de metileno e quantidade equivalente de ácido metanosulfônico foi adicionado. Em 10 min o solvente foi evaporado, o produto obtido foi lavado com hexano e seco em vácuo. O rendimento de mesilato 5b.CH3SO3H é 90%. LCMS (M+H): encontrado 349; calculado 348.39. 1H NMR (DMSOA), 400 MHz: 8.91 (d, J = 13.2 Hz, 1H), 7.83 (br, 3H), 6.74 (s, 1H), 6.22 (t, J = 54 Hz, 1H), 4.31 (d, J = 8.4 Hz, 1H), 4.16 (q, J = 7.2 Hz, 2H), 3.45 (m, 1H), 3.15 (dd, Ji = 11.2 Hz, J2 = 8.8 Hz, 1H), 2.59 (dd, Ji = 18 Hz, J2 = 6 Hz, 1H), 2.38 (m, 1H), 2.31 (s, 3H), 1.66 (m, 1H), 1.57 (m, 1H), 1.47 (m, 1H), 1.39 (m, 1H), 1.22 (t, J = 7.6 Hz, 3H), 0.891 (t, J = 7.2 Hz, 3H), 0.842 (t, J = 7.2 Hz, 3H). A uma solução de (3R, 4R, 5S)-5-amino-4-(2,2-difluoroacetamido)-3-(pentan-3-iloxi)cicloexeno-1-carboxilato de etila 5b (1,6 g; 0,004598 mol; 1eq.) em DMF (16 mL) resfriada em banho de gelo foram subsequentemente adicionados trietilamina (2.57 g; 0,0253 mol; 5.5 eq.), N,N- di-boc-tioureia (0,00505 mol; 1.35 g; 1.1eq.) e cloreto (II) de mercúrio (0,0055 mol; 1.49 g; 1.2 eq.). A mistura obtida foi agitada com resfriamento em banho de gelo por 1,5 h. após a reação ser concluída o sólido foi filtrado através de celite, DMF foi evaporado em vácuo, o óleo residual foi dissolvido em acetato de etila, lavado com 5% de solução de NaHCO3, seco sobre Na2SO4, filtrado e evaporado em vácuo. O mesmo proporcionou 1,82 g (67%) de (3R, 4R, 5S)-5-((Z)-2,3-bis(terc- butoxicarbonil)guanidino)-4-(2,2-difluoroacetamido)-3-(pentan-3-iloxi)cicloexeno-1- carboxilato de etila 6b. LCMS (M+H): encontrado 591; calculado 590,67. A solução de (3R, 4R, 5S)-5-((Z)-2,3-bis(terc-butoxicarbonil)guanidino)-4-(2,2-difluoroacetamido)-3-(pentan-3-iloxi)cicloexeno-1-carboxilato de etila 6b (1,82 g; 0,00308 mol) em 10% de solução de ácido trifluoroacético em cloreto de metileno (20 ml) foi agitada a temperatura ambiente por 12 h. Então os solventes foram evaporados em vácuo, o óleo residual foi dissolvido em acetato de etila, lavado com 5% de solução de NaHCO3, seco sobre Na2SO4, filtrado e evaporado em vácuo. O mesmo proporciona 1,1 g (92%) de (3R, 4R, 5S)-4-(2,2-difluoroacetamido)-5- guanidino-3-(pentan-3-iloxi)cicloexeno-1-carboxilato de etila1.6. A uma solução do produto preparado em cloreto de metileno em quantidade equivalente de ácido metanosulfônico foi adicionado. Em 10 min o solvente foi evaporado, o produto foi lavado com hexano e seco em vácuo. O mesmo proporciona (3R,4R,5S)-4-(2,2- difluoroacetamido)-5-guanidino-3-(pentan-3-iloxi)cicloexeno-1-carboxilato mesilato de etila 1.6-CH3SO3H, rendimento é 95%. LCMS (M+H): encontrado 391; calculado 390.43. 1H NMR (DMSOA), 400 MHz: 8.67 (d, J = 8.4 Hz, 1H), 7.63 (d, J = 9.6 Hz, 1H), 6.65 (s, 1H), 6.27 (t, J = 53.6 Hz, 1H), 4.14 (q, J = 7.2 Hz, 2H), 4.12 (m, 7H), 3.54 (m, 1H), 3.41 (m, 1H), 2.6 (m, 1H), 2.36 (s, 3H), 1.66 (m, 1H), 1.44 (m, 4H), 1.22 (t, J = 7.2 Hz, 3H), 0.856 (t, J = 7.6 Hz, 3H), 0.795 (t, J = 7.6 Hz, 3H).
[045]Em um modo similar ao composto 1.7 - (3R, 4R, 5S)-5-guanidino-4- (2,2-difluoroacetamido)-3-(pentan-3-iloxi)cicloexeno-1-carboxilato de alila (LCMS (M+H): encontrado 354; calculado 353.44, (em direção de A/Califórnia/04/09 vírus IC50 <1 nM) e composto 1.8 - prop-2-inila (3R, 4R, 5S)-5-guanidino-4-(2,2- difluoroacetamido)-3-(pentan-3-iloxi)cicloexeno-1-carboxilato (LCMS (M+H): encontrado 352; calculado 351,42, (em direção de A/Califórnia/04/09 vírus IC50 <1 nM), foram preparados quando como materiais de partida (como o composto 2) (3R,4R,5£)-4-amino-5-(terc-butoxicarbonilamino)-3-(pentan-3-iloxi)cicloexeno-1- carboxilato de alila e prop-2-inila (3R, 4R, 5S)--4-amino-5-(terc-butoxicarbonilamino)- 3-(pentan-3-iloxi)cicloexeno-1-carboxilato foram usados, respectivamente.
[046]Ao se usar o correspondente (3R, 4R, 5S)-4-amino-5-(terc- butoxicarbonilamino)-3-(pentan-3-iloxi)cicloexeno-1-carboxilato como o material de partida (composto 2) os compostos a seguir foram preparados:2-cicloexila (3R, 4R, 5S)-5-guanidino-4-(2,2-difluoroacetamido)-3-(pentan-3- iloxi)cicloexeno-1-carboxilato 1.9 (LCMS (M+H): encontrado 460; calculado 459.55, IC50 <1 nM em direção de A/Califórnia/04/09 vírus;2-feniletila (3R, 4R, 5S)-5-guanidino-4-(2,2-difluoroacetamido)-3-(pentan-3- iloxi)cicloexeno-1-carboxilato 1.10 (LCMS (M+H): encontrado 454; calculado 453.51, IC50 <1 nM em direção de A/Califórnia/04/09 vírus;2-piridin-3-iletila (3R, 4R, 5S)-5-guanidino-4-(2,2-difluoroacetamido)-3- (pentan-3-iloxi)cicloexeno-1-carboxilato 1,11 (LCMS (M+H): encontrado 455; calculado 454.49, IC50 <1 nM em direção de A/Califórnia/04/09 vírus);2-metoxietila (3R, 4R, 5S)-5-guanidino-4-(2,2-difluoroacetamido)-3-(pentan- 3-iloxi)cicloexeno-1-carboxilato 1,12 (LCMS (M+H): encontrado 422; calculado 421.46, IC50 <1 nM em direção de A/Califórnia/04/09 vírus).
[047]Exemplo 2. Mesilato de etila (3R, 4R, 5S)-4-(2-fluoroacetamido)-5- guanidino-3-(pentan-3-iloxi)cicloexeno-1-carboxilato 1.3.CH3SO3H foi preparado de acordo com o procedimento dado no exemplo 1 usando ácido monofluoroacético como agente de acilação. LCMS (M+H): encontrado 373; calculado 372.44.
[048]Exemplo 3. Ácido (3R, 4R, 5S)-4-(2,2-difluoroacetamido)-5-guanidino-3- (pentan-3-iloxi)cicloexeno-1-carboxílico 1.4. 5% de solução de hidróxido de lítio (2,5 mL) foi adicionado a uma solução de (3R, 4R, 5S)-5-((Z)-2,3-bis(terc- butoxicarbonil)guanidino-4-(2,2-difluoroacetamido)-3-(pentan-3-iloxi)cicloexeno-1- carboxilato de etila 6b (250 mg) em dioxano (5 mL) e a mistura de reação foi agitada a temperatura ambiente por 45 min. Então hidróxido de lítio foi passivado ao se adicionar ácido acético (300 mcl), e os solventes foram evaporados em vácuo. O sólido obtido foi extraído com álcool isopropílico, o extrato foi seco sobre Na2SO4 e evaporado em vácuo. O mesmo proporciona o ácido (3R,4R,5S)-5-((Z)-2,3-bis(terc- butoxicarbonil)guanidino)-4-(2,2-difluoroacetamido)-3-(pentan-3-iloxi)cicloexeno-1- carboxílico 8b (200 mg, 84%). LCMS (M+H): encontrado 563; calculado 562.62. o ácido obtido 8b (200 mg) foi dissolvido em 10% de solução de ácido trifluoroacético em cloreto de metileno (2 ml) e agitado a temperatura ambiente por 12 h. Então os solventes foram evaporados em vácuo. O ácido (3R, 4R, 5S)-4-(2,2- Difluoroacetamido)-5-guanidino-3-(pentan-3-iloxi)cicloexeno-1-carboxílico 1.4 foiseparado por método HPLC. LCMS (M+H): encontrado 363; calculado 362.28. 1H NMR (DMSOA), 400 MHz: 8.68 (d, J = 8.4 Hz, 1H), 7.6 (d, J = 10 Hz, 1H), 7.26 (br, 2H), 6.91 (br, 2H), 6.63 (s, 1H), 6.27 (t, J = 53.6 Hz, 1H), 4.18 (d, J = 8 Hz, 2H), 4.09 (m, 1H), 3.54 (q, J = 10 Hz, 1H), 3.39 (m, 2H), 2.57 (dd, Ji = 18 Hz, J2 = 6 Hz, 1H), 2.31 (m, 1H), 1.44 (m, 4H), 0.85 (t, J = 8 Hz, 3H), 0.795(t, J = 7.6 Hz, 3H).
[049]Exemplo 4. O ácido (3R, 4R, 5S)-4-(2-fluoroacetamido)-5-guanidino-3- (pentan-3-iloxi)cicloexeno-1-carboxílico 1.1 foi preparado de acordo com o procedimento dado no exemplo 3. LCMS (M+H): encontrado 345; calculado 345. 1H NMR (DMSOA), 400 MHz: 8.16 (d, J = 10 Hz, 1H), 7.56 (d, J = 9.6 Hz, 1H), 6.64 (s, 1H), 4.80 (d, J = 47.3 Hz, 2H), 4.21 (d, J = 8.4 Hz, 1H), 3.89 (q, J = 10.4 Hz, 1H), 3.71 (m, 1H), 2.67 (m, 1H), 2.25 (m, 1H), 1.42 (m, 4H), 0.85 (t, J = 7.2 Hz, 3H), 0.78 (t, J = 7.2 Hz, 3H).
[050]Exemplo 5. Mesilato de metila (3R, 4R, 5S)-4-(2-fluoroacetamido)-5- guanidino-3-(pentan-3-iloxi)cicloexeno-1-carboxilato 1.2.CH3SO3H foi preparado de acordo com o procedimento dado no exemplo 1 usando m(3R, 4R, 5S)-4-amino-5- (terc-butoxicarbonilamino)-3-(pentan-3-iloxi)cicloexeno-1-carboxilato de etila como o material de partida e ácido monofluoroacético como o agente de acilação. LCMS (M+H): encontrado 359; calculado 358.42.
[051]Exemplo 6. Mesilato de m(3R, 4R, 5S)-4-(2,2-difluoroacetamido)-5- guanidino-3-(pentan-3-iloxi)cicloexeno-1-carboxilato de etila 1.5.CH3SO3H foi preparado de acordo com o procedimento dado no exemplo 1 usando m(3R, 4R, 5S)-4-amino-5-(terc-butoxicarbonilamino)-3-(pentan-3-iloxi)cicloexeno-1-carboxilato de etila como o material de partida e ácido difluoroacético como o agente de acilação. LCMS (M+H): encontrado 373; calculado 372.44.
[052]Exemplo 7. Preparação de composição farmacêutica na forma de tabletes.
[053]Amido (1600 mg), lactose triturada (1600 mg), talco (400 mg) e ácido (3R, 4R, 5S)-4-(2-fluoroacetamido)-5-guanidino-3-(pentan-3-iloxi)cicloexeno-1- carboxílico 1.1 (1000 mg) foram cuidadosamente misturados juntos e prensados em um tijolo. O tijolo preparado foi triturado em grânulos e passado através de peneiras, capturando grânulos de 14-16 de tamanho de malha. Os grânulos obtidos foram granulados em tabletes de forma adequados de 560 mg por peso cada.
[054]Exemplo 8. Preparação de composição farmacêutica em forma de cápsula.
[055]O ácido (3R, 4R, 5S)-4-(2-fluoroacetamido)-5-guanidino-3-(pentan-3- iloxi)cicloexeno-1-carboxílico 1.1 foi cuidadosamente misturado com um pó de lactose em uma proporção de 2:1a mistura em pó preparada foi embalada em cápsulas gelatinosas de tamanho adequado por 300 mg cada .
[056]Exemplo 9. Preparação de composição farmacêutica em forma de injeção para injeções intramusculares, intraperitoneais ou subcutâneas. O ácido (3R, 4R, 5S)-4-(2-fluoroacetamido)-5-guanidino-3-(pentan-3-iloxi)cicloexeno-1-carboxílico 1.1 (500 mg) foi misturado com clorobutanol (300 mg), propileno glicol (2 ml) e água injetável (100 mL). A solução resultante foi filtrada e disposta em ampolas de 1 mL que foram seladas.
[057]Exemplo 10. Determinação da atividade em direção de neuraminidase do vírus da influenza para os compostos de fórmula geral 1. Em experimentos preliminares diluições para as cepas de vírus alantóicos de influenza A/Califórnia/07/09 (H1N1) e A/Aichi/2/69 (H3N2) assim como para os vírus resistentes da influenza A/Vladivostok/16/09 (H1N1) que foi preparado em cultura celular oseltamivir foram determinados. Para esse propósito em uma placa de 96 cavidades com um fundo arredondado por 60 pl de cada vírus diluído 2 vezes na mistura de tampão de reação (RBM, 50 mM MES, 5 mM CaCb, pH 6.5) foram preparados. A partir da referida placa por 50 pl de vírus diluído 2 vezes foi transferida em placas de 96 cavidades com fundo arredondado para medição de fluorescência (FluoroNunc, black, kat. No. 237105), então, um volume igual de tampão de substrato (SB, 12,5 mM de ácido 2'-(4-metilumbelliferil)-a-D-N- acetilneurâmico, Sigma, 40 mM de tampão de acetato pH = 5,8) foi adicionado aos mesmos. Como controle, foram usadas as cavidades de cada um dos quais por 50 pl de RBM foi adicionado em vez do vírus. Após a incubação da placa em agitação suave por 1 h a 37°, 100 pl de solução de interrupção (2.225 mL de 0.824M NaOH em 11,0 mL de etanol) foi adicionado a cada cavidade, que foi seguido por medição de fluorescência a Aex =360 nm e Aem= 448 nm usando o instrumento Varioskan Flach (Thermo Scientific). Para experimentos adicionais foram escolhidas as diluições de vírus, que corresponderam ao meio da seção linear da curva de influência: diluição de vírus contra valor de fluorescência. Para a determinação de atividade de anti-neuraminidase diluições dos compostos descritos e de seus análogos das fórmulas A2 e A4 (por 50 pl, preparados com RBM) foram adicionadas ás cavidades de fileiras a partir de B a H (concentrações usadas - 0,03; 0.3; 3; 30; 300; 3000; 30000 nM - cada concentração em uma fileira) em placas de 96 cavidades com fundo chato para a medição de fluorescência (FluoroNunc, black, kat. No. 237105). As cavidades da fileria A foram usadas como o controle de vírus a qual em vez do vírus o volume igual (50 pl) de RBM foi adicionado. Então às cavidades correspondentes foram adicionadas por 50 pl das diluições de trabalho escolhidas (RBM) de cada vírus. Como o controle as cavidades foram usadas às quais em vez do vírus o volume igual de RBM foi adicionado. Após agitação e incubação a temperatura ambiente por 45 min a todas as cavidades o volume igual de RBM foi adicionado. Após agitação e incubação repetida a placa a 37° por 1h solução de interrupção em uma quantidade de 100 pl foi adicionada a cada cavidade. Medição de fluorescências foi feita a Aex =360 nm e A,em=448 nm com o uso do instrumento Varioskan Flach (Thermo Scientific). Todas as determinações foram realizadas pelo menos em duplicata (duas cavidades da placa). O percentual de inibição da atividade de neuraminidase por composto testado de fórmula geral 1 foi calculado pela fórmula: inibição % = 100-(SUF experimento - SUF controle / SUF controle de vírus na ausência do composto - SUF controle), onde SUF é uma unidade padrão de fluorescência). A concentração de um composto no qual o valor SUF foi reduzido por 50% foi tido como a concentração de inibição 50 (IC50).
[058]Exemplo 11. Investigação de atividade anti-influenza de compostos de fórmula geral 1 (1.1., 1.3., 1.4 e 1.6) no modelo de influenza pneumonia em camundongos. Camundongos pré-pesados (fêmea não linear, peso médio 12-15 g) foram infectados com vírus da influenza A/Aichi/2/69 (H3N2) (10 LD50 em 50 pl) por meio de introdução intranasal sob anestesia leve com éter. A determinação de LD50 foi realizada em um experimento preliminar por meio da titulação do vírus alontóico usando o mesmo camundongo que o posteriormente foram usados no experimento principal. O esquema de tratamento a seguir foi usado: os animais foram injetados duas vezes: 24 h e 1 h antes da infecção, em 24 h após a infecção e então 1 vez ao dia durante os próximos 5 dias. Para a administração oral lima seringa de insulina descartável com uma agulha especial (lavagem) foi usada; o efeito das doses a seguir foi investigado: 25 mg/kg/dia de cada composto em um volume de 100 pl. como um composto de referência foi usado Tamiflu em doses que variaram a partir de 5 mg/kg/dia a 30 mg/kg/dia. Houveram 10 animais no grupo de "controle de vírus", assim como em cada grupo de animais "tratados com os compostos" de fórmula geral 1 ou Tamiflu de formula A3. Os animais "tratados" e de controle foram observados diariamente; durante os primeiros 5 dias após a infecção os mesmos foram pesados a cada dia, e posteriormente - em um dia. A atividade quimioterapêutica dos compostos no modelo de influenza pneumonia em camundongos foi estimada pelo índice de proteção contra infecção viral letal e por perda de peso nos grupos de animais tratados com os compostos testados em comparação com oi peso dos animais no grupo de controle. A redução ou o aumento de peso foi calculado para cada camundongo individualmente e expressos em percentual. O peso dos animais antes a infecção foi tido como 100%. Para todos os animais de um grupo o percentual médio de perda de peso assim como o ganho de peso foi determinado.
[059]Em um experimento preliminar a dose do vírus contendo 10 LD50 em volume de 100 pl foi determinada. Então todos os animais do grupo foram infectados com a referida dose. A eficácia dos compostos de fórmula geral 1 no modelo de influenza pneumonia em camundongos foi estimada pelo número de animais que sobreviveram após a infecção por vírus, pelo tempo de vida médio e pelas mudanças de peso dos animais infectados.
[060]Foi observado que no 7 dia de observação todos os camundongos infectados com vírus e não tratados com os compostos testados (grupo de "controle de vírus") morreram.
[061]Os experimentos mostraram que na ocasião em que o último animal do grupo de "controle de vírus" morreu os animais tratados com compostos de fórmula geral 1 e Tamiflu ("tratado com os compostos") foram completamente prevenidos.
[062]A ação anti-influenza dos compostos testados de fórmula geral 1 e Tamiflu de formula A3 consiste em reduzir a perda de peso em grupos de "camundongos tratados " em comparação com o grupo de "controle de vírus". A perda de peso do animal é uma das implicações clínicas de influenza pneumonia. O curso mais severo da doença é sempre acompanhado por perda de peso preponderante do animal. A pesagem foi realizada nos dias 1, 2, 3, 4 e 5 após a infecção, então a cada dia sim dia não até o 15 dia de observação. Foi observado que os animais do grupo de “controle de vírus" a maior parte da perda de peso foi observada no 5 dia após a infecção (cerca de 10%). De modo diferente com os animais do grupo de "controle de vírus" os animais tratados com os compostos de fórmula geral 1 e Tamiflu, em média, não tiveram perda de peso. Todos os animais do "grupo tratado" extensivamente e uniformemente ganharam peso iniciando a partir do 9 dia.
[063]Assim, a alta eficiência dos compostos de formulas 1.1, 1.3, 1.4, e 1.6 no tratamento de influenza pneumonia em camundongos foi mostrada.
[064]A presente invenção pode ser usada na medicina e em veterinária.
Claims (8)
2. Composto, de acordo com a reivindicação 1, CARACTERIZADO pelo fato de que representa:ácido (3R,4R,5S)-5-guanidino-4-fluoroacetamido-3-(pentan-3- iloxi)ciclohexeno-1-carboxílico (1.1),(3R,4R,5S)-5-guanidino-4-fluoroacetamido-3-(pentan-3-iloxi)ciclohexeno-1- carboxilato de metila (1.2),(3R,4R,5S)-5-guanidino-4-fluoroacetamido-3-(pentan-3-iloxi)ciclohexeno-1- carboxilato de etila (1.3).
3. Composto, de acordo com a reivindicação 1 ou 2, CARACTERIZADO pelo fato de que exibe atividade para a neuraminidase do vírus influenza.
4. Composição farmacêutica que exibe atividade antiviral e é pretendida para o tratamento de influenza e doenças causadas pelo vírus influenza, CARACTERIZADA pelo fato de que compreende uma quantidade terapeuticamente eficaz do composto como definido na reivindicação 3 e pelo menos um excipiente farmaceuticamente aceitável.
5. Composição farmacêutica, de acordo com a reivindicação 4, CARACTERIZADA pelo fato de que é na forma de tabletes, cápsulas, ou injeções dispostas em uma embalagem farmaceuticamente aceitável.
6. Composição farmacêutica, de acordo com a reivindicação 4 ou 5, CARACTERIZADA pelo fato de que é para tratamento de pneumonia causada por vírus influenza.
7. Uso da composição farmacêutica, como definida na reivindicação 4 ou 5, CARACTERIZADO pelo fato de que é para a fabricação de um medicamento para profilaxia e tratamento de influenza e doenças causadas pelo vírus influenza.
8. Uso da composição farmacêutica, como definida na reivindicação 4 ou 5, CARACTERIZADO pelo fato de que é para a fabricação de um medicamento para o tratamento de pneumonia causada pelo vírus influenza.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2012119272 | 2012-05-12 | ||
| RU2012119272/04A RU2489422C1 (ru) | 2012-05-12 | 2012-05-12 | Фторзамещенные (3r,4r,5s)-5-гуанидино-4-ациламино-3-(пентан-3-илокси)циклогексен-1-карбоновые кислоты, их эфиры и способ применения |
| PCT/RU2013/000384 WO2013172741A2 (ru) | 2012-05-12 | 2013-05-07 | Фторзамещенные (3r,4r,5s)-5-гуанидино-4-ациламино-3-(пентан-3-илокси) циклогексен-1-карбоновые кислоты, их эфиры и способ применения |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| BR112014028362A2 BR112014028362A2 (pt) | 2018-04-17 |
| BR112014028362B1 true BR112014028362B1 (pt) | 2022-02-01 |
Family
ID=49159508
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| BR112014028362-1A BR112014028362B1 (pt) | 2012-05-12 | 2013-05-07 | Ácidos (3r, 4r, 5s)-5-guanidino-4-acetamido-3-(pentan-3-iloxi)cicloexeno-1-carboxílicos flúor substituídos, os seus ésteres, composição farmacêutica e uso da mesma |
Country Status (17)
| Country | Link |
|---|---|
| US (1) | US8895613B2 (pt) |
| EP (1) | EP2848606B1 (pt) |
| JP (1) | JP6034960B2 (pt) |
| KR (1) | KR101902567B1 (pt) |
| CN (1) | CN104284884B (pt) |
| AU (1) | AU2013263513B2 (pt) |
| BR (1) | BR112014028362B1 (pt) |
| CA (1) | CA2872733C (pt) |
| DK (1) | DK2848606T3 (pt) |
| EA (1) | EA024765B1 (pt) |
| HU (1) | HUE035856T2 (pt) |
| MX (1) | MX360369B (pt) |
| PL (1) | PL2848606T3 (pt) |
| RU (1) | RU2489422C1 (pt) |
| UA (1) | UA113201C2 (pt) |
| WO (1) | WO2013172741A2 (pt) |
| ZA (1) | ZA201408026B (pt) |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103923060B (zh) * | 2014-03-27 | 2016-05-25 | 山东大学 | 奥司他韦衍生物及其制备方法和应用 |
| CN106905193B (zh) * | 2017-02-15 | 2018-11-27 | 中国药科大学 | 芳酰基胍基奥司他韦羧酸衍生物及其制备方法和应用 |
| US20190081317A1 (en) * | 2017-09-11 | 2019-03-14 | Andreas Keil | Web coating and calendering system and method |
| CN110272381A (zh) * | 2019-06-19 | 2019-09-24 | 五邑大学 | 含吡啶片段的奥司他韦类似物及其应用 |
| WO2022022448A1 (zh) * | 2020-07-29 | 2022-02-03 | 广州市恒诺康医药科技有限公司 | 神经氨酸酶抑制剂类化合物、其药物组合物及其用途 |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AUPM354694A0 (en) * | 1994-01-27 | 1994-02-17 | Biota Scientific Management Pty Ltd | Chemical compounds |
| ATE191711T1 (de) * | 1995-02-27 | 2000-04-15 | Gilead Sciences Inc | Neue selektive inhibitoren viraler oder bakterieller neuraminidasen |
| JP3233392B2 (ja) * | 1998-01-22 | 2001-11-26 | 三共株式会社 | ノイラミン酸誘導体を含有する抗インフルエンザ薬 |
| US6518048B2 (en) * | 2000-04-10 | 2003-02-11 | Hoffmann-La Roche Inc. | Stereo-specific synthesis of shimikic acid derivatives with improved efficiency |
| WO2009129305A2 (en) * | 2008-04-15 | 2009-10-22 | Tsrl, Inc. | Prodrugs of neuraminidase inhibitors |
| RU2469020C1 (ru) * | 2011-11-08 | 2012-12-10 | Александр Васильевич Иващенко | (3r,4r,5s)-5-амино-4-ациламино-3-(1-этил-пропокси)-циклогекс-1-ен-карбоновые кислоты, их эфиры и способ применения |
-
2012
- 2012-05-12 RU RU2012119272/04A patent/RU2489422C1/ru active
-
2013
- 2013-04-29 US US13/872,174 patent/US8895613B2/en active Active
- 2013-05-07 HU HUE13791641A patent/HUE035856T2/hu unknown
- 2013-05-07 KR KR1020147034876A patent/KR101902567B1/ko active Active
- 2013-05-07 MX MX2014013761A patent/MX360369B/es active IP Right Grant
- 2013-05-07 WO PCT/RU2013/000384 patent/WO2013172741A2/ru not_active Ceased
- 2013-05-07 EA EA201401238A patent/EA024765B1/ru not_active IP Right Cessation
- 2013-05-07 JP JP2015512601A patent/JP6034960B2/ja active Active
- 2013-05-07 PL PL13791641T patent/PL2848606T3/pl unknown
- 2013-05-07 BR BR112014028362-1A patent/BR112014028362B1/pt active IP Right Grant
- 2013-05-07 AU AU2013263513A patent/AU2013263513B2/en not_active Ceased
- 2013-05-07 CN CN201380024800.0A patent/CN104284884B/zh active Active
- 2013-05-07 CA CA2872733A patent/CA2872733C/en not_active Expired - Fee Related
- 2013-05-07 DK DK13791641.7T patent/DK2848606T3/en active
- 2013-05-07 EP EP13791641.7A patent/EP2848606B1/en not_active Not-in-force
- 2013-07-05 UA UAA201410979A patent/UA113201C2/uk unknown
-
2014
- 2014-11-03 ZA ZA2014/08026A patent/ZA201408026B/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| KR20150017734A (ko) | 2015-02-17 |
| ZA201408026B (en) | 2015-11-25 |
| AU2013263513A1 (en) | 2014-11-06 |
| US20130303609A1 (en) | 2013-11-14 |
| EA024765B1 (ru) | 2016-10-31 |
| UA113201C2 (xx) | 2016-12-26 |
| WO2013172741A3 (ru) | 2014-01-09 |
| MX2014013761A (es) | 2015-02-04 |
| CN104284884B (zh) | 2016-07-13 |
| KR101902567B1 (ko) | 2018-09-28 |
| CA2872733C (en) | 2017-03-21 |
| PL2848606T3 (pl) | 2018-01-31 |
| RU2489422C1 (ru) | 2013-08-10 |
| AU2013263513B2 (en) | 2016-10-06 |
| CN104284884A (zh) | 2015-01-14 |
| US8895613B2 (en) | 2014-11-25 |
| CA2872733A1 (en) | 2013-11-21 |
| MX360369B (es) | 2018-10-29 |
| EP2848606A4 (en) | 2015-12-23 |
| EP2848606A2 (en) | 2015-03-18 |
| JP2015521186A (ja) | 2015-07-27 |
| EP2848606B1 (en) | 2017-08-30 |
| WO2013172741A2 (ru) | 2013-11-21 |
| DK2848606T3 (en) | 2017-10-02 |
| JP6034960B2 (ja) | 2016-11-30 |
| EA201401238A1 (ru) | 2015-02-27 |
| HUE035856T2 (hu) | 2018-05-28 |
| BR112014028362A2 (pt) | 2018-04-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101422744B1 (ko) | (1s,2s,3s,4r)-3-[(1s)-1-아세틸아미노-2-에틸-부틸]-4-구아니디노-2-하이드록시-사이클로펜틸―1-카복실산 하이드레이트 및 이의 약제학적 용도 | |
| TW202333743A (zh) | (s)-2-乙基丁基2-(((s)-(((2r,3s,4r,5r)-5-(4-胺基吡咯并[2,1-f] [1,2,4]三嗪-7-基)-5-氰基-3,4-二羥基四氫呋喃-2-基)甲氧基)(苯氧基)磷醯基)胺基)丙酸酯之結晶形式 | |
| US20140066454A1 (en) | Antibiotic Tolerance Inhibitors | |
| JP2013536825A (ja) | ドパミン作動性安定化剤として有用なプリドピジンの重水素化類似体 | |
| IL203910A (en) | Therapeutic isoxazole compounds | |
| BR112014028362B1 (pt) | Ácidos (3r, 4r, 5s)-5-guanidino-4-acetamido-3-(pentan-3-iloxi)cicloexeno-1-carboxílicos flúor substituídos, os seus ésteres, composição farmacêutica e uso da mesma | |
| US20110065762A1 (en) | Methods of use of antiviral compounds | |
| CN106957315B (zh) | N-取代苯磺酰基-氮杂吲哚氧基苯甲酰胺类化合物及其制备药物的用途 | |
| CN101434595A (zh) | 抗真菌剂-硫色满酮缩氨基(硫)脲系列物 | |
| RU2469020C1 (ru) | (3r,4r,5s)-5-амино-4-ациламино-3-(1-этил-пропокси)-циклогекс-1-ен-карбоновые кислоты, их эфиры и способ применения | |
| WO2020125673A1 (zh) | 流感病毒复制抑制剂及其中间体和用途 | |
| JP6610793B2 (ja) | 環状アミン誘導体の結晶及びその医薬用途 | |
| RU2626003C2 (ru) | Амид 1,2,4-триазол-3-илтиогликолевой кислоты, обладающий противовирусной активностью, или его фармацевтически приемлемые соли, фармацевтические композиции и их применение для лечения и профилактики гриппа | |
| RU2520836C1 (ru) | (3r,4r,5s)-4-амино-5-(2,2-дифторацетиламино)-3-(1-этилпропокси)-циклогекс-1-енкарбоновая кислота и ее эфиры, способ их получения и применения | |
| US20110263713A1 (en) | Polymorphs | |
| JP2009533428A (ja) | 筋肉内抗ウイルス処置 | |
| WO2025174912A1 (en) | Alkoxy-carbonyloxy-alkyl and alkylcarbonyloxy-alkyl prodrugs of tamiflu | |
| WO2007136302A2 (en) | Active substances, pharmaceutical composition and a method for the production and use thereof | |
| CN107344920A (zh) | 一种帕拉米韦倍半水合物化合物 | |
| EA047104B1 (ru) | Соединения, пригодные для лечения инфекций вируса гриппа | |
| CN108368052A (zh) | 半对甲苯磺酸索拉非尼一水合物结晶及其制备方法 | |
| CN106045880A (zh) | N‑卤代芳基取代的手性氨基酸酯类化合物及其制备方法和应用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| B06F | Objections, documents and/or translations needed after an examination request according [chapter 6.6 patent gazette] | ||
| B07D | Technical examination (opinion) related to article 229 of industrial property law [chapter 7.4 patent gazette] |
Free format text: DE ACORDO COM O ARTIGO 229-C DA LEI NO 10196/2001, QUE MODIFICOU A LEI NO 9279/96, A CONCESSAO DA PATENTE ESTA CONDICIONADA A ANUENCIA PREVIA DA ANVISA. CONSIDERANDO A APROVACAO DOS TERMOS DO PARECER NO 337/PGF/EA/2010, BEM COMO A PORTARIA INTERMINISTERIAL NO 1065 DE 24/05/2012, ENCAMINHA-SE O PRESENTE PEDIDO PARA AS PROVIDENCIAS CABIVEIS. |
|
| B07E | Notification of approval relating to section 229 industrial property law [chapter 7.5 patent gazette] | ||
| B06U | Preliminary requirement: requests with searches performed by other patent offices: procedure suspended [chapter 6.21 patent gazette] | ||
| B07A | Application suspended after technical examination (opinion) [chapter 7.1 patent gazette] | ||
| B09A | Decision: intention to grant [chapter 9.1 patent gazette] | ||
| B16A | Patent or certificate of addition of invention granted [chapter 16.1 patent gazette] |
Free format text: PRAZO DE VALIDADE: 20 (VINTE) ANOS CONTADOS A PARTIR DE 07/05/2013, OBSERVADAS AS CONDICOES LEGAIS. |