WO2015105083A1 - アンチセンスオリゴヌクレオチド及び糖誘導体を含む二本鎖オリゴヌクレオチド - Google Patents
アンチセンスオリゴヌクレオチド及び糖誘導体を含む二本鎖オリゴヌクレオチド Download PDFInfo
- Publication number
- WO2015105083A1 WO2015105083A1 PCT/JP2015/050083 JP2015050083W WO2015105083A1 WO 2015105083 A1 WO2015105083 A1 WO 2015105083A1 JP 2015050083 W JP2015050083 W JP 2015050083W WO 2015105083 A1 WO2015105083 A1 WO 2015105083A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- compound
- substituted
- group
- unsubstituted
- double
- Prior art date
Links
- 0 CC*(C)C(C)(C)CC(CC(C)(C)*)(CC(C)(C)*1CC1)N(C)C Chemical compound CC*(C)C(C)(C)CC(CC(C)(C)*)(CC(C)(C)*1CC1)N(C)C 0.000 description 9
- MJPQPUSGOPWHOZ-UHFFFAOYSA-N CC(C)OC(c1ccccc1)c1ccccn1 Chemical compound CC(C)OC(c1ccccc1)c1ccccn1 MJPQPUSGOPWHOZ-UHFFFAOYSA-N 0.000 description 1
- XHVKGDZBDODAED-UHFFFAOYSA-N CC(C1CCCCC1)c1ccccn1 Chemical compound CC(C1CCCCC1)c1ccccn1 XHVKGDZBDODAED-UHFFFAOYSA-N 0.000 description 1
- ZFZPQOVKSLKIKI-UHFFFAOYSA-N CC(c1ccccc1)c1ccccn1 Chemical compound CC(c1ccccc1)c1ccccn1 ZFZPQOVKSLKIKI-UHFFFAOYSA-N 0.000 description 1
- CHWJBMPGMPUBCD-UHFFFAOYSA-N CC(c1ncccc1)c1ncccc1 Chemical compound CC(c1ncccc1)c1ncccc1 CHWJBMPGMPUBCD-UHFFFAOYSA-N 0.000 description 1
- JVUAARCHMGEFJX-UHFFFAOYSA-N COC(C1CCCCC1)c1ccccn1 Chemical compound COC(C1CCCCC1)c1ccccn1 JVUAARCHMGEFJX-UHFFFAOYSA-N 0.000 description 1
- CCOBXWMNEIZGNG-UHFFFAOYSA-N COC(c1ccccn1)c1ncccc1 Chemical compound COC(c1ccccn1)c1ncccc1 CCOBXWMNEIZGNG-UHFFFAOYSA-N 0.000 description 1
- RINCXYDBBGOEEQ-UHFFFAOYSA-N O=C(CC1)OC1=O Chemical compound O=C(CC1)OC1=O RINCXYDBBGOEEQ-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
- C12N15/1137—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing against enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/54—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound
- A61K47/549—Sugars, nucleosides, nucleotides or nucleic acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/111—General methods applicable to biologically active non-coding nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y602/00—Ligases forming carbon-sulfur bonds (6.2)
- C12Y602/01—Acid-Thiol Ligases (6.2.1)
- C12Y602/01003—Long-chain-fatty-acid-CoA ligase (6.2.1.3)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/26—Carbohydrates, e.g. sugar alcohols, amino sugars, nucleic acids, mono-, di- or oligo-saccharides; Derivatives thereof, e.g. polysorbates, sorbitan fatty acid esters or glycyrrhizin
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/11—Antisense
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/32—Chemical structure of the sugar
- C12N2310/323—Chemical structure of the sugar modified ring structure
- C12N2310/3231—Chemical structure of the sugar modified ring structure having an additional ring, e.g. LNA, ENA
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/34—Spatial arrangement of the modifications
- C12N2310/346—Spatial arrangement of the modifications having a combination of backbone and sugar modifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/35—Nature of the modification
- C12N2310/351—Conjugate
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/35—Nature of the modification
- C12N2310/351—Conjugate
- C12N2310/3515—Lipophilic moiety, e.g. cholesterol
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/30—Special therapeutic applications
- C12N2320/32—Special delivery means, e.g. tissue-specific
Definitions
- two antisense strands are antisense oligonucleotides having an activity of suppressing the expression of a target protein, and a sugar derivative having an interaction with an asialoglycoprotein receptor is bound to the sense strand via a linker. Relates to strand oligonucleotides.
- An antisense oligonucleotide is an oligonucleotide complementary to ncRNA (non-coding RNA) such as mRNA, mRNA precursor or ribosomal RNA, transfer RNA, miRNA, etc. of a target gene, and consists of about 8 to 30 bases. Strand DNA, RNA and / or structural analogs thereof. The function of mRNA, mRNA precursor or ncRNA is suppressed by forming a double strand with the mRNA, mRNA precursor or ncRNA targeted by the antisense oligonucleotide.
- ncRNA non-coding RNA
- nucleic acid drugs such as antisense oligonucleotides and siRNA are difficult to put to practical use because they are easily degraded by nucleases in living bodies and have low efficiency of incorporation into target cells.
- chemical modification of the active ingredient nucleic acid itself and drug delivery system (DDS) for delivering the nucleic acid into the target cell have been studied for many years.
- Examples of chemical modification of the antisense oligonucleotide itself include S-oligo (phosphorothioate) in which the phosphate moiety is modified, and 2 ′, 4′-BNA (bridged nucleic acid) / LNA (in which the sugar moiety is modified). locked nucleic acid) (see Patent Documents 1 to 5).
- Non-Patent Document 1 suggests that liposomes modified with a galactose derivative, which is a sugar derivative that interacts with the asialoglycoprotein receptor, are useful for the incorporation of drugs into liver cells.
- Patent Documents 6 to 8 suggest that liposomes modified with a GalNac (N-acetylgalactosamine) derivative, which is a sugar derivative that interacts with the asialoglycoprotein receptor, are useful for siRNA uptake into liver cells.
- Patent Document 9 describes an siRNA in which a GalNac derivative is bound via a linker, and describes that when the siRNA is administered subcutaneously, the expression of a target gene in the liver is suppressed.
- Patent Document 10 discloses that, in a mouse, by binding tocophenol to a double-stranded oligonucleotide containing an RNA oligonucleotide complementary to an antisense oligonucleotide, compared to a single-stranded antisense oligonucleotide, It is described that it was efficiently delivered and accumulated in the liver, and the expression of the target gene in the liver was suppressed.
- An object of the present invention is to provide a novel complex capable of efficiently transporting a DNA antisense oligonucleotide to the liver.
- antisense oligonucleotides When using antisense oligonucleotides as pharmaceuticals, single-stranded antisense oligonucleotides, which are active ingredients, are poorly absorbed into the target cells due to poor stability in the stomach and poor absorption from the intestine. In general, research and development have been conducted on injections that easily reach the target tissue. However, depending on the disease, a dosage form other than an injection may be preferable, for example, because injection is difficult due to the thickness of the patient's subcutaneous fat. Based on the method described in Patent Document 10, the present inventors conducted research using a tocopherol-modified double-stranded oligonucleotide.
- the target gene expression inhibitory activity in the liver was improved by intravenous injection, but the target gene expression inhibitory activity was improved by subcutaneous administration. Improvement could not be confirmed.
- the present inventors have found that the double-stranded oligonucleotide of the present invention has excellent target gene expression inhibitory activity in the liver for both intravenous injection and subcutaneous administration.
- the double-stranded oligonucleotide of the present invention is very useful because it can efficiently deliver and accumulate an antisense oligonucleotide, which is an active ingredient of a nucleic acid drug, to the liver to exert its effect.
- the present inventors measured aspartate aminotransferase (AST) and alanine aminotransferase (ALT) during intravenous injection and subcutaneous administration using the double-stranded oligonucleotide of the present invention, and liver toxicity was observed. Confirm that there is no. Therefore, the double-stranded oligonucleotide of the present invention has low toxicity and is sufficiently safe for use as a medicine.
- AST aspartate aminotransferase
- ALT alanine aminotransferase
- the double-stranded oligonucleotide of the present invention utilizes, for example, a GalNac derivative.
- Patent Document 9 describes a siRNA in which a GalNac derivative is bound via a linker, and describes that the expression of a target gene in the liver is suppressed when the siRNA is administered intravenously or subcutaneously. Yes.
- DDS that has been shown to be usable in siRNA for the following reasons is not always applicable to antisense oligonucleotides as they are.
- Methods for suppressing protein expression targeting mRNA include an antisense method using an antisense oligonucleotide or an RNA interference (RNAi) approach using siRNA.
- the antisense method is, for example, cleaving mRNA strands by RNaseH that recognizes RNA / DNA heteroduplexes generated by hybridizing to target mRNA using single-stranded DNA (antisense oligonucleotide) around 20 mer. This is a technique for suppressing protein production.
- RNA interference is incorporated into RISC (RNA-induced silencing complex) in cells by using, for example, 20 to 30-mer double-stranded RNA (siRNA; short interfering RNA), and then homologous to the incorporated siRNA. This is a technique for suppressing protein expression by cleaving a typical mRNA chain.
- RNA interference In order for both the antisense method and RNA interference to exert sufficient effects in vivo, it is important to improve the degradation resistance against in vivo nuclease and the delivery efficiency to the target organ.
- approaches using chemically modified nucleic acids and biological ligand molecules eg, GalNac derivatives
- usable chemical modifications depend on differences in molecular structure and mRNA chain cleavage mechanism. The type of nucleic acid, the optimal ligand molecule, and the binding site are considered to be different.
- the antisense strand is a DNA antisense oligonucleotide having 8 to 25 bases, which may contain a nucleoside derivative,
- a double-stranded oligonucleotide to which a sugar derivative having an interaction with an asialoglycoprotein receptor is bound via a linker.
- the sugar derivative is (Where P1A , P1B , P2A , P2B , P3A , P3B , P4A , P4B , P4C , T1A , T1B , T2A , T2B , T3A , T3B , T4A , T4B And T 4C are each independently absent or CO, NH, O, S, OC ( ⁇ O), NHC ( ⁇ O), CH 2 , CH 2 NH or CH 2 O; Q 1A , Q 1B , Q 2A , Q 2B , Q 3A , Q 3B , Q 4A , Q 4B and Q 4C are each independently absent or substituted or unsubstituted alkylene; R 1A , R 1B , R 2A , R 2B , R 3A , R 3B , R 4A , R 4B and R 4C are each independently absent or NH, O, S, CH 2 , C ( ⁇ O
- the crosslinked structure is 4 ′-(CH 2 ) m—O-2 ′ (m is an integer of 1 to 4) or 4′-C ( ⁇ O) —NR 6 -2 ′ (R 6 is The double-stranded oligonucleotide according to (5), which is a hydrogen atom or alkyl).
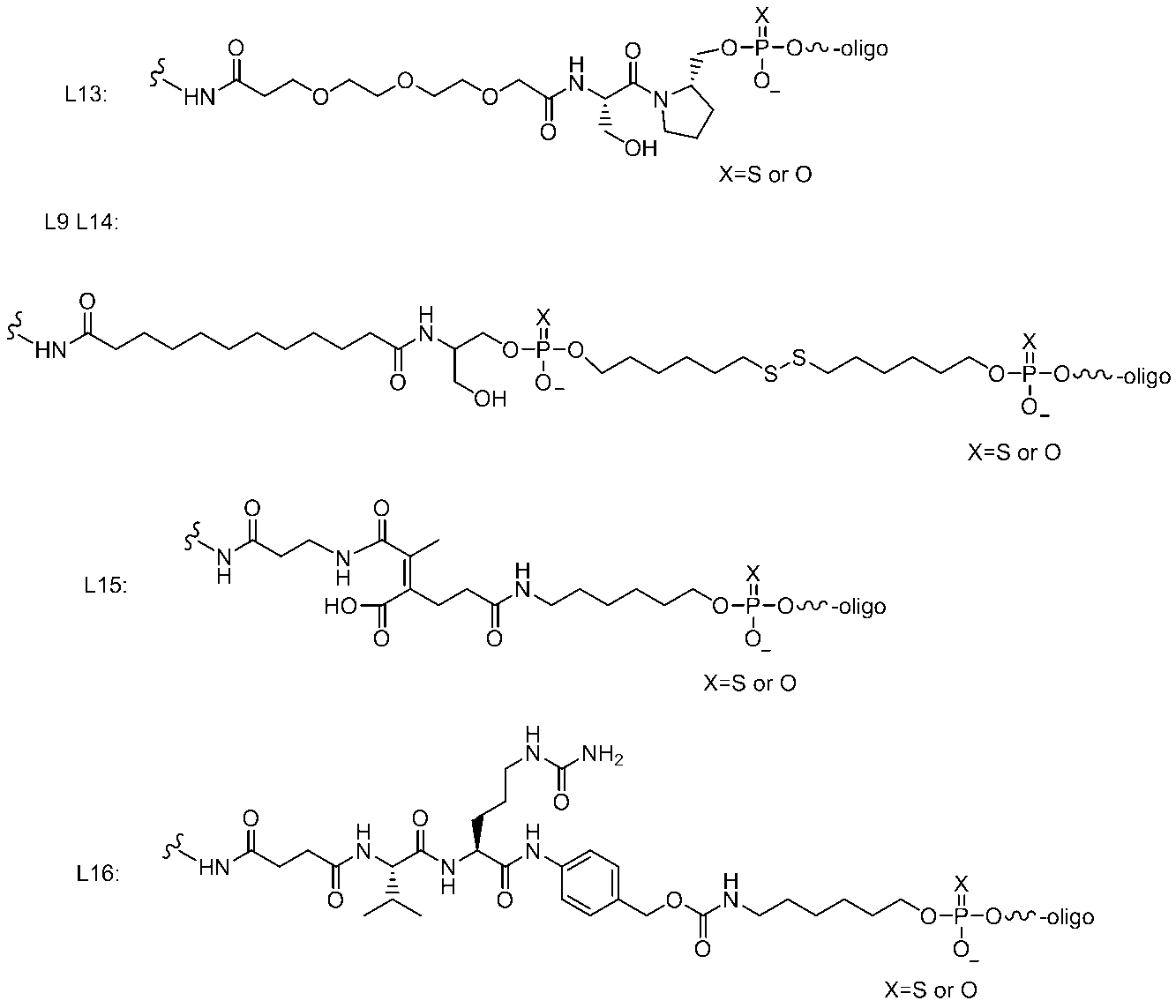
- the linker is (Where L 1 binds to the 3 ′ end and / or the 5 ′ end of the sense strand, and L 5 binds to the sugar derivative.
- L 1 is C ( ⁇ O) NH, NHC ( ⁇ O), NHC ( ⁇ O) NH, Where R 7 is alkyl or alkyloxy.
- Each L 2 independently represents a substituted or unsubstituted alkylene having 1 to 20 carbon atoms or an aromatic ring which may be interposed via an aromatic ring;
- Each L 3 is independently absent, C ( ⁇ O) NR 8 (R 8 is hydrogen or substituted or unsubstituted alkyl), NR 9 C ( ⁇ O) (R 9 is hydrogen or substituted or An unsubstituted alkyl or R 9 may form a substituted or unsubstituted nitrogen-containing ring together with the carbon in the alkylene of L 2 );
- Each L 4 independently is a substituted or unsubstituted alkylene having 1 to 20 carbon atoms or an aromatic ring which may not exist or may be interposed via an aromatic ring;
- L 5 is C ( ⁇ O) NH, NHC ( ⁇ O), NH or O
- L 1 is C ( ⁇ O) NH, NHC ( ⁇ O), NHC ( ⁇ O) NH, Where R 7 is alkyl or alkyloxy.
- Each L 2 independently represents a substituted or unsubstituted alkylene having 1 to 20 carbon atoms or an aromatic ring which may be interposed via an aromatic ring;
- Each L 3 is independently absent, C ( ⁇ O) NR 8 (R 8 is hydrogen or substituted or unsubstituted alkyl) or NR 9 C ( ⁇ O) (R 9 is hydrogen or substituted or An unsubstituted alkyl, or R 9 together with the carbon in the alkylene of L 2 may form a substituted or unsubstituted nitrogen-containing ring),
- Each L 4 independently is a substituted or unsubstituted alkylene having 1 to 20 carbon atoms or an aromatic ring which may not exist or may be interposed via an aromatic ring;
- L 5 is C ( ⁇ O) NH, NHC ( ⁇ O), NH or
- the double-stranded oligonucleotide of the present invention exhibits high activity by stably delivering and accumulating an antisense oligonucleotide, which is an active ingredient, to the liver regardless of the route of intravenous administration or subcutaneous administration. Since the double-stranded oligonucleotide was not toxic, it is useful as a nucleic acid pharmaceutical.
- Knockdown evaluation of ⁇ -tocopherol modified oligonucleotide (Comparative Example). The remaining amount of mRNA was expressed as a relative value when the physiological saline-administered group was taken as 100. The dose of SEQ-7 (10, 3.3 or 1.1 mg / kg) was expressed in terms of the amount of antisense strand. Knockdown evaluation of the double-stranded oligonucleotide (SEQ-8) of the present invention. The remaining amount of mRNA was expressed as a relative value when the physiological saline-administered group was taken as 100. The dose of SEQ-8 (20, 6.6 or 2.2 mg / kg) was expressed in terms of the amount of antisense strand.
- the dose of SEQ-21 or 22 (4 or 2 mg / kg) was expressed in terms of the amount of antisense strand.
- Knockdown evaluation of the double-stranded oligonucleotide (SEQ-20, 23-25) of the present invention The remaining amount of mRNA was expressed as a relative value when the physiological saline-administered group was taken as 100.
- the doses of SEQ-20 and 23-25 (4 or 2 mg / kg) were expressed in terms of the amount of antisense strand.
- the remaining amount of mRNA was expressed as a relative value when the physiological saline-administered group was taken as 100.
- the dose of SEQ-30 to 32 (0.2 mg / kg) was expressed in terms of the amount of antisense strand.
- Nucleoside means a compound in which a nucleobase and a sugar form an N-glycoside bond.
- An oligonucleotide means a nucleotide in which a plurality of identical or different nucleosides are bound.
- the bond between sugars in the oligonucleotide may be a bond that a natural nucleic acid has, a phosphodiester (D-oligo), an artificially modified bond, or a bond that does not have a phosphorus atom. Also good. Any bond known in the art can be used. Examples of the bonds that have been artificially modified include phosphorothioate (S-oligo), methylphosphonate (M-oligo), and boranophosphonate. Examples of the bond having no phosphorus atom include alkyl, non-aromatic carbocycle, haloalkyl, halogen-substituted non-aromatic carbocycle, and the like.
- siloxane siloxane, sulfide, sulfoxide, sulfone, acetyl, acetyl formate, acetyl thioformate, acetyl methylene formate, acetyl thioformate, alkenyl, sulfamate, methyleneimino, methylenehydrazino, sulfonate, sulfonamide, amide and the like.
- all may be the same bond or may contain different bonds.
- DNA nucleoside or “RNA nucleoside” means a natural DNA nucleoside or a natural RNA nucleoside and means a part of a nucleotide which is one unit constituting an oligonucleotide.
- Natural DNA nucleoside means: (Wherein, B X1 is adenine, guanine, cytosine or thymine.)
- Natural RNA nucleoside means: (In the formula, B X2 is adenine, guanine, cytosine or uracil.)
- DNA oligonucleotide is an oligonucleotide in which a plurality of DNA nucleosides are bound
- RNA oligonucleotide is an oligonucleotide in which a plurality of RNA nucleosides are bound.
- nucleoside derivative means a nucleoside in which the nucleobase and / or sugar site of the DNA nucleoside or the RNA nucleoside is artificially modified. Any modification of nucleosides known in the art can be used.
- nucleobase modifications include 5-methylcytosine, 5-hydroxymethylcytosine, 5-propynylcytosine and the like.
- Examples of the modification of the sugar moiety include substitution at the 2 ′ position of the sugar. Specifically, 2′-F, 2′-OCH 3 (2′-OMe), 2′-OCH 2 CH 2 OCH 3 (2′-MOE) and the like. Moreover, for example, a cross-linked structure between the 4′-position and the 2′-position of the following sugars can be mentioned.
- R 6 is preferably a hydrogen atom, alkyl, alkenyl, alkynyl, aromatic carbocyclic group, non-aromatic carbocyclic group, aromatic heterocyclic group, non-aromatic heterocyclic group, aromatic carbocycle It is alkyl, non-aromatic carbocyclic alkyl, aromatic heterocyclic alkyl or non-aromatic heterocyclic alkyl, and may have one or more arbitrary substituents selected from ⁇ group.
- the ⁇ group is a hydroxyl group, alkyl, alkyloxy, mercapto, alkylthio, amino, alkylamino or halogen.
- R 10 and R 11 are preferably a hydrogen atom.
- the crosslinked structure is preferably 4 ′-(CR 10 R 11 ) m—O-2 ′ or 4 ′-(CR 10 R 11 ) m 1 —C ( ⁇ O) —NR 6 -2 ′ (AmNA, Bridged nucleic acid) here
- R 6 is a hydrogen atom, substituted or unsubstituted alkyl, substituted or unsubstituted alkenyl or substituted or unsubstituted alkynyl
- Each R 10 is independently a hydrogen atom, halogen, cyano, substituted or unsubstituted alkyl, substituted or unsubstituted alkenyl, or substituted or unsubstituted alkynyl
- Each of R 11 is independently a hydrogen atom, halogen, cyano, substituted or unsubstituted alkyl, substituted or unsubstituted alkenyl, or substituted or unsubstituted alkynyl
- m is an integer of
- the cross-linked structure is particularly preferably 4 ′-(CH 2 ) m—O-2 ′ (m is an integer of 1 to 4) or 4′-C ( ⁇ O) —NR 6 -2 ′ (R 6 Is a hydrogen atom or alkyl).
- 4 ′-(CH 2 ) m—O-2 ′ (m is an integer of 1 to 4)
- 4′—CH 2 —O-2 ′ (LNA, Locked Nucleic Acid) is particularly preferable.
- Specific examples and preparation methods thereof are described in International Publication No. 98/39352, International Publication No. 2003/066875, International Publication No. 2005/021570, and the like.
- 4′-C ( ⁇ O) —NR 6 ⁇ 2 ′ (R 6 is a hydrogen atom or alkyl)
- 4′—C ( ⁇ O) —NCH 3 ⁇ 2 ′ is particularly preferable. Specific examples and preparation methods thereof are described in International Publication No. 2011/052436.
- Nucleotide modification and modification methods known in the art are also disclosed in, for example, the following patent documents.
- the “double-stranded oligonucleotide” of the present invention is a DNA antisense oligonucleotide of 8 to 25 bases in which the antisense strand may contain a nucleoside derivative,
- the antisense strand of the “double-stranded oligonucleotide” of the present invention is a DNA antisense oligonucleotide of 8 to 25 bases which may contain a nucleoside derivative.
- the “DNA antisense oligonucleotide” is an oligonucleotide complementary to the target gene mRNA, mRNA precursor or ncRNA, and is composed of single-stranded DNA. The function of mRNA, mRNA precursor or ncRNA is suppressed by forming a double strand with the mRNA, mRNA precursor or ncRNA targeted by the antisense oligonucleotide.
- the “DNA antisense oligonucleotide” includes not only those that are completely complementary to the target mRNA, mRNA precursor, or ncRNA, but also those that can hybridize with the mRNA, mRNA precursor, or ncRNA under stringent conditions.
- ncRNA non-coding RNA
- target gene includes a gene whose expression is increased in various diseases.
- the length of “DNA antisense oligonucleotide” is 8 to 25 bases.
- 8 to 19 bases 10 to 19 bases, 13 to 19 bases, 13 bases, 14 bases, 15 bases, 16 bases, 17 bases, 18 bases or 19 bases.
- the sense strand of the “double-stranded oligonucleotide” of the present invention contains a sequence capable of hybridizing to the antisense strand under stringent conditions, and may contain a DNA nucleoside and / or a nucleoside derivative of 8 to 35 bases.
- Sense strand RNA oligonucleotides include those in which one or several mismatches exist at the site of hybridization, as long as they can hybridize to the antisense strand DNA antisense oligonucleotide under stringent conditions.
- the hybridizing site has at least 70% or more, preferably 80% or more, more preferably 90% or more, most preferably 95% or more homology with the complementary sequence of the DNA antisense oligonucleotide of the antisense strand.
- Antisense oligonucleotides are mentioned.
- the homology is indicated in the score by using a search program BLAST using an algorithm developed by Altschul et al. (The Journal of Molecular Biology, 215, 403-410 (1990)), for example. .
- the length of the sense strand of the double-stranded oligonucleotide of the present invention is 8 to 35 bases. For example, 8 to 30, 8 to 19 bases, 10 to 19 bases, 13 to 19 bases, 13 bases, 14 bases, 15 bases, 16 bases, 17 bases, 18 bases or 19 bases.
- the length of the sense strand may be the same length as the antisense strand, or may be shorter by one or several bases than the length of the antisense strand as long as it hybridizes with the antisense strand. Further, the length of the sense strand may be longer than the length of the antisense strand by adding one or several bases to one side or both sides of the site that hybridizes with the antisense strand.
- the base in the sense strand may hybridize at a portion that does not hybridize with the antisense strand, so that it may have a hairpin structure.
- “One or several bases” means 1 to 10, 1 to 5, 1 to 3, or 1 or 2 bases.
- “Stringent conditions” means that a certain base sequence forms a hybrid with a specific sequence (so-called specific hybrid), and a base sequence that does not have an equivalent function forms a hybrid with a specific sequence (so-called non-specific hybrid) It means a condition that does not.
- Those skilled in the art can easily select such conditions by changing the temperature during the hybridization reaction and washing, the salt concentration of the hybridization reaction solution and the washing solution, and the like. Specifically, it is 42 ° C. in 6 ⁇ SSC (0.9 M NaCl, 0.09 M trisodium citrate) or 6 ⁇ SSPE (3 M NaCl, 0, 2 M NaH 2 PO 4 , 20 mM EDTA ⁇ 2Na, pH 7.4).
- Examples of the stringent conditions of the present invention include, but are not limited to, the conditions in which the cells are hybridized with and washed with 0.5 ⁇ SSC at 42 ° C.
- a hybridization method a well-known and commonly used method in this field, for example, a Southern blot hybridization method or the like can be used. Specifically, Molecular Cloning: A Laboratory Manual, Second Edition (1989) (Cold Spring Harbor Laboratory Press), Current Protocol in Amplification in Coal (1994) (Ten-Proc. It can be carried out according to the method described in Second Edition (1995) (Oxford University Press) and the like.
- One or several mismatches means 1 to 5, preferably 1 to 3, more preferably 1 or 2 mismatches.
- the antisense strand DNA antisense oligonucleotide and the sense strand RNA oligonucleotide in the “double-stranded oligonucleotide” of the present invention preferably contain one or more nucleoside derivatives.
- the sense strand may further contain a DNA nucleoside. That is, in the DNA antisense oligonucleotide of the antisense strand, at least one nucleoside is a DNA nucleoside, but the other nucleoside may be a DNA nucleoside or a nucleoside derivative.
- At least one nucleoside is an RNA nucleoside, but the other nucleoside may be an RNA nucleoside, a DNA nucleoside, or a nucleoside derivative.
- Examples of the pattern of the nucleoside derivative and the DNA nucleoside or RNA nucleoside include gapmer or mixmer.
- a gapmer includes a central region (“gap”) and regions on both sides of the central region, wings (“5 ′ wing” on the 5 ′ side or “3 ′ wing” on the 3 ′ side), and each wing has at least It means an oligonucleotide containing one nucleoside derivative.
- “5 ′ wing” and / or “3 ′ wing” contains one or more nucleoside derivatives, preferably 1 to 5, more preferably 2 to 3.
- the type, number, and position of the modification in one wing may be the same as or different from the type, number, and position of the modification in the other wing.
- a mixmer means an oligonucleotide containing a nucleoside derivative at random.
- the DNA antisense oligonucleotide of the antisense strand is particularly preferably a gapmer.
- any nucleoside derivative known in the art can be used as the nucleoside derivative in the “double-stranded oligonucleotide” of the present invention.
- it is a nucleoside having a substituent at the 2′-position of the sugar and / or a nucleoside having a cross-linking structure between the 4′-position and the 2′-position of the sugar.
- the substituent at the 2′-position of the sugar is preferably F, OCH 3 or OCH 2 CH 2 OCH 3 .
- the cross-linked structure between the 4′-position and the 2′-position of the sugar is preferably 4 ′-(CH 2 ) m—O-2 ′ (m is an integer of 1 to 4), 4′-C ( ⁇ O) —NR 6 -2 ′ (R 6 is a hydrogen atom or alkyl).
- a DNA antisense oligonucleotide having an antisense strand is preferably phosphorothioate (S-oligo).
- the DNA antisense oligonucleotide of the antisense strand and the RNA oligonucleotide of the sense strand in the “double-stranded oligonucleotide” of the present invention can be synthesized by a conventional method in the art, for example, a commercially available nucleic acid automatic synthesizer (For example, Applied Biosystems, Dainippon Seiki Co., Ltd., etc.) can be easily synthesized.
- Examples of the synthesis method include a solid phase synthesis method using phosphoramidite and a solid phase synthesis method using hydrogen phosphonate. For example, it is disclosed in Examples 3) 1) to 7), Tetrahedron Letters 22, 1859-1862 (1981), International Publication No. 2011/052436, and the like.
- the synthesized antisense strand and sense strand are hybridized by a known method to form a double-stranded oligonucleotide. For example, it is disclosed in Example 3 of Example 3 below, Example 1 of International Publication No. 2013/0889283, and the like.
- a sugar derivative having an interaction with an asialoglycoprotein receptor is bonded to the 3 ′ end and / or the 5 ′ end of the sense strand via a linker.
- “Asialoglycoprotein receptor” is present on the surface of liver cells and has the function of recognizing galactose residues of asialoglycoprotein and taking them into the cells for degradation. That is, “a sugar derivative having an interaction with an asialoglycoprotein receptor” means a compound having a structure similar to that of a galactose residue and binding to the asialoglycoprotein receptor and taken into a cell. Examples thereof include GalNac (N-acetylgalactosamine) derivatives, galactose derivatives, and lactose derivatives.
- GalNac N-acetylgalactosamine
- a GalNac derivative is a compound containing the following groups. (Where R X1 , R X2 and R X3 are each independently a hydrogen atom or substituted or unsubstituted alkyl; R X4 ′ is substituted or unsubstituted alkyl. )
- a galactose derivative is a compound containing the following groups. (In the formula, R X1 , R X2 and R X3 are each independently a hydrogen atom or substituted or unsubstituted alkyl.)
- a lactose derivative is a compound containing the following groups.
- R X1 is a hydrogen atom or substituted or unsubstituted alkyl
- R X2 and R X3 are each independently a hydrogen atom or substituted or unsubstituted alkyl
- Each R X4 is independently OH or NHCOR X4 ′ (R X4 ′ is a substituted or unsubstituted alkyl).
- Preferred examples of the “sugar derivative having an interaction with the asialoglycoprotein receptor” include the following. (Where P 0A, P 1A, P 1B , P 2A, P 2B, P 3A, P 3B, P 4A, P 4B, P 4C, T 0A, T 1A, T 1B, T 2A, T 2B, T 3A, T 3B , T 4A , T 4B and T 4C are each independently absent or in CO, NH, O, S, OC ( ⁇ O), NHC ( ⁇ O), CH 2 , CH 2 NH or CH 2 O Yes, Q 0A , Q 1A , Q 1B , Q 2A , Q 2B , Q 3A , Q 3B , Q 4A , Q 4B and Q 4C are each independently absent or substituted or unsubstituted alkylene; R 0A , R 1A , R 1B , R 2A , R 2B , R 3A , R 3B
- Amino acid side chain is a part of the structure of an amino acid, for example, CH 3 , CH 2 SH, CH 2 COOH, CH 2 CH 2 COOH, CH 2 C 6 H 5 , CH 2 C 3 H 3 N 2 , CH (CH 3 ) CH 2 CH 3 , (CH 2 ) 4 NH 2 , CH 2 CH (CH 3 ) 2 , CH 2 CH 2 SCH 3 , CH 2 CONH 2 , CH 2 CH 2 CONH 2 , (CH 2 ) 3 NHC (NH) NH 2 , CH 2 OH, CH (OH) CH 3 , CH 2 SeH, CH (CH 3 ) 2 , CH 2 C 8 H 6 N, CH 2 C 6 H 4 OH, etc. It is done.
- Any linker can be used as a linker through the sense strand and the sugar derivative as long as it is a linker used in this field.
- L 1 binds to the 3 ′ end and / or the 5 ′ end of the sense strand, and L 5 binds to the sugar derivative.
- L 1 is C ( ⁇ O) NH, NHC ( ⁇ O), NHC ( ⁇ O) NH, Where R 7 is alkyl or alkyloxy.
- Each L 2 independently represents a substituted or unsubstituted alkylene having 1 to 20 carbon atoms or an aromatic ring which may be interposed via an aromatic ring;
- Each L 3 is independently absent, C ( ⁇ O) NR 8 (R 8 is hydrogen or substituted or unsubstituted alkyl), NR 9 C ( ⁇ O) (R 9 is hydrogen or substituted or An unsubstituted alkyl or R 9 may form a substituted or unsubstituted nitrogen-containing ring together with the carbon in the alkylene of L 2 ); (Note that when L 3 is represented by the above formula, L 2 is bonded to the left side in the formula) And Each L 4 independently is a substituted or unsubstituted alkylene having 1 to 20 carbon atoms or an aromatic ring which may not exist or may be interposed via an aromatic ring;
- L 5 is C ( ⁇ O) NH, NHC ( ⁇ O), NH or O, n is 1 or 2.
- L 1 binds to the 3 ′ end and / or the 5 ′ end of the sense strand, and L 5 binds to the sugar derivative.
- L 1 is C ( ⁇ O) NH, NHC ( ⁇ O), NHC ( ⁇ O) NH, Where R 7 is alkyl or alkyloxy.
- Each L 2 independently represents a substituted or unsubstituted alkylene having 1 to 20 carbon atoms or an aromatic ring which may be interposed via an aromatic ring;
- Each L 3 is independently absent, C ( ⁇ O) NR 8 (R 8 is hydrogen or substituted or unsubstituted alkyl) or NR 9 C ( ⁇ O) (R 9 is hydrogen or substituted or An unsubstituted alkyl, or R 9 together with the carbon in the alkylene of L 2 may form a substituted or unsubstituted nitrogen-containing ring),
- Each L 4 independently is a substituted or unsubstituted alkylene having 1 to 20 carbon atoms or an aromatic ring which may not exist or may be interposed via an aromatic ring;
- L 5 is C ( ⁇ O) NH, NHC ( ⁇ O), NH or O, n is 1 or 2.
- L 2 or L 4 is “substituted or unsubstituted alkylene optionally via an aromatic ring” or “aromatic ring”, the aromatic ring is preferably a benzene ring, a biphenyl ring or the like. It is done.
- R 9 together with carbon in the alkylene of L 2 may form a substituted or unsubstituted nitrogen-containing ring” means the following. (In the formula, a is an integer of 0 to 18, and b is an integer of 1 to 5. The alkylene and the nitrogen-containing ring may have a substituent.) Specific examples include the following.
- L 1 is bound to the 3 ′ position of the sugar at the end of the oligonucleotide.
- L 1 is bound to the 4 ′ position of the end of the oligonucleotide via a substituted or unsubstituted methylene.
- linker examples include the following.
- L 1 is preferably It is.
- L 2 is preferably 1 to 20 substituted or unsubstituted alkylene, benzene ring or biphenyl ring.
- L 3 is preferably absent, C ( ⁇ O) NH or NR 9 C ( ⁇ O) (R 9 is hydrogen, R 9 is substituted with carbon in the alkylene of L 2 or NR 9 C ( ⁇ O) (R 9 together with the carbon in the alkylene of L 2 forms a substituted or unsubstituted nitrogen-containing ring, which may form an unsubstituted nitrogen-containing ring) ), (Note that when L 3 is represented by the above formula, L 2 is bonded to the left side in the formula) It is.
- L 4 is preferably absent, substituted or unsubstituted 1 to 20 alkylene, benzene ring or biphenyl ring.
- L 5 is preferably C ( ⁇ O) NH.
- n 1 and n 2 are each independently an integer of 1 to 20, and n 3 is an integer of 1 to 6)
- the “sugar derivative interacting with the asialoglycoprotein receptor” and the linker were synthesized as a compound containing a sugar derivative and a part of the linker as described in Example 1 below, and the compound was synthesized as described in the following Example. It is solid-phased on the resin and introduced into the RNA oligonucleotide of the sense strand as described in 9) and 10) of Example 3 below. Thereafter, as described in Example 3 below 11), the antisense strand DNA antisense oligonucleotide is hybridized to obtain the “double-stranded oligonucleotide” of the present invention.
- Specific examples of the “compound containing a sugar derivative and a part of the linker” include the compounds described in Example 1 below.
- the 3 ′ end or 5 ′ end to which the sugar derivative of the “double-stranded oligonucleotide” of the present invention is not bound, or the linker may be further modified.
- modifying groups known in the art to enable tracking of the oligonucleotide, to improve the pharmacokinetics or pharmacodynamics of the oligonucleotide, or to improve the stability or binding affinity of the oligonucleotide.
- examples thereof include a hydroxyl protecting group, a reporter molecule, cholesterol, phospholipid, a dye, and a fluorescent molecule.
- the 3 ′ end or 5 ′ end to which the sugar derivative of the “double-stranded oligonucleotide” of the present invention is not bound may contain a phosphate ester moiety.
- Phosphate ester moiety means a terminal phosphate group, including phosphate esters as well as modified phosphate esters.
- the phosphate ester moiety may be located at either end, but is preferably a 5′-terminal nucleoside. Specifically, it is a group represented by the formula: —OP ( ⁇ O) (OH) OH or a modifying group thereof.
- O and OH is replaced by H, O, OR ′, S, N (R ′) (where R ′ is H, an amino protecting group or substituted or unsubstituted alkyl) or alkyl May be.
- R ′ is H, an amino protecting group or substituted or unsubstituted alkyl
- alkyl May be.
- the 5 ′ or 3 ′ end may each independently contain 1 to 3 phosphate ester moieties that are substituted or unsubstituted.
- Halogen includes fluorine atom, chlorine atom, bromine atom and iodine atom. In particular, a fluorine atom and a chlorine atom are preferable.
- Alkyl includes straight or branched hydrocarbon groups having 1 to 15 carbon atoms, preferably 1 to 10 carbon atoms, more preferably 1 to 6 carbon atoms, and still more preferably 1 to 4 carbon atoms. To do. For example, methyl, ethyl, n-propyl, isopropyl, n-butyl, isobutyl, sec-butyl, tert-butyl, n-pentyl, isopentyl, neopentyl, n-hexyl, isohexyl, n-heptyl, isoheptyl, n-octyl , Isooctyl, n-nonyl, n-decyl and the like.
- alkyl examples include methyl, ethyl, n-propyl, isopropyl, n-butyl, isobutyl, sec-butyl, tert-butyl and n-pentyl. Further preferred examples include methyl, ethyl, n-propyl, isopropyl and tert-butyl.
- Alkenyl has 2 to 15 carbon atoms, preferably 2 to 10 carbon atoms, more preferably 2 to 6 carbon atoms, and further preferably 2 to 4 carbon atoms, having one or more double bonds at any position. These linear or branched hydrocarbon groups are included.
- alkenyl include vinyl, allyl, propenyl, isopropenyl, butenyl, isobutenyl, prenyl, butadienyl, pentenyl, isopentenyl, pentadienyl, hexenyl, isohexenyl, hexadienyl, heptenyl, octenyl, nonenyl, decenyl, undecenyl, dodecenyl, tridecenyl, decenyl, tridecenyl, decenyl Etc.
- alkenyl include vinyl, allyl, propenyl, isopropenyl and butenyl.
- Alkynyl has 2 to 10 carbon atoms, preferably 2 to 8 carbon atoms, more preferably 2 to 6 carbon atoms, more preferably 2 to 4 carbon atoms, having one or more triple bonds at any position. Includes straight chain or branched hydrocarbon groups. Examples include ethynyl, propynyl, butynyl, pentynyl, hexynyl, heptynyl, octynyl, nonynyl, decynyl and the like. These may further have a double bond at an arbitrary position. Preferred embodiments of “alkynyl” include ethynyl, propynyl, butynyl and pentynyl.
- Alkylene is a straight or branched divalent hydrocarbon having 1 to 15 carbon atoms, preferably 1 to 10 carbon atoms, more preferably 1 to 6 carbon atoms, and still more preferably 1 to 4 carbon atoms. Includes groups. Examples include methylene, ethylene, trimethylene, propylene, tetramethylene, pentamethylene, hexamethylene and the like.
- “Aromatic carbocyclic group” means a monocyclic or bicyclic or more cyclic aromatic hydrocarbon group. For example, phenyl, naphthyl, anthryl, phenanthryl and the like can be mentioned. A preferred embodiment of the “aromatic carbocyclic group” includes phenyl.
- non-aromatic carbocyclic group means a cyclic saturated hydrocarbon group or a cyclic non-aromatic unsaturated hydrocarbon group having one or more rings.
- the non-aromatic carbocyclic group having two or more rings includes a monocyclic ring or a non-aromatic carbocyclic group having two or more rings condensed with the ring in the above “aromatic carbocyclic group”.
- the “non-aromatic carbocyclic group” includes a group which forms a bridge or a spiro ring as described below.
- the monocyclic non-aromatic carbocyclic group preferably has 3 to 16 carbon atoms, more preferably 3 to 12 carbon atoms, and still more preferably 4 to 8 carbon atoms.
- Examples include cyclopropyl, cyclobutyl, cyclopentyl, cyclohexyl, cycloheptyl, cyclooctyl, cyclononyl, cyclodecyl, cyclopropenyl, cyclobutenyl, cyclopentenyl, cyclohexenyl, cycloheptenyl, cyclohexadienyl, and the like.
- Examples of the two or more non-aromatic carbocyclic groups include indanyl, indenyl, acenaphthyl, tetrahydronaphthyl, fluorenyl and the like.
- “Aromatic heterocyclic group” means a monocyclic or bicyclic or more aromatic cyclic group having one or more heteroatoms arbitrarily selected from O, S and N in the ring. To do.
- the aromatic heterocyclic group having two or more rings includes those obtained by condensing a ring in the above “aromatic carbocyclic group” to a monocyclic or two or more aromatic heterocyclic group.
- the monocyclic aromatic heterocyclic group is preferably 5 to 8 members, more preferably 5 or 6 members.
- Examples include pyrrolyl, imidazolyl, pyrazolyl, pyridyl, pyridazinyl, pyrimidinyl, pyrazinyl, triazolyl, triazinyl, tetrazolyl, furyl, thienyl, isoxazolyl, oxazolyl, oxadiazolyl, isothiazolyl, thiazolyl, thiadiazolyl and the like.
- bicyclic aromatic heterocyclic group examples include indolyl, isoindolyl, indazolyl, indolizinyl, quinolinyl, isoquinolinyl, cinnolinyl, phthalazinyl, quinazolinyl, naphthyridinyl, quinoxalinyl, purinyl, pteridinyl, benzimidazolyl, benzisoxazolyl, benzisoxazolyl, Oxazolyl, benzoxiadiazolyl, benzisothiazolyl, benzothiazolyl, benzothiadiazolyl, benzofuryl, isobenzofuryl, benzothienyl, benzotriazolyl, imidazopyridyl, triazolopyridyl, imidazothiazolyl, pyrazinopyr Dazinyl, oxazolopyridyl, thiazolopyridyl and the like can be mentioned
- aromatic heterocyclic group having 3 or more rings examples include carbazolyl, acridinyl, xanthenyl, phenothiazinyl, phenoxathinyl, phenoxazinyl, dibenzofuryl and the like.
- non-aromatic heterocyclic group is a monocyclic or bicyclic or more cyclic non-aromatic cyclic group having one or more of the same or different heteroatoms arbitrarily selected from O, S and N in the ring Means group.
- the non-aromatic heterocyclic group having two or more rings includes the above-mentioned “aromatic carbocyclic group”, “non-aromatic carbocyclic group”, and monocyclic or two or more non-aromatic heterocyclic groups, and Also included are those in which each ring in the “aromatic heterocyclic group” is condensed.
- non-aromatic heterocyclic group also includes a group that forms a bridge or a spiro ring as described below.
- the monocyclic non-aromatic heterocyclic group is preferably 3 to 8 members, more preferably 5 or 6 members.
- Heterocycle means a ring derived from the above “aromatic heterocyclic group” and “non-aromatic heterocyclic group”.
- Aromatic ring means a ring derived from the above “aromatic carbocyclic group” and “aromatic heterocyclic group”.
- Alkyloxy means a group in which the above “alkyl” is bonded to an oxygen atom. Examples thereof include methoxy, ethoxy, n-propyloxy, isopropyloxy, n-butyloxy, tert-butyloxy, isobutyloxy, sec-butyloxy, pentyloxy, isopentyloxy, hexyloxy and the like. Preferable embodiments of “alkyloxy” include methoxy, ethoxy, n-propyloxy, isopropyloxy, tert-butyloxy.
- Alkenyloxy means a group in which the above “alkenyl” is bonded to an oxygen atom. Examples thereof include vinyloxy, allyloxy, 1-propenyloxy, 2-butenyloxy, 2-pentenyloxy, 2-hexenyloxy, 2-heptenyloxy, 2-octenyloxy and the like.
- Alkynyloxy means a group in which the above “alkynyl” is bonded to an oxygen atom. Examples include ethynyloxy, 1-propynyloxy, 2-propynyloxy, 2-butynyloxy, 2-pentynyloxy, 2-hexynyloxy, 2-heptynyloxy, 2-octynyloxy and the like.
- Haloalkyl means a group in which one or more of the “halogen” is bonded to the “alkyl”. For example, monofluoromethyl, monofluoroethyl, monofluoropropyl, 2,2,3,3,3-pentafluoropropyl, monochloromethyl, trifluoromethyl, trichloromethyl, 2,2,2-trifluoroethyl, 2, Examples include 2,2-trichloroethyl, 1,2-dibromoethyl, 1,1,1-trifluoropropan-2-yl and the like. Preferable embodiments of “haloalkyl” include trifluoromethyl and trichloromethyl.
- Haloalkyloxy means a group in which the above “haloalkyl” is bonded to an oxygen atom. Examples thereof include monofluoromethoxy, monofluoroethoxy, trifluoromethoxy, trichloromethoxy, trifluoroethoxy, trichloroethoxy and the like. Preferable embodiments of “haloalkyloxy” include trifluoromethoxy and trichloromethoxy.
- Alkyloxyalkyl means a group in which the above “alkyloxy” is bonded to the above “alkyl”. For example, methoxymethyl, methoxyethyl, ethoxymethyl and the like can be mentioned.
- Alkyloxyalkyloxy means a group in which the “alkyloxy” is bonded to the “alkyloxy”. Examples thereof include methoxymethoxy, methoxyethoxy, ethoxymethoxy, ethoxyethoxy and the like.
- Alkylthio means a group in which the above “alkyl” is bonded to a sulfur atom.
- Alkylcarbonyl means a group in which the above “alkyl” is bonded to a carbonyl group. Examples thereof include methylcarbonyl, ethylcarbonyl, propylcarbonyl, isopropylcarbonyl, tert-butylcarbonyl, isobutylcarbonyl, sec-butylcarbonyl, pentylcarbonyl, isopentylcarbonyl, hexylcarbonyl and the like. Preferable embodiments of “alkylcarbonyl” include methylcarbonyl, ethylcarbonyl, and n-propylcarbonyl.
- Alkenylcarbonyl means a group in which the above “alkenyl” is bonded to a carbonyl group.
- alkenyl ethylenylcarbonyl, propenylcarbonyl and the like can be mentioned.
- Alkynylcarbonyl means a group in which the above “alkynyl” is bonded to a carbonyl group. For example, ethynylcarbonyl, propynylcarbonyl and the like can be mentioned.
- Alkylamino includes monoalkylamino and dialkylamino.
- “Monoalkylamino” means a group in which the above “alkyl” is replaced with one hydrogen atom bonded to the nitrogen atom of the amino group.
- methylamino, ethylamino, isopropylamino and the like can be mentioned.
- methylamino and ethylamino are used.
- “Dialkylamino” means a group in which the above “alkyl” is replaced with two hydrogen atoms bonded to the nitrogen atom of the amino group. The two alkyls may be the same or different.
- Examples include dimethylamino, diethylamino, N, N-diisopropylamino, N-methyl-N-ethylamino, N-isopropyl-N-ethylamino and the like. Preferable examples include dimethylamino and diethylamino.
- Alkylsulfonyl means a group in which the above “alkyl” is bonded to a sulfonyl group.
- methylsulfonyl, ethylsulfonyl, propylsulfonyl, isopropylsulfonyl, tert-butylsulfonyl, isobutylsulfonyl, sec-butylsulfonyl and the like can be mentioned.
- Preferable embodiments of “alkylsulfonyl” include methylsulfonyl and ethylsulfonyl.
- Alkenylsulfonyl means a group in which the above “alkenyl” is bonded to a sulfonyl group.
- alkenyl ethylenylsulfonyl, propenylsulfonyl and the like can be mentioned.
- Alkynylsulfonyl means a group in which the above “alkynyl” is bonded to a sulfonyl group. For example, ethynylsulfonyl, propynylsulfonyl and the like can be mentioned.
- “Monoalkylcarbonylamino” means a group in which the above “alkylcarbonyl” is replaced with one hydrogen atom bonded to the nitrogen atom of the amino group.
- methylcarbonylamino, ethylcarbonylamino, propylcarbonylamino, isopropylcarbonylamino, tert-butylcarbonylamino, isobutylcarbonylamino, sec-butylcarbonylamino and the like can be mentioned.
- Preferable embodiments of “monoalkylcarbonylamino” include methylcarbonylamino and ethylcarbonylamino.
- Dialkylcarbonylamino means a group in which the above “alkylcarbonyl” is replaced with two hydrogen atoms bonded to the nitrogen atom of the amino group. Two alkylcarbonyl groups may be the same or different. For example, dimethylcarbonylamino, diethylcarbonylamino, N, N-diisopropylcarbonylamino and the like can be mentioned. Preferred embodiments of “dialkylcarbonylamino” include dimethylcarbonylamino and diethylcarbonylamino.
- “Monoalkylsulfonylamino” means a group in which the above “alkylsulfonyl” is replaced with one hydrogen atom bonded to the nitrogen atom of the amino group.
- methylsulfonylamino, ethylsulfonylamino, propylsulfonylamino, isopropylsulfonylamino, tert-butylsulfonylamino, isobutylsulfonylamino, sec-butylsulfonylamino and the like can be mentioned.
- Preferable embodiments of “monoalkylsulfonylamino” include methylsulfonylamino and ethylsulfonylamino.
- Dialkylsulfonylamino means a group in which the above “alkylsulfonyl” is replaced with two hydrogen atoms bonded to the nitrogen atom of the amino group. Two alkylsulfonyl groups may be the same or different. For example, dimethylsulfonylamino, diethylsulfonylamino, N, N-diisopropylsulfonylamino and the like can be mentioned. Preferred embodiments of “dialkylcarbonylamino” include dimethylsulfonylamino and diethylsulfonylamino.
- Alkylimino means a group in which the above “alkyl” is replaced with a hydrogen atom bonded to the nitrogen atom of the imino group.
- methylimino, ethylimino, n-propylimino, isopropylimino and the like can be mentioned.
- Alkenylimino means a group in which the above “alkenyl” is replaced with a hydrogen atom bonded to the nitrogen atom of the imino group. Examples thereof include ethylenylimino and propenylimino.
- Alkynylimino means a group in which the above “alkynyl” is replaced with a hydrogen atom bonded to the nitrogen atom of the imino group.
- alkynylimino ethynylimino, propynylimino and the like can be mentioned.
- Alkylcarbonylimino means a group in which the above “alkylcarbonyl” is replaced with a hydrogen atom bonded to the nitrogen atom of the imino group.
- methylcarbonylimino, ethylcarbonylimino, n-propylcarbonylimino, isopropylcarbonylimino and the like can be mentioned.
- Alkenylcarbonylimino means a group in which the above “alkenylcarbonyl” is replaced with a hydrogen atom bonded to the nitrogen atom of the imino group.
- alkenylcarbonylimino ethylenylcarbonylimino, propenylcarbonylimino and the like can be mentioned.
- Alkynylcarbonylimino means a group in which the above “alkynylcarbonyl” is replaced with a hydrogen atom bonded to the nitrogen atom of the imino group.
- alkynylcarbonylimino ethynylcarbonylimino, propynylcarbonylimino and the like can be mentioned.
- Alkyloxyimino means a group in which the above “alkyloxy” is replaced with a hydrogen atom bonded to the nitrogen atom of the imino group. Examples thereof include methyloxyimino, ethyloxyimino, n-propyloxyimino, isopropyloxyimino and the like.
- Alkenyloxyimino means a group in which the above “alkenyloxy” is replaced with a hydrogen atom bonded to the nitrogen atom of the imino group.
- alkenyloxyimino ethylenyloxyimino, propenyloxyimino and the like can be mentioned.
- Alkynyloxyimino means a group in which the above “alkynyloxy” is replaced with a hydrogen atom bonded to the nitrogen atom of the imino group.
- alkynyloxyimino ethynyloxyimino, propynyloxyimino and the like can be mentioned.
- Alkylcarbonyloxy means a group in which the above “alkylcarbonyl” is bonded to an oxygen atom. Examples thereof include methylcarbonyloxy, ethylcarbonyloxy, propylcarbonyloxy, isopropylcarbonyloxy, tert-butylcarbonyloxy, isobutylcarbonyloxy, sec-butylcarbonyloxy and the like. Preferable embodiments of “alkylcarbonyloxy” include methylcarbonyloxy and ethylcarbonyloxy.
- Alkenylcarbonyloxy means a group in which the above “alkenylcarbonyl” is bonded to an oxygen atom.
- alkenylcarbonyl ethylenylcarbonyloxy, propenylcarbonyloxy and the like can be mentioned.
- Alkynylcarbonyloxy means a group in which the above “alkynylcarbonyl” is bonded to an oxygen atom.
- alkynylcarbonyloxy ethynylcarbonyloxy, propynylcarbonyloxy and the like can be mentioned.
- Alkyloxycarbonyl means a group in which the above “alkyloxy” is bonded to a carbonyl group. For example, methyloxycarbonyl, ethyloxycarbonyl, propyloxycarbonyl, isopropyloxycarbonyl, tert-butyloxycarbonyl, isobutyloxycarbonyl, sec-butyloxycarbonyl, pentyloxycarbonyl, isopentyloxycarbonyl, hexyloxycarbonyl, etc. It is done.
- Preferable embodiments of “alkyloxycarbonyl” include methyloxycarbonyl, ethyloxycarbonyl, propyloxycarbonyl.
- Alkenyloxycarbonyl means a group in which the above “alkenyloxy” is bonded to a carbonyl group. For example, ethylenyloxycarbonyl, propenyloxycarbonyl and the like can be mentioned.
- Alkynyloxycarbonyl means a group in which the above “alkynyloxy” is bonded to a carbonyl group. For example, ethynyloxycarbonyl, propynyloxycarbonyl and the like can be mentioned.
- Alkylsulfanyl means a group in which the above “alkyl” is replaced with a hydrogen atom bonded to a sulfur atom of a sulfanyl group.
- methylsulfanyl, ethylsulfanyl, n-propylsulfanyl, isopropylsulfanyl and the like can be mentioned.
- Alkenylsulfanyl means a group in which the above “alkenyl” is replaced with a hydrogen atom bonded to a sulfur atom of a sulfanyl group.
- alkenyl ethylenylsulfanyl, propenylsulfanyl and the like can be mentioned.
- Alkynylsulfanyl means a group in which the above “alkynyl” is replaced with a hydrogen atom bonded to a sulfur atom of a sulfanyl group.
- alkynylsulfanyl ethynylsulfanyl, propynylsulfanyl and the like can be mentioned.
- Alkylsulfinyl means a group in which the above “alkyl” is bonded to a sulfinyl group. Examples thereof include methylsulfinyl, ethylsulfinyl, n-propylsulfinyl, isopropylsulfinyl and the like.
- Alkenylsulfinyl means a group in which the above “alkenyl” is bonded to a sulfinyl group.
- alkenyl ethylenylsulfinyl, propenylsulfinyl and the like can be mentioned.
- Alkynylsulfinyl means a group in which the above “alkynyl” is bonded to a sulfinyl group. For example, ethynylsulfinyl, propynylsulfinyl and the like can be mentioned.
- “Monoalkylcarbamoyl” means a group in which the above “alkyl” is replaced with one hydrogen atom bonded to the nitrogen atom of the carbamoyl group. Examples thereof include methylcarbamoyl and ethylcarbamoyl.
- Dialkylcarbamoyl means a group in which the above “alkyl” is replaced with two hydrogen atoms bonded to the nitrogen atom of the carbamoyl group.
- Two alkyl groups may be the same or different. Examples thereof include dimethylcarbamoyl, diethylcarbamoyl and the like.
- “Monoalkylsulfamoyl” means a group in which the above “alkyl” is replaced with one hydrogen atom bonded to the nitrogen atom of the sulfamoyl group. For example, methylsulfamoyl, dimethylsulfamoyl, etc. are mentioned.
- Dialkylsulfamoyl means a group in which the above “alkyl” is replaced with two hydrogen atoms bonded to the nitrogen atom of the sulfamoyl group.
- Two alkyl groups may be the same or different. Examples thereof include dimethylsulfamoyl and diethylsulfamoyl.
- Trialkylsilyl means a group in which the above three “alkyls” are bonded to a silicon atom.
- the three alkyls may be the same or different.
- trimethylsilyl, triethylsilyl, tert-butyldimethylsilyl and the like can be mentioned.
- “Aromatic carbocyclic alkyl” means an alkyl substituted with one or more of the above “aromatic carbocyclic groups”. For example, benzyl, phenethyl, phenylpropyl, benzhydryl, trityl, naphthylmethyl, groups shown below Etc.
- aromatic carbocyclic alkyl Preferable embodiments of “aromatic carbocyclic alkyl” include benzyl, phenethyl and benzhydryl.
- Non-aromatic carbocyclic alkyl means alkyl substituted with one or more of the above “non-aromatic carbocyclic groups”.
- the “non-aromatic carbocyclic alkyl” also includes “non-aromatic carbocyclic alkyl” in which the alkyl moiety is substituted with the above “aromatic carbocyclic group”. For example, cyclopropylmethyl, cyclobutylmethyl, cyclopentylmethyl, cyclohexylmethyl, groups shown below Etc.
- “Aromatic heterocyclic alkyl” means alkyl substituted with one or more of the above “aromatic heterocyclic groups”. “Aromatic heterocyclic alkyl” also includes “aromatic heterocyclic alkyl” in which the alkyl moiety is substituted with the above “aromatic carbocyclic group” and / or “non-aromatic carbocyclic group”. .
- pyridylmethyl furanylmethyl, imidazolylmethyl, indolylmethyl, benzothiophenylmethyl, oxazolylmethyl, isoxazolylmethyl, thiazolylmethyl, isothiazolylmethyl, pyrazolylmethyl, isopyrazolylmethyl, pyrrolidinylmethyl, benz Oxazolylmethyl, group shown below Etc.
- Non-aromatic heterocyclic alkyl means an alkyl substituted with one or more of the above “non-aromatic heterocyclic groups”.
- the alkyl portion is substituted with the above “aromatic carbocyclic group”, “non-aromatic carbocyclic group” and / or “aromatic heterocyclic group”.
- non-aromatic heterocyclic alkyl For example, tetrahydropyranylmethyl, morpholinylethyl, piperidinylmethyl, piperazinylmethyl, groups shown below Etc.
- “Aromatic carbocyclic alkyloxy” means alkyloxy substituted with one or more of the above “aromatic carbocyclic groups”. For example, benzyloxy, phenethyloxy, phenylpropyloxy, benzhydryloxy, trityloxy, naphthylmethyloxy, groups shown below Etc.
- Non-aromatic carbocyclic alkyloxy means alkyloxy substituted with one or more of the above “non-aromatic carbocyclic groups”.
- the “non-aromatic carbocyclic alkyloxy” also includes “non-aromatic carbocyclic alkyloxy” in which the alkyl moiety is substituted with the above “aromatic carbocyclic group”. For example, cyclopropylmethyloxy, cyclobutylmethyloxy, cyclopentylmethyloxy, cyclohexylmethyloxy, groups shown below Etc.
- “Aromatic heterocyclic alkyloxy” means alkyloxy substituted with one or more of the above “aromatic heterocyclic groups”. “Aromatic heterocyclic alkyloxy” also includes “aromatic heterocyclic alkyloxy” in which the alkyl moiety is substituted with the above “aromatic carbocyclic group” and / or “non-aromatic carbocyclic group”. Include.
- Non-aromatic heterocyclic alkyloxy means alkyloxy substituted with one or more of the above “non-aromatic heterocyclic groups”.
- the alkyl moiety is substituted with the above “aromatic carbocyclic group”, “non-aromatic carbocyclic group” and / or “aromatic heterocyclic group”. It also includes “non-aromatic heterocyclic alkyloxy”. For example, tetrahydropyranylmethyloxy, morpholinylethyloxy, piperidinylmethyloxy, piperazinylmethyloxy, groups shown below Etc.
- “Aromatic carbocyclic alkyloxycarbonyl” means alkyloxycarbonyl substituted with one or more of the above “aromatic carbocyclic groups”. For example, benzyloxycarbonyl, phenethyloxycarbonyl, phenylpropyloxycarbonyl, benzhydryloxycarbonyl, trityloxycarbonyl, naphthylmethyloxycarbonyl, groups shown below Etc.
- Non-aromatic carbocyclic alkyloxycarbonyl means alkyloxycarbonyl substituted with one or more of the above “non-aromatic carbocyclic groups”.
- the “non-aromatic carbocyclic alkyloxycarbonyl” also includes “non-aromatic carbocyclic alkyloxycarbonyl” in which the alkyl moiety is substituted with the above “aromatic carbocyclic group”. For example, cyclopropylmethyloxycarbonyl, cyclobutylmethyloxycarbonyl, cyclopentylmethyloxycarbonyl, cyclohexylmethyloxycarbonyl, groups shown below Etc.
- “Aromatic heterocyclic alkyloxycarbonyl” means alkyloxycarbonyl substituted with one or more of the above “aromatic heterocyclic groups”.
- the “aromatic heterocyclic alkyloxycarbonyl” is an “aromatic heterocyclic alkyloxycarbonyl” in which the alkyl moiety is substituted with the above “aromatic carbocyclic group” and / or “non-aromatic carbocyclic group”. Is also included.
- pyridylmethyloxycarbonyl furanylmethyloxycarbonyl, imidazolylmethyloxycarbonyl, indolylmethyloxycarbonyl, benzothiophenylmethyloxycarbonyl, oxazolylmethyloxycarbonyl, isoxazolylmethyloxycarbonyl, thiazolylmethyl Oxycarbonyl, isothiazolylmethyloxycarbonyl, pyrazolylmethyloxycarbonyl, isopyrazolylmethyloxycarbonyl, pyrrolidinylmethyloxycarbonyl, benzoxazolylmethyloxycarbonyl, groups shown below Etc.
- Non-aromatic heterocyclic alkyloxycarbonyl means alkyloxycarbonyl substituted with one or more of the above “non-aromatic heterocyclic groups”.
- the alkyl moiety is substituted with the above “aromatic carbocyclic group”, “non-aromatic carbocyclic group” and / or “aromatic heterocyclic group”.
- non-aromatic heterocyclic alkyloxycarbonyl For example, tetrahydropyranylmethyloxy, morpholinylethyloxy, piperidinylmethyloxy, piperazinylmethyloxy, groups shown below Etc.
- “Aromatic carbocyclic alkyloxyalkyl” means alkyloxyalkyl substituted with one or more of the above “aromatic carbocyclic groups”. For example, benzyloxymethyl, phenethyloxymethyl, phenylpropyloxymethyl, benzhydryloxymethyl, trityloxymethyl, naphthylmethyloxymethyl, groups shown below Etc.
- Non-aromatic carbocyclic alkyloxyalkyl means alkyloxyalkyl substituted with one or more of the above “non-aromatic carbocyclic groups”.
- non-aromatic carbocyclic alkyloxyalkyl means “non-aromatic carbocyclic alkyloxyalkyl” in which the alkyl moiety to which the non-aromatic carbocycle is bonded is substituted with the above “aromatic carbocyclic group”. Is also included. For example, cyclopropylmethyloxymethyl, cyclobutylmethyloxymethyl, cyclopentylmethyloxymethyl, cyclohexylmethyloxymethyl, groups shown below Etc.
- “Aromatic heterocyclic alkyloxyalkyl” means alkyloxyalkyl substituted with one or more of the above “aromatic heterocyclic groups”.
- the “aromatic heterocycle alkyloxyalkyl” is obtained by substituting the alkyl moiety to which the aromatic heterocycle is bonded with the above “aromatic carbocyclic group” and / or “non-aromatic carbocyclic group”. Also included are “aromatic heterocyclic alkyloxyalkyl”.
- pyridylmethyloxymethyl furanylmethyloxymethyl, imidazolylmethyloxymethyl, indolylmethyloxymethyl, benzothiophenylmethyloxymethyl, oxazolylmethyloxymethyl, isoxazolylmethyloxymethyl, thiazolylmethyl Oxymethyl, isothiazolylmethyloxymethyl, pyrazolylmethyloxymethyl, isopyrazolylmethyloxymethyl, pyrrolidinylmethyloxymethyl, benzoxazolylmethyloxymethyl, groups shown below Etc.
- Non-aromatic heterocyclic alkyloxyalkyl means alkyloxyalkyl substituted with one or more of the above “non-aromatic heterocyclic groups”.
- non-aromatic heterocyclic alkyloxy means that the alkyl moiety to which the non-aromatic heterocyclic ring is bonded is the above “aromatic carbocyclic group”, “non-aromatic carbocyclic group” and / or “aromatic”.
- non-aromatic heterocyclic alkyloxyalkyl substituted with “aromatic heterocyclic group”. For example, tetrahydropyranylmethyloxymethyl, morpholinylethyloxymethyl, piperidinylmethyloxymethyl, piperazinylmethyloxymethyl, groups shown below Etc.
- “Aromatic carbocyclic alkylamino” means a group in which the above “aromatic carbocyclic alkyl” is replaced with one or two hydrogen atoms bonded to the nitrogen atom of the amino group. Examples include benzylamino, phenethylamino, phenylpropylamino, benzhydrylamino, tritylamino, naphthylmethylamino, dibenzylamino and the like.
- Non-aromatic carbocyclic alkylamino means a group in which the above “non-aromatic carbocyclic alkyl” is replaced with one or two hydrogen atoms bonded to the nitrogen atom of the amino group.
- cyclopropylmethylamino, cyclobutylmethylamino, cyclopentylmethylamino, cyclohexylmethylamino and the like can be mentioned.
- “Aromatic heterocyclic alkylamino” means a group in which the above “aromatic heterocyclic alkyl” is replaced with one or two hydrogen atoms bonded to the nitrogen atom of the amino group.
- aromatic heterocyclic alkyl For example, pyridylmethylamino, furanylmethylamino, imidazolylmethylamino, indolylmethylamino, benzothiophenylmethylamino, oxazolylmethylamino, isoxazolylmethylamino, thiazolylmethylamino, isothiazolylmethylamino , Pyrazolylmethylamino, isopyrazolylmethylamino, pyrrolidinylmethylamino, benzoxazolylmethylamino and the like.
- Non-aromatic heterocyclic alkylamino means a group in which the above-mentioned “non-aromatic heterocyclic alkyl” is replaced with one or two hydrogen atoms bonded to the nitrogen atom of the amino group.
- non-aromatic heterocyclic alkyl For example, tetrahydropyranylmethylamino, morpholinylethylamino, piperidinylmethylamino, piperazinylmethylamino and the like can be mentioned.
- aromatic carbocyclic oxy means a group in which an “aromatic carbocycle” is bonded to an oxygen atom.
- aromatic carbocyclic carbonyl means a group in which an “aromatic carbocycle” is bonded to a carbonyl group.
- “Aromatic carbocyclic oxycarbonyl” means a group in which the above “aromatic carbocyclic oxy” is bonded to a carbonyl group.
- “Aromatic carbocyclic sulfanyl” means a group in which an “aromatic carbocyclic ring” is replaced with a hydrogen atom bonded to a sulfur atom of a sulfanyl group. Examples thereof include phenylsulfanyl and naphthylsulfanyl.
- “Aromatic carbocyclic sulfonyl” means a group in which “aromatic carbocycle” is bonded to a sulfonyl group.
- aromatic carbocycle for example, phenylsulfonyl, naphthylsulfonyl and the like can be mentioned.
- Non-aromatic carbocyclic oxy “non-aromatic carbocyclic carbonyl”, “non-aromatic carbocyclic oxycarbonyl”, “non-aromatic carbocyclic sulfanyl”, and “non-aromatic carbocyclic sulfonyl”
- the “aromatic carbocyclic” moiety is the same as the above “non-aromatic carbocyclic group”.
- Non-aromatic carbocyclic oxy means a group in which “non-aromatic carbocycle” is bonded to an oxygen atom. For example, cyclopropyloxy, cyclohexyloxy, cyclohexenyloxy and the like can be mentioned.
- Non-aromatic carbocycle carbonyl means a group in which “non-aromatic carbocycle” is bonded to a carbonyl group.
- cyclopropylcarbonyl, cyclohexylcarbonyl, cyclohexenylcarbonyl and the like can be mentioned.
- the “non-aromatic carbocyclic oxycarbonyl” means a group in which the above “non-aromatic carbocyclic oxy” is bonded to a carbonyl group.
- cyclopropyloxycarbonyl, cyclohexyloxycarbonyl, cyclohexenyloxycarbonyl and the like can be mentioned.
- Non-aromatic carbocyclic sulfanyl means a group in which a “non-aromatic carbocyclic ring” is replaced with a hydrogen atom bonded to a sulfur atom of a sulfanyl group. Examples include cyclopropylsulfanyl, cyclohexylsulfanyl, cyclohexenylsulfanyl and the like.
- Non-aromatic carbocycle sulfonyl means a group in which “non-aromatic carbocycle” is bonded to a sulfonyl group. For example, cyclopropylsulfonyl, cyclohexylsulfonyl, cyclohexenylsulfonyl and the like can be mentioned.
- aromatic heterocycle portion of “aromatic heterocycle oxy”, “aromatic heterocycle carbonyl”, “aromatic heterocycle oxycarbonyl”, “aromatic heterocycle sulfanyl”, and “aromatic heterocycle sulfonyl”
- Aromatic heterocycle oxy means a group in which “aromatic heterocycle” is bonded to an oxygen atom.
- pyridyloxy, oxazolyloxy and the like can be mentioned.
- Aromatic heterocycle carbonyl means a group in which “aromatic heterocycle” is bonded to a carbonyl group.
- “Aromatic heterocyclic oxycarbonyl” means a group in which the above “aromatic heterocyclic oxy” is bonded to a carbonyl group.
- “Aromatic heterocycle sulfanyl” means a group in which an “aromatic heterocycle” is replaced with a hydrogen atom bonded to a sulfur atom of a sulfanyl group.
- pyridylsulfanyl, oxazolylsulfanyl and the like can be mentioned.
- “Aromatic heterocycle sulfonyl” means a group in which “aromatic heterocycle” is bonded to a sulfonyl group.
- aromatic heterocycle for example, pyridylsulfonyl, oxazolylsulfonyl and the like can be mentioned.
- Non-aromatic heterocyclic oxy means a group in which “non-aromatic heterocyclic” is bonded to an oxygen atom.
- Non-aromatic heterocyclic oxy means a group in which “non-aromatic heterocyclic” is bonded to an oxygen atom.
- piperidinyloxy, tetrahydrofuryloxy and the like can be mentioned.
- Non-aromatic heterocyclic carbonyl means a group in which “non-aromatic heterocyclic” is bonded to a carbonyl group.
- piperidinylcarbonyl, tetrahydrofurylcarbonyl and the like can be mentioned.
- the “non-aromatic heterocyclic oxycarbonyl” means a group in which the “non-aromatic heterocyclic oxy” is bonded to a carbonyl group.
- piperidinyloxycarbonyl, tetrahydrofuryloxycarbonyl and the like can be mentioned.
- Non-aromatic heterocyclic sulfanyl means a group in which a “non-aromatic heterocyclic ring” is replaced with a hydrogen atom bonded to a sulfur atom of a sulfanyl group.
- piperidinylsulfanyl, tetrahydrofurylsulfanyl and the like can be mentioned.
- Non-aromatic heterocyclic sulfonyl means a group in which “non-aromatic heterocyclic” is bonded to a sulfonyl group.
- piperidinylsulfonyl, tetrahydrofurylsulfonyl and the like can be mentioned.
- the carbon atom at any position may be bonded to one or more groups selected from the following substituents.
- substituents halogen, hydroxy, carboxy, amino, imino, hydroxyamino, hydroxyimino, formyl, formyloxy, carbamoyl, sulfamoyl, sulfanyl, sulfino, sulfo, thioformyl, thiocarboxy, dithiocarboxy, thiocarbamoyl, cyano, nitro, nitroso , Azide, hydrazino, ureido, amidino, guanidino, trialkylsilyl, alkyloxy, alkenyloxy, alkynyloxy, haloalkyloxy, alkylcarbonyl, alkenylcarbonyl, alkynylcarbonyl, monoalkylamino, dialkylamino, alkylsulfonyl, alkeny
- An atom at any position on the ring may be bonded to one or more groups selected from the following substituents.
- substituents halogen, hydroxy, carboxy, amino, imino, hydroxyamino, hydroxyimino, formyl, formyloxy, carbamoyl, sulfamoyl, sulfanyl, sulfino, sulfo, thioformyl, thiocarboxy, dithiocarboxy, thiocarbamoyl, cyano, nitro, nitroso , Azide, hydrazino, ureido, amidino, guanidino, trialkylsilyl, alkyl, alkenyl, alkynyl, haloalkyl, alkyloxy, alkenyloxy, alkynyloxy, haloalkyloxy, alkyloxyalkyl, alkylcarbonyl, alkylcarbonyl, alkyl,
- substituted or unsubstituted non-aromatic carbocyclic group and “substituted or unsubstituted non-aromatic heterocyclic group” may be substituted with “oxo”. In this case, it means a group in which two hydrogen atoms on a carbon atom are substituted as follows.
- the present invention also encompasses a pharmaceutical composition containing the “double-stranded oligonucleotide” of the present invention.
- a pharmaceutical composition containing the “double-stranded oligonucleotide” of the present invention As the administration method and preparation of the pharmaceutical composition of the present invention, any administration method and preparation known in the art can be used. Antisense oligonucleotide administration methods and preparations are also disclosed in, for example, the following documents. International Publication No. 2004/016749, International Publication No. 2005/083124, International Publication No. 2007/143315, International Publication No. 2009/071680, International Publication No. 2013/0889283, and the like.
- the pharmaceutical composition of the present invention can be administered by various methods depending on whether local or systemic treatment is desired or on the region to be treated.
- the administration method may be, for example, topical (including eye drops, intravaginal, rectal, intranasal, transdermal), oral, or parenteral.
- Parenteral administration includes intravenous injection or infusion, subcutaneous, intraperitoneal or intramuscular injection, pulmonary administration by inhalation or inhalation, intradural administration, intraventricular administration, and the like. Intravenous injection or subcutaneous administration is preferred.
- compositions for oral administration include powders, granules, suspensions or solutions dissolved in water or non-aqueous media, capsules, powders, tablets and the like.
- compositions for parenteral, subdural space, or intraventricular administration include sterile aqueous solutions containing buffers, diluents and other suitable additives.
- the pharmaceutical composition of the present invention comprises various pharmaceutical additives such as excipients, binders, wetting agents, disintegrants, lubricants, diluents and the like suitable for the dosage form in the effective amount of the antisense oligonucleotide of the present invention.
- the agent can be obtained by mixing as necessary. In the case of an injection, it may be sterilized with an appropriate carrier to form a preparation.
- Excipients include lactose, sucrose, glucose, starch, calcium carbonate or crystalline cellulose.
- binder include methyl cellulose, carboxymethyl cellulose, hydroxypropyl cellulose, gelatin, and polyvinyl pyrrolidone.
- disintegrant include carboxymethyl cellulose, sodium carboxymethyl cellulose, starch, sodium alginate, agar powder, or sodium lauryl sulfate.
- lubricant include talc, magnesium stearate or macrogol. As a suppository base, cocoa butter, macrogol, methylcellulose, or the like can be used.
- solubilizers when preparing as liquid or emulsion or suspension injections, commonly used solubilizers, suspending agents, emulsifiers, stabilizers, preservatives, isotonic agents, etc. are added as appropriate. You may do it. In the case of oral administration, flavoring agents, fragrances and the like may be added.
- the optimal dosing schedule can be calculated from measurements of drug accumulation in the body. Persons of ordinary skill in the art can determine optimum dosages, dosing methodologies and repetition rates. The optimal dose will vary depending on the relative potency of the individual antisense oligonucleotides, but can generally be calculated based on the IC50 or EC50 in in vitro and in vivo animal experiments.
- an antisense oligonucleotide derived from the antisense oligonucleotide sequence and chemical structure
- an effective dose derived experimentally
- IC50 for example, mg / kg
- the NMR analysis obtained in the examples was performed at 300 MHz and measured using DMSO-d6 or CDCl 3 .
- Step 1 Synthesis of Compound 102 Sodium hydride (60% w / w, 5.26 g, 1.5 eq.) was added to a solution of Compound 101 (15.0 g, 88.0 mmol) in N, N′-dimethylformamide (100 mL) at room temperature. ) And stirred for 30 minutes, then benzyl bromide (10.42 g, 88.0 mmol) was added and stirred at room temperature for 5.5 hours. Methanol (5 ml) was added to the reaction mixture, saturated brine was added, the mixture was extracted with ethyl acetate, washed with saturated brine, and dried over magnesium sulfate.
- Step 2 Synthesis of Compound 103
- pyridinium dichromate (19.3 g, 51.3 mmol)
- ethyl acetate 200 mL
- saturated brine was added to the filtrate, extracted with ethyl acetate, washed with saturated brine, and then dried over magnesium sulfate.
- Step 3 Synthesis of Compound 104 and Compound 105
- Compound 104 was synthesized by the method described in Example 3 of International Publication No. 2012/037254, and then Compound 105 was synthesized.
- Step 4 Synthesis of Compound 106 To a solution of Compound 103 (218 mg, 17.1 mmol) in N, N′-dimethylformamide (3 mL) at room temperature, N, N′-diisopropylethylamine (405 ⁇ l, 2.32 mmol), HBTU (324 mg, 0 .855 mmol) was added and stirred at room temperature for 10 minutes, and then a solution of compound 105 (218 mg, 17.1 mmol) in N, N′-dimethylformamide (3 mL), N, N′-diisopropylethylamine (75 ⁇ l, 0.428 mmol) And stirred at room temperature for 12 hours.
- reaction solution was diluted with chloroform, washed successively with 10% aqueous sodium hydrogen carbonate solution and saturated brine, then dried over magnesium sulfate, and the solvent was evaporated under reduced pressure.
- Step 5 Synthesis of Compound 107
- Pd—C 10%, 50 mg
- the catalyst was filtered off from the reaction solution, and the filtrate was concentrated to obtain Compound 107 (79 mg, yield 92%) as a colorless powder.
- ESI-MS (m / z): 1992.10 (M-1).
- Step 6 Synthesis of Compound 1 To a methylene chloride solution (7 mL) of Compound 107 (722 mg, 0.362 mmol) at 0 ° C., N, N′-diisopropylethylamine (253 ⁇ l, 1.45 mmol), 3- (chloro (diisopropylamino) Phosphinoxy) propanenitrile (0.162 ml, 0.725 mmol) was added and stirred at room temperature for 2 hours. The reaction mixture was diluted with methylene chloride, washed successively with 10% aqueous sodium hydrogen carbonate solution and saturated brine, and dried over magnesium sulfate, and the solvent was evaporated under reduced pressure.
- Step 1 Synthesis of Compound 109
- the compound 109 was synthesized in two steps from Compound 108 according to the method described in Bioorganic Medicinal Chemistry Letters, 11, 383-386 (2001).
- Step 2 Synthesis of Compound 110 Compound 109 (11.84 g, 19.2 mmol) in N, N′-dimethylformamide solution (50 mL) at room temperature with imidazole (1.57 g, 23.1 mmol, 1.2 eq.), Third Butyldimethylsilyl chloride (1.59 g, 21.2 mmol, 1.1 eq.) was sequentially added, and the mixture was stirred at room temperature for 2 hours.
- reaction mixture was diluted with ethyl acetate, washed successively with 10% aqueous sodium hydrogen carbonate solution and saturated brine, and dried over magnesium sulfate, and the solvent was evaporated under reduced pressure to give compound 110 (14.35 g, crude product).
- Step 3 Synthesis of Compound 111 Piperidine was added to a solution of Compound 110 (14.35 g, crude) in N, N′-dimethylformamide (50 mL) and stirred at room temperature for 5.5 hours, and then the reaction solution was concentrated under reduced pressure. Gave a crude product of compound 111 (14.46 g).
- Step 4 Synthesis of Compound 112 N, N′-diisopropylethylamine (4) was added to a solution of 12-methoxy-12-oxododecanoic acid (1.81 g, 7.40 mmol) in N, N′-dimethylformamide (10 ml) at room temperature.
- Step 5 Synthesis of Compound 113
- a compound 112 (2.70 g, 3.68 mmol) in methanol (20 ml) -tetrahydrofuran (8 ml) was added 2 mol / L aqueous sodium hydroxide solution (3.68 ml, 2 eq.) At room temperature. For 2 hours. The reaction solution was neutralized by adding 2 mol / L hydrochloric acid at ⁇ 78 ° C., diluted with ethyl acetate, washed successively with saturated brine, then dried over magnesium sulfate, and the solvent was distilled off under reduced pressure. Compound 113 (2.23 g, yield 88%) was obtained.
- Step 6 Synthesis of Compound 114 To a solution of Compound 113 (671 mg, 17.1 mmol) in N, N′-dimethylformamide (5 mL) at room temperature, N, N′-diisopropylethylamine (0.549 ml, 3.14 mmol), HBTU (358 mg) 0.94 mmol), and the mixture was stirred at room temperature for 10 minutes, and then a solution of compound 105 (1.20 g, 0.629 mmol) in N, N′-dimethylformamide (5 mL), N, N′-diisopropylethylamine (0. 132 ml, 0.755 mmol) was added and stirred at room temperature for 12 hours.
- Step 7 Synthesis of Compound 115
- ESI-MS (m / z): 1214 (M / 2 + Na).
- Step 1 Synthesis of Compound 117
- a pyridine solution (40 ml) of Compound 116 (10.0 g, 30.9 mmol) was added 4,4′-dimethoxytrityl chloride (11.0 g, 32.5 mmol, 1.05 eq.) At room temperature. And stirred at room temperature for 2 hours. The reaction mixture was diluted with ethyl acetate, washed successively with 10% aqueous sodium hydrogen carbonate solution and saturated brine, and dried over magnesium sulfate, and the solvent was evaporated under reduced pressure to give compound 117 (22.95 g, crude product).
- Step 2 Synthesis of Compound 118 Piperidine (3.65 ml, 36.9 mmol) was added to a solution of Compound 117 (22.85 g, crude) in N, N′-dimethylformamide (70 ml), and the mixture was stirred at room temperature for 2 hours. The liquid was concentrated under reduced pressure to obtain a crude product of Compound 118 (22.75 g).
- Step 3 Synthesis of Compound 119
- Compound 119 was obtained as a colorless foam (yield 69% from Compound 117).
- 1 H-NMR was observed as a 6: 4 rotamer mixture.
- Step 4 Synthesis of Compound 120 By the same method as in Step 2, compound 120 was obtained as a crude product.
- Step 5 Synthesis of Compound 121 By the same method as in Step 4 of Compound 4, Compound 121 was obtained as a colorless foam (46% yield from Compound 119).
- ESI-MS m / z: 854 (M + Na), 830 (MH).
- Step 6 Synthesis of Compound 122
- Compound 122 was obtained as a colorless foam (yield 90%).
- ESI-MS (m / z): 816 (M-H).
- Step 7 Synthesis of Compound 123
- Compound 123 was obtained as a colorless foam (yield 61%).
- ESI-MS (m / z): 1319 (M / 2 + Na).
- Step 8 Synthesis of Compound 124
- ESI-MS (m / z): 1262 (M / 2 + Na).
- Step 9 Synthesis of Compound 5
- Compound 124 (545 mg, 0.220 mmol) in dichloromethane solution (4 ml) at room temperature with triethylamine (0.061 ml, 0.440 mmol, 2.0 eq.), Succinic anhydride (33 mg, 0.330 mmol, 1.5 eq.) And dimethylaminopyridine (5 mg) were added and stirred at room temperature for 2 hours, and then the reaction solution was concentrated under reduced pressure.
- Step 2 Synthesis of Compound 134
- Compound 134 was obtained as a colorless foamy substance in the same manner as in Step 6 of Compound 4 (yield 57%).
- Step 3 Synthesis of Compound 135
- Compound 135 was obtained as a colorless powder by the same step as in Step 7 of Compound 4 (yield 60%).
- ESI-MS m / z: 1157 (M + Na).
- Step 4 Synthesis of Compound 7 Compound 7 is obtained in the same manner as in Step 8 of Compound 4.
- Step 1 Synthesis of Compound 136
- Compound 136 was obtained as a colorless foam by the same method as in Step 1 of Compound 7 (yield 85%).
- 1 H-NMR was observed as a 63:37 rotamer mixture.
- Step 2 Synthesis of Compound 137
- Compound 137 was obtained as a colorless foamy substance in the same manner as in Step 4 of Compound 4 (yield 50%).
- 1 H-NMR was observed as a 70:30 rotamer mixture.
- ESI-MS (m / z): 1263 (M / 2 + Na).
- Step 3 Synthesis of Compound 138
- Compound 138 was obtained as a colorless foamy substance in the same manner as in Step 5 of Compound 5 (yield 80%).
- Step 4 Synthesis of Compound 8
- Compound 8 was obtained as a colorless foamy substance in the same manner as in Step 9 of Compound 5 (yield 82%).
- ESI-MS (m / z): 1255 (M / 2 + Na).
- Step 1 Synthesis of Compound 140
- Compound 140 was obtained as a colorless foamy substance in the same manner as in Step 7 of Compound 7 (yield 57%).
- ESI-MS (m / z): 663 (MH).
- Step 2 Synthesis of Compound 141
- Compound 141 was obtained as a colorless foamy substance in the same manner as in Step 6 of Compound 4 (yield 57%).
- Step 3 Synthesis of Compound 142
- Compound 142 was obtained as a colorless foam by the same method as in Step 5 of Compound 5 (yield 68%).
- Step 4 Synthesis of Compound 9
- Compound 9 was obtained as a colorless foam by the same method as in Step 5 of Compound 5 (yield 83%).
- Step 1 Synthesis of Compound 144 To a 1,2-dimethoxyethane solution (100 mL) of Compound 143 (10.0 g, 37.7 mmol) at room temperature (4-tert-butoxycarbonyl) phenyl) boronic acid (9.21 g, 41.41). 5 mmol), 2 mol / L aqueous potassium carbonate solution (56.6 ml, 113 mmol) and PdCl 2 (dppf) (3.07 g, 3.77 mmol) were added, and the mixture was stirred at 80 ° C. for 1 hour.
- Step 3 Synthesis of Compound 146
- Compound 146 was obtained as a colorless solid in the same manner as in Step 4 of Compound 4 (yield 74%).
- Step 4 Synthesis of Compound 147
- After treating in the same manner as in Step 5 of Compound 4, purify by silica gel column chromatography (chloroform: methanol: triethylamine 97.5: 2.5: 1 ⁇ 90: 10: 1).
- Gave compound 147 as a colorless solid (47% yield).
- 1 H-NMR was observed as a 60:40 rotamer mixture.
- Step 5 Synthesis of Compound 148
- Compound 148 was obtained as a colorless foamy substance in the same manner as in Step 6 of Compound 4 (yield 52%).
- 1 H-NMR was observed as a 59:41 rotamer mixture.
- Step 6 Synthesis of Compound 149
- Compound 149 was obtained as a colorless foamy substance in the same manner as in Step 5 of Compound 5 (yield%).
- Step 7 Synthesis of Compound 14 By the same method as in Step 5 of Compound 5, Compound 14 was obtained as a colorless foam (yield 82%).
- Step 1 Synthesis of Compound 151 Sodium hydride (116 mg, 2 mg) was added to a tetrahydrofuran solution (100 mL) in which Compound 150 (18.1 g, 76.0 mmol) and methyl acrylate (5.0 g, 5.23 mmol) were dissolved. .90 mmol) was added, followed by stirring at the same temperature for 2 hours. The reaction mixture was diluted with ethyl acetate, washed with saturated aqueous ammonium chloride solution and saturated brine, and dried over magnesium sulfate, and the solvent was evaporated under reduced pressure.
- Step 2 Synthesis of Compound 152 To a methanol (10 mL) solution in which Compound 151 (1.02 g, 3.13 mmol) was dissolved, 10% palladium carbon (200 mg) was added, and the mixture was stirred at room temperature under a normal pressure hydrogen stream for 12 hours. The catalyst was filtered off from the reaction solution, and the filtrate was concentrated. The obtained residue was dissolved in a mixed solution of acetonitrile (5 ml) -water (5 ml), and then 2,2,6,6-tetramethylpiperidine 1-oxyl (98 mg, 0.625 mmol), iodobenzene diaceter at room temperature. (2.22 g, 6.88 mmol) was added and stirred at the same temperature for 1 hour.
- Step 3 Synthesis of Compound 153
- Compound 153 was obtained as a colorless oil by the same method as in Step 4 of Compound 4 (yield 70%).
- 1 H-NMR was observed as a 60:40 rotamer mixture.
- ESI-MS (m / z): 859 (M + Na).
- Step 5 Synthesis of Compound 155
- Compound 155 was obtained as a colorless foam (yield 46%).
- 1 H-NMR was observed as a 60:40 rotamer mixture.
- Step 6 Synthesis of Compound 156
- Compound 156 was obtained as a colorless foamy substance in the same manner as in Step 5 of Compound 5 (yield 66%).
- Step 7 Synthesis of Compound 18 By the same method as in Step 5 of Compound 5, Compound 18 was obtained as a colorless foam (yield 75%).
- Step 1 Synthesis of Compound 157 Synthesized according to the method described in International Publication No. 2011/148922.
- Step 2 Synthesis of Compound 158
- Compound 158 was synthesized from Compound 157 in two steps by a method similar to the method described in Bioorganic Medicinal Chemistry Letters, 11, 383-386 (2001).
- Step 7 Synthesis of Compound 163
- Compound 163 was obtained as a colorless foamy substance in the same manner as in Step 4 of Compound 4 (yield 83%).
- ESI-MS (m / z) 1220 (M / 2 + Na).
- Step 8 Synthesis of Compound 19 Compound 19 was obtained as a colorless foam by the same method as in Step 8 of Compound 4 (yield 71%).
- Step 1 Synthesis of Compound 165
- Oxalyl chloride (171 ⁇ L, 1.95 mmol) was added to a dichloromethane solution (3.6 mL) of Compound 164 (US 2012/0157509) (90 mg, 0.489 mmol) at room temperature. After stirring for 21 hours, the solvent was distilled off. The obtained residue was dissolved in dichloromethane (1.8 mL), and a solution of compound 105 (877 mg, 0.489 mmol) and pyridine (158 ⁇ L, 1.96 mmol) in dichloromethane (5.4 mL) was added under ice cooling for 7 hours. Stir. A 10% aqueous citric acid solution was added to the reaction solution, and the mixture was extracted with chloroform.
- Step 1 Synthesis of Compound 167 Diethylamine (84 uL, 0.80 mmol) was added to a solution of Compound 166 (161 mg, 0.27 mmol) in N, N-dimethylformamide (1 mL) prepared according to the method described in EP 624377. ) And stirred at room temperature for 3 hours. Diethylamine and N, N-dimethylformamide were distilled off by concentrating the reaction solution under reduced pressure to make the reaction solution weight 1 g.
- N, N-diisopropylethylamine 55 uL, 0.32 mmol
- HBTU 44 mg, 0.12 mmol
- DMF solution 2 mL
- HBTU HBTU
- 0.5 g corresponding to 0.13 mmol
- water was added to the reaction solution, and the aqueous layer was washed with chloroform.
- the residue obtained by concentration of the aqueous layer under reduced pressure was dissolved in N, N-dimethylformamide (2 mL).
- Diisopropylethylamine (50 ⁇ L) was added to a DMF solution (2 mL) of compound 3 (290 mg, 100 ⁇ mol), and then stirred under ice cooling. A DMF solution (0.2 mL) of isobutyl chloroformate (13 ⁇ L, 100 ⁇ mol) was added and stirred for 3 minutes. Diisopropylethylamine (350 ⁇ L) was added to a DMF suspension of PrimerSupport 200 (underivatized support) (GE Healthcare) (1 g), and then the above-mentioned compound 3 reaction solution was added and stirred at room temperature for 24 hours.
- PrimerSupport 200 underivatized support
- oligonucleotides SEQ-1 to SEQ-36 shown in Tables 2 to 4 were synthesized by the following method. 1) Amidite synthesis DNA amidites, RNA amidites, and 2'OMe-RNA amidites having standard protecting groups were purchased from Proligo Reagents. Specifically, the following was used.
- N6-benzoyl-5'-O-dimethoxytrityl-2'deoxyadenosine-3'-ON N'-diisopropyl-2-cyanoethyl phosphoramidite5'-O-dimethoxytritylthymidine-3'-O -N, N'-diisopropyl-2-cyanoethyl phosphoramidite, N2-tertbutylphenoxyacetyl-5'-O-dimethoxytrityl-2'deoxyguanosine-3'-ON, N'-diisopropyl-2-cyanoethyl Phosphoramidite N4-benzoyl-5'-O-dimethoxytrityl-2'deoxycytidine-3'-ON, N'-diisopropyl-2-cyanoethyl phosphoramidite N6-benzoyl-5'-O-dimethoxy Trityl adenosine-2 'tertbut
- AmNA amidite was synthesized based on the method described in International Publication No. 2011/052436 and the method described below.
- Step 1 Synthesis of Compound 909 DMF (3.9 L) suspension of Compound 901 (1300 g, 2.53 mol according to the method described in Organic Letters, 7, 1569-1572 (2005)) under nitrogen atmosphere A solution of TBS chloride (1717 g, 11.39 mol) in DMF (2.6 L) was added dropwise at an internal temperature of 5 to 15 ° C. Subsequently, sodium iodide (1138 g, 7.59 mol) was added at an internal temperature of 10 to 20 ° C., and N-methylimidazole (999 mL, 12.7 mol) was added dropwise at the same temperature. The mixture was stirred at an internal temperature of 20 to 30 ° C. for 6 hours and allowed to stand overnight.
- the reaction mixture was poured into a mixture of ethyl acetate (3.9 L) and ice water (10.4 L), and ethyl acetate (2.6 L) and water (2.6 L) were further added.
- the organic layer was washed sequentially with 1 mol / L hydrochloric acid (6.5 L), 10% aqueous sodium carbonate solution (6.5 L), and 10% brine (6.5 L).
- the solvent was distilled off under reduced pressure, and methanol (2.6 L) was added to the obtained residue (2.68 kg).
- the solvent was distilled off again under reduced pressure to obtain a crude product of compound 909 (2.62 kg).
- Step 2 Synthesis of Compound 910
- methanol 6.5 L
- 35% hydrochloric acid 633 mL, 7.59 mol
- the reaction mixture was poured into a mixture of diisopropyl ether (6.5 L) and ice water (3.9 L), and diisopropyl ether (6.5 L) and water (2.6 L) were further added.
- the aqueous layer was washed with diisopropyl ether (3.25 L), a solution of sodium carbonate (1073 g, 10.1 mol) in water (6.5 L) was added, and the mixture was extracted with ethyl acetate (19.5 L and 6.5 L). The organic layer was dried over anhydrous magnesium sulfate. The solvent was distilled off under reduced pressure, and tetrahydrofuran (2.6 L) was added to the obtained residue. The solvent was distilled off again under reduced pressure to obtain a crude product of compound 910 (1.08 kg).
- Step 3 Synthesis of Compound 911 Under nitrogen atmosphere, a crude product (17.7 g) of Compound 910 obtained in Step 2 and a solution of pyridine (10.1 mL, 125 mmol) in tetrahydrofuran (80 mL) were added at an internal temperature of 0 to 10 ° C. Trifluoroacetic anhydride (17.8 mL, 125 mmol) was added dropwise and stirred for 1 hour. The reaction mixture was poured into a 20% aqueous sodium carbonate solution (112 mL) under ice cooling, and tetrahydrofuran (24 mL) and water (48 mL) were added.
- Step 4 Synthesis of Compound 912 Under a nitrogen atmosphere, a solution of Compound 911 (450 g, 935 mmol) in dimethyl sulfoxide (1.35 L) was added to EDC (538 g, 2800 mmol), dimethyl sulfoxide (675 mL), pyridinium paratoluenesulfonate (235 g, 935 mmol). ) And dimethyl sulfoxide (225 mL) were sequentially added, and the mixture was stirred at an internal temperature of 20 to 30 ° C. for 2.5 hours.
- Step 5 Synthesis of Compound 913
- a solution of the crude product of Compound 912 obtained in Step 4 (540 g) in acetonitrile (1.8 L) 37% formalin aqueous solution (900 mL) and N-methylmorpholine (900 mL) were sequentially added.
- the mixture was stirred at an internal temperature of 70-80 ° C. for 4 hours.
- ethyl acetate (2.25 L) was added, followed by 4 mol / L hydrochloric acid (2.25 L) at an internal temperature of 10-20 ° C.
- the organic layer was washed twice with water (2.25 L) to obtain an ethyl acetate solution containing compound 913.
- Step 6 Synthesis of Compound 914 Into an ethyl acetate solution containing Compound 913 obtained in Step 5, sodium dihydrogen phosphate dihydrate (292 g, 1870 mmol) in water (1.35 L), squalene (898 mL, 1870 mmol) Acetonitrile (1.35 L) was sequentially added. A solution of sodium chlorite (423 g, 4670 mmol) in water (2.25 L) was added dropwise at an internal temperature of 20-30 ° C. and stirred for 3 hours.
- aqueous layers were combined and washed with ethyl acetate (900 mL), and then ethyl acetate (5.4 L) and a 2 mol / L aqueous hydrochloric acid solution (2.25 L) were added to the aqueous layer.
- the organic layer was washed with 10% brine (2.25 L) and dried over anhydrous sodium sulfate.
- the mixture was filtered, and the drying agent was washed with ethyl acetate (1.35 L).
- potassium acetate (82.5 g, 841 mmol) and ethanol (338 mL) were added. The mixture was stirred at an internal temperature of 20-30 ° C. for 1 hour.
- Step 1 Synthesis of Compound 915
- a 1 mol / L tetrabutylammonium fluoride-tetrahydrofuran solution (0.888 mL, 0.888 mmol) was added to a suspension of compound 914 (455 mg, 0.807 mmol) in pyridine (4 mL).
- the mixture was added dropwise, stirred at an internal temperature of 60 to 70 ° C. for 9 hours, and then allowed to stand overnight at room temperature. The next day, the mixture was further stirred at an internal temperature of 60 to 70 ° C. for 9 hours, and then allowed to stand overnight at room temperature.
- EDC hydrochloride 310 mg, 1.62 mmol
- EDC hydrochloride (310 mg, 1.62 mmol) was added, and the mixture was allowed to stand overnight at room temperature. After adding 4,4′-dimethoxytrityl chloride (547 mg, 1.61 mmol) and stirring at room temperature for 5 hours, further 4,4′-dimethoxytrityl chloride (547 mg, 1.61 mmol) was added and stirred for 2 hours. 5% Aqueous sodium hydrogen carbonate solution (10 mL) was added to the reaction mixture, and the mixture was extracted with ethyl acetate (10 mL), and washed 3 times with water (5 mL). Each water wash was extracted with ethyl acetate (5 mL).
- Step 2 Synthesis of Compound 916 (T Amidite)
- Compound 916 was synthesized according to a method according to the method described in International Publication No. 2011/052436.
- Step 1 Synthesis of Compound 917 Under a nitrogen atmosphere, N, O-bis (trimethylsilyl) was added to a suspension of compound 914 (170 g, 271 mmol) and 6-N-benzoyladenine (64.9 g, 271 mmol) in cyclopentyl methyl ether (1700 mL). ) Acetamide (466 mL, 1900 mmol) and TMSOTf (98 mL, 543 mmol) were added and stirred at 70-73 ° C. for 4 hours.
- Tetrahydrofuran (2920 mL), 2 mol / L hydrochloric acid (1700 mL) and water (1020 mL) were added to the reaction solution under ice cooling, and then the organic layer and aqueous layer were partitioned.
- the organic layer was 0.1 mol / L hydrochloric acid (1700 mL).
- Chloroform (340 mL) was added to the residue obtained by distilling off the solvent under reduced pressure, and the resulting slurry obtained by stirring for 20 minutes was filtered.
- the solid collected by filtration was washed with chloroform (510 mL) and then air-dried to obtain Compound 917 (165 g, yield 80.9%).
- Step 2 Synthesis of Compound 918 Under a nitrogen atmosphere, a solution of Compound 917 (4.75 g, 7.44 mmol) in tetrahydrofuran (25 mL) was added 1 mol / L tetrabutylammonium fluoride-tetrahydrofuran solution (14.9 mL, 14.9 mmol). The solution was added dropwise and stirred at an internal temperature of 60 to 65 ° C. for 3.5 hours. EDC hydrochloride (1.71 g, 8.92 mmol) was added, and the mixture was stirred at an internal temperature of 60 to 65 ° C. for 1 hour.
- Step 3 Synthesis of Compound 919 Under a nitrogen atmosphere, a solution of the crude product of compound 918 obtained in Step 2 (9.12 g) in dichloromethane (25 mL) was added DABCO (2.09 g, 18.6 mmol) and 4,4′- Dimethoxytrityl chloride (5.04 g, 14.9 mmol) was added and stirred at room temperature for 2 hours. 4,4′-Dimethoxytrityl chloride (1.26 g, 3.72 mmol) was added, and the mixture was further stirred for 2 hours.
- a 5% aqueous sodium hydrogen carbonate solution (50 mL) and dichloromethane (50 mL) were added to the reaction solution, and the organic layer was washed with water (50 ml), and the aqueous wash was extracted with dichloromethane (50 mL).
- the organic layers were combined, methanol (50 mL) was added, the solvent was distilled off until the weight reached 60 g, methanol (50 mL) was added again, and the solvent was distilled off until the weight reached 67 g. Methanol (25 mL) was added again, and the resulting slurry was stirred for 30 minutes at room temperature and filtered.
- Step 4 Synthesis of Compound 920 (A Amidite)
- a suspension of compound 919 500 mg, 0.702 mmol
- N, N′-diisopropylethylamine 0.368 mL, 2.11 mmol
- 2-cyanoethyl-N, N-diisopropylchlorophosphoramidite (0.235 mL, 1.05 mmol) was added dropwise and stirred at room temperature for 2 hours.
- 5% aqueous sodium hydrogen carbonate solution 5 mL was added to the reaction mixture, and the mixture was extracted with ethyl acetate (5 mL).
- Step 1 Synthesis of Compound 921 N, O-bis (trimethylsilyl) was added to a suspension of compound 914 (15.0 g, 26.6 mmol) and guanine (4.02 g, 26.6 mmol) in cyclopentyl methyl ether (135 mL) under a nitrogen atmosphere.
- Acetamide (65.1 mL, 266 mmol) and cyclopentyl methyl ether (7.5 mL) were added, and the mixture was stirred at an internal temperature of 60 to 70 ° C. for 10 minutes, then TMSOTf (11.83 g, 53.20 mmol) and cyclopentyl methyl ether (7 0.5 mL) was added and stirred for 2 hours.
- Ethyl acetate (150 mL) was added to the reaction solution at an internal temperature of 20-30 ° C., and 2 mol / L hydrochloric acid (75 mL), tetrahydrofuran (150 mL) and water (75 mL) were further added at an internal temperature of 15-30 ° C., and the organic layer was washed with water. Washed twice with (150 mL). The washings were combined and extracted with ethyl acetate (150 mL) and washed with water (75 mL). The organic layers were combined and the solvent was distilled off under reduced pressure.
- Step 2 Synthesis of Compound 922 To a solution of Compound 921 (14.0 g, 23.9 mmol) and N-methylimidazole (7.60 mL, 95.4 mmol) in N, N′-dimethylacetamide (70 mL) under a nitrogen atmosphere A 1 mol / L tetrabutylammonium fluoride-tetrahydrofuran solution (28.6 mL, 28.6 mmol) and N, N′-dimethylacetamide (14 mL) were added, and the mixture was stirred at an internal temperature of 70 to 80 ° C. for 8 hours.
- Step 3 Synthesis of Compound 923 Trimethylsilyl chloride (9.33 g, 85) was added to a suspension of compound 922 (7.50 g, 17.2 mmol) in pyridine (37.5 mL, 464 mmol) in a nitrogen atmosphere at an internal temperature of 10 to 20 ° C. .9 mmol) was added dropwise, followed by stirring at room temperature for 30 minutes. Next, phenoxyacetyl chloride (3.52 g, 20.6 mmol) was added dropwise at an internal temperature of 0 to 5 ° C., and the mixture was stirred at room temperature for 1 hour.
- the reaction mixture was diluted with ethyl acetate (150 mL), and a mixed solution of 10% brine (37.5 mL) and concentrated hydrochloric acid (30.0 mL) was added dropwise at an internal temperature of 0 to 10 ° C.
- the organic layer was washed twice with 1 mol / L hydrochloric acid (75 mL) and water (75 mL), and then ethyl acetate (37.5 mL) and 2 mol / L hydrochloric acid methanol solution (38.7 mL, 77.4 mmol) were sequentially added. Stir at room temperature for 1 hour.
- Step 4 Synthesis of Compound 924 (G Amidite) To a solution of Compound 923 (500 mg, 1.10 mmol) in dimethylacetamide (3.5 mL) under a nitrogen atmosphere was added 4,4′-dimethoxytrityl chloride (1.11 g, 3 .29 mmol) and DABCO (369 mg, 3.21 mmol) were added and stirred at room temperature for 2.5 hours. DABCO (369 mg, 3.21 mmol) and 2-cyanoethyldiisopropylchlorophosphoramidite (0.587 mL, 2.63 mmol) were added to the reaction solution at 10 ° C. or lower, and the mixture was stirred at room temperature for 1 hour.
- Step 1 Synthesis of Compound 925 108.1 g of Compound 915 (Purity: 92.53%, Content: 100 g, 0.167 mol), DMF 300 ml, Imidazole 47.8 g (4.2 eq.), TBS Chloride 51.6 g (2. 05 eq.) And stirred at around 25 ° C. for 23 hours. Separation was performed by adding 600 ml of ethyl acetate and 600 ml of water, and the aqueous layer was re-extracted with 300 ml of ethyl acetate. The organic layers were mixed, washed with 600 ml of 5% aqueous sodium hydrogen carbonate solution and 600 ml of 5% brine, and the solvent was recovered.
- Step 2 Synthesis of Compound 926
- Compound 925 132.6 g (corresponding to 0.167 mol), acetonitrile 800 ml, triethylamine 50.7 g (3 eq.), 4-dimethylaminopyridine 2.0 g (0.1 eq.), 2 ′, 4 ′ , 6′-triisopropylsulfonyl chloride 65.8 g (1.3 eq.) was added and stirred at around 25 ° C. for 22 hours.
- 800 ml of 25% aqueous ammonia was added and stirred at around 25 ° C. for 2 hours.
- Acetonitrile was roughly recovered, and 400 ml of ethyl acetate and 400 ml of water were added for liquid separation, and the aqueous layer was re-extracted with 300 ml of ethyl acetate.
- the organic layers were mixed, washed with 400 ml of 5% saline twice, and the solvent was recovered.
- the solidified amorphous was loosened to obtain the desired compound 926 (192.8 g, crude yield 161.9% from compound 915).
- Step 3 Synthesis of Compound 927 192.8 g (corresponding to 0.167 mol) of Compound 926, 500 ml of DMF, and 75.6 g (2 eq.) Of benzoic anhydride were added and stirred at around 25 ° C. for 22 hours. Separation was performed by adding 1000 ml of ethyl acetate and 1000 ml of 5% sodium hydrogen carbonate, and the aqueous layer was re-extracted with 500 ml of ethyl acetate. The organic layers were mixed, washed with 500 ml of 5% aqueous sodium hydrogen carbonate solution and 500 ml of 5% brine, and the solvent was recovered to obtain a crude product of compound 927.
- Step 4 Compound 928 124.1 g (0.152 mol) of compound 927, tetrahydrofuran 869 ml, 1 mol / L tetrabutylammonium fluoride / tetrahydrofuran 182 ml (1.2 eq.) Were added, and the mixture was stirred for 2 hours. The solvent was recovered, and liquid separation was performed by adding 620 ml of ethyl acetate and 620 ml of 5% aqueous sodium hydrogen carbonate solution. The solvent was recovered by washing with 620 ml of 5% saline.
- Oligonucleotide (SEQ-26) was purchased from Gene Design Co., Ltd. (Osaka, Japan).
- oligonucleotides were confirmed to have the desired sequence synthesized when the molecular weights measured by UPLC / MS coincided with the theoretical molecular weights.
- Xevo G2 Tof System (made by Waters) Column: Aquity OST C18 (2.1 ⁇ 50 mm) (manufactured by Waters) Mobile phase A solution: 200 mM 1,1,1,3,3,3-hexafluoro-2-propanol / 8 mM triethylamine B solution: methanol B concentration gradient: 10-30% (10 min) Temperature: 50 ° C Flow rate: 0.2 mL / min
- the dose per mouse is 1.1 mg / kg in terms of antisense oligo amount, 3 It was administered intravenously or subcutaneously to 3 mg / kg or 10 mg / kg.
- a solution of SEQ-1 was administered so that the dose per mouse was 10 mg / kg.
- liver tissue was collected under somnopentyl anesthesia. RNA extraction from the liver was performed according to the manufacturer's recommended protocol using RNeasy 96 Universal Tissue Kit (Qiagen).
- RNA 1000 ng was subjected to reverse transcription according to a standard protocol using SuperScript III First-Strand Synthesis SuperMix for qRT-PCR (manufactured by Life Science) to obtain cDNA. Quantitative PCR was performed using SYBR Premix Ex Taq II (manufactured by Takara Bio Inc.).
- the primer sequence used to measure the expression level of mouse ACSL1 is Fw primer: AGGTGCTTCAGCCCACATC (SEQ ID NO: 3) Rv primer: AAAGTCCAACAGCCATCGCTTC (SEQ ID NO: 4)
- the primer sequence used to measure the expression level of mouse GAPDH is: Fw primer: TGTGTCCGTCGTGGATCTGA (SEQ ID NO: 5) Rv primer: TTGCTGTTTGAAGTCGCAGAG (SEQ ID NO: 6) was used.
- the knockdown efficiency was expressed as a ratio of the reduced amount of Acsl1 mRNA normalized by Gapdh to the physiological saline administration group.
- GAPDH was used as an endogenous control, and the same primers as those used in the in vitro experiment were used.
- Example 4 Evaluation of in vivo activity of double-stranded oligonucleotide of the present invention (4-1) Knockdown activity of double-stranded oligonucleotide of the present invention by intravenous administration or subcutaneous administration
- single-stranded antisense oligo ACSL1 in the mouse liver of the double-stranded oligonucleotide (SEQ-8) of the present invention comprising a nucleotide (SEQ-1) and a sugar derivative (GalNAc derivative) having an interaction with the asialoglycoprotein receptor at the 5 ′ end of the sense strand
- the knockdown activity was evaluated by changing the mRNA expression level.
- Diet-induced obesity (DIO) mice were prepared by giving C57BL / 6J (male 7-week-old, Claire Japan) a high fat fat diet (60% kcal fat: manufactured by TestDiet) for 4 weeks.
- C57BL / 6J male 7-week-old, Claire Japan
- a high fat fat diet (60% kcal fat: manufactured by TestDiet) for 4 weeks.
- SEQ-8 solution dissolved in physiological saline (Otsuka raw food injection, Otsuka Pharmaceutical Factory) to DIO mice, the dose per mouse individual is 2.2 mg / kg in terms of antisense chain amount, 6 It was intravenously administered or subcutaneously administered so as to be 6 mg / kg and 20 mg / kg.
- As a positive control a solution of SEQ-1 was administered so that the dose per mouse was 20 mg / kg.
- the double-stranded oligonucleotide (SEQ-8) of the present invention improved the knockdown activity in a dose-dependent manner in both intravenous administration and subcutaneous administration, and single-stranded antisense oligonucleotide (SEQ-1). As a result, it was confirmed that the knockdown activity was improved about 9 times.
- Diet-induced obesity (DIO) mice were prepared by giving C57BL / 6J (male 7-week-old, Claire Japan) a high fat fat diet (60% kcal fat: manufactured by TestDiet) for 4 weeks. About 0.2 mL of any solution of SEQ-8 to 11 dissolved in physiological saline (Otsuka raw food injection, Otsuka Pharmaceutical Factory) to DIO mice, the dose per mouse individual is 2.2 mg in terms of antisense strand. / Kg, 6.6 mg / kg and 20 mg / kg were administered subcutaneously. As a positive control, a solution of SEQ-1 was administered so that the dose per mouse was 20 mg / kg. Seven days after administration, liver tissue was collected under somnopentyl anesthesia and evaluated for activity.
- physiological saline Otsuka raw food injection, Otsuka Pharmaceutical Factory
- the double-stranded oligonucleotide of the present invention has no difference in knockdown activity due to the difference in the binding position and phosphate bond of the sugar derivative that interacts with the asialoglycoprotein receptor in subcutaneous administration. It was confirmed that the knockdown activity was improved about 9 times compared with the antisense oligonucleotide (SEQ-1).
- Diet-induced obesity (DIO) mice were prepared by giving C57BL / 6J (male 7-week-old, Claire Japan) a high fat fat diet (60% kcal fat: manufactured by TestDiet) for 4 weeks. About 0.2 mL of a solution of SEQ-21 or 22 dissolved in physiological saline (Otsuka raw food injection, Otsuka Pharmaceutical Factory) to DIO mice, the dose per mouse individual is 2 mg / kg and 4 mg in terms of antisense chain amount. / Kg was administered intravenously or subcutaneously. As a positive control, a solution of SEQ-12 was administered so that the dose per mouse was 20 mg / kg.
- physiological saline Otsuka raw food injection, Otsuka Pharmaceutical Factory
- the double-stranded oligonucleotide (SEQ-21 or 22) of the present invention has a knockdown activity that is dose-dependently improved and binds to a sugar derivative that interacts with the asialoglycoprotein receptor. There was no difference in the knockdown activity due to the difference between the two groups, and the same activity was shown at a dose of 1/10 compared with the single-stranded antisense oligonucleotide (SEQ-12).
- any double-stranded oligonucleotide improved the knockdown activity in a dose-dependent manner.
- an antisense oligonucleotide (SEQ-26), a double-stranded oligonucleotide (SEQ-30) that does not contain a sugar derivative that interacts with the asialoglycoprotein receptor, and an asialog sugar at the 3 ′ end of the antisense strand
- SEQ-32 a double-stranded oligonucleotide containing a sugar-inducible c-conductor (GalNAc derivative) that interacts with a protein receptor was used.
- RNA extraction from the liver was performed according to the manufacturer's recommended protocol using RNeasy Mini Kit (Qiagen).
- the primer sequence used to measure the expression level of mouse ApoB is: Fw primer: TCATGTGGCTGATGACTACTTC (SEQ ID NO: 7) Rv primer: CGTCCACAGTATATTTCCCAGCGTA (SEQ ID NO: 8) was used.
- the primer sequence used to measure the expression level of mouse Gapdh is: Fw primer: TGTGTCCGTCGTGGATCTGA (SEQ ID NO: 5) Rv primer: TTGCTGTTTGAAGTCGCAGAG (SEQ ID NO: 6) was used.
- SEQ-30 which is a double-stranded oligonucleotide that does not contain a sugar derivative that interacts with the asialoglycoprotein receptor (GalNAc derivative)
- GalNAc derivative includes a sugar derivative that interacts with the asialoglycoprotein receptor (GalNAc derivative)
- no improvement in knockdown activity was observed with SEQ-29 having a single-stranded structure or SEQ-32 binding to the antisense strand of a double-stranded oligonucleotide. From the above results, it was revealed that the double-stranded oligonucleotide of the present invention has an optimal design for efficiently knocking down a target gene in the liver.
- the double-stranded oligonucleotide of the present invention has excellent target gene expression-suppressing activity in the liver, whether administered intravenously or subcutaneously. Therefore, the double-stranded oligonucleotide of the present invention is very useful as a complex because it efficiently transports an active ingredient DNA antisense oligonucleotide to the liver.
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Chemical & Material Sciences (AREA)
- Biomedical Technology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Molecular Biology (AREA)
- General Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Biotechnology (AREA)
- Biochemistry (AREA)
- Physics & Mathematics (AREA)
- Veterinary Medicine (AREA)
- Plant Pathology (AREA)
- Biophysics (AREA)
- Microbiology (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Virology (AREA)
- Dermatology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
本発明は、DNAアンチセンスオリゴヌクレオチドを肝臓へ効率よく輸送可能な新規の複合体である、 アンチセンス鎖が、ヌクレオシド誘導体を含んでいてもよい8~25塩基のDNAアンチセンスオリゴヌクレオチドであり、 センス鎖が、ストリンジェントな条件で該アンチセンス鎖にハイブリダイズ可能な配列を含み、DNAヌクレオシド及び/又はヌクレオシド誘導体を含んでいてもよい8~35塩基のRNAオリゴヌクレオチドであり、 センス鎖の3'末端及び/又は5'末端に、 リンカーを介して アシアロ糖タンパク質受容体と相互作用を有する糖誘導体 が結合している二本鎖オリゴヌクレオチドを提供する。
Description
本発明は、アンチセンス鎖が、標的タンパク質の発現抑制活性を有するアンチセンスオリゴヌクレオチドであり、センス鎖にリンカーを介してアシアロ糖タンパク質受容体と相互作用を有する糖誘導体が結合している二本鎖オリゴヌクレオチドに関する。
アンチセンスオリゴヌクレオチドは、標的遺伝子のmRNA、mRNA前駆体又はリボソームRNA、転移RNA、miRNA等のncRNA(ノンコーディングRNA)に対して相補的なオリゴヌクレオチドであり、約8~30塩基からなる1本鎖のDNA、RNA及び/又はそれらの構造類似体である。該アンチセンスオリゴヌクレオチドが標的とするmRNA、mRNA前駆体、又はncRNAと二本鎖を形成することによりmRNA、mRNA前駆体又はncRNAの働きを抑制する。
しかし、アンチセンスオリゴヌクレオチドやsiRNA等の核酸医薬は、生体内のヌクレアーゼにより分解されやすく、標的細胞への取り込み効率が低いため、実用化が難しい。2つの大きな問題点を克服するために、有効成分である核酸自体の化学修飾と、核酸を標的細胞内へ送達させるドラッグデリバリーシステム(DDS)の研究が長年行われている。
アンチセンスオリゴヌクレオチド自体の化学修飾の例としては、リン酸部分が修飾されているS-オリゴ(ホスホロチオエート)、糖部分が修飾されている2’,4’-BNA(bridged nucleic acid)/LNA(locked nucleic acid)(特許文献1~5参照)等がある。
DDSの例としては、カチオン性リポソームや高分子ミセル等のキャリアを利用する方法等が知られている。また、非特許文献1は、アシアロ糖タンパク質受容体と相互作用を有する糖誘導体であるガラクトース誘導体で修飾したリポソームが、医薬の肝臓細胞への取り込みに有用であることが示唆されている。特許文献6~8には、アシアロ糖タンパク質受容体と相互作用を有する糖誘導体であるGalNac(N-アセチルガラクトサミン)誘導体で修飾したリポソームが、siRNAの肝臓細胞への取り込みに有用であることが示唆されている。特許文献9には、GalNac誘導体がリンカーを介して結合しているsiRNAが記載されており、該siRNAを皮下投与すると、肝臓での標的遺伝子の発現が抑制されたことが記載されている。
また、特許文献10には、アンチセンスオリゴヌクレオチドと相補的なRNAオリゴヌクレオチドを含む二本鎖オリゴヌクレオチドにトコフェノールを結合させることにより、マウスにおいて、一本鎖アンチセンスオリゴヌクレオチドと比較して、効率よく肝臓に送達、集積され、肝臓での標的遺伝子の発現が抑制されたことが記載されている。
J. Med. Chem 1999, 42, 609-618
Nucleic Acids Research, 2014, Vol. 42, No.13, 8796-8807
本発明の目的は、DNAアンチセンスオリゴヌクレオチドを肝臓へ効率よく輸送可能な新規の複合体を提供することにある。
アンチセンスオリゴヌクレオチドを医薬として利用する際、有効成分である一本鎖アンチセンスオリゴヌクレオチドは、胃内における安定性の問題や腸からの吸収に乏しいため、標的細胞への取り込み効率が低いことから、一般的に、標的組織に到達しやすい注射剤での研究及び開発が行われている。しかし、例えば患者の皮下脂肪の厚さが原因で注射が困難といった理由で、疾患によっては注射剤以外の剤形が好ましい場合がある。
本発明者らは、特許文献10に記載の方法に基づきトコフェロール修飾二本鎖オリゴヌクレオチドを用いて研究を行った。1本鎖のアンチセンスオリゴヌクレオチドを投与した場合と比較し、静脈注射投与では肝臓における標的遺伝子の発現抑制活性が向上していることが確認されたが、皮下投与では標的遺伝子の発現抑制活性の向上が確認できなかった。
その後、本発明者らは、本発明の二本鎖オリゴヌクレオチドが、静脈注射投与、皮下投与共に、肝臓における標的遺伝子の発現抑制活性が優れていることを見出した。本発明の二本鎖オリゴヌクレオチドは核酸医薬の活性成分であるアンチセンスオリゴヌクレオチドを効率的に肝臓へ送達、集積し、効果を発揮させることができ、非常に有用である。
さらに、本発明者らは、本発明の二本鎖オリゴヌクレオチドを用いた静脈注射投与、皮下投与時におけるアスパラギン酸アミノトランスフェラーゼ(AST)及びアラニンアミノトランスフェラーゼ(ALT)を測定し、肝臓毒性が認められないことを確認している。そのため、本発明の二本鎖オリゴヌクレオチドは毒性が低く、医薬として使用するために十分安全である。
本発明者らは、特許文献10に記載の方法に基づきトコフェロール修飾二本鎖オリゴヌクレオチドを用いて研究を行った。1本鎖のアンチセンスオリゴヌクレオチドを投与した場合と比較し、静脈注射投与では肝臓における標的遺伝子の発現抑制活性が向上していることが確認されたが、皮下投与では標的遺伝子の発現抑制活性の向上が確認できなかった。
その後、本発明者らは、本発明の二本鎖オリゴヌクレオチドが、静脈注射投与、皮下投与共に、肝臓における標的遺伝子の発現抑制活性が優れていることを見出した。本発明の二本鎖オリゴヌクレオチドは核酸医薬の活性成分であるアンチセンスオリゴヌクレオチドを効率的に肝臓へ送達、集積し、効果を発揮させることができ、非常に有用である。
さらに、本発明者らは、本発明の二本鎖オリゴヌクレオチドを用いた静脈注射投与、皮下投与時におけるアスパラギン酸アミノトランスフェラーゼ(AST)及びアラニンアミノトランスフェラーゼ(ALT)を測定し、肝臓毒性が認められないことを確認している。そのため、本発明の二本鎖オリゴヌクレオチドは毒性が低く、医薬として使用するために十分安全である。
本発明の二本鎖オリゴヌクレオチドは、例えば、GalNac誘導体を利用している。特許文献9にはGalNac誘導体がリンカーを介して結合しているsiRNAが記載されており、該siRNAを静脈注射投与又は皮下投与すると、肝臓での標的遺伝子の発現が抑制されたことが記載されている。しかし、以下の理由により、siRNAで利用可能であることが示されているDDSが、そのままアンチセンスオリゴヌクレオチドに応用可能であるとは限らない。
mRNAを標的としたタンパク質の発現抑制法には、アンチセンスオリゴヌクレオチドを用いたアンチセンス法又はsiRNAを用いたRNA干渉(RNAi)のアプローチがある。アンチセンス法とは、例えば、20mer前後の一本鎖DNA(アンチセンスオリゴヌクレオチド)を用いて標的mRNAにハイブリダイズさせることで生成したRNA/DNAヘテロ二重鎖を認識するRNaseHによってmRNA鎖を切断することで、タンパク質の生成を抑制する手法である。一方、RNA干渉は、例えば、20~30merの二本鎖RNA(siRNA; short interfering RNA)を用いることで、細胞内でRISC(RNA-induced silencing complex)に取り込まれ、その後取り込まれたsiRNAに相同的なmRNA鎖が切断されることで、タンパク質発現を抑制する手法である。
アンチセンス法およびRNA干渉ともに、生体内で十分な効果を発揮させるためには、生体内ヌクレアーゼに対する分解耐性と標的臓器へのデリバリー効率を高めることが重要である。このような課題に対して、化学修飾核酸や生体リガンド分子(例えば、GalNac誘導体)を用いるアプローチが報告されているが、分子構造の違いやmRNA鎖の切断メカニズムの違いによって、使用可能な化学修飾核酸の種類や最適なリガンド分子及びその結合箇所は異なってくると考えられる。
mRNAを標的としたタンパク質の発現抑制法には、アンチセンスオリゴヌクレオチドを用いたアンチセンス法又はsiRNAを用いたRNA干渉(RNAi)のアプローチがある。アンチセンス法とは、例えば、20mer前後の一本鎖DNA(アンチセンスオリゴヌクレオチド)を用いて標的mRNAにハイブリダイズさせることで生成したRNA/DNAヘテロ二重鎖を認識するRNaseHによってmRNA鎖を切断することで、タンパク質の生成を抑制する手法である。一方、RNA干渉は、例えば、20~30merの二本鎖RNA(siRNA; short interfering RNA)を用いることで、細胞内でRISC(RNA-induced silencing complex)に取り込まれ、その後取り込まれたsiRNAに相同的なmRNA鎖が切断されることで、タンパク質発現を抑制する手法である。
アンチセンス法およびRNA干渉ともに、生体内で十分な効果を発揮させるためには、生体内ヌクレアーゼに対する分解耐性と標的臓器へのデリバリー効率を高めることが重要である。このような課題に対して、化学修飾核酸や生体リガンド分子(例えば、GalNac誘導体)を用いるアプローチが報告されているが、分子構造の違いやmRNA鎖の切断メカニズムの違いによって、使用可能な化学修飾核酸の種類や最適なリガンド分子及びその結合箇所は異なってくると考えられる。
すなわち、本発明は、以下に関する。
(1)アンチセンス鎖が、ヌクレオシド誘導体を含んでいてもよい8~25塩基のDNAアンチセンスオリゴヌクレオチドであり、
センス鎖が、ストリンジェントな条件で該アンチセンス鎖にハイブリダイズ可能な配列を含み、DNAヌクレオシド及び/又はヌクレオシド誘導体を含んでいてもよい8~35塩基のRNAオリゴヌクレオチドであり、
センス鎖の3’末端及び/又は5’末端に、
リンカーを介して
アシアロ糖タンパク質受容体と相互作用を有する糖誘導体
が結合している二本鎖オリゴヌクレオチド。
(2)糖誘導体が、
(式中、
P1A、P1B、P2A、P2B、P3A、P3B、P4A、P4B、P4C、T1A、T1B、T2A、T2B、T3A、T3B、T4A、T4B及びT4Cはそれぞれ独立して、存在しないか、CO、NH、O、S、OC(=O)、NHC(=O)、CH2、CH2NH又はCH2Oであり、
Q1A、Q1B、Q2A、Q2B、Q3A、Q3B、Q4A、Q4B及びQ4Cはそれぞれ独立して、存在しないか又は置換若しくは非置換のアルキレンであり、
R1A、R1B、R2A、R2B、R3A、R3B、R4A、R4B及びR4Cはそれぞれ独立して、存在しないか、NH、O、S、CH2、C(=O)O、C(=O)NH、NHCH(R5)C(=O)、C(=O)CH(R5)NH、CO、CH=N-O、複素環、
であり、
R5は水素原子又はアミノ酸側鎖であり、
q1A、q1B、q2A、q2B、q3A、q3B、q4A、q4B及びq4Cはそれぞれ独立して、0~20の整数であり、
LG1A、LG1B、LG2A、LG2B、LG3A、LG3B、LG4A、LG4B及びLG4Cはそれぞれ独立して、
(式中、
RX1、RX2及びRX3はそれぞれ独立して、水素原子又は置換若しくは非置換のアルキルであり、
RX4はOH又はNHCORX4’(RX4’は置換又は非置換のアルキル)である)
である、(1)記載の二本鎖オリゴヌクレオチド。
(3)糖誘導体が、
である、(2)記載の二本鎖オリゴヌクレオチド。
(4)糖誘導体が、
である、(3)記載の二本鎖オリゴヌクレオチド。
(5)ヌクレオシド誘導体が、糖の2’位に置換基を有するヌクレオシド及び/又は糖の4’位と2’位との間に架橋構造を有するクレオシドである、(1)~(4)いずれかに記載の二本鎖オリゴヌクレオチド。
(6)該置換基が、F、OCH3又はOCH2CH2OCH3である、(5)記載の二本鎖オリゴヌクレオチド。
(7)該架橋構造が、4’-(CH2)m-O-2’(mは1~4の整数)又は4’-C(=O)-NR6-2’(R6は、水素原子又はアルキルである)である、(5)記載の二本鎖オリゴヌクレオチド。
(8)リンカーが、
(式中、
L1はセンス鎖の3’末端及び/又は5’末端に結合し、L5は糖誘導体に結合する。
L1はC(=O)NH、NHC(=O)、NHC(=O)NH、
(式中、R7はアルキル又はアルキルオキシである)であり、
L2はそれぞれ独立して、芳香族環を介していてもよい置換若しくは非置換の炭素数が1~20のアルキレン又は芳香族環であり、
L3はそれぞれ独立して、存在しないか、C(=O)NR8(R8は水素又は置換若しくは非置換のアルキルである)、NR9C(=O)(R9は水素又は置換若しくは非置換のアルキルであるか、R9はL2のアルキレン中の炭素と一緒になって置換若しくは非置換の含窒素環を形成してもよい)、
であり、
L4はそれぞれ独立して、存在しないか、芳香族環を介していてもよい置換若しくは非置換の炭素数が1~20のアルキレン又は芳香族環であり、
L5はC(=O)NH、NHC(=O)、NH又はOであり、
nは1又は2である)
である、(1)~(7)いずれかに記載の二本鎖オリゴヌクレオチド。
(9)リンカーが、
(式中、
L1はセンス鎖の3’末端及び/又は5’末端に結合し、L5は糖誘導体に結合する。
L1はC(=O)NH、NHC(=O)、NHC(=O)NH、
(式中、R7はアルキル又はアルキルオキシである)であり、
L2はそれぞれ独立して、芳香族環を介していてもよい置換若しくは非置換の炭素数が1~20のアルキレン又は芳香族環であり、
L3はそれぞれ独立して、存在しないか、C(=O)NR8(R8は水素又は置換若しくは非置換のアルキルである)又はNR9C(=O)(R9は水素又は置換若しくは非置換のアルキルであるか、R9はL2のアルキレン中の炭素と一緒になって置換若しくは非置換の含窒素環を形成してもよい)であり、
L4はそれぞれ独立して、存在しないか、芳香族環を介していてもよい置換若しくは非置換の炭素数が1~20のアルキレン又は芳香族環であり、
L5はC(=O)NH、NHC(=O)、NH又はOであり、
nは1又は2である)
である、(1)~(7)いずれかに記載の二本鎖オリゴヌクレオチド。
(10)(1)~(9)いずれかに記載の二本鎖オリゴヌクレオチドを含有する医薬組成物。
(1)アンチセンス鎖が、ヌクレオシド誘導体を含んでいてもよい8~25塩基のDNAアンチセンスオリゴヌクレオチドであり、
センス鎖が、ストリンジェントな条件で該アンチセンス鎖にハイブリダイズ可能な配列を含み、DNAヌクレオシド及び/又はヌクレオシド誘導体を含んでいてもよい8~35塩基のRNAオリゴヌクレオチドであり、
センス鎖の3’末端及び/又は5’末端に、
リンカーを介して
アシアロ糖タンパク質受容体と相互作用を有する糖誘導体
が結合している二本鎖オリゴヌクレオチド。
(2)糖誘導体が、
(式中、
P1A、P1B、P2A、P2B、P3A、P3B、P4A、P4B、P4C、T1A、T1B、T2A、T2B、T3A、T3B、T4A、T4B及びT4Cはそれぞれ独立して、存在しないか、CO、NH、O、S、OC(=O)、NHC(=O)、CH2、CH2NH又はCH2Oであり、
Q1A、Q1B、Q2A、Q2B、Q3A、Q3B、Q4A、Q4B及びQ4Cはそれぞれ独立して、存在しないか又は置換若しくは非置換のアルキレンであり、
R1A、R1B、R2A、R2B、R3A、R3B、R4A、R4B及びR4Cはそれぞれ独立して、存在しないか、NH、O、S、CH2、C(=O)O、C(=O)NH、NHCH(R5)C(=O)、C(=O)CH(R5)NH、CO、CH=N-O、複素環、
であり、
R5は水素原子又はアミノ酸側鎖であり、
q1A、q1B、q2A、q2B、q3A、q3B、q4A、q4B及びq4Cはそれぞれ独立して、0~20の整数であり、
LG1A、LG1B、LG2A、LG2B、LG3A、LG3B、LG4A、LG4B及びLG4Cはそれぞれ独立して、
(式中、
RX1、RX2及びRX3はそれぞれ独立して、水素原子又は置換若しくは非置換のアルキルであり、
RX4はOH又はNHCORX4’(RX4’は置換又は非置換のアルキル)である)
である、(1)記載の二本鎖オリゴヌクレオチド。
(3)糖誘導体が、
である、(2)記載の二本鎖オリゴヌクレオチド。
(4)糖誘導体が、
である、(3)記載の二本鎖オリゴヌクレオチド。
(5)ヌクレオシド誘導体が、糖の2’位に置換基を有するヌクレオシド及び/又は糖の4’位と2’位との間に架橋構造を有するクレオシドである、(1)~(4)いずれかに記載の二本鎖オリゴヌクレオチド。
(6)該置換基が、F、OCH3又はOCH2CH2OCH3である、(5)記載の二本鎖オリゴヌクレオチド。
(7)該架橋構造が、4’-(CH2)m-O-2’(mは1~4の整数)又は4’-C(=O)-NR6-2’(R6は、水素原子又はアルキルである)である、(5)記載の二本鎖オリゴヌクレオチド。
(8)リンカーが、
(式中、
L1はセンス鎖の3’末端及び/又は5’末端に結合し、L5は糖誘導体に結合する。
L1はC(=O)NH、NHC(=O)、NHC(=O)NH、
(式中、R7はアルキル又はアルキルオキシである)であり、
L2はそれぞれ独立して、芳香族環を介していてもよい置換若しくは非置換の炭素数が1~20のアルキレン又は芳香族環であり、
L3はそれぞれ独立して、存在しないか、C(=O)NR8(R8は水素又は置換若しくは非置換のアルキルである)、NR9C(=O)(R9は水素又は置換若しくは非置換のアルキルであるか、R9はL2のアルキレン中の炭素と一緒になって置換若しくは非置換の含窒素環を形成してもよい)、
であり、
L4はそれぞれ独立して、存在しないか、芳香族環を介していてもよい置換若しくは非置換の炭素数が1~20のアルキレン又は芳香族環であり、
L5はC(=O)NH、NHC(=O)、NH又はOであり、
nは1又は2である)
である、(1)~(7)いずれかに記載の二本鎖オリゴヌクレオチド。
(9)リンカーが、
(式中、
L1はセンス鎖の3’末端及び/又は5’末端に結合し、L5は糖誘導体に結合する。
L1はC(=O)NH、NHC(=O)、NHC(=O)NH、
(式中、R7はアルキル又はアルキルオキシである)であり、
L2はそれぞれ独立して、芳香族環を介していてもよい置換若しくは非置換の炭素数が1~20のアルキレン又は芳香族環であり、
L3はそれぞれ独立して、存在しないか、C(=O)NR8(R8は水素又は置換若しくは非置換のアルキルである)又はNR9C(=O)(R9は水素又は置換若しくは非置換のアルキルであるか、R9はL2のアルキレン中の炭素と一緒になって置換若しくは非置換の含窒素環を形成してもよい)であり、
L4はそれぞれ独立して、存在しないか、芳香族環を介していてもよい置換若しくは非置換の炭素数が1~20のアルキレン又は芳香族環であり、
L5はC(=O)NH、NHC(=O)、NH又はOであり、
nは1又は2である)
である、(1)~(7)いずれかに記載の二本鎖オリゴヌクレオチド。
(10)(1)~(9)いずれかに記載の二本鎖オリゴヌクレオチドを含有する医薬組成物。
本発明の二本鎖オリゴヌクレオチドは、活性成分であるアンチセンスオリゴヌクレオチドを、静脈注射投与又は皮下投与いずれの投与経路であっても、安定して肝臓へ送達、集積させ、高い活性を示す。該二本鎖オリゴヌクレオチドは毒性も見られなかったことから、核酸医薬品として有用である。
本明細書において使用される用語は、特に言及する場合を除いて、当該分野で通常用いられる意味で用いられる。
本発明においては、当該分野で公知の遺伝子操作方法の使用が可能である。例えば、Molecular Cloning, A Laboratory Manual, Third Edition, Cold Spring Harbor Laboratory Press (2001)、Current Protocols in Molecular Biology, John Wiley & Sons (2003)に記載された方法等が挙げられる。
本発明においては、当該分野で公知の遺伝子操作方法の使用が可能である。例えば、Molecular Cloning, A Laboratory Manual, Third Edition, Cold Spring Harbor Laboratory Press (2001)、Current Protocols in Molecular Biology, John Wiley & Sons (2003)に記載された方法等が挙げられる。
ヌクレオシドとは、核酸塩基と糖とがN-グリコシド結合をした化合物を意味する。オリゴヌクレオチドとは、同一又は異なるヌクレオシドが複数個結合したヌクレオチドを意味する。
オリゴヌクレオチドにおける糖と糖の間の結合は、天然の核酸が有する結合、ホスホジエステル(D-オリゴ)でもよいし、人工的に修飾がなされた結合又はリン原子を有していない結合であってもよい。当該分野で公知の結合であれば、いずれも利用可能である。人工的に修飾がなされた結合としては、ホスホロチオエート(S-オリゴ)、メチルホスホネート(M-オリゴ)、ボラノホスホネート等が挙げられる。リン原子を有していない結合としては、アルキル、非芳香族炭素環、ハロアルキル、ハロゲンで置換された非芳香族炭素環等が挙げられる。例えば、シロキサン、スルフィド、スルホキシド、スルホン、アセチル、ギ酸アセチル、チオギ酸アセチル、メチレンギ酸アセチル、チオギ酸アセチル、アルケニル、スルファマート、メチレンイミノ、メチレンヒドラジノ、スルホナート、スルホンアミド、アミド等である。オリゴヌクレオチド中、全て同じ結合でもよいし、異なる結合を含んでいてもよい。
本明細書において、「DNAヌクレオシド」又は「RNAヌクレオシド」とは、天然のDNAヌクレオシド又は天然のRNAヌクレオシドであり、オリゴヌクレオチドを構成する1単位であるヌクレオチドの一部を意味する。「天然のDNAヌクレオシド」とは、以下を意味する。
(式中、BX1は、アデニン、グアニン、シトシン又はチミンである。)
「天然のRNAヌクレオシド」とは、以下を意味する。
(式中、BX2は、アデニン、グアニン、シトシン又はウラシルである。)
(式中、BX1は、アデニン、グアニン、シトシン又はチミンである。)
「天然のRNAヌクレオシド」とは、以下を意味する。
(式中、BX2は、アデニン、グアニン、シトシン又はウラシルである。)
「DNAオリゴヌクレオチド」とは、DNAヌクレオシドが複数個結合したオリゴヌクレオチドであり、「RNAオリゴヌクレオチド」とは、RNAヌクレオシドが複数個結合したオリゴヌクレオチドである。
本明細書において、「ヌクレオシド誘導体」とは、上記DNAヌクレオシド又は上記RNAヌクレオシドの核酸塩基及び/又は糖部位に人工的な修飾がなされたヌクレオシドを意味する。当該分野で公知のヌクレオシドの修飾であれば、いずれも利用可能である。
核酸塩基の修飾としては、例えば、5-メチルシトシン、5-ヒドロキシメチルシトシン、5-プロピニルシトシン等が挙げられる。
糖部位の修飾としては、例えば、糖の2’位の置換が挙げられる。具体的には、2’-F、2’-OCH3(2’-OMe)、2’-OCH2CH2OCH3(2’-MOE)等である。
また、例えば、以下の糖の4’位と2’位との間の架橋構造が挙げられる。
4’-(CR10R11)m-O-2’、4’-(CR10R11)m-S-2’、4’-(CR10R11)m-O-C(=O)-2’、4’-(CR10R11)m-NR6-O-(CR10R11)m1-2’、4’-(CR10R11)m1-C(=O)-NR6-2’又は4’-(CR10R11)m2-C(=O)-NR6-X1-2’、4’-(CR10R11)m1-SO2-NR6-2’、又は
であり、
ここで、
X1は、O、S、NH又はCH2であり、
R6は、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、置換若しくは非置換の非芳香族複素環式基、置換若しくは非置換の芳香族炭素環アルキル、置換若しくは非置換の非芳香族炭素環アルキル、置換若しくは非置換の芳香族複素環アルキル又は置換若しくは非置換の非芳香族複素環アルキルであり、
R10は、それぞれ独立して、水素原子、ハロゲン、シアノ、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル又は置換若しくは非置換のアルキニルであり、
R11は、それぞれ独立して、水素原子、ハロゲン、シアノ、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル又は置換若しくは非置換のアルキニルであり、
Y1はCR12又はNであり、
Y2はCR13又はNであり、
Y3はCR14又はNであり、
R12、R13及びR14はそれぞれ独立して、水素原子、ハロゲン、シアノ、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換のアミノ、置換若しくは非置換のアルコキシ、置換若しくは非置換のアルキルカルボニルアミノ、置換若しくは非置換のアルケニルカルボニルアミノ、置換若しくは非置換のアルキニルカルボニルアミノ、置換若しくは非置換のアルキルカルバモイル、置換若しくは非置換のアルケニルカルバモイル又は置換若しくは非置換のアルキニルカルバモイルであり、
mは、1~4の整数であり、
m1は、0~3の整数であり、
m2は、0又は1である。
また、例えば、以下の糖の4’位と2’位との間の架橋構造が挙げられる。
4’-(CR10R11)m-O-2’、4’-(CR10R11)m-S-2’、4’-(CR10R11)m-O-C(=O)-2’、4’-(CR10R11)m-NR6-O-(CR10R11)m1-2’、4’-(CR10R11)m1-C(=O)-NR6-2’又は4’-(CR10R11)m2-C(=O)-NR6-X1-2’、4’-(CR10R11)m1-SO2-NR6-2’、又は
であり、
ここで、
X1は、O、S、NH又はCH2であり、
R6は、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換の芳香族炭素環式基、置換若しくは非置換の非芳香族炭素環式基、置換若しくは非置換の芳香族複素環式基、置換若しくは非置換の非芳香族複素環式基、置換若しくは非置換の芳香族炭素環アルキル、置換若しくは非置換の非芳香族炭素環アルキル、置換若しくは非置換の芳香族複素環アルキル又は置換若しくは非置換の非芳香族複素環アルキルであり、
R10は、それぞれ独立して、水素原子、ハロゲン、シアノ、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル又は置換若しくは非置換のアルキニルであり、
R11は、それぞれ独立して、水素原子、ハロゲン、シアノ、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル又は置換若しくは非置換のアルキニルであり、
Y1はCR12又はNであり、
Y2はCR13又はNであり、
Y3はCR14又はNであり、
R12、R13及びR14はそれぞれ独立して、水素原子、ハロゲン、シアノ、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル、置換若しくは非置換のアルキニル、置換若しくは非置換のアミノ、置換若しくは非置換のアルコキシ、置換若しくは非置換のアルキルカルボニルアミノ、置換若しくは非置換のアルケニルカルボニルアミノ、置換若しくは非置換のアルキニルカルボニルアミノ、置換若しくは非置換のアルキルカルバモイル、置換若しくは非置換のアルケニルカルバモイル又は置換若しくは非置換のアルキニルカルバモイルであり、
mは、1~4の整数であり、
m1は、0~3の整数であり、
m2は、0又は1である。
R6は、好ましくは、水素原子、アルキル、アルケニル、アルキニル、芳香族炭素環式基、非芳香族炭素環式基、芳香族複素環式基、非芳香族複素環式基、芳香族炭素環アルキル、非芳香族炭素環アルキル、芳香族複素環アルキル又は非芳香族複素環アルキルであり、α群から選択される任意の置換基を1以上有していてもよい。
α群は、水酸基、アルキル、アルキルオキシ、メルカプト、アルキルチオ、アミノ、アルキルアミノ又はハロゲンである。
α群は、水酸基、アルキル、アルキルオキシ、メルカプト、アルキルチオ、アミノ、アルキルアミノ又はハロゲンである。
R10及びR11は、好ましくは、水素原子である。
該架橋構造として、好ましくは、4’-(CR10R11)m-O-2’又は4’-(CR10R11)m1-C(=O)-NR6-2’(AmNA、Bridged nucleic acid)であり、
ここで、
R6は、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル又は置換若しくは非置換のアルキニルであり、
R10は、それぞれ独立して、水素原子、ハロゲン、シアノ、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル又は置換若しくは非置換のアルキニルであり、
R11は、それぞれ独立して、水素原子、ハロゲン、シアノ、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル又は置換若しくは非置換のアルキニルであり、
mは、1~4の整数であり、
m1は、0~2の整数である。
ここで、
R6は、水素原子、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル又は置換若しくは非置換のアルキニルであり、
R10は、それぞれ独立して、水素原子、ハロゲン、シアノ、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル又は置換若しくは非置換のアルキニルであり、
R11は、それぞれ独立して、水素原子、ハロゲン、シアノ、置換若しくは非置換のアルキル、置換若しくは非置換のアルケニル又は置換若しくは非置換のアルキニルであり、
mは、1~4の整数であり、
m1は、0~2の整数である。
該架橋構造として、特に好ましくは、4’-(CH2)m-O-2’(mは1~4の整数)又は、4’-C(=O)-NR6-2’(R6は、水素原子又はアルキルである)である。
4’-(CH2)m-O-2’(mは1~4の整数)の中で、特に好ましくは4’-CH2-O-2’(LNA、Locked nucleic acid)である。具体例及びその調製方法は、国際公開第98/39352号、国際公開第2003/068795号、国際公開第2005/021570号等に記載されている。
4’-C(=O)-NR6-2’(R6は、水素原子又はアルキルである)の中で、特に好ましくは4’-C(=O)-NCH3-2’である。具体例及びその調製方法は、国際公開第2011/052436号に記載されている。
4’-(CH2)m-O-2’(mは1~4の整数)の中で、特に好ましくは4’-CH2-O-2’(LNA、Locked nucleic acid)である。具体例及びその調製方法は、国際公開第98/39352号、国際公開第2003/068795号、国際公開第2005/021570号等に記載されている。
4’-C(=O)-NR6-2’(R6は、水素原子又はアルキルである)の中で、特に好ましくは4’-C(=O)-NCH3-2’である。具体例及びその調製方法は、国際公開第2011/052436号に記載されている。
当該分野で公知のヌクレオチドの修飾及び修飾方法については、例えば、以下の特許文献にも開示されている。
国際公開第98/39352号、国際公開第99/014226号、国際公開2000/056748、国際公開第2005/021570号、国際公開第2003/068795号、国際公開第2011/052436号、国際公開第2004/016749号、国際公開第2005/083124号、国際公開2007/143315号、国際公開第2009/071680号、国際公開2014/112463号、国際公開2014/126229号等。
国際公開第98/39352号、国際公開第99/014226号、国際公開2000/056748、国際公開第2005/021570号、国際公開第2003/068795号、国際公開第2011/052436号、国際公開第2004/016749号、国際公開第2005/083124号、国際公開2007/143315号、国際公開第2009/071680号、国際公開2014/112463号、国際公開2014/126229号等。
以下に本発明について詳細に説明する。
本発明の「二本鎖オリゴヌクレオチド」は
アンチセンス鎖が、ヌクレオシド誘導体を含んでいてもよい8~25塩基のDNAアンチセンスオリゴヌクレオチドであり、
センス鎖が、ストリンジェントな条件で該アンチセンス鎖にハイブリダイズ可能な配列を含み、DNAヌクレオシド及び/又はヌクレオシド誘導体を含んでいてもよい8~35塩基のRNAオリゴヌクレオチドであり、
センス鎖の3’末端及び/又は5’末端に、
リンカーを介して
アシアロ糖タンパク質受容体と相互作用を有する糖誘導体
が結合している二本鎖オリゴヌクレオチド
である。
アンチセンス鎖が、ヌクレオシド誘導体を含んでいてもよい8~25塩基のDNAアンチセンスオリゴヌクレオチドであり、
センス鎖が、ストリンジェントな条件で該アンチセンス鎖にハイブリダイズ可能な配列を含み、DNAヌクレオシド及び/又はヌクレオシド誘導体を含んでいてもよい8~35塩基のRNAオリゴヌクレオチドであり、
センス鎖の3’末端及び/又は5’末端に、
リンカーを介して
アシアロ糖タンパク質受容体と相互作用を有する糖誘導体
が結合している二本鎖オリゴヌクレオチド
である。
本発明の「二本鎖オリゴヌクレオチド」のアンチセンス鎖は、ヌクレオシド誘導体を含んでいてもよい8~25塩基のDNAアンチセンスオリゴヌクレオチドである。
「DNAアンチセンスオリゴヌクレオチド」とは、標的遺伝子のmRNA、mRNA前駆体又はncRNAに対して相補的なオリゴヌクレオチドであり、1本鎖のDNAから構成される。当該アンチセンスオリゴヌクレオチドが標的とするmRNA、mRNA前駆体又はncRNAと二本鎖を形成することによりmRNA、mRNA前駆体又はncRNAの働きを抑制する。該「DNAアンチセンスオリゴヌクレオチド」には、標的となるmRNA、mRNA前駆体又はncRNAと完全に相補的であるもののみならず、mRNA、mRNA前駆体又はncRNAとストリンジェントな条件でハイブリダイズできる限り、1又は数個のミスマッチが存在するものも含まれる。
ncRNA(ノンコーディングRNA)とは、タンパク質へ翻訳されずに機能するRNAの総称である。例えば、リボソームRNA、転移RNA、miRNA等が挙げられる。
「標的遺伝子」としては、特に制限なく、各種疾患において発現が亢進している遺伝子が挙げられる。
ncRNA(ノンコーディングRNA)とは、タンパク質へ翻訳されずに機能するRNAの総称である。例えば、リボソームRNA、転移RNA、miRNA等が挙げられる。
「標的遺伝子」としては、特に制限なく、各種疾患において発現が亢進している遺伝子が挙げられる。
「DNAアンチセンスオリゴヌクレオチド」の長さは、8~25塩基である。例えば、8~19塩基、10~19塩基、13~19塩基、13塩基、14塩基、15塩基、16塩基、17塩基、18塩基又は19塩基である。
本発明の「二本鎖オリゴヌクレオチド」のセンス鎖は、ストリンジェントな条件で該アンチセンス鎖にハイブリダイズ可能な配列を含み、DNAヌクレオシド及び/又はヌクレオシド誘導体を含んでいてもよい8~35塩基のRNAオリゴヌクレオチドである。
センス鎖のRNAオリゴヌクレオチドは、アンチセンス鎖のDNAアンチセンスオリゴヌクレオチドとストリンジェントな条件でハイブリダイズできる限り、ハイブリダイズする部位において、1又は数個のミスマッチが存在するものも含まれる。
例えば、ハイブリダイズする部位が、アンチセンス鎖のDNAアンチセンスオリゴヌクレオチドの相補配列と少なくとも70%以上、好ましくは80%以上、より好ましくは90%以上、もっとも好ましくは95%以上の相同性を有するアンチセンスオリゴヌクレオチドが挙げられる。ここで、相同性は、例えば、Altschulら(The Journal of Molecular Biology,215,403-410(1990).)の開発したアルゴリズムを使用した検索プログラムBLASTを用いることにより、スコアで類似度が示される。
例えば、ハイブリダイズする部位が、アンチセンス鎖のDNAアンチセンスオリゴヌクレオチドの相補配列と少なくとも70%以上、好ましくは80%以上、より好ましくは90%以上、もっとも好ましくは95%以上の相同性を有するアンチセンスオリゴヌクレオチドが挙げられる。ここで、相同性は、例えば、Altschulら(The Journal of Molecular Biology,215,403-410(1990).)の開発したアルゴリズムを使用した検索プログラムBLASTを用いることにより、スコアで類似度が示される。
本発明の二本鎖オリゴヌクレオチドのセンス鎖の長さは、8~35塩基である。例えば、8~30、8~19塩基、10~19塩基、13~19塩基、13塩基、14塩基、15塩基、16塩基、17塩基、18塩基又は19塩基である。センス鎖の長さは、アンチセンス鎖と同じ長さであってもよいし、アンチセンス鎖とハイブリダイズする限りにおいて、アンチセンス鎖の長さより1又は数個の塩基の分短くてもよい。また、アンチセンス鎖とハイブリダイズする部位の片側又は両側に1又は数個の塩基が付加することにより、センス鎖の長さはアンチセンス鎖の長さより長くてもよい。センス鎖の長さがアンチセンス鎖の長さより長い場合、アンチセンス鎖とハイブリダイズしない部分においてセンス鎖中の塩基同士がハイブリダイズすることにより、ヘアピン構造を有していてもよい。
「1又は数個の塩基」とは、1~10個、1~5個、1~3個又は1若しくは2個の塩基を意味している。
「1又は数個の塩基」とは、1~10個、1~5個、1~3個又は1若しくは2個の塩基を意味している。
「ストリンジェントな条件」とは、ある塩基配列が特定配列とハイブリット(いわゆる特異的ハイブリット)を形成し、同等の機能を有しない塩基配列は該特定配列とハイブリット(いわゆる非特異的ハイブリット)を形成しない条件を意味する。当業者は、ハイブリダイゼーション反応及び洗浄時の温度や、ハイブリダイゼーション反応液及び洗浄液の塩濃度等を変化させることによって、このような条件を容易に選択することができる。具体的には、6×SSC(0.9M NaCl,0.09M クエン酸三ナトリウム)又は6×SSPE(3M NaCl,0,2M NaH2PO4,20mM EDTA・2Na,pH7.4)中42℃でハイブリダイズさせ、さらに42℃で0.5×SSCにより洗浄する条件が、本発明のストリンジェントな条件の1例として挙げられるが、これに限定されるものではない。ハイブリダイゼーション方法としては、当該分野において周知慣用な手法、例えば、サザンブロットハイブリダイゼーション法等を用いることができる。具体的には、Molecular Cloning:A Laboratory Manual,Second Edition(1989)(Cold Spring Harbor Laboratory Press)、Current Protocols in Molecular Biology(1994)(Wiley-Interscience)、DNA Cloning 1:Core Techniques、A Practical Approach,Second Edition(1995)(Oxford University Press)等に記載されている方法に準じて行うことができる。
「1又は数個のミスマッチ」とは、1~5個、好ましくは1~3個、さらに好ましくは1又は2個のミスマッチを意味している。
本発明の「二本鎖オリゴヌクレオチド」中のアンチセンス鎖のDNAアンチセンスオリゴヌクレオチド及びセンス鎖のRNAオリゴヌクレオチドは、ヌクレオシド誘導体を1以上含んでいることが好ましい。センス鎖はさらにDNAヌクレオシドを含んでいてもよい。つまり、アンチセンス鎖のDNAアンチセンスオリゴヌクレオチドは、少なくとも1つのヌクレオシドはDNAヌクレオシドであるが、その他のヌクレオシドはDNAヌクレオシドであってもヌクレオシド誘導体であってもよい。センス鎖のRNAオリゴヌクレオチドは、少なくとも1つのヌクレオシドはRNAヌクレオシドであるが、その他のヌクレオシドはRNAヌクレオシド、DNAヌクレオシド、ヌクレオシド誘導体のいずれであってもよい。
ヌクレオシド誘導体とDNAヌクレオシド又はRNAヌクレオシドのパターンとしては、例えば、ギャップマー又はミクスマーが挙げられる。
ギャップマーとは、中心領域(“ギャップ”)と該中心領域の両側の領域、ウイング(5’側の“5’ウイング”又は3’側の“3’ウイング”)を含み、各ウイングに少なくとも1つのヌクレオシド誘導体を含むオリゴヌクレオチドを意味する。例えば、“5’ウイング”及び /又は“3’ウイング”に、ヌクレオシド誘導体を1以上、好ましくは、1~5、さらに好ましくは、2~3含有する。一方のウイング内の修飾の種類、数、位置は他方のウイングにおける修飾の種類、数、位置と同じであっても異なっていてもよい。
ミクスマーとは、ランダムにヌクレオシド誘導体を含むオリゴヌクレオチドを意味する。
アンチセンス鎖のDNAアンチセンスオリゴヌクレオチドは、特に好ましくは、ギャップマーである。
ヌクレオシド誘導体とDNAヌクレオシド又はRNAヌクレオシドのパターンとしては、例えば、ギャップマー又はミクスマーが挙げられる。
ギャップマーとは、中心領域(“ギャップ”)と該中心領域の両側の領域、ウイング(5’側の“5’ウイング”又は3’側の“3’ウイング”)を含み、各ウイングに少なくとも1つのヌクレオシド誘導体を含むオリゴヌクレオチドを意味する。例えば、“5’ウイング”及び /又は“3’ウイング”に、ヌクレオシド誘導体を1以上、好ましくは、1~5、さらに好ましくは、2~3含有する。一方のウイング内の修飾の種類、数、位置は他方のウイングにおける修飾の種類、数、位置と同じであっても異なっていてもよい。
ミクスマーとは、ランダムにヌクレオシド誘導体を含むオリゴヌクレオチドを意味する。
アンチセンス鎖のDNAアンチセンスオリゴヌクレオチドは、特に好ましくは、ギャップマーである。
本発明の「二本鎖オリゴヌクレオチド」中のヌクレオシド誘導体としては、上記に記載の通り、当該分野で公知のヌクレオシドの修飾であれば、いずれも利用可能である。
好ましくは、糖の2’位に置換基を有するヌクレオシド及び/又は糖の4’位と2’位との間に架橋構造を有するヌクレオシドである。
糖の2’位に置換基として好ましくは、F、OCH3又はOCH2CH2OCH3である。
糖の4’位と2’位との間の架橋構造として好ましくは、4’-(CH2)m-O-2’(mは1~4の整数)、4’-C(=O)-NR6-2’(R6は、水素原子又はアルキルである)である。
好ましくは、糖の2’位に置換基を有するヌクレオシド及び/又は糖の4’位と2’位との間に架橋構造を有するヌクレオシドである。
糖の2’位に置換基として好ましくは、F、OCH3又はOCH2CH2OCH3である。
糖の4’位と2’位との間の架橋構造として好ましくは、4’-(CH2)m-O-2’(mは1~4の整数)、4’-C(=O)-NR6-2’(R6は、水素原子又はアルキルである)である。
本発明の「二本鎖オリゴヌクレオチド」中のアンチセンス鎖のDNAアンチセンスオリゴヌクレオチドとして好ましくは、ホスホロチオエート(S-オリゴ)である。
本発明の「二本鎖オリゴヌクレオチド」中のアンチセンス鎖のDNAアンチセンスオリゴヌクレオチド及びセンス鎖のRNAオリゴヌクレオチドは、当該分野の常法によって合成することができ、例えば、市販の核酸自動合成装置(例えば、AppliedBiosystems社製、(株)大日本精機製等)によって容易に合成することができる。合成法はホスホロアミダイトを用いた固相合成法、ハイドロジェンホスホネートを用いた固相合成法等がある。例えば、下記実施例3の1)~7)、Tetrahedron Letters 22, 1859-1862 (1981)、国際公開第2011/052436号等に開示されている。
合成されたアンチセンス鎖及びセンス鎖は公知の方法でハイブリダイズさせることにより二本鎖オリゴヌクレオチドを形成する。例えば、下記実施例3の11)、国際公開第2013/089283の実施例1等に開示されている。
本発明の「二本鎖オリゴヌクレオチド」は、センス鎖の3’末端及び/又は5’末端に、リンカーを介してアシアロ糖タンパク質受容体と相互作用を有する糖誘導体が結合している。
「アシアロ糖タンパク質受容体」とは肝臓細胞表面に存在し、アシアロ糖タンパク質のガラクトース残基を認識して細胞内に取り込み分解する働きを持つ。つまり、「アシアロ糖タンパク質受容体と相互作用を有する糖誘導体」とは、ガラクトース残基に類似の構造を持ち、アシアロ糖タンパク質受容体と結合して細胞内に取り込まれる化合物を意味する。例えば、GalNac(N-アセチルガラクトサミン)誘導体、ガラクトース誘導体、ラクトース誘導体が挙げられる。
GalNac誘導体とは、以下の基を含有する化合物である。
(式中、
RX1、RX2及びRX3は、それぞれ独立して、水素原子又は置換若しくは非置換のアルキルであり、
RX4’は置換又は非置換のアルキルである。)
(式中、
RX1、RX2及びRX3は、それぞれ独立して、水素原子又は置換若しくは非置換のアルキルであり、
RX4’は置換又は非置換のアルキルである。)
ラクトース誘導体は、以下の基を含有する化合物である。
(式中、
RX1は、水素原子又は置換若しくは非置換のアルキルであり、
RX2及びRX3は、それぞれ独立して、水素原子又は置換若しくは非置換のアルキルであり、
RX4は、それぞれ独立して、OH又はNHCORX4’(RX4’は置換又は非置換のアルキル)である。)
(式中、
RX1は、水素原子又は置換若しくは非置換のアルキルであり、
RX2及びRX3は、それぞれ独立して、水素原子又は置換若しくは非置換のアルキルであり、
RX4は、それぞれ独立して、OH又はNHCORX4’(RX4’は置換又は非置換のアルキル)である。)
「アシアロ糖タンパク質受容体と相互作用を有する糖誘導体」として好ましくは、以下が挙げられる。
(式中、
P0A、P1A、P1B、P2A、P2B、P3A、P3B、P4A、P4B、P4C、T0A、T1A、T1B、T2A、T2B、T3A、T3B、T4A、T4B及びT4Cはそれぞれ独立して、存在しないか、CO、NH、O、S、OC(=O)、NHC(=O)、CH2、CH2NH又はCH2Oであり、
Q0A、Q1A、Q1B、Q2A、Q2B、Q3A、Q3B、Q4A、Q4B及びQ4Cはそれぞれ独立して、存在しないか又は置換若しくは非置換のアルキレンであり、
R0A、R1A、R1B、R2A、R2B、R3A、R3B、R4A、R4B及びR4Cはそれぞれ独立して、存在しないか、NH、O、S、CH2、C(=O)O、C(=O)NH、NHCH(R5)C(=O)、C(=O)CH(R5)NH、CO、CH=N-O、複素環、
(なお、R0A~R4Cが上記式で表される場合、式中、左側にQ0A~Q4Cが結合する)
であり、
R5は水素原子又はアミノ酸側鎖であり、
q0A、q1A、q1B、q2A、q2B、q3A、q3B、q4A、q4B及びq4Cはそれぞれ独立して、0~20の整数であり、
LG0A、LG1A、LG1B、LG2A、LG2B、LG3A、LG3B、LG4A、LG4B及びLG4Cはそれぞれ独立して、
(式中、
RX1、RX2及びRX3はそれぞれ独立して、水素原子又は置換若しくは非置換のアルキルであり、
RX4はOH又はNHCORX4’(RX4’は置換又は非置換のアルキル)である)
(式中、
P0A、P1A、P1B、P2A、P2B、P3A、P3B、P4A、P4B、P4C、T0A、T1A、T1B、T2A、T2B、T3A、T3B、T4A、T4B及びT4Cはそれぞれ独立して、存在しないか、CO、NH、O、S、OC(=O)、NHC(=O)、CH2、CH2NH又はCH2Oであり、
Q0A、Q1A、Q1B、Q2A、Q2B、Q3A、Q3B、Q4A、Q4B及びQ4Cはそれぞれ独立して、存在しないか又は置換若しくは非置換のアルキレンであり、
R0A、R1A、R1B、R2A、R2B、R3A、R3B、R4A、R4B及びR4Cはそれぞれ独立して、存在しないか、NH、O、S、CH2、C(=O)O、C(=O)NH、NHCH(R5)C(=O)、C(=O)CH(R5)NH、CO、CH=N-O、複素環、
(なお、R0A~R4Cが上記式で表される場合、式中、左側にQ0A~Q4Cが結合する)
であり、
R5は水素原子又はアミノ酸側鎖であり、
q0A、q1A、q1B、q2A、q2B、q3A、q3B、q4A、q4B及びq4Cはそれぞれ独立して、0~20の整数であり、
LG0A、LG1A、LG1B、LG2A、LG2B、LG3A、LG3B、LG4A、LG4B及びLG4Cはそれぞれ独立して、
(式中、
RX1、RX2及びRX3はそれぞれ独立して、水素原子又は置換若しくは非置換のアルキルであり、
RX4はOH又はNHCORX4’(RX4’は置換又は非置換のアルキル)である)
「アミノ酸側鎖」とは、アミノ酸の構造の一部であり、例えば、CH3、CH2SH、CH2COOH、CH2CH2COOH、CH2C6H5、CH2C3H3N2、CH(CH3)CH2CH3、(CH2)4NH2、CH2CH(CH3)2、CH2CH2SCH3、CH2CONH2、CH2CH2CONH2、(CH2)3NHC(NH)NH2、CH2OH、CH(OH)CH3、CH2SeH、CH(CH3)2、CH2C8H6N、CH2C6H4OH等が挙げられる。
センス鎖と糖誘導体を介するリンカーとしては、当該分野で用いられるリンカーであれば、いずれでも利用可能である。
例えば、以下が挙げられる。
(式中、
L1はセンス鎖の3’末端及び/又は5’末端に結合し、L5は糖誘導体に結合する。
L1はC(=O)NH、NHC(=O)、NHC(=O)NH、
(式中、R7はアルキル又はアルキルオキシである)であり、
L2はそれぞれ独立して、芳香族環を介していてもよい置換若しくは非置換の炭素数が1~20のアルキレン又は芳香族環であり、
L3はそれぞれ独立して、存在しないか、C(=O)NR8(R8は水素又は置換若しくは非置換のアルキルである)、NR9C(=O)(R9は水素又は置換若しくは非置換のアルキルであるか、R9はL2のアルキレン中の炭素と一緒になって置換若しくは非置換の含窒素環を形成してもよい)、
(なお、L3が上記式で表される場合、式中、左側にL2が結合する)
であり、
L4はそれぞれ独立して、存在しないか、芳香族環を介していてもよい置換若しくは非置換の炭素数が1~20のアルキレン又は芳香族環であり、
L5はC(=O)NH、NHC(=O)、NH又はOであり、
nは1又は2である)。
(式中、
L1はセンス鎖の3’末端及び/又は5’末端に結合し、L5は糖誘導体に結合する。
L1はC(=O)NH、NHC(=O)、NHC(=O)NH、
(式中、R7はアルキル又はアルキルオキシである)であり、
L2はそれぞれ独立して、芳香族環を介していてもよい置換若しくは非置換の炭素数が1~20のアルキレン又は芳香族環であり、
L3はそれぞれ独立して、存在しないか、C(=O)NR8(R8は水素又は置換若しくは非置換のアルキルである)、NR9C(=O)(R9は水素又は置換若しくは非置換のアルキルであるか、R9はL2のアルキレン中の炭素と一緒になって置換若しくは非置換の含窒素環を形成してもよい)、
(なお、L3が上記式で表される場合、式中、左側にL2が結合する)
であり、
L4はそれぞれ独立して、存在しないか、芳香族環を介していてもよい置換若しくは非置換の炭素数が1~20のアルキレン又は芳香族環であり、
L5はC(=O)NH、NHC(=O)、NH又はOであり、
nは1又は2である)。
または、以下が挙げられる。
(式中、
L1はセンス鎖の3’末端及び/又は5’末端に結合し、L5は糖誘導体に結合する。
L1はC(=O)NH、NHC(=O)、NHC(=O)NH、
(式中、R7はアルキル又はアルキルオキシである)であり、
L2はそれぞれ独立して、芳香族環を介していてもよい置換若しくは非置換の炭素数が1~20のアルキレン又は芳香族環であり、
L3はそれぞれ独立して、存在しないか、C(=O)NR8(R8は水素又は置換若しくは非置換のアルキルである)又はNR9C(=O)(R9は水素又は置換若しくは非置換のアルキルであるか、R9はL2のアルキレン中の炭素と一緒になって置換若しくは非置換の含窒素環を形成してもよい)であり、
L4はそれぞれ独立して、存在しないか、芳香族環を介していてもよい置換若しくは非置換の炭素数が1~20のアルキレン又は芳香族環であり、
L5はC(=O)NH、NHC(=O)、NH又はOであり、
nは1又は2である)。
(式中、
L1はセンス鎖の3’末端及び/又は5’末端に結合し、L5は糖誘導体に結合する。
L1はC(=O)NH、NHC(=O)、NHC(=O)NH、
(式中、R7はアルキル又はアルキルオキシである)であり、
L2はそれぞれ独立して、芳香族環を介していてもよい置換若しくは非置換の炭素数が1~20のアルキレン又は芳香族環であり、
L3はそれぞれ独立して、存在しないか、C(=O)NR8(R8は水素又は置換若しくは非置換のアルキルである)又はNR9C(=O)(R9は水素又は置換若しくは非置換のアルキルであるか、R9はL2のアルキレン中の炭素と一緒になって置換若しくは非置換の含窒素環を形成してもよい)であり、
L4はそれぞれ独立して、存在しないか、芳香族環を介していてもよい置換若しくは非置換の炭素数が1~20のアルキレン又は芳香族環であり、
L5はC(=O)NH、NHC(=O)、NH又はOであり、
nは1又は2である)。
L2又はL4が、「芳香族環を介していてもよい置換若しくは非置換のアルキレン」又は「芳香族環」である場合、芳香族環として、好ましくは、ベンゼン環、ビフェニル環等が挙げられる。
「R9はL2のアルキレン中の炭素と一緒になって置換若しくは非置換の含窒素環を形成してもよい」とは、以下を意味する。
(式中、aは0~18の整数であり、bは1~5の整数である。アルキレンや含窒素環は置換基を有していてもよい。)
具体的には、以下が挙げられる。
(式中、aは0~18の整数であり、bは1~5の整数である。アルキレンや含窒素環は置換基を有していてもよい。)
具体的には、以下が挙げられる。
センス鎖の3’末端にリンカーを介して糖誘導体が結合する場合、オリゴヌクレオチドの末端の糖の3’位にL1が結合する。
センス鎖の5’末端に糖誘導体が結合する場合、オリゴヌクレオチドの末端の4’位に置換又は非置換のメチレンを介してL1が結合する。
センス鎖の5’末端に糖誘導体が結合する場合、オリゴヌクレオチドの末端の4’位に置換又は非置換のメチレンを介してL1が結合する。
L1として好ましくは、
である。
L2として好ましくは、1~20の置換又は非置換のアルキレン、ベンゼン環又はビフェニル環である。
L3として好ましくは、存在しないか、C(=O)NH又はNR9C(=O)(R9は水素であるか、R9はL2のアルキレン中の炭素と一緒になって置換若しくは非置換の含窒素環を形成してもよい)、NR9C(=O)(R9はL2のアルキレン中の炭素と一緒になって置換若しくは非置換の含窒素環を形成している)、
(なお、L3が上記式で表される場合、式中、左側にL2が結合する)
である。
L4として好ましくは、存在しないか、置換又は非置換の1~20のアルキレン、ベンゼン環又はビフェニル環である。
L5として好ましくは、C(=O)NHである。
である。
L2として好ましくは、1~20の置換又は非置換のアルキレン、ベンゼン環又はビフェニル環である。
L3として好ましくは、存在しないか、C(=O)NH又はNR9C(=O)(R9は水素であるか、R9はL2のアルキレン中の炭素と一緒になって置換若しくは非置換の含窒素環を形成してもよい)、NR9C(=O)(R9はL2のアルキレン中の炭素と一緒になって置換若しくは非置換の含窒素環を形成している)、
(なお、L3が上記式で表される場合、式中、左側にL2が結合する)
である。
L4として好ましくは、存在しないか、置換又は非置換の1~20のアルキレン、ベンゼン環又はビフェニル環である。
L5として好ましくは、C(=O)NHである。
「アシアロ糖タンパク質受容体と相互作用を有する糖誘導体」とリンカーは、下記実施例1に記載の通り糖誘導体とリンカーの一部を含む化合物として合成し、下記実施例に記載の通り該化合物を樹脂に固相化し、下記実施例3の9)及び10)に記載の通りセンス鎖のRNAオリゴヌクレオチドに導入する。その後、下記実施例3の11)に記載の通りアンチセンス鎖のDNAアンチセンスオリゴヌクレオチドをハイブリダイズさせることにより、本発明の「二本鎖オリゴヌクレオチド」が得られる。「糖誘導体とリンカーの一部を含む化合物」の具体例としては、下記実施例1に記載の化合物等が挙げられる。
「アシアロ糖タンパク質受容体と相互作用を有する糖誘導体」及びリンカーの具体例と調整方法は、例えば、上記非特許文献1、特許文献6~9、Bioconjugate Chemistry、22、17-225(1991)、Bioconjugate Chemistry、14、18-29(2003)等にも開示されている。
「アシアロ糖タンパク質受容体と相互作用を有する糖誘導体」及びリンカーの具体例と調整方法は、例えば、上記非特許文献1、特許文献6~9、Bioconjugate Chemistry、22、17-225(1991)、Bioconjugate Chemistry、14、18-29(2003)等にも開示されている。
本発明の「二本鎖オリゴヌクレオチド」の糖誘導体が結合していない3’末端又は5’末端、あるいはリンカーはさらに修飾されていてもよい。オリゴヌクレオチドの追跡を可能にするため、オリゴヌクレオチドの薬物動態又は薬力学を改善するため、あるいはオリゴヌクレオチドの安定性又は結合親和性を向上させるために、当該分野で公知の修飾基を利用することができる。例えば、水酸基の保護基、レポーター分子、コレステロール、リン脂質、色素、蛍光分子等が挙げられる。
また、本発明の「二本鎖オリゴヌクレオチド」の糖誘導体が結合していない3’末端又は5’末端はリン酸エステル部分を含んでいてもよい。「リン酸エステル部分」とは、リン酸エステル並びに修飾リン酸エステルが含まれる、末端リン酸基を意味する。リン酸エステル部分は、いずれの末端に位置してもよいが、5’-末端ヌクレオシドであることが好ましい。具体的には、式:-O-P(=O)(OH)OHで示される基又はその修飾基である。つまり、O及びOHの1以上が、H、O、OR’、S、N(R’)(ここでR’は、H、アミノ保護基又は置換若しくは非置換のアルキルである)又はアルキルで置換されていてもよい。5’又は3’末端は、それぞれ独立して置換又は非置換の1~3のリン酸エステル部分を含んでいてもよい。
また、本発明の「二本鎖オリゴヌクレオチド」の糖誘導体が結合していない3’末端又は5’末端はリン酸エステル部分を含んでいてもよい。「リン酸エステル部分」とは、リン酸エステル並びに修飾リン酸エステルが含まれる、末端リン酸基を意味する。リン酸エステル部分は、いずれの末端に位置してもよいが、5’-末端ヌクレオシドであることが好ましい。具体的には、式:-O-P(=O)(OH)OHで示される基又はその修飾基である。つまり、O及びOHの1以上が、H、O、OR’、S、N(R’)(ここでR’は、H、アミノ保護基又は置換若しくは非置換のアルキルである)又はアルキルで置換されていてもよい。5’又は3’末端は、それぞれ独立して置換又は非置換の1~3のリン酸エステル部分を含んでいてもよい。
以下に本明細書中で使用する上記以外の用語を説明する。なお、本明細書中、下記用語は単独で使用されている場合も、又は他の用語と一緒になって使用されている場合も、特に記載の無い限り、同一の意義を有する。
「ハロゲン」とは、フッ素原子、塩素原子、臭素原子、及びヨウ素原子を包含する。特にフッ素原子、及び塩素原子が好ましい。
「アルキル」とは、炭素数1~15、好ましくは炭素数1~10、より好ましくは炭素数1~6、さらに好ましくは炭素数1~4の直鎖又は分枝状の炭化水素基を包含する。例えば、メチル、エチル、n-プロピル、イソプロピル、n-ブチル、イソブチル、sec-ブチル、tert-ブチル、n-ペンチル、イソペンチル、ネオペンチル、n-ヘキシル、イソヘキシル、n-へプチル、イソヘプチル、n-オクチル、イソオクチル、n-ノニル、n-デシル等が挙げられる。
「アルキル」の好ましい態様として、メチル、エチル、n-プロピル、イソプロピル、n-ブチル、イソブチル、sec-ブチル、tert-ブチル、n-ペンチルが挙げられる。さらに好ましい態様として、メチル、エチル、n-プロピル、イソプロピル、tert-ブチルが挙げられる。
「アルキル」の好ましい態様として、メチル、エチル、n-プロピル、イソプロピル、n-ブチル、イソブチル、sec-ブチル、tert-ブチル、n-ペンチルが挙げられる。さらに好ましい態様として、メチル、エチル、n-プロピル、イソプロピル、tert-ブチルが挙げられる。
「アルケニル」とは、任意の位置に1以上の二重結合を有する、炭素数2~15、好ましくは炭素数2~10、より好ましくは炭素数2~6、さらに好ましくは炭素数2~4の直鎖又は分枝状の炭化水素基を包含する。例えば、ビニル、アリル、プロペニル、イソプロペニル、ブテニル、イソブテニル、プレニル、ブタジエニル、ペンテニル、イソペンテニル、ペンタジエニル、ヘキセニル、イソヘキセニル、ヘキサジエニル、ヘプテニル、オクテニル、ノネニル、デセニル、ウンデセニル、ドデセニル、トリデセニル、テトラデセニル、ペンタデセニル等が挙げられる。
「アルケニル」の好ましい態様として、ビニル、アリル、プロペニル、イソプロペニル、ブテニルが挙げられる。
「アルケニル」の好ましい態様として、ビニル、アリル、プロペニル、イソプロペニル、ブテニルが挙げられる。
「アルキニル」とは、任意の位置に1以上の三重結合を有する、炭素数2~10、好ましくは炭素数2~8、さらに好ましくは炭素数2~6、さらに好ましくは炭素数2~4の直鎖又は分枝状の炭化水素基を包含する。例えば、エチニル、プロピニル、ブチニル、ペンチニル、ヘキシニル、ヘプチニル、オクチニル、ノニニル、デシニル等を包含する。これらはさらに任意の位置に二重結合を有していてもよい。
「アルキニル」の好ましい態様として、エチニル、プロピニル、ブチニル、ペンチニルが挙げられる。
「アルキニル」の好ましい態様として、エチニル、プロピニル、ブチニル、ペンチニルが挙げられる。
「アルキレン」とは、炭素数1~15、好ましくは炭素数1~10、より好ましくは炭素数1~6、さらに好ましくは炭素数1~4の直鎖又は分枝状の2価の炭化水素基を包含する。例えば、メチレン、エチレン、トリメチレン、プロピレン、テトラメチレン、ペンタメチレン、ヘキサメチレン等が挙げられる。
「芳香族炭素環式基」とは、単環又は2環以上の、環状芳香族炭化水素基を意味する。例えば、フェニル、ナフチル、アントリル、フェナントリル等が挙げられる。
「芳香族炭素環式基」の好ましい態様として、フェニルが挙げられる。
「芳香族炭素環式基」の好ましい態様として、フェニルが挙げられる。
「非芳香族炭素環式基」とは、単環又は2環以上の、環状飽和炭化水素基又は環状非芳香族不飽和炭化水素基を意味する。2環以上の非芳香族炭素環式基は、単環又は2環以上の非芳香族炭素環式基に、上記「芳香族炭素環式基」における環が縮合したものも包含する。
さらに、「非芳香族炭素環式基」は、以下のように架橋している基、又はスピロ環を形成する基も包含する。
単環の非芳香族炭素環式基としては、炭素数3~16が好ましく、より好ましくは炭素数3~12、さらに好ましくは炭素数4~8である。例えば、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル、シクロオクチル、シクロノニル、シクロデシル、シクロプロペニル、シクロブテニル、シクロペンテニル、シクロヘキセニル、シクロヘプテニル、シクロヘキサジエニル等が挙げられる。
2環以上の非芳香族炭素環式基としては、例えば、インダニル、インデニル、アセナフチル、テトラヒドロナフチル、フルオレニル等が挙げられる。
さらに、「非芳香族炭素環式基」は、以下のように架橋している基、又はスピロ環を形成する基も包含する。
単環の非芳香族炭素環式基としては、炭素数3~16が好ましく、より好ましくは炭素数3~12、さらに好ましくは炭素数4~8である。例えば、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル、シクロオクチル、シクロノニル、シクロデシル、シクロプロペニル、シクロブテニル、シクロペンテニル、シクロヘキセニル、シクロヘプテニル、シクロヘキサジエニル等が挙げられる。
2環以上の非芳香族炭素環式基としては、例えば、インダニル、インデニル、アセナフチル、テトラヒドロナフチル、フルオレニル等が挙げられる。
「芳香族複素環式基」とは、O、S及びNから任意に選択される同一又は異なるヘテロ原子を環内に1以上有する、単環又は2環以上の、芳香族環式基を意味する。
2環以上の芳香族複素環式基は、単環又は2環以上の芳香族複素環式基に、上記「芳香族炭素環式基」における環が縮合したものも包含する。
単環の芳香族複素環式基としては、5~8員が好ましく、より好ましくは5員又は6員である。例えば、ピロリル、イミダゾリル、ピラゾリル、ピリジル、ピリダジニル、ピリミジニル、ピラジニル、トリアゾリル、トリアジニル、テトラゾリル、フリル、チエニル、イソオキサゾリル、オキサゾリル、オキサジアゾリル、イソチアゾリル、チアゾリル、チアジアゾリル等が挙げられる。
2環の芳香族複素環式基としては、例えば、インドリル、イソインドリル、インダゾリル、インドリジニル、キノリニル、イソキノリニル、シンノリニル、フタラジニル、キナゾリニル、ナフチリジニル、キノキサリニル、プリニル、プテリジニル、ベンズイミダゾリル、ベンズイソオキサゾリル、ベンズオキサゾリル、ベンズオキサジアゾリル、ベンズイソチアゾリル、ベンゾチアゾリル、ベンゾチアジアゾリル、ベンゾフリル、イソベンゾフリル、ベンゾチエニル、ベンゾトリアゾリル、イミダゾピリジル、トリアゾロピリジル、イミダゾチアゾリル、ピラジノピリダジニル、オキサゾロピリジル、チアゾロピリジル等が挙げられる。
3環以上の芳香族複素環式基としては、例えば、カルバゾリル、アクリジニル、キサンテニル、フェノチアジニル、フェノキサチイニル、フェノキサジニル、ジベンゾフリル等が挙げられる。
2環以上の芳香族複素環式基は、単環又は2環以上の芳香族複素環式基に、上記「芳香族炭素環式基」における環が縮合したものも包含する。
単環の芳香族複素環式基としては、5~8員が好ましく、より好ましくは5員又は6員である。例えば、ピロリル、イミダゾリル、ピラゾリル、ピリジル、ピリダジニル、ピリミジニル、ピラジニル、トリアゾリル、トリアジニル、テトラゾリル、フリル、チエニル、イソオキサゾリル、オキサゾリル、オキサジアゾリル、イソチアゾリル、チアゾリル、チアジアゾリル等が挙げられる。
2環の芳香族複素環式基としては、例えば、インドリル、イソインドリル、インダゾリル、インドリジニル、キノリニル、イソキノリニル、シンノリニル、フタラジニル、キナゾリニル、ナフチリジニル、キノキサリニル、プリニル、プテリジニル、ベンズイミダゾリル、ベンズイソオキサゾリル、ベンズオキサゾリル、ベンズオキサジアゾリル、ベンズイソチアゾリル、ベンゾチアゾリル、ベンゾチアジアゾリル、ベンゾフリル、イソベンゾフリル、ベンゾチエニル、ベンゾトリアゾリル、イミダゾピリジル、トリアゾロピリジル、イミダゾチアゾリル、ピラジノピリダジニル、オキサゾロピリジル、チアゾロピリジル等が挙げられる。
3環以上の芳香族複素環式基としては、例えば、カルバゾリル、アクリジニル、キサンテニル、フェノチアジニル、フェノキサチイニル、フェノキサジニル、ジベンゾフリル等が挙げられる。
「非芳香族複素環式基」とは、O、S及びNから任意に選択される同一又は異なるヘテロ原子を環内に1以上有する、単環又は2環以上の、環状非芳香族環式基を意味する。
2環以上の非芳香族複素環式基は、単環又は2環以上の非芳香族複素環式基に、上記「芳香族炭素環式基」、「非芳香族炭素環式基」、及び/又は「芳香族複素環式基」におけるそれぞれの環が縮合したものも包含する。
さらに、「非芳香族複素環式基」は、以下のように架橋している基、又はスピロ環を形成する基も包含する。
単環の非芳香族複素環式基としては、3~8員が好ましく、より好ましくは5員又は6員である。例えば、ジオキサニル、チイラニル、オキシラニル、オキセタニル、オキサチオラニル、アゼチジニル、チアニル、チアゾリジニル、ピロリジニル、ピロリニル、イミダゾリジニル、イミダゾリニル、ピラゾリジニル、ピラゾリニル、ピペリジル、ピペラジニル、モルホリニル、モルホリノ、チオモルホリニル、チオモルホリノ、ジヒドロピリジル、テトラヒドロピリジル、テトラヒドロフリル、テトラヒドロピラニル、ジヒドロチアゾリル、テトラヒドロチアゾリル、テトラヒドロイソチアゾリル、ジヒドロオキサジニル、ヘキサヒドロアゼピニル、テトラヒドロジアゼピニル、テトラヒドロピリダジニル、ヘキサヒドロピリミジニル、ジオキソラニル、ジオキサジニル、アジリジニル、ジオキソリニル、オキセパニル、チオラニル、チイニル、チアジニル等が挙げられる。
2環以上の非芳香族複素環式基としては、例えば、インドリニル、イソインドリニル、クロマニル、イソクロマニル等が挙げられる。
2環以上の非芳香族複素環式基は、単環又は2環以上の非芳香族複素環式基に、上記「芳香族炭素環式基」、「非芳香族炭素環式基」、及び/又は「芳香族複素環式基」におけるそれぞれの環が縮合したものも包含する。
さらに、「非芳香族複素環式基」は、以下のように架橋している基、又はスピロ環を形成する基も包含する。
単環の非芳香族複素環式基としては、3~8員が好ましく、より好ましくは5員又は6員である。例えば、ジオキサニル、チイラニル、オキシラニル、オキセタニル、オキサチオラニル、アゼチジニル、チアニル、チアゾリジニル、ピロリジニル、ピロリニル、イミダゾリジニル、イミダゾリニル、ピラゾリジニル、ピラゾリニル、ピペリジル、ピペラジニル、モルホリニル、モルホリノ、チオモルホリニル、チオモルホリノ、ジヒドロピリジル、テトラヒドロピリジル、テトラヒドロフリル、テトラヒドロピラニル、ジヒドロチアゾリル、テトラヒドロチアゾリル、テトラヒドロイソチアゾリル、ジヒドロオキサジニル、ヘキサヒドロアゼピニル、テトラヒドロジアゼピニル、テトラヒドロピリダジニル、ヘキサヒドロピリミジニル、ジオキソラニル、ジオキサジニル、アジリジニル、ジオキソリニル、オキセパニル、チオラニル、チイニル、チアジニル等が挙げられる。
2環以上の非芳香族複素環式基としては、例えば、インドリニル、イソインドリニル、クロマニル、イソクロマニル等が挙げられる。
「複素環」とは、上記「芳香族複素環式基」及び「非芳香族複素環式基」から誘導される環を意味する。
「芳香族環」とは、上記「芳香族炭素環式基」及び「芳香族複素環式基」から誘導される環を意味する。
「アルキルオキシ」とは、上記「アルキル」が酸素原子に結合した基を意味する。例えば、メトキシ、エトキシ、n-プロピルオキシ、イソプロピルオキシ、n-ブチルオキシ、tert-ブチルオキシ、イソブチルオキシ、sec-ブチルオキシ、ペンチルオキシ、イソペンチルオキシ、へキシルオキシ等が挙げられる。
「アルキルオキシ」の好ましい態様として、メトキシ、エトキシ、n-プロピルオキシ、イソプロピルオキシ、tert-ブチルオキシが挙げられる。
「アルキルオキシ」の好ましい態様として、メトキシ、エトキシ、n-プロピルオキシ、イソプロピルオキシ、tert-ブチルオキシが挙げられる。
「アルケニルオキシ」とは、上記「アルケニル」が酸素原子に結合した基を意味する。
例えば、ビニルオキシ、アリルオキシ、1-プロペニルオキシ、2-ブテニルオキシ、2-ペンテニルオキシ、2-ヘキセニルオキシ、2-ヘプテニルオキシ、2-オクテニルオキシ等が挙げられる。
例えば、ビニルオキシ、アリルオキシ、1-プロペニルオキシ、2-ブテニルオキシ、2-ペンテニルオキシ、2-ヘキセニルオキシ、2-ヘプテニルオキシ、2-オクテニルオキシ等が挙げられる。
「アルキニルオキシ」とは、上記「アルキニル」が酸素原子に結合した基を意味する。
例えば、エチニルオキシ、1-プロピニルオキシ、2-プロピニルオキシ、2-ブチニルオキシ、2-ペンチニルオキシ、2-ヘキシニルオキシ、2-ヘプチニルオキシ、2-オクチニルオキシ等が挙げられる。
例えば、エチニルオキシ、1-プロピニルオキシ、2-プロピニルオキシ、2-ブチニルオキシ、2-ペンチニルオキシ、2-ヘキシニルオキシ、2-ヘプチニルオキシ、2-オクチニルオキシ等が挙げられる。
「ハロアルキル」とは、1以上の上記「ハロゲン」が上記「アルキル」に結合した基を意味する。例えば、モノフルオロメチル、モノフルオロエチル、モノフルオロプロピル、2,2,3,3,3-ペンタフルオロプロピル、モノクロロメチル、トリフルオロメチル、トリクロロメチル、2,2,2-トリフルオロエチル、2,2,2-トリクロロエチル、1,2-ジブロモエチル、1,1,1-トリフルオロプロパン-2-イル等が挙げられる。
「ハロアルキル」の好ましい態様として、トリフルオロメチル、トリクロロメチルが挙げられる。
「ハロアルキル」の好ましい態様として、トリフルオロメチル、トリクロロメチルが挙げられる。
「ハロアルキルオキシ」とは、上記「ハロアルキル」が酸素原子に結合した基を意味する。例えば、モノフルオロメトキシ、モノフルオロエトキシ、トリフルオロメトキシ、トリクロロメトキシ、トリフルオロエトキシ、トリクロロエトキシ等が挙げられる。
「ハロアルキルオキシ」の好ましい態様として、トリフルオロメトキシ、トリクロロメトキシが挙げられる。
「ハロアルキルオキシ」の好ましい態様として、トリフルオロメトキシ、トリクロロメトキシが挙げられる。
「アルキルオキシアルキル」とは、上記「アルキルオキシ」が上記「アルキル」に結合した基を意味する。例えば、メトキシメチル、メトキシエチル、エトキシメチル等が挙げられる。
「アルキルオキシアルキルオキシ」とは、上記「アルキルオキシ」が上記「アルキルオキシ」に結合した基を意味する。例えば、メトキシメトキシ、メトキシエトキシ、エトキシメトキシ、エトキシエトキシ等が挙げられる。
「アルキルチオ」とは、上記「アルキル」が硫黄原子に結合した基を意味する。
「アルキルカルボニル」とは、上記「アルキル」がカルボニル基に結合した基を意味する。例えば、メチルカルボニル、エチルカルボニル、プロピルカルボニル、イソプロピルカルボニル、tert-ブチルカルボニル、イソブチルカルボニル、sec-ブチルカルボニル、ペンチルカルボニル、イソペンチルカルボニル、へキシルカルボニル等が挙げられる。
「アルキルカルボニル」の好ましい態様として、メチルカルボニル、エチルカルボニル、n-プロピルカルボニルが挙げられる。
「アルキルカルボニル」の好ましい態様として、メチルカルボニル、エチルカルボニル、n-プロピルカルボニルが挙げられる。
「アルケニルカルボニル」とは、上記「アルケニル」がカルボニル基に結合した基を意味する。例えば、エチレニルカルボニル、プロペニルカルボニル等が挙げられる。
「アルキニルカルボニル」とは、上記「アルキニル」がカルボニル基に結合した基を意味する。例えば、エチニルカルボニル、プロピニルカルボニル等が挙げられる。
「アルキルアミノ」には、モノアルキルアミノとジアルキルアミノが含まれる。
「モノアルキルアミノ」とは、上記「アルキル」がアミノ基の窒素原子と結合している水素原子1個と置き換わった基を意味する。例えば、メチルアミノ、エチルアミノ、イソプロピルアミノ等が挙げられる。好ましくは、メチルアミノ、エチルアミノが挙げられる。
「ジアルキルアミノ」とは、上記「アルキル」がアミノ基の窒素原子と結合している水素原子2個と置き換わった基を意味する。2個のアルキルは、同一でも異なっていてもよい。例えば、ジメチルアミノ、ジエチルアミノ、N,N-ジイソプロピルアミノ、N-メチル-N-エチルアミノ、N-イソプロピル-N-エチルアミノ等が挙げられる。好ましくは、ジメチルアミノ、ジエチルアミノが挙げられる。
「モノアルキルアミノ」とは、上記「アルキル」がアミノ基の窒素原子と結合している水素原子1個と置き換わった基を意味する。例えば、メチルアミノ、エチルアミノ、イソプロピルアミノ等が挙げられる。好ましくは、メチルアミノ、エチルアミノが挙げられる。
「ジアルキルアミノ」とは、上記「アルキル」がアミノ基の窒素原子と結合している水素原子2個と置き換わった基を意味する。2個のアルキルは、同一でも異なっていてもよい。例えば、ジメチルアミノ、ジエチルアミノ、N,N-ジイソプロピルアミノ、N-メチル-N-エチルアミノ、N-イソプロピル-N-エチルアミノ等が挙げられる。好ましくは、ジメチルアミノ、ジエチルアミノが挙げられる。
「アルキルスルホニル」とは、上記「アルキル」がスルホニル基に結合した基を意味する。例えば、メチルスルホニル、エチルスルホニル、プロピルスルホニル、イソプロピルスルホニル、tert-ブチルスルホニル、イソブチルスルホニル、sec-ブチルスルホニル等が挙げられる。
「アルキルスルホニル」の好ましい態様として、メチルスルホニル、エチルスルホニルが挙げられる。
「アルキルスルホニル」の好ましい態様として、メチルスルホニル、エチルスルホニルが挙げられる。
「アルケニルスルホニル」とは、上記「アルケニル」がスルホニル基に結合した基を意味する。例えば、エチレニルスルホニル、プロペニルスルホニル等が挙げられる。
「アルキニルスルホニル」とは、上記「アルキニル」がスルホニル基に結合した基を意味する。例えば、エチニルスルホニル、プロピニルスルホニル等が挙げられる。
「モノアルキルカルボニルアミノ」とは、上記「アルキルカルボニル」がアミノ基の窒素原子と結合している水素原子1個と置き換わった基を意味する。例えば、メチルカルボニルアミノ、エチルカルボニルアミノ、プロピルカルボニルアミノ、イソプロピルカルボニルアミノ、tert-ブチルカルボニルアミノ、イソブチルカルボニルアミノ、sec-ブチルカルボニルアミノ等が挙げられる。
「モノアルキルカルボニルアミノ」の好ましい態様としては、メチルカルボニルアミノ、エチルカルボニルアミノが挙げられる。
「モノアルキルカルボニルアミノ」の好ましい態様としては、メチルカルボニルアミノ、エチルカルボニルアミノが挙げられる。
「ジアルキルカルボニルアミノ」とは、上記「アルキルカルボニル」がアミノ基の窒素原子と結合している水素原子2個と置き換わった基を意味する。2個のアルキルカルボニル基は、同一でも異なっていてもよい。例えば、ジメチルカルボニルアミノ、ジエチルカルボニルアミノ、N,N-ジイソプロピルカルボニルアミノ等が挙げられる。
「ジアルキルカルボニルアミノ」の好ましい態様として、ジメチルカルボニルアミノ、ジエチルカルボニルアミノが挙げられる。
「ジアルキルカルボニルアミノ」の好ましい態様として、ジメチルカルボニルアミノ、ジエチルカルボニルアミノが挙げられる。
「モノアルキルスルホニルアミノ」とは、上記「アルキルスルホニル」がアミノ基の窒素原子と結合している水素原子1個と置き換わった基を意味する。例えば、メチルスルホニルアミノ、エチルスルホニルアミノ、プロピルスルホニルアミノ、イソプロピルスルホニルアミノ、tert-ブチルスルホニルアミノ、イソブチルスルホニルアミノ、sec-ブチルスルホニルアミノ等が挙げられる。
「モノアルキルスルホニルアミノ」の好ましい態様としては、メチルスルホニルアミノ、エチルスルホニルアミノが挙げられる。
「モノアルキルスルホニルアミノ」の好ましい態様としては、メチルスルホニルアミノ、エチルスルホニルアミノが挙げられる。
「ジアルキルスルホニルアミノ」とは、上記「アルキルスルホニル」がアミノ基の窒素原子と結合している水素原子2個と置き換わった基を意味する。2個のアルキルスルホニル基は、同一でも異なっていてもよい。例えば、ジメチルスルホニルアミノ、ジエチルスルホニルアミノ、N,N-ジイソプロピルスルホニルアミノ等が挙げられる。
「ジアルキルカルボニルアミノ」の好ましい態様として、ジメチルスルホニルアミノ、ジエチルスルホニルアミノが挙げられる。
「ジアルキルカルボニルアミノ」の好ましい態様として、ジメチルスルホニルアミノ、ジエチルスルホニルアミノが挙げられる。
「アルキルイミノ」とは、上記「アルキル」がイミノ基の窒素原子と結合している水素原子と置き換わった基を意味する。例えば、メチルイミノ、エチルイミノ、n-プロピルイミノ、イソプロピルイミノ等が挙げられる。
「アルケニルイミノ」とは、上記「アルケニル」がイミノ基の窒素原子と結合している水素原子と置き換わった基を意味する。例えば、エチレニルイミノ、プロペニルイミノ等が挙げられる。
「アルキニルイミノ」とは、上記「アルキニル」がイミノ基の窒素原子と結合している水素原子と置き換わった基を意味する。例えば、エチニルイミノ、プロピニルイミノ等が挙げられる。
「アルキルカルボニルイミノ」とは、上記「アルキルカルボニル」がイミノ基の窒素原子と結合している水素原子と置き換わった基を意味する。例えば、メチルカルボニルイミノ、エチルカルボニルイミノ、n-プロピルカルボニルイミノ、イソプロピルカルボニルイミノ等が挙げられる。
「アルケニルカルボニルイミノ」とは、上記「アルケニルカルボニル」がイミノ基の窒素原子と結合している水素原子と置き換わった基を意味する。例えば、エチレニルカルボニルイミノ、プロペニルカルボニルイミノ等が挙げられる。
「アルキニルカルボニルイミノ」とは、上記「アルキニルカルボニル」がイミノ基の窒素原子と結合している水素原子と置き換わった基を意味する。例えば、エチニルカルボニルイミノ、プロピニルカルボニルイミノ等が挙げられる。
「アルキルオキシイミノ」とは、上記「アルキルオキシ」がイミノ基の窒素原子と結合している水素原子と置き換わった基を意味する。例えば、メチルオキシイミノ、エチルオキシイミノ、n-プロピルオキシイミノ、イソプロピルオキシイミノ等が挙げられる。
「アルケニルオキシイミノ」とは、上記「アルケニルオキシ」がイミノ基の窒素原子と結合している水素原子と置き換わった基を意味する。例えば、エチレニルオキシイミノ、プロペニルオキシイミノ等が挙げられる。
「アルキニルオキシイミノ」とは、上記「アルキニルオキシ」がイミノ基の窒素原子と結合している水素原子と置き換わった基を意味する。例えば、エチニルオキシイミノ、プロピニルオキシイミノ等が挙げられる。
「アルキルカルボニルオキシ」とは、上記「アルキルカルボニル」が酸素原子に結合した基を意味する。例えば、メチルカルボニルオキシ、エチルカルボニルオキシ、プロピルカルボニルオキシ、イソプロピルカルボニルオキシ、tert-ブチルカルボニルオキシ、イソブチルカルボニルオキシ、sec-ブチルカルボニルオキシ等が挙げられる。
「アルキルカルボニルオキシ」の好ましい態様としては、メチルカルボニルオキシ、エチルカルボニルオキシが挙げられる。
「アルキルカルボニルオキシ」の好ましい態様としては、メチルカルボニルオキシ、エチルカルボニルオキシが挙げられる。
「アルケニルカルボニルオキシ」とは、上記「アルケニルカルボニル」が酸素原子に結合した基を意味する。例えば、エチレニルカルボニルオキシ、プロペニルカルボニルオキシ等が挙げられる。
「アルキニルカルボニルオキシ」とは、上記「アルキニルカルボニル」が酸素原子に結合した基を意味する。例えば、エチニルカルボニルオキシ、プロピニルカルボニルオキシ等が挙げられる。
「アルキルオキシカルボニル」とは、上記「アルキルオキシ」がカルボニル基に結合した基を意味する。例えば、メチルオキシカルボニル、エチルオキシカルボニル、プロピルオキシカルボニル、イソプロピルオキシカルボニル、tert-ブチルオキシカルボニル、イソブチルオキシカルボニル、sec-ブチルオキシカルボニル、ペンチルオキシカルボニル、イソペンチルオキシカルボニル、へキシルオキシカルボニル等が挙げられる。
「アルキルオキシカルボニル」の好ましい態様としては、メチルオキシカルボニル、エチルオキシカルボニル、プロピルオキシカルボニルが挙げられる。
「アルキルオキシカルボニル」の好ましい態様としては、メチルオキシカルボニル、エチルオキシカルボニル、プロピルオキシカルボニルが挙げられる。
「アルケニルオキシカルボニル」とは、上記「アルケニルオキシ」がカルボニル基に結合した基を意味する。例えば、エチレニルオキシカルボニル、プロペニルオキシカルボニル等が挙げられる。
「アルキニルオキシカルボニル」とは、上記「アルキニルオキシ」がカルボニル基に結合した基を意味する。例えば、エチニルオキシカルボニル、プロピニルオキシカルボニル等が挙げられる。
「アルキルスルファニル」とは、上記「アルキル」がスルファニル基の硫黄原子と結合している水素原子と置き換わった基を意味する。例えば、メチルスルファニル、エチルスルファニル、n-プロピルスルファニル、イソプロピルスルファニル等が挙げられる。
「アルケニルスルファニル」とは、上記「アルケニル」がスルファニル基の硫黄原子と結合している水素原子と置き換わった基を意味する。例えば、エチレニルスルファニル、プロペニルスルファニル等が挙げられる。
「アルキニルスルファニル」とは、上記「アルキニル」がスルファニル基の硫黄原子と結合している水素原子と置き換わった基を意味する。例えば、エチニルスルファニル、プロピニルスルファニル等が挙げられる。
「アルキルスルフィニル」とは、上記「アルキル」がスルフィニル基に結合した基を意味する。例えば、メチルスルフィニル、エチルスルフィニル、n-プロピルスルフィニル、イソプロピルスルフィニル等が挙げられる。
「アルケニルスルフィニル」とは、上記「アルケニル」がスルフィニル基に結合した基を意味する。例えば、エチレニルスルフィニル、プロペニルスルフィニル等が挙げられる。
「アルキニルスルフィニル」とは、上記「アルキニル」がスルフィニル基に結合した基を意味する。例えば、エチニルスルフィニル、プロピニルスルフィニル等が挙げられる。
「モノアルキルカルバモイル」とは、上記「アルキル」がカルバモイル基の窒素原子と結合している水素原子1個と置き換わった基を意味する。例えば、メチルカルバモイル、エチルカルバモイル等が挙げられる。
「ジアルキルカルバモイル」とは、上記「アルキル」がカルバモイル基の窒素原子と結合している水素原子2個と置き換わった基を意味する。2個のアルキル基は、同一でも異なっていてもよい。例えば、ジメチルカルバモイル、ジエチルカルバモイル等が挙げられる。
「モノアルキルスルファモイル」とは、上記「アルキル」がスルファモイル基の窒素原子と結合している水素原子1個と置き換わった基を意味する。例えば、メチルスルファモイル、ジメチルスルファモイル等が挙げられる。
「ジアルキルスルファモイル」とは、上記「アルキル」がスルファモイル基の窒素原子と結合している水素原子2個と置き換わった基を意味する。2個のアルキル基は、同一でも異なっていてもよい。例えば、ジメチルスルファモイル、ジエチルスルファモイル等が挙げられる。
「トリアルキルシリル」とは、上記「アルキル」3個がケイ素原子に結合している基を意味する。3個のアルキルは同一でも異なっていてもよい。例えば、トリメチルシリル、トリエチルシリル、tert-ブチルジメチルシリル等が挙げられる。
「芳香族炭素環アルキル」、「非芳香族炭素環アルキル」、「芳香族複素環アルキル」、及び「非芳香族複素環アルキル」、
「芳香族炭素環アルキルオキシ」、「非芳香族炭素環アルキルオキシ」、「芳香族複素環アルキルオキシ」、及び「非芳香族複素環アルキルオキシ」、
「芳香族炭素環アルキルオキシカルボニル」、「非芳香族炭素環アルキルオキシカルボニル」、「芳香族複素環アルキルオキシカルボニル」、及び「非芳香族複素環アルキルオキシカルボニル」、
「芳香族炭素環アルキルオキシアルキル」、「非芳香族炭素環アルキルオキシアルキル」、「芳香族複素環アルキルオキシアルキル」、及び「非芳香族複素環アルキルオキシアルキル」、ならびに
「芳香族炭素環アルキルアミノ」、「非芳香族炭素環アルキルアミノ」、「芳香族複素環アルキルアミノ」、及び「非芳香族複素環アルキルアミノ」のアルキル部分も、上記「アルキル」と同様である。
「芳香族炭素環アルキルオキシ」、「非芳香族炭素環アルキルオキシ」、「芳香族複素環アルキルオキシ」、及び「非芳香族複素環アルキルオキシ」、
「芳香族炭素環アルキルオキシカルボニル」、「非芳香族炭素環アルキルオキシカルボニル」、「芳香族複素環アルキルオキシカルボニル」、及び「非芳香族複素環アルキルオキシカルボニル」、
「芳香族炭素環アルキルオキシアルキル」、「非芳香族炭素環アルキルオキシアルキル」、「芳香族複素環アルキルオキシアルキル」、及び「非芳香族複素環アルキルオキシアルキル」、ならびに
「芳香族炭素環アルキルアミノ」、「非芳香族炭素環アルキルアミノ」、「芳香族複素環アルキルアミノ」、及び「非芳香族複素環アルキルアミノ」のアルキル部分も、上記「アルキル」と同様である。
「芳香族炭素環アルキル」とは、1以上の上記「芳香族炭素環式基」で置換されているアルキルを意味する。例えば、ベンジル、フェネチル、フェニルプロピル、ベンズヒドリル、トリチル、ナフチルメチル、以下に示される基
等が挙げられる。
「芳香族炭素環アルキル」の好ましい態様としては、ベンジル、フェネチル、ベンズヒドリルが挙げられる。
等が挙げられる。
「芳香族炭素環アルキル」の好ましい態様としては、ベンジル、フェネチル、ベンズヒドリルが挙げられる。
「非芳香族炭素環アルキル」とは、1以上の上記「非芳香族炭素環式基」で置換されているアルキルを意味する。また、「非芳香族炭素環アルキル」は、アルキル部分が上記「芳香族炭素環式基」で置換されている「非芳香族炭素環アルキル」も包含する。例えば、シクロプロピルメチル、シクロブチルメチル、シクロペンチルメチル、シクロへキシルメチル、以下に示される基
等が挙げられる。
等が挙げられる。
「芳香族複素環アルキル」とは、1以上の上記「芳香族複素環式基」で置換されているアルキルを意味する。また、「芳香族複素環アルキル」は、アルキル部分が上記「芳香族炭素環式基」及び/又は「非芳香族炭素環式基」で置換されている「芳香族複素環アルキル」も包含する。例えば、ピリジルメチル、フラニルメチル、イミダゾリルメチル、インドリルメチル、ベンゾチオフェニルメチル、オキサゾリルメチル、イソキサゾリルメチル、チアゾリルメチル、イソチアゾリルメチル、ピラゾリルメチル、イソピラゾリルメチル、ピロリジニルメチル、ベンズオキサゾリルメチル、以下に示される基
等が挙げられる。
等が挙げられる。
「非芳香族複素環アルキル」とは、1以上の上記「非芳香族複素環式基」で置換されているアルキルを意味する。また、「非芳香族複素環アルキル」は、アルキル部分が上記「芳香族炭素環式基」、「非芳香族炭素環式基」及び/又は「芳香族複素環式基」で置換されている「非芳香族複素環アルキル」も包含する。例えば、テトラヒドロピラニルメチル、モルホリニルエチル、ピペリジニルメチル、ピペラジニルメチル、以下に示される基
等が挙げられる。
等が挙げられる。
「芳香族炭素環アルキルオキシ」とは、1以上の上記「芳香族炭素環式基」で置換されているアルキルオキシを意味する。例えば、ベンジルオキシ、フェネチルオキシ、フェニルプロピルオキシ、ベンズヒドリルオキシ、トリチルオキシ、ナフチルメチルオキシ、以下に示される基
等が挙げられる。
等が挙げられる。
「非芳香族炭素環アルキルオキシ」とは、1以上の上記「非芳香族炭素環式基」で置換されているアルキルオキシを意味する。また、「非芳香族炭素環アルキルオキシ」は、アルキル部分が上記「芳香族炭素環式基」で置換されている「非芳香族炭素環アルキルオキシ」も包含する。例えば、シクロプロピルメチルオキシ、シクロブチルメチルオキシ、シクロペンチルメチルオキシ、シクロへキシルメチルオキシ、以下に示される基
等が挙げられる。
等が挙げられる。
「芳香族複素環アルキルオキシ」とは、1以上の上記「芳香族複素環式基」で置換されているアルキルオキシを意味する。また、「芳香族複素環アルキルオキシ」は、アルキル部分が上記「芳香族炭素環式基」及び/又は「非芳香族炭素環式基」で置換されている「芳香族複素環アルキルオキシ」も包含する。例えば、ピリジルメチルオキシ、フラニルメチルオキシ、イミダゾリルメチルオキシ、インドリルメチルオキシ、ベンゾチオフェニルメチルオキシ、オキサゾリルメチルオキシ、イソキサゾリルメチルオキシ、チアゾリルメチルオキシ、イソチアゾリルメチルオキシ、ピラゾリルメチルオキシ、イソピラゾリルメチルオキシ、ピロリジニルメチルオキシ、ベンズオキサゾリルメチルオキシ、以下に示される基
等が挙げられる。
等が挙げられる。
「非芳香族複素環アルキルオキシ」とは、1以上の上記「非芳香族複素環式基」で置換されているアルキルオキシを意味する。また、「非芳香族複素環アルキルオキシ」は、アルキル部分が上記「芳香族炭素環式基」、「非芳香族炭素環式基」及び/又は「芳香族複素環式基」で置換されている「非芳香族複素環アルキルオキシ」も包含する。例えば、テトラヒドロピラニルメチルオキシ、モルホリニルエチルオキシ、ピペリジニルメチルオキシ、ピペラジニルメチルオキシ、以下に示される基
等が挙げられる。
等が挙げられる。
「芳香族炭素環アルキルオキシカルボニル」とは、1以上の上記「芳香族炭素環式基」で置換されているアルキルオキシカルボニルを意味する。例えば、ベンジルオキシカルボニル、フェネチルオキシカルボニル、フェニルプロピルオキシカルボニル、ベンズヒドリルオキシカルボニル、トリチルオキシカルボニル、ナフチルメチルオキシカルボニル、以下に示される基
等が挙げられる。
等が挙げられる。
「非芳香族炭素環アルキルオキシカルボニル」とは、1以上の上記「非芳香族炭素環式基」で置換されているアルキルオキシカルボニルを意味する。また、「非芳香族炭素環アルキルオキシカルボニル」は、アルキル部分が上記「芳香族炭素環式基」で置換されている「非芳香族炭素環アルキルオキシカルボニル」も包含する。例えば、シクロプロピルメチルオキシカルボニル、シクロブチルメチルオキシカルボニル、シクロペンチルメチルオキシカルボニル、シクロへキシルメチルオキシカルボニル、以下に示される基
等が挙げられる。
等が挙げられる。
「芳香族複素環アルキルオキシカルボニル」とは、1以上の上記「芳香族複素環式基」で置換されているアルキルオキシカルボニルを意味する。また、「芳香族複素環アルキルオキシカルボニル」は、アルキル部分が上記「芳香族炭素環式基」及び/又は「非芳香族炭素環式基」で置換されている「芳香族複素環アルキルオキシカルボニル」も包含する。例えば、ピリジルメチルオキシカルボニル、フラニルメチルオキシカルボニル、イミダゾリルメチルオキシカルボニル、インドリルメチルオキシカルボニル、ベンゾチオフェニルメチルオキシカルボニル、オキサゾリルメチルオキシカルボニル、イソキサゾリルメチルオキシカルボニル、チアゾリルメチルオキシカルボニル、イソチアゾリルメチルオキシカルボニル、ピラゾリルメチルオキシカルボニル、イソピラゾリルメチルオキシカルボニル、ピロリジニルメチルオキシカルボニル、ベンズオキサゾリルメチルオキシカルボニル、以下に示される基
等が挙げられる。
等が挙げられる。
「非芳香族複素環アルキルオキシカルボニル」とは、1以上の上記「非芳香族複素環式基」で置換されているアルキルオキシカルボニルを意味する。また、「非芳香族複素環アルキルオキシカルボニル」は、アルキル部分が上記「芳香族炭素環式基」、「非芳香族炭素環式基」及び/又は「芳香族複素環式基」で置換されている「非芳香族複素環アルキルオキシカルボニル」も包含する。例えば、テトラヒドロピラニルメチルオキシ、モルホリニルエチルオキシ、ピペリジニルメチルオキシ、ピペラジニルメチルオキシ、以下に示される基
等が挙げられる。
等が挙げられる。
「芳香族炭素環アルキルオキシアルキル」とは、1以上の上記「芳香族炭素環式基」で置換されているアルキルオキシアルキルを意味する。例えば、ベンジルオキシメチル、フェネチルオキシメチル、フェニルプロピルオキシメチル、ベンズヒドリルオキシメチル、トリチルオキシメチル、ナフチルメチルオキシメチル、以下に示される基
等が挙げられる。
等が挙げられる。
「非芳香族炭素環アルキルオキシアルキル」とは、1以上の上記「非芳香族炭素環式基」で置換されているアルキルオキシアルキルを意味する。また、「非芳香族炭素環アルキルオキシアルキル」は、非芳香族炭素環が結合しているアルキル部分が上記「芳香族炭素環式基」で置換されている「非芳香族炭素環アルキルオキシアルキル」も包含する。例えば、シクロプロピルメチルオキシメチル、シクロブチルメチルオキシメチル、シクロペンチルメチルオキシメチル、シクロへキシルメチルオキシメチル、以下に示される基
等が挙げられる。
等が挙げられる。
「芳香族複素環アルキルオキシアルキル」とは、1以上の上記「芳香族複素環式基」で置換されているアルキルオキシアルキルを意味する。また、「芳香族複素環アルキルオキシアルキル」は、芳香族複素環が結合しているアルキル部分が上記「芳香族炭素環式基」及び/又は「非芳香族炭素環式基」で置換されている「芳香族複素環アルキルオキシアルキル」も包含する。例えば、ピリジルメチルオキシメチル、フラニルメチルオキシメチル、イミダゾリルメチルオキシメチル、インドリルメチルオキシメチル、ベンゾチオフェニルメチルオキシメチル、オキサゾリルメチルオキシメチル、イソキサゾリルメチルオキシメチル、チアゾリルメチルオキシメチル、イソチアゾリルメチルオキシメチル、ピラゾリルメチルオキシメチル、イソピラゾリルメチルオキシメチル、ピロリジニルメチルオキシメチル、ベンズオキサゾリルメチルオキシメチル、以下に示される基
等が挙げられる。
等が挙げられる。
「非芳香族複素環アルキルオキシアルキル」とは、1以上の上記「非芳香族複素環式基」で置換されているアルキルオキシアルキルを意味する。また、「非芳香族複素環アルキルオキシ」は、非芳香族複素環が結合しているアルキル部分が上記「芳香族炭素環式基」、「非芳香族炭素環式基」及び/又は「芳香族複素環式基」で置換されている「非芳香族複素環アルキルオキシアルキル」も包含する。例えば、テトラヒドロピラニルメチルオキシメチル、モルホリニルエチルオキシメチル、ピペリジニルメチルオキシメチル、ピペラジニルメチルオキシメチル、以下に示される基
等が挙げられる。
等が挙げられる。
「芳香族炭素環アルキルアミノ」とは、上記「芳香族炭素環アルキル」がアミノ基の窒素原子と結合している水素原子1個又は2個と置き換わった基を意味する。例えば、ベンジルアミノ、フェネチルアミノ、フェニルプロピルアミノ、ベンズヒドリルアミノ、トリチルアミノ、ナフチルメチルアミノ、ジベンジルアミノ等が挙げられる。
「非芳香族炭素環アルキルアミノ」とは、上記「非芳香族炭素環アルキル」がアミノ基の窒素原子と結合している水素原子1個又は2個と置き換わった基を意味する。例えば、シクロプロピルメチルアミノ、シクロブチルメチルアミノ、シクロペンチルメチルアミノ、シクロへキシルメチルアミノ等が挙げられる。
「芳香族複素環アルキルアミノ」とは、上記「芳香族複素環アルキル」がアミノ基の窒素原子と結合している水素原子1個又は2個と置き換わった基を意味する。例えば、ピリジルメチルアミノ、フラニルメチルアミノ、イミダゾリルメチルアミノ、インドリルメチルアミノ、ベンゾチオフェニルメチルアミノ、オキサゾリルメチルアミノ、イソキサゾリルメチルアミノ、チアゾリルメチルアミノ、イソチアゾリルメチルアミノ、ピラゾリルメチルアミノ、イソピラゾリルメチルアミノ、ピロリジニルメチルアミノ、ベンズオキサゾリルメチルアミノ等が挙げられる。
「非芳香族複素環アルキルアミノ」とは、上記「非芳香族複素環アルキル」がアミノ基の窒素原子と結合している水素原子1個又は2個と置き換わった基を意味する。例えば、テトラヒドロピラニルメチルアミノ、モルホリニルエチルアミノ、ピペリジニルメチルアミノ、ピペラジニルメチルアミノ等が挙げられる。
「芳香族炭素環オキシ」、「芳香族炭素環カルボニル」、「芳香族炭素環オキシカルボニル」、「芳香族炭素環スルファニル」、及び「芳香族炭素環スルホニル」の「芳香族炭素環」部分も、上記「芳香族炭素環式基」と同様である。
「芳香族炭素環オキシ」とは、「芳香族炭素環」が酸素原子に結合した基を意味する。例えば、フェニルオキシ、ナフチルオキシ等が挙げられる。
「芳香族炭素環カルボニル」とは、「芳香族炭素環」がカルボニル基に結合した基を意味する。例えば、フェニルカルボニル、ナフチルカルボニル等が挙げられる。
「芳香族炭素環オキシカルボニル」とは、上記「芳香族炭素環オキシ」がカルボニル基に結合した基を意味する。例えば、フェニルオキシカルボニル、ナフチルオキシカルボニル等が挙げられる。
「芳香族炭素環スルファニル」とは、「芳香族炭素環」がスルファニル基の硫黄原子と結合している水素原子と置き換わった基を意味する。例えば、フェニルスルファニル、ナフチルスルファニル等が挙げられる。
「芳香族炭素環スルホニル」とは、「芳香族炭素環」がスルホニル基に結合した基を意味する。例えば、フェニルスルホニル、ナフチルスルホニル等が挙げられる。
「芳香族炭素環オキシ」とは、「芳香族炭素環」が酸素原子に結合した基を意味する。例えば、フェニルオキシ、ナフチルオキシ等が挙げられる。
「芳香族炭素環カルボニル」とは、「芳香族炭素環」がカルボニル基に結合した基を意味する。例えば、フェニルカルボニル、ナフチルカルボニル等が挙げられる。
「芳香族炭素環オキシカルボニル」とは、上記「芳香族炭素環オキシ」がカルボニル基に結合した基を意味する。例えば、フェニルオキシカルボニル、ナフチルオキシカルボニル等が挙げられる。
「芳香族炭素環スルファニル」とは、「芳香族炭素環」がスルファニル基の硫黄原子と結合している水素原子と置き換わった基を意味する。例えば、フェニルスルファニル、ナフチルスルファニル等が挙げられる。
「芳香族炭素環スルホニル」とは、「芳香族炭素環」がスルホニル基に結合した基を意味する。例えば、フェニルスルホニル、ナフチルスルホニル等が挙げられる。
「非芳香族炭素環オキシ」、「非芳香族炭素環カルボニル」、「非芳香族炭素環オキシカルボニル」、「非芳香族炭素環スルファニル」、及び「非芳香族炭素環スルホニル」の「非芳香族炭素環」部分も、上記「非芳香族炭素環式基」と同様である。
「非芳香族炭素環オキシ」とは、「非芳香族炭素環」が酸素原子に結合した基を意味する。例えば、シクロプロピルオキシ、シクロヘキシルオキシ、シクロへキセニルオキシ等が挙げられる。
「非芳香族炭素環カルボニル」とは、「非芳香族炭素環」がカルボニル基に結合した基を意味する。例えば、シクロプロピルカルボニル、シクロヘキシルカルボニル、シクロへキセニルカルボニル等が挙げられる。
「非芳香族炭素環オキシカルボニル」とは、上記「非芳香族炭素環オキシ」がカルボニル基に結合した基を意味する。例えば、シクロプロピルオキシカルボニル、シクロヘキシルオキシカルボニル、シクロへキセニルオキシカルボニル等が挙げられる。
「非芳香族炭素環スルファニル」とは、「非芳香族炭素環」がスルファニル基の硫黄原子と結合している水素原子と置き換わった基を意味する。例えば、シクロプロピルスルファニル、シクロヘキシルスルファニル、シクロヘキセニルスルファニル等が挙げられる。
「非芳香族炭素環スルホニル」とは、「非芳香族炭素環」がスルホニル基に結合した基を意味する。例えば、シクロプロピルスルホニル、シクロヘキシルスルホニル、シクロヘキセニルスルホニル等が挙げられる。
「非芳香族炭素環オキシ」とは、「非芳香族炭素環」が酸素原子に結合した基を意味する。例えば、シクロプロピルオキシ、シクロヘキシルオキシ、シクロへキセニルオキシ等が挙げられる。
「非芳香族炭素環カルボニル」とは、「非芳香族炭素環」がカルボニル基に結合した基を意味する。例えば、シクロプロピルカルボニル、シクロヘキシルカルボニル、シクロへキセニルカルボニル等が挙げられる。
「非芳香族炭素環オキシカルボニル」とは、上記「非芳香族炭素環オキシ」がカルボニル基に結合した基を意味する。例えば、シクロプロピルオキシカルボニル、シクロヘキシルオキシカルボニル、シクロへキセニルオキシカルボニル等が挙げられる。
「非芳香族炭素環スルファニル」とは、「非芳香族炭素環」がスルファニル基の硫黄原子と結合している水素原子と置き換わった基を意味する。例えば、シクロプロピルスルファニル、シクロヘキシルスルファニル、シクロヘキセニルスルファニル等が挙げられる。
「非芳香族炭素環スルホニル」とは、「非芳香族炭素環」がスルホニル基に結合した基を意味する。例えば、シクロプロピルスルホニル、シクロヘキシルスルホニル、シクロヘキセニルスルホニル等が挙げられる。
「芳香族複素環オキシ」、「芳香族複素環カルボニル」、「芳香族複素環オキシカルボニル」、「芳香族複素環スルファニル」、及び「芳香族複素環スルホニル」の「芳香族複素環」部分も、上記「芳香族複素環式基」と同様である。
「芳香族複素環オキシ」とは、「芳香族複素環」が酸素原子に結合した基を意味する。例えば、ピリジルオキシ、オキサゾリルオキシ等が挙げられる。
「芳香族複素環カルボニル」とは、「芳香族複素環」がカルボニル基に結合した基を意味する。例えば、ピリジルカルボニル、オキサゾリルカルボニル等が挙げられる。
「芳香族複素環オキシカルボニル」とは、上記「芳香族複素環オキシ」がカルボニル基に結合した基を意味する。例えば、ピリジルオキシカルボニル、オキサゾリルオキシカルボニル等が挙げられる。
「芳香族複素環スルファニル」とは、「芳香族複素環」がスルファニル基の硫黄原子と結合している水素原子と置き換わった基を意味する。例えば、ピリジルスルファニル、オキサゾリルスルファニル等が挙げられる。
「芳香族複素環スルホニル」とは、「芳香族複素環」がスルホニル基に結合した基を意味する。例えば、ピリジルスルホニル、オキサゾリルスルホニル等が挙げられる。
「芳香族複素環オキシ」とは、「芳香族複素環」が酸素原子に結合した基を意味する。例えば、ピリジルオキシ、オキサゾリルオキシ等が挙げられる。
「芳香族複素環カルボニル」とは、「芳香族複素環」がカルボニル基に結合した基を意味する。例えば、ピリジルカルボニル、オキサゾリルカルボニル等が挙げられる。
「芳香族複素環オキシカルボニル」とは、上記「芳香族複素環オキシ」がカルボニル基に結合した基を意味する。例えば、ピリジルオキシカルボニル、オキサゾリルオキシカルボニル等が挙げられる。
「芳香族複素環スルファニル」とは、「芳香族複素環」がスルファニル基の硫黄原子と結合している水素原子と置き換わった基を意味する。例えば、ピリジルスルファニル、オキサゾリルスルファニル等が挙げられる。
「芳香族複素環スルホニル」とは、「芳香族複素環」がスルホニル基に結合した基を意味する。例えば、ピリジルスルホニル、オキサゾリルスルホニル等が挙げられる。
「非芳香族複素環オキシ」、「非芳香族複素環カルボニル」、「非芳香族複素環オキシカルボニル」、「非芳香族複素環スルファニル」、及び「非芳香族複素環スルホニル」の「非芳香族複素環」部分も、上記「非芳香族複素環式基」と同様である。
「非芳香族複素環オキシ」とは、「非芳香族複素環」が酸素原子に結合した基を意味する。例えば、ピペリジニルオキシ、テトラヒドロフリルオキシ等が挙げられる。
「非芳香族複素環カルボニル」とは、「非芳香族複素環」がカルボニル基に結合した基を意味する。例えば、ピペリジニルカルボニル、テトラヒドロフリルカルボニル等が挙げられる。
「非芳香族複素環オキシカルボニル」とは、上記「非芳香族複素環オキシ」がカルボニル基に結合した基を意味する。例えば、ピペリジニルオキシカルボニル、テトラヒドロフリルオキシカルボニル等が挙げられる。
「非芳香族複素環スルファニル」とは、「非芳香族複素環」がスルファニル基の硫黄原子と結合している水素原子と置き換わった基を意味する。例えば、ピペリジニルスルファニル、テトラヒドロフリルスルファニル等が挙げられる。
「非芳香族複素環スルホニル」とは、「非芳香族複素環」がスルホニル基に結合した基を意味する。例えば、ピペリジニルスルホニル、テトラヒドロフリルスルホニル等が挙げられる。
「非芳香族複素環オキシ」とは、「非芳香族複素環」が酸素原子に結合した基を意味する。例えば、ピペリジニルオキシ、テトラヒドロフリルオキシ等が挙げられる。
「非芳香族複素環カルボニル」とは、「非芳香族複素環」がカルボニル基に結合した基を意味する。例えば、ピペリジニルカルボニル、テトラヒドロフリルカルボニル等が挙げられる。
「非芳香族複素環オキシカルボニル」とは、上記「非芳香族複素環オキシ」がカルボニル基に結合した基を意味する。例えば、ピペリジニルオキシカルボニル、テトラヒドロフリルオキシカルボニル等が挙げられる。
「非芳香族複素環スルファニル」とは、「非芳香族複素環」がスルファニル基の硫黄原子と結合している水素原子と置き換わった基を意味する。例えば、ピペリジニルスルファニル、テトラヒドロフリルスルファニル等が挙げられる。
「非芳香族複素環スルホニル」とは、「非芳香族複素環」がスルホニル基に結合した基を意味する。例えば、ピペリジニルスルホニル、テトラヒドロフリルスルホニル等が挙げられる。
「置換若しくは非置換のアルキル」、「置換若しくは非置換のアルケニル」、「置換若しくは非置換のアルキニル」、「置換若しくは非置換のアルキレン」、「置換又は非置換のメチレン」、「置換若しくは非置換のアルキルオキシ」、「置換若しくは非置換のアルケニルオキシ」、「置換若しくは非置換のアルキニルオキシ」、「置換若しくは非置換のアルキルカルボニル」、「置換若しくは非置換のアルケニルカルボニル」、「置換若しくは非置換のアルキニルカルボニル」、「置換若しくは非置換のモノアルキルアミノ」、「置換若しくは非置換のジアルキルアミノ」、「置換若しくは非置換のアルキルスルホニル」、「置換若しくは非置換のアルケニルスルホニル」、「置換若しくは非置換のアルキニルスルホニル」、「置換若しくは非置換のモノアルキルカルボニルアミノ」、「置換若しくは非置換のジアルキルカルボニルアミノ」、「置換若しくは非置換のモノアルキルスルホニルアミノ」、「置換若しくは非置換のジアルキルスルホニルアミノ」、「置換若しくは非置換のアルキルイミノ」、「置換若しくは非置換のアルケニルイミノ」、「置換若しくは非置換のアルキニルイミノ」、「置換若しくは非置換のアルキルカルボニルイミノ」、「置換若しくは非置換のアルケニルカルボニルイミノ」、「置換若しくは非置換のアルキニルカルボニルイミノ」、「置換若しくは非置換のアルキルオキシイミノ」、「置換若しくは非置換のアルケニルオキシイミノ」、「置換若しくは非置換のアルキニルオキシイミノ」、「置換若しくは非置換のアルキルカルボニルオキシ」、「置換若しくは非置換のアルケニルカルボニルオキシ」、「置換若しくは非置換のアルキニルカルボニルオキシ」、「置換若しくは非置換のアルキルオキシカルボニル」、「置換若しくは非置換のアルケニルオキシカルボニル」、「置換若しくは非置換のアルキニルオキシカルボニル」、「置換若しくは非置換のアルキルスルファニル」、「置換若しくは非置換のアルケニルスルファニル」、「置換若しくは非置換のアルキニルスルファニル」、「置換若しくは非置換のアルキルスルフィニル」、「置換若しくは非置換のアルケニルスルフィニル」、「置換若しくは非置換のアルキニルスルフィニル」、「置換若しくは非置換のモノアルキルカルバモイル」、「置換若しくは非置換のジアルキルカルバモイル」、「置換若しくは非置換のモノアルキルスルファモイル」、及び「置換若しくは非置換のジアルキルスルファモイル」の置換基としては、次の置換基が挙げられる。任意の位置の炭素原子が次の置換基から選択される1以上の基と結合していてもよい。
置換基:ハロゲン、ヒドロキシ、カルボキシ、アミノ、イミノ、ヒドロキシアミノ、ヒドロキシイミノ、ホルミル、ホルミルオキシ、カルバモイル、スルファモイル、スルファニル、スルフィノ、スルホ、チオホルミル、チオカルボキシ、ジチオカルボキシ、チオカルバモイル、シアノ、ニトロ、ニトロソ、アジド、ヒドラジノ、ウレイド、アミジノ、グアニジノ、トリアルキルシリル、アルキルオキシ、アルケニルオキシ、アルキニルオキシ、ハロアルキルオキシ、アルキルカルボニル、アルケニルカルボニル、アルキニルカルボニル、モノアルキルアミノ、ジアルキルアミノ、アルキルスルホニル、アルケニルスルホニル、アルキニルスルホニル、モノアルキルカルボニルアミノ、ジアルキルカルボニルアミノ、モノアルキルスルホニルアミノ、ジアルキルスルホニルアミノ、アルキルイミノ、アルケニルイミノ、アルキニルイミノ、アルキルカルボニルイミノ、アルケニルカルボニルイミノ、アルキニルカルボニルイミノ、アルキルオキシイミノ、アルケニルオキシイミノ、アルキニルオキシイミノ、アルキルカルボニルオキシ、アルケニルカルボニルオキシ、アルキニルカルボニルオキシ、アルキルオキシカルボニル、アルケニルオキシカルボニル、アルキニルオキシカルボニル、アルキルスルファニル、アルケニルスルファニル、アルキニルスルファニル、アルキルスルフィニル、アルケニルスルフィニル、アルキニルスルフィニル、モノアルキルカルバモイル、ジアルキルカルバモイル、モノアルキルスルファモイル、ジアルキルスルファモイル、芳香族炭素環式基、非芳香族炭素環式基、芳香族複素環式基、非芳香族複素環式基、芳香族炭素環オキシ、非芳香族炭素環オキシ、芳香族複素環オキシ、非芳香族複素環オキシ、芳香族炭素環カルボニル、非芳香族炭素環カルボニル、芳香族複素環カルボニル、非芳香族複素環カルボニル、芳香族炭素環オキシカルボニル、非芳香族炭素環オキシカルボニル、芳香族複素環オキシカルボニル、非芳香族複素環オキシカルボニル、芳香族炭素環アルキルオキシ、非芳香族炭素環アルキルオキシ、芳香族複素環アルキルオキシ、非芳香族複素環アルキルオキシ、芳香族炭素環アルキルオキシカルボニル、非芳香族炭素環アルキルオキシカルボニル、芳香族複素環アルキルオキシカルボニル、非芳香族複素環アルキルオキシカルボニル、芳香族炭素環アルキルアミノ、非芳香族炭素環アルキルアミノ、芳香族複素環アルキルアミノ、非芳香族複素環アルキルアミノ、芳香族炭素環スルファニル、非芳香族炭素環スルファニル、芳香族複素環スルファニル、非芳香族複素環スルファニル、非芳香族炭素環スルホニル、芳香族炭素環スルホニル、芳香族複素環スルホニル、及び非芳香族複素環スルホニル。
置換基:ハロゲン、ヒドロキシ、カルボキシ、アミノ、イミノ、ヒドロキシアミノ、ヒドロキシイミノ、ホルミル、ホルミルオキシ、カルバモイル、スルファモイル、スルファニル、スルフィノ、スルホ、チオホルミル、チオカルボキシ、ジチオカルボキシ、チオカルバモイル、シアノ、ニトロ、ニトロソ、アジド、ヒドラジノ、ウレイド、アミジノ、グアニジノ、トリアルキルシリル、アルキルオキシ、アルケニルオキシ、アルキニルオキシ、ハロアルキルオキシ、アルキルカルボニル、アルケニルカルボニル、アルキニルカルボニル、モノアルキルアミノ、ジアルキルアミノ、アルキルスルホニル、アルケニルスルホニル、アルキニルスルホニル、モノアルキルカルボニルアミノ、ジアルキルカルボニルアミノ、モノアルキルスルホニルアミノ、ジアルキルスルホニルアミノ、アルキルイミノ、アルケニルイミノ、アルキニルイミノ、アルキルカルボニルイミノ、アルケニルカルボニルイミノ、アルキニルカルボニルイミノ、アルキルオキシイミノ、アルケニルオキシイミノ、アルキニルオキシイミノ、アルキルカルボニルオキシ、アルケニルカルボニルオキシ、アルキニルカルボニルオキシ、アルキルオキシカルボニル、アルケニルオキシカルボニル、アルキニルオキシカルボニル、アルキルスルファニル、アルケニルスルファニル、アルキニルスルファニル、アルキルスルフィニル、アルケニルスルフィニル、アルキニルスルフィニル、モノアルキルカルバモイル、ジアルキルカルバモイル、モノアルキルスルファモイル、ジアルキルスルファモイル、芳香族炭素環式基、非芳香族炭素環式基、芳香族複素環式基、非芳香族複素環式基、芳香族炭素環オキシ、非芳香族炭素環オキシ、芳香族複素環オキシ、非芳香族複素環オキシ、芳香族炭素環カルボニル、非芳香族炭素環カルボニル、芳香族複素環カルボニル、非芳香族複素環カルボニル、芳香族炭素環オキシカルボニル、非芳香族炭素環オキシカルボニル、芳香族複素環オキシカルボニル、非芳香族複素環オキシカルボニル、芳香族炭素環アルキルオキシ、非芳香族炭素環アルキルオキシ、芳香族複素環アルキルオキシ、非芳香族複素環アルキルオキシ、芳香族炭素環アルキルオキシカルボニル、非芳香族炭素環アルキルオキシカルボニル、芳香族複素環アルキルオキシカルボニル、非芳香族複素環アルキルオキシカルボニル、芳香族炭素環アルキルアミノ、非芳香族炭素環アルキルアミノ、芳香族複素環アルキルアミノ、非芳香族複素環アルキルアミノ、芳香族炭素環スルファニル、非芳香族炭素環スルファニル、芳香族複素環スルファニル、非芳香族複素環スルファニル、非芳香族炭素環スルホニル、芳香族炭素環スルホニル、芳香族複素環スルホニル、及び非芳香族複素環スルホニル。
「置換若しくは非置換の芳香族炭素環式基」、「置換若しくは非置換の非芳香族炭素環式基」、「置換若しくは非置換の芳香族複素環式基」、及び「置換若しくは非置換の非芳香族複素環式基」、
「置換若しくは非置換の芳香族炭素環オキシ」、「置換若しくは非置換の非芳香族炭素環オキシ」、「置換若しくは非置換の芳香族複素環オキシ」、及び「置換若しくは非置換の非芳香族複素環オキシ」、
「置換若しくは非置換の芳香族炭素環カルボニル」、「置換若しくは非置換の非芳香族炭素環カルボニル」、「置換若しくは非置換の芳香族複素環カルボニル」、及び「置換若しくは非置換の非芳香族複素環カルボニル」、
「置換若しくは非置換の芳香族炭素環オキシカルボニル」、「置換若しくは非置換の非芳香族炭素環オキシカルボニル」、「置換若しくは非置換の芳香族複素環オキシカルボニル」、及び「置換若しくは非置換の非芳香族複素環オキシカルボニル」、
「置換若しくは非置換の芳香族炭素環スルファニル」、「置換若しくは非置換の非芳香族炭素環スルファニル」、「置換若しくは非置換の芳香族複素環スルファニル」、及び「置換若しくは非置換の非芳香族複素環スルファニル」、ならびに
「置換若しくは非置換の芳香族炭素環スルホニル」、「置換若しくは非置換の非芳香族炭素環スルホニル」、「置換若しくは非置換の芳香族複素環スルホニル」、及び「置換若しくは非置換の非芳香族複素環スルホニル」の「芳香族炭素環」、「非芳香族炭素環」、「芳香族複素環」及び
「非芳香族複素環」の環上の置換基及び「置換若しくは非置換の含窒素環」の環上の置換基としては、次の置換基が挙げられる。環上の任意の位置の原子が次の置換基から選択される1以上の基と結合していてもよい。
置換基:ハロゲン、ヒドロキシ、カルボキシ、アミノ、イミノ、ヒドロキシアミノ、ヒドロキシイミノ、ホルミル、ホルミルオキシ、カルバモイル、スルファモイル、スルファニル、スルフィノ、スルホ、チオホルミル、チオカルボキシ、ジチオカルボキシ、チオカルバモイル、シアノ、ニトロ、ニトロソ、アジド、ヒドラジノ、ウレイド、アミジノ、グアニジノ、トリアルキルシリル、アルキル、アルケニル、アルキニル、ハロアルキル、アルキルオキシ、アルケニルオキシ、アルキニルオキシ、ハロアルキルオキシ、アルキルオキシアルキル、アルキルオキシアルキルオキシ、アルキルカルボニル、アルケニルカルボニル、アルキニルカルボニル、モノアルキルアミノ、ジアルキルアミノ、アルキルスルホニル、アルケニルスルホニル、アルキニルスルホニル、モノアルキルカルボニルアミノ、ジアルキルカルボニルアミノ、モノアルキルスルホニルアミノ、ジアルキルスルホニルアミノ、アルキルイミノ、アルケニルイミノ、アルキニルイミノ、アルキルカルボニルイミノ、アルケニルカルボニルイミノ、アルキニルカルボニルイミノ、アルキルオキシイミノ、アルケニルオキシイミノ、アルキニルオキシイミノ、アルキルカルボニルオキシ、アルケニルカルボニルオキシ、アルキニルカルボニルオキシ、アルキルオキシカルボニル、アルケニルオキシカルボニル、アルキニルオキシカルボニル、アルキルスルファニル、アルケニルスルファニル、アルキニルスルファニル、アルキルスルフィニル、アルケニルスルフィニル、アルキニルスルフィニル、モノアルキルカルバモイル、ジアルキルカルバモイル、モノアルキルスルファモイル、ジアルキルスルファモイル、芳香族炭素環式基、非芳香族炭素環式基、芳香族複素環式基、非芳香族複素環式基、芳香族炭素環オキシ、非芳香族炭素環オキシ、芳香族複素環オキシ、非芳香族複素環オキシ、芳香族炭素環カルボニル、非芳香族炭素環カルボニル、芳香族複素環カルボニル、非芳香族複素環カルボニル、芳香族炭素環オキシカルボニル、非芳香族炭素環オキシカルボニル、芳香族複素環オキシカルボニル、非芳香族複素環オキシカルボニル、芳香族炭素環アルキル、非芳香族炭素環アルキル、芳香族複素環アルキル、非芳香族複素環アルキル、芳香族炭素環アルキルオキシ、非芳香族炭素環アルキルオキシ、芳香族複素環アルキルオキシ、非芳香族複素環アルキルオキシ、芳香族炭素環アルキルオキシカルボニル、非芳香族炭素環アルキルオキシカルボニル、芳香族複素環アルキルオキシカルボニル、非芳香族複素環アルキルオキシカルボニル、芳香族炭素環アルキルオキシアルキル、非芳香族炭素環アルキルオキシアルキル、芳香族複素環アルキルオキシアルキル、非芳香族複素環アルキルオキシアルキル、芳香族炭素環アルキルアミノ、非芳香族炭素環アルキルアミノ、芳香族複素環アルキルアミノ、非芳香族複素環アルキルアミノ、芳香族炭素環スルファニル、非芳香族炭素環スルファニル、芳香族複素環スルファニル、非芳香族複素環スルファニル、非芳香族炭素環スルホニル、芳香族炭素環スルホニル、芳香族複素環スルホニル、及び非芳香族複素環スルホニル。
「置換若しくは非置換の芳香族炭素環オキシ」、「置換若しくは非置換の非芳香族炭素環オキシ」、「置換若しくは非置換の芳香族複素環オキシ」、及び「置換若しくは非置換の非芳香族複素環オキシ」、
「置換若しくは非置換の芳香族炭素環カルボニル」、「置換若しくは非置換の非芳香族炭素環カルボニル」、「置換若しくは非置換の芳香族複素環カルボニル」、及び「置換若しくは非置換の非芳香族複素環カルボニル」、
「置換若しくは非置換の芳香族炭素環オキシカルボニル」、「置換若しくは非置換の非芳香族炭素環オキシカルボニル」、「置換若しくは非置換の芳香族複素環オキシカルボニル」、及び「置換若しくは非置換の非芳香族複素環オキシカルボニル」、
「置換若しくは非置換の芳香族炭素環スルファニル」、「置換若しくは非置換の非芳香族炭素環スルファニル」、「置換若しくは非置換の芳香族複素環スルファニル」、及び「置換若しくは非置換の非芳香族複素環スルファニル」、ならびに
「置換若しくは非置換の芳香族炭素環スルホニル」、「置換若しくは非置換の非芳香族炭素環スルホニル」、「置換若しくは非置換の芳香族複素環スルホニル」、及び「置換若しくは非置換の非芳香族複素環スルホニル」の「芳香族炭素環」、「非芳香族炭素環」、「芳香族複素環」及び
「非芳香族複素環」の環上の置換基及び「置換若しくは非置換の含窒素環」の環上の置換基としては、次の置換基が挙げられる。環上の任意の位置の原子が次の置換基から選択される1以上の基と結合していてもよい。
置換基:ハロゲン、ヒドロキシ、カルボキシ、アミノ、イミノ、ヒドロキシアミノ、ヒドロキシイミノ、ホルミル、ホルミルオキシ、カルバモイル、スルファモイル、スルファニル、スルフィノ、スルホ、チオホルミル、チオカルボキシ、ジチオカルボキシ、チオカルバモイル、シアノ、ニトロ、ニトロソ、アジド、ヒドラジノ、ウレイド、アミジノ、グアニジノ、トリアルキルシリル、アルキル、アルケニル、アルキニル、ハロアルキル、アルキルオキシ、アルケニルオキシ、アルキニルオキシ、ハロアルキルオキシ、アルキルオキシアルキル、アルキルオキシアルキルオキシ、アルキルカルボニル、アルケニルカルボニル、アルキニルカルボニル、モノアルキルアミノ、ジアルキルアミノ、アルキルスルホニル、アルケニルスルホニル、アルキニルスルホニル、モノアルキルカルボニルアミノ、ジアルキルカルボニルアミノ、モノアルキルスルホニルアミノ、ジアルキルスルホニルアミノ、アルキルイミノ、アルケニルイミノ、アルキニルイミノ、アルキルカルボニルイミノ、アルケニルカルボニルイミノ、アルキニルカルボニルイミノ、アルキルオキシイミノ、アルケニルオキシイミノ、アルキニルオキシイミノ、アルキルカルボニルオキシ、アルケニルカルボニルオキシ、アルキニルカルボニルオキシ、アルキルオキシカルボニル、アルケニルオキシカルボニル、アルキニルオキシカルボニル、アルキルスルファニル、アルケニルスルファニル、アルキニルスルファニル、アルキルスルフィニル、アルケニルスルフィニル、アルキニルスルフィニル、モノアルキルカルバモイル、ジアルキルカルバモイル、モノアルキルスルファモイル、ジアルキルスルファモイル、芳香族炭素環式基、非芳香族炭素環式基、芳香族複素環式基、非芳香族複素環式基、芳香族炭素環オキシ、非芳香族炭素環オキシ、芳香族複素環オキシ、非芳香族複素環オキシ、芳香族炭素環カルボニル、非芳香族炭素環カルボニル、芳香族複素環カルボニル、非芳香族複素環カルボニル、芳香族炭素環オキシカルボニル、非芳香族炭素環オキシカルボニル、芳香族複素環オキシカルボニル、非芳香族複素環オキシカルボニル、芳香族炭素環アルキル、非芳香族炭素環アルキル、芳香族複素環アルキル、非芳香族複素環アルキル、芳香族炭素環アルキルオキシ、非芳香族炭素環アルキルオキシ、芳香族複素環アルキルオキシ、非芳香族複素環アルキルオキシ、芳香族炭素環アルキルオキシカルボニル、非芳香族炭素環アルキルオキシカルボニル、芳香族複素環アルキルオキシカルボニル、非芳香族複素環アルキルオキシカルボニル、芳香族炭素環アルキルオキシアルキル、非芳香族炭素環アルキルオキシアルキル、芳香族複素環アルキルオキシアルキル、非芳香族複素環アルキルオキシアルキル、芳香族炭素環アルキルアミノ、非芳香族炭素環アルキルアミノ、芳香族複素環アルキルアミノ、非芳香族複素環アルキルアミノ、芳香族炭素環スルファニル、非芳香族炭素環スルファニル、芳香族複素環スルファニル、非芳香族複素環スルファニル、非芳香族炭素環スルホニル、芳香族炭素環スルホニル、芳香族複素環スルホニル、及び非芳香族複素環スルホニル。
また、「置換若しくは非置換の非芳香族炭素環式基」及び「置換若しくは非置換の非芳香族複素環式基」は「オキソ」で置換されていてもよい。この場合、以下のように炭素原子上の2個の水素原子が置換されている基を意味する。
上記、「置換若しくは非置換の非芳香族炭素環オキシ」、「置換若しくは非置換の非芳香族複素環オキシ」、「置換若しくは非置換の非芳香族炭素環カルボニル」、「置換若しくは非置換の非芳香族複素環カルボニル」、「置換若しくは非置換の非芳香族炭素環オキシカルボニル」、「置換若しくは非置換の非芳香族複素環オキシカルボニル」、「置換若しくは非置換の非芳香族炭素環スルファニル」、「置換若しくは非置換の非芳香族複素環スルファニル」、「置換若しくは非置換の非芳香族炭素環スルホニル」、及び「置換若しくは非置換の非芳香族複素環スルホニル」の非芳香族炭素環、及び非芳香族複素環部分も上記と同様に「オキソ」で置換されていてもよい。
本発明は、本発明の「二本鎖オリゴヌクレオチド」を含有する医薬組成物も包含する。本発明の医薬組成物の投与方法及び製剤は、当該分野で公知の投与方法及び製剤であれば、いずれも利用可能である。アンチセンスオリゴヌクレオチドの投与方法及び製剤は、例えば、以下の文献にも開示されている。
国際公開第2004/016749号、国際公開第2005/083124号、国際公開2007/143315号、国際公開第2009/071680号、国際公開第2013/089283号等。
国際公開第2004/016749号、国際公開第2005/083124号、国際公開2007/143315号、国際公開第2009/071680号、国際公開第2013/089283号等。
本発明の医薬組成物は、局所的あるいは全身的な治療のいずれが望まれるのか、又は治療すべき領域に応じて、様々な方法により投与することができる。投与方法としては、例えば、局所的(点眼、膣内、直腸内、鼻腔内、経皮を含む)、経口的、又は、非経口的であってもよい。非経口的投与としては、静脈内注射若しくは点滴、皮下、腹腔内若しくは筋肉内注入、吸引若しくは吸入による肺投与、硬膜下腔内投与、脳室内投与等が挙げられる。好ましくは、静脈内注射又は皮下投与である。
本発明の医薬組成物を局所投与する場合、経皮パッチ、軟膏、ローション、クリーム、ゲル、滴下剤、坐剤、噴霧剤、液剤、散剤等の製剤を用いることができる。
経口投与用組成物としては、散剤、顆粒剤、水若しくは非水性媒体に溶解させた懸濁液又は溶液、カプセル、粉末剤、錠剤等が挙げられる。
非経口、硬膜下腔、又は、脳室内投与用組成物としては、バッファー、希釈剤及びその他の適当な添加剤を含む無菌水溶液等が挙げられる。
経口投与用組成物としては、散剤、顆粒剤、水若しくは非水性媒体に溶解させた懸濁液又は溶液、カプセル、粉末剤、錠剤等が挙げられる。
非経口、硬膜下腔、又は、脳室内投与用組成物としては、バッファー、希釈剤及びその他の適当な添加剤を含む無菌水溶液等が挙げられる。
本発明の医薬組成物は、本発明のアンチセンスオリゴヌクレオチドの有効量にその剤型に適した賦形剤、結合剤、湿潤剤、崩壊剤、滑沢剤、希釈剤等の各種医薬用添加剤を必要に応じて混合して得ることができる。注射剤の場合には適当な担体と共に滅菌処理を行なって製剤とすればよい。
賦形剤としては乳糖、白糖、ブドウ糖、デンプン、炭酸カルシウム又は結晶セルロース等が挙げられる。結合剤としてはメチルセルロース、カルボキシメチルセルロース、ヒドロキシプロピルセルロース、ゼラチン又はポリビニルピロリドン等が挙げられる。崩壊剤としてはカルボキシメチルセルロース、カルボキシメチルセルロースナトリウム、デンプン、アルギン酸ナトリウム、カンテン末又はラウリル硫酸ナトリウム等が挙げられる。滑沢剤としてはタルク、ステアリン酸マグネシウム又はマクロゴール等が挙げられる。坐剤の基剤としてはカカオ脂、マクロゴール又はメチルセルロース等を用いることができる。また、液剤又は乳濁性、懸濁性の注射剤として調製する場合には通常使用されている溶解補助剤、懸濁化剤、乳化剤、安定化剤、保存剤、等張剤等を適宜添加しても良い。経口投与の場合には嬌味剤、芳香剤等を加えても良い。
投与は、治療される病態の重度と反応度に依存し、治療コースは、数日から数ヶ月、あるいは、治癒が実現されるまで、又は、病状の減退が達成されるまで持続する。最適投与スケジュールは、生体における薬剤蓄積の測定から計算が可能である。当該分野の当業者であれば、最適用量、投与法、及び、繰り返し頻度を定めることができる。最適用量は、個々のアンチセンスオリゴヌクレオチドの相対的効力に応じて変動するが、一般に、インビトロ及びインビボの動物実験におけるIC50又はEC50に基づいて計算することが可能である。例えば、アンチセンスオリゴヌクレオチドの分子量(アンチセンスオリゴヌクレオチド配列及び化学構造から導かれる)と、例えば、IC50のような効果的用量(実験的に導かれる)が与えられたならば、mg/kgで表される用量が通例にしたがって計算される。
なお、本明細書中で用いる略語は以下の意味を表す。
Ac:アセチル
Bn:ベンジル
Bz:ベンゾイル
DABCO:1,4-ジアザビシクロ[2.2.2]オクタン
DMTr:ジメトキシトリチル
DMF:N,N’-ジメチルホルムアミド
EDC:1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド
Fmoc:9-フルオレニルメチルオキシカルボニル
HBTU:O-ベンゾトリアゾール-N,N,N’,N’-テトラメチル-ウロニウム-ヘキサフルオロ-ホスフェート
Me:メチル
Ph:フェニル
TBS:tert-ブチルジメチルシリル
TFA:トリフルオロ酢酸
TMSOTf:トリフルオロメタンスルホン酸トリメチルシリル
Ac:アセチル
Bn:ベンジル
Bz:ベンゾイル
DABCO:1,4-ジアザビシクロ[2.2.2]オクタン
DMTr:ジメトキシトリチル
DMF:N,N’-ジメチルホルムアミド
EDC:1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド
Fmoc:9-フルオレニルメチルオキシカルボニル
HBTU:O-ベンゾトリアゾール-N,N,N’,N’-テトラメチル-ウロニウム-ヘキサフルオロ-ホスフェート
Me:メチル
Ph:フェニル
TBS:tert-ブチルジメチルシリル
TFA:トリフルオロ酢酸
TMSOTf:トリフルオロメタンスルホン酸トリメチルシリル
以下に本発明の実施例及び参考例、ならびに試験例を挙げて本発明をさらに詳しく説明するが、本発明はこれらにより限定されるものではない。
実施例で得られたNMR分析は300MHzで行い、DMSO-d6あるいはCDCl3を用いて測定した。
UPLC分析は以下の条件を用いた。
移動相:[A]は0.1%ギ酸含有水溶液[B]は0.1%ギ酸含有アセトニトリル溶液
グラジエント:3.5分間で5%-100%溶媒[B]のリニアグラジエントを行った後、0.5分間、100%溶媒[B]を維持した。
カラム:ACQUITY UPLC(登録商標)BEH C18(1.7μm、i.d.2.1x50mm)(Waters)
流速:0.8 mL/分
PDA検出波長:254nm(検出範囲210-500nm)
移動相:[A]は0.1%ギ酸含有水溶液[B]は0.1%ギ酸含有アセトニトリル溶液
グラジエント:3.5分間で5%-100%溶媒[B]のリニアグラジエントを行った後、0.5分間、100%溶媒[B]を維持した。
カラム:ACQUITY UPLC(登録商標)BEH C18(1.7μm、i.d.2.1x50mm)(Waters)
流速:0.8 mL/分
PDA検出波長:254nm(検出範囲210-500nm)
実施例1 アシアロ糖タンパク質受容体と相互作用を有する糖誘導体を含有する化合物の合成
工程1 化合物102の合成
化合物101(15.0g、88.0mmol)のN,N’-ジメチルホルムアミド溶液(100mL)に室温で水素化ナトリウム(60% w/w、5.26g、1.5eq.)を加え、30分間撹拌した後、ベンジルブロミド(10.42g、88.0mmol)を加え、室温で5.5時間撹拌した。反応液にメタノール(5ml)を加えた後、飽和食塩水を加え、酢酸エチルにて抽出、飽和食塩水にて洗浄、次いで硫酸マグネシウムで乾燥した。溶媒を減圧留去した後、得られた残渣をシリカゲルカラムクロマトグラフィー(SiO2:330g、n-ヘキサン:酢酸エチル=90:10→75:25)により精製し、化合物102(11.0g、収率42%)を油状物質として得た。
ESI-MS(m/z) : 293.10 (M+1).
化合物101(15.0g、88.0mmol)のN,N’-ジメチルホルムアミド溶液(100mL)に室温で水素化ナトリウム(60% w/w、5.26g、1.5eq.)を加え、30分間撹拌した後、ベンジルブロミド(10.42g、88.0mmol)を加え、室温で5.5時間撹拌した。反応液にメタノール(5ml)を加えた後、飽和食塩水を加え、酢酸エチルにて抽出、飽和食塩水にて洗浄、次いで硫酸マグネシウムで乾燥した。溶媒を減圧留去した後、得られた残渣をシリカゲルカラムクロマトグラフィー(SiO2:330g、n-ヘキサン:酢酸エチル=90:10→75:25)により精製し、化合物102(11.0g、収率42%)を油状物質として得た。
ESI-MS(m/z) : 293.10 (M+1).
工程2 化合物103の合成
化合物102(5.00g、17.1mol)のN,N’-ジメチルホルムアミド溶液(40mL)に室温で二クロム酸ピリジニウム(19.3g、51.3mmol)を加え、室温で5.5時間撹拌した後、酢酸エチル(200mL)を加え、反応混合物をセライトろ過した。ろ液に飽和食塩水を加えた後、酢酸エチルで抽出、飽和食塩水にて洗浄、次いで硫酸マグネシウムで乾燥した。溶媒を減圧留去した後、得られた残渣をシリカゲルカラムクロマトグラフィー(SiO2:120g、n-ヘキサン:酢酸エチル=90:10→50:50)により精製し、化合物103(3.32g、収率63%)を得た。
1H-NMR(CDCl3)δ:7.36 -7.32 (m, 4H), 7.28 (dd, J = 8.4, 4.0 Hz, 1H), 7.20 (m, 1H), 4.51 (s, 2H, -OCH2Ph), 3.46 (t, J = 6.7 Hz, 2H), 2.34 (t, J = 7.5 Hz, 2H), 1.68-1.56 (m, 4H), 1.40-1.23 (m, 14H).
化合物102(5.00g、17.1mol)のN,N’-ジメチルホルムアミド溶液(40mL)に室温で二クロム酸ピリジニウム(19.3g、51.3mmol)を加え、室温で5.5時間撹拌した後、酢酸エチル(200mL)を加え、反応混合物をセライトろ過した。ろ液に飽和食塩水を加えた後、酢酸エチルで抽出、飽和食塩水にて洗浄、次いで硫酸マグネシウムで乾燥した。溶媒を減圧留去した後、得られた残渣をシリカゲルカラムクロマトグラフィー(SiO2:120g、n-ヘキサン:酢酸エチル=90:10→50:50)により精製し、化合物103(3.32g、収率63%)を得た。
1H-NMR(CDCl3)δ:7.36 -7.32 (m, 4H), 7.28 (dd, J = 8.4, 4.0 Hz, 1H), 7.20 (m, 1H), 4.51 (s, 2H, -OCH2Ph), 3.46 (t, J = 6.7 Hz, 2H), 2.34 (t, J = 7.5 Hz, 2H), 1.68-1.56 (m, 4H), 1.40-1.23 (m, 14H).
工程3 化合物104及び化合物105の合成
国際公開第2012/037254号の実施例3に記載の方法にて、化合物104を合成し、続いて化合物105を合成した。
国際公開第2012/037254号の実施例3に記載の方法にて、化合物104を合成し、続いて化合物105を合成した。
工程4 化合物106の合成
化合物103(218mg、17.1mmol)のN,N’-ジメチルホルムアミド溶液(3mL)に室温でN,N’-ジイソプロピルエチルアミン(405μl、2.32mmol)、HBTU(324mg、0.855mmol)を加え、室温で10分間撹拌した後、化合物105(218mg、17.1mmol)のN,N’-ジメチルホルムアミド溶液(3mL)、N,N’-ジイソプロピルエチルアミン(75μl、0.428mmol)を加え、室温で12時間撹拌した。反応液をクロロホルムで希釈し、10%炭酸水素ナトリウム水溶液、飽和食塩水にて順次洗浄、次いで硫酸マグネシウム乾燥後、溶媒を減圧留去した。得られた残渣をシリカゲルカラムクロマトグラフィー(SiO2:24g、クロロホルム:メタノール=90:10→80:20)により精製し、化合物106(430mg、収率58%)を得た。
1H-NMR(CDCl3)δ:7.38-7.31 (m, 4H), 7.23 (m, 1H), 7.00-6.90 (m, 3H, -NH), 6.69-6.60 (m, 2H, -NH), 6.46 (br.s, 1H, -NH), 5.35 (d, J = 2.9 Hz, 3H, H-4 of GalNAc), 5.24-5.14 (m, 3H, H-3 of GalNAc), 4.61 (d, J = 8.4 Hz, 3H, H-1 of GalNAc), 4.50 (s, 2H, -CH2Ph), 4.22-4.00 (m, 9H), 3.99-3.88 (m, 6H), 3.79-3.60 (m, 12H), 3.56-3.43 (m, 3H), 3.47 (t, J = 6.7 Hz, 2H), 3.39-3.20 (m, 12H), 2.47-2.40 (m, 6H), 2.32-2.16 (m, 6H), 2.15 (s, 9H), 2.05 (s, 9H), 2.00 (s, 9H), 1.95 (s, 9H), 1.85-1.50 (18H, m), 1.32-1.23 (12H, m).
化合物103(218mg、17.1mmol)のN,N’-ジメチルホルムアミド溶液(3mL)に室温でN,N’-ジイソプロピルエチルアミン(405μl、2.32mmol)、HBTU(324mg、0.855mmol)を加え、室温で10分間撹拌した後、化合物105(218mg、17.1mmol)のN,N’-ジメチルホルムアミド溶液(3mL)、N,N’-ジイソプロピルエチルアミン(75μl、0.428mmol)を加え、室温で12時間撹拌した。反応液をクロロホルムで希釈し、10%炭酸水素ナトリウム水溶液、飽和食塩水にて順次洗浄、次いで硫酸マグネシウム乾燥後、溶媒を減圧留去した。得られた残渣をシリカゲルカラムクロマトグラフィー(SiO2:24g、クロロホルム:メタノール=90:10→80:20)により精製し、化合物106(430mg、収率58%)を得た。
1H-NMR(CDCl3)δ:7.38-7.31 (m, 4H), 7.23 (m, 1H), 7.00-6.90 (m, 3H, -NH), 6.69-6.60 (m, 2H, -NH), 6.46 (br.s, 1H, -NH), 5.35 (d, J = 2.9 Hz, 3H, H-4 of GalNAc), 5.24-5.14 (m, 3H, H-3 of GalNAc), 4.61 (d, J = 8.4 Hz, 3H, H-1 of GalNAc), 4.50 (s, 2H, -CH2Ph), 4.22-4.00 (m, 9H), 3.99-3.88 (m, 6H), 3.79-3.60 (m, 12H), 3.56-3.43 (m, 3H), 3.47 (t, J = 6.7 Hz, 2H), 3.39-3.20 (m, 12H), 2.47-2.40 (m, 6H), 2.32-2.16 (m, 6H), 2.15 (s, 9H), 2.05 (s, 9H), 2.00 (s, 9H), 1.95 (s, 9H), 1.85-1.50 (18H, m), 1.32-1.23 (12H, m).
工程5 化合物107の合成
化合物106(90mg、0.043mmol)のメタノール溶液(3mL)に室温でPd-C(10%、50mg)を加え、水素気流下、室温で12時間撹拌した。反応液より触媒をろ別した後、ろ液を濃縮することにより化合物107(79mg、収率92%)を無色粉末として得た。
ESI-MS(m/z) : 1992.10 (M-1).
化合物106(90mg、0.043mmol)のメタノール溶液(3mL)に室温でPd-C(10%、50mg)を加え、水素気流下、室温で12時間撹拌した。反応液より触媒をろ別した後、ろ液を濃縮することにより化合物107(79mg、収率92%)を無色粉末として得た。
ESI-MS(m/z) : 1992.10 (M-1).
工程6 化合物1の合成
化合物107(722mg、0.362mmol)の塩化メチレン溶液(7mL)に0℃で、N,N’-ジイソプロピルエチルアミン(253μl、1.45mmol)、3-(クロロ(ジイソプロピルアミノ)ホスフィノキシ)プロパンニトリル(0.162ml、0.725mmol)を加え、室温で2時間撹拌した。反応液を塩化メチレンで希釈し、10%炭酸水素ナトリウム水溶液、飽和食塩水にて順次洗浄、次いで硫酸マグネシウム乾燥後、溶媒を減圧留去した。得られた残渣をシリカゲルカラムクロマトグラフィー(SiO2:24g、クロロホルム:メタノール:トリエチルアミン=95:5:1→90:10:1)により精製し、化合物1(551mg、収率57%)を無色粉末として得た。
1H-NMR(CDCl3)δ:7.25-7.15 (m, 5H, -NH), 7.05-6.90 (m, 2H, -NH), 6.70-6.61 (m, 2H, -NH), 6.45 (s, 1H, -NH), 5.35 (br.s, 3H, H-4 of GalNAc), 5.20 (m, 3H, H-3 of GalNAc), 4.61 (d, J = 8.3 Hz, 3H, H-1 of GalNAc), 4.22-4.01 (m, 9H), 3.98-3.89 (m, 6H), 3.83 (dd, J = 14.0, 6.9 Hz, 3H, H-6 of GalNAc), 3.72-3.62 (m, 12H), 3.59 (dd, J = 14.0, 8.0 Hz, 3H, H-6 of GalNAc), 3.56-3.47 (m, 3H), 3.36-3.10 (m, 12H), 2.65 (t, J = 7.2 Hz, 2H, -OCH2CH2CN), 2.47-2.40 (m, 6H), 2.32-2.18 (m, 6H), 2.15 (s, 9H), 2.05 (s, 9H), 2.00 (s, 9H), 1.95 (s, 9H), 1.80-1.52 (12H, m), 1.37-1.20 (24H, m), 1.19 (d, J = 6.5 Hz, -CH(CH3)2), 1.18 (d, J = 6.5 Hz, -CH(CH3)2).
化合物107(722mg、0.362mmol)の塩化メチレン溶液(7mL)に0℃で、N,N’-ジイソプロピルエチルアミン(253μl、1.45mmol)、3-(クロロ(ジイソプロピルアミノ)ホスフィノキシ)プロパンニトリル(0.162ml、0.725mmol)を加え、室温で2時間撹拌した。反応液を塩化メチレンで希釈し、10%炭酸水素ナトリウム水溶液、飽和食塩水にて順次洗浄、次いで硫酸マグネシウム乾燥後、溶媒を減圧留去した。得られた残渣をシリカゲルカラムクロマトグラフィー(SiO2:24g、クロロホルム:メタノール:トリエチルアミン=95:5:1→90:10:1)により精製し、化合物1(551mg、収率57%)を無色粉末として得た。
1H-NMR(CDCl3)δ:7.25-7.15 (m, 5H, -NH), 7.05-6.90 (m, 2H, -NH), 6.70-6.61 (m, 2H, -NH), 6.45 (s, 1H, -NH), 5.35 (br.s, 3H, H-4 of GalNAc), 5.20 (m, 3H, H-3 of GalNAc), 4.61 (d, J = 8.3 Hz, 3H, H-1 of GalNAc), 4.22-4.01 (m, 9H), 3.98-3.89 (m, 6H), 3.83 (dd, J = 14.0, 6.9 Hz, 3H, H-6 of GalNAc), 3.72-3.62 (m, 12H), 3.59 (dd, J = 14.0, 8.0 Hz, 3H, H-6 of GalNAc), 3.56-3.47 (m, 3H), 3.36-3.10 (m, 12H), 2.65 (t, J = 7.2 Hz, 2H, -OCH2CH2CN), 2.47-2.40 (m, 6H), 2.32-2.18 (m, 6H), 2.15 (s, 9H), 2.05 (s, 9H), 2.00 (s, 9H), 1.95 (s, 9H), 1.80-1.52 (12H, m), 1.37-1.20 (24H, m), 1.19 (d, J = 6.5 Hz, -CH(CH3)2), 1.18 (d, J = 6.5 Hz, -CH(CH3)2).
化合物105(1.20g、0.629mmol)の塩化メチレン溶液(12mL)に室温でトリエチルアミン(0.218ml、1.57mmol)、無水コハク酸(76mg、0.755mmol)を加え、室温で12時間撹拌した。反応液を濃縮した後、得られた残渣をシリカゲルカラムクロマトグラフィー(SiO2:40g、クロロホルム:メタノール=75:25→クロロホルム:メタノール:水=6:4:1)により精製し、化合物2(612mg、収率51%)を無色粉末として得た。
1H-NMR(CDCl3)δ:5.35 (br.s, 3H, H-4 of GalNAc), 5.19 (m, 3H, H-3 of GalNAc), 4.61 (d, J = 8.2 Hz, 3H, H-1 of GalNAc), 4.22-4.01 (m, 9H), 3.97-3.89 (m, 6H), 3.79-3.57 (m, 12H), 3.57-3.45 (m, 3H), 3.37-3.17 (m, 12H), 2.66-2.57 (m, 2H), 2.52-2.37 (m, 6H), 2.31-2.18 (m, 2H), 2.15 (s, 9H), 2.05 (s, 9H), 2.00 (s, 9H), 1.95 (s, 9H), 1.72-1.52 (18H, m).
1H-NMR(CDCl3)δ:5.35 (br.s, 3H, H-4 of GalNAc), 5.19 (m, 3H, H-3 of GalNAc), 4.61 (d, J = 8.2 Hz, 3H, H-1 of GalNAc), 4.22-4.01 (m, 9H), 3.97-3.89 (m, 6H), 3.79-3.57 (m, 12H), 3.57-3.45 (m, 3H), 3.37-3.17 (m, 12H), 2.66-2.57 (m, 2H), 2.52-2.37 (m, 6H), 2.31-2.18 (m, 2H), 2.15 (s, 9H), 2.05 (s, 9H), 2.00 (s, 9H), 1.95 (s, 9H), 1.72-1.52 (18H, m).
工程1 化合物109の合成
Bioorganic Medicinal Chemistry Letters,11,383―386(2001)に記載の方法に従って、化合物108より2工程で合成した。
工程2 化合物110の合成
化合物109(11.84g、19.2mmol)のN,N’-ジメチルホルムアミド溶液(50mL)に室温でイミダゾール(1.57g、23.1mmol,1.2eq.)、第3ブチルジメチルシリルクロリド(1.59g、21.2mmol、1.1eq.)を順次加え、室温で2時間撹拌した。反応液を酢酸エチルで希釈し、10%炭酸水素ナトリウム水溶液、飽和食塩水にて順次洗浄、次いで硫酸マグネシウム乾燥後、溶媒を減圧留去し、化合物110(14.35g、粗製)を得た。
Bioorganic Medicinal Chemistry Letters,11,383―386(2001)に記載の方法に従って、化合物108より2工程で合成した。
工程2 化合物110の合成
化合物109(11.84g、19.2mmol)のN,N’-ジメチルホルムアミド溶液(50mL)に室温でイミダゾール(1.57g、23.1mmol,1.2eq.)、第3ブチルジメチルシリルクロリド(1.59g、21.2mmol、1.1eq.)を順次加え、室温で2時間撹拌した。反応液を酢酸エチルで希釈し、10%炭酸水素ナトリウム水溶液、飽和食塩水にて順次洗浄、次いで硫酸マグネシウム乾燥後、溶媒を減圧留去し、化合物110(14.35g、粗製)を得た。
工程3 化合物111の合成
化合物110(14.35g、粗製)のN,N’-ジメチルホルムアミド溶液(50mL)にピペリジンを加え、室温で5.5時間撹拌した後、反応液を減圧下濃縮することにより、化合物111(14.46g)の粗生成物を得た。
工程4 化合物112の合成
12-メトキシ-12-オキソードデカン酸(1.81g、7.40mmol)のN,N’-ジメチルホルムアミド溶液(10ml)に室温で、N,N’-ジイソプロピルエチルアミン(4.31ml、24.7mmol)、HBTU(3.27g、8.63mmol)を加え、室温で10分間撹拌した後、化合物111(4.83g、6.16mmol)のN,N’-ジメチルホルムアミド溶液(8ml)を加え、室温で12時間撹拌した。反応液を酢酸エチルで希釈した後、10%炭酸水素ナトリウム水溶液、飽和食塩水にて順次洗浄、次いで硫酸マグネシウム乾燥後、溶媒を減圧留去した。得られた残渣をシリカゲルカラムクロマトグラフィー(SiO2:320g、n-ヘキサン:酢酸エチル:トリエチルアミン=60:40:1→40:60:1)により精製し、化合物112(2.94g、化合物109からの収率65%)を無色泡状物質として得た。
化合物110(14.35g、粗製)のN,N’-ジメチルホルムアミド溶液(50mL)にピペリジンを加え、室温で5.5時間撹拌した後、反応液を減圧下濃縮することにより、化合物111(14.46g)の粗生成物を得た。
工程4 化合物112の合成
12-メトキシ-12-オキソードデカン酸(1.81g、7.40mmol)のN,N’-ジメチルホルムアミド溶液(10ml)に室温で、N,N’-ジイソプロピルエチルアミン(4.31ml、24.7mmol)、HBTU(3.27g、8.63mmol)を加え、室温で10分間撹拌した後、化合物111(4.83g、6.16mmol)のN,N’-ジメチルホルムアミド溶液(8ml)を加え、室温で12時間撹拌した。反応液を酢酸エチルで希釈した後、10%炭酸水素ナトリウム水溶液、飽和食塩水にて順次洗浄、次いで硫酸マグネシウム乾燥後、溶媒を減圧留去した。得られた残渣をシリカゲルカラムクロマトグラフィー(SiO2:320g、n-ヘキサン:酢酸エチル:トリエチルアミン=60:40:1→40:60:1)により精製し、化合物112(2.94g、化合物109からの収率65%)を無色泡状物質として得た。
工程5 化合物113の合成
化合物112(2.70g、3.68mmol)のメタノール(20ml)-テトラヒドロフラン(8ml)に室温で2mol/Lの水酸化ナトリウム水溶液(3.68ml、2eq.)を加え、室温で2時間撹拌した。-78℃で反応液に2mol/Lの塩酸を加えることにより中和した後、酢酸エチルで希釈し、飽和食塩水にて順次洗浄、次いで硫酸マグネシウム乾燥後、溶媒を減圧留去することにより、化合物113(2.23g、収率 88%)を得た。
1H-NMR(CDCl3)δ:7.39 (d, J = 7.8 Hz, 2H), 7.28 (d, J = 8.5 Hz, 4H), 7.25-7.21 (m, 2H), 7.18 (d, J = 7.3 Hz, 1H), 6.79 (d, J = 8.5 Hz, 4H), 5.66 (d, J = 8.2 Hz, 1H, -NH), 4.11 (m, 1H), 3.79 (dd, J = 9.7, 3.4 Hz, 1H), 3.75 (s, 6H), 3.66 (dd, J = 9.7, 6.0 Hz, 1H), 3.31 (dd, J = 8.7, 4.5 Hz, 1H), 3.04 (dd, J = 8.7, 6.1 Hz, 1H), 2.23 (br.s, 2H), 2.06 (t, J = 7.5 Hz, 2H), 1.62-1.45 (m, 4H), 1.32-1.10 (m, 14H), 0.81 (s, 9H), -0.02 (s, 4H)
化合物112(2.70g、3.68mmol)のメタノール(20ml)-テトラヒドロフラン(8ml)に室温で2mol/Lの水酸化ナトリウム水溶液(3.68ml、2eq.)を加え、室温で2時間撹拌した。-78℃で反応液に2mol/Lの塩酸を加えることにより中和した後、酢酸エチルで希釈し、飽和食塩水にて順次洗浄、次いで硫酸マグネシウム乾燥後、溶媒を減圧留去することにより、化合物113(2.23g、収率 88%)を得た。
1H-NMR(CDCl3)δ:7.39 (d, J = 7.8 Hz, 2H), 7.28 (d, J = 8.5 Hz, 4H), 7.25-7.21 (m, 2H), 7.18 (d, J = 7.3 Hz, 1H), 6.79 (d, J = 8.5 Hz, 4H), 5.66 (d, J = 8.2 Hz, 1H, -NH), 4.11 (m, 1H), 3.79 (dd, J = 9.7, 3.4 Hz, 1H), 3.75 (s, 6H), 3.66 (dd, J = 9.7, 6.0 Hz, 1H), 3.31 (dd, J = 8.7, 4.5 Hz, 1H), 3.04 (dd, J = 8.7, 6.1 Hz, 1H), 2.23 (br.s, 2H), 2.06 (t, J = 7.5 Hz, 2H), 1.62-1.45 (m, 4H), 1.32-1.10 (m, 14H), 0.81 (s, 9H), -0.02 (s, 4H)
工程6 化合物114の合成
化合物113(671mg,17.1mmol)のN,N’-ジメチルホルムアミド溶液(5mL)に室温でN,N’-ジイソプロピルエチルアミン(0.549ml、3.14mmol)、HBTU(358mg、0.94mmol)を加え、室温で10分間撹拌した後、化合物105(1.20g、0.629mmol)のN,N’-ジメチルホルムアミド溶液(5mL)、N,N’-ジイソプロピルエチルアミン(0.132ml、0.755mmol)を加え、室温で12時間撹拌した。反応液を酢酸エチルで希釈した後、10%炭酸水素ナトリウム水溶液、飽和食塩水にて順次洗浄、次いで硫酸マグネシウム乾燥後、溶媒を減圧留去した。得られた残渣をシリカゲルカラムクロマトグラフィー(SiO2:40g、クロロホルム:メタノール:トリエチルアミン=95:5:1→90:10:1)により精製し、化合物114(685mg、収率44%)を得た。
ESI-MS (m/z): 1271 (M/2 + Na).
1H-NMR(CDCl3)δ:7.41 (d, J = 8.0Hz, 2H), 7.29 (d, J = 8.7 Hz, 4H), 7.29-7.16 (m, 8H), 7.07-6.96 (m, 8H), 6.82 (d, J = 8.7 Hz, 4H), 6.79-6.70 (m, 2H, -NH), 6.53 (m, 1H, -NH), 5.68 (d, J = 8.5 Hz, -NH), 5.35 (d, J = 3.0 Hz, 3H, H-4 of GalNAc), 5.24-5.16 (m, 3H, H-3 of GalNAc), 4.61 (d, J = 8.3 Hz, 3H, H-1 of GalNAc), 4.21-4.01 (m, 12H), 3.98-3.88 (m, 6H), 3.79 (s, 6H), 3.75-3.61 (m, 12H), 3.56-3.46 (m, 3H), 3.39-3.19 (m, 12H), 3.07 (m, 1H), 2.98 (m, 1H), 2.45-2.39 (m, 6H), 2.35-2.16 (m, 6H), 2.17-2.06 (m, 4H), 2.15 (s, 9H), 2.04 (s, 9H), 2.00 (s, 9H), 1.95 (s, 9H), 1.80-1.51 (22H, m), 1.30-1.21 (12H, m), 0.82 (s, 9H), 0.02 (s, 3H), 0.00 (s, 3H).
化合物113(671mg,17.1mmol)のN,N’-ジメチルホルムアミド溶液(5mL)に室温でN,N’-ジイソプロピルエチルアミン(0.549ml、3.14mmol)、HBTU(358mg、0.94mmol)を加え、室温で10分間撹拌した後、化合物105(1.20g、0.629mmol)のN,N’-ジメチルホルムアミド溶液(5mL)、N,N’-ジイソプロピルエチルアミン(0.132ml、0.755mmol)を加え、室温で12時間撹拌した。反応液を酢酸エチルで希釈した後、10%炭酸水素ナトリウム水溶液、飽和食塩水にて順次洗浄、次いで硫酸マグネシウム乾燥後、溶媒を減圧留去した。得られた残渣をシリカゲルカラムクロマトグラフィー(SiO2:40g、クロロホルム:メタノール:トリエチルアミン=95:5:1→90:10:1)により精製し、化合物114(685mg、収率44%)を得た。
ESI-MS (m/z): 1271 (M/2 + Na).
1H-NMR(CDCl3)δ:7.41 (d, J = 8.0Hz, 2H), 7.29 (d, J = 8.7 Hz, 4H), 7.29-7.16 (m, 8H), 7.07-6.96 (m, 8H), 6.82 (d, J = 8.7 Hz, 4H), 6.79-6.70 (m, 2H, -NH), 6.53 (m, 1H, -NH), 5.68 (d, J = 8.5 Hz, -NH), 5.35 (d, J = 3.0 Hz, 3H, H-4 of GalNAc), 5.24-5.16 (m, 3H, H-3 of GalNAc), 4.61 (d, J = 8.3 Hz, 3H, H-1 of GalNAc), 4.21-4.01 (m, 12H), 3.98-3.88 (m, 6H), 3.79 (s, 6H), 3.75-3.61 (m, 12H), 3.56-3.46 (m, 3H), 3.39-3.19 (m, 12H), 3.07 (m, 1H), 2.98 (m, 1H), 2.45-2.39 (m, 6H), 2.35-2.16 (m, 6H), 2.17-2.06 (m, 4H), 2.15 (s, 9H), 2.04 (s, 9H), 2.00 (s, 9H), 1.95 (s, 9H), 1.80-1.51 (22H, m), 1.30-1.21 (12H, m), 0.82 (s, 9H), 0.02 (s, 3H), 0.00 (s, 3H).
工程7 化合物115の合成
化合物114(563mg、0.226mmol)のテトラヒドロフラン溶液(3ml)に室温で1mol/L テトラブチルアンモニウムフロリドーテトラヒドロフラン溶液(0.510ml、2.25eq.)を加え、室温で12時間撹拌した後、反応液を減圧下濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィー(SiO2:24g、クロロホルム:メタノール:トリエチルアミン=95:5:1→90:10:1)により精製し、化合物115(485mg、収率90%)を得た。
ESI-MS (m/z): 1214 (M/2 + Na).
化合物114(563mg、0.226mmol)のテトラヒドロフラン溶液(3ml)に室温で1mol/L テトラブチルアンモニウムフロリドーテトラヒドロフラン溶液(0.510ml、2.25eq.)を加え、室温で12時間撹拌した後、反応液を減圧下濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィー(SiO2:24g、クロロホルム:メタノール:トリエチルアミン=95:5:1→90:10:1)により精製し、化合物115(485mg、収率90%)を得た。
ESI-MS (m/z): 1214 (M/2 + Na).
工程8 化合物4の合成
化合物115(485mg、0.204mmol)のジクロロメタン溶液(3ml)に室温でジメチルアミノピリジン(50mg、0.407mmol、2.0eq.)、無水コハク酸(31mg、0.305mmol、1.5eq.)を加え、室温で2時間撹拌した後、反応液を減圧下濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィー(SiO2:24g、クロロホルム:メタノール:トリエチルアミン=95:5:1→80:20:1)により精製し、化合物4(435mg、収率86%)を得た。
ESI-MS (m/z): 1263 (M/2 + Na).
1H-NMR(CDCl3)δ:7.40 (d, J =7.7 Hz, 2H), 7.29 (d, J = 8.5 Hz, 4H), 7.21 (m, 1H), 7.02-7.02 (m, 3H, -NH), 6.83 (d, J = 8.5 Hz, 4H), 6.65 (m, 1H, -NH), 6.19 (d, J = 8.2 Hz, -NH), 5.35 (d, J = 3.0 Hz, 3H, H-4 of GalNAc), 5.19 (m, 3H, H-3 of GalNAc), 4.61 (d, J = 8.3 Hz, 3H, H-1 of GalNAc), 4.35 (m, 1H), 4.31-4.27 (m, 2H), 4.21-4.01 (m, 9H), 3.99-3.88 (m, 6H), 3.79 (s, 6H), 3.75-3.61 (m, 12H), 3.55-3.45 (m, 3H), 3.38-3.19 (m, 12H), 3.21-3.12 (m, 2H), 2.88-2.80 (m, 2H), 2.54 (br.s, 2H), 2.46-2.40 (m, 6H), 2.32-2.18 (m, 3H), 2.18-2.08 (m, 6H), 2.15 (s, 9H), 2.04 (s, 9H), 1.99 (s, 9H), 1.95 (s, 9H), 1.80-1.50 (22H, m), 1.32-1.21 (12H, m).
化合物115(485mg、0.204mmol)のジクロロメタン溶液(3ml)に室温でジメチルアミノピリジン(50mg、0.407mmol、2.0eq.)、無水コハク酸(31mg、0.305mmol、1.5eq.)を加え、室温で2時間撹拌した後、反応液を減圧下濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィー(SiO2:24g、クロロホルム:メタノール:トリエチルアミン=95:5:1→80:20:1)により精製し、化合物4(435mg、収率86%)を得た。
ESI-MS (m/z): 1263 (M/2 + Na).
1H-NMR(CDCl3)δ:7.40 (d, J =7.7 Hz, 2H), 7.29 (d, J = 8.5 Hz, 4H), 7.21 (m, 1H), 7.02-7.02 (m, 3H, -NH), 6.83 (d, J = 8.5 Hz, 4H), 6.65 (m, 1H, -NH), 6.19 (d, J = 8.2 Hz, -NH), 5.35 (d, J = 3.0 Hz, 3H, H-4 of GalNAc), 5.19 (m, 3H, H-3 of GalNAc), 4.61 (d, J = 8.3 Hz, 3H, H-1 of GalNAc), 4.35 (m, 1H), 4.31-4.27 (m, 2H), 4.21-4.01 (m, 9H), 3.99-3.88 (m, 6H), 3.79 (s, 6H), 3.75-3.61 (m, 12H), 3.55-3.45 (m, 3H), 3.38-3.19 (m, 12H), 3.21-3.12 (m, 2H), 2.88-2.80 (m, 2H), 2.54 (br.s, 2H), 2.46-2.40 (m, 6H), 2.32-2.18 (m, 3H), 2.18-2.08 (m, 6H), 2.15 (s, 9H), 2.04 (s, 9H), 1.99 (s, 9H), 1.95 (s, 9H), 1.80-1.50 (22H, m), 1.32-1.21 (12H, m).
工程1 化合物117の合成
化合物116(10.0g、30.9mmol)のピリジン溶液(40ml)に室温で4,4’-ジメトキシトリチルクロリド(11.0g、32.5mmol、1.05eq.)を加え、室温で2時間撹拌した。反応液を酢酸エチルで希釈し、10%炭酸水素ナトリウム水溶液、飽和食塩水にて順次洗浄、次いで硫酸マグネシウム乾燥後、溶媒を減圧留去し、化合物117(22.95g、粗製)を得た。
工程2 化合物118の合成
化合物117(22.85g、粗製)のN,N’-ジメチルホルムアミド溶液(70ml)にピペリジン(3.65ml、36.9mmol)を加え、室温で2時間撹拌した後、反応液を減圧下濃縮することにより、化合物118(22.75g)の粗生成物を得た。
化合物116(10.0g、30.9mmol)のピリジン溶液(40ml)に室温で4,4’-ジメトキシトリチルクロリド(11.0g、32.5mmol、1.05eq.)を加え、室温で2時間撹拌した。反応液を酢酸エチルで希釈し、10%炭酸水素ナトリウム水溶液、飽和食塩水にて順次洗浄、次いで硫酸マグネシウム乾燥後、溶媒を減圧留去し、化合物117(22.95g、粗製)を得た。
工程2 化合物118の合成
化合物117(22.85g、粗製)のN,N’-ジメチルホルムアミド溶液(70ml)にピペリジン(3.65ml、36.9mmol)を加え、室温で2時間撹拌した後、反応液を減圧下濃縮することにより、化合物118(22.75g)の粗生成物を得た。
工程3 化合物119の合成
化合物4の工程4と同様な手法により、化合物119を無色泡状物質として得た(化合物117からの収率69%)を得た。1H-NMRでは6:4のロータマー混合物として観測された。
1H-NMR(CDCl3)δ:(Major) 7.79-7.74 (m, 2H), 7.65-7.55 (m, 2H), 7.44-7.34 (m, 5H), 7.39-7.26 (m, 7H), 7.21 (m, 1H), 6.85-6.76 (m, 4H), 5.64 (d, J = 8.7 Hz, 1H. -NH), 4.58 (m, 1H), 4.38 (m, 1H), 4.38-4.26 (m, 2H), 4.18 (m, 1H), 3.79 (s, 6H), 3.68-3.58 (m, 2H), 3.58-3.44 (m, 2H), 2.81 (m, 1H), 2.01-1.70 (m, 4H), 0.75 (s, 9H), -0.11 (s, 3H), -0.06 (s, 3H). (Minor) 7.79-7.74 (m, 2H), 7.65-7.55 (m, 2H), 7.44-7.34 (m, 5H), 7.39-7.26 (m, 7H), 7.10 (m, 1H), 6.85-6.76 (m, 4H), 5.58 (d, J = 7.9 Hz, 1H. -NH), 4.66 (m, 1H), 3.70 (s, 6H), 3.25-3.13 (m, 2H), 2.01-1.70 (m, 4H), 0.87 (s, 9H), 0.04 (s, 3H), 0.03 (s, 3H).
化合物4の工程4と同様な手法により、化合物119を無色泡状物質として得た(化合物117からの収率69%)を得た。1H-NMRでは6:4のロータマー混合物として観測された。
1H-NMR(CDCl3)δ:(Major) 7.79-7.74 (m, 2H), 7.65-7.55 (m, 2H), 7.44-7.34 (m, 5H), 7.39-7.26 (m, 7H), 7.21 (m, 1H), 6.85-6.76 (m, 4H), 5.64 (d, J = 8.7 Hz, 1H. -NH), 4.58 (m, 1H), 4.38 (m, 1H), 4.38-4.26 (m, 2H), 4.18 (m, 1H), 3.79 (s, 6H), 3.68-3.58 (m, 2H), 3.58-3.44 (m, 2H), 2.81 (m, 1H), 2.01-1.70 (m, 4H), 0.75 (s, 9H), -0.11 (s, 3H), -0.06 (s, 3H). (Minor) 7.79-7.74 (m, 2H), 7.65-7.55 (m, 2H), 7.44-7.34 (m, 5H), 7.39-7.26 (m, 7H), 7.10 (m, 1H), 6.85-6.76 (m, 4H), 5.58 (d, J = 7.9 Hz, 1H. -NH), 4.66 (m, 1H), 3.70 (s, 6H), 3.25-3.13 (m, 2H), 2.01-1.70 (m, 4H), 0.87 (s, 9H), 0.04 (s, 3H), 0.03 (s, 3H).
工程4 化合物120の合成
工程2と同様の方法により、化合物120を粗生成物として得た。
工程5 化合物121の合成
化合物4の工程4と同様の手法により、化合物121を無色泡状物質として得た(化合物119からの収率46%)を得た。
ESI-MS (m/z): 854 (M +Na), 830 (M-H).
工程2と同様の方法により、化合物120を粗生成物として得た。
工程5 化合物121の合成
化合物4の工程4と同様の手法により、化合物121を無色泡状物質として得た(化合物119からの収率46%)を得た。
ESI-MS (m/z): 854 (M +Na), 830 (M-H).
工程6 化合物122の合成
化合物4の工程5と同様の手法により、化合物122を無色泡状物質として得た(収率90%)を得た。
ESI-MS (m/z): 816 (M - H).
1H-NMR(CDCl3)δ:7.42-7.35 (m, 2H), 7.32-7.24 (m, 6H), 7.19 (m, 1H), 6.82 (d, J = 8.7 Hz, 2H), 6.81 (d, J = 8.7 Hz, 2H), 4.94 (m, 1H, -NH), 4.35 (m, 1H), 3.79 (s, 6H), 3.75 (dd, J = 8.4, 4.8 Hz, 0.5H), 3.70-3.54 (m, 4H), 3.52 (dd, J = 8.4, 3.6 Hz, 0.5H), 3.25 (dd, J = 10.0, 5.6 Hz, 0.5H), 3.16 (dd, J = 10.0, 3.9 Hz, 0.5H), 2.81 (m, 1H), 2.40-2.30 (m, 2H), 2.19 (t, J = 8.0 Hz, 2H), 2.03-1.80 (m, 4H), 1.70-1.47 (m, 4H), 1.42-1.20 (m, 14H), 0.84 (s, 3H), 0.72 (s, 6H), -0.09 (s, 2H), -0.16 (s, 2H).
化合物4の工程5と同様の手法により、化合物122を無色泡状物質として得た(収率90%)を得た。
ESI-MS (m/z): 816 (M - H).
1H-NMR(CDCl3)δ:7.42-7.35 (m, 2H), 7.32-7.24 (m, 6H), 7.19 (m, 1H), 6.82 (d, J = 8.7 Hz, 2H), 6.81 (d, J = 8.7 Hz, 2H), 4.94 (m, 1H, -NH), 4.35 (m, 1H), 3.79 (s, 6H), 3.75 (dd, J = 8.4, 4.8 Hz, 0.5H), 3.70-3.54 (m, 4H), 3.52 (dd, J = 8.4, 3.6 Hz, 0.5H), 3.25 (dd, J = 10.0, 5.6 Hz, 0.5H), 3.16 (dd, J = 10.0, 3.9 Hz, 0.5H), 2.81 (m, 1H), 2.40-2.30 (m, 2H), 2.19 (t, J = 8.0 Hz, 2H), 2.03-1.80 (m, 4H), 1.70-1.47 (m, 4H), 1.42-1.20 (m, 14H), 0.84 (s, 3H), 0.72 (s, 6H), -0.09 (s, 2H), -0.16 (s, 2H).
工程7 化合物123の合成
化合物4の工程6と同様の手法により、化合物123を無色泡状物質として得た(収率61%)を得た。
ESI-MS (m/z): 1319 (M/2 + Na).
1H-NMR(CDCl3)δ:7.43-7.35 (m, 2H), 7.32-7.24 (m, 9H), 7.24-7.14 (m, 3H), 7.03-6.92 (m, 3H), 6.85-6.72 (m, 4H), 6.67-6.77 (m, 2H), 5.35 (d, J = 2.8 Hz, 3H, H-4 of GalNAc), 5.22-5.15 (m, 3H, H-3 of GalNAc), 4.61 (d, J = 8.3 Hz, 3H, H-1 of GalNAc), 4.21-4.03 (m, 9H), 3.98-3.88 (m, 6H), 3.78 (s, 6H), 3.78-3.53 (m, 14H), 3.53-3.47 (m, 3H), 3.38-3.18 (m, 14H), 2.46-2.40 (m, 6H), 2.32-2.16 (m, 6H), 2.18-2.12 (m, 4H), 2.15 (s, 9H), 2.05 (s, 9H), 2.00 (s, 9H), 1.95 (s, 9H), 1.80-1.50 (20H, m), 1.33-1.21 (18H, m).
工程8 化合物124の合成
化合物123(780mg、0.301mmol)のテトラヒドロフラン溶液(5ml)に室温で1mol/Lテトラブチルアンモニウムフロリドーテトラヒドロフラン溶液(0.451ml、1.55eq.)を加え、室温で12時間撹拌した後、反応液を減圧下濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィー(SiO2:24g、クロロホルム:メタノール:トリエチルアミン=95:5:1→75:251)により精製し、化合物124(635mg、収率85%)を得た。
ESI-MS (m/z): 1262 (M/2 + Na).
化合物4の工程6と同様の手法により、化合物123を無色泡状物質として得た(収率61%)を得た。
ESI-MS (m/z): 1319 (M/2 + Na).
1H-NMR(CDCl3)δ:7.43-7.35 (m, 2H), 7.32-7.24 (m, 9H), 7.24-7.14 (m, 3H), 7.03-6.92 (m, 3H), 6.85-6.72 (m, 4H), 6.67-6.77 (m, 2H), 5.35 (d, J = 2.8 Hz, 3H, H-4 of GalNAc), 5.22-5.15 (m, 3H, H-3 of GalNAc), 4.61 (d, J = 8.3 Hz, 3H, H-1 of GalNAc), 4.21-4.03 (m, 9H), 3.98-3.88 (m, 6H), 3.78 (s, 6H), 3.78-3.53 (m, 14H), 3.53-3.47 (m, 3H), 3.38-3.18 (m, 14H), 2.46-2.40 (m, 6H), 2.32-2.16 (m, 6H), 2.18-2.12 (m, 4H), 2.15 (s, 9H), 2.05 (s, 9H), 2.00 (s, 9H), 1.95 (s, 9H), 1.80-1.50 (20H, m), 1.33-1.21 (18H, m).
工程8 化合物124の合成
化合物123(780mg、0.301mmol)のテトラヒドロフラン溶液(5ml)に室温で1mol/Lテトラブチルアンモニウムフロリドーテトラヒドロフラン溶液(0.451ml、1.55eq.)を加え、室温で12時間撹拌した後、反応液を減圧下濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィー(SiO2:24g、クロロホルム:メタノール:トリエチルアミン=95:5:1→75:251)により精製し、化合物124(635mg、収率85%)を得た。
ESI-MS (m/z): 1262 (M/2 + Na).
工程9 化合物5の合成
化合物124(545mg、0.220mmol)のジクロロメタン溶液(4ml)に室温でトリエチルアミン(0.061ml、0.440mmol、2.0eq.)、無水コハク酸(33mg、0.330mmol、1.5eq.)、ジメチルアミノピリジン(5mg)を加え、室温で2時間撹拌した後、反応液を減圧下濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィー(SiO2:24g、クロロホルム:メタノール:トリエチルアミン=100:0:1→75:25:1)にて精製し、化合物5(471mg、収率83%)を無色粉末として得た。
ESI-MS (m/z): 1289 (M/2-H).
1H-NMR(CDCl3)δ:7.40-7.33 (m, 2H), 7.33-7.19 (m, 6H), 7.20 (m, 1H), 711-7.00 (m, 3H, -NH), 6.82 (d, J = 7.7 Hz, 4H), 6.67 (d, J = 7.8 Hz, 1H, -NH), 6.64 (br.s, 1H, -NH), 5.35 (d, J = 2.9 Hz, 3H, H-4 of GalNAc), 5.22-5.15 (m, 3H, H-3 of GalNAc), 5.12-5.01 (m, 2H), 4.61 (d, J = 8.3 Hz, 3H, H-1 of GalNAc), 4.31 (m, 1H), 4.28-4.00 (m, 9H), 3.98-3.88 (m, 6H), 3.79 (s, 6H), 3.73-3.50 (m, 12H), 3.58-3.47 (m, 3H), 3.49-3.21(m, 12H), 3.28-3.11 (m, 2H), 2.93-2.82 (m, 3H), 2.57-2.43 (m, 3H), 2.47-2.40 (m, 6H), 2.34-2.08 (m, 11H), 2.17 (s, 9H), 2.04 (s, 9H), 1.99 (s, 9H), 1.95 (s, 9H), 1.80-1.50 (24H, m), 1.34-1.22 (14H, m).
化合物124(545mg、0.220mmol)のジクロロメタン溶液(4ml)に室温でトリエチルアミン(0.061ml、0.440mmol、2.0eq.)、無水コハク酸(33mg、0.330mmol、1.5eq.)、ジメチルアミノピリジン(5mg)を加え、室温で2時間撹拌した後、反応液を減圧下濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィー(SiO2:24g、クロロホルム:メタノール:トリエチルアミン=100:0:1→75:25:1)にて精製し、化合物5(471mg、収率83%)を無色粉末として得た。
ESI-MS (m/z): 1289 (M/2-H).
1H-NMR(CDCl3)δ:7.40-7.33 (m, 2H), 7.33-7.19 (m, 6H), 7.20 (m, 1H), 711-7.00 (m, 3H, -NH), 6.82 (d, J = 7.7 Hz, 4H), 6.67 (d, J = 7.8 Hz, 1H, -NH), 6.64 (br.s, 1H, -NH), 5.35 (d, J = 2.9 Hz, 3H, H-4 of GalNAc), 5.22-5.15 (m, 3H, H-3 of GalNAc), 5.12-5.01 (m, 2H), 4.61 (d, J = 8.3 Hz, 3H, H-1 of GalNAc), 4.31 (m, 1H), 4.28-4.00 (m, 9H), 3.98-3.88 (m, 6H), 3.79 (s, 6H), 3.73-3.50 (m, 12H), 3.58-3.47 (m, 3H), 3.49-3.21(m, 12H), 3.28-3.11 (m, 2H), 2.93-2.82 (m, 3H), 2.57-2.43 (m, 3H), 2.47-2.40 (m, 6H), 2.34-2.08 (m, 11H), 2.17 (s, 9H), 2.04 (s, 9H), 1.99 (s, 9H), 1.95 (s, 9H), 1.80-1.50 (24H, m), 1.34-1.22 (14H, m).
工程1 化合物133の合成
化合物111(620mg、粗製)のジクロロメタン溶液(2.5ml)に室温でトリエチルアミン(0.169ml、1.22mmol)、無水コハク酸(89mg、0.893mmol)を加え、室温で2時間撹拌した後、反応液を減圧下濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィー(SiO2:24g、n-ヘキサン:酢酸エチル:トリエチルアミン=50:50:1→クロロホルム:メタノール:トリエチルアミン=95:5:1→75:25:1)にて精製し、化合物133(453mg、化合物109からの収率79%)を無色泡状物質として得た。
1H-NMR(CDCl3)δ:7.43 (d, J = 7.9 Hz, 2H), 7.31 (d, J = 8.7 Hz, 4H), 7.27 (d, J = 7.1 Hz, 2H), 7.20 (dd, J = 7.9, 7.1 Hz, 1H), 6.82 (d, J = 8.7 Hz, 4H), 6.59 (m, 1H, -NH), 4.14 (m, 1H), 3.80 (m, 1H), 3.79 (s, 6H), 3.71 (m, 1H), 3.71 (dd, J = 9.5, 6.5 Hz, 1H), 3.71 (dd, J = 8.7, 4.5 Hz, 1H), 3.08 (dd, J = 8.7, 5.8 Hz, 1H), 2.54 (t, J = 6.4 Hz, 2H), 2.46 (t, J = 6.4 Hz, 2H), 0.82 (s, 9H), 0.01 (s, 4H)
化合物111(620mg、粗製)のジクロロメタン溶液(2.5ml)に室温でトリエチルアミン(0.169ml、1.22mmol)、無水コハク酸(89mg、0.893mmol)を加え、室温で2時間撹拌した後、反応液を減圧下濃縮した。得られた残渣をシリカゲルカラムクロマトグラフィー(SiO2:24g、n-ヘキサン:酢酸エチル:トリエチルアミン=50:50:1→クロロホルム:メタノール:トリエチルアミン=95:5:1→75:25:1)にて精製し、化合物133(453mg、化合物109からの収率79%)を無色泡状物質として得た。
1H-NMR(CDCl3)δ:7.43 (d, J = 7.9 Hz, 2H), 7.31 (d, J = 8.7 Hz, 4H), 7.27 (d, J = 7.1 Hz, 2H), 7.20 (dd, J = 7.9, 7.1 Hz, 1H), 6.82 (d, J = 8.7 Hz, 4H), 6.59 (m, 1H, -NH), 4.14 (m, 1H), 3.80 (m, 1H), 3.79 (s, 6H), 3.71 (m, 1H), 3.71 (dd, J = 9.5, 6.5 Hz, 1H), 3.71 (dd, J = 8.7, 4.5 Hz, 1H), 3.08 (dd, J = 8.7, 5.8 Hz, 1H), 2.54 (t, J = 6.4 Hz, 2H), 2.46 (t, J = 6.4 Hz, 2H), 0.82 (s, 9H), 0.01 (s, 4H)
工程2 化合物134の合成
化合物4の工程6と同様な手法により、化合物134を無色泡状物質として得た(収率57%)。
1H-NMR(CDCl3)δ:7.40 (d, , J = 7.7 Hz, 2H), 7.28 (d, , J = 8.7 Hz, 4H), 7.26-7.24 (m, 2H), 7.20 (dd, , J = 7.7, 7.7 Hz, 1H), 7.02-6.89 (m, 3H, -NH), 6.84-6.74 (m, 3H, -NH), 6.82 (d, J = 8.7 Hz, 4H), 6.72 (br.s, 1H, -NH), 6.16 (m, 1H, -NH), 5.35 (d, J = 2.9 Hz, 3H, H-4 of GalNAc), 5.22-5.14 (m, 3H, H-3 of GalNAc), 4.62 (d, J = 8.4 Hz, 3H, H-1 of GalNAc), 4.21-4.02 (m, 10H), 3.97-3.87 (m, 6H), 3.80 (m, 1H), 3.79 (s, 6H), 3.69 (m, 1H), 3.65-3.58 (m, 12H), 3.55-3.47 (m, 3H), 3.35-3.19 (m, 12H), 3.18 (t, , J = 7.3 Hz, 2H), 2.49-2.42 (m, 4H), 2.42-2.35 (m, 6H), 2.27-2.18 (m, 6H), 2.14 (s, 9H), 2.04 (s, 9H), 1.99 (s, 9H), 1.95 (s, 9H), 1.79-1.52 (12H, m), 0.82 (s, 9H), 0.01 (s, 2H), -0.01 (s, 2H).
工程3 化合物135の合成
化合物4の工程7と同様の工程により、化合物135を無色粉末として得た(収率60%)。
ESI-MS (m/z): 1157 (M+Na).
工程4 化合物7の合成
化合物4の工程8と同様の手法により、化合物7を得る。
化合物4の工程6と同様な手法により、化合物134を無色泡状物質として得た(収率57%)。
1H-NMR(CDCl3)δ:7.40 (d, , J = 7.7 Hz, 2H), 7.28 (d, , J = 8.7 Hz, 4H), 7.26-7.24 (m, 2H), 7.20 (dd, , J = 7.7, 7.7 Hz, 1H), 7.02-6.89 (m, 3H, -NH), 6.84-6.74 (m, 3H, -NH), 6.82 (d, J = 8.7 Hz, 4H), 6.72 (br.s, 1H, -NH), 6.16 (m, 1H, -NH), 5.35 (d, J = 2.9 Hz, 3H, H-4 of GalNAc), 5.22-5.14 (m, 3H, H-3 of GalNAc), 4.62 (d, J = 8.4 Hz, 3H, H-1 of GalNAc), 4.21-4.02 (m, 10H), 3.97-3.87 (m, 6H), 3.80 (m, 1H), 3.79 (s, 6H), 3.69 (m, 1H), 3.65-3.58 (m, 12H), 3.55-3.47 (m, 3H), 3.35-3.19 (m, 12H), 3.18 (t, , J = 7.3 Hz, 2H), 2.49-2.42 (m, 4H), 2.42-2.35 (m, 6H), 2.27-2.18 (m, 6H), 2.14 (s, 9H), 2.04 (s, 9H), 1.99 (s, 9H), 1.95 (s, 9H), 1.79-1.52 (12H, m), 0.82 (s, 9H), 0.01 (s, 2H), -0.01 (s, 2H).
工程3 化合物135の合成
化合物4の工程7と同様の工程により、化合物135を無色粉末として得た(収率60%)。
ESI-MS (m/z): 1157 (M+Na).
工程4 化合物7の合成
化合物4の工程8と同様の手法により、化合物7を得る。
工程1 化合物136の合成
化合物7の工程1と同様な手法により、化合物136を無色泡状物質として得た(収率85%)。1H-NMRでは63:37のロータマー混合物として観測された。
ESI-MS (m/z): 703 (M-H).
1H-NMR(CDCl3)δ:(Major) 7.44-7.35 (m, 2H), 7.32-7.24 (m, 6H), 7.19 (dd, J=7.0, 7.0Hz, 1H), 7.13 (dd, J=8.0 Hz, 1H, -NH), 6.86-6.76 (m, 4H), 4.83 (m, 1H), 4.36 (m, 1H), 3.78 (s, 6H), 3.72-3.41 (m, 6H), 2.63-2.57 (m, 2H), 2.55-2.48 (m, 2H), 2.04-1.68 (m, 4H), 0.72 (s, 9H), -0.08 (s, 3H), -0.15 (s, 3H). (Minor) 7.44-7.35 (m, 2H), 7.32-7.24 (m, 6H), 7.19 (dd, J=7.0, 7.0Hz, 1H), 6.96 (dd, J=7.5 Hz, 1H, -NH), 6.86-6.76 (m, 4H), 4.89 (m, 1H), 4.36 (m, 1H), 3.78 (s, 6H), 3.72-3.41 (m, 6H), 2.63-2.57 (m, 2H), 2.55-2.48 (m, 2H), 2.04-1.68 (m, 4H), 0.85 (s, 9H), 0.03 (s, 3H), 0.01 (s, 3H).
工程2 化合物137の合成
化合物4の工程6と同様の手法により、化合物137を無色泡状物質として得た(収率50%)。1H-NMRでは70:30のロータマー混合物として観測された。
ESI-MS (m/z): 1263 (M/2+Na).
1H-NMR(CDCl3)δ:(Major) 7.38 (dd, J=7.8, 7.8Hz, 2H), 7.35-7.23 (m, 9H), 7.19 (dd, J=7.0, 7.0Hz, 1H), 7.12-6.86 (m, 4H), 6.85-6.77 (m, 6H), 6.68 (s, 1H), 5.35 (d, J = 2.8 Hz, 3H, H-4 of GalNAc), 5.25-5.17 (m, 3H, H-3 of GalNAc), 4.74 (m, 1H), 4.66-4.59 (m, 3H, H-1 of GalNAc), 4.22-3.98 (m, 9H), 3.97-3.86 (m, 6H), 3.79 (s, 6H), 3.75-3.57 (m, 16H), 3.57-3.39 (m, 5H), 3.36-3.11 (m, 13H), 2.51-2.45 (m, 4H), 2.44-2.36 (m, 8H), 2.30-2.13 (m, 8H), 2.15 (s, 9H), 2.04 (s, 9H), 2.00 (s, 9H), 1.95 (s, 9H), 1.78-1.52 (18H, m), 0.74 (s, 9H), -0.07 (s, 3H), -0.13 (s, 3H). (Minor) 7.38 (dd, J=7.8, 7.8Hz, 2H), 7.35-7.23 (m, 9H), 7.19 (dd, J=7.0, 7.0Hz, 1H), 7.12-6.86 (m, 4H), 6.85-6.77 (m, 6H), 6.64 (s, 1H), 5.35 (d, J = 2.8 Hz, 3H, H-4 of GalNAc), 5.25-5.17 (m, 3H, H-3 of GalNAc), 4.74 (m, 1H), 4.66-4.59 (m, 3H, H-1 of GalNAc), 4.22-3.98 (m, 9H), 3.97-3.86 (m, 6H), 3.79 (s, 6H), 3.75-3.57 (m, 16H), 3.57-3.39 (m, 5H), 3.36-3.11 (m, 13H), 2.51-2.45 (m, 4H), 2.44-2.36 (m, 8H), 2.30-2.13 (m, 8H), 2.15 (s, 9H), 2.04 (s, 9H), 2.00 (s, 9H), 1.95 (s, 9H), 1.78-1.52 (18H, m), 0.85 (s, 9H), 0.03 (s, 3H), 0.01 (s, 3H).
化合物7の工程1と同様な手法により、化合物136を無色泡状物質として得た(収率85%)。1H-NMRでは63:37のロータマー混合物として観測された。
ESI-MS (m/z): 703 (M-H).
1H-NMR(CDCl3)δ:(Major) 7.44-7.35 (m, 2H), 7.32-7.24 (m, 6H), 7.19 (dd, J=7.0, 7.0Hz, 1H), 7.13 (dd, J=8.0 Hz, 1H, -NH), 6.86-6.76 (m, 4H), 4.83 (m, 1H), 4.36 (m, 1H), 3.78 (s, 6H), 3.72-3.41 (m, 6H), 2.63-2.57 (m, 2H), 2.55-2.48 (m, 2H), 2.04-1.68 (m, 4H), 0.72 (s, 9H), -0.08 (s, 3H), -0.15 (s, 3H). (Minor) 7.44-7.35 (m, 2H), 7.32-7.24 (m, 6H), 7.19 (dd, J=7.0, 7.0Hz, 1H), 6.96 (dd, J=7.5 Hz, 1H, -NH), 6.86-6.76 (m, 4H), 4.89 (m, 1H), 4.36 (m, 1H), 3.78 (s, 6H), 3.72-3.41 (m, 6H), 2.63-2.57 (m, 2H), 2.55-2.48 (m, 2H), 2.04-1.68 (m, 4H), 0.85 (s, 9H), 0.03 (s, 3H), 0.01 (s, 3H).
工程2 化合物137の合成
化合物4の工程6と同様の手法により、化合物137を無色泡状物質として得た(収率50%)。1H-NMRでは70:30のロータマー混合物として観測された。
ESI-MS (m/z): 1263 (M/2+Na).
1H-NMR(CDCl3)δ:(Major) 7.38 (dd, J=7.8, 7.8Hz, 2H), 7.35-7.23 (m, 9H), 7.19 (dd, J=7.0, 7.0Hz, 1H), 7.12-6.86 (m, 4H), 6.85-6.77 (m, 6H), 6.68 (s, 1H), 5.35 (d, J = 2.8 Hz, 3H, H-4 of GalNAc), 5.25-5.17 (m, 3H, H-3 of GalNAc), 4.74 (m, 1H), 4.66-4.59 (m, 3H, H-1 of GalNAc), 4.22-3.98 (m, 9H), 3.97-3.86 (m, 6H), 3.79 (s, 6H), 3.75-3.57 (m, 16H), 3.57-3.39 (m, 5H), 3.36-3.11 (m, 13H), 2.51-2.45 (m, 4H), 2.44-2.36 (m, 8H), 2.30-2.13 (m, 8H), 2.15 (s, 9H), 2.04 (s, 9H), 2.00 (s, 9H), 1.95 (s, 9H), 1.78-1.52 (18H, m), 0.74 (s, 9H), -0.07 (s, 3H), -0.13 (s, 3H). (Minor) 7.38 (dd, J=7.8, 7.8Hz, 2H), 7.35-7.23 (m, 9H), 7.19 (dd, J=7.0, 7.0Hz, 1H), 7.12-6.86 (m, 4H), 6.85-6.77 (m, 6H), 6.64 (s, 1H), 5.35 (d, J = 2.8 Hz, 3H, H-4 of GalNAc), 5.25-5.17 (m, 3H, H-3 of GalNAc), 4.74 (m, 1H), 4.66-4.59 (m, 3H, H-1 of GalNAc), 4.22-3.98 (m, 9H), 3.97-3.86 (m, 6H), 3.79 (s, 6H), 3.75-3.57 (m, 16H), 3.57-3.39 (m, 5H), 3.36-3.11 (m, 13H), 2.51-2.45 (m, 4H), 2.44-2.36 (m, 8H), 2.30-2.13 (m, 8H), 2.15 (s, 9H), 2.04 (s, 9H), 2.00 (s, 9H), 1.95 (s, 9H), 1.78-1.52 (18H, m), 0.85 (s, 9H), 0.03 (s, 3H), 0.01 (s, 3H).
工程3 化合物138の合成
化合物5の工程8と同様の手法により、化合物138を無色泡状物質として得た(収率80%)。
工程4 化合物8の合成
化合物5の工程9と同様の手法により、化合物8を無色泡状物質として得た(収率82%)。
ESI-MS (m/z): 1255 (M/2+Na).
1H-NMR(CDCl3)δ:7.40-7.30 (m, 5H), 7.30-7.22 (m, 6H), 7.20 (m, 1H), 7.11-6.96 (m, 4H), 6.94-6.79 (m, 4H), 6.81 (d, J=8.1 Hz, 4H), 5.35 (d, J = 2.8 Hz, 3H, H-4 of GalNAc), 5.25-5.16 (m, 3H, H-3 of GalNAc), 4.62 (d, J = 8.3 Hz, 3H, H-1 of GalNAc), 4.35 (dd, J=11.4, 4.3Hz, 1H), 4.29 (m, 1H), 4.22-4.02 (m, 10H), 3.98-3.85 (m, 6H), 3.79 (s, 6H), 3.74-3.58 (m, 14H), 3.56-3.45 (m, 4H), 3.38-3.19 (m, 12H), 3.21-3.11 (m, 2H), 2.62-2.43 (m, 8H), 2.45-2.38 (m, 6H), 2.32-2.14 (m, 8H), 2.15 (s, 9H), 2.04 (s, 9H), 2.00 (s, 9H), 1.95 (s, 9H), 1.80-1.50 (18H, m).
化合物5の工程8と同様の手法により、化合物138を無色泡状物質として得た(収率80%)。
工程4 化合物8の合成
化合物5の工程9と同様の手法により、化合物8を無色泡状物質として得た(収率82%)。
ESI-MS (m/z): 1255 (M/2+Na).
1H-NMR(CDCl3)δ:7.40-7.30 (m, 5H), 7.30-7.22 (m, 6H), 7.20 (m, 1H), 7.11-6.96 (m, 4H), 6.94-6.79 (m, 4H), 6.81 (d, J=8.1 Hz, 4H), 5.35 (d, J = 2.8 Hz, 3H, H-4 of GalNAc), 5.25-5.16 (m, 3H, H-3 of GalNAc), 4.62 (d, J = 8.3 Hz, 3H, H-1 of GalNAc), 4.35 (dd, J=11.4, 4.3Hz, 1H), 4.29 (m, 1H), 4.22-4.02 (m, 10H), 3.98-3.85 (m, 6H), 3.79 (s, 6H), 3.74-3.58 (m, 14H), 3.56-3.45 (m, 4H), 3.38-3.19 (m, 12H), 3.21-3.11 (m, 2H), 2.62-2.43 (m, 8H), 2.45-2.38 (m, 6H), 2.32-2.14 (m, 8H), 2.15 (s, 9H), 2.04 (s, 9H), 2.00 (s, 9H), 1.95 (s, 9H), 1.80-1.50 (18H, m).
工程1 化合物140の合成
化合物7の工程1と同様な手法により、化合物140を無色泡状物質として得た(収率57%)。
ESI-MS (m/z): 663 (M-H).
1H-NMR(CDCl3)δ:7.39 (d, J = 7.3 Hz, 2H), 7.32-7.24 (m, 6H), 7.20 (dd, J = 7.3, 7.3 Hz, 1H), 7.02 (t, J = 5.5 Hz, NH), 6.84 (d, J = 10.6 Hz, NH), 6.82 (d, J = 8.6 Hz, 4H), 4.41 (ddd, J = 10.6, 6.8, 3.8 Hz), 4.05 (dd, J = 9.6, 3.8 Hz, 1H), 3.78 (s, 6H), 3.61 (dd, J = 9.6, 6.8 Hz, 1H), 3.49 (m, 1H), 3.41 (m, 1H), 3.22 (dt, J = 9.1, 6.0 Hz, 1H), 3.14 (dt, J = 9.1, 6.0 Hz, 1H), 2.66 (dt, J = 16.4, 6.3 Hz, 1H), 2.58 (dt, J = 16.4, 6.3 Hz, 1H), 2.48 (t, J = 6.3 Hz, 2H), 0.85 (s, 9H), 0.04 (s, 6H).
工程2 化合物141の合成
化合物4の工程6と同様の手法により、化合物141を無色泡状物質として得た(収率57%)。
ESI-MS (m/z): 1355 (M/2 + Na).
1H-NMR(CDCl3)δ:7.40 (d, J=7.8 Hz, 2H), 7.33-7.16 (m,12H), 7.08-6.86 (m, 3H), 6.85-6.71 (m, 4H), 6.81 (d, J=8.6 Hz, 2H), 5.39-5.31 (m, 3H, H-4 of GalNAc), 5.25-5.15 (m, 3H, H-3 of GalNAc), 4.62 (d, J=8.1 Hz, 3H, H-1 of GalNAc),4.38 (m, 1H), 4.22-3.97 (m, 10H), 3.97-3.86 (m, 6H), 3.79 (s, 6H), 3.71-3.56 (m, 14H), 3.55-3.45 (m, 3H), 3.40-3.06 (m, 15H), 2.63-2.44 (m, 4H), 2.43-2.34 (m, 6H), 2.32-2.16 (m, 4H), 2.15 (s, 9H), 2.04 (s, 9H), 1.99 (s, 9H), 1.94 (s, 9H), 1.79-1.52 (18H, m), 0.84 (s, 9H), 0.02 (s, 3H), 0.01 (s, 3H).
化合物7の工程1と同様な手法により、化合物140を無色泡状物質として得た(収率57%)。
ESI-MS (m/z): 663 (M-H).
1H-NMR(CDCl3)δ:7.39 (d, J = 7.3 Hz, 2H), 7.32-7.24 (m, 6H), 7.20 (dd, J = 7.3, 7.3 Hz, 1H), 7.02 (t, J = 5.5 Hz, NH), 6.84 (d, J = 10.6 Hz, NH), 6.82 (d, J = 8.6 Hz, 4H), 4.41 (ddd, J = 10.6, 6.8, 3.8 Hz), 4.05 (dd, J = 9.6, 3.8 Hz, 1H), 3.78 (s, 6H), 3.61 (dd, J = 9.6, 6.8 Hz, 1H), 3.49 (m, 1H), 3.41 (m, 1H), 3.22 (dt, J = 9.1, 6.0 Hz, 1H), 3.14 (dt, J = 9.1, 6.0 Hz, 1H), 2.66 (dt, J = 16.4, 6.3 Hz, 1H), 2.58 (dt, J = 16.4, 6.3 Hz, 1H), 2.48 (t, J = 6.3 Hz, 2H), 0.85 (s, 9H), 0.04 (s, 6H).
工程2 化合物141の合成
化合物4の工程6と同様の手法により、化合物141を無色泡状物質として得た(収率57%)。
ESI-MS (m/z): 1355 (M/2 + Na).
1H-NMR(CDCl3)δ:7.40 (d, J=7.8 Hz, 2H), 7.33-7.16 (m,12H), 7.08-6.86 (m, 3H), 6.85-6.71 (m, 4H), 6.81 (d, J=8.6 Hz, 2H), 5.39-5.31 (m, 3H, H-4 of GalNAc), 5.25-5.15 (m, 3H, H-3 of GalNAc), 4.62 (d, J=8.1 Hz, 3H, H-1 of GalNAc),4.38 (m, 1H), 4.22-3.97 (m, 10H), 3.97-3.86 (m, 6H), 3.79 (s, 6H), 3.71-3.56 (m, 14H), 3.55-3.45 (m, 3H), 3.40-3.06 (m, 15H), 2.63-2.44 (m, 4H), 2.43-2.34 (m, 6H), 2.32-2.16 (m, 4H), 2.15 (s, 9H), 2.04 (s, 9H), 1.99 (s, 9H), 1.94 (s, 9H), 1.79-1.52 (18H, m), 0.84 (s, 9H), 0.02 (s, 3H), 0.01 (s, 3H).
工程3 化合物142の合成
化合物5の工程8と同様の手法により、化合物142を無色泡状物質として得た(収率68%)。
ESI-MS (m/z): 1186 (M/2 + Na).
工程4 化合物9の合成
化合物5の工程9と同様の手法により、化合物9を無色泡状物質として得た(収率83%)。
ESI-MS (m/z): 1235 (M/2 + Na).
1H-NMR(CDCl3)δ:7.46 (m, 1H), 7.41 (d, J=7.6 Hz, 2H), 7.36-7.22 (m,11H), 7.19 (dd, J=7.0, 7.0Hz, 1H), 7.05 (m, 1H), 7.02-6.95 (m, 2H), 7.00 (br s, 1H), 6.86-6.77 (m, 2H), 6.81 (d, J=8.6 Hz, 4H), 5.39-5.32 (m, 3H, H-4 of GalNAc), 5.25-5.14 (m, 3H, H-3 of GalNAc), 4.62 (d, J=8.3Hz, H-1 of GalNAc), 4.56-4.39 (m, 2H), 4.22-4.03 (m, 9H), 3.98-3.91 (m, 6H), 3.79 (s, 6H), 3.70-3.55 (m, 13H), 3.55-3.46 (m, 4H), 3.35-3.14 (m, 15H), 2.63-2.47 (m, 5H), 2.47-2.34 (m, 9H), 2.29-2.16 (m, 6H), 2.14 (s, 9H), 2.04 (s, 9H), 1.99 (s, 9H), 1.94 (s, 9H), 1.79-1.52 (18H, m).
化合物5の工程8と同様の手法により、化合物142を無色泡状物質として得た(収率68%)。
ESI-MS (m/z): 1186 (M/2 + Na).
工程4 化合物9の合成
化合物5の工程9と同様の手法により、化合物9を無色泡状物質として得た(収率83%)。
ESI-MS (m/z): 1235 (M/2 + Na).
1H-NMR(CDCl3)δ:7.46 (m, 1H), 7.41 (d, J=7.6 Hz, 2H), 7.36-7.22 (m,11H), 7.19 (dd, J=7.0, 7.0Hz, 1H), 7.05 (m, 1H), 7.02-6.95 (m, 2H), 7.00 (br s, 1H), 6.86-6.77 (m, 2H), 6.81 (d, J=8.6 Hz, 4H), 5.39-5.32 (m, 3H, H-4 of GalNAc), 5.25-5.14 (m, 3H, H-3 of GalNAc), 4.62 (d, J=8.3Hz, H-1 of GalNAc), 4.56-4.39 (m, 2H), 4.22-4.03 (m, 9H), 3.98-3.91 (m, 6H), 3.79 (s, 6H), 3.70-3.55 (m, 13H), 3.55-3.46 (m, 4H), 3.35-3.14 (m, 15H), 2.63-2.47 (m, 5H), 2.47-2.34 (m, 9H), 2.29-2.16 (m, 6H), 2.14 (s, 9H), 2.04 (s, 9H), 1.99 (s, 9H), 1.94 (s, 9H), 1.79-1.52 (18H, m).
工程1 化合物144の合成
化合物143(10.0g,37.7mmol)の1,2-ジメトキシエタン溶液(100mL)に室温で(4-第三ブトキシカルボニル)フェニル)ボロン酸(9.21g、41.5mmol)、2mol/L 炭酸カリウム水溶液(56.6ml、113mmol)、PdCl2(dppf)(3.07g、3.77mmol)を加えた後、80℃で1時間撹拌した。冷却後、反応液を酢酸エチルで希釈した後、飽和食塩水にて洗浄、次いで硫酸マグネシウム乾燥後、溶媒を減圧留去した。得られた残渣にn-ヘキサンを加えて、粉末化した後、酢酸エチルおよびn-ヘキサンにて洗浄、70℃で減圧乾燥することにより、化合物144(13.5g、収率99%)を黒色粉末として得た。
1H-NMR(CDCl3)δ:8.64 (s, 1H), 8.11 (d, J = 8.0 Hz, 2H), 8.11 (d, J = 8.0 Hz, 1H), 8.10 (s, 1H), 8.05 (d, J = 8.7 Hz, 1H), 7.96 (d, J = 8.7 Hz, 1H), 7.82 (d, J = 8.0 Hz, 1H), 4.00 (s, 3H), 1.63 (s, 9H).
工程2 化合物145の合成
化合物144(3.0g,8.28mmol)のトリフルオロ酢酸(60ml)―ジクロロメタン(10ml)の懸濁し、25℃で1時間撹拌した。反応液より不溶物をろ取し、n-ヘキサンにて洗浄、70℃で減圧乾燥することにより、化合物145(13.5g、収率99%)を無色固体として得た。
1H-NMR(d6-DMSO)δ:8.71 (s, 1H), 8.44 (s, 1H), 8.29 (d, J = 8.7 Hz, 1H), 8.17 (d, J = 8.7 Hz, 1H), 8.12 (d, J = 8.2 Hz, 2H), 8.06 (d, J = 8.7 Hz, 1H), 8.02 (d, J = 8.7 Hz, 1H), 8.02 (d, J = 8.2 Hz, 1H), 3.96 (s, 3H).
化合物143(10.0g,37.7mmol)の1,2-ジメトキシエタン溶液(100mL)に室温で(4-第三ブトキシカルボニル)フェニル)ボロン酸(9.21g、41.5mmol)、2mol/L 炭酸カリウム水溶液(56.6ml、113mmol)、PdCl2(dppf)(3.07g、3.77mmol)を加えた後、80℃で1時間撹拌した。冷却後、反応液を酢酸エチルで希釈した後、飽和食塩水にて洗浄、次いで硫酸マグネシウム乾燥後、溶媒を減圧留去した。得られた残渣にn-ヘキサンを加えて、粉末化した後、酢酸エチルおよびn-ヘキサンにて洗浄、70℃で減圧乾燥することにより、化合物144(13.5g、収率99%)を黒色粉末として得た。
1H-NMR(CDCl3)δ:8.64 (s, 1H), 8.11 (d, J = 8.0 Hz, 2H), 8.11 (d, J = 8.0 Hz, 1H), 8.10 (s, 1H), 8.05 (d, J = 8.7 Hz, 1H), 7.96 (d, J = 8.7 Hz, 1H), 7.82 (d, J = 8.0 Hz, 1H), 4.00 (s, 3H), 1.63 (s, 9H).
工程2 化合物145の合成
化合物144(3.0g,8.28mmol)のトリフルオロ酢酸(60ml)―ジクロロメタン(10ml)の懸濁し、25℃で1時間撹拌した。反応液より不溶物をろ取し、n-ヘキサンにて洗浄、70℃で減圧乾燥することにより、化合物145(13.5g、収率99%)を無色固体として得た。
1H-NMR(d6-DMSO)δ:8.71 (s, 1H), 8.44 (s, 1H), 8.29 (d, J = 8.7 Hz, 1H), 8.17 (d, J = 8.7 Hz, 1H), 8.12 (d, J = 8.2 Hz, 2H), 8.06 (d, J = 8.7 Hz, 1H), 8.02 (d, J = 8.7 Hz, 1H), 8.02 (d, J = 8.2 Hz, 1H), 3.96 (s, 3H).
工程3 化合物146の合成
化合物4の工程4と同様の手法により、化合物146を無色固体として得た(収率74%)。
ESI-MS (m/z): 892 (M-H).
工程4 化合物147の合成
化合物4の工程5と同様に処理した後、シリカゲルカラムクロマトグラフィー(クロロホルム:メタノール:トリエチルアミン=97.5:2.5:1→90:10:1)にて精製することにより、化合物147を無色固体として得た(収率47%)。1H-NMRでは60:40のロータマー混合物として観測された。
ESI-MS (m/z): 878 (M+).
1H-NMR(CDCl3)δ:(Major) 8.56 (s, 1H), 8.11 (dd, J = 8.0, 1.3 Hz, 1H), 7.94 (d, J = 8.0 Hz, 1H), 7.93 (s, 1H), 7.91-7.84 (m, 3H), 7.67 (d, J = 8.0 Hz, 2H), 7.66 (m, 1H), 7.43 (d, J = 8.0 Hz, 2H), 7.36-7.18 (m, 7H), 6.85-6.74 (m, 4H), 5.06 (m, 1H), 4.43 (m, 1H), 3.93 (dd, 1H, J = 9.5, 5.5 Hz), 3.85-3.60 (m, 4H), 3.78 (s, 6H), 3.56 (dd, 1H, J = 9.0, 3.8 Hz), 3.28 (m, 1H), 2.07-1.78 (m, 4H), 0.77 (s, 9H), -0.02 (s, 3H), -0.08 (s, 3). (Minor) 8.61 (s, 1H), 8.16 (dd, J = 8.0, 1.3 Hz, 1H), 8.01 (s, 1H), 7.99 (d, J = 8.7 Hz, 1H), 7.91-7.84 (m, 3H), 7.73 (d, J = 8.0 Hz, 2H), 7.72 (m, 1H), 7.39 (d, J = 8.0 Hz, 2H), 7.36-7.18 (m, 7H), 6.85-6.74 (m, 4H), 5.15 (m, 1H), 4.52 (m, 1H), 4.00 (dd, 1H, J = 9.5, 4.7 Hz), 3.85-3.60 (m, 4H), 3.67 (s, 3H), 3.64 (s, 3H), 3.56 (dd, 1H, J = 9.0, 3.8 Hz), 3.23 (m, 1H), 2.07-1.78 (m, 4H), 0.89 (s, 9H), 0.07 (s, 3H), 0.06 (s, 3).
化合物4の工程4と同様の手法により、化合物146を無色固体として得た(収率74%)。
ESI-MS (m/z): 892 (M-H).
工程4 化合物147の合成
化合物4の工程5と同様に処理した後、シリカゲルカラムクロマトグラフィー(クロロホルム:メタノール:トリエチルアミン=97.5:2.5:1→90:10:1)にて精製することにより、化合物147を無色固体として得た(収率47%)。1H-NMRでは60:40のロータマー混合物として観測された。
ESI-MS (m/z): 878 (M+).
1H-NMR(CDCl3)δ:(Major) 8.56 (s, 1H), 8.11 (dd, J = 8.0, 1.3 Hz, 1H), 7.94 (d, J = 8.0 Hz, 1H), 7.93 (s, 1H), 7.91-7.84 (m, 3H), 7.67 (d, J = 8.0 Hz, 2H), 7.66 (m, 1H), 7.43 (d, J = 8.0 Hz, 2H), 7.36-7.18 (m, 7H), 6.85-6.74 (m, 4H), 5.06 (m, 1H), 4.43 (m, 1H), 3.93 (dd, 1H, J = 9.5, 5.5 Hz), 3.85-3.60 (m, 4H), 3.78 (s, 6H), 3.56 (dd, 1H, J = 9.0, 3.8 Hz), 3.28 (m, 1H), 2.07-1.78 (m, 4H), 0.77 (s, 9H), -0.02 (s, 3H), -0.08 (s, 3). (Minor) 8.61 (s, 1H), 8.16 (dd, J = 8.0, 1.3 Hz, 1H), 8.01 (s, 1H), 7.99 (d, J = 8.7 Hz, 1H), 7.91-7.84 (m, 3H), 7.73 (d, J = 8.0 Hz, 2H), 7.72 (m, 1H), 7.39 (d, J = 8.0 Hz, 2H), 7.36-7.18 (m, 7H), 6.85-6.74 (m, 4H), 5.15 (m, 1H), 4.52 (m, 1H), 4.00 (dd, 1H, J = 9.5, 4.7 Hz), 3.85-3.60 (m, 4H), 3.67 (s, 3H), 3.64 (s, 3H), 3.56 (dd, 1H, J = 9.0, 3.8 Hz), 3.23 (m, 1H), 2.07-1.78 (m, 4H), 0.89 (s, 9H), 0.07 (s, 3H), 0.06 (s, 3).
工程5 化合物148の合成
化合物4の工程6と同様の手法により、化合物148を無色泡状物質として得た(収率52%)。1H-NMRでは59:41のロータマー混合物として観測された。
ESI-MS (m/z): 1350 (M/2+H).
1H-NMR(CDCl3)δ: (Major) 8.40 (br.s, 1H), 8.11 (br.s, 1H), 8.08 (dd, J=8.5, 2.0Hz, 1H), 7.99-7.88 (m, 4H), 7.83 (m, 1H), 7.80 (d, J=8.3Hz, 2H), 7.45-7.41 (m, 2H), 7.36-7.08 (m, 12H), 6.93-6.86 (m, 3H), 6.85-6.81 (m, 4H), 6.77 (t, J=9.0Hz, 3H, -NH), 5.34 (d, J=3.0Hz, 3H, H-4 of GalNAc), 5.18 (dd, J=11.0, 3.0Hz, 3H, H-3 of GalNAc), 5.05 (m, 1H), 4.60 (d, J=8.0Hz, 3H, H-1 of GalNAc), 4.42 (m, 1H), 4.20-4.04 (m, 10H), 3.94-3.84 (m, 13H), 3.82-3.73 (m, 6H), 3.79 (s, 6H), 3.57-3.45 (m, 5H), 3.31-3.15 (m, 12H), 2.49 (t, J=5.5Hz, 6H), 2.26-2.11 (m, 8H), 2.14 (s, 9H), 2.04 (s, 9H), 1.99 (s, 9H), 1.92 (s, 9H), 1.81-1.49 (20H, m), 0.76 (s, 9H), -0.04 (s, 3H), -0.10 (s, 3H). (Minor) 8.40 (br.s, 1H), 8.11 (br.s, 1H), 8.08 (dd, J=8.5, 2.0Hz, 1H), 7.99-7.88 (m, 4H), 7.83 (m, 1H), 7.80 (d, J=8.3Hz, 2H), 7.40-7.36 (m, 2H), 7.36-7.08 (m, 12H), 6.93-6.86 (m, 3H), 6.85-6.81 (m, 4H), 6.77 (t, J=9.0Hz, 3H, -NH), 5.34 (d, J=3.0Hz, 3H, H-4 of GalNAc), 5.18 (dd, J=11.0, 3.0Hz, 3H, H-3 of GalNAc), 5.05 (m, 1H), 4.60 (d, J=8.0Hz, 3H, H-1 of GalNAc), 4.51 (m, 1H), 4.20-4.04 (m, 10H), 3.94-3.84 (m, 13H), 3.82-3.73 (m, 6H), 3.79 (s, 6H), 3.57-3.45 (m, 5H), 3.31-3.15 (m, 12H), 2.49 (t, J=5.5Hz, 6H), 2.26-2.11 (m, 8H), 2.14 (s, 9H), 2.04 (s, 9H), 1.99 (s, 9H), 1.92 (s, 9H), 1.81-1.49 (20H, m), 0.89 (s, 9H), -0.07 (s, 3H), -0.05 (s, 3H).
工程6 化合物149の合成
化合物5の工程8と同様の手法により、化合物149を無色泡状物質として得た(収率%)。
工程7 化合物14の合成
化合物5の工程9と同様の手法により、化合物14を無色泡状物質として得た(収率82%)。
ESI-MS (m/z): 1343 (M/2+H).
1H-NMR(CDCl3)δ: 7.99-7.87 (m, 4H), 7.84-7.75 (m, 3H), 7.47-7.35 (m, 2H), 7.34-7.25 (m, 7H), 7.25-7.06 (m, 6H), 6.94-6.73 (m, 5H), 6.83 (d, J = 8.5 Hz, 4H), 5.35 (d, J=3.0Hz, 3H, H-4 of GalNAc), 5.21-5.13 (m, 3H, H-3 of GalNAc), 4.59-4.53 (m, 3H, H-1 of GalNAc), 4.41-4.25 (m, 2H), 4.20-4.05 (m, 9H), 3.95-3.84 (m, 12H), 3.81-3.73 (m, 6H), 3.79 (s, 6H), 3.50-3.40 (m, 4H), 3.29-3.21 (m, 2H), 3.21-3.06 (m, 12H), 2.53-2.42 (m, 10H), 2.25-2.08 (m, 10H), 2.13 (s, 9H), 2.03 (s, 9H), 2.01 (s, 9H), 1.98 (s, 9H), 1.75-1.43 (18H, m).
化合物4の工程6と同様の手法により、化合物148を無色泡状物質として得た(収率52%)。1H-NMRでは59:41のロータマー混合物として観測された。
ESI-MS (m/z): 1350 (M/2+H).
1H-NMR(CDCl3)δ: (Major) 8.40 (br.s, 1H), 8.11 (br.s, 1H), 8.08 (dd, J=8.5, 2.0Hz, 1H), 7.99-7.88 (m, 4H), 7.83 (m, 1H), 7.80 (d, J=8.3Hz, 2H), 7.45-7.41 (m, 2H), 7.36-7.08 (m, 12H), 6.93-6.86 (m, 3H), 6.85-6.81 (m, 4H), 6.77 (t, J=9.0Hz, 3H, -NH), 5.34 (d, J=3.0Hz, 3H, H-4 of GalNAc), 5.18 (dd, J=11.0, 3.0Hz, 3H, H-3 of GalNAc), 5.05 (m, 1H), 4.60 (d, J=8.0Hz, 3H, H-1 of GalNAc), 4.42 (m, 1H), 4.20-4.04 (m, 10H), 3.94-3.84 (m, 13H), 3.82-3.73 (m, 6H), 3.79 (s, 6H), 3.57-3.45 (m, 5H), 3.31-3.15 (m, 12H), 2.49 (t, J=5.5Hz, 6H), 2.26-2.11 (m, 8H), 2.14 (s, 9H), 2.04 (s, 9H), 1.99 (s, 9H), 1.92 (s, 9H), 1.81-1.49 (20H, m), 0.76 (s, 9H), -0.04 (s, 3H), -0.10 (s, 3H). (Minor) 8.40 (br.s, 1H), 8.11 (br.s, 1H), 8.08 (dd, J=8.5, 2.0Hz, 1H), 7.99-7.88 (m, 4H), 7.83 (m, 1H), 7.80 (d, J=8.3Hz, 2H), 7.40-7.36 (m, 2H), 7.36-7.08 (m, 12H), 6.93-6.86 (m, 3H), 6.85-6.81 (m, 4H), 6.77 (t, J=9.0Hz, 3H, -NH), 5.34 (d, J=3.0Hz, 3H, H-4 of GalNAc), 5.18 (dd, J=11.0, 3.0Hz, 3H, H-3 of GalNAc), 5.05 (m, 1H), 4.60 (d, J=8.0Hz, 3H, H-1 of GalNAc), 4.51 (m, 1H), 4.20-4.04 (m, 10H), 3.94-3.84 (m, 13H), 3.82-3.73 (m, 6H), 3.79 (s, 6H), 3.57-3.45 (m, 5H), 3.31-3.15 (m, 12H), 2.49 (t, J=5.5Hz, 6H), 2.26-2.11 (m, 8H), 2.14 (s, 9H), 2.04 (s, 9H), 1.99 (s, 9H), 1.92 (s, 9H), 1.81-1.49 (20H, m), 0.89 (s, 9H), -0.07 (s, 3H), -0.05 (s, 3H).
工程6 化合物149の合成
化合物5の工程8と同様の手法により、化合物149を無色泡状物質として得た(収率%)。
工程7 化合物14の合成
化合物5の工程9と同様の手法により、化合物14を無色泡状物質として得た(収率82%)。
ESI-MS (m/z): 1343 (M/2+H).
1H-NMR(CDCl3)δ: 7.99-7.87 (m, 4H), 7.84-7.75 (m, 3H), 7.47-7.35 (m, 2H), 7.34-7.25 (m, 7H), 7.25-7.06 (m, 6H), 6.94-6.73 (m, 5H), 6.83 (d, J = 8.5 Hz, 4H), 5.35 (d, J=3.0Hz, 3H, H-4 of GalNAc), 5.21-5.13 (m, 3H, H-3 of GalNAc), 4.59-4.53 (m, 3H, H-1 of GalNAc), 4.41-4.25 (m, 2H), 4.20-4.05 (m, 9H), 3.95-3.84 (m, 12H), 3.81-3.73 (m, 6H), 3.79 (s, 6H), 3.50-3.40 (m, 4H), 3.29-3.21 (m, 2H), 3.21-3.06 (m, 12H), 2.53-2.42 (m, 10H), 2.25-2.08 (m, 10H), 2.13 (s, 9H), 2.03 (s, 9H), 2.01 (s, 9H), 1.98 (s, 9H), 1.75-1.43 (18H, m).
工程1 化合物151の合成
化合物150(18.1g,76.0mmol)とアクリル酸メチル(5.0g,5.23mmol)が溶解したテトラヒドロフラン溶液(100mL)に、0℃で水素化ナトリウム(116mg、2.90mmol)を加えた後、同温度で2時間撹拌した。反応液を酢酸エチルで希釈した後、飽和塩化アンモニウム水溶液、飽和食塩水にて洗浄、次いで硫酸マグネシウム乾燥後、溶媒を減圧留去した。得られた残渣をシリカゲルカラムクロマトグラフィー(SiO2:320g、n-ヘキサン:酢酸エチル=60:40→40:60)にて精製し、化合物151(11.8g、収率62%)を無色油状物として得た。
ESI-MS (m/z): 327 (M+H).
1H-NMR(CDCl3)δ:7.38-7.31 (m, 4H), 7.29 (m, 1H), 4.57 (s, 2H), 3.75 (t, J = 6.5 Hz, 2H), 3.71-3.60 (m,15H), 2.60 (t, J = 6.5 Hz, 2H).
工程2 化合物152の合成
化合物151(1.02g,3.13mmol)が溶解したメタノール(10mL)溶液に10%パラジウム炭素(200mg)を加え、常圧水素気流下、室温で12時間撹拌した後、反応液より触媒を濾別し、濾液を濃縮した。
得られた残渣をアセトニトリル(5ml)-水(5ml)の混合溶液に溶解した後、室温で2,2,6,6-テトラメチルピペリジン 1-オキシル(98mg,0.625mmol)、ヨードベンゼンジアセタート(2.22g,6.88mmol)を加え、同温度で1時間撹拌した。反応液を飽和炭酸水素ナトリウム溶液に空けた後、水層を酢酸エチルで洗浄した。得られた水層に2mol/L 塩酸を加えて、酸性にした後、クロロホルムにて抽出し、硫酸マグネシウム乾燥後、溶媒を減圧留去した。得られた残渣をシリカゲルカラムクロマトグラフィー(SiO2:30g、クロロホルム:メタノール=97.5:2.5→75:25→クロロホルム:メタノール:水=6:4:1)にて精製し、化合物152(483mg、収率62%)を無色油状物として得た。
ESI-MS (m/z): 251 (M+H).
1H-NMR(CDCl3)δ:4.09 (s, 2H), 3.76 (t, J = 6.6 Hz, 2H), 3.74-3.60 (m,8H), 3.69 (s, 3H), 2.61 (t, J = 6.6 Hz, 2H).
化合物150(18.1g,76.0mmol)とアクリル酸メチル(5.0g,5.23mmol)が溶解したテトラヒドロフラン溶液(100mL)に、0℃で水素化ナトリウム(116mg、2.90mmol)を加えた後、同温度で2時間撹拌した。反応液を酢酸エチルで希釈した後、飽和塩化アンモニウム水溶液、飽和食塩水にて洗浄、次いで硫酸マグネシウム乾燥後、溶媒を減圧留去した。得られた残渣をシリカゲルカラムクロマトグラフィー(SiO2:320g、n-ヘキサン:酢酸エチル=60:40→40:60)にて精製し、化合物151(11.8g、収率62%)を無色油状物として得た。
ESI-MS (m/z): 327 (M+H).
1H-NMR(CDCl3)δ:7.38-7.31 (m, 4H), 7.29 (m, 1H), 4.57 (s, 2H), 3.75 (t, J = 6.5 Hz, 2H), 3.71-3.60 (m,15H), 2.60 (t, J = 6.5 Hz, 2H).
工程2 化合物152の合成
化合物151(1.02g,3.13mmol)が溶解したメタノール(10mL)溶液に10%パラジウム炭素(200mg)を加え、常圧水素気流下、室温で12時間撹拌した後、反応液より触媒を濾別し、濾液を濃縮した。
得られた残渣をアセトニトリル(5ml)-水(5ml)の混合溶液に溶解した後、室温で2,2,6,6-テトラメチルピペリジン 1-オキシル(98mg,0.625mmol)、ヨードベンゼンジアセタート(2.22g,6.88mmol)を加え、同温度で1時間撹拌した。反応液を飽和炭酸水素ナトリウム溶液に空けた後、水層を酢酸エチルで洗浄した。得られた水層に2mol/L 塩酸を加えて、酸性にした後、クロロホルムにて抽出し、硫酸マグネシウム乾燥後、溶媒を減圧留去した。得られた残渣をシリカゲルカラムクロマトグラフィー(SiO2:30g、クロロホルム:メタノール=97.5:2.5→75:25→クロロホルム:メタノール:水=6:4:1)にて精製し、化合物152(483mg、収率62%)を無色油状物として得た。
ESI-MS (m/z): 251 (M+H).
1H-NMR(CDCl3)δ:4.09 (s, 2H), 3.76 (t, J = 6.6 Hz, 2H), 3.74-3.60 (m,8H), 3.69 (s, 3H), 2.61 (t, J = 6.6 Hz, 2H).
工程3 化合物153の合成
化合物4の工程4と同様な手法により、化合物153を無色油状物として得た(収率70%)。1H-NMRでは60:40のロータマー混合物として観測された。
ESI-MS (m/z): 859 (M+Na).
1H-NMR(CDCl3)δ:(Major) 7.40 (d, J = 8.0 Hz, 2H), 7.32-7.22 (m, 7H), 7.19 (m,1H), 6.84-6.78 (m, 4H), 4.87 (m, 1H), 4.38 (m, 1H), 4.02 (d, 1H, J = 14.3 Hz), 3.96 (d, 1H, J = 14.3 Hz), 3.86-3.53 (m, 18H), 3.76 (s, 6H), 3.49 (dd, 1H, J = 8.7, 3.4 Hz), 2.60 (t, 2H, J = 6.5 Hz), 2.03-1.71 (m, 4H), 0.74 (s, 9H), -0.07 (s, 3H), -0.13 (s, 3). (Minor) 7.37 (d, J = 8.0 Hz, 2H), 7.32-7.22 (m, 7H), 7.19 (m,1H), 6.84-6.78 (m, 4H), 4.94 (m, 1H), 4.38 (m, 1H), 3.86-3.53 (m, 18H), 3.76 (s, 6H), 3.49 (dd, 1H, J = 8.7, 3.4 Hz), 3.17 (m, 1H), 3.13 (m, 1H), 2.03-1.71 (m, 4H), 0.86 (s, 9H), 0.03 (s, 3H), 0.02 (s, 3).
工程4 化合物154の合成
化合物4の工程5と同様に処理した後、シリカゲルカラムクロマトグラフィー(クロロホルム:メタノール:トリエチルアミン=97.5:2.5:1→85:15:1)にて精製することにより、化合物154を無色泡状物質として得た(収率74%)。1H-NMRでは65:35のロータマー混合物として観測された。
1H-NMR(CDCl3)δ:(Major) 8.56 (s, 1H), 8.11 (dd, J = 8.0, 1.3 Hz, 1H), 7.94 (d, J = 8.0 Hz, 1H), 7.93 (s, 1H), 7.91-7.84 (m, 3H), 7.67 (d, J = 8.0 Hz, 2H), 7.66 (m, 1H), 7.43 (d, J = 8.0 Hz, 2H), 7.36-7.18 (m, 7H), 6.85-6.74 (m, 4H), 5.06 (m, 1H), 4.43 (m, 1H), 3.93 (dd, 1H, J = 9.5, 5.5 Hz), 3.85-3.60 (m, 4H), 3.78 (s, 6H), 3.56 (dd, 1H, J = 9.0, 3.8 Hz), 3.28 (m, 1H), 2.07-1.78 (m, 4H), 0.77 (s, 9H), -0.02 (s, 3H), -0.08 (s, 3). (Minor) 8.61 (s, 1H), 8.16 (dd, J = 8.0, 1.3 Hz, 1H), 8.01 (s, 1H), 7.99 (d, J = 8.7 Hz, 1H), 7.91-7.84 (m, 3H), 7.73 (d, J = 8.0 Hz, 2H), 7.72 (m, 1H), 7.39 (d, J = 8.0 Hz, 2H), 7.36-7.18 (m, 7H), 6.85-6.74 (m, 4H), 5.15 (m, 1H), 4.52 (m, 1H), 4.00 (dd, 1H, J = 9.5, 4.7 Hz), 3.85-3.60 (m, 4H), 3.67 (s, 3H), 3.64 (s, 3H), 3.56 (dd, 1H, J = 9.0, 3.8 Hz), 3.23 (m, 1H), 2.07-1.78 (m, 4H), 0.89 (s, 9H), 0.07 (s, 3H), 0.06 (s, 3).
化合物4の工程4と同様な手法により、化合物153を無色油状物として得た(収率70%)。1H-NMRでは60:40のロータマー混合物として観測された。
ESI-MS (m/z): 859 (M+Na).
1H-NMR(CDCl3)δ:(Major) 7.40 (d, J = 8.0 Hz, 2H), 7.32-7.22 (m, 7H), 7.19 (m,1H), 6.84-6.78 (m, 4H), 4.87 (m, 1H), 4.38 (m, 1H), 4.02 (d, 1H, J = 14.3 Hz), 3.96 (d, 1H, J = 14.3 Hz), 3.86-3.53 (m, 18H), 3.76 (s, 6H), 3.49 (dd, 1H, J = 8.7, 3.4 Hz), 2.60 (t, 2H, J = 6.5 Hz), 2.03-1.71 (m, 4H), 0.74 (s, 9H), -0.07 (s, 3H), -0.13 (s, 3). (Minor) 7.37 (d, J = 8.0 Hz, 2H), 7.32-7.22 (m, 7H), 7.19 (m,1H), 6.84-6.78 (m, 4H), 4.94 (m, 1H), 4.38 (m, 1H), 3.86-3.53 (m, 18H), 3.76 (s, 6H), 3.49 (dd, 1H, J = 8.7, 3.4 Hz), 3.17 (m, 1H), 3.13 (m, 1H), 2.03-1.71 (m, 4H), 0.86 (s, 9H), 0.03 (s, 3H), 0.02 (s, 3).
工程4 化合物154の合成
化合物4の工程5と同様に処理した後、シリカゲルカラムクロマトグラフィー(クロロホルム:メタノール:トリエチルアミン=97.5:2.5:1→85:15:1)にて精製することにより、化合物154を無色泡状物質として得た(収率74%)。1H-NMRでは65:35のロータマー混合物として観測された。
1H-NMR(CDCl3)δ:(Major) 8.56 (s, 1H), 8.11 (dd, J = 8.0, 1.3 Hz, 1H), 7.94 (d, J = 8.0 Hz, 1H), 7.93 (s, 1H), 7.91-7.84 (m, 3H), 7.67 (d, J = 8.0 Hz, 2H), 7.66 (m, 1H), 7.43 (d, J = 8.0 Hz, 2H), 7.36-7.18 (m, 7H), 6.85-6.74 (m, 4H), 5.06 (m, 1H), 4.43 (m, 1H), 3.93 (dd, 1H, J = 9.5, 5.5 Hz), 3.85-3.60 (m, 4H), 3.78 (s, 6H), 3.56 (dd, 1H, J = 9.0, 3.8 Hz), 3.28 (m, 1H), 2.07-1.78 (m, 4H), 0.77 (s, 9H), -0.02 (s, 3H), -0.08 (s, 3). (Minor) 8.61 (s, 1H), 8.16 (dd, J = 8.0, 1.3 Hz, 1H), 8.01 (s, 1H), 7.99 (d, J = 8.7 Hz, 1H), 7.91-7.84 (m, 3H), 7.73 (d, J = 8.0 Hz, 2H), 7.72 (m, 1H), 7.39 (d, J = 8.0 Hz, 2H), 7.36-7.18 (m, 7H), 6.85-6.74 (m, 4H), 5.15 (m, 1H), 4.52 (m, 1H), 4.00 (dd, 1H, J = 9.5, 4.7 Hz), 3.85-3.60 (m, 4H), 3.67 (s, 3H), 3.64 (s, 3H), 3.56 (dd, 1H, J = 9.0, 3.8 Hz), 3.23 (m, 1H), 2.07-1.78 (m, 4H), 0.89 (s, 9H), 0.07 (s, 3H), 0.06 (s, 3).
工程5 化合物155の合成
化合物4の工程6と同様の手法により、化合物155を無色泡状物質として得た(収率46%)。1H-NMRでは60:40のロータマー混合物として観測された。
1H-NMR(CDCl3)δ:(Major) 7.42-7.35 (m, 2H), 7.33-7.15 (m, 11H), 7.04-6.92 (m, 3H), 6.85-6.76 (m, 6H), 6.75-6.68 (m, 2H), 5.35 (d, J=3.0Hz, 3H, H-4 of GalNAc), 5.25-5.20 (m, 3H, H-3 of GalNAc), 4.84 (m, 1H), 4.66-4.59 (m, 3H, H-1 of GalNAc), 4.35 (m, 1H), 4.22-3.98 (m, 11H), 3.98-3.88 (m, 6H), 3.79 (s, 6H), 3.75-3.57 (m, 27H), 3.55-3.41 (m, 4H), 3.37-3.12 (m, 12H), 2.47-2.19 (m, 8H), 2.32-2.17 (m, 8H), 2.15 (s, 9H), 2.05 (s, 9H), 1.99 (s, 9H), 1.95 (s, 9H), 1.99-1.52 (m, 20H), 0.75 (s, 9H), -0.06 (s, 3H), -0.11 (s, 3H) (Minor) 7.42-7.35 (m, 2H), 7.33-7.15 (m, 11H), 7.04-6.92 (m, 3H), 6.85-6.76 (m, 6H), 6.75-6.68 (m, 2H), 5.35 (d, J=3.0Hz, 3H, H-4 of GalNAc), 5.25-5.20 (m, 3H, H-3 of GalNAc), 4.92 (m, 1H), 4.66-4.59 (m, 3H, H-1 of GalNAc), 4.40 (m, 1H), 4.22-3.98 (m, 11H), 3.98-3.88 (m, 6H), 3.79 (s, 6H), 3.75-3.57 (m, 27H), 3.55-3.41 (m, 4H), 3.37-3.12 (m, 12H), 2.47-2.19 (m, 8H), 2.32-2.17 (m, 8H), 2.15 (s, 9H), 2.05 (s, 9H), 1.99 (s, 9H), 1.95 (s, 9H), 1.99-1.52 (m, 20H), 0.86 (s, 9H), 0.03 (s, 3H), 0.02 (s, 3H).
工程6 化合物156の合成
化合物5の工程8と同様の手法により、化合物156を無色泡状物質として得た(収率66%)。
ESI-MS (m/z): 1242 (M/2+H).
工程7 化合物18の合成
化合物5の工程9と同様の手法により、化合物18を無色泡状物質として得た(収率75%)。
ESI-MS (m/z): 1315 (M/2 + Na).
1H-NMR(CDCl3)δ:7.60 (m, 1H), 7.37 (dd, J=7.5, 7.5Hz, 2H), 7.38-7.30 (m, 9H), 7.20 (m, 1H), 7.13-6.98 (m, 3H), 6.94-6.76 (m, 4H), 6.82 (d, J=8.6 Hz, 4H), 5.35 (d, J=3.1Hz, 3H, H-4 of GalNAc), 5.20 (dd, J=11.0, 3.1Hz, 3H, H-3 of GalNAc), 5.07 (m, 1H), 4.62 (d, J=8.4Hz, 3H, H-1 of GalNAc), 4.26-3.98 (m, 12H), 3.97-3.88 (m, 6H), 3.79 (s, 6H), 3.75-3.58 (m, 24H), 3.55-3.46 (m, 4H), 3.40-3.21 (m, 12H), 3.22-3.14 (m, 2H), 2.87-2.77 (m, 2H), 2.56 (br s, 2H), 2.54-2.46 (m, 2H), 2.46-2.38 (m, 8H), 2.32-2.18 (m, 8H), 2.15 (s, 9H), 2.04 (s, 9H), 1.99 (s, 9H), 1.95 (s, 9H), 1.80-1.52 (18H, m).
化合物4の工程6と同様の手法により、化合物155を無色泡状物質として得た(収率46%)。1H-NMRでは60:40のロータマー混合物として観測された。
1H-NMR(CDCl3)δ:(Major) 7.42-7.35 (m, 2H), 7.33-7.15 (m, 11H), 7.04-6.92 (m, 3H), 6.85-6.76 (m, 6H), 6.75-6.68 (m, 2H), 5.35 (d, J=3.0Hz, 3H, H-4 of GalNAc), 5.25-5.20 (m, 3H, H-3 of GalNAc), 4.84 (m, 1H), 4.66-4.59 (m, 3H, H-1 of GalNAc), 4.35 (m, 1H), 4.22-3.98 (m, 11H), 3.98-3.88 (m, 6H), 3.79 (s, 6H), 3.75-3.57 (m, 27H), 3.55-3.41 (m, 4H), 3.37-3.12 (m, 12H), 2.47-2.19 (m, 8H), 2.32-2.17 (m, 8H), 2.15 (s, 9H), 2.05 (s, 9H), 1.99 (s, 9H), 1.95 (s, 9H), 1.99-1.52 (m, 20H), 0.75 (s, 9H), -0.06 (s, 3H), -0.11 (s, 3H) (Minor) 7.42-7.35 (m, 2H), 7.33-7.15 (m, 11H), 7.04-6.92 (m, 3H), 6.85-6.76 (m, 6H), 6.75-6.68 (m, 2H), 5.35 (d, J=3.0Hz, 3H, H-4 of GalNAc), 5.25-5.20 (m, 3H, H-3 of GalNAc), 4.92 (m, 1H), 4.66-4.59 (m, 3H, H-1 of GalNAc), 4.40 (m, 1H), 4.22-3.98 (m, 11H), 3.98-3.88 (m, 6H), 3.79 (s, 6H), 3.75-3.57 (m, 27H), 3.55-3.41 (m, 4H), 3.37-3.12 (m, 12H), 2.47-2.19 (m, 8H), 2.32-2.17 (m, 8H), 2.15 (s, 9H), 2.05 (s, 9H), 1.99 (s, 9H), 1.95 (s, 9H), 1.99-1.52 (m, 20H), 0.86 (s, 9H), 0.03 (s, 3H), 0.02 (s, 3H).
工程6 化合物156の合成
化合物5の工程8と同様の手法により、化合物156を無色泡状物質として得た(収率66%)。
ESI-MS (m/z): 1242 (M/2+H).
工程7 化合物18の合成
化合物5の工程9と同様の手法により、化合物18を無色泡状物質として得た(収率75%)。
ESI-MS (m/z): 1315 (M/2 + Na).
1H-NMR(CDCl3)δ:7.60 (m, 1H), 7.37 (dd, J=7.5, 7.5Hz, 2H), 7.38-7.30 (m, 9H), 7.20 (m, 1H), 7.13-6.98 (m, 3H), 6.94-6.76 (m, 4H), 6.82 (d, J=8.6 Hz, 4H), 5.35 (d, J=3.1Hz, 3H, H-4 of GalNAc), 5.20 (dd, J=11.0, 3.1Hz, 3H, H-3 of GalNAc), 5.07 (m, 1H), 4.62 (d, J=8.4Hz, 3H, H-1 of GalNAc), 4.26-3.98 (m, 12H), 3.97-3.88 (m, 6H), 3.79 (s, 6H), 3.75-3.58 (m, 24H), 3.55-3.46 (m, 4H), 3.40-3.21 (m, 12H), 3.22-3.14 (m, 2H), 2.87-2.77 (m, 2H), 2.56 (br s, 2H), 2.54-2.46 (m, 2H), 2.46-2.38 (m, 8H), 2.32-2.18 (m, 8H), 2.15 (s, 9H), 2.04 (s, 9H), 1.99 (s, 9H), 1.95 (s, 9H), 1.80-1.52 (18H, m).
工程1 化合物157の合成
国際公開第2011/148922号に記載の方法に従って合成した。
工程2 化合物158の合成
Bioorganic Medicinal Chemistry Letters,11,383―386(2001)に記載の方法と同様な手法にて、化合物157より化合物158を2工程で合成した。
工程3 化合物159の合成
化合物4の工程2および工程3と同様の手法にて反応し、シリカゲルカラムクロマトグラフィー(SiO2:320g、n-ヘキサン:酢酸エチル:トリエチルアミン=200:100:3)により精製することにより、化合物159を無色泡状物質として得た(収率91%)。
1H-NMR(CDCl3)δ:7.44-7.41 (m, 2H), 7.34-7.28 (m, 4H), 7.27-7.25 (m, 2H), 7.19(m, 1H), 6.84-6.79 (m, 4H), 3.78 (s, 6H), 3.68 (dd, J=10.0, 5.9 Hz, 1H), 3.63 (dd, J=10.0, 5.6 Hz, 1H), 3H), 3.15 (dd, J=9.2, 5.3 Hz, 1H), 3.63 (dd, J=9.2, 5.9 Hz, 1H), 2.68 (m, 1H), 2.35 (s, 3H), 0.85 (s, 9H), 0.02 (s, 6H).
国際公開第2011/148922号に記載の方法に従って合成した。
工程2 化合物158の合成
Bioorganic Medicinal Chemistry Letters,11,383―386(2001)に記載の方法と同様な手法にて、化合物157より化合物158を2工程で合成した。
工程3 化合物159の合成
化合物4の工程2および工程3と同様の手法にて反応し、シリカゲルカラムクロマトグラフィー(SiO2:320g、n-ヘキサン:酢酸エチル:トリエチルアミン=200:100:3)により精製することにより、化合物159を無色泡状物質として得た(収率91%)。
1H-NMR(CDCl3)δ:7.44-7.41 (m, 2H), 7.34-7.28 (m, 4H), 7.27-7.25 (m, 2H), 7.19(m, 1H), 6.84-6.79 (m, 4H), 3.78 (s, 6H), 3.68 (dd, J=10.0, 5.9 Hz, 1H), 3.63 (dd, J=10.0, 5.6 Hz, 1H), 3H), 3.15 (dd, J=9.2, 5.3 Hz, 1H), 3.63 (dd, J=9.2, 5.9 Hz, 1H), 2.68 (m, 1H), 2.35 (s, 3H), 0.85 (s, 9H), 0.02 (s, 6H).
工程4 化合物160の合成
化合物4の工程4と同様の手法により、化合物160を無色泡状物質として得た(収率52%)。1H-NMRでは57:43のロータマー混合物として観測された。
1H-NMR(CDCl3)δ:(Major) 7.42 (m, 2H), 7.32-7.23 (m, 6H), 7.21 (dd, J=7.3, 7.3 Hz, 1H), 6.84-6.76 (m, 4H), 4.15 (m, 1H), 3.79 (s, 3H), 3.78 (s, 3H), 3.71 (m, 1H), 3.66 (s, 3H), 3.59-3.51 (m, 1H), 3.17-3.12 (m, 2H), 2.67 (s, 3H), 2.48 (m, 1H), 2.34-2.25 (m, 3H), 1.73-1.54 (m, 4H), 1.40-1.25 (m, 12H), 0.81 (s, 9H), -0.02 (s, 3H), -0.03 (s, 3H) . (Minor) 7.42 (m, 2H), 7.32-7.23 (m, 6H), 7.21 (dd, J=7.3, 7.3 Hz, 1H), 6.84-6.76 (m, 4H), 4.79 (m, 1H), 3.79 (s, 3H), 3.78 (s, 3H), 3.71 (m, 1H), 3.66 (s, 3H), 3.59-3.51 (m, 1H), 3.28 (dd, J=9.5, 5.0 Hz, 1H), 3.18 (dd, J=9.5, 8.0 Hz, 1H), 2.89 (s, 3H), 2.48 (m, 1H), 2.34-2.25 (m, 3H), 1.73-1.54 (m, 4H), 1.40-1.25 (m, 12H), 0.78 (s, 9H), -0.04 (s, 6H)
工程5 化合物161の合成
化合物4の工程5と同様の手法により、化合物161を無色泡状物質として得た(収率90%)。
化合物4の工程4と同様の手法により、化合物160を無色泡状物質として得た(収率52%)。1H-NMRでは57:43のロータマー混合物として観測された。
1H-NMR(CDCl3)δ:(Major) 7.42 (m, 2H), 7.32-7.23 (m, 6H), 7.21 (dd, J=7.3, 7.3 Hz, 1H), 6.84-6.76 (m, 4H), 4.15 (m, 1H), 3.79 (s, 3H), 3.78 (s, 3H), 3.71 (m, 1H), 3.66 (s, 3H), 3.59-3.51 (m, 1H), 3.17-3.12 (m, 2H), 2.67 (s, 3H), 2.48 (m, 1H), 2.34-2.25 (m, 3H), 1.73-1.54 (m, 4H), 1.40-1.25 (m, 12H), 0.81 (s, 9H), -0.02 (s, 3H), -0.03 (s, 3H) . (Minor) 7.42 (m, 2H), 7.32-7.23 (m, 6H), 7.21 (dd, J=7.3, 7.3 Hz, 1H), 6.84-6.76 (m, 4H), 4.79 (m, 1H), 3.79 (s, 3H), 3.78 (s, 3H), 3.71 (m, 1H), 3.66 (s, 3H), 3.59-3.51 (m, 1H), 3.28 (dd, J=9.5, 5.0 Hz, 1H), 3.18 (dd, J=9.5, 8.0 Hz, 1H), 2.89 (s, 3H), 2.48 (m, 1H), 2.34-2.25 (m, 3H), 1.73-1.54 (m, 4H), 1.40-1.25 (m, 12H), 0.78 (s, 9H), -0.04 (s, 6H)
工程5 化合物161の合成
化合物4の工程5と同様の手法により、化合物161を無色泡状物質として得た(収率90%)。
工程6 化合物162の合成
化合物4の工程6と同様の手法により、化合物162を無色泡状物質として得た(収率51%)。1H-NMRでは58:42のロータマー混合物として観測された。
1H-NMR(CDCl3)δ:(Major) 7.39 (dd, J=9.3, 9.3 Hz, 2H), 7.33-7.23 (m, 9H), 7.21 (dd, J=7.5, 7.5Hz, 1H), 7.14-7.00 (m, 3H, -NH), 6.98-6.86 (m, 3H), 6.84-6.81 (m, 4H), 6.62 (m, 1H, -NH), 5.39-5.33 (m, 3H, H-4 of GalNAc), 5.23-5.16 (m, 3H, H-3 of GalNAc), 4.65-4.59 (m, 3H, H-1 of GalNAc), 4.21-4.04 (m, 10H), 3.98-3.83 (m, 6H), 3.791 (s, 6H), 3.73-3.63 (m, 13H), 3.59-3.55 (m, 2H), 3.55-3.46 (m, 3H), 3.37-3.20 (m, 12H), 3.19-3.13 (m, 2H), 2.69-2.65 (m, 3H), 2.47-2.39 (m, 6H), 2.37-2.13 (m, 10H), 2.15 (s, 9H), 2.04 (s, 9H), 2.00 (s, 9H), 1.95 (s, 9H), 1.80-1.51 (18H, m), 1.40-1.24 (12H, m), 0.81 (s, 9H), -0.018 (s, 3H), -0.04 (s, 3H). (Minor) 7.39 (dd, J=9.3, 9.3 Hz, 2H), 7.33-7.23 (m, 9H), 7.21 (dd, J=7.5, 7.5Hz, 1H), 7.14-7.00 (m, 3H, -NH), 6.98-6.86 (m, 3H), 6.84-6.81 (m, 4H), 6.62 (m, 1H, -NH), 5.39-5.33 (m, 3H, H-4 of GalNAc), 5.23-5.16 (m, 3H, H-3 of GalNAc), 4.65-4.59 (m, 3H, H-1 of GalNAc), 4.21-4.04 (m, 10H), 3.98-3.83 (m, 6H), 3.785 (s, 6H), 3.73-3.63 (m, 13H), 3.59-3.55 (m, 2H), 3.55-3.46 (m, 3H), 3.37-3.20 (m, 12H), 3.19-3.13 (m, 2H), 2.85-2.80 (m, 3H), 2.47-2.39 (m, 6H), 2.37-2.13 (m, 10H), 2.15 (s, 9H), 2.04 (s, 9H), 2.00 (s, 9H), 1.95 (s, 9H), 1.80-1.51 (18H, m), 1.40-1.24 (12H, m), 0.78 (s, 9H), -0.026 (s, 3H), -0.024 (s, 3H).
工程7 化合物163の合成
化合物4の工程7と同様の手法により、化合物163を無色泡状物質として得た(収率83%)。
ESI-MS (m/z): 1220 (M/2 + Na).
工程8 化合物19の合成
化合物4の工程8と同様の手法により、化合物19を無色泡状物質として得た(収率71%)。
ESI-MS (m/z): 1248 (M/2+H), 1247 (M/2).
1H-NMR(CDCl3)δ:7.40-7.34 (m, 2H), 7.34-7.18 (m, 11H), 7.14-7.03 (m, 3H, -NH), 6.94-6.80 (m, 2H), 6.85-6.81 (m, 4H), 6.68 (m, 1H, -NH), 5.35 (d, J = 3.0 Hz, 3H, H-4 of GalNAc), 5.24-5.16 (m, 3H, H-3 of GalNAc), 4.61 (d, J = 8.0 Hz, 3H, H-1 of GalNAc), 4.32 (m, 1H), 4.22-4.04 (m, 11H), 3.98-3.86 (m, 5H), 3.79 (s, 6H), 3.75-3.60 (m, 13H), 3.55-3.45 (m, 3H), 3.36-3.14 (m, 15H), 2.95-2.84 (s, 3H), 2.61-2.54 (m, 4H), 2.49-2.40 (m, 8H), 2.35-2.18 (m, 6H), 2.15 (s, 9H), 2.03 (s, 9H), 2.00 (s, 9H), 1.95 (s, 9H), 1.80-1.51 (18H, m), 1.39-1.18 (16H, m).
化合物4の工程6と同様の手法により、化合物162を無色泡状物質として得た(収率51%)。1H-NMRでは58:42のロータマー混合物として観測された。
1H-NMR(CDCl3)δ:(Major) 7.39 (dd, J=9.3, 9.3 Hz, 2H), 7.33-7.23 (m, 9H), 7.21 (dd, J=7.5, 7.5Hz, 1H), 7.14-7.00 (m, 3H, -NH), 6.98-6.86 (m, 3H), 6.84-6.81 (m, 4H), 6.62 (m, 1H, -NH), 5.39-5.33 (m, 3H, H-4 of GalNAc), 5.23-5.16 (m, 3H, H-3 of GalNAc), 4.65-4.59 (m, 3H, H-1 of GalNAc), 4.21-4.04 (m, 10H), 3.98-3.83 (m, 6H), 3.791 (s, 6H), 3.73-3.63 (m, 13H), 3.59-3.55 (m, 2H), 3.55-3.46 (m, 3H), 3.37-3.20 (m, 12H), 3.19-3.13 (m, 2H), 2.69-2.65 (m, 3H), 2.47-2.39 (m, 6H), 2.37-2.13 (m, 10H), 2.15 (s, 9H), 2.04 (s, 9H), 2.00 (s, 9H), 1.95 (s, 9H), 1.80-1.51 (18H, m), 1.40-1.24 (12H, m), 0.81 (s, 9H), -0.018 (s, 3H), -0.04 (s, 3H). (Minor) 7.39 (dd, J=9.3, 9.3 Hz, 2H), 7.33-7.23 (m, 9H), 7.21 (dd, J=7.5, 7.5Hz, 1H), 7.14-7.00 (m, 3H, -NH), 6.98-6.86 (m, 3H), 6.84-6.81 (m, 4H), 6.62 (m, 1H, -NH), 5.39-5.33 (m, 3H, H-4 of GalNAc), 5.23-5.16 (m, 3H, H-3 of GalNAc), 4.65-4.59 (m, 3H, H-1 of GalNAc), 4.21-4.04 (m, 10H), 3.98-3.83 (m, 6H), 3.785 (s, 6H), 3.73-3.63 (m, 13H), 3.59-3.55 (m, 2H), 3.55-3.46 (m, 3H), 3.37-3.20 (m, 12H), 3.19-3.13 (m, 2H), 2.85-2.80 (m, 3H), 2.47-2.39 (m, 6H), 2.37-2.13 (m, 10H), 2.15 (s, 9H), 2.04 (s, 9H), 2.00 (s, 9H), 1.95 (s, 9H), 1.80-1.51 (18H, m), 1.40-1.24 (12H, m), 0.78 (s, 9H), -0.026 (s, 3H), -0.024 (s, 3H).
工程7 化合物163の合成
化合物4の工程7と同様の手法により、化合物163を無色泡状物質として得た(収率83%)。
ESI-MS (m/z): 1220 (M/2 + Na).
工程8 化合物19の合成
化合物4の工程8と同様の手法により、化合物19を無色泡状物質として得た(収率71%)。
ESI-MS (m/z): 1248 (M/2+H), 1247 (M/2).
1H-NMR(CDCl3)δ:7.40-7.34 (m, 2H), 7.34-7.18 (m, 11H), 7.14-7.03 (m, 3H, -NH), 6.94-6.80 (m, 2H), 6.85-6.81 (m, 4H), 6.68 (m, 1H, -NH), 5.35 (d, J = 3.0 Hz, 3H, H-4 of GalNAc), 5.24-5.16 (m, 3H, H-3 of GalNAc), 4.61 (d, J = 8.0 Hz, 3H, H-1 of GalNAc), 4.32 (m, 1H), 4.22-4.04 (m, 11H), 3.98-3.86 (m, 5H), 3.79 (s, 6H), 3.75-3.60 (m, 13H), 3.55-3.45 (m, 3H), 3.36-3.14 (m, 15H), 2.95-2.84 (s, 3H), 2.61-2.54 (m, 4H), 2.49-2.40 (m, 8H), 2.35-2.18 (m, 6H), 2.15 (s, 9H), 2.03 (s, 9H), 2.00 (s, 9H), 1.95 (s, 9H), 1.80-1.51 (18H, m), 1.39-1.18 (16H, m).
工程1 化合物165の合成
化合物164(米国特許出願公開第2012/0157509号明細書)(90mg,0.489mmol)のジクロロメタン溶液(3.6mL)に塩化オキサリル(171μL,1.95mmol)を加え、室温で 21時間撹拌し後、溶媒を留去した。得られた残渣をジクロロメタン(1.8mL)に溶解させ、氷冷下、化合物105(877mg,0.489mmol)とピリジン(158μL,1.96mmol)のジクロロメタン溶液(5.4mL)を加え、7時間撹拌した。反応液へ10%クエン酸水溶液を加えてクロロホルムで抽出した。有機層を無水硫酸マグネシウムで乾燥させた後、溶媒を留去して化合物165(365mg,収率38%)を淡黄色固体物質として得た。
ESI-MS(m/z)=1959.8.(M+H)
HPLC Peak RT = 1.42 minutes
工程2 化合物20の合成
化合物165(150mg,0.077mmol)のメタノール溶液(3.5mL)に、室温下、水(3.0mL)とトリエチルアミン(2.0mL)を加えて19時間撹拌した。メタノールとトリエチルアミンを減圧留去した後、残渣へDowex(登録商標)-50W×8-200(シグマアルドリッチ社から購入)(600mg)を加え、室温下、45分間緩やかに撹拌した後、ろ過した。溶媒を留去して化合物20(113mg,93%)を淡黄色固体物質として得た。
ESI-MS(m/z)=1981.8.(M+H)
HPLC Peak RT = 0.71 minutes
化合物164(米国特許出願公開第2012/0157509号明細書)(90mg,0.489mmol)のジクロロメタン溶液(3.6mL)に塩化オキサリル(171μL,1.95mmol)を加え、室温で 21時間撹拌し後、溶媒を留去した。得られた残渣をジクロロメタン(1.8mL)に溶解させ、氷冷下、化合物105(877mg,0.489mmol)とピリジン(158μL,1.96mmol)のジクロロメタン溶液(5.4mL)を加え、7時間撹拌した。反応液へ10%クエン酸水溶液を加えてクロロホルムで抽出した。有機層を無水硫酸マグネシウムで乾燥させた後、溶媒を留去して化合物165(365mg,収率38%)を淡黄色固体物質として得た。
ESI-MS(m/z)=1959.8.(M+H)
HPLC Peak RT = 1.42 minutes
工程2 化合物20の合成
化合物165(150mg,0.077mmol)のメタノール溶液(3.5mL)に、室温下、水(3.0mL)とトリエチルアミン(2.0mL)を加えて19時間撹拌した。メタノールとトリエチルアミンを減圧留去した後、残渣へDowex(登録商標)-50W×8-200(シグマアルドリッチ社から購入)(600mg)を加え、室温下、45分間緩やかに撹拌した後、ろ過した。溶媒を留去して化合物20(113mg,93%)を淡黄色固体物質として得た。
ESI-MS(m/z)=1981.8.(M+H)
HPLC Peak RT = 0.71 minutes
工程1 化合物167の合成
欧州特許出願公開第624377号明細書に記載の方法に従って調製した化合物166(161mg、0.27mmol)のN,N-ジメチルホルムアミド溶液(1mL)にジエチルアミン(84uL,0.80mmol)を加えて、室温下3時間撹拌した。反応溶液を減圧濃縮することでジエチルアミンならびにN,N-ジメチルホルムアミドを留去し、反応液重量を1gとした。続いて、化合物2(200mg,0.13mmol)のDMF溶液(2mL)にN,N-ジイソプロピルエチルアミン(55uL, 0.32mmol)およびHBTU(44mg,0.12mmol)を室温下加えて、10分間撹拌した。そこへ前述の化合物167反応液から0.5g(0.13mmol相当)を加えて、さらに24時間撹拌した。氷冷下、反応液に水を加えて水層をクロロホルムで洗浄した。水層を減圧濃縮して得られた残渣をN,N-ジメチルホルムアミド(2mL)に溶解した。シリカゲル(2g)を加えて減圧濃縮して乾式クロマトグラフィー(SiO 10g)(クロロホルム:メタノール=90:10 →60:40)にて精製し、化合物167を淡褐色個体(60mg,収率25%)として得た。
ESI-MS(m/z) = 1129[M+2H]2+,753[M+3H]3+
HPLC Peak RT = 1.31 minutes
工程2 化合物21の合成
化合物167(10mg, 4.43μmol)のN-メチルピロリドン溶液(0.15mL)にN,N-ジイソプロピルエチルアミン(7.7μL, 44μmol)およびクロロギ酸4-ニトロフェニル(5mg, 22umol)を加えて室温下24時間撹拌した。その後、N,N-ジイソプロピルエチルアミン(7.7μL, 44μmol)およびクロロギ酸4-ニトロフェニル(5mg, 22μmol)を加えて、さらに室温下24時間撹拌した。LC/MS測定にて、原料の消失ならびに化合物21の生成を確認した。精製工程を省略して、反応液を実施例3(7-10)に用いた。
ESI-MS(m/z) = 1211[M+2H]2+,808[M+3H]3+
HPLC Peak RT = 1.73 minutes
欧州特許出願公開第624377号明細書に記載の方法に従って調製した化合物166(161mg、0.27mmol)のN,N-ジメチルホルムアミド溶液(1mL)にジエチルアミン(84uL,0.80mmol)を加えて、室温下3時間撹拌した。反応溶液を減圧濃縮することでジエチルアミンならびにN,N-ジメチルホルムアミドを留去し、反応液重量を1gとした。続いて、化合物2(200mg,0.13mmol)のDMF溶液(2mL)にN,N-ジイソプロピルエチルアミン(55uL, 0.32mmol)およびHBTU(44mg,0.12mmol)を室温下加えて、10分間撹拌した。そこへ前述の化合物167反応液から0.5g(0.13mmol相当)を加えて、さらに24時間撹拌した。氷冷下、反応液に水を加えて水層をクロロホルムで洗浄した。水層を減圧濃縮して得られた残渣をN,N-ジメチルホルムアミド(2mL)に溶解した。シリカゲル(2g)を加えて減圧濃縮して乾式クロマトグラフィー(SiO 10g)(クロロホルム:メタノール=90:10 →60:40)にて精製し、化合物167を淡褐色個体(60mg,収率25%)として得た。
ESI-MS(m/z) = 1129[M+2H]2+,753[M+3H]3+
HPLC Peak RT = 1.31 minutes
工程2 化合物21の合成
化合物167(10mg, 4.43μmol)のN-メチルピロリドン溶液(0.15mL)にN,N-ジイソプロピルエチルアミン(7.7μL, 44μmol)およびクロロギ酸4-ニトロフェニル(5mg, 22umol)を加えて室温下24時間撹拌した。その後、N,N-ジイソプロピルエチルアミン(7.7μL, 44μmol)およびクロロギ酸4-ニトロフェニル(5mg, 22μmol)を加えて、さらに室温下24時間撹拌した。LC/MS測定にて、原料の消失ならびに化合物21の生成を確認した。精製工程を省略して、反応液を実施例3(7-10)に用いた。
ESI-MS(m/z) = 1211[M+2H]2+,808[M+3H]3+
HPLC Peak RT = 1.73 minutes
化合物3(290mg、100μmol)のDMF溶液(2mL)にジイソプロピルエチルアミン(50μL)を加えてから、氷冷下撹拌した。クロロギ酸イソブチル(13μL,100μmol)のDMF溶液(0.2mL)を加えて、3分間撹拌した。PrimerSupport200(underivatized support)(GE Healthcare社)(1g)のDMF懸濁液にジイソプロピルエチルアミン(350μL)を加えた後、前述の化合物3反応液を加えて室温下24時間振とう撹拌した。反応液をろ過後、PrimerSupportをアセトニトリル(40mL)で洗浄後、通気乾燥した。乾燥したPrimerSupportに無水酢酸(20%v/v)、ピリジン(20%v/v)、N-メチルイミダゾール(10%v/v)のアセトニトリル溶液(10mL)を加えて、室温下1時間振とう撹拌した。反応液をろ過後、アセトニトリル(40mL)及びジクロロメタン(20mL)で洗浄後、減圧下で乾燥した。化合物3の担持量はDMTrカチオンの比色定量により算出し、30μmol/gの化合物1001を得た。
同様の方法で、実施例1で合成した化合物4、5、8、9、14を固相化することができる。
実施例3 オリゴヌクレオチドの合成
以下の方法で表2~4に記載のオリゴヌクレオチドSEQ-1~SEQ-36を合成した。
1)アミダイト合成
標準的な保護基を有するDNAアミダイト、RNAアミダイト、2’OMe-RNAアミダイトは、Proligo Reagents社より購入した。具体的には、以下を使用した。
・N6-ベンゾイル-5’-O-ジメトキシトリチル-2’デオキシアデノシン-3’-O-N,N’-ジイソプロピル-2-シアノエチルホスホロアミダイト
・5’-O-ジメトキシトリチルチミジン-3’-O-N,N’-ジイソプロピル-2-シアノエチルホスホロアミダイト
・N2-tertブチルフェノキシアセチル-5’-O-ジメトキシトリチル-2’デオキシグアノシン‐3’-O-N,N’-ジイソプロピル-2-シアノエチルホスホロアミダイト
・N4-ベンゾイル-5’-O-ジメトキシトリチル-2’デオキシシチジン-3’-O-N,N’-ジイソプロピル-2-シアノエチルホスホロアミダイト
・N6-ベンゾイル-5’-O-ジメトキシトリチルアデノシン-2’tertブチルジメチルシリル-3’-O-N,N’-ジイソプロピル-2-シアノエチルホスホロアミダイト
・5’-O-ジメトキシトリチルウリジン-2’tertブチルジメチルシリル-3’-O-N,N’-ジイソプロピル-2-シアノエチルホスホロアミダイト
・N2-イソブチリル-5’-O-ジメトキシトリチルグアノシン-2’tertブチルジメチルシリル、3’-O-N,N’-ジイソプロピル-2-シアノエチルホスホロアミダイト
・N4-ベンゾイル-5’-O-ジメトキシトリチルシチジン-2’tertブチルジメチルシリル-3’-O-N,N’-ジイソプロピル-2-シアノエチルホスホロアミダイト
・N6-ベンゾイル-5’-O-ジメトキシトリチル-アデノシン-2’-O-メチル-3’-O-N,N’-ジイソプロピル-2-シアノエチルホスホロアミダイト
・5’-O-ジメトキシトリチルウリジン-2’-O-メチル-3’-O-N,N’-ジイソプロピル-2-シアノエチルホスホロアミダイト
・N2-イソブチリル-5’-O-ジメトキシトリチル-グアノシン-2’-O-メチル‐3’-O-N,N’-ジイソプロピル-2-シアノエチルホスホロアミダイト
・N4-ベンゾイル-5’-O-ジメトキシトリチルシチジン-2’-O-メチル-3’-O-N,N’-ジイソプロピル-2-シアノエチルホスホロアミダイト
以下の方法で表2~4に記載のオリゴヌクレオチドSEQ-1~SEQ-36を合成した。
1)アミダイト合成
標準的な保護基を有するDNAアミダイト、RNAアミダイト、2’OMe-RNAアミダイトは、Proligo Reagents社より購入した。具体的には、以下を使用した。
・N6-ベンゾイル-5’-O-ジメトキシトリチル-2’デオキシアデノシン-3’-O-N,N’-ジイソプロピル-2-シアノエチルホスホロアミダイト
・5’-O-ジメトキシトリチルチミジン-3’-O-N,N’-ジイソプロピル-2-シアノエチルホスホロアミダイト
・N2-tertブチルフェノキシアセチル-5’-O-ジメトキシトリチル-2’デオキシグアノシン‐3’-O-N,N’-ジイソプロピル-2-シアノエチルホスホロアミダイト
・N4-ベンゾイル-5’-O-ジメトキシトリチル-2’デオキシシチジン-3’-O-N,N’-ジイソプロピル-2-シアノエチルホスホロアミダイト
・N6-ベンゾイル-5’-O-ジメトキシトリチルアデノシン-2’tertブチルジメチルシリル-3’-O-N,N’-ジイソプロピル-2-シアノエチルホスホロアミダイト
・5’-O-ジメトキシトリチルウリジン-2’tertブチルジメチルシリル-3’-O-N,N’-ジイソプロピル-2-シアノエチルホスホロアミダイト
・N2-イソブチリル-5’-O-ジメトキシトリチルグアノシン-2’tertブチルジメチルシリル、3’-O-N,N’-ジイソプロピル-2-シアノエチルホスホロアミダイト
・N4-ベンゾイル-5’-O-ジメトキシトリチルシチジン-2’tertブチルジメチルシリル-3’-O-N,N’-ジイソプロピル-2-シアノエチルホスホロアミダイト
・N6-ベンゾイル-5’-O-ジメトキシトリチル-アデノシン-2’-O-メチル-3’-O-N,N’-ジイソプロピル-2-シアノエチルホスホロアミダイト
・5’-O-ジメトキシトリチルウリジン-2’-O-メチル-3’-O-N,N’-ジイソプロピル-2-シアノエチルホスホロアミダイト
・N2-イソブチリル-5’-O-ジメトキシトリチル-グアノシン-2’-O-メチル‐3’-O-N,N’-ジイソプロピル-2-シアノエチルホスホロアミダイト
・N4-ベンゾイル-5’-O-ジメトキシトリチルシチジン-2’-O-メチル-3’-O-N,N’-ジイソプロピル-2-シアノエチルホスホロアミダイト
AmNAアミダイトは、国際公開第2011/052436号に記載の方法及び以下に記載の方法に基づき、合成した。
(1-1)(2R,3S,4R,5R)-3-(tert-ブチルジメチルシキルオキシ)-2-ヒドロキシメチル-5-(5-メチル-2,4-ジオキソ-3,4-ジヒドロピリミジン-1(2H)-イル)-4-(2,2,2-トリフルオロ-N-メチルアセタミド)テトラヒドロフラン-2-カルボン酸カリウム(化合物914)の合成
工程1 化合物909の合成
窒素雰囲気下、化合物901(合成法はOrganic Letters,7,1569-1572(2005)に記載の方法に準じる、1300g、2.53mol)のDMF(3.9L)懸濁液に、TBSクロリド(1717g、11.39mol)のDMF(2.6L)溶液を内温5~15℃で滴下した。続いて、内温10~20℃でヨウ化ナトリウム(1138g、7.59mol)を加え、同温下でN-メチルイミダゾール(999mL、12.7mol)を滴下した。内温20~30℃で6時間撹拌した後、終夜で静置した。反応液を酢酸エチル(3.9L)と氷水(10.4L)の混合物に注加し、更に酢酸エチル(2.6L)、水(2.6L)を加えた。有機層を1mol/L塩酸(6.5L)、10%炭酸ナトリウム水溶液(6.5L)、10%食塩水(6.5L)で順次洗浄した。溶媒を減圧留去し、得られた残渣(2.68kg)にメタノール(2.6L)を加えた。再び溶媒を減圧留去し、化合物909の粗生成物(2.62kg)を得た。
窒素雰囲気下、化合物901(合成法はOrganic Letters,7,1569-1572(2005)に記載の方法に準じる、1300g、2.53mol)のDMF(3.9L)懸濁液に、TBSクロリド(1717g、11.39mol)のDMF(2.6L)溶液を内温5~15℃で滴下した。続いて、内温10~20℃でヨウ化ナトリウム(1138g、7.59mol)を加え、同温下でN-メチルイミダゾール(999mL、12.7mol)を滴下した。内温20~30℃で6時間撹拌した後、終夜で静置した。反応液を酢酸エチル(3.9L)と氷水(10.4L)の混合物に注加し、更に酢酸エチル(2.6L)、水(2.6L)を加えた。有機層を1mol/L塩酸(6.5L)、10%炭酸ナトリウム水溶液(6.5L)、10%食塩水(6.5L)で順次洗浄した。溶媒を減圧留去し、得られた残渣(2.68kg)にメタノール(2.6L)を加えた。再び溶媒を減圧留去し、化合物909の粗生成物(2.62kg)を得た。
工程2 化合物910の合成
工程1で得た化合物909の粗生成物(2.62kg)のメタノール(6.5L)溶液に、35%塩酸(633mL、7.59mol)を内温20~30℃で滴下し、4時間撹拌した。反応液をジイソプロピルエーテル(6.5L)と氷水(3.9L)の混合物に注加し、更にジイソプロピルエーテル(6.5L)、水(2.6L)を加えた。水層をジイソプロピルエーテル(3.25L)で洗浄した後、炭酸ナトリウム(1073g、10.1mol)の水(6.5L)溶液を加え、酢酸エチル(19.5L及び6.5L)で抽出し、有機層を無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣にテトラヒドロフラン(2.6L)を加えた。再び溶媒を減圧留去し、化合物910の粗生成物(1.08kg)を得た。
1H-NMR(DMSO-d6)δ:0.13 (s, 6H), 0.91 (s, 9H), 1.40-1.55 (br, 1H), 1.79 (s, 3H), 2.28 (s, 3H), 3.15-3.20 (d, J = 4.1Hz, 1H), 3.52-3.65 (m, 2H), 3.85 (s, 1H), 4.30-4.35 (d, J = 4.1Hz, 1H), 5.18-5.24 (br, 1H), 5.64-5.70 (d, J = 7.3Hz), 7.73 (s, 1H), 11.34 (s, 1H).
工程1で得た化合物909の粗生成物(2.62kg)のメタノール(6.5L)溶液に、35%塩酸(633mL、7.59mol)を内温20~30℃で滴下し、4時間撹拌した。反応液をジイソプロピルエーテル(6.5L)と氷水(3.9L)の混合物に注加し、更にジイソプロピルエーテル(6.5L)、水(2.6L)を加えた。水層をジイソプロピルエーテル(3.25L)で洗浄した後、炭酸ナトリウム(1073g、10.1mol)の水(6.5L)溶液を加え、酢酸エチル(19.5L及び6.5L)で抽出し、有機層を無水硫酸マグネシウムで乾燥した。溶媒を減圧留去し、得られた残渣にテトラヒドロフラン(2.6L)を加えた。再び溶媒を減圧留去し、化合物910の粗生成物(1.08kg)を得た。
1H-NMR(DMSO-d6)δ:0.13 (s, 6H), 0.91 (s, 9H), 1.40-1.55 (br, 1H), 1.79 (s, 3H), 2.28 (s, 3H), 3.15-3.20 (d, J = 4.1Hz, 1H), 3.52-3.65 (m, 2H), 3.85 (s, 1H), 4.30-4.35 (d, J = 4.1Hz, 1H), 5.18-5.24 (br, 1H), 5.64-5.70 (d, J = 7.3Hz), 7.73 (s, 1H), 11.34 (s, 1H).
工程3 化合物911の合成
窒素雰囲気下、工程2で得た化合物910の粗生成物(17.7g)及びピリジン(10.1mL、125mmol)のテトラヒドロフラン(80mL)溶液に、内温0~10℃でトリフルオロ酢酸無水物(17.8mL、125mmol)を滴下し、1時間撹拌した。反応液を氷冷下、20%炭酸ナトリウム水溶液(112mL)へ注加し、テトラヒドロフラン(24mL)及び水(48mL)を加えた。氷冷下で20分間、室温で1時間撹拌した後、酢酸エチル(112mL)、n-ヘキサン(80mL)、10%食塩水(32mL)及び水(176mL)を加えた。有機層を2mol/L塩酸(80mL)、0.4mol/L塩酸(80mL)、5%炭酸水素ナトリウム水溶液(80mL)、10%食塩水(80mL)で順次洗浄した。各水層はそれぞれ酢酸エチル(80mL)で抽出した。有機層を合わせ、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた残渣に酢酸エチル(24mL)を加え、60℃に加熱して溶解させた後、n-ヘキサン(72mL)を加えた。生じたスラリーを室温まで冷却した後、ろ過して得られた固体を酢酸エチル/n-ヘキサン(3.2mL/60.8mL)で洗浄した後、通風乾燥を1日行い、化合物911(15.8g、工程1からの通算収率79.1%)を得た。
1H-NMR(DMSO-d6)δ:-0.01 (2.1H, s), 0.02 (0.9H, s), 0.08 (2.1H, s), 0.09 (s, 0.9H, s), 0.86 (6.3H, s), 0.87 (2.7H, s), 1.78 (0.9H, d, J = 0.8Hz), 1.79 (2.1H, d, J = 0.8Hz), 3.12 (0.9H, s), 3.20 (2.1H, s), 3.61-3.57 (1.0H, m), 3.72-3.67 (1.0H, m), 3.99 (0.7H, q, J = 3.3Hz), 4.02 (0.3H, m), 4.45 (0.3H, m), 4.45 (0.3H, m), 4.52 (0.7H, dd, J = 6.8, 3.3Hz), 4.77 (0.7H, dd, J = 7.6, 6.8Hz), 5.30 (0.7H, t, J = 4.7Hz), 5.38 (0.3H, t, J = 4.7Hz), 6.37 (0.3H, m), 6.39 (0.7H, d, J = 7.6Hz), 7.73 (1.0H, s), 11.44 (0.7H, brs), 11.5 (0.3H, brs).
窒素雰囲気下、工程2で得た化合物910の粗生成物(17.7g)及びピリジン(10.1mL、125mmol)のテトラヒドロフラン(80mL)溶液に、内温0~10℃でトリフルオロ酢酸無水物(17.8mL、125mmol)を滴下し、1時間撹拌した。反応液を氷冷下、20%炭酸ナトリウム水溶液(112mL)へ注加し、テトラヒドロフラン(24mL)及び水(48mL)を加えた。氷冷下で20分間、室温で1時間撹拌した後、酢酸エチル(112mL)、n-ヘキサン(80mL)、10%食塩水(32mL)及び水(176mL)を加えた。有機層を2mol/L塩酸(80mL)、0.4mol/L塩酸(80mL)、5%炭酸水素ナトリウム水溶液(80mL)、10%食塩水(80mL)で順次洗浄した。各水層はそれぞれ酢酸エチル(80mL)で抽出した。有機層を合わせ、無水硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた残渣に酢酸エチル(24mL)を加え、60℃に加熱して溶解させた後、n-ヘキサン(72mL)を加えた。生じたスラリーを室温まで冷却した後、ろ過して得られた固体を酢酸エチル/n-ヘキサン(3.2mL/60.8mL)で洗浄した後、通風乾燥を1日行い、化合物911(15.8g、工程1からの通算収率79.1%)を得た。
1H-NMR(DMSO-d6)δ:-0.01 (2.1H, s), 0.02 (0.9H, s), 0.08 (2.1H, s), 0.09 (s, 0.9H, s), 0.86 (6.3H, s), 0.87 (2.7H, s), 1.78 (0.9H, d, J = 0.8Hz), 1.79 (2.1H, d, J = 0.8Hz), 3.12 (0.9H, s), 3.20 (2.1H, s), 3.61-3.57 (1.0H, m), 3.72-3.67 (1.0H, m), 3.99 (0.7H, q, J = 3.3Hz), 4.02 (0.3H, m), 4.45 (0.3H, m), 4.45 (0.3H, m), 4.52 (0.7H, dd, J = 6.8, 3.3Hz), 4.77 (0.7H, dd, J = 7.6, 6.8Hz), 5.30 (0.7H, t, J = 4.7Hz), 5.38 (0.3H, t, J = 4.7Hz), 6.37 (0.3H, m), 6.39 (0.7H, d, J = 7.6Hz), 7.73 (1.0H, s), 11.44 (0.7H, brs), 11.5 (0.3H, brs).
工程4 化合物912の合成
窒素雰囲気下、化合物911(450g、935mmol)のジメチルスルホキシド(1.35L)溶液に、EDC(538g、2800mmol)、ジメチルスルホキシド(675mL)、パラトルエンスルホン酸ピリジニウム(235g、935mmol)及びジメチルスルホキシド(225mL)を順次加え、内温20~30℃で2.5時間撹拌した。続いて内温10~20℃で酢酸エチル(4.5L)、水(2.25L)及び酢酸エチル(2.25L)を順次加えた。有機層を水(2.25L)で2回洗浄した後、溶媒を減圧留去し、得られた残渣にアセトニトリル(900mL)を加えた。再び溶媒を減圧留去し、化合物912の粗生成物(540g)を得た。
窒素雰囲気下、化合物911(450g、935mmol)のジメチルスルホキシド(1.35L)溶液に、EDC(538g、2800mmol)、ジメチルスルホキシド(675mL)、パラトルエンスルホン酸ピリジニウム(235g、935mmol)及びジメチルスルホキシド(225mL)を順次加え、内温20~30℃で2.5時間撹拌した。続いて内温10~20℃で酢酸エチル(4.5L)、水(2.25L)及び酢酸エチル(2.25L)を順次加えた。有機層を水(2.25L)で2回洗浄した後、溶媒を減圧留去し、得られた残渣にアセトニトリル(900mL)を加えた。再び溶媒を減圧留去し、化合物912の粗生成物(540g)を得た。
工程5 化合物913の合成
工程4で得られた化合物912の粗生成物(540g)のアセトニトリル(1.8L)溶液に、37%ホルマリン水溶液(900mL)、N-メチルモルホリン(900mL)を順次加え、内温70~80℃で4時間撹拌した。反応液を内温20~30℃へ冷却した後、酢酸エチル(2.25L)を加え、続いて内温10~20℃で4mol/L塩酸(2.25L)を加えた。有機層を水(2.25L)で2回洗浄し、化合物913を含有する酢酸エチル溶液を得た。
工程4で得られた化合物912の粗生成物(540g)のアセトニトリル(1.8L)溶液に、37%ホルマリン水溶液(900mL)、N-メチルモルホリン(900mL)を順次加え、内温70~80℃で4時間撹拌した。反応液を内温20~30℃へ冷却した後、酢酸エチル(2.25L)を加え、続いて内温10~20℃で4mol/L塩酸(2.25L)を加えた。有機層を水(2.25L)で2回洗浄し、化合物913を含有する酢酸エチル溶液を得た。
工程6 化合物914の合成
工程5で得られた化合物913を含有する酢酸エチル溶液にリン酸二水素ナトリウム2水和物(292g、1870mmol)の水(1.35L)水溶液、スクアレン(898mL、1870mmol)、アセトニトリル(1.35L)を順次加えた。内温20~30℃で亜塩素酸ナトリウム(423g、4670mmol)の水(2.25L)溶液を滴下し、3時間撹拌した。続いて内温10~15℃で0.5mol/L水酸化ナトリウム水溶液(3.6L)、チオ硫酸ナトリウム5水和物(1160g、4670mmol)を順次加え、内温5~15℃で20分間撹拌した。反応液に酢酸エチル(900mL)及び水(900mL)を加え、有機層を水(900mL)で洗浄した。水層を合わせて酢酸エチル(900mL)で洗浄した後、水層に酢酸エチル(5.4L)及び2mol/L塩酸水溶液(2.25L)を加えた。有機層を10%食塩水(2.25L)で洗浄し、無水硫酸ナトリウムで乾燥した。混合物をろ過、乾燥剤を酢酸エチル(1.35L)で洗浄して得られたろ液に酢酸カリウム(82.5g、841mmol)及びエタノール(338mL)を加えた。混合物を内温20~30℃で1時間撹拌した。生じたスラリーをろ過して得られた固体を酢酸エチル/エタノール(3860mL/193mL)で洗浄した後、通風乾燥を1日行い、化合物914(283g、工程4からの通算収率53.8%)を得た。
1H-NMR(DMSO-d6)δ :-0.11 (1.8H, s), -0.09 (1.2H, s), 0.09 (1.8H, s), 0.10 (1.2H, s), 0.82 (3.6H, s), 0.83 (5.4H, s), 1.77 (1.2H, s), 1.78 (1.8H, s), 3.18 (1.2H, s), 3.33 (1.8H, s), 3.54 (1.0H, d, J = 10.8Hz), 3.68 (0.6H, d, J = 10.8Hz), 3.69 (0.4H, d, J = 10.8Hz), 4.18 (0.4H, dd, J = 8.6, 7.8Hz), 4.49 (0.4H, d, J = 8.6Hz), 4.51 (0.6H, d, J = 8.6Hz), 4.73 (0.6H, dd, J = 8.6, 7.8Hz), 6.1 (1H, br), 6.90 (0.4H, d, J = 7.8Hz), 6.92 (0.6H, d, J = 7.8Hz), 7.61 (0.6H, s), 7.65 (0.4H, s).
工程5で得られた化合物913を含有する酢酸エチル溶液にリン酸二水素ナトリウム2水和物(292g、1870mmol)の水(1.35L)水溶液、スクアレン(898mL、1870mmol)、アセトニトリル(1.35L)を順次加えた。内温20~30℃で亜塩素酸ナトリウム(423g、4670mmol)の水(2.25L)溶液を滴下し、3時間撹拌した。続いて内温10~15℃で0.5mol/L水酸化ナトリウム水溶液(3.6L)、チオ硫酸ナトリウム5水和物(1160g、4670mmol)を順次加え、内温5~15℃で20分間撹拌した。反応液に酢酸エチル(900mL)及び水(900mL)を加え、有機層を水(900mL)で洗浄した。水層を合わせて酢酸エチル(900mL)で洗浄した後、水層に酢酸エチル(5.4L)及び2mol/L塩酸水溶液(2.25L)を加えた。有機層を10%食塩水(2.25L)で洗浄し、無水硫酸ナトリウムで乾燥した。混合物をろ過、乾燥剤を酢酸エチル(1.35L)で洗浄して得られたろ液に酢酸カリウム(82.5g、841mmol)及びエタノール(338mL)を加えた。混合物を内温20~30℃で1時間撹拌した。生じたスラリーをろ過して得られた固体を酢酸エチル/エタノール(3860mL/193mL)で洗浄した後、通風乾燥を1日行い、化合物914(283g、工程4からの通算収率53.8%)を得た。
1H-NMR(DMSO-d6)δ :-0.11 (1.8H, s), -0.09 (1.2H, s), 0.09 (1.8H, s), 0.10 (1.2H, s), 0.82 (3.6H, s), 0.83 (5.4H, s), 1.77 (1.2H, s), 1.78 (1.8H, s), 3.18 (1.2H, s), 3.33 (1.8H, s), 3.54 (1.0H, d, J = 10.8Hz), 3.68 (0.6H, d, J = 10.8Hz), 3.69 (0.4H, d, J = 10.8Hz), 4.18 (0.4H, dd, J = 8.6, 7.8Hz), 4.49 (0.4H, d, J = 8.6Hz), 4.51 (0.6H, d, J = 8.6Hz), 4.73 (0.6H, dd, J = 8.6, 7.8Hz), 6.1 (1H, br), 6.90 (0.4H, d, J = 7.8Hz), 6.92 (0.6H, d, J = 7.8Hz), 7.61 (0.6H, s), 7.65 (0.4H, s).
工程1 化合物915の合成
窒素雰囲気下、化合物914(455mg、0.807mmol)のピリジン(4mL)懸濁液に、1mol/L テトラブチルアンモニウムフロリド-テトラヒドロフラン溶液(0.888mL、0.888mmol)を滴下し、内温60~70℃で9時間撹拌した後、終夜室温で静置した。翌日さらに内温60~70℃で9時間撹拌した後、終夜室温で静置した。EDC塩酸塩(310mg、1.62mmol)を加え、内温60~70℃で9時間撹拌した後、EDC塩酸塩(310mg、1.62mmol)を追加し、終夜室温で静置した。4,4’-ジメトキシトリチルクロリド(547mg、1.61mmol)を加えて室温で5時間撹拌した後、さらに4,4’-ジメトキシトリチルクロリド(547mg、1.61mmol)を加え、2時間撹拌した。反応液に5%炭酸水素ナトリウム水溶液(10mL)を加え、酢酸エチル(10mL)で抽出した後、水(5mL)で3回洗浄した。それぞれの水洗浄液は酢酸エチル(5mL)で抽出した。有機層を合わせて溶媒を減圧留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(クロロホルム-メタノール)により精製し、化合物915(334mg、収率69.1%)を得た。
1H-NMR(CDCl3)δ:1.70 (s, 3H), 1.97 (d, J = 5.1Hz, 1H), 3.02 (s, 3H), 3.61 (d, J = 12.3Hz, 1H), 3.79 (s, 6H), 3.95 (d, J = 12.3Hz, 1H), 4.11 (s, 1H), 4.37 (d, J = 4.9Hz, 1H), 5.41 (s, 1H), 6.85 (dd, J = 8.5, 2.5Hz, 4H), 7.23-7.36 (m, 7H), 7.45 (d, J = 7.7Hz, 2H), 7.76 (s, 1H), 8.55 (s, 1H).
窒素雰囲気下、化合物914(455mg、0.807mmol)のピリジン(4mL)懸濁液に、1mol/L テトラブチルアンモニウムフロリド-テトラヒドロフラン溶液(0.888mL、0.888mmol)を滴下し、内温60~70℃で9時間撹拌した後、終夜室温で静置した。翌日さらに内温60~70℃で9時間撹拌した後、終夜室温で静置した。EDC塩酸塩(310mg、1.62mmol)を加え、内温60~70℃で9時間撹拌した後、EDC塩酸塩(310mg、1.62mmol)を追加し、終夜室温で静置した。4,4’-ジメトキシトリチルクロリド(547mg、1.61mmol)を加えて室温で5時間撹拌した後、さらに4,4’-ジメトキシトリチルクロリド(547mg、1.61mmol)を加え、2時間撹拌した。反応液に5%炭酸水素ナトリウム水溶液(10mL)を加え、酢酸エチル(10mL)で抽出した後、水(5mL)で3回洗浄した。それぞれの水洗浄液は酢酸エチル(5mL)で抽出した。有機層を合わせて溶媒を減圧留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(クロロホルム-メタノール)により精製し、化合物915(334mg、収率69.1%)を得た。
1H-NMR(CDCl3)δ:1.70 (s, 3H), 1.97 (d, J = 5.1Hz, 1H), 3.02 (s, 3H), 3.61 (d, J = 12.3Hz, 1H), 3.79 (s, 6H), 3.95 (d, J = 12.3Hz, 1H), 4.11 (s, 1H), 4.37 (d, J = 4.9Hz, 1H), 5.41 (s, 1H), 6.85 (dd, J = 8.5, 2.5Hz, 4H), 7.23-7.36 (m, 7H), 7.45 (d, J = 7.7Hz, 2H), 7.76 (s, 1H), 8.55 (s, 1H).
工程2 化合物916(Tアミダイト)の合成
国際公開第2011/052436号に記載の方法に準じた方法に従って、化合物916を合成した。
国際公開第2011/052436号に記載の方法に準じた方法に従って、化合物916を合成した。
工程1 化合物917の合成
窒素雰囲気下、化合物914(170g、271mmol)及び6-N-ベンゾイルアデニン(64.9g、271mmol)のシクロペンチルメチルエーテル(1700mL)懸濁液に、N,O-ビス(トリメチルシリル)アセトアミド(466mL、1900mmol)及びTMSOTf(98mL、543mmol)を加え、70~73℃で4時間撹拌した。反応液に氷冷下、テトラヒドロフラン(2920mL)、2mol/L塩酸(1700mL)及び水(1020mL)を加えた後、有機層と水層に分配し、有機層を0.1mol/L塩酸(1700mL)及び水(1700mL)で洗浄した。溶媒を減圧留去して得られた残渣にクロロホルム(340mL)を加え、20分攪拌して得られたスラリーをろ過した。ろ取した固体をクロロホルム(510mL)で洗浄した後、風乾することにより化合物917(165g、収率80.9%)を得た。
1H-NMR(DMSO-d6)δ:-0.06 (s, 3H), 0.13 (s, 2.1H), 0.14 (s, 0.9H), 0.89 (s, 9H), 3.22 (s, 0.9H), 3.31 (s, 2.1H), 3.82 (d, J = 12.0Hz, 1H), 3.89-3.95 (m, 1H), 4.70 (d, J = 7.3Hz, 0.3H), 4.75 (d, J = 7.3Hz, 0.7H), 5.04 (t, J = 7.5Hz, 0.3H), 5.41 (brs, 0.7H), 5.49 (t, J = 8.0Hz, 0.7H), 5.55 (brs, 0.3H), 7.02 (d, J = 8.5Hz, 0.3H), 7.04 (d, J = 8.5Hz, 0.7H), 7.56 (t, J = 7.4Hz, 2H), 7.66 (t, J = 7.4Hz, 1H), 8.04 (d, J = 7.8Hz, 2H), 8.78 (s, 1H), 8.80 (s, 1H), 11.31 (s, 1H), 13.34 (brs, 1H).
窒素雰囲気下、化合物914(170g、271mmol)及び6-N-ベンゾイルアデニン(64.9g、271mmol)のシクロペンチルメチルエーテル(1700mL)懸濁液に、N,O-ビス(トリメチルシリル)アセトアミド(466mL、1900mmol)及びTMSOTf(98mL、543mmol)を加え、70~73℃で4時間撹拌した。反応液に氷冷下、テトラヒドロフラン(2920mL)、2mol/L塩酸(1700mL)及び水(1020mL)を加えた後、有機層と水層に分配し、有機層を0.1mol/L塩酸(1700mL)及び水(1700mL)で洗浄した。溶媒を減圧留去して得られた残渣にクロロホルム(340mL)を加え、20分攪拌して得られたスラリーをろ過した。ろ取した固体をクロロホルム(510mL)で洗浄した後、風乾することにより化合物917(165g、収率80.9%)を得た。
1H-NMR(DMSO-d6)δ:-0.06 (s, 3H), 0.13 (s, 2.1H), 0.14 (s, 0.9H), 0.89 (s, 9H), 3.22 (s, 0.9H), 3.31 (s, 2.1H), 3.82 (d, J = 12.0Hz, 1H), 3.89-3.95 (m, 1H), 4.70 (d, J = 7.3Hz, 0.3H), 4.75 (d, J = 7.3Hz, 0.7H), 5.04 (t, J = 7.5Hz, 0.3H), 5.41 (brs, 0.7H), 5.49 (t, J = 8.0Hz, 0.7H), 5.55 (brs, 0.3H), 7.02 (d, J = 8.5Hz, 0.3H), 7.04 (d, J = 8.5Hz, 0.7H), 7.56 (t, J = 7.4Hz, 2H), 7.66 (t, J = 7.4Hz, 1H), 8.04 (d, J = 7.8Hz, 2H), 8.78 (s, 1H), 8.80 (s, 1H), 11.31 (s, 1H), 13.34 (brs, 1H).
工程2 化合物918の合成
窒素雰囲気下、化合物917(4.75g、7.44mmol)のテトラヒドロフラン(25mL)溶液に、1mol/L テトラブチルアンモニウムフロリド-テトラヒドロフラン溶液(14.9mL、14.9mmol)を滴下し、内温60~65℃で3.5時間撹拌した。EDC塩酸塩(1.71g、8.92mmol)を加え、内温60~65℃で1時間撹拌した。溶媒を減圧留去し、得られた残渣にアセトニトリル(50mL)を加え、再び溶媒を減圧留去することを3回繰り返し、化合物918の粗生成物(9.12g)を得た。
1H-NMR(CDCl3)δ:3.14 (s, 3H), 4.09 (dd, J = 13.8, 6.8Hz, 1H), 4.18 (dd, J = 14.0, 3.3Hz, 1H), 4.37 (s, 1H), 4.64 (s, 1H), 5.26 (m, 1H), 5.89 (s, 1H), 6.46(brs, 1H), 7.52 (t, J = 7.5Hz, 2H), 7.60 (t, J = 7.3Hz, 1H), 8.01 (d, J = 7.7Hz, 2H), 8.56(s, 1H), 8.78 (s, 1H), 9.31 (s, 1H).
窒素雰囲気下、化合物917(4.75g、7.44mmol)のテトラヒドロフラン(25mL)溶液に、1mol/L テトラブチルアンモニウムフロリド-テトラヒドロフラン溶液(14.9mL、14.9mmol)を滴下し、内温60~65℃で3.5時間撹拌した。EDC塩酸塩(1.71g、8.92mmol)を加え、内温60~65℃で1時間撹拌した。溶媒を減圧留去し、得られた残渣にアセトニトリル(50mL)を加え、再び溶媒を減圧留去することを3回繰り返し、化合物918の粗生成物(9.12g)を得た。
1H-NMR(CDCl3)δ:3.14 (s, 3H), 4.09 (dd, J = 13.8, 6.8Hz, 1H), 4.18 (dd, J = 14.0, 3.3Hz, 1H), 4.37 (s, 1H), 4.64 (s, 1H), 5.26 (m, 1H), 5.89 (s, 1H), 6.46(brs, 1H), 7.52 (t, J = 7.5Hz, 2H), 7.60 (t, J = 7.3Hz, 1H), 8.01 (d, J = 7.7Hz, 2H), 8.56(s, 1H), 8.78 (s, 1H), 9.31 (s, 1H).
工程3 化合物919の合成
窒素雰囲気下、工程2で得た化合物918の粗生成物(9.12g)のジクロロメタン(25mL)溶液に、DABCO(2.09g、18.6mmol)及び4,4’-ジメトキシトリチルクロリド(5.04g、14.9mmol)を加え、室温で2時間撹拌した。4,4’-ジメトキシトリチルクロリド(1.26g、3.72mmol)を追加し、さらに2時間撹拌した。反応液に5%炭酸水素ナトリウム水溶液(50mL)及びジクロロメタン(50mL)を加え、有機層を水(50ml)で洗浄し、水洗浄液はジクロロメタン(50mL)で抽出した。有機層を合わせてメタノール(50mL)を加え、重量が60gになるまで溶媒を留去した後、再びメタノール(50mL)を加え、重量が67gになるまで溶媒を留去した。再びメタノール(25mL)を加え、室温で30分間撹拌して得られたスラリーをろ過した。ろ取した固体をメタノール(35mL)で洗浄した後、風乾することにより化合物919(4.31g、工程2からの通算収率81.3%)を得た。
1H-NMR(DMSO-d6)δ:2.98 (s, 3H), 3.26 (d, J = 11.0Hz, 1H), 3.42 (d, J = 11.7Hz, 1H), 3.73 (s, 6H), 4.67 (s, 1H), 4.79 (brs, 1H), 6.14 (s, 1H), 6.19 (brs, 1H), 6.88 (d, J = 8.3Hz, 4H), 7.21-7.32 (m, 7H), 7.39 (d, J = 7.8Hz, 2H), 7.57 (t, J = 7.4 Hz, 2H), 7.67 (t, J = 7.4Hz, 1H), 8.06 (d, J = 7.4Hz, 2H), 8.53 (s, 1H), 8.84 (s, 1H), 11.33 (brs, 1H).
1H-NMR(CDCl3)δ:8.98(1H, s), 8.81 (1H, s), 8.39 (1H, s), 8.03 (1H, d, J=8.0 Hz), 7.63 (1H, t, J=8.0 Hz), 7.55 (2H, t, J=8.0 Hz), 7.46 (2H, d, J=8.0 Hz), 7.38-7.24 (7H, m), 6.86 (4H, d, J=8.0 Hz), 5.89 (1H, s), 4.51 (1H, s), 4.47 (1H, m), 3.91 (1H, d, J=12.0 Hz), 3.79 (6H, s), 3.73 (1H, d, J=12.0 Hz), 3.15 (3H, s), 2.07 (1H, br s, 4.0 Hz).
LC-MS: UPLC 4min base 2.28 min M+H = 713
窒素雰囲気下、工程2で得た化合物918の粗生成物(9.12g)のジクロロメタン(25mL)溶液に、DABCO(2.09g、18.6mmol)及び4,4’-ジメトキシトリチルクロリド(5.04g、14.9mmol)を加え、室温で2時間撹拌した。4,4’-ジメトキシトリチルクロリド(1.26g、3.72mmol)を追加し、さらに2時間撹拌した。反応液に5%炭酸水素ナトリウム水溶液(50mL)及びジクロロメタン(50mL)を加え、有機層を水(50ml)で洗浄し、水洗浄液はジクロロメタン(50mL)で抽出した。有機層を合わせてメタノール(50mL)を加え、重量が60gになるまで溶媒を留去した後、再びメタノール(50mL)を加え、重量が67gになるまで溶媒を留去した。再びメタノール(25mL)を加え、室温で30分間撹拌して得られたスラリーをろ過した。ろ取した固体をメタノール(35mL)で洗浄した後、風乾することにより化合物919(4.31g、工程2からの通算収率81.3%)を得た。
1H-NMR(DMSO-d6)δ:2.98 (s, 3H), 3.26 (d, J = 11.0Hz, 1H), 3.42 (d, J = 11.7Hz, 1H), 3.73 (s, 6H), 4.67 (s, 1H), 4.79 (brs, 1H), 6.14 (s, 1H), 6.19 (brs, 1H), 6.88 (d, J = 8.3Hz, 4H), 7.21-7.32 (m, 7H), 7.39 (d, J = 7.8Hz, 2H), 7.57 (t, J = 7.4 Hz, 2H), 7.67 (t, J = 7.4Hz, 1H), 8.06 (d, J = 7.4Hz, 2H), 8.53 (s, 1H), 8.84 (s, 1H), 11.33 (brs, 1H).
1H-NMR(CDCl3)δ:8.98(1H, s), 8.81 (1H, s), 8.39 (1H, s), 8.03 (1H, d, J=8.0 Hz), 7.63 (1H, t, J=8.0 Hz), 7.55 (2H, t, J=8.0 Hz), 7.46 (2H, d, J=8.0 Hz), 7.38-7.24 (7H, m), 6.86 (4H, d, J=8.0 Hz), 5.89 (1H, s), 4.51 (1H, s), 4.47 (1H, m), 3.91 (1H, d, J=12.0 Hz), 3.79 (6H, s), 3.73 (1H, d, J=12.0 Hz), 3.15 (3H, s), 2.07 (1H, br s, 4.0 Hz).
LC-MS: UPLC 4min base 2.28 min M+H = 713
工程4 化合物920(Aアミダイト)の合成
窒素雰囲気下、化合物919(500mg、0.702mmol)及びN,N’-ジイソプロピルエチルアミン(0.368mL、2.11mmol)のピリジン(2mL)懸濁液に氷冷下、2-シアノエチル-N,N-ジイソプロピルクロロホスホロアミジト(0.235mL、1.05mmol)を滴下し、室温で2時間撹拌した。反応液に氷冷下、5%炭酸水素ナトリウム水溶液(5mL)を加え、酢酸エチル(5mL)で抽出した。有機層を3%塩化ナトリウム水溶液(5mL)で2回洗浄し、洗浄液はそれぞれ酢酸エチル(5mL)で抽出し、有機層を合わせて硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(酢酸エチル)により精製し、化合物920(391mg、収率61.0%)を得た。
1H-NMR(DMSO-d6)δ:0.87 (d, J = 6.8Hz, 2H), 0.92 (d, J = 6.5Hz, 4H), 1.06 (d, J = 6.8Hz, 2H), 1.08 (d, J = 6.8Hz, 4H), 2.55 (dd, J = 11.7, 5.4Hz, 1.3H), 2.70 (m, 0.7H), 2.99 (s, 2H), 3.01 (s, 1H), 3.18 (d, J = 11.5Hz, 0.7H), 3.22 (d, J = 11.5Hz, 0.3H), 3.43-3.57 (m, 4.3H), 3.65-3.70 (m, 0.7H), 3.72 (s, 2H), 3.73 (s, 4H), 4.98 (s, 1H), 5.04 (d, J = 4.8Hz, 0.3H), 5.12 (d, J = 7.8Hz, 0.7H), 6.28 (s, 0.7H), 6.29 (s, 0.3H), 6.85-6.89 (m, 4H), 7.21-7.31 (m, 7H), 7.36-7.39 (m, 2H), 7.57 (t, J = 7.5Hz, 2H), 7.66 (t, J = 7.3Hz, 1H), 8.06 (d, J = 7.5Hz, 2H), 8.50 (s, 0.3H), 8.52 (s, 0.7H), 8.83 (s, 1H), 11.31 (brs, 1H).
31P-NMR(DMSO-d6)δ:150.13 (s, 0.3H), 150.42 (s, 0.7H).
窒素雰囲気下、化合物919(500mg、0.702mmol)及びN,N’-ジイソプロピルエチルアミン(0.368mL、2.11mmol)のピリジン(2mL)懸濁液に氷冷下、2-シアノエチル-N,N-ジイソプロピルクロロホスホロアミジト(0.235mL、1.05mmol)を滴下し、室温で2時間撹拌した。反応液に氷冷下、5%炭酸水素ナトリウム水溶液(5mL)を加え、酢酸エチル(5mL)で抽出した。有機層を3%塩化ナトリウム水溶液(5mL)で2回洗浄し、洗浄液はそれぞれ酢酸エチル(5mL)で抽出し、有機層を合わせて硫酸ナトリウムで乾燥した。溶媒を減圧留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(酢酸エチル)により精製し、化合物920(391mg、収率61.0%)を得た。
1H-NMR(DMSO-d6)δ:0.87 (d, J = 6.8Hz, 2H), 0.92 (d, J = 6.5Hz, 4H), 1.06 (d, J = 6.8Hz, 2H), 1.08 (d, J = 6.8Hz, 4H), 2.55 (dd, J = 11.7, 5.4Hz, 1.3H), 2.70 (m, 0.7H), 2.99 (s, 2H), 3.01 (s, 1H), 3.18 (d, J = 11.5Hz, 0.7H), 3.22 (d, J = 11.5Hz, 0.3H), 3.43-3.57 (m, 4.3H), 3.65-3.70 (m, 0.7H), 3.72 (s, 2H), 3.73 (s, 4H), 4.98 (s, 1H), 5.04 (d, J = 4.8Hz, 0.3H), 5.12 (d, J = 7.8Hz, 0.7H), 6.28 (s, 0.7H), 6.29 (s, 0.3H), 6.85-6.89 (m, 4H), 7.21-7.31 (m, 7H), 7.36-7.39 (m, 2H), 7.57 (t, J = 7.5Hz, 2H), 7.66 (t, J = 7.3Hz, 1H), 8.06 (d, J = 7.5Hz, 2H), 8.50 (s, 0.3H), 8.52 (s, 0.7H), 8.83 (s, 1H), 11.31 (brs, 1H).
31P-NMR(DMSO-d6)δ:150.13 (s, 0.3H), 150.42 (s, 0.7H).
工程1 化合物921の合成
窒素雰囲気下、化合物914(15.0g、26.6mmol)及びグアニン(4.02g、26.6mmol)のシクロペンチルメチルエーテル(135mL)懸濁液にN,O-ビス(トリメチルシリル)アセトアミド(65.1mL、266mmol)及びシクロペンチルメチルエーテル(7.5mL)を加え、内温60~70℃で10分間攪拌した後、TMSOTf(11.83g、53.20mmol)及びシクロペンチルメチルエーテル(7.5mL)を加え、2時間撹拌した。反応液に内温20~30℃で酢酸エチル(150mL)を加え、さらに内温15~30℃で2mol/L塩酸(75mL)、テトラヒドロフラン(150mL)及び水(75mL)を加え、有機層を水(150mL)で2回洗浄した。洗浄液は合わせて酢酸エチル(150mL)で抽出し、水(75mL)で洗浄した。有機層を合わせて溶媒を減圧留去し、得られた残渣に酢酸エチル(37.5mL)及びn-ヘキサン(112.5mL)を加え、室温で20分間撹拌した。得られたスラリーをろ過し、ろ取した固体を酢酸エチル-n-ヘキサン(1:9、75mL)で洗浄した後、風乾することにより化合物921(14.35g、収率91.8%)を得た。
1H-NMR(DMSO-d6)δ:-0.09 (3H, s), 0.11 (3H, s), 0.85 (9H, s), 3.10 - 3.60 (4H, m), 3.74 (1H, dd, J = 11.8, 6.8Hz), 3.90 (1H, dd, J = 11.9, 9.4Hz), 4.65 (1H, m), 5.09 (1H, t, J = 8.2Hz), 6.50 - 6.70 (3H, m), 8.00 (1H, d, J = 9.0Hz), 10.74 (1H, s), 13.24 (1H, brs).
窒素雰囲気下、化合物914(15.0g、26.6mmol)及びグアニン(4.02g、26.6mmol)のシクロペンチルメチルエーテル(135mL)懸濁液にN,O-ビス(トリメチルシリル)アセトアミド(65.1mL、266mmol)及びシクロペンチルメチルエーテル(7.5mL)を加え、内温60~70℃で10分間攪拌した後、TMSOTf(11.83g、53.20mmol)及びシクロペンチルメチルエーテル(7.5mL)を加え、2時間撹拌した。反応液に内温20~30℃で酢酸エチル(150mL)を加え、さらに内温15~30℃で2mol/L塩酸(75mL)、テトラヒドロフラン(150mL)及び水(75mL)を加え、有機層を水(150mL)で2回洗浄した。洗浄液は合わせて酢酸エチル(150mL)で抽出し、水(75mL)で洗浄した。有機層を合わせて溶媒を減圧留去し、得られた残渣に酢酸エチル(37.5mL)及びn-ヘキサン(112.5mL)を加え、室温で20分間撹拌した。得られたスラリーをろ過し、ろ取した固体を酢酸エチル-n-ヘキサン(1:9、75mL)で洗浄した後、風乾することにより化合物921(14.35g、収率91.8%)を得た。
1H-NMR(DMSO-d6)δ:-0.09 (3H, s), 0.11 (3H, s), 0.85 (9H, s), 3.10 - 3.60 (4H, m), 3.74 (1H, dd, J = 11.8, 6.8Hz), 3.90 (1H, dd, J = 11.9, 9.4Hz), 4.65 (1H, m), 5.09 (1H, t, J = 8.2Hz), 6.50 - 6.70 (3H, m), 8.00 (1H, d, J = 9.0Hz), 10.74 (1H, s), 13.24 (1H, brs).
工程2 化合物922の合成
窒素雰囲気下、化合物921(14.0g、23.9mmol)及びN-メチルイミダゾール(7.60mL、95.4mmol)のN,N’-ジメチルアセタミド(70mL)溶液に、1mol/L テトラブチルアンモニウムフロリド-テトラヒドロフラン溶液(28.6mL、28.6mmol)及びN,N’-ジメチルアセタミド(14mL)を加え、内温70~80℃で8時間撹拌した。EDC塩酸塩(13.72g、71.55mmol)及びN,N’-ジメチルアセタミド(7mL)を内温20~30℃で加え、4時間撹拌した。反応液にN-メチルイミダゾール(7.60mL、95.4mmol)を加えた後、TBSクロリド(14.38g、95.40mmol)を内温20℃以下で加え、室温で2時間撹拌した。反応液に酢酸エチル(280mL)及び10%食塩水(140mL)を加え、有機層を水(140mL)で2回洗浄した。洗浄液はそれぞれ酢酸エチル(140mL)で抽出した。有機層を合わせて溶媒を減圧留去し、得られた残渣にアセトニトリル(56mL)、イソプロピルアルコール(28mL)及び水(266mL)を室温で順次加え、内温0~10℃で1時間撹拌した。得られたスラリーをろ過し、ろ取した固体をアセトニトリル-水(1:9、70mL)で洗浄した後、減圧下、60℃で乾燥し、化合物922(7.71g、収率74.1%)を得た。
1H-NMR(DMSO-d6)δ :-0.09 (3H, s), 0.10 (3H, s), 0.81 (9H, s), 2.92 (3H, s), 3.89 (2H, dd, J = 33.0, 12.7Hz), 4.33 (2H, s), 5.67 (1H, s), 5.93 (1H, brs), 6.54 (2H, brs), 7.69 (1H, s), 10.72 (1H, brs).
窒素雰囲気下、化合物921(14.0g、23.9mmol)及びN-メチルイミダゾール(7.60mL、95.4mmol)のN,N’-ジメチルアセタミド(70mL)溶液に、1mol/L テトラブチルアンモニウムフロリド-テトラヒドロフラン溶液(28.6mL、28.6mmol)及びN,N’-ジメチルアセタミド(14mL)を加え、内温70~80℃で8時間撹拌した。EDC塩酸塩(13.72g、71.55mmol)及びN,N’-ジメチルアセタミド(7mL)を内温20~30℃で加え、4時間撹拌した。反応液にN-メチルイミダゾール(7.60mL、95.4mmol)を加えた後、TBSクロリド(14.38g、95.40mmol)を内温20℃以下で加え、室温で2時間撹拌した。反応液に酢酸エチル(280mL)及び10%食塩水(140mL)を加え、有機層を水(140mL)で2回洗浄した。洗浄液はそれぞれ酢酸エチル(140mL)で抽出した。有機層を合わせて溶媒を減圧留去し、得られた残渣にアセトニトリル(56mL)、イソプロピルアルコール(28mL)及び水(266mL)を室温で順次加え、内温0~10℃で1時間撹拌した。得られたスラリーをろ過し、ろ取した固体をアセトニトリル-水(1:9、70mL)で洗浄した後、減圧下、60℃で乾燥し、化合物922(7.71g、収率74.1%)を得た。
1H-NMR(DMSO-d6)δ :-0.09 (3H, s), 0.10 (3H, s), 0.81 (9H, s), 2.92 (3H, s), 3.89 (2H, dd, J = 33.0, 12.7Hz), 4.33 (2H, s), 5.67 (1H, s), 5.93 (1H, brs), 6.54 (2H, brs), 7.69 (1H, s), 10.72 (1H, brs).
工程3 化合物923の合成
窒素雰囲気下、化合物922(7.50g、17.2mmol)のピリジン(37.5mL、464mmol)懸濁液に、内温10~20℃でトリメチルシリルクロリド(9.33g、85.9mmol)を滴下した後、室温で30分間撹拌した。次に内温0~5℃でフェノキシアセチルクロリド(3.52g、20.6mmol)を滴下した後、室温で1時間撹拌した。反応液を酢酸エチル(150mL)で希釈した後、内温0~10℃で10%食塩水(37.5mL)及び濃塩酸(30.0mL)の混合液を滴下した。有機層を1mol/L塩酸(75mL)及び水(75mL)で2回洗浄し、次に酢酸エチル(37.5mL)及び2mol/L塩酸メタノール溶液(38.7mL、77.4mmol)を順次加え、室温で1時間撹拌した。得られたスラリーにメタノール(15mL)を加え、室温で30分間撹拌した後、ろ過し、ろ取した固体を酢酸エチル(45mL)で洗浄した後、風乾することにより化合物923(5.51g、収率70.3%)を得た。
1H-NMR(DMSO-d6)δ:2.95 (3H, s), 3.68 (1H, d, J = 13.6Hz), 3.82 (1H, d, J = 13.3Hz), 4.35 (1H, s), 4.41 (1H, s), 4.92 (2H, s), 5.80 (1H, s), 6.99 (3H, m), 7.32 (2H, m), 8.19(1H, s), 11.82(2H, br).
窒素雰囲気下、化合物922(7.50g、17.2mmol)のピリジン(37.5mL、464mmol)懸濁液に、内温10~20℃でトリメチルシリルクロリド(9.33g、85.9mmol)を滴下した後、室温で30分間撹拌した。次に内温0~5℃でフェノキシアセチルクロリド(3.52g、20.6mmol)を滴下した後、室温で1時間撹拌した。反応液を酢酸エチル(150mL)で希釈した後、内温0~10℃で10%食塩水(37.5mL)及び濃塩酸(30.0mL)の混合液を滴下した。有機層を1mol/L塩酸(75mL)及び水(75mL)で2回洗浄し、次に酢酸エチル(37.5mL)及び2mol/L塩酸メタノール溶液(38.7mL、77.4mmol)を順次加え、室温で1時間撹拌した。得られたスラリーにメタノール(15mL)を加え、室温で30分間撹拌した後、ろ過し、ろ取した固体を酢酸エチル(45mL)で洗浄した後、風乾することにより化合物923(5.51g、収率70.3%)を得た。
1H-NMR(DMSO-d6)δ:2.95 (3H, s), 3.68 (1H, d, J = 13.6Hz), 3.82 (1H, d, J = 13.3Hz), 4.35 (1H, s), 4.41 (1H, s), 4.92 (2H, s), 5.80 (1H, s), 6.99 (3H, m), 7.32 (2H, m), 8.19(1H, s), 11.82(2H, br).
工程4 化合物924(Gアミダイト)の合成
窒素雰囲気下、化合物923(500mg、1.10mmol)のジメチルアセタミド(3.5mL)溶液に、4,4’-ジメトキシトリチルクロリド(1.11g、3.29mmol)及びDABCO(369mg、3.21mmol)を加え、室温で2.5時間撹拌した。反応液に10℃以下でDABCO(369mg、3.21mmol)及び2-シアノエチルジイソプロピルクロロホスホロアミジト(0.587mL、2.63mmol)を加え、室温で1時間撹拌した。反応液に酢酸エチル(10mL)、5%炭酸水素ナトリウム水溶液(2.5mL)及び10%食塩水(2.5mL)を加え、有機層を10%食塩水(5mL)で2回洗浄した。洗浄液は合わせて酢酸エチル(2.5mL)で抽出した。有機層を合わせて無水硫酸ナトリウムで乾燥した後、溶媒を減圧留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(ヘキサン/酢酸エチル)により精製し、化合物924(720mg、酢酸エチル9.9wt%含有、収率61.7%)を得た。
1H-NMR (DMSO-d6) δ: 11.87 (1.0H, br s), 11.77 (1.0H, br s), 8.07 (1.0H, s), 7.40 (1.9H, t, J = 7.4 Hz), 7.35-7.23 (9.0H, m), 7.02-6.97 (3.0H, m), 6.93-6.88 (4.0H, m), 6.08 (1.0H, s), 4.91 (2.0H, s), 4.78 (1.0H, s), 4.64 (0.7H, d, J = 8.8 Hz), 4.59 (0.3H, d, J = 6.0 Hz), 3.75 (4.2H, s), 3.74 (1.8H, s), 3.72-3.60 (0.6H, m), 3.60-3.49 (1.3H, m), 3.48-3.39 (1.4H, m), 3.21 (0.7H, dd, J = 15.4, 11.6 Hz), 2.98 (0.9H, s), 2.97 (2.1H, s), 2.70 (0.6H, dd, J = 10.1, 5.4 Hz), 2.58 (1.4H, t, J = 5.9 Hz), 1.09-1.05 (6.0H, m), 0.91-0.83 (6.0H, m).
31P-NMR (CDCl3) δ: 148.90, 149.98
窒素雰囲気下、化合物923(500mg、1.10mmol)のジメチルアセタミド(3.5mL)溶液に、4,4’-ジメトキシトリチルクロリド(1.11g、3.29mmol)及びDABCO(369mg、3.21mmol)を加え、室温で2.5時間撹拌した。反応液に10℃以下でDABCO(369mg、3.21mmol)及び2-シアノエチルジイソプロピルクロロホスホロアミジト(0.587mL、2.63mmol)を加え、室温で1時間撹拌した。反応液に酢酸エチル(10mL)、5%炭酸水素ナトリウム水溶液(2.5mL)及び10%食塩水(2.5mL)を加え、有機層を10%食塩水(5mL)で2回洗浄した。洗浄液は合わせて酢酸エチル(2.5mL)で抽出した。有機層を合わせて無水硫酸ナトリウムで乾燥した後、溶媒を減圧留去し、得られた残渣をシリカゲルカラムクロマトグラフィー(ヘキサン/酢酸エチル)により精製し、化合物924(720mg、酢酸エチル9.9wt%含有、収率61.7%)を得た。
1H-NMR (DMSO-d6) δ: 11.87 (1.0H, br s), 11.77 (1.0H, br s), 8.07 (1.0H, s), 7.40 (1.9H, t, J = 7.4 Hz), 7.35-7.23 (9.0H, m), 7.02-6.97 (3.0H, m), 6.93-6.88 (4.0H, m), 6.08 (1.0H, s), 4.91 (2.0H, s), 4.78 (1.0H, s), 4.64 (0.7H, d, J = 8.8 Hz), 4.59 (0.3H, d, J = 6.0 Hz), 3.75 (4.2H, s), 3.74 (1.8H, s), 3.72-3.60 (0.6H, m), 3.60-3.49 (1.3H, m), 3.48-3.39 (1.4H, m), 3.21 (0.7H, dd, J = 15.4, 11.6 Hz), 2.98 (0.9H, s), 2.97 (2.1H, s), 2.70 (0.6H, dd, J = 10.1, 5.4 Hz), 2.58 (1.4H, t, J = 5.9 Hz), 1.09-1.05 (6.0H, m), 0.91-0.83 (6.0H, m).
31P-NMR (CDCl3) δ: 148.90, 149.98
工程1 化合物925の合成
化合物915 108.1g(純度:92.53%、含量:100g、0.167mol)、DMF 300ml、イミダゾール47.8g(4.2eq.)、TBSクロリド 51.6g(2.05eq.)を仕込み25℃付近で23時間撹拌を行った。酢酸エチル 600ml、水 600mlを加えて分液を行い、水層を酢酸エチル 300mlで再抽出を行った。有機層を混合し、5%炭酸水素ナトリウム水溶液 600ml、5%食塩水 600mlで洗浄を行い、溶媒を回収した。TBSOHの除去を目的にトルエン 500ml×3回溶媒置換を行った後、アモルファスを固化させたものをほぐして目的の化合物925(132.6g、粗収率 111.2%)を得た。
1H-NMR (CDCl3) δ: 8.33 (1H, s), 7.89 (1H, s), 7.41 (2H, d, J = 7.0 Hz), 7.33-7.21 (7H, m), 6.82 (4H, dd, J = 8.8, 5.6 Hz), 5.43 (1H, s), 4.50 (1H, s), 4.04 (1H, s), 3.87 (1H, d, J = 11.8 Hz), 3.789 (3H, s), 3.787 (3H, s), 3.41 (1H, d, J = 11.8 Hz), 3.00 (3H, s), 1.56 (3H, s), 0.75 (9H, s), 0.04 (2H, s), -0.04 (2H, s).
化合物915 108.1g(純度:92.53%、含量:100g、0.167mol)、DMF 300ml、イミダゾール47.8g(4.2eq.)、TBSクロリド 51.6g(2.05eq.)を仕込み25℃付近で23時間撹拌を行った。酢酸エチル 600ml、水 600mlを加えて分液を行い、水層を酢酸エチル 300mlで再抽出を行った。有機層を混合し、5%炭酸水素ナトリウム水溶液 600ml、5%食塩水 600mlで洗浄を行い、溶媒を回収した。TBSOHの除去を目的にトルエン 500ml×3回溶媒置換を行った後、アモルファスを固化させたものをほぐして目的の化合物925(132.6g、粗収率 111.2%)を得た。
1H-NMR (CDCl3) δ: 8.33 (1H, s), 7.89 (1H, s), 7.41 (2H, d, J = 7.0 Hz), 7.33-7.21 (7H, m), 6.82 (4H, dd, J = 8.8, 5.6 Hz), 5.43 (1H, s), 4.50 (1H, s), 4.04 (1H, s), 3.87 (1H, d, J = 11.8 Hz), 3.789 (3H, s), 3.787 (3H, s), 3.41 (1H, d, J = 11.8 Hz), 3.00 (3H, s), 1.56 (3H, s), 0.75 (9H, s), 0.04 (2H, s), -0.04 (2H, s).
工程2 化合物926の合成
化合物925 132.6g(0.167mol相当)、アセトニトリル 800ml、トリエチルアミン 50.7g(3eq.)、4-ジメチルアミノピリジン 2.0g(0.1eq.)、2’,4’,6’-トリイソプロピルスルホニルクロリド 65.8g(1.3eq.)を加え、25℃付近で22時間撹拌した。25%アンモニア水 800mlを加え25℃付近で2時間撹拌した。アセトニトリルを粗く回収し、酢酸エチル 400ml、水 400mlを加えて分液を行い、水層を酢酸エチル 300mlで再抽出した。有機層を混合し、5%食塩水 400ml×2回洗浄を行い、溶媒を回収した。アモルファスを固化させたものをほぐして目的の化合物926(192.8g、化合物915からの粗収率 161.9%)を得た。
1H-NMR (CDCl3) δ: 7.97 (1H, s), 7.53 (2H, d, J = 7.2 Hz), 7.35-7.25 (7H, m), 6.83 (4H, dd, J = 8.8, 6.8 Hz), 5.51 (1H, s), 4.46 (1H, s), 4.19 (1H, s), 3.88 (1H, d, J = 11.7 Hz), 3.79 (6H, s), 3.39 (1H, d, J = 11.7 Hz), 3.02 (3H, s), 1.85 (3H, s), 1.66 (3H, s), 0.74 (9H, s), 0.04 (2H, s), -0.04 (2H, s).
化合物925 132.6g(0.167mol相当)、アセトニトリル 800ml、トリエチルアミン 50.7g(3eq.)、4-ジメチルアミノピリジン 2.0g(0.1eq.)、2’,4’,6’-トリイソプロピルスルホニルクロリド 65.8g(1.3eq.)を加え、25℃付近で22時間撹拌した。25%アンモニア水 800mlを加え25℃付近で2時間撹拌した。アセトニトリルを粗く回収し、酢酸エチル 400ml、水 400mlを加えて分液を行い、水層を酢酸エチル 300mlで再抽出した。有機層を混合し、5%食塩水 400ml×2回洗浄を行い、溶媒を回収した。アモルファスを固化させたものをほぐして目的の化合物926(192.8g、化合物915からの粗収率 161.9%)を得た。
1H-NMR (CDCl3) δ: 7.97 (1H, s), 7.53 (2H, d, J = 7.2 Hz), 7.35-7.25 (7H, m), 6.83 (4H, dd, J = 8.8, 6.8 Hz), 5.51 (1H, s), 4.46 (1H, s), 4.19 (1H, s), 3.88 (1H, d, J = 11.7 Hz), 3.79 (6H, s), 3.39 (1H, d, J = 11.7 Hz), 3.02 (3H, s), 1.85 (3H, s), 1.66 (3H, s), 0.74 (9H, s), 0.04 (2H, s), -0.04 (2H, s).
工程3 化合物927の合成
化合物926 192.8g(0.167mol相当)、DMF 500ml、安息香酸無水物 75.6g(2eq.)を加え、25℃付近で22時間撹拌した。酢酸エチル 1000ml、5%炭酸水素ナトリウム 1000mlを加えて分液を行い、水層を酢酸エチル 500mlで再抽出した。有機層を混合し、5%炭酸水素ナトリウム水溶液 500ml、5%食塩水 500mlで洗浄を行い、溶媒を回収して化合物927の粗生成物を得た。シリカゲル1.3kg、展開溶媒ヘキサン/酢酸エチル=8/2→6/4で精製を行い、アモルファスを固化させたものをほぐして目的の化合物927(124.1g、化合物915からの収率 91%)を得た。
1H-NMR (CDCl3) δ: 8.33 (2H, d, J = 7.2 Hz), 8.05 (1H, s), 7.53 (1H, dd, J = 7.4, 7.4 Hz), 7.49-7.41 (5H, m), 7.35-7.28 (7H, m), 7.25 (1H, m), 6.84 (4H, dd, J = 8.8, 6.4 Hz), 5.49(1H, s), 4.51 (1H, s), 4.10 (1H, s), 3.90 (1H, d, J = 11.7 Hz), 3.803 (3H, s), 3.800 (3H, s), 3.42 (1H, d, J = 11.7 Hz), 3.11 (3H, s), 1.85 (3H, s), 0.74 (9H, s), 0.04 (2H, s), -0.04 (2H, s).
化合物926 192.8g(0.167mol相当)、DMF 500ml、安息香酸無水物 75.6g(2eq.)を加え、25℃付近で22時間撹拌した。酢酸エチル 1000ml、5%炭酸水素ナトリウム 1000mlを加えて分液を行い、水層を酢酸エチル 500mlで再抽出した。有機層を混合し、5%炭酸水素ナトリウム水溶液 500ml、5%食塩水 500mlで洗浄を行い、溶媒を回収して化合物927の粗生成物を得た。シリカゲル1.3kg、展開溶媒ヘキサン/酢酸エチル=8/2→6/4で精製を行い、アモルファスを固化させたものをほぐして目的の化合物927(124.1g、化合物915からの収率 91%)を得た。
1H-NMR (CDCl3) δ: 8.33 (2H, d, J = 7.2 Hz), 8.05 (1H, s), 7.53 (1H, dd, J = 7.4, 7.4 Hz), 7.49-7.41 (5H, m), 7.35-7.28 (7H, m), 7.25 (1H, m), 6.84 (4H, dd, J = 8.8, 6.4 Hz), 5.49(1H, s), 4.51 (1H, s), 4.10 (1H, s), 3.90 (1H, d, J = 11.7 Hz), 3.803 (3H, s), 3.800 (3H, s), 3.42 (1H, d, J = 11.7 Hz), 3.11 (3H, s), 1.85 (3H, s), 0.74 (9H, s), 0.04 (2H, s), -0.04 (2H, s).
工程4 化合物928の合成
化合物927 124.1g(0.152mol)、テトラヒドロフラン 869ml、1mol/L テトラブチルアンモニウムフロリド/テトラヒドロフラン 182ml(1.2eq.)を加え2時間撹拌を行った。溶媒を回収し、酢酸エチル 620ml、5%炭酸水素ナトリウム水溶液 620mlを加えて分液を行った。5%食塩水 620mlで洗浄し溶媒を回収した。TBSOHの除去を目的にトルエン 620ml×3回溶媒置換を行った後、アモルファスを固化させたものをほぐして目的の化合物928(119.2g、化合物927からの収率 119%)を得た。
1H-NMR (CDCl3) δ: 13.44 (1H, br s), 8.32 (2H, d, J = 7.5 Hz), 7.92 (1H, s), 7.55 (1H, dd, J = 7.3, 7.3 Hz), 7.50-7.43 (4H, m), 7.40-7.30 (7H, m), 7.26 (1H, m), 6.86 (4H, dd, J = 8.8, 3.6 Hz), 5.46 (1H, s), 4.37 (1H, br.s), 4.16 (1H, s), 3.92 (1H, d, J = 12.3 Hz), 3.803 (3H, s), 3.800 (3H, s), 3.57-3.42 (4H, m), 3.63 (1H, d, J = 12.3 Hz), 3.03 (3H, s), 1.90 (3H, s).
化合物927 124.1g(0.152mol)、テトラヒドロフラン 869ml、1mol/L テトラブチルアンモニウムフロリド/テトラヒドロフラン 182ml(1.2eq.)を加え2時間撹拌を行った。溶媒を回収し、酢酸エチル 620ml、5%炭酸水素ナトリウム水溶液 620mlを加えて分液を行った。5%食塩水 620mlで洗浄し溶媒を回収した。TBSOHの除去を目的にトルエン 620ml×3回溶媒置換を行った後、アモルファスを固化させたものをほぐして目的の化合物928(119.2g、化合物927からの収率 119%)を得た。
1H-NMR (CDCl3) δ: 13.44 (1H, br s), 8.32 (2H, d, J = 7.5 Hz), 7.92 (1H, s), 7.55 (1H, dd, J = 7.3, 7.3 Hz), 7.50-7.43 (4H, m), 7.40-7.30 (7H, m), 7.26 (1H, m), 6.86 (4H, dd, J = 8.8, 3.6 Hz), 5.46 (1H, s), 4.37 (1H, br.s), 4.16 (1H, s), 3.92 (1H, d, J = 12.3 Hz), 3.803 (3H, s), 3.800 (3H, s), 3.57-3.42 (4H, m), 3.63 (1H, d, J = 12.3 Hz), 3.03 (3H, s), 1.90 (3H, s).
工程5 化合物929(MeC(Bz)アミダイト)の合成
化合物928 108.2g(0.138mol相当)、ジクロロメタン 564ml、N, N’-ジイソプロピルエチルアミン 35.7g(2eq.)を仕込み、5℃以下で2-シアノエチルジイソプロピルクロロホスフォロアミダイト 49.0g(1.5eq.)を滴下した。その後、25℃付近で2時間撹拌した。5%炭酸水素ナトリウム水溶液 564mlを加え分液し、溶媒を回収してMeC(Bz)の粗生成物を得た。シリカゲル2.3kg、展開溶媒ヘキサン/酢酸エチル=7/3→5/5で精製を行い、アモルファスを固化させたものをほぐして目的の化合物929(MeC(Bz)アミダイト、105.2g、化合物927からの収率 84%、2種のジアステレオマー比(HPLCの積分値より算出)=54:46)を得た。
1H-NMR (CDCl3) δ:(major diastereomer)13.47 (1H, br s), 8.33 (2H, d, J = 7.4 Hz), 7.98 (1H, s), 7.52 (1H, dd, J = 7.4, 7.4 Hz),7.50-7.42 (4H, m), 7.37-7.24 (8H, m), 6.86 (4H, dd, J = 8.8, 6.6 Hz), 5.52 (1H, s), 4.64 (1H, d, J = 6.9 Hz), 4.37 (1H, s), 3.92 (1H, d, J = 11.7 Hz), 3.812 (3H, s), 3.807 (3H, s), 3.57-3.42 (4H, m), 3.51 (1H, d, J = 11.7 Hz), 3.02 (3H, s), 2.36 (2H, t, J = 5.9 Hz), 1.77 (3H, s), 1.14 (6H, d, J = 6.8 Hz), 1.05 (6H, d, J = 6.8 Hz).(minor diastereomer)13.47 (1H, br s), 8.33 (2H, d, J = 7.3 Hz), 7.98 (1H, s), 7.56 (1H, dd, J = 7.3, 7.3 Hz), 7.47-7.43 (4H, m), 7.35-7.28 (7H, m), 7.22 (1H, m), 6.86 (4H, dd, J = 8.8, 5.5 Hz), 5.51 (1H, s), 4.60 (1H, d, J = 4.3 Hz), 4.43 (1H, s), 3.88 (1H, d, J = 11.7 Hz), 3.802 (3H, s), 3.798 (3H, s), 3.64 (1H, m), 3.52 (1H, d, J = 11.7 Hz), 3.52-3.44 (3H, m), 3.04 (3H, s), 2.60-2.52 (2H, m), 1.79 (3H, s), 1.11 (6H, d, J = 6.8 Hz), 0.99 (6H, d, J = 6.8 Hz).
31P-NMR (CDCl3) δ: 151.24, 151.05.
化合物928 108.2g(0.138mol相当)、ジクロロメタン 564ml、N, N’-ジイソプロピルエチルアミン 35.7g(2eq.)を仕込み、5℃以下で2-シアノエチルジイソプロピルクロロホスフォロアミダイト 49.0g(1.5eq.)を滴下した。その後、25℃付近で2時間撹拌した。5%炭酸水素ナトリウム水溶液 564mlを加え分液し、溶媒を回収してMeC(Bz)の粗生成物を得た。シリカゲル2.3kg、展開溶媒ヘキサン/酢酸エチル=7/3→5/5で精製を行い、アモルファスを固化させたものをほぐして目的の化合物929(MeC(Bz)アミダイト、105.2g、化合物927からの収率 84%、2種のジアステレオマー比(HPLCの積分値より算出)=54:46)を得た。
1H-NMR (CDCl3) δ:(major diastereomer)13.47 (1H, br s), 8.33 (2H, d, J = 7.4 Hz), 7.98 (1H, s), 7.52 (1H, dd, J = 7.4, 7.4 Hz),7.50-7.42 (4H, m), 7.37-7.24 (8H, m), 6.86 (4H, dd, J = 8.8, 6.6 Hz), 5.52 (1H, s), 4.64 (1H, d, J = 6.9 Hz), 4.37 (1H, s), 3.92 (1H, d, J = 11.7 Hz), 3.812 (3H, s), 3.807 (3H, s), 3.57-3.42 (4H, m), 3.51 (1H, d, J = 11.7 Hz), 3.02 (3H, s), 2.36 (2H, t, J = 5.9 Hz), 1.77 (3H, s), 1.14 (6H, d, J = 6.8 Hz), 1.05 (6H, d, J = 6.8 Hz).(minor diastereomer)13.47 (1H, br s), 8.33 (2H, d, J = 7.3 Hz), 7.98 (1H, s), 7.56 (1H, dd, J = 7.3, 7.3 Hz), 7.47-7.43 (4H, m), 7.35-7.28 (7H, m), 7.22 (1H, m), 6.86 (4H, dd, J = 8.8, 5.5 Hz), 5.51 (1H, s), 4.60 (1H, d, J = 4.3 Hz), 4.43 (1H, s), 3.88 (1H, d, J = 11.7 Hz), 3.802 (3H, s), 3.798 (3H, s), 3.64 (1H, m), 3.52 (1H, d, J = 11.7 Hz), 3.52-3.44 (3H, m), 3.04 (3H, s), 2.60-2.52 (2H, m), 1.79 (3H, s), 1.11 (6H, d, J = 6.8 Hz), 0.99 (6H, d, J = 6.8 Hz).
31P-NMR (CDCl3) δ: 151.24, 151.05.
2)固相合成
すべてのオリゴヌクレオチドはAKTA Oligopilot10 (GE Healthcare)を用いて、ホスホロアミダイト法により合成した。モノマーは上記アミダイト合成で得られたアミダイトを用いて、0.1Mアセトニトリル溶液に調製した。カップリング時間は5~10分間とし、1つのモノマーの縮合に4当量のアミダイト体を用いた。PO酸化にはヨウ素/ピリジン/水/=12.7/9/1(w/v/v)を使用し、PS酸化には0.2mol/Lフェニルアセチルジスルフィドのアセトニトリル/3-ピコリン1/1(v/v)溶液を用いた。
すべてのオリゴヌクレオチドはAKTA Oligopilot10 (GE Healthcare)を用いて、ホスホロアミダイト法により合成した。モノマーは上記アミダイト合成で得られたアミダイトを用いて、0.1Mアセトニトリル溶液に調製した。カップリング時間は5~10分間とし、1つのモノマーの縮合に4当量のアミダイト体を用いた。PO酸化にはヨウ素/ピリジン/水/=12.7/9/1(w/v/v)を使用し、PS酸化には0.2mol/Lフェニルアセチルジスルフィドのアセトニトリル/3-ピコリン1/1(v/v)溶液を用いた。
3)脱保護I (樹脂からの切り出し、塩基及びリン酸の脱保護)
DNAオリゴヌクレオチド(SEQ-1、12)の切り出しは0.2mol/L 水酸化ナトリウム(メタノール/水=4/1)を用いて、室温下で15時間振とうした。樹脂を50%エタノール水で洗浄後、ろ過液を5%クエン酸水溶液で中和して減圧下で濃縮した。
SEQ-2~6、13~19、27~29、33、34、36の切り出しは28%アンモニア水/メチルアミン/エタノール=6/2/2(v/v)を用いて、室温下で24時間振とうした。樹脂を50%エタノール水で洗浄後、ろ過液を減圧下で濃縮した後、凍結乾燥にて白色粉末を得た。
DNAオリゴヌクレオチド(SEQ-1、12)の切り出しは0.2mol/L 水酸化ナトリウム(メタノール/水=4/1)を用いて、室温下で15時間振とうした。樹脂を50%エタノール水で洗浄後、ろ過液を5%クエン酸水溶液で中和して減圧下で濃縮した。
SEQ-2~6、13~19、27~29、33、34、36の切り出しは28%アンモニア水/メチルアミン/エタノール=6/2/2(v/v)を用いて、室温下で24時間振とうした。樹脂を50%エタノール水で洗浄後、ろ過液を減圧下で濃縮した後、凍結乾燥にて白色粉末を得た。
4)脱保護II (2’-TBS基の脱保護)
得られた白色粉末に、N-メチルピロリドン/トリエチルアミン/3-フッ化水素トリエチルアミン=6/1/2(v/v)を加えて65℃下で1.5時間撹拌した。反応液に同量のエトキシトリメチルシランを加えて室温下で10分間激しく撹拌すると沈殿物が得られた。2500xg(2分間)にて遠心分離後、有機溶媒層を注意深く除去した。得られた沈殿物にジエチルエーテルを加えて激しく撹拌後、同様に遠心分離を行い有機溶媒を除去して、粗RNA体(白色固体)を得た。
得られた白色粉末に、N-メチルピロリドン/トリエチルアミン/3-フッ化水素トリエチルアミン=6/1/2(v/v)を加えて65℃下で1.5時間撹拌した。反応液に同量のエトキシトリメチルシランを加えて室温下で10分間激しく撹拌すると沈殿物が得られた。2500xg(2分間)にて遠心分離後、有機溶媒層を注意深く除去した。得られた沈殿物にジエチルエーテルを加えて激しく撹拌後、同様に遠心分離を行い有機溶媒を除去して、粗RNA体(白色固体)を得た。
5)精製
SEQ-1、12は陰イオン交換モードで精製を行った。SEQ-2~6、13~19、27~29、33、34、36は逆相モードで精製を行った。
陰イオン交換モードの条件
移動相 A液:20mmol/L Tris-HCl(pH8)/ 1mmol/L EDTA
B液:20mmol/L Tris-HCl(pH8)/ 1mmol/L EDTA 2.0M NaBr
B濃度グラジエント:10-80%
Column:SOURCE 30Q(26/10)(GE Healthcare社製)
流速:19mL/min
カラム温度:室温
検出UV:260nm
逆相モードの条件は、SEQ-2は精製条件2を選択し、SEQ-3~6、13~19、27~29、33、34、36は精製条件1を選択した。
精製条件1
移動相 A液:10mmol/L TEAA(pH7)
B液:10mM TEAA(pH7)/アセトニトリル=1/1(v/v)
B濃度グラジエント:20-60%
Column:YMC Hydrosphere C18(20x100mm)(YMC社製)
流速:15mL/min
カラム温度:室温
検出UV:260nm
精製条件2
移動相 A液:50mmol/L リン酸緩衝液(pH8)
B液:アセトニトリル
B濃度グラジエント:30-60%
Column:YMC-Pack C4(20x100mm)(YMC社製)
流速:15mL/min
カラム温度:室温
検出UV:260nm
SEQ-1、12は陰イオン交換モードで精製を行った。SEQ-2~6、13~19、27~29、33、34、36は逆相モードで精製を行った。
陰イオン交換モードの条件
移動相 A液:20mmol/L Tris-HCl(pH8)/ 1mmol/L EDTA
B液:20mmol/L Tris-HCl(pH8)/ 1mmol/L EDTA 2.0M NaBr
B濃度グラジエント:10-80%
Column:SOURCE 30Q(26/10)(GE Healthcare社製)
流速:19mL/min
カラム温度:室温
検出UV:260nm
逆相モードの条件は、SEQ-2は精製条件2を選択し、SEQ-3~6、13~19、27~29、33、34、36は精製条件1を選択した。
精製条件1
移動相 A液:10mmol/L TEAA(pH7)
B液:10mM TEAA(pH7)/アセトニトリル=1/1(v/v)
B濃度グラジエント:20-60%
Column:YMC Hydrosphere C18(20x100mm)(YMC社製)
流速:15mL/min
カラム温度:室温
検出UV:260nm
精製条件2
移動相 A液:50mmol/L リン酸緩衝液(pH8)
B液:アセトニトリル
B濃度グラジエント:30-60%
Column:YMC-Pack C4(20x100mm)(YMC社製)
流速:15mL/min
カラム温度:室温
検出UV:260nm
6)精製オリゴヌクレオチドの脱塩及び凍結乾燥
得られたオリゴヌクレオチドはVivaSpin20(MWCO 3000)(Sartorius社製)を用いて、限外濾過を繰り返すことでフラクションに含まれる塩成分を除去した。その後、凍結乾燥にて目的とするオリゴヌクレオチドを粉末として得た。
得られたオリゴヌクレオチドはVivaSpin20(MWCO 3000)(Sartorius社製)を用いて、限外濾過を繰り返すことでフラクションに含まれる塩成分を除去した。その後、凍結乾燥にて目的とするオリゴヌクレオチドを粉末として得た。
7)各オリゴヌクレオチドについて
PO酸化にはヨウ素/ピリジン/水/=12.7/9/1(w/v/v)を使用し、PS酸化には0.2mol/Lフェニルアセチルジスルフィドのアセトニトリル/3-ピコリン1/1(v/v)溶液を用いた。
(7-1)SEQ-2の合成
5’末端のα―トコフェロール体(化合物204)の導入は5’-Tocopherol-CE Phosphoramidite(link technologies社より購入)を用いた。
PO酸化にはヨウ素/ピリジン/水/=12.7/9/1(w/v/v)を使用し、PS酸化には0.2mol/Lフェニルアセチルジスルフィドのアセトニトリル/3-ピコリン1/1(v/v)溶液を用いた。
(7-1)SEQ-2の合成
5’末端のα―トコフェロール体(化合物204)の導入は5’-Tocopherol-CE Phosphoramidite(link technologies社より購入)を用いた。
(7-2)SEQ-3又は4(リンカーがL6)の合成
5’末端のアシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNac誘導体、化合物205)の導入には化合物1を用いた。
5’末端のアシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNac誘導体、化合物205)の導入には化合物1を用いた。
(7-3)SEQ-5、6又は13(リンカーがL7)の合成
3’末端のアシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNac誘導体、化合物205)の導入には合成固相担体として化合物1001を用いた。
3’末端のアシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNac誘導体、化合物205)の導入には合成固相担体として化合物1001を用いた。
(7-4)SEQ-14(リンカーがL8)の合成
シグマアルドリッチ社から市販されているMMT-Hexylaminolinker amiditeを用いて5’末端にアミノ基を露出させた状態でオリゴヌクレオチド合成を終了した。その後、HBTUを用いて化合物2と縮合することでアシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNac誘導体、化合物205)の導入を行い、切り出し、脱保護を行った。
シグマアルドリッチ社から市販されているMMT-Hexylaminolinker amiditeを用いて5’末端にアミノ基を露出させた状態でオリゴヌクレオチド合成を終了した。その後、HBTUを用いて化合物2と縮合することでアシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNac誘導体、化合物205)の導入を行い、切り出し、脱保護を行った。
(7-5)SEQ-15、16又は28(リンカーがL9)の合成
3’末端のアシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNac誘導体、化合物205)の導入には合成固相担体として化合物1002を用いた。
3’末端のアシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNac誘導体、化合物205)の導入には合成固相担体として化合物1002を用いた。
(7-6)SEQ-29(リンカーがL9)の合成
3’末端のアシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNac誘導体、化合物205)の導入には合成固相担体として化合物1002を用いた。LNA(化合物203)を導入するためのアミダイト試薬はコスモ・バイオ株式会社から購入した。
3’末端のアシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNac誘導体、化合物205)の導入には合成固相担体として化合物1002を用いた。LNA(化合物203)を導入するためのアミダイト試薬はコスモ・バイオ株式会社から購入した。
(7-7)SEQ-17(リンカーがL10)、18(リンカーがL11)、19(リンカーがL12)又は33(リンカーがL13)の合成
3’末端のアシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNac誘導体、化合物205)の導入には合成固相担体として、それぞれ化合物1003、1004、1005又は1006を用いた。
3’末端のアシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNac誘導体、化合物205)の導入には合成固相担体として、それぞれ化合物1003、1004、1005又は1006を用いた。
(7-8)SEQ-34(リンカーがL9L14)の合成
3’末端のアシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNac誘導体、化合物205)の導入には合成固相担体として化合物1002を用いた。また、ジスルフィド結合の導入にはLinkTechnology社から市販されているThiol-Modifier-C6-S-S CE Phosphoroamidete試薬を用いた。
3’末端のアシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNac誘導体、化合物205)の導入には合成固相担体として化合物1002を用いた。また、ジスルフィド結合の導入にはLinkTechnology社から市販されているThiol-Modifier-C6-S-S CE Phosphoroamidete試薬を用いた。
(7-9)SEQ-35(リンカーがL15)の合成
シグマアルドリッチ社から市販されているMMT-Hexylaminolinker amiditeを用いて5’末端にアミノ基を有するオリゴヌクレオチドを得る。その後、化合物20と縮合させることでアシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNac誘導体、化合物205)を導入することができる。
シグマアルドリッチ社から市販されているMMT-Hexylaminolinker amiditeを用いて5’末端にアミノ基を有するオリゴヌクレオチドを得る。その後、化合物20と縮合させることでアシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNac誘導体、化合物205)を導入することができる。
(7-10)SEQ-36(リンカーがL16)の合成
シグマアルドリッチ社から市販されているMMT-Hexylaminolinker amiditeを用いて5’末端にアミノ基を有するオリゴヌクレオチドを樹脂上に合成した。この樹脂(14mg、0.5μmol相当)に対して、化合物21のNMP溶液(0.15mL、4μmol相当)を加えて50℃下で1日間加熱することで、アシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNac誘導体、化合物205)の導入を行った。
シグマアルドリッチ社から市販されているMMT-Hexylaminolinker amiditeを用いて5’末端にアミノ基を有するオリゴヌクレオチドを樹脂上に合成した。この樹脂(14mg、0.5μmol相当)に対して、化合物21のNMP溶液(0.15mL、4μmol相当)を加えて50℃下で1日間加熱することで、アシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNac誘導体、化合物205)の導入を行った。
(7-11)オリゴヌクレオチドの購入
オリゴヌクレオチド(SEQ―26)は株式会社ジーンデザイン社(大阪、日本)から購入した。
オリゴヌクレオチド(SEQ―26)は株式会社ジーンデザイン社(大阪、日本)から購入した。
8)オリゴヌクレオチドの純度分析
得られたオリゴヌクレオチドは、UPLC/MS測定による実測分子量が理論分子量と一致することで、目的の配列が合成できていることを確認した。
Xevo G2 Tof System(Waters社製)
Column:Aquity OST C18(2.1x50mm)(Waters社製)
移動相 A液:200mM 1,1,1,3,3,3-ヘキサフルオロ-2-プロパノール/8mMトリエチルアミン
B液:メタノール
B濃度グラジエント:10-30%(10min)
温度:50℃
流速:0.2mL/min
得られたオリゴヌクレオチドは、UPLC/MS測定による実測分子量が理論分子量と一致することで、目的の配列が合成できていることを確認した。
Xevo G2 Tof System(Waters社製)
Column:Aquity OST C18(2.1x50mm)(Waters社製)
移動相 A液:200mM 1,1,1,3,3,3-ヘキサフルオロ-2-プロパノール/8mMトリエチルアミン
B液:メタノール
B濃度グラジエント:10-30%(10min)
温度:50℃
流速:0.2mL/min
9)二重鎖核酸の調製
SEQ-7~11、20~25、30~32の二重鎖核酸は以下のようにして調製した。各オリゴヌクレオチドを等モル量混合した後、蒸留水を加えて濃度0.5mmol/L溶液とした。その後60℃下で10分間静置後、室温まで自然冷却させることで二重鎖核酸を得た。二重鎖形成の確認は、サイズ排除クロマトグラフィーにより実施した。
Column:YMC-PAC Diol-120(4.6x300mm)(YMC社製)
移動相:10%アセトニトリル含有1xPBS溶液
流速0.5mL/min
温度:室温
同様に、SEQ-37~40の二重鎖核酸を調製することができる。
SEQ-7~11、20~25、30~32の二重鎖核酸は以下のようにして調製した。各オリゴヌクレオチドを等モル量混合した後、蒸留水を加えて濃度0.5mmol/L溶液とした。その後60℃下で10分間静置後、室温まで自然冷却させることで二重鎖核酸を得た。二重鎖形成の確認は、サイズ排除クロマトグラフィーにより実施した。
Column:YMC-PAC Diol-120(4.6x300mm)(YMC社製)
移動相:10%アセトニトリル含有1xPBS溶液
流速0.5mL/min
温度:室温
同様に、SEQ-37~40の二重鎖核酸を調製することができる。
比較例 トコフェロールを含む二本鎖オリゴヌクレオチドのin vivo活性評価
一本鎖アンチセンスオリゴヌクレオチド(SEQ-1)とセンス鎖をトコフェロールを含む二本鎖オリゴヌクレオチド(SEQ-7)のマウス肝臓におけるACSL1のmRNA発現量変化によるノックダウン活性評価を行った。C57BL/6J(オス7週齢、日本クレア社)に4週間、高脂脂肪食(60%kcal脂肪:TestDiet社製)を4週間与えることで食餌誘導性肥満(DIO)マウスを作製した。DIOマウスへ、生理食塩水(大塚生食注、大塚製薬工場)に溶解したSEQ-7の溶液、約0.2mLを、マウス個体あたり投与量がアンチセンスオリゴ量換算で1.1mg/kg、3.3mg/kg又は10mg/kgとなるように静脈投与あるいは皮下投与した。陽性対照として、SEQ-1の溶液を、マウス個体あたり投与量が10mg/kgとなるように投与した。投与7日後にソムノペンチル麻酔下で肝臓組織を採取した。肝臓からのRNA抽出はRNeasy 96 Universal Tissue Kit(Qiagen社製)を用いてメーカー推奨プロトコル通りに行った。得られたRNAのうち1000ngを、SuperScript III First-Strand Synthesis SuperMix for qRT-PCR(Life Science社製)を用いて、標準プロトコルに準じて逆転写を行うことでcDNAを得た。SYBR Premix Ex Taq II(タカラバイオ社製)を用いて定量的PCRを行った。
マウスACSL1の発現量を測定するために使用したプライマー配列は、
Fwプライマー:AGGTGCTTCAGCCCACCATC(配列番号:3)
Rvプライマー:AAAGTCCAACAGCCATCGCTTC(配列番号:4)
を用い、
マウスGAPDHの発現量を測定するために使用したプライマー配列は、
Fwプライマー:TGTGTCCGTCGTGGATCTGA(配列番号:5)
Rvプライマー:TTGCTGTTGAAGTCGCAGGAG(配列番号:6)
を用いた。ノックダウン効率は、Gapdhで正規化したAcsl1のmRNA減少量について、生理食塩水投与群に対する割合として示した。
内在性コントロールとしてGAPDHを使用し、プライマーはin vitro実験と同一のものを用いた。結果を図1に示す。GAPDHで正規化したACSL1のmRNA量について、生理食塩水投与群に対する割合を示した。この結果、トコフェロールを含む二本鎖オリゴヌクレオチド(SEQ-7)は、一本鎖アンチセンスオリゴヌクレオチド(SEQ-1)と比較して静脈投与においては約9倍のノックダウン活性の向上が確認されたが、皮下投与においてはノックダウン活性の向上は確認できなかった。
一本鎖アンチセンスオリゴヌクレオチド(SEQ-1)とセンス鎖をトコフェロールを含む二本鎖オリゴヌクレオチド(SEQ-7)のマウス肝臓におけるACSL1のmRNA発現量変化によるノックダウン活性評価を行った。C57BL/6J(オス7週齢、日本クレア社)に4週間、高脂脂肪食(60%kcal脂肪:TestDiet社製)を4週間与えることで食餌誘導性肥満(DIO)マウスを作製した。DIOマウスへ、生理食塩水(大塚生食注、大塚製薬工場)に溶解したSEQ-7の溶液、約0.2mLを、マウス個体あたり投与量がアンチセンスオリゴ量換算で1.1mg/kg、3.3mg/kg又は10mg/kgとなるように静脈投与あるいは皮下投与した。陽性対照として、SEQ-1の溶液を、マウス個体あたり投与量が10mg/kgとなるように投与した。投与7日後にソムノペンチル麻酔下で肝臓組織を採取した。肝臓からのRNA抽出はRNeasy 96 Universal Tissue Kit(Qiagen社製)を用いてメーカー推奨プロトコル通りに行った。得られたRNAのうち1000ngを、SuperScript III First-Strand Synthesis SuperMix for qRT-PCR(Life Science社製)を用いて、標準プロトコルに準じて逆転写を行うことでcDNAを得た。SYBR Premix Ex Taq II(タカラバイオ社製)を用いて定量的PCRを行った。
マウスACSL1の発現量を測定するために使用したプライマー配列は、
Fwプライマー:AGGTGCTTCAGCCCACCATC(配列番号:3)
Rvプライマー:AAAGTCCAACAGCCATCGCTTC(配列番号:4)
を用い、
マウスGAPDHの発現量を測定するために使用したプライマー配列は、
Fwプライマー:TGTGTCCGTCGTGGATCTGA(配列番号:5)
Rvプライマー:TTGCTGTTGAAGTCGCAGGAG(配列番号:6)
を用いた。ノックダウン効率は、Gapdhで正規化したAcsl1のmRNA減少量について、生理食塩水投与群に対する割合として示した。
内在性コントロールとしてGAPDHを使用し、プライマーはin vitro実験と同一のものを用いた。結果を図1に示す。GAPDHで正規化したACSL1のmRNA量について、生理食塩水投与群に対する割合を示した。この結果、トコフェロールを含む二本鎖オリゴヌクレオチド(SEQ-7)は、一本鎖アンチセンスオリゴヌクレオチド(SEQ-1)と比較して静脈投与においては約9倍のノックダウン活性の向上が確認されたが、皮下投与においてはノックダウン活性の向上は確認できなかった。
実施例4 本発明の二本鎖オリゴヌクレオチドのin vivo活性評価
(4-1)静脈投与又は皮下投与における本発明の二本鎖オリゴヌクレオチドのノックダウン活性
本実施例では、一本鎖アンチセンスオリゴヌクレオチド(SEQ-1)とセンス鎖の5’末端にアシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNAc誘導体)を含む本発明の二本鎖オリゴヌクレオチド(SEQ-8)のマウス肝臓におけるACSL1のmRNA発現量変化によるノックダウン活性評価を行った。C57BL/6J(オス7週齢、日本クレア社)に4週間、高脂脂肪食(60%kcal脂肪:TestDiet社製)を4週間与えることで食餌誘導性肥満(DIO)マウスを作製した。DIOマウスへ、生理食塩水(大塚生食注、大塚製薬工場)に溶解したSEQ-8の溶液、約0.2mLを、マウス個体あたり投与量がアンチセンス鎖量換算で2.2mg/kg、6.6mg/kg及び20mg/kgとなるように静脈投与あるいは皮下投与した。陽性対照として、SEQ-1の溶液を、マウス個体あたり投与量が20mg/kgとなるように投与した。投与7日後にソムノペンチル麻酔下で肝臓組織を採取し、活性評価を行った。結果を図2に示す。この結果、本発明の二本鎖オリゴヌクレオチド(SEQ-8)は、静脈投与及び皮下投与いずれにおいても投与量依存的にノックダウン活性が向上し、一本鎖アンチセンスオリゴヌクレオチド(SEQ-1)と比較して約9倍のノックダウン活性の向上が確認された。
(4-1)静脈投与又は皮下投与における本発明の二本鎖オリゴヌクレオチドのノックダウン活性
本実施例では、一本鎖アンチセンスオリゴヌクレオチド(SEQ-1)とセンス鎖の5’末端にアシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNAc誘導体)を含む本発明の二本鎖オリゴヌクレオチド(SEQ-8)のマウス肝臓におけるACSL1のmRNA発現量変化によるノックダウン活性評価を行った。C57BL/6J(オス7週齢、日本クレア社)に4週間、高脂脂肪食(60%kcal脂肪:TestDiet社製)を4週間与えることで食餌誘導性肥満(DIO)マウスを作製した。DIOマウスへ、生理食塩水(大塚生食注、大塚製薬工場)に溶解したSEQ-8の溶液、約0.2mLを、マウス個体あたり投与量がアンチセンス鎖量換算で2.2mg/kg、6.6mg/kg及び20mg/kgとなるように静脈投与あるいは皮下投与した。陽性対照として、SEQ-1の溶液を、マウス個体あたり投与量が20mg/kgとなるように投与した。投与7日後にソムノペンチル麻酔下で肝臓組織を採取し、活性評価を行った。結果を図2に示す。この結果、本発明の二本鎖オリゴヌクレオチド(SEQ-8)は、静脈投与及び皮下投与いずれにおいても投与量依存的にノックダウン活性が向上し、一本鎖アンチセンスオリゴヌクレオチド(SEQ-1)と比較して約9倍のノックダウン活性の向上が確認された。
(4-2)結合位置又はリン酸結合の異なる本発明の二本鎖オリゴヌクレオチドのノックダウン活性
一本鎖アンチセンスオリゴヌクレオチド(SEQ-1)とセンス鎖の5’末端あるいは3’末端にアシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNAc誘導体)を含む本発明の二本鎖オリゴヌクレオチド(SEQ-8~11)のマウス肝臓におけるACSL1のmRNA発現量変化によるノックダウン活性評価を行った。C57BL/6J(オス7週齢、日本クレア社)に4週間、高脂脂肪食(60%kcal脂肪:TestDiet社製)を4週間与えることで食餌誘導性肥満(DIO)マウスを作製した。DIOマウスへ、生理食塩水(大塚生食注、大塚製薬工場)に溶解したSEQ-8~11いずれかの溶液、約0.2mLを、マウス個体あたり投与量がアンチセンス鎖換算量で2.2mg/kg、6.6mg/kg及び20mg/kgとなるように皮下投与した。陽性対照として、SEQ-1の溶液を、マウス個体あたり投与量が20mg/kgとなるように投与した。投与7日後にソムノペンチル麻酔下で肝臓組織を採取し、活性評価を行った。結果を図3に示す。この結果、本発明の二本鎖オリゴヌクレオチドは、皮下投与において、アシアロ糖タンパク質受容体と相互作用を有する糖誘導体の結合位置及びリン酸結合の違いによってノックダウン活性に差はなく、一本鎖アンチセンスオリゴヌクレオチド(SEQ-1)と比較して約9倍のノックダウン活性の向上が確認された。
一本鎖アンチセンスオリゴヌクレオチド(SEQ-1)とセンス鎖の5’末端あるいは3’末端にアシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNAc誘導体)を含む本発明の二本鎖オリゴヌクレオチド(SEQ-8~11)のマウス肝臓におけるACSL1のmRNA発現量変化によるノックダウン活性評価を行った。C57BL/6J(オス7週齢、日本クレア社)に4週間、高脂脂肪食(60%kcal脂肪:TestDiet社製)を4週間与えることで食餌誘導性肥満(DIO)マウスを作製した。DIOマウスへ、生理食塩水(大塚生食注、大塚製薬工場)に溶解したSEQ-8~11いずれかの溶液、約0.2mLを、マウス個体あたり投与量がアンチセンス鎖換算量で2.2mg/kg、6.6mg/kg及び20mg/kgとなるように皮下投与した。陽性対照として、SEQ-1の溶液を、マウス個体あたり投与量が20mg/kgとなるように投与した。投与7日後にソムノペンチル麻酔下で肝臓組織を採取し、活性評価を行った。結果を図3に示す。この結果、本発明の二本鎖オリゴヌクレオチドは、皮下投与において、アシアロ糖タンパク質受容体と相互作用を有する糖誘導体の結合位置及びリン酸結合の違いによってノックダウン活性に差はなく、一本鎖アンチセンスオリゴヌクレオチド(SEQ-1)と比較して約9倍のノックダウン活性の向上が確認された。
(4-3)リン酸結合の異なる本発明の二本鎖オリゴヌクレオチドのノックダウン活性
本実施例では、一本鎖アンチセンスオリゴヌクレオチド(SEQ-12)とセンス鎖の3’末端にアシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNAc誘導体)を含む本発明の二本鎖オリゴヌクレオチド(SEQ-21又は22)のマウス肝臓におけるACSL1のmRNA発現量変化によるノックダウン活性評価を行った。C57BL/6J(オス7週齢、日本クレア社)に4週間、高脂脂肪食(60%kcal脂肪:TestDiet社製)を4週間与えることで食餌誘導性肥満(DIO)マウスを作製した。DIOマウスへ、生理食塩水(大塚生食注、大塚製薬工場)に溶解したSEQ-21又は22の溶液、約0.2mLを、マウス個体あたり投与量がアンチセンス鎖量換算で2mg/kg及び4mg/kgとなるように静脈投与あるいは皮下投与した。陽性対照として、SEQ-12の溶液を、マウス個体あたり投与量が20mg/kgとなるように投与した。投与3日後及び7日後にソムノペンチル麻酔下で肝臓組織を採取し、活性評価を行った。結果を図4に示す。この結果、本発明の二本鎖オリゴヌクレオチド(SEQ-21又は22)は、投与量依存的にノックダウン活性が向上し、アシアロ糖タンパク質受容体と相互作用を有する糖誘導体を結合させるリン酸結合の違いによってノックダウン活性に差はなく、一本鎖アンチセンスオリゴヌクレオチド(SEQ-12)と比較して10分の1の投与量で同程度の活性を示した。
本実施例では、一本鎖アンチセンスオリゴヌクレオチド(SEQ-12)とセンス鎖の3’末端にアシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNAc誘導体)を含む本発明の二本鎖オリゴヌクレオチド(SEQ-21又は22)のマウス肝臓におけるACSL1のmRNA発現量変化によるノックダウン活性評価を行った。C57BL/6J(オス7週齢、日本クレア社)に4週間、高脂脂肪食(60%kcal脂肪:TestDiet社製)を4週間与えることで食餌誘導性肥満(DIO)マウスを作製した。DIOマウスへ、生理食塩水(大塚生食注、大塚製薬工場)に溶解したSEQ-21又は22の溶液、約0.2mLを、マウス個体あたり投与量がアンチセンス鎖量換算で2mg/kg及び4mg/kgとなるように静脈投与あるいは皮下投与した。陽性対照として、SEQ-12の溶液を、マウス個体あたり投与量が20mg/kgとなるように投与した。投与3日後及び7日後にソムノペンチル麻酔下で肝臓組織を採取し、活性評価を行った。結果を図4に示す。この結果、本発明の二本鎖オリゴヌクレオチド(SEQ-21又は22)は、投与量依存的にノックダウン活性が向上し、アシアロ糖タンパク質受容体と相互作用を有する糖誘導体を結合させるリン酸結合の違いによってノックダウン活性に差はなく、一本鎖アンチセンスオリゴヌクレオチド(SEQ-12)と比較して10分の1の投与量で同程度の活性を示した。
(4-4)リンカー部位構造の異なる本発明の二本鎖オリゴヌクレオチドのノックダウン活性
本実施例では、センス鎖の3’末端に種々のリンカー構造を介して結合させたアシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNAc誘導体)を含む本発明の二本鎖オリゴヌクレオチド(SEQ-20,23~25)のマウス肝臓におけるACSL1のmRNA発現量変化によるノックダウン活性評価を行った。C57BL/6J(オス8週齢、日本クレア社)へ、生理食塩水(大塚生食注、大塚製薬工場)に溶解した二本鎖オリゴヌクレオチドの溶液、約0.2mLを、マウス個体あたり投与量がアンチセンス鎖量換算で2mg/kg及び4mg/kgとなるように1週間おきに2回、皮下投与した。最終投与後7日目に、ソムノペンチル麻酔下で肝臓組織を採取し、活性評価を行った。結果を図5に示す。この結果、本発明の二本鎖オリゴヌクレオチド群(SEQ-20,23~25)において、アシアロ糖タンパク質受容体と相互作用を有する糖誘導体を結合させるリンカー部位構造の違いによってノックダウン活性に大きな差は認められなかった。また、いずれの二本鎖オリゴヌクレオチドも投与量依存的にノックダウン活性が向上した。
本実施例では、センス鎖の3’末端に種々のリンカー構造を介して結合させたアシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNAc誘導体)を含む本発明の二本鎖オリゴヌクレオチド(SEQ-20,23~25)のマウス肝臓におけるACSL1のmRNA発現量変化によるノックダウン活性評価を行った。C57BL/6J(オス8週齢、日本クレア社)へ、生理食塩水(大塚生食注、大塚製薬工場)に溶解した二本鎖オリゴヌクレオチドの溶液、約0.2mLを、マウス個体あたり投与量がアンチセンス鎖量換算で2mg/kg及び4mg/kgとなるように1週間おきに2回、皮下投与した。最終投与後7日目に、ソムノペンチル麻酔下で肝臓組織を採取し、活性評価を行った。結果を図5に示す。この結果、本発明の二本鎖オリゴヌクレオチド群(SEQ-20,23~25)において、アシアロ糖タンパク質受容体と相互作用を有する糖誘導体を結合させるリンカー部位構造の違いによってノックダウン活性に大きな差は認められなかった。また、いずれの二本鎖オリゴヌクレオチドも投与量依存的にノックダウン活性が向上した。
(4-5)本発明の二本鎖オリゴヌクレオチドと一本鎖オリゴヌクレオチドのノックダウン活性比較
本実施例では、センス鎖の3’末端にアシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNAc誘導体)を含む本発明の二本鎖オリゴヌクレオチド(SEQ-31)と3’末端にアシアロ糖タンパク質受容体を含むアンチセンスオリゴヌクレオチド(SEQ-29)のマウス肝臓におけるApoBのmRNA発現量変化によるノックダウン活性評価を行った。比較対象として、アンチセンスオリゴヌクレオチド(SEQ-26)、アシアロ糖タンパク質受容体と相互作用を有する糖誘導体を含まない二本鎖オリゴヌクレオチド(SEQ-30)、アンチセンス鎖の3’末端にアシアロ糖タンパク質受容体と相互作用を有する糖誘c導体(GalNAc誘導体)を含む二本鎖オリゴヌクレオチド(SEQ-32)を用いた。C57BL/6J(オス7週齢、日本クレア社)へ、生理食塩水(大塚生食注、大塚製薬工場)に溶解した二本鎖オリゴヌクレオチドの溶液、約0.2mLを、マウス個体あたり投与量がアンチセンス鎖量換算で0.2mg/kgとなるように皮下投与した。投与後3日目にソムノペンチル麻酔下で肝臓組織を採取し、活性評価を行った。
肝臓からのRNA抽出はRNeasy Mini Kit(Qiagen社製)を用いてメーカー推奨プロトコル通りに行った。得られたRNAのうち10ngを、One Step SYBR PrimeScript PLUS RT-PCR Kit(タカラバイオ社製)を用いて、定量的PCRを行い ApoB mRNAの発現量を評価した。
マウスApoBの発現量を測定するために使用したプライマー配列は、
Fwプライマー:TCATGTGGCTGATGGACTCATTC(配列番号:7)
Rvプライマー:CGTCCACAGTATATGTTCCAGCGTA(配列番号:8)
を用いた。
マウスGapdhの発現量を測定するために使用したプライマー配列は、
Fwプライマー:TGTGTCCGTCGTGGATCTGA(配列番号5)
Rvプライマー:TTGCTGTTGAAGTCGCAGGAG(配列番号6)
を用いた。
各サンプル投与群におけるGapdhのmRNA発現量で正規化したApoBの mRNA発現量について、生理食塩水投与群の発現量を100%とした場合の相対値(%)を比較した。結果を図6に示す。この結果、本発明の二本鎖オリゴヌクレオチド(SEQ-31)はアンチセンスオリゴヌクレオチド(SEQ-26)が活性を示さない低投与量域においても80%ノックダウン活性を示し、前述の実施例に示す結果と同様に、活性の向上が確認された。一方、アシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNAc誘導体)を含まない二重鎖オリゴヌクレオチドであるSEQ-30、アシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNAc誘導体)を含むものの、一本鎖構造であるSEQ-29や二本鎖オリゴヌクレオチドのアンチセンス鎖に結合するSEQ-32では、ノックダウン活性の向上は認められなかった。
以上の結果から、本発明の二重鎖オリゴヌクレオチドは、肝臓における標的遺伝子を効率よくノックダウンさせる最適な設計であることが明らかになった。
本実施例では、センス鎖の3’末端にアシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNAc誘導体)を含む本発明の二本鎖オリゴヌクレオチド(SEQ-31)と3’末端にアシアロ糖タンパク質受容体を含むアンチセンスオリゴヌクレオチド(SEQ-29)のマウス肝臓におけるApoBのmRNA発現量変化によるノックダウン活性評価を行った。比較対象として、アンチセンスオリゴヌクレオチド(SEQ-26)、アシアロ糖タンパク質受容体と相互作用を有する糖誘導体を含まない二本鎖オリゴヌクレオチド(SEQ-30)、アンチセンス鎖の3’末端にアシアロ糖タンパク質受容体と相互作用を有する糖誘c導体(GalNAc誘導体)を含む二本鎖オリゴヌクレオチド(SEQ-32)を用いた。C57BL/6J(オス7週齢、日本クレア社)へ、生理食塩水(大塚生食注、大塚製薬工場)に溶解した二本鎖オリゴヌクレオチドの溶液、約0.2mLを、マウス個体あたり投与量がアンチセンス鎖量換算で0.2mg/kgとなるように皮下投与した。投与後3日目にソムノペンチル麻酔下で肝臓組織を採取し、活性評価を行った。
肝臓からのRNA抽出はRNeasy Mini Kit(Qiagen社製)を用いてメーカー推奨プロトコル通りに行った。得られたRNAのうち10ngを、One Step SYBR PrimeScript PLUS RT-PCR Kit(タカラバイオ社製)を用いて、定量的PCRを行い ApoB mRNAの発現量を評価した。
マウスApoBの発現量を測定するために使用したプライマー配列は、
Fwプライマー:TCATGTGGCTGATGGACTCATTC(配列番号:7)
Rvプライマー:CGTCCACAGTATATGTTCCAGCGTA(配列番号:8)
を用いた。
マウスGapdhの発現量を測定するために使用したプライマー配列は、
Fwプライマー:TGTGTCCGTCGTGGATCTGA(配列番号5)
Rvプライマー:TTGCTGTTGAAGTCGCAGGAG(配列番号6)
を用いた。
各サンプル投与群におけるGapdhのmRNA発現量で正規化したApoBの mRNA発現量について、生理食塩水投与群の発現量を100%とした場合の相対値(%)を比較した。結果を図6に示す。この結果、本発明の二本鎖オリゴヌクレオチド(SEQ-31)はアンチセンスオリゴヌクレオチド(SEQ-26)が活性を示さない低投与量域においても80%ノックダウン活性を示し、前述の実施例に示す結果と同様に、活性の向上が確認された。一方、アシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNAc誘導体)を含まない二重鎖オリゴヌクレオチドであるSEQ-30、アシアロ糖タンパク質受容体と相互作用を有する糖誘導体(GalNAc誘導体)を含むものの、一本鎖構造であるSEQ-29や二本鎖オリゴヌクレオチドのアンチセンス鎖に結合するSEQ-32では、ノックダウン活性の向上は認められなかった。
以上の結果から、本発明の二重鎖オリゴヌクレオチドは、肝臓における標的遺伝子を効率よくノックダウンさせる最適な設計であることが明らかになった。
以上の実施例から明らかなように、本発明の二本鎖オリゴヌクレオチドは、静脈注射投与、皮下投与のいずれであっても、肝臓における標的遺伝子の発現抑制活性が優れている。したがって、本発明の二本鎖オリゴヌクレオチドは活性成分であるDNAアンチセンスオリゴヌクレオチドを肝臓へ効率よく輸送するため複合体として非常に有用である。
Claims (9)
- アンチセンス鎖が、ヌクレオシド誘導体を含んでいてもよい8~25塩基のDNAアンチセンスオリゴヌクレオチドであり、
センス鎖が、ストリンジェントな条件で該アンチセンス鎖にハイブリダイズ可能な配列を含み、DNAヌクレオシド及び/又はヌクレオシド誘導体を含んでいてもよい8~35塩基のRNAオリゴヌクレオチドであり、
センス鎖の3’末端及び/又は5’末端に、
リンカーを介して
アシアロ糖タンパク質受容体と相互作用を有する糖誘導体
が結合している二本鎖オリゴヌクレオチド。 - 糖誘導体が、
(式中、
P1A、P1B、P2A、P2B、P3A、P3B、P4A、P4B、P4C、T1A、T1B、T2A、T2B、T3A、T3B、T4A、T4B及びT4Cはそれぞれ独立して、存在しないか、CO、NH、O、S、OC(=O)、NHC(=O)、CH2、CH2NH又はCH2Oであり、
Q1A、Q1B、Q2A、Q2B、Q3A、Q3B、Q4A、Q4B及びQ4Cはそれぞれ独立して、存在しないか又は置換若しくは非置換のアルキレンであり、
R1A、R1B、R2A、R2B、R3A、R3B、R4A、R4B及びR4Cはそれぞれ独立して、存在しないか、NH、O、S、CH2、C(=O)O、C(=O)NH、NHCH(R5)C(=O)、C(=O)CH(R5)NH、CO、CH=N-O、複素環、
であり、
R5は水素原子又はアミノ酸側鎖であり、
q1A、q1B、q2A、q2B、q3A、q3B、q4A、q4B及びq4Cはそれぞれ独立して、0~20の整数であり、
LG1A、LG1B、LG2A、LG2B、LG3A、LG3B、LG4A、LG4B及びLG4Cはそれぞれ独立して、
(式中、
RX1、RX2及びRX3はそれぞれ独立して、水素原子又は置換若しくは非置換のアルキルであり、
RX4はOH又はNHCORX4’(RX4’は置換又は非置換のアルキル)である)
である、請求項1記載の二本鎖オリゴヌクレオチド。 - ヌクレオシド誘導体が、糖の2’位に置換基を有するヌクレオシド及び/又は糖の4’位と2’位との間に架橋構造を有するヌクレオシドである、請求項1~4いずれかに記載の二本鎖オリゴヌクレオチド。
- 該置換基が、F、OCH3又はOCH2CH2OCH3である、請求項5記載の二本鎖オリゴヌクレオチド。
- 該架橋構造が、4’-(CH2)m-O-2’(mは1~4の整数)又は4’-C(=O)-NR6-2’(R6は、水素原子又はアルキルである)である、請求項5記載の二本鎖オリゴヌクレオチド。
- リンカーが、
(式中、
L1はセンス鎖の3’末端及び/又は5’末端に結合し、L5は糖誘導体に結合する。
L1はC(=O)NH、NHC(=O)、NHC(=O)NH、
(式中、R7はアルキル又はアルキルオキシである)であり、
L2はそれぞれ独立して、芳香族環を介していてもよい置換若しくは非置換の炭素数が1~20のアルキレン又は芳香族環であり、
L3はそれぞれ独立して、存在しないか、C(=O)NR8(R8は水素又は置換若しくは非置換のアルキルである)、NR9C(=O)(R9は水素又は置換若しくは非置換のアルキルであるか、R9はL2のアルキレン中の炭素と一緒になって置換若しくは非置換の含窒素環を形成してもよい)、
であり、
L4はそれぞれ独立して、存在しないか、芳香族環を介していてもよい置換若しくは非置換の炭素数が1~20のアルキレン又は芳香族環であり、
L5はC(=O)NH、NHC(=O)、NH又はOであり、
nは1又は2である)
である、請求項1~7いずれかに記載の二本鎖オリゴヌクレオチド。 - 請求項1~8いずれかに記載の二本鎖オリゴヌクレオチドを含有する医薬組成物。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2015556799A JP6482475B2 (ja) | 2014-01-07 | 2015-01-06 | アンチセンスオリゴヌクレオチド及び糖誘導体を含む二本鎖オリゴヌクレオチド |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2014-001195 | 2014-01-07 | ||
| JP2014001195 | 2014-01-07 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2015105083A1 true WO2015105083A1 (ja) | 2015-07-16 |
Family
ID=53523908
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2015/050083 WO2015105083A1 (ja) | 2014-01-07 | 2015-01-06 | アンチセンスオリゴヌクレオチド及び糖誘導体を含む二本鎖オリゴヌクレオチド |
Country Status (2)
| Country | Link |
|---|---|
| JP (1) | JP6482475B2 (ja) |
| WO (1) | WO2015105083A1 (ja) |
Cited By (30)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2017010575A1 (ja) * | 2015-07-16 | 2017-01-19 | 協和発酵キリン株式会社 | β2GPI遺伝子発現抑制核酸複合体 |
| WO2017131236A1 (ja) | 2016-01-29 | 2017-08-03 | 協和発酵キリン株式会社 | 核酸複合体 |
| WO2017178656A1 (en) * | 2016-04-14 | 2017-10-19 | Roche Innovation Center Copenhagen A/S | TRITYL-MONO-GalNAc COMPOUNDS AND THEIR USE |
| WO2018004004A1 (ja) | 2016-06-30 | 2018-01-04 | 協和発酵キリン株式会社 | 核酸複合体 |
| KR20180054854A (ko) * | 2015-09-30 | 2018-05-24 | 시오노기 앤드 컴파니, 리미티드 | 면역 부활 활성을 갖는 핵산 유도체 |
| WO2018143475A1 (ja) | 2017-02-06 | 2018-08-09 | 日産化学工業株式会社 | 一本鎖オリゴヌクレオチド |
| WO2018181428A1 (ja) | 2017-03-29 | 2018-10-04 | 塩野義製薬株式会社 | 核酸医薬及び多分岐脂質の複合体 |
| WO2018199340A1 (ja) | 2017-04-28 | 2018-11-01 | 協和発酵キリン株式会社 | オリゴヌクレオチド誘導体またはその塩 |
| WO2019022196A1 (ja) | 2017-07-26 | 2019-01-31 | 日産化学株式会社 | 一本鎖オリゴヌクレオチド |
| WO2019027009A1 (ja) * | 2017-08-02 | 2019-02-07 | 協和発酵キリン株式会社 | 核酸複合体 |
| WO2019027015A1 (ja) * | 2017-08-02 | 2019-02-07 | 協和発酵キリン株式会社 | 核酸複合体 |
| WO2019172286A1 (ja) | 2018-03-09 | 2019-09-12 | 第一三共株式会社 | 糖原病Ia型治療薬 |
| JPWO2018179172A1 (ja) * | 2017-03-29 | 2020-02-06 | 塩野義製薬株式会社 | 免疫賦活活性を有する核酸誘導体 |
| WO2020111280A1 (ja) | 2018-11-30 | 2020-06-04 | 協和キリン株式会社 | 核酸複合体 |
| WO2020138509A1 (en) | 2018-12-28 | 2020-07-02 | Nippon Shinyaku Co., Ltd. | Myostatin signal inhibitor |
| CN111527207A (zh) * | 2017-09-14 | 2020-08-11 | 詹森生物制药有限公司 | GalNAc衍生物 |
| WO2021020412A1 (ja) | 2019-07-30 | 2021-02-04 | 塩野義製薬株式会社 | Murf1を標的とする核酸医薬 |
| JP2021506239A (ja) * | 2017-12-14 | 2021-02-22 | アイオーニス ファーマシューティカルズ, インコーポレーテッドIonis Pharmaceuticals,Inc. | 複合アンチセンス化合物及びその使用 |
| US10940201B2 (en) | 2015-09-30 | 2021-03-09 | Shionogi & Co., Ltd. | Nucleic acid derivative having immunostimulatory activity |
| WO2021049504A1 (ja) | 2019-09-10 | 2021-03-18 | 第一三共株式会社 | 肝臓送達用GalNAc-オリゴヌクレオチドコンジュゲートおよび製造方法 |
| WO2021153687A1 (ja) | 2020-01-30 | 2021-08-05 | エーザイ・アール・アンド・ディー・マネジメント株式会社 | 核酸複合体及びそれを含む医薬組成物 |
| WO2022161452A1 (zh) * | 2021-01-28 | 2022-08-04 | 南京桦冠生物技术有限公司 | 缀合物及其用途 |
| US11530409B2 (en) | 2016-01-26 | 2022-12-20 | Nissan Chemical Corporation | Single-stranded oligonucleotide |
| WO2023282345A1 (ja) | 2021-07-08 | 2023-01-12 | 日本新薬株式会社 | 腎毒性軽減剤 |
| WO2023282344A1 (ja) | 2021-07-08 | 2023-01-12 | 日本新薬株式会社 | 腎毒性軽減剤 |
| WO2023282346A1 (ja) | 2021-07-08 | 2023-01-12 | 日本新薬株式会社 | 析出抑制剤 |
| WO2023034719A1 (en) * | 2021-08-30 | 2023-03-09 | Hongene Biotech Corporation | Functionalized n-acetylgalactosamine analogs |
| US11963974B2 (en) | 2017-03-10 | 2024-04-23 | National Center For Child Health And Development | Antisense oligonucleotide and composition for prevention or treatment of glycogen storage disease type Ia |
| US11993626B2 (en) | 2021-12-15 | 2024-05-28 | Hongene Biotech Corporation | Functionalized N-acetylgalactosamine analogs |
| WO2024152886A1 (zh) * | 2023-01-17 | 2024-07-25 | 中国科学院上海药物研究所 | 去唾液酸糖蛋白受体配体与细胞毒素的偶联物及其应用 |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP7442411B2 (ja) | 2020-08-20 | 2024-03-04 | 株式会社ハーマン | コンロ |
Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2005113571A2 (en) * | 2004-05-13 | 2005-12-01 | The University Of North Carolina At Chapel Hill | Methods for the delivery of oligomeric compounds |
| JP2011528221A (ja) * | 2008-07-16 | 2011-11-17 | オンコセラピー・サイエンス株式会社 | 肺癌および食道癌に関する治療標的および予後指標としてのect2癌遺伝子 |
| WO2012037254A1 (en) * | 2010-09-15 | 2012-03-22 | Alnylam Pharmaceuticals, Inc. | MODIFIED iRNA AGENTS |
| WO2012083046A2 (en) * | 2010-12-17 | 2012-06-21 | Arrowhead Research Corporation | Galactose cluster-pharmacokinetic modulator targeting moiety for sirna |
| WO2013033230A1 (en) * | 2011-08-29 | 2013-03-07 | Isis Pharmaceuticals, Inc. | Oligomer-conjugate complexes and their use |
| WO2013089283A1 (en) * | 2011-12-16 | 2013-06-20 | National University Corporation Tokyo Medical And Dental University | Chimeric double-stranded nucleic acid |
| WO2014179620A1 (en) * | 2013-05-01 | 2014-11-06 | Isis Pharmaceuticals, Inc. | Conjugated antisense compounds and their use |
-
2015
- 2015-01-06 JP JP2015556799A patent/JP6482475B2/ja active Active
- 2015-01-06 WO PCT/JP2015/050083 patent/WO2015105083A1/ja active Application Filing
Patent Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2005113571A2 (en) * | 2004-05-13 | 2005-12-01 | The University Of North Carolina At Chapel Hill | Methods for the delivery of oligomeric compounds |
| JP2011528221A (ja) * | 2008-07-16 | 2011-11-17 | オンコセラピー・サイエンス株式会社 | 肺癌および食道癌に関する治療標的および予後指標としてのect2癌遺伝子 |
| WO2012037254A1 (en) * | 2010-09-15 | 2012-03-22 | Alnylam Pharmaceuticals, Inc. | MODIFIED iRNA AGENTS |
| WO2012083046A2 (en) * | 2010-12-17 | 2012-06-21 | Arrowhead Research Corporation | Galactose cluster-pharmacokinetic modulator targeting moiety for sirna |
| WO2013033230A1 (en) * | 2011-08-29 | 2013-03-07 | Isis Pharmaceuticals, Inc. | Oligomer-conjugate complexes and their use |
| WO2013089283A1 (en) * | 2011-12-16 | 2013-06-20 | National University Corporation Tokyo Medical And Dental University | Chimeric double-stranded nucleic acid |
| WO2014179620A1 (en) * | 2013-05-01 | 2014-11-06 | Isis Pharmaceuticals, Inc. | Conjugated antisense compounds and their use |
Non-Patent Citations (1)
| Title |
|---|
| JEKERIE, V. ET AL.: "Functional comparison of single- and double-stranded mdrl antisense oligodeoxynucleotides in human ovarian cancer", CELL LINES., J. PHARM. PHARM. SCI., vol. 8, no. 3, 2005, pages 516 - 527 * |
Cited By (58)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2017010575A1 (ja) * | 2015-07-16 | 2017-01-19 | 協和発酵キリン株式会社 | β2GPI遺伝子発現抑制核酸複合体 |
| CN108472358A (zh) * | 2015-09-30 | 2018-08-31 | 盐野义制药株式会社 | 具有免疫赋活活性的核酸衍生物 |
| CN108472358B (zh) * | 2015-09-30 | 2022-06-24 | 盐野义制药株式会社 | 具有免疫赋活活性的核酸衍生物 |
| US10940201B2 (en) | 2015-09-30 | 2021-03-09 | Shionogi & Co., Ltd. | Nucleic acid derivative having immunostimulatory activity |
| KR20180054854A (ko) * | 2015-09-30 | 2018-05-24 | 시오노기 앤드 컴파니, 리미티드 | 면역 부활 활성을 갖는 핵산 유도체 |
| KR102230325B1 (ko) * | 2015-09-30 | 2021-03-19 | 시오노기 앤드 컴파니, 리미티드 | 면역 부활 활성을 갖는 핵산 유도체 |
| AU2016332266B2 (en) * | 2015-09-30 | 2020-05-07 | Shionogi & Co., Ltd. | Nucleic acid derivative having immunostimulatory activity |
| EP3357507A4 (en) * | 2015-09-30 | 2019-05-29 | Shionogi & Co., Ltd | NUCLEIC ACID DERIVATIVE WITH IMMUNOSTIMULATING EFFECT |
| RU2730871C1 (ru) * | 2015-09-30 | 2020-08-26 | Сионоги Энд Ко., Лтд. | Производное нуклеиновой кислоты, обладающее иммуностимулирующей активностью |
| US11530409B2 (en) | 2016-01-26 | 2022-12-20 | Nissan Chemical Corporation | Single-stranded oligonucleotide |
| TWI733751B (zh) * | 2016-01-29 | 2021-07-21 | 日商協和麒麟股份有限公司 | 核酸複合體 |
| WO2017131236A1 (ja) | 2016-01-29 | 2017-08-03 | 協和発酵キリン株式会社 | 核酸複合体 |
| US10745700B2 (en) | 2016-01-29 | 2020-08-18 | Kyowa Kirin Co., Ltd. | Nucleic acid conjugate |
| US11248019B2 (en) | 2016-04-14 | 2022-02-15 | Hoffmann-La Roche Inc. | Trityl-mono-GalNAc compounds and their use |
| KR20180134364A (ko) * | 2016-04-14 | 2018-12-18 | 에프. 호프만-라 로슈 아게 | 트리틸-모노-GalNAc 화합물 및 이의 용도 |
| WO2017178656A1 (en) * | 2016-04-14 | 2017-10-19 | Roche Innovation Center Copenhagen A/S | TRITYL-MONO-GalNAc COMPOUNDS AND THEIR USE |
| CN109153697A (zh) * | 2016-04-14 | 2019-01-04 | 豪夫迈·罗氏有限公司 | 三苯甲基-单-GalNAc化合物及其用途 |
| JP2019513771A (ja) * | 2016-04-14 | 2019-05-30 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | トリチル−モノ−GalNAc化合物とその利用 |
| KR102468177B1 (ko) | 2016-04-14 | 2022-11-16 | 에프. 호프만-라 로슈 아게 | 트리틸-모노-GalNAc 화합물 및 이의 용도 |
| KR20190022832A (ko) | 2016-06-30 | 2019-03-06 | 교와 핫꼬 기린 가부시키가이샤 | 핵산 복합체 |
| WO2018004004A1 (ja) | 2016-06-30 | 2018-01-04 | 協和発酵キリン株式会社 | 核酸複合体 |
| US11572558B2 (en) | 2017-02-06 | 2023-02-07 | Nissan Chemical Corporation | Single-stranded oligonucleotide |
| WO2018143475A1 (ja) | 2017-02-06 | 2018-08-09 | 日産化学工業株式会社 | 一本鎖オリゴヌクレオチド |
| US11963974B2 (en) | 2017-03-10 | 2024-04-23 | National Center For Child Health And Development | Antisense oligonucleotide and composition for prevention or treatment of glycogen storage disease type Ia |
| JP7190794B2 (ja) | 2017-03-29 | 2022-12-16 | 塩野義製薬株式会社 | 核酸医薬及び多分岐脂質の複合体 |
| US11638717B2 (en) | 2017-03-29 | 2023-05-02 | Shionogi & Co., Ltd. | Complex of nucleic acid medicine and multibranched lipid |
| WO2018181428A1 (ja) | 2017-03-29 | 2018-10-04 | 塩野義製薬株式会社 | 核酸医薬及び多分岐脂質の複合体 |
| JPWO2018181428A1 (ja) * | 2017-03-29 | 2020-02-06 | 塩野義製薬株式会社 | 核酸医薬及び多分岐脂質の複合体 |
| JPWO2018179172A1 (ja) * | 2017-03-29 | 2020-02-06 | 塩野義製薬株式会社 | 免疫賦活活性を有する核酸誘導体 |
| WO2018199340A1 (ja) | 2017-04-28 | 2018-11-01 | 協和発酵キリン株式会社 | オリゴヌクレオチド誘導体またはその塩 |
| US11555188B2 (en) | 2017-07-26 | 2023-01-17 | Nissan Chemical Corporation | Single-stranded oligonucleotide |
| WO2019022196A1 (ja) | 2017-07-26 | 2019-01-31 | 日産化学株式会社 | 一本鎖オリゴヌクレオチド |
| WO2019027009A1 (ja) * | 2017-08-02 | 2019-02-07 | 協和発酵キリン株式会社 | 核酸複合体 |
| WO2019027015A1 (ja) * | 2017-08-02 | 2019-02-07 | 協和発酵キリン株式会社 | 核酸複合体 |
| JP2020533009A (ja) * | 2017-09-14 | 2020-11-19 | ヤンセン バイオファーマ インク. | GalNAc誘導体 |
| CN111527207A (zh) * | 2017-09-14 | 2020-08-11 | 詹森生物制药有限公司 | GalNAc衍生物 |
| CN111527207B (zh) * | 2017-09-14 | 2024-04-26 | 詹森生物制药有限公司 | GalNAc衍生物 |
| US11725208B2 (en) | 2017-12-14 | 2023-08-15 | Ionis Pharmaceuticals, Inc. | Conjugated antisense compounds and their use |
| JP2021506239A (ja) * | 2017-12-14 | 2021-02-22 | アイオーニス ファーマシューティカルズ, インコーポレーテッドIonis Pharmaceuticals,Inc. | 複合アンチセンス化合物及びその使用 |
| US11958878B2 (en) | 2018-03-09 | 2024-04-16 | Daiichi Sankyo Company, Limited | Therapeutic agent for glycogen storage disease type IA |
| KR20210130854A (ko) | 2018-03-09 | 2021-11-01 | 다이이찌 산쿄 가부시키가이샤 | 당원병 Ia형 치료약 |
| WO2019172286A1 (ja) | 2018-03-09 | 2019-09-12 | 第一三共株式会社 | 糖原病Ia型治療薬 |
| KR20200128513A (ko) | 2018-03-09 | 2020-11-13 | 다이이찌 산쿄 가부시키가이샤 | 당원병 Ia형 치료약 |
| WO2020111280A1 (ja) | 2018-11-30 | 2020-06-04 | 協和キリン株式会社 | 核酸複合体 |
| WO2020138509A1 (en) | 2018-12-28 | 2020-07-02 | Nippon Shinyaku Co., Ltd. | Myostatin signal inhibitor |
| WO2021020412A1 (ja) | 2019-07-30 | 2021-02-04 | 塩野義製薬株式会社 | Murf1を標的とする核酸医薬 |
| KR20220061972A (ko) | 2019-09-10 | 2022-05-13 | 다이이찌 산쿄 가부시키가이샤 | 간장 송달용 GalNAc-올리고뉴클레오티드 콘주게이트 및 제조 방법 |
| WO2021049504A1 (ja) | 2019-09-10 | 2021-03-18 | 第一三共株式会社 | 肝臓送達用GalNAc-オリゴヌクレオチドコンジュゲートおよび製造方法 |
| WO2021153687A1 (ja) | 2020-01-30 | 2021-08-05 | エーザイ・アール・アンド・ディー・マネジメント株式会社 | 核酸複合体及びそれを含む医薬組成物 |
| WO2022161452A1 (zh) * | 2021-01-28 | 2022-08-04 | 南京桦冠生物技术有限公司 | 缀合物及其用途 |
| WO2023282345A1 (ja) | 2021-07-08 | 2023-01-12 | 日本新薬株式会社 | 腎毒性軽減剤 |
| WO2023282346A1 (ja) | 2021-07-08 | 2023-01-12 | 日本新薬株式会社 | 析出抑制剤 |
| WO2023282344A1 (ja) | 2021-07-08 | 2023-01-12 | 日本新薬株式会社 | 腎毒性軽減剤 |
| US11692001B2 (en) | 2021-08-30 | 2023-07-04 | Hongene Biotech Corporation | Functionalized n-acetylgalactosamine analogs |
| US11884691B2 (en) | 2021-08-30 | 2024-01-30 | Hongene Biotech Corporation | Functionalized n-acetylgalactosamine analogs |
| WO2023034719A1 (en) * | 2021-08-30 | 2023-03-09 | Hongene Biotech Corporation | Functionalized n-acetylgalactosamine analogs |
| US11993626B2 (en) | 2021-12-15 | 2024-05-28 | Hongene Biotech Corporation | Functionalized N-acetylgalactosamine analogs |
| WO2024152886A1 (zh) * | 2023-01-17 | 2024-07-25 | 中国科学院上海药物研究所 | 去唾液酸糖蛋白受体配体与细胞毒素的偶联物及其应用 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP6482475B2 (ja) | 2019-03-13 |
| JPWO2015105083A1 (ja) | 2017-03-23 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| WO2015105083A1 (ja) | アンチセンスオリゴヌクレオチド及び糖誘導体を含む二本鎖オリゴヌクレオチド | |
| TWI775743B (zh) | 標靶性配體 | |
| TWI842117B (zh) | 治療性化合物之標靶性配體 | |
| JP6647430B2 (ja) | アンチセンス核酸 | |
| JP7190794B2 (ja) | 核酸医薬及び多分岐脂質の複合体 | |
| TW201801748A (zh) | 5’-環-磷酸修飾之核苷酸 | |
| WO2002018388A1 (fr) | Analogues de nucleosides et derives d'oligonucleotides renfermant ces analogues | |
| JPWO2014046212A1 (ja) | グアニジン架橋を有する人工ヌクレオシドおよびオリゴヌクレオチド | |
| US9914745B2 (en) | Morpholino-based antisense agent | |
| TW202043470A (zh) | 用於抑制HIF-2α(EPAS1)表現之RNAi藥劑、其組合物及使用方法 | |
| JP7016170B2 (ja) | ヌクレオシド誘導体及びその利用 | |
| US20040033967A1 (en) | Alkylated hexitol nucleoside analogues and oligomers thereof | |
| US12104154B2 (en) | Antisense oligonucleic acid | |
| US20220170020A1 (en) | Antisense oligonucleic acid | |
| EA043375B1 (ru) | Нацеливающие лиганды | |
| JP2014177404A (ja) | 核酸抗生物質誘導体 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 15735281 Country of ref document: EP Kind code of ref document: A1 |
|
| ENP | Entry into the national phase |
Ref document number: 2015556799 Country of ref document: JP Kind code of ref document: A |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| 122 | Ep: pct application non-entry in european phase |
Ref document number: 15735281 Country of ref document: EP Kind code of ref document: A1 |