RU2761953C2 - Лечение рака желудка с применением комбинационных видов терапии, содержащих липосомальный иринотекан, оксалиплатин, 5-фторурацил (и лейковорин) - Google Patents
Лечение рака желудка с применением комбинационных видов терапии, содержащих липосомальный иринотекан, оксалиплатин, 5-фторурацил (и лейковорин) Download PDFInfo
- Publication number
- RU2761953C2 RU2761953C2 RU2019114952A RU2019114952A RU2761953C2 RU 2761953 C2 RU2761953 C2 RU 2761953C2 RU 2019114952 A RU2019114952 A RU 2019114952A RU 2019114952 A RU2019114952 A RU 2019114952A RU 2761953 C2 RU2761953 C2 RU 2761953C2
- Authority
- RU
- Russia
- Prior art keywords
- dose
- yes
- oxaliplatin
- administered
- irinotecan
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/4353—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems
- A61K31/437—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems the heterocyclic ring system containing a five-membered ring having nitrogen as a ring hetero atom, e.g. indolizine, beta-carboline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4164—1,3-Diazoles
- A61K31/4178—1,3-Diazoles not condensed 1,3-diazoles and containing further heterocyclic rings, e.g. pilocarpine, nitrofurantoin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4453—Non condensed piperidines, e.g. piperocaine only substituted in position 1, e.g. propipocaine, diperodon
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/4738—Quinolines; Isoquinolines ortho- or peri-condensed with heterocyclic ring systems
- A61K31/4745—Quinolines; Isoquinolines ortho- or peri-condensed with heterocyclic ring systems condensed with ring systems having nitrogen as a ring hetero atom, e.g. phenantrolines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/513—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim having oxo groups directly attached to the heterocyclic ring, e.g. cytosine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/555—Heterocyclic compounds containing heavy metals, e.g. hemin, hematin, melarsoprol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K33/00—Medicinal preparations containing inorganic active ingredients
- A61K33/24—Heavy metals; Compounds thereof
- A61K33/243—Platinum; Compounds thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
- A61K9/127—Liposomes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Dispersion Chemistry (AREA)
- Dermatology (AREA)
- Inorganic Chemistry (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Medicinal Preparation (AREA)
Abstract
Описаны схемы комбинированной терапии, включающие липосомальный иринотекан, оксалиплатин и 5-фторурацил, полезные в лечении рака желудка, включая лечение пациентов с диагнозом ранее нелеченного рака желудка. Комбинированная терапия может включать введение липосомального иринотекана, оксалиплатина, лейковорина и 5-фторурацила один раз каждые две недели. 24 з.п. ф-лы, 5 пр., 19 табл., 14 ил.
Description
ОБЛАСТЬ ТЕХНИКИ
[001] Настоящее раскрытие относится к новым видам терапии, пригодным для лечения рака желудка, включающим применение липосомального иринотекана в комбинации с 5-фторурацилом и оксалиплатином для (первой линии) лечения пациентов с диагнозом "ранее нелеченый рак желудка".
УРОВЕНЬ ТЕХНИКИ
[002] Рак желудка является одной из наиболее распространенных причин смертности от рака во всем мире. Ожидалось, что приблизительно 18,000 пациентов с метастатическим раком желудка будут лечиться курсами лекарственного лечения в Соединенных Штатах в 2015 году. Из этой группы приблизительно 7,000 пациентов попадают в категорию начального HER2-отрицательного лечения. HER2-отрицательный рак желудка является высоко гетерогенным заболеванием, и направленные терапии, такие как бевацизумаб, рилотумумаб и цетуксимаб, оказались безуспешными. Осложняя прогноз, у многих пациентов с раком желудка обнаруживается поздняя стадия заболевания на момент постановки диагноза. В настоящее время не существует всемирно принятой стандартной химиотерапевтической схемы лечения рака желудка поздней стадии, несмотря на то, что несколько схем лечения были исследованы с ограниченной эффективностью (5-летний коэффициент выживаемости ~ 4%). Заболевание обычно лечат химиотерапией, хирургией и лучевой терапией. Учитывая плохой прогноз и низкий медианный коэффициент выживаемости пациентов с раком желудка, новые варианты лечения все еще необходимы.
[003] Переносимость многокомпонентных лекарственных схем важна при лечении рака. Более долгая продолжительность контролируемого лечения должна приводить к улучшенному результату из-за длительного воздействия препарата. Одной из широко используемых терапий первой линии для пациентов с раком желудка является оксалиплатин плюс инфузионный 5-фторурацил (5-FU) и лейковорин (LV). В частности, модифицированная схема FOLFOX6 (mFOLFOX6) включает 5-FU/LV (400 мг/м2 в/в болюс+2400 мг/м2 в виде 46-часовой инфузии/400 мг/м2)+оксалиплатин (85 мг/м2), один раз в 2 недели. Хотя лечение, как правило, хорошо переносится, общая выживаемость не увеличивается.
[004] В течение последних 5 лет другой комбинированной химиотерапевтической схемой, которая стала первой линией лечения рака желудка, является комбинированная терапия 5-фторурацилом (5-FU)/лейковорином (LV)+иринотеканом+оксалиплатином (FOLFIRINOX). Однако известно, что FOLFIRINOX обладает значительной токсичностью, и применение ограничено пациентами с более лучшим показателем общего состояния (т.е. баллом оценки состояния по шкале ECOG 0 или 1). При длительном лечении с помощью FOLFIRINOX оксалиплатин часто убирают из схемы из-за токсичности. Следовательно, если могут быть идентифицированы одинаково эффективные двойные схемы, пациенты могут перенести длительное лечение лучше, и даже пациенты с плохим показателем общего состояния могут получить пользу. Хотя схема FOLFIRINOX рекомендована Национальной всеобщей онкологической сетью (NCCN) в качестве предпочтительного варианта первой линии лечения метастатического заболевания с 2011 года, существуют некоторые опасения по поводу токсичности, связанной с FOLFIRINOX. Одна доза FOLFIRINOX представляет собой 85 мг/м2 оксалиплатина, 180 мг/м2 иринотекана и фторурацил в дозе 400 мг/м2, вводимой в/в болюсом, с последующей непрерывной инфузией 2400 мг/м2. Тем не менее, из-за токсичности часто используются модифицированные схемы FOLFIRINOX (например, устранение болюса 5-FU) с неизвестными эффектами на эффективность и безопасность модифицированных схем.
[005] СРТ-11 представляет собой тригидрат иринотекана гидрохлорида, поставляемый на рынок под названием Camptosar® в Соединенных Штатах, одобренный для использования в комбинации с 5-фторурацилом и лейковорином в качестве терапии первой линии для пациентов с метастатической карциномой толстой или прямой кишки или для пациентов с метастатической карциномой толстой кишки или прямой кишки, заболевание которых рецидивировало или прогрессировало после первоначальной терапии на основе фторурацила.
[006] MM-398 представляет собой липосомальный иринотекан и продается в США как одобренный Управлением по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) продукт ONIVYDE® в комбинации с 5-фторурацилом и лейковорином для лечения пациентов с определенными формами рака поджелудочной железы после прогрессирования заболевания, следующего за терапией на основе гемцитабина.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[007] Усовершенствованные виды противоопухолевой терапии для лечения рака желудка обеспечивают введение липосомального иринотекана в комбинации с оксалиплатином и 5-фторурацилом пациентам с ранее нелеченым раком желудка. 5-Фторурацил может быть введен в комбинации с лейковорином. Улучшенные виды противоопухолевой терапии могут обеспечить улучшенный терапевтический индекс (например, улучшенные профили токсичности) по сравнению с предыдущими схемами FOLFIRINOX.
[008] Способ лечения рака желудка может включать введение пациенту противоопухолевой терапии из липосомального иринотекана (например, MM-398), оксалиплатина и 5-фторурацила один раз каждые две недели. Необязательно, лейковорин также может быть введен перед каждым введением 5-фторурацила. Каждое введение липосомального иринотекана может быть введено в общей дозе 50 мг/м2 или 55 мг/м2 (может рассматриваться как 56 мг/м2) липосомального иринотекана (доза, относящаяся к свободному основанию, как определено в настоящем документе) или 60 мг/м2 или 65 мг/м2 липосомального иринотекана (доза, относящаяся к тригидрату гидрохлорида, как определено в настоящем документе). В общей сложности 2400 мг/м2 5-фторурацила может быть введено в течение 46 часов, начиная с каждого дня, когда вводят липосомальный иринотекан. В общей сложности 60, 70, 75 или 85 мг/м2 оксалиплатина может быть введено каждый день, когда вводят липосомальный иринотекан. В общей сложности 200 мг/м2 (l)-лейковорина может быть введено перед каждым введением 5-фторурацила (например, необязательно введено в виде 400 мг/м2 (l+d)-лейковорина). Противоопухолевая терапия может быть проведена, начиная с 1 и 15 дня 28-дневного курса лечения, с липосомальным иринотеканом, оксалиплатином и, необязательно, лейковорином, вводимыми в 1 и 15 дни, и начиная с 46-часового введения 5-фторурацила в дни 1 и 15. Общая доза каждого введения липосомального иринотекана и 5-фторурацила может быть уменьшена на 25% для определенных пациентов, включая пациентов, которые испытывают нежелательные явления 3 или 4 степени на предыдущую дозу противоопухолевой терапии.
[009] Изобретение частично основано на нескольких доклинических открытиях. Во-первых, липосомальный иринотекан улучшал противоопухолевую активность ингибитора топоизомеразы 1 SN-38 (активный метаболит иринотекана) по сравнению с равноценными дозами воздействия нелипосомального иринотекана. Во-вторых, липосомальный иринотекан в комбинации с 5-фторурацилом и оксалиплатином последовательно улучшал ингибирование роста опухоли и выживаемость в мышиных моделях ксенотрансплантата рака желудка по сравнению с нелипосомальным иринотеканом, не усиливая исходную токсичность этих агентов.
[010] Кроме того, изобретение основано, в частности, на открытии того факта, что введение дозы начальной противоопухолевой терапии людям, состоящей из 70 мг/м2 липосомального иринотекана (свободного основания), плохо переносилось людьми при введении в комбинации с 60 мг/м2 оксалиплатина, 2400 мг/м2 5-фторурацила и 400 мг/м2 (l+d)-лейковорина. В частности, применение этой начальной противоопухолевой терапии привело к неожиданным нежелательным явлениям со стороны желудочно-кишечного тракта. Однако последующая противоопухолевая терапия, состоящая из новой комбинации 50 мг/м2липосомального иринотекана, оксалиплатина 60 мг/м2, 2400 мг/м2 5-фторурацила и 400 мг/м2 (l+d) лейковорина, не привела к появлению нежелательных явлений со стороны желудочно-кишечного тракта, наблюдаемых при начальной противоопухолевой терапии.
[011] SN-38 представляет собой сильнодействующий активный метаболит липосомального иринотекана. Средний неинкапсулированный SN-38 (Cср uSN38) связан с повышенной эффективностью липосомального иринотекана, в то время как более высокие уровни других ФК-параметров связаны с пониженной переносимостью липосомального иринотекана. Например, более высокая общая максимальная концентрация иринотекана в плазме (Cмакс tIRI) связана с диареей, а более высокая максимальная концентрация неинкапсулированного SN38 в плазме (Cмакс uSN38) связана с нейтропенией. Эти фармакокинетические параметры пропорциональны дозе препарата.
[012] Введение липосомального иринотекана, оксалиплатина, 5-фторурацила и лейковорина с уровнем дозы 60 мг оксалиплатина и 80 мг/м2 липосомального иринотекана приводило к увеличению более чем на 100% средней концентрации в плазме неинкапсулированного Cмакс uSN38, в то время как введение этих четырех агентов с уровнем дозы 60 мг оксалиплатина и 60 мг/м2 липосомального иринотекана (см. уровень дозы -1 в таблице 2) приводило к увеличению приблизительно на 9%. Кроме того, ФК-параметры, связанные со сниженной переносимостью (Cмакс tIRI или Cмакс uSN38), увеличивались примерно на 15% и 44% для 60 мг/80 мг/м2 (соответственно), но снижались для уровня дозы -1 на 3% и 27% (соответственно). Поэтому неожиданно, что введение меньшего количества липосомального иринотекана привело к более переносимой дозе, в то же время сохраняя эффективность. В настоящей заявке введение оксалиплатина, липосомального иринотекана, оксалиплатина, 5-фторурацила и лейковорина при уровне дозы -1 или -3 (таблица 2) увеличивает Cср uSN38 в плазме без значительного увеличения Cмакс tIRI или Cмакс uSN38, что позволяет вводить эти дозы с большей переносимостью.
[013] Соответственно, предпочтительные способы лечения (ранее нелеченого) рака желудка предусматривают применение переносимой человеком противоопухолевой терапии один раз каждые две недели, где каждое применение противоопухолевой терапии представляет собой комбинацию противоопухолевых агентов липосомального иринотекана, оксалиплатина и 5-фторурацила, представленную в настоящем документе. Предпочтительно противоопухолевая терапия, применяемая один раз каждые две недели, состоит из: (a) общей дозы 50 мг/м2 липосомального иринотекана (доза, относящаяся к свободному основанию, как определено в настоящем документе), (b) общей дозы 60-85 мг/м2 оксалиплатина (включая, например, 60, 70 или 85 мг/м2) и (c) в общей сложности 2400 мг/м2 5-фторурацила, необязательно вводимого в комбинации с лейковорином; или (a) общей дозы 55 мг/м2 липосомального иринотекана (доза, относящаяся к свободному основанию, как определено в настоящем документе), (b) общей дозы 60-85 мг/м2 оксалиплатина (включая, например, 60, 70 или 85 мг/м2) и (c) в общей сложности 2400 мг/м2 5-фторурацила, необязательно вводимого в комбинации с лейковорином. Необязательно, комбинация может включать введение в общей сложности 200 мг/м2 (l)-лейковорина (необязательно вводимого в виде 400 мг/м2 (l+d)-лейковорина) до начала введения 5-фторурацила. Предпочтительно, во время противоопухолевой терапии не вводят никакой другой противоопухолевый агент, отличный от количества SN-38, продуцируемого у пациента из липосомального иринотекана, после введения липосомального иринотекана. Например, противоопухолевая терапия может применяться без (нелипосомального) иринотекана CPT-11. Предпочтительно липосомальный иринотекан, оксалиплатин и (необязательно) лейковорин вводят последовательно в виде отдельных инфузий в течение одного (первого) дня, а 5-фторурацил вводят, начиная с первого дня после введения лейковорина (если вводят), и продолжают на следующий день (например, в течение более 46 часов).
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
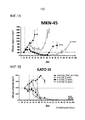
[014] Фигура 1A представляет собой график, демонстрирующий активность nal-IRI в модели опухоли желудка MKN-45; Фигура 1B представляет собой график, демонстрирующий активность nal-IRI в модели опухоли желудка KATO III.
[015] Фигуры 2A и 2B представляют собой графики, демонстрирующие противоопухолевую активность MM-398 по сравнению с монотерапией свободным иринотеканом в модели ксенотрансплантата рака ЖКТ. Мышей, несущих опухоли MKN-45, лечили физиологическим раствором, 12,5 мг/кг свободного иринотекана или 2,5 мг/кг MM-398 еженедельно в течение 3 недель (фигура 2A) или физиологическим раствором, 25 мг/кг свободного иринотекана и 5 мг/кг MM-398 еженедельно в течение 3 недель (фигура 2B) (дни дозирования указаны горизонтальными пунктирными линиями; n=X на группу мышей).
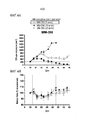
[016] Фигура 3A представляет собой график, демонстрирующий противоопухолевую активность MM-398 по сравнению со свободным иринотеканом в контексте комбинированной терапии с 5-FU и оксалиплатином; Фигура 3B представляет собой график, демонстрирующий противоопухолевую активность MM-398 по сравнению со свободным иринотеканом в контексте триплетной комбинированной терапии с 5-FU и оксалиплатином.
[017] Фигуры 4A-4H представляют собой графики, демонстрирующие, что MM-398 проявляет превосходную противоопухолевую активность на моделях опухолей, менее чувствительных к оксалиплатину, 5-FU и свободному иринотекану (равное воздействие) (исследование эффективности в модели ЖКТ (MKN-45) - монотерапия). Фигура 4A. ММ-398 объем опухоли; Фигура 4B. MM-398 масса тела; Фигура 4C. Оксалиплатин объем опухоли; Фигура 4D. Оксалиплатин масса тела; Фигура 4E. 5-FU Объем опухоли; Фигура 4F. 5-FU масса тела; Фигура 4G. Свободный иринотекан объем опухоли; и Фигура 4H. Свободный иринотекан масса тела. MM-398 в дозе 5 мг/кг обладает лучшей противоопухолевой активностью, чем все другие протестированные методы лечения.
[018] Фигуры 5A изображают схему FOLFIRI, и Фигура 5B изображает схему FOLFOX по сравнению с MM-398 в MKN45. Монотерапия MM-398 обладает лучшей противоопухолевой активностью, чем FOLFIRI и FOLFOX в тестируемых дозах.
[019] Фигуры 6А-6C отображают изменение массы тела в ответ на: Фигура 6A. схемы монотерапии, Фигура 6B. дублетные схемы и Фигура 6C. триплетные схемы. Наблюдалась приемлемая потеря веса во всех группах.
[020] Фигуры 7A и 7B представляют собой графики, демонстрирующие противоопухолевую активность (A) MM-398 по сравнению со (B) свободным иринотеканом в низких дозах.
[021] Фигуры 8A и 8B представляют собой графики, демонстрирующие противоопухолевую активность (A) MM-398 по сравнению со (B) свободным иринотеканом в высоких дозах.
[022] Фигура 9 представляет собой схему клинического испытания при раке ЖКТ.
[023] Фигуры 10A и 10B представляют собой графики, демонстрирующие продолжительность устойчивых уровней SN-38 в опухоли: Фигура 10A. Концентрация SN-38 в опухоли; Фигура 10B. Время концентрации SN-38 прогнозируется как превышающее пороговую величину из 6-недельного цикла.
[024] Фигура 11 представляет собой график, демонстрирующий ретроспективные медианные результаты общей выживаемости (OS) выбранных схем первой линии лечения рака ЖКТ в различных испытаниях.
[025] Фигура 12 представляет собой график, демонстрирующий безопасность уровня дозы 1 и уровня дозы -1.
[026] Фигура 13 представляет собой график, демонстрирующий эффективность уровня дозы 1 и уровня дозы -1.
[027] Фигура 14 представляет собой таблицу, демонстрирующую нежелательные явления в ответ на лечение уровнем дозы -1 и уровнем дозы 1.
ПОДРОБНОЕ ОПИСАНИЕ
[028] Дозы nal-IRI в некоторых исследованиях рассчитывали на основе эквивалентной дозы тригидрата гидрохлорида иринотекана (соли); в настоящем описании, если не указано иное, дозы относятся к иринотекану в виде свободного основания.
[029] На грамм тригидрата гидрохлорида иринотекана приходится приблизительно 866 мг иринотекана. Например, доза 80 мг/м2 липосомального иринотекана в расчете на количество исходного вещества тригидрата гидрохлорида иринотекана фактически содержит приблизительно 0,866 × (80 мг/м2)=69,38 мг/м2 свободного основания иринотекана, которое может быть округлено до целого числа, чтобы избежать ошибок дозирования. Например, 69,38 мг/м2 можно округлить до 70 мг/м2, как показано в таблице А.
[030] Другим примером является доза 65 мг/м2 липосомального иринотекана, относящаяся к тригидратной соли, которая означает количество свободного основания липосомального иринотекана, обеспечивающее такое же количество инкапсулированного в липосомах иринотекана, которое присутствует в 65 мг/м2 липосомального тригидрата гидрохлорида иринотекана, что эквивалентно дозе 56,29 мг/м2 свободного основания липосомального иринотекана, которую можно округлить, чтобы избежать ошибок дозирования, до дозы от 55 мг/м2 до 57 мг/м2, например, 55 мг/м2, 56 мг/м2 или 57 мг/м2. Другим примером является доза 60 мг/м2 липосомального иринотекана, относящаяся к тригидратной соли, которая означает количество свободного основания липосомального иринотекана, обеспечивающее такое же количество инкапсулированного в липосомах иринотекана, которое присутствует в 60 мг/м2 тригидрата гидрохлорида иринотекана, и эквивалентно дозе 51,96 мг/м2, которую можно округлить, чтобы избежать ошибок дозирования, до дозы от приблизительно 50 мг/м2 до приблизительно 52 мг/м2, например, до 50 мг/м2, 51 мг/м2 или 52 мг/м2 свободного основания липосомального иринотекана. Аналогично, доза 50 мг/м2 тригидрата гидрохлорида липосомального иринотекана может быть преобразована в 43,30 мг/м2 свободного основания липосомального иринотекана, которые можно округлить, чтобы избежать ошибок дозирования, до 43 мг/м2 или 44 мг/м2. Аналогично, доза 49 мг/м2 тригидрата гидрохлорида липосомального иринотекана может быть преобразована в 42,22 мг/м2 свободного основания липосомального иринотекана, которые можно округлить, чтобы избежать ошибок дозирования, до 42 мг/м2 или 43 мг/м2. Другим вариантом осуществления является доза 45 мг/м2 тригидрата гидрохлорида липосомального иринотекана, которая может быть преобразована в 38,97 мг/м2 свободного основания липосомального иринотекана, которые можно округлить, чтобы избежать ошибок дозирования, до 38 мг/м2 или 39 мг/м2. В другом примере доза 40 мг/м2 тригидрата гидрохлорида липосомального иринотекана может быть преобразована в 34,64 мг/м2 свободного основания липосомального иринотекана, которые можно округлить, чтобы избежать ошибок дозирования, до 34 мг/м2 или 35 мг/м2. В другом примере доза 33 мг/м2 тригидрата гидрохлорида липосомального иринотекана может быть преобразована в 28,15 мг/м2 свободного основания липосомального иринотекана, которые можно округлить, чтобы избежать ошибок дозирования, до 28 мг/м2 или 29 мг/м2. В другом примере доза 30 мг/м2 тригидрата липосомального гидрохлорида иринотекана может быть преобразована в 32,5 мг/м2 свободного основания липосомального иринотекана, которые можно округлить, чтобы избежать ошибок дозирования, до 32 мг/м2 или 33 мг/м2.
[031] Дополнительные примеры приведены в таблице А.
[032] Таблица A
| Тригидрат гидрохлоридной соли иринотекана мг/м2 |
Свободное основание иринотекана мг/м2 |
Преобразование тригидрата гидрохлоридной соли в свободное основание с использованием коэффициента преобразования 0,866 |
| 120 | 100 | 103,92 |
| 80 | 70 | 69,38 |
| 65 | 55 | 56,29 |
| 60 | 50 | 51,96 |
| 50 | 43 | 43,30 |
| 49 | 42 | 42,22 |
| 45 | 39 | 38,97 |
| 40 | 35 | 34,64 |
| 33 | 28 | 28,15 |
| 30 | 33 | 32,50 |
[033] В контексте настоящего описания, если не указано иное, термин "nal-IRI" (нанолипосомальный иринотекан) и "MM-398" относятся к форме липосомального иринотекана. Термин "СРТ-11" относится к (нелипосомальному) тригидрату гидрохлорида иринотекана.
[034] В контексте настоящего описания термины "5-FU" и "5FU" используются взаимозаменяемо и относятся к 5-фторурацилу.
[035] Все цитируемые документы включены в настоящую заявку посредством ссылки.
[036] В контексте настоящего описания, конечные точки выражаемого диапазона включены в диапазон. Например, диапазон от 30 мг до 70 мг включает 30 и 70 (и все числа между конечными точками).
[037] Испытание моделей ксенотрансплантата рака ЖКТ в Примере 2 продемонстрировало улучшенную противоопухолевую активность липосомального иринотекана по сравнению с равноценными дозами воздействия нелипосомального иринотекана. В исследованиях на мышах в Примере 2 доза "x" мг/кг липосомального иринотекана обеспечивает примерно такое же воздействие ингибитора топоизомеразы 1 (иринотекана и/или SN-38), что и доза "5x" нелипосомального иринотекана. (СРТ-11). Липосомальный иринотекан последовательно улучшал ингибирование роста опухоли и выживаемость по сравнению с нелипосомным иринотеканом в доклинических моделях как в виде монотерапии, так и в комбинации с 5-FU и оксалиплатином. Эти полученные данные иллюстрируют терапевтический потенциал липосомального иринотекана в комбинации с 5-FU/LV и оксалиплатином и подтверждают клиническое испытание этой триплетной схемы в первой линии лечения рака ЖКТ (пример 4).
[038] Животную модель схемы FOLFIRINOX тестировали в сравнении со схемой MM-398+5-FU/LV+оксалиплатин на мышиной модели ксенотрансплантата опухоли ЖКТ. Липосомальный иринотекан (MM-398) показал более лучшие результаты, чем обычный (нелипосомальный) иринотекан (СРТ-11), в эквивалентных дозах воздействия (5 мг/кг MM-398 по сравнению с 25 мг/кг свободного IRI) в моделях ксенотрансплантата рака ЖКТ (Пример 2) либо в монотерапии (например, фигура 2A), либо в комбинации с оксалиплатином и/или 5-FU (например, фигура 2B).
[039] Эти доклинические данные подтверждают терапевтическое использование липосомального иринотекана в комбинации с 5-FU/LV и оксалиплатином и клиническое испытание этой триплетной схемы в первой линии лечения рака ЖКТ (Пример 4). На фигурах 3A и 3B изображено графическое представление плана исследования с использованием комбинации MM-398+5-FU/LV+оксалиплатин, как описано в настоящем документе.
[040] Например, применение комбинации липосомального иринотекана, оксалиплатина и 5-фторурацила для лечения рака ЖКТ у пациента-человека, который ранее не получал химиотерапию для лечения рака ЖКТ, включает введение противоопухолевого терапевтического средства пациенту в общей сложности один раз каждые две недели, причем противоопухолевое терапевтическое средство состоит из: (a) 50 мг/м2 липосомального иринотекана, 60 мг/м2 оксалиплатина, 200 мг/м2 (l)-формы лейковорина или 400 мг/м2 рацемической (l+d)-формы лейковорина и 2400 мг/м2 5-фторурацила для лечения рака ЖКТ у пациента-человека; (b) 50 мг/м2 липосомального иринотекана, 85 мг/м2 оксалиплатина, 200 мг/м2 (l)-формы лейковорина или 400 мг/м2 рацемической (l+d)-формы лейковорина и 2400 мг/м2 5-фторурацила для лечения рака ЖКТ у пациента-человека; (c) 55 мг/м2 липосомального иринотекана, 70 мг/м2 оксалиплатина, 200 мг/м2 (l)-формы лейковорина или 400 мг/м2 рацемической (l+d)-формы лейковорина и 2400 мг/м2 5-фторурацила для лечения рака ЖКТ у пациента-человека; (d) 50 мг/м2 липосомального иринотекана, 60 мг/м2 оксалиплатина, 200 мг/м2 (l)-формы лейковорина или 400 мг/м2 рацемической (l+d)-формы лейковорина и 2400 мг/м2-5-фторурацила для лечения рака ЖКТ у пациента-человека, где липосомальный иринотекан, оксалиплатин, 5-фторурацил и лейковорин вводят в 1 и 15 дни 28-дневного курса лечения; (e) 50 мг/м2 липосомального иринотекана, 85 мг/м2 оксалиплатина, 200 мг/м2 (l)-формы лейковорина или 400 мг/м2 рацемической (l+d)-формы лейковорина и 2400 мг/м2 5-фторурацила для лечения рака ЖКТ у пациента-человека, где липосомальный иринотекан, оксалиплатин, 5-фторурацил и лейковорин вводят в 1 и 15 дни 28-дневного курса лечения; (f) 55 мг/м2 липосомального иринотекана, 70 мг/м2 оксалиплатина, 200 мг/м2 (l)-формы лейковорина или 400 мг/м2 рацемической (l+d)-формы лейковорина и 2400 мг/м2 5-фторурацила для лечения рака ЖКТ у пациента-человека, где липосомальный иринотекан, оксалиплатин, 5-фторурацил и лейковорин вводят в 1 и 15 дни 28-дневного курса лечения; (g) 50 мг/м2 липосомального иринотекана, 60 мг/м2 оксалиплатина, 200 мг/м2 (l)-формы лейковорина или 400 мг/м2 рацемической (l+d)-формы лейковорина и 2400 мг/м2 5-фторурацила для лечения рака ЖКТ у пациента-человека, где липосомальный иринотекан вводят с последующим введением оксалиплатина, с последующим введением лейковорина, с последующим введением 5-фторурацила; (h) 50 мг/м2 липосомального иринотекана, 85 мг/м2 оксалиплатина, 200 мг/м2 (l)-формы лейковорина или 400 мг/м2 рацемической (l+d)-формы лейковорина и 2400 мг/м2 5-фторурацила для лечения рака ЖКТ у пациента-человека, где липосомальный иринотекан вводят с последующим введением оксалиплатина, с последующим введением лейковорина, с последующим введением 5-фторурацила; (i) 55 мг/м2 липосомального иринотекана, 70 мг/м2 оксалиплатина, 200 мг/м2 (l)-формы лейковорина или 400 мг/м2 рацемической (l+d)-формы лейковорина и 2400 мг/м2 5-фторурацила для лечения рака ЖКТ у пациента-человека, где липосомальный иринотекан вводят с последующим введением оксалиплатина, с последующим введением лейковорина, с последующим введением 5-фторурацила; или (j) 50 мг/м2-55 мг/м2 липосомального иринотекана, 60 мг/м2-85 мг/м2 оксалиплатина, 200 мг/м2 (l)-формы лейковорина или 400 мг/м2 рацемической (l+d)-формы лейковорина и 2400 мг/м2 5-фторурацила для лечения рака ЖКТ у пацинета-человека, где липосомальный иринотекан, оксалиплатин, 5-фторурацил и лейковорин вводят в 1 и 15 дни 28-дневного курса лечения, где липосомальный иринотекан вводят с последующим введением оксалиплатина, с последующим введением лейковорина, с последующим введением 5-фторурацила, причем введение оксалиплатина начинается через 2 часа после завершения каждого введения липосомального иринотекана. Каждое из этих приводимых в качестве примера применений может быть модифицировано с заменой доз липосомального иринотекана, оксалиплатина, лейковорина и 5-фторурацила, описанных в настоящем документе, в следующих частях, относящихся к этим конкретным компонентам. Иногда липосомальный иринотекан содержит иринотекана-сахарозы октасульфат, инкапсулированный в липосомы. Иногда липосомальный иринотекан включает иринотекан, инкапсулированный в липосомные везикулы, состоящие из 1,2-дистеароил-sn-глицеро-3-фосфохолина (DSPC), холестерина и N-(карбонилметоксиполиэтиленгликоль-2000)-1,2-дистеароил-sn-глицеро-3-фосфоэтаноламина (MPEG-2000-DSPE).
[041] Как предусмотрено в настоящем документе, иринотекан может быть введен в виде иринотеканового липосомного препарата. Предпочтительно, липосомальный иринотекан представляет собой липосомную инъекцию иринотекана-сахарозы сульфата (иначе именуемую "инъекцией липосом с октасульфатной солью иринотекана-сахарозы" или "инъекцию липосом с сукрозофатом иринотекана"), состав, упоминаемый в настоящем документе как "MM-398" (также известный как PEP02, см. US 8,147,867), представляет собой форму "нанолипосомального иринотекана" (также называемую "иринотекановой липосомой" или "липосомальным иринотеканом"). MM-398 представляет собой иринотекан в виде октасульфатной соли иринотекана-сахарозы, инкапсулированной в систему доставки лекарственного средства на основе нанолипосом.
[042] Липосомальный иринотекан может представлять собой фармацевтическую композицию, приготовленную для внутривенного введения человеку. Например, липосомальный иринотекан может быть предоставлен в виде стерильной инъецируемой парентеральной жидкости для внутривенной инъекции. Требуемое количество липосомального иринотекана может быть разбавлено, например, в 500 мл 5% декстрозы для инъекций ФСША, чтобы обеспечить различные концентрации, например, 5 мг/мл, и может быть инфузировано в течение 90-минутного периода.
[043] Активный ингредиент инъекции MM-398, иринотекан, является членом класса ингибиторов топоизомеразы I и является полусинтетическим и водорастворимым аналогом встречающегося в природе алкалоида камптотецина. Ингибиторы топоизомеразы I работают, чтобы остановить неконтролируемый рост клеток путем предотвращения раскручивания ДНК и, следовательно, предотвращения репликации. Фармакология иринотекана является сложной, с обширными метаболическими превращениями, участвующими в активации, инактивации и удалении лекарственного средства из организма. Иринотекан представляет собой пролекарство, которое с помощью неспецифических карбоксилэстераз превращается в более активный в 100-1000 раз метаболит SN-38. SN-38 выводится через глюкуронидацию (для которой были показаны основные фармакогенетические различия) и экскрецию с желчью. Эти свойства лекарственного средства способствуют заметным различиям в эффективности и токсичности, наблюдаемым в клинических исследованиях с иринотеканом.
[044] Липосомальный иринотекан может представлять собой однослойные везикулы из липидных бислоев диаметром приблизительно 80-140 нм, которые инкапсулируют водное пространство, которое содержит иринотекан, образующий комплекс в гелеобразном или осажденном состоянии, в виде соли с октасульфатом сахарозы. Липидная мембрана липосомы состоит из фосфатидилхолина, холестерина и дериватизированного полиэтиленгликолем фосфатидил-этаноламина в количестве приблизительно одной молекулы полиэтиленгликоля (ПЭГ) на каждые 200 молекул фосфолипида.
[045] Количество липосомального иринотекана, вводимого пациенту-человеку, может варьироваться от приблизительно 30 мг/м2 до приблизительно 170 мг/м2, предпочтительно 50 мг/м2 или 55 мг/м2, или 56 мг/м2, при введении в комбинации с оксалиплатином и 5-фторурацилом для лечения рака ЖКТ (доза, выраженная в пересчете на свободное основание).
[046] Фармакокинетику в плазме общего иринотекана и общего SN-38 оценивали у пациентов с раком, которые получали MM-398 в качестве монотерапии или в качестве части комбинированной химиотерапии в дозах от 50 до 155 мг/м2 (количество свободного основания иринотекана, эквивалентного дозе 60-180 мг/м2, выраженной в пересчете на количество тригидрата гидрохлоридной соли иринотекана), и 353 больных раком пациантов с использованием популяционного фармакокинетического анализа. В диапазоне доз от 50 до 155 мг/м2 Cмакс и площадь под кривой "концентрация-время" (AUC) общего иринотекана увеличиваются с увеличением дозы. Кроме того, Cмакс общего SN-38 увеличивается пропорционально дозе; однако AUC общего SN-38 увеличивается менее чем пропорционально дозе.
[047] Фармакокинетические параметры общего иринотекана и общего SN-38 после введения 50 мг/м2 MM-398 (свободное основание) в качестве монотерапии или части комбинированной химиотерапии представлены в таблице B.
[048] Таблица B: Общий иринотекан и общий SN-38
[049] Фармакокинетические параметры у пациентов с солидными опухолями.
| Доза (мг/м2) свободное основание |
Общий иринотекан | Общий SN-38 | |||
| [001] | Cмакс [мкг/мл] |
AUC0-∞ [ч⋅мкг/мл] |
t1/2[ч] | Cмакс [нг/мл] |
t1/2[ч] |
| Макс. (125%) | 32,5 | 1193,5 | 25,8 | 4,8 | 67,8 |
| 50 | 26 | 954,8 | 25,8 | 3,8 | 67,8 |
| Мин. (80%) | 20,8 | 763,8 | 25,8 | 3,0 | 67,8 |
[050] Cмакс для SN-38 увеличивается пропорционально дозе липосомального иринотекана, но AUC SN-38 увеличивается менее чем пропорционально дозе, обеспечивая новые способы корректировки дозировки. Например, значение параметра, связанного с нежелательными явлениями (Cмакс), уменьшается в относительно большей степени, чем значение параметра, связанного с эффективностью лечения (AUC). Соответственно, когда наблюдается нежелательное явление, может быть реализовано уменьшение дозировки липосомального иринотекана, что максимизирует разницу между снижением Cмакс и AUC. Это открытие означает, что в схемах лечения заданный AUC для SN-38 может быть достигнут с неожиданно низким Cмакс для SN-38. Аналогично, заданное значение Cмакс для SN-38 может быть достигнуто с удивительно высоким значением AUC для SN-38.
[051] Прямое измерение липосом с иринотеканом показало, что 95% иринотекана остается инкапсулированным в липосому, и соотношения между общей и инкапсулированной формами не менялись со временем от 0 до 169,5 часов после введения дозы.
[052] В некоторых вариантах осуществления липосомальный иринотекан может быть охарактеризован параметрами в таблице B. В некоторых вариантах осуществления липосомальный иринотекан может представлять собой MM-398 или продукт, который биоэквивалентен MM-398. В некоторых вариантах осуществления липосомальный иринотекан может быть охарактеризован параметрами в таблице C, включая значения Cмакс и/или AUC, которые составляют 80-125% от соответствующих значений в таблице B. Фармакокинетические параметры общего иринотекана для различных альтернативных составов липосомального иринотекана, содержащих 50 мг/м2 свободного основания иринотекана, один раз каждые две недели, предоставлены в таблице C.
[053] Таблица C
[054] Общие фармакокинетические параметры иринотекана в альтернативных составах липосомального иринотекана
| Доза (мг/м2) Свободное основание |
Общий иринотекан | ||
| [001] | Cмакс [мкг/мл] (n=25) |
AUC0-∞ [ч⋅мкг/мл] (n=23) |
|
| 50 | 20,8-32,5 | 763,8-1193,5 | |
| Cмакс: Максимальная концентрация в плазме AUC0-∞: Площадь под кривой зависимости концентрации в плазме от времени, экстраполированной к бесконечности t½: Терминальный период полувыведения |
|||
[055] Комбинированное лечение, описанное в настоящем документе, включает введение липосомального иринотекана MM-398 в комбинации с несколькими дополнительными активными агентами: оксалиплатином, лейковорином и 5-фторурацилом в дозах и схемах для пациентов-людей с раком ЖКТ, ранее не получавших предшествующий химиотерапевтический агент в терапии метастатических форм рака, как описано в настоящем документе.
[056] 5-Фторурацил является пиримидиновым антагонистом, который препятствует биосинтезу нуклеиновых кислот. Дезоксирибонуклеотид лекарственного средства ингибирует тимидилатсинтетазу, тем самым ингибируя образование тимидиловой кислоты из дезоксиуридиловой кислоты, таким образом препятствуя синтезу ДНК. Это также препятствует синтезу РНК. Типичное эффективное количество 5-фторурацила, вводимого пациенту-человеку, может варьироваться от приблизительно 2000 мг/м2 до приблизительно 3000 мг/м2. В некоторых вариантах осуществления количество 5-фторурацила, вводимого пациенту-человеку, составляет 2400 мг/м2.
[057] Лейковорин необязательно вводят до 5-фторурацила. Лейковорин действует как биохимический кофактор для реакций переноса 1-углерода в синтезе пуринов и пиримидинов. Лейковорин не требует фермента дигидрофолатредуктазы (DHFR) для превращения в тетрагидрофолиевую кислоту. Эффекты метотрексата и других антагонистов DHFR ингибируются лейковорином. Лейковорин может усиливать цитотоксическое действие фторированных пиримидинов (то есть фторурацила и флоксуридина). После того как 5-FU активируется в клетке, он сопровождается кофактором фолата и ингибирует фермент тимидилат-синтетазу, тем самым ингибируя синтез пиримидина. Лейковорин увеличивает фолатный пул, тем самым увеличивая связывание фолатного кофактора и активного 5-FU с тимидилат-синтетазой. Лейковорин имеет декстро- и лево-изомеры, только последний является фармакологически полезным. Как таковой, биологически активный лево-изомер ("лево-лейковорин") также был одобрен Управлением по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) для лечения рака. Дозировка лейковорина представляет собой дозировку рацемической смеси, содержащей как декстро (d)-, так и лево (l)-изомеры, или, необязательно, (l)-форму лейковорина в половине дозы рацемической (l+d)-формы. Типичное эффективное количество лейковорина, вводимого пациенту-человеку, может включать количество лейковорина в (1)-форме в диапазоне от приблизительно 100 мг/м2 до приблизительно 300 мг/м2. В некоторых вариантах осуществления количество лейковорина в (1)-форме, вводимого пациенту-человеку, составляет 200 мг/м2. В других вариантах осуществления вводимый лейковорин представляет собой (l+d)-форму лейковорина в количестве в диапазоне от приблизительно 200 мг/м2 до приблизительно 600 мг/м2. В некоторых вариантах осуществления количество (l+d)-формы вводимого лейковорина составляет 400 мг/м2.
[058] Оксалиплатин представляет собой лекарственное средство на основе платины, которое действует как сшивающий ДНК агент для эффективного ингибирования репликации и транскрипции ДНК, что приводит к цитотоксичности, которая неспецифична для клеточного цикла. Оксалиплатин обычно используется в комбинации с инфузионным 5-FU/LV и одобрен для использования при поздней стадии колоректального рака (более подробную информацию см. на вкладыше в упаковку). Эффективное количество оксалиплатина, вводимого пациенту-человеку, может варьироваться от приблизительно 30 мг/м2 до приблизительно 150 мг/м2, например, от приблизительно 40 мг/м2 до приблизительно 100 мг/м2, или количество оксалиплатина составляет 50 мг/м2, 55 мг/м2, 60 мг/м2, 65 мг/м2, 70 мг/м2, 75 мг/м2, 80 мг/м2, 85 мг/м2, 90 мг/м2 или 95 мг/м2.
[059] Модификации дозы могут быть внесены в способы применения комбинированного лечения, описанные в настоящем документе, в результате нежелательных явлений, включая гематологические и негематологические нежелательные явления.
[060] В некоторых вариантах осуществления способы применения комбинированного лечения, описанного в настоящем документе, к пациентам, имеющим одну или несколько характеристик, могут включать уменьшение или иное изменение дозы MM-398, вводимой в соответствии с вариантами осуществления, описанными в настоящем документе. В некоторых вариантах осуществления доза MM-398 модифицируется в соответствии с таблицей 1А.
[061] Таблица 1А: Примеры модификаций дозы для ММ-398 (соль)
| Токсичность по NCI CTCAE версии 4.0 | Возникновение | Корректировка дозы MM-398 у пациентов, получающих 60 мг/м2‡ (соль) 50 мг/м2 (свободное основание) |
Пациенты, гомозиготные по UGT1A1*28 без предварительного увеличения до 60 мг/м2 (соль) 50 мг/м2 (свободное основание) |
| Нежелательные явления 3 или 4 степени | Прекратить ММ-398. Начать лоперамид для диареи с поздним началом любой степени тяжести. Ввести внутривенно или подкожно атропин от 0,25 до 1 мг (если клинически не противопоказано) для диареи с ранним началом любой степени тяжести. После восстановления до уровня ≤1 или исходной степени возобновить MM-398 в дозах: |
||
| [001] | Первое | 45 мг/м2 (соль) | 45 мг/м2 (соль) |
| [001] | Второе | 30 мг/м2 (соль) | 30 мг/м2 (соль) |
| [001] | Третье | Отмена MM-398 | Отмена MM-398 |
| Интерстициальное заболевание легких | Первое | Отмена MM-398 | Отмена MM-398 |
| Анафилактическая реакция | Первое | Отмена MM-398 | Отмена MM-398 |
[062] В некоторых вариантах осуществления первая, вторая или любая последующая доза MM-398 может быть снижена на 20-30% (включая снижение дозы на 20%, 25% и/или 30%) в ответ на ограничения переносимости пациентом, такие как побочная реакция на первую или последующую дозу MM-398 и/или другого противоопухолевого агента и/или идентификацию пациента как гомозиготного по аллелю UGT1A1*28. В некоторых вариантах осуществления вторая или последующая доза MM-398 снижается еще приблизительно на 20%, 25% или 30% (уменьшение дозы составляет приблизительно 40%, 50% или 60% от первоначальной дозы). Например, доза 60 мг/м2 MM-398, сниженная на 25%, составляет 45 мг/м2, а второе снижение еще на 25% составляет 30 мг/м2. В некоторых вариантах осуществления доза MM-398 снижается на 25%. В некоторых вариантах осуществления доза MM-398 снижается на 30%. В некоторых вариантах осуществления сниженная доза MM-398 находится в диапазоне от 30 мг/м2 до (и включая) 55 мг/м2. В некоторых вариантах осуществления доза MM-398 снижается до 50 мг/м2. В некоторых вариантах осуществления доза MM-398 снижается до 45 мг/м2. В некоторых вариантах осуществления доза MM-398 снижается до 35 мг/м2.
[063] Другие графики снижения дозы приведены в таблицах 1B-1E ниже. Когда начальная (исходная) доза MM-398 составляет 50 мг/м2, 5FU 2400 мг/м2, LV (l+d) 400 мг/м2, и оксалиплатин составляет либо 85 мг/м2, либо 60 мг/м2, тогда снижение первой дозы в ответ на гематотоксичность III или IV степени составляет предпочтительно снижение дозы на 25% для каждой из доз MM-398, 5-FU и оксалиплатина для каждого применения противоопухолевой терапии. Для устойчивых токсичностей, несмотря на уменьшение первой дозы, предпочтительным является дополнительное снижение дозы на 25% для каждого из противоопухолевых агентов MM-398, 5-фторурацила и оксалиплатина. Дополнительная токсичность может привести к прекращению лечения в некоторых случаях. В случае негематологических токсичностей может применяться та же схема снижения дозы, что и в случае гематотоксичности, за исключением специфических токсичностей, связанных с лекарственным средством (то есть вызванная 5FU акральная эритема и оксалиплатиновая невропатия), которая может быть выбрана на основе подходящей с медицинской точки зрения дозы для пациента.
[064] Таблица 1B. Примеры сниженных доз MM-398 и оксалиплатина
| Доза | MM-398 (мг/м2) (соль) |
Оксалиплатин (мг/м2) |
5-фторурацил (5FU) (мг/м2) |
| Начальная | 60 | 60 | 2400 |
| Первое снижение | 45 | 45 | 1800 |
| Второе снижение | 30 | 30 | 1350 |
[065] Таблица 1C Примеры сниженных доз MM-398 и оксалиплатина
| Доза | MM-398 (мг/м2) (соль) |
Оксалиплатин (мг/м2) |
5-фторурацил (5FU) (мг/м2) |
| Начальная | 60 | 80 | 2400 |
| Первое снижение | 45 | 60 | 1800 |
| Второе снижение | 30 | 40 | 1350 |
[066] Таблица 1D Примеры сниженных доз MM-398 и оксалиплатина
| Доза | MM-398 (мг/м2) (соль) |
Оксалиплатин (мг/м2) |
5-фторурацил (5FU) (мг/м2) |
| Начальная | 60 | 60 | 2400 |
| Первое снижение | 45 | 45 | 2400 |
| Второе снижение | 30 | 30 | 1800 |
[067] Таблица 1E Примеры сниженных доз MM-398 и оксалиплатина
| Доза | MM-398 (мг/м2) (соль) |
Оксалиплатин (мг/м2) |
5-фторурацил (5FU) (мг/м2) |
| Начальная | 60 | 80 | 2400 |
| Первое снижение | 45 | 60 | 2400 |
| Второе снижение | 30 | 40 | 1800 |
[068] В некоторых вариантах осуществления способы применения комбинированного лечения, описанного в настоящем документе, к пациентам, имеющим одну или несколько характеристик, могут включать уменьшение или иное изменение дозы оксалиплатина, вводимой в соответствии с вариантами осуществления, приведенными в настоящем документе. В некоторых вариантах доза оксалиплатина снижается на 20-30%. В некоторых вариантах осуществления доза оксалиплатина снижается на 20%. В некоторых вариантах осуществления доза оксалиплатина снижается на 25%. В некоторых вариантах осуществления доза оксалиплатина снижается на 30%. В некоторых вариантах осуществления сниженная доза оксалиплатина находится в диапазоне от 30 мг/м2 до 75 мг/м2. В некоторых вариантах осуществления доза оксалиплатина снижается до 75 мг/м2. В некоторых вариантах осуществления доза оксалиплатина снижается до 65 мг/м2. В некоторых вариантах осуществления доза оксалиплатина снижается до 60 мг/м2. В некоторых вариантах осуществления доза оксалиплатина снижается до 45 мг/м2. В некоторых вариантах осуществления доза оксалиплатина снижается до 45 мг/м2. В некоторых вариантах осуществления доза оксалиплатина снижается до 34 мг/м2.
[069] В некоторых вариантах осуществления способы применения комбинированного лечения, описанного в настоящем документе, к пациентам, имеющим одну или несколько характеристик, могут включать снижение или иное изменение дозы 5-фторурацила, вводимой в соответствии с вариантами осуществления, приведенными в настоящем документе. В некоторых вариантах осуществления доза 5-фторурацила снижается на 20-30%. В некоторых вариантах осуществления доза 5-фторурацила снижается на 20%. В некоторых вариантах осуществления доза 5-фторурацила снижается на 25%. В некоторых вариантах осуществления доза 5-фторурацила снижается на 30%. В некоторых вариантах осуществления сниженная доза 5-фторурацила находится в диапазоне от 1000 мг/м2 до 1800 мг/м2. В некоторых вариантах осуществления доза 5-фторурацила снижается до 1800 мг/м2. В некоторых вариантах осуществления доза 5-фторурацила снижается до 1350 мг/м2. В некоторых вариантах осуществления доза 5-фторурацила снижается до 1400 мг/м2. В некоторых вариантах осуществления доза 5-фторурацила снижается до 1200 мг/м2.
[070] В некоторых вариантах осуществления способы применения комбинированного лечения, описанного в настоящем документе, к пациентам, имеющим одну или несколько характеристик, могут включать дополнительное снижение или иное изменение дозы MM-398, оксалиплатина и/или 5-фторурацила, вводимых в соответствии с вариантами осуществления, приведенными в настоящем документе.
[071] В некоторых вариантах осуществления способы применения комбинированного лечения, описанного в настоящем документе, к пациентам, имеющим одну или несколько характеристик, могут включать снижение или иное изменение дозы более чем одного из MM-398, оксалиплатина и 5-фторурацила, вводимых в соответствии с вариантами осуществления, приведенными в настоящем документе.
[072] Дополнительные модификации дозы для MM-398, оксалиплатина и/или 5-фторурацила могут быть найдены в соответствующих вкладышах в упаковку, которые включены в настоящий документ посредством ссылки.
[073] В одном варианте осуществления способ применения комбинированного лечения включает 30, 40, 50 или 55 мг/м2 липосомального иринотекана, 30, 36, 42, 45, 53, 60, 64, 70 или 85 мг/м2 оксалиплатина, 200 мг/м2 (l)-формы лейковорина или 400 мг/м2 рацемической (1+d)-формы лейковорина и 1200, 1350, 1800 или 2400 мг/м2 5-фторурацила для лечения рак ЖКТ у пациента-человека.
[074] Таким образом, в некоторых вариантах осуществления способ применения комбинированного лечения для лечения рака ЖКТ у пациента-человека включает введение следующей дозы липосомального иринотекана, оксалиплатина и лейковорина, как показано в таблице 1F ниже. Лейковорин обычно вводят в дозе 200 мг/м2 (1)-формы лейковорина или 400 мг/м2 рацемической (1+d)-формы, но доза может варьироваться врачом пациента. Любой из вариантов осуществления в таблице может быть введен с 200 мг/м2 (1)-формы лейковорина или 400 мг/м2 рацемической (1+d)-формы или другой предписанной врачом дозой.
[075] Таблица 1F Варианты осуществления настоящего изобретения
| Доза тригидрата гидрохлорида иринотекана мг/м2 (соль) | Доза оксалиплатина мг/м2 | 5-фторурацил мг/м2 | Лейковорин |
| 30 | 30 | 1,200 | Да |
| 30 | 30 | 1,350 | Да |
| 30 | 30 | 1,400 | Да |
| 30 | 30 | 1,800 | Да |
| 30 | 30 | 2,400 | Да |
| 30 | 36 | 1,200 | Да |
| 30 | 36 | 1,350 | Да |
| 30 | 36 | 1,400 | Да |
| 30 | 36 | 1,800 | Да |
| 30 | 36 | 2,400 | Да |
| 30 | 42 | 1,200 | Да |
| 30 | 42 | 1,350 | Да |
| 30 | 42 | 1,400 | Да |
| 30 | 42 | 1,800 | Да |
| 30 | 42 | 2,400 | Да |
| 30 | 45 | 1,200 | Да |
| 30 | 45 | 1,350 | Да |
| 30 | 45 | 1,400 | Да |
| 30 | 45 | 1,800 | Да |
| 30 | 45 | 2,400 | Да |
| 30 | 53 | 1,200 | Да |
| 30 | 53 | 1,350 | Да |
| 30 | 53 | 1,400 | Да |
| 30 | 53 | 1,800 | Да |
| 30 | 53 | 2,400 | Да |
| 30 | 60 | 1,200 | Да |
| 30 | 60 | 1,350 | Да |
| 30 | 60 | 1,400 | Да |
| 30 | 60 | 1,800 | Да |
| 30 | 60 | 2,400 | Да |
| 30 | 64 | 1,200 | Да |
| 30 | 64 | 1,350 | Да |
| 30 | 64 | 1,400 | Да |
| 30 | 64 | 1,800 | Да |
| 30 | 64 | 2,400 | Да |
| 30 | 70 | 1,200 | Да |
| 30 | 70 | 1,350 | Да |
| 30 | 70 | 1,400 | Да |
| 30 | 70 | 1,800 | Да |
| 30 | 70 | 2,400 | Да |
| 30 | 85 | 1,200 | Да |
| 30 | 85 | 1,350 | Да |
| 30 | 85 | 1,400 | Да |
| 30 | 85 | 1,800 | Да |
| 30 | 85 | 2,400 | Да |
| 33 | 30 | 1,200 | Да |
| 33 | 30 | 1,350 | Да |
| 33 | 30 | 1,400 | Да |
| 33 | 30 | 1,800 | Да |
| 33 | 30 | 2,400 | Да |
| 33 | 36 | 1,200 | Да |
| 33 | 36 | 1,350 | Да |
| 33 | 36 | 1,400 | Да |
| 33 | 36 | 1,800 | Да |
| 33 | 36 | 2,400 | Да |
| 33 | 42 | 1,200 | Да |
| 33 | 42 | 1,350 | Да |
| 33 | 42 | 1,400 | Да |
| 33 | 42 | 1,800 | Да |
| 33 | 42 | 2,400 | Да |
| 33 | 45 | 1,200 | Да |
| 33 | 45 | 1,350 | Да |
| 33 | 45 | 1,400 | Да |
| 33 | 45 | 1,800 | Да |
| 33 | 45 | 2,400 | Да |
| 33 | 53 | 1,200 | Да |
| 33 | 53 | 1,350 | Да |
| 33 | 53 | 1,400 | Да |
| 33 | 53 | 1,800 | Да |
| 33 | 53 | 2,400 | Да |
| 33 | 60 | 1,200 | Да |
| 33 | 60 | 1,350 | Да |
| 33 | 60 | 1,400 | Да |
| 33 | 60 | 1,800 | Да |
| 33 | 60 | 2,400 | Да |
| 33 | 64 | 1,200 | Да |
| 33 | 64 | 1,350 | Да |
| 33 | 64 | 1,400 | Да |
| 33 | 64 | 1,800 | Да |
| 33 | 64 | 2,400 | Да |
| 33 | 70 | 1,200 | Да |
| 33 | 70 | 1,350 | Да |
| 33 | 70 | 1,400 | Да |
| 33 | 70 | 1,800 | Да |
| 33 | 70 | 2,400 | Да |
| 33 | 85 | 1,200 | Да |
| 33 | 85 | 1,350 | Да |
| 33 | 85 | 1,400 | Да |
| 33 | 85 | 1,800 | Да |
| 33 | 85 | 2,400 | Да |
| 36 | 30 | 1,200 | Да |
| 36 | 30 | 1,350 | Да |
| 36 | 30 | 1,400 | Да |
| 36 | 30 | 1,800 | Да |
| 36 | 30 | 2,400 | Да |
| 36 | 36 | 1,200 | Да |
| 36 | 36 | 1,350 | Да |
| 36 | 36 | 1,400 | Да |
| 36 | 36 | 1,800 | Да |
| 36 | 36 | 2,400 | Да |
| 36 | 42 | 1,200 | Да |
| 36 | 42 | 1,350 | Да |
| 36 | 42 | 1,400 | Да |
| 36 | 42 | 1,800 | Да |
| 36 | 42 | 2,400 | Да |
| 36 | 45 | 1,200 | Да |
| 36 | 45 | 1,350 | Да |
| 36 | 45 | 1,400 | Да |
| 36 | 45 | 1,800 | Да |
| 36 | 45 | 2,400 | Да |
| 36 | 53 | 1,200 | Да |
| 36 | 53 | 1,350 | Да |
| 36 | 53 | 1,400 | Да |
| 36 | 53 | 1,800 | Да |
| 36 | 53 | 2,400 | Да |
| 36 | 60 | 1,200 | Да |
| 36 | 60 | 1,350 | Да |
| 36 | 60 | 1,400 | Да |
| 36 | 60 | 1,800 | Да |
| 36 | 60 | 2,400 | Да |
| 36 | 64 | 1,200 | Да |
| 36 | 64 | 1,350 | Да |
| 36 | 64 | 1,400 | Да |
| 36 | 64 | 1,800 | Да |
| 36 | 64 | 2,400 | Да |
| 36 | 70 | 1,200 | Да |
| 36 | 70 | 1,350 | Да |
| 36 | 70 | 1,400 | Да |
| 36 | 70 | 1,800 | Да |
| 36 | 70 | 2,400 | Да |
| 36 | 85 | 1,200 | Да |
| 36 | 85 | 1,350 | Да |
| 36 | 85 | 1,400 | Да |
| 36 | 85 | 1,800 | Да |
| 36 | 85 | 2,400 | Да |
| 40 | 30 | 1,200 | Да |
| 40 | 30 | 1,350 | Да |
| 40 | 30 | 1,400 | Да |
| 40 | 30 | 1,800 | Да |
| 40 | 30 | 2,400 | Да |
| 40 | 36 | 1,200 | Да |
| 40 | 36 | 1,350 | Да |
| 40 | 36 | 1,400 | Да |
| 40 | 36 | 1,800 | Да |
| 40 | 36 | 2,400 | Да |
| 40 | 42 | 1,200 | Да |
| 40 | 42 | 1,350 | Да |
| 40 | 42 | 1,400 | Да |
| 40 | 42 | 1,800 | Да |
| 40 | 42 | 2,400 | Да |
| 40 | 45 | 1,200 | Да |
| 40 | 45 | 1,350 | Да |
| 40 | 45 | 1,400 | Да |
| 40 | 45 | 1,800 | Да |
| 40 | 45 | 2,400 | Да |
| 40 | 53 | 1,200 | Да |
| 40 | 53 | 1,350 | Да |
| 40 | 53 | 1,400 | Да |
| 40 | 53 | 1,800 | Да |
| 40 | 53 | 2,400 | Да |
| 40 | 60 | 1,200 | Да |
| 40 | 60 | 1,350 | Да |
| 40 | 60 | 1,400 | Да |
| 40 | 60 | 1,800 | Да |
| 40 | 60 | 2,400 | Да |
| 40 | 64 | 1,200 | Да |
| 40 | 64 | 1,350 | Да |
| 40 | 64 | 1,400 | Да |
| 40 | 64 | 1,800 | Да |
| 40 | 64 | 2,400 | Да |
| 40 | 70 | 1,200 | Да |
| 40 | 70 | 1,350 | Да |
| 40 | 70 | 1,400 | Да |
| 40 | 70 | 1,800 | Да |
| 40 | 70 | 2,400 | Да |
| 40 | 85 | 1,200 | Да |
| 40 | 85 | 1,350 | Да |
| 40 | 85 | 1,400 | Да |
| 40 | 85 | 1,800 | Да |
| 40 | 85 | 2,400 | Да |
| 45 | 30 | 1,200 | Да |
| 45 | 30 | 1,350 | Да |
| 45 | 30 | 1,400 | Да |
| 45 | 30 | 1,800 | Да |
| 45 | 30 | 2,400 | Да |
| 45 | 36 | 1,200 | Да |
| 45 | 36 | 1,350 | Да |
| 45 | 36 | 1,400 | Да |
| 45 | 36 | 1,800 | Да |
| 45 | 36 | 2,400 | Да |
| 45 | 42 | 1,200 | Да |
| 45 | 42 | 1,350 | Да |
| 45 | 42 | 1,400 | Да |
| 45 | 42 | 1,800 | Да |
| 45 | 42 | 2,400 | Да |
| 45 | 45 | 1,200 | Да |
| 45 | 45 | 1,350 | Да |
| 45 | 45 | 1,400 | Да |
| 45 | 45 | 1,800 | Да |
| 45 | 45 | 2,400 | Да |
| 45 | 53 | 1,200 | Да |
| 45 | 53 | 1,350 | Да |
| 45 | 53 | 1,400 | Да |
| 45 | 53 | 1,800 | Да |
| 45 | 53 | 2,400 | Да |
| 45 | 60 | 1,200 | Да |
| 45 | 60 | 1,350 | Да |
| 45 | 60 | 1,400 | Да |
| 45 | 60 | 1,800 | Да |
| 45 | 60 | 2,400 | Да |
| 45 | 64 | 1,200 | Да |
| 45 | 64 | 1,350 | Да |
| 45 | 64 | 1,400 | Да |
| 45 | 64 | 1,800 | Да |
| 45 | 64 | 2,400 | Да |
| 45 | 70 | 1,200 | Да |
| 45 | 70 | 1,350 | Да |
| 45 | 70 | 1,400 | Да |
| 45 | 70 | 1,800 | Да |
| 45 | 70 | 2,400 | Да |
| 45 | 85 | 1,200 | Да |
| 45 | 85 | 1,350 | Да |
| 45 | 85 | 1,400 | Да |
| 45 | 85 | 1,800 | Да |
| 45 | 85 | 2,400 | Да |
| 49 | 30 | 1,200 | Да |
| 49 | 30 | 1,350 | Да |
| 49 | 30 | 1,400 | Да |
| 49 | 30 | 1,800 | Да |
| 49 | 30 | 2,400 | Да |
| 49 | 36 | 1,200 | Да |
| 49 | 36 | 1,350 | Да |
| 49 | 36 | 1,400 | Да |
| 49 | 36 | 1,800 | Да |
| 49 | 36 | 2,400 | Да |
| 49 | 42 | 1,200 | Да |
| 49 | 42 | 1,350 | Да |
| 49 | 42 | 1,400 | Да |
| 49 | 42 | 1,800 | Да |
| 49 | 42 | 2,400 | Да |
| 49 | 45 | 1,200 | Да |
| 49 | 45 | 1,350 | Да |
| 49 | 45 | 1,400 | Да |
| 49 | 45 | 1,800 | Да |
| 49 | 45 | 2,400 | Да |
| 49 | 53 | 1,200 | Да |
| 49 | 53 | 1,350 | Да |
| 49 | 53 | 1,400 | Да |
| 49 | 53 | 1,800 | Да |
| 49 | 53 | 2,400 | Да |
| 49 | 60 | 1,200 | Да |
| 49 | 60 | 1,350 | Да |
| 49 | 60 | 1,400 | Да |
| 49 | 60 | 1,800 | Да |
| 49 | 60 | 2,400 | Да |
| 49 | 64 | 1,200 | Да |
| 49 | 64 | 1,350 | Да |
| 49 | 64 | 1,400 | Да |
| 49 | 64 | 1,800 | Да |
| 49 | 64 | 2,400 | Да |
| 49 | 70 | 1,200 | Да |
| 49 | 70 | 1,350 | Да |
| 49 | 70 | 1,400 | Да |
| 49 | 70 | 1,800 | Да |
| 49 | 70 | 2,400 | Да |
| 49 | 85 | 1,200 | Да |
| 49 | 85 | 1,350 | Да |
| 49 | 85 | 1,400 | Да |
| 49 | 85 | 1,800 | Да |
| 49 | 85 | 2,400 | Да |
| 50 | 30 | 1,200 | Да |
| 50 | 30 | 1,350 | Да |
| 50 | 30 | 1,400 | Да |
| 50 | 30 | 1,800 | Да |
| 50 | 30 | 2,400 | Да |
| 50 | 36 | 1,200 | Да |
| 50 | 36 | 1,350 | Да |
| 50 | 36 | 1,400 | Да |
| 50 | 36 | 1,800 | Да |
| 50 | 36 | 2,400 | Да |
| 50 | 42 | 1,200 | Да |
| 50 | 42 | 1,350 | Да |
| 50 | 42 | 1,400 | Да |
| 50 | 42 | 1,800 | Да |
| 50 | 42 | 2,400 | Да |
| 50 | 45 | 1,200 | Да |
| 50 | 45 | 1,350 | Да |
| 50 | 45 | 1,400 | Да |
| 50 | 45 | 1,800 | Да |
| 50 | 45 | 2,400 | Да |
| 50 | 53 | 1,200 | Да |
| 50 | 53 | 1,350 | Да |
| 50 | 53 | 1,400 | Да |
| 50 | 53 | 1,800 | Да |
| 50 | 53 | 2,400 | Да |
| 50 | 60 | 1,200 | Да |
| 50 | 60 | 1,350 | Да |
| 50 | 60 | 1,400 | Да |
| 50 | 60 | 1,800 | Да |
| 50 | 60 | 2,400 | Да |
| 50 | 64 | 1,200 | Да |
| 50 | 64 | 1,350 | Да |
| 50 | 64 | 1,400 | Да |
| 50 | 64 | 1,800 | Да |
| 50 | 64 | 2,400 | Да |
| 50 | 70 | 1,200 | Да |
| 50 | 70 | 1,350 | Да |
| 50 | 70 | 1,400 | Да |
| 50 | 70 | 1,800 | Да |
| 50 | 70 | 2,400 | Да |
| 50 | 85 | 1,200 | Да |
| 50 | 85 | 1,350 | Да |
| 50 | 85 | 1,400 | Да |
| 50 | 85 | 1,800 | Да |
| 50 | 85 | 2,400 | Да |
| 60 | 30 | 1,200 | Да |
| 60 | 30 | 1,350 | Да |
| 60 | 30 | 1,400 | Да |
| 60 | 30 | 1,800 | Да |
| 60 | 30 | 2,400 | Да |
| 60 | 36 | 1,200 | Да |
| 60 | 36 | 1,350 | Да |
| 60 | 36 | 1,400 | Да |
| 60 | 36 | 1,800 | Да |
| 60 | 36 | 2,400 | Да |
| 60 | 42 | 1,200 | Да |
| 60 | 42 | 1,350 | Да |
| 60 | 42 | 1,400 | Да |
| 60 | 42 | 1,800 | Да |
| 60 | 42 | 2,400 | Да |
| 60 | 45 | 1,200 | Да |
| 60 | 45 | 1,350 | Да |
| 60 | 45 | 1,400 | Да |
| 60 | 45 | 1,800 | Да |
| 60 | 45 | 2,400 | Да |
| 60 | 53 | 1,200 | Да |
| 60 | 53 | 1,350 | Да |
| 60 | 53 | 1,400 | Да |
| 60 | 53 | 1,800 | Да |
| 60 | 53 | 2,400 | Да |
| 60 | 60 | 1,200 | Да |
| 60 | 60 | 1,350 | Да |
| 60 | 60 | 1,400 | Да |
| 60 | 60 | 1,800 | Да |
| 60 | 60 | 2,400 | Да |
| 60 | 64 | 1,200 | Да |
| 60 | 64 | 1,350 | Да |
| 60 | 64 | 1,400 | Да |
| 60 | 64 | 1,800 | Да |
| 60 | 64 | 2,400 | Да |
| 60 | 70 | 1,200 | Да |
| 60 | 70 | 1,350 | Да |
| 60 | 70 | 1,400 | Да |
| 60 | 70 | 1,800 | Да |
| 60 | 70 | 2,400 | Да |
| 60 | 85 | 1,200 | Да |
| 60 | 85 | 1,350 | Да |
| 60 | 85 | 1,400 | Да |
| 60 | 85 | 1,800 | Да |
| 60 | 85 | 2,400 | Да |
| 65 | 30 | 1,200 | Да |
| 65 | 30 | 1,350 | Да |
| 65 | 30 | 1,400 | Да |
| 65 | 30 | 1,800 | Да |
| 65 | 30 | 2,400 | Да |
| 65 | 36 | 1,200 | Да |
| 65 | 36 | 1,350 | Да |
| 65 | 36 | 1,400 | Да |
| 65 | 36 | 1,800 | Да |
| 65 | 36 | 2,400 | Да |
| 65 | 42 | 1,200 | Да |
| 65 | 42 | 1,350 | Да |
| 65 | 42 | 1,400 | Да |
| 65 | 42 | 1,800 | Да |
| 65 | 42 | 2,400 | Да |
| 65 | 45 | 1,200 | Да |
| 65 | 45 | 1,350 | Да |
| 65 | 45 | 1,400 | Да |
| 65 | 45 | 1,800 | Да |
| 65 | 45 | 2,400 | Да |
| 65 | 53 | 1,200 | Да |
| 65 | 53 | 1,350 | Да |
| 65 | 53 | 1,400 | Да |
| 65 | 53 | 1,800 | Да |
| 65 | 53 | 2,400 | Да |
| 65 | 60 | 1,200 | Да |
| 65 | 60 | 1,350 | Да |
| 65 | 60 | 1,400 | Да |
| 65 | 60 | 1,800 | Да |
| 65 | 60 | 2,400 | Да |
| 65 | 64 | 1,200 | Да |
| 65 | 64 | 1,350 | Да |
| 65 | 64 | 1,400 | Да |
| 65 | 64 | 1,800 | Да |
| 65 | 64 | 2,400 | Да |
| 65 | 70 | 1,200 | Да |
| 65 | 70 | 1,350 | Да |
| 65 | 70 | 1,400 | Да |
| 65 | 70 | 1,800 | Да |
| 65 | 70 | 2,400 | Да |
| 65 | 85 | 1,200 | Да |
| 65 | 85 | 1,350 | Да |
| 65 | 85 | 1,400 | Да |
| 65 | 85 | 1,800 | Да |
| 65 | 85 | 2,400 | Да |
[076] Липосомальный иринотекан предпочтительно вводят внутривенно в комбинации с оксалиплатином, 5-фторурацилом (5-FU) и лейковорином. В одном варианте осуществления липосомальный иринотекан вводят до введения оксалиплатина, 5-FU и лейковорина. В другом варианте осуществления лейковорин вводят до введения 5-FU. В другом варианте осуществления липосомальный иринотекан MM-398 вводят с последующим введением оксалиплатина, с последующим введением лейковорина и последующим введением 5-фторурацила. В определенных вариантах осуществления липосомальный иринотекан вводят пациенту внутривенно в течение 90 минут. В другом варианте осуществления оксалиплатин вводят пациенту внутривенно в течение 120 минут. В другом варианте осуществления 5-FU вводят внутривенно в течение 46 часов. В одном варианте осуществления оксалиплатин вводят приблизительно через 6-72 часа после введения липосомального иринотекана. В другом варианте осуществления оксалиплатин вводят, например, через 6 часов, 12 часов, 24 часа, 36 часов, 48 часов, 60 часов или 72 часа после введения липосомального иринотекана. В другом варианте осуществления лейковорин вводят внутривенно в течение 30 минут. В различных вариантах осуществления липосомальный иринотекан представляет собой MM-398. В различных вариантах осуществления пациенту с раком ЖКТ предварительно вводят дексаметазон и антагонист 5-HT3 или другое противорвотное средство перед введением липосомального иринотекана MM-398 и других активных агентов.
[077] Дополнительные варианты осуществления изобретения
[078] Следующие способы и варианты осуществления могут рассматриваться отдельно, в комбинации с другими вариантами осуществления в этом разделе или в комбинации со способами, раскрытыми выше. Изобретение предоставляет способы лечения рака ЖКТ у пациента-человека, такого как у пациента, ранее не получавшего предшествующий химиотерапевтический агент в терапии метастатических форм рака, причем способ включает введение пациенту липосомального иринотекана, также именуемого как MM-398 (например, инъекции липосом с октасульфатной солью иринотекана-сахарозы), в комбинации с оксалиплатином, лейковорином и 5-FU.
[079] 1. Способ лечения рака ЖКТ у человека, который ранее не получал химиотерапию для лечения рака ЖКТ, причем способ включает: введение субъекту терапевтически эффективного количества липосомального иринотекана MM-398 в комбинации с оксалиплатином, лейковорином и 5-FU для лечения рака ЖКТ у человека.
[080] 2. Способ по варианту осуществления 1, в котором количество вводимого липосомального иринотекана MM-398 составляет 50 мг/м2 (свободное основание) или 55 мг/м2 (свободное основание).
[081] 3. Способ лечения рака ЖКТ у человека, который ранее не получал химиотерапию для лечения рака ЖКТ, причем способ включает: введение субъекту 60 мг/м2 (соль) или 65 мг/м2 (соль) липосомального иринотекана MM-398 в комбинации с оксалиплатином, лейковорином и 5-FU для лечения рака ЖКТ у человека.
[082] 4. Способ по любому из вариантов осуществления 1-3, в котором количество вводимого оксалиплатина составляет от приблизительно 50 мг/м2 до приблизительно 100 мг/м2, например, от приблизительно 60 мг/м2 до приблизительно 85 мг/м2, например, 60 мг/м2, 70 мг/м2, 75 мг/м2 или 85 мг/м2.
[083] 5. Способ по любому из вариантов осуществления 1-4, в котором лейковорин вводят в дозе 400 мг/м2 рацемической (1+d)-формы или 200 мг/м2 (1)-формы.
[084] 6. Способ по любому из вариантов осуществления 1-5, в котором количество вводимого 5-FU составляет 2400 мг/м2.
[085] 7. Способ по любому из вариантов осуществления 1-6, в котором липосомальный иринотекан MM-398, оксалиплатин, лейковорин и 5-FU вводят по меньшей мере один раз, такой, как где MM-398, оксалиплатин, лейковорин и 5-FU вводят в дни 1 и 15 28-дневного курса.
[086] 8. Способ по любому из вариантов осуществления 1-7, в котором вводят несколько курсов.
[087] 9. Способ по любому из вариантов осуществления 1-8, в котором оксалиплатин вводят пациенту до введения лейковорина, такой, как где лейковорин вводят пациенту до введения 5-FU, необязательно, где липосомальный иринотекан MM-398 вводят пациенту до введения оксалиплатина, лейковорина и 5-FU.
[088] 10. Способ по варианту осуществления 9, в котором MM-398 вводят в течение 90 минут с последующим введением оксалиплатина в течение 120 минут, с последующим введением лейковорина в течение 30 минут с последующим введением 5-FU в течение 46 часов.
[089] В конкретном варианте осуществления пациента-человека с раком желудка, ранее не получавшего предшествующий химиотерапевтический агент в терапии метастатических форм рака, лечат комбинированным режимом согласно настоящему раскрытию, причем способ включает внутривенное введение пациенту, начиная с 1 дня 2-недельного курса, 50 мг/м2 липосомального иринотекана MM-398 в течение 90 минут, затем 60-85 мг/м2 оксалиплатина, затем 200 мг/м2 (l)-формы лейковорина или 400 мг/м2 рацемической (1+d)-формы лейковорина с последующим введением 2400 мг/м2 5-FU, где пациента-человека лечат одним или несколькими курсами. В другом конкретном варианте осуществления пациента с раком желудка, ранее не получавшего предшествующий химиотерапевтический агент в терапии метастатических форм рака, лечат комбинированным режимом согласно настоящему раскрытию, причем способ включает внутривенное введение пациенту, начиная с 1 дня 2-недельного курса, 55 мг/м2 липосомального иринотекана MM-398 в течение 90 минут, затем 60-85 мг/м2 оксалиплатина, затем 200 мг/м2 (l)-формы лейковорина или 400 мг/м2 рацемической (1+d)-формы лейковорина с последующим введением 2400 мг/м2 5-FU, где пациента-человека лечат одним или несколькими курсами. В вариантах осуществления, раскрытых в настоящем документе, эффективное количество липосомального иринотекана MM-398, вводимого пациенту-человеку, может находиться в диапазоне от приблизительно 30 мг/м2 до приблизительно 60 мг/м2, например, от приблизительно 40 мг/м2 до приблизительно 50 мг/м2 или от приблизительно 50 мг/м2 до приблизительно 55 мг/м2. В различных вариантах осуществления количество липосомального иринотекана MM-398, вводимого пациенту-человеку, составляет 50 мг/м2. В различных вариантах осуществления количество липосомального иринотекана MM-398, вводимого пациенту-человеку, составляет 55 мг/м2. В вариантах осуществления, раскрытых в настоящем документе, эффективное количество оксалиплатина, вводимое пациенту-человеку, может находиться в диапазоне от приблизительно 40 мг/м2 до приблизительно 100 мг/м2, например, от приблизительно 60 мг/м2 до приблизительно 85 мг/м2 или, например, от приблизительно 60 мг/м2 до приблизительно 70 мг/м2. В различных вариантах осуществления количество оксалиплатина, вводимое пациенту-человеку, составляет 60 мг/м2, 70 мг/м2 или 85 мг/м2. В одном варианте этого варианта осуществления оксалиплатин вводят в течение 120 минут, лейковорин вводят в течение 30 минут, и 5-FU вводят в течение 46 часов.
[090] Примеры
[091] Пример 1. Оценка переносимости in vivo и эффективности nal-IRI на моделях опухолей желудка.
[092] Противоопухолевую активность MM-398 оценивали на моделях опухолей желудка MKN-45 и KATO III. Мышей, несущих ксенотрансплантаты опухолей, лечили физиологическим раствором, 25 мг/кг свободного иринотекана, 5 мг/кг MM-398, 10 мг/кг MM-398 или 20 мг/кг MM-398, вводимым еженедельно в течение 4 недель (фигуры 1A и 1B). Все дозы хорошо переносились. nal-IRI проявляет противоопухолевую активность с регрессией опухоли в дозе 10 и 20 мг/кг.
[093] Пример 2. Оценка переносимости in vivo и эффективности комбинированных видов терапии на животной модели.
[094] Оценивали противоопухолевую активность MM-398 по сравнению со свободным иринотеканом в контексте комбинированной триплетной терапии с 5-FU и оксалиплатином. Мышей, несущих ксенотрансплантаты опухоли MKN-45, лечили физиологическим раствором, 100 мг/кг 5-FU+5 мг/кг оксалиплатина, 25 мг/кг свободного иринотекана, 5 мг/кг MM-398, триплетом из свободного иринотекана+5-FU+оксалиплатина или MM-398+5-FU+оксалиплатина, вводимым еженедельно в течение 3 недель. Во всех группах выполняли одно и то же исследование, и их все разделяют на две рабочие группы с целью визуализации. 5-FU вводили внутрибрюшинно, тогда как все остальные агенты вводили внутривенно; дни дозирования обозначены горизонтальными пунктирными линиями; n=X на группу мышей (фигуры 2A и 2B).
[095] Пример 3: Переносимость противоопухолевых видов терапии в клинических испытаниях на людях
[096] Переносимость противоопухолевых видов терапии, сочетающих липосомальный иринотекан, 5-FU/лейковорин и оксалиплатин, оценивали в клиническом испытании на людях с использованием двух разных доз: 80 мг/м2 (соль) липосомального иринотекана (MM-398) и 60 мг/м2 (соль) липосомального иринотекана (MM-398). В таблице 2 приведены четыре схемы дозирования для лечения ранее нелеченого (первой линии) рака поджелудочной железы у людей в течение 28-дневного курса лечения.
[097] Таблица 2 Таблица доз (MM-398+5-FU/LV+оксалиплатин)
| Уровень | Оксалиплатин | 5-FU/LV | MM-398 (nal-IRI) | |||
| Доза (мг/м2)a | День введения дозыc | Доза (мг/м2)b | День введения дозыc | Доза (мг/м2) (соль) | День введения дозыc | |
| 1 | 60 | 1, 15 | 2400/400 | 1, 15 | 80 | 1, 15 |
| 2 | 85 | 1, 15 | 2400/400 | 1, 15 | 60 | 1, 15 |
| -2A | 75 | 1, 15 | 2400/400 | 1, 15 | 60 | 1, 15 |
| 3 | 70 | 1, 15 | 2400/400 | 1, 15 | 65 | 1, 15 |
aвведение первой дозы в соответствии с первой дозой nal-IRI; оксалиплатин следует вводить через 2 часа после завершения инфузии nal-IRI.
b46-часовая инфузия, никакой болюс не дают; лейковорин и 5-FU будут вводиться последними после завершения инфузии оксалиплатина.
cУказанный день является частью 28-дневного курса.
Примечание: доза nal-IRI и 5-FU/LV в приведенном выше уровне дозы 1 и 2 соответствует той же дозе и схеме, которые ранее использовали в фазе 3 исследования NAPOLI-1.
[098] Первоначально комбинацию оксалиплатина, липосомального иринотекана MM-398, лейковорина и 5-фторурацила оценивали на уровне дозы 1 в таблице 2 выше. Результаты суммированы в таблице 3 для уровня дозы 1 в таблице 2 выше (для дозы MM-398 80 мг/м2 (соль)), демонстрируя, что доза липосомального иринотекана (MM-398) 80 мг/м2 (соль) в комбинации с оксалиплатином и 5-фторурацилом/лейковорином на уровне дозы 1 не являлась переносимой у людей.
[099] Таблица 3: Противоопухолевая терапия с использованием 80 мг/м2 липосомального иринотекана (соль) в комбинации с оксалиплатином/5FU/лейковорином в клинических испытаниях на людях
| Пациент | Курс 1 День 1 |
Курс 1 День 15 |
Курс 2 День 1 |
Курс 2 День 15 |
Курс 3 День 1 |
Курс 3 День 15 |
Курс 4 День 1 |
Курс 4 День 15 |
| 1 | X | X | X | X | X | X | ||
| 2 | R* | R2* | R2* | X | X | X | X | |
| 3 | X | X | X | X | X | X | X | |
| 4 | X | X | X | X | X | X | ||
| 5 | X | X | X | X | X | X | X | |
| 6 | R1* | R1 | X | R1 | R1 | X | ||
| 7 | X | X | X | X | X | X | X |
*Введение дозы останавливали с целью восстановления от токсичности, связанной с исследуемым лечением.
[100] В таблице 3 сведены результаты лечения в общей сложности семи (7) пациентов с диагнозом рак поджелудочной железы.
[101] "Галочка" (√) в таблице 3 указывает на то, что пациент получал противоопухолевую терапию с уровнем дозы 1 в таблице 2 выше, начиная с указанных дней 3-х последовательных 28-дневных курсов лечения: 80 мг/м2 липосомального иринотекана (MM-398, доза, относящаяся к соответствующему количеству тригидрата гидрохлоридной соли иринотекана), 60 мг/м2 оксалиплатина, 400 мг/м2 (1+d)-лейковорина и 2400 мг/м2 5-фторурацила, как описано в протоколе примера 4.
[102] "R" в таблице 3 указывает на то, что пациент получал сниженную дозу противоопухолевой терапии с уровнем дозы -1 в таблице 2 в соответствующем курсе и в соответствующий день: 60 мг/м2 липосомального иринотекана (MM-398, доза, относящаяся к соответствующему количеству тригидрата гидрохлоридной соли иринотекана), 60 мг/м2 оксалиплатина, 400 мг/м2 (1+d)-лейковорина и 2400 мг/м2 5-фторурацила, как описано в протоколе примера 4.
[103] "R1" в таблице 3 указывает на то, что пациент получал сниженную дозу противоопухолевой терапии с уровнем дозы -1 в таблице 2 (пример 3 выше) в соответствующем курсе и в соответствующий день: 60 мг/м2 липосомального иринотекана (MM-398 доза, относящаяся к соответствующему количеству тригидрата гидрохлоридной соли иринотекана), 60 мг/м2 оксалиплатина, 400 мг/м2 (1+d)-лейковорина и 2400 мг/м2 5-фторурацила, как описано в протоколе примера 3.
[104] "R2" в таблице 3 указывает на то, что пациент получал сниженную дозу противоопухолевой терапии в дозе в соответствующем курсе и в соответствующий день: 50 мг/м2 липосомального иринотекана (MM-398, доза, относящаяся к соответствующему количеству тригидрата гидрохлоридной соли иринотекана), 60 мг/м2 оксалиплатина, 400 мг/м2 (1+d)-лейковорина и 1200 мг/м2 5-фторурацила (снижение на 50% по сравнению с дозой на уровне дозы -1), как описано в протоколе примера 3.
[105] "X" в таблице 3 указывает на то, что пациент не получал противоопухолевую терапию, комбинирующую липосомальный иринотекан, оксалиплатин, 5-фторурацил и лейковорин, или комбинирующую липосомальный иринотекан, оксалиплатин и 5-фторурацил. После 1-го дня 1-го курса и до 15-го дня 1-го курса пациент 2 был определен как гомозиготный по аллелю UGT1A1*28, и последующие сниженные дозы противоопухолевой терапии вводили в дни, указанные в таблице 3, на основании протокола примера 4. Пациенты 1 и 3-7 не были гомозиготными по аллелю UGT1A1*28.
[106] Противоопухолевую терапию с уровнем дозы 1 в таблице 2 (Пример 3) применяли только к 3 из этих 7 пациентов на день 15 (28-дневного) курса 1, ни один из пациентов не получал уровень дозы 1 для более чем 2 последовательных доз, и ни один из пациентов не получал эту терапию после курса 1.
[107] Соответственно, как отмечено в Таблице 3, противоопухолевые виды терапии, сочетающие дозу липосомального иринотекана (80 мг/м2) с 60 мг/м2 оксалиплатина и дозы 2400 и 400 мг/м+2 5-фторурацила и (l+d)-лейковорина, плохо переносились в клинических испытаниях на людях (что приводило к токсичности, ограничивающей дозу). Примеры противоопухолевых видов терапии, сочетающих дозу липосомального иринотекана (80 мг/м2) с 60 мг/м2 оксалиплатина и дозы 2400 и 400 мг/м+2 5-фторурацила и (l+d)-лейковорина, включают виды терапии, приведенные в таблице 2.
[108] В отличие от этого, как отмечено в приведенной ниже таблице 4, противоопухолевые виды терапии, сочетающие дозу 60 мг/м2 липосомального иринотекана (соль) с 60 мг/м2 оксалиплатина и дозы 2400 и 400 мг/м2 5-фторурацила и (l+d)-лейковорина, переносились в клинических испытаниях на людях. В частности, уровень дозы -1 в таблице 4 (доза M-398 60 мг/м2 (соль)) вводили два или более раз подряд множеству пациентов-людей в клиническом испытании, описанном в примере 4. Эти противоопухолевые виды терапии, включающие уменьшенные 60 мг/м2 (соль) липосомального иринотекана (MM-398) в комбинации с оксалиплатином и 5-фторурацилом/лейковорином лучше переносились людьми, чем уровень дозы 1 (фигуры 12-14). В других вариантах осуществления к пациентам применяют терапию с уровнем дозы -2B или -3 в таблице 4.
[109] Таблица 4 Таблица доз оксалиплатина
| Уровень | Оксалиплатин | 5-FU/LV | MM-398 (nal-IRI) | |||
| Доза (мг/м2)a | День введения дозыc | Доза (мг/м2)b | День введения дозыc | Доза (мг/м2) (соль) | День введения дозыc | |
| -1 | 60 | 1, 15 | 2400/400 | 1, 15 | 60 | 1, 15 |
| 1 | 60 | 1, 15 | 2400/400 | 1, 15 | 80 | 1, 15 |
| -2B | 85 | 1, 15 | 2400/400 | 1, 15 | 60 | 1, 15 |
| -3 | 70 | 1, 15 | 2400/400 | 1, 15 | 65 | 1, 15 |
aвведение первой дозы в соответствии с первой дозой MM-398; оксалиплатин следует вводить через 2 часа после завершения nal-IRI.
b46-часовая инфузия, никакой болюс не дают; лейковорин и 5-FU будут вводиться последними после завершения инфузии оксалиплатина.
cУказанный день является частью 28-дневного курса.
[110] Таблица 5: Противоопухолевая терапия с 60 мг/м2 липосомального иринотекана (соль) в комбинации с оксалиплатином/5FU/лейковорином в клинических испытаниях на людях
| Пациент | Курс 1 День 1 |
Курс 1 День 15 |
Курс 2 День 1 |
Курс 2 День 15 |
Курс 3 День 1 |
Курс 3 День 15 |
Курс 4 День 1 |
Курс 4 День 15 |
Дополнительные циклы |
| 1 | X | R3 | R3 | R3 | R3 | X | 4 при R3 | ||
| 2 | X | X | X | X | X | X | X | - | |
| 3 | 11 (исходная доза) с некоторой задержкой дозы | ||||||||
| 4 | 1 (исходная доза); 11 (R4) с некоторой задержкой дозы | ||||||||
| 5 | X | X | X | R5 | R6 | R6 | 2 (R6) | ||
| 6 | 5 (исходная доза) с некоторой задержкой дозы | ||||||||
| 7 | X | X | X | X | - |
*Введение дозы останавливали с целью восстановления от токсичности, связанной с исследуемым лечением.
∧Субъект умирал (в связи с заболеванием).
[111] В таблице 5 сведены результаты лечения семи (7) пациентов с диагнозом рак поджелудочной железы. "Галочка" (√) в таблице 5 указывает, что пациент получал противоопухолевую терапию с уровнем дозы -1 в таблице 4 выше, начиная с указанных дней 3-х последовательных 28-дневных курсов лечения: 60 мг/м2 липосомального иринотекана (MM-398, доза, относящаяся к соответствующему количеству тригидрата гидрохлоридной соли иринотекана), 60 мг/м2 оксалиплатина, 400 мг/м2 (1+d)-лейковорина и 2400 мг/м2 5-фторурацила, как описано в протоколе примера 4.
[112] В отличие от противоопухолевой терапии с уровнем дозы 1 в таблице 2, противоопухолевую терапию с уровнем дозы -1 в таблице 2 (пример 3) применяли повторно к пациентам 3, 4 и 6 по меньшей мере для 3-х последовательных введений (включая 14 последовательных введений для пациента 6).
[113] Противоопухолевую терапию с уровнем дозы -1 в таблице 4 (пример 3) применяли к 6 из 7 пациентов в дни 1 и 15 (28-дневного) курса 1, и в дни 1 и 15 (28-дневного) курса 2, и по меньшей мере к 4 из 7 пациентов в исследовании, без ограничивающей дозу токсичности.
[114] "Галочка" (√) в таблице 5 указывает на то, что пациент получал противоопухолевую терапию с уровнем дозы -1 в таблице 4 выше, начиная с указанных дней 3-х последовательных 28-дневных курсов лечения: 80 мг/м2 липосомального иринотекана (MM-398, доза, относящаяся к соответствующему количеству тригидрата гидрохлоридной соли иринотекана), 60 мг/м2 оксалиплатина, 400 мг/м2 (1+d)-лейковорина и 2400 мг/м2 5-фторурацила, как описано в протоколе примера 4.
[115] "R3" в таблице 5 указывает на то, что пациент получал сниженную дозу противоопухолевой терапии в дозе в соответствующем курсе и в соответствующий день: 50 мг/м2 липосомального иринотекана (MM-398, доза, относящаяся к соответствующему количеству тригидрата гидрохлоридной соли иринотекана), 60 мг/м2 оксалиплатина, 400 мг/м2 (1+d)-лейковорина и 1800 мг/м2 5-фторурацила (снижение на 25% по сравнению с дозой на уровне дозы -1), как описано в протоколе примера 4. Один пациент в таблице 5 получал эту сниженную дозу в ответ на симптомы II степени (негематологические), но без ограничивающей дозу токсичности.
[116] "R4" в таблице 5 указывает на то, что пациент получал сниженную дозу противоопухолевой терапии в дозе в соответствующем курсе и в соответствующий день: 60 мг/м2 липосомального иринотекана (MM-398, доза, относящаяся к соответствующему количеству тригидрата гидрохлоридной соли иринотекана), 45 мг/м2 оксалиплатина, 400 мг/м2 (1+d)-лейковорина и 2400 мг/м2 5-фторурацила (снижение на 50% по сравнению с дозой на уровне дозы -1), как описано в протоколе примера 3.
[117] "R5" в таблице 5 указывает на то, что пациент получал сниженную дозу противоопухолевой терапии в дозе в соответствующем курсе и в соответствующий день: 30 мг/м2 липосомального иринотекана (MM-398, доза, относящаяся к соответствующему количеству тригидрата гидрохлоридной соли иринотекана) (снижение на 50% по сравнению с дозой на уровне дозы -1), 30 мг/м2 оксалиплатина (снижение на 50% по сравнению с дозой на уровне дозы -1), 197 мг/м2 (1+d)-лейковорина и 1200 мг/м2 5-фторурацила (снижение на 50% по сравнению с дозой на уровне дозы -1), как описано в протоколе примера 3.
[118] "R6" в таблице 5 указывает на то, что пациент получал сниженную дозу противоопухолевой терапии в дозе в соответствующем курсе и в соответствующий день: 36 мг/м2 липосомального иринотекана (MM-398, доза, относящаяся к соответствующему количеству тригидрата гидрохлоридной соли иринотекана), 36 мг/м2 оксалиплатина, 240 мг/м2 (1+d)-лейковорина и 1440 мг/м2 5-фторурацила, как описано в протоколе примера 4.
[119] Соответственно, как отмечено в Таблице 5, противоопухолевые виды терапии, сочетающие дозу 60 мг/м2 липосомального иринотекана (соль) с 60 мг/м2 оксалиплатина и дозы 2400 и 400 мг/м2 5-фторурацила и (1+d)-лейковорина, хорошо переносились в клинических испытаниях на людях.
[120] Пример противоопухолевых видов терапии, сочетающих дозу 60 мг/м2 липосомального иринотекана с 85 мг/м2 оксалиплатина и дозы 2400 и 400 мг/м2 5-фторурацила и (l+d)-лейковорина, включает виды терапии, приведенные в таблице 2.
[121] Таблица 6: Противоопухолевая терапия с 60 мг/м2 липосомального иринотекана в комбинации с оксалиплатином/5FU/лейковорином в клинических испытаниях на людях.
| Пациент | Курс 1 День 1 |
Курс 1 День 15 |
Курс 2 День 1 |
Курс 2 День 15 |
Курс 3 День 1 |
Курс 3 День 15 |
Курс 4 День 1 |
Курс 4 День 15 |
Дополнительные циклы (доза) |
| 1 | X | X | X | X | X | X | X | - | |
| 2 | 5 (исходная доза) с некоторой задержкой дозы; 2 дополнительных со сниженным оксалиплатином | ||||||||
| 3 | X | ||||||||
| 4 | X | X | X | X | X | X | X | - | |
| 5 | X | X | X | X | X | X | X | - | |
| 6 | R7* | R7 | X | R7 | R7 | R7 | 3 (исходная доза) с некоторой задержкой дозы | ||
| 7 | X | X | X | X | X | X | X | - | |
| 8 | R7* | R7 | R7 | X | X | X | X | - | |
| 9 | 2 (исходная доза) с некоторой задержкой дозы | ||||||||
| 10 | X | R8 | R8 | X | X | X | X | - |
*Введение дозы останавливали с целью восстановления от токсичности, связанной с исследуемым лечением.
∧Субъект умирал (в связи с заболеванием).
[122] В таблице 5 сведены предварительные клинические результаты лечения десяти (10) пациентов с диагнозом рак поджелудочной железы.
[123] "Галочка" (√) в таблице 6 указывает на то, что пациент получал противоопухолевую терапию с уровнем дозы -2B в таблице 4 выше, начиная с указанных дней 3-х последовательных 28-дневных курсов лечения: 60 мг/м2 липосомального иринотекана (MM-398, доза, относящаяся к соответствующему количеству тригидрата гидрохлоридной соли иринотекана), 85 мг/м2 оксалиплатина, 400 мг/м2 (1+d)-лейковорина и 2400 мг/м2 5-фторурацила, как описано в протоколе примера 3.
[124] "R7" в таблице 6 указывает на то, что пациент получал сниженную дозу противоопухолевой терапии в дозе в соответствующем курсе и в соответствующий день: 50 мг/м2 липосомального иринотекана (MM-398, доза, относящаяся к соответствующему количеству тригидрата гидрохлоридной соли иринотекана), 85 мг/м2 оксалиплатина, 400 мг/м2 (1+d)-лейковорина и 1800 мг/м2 5-фторурацила (снижение на 25% по сравнению с дозой на уровне дозы -2В), как описано в протоколе примера 3.
[125] "R8" в таблице 6 указывает на то, что пациент получал сниженную дозу противоопухолевой терапии в дозе в соответствующем курсе и в соответствующий день: 50 мг/м2 липосомального иринотекана (MM-398, доза, относящаяся к соответствующему количеству тригидрата гидрохлоридной соли иринотекана), 60 мг/м2 оксалиплатина, 400 мг/м2 (1+d)-лейковорина и 1800 мг/м2 5-фторурацила (снижение на 25% по сравнению с дозой на уровне дозы -2В), как описано в протоколе примера 3.
[126] "X" в таблице 6 указывает на то, что пациент не получал противоопухолевую терапию, комбинирующую липосомальный иринотекан, оксалиплатин, 5-фторурацил и лейковорин, или комбинирующую липосомальный иринотекан, оксалиплатин и 5-фторурацил.
[0127] Пример 4: Лечение рака желудка
[0128] Как схематически показано на фигуре 9, настоящее исследование представляет собой фазу 3 открытого сравнительного исследования для оценки безопасности, переносимости и эффективности MM-398 в комбинации с другими противораковыми видами терапии по сравнению с mFOLFOX6 у пациентов с раком желудка, которые не получали предшествующую химиотерапию. В настоящем исследовании оцениваются следующие схемы лечения: (1) MM-398+5-FU/LV+оксалиплатин (группа 1) и (2) 5-FU/LV+оксалиплатин (группа 2).
[0129] Эта фаза 3 исследования оценивает эффективность оксалиплатина+5-FU/LV с MM-398 или без него у пациентов с ранее не леченным раком желудка. Исследование также может предоставить важную информацию о влиянии комбинированного лечения MM-398 на HRQL-пациента и выявить потенциальные биомаркеры ответа.
[0130] В этом исследовании MM-398 вводят вместо обычного иринотекана для улучшения безопасности, переносимости и, в конечном итоге, эффективности схемы FOLFIRINOX. Добавление оксалиплатина в схему NAPOLI-1 включено для увеличения повреждения ДНК и усиления эффективности. Кроме того, благодаря пролонгированным ФК-свойствам MM-398 и длительному воздействию на опухоль, применение MM-398 вместо обычного иринотекана предназначено для дополнительного повышения эффективности FOLFIRINOX.
[0131] Модифицированная триплетная схема комбинации липосомального иринотекана, оксалиплатина, 5-фторурацила (5-FU)/лейковорина предоставлена в настоящем документе, в результате чего никакой болюс 5-FU не будет вводиться. Целевая доза оксалиплатина, 60, 70 или 85 мг/м2, оценивается в комбинированной схеме в группе 1 с непрерывным инфузионным дозированием 5-FU (исключая болюс) и каждые 2 недели c дозой MM-398, которая, как предварительно показано, является переносимой и эффективной в комбинации с 5-FU. Обратите внимание, что при введении дозы MM-398 Cмакс SN-38, как ожидается, будет ниже, чем ожидалось бы при стандартной дозировке со свободным иринотеканом.
[0132] Основываясь на предыдущем опыте с иринотеканом, субъекты, которые являются гомозиготными по аллелю UGT1A1*28 (генотип UGT1A1 7/7), подвергаются повышенному риску нейтропении после начала лечения иринотеканом. Согласно инструкции по медицинскому применению иринотекана, в исследовании 66 пациентов, получавших иринотекан в виде монотерапии (350 мг/м2 один раз в 3 недели), частота возникновения нейтропении 4-й степени у пациентов, гомозиготных по аллелю UGT1A1*28, составила вплоть до 50%, и у пациентов, гетерозиготных по этому аллелю (генотип UGT1A1 6/7), заболеваемость составила 12,5%. Важно отметить, что нейтропения 4-й степени не наблюдалась у пациентов, гомозиготных по аллелю дикого типа (ДТ) (генотип UGT1A1 6/6). В других исследованиях описана более низкая распространенность сопутствующей угрожающей жизни нейтропении (подробности см. в инструкции по медицинскому применению иринотекана). Популяционные ФК-исследования MM-398 не выявили взаимосвязи между гомозиготностью UGT1A1*28 и повышенным воздействием SN-38 (см. брошюру исследователя). В фазе I исследования не было выявлено различий в токсичности у когорт гетерозиготных пациентов или пациентов с ДТ, а в обеих когортах наблюдались ограничивающие дозу токсичности (DLT) в виде диареи с сопутствующей дегидратацией или утомляемостью или без них. По этим причинам, а также потому, что распространенность гомозиготности по UGT1A1*28 является относительно низкой, результаты испытаний не требуются до первой дозы MM-398 в этом исследовании, и начальная доза для всех пациентов будет 60 мг/м2 (соли), что эквивалентно 50 мг/м2 (свободного основания). Однако если известно, что пациенты гомозиготны по UGT1A1*28, доза MM-398 может быть уменьшена, как описано в настоящем документе.
[0133] Пациентов будут разделены по группам случайным образом для лечения (1:1:1) либо MM-398+5-FU/LV+оксалиплатином, либо 5-FU/LV+оксалиплатином. Рандомизация стратифицирована на основе региона (Восточная Азия против остального мира) и показателя общего состояния (ECOG 0 против 1).
[0134] Следующие нежелательные явления являются общими (≥40%) при прошлом лечении оксалиплатином в комбинации с 5-FU/LV и должны ожидаться при комбинированном режиме, содержащем MM-398: периферическая сенсорная невропатия, нейтропения, тромбоцитопения, анемия, тошнота, увеличение уровней трансаминаз и щелочных фосфатаз, диарея, утомляемость, рвота и стоматит. Можно ожидать дополнительных нежелательных явлений, как описано во вкладыше в упаковку для оксалиплатина, включая аллергические и анафилактические реакции. В фазе 3 исследовании комбинации FOLFIRINOX наиболее частыми (>5%) нежелательными явлениями 3-4 степени были: нейтропения, утомляемость, рвота, диарея, тромбоцитопения, сенсорная невропатия, анемия, повышенный уровень аланинаминотрансферазы (ALT), тромбоэмболия и фебрильная нейтропения. Учитывая эти ожидаемые токсичности, группу 1 оценивали на безопасность и переносимость.
[0135] Доза оксалиплатина 70 мг/м2 или 85 мг/м2 является целевой дозой для этого исследования. Исследование подтвердит, совместимы ли эти дозы при использовании MM-398 вместо обычного иринотекана. В случае, если есть какие-либо неожиданные токсичности, пациенты могут лечиться при более низкой дозе оксалиплатина (60 мг/м2).
[0136] Таблица 7 Дозирование (MM-398+5-FU/LV+оксалиплатин) в группе 1
| Оксалиплатин | 5-FU/LV | MM-398 (nal-IRI) | |||
| Доза (мг/м2)a | День введения дозыc | Доза (мг/м2)b | День введения дозыc | Доза (мг/м2) | День введения дозыc |
| 60 | 1, 15 | 2400/400 | 1, 15 | 50 | 1, 15 |
| 85 | 1, 15 | 2400/400 | 1, 15 | 50 | 1, 15 |
| 70 | 1, 15 | 2400/400 | 1, 15 | 55 | 1, 15 |
aвведение первой дозы в соответствии с первой дозой MM-398; оксалиплатин следует вводить через 2 часа после завершения nal-IRI.
b46-часовая инфузия, никакой болюс не дают; лейковорин и 5-FU будут вводиться последними после завершения инфузии оксалиплатина
cУказанный день является частью 28-дневного курса
[0137] Группа 1: MM-398+5-FU/LV+оксалиплатин
[0138] Порядок инфузий, которые следует вводить в клинике, следующий: сначала вводят MM-398, затем оксалиплатин, затем LV, а затем 5-FU.
[0139] Пациенты получают инфузию оксалиплатина через 2 часа после завершения инфузии MM-398. Если инфузионных реакций не наблюдается, пациенты могут получать оксалиплатин непосредственно после завершения инфузии MM-398. Если у пациентов наблюдаются какие-либо инфузионные реакции степени 3 или выше, Независимый комитет по мониторингу данных и безопасности субъектов исследования (DSMB) может решить вернуться к введению оксалиплатина через два часа после завершения инфузии MM-398.
[0140] Группа 2: 5-FU/LV+оксалиплатин
[0141] Пациенты получают инфузию оксалиплатина (85 мг/м2) с последующим введением лейковорина и 5-FU (400 мг/м2 внутривенный болюс+2400 мг/м2 в виде 46-часовой инфузии/400 мг/м2).
[0142] Премедикация
[0143] Все пациенты до инфузии MM-398, инфузии 5-FU/LV и инфузии оксалиплатина должны предварительно получить стандартные дозы дексаметазона и антагониста 5-HT3 или эквивалентных других противорвотных средств в соответствии со стандартной стационарной практикой для введения иринотекана, 5-FU и оксалиплатина, или Краткой характеристикой лекарственного препарата (SmPC) для исследовательских центров, расположенных в Европейском Союзе (ЕС). Атропин может быть назначен профилактически для пациентов, которые испытывали острые холинергические симптомы в предыдущих курсах.
[0144] Дозы и введение MM-398 (Группа 1)
[0145] MM-398 вводят внутривенной (в/в) инфузией в течение 90 минут (±10 минут) каждые две недели. День 1 первого курса является фиксированным днем; последующие дозы следует вводить в первый день каждого курса +/- 2 дня.
[0146] Перед введением подходящую дозу MM-398 необходимо развести в 5% растворе декстрозы для инъекций (D5W) или в физиологическом растворе до конечного объема 500 мл. Следует соблюдать осторожность, чтобы не использовать встроенные фильтры или какие-либо разбавители, кроме D5W или физиологического раствора. MM-398 может быть введен со скоростью до 1 мл/с (30 мг/с).
[0147] Фактическая доза MM-398, подлежащая введению, будет определяться путем расчета площади поверхности тела пациента в начале каждого курса. Разница в +/- 5% в рассчитанной общей дозе будет разрешена для облегчения введения дозы. Поскольку флаконы MM-398 являются одноразовыми флаконами, персонал исследовательского центра не должен хранить какую-либо неиспользованную часть флакона для будущего использования, а также должен выбрасывать неиспользованные части продукта.
[0148] Дозы и введение 5-FU и лейковорина (группы 1 и 2)
[0149] Лейковорин вводят в дозе 400 мг/м2 рацемической (l+d)-формы или 200 мг/м2 (l)-формы в виде внутривенной инфузии в течение 30 минут (±5 минут) в дни 1 и 15 каждого 28-дневного курса.
[0150] 5-FU вводят в дозе 2400 мг/м2 в виде внутривенной инфузии в течение 46 часов (±60 минут) в дни 1 и 15 каждого 28-дневного курса. В группе 2 в дополнение к 46-часовой инфузии вводят в/в болюс 400 мг/м2 5-FU.
[0151] Лейковорин следует восстанавливать в соответствии с инструкциями на вкладыше в упаковку, SmPC или стандартными правилами по восстановлению лейковорина, принятыми в учереждении.
[0152] Лейковорин следует вводить до инфузии 5-FU и может назначаться одновременно с оксалиплатином. Фактическая доза 5-FU и лейковорина для введения определяется путем расчета площади поверхности тела пациента перед каждым курсом. Разница в +/- 5% в рассчитанной общей дозе будет разрешена для облегчения введения дозы.
[0153] Дозы и введение оксалиплатина (группы 1 и 2)
[0154] Оксалиплатин вводят в дозе 70 мг/м2 или 85 мг/м2 в/в в течение 120 минут (±10 минут) в дни 1 и 15 каждого 28-дневного курса (если целевая доза подтверждается в соответствии с методами, описанными в настоящем документе). Если целевая доза не переносится, дозу оксалиплатина можно довести до 60 мг/м2.
[0155] Оксалиплатин следует готовить в соответствии с инструкциями на вкладыше в упаковку, SmPC или в соответствии со стандартными правилами по приготовлению и введению оксалиплатина, принятыми в учереждении.
[0156] Оксалиплатин следует вводить после инфузии MM-398 в группе 1. Фактическую дозу оксалиплатина, подлежащую введению, определяют путем расчета площади поверхности тела пациента перед каждым курсом. Разница в +/- 5% в рассчитанной общей дозе допускается для облегчения введения дозы.
[0157] Ограничивающая дозу токсичность (DLT)
[0158] Для MM-398, вводимого в комбинации с 5-FU/LV и оксалиплатином, следующие нежелательные явления рассматриваются как ограничивающие дозу токсичности (DLT), если они возникают во время первого курса лечения и считаются связанными с исследуемой схемой лечения:
[0159] Нейтропения или тромбоцитопения 4 степени, которая не устраняется в течение 7 дней, несмотря на оптимальную терапию (отказ от исследуемого лекарственного средства и введение препарата сопутствующей терапии, например, введение G-CSF для нейтропении);
[0160] Нейтропения 4 степени, осложненная лихорадкой≥38,5°C (то есть фебрильная нейтропения) и/или нейтропения 3 степени с инфекцией;
[0161] Невозможность начать последующий курс лечения в течение 14 дней от запланированной даты из-за токсичности, связанной с лекарственным средством; и
[0162] Любая негематологическая токсичность 4 степени с конкретным исключением: утомляемости/астении продолжительностью <2 недель, повышения уровня щелочной фосфатазы, тошноты и рвоты продолжительностью≤3 дней (считается ограничением дозы, если они продолжаются >72 часа после лечение с помощью оптимальной противорвотной схемы) и диареей продолжительностью≤3 дней (считается ограничением дозы, если диарея длится >72 часа после лечения с помощью оптимальной антидиарейной схемы).
[0163] Любая токсичность, связанная с прогрессированием заболевания, не будет считаться DLT.
[0164] Период оценки безопасности для целей оценки DLT и решений об увеличении дозы составляет один курс лечения (то есть 28 дней или 14 дней после 2-й дозы исследуемого лечения, если имеется задержка лечения, как описано в настоящем документе). Доза может увеличиться до следующего уровня только после того, как данные безопасности будут оценены при текущем уровне дозы (после того, как последний пациент, включенный в когорту, завершит первый курс лечения), и критерии безопасности и переносимости оптимальной дозы не были превышены. Кроме того, любые связанные с лекарственными средствами токсичности степени 3 или выше, возникающие после курса 1 (если применимо), оцениваются на предмет их потенциальной связи с кумулятивными дозами MM-398 или дозами комбинированной терапии и учитываются при принятии решения об увеличении дозы. ФК-данные могут быть доступны, но не требуются для принятия решений об увеличении дозы.
[0165] Таблица 8
| Критерии включения | Критерии исключения |
| Для включения в исследование пациенты должны иметь/быть: Патологически подтвержденный рак желудка, который ранее не лечился в терапии метастатических форм рака Измеримое или неизмеримое заболевание в соответствии с определением RECIST v1.1 Показатель общего состояния ECOG 0 или 1 Адекватные биологические параметры, о чем свидетельствуют следующие анализы крови: АЧН >1,500 клеток/мкл без использования гематопоэтических факторов роста, Количество тромбоцитов >100,000 клеток/мкл, и Гемоглобин >9 г/дл Адекватную функцию печени, о чем свидетельствуют: Общий билирубин в сыворотке крови ≤ ВПН (холангиостомия разрешена для обструкции желчных путей), и АсТ и АлТ ≤ 2,5 × ВПН (≤ 5 × ВПН допустимо при наличии метастазов в печени) Адекватную функцию почек, о чем свидетельствует сывороточный креатинин ≤1,5 × ВПН, и рассчитанный клиренс ≥60 мл/мин/1,72 м2 для пациентов с уровнями креатинина в сыворотке выше или ниже установленного нормального значения. Истинную массу тела следует использовать для расчета клиренса креатинина с использованием уравнения Кокрофта-Голта (Клиренс креатинина)=Пол * ((140 - возраст)/(Креатинин в сыворотке)) * (Масса/72); для пациентов с индексом массы тела (ИМТ) >30 кг/м2, вместо нее следует использовать сухую массу тела. Нормальную ЭКГ или ЭКГ без каких-либо клинически значимых отклонений Оправившимися от последствий любой предшествующей операции или лучевой терапии Возраст ≥18 лет Согласие представить неокрашенную заархивированную опухолевую ткань для анализа, если таковая имеется Способность понять и подписать информированное согласие (или иметь законного представителя, который может это сделать) |
Пациенты должны соответствовать всем критериям включения и ни одному из следующих критериев исключения: Предварительное лечение рака желудка в терапии метастатических форм рака с помощью хирургии, лучевой терапии, химиотерапии или экспериментальной терапии Предварительное лечение рака желудка цитотоксическими дозами химиотерапии (пациенты, получавшие предшествующее лечение химиотерапией в качестве радиосенсибилизатора, имеют право, если прошло ≥6 месяцев после завершения терапии) Имеющиеся метастазы в центральную нервную систему Клинически значимое нарушение со стороны желудочно-кишечного тракта, включая печеночные расстройства, кровотечение, воспаление, окклюзию, диарею степени >1, синдром мальабсорбции, язвенный колит, воспалительное заболевание кишечника или частичную кишечную непроходимость Любое второе злокачественное новообразование в анамнезе за последние 3 года; пациенты с раком in situ или базальным или плоскоклеточным раком кожи в предшествующем анамнезе пригодны. Пациенты с другими злокачественными новообразованиями в анамнезе пригодны, если они были непрерывно без признаков заболевания в течение по меньшей мере 3 лет Известна повышенная чувствительность к любому из компонентов MM-398, другим липосомальным продуктам или любым компонентам из 5-FU, лейковорина или оксалиплатина Известна повышенная чувствительность к любому из компонентов наб-паклитаксела или гемцитабина (только часть 2) Сопутствующие заболевания, которые могут быть относительными противопоказаниями к участию в испытаниях, такие как хронические заболевания сердца или печени, в том числе: Тяжелые артериальные тромбоэмболические осложнения (инфаркт миокарда, нестабильная стенокардия, инсульт) менее чем за 6 месяцев до включения Застойная сердечная недостаточность класса III или IV по классификации Нью-Йоркской кардиологической ассоциации (NYHA), желудочковые аритмии или неконтролируемое артериальное давление Известное в прошлом или хроническое инфицирование ВИЧ, гепатитом B или гепатитом C Активная инфекция или необъяснимая лихорадка >38,5°C во время скрининговых визитов или в первый запланированный день приема дозы (по усмотрению исследователя пациенты с опухолевой лихорадкой могут быть включены), которые, по мнению исследователя, могут поставить под угрозу участие пациента в испытаниях или повлиять на результат исследования Использование сильных ингибиторов или индукторов CYP3A4 или наличие любых других противопоказаний для иринотекана Наличие каких-либо противопоказаний для 5-FU, лейковорина или оксалиплатина Использование сильных ингибиторов или индукторов CYP2C8 или наличие любых других противопоказаний для наб-паклитаксела или гемцитабина (только часть 2) Любое другое медицинское или социальное состояние, которое, по мнению исследователя, может повлиять на способность пациента подписать информированное согласие, сотрудничать и участвовать в исследовании или препятствовать интерпретации результатов. Беременность или кормление грудью; женщины, способные к деторождению, должны иметь отрицательный результат теста на беременность во время включения в исследование на основе анализа мочи или сыворотки крови. Пациенты, как мужского пола, так и женского пола, способные к деторождению, должны согласиться использовать высокоэффективный метод контроля над рождаемостью во время исследования и в течение 3 месяцев после последней дозы исследуемого лекарственного средства. |
[0166] Модификации дозы
[0167] Токсичность каждого курса должна регистрироваться до введения последующего курса и классифицироваться в соответствии с общепринятыми терминологическими критериями для нежелательных явлений Национального института рака (NCI CTCAE) (Версия 4.03). Все снижения дозы для всех групп должны основываться на наихудшей предшествующей токсичности.
[0168] Введение дозы может быть остановлено на срок до 2 недель с момента, когда оно должно было иметь место, в связи с необходимостью создания благоприятных условий для восстановления после токсичности, связанной с исследуемым лечением. Если время, необходимое для восстановления от токсичности, составляет более 2 недель, пациента следует исключить из исследования, если только пациент не получает пользу от исследуемого лечения, и в этом случае продолжение пациентом принятия участия в исследовании должно быть обсуждено между исследователем и спонсором относительно рисков и преимуществ продолжения. Если оксалиплатин плохо переносится пациентами, включенными в группу 1, оксалиплатин может быть отменен, и пациенты могут продолжать получать MM-398+5-FU/LV по усмотрению исследователя.
[0169] Если доза пациента снижается во время исследования из-за токсичности, она должна оставаться сниженной на время исследования; повторное повышение дозы до более ранней дозы не допускается. Любой пациент, у которого имеется 2 снижения дозы и испытывающий нежелательное явление, которое потребовало бы снижения третьей дозы, должен быть исключен из исследования.
[0170] Модификации дозы
[0171] Перед каждым введением дозы пациенты должны иметь: АЧН≥1500/мм3, БКК≥3500/мм3, количество тромбоцитов≥100,000/мм3 и диарею≤1 степени.
[0172] Лечение следует отложить, чтобы обеспечить достаточное время для восстановления до уровней, указанных выше, а после восстановления лечение следует проводить в соответствии с рекомендациями, приведенными в таблицах ниже. Если у пациента была фебрильная нейтропения, АЧН должен был восстановиться до≥1500/мм3, и пациент должен был излечиться от инфекции. При негематологических токсичностях 3 или 4 степени лечение следует отложить до тех пор, пока они не возвратятся к 1 степени или исходному уровню. Рекомендации по корректировке дозы каждого отдельного лечения в рамках схемы приведены в таблицах ниже. В случае, если пациент испытывает инфузионную реакцию, следует следовать либо правилам, принятым в учреждении, либо правилам, предусмотренным для контроля инфузионной реакции.
[0173] Для всех приведенных ниже таблиц пациент должен быть исключен из исследуемого лечения, если требуется более чем 2 снижения дозы или если требуются снижения MM-398 ниже 30 мг/м2. Никаких корректировок дозы при токсичности для лейковорина не требуется. Лейковорин должен быть введен непосредственно перед каждой дозой 5-FU; следовательно, если откладывается введение дозы 5-FU, следует также отложить введение дозы лейковорина.
[0174] Прекращение лечения, которое требуется из-за токсичности MM-398 или 5-FU, приведет к исключению из исследования. Однако для группы 1 токсичность, которая требует отказ только от оксалиплатина (например, невропатия), приведет к возможности продолжить исследуемое лечение только с помощью MM-398+5-FU/LV для всех будущих введений доз.
[0175] Начальная доза ONIVYDE будет либо 50 мг/м2, либо 55 мг/м2, 5FU 2400 мг/м2, LV 400 мг/м2, и оксалиплатина будет 85 мг/м2, 70 мг/м2 или 60 мг/м2. Снижение дозы будет представлять собой снижение на 25% для всех агентов для любой гематотоксичности III-IV степени. Для стойких токсичностей, независимо от первого снижения дозы, будет иметь место дополнительное снижение дозы на 25% для всех агентов. Дополнительная токсичность приведет к исключению из клинического исследования.
[0176] В случае негематологической токсичности снижение дозы будет представлять собой ту же схему снижения дозы, что и для гематотоксичности, за исключением специфической токсичности, связанной с лекарственным средством (то есть вызванная 5-FU акральная эритема и оксалиплатиновая невропатия), которое будет таким, как показано в таблице 3.
[0177] Таблица 9: Модификации дозы для группы 1
| Степень наихудшей токсичности по CTCAE | Nal-IRI (MM-398) | 5-FU | Оксалиплатин |
| Гематологические токсичности | |||
| Гематотоксичность 2 степени | 100% от предыдущей дозы | ||
| Нейтропения (АЧН ≤1000/мм3) или фебрильная нейтропения и/или тромбоцитопения 3 или 4 степениa | 1-е возникновение: Снизить дозу на 25% 2-е возникновение: Снизить дозу еще на 25% (50% от первоначальной дозы) |
||
| Другие гематологические токсичности 3 или 4 степени, не указанные выше | 1-е возникновение: Снизить дозу на 25% 2-е возникновение: Снизить дозу еще на 25% (50% от первоначальной дозы) |
||
| Негематологические токсичности, отличные от астении и анорексии 3 степени | |||
| 1 или 2 степени, включая диарею | 100% от предыдущей дозы | 100% от предыдущей дозы, за исключением акральной эритемы 2 степени, кардиотоксичности 2 степени или нейроцеребральной токсичность любой степени | 100% от предыдущей дозы, за исключением сенсорной невропатии 2 степени |
| 3 или 4 степени, включая диарею (за исключением тошноты и рвоты)d | 1-е возникновение: Снизить дозу на 25% 2-е возникновение: Снизить дозу еще на 25% (50% от первоначальной дозы) |
1-е возникновение: Снизить дозу на 25% 2-е возникновение: Снизить дозу еще на 25% (50% от первоначальной дозы) *за исключением акральной эритемы 3 или 4 степени |
1-е возникновение: Снизить дозу на 25% 2-е возникновение: Снизить дозу еще на 25% (50% от первоначальной дозы) |
| Тошнота и/или рвота 3 или 4 степени, несмотря на противорвотную терапиюd | 1-е возникновение: Снизить дозу на 25% 2-е возникновение: Снизить дозу еще на 25% (50% от первоначальной дозы) |
||
| Акральная эритема 2 степени | 100% от предыдущей дозы | 1-е возникновение: Снизить дозу на 25% 2-е возникновение: Снизить дозу еще на 25% (50% от первоначальной дозы) |
100% от предыдущей дозы |
| Акральная эритема 3 или 4 степени | 100% от предыдущей дозы | Прекратить терапию | 100% от предыдущей дозы |
| Нейроцеребральная токсичность любой степени или кардиотоксичность 2 степени | 100% от предыдущей дозы | Прекратить терапию | 100% от предыдущей дозы |
| Сенсорная невропатия | 100% от предыдущей дозы Никаких изменений дозы не требуется |
100% от предыдущей дозы Никаких изменений дозы не требуется |
2 степени, постоянная: Снизить дозу от 85 мг/м2 до 60 мг/м2 или от 60 мг/м2 до 45 мг/м2 на 25% 3 степени, исчезает до следующего курса: Снизить дозу от 85 мг/м2 до 60 мг/м2 или от 60 мг/м2 до 45 мг/м2 на 25% 3 степени, постоянная: Прекратить терапию 4 степени: Прекратить терапию |
aРассмотреть использование Г-КСФ для пациентов, которые испытывают нейтропению или фебрильную нейтропению≥3 степени.
bАстения и анорексия 3 степени не требуют изменения дозы
cДиарея 1 степени: 2-3 стула/день > предшествующий курс; диарея 2 степени: 4-6 стулов/день > предшествующий курс
dДиарея 3 степени: 7-9 стулов/день > предшествующий курс; 4 класс диареи:> 10 стулов/день > предшествующий курс
[0178] Инфузионные реакции будут контролироваться. Инфузионные реакции будут определены в соответствии с определением аллергических реакциий/инфузионных реакций и анафилаксии Национального института рака CTCAE (Версия 4.0), как определено ниже:
[0179] Таблица 10
| 1 степень: Преходящая гиперемия или сыпь, лекарственная лихорадка <38°C (<100,4°F); вмешательство не показано |
| 2 степень: Показано вмешательство или прерывание инфузии; незамедлительно реагирует на симптоматическое лечение (например, антигистаминные препараты, НПВП, средства для наркоза); профилактические лекарственные средства показаны в течение <24 часов |
| 3 степень: Симптоматический бронхоспазм с уртикарной сыпью или без нее; показано парентеральное вмешательство; связанный с аллергией отек/отек Квинке; гипотония |
| 4 степень: опасные для жизни последствия; показано срочное вмешательство |
[0180] Для контроля инфузионных реакций должны использоваться меры, принятые в центре проведения клинического исследования, или следующие рекомендации по лечению.
[0181] Таблица 11
| 1 степени Замедлить скорость инфузии на 50% Наблюдать за пациентом каждые 15 минут на предмет ухудшения состояния |
| 2 степени Прекратить инфузию Ввести дифенгидрамина гидрохлорид 50 мг в/в, ацетаминофен 650 мг перорально и кислород Возобновить инфузию со скоростью, составляющей 50% от предыдущей скорости, после устранения инфузионной реакции Наблюдать за пациентом каждые 15 минут на предмет ухудшения состояния Для всех последующих инфузий, премедикация с использованием дифенгидрамина гидрохлорида 25-50 мг ВВ |
| 3 степени Прекратить инфузию и отсоединить инфузионную трубку от пациента Ввести дифенгидрамина гидрохлорид 50 мг в/в, дексаметазон 10 мг в/в, бронходилататоры для бронхоспазма и другие лекарственные средства или кислород по мере необходимости Никакое дальнейшее лечение с использованием MM-398 не будет разрешено |
| 4 степени Прекратить инфузию и отсоединить инфузионную трубку от пациента Ввести адреналина, бронходилататоры или кислород, как показано для бронхоспазма Ввести дифенгидрамина гидрохлорид 50 мг в/в, дексаметазон 10 мг ВВ Рассмотреть госпитализацию для наблюдения Никакое дальнейшее лечение с использованием MM-398 не будет разрешено |
[0182] Пациентам, которые испытывают инфузионную реакцию 1 или 2 степени, дальнейшие инфузии могут быть введены с пониженной скоростью (более 120 минут) с осторожностью.
[0183] Пациентам, которые испытывают инфузионную реакцию 1 или 2 степени, вводят дексаметазон 10 мг в/в. Все последующие инфузии должны быть с премедикацией дифенгидрамина гидрохлоридом 50 мг в/в, дексаметазоном 10 мг в/в и ацетаминофеном 650 мг перорально.
[0184] Модификации дозы MM-398 для гематологических токсичностей
[0185] Перед началом нового курса терапии пациенты должны иметь:
[0186] АЧН≥1500/мм3
[0187] Количество тромбоцитов≥100,000/мм3
[0188] Лечение следует отложить, чтобы дать достаточно времени для восстановления, а после восстановления лечение следует проводить в соответствии с рекомендациями, приведенными в таблицах ниже. Если у пациента была фебрильная нейтропения, АЧН должно было восстановиться до≥1500/мм3, и пациент должен был излечиться от инфекции.
[0189] Таблица 12: Модификации дозы MM-398 для числа нейтрофилов
| АЧН: клеток/мм3 (наихудшая степень по CTCAE) | Доза MM-398 для следующего курса | ||
| [001] | Группа A: пациенты, не гомозиготные по UGT1A1*28 | Группа A: пациенты, гомозиготные по UGT1A1*28 Группа C: пациенты, не гомозиготные по UGT1A1*28 |
Группа C: пациенты, гомозиготные по UGT1A1*28 |
| ≥1000 до 1999 (1 или 2 степени) | 100% от предыдущей дозы | 100% от предыдущей дозы | 100% от предыдущей дозы |
| <1000 (3/4 степени) или фебрильная нейтропения |
Снизить дозу на 20 мг/м2 до минимальной дозы 30 мг/м2 | Снизить дозу до 40 мг/м2 для первого возникновения и до 30 мг/м2 для второго возникновения | Снизить дозу до 40 мг/м2 для первого возникновения и до 30 мг/м2 для второго возникновения |
[0190] Таблица 13: Модификации дозы MM-398 при другой гематологической токсичности
| Наихудшая степень токсичности по CTCAE | Доза MM-398 для следующего курса | ||
| [001] | Группа A: пациенты, не гомозиготные по UGT1A1*28 | Группа A: пациенты, гомозиготные по UGT1A1*28 Группа C: пациенты, не гомозиготные по UGT1A1*28 |
Группа C: пациенты, гомозиготные по UGT1A1*28 |
| ≤2 степени | 100% от предыдущей дозы | 100% от предыдущей дозы | 100% от предыдущей дозы |
| 3/4 степени | Снизить дозу на 20 мг/м2 до минимальной дозы 30 мг/м2 | Снизить дозу до 40 мг/м2 для первого возникновения и до 30 мг/м2 для второго возникновения | Снизить дозу до 40 мг/м2 для первого возникновения и до 30 мг/м2 для второго возникновения |
[0191] Модификации дозы MM-398 при негематологических токсичностях
[0192] Лечение следует отложить до тех пор, пока диарея не достигнет≤1 степени, а при других негематологических токсичностях 3 или 4 степени до тех пор, пока они не возвратятся к 1 степени или исходному уровню. Ниже приведены рекомендации по корректировке дозы MM-398 при диарее, связанной с приемом лекарственных средств, и других негематологических токсичностях 3 или 4 степени. Инфузионные реакции следует контролировать, как описано выше.
[0193] Таблица 14: Модификации дозы MM-398 при диарее
| Наихудшая степень токсичности по CTCAE | Доза MM-398 для следующего курсаa | ||
| [001] | Группа A: пациенты, не гомозиготные по UGT1A1*28 | Группа A: пациенты, гомозиготные по UGT1A1*28 Группа C: пациенты, не гомозиготные по UGT1A1*28 |
Группа C: пациенты, гомозиготные по UGT1A1*28 |
| 1 или 2 степени (2-3 стула/день > предшествующий курс или 4-6 стулов/день > предшествующий курс) | 100% от предыдущей дозы | 100% от предыдущей дозы | 100% от предыдущей дозы |
| 3 степени (7-9 стулов/день > предшествующий курс) или 4 степени (>10 стулов/день > предшествующий курс) | Снизить дозу на 20 мг/м2 до минимальной дозы 30 мг/м2 | Снизить дозу до 40 мг/м2 для первого возникновения и до 30 мг/м2 для второго возникновения | Снизить дозу до 40 мг/м2 для первого возникновения и до 30 мг/м2 для второго возникновения |
[0194] Таблица 15: Модификации дозы MM-398 при негематологических токсичностях, отличных от диареи, астении и анорексии 3 степени
| Наихудшая степень токсичности по CTCAE | Доза MM-398 для следующего курса | ||
| [001] | Группа A: пациенты, не гомозиготные по UGT1A1*28 | Группа A: пациенты, гомозиготные по UGT1A1*28 Группа C: пациенты, не гомозиготные по UGT1A1*28 |
Группа C: пациенты, гомозиготные по UGT1A1*28 |
| 1 или 2 степени | 100% от предыдущей дозы | 100% от предыдущей дозы | 100% от предыдущей дозы |
| 3 или 4 степени (за исключением тошноты и рвоты) | Снизить дозу на 20 мг/м2 до минимальной дозы 30 мг/м2 | Снизить дозу до 40 мг/м2 для первого возникновения и до 30 мг/м2 для второго возникновения | Снизить дозу до 40 мг/м2 для первого возникновения и до 30 мг/м2 для второго возникновения |
| Тошнота и/или рвота 3 или 4 степени, несмотря на противорвотную терапию | Оптимизировать противорвотную терапию И снизить дозу на 20 мг/м2 до минимальной дозы 30 мг/м2 | Оптимизировать противорвотную терапию И снизить дозу до 30 мг/м2 | Оптимизировать противорвотную терапию И снизить дозу до 30 мг/м2 |
[0195] Модификации дозы 5-FU и лейковорина:
[0196] Рекомендации по модификации дозы 5-FU приведены ниже. Никаких корректировок дозы при токсичности для лейковорина не требуется. Лейковорин должен быть введен непосредственно перед каждой дозой 5-FU; следовательно, если откладывается введение дозы 5-FU, следует также отложить введение дозы лейковорина. В случае, если пациент испытывает инфузионную реакцию, следует следовать либо правилам, принятым в учреждении, либо правилам, предусмотренным для контроля инфузионной реакции на MM-398.
[0197] Модификация дозы 5-FU при гематологических токсичностях
[0198] Перед следующей дозой в курсе или перед началом нового курса терапии пациенты должны иметь:
[0199] АЧН≥1500/мм3
[0200] БКК≥3500/мм3
[0201] Количество тромбоцитов≥75,000/мм3 (согласно европейской краткой характеристики лекарственного препарата для 5-FU, тромбоциты должны быть восстановлены до≥100,000/мм3 до начала терапии)
[0202] Лечение следует отложить, чтобы обеспечить достаточно времени для восстановления, а после восстановления лечение следует проводить в соответствии с рекомендациями, приведенными в таблице ниже.
[0203] Таблица 16 Модификации дозы 5-FU при гематологических токсичностях (группа B и C)
| АЧН (клеток/мм3) | Тромбоциты (клеток/мм3) |
Доза 5-FU в день 8, день 15, день 22a | Доза 5-FU для следующего курсаa | |
| ≥1000 | и | ≥50,000 | 100% от предыдущей дозы | 100% от предыдущей дозы |
| 500-999 | или | <50,000-25,000 | Отложить введение дозы; когда восстановится, снизить дозу на 25%b | Снизить дозу на 25%b |
| <500 или фебрильная нейтропения | или | <25,000 или тромбоцитопения с кровотечением | Отложить введение дозы; когда восстановится, снизить дозу на 25%b | Снизить дозу на 25%b |
aВсе модификации дозы должны основываться на наихудшей предшествующей токсичности
bПациенты, которым требуется более чем 2 снижения дозы, должны быть исключены из исследования
[0204] Модификации дозы 5-FU при негематологических токсичностях
[0205] Лечение следует отложить до тех пор, пока все негематологические токсичности 3 или 4 степени не возвратятся к 1 степени или исходному уровню. Рекомендации по корректировке дозы при токсичности, связанной с 5-FU, приведены ниже.
[0206] Таблица 17: Модификации дозы 5-FU при негематологических токсичностях, отличных от астении и анорексии 3 степениc
| Степень наихудшей токсичности по CTCAE | Доза 5-FU в день 8, день 15, день 22a | Доза 5-FU для следующего курсаa |
| 1 или 2 степени | 100% от предыдущей дозы, за исключением акральной эритемы 2 степени, кардиотоксичности 2 степени или нейроцеребральной токсичности любой степени | 100% от предыдущей дозы, за исключением акральной эритемы 2 степени, кардиотоксичности 2 степени или нейроцеребральной токсичности любой степени |
| Акральная эритема 2 степени | Снизить дозу на 25%b | Снизить дозу на 25%b |
| Нейроцеребральная токсичность любой степени или кардиотоксичность ≥2 степени | Прекратить терапию | Прекратить терапию |
| 3 или 4 степени | Отложить введение дозы; когда восстановится, снизить дозу на 25%b, за исключением акральной эритемы 3 или 4 степени | Снизить дозу на 25%b, за исключением акральной эритемы 3 или 4 степени |
| Акральная эритема 3 или 4 степени | Прекратить терапию | Прекратить терапию |
aВсе модификации дозы должны основываться на наихудшей предшествующей токсичности
bПациенты, которым требуется более чем 2 снижения дозы, должны быть исключены из исследования
cАстения и анорексия 3 степени не требуют изменения дозы
[0207] Модификации дозы MM-398 для UGT1A1*28-положительных пациентов (группа 1)
[0208] Пациентов проверяют на UGT1A1*28-статус во время скрининга, однако результат теста не требуется до начальной дозы MM-398. Всем пациентам начнут введение доз на уровне 50 мг/м2 (свободное основание), однако будущие дозы могут быть снижены для пациентов, которые являются положительными (т.е. гомозиготными) по генотипу UGT1A1*28 7/7. Любые пациенты, которые получают сниженную дозу во время курса 1 из-за гомозиготности по UGT1A1*28, не могут быть поддающимися оценке для когорты и заменяются.
[0209] Таблица 18: Модификации дозы для группы 2 в части 2 (nal-IRI+5-FU/LV) при гематологических токсичностях
| Наихудшая степень токсичности по CTCAE | Nal-IRI | 5-FU |
| Нейтропения 2 степени (АЧН <1500-1000 клеток/мм3) |
100% от предыдущей дозы | |
| Нейтропения 3 или 4 степени (АЧН ≤1000/мм3) или фебрильная нейтропенияa |
1-е возникновение: Снизить дозу до 60 мг/м2 2-е возникновение: Снизить дозу до 50 мг/м2 |
1-е возникновение: Снизить дозу на 25% 2-е возникновение: Снизить дозу еще на 25% (50% от первоначальной дозы) |
| Тромбоцитопения ≥2 степени (2 степени: тромбоциты ≤75,000/мм3-50,000/мм3 или 3-4 степени: тромбоциты <50,000/мм3) |
Если 2 степени: 100% от предыдущей дозы Если ≥3 степени: 1-е возникновение: Снизить дозу до 60 мг/м2 2-е возникновение: Снизить дозу до 50 мг/м2 |
Если 2 степени: 100% от предыдущей дозы Если ≥3 степени: 1-е возникновение: Снизить дозу на 25% 2-е возникновение: Снизить дозу еще на 25% (50% от первоначальной дозы) |
| Другие гематологические токсичности, не указанные выше | Если 2 степени: 100% от предыдущей дозы Если ≥3 степени: 1-е возникновение: Снизить дозу до 60 мг/м2 2-е возникновение: Снизить дозу до 50 мг/м2 |
Если 2 степени: 100% от предыдущей дозы Если ≥3 степени: 1-е возникновение: Снизить дозу на 25% 2-е возникновение: Снизить дозу еще на 25% (50% от первоначальной дозы) |
aРассмотреть использование Г-КСФ для пациентов, которые испытывают нейтропению или фебрильную нейтропению≥3 степени.
[0210] Таблица 19: Модификации дозы для группы 2 в части 2 (nal-IRI+5-FU/LV) при негематологических токсичностях, отличных от астении и анорексии 3 степениa, d, e
| Степень наихудшей токсичности по CTCAE | Nal-IRI | 5-FU |
| 1 или 2 степени, включая диареюb |
100% от предыдущей дозы | 100% от предыдущей дозы, за исключением акральной эритемы 2 степени, кардиотоксичности 2 степени или нейроцеребральной токсичности любой степени |
| 3 или 4 степени, включая диареюc (кроме тошноты и рвоты) |
1-е возникновение: Снизить дозу до 60 мг/м2 2-е возникновение: Снизить дозу до 50 мг/м2 |
Снизить дозу на 25% 2-е возникновение: Снизить дозу еще на 25% (50% от первоначальной дозы) Примечание: за исключением акральной эритемы 3 или 4 степени |
| Тошнота и/или рвота 3 или 4 степени, несмотря на противорвотную терапию | Оптимизировать противорвотную терапию И снизить дозу до 60 мг/м2; если пациент уже получает 60 мг/м2, снизить дозу до 50 мг/м2 | Оптимизировать противорвотную терапию И снизить дозу на 25%; если пациент уже получает сниженную дозу, снизить дозу еще на 25% |
| Акральная эритема 2 степени | 100% от предыдущей дозы | 1-е возникновение: Снизить дозу на 25% 2-е возникновение: Снизить дозу еще на 25% (50% от первоначальной дозы) |
| Акральная эритема 3 или 4 степени | 100% от предыдущей дозы | Прекратить терапию |
| Нейроцеребральная токсичность любой степени или кардиотоксичность ≥2 степени | 100% от предыдущей дозы | Прекратить терапию |
aАстения и анорексия 3 степени не требуют изменения дозы.
bДиарея 1 степени: 2-3 стула/день > предшествующий курс; диарея 2 степени: 4-6 стулов/день > предшествующий курс.
cДиарея 3 степени: 7-9 стулов/день > предшествующий курс; диарея 4 степени: >10 стулов/день > предшествующий курс.
dЛюбая токсичность≥2 степени, за исключением анемии и алопеции, может оправдать снижение дозы, если это показано с медицинской точки зрения.
eПациенты, которым требуется более чем 2 снижения дозы, должны быть исключены из исследования.
[0211] Оценка заболевания
[0212] Опухолевые ответы оценивают в соответствии с Критериями оценки ответов в солидных опухолях (RECIST) версии 1.1, чтобы установить прогрессирование заболевания с помощью КТ или МРТ. Кроме того, другие процедуры визуализации, которые сочтет целесообразными исследователь, выполняются для оценки очагов поражения опухолью. Один и тот же способ оценки должен использоваться на протяжении всего исследования. Исследователи должны выбрать целевые и нецелевые поражения в соответствии с рекомендациями RECIST v1.1. Последующие измерения и общий ответ также должны соответствовать этим рекомендациям.
[0213] Оценку опухоли следует завершать до тех пор, пока не будет установлено, что у пациента прогрессирующее заболевание (в соответствии с RECIST v1.1). Для пациентов, у которых нет документально подтвержденного прогрессирования заболевания в соответствии с RECIST v. 1.1 на момент прекращения лечения, визуализирующие исследования должны проводиться непрерывно с начала периода наблюдения каждые 8 недель до документального подтверждения прогрессирования заболевания. Непрерывный последующий визуализирующий контроль в соответствии с графиком рекомендуется, чтобы уменьшить потенциальное смещение в оценках воздействия экспериментального лечения на заболевание.
[0214] EORTC-QLQ-C30 и EQ-5D-5L
[0215] Качество жизни, обусловленное состоянием здоровья (HRQL), оценивают с помощью средств EORTC-QLQ-C30 и EQ-5D-5L. EORTC-QLQ-C30 является надежным и достоверным показателем качества жизни раковых пациентов в условиях многонационального клинического исследования. Он включает в себя девять разнородных шкал: пять функциональных шкал (физическая, ролевая, когнитивная, эмоциональная и социальная); три шкалы симптомов (утомляемость, боль, тошнота и рвота); и шкала здоровья и качества жизни в целом. Несколько показателей отдельных симптомов также включены. EQ-5D представляет собой общий, основанный на предпочтениях пациентов показатель HRQL. Описательная система EQ-5D-5L включает в себя следующие 5 измерений: мобильность, самообслуживание, повседневная деятельность, боль/дискомфорт и тревога/депрессия. Каждое измерение имеет 5 уровней: нет проблем, небольшие проблемы, умеренные проблемы, серьезные проблемы и неспособность сделать.
[0216] Пациенты должны заполнить оба вопросника в сроки, указанные в графике оценок. В дни, когда пациент должен получать исследуемое лекарственное средство, оценки должны быть завершены до введения исследуемого лекарственного средства. Только тем пациентам, для которых доступны утвержденные переводы вопросников, будет необходимо заполнять вопросник.
[0217] Анализ эффективности
[0218] В оценках эффективности, MM-398-содержащая группа сравнивается с контрольной группой. Для сравнения эффективности используются стратифицированные анализы, включающие рандомизационные страты. Каждое сравнение использует односторонний критерий с уровнем 0,10, чтобы оценить, улучшает ли MM-398-содержащая группа параметр эффективности. Доверительные интервалы представлены на двустороннем уровне 95% для наглядности. Критерии проверки гипотез и доверительные интервалы не корректируются для множественных сравнений. Первичные сравнения эффективности основаны на совокупности "все рандомизированные пациенты согласно назначенному лечению" (ITT), которая включает всех рандомизированных пациентов.
[0219] Оценка опухоли измеряется в соответствии с RECIST v1.1. Для каждого пациента время выживаемости без прогрессирования определяется как время от рандомизации до первого документально подтвержденного рентгенографического прогрессирования заболевания (PD) на каждого исследователя с использованием RECIST 1.1, или смерти от любой причины, в зависимости от того, что наступит раньше. Если прогрессирование или смерть наступают в момент времени, который превышает 12 недель после последней оценки опухоли без PD, тогда время выживаемости без прогрессирования цензурируется на момент последней оценки опухоли без PD.
[0220] Первичный анализ проводится, когда можно определить статус без прогрессирования в течение 24 неделе для всех рандомизированных пациентов, прогнозируемый приблизительно через 24 недели после рандомизации последнего пациента. Последующий анализ для выживаемости без прогрессирования (PFS) и других конечных точек выполняется, когда события PFS произошли по меньшей мере у 120 (т.е. 80% рандомизированных пациентов) пациентов.
[0221] Первичный анализ эффективности
[0222] В анализе всех рандомизированных пациентов согласно назначенному лечению (ITT) считается, что пациент достиг выживаемости без прогрессирования в течение 24 недель, если у пациента есть данные, свидетельствующие о том, что у пациента не наблюдалось прогрессирование в течение 24 недель. Таким образом, пациент считается ответившим на лечение, если на 24-й неделе или позже проводится хотя бы одна оценка без PD до прогрессирования или новой противораковой терапии.
[0223] Пациенты, которые не отвечают критериям достижения выживаемости без прогрессирования в течение 24 недель (например, у пациентов наблюдалось прогрессирование/пациенты умерли до 24 недели, пациенты подвергались цензурированию до 24 недели), если прогрессирование или смерть наступили в момент времени, превышающий 12 недель после последней оценки опухоли без PD.
[0224] Для каждой группы скорость достижения выживаемости без прогрессирования заболевания в течение 24 недель оценивается по количеству пациентов, удовлетворяющих критериям достижения в течение 24 недель, поделенному на количество рандомизированных пациентов согласно назначенному лечению в группе. Оценки скорости представлены с соответствующими 95% доверительными интервалами. MM-398-содержащая группа оценивается на предмет увеличения скорости относительно контрольной группы с использованием одностороннего критерия Кохрана-Мантеля-Хензеля, включающего факторы стратификации рандомизации, на уровне значимости 0,10.
[0225] Вторичный анализ эффективности
[0226] Выживаемость без прогрессирования (PFS) обобщена при помощи дескриптивных методов для каждой группы с использованием методологии Каплана-Мейера. Медианное время PFS и соответствующие 95% доверительные пределы представлены. Для MM-398-содержащей группы PFS сравнивается с контрольной группой. Проверки гипотез проводятся на наличие различий в PFS с использованием одностороннего стратифицированного логарифмического рангового критерия. Отношения рисков (с доверительным интервалом 95%) для PFS оцениваются с использованием стратифицированных моделей Кокса.
[0227] Наилучший общий ответ (BOR) определяется как наилучший ответ, зафиксированный от начала исследования лекарственного средства до прогрессирования заболевания. Пациенты без оценки опухоли после исходного уровня считаются не поддающимися оценке BOR. Чтобы классифицировать BOR как стабильное заболевание (SD), необходимо провести квалификационную оценку SD как минимум через 6 недель после рандомизации. Частота объективного ответа (ORR) определяется как доля пациентов с BOR, характеризующимся как полный ответ (CR) или частичный ответ (PR), по отношению к общему количеству оцениваемых пациентов. Только пациенты с измеримым заболеванием на исходном уровне будут включены в анализ объективного ответа. Оценки частоты объективных ответов и их соответствующих 95% ДИ рассчитываются для каждой группы лечения. Для каждой MM-398-содержащей группы ORR сравнивается с контрольной группой. Различия в частоте объективного ответа между MM-398-содержащей группой и контрольной группой обеспечены 95% ДИ. Критерии Кохрана-Мантеля-Хензеля с поправкой на рандомизационную страту используются для сравнения частоты объективных ответов.
[0228] Общая выживаемость (OS) представляет собой время от рандомизации до даты смерти по любой причине. Пациенты, которые живы или чей контакт для последующего наблюдения утрачен на момент проведения анализа, будут цензурированы по последней известной дате нахождения в живых. OS обобщена при помощи дескриптивных методов для каждой группы с использованием методологии Каплана-Мейера. Для MM-398-содержащей группы OS сравнивается с контрольной группой. Проверки гипотез проводятся на наличие различий в OS с использованием одностороннего стратифицированного логарифмического рангового критерия. Отношения рисков (с доверительным интервалом 95%) для PFS оцениваются с использованием стратифицированных моделей Кокса.
[0229] Анализ качества жизни
[0230] Анализ качества жизни проводят с использованием пациентов в анализируемых популяциях для каждого показателя качества жизни (EORTC-QLC-C30, EQ-5D-5L). Результаты EORTC-QLQ-30 и EQ-5D-5L будут обобщены при каждом посещении по группам лечения.
[0231] Для каждого контролируемого EORTC QLQ-C30 баллы рассчитываются по следующим шкалам: общее состояние здоровья, физическое функционирование, ролевое функционирование, эмоциональное функционирование, когнитивное функционирование, социальное функционирование, утомляемость, тошнота и рвота, боль, одышка, бессонница, потеря аппетита, обстипация, диарея, финансовые трудности.
[0232] Оценка проводится, как описано в Руководстве по оценке EORTC QLQ-C30 (Fayers, Aaronson, Bjordal, Curran & Groenvald, 2001). Линейные преобразования применяются к первичным оценкам, так что сообщаемая оценка будет иметь диапазон 0-100 для всех шкал. Сводная статистика представлена для каждой подшкалы. Сводное значение индекса состояния работоспособности вычисляется для каждой оценки EQ-5D-5L. Сводные статистические данные представлены для сводного индекса состояния здоровья. Для каждого показателя EQ-5D-5L (мобильность, самообслуживание, повседневная деятельность, боль/дискомфорт и тревога/депрессия) ответы внесены в таблицу.
[0233] Анализ безопасности
[0234] Анализы безопасности (нежелательные явления и лабораторные анализы) будут выполняться с использованием выборки для оценки безопасности. Нежелательные явления представлены согласно Словарю медицинской нормативно-правовой лексики (MedDRA) версии 17.1 или выше. Токсичность классифицируется в соответствии с NCI CTCAE версии 4.03.
[0235] Период возникновения нежелательных явлений, появившихся за время лечения, и данных о безопасности представляет собой период с момента первого введения исследуемого препарата до 30 дней после даты последнего введения исследуемого препарата. Если нежелательное явление возникает в день первого введения исследуемого лекарственного средства без учета времени, явление считается появившимся за время лечения.
[0236] Сводки в виде таблицы должны быть представлены для всех нежелательных явлений, нежелательных явлений, предшествующих лечению, нежелательных явлений, возникающих при лечении (TEAE), серьезных нежелательных явлений, нежелательных явлений, ведущих к прекращению приема исследуемого лекарственного средства, TEAE, связанных с исследуемым лекарственным средством, и TEAE 3/4 степени. Неблагоприятные явления должны быть обобщены по классу систем и органов и предпочтительному наименованию. Все данные о нежелательных явлениях должны быть перечислены пациентом.
[0237] Лабораторные данные представлены по курсам. Аномальные лабораторные значения оцениваются с использованием всех имеющихся данных, и классификация токсичности будет назначаться в соответствии со шкалой токсичности NCI CTCAE, если для этого имеются критерии. О максимальном и минимальном уменьшении/увеличении текущих лабораторных данных сообщается. Оцениваются частота и процент аномальных лабораторных значений (L/ULN, 2*L/ULN). Переход к наиболее тяжелой степени токсичности указывается в виде сводных данных.
[0238] Показатели жизненно важных функций и ЭКГ сведены в таблицу для изменения от исходного уровня к моменту времени. Дополнительные анализы могут быть выполнены, как подробно описано в плане статистического анализа (SAP).
[0239] Показатели жизненно важных функций сведены в таблицу для изменения от исходного уровня к моменту времени. Дополнительные анализы могут быть выполнены, как подробно описано в SAP.
[0240] Анализ подгруппы биомаркеров
[0241] Анализы выполняются для оценки связей между потенциальными биомаркерами (из плазмы и заархивированной ткани) и параметрами эффективности (ORR, процентное изменение размера целевого очага поражения и PFS или в зависимости от конкретного случая). Графические представления выполняются при необходимости.
[0242] Фармакокинетический анализ
[0243] Концентрации в плазме MM-398 и оксалиплатина могут быть использованы для характеристики ФК-параметров. Из-за неплотного графика отбора проб для определения ФК ФК-параметры для отдельных пациентов могут быть оценены на основе метода эмпирического байесовского метода оценки с использованием априорных данных из ранее оцененных (MM-398) или опубликованных (оксалиплатин) параметров ФК-модели популяции. Моделируемые воздействия в модели, например, Cмакс, AUC (площадь под кривой), используются для изучения любых возможных взаимодействий между MM-398 и оксалиплатином путем сравнения геометрических средних отношений наименьших квадратов (LS-GMR) воздействий лекарственных средств. NONMEM®, версия 7.3, используется для оценки отдельных ФК-параметров и моделирования содержаний веществ в плазме крови.
[0244] Пример 5: Липосомальный иринотекан ONIVYDE® (липосомальный иринотекан для инъекций)
[0245] Одним предпочтительным примером иринотекановой липосомы, описанной в настоящем документе, является продукт, продаваемый как ONIVYDE® (липосомальный иринотекан для инъекций). ONIVYDE® представляет собой ингибитор топоизомеразы, составленный с использованием иринотекана в липосомальной дисперсии, для внутривенного применения.
[0246] Готовый продукт ONIVYDE® представляет собой непрозрачный стерильный концентрат для инфузии от белого до слегка желтого цвета. Он состоит из изотонической дисперсии липосом, содержащих тригидрат гидрохлорида иринотекана. Липосомы представляют собой небольшие однослойные везикулы из липидных бислоев диаметром приблизительно 110 нм, охватывающие водную камеру, содержащую иринотекан в гелеобразном или осажденном состоянии, в виде сукрозофатной соли. Везикула состоит из 6,81 мг/мл 1,2-дистеароил-sn-глицеро-3-фосфохолина (DSPC), 2,22 мг/мл холестерина и 0,12 мг/мл полиэтиленгликоль с концевыми метоксигруппами (MW 2000)-дистеароилфосфатидилэтаноламина (MPEG-2000-DSPE). Каждый мл также содержит 4,05 мг/мл 2-[4-(2-гидроксиэтил)пиперазин-1-ил]этансульфоновой кислоты (HEPES) в качестве буфера и 8,42 мг/мл хлорида натрия в качестве изотонического реагента. Липосомы диспергированы в водном забуференном растворе.
[0247] Продукт ONIVYDE® содержит иринотекана сукрозофат, инкапсулированный в липосому, полученный из исходного вещества тригидрата гидрохлорида иринотекана. Химическое название иринотекана представляет собой (S)-4,11-диэтил-3,4,12,14-тетрагидро-4-гидрокси-3,14-диоксо1Н-пирано[3',4':6,7]-индолизино[1,2-b]хинолин-9-ил-[1,4'бипиперидин]-1'-карбоксилат. Дозировка ONIVYDE® может быть рассчитана на основе эквивалентного количества исходного вещества тригидрата гидрохлорида иринотекана, используемого для получения липосом иринотекана, или на основе количества иринотекана в липосоме. Имеет место приблизительно 866 мг иринотекана на грамм тригидрата гидрохлорида иринотекана. Например, доза ONIVYDE® 80 мг, относящаяся к количеству исходного вещества тригидрата гидрохлорида иринотекана, фактически содержит приблизительно 0,866 × (80 мг) свободного основания иринотекана в конечном продукте (то есть доза 80 мг/м2 ONIVYDE®, относящаяся к массе исходного вещества гидрохлорида иринотекана, клинически эквивалентна приблизительно 70 мг/м2 свободного основания иринотекана в конечном продукте). Каждый однодозный флакон 10 мл содержит 43 мг свободного основания иринотекана в концентрации 4,3 мг/мл.
Claims (35)
1. Способ лечения рака желудка у пациента-человека, который ранее не получал противоопухолевое средство для лечения рака желудка, причем способ включает применение противоопухолевой терапии к пациенту один раз каждые две недели, причем противоопухолевая терапия состоит из:
a) 50 или 55 мг/м2 ± 5% липосомального иринотекана,
b) 60, 70 или 85 мг/м2 ± 5% оксалиплатина,
c) 200 мг/м2 (l)-формы лейковорина или 400 мг/м2 рацемической (l+d)-формы лейковорина и
d) 2400 мг/м2 5-фторурацила;
для лечения рака желудка у пациента-человека.
2. Способ по п. 1, в котором в общей сложности 50 мг/м2 ± 5% липосомального иринотекана вводят пациенту во время противоопухолевой терапии один раз каждые две недели.
3. Способ по п. 1, в котором в общей сложности 55 мг/м2 ± 5% липосомального иринотекана вводят пациенту во время противоопухолевой терапии один раз каждые две недели.
4. Способ по любому из пп. 1-3, в котором в общей сложности 60 мг/м2 ± 5% оксалиплатина вводят пациенту во время противоопухолевой терапии один раз каждые две недели.
5. Способ по любому из пп. 1-3, в котором в общей сложности 70 мг/м2 ± 5% оксалиплатина вводят пациенту во время противоопухолевой терапии один раз каждые две недели.
6. Способ по любому из пп. 1-3, в котором в общей сложности 85 мг/м2 ± 5% оксалиплатина вводят пациенту во время противоопухолевой терапии один раз каждые две недели.
7. Способ по п. 1, в котором в общей сложности 50 мг/м2 ± 5% липосомального иринотекана и в общей сложности 60 мг/м2 оксалиплатина вводят пациенту во время противоопухолевой терапии один раз каждые две недели.
8. Способ по п. 1, в котором в общей сложности 55 мг/м2 ± 5% липосомального иринотекана и в общей сложности 70 мг/м2 ± 5% оксалиплатина вводят пациенту во время противоопухолевой терапии один раз в две недели.
9. Способ по п. 1, в котором в общей сложности 50 мг/м2 ± 5% липосомального иринотекана и в общей сложности 85 мг/м2 ± 5% оксалиплатина вводят пациенту во время противоопухолевой терапии один раз в две недели.
10. Способ по любому из пп. 1-9, в котором каждое введение оксалиплатина начинается через 2 часа после завершения каждого введения липосомального иринотекана.
11. Способ по любому из пп. 1-10, в котором 5-фторурацил вводят в виде инфузии в течение 46 часов.
12. Способ по любому из пп. 1-11, в котором лейковорин вводят непосредственно перед 5-фторурацилом.
13. Способ по любому из пп. 1-12, в котором липосомальный иринотекан, оксалиплатин, 5-фторурацил и лейковорин вводят в дни 1 и 15 28-дневного курса лечения.
14. Способ по любому из пп. 1-13, в котором липосомальный иринотекан вводят в виде инфузии в течение в общей сложности приблизительно 90 минут.
15. Способ по любому из пп. 1-14, в котором липосомальный иринотекан вводят с последующим введением оксалиплатина, с последующим введением лейковорина, с последующим введением 5-фторурацила.
16. Способ по любому из пп. 1-15, в котором липосомальный иринотекан включает иринотекана-сахарозы октасульфат, инкапсулированный в липосомы.
17. Способ по любому из пп. 1-16, в котором липосомальный иринотекан включает иринотекан, инкапсулированный в липосомные везикулы, состоящие из 1,2-дистеароил-sn-глицеро-3-фосфохолина (DSPC), холестерина и N-(карбонилметоксиполиэтиленгликоль-2000)-1,2-дистеароил-sn-глицеро-3-фосфоэтаноламина (MPEG-2000-DSPE).
18. Способ по п. 2, в котором липосомальный иринотекан включает иринотекана-сахарозы октасульфат, инкапсулированный в липосомы, и липосомальный иринотекан включает иринотекан, инкапсулированный в липосомные везикулы, состоящие из 1,2-дистеароил-sn-глицеро-3-фосфохолина (DSPC), холестерина и N-(карбонилметоксиполиэтиленгликоль-2000)-1,2-дистеароил-sn-глицеро-3-фосфоэтаноламина (MPEG-2000-DSPE).
19. Способ по п. 18, в котором липосомальный иринотекан, оксалиплатин, 5-фторурацил и лейковорин вводят в дни 1 и 15 28-дневного курса лечения; каждое введение липосомального иринотекана вводят до введения лейковорина; лейковорин вводят непосредственно перед каждым введением 5-фторурацила и каждое введение 5-фторурацила вводят в виде инфузии в течение 46 часов.
20. Способ по п. 10, в котором липосомальный иринотекан включает иринотекана-сахарозы октасульфат, инкапсулированный в липосомы, и липосомальный иринотекан включает иринотекан, инкапсулированный в липосомные везикулы, состоящие из 1,2-дистеароил-sn-глицеро-3-фосфохолина (DSPC), холестерина и N-(карбонилметоксиполиэтиленгликоль-2000)-1,2-дистеароил-sn-глицеро-3-фосфоэтаноламина (MPEG-2000-DSPE).
21. Способ по п. 20, в котором липосомальный иринотекан, оксалиплатин, 5-фторурацил и лейковорин вводят в дни 1 и 15 28-дневного курса лечения; каждое введение липосомального иринотекана вводят до введения лейковорина; лейковорин вводят непосредственно перед каждым введением 5-фторурацила и каждое введение 5-фторурацила вводят в виде инфузии в течение 46 часов.
22. Способ по п. 1, в котором 55 мг/м2 ± 5% липосомального иринотекана и 85 мг/м2 ± 5% оксалиплатина вводят пациенту во время противоопухолевой терапии один раз каждые две недели.
23. Способ по п. 1, в котором 50 мг/м2 ± 5% липосомального иринотекана и 70 мг/м2 ± 5% оксалиплатина вводят пациенту во время противоопухолевой терапии один раз каждые две недели.
24. Способ по п. 1, в котором 55 мг/м2 ± 5% липосомального иринотекана и 60 мг/м2 ± 5% оксалиплатина вводят пациенту во время противоопухолевой терапии один раз каждые две недели.
25. Способ по любому из пп. 22-24, в котором
a) липосомальный иринотекан включает иринотекана-сахарозы октасульфат, инкапсулированный в липосомные везикулы, содержащие 1,2-дистеароил-sn-глицеро-3-фосфохолин (DSPC), холестерин и N-(карбонилметоксиполиэтиленгликоль-2000)-1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (MPEG-2000-DSPE);
b) липосомальный иринотекан, оксалиплатин, 5-фторурацил и лейковорин вводят в дни 1 и 15 28-дневного курса лечения;
c) каждое введение липосомального иринотекана вводят до введения лейковорина;
d) лейковорин вводят непосредственно перед каждым введением 5-фторурацила и
e) каждое введение 5-фторурацила вводят в виде инфузии в течение 46 часов.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662416317P | 2016-11-02 | 2016-11-02 | |
| US62/416,317 | 2016-11-02 | ||
| PCT/GB2017/053293 WO2018083470A1 (en) | 2016-11-02 | 2017-11-01 | Treating gastric cancer using combination therapies comprising liposomal irinotecan, oxaliplatin, 5-fluoruracil (and leucovorin) |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| RU2019114952A RU2019114952A (ru) | 2020-12-03 |
| RU2019114952A3 RU2019114952A3 (ru) | 2021-03-03 |
| RU2761953C2 true RU2761953C2 (ru) | 2021-12-14 |
Family
ID=60569939
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2019114952A RU2761953C2 (ru) | 2016-11-02 | 2017-11-01 | Лечение рака желудка с применением комбинационных видов терапии, содержащих липосомальный иринотекан, оксалиплатин, 5-фторурацил (и лейковорин) |
Country Status (18)
| Country | Link |
|---|---|
| US (1) | US11071726B2 (ru) |
| EP (1) | EP3535026A1 (ru) |
| JP (2) | JP2019533684A (ru) |
| KR (1) | KR20190077441A (ru) |
| CN (1) | CN110402163A (ru) |
| AU (1) | AU2017354903B2 (ru) |
| BR (1) | BR112019007844A2 (ru) |
| CA (1) | CA3040395A1 (ru) |
| EA (1) | EA201990979A1 (ru) |
| IL (2) | IL266187A (ru) |
| MA (1) | MA46709A (ru) |
| MX (1) | MX2019004783A (ru) |
| MY (1) | MY202377A (ru) |
| PH (1) | PH12019500892A1 (ru) |
| RU (1) | RU2761953C2 (ru) |
| SG (2) | SG11201903615WA (ru) |
| TW (1) | TWI791467B (ru) |
| WO (1) | WO2018083470A1 (ru) |
Families Citing this family (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101462819B1 (ko) * | 2004-05-03 | 2014-11-21 | 헤르메스 바이오사이언스, 인코포레이티드 | 약물 전달에 유용한 리포좀 |
| US9717724B2 (en) | 2012-06-13 | 2017-08-01 | Ipsen Biopharm Ltd. | Methods for treating pancreatic cancer using combination therapies |
| AU2013202947B2 (en) | 2012-06-13 | 2016-06-02 | Ipsen Biopharm Ltd. | Methods for treating pancreatic cancer using combination therapies comprising liposomal irinotecan |
| US11318131B2 (en) | 2015-05-18 | 2022-05-03 | Ipsen Biopharm Ltd. | Nanoliposomal irinotecan for use in treating small cell lung cancer |
| CA2992789A1 (en) | 2015-08-20 | 2017-02-23 | Ipsen Biopharm Ltd. | Combination therapy using liposomal irinotecan and a parp inhibitor for cancer treatment |
| JP2018528185A (ja) | 2015-08-21 | 2018-09-27 | イプセン バイオファーム リミティド | リポソーム型イリノテカン及びオキサリプラチンを含む組み合わせ療法を使用して転移性膵臓癌を治療するための方法 |
| US10456360B2 (en) | 2015-10-16 | 2019-10-29 | Ipsen Biopharm Ltd. | Stabilizing camptothecin pharmaceutical compositions |
| MA46709A (fr) | 2016-11-02 | 2019-09-11 | Ipsen Biopharm Ltd | Traitement du cancer gastrique au moyen de polythérapies comprenant de l'oxaliplatine, du 5-fluoruracile (et de la leucovorine) et de l'irinotécan sous forme liposomale |
| AU2018246024B2 (en) | 2017-03-31 | 2020-08-06 | Fujifilm Corporation | Liposome composition and pharmaceutical composition |
| TWI837189B (zh) * | 2018-10-01 | 2024-04-01 | 日商富士軟片股份有限公司 | 包含內含藥物之脂質體組成物及鉑製劑之組合醫藥 |
| KR20210095139A (ko) * | 2018-10-17 | 2021-07-30 | 바이오라인알엑스 리미티드 | 전이성 췌장 선암종의 치료 방법 |
| WO2020148744A1 (en) * | 2019-01-17 | 2020-07-23 | Biolinerx Ltd. | Combination therapy for treatment of pancreatic cancer |
| EP3911353A1 (en) * | 2019-01-17 | 2021-11-24 | BioLineRx Ltd. | Specific combination therapy for treatment of pancreatic cancer |
| US20200269041A1 (en) * | 2019-02-22 | 2020-08-27 | Novocure Gmbh | Treating Gastric Cancer Using TTFields Combined with XELOX, FOLFOX or the Individual Constituents Thereof |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2013188586A1 (en) * | 2012-06-13 | 2013-12-19 | Merrimack Pharmaceuticals, Inc. | Methods for treating pancreatic cancer using combination therapies comprising liposomal irinotecan |
Family Cites Families (85)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS6019790A (ja) | 1983-07-14 | 1985-01-31 | Yakult Honsha Co Ltd | 新規なカンプトテシン誘導体 |
| US5077056A (en) | 1984-08-08 | 1991-12-31 | The Liposome Company, Inc. | Encapsulation of antineoplastic agents in liposomes |
| JPH0720857B2 (ja) | 1988-08-11 | 1995-03-08 | テルモ株式会社 | リポソームおよびその製法 |
| IL91664A (en) | 1988-09-28 | 1993-05-13 | Yissum Res Dev Co | Ammonium transmembrane gradient system for efficient loading of liposomes with amphipathic drugs and their controlled release |
| US5013556A (en) | 1989-10-20 | 1991-05-07 | Liposome Technology, Inc. | Liposomes with enhanced circulation time |
| US5538954A (en) | 1994-06-24 | 1996-07-23 | A/S Dumex (Dumex Ltd.) | Salts of tetracyclines |
| US5783568A (en) | 1994-06-10 | 1998-07-21 | Sugen, Inc. | Methods for treating cancer and other cell proliferative diseases |
| US5543152A (en) | 1994-06-20 | 1996-08-06 | Inex Pharmaceuticals Corporation | Sphingosomes for enhanced drug delivery |
| US6214388B1 (en) | 1994-11-09 | 2001-04-10 | The Regents Of The University Of California | Immunoliposomes that optimize internalization into target cells |
| US5800833A (en) | 1995-02-27 | 1998-09-01 | University Of British Columbia | Method for loading lipid vesicles |
| DE19605024A1 (de) | 1996-01-31 | 1997-08-07 | Schering Ag | Neue selektive Taxane, Verfahren zu ihrer Herstellung und ihre pharmazeutische Verwendung |
| US5997899A (en) | 1996-10-01 | 1999-12-07 | Skyepharma Inc. | Method for producing liposomes with increased percent of compound encapsulated |
| CA2269758C (en) | 1996-10-22 | 2008-01-08 | Hermes Biosciences, Inc. | Liposome compositions comprising ionizable compounds in stable precipitated form and methods for their preparation |
| US6210707B1 (en) | 1996-11-12 | 2001-04-03 | The Regents Of The University Of California | Methods of forming protein-linked lipidic microparticles, and compositions thereof |
| US6787132B1 (en) | 1997-12-04 | 2004-09-07 | Yissum Research Development Company Of The Hebrew University Of Jerusalem | Combined chemo-immunotherapy with liposomal drugs and cytokines |
| US7244826B1 (en) | 1998-04-24 | 2007-07-17 | The Regents Of The University Of California | Internalizing ERB2 antibodies |
| US6726925B1 (en) | 1998-06-18 | 2004-04-27 | Duke University | Temperature-sensitive liposomal formulation |
| JP2002527466A (ja) | 1998-09-16 | 2002-08-27 | アルザ・コーポレーション | リポソーム−閉込めトポイソメラーゼ阻害剤 |
| US7311924B2 (en) | 1999-04-01 | 2007-12-25 | Hana Biosciences, Inc. | Compositions and methods for treating cancer |
| WO2000066125A1 (en) | 1999-04-29 | 2000-11-09 | Aventis Pharma S.A. | Method for treating cancer using camptothecin derivatives and 5-fluorouracil |
| US6720001B2 (en) | 1999-10-18 | 2004-04-13 | Lipocine, Inc. | Emulsion compositions for polyfunctional active ingredients |
| US6511676B1 (en) | 1999-11-05 | 2003-01-28 | Teni Boulikas | Therapy for human cancers using cisplatin and other drugs or genes encapsulated into liposomes |
| ES2272496T3 (es) | 2000-02-04 | 2007-05-01 | Lipoxen Technologies Limited | Procedimiento de deshidratacion/rehidritacion para la preparacion de lipososmas. |
| US6545010B2 (en) | 2000-03-17 | 2003-04-08 | Aventis Pharma S.A. | Composition comprising camptothecin or a camptothecin derivative and a platin derivative for the treatment of cancer |
| EP1286671B1 (en) | 2000-05-15 | 2006-04-05 | Celgene Corporation | Compositions for the treatment of colorectal cancer comprising thalidomide and irinotecan |
| IL153676A0 (en) | 2000-06-30 | 2003-07-06 | Inex Pharmaceuticals Corp | Liposomal pharmaceutical compositions |
| TWI283575B (en) | 2000-10-31 | 2007-07-11 | Eisai Co Ltd | Medicinal compositions for concomitant use as anticancer agent |
| CA2442261A1 (en) | 2001-03-26 | 2002-10-03 | Alza Corporation | Liposome composition for improved intracellular delivery of a therapeutic agent |
| US7219016B2 (en) | 2001-04-20 | 2007-05-15 | Yale University | Systems and methods for automated analysis of cells and tissues |
| WO2003030864A1 (en) | 2001-05-29 | 2003-04-17 | Neopharm, Inc. | Liposomal formulation of irinotecan |
| EP1408975A2 (en) | 2001-07-23 | 2004-04-21 | Epidauros Biotechnologie AG | Methods for the treatment of cancer with irinotecan based on cyp3a5 |
| US7850990B2 (en) | 2001-10-03 | 2010-12-14 | Celator Pharmaceuticals, Inc. | Compositions for delivery of drug combinations |
| EP3100719A3 (en) | 2002-05-15 | 2017-02-22 | California Pacific Medical Center | Delivery of nucleic acid-like compounds |
| MXPA04011871A (es) | 2002-05-31 | 2005-07-26 | Transmolecular Inc | Quimioterapia en combinacion con clorotoxina. |
| WO2004035032A2 (en) | 2002-08-20 | 2004-04-29 | Neopharm, Inc. | Pharmaceutical formulations of camptothecine derivatives |
| KR20120104408A (ko) | 2003-05-30 | 2012-09-20 | 제넨테크, 인크. | 항-vegf 항체를 사용한 치료 |
| US8658203B2 (en) | 2004-05-03 | 2014-02-25 | Merrimack Pharmaceuticals, Inc. | Liposomes useful for drug delivery to the brain |
| KR101462819B1 (ko) | 2004-05-03 | 2014-11-21 | 헤르메스 바이오사이언스, 인코포레이티드 | 약물 전달에 유용한 리포좀 |
| ES2594621T3 (es) * | 2004-06-01 | 2016-12-21 | Kabushiki Kaisha Yakult Honsha | Preparación de irinotecán |
| JP2006248978A (ja) | 2005-03-10 | 2006-09-21 | Mebiopharm Co Ltd | 新規なリポソーム製剤 |
| TWI375673B (en) | 2005-04-11 | 2012-11-01 | Abbott Lab | 1h-benzimidazole-4-carboxamides substituted with a quaternary carbon at the 2-position are potent parp inhibitors |
| AU2006306108B2 (en) | 2005-10-25 | 2012-10-04 | Celator Pharmaceuticals, Inc. | Fixed ratio drug combination treatments for solid tumors |
| EP1976485A4 (en) | 2005-12-22 | 2011-10-26 | Celator Pharmaceuticals Inc | LIPOSOMAL FORMULATIONS COMPRISING SECONDARY AND TERTIARY AMINES AND METHODS FOR THE PREPARATION OF SAID FORMULATIONS |
| RS53082B (en) | 2006-01-17 | 2014-06-30 | Abbvie Bahamas Ltd. | COMBINED THERAPY WITH PARP INHIBITORS |
| CN101442998B (zh) | 2006-03-16 | 2012-03-14 | 比奥纽默里克药物公司 | 抗癌活性加强化合物和制剂及其用法 |
| DK2129396T3 (da) | 2007-02-16 | 2013-11-25 | Merrimack Pharmaceuticals Inc | Antistoffer mod ErbB3 og anvendelser deraf |
| US20120003160A1 (en) | 2007-06-29 | 2012-01-05 | Amag Pharmaceuticals, Inc. | Macrophage-Enhanced MRI (MEMRI) in a Single Imaging Session |
| US20120003294A1 (en) | 2007-08-17 | 2012-01-05 | Celator Pharmaceuticals, Inc. | Fixed ratio camptothecens/platinum agents |
| CA2700810A1 (en) | 2007-09-28 | 2009-04-02 | Universitatsspital Basel | Immunoliposomes for treatment of cancer |
| KR20100102607A (ko) | 2007-11-12 | 2010-09-24 | 바이파 사이언스 인코포레이티드 | Parp 억제제를 단독으로 사용하거나 항종양제와 병용하여 자궁암 및 난소암을 치료하는 방법 |
| CN101888777A (zh) | 2007-12-07 | 2010-11-17 | 彼帕科学公司 | 用拓扑异构酶抑制剂和parp抑制剂的组合治疗癌症 |
| CA2718918A1 (en) | 2008-03-25 | 2009-11-26 | Schering Corporation | Methods for treating or preventing colorectal cancer |
| US8067432B2 (en) | 2008-03-31 | 2011-11-29 | University Of Kentucky Research Foundation | Liposomal, ring-opened camptothecins with prolonged, site-specific delivery of active drug to solid tumors |
| EP2860260A1 (en) | 2008-04-11 | 2015-04-15 | Merrimack Pharmaceuticals, Inc. | Human serum albumin linkers and conjugates thereof |
| US8852630B2 (en) | 2008-05-13 | 2014-10-07 | Yale University | Chimeric small molecules for the recruitment of antibodies to cancer cells |
| CN102282168A (zh) | 2008-11-18 | 2011-12-14 | 梅里麦克制药股份有限公司 | 人血清白蛋白接头以及其结合物 |
| CN102573826A (zh) | 2009-05-01 | 2012-07-11 | 奥克兹美制药公司 | 用于治疗癌症的喷他脒组合 |
| CN102271659B (zh) | 2009-12-03 | 2013-09-18 | 江苏恒瑞医药股份有限公司 | 伊立替康或盐酸伊立替康脂质体及其制备方法 |
| NZ706745A (en) | 2010-06-04 | 2017-01-27 | Abraxis Bioscience Llc | Methods of treatment of pancreatic cancer |
| EP2595618A1 (en) | 2010-07-19 | 2013-05-29 | BiPar Sciences, Inc. | Methods of treating breast cancer using 4-iodo-3-nitrobenzamide in combination with anti-tumor agents |
| CA2806076A1 (en) | 2010-07-22 | 2012-01-26 | The Regents Of The University Of California | Anti-tumor antigen antibodies and methods of use |
| RU2541100C2 (ru) | 2010-09-03 | 2015-02-10 | Боард Оф Регентс Оф Зе Юниверсити Оф Небраска | Способ и композиция для лечения рака |
| KR20140041396A (ko) | 2010-12-06 | 2014-04-04 | 메리맥 파마슈티컬즈, 인크. | 안트라사이클린 화학요법제를 포함하는 erbb2-표적 면역리포좀으로의 치료에서 심장독성을 예방하기 위한 용량 및 투여 |
| AU2011344865B2 (en) | 2010-12-14 | 2017-03-09 | Rigshospitalet | Entrapment of radionuclides in nanoparticle compositions |
| AU2012217685B2 (en) | 2011-02-15 | 2017-05-18 | Merrimack Pharmaceuticals, Inc. | Compositions and methods for delivering nucleic acid to a cell |
| WO2012145507A2 (en) | 2011-04-19 | 2012-10-26 | Merrimack Pharmaceuticals, Inc. | Monospecific and bispecific anti-igf-1r and anti-erbb3 antibodies |
| JO3283B1 (ar) | 2011-04-26 | 2018-09-16 | Sanofi Sa | تركيب يتضمن أفليبيرسيبت, حمض فولينيك, 5- فلورويوراسيل (5- Fu) وإرينوسيتان (FOLFIRI) |
| US8691231B2 (en) | 2011-06-03 | 2014-04-08 | Merrimack Pharmaceuticals, Inc. | Methods of treatment of tumors expressing predominantly high affinity EGFR ligands or tumors expressing predominantly low affinity EGFR ligands with monoclonal and oligoclonal anti-EGFR antibodies |
| AU2013201584A1 (en) | 2012-03-12 | 2013-09-26 | Merrimack Pharmaceuticals, Inc. | Methods for treating pancreatic cancer using combination therapies comprising an anti-ErbB3 antibody |
| JP6245481B2 (ja) | 2012-04-17 | 2017-12-13 | メリマック ファーマシューティカルズ インコーポレーティッド | 非侵襲的イメージングのための組成物および方法 |
| US9717724B2 (en) | 2012-06-13 | 2017-08-01 | Ipsen Biopharm Ltd. | Methods for treating pancreatic cancer using combination therapies |
| WO2014113167A1 (en) | 2012-12-14 | 2014-07-24 | Merrimack Pharmaceuticals, Inc. | Non-invasive imaging methods for patient selection for treatment with nanoparticulate therapeutic agents |
| JP6002835B2 (ja) | 2013-03-27 | 2016-10-05 | 大鵬薬品工業株式会社 | 低用量イリノテカン塩酸塩水和物を含有する抗腫瘍剤 |
| WO2015031536A1 (en) | 2013-08-27 | 2015-03-05 | Northeastern University | Nanoparticle drug delivery system and method of treating cancer and neurotrauma |
| WO2015061592A1 (en) | 2013-10-23 | 2015-04-30 | Merrimack Pharmaceuticals, Inc. | Liposomes for non-invasive imaging and drug delivery |
| WO2016094402A1 (en) | 2014-12-09 | 2016-06-16 | Merrimack Pharmaceuticals, Inc. | Treatment of breast cancer with liposomal irinotecan |
| WO2016168451A1 (en) | 2015-04-14 | 2016-10-20 | Merrimack Pharmaceuticals, Inc. | Compositions for improving the pharmacokinetics and therapeutic index of cancer treatment |
| CA2992789A1 (en) | 2015-08-20 | 2017-02-23 | Ipsen Biopharm Ltd. | Combination therapy using liposomal irinotecan and a parp inhibitor for cancer treatment |
| JP2018528185A (ja) | 2015-08-21 | 2018-09-27 | イプセン バイオファーム リミティド | リポソーム型イリノテカン及びオキサリプラチンを含む組み合わせ療法を使用して転移性膵臓癌を治療するための方法 |
| US10456360B2 (en) | 2015-10-16 | 2019-10-29 | Ipsen Biopharm Ltd. | Stabilizing camptothecin pharmaceutical compositions |
| US20170202840A1 (en) | 2016-01-14 | 2017-07-20 | Merrimack Pharmaceuticals, Inc. | Treatment of pancreatic cancer with liposomal irinotecan |
| WO2017172678A1 (en) | 2016-03-30 | 2017-10-05 | Merrimack Pharmaceuticals, Inc. | Methods for treating cancer using combination therapies comprising an oligoclonal anti-egfr antibody preparation and lipsomal irinotecan |
| US20170333421A1 (en) | 2016-05-18 | 2017-11-23 | Ipsen Biopharm Ltd. | Population Pharmacokinetics of Liposomal Irinotecan |
| KR20190009319A (ko) | 2016-05-18 | 2019-01-28 | 입센 바이오팜 리미티드 | 소세포 폐암을 치료하는데 사용하기 위한 나노리포솜성 이리노테칸 |
| MA46709A (fr) | 2016-11-02 | 2019-09-11 | Ipsen Biopharm Ltd | Traitement du cancer gastrique au moyen de polythérapies comprenant de l'oxaliplatine, du 5-fluoruracile (et de la leucovorine) et de l'irinotécan sous forme liposomale |
-
2017
- 2017-11-01 MA MA046709A patent/MA46709A/fr unknown
- 2017-11-01 MY MYPI2019002087A patent/MY202377A/en unknown
- 2017-11-01 TW TW106137766A patent/TWI791467B/zh active
- 2017-11-01 EA EA201990979A patent/EA201990979A1/ru unknown
- 2017-11-01 WO PCT/GB2017/053293 patent/WO2018083470A1/en active Application Filing
- 2017-11-01 RU RU2019114952A patent/RU2761953C2/ru active
- 2017-11-01 SG SG11201903615WA patent/SG11201903615WA/en unknown
- 2017-11-01 MX MX2019004783A patent/MX2019004783A/es unknown
- 2017-11-01 CN CN201780080584.XA patent/CN110402163A/zh active Pending
- 2017-11-01 KR KR1020197014970A patent/KR20190077441A/ko not_active Application Discontinuation
- 2017-11-01 SG SG10201912338RA patent/SG10201912338RA/en unknown
- 2017-11-01 EP EP17808557.7A patent/EP3535026A1/en not_active Ceased
- 2017-11-01 CA CA3040395A patent/CA3040395A1/en active Pending
- 2017-11-01 BR BR112019007844A patent/BR112019007844A2/pt unknown
- 2017-11-01 JP JP2019522381A patent/JP2019533684A/ja not_active Ceased
- 2017-11-01 AU AU2017354903A patent/AU2017354903B2/en active Active
- 2017-11-01 US US16/346,436 patent/US11071726B2/en active Active
-
2019
- 2019-04-23 IL IL266187A patent/IL266187A/en unknown
- 2019-04-24 PH PH12019500892A patent/PH12019500892A1/en unknown
-
2022
- 2022-03-24 IL IL291679A patent/IL291679A/en unknown
- 2022-09-15 JP JP2022146925A patent/JP2022171808A/ja active Pending
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2013188586A1 (en) * | 2012-06-13 | 2013-12-19 | Merrimack Pharmaceuticals, Inc. | Methods for treating pancreatic cancer using combination therapies comprising liposomal irinotecan |
Non-Patent Citations (7)
| Title |
|---|
| Bouche, O., et al. Randomized multicenter phase II trial of a biweekly regimen of fluorouracil and leucovorin (Lv5fu2), Lv5fu2 plus cisplatin, or Lv5fu2 plus irinotecan in patients with previously untreated metastatic gastric cancer: a Federation Francophone De Cancerologie Digestive Group Study Ffcd 9803, J Clin Oncol. 2004 Nov 1;22(21):4319-28, найдено онлайн, найдено в Интернете: https://ascopubs.org/doi/10.1200/JCO.2004.01.140?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed;. * |
| Chiang, N.-J., et al., Development of nanoliposomal irinotecan (nal-IRI, MM-398, PEP02) in the management of metastatic pancreatic cancer. Expert Opinion on Pharmacotherapy, 17(10), 1413-1420, Published online: 17 May 2016, найдено онлайн, найдено в Интернет: https://www.tandfonline.com/doi/abs/10.1080/14656566.2016.1183646?journalCode=ieop20. * |
| Matteo Dalla Chiesa at al., Sequential chemotherapy with dose-dense docetaxel, cisplatin, folinic acid and 5-fluorouracil (TCF-dd) followed by combination of oxaliplatin, folinic acid, 5-fluorouracil and irinotecan (COFFI) in metastatic gastric cancer: results of a phase II trial, Cancer Chemother Pharmacol, Published online: 5 March 2010, 67 (1):41-48, the abstract, Patients and Methods, Results, Discussion, doi:10.1007/s00280-010-1281-5. * |
| Matteo Dalla Chiesa at al., Sequential chemotherapy with dose-dense docetaxel, cisplatin, folinic acid and 5-fluorouracil (TCF-dd) followed by combination of oxaliplatin, folinic acid, 5-fluorouracil and irinotecan (COFFI) in metastatic gastric cancer: results of a phase II trial, Cancer Chemother Pharmacol, Published online: 5 March 2010, 67 (1):41-48, the abstract, Patients and Methods, Results, Discussion, doi:10.1007/s00280-010-1281-5. STEFAN PEINERT ET AL, "Safety and efficacy of weekly 5-fluorouracil/ folinic acid/oxaliplatin/irinotecan in the first-line treatment of gastrointestinal cancer", Therapeutic Advances in Medical Oncology, Vol. 2 (3), 01 May 2010, page 161-174, the abstract, 'Patients and Methods', Results, Discussion', DOI: 10.1177/1758834010365061 external link. Bouche, O., et al. Randomized multicenter phase II trial of a biweekly regimen of fluorouracil and leucovorin (Lv5fu2), Lv5fu2 plus cisplatin, or Lv5fu2 plus irinotecan in patients with previously untreated m * |
| Min H Kang et al., Activity of MM-398, nanoliposomal irinotecan (nal-IRI), in Ewing's family tumor xenografts is associated with high exposure of tumor to drug and high SLFN11 expression Clin Cancer Res. 2015 Mar 1;21(5):1139-50. Найдено онлайн, найдено в Интернете: https://pubmed.ncbi.nlm.nih.gov/25733708/. * |
| STEFAN PEINERT ET AL, "Safety and efficacy of weekly 5-fluorouracil/ folinic acid/oxaliplatin/irinotecan in the first-line treatment of gastrointestinal cancer", Therapeutic Advances in Medical Oncology, Vol. 2 (3), 01 May 2010, page 161-174, the abstract, 'Patients and Methods', Results, Discussion', DOI: 10.1177/1758834010365061 external link. * |
| W. KOIZUMI at al., Phase I/II Study of Bi-weekly Irinotecan plus Cisplatin in the Treatment of Advanced Gastric Cancer, Anticancer Res. Mar-Apr 2005;25(2B):1257-62., найдено онлайн, найдено в Интернете: https://ar.iiarjournals.org/content/25/2B/1257. * |
Also Published As
| Publication number | Publication date |
|---|---|
| TWI791467B (zh) | 2023-02-11 |
| AU2017354903A1 (en) | 2019-05-02 |
| EA201990979A1 (ru) | 2019-09-30 |
| WO2018083470A1 (en) | 2018-05-11 |
| CA3040395A1 (en) | 2018-05-11 |
| CN110402163A (zh) | 2019-11-01 |
| US20200030302A1 (en) | 2020-01-30 |
| JP2019533684A (ja) | 2019-11-21 |
| AU2017354903B2 (en) | 2023-04-13 |
| IL266187A (en) | 2019-06-30 |
| EP3535026A1 (en) | 2019-09-11 |
| MX2019004783A (es) | 2019-08-12 |
| TW201825097A (zh) | 2018-07-16 |
| PH12019500892A1 (en) | 2019-06-17 |
| US11071726B2 (en) | 2021-07-27 |
| MA46709A (fr) | 2019-09-11 |
| MY202377A (en) | 2024-04-24 |
| KR20190077441A (ko) | 2019-07-03 |
| RU2019114952A3 (ru) | 2021-03-03 |
| JP2022171808A (ja) | 2022-11-11 |
| IL291679A (en) | 2022-05-01 |
| SG10201912338RA (en) | 2020-02-27 |
| BR112019007844A2 (pt) | 2019-07-16 |
| RU2019114952A (ru) | 2020-12-03 |
| SG11201903615WA (en) | 2019-05-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2761953C2 (ru) | Лечение рака желудка с применением комбинационных видов терапии, содержащих липосомальный иринотекан, оксалиплатин, 5-фторурацил (и лейковорин) | |
| US20230062425A1 (en) | Methods for Treating Metastatic Pancreatic Cancer Using Combination Therapies Comprising Liposomal Irinotecan and Oxaliplatin | |
| JP6857210B2 (ja) | リポソームイリノテカンを含む併用療法を用いた、膵臓癌を治療するための方法 | |
| McCormack et al. | Dasatinib: a review of its use in the treatment of chronic myeloid leukaemia and Philadelphia chromosome-positive acute lymphoblastic leukaemia | |
| US20230088999A1 (en) | Methods For Treating Pancreatic Cancer Using Combination Therapies | |
| TW201701880A (zh) | 改善持續釋放藥物治療之藥物動力學及治療指數之方法 | |
| US20240358706A1 (en) | Methods for Treating Metastatic Pancreatic Cancer Using Combination Therapies Comprising Liposomal Irinotecan and Oxaliplatin |