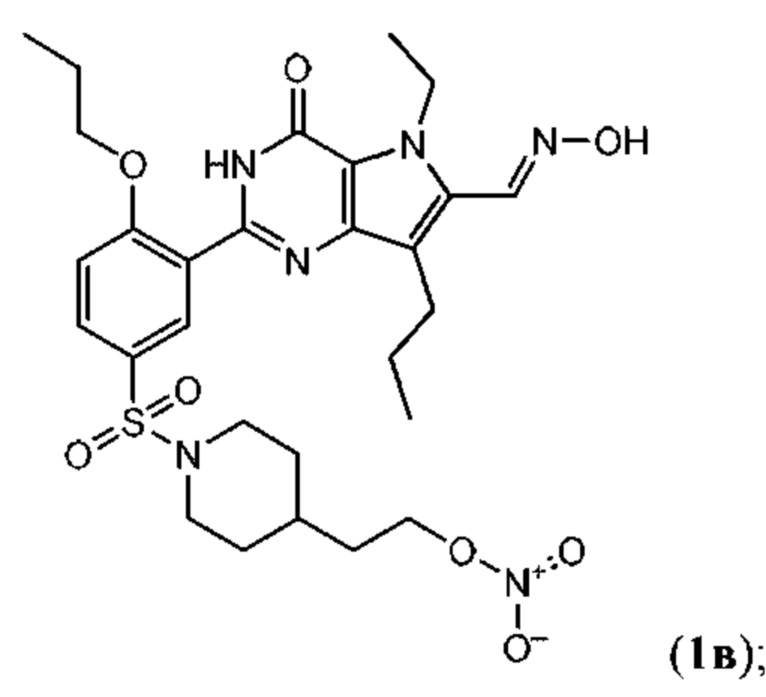
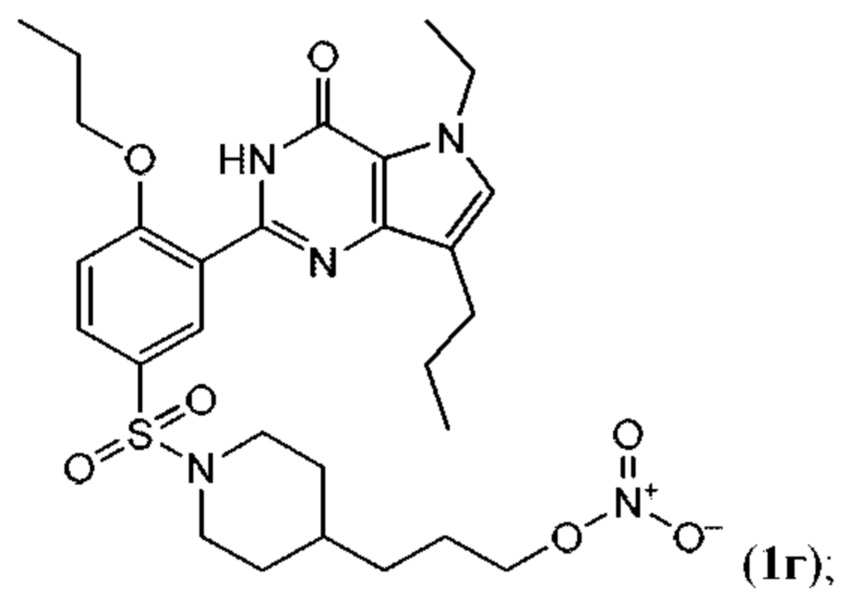
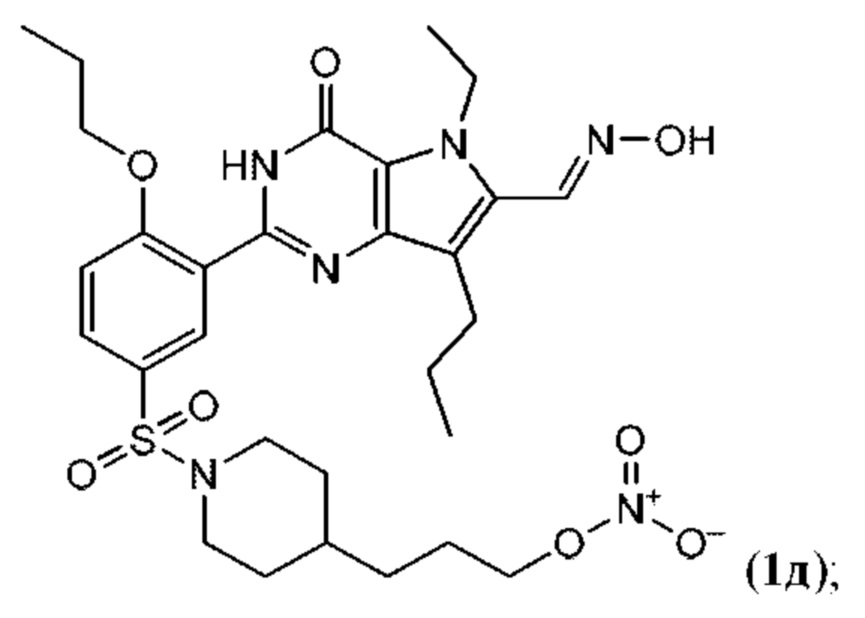
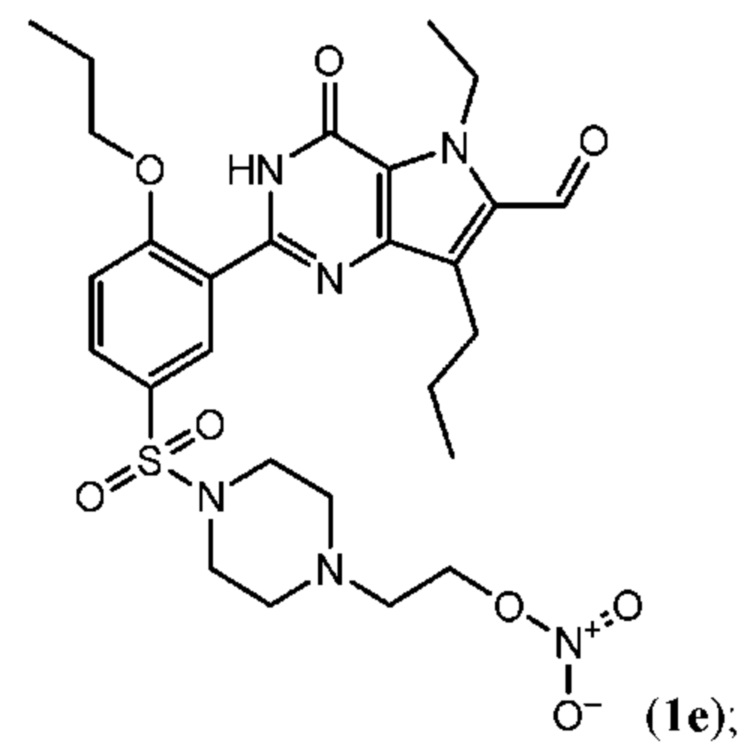
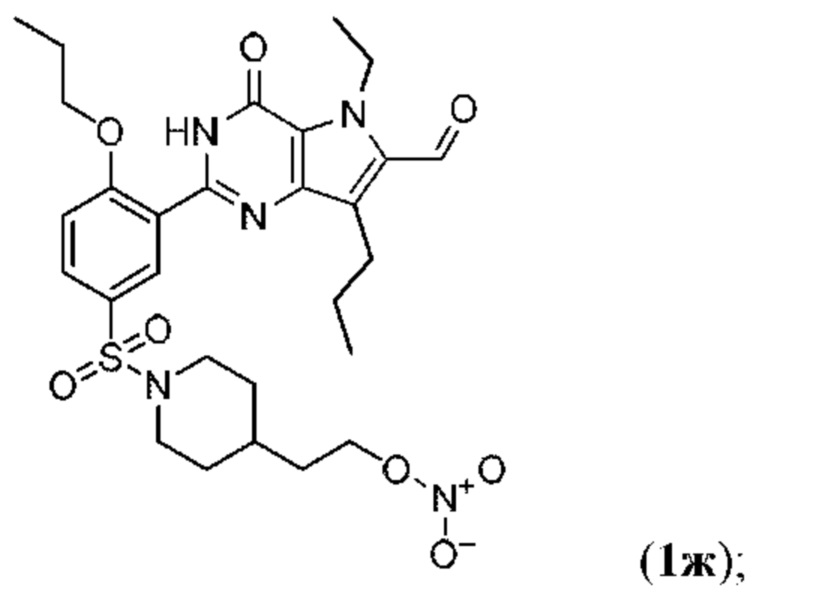
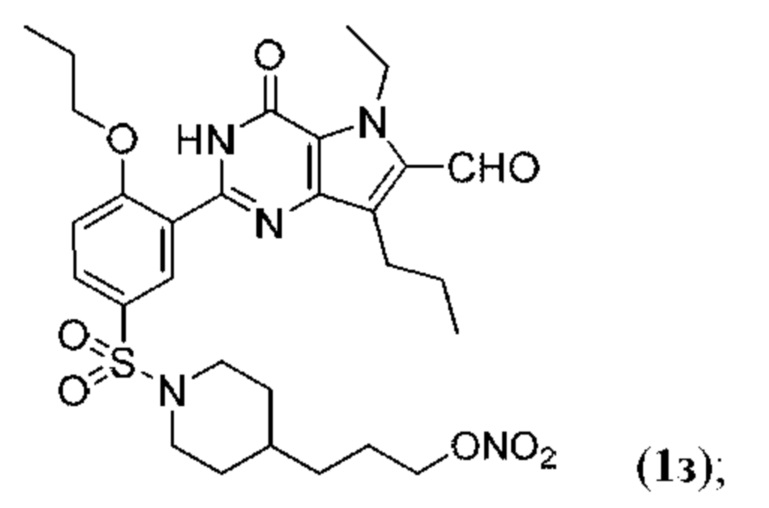
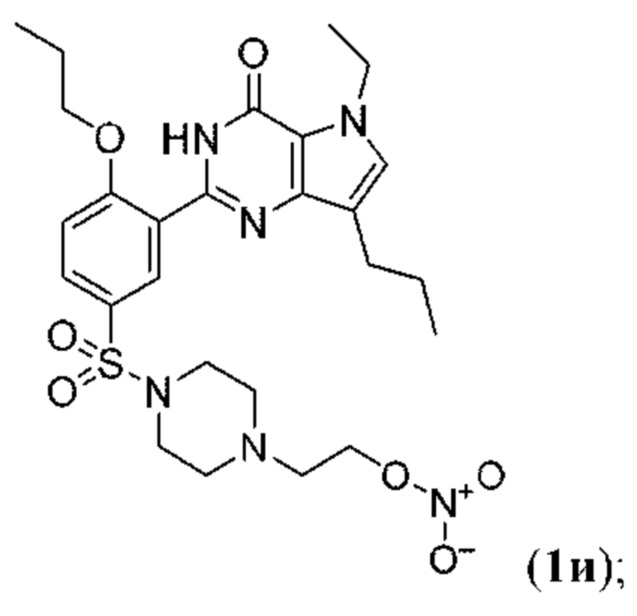
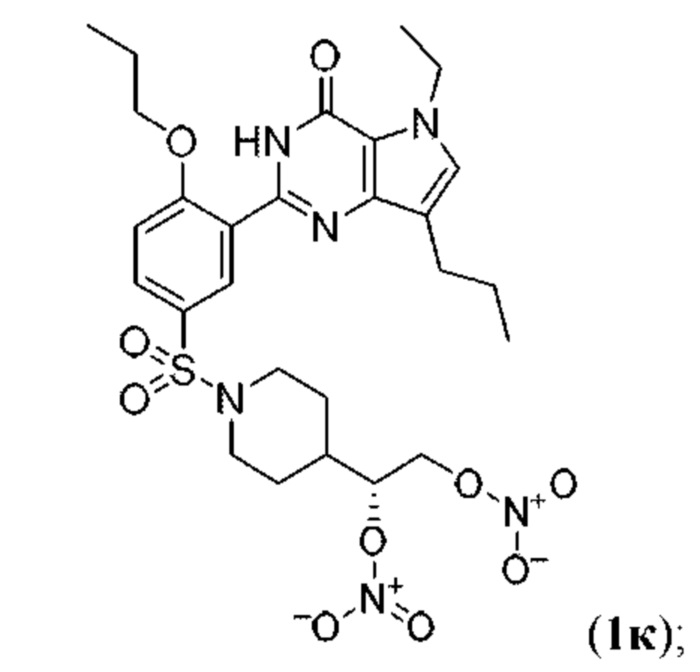
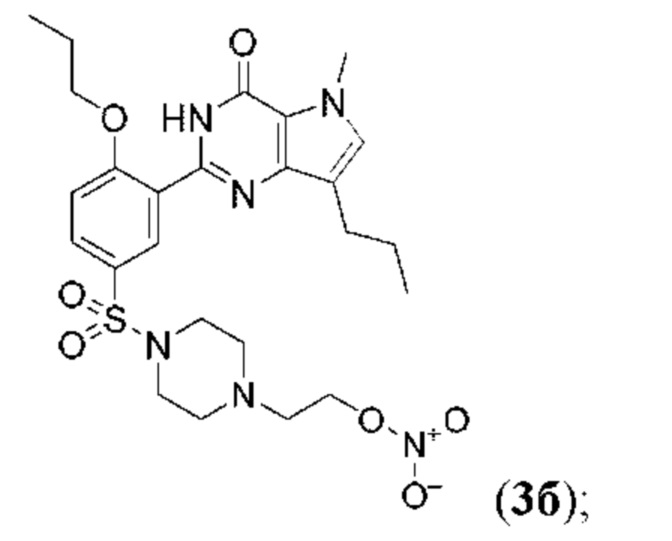
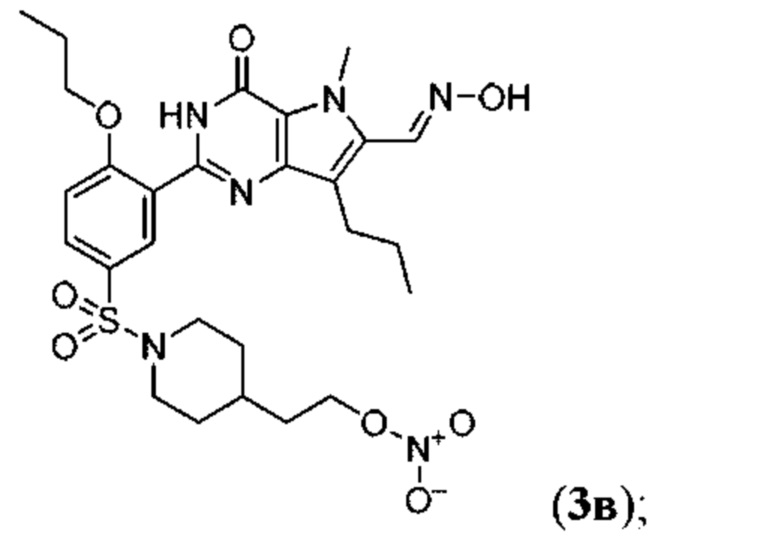
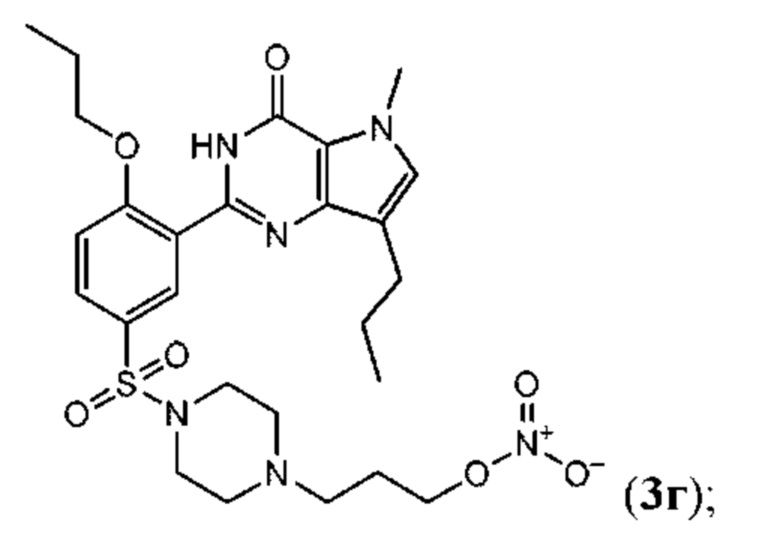
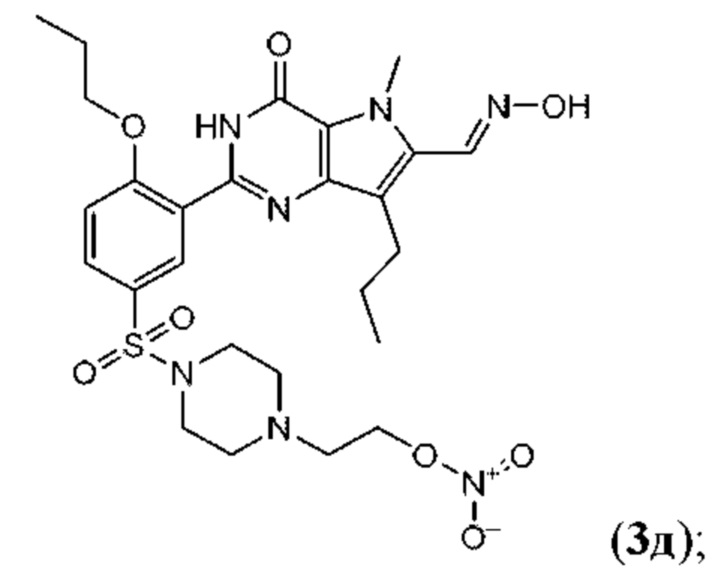
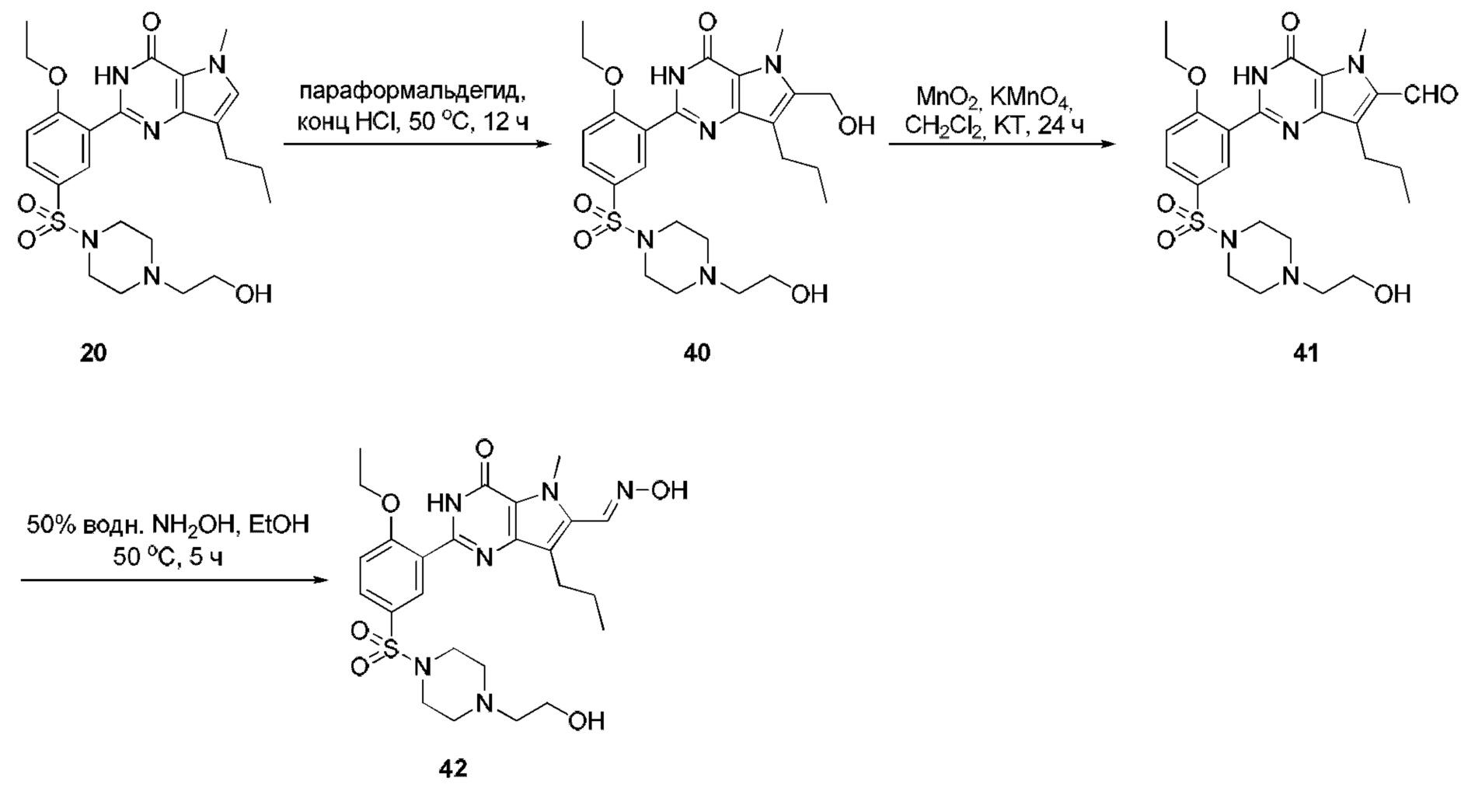
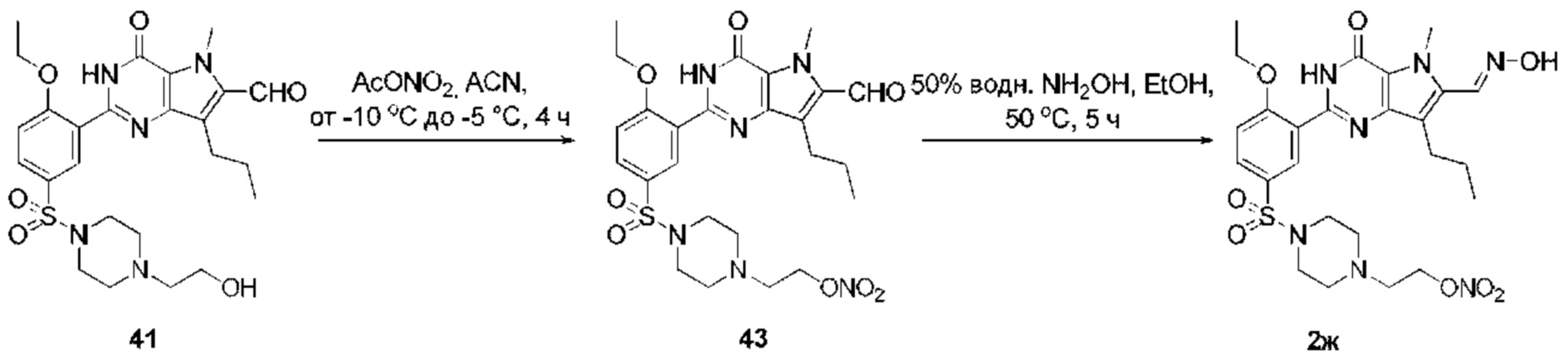
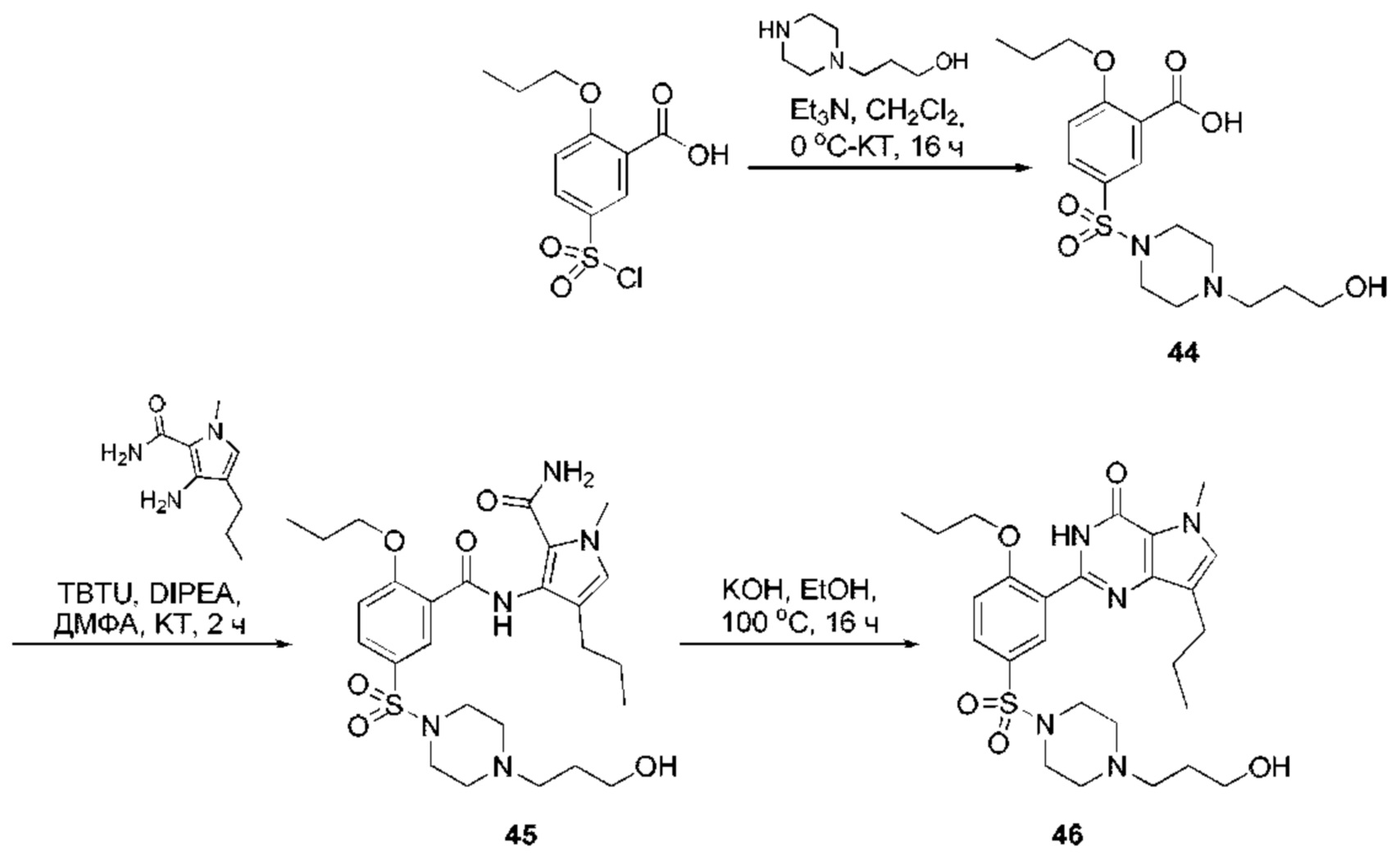
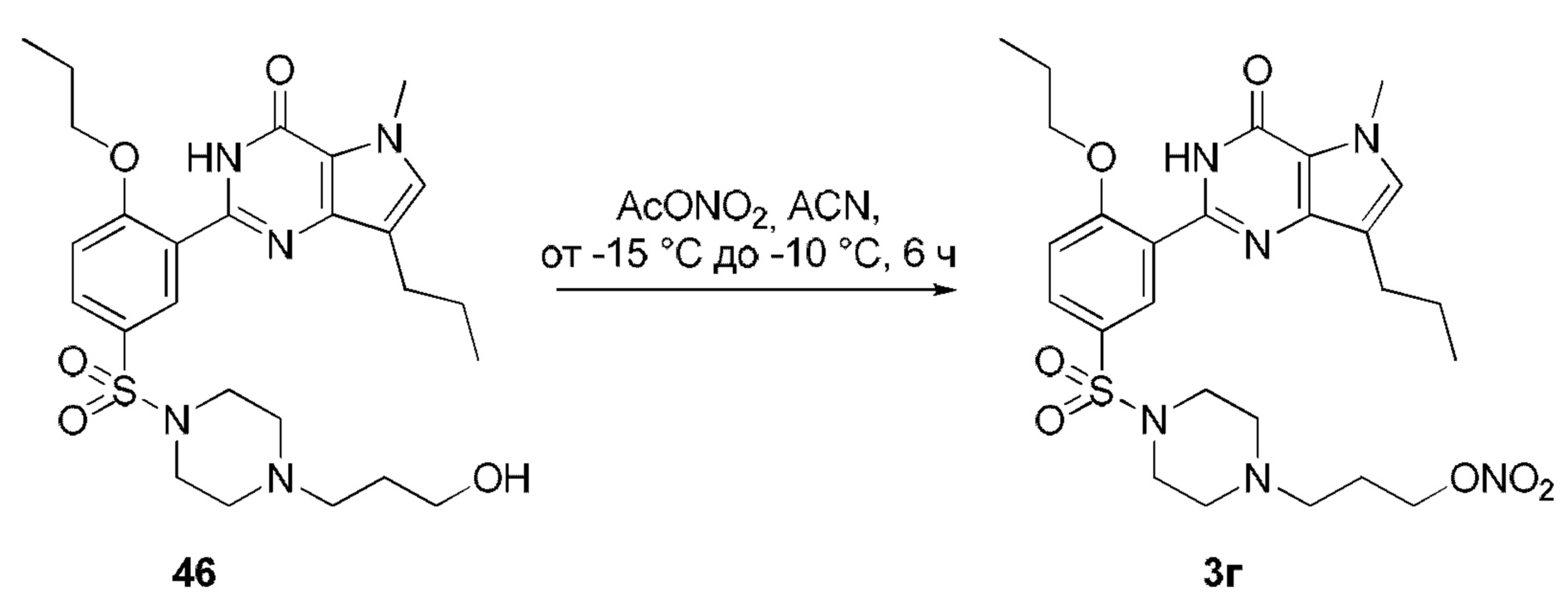
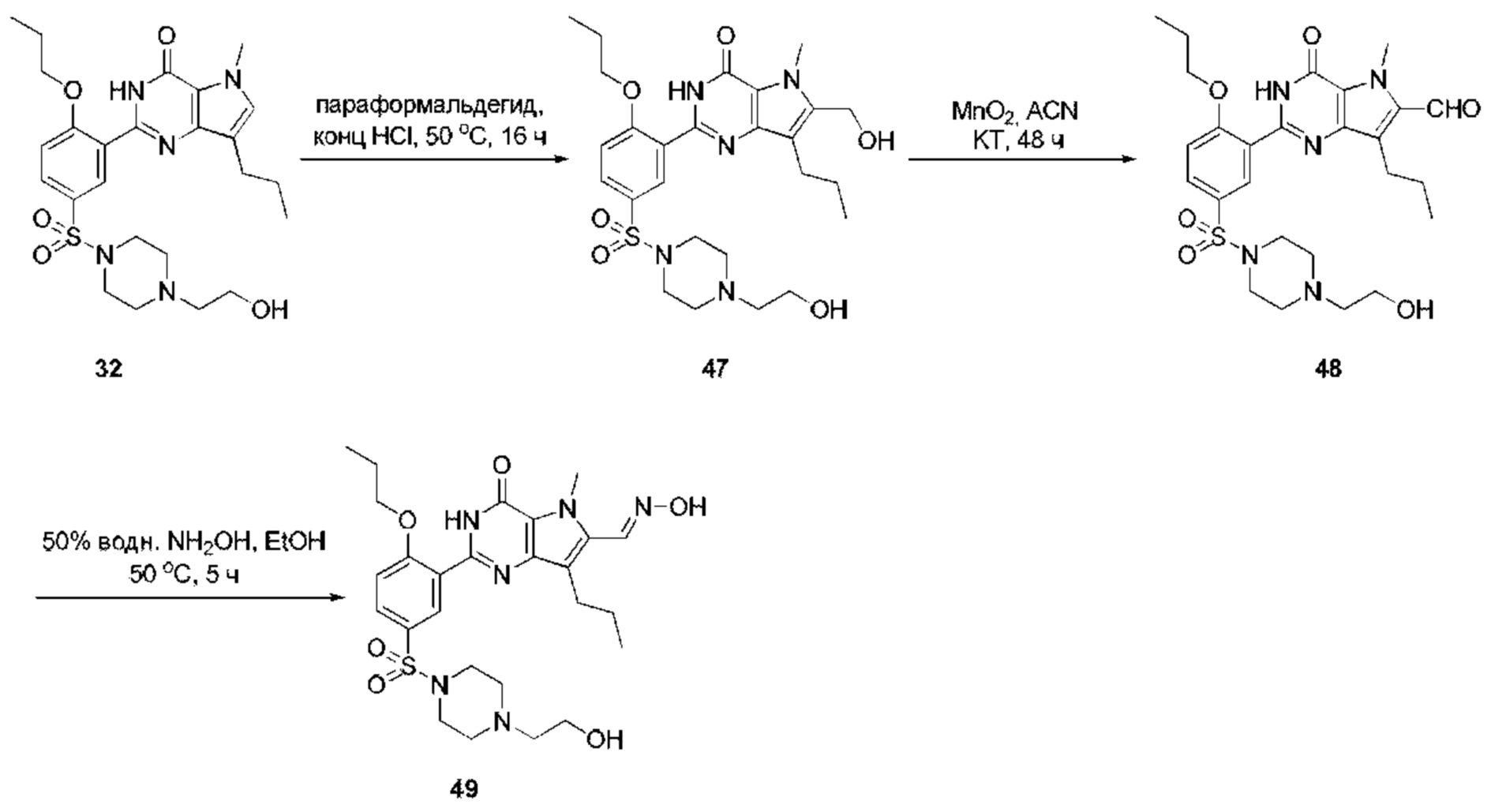
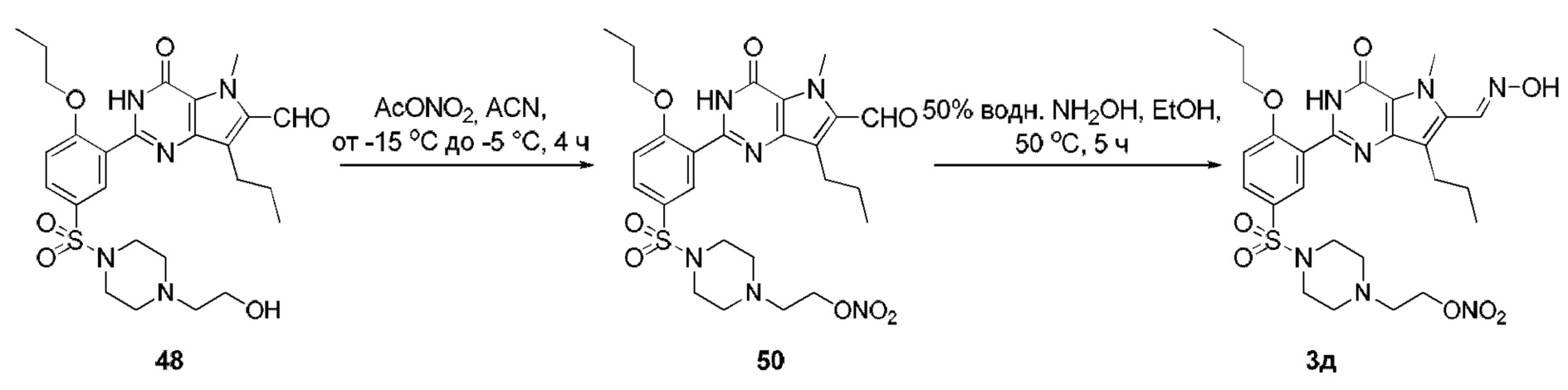
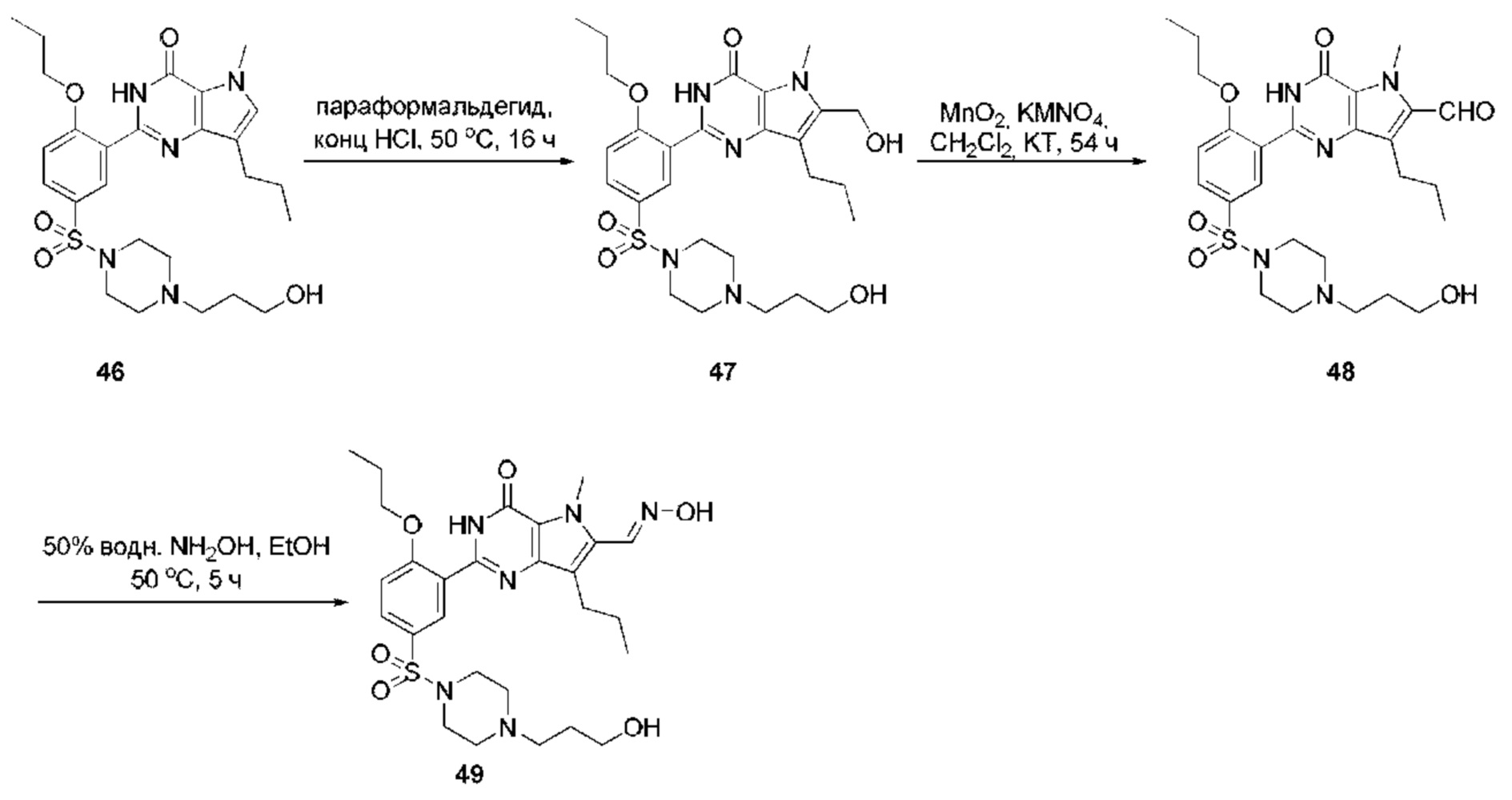
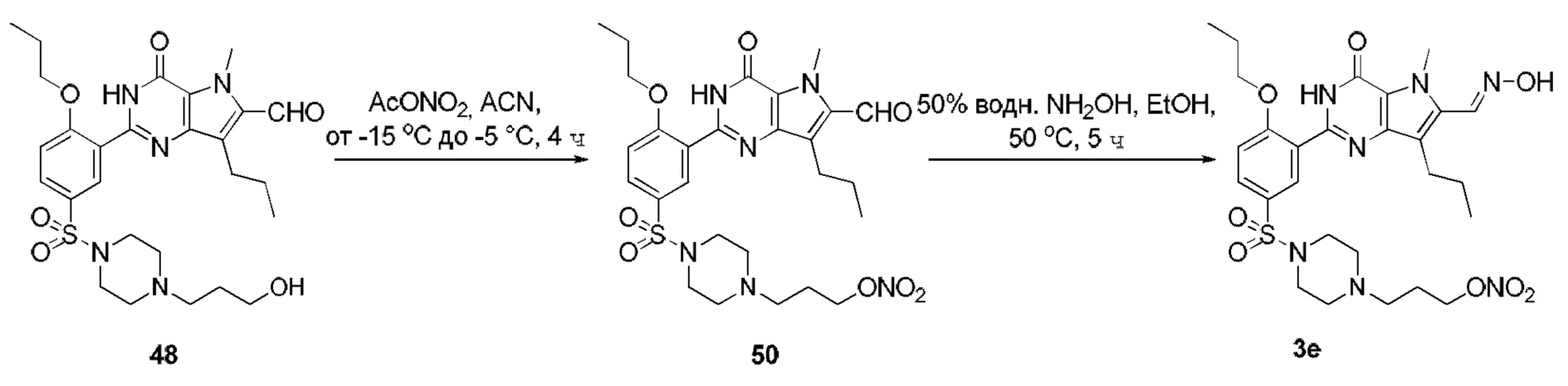
RU2758373C2 - Новые активаторы растворимой гуанилатциклазы и ингибиторы фосфодиэстеразы с двойным механизмом действия и их применение - Google Patents
Новые активаторы растворимой гуанилатциклазы и ингибиторы фосфодиэстеразы с двойным механизмом действия и их применение Download PDFInfo
- Publication number
- RU2758373C2 RU2758373C2 RU2019133200A RU2019133200A RU2758373C2 RU 2758373 C2 RU2758373 C2 RU 2758373C2 RU 2019133200 A RU2019133200 A RU 2019133200A RU 2019133200 A RU2019133200 A RU 2019133200A RU 2758373 C2 RU2758373 C2 RU 2758373C2
- Authority
- RU
- Russia
- Prior art keywords
- ono
- alkyl
- optionally substituted
- propyl
- sulfonyl
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/02—Nasal agents, e.g. decongestants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/10—Drugs for genital or sexual disorders; Contraceptives for impotence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/14—Drugs for dermatological disorders for baldness or alopecia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/02—Drugs for disorders of the nervous system for peripheral neuropathies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
- A61P27/06—Antiglaucoma agents or miotics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/14—Vasoprotectives; Antihaemorrhoidals; Drugs for varicose therapy; Capillary stabilisers
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Diabetes (AREA)
- Endocrinology (AREA)
- Neurosurgery (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Reproductive Health (AREA)
- Gynecology & Obstetrics (AREA)
- Cardiology (AREA)
- Epidemiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Hematology (AREA)
- Emergency Medicine (AREA)
- Obesity (AREA)
- Pulmonology (AREA)
- Dermatology (AREA)
- Hospice & Palliative Care (AREA)
- Ophthalmology & Optometry (AREA)
- Vascular Medicine (AREA)
- Rheumatology (AREA)
- Otolaryngology (AREA)
- Psychiatry (AREA)
- Gastroenterology & Hepatology (AREA)
- Urology & Nephrology (AREA)
- Pain & Pain Management (AREA)
- Immunology (AREA)
Abstract
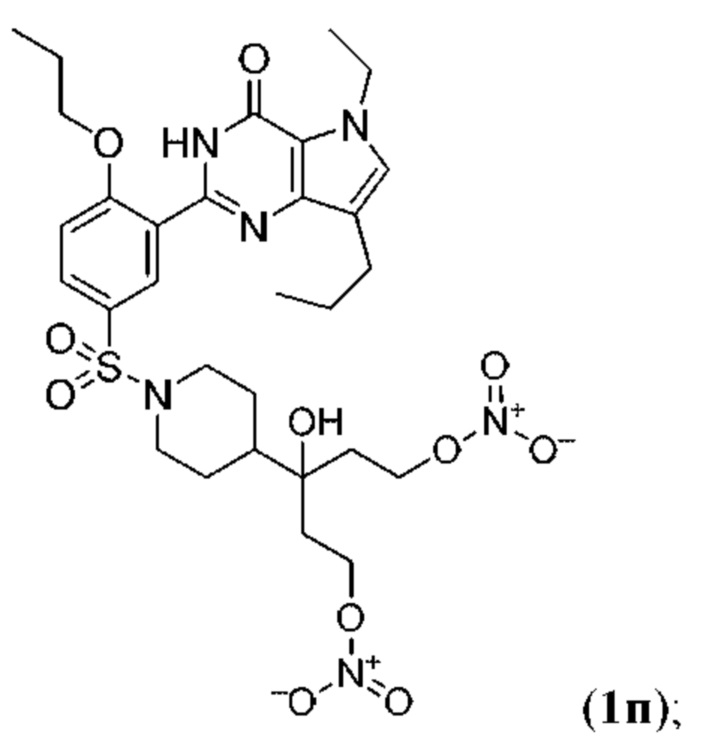
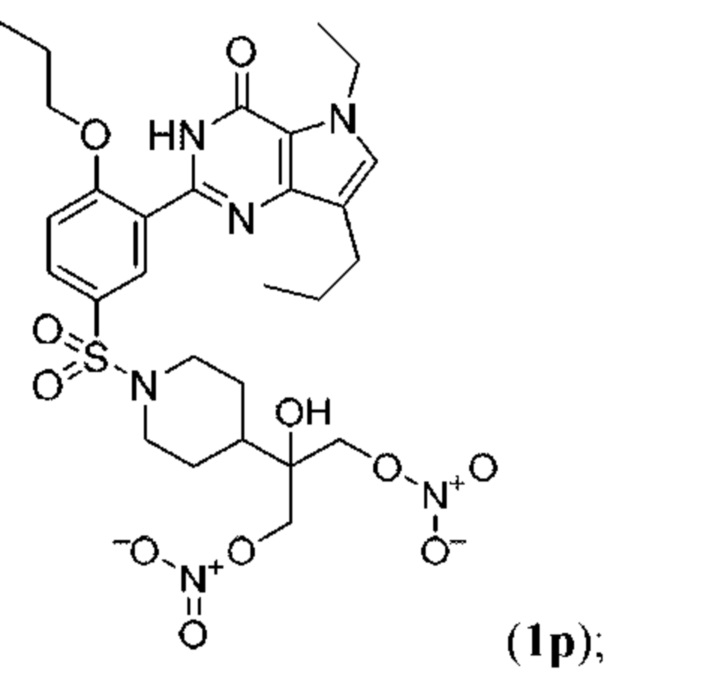
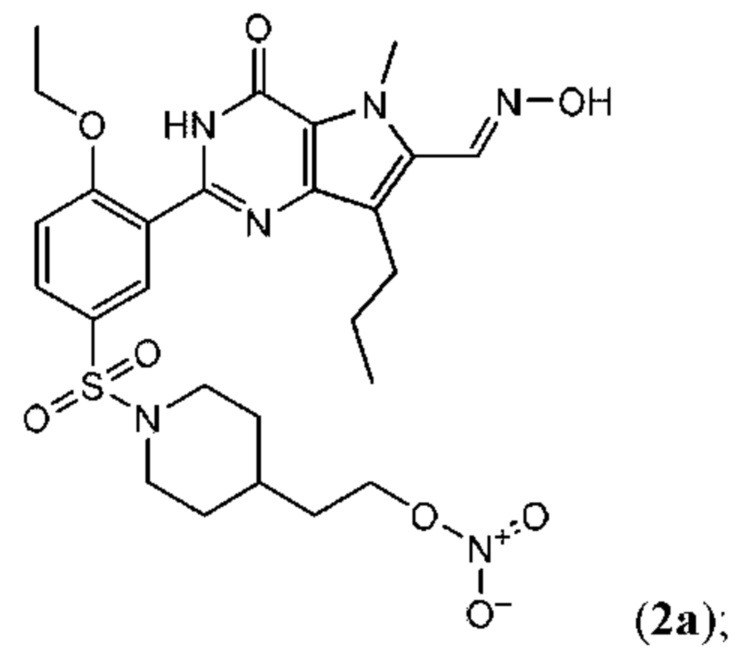
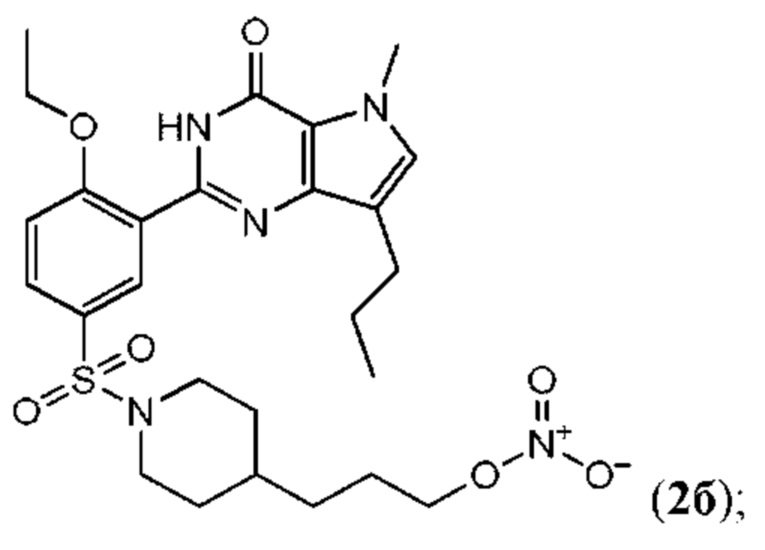
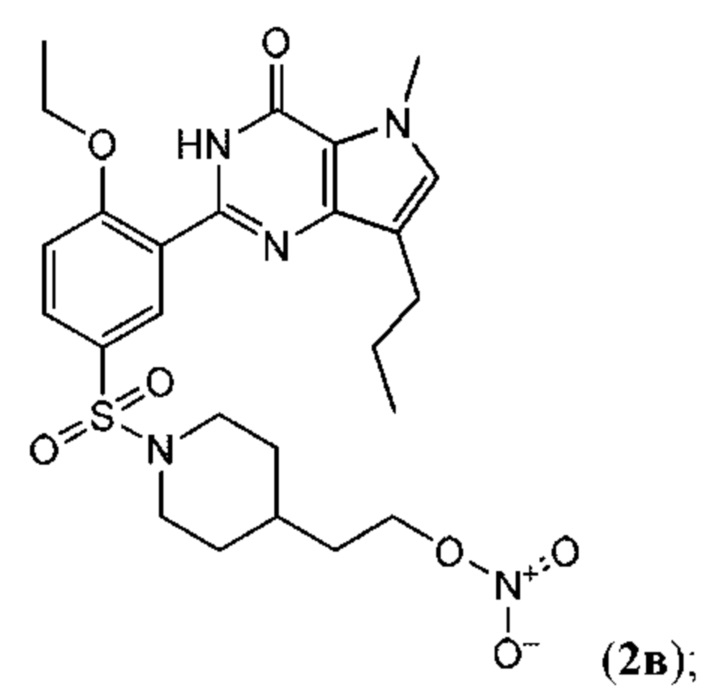
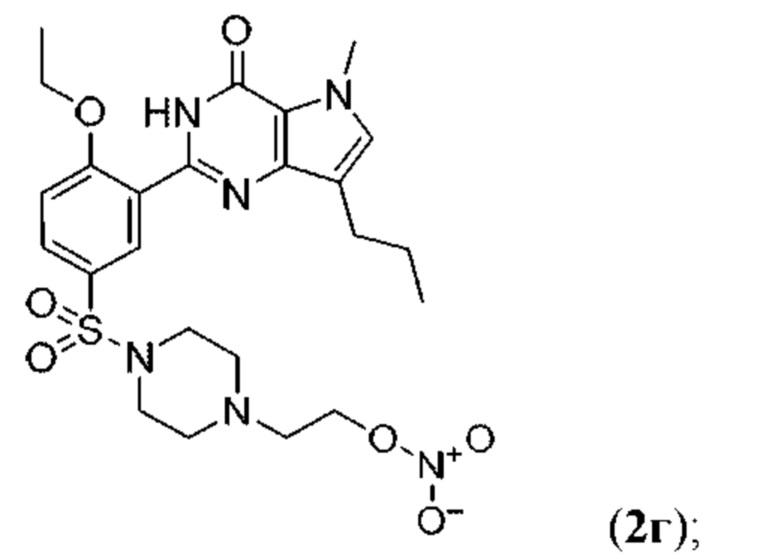
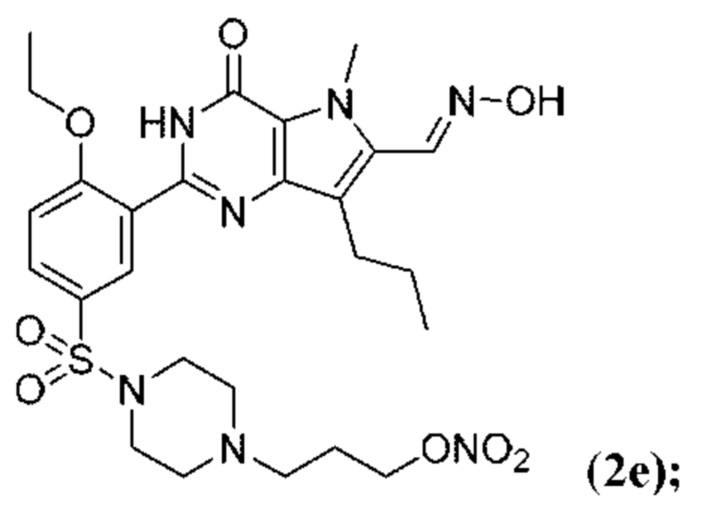
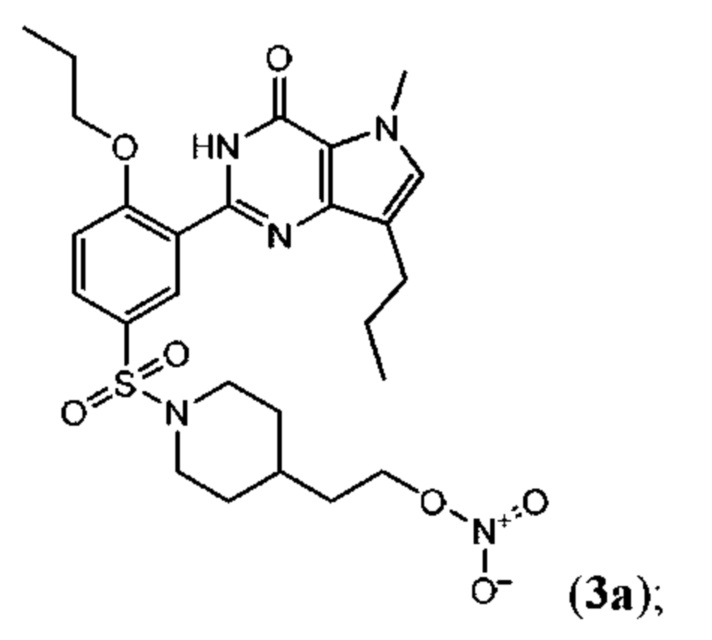
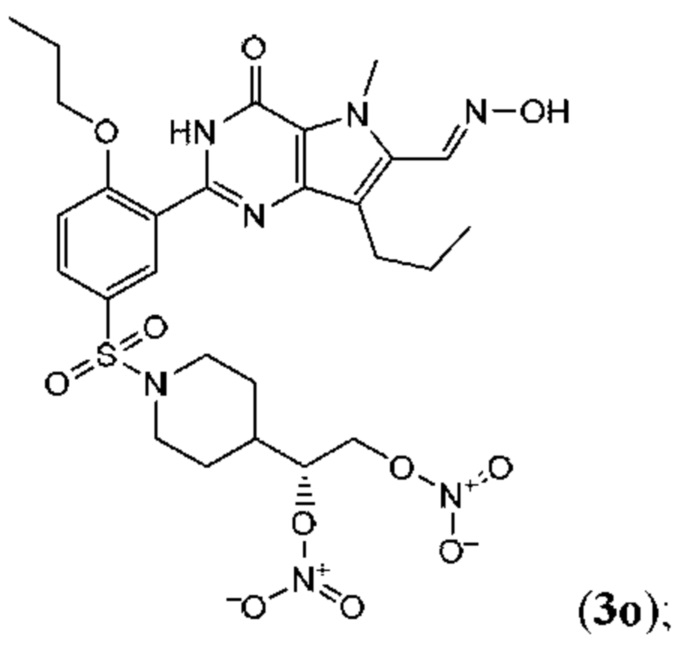
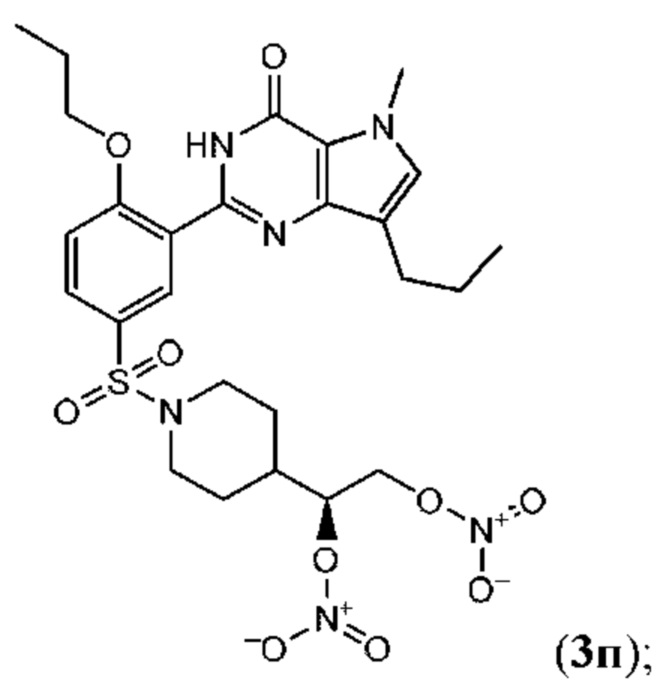
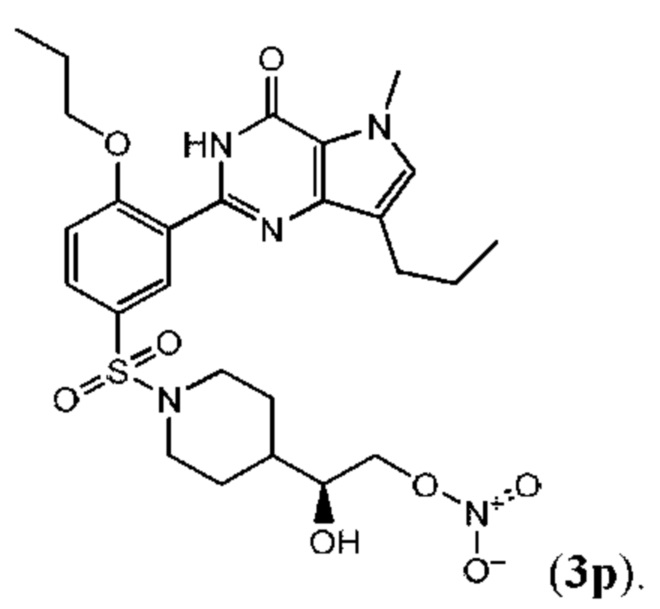
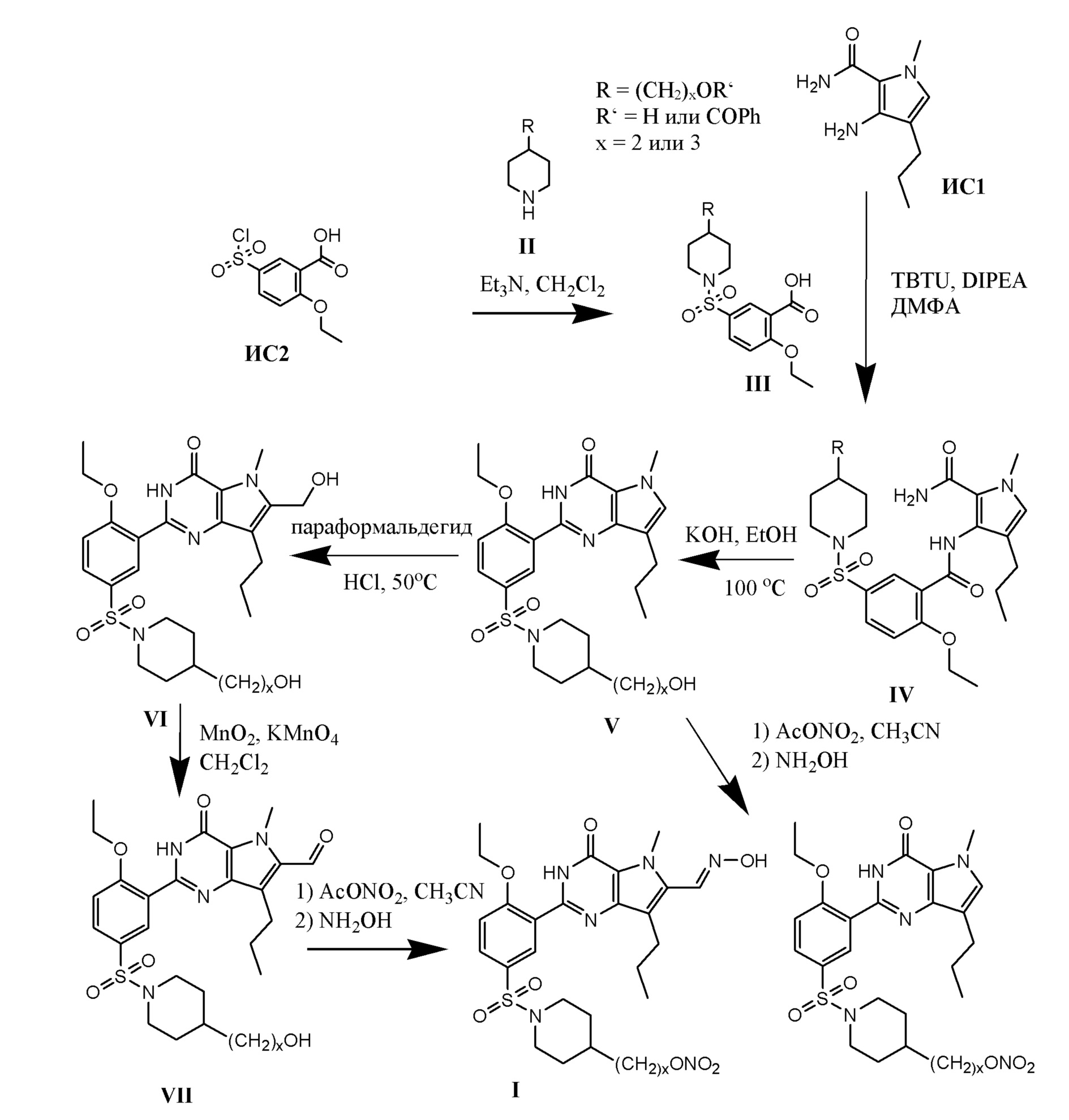
Настоящая группа изобретений относится к области химии и фармацевтики, а именно к соединению формулы I или его фармацевтически приемлемой соли, где по меньшей мере один из R2, R4или R5, каждый независимо, включает по меньшей мере один фрагмент ONO2или ONO; R1представляет собой C1-C3-алкил, необязательно замещенный F; R2представляет собой H, C1-C3-алкил, необязательно замещенный OH, ONO, ONO2; C(O)OH, C(O)OC1-C3-алкил, CHO, CN, C(O)N(R6)OR7, CR8=N-OR9, CR8=NR12, CR8=N-ONO2, C1-C3-алкокси; C1-C3-алкилен-Y, причем Y представляет собой ONO, ONO2, C(O)OH, C(O)OC1-C3-алкил, CHO, CN, OH, OC(O)H, OC(O)-C1-C3-алкил, C(O)N(R6)OR7, OC1-C3-алкилен-C(O)OH, OC1-C3-алкилен-C(O)OC1-C3-алкил, OC1-C3-алкилен-C(O)N(R6)OR7, S(O0-2)C1-C3-алкил, CR8=N-OR9, CR8=NR12или CR8=N-ONO2; R3представляет собой C1-C4-алкил, необязательно замещенный F, C1-C3-алкокси, C3-циклоалкилом; R4представляет собой C1-C6-алкил, необязательно замещенный C3-C6-циклоалкилом, C1-C6-алкокси, F, ONO, ONO2; R5представляет собой SO2NR13R14; R6представляет собой H или C1-C3-алкил; R7представляет собой H, C1-C3-алкил, C1-C3-алкокси; R8представляет собой H, CH3или C2H5; R9представляет собой H, C1-C3-алкил, необязательно замещенный OH, ONO, ONO2, CN, COOH, COOC1-C3-алкилом, C1-C3-алкокси, OC(O)H, OC(O)-C1-C3-алкилом, C(O)N(R6)OR7, OC1-C3-алкилен-C(O)OH; R12представляет собой C1-C3-алкил, необязательно замещенный OH, ONO, ONO2,CN, COOH, COOC1-C3-алкилом, C1-C3-алкокси, OC(O)H, OC(O)-C1-C3-алкилом, C(O)N(R6)OR7, OC1-C3-алкилен-C(O)OH; R13и R14вместе с атомом азота, к которому они присоединены, образуют гетероциклическое кольцо, причем указанное гетероциклическое кольцо выбрано из пиперидина и пиперазина, причем указанное гетероциклическое кольцо необязательно замещено R15; R15представляет собой C1-C6-алкил, необязательно замещенный галогеном, OH, ONO, ONO2, C1-C3-алкокси, C1-C3-галогеналкокси, COOR16, NR17R18, C=NR19; R16представляет собой H или C1-C4-алкил, необязательно замещенный F, OH, ONO, ONO2, NR17R18; R17и R18, каждый независимо, представляют собой H или C1-C4-алкил, необязательно замещенный ONO, ONO2; R19представляет собой C1-C4-алкил, необязательно замещенный F, ONO, ONO2; C3-C6-циклоалкил, кроме того, описана фармацевтическая композиция для ингибирования ФДЭ5 на основе указанных соединений. Технический результат: получены и описаны новые соединения, которые могут найти свое применение для предотвращения заболевания, облегчаемого ингибированием ФДЭ5. 2 н. и 13 з.п. ф-лы, 3 ил., 2 табл., 112 пр.
Description
Настоящее изобретение относится к фармацевтически полезным соединениям, в частности, к соединениям, являющимся активаторами фермента растворимая гуанилатциклаза (рГЦ) и в то же время ингибирующим фосфодиэстеразы циклического гуанозин-3',5'-монофосфата (цГМФ ФДЭ), в частности, тип 5 фосфодиэстеразы циклического гуанозин-3',5'-монофосфата (цГМФ ФДЭ5). Соединения по настоящему изобретению можно применять в различных терапевтических областях, включая эректильную дисфункцию у мужчин (ЭДуМ), приапизм, сексуальную дисфункцию у женщин, болезнь Альцгеймера, легочную артериальную гипертензию (ЛАГ), хроническую тромбоэмболическую легочную гипертензию, ливедоидную васкулопатию, облитерирующий тромбангиит, хроническую анальную трещину, фиброз кожи, глаукому, эндотелиальнауюдисфункцию (ЭД), доброкачественную гиперплазию предстательной железы (ДГПЖ) и симптом нижних мочевых путей (СНМП), приапизм, выпадение волос, кистозный фиброз, заболевание периферических сосудов, сосудистые расстройства, такие как болезнь Рейно, системный склероз (SSc), склеродермию, диабет и, в частности, при легочной артериальной гипертензии (ЛАГ), хронической тромбоэмболической легочной гипертензии, эректильной дисфункции у мужчин, приапизме, половой дисфункции у женщин, заживающих ранах, в частности, хронических заживающих ранах, диабетической стопе, язве при диабетической стопе, ножной язве, диабетической невропатии и пролежневой язве.
УРОВЕНЬ ТЕХНИКИ
Фосфодиэстеразы (ФДЭ) представляют собой ферменты, катализирующие гидролиз и, следовательно, деградацию циклического аденозинмонофосфата (цАМФ) и циклического гуанозинмонофосфата (цГМФ) и тем самым регулирующие внутриклеточные уровни вторичных мессенджеров. Ингибирование ФДЭ приводит к увеличению внутриклеточных концентраций эндогенных цАМФ/цГМФ. Следовательно, ингибирование ФДЭ может опосредовать различные физиологические механизмы на разных уровнях клеток и органов.
Фосфодиэстераза типа 5 (ФДЭ5) гидролизует циклический гуанилатмонофосфат (цГМФ) исключительно до 5' ГМФ. Селективное ингибирование ФДЭ5 было подтверждено при использовании соответствующих подхода и стратегий, направленных на стимулирование ингибирования активности ФДЭ5, в качестве терапевтических средств, в частности, при нейрональных и сердечно-сосудистых заболеваниях. Кроме того, внедрение ингибиторов ФДЭ5 произвело революцию в лечении эректильной дисфункции у мужчин (ЭДуМ) (Dobhal Т, Kaur S, Prakash Sharma О, Hari Kumar SL, Critical Review in Pharmaceutical Sciences (2012) 1(3): 13-27; Palit V, Eardley I, Nature Reviews Urology (2010) 7(11):603-609). Некоторые ингибиторы ФДЭ5 представлены на рынке и охарактеризованы, в частности, для ЭДуМ или легочной гипертензии (ЛГ), в частности, легочной артериальной гипертензии (ЛАГ) (Papapetropoulos A, Hobbs AJ, Topouzis S, British Journal of Pharmacology (2015) 172:1397-1414; Monica FZ, Murad F, Bian K, OA Biochemistry (2014) Mar 11; 2(1):3; Beedimani RS, Kalmath B, Int J Pharm Bio Sci (2014) 5(2): 530-539; Wronski S, Cent European J Urol (2014) 67: 314-318; и ссылки, цитируемые в них). Наиболее яркими примерами ингибиторов ФДЭ5 являются Силденафил, Тадалафил, Варденафил и Мироденафил, описанные, в частности, в WO 99/24433, WO 01/60825, ЕР 995'751 и WO 2011/075655.
Наряду с успехом известных ингибиторов ФДЭ5, все еще существует потребность в дополнительных, в частности, более эффективных лекарствах и их фармацевтических композициях для применения в терапевтическом лечении или профилактике заболеваний, связанных с нарушением баланса цГМФ. Более того, и в целом все еще существует потребность в соединениях и их фармацевтических композициях, полезных для применения в терапевтическом лечении или профилактике заболеваний, связанных с нарушением баланса цГМФ.
Эндотелиальная дисфункция приводит к дисбалансу вазодилататорных и вазоконстрикторных медиаторов, и к преобладанию последних. Одним из ключевых механизмов остается нарушение генерации эндотелиального NO и связанная с этим пониженная активация растворимой гуанилилциклазы (рГЦ) в прилегающих гладкомышечных клетках. Описаны стратегии повышения нарушенных уровней цГМФ путем усиления цГМФ в гладкой мускулатуре сосудов путем улучшения синтеза цГМФ и ингибирования его деградации. Примерами являются комбинации стимуляторов или активаторов рГЦ в сочетании с ингибиторами ФДЭ5, описанные, например, в WO 2010/081647 или US 2002/0182162. Однако соединения, которые стимулируют рГЦ и одновременно ингибируют ФДЭ5, не были описаны.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Мы неожиданно обнаружили, что соединения по настоящему изобретению являются ингибиторами ФДЭ5 с двойным фармакологическим действием, приводящими к высвобождению NO, которые, как полагают, высвобождают NO в дополнение к ингибированию ФДЭ5 более чем аддитивным образом, то есть синергетически. Кроме того, мы неожиданно обнаружили, что соединения по настоящему изобретению при достижении кровотока связываются с белками плазмы с высокой степенью. Такие соединения с высокой степенью связывания не могут проявлять свою биологическую активность, что делает их особенно предрасполагающими к местному применению и местному действию. Синергетическое увеличение уровня цГМФ приводит к сильнодействующим вазодилатации, ангиогенезу и ингибированию эндотелиальной дисфункции (см. Фиг. 1). Таким образом, ожидается, что ингибиторы ФДЭ5 с двойным фармакологическим действием, приводящими к высвобождению NO, по настоящему изобретению, будут особенно полезны при лечении расстройств, при которых образование NO снижено, например, в условиях эндотелиальной дисфункции. Кроме того, ингибиторы ФДЭ5 по настоящему изобретению с двойным фармакологическим действием, приводящие к высвобождению NO, также считаются очень полезными для лечения пациентов с диабетом.
Более того, мы неожиданно обнаружили, что соединения по настоящему изобретению демонстрируют даже значительно более высокую эффективность повышения внутриклеточного цГМФ по сравнению с известными ингибиторами ФДЭ5, такими как силденафил или мироденафил. Вдобавок, мы обнаружили очень высокую степень связывания белков плазмы с несколькими соединениями по настоящему изобретению, что делает их особенно предрасполагающими к местному применению и местному воздействию. Как следствие, новые пирролопиримидоновые соединения по настоящему изобретению являются полезными в терапии и профилактике заболеваний, связанных с нарушением баланса цГМФ.
Из-за сильного и селективного ингибирования ФДЭ5 в сочетании со стимуляцией растворимой гуанилатциклазы, проявляемых соединениями по настоящему изобретению, уровни цГМФ являются повышенными, что, в свою очередь, может вызывать полезное вазодилаторное, антивазоспастическое, антитромбоцитарное, натрийуретическое и диуретическое действие. Кроме того, ингибиторы ФДЭ5 с двойным фармакологическим действием, приводящие к высвобождению NO, допускают высвобождение окислов азота для активации растворимой гуанилатциклазы, а также ингибирование ФДЭ5 более чем аддитивным образом. Таким образом, соединения по настоящему изобретению полезны в различных терапевтических областях, где имеет место нарушение баланса цГМФ и/или ингибирование ФДЭ5 считается полезным. Некоторыми из предпочтительных терапевтических областей являются легочная артериальная гипертензия (ЛАГ), хроническая тромбоэмболическая легочная гипертензия, эректильная дисфункция у мужчин, приапизм, сексуальная дисфункция у женщин, заживающие раны, в частности, хронические заживающие раны, диабетическая стопа, язва при диабетической стопе, ножная язва, Рейно, эректильная дисфункция у мужчин, болезнь Альцгеймера, ливедоидная васкулопатия, облитерирующий тромбангиит, хроническая анальная трещина, фиброз кожи, диабет, выпадение волос, старение кожи, старение сосудов, гипертензия легочной артерии и хроническая сердечная недостаточность. Соединения по настоящему изобретению особенно подходят для местного применения лекарственного средства, как показано на Фиг. 2.
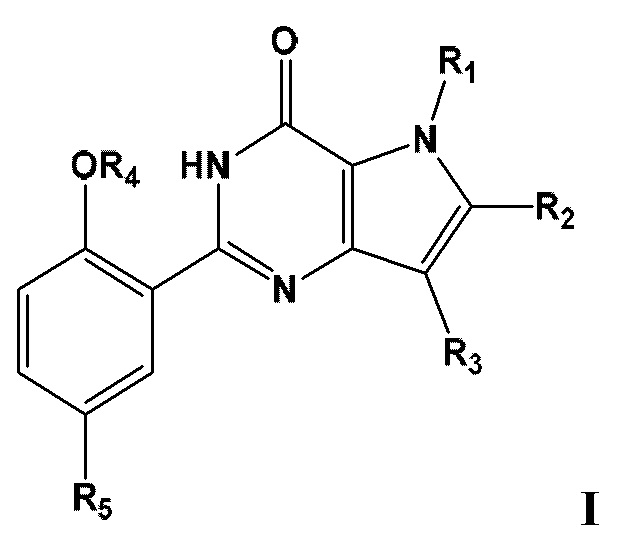
Таким образом, в первом аспекте настоящего изобретения предложено соединение формулы I
или его фармацевтически приемлемую соль, сольват или гидрат, где
по меньшей мере один из R1, R2, R3, R4 или R5, каждый независимо, включает по меньшей мере один фрагмент ONO2 или ONO, и где предпочтительно R1, R2, R3, R4 и R5 вместе включают по меньшей мере два фрагмента ONO2 или ONO;
R1 представляет собой C1-С3-алкил, необязательно замещенный F, С3-С6-циклоалкилом, C1-С3-алкокси, ONO, ONO2;
R2 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2; С(O)ОН, С(O)OC1-С3-алкил, СНО, CN, C(O)N(R6)OR7, CR8=N-OR9, CR8=N-NR10R11, CR8=NR12, CR8=N-ONO2, C1-С3-алкокси; C1-С3-алкилен-Y, причем Y представляет собой ONO, ONO2, C(O)OH, С(O)OC1-С3-алкил, СНО, CN, ОН, ОС(O)Н, ОС(O)-C1-С3-алкил, C(O)N(R6)OR7, OC1-С3-алкилен-С(O)ОН, OC1-С3-алкилен-С(O)OC1-С3-алкил, OC1-С3-алкилен-С(O)N(R6)OR7, S(О0-2)C1-С3-алкил, CR8=N-OR9, CR8=N-NR10R11, CR8=NR12 или CR8=N-ONO2;
R3 представляет собой С1-С4-алкил, необязательно замещенный F, ОН, ONO, ONO2, C1-С3-алкокси, С3-С6-циклоалкилом; С3-С6-циклоалкил, С2-С6-алкенил, С2-С6-алкинил;
R4 представляет собой C1-С6-алкил, необязательно замещенный С3-С6-циклоалкилом, C1-С6-алкокси, F, ONO, ONO2; С2-С6-алкенил, С2- С6-алкинил, С3-С6-циклоалкил;
R5 представляет собой Н, SO2NR13R14, NHSO2NR13R14;
R6 представляет собой Н или C1-С3-алкил;
R7 представляет собой Н, C1-С3-алкил, C1-С3-алкокси, C1-С3-алкил, замещенный фенилом, бензилом или гетероциклическим кольцом, причем указанный фенил, бензил или указанное гетероциклическое кольцо независимо необязательно замещены C1-С3-алкилом, F;
R8 представляет собой Н, СН3 или С2Н5;
R9 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2, CN, СООН, COOC1-С3-алкилом, C1-С3-алкокси, ОС(O)Н, ОС(O)-C1-С3-алкилом, C(O)N(R6)OR7, OC1-С3-алкилен-С(O)ОН, OC1-С3- алкилен-С(O)OC1-С3-алкилом, OC1-С3-алкилен-C(O)N(R6)OR7, S(О0-2)C1-С3-алкилом;
R10 и R11, каждый независимо, представляют собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2, CN, СООН, COOC1-С3, C1-С3-алкокси, ОС(O)Н, OC(O)-C1-С3-алкилом, C(O)N(R6)OR7, OC1-С3-алкилен-С(O)ОН, OC1-С3-алкилен-С(O)OC1-С3-алкилом, OC1-C3-алкилен-C(O)N(R6)OR7, S(О0-2)C1-С3-алкилом; или вместе с атомом азота, к которому они присоединены, образуют гетероциклическое кольцо, причем предпочтительно указанное гетероциклическое кольцо выбрано из азиридина, азетидина, пирролидина, пиперидина, морфолина, пиперазина и гомопиперазина, причем указанное гетероциклическое кольцо необязательно замещено C1-С3-алкилом;
R12 представляет собой C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2, CN, СООН, COOC1-С3-алкилом, C1-С3-алкокси, ОС(O)Н, ОС(O)-C1-С3-алкилом, C(O)N(R6)OR7, OC1-С3-алкилен-С(O)ОН, OC1-С3-алкилен-С(O)OC1-С3-алкилом, OC1-С3-алкилен-C(O)N(R6)OR7, S(О0-2)C1-С3-алкилом;
R13 и R14, каждый независимо, представляют собой Н или C1-С6-алкил, необязательно замещенный F, ОН, ONO, ONO2, СООН, C1-С3-алкокси, С3-С6-циклоалкилом; или вместе с атомом азота, к которому они присоединены, образуют гетероциклическое кольцо, причем предпочтительно указанное гетероциклическое кольцо выбрано из азиридина, азетидина, пирролидина, пиперидина, морфолина, пиперазина, гомопиперазина, 2,5-диазабицикло[2,2,1]гептана или 3,7-диазабицикло[3,3,0]октана, причем указанное гетероциклическое кольцо необязательно замещено R15;
R15 представляет собой C1-С6-алкил, необязательно замещенный галогеном, ОН, ONO, ONO2, C1-С3-алкокси, C1-С3-галогеналкокси, COOR16, NR17R18, C=NR19, или тетразольным фрагментом, необязательно замещенным C1-С3-алкилом; или гетероарильное кольцо, необязательно замещенное F, причем по меньшей мере один гетероатом указанного гетероарильного кольца является азотом;
R16 представляет собой Н или С1-С4-алкил, необязательно замещенный F, ОН, ONO, ONO2, NR17R18 или гетероарильным кольцом, причем по меньшей мере один гетероатом указанного гетероарильного кольца является азотом, и причем предпочтительно указанное гетероарильное кольцо выбрано из пирролидина, пиперидина, пиперазина, морфолина, пиррола и имидазола, причем атом азота напрямую связан с С1-С4-алкилом;
R17 и R18, каждый независимо, представляют собой Н или C1-С4-алкил, необязательно замещенный ONO, ONO2;
R19 представляет собой C1-С4-алкил, необязательно замещенный F, ONO, ONO2; С3-С6-циклоалкил.
В дополнительном аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая по меньшей мере одно из соединений формулы I по настоящему изобретению или его фармацевтически приемлемую соль, сольват или гидрат и фармацевтически приемлемый наполнитель, вспомогательное вещество или носитель.
В другом аспекте настоящего изобретения предложено соединение формулы I или фармацевтическая композиция, или фармацевтически приемлемая соль, сольват или гидрат указанного соединения для применения в качестве лекарственного средства.
В другом аспекте настоящего изобретения предложено соединение формулы I или фармацевтическая композиция, или фармацевтически приемлемая соль, сольват или гидрат указанного соединения для применения в способе лечения или предотвращения заболевания, облегчаемого ингибированием ФДЭ5, у человека или у млекопитающего, не являющегося человеком, предпочтительно у человека, причем предпочтительно указанное заболевание выбрано из заживающих ран, хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, болезни Рейно, эректильной дисфункции у мужчин, приапизма, половой дисфункции у женщин, выпадения волос, старения кожи, старения сосудов, гипертензии легочной артерии; ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи, стабильной, нестабильной и вариантной (Принцметала) стенокардии; гипертензии, легочной гипертензии, хронической обструктивной болезни легких, застойной сердечной недостаточности, почечной недостаточности, атеросклероза, состояния пониженной проходимости кровеносных сосудов, заболевания периферических сосудов, сосудистых расстройств, системного склероза (SSc), склеродермии, локализованной склеродермии, воспалительных заболеваний, инсульта, бронхита, хронической астмы, аллергической астмы, аллергического ринита, диабетической невропатии, идиопатического легочного фиброза (ИЛФ), болезни Пейрони, глаукомы или заболевания, характеризующегося нарушениями моторики кишечника, такого как синдром раздраженного кишечника, фиброза печени, болезни Альцгеймера и хронической сердечной недостаточности.
В другом аспекте настоящего изобретения предложено соединение формулы I или фармацевтическая композиция, или фармацевтически приемлемая соль, сольват или гидрат указанного соединения для применения в способе лечения или предотвращения заболевания у человека или у млекопитающего, не являющегося человеком, предпочтительно у человека, где указанное заболевание выбрано из заживающих ран, хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, болезни Рейно, эректильной дисфункции у мужчин, приапизма, половой дисфункции у женщин, выпадения волос, старения кожи, старения сосудов, гипертензии легочной артерии; ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи, стабильной, нестабильной и вариантной (Принцметала) стенокардии; гипертензии, легочной гипертензии, хронической обструктивной болезни легких, застойной сердечной недостаточности, почечной недостаточности, атеросклероза, состояния пониженной проходимости кровеносных сосудов, заболевания периферических сосудов, сосудистых расстройств, системного склероза (SSc), склеродермии, локализованной склеродермии, воспалительных заболеваний, инсульта, бронхита, хронической астмы, аллергической астмы, аллергического ринита, диабетической невропатии, идиопатического легочного фиброза (ИЛФ), болезни Пейрони, глаукомы или заболевания, характеризующегося нарушениями моторики кишечника, такого как синдром раздраженного кишечника, фиброза печени, болезни Альцгеймера и хронической сердечной недостаточности, причем предпочтительно указанное заболевание выбрано из легочной артериальной гипертензии (ЛАГ), хронической тромбоэмболической легочной гипертензии, эректильной дисфункции у мужчин, приапизма и половой дисфункции у женщин, ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи, заживающих ран, хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, диабетической невропатии и пролежневой язвы.
Дополнительные аспекты и варианты осуществления настоящего изобретения станут очевидными по мере продолжения настоящего описания.
ОПИСАНИЕ ФИГУР
Фиг. 1: Ингибирование ФДЭ5 и активация растворимой гуанилатциклазы одной молекулой
Фиг. 2: Ингибиторы ФДЭ5 с двойным фармакологическим действием, приводящие к высвобождению NO, в случае нарушенного баланса цГМФ при заболеваниях с нарушенным балансом цГМФ.
Фиг. 3: Измерения зависящего от концентрации циклического гуанозин-3' -5' - монофосфата (цГМФ) в клетках гладких мышц легочной артерии человека (hPASMC), инкубированных в присутствии соединений по настоящему изобретению или контрольного ингибитора ФДЭ5 силденафила и мироденафила.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Если не указано иное, все технические и научные термины, используемые в настоящем изобретении, имеют те же значения, которые обычно понимает средний специалист в области техники, к которой относится данное изобретение.
Мы неожиданно обнаружили, что соединения по настоящему изобретению являются ингибиторами ФДЭ5 с двойным фармакологическим действием, приводящими к высвобождению NO, которые, как полагают, высвобождают NO в дополнение к ингибированию ФДЭ5, что приводит к более чем аддитивной стимуляции повышения уровня внутриклеточного цГМФ. Кроме того, соединения по настоящему изобретению проявляют даже значительно более высокую эффективность стимуляции цГМФ по сравнению с известными ингибиторами ФДЭ5 с одиночным фармакологическим действием, такими как силденафил или мироденафил. Кроме того, соединения по настоящему изобретению с высокой степенью связываются с белками плазмы, при достижении кровотока, что делает их особенно предрасполагающими к местному применению и местному действию.
Таким образом, в первом аспекте настоящего изобретения предложено соединение формулы I
или его фармацевтически приемлемую соль, сольват или гидрат, где
по меньшей мере один из R1, R2, R3, R4 или R5, каждый независимо, включает по меньшей мере один фрагмент ONO2 или ONO, и где предпочтительно R1, R2, R3, R4 и R5 вместе включают по меньшей мере два фрагмента ONO2 или ONO;
R1 представляет собой C1-С3-алкил, необязательно замещенный F, С3-С6-циклоалкилом, C1-С3-алкокси, ONO, ONO2;
R2 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2; С(O)ОН, С(O)OC1-С3-алкил, СНО, CN, C(O)N(R6)OR7, CR8=N-OR9, CR8=N-NR10R11, CR8=NR12, CR8=N-ONO2, C1-С3-алкокси; С1-С3-алкилен-Y, причем Y представляет собой ONO, ONO2, С(O)ОН, С(O)OC1-С3-алкил, СНО, CN, ОН, ОС(O)Н, ОС(O)-C1-С3-алкил, C(O)N(R6)OR7, OC1-С3-алкилен-С(O)ОН, OC1-С3-алкилен-С(O)OC1-С3-алкил, OC1-С3-алкилен-C(O)N(R6)OR7, S(О0-2)C1-С3-алкил, CR8=N-OR9, CR8=N-NR10R11, CR8=NR12 или CR8=N-ONO2;
R3 представляет собой С1-С4-алкил, необязательно замещенный F, ОН, ONO, ONO2, C1-С3-алкокси, С3-С6-циклоалкилом; С3-С6-циклоалкил, С2-С6-алкенил, С2-С6-алкинил;
R4 представляет собой C1-С6-алкил, необязательно замещенный С3-С6-циклоалкилом, C1-С6-алкокси, F, ONO, ONO2; С2-С6-алкенил, С2-С6-алкинил, С3-С6-циклоалкил;
R5 представляет собой Н, SO2NR13R14, NHSO2NR13R14;
R6 представляет собой Н или C1-С3-алкил;
R7 представляет собой Н, C1-С3-алкил, C1-С3-алкокси, C1-С3-алкил, замещенный фенилом, бензилом или гетероциклическим кольцом, причем указанный фенил, бензил или указанное гетероциклическое кольцо независимо необязательно замещены C1-С3-алкилом, F;
R8 представляет собой Н, СН3 или С2Н5;
R9 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2, CN, СООН, COOC1-С3-алкилом, C1-С3-алкокси, ОС(O)Н, ОС(O)-C1-С3-алкилом, C(O)N(R6)OR7, OC1-С3-алкилен-С(O)ОН, OC1-С3-алкилен-С(O)OC1-С3-алкилом, OC1-С3-алкилен-C(O)N(R6)OR7, S(О0-2)C1-С3-алкилом;
R10 и R11, каждый независимо, представляют собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2, CN, СООН, COOC1-С3, C1-С3-алкокси, ОС(O)Н, OC(O)-C1-С3-алкилом, C(O)N(R6)OR7, OC1-С3-алкилен-С(O)ОН, OC1-С3-алкилен-С(O)OC1-С3-алкилом, OC1-C3-алкилен-C(O)N(R6)OR7, S(О0-2)C1-С3-алкилом; или вместе с атомом азота, к которому они присоединены, образуют гетероциклическое кольцо, причем предпочтительно указанное гетероциклическое кольцо выбрано из азиридина, азетидина, пирролидина, пиперидина, морфолина, пиперазина и гомопиперазина, причем указанное гетероциклическое кольцо необязательно замещено C1-С3-алкилом;
R12 представляет собой C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2, CN, СООН, COOC1-С3-алкилом, C1-С3-алкокси, ОС(O)Н, ОС(O)-C1-С3-алкилом, C(O)N(R6)OR7, OC1-С3-алкилен-С(O)ОН, OC1-С3-алкилен-С(O)OC1-С3-алкилом, OC1-С3-алкилен-C(O)N(R6)OR7, S(О0-2)C1-С3-алкилом;
R13 и R14, каждый независимо, представляют собой Н или C1-С6-алкил, необязательно замещенный F, ОН, ONO, ONO2, СООН, C1-С3-алкокси, С3-С6-циклоалкилом; или вместе с атомом азота, к которому они присоединены, образуют гетероциклическое кольцо, причем предпочтительно указанное гетероциклическое кольцо выбрано из азиридина, азетидина, пирролидина, пиперидина, морфолина, пиперазина, гомопиперазина, 2,5-диазабицикло[2,2,1]гептана или 3,7-диазабицикло[3,3,0]октана, причем указанное гетероциклическое кольцо необязательно замещено R15;
R15 представляет собой C1-С6-алкил, необязательно замещенный галогеном, ОН, ONO, ONO2, C1-С3-алкокси, C1-С3-галогеналкокси, COOR16, NR17R18, C=NR19, или тетразольным фрагментом, необязательно замещенным C1-С3-алкилом; или гетероарильное кольцо, необязательно замещенное F, причем по меньшей мере один гетероатом указанного гетероарильного кольца является азотом;
R16 представляет собой Н или С1-С4-алкил, необязательно замещенный F, ОН, ONO, ONO2, NR17R18 или гетероарильным кольцом, причем по меньшей мере один гетероатом указанного гетероарильного кольца является азотом, и причем предпочтительно указанное гетероарильное кольцо выбрано из пирролидина, пиперидина, пиперазина, морфолина, пиррола и имидазола, причем атом азота напрямую связан с С1-С4-алкилом;
R17 и R18, каждый независимо, представляют собой Н или С1-С4-алкил, необязательно замещенный ONO, ONO2;
R19 представляет собой С1-С4-алкил, необязательно замещенный F, ONO, ONO2; С3-С6-циклоалкил.
Таким образом, в дополнительном аспекте настоящего изобретения предложено соединение формулы I
где
по меньшей мере один из R1, R2, R3, R4 или R5, каждый независимо, включает по меньшей мере один фрагмент ONO2 или ONO, и где предпочтительно R1, R2, R3, R4 и R5 вместе включают по меньшей мере два фрагмента ONO2 или ONO;
R1 представляет собой C1-С3-алкил, необязательно замещенный F, С3-С6-циклоалкилом, C1-С3-алкокси, ONO, ONO2;
R2 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2; С(O)ОН, С(O)OC1-С3-алкил, СНО, CN, C(O)N(R6)OR7, CR8=N-OR9, CR8=N-NR10R11, CR8=NR12, CR8=N-ONO2, C1-С3-алкокси; С1-С3-алкилен-Y, причем Y представляет собой ONO, ONO2, С(O)ОН, С(O)OC1-С3-алкил, СНО, CN, ОН, ОС(O)Н, ОС(O)-C1-С3-алкил, C(O)N(R6)OR7, OC1-С3-алкилен-С(O)ОН, OC1-С3-алкилен-С(O)OC1-С3-алкил, OC1-С3-алкилен-C(O)N(R6)OR7, S(О0-2)C1-С3-алкил, CR8=N-OR9, CR8=N-NR10R11, CR8=NR12 или CR8=N-ONO2;
R3 представляет собой С1-С4-алкил, необязательно замещенный F, ОН, ONO, ONO2, C1-С3-алкокси, С3-С6-циклоалкилом; С3-С6-циклоалкил, С2-С6-алкенил, С2-С6-алкинил;
R4 представляет собой C1-С6-алкил, необязательно замещенный С3-С6-циклоалкилом, C1-С6-алкокси, F, ONO, ONO2; С2-С6-алкенил, С3-С6-алкинил, С3-С6-циклоалкил;
R5 представляет собой Н, SO2NR13R14, NHSO2NR13R14;
R6 представляет собой Н или C1-С3-алкил;
R7 представляет собой Н, C1-С3-алкил, C1-С3-алкокси, C1-С3-алкил, замещенный фенилом, бензилом или гетероциклическим кольцом, причем указанный фенил, бензил или указанное гетероциклическое кольцо независимо необязательно замещены C1-С3-алкилом, F;
R8 представляет собой Н, СН3 или С2Н5;
R9 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2, CN, СООН, COOC1-С3-алкилом, C1-С3-алкокси, ОС(O)Н, ОС(O)-C1-С3-алкилом, C(O)N(R6)OR7, OC1-С3-алкилен-С(O)OH, OC1-С3- алкилен-С(O)OC1-С3-алкилом, OC1-С3-алкилен-С(O)N(R6)OR7, S(О0-2)C1-С3-алкилом;
R10 и R11, каждый независимо, представляют собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2, CN, СООН, COOC1-С3, C1-С3-алкокси, ОС(O)Н, OC(O)-C1-С3-алкилом, C(O)N(R6)OR7, OC1-С3-алкилен-С(O)ОН, OC1-С3-алкилен-С(O)OC1-С3-алкилом, OC1-C3-алкилен-C(O)N(R6)OR7, S(О0-2)C1-С3-алкилом; или вместе с атомом азота, к которому они присоединены, образуют гетероциклическое кольцо, причем предпочтительно указанное гетероциклическое кольцо выбрано из азиридина, азетидина, пирролидина, пиперидина, морфолина, пиперазина и гомопиперазина, причем указанное гетероциклическое кольцо необязательно замещено C1-С3-алкилом;
R12 представляет собой C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2, CN, СООН, COOC1-С3-алкилом, C1-С3-алкокси, ОС(O)Н, ОС(O)-C1-С3-алкилом, C(O)N(R6)OR7, OC1-С3-алкилен-С(O)ОН, OC1-С3-алкилен-С(O)OC1-С3-алкилом, OC1-С3-алкилен-C(O)N(R6)OR7, S(О0-2)C1-С3-алкилом;
R13 и R14, каждый независимо, представляют собой Н или C1-С6-алкил, необязательно замещенный F, ОН, ONO, ONO2, СООН, C1-С3-алкокси, С3-С6-циклоалкилом; или вместе с атомом азота, к которому они присоединены, образуют гетероциклическое кольцо, причем предпочтительно указанное гетероциклическое кольцо выбрано из азиридина, азетидина, пирролидина, пиперидина, морфолина, пиперазина, гомопиперазина, 2,5-диазабицикло[2,2,1]гептана или 3,7-диазабицикло[3,3,0]октана, причем указанное гетероциклическое кольцо необязательно замещено R15;
R15 представляет собой C1-С6-алкил, необязательно замещенный галогеном, ОН, ONO, ONO2, C1-С3-алкокси, C1-С3-галогеналкокси, COOR16, NR17R18, C=NR19, или тетразольным фрагментом, необязательно замещенным C1-С3-алкилом; или гетероарильное кольцо, необязательно замещенное F, причем по меньшей мере один гетероатом указанного гетероарильного кольца является азотом;
R16 представляет собой Н или С1-С4-алкил, необязательно замещенный F, ОН, ONO, ONO2, NR17R18 или гетероарильным кольцом, причем по меньшей мере один гетероатом указанного гетероарильного кольца является азотом, и причем предпочтительно указанное гетероарильное кольцо выбрано из пирролидина, пиперидина, пиперазина, морфолина, пиррола и имидазола, причем атом азота напрямую связан с С1-С4-алкилом;
R17 и R18, каждый независимо, представляют собой Н или С1-С4-алкил, необязательно замещенный ONO, ONO2;
R19 представляет собой С1-С4-алкил, необязательно замещенный F, ONO, ONO2; С3-С6-циклоалкил.
В контексте настоящего изобретения, термин «алкил» относится к радикалу прямой или разветвленной углеводородной цепи, состоящей исключительно из атомов углерода и водорода, не содержащей ненасыщенности, имеющей обычно и предпочтительно от одного до шести атомов углерода (например, C1-6-алкил), и который обычно присоединен к остальной части молекулы одинарной связью. При любом появлении в настоящем документе, числовой диапазон, такой как «от 1 до 6», указывает на каждое целое число в данном диапазоне. Например, «от 1 до 6 атомов углерода» означает, что алкильная группа может состоять из 1 атома углерода, 2 атомов углерода, 3 атомов углерода и т.д., вплоть до 6 атомов углерода включительно, хотя указанное определение также предназначено охватывать употребление термина «алкил», где числового диапазон не обозначен конкретно. Типичные алкильные группы включают, но не ограничиваются ими, метил, этил, н-пропил, проп-2-ил, н-бутил, бут-2-ил, 2-метилпроп-1-ил или 2 -метилпроп-2-ил. Примеры алкокси включают метокси, этокси, пропокси, изопропокси, н-бутокси, втор-бутокси, дареда-бутокси, н-пентокси, нео-пентокси, н-гексокси.
В контексте настоящего изобретения, термин «алкилен» относится к бирадикалу прямой или разветвленной углеводородной цепи, полученному из алкила, как определено в настоящем изобретении, где один водород указанного алкила отщеплен с образованием второго радикала указанного алкилена. Примерами алкилена, в качестве иллюстрации, являются -СН2-, -СН2-СН2-, -СН(СН3)-, -СН2-СН2-СН2-, -СН(СН3)-СН2- или -СН(СН2СН3)-.
Каждый циклоалкильный фрагмент может находиться в моно- или бициклической форме, обычно и предпочтительно в моноциклической форме, и предпочтительно содержит от 3 до 8 атомов углерода, более предпочтительно от 3 до 7 атомов углерода. Примеры моноциклических циклоалкильных фрагментов включают циклопропил, циклобутил и циклогексил.
Каждый алкенильный фрагмент, либо один, либо как часть большего фрагмента, такого как алкенилокси или алкенилен, представляет собой прямую или разветвленную цепь и предпочтительно представляет собой С2-С6-алкенил, более предпочтительно С2-С4-алкенил. Каждый фрагмент может иметь (E)- или (Z)-конфигурацию. Примеры включают винил и аллил. Таким образом, соединение по настоящему изобретению, содержащее алкенильный фрагмент, может включать, если данное условие применимо, либо указанное соединение с указанным алкенильным фрагментом в его (E)-конфигурации, либо указанное соединение с указанным алкенильным фрагментом в его (Z)-конфигурации, либо их смеси в любом соотношении.
Каждый алкинильный фрагмент, либо один, либо как часть большего фрагмента, такого как алкинилокси, представляет собой прямую или разветвленную цепь и предпочтительно представляет собой С2-С6-алкинил, более предпочтительно С2-С4-алкинил. Примерами являются этинил и пропаргил.
Термин «ONO2» относится к нитратному фрагменту *-O-NO2, как описано в настоящем изобретении, где * указывает на присоединение к первичной структуре и остальной части молекулы. Предпочтительно, указанный ONO2 представляет собой концевой заместитель ONO2.
Термин «ONO» относится к нитритному фрагменту *-O-NO, как описано в настоящем изобретении, где * указывает на присоединение к первичной структуре и остальной части молекулы. Предпочтительно, указанный ONO представляет собой концевой заместитель ONO.
Термин «алкокси» относится к группе -О-алкил, обычно включающей от 1 до 6 атомов углерода с прямой, разветвленной конфигурацией и их комбинацией, присоединенные к первичной структуре через кислород, также называемый C1-6-алкокси или O-C1-6-алкил. Примеры включают, но не ограничиваются ими, метокси, этокси, пропокси, изопропокси, циклопропилокси и циклогексилокси. Как описано в настоящем изобретении, алкокси может включать дополнительные заместители, такие как атомы галогена, что приводит к галогеналкокси фрагментам.
Галоген представляет собой фтор, хлор, бром или йод.
Каждый галогеналкильный фрагмент, либо один, либо как часть большего фрагмента, такого как галогеналкокси, представляет собой алкильный фрагмент, замещенный одним или несколькими одинаковыми или разными атомами галогена. Примеры включают дифторметил, трифторметил, хлордифторметил и 2,2,2-трифторэтил.
Термин «гетероциклическое кольцо» относится к насыщенному или частично ненасыщенному карбоциклическому кольцу, содержащему от одного до четырех гетероатомов, выбранных из азота, кислорода и серы в качестве членов кольца. Такие кольца не содержат смежных атомов кислорода, смежных атомов серы или смежных атомов кислорода и серы внутри кольца. Предпочтительными примерами являются азиридин, азетидин, пирролидин, пиперидин, морфолин, пиперазин, гомопиперазин, тетрагидрофуран, диоксан, 2,5-диазабицикло[2,2,1]гептан и 3,7-диазабицикло[3,3,0]октан, более предпочтительными являются азиридин, азетидин, пирролидин, пиперидин, морфолин, пиперазин, гомопиперазин, 2,5-диазабицикло[2,2,1]гептан и 3,7-диазабицикло[3,3,0]октан.
Термин «гетероарил» относится к ароматической кольцевой системе, содержащей по меньшей мере один гетероатом и предпочтительно до трех гетероатомов, выбранных из азота, кислорода и серы в качестве членов кольца. Гетероарильные кольца не содержат смежных атомов кислорода, смежных атомов серы или смежных атомов кислорода и серы внутри кольца. Предпочтительные примеры включают пирролидин, пиперидин, пиперазин, морфолин, пиридин, пиримидин, пиразин, пиридазин, пиррол, пиразол, имидазол, триазол, изоксазол, оксазол, изотиазол, тиазол, тетразол, фуран и тиофен, более предпочтительно пирролидин, пиперидин, пиперазин, морфолин, пиррол и имидазол.
Если фрагмент назван необязательно замещенным, предпочтительно у фрагмента необязательно присутствуют 1-5 заместителей, более предпочтительно необязательно присутствуют 1-3 заместителя, еще более предпочтительно необязательно присутствуют 1 или 2 заместителя. Если фрагмент назван необязательно замещенным, и когда присутствует более одного заместителя для указанного необязательного замещения указанного фрагмента, указанные несколько заместителей могут быть одинаковыми или разными.
Некоторые соединения формулы I по настоящему изобретению могут содержать один или два или более центров хиральности, и такие соединения могут быть предложены в виде чистых энантиомеров или чистых диастереоизомеров, а также их смесей в любом соотношении. Соединения по настоящему изобретению также включают все таутомерные формы соединений формулы I. Соединения формулы I также могут быть сольватированными, особенно гидратированными, что также включено в соединения формулы I. Сольватация и гидратация могут происходить во время процесса получения.
Как следствие, соединения по настоящему изобретению и, таким образом, соединения формулы I включают стереоизомеры, геометрические изомеры и таутомеры. Кроме того, соединения по настоящему изобретению и, таким образом, соединения формулы I включают сольваты или гидраты, фармацевтически приемлемые соли и сольваты или гидраты их солей.
Соединения формулы I по настоящему изобретению включают фармацевтически приемлемые соли указанных соединений. В частности, в контексте настоящего изобретения, термин «фармацевтически приемлемая соль» относится к фармацевтически приемлемым органическим или неорганическим солям соединения по настоящему изобретению, в частности к солям присоединения кислоты. Типичные соли включают, но не ограничиваются ими, соли физиологически приемлемых минеральных кислот, таких как хлороводородная кислота, серная кислота, азотная кислота и фосфорная кислота, или соли органических кислот, таких как метансульфоновая кислота, n-толуолсульфоновая кислота, молочная кислота, яблочная кислота, винная кислота, уксусная кислота, трифторуксусная кислота, лимонная кислота, янтарная кислота, фумаровая кислота, малеиновая кислота и салициловая кислота. Дополнительными примерами фармакологически приемлемых солей соединений формулы I являются соли щелочных и щелочноземельных металлов, такие как, например, соли натрия, калия, лития, кальция или магния, соли аммония или соли органических оснований, такие как, например, соли метиламина, диметиламина, триэтиламина, пиперидина, этилендиамина, лизина, гидроксида холина, меглюмина, морфолина или аргинина. Дополнительные примеры фармацевтически приемлемых солей соединений формулы I включают гидрохлорид, гидробромид, сульфат, бисульфат, фосфат, гидрофосфат, нитрат, ацетат, бензоат, сукцинат, фумарат, малеат, лактат, цитрат, бензолсульфонат, n-толуолсульфонат или подобные.
«Сольват» относится к ассоциации или комплексу из одной или нескольких молекул растворителя и соединения по настоящему изобретению. Примеры растворителей, образующих сольваты, включают, но не ограничиваются ими, воду, изопропанол, этанол, метанол, диметилсульфоксид (ДМСО), этилацетат, уксусную кислоту и этаноламин. Термин «гидрат» относится к комплексу, где молекулой растворителя является вода.
В предпочтительном варианте осуществления настоящего изобретения, указанное соединение формулы I содержит ровно один фрагмент ONO2. В другом предпочтительном варианте осуществления настоящего изобретения, указанное соединение формулы I содержит ровно один фрагмент ONO. В предпочтительном варианте осуществления настоящего изобретения, указанное соединение формулы I содержит, по меньшей мере, два фрагмента, выбранные из фрагментов ONO2 или ONO. В другом предпочтительном варианте осуществления настоящего изобретения, указанное соединение формулы I содержит ровно два фрагмента ONO2 или два фрагмента ONO. В другом предпочтительном варианте осуществления настоящего изобретения, указанное соединение формулы I содержит ровно один фрагмент ONO2 и один фрагмент ONO. В другом предпочтительном варианте осуществления настоящего изобретения, указанное соединение формулы I включает, по меньшей мере, три фрагмента, выбранных из фрагментов ONO2 или ONO. В другом предпочтительном варианте осуществления настоящего изобретения, указанное соединение формулы I содержит ровно три ONO2 фрагмента или три ONO фрагмента. В другом предпочтительном варианте осуществления настоящего изобретения, указанное соединение формулы I содержит ровно три фрагмента, выбранных из фрагментов ONO2 или ONO.
В предпочтительном варианте осуществления настоящего изобретения, R1 представляет собой C1-С3-алкил, замещенный ONO2. В дополнительном предпочтительном варианте осуществления настоящего изобретения, R1 представляет собой C1-С3-алкил. В дополнительном предпочтительном варианте осуществления, R1 представляет собой СН3 или С2Н5. В дополнительном очень предпочтительном варианте осуществления, R1 представляет собой СН3. В дополнительном очень предпочтительном варианте осуществления, R1 представляет собой С2Н5.
В дополнительном предпочтительном варианте осуществления, указанный R2 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2; С(O)ОН, С(O)OC1-С3-алкил, СНО, CN, C(O)N(R6)OR7, CR8=N-OR9, CR8=N-NR10R11, CR8=NR12, CR8=N-ONO2, C1-С3-алкокси; С1-С3-алкилен-Y, причем Y представляет собой ONO, ONO2, С(O)ОН, С(O)OC1-С3-алкил, СНО, CN, ОН, ОС(O)Н, ОС(O)-C1-С3-алкил, C(O)N(R6)OR7, OC1-С3-алкилен-С(O)ОН, OC1-С3-алкилен-С(O)OC1-С3-алкил, OC1-С3-алкилен-C(O)N(R6)OR7, S(О0-2)C1-С3-алкил, CR8=N-OR9, CR8=N-NR10R11, CR8=NR12 или CR8=N-ONO2.
В дополнительном предпочтительном варианте осуществления, R7 представляет собой Н, C1-С3-алкил, C1-С3-алкокси, C1-С3-алкил, замещенный фенилом, бензилом или гетероциклическим кольцом, выбранным из азиридина, азетидина, пирролидина, пиперидина, морфолина, пиперазина, гомопиперазина, 2,5-диазабицикло[2,2,1]гептана и 3,7-диазабицикло[3,3,0]октана, причем указанный фенил, бензил или указанное гетероциклическое кольцо независимо необязательно замещены C1-С3-алкилом, F. В дополнительном предпочтительном варианте осуществления, R7 представляет собой Н, C1-С3-алкил, C1-С3-алкокси, C1-С3-алкил, замещенный фенилом, бензилом или гетероциклическим кольцом, выбранным из пирролидина, пиперидина, морфолина, пиперазина, гомопиперазина, причем указанный фенил, бензил или указанное гетероциклический кольцо независимо необязательно замещены C1-С3-алкилом.
В дополнительном предпочтительном варианте осуществления, R9 представляет собой Н, C1-С3-алкил, замещенный ОН, CN, СООН, COOC1-С3-алкилом, C1-С3-алкокси, ОС(O)Н, ОС(O)-C1-С3-алкилом, C(O)N(R6)OR7, OC1-С3-алкилен-С(O)ОН, OC1-С3-алкилен-С(O)OC1-С3-алкилом, OC1-C3-алкилен-C(O)N(R6)OR7, S(О0-2)C1-С3-алкилом. В дополнительном предпочтительном варианте осуществления, указанный R9 представляет собой Н, C1-С3-алкил, замещенный ОН, CN, СООН, COOC1-С3-алкилом, C1-С3-алкокси, ОС(O)Н, ОС(O)-C1-С3-алкилом, C(O)N(R6)OR7, OC1-С3-алкилен-С(O)ОН, OC1-С3-алкилен-С(O)OC1-С3-алкил, OC1-C3-алкилен-C(O)N(R6)OR7.
В дополнительном предпочтительном варианте осуществления, указанные R10 и R11, каждый независимо, представляют собой Н, C1-С3-алкил, необязательно замещенный ОН, CN, СООН, COOC1-С3, C1-С3-алкокси, ОС(O)Н, ОС(O)-C1-С3-алкилом, C(O)N(R6)OR7, OC1-С3-алкилен-С(O)ОН, OC1-С3-алкилен-С(O)OC1-С3-алкилом, OC1-С3-алкилен-C(O)N(R6)OR7, S(О0-2)C1-С3-алкил; или вместе с атомом азота, к которому они присоединены, образуют гетероциклическое кольцо, причем предпочтительно указанное гетероциклическое кольцо выбрано из азиридина, азетидина, пирролидина, пиперидина, морфолина, пиперазина и гомопиперазина, причем указанное гетероциклическое кольцо необязательно замещено C1-С3-алкилом. В дополнительном предпочтительном варианте осуществления, указанные R10 и R11, каждый независимо, представляют собой Н, C1-С3-алкил, необязательно замещенный ОН, CN, СООН, COOC1-С3, C1-С3-алкокси, ОС(O)Н, ОС(O)-C1-С3-алкилом, C(O)N(R6)OR7, OC1-С3-алкилен-С(O)ОН, OC1-С3-алкилен-С(O)OC1-С3-алкилом, OC1-C3-алкилен-C(O)N(R6)OR7, S(О0-2)C1-С3-алкилом; или вместе с атомом азота, к которому они присоединены, образуют гетероциклическое кольцо, причем предпочтительно указанное гетероциклическое кольцо выбрано из пирролидина, пиперидина, морфолина, пиперазина и гомопиперазина, причем указанное гетероциклическое кольцо необязательно замещено C1-С3-алкилом.
В дополнительном предпочтительном варианте осуществления, указанный R2 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2; С(O)ОН, С(O)OC1-С3-алкил, СНО, CN, CR8=N-OR9, CR8=N-NR10R11, CR8=NR12, CR8=N-ONO2, C1-С3-алкокси; C1-С3-алкилен-Y, причем Y представляет собой ONO, ONO2, СНО, CN, ОН, ОС(O)Н, OC1-С3-алкилен-С(O)ОН, OC1-C3-алкилен-C(O)N(R6)OR7, ОС(O)-C1-С3-алкил, С(O)OC1-С3-алкил, C(O)N(R6)OR7, CR8=N-OR9, CR8=N-NR10R11, CR8=NR12 или CR8=N-ONO2, причем указанные R6 и R8, каждый независимо, предпочтительно представляют собой Н или СН3.
В дополнительном предпочтительном варианте осуществления, указанный R2 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2; СНО, CN, CR8=N-OR9, CR8=N-NR10R11, C1-С3-алкокси; C1-С3-алкилен-Y, причем Y представляет собой ONO, ONO2, СНО, CN, ОН, ОС(O)Н, С(O)OC1-С3-алкил, CR8=N-OR9, CR8=N-NR10R11 или CR8=N-ONO2.
В дополнительном предпочтительном варианте осуществления, указанный R2 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2; СНО, CN, CR8=N-OR9, CR8=N-NR10R11, C1-С3-алкокси; C1-С3-алкилен-Y, причем Y представляет собой ONO, ONO2, СНО, CN, ОН, ОС(O)Н, С(O)OC1-С3-алкил, CR8=N-OR9, CR8=N-NR10R11 или CR8=N-ONO2, причем R6 и R8, каждый независимо, представляют собой Н или СН3. R9 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2, CN, СООН, C1-С3-алкокси, ОС(O)Н, ОС(O)-C1-С3-алкилом; R10 и R11, каждый независимо, представляют собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2, CN, СООН, C1-С3-алкокси, ОС(O)Н, ОС(O)-C1-С3-алкилом.
В дополнительном очень предпочтительном варианте осуществления, указанный R2 представляет собой Н, СНО, CN, C1-С3-алкокси, C1-С3-алкокси, необязательно замещенный ONO2; CR8=N-OR9, предпочтительно (E)-CR8=N-OR9, причем указанный R8 представляет собой Н или СН3, причем предпочтительно указанный R8 представляет собой Н, и причем указанный R9 представляет собой Н или C1-С3-алкил, необязательно замещенный ОН или C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2, CN, СООН, COOC1-С3-алкилом, ОС(O)Н, ОС(O)-C1-С3-алкилом.
В дополнительном очень предпочтительном варианте осуществления, указанный R2 представляет собой Н, СНО, CN, C1-С3-алкокси, C1-С3-алкокси, необязательно замещенный ONO2; CH=N-OR9, предпочтительно (E)-CH=N-OR9, причем указанный R9 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2, CN, СООН, COOC1-С3-алкилом, ОС(O)Н, ОС(O)-C1-С3-алкилом.
В дополнительном очень предпочтительном варианте осуществления, указанный R2 представляет собой Н, СНО, CN, C1-С3-алкокси, C1-С3-алкокси, необязательно замещенный ONO2; CH=N-OR9, предпочтительно (E)-CH=N-OR9, причем указанный R9 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2, CN.
В дополнительном очень предпочтительном варианте осуществления, указанный R2 представляет собой Н, СНО, CN, C1-С3-алкокси, C1-С3-алкокси, необязательно замещенный ONO2; CH=N-OR9, предпочтительно (E)-CH=N-OR9, причем указанный R9 представляет собой Н, C1-С3-алкил, необязательно замещенный ONO2.
В дополнительном очень предпочтительном варианте осуществления, указанный R2 представляет собой Н.
В дополнительном очень предпочтительном варианте осуществления, указанный R2 представляет собой СНО.
В дополнительном очень предпочтительном варианте осуществления, указанный R2 представляет собой C1-С3-алкокси. В дополнительном очень предпочтительном варианте осуществления, указанный R2 представляет собой C1-С3-алкокси, необязательно замещенный ONO2.
В дополнительном очень предпочтительном варианте осуществления, указанный R2 представляет собой метокси (СН2ОН) или этокси (С2Н5ОН).
В дополнительном очень предпочтительном варианте осуществления, указанный R2 представляет собой метокси.
В дополнительном очень предпочтительном варианте осуществления, указанный R2 представляет собой CH=N-OR9, предпочтительно (E)-CH=N-OR9, причем указанный R9 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2, CN, СООН, COOC1-С3-алкилом, ОС(O)Н, ОС(O)-C1-С3-алкилом.
В дополнительном очень предпочтительном варианте осуществления, указанный R2 представляет собой CH=N-OR9, предпочтительно (E)-CH=N-OR9, причем указанный R9 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO2.
В дополнительном очень предпочтительном варианте осуществления, указанный R2 представляет собой CH=N-OR9, предпочтительно (E)-CH=N-OR9, причем указанный R9 представляет собой Н, C1-С3-алкил, необязательно замещенный ONO2.
В дополнительном очень предпочтительном варианте осуществления, указанный R2 представляет собой CH=N-OR9, предпочтительно (E)-CH=N-OR9, причем указанный R9 представляет собой Н.
В другом предпочтительном варианте осуществления, R3 представляет собой С1-С4-алкил, необязательно замещенный ОН, ONO, ONO2, C1-С3-алкокси; С2-С4-алкенил. В другом предпочтительном варианте осуществления, R3 представляет собой C1-С4-алкил, необязательно замещенный F, ОН, ONO, ONO2, C1-С3-алкокси, С3-С6-циклоалкилом. В дополнительном предпочтительном варианте осуществления, R3 представляет собой С2-С3-алкил, необязательно замещенный F, ОН, ONO, ONO2, C1-С3-алкокси, С3-С6-циклоалкилом, С2-С4-алкенилом. В дополнительном предпочтительном варианте осуществления, R3 представляет собой С1-С4-алкил, необязательно замещенный ONO, ONO2 или С3-С5-циклоалкилом. В дополнительном предпочтительном варианте осуществления, R3 представляет собой С1-С4-алкил, необязательно замещенный ONO2 или С3-С5-циклоалкилом. В дополнительном предпочтительном варианте осуществления, R3 представляет собой C1-С4-алкил, необязательно замещенный ONO2. В дополнительном предпочтительном варианте осуществления, R3 представляет собой C1-С4-алкил, очень предпочтительно R3 представляет собой С2-С3-алкил. В очень предпочтительном варианте осуществления, R3 представляет собой н-пропил.
В другом предпочтительном варианте осуществления, R4 представляет собой С1-С4-алкил, необязательно замещенный С3-С6-циклоалкилом, C1-С6-алкокси, F, ONO, ONO2; С2-С4-алкенил. В дополнительном предпочтительном варианте осуществления, R4 представляет собой С1-С4-алкил, необязательно замещенный ONO, ONO2, C1-С6-алкокси или С3-С5-циклоалкилом. В дополнительном предпочтительном варианте осуществления, R4 представляет собой С1-С4-алкил, необязательно замещенный ONO, ONO2 или C1-С6-алкокси. В дополнительном предпочтительном варианте осуществления, R4 представляет собой С1-С4-алкил, необязательно замещенный ONO2 или C1-С6-алкокси. В дополнительном предпочтительном варианте осуществления, R4 представляет собой C1-С4-алкил, замещенный ONO2. В дополнительном предпочтительном варианте осуществления, R4 представляет собой С2-С3-алкил, замещенный ONO2. В дополнительном предпочтительном варианте осуществления, R4 представляет собой этил или н-пропил. В дополнительном очень предпочтительном варианте осуществления, R4 представляет собой этил. В дополнительном очень предпочтительном варианте осуществления, R4 представляет собой н-пропил.
В дополнительном предпочтительном варианте осуществления, R1 представляет собой C1-С3-алкил; R3 представляет собой С1-С4-алкил, необязательно замещенный F, ОН, ONO, ONO2, C1-С3-алкокси, С3-С6-циклоалкилом, С2-С4-алкенилом; и R4 представляет собой С1-С4-алкил, необязательно замещенный С3-С6-циклоалкилом, C1-С3-алкоси, F, ONO, ONO2; С2-С4-алкенил.
В дополнительном предпочтительном варианте осуществления, указанный R1 представляет собой СН3 или С2Н5, предпочтительно R1 представляет собой СН3; R3 представляет собой н-пропил; и R4 представляет собой С1-С4-алкил, необязательно замещенный ONO2 или С3-С5-циклоалкилом, предпочтительно R4 представляет собой этил или н-пропил.
В дополнительном предпочтительном варианте осуществления, указанный R5 представляет собой SO2NR13R14, NHSO2NR13R14. В дополнительном предпочтительном варианте осуществления, указанные R13 и R14 вместе с атомом азота, к которому они присоединены, образуют гетероциклическое кольцо, причем указанное гетероциклическое кольцо предпочтительно выбрано из азиридина, азетидина, пирролидина, пиперидина, морфолина, пиперазина и гомопиперазина, 2,5-диазабицикло[2,2,1]гептана и 3,7-диазабицикло[3,3,0]октана, причем указанное гетероциклическое кольцо необязательно замещено R15; R15 представляет собой С1-С4-алкил, необязательно замещенный галогеном, ОН, ONO, ONO2, C1-С3-алкокси, C1-С3-галогеналкокси, COOR16, NR17R18, C=NR19; R16 представляет собой Н или С1-С4-алкил, необязательно замещенный F, ОН, ONO, ONO2; R17 и R18, каждый независимо, представляют собой Н или С1-С4-алкил, необязательно замещенный ONO, ONO2, предпочтительно R17 и R18, каждый независимо, представляют собой Н или С1-С4-алкил, необязательно замещенный ONO2; R19 представляет собой C1-С4-алкил, необязательно замещенный F, ONO, ONO2, предпочтительно R19 представляет собой C1-С4-алкил, необязательно замещенный ONO2.
В дополнительном предпочтительном варианте осуществления, указанный R5 представляет собой SO2NR13R14, NHSO2NR13R14; указанные R13 и R14 вместе с атомом азота, к которому они присоединены, образуют гетероциклическое кольцо, причем указанное гетероциклическое кольцо предпочтительно выбрано из азиридина, азетидина, пирролидина, пиперидина, морфолина, пиперазина, гомопиперазина, 2,5-диазабицикло[2,2,1]гептана и 3,7-диазабицикло[3,3,0]октана, причем указанное гетероциклическое кольцо необязательно замещено R15; указанный R15 представляет собой С1-С4-алкил, необязательно замещенный галогеном, ОН, ONO, ONO2, C1-С3-алкокси, COOR16, NR17R18, C=NR19; R16 представляет собой Н или С1-С4-алкил, необязательно замещенный F, ОН, ONO, ONO2; указанные R17 и R18, каждый независимо, представляют собой Н или С1-С4-алкил, необязательно замещенный ONO, ONO2; указанный R19 представляет собой С1-С4-алкил, необязательно замещенный F, ONO, ONO2.
В дополнительном предпочтительном варианте осуществления, указанный R5 представляет собой SO2NR13R14, причем R13 и R14, каждый независимо, представляют собой Н или вместе с атомом азота, к которому они присоединены, образуют монооциклическое кольцо, выбранное из имидазола, азиридина, азетидина, пирролидина, пиперидина, морфолина, пиперазина и гомопиперазина, необязательно замещенное R15; указанный R15 представляет собой С1-С4-алкил, необязательно замещенный галогеном, ОН, ONO, ONO2, C1-С3-алкокси, COOR16, NR17R18, C=NR19; R16 представляет собой Н или C1-С4-алкил, необязательно замещенный F, ОН, ONO, ONO2; указанные R17 и R18, каждый независимо, представляют собой Н или С1-С4-алкил, необязательно замещенный ONO, ONO2; указанный R19 представляет собой C1-С4-алкил, необязательно замещенный F, ONO, ONO2.
В дополнительном предпочтительном варианте осуществления, указанный R5 представляет собой SO2NR13R14, причем R13 и R14 вместе с атомом азота, к которому они присоединены, образуют моноциклическое кольцо, выбранное из имидазола, азиридина, азетидина, пирролидина, пиперидина, морфолина, пиперазина и гомопиперазина, необязательно замещенное R15; указанный R15 представляет собой C1-С4-алкил, необязательно замещенный галогеном, ОН, ONO, ONO2, C1-С3-алкокси, COOR16, NR17R18, C=NR19; R16 представляет собой Н или C1-С4-алкил, необязательно замещенный ОН, ONO, ONO2; указанные R17 и R18, каждый независимо, представляют собой Н или C1-С4-алкил, необязательно замещенный ONO, ONO2; указанный R19 представляет собой C1-С4-алкил, необязательно замещенный ONO, ONO2.
В дополнительном предпочтительном варианте осуществления, указанный R5 представляет собой SO2NR13R14, причем R13 и R14 вместе с атомом азота, к которому они присоединены, образуют моноциклическое кольцо, выбранное из имидазола, азиридина, азетидина, пирролидина, пиперидина, морфолина, пиперазина и гомопиперазина, необязательно замещенное R15; указанный R15 представляет собой C1-С4-алкил, необязательно замещенный галогеном, ОН, ONO2, C1-С3-алкокси, COOR16, NR17R18, C=NR19; R16 представляет собой Н или C1-С4-алкил, необязательно замещенный ОН, ONO2; указанные R17 и R18, каждый независимо, представляют собой Н или C1-С4-алкил, необязательно замещенный ONO2; указанный R19 представляет собой C1-С4-алкил, необязательно замещенный ONO2.
В дополнительном предпочтительном варианте осуществления, указанный R5 представляет собой SO2NR13R14, причем R13 и R14 вместе с атомом азота, к которому они присоединены, образуют моноциклическое кольцо, выбранное из имидазола, пирролидина, пиперидина, морфолина, пиперазина и гомопиперазина, необязательно замещенное R15; указанный R15 представляет собой С1-С4-алкил, необязательно замещенный ОН, ONO2, C1-С3-алкокси, COOR16, NR17R18, C=NR19; R16 представляет собой Н или С1-С4-алкил, необязательно замещенный ОН, ONO2; указанные R17 и R18, каждый независимо, представляют собой Н или C1-С4-алкил, необязательно замещенный ONO2; указанный R19 представляет собой C1-С4-алкил, необязательно замещенный ONO2.
В дополнительном предпочтительном варианте осуществления, указанный R5 представляет собой SO2NR13R14, причем R13 и R14 вместе с атомом азота, к которому они присоединены, образуют моноциклическое кольцо, выбранное из пиперидина и пиперазина, необязательно замещенное R15; указанный R15 представляет собой С1-С4-алкил, необязательно замещенный ОН, ONO, ONO2.
В дополнительном очень предпочтительном варианте осуществления, указанный R5 представляет собой SO2NR13R14, причем R13 и R14 вместе с атомом азота, к которому они присоединены, образуют моноциклическое кольцо, выбранное из пиперидина и пиперазина, необязательно замещенное R15; указанный R15 представляет собой C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2.
В дополнительном очень предпочтительном варианте осуществления, указанный R5 представляет собой SO2NR13R14, причем R13 и R14 вместе с атомом азота, к которому они присоединены, образуют моноциклическое кольцо, выбранное из пиперидина и пиперазина, необязательно замещенное R15; указанный R15 представляет собой C1-С3-алкил, необязательно замещенный ОН, ONO2.
В дополнительном очень предпочтительном варианте осуществления, указанный R5 представляет собой SO2NR13R14, причем R13 и R14 вместе с атомом азота, к которому они присоединены, образуют моноциклическое кольцо, выбранное из пиперидина и пиперазина, необязательно замещенное R15; указанный R15 представляет собой C1-С3-алкил, замещенный ONO2.
В дополнительном очень предпочтительном варианте осуществления, указанный R5 представляет собой SO2NR13R14, причем R13 и R14 вместе с атомом азота, к которому они присоединены, образуют моноциклическое кольцо, выбранное из пиперидина и пиперазина, необязательно замещенное R15; указанный R15 представляет собой C1-С3-алкил, замещенный ONO.
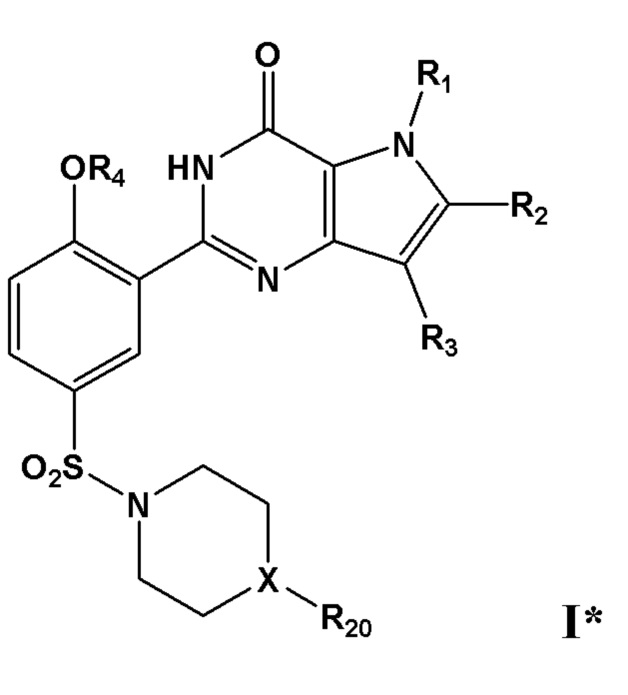
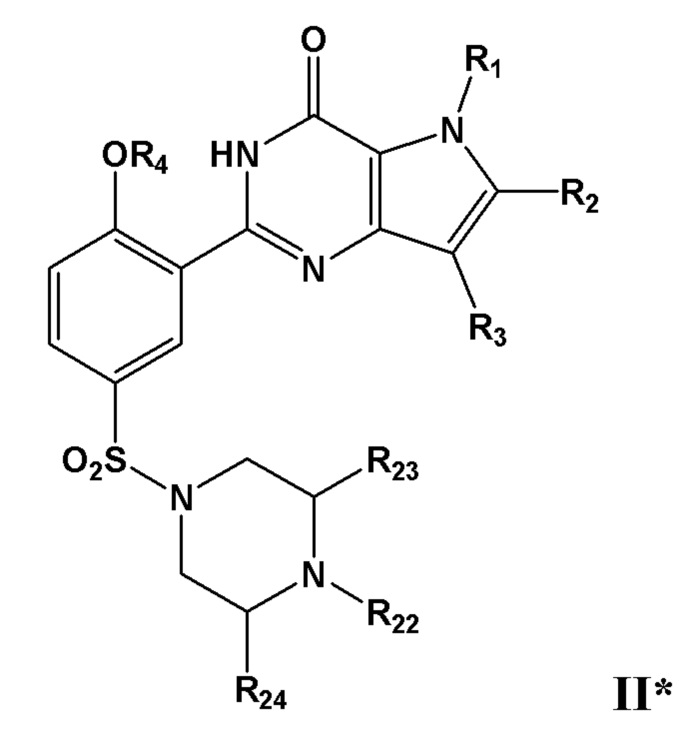
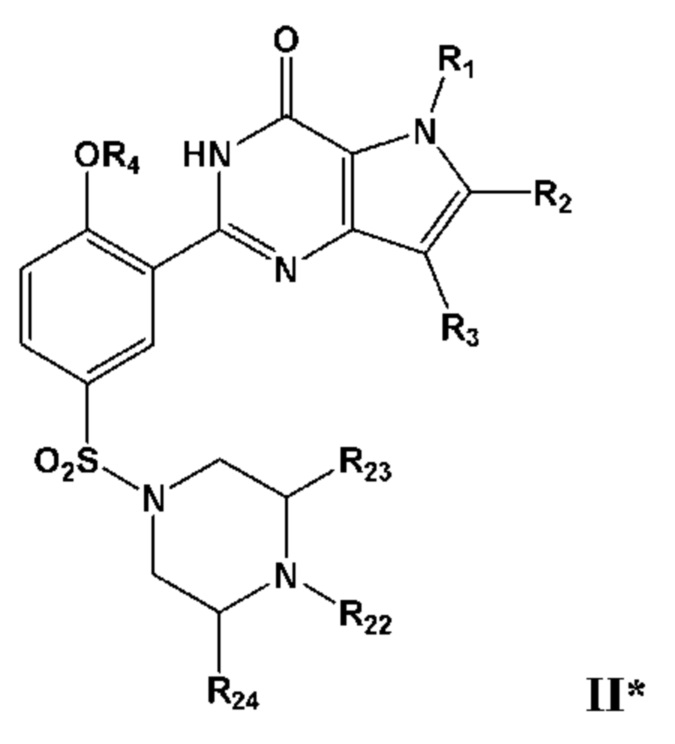
В дополнительном очень предпочтительном варианте осуществления, указанное соединение формулы I представляет собой соединение формулы I* или его фармацевтически приемлемую соль, сольват или гидрат;
причем R1, R2, R3 и R4 определены в настоящем изобретении; и причем X представляет собой CR21 или N; и причем по меньшей мере один из R1, R2, R3, R4, R20 или R21, каждый независимо, включает по меньшей мере один фрагмент ONO2 или ONO, и причем предпочтительно R1, R2, R3, R4, R20 или R21 вместе включают по меньшей мере два фрагмента ONO2 или ONO;
R20 представляет собой С1-С4-алкил, необязательно замещенный галогеном, ОН, ONO, ONO2, C1-С3-алкокси, C1-С3-галогеналкокси, COOR25, NR26R27, C=NR28;
R21 представляет собой Н или C1-С4-алкил, необязательно замещенный галогеном, ОН, ONO, ONO2, C1-С3-алкокси, C1-С3-галогеналкокси, COOR25, NR26R27, C=NR28;
R25 представляет собой Н или C1-С4-алкил, необязательно замещенный F, ОН, ONO, ONO2;
R26 и R27, каждый независимо, представляют собой Н или C1-С4-алкил, необязательно замещенный ONO, ONO2;
R28 представляет собой C1-С4-алкил, необязательно замещенный F, ONO, ONO2.
В дополнительном очень предпочтительном варианте осуществления, указанный R20 или R21, каждый независимо, включает по меньшей мере один фрагмент ONO2 или ONO. В дополнительном очень предпочтительном варианте осуществления, указанный R20 или указанный R21, каждый независимо, включает ровно один фрагмент ONO2. В дополнительном очень предпочтительном варианте осуществления, указанный R20 включает ровно один фрагмент ONO2. В дополнительном очень предпочтительном варианте осуществления, указанный R21 включает ровно один фрагмент ONO2. В дополнительном очень предпочтительном варианте осуществления, указанный R20 и указанный R21 вместе включают по меньшей мере два фрагмента ONO2 или ONO. В дополнительном очень предпочтительном варианте осуществления, указанный R20 и указанный R21 вместе включают ровно два фрагмента ONO2 или ONO. В дополнительном очень предпочтительном варианте осуществления, указанный R20 и указанный R21 вместе включают ровно два фрагмента, один фрагмент ONO2 и один фрагмент ONO. В дополнительном очень предпочтительном варианте осуществления, указанный R20 включает ровно два фрагмента ONO2. В дополнительном очень предпочтительном варианте осуществления, указанный R20 включает ровно два фрагмента ONO. В дополнительном очень предпочтительном варианте осуществления, указанный R20 и указанный R21 каждый включает ровно один фрагмент, выбранный из ONO2 или ONO. В дополнительном очень предпочтительном варианте осуществления, указанный R20 и указанный R21 каждый включает ровно один ONO2 фрагмент. В дополнительном очень предпочтительном варианте осуществления, указанный R20 и указанный R21 вместе включают по меньшей мере три фрагмента ONO2 или ONO. В дополнительном очень предпочтительном варианте осуществления, указанный R20 и указанный R21 вместе включают ровно три фрагмента ONO2 или три фрагмента ONO. В дополнительном очень предпочтительном варианте осуществления, указанный R20 и указанный R21 вместе включают ровно три фрагмента, выбранных из фрагментов ONO2 или ONO. В дополнительном очень предпочтительном варианте осуществления, указанный R20 включает ровно три фрагмента ONO. В дополнительном очень предпочтительном варианте осуществления, указанный R21 представляет собой Н.
В дополнительном очень предпочтительном варианте осуществления, указанное соединение формулы I представляет собой соединение формулы I* или его фармацевтически приемлемую соль, сольват или гидрат, причем по меньшей мере один из R1, R2, R3, R4 или R20, каждый независимо, включает по меньшей мере один фрагмент ONO2 или ONO, и причем предпочтительно R1, R2, R3, R4 или R20 вместе включают по меньшей мере два фрагмента, выбранных из фрагментов ONO2 или ONO;
где R1, R2, R3 и R4 определены в настоящем изобретении; и где X представляет собой СН или N;
R20 представляет собой С1-С4-алкил, необязательно замещенный галогеном, ОН, ONO, ONO2, C1-С3-алкокси, C1-С3-галогеналкокси, COOR25, NR26R27, C=NR28;
R25 представляет собой Н или C1-С4-алкил, необязательно замещенный F, ОН, ONO, ONO2;
R26 и R27, каждый независимо, представляют собой Н или C1-С4-алкил, необязательно замещенный ONO, ONO2;
R28 представляет собой C1-С4-алкил, необязательно замещенный F, ONO, ONO2.
В дополнительном очень предпочтительном варианте осуществления, указанное соединение формулы I представляет собой соединение формулы I** или его фармацевтически приемлемую соль, сольват или гидрат, где по меньшей мере один из R1, R2, R3, R4, R22, R23 или R24 каждый независимо, включает по меньшей мере один фрагмент ONO2 или ONO, и где предпочтительно R1, R2, R3, R4, R22, R23 или R24 вместе включают по меньшей мере два фрагмента, выбранных из фрагментов ONO2 или ONO;
где R1, R2, R3 и R4 определены в настоящем изобретении;
R22 представляет собой Н или C1-С4-алкил, необязательно замещенный галогеном, ОН, ONO, ONO2, C1-С3-алкокси, C1-С3-галогеналкокси, COOR25, NR26R27, C=NR28; R23 и R24, каждый независимо, представляют собой C1-С4-алкил, необязательно замещенный галогеном, ОН, ONO, ONO2, C1-С3-алкокси, C1-С3-галогеналкокси, COOR25, NR26R27, C=NR28;
R25 представляет собой Н или C1-С4-алкил, необязательно замещенный F, ОН, ONO, ONO2;
R26 и R27, каждый независимо, представляют собой Н или C1-С4-алкил, необязательно замещенный ONO, ONO2;
R28 представляет собой C1-С4-алкил, необязательно замещенный F, ONO, ONO2.
В дополнительном очень предпочтительном варианте осуществления, указанный R22, R23 или R24, каждый независимо, включает по меньшей мере один фрагмент ONO2 или ONO. В дополнительном очень предпочтительном варианте осуществления, указанные R22, R23 и R24 вместе включают по меньшей мере два фрагмента, выбранные из фрагментов ONO2 или ONO. В дополнительном очень предпочтительном варианте осуществления, указанные R22, R23 и R24 вместе включают ровно два фрагмента, выбранные из фрагментов ONO2 или ONO. В дополнительном очень предпочтительном варианте осуществления, указанный R23 и указанный R24 вместе включают ровно два фрагмента ONO2 и два фрагмента ONO. В дополнительном очень предпочтительном варианте осуществления, указанный R23 и указанный R24 вместе включают ровно один фрагмент ONO2 и один фрагмент ONO. В дополнительном очень предпочтительном варианте осуществления, указанный R23 и указанный R24 включают ровно один фрагмент ONO2. В дополнительном очень предпочтительном варианте осуществления, указанный R23 и указанный R24 включают ровно один фрагмент ONO.
В дополнительном очень предпочтительном варианте осуществления, указанное соединение формулы I представляет собой соединение формулы I*, где R1 представляет собой C1-С3-алкил; и
R2 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2; СНО, CN, CR8=N-OR9, CR8=N-NR10R11, C1-С3-алкокси; C1-С3-алкилен-Y, причем Y представляет собой ONO, ONO2, СНО, CN, ОН, ОС(O)Н, С(O)OC1-С3-алкил, CR8=N-OR9, CR8=N-NR10R11 или CR8=N-ONO2, причем R6 и R8, каждый независимо, представляют собой Н или СН3; R9 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2, CN, СООН, C1-С3-алкокси, ОС(O)Н, ОС(O)-C1-С3-алкилом; R10 и R11, каждый независимо, представляют собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2, CN, СООН, C1-С3-алкокси, ОС(O)Н, ОС(O)-C1-С3-алкил;
R3 представляет собой С1-С4-алкил, необязательно замещенный ОН, ONO, ONO2, C1-С3-алкокси;
R4 представляет собой C1-С4-алкил, необязательно замещенный C1-С3-алкокси, F, ONO, ONO2;
R20 представляет собой C1-С4-алкил, необязательно замещенный галогеном, ОН, ONO, ONO2, C1-С3-алкокси, COOR25, NR26R27; причем R25 представляет собой Н или С1-С4-алкил, необязательно замещенный ОН, ONO, ONO2;
R26 и R27, каждый независимо, представляют собой Н или C1-С4-алкил, необязательно замещенный ONO, ONO2.
В дополнительном очень предпочтительном варианте осуществления, указанное соединение формулы I представляет собой соединение формулы I*, где R1 представляет собой C1-С3-алкил; и
R2 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2; СНО, CN, CR8=N-OR9, CR8=N-NR10R11, C1-С3-алкокси; С1-С3-алкилен-Y, причем Y представляет собой ONO, ONO2, СНО, CN, ОН, ОС(O)Н, С(O)OC1-С3-алкил, CR8=N-OR9, CR8=N-NR10R11 или CR8=N-ONO2, причем R6 и R8, каждый независимо, представляют собой Н или СН3; R9 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2, CN, СООН, C1-С3-алкокси, ОС(O)Н, ОС(O)-C1-С3-алкилом; R10 и R11, каждый независимо, представляют собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2, CN, СООН, C1-С3-алкокси, ОС(O)Н, ОС(O)-C1-С3-алкил;
R3 представляет собой С1-С4-алкил, необязательно замещенный ОН, ONO, ONO2, C1-С3-алкокси;
R4 представляет собой С1-С4-алкил, необязательно замещенный C1-С3-алкокси, F, ONO, ONO2;
R20 представляет собой С1-С4-алкил, необязательно замещенный галогеном, ОН, ONO, ONO2, C1-С3-алкокси, COOR25, NR26R27; причем R25 представляет собой Н или С1-С4-алкил, необязательно замещенный ОН, ONO, ONO2;
R21 представляет собой Н или С1-С4-алкил, необязательно замещенный галогеном, ОН, ONO, ONO2, C1-С3-алкокси, COOR25, NR26R27; причем R25 представляет собой Н или C1-С4-алкил, необязательно замещенный ОН, ONO, ONO2;
R26 и R27, каждый независимо, представляют собой Н или С1-С4-алкил, необязательно замещенный ONO, ONO2.
В дополнительном очень предпочтительном варианте осуществления, указанное соединение формулы I представляет собой соединение формулы I*, где R1 представляет собой C1-С2-алкил;
R2 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2; СНО, CR8=N-OR9, C1-С3-алкокси; С1-С3-алкилен-Y, причем Y представляет ONO, ONO2, CN или CR8=N-OR9, где R9 представляет собой Н или СН3; R9 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2;
R3 представляет собой С2-С3-алкил, необязательно замещенный ОН, ONO, ONO2;
R4 представляет собой С2-С3-алкил, необязательно замещенный ONO, ONO2;
R20 представляет собой C1-С3-алкил, замещенный по меньшей мере одним заместителем, выбранным из ОН, ONO и ONO2;
R21 представляет собой Н или C1-С3-алкил, замещенный по меньшей мере одним заместителем, выбранным из ОН, ONO и ONO2.
В дополнительном очень предпочтительном варианте осуществления, указанное соединение формулы I представляет собой соединение формулы I*, где R1 представляет собой C1-С2-алкил;
R2 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2; СНО, CR8=N-OR9, C1-С3-алкокси; C1-С3-алкилен-Y, причем Y представляет ONO, ONO2, CN или CR8=N-OR9, причем R8 представляет собой Н или СН3; R9 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2;
R3 представляет собой С2-С3-алкил, необязательно замещенный ОН, ONO, ONO2;
R4 представляет собой С2-С3-алкил, необязательно замещенный ONO, ONO2;
R20 представляет собой C1-С3-алкил, замещенный одним, двумя или тремя заместителями, выбранными из ОН, ONO и ONO2;
R21 представляет собой Н или C1-С3-алкил, замещенный одним, двумя или тремя заместителями, выбранными из ОН, ONO и ONO2.
В дополнительном очень предпочтительном варианте осуществления, указанное соединение формулы I представляет собой соединение формулы I*, где R1 представляет собой C1-С2-алкил;
R2 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2; СНО, CR8=N-OR9, C1-С3-алкокси; C1-С3-алкилен-Y, причем Y представляет ONO, ONO2, CN или CR8=N-OR9, причем R8 представляет собой Н или СН3; R9 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2;
R3 представляет собой С2-С3-алкил, необязательно замещенный ОН, ONO, ONO2;
R4 представляет собой С2-С3-алкил, необязательно замещенный ONO, ONO2;
R20 представляет собой C1-С3-алкил, замещенный одним или двумя заместителями, выбранными из ONO и ONO2, и необязательно замещенный ОН;
R21 представляет собой Н.
В дополнительном очень предпочтительном варианте осуществления, указанное соединение формулы I представляет собой соединение формулы I*, где R1 представляет собой C1-С2-алкил;
R2 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2; СНО, CR8=N-OR9, C1-С3-алкокси; C1-С3-алкилен-Y, причем Y представляет ONO, ONO2, CN или CR8=N-OR9, причем R8 представляет собой Н или СН3; R9 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2;
R3 представляет собой С2-С3-алкил, необязательно замещенный ОН, ONO, ONO2;
R4 представляет собой С2-С3-алкил, необязательно замещенный ONO, ONO2;
R20 представляет собой C1-С3-алкил, замещенный одним или двумя заместителями, выбранными из ONO и ONO2, и необязательно замещенный одним ОН;
R21 представляет собой Н.
В дополнительном очень предпочтительном варианте осуществления, указанное соединение формулы I представляет собой соединение формулы I*, где R1 представляет собой C1-С2-алкил;
R2 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2; СНО, CR8=N-OR9, C1-С3-алкокси; C1-С3-алкилен-Y, причем Y представляет ONO, ONO2, CN или CR8=N-OR9, причем R8 представляет собой Н или СН3; R9 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2;
R3 представляет собой С2-С3-алкил, необязательно замещенный ОН, ONO, ONO2;
R4 представляет собой С2-С3-алкил, необязательно замещенный ONO, ONO2;
R20 выбран из CH2ONO2, CH2ONO, CH2CH2ONO, CH2CH2ONO2, CH(OH)CH2ONO2, CH(OH)CH2ONO, CH2CH2CH2ONO2, CH2CH2CH2ONO, CH(ONO2)CH2OH, CH(ONO)CH2OH, CH(ONO2)CH2ONO2, CH(ONO)CH2ONO2, CH(ONO2)CH2ONO, C(OH)(CH2ONO2)CH2ONO, C(OH)(CH2ONO)CH2ONO2, C(OH)(CH2ONO2)CH2ONO2, C(OH)(CH2CH2ONO)CH2CH2ONO2, C(OH)(CH2CH2ONO2)CH2CH2ONO, C(OH)(CH2CH2ONO2)CH2CH2ONO2, и причем R20 предпочтительно выбран из CH2ONO2, CH2CH2ONO2, CH(OH)CH2ONO2, CH2CH2CH2ONO2, CH(ONO2)CH2OH, CH(ONO2)CH2ONO2, C(OH)(CH2ONO2)CH2ONO2, C(OH)(CH2CH2ONO2)CH2CH2ONO2;
R21 представляет собой H.
В дополнительном очень предпочтительном варианте осуществления, указанное соединение формулы I представляет собой соединение формулы I*, где R1 представляет собой C1-С2-алкил;
R2 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2; СНО, CR8=N-OR9, C1-С3-алкокси; C1-С3-алкилен-Y, причем Y представляет ONO, ONO2, CN или CR8=N-OR9, причем R8 представляет собой Н или СН3; R9 представляет собой Н, С1-С3-алкил, необязательно замещенный ОН, ONO, ONO2;
R3 представляет собой С2-С3-алкил, необязательно замещенный ОН, ONO, ONO2;
R4 представляет собой С2-С3-алкил, необязательно замещенный ONO, ONO2;
R20 выбран из CH2ONO2, CH2ONO, CH2CH2ONO, CH2CH2ONO2, и причем R20 предпочтительно выбран из CH2ONO2 или CH2CH2ONO2;
R21 выбран из CH2ONO2, CH2ONO, CH2CH2ONO, CH2CH2ONO2 и причем R21 предпочтительно выбран из CH2ONO2 или CH2CH2ONO2.
В дополнительном очень предпочтительном варианте осуществления, указанное соединение формулы I представляет собой соединение формулы I*, где R1 представляет собой C1-С2-алкил;
R2 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2; СНО, CR8=N-OR9, C1-С3-алкокси; C1-С3-алкилен-Y, причем Y представляет ONO, ONO2, CN или CR8=N-OR9, причем R8 представляет собой Н или СН3; R9 представляет собой Н, С1-С3-алкил, необязательно замещенный ОН, ONO, ONO2;
R3 представляет собой С2-С3-алкил, необязательно замещенный ОН, ONO, ONO2;
R4 представляет собой С2-С3-алкил, необязательно замещенный ONO, ONO2;
R20 представляет собой С2-С3-алкил, замещенный ОН, ONO, ONO2.
В дополнительном очень предпочтительном варианте осуществления, указанное соединение формулы I представляет собой соединение формулы I*, где R1 представляет собой C1-С2-алкил;
R2 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2; СНО, CR8=N-OR9, C1-С3-алкокси; C1-С3-алкилен-Y, причем Y представляет ONO, ONO2, CN или CR8=N-OR9, причем R8 представляет собой Н или СН3; R9 представляет собой Н, С1-С3-алкил, необязательно замещенный ОН, ONO, ONO2;
R3 представляет собой С2-С3-алкил, необязательно замещенный ОН, ONO, ONO2;
R4 представляет собой С2-С3-алкил, необязательно замещенный ONO, ONO2;
R20 представляет собой С2-С3-алкил, замещенный ONO2, предпочтительно С2-С3-алкил, замещенный одним, двумя или тремя ONO2, также предпочтительно С2-С3-алкил, замещенный одним или двумя ONO2.
В дополнительном очень предпочтительном варианте осуществления, указанное соединение формулы I представляет собой соединение формулы I*, где R1 представляет собой метил или этил;
R2 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2; СНО, CR8=N-OR9, C1-С3-алкокси; C1-С3-алкилен-Y, причем Y представляет ONO, ONO2, CN или CR8=N-OR9, причем R8 представляет собой Н или СН3; R9 представляет собой Н, С1-С3-алкил, необязательно замещенный ОН, ONO, ONO2;
R3 представляет собой С2-С3-алкил, необязательно замещенный ОН, ONO, ONO2;
R4 представляет собой С2-С3-алкил, необязательно замещенный ONO, ONO2;
R20 представляет собой С2-С3-алкил, замещенный ONO2, предпочтительно С2-С3-алкил, замещенный одним, двумя или тремя ONO2, также предпочтительно С2-С3-алкил, замещенный одним или двумя ONO2.
В дополнительном очень предпочтительном варианте осуществления, указанное соединение формулы I представляет собой соединение формулы I*, где R1 представляет собой метил или этил;
R2 представляет собой Н, СНО, CN, C1-С3-алкокси, C1-С3-алкокси, необязательно замещенный ONO2; CH=N-OR9, предпочтительно (Е)-CH=N-OR9, причем R9 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2, CN, СООН, COOC1-С3-алкилом, ОС(O)Н, ОС(O)-С1-С3-алкилом;
R3 представляет собой С2-С3-алкил, необязательно замещенный ОН, ONO, ONO2;
R4 представляет собой С2-С3-алкил, необязательно замещенный ONO, ONO2;
R20 представляет собой С2-С3-алкил, замещенный ONO2, предпочтительно С2-С3-алкил, замещенный одним, двумя или тремя ONO2, также предпочтительно С2-С3-алкил, замещенный одним или двумя ONO2.
В дополнительном очень предпочтительном варианте осуществления, указанное соединение формулы I представляет собой соединение формулы I*, где R1 представляет собой метил или этил;
R2 представляет собой Н, СНО, CN, C1-С3-алкокси, C1-С3-алкокси, необязательно замещенный ONO2; CH=N-OR9, предпочтительно (E)-CH=N-OR9, причем R9 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2;
R3 представляет собой С2-С3-алкил, необязательно замещенный ОН, ONO, ONO2;
R4 представляет собой С2-С3-алкил, необязательно замещенный ONO, ONO2;
R20 представляет собой С2-С3-алкил, замещенный ONO2, предпочтительно С2-С3-алкил, замещенный одним, двумя или тремя ONO2, также предпочтительно С2-С3-алкил, замещенный одним или двумя ONO2.
В дополнительном очень предпочтительном варианте осуществления, указанное соединение формулы I представляет собой соединение формулы I*, где R1 представляет собой метил или этил;
R2 представляет собой Н, СНО, CN, C1-С3-алкокси, C1-С3-алкокси, необязательно замещенный ONO2; CH=N-OR9, предпочтительно (E)-CH=N-OR9, причем R9 представляет собой Н, C1-С3-алкил, необязательно замещенный ONO2;
R3 представляет собой С2-С3-алкил, необязательно замещенный ОН, ONO, ONO2;
R4 представляет собой С2-С3-алкил, необязательно замещенный ONO, ONO2;
R20 представляет собой С2-С3-алкил, замещенный ONO2, предпочтительно С2-С3-алкил, замещенный одним, двумя или тремя ONO2, также предпочтительно С2-С3-алкил, замещенный одним или двумя ONO2.
В дополнительном очень предпочтительном варианте осуществления, указанное соединение формулы I представляет собой соединение формулы I** или его фармацевтически приемлемую соль, сольват или гидрат, где по меньшей мере один из R1, R2, R3, R4, R22, R23 или R24 каждый независимо, включает по меньшей мере один фрагмент ONO2 или ONO, и где предпочтительно указанные R1, R2, R3, R4, R22, R23 или R24 вместе включают по меньшей мере два фрагмента, выбранные из фрагментов ONO2 или ONO;
где R1, R2, R3 и R4 определены в настоящем изобретении;
R22 представляет собой Н или С1-С4-алкил, необязательно замещенный галогеном, ОН, ONO, ONO2, C1-С3-алкокси, C1-С3-галогеналкокси, COOR25, NR26R27, C=NR28;
R23 и R24, каждый независимо, представляют собой С1-С4-алкил, необязательно замещенный галогеном, ОН, ONO, ONO2, C1-С3-алкокси, C1-С3-галогеналкокси, COOR25, NR26R27, C=NR28;
R25 представляет собой Н или С1-С4-алкил, необязательно замещенный F, ОН, ONO, ONO2;
R26 и R27, каждый независимо, представляют собой Н или C1-C4-алкил, необязательно замещенный ONO, ONO2;
R28 представляет собой C1-C4-алкил, необязательно замещенный F, ONO, ONO2.
В дополнительном очень предпочтительном варианте осуществления, указанное соединение формулы I представляет собой соединение формулы I**, где R1 представляет собой C1-С3-алкил; и
R2 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2; СНО, CN, CR8=N-OR9, CR8=N-NR10R11, C1-С3-алкокси; C1-С3-алкилен-Y, причем Y представляет собой ONO, ONO2, СНО, CN, ОН, ОС(O)Н, С(O)ОС1-С3-алкил, CR8=N-OR9, CR8=N-NR10R11 или CR8=N-ONO2, причем R6 и R8, каждый независимо, представляют собой Н или СН3; R9 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2, CN, СООН, C1-С3-алкокси, ОС(O)Н, ОС(O)-С1-С3-алкилом; R10 и R11, каждый независимо, представляют собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2, CN, СООН, C1-С3-алкокси, ОС(O)Н, ОС(O)-С1-С3-алкил;
R3 представляет собой С1-С4-алкил, необязательно замещенный ОН, ONO, ONO2, С1-С3-алкокси;
R4 представляет собой С1-С4-алкил, необязательно замещенный C1-С3-алкокси, F, ONO, ONO2;
R22 представляет собой Н или С1-С4-алкил, необязательно замещенный галогеном, ОН, ONO, ONO2, C1-С3-алкокси, C1-С3-галогеналкокси, COOR25, NR26R27, C=NR28; R23 и R24, каждый независимо, представляют собой С1-С4-алкил, необязательно замещенный галогеном, ОН, ONO, ONO2, C1-С3-алкокси, C1-С3-галогеналкокси, COOR25, NR26R27, C=NR28;
R25 представляет собой Н или С1-С4-алкил, необязательно замещенный F, ОН, ONO, ONO2;
R26 и R27, каждый независимо, представляют собой Н или С1-С4-алкил, необязательно замещенный ONO, ONO2;
R28 представляет собой С1-С4-алкил, необязательно замещенный F, ONO, ONO2.
В дополнительном очень предпочтительном варианте осуществления, указанное соединение формулы I представляет собой соединение формулы I**, где R1 представляет собой C1-С2-алкил;
R2 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2; СНО, CR8=N-OR9, C1-С3-алкокси; С1-С3-алкилен-Y, причем Y представляет ONO, ONO2, CN или CR8=N-OR9, причем R8 представляет собой Н или СН3; R9 представляет собой Н, С1-С3-алкил, необязательно замещенный ОН, ONO, ONO2;
R3 представляет собой С2-С3-алкил, необязательно замещенный ОН, ONO, ONO2;
R4 представляет собой С2-С3-алкил, необязательно замещенный ONO, ONO2;
R22 представляет собой Н или C1-C4-алкил, необязательно замещенный галогеном, ОН, ONO, ONO2;
R23 и R24, каждый независимо, представляют собой C1-C4-алкил, необязательно замещенный галогеном, ОН, ONO, ONO2.
В дополнительном очень предпочтительном варианте осуществления, указанное соединение формулы I представляет собой соединение формулы I**, где R1 представляет собой C1-С2-алкил;
R2 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2; СНО, CR8=N-OR9, C1-С3-алкокси; C1-С3-алкилен-Y, причем Y представляет ONO, ONO2, CN или CR8=N-OR9, причем R8 представляет собой Н или СН3; R9 представляет собой Н, С1-С3-алкил, необязательно замещенный ОН, ONO, ONO2;
R3 представляет собой С2-С3-алкил, необязательно замещенный ОН, ONO, ONO2;
R4 представляет собой С2-С3-алкил, необязательно замещенный ONO, ONO2;
R22 представляет собой C1-С2-алкил, предпочтительно метил;
R23 и R24, каждый независимо, представляют собой C1-С3-алкил, замещенный ОН, ONO, ONO2, причем предпочтительно R23 и R24, каждый независимо, представляют собой C1-С3-алкил, замещенный ONO, ONO2.
В дополнительном очень предпочтительном варианте осуществления, указанное соединение формулы I представляет собой соединение формулы I**, где R1 представляет собой C1-С2-алкил;
R2 представляет собой Н, C1-С3-алкил, необязательно замещенный ОН, ONO, ONO2; СНО, CR8=N-OR9, C1-С3-алкокси; C1-С3-алкилен-Y, причем Y представляет ONO, ONO2, CN или CR8=N-OR9, причем R8 представляет собой Н или СН3; R9 представляет собой Н, С1-С3-алкил, необязательно замещенный ОН, ONO, ONO2;
R3 представляет собой С2-С3-алкил, необязательно замещенный ОН, ONO, ONO2;
R4 представляет собой С2-С3-алкил, необязательно замещенный ONO, ONO2;
R22 представляет собой C1-С2-алкил, предпочтительно метил;
R23 и R24, каждый независимо, представляют собой C1-С2-алкил, замещенный ONO, ONO2, причем предпочтительно R23 и R24, каждый независимо, представляют собой C1-С2-алкил, замещенный ONO2.
В дополнительном очень предпочтительном варианте осуществления, указанный R1 представляет собой C1-С3-алкил.
В дополнительном очень предпочтительном варианте осуществления, указанный R1 представляет собой СН3 или С2Н5, R1 предпочтительно представляет собой СН3.
В дополнительном предпочтительном варианте осуществления, указанный R3 представляет собой С1-С4-алкил, необязательно замещенный F, ОН, ONO, ONO2, С1-С3-алкокси, С3-С6-циклоалкилом, С2-С4-алкенилом.
В дополнительном очень предпочтительном варианте осуществления, указанный R3 представляет собой C1-C4-алкил, необязательно замещенный ONO2 или С3-С5-циклоалкилом.
В дополнительном очень предпочтительном варианте осуществления, указанный R3 представляет собой н-пропил.
В дополнительном предпочтительном варианте осуществления, указанный R4 представляет собой C1-C4-алкил, необязательно замещенный С3-С6-циклоалкилом, С1-С3-алкокси, F, ONO, ONO2; С2-С4-алкенил.
В дополнительном предпочтительном варианте осуществления, указанный R4 представляет собой C1-C4-алкил, необязательно замещенный ONO2 или С3-С5-циклоалкилом.
В дополнительном предпочтительном варианте осуществления, указанный R4 представляет собой этил или н-пропил.
Дополнительные очень предпочтительные варианты осуществления настоящего изобретения представлены отдельными соединениями формулы I или их фармацевтически приемлемыми солями, сольватами или гидратами.
Таким образом, в другом очень предпочтительном варианте осуществления, указанное соединение формулы I выбрано из:
(E)-2-(4-(3-(5-этил-6-((гидроксиимино)метил)-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)этилнитрата
2-(1-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрата
(Е)-2-(1-((3-(5-этил-6-((гидроксиимино)метил)-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрата
3-(1-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)пропилнитрата
(E)-3-(1-((3-(5-этил-6-((гидроксиимино)метил)-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)пропилнитрата
2-(4-((3-(5-этил-6-формил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)этилнитрата
2-(1-((3-(5-этил-6-формил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрата
3-(1-((3-(5-этил-6-формил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)пропилнитрата
-(4-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)этилнитрата
(R)-1-(1-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этан-1,2-диилдинитрата
(S)-1-(1-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этан-1,2-диилдинитрата
((2R,6S)-4-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)-1-метилпиперазин-2,6-диил)бис(этан-2,1-диил)динитрата
(1-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4,4-диил)бис(этан-2,1-диил)динитрата
((2S,6S)-4-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)-1-метилпиперазин-2,6-диил)бис(этан-2,1-диил)динитрата
3-(1-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)-3-гидроксипентан-1,5-диилдинитрата
2-(1-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)-2-гидроксипропан-1,3-диилдинитрата
(E)-2-(1-((4-этокси-3-(6-((гидроксиимино)метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперидин-4-ил)этилнитрата
3-(1-((4-этокси-3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперидин-4-ил)пропилнитрата
2-(1-((4-этокси-3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперидин-4-ил)этилнитрата
2-(4-((4-этокси-3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперазин-1-ил)этилнитрата
2-(1-((4-этокси-3-(6-формил-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперидин-4-ил)этилнитрата
(E)-3-(4-((4-этокси-3-(6-((гидроксиимино)метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперазин-1-ил)пропилнитрата
(E)-2-(4-((4-этокси-3-(6-((гидроксиимино)-метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперазин-1-ил)этилнитрата
2-(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрата
2-(4-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)этилнитрата
(Е)-2-(1-((3-(6-((гидроксиимино)метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрата
3-(4-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)пропилнитрата
(E)-2-(4-((3-(6-((гидроксиимино)метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)этилнитрата
(E)-3-(4-((3-(6-((гидроксиимино)метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)пропилнитрата
(R)-1-(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этан-1,2-диилдинитрата
(S)-1-(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этан-1,2-диилдинитрата
(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4,4-диил)бис(метилен)динитрата
(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)метилнитрата
(R)-2-гидрокси-2-(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрата
2-гидрокси-1-(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрата изомера а
2-гидрокси-1-(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрата изомера б
(R,E)-1-(1-((3-(6-((гидроксиимино)метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этан-1,2-диилдинитрата
(S)-1-(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этан-1,2-диилдинитрата
(S)-2-гидрокси-2-(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрата
В дополнительном очень предпочтительном варианте осуществления, указанное соединение формулы I выбрано из:
(E)-2-(4-(3-(5-этил-6-((гидроксиимино)метил)-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)этилнитрата (1а);
2-(1-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрата (1б);
(E)-2-(1-((3-(5-этил-6-((гидроксиимино)метил)-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрата (1в);
3-(1-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)пропилнитрата (1г);
(E)-3-(1-((3-(5-этил-6-((гидроксиимино)метил)-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)пропилнитрата (1д);
2-(4-((3-(5-этил-6-формил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)этилнитрата (1е);
2-(1-((3-(5-этил-6-формил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрата (1ж);
3-(1-((3-(5-этил-6-формил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)пропилнитрата (1з);
2-(4-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)этилнитрата (1и);
(R)-1-(1-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этан-1,2-диилдинитрата (1к);
(S)-1-(1-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этан-1,2-диилдинитрата (1л);
((2R,6S)-4-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)-1-метилпиперазин-2,6-диил)бис(этан-2,1-диил)динитрата (1м);
(1-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4,4-диил)бис(этан-2,1-диил)динитрата (1н);
((2S,6S)-4-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)-1-метилпиперазин-2,6-диил)бис(этан-2,1-диил)динитрата (1о);
3-(1-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)-3-гидроксипентан-1,5-диилдинитрата (1п);
2-(1-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)-2-гидроксипропан-1,3-диилдинитрата (1р);
(E)-2-(1-((4-этокси-3-(6-((гидроксиимино)метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперидин-4-ил)этилнитрата (2а);
3-(1-((4-этокси-3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперидин-4-ил)пропилнитрата (2б);
2-(1-((4-этокси-3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперидин-4-ил)этилнитрата (2в);
2-(4-((4-этокси-3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперазин-1-ил)этилнитрата (2г);
2-(1-((4-этокси-3-(6-формил-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперидин-4-ил)этилнитрата (2д);
(E)-3-(4-((4-этокси-3-(6-((гидроксиимино)метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперазин-1-ил)пропилнитрата (2е)
(E)-2-(4-((4-этокси-3-(6-((гидроксиимино)-метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперазин-1-ил)этилнитрата (2ж);
2-(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрата (3а);
2-(4-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)этилнитрата (3б);
(Е)-2-(1-((3-(6-((гидроксиимино)метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрата (3в);
3-(4-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)пропилнитрата (3г);
(E)-2-(4-((3-(6-((гидроксиимино)метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)этилнитрата (3д);
(E)-3-(4-((3-(6-((гидроксиимино)метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)пропилнитрата (3е);
(R)-1-(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этан-1,2-диилдинитрата (3ж);
(S)-1-(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этан-1,2-диилдинитрата (3з);
(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4,4-диил)бис(метилен)динитрата (3и);
(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)метилнитрата (3к);
(R)-2-гидрокси-2-(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрата (3л);
2-гидрокси-1-(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитратаизомер а (3м);
2-гидрокси-1-(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитратаизомер б (3н);
(R,E)-1-(1-((3-(6-((гидроксиимино)метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этан-1,2-диилдинитрата (3о);
(S)-1-(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этан-1,2-диилдинитрата (3п) и
(S)-2-гидрокси-2-(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрата (3р).
В дополнительном очень предпочтительном варианте осуществления, указанное соединение выбрано из:
В дополнительном предпочтительном варианте осуществления, указанное соединение выбрано из:
2-(1-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрата (1б);
(Е)-2-(1-((4-этокси-3-(6-((гидроксиимино)метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперидин-4-ил)этилнитрата (2а);
2-(1-((4-этокси-3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперидин-4-ил)этилнитрата (2в); и
2-(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрата (3а).
Было показано, что соединения по настоящему изобретению являются высокоактивными и селективными ингибиторами цГМФ-специфической ФДЭ. Кроме того, было обнаружено, что соединения по настоящему изобретению являются ингибиторами ФДЭ5 с двойным фармакологическим действием, приводящими к высвобождению NO, которые, как полагают, высвобождают NO в дополнение к ингибированию ФДЭ5 более чем аддитивным образом. Таким образом, соединения формулы I представляют интерес для применения в терапии, в частности, для лечения различных состояний, где считается, что ингибирование цГМФ-специфической ФДЭ является полезным. Учитывая обнаруженную высокую степень связывания с белками плазмы, соединения по настоящему изобретению особенно подходят для местного действия после местного применения (см. Фиг. 2).
Таким образом, в дополнительном аспекте, в настоящем изобретении предложена фармацевтическая композиция, содержащая по меньшей мере одно из соединений формулы I по настоящему изобретению или его фармацевтически приемлемую соль, сольват или гидрат и фармацевтически приемлемый наполнитель, адъювант или носитель.
В другом аспекте, в настоящем изобретении предложена фармацевтическая композиция, содержащая ровно одно соединение формулы I по настоящему изобретению или его фармацевтически приемлемую соль, сольват или гидрат и фармацевтически приемлемый наполнитель, адъювант или носитель. Фармацевтически приемлемый наполнитель, адъювант или носитель известны специалисту в данной области.
В другом аспекте, в настоящем изобретении предложено соединение формулы I или его фармацевтическая композиция или его фармацевтически приемлемая соль, сольват или гидрат для применения в качестве лекарственного средства.
В другом аспекте, в настоящем изобретении предложено соединение формулы I или его фармацевтически приемлемая соль, сольват или гидрат для применения в качестве фармацевтического препарата. Опять же в другом аспекте, в настоящем изобретении предложено соединение формулы I или его фармацевтически приемлемая соль, сольват или гидрат для применения в качестве лекарственного средства для животных.
Неожиданно было обнаружено, что соединения по настоящему изобретению являются ингибиторами ФДЭ5 с двойным фармакологическим действием, приводящими к высвобождению NO, которые, как полагают, высвобождают NO в дополнение к ингибированию ФДЭ5 более чем аддитивным образом. Как следствие, новые соединения пирролопиримидина по настоящему изобретению полезны для терапии и профилактики заболеваний, которые связаны с нарушением баланса цГМФ. В частности, соединения по настоящему изобретению являются активаторами растворимой гуанилилциклазы (рГЦ) и в то же время селективными ингибиторами циклической гуанозин-3'-5'-монофосфат-специфической фосфодиэстеразы 5 (цГМФ-специфичной ФДЭ5) и, таким образом, могут быть использованы в множестве терапевтических областей, где такое ингибирование является выгодным.
Некоторые из предпочтительных терапевтических областей включают заживающие раны, в частности, хронические заживающие раны, диабетическую стопу, язву при диабетической стопе, ножную язву, Рейно, эректильную дисфункцию у мужчин, женскую половую дисфункцию, диабет, выпадение волос, старение кожи, старение сосудов, гипертензию легочной артерии и ливедоидную васкулопатию, облитерирующий тромбангиит, хроническую анальную трещину, фиброз кожи.
Как следствие селективного ингибирования ФДЭ5, проявляемого соединениями по настоящему изобретению, ожидается повышение уровней цГМФ, что, в свою очередь, может привести к полезному антитромбоцитарному, антивазоспастическому, вазодилаторному, натрийуретическому и диуретическому действию, а также к усилению эффектов эндотелиального фактора расслабления (ЭФР), оксида азота (NO), нитровазодилататоров, предсердного натрийуретического фактора (ПНФ), мозгового натрийуретического пептида (МНП), натрийуретического пептида С-типа (CNP) и эндотелий-зависимых расслабляющих средств, таких как брадикинин, ацетилхолин и 5-НТ1. Следовательно, соединения формулы I полезны при лечении ряда расстройств, включая стабильную, нестабильную и вариантную (Принцметала) стенокардию, гипертензию, легочную гипертензию, застойную сердечную недостаточность, почечную недостаточность, атеросклероз, состояния пониженной проходимости кровеносных сосудов (например, чрескожная транслюминальная коронарная ангиопластика), заболевания периферических сосудов, сосудистые заболевания, такие как болезнь Рейно, воспалительные заболевания, инсульт, бронхит, хроническую астму, аллергическую астму, аллергический ринит, диабет, глаукому и заболевания, характеризующиеся нарушениями моторики кишечника, такие как синдром раздраженного кишечника, заживающие раны, в частности, хронические заживающие раны, диабетическую стопу, язву при диабетической стопе, ножную язву, болезнь Альцгеймера, выпадение волос, старение кожи, старение сосудов, гипертензию легочной артерии и хроническую сердечную недостаточность.
Таким образом, в другом аспекте, в настоящем изобретении предложено соединение формулы I или его фармацевтическая композиция или его фармацевтически приемлемая соль, сольват или гидрат для использования в способе лечения или предотвращения заболевания, облегчаемого путем ингибирования ФДЭ5, у человека или у млекопитающего, не являющегося человеком, предпочтительно у человека. Предпочтительно, указанное заболевание выбрано из заживающих ран, хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, болезни Рейно, эректильной дисфункции у мужчин, приапизма, половой дисфункции у женщин, выпадения волос, старения кожи, старения сосудов, гипертензии легочной артерии; ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи, стабильной, нестабильной и вариантной (Принцметала) стенокардии; гипертензии, легочной гипертензии, хронической обструктивной болезни легких, застойной сердечной недостаточности, почечной недостаточности, атеросклероза, состояния пониженной проходимости кровеносных сосудов, заболевания периферических сосудов, сосудистых расстройств, системного склероза (SSc), склеродермии, локализованной склеродермии, воспалительных заболеваний, инсульта, бронхита, хронической астмы, аллергической астмы, аллергического ринита, диабетической невропатии, идиопатического легочного фиброза (ИЛФ), болезни Пейрони, глаукомы или заболевания, характеризующегося нарушениями моторики кишечника, такого как синдром раздраженного кишечника, фиброза печени, болезни Альцгеймера и хронической сердечной недостаточности, причем предпочтительно настоящее заболевание выбрано из заживающих ран, хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, диабетической невропатии, заболевания периферических сосудов, сосудистых расстройств, таких как болезнь Рейно, ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи, системного склероза (SSc), склеродермии, легочной артериальной гипертензии (ЛАГ), хронической тромбоэмболической легочной гипертензии, эректильной дисфункции у мужчин, приапизма и половой дисфункции у женщин, и причем еще более предпочтительно настоящее заболевание выбрано из легочной артериальной гипертензии (ЛАГ), хронической тромбоэмболической легочной гипертензии, эректильной дисфункции у мужчин, приапизма и половой дисфункции у женщин, ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи, заживающих ран, хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, диабетической невропатии и пролежневой язвы.
Опять же в другом аспекте, в настоящем изобретении предложено соединение формулы I по настоящему изобретению или фармацевтическую композицию по настоящему изобретению, или его фармацевтически приемлемую соль, сольват или гидрат для применения в способе лечения или предотвращения заболевания у человека или у млекопитающего, не являющегося человеком, предпочтительно у человека, где указанное заболевание предпочтительно выбрано из заживающих ран, хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, болезни Рейно, эректильной дисфункции у мужчин, приапизма, половой дисфункции у женщин, выпадения волос, старения кожи, старения сосудов, гипертензии легочной артерии; ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи, стабильной, нестабильной и вариантной (Принцметала) стенокардии; гипертензии, легочной гипертензии, хронической обструктивной болезни легких, застойной сердечной недостаточности, почечной недостаточности, атеросклероза, состояния пониженной проходимости кровеносных сосудов, заболевания периферических сосудов, сосудистых расстройств, системного склероза (SSc), склеродермии, локализованной склеродермии, воспалительных заболеваний, инсульта, бронхита, хронической астмы, аллергической астмы, аллергического ринита, диабетической невропатии, идиопатического легочного фиброза (ИЛФ), болезни Пейрони, глаукомы или заболевания, характеризующегося нарушениями моторики кишечника, такого как синдром раздраженного кишечника, фиброза печени, болезни Альцгеймера и хронической сердечной недостаточности, причем предпочтительно настоящее заболевание выбрано из заживающих ран, хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, диабетической невропатии, заболевания периферических сосудов, сосудистых расстройств, таких как болезнь Рейно, ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи, системного склероза (SSc), склеродермии, легочной артериальной гипертензии (ЛАГ), хронической тромбоэмболической легочной гипертензии, эректильной дисфункции у мужчин, приапизма и половой дисфункции у женщин, и причем еще более предпочтительно настоящее заболевание выбрано из легочной артериальной гипертензии (ЛАГ), хронической тромбоэмболической легочной гипертензии, эректильной дисфункции у мужчин, приапизма и половой дисфункции у женщин, ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи, заживающих ран, хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, диабетической невропатии и пролежневой язвы.
Опять же в другом аспекте, в настоящем изобретении предложено соединение формулы I или фармацевтическая композиция, или его фармацевтически приемлемая соль, сольват или гидрат для применения в способе лечения или предотвращения заболевания активацией растворимой гуанилилциклазы (рГЦ) и ингибированием ФДЭ5, у человека или у млекопитающего, не являющегося человеком, предпочтительно у человека. Опять же в другом аспекте, в настоящем изобретении предложено соединение формулы I или фармацевтическая композиция, или его фармацевтически приемлемая соль, сольват или гидрат для применения в способе лечения или предотвращения заболевания активацией растворимой гуанилилциклазы (рГЦ) или ингибированием ФДЭ5, у человека или у млекопитающего, не являющегося человеком, предпочтительно у человека. Опять же в другом аспекте, в настоящем изобретении предложено соединение формулы I или фармацевтическая композиция, или его фармацевтически приемлемая соль, сольват или гидрат для применения в способе лечения медицинского состояния у человека или у млекопитающего, не являющегося человеком, предпочтительно у человека, где для указанного медицинского состояния ингибирование ФДЭ5 и/или активация растворимой гуанилилциклазы (рГЦ) являются желательными. Очень предпочтительно указанное заболевание выбрано из легочной артериальной гипертензии (ЛАГ), хронической тромбоэмболической легочной гипертензии, эректильной дисфункции у мужчин, приапизма и половой дисфункции у женщин, ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи, заживающих ран, хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, диабетической невропатии и пролежневой язвы.
Опять же в другом аспекте, в настоящем изобретении предложено применение соединения формулы I или фармацевтической композиции, или его фармацевтически приемлемой соли, сольвата или гидрата для получения лекарственного средства для лечения или предотвращения заболевания активацией растворимой гуанилилциклазы (рГЦ) и/или ингибированием ФДЭ5, у человека или у млекопитающего, не являющегося человеком, предпочтительно у человека. Опять же в другом аспекте, в настоящем изобретении предложено применение соединения формулы I или фармацевтической композиции, или его фармацевтически приемлемой соли, сольвата или гидрата для получения лекарственного средства для лечения или предотвращения заболевания, облегчаемого активацией растворимой гуанилилциклазы (рГЦ) и/или ингибированием ФДЭ5, у человека или у млекопитающего, не являющегося человеком, предпочтительно у человека. Опять же в другом аспекте, в настоящем изобретении предложено применение соединения формулы I или фармацевтической композиции, или его фармацевтически приемлемой соли, сольвата или гидрата для получения лекарственного средства для лечения заболевания у человека или у млекопитающего, не являющегося человеком, предпочтительно у человека, где для указанного медицинского состояния активация растворимой гуанилилциклазы (рГЦ) и/или ингибирование ФДЭ5 являются желательными. Опять же в другом аспекте, в настоящем изобретении предложено применение соединения формулы I или фармацевтической композиции, или его фармацевтически приемлемой соли, сольвата или гидрата для получения лекарственного средства для лечения или предотвращения заболевания, причем указанное заболевание выбрано из заживающих ран, хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, болезни Рейно, эректильной дисфункции у мужчин, приапизма, половой дисфункции у женщин, выпадения волос, старения кожи, старения сосудов, гипертензии легочной артерии; ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи, стабильной, нестабильной и вариантной (Принцметала) стенокардии; гипертензии, легочной гипертензии, хронической обструктивной болезни легких, застойной сердечной недостаточности, почечной недостаточности, атеросклероза, состояния пониженной проходимости кровеносных сосудов, заболевания периферических сосудов, сосудистых расстройств, системного склероза (SSc), склеродермии, локализованной склеродермии, воспалительных заболеваний, инсульта, бронхита, хронической астмы, аллергической астмы, аллергического ринита, диабетической невропатии, идиопатического легочного фиброза (ИЛФ), болезни Пейрони, глаукомы или заболевания, характеризующегося нарушениями моторики кишечника, такого как синдром раздраженного кишечника, фиброза печени, болезни Альцгеймера и хронической сердечной недостаточности, причем предпочтительно настоящее заболевание выбрано из заживающих ран, хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, диабетической невропатии, заболевания периферических сосудов, сосудистых расстройств, таких как болезнь Рейно, ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи, системного склероза (SSc), склеродермии, легочной артериальной гипертензии (ЛАГ), хронической тромбоэмболической легочной гипертензии, эректильной дисфункции у мужчин, приапизма и половой дисфункции у женщин, и причем еще более предпочтительно настоящее заболевание выбрано из легочной артериальной гипертензии (ЛАГ), хронической тромбоэмболической легочной гипертензии, эректильной дисфункции у мужчин, приапизма и половой дисфункции у женщин, ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи, заживающих ран, хронических заживающих ран, диабетической стопы, язвы при диабетической стопе ножной язвы, диабетической невропатии и пролежневой язвы.
Опять же в другом аспекте, в настоящем изобретении предложен способ лечения или предотвращения заболевания активацией растворимой гуанилилциклазы (рГЦ) и/или ингибированием ФДЭ5 у человека или у млекопитающего, не являющегося человеком, предпочтительно у человека, включающий введение указанному человеку или указанному млекопитающему, не являющемуся человеком, предпочтительно указанному человеку эффективного количества соединения формулы I или фармацевтической композиции, или его фармацевтически приемлемой соли, сольвата или гидрата. Опять же в другом аспекте, в настоящем изобретении предложен способ лечения или предотвращения заболевания, облегчаемого активацией растворимой гуанилилциклазы (рГЦ) и/или ингибированием ФДЭ5, у человека или у млекопитающего, не являющегося человеком, предпочтительно у человека, включающий введение указанному человеку или указанному млекопитающему, не являющемуся человеком, предпочтительно указанному человеку эффективного количества соединения формулы I или фармацевтической композиции, или его фармацевтически приемлемой соли, сольвата или гидрата. Опять же в другом аспекте, в настоящем изобретении предложен способ лечения медицинского состояния у человека или у млекопитающего, не являющегося человеком, предпочтительно у человека, где для указанного медицинского состояния активация растворимой гуанилилциклазы (рГЦ) и/или ингибирование ФДЭ5 являются желательными, включающий введение указанному человеку или указанному млекопитающему, не являющемуся человеком, предпочтительно указанному человеку эффективного количества соединения формулы I или фармацевтической композиции, или его фармацевтически приемлемой соли, сольвата или гидрата. Опять же в другом аспекте, в настоящем изобретении предложен способ лечения или предотвращения заболевания у человека или у млекопитающего, не являющегося человеком, предпочтительно у человека, включающий введение указанному человеку или указанному млекопитающему, не являющемуся человеком, предпочтительно указанному человеку эффективного количества соединения формулы I или фармацевтической композиции, или его фармацевтически приемлемой соли, сольвата или гидрата, причем указанное заболевание выбрано из заживающих ран, хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, болезни Рейно, эректильной дисфункции у мужчин, приапизма, половой дисфункции у женщин, выпадения волос, старения кожи, старения сосудов, гипертензии легочной артерии; ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи, стабильной, нестабильной и вариантной (Принцметала) стенокардии; гипертензии, легочной гипертензии, хронической обструктивной болезни легких, застойной сердечной недостаточности, почечной недостаточности, атеросклероза, состояния пониженной проходимости кровеносных сосудов, заболевания периферических сосудов, сосудистых расстройств, системного склероза (SSc), склеродермии, локализованной склеродермии, воспалительных заболеваний, инсульта, бронхита, хронической астмы, аллергической астмы, аллергического ринита, диабетической невропатии, идиопатического легочного фиброза (ИЛФ), болезни Пейрони, глаукомы или заболевания, характеризующегося нарушениями моторики кишечника, такого как синдром раздраженного кишечника, фиброза печени, болезни Альцгеймера и хронической сердечной недостаточности, причем предпочтительно настоящее заболевание выбрано из заживающих ран, хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, диабетической невропатии, заболевания периферических сосудов, сосудистых расстройств, таких как болезнь Рейно, ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи, системного склероза (SSc), склеродермии, легочной артериальной гипертензии (ЛАГ), хронической тромбоэмболической легочной гипертензии, эректильной дисфункции у мужчин, приапизма и половой дисфункции у женщин, и причем еще более предпочтительно настоящее заболевание выбрано из легочной артериальной гипертензии (ЛАГ), хронической тромбоэмболической легочной гипертензии, эректильной дисфункции у мужчин, приапизма и половой дисфункции у женщин, ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи, заживающих ран, хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, диабетической невропатии и пролежневой язвы.
В предпочтительном варианте осуществления настоящего изобретения, указанное заболевание или указанное медицинское состояние выбрано из ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи, заживающих ран, предпочтительно хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, болезни Рейно, эректильной дисфункции у мужчин, половой дисфункции у женщин, диабета, выпадения волос, старения кожи, старения сосудов, легочной артериальной гипертензии; стабильной, нестабильной и вариантной (Принцметала) стенокардии; гипертензии, легочной гипертензии, хронической обструктивной болезни легких, застойной сердечной недостаточности, почечной недостаточности, атеросклероза, состояния пониженной проходимости кровеносных сосудов, заболевания периферических сосудов, сосудистых расстройств, системного склероза (SSc), склеродермии, локализованной склеродермии, воспалительных заболеваний, инсульта, бронхита, хронической астмы, аллергической астмы, аллергического ринита, диабетической невропатии, идиопатического легочного фиброза (ИЛФ), болезни Пейрони, глаукомы или заболевания, характеризующегося нарушениями моторики кишечника, такого как синдром раздраженного кишечника, фиброза печени, болезни Альцгеймера и хронической сердечной недостаточности, причем предпочтительно настоящее заболевание выбрано из ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи, заживающих ран, предпочтительно хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, диабетической невропатии, аболевания периферических сосудов, сосудистых расстройств, таких как болезнь Рейно, системного склероза (SSc), склеродермии, легочной артериальной гипертензии (ЛАГ), хронической тромбоэмболической легочной гипертензии, диабета, эректильной дисфункции у мужчин и причем еще более предпочтительно настоящее заболевание выбрано из легочной артериальной гипертензии (ЛАГ), хронической тромбоэмболической легочной гипертензии, эректильной дисфункции у мужчин, приапизма и половой дисфункции у женщин, ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи, заживающих ран, хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, диабетической невропатии и пролежневой язвы.
Таким образом, в качестве дополнительного аспекта настоящего изобретения, предложено соединение формулы I для применения при лечении заживающих ран, предпочтительно хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, болезни Рейно, эректильной дисфункции у мужчин, половой дисфункции у женщин, диабета, выпадения волос, старения кожи, старения сосудов, легочной артериальной гипертензии; стабильной, нестабильной и вариантной (Принцметала) стенокардия; стенокардии; гипертензии, легочной гипертензии, хронической обструктивной болезни легких, застойной сердечной недостаточности, почечной недостаточности, атеросклероза, состояния пониженной проходимости кровеносных сосудов, заболевания периферических сосудов, сосудистых расстройств, системного склероза (SSc), склеродермии, локализованной склеродермии, воспалительных заболеваний, инсульта, бронхита, хронической астмы, аллергической астмы, аллергического ринита, диабетической невропатии, идиопатического легочного фиброза (ИЛФ), болезни Пейрони, глаукомы или заболевания, характеризующегося нарушениями моторики кишечника, такого как синдром раздраженного кишечника, фиброза печени, болезни Альцгеймера и хронической сердечной недостаточности, причем предпочтительно настоящее заболевание выбрано из ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи, заживающих ран, предпочтительно хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, диабетической невропатии, аболевания периферических сосудов, сосудистых расстройств, таких как болезнь Рейно, системного склероза (SSc), склеродермии, легочной артериальной гипертензии (ЛАГ), хронической тромбоэмболической легочной гипертензии, диабета, эректильной дисфункции у мужчин и причем еще более предпочтительно настоящее заболевание выбрано из легочной артериальной гипертензии (ЛАГ), хронической тромбоэмболической легочной гипертензии, эректильной дисфункции у мужчин, приапизма и половой дисфункции у женщин, ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи, заживающих ран, хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, диабетической невропатии и пролежневой язвы.
В соответствии с другим аспектом настоящего изобретения, предложено применение соединения формулы I для получения лекарственного средства для лечения заживающих ран, предпочтительно хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, болезни Рейно, эректильной дисфункции у мужчин, половой дисфункции у женщин, диабета, выпадения волос, старения кожи, старения сосудов, легочной артериальной гипертензии; стабильной, нестабильной и вариантной (Принцметала) стенокардии; гипертензии, легочной гипертензии, хронической обструктивной болезни легких, застойной сердечной недостаточности, почечной недостаточности, атеросклероза, состояния пониженной проходимости кровеносных сосудов, заболевания периферических сосудов, сосудистых расстройств, системного склероза (SSc), склеродермии, локализованной склеродермии, воспалительных заболеваний, инсульта, бронхита, хронической астмы, аллергической астмы, аллергического ринита, диабетической невропатии, идиопатического легочного фиброза (ИЛФ), болезни Пейрони, глаукомы или заболевания, характеризующегося нарушениями моторики кишечника, такого как синдром раздраженного кишечника, фиброза печени, болезни Альцгеймера и хронической сердечной недостаточности, причем предпочтительно настоящее заболевание выбрано из ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи, заживающих ран, предпочтительно хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, диабетической невропатии, аболевания периферических сосудов, сосудистых расстройств, таких как болезнь Рейно, системного склероза (SSc), склеродермии, легочной артериальной гипертензии (ЛАГ), хронической тромбоэмболической легочной гипертензии, диабета, эректильной дисфункции у мужчин и причем еще более предпочтительно настоящее заболевание выбрано из легочной артериальной гипертензии (ЛАГ), хронической тромбоэмболической легочной гипертензии, эректильной дисфункции у мужчин, приапизма и половой дисфункции у женщин, ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи, заживающих ран, хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, диабетической невропатии и пролежневой язвы.
В дополнительном аспекте, в настоящем изобретении предложен способ лечения заживающих ран, предпочтительно хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, болезни Рейно, эректильной дисфункции у мужчин, половой дисфункции у женщин, диабета, выпадения волос, старения кожи, старения сосудов, легочной артериальной гипертензии; стабильной, нестабильной и вариантной (Принцметала) стенокардии; гипертензии, легочной гипертензии, хронической обструктивной болезни легких, застойной сердечной недостаточности, почечной недостаточности, атеросклероза, состояния пониженной проходимости кровеносных сосудов, заболевания периферических сосудов, сосудистых расстройств, системного склероза (SSc), склеродермии, локализованной склеродермии, воспалительных заболеваний, инсульта, бронхита, хронической астмы, аллергической астмы, аллергического ринита, диабетической невропатии, идиопатического легочного фиброза (ИЛФ), болезни Пейрони, глаукомы или заболевания, характеризующегося нарушениями моторики кишечника, такого как синдром раздраженного кишечника, фиброза печени, болезни Альцгеймера и хронической сердечной недостаточности, причем предпочтительно настоящее заболевание выбрано из ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи, заживающих ран, предпочтительно хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, диабетической невропатии, аболевания периферических сосудов, сосудистых расстройств, таких как болезнь Рейно, системного склероза (SSc), склеродермии, легочной артериальной гипертензии (ЛАГ), хронической тромбоэмболической легочной гипертензии, диабета, эректильной дисфункции у мужчин и причем еще более предпочтительно настоящее заболевание выбрано из легочной артериальной гипертензии (ЛАГ), хронической тромбоэмболической легочной гипертензии, эректильной дисфункции у мужчин, приапизма и половой дисфункции у женщин, ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи, заживающих ран, хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, диабетической невропатии и пролежневой язвы у человека или у млекопитающего, не являющегося человеком, предпочтительно у человека, указанный способ включает введение указанному человеку или указанному млекопитающему, не являющемуся человеком, предпочтительно указанному человеку эффективного количества соединения формулы I.
В очень предпочтительном варианте осуществления настоящего изобретения, указанное заболевание или указанное медицинское состояние выбрано из легочной артериальной гипертензии (ЛАГ), хронической тромбоэмболической легочной гипертензии, эректильной дисфункции у мужчин, приапизма и половой дисфункции у женщин, ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи, заживающих ран, хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, диабетической невропатии и пролежневой язвы.
В очень предпочтительном варианте осуществления настоящего изобретения, указанное заболевание или указанное медицинское состояние выбрано из заживающих ран, предпочтительно хронических заживающих ран, диабетической стопы, язвы при диабетической стопе и ножной язвы, легочной артериальной гипертензии и эректильной дисфункции у мужчин, и ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи.
На хронические незаживающие кожные раны, как при сахарном диабете, влияют сложные механизмы заболевания, включая нарушенный ангиогенез, дефектную микроциркуляцию и эндотелиальную дисфункцию. Язва при диабетической стопе и хронические раны являются основным источником осложнений и ведущей причиной госпитализации пациентов с диабетом. Они поражают 15% больных диабетом (275 млн.) и являются тяжелым бременем для пациентов и плательщиков (12 млрд. долл. США в год). 3-4% всех пациентов с диабетом получают ампутации нижних конечностей каждый год. Можно ожидать, что сверхпотентные ингибиторы ФДЭ5 или соединения, сочетающие высокоэффективную активацию растворимой гуанилилциклазы (рГЦ) и/или ингибирование ФДЭ5 и активацию зависимой от оксида азота растворимой гуанилатциклазы, как соединения согласно настоящему изобретению, ускоряют заживление ран.
В контексте настоящего изобретения, термины «лечение», «лечить», «вылеченный» или «лечащий» относятся к профилактике и/или терапии. В одном варианте осуществления, термины «лечение», «лечить», «вылеченный» или «лечащий» относятся к терапевтическому лечению. В другом варианте осуществления, термины «лечение», «лечить», «вылеченный» или «лечащий» относятся к профилактическому лечению. Предпочтительно, полезные или желательные клинические результаты указанного лечения включают, но не ограничиваются ими, ослабление симптомов, уменьшение степени заболевания или медицинского состояния, стабилизированное (то есть не ухудшающееся) состояние заболевания или медицинского состояния, задержку или замедление развития заболевания или медицинского состояния, улучшение или смягчение статуса заболевания или медицинского состояния.
В контексте настоящего изобретения, термин «эффективное количество» относится к количеству, необходимому или достаточному для реализации желаемого биологического эффекта. Предпочтительно, термин «эффективное количество» относится к количеству соединения формулы I по настоящему изобретению, которое (i) лечит или предотвращает конкретное заболевание, медицинское состояние или расстройство, (ii) ослабляет, улучшает или устраняет один или несколько симптомов конкретного заболевания, медицинского состояния или расстройства или (iii) предотвращает или задерживает возникновение одного или нескольких симптомов конкретного заболевания, медицинского состояния или расстройства, описанных в настоящем изобретении. Эффективное количество соединения формулы I по настоящему изобретению или указанной фармацевтической композиции представляет собой количество, которое позволяет достигнуть указанного выбранного результата, и такое количество может быть определено специалистом в данной области обычным образом. Кроме того, предпочтительно, термин «эффективное количество», в контексте настоящего изобретения, относится к количеству, необходимому или достаточному, чтобы быть эффективным для активации растворимой гуанилилциклазы (рГЦ) и/или увеличения ингибирования ФДЭ5, обычно и предпочтительно, как определено в Примере 54, или для увеличения образования цГМФ, обычно и предпочтительно, как определено в Примере 56. Эффективное количество может варьироваться в зависимости от конкретной вводимой композиции и размера субъекта. Средний специалист в данной области техники может эмпирически определить эффективное количество конкретной композиции по настоящему изобретению без необходимости проведения ненадлежащих экспериментов.
В контексте настоящего изобретения, термин «млекопитающее» включает, но не ограничивается ими, людей, мышей, крыс, морских свинок, обезьян, собак, кошек, лошадей, коров, свиней и овец. В контексте настоящего изобретения, термин «млекопитающее» предпочтительно относится к людям.
Соединения формулы I и фармацевтические композиции по настоящему изобретению можно вводить любым подходящим путем, например пероральным, трансбуккальным, сублингвальным, ректальным, вагинальным, интраназальным, назальным, топическим, внутрикожным, трансдермальным, подкожным, чрескожным, энтеральным или парентеральным способом введения, который устанавливает другие аспекты настоящего изобретения. В данной области техники известны и другие пути, которые также могут быть использованы, например, через хирургические отверстия. Так, для введения может быть использовано устройство, такое как обычные иглы и шприцы, микроиглы, пластыри (например, как в WO 98/20734), безыгольные инъекционные системы (например, как в WO 1999027961 А1), устройства-спреи и тому подобное, в зависимости от формы дозы и пути введения. Указанное устройство может быть предварительно заполнено или покрыто соединением по настоящему изобретению или фармацевтической композицией.
Термин «местное введение» используется в самом широком смысле, включая введение на поверхность тела, обычно открытую для окружающей среды. Указанная поверхность тела включает не только кожу, но и полости носа и рта и гениталии. Таким образом, местное введение может включать нанесение на кожу, нанесение на полости носа, нанесение на полость рта (включая верхнюю часть глотки) и нанесение на гениталии. Составы для местного применения были доступны в различных формах, включая кремы, мази, растворы, лосьоны, суспензии, пасты, эмульсии, пены и тому подобное. Смешивающиеся в воде кремы обычно используют для влажных или мокнущих поражений, тогда как мази обычно выбирают для сухих, покрытых струпьями или чешуйчатых поражений или когда требуется более окклюзионный эффект. Лосьоны обычно полезны, когда требуется нанесение минимального количества на большую или покрытую волосами область, или для лечения экссудативных поражений. Термин «локальное введение» используется в настоящем изобретении для обозначения местного введения, а также введения в глаза.
Соединения формулы I по настоящему изобретению могут быть получены в соответствии со схемой реакции 1 и схемой реакции 2. Указанные схемы представляют синтез базовых соединений формулы I и являются частью настоящего изобретения.
Так, способ получения соединений формулы I включает синтез промежуточного сульфонамида III, который получают из коммерчески доступной 5-хлорсульфонил-2-этоксибензойной кислоты ИС2 и аминов II в апротонных растворителях и при избытке третичных аминов. Промежуточные соединения IV получают при стандартных условиях образования пептидов, используя коммерчески доступный 3-амино-1-метил-4-пропилпиррол ИС1 (описано в WO 2001/060825) и реагенты для конденсации, такие как TBTU/DIPEA, в полярных растворителях, таких как ДМФА. Конденсация при основных условиях с использованием гидроксида калия или похожих оснований при нагревании приводит к соединениям пирролопиримидина V. Указанное промежуточное соединение непосредственно превращается в соединения формулы I путем нитрования с использованием полученного in situ ацетилнитрата в растворителях, таких как ацетонитрил. Промежуточное соединение V также может быть гидроксиметилировано в положении 6 гетероцикла, используя параформальдегид в кислых условиях, что приводит к соединениям с общей структурой VI. Селективное окисление с использованием MnO2/KMnO4 приводит к промежуточным соединениям альдегидам VII, которые можно превратить в сложные эфиры нитратов I с использованием описанных условий нитрования с помощью ацетилнитрата (Схема 1).
Соединения формулы I с этильным заместителем в положении 5 гетероцикла пирролопиримидин можно легко получить, начиная с мироденафила (WO 2001/060825), как показано на Схеме 2. Кислотный гидролиз приводит к промежуточной сульфоновой кислоте X. Образование производного хлорсульфоновой кислоты XI и обработка аминами II приводит к сульфонамидам XII. Нитрование с использованием ацетилнитрата приводит к соединениям I. Нитрование непосредственно мироденафила или промежуточных соединений IX также приводит к соединениям I с двойным фармакологическим действием.
Схема 1:
Схема 2:
ПРИМЕРЫ
Синтез предпочтительных соединений формулы I приведен ниже в качестве примера, обычно с предшествующей схемой реакции. Следующие примеры дополнительно иллюстрируют настоящее изобретение, но не должны рассматриваться как ограничивающие его объем.
Схема 3:
ПРИМЕР 1
5-Этил-2-(5-((4-(2-гидроксиэтил)пиперазин-1-ил)сульфонил)-2-пропоксифенил)-6-(гидроксиметил)-7-пропил-3,5-дигидро-4Н-пирроло[3,2-d]пиримидин-4-он (1):
К перемешиваемому раствору соли 5-этил-2-(5-((4-(2-гидроксиэтил)пиперазин-1-ил) сульфонил)-2-пропоксифенил)-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-он дигидрохлорида (Мироденафил.2HCl; WO 01/60825) (2,0 г, 3,31 ммоль) в концентрированном растворе HCl (20 мл) добавляли параформальдегид (1,0 г, 0,5 масс, доля) при комнатной температуре. Реакционную смесь нагревали при 50°С в течение 10 ч. Реакцию контролировали с помощью ТСХ (используя 10% МеОН в CH2Cl2) и LCMS анализа. После завершения реакции, реакционную смесь охлаждали до комнатной температуры, разбавляли водой (20 мл) и доводили рН до ~8, используя насыщенный раствор NaHCO3 (300 мл). Полученный раствор экстрагировали 10% метанолом в дихлорметане (6×300 мл). Объединенные органические экстракты сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С18; Grace System), элюируя 25-35% градиент ацетонитрила в воде. Чистые фракции упаривали при пониженном давлении до полного удаления ацетонитрила. Полученный водный раствор экстрагировали 10% метанолом в дихлорметане (8×500 мл). Объединенные органические экстракты упаривали при пониженном давлении, получая 1 (1,5 г; выход 79%) в виде грязно-белого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,63 (уш. с, 1Н), 7,90 (уш. с, 1Н), 7,80 (уш. д, J=8,8 Гц, 1Н), 7,38 (уш. д, J=8,8 Гц, 1Н), 5,19 (т, J=5,1 Гц, 1Н), 4,57 (д, J=5,1 Гц, 2Н), 4,47 (кв, J=7,0 Гц, 2Н), 4,33 (уш. с, 1Н), 4,13 (т, J=6,4 Гц, 2Н), 3,42-3,40 (м, 2Н), 2,91-2,88 (м, 4Н), 2,61-2,58 (м, 2Н), 2,46-2,49 (м, 4Н), 2,38-2,35 (м, 2Н), 1,79-1,71 (м, 2Н), 1,64-1,52 (м, 2Н), 1,34 (т, J=7,1 Гц, 3Н), 0,96 (т, J=7,3 Гц, 3Н), 0,88 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 562,5 [М+Н+]; чистота ~97,6%.
ПРИМЕР 2
5-Этил-2-(5-((4-(2-гидроксиэтил)пиперазин-1-ил)сульфонил)-2-пропоксифенил)-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегид (2):
К перемешиваемому раствору 5-этил-2-(5-((4-(2-гидроксиэтил)пиперазин-1-ил)сульфонил)-2-пропоксифенил)-6-(гидроксиметил)-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 1 (2,0 г, 3,56 ммоль) в CH2Cl2 (40 мл) частями добавляли периодинан Десс-Мартина (2,3 г, 5,34 ммоль) при 0°С в течение 20 мин в атмосфере аргона. Реакционную смесь перемешивали при той же температуре в течение 3 ч. После завершения реакции (контроль с помощью ТСХ), реакцию останавливали, добавлением 10% водного раствора тиосульфата натрия (20 мл), и перемешивали в течение 30 мин. Органический слой отделяли и промывали насыщенным раствором NaHCO3 (20 мл), насыщенным солевым раствором (20 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией на силикагеле (используя Grace System), элюируя 4-30% градиентом метанола в дихлорметане, получая 2 (900 мг, выход 41%) в виде бледно-желтого твердого вещества. 1Н-ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,15 (уш. с, 1Н), 10,14 (с, 1Н), 7,90-7,78 (м, 2Н), 7,39 (д, J=8,8 Гц, 1Н), 4,85 (кв, J=6,7 Гц, 2Н) 4,38 (т, J=5,3 Гц, 1Н), 4,13 (уш. т, J=6,4 Гц, 2Н), 3,42 (кв, J=6,0 Гц, 2Н), 3,03-2,80 (м, 6Н), 2,49-2,46 (м, 2Н), 2,48-2,44 (м, 2Н), 2,38-2,32 (м, 2Н), 1,80-1,58 (м, 4Н), 1,15 (т, J=7,1 Гц, 3Н), 0,98-0,93 (м, 6Н); LCMS (ESI): m/z 560,6 [М+Н]+; чистота ~91%.
ПРИМЕР 3
2-(4-((3-(5-Этил-6-формил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)этилнитрат (1е):
К перемешиваемому раствору 5-этил-2-(5-((4-(2-гидроксиэтил)пиперазин-1-ил)сульфонил)-2-пропоксифенил)-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегида 2 (500 мг, 0,90 ммоль) в ацетонитриле (15 мл) по каплям добавляли раствор свежеприготовленного ацетилнитрата (0,4 мл; 4,5 ммоль) [(ацетилнитрат готовили отдельно, медленно добавляя дымящую HNO3 (1,1 мл, 25,5 ммоль) по каплям в уксусный ангидрид (2,5 мл, 26,5 ммоль) при -15°С в течение 30 мин в атмосфере аргона (Примечание: температура не должна превышать 0°С))] при -15°С в течение 30 мин в атмосфере аргона. Реакционную смесь выдерживали при температуре от -15 до -5°С в течение 4 ч. После завершения реакции (контроль с помощью ТСХ) реакцию останавливали, добавлением насыщенного раствора NaHCO3 (15 мл) при 0°С и экстрагировали EtOAc (3×25 мл). Объединенные органические слои промывали насыщенным солевым раствором (25 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении, получая неочищенный продукт If (500 мг) в виде коричневого полутвердого вещества, которое непосредственно использовали для следующей реакции без дополнительной очистки. LCMS (ESI): m/z 605,5 [М+Н+]; чистота ~56%.
ПРИМЕР 4
(E)-2-(4-(3-(5-этил-6-((гидроксиимино)метил)-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)этилнитрат (1а):
К перемешиваемому раствору 2-(4-((3-(5-этил-6-формил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2)-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)этилнитрата 1f (500 мг) в EtOH (60 мл) добавляли 50% водный раствор гидроксиламина (10 мл) при комнатной температуре. Реакционную смесь перемешивали при 50°С в течение 5 ч в атмосфере аргона. После завершения реакции (контроль с помощью ТСХ и LCMS), реакцию охлаждали до комнатной температуры и упаривали при пониженном давлении. Полученный остаток разбавляли этилацетатом (25 мл), промывали водой (15 мл), насыщенным солевым раствором (15 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией на силикагеле (Grace system), используя 50-60% градиент этилацетата в петролейном эфире, с последующей перекристаллизацией из изопропанола (3 мл) и сушили в вакууме с получением 1а (130 мг; ~22% общий выход с двух стадий из 2) в виде грязно-белого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,77 (уш. с, 1Н; обмен с D2O), 11,59 (с, 1Н; обмен с D2O), 8,34 (с, 1Н) 7,89 (д, J=2,4 Гц, 1Н), 7,81 (д.д, J=8,8; 2,4 Гц, 1Н), 7,38 (д, J=8,8 Гц, 1Н), 4,72 (кв, J=6,8 Гц, 2Н), 4,56 (т, J=5,1 Гц, 2Н), 4,14 (т, J=6,4 Гц, 2Н), 2,92-2,89 (м, 4Н), 2,76-2,73 (м, 2Н), 2,67-2,64 (м, 2Н), 2,57-2,51 (м, 4Н), 1,77-1,74 (м, 2Н), 1,59-1,56 (м, 2Н), 1,28 (т, J=7,1 Гц, 3Н), 0,96 (т, J=7,3 Гц, 3Н), 0,88 (т, J=7,3 Гц, 3Н); LCMS (ES): m/z 620,5 [М+Н+]; чистота ~95%.
Схема 4:
ПРИМЕР 5
3-(5-Этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксибензолсульфоновая кислота (3):
К перемешиваемому раствору 5-этил-2-(5-((4-(2-гидроксиэтил)пиперазин-1-ил) сульфонил)-2-пропоксифенил)-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она дигидрохлорида (Мироденафил.2HCl; WO 01/60825) (5,0 г, 8,27 ммоль) в воде (105 мл) по каплям добавляли концентрированную серную кислоту (80 мл) при комнатной температуре в инертной атмосфере в течение 1 ч. После добавления реакционную смесь нагревали до 100°С в течение 108 ч (4,5 дня). После завершения реакции (контроль с помощью ТСХ и LCMS), реакционную смесь охлаждали до ~10°С и нейтрализовали 25% водным раствором NaOH (360 мл). Полученную гетерогенную смесь упаривали при пониженном давлении до полного удаления воды. Полученный остаток обрабатывали 20% метанолом в дихлорметане (6×500 мл) и фильтровали. Объединенные органические фильтраты сушили над безводным Na2SO4 и упаривали при пониженном давлении. Неочищенный продукт перегоняли совместно с толуолом (2×100 мл), затем растирали с диэтиловым эфиром (100 мл), отфильтровывали и сушили в вакууме, получая указанное в заголовке соединение 3 (3,2 г, выход 92%) в виде грязно-белого твердого вещества. 1Н-ЯМР (300 МГц, ДМСО-d6) δ м.д. 11,50 (уш. с, 1Н), 7,96 (д, J=2,2 Гц, 1Н), 7,65 (д.д, J=8,4; 2,2 Гц, 1Н), 7,29 (с, 1Н), 7,08 (д, J=8,8 Гц, 1Н), 4,37 (кв, J=7,0 Гц, 2Н), 4,06 (т, J=6,42 Гц, 2Н), 2,64-2,55 (м, 2Н), 1,82-1,57 (м, 4Н), 1,36 (т, J=7,1 Гц, 3Н), 0,98 (т, J=7,4 Гц, 3Н), 0,95 (т, J=7,4 Гц, 3Н); LCMS (ESI): m/z 420,4 [М+Н+]; чистота ~95,4%.
ПРИМЕР 6
5-Этил-2-(5-((4-(2-гидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-он (5):
К перемешиваемому раствору 3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксибензолсульфоновой кислоты (3) (1,6 г, 3,63 ммоль) в смеси CH2Cl2 (96 мл) и ДМФА (0,8 мл) по каплям добавляли оксалилхлорид (1 мл, 10,89 ммоль) при 0°С в атмосфере аргона в течение 20 мин. После добавления, реакционную смесь перемешивали при той же температуре в течение 6 ч. После завершения реакции (контроль с помощью ТСХ), реакционную смесь упаривали при температуре ниже 20°С при пониженном давлении и вакуум снова заполняли атмосферой аргона, получая неочищенный продукт 2 в виде бледно-желтой жидкости, которую непосредственно брали для следующей реакции без какой-либо очистки.
К перемешиваемому раствору неочищенного соединения 2 в CH2Cl2 (96 мл) добавляли триэтиламин по каплям (7,6 мл, 54,45 ммоль) при 0°С, а затем раствор 2-(пиперидин-4-ил)этан-1-ола (590 мг, 4,54 ммоль) в CH2Cl2 (15 мл) при той же температуре в инертной атмосфере. Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 24 ч. После завершения реакции (контроль LCMS), реакционную смесь упаривали при пониженном давлении. Полученный остаток разбавляли EtOAc (200 мл), промывали водой (50 мл), насыщенным солевым раствором (50 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении с получением неочищенного продукта (1 г) в виде полутвердого вещества. Примечание: указанную реакцию повторяли в масштабе 1,5 г, оба неочищенных соединения объединяли и очищали колоночной хроматографией на силикагеле, элюируя 1-3% градиент метанола в CH2Cl2, с получением указанного в заголовке соединения 5 (1,6 г, выход 40%) в виде грязно-белого твердого вещества. 1Н-ЯМР (300 МГц, ДМСО-d6) δ м.д. 11,62 (уш. с, 1Н), 7,92 (д, J=2,2 Гц, 1Н), 7,79 (д.д, J=8,8; 2,2 Гц, 1Н), 7,36 (д, J=8,8 Гц, 1Н), 7,30 (с, 1Н), 4,37-4,28 (м, 3Н), 4,13 (т, J=6,4 Гц, 2Н), 3,62-3,59 (м, 2Н), 3,39-3,36 (м, 2Н), 2,58-2,55 (м, 2Н), 2,30-2,17 (м, 2Н), 1,83-1,54 (м, 6Н), 1,45-1,24 (м, 6Н), 1,23-1,16 (м, 2Н), 0,97 (т, J=7,3 Гц, 3Н), 0,96 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 531,5 [М+Н]+; чистота ~94,2%.
Схема 5:
ПРИМЕР 7
2-(1-((3-(5-Этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрат (1б):
К перемешиваемому раствору 5-этил-2-(5-((4-(2-гидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 5 (90 мг, 0,17 ммоль) в ацетонитриле (2,7 мл) по каплям добавляли раствор свежеприготовленного ацетилнитрата (0,08 мл; 0,85 ммоль) [(ацетилнитрат готовили отдельно, медленно добавляя дымящую HNO3 (1,1 мл, 25,5 ммоль) по каплям в уксусный ангидрид (2,5 мл, 26,5 ммоль) при -15°С в течение 30 мин в атмосфере аргона (Примечание: температура не должна превышать 0°С))] при -15°С в течение 30 мин в атмосфере аргона. Реакционную смесь перемешивали при температуре от -15 до -0°С в течение 4 ч. После завершения реакции (контроль с помощью ТСХ), реакцию останавливали, добавлением насыщенного раствора NaHCO3 (6 мл) при 0°С и экстрагировали EtOAc (3×10 мл). Объединенные органические слои промывали насыщенным солевым раствором (10 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С-18; Grace System), элюируя 60-65% градиентом ацетонитрила в воде. Чистые фракции лиофилизировали, получая указанное в заголовке соединение 1б (19 мг; выход 19%) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,61 (с, 1Н; обмен с D2O), 7,93 (д, J=2,2 Гц, 1Н), 7,80 (д.д, J=8,8; 2,2 Гц, 1Н), 7,36 (д, J=8,8 Гц, 1Н), 7,30 (с, 1Н), 4,51 (т, J=6,6 Гц, 2Н), 4,37 (кв, J=7,0 Гц, 2Н), 4,13 (т, J=6,4 Гц, 2Н), 3,64-3,61 (м, 2Н), 2,58-2,55 (м, 2Н), 2,28-2,24 (м, 2Н), 1,82-1,69 (м, 4Н), 1,68-1,53 (м, 4Н), 1,37-1,35 (м, 4Н), 1,28-1,17 (м, 2Н), 1,03-0,85 (м, 6Н); LCMS (ES): m/z 576,4 [М+Н+]; чистота ~99%.
Схема 6:
ПРИМЕР 8
5-Этил-2-(5-((4-(2-гидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-6-(гидроксиметил)-7-пропил-3,5-дигидро-4Н-пирроло[3,2-d]пиримидин-4-он (6):
К перемешиваемому раствору 5-этил-2-(5-((4-(2-гидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 5 (650 мг, 1,23 ммоль) в концентрированном растворе HCl (6,5 мл) добавляли параформальдегид (325 мг, 0,5 масс. доля) при комнатной температуре в инертной атмосфере. Реакционную смесь нагревали до 50°С в течение 12 ч. Реакцию контролировали с помощью ТСХ и LCMS анализа. Через 12 ч реакционную смесь охлаждали до комнатной температуры, рН доводили до 7-8 с помощью насыщенного раствора NaHCO3 (100 мл). Полученный раствор экстрагировали 10% метанолом в дихлорметане (3×100 мл). Объединенные органические экстракты сушили над безводным Na2SO4 и упаривали при пониженном давлении, получая неочищенный продукт. Примечание: эту же реакцию выполняли ранее в масштабе 50 мг и 100 мг. Все указанные партии объединяли и очищали хроматографией с обращенной фазой (колонка С18; Grace System), элюируя 40-50% градиентом ацетонитрила в воде, чтобы получить указанное в заголовке соединение 6 (380 мг; выход 54% исходя из регенерации 5) в виде грязно-белого твердого вещества и непрореагировавшее 5 (200 мг; чистота ~ 69%). 1Н-ЯМР (300 МГц, ДМСО-d6) δ м.д. 11,64 (уш. с, 1Н; обмен с D2O), 7,91 (уш. д, J=1,8 Гц, 1Н), 7,80 (д.д, J=8,8; 1,8 Гц, 1Н), 7,36 (д, J=8,8 Гц, 1Н), 5,22 (уш. с, 1Н; обмен с D2O), 4,58-4,56 (м, 2Н), 4,48-4,44 (м, 2Н), 4,32 (уш. т, J=4,8 Гц, 1Н; обмен с D2O), 4,13-4,11 (м, 2Н), 3,61-3,57 (м, 2Н), 3,39-3,36 (м, 2Н), 2,64-2,56 (м, 2Н), 2,28-2,22 (м, 2Н), 1,80-1,65 (м, 4Н), 1,59-1,56 (м, 2Н), 1,40-1,27 (м, 6Н), 1,21-1,16 (м, 2Н), 0,97 (т, J=7,3 Гц, 3Н), 0,88 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 561,5 [М+Н+]; чистота ~98,9%.
ПРИМЕР 9
5-Этил-2-(5-((4-(2-гидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегид (7):
К перемешиваемому раствору 5-этил-2-(5-((4-(2-гидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-6-(гидроксиметил)-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 6 (400 мг, 0,71 ммоль) в CH2Cl2 (80 мл) добавляли активированный MnO2 (1,08 г, 12,33 ммоль) и KMnO4 (360 мг, 2,28 ммоль) при комнатной температуре. После перемешивания в течении 24 ч реакционную смесь фильтровали через целитовую прокладку и промывали CH2Cl2 (200 мл). Фильтрат упаривали до 1/3 его объема и к нему добавляли активированный MnO2 (1,08 г, 12,33 ммоль) и KMnO4 (360 мг, 2,28 ммоль) снова при комнатной температуре и перемешивали в течение 40 ч. После полного расходования исходного соединения (контроль с помощью ТСХ) реакционную смесь фильтровали через целитовую прокладку и промывали CH2Cl2 (200 мл). Фильтрат выпаривали и полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (Grace System), элюируя 4% раствора 30% метанола в дихлорметане с дихлорметаном, с получением 7 (215 мг, выход 52%) в виде грязно-белого твердого вещества. 1Н-ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,09 (с, 1Н), 10,14 (с, 1Н), 7,89 (д, J=2,20 Гц, 1Н), 7,82 (д.д, J=8,8; 2,2 Гц, 1Н), 7,37 (д, J=8,8 Гц, 1Н), 4,85 (кв, J=6,6 Гц, 2Н), 4,31 (т, J=5,1 Гц, 1Н), 4,12 (т, J=6,4 Гц, 2Н), 3,62-3,59 (м, 2Н), 3,40-3,35 (м, 2Н), 2,97-2,94 (м, 2Н), 2,26-2,21 (м, 2Н), 1,80-1,61 (м, 6Н), 1,34-1,29 (м, 6Н), 1,18-1,14 (м, 2Н), 1,01-0,85 (м, 6Н); LCMS (ESI): m/z 559,5 [М+Н]+; чистота ~96%.
ПРИМЕР 10
(E)-5-Этил-2-(5-((4-(2-гидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2d]пиримидин-6-карбальдегид оке им (8):
К перемешиваемому раствору 5-этил-2-(5-((4-(2-гидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегида 7 (75 мг, 0,13 ммоль) в EtOH (9 мл) добавляли 50% водный раствор гидроксиламина (1,5 мл) при комнатной температуре. Реакционную смесь нагревали до 50°С и перемешивали в атмосфере аргона в течение 5 ч. После завершения реакции (контроль с помощью ТСХ), реакцию упаривали при пониженном давлении. Полученный остаток разбавляли этилацетатом (20 мл), промывали водой (5 мл), насыщенным солевым раствором (5 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали перекристаллизацией из изопропанола (2 мл) и сушили в вакууме, получая указанное в заголовке соединение 8 (41 мг; выход 52%) в виде грязно-белого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,75 (с, 1Н; обмен с D2O), 11,59 (с, 1Н; обмен с D2O), 8,34 (с, 1Н), 7,93 (д, J=2,4 Гц, 1Н), 7,80 (д.д, J=8,8; 2,4 Гц, 1Н), 7,37 (д, J=8,8 Гц, 1Н), 4,73-4,71 (м, 2Н), 4,29 (т, J=4, 9 Гц, 1Н; обмен с D2O), 4,13 (т, J=6,4 Гц, 2Н), 3,62-3,58 (м, 2Н), 3,40-3,36 (м, 2Н), 2,76-2,73 (м, 2Н), 2,27-2,23 (м, 2Н), 1,88-1,69 (м, 4Н), 1,63-1,49 (м, 2Н), 1,42-1,21 (м, 6Н), 1,18-1,14 (м, 2Н), 0,97 (т, J=7,3 Гц, 3Н), 0,88 (т, J=7,3 Гц, 3Н); LCMS (ES): m/z 574,6 [М+Н+]; чистота ~97,6%.
Схема 7:
ПРИМЕР 11
2-(1-((3-(5-Этил-6-формил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрат (1ж);
К перемешиваемому раствору 5-этил-2-(5-((4-(2-гидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегида 7 (215 мг, 0,42 ммоль) в ацетонитриле (6,5 мл) по каплям добавляли раствор свежеприготовленного ацетилнитрата (0,19 мл; 2,1 ммоль) [(ацетилнитрат готовили отдельно, медленно добавляя дымящую HNO3 (2,5 мл, 51 ммоль) по каплям в уксусный ангидрид (5,0 мл, 53,0 ммоль) при -15°С в течение 30 мин в атмосфере аргона (Примечание: температура не должна превышать 0°С))] при -15°С в течение 30 мин в атмосфере аргона. Реакционную смесь перемешивали при температуре от -15 до -0°С в течение 4 ч. После завершения реакции (контроль с помощью ТСХ), реакцию останавливали, добавлением насыщенного раствора NaHCO3 (10 мл) при 0°С и экстрагировали EtOAc (3×20 мл). Объединенные органические слои промывали насыщенным солевым раствором (10 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении, получая неочищенный продукт 1ж (190 мг) в виде коричневого полутвердого вещества, которое непосредственно использовали для следующей реакции без дополнительной очистки. LCMS (ESI): m/z 604,5 [М+Н+]; чистота ~64%.
ПРИМЕР 12
(E)-2-(1-((3-(5-этил-6-((гидроксиимино)метил)-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрат (1в):
К перемешиваемому раствору 2-(1-((3-(5-этил-6-формил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрата 1ж (190 мг) в EtOH (24 мл) добавляли 50% водный раствор гидроксиламина (4 мл) при комнатной температуре. Реакционную смесь нагревали до 50°С и перемешивали в течение 5 ч в атмосфере аргона. После завершения реакции (контроль с помощью ТСХ), реакционную смесь упаривали при пониженном давлении. Полученный остаток разбавляли водой (5 мл) и экстрагировали EtOAc (3×20 мл). Объединенные органические слои промывали насыщенным солевым раствором (10 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (Grace system), элюируя 45-50%) градиентом EtOAc в петролейном эфире, получая (110 мг; ~91% чистота по LCMS), который дополнительно очищали растиранием с изопропанолом (7,5 мл) при 80°С в течение 30 мин и затем перемешиванием при комнатной температуре в течение 2 ч. Твердое вещество отфильтровывали и сушили в вакууме, получая 1в (80 мг; выход 39%) в виде грязно-белого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,80 (уш. с, 1Н; обмен с D2O), 11,63 (уш, с, 1Н; обмен с D2O), 8,35 (с, 1Н), 7,91 (д, J=2,2 Гц, 1Н), 7,81 (д.д, J=8,8; 2,2 Гц, 1Н), 7,37 (д, J=8,8 Гц, 1Н), 4,72 (кв, J=6,8 Гц, 2Н), 4,51 (т, J=6,4 Гц, 2Н), 4,13 (т, J=6,1 Гц, 2Н), 3,63-3,61 (м, 2Н), 2,75-2,72 (м, 2Н), 2,26-2,21 (м, 2Н), 1,83-1,67 (м, 4Н), 1,65-1,50 (м, 4Н), 1,43-1,12 (м, 6Н), 0,97 (т, J=7,3 Гц, 3Н), 0,88 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 619,5 [М+Н+]; чистота ~95,7%.
Схема 8:
ПРИМЕР 13
5-Этил-2-(5-((4-(3-гидроксипропил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-7-пропил-3,5-дигидро-4Н-пирроло[3,2-d]пиримидин-4-он (15):
К перемешиваемому раствору вышеуказанного неочищенного соединения 4 в CH2Cl2 (60 мл) добавляли по каплям триэтиламин (9,5 мл, 65,66 ммоль) при 0°С с последующим добавлением по каплям 3-(пиперидин-4-ил)пропан-1-ола (811 мг, 5,66 ммоль), растворенного в CH2Cl2 (20 мл), при 0°С. Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 16 ч. После завершения реакции (контроль с помощью LCMS), реакционную смесь упаривали при пониженном давлении. Остаток растворяли в EtOAc (30 мл), промывали водой (30 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией на силикагеле, элюируя 60-70% градиентом EtOAc в петролейном эфире, и получая 15 (650 мг, выход 27%) в виде белого твердого вещества. 1H-ЯМР (300 МГц, ДМСО-d6) δ м.д. 11,66 (уш. с, 1Н), 7,91 (д, J=2,0 Гц, 1Н) 7,78 (д.д, J=8,8; 2,0 Гц, 1Н), 7,35 (д, J=8,8 Гц, 1Н), 7,29 (с, 1Н), 4,38-4,31 (м, 3Н), 4,12 (т, J=6,4 Гц, 2Н), 3,62-3,60 (м, 2Н), 3,35-3,31 (м, 2Н), 2,58-2,56 (м, 2Н), 2,25-2,22 (м, 2Н), 1,81-1,59 (м, 6Н), 1,37-1,33 (м, 5Н), 1,23-1,10 (м, 5Н), 1,02-0,88 (м, 6Н); LCMS (ESI): m/z 545,5 [М+Н]+; чистота ~97,1%.
Схема 9:
ПРИМЕР 14
3-(1-((3-(5-Этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)пропилнитрат (1 г):
К перемешиваемому раствору 5-этил-2-(5-((4-(3-гидроксипропил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 15 (160 мг, 0,29 ммоль) в ацетонитриле (5,0 мл) по каплям добавляли раствор свежеприготовленного ацетилнитрата (0,13 мл; 1,47 ммоль) [(ацетилнитрат готовили отдельно, медленно добавляя дымящую HNO3 (1,1 мл, 25,5 ммоль) по каплям в уксусный ангидрид (2,5 мл, 26,5 ммоль) при -15°С в течение 30 мин в атмосфере аргона (Примечание: температура не должна превышать 0°С))] при -15°С в течение 30 мин в атмосфере аргона. Реакционную смесь выдерживали при температуре от -15 до -5°С в течение 4 ч. После завершения реакции (контроль с помощью ТСХ), реакцию останавливали добавлением насыщенного раствора NaHCO3 (15 мл) при 0°С и экстрагировали EtOAc (3×25 мл). Объединенные органические слои промывали насыщенным солевым раствором (10 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С-18, Grace System), элюируя 60-65% градиентом ацетонитрила в воде. Чистые фракции лиофилизировали, получая указанное в заголовке соединение 1 г (45 мг; выход ~25%) в виде грязно-белого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,62 (уш. с, 1Н; обмен с D2O), 7,93 (д, J=2,4 Гц, 1Н), 7,79 (д.д, J=8,8; 2,4 Гц, 1Н), 7,36 (д, J=8,8 Гц, 1Н), 7,30 (с, 1Н), 4,46 (т, J=6,6 Гц, 2Н), 4,37 (кв, J=7,3 Гц, 2Н), 4,13 (т, J=6,4 Гц, 2Н), 3,64-3,62 (м, 2Н), 2,58-2,56 (м, 2Н), 2,26-2,22 (м, 2Н), 1,81-1,56 (м, 8 Н), 1,36 (т, J=7,3 Гц, 3Н), 1,29-1,10 (м, 5Н), 1,01-0,87 (м, 6Н); LCMS (ESI): m/z 590,5 [М+Н+]; чистота ~98,9%.
Схема 10:
ПРИМЕР 15
5-Этил-6-(гидроксиметил)-2-(5-((4-(3-гидроксипропил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-он (9):
К перемешиваемому раствору 5-этил-2-(5-((4-(3-гидроксипропил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 15 (900 мг, 1,65 ммоль) в концентрированном растворе HCl (9 мл) добавляли параформальдегвд (450 мг, 0,5 масс, доля) при комнатной температуре и нагревали до 50°С в инертной атмосфере. Реакцию контролировали с помощью LCMS анализа. После 12 ч перемешивания реакционную смесь охлаждали до комнатной температуры и нейтрализовали насыщенным раствором NaHCO3 (150 мл). Полученный раствор экстрагировали 10% метанолом в дихлорметане (3×100 мл). Объединенные органические экстракты сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С-18; Grace System), элюируя 40-50% градиентом ацетонитрила в воде, получая указанное в заголовке соединение 9 (240 мг; выход 46% исходя из регенерации 8) в виде грязно-белого твердого вещества и 420 мг непрореагировавшего 8. 1H-ЯМР (300 МГц, ДМСО-d6) δ м.д. 11,66 (с, 1Н), 7,90 (д, J=2,5 Гц, 1Н), 7,79 (д.д, J=8,8; 2,5 Гц, 1Н), 7,36 (д, J=8,80 Гц, 1Н), 5,26-5,21 (м, 1Н), 4,57 (д, J=4,4 Гц, 2Н), 4,46 (кв, J=7,0 Гц, 2Н), 4,35 (уш. с, 1Н), 4,13-4,11 (м, 2Н), 3,63-3,61 (м, 2Н), 3,42-3,35 (м, 2Н), 2,61-2,55 (м, 2Н), 2,26-2,18 (м, 2Н), 1,78-1,66 (м, 4Н), 1,60-1,54 (м, 2Н), 1,39-1,33 (м, 5Н), 1,18-1,11 (м, 5Н), 0,96 (т, J=7,3 Гц, 3Н), 0,88 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 575,4 [М+Н+]; чистота ~97,6%.
ПРИМЕР 16
5-Этил-2-(5-((4-(3-гидроксипропил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегид (10):
К перемешиваемому раствору 5-этил-6-(гидроксиметил)-2-(5-((4-(3-гидроксипропил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 9 (240 мг, 0,42 ммоль) в CH2Cl2 (48 мл) добавляли активированный MnO2 (632 мг, 7,3 ммоль) и KMnO4 (213 мг, 1,35 ммоль) при комнатной температуре и перемешивали в течение 24 ч. Реакцию контролировали с помощью ТСХ и LCMS анализа. Через 24 ч реакционную смесь фильтровали через целитовую прокладку и промывали CH2Cl2 (100 мл). Фильтрат упаривали до 50 мл раствора и снова добавляли активированный MnO2 (632 мг, 7,3 ммоль) и KMnO4 (213 мг, 1,35 ммоль) при комнатной температуре и перемешивали в течение 24 ч. То же самое повторяли снова и перемешивали в течение дополнительных 24 ч для полного расходования исходного соединения. Затем реакционную смесь фильтровали через целитовую прокладку и промывали CH2Cl2 (200 мл). Фильтрат упаривали, получая указанное в заголовке соединение 10 (150 мг, выход 57%) в виде грязно-белого твердого вещества. 1Н-ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,10 (с, 1Н), 10,14 (с, 1Н), 7,89 (д, J=2,2 Гц, 1Н), 7,82 (д.д, J=8,8; 2,2 Гц, 1Н), 7,37 (д, J=8,8 Гц, 1Н), 4,85 (кв, J=7,0 Гц, 2Н), 4,33 (т, J=5,1 Гц, 1Н), 4,13-4,11 (м, 2Н), 3,63-3,61 (м, 2Н), 3,35-3,33 (м, 2Н), 2,97-2,94 (м, 2Н), 2,26-2,20 (м, 2Н), 1,78-1,61 (м, 6Н), 1,41-1,27 (м, 5Н) 1,19-1,12 (м, 5Н), 1,01-0,84 (м, 6Н); LCMS (ESI): m/z 573,5 [М+Н]+; чистота ~92,1%.
ПРИМЕР 17
(E)-5-Этил-2-(5-((4-(3-гидроксипропил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегид оксим (11):
К перемешиваемому раствору 5-этил-2-(5-((4-(3-гидроксипропил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегида 10 (150 мг, 0,26 ммоль) в EtOH (18 мл) добавляли 50% водный раствор гидроксиламина (3 мл) при комнатной температуре. Реакционную смесь нагревали до 50°С в течение 5 ч в атмосфере аргона. После завершения реакции (контроль с помощью ТСХ), реакцию упаривали при пониженном давлении. Полученный остаток разбавляли этилацетатом (25 мл), промывали водой (10 мл), насыщенным солевым раствором (10 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (Grace System), элюируя 4% раствора 30% метанола в дихлорметане с дихлорметаном, с получением продукта с чистотой 94%, который дополнительно очищали перекристаллизацией из изопропанола (2 мл) с получением указанного в заголовке соединения 11 (65 мг; выход 42%) в виде белого твердого вещества. 1H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,78 (уш. с, 1Н; обмен с D2O), 11,61 (с, 1Н; обмен с D2O), 8,35 (с, 1Н), 7,92 (д, J=2,4 Гц, 1Н), 7,80 (д.д, J=8,8; 2,4 Гц, 1Н), 7,37 (д, J=8,8 Гц, 1Н), 4,76-4,68 (м, 2Н), 4,32 (т, J=5,4 Гц, 1Н; обмен с D2O), 4,14-4,12 (м, 2Н), 3,63-3,61 (м, 2Н), 3,36-3,33 (м, 2Н), 2,75-2,73 (м, 2Н), 2,24-2,21 (м, 2Н), 1,81-1,66 (м, 4Н), 1,63-1,53 (м, 2Н), 1,41-1,33 (м, 2Н), 1,28 (т, J=7,1 Гц, 3Н), 1,22-1,09 (м, 5Н), 0,97 (т, J=7,3 Гц, 3Н), 0,88 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 588,5 [М+Н+]; чистота ~99,4%.
Схема 11:
ПРИМЕР 18
3-(1-((3-(5-Этил-6-формил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)пропилнитрат (1з):
К перемешиваемому раствору 5-этил-2-(5-((4-(3-гидроксипропил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегида 10 (150 мг, 0,26 ммоль) в ацетонитриле (6,5 мл) по каплям добавляли раствор свежеприготовленного ацетилнитрата (0,12 мл; 1,31 ммоль) [(ацетилнитрат готовили отдельно, медленно добавляя дымящую HNO3 (1,1 мл, 25,5 ммоль) по каплям в уксусный ангидрид (2,5 мл, 26,5 ммоль) при -15°С в течение 30 мин в атмосфере аргона (Примечание: температура не должна превышать 0°С))] при -15°С в течение 30 мин в атмосфере аргона. Реакцию выдерживали при температуре от -15 до -5°С в течение 4 ч. После завершения реакции (контроль с помощью ТСХ) реакцию останавливали, добавлением насыщенного раствора NaHCO3 (10 мл) при 0°С и экстрагировали EtOAc (3×20 мл). Объединенные органические слои промывали насыщенным солевым раствором (10 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении, получая неочищенный продукт 1з (100 мг) в виде коричневого полутвердого вещества, которое непосредственно использовали для следующей реакции без дополнительной очистки. LCMS (ESI): m/z 618,7 [М+Н+]; чистота ~59%.
ПРИМЕР 19
(E)-3-(1-((3-(5-Этил-6-((гидроксиимино)метил)-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)пропилнитрат (1д):
К перемешиваемому раствору 3-(1-((3-(5-этил-6-формил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)пропилнитрата 1з (100 мг) в EtOH (12 мл) добавляли 50% водный раствор гидроксиламина (2 мл) при комнатной температуре и перемешивали при 50°С в течение 5 ч в атмосфере аргона. После завершения реакции (контроль с помощью ТСХ), реакцию упаривали при пониженном давлении. Полученный остаток разбавляли водой (5 мл) и экстрагировали EtOAc (3×20 мл). Объединенные органические слои промывали насыщенным солевым раствором (10 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией на силикагеле (Grace System), элюируя 45-50% градиентом EtOAc в петролейном эфире, с получением 110 мг указанного в заголовке соединения с чистотой ~ 91%, которое дополнительно очищали перекристаллизацией в горячем изопропаноле (7,5 мл) с получением указанного в заголовке соединения 1д (40 мг) в виде грязно-белого твердого вещества. 1H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,75 (уш. с, 1Н; обмен с D2O), 11,59 (с, 1Н; обмен с D2O), 8,34 (с, 1Н), 7,93 (д, J=2,4 Гц, 1Н), 7,81 (д.д, J=8,8; 2,4 Гц, 1Н), 7,37 (д, J=8,8 Гц, 1Н), 4,72 (кв, J=6,8 Гц, 2Н), 4,46 (т, J=6,6 Гц, 2Н), 4,13 (т, J=6,4 Гц, 2Н) 3,64-3,62 (м, 2Н), 2,75-2,73 (м, 2Н), 2,27-2,23 (м, 2Н), 1,81-1,67 (м, 4Н), 1,67-1,53 (м, 4Н), 1,33-1,08 (м, 8Н), 0,97 (т, J=7,6 Гц, 3Н), 0,88 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 633,5 [М+Н+]; чистота ~98,7%.
Схема 12:
ПРИМЕР 20
2-(4-((3-(5-Этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)этилнитрат (1и):
К перемешиваемому раствору 5-этил-2-(5-((4-(2-гидроксиэтил)пиперазин-1-ил) сульфонил)-2-пропоксифенил)-7-пропил-3,5-дигидро-4Н-пирроло[3,2-d]пиримидин-4-она (Мироденафил) (300 мг, 0,56 ммоль) в ацетонитриле (12 мл) по каплям добавляли свежеприготовленный ацетилнитрат (0,25 мл; 2,82 ммоль) [(ацетилнитрат готовили отдельно, медленно добавляя дымящую HNO3 (1,1 мл, 25,5 ммоль) по каплям в уксусный ангидрид (2,5 мл, 26,5 ммоль) при -15°С в течение 30 мин в атмосфере аргона (Примечание: температура не должна превышать 0°С))] при -10°С в атмосфере аргона. Реакцию поддерживали при температуре от -10 до -5°С и контролировали с помощью LCMS анализа. Через 4 ч добавляли еще 2 эквивалента ацетилнитрата (0,1 мл) при -10°С и перемешивание продолжали при температуре от -10°С до -5°С в течение 2 ч. Затем реакцию останавливали добавлением насыщенного раствора NaHCO3 (15 мл) при 0°С и перемешивали при комнатной температуре в течение 16 ч. Полученный раствор экстрагировали EtOAc (2×30 мл). Объединенные органические слои промывали насыщенным солевым раствором (20 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией на силикагеле (Grace System), элюируя 4% раствора 30% метанола в CH2Cl2 с CH2Cl2, с получением 180 мг продукта в виде липкого твердого вещества, которое дополнительно очищали колоночной хроматографией с обращенной фазой (колонка С18; Grace System), элюируя 45% ацетонитрила в воде с получением чистого указанного в заголовке соединения 1и (25 мг; чистота 95%) в виде бледно-желтого твердого вещества и его смеси (80 мг, чистота 78%). 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,64 (уш. с, 1Н; обмен с D2O), 7,89 (д, J=2,4 Гц, 1Н), 7,80 (д.д, J=8,8; 2,4 Гц, 1Н), 7,38 (д, J=8,8 Гц, 1Н), 7,31 (с, 1Н), 4,56 (т, J=5,1 Гц, 2Н), 4,37 (кв, J=7,3 Гц, 2Н), 4,13 (т, J=6,4 Гц, 2Н), 2,90-2,87 (м, 4Н), 2,66-2,63 (м, 2Н), 2,58-2,55 (м, 2Н), 2,54-2,51 (м, 4Н), 1,76-1,72 (м, 2Н), 1,67-1,58 (м, 2Н), 1,36 (т, J=7,3 Гц, 3Н), 0,96 (т, J=7,4 Гц, 3Н), 0,92 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 577,2 [М+Н+]; чистота ~95,1%.
Схема 13:
ПРИМЕР 21
5-((4-(2-(Бензоилокси)этил)пиперидин-1-ил)сульфонил)-2-этоксибензойная кислота
К перемешиваемому раствору 2-(пиперидин-4-ил)этилбензоата в виде соли ТФУ (980 мг, 2,83 ммоль) в CH2Cl2 (5 мл) добавляли триэтиламин (1,96 мл, 14,1 ммоль) при 0°С в инертной атмосфере. К полученной смеси по каплям добавляли раствор 5-(хлорсульфонил)-2-этоксибензойной кислоты (750 мг, 2,83 ммоль) в CH2Cl2 (10 мл) при 0°С в инертной атмосфере. Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 16 ч. После завершения реакции (контроль с помощью ТСХ и LCMS), реакционную смесь разбавляли в CH2Cl2 (50 мл), промывали охлажденной водой (10 мл), охлажденным 10% водным раствором лимонной кислоты (2×10 мл), насыщенным солевым раствором (10 мл), сушили над Na2SO4 и упаривали при пониженном давлении, получая указанное в заголовке соединение 12 (710 мг, выход 52%) в виде белого твердого вещества. 1H-ЯМР (300 МГц, CDCl3) δ м.д. 8,49 (д, J=2,2 Гц, 1Н), 8,08-7,83 (м, 3Н), 7,59-7,51 (м, 1Н), 7,47-7,38 (м, 2Н), 7,14 (д, J=8,8 Гц, 1Н), 4,49-4,25 (м, 4Н), 3,83-3,80 (м, 2Н), 2,30-2,26 (м, 2Н), 1,84-1,82 (м, 2Н), 1,73-1,71 (м, 2Н), 1,60 (т, J=7,1 Гц, 3Н), 1,45-1,33 (м, 3Н); LCMS (ESI): m/z 462,4 [М+Н+]; чистота ~96,4%.
ПРИМЕР 22
2-(1-((3-((2-Карбамоил-1-метил-4-пропил-1Н-пиррол-3-ил)карбамоил)-4-этоксифенил) сульфонил)пиперидин-4-ил)этилбензоат (13):
К перемешиваемому раствору 5-((4-(2-(бензоилокси)этил)пиперидин-1-ил)сульфонил)-2-этоксибензойной кислоты 12 (250 мг, 0,54 ммоль) в ДМФА (2,5 мл) добавляли диизопропилэтиламин (210 мг, 1,62 ммоль) и TBTU (347 мг, 1,08 ммоль) при комнатной температуре и перемешивали в течение 30 мин. К полученной меси добавляли 3-амино-1-метил-4-пропил-1Н-пиррол-2-карбоксамид (98 мг, 0,541 ммоль) при комнатной температуре и перемешивали в течение 15 ч в инертной атмосфере. После завершения реакции (контроль с помощью ТСХ и LCMS), реакцию останавливали добавлением охлажденной воды (25 мл) и экстрагировали EtOAc (2×25 мл). Объединенные органические слои промывали насыщенным солевым раствором (2×15 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С-18, Grace System), элюируя 50% ацетонитрилом в воде. Фракции упаривали с получением твердого вещества, которое растирали с диэтиловым эфиром (5 мл), фильтровали и сушили с получением указанного в заголовке соединения 13 (85 мг; выход ~ 23%) в виде грязно-белого твердого вещества. 1Н-ЯМР (400 МГц, CDCl3) δ м.д. 9,17 (с, 1Н), 8,64 (д, J=2,4 Гц, 1Н), 8,03-7,96 (м, 2Н), 7,91 (д.д, J=8,8; 2,4 Гц, 1Н), 7,60-7,52 (м, 1Н), 7,47-7,38 (м, 2Н), 7,15 (д, J=8,8 Гц, 1Н), 6,53 (с, 1Н), 4,43-4,29 (м, 4Н), 3,85-3,83 (м, 5 Н), 2,39-2,24 (м, 4Н), 1,84-1,82 (м, 2Н), 1,73-1,71 (м, 2Н), 1,56-1,43 (м, 5 Н), 1,43-1,39 (м, 3Н), 0,92 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 625,5 [М+Н+]; чистота ~93%.
ПРИМЕР 23
2-(2-Этокси-5-((4-(2-гидроксиэтил)пиперидин-1-ил)сульфонил)фенил)-5-метил-7-пропил-3,5-дигидро-4Н-пирроло[3,2-d]пиримидин-4-он (14):
В герметично закрываемую трубку загружали 2-(1-((3-((2-карбамоил-1-метил-4-пропил- 1Н-пиррол-3-ил)карбамоил)-4-этоксифенил) сульфонил)пиперидин-4-ил)этилбензоат 13 (85 мг, 0,14 ммоль), этанол (1,3 мл) и затем 1М водный раствор КОН (1,2 мл) при комнатной температуре. Трубку закрывали крышкой и реакционную смесь перемешивали при 100°С в течение 24 ч. После завершения реакции (контроль с помощью ТСХ и LCMS), реакцию охлаждали до комнатной температуры и упаривали при пониженном давлении. Полученный остаток разбавляли водой (5 мл) и экстрагировали дихлорметаном (3×20 мл). Объединенные органические слои промывали насыщенным солевым раствором (10 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С-18; Grace System), элюируя 40-43% градиентом ацетонитрила в воде. Чистые фракции лиофилизировали, получая указанное в заголовке соединение 14 (34,5 мг, выход 50%) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,67 (уш. с, 1Н; обмен с D2O), 7,89 (д, J=2,4 Гц, 1Н), 7,79 (д.д, J=8,8; 2,4 Гц, 1Н), 7,34 (д, J=8,80 Гц, 1Н), 7,20 (с, 1Н), 4,31 (уш. с, 1Н; обмен с D2O), 4,21 (кв, J=6,9 Гц, 2Н), 3,98 (с, 3Н), 3,61-3,59 (м, 2Н), 3,39-3,37 (м, 2Н), 2,57-2,55 (м, 2Н), 2,31-2,17 (м, 2Н), 1,77-1,56 (м, 4Н), 1,43-1,26 (м, 6Н), 1,23-1,09 (м, 2Н), 0,92 (т, J=7,6 Гц, 3Н); LCMS (ESI): m/z 503,4 [М+Н+]; чистота ~99,2%.
Схема 14:
ПРИМЕР 24
2-(1-((4-Этокси-3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперидин-4-ил)этилнитрат (2в):
К перемешиваемому раствору 2-(2-этокси-5-((4-(2-гидроксиэтил)пиперидин-1-ил)сульфонил)фенил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 14 (150 мг, 0,30 ммоль) в ацетонитриле (4,5 мл) по каплям добавляли раствор свежеприготовленного ацетилнитрата (0,13 мл; 1,5 ммоль) [(ацетилнитрат готовили отдельно, медленно добавляя дымящую HNO3 (1,1 мл, 25,5 ммоль) по каплям в уксусный ангидрид (2,5 мл, 26,5 ммоль) при -15°С в течение 30 мин в атмосфере аргона (Примечание: температура не должна превышать 0°С))] при -10°С в течение 10 мин в атмосфере аргона. Реакционную смесь перемешивали при температуре от -10 до -5°С в течение 4 ч. После завершения реакции (контроль с помощью ТСХ), реакцию останавливали добавлением насыщенного раствора NaHCO3 (10 мл) при 0°С и экстрагировали EtOAc (3×20 мл). Объединенные органические слои промывали насыщенным солевым раствором (10 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С-18, Grace System), элюируя 55-60% градиентом ацетонитрила в воде. Чистые фракции лиофилизировали, получая указанное в заголовке соединение 2в (42 мг; выход ~26%) в виде бледно-желтого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,64 (уш. с, 1Н; обмен с D2O), 7,91 (д, J=2,4 Гц, 1Н), 7,80 (д.д, J=8,8; 2,4 Гц, 1Н), 7,35 (д, J=8,8 Гц, 1Н), 7,21 (с, 1Н), 4,51 (т, J=6,6 Гц, 2Н), 4,22 (кв, J=6,9 Гц, 2Н), 3,98 (с, 3Н), 3,64-3,59 (м, 2Н), 2,58-2,56 (м, 2Н), 2,30-2,26 (м, 2Н), 1,76-1,72 (м, 2Н), 1,66-1,58 (м, 4Н), 1,40-1,35 (м, 4Н), 1,22-1,06 (м, 2Н), 0,92 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 548,5 [М+Н+]; чистота ~97%.
Схема 15:
ПРИМЕР 25
2-(2-Этокси-5-((4-(2-гидроксиэтил)пиперидин-1-ил)сульфонил)фенил)-6-(гидроксиметил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-он (5):
К перемешиваемому раствору 2-(2-этокси-5-((4-(2-гидроксиэтил)пиперидин-1-ил)сульфонил)фенил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 14 (450 мг, 0,9 ммоль) в концентрированном растворе HCl (4,5 мл) добавляли параформальдегид (225 мг, 0,5 масс, доля) при комнатной температуре и нагревали до 50°С в инертной атмосфере. Реакцию контролировали с помощью LCMS анализа. После 12 ч перемешивания реакционную смесь охлаждали до комнатной температуры и нейтрализовывали насыщенным раствором NaHCO3 (100 мл). Полученный раствор экстрагировали 10% метанолом в дихлорметане (3×100 мл). Объединенные органические экстракты сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С-18; Grace System), элюируя 35-40% градиентом ацетонитрила в воде, чтобы получить указанное в заголовке соединение 15 (380 мг; выход 76%) в виде грязно-белого твердого вещества. 1Н-ЯМР (300 МГц, ДМСО-d6) δ м.д. 11,67 (уш. с, 1Н), 7,91 (д, J=2,4 Гц, 1Н), 7,79 (д.д, J=8,8; 2,4 Гц, 1Н), 7,35 (д, J=8,8 Гц, 1Н), 5,17 (т, J=5,1 Гц, 1Н), 4,56 (д, J=5,1 Гц, 2Н), 4,32 (т, J=5,0 Гц, 1Н), 4,21 (кв, J=6,7 Гц, 2Н), 4,05 (с, 3Н), 3,63-3,59 (м, 2Н), 3,42-3,38 (м, 2Н), 2,61-2,58 (м, 2Н), 2,26-2,22 (м, 2Н), 1,74-1,51 (м, 4Н), 1,38-1,26 (м, 6Н), 1,21-1,15 (м, 2Н), 0,88 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 533,5 [М+Н+]; чистота ~95%.
ПРИМЕР 26
2-(2-Этокси-5-((4-(2-гидроксиэтил)пиперидин-1-ил)сульфонил)фенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегид (16):
К перемешиваемому раствору 2-(2-этокси-5-((4-(2-гидроксиэтил)пиперидин-1-ил)сульфонил)фенил)-6-(гидроксиметил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 15 (330 мг, 0,62 ммоль) в CH2Cl2 (80 мл) добавляли активированный MnO2 (минимум 58% Mn) (933 мг, 10,73 ммоль) и KMnO4 (314 мг, 2,0 ммоль) при комнатной температуре и перемешивали в течение 60 ч. Реакцию контролировали с помощью ТСХ. Через 60 ч реакционную смесь фильтровали через целитовую прокладку и промывали CH2Cl2 (200 мл). Фильтрат упаривали, получая указанное в заголовке соединение 16 (220 мг) в виде грязно-белого твердого вещества, которое непосредственно использовали для следующей реакции без дополнительной очистки. 1Н-ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,11 (уш. с, 1Н), 10,15 (с, 1Н), 7,88 (д, J=2,4 Гц, 1Н), 7,82 (д.д, J=8,8; 2,4 Гц, 1Н), 7,36 (д, J=8,8 Гц, 1Н), 4,29-4,25 (м, 4Н), 4,21 (кв, J=7,0 Гц, 2Н), 3,63-3,59 (м, 2Н), 3,41-3,38 (м, 2Н), 2,96-2,93 (м, 2Н), 2,28-2,21 (м, 2Н), 1,74-1,67 (м, 4Н), 1,34-1,26 (м, 6Н), 1,24-1,12 (м, 2Н), 0,91 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 531,5 [М+Н]+; чистота ~88,6%.
ПРИМЕР 27
(E)-2-(2-Этокси-5-((4-(2-гидроксиэтил)пиперидин-1-ил)сульфонил)фенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегид оке им (17):
К перемешиваемому раствору 2-(2-этокси-5-((4-(2-гидроксиэтил)пиперидин-1-ил)сульфонил)фенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегида 16 (80 мг, 0,15 ммоль) в этаноле (9,6 мл) добавляли 50% водный раствор гидроксиламина (1,6 мл) при комнатной температуре. Реакционную смесь нагревали до 50°С в течение 5 ч в атмосфере аргона. После завершения реакции (контроль с помощью ТСХ), реакцию упаривали при пониженном давлении. Полученный остаток разбавляли водой (4 мл) и экстрагировали этилацетатом (3×10 мл). Объединенные органические слои промывали насыщенным солевым раствором (10 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С-18; Grace System), элюируя 35% градиентом ацетонитрила в воде. Чистые фракции лиофилизировали, получая указанное в заголовке соединение 17 (16,7 мг) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,78 (уш.с, 1Н; обмен с D2O), 11,59 (с, 1Н, обмен с D2O), 8,34 (с, 1Н), 7,92 (д, J=2,4 Гц, 1Н), 7,80 (д.д, J=8,8; 2,4 Гц, 1Н), 7,35 (д, J=8,8 Гц, 1Н), 4,28 (т, J=5,1 Гц, 1Н; обмен с D2O), 4,22 (кв, J=6,9 Гц, 2Н), 4,17 (с, 3Н), 3,64-3,59 (м, 2Н), 3,42-3,38 (м, 2Н), 2,79-2,75 (м, 2Н), 2,26-2,20 (м, 2Н), 1,74-1,70 (м, 2Н), 1,63-1,56 (м, 2Н), 1,40-1,29 (м, 6 Н), 1,14-1,09 (м, 2Н), 0,88 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 546,6 [М+Н+]; чистота ~97,7%.
Схема 16:
ПРИМЕР 28
2-(1-((4-Этокси-3-(6-формил-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперидин-4-ил)этилнитрат (2д):
К перемешиваемому раствору 2-(2-этокси-5-((4-(2-гидроксиэтил)пиперидин-1-ил)сульфонил)фенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегида 2 (140 мг, 0,26 ммоль) в ацетонитриле (5,6 мл) по каплям добавляли раствор свежеприготовленного ацетилнитрата (0,12 мл; 1,32 ммоль) [(ацетилнитрат готовили отдельно, медленно добавляя дымящую HNO3 (1,1 мл, 25,5 ммоль) по каплям в уксусный ангидрид (2,5 мл, 26,5 ммоль) при -15°С в течение 30 мин в атмосфере аргона (Примечание: температура не должна превышать 0°С))] при -10°С в течение 10 мин в атмосфере аргона. Реакцию перемешивали при -5°С в течение 4 ч. После завершения реакции (контроль с помощью ТСХ), реакцию останавливали добавлением насыщенного раствора NaHCO3 (10 мл) при 0°С и экстрагировали EtOAc (2×25 мл). Объединенные органические слои промывали насыщенным солевым раствором (20 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении, получая неочищенный продукт 3 (140 мг) в виде коричневого полутвердого вещества, которое непосредственно использовали для следующей реакции без дополнительной очистки. LCMS (ESI): m/z 576,6 [М+Н+]; чистота ~75,5%.
ПРИМЕР 29
(E)-2-(1-((4-Этокси-3-(6-((гидроксиимино)метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперидин-4-ил)этилнитрат (2а):
К перемешиваемому раствору 2-(1-((4-этокси-3-(6-формил-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперидин-4-ил)этилнитрат 2д (140 мг) в этаноле (17 мл) добавляли 50% водный раствор гидроксиламина (2,8 мл) при комнатной температуре и перемешивали при 50°С в течение 5 ч в атмосфере аргона. После завершения реакции (контроль с помощью LCMS анализа) реакционную упаривали при пониженном давлении. Полученный остаток разбавляли водой (5 мл) и экстрагировали EtOAc (2×20 мл). Объединенные органические слои промывали насыщенным солевым раствором (20 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией на силикагеле (Grace System), элюируя 45-50% градиентом EtOAc в петролейном эфире, с получением 70 мг указанного в заголовке соединения с чистотой ~93%, которое дополнительно очищали перекристаллизацией в горячем изопропаноле (2,5 мл) с получением указанного в заголовке соединения 2а (38 мг) в виде грязно-белого твердого вещества. 1H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,77 (уш.с, 1Н; обмен с D2O), 11,59 (с, 1Н; обмен с D2O), 8,34 (с, 1Н), 7,92 (д, J=2,4 Гц, 1Н), 7,81 (д.д, J=8,8; 2,4 Гц, 1Н), 7,36 (д, J=8,8 Гц, 1Н), 4,51 (т, J=6,4 Гц, 2Н), 4,22 (кв, J=6,8 Гц, 2Н), 4,17 (с, 3Н), 3,64-3,59 (м, 2Н), 2,79-2,75 (м, 2Н), 2,27-2,22 (м, 2Н), 1,78-1,74 (м, 2Н), 1,63-1,56 (м, 4Н), 1,38-1,33 (м, 4Н), 1,22-1,17 (м, 2Н), 0,88 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 591,1 [М+Н+]; чистота ~99,1%.
Схема 17:
ПРИМЕР 30
2-Этокси-5-((4-(2-гидроксиэтил)пиперазин-1-ил)сульфонил)бензойная кислота (18):
К перемешиваемому раствору 2-(пиперазин-1-ил)этан-1-ола (740 мг, 5,67 ммоль) в CH2Cl2 (9 мл) добавляли триэтиламин (4 мл, 28,35 ммоль) при 0°С в инертной атмосфере. К полученной смеси по каплям добавляли раствор 5-(хлорсульфонил)-2-этоксибензойной кислоты (1,5 г, 5,67 ммоль) в CH2Cl2 (9 мл) при 0°С в инертной атмосфере. Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 16 ч. После завершения реакции (контроль с помощью LCMS анализа), реакционную смесь очищали (без дополнительной обработки) колоночной хроматографией с обращенной фазой (колонка С-18, Grace System), элюируя 0-15% ацетонитрила в воде, чтобы получить указанное в заголовке соединение 18 (2,0 г) в виде грязно-белого полутвердого вещества. 1H-ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,72-7,63 (м, 2Н), 7,24 (д, J=8,4 Гц, 1Н), 4,16 (кв, J=6,9 Гц, 2Н), 3,44-3,29 (м, 3Н), 2,83-2,78 (м, 4Н), 2,51-2,47 (м, 4Н), 2,36-2,33 (м, 2Н), 1,34 (т, J=6,9 Гц, 3Н); LCMS (ESI): m/z 359,0 [М+Н+]; чистота ~95,9%.
ПРИМЕР 97
3-(2-Этокси-5-((4-(2-гидроксиэтил)пиперазин-1-ил)сульфонил)бензамидо)-1-метил-4-пропил-1H-пиррол-2-карбоксамид (19):
К перемешиваемому раствору 2-этокси-5-((4-(2-гидроксиэтил)пиперазин-1-ил)сульфонил)бензойной кислоты 18 (8,0 г, 22,32 ммоль) в ДМФА (40 мл) по каплям добавляли диизопропилэтиламин (19,5 мл, 111,64 ммоль), а затем TBTU (14,5 г, 45,16 ммоль) при 15°С и перемешивали в течение 20 мин. К полученной смеси добавляли 3-амино-1-метил-4-пропил-1H-пиррол-2-карбоксамид (4,0 г, 22,32 ммоль) при 15°С в инертной атмосфере. Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 1,5 ч. После завершения реакции (контроль с помощью ТСХ и LCMS), реакцию останавливали добавлением ледяной воды (400 мл) и экстрагировали EtOAc (4×200 мл). Объединенные органические слои промывали насыщенным солевым раствором (4×100 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали растиранием с дихлорметаном (50 мл) и н-гексаном (200 мл) и отфильтровывали. Твердое вещество промывали диэтиловым эфиром (50 мл) и сушили в вакууме, получая указанное в заголовке соединение 19 (7,5 г, выход ~59%) в виде бледно-коричневого твердого вещества. 1Н-ЯМР (300 МГц, ДМСО-d6) δ м.д. 9,57 (уш.с, 1Н), 7,83-7,78 (м, 2Н), 7,41 (д, J=8,4 Гц, 1Н), 7,24 (уш.с, 1Н), 6,93 (уш.с, 1Н), 6,72 (с, 1Н), 4,37 (т, J=5,3 Гц, 1Н), 4,29 (кв, J=6,7 Гц, 2Н), 3,75 (с, 3Н), 3,43-3,39 (м, 2Н), 2,87-2,84 (м, 4Н), 2,57-2,54 (м, 4Н), 2,37-2,34 (м, 2Н), 2,28-2,26 (м, 2Н), 1,54-1,38 (м, 5 Н), 0,88 (т, J=7,1 Гц, 3Н); LCMS (ESI): m/z 522,2 [М+Н+]; чистота ~91,5%.
ПРИМЕР 32
2-(2-Этокси-5-((4-(2-гидроксиэтил)пиперазин-1-ил)сульфонил)фенил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-он (20):
В герметично закрываемую трубку загружали 3-(2-этокси-5-((4-(2-гидроксиэтил)пиперазин-1-ил)сульфонил)бензамидо)-1-метил-4-пропил-1H-пиррол-2-карбоксамид 19 (190 мг, 0,364 ммоль), этанол (3,0 мл), затем 1М водный раствор КОН (2,7 мл) при комнатной температуре. Трубку закрывали крышкой и реакционную смесь перемешивали при 100°С в течение 16 ч. После завершения реакции (контроль с помощью ТСХ и LCMS анализа), реакцию охлаждали до комнатной температуры и упаривали при пониженном давлении. Полученный остаток разбавляли водой (5 мл) и экстрагировали этилацетатом (2×25 мл). Объединенные органические слои промывали насыщенным солевым раствором (20 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (Grace System), элюируя 12% раствора 30% метанола в CH2Cl2 с CH2Cl2. Чистые фракции лиофилизировали и полученное твердое вещество растирали с н-пентаном (4×10 мл) с получением указанного в заголовке соединения 20 (35 мг) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,67 (уш.с, 1Н; обмен с D2O), 7,88 (д, J=2,0 Гц, 1Н), 7,80 (д.д, J=8,8; 2,0 Гц, 1Н), 7,36 (д, J=8,8 Гц, 1Н), 7,21 (с, 1Н), 4,33 (т, J=5,4 Гц, 1Н; обмен с D2O), 4,22 (кв, J=6,8 Гц, 2Н), 3,98 (с, 3Н), 3,43-3,41 (м, 2Н), 2,90-2,87 (м, 4Н), 2,60-2,57 (м, 2Н), 2,52-2,48 (м, 4Н), 2,39-2,36 (м, 2Н), 1,67-1,60 (м, 2Н), 1,36 (т, J=6,8 Гц, 3Н), 0,92 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 504,1 [М+Н+]; чистота ~99%.
Схема 18:
ПРИМЕР 33
2-(4-((4-Этокси-3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперазин-1-ил)этилнитрат (2г):
К перемешиваемому раствору 2-(2-этокси-5-((4-(2-гидроксиэтил)пиперазин-1-ил)сульфонил)фенил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 20 (100 мг, 0,20 ммоль) в ацетонитриле (4 мл) по каплям добавляли раствор свежеприготовленного ацетилнитрата (0,12 мл; 1,4 ммоль) [(ацетилнитрат готовили отдельно, медленно добавляя дымящую HNO3 (1,1 мл, 25,5 ммоль) по каплям в уксусный ангидрид (2,5 мл, 26,5 ммоль) при -15°С в течение 30 мин в атмосфере аргона (Примечание: температура не должна превышать 0°С))] при -10°С в течение 10 мин в атмосфере аргона. Реакцию перемешивали при температуре от -10 до -5°С в течение 4 ч. После завершения реакции (контроль с помощью ТСХ), реакцию оастанавливали добавлением насыщенного раствора NaHCO3 (10 мл) при 0°С и экстрагировали EtOAc (3×20 мл). Объединенные органические слои промывали насыщенным солевым раствором (20 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С-18, Grace System), элюируя 40% ацетонитрила в воде, с получением 38 мг указанного в заголовке соединения с чистотой ~93%, которое дополнительно очищали перекристаллизацией в горячем изопропаноле (2,5 мл) с получением указанного в заголовке соединения 2г (22 мг) в виде бледно-желтого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,66 (с, 1Н; обмен с D2O), 7,88 (д, J=2,2 Гц, 1Н), 7,80 (д.д, J=8,8; 2,2 Гц, 1Н), 7,36 (д, J=8,8 Гц, 1Н), 7,21 (с, 1Н), 4,56 (т, J=5,1 Гц, 2Н), 4,22 (кв, J=6,8 Гц, 2Н), 3,98 (с, 3Н), 2,90-2,87 (м, 4Н), 2,64-2,61 (м, 2Н), 2,59-2,54 (м, 2Н), 2,52-2,49 (м, 4Н), 1,68-1,59 (м, 2Н), 1,35 (т, J=6,8 Гц, 3Н), 0,92 (т, J=7,34 Гц, 3Н); LCMS (ESI): m/z 549,1 [М+Н+]; чистота ~96,7%.
Схема 19:
ПРИМЕР 34
2-Этокси-5-((4-(3-гидроксипропил)пиперазин-1-ил)сульфонил)бензойная кислота (21):
К перемешиваемому раствору 2-(пиперазин-1-ил)пропан-1-ола (1,0 г, 6,8 ммоль) в CH2Cl2 (11 мл) добавляли триэтиламин (4,6 мл, 34 ммоль) при 0°С в инертной атмосфере. К полученной смеси по каплям добавляли раствор 5-(хлорсульфонил)-2-этоксибензойной кислоты (1,8 г, 6,8 ммоль) в CH2Cl2 (11 мл) при 0°С в инертной атмосфере. Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 16 ч. После завершения реакции (контроль с помощью LCMS анализа), реакционную смесь непосредственно очищали (без дополнительной обработки) колоночной хроматографией с обращенной фазой (колонка С-18, Grace System), элюируя 0-15% ацетонитрила в воде, получая указанное в заголовке соединение 21 (2,6 г) в виде грязно-белого полутвердого вещества, которое непосредственно использовали для следующей реакции без дополнительной очистки. 1H-ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,74-7,68 (м, 2Н), 7,26 (д, J=8,80 Гц, 1Н), 4,17 (кв, J=6,9 Гц, 2Н), 3,36-3,34 (м, 3Н), 2,85-2,80 (м, 4Н), 2,42 -2,39 (м, 4Н), 2,32-2,29 (м, 2Н), 1,54-1,49 (м, 2Н), 1,34 (т, J=6,9 Гц, 3Н); LCMS (ESI): m/z 373,08 [М+Н+]; чистота ~87%.
ПРИМЕР 35
3-(2-Этокси-5-((4-(3-гидроксипропил)пиперазин-1-ил)сульфонил)бензамидо)-1-метил-4-пропил-1H-пиррол-2-карбоксамид (22):
К перемешиваемому раствору 2-этокси-5-((4-(3-гидроксипропил)пиперазин-1-ил)сульфонил)бензойной кислоты 21 (2,6 г) в ДМФА (10 мл) по каплям добавляли диизопропилэтиламин (6,1 мл, 35,0 ммоль), а затем TBTU (4,5 г, 14,0 ммоль) при 15°С и перемешивали в течение 20 мин. К полученной смеси добавляли раствор 3-амино-1-метил-4-пропил-1H-пиррол-2-карбоксамид (1,27 г, 7,0 ммоль) в растворе ДМФА (3 мл) при 15°С и перемешивали в течение 1 ч при комнатной температуре в инертной атмосфере. После завершения реакции (контроль с помощью ТСХ и LCMS), реакцию останавливали добавлением ледяной воды (130 г) и экстрагировали EtOAc (4×50 мл). Объединенные органические слои промывали насыщенным солевым раствором (4×50 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (Grace System), элюируя 10-15%) градиентом раствора 30% метанола в CH2Cl2: СН2С2, с получением указанного в заголовке соединения 22 (2,4 г; выход ~66% с двух стадий) в виде бледно- коричневого твердого вещества. LCMS (ESI): m/z 536,2 [М+Н+]; чистота ~95%.
ПРИМЕР 36
2-(2-Этокси-5-((4-(3-гидроксипропил)пиперазин-1-ил)сульфонил)фенил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-он (23):
В герметично закрываемую трубку загружали 3-(2-этокси-5-((4-(3-гидроксипропил)пиперазин-1-ил)сульфонил)бензамидо)-1-метил-4-пропил-1H-пиррол-2-карбоксамид 22 (170 мг, 0,32 ммоль), этанол (2,7 мл) и затем 1М водный раствор КОН (2,4 мл) при комнатной температуре. Трубку закрывали крышкой и реакционную смесь перемешивали при 100°С в течение 16 ч. После завершения реакции (контроль с помощью ТСХ и LCMS), реакцию охлаждали до комнатной температуры и упаривали при пониженном давлении. Полученный остаток разбавляли водой (5 мл) и экстрагировали этилацетатом (2×25 мл). Объединенные органические слои промывали насыщенным солевым раствором (20 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (Grace System), элюируя 14% раствора 30% МеОН в CH2Cl2: CH2Cl2. Чистые фракции лиофилизировали и растирали с н-пентаном (4×10 мл), получая указанное в заголовке соединение 23 (32 мг) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,67 (с, 1Н; обмен с D2O), 7,88 (д, J=2,2 Гц, 1Н), 7,80 (д.д, J=8,8; 2,2 Гц, 1Н), 7,36 (д, J=8,8 Гц, 1Н), 7,21 (с, 1Н), 4,31 (уш.т, J=5,1 Гц, 1Н; обмен с D2O), 4,22 (кв, J=6,9 Гц, 2Н), 3,98 (с, 3Н), 3,39-3,33 (м, 2Н), 2,90-2,87 (м, 4Н), 2,59-2,56 (м, 2Н), 2,43-2,39 (м, 4Н), 2,34-2,29 (м, 2Н), 1,67-1,59 (м, 2Н), 1,53-1,45 (м, 2Н), 1,35 (т, J=6,9 Гц, 3Н), 0,92 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 518,2 [М+Н+]; чистота ~99,7%.
Схема 20:
ПРИМЕР 37
3-(1-((4-Этокси-3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперидин-4-ил)пропилнитрат (2б):
К перемешиваемому раствору 2-(2-этокси-5-((4-(3-гидроксипропил)пиперазин-1-ил)сульфонил)фенил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 23 (150 мг, 0,29 ммоль) в ацетонитриле (6,0 мл) по каплям добавляли раствор свежеприготовленного ацетилнитрата (0,13 мл; 1,5 ммоль) [(ацетилнитрат готовили отдельно, медленно добавляя дымящую HNO3 (1,1 мл, 25,5 ммоль) по каплям в уксусный ангидрид (2,5 мл, 26,5 ммоль) при -15°С в течение 30 мин в атмосфере аргона (Примечание: температура не должна превышать 0°С))] при -10°С в течение 10 мин в атмосфере аргона. Реакцию перемешивали при температуре от -10 до -5°С в течение 4 ч. Реакцию контролировали с помощью ТСХ. Через 4 ч реакцию охлаждали до -15°С и добавляли ацетилнитрат (0,05 мл; 0,6 ммоль). Реакционную смесь перемешивали при температуре от -10 до -5°С в течение еще 2 ч. После завершения реакции (контроль с помощью ТСХ), реакцию останавливали добавлением насыщенного раствора NaHCO3 (10 мл) при 0°С и экстрагировали EtOAc (3×20 мл). Объединенные органические слои промывали насыщенным солевым раствором (20 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С-18, Grace System), элюируя 45% градиентом ацетонитрила в воде. Полученное твердое вещество растирали с диэтиловым эфиром (3 мл), получая указанное в заголовке соединение 2б (43,4 мг; выход -26%) в виде бледно-желтого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,67 (с, 1Н; обмен с D2O), 7,89 (д, J=2,4 Гц, 1Н), 7,80 (д.д, J=8,8; 2,4 Гц, 1Н), 7,36 (д, J=8,8 Гц, 1Н), 7,21 (с, 1Н), 4,48 (т, J=6,6 Гц, 2Н), 4,22 (кв, J=6,8 Гц, 2Н), 3,98 (с, 3Н), 2,93-2,89 (м, 4Н), 2,58-2,55 (м, 2Н), 2,45-2,42 (м, 4Н), 2,36-2,32 (м, 2Н), 1,81-1,77 (м, 2Н), 1,67-1,59 (м, 2Н), 1,35 (т, J=6,8 Гц, 3Н), 0,92 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 563,1 [М+Н+]; чистота ~97,5%.
Схема 21:
ПРИМЕР 38
2-(2-Этокси-5-((4-(3-гидроксипропил)пиперазин-1-ил)сульфонил)фенил)-6-(гидроксиметил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-он (24):
К перемешиваемому раствору 2-(2-этокси-5-((4-(3-гидроксипропил)пиперазин-1-ил)сульфонил)фенил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 23 (1,55 г, 3,0 ммоль) в концентрированном растворе HCl (15,5 мл) добавляли параформальдегид (780 мг, 0,5 масс. доля) при комнатной температуре и нагревали до 50°С в инертной атмосфере. Реакцию контролировали с помощью LCMS анализа. После перемешивания в течение 12 ч реакционную смесь охлаждали до комнатной температуры и нейтрализовали насыщенным раствором NaHCO3 (200 мл). Полученный раствор экстрагировали 10% метанолом в дихлорметане (3×150 мл). Объединенные органические экстракты сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С-18; Grace System), элюируя 45% ацетонитрила в воде, с получением указанного в заголовке соединения 24 (1,12 г; выход 68%) в виде грязно-белого твердого вещества. 1H-ЯМР (300 МГц, ДМСО-d6) δ м.д. 11,70 (уш.с, 1Н), 7,87 (д, J=2,2 Гц, 1Н), 7,80 (д.д, J=8,8; 2,2 Гц, 1Н), 7,36 (д, J=8,8 Гц, 1Н), 5,16 (уш.с, 1Н), 4,56 (уш.д, J=4,4 Гц, 2Н), 4,35 (т, J=5,0 Гц, 1Н), 4,22 (кв, J=6,8 Гц, 2Н), 4,05 (с, 3Н), 3,42-3,35 (м, 2Н), 2,90-2,86 (м, 4Н), 2,62-2,59 (м, 2Н), 2,42-2,39 (м, 4Н), 2,33-2,29 (м, 2Н), 1,64-1,45 (м, 4Н), 1,34 (т, J=6,8 Гц, 3Н), 0,88 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 548,6 [М+Н+]; чистота ~94%.
ПРИМЕР 39
2-(2-Этокси-5-((4-(3-гидроксипропил)пиперазин-1-ил)сульфонил)фенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегид (25):
К перемешиваемому раствору 2-(2-этокси-5-((4-(3-гидроксипропил)пиперазин-1-ил)сульфонил)фенил)-6-(гидроксиметил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 24 (920 мг, 1,68 ммоль) в CH2Cl2 (230 мл) добавляли активированный MnO2 (минимум 58% Mn) (2,53 г, 29,1 ммоль) и KMnO4 (850 мг, 5,38 ммоль) при комнатной температуре и перемешивание в течение 48 ч. Реакцию контролировали с помощью ТСХ (~30% непрореагировавшего исходного соединения присутствуют через 48 ч). Реакционную смесь фильтровали через целитовую прокладку и промывали CH2Cl2 (50 мл). Дополнительное количество активированного MnO2 (1,82 г, 21,0 ммоль) добавляли к фильтрату в круглодонной колбе и перемешивали при комнатной температуре в течение 24 ч. После полного расходования исходного соединения, реакционную смесь фильтровали через целитовую прокладку и промывали CH2Cl2 (250 мл). Фильтрат упаривали, получая указанное в заголовке соединение 25 (750 мг, чистота ~86%) в виде бледно-желтого твердого вещества, которое непосредственно использовали для следующей реакции без дополнительной очистки. 1Н-ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,15 (уш.с, 1Н), 10,15 (с, 1Н), 7,86-7,78 (м, 2Н), 7,39 (д, J=8,8 Гц, 1Н), 4,39-4,34 (м, 3Н + ОН), 4,22 (кв, J=6,8 Гц, 2Н), 3,38-3,34 (м, 2Н), 2,99-2,84 (м, 6 Н), 2,41-2,38 (м, 4Н), 2,31-2,29 (м, 2Н), 1,71-1,62 (м, 2Н), 1,49-1,42 (м, 2Н), 1,34 (т, J=6,8 Гц, 3Н), 0,91 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 546,5 [М+Н]+; чистота ~86,0%.
ПРИМЕР 40
(E)-2-(2-Этокси-5-((4-(3-гидроксипропил)пиперазин-1-ил)сульфонил)фенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегид оксим (26):
К перемешиваемому раствору 2-(2-этокси-5-((4-(3-гидроксипропил)пиперазин-1-ил)сульфонил)фенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегида 25 (150 мг) в этаноле (18 мл) добавляли 50% водный раствор гидроксиламина (3 мл) при комнатной температуре. Реакционную смесь нагревали до 50°С в течение 5 ч в атмосфере аргона. После завершения реакции (контроль с помощью ТСХ), реакционную смесь упаривали при пониженном давлении. Полученный остаток разбавляли водой (10 мл) и экстрагировали этилацетатом (5×25 мл). Объединенные органические слои промывали насыщенным солевым раствором (20 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С-18; Grace System), элюируя 35% ацетонитрила в воде. Чистые фракции лиофилизировали, получая указанное в заголовке соединение 26 (52,7 мг) в виде грязно-белого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,82 (уш.с, 1Н; обмен с D2O), 11,60 (с, 1Н), 8,34 (с, 1Н), 7,88 (д, J=2,2 Гц, 1Н), 7,81 (д.д, J=8,8; 2,2 Гц, 1Н), 7,37 (д, J=8,8 Гц, 1Н), 4,33 (т, J=5,1 Гц, 1Н; обмен с D2O), 4,22 (кв, J=6,8 Гц, 2Н), 4,17 (с, 3Н), 3,37-3,35 (м, 2Н), 2,91-2,88 (м, 4Н), 2,76-2,73 (м, 2Н), 2,43-2,40 (м, 4Н), 2,32-2,28 (м, 2Н), 1,61-1,57 (м, 2Н), 1,51-1,47 (м, 2Н), 1,35 (т, J=6,8 Гц, 3Н), 0,88 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 559,4 [М-Н]-; чистота ~95,8%.
Схема 22:
ПРИМЕР 41
(E)-3-(4-((4-Этокси-3-(6-((гидроксиимино)метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперазин-1-ил)пропилнитрат (2е):
По аналогии с 2а (Пример 29) и 2b (Пример 37), к перемешиваемому раствору (E)-2-(2-этокси-5-((4-(3-гидроксипропил)пиперазин-1-ил)сульфонил)фенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегид оксима 26 (150 мг, 0,29 ммоль) в ацетонитриле (6,0 мл) по каплям добавляли раствор свежеприготовленного ацетилнитрата (0,13 мл; 1,5 ммоль) [(ацетилнитрат готовили отдельно, медленно добавляя дымящую HNO3 (1,1 мл, 25,5 ммоль) по каплям в уксусный ангидрид (2,5 мл, 26,5 ммоль) при -15°С в течение 30 мин в атмосфере аргона (Примечание: температура не должна превышать 0°С))] при -10°С в течение 10 мин в атмосфере аргона. Реакционную смесь перемешивали при температуре от -10 до -5°С в течение 4 ч. Реакцию контролировали с помощью ТСХ. Через 4 ч реакционную смесь охлаждали до -15°С и добавляли ацетилнитрат (0,05 мл; 0,6 ммоль). Реакционную смесь перемешивали при температуре от -10 до -5°С в течение еще 2 ч. После завершения реакции (контроль с помощью ТСХ), реакцию останавливали добавлением насыщенного раствора NaHCO3 (10 мл) при 0°С и экстрагировали EtOAc (3×20 мл). Объединенные органические слои промывали насыщенным солевым раствором (20 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С-18, Grace System), элюируя 45% градиентом ацетонитрила в воде. Полученное твердое вещество растирали с диэтиловым эфиром (3 мл), получая указанное в заголовке соединение 2е.
Схема 23:
ПРИМЕР 42
5-((4-(2-Гидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксибензойная кислота (27):
К перемешиваемому раствору 2-(пиперидин-4-ил)этан-1-ола (231 мг, 1,79 ммоль) в CH2Cl2 (3 мл) добавляли триэтиламин (1,26 мл, 8,96 ммоль) при 0°С в инертной атмосфере. К полученной смеси по каплям добавляли раствор 5-(хлорсульфонил)-2-пропоксибензойной кислоты (500 мг, 1,79 ммоль) в CH2Cl2 (3 мл) при 0°С в инертной атмосфере. Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 16 ч. После завершения реакции (контроль с помощью ТСХ и LCMS), реакционную смесь разбавляли CH2Cl2 (40 мл), промывали охлажденной водой (10 мл), охлажденным 10% водным раствором лимонной кислоты (2×10 мл), насыщенным солевым раствором (10 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении, получая указанное в заголовке соединение 27 (410 мг, выход ~57%) в виде белого твердого вещества. 1H-ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,05 (уш.с, 1Н), 7,90 (д, J=2,2 Гц, 1Н), 7,81 (д.д, J=8,8; 2,2 Гц, 1Н), 7,33 (д, J=8,8 Гц, 1Н), 4,30 (уш.т, J=4,9 Гц, 1Н), 4,10 (т, J=6,21 Гц, 2Н), 3,60-3,56 (м, 2Н), 3,41-3,34 (м, 2Н), 2,19-2,15 (м, 2 Н), 1,82-1,64 (м, 4Н), 1,25-1,20 (м, 3Н), 1,16-1,08 (м, 2Н), 1,00 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 372,4 [М+Н+]; чистота ~92%.
ПРИМЕР 43
3-(5-((4-(2-Гидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксибензамидо)-1-метил-4-пропил-1H-пиррол-2-карбоксамид (28):
К перемешиваемому раствору 5-((4-(2-гидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксибензойной кислоты 27 (400 мг, 1,07 ммоль) в ДМФА (3 мл) добавляли диизопропилэтиламин (418 мг, 3,23 ммоль) и TBTU (692 мг, 2,15 ммоль) при ~15°С и перемешивали в течение 20 мин. К полученной смеси добавляли раствор 3-амино-1-метил-4-пропил-1H-пиррол-2-карбоксамида (196 мг, 1,07 ммоль) в ДМФА (1 мл) в инертной атмосфере. Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 2,5 ч. После завершения реакции (контроль с помощью ТСХ и LCMS), реакцию останавливали добавлением охлажденной воды (50 мл) и экстрагировали EtOAc (2×50 мл). Объединенные органические слои промывали насыщенным солевым раствором (50 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (Grace System), элюируя 2-8% градиентом раствора 30% МеОН в CH2Cl2: CH2Cl2, с получением указанного в заголовке соединения 28 (210 мг; выход ~34%) в виде грязно-белого твердого вещества. 1Н-ЯМР (300 МГц, ДМСО-d6) δ м.д. 9,52 (уш.с, 1Н), 7,84-7,77 (м, 2Н), 7,40 (д, J=8,8 Гц, 1Н), 7,22 (уш.с, 1Н), 6,91 (уш.с, 1Н), 6,72 (с, 1Н), 4,32 (т, J=5,1 Гц, 1Н), 4,18 (т, J=6,6 Гц, 2Н), 3,74 (с, 3Н), 3,62-3,58 (м, 2Н), 3,41-3,36 (м, 2Н), 2,33-2,28 (м, 2Н), 2,24-2,18 (м, 2Н), 1,87-1,77 (м, 2Н), 1,73-1,69 (м, 2Н), 1,55-1,43 (м, 2Н), 1,28-1,19 (м, 3Н), 1,19-1,12 (м, 2Н), 0,98 (т, J=7,3 Гц, 3Н), 0,88 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 535,1 [М+Н+]; чистота ~94,7%.
ПРИМЕР 44
2-(5-((4-(2-Гидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-7-пропил-3,5-дигидро-4Н-пирроло[3,2-d]пиримидин-4-он (29):
В герметично закрываемую трубку загружали 3-(5-((4-(2-гидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксибензамидо)-1-метил-4-пропил-1H-пиррол-2-карбоксамид 28 (200 мг, 0,37 ммоль), этанол (3,2 мл), и затем 1М водный раствор КОН (2,8 мл) при комнатной температуре. Трубку закрывали крышкой и реакционную смесь перемешивали при 100°С в течение 16 ч. После завершения реакции (контроль с помощью ТСХ и LCMS), реакционную смесь охлаждали до комнатной температуры и упаривали при пониженном давлении. Полученный остаток разбавляли водой (20 мл) и экстрагировали дихлорметаном (3×50 мл). Объединенные органические слои промывали насыщенным солевым раствором (50 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (Grace System), элюируя 2-8% градиентом раствора 30% метанола в CH2Cl2: CH2Cl2. Чистые фракции упаривали, получая указанное в заголовке соединение 29 (130 мг, выход 67%) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,63 (уш.с, 1Н; обмен с D2O), 7,90 (д, J=2,2 Гц, 1Н), 7,79 (д.д, J=8,8; 2,2 Гц, 1Н), 7,35 (д, J=8,8 Гц, 1Н), 7,21 (с, 1Н), 4,31 (т, J=5,1 Гц, 1Н; обмен с D2O), 4,12 (т, J=6,4 Гц, 2Н), 3,98 (с, 3Н), 3,62-3,59 (м, 2Н), 3,42-3,36 (м, 2Н), 2,60-2,56 (м, 2Н), 2,24-2,19 (м, 2Н), 1,81-1,59 (м, 6 Н), 1,33-1,31 (м, 3Н), 1,20-1,15 (м, 2Н), 1,00-0,92 (м, 6 Н); LCMS (ESI): m/z 517,6 [М+Н+]; чистота ~98,1%.
Схема 24:
ПРИМЕР 45
2-(1-((3-(5-Метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрат (3а):
К 2-(5-((4-(2-гидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-7-пропил-3,5-дигидро-4Н-пирроло[3,2-d]пиримидин-4-ону 29 (150 мг, 0,29 ммоль) в ацетонитриле (4,5 мл) по каплям добавляли раствор свежеприготовленного ацетилнитрата (0,12 мл; 1,45 ммоль) [(ацетилнитрат готовили отдельно, медленно добавляя дымящую HNO3 (1,1 мл, 25,5 ммоль) по каплям в уксусный ангидрид (2,5 мл, 26,5 ммоль) при -15°С в течение 30 мин в атмосфере аргона (Примечание: температура не должна превышать 0°С))] при -10°С в течение 10 мин в атмосфере аргона. Реакционную смесь перемешивали при температуре от -10 до -5°С в течение 4 ч. После завершения реакции (контроль с помощью ТСХ), реакцию останавливали добавлением насыщенного раствора NaHCO3 (10 мл) при 0°С и экстрагировали EtOAc (3×20 мл). Объединенные органические слои промывали насыщенным солевым раствором (10 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С-18, Grace System), элюируя 60-70% градиентом ацетонитрила в воде. Чистые фракции лиофилизировали, получая указанное в заголовке соединение 3а (33 мг; выход ~20%) в виде белого твердого вещества. 1H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,60 (уш.с, 1Н; обмен с D2O), 7,92 (д, J=2,4 Гц, 1Н), 7,80 (д.д, J=8,8; 2,4 Гц, 1Н), 7,36 (д, J=8,8 Гц, 1Н), 7,21 (с, 1Н), 4,51 (т, J=6,6 Гц, 2Н), 4,12 (т, J=6,4 Гц, 2Н), 3,98 (с, 3Н), 3,63-3,61 (м, 2Н), 2,59-2,56 (м, 2Н), 2,28-2,23 (м, 2Н), 1,79-1,71 (м, 4Н), 1,67-1,58 (м, 4Н), 1,35-1,31 (м, 1Н), 1,26-1,18 (м, 2Н), 0,97 (т, J=7,3 Гц, 3Н), 0,92 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 562,1 [М+Н+]; чистота ~97%.
Схема 25:
ПРИМЕР 46
5-((4-(2-Гидроксиэтил)пиперазин-1-ил)сульфонил)-2-пропоксибензойная кислота (30):
К перемешиваемому раствору 2-(пиперазин-1-ил)этан-1-ола (233 мг, 1,79 ммоль) в CH2Cl2 (3 мл) добавляли триэтиламин (1,24 мл, 8,97 ммоль) при 0°С в инертной атмосфере. К полученной смеси по каплям добавляли раствор 5-(хлорсульфонил)-2-пропоксибензойной кислоты (500 мг, 1,79 ммоль) в CH2Cl2 (3 мл) при 0°С в инертной атмосфере. Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 16 ч. После завершения реакции (контроль с помощью LCMS), реакционную смесь очищали колоночной хроматографией с обращенной фазой (колонка С-18; Grace System), элюируя 30-40% градиентом ацетонитрила в воде. Фракции продукта упаривали при пониженном давлении. Полученное липкое твердое вещество растирали с CH2Cl2 (0,5 мл) и гексаном (6 мл), получая указанное в заголовке соединение 30 (510 мг) в виде белого твердого вещества, которое непосредственно использовали для следующей реакции без дополнительной очистки. LCMS (ESI): m/z 373,5 [М+Н+]; чистота ~85%.
ПРИМЕР 47
3-(5-((4-(2-Гидроксиэтил)пиперазин-1-ил)сульфонил)-2-пропоксибензамидо)-1-метил-4-пропил-1H-пиррол-2-карбоксамид (31):
К перемешиваемому раствору 5-((4-(2-гидроксиэтил)пиперазин-1-ил)сульфонил)-2-пропоксибензойной кислоты 30 (500 мг) в ДМФА (3 мл) добавляли диизопропилэтиламин (0,7 мл, 4,03 ммоль) и TBTU (862 мг, 2,68 ммоль) при ~15°С и перемешивали в течение 30 мин. К полученной смеси по каплям добавляли раствор 3-амино-1-метил-4-пропил-1H-пиррол-2-карбоксамида (243,6 мг, 1,34 ммоль) в ДМФА (2 мл) при ~15°С в инертной атмосфере. Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 1 ч. После завершения реакции (контроль с помощью ТСХ и LCMS), реакцию останавливали добавлением охлажденной воды (50 мл) и экстрагировали EtOAc (2×50 мл). Объединенные органические слои промывали насыщенным солевым раствором (50 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (Grace System), элюируя 10-15% градиентом раствора 30% метанола в CH2Cl2: CH2Cl2. Фракции продукта упаривали при пониженном давлении с получением указанного в заголовке соединения 31 (260 мг; ~27% общий выход с двух стадий) в виде бледно-желтого твердого вещества. 1H-ЯМР (300 МГц, ДМСО-d6) δ м.д. 9,54 (уш.с, 1Н), 7,82-7,79 (м, 2Н), 7,41 (д, J=8,4 Гц, 1Н), 7,24 (уш.с, 1Н), 6,92 (уш.с, 1Н), 6,72 (с, 1Н), 4,37 (уш.т, J=5,3 Гц, 1Н), 4,19 (т, J=6,6 Гц, 2Н), 3,74 (с, 3Н), 3,42-3,39 (м, 2Н), 2,83-2,78 (м, 4Н), 2,53-2,49 (м, 4Н), 2,38-2,35 (м, 2Н), 2,28-2,25 (м, 2Н), 1,83-1,79 (м, 2Н), 1,52-1,44 (м, 2Н), 0,98 (т, J=7,3 Гц, 3Н), 0,88 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 536,2 [М+Н+]; чистота ~90%.
ПРИМЕР 48
2-(5-((4-(2-Гидроксиэтил)пиперазин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-он (32):
В герметично закрываемую трубку загружали 3-(5-((4-(2-гидроксиэтил)пиперазин-1-ил)сульфонил)-2-пропоксибензамидо)-1-метил-4-пропил-1H-пиррол-2-карбоксамид 31 (260 мг, 0,48 ммоль), этанол (4,2 мл) и затем 1М водный раствор КОН (3,6 мл) при комнатной температуре. Трубку закрывали крышкой и реакционную смесь перемешивали при 100°С в течение 16 ч. После завершения реакции (контроль с помощью ТСХ и LCMS), реакционную смесь охлаждали до комнатной температуры и упаривали при пониженном давлении. Полученный остаток разбавляли водой (20 мл) и экстрагировали этилацетатом (3×20 мл). Объединенные органические слои промывали насыщенным солевым раствором (50 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С-18; Grace System), элюируя 60-70% градиентом ацетонитрила в воде. Чистые фракции лиофилизировали, получая указанное в заголовке соединение 32 (130 мг, выход 51%) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,64 (уш.с, 1Н; обмен с D2O), 7,88 (д, J=2,0 Гц, 1Н), 7,79 (д.д, J=8,8; 2,0 Гц, 1Н), 7,37 (д, J=8,8 Гц, 1Н), 7,21 (с, 1Н), 4,33 (т, J=5,4 Гц, 1Н; обмен с D2O), 4,12 (т, J=6,4 Гц, 2Н), 3,98 (с, 3Н), 3,43-3,41 (м, 2Н), 2,89-2,87 (м, 4Н), 2,58-2,55 (м, 2Н), 2,51-2,48 (м, 4Н), 2,37-2,35 (м, 2Н), 1,78-1,71 (м, 2Н), 1,67-1,59 (м, 2Н), 0,96 (т, J=7,3 Гц, 3Н), 0,92 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 518,2 [М+Н+]; чистота ~99,4%.
Схема 26:
ПРИМЕР 49
2-(4-((3-(5-Метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)этилнитрат (3б):
К перемешиваемому раствору 2-(5-((4-(2-гидроксиэтил)пиперазин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 32 (100 мг, 0,19 ммоль) в ацетонитриле (3 мл) по каплям добавляли раствор свежеприготовленного ацетилнитрата (0,13 мл) [(ацетилнитрат готовили отдельно, медленно добавляя дымящую HNO3 (1,1 мл, 25,5 ммоль) по каплям в уксусный ангидрид (2,5 мл, 26,5 ммоль) при -15°С в течение 30 мин в атмосфере аргона (Примечание: температура не должна превышать 0°С))] при -15°С в течение 15 мин в атмосфере аргона. Реакционную смесь перемешивали при температуре от -15 до -5°С в течение 4 ч. После завершения реакции (контроль с помощью ТСХ), реакцию останавливали добавлением насыщенного раствора NaHCO3 (10 мл) при 0°С и экстрагировали EtOAc (3×20 мл). Объединенные органические слои промывали насыщенным солевым раствором (20 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С-18, Grace System), элюируя 60-70% градиентом ацетонитрила в воде. Чистые фракции лиофилизировали, получая указанное в заголовке соединение 36 (40 мг; выход ~36%) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,62 (с, 1Н; обмен с D2O), 7,88 (д, J=2,4 Гц, 1Н), 7,80 (д.д, J=8,8; 2,4 Гц, 1Н), 7,37 (д, J=8,8 Гц, 1Н), 7,21 (с, 1Н), 4,56 (т, J=5,1 Гц, 2Н), 4,13 (т, J=6,4 Гц, 2Н), 3,98 (с, 3Н), 2,90-2,87 (м, 4Н), 2,66 (т, J=5,1 Гц, 2Н), 2,59-2,55 (м, 2Н), 2,53-2,50 (м, 4Н), 1,78-1,71 (м, 2Н), 1,66-1,59 (м, 2Н), 0,96 (т, J=7,3 Гц, 3Н), 0,92 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 563,1 [М+Н+]; чистота ~96,5%.
Схема 27:
ПРИМЕР 50
2-(5-((4-(2-Гидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-6-(гидроксиметил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-он (33):
К перемешиваемому раствору 2-(5-((4-(2-гидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-7-пропил-3,5-дигидро-4Н-пирроло[3,2-d]пиримидин-4-она 29 (430 мг, 0,83 ммоль) в концентрированном растворе HCl (4,3 мл) добавляли параформальдегид (215 мг, 0,5 масс, доля) при комнатной температуре и нагревали до 50°С в течение 15 ч. Реакцию контролировали с помощью LCMS анализа. Реакционную смесь охлаждали до комнатной температуры и нейтрализовали насыщенным раствором NaHCO3 (100 мл). Полученный раствор экстрагировали 10% метанолом в дихлорметане (3×100 мл). Объединенные органические экстракты сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С-18; Grace System), элюируя 60-70% градиентом ацетонитрила в воде, с получением указанного в заголовке соединения 33 (270 мг; выход ~56%) в виде белого твердого вещества. 1Н-ЯМР (300 МГц, ДМСО-d6) δ м.д. 10,42 (уш.с, 1Н), 7,87 (д, J=2,2 Гц, 1Н), 7,80 (д.д, J=8,8; 2,2 Гц, 1Н), 7,37 (д, J=8,8 Гц, 1Н), 5,16 (уш.с, 1Н), 4,56 (с, 2Н), 4,35 (уш.с, 1Н), 4,13-4,10 (м, 2Н), 4,05 (с, 3Н), 3,43-3,39 (м, 2Н), 2,91-2,86 (м, 4Н), 2,61-2,57 (м, 2Н), 2,47-2,43 (м, 4Н), 2,37-2,33 (м, 2Н), 1,79-1,69 (м, 2Н), 1,62-1,52 (м, 2Н), 0,97 (т, J=7,3 Гц, 3Н), 0,88 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 548,6 [М+Н+]; чистота ~95,3%.
ПРИМЕР 51
2-(5-((4-(2-Гидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегид (34):
К перемешиваемому раствору 2-(5-((4-(2-гидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-6-(гидроксиметил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 33 (260 мг, 0,47 ммоль) в CH2Cl2 (78 мл) добавляли активированный MnO2 (минимум 58% Mn) (704 мг, 8,10 ммоль) и KMnO4 (240 мг, 1,52 ммоль) при комнатной температуре и перемешивали в течение 40 ч. Реакцию контролировали с помощью ТСХ. Затем реакционную смесь фильтровали через целитовую прокладку и промывали CH2Cl2 (100 мл). Фильтрат упаривали и полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (Grace System), элюируя 2-5% градиентом метанола в дихлорметане, с получением указанного в заголовке соединения 34 (190 мг) в виде белого твердого вещества, которое непосредственно использовали для следующей реакции без дополнительной очистки. 1Н-ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,13 (уш.с, 1Н), 10,14 (с, 1Н), 7,90-7,77 (м, 2Н), 7,39 (д, J=8,4 Гц, 1Н), 4,38 (т, J=5,3 Гц, 1Н), 4,32 (с, 3Н), 4,12 (т, J=6,2 Гц, 2Н), 3,44-3,40 (м, 2Н), 3,01-2,78 (м, 6 Н), 2,48-2,45 (м, 4Н), 2,38-2,35 (м, 2Н), 1,78-1,61 (м, 4Н), 0,97-0,84 (м, 6 Н); LCMS (ESI): m/z 546,3 [М+Н+]; чистота ~98,9%.
ПРИМЕР 52
(E)-2-(5-((4-(2-Гидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегид оксим (35):
К перемешиваемому раствору 2-(5-((4-(2-гидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегид 34 (190 мг, 0,34 ммоль) в этаноле (22,8 мл) добавляли 50% водный раствор гидроксиламина (3,8 мл) при комнатной температуре. Реакционную смесь нагревали до 50°С в течение 5 ч в атмосфере аргона. После завершения реакции (контроль с помощью ТСХ), реакционную смесь упаривали при пониженном давлении. Полученный остаток разбавляли водой (10 мл) и экстрагировали этилацетатом (3×25 мл). Объединенные органические слои промывали насыщенным солевым раствором (25 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С-18; Grace System), элюируя 40-50% градиентом ацетонитрила в воде. Чистые фракции лиофилизировали с получением указанного в заголовке соединения 35 (60 мг; ~22% выход с двух стадий) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,77 (уш.с, 1Н; обмен с D2O), 11,58 (уш.с, 1Н; обмен с D2O), 8,33 (с, 1Н), 7,88 (д, J=2,0 Гц, 1Н), 7,80 (д.д, J=8,8; 2,0 Гц, 1Н), 7,37 (д, J=8,8 Гц, 1Н), 4,34 (д, J=5,1 Гц, 1Н; обмен с D2O), 4,17 (с, 3Н), 4,13-4,04 (м, 2Н), 3,44-3,39 (м, 2Н), 2,91-2,87 (м, 4Н), 2,76-2,72 (м, 2Н), 2,51-2,47 (м, 4Н), 2,38-2,35 (м, 2Н), 1,78-1,70 (м, 2Н), 1,63-1,54 (м, 2Н), 0,96 (т, J=7,3 Гц, 3Н), 0,88 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 561,6 [М+Н+]; чистота ~95,3%.
Схема 28:
ПРИМЕР 53
(E)-2-(1-((3-(6-((Гидроксиимино)метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрат (3в):
По аналогии с 2а (Пример 29) и 2b (Пример 37), к перемешиваемому раствору (Е)-2-(5-((4-(2-гидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегид оксима 35 (150 мг, 0,29 ммоль) в ацетонитриле (6,0 мл) по каплям добавляли раствор свежеприготовленного ацетилнитрата (0,13 мл; 1,5 ммоль) [(ацетилнитрат готовили отдельно, медленно добавляя дымящую HNO3 (1,1 мл, 25,5 ммоль) по каплям в уксусный ангидрид (2,5 мл, 26,5 ммоль) при -15°С в течение 30 мин в атмосфере аргона (Примечание: температура не должна превышать 0°С))] при -10°С в течение 10 мин в атмосфере аргона. Реакционную смесь перемешивали при температуре от -10 до -5°С в течение 4 ч. Реакцию контролировали с помощью ТСХ. Через 4 ч реакционную смесь охлаждали до -15°С и добавляли ацетилнитрат (0,05 мл; 0,6 ммоль). Реакционную смесь перемешивали при температуре от -10 до -5°С в течение еще 2 ч. После завершения реакции (контроль с помощью ТСХ), реакцию останавливали добавлением насыщенного раствора NaHCO3 (10 мл) при 0°С и экстрагировали EtOAc (3×20 мл). Объединенные органические слои промывали насыщенным солевым раствором (20 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С-18, Grace System), элюируя 45% градиентом ацетонитрила в воде. Полученное твердое вещество растирали с диэтиловым эфиром (3 мл), получая указанное в заголовке соединение 3в. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,81 (с, 1Н; обмен с D2O), 11,63 (с, 1Н; обмен с D2O), 8,34 (с, 1Н), 7,87 (д, J=2,0 Гц, 1Н), 7,81 (д.д, J=8,8; 2,0 Гц, 1Н), 7,38 (д, J=8,8 Гц, 1Н), 4,57-4,55 (м, 2Н), 4,17 (с, 3Н), 4,12 (т, J=6,1 Гц, 2Н), 2,91-2,88 (м, 4Н), 2,76-2,73 (м, 2Н), 2,67-2,64 (м, 2Н), 2,54-2,51 (м, 4Н), 1,78-1,69 (м, 2Н), 1,62-1,53 (м, 2Н), 0,96 (т, J=7,6 Гц, 3Н), 0,87 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 606,5 [М+Н+]; чистота ~96,5%.
Схема 29:
ПРИМЕР 54
(R)-2-(5-((4-(1,2-Дигидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-этил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-он (37):
К перемешиваемому раствору 3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксибензолсульфоновой кислоты (3) (500 мг, 1,13 ммоль) в растворе CH2Cl2 (30 мл) и ДМФА (0,5 мл) по каплям добавляли оксалилхлорид (0,5 мл, 5,67 ммоль) при 0°С в атмосфере аргона в течение 15 мин. После добавления, реакционную смесь перемешивали при той же температуре в течение 6 ч. После завершения реакции (контроль с помощью ТСХ и LCMS), реакционную смесь упаривали при температуре ниже 20°С при пониженном давлении и вакуум снова заполняли атмосферой аргона. Полученный остаток перегоняли совместно с CH2Cl2 (2×6 мл) с получением неочищенного продукта 4 в виде бледно-желтой жидкости.
К перемешиваемому раствору вышеуказанного неочищенного соединения 4 в этаноле (20 мл) добавляли триэтиламин по каплям (2,4 мл, 17 ммоль) при 0°С, а затем раствор соли (R)-1-(пиперидин-4-ил)этан-1,2-диол.HCl (получение 36 WO 2005026145 А1) (186 мг, 0,56 ммоль) в этаноле (10 мл) при той же температуре в инертной атмосфере. Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 12 ч. После завершения реакции (контроль с помощью ЖХМС), реакционную смесь упаривали при пониженном давлении с получением остатка, который очищали колоночной хроматографией с обращенной фазой (колонка С-18; Grace System), элюируя 50-55% градиентом ацетонитрила в воде с получением указанного в заголовке соединения 37 (37 мг) в виде грязно-белого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,61 (уш.с, 1Н; обмен с D2O), 7,92 (д, J=2,4 Гц, 1Н), 7,79 (д.д, J=8,8; 2,4 Гц, 1Н), 7,36 (д, J=9,3 Гц, 1Н), 7,30 (с, 1Н), 4,27-4,49 (м, 2Н + (2-ОН; обмен с D2O)), 4,13 (т, J=6,1 Гц, 2Н), 3,67-3,64 (м, 2Н), 3,27-3,12 (м, 3Н), 2,59-2,55 (м, 2Н), 2,25-2,11 (м, 2Н), 1,78-1,72 (м, 3Н), 1,69-1,54 (м, 3Н), 1,45-1,18 (м, 6 Н), 0,97 (т, J=7,3 Гц, 3Н), 0,92 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 547,49 [М+Н]+; чистота ~98,5%.
Схема 30:
ПРИМЕР 55
(R)-1-(1-((3-(5-Этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этан-1,2-диилдинитрат (1к):
К перемешиваемому раствору (R)-2-(5-((4-(1,2-дигидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-этил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 37 (140 мг, 0,25 ммоль) в CH2Cl2 (2,1 мл) по каплям добавляли раствор свежеприготовленного ацетилнитрата (0,24 мл) [(ацетилнитрат готовили отдельно, медленно добавляя дымящую HNO3 (0,04 мл; 6,0 экв.) по каплям в уксусный ангидрид (0,2 мл, 1:5 HNO3)) при -10°С в атмосфере аргона (Примечание: температура не должна превышать 0°С))] при -10°С в атмосфере аргона. Реакционную смесь перемешивали при 0°С в течение 1 ч. После завершения реакции (контроль с помощью ТСХ), реакцию останавливали добавлением насыщенного раствора NaHCO3 (15 мл) и экстрагировали CH2Cl2 (2×25 мл). Объединенные органические слои промывали насыщенным солевым раствором (25 мл) и сушили над безводным Na2SO4, и упаривали при пониженном давлении. Полученный неочищенный продукт очищали с помощью препаративной ВЭЖХ (колонка XBridge С18; 35-100% градиент ацетонитрила в воде). Чистые фракции лиофилизировали, получая указанное в заголовке соединение 1к (50 мг; выход 31%) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,61 (с, 1Н; обмен с D2O), 7,94 (д, J=2,4 Гц, 1Н), 7,80 (д.д, J=8,8; 2,4 Гц, 1Н), 7,37 (д, J=8,8 Гц, 1Н), 7,31 (с, 1Н), 5,33-5,29 (м, 1Н), 4,94 (д.д, 7=12,7; 2,4 Гц, 1Н), 4,71 (д.д, 7=12,7; 6,1 Гц, 1Н), 4,37 (кв, J=7,3 Гц, 2Н), 4,13 (т, J=6,4 Гц, 2Н), 3,76-3,64 (м, 2Н), 2,59-2,55 (м, 2Н), 2,29-2,23 (м, 2Н), 1,87-1,70 (м, 5 Н), 1,66-1,61 (м, 2Н), 1,46-1,42 (м, 2Н), 1,36 (т, J=7,1 Гц, 3Н), 0,97 (т, J=7,3 Гц, 3Н), 0,92 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 637,31 [М+Н]+; чистота ~99,7%.
Схема 31:
ПРИМЕР 56
(S)-2-(5-((4-(1,2-Дигидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-этил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-он (39):
К перемешиваемому раствору 3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксибензолсульфоновой кислоты 3 (250 мг, 0,56 ммоль) в растворе CH2Cl2 (15 мл) и ДМФА (0,25 мл) по каплям добавляли оксалилхлорид (0,29 мл, 3,39 ммоль) при 0°С в атмосфере аргона в течение 15 мин. После добавления, реакционную смесь перемешивали при той же температуре в течение 6 ч. После завершения реакции (контроль с помощью LCMS), реакционную смесь упаривали при температуре ниже 20°С при пониженном давлении и вакуум снова заполняли атмосферой аргона. Полученный остаток перегоняли совместно с CH2Cl2 (2×5 мл), получая неочищенный продукт 4 в виде бледно-желтой жидкости.
К перемешиваемому раствору вышеуказанного неочищенного соединения 4 в этаноле (5 мл) добавляли триэтиламин по каплям (1,17 мл, 8,49 ммоль) при 0°С, а затем раствор соли (S)-1-(пиперидин-4-ил)этан-1,2-диол.HCl (получение 38 WO 2005026145 А1) (154 мг, 0,84 ммоль) в этаноле (10 мл) при той же температуре в инертной атмосфере. Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 12 ч. После завершения реакции (контроль с помощью LCMS), реакционную смесь упаривали при пониженном давлении с получением остатка, который очищали колоночной хроматографией с обращенной фазой (колонка С-18; Grace System), элюируя 50% ацетонитрилом в воде, чтобы получить указанное в заголовке соединение 39 (36 мг) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,61 (уш.с, 1Н; обмен с D2O), 7,92 (д, J=2,4 Гц, 1Н), 7,79 (д.д, J=8,8; 2,4 Гц, 1Н), 7,36 (д, J=9,3 Гц, 1Н), 7,30 (с, 1Н), 4,27-4,49 (м, 2Н + (2-ОН; обмен с D2O)), 4,13 (т, J=6,1 Гц, 2Н), 3,67 -3,64 (м, 2Н), 3,27-3,12 (м, 3Н), 2,59-2,55 (м, 2Н), 2,25-2,11 (м, 2Н), 1,78-1,72 (м, 3Н), 1,69-1,54 (м, 3Н), 1,45-1,18 (м, 6 Н), 0,97 (т, J=7,3 Гц, 3Н), 0,92 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 547,46 [М+Н]+; чистота ~98,74%.
Схема 32:
ПРИМЕР 122
(S)-1-(1-((3-(5-Этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этан-1,2-диилдинитрат (1л):
К перемешиваемому раствору (S)-2-(5-((4-(1,2-дигидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-этил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 39 (140 мг, 0,25 ммоль) в CH2Cl2 (2,1 мл) по каплям добавляли раствор свежеприготовленного ацетилнитрата (0,24 мл) [(ацетилнитрат готовили отдельно, медленно добавляя дымящую HNO3 (0,04 мл; 6,0 же.) по каплям в уксусный ангидрид (0,2 мл, 1:5 HNO3)) при -10°С в атмосфере аргона (Примечание: температура не должна превышать 0°С))] при -10°С в атмосфере аргона. Реакционную смесь перемешивали при 0°С в течение 1 ч. После завершения реакции (контроль с помощью ТСХ), реакцию останавливали добавлением насыщенного раствора NaHCO3 (20 мл) и экстрагировали CH2Cl2 (3×10 мл). Объединенные органические слои промывали насыщенным солевым раствором (25 мл) и сушили над безводным Na2SO4, и упаривали при пониженном давлении. Полученный неочищенный продукт очищали с помощью препаративной ВЭЖХ (колонка XBridge С18; 35-100% градиент ацетонитрила в воде). Чистые фракции лиофилизировали, получая указанное в заголовке соединение 1л (13,5 мг) в виде белого твердого вещества. 1H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,61 (с, 1Н; обмен с D2O), 7,94 (д, J=2,4 Гц, 1Н), 7,80 (д.д, J=8,8; 2,4 Гц, 1Н), 7,37 (д, J=8,8 Гц, 1Н), 7,31 (с, 1Н), 5,33-5,29 (м, 1Н), 4,94 (д.д, J=12,7; 2,4 Гц, 1Н), 4,71 (д.д, 7=12,7; 6,1 Гц, 1Н), 4,37 (кв, J=7,3 Гц, 2Н), 4,13 (т, J=6,4 Гц, 2Н), 3,76-3,64 (м, 2Н), 2,59-2,55 (м, 2Н), 2,29-2,23 (м, 2Н), 1,87-1,70 (м, 5 Н), 1,66-1,61 (м, 2Н), 1,46-1,42 (м, 2Н), 1,36 (т, J=7,1 Гц, 3Н), 0,97 (т, J=7,3 Гц, 3Н), 0,92 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 637,29 [М+Н]+; чистота ~98,2%.
Схема 32:
ПРИМЕР 58
2-(2-Этокси-5-((4-(2-гидроксиэтил)пиперазин-1-ил)сульфонил)фенил)-6-(гидроксиметил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-он (40):
К перемешиваемому раствору 2-(2-этокси-5-((4-(2-гидроксиэтил)пиперазин-1-ил)сульфонил)фенил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 20 (2,5 г, 4,96 ммоль) в концентрированном растворе HCl (25 мл) добавляли параформальдегид (1,25 г, 0,5 масс, доля) при комнатной температуре и нагревали до 50°С в инертной атмосфере в течение 12 ч. После завершения реакции (контроль с помощью ТСХ), реакционную смесь охлаждали до комнатной температуры и нейтрализовали насыщенным раствором NaHCO3 (250 мл). Полученный раствор экстрагировали 10% метанолом в дихлорметане (3×200 мл). Объединенные органические слои сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С18; Grace System), элюируя 20-35% градиентом ацетонитрила в воде, чтобы получить указанное в заголовке соединение 40 (1,5 г; чистота ~86%) в виде грязно-белого твердого вещества, которое непосредственно использовали для следующей реакции без дополнительной очистки. 1Н-ЯМР (300 МГц, ДМСО-d6) δ м.д. 11,73 (уш.с, 1Н), 7,96-7,81 (м, 2Н), 7,39 (д, J=8,4 Гц, 1Н), 5,18 (т, J=4,9 Гц, 1Н), 4,56 (д, J=4,9 Гц, 2Н), 4,23 (кв, J=6,8 Гц, 2Н), 4,05 (с, 3Н), 3,82-3,682 (м, 4Н), 3,22-3,11 (м, 2Н), 2,91-2,79 (м, 4Н), 2,63-2,58 (м, 2Н), 2,48-2,32 (м, 3Н), 1,63-1,52 (м, 2Н), 1,35 (т, J=6,8 Гц, 3Н), 0,88 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 534,1 [М+Н+]; чистота ~86%.
ПРИМЕР 59
2-(2-Этокси-5-((4-(2-гидроксиэтил)пиперазин-1-ил)сульфонил)фенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегид (41):
К перемешиваемому раствору 2-(2-этокси-5-((4-(2-гидроксиэтил)пиперазин-1-ил)сульфонил)фенил)-6-(гидроксиметил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 40 (800 мг) в дихлорметане (320 мл) добавляли активированный 58% MnO2 (2,26 г, 26 ммоль) и KMnO4 (760 мг, 4,8 ммоль) при комнатной температуре и перемешивали в течение 24 ч. Реакцию контролировали с помощью ТСХ. Реакционную смесь фильтровали через целитовую прокладку и промывали дихлорметаном (250 мл). Фильтрат упаривали и полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (Grace System), элюируя 6-8% градиентом раствора 30% метанола в дихлорметане с дихлорметаном, с получением указанного в заголовке соединения 41 (180 мг) в виде белого твердого вещества; с последующим элюированием с 15-20% градиентом раствора 30% метанола в дихлорметане с дихлорметаном, получая непрореагировавшее 40 (400 мг) в виде грязно-белого твердого вещества. 1Н-ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,14 (уш.с, 1Н), 10,15 (с, 1Н), 7,86 (д, J=2,1 Гц, 1Н), 7,84 (д.д, J=8,4; 2,1 Гц, 1Н), 7,38 (д, J=8,4 Гц, 1Н), 4,36 (т, J=5,3 Гц, 1Н), 4,32 (с, 3Н), 4,22 (кв, J=6,8 Гц, 2Н), 3,44-3,38 (м, 2Н), 2,97-2,86 (м, 6 Н), 2,49-2,43 (м, 4Н), 2,38-2,34 (м, 2Н), 1,72-1,60 (м, 2Н), 1,34 (т, J=6,8 Гц, 3Н), 0,91 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 532,3 [М+Н]+; чистота ~96,7%.
ПРИМЕР 60
(E)-2-(2-Этокси-5-((4-(2-гидроксиэтил)пиперазин-1-ил)сульфонил)фенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегид оксим (42):
К перемешиваемому раствору 2-(2-этокси-5-((4-(2-гидроксиэтил)пиперазин-1-ил)сульфонил)фенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегида 41 (80 мг, 0,15 ммоль) в этаноле (9,6 мл) добавляли 50% водный раствор гидроксиламина (1,6 мл) при комнатной температуре и нагревали до 50°С в течение 5 ч. После завершения реакции (контроль с помощью ТСХ), реакционную смесь упаривали при пониженном давлении. Полученный остаток разбавляли водой (10 мл) и экстрагировали 10% метанолом в дихлорметане (3×20 мл). Объединенные органические слои промывали насыщенным солевым раствором (20 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Неочищенный продукт растворяли в изопропаноле (3,0 мл) при 80°С и оставляли охлаждаться до комнатной температуры. Осажденное твердое вещество отфильтровывали и сушили, получая указанное в заголовке соединение 42 (24,5 мг, выход 30%) в виде бледно-желтого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,81 (с, 1Н; обмен с D2O), 11,59 (с, 1Н; обмен с D2O), 8,34 (с, 1Н), 7,89 (д, J=2,2 Гц, 1Н), 7,81 (д.д, J=8,8; 2,2 Гц, 1Н), 7,37 (д, J=8,8 Гц, 1Н), 4,33 (т, J=5,4 Гц, 1Н; обмен с D2O), 4,23 (кв, J=6,8 Гц, 2Н), 4,17 (с, 3Н), 3,44-3,40 (м, 2Н), 2,91-2,87 (м, 4Н), 2,76-2,74 (м, 2Н), 2,49-2,44 (м, 4Н), 2,38-2,34 (м, 2Н), 1,62-1,56 (м, 2Н), 1,35 (т, J=6,8 Гц, 3Н), 0,88 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 547,6 [М+Н+]; чистота ~95,9%.
Схема 33:
ПРИМЕР 61
2-(4-((4-Этокси-3-(6-формил-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперазин-1-ил)этилнитрат (43):
К перемешиваемому раствору 2-(2-этокси-5-((4-(2-гидроксиэтил)пиперазин-1-ил)сульфонил)фенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегида 41 (230 мг, 0,43 ммоль) в ацетонитриле (9,2 мл) по каплям добавляли раствор свежеприготовленного ацетилнитрата (0,4 мл; 4,6 ммоль) [(ацетилнитрат готовили отдельно, медленно добавляя дымящую HNO3 (1,1 мл, 25,5 ммоль) по каплям в уксусный ангидрид (2,5 мл, 26,5 ммоль) при -15°С в течение 30 мин в атмосфере аргона (Примечание: температура не должна превышать 0°С))] при -10°С в течение 10 мин в атмосфере аргона. Реакционную смесь перемешивали при -5°С в течение 4 ч. После завершения реакции (контроль с помощью ТСХ), реакцию останавливали добавлением насыщенного раствора NaHCO3 (20 мл) при 0°С и экстрагировали этилацетатом (3×20 мл). Объединенные органические слои промывали 5 насыщенным солевым раствором (20 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении, получая неочищенный продукт 43 (250 мг) в виде коричневого полутвердого вещества, которое непосредственно использовали для следующей реакции без дополнительной очистки. LCMS (ESI): m/z 577.6 [М+Н+]; чистота ~74%.
ПРИМЕР 62
(E)-2-(4-((4-Этокси-3-(6-((гидроксиимино)-метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперазин-1-ил)этилнитрат (2ж):
К перемешиваемому раствору 2-(4-((4-этокси-3-(6-формил-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперазин-1-ил)этилнитрата 43 (250 мг, чистота ~74%) в этаноле (30 мл) добавляли 50% водный раствор гидроксиламина (5 мл) при комнатной температуре. Реакционную смесь нагревали до 50°С в течение 5 ч. После завершения реакции (контроль с помощью LCMS анализа), реакционную смесь охлаждали до комнатной температуры и упаривали при пониженном давлении. Полученный остаток разбавляли водой (15 мл) и экстрагировали этилацетатом (3×25 мл). Объединенные органические слои промывали насыщенным солевым раствором (20 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией на силикагеле (Grace System), элюируя 6% раствора 30% метанола в дихлорметане с дихлорметаном с последующей перекристаллизацией из горячего изопропанола (3 мл) с получением указанного в заголовке соединения 2ж (29,3 мг) в виде бледно-желтого твердого вещества. 1H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,80 (с, 1Н; обмен с D2O), 11,59 (с, 1Н; обмен с D2O), 8,34 (с, 1Н), 7,89 (д, J=2,4 Гц, 1Н), 7,81 (д.д, J=8,8; 2,4 Гц, 1Н), 7,37 (д, J=8,8 Гц, 1Н), 4,56 (т, J=5,1 Гц, 2Н), 4,23 (кв, J=6,8 Гц, 2Н), 4,17 (с, 3Н), 2,91-2,89 (м, 4Н), 2,77-2,74 (м, 2Н), 2,67-2,65 (м, 2Н), 2,54-2,51 (м, 4Н), 1,63-1,54 (м, 2Н), 1,35 (т, J=6,8 Гц, 3Н), 0,88 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 590,4 [М-Н]-; чистота ~96,6%.
Схема 34:
ПРИМЕР 63
5-((4-(3-Гидроксипропил)пиперазин-1-ил)сульфонил)-2-пропоксибензойная кислота (44):
К перемешиваемому раствору 2-(пиперазин-1-ил)пропан-1-ола (3,1 г, 21,52 ммоль) в дихлорметане (36 мл) добавляли триэтиламин (14,9 мл, 107,64 ммоль) при 0°С в инертной атмосфере. К полученной смеси по каплям добавляли раствор 5-(хлорсульфонил)-2-пропоксибензойной кислоты (6,0 г, 21,52 ммоль) в дихлорметане (36 мл) при 0°С в инертной атмосфере. Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 16 ч. После завершения реакции (контроль с помощью LCMS анализа), реакционную смесь непосредственно очищали (без дополнительной обработки) колоночной хроматографией с обращенной фазой (колонка С18, Grace System), элюируя 5-20% градиентом ацетонитрила в воде, и получая 12 г соединения 44, содержащее триэтиламин гидрохлорид в качестве примеси. Полученный продукт растворяли в CH2Cl2 (30 мл) и затем разбавляли н-гексаном (200 мл). Полученную смесь перемешивали при комнатной температуре в течение 2 ч и фильтровали. Фильтрат упаривали при пониженном давлении с получением указанного в заголовке соединения 2 (8,3 г) в виде белой смолы. 1H-ЯМР (400 МГц, CDCl3) δ м.д. 11,8 (уш.с, 1Н), 8,24 (д, J=2,4 Гц, 1Н), 7,76 (д.д, J=8,4; 2,4 Гц, 1Н), 7,05 (д, J=8,4 Гц, 1Н), 4,18-4,15 (м, 2Н), 3,72-3,70 (м, 2Н), 3,06-3,03 (м, 5Н), 2,61-2,58 (м, 6Н), 1,94-1,89 (м, 2Н), 1,70-1,67 (м, 2Н), 1,09 (т, J=7,2 Гц, 3Н); LCMS (ESI): m/z 387,5 [М+Н+]; чистота ~95,4%.
ПРИМЕР 64
3-(5-((4-(3-Гидроксипропил)пиперазин-1-ил)сульфонил)-2-пропоксибензамидо)-1-метил-4-пропил-1H-пиррол-2-карбоксамид (45):
К перемешиваемому раствору 5-((4-(3-гидроксипропил)пиперазин-1-ил)сульфонил)-2-пропоксибензойной кислоты 44 (8,3 г) в ДМФА (49,8 мл) добавляли диизопропилэтиламин (11,2 мл, 64,5 ммоль), а затем TBTU (13,8 г, 43,0 ммоль) при 15-20°С и перемешивали в течение 20 мин. К полученной смеси порциями добавляли 3-амино-1-метил-4-пропил-1H-пиррол-2-карбоксамид (WO 2001060825 А1) (3,89 г, 21,50 ммоль) при той же температуре в течение 30 мин. Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 2 ч в инертной атмосфере. После завершения реакции (мониторинг с помощью ТСХ и LCMS анализа), реакцию останавливали добавлением ледяной воды (500 мл) и экстрагировали этилацетатом (3×100 мл). Объединенные органические слои промывали насыщенным солевым раствором (150 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (Grace System), элюируя 10-15% градиентом раствора 30% метанола в дихлорметане с дихлорметаном, с получением указанного в заголовке соединения 45 (2,1 г) в виде белого твердого вещества. 1H-ЯМР (300 МГц, ДМСО-d6) δ м.д. 9,49 (с, 1Н), 7,82-7,79 (м, 2Н), 7,41 (д, J=8,8 Гц, 1Н), 7,24 (уш.с, 1Н), 6,92 (уш.с, 1Н), 6,71 (с, 1Н), 4,34 (уш.т, J=4,8 Гц, 1Н), 4,21-4,16 (м, 2Н), 3,74 (с, 3Н), 3,38-3,31 (м, 2Н), 2,89-2,84 (м, 4Н), 2,45-2,39 (м, 4Н), 2,33-2,24 (м, 4Н), 1,85-1,75 (м, 2Н), 1,51-1,42 (м, 4Н), 0,98 (т, J=7,2 Гц, 3Н), 0,88 (т, J=7,2 Гц, 3Н).
ПРИМЕР 65
2-(5-((4-(3-Гидроксипропил)пиперазин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-он (46):
К перемешиваемому раствору 3-(5-((4-(3-гидроксипропил)пиперазин-1-ил)сульфонил)-2-пропоксибензамидо)-1-метил-4-пропил-1H-пиррол-2-карбоксамида 45 (2,1 г, 3,82 ммоль) в этаноле (33,6 мл) добавляли 1М водный раствор КОН (29,4 мл) при комнатной температуре. Реакционную смесь нагревали при 100°С в течение 16 ч. После завершения реакции (контроль с помощью ТСХ), реакционную смесь охлаждали до комнатной температуры и упаривали при пониженном давлении. Полученный остаток разбавляли водой (110 мл) и экстрагировали этилацетатом (3×50 мл). Объединенные органические слои промывали насыщенным солевым раствором (50 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении, получая указанное в заголовке соединение 46 (1,55 г, выход 73%) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,64 (уш.с, 1Н; обмен с D2O), 7,88 (д, J=2,4 Гц, 1Н), 7,79 (д.д, J=8,8; 2,4 Гц, 1Н), 7,37 (д, J=8,8 Гц, 1Н), 7,21 (с, 1Н), 4,32 (уш.т, J=5,1 Гц, 1Н; обмен с D2O), 4,13 (т, J=6,4 Гц, 2Н), 3,98 (с, 3Н), 3,41-3,32 (м, 2Н), 2,92-2,86 (м, 4Н), 2,58-2,55 (м, 2Н), 2,44-2,38 (м, 4Н), 2,32-2,29 (м, 2Н), 1,78-1,70 (м, 2Н), 1,68-1,59 (м, 2Н), 1,53-1,48 (м, 2Н), 0,96 (т, J=7,3 Гц, 3Н), 0,92 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 532,6 [М+Н+]; чистота ~97,5%.
Схема 35:
ПРИМЕР 65
3-(4-((3-(5-Метил-4-оксо-7-пропил-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)пропилнитрат (3г):
К перемешиваемому раствору 2-(5-((4-(3-гидроксипропил)пиперазин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 46 (200 мг, 0,37 ммоль) в ацетонитриле (6,0 мл) по каплям добавляли раствор свежеприготовленного ацетилнитрата (0,13 мл; 1,88 ммоль) [(ацетилнитрат готовили отдельно, медленно добавляя дымящую HNO3 (1,1 мл, 25,5 ммоль) по каплям в уксусный ангидрид (2,5 мл, 26,5 ммоль) при -15°С в течение 30 мин в атмосфере аргона (Примечание: температура не должна превышать 0°С))] при -10°С в течение 10 мин в атмосфере аргона. Реакционную смесь перемешивали при температуре от -15 до -10°С в течение 4 ч. Реакцию контролировали с помощью ТСХ и LCMS анализа. Реакцию останавливали добавлением насыщенного раствора NaHCO3 (14 мл) при 0°С и экстрагировали этилацетатом (3×20 мл). Объединенные органические слои промывали насыщенным солевым раствором (30 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С18, Grace System), элюируя 35-40% градиентом ацетонитрила в воде. Чистые фракции лиофилизировали с получением указанного в заголовке соединения 3г (32 мг) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,63 (с, 1Н; обмен с D2O), 7,89 (д, J=2,4 Гц, 1Н), 7,80 (д.д; J=8,8, 2,4 Гц, 1Н), 7,37 (д, J=8,8 Гц, 1Н), 7,21 (с, 1Н), 4,48 (т, J=6,6 Гц, 2Н), 4,13 (т, J=6,1 Гц, 2Н), 3,98 (с, 3Н), 2,95-2,89 (м, 4Н), 2,58-2,55 (м, 2Н), 2,48-2,42 (м, 4Н), 2,38-2,34 (м, 2Н), 1,80-1,70 (м, 4Н), 1,68-1,58 (м, 2Н), 0,97 (т, J=7,4 Гц, 3Н), 0,92 (т, J=7,4 Гц, 3Н); LCMS (ESI): m/z 577,6 [М+Н+]; чистота ~95,2%.
Схема 36:
ПРИМЕР 66
2-(5-((4-(2-Гидроксиэтил)пиперазин-1-ил)сульфонил)-2-пропоксифенил)-6-(гидроксиметил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-он (47):
К перемешиваемому раствору 2-(5-((4-(2-гидроксиэтил)пиперазин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 32 (550 мг, 1,06 ммоль) в концентрированном растворе HCl (5,5 мл) добавляли параформальдегид (275 мг, 0,5 масс, доля) при комнатной температуре и нагревали до 50°С при инертной атмосфере. Реакцию контролировали с помощью LCMS анализа. Через 16 ч реакционную смесь охлаждали до комнатной температуры, разбавляли водой (30 мл) и нейтрализовали насыщенным раствором NaHCO3 (150 мл). Полученный раствор экстрагировали 10% метанолом в дихлорметане (3×100 мл). Объединенные органические слои сушили над безводным Na2SO4 и упаривали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С-18; Grace System), элюируя 35-40% градиентом ацетонитрила в воде, с получением указанного в заголовке соединения 47 (230 мг; выход 37%) в виде белого твердого вещества. 1H-ЯМР (300 МГц, ДМСО-d6) δ м.д. 10,42 (уш.с, 1Н), 7,87 (д, J=2,2 Гц, 1Н), 7,80 (д.д, J=8,8; 2,2 Гц, 1Н), 7,37 (д, J=8,8 Гц, 1Н), 5,16 (уш.с, 1Н), 4,56 (с, 2Н), 4,35 (уш.с, 1Н), 4,13-4,10 (м, 2Н), 4,05 (с, 3Н), 3,43-3,39 (м, 2Н), 2,91-2,86 (м, 4Н), 2,61-2,57 (м, 2Н), 2,47-2,43 (м, 4Н), 2,37-2,33 (м, 2Н), 1,79-1,69 (м, 2Н), 1,62-1,52 (м, 2Н), 0,97 (т, J=7,3 Гц, 3Н), 0,88 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 548,6 [М+Н+]; чистота ~95,3%.
ПРИМЕР 67
2-(5-((4-(2-Гидроксиэтил)пиперазин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегид (48):
К перемешиваемому раствору 2-(5-((4-(2-гидроксиэтил)пиперазин-1-ил)сульфонил)-2-пропоксифенил)-6-(гидроксиметил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 47 (700 мг, 1,28 ммоль) в ацетонитриле (350 мл) добавляли активированный 58% MnO2 (1,89 г, 21,79 ммоль) при комнатной температуре и перемешивали в течение 24 ч. Реакцию контролировали с помощью ТСХ и LCMS анализа. Реакционную смесь фильтровали через целитовую прокладку. Активированный 58% MnO2 (1,89 г, 21,79 ммоль) добавляли к фильтрату при комнатной температуре и перемешивали в течение дополнительных 24 ч. Реакционную смесь фильтровали через целитовую прокладку и промывали ацетонитрилом (100 мл). Полученный фильтрат упаривали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией на силикагеле (Grace system), элюируя 4-8% градиентом раствора 30% метанола в дихлорметане с дихлорметаном, с получением указанного в заголовке соединения 48 (220 мг, выход 31%) в виде белого твердого вещества. 1Н-ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,13 (уш.с, 1Н), 10,14 (с, 1Н), 7,90-7,77 (м, 2Н), 7,39 (д, J=8,4 Гц, 1Н), 4,38 (т, J=5,3 Гц, 1Н), 4,32 (с, 3Н), 4,12 (т, J=6,2 Гц, 2Н), 3,44-3,40 (м, 2Н), 3,01-2,78 (м, 6Н), 2,48-2,45 (м, 4Н), 2,38-2,35 (м, 2Н), 1,78-1,61 (м, 4Н), 0,97-0,84 (м, 6Н); LCMS (ESI): m/z 546,3 [М+Н+]; чистота ~98,9%.
ПРИМЕР 68
(Е)-2-(5-((4-(2-гидроксиэтил)пиперазин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-6-карбальдегид оксим (49):
К перемешиваемому раствору 2-(5-((4-(2-гидроксиэтил)пиперазин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегида 48 (80 мг, 0,15 ммоль) в этаноле (9,6 мл) добавляли 50% водный раствор гидроксиламина (1,6 мл) при комнатной температуре. Реакционную смесь нагревали до 50°С в течение 5 ч в атмосфере аргона. После завершения реакции (контроль с помощью ТСХ), реакционную смесь упаривали при пониженном давлении. Полученный остаток разбавляли водой (10 мл) и экстрагировали этилацетатом (3×10 мл). Объединенные органические слои промывали насыщенным солевым раствором (10 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С18; Grace System), элюируя 35-40% градиентом ацетонитрила в воде. Чистые фракции лиофилизировали и получали указанное в заголовке соединение 49 (13,3 мг) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,77 (уш.с, 1Н; обмен с D2O), 11,58 (уш.с, 1Н; обмен с D2O), 8,33 (с, 1Н), 7,88 (д, J=2,0 Гц, 1Н), 7,80 (д.д, J=8,8; 2,0 Гц, 1Н), 7,37 (д, J=8,8 Гц, 1Н), 4,34 (д, J=5,1 Гц, 1Н; обмен с D2O), 4,17 (с, 3Н), 4,13-4,04 (м, 2Н), 3,44-3,39 (м, 2Н), 2,91-2,87 (м, 4Н), 2,76-2,72 (м, 2Н), 2,51-2,47 (м, 4Н), 2,38-2,35 (м, 2Н), 1,78-1,70 (м, 2Н), 1,63-1,54 (м, 2Н), 0,96 (т, J=7,3 Гц, 3Н), 0,88 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 561,6 [М+Н+]; чистота ~95,3%.
Схема 37:
ПРИМЕР 68
2-(4-((3-(6-Формил-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)этилнитрат (50):
К перемешиваемому раствору 2-(5-((4-(2-гидроксиэтил)пиперазин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегида 48 (220 мг, 0,40 ммоль) в ацетонитриле (6,6 мл) по каплям добавляли раствор свежеприготовленного ацетилнитрата (0,2 мл; 2,82 ммоль) [(ацетилнитрат готовили отдельно, медленно добавляя дымящую HNO3 (1,1 мл, 25,5 ммоль) по каплям в уксусный ангидрид (2,5 мл, 26,5 ммоль) при -15°С в течение 30 мин в атмосфере аргона (Примечание: температура не должна превышать 0°С))] при -15°С в течение 30 мин в атмосфере аргона. Реакционную смесь перемешивали при температуре от -10 до -5°С в течение 4 ч. После завершения реакции (контроль с помощью ТСХ), реакцию останавливали добавлением насыщенного раствора NaHCO3 (15 мл) при 0°С и экстрагировали этилацетатом (3×20 мл). Объединенные органические слои промывали насыщенным солевым раствором (20 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении, получая неочищенный продукт 50 (200 мг) в виде желтого твердого вещества, которое непосредственно использовали для следующей реакции. LCMS (ESI): m/z 591,3 [М+Н+]; чистота ~94,6%.
ПРИМЕР 69
(E)-2-(4-((3-(6-((Гидроксиимино)метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)этилнитрат (3д):
К перемешиваемому раствору 2-(4-((3-(6-формил-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)этилнитрата 50 (200 мг, 0,34 ммоль) в этаноле (24 мл) добавляли 50% водный раствор гидроксиламина (3 мл) при комнатной температуре. Реакционную смесь нагревали до 50°С в течение 5 ч. После завершения реакции (контроль с помощью ТСХ), реакционную смесь упаривали при пониженном давлении. Полученный остаток разбавляли водой (10 мл) и экстрагировали этилацетатом (3×30 мл). Объединенные органические слои промывали насыщенным солевым раствором (30 мл), сушили над безводным Na2SO4 и упаривалит при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией на силикагеле (Grace System), элюируя 10% раствора 30% метанола в дихлорметане с дихлорметаном, с получением указанного в заголовке соединения 3д (43,8 мг) в виде грязно-белого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,81 (с, 1Н; обмен с D2O), 11,63 (с, 1Н; обмен с D2O), 8,34 (с, 1Н), 7,87 (д, J=2,0 Гц, 1Н), 7,81 (д.д, J=8,8; 2,0 Гц, 1Н), 7,38 (д, J=8,8 Гц, 1Н), 4,57-4,55 (м, 2Н), 4,17 (с, 3Н), 4,12 (т, J=6,1 Гц, 2Н), 2,91-2,88 (м, 4Н), 2,76-2,73 (м, 2Н), 2,67-2,64 (м, 2Н), 2,54-2,51 (м, 4Н), 1,78-1,69 (м, 2Н), 1,62-1,53 (м, 2Н), 0,96 (т, J=7,6 Гц, 3Н), 0,87 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 606,5 [М+Н+]; чистота ~96,5%.
Схема 38:
ПРИМЕР 70
6-(Гидроксиметил)-2-(5-((4-(3-гидроксипропил)пиперазин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-он (47):
К перемешиваемому раствору 2-(5-((4-(3-гидроксипропил)пиперазин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 46 (1,0 г, 1,88 ммоль) в концентрированном растворе HCl (10 мл) добавляли параформальдегид (500 мг, 0,5 масс. доля) при комнатной температуре и нагревали до 50°С в течение 16 ч. После завершения реакции (контроль с помощью ТСХ и LCMS анализа), реакционную смесь охлаждали до комнатной температуры, разбавляли ледяной водой (50 мл) и нейтрализовали насыщенным раствором NaHCO3 (200 мл). Полученный раствор экстрагировали 10% метанолом в дихлорметане (3×150 мл). Объединенные органические слои сушили над безводным Na2SO4 и упаривали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С18; Grace System), элюируя 25-35% градиентом ацетонитрила в воде, получая указанное в заголовке соединение 47 (560 мг; выход 51%) в виде белого твердого вещества. 1Н-ЯМР (300 МГц, ДМСО-d6) δ м.д. 11,69 (уш.с, 1Н), 7,88 (с, 1Н), 7,82 (д, J=8,8 Гц, 1Н), 7,38 (д, J=8,8 Гц, 1Н), 5,18 (уш.т, J=5,1 Гц, 1Н), 4,56 (уш.д, J=5,1 Гц, 2Н), 4,36 (уш.с, 1Н), 4,13 (т, J=6,2 Гц, 2Н), 4,05 (с, 3Н), 3,39-3,34 (м, 2Н), 2,91-2,86 (м, 4Н), 2,63-2,58 (м, 4Н), 2,50-2,21 (м, 4Н), 1,80-1,68 (м, 2Н), 1,64-1,62 (м, 4Н), 0,96 (т, J=7,3 Гц, 3Н), 0,88 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 562,4 [М+Н+]; чистота ~82,4%.
ПРИМЕР 71
2-(5-((4-(3-Гидроксипропил)пиперазин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегид (48):
К перемешиваемому раствору 6-(гидроксиметил)-2-(5-((4-(3-гидроксипропил)пиперазин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 47 (450 мг) в дихлорметане (225 мл) добавляли активированный 58% MnO2 (1,18 г, 13,66 ммоль) и KMnO4 (405 мг, 2,56 ммоль) при комнатной температуре и перемешивали в течение 30 ч. Затем реакционную смесь фильтровали через целитовую прокладку. К фильтрату снова добавляли активированный 58% MnO2 (1,18 г, 21,79 ммоль) и KMnO4 (405 мг, 2,56 ммоль) при комнатной температуре и перемешивали в течение 24 ч. Реакцию контролировали с помощью ТСХ и LCMS анализа. Реакционную смесь фильтровали через целитовую прокладку и промывали дихлорметаном (200 мл). Фильтрат упаривали при пониженном давлении и полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (Grace System), элюируя 6-8% градиентом раствора 30% метанола в дихлорметане с дихлорметаном, с получением указанного в заголовке соединения 48 (220 мг, выход 35%) в виде белого твердого вещества. 1Н-ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,13 (уш.с, 1Н), 10,14 (с, 1Н), 7,85-7,80 (м, 2Н), 7,39 (д, J=8,8 Гц, 1Н), 4,37 (т, J=5,3 Гц, 1Н), 4,32 (с, 3Н), 4,12 (т, J=6,2 Гц, 2Н), 3,30-3,24 (м, 2Н), 3,01-2,83 (м, 6Н), 2,46-2,38 (м, 4Н), 2,33-2,28 (м, 2Н), 1,78-1,61 (м, 4Н), 1,54-1,45 (м, 2Н), 0,97-0,88 (м, 6Н); LCMS (ESI): m/z 560,6 [М+Н+]; чистота ~88,3%.
ПРИМЕР 72
(E)-2-(5-((4-(3-гидроксипропил)пиперазин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегид оксим (49):
К перемешиваемому раствору 2-(5-((4-(3-гидроксипропил)пиперазин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегида 48 (80 мг, 0,14 ммоль) в этаноле (9,6 мл) добавляли 50% водный раствор гидроксиламина (1,6 мл) при комнатной температуре и нагревали до 50°С в течение 5 ч. После завершения реакции (контроль с помощью ТСХ и LCMS анализа), реакционную смесь упаривали при пониженном давлении. Полученный остаток разбавляли водой (10 мл) и экстрагировали этилацетатом (2×10 мл). Объединенные органические слои промывали насыщенным солевым раствором (10 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С18; Grace System), элюируя 30-35% градиентом ацетонитрила в воде, и чистые фракции лиофилизировали с получением указанного в заголовке соединения 49 (17,4 мг) в виде белого твердого вещества. 1H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,77 (уш.с, 1Н; обмен с D2O), 11,59 (с, 1Н; обмен с D2O), 8,34 (с, 1Н), 7,88 (д, J=2,0 Гц, 1Н), 7,80 (д.д, J=8,8; 2,0 Гц, 1Н), 7,38 (д, J=8,8 Гц, 1Н), 4,32 (т, J=5,1 Гц, 1Н; обмен с D2O), 4,17 (с, 3Н), 4,13 (т, J=6,4 Гц, 2Н), 3,38-3,33 (м, 2Н), 2,92-2,88 (м, 4Н), 2,76-2,73 (м, 2Н), 2,44-2,39 (м, 4Н), 2,33-2,29 (м, 2Н), 1,77-1,71 (м, 2Н), 1,61-1,55 (м, 2Н), 1,53-1,46 (м, 2Н), 0,96 (т, J=7,3 Гц, 3Н), 0,88 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 575,2 [М+Н+]; чистота ~95,8%.
Схема 39:
ПРИМЕР 73
3-(4-((3-(6-Формил-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)пропилнитрат (50):
К перемешиваемому раствору 2-(5-((4-(3-гидроксипропил)пиперазин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-6-карбальдегида 48 (140 мг, 0,25 ммоль) в ацетонитриле (4,2 мл) по каплям добавляли раствор свежеприготовленного ацетилнитрата (0,09 мл; 1,25 ммоль) [(ацетилнитрат готовили отдельно, медленно добавляя дымящую HNO3 (1,1 мл, 25,5 ммоль) по каплям в уксусный ангидрид (2,5 мл, 26,5 ммоль) при -15°С в течение 30 мин в атмосфере аргона (Примечание: температура не должна превышать 0°С))] при -15°С в течение 30 мин в атмосфере аргона. Реакционную смесь перемешивали при температуре от -10 до -5°С в течение 4 ч. После завершения реакции (контроль с помощью ТСХ), реакцию останавливали добавлением насыщенного раствора NaHCO3 (10 мл) при 0°С и экстрагировали этилацетатом (3×20 мл). Объединенные органические слои промывали насыщенным солевым раствором (10 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении, получая неочищенный продукт 50 (130 мг) в виде светло-коричневого твердого вещества, которое непосредственно использовали для следующей реакции без дополнительной очистки. LCMS (ESI): m/z 605,2 [М+Н+]; чистота ~75,1%.
ПРИМЕР 74
(E)-3-(4-((3-(6-((Гидроксиимино)метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)пропилнитрат (3е):
К перемешиваемому раствору неочищенного 3-(4-((3-(6-формил-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)пропилнитрата 50 (130 мг) в этаноле (15,6 мл) добавляли 50% водный раствор гидроксиламина (2,6 мл) при комнатной температуре и нагревали до 50°С в течение 5 ч. После завершения реакции (контроль с помощью ТСХ), реакционную смесь упаривали при пониженном давлении. Полученный остаток разбавляли водой (10 мл) и экстрагировали этилацетатом (3×10 мл). Объединенные органические слои промывали насыщенным солевым раствором (20 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Неочищенный продукт очищали препаративной ВЭЖХ (колонка XBrige С18, 50-100% градиент ацетонитрила в воде) и чистые фракции лиофилизировали с получением указанного в заголовке соединения 3е (13,6 мг) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,81 (уш.с, 1Н; обмен с D2O), 11,63 (с, 1Н; обмен с D2O), 8,30 (с, 1Н), 7,88 (с, 1Н), 7,83 (д, J=8,8 Гц, 1Н), 7,39 (д, J=8,8 Гц, 1Н), 4,48 (т, J=6,6 Гц, 2Н), 4,18 (с, 3Н), 4,10-4,04 (м, 2Н), 2,94-2,89 (м, 4Н), 2,73-2,68 (м, 2Н), 2,47-2,41 (м, 4Н), 2,38-2,35 (м, 2Н), 1,81-1,72 (м, 4Н), 1,61-1,55 (м, 2Н), 0,97 (т, J=7,4 Гц, 3Н), 0,92 (т, J=7,4 Гц, 3Н); LCMS (ESI): m/z 618,1 [М+Н+]; чистота ~97,2%.
Схема 40:
ПРИМЕР 75
1-Метил-3-(2-пропоксибензамидо)-4-пропил-1H-пиррол-2-карбоксамид (51):
К перемешиваемому раствору 2-пропоксибензойной кислоты (5,0 г, 27,75 ммоль) в ДМФА (25 мл) добавляли диизопропилэтиламин (24 мл, 138,7 ммоль) и TBTU (17,9 г, 55,5 ммоль) при немного пониженной температуре (~15°С). Реакционную смесь перемешивали при той же температуре в течение 30 мин и порциями добавляли 3-амино-1-метил-4-пропил-1H-пиррол-2-карбоксамид (WO 2001060825 А1) (5,03 г, 27,7 ммоль) в течение 5 мин. Реакционная смесь оставляли перемешиваться при комнатной температуре в течение 1,5 ч. После завершения реакции (контроль с помощью ТСХ), реакцию останавливали добавлением охлажденной воды (250 мл) и экстрагировали этилацетатом (3×100 мл). Объединенные органические слои промывали насыщенным солевым раствором (3×100 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Неочищенный продукт растирали с метил-трет-бутиловым эфиром (90 мл) при комнатной температуре в течение 1 ч. Твердое вещество отфильтровывали, промывали н-гексаном (30 мл) и сушили в вакууме, получая указанное в заголовке соединение 51 (7,3 г; выход 76%) в виде грязно-белого твердого вещества. 1Н-ЯМР (300 МГц, ДМСО-d6) δ м.д. 9,39 (уш.с, 1Н), 7,60 (д.д, J=7,5; 1,7 Гц, 1Н), 7,53-7,42 (м, 1Н), 7,28-6,90 (м, 4Н), 6,70 (с, 1Н), 4,09 (т, J=6,6 Гц, 2Н), 3,74 (с, 3Н), 2,26 (т, J=7,7 Гц, 2Н), 1,85-1,73 (м, 2Н), 1,54-1,42 (м, 2Н), 0,97 (т, J=7,3 Гц, 3Н), 0,87 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 344,3 [М+Н+]; чистота ~99%.
ПРИМЕР 76
5-Метил-2-(2-пропоксифенил)-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-он (52):
К перемешиваемому раствору 1-метил-3-(2-пропоксибензамидо)-4-пропил-1H-пиррол-2-карбоксамида 51 (7,3 г, 21,26 ммоль) в этаноле (117 мл) добавляли 1М водный раствор КОН (102 мл) при комнатной температуре. Реакционный сосуд закрывали крышкой и нагревали до 100°С в течение 3 ч. После завершения реакции (контроль с помощью ТСХ), реакционную смесь охлаждали до комнатной температуры и упаривали при пониженном давлении. Полученный остаток разбавляли водой (50 мл) и экстрагировали этилацетатом (3×100 мл). Объединенные органические слои промывали насыщенным солевым раствором (100 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Неочищенный продукт растирали с н-гексаном (70 мл) при комнатной температуре в течение 1 ч, отфильтровывали твердое вещество и сушили в вакууме с получением указанного в заголовке соединения 52 (5,5 г, выход 78%) в виде грязно-белого твердого вещества. 1Н-ЯМР (300 МГц, ДМСО-d6) δ м.д. 11,45 (уш.с, 1Н), 7,75 (д.д, J=7,7; 1,5 Гц, 1Н), 7,54-7,38 (м, 1Н), 7,20 (с, 1Н), 7,15 (д, J=8,4 Гц, 1Н), 7,06 (т, J=7,5 Гц, 1Н), 4,05 (т, J=6,2 Гц, 2Н), 3,97 (с, 3Н), 2,59-2,54 (м, 2Н), 1,82-1,56 (м, 4Н), 0,98 (т, J=7,5 Гц, 3Н), 0,92 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 326,3 [М+Н+]; чистота ~98,1%.
ПРИМЕР 77
3-(5-Метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксибензолсульфонилхлорид (53):
К перемешиваемой и охлажденной хлорсульфоновой кислоте (6,2 мл) на ледяной бане (0-5°С) в атмосфере азота порциями добавляли 5-метил-2-(2-пропоксифенил)-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-он 52 (1,5 г, 4,61 ммоль), и реакционную смесь перемешивали при той же температуре в течение 1 ч. Реакционную смесь постепенно нагревали до комнатной температуры и перемешивание продолжали в течение дополнительных 1,5 ч. Полученную смесь по каплям переносили в хорошо перемешиваемую смесь хлороформа (50 мл) и льда (50 г) и экстрагировали 5% метанолом в хлороформе (2×100 мл). Объединенные органические слои сушили над безводным Na2SO4 и упаривали при пониженном давлении при температуре ниже 30°С в инертной атмосфере, получая неочищенный продукт в виде бледно-желтого полутвердого вещества. Неочищенный продукт кристаллизовали путем растворения в хлороформе (20 мл) с последующим разбавлением диэтиловым эфиром (30 мл) и н-гексаном (110 мл). Осажденное твердое вещество отфильтровывали в инертной атмосфере и сушили в вакууме, получая указанное в заголовке соединение 53 (1,7 г, выход 79%) в виде грязно-белого твердого вещества. 1H-ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,44 (уш.с, 1Н), 7,94 (д, J=1,8 Гц, 1Н), 7,85-7,81 (м, 1Н), 7,53-7,44 (м, 1Н), 7,23-7,18 (м, 1Н), 4,14-3,94 (м, 5Н), 2,63-2,58 (м, 2Н), 1,77-1,49 (м, 4Н), 0,96-0,87 (м, 6Н); LCMS (ESI): m/z 424,3 [М+Н+]; чистота ~90,9%.
ПРИМЕР 78
(R)-2-(5-((4-(1,2-Дигидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-он (54):
К перемешиваемому раствору 3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксибензолсульфонилхлорида 53 (500 мг, 1,2 ммоль) и (R)-1-(пиперидин-4-ил)этан-1,2-диол гидрохлорида (WO 2005026145 А1) (262 мг, 1,44 ммоль) в дихлорметане (40 мл) по каплям добавляли триэтиламин (0,9 мл, 6,0 ммоль) при 0°С в атмосфере аргона. Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 12 ч. После завершения реакции (контроль с помощью ТСХ и LCMS анализа), реакционную смесь промывали водой (20 мл) и насыщенным солевым раствором (20 мл). Органический слой сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (Grace System), элюируя 15% раствора 30% метанола в дихлорметане и дихлорметана, с получением указанного в заголовке соединения 54 (380 мг, чистота ~93%) в виде грязно-белого твердого вещества. Аналитически чистое соединение получали растиранием 80 мг указанного вещества в диэтиловом эфире (3 мл) в течение 1 ч. Твердое вещество отфильтровывали и сушили в вакууме, получая 60 мг указанного в заголовке соединения с чистотой >99% в виде белого твердого вещества. 1H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,64 (с, 1Н; обмен с D2O), 7,89 (д, J=2,4 Гц, 1Н), 7,79 (д.д, J=8,8; 2,4 Гц, 1Н), 7,36 (д, J=8,8 Гц, 1Н), 7,22 (с, 1Н), 4,43 (д, J=4,9 Гц, 1Н; обмен с D2O), 4,39 (т, J=5,6 Гц, 1Н; обмен с D2O), 4,12 (т, J=6,1 Гц, 2Н), 3,98 (с, 3Н), 3,68-3,63 (м, 2Н), 3,31-3,23 (м, 2Н), 3,22-3,16 (м, 1Н), 2,58-2,54 (м, 2Н), 2,23-2,10 (м, 2Н), 1,80-1,69 (м, 3Н), 1,68-1,56 (м, 3Н), 1,42-1,25 (м, 3Н), 0,96 (т, J=7,6 Гц, 3Н), 0,92 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 533,5 [М+Н+]; чистота ~99,3%; SOR: -1,2° (с=0,5%) в метаноле); ее=59,84%, определено хиральной СФХ.
Схема 41:
ПРИМЕР 79
(R)-1-(1-((3-(5-Метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этан-1,2-диилдинитрат (3ж) и (R)-2-гидрокси-2-(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрат (3л):
К перемешиваемому раствору (R)-2-(5-((4-(1,2-дигидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 54 (350 мг, 0,66 ммоль) в этилацетате (16,0 мл) и дихлорметане (1,8 мл) по каплям добавляли свежеприготовленный раствор ацетилнитрата (0,84 мл; 9,9 ммоль) [(ацетилнитрат готовили отдельно, медленно добавляя дымящую HNO3 (1,1 мл, 25,5 ммоль) по каплям в уксусный ангидрид (2,5 мл, 26,5 ммоль) при -15°С в течение 30 мин в атмосфере аргона (Примечание: температура не должна превышать 0°С))] при -10°С в течение 10 мин в атмосфере аргона. Реакционную смесь перемешивали при -5°С в течение 3 ч. После завершения реакции (контроль с помощью ТСХ), реакцию останавливали добавлением насыщенного раствора NaHCO3 (100 мл) при 0°С и экстрагировали этилацетатом (3×25 мл). Объединенные органические слои промывали насыщенным солевым раствором (40 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Неочищенную смесь очищали колоночной хроматографией с обращенной фазой (колонка С18, Grace system), элюируя 60-65% градиентом ацетонитрила в воде, с получением указанного в заголовке соединения 3ж (31,6 мг) в виде бледно-желтого твердого вещества и мононитрата 3л (25,2 мг) в виде бледно-желтого твердого вещества.
3ж:
1H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,60 (с, 1Н; обмен с D2O), 7,93 (д, J=2,2 Гц, 1Н), 7,80 (д.д, J=8,8; 2,2 Гц, 1Н), 7,36 (д, J=8,8 Гц, 1Н), 7,21 (с, 1Н), 5,33-5,30 (м, 1Н), 4,95-4,92 (м, 1Н), 4,73-4,68 (м, 1Н), 4,12 (т, J=6,1 Гц, 2Н), 3,98 (с, 3Н), 3,73-3,67 (м, 2Н), 2,58-2,55 (м, 2Н), 2,31-2,19 (м, 2Н), 1,84-1,71 (м, 5Н), 1,68-1,59 (м, 2Н), 1,49-1,35 (м, 2Н), 0,97 (т, J=7,3 Гц, 3Н), 0,92 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 623,3 [М+Н+]; чистота ~96,9%.
3л:
1H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,60 (с, 1Н; обмен с D2O), 7,92 (д, J=2,4 Гц, 1Н), 7,79 (д.д, J=8,8; 2,4 Гц, 1Н), 7,36 (д, J=8,8 Гц, 1Н), 7,21 (с, 1Н), 5,20 (д, J=5,4 Гц, 1Н; обмен с D2O), 4,52 (д.д, J=11,0; 3,2 Гц, 1Н), 4,37 (д.д, J=11,0; 7,1 Гц, 1Н), 4,12 (т, J=6,4 Гц, 2Н), 3,98 (с, 3Н), 3,69-3,64 (м, 2Н), 3,55-3,50 (м, 1Н), 2,58-2,55 (м, 2Н), 2,24-2,18 (м, 2Н), 1,80-1,72 (м, 3Н), 1,66-1,61 (м, 3Н), 1,39-1,31 (м, 3Н), 0,97 (т, J=7,3 Гц, 3Н), 0,92 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 578,3 [М+Н+]; чистота ~95,8%.
Схема 42:
ПРИМЕР 80
(S)-2-(5-((4-(1,2-Дигидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-он (55):
К перемешиваемому раствору 3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксибензолсульфонилхлорида 53 (500 мг, 1,18 ммоль) и (S)-1-(пиперидин-4-ил)этан-1,2-диол гидрохлорида (WO 2005026145 А1) (321 мг, 1,76 ммоль) в дихлорметане (40 мл) по каплям добавляли триэтиламин (0,84 мл, 5,89 ммоль) при 0°С в атмосфере аргона. Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 16 ч. После завершения реакции (контроль с помощью ТСХ и LCMS анализа), реакционную смесь промывали водой (30 мл). Водный слой экстрагировали дихлорметаном (25 мл). Объединенные органические слои сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией с обращенной фазой (Grace System), элюируя 40-50% градиентом ацетонитрила в воде. Чистые фракции упаривали в вакууме с получением указанного в заголовке соединения 55 (44,2 мг) в виде белого твердого вещества. 1H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,60 (с, 1Н; обмен с D2O), 7,89 (д, J=2,4 Гц, 1Н), 7,79 (д.д, J=8,8; 2,4 Гц, 1Н), 7,36 (д, J=8,8 Гц, 1Н), 7,22 (с, 1Н), 4,40 (д, J=4,9 Гц, 1Н; обмен с D2O), 4,36 (т, J=5,6 Гц, 1Н; обмен с D2O), 4,12 (т, J=6,3 Гц, 2Н), 3,98 (с, 3Н), 3,68-3,63 (м, 2Н), 3,31-3,23 (м, 2Н), 3,22-3,16 (м, 1Н), 2,58-2,54 (м, 2Н), 2,22-2,11 (м, 2Н), 1,80-1,69 (м, 3Н), 1,68-1,56 (м, 3Н), 1,42-1,25 (м, 3Н), 0,96 (т, J=7,6 Гц, 3Н), 0,92 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 533,3 [М+Н+]; чистота ~99,1%; ее=50,25%, определено хиральной СФХ.
Схема 43:
ПРИМЕР 81
(S)-1-(1-((3-(5-Метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этан-1,2-диилдинитрат (3з):
К перемешиваемому раствору (S)-2-(5-((4-(1,2-дигидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 55 (160 мг, 0,30 ммоль) в дихлорметане (8,0 мл) по каплям добавляли свежеприготовленный раствор ацетилнитрата (0,38 мл; 4,50 ммоль) [(ацетилнитрат готовили отдельно, медленно добавляя дымящую HNO3 (1,1 мл, 25,5 ммоль) по каплям в уксусный ангидрид (2,5 мл, 26,5 ммоль) при -15°С в течение 30 мин в атмосфере аргона (Примечание: температура не должна превышать 0°С))] при -10°С в течение 10 мин в атмосфере аргона. Реакционную смесь перемешивали при -5°С в течение 30 мин. После завершения реакции (контроль с помощью ТСХ и LCMS анализа), реакцию останавливали добавлением насыщенного раствора NaHCO3 (20 мл) при 0°С и перемешивали в течение 1 ч. Полученный раствор экстрагировали дихлорметаном (3×20 мл). Объединенные органические слои промывали насыщенным солевым раствором (40 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С18, Grace System), элюируя 60-70% градиентом ацетонитрила в воде. Чистые фракции лиофилизировали, получая указанное в заголовке соединение 3з (40 мг, выход 21%) в виде белого твердого вещества. 1H-ЯМР (300 МГц, ДМСО-d6) δ м.д. 11,64 (с, 1Н; обмен с D2O), 7,92 (д, J=2,2 Гц, 1Н), 7,80 (д.д, J=8,8; 2,2 Гц, 1Н), 7,36 (д, J=8,8 Гц, 1Н), 7,21 (с, 1Н), 5,33-5,30 (м, 1Н), 4,97-4,92 (м, 1Н), 4,73-4,68 (м, 1Н), 4,12 (т, J=6,2 Гц, 2Н), 3,98 (с, 3Н), 3,73-3,67 (м, 2Н), 2,58-2,55 (м, 2Н), 2,30-2,19 (м, 2Н), 1,82-1,70 (м, 5Н), 1,68-1,59 (м, 2Н), 1,49-1,35 (м, 2Н), 0,97 (т, J=7,3 Гц, 3Н), 0,92 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 623,4 [М+Н+]; чистота ~98,5%.
Схема 44:
ПРИМЕР 82
1-(трет-Бутил) 4,4-диэтилпиперидин-1,4,4-трикарбоксилат (56):
К перемешиваемому раствору 1-(трет-бутил) 4-этилпиперидин-1,4-дикарбоксилата (5,0 г, 19,45 ммоль) в ТГФ (50 мл) по каплям добавляли диизопропиламид лития (2М раствор в ТГФ; 28,66 мл, 57,32 ммоль) при -78°С в инертной атмосфере в течение 30 мин. Реакционную смесь перемешивали при -78°С в течение 2 ч, затем при -40°С в течение 3 ч. Раствор снова охлаждали до -78°С и добавляли раствор этилхлорформиата (6,5 мл, 68,28 ммоль) в ТГФ (40 мл). Полученный раствор оставляли нагреваться до комнатной температуры в течение 16 ч. Реакцию останавливали добавлением 10% водного раствора хлорида аммония (100 мл) и полученный раствор экстрагировали этилацетатом (3×100 мл). Органические слои объединяли, сушили над безводным Na2SO4 и упаривали при пониженном давлении, получая неочищеннное указанное в заголовке соединение 56 (10,1 г) в виде коричневой жидкости, которое непосредственно использовали для следующей реакции без очистки. GC-FID: m/z 329,2 [М+]; чистота ~55%.
ПРИМЕР 83
трет-Бутил-4,4-бис(гидроксиметил)пиперидин-1-карбоксилат (57):
По аналогии с описанным в WO 2005026145 А1, к перемешиваемому раствору неочищенного 1-(трет-бутил) 4,4-диэтилпиперидин-1,4,4-трикарбоксилата 56 (10,0 г) в толуоле : ТГФ (1:1; 200 мл) добавляли борогидрид лития (2,27 г, 104,4 ммоль) при комнатной температуре в инертной атмосфере. Реакционную смесь нагревали до 60°С в течение 16 ч. Реакционную смесь охлаждали до 0°С и реакцию останавливали добавлением насыщенного раствора хлорида аммония (200 мл). рН полученного раствора доводили до ~12 насыщенным раствором NaHCO3 (100 мл) и слои разделяли. Водный слой экстрагировали этилацетатом (3×200 мл). Объединенные органические слои промывали водой (500 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Неочищенный продукт очищали растиранием с пентаном (200 мл) при комнатной температуре в течение 1 ч. Образовавшееся твердое вещество отфильтровывали, промывали н-пентаном (200 мл) и сушили в вакууме, получая 57 (2,8 г, 59% с двух стадий) в виде белого твердого вещества. 1Н-ЯМР (300 МГц, CDCl3) δ м.д. 3,66 (с, 4Н), 3,44-3,37 (м, 4Н), 2,40 (уш.с, 2Н), 1,47-1,45 (м, 13Н).
ПРИМЕР 84
Пиперидин-4,4-диилдиметанол гидрохлорид (58):
По аналогии с описанным в WO 2006043490 А1, к перемешиваемому раствору трет-бутил 4,4-бис(гидроксиметил)пиперидин-1-карбоксилата 57 (1,0 г; 4,08 ммоль) в метаноле (4 мл) добавляли 4М HCl в растворе 1,4-диоксана (4 мл) при 0°С. Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 16 ч. После завершения реакции (проверено с помощью 1H-ЯМР анализа), реакционную смесь упаривали при пониженном давлении. Неочищенный продукт очищали растиранием с н-пентаном (20 мл) при комнатной температуре в течение 1 ч, твердое вещество отфильтровывали и снова промывали н-пентаном (10 мл) и сушили в вакууме, получая 58 (0,6 г, количественно) в виде белого твердого вещества. 1H-ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,67 (уш.с, 2Н), 4,39 (уш.с, 2Н), 3,43-3,32 (м, 4Н), 3,03-2,97 (м, 4Н), 1,54-1,52 (м, 4Н); MS (ESI): m/z 146,3 [М+Н+].
Схема 44:
ПРИМЕР 85
2-(5-((4,4-Бис(гидроксиметил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-он (59):
К перемешиваемому раствору пиперидин-4,4-диилдиметанол гидрохлорида 58 (206 мг, 1,41 ммоль) в дихлорметане (10 мл) добавляли раствор 3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксибензолсульфонилхлорида 53 (500 мг, 1,18 ммоль) в дихлорметане (10 мл) при 0°С. К полученной смеси по каплям добавляли триэтиламин (0,81 мл, 5,90 ммоль) при 0°С в атмосфере аргона. Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 16 ч. После завершения реакции (контроль с помощью ТСХ и LCMS анализа), реакционную смесь разбавляли дихлорметаном (20 мл) и промывали водой (20 мл), насыщенным солевым раствором (20 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией на силикагеле (Grace System), элюируя 5-10% градиентом раствора 10% метанола в дихлорметане с дихлорметаном, с получением указанного в заголовке соединения 59 (335 мг, выход 49%) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,67 (с, 1Н; обмен с D2O), 7,91 (д, J=2,4 Гц, 1Н), 7,80 (д.д, J=8,8; 2,4 Гц, 1Н), 7,36 (д, J=8,8 Гц, 1Н), 7,22 (с, 1Н), 4,39 (т, J=5,4 Гц, 2Н; обмен с D2O), 4,12 (т, J=6,4 Гц, 2Н), 3,98 (с, 3Н), 3,16 (д, J=5,4 Гц, 4Н), 2,93-2,89 (м, 4Н), 2,58-2,54 (м, 2Н), 1,79-1,70 (м, 2Н), 1,68-1,58 (м, 2Н), 1,46-1,41 (м, 4Н), 0,97 (т, J=7,3 Гц, 3Н), 0,92 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 533,2 [М+Н]+; чистота ~92,4%.
Схема 45:
ПРИМЕР 86
(1-((3-(5-Метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4,4-диил)бис(метилен)динитрат (3и):
К перемешиваемому раствору 2-(5-((4,4-бис(гидроксиметил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 59 (200 мг, 0,37 ммоль) в ацетонитриле (6 мл) по каплям добавляли раствор свежеприготовленного ацетилнитрата (0,31 мл; 3,75 ммоль) [(ацетилнитрат готовили отдельно, медленно добавляя дымящую HNO3 (1,1 мл, 25,5 ммоль) по каплям в уксусный ангидрид (2,5 мл, 26,5 ммоль) при -15°С в течение 30 мин в атмосфере аргона (Примечание: температура не должна превышать 0°С))] при -15°С в течение 30 мин в атмосфере аргона. Реакционную смесь перемешивали при температуре от -10 до -5°С в течение 4 ч. После завершения реакции (контроль с помощью ТСХ) реакцию останавливали добавлением насыщенного раствора NaHCO3 (10 мл) при 0°С и экстрагировали этилацетатом (3×30 мл). Объединенные органические слои промывали насыщенным солевым раствором (30 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией на силикагеле (Grace System), элюируя 2-8% градиентом раствора 10% метанола в дихлорметане с дихлорметаном, с получением указанного в заголовке соединения 3и (53 мг; выход 21%) в виде бледно-желтого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,63 (с, 1Н; обмен с D2O), 7,96 (д, J=2,0 Гц, 1Н), 7,82 (д.д, J=8,8; 2,0 Гц, 1Н), 7,36 (д, J=8,8 Гц, 1Н), 7,22 (с, 1Н), 4,43 (с, 4Н), 4,13 (т, J=6,4 Гц, 2Н), 3,98 (с, 3Н), 3,10-3,06 (м, 4Н), 2,59-2,45 (м, 2Н), 1,80-1,71 (м, 2Н), 1,69-1,58 (м, 6Н), 0,97 (т, J=7,3 Гц, 3Н), 0,92 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 623,2 [М+Н+]; чистота ~97,5%.
Схема 46:
ПРИМЕР 87
2-(5-((4-(Гидроксиметил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-он (60):
К перемешиваемому раствору 3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксибензолсульфонилхлорида 53 (100 мг, 0,23 ммоль) и пиперидин-4-илметанола (32,6 мг, 0,28 ммоль) в дихлорметане (10 мл) по каплям добавляли триэтиламин (0,164 мл, 1,18 ммоль) при 0°С в атмосфере аргона. Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. После завершения реакции (контроль с помощью ТСХ), реакционную смесь разбавляли дихлорметаном (5 мл) и промывали водой (2×10 мл). Органический слой сушили над безводным Na2SO4 и упаривали. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле (Grace System), элюируя 10-15% градиентом раствора 10% метанола в дихлорметане с дихлорметаном с получением указанного в заголовке соединения 60 (35,2 мг, выход 28%) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,66 (с, 1Н; обмен с D2O), 7,90 (д, J=2,0 Гц, 1Н), 7,80 (д.д, J=8,8; 2,0 Гц, 1Н), 7,36 (д, J=8,8 Гц, 1Н), 7,22 (с, 1Н), 4,49 (т, J=5,1 Гц, 1Н; обмен с D2O), 4,12 (т, J=6,4 Гц, 2Н), 3,98 (с, 3Н), 3,67-3,62 (м, 2Н), 3,23-3,19 (м, 2Н), 2,58-2,54 (м, 2Н), 2,27-2,19 (м, 2Н), 1,78-1,58 (м, 6Н), 1,36-1,23 (м, 1Н), 1,21-1,10 (м, 2Н), 0,97 (т, J=7,3 Гц, 3Н), 0,92 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 503,3 [М+Н]+; чистота ~97,7%.
Схема 47:
ПРИМЕР 88
(1-((3-(5-Метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)метилнитрат (3к):
К перемешиваемому раствору 2-(5-((4-(гидроксиметил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 60 (200 мг, 0,39 ммоль) в ацетонитриле (6 мл) по каплям добавляли раствор свежеприготовленного ацетилнитрата (0,23 мл; 2,78 ммоль) [(ацетилнитрат готовили отдельно, медленно добавляя дымящую HNO3 (1,1 мл, 25,5 ммоль) по каплям в уксусный ангидрид (2,5 мл, 26,5 ммоль) при -15°С в течение 30 мин в атмосфере аргона (Примечание: температура не должна превышать 0°С))] при -10°С в течение 30 мин в атмосфере аргона. Реакционную смесь перемешивали при температуре от -10 до -5°С в течение 4 ч. После завершения реакции (контроль с помощью ТСХ), реакцию останавливали добавлением насыщенного раствора NaHCO3 (10 мл) при 0°С и экстрагировали этилацетатом (3×30 мл). Объединенные органические слои промывали насыщенным солевым раствором (30 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С18; Grace System), элюируя 50-60% градиентом ацетонитрила в воде. Чистые фракции лиофилизировали, получая указанное в заголовке соединение 3к (19,5 мг) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,61 (с, 1Н; обмен с D2O), 7,93 (д, J=2,4 Гц, 1Н), 7,80 (д.д, J=8,8; 2,4 Гц, 1Н), 7,36 (д, J=8,8 Гц, 1Н), 7,21 (с, 1Н), 4,38 (д, J=6,4 Гц, 2Н), 4,12 (т, J=6,1 Гц, 2Н), 3,98 (с, 3Н), 3,69-3,64 (м, 2Н), 2,58-2,54 (м, 2Н), 2,32-2,27 (м, 2Н), 1,79-1,71 (м, 5Н), 1,68-1,59 (м, 2Н), 1,37-1,26 (м, 2Н), 0,97 (т, J=7,3 Гц, 3Н), 0,92 (т, J=7,3 Гц, 3Н); LCMS (ESI): m/z 548,5 [М+Н+]; чистота ~99,7%.
Схема 48:
ПРИМЕР 89
(R)-2-(5-((4-(1,3-Диоксолан-4-ил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-6-(гидроксиметил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-он (61):
К перемешиваемому раствору (R)-2-(5-((4-(1,2-дигидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она (54) (500 мг, 0,94 ммоль) в концентрированном растворе HCl (35% водн.; 5,0 мл) добавляли параформальдегид (250 мг, 0,5 масс, доля) при комнатной температуре в инертной атмосфере. Реакционную смесь нагревали до 50°С и перемешивали в течение 6 ч. После завершения реакции (контроль с помощью LCMS), реакционную смесь охлаждали до комнатной температуры и рН доводили до 7,0-8,0 с помощью насыщенного водного раствора NaHCO3 (100 мл). Полученный раствор экстрагировали 10% метанолом в дихлорметане (3×100 мл). Объединенные органические экстракты сушили над безводным Na2SO4 и упаривали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С-18; Grace System), элюируя 45-50% градиентом ацетонитрила в воде, с получением указанного в заголовке соединения 61 (230 мг; выход 38%) в виде белого твердого вещества. 1H-ЯМР (300 МГц, ДМСО-d6) δ м.д. 11,72 (уш.с, 1Н; обмен с D2O), 7,91 (д, J=2,1 Гц, 1Н), 7,81 (д.д, J=8,8; 2,1 Гц, 1Н), 7,36 (д, J=8,8 Гц, 1Н), 4,86 (с, 1Н), 4,72 (с, 1Н), 4,56 (с, 2Н), 4,14-4,09 (м, 2Н), 4,05 (с, 3Н), 3,87 (уш.с, 1Н; обмен с D2O), 3,86-3,81 (м, 1Н), 3,71-3,64 (м, 3Н), 3,49-3,45 (м, 1Н), 2,63-2,57 (м, 2Н), 2,27-2,20 (м, 2Н), 1,87-1,83 (м, 1Н), 1,77-1,70 (м, 2Н), 1,61-1,54 (м, 3Н), 1,36-1,22 (м, 3Н), 0,96 (т, J=6,9 Гц, 3Н), 0,88 (т, J=6,9 Гц, 3Н); LCMS (ESI): m/z 575,40 [М+Н+]; чистота ~87,7%.
ПРИМЕР 90
(R)-2-(5-((4-(1,3-Диоксолан-4-ил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегид (62):
К перемешиваемому раствору (R)-2-(5-((4-(1,3-диоксолан-4-ил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-6-(гидроксиметил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она (61) (230 мг, 0,40 ммоль) в CH3CN (115 мл) добавляли активированный MnO2 (58% Mn; 1,05 г, 12 ммоль) при комнатной температуре и перемешивали в течение 16 ч. После завершения реакции (контроль с помощью LCMS), реакционную смесь фильтровали через целитовую прокладку и промывали CH2Cl2 (300 мл). Фильтрат упаривали, получая неочищенный продукт. Примечание: эту же реакцию повторяли в масштабе 170 мг и оба неочищенных продукта объединяли и очищали колоночной хроматографией на силикагеле (100-200 меш), элюируя 1% МеОН : CH2Cl2, с получением указанного в заголовке соединения 62 (250 мг, выход -58%) в виде белого твердого вещества. 1H-ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,13 (с, 1Н), 10,15 (с, 1Н), 7,90-7,81 (м, 2Н), 7,37 (д, J=8,8 Гц, 1Н), 4,86 (с, 1Н), 4,72 (с, 1Н), 4,32 (с, 3Н), 4,13-4,09 (м, 2Н), 3,86-3,82 (м, 1Н), 3,71-3,63 (м, 3Н), 3,50-3,46 (м, 1Н), 2,96-2,92 (м, 2Н), 2,28-2,20 (м, 2Н), 1,86-1,82 (м, 1Н), 1,76-1,62 (м, 4Н), 1,41-1,24 (м, 4Н), 0,97-0,87 (м, 6Н); LCMS (ESI): m/z 573,42 [М+Н+]; чистота ~92,6%.
ПРИМЕР 91
(R)-2-(5-((4-(1,2-Дигидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегид (63):
К перемешиваемому раствору (R)-2-(5-((4-(1,3-диоксолан-4-ил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегида 62 (120 мг, 0,21 ммоль) в МеОН : CH2Cl2 (1:2, 3,0 мл) добавляли концентрированный раствор HCl (35% водн.; 1,0 мл) при комнатной температуре и перемешивали в течение 16 ч. После завершения реакции (контроль с помощью ТСХ), реакционную смесь нейтрализовали (рН ~7-8) насыщенным водным раствором NaHCO3 (20 мл). Полученный раствор экстрагировали CH2Cl2 (2×20 мл). Объединенные органические слои сушили над безводным Na2SO4 и упаривали при пониженном давлении, получая неочищенный 63 (110 мг) в виде полутвердого вещества, которое непосредственно использовали для следующей реакции без дополнительной очистки. LCMS (ESI): m/z 561,47 [М+Н+]; чистота ~68%.
ПРИМЕР 92
(R,E)-2-(5-((4-(1,2-Дигидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегид оксим (64):
К перемешиваемому раствору (R)-2-(5-((4-(1,2-дигидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегида 63 (110 мг, чистота ~68%) в этаноле (13,2 мл) добавляли 50% водный раствор гидроксиламина (1,7 мл) при комнатной температуре в инертной атмосфере. Реакционную смесь нагревали до 50°С и перемешивали в течение 5 ч. После завершения реакции (контроль с помощью LCMS), реакционную смесь упаривали при пониженном давлении. Полученный остаток разбавляли этилацетатом (30 мл), промывали водой (10 мл), насыщенным солевым раствором (10 мл) и сушили над безводным Na2SO4 и упаривали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С-18; Grace System), элюируя 30-35% градиентом ацетонитрила в воде. Чистые фракции лиофилизировали, получая указанное в заголовке соединение 64 (18,5 мг; 15% выход с двух стадий) в виде белого твердого вещества. 1H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,77 (уш.с, 1Н; обмен с D2O), 11,58 (уш.с, 1Н; обмен с D2O), 8,33 (с, 1Н), 7,88 (д, J=2,0 Гц, 1Н), 7,80 (д.д, J=8,8; 2,0 Гц, 1Н), 7,34 (д, J=8,8 Гц, 1Н), 4,43-4,36 (м, 2Н; обмен с D2O), 4,17 (с, 3Н), 4,13-4,09 (м, 2Н), 3,65-3,62 (м, 2Н), 3,27-3,18 (м, 3Н), 2,75-2,71 (м, 2Н), 2,22-2,14 (м, 2Н), 1,77-1,69 (м, 3Н), 1,61-1,53 (м, 3Н), 1,41-1,27 (м, 3Н), 0,96 (т, J=7,2 Гц, 3Н), 0,88 (т, J=7,2 Гц, 3Н); LCMS (ESI): m/z 576,48 [М+Н+]; чистота ~98,5%.
Схема 49:
ПРИМЕР 93
(R)-1-(1-((3-(6-Формил-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этан-1,2-диилдинитрат (64):
К перемешиваемому раствору (R)-2-(5-((4-(1,2-дигидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегида 63 (240 мг, 0,43 ммоль) в CH2Cl2 (3,6 мл) по каплям добавляли раствор свежеприготовленного ацетилнитрата (0,36 мл) [(ацетилнитрат готовили отдельно, медленно добавляя дымящую HNO3 (0,06 мл; 6,0 экв.) по каплям в уксусный ангидрид (0,3 мл, 1:5 HNO3)) при -10°С в атмосфере аргона (Примечание: температура не должна превышать 0°С))] при -10°С в атмосфере аргона. Реакционную смесь перемешивали при температуре от -10 до 0°С в течение 1 ч. После завершения реакции (контроль с помощью ТСХ), рН реакционной смеси доводили до 7,0-8,0 с помощью насыщенного раствора NaHCO3 (~25 мл) при 0°С. Полученный раствор экстрагировали CH2Cl2 (2×30 мл). Объединенные органические слои промывали насыщенным солевым раствором (25 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении, получая неочищенный продукт 64 (250 мг), содержащий смесь желаемого динитрата (55%) вместе с мононитратом (21%); который непосредственно использовали для следующей реакции без дополнительной очистки. LCMS (ESI): m/z 651,47 [М+Н+]; чистота ~55% и m/z 606,47 [М+Н+]; чистота ~21%.
ПРИМЕР 94
(R,E)-1-(1-((3-(6-((Гидроксиимино)метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этан-1,2-диилдинитрат (3o) и (R,E)-2-гидрокси-2-(1-((3-(6-((гидроксиимино)метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрат (3р):
К перемешиваемому раствору вышеуказанной неочищенной смеси 64 (250 мг) в этаноле (30 мл) добавляли 50% водный раствор гидроксиламина (3,8 мл) при комнатной температуре и перемешивали при 50°С в течение 5 ч в атмосфере аргона. После завершения реакции (контроль с помощью LCMS), реакционную смесь упаривали при пониженном давлении. Полученный остаток разбавляли водой (10 мл) и экстрагировали EtOAc (2 X 30 мл). Объединенные органические слои промывали насыщенным солевым раствором (25 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Неочищенный продукт очищали препаративной ВЭЖХ (колонка: XBridge С18 (19 × 150) мм; 5 мкм), элюируя 35-100% градиентом ацетонитрила в воде. Чистые фракции лиофилизировали, получая указанное в заголовке соединение 3о (52 мг) в виде белого твердого вещества и 3р (21,6 мг) в виде белого твердого вещества.
3o: 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,74 (уш.с, 1Н; обмен с D2O), 11,60 (с, 1Н; обмен с D2O), 8,34 (с, 1Н), 7,93 (д, J=2,4 Гц, 1Н), 7,81 (д.д, J=8,8; 2,4 Гц, 1Н), 7,37 (д, J=8,8 Гц, 1Н), 5,32-5,30 (м, 1Н), 4,93 (д.д, J=12,4; 2,4 Гц, 1Н), 4,71 (д.д, J=12,4; 6,0 Гц, 1Н), 4,17 (с, 3Н), 4,14-4,11 (м, 2Н), 3,72-3,68 (м, 2Н), 2,77-2,72 (м, 2Н), 2,31-2,23 (м, 2Н), 1,83-1,72 (м, 5Н), 1,63-1,56 (м, 2Н), 1,51-1,36 (м, 2Н), 0,97 (т, J=7,3 Гц, 3Н), 0,88 (т, J=7,6 Гц, 3Н); LCMS (ESI): m/z 666,28 [М+Н+]; чистота ~96,54%.
3р: 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,79 (уш.с, 1Н; обмен с D2O), 11,61 (с, 1Н; обмен с D2O), 8,34 (с, 1Н), 7,91 (д, J=2,4 Гц, 1Н), 7,81 (д.д, J=8,8; 2,4 Гц, 1Н), 7,37 (д, J=8,8 Гц, 1Н), 5,22 (д, J=5,6 Гц, 1Н; обмен с D2O), 4,52 (д.д, J=11,6; 3,2 Гц, 1Н), 4,37 (д.д, J=11,6; 7,6 Гц, 1Н), 4,17 (с, 3Н), 4,14-4,11 (м, 2Н), 3,71-3,63 (м, 2Н), 3,55-3,51 (м, 1Н), 2,77-2,72 (м, 2Н), 2,25-2,17 (м, 2Н), 1,81-1,70 (м, 3Н), 1,63-1,55 (м, 3Н), 1,41-1,29 (м, 3Н), 0,96 (т, J=7,2 Гц, 3Н), 0,88 (т, J=7,2 Гц, 3Н); LCMS (ESI): m/z 621,30 [М+Н+]; чистота ~97,79%.
Схема 50:
ПРИМЕР 95
(S)-2-(5-((4-(1,3-Диоксолан-4-ил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-6-(гидроксиметил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-он (65):
К перемешиваемому раствору (S)-2-(5-((4-(1,2-дигидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 55 (500 мг, 0,94 ммоль) в концентрированном растворе HCl (35% водн.; 5,0 мл), добавляли параформальдегид (250 мг, 0,5 масс. доля) при комнатной температуре. Реакционную смесь нагревали до 50°С и перемешивали в течение 7 ч. После завершения реакции (контроль с помощью LCMS анализа), реакционную смесь охлаждали до комнатной температуры, разбавляли водой (50 мл) и нейтрализовали насыщенным раствором NaHCO3 (200 мл). Полученный раствор экстрагировали 10% метанолом в дихлорметане (3 X 100 мл). Объединенные органические экстракты сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С-18; Grace System), элюируя 45-60% градиентом ацетонитрила в воде, с получением указанного в заголовке соединения 65 (250 мг; выход 43%) в виде белого твердого вещества. 1H-ЯМР (300 МГц, ДМСО-d6) δ м.д. 11,72 (уш.с, 1Н), 7,91 (д, J=2,1 Гц, 1Н), 7,81 (д.д, J=8,8; 2,1 Гц, 1Н), 7,36 (д, J=8,8 Гц, 1Н), 5,16 (уш.с, 1Н), 4,86 (с, 1Н), 4,72 (с, 1Н), 4,56 (с, 2Н), 4,14-4,09 (м, 2Н), 4,05 (с, 3Н), 3,86-3,81 (м, 1Н), 3,71-3,64 (м, 3Н), 3,49-3,45 (м, 1Н), 2,63-2,57 (м, 2Н), 2,27-2,20 (м, 2Н), 1,87-1,83 (м, 1Н), 1,77-1,70 (м, 2Н), 1,61-1,54 (м, 3Н), 1,38-1,23 (м, 3Н), 0,96 (т, J=6,9 Гц, 3Н), 0,88 (т, J=6,9 Гц, 3Н); LCMS (ESI): m/z 575,47 [М+Н+]; чистота ~94,1%.
ПРИМЕР 96
(S)-2-(5-((4-(1,3-Диоксолан-4-ил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегид (66):
К перемешиваемому раствору (S)-2-(5-((4-(1,3-диоксолан-4-ил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-6-(гидроксиметил)-5-метил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она 1 (250 мг, 0,435 ммоль) в ACN (125 мл) добавляли активированный MnO2 (58% Mn; 757 мг, 8,702 ммоль) при комнатной температуре и перемешивали в течение 16 ч. После завершения реакции (контроль с помощью LCMS), реакционную смесь фильтровали через целитовую прокладку и промывали ACN (50 мл). Фильтрат упаривали, получая указанное в заголовке соединение 66 (250 мг, выход 90%) в виде белого твердого вещества. 1H-ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,11 (с, 1Н), 10,16 (с, 1Н), 7,90-7,81 (м, 2Н), 7,38 (д, J=8,8 Гц, 1Н), 4,86 (с, 1Н), 4,72 (с, 1Н), 4,32 (с, 3Н), 4,13-4,09 (м, 2Н), 3,86-3,82 (м, 1Н), 3,71-3,63 (м, 3Н), 3,50-3,46 (м, 1Н), 2,96-2,92 (м, 2Н), 2,28-2,20 (м, 2Н), 1,86-1,82 (м, 1Н), 1,76-1,62 (м, 4Н), 1,41-1,24 (м, 4Н), 0,97-0,87 (м, 6Н); LCMS (ESI): m/z 573,45 [М+Н+]; чистота ~94,9%.
ПРИМЕР 97
(S)-2-(5-((4-(1,2-Дигидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегид (67):
К перемешиваемому раствору (S)-2-(5-((4-(1,3-диоксолан-4-ил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегида 66 (250 мг, 0,43 ммоль) в МеОН : CH2Cl2 (1:1; 5 мл) добавляли концентрированный раствор HCl (35% водн.; 2,5 мл) при комнатной температуре и перемешивали в течение 24 ч. После завершения реакции (контроль с помощью LCMS), реакционную смесь разбавляли водой (10 мл) и нейтрализовали насыщенным раствором NaHCO3 (100 мл). Полученный раствор экстрагировали 10% метанолом в дихлорметане (2 X 50 мл). Объединенные органические слои промывали насыщенным солевым раствором (50 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении, получая указанное в заголовке соединение 67 (210 мг; выход 76%) в виде грязно-белого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,09 (уш.с, 1Н; обмен с D2O), 10,17 (уш.с, 1Н), 7,87 (д, J=2,4 Гц, 1Н), 7,81 (д.д, J=8,8; 2,4 Гц, 1Н), 7,37 (д, J=8,8 Гц, 1Н), 4,43-4,36 (м, 2Н; обмен с D2O), 4,32 (с, 3Н), 4,13-4,09 (м, 2Н), 3,68-3,62 (м, 2Н), 3,29-3,24 (м, 2Н), 3,23-3,17 (м, 1Н), 2,97-2,91 (м, 2Н), 2,22-2,13 (м, 2Н), 1,78-1,62 (м, 6Н), 1,43-1,28 (м, 3Н), 0,97-0,85 (м, 6Н); LCMS (ESI): m/z 561,47 [М+Н+]; чистота ~89,5%.
ПРИМЕР 98
(S,E)-2-(5-((4-(1,2-Дигидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегида (68):
К перемешиваемому раствору (S)-2-(5-((4-(1,2-дигидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегида 67 (50 мг, 0,089 ммоль) в этаноле (6 мл) добавляли 50% водный раствор гидроксиламина (0,75 мл) при комнатной температуре. Реакционную смесь нагревали до 50°С и перемешивали в течение 5 ч. После завершения реакции (контроль с помощью ТСХ), реакционную смесь упаривали при пониженном давлении. Полученный остаток разбавляли водой (5 мл) и экстрагировали этилацетатом (3 X 10 мл). Объединенные органические экстракты промывали насыщенным солевым раствором (10 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка С-18; Grace System), элюируя 35-40%) градиентом ацетонитрила в воде, с получением указанного в заголовке соединения 68 (9,4 мг; выход ~17%) в виде белого твердого вещества. 1H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,77 (уш.с, 1Н; обмен с D2O), 11,58 (уш.с, 1Н; обмен с D2O), 8,33 (с, 1Н), 7,86 (д, J=2,0 Гц, 1Н), 7,78 (д.д, J=8,8; 2,0 Гц, 1Н), 7,33 (д, J=8,8 Гц, 1Н), 4,43-4,36 (м, 2Н; обмен с D2O), 4,17 (с, 3Н), 4,12-4,07 (м, 2Н), 3,65-3,62 (м, 2Н), 3,27-3,18 (м, 3Н), 2,75-2,71 (м, 2Н), 2,22-2,14 (м, 2Н), 1,77-1,69 (м, 3Н), 1,61-1,53 (м, 3Н), 1,41-1,27 (м, 3Н), 0,96 (т, J=7,2 Гц, 3Н), 0,88 (т, J=7,2 Гц, 3Н); LCMS (ESI): m/z 576,64 [М+Н+]; чистота ~96,07%.
Схема 51:
ПРИМЕР 99
(S)-1-(1-((3-(6-Формил-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этан-1,2-диилдинитрат (68):
К перемешиваемому раствору (S)-2-(5-((4-(1,2-дигидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-6-карбальдегида 67 (200 мг, 0,35 ммоль) в CH2Cl2 (2,1 мл) по каплям добавляли раствор свежеприготовленного ацетилнитрата (0,45 мл) [(ацетилнитрат готовили отдельно, медленно добавляя дымящую HNO3 (0.075 мл) по каплям в уксусный ангидрид (0.375 мл) при -15°С в течение 30 мин в атмосфере аргона (Примечание: температура не должна превышать 0°С))] при -10°С в атмосфере аргона. Реакционную смесь перемешивали при температуре от -10 до -5°С в течение 1 ч. После завершения реакции (контроль с помощью ТСХ), реакцию останавливали добавлением насыщенного раствора NaHCO3 (20 мл) при 0°С. Полученный раствор экстрагировали 10% метанолом в дихлорметане (3 X 30 мл). Объединенные органические слои промывали насыщенным солевым раствором (40 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении, получая неочищенный продукт 68 (200 мг) в виде желтого твердого вещества, которое непосредственно использовали для следующей реакции без дополнительной очистки. LCMS (ESI): m/z 651,4 [М+Н+]; чистота ~71,1%.
ПРИМЕР 100
(S,E)-1-(1-((3-(6-((Гидроксиимино)метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этан-1,2-диилдинитрат (3п):
К перемешиваемому раствору (S)-1-(1-((3-(6-формил-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этан-1,2-диилдинитрата 68 (200 мг; чистота ~71%) в этаноле (24 мл) добавляли 50% водный раствор гидроксиламина (3 мл) при комнатной температуре и перемешивали при 50°С в течение 5 ч. После завершения реакции (контроль с помощью ТСХ), реакционную смесь упаривали при пониженном давлении. Полученный остаток разбавляли водой (10 мл) и экстрагировали этилацетатом (3 X 30 мл). Объединенные органические слои промывали насыщенным солевым раствором (30 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Неочищенный продукт очищали препаративной ВЭЖХ (колонка: XBridge С18 (19 × 150 мм); 5 мкм), элюируя 50-100% градиентом ацетонитрила в воде. Чистые фракции лиофилизировали, получая указанное в заголовке соединение 3п (22 мг) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,71 (уш.с, 1Н; обмен с D2O), 11,50 (с, 1Н; обмен с D2O), 8,32 (с, 1Н), 7,90 (д, J=2,4 Гц, 1Н), 7,77 (д.д, J=8,8; 2,4 Гц, 1Н), 7,34 (д, J=8,8 Гц, 1Н), 5,32-5,30 (м, 1Н), 4,93 (д.д, J=12,4; 2,4 Гц, 1Н), 4,71 (д.д, J=12,4; 6,0 Гц, 1Н), 4,17 (с, 3Н), 4,14-4,11 (м, 2Н), 3,72-3,68 (м, 2Н), 2,76-2,72 (м, 2Н), 2,31-2,23 (м, 2Н), 1,83-1,72 (м, 5Н), 1,61-1,55 (м, 2Н), 1,50-1,37 (м, 2Н), 0,96 (т, J=7,3 Гц, 3Н), 0,88 (т, J=7,6 Гц, 3Н); LCMS (ESI): m/z 666,33 [М+Н+]; чистота ~98,62%.
Схема 51:
ПРИМЕР 101
Диэтил 2,2'-((2S,6R)-4-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)-1-метилпиперазин-2,6-диил)диацетат (70):
К перемешиваемому раствору диэтил 2,2'-((2R,6S)-1-метилпиперазин-2,6-диил)диацетат ацетата 69 (см. J. Med. Chem. 2009, 52, 3689-3702) (617 мг, 2,26 ммоль) в этаноле (30 мл) добавляли основную смолу Amberlyst А-21 (3,0 г) при комнатной температуре и перемешивали в течение 2 ч. Смесь фильтровали и промывали этанолом (15 мл). К фильтрату при 0°С в атмосфере добавляли триэтиламин (2,3 мл, 17,48 ммоль), а затем раствор 3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксибензолсульфонилхлорида (4) (500 мг, 1,13 ммоль) в дихлорметане (10 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. После завершения (контроль с помощью LCMS), реакционную смесь непосредственно использовали для хроматографии на колонке с обращенной фазой (без дополнительной обработки) (колонка Reveleris ® С18-40 g; Grace System) путем элюирования 30-65% градиентом ацетонитрила в воде для получения указанного в заголовке соединение 70 (90 мг) в виде грязно-белого твердого вещества. 1Н-ЯМР (300 МГц, ДМСО-d6) δ м.д. 11,67 (уш.с, 1Н), 7,90 (д, J=2,2 Гц, 1Н), 7,79 (д.д, J=8,8; 2,2 Гц, 1Н), 7,39 (д, J=8,8 Гц, 1Н), 7,31 (с, 1Н), 4,37 (кв, J=7,1 Гц, 2Н), 4,13 (т, J=6,2 Гц, 2Н), 4,03 (кв, J=7,1 Гц, 4Н), 3,44-3,37 (м, 2Н), 2,77-2,71 (м, 2Н), 2,63-2,52 (м, 4Н), 2,39-2,28 (м, 4Н), 2,08 (с, 3Н), 1,78-1,66 (м, 2Н), 1,64-1,38 (м, 2Н), 1,34 (т, J=7,1 Гц, 3Н), 1,13 (т, J=7,1 Гц, 6Н), 0,97 (т, J=7,1 Гц, 3Н), 0,91 (т, J=7,1 Гц, 3Н); LCMS (ESI): m/z 674,62 [М+Н]+; чистота ~88,69%.
ПРИМЕР 102
2-(5-(((3S,5R)-3,5-Бис(2-гидроксиэтил)-4-метилпиперазин-1-ил)сульфонил)-2-пропоксифенил)-5-этил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-он (71):
К перемешиваемому раствору диэтил 2,2'-((2S,6R)-4-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)-1-метилпиперазин-2,6-диил)диацетата (70) (90 мг, 0,13 ммоль) в ТГФ (4,5 мл) по каплям добавляли 1М раствор LiAlH4 в ТГФ (0,3 мл, 0,4 ммоль) при 0°С в течение 10 мин в атмосфере аргона. Реакционную смесь перемешивали при 0°С в течение 2 ч. После завершения реакции (контроль с помощью ТСХ и LCMS анализа), реакцию останавливали добавлением насыщенного раствора хлорида аммония (4 мл) при 0°С и экстрагировали этилацетатом (3 X 30 мл). Объединенные органические слои промывали насыщенным солевым раствором (40 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка Reveleris® C18-12g; Grace System), элюируя 30-35% градиентом ацетонитрила в воде, и чистые фракции лиофилизировали с получением указанного в заголовке соединения 71 (35 мг, выход 33%) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,59 (уш.с, 1H; обмен с D2O), 7,90 (д, J=2,0 Гц, 1Н), 7,81 (д.д, J=8,8; 2,0 Гц, 1Н), 7,36 (д, J=8,8 Гц, 1Н), 7,30 (с, 1Н), 4,47 (уш.с, 2Н; обмен с D2O), 4,37 (д, J=7,1 Гц, 2Н), 4,12 (т, J=6,4 Гц, 2Н), 3,45-3,36 (м, 6Н), 2,59-2,53 (м, 2Н), 2,51-2,45 (м, 2Н), 2,20-2,14 (м, 2Н), 1,77 (с, 3Н), 1,77-1,66 (м, 6Н), 1,42-1,38 (м, 2Н), 1,35 (т, J=7,1 Гц, 3Н), 0,97 (т, J=7,1 Гц, 3Н), 0,91 (т, J=7,1 Гц, 3Н); LCMS (ESI): m/z 590,37 [М+Н]+; чистота ~99,59%.
Схема 52:
ПРИМЕР 103
((2R,6S)-4-((3-(5-Этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)-1-метилпиперазин-2,6-диил)бис(этан-2,1-диил)динитрат (1м):
К перемешиваемому раствору 2-(5-(((3S,5R)-3,5-бис(2-гидроксиэтил)-4-метилпиперазин-1-ил)сульфонил)-2-пропоксифенил)-5-этил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она (71) (130 мг, 0,22 ммоль) в дихлорметане (2 мл) по каплям добавляли раствор свежеприготовленного ацетилнитрата (0,32 мл) [(ацетилнитрат готовили отдельно, медленно добавляя дымящую HNO3 (0.005 мл, 2,64 ммоль) по каплям в уксусный ангидрид (0.27 мл) при -15°С в течение 30 мин в атмосфере аргона (Примечание: температура не должна превышать 0°С))] при -15°С в течение 30 мин в атмосфере аргона. Реакционную смесь перемешивали при температуре от -15 до -0°С в течение 30 мин. После завершения реакции (контроль с помощью ТСХ), реакцию останавливали добавлением насыщенного водным раствором NaHCO3 (10 мл) при 0°С и экстрагировали дихлорметаном (3 X 20 мл). Объединенные органические слои промывали насыщенным солевым раствором (30 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Неочищенный продукт очищали препаративной ВЭЖХ (колонка: KROMOSIL С18 (150 × 25) мм, 10 мкм; подвижная фаза А: 100% вода, В: ацетонитрил; поток: 25 мл/мин. Растворимость: ACN + вода + THF). Соответствующие чистые фракции лиофилизировали, получая указанное в заголовке соединение 1 м (10 мг) в виде белого твердого вещества. 1H-ЯМР (400 МГц, ДМСО-d6) 5 м.д. 11,68 (уш.с, 1Н; обмен с D2O), 7,93 (д, J=2,0 Гц, 1Н), 7,84-7,81 (м, 1Н), 7,36 (д, J=8,8 Гц, 1Н), 7,31 (с, 1Н), 4,52 (т, J=6,6 Гц, 4Н), 4,37 (кв, J=7,1 Гц, 2Н), 4,13 (т, J=6,4 Гц, 2Н), 3,38-3,31 (м, 2Н), 2,65-2,59 (м, 2Н), 2,58-2,53 (м, 2Н), 2,33-2,27 (м, 2Н), 2,04 (с, 3Н), 1,88-1,70 (м, 6Н), 1,66-1,59 (м, 2Н), 1,35 (т, J=7,1 Гц, 3Н), 0,97 (т, J=7,1 Гц, 3Н), 0,91 (т, J=7,1 Гц, 3Н); LCMS (ESI): m/z 678,43 [М-Н]-; чистота ~95,48%.
Аналогичным образом ((2S,6S)-4-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)-1-метилпиперазин-2,6-диил)бис(этан-2,1-диил)динитрат (1о) синтезировали с использованием диэтил 2,2'-((2S,6S))-1-метилпиперазин-2,6-диил)диацетат ацетата (см. J. Med. Chem. 2009, 52, 3689-3702) вместо 69.
Схема 53:
ПРИМЕР 104
Диэтил 2,2'-(1-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4,4-диил)диацетат (73):
К перемешиваемому раствору диэтил 2,2'-(пиперидин-4,4-диил)диацетат гидрохлорида (72, см. WO 02001096334) (882 мг, 3,42 ммоль) в дихлорметане (30 мл) добавляли основную смолу Amberlyst А-21 (3,0 г) при комнатной температуре и перемешивали в течение 2 ч. Смесь фильтровали. К фильтрату добавляли при 0°С в атмосфере триэтиламин (2,8 мл, 20,55 ммоль), а затем раствор 3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксибензолсульфонилхлорида (4) (600 мг, 1,37 ммоль) в дихлорметане (10 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. После завершения реакции (контроль с помощью LCMS), реакционную смесь разбавляли дихлорметаном (10 мл), промывали водой (2 X 25 мл), насыщенным солевым раствором (20 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении, получая указанное в заголовке соединение 73 (650 мг) в виде коричневой жидкости, которую использовали для следующей реакции без очистки. LCMS (ESI): m/z 659,80 [М+Н]+; чистота ~83,75%.
ПРИМЕР 105
2-(5-((4,4-Бис(2-гидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-этил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-он (74):
К перемешиваемому раствору диэтил 2,2'-(1-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4,4-диил)диацетата 73 (600 мг, 0,91 ммоль) в ТГФ (12 мл) по каплям добавляли 1М раствор LiAlH4 в ТГФ (1,8 мл) при 0°С в течение 10 мин в атмосфере аргона. Реакционную смесь перемешивали при 0°С в течение 2 ч. После завершения реакции (контроль с помощью ТСХ и LCMS анализа), реакцию останавливали добавлением насыщенного раствора хлорида аммония (25 мл) при 0°С и экстрагировали этилацетатом (3 X 50 мл). Объединенные органические слои промывали насыщенным солевым раствором (50 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией с обращенной фазой (колонка Reveleris® C18-40g; Grace System), элюируя 60-65% градиентом ацетонитрила в воде, и чистые фракции лиофилизировали с получением указанного в заголовке соединения 74 (150 мг, выход 28%) в виде белого твердого вещества. 1H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,69 (уш.с, 1Н; обмен с D2O), 7,93 (д, J=2,0 Гц, 1Н), 7,81 (д.д, J=8,8; 2,0 Гц, 1Н), 7,37 (д, J=8,8 Гц, 1Н), 7,31 (с, 1Н), 4,37 (кв, J=7,3 Гц, 2Н), 4,30 (т, J=4,9 Гц, 2Н; обмен с D2O), 4,14-4,11 (м, 2Н), 3,41-3,32 (м, 4Н), 2,95-2,92 (м, 4Н), 2,59-2,55 (м, 2Н), 1,78-1,72 (м, 2Н), 1,67-1,61 (м, 2Н), 1,50-1,43 (м, 4Н), 1,37-1,32 (м, 7Н), 0,97 (т, J=7,3 Гц, 3Н), 0,912 (т, J=7,1 Гц, 3Н); LCMS (ESI): m/z 575,56 [М+Н]+; чистота ~99,92%.
Схема 54:
ПРИМЕР 106
(1-((3-(5-Этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4,4-диил)бис(этан-2,1-диил)динитрат (1н):
К перемешиваемому раствору 2-(5-((4,4-бис(2-гидроксиэтил)пиперидин-1-ил)сульфонил)-2-пропоксифенил)-5-этил-7-пропил-3,5-дигидро-4H-пирроло[3,2-d]пиримидин-4-она (74) (125 мг, 0,217 ммоль) в дихлорметане (1,8 мл) по каплям добавляли раствор свежеприготовленного ацетилнитрата (0,32 мл) [(ацетилнитрат готовили отдельно, медленно добавляя дымящую HNO3 (0.005 мл, 2,64 ммоль) по каплям в уксусный ангидрид (0.27 мл) при -15°С в течение 30 мин в атмосфере аргона (Примечание: температура не должна превышать 0°С))] при -15°С в течение 30 мин в атмосфере аргона. Реакционную смесь перемешивали при температуре от -15 до 0°С в течение 30 мин. После завершения реакции (контроль с помощью ТСХ), реакцию останавливали добавлением насыщенного раствора NaHCO3 (10 мл) при 0°С и экстрагировали дихлорметаном (3 X 20 мл). Объединенные органические слои промывали насыщенным солевым раствором (30 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученный неочищенный продукт очищали препаративной ВЭЖХ (колонка: KROMASIL С18 (150 × 25) мм, 10 мкм; подвижная фаза А: 10 мМ бикарбоната аммония (водн.); подвижная фаза В: ацетонитрил, метод Т/%В = 0/40, 1/40, 10/80, 10,5/100, 12/100, 12,5/40, 15/40; Поток: 25 мл/мл; Растворимость: ACN + вода + ТГФ). Чистые фракции лиофилизировали, получая указанное в заголовке соединение 1н (57 мг, выход 39%) в виде белого твердого вещества. 1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,68 (уш.с, 1Н), 7,94 (д, J=2,0 Гц, 1Н), 7,82 (д.д, J=8,8; 2,0 Гц, 1Н), 7,36 (д, J=8,8 Гц, 1Н), 7,31 (с, 1Н), 4,53 (т, J=7,3 Гц, 4Н), 4,37 (кв, J=6,9 Гц, 2Н), 4,14-4,11 (м, 2Н), 3,02-2,97 (м, 4Н), 2,59-2,55 (м, 2Н), 1,79-1,71 (м, 2Н), 1,69-1,60 (м, 6Н), 1,57-1,47 (м, 4Н), 1,35 (т, J=6,9 Гц, 3Н), 0,97 (т, J=7,3 Гц, 3Н), 0,912 (т, J=7,1 Гц, 3Н); LCMS (ESI): m/z 665,31 [М+Н]+; чистота ~98,81%.
Схема 55:
Схема 56:
Схема 57:
ПРИМЕР 107
Общие методики:
К перемешиваемому раствору производных пиперидина (81-83, Схемы 55-57) (3,5 ммоль) в дихлорметане (30 мл) добавляли основную смолу Amberlyst А-21 (3,0 г) при комнатной температуре и перемешивали в течение 2 ч. Смесь фильтровали. К фильтрату добавляли триэтиламин при 0°С в атмосфере (3 мл, 22 ммоль), а затем раствор 3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксибензолсульфонилхлорида (4) (600 мг, 1,37 ммоль) в дихлорметане (10 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. После завершения реакции (контроль с помощью LCMS), реакционную смесь разбавляли дихлорметаном (10 мл), промывали водой (2 × 25 мл), насыщенным солевым раствором (20 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении.
Полученные таким образом неочищенные промежуточные ди- и триолы растворяли в дихлорметане (3 мл). К полученным растворам по каплям добавляли раствор свежеприготовленного ацетилнитрата (0,32 мл) [(ацетилнитрат готовили отдельно, медленно добавляя дымящую HNO3 (0.005 мл, 2,64 ммоль) по каплям в уксусный ангидрид (0.27 мл) при -15°С в течение 30 мин в атмосфере аргона (Примечание: температура не должна превышать 0°С))] при -15°С в течение 30 мин в атмосфере аргона. Реакционную смесь перемешивали при температуре от -15 до 0°С в течение 30 мин. После завершения реакции (контроль с помощью ТСХ), реакцию останавливали добавлением насыщенного раствора NaHCO3 (10 мл) при 0°С и экстрагировали дихлорметаном (3 X 20 мл). Объединенные органические слои промывали насыщенным солевым раствором (30 мл), сушили над безводным Na2SO4 и упаривали при пониженном давлении. Полученные неочищенные продукты очищали препаративной ВЭЖХ (колонка: KROMASIL С18 (150 × 25) мм, 10 мкм; подвижная фаза А: 10 мМ бикарбонат аммония (водн.); подвижная фаза В: ацетонитрил, метод Т/%В=0/40, 1/40, 10/80, 10,5/100, 12/100, 12,5/40, 15/40; Поток: 25 мл/мл; Растворимость: ACN + вода + ТГФ). Чистые фракции лиофилизировали с получением следующих соединений:
3-(1-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d|пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)-3-гидроксипентан-1,5-диилдинитрат (1п)
и
2-(1-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)-2-гидроксипропан-1,3-диилдинитрат (1р).
ПРИМЕР 108
Де-нитрование динитрата, полученного из амина 83 и сульфонилхлорида 4, осуществляли путем частичного гидролиза с использованием йодида натрия в ацетоне при комнатной температуре. Два энантиомера могут быть разделены на хиральной колонке ВЭЖХ:
2-гидрокси-1-(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрат изомер а (3м)
и
2-гидрокси-1-(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрат изомер б (3н).
ПРИМЕР 109
Анализ ФДЭ5
Цель: оценка действия соединений по настоящему изобретению на активность фосфодиэстеразы-5 человека, количественно определяемое измерением формирования 5'ГМФ из цГМФ с использованием фермента ФДЭ5, выделенного из тромбоцитов человека. Последнее выполняли в соответствии с методом, описанным в Masaaki I, Nishikawa М, Fujioka М, Miyahara М, Isaka N, Shiku H, Nakano T, Cell Signal (1996), 8(8):575-581.
Описание опыта: анализируемое соединение, то есть соединение по настоящему изобретению, эталонное соединение или воду (контроль), добавляли в буфер, содержащий 40 мМ Трис/HCl (рН 7,8), 3 мМ MgCl2, 1,4 мМ ДТТ, 0,21% БСА, 200 мМ NH4Cl, 1 мкМ цГМФ и 0,1 мкКи [3Н]цГМФ. После этого реакцию инициировали добавлением указанного фермента и смесь инкубировали в течение 60 мин при 22°С.
Для базовых контрольных измерений указанный фермент исключали из реакционной смеси. После инкубации, добавляли гранулы сцинтилляционного анализа сближения (SPA). Через 20 мин при 22°С при встряхивании количество [3Н]5'ГМФ количественно определяли с помощью сцинтилляционного счетчика (Topcount, Packard).
Результаты, представленные в Таблице 1, выражены в процентах ингибирования активности контрольного фермента. Стандартным ингибирующим эталонным соединением является дипиридамол, который анализировали в каждом эксперименте при нескольких концентрациях, чтобы получить кривую ингибирования, из которой рассчитывали его значение IC50.
Как показано в Таблице 1, соединения по настоящему изобретению являются сильнодействующими и селективными ингибиторами цГМФ-специфической человеческой ФДЭ5.
ПРИМЕР 110
Анализ активности фосфодиэстеразы-5
Ингибирование рекомбинантной человеческой (рч) ФДЭ5А анализируемыми соединениями измеряли с помощью радиометрического анализа, основанного на технологии сцинтилляционного анализа сближения (SPA). Субстрат [3Н]цГМФ/цГМФ гидролизуется до [3Н]5'ГМФ/5'ГМФ в зависимости от активности рчФДЭ5А. Получающийся [3Н] 5'ГМФ/5'ГМФ, но не [3Н]цГМФ/цГМФ, связывается с гранулами силиката иттрия SPA в присутствии Zn++, что вызывает испускание света сцинтиллятором внутри гранулы, которое регистрируется β-счетчиком. Анализ осуществляли на 96-луночном планшете.
Анализ проводили в 20 мМ Трис HCl рН 7,4, 5 мМ MgCl2, 0,5 мкМ субстрата цГМФ/[3Н]цГМФ (около 60000 dpm/ячейка) с рчФДЭ5А1 (меченная GST, SIGMA Е9034), добавленной в количестве, не превышающем 20% гидролиза цГМФ в пределах 20 мин в Трис 20 мМ рН 7,4 с добавлением 0,01% бычьего сывороточного альбумина (БСА) в присутствии анализируемых соединений или носителя (0,1% ДМСО). Конечный объем анализа составлял 100 мкл, и реакцию проводили в течение 20 минут при 37°С.
Гидролиз [3Н]цГМФ/цГМФ, осуществляемый рчФДЭ5А прекращали добавлением гранул SPA при 50 мкл/ячейка (Perkin Elmer, RPNQ0024), предварительно разведенных в воде в соответствии с инструкциями производителя и дополненных 3-изобутил-1-метилксантином (1 мМ). Гранулам давали отстояться в течение не менее 30 мин перед измерением с помощью Wallac Microbeta 2 (Perkin Elmer).
Как правило, тестируемые соединения добавляли в семи различных концентрациях от 1 пМ до 1 мкМ с логарифмическим шагом. Рассчитывали процент значения ингибирования по сравнению с контролем носителя (0,1% ДМСО) и значения IC50 с использованием программного обеспечения GraphPad Prism 7.03. Результаты (IC50) приведены как среднее значение по меньшей мере от двух независимых экспериментов, каждый из которых выполняли три раза.
* Значения IC50, измеренные с помощью анализа, описанного в Примере 110, все другие значения, определены с помощью анализа, описанного в Примере 109.
ПРИМЕР 111
Измерения связывания с белками плазмы человека
Аликвоту 200 мкл плазмы человека, содержащую анализируемое соединение, помещали в ячейку-донор (красная камера) вставки. 350 мкл ФСБ добавляли в ячейку-применик (белая камера) вставки.
Образцы уравновешивали матрицей, используя противоположную матрицу (25 мкл образца плазма/буфер выравнивали с 25 мкл контроля буфер/плазма). Выровненные матрицей образцы осаждали с помощью 200 мкл ацетонитрила, содержащего внутренний стандарт. Образцы перемешивали вихревым способом при 1000 об/мин в течение 5 мин и центрифугировали при 4000 об/мин в течение 10 мин. Надосадочную жидкость отделяли, разбавляли водой в 2 раза и анализировали с помощью LC-MS/MS. Контрольные образцы Т0 обрабатывали сразу после приготовления рабочих растворов запаса плазмы. Указанные образцы служили в качестве меры для расчета процента обратного выделения тестируемых соединений.
ПРИМЕР 112
Измерения цГМФ в клетках гладких мышц легочной артерии человека (hPASMC)
Клетки гладких мышц легочной артерии человека (hPASMC) приобретали у Clonetics™ Lonza (Lonza, кодовый номер СС-2581) и культивировали в среде для выращивания гладких мышц Clonetics™ (Clonetics™ SmGM™-2 с добавками фактора роста BulletKit™ (Lonza, кодовый номер СС-3182) при 37°С в 5% СО2. Культуральную среду заменяли каждые 48 ч. Клетки выращивали в культуральных планшетах размера 75 см2.
За 48 ч до экспериментов, клетки трипсинизировали (набор Trypsin One ReagentPack™ (СС-5034), Lonza) и высевали в 96-луночные планшеты, предварительно покрытые коллагеном I, в количестве 10000 клеток на лунку. За 24 ч до экспериментов, культуральную среду заменяли средой с пониженным содержанием сыворотки (0,5% ЭБС). Непосредственно перед экспериментами, среду заменяли и инкубировали hPASMC в присутствии соединений по изобретению 1б и 1и (в концентрациях 1×10-13 М (0,1 пМ) - 1×10-6 М (1 мкМ)) или носителя (0,1% ДМСО) в течение 30 мин.
Измерения внутриклеточного цГМФ проводили с использованием Amersham cGMP EIA System (GE Healthcare, RPN226), следуя инструкциям производителя. Анализ имеет чувствительность 2 фмоль цГМФ на лунку. В течение короткого периода, инкубацию прекращали, добавляя лизирующий буфер Amersham 1, и клетки оставляли на 10 мин при перемешивании для обеспечения полного лизиса. Затем цГМФ в образцах ацетилировали с использованием триэтиламина и уксусного ангидрида и определяли с помощью конкурентного ELISA. Указанный ELISA основан на конкуренции между ацетилированным цГМФ в лизатах клеточной культуры и меченным пероксидазой конъюгатом цГМФ за ограниченные сайты связывания в специфической для цГМФ антисыворотке, иммобилизованной на предварительно покрытом 96-луночном микротитрационном планшете. цГМФ определяли на основе стандартной кривой. Результаты выражали как фмоль цГМФ в 104 клетках в виде среднего значения +/- SE из 3 независимых экспериментов с тремя повторами (Фиг. 3). Неожиданным образом, соединения 1б и 1и по настоящему изобретению продемонстрировали значительно более высокую эффективность в повышении уровня цГМФ по сравнению с эталонным ингибитором силденафилом, мироденафилом или соединением 5, которые являются гораздо более сильными ингибиторами ФДЭ5 (см. Таблицу 1, Пример 110), по сравнению с соединениями по настоящему изобретению 1б и 1и.
Claims (106)
1. Соединение формулы I
или его фармацевтически приемлемая соль, где
по меньшей мере один из R2, R4 или R5, каждый независимо, включает по меньшей мере один фрагмент ONO2 или ONO;
R1 представляет собой C1-C3-алкил, необязательно замещенный F;
R2 представляет собой H, C1-C3-алкил, необязательно замещенный OH, ONO, ONO2; C(O)OH, C(O)OC1-C3-алкил, CHO, CN, C(O)N(R6)OR7, CR8=N-OR9, CR8=NR12, CR8=N-ONO2, C1-C3-алкокси; C1-C3-алкилен-Y, причем Y представляет собой ONO, ONO2, C(O)OH, C(O)OC1-C3-алкил, CHO, CN, OH, OC(O)H, OC(O)-C1-C3-алкил, C(O)N(R6)OR7, OC1-C3-алкилен-C(O)OH, OC1-C3-алкилен-C(O)OC1-C3-алкил, OC1-C3-алкилен-C(O)N(R6)OR7, S(O0-2)C1-C3-алкил, CR8=N-OR9, CR8=NR12 или CR8=N-ONO2;
R3 представляет собой C1-C4-алкил, необязательно замещенный F, C1-C3-алкокси, C3-циклоалкилом;
R4 представляет собой C1-C6-алкил, необязательно замещенный C3-C6-циклоалкилом, C1-C6-алкокси, F, ONO, ONO2;
R5 представляет собой SO2NR13R14;
R6 представляет собой H или C1-C3-алкил;
R7 представляет собой H, C1-C3-алкил, C1-C3-алкокси;
R8 представляет собой H, CH3 или C2H5;
R9 представляет собой H, C1-C3-алкил, необязательно замещенный OH, ONO, ONO2, CN, COOH, COOC1-C3-алкилом, C1-C3-алкокси, OC(O)H, OC(O)-C1-C3-алкилом, C(O)N(R6)OR7, OC1-C3-алкилен-C(O)OH;
R12 представляет собой C1-C3-алкил, необязательно замещенный OH, ONO, ONO2, CN, COOH, COOC1-C3-алкилом, C1-C3-алкокси, OC(O)H, OC(O)-C1-C3-алкилом, C(O)N(R6)OR7, OC1-C3-алкилен-C(O)OH;
R13 и R14 вместе с атомом азота, к которому они присоединены, образуют гетероциклическое кольцо, причем указанное гетероциклическое кольцо выбрано из пиперидина и пиперазина, причем указанное гетероциклическое кольцо необязательно замещено R15;
R15 представляет собой C1-C6-алкил, необязательно замещенный галогеном, OH, ONO, ONO2, C1-C3-алкокси, C1-C3-галогеналкокси, COOR16, NR17R18, C=NR19;
R16 представляет собой H или C1-C4-алкил, необязательно замещенный F, OH, ONO, ONO2, NR17R18;
R17 и R18, каждый независимо, представляют собой H или C1-C4-алкил, необязательно замещенный ONO, ONO2;
R19 представляет собой C1-C4-алкил, необязательно замещенный F, ONO, ONO2; C3-C6-циклоалкил.
2. Соединение по п. 1, отличающееся тем, что R1 представляет собой C1-C3-алкил.
3. Соединение по п. 1 или 2, отличающееся тем, что R2 представляет собой H, C1-C3-алкил, необязательно замещенный OH, ONO, ONO2; C(O)OH, C(O)OC1-C3-алкил, CHO, CN, CR8=N-OR9, CR8=NR12, CR8=N-ONO2, C1-C3-алкокси; C1-C3-алкилен-Y, причем Y представляет собой ONO, ONO2, CHO, CN, OH, OC(O)H, OC1-C3-алкилен-C(O)OH, OC1-C3-алкилен-C(O)N(R6)OR7, OC(O)-C1-C3-алкил, C(O)OC1-C3-алкил, C(O)N(R6)OR7, CR8=N-OR9, CR8=NR12 или CR8=N-ONO2, причем предпочтительно указанные R6 и R8, каждый независимо, представляют собой H или CH3.
4. Соединение по любому из пп. 1-3, отличающееся тем, что R3 представляет собой C1-C4-алкил.
5. Соединение по любому из пп. 1-4, отличающееся тем, что R4 представляет собой C1-C4-алкил, необязательно замещенный C1-C3-алкокси, F, ONO, ONO2.
6. Соединение по любому из пп. 1-5, отличающееся тем, что R13 и R14 вместе с атомом азота, к которому они присоединены, образуют гетероциклическое кольцо, причем предпочтительно указанное гетероциклическое кольцо выбрано из пиперидина и пиперазина, и причем указанное гетероциклическое кольцо замещено R15; причем R15 представляет собой C1-C4-алкил, необязательно замещенный галогеном, OH, ONO, ONO2, C1-C3-алкокси, C1-C3-галогеналкокси, COOR16, NR17R18, C=NR19; и причем
R16 представляет собой H или C1-C4-алкил, необязательно замещенный F, OH, ONO, ONO2;
R17 и R18, каждый независимо, представляют собой H или C1-C4-алкил, необязательно замещенный ONO, ONO2;
R19 представляет собой C1-C4-алкил, необязательно замещенный F, ONO, ONO2.
7. Соединение по любому из пп. 1-5, отличающееся тем, что указанное соединение формулы I представляет собой соединение формулы I* или его фармацевтически приемлемую соль, где по меньшей мере один из R2, R4 или R20, каждый независимо, включает по меньшей мере один фрагмент ONO2 или ONO;
где R1, R2, R3 и R4 определены в пп. 2-5; и где
X представляет собой CR21 или N;
R20 представляет собой C1-C4-алкил, необязательно замещенный галогеном, OH, ONO, ONO2, C1-C3-алкокси, C1-C3-галогеналкокси, COOR25, NR26R27, C=NR28;
R21 представляет собой H или C1-C4-алкил, необязательно замещенный галогеном, OH, ONO, ONO2, C1-C3-алкокси, C1-C3-галогеналкокси, COOR25, NR26R27, C=NR28;
R25 представляет собой H или C1-C4-алкил, необязательно замещенный F, OH, ONO, ONO2;
R26 и R27, каждый независимо, представляют собой H или C1-C4-алкил, необязательно замещенный ONO, ONO2;
R28 представляет собой C1-C4-алкил, необязательно замещенный F, ONO, ONO2.
8. Соединение по п. 7, отличающееся тем, что
R1 представляет собой C1-C3-алкил;
R2 представляет собой H, C1-C3-алкил, необязательно замещенный OH, ONO, ONO2; CHO, CN, CR8=N-OR9, C1-C3-алкокси; C1-C3-алкилен-Y, причем Y представляет собой ONO, ONO2, CHO, CN, OH, OC(O)H, C(O)OC1-C3-алкил, CR8=N-OR9, или CR8=N-ONO2, причем R6 и R8, каждый независимо, представляют собой H или CH3; R9 представляет собой H, C1-C3-алкил, необязательно замещенный OH, ONO, ONO2, CN, COOH, C1-C3-алкокси, OC(O)H, OC(O)-C1-C3-алкилом;
R3 представляет собой C1-C4-алкил;
R4 представляет собой C1-C4-алкил, необязательно замещенный C1-C3-алкокси, F, ONO, ONO2;
R20 представляет собой C1-C4-алкил, необязательно замещенный галогеном, OH, ONO, ONO2, C1-C3-алкокси, COOR25, NR26R27;
R21 представляет собой H или C1-C4-алкил, необязательно замещенный галогеном, OH, ONO, ONO2, C1-C3-алкокси, COOR25, NR26R27;
где R25 представляет собой H или C1-C4-алкил, необязательно замещенный OH, ONO, ONO2;
R26 и R27, каждый независимо, представляют собой H или C1-C4-алкил, необязательно замещенный ONO, ONO2.
9. Соединение по п. 7, отличающееся тем, что
R1 представляет собой C1-C2-алкил;
R2 представляет собой H, C1-C3-алкил, необязательно замещенный OH, ONO, ONO2; CHO, CR8=N-OR9, C1-C3-алкокси; C1-C3-алкилен-Y, причем Y представляет ONO, ONO2, CN или CR8=N-OR9, причем R8 представляет собой H или CH3; R9 представляет собой H, C1-C3-алкил, необязательно замещенный OH, ONO, ONO2;
R3 представляет собой C2-C3-алкил;
R4 представляет собой C2-C3-алкил, необязательно замещенный ONO, ONO2;
R20 представляет собой C1-C3-алкил, замещенный одним, двумя или тремя заместителями, выбранными из OH, ONO и ONO2;
R21 представляет собой H или C1-C3-алкил, замещенный одним или двумя заместителями, выбранными из OH, ONO и ONO2.
10. Соединение по любому из пп. 1-5, отличающееся тем, что указанное соединение формулы I представляет собой соединение формулы II** или его фармацевтически приемлемую соль, где по меньшей мере один из R2, R4, R22, R23 или R24, каждый независимо, включает по меньшей мере один фрагмент ONO2 или ONO;
где R1, R2, R3 и R4 определены в пп. 2-9; и где
R22 представляет собой H или C1-C4-алкил, необязательно замещенный галогеном, OH, ONO, ONO2, C1-C3-алкокси, C1-C3-галогеналкокси, COOR25, NR26R27, C=NR28;
R23 и R24, каждый независимо, представляют собой C1-C4-алкил, необязательно замещенный галогеном, OH, ONO, ONO2, C1-C3-алкокси, C1-C3-галогеналкокси, COOR25, NR26R27, C=NR28;
R25 представляет собой H или C1-C4-алкил, необязательно замещенный F, OH, ONO, ONO2;
R26 и R27, каждый независимо, представляют собой H или C1-C4-алкил, необязательно замещенный ONO, ONO2;
R28 представляет собой C1-C4-алкил, необязательно замещенный F, ONO, ONO2.
11. Соединение по п. 10, отличающееся тем, что
R22 представляет собой C1-C2-алкил, предпочтительно метил;
R23 и R24, каждый независимо, представляют собой C1-C3-алкил, замещенный OH, ONO, ONO2, причем предпочтительно R23 и R24, каждый независимо, представляют собой C1-C3-алкил, замещенный ONO, ONO2.
12. Соединение по п. 1, отличающееся тем, что указанное соединение выбрано из
(Е)-2-(4-(3-(5-этил-6-((гидроксиимино)метил)-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)этилнитрат (1а);
2-(1-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрат (1б);
(Е)-2-(1-((3-(5-этил-6-((гидроксиимино)метил)-4-оксо-7-пропил-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрат (1в);
3-(1-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)пропилнитрат (1г);
(Е)-3-(1-((3-(5-этил-6-((гидроксиимино)метил)-4-оксо-7-пропил-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)пропилнитрат (1д);
2-(4-((3-(5-этил-6-формил-4-оксо-7-пропил-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)этилнитрат (1е);
2-(1-((3-(5-этил-6-формил-4-оксо-7-пропил-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрат (1ж);
3-(1-((3-(5-этил-6-формил-4-оксо-7-пропил-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)пропилнитрат (1з);
2-(4-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)этилнитрат (1и);
(R)-1-(1-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этан-1,2-диилдинитрат (1к);
(S)-1-(1-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этан-1,2-диилдинитрат (1л);
((2R,6S)-4-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)-1-метилпиперазин-2,6-диил)бис(этан-2,1-диил)динитрат (1м);
(1-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4,4-диил)бис(этан-2,1-диил)динитрат (1н);
((2S,6S)-4-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)-1-метилпиперазин-2,6-диил)бис(этан-2,1-диил)динитрат (1о);
3-(1-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)-3-гидроксипентан-1,5-диилдинитрат (1п);
2-(1-((3-(5-этил-4-оксо-7-пропил-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)-2-гидроксипропан-1,3-диилдинитрат (1р);
(Е)-2-(1-((4-этокси-3-(6-((гидроксиимино)метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперидин-4-ил)этилнитрат (2а);
3-(1-((4-этокси-3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперидин-4-ил)пропилнитрат (2б);
2-(1-((4-этокси-3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперидин-4-ил)этилнитрат (2в);
2-(4-((4-этокси-3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперазин-1-ил)этилнитрат (2г);
2-(1-((4-этокси-3-(6-формил-5-метил-4-оксо-7-пропил-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперидин-4-ил)этилнитрат (2д);
(Е)-3-(4-((4-этокси-3-(6-((гидроксиимино)метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперазин-1-ил)пропилнитрат (2е);
(Е)-2-(4-((4-этокси-3-(6-((гидроксиимино)-метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-2-ил)фенил)сульфонил)пиперазин-1-ил)этилнитрат (2ж);
2-(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрат (3а);
2-(4-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)этилнитрат (3б);
(Е)-2-(1-((3-(6-((гидроксиимино)метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрат (3в);
3-(4-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)пропилнитрат (3г);
(Е)-2-(4-((3-(6-((гидроксиимино)метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)этилнитрат (3д);
(Е)-3-(4-((3-(6-((гидроксиимино)метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперазин-1-ил)пропилнитрат (3е);
(R)-1-(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этан-1,2-диилдинитрат (3ж);
(S)-1-(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этан-1,2-диилдинитрат (3з);
(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4,4-диил)бис(метилен)динитрат (3и);
(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)метилнитрат (3к);
(R)-2-гидрокси-2-(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрат (3л);
2-гидрокси-1-(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрат изомер а (3м);
2-гидрокси-1-(1-((3-(5-метил-4-оксо-7-пропил-4,5-дигидро-3Н-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрат изомер б (3н);
(R,E)-1-(1-((3-(6-((гидроксиимино)метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этан-1,2-диилдинитрат (3o);
(S,E)-1-(1-((3-(6-((гидроксиимино)метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этан-1,2-диилдинитрат (3п); и
(R,E)-2-гидрокси-2-(1-((3-(6-((гидроксиимино)метил)-5-метил-4-оксо-7-пропил-4,5-дигидро-3H-пирроло[3,2-d]пиримидин-2-ил)-4-пропоксифенил)сульфонил)пиперидин-4-ил)этилнитрат (3р).
13. Фармацевтическая композиция для ингибирования ФДЭ5, содержащая эффективное количество соединения формулы I по любому из пп. 1-12 или его фармацевтически приемлемую соль и фармацевтически приемлемый наполнитель, вспомогательное вещество или носитель.
14. Соединение формулы I по любому из пп. 1-12 или фармацевтическая композиция по п. 13 для применения в способе лечения или предотвращения заболевания, облегчаемого ингибированием ФДЭ5, у человека или у млекопитающего, не являющегося человеком, предпочтительно у человека, где предпочтительно указанное заболевание выбрано из заживающих ран, хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, болезни Рейно, эректильной дисфункции у мужчин, приапизма, половой дисфункции у женщин, выпадения волос, старения кожи, старения сосудов, гипертензии лёгочной артерии; ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи, стабильной, нестабильной и вариантной (Принцметала) стенокардии; гипертензии, легочной гипертензии, хронической обструктивной болезни легких, застойной сердечной недостаточности, почечной недостаточности, атеросклероза, состояния пониженной проходимости кровеносных сосудов, заболевания периферических сосудов, сосудистых расстройств, системного склероза (SSc), склеродермии, локализованной склеродермии, воспалительных заболеваний, инсульта, бронхита, хронической астмы, аллергической астмы, аллергического ринита, диабетической невропатии, идиопатического легочного фиброза (ИЛФ), болезни Пейрони, глаукомы или заболевания, характеризующегося нарушениями моторики кишечника, такого как синдром раздраженного кишечника, фиброза печени, болезни Альцгеймера и хронической сердечной недостаточности.
15. Соединение формулы I по любому из пп. 1-12 или фармацевтическая композиция по п. 13 для применения в способе лечения или предотвращения заболевания у человека или у млекопитающего, не являющегося человеком, предпочтительно у человека, где указанное заболевание выбрано из заживающих ран, хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, болезни Рейно, эректильной дисфункции у мужчин, приапизма, половой дисфункции у женщин, выпадения волос, старения кожи, старения сосудов, гипертензии лёгочной артерии; ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи, стабильной, нестабильной и вариантной (Принцметала) стенокардии; гипертензии, легочной гипертензии, хронической обструктивной болезни легких, застойной сердечной недостаточности, почечной недостаточности, атеросклероза, состояния пониженной проходимости кровеносных сосудов, заболевания периферических сосудов, сосудистых расстройств, системного склероза (SSc), склеродермии, локализованной склеродермии, воспалительных заболеваний, инсульта, бронхита, хронической астмы, аллергической астмы, аллергического ринита, диабетической невропатии, идиопатического легочного фиброза (ИЛФ), болезни Пейрони, глаукомы или заболевания, характеризующегося нарушениями моторики кишечника, такого как синдром раздраженного кишечника, фиброза печени, болезни Альцгеймера и хронической сердечной недостаточности, где предпочтительно указанное заболевание выбрано из заживающих ран, хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, диабетической невропатии, заболевания периферических сосудов, сосудистых расстройств, таких как болезнь Рейно, ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи, системного склероза (SSc), склеродермии, легочной артериальной гипертензии (ЛАГ), хронической тромбоэмболической лёгочной гипертензии, эректильной дисфункции у мужчин, приапизма и половой дисфункции у женщин, и где еще более предпочтительно указанное заболевание выбрано из легочной артериальной гипертензии (ЛАГ), хронической тромбоэмболической лёгочной гипертензии, эректильной дисфункции у мужчин, приапизма и половой дисфункции у женщин, ливедоидной васкулопатии, облитерирующего тромбангиита, хронической анальной трещины, фиброза кожи, заживающих ран, хронических заживающих ран, диабетической стопы, язвы при диабетической стопе, ножной язвы, диабетической невропатии и пролежневой язвы.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP17172193.9 | 2017-05-22 | ||
| EP17172193 | 2017-05-22 | ||
| PCT/EP2018/063339 WO2018215433A1 (en) | 2017-05-22 | 2018-05-22 | Novel dual mode of action soluble guanylate cyclase activators and phosphodiesterase inhibitors and uses thereof |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| RU2019133200A RU2019133200A (ru) | 2021-06-23 |
| RU2019133200A3 RU2019133200A3 (ru) | 2021-06-23 |
| RU2758373C2 true RU2758373C2 (ru) | 2021-10-28 |
Family
ID=58772403
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2019133200A RU2758373C2 (ru) | 2017-05-22 | 2018-05-22 | Новые активаторы растворимой гуанилатциклазы и ингибиторы фосфодиэстеразы с двойным механизмом действия и их применение |
Country Status (15)
| Country | Link |
|---|---|
| US (3) | US11155558B2 (ru) |
| EP (2) | EP4696376A2 (ru) |
| JP (1) | JP7182568B2 (ru) |
| KR (1) | KR102670626B1 (ru) |
| CN (2) | CN118063458A (ru) |
| AU (1) | AU2018274599B9 (ru) |
| BR (1) | BR112019024300A2 (ru) |
| CA (1) | CA3060525A1 (ru) |
| IL (1) | IL269835B (ru) |
| MX (1) | MX2019013626A (ru) |
| NZ (1) | NZ758385A (ru) |
| PH (1) | PH12019550217A1 (ru) |
| RU (1) | RU2758373C2 (ru) |
| WO (1) | WO2018215433A1 (ru) |
| ZA (1) | ZA201908389B (ru) |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN112566670B (zh) | 2018-08-06 | 2024-11-12 | 尼科斯股份有限公司 | 一氧化氮释放第5型磷酸二酯酶抑制剂 |
| MX2021005892A (es) * | 2018-11-28 | 2021-06-23 | Topadur Pharma Ag | Novedosos activadores de guanilato ciclasa soluble e inhibidores de fosfodiesterasa con modo de accion dual y usos de estos. |
| KR20210132740A (ko) * | 2019-03-24 | 2021-11-04 | 주식회사 아리바이오 | 아밀로이드 베타 형성을 줄이기 위한 방법 및 이를 위한 조성물 |
| CA3166602A1 (en) | 2020-02-05 | 2021-08-12 | Nicoletta Almirante | Compositions for the treatment of glaucoma and ocular hypertension |
| WO2021245192A1 (en) | 2020-06-04 | 2021-12-09 | Topadur Pharma Ag | Novel dual mode of action soluble guanylate cyclase activators and phosphodiesterase inhibitors and uses thereof |
| KR102900330B1 (ko) * | 2020-07-16 | 2025-12-15 | 제이투에이치바이오텍 (주) | 이중 억제제 화합물 및 이들의 의약 용도 |
| JP2023547441A (ja) | 2020-11-02 | 2023-11-10 | ニコックス エス.エー. | 萎縮型加齢黄斑変性、地図状萎縮および緑内障関連神経変性の処置において使用するためのno-pde5阻害剤 |
| AU2023227111A1 (en) | 2022-03-02 | 2024-07-25 | Topadur Pharma Ag | Topical compositions and uses therof |
| KR20230129639A (ko) | 2022-03-02 | 2023-09-11 | 연세대학교 산학협력단 | 이중작용 pde5 억제제/질산유기에스터의 국소 혈류 증진을 위한 경피 투약 형태 |
| WO2025245423A1 (en) * | 2024-05-23 | 2025-11-27 | Angiocrine Bioscience, Inc. | Endothelial cells for treatment of anal fissure |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2001060825A1 (en) * | 2000-02-17 | 2001-08-23 | Sk Chemicals Co., Ltd. | Pyrrolopyrimidinone derivatives, process of preparation and use |
| US20060106019A1 (en) * | 2002-07-26 | 2006-05-18 | Greenpharma | Novel substituted pyrazolo[1,5 a]-1,3,5-triazine derivatives and their analogues, pharmaceutical compositions containing same, use thereof as medicine and methods for preparing same |
| RU2323220C2 (ru) * | 2003-06-06 | 2008-04-27 | Тяньцзинь Тесли Груп Ко., Лтд. | ПРОИЗВОДНЫЕ 2-ЗАМЕЩЕННЫХ ФЕНИЛ-5, 7-ДИГИДРОКАРБИЛ-3, 7-ДИГИДРОПИРРОЛО [2, 3-d] ПИРИМИДИН-4-ОНОВ, ИХ ПОЛУЧЕНИЕ И ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ |
| RU2555364C2 (ru) * | 2011-01-21 | 2015-07-10 | Чжецзян Дадэ Фармасьютикал Груп Ко. Лтд | Пиразолопиримидоновое соединение для лечения эректильной дисфункции |
Family Cites Families (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0941086A4 (en) * | 1996-11-01 | 2000-07-12 | Nitromed Inc | NITROSIZED AND NITROSYLATED PHOSPHODIESTERASE INHIBITING COMPOUNDS, COMPOSITIONS AND THEIR USE |
| US5958926A (en) * | 1996-11-01 | 1999-09-28 | Nitromed, Inc. | Nitrosated and nitrosylated phosphodiesterase inhibitor compounds, compositions and their uses |
| US5980898A (en) | 1996-11-14 | 1999-11-09 | The United States Of America As Represented By The U.S. Army Medical Research & Material Command | Adjuvant for transcutaneous immunization |
| IL135462A0 (en) | 1997-11-12 | 2001-05-20 | Bayer Ag | 2-phenyl substituted imidazotriazinones as phosphodiesterase inhibitors |
| HUP0101139A3 (en) | 1997-12-02 | 2003-11-28 | Powderject Vaccines Inc Madiso | Transdermal delivery of particulate vaccine compositions |
| GB9823103D0 (en) | 1998-10-23 | 1998-12-16 | Pfizer Ltd | Pharmaceutically active compounds |
| US6933304B2 (en) | 2000-06-15 | 2005-08-23 | Pharmacia Corporation | Heteroarylalkanoic acids as integrin receptor antagonists |
| US6831074B2 (en) * | 2001-03-16 | 2004-12-14 | Pfizer Inc | Pharmaceutically active compounds |
| US20020182162A1 (en) | 2002-08-07 | 2002-12-05 | Mohsen Shahinpoor | Nitric oxide (NO) donor+cGMP-PDE5 inhibitor as a topical drug for enhanced hair growth |
| WO2005026145A2 (en) | 2003-09-12 | 2005-03-24 | Warner-Lambert Company Llc | Quinolone antibacterial agents |
| TW200621257A (en) | 2004-10-20 | 2006-07-01 | Astellas Pharma Inc | Pyrimidine derivative fused with nonaromatic ring |
| CN1966506A (zh) * | 2005-11-17 | 2007-05-23 | 上海特化医药科技有限公司 | 吡唑并嘧啶酮衍生物及其制备方法和用途 |
| CA2647932C (en) * | 2006-04-04 | 2011-06-07 | Dong A Pharm. Co. Ltd. | Agent for the prevention and treatment of prostatic hyperplasia comprising pyrazolopyrimidinone compound |
| BRPI1006869A2 (pt) | 2009-01-17 | 2016-03-15 | Bayer Schering Pharma Ag | estimuladores de sgc ou ativadores da sgc em combinação com inibidores da pde5 para o tratamento de disfunção erétil |
| TWI404721B (zh) * | 2009-01-26 | 2013-08-11 | Pfizer | 胺基-雜環化合物 |
| AU2010330813B2 (en) | 2009-12-18 | 2016-04-28 | Exodos Life Sciences Limited Partnership | Methods and compositions for treating peripheral vascular disease |
-
2018
- 2018-05-22 EP EP25185630.8A patent/EP4696376A2/en active Pending
- 2018-05-22 JP JP2019564095A patent/JP7182568B2/ja active Active
- 2018-05-22 CN CN202410088269.3A patent/CN118063458A/zh active Pending
- 2018-05-22 US US16/615,283 patent/US11155558B2/en active Active
- 2018-05-22 RU RU2019133200A patent/RU2758373C2/ru active
- 2018-05-22 WO PCT/EP2018/063339 patent/WO2018215433A1/en not_active Ceased
- 2018-05-22 KR KR1020197033320A patent/KR102670626B1/ko active Active
- 2018-05-22 NZ NZ758385A patent/NZ758385A/en unknown
- 2018-05-22 EP EP18730981.0A patent/EP3630769B1/en active Active
- 2018-05-22 AU AU2018274599A patent/AU2018274599B9/en active Active
- 2018-05-22 CN CN201880031833.0A patent/CN110621676B/zh active Active
- 2018-05-22 BR BR112019024300-3A patent/BR112019024300A2/pt not_active Application Discontinuation
- 2018-05-22 MX MX2019013626A patent/MX2019013626A/es unknown
- 2018-05-22 CA CA3060525A patent/CA3060525A1/en active Pending
- 2018-05-22 IL IL269835A patent/IL269835B/en unknown
-
2019
- 2019-10-21 PH PH12019550217A patent/PH12019550217A1/en unknown
- 2019-12-17 ZA ZA201908389A patent/ZA201908389B/en unknown
-
2021
- 2021-09-16 US US17/477,122 patent/US11905293B2/en active Active
-
2023
- 2023-12-21 US US18/392,470 patent/US20240360136A1/en active Pending
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2001060825A1 (en) * | 2000-02-17 | 2001-08-23 | Sk Chemicals Co., Ltd. | Pyrrolopyrimidinone derivatives, process of preparation and use |
| US20060106019A1 (en) * | 2002-07-26 | 2006-05-18 | Greenpharma | Novel substituted pyrazolo[1,5 a]-1,3,5-triazine derivatives and their analogues, pharmaceutical compositions containing same, use thereof as medicine and methods for preparing same |
| RU2323220C2 (ru) * | 2003-06-06 | 2008-04-27 | Тяньцзинь Тесли Груп Ко., Лтд. | ПРОИЗВОДНЫЕ 2-ЗАМЕЩЕННЫХ ФЕНИЛ-5, 7-ДИГИДРОКАРБИЛ-3, 7-ДИГИДРОПИРРОЛО [2, 3-d] ПИРИМИДИН-4-ОНОВ, ИХ ПОЛУЧЕНИЕ И ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ |
| RU2555364C2 (ru) * | 2011-01-21 | 2015-07-10 | Чжецзян Дадэ Фармасьютикал Груп Ко. Лтд | Пиразолопиримидоновое соединение для лечения эректильной дисфункции |
Non-Patent Citations (1)
| Title |
|---|
| BOBBY NOSSAMAN ET AL. "Stimulators and Activators of Soluble Guanylate Cyclase: Review and Potential Therapeutic Indications", CRITICAL CARE RESEARCH AND PRACTICE, (2012.01.01), vol. 2012, стр. 1-12. * |
Also Published As
| Publication number | Publication date |
|---|---|
| KR102670626B1 (ko) | 2024-05-29 |
| NZ758385A (en) | 2025-11-28 |
| WO2018215433A1 (en) | 2018-11-29 |
| AU2018274599A1 (en) | 2019-11-14 |
| US11155558B2 (en) | 2021-10-26 |
| CN110621676B (zh) | 2024-02-09 |
| RU2019133200A (ru) | 2021-06-23 |
| EP3630769A1 (en) | 2020-04-08 |
| EP3630769C0 (en) | 2025-07-02 |
| BR112019024300A2 (pt) | 2020-06-16 |
| AU2018274599B2 (en) | 2022-03-03 |
| CN110621676A (zh) | 2019-12-27 |
| EP4696376A2 (en) | 2026-02-18 |
| MX2019013626A (es) | 2020-01-13 |
| AU2018274599B9 (en) | 2022-04-07 |
| PH12019550217A1 (en) | 2020-09-14 |
| CN118063458A (zh) | 2024-05-24 |
| KR20200010228A (ko) | 2020-01-30 |
| IL269835A (en) | 2019-11-28 |
| JP2020520945A (ja) | 2020-07-16 |
| JP7182568B2 (ja) | 2022-12-02 |
| ZA201908389B (en) | 2020-11-25 |
| IL269835B (en) | 2022-08-01 |
| EP3630769B1 (en) | 2025-07-02 |
| CA3060525A1 (en) | 2018-11-29 |
| US20240360136A1 (en) | 2024-10-31 |
| US11905293B2 (en) | 2024-02-20 |
| RU2019133200A3 (ru) | 2021-06-23 |
| US20220073529A1 (en) | 2022-03-10 |
| US20200181149A1 (en) | 2020-06-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2758373C2 (ru) | Новые активаторы растворимой гуанилатциклазы и ингибиторы фосфодиэстеразы с двойным механизмом действия и их применение | |
| US11242347B2 (en) | 2-phenyl-3,4-dihydropyrrolo[2,1-Ff] [1,2,4]triazinone derivatives as phosphodiesterase inhibitors and uses thereof | |
| JP7652691B2 (ja) | 新規の二重作用型可溶性グアニル酸シクラーゼ活性化剤およびホスホジエステラーゼ阻害剤とその使用法 | |
| EP1689752B1 (en) | Pyrazolopyrimidines | |
| HK40107610A (zh) | 可溶性鸟苷酸环化酶激活剂和磷酸二酯酶抑制剂的新型双重作用模式及其用途 | |
| RU2774861C2 (ru) | Производные 2-фенил-3,4-дигидропирроло[2,1-f][1,2,4]триазинона как ингибиторы фосфодиэстеразы и их применение | |
| CN114685472A (zh) | 多取代的尿嘧啶衍生物及其用途 | |
| HK1257071B (en) | 2-phenyl-3,4-dihydropyrrolo[2,1-f][1,2,4]triazinone derivatives as phosphodiesterase inhibitors and uses thereof |