RU2576611C2 - Способы применения производных циклического амида для лечения шизофрении - Google Patents
Способы применения производных циклического амида для лечения шизофрении Download PDFInfo
- Publication number
- RU2576611C2 RU2576611C2 RU2013107382/15A RU2013107382A RU2576611C2 RU 2576611 C2 RU2576611 C2 RU 2576611C2 RU 2013107382/15 A RU2013107382/15 A RU 2013107382/15A RU 2013107382 A RU2013107382 A RU 2013107382A RU 2576611 C2 RU2576611 C2 RU 2576611C2
- Authority
- RU
- Russia
- Prior art keywords
- schizophrenia
- compound
- symptom
- sleep
- subject
- Prior art date
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D217/00—Heterocyclic compounds containing isoquinoline or hydrogenated isoquinoline ring systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/06—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N43/00—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds
- A01N43/34—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with one nitrogen atom as the only ring hetero atom
- A01N43/40—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with one nitrogen atom as the only ring hetero atom six-membered rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/454—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. pimozide, domperidone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/20—Hypnotics; Sedatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D217/00—Heterocyclic compounds containing isoquinoline or hydrogenated isoquinoline ring systems
- C07D217/02—Heterocyclic compounds containing isoquinoline or hydrogenated isoquinoline ring systems with only hydrogen atoms or radicals containing only carbon and hydrogen atoms, directly attached to carbon atoms of the nitrogen-containing ring; Alkylene-bis-isoquinolines
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D217/00—Heterocyclic compounds containing isoquinoline or hydrogenated isoquinoline ring systems
- C07D217/22—Heterocyclic compounds containing isoquinoline or hydrogenated isoquinoline ring systems with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to carbon atoms of the nitrogen-containing ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
-
- H—ELECTRICITY
- H04—ELECTRIC COMMUNICATION TECHNIQUE
- H04L—TRANSMISSION OF DIGITAL INFORMATION, e.g. TELEGRAPHIC COMMUNICATION
- H04L5/00—Arrangements affording multiple use of the transmission path
- H04L5/0001—Arrangements for dividing the transmission path
- H04L5/0003—Two-dimensional division
- H04L5/0005—Time-frequency
- H04L5/0007—Time-frequency the frequencies being orthogonal, e.g. OFDM(A), DMT
- H04L5/001—Time-frequency the frequencies being orthogonal, e.g. OFDM(A), DMT the frequencies being arranged in component carriers
-
- H—ELECTRICITY
- H04—ELECTRIC COMMUNICATION TECHNIQUE
- H04L—TRANSMISSION OF DIGITAL INFORMATION, e.g. TELEGRAPHIC COMMUNICATION
- H04L5/00—Arrangements affording multiple use of the transmission path
- H04L5/0001—Arrangements for dividing the transmission path
- H04L5/0014—Three-dimensional division
- H04L5/0016—Time-frequency-code
-
- H—ELECTRICITY
- H04—ELECTRIC COMMUNICATION TECHNIQUE
- H04L—TRANSMISSION OF DIGITAL INFORMATION, e.g. TELEGRAPHIC COMMUNICATION
- H04L5/00—Arrangements affording multiple use of the transmission path
- H04L5/0001—Arrangements for dividing the transmission path
- H04L5/0014—Three-dimensional division
- H04L5/0016—Time-frequency-code
- H04L5/0019—Time-frequency-code in which one code is applied, as a temporal sequence, to all frequencies
-
- H—ELECTRICITY
- H04—ELECTRIC COMMUNICATION TECHNIQUE
- H04L—TRANSMISSION OF DIGITAL INFORMATION, e.g. TELEGRAPHIC COMMUNICATION
- H04L5/00—Arrangements affording multiple use of the transmission path
- H04L5/003—Arrangements for allocating sub-channels of the transmission path
- H04L5/0048—Allocation of pilot signals, i.e. of signals known to the receiver
-
- H—ELECTRICITY
- H04—ELECTRIC COMMUNICATION TECHNIQUE
- H04L—TRANSMISSION OF DIGITAL INFORMATION, e.g. TELEGRAPHIC COMMUNICATION
- H04L5/00—Arrangements affording multiple use of the transmission path
- H04L5/003—Arrangements for allocating sub-channels of the transmission path
- H04L5/0048—Allocation of pilot signals, i.e. of signals known to the receiver
- H04L5/005—Allocation of pilot signals, i.e. of signals known to the receiver of common pilots, i.e. pilots destined for multiple users or terminals
-
- H—ELECTRICITY
- H04—ELECTRIC COMMUNICATION TECHNIQUE
- H04L—TRANSMISSION OF DIGITAL INFORMATION, e.g. TELEGRAPHIC COMMUNICATION
- H04L5/00—Arrangements affording multiple use of the transmission path
- H04L5/003—Arrangements for allocating sub-channels of the transmission path
- H04L5/0053—Allocation of signaling, i.e. of overhead other than pilot signals
-
- H—ELECTRICITY
- H04—ELECTRIC COMMUNICATION TECHNIQUE
- H04W—WIRELESS COMMUNICATION NETWORKS
- H04W4/00—Services specially adapted for wireless communication networks; Facilities therefor
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Signal Processing (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Biomedical Technology (AREA)
- Epidemiology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Computer Networks & Wireless Communication (AREA)
- Psychiatry (AREA)
- Anesthesiology (AREA)
- Hospice & Palliative Care (AREA)
- Agronomy & Crop Science (AREA)
- Pest Control & Pesticides (AREA)
- Plant Pathology (AREA)
- Dentistry (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Environmental Sciences (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
Группа изобретений относится к медицине, а именно к психиатрии, и касается лечения шизофрении. Для этого вводят эффективное количество соединения
или его фармацевтически приемлемой соли. Это обеспечивает эффективное лечение симптомов шизофрении и коррекцию расстройств сна. 6 н. и 17 з.п. ф-лы, 3 пр.
Description
[0001] Психическое расстройство шизофрения значительно воздействует на здоровье и благополучие субъектов, страдающих от этого расстройства. Субъекты с шизофренией могут страдать от бесчисленных симптомов и могут требовать существенной опеки и продолжительной медикаментозной и/или поведенческой терапии, ведущей к существенным общественным и экономическим затратам, даже в отсутствие госпитализации или помещения в специальные учреждения.
[0002] Симптомы шизофрении делятся на два широких класса: позитивные симптомы и негативные симптомы.
[0003] Позитивные симптомы в основном включают ощущение чего-то в сознании, чего обычно не должно быть. Например, галлюцинации и заблуждения представляют ощущения или убеждения, которые обычно не должны испытываться. В дополнение к галлюцинациям и заблуждениям, пациенты с шизофренией зачастую имеют обозначенные нарушения в логическом процессе собственного мышления. Особенно, процессами психотического мышления характерным образом являются небрежность, неорганизованность, нелогичность или эксцентричность. Данные расстройства в мыслительном процессе часто вызывают заметные манеры поведения, которые также характеризуются неорганизованностью и эксцентричностью. Резкие расстройства памяти и мыслительного процесса, которые включают позитивные симптомы, часто являются наиболее распознаваемыми и выдающимися особенностями шизофрении.
[0004] В дополнение к позитивным симптомам, было отмечено, что пациенты с шизофренией проявляют значительный дефицит в мотивации и спонтанности. Данные симптомы относят к негативным симптомам.
[0005] В то время, как позитивные симптомы выражают присутствие чего-то, что не испытывается в нормальном состоянии, негативные симптомы отражают отсутствие намерений и поведение, которое можно было бы ожидать в других обстоятельствах и таким образом отражают уменьшение или потерю нормального функционирования или потерю или отсутствие нормального поведения. Негативные симптомы шизофрении включают, например, уплощенные или притупленные эмоции, тяжелые мысли, полное равнодушие к радостям жизни (неспособность испытывать удовольствие), отсутствие мотивации, спонтанности, и инициативы. Упрямство или непреклонность мышления означает ухудшение способности думать абстрактно. Притупление эмоций относится к общему снижению способности испытывать эмоции. Отсутствие мотивации и неспособность к началу действий представляют важную первопричину продолжительной беспомощности при шизофрении. Полное равнодушие к радостям жизни ведет к дефициту способности испытывать удовольствие и соответственно реагировать на приятные ситуации.
[0006] Позитивные симптомы, такие как галлюцинации ответственны за множество острых душевных страданий, связанных с шизофренией. Негативные симптомы несут ответственность за множество хронических и продолжительных состояний беспомощности, ассоциируемых с заболеванием. Современные методы лечения шизофрении показали ограниченную пользу в лечении негативных симптомов.
[0007] Негативные симптомы шизофрении далее могут быть подразделены на первичные и вторичные негативные симптомы. Первичные негативные симптомы не включают симптомы, которые лучше учитываются, побочные эффекты лечения, пост-психическую депрессию или деморализацию. Предпочтительнее, примеры первичных негативных симптомов включают: эмоциональную тупость (например, эмоциональную неподвижность, невосприимчивость, плохой зрительный контакт, и ограничение передвижения); потеря речи (это когда пациент проявляет скудость речи и обычно проявляет себя пациентом, дающим короткие ответы во время разговора); безволие (неспособность к инициативе и упорство в целенаправленном действии); полное равнодушие к радостям жизни (потеря интереса или способности испытывать удовольствие); дисфотическое настроение (депрессия, беспокойство и раздражение); нарушения сна (сон в дневное время, бессонница/активность в ночное время); не нормальная психомоторная деятельность (ходьба, раскачивание, апатичная неподвижность): и недостаток понимания.
[0008] Вторичные негативные симптомы, некоторые из которых случаются в сочетании с позитивными симптомами и/или побочными эффектами лечения, включают например, нарушения движения такие, как экстрапирамидальные симптомы, акатизию (неусидчивость больного с постоянным стремлением к движениям) и позднюю дискинезию (осложнение длительного приема нейролептиков) и деморализацию.
[0009] Остается необходимым определить лекарственные средства и способы применения при лечении негативных симптомов шизофрении, и более того, композиции и способы лечения, которые улучшают эффективность существующих методов лечения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0010] Сигма рецептор/связывающие участки головного мозга являются важной целью для разработки антипсихотических лекарственных средств, которые свободны от побочных эффектов традиционных антипсихотических лекарств, или имеют пониженные побочные эффекты традиционных антипсихотических лекарств, проявляющих противоборствующее воздействие на допамин D2 рецептор (см., E.g., J. M. Walker et al., Pharmacological Reviews, 42:355-402, 1990).
[0011] Сигма 1 связывающий участок характеризовали, как имеющий высокое сродство для галоперидола, ди-о-толилгуанидина (DTG) и (+)-бензоморфанов таких, как (+)-пентазоцин. Сигма 2 связывающий участок характеризуется, как имеющий высокое сродство для галоперидола и DTG, но имеющий низкое сродство для (+)-бензоморфана.
[0012] Лиганды сигма 1 могут воздействовать на желудочно-кишечный тракт. Сигма 1 участок допускает возможность промежуточного подавления мускарин-подобного ацетилхолинового рецептора/фосфоинозитидного отклика посредством сигма лигандов. Сигма 1 связующий участок находится не только в головном мозге, но и в клетках селезенки (Y. Lin et al., J. Neuroimmunol., 58:143-154, 1995), и такие сигма лиганды могут подавлять иммунную систему (H. H. Garza et al., J. Immunol., 151:4672-4680, 1993).
[0013] Сигма 2 связующий участок широко распространен в печени (A.E. Bruce et al., Neurosci. Abstr., 16:370, 1990), почках (W.D. Bowen et al., Soc. Neurosci. Abstr., 18:456), и в сердце (M. Dumont and S. Lemaire, Eur. J. Pharmacol., 209:245, 248, 1991). В головном мозге сигма 2 связующий участок находится в гипоталамусе, мозжечке, мосте продолговатого мозга и продолговатом мозге. В гипоталамусе, фронтальной доле и затылочной доле в головном мозге крыс, данный участок присутствует более широко, чем сигма 1 связующий участок. В гиппокампальной синаптосоме морской свинки имеется сигма 2 связующий участок, который выборочно метят посредством [3H] BIMU (D.W. Bonhaus et al., J. Pharmacol. Exp. Ther., 267:961-970, 1993). Связь между сигма 2 связующим участком и корой головного мозга, также как и лимбической системой поддерживает пригодность соединений, используемых для лечения психических заболеваний (D.C. Mash and C.P. Zabetian, Synapse, 12:195-205, 1992). Предполагалось, что сигма 2 связующий участок вовлечен в функции моторики, особенно дистонию; однако никаких доказательств, демонстрирующих такое воздействие, не было обнаружено на моделях приматов в отношении функциональных расстройств экстрапирамидального тракта (L.T. Malzer et al., Neuropharmacology, 31:961-967, 1992).
[0014] Галоперидол, клинически эффективный допаминэргический антипсихотический агент, показывает высокое сродство для обоих сигма подтипов 1 и 2. Однако, пониженный метаболит галоперидола, который воздействует на центральную нервную систему, имеет более высокое сродство и селективность в отношении сигма 2 рецептора, чем допамин D2 в сравнении с галоперидолом (J.C. Jaen. et al., J. Med. Chem., 36:3929-3936, 1993).
[0015] Патент США 7166617, включенный в данный документ, посредством ссылки на него, раскрывает производные циклического амида, имеющие высокое сродство в отношении сигма 2 связующего участка. Некоторые соединения, раскрытые в данном патенте, также имеют высокое сродство в отношении сигма лиганд связующего участка и низкое ингибирование константы Кi в отношении сигма 1 и/или сигма 2, также, как и селективное связывание профилей, полностью отличающихся от профилей общепринятых известных соединений. Такие соединения могут быть полезными для лечения заболеваний, которые могут подвергаться терапевтическому и/или профилактическому лечению посредством контроля нервных функций сигма лигандов. Однако в Патенте США 7166617 не были раскрыты свойства и характеристики производных лекарственных средств.
[0016] В данном изобретении, показаны соединения формулы I, как имеющие свойства, полезные для лечения шизофрении и/или одного или более симптомов шизофрении. В аспекте изобретения, соединения формулы I показаны полезными для лечения одного или более негативных симптомов шизофрении. Далее изобретение представляет способы и фармацевтические композиции для лечения различных аспектов шизофрении.
[0018] Используемый в описании термин “шизофрения” охватывает полный спектр шизофренических расстройств, известных специалистам в данной области. Данные расстройства включают, но не ограничиваются ими, следующие: кататоническую шизофрению, гебефрению, параноидную, остаточную и недифференцированную шизофрению; шизофрениформные расстройства и шизоаффективные расстройства.
[0019] Термин “рецептор”, применяемый в описании, означает мембрано-связующий тип рецептора, также как и другие связующие участки. Например, известно существование, по меньшей мере, двух подтипов сигма рецепторов, а именно сигма 1 и сигма 2, и представлена классификация сигма связующих участков (R. Quirion et al., TiPS, 13:85-86, 1992).
[0020] Термин “субъект” относится к какому-либо животному, включая млекопитающих, таких как, но не ограниченных ими, человек, мыши, крысы, другие грызуны, кролики, собаки, кошки, свиньи, коровы, овцы, лошади или обезьяны.
[0021] Термин “лечение” (и соответствующие термины “подвергать воздействию” и “излечение”) включает болеутоляющее, смягчающее, тонизирующее, и превентивное (“профилактическое”) лечение субъекта. Термин “болеутоляющее, смягчающее лечение” относится к воздействию, которое облегчает или снижает действие или степень выраженности состояния у субъекта без выздоровления. Термин “превентивное лечение” (и соответствующий термин “профилактическое лечение”) относится к воздействию, которое предотвращает возникновение болезненного состояния у субъекта. Термин “тонизирующее лечение” (“радикальное”) относится к лечению, которое останавливает прогрессирование болезни, снижает патологические проявления, или полностью устраняет болезненное состояние у субъекта. Лечение может быть осуществлено терапевтически эффективным количеством соединения, его соли или композиции, которое вызывает биологическую или медицинскую ответную реакцию в ткани, системе или у субъекта, которая ожидается субъектом, таким как исследователь, доктор, ветеринар или практикующий врач.
[0022] “PANSS” относится к Шкале Позитивного и Негативного Синдрома.
[0023] “BACS” относится к тесту Краткая оценка когнитивных функций у пациентов с шизофренией.
[0024] “HAMD” относится к Шкале Гамильтона для Оценки Депрессии.
[0025] “HAMA” относится к Шкале Гамильтона для Оценки Выраженности Тревоги.
[0026] “ADAS COG” относится к Шкале Оценки Болезни Альцгеймера - когнитивная подвижная шкала и тест.
[0027] “MADRS” относится к Шкале Оценки Депрессии Монтгомери-Асберга.
[0028] “PSQI” относится к Питтсбургскому Индексу Качества Сна.
[0029] В одном аспекте данного изобретения, было показано, что соединения формулы I имеют свойства, полезные для лечения шизофрении и/или одного или более симптомов шизофрении. В аспекте изобретения, соединения формулы I полезны для лечения одного или более негативных симптомов шизофрении. В другом аспекте изобретения, соединения формулы I полезны для лечения одного или более негативных симптомов шизофрении, при этом, не затрагивая один или более позитивных симптомов шизофрении. В другом аспекте изобретения, соединения формулы I полезны для лечения одного или более негативных симптомов шизофрении, при этом также оказывая воздействие на один или более позитивных симптомов шизофрении. В другом аспекте изобретения, соединения формулы I полезны для лечения одного или более негативных симптомов шизофрении, при этом также оказывая воздействие на один или более общих симптомов шизофрении. В еще одном аспекте изобретения, соединения формулы I полезны для лечения одного или более позитивных симптомов шизофрении.
[0030] В другом аспекте изобретения, соединения формулы I полезны для укрепляющего лечения шизофрении у субъекта, получающего в данный момент одно или более соединений для лечения шизофрении. В еще одном аспекте изобретения, соединения формулы 1 являются полезными для лечения шизофрении в сочетании с одним или более дополнительными антипсихотическими соединениями. В еще одном аспекте изобретения, соединения формулы I полезны для лечения шизофрении в сочетании с одним или более дополнительными антипсихотическими соединениями, путем уменьшения терапевтически эффективной дозировки одного или более дополнительных антипсихотических соединений. В еще одном аспекте изобретения, соединения формулы полезны для лечения шизофрении в сочетании с одним или более дополнительными антипсихотическими соединениями, путем уменьшения терапевтически эффективной дозировки одного или более дополнительных антипсихотических соединений, в котором также описывается дозировка соединений формулы I.
[0031] В аспекте изобретения, соединения формулы I полезны для укрепляющего лечения шизофрении у субъекта, получающего в данный момент одно или более соединений для лечения шизофрении, путем воздействия на один или более негативных симптомов шизофрении. В воплощении изобретения, соединения формулы I полезны для лечения шизофрении в сочетании с одним или более дополнительными антипсихотическими соединениями, путем улучшения, по меньшей мере, одного аспекта и/или параметра сна у субъекта.
[0032] В воплощении изобретения, соединение формулы I включает соединение, изложенное в формуле II:
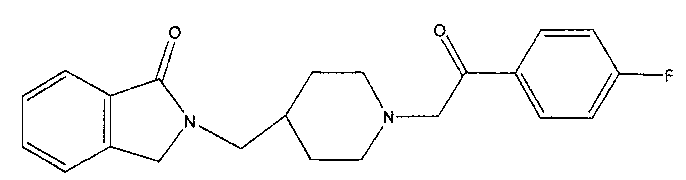
[0034] 2-[[1-[2-(4-Фторфенил)-2-оксоэтил]пиперидин-4-ил]метил]изоиндолин-1-он.
[0035] В другом воплощении изобретения, соединение формулы I включает соединение, изложенное в формуле III:
[0037] В одном воплощении изобретения, соединение формулы III имеет свойства и/или активность, аналогичные для соединения формулы II.
[0038] В аспекте изобретения, представленное соединение формулы I обладает рецептор-связывающим профилем, демонстрирующим избирательное связывание для сигма 2 рецепторов, 5-НТ2А рецепторов и α1 адренергических рецепторов. В другом аспекте изобретения, соединение формулы I обладает рецептор-связывающим профилем, включающим избирательное сродство для сигма 2 рецепторов, демонстрирующим при этом небольшое сродство или не имеет его вовсе для сигма I рецепторов. В еще одном аспекте изобретения, соединение формулы I обладает рецептор-связывающим профилем, включающим предпочтительное сродство для сигма 2 рецепторов, чем для сигма I рецепторов. Однако должно быть понятно, что некоторые соединения формулы I могут не иметь избирательного сродства для той же группы рецепторов, и в некоторых отдельных случаях могут демонстрировать избирательное связывание для одного или более различных рецепторов, включающих меньше, чем все сигма 2, 5-НТ2А, и α1 адренергических рецепторов. В другом аспекте изобретения, представленные соединения могут иметь небольшое сродство или не иметь вовсе для допаминергических, мускариновых, холинергических или гистаминергических рецепторов, и могут иметь различное сродство для любых комбинаций данных рецепторов. В одном воплощении изобретения, соединение формулы II имеет небольшое сродство или не имеет вовсе для допаминергических, мускариновых, холинергических или гистаминергических рецепторов.
[0039] В одном аспекте изобретения, соединение формулы может иметь рецептор-связывающий профиль с величиной Кi менее, чем 5 нмоль/л, менее чем 10 нмоль/л, менее чем 15 нмоль/л, менее чем 20 нмоль/л, менее чем 25 нмоль/л, или менее чем 50 нмоль/л для 5-НТ2 рецептора; величиной Кi менее, чем 10 нмоль/л, менее чем 15 нмоль/л, менее чем 20 нмоль/л, менее чем 25 нмоль/л, или менее чем 30 нмоль/л для α1 адренергических рецепторов; и величиной Кi менее чем 5 нмоль/л, менее чем 10 нмоль/л, менее чем 15 нмоль/л, менее чем 20 нмоль/л, менее чем 25 нмоль/л для сигма 2 рецептора или любого их сочетания. Как будет понятно специалистам в данной области, может быть различие в связующем сродстве для соединений формулы I при проведении исследований в отношении одних и тех же рецепторов на различных организмах и видах.
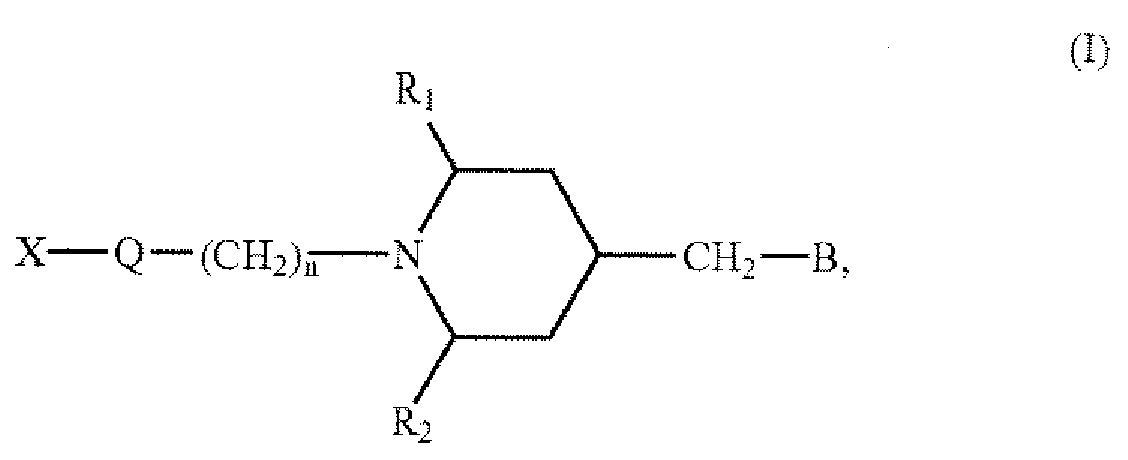
[0040] В воплощении изобретения предоставляется способ лечения шизофрении у субъекта, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли, гидрата или сольвата, где Х представляет собой алкильную группу, циклоалкил-замещенную алкильную группу, арил-замещенную алкильную группу, арил-замещенную алкенильную группу, арил-замещенную алкинильную группу, моноциклическую или полициклическую циклоалкильную группу, которая может быть замещена алкильной группой, арильной группой, гетероциклической группой, или замещенную или незамещенную амино группу; Q представляет собой группу, включающую --СО--, --О--, --S--, --CH(OR7)--, --С(=CH2)-- или --С(=NR8)--, где R7 представляет собой атом водорода, алкильную группу, гидроксиалкильную группу или ацильную группу, а R8 представляет собой гидроксильную группу, алкоксильную группу, аралкилоксигруппу, ацилоксигруппу, ациламиногруппу или алкоксикарбониламиногруппу; n представляет собой целое число от 0 до 5; R1 и R2 каждый независимо представляет атом водорода или алкильную группу.
[0041] В формуле I, В представляет собой следующие группы:
[0043] где R3, R4, R5 и R6 каждый независимо представляет собой заместитель, выбранный из группы, состоящей из атома водорода, атома галогена, нитрогруппы, алкильной группы, галогенированной алкильной группы, гидроксильной группы, алкоксильной группы, галогенированной алкоксильной группы и цианогруппы; а m представляет собой 1 или 2.
[0044] В аспекте изобретения, соединение формулы I не демонстрирует ингибирования цитохрома Р450 2D6 (“2D6”) и/или модуляторную активность. В другом воплощении изобретения, соединение формулы I демонстрирует минимальное ингибирование 2D6 и/или модуляторную активность, так как при этом соединение все еще считается полезным, оно не понижает в значительной степени эффективность предполагаемого для использования лечения.
Негативные, позитивные, общие и ассоциируемые симптомы шизофрении
[0045] В одном воплощении изобретения, предоставляется способ лечения, по меньшей мере, одного негативного симптома шизофрении у субъекта, включая введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, как описано выше. В одном воплощении изобретения, предоставляется способ, в котором соединением является соединение, изложенное в формуле II. В другом воплощении изобретения, предоставляется способ, в котором соединением является соединение, изложенное в формуле III.
[0046] В воплощении изобретения, предоставляется способ лечения, по меньшей мере, одного негативного симптома шизофрении у субъекта, включая введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, как описано выше, при котором, по меньшей мере, один негативный симптом подвергается лечению. В воплощении изобретения, лечению подвергается, по меньшей мере, один первичный негативный симптом. В другом воплощении изобретения, лечению подвергается, по меньшей мере, один вторичный негативный симптом. В воплощении изобретения, лечению подвергается, по меньшей мере, одно расстройство сна. В другом воплощении изобретения, у пациента улучшается, по меньшей мере, один аспект или параметр сна. В воплощении изобретения, у пациента, страдающего шизофренией, улучшается сон.
[0047] В аспекте изобретения, по меньшей мере, одно нарушение, расстройство или параметр сна ассоциируется с шизофренией. В воплощении изобретения, по меньшей мере, одно нарушение, расстройство или параметр сна является симптомом шизофрении. В другом воплощении изобретения, по меньшей мере, одно нарушение, расстройство или параметр сна не является ни позитивным, ни негативным симптомом шизофрении, но скорее, всего лишь ассоциируется с шизофренией. Данное описание предоставляет способ для лечения, по меньшей мере, одного расстройства или параметра сна независимо от того, как возникает расстройство сна или нарушается параметр сна.
[0048] В воплощении изобретения у пациента, у которого нет шизофрении, сон улучшается. В аспекте изобретения, по меньшей мере, одно расстройство или параметр сна подвергается лечению и/или улучшению состояния. В аспекте изобретения предоставляется способ улучшения, по меньшей мере, одного аспекта сна, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, как описано выше. Различные аспекты сна могут быть подвержены лечению, включая, но не ограничиваясь ими, латентный период засыпания, латентный период постоянного сна, и распределение медленноволнового сна во время периода сна, или одного или более сегментов времени периода сна. В аспекте изобретения, общая продолжительность сна уменьшается. В аспекте изобретения, индекс эффективности сна (SEI) уменьшается на 2,4%. В аспекте изобретения, увеличивается длительность пробуждения после засыпания (WASO). В аспекте изобретения, медленноволновой сон (SWS) увеличивается в первой трети времени периода сна (SPT1). В аспекте изобретения, медленноволновой сон (SWS) уменьшается в последней трети времени периода сна (SPT3).
[0049] В воплощении изобретения, предоставляется способ лечения или улучшения познавательной способности, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, как описано выше. Как будет понятно из данного описания, изменение параметров сна может улучшать познавательную способность. Посредством не ограничивающих примеров, улучшение и/или увеличение медленноволнового сна SWS улучшает познавательную способность. В аспекте изобретения, в общем, улучшается познавательная способность. В другом аспекте изобретения, один или более аспектов познавательной способности улучшается, включая среди других, улучшение памяти, исполнительно-распорядительную деятельность, словесную память и плавность речи.
[0050] В воплощении изобретения, предоставляется способ лечения или улучшения, по меньшей мере, одного аспекта или параметра сна, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, как описано выше, причем субъект подвержен шизофрении. В аспекте изобретения лечению подвергается расстройство сна.
[0051] Негативные симптомы шизофрении включают, но не ограничиваются ими, аффективную тупость (например, ослабленная эмоциональная ответная реакция, что характеризуется отсутствующим выражением лица, снижением модуляции чувствами, и коммуникативной жестикуляции), эмоциональное отчуждение (например, недостаток интереса, безучастность и недостаток аффективной ориентации к жизненным ценностям), малоконтактность (например, недостаток межличностного сочувствия, недостаток откровенности в разговоре, недостаток чувства близости или интереса, межличностное отстранение и снижение словесного и несловесного общения), пассивное/апатичное социальное отчуждение (например, ослабление интереса и инициативы в социальных взаимодействиях вследствие пассивности, апатии, вялости, или безволия; снижение межличностной сопричастности и пренебрежение повседневной жизнедеятельностью), затруднения в абстрактном мышлении (например, нарушения в использовании абстрактно-символического образа мысли, что подтверждается трудностью классификации, построения обобщений и поведением за пределами конкретного или субъективного мышления в задачах на разрешение проблемы), недостаток спонтанности и непосредственности и плавного течения беседы (например, снижение нормального хода общения, ассоциируемое с апатией, безволием, защитным поведением или расстройством познавательных способностей, снижением подвижности и продуктивности процесса словесного взаимодействия), стереотипное мышление (например, уменьшенная подвижность, спонтанность и гибкость мышления, что подтверждается жестким, многословным (или повторяющимся) или абсолютно пустым содержанием мыслей).
[0052] Другие негативные симптомы и их примеры могут быть обнаружены, например, по шкале PANSS, как инструмент применяемым клинически для оценки тяжести заболевания шизофренией. Полная шкала PANSS, может быть найдена на www<dot>tepou<dot>co<dot>nz/file/information-programme/pans.pdf (доступной с 14 июня 2010 г.).
[0053] В воплощении изобретения, предоставляется способ лечения, по меньшей мере, одного негативного симптома шизофрении у субъекта, включая введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, как описано выше, при котором, по меньшей мере, один негативный симптом подвергается лечению, а также при котором, по меньшей мере, один позитивный симптом шизофрении не подвергается лечению. В другом воплощении изобретения, предоставляется способ лечения, по меньшей мере, одного негативного симптома шизофрении у субъекта, включая введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, как описано выше, при котором, по меньшей мере, один негативный симптом подвергается лечению, и также при котором, по меньшей мере, один позитивный симптом шизофрении тоже подвергается лечению.
[0054] Позитивные симптомы шизофрении включают, но не ограничиваются ими, бред (необоснованные, нереалистичные, идиосинкразические убеждения), концептуальную дезорганизацию (например, процесс беспорядочного мышления, характеризуемый нарушением целенаправленной пошаговой последовательности, например, перегруженность речи ненужными деталями, тангенциальность мышления, разобщенность, нелогичные и неверные выводы, полная нелогичность или мыслительная заторможенность), галлюцинации (например, дословная передача или поведение, выдающее ощущения, которые не вызываются внешними раздражителями и которые могут возникнуть в аудиторно-визуальных, обонятельных или соматических сферах), гиперактивность и возбуждение (например, ускоренно-двигательное поведение, повышенная быстрота реакции или восприимчивость на стимул, сверхнастороженность, или чрезмерно капризное расположение духа), мания величия (например, преувеличенное самомнение или самоуверенность и нереалистичные убеждения в превосходстве, включая иллюзии (несбыточные мечты) в экстраординарных дарованиях и способностях, здоровья, эрудиции и познаниях, знаменитости, могуществе и моральной нравственности), мнительность (недоверчивость)/мания преследования (например, нереалистичные или преувеличенные идеи преследования, что отражается в осмотрительности, подозрительном отношении, настороженной сверхбдительности, или откровенное заблуждение, что другие означают один вред и неприятности), и враждебность (например, словесное или несловесное выражение злости и негодования, включая сарказм, пассивно-агрессивное поведение (манера говорить и делать гадости исподтишка), словесные ругательства и агрессивность). Другие позитивные симптомы и их примеры, могут быть обнаружены, например, по шкале PANSS, как указывалось выше.
[0055] В воплощении изобретения, предоставляется способ лечения, по меньшей мере, одного негативного симптома шизофрении у субъекта, включая введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, как описано выше, при котором, по меньшей мере, один негативный симптом подвергается лечению, а также при котором общий симптом шизофрении не подвергается лечению. В воплощении изобретения, предоставляется способ лечения, по меньшей мере, одного негативного симптома шизофрении у субъекта, включая введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, как описано выше, при котором, по меньшей мере, один негативный симптом подвергается лечению, и также при котором, по меньшей мере, один общий симптом шизофрении подвергается лечению.
[0056] Общие симптомы шизофрении включают, но не ограничиваются ими, обеспокоенность соматическим здоровьем (ипохондрию) (например, жалобы на здоровье или убеждение в болезни организма или нарушении функционирования), тревога (например, субъективное испытание нервозности, волнения, дурных предчувствий или беспокойства, в пределах от чрезмерного беспокойства о настоящем или будущем до ощущения паники), чувство вины (например, ощущение раскаяния или самоупрека в отношении реальных или вымышленных проступков в прошлом), напряженность (неловкость) (например, открытые физические проявления страха, беспокойства и возбуждения, такого, как скованность, дрожь, обильная потливость и возбужденное состояние), манерность (причуды) и позерство (например, неестественные движения или позы, характеризуемые неуклюжестью, напыщенностью, безалаберностью или проявлением причудливости), подавленное состояние (депрессию) (например, чувство печали, уныние, беспомощность и пессимизм), заторможенное движение (например, снижение двигательной активности, что отражается в замедлении или уменьшении двигательной и речевой деятельности, пониженная ответная реакция на стимул, и пониженный физический тонус), неконтактность (например, активный отказ подчинятся воле близкого человека, включая обследователя, персонал госпиталя или членов семьи, который может ассоциироваться с недоверием, защитным поведением, упрямством, бессмысленным сопротивлением, неприятие авторитета, враждебность или воинственность), необычный образ мыслей (например, мышление, характеризуемое странными, фантазийными или причудливыми идеями, в пределах от тех, которые маловероятны или нетипичны до тех, которые извращенные, нецелесообразные и явно абсурдные), дезориентацию (например, неосведомленность или отсутствие знаний по отношению к окружающей обстановке, включая действующих лиц, место, и время, что может быть вследствие смущения, замешательства или отчуждения), недостаток внимания (например, недостаток сосредоточенной внимательности, вызываемый плохой концентрацией, отвлечение внимания от внутренних и внешних стимулов, и затруднение в освоении, поддержании или перемещении центра внимания на новый стимул), недостаток рассудительности и проницательности (например, нарушение осознанности или понимания кого-либо своего психиатрического состояния и жизненной ситуации), нарушение волевой способности (например, нарушение в проявлении несговорчивости, жизнеобеспечении и какого-либо контроля над мыслями, поведением, движениями и речью), расстройств контроля над побуждениями (например, нарушенная регуляция и контроль действия на внутренние побуждения, приводящее к неожиданной, немодулированной, произвольной или неверной разрядке напряженности и эмоций без привязки к последствиям), озабоченность (например, поглощенность внутренними помыслами и чувствами и аутистичное отношение в ущерб ориентации в реальности и приспособленческое поведение), и активное социальное уклонение (например, пониженная социальная включенность, ассоциируемая с неуместным опасением, враждебностью или подозрительностью). Другие общие симптомы и их примеры, могут быть обнаружены, например, по шкале PANSS, как указывалось выше. Как будет понятно специалисту в данной области, шкала PANSS может быть использована для определения и/или измерения общих, позитивных и негативных симптомов шизофрении.
Лекарственные формы и дозировки
[0057] Для терапевтического введения препарата согласно данному изобретению, соединение формулы I может применяться в форме его свободного основания, но предпочтительно используется в виде фармацевтически приемлемой соли, обычно гидрохлоридной соли.
[0058] Другие соли соединения формулы I c фармацевтически приемлемыми кислотами тоже могут применяться для терапевтического введения, например, соли, полученные из функционального свободного основания и кислот, включая, но не ограничиваясь ими, пальмитиновую кислоту, бромистоводородную кислоту, фосфорную кислоту, уксусную кислоту, фумаровую кислоту, малеиновую кислоту, салициловую кислоту, лимонную кислоту, щавелевую кислоту, молочную кислоту, яблочную кислоту, метансульфоновую кислоту и пара-толуолсульфоновую кислоту.
[0059] Все сольваты и все другие физические формы соединения формулы I или его фармацевтически приемлемые производные, упомянутые выше, включая, но не ограничиваясь ими, другие кристаллические формы, аморфные и полиморфные формы, также охватываются объемом данного изобретения, и все ссылки в данном описании на соединение формулы I включают все его фармацевтически приемлемые соли, все его сольваты и другие физические формы соединения.
[0060] Для терапевтического введения, соединение формулы I или его фармацевтически приемлемая соль, например, соединение формулы II, может применяться в чистой форме, но для него предпочтительно входить в рецептуру любой подходящей фармацевтически приемлемой и эффективной композиции, которая обеспечивает эффективные уровни действия ингредиентов в теле пациента.
[0061] Предпочтительные формы включают, но не ограничиваются ими, лекарственные формы пролонгированного действия (например, кристаллизованные, эмульсии), препараты замедленного действия, подходящие для внутримышечных или подкожных инъекций, препараты с контролируемым высвобождением, включая таблетки с контролируемым высвобождением, трансдермальные терапевтические системы (например, пластырь), буккальные (щечные) формы (например, пленки, таблетки), шипучие таблетки и подкожные пастилки. В воплощении изобретения, лекарственная форма пролонгированного действия включает пальмитатные соли соединения формулы I.
[0062] В аспекте изобретения, способ введения соединения формулы I может включать титрование соединения до заранее заданного уровня. В одном воплощении изобретения, соединение применяют при нормативных уровнях (например, 2 мг дважды в день, 4 мг дважды в день, 8 мг дважды в день, 16 мг дважды в день). В одном воплощении изобретения, соединение титруют до заранее заданной дозировки (например, титруют до 16 мг дважды в день, 32 мг дважды в день, 64 мг дважды в день, и т.д.).
[0063] Введение соединения для любой цели, упомянутой в описании, в любой представленной форме или комбинации может включать введение соединения формулы I или его фармацевтически приемлемой соли в дозировке 10 нг - 1 г, 100 нг - 750 мг, 500 нг - 500 мг, 10 мкг - 200 мг, 15 мкг - 190 мг, 25 мкг - 180 мг, 50 мкг - 170 мг, 75 мкг - 160 мг, 100 мкг - 150 мг, 250 мкг - 140 мг, 400 мкг - 130 мг, между 500 мкг - 128 мг, 600 мкг - 100 мг, 750 мкг - 75 мг, 900 мкг - 50 мг, или в дозировке между 1 мг - 64 мг. Лечение шизофрении может включать введение соединения формулы I или его фармацевтически приемлемой соли в дозировке <1 г, <500 мг, <200 мг, <150 мг, <100 мг, <50 мг, <40 мг, <30 мг, <20 мг, <10 мг, <9 мг, <8 мг, <7 мг, <6 мг, <5 мг, <4 мг, <3 мг, <2 мг, <1 мг, <0,5 мг, <0,25 мг, <0,1 мг, <0,05 мг или <0,01 мг, <0,005 мг, или <0,001 мг. Дозировка может быть назначена как недельная доза, доза через день, единичная дневная доза, дважды в день, три раза в день, четыре раза в день, пять раз в день, или более многократно. В воплощении изобретения, соединение формулы I или его фармацевтически приемлемую соль вводят в дозе от 8 мг - 32 мг дважды в день.
[0064] В воплощении изобретения, соединение формулы I или его фармацевтически приемлемую соль назначают независимо от любого другого лекарственного средства.
[0065] В воплощении изобретения, соединение формулы I или его фармацевтически приемлемую соль назначают субъекту, который является эффективным метаболизатором 2D6. Как будет понятно специалисту в данной области, эффективным метаболизатором 2D6 является субъект, имеющий среднюю или больше средней метаболическую активность 2D6.
Совместное (комбинированное) введение соединений
[0066] В другом воплощении изобретения, соединение формулы I или его фармацевтически приемлемую соль вводят в сочетании с одним или более другими лекарственными средствами. Такие другие лекарственные средства могут быть назначены для отдельного или совместного введения в рецептурных формах и дозировках, известных в данной области, или альтернативно, как было представлено выше для соединения формулы I.
[0067] Соединение формулы I, например, соединение, представленное в формуле II или его фармацевтически приемлемая соль как того, так и другого, может успешным образом вводиться в сочетании, по меньшей мере, с одним нейролептическим агентом (например, типичным или нетипичным антипсихотическим агентом) для обеспечения улучшенного лечения любой комбинации негативных симптомов шизофрении, позитивных симптомов шизофрении, общих симптомов шизофрении или лечения шизофрении самой по себе. Комбинации, применение и способы лечения в изобретении могут обеспечивать преимущество в лечении пациентов, которые не оправдывают надежд на адекватную ответную реакцию или которые не поддаются другим известным методам лечения.
[0068] В воплощении изобретения, соединение формулы I может быть назначено пациенту уже подвергающемуся лечению, по меньшей мере, одним нейролептическим агентом (например, типичным или нетипичным антипсихотическим агентом), для обеспечения улучшенного лечения любой комбинации негативных симптомов шизофрении, позитивных симптомов шизофрении, общих симптомов шизофрении или шизофрении самой по себе.
[0069] Атипичные антипсихотические средства включают, но не ограничиваются ими, оланзапин, клозапин, рисперидон, палиперидон, арипиразол, кветиапин, илоперидон, зипразидон, асенапин, лурасидон, сетриндол, амисулприд, клотиапин, мосапрамин, пероспирон, сулпирид и зотепин. Типичные антипсихотические средства включают, но не ограничиваются ими, галоперидол, бенперидол, локсапин, молиндон, пимозид, тиоридазин, мезоридазин, тиотиксен, хлорпротиксен, флуфеназин, трифлуоперазин, хлорпромазин, перфеназин, прохлорперазин, дроперидол и зуклопентиксол.
[0070] В аспекте изобретения, соединение, которое вводят совместно с соединением формулы I, не демонстрирует какого-либо ингибирования 2D6 и/или модуляторной активности. В другом аспекте изобретения, соединение, которое вводят совместно с соединением формулы I, демонстрирует минимальное ингибирование 2D6 и/или модуляторную активность, так, что соединение является при этом все еще полезным, оно не уменьшает существенным образом эффективность проводимого лечения.
Интенсификация лечения симптомов и шизофрении
[0071] В воплощении изобретения, соединение формулы I, может быть введено пациенту в сочетании, по меньшей мере, с одним нейролептическим агентом, или пациенту уже подвергающемуся лечению, по меньшей мере, одним нейролептическим агентом, для улучшенного лечения любой комбинации негативных симптомов шизофрении, позитивных симптомов шизофрении, общих симптомов шизофрении или шизофрении самой по себе. В воплощении изобретения, введение соединения формулы I понижает концентрацию нейролептического агента, требуемого для получения терапевтически эффективного количества нейролептического агента. В аспекте изобретения, соединение формулы I обеспечивает синергестический (взаимоусиливающий) эффект нейролептическому агенту.
[0072] В воплощении изобретения, соединение формулы I, может быть введено пациенту в сочетании, по меньшей мере, с одним нейролептическим агентом, или пациенту уже подвергающемуся лечению, по меньшей мере, одним нейролептическим агентом, в котором нейролептический агент не пролонгирует интервал QT. Такие нейролептические агенты включают, но не ограничиваются ими, рисперидон, кветиапин, арипиразол и оланзапин, и их фармацевтически приемлемые соли, включающие, но не ограниченные ими, соли пальмитата. В аспекте изобретения, соединение формулы I, такое как соединение, представленное в формуле II, подбирается с одним или более антипсихотическими соединениями, имеющими склонность к пролонгации QT. Специалисту в данной области будет ясно, как выбрать, определить и/или оценить склонность к пролонгации QT антипсихотических средств, особенно принимая во внимание представленные в описании рекомендации.
[0073] В воплощении изобретения, соединение формулы I, может быть введено пациенту в сочетании, по меньшей мере, с одним нейролептическим агентом, или пациенту уже подвергающемуся лечению, по меньшей мере, одним нейролептическим агентом, при котором введение соединения формулы I усиливает лечение, по меньшей мере, одного негативного симптома шизофрении. В другом воплощении изобретения, соединение формулы I, может быть введено пациенту в сочетании, по меньшей мере, с одним нейролептическим агентом, или пациенту уже подвергающемуся лечению, по меньшей мере, одним нейролептическим агентом, при котором введение соединения формулы I усиливает лечение любой комбинации, по меньшей мере, одного негативного симптома шизофрении, по меньшей мере, одного позитивного симптома шизофрении, по меньшей мере, одного общего симптома шизофрении или шизофрении самой по себе.
[0074] В одном воплощении изобретения, предоставляется способ лечения, по меньшей мере, одного негативного симптома шизофрении у субъекта, включая введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, как описано выше, при котором, по меньшей мере, один негативный симптом подвергается лечению, при котором в дальнейшем улучшается познавательная способность, обусловленная шизофренией. Навыки познавательной способности включают, но не ограничиваются ими, подвижность, словесную память, беглость речи. Улучшение познавательной способности описывается где-либо еще в других документах.
[0075] ЭКСПЕРИМЕНТАЛЬНЫЕ ПРИМЕРЫ
Пример 1: Клиническое исследование CYR-101
Исследование проводили с использованием соединения формулы II, для проверки силы воздействия на шизофрению и лечения симптомов шизофрении. Исследование было многоцентровым, на стационарном больном и амбулаторном, фаза 2, двойной анонимности, рандомизированным, плацебо-контролируемым исследованием обоснованности концепции соединения формулы II у пациентов c DSM -IV шизофренией. Исследование проводили в 21 центре, расположенных в трех разных странах.
Исследование было предназначено для определения терапевтической эффективности соединения формулы II на всех проявлениях заболевания шизофренией (например, позитивных, негативных и общих симптомов, познавательной способности, сна, расположения духа и тревожного состояния). Исследование также определяло безопасность назначенных дозировок соединения формулы II (упоминаемого также как CYR-101), включая сердечную реполяризацию (т.е. интервал QT), изменение веса, побочные эффекты, пролактин и экстрапирамидальные симптомы).
Исследование проводили во временной период три месяца. Данный период времени был достаточным, чтобы позволить соединению продемонстрировать весь терапевтический потенциал, особенно в отношении параметров познавательной способности.
Цели исследования включают следующие:
| 1. Оценка в сравнении с плацебо эффективности CYR-101 на общую шкалу PANSS и элемент общего результата после одного месяца (28 дней ±2 дня) лечения | |
| 2. Исследование, будет ли назначенная доза CYR-101 демонстрировать значительное увеличение эффективности по оценке общей шкалы PANSS и элемента общего результата после трех месяцев (84 дня ±2 дня) лечения | |
| 3. Оценка в сравнении с плацебо эффективности CYR-101 по оценке CGI-S после одного и трех месяцев лечения | |
| 4. Оценка субъективной эффективности CYR-101 у пациентов в сравнении с плацебо по оценке Опросника Отношения к Лекарственным Средствам-10 (DAI-10) после одного и трех месяцев лечения | |
| 5. Оценка субъективного качества сна по оценке Питтсбургского Индекса Качества Сна (PSQI) после трех месяцев лечения | |
| 6. Исследование в сравнении с плацебо эффективности CYR-101 на функцию познавательной способности, определенной с помощью шкалы BACS (Краткая оценка когнитивных функций у пациентов с шизофренией) после одного и трех месяцев лечения | |
| 7. Оценка в сравнении с плацебо эффективности CYR-101 при депрессивных симптомах, определенной с помощью общей шкалы (MADRS) Шкалы Оценки Депрессии Монтгомери-Асберга после одного месяца лечения | |
| 8. Оценка в сравнении с плацебо эффективности CYR-101 при беспокойстве, определенной с помощью общей Шкалы Гамильтона для Оценки Выраженности Тревоги (HAMA) после одного месяца лечения | |
| 9. Определение сердечнососудистой безопасности (в особенности вентрикулярной реполяризации, определенной с помощью измерения интервалов QT/QTc) CYR-101 в сравнении с плацебо | |
| 10. Определение общей безопасности и переносимости CYR-101 в сравнении с плацебо | |
| 11. Определение фармакокинетики CYR-101 у пациентов с шизофренией |
CYR-101 8 мг оральные таблетки (SR) с замедленным высвобождением при оральном введении 1, 2 или 4 таблеток (8, 16 или 32 мг CYR-101) назначались дважды в день во время еды. Во время периода отладки приема доз, CYR-101 вводили орально, дважды в день утром и вечером, при ежедневной дозе 16 мг в течение 2 дней, затем дозу повышали на каждые два дня до 32 мг и 64 мг соответственно. Во время периода фиксированных доз, вводили оптимально адекватную дозу, определенную для каждого пациента или максимальную дневную дозу 64 мг CYR-101. В одном аспекте исследования, дозировка соединения повышалась до 32 мг два раза в день.
Во время начального периода, оральное введение 1 плацебо SR таблетки проводили дважды в день в течение 3 дней. Во время периода отладки доз и периода фиксированных доз, оральное введение 1, 2 или 4 таблеток плацебо SR применяли дважды в день, как осуществлялось для испытуемого продукта.
Полученные данные подвергались анализу одним из трех способов: 1.) Множество пациентов для анализа безопасности препарата; 2.) Набор данных для полного анализа, с каждым пациентом, имеющим, по меньшей мере, одну оценку PANSS после начала лечения, включенного в анализ эффективности. Используется методика LOCF; и 3.) Популяция анализа по протоколу, при котором в некоторые исследования включены все пациенты, имеющие завершенное трехмесячное лечение. Применяли анализ ковариации ANCOVA с последующим сравнительным анализом в каждый момент времени и в некоторых случаях использовали непараметрический критерий Wilcoxon.
Критерии, используемые для оценки, были следующие:
1. Первичный: шкала PANSS и элемент общего результата после одного месяца лечения.
2. Вторичный: шкала PANSS и элемент общего результата после трех месяцев лечения, шкала GGI-S, шкала DAI-10, шкала PSQI, шкала BACS, общая шкала MADRS и общая шкала HAMA, Вопросник Готовности (пациента) к Выписке(RDQ).
3. Исследовательский: В подгруппе пациентов, продолжительность полисомнографического сна и параметры структуры сна.
4. Безвредность для здоровья: ЭКГ в 12-ти отведениях, запись о нежелательном (побочном) явлении (АЕ), основные показатели жизнедеятельности (физиологические), клиническое обследование, вес и обхват талии, лабораторные испытания безопасности, оценка экстрапирамидальных симптомов (измеряемых по шкале Симпсона и Ангуса), и уровни пролактина.
5. Фармакокинетика (изучение концентрации и скорости прохождения лекарственного средства в организме): уровни CYR-101, BFB-520 и BFB-999 в плазме.
Используемыми методами статистики были следующие:
1. Первичная переменная эффективности: Анализ Ковариации (ANCOVA) с лечением и шаблона, как фиксированных эффектов, и исходного значения как ковариаты, после одного месяца лечения, на изменение от исходного уровня общей шкалы PANSS и элемента общего результата на Наборе Данных для Полного Анализа (FAS).
2. Вторичная переменная эффективности: Тот же метод для общей шкалы PANSS и элемента общего результата при трех месячном лечении, BACS, DAI-10, MADRS, HAMA, и PSQI на Наборе Данных для Полного Анализа (FAS). Процедура Переноса Вперед Данных Последнего Наблюдения (LOCF) использовалась для вменения пропущенных значений. Анализ вариации (ANOVA) для Вопросника Готовности (пациента) к Выписке(RDQ) в 14 дней. Критерий суммы рангов Уилкоксона для CGI-S. Описательная статистика и графическое представление на изменение от исходного уровня на FAS. Анализ эффективности (ANCOVA) дополнительно проводимый на списке пациентов, завершивших участие в исследовании и выполнивших все условия протокола. Поддерживающий исследовательский анализ на PANSS с использованием лонгитюдной, вероятностной модели смешанного действия на FAS без вменения пропущенных значений. На субтесте пациентов, полисомнографические (PSG) параметры регистрации подвергались анализу с использованием описательной статистики и ANCOVA на изменения от исходного уровня.
3. Безопасность: Описательная статистика на множестве пациентов для анализа безопасности препарата для продолжительности лечения, запись побочных действий, лабораторные испытания безопасности, ЭКГ в 12-ти отведениях, основные показатели жизнедеятельности, клиническое обследование, вес и обхват талии, оценка экстрапирамидальных симптомов, уровни пролактина.
Заключение о результатах
Результаты не показали значительной разницы между CYR-101 и плацебо группами в отношении состояния пациента при выходе его из-под влияния лекарственного средства или усугубления экстрапирамидальных симптомов. Было три статистически значимых побочных явления (SAE), два из которых были в плацебо группе. Одно SAE в группе активного лечения было с меньшей вероятностью связано с CYR-101 на основании истории болезни пациента.
Улучшение негативных симптомов наблюдалось немедленно, и продолжалось во время курса лечения. Данное действие соединения было неожиданным. Позитивные симптомы не проявляли улучшения, пока не проходили первые четыре недели лечения. Более того, улучшение как позитивных, так и негативных симптомов продолжалось в течение более чем двенадцати недель. Это также удивительно, так как другие антипсихотические средства обычным образом показывают улучшение только в течение шести недель.
Далее, отмечено, что CYR-101 обладает позитивным воздействием на познавательную способность у больных с шизофренией. Было показано, что познавательная способность быстро улучшается после начала лечения пациентов с помощью CYR-101. Когнитивная деятельность, определенная посредством BACS не показывает на FAS никакой разницы между плацебо группой и группой CYR-101, за исключением задания на выполнение движений Token. На РРС при D84, пояснительные надписи показывают слабое различие в содействии CYR-101 группы по сравнению с группой плацебо для задания на выполнение движений Token, списка задач обучения и для словесной беглости речи, также как и для скорости обработки информации. Данные различия не были статистически значимыми. Однако, в сравнении, должно быть понятно, что большинство других антипсихотических методов лечения имеют отмеченное негативное воздействие на познавательную способность.
Увеличение интервала QT наблюдалось после того, как CYR-101 назначали для введения при дозировке до 32 мг дважды в день. Однако наблюдаемое увеличение оставалось стабильным на протяжении времени и не расходилось с клинически допустимыми пределами (например, 10-15 миллисекунд или меньше).
В заключение, CYR-101 вызвало удивительное и неожиданно непосредственное и устойчивое влияние на негативные симптомы и некоторые когнитивные функции, нарушенные у пациентов с шизофренией. CYR-101 оказывает также некоторое влияние на позитивные симптомы, но есть необходимость более длительного периода лечения для того, чтобы увидеть дифференцированность от плацебо. Все вышеупомянутые воздействия и влияния сопровождаются некоторыми улучшениями настроения состояния беспокойства и сна, делая CYR-101 желательной основой для терапии для лечения шизофрении и симптомов шизофрении с минимумом побочных эффектов и благоприятным, немедленным и положительным воздействием на негативные симптомы и познавательную способность.
Подробные результаты
Изменение от исходного уровня в общей шкале PANSS после одного месяца лечения (при D28) является первичным критерием эффективности. При D28, на Наборе Данных для Полного Анализа FAS, общая шкала PANSS, под-шкала PANSS общей психопатологии и под-шкала PANSS позитивности, показывают уменьшение в обеих группах без разницы в лечении между группами плацебо и CYR-101.
При D28, на РРС, общая шкала PANSS, под-шкала PANSS общей психопатологии и под-шкала PANSS позитивности, показывают статистически значимое уменьшение для обеих групп без разницы в лечении между группами плацебо и CYR-101.
Итоги FAS на под-шкале PANSS негативности при D28 демонстрируют благоприятную тенденцию преимущества CYR-101 над плацебо со статистически значимым уменьшением -1,7, (р<0,05) и -1,9, (р<0,01), для плацебо и CYR-101 соответственно. Пример, показанный на FAS анализе, подтверждается на результатах РРС. Под-шкала PANSS негативности при D28 демонстрирует большее благоприятное преимущество CYR-101 над плацебо со статистически значимым уменьшением -4,2, (р<0,0010) и -4,7, (р<0,0010), для плацебо и CYR-101 соответственно.
Аналогично, результатам, следующим за одним месяцем лечения, при D84, на Наборе Данных для Полного Анализа FAS, изменение от исходного уровня в общей шкале PANSS, под-шкале PANSS общей психопатологии и под-шкале PANSS позитивности, не показало значительной разницы в лечении между группами плацебо и CYR-101. В противоположность результатам на FAS, результаты на РРС показали благоприятную тенденцию CYR-101 над плацебо с очевидным изменением параметра на D56 для общей шкалы PANSS, на D70 для подшкалы PANSS общей психопатологии и между D56 и D70 на под-шкале PANSS позитивности.
Результаты FAS подшкалы PANSS негативности при D84 демонстрируют благоприятную тенденцию CYR-101 над плацебо только с CYR-101, показывающим статистически значимое уменьшение по отношению к плацебо: точечная оценка уменьшения -1,2, (р=0,126) и -2,3, (р<0,01), для плацебо и CYR-101 соответственно.
Данная благоприятная тенденция CYR-101 над плацебо убедительно подтверждается анализом РРС на под-шкале PANSS негативности при D84. Уменьшение является статистически значимым для обеих групп и более очевидно для CYR-101 с улучшением -3,4, (р=0,0077) и -5,8, (р<0,001), для плацебо и CYR-101 соответственно. В дополнение, данное превосходство показывает непосредственно статистически значимую (р=0,0581) разницу в лечении в пользу CYR-101.
Шкала CGI-S не показывает значительной разницы между группами CYR-101 и плацебо на наборе FAS при D28 и D84. На РРС, от D56 до D84, есть незначительное, но интересное изменение параметра в пользу CYR-101 на средней разнице шкалы CGI-S.
Общая шкала DAI-10 изменения от исходного уровня до D28 и D84 не показывает значительной разницы между двумя группами на FAS и РРС.
Результаты PSQI показывают на FAS, что качество сна было лучше для обеих групп по окончании исследования. Данное улучшение было большим в CYR-101 группе (-4 пункта ±4,9) в сравнении с плацебо группой (-1,4 пункта ±6,6). Как для результатов FAS, данные РРС указывают, что качество сна было лучшим для обеих групп по окончании исследования. Данное улучшение было большим в CYR-101 группе (-4,6 пункта ±4,3) в сравнении с плацебо группой (-1,2 пункта ±6,2).
Достижения в познавательной способности, определенные посредством BACS не показали на FAS разницы между плацебо группой и группой CYR-101, за исключением задания на выполнение движений Token. На РРС при D84, пояснительные надписи показывают легкое различие в пользу группы CYR-101 по сравнению с плацебо группой для задания на выполнение движений Token, списка задач обучения и для словесной беглости речи. Данные различия не были статистически значимыми.
На FAS и РРС при D28 и D84, снижение общей шкалы изменения MADRS наблюдалось в обеих группах. Данные различия не были статистически значимыми.
На FAS при D28 и D84, результаты показывают легкое снижение общей шкалы HAMA в обеих группах без статистически значимых изменений от исходного уровня. Период действия диаграммы на РРС является различным, как при D28, несмотря на статистически значимую разницу в лечении между обеими группами, данные показывают значительное понижение -1,6, (р=0,1000) и -1,0, (р=0,2920), для плацебо и CYR-101 соответственно. При D84, есть изменение в пользу CYR-101. Обе группы показали количественное сокращение, большее в группе CYR-101 по сравнению с плацебо группой: -2,2, (р=0,1523) и -2,9, (р=0,0642).
Данные полисомнографической (PSG) записи показывают, что параметры поддержания сна не демонстрируют значительного эффекта от лечения. Сопоставление обнаружило, что по сравнению с плацебо, CYR-101 уменьшило общее время сна (TST) на 13,7 минут и индекс эффективности сна (SEI) на 2,4% и увеличило продолжительность пробуждения после наступления сна (WASO) на 26,6 минут. Данные различия не достигли статистической значимости.
Анализ параметров распределения стадий не показывает значительного лечебного эффекта. Сопоставление обнаружило, что по сравнению с плацебо, CYR-101 увеличило Общее Время Пробуждения (TTA), Медленноволновой Сон (SWS) и сон без сновидений (NREM), в то время как оно снизило Стадию 1 (ST1), Стадию 2 (ST2 в минутах) и быстрый сон (сон с быстрым движением глазных яблок или стадия сновидений) (REM). Данные различия не достигли статистической значимости, за исключением для REMTST (p<0,05). Два значительных лечебных эффекта (p<0,05) проявились на распределении медленноволнового сна через первую и последнюю треть периода времени сна (SPT). Значительный контраст (p<0,05) обнаружил, что по сравнению с плацебо, CYR-101 увеличило SWS в первой трети SPT (SWS-SPT1) на 23,6%, в то время как оно уменьшило продолжительность в последней трети SPT (SWS-SPT1) на 22,1%. Было обнаружено легкое увеличение быстрого сна на 1,4% в первой трети SPT (REM_SPT1) и легкое уменьшение после (на 3,03% в SPT2 и в SPT3). Данные результаты не были статистически значимыми. Результаты обоих незначительных сопоставлений латентных периодов показали, что с CYR-101, SWS проявлялся быстрее, а быстрый сон позднее.
Пример 2: Свойства CYR-101
Патент США 7166617, включенный в описание путем ссылки на него, раскрывает избирательную связуемость CYR-101 с участком сигма 2 рецептора. Испытуемым соединением Примера 1 Патента США 7166617 является CYR-101. Как представлено в Таблице 3 Патента США 7166617, CYR-101 имеет сродство 13 нМ для сигма 2 рецептора. Эти данные показывают, что CYR-101 проявляет избирательное связывание сигма 2 рецептора. Кроме того, известно, что CYR-101 является двойным 5-НТ2А/сигма 2 антагонистом и не имеет допамин-связующих свойств.
Пример 3: Воздействие CYR-101 на Сон
Изучение воздействия CYR-101 на сон предполагает, что CYR-101 улучшает сон у пациентов с шизофренией, и может, в общем, быть полезным для лечения расстройств сна.
Полисомнографическое снятие показаний имело место в подгруппе пациентов. Параметры сна записывали с 11:00 после полудня до 7:00 утра на D-1 после привыкания к темноте (условия исходного уровня) и на D14. Анализы параметров в отношении продолжительности сна, стадии распределения и профиля стадии были исследовательскими. Различия в лечении на каждом из этих параметров сна анализировали с использованием D14 величин с ANOVA и ANCOVA в зависимости от страны и метода лечения, как главными действиями и исходным уровнем как ковариатой.
Среди 33 пациентов, в отношении которых выполняли снятие PSG показаний при проведении осмотра в первый день, 19 получили плацебо, а 14 получили исследовательское лечение. Среди них, 7 пациентов испытывали техническую проблему и/или бессонницу в течение исходного уровня и/или ночного лечения и были, поэтому, исключены из исследования. Окончательно, 20 пациентов были включены в анализируемую группу ANOVA и 19 пациентов были включены в анализируемую группу ANCOVA, и согласно данным SAP, только результаты ANCOVA были взяты в расчет и обсуждались далее в следующих секциях.
Результаты ANCOVA проведенного на параметрах вызывания сна не показывают значительного лечебного эффекта. Однако может наблюдаться тенденция к улучшению во время ожидания засыпания также, как и во время ожидания глубокого сна. Результаты ANCOVA, проведенного на параметрах поддержания сна, не показывают значительного лечебного эффекта. Сопоставление обнаружило, что по сравнению с плацебо, CYR-101 уменьшило общее время сна (TST) на 13,7 минут и индекс эффективности сна (SEI) на 2,4% и увеличило длительность пробуждения после засыпания (WASO) на 26,6 минут. Данные различия не достигли статистической значимости.
Результаты ANCOVA, проведенного на параметрах распределения стадий, не показывают значительного лечебного эффекта. Сопоставление обнаружило, что по сравнению с плацебо, CYR-101 увеличило Общее Время Пробуждения (TTA), Медленноволновой сон (SWS) и сон без сновидений (NREM), в то время, как оно снизило Стадию 1 (ST1), Стадию 2 (ST2 в минутах) и быстрый сон (сон с быстрым движением глазных яблок или стадия сновидений) (REM). Данные различия не достигли статистической значимости, за исключением для REM-TST (p<0,05).
Результаты смешанных моделей, приведенных на параметрах профиля сна, показывают два значительных лечебных эффекта (p<0,05) на распределении медленноволнового сна через первую и последнюю треть периода времени сна (SPT). Значительный контраст (p<0,05) обнаружил, что по сравнению с плацебо, CYR-101 увеличило SWS в первой трети SPT (SWS-SPT1) на 23,6%, в то время, как оно уменьшило продолжительность в последней трети SPT (SWS-SPT3) на 22,1%. Было обнаружено легкое увеличение быстрого сна на 1,4% в первой трети SPT (REM_SPT1) и легкое уменьшение после (на 3,03% в SPT2 и в SPT3), но данные результаты не были статистически значимыми. Результаты обоих незначительных сопоставлений латентных периодов показали, что с CYR-101, SWS проявлялся быстрее, а быстрый сон позднее.
Результаты данного исследования показывают, что CYR-101 не имеет значительного влияния на EEG параметры сна во время распространения медленноволнового сна. CYR-101 способствовало переносу распространения медленноволнового сна от конца на начало ночи (наступления темноты): оно значительно увеличило медленноволновой сон в первой трети ночи и уменьшило в последней трети ночи. Результаты также подразумевают, что CYR-101 может обладать стимулирующим сон воздействием, так как оно улучшает (но незначительно) параметры наступления сна. Важно отметить, что эти результаты были получены в параллельных намеченных группах на очень маленьких группах пациентов (N=19) из которых только 7 получали CYR-101. Кроме того, EEG параметры сна у пациентов с шизофренией имеют высокую степень изменчивости (вследствие неоднородности заболевания и/или сопутствующей лекарственной терапии). В данном контексте, некоторые из различий, наблюдаемых в этом исследовании, могут достичь статистической значимости при большей численности объектов испытания.
На основании представленного описания, специалисту в данной области будет понятно как лечить расстройства сна или как улучшить параметры сна. Далее, на основании представленного описания, специалисту в данной области будет понятно как измерять и/или оценивать эффективность лечения расстройства сна или улучшения параметров сна. В общем направлении, любое усиление или улучшение качества сна, или благотворного действия сна, может расцениваться как лечение или улучшение.
Изобретение представлено со ссылкой не некоторые предыдущие воплощения. Однако, после того как особенные различия станут очевидными для специалистов в данной области, на основании раскрытия предмета изобретения, представленного в описании, изобретение не должно рассматриваться как ограничивающее. Все патенты, патентные заявки и приведенные где-либо ссылки включены в данный документ посредством ссылок.
Claims (23)
2. Применение по п. 1, где субъект не страдает от шизофрении.
3. Применение по п. 1, где субъект страдает от шизофрении.
5. Применение по п. 4, где по меньшей мере один симптом выбран из группы, состоящей из позитивного симптома шизофрении, негативного симптома шизофрении и общего симптома шизофрении.
6. Применение по п. 5, где позитивный симптом выбран из группы, состоящей из бреда, галлюцинации, гиперактивности, мании величия, мнительности и враждебности.
7. Применение по п. 5, где негативный симптом выбран из группы, состоящей из аффективной тупости, эмоционального отчуждения, малоконтактности, пассивного социального отчуждения, затруднения в абстрактном мышлении, недостатка спонтанности, стереотипного мышления, расстройства сна, вызванного негативностью параметра или аспекта сна.
8. Применение по п. 5, где негативный симптом выбран из группы, состоящей из первичного негативного симптома и вторичного негативного симптома.
9. Применение по п. 5, где общий симптом выбран из группы, состоящей из обеспокоенности соматическим здоровьем, тревоги, чувства вины, напряженности, позерства, манерности, депрессии, заторможенности движения, неконтактности, необычного образа мыслей, дезориентации, недостатка внимания, недостатка рассудительности, нарушения волевой способности, расстройства контроля над побуждениями, озабоченности и активного социального уклонения.
10. Применение по п. 5, где лечат по меньшей мере два симптома.
11. Применение композиции для изготовления лекарственного средства для лечения или улучшения по меньшей мере одного симптома шизофрении у субъекта, где композиция включает:
(a) терапевтически эффективное количество рисперидона, кветиапина, арипипразола или оланзапина;
и
(b) терапевтически эффективное количество соединения
или его фармацевтически приемлемой соли, гидрата или сольвата.
(a) терапевтически эффективное количество рисперидона, кветиапина, арипипразола или оланзапина;
и
(b) терапевтически эффективное количество соединения
или его фармацевтически приемлемой соли, гидрата или сольвата.
13. Применение по п. 1, где указанное соединение вводят в дозе от 0,1 мг до 128 мг.
14. Применение по п. 1, где указанное соединение вводят в дозе от 8 мг до 32 мг.
15. Применение по п. 1, в котором указанное соединение вводят от одного раза в день до четырех раз в день.
16. Применение по п. 1, в котором указанное соединение вводят дважды в день.
18. Применение соединения
или его фармацевтически приемлемой соли, гидрата или сольвата для изготовления лекарственного средства для лечения шизофрении или лечения или облегчения по меньшей мере одного симптома шизофрении у субъекта, где соединение имеет рецептор-связывающий профиль с величиной Ki менее чем 10 нмоль/л для 5-НТ2А, величиной Кi менее чем 20 нмоль/л для α1 адренергических рецепторов и величиной Ki менее 10 нмоль в отношении сигма 2 рецепторов.
или его фармацевтически приемлемой соли, гидрата или сольвата для изготовления лекарственного средства для лечения шизофрении или лечения или облегчения по меньшей мере одного симптома шизофрении у субъекта, где соединение имеет рецептор-связывающий профиль с величиной Ki менее чем 10 нмоль/л для 5-НТ2А, величиной Кi менее чем 20 нмоль/л для α1 адренергических рецепторов и величиной Ki менее 10 нмоль в отношении сигма 2 рецепторов.
19. Применение по п. 12, где одно или более соединений для лечения шизофрении выбраны из группы, состоящей из рисперидона, кветиапина, арипипразола или оланзапина.
20. Применение по п. 4, где указанное соединение вводят в дозе от 0,1 до 128 мг.
21. Применение по п. 4, где указанное соединение вводят в дозе от 8 до 32 мг.
22. Применение по п. 4, где указанное соединение вводят от одного до четырех раз в день.
23. Применение по п. 4, где указанное соединение вводят два раза в день.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US36607510P | 2010-07-20 | 2010-07-20 | |
| US61/366,075 | 2010-07-20 | ||
| PCT/US2011/044697 WO2012012542A1 (en) | 2010-07-20 | 2011-07-20 | Methods of use of cyclic amide derivatives to treat schizophrenia |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2013107382A RU2013107382A (ru) | 2014-08-27 |
| RU2576611C2 true RU2576611C2 (ru) | 2016-03-10 |
Family
ID=45497166
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2013107382/15A RU2576611C2 (ru) | 2010-07-20 | 2011-07-20 | Способы применения производных циклического амида для лечения шизофрении |
Country Status (21)
| Country | Link |
|---|---|
| US (2) | US20180155318A1 (ru) |
| EP (3) | EP2595484B1 (ru) |
| JP (2) | JP6053678B2 (ru) |
| KR (1) | KR101867633B1 (ru) |
| CN (1) | CN103220910B (ru) |
| BR (1) | BR112013001303A2 (ru) |
| CA (2) | CA3117855C (ru) |
| DK (2) | DK2595484T3 (ru) |
| ES (2) | ES2656313T3 (ru) |
| FI (1) | FI3135286T3 (ru) |
| HR (1) | HRP20231446T1 (ru) |
| HU (1) | HUE064157T2 (ru) |
| LT (1) | LT3135286T (ru) |
| NO (1) | NO2595484T3 (ru) |
| PL (2) | PL2595484T3 (ru) |
| PT (2) | PT2595484T (ru) |
| RS (1) | RS64819B1 (ru) |
| RU (1) | RU2576611C2 (ru) |
| SI (1) | SI3135286T1 (ru) |
| TW (1) | TWI583679B (ru) |
| WO (1) | WO2012012542A1 (ru) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2812901C2 (ru) * | 2017-06-21 | 2024-02-05 | Минерва Ньюросайенсиз, Инк. | Кишечнорастворимые лекарственные формы для перорального применения с контролируемым высвобождением |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PT3227273T (pt) * | 2014-12-02 | 2022-04-06 | Minerva Neurosciences Inc | Composições que compreendem 2-((1-(2(4-fluorofenil)-2-oxoetil)piperidin-4-il)metil)isoindolin-1-ona para tratamento de esquizofrenia |
| KR20240005110A (ko) * | 2016-05-25 | 2024-01-11 | 미쓰비시 타나베 파마 코퍼레이션 | 비-조현병성 환자에서 음성 증상을 치료하기 위한 조성물 및 방법 |
| EA202090932A1 (ru) | 2017-10-10 | 2021-05-20 | Нейрокрин Байосайенсиз, Инк | Способы введения некоторых vmat2-ингибиторов |
| MX2021002017A (es) * | 2018-08-21 | 2021-04-28 | Minerva Neurosciences Inc | Uso de roluperidona para tratar sintomas y trastornos negativos, aumentar la neuroplasticidad y promover la neuroproteccion. |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2008152440A (ru) * | 2006-05-30 | 2010-07-10 | Элбион Гмбх (De) | ПИРИДО[3,2-e]ПИРАЗИНЫ, ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ФОСФОДИЭСТЕРАЗЫ 10 И СПОСОБЫ ИХ ПОЛУЧЕНИЯ |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE3888340T2 (de) * | 1988-01-21 | 1994-06-30 | Merrell Dow Pharma | Verwendung von 1,4-disubstituierten-Piperidinyl-Verbindungen zur Herstellung eines Arzneimittels zur Behandlung von Schlaflosigkeit. |
| WO1991006297A1 (en) * | 1989-10-27 | 1991-05-16 | The Du Pont Merck Pharmaceutical Company | (n-phthalimidoalkyl) piperidines |
| IE903857A1 (en) * | 1989-10-27 | 1991-05-08 | Du Pont Merck Pharma | (N-Phthalimidoalkyl)Piperidines |
| ES2291293T3 (es) * | 2000-02-29 | 2008-03-01 | Mitsubishi Pharma Corporation | Nuevos derivados amida ciclicos. |
| EP1891002B1 (en) * | 2005-06-06 | 2012-05-30 | Merck Sharp & Dohme Limited | Cyclohexanesulfonyl derivatives as glyt1 inhibitors to treat schizophrenia |
-
2011
- 2011-07-20 HR HRP20231446TT patent/HRP20231446T1/hr unknown
- 2011-07-20 ES ES11810349.8T patent/ES2656313T3/es active Active
- 2011-07-20 JP JP2013520840A patent/JP6053678B2/ja active Active
- 2011-07-20 PT PT118103498T patent/PT2595484T/pt unknown
- 2011-07-20 ES ES16181339T patent/ES2963362T3/es active Active
- 2011-07-20 TW TW100125661A patent/TWI583679B/zh active
- 2011-07-20 RU RU2013107382/15A patent/RU2576611C2/ru active
- 2011-07-20 CN CN201180045067.1A patent/CN103220910B/zh active Active
- 2011-07-20 CA CA3117855A patent/CA3117855C/en active Active
- 2011-07-20 WO PCT/US2011/044697 patent/WO2012012542A1/en active Application Filing
- 2011-07-20 NO NO11810349A patent/NO2595484T3/no unknown
- 2011-07-20 SI SI201132096T patent/SI3135286T1/sl unknown
- 2011-07-20 PL PL11810349T patent/PL2595484T3/pl unknown
- 2011-07-20 DK DK11810349.8T patent/DK2595484T3/en active
- 2011-07-20 KR KR1020137004217A patent/KR101867633B1/ko active IP Right Grant
- 2011-07-20 EP EP11810349.8A patent/EP2595484B1/en active Active
- 2011-07-20 EP EP16181339.9A patent/EP3135286B1/en active Active
- 2011-07-20 PT PT161813399T patent/PT3135286T/pt unknown
- 2011-07-20 PL PL16181339.9T patent/PL3135286T3/pl unknown
- 2011-07-20 EP EP17196800.1A patent/EP3335731A1/en active Pending
- 2011-07-20 FI FIEP16181339.9T patent/FI3135286T3/fi active
- 2011-07-20 BR BR112013001303A patent/BR112013001303A2/pt not_active Application Discontinuation
- 2011-07-20 DK DK16181339.9T patent/DK3135286T3/da active
- 2011-07-20 CA CA2806017A patent/CA2806017C/en active Active
- 2011-07-20 RS RS20231061A patent/RS64819B1/sr unknown
- 2011-07-20 HU HUE16181339A patent/HUE064157T2/hu unknown
- 2011-07-20 LT LTEP16181339.9T patent/LT3135286T/lt unknown
-
2016
- 2016-08-23 JP JP2016163049A patent/JP6200561B2/ja active Active
-
2017
- 2017-07-21 US US15/656,062 patent/US20180155318A1/en not_active Abandoned
-
2022
- 2022-05-16 US US17/745,024 patent/US20220274951A1/en active Pending
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2008152440A (ru) * | 2006-05-30 | 2010-07-10 | Элбион Гмбх (De) | ПИРИДО[3,2-e]ПИРАЗИНЫ, ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ФОСФОДИЭСТЕРАЗЫ 10 И СПОСОБЫ ИХ ПОЛУЧЕНИЯ |
Non-Patent Citations (1)
| Title |
|---|
| DUTHEIL F et al. "Xenobiotic-metabolizing enzymes and transporters in the normal human brain: regional and cellular mapping as a basis for putatine roles in cerebral function". Drug Metab Dispos 2009 Jul;37(7):1528-38, реферат, найдено 27.04.2015, найдено из PubMed PMID:19359404. YANG C et al. "Clinical significance of sleep EEG abnormalities in chronic schizophrenia". Schizophr Res. 2006 Feb 28;82(2-3):251-60, реферат, найдено 27.04.2015, найдено из PubMed PMID: 16377158. * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2812901C2 (ru) * | 2017-06-21 | 2024-02-05 | Минерва Ньюросайенсиз, Инк. | Кишечнорастворимые лекарственные формы для перорального применения с контролируемым высвобождением |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US9732059B2 (en) | Methods of use of cyclic amide derivatives to treat schizophrenia | |
| ES2879631T3 (es) | Pridopidina para el tratamiento de la enfermedad de Huntington | |
| US20220274951A1 (en) | Methods of use of cyclic amide derivatives to treat schizophrenia | |
| JP6419294B2 (ja) | シグマ受容体に仲介される障害を処置するための環状アミド誘導体の使用の方法 | |
| WO2000054764A2 (en) | A method of treating bulimia nervosa and related eating disorders by administration of atypical antipsychotic medications | |
| WO2023243659A1 (ja) | 線条体ストリオソームのドパミンd1シグナルを標的とした強迫性障害の薬物療法 | |
| WO2024107681A1 (en) | Methods of switching neuropsychiatric medications using ulotaront | |
| Consta | Major eligibility requirements for PATS |