RU2531548C2 - Композиция для лечения заболевания - Google Patents
Композиция для лечения заболевания Download PDFInfo
- Publication number
- RU2531548C2 RU2531548C2 RU2011117293/10A RU2011117293A RU2531548C2 RU 2531548 C2 RU2531548 C2 RU 2531548C2 RU 2011117293/10 A RU2011117293/10 A RU 2011117293/10A RU 2011117293 A RU2011117293 A RU 2011117293A RU 2531548 C2 RU2531548 C2 RU 2531548C2
- Authority
- RU
- Russia
- Prior art keywords
- antibody
- domain
- humanized anti
- chain
- patient
- Prior art date
Links
- 0 C1C2C1CC(C1)C1*2 Chemical compound C1C2C1CC(C1)C1*2 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2812—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against CD4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39541—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against normal tissues, cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Molecular Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Epidemiology (AREA)
- Mycology (AREA)
- Microbiology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Rheumatology (AREA)
- Biomedical Technology (AREA)
- Transplantation (AREA)
- Pain & Pain Management (AREA)
- Physical Education & Sports Medicine (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Abstract
Настоящее изобретение относится к биотехнологии и представляет собой фармацевтическую комбинацию для лечения ревматического заболевания, содержащую гуманизированное анти-CD4 антитело, способное к активации CD4+CD25+ регуляторных Т-клеток, и метотрексат. Настоящее изобретение также раскрывает набор и способы лечения ревматического заболевания с использованием указанной фармацевтической комбинации и указанного набора. Изобретение позволяет осуществлять более эффективные способы лечения ревматических заболеваний, в том числе ревматоидного артрита. 6 н. и 51 з.п. ф-лы, 8 ил., 2 табл., 2 пр.
Description
Настоящее изобретение связано с лечением ревматических заболеваний. Изобретение включает высокоэффективную фармацевтическую композицию, содержащую средство, способное к активации CD4+CD25+ регуляторных Т-клеток, такое как гуманизированное моноклональное антитело, и лекарственное средство метотрексат. Композиция и наборы изобретения являются особенно эффективными при лечении ревматоидного артрита. Изобретение предусматривает фармацевтические композиции или наборы, содержащие средство и метотрексат, а также применения и способы лечения с использованием композиции и наборов.
Ревматические заболевания представляют собой группу заболеваний, поражающих соединительную ткань, особенно, суставы и относящиеся к ним структуры, и характеризуются воспалением, дегенерацией или метаболическим нарушением. Примерами ревматических заболеваний являются ревматоидный артрит, псориатический артрит, ювенильный ревматоидный артрит и анкилозирующий спондилит.
Ревматоидный артрит представляет собой аутоиммунное заболевание, которое вызывает хроническое воспаление суставов и окружающих тканей и может также поражать другие ткани и органы организма. Заболевание происходит, когда Т-клетки, которые в норме являются толерантными по отношению к аутологической ткани, распознают “собственные” молекулы и взаимодействуют с ними, то есть молекулами, вырабатываемыми клетками хозяина. Активация “аутореактивных” Т-клеток посредством представления аутоантигенов, обрабатываемых антиген-представляющими клетками (APC), приводит к их клональной экспансии и миграции в конкретные ткани, где они индуцируют воспаление и разрушение ткани.
Существует широкий диапазон терапий для лечения ревматоидного артрита, которые являются доступными в настоящее время, включающих лекарственные средства первой линии для снятия боли и воспаления, классифицируемые как нестероидные противовоспалительные препараты (NSAID), например аспирин, ибупрофен, напроксен и т.д. Вторичное лечение артрита включает кортикостероиды (например, преднизон и дексаметазон), которые представляют собой синтетические версии гормона кортизона в организме, медленно действующие противоревматические лекарственные средства (SAARD) или модифицирующие заболевание противоревматические лекарственные средства (DMARD), например гидроксихлорохин, сульфасалазин, метотрексат, пенициллинамин, циклофосфамид, соли золота, азотиоприн, лефлуномид и т.д.
Лечение многих пациентов с вновь диагностируемым RA начинают с DMARD, таким как метотрексат (MTX). MTX (4-амино-N10-метилптероилглутаминовая кислота) является аналогом фолиевой кислоты, который, как известно, препятствует выработке формы фолиевой кислоты, важной для активно растущих клеток, таких как клетки, обнаруженные в коже, крови, тканях желудочно-кишечного тракта, и клетки, вовлеченные в иммунную систему. До конца непонятно, как MTX снижает тяжесть RA, однако полагают, что он имеет значение для противовоспалительного действия, и были предложены разнообразные фармакологические механизмы его действия, включающие ингибирование синтеза пуринов, инициацию высвобождения аденозина, ингибирование выработки провоспалительных цитокинов и модуляцию воспаления (Swierkot et al., 2006). Также известно, что MTX ингибирует, например, активность фермента дигидрофолатредуктазы (DHFR) и также взаимодействует с некоторыми другими ферментами.
Еще одну группу лекарственных средств для лечения RA именуют как модификаторы биологического ответа (BRM), которые включают моноклональные антитела. Их примерами являются антагонисты фактора некроза опухолей-альфа (TNF-альфа), такие как адалимумаб, инфликсимаб и этанерцепт, которые осуществляют свое действие посредством связывания с рецептором TNF-альфа или непосредственно связываясь с самим белком TNF-альфа. Некоторые ингибиторы TNF-альфа были разрешены FDA для лечения ревматоидного артрита, включая адалимумаб (Humira®), Инфликсимаб (Remicade®) и Этанерцепт (Enbrel®). TNF-альфа представляет собой ключевой медиатор при ревматоидном артрите, и он, в основном, продуцируется активированными макрофагами в синовиальной ткани пациентов с RA. Действуя в качестве провоспалительного цитокина, TNF-альфа в большом количестве присутствует в синовиальной ткани пациентов с RA. Он индуцирует выработку и высвобождение хемокинов, которые привлекают лейкоциты из крови в воспаленную ткань (Tracey et al., 2008). Кроме опосредования синовиального воспаления, TNF-альфа вовлечен в разрушение суставов и деградацию хрящевой ткани. Дополнительно, он обладает способностью к ингибированию супрессивной активности CD4+CD25+ регуляторных T-клеток (Andersson et al., 2008).
В некоторых случаях пациентов с RA подвергают лечению комбинацией лекарственных средств, обсуждаемых выше. В частности, DMARD часто применяют в качестве первого лечения. Однако у пациентов, где контроль над заболеванием не достигнут, может быть желательным использовать их в комбинации с терапиями, которые были разрешены к применению совсем недавно, таких как биологические средства, например антагонисты TNF-альфа. Сообщалось, что комбинация MTX с некоторыми моноклональными антителами (этанерцепт, инфликсимаб, адалимумаб и анакирина) приводит к лучшей терапевтической эффективности по сравнению с терапией одним MTX (Swierkot et al., 2006). Однако MTX проявляет разнообразные фармакологические действия и его клинические эффекты могут быть отнесены к множеству целей (Wessels et al., 2008). Соответственно, нельзя легко предсказать, как MTX будет воздействовать на терапевтическую активность, и, следовательно, эффективность лекарственного средства, которое является эффективным как единственное средство.
Несмотря на диапазон доступных в настоящее лекарственных средств, не все пациенты хорошо реагируют на указанные выше терапии, и существует ряд неблагоприятных побочных эффектов. Например, лечение TNF-альфа подавляет иммунную систему, делая пациентов, проходящих лечение, более подверженными инфекциям и заболеванию. Соответственно, все еще существует необходимость в развитии альтернативных терапий.
В целом, принято считать, что CD4+ Т-клетки играют основную роль в инициации и поддержании аутоиммунитета. Соответственно, было предложено применять моноклональные антитела (mAb) против молекул поверхности CD4+ Т-клеток, и, в частности, анти-CD4 mAb, в качестве иммуносупрессивных средств при лечении заболеваний, таких как ревматоидный артрит.
Один пример, находящийся на стадии дополнительных исследований, представляет собой анти-CD4 антитело B-F5 (мышиные IgG1 против человеческих CD4), которое тестировали при различных аутоиммунных заболеваниях. У пациентов с ревматоидным артритом результаты, наблюдаемые при испытании с плацебо-контролем с суточной дозой B-F5, не показали значительного улучшения (Wendling et al. J Rheumatol; 25(8):1457-61, 1998). Однако в WO 2004/083247, было разработано гуманизированное B-F5 (далее именуемое здесь как hB-F5 или BT061) антитело, имеющее сходные свойства связывания CD4 с родительским мышиным B-F5. Предварительная оценка эффекта гуманизированной версии мышиного B-F5 антитела у пациентов, также принимающих нестероидное противовоспалительное лекарственное средство Диклофенак, предоставила указания на эффективную иммуносупрессию, отраженную положительным клиническим эффектом у пациентов, при использовании в 10-дневном курсе лечения.
Также описано исследование Wijdenes et al., в реферате и постере, представленных на конференции EULAR, Июнь 2005. Эти авторы описали лечение 11 пациентов, страдающих ревматоидным артритом, 5 внутривенными инфузиями по 5 мг hB-F5 через день с сопутствующим лечением 150 мг Диклофенака (Wijdenes et al., Реферат и постер, конференция EULAR, Июнь 2005).
В WO 2004/083247 было отмечено, что антитело обладало способностью к активации конкретной субпопуляции CD4+ Т-клеток, а именно CD4+CD25+ регуляторных Т-клеток (Treg). Эти клетки составляют 5-10% от периферических CD4+ Т-клеток и при однократной стимуляции являются компетентными для подавления ответа CD4+ Т-клеток и CD8+ Т-клеток, а также ингибирования активации B-клеток и клональной экспансии. Таким образом, эти клетки представляют важный уровень управления в иммунной системе. В частности, CD4+CD25+Treg клетки вовлечены в поддержание иммунного гомеостаза на периферии и регуляцию аутоиммунитета и патогенных иммунных ответов.
Лечение ревматоидного артрита через механизм, который активирует CD4+CD25+ регуляторные Т-клетки, представляет важное направление исследований, и применение hB-F5 средства на фазе II клинических испытаний на пациентах, страдающих ревматоидным артритом, обсуждается в Международных патентных заявках под номерами PCT/EP2009/052809, PCT/EP2009/052811 и PCT/EP2009/052810.
Однако невозможно с легкостью предсказать, может ли любой новый способ лечения успешно сочетаться с принятыми в настоящее время терапиями с получением благоприятного терапевтического эффекта. Как упомянуто выше, это конкретно относится к случаю с MTX.
В нескольких исследованиях сообщалось о результатах, которые позволяют предположить, что MTX обладает отрицательным воздействием на регуляторные Т-клетки, и, следовательно, вероятно, следует предотвращать использование MTX в комбинационной терапии вместе со средством, действие которого основано на активации CD4+CD25+ регуляторных Т-клеток для их терапевтического механизма. Wascher et al., (1994) и Herman et al., (2005) сообщают о результатах, которые позволяют предположить, что MTX может снижать количество доступных Т-лимфоцитов. Wascher et al. сообщили, что введение высокой дозы MTX, даваемого внутривенно, через 12 недель значительно (P<0,01) снижало общее количество периферических лимфоцитов крови и приводило к выраженному перераспределению субпопуляций лимфоцитов с предпочтительным подавлением B-лимфоцитов (P<0,005) и Т-лимфоцитов (P<0,05). Herman et al., 2005, сообщили о эффекте MTX на индуцирование апоптоза в Т-лимфоцитах in vitro, при концентрациях, отражающих низкодозовую терапию пациентов с RA (7,5 мг).
Дополнительно, в исследовании in vitro, проведенном Porter et al., 2006, сообщалось о влиянии MTX на жизнеспособность регуляторных Т-клеток. При концентрациях in vitro, равных 50 нM (наивысшая анализируемая концентрация) суппрессорная активность Treg клеток значительно снижалась от 94% до 88% (p<0,05). Этот факт позволяет предположить, что присутствие MTX может ингибировать подавление Treg.
Еще дополнительно, Yamaguchi et al., 2007, сообщали, что природные Treg клетки конститутивно экспрессируют высокие количества фолатного рецептора 4 (FR4). Так как MTX является аналогом фолата, предполагают, что MTX может также поглощаться Treg клетками. Такое поглощение, вероятно, приводит к вмешательству в метаболизм в данной клеточной популяции.
Кроме того, известно, что на терапевтическую активность многих антител оказывают влияние Fc рецепторы на клетках, экспрессирующих Fc рецептор. Для некоторых антител даже является необходимым связаться с Fc рецепторами на клетках, экспрессирующих Fc рецептор, чтобы быть активными. Однако известно, что терапия MTX приводит к уменьшению экспрессии Fc гамма R1 на моноцитах (Wijngaarden et al., 2004, 2005) in vivo. Подавляющее влияние MTX на экспрессию Fc рецептора на моноцитах было также продемонстрировано у пациентов, которые проходили лечение MTX и терапевтическим антителом анти-TNF-альфа Инфликсимаб (Wijngaarden et al., 2008). В результате, в целом, считают, что MTX отрицательно влияет на активность антител, связывающихся с Fc рецептором. Соответственно, ожидается, что MTX будет отрицательно влиять на способность антитела к активации Treg.
С учетом вышесказанного, ожидают, что MTX будет иметь отрицательное воздействие на терапевтическую способность средства, которое действует через активацию CD4+CD25+ регуляторных Т-клеток, таких как hB-F5. По существу, очевидно, что клинический результат подходов, связанных с комбинационным лечением, не может быть предсказан.
Имеющая отношение к описанному выше уровню предшествующего уровня техники задача настоящего изобретения состоит в дополнительной разработке и улучшении фармацевтических композиций для лечения ревматоидного артрита.
Соответственно, настоящее изобретение предоставляет фармацевтическую композицию, содержащую средство, способное к активации CD4+CD25+ регуляторных Т-клеток, и метотрексат. Настоящее изобретение дополнительно предоставляет набор, содержащий раздельно средство, способное к активации CD4+CD25+ регуляторных Т-клеток, и метотрексат.
Авторы настоящего изобретения неожиданно обнаружили, что комбинация средства, способного к активации CD4+CD25+ регуляторных Т-клеток, с метотрексатом, обладает терапевтическим эффектом и является на удивление более эффективной по отношению к сниженному количеству относящихся к антителу побочных эффектов. Данная комбинация также является на удивление более эффективной в плане скорости, при которой достигается высокий уровень терапевтического эффекта.
Соответственно, настоящее изобретение также предоставляет способ лечения ревматического заболевания у пациента, включающий стадию (a) введения средства, способного к активации CD4+CD25+ регуляторных Т-клеток, и стадию (b) введения метотрексата, где стадия (a) и стадия (b) могут быть проведены одновременно, раздельно или последовательно и в любом порядке.
Дополнительно, настоящее изобретение предоставляет способ лечения ревматического заболевания у пациента, проходящего лечение метотрексатом, включающий стадию введения средства, способного к активации CD4+CD25+ регуляторных Т-клеток. Альтернативно, настоящее изобретение предоставляет способ лечения ревматического заболевания у пациента, проходящего лечение средством, способным к активации CD4+CD25+ регуляторных Т-клеток, включающий стадию введения метотрексата.
Еще дополнительно, настоящее изобретение предоставляет способ лечения ревматоидного артрита у пациента, который не реагирует на лечение модифицирующим заболевание противоревматическим лекарственным средством (DMARD), включающий стадию (a) введения средства, способного к активации CD4+CD25+ регуляторных Т-клеток, и стадию (b) введения метотрексата, где стадия (a) и стадия (b) могут быть проведены одновременно, раздельно или последовательно и в любом порядке.
В дополнение, настоящее изобретение предоставляет средство, способное к активации CD4+CD25+ регуляторных Т-клеток, и метотрексат в качестве комбинированного препарата для одновременного, раздельного или последовательного применения в медицине. В одном аспекте, настоящее изобретение предоставляет средство, способное к активации CD4+CD25+ регуляторных Т-клеток, и метотрексат в качестве комбинированного препарата для одновременного, раздельного или последовательного применения при лечении ревматического заболевания. В альтернативном аспекте настоящее изобретение предоставляет средство, способное к активации CD4+CD25+ регуляторных Т-клеток для применения при лечении ревматического заболевания у пациента, где пациент проходит лечение метотрексатом. В дополнительном альтернативном аспекте, настоящее изобретение предоставляет композицию, содержащую метотрексат, для применения при лечении ревматического заболевания у пациента, где пациент проходит лечение средством, способным к активации CD4+CD25+ регуляторных Т-клеток.
В еще дополнительном аспекте настоящее изобретение предоставляет средство, способное к активации CD4+CD25+ регуляторных Т-клеток, и метотрексат, в качестве комбинированного препарата для одновременного, раздельного или последовательного применения при лечении ревматического заболевания у пациента, который не реагирует на лечение модифицирующим заболевание противоревматическим лекарственным средством (DMARD).
Изобретение будет проиллюстрировано посредством только примера, со ссылкой на следующие фигуры, в которых:
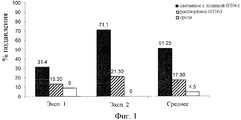
Фиг.1 показывает результаты анализа пролиферации in vitro, проведенной с CD4+CD25+ регуляторными Т-клетками, взятыми от двух доноров (Эксп. 1 и Эксп. 2) в Примере 1.
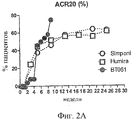
Фиг.2А и 2B показывают графики % пациентов, достигающих, по меньшей мере, балльной оценки ACR 20 при прохождении клинического испытания, описанного в Примере 2, по сравнению с пациентами в наиболее эффективных дозовых группах, о которых сообщается на фазе III испытаний, в публикации Keystone et al., (2004) и (2009). График на Фиг.2B является скорректированным с учетом плацебо.
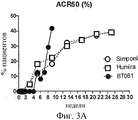
Фиг.3А и 3B показывают графики % пациентов, достигающих, по меньшей мере, балльной оценки ACR 50 при прохождении клинического испытания, описанного в Примере 2, по сравнению с пациентами в наиболее эффективных дозовых группах, о которых сообщается на фазе III испытаний, в публикации Keystone et al., (2004) и (2009). График на Фиг.3B является скорректированным с учетом плацебо.
Фиг.4A и 4B показывают графики % пациентов, достигающих, по меньшей мере, балльной оценки ACR 70 при прохождении клинического испытания, описанного в Примере 2, по сравнению с пациентами в наиболее эффективных дозовых группах, о которых сообщается на фазе III испытаний, в публикации Keystone et al., (2004) и (2009). График на Фиг.4B является скорректированным с учетом плацебо.
Фиг.5 показывает нуклеотидную последовательность (SEQ ID NO: 3) фрагмента плазмиды, кодирующего VH область гуманизированного B-F5. Последовательность, кодирующая V область, подчеркнута, и соответствующая полипептидная последовательность (SEQ ID NO: 15) указана ниже нуклеотидной последовательности;
Фиг.6 показывает нуклеотидную последовательность (SEQ ID NO: 4) фрагмента плазмиды, кодирующего VK области гуманизированного B-F5. Последовательность, кодирующая V область, подчеркнута, и соответствующая полипептидная последовательность (SEQ ID NO: 2) указана ниже нуклеотидной последовательности;
Фиг.7 показывает выравнивание полипептидных последовательностей мышиного B-F5 VK (SEQ ID NO: 6), FK-001 (SEQ ID NO: 7, 8, 9 и 10), L4L (SEQ ID NO: 16) и L4M (SEQ ID NO: 2) в конструкции гуманизированной формы B-F5 (т.е. BT061).
Фиг.8 показывает выравнивание полипептидных последовательностей мышиного B-F5 VH (SEQ ID NO: 5), M26 (SEQ ID NO: 11, 12, 13 и 14), H37L (SEQ ID NO: 1) и H37V (SEQ ID NO: 15) в конструкции гуманизированной формы B-F5.
Как описано выше, настоящее изобретение предоставляет фармацевтическую композицию, содержащую средство, способное к активации CD4+CD25+ регуляторных Т-клеток, и метотрексат. Настоящее изобретение дополнительно предоставляет набор, содержащий раздельно средство, способное к активации CD4+CD25+ регуляторных Т-клеток, и метотрексат.
Средство, способное к активации CD4+CD25+ регуляторных Т-клеток, и метотрексат могут находиться в виде единственной готовой лекарственной формы или в раздельных готовых лекарственных формах. Готовые лекарственные формы могут состоять из средства и/или метотрексата. Альтернативно, готовые формы могут содержать средство и/или метотрексат и дополнительно содержать фармацевтически приемлемые компоненты, такие как носители или эксципиенты.
В одном аспекте изобретения средство и/или метотрексат приспособлены для парентерального введения, предпочтительно внутримышечного, внутривенного или подкожного введения. Наиболее предпочтительно, чтобы средство и/или метотрексат были пригодными для подкожного введения.
В одном варианте осуществления этого аспекта изобретения средство и/или метотрексат приспособлены для внутривенного введения и предоставлены в объеме дозировки от 0,5 до 500 мл или в форме для разведения до объема дозировки от 0,5 до 500 мл. В альтернативном варианте осуществления композиция является пригодной для подкожного или внутримышечного введения и предоставлена в объеме дозировки от 0,1 до 3 мл. Альтернативно, средство и/или метотрексат являются пригодными для предоставления объема дозировки от 0,5 до 1,5 мл или от 15 до 25 мл.
В альтернативном аспекте метотрексат приспособлен для перорального введения и может быть представлен в форме таблетки.
В дополнительных аспектах изобретения композиция или набор могут быть пригодными для применения в виде однократной дозы или пригодными для применения в виде части множества доз, в частности, когда доза должна вводиться еженедельно, однократно каждые две недели, однократно каждые четыре недели, однократно каждые шесть недель или однократно каждые восемь недель.
В одном варианте осуществления этого аспекта набор по изобретению содержит множество раздельных доз средства и метотрексата. В дополнительном варианте осуществления предоставлена упаковка для дозировки, содержащая множество раздельно упакованных доз фармацевтической композиции.
В одном конкретном варианте осуществления средство, необязательно вместе с метотрексатом, является пригодным для подкожного введения и предоставлено в готовой для введения форме, которая не требует разведения, так, чтобы они могли легко вводиться немедицинским персоналом.
Средства, которые являются пригодными для применения в настоящем изобретении, представляют собой такие средства, которые являются способными к активации CD4+CD25+ регуляторных Т-клеток. Средство может представлять собой полипептид, белок или антитело. Когда средство представляет собой антитело, оно может являться моноклональным антителом. Предпочтительно, антитело представляет собой моноклональное антитело анти-CD4. Антитело может также предпочтительно являться IgG1 антителом и может быть немодифицированным IgG1 антителом.
Антитела, которые являются наиболее пригодными для применения в настоящем изобретении, являются гуманизированными анти-CD4 антителами или их фрагментами, или производными, которые являются способными к активации CD4+CD25+ регуляторных Т-клеток. Примеры антител, которые являются способными к активации CD4+CD25+ регуляторных Т-клеток, обсуждаются в Becker et al., (European Journal of Immunology (2007), Vol. 37: стр. 1217-1223) и описаны в WO 2004/083247.
В общем случае, антитело, применяемое в изобретении, содержит один или более вариабельных доменов, которые способны к связыванию с CD4. Антитело может содержать человеческую константную область (Fc). Эта константная область может быть выбрана среди константных доменов из любого класса иммуноглобулинов, включая IgM, IgG, IgD, IgA и IgE и любой изотип, включая IgG1, IgG2, IgG3 и IgG4. Предпочтительные константные области выбирают среди константных доменов IgG, в частности IgG1.
Настоящее изобретение также включает любой фрагмент антитела. Фрагменты предпочтительно содержат антигенсвязывающие или V области антитела, и представляют собой, конкретно, Fab, Fab', F(ab)'2, Fv и scFv фрагменты.
В особенно предпочтительном аспекте настоящего изобретения антитело представляет собой гуманизированное анти-CD4 антитело или его фрагмент, или производное, полученное из мышиного моноклонального анти-CD4 антитела B-F5. Антитело может представлять собой гуманизированное антитело анти-CD4, которое содержит последовательность, содержащую области, определяющие комплементарность (CDR) мышиного моноклонального антитела B-F5, необязательно с вариациями в последовательности, которые не оказывают существенного воздействия на специфичность антитела и/или его аффинность.
Примеры антител предоставлены в WO 2004/083247, в которой раскрыто получение некоторых гуманизированных версий мышиного B-F5 антитела. В частности, WO 2004/083247 раскрывает получение гуманизированного антитела BT061 (hB-F5), имеющего V домены, определяемые следующими полипептидными последовательностями:
- H цепь V домен:
- L цепь V домен:
Производные этого антитела также являются пригодными для применения в настоящем изобретении. Производные включают производные с V доменами, определяемые полипептидными последовательностями, имеющими, по меньшей мере, 80%, предпочтительно, по меньшей мере, 90%, наиболее предпочтительно, по меньшей мере, 95% идентичность последовательности с SEQ ID NO: 1 или SEQ ID NO: 2.
Особенно предпочтительными антителами являются такие, которые содержат области, определяющие комплементарность (CDR) мышиного B-F5 mAb, и сохраняют способность hB-F5 активировать CD4+ CD25+ регуляторные Т-клетки. Расположение CDR внутри VH и VK доменов показано на Фиг.7 и 8. Такие антитела могут необязательно иметь вариации в последовательности CDR, которые не оказывает существенного воздействия на специфичность и/или сродство к связыванию.
В целом, антитело, используемое в изобретении, дополнительно содержит человеческую константную область (Fc). Эта константная область может быть выбрана из константных доменов, указанных выше.
Настоящее изобретение также включает любой фрагмент hB-F5 антитела или его производного, содержащий его V области. Этот фрагмент содержит, в частности, Fab, Fab', F(ab)'2, Fv и scFv фрагменты.
Чтобы получить hB-F5 антитело, полинуклеотид, кодирующий V домены H цепи или L цепи антитела BT061, может быть гибридизирован с полинуклеотидом, кодирующим константную область человеческой H или L цепи. С целью экспрессии полных H и L цепей, полученных таким образом, может также быть добавлена последовательность, кодирующая сигнальный пептид, обеспечивающий секрецию белка.
Полинуклеотид, как описано выше, связан в векторе экспрессии с соответствующими контрольными последовательностями, обеспечивающими регуляцию его транскрипции и трансляции в выбранной клетке-хозяине. Эти конструкции рекомбинантной ДНК могут быть получены и внедрены в клетки-хозяева посредством хорошо известных методов рекомбинантных ДНК и генной инженерии.
Применимые клетки-хозяева могут представлять собой прокариотические или эукариотические клетки. Среди пригодных эукариотических клеток можно упомянуть посредством примера растительные клетки, клетки дрожжей, таких как Saccharomyces, клетки насекомых, таких как Drosophila или Spodoptera, и клетки млекопитающих, таких как HeLa, CHO, 3T3, C127, BHK, COS и т.д.
BT061 (hB-F5) антитело, используемое в изобретении, может быть получено посредством культивирования клетки-хозяина, содержащей вектор экспрессии, включающий последовательность нуклеиновой кислоты, кодирующую указанное антитело, при условиях, пригодных для его экспрессии, и извлечения указанного антитела из культуры клетки-хозяина.
Дополнительным аспектом изобретения является способ, включающий набор или фармацевтическую композицию, содержащие средство и метотрексат.
Как указано выше, настоящее изобретение дополнительно предоставляет медицинские применения и способы лечения пациентов, страдающих от ревматических заболеваний или подверженных им. В частности, в одном аспекте предоставлен способ лечения ревматического заболевания у пациента, включающий стадию (a) введения средства, способного к активации CD4+CD25+ регуляторных Т-клеток, и стадию (b) введения метотрексата, где стадия (a) и стадия (b) могут быть проведены одновременно, раздельно или последовательно и в любом порядке. В одном варианте осуществления этого аспекта стадию (a) и стадию (b) проводят в один и тот же день. В альтернативном варианте осуществления этого аспекта стадию (a) и стадию (b) проводят в пределах одной и той же недели.
В альтернативных аспектах, настоящее изобретение предоставляет способ лечения ревматического заболевания у пациента, проходящего лечение метотрексатом, включающий стадию введения средства, способного к активации CD4+CD25+ регуляторных Т-клеток, и способ лечения ревматического заболевания у пациента, проходящего лечение средством, способным к активации CD4+CD25+ регуляторных Т-клеток, включающий стадию введения метотрексата.
Ревматические заболевания определяют как заболевания, поражающие соединительную ткань, особенно суставы и относящиеся к ним структуры, конкретно, характеризуемые воспалением, дегенерацией или метаболическим нарушением. В предпочтительном аспекте изобретения ревматическое заболевание представляет собой ревматоидный артрит, псориатический артрит, ювенильный ревматоидный артрит или анкилозирующий спондилит.
Лечение ревматоидного артрита является предпочтительным. В случае ревматоидного артрита клиническую эффективность лечения можно оценить с использованием балльной оценки по шкале ACR.
Балльная оценка по шкале ACR представляет собой метод оценки ревматоидного артрита, проявляемого пациентом, проходящим лечение, предложенный Американским Колледжем Ревматологии (ACR) и осуществляемый посредством измерения базового набора параметров (Felson et al, Arthritis & Rheumatism, 1995, 38(6), 727-735). Эта система определяет значение ACR, равное 20 как, по меньшей мере, 20% улучшение по результатам подсчета болезненности и набухания сустава и, по меньшей мере, 20% улучшение в 3 из 5 остающихся измерений из базового набора ACR: глобальные оценки пациента и терапевта, боль, потеря трудоспособности и реагент острой фазы, такие как С-реактивный белок (CRP) или Скорость Осаждения Эритроцитов (СОЭ). Подобным образом, балльные оценки ACR 50 и ACR 70 определяют, по меньшей мере, 50% и, по меньшей мере, 70% улучшение, соответственно.
В дополнительном аспекте изобретения лечение может назначаться пациенту, который не реагирует на лечение модифицирующим заболевание противоревматическим лекарственным средством (DMARD). Субъект, не реагирующий на лечение, представляет собой пациента, который проявляет неадекватный ответ на лечение DMARD. В частности, пациент показывает неадекватный ответ, если он/она имеет продолжительный клинически активный ревматоидный артрит, например, если лекарственное средство не позволяет достичь ACR20 у пациента или не позволяет достичь ингибирования развития структурного повреждения в суставах, или если первоначальный ответ на лекарство потерян в течение времени лечения.
Примеры DMARD представляют собой, например, гидроксихлорохин, сульфасалазин, метотрексат, пенициллинамин, циклофосфамид, соли золота, азотиоприн, лефлуномид и т.д.
Как указано выше, средство и метотрексат могут вводиться пациенту любым пригодным образом. В частности, они могут вводиться парентерально, например, посредством внутривенной, внутримышечной или подкожной инъекции. Для введения средства внутривенное или подкожное введение является особенно предпочтительным. Дополнительно, метотрексат может вводиться перорально.
Объем, в котором дозируют средство и/или метотрексат, будет варьировать в зависимости от способа введения. Когда доза должна вводиться посредством внутривенной инфузии, объем дозировки может составлять от 0,1 или 0,5 мл вплоть до 500 мл, предпочтительно между 15 и 25 мл и обычно приблизительно 20 мл. Когда доза должна вводиться посредством подкожной или внутримышечной инъекции, объем дозировки может составлять между 0,1 и 3 мл, предпочтительно между 0,5 и 1,5 мл и обычно приблизительно 1 мл.
Частоту введения не ограничивают конкретно, при условии, что это не влияет на эффективность лечения. Лечение может включать в себя единичную дозу или множество доз. Является предпочтительным, чтобы множество доз вводилось на, по меньшей мере, следующих основаниях: еженедельно, каждые две недели, каждые 4 недели, каждые 6 недель, каждые 12 недель, каждые 24 недели, каждый календарный месяц, каждые 6 календарных месяцев или ежегодно. Таким образом, дозы могут быть разделены на, по меньшей мере, одну неделю, или на, по меньшей мере, две недели, на, по меньшей мере, один месяц, или на, по меньшей мере, 3 месяца, или на, по меньшей мере, 6 месяцев, или на, по меньшей мере, один год (что означает, что дозы принимают каждую неделю, каждые две недели, или каждый месяц, или каждые 6 месяцев, или каждый год). Особенно предпочтительно, чтобы дозы вводились, по меньшей мере, каждые две-три недели.
Продолжительность лечения особенно не ограничивают, и, что является обычным при лечении аутоиммунных заболеваний, лечение протекает неопределенно долго или до тех пор, пока симптомы не снизятся до управляемого уровня для пациента. В общем случае, лечение назначают субъекту на, по меньшей мере, 1 месяц.
Следует понимать, что средство и метотрексат должны вводиться в терапевтически эффективных количествах, т.е. в количествах, которые являются эффективными для улучшения протекания, предотвращения или лечения ревматического заболевания.
В частности, когда заболевание представляет собой ревматоидный артрит, средство и метотрексат предпочтительно вводят в количестве, которое является эффективным для предоставления ACR50 ответа, более предпочтительно ACR70 ответа.
В одном аспекте изобретения средство должно вводиться субъекту в дозе от 0,2 до 10 мг и, более предпочтительно, в дозе от 0,2 до 6,25 мг и, наиболее предпочтительно, в дозе от 0,2 до 3 мг. Эти дозы являются особенно предпочтительными, когда дозу вводят внутривенно.
Когда средство представляет собой гуманизированное антитело BT061, авторы изобретения неожиданно обнаружили, что значения эффективной Cmax антитела, циркулирующего в плазме здоровых добровольцев через 3 часа после окончания внутривенной инфузии, являются намного более низкими, чем ожидалось, как показано в Таблице 1, ниже. Считают, что это отражает более быстрый опосредованный мишенью клиренс.
| Таблица 1 Ожидаемые и эффективные уровни BT061 в плазме после внутривенного введения. Указан интервал уровней в плазме, измеренных у трех здоровых добровольцев на дозовую группу. |
|||
| Дозировка (мг) | Уровень в плазме (мкг/мл) | ||
| Теоретическая Cmax | Эффективная Cmax (после окончания инфузии) | Концентрация через 3 ч после окончания инфузии | |
| 2,5 | 0,71 | 0,06-0,14 | 0 |
| 5 | 1,43 | 0,32-0,44 | 0,09-0,16 |
| 10 | 2,86 | 0,8-2,0 | 0,46-1,4 |
| 20 | 5,71 | 2,3-4,1 | 1,7-3,3 |
| 40 | 11,43 | 5,9-6,5 | 4,4-6,1 |
| 60 | 17,14 | 8,9-15,1 | 7,7-11,08 |
Соответственно, в предпочтительном варианте осуществления изобретения от 0,2 до 10 мг средства вводят внутривенно, и максимальная концентрация средства в плазме пациента через три часа после введения составляет меньше чем 2,5 мкг/мл. Предпочтительно, от 0,2 до 5 мг средства вводят внутривенно, и максимальная концентрация средства в плазме пациента через три часа после введения составляет меньше чем 0,3 мкг/мл. Еще более предпочтительно, от 0,5 до 3 мг средства вводят внутривенно, и максимальная концентрация средства в плазме пациента через три часа после введения составляет меньше чем 0,1 мкг/мл. Эти значения получают после любого введения и/или после первого и/или второго введения средства.
Доза может также быть рассчитана на основании площади поверхности тела (BSA) субъекта. Площадь поверхности тела (BSA) может быть рассчитана в соответствии с любым известным методом. Примеры методов расчета BSA представляют собой: Формула Mosteller (BSA (м2) = ([Рост(см) × Масса тела(кг)]/3600)1/2 (Mosteller RD., N Engl J Med 1987 Oct 22;317(17):1098); DuBois и формула DuBois BSA (м2) = 0,20247 × Рост(м)0,725 × Масса тела(кг)0,425 (DuBois D; DuBois EF., Arch Int Med 1916 17:863-71); формула Haycock BSA (м2) = 0,024265 × Рост(см)0,3964 × Масса тела(кг)0,5378 (Haycock G.B., et al, Journal of Pediatrics 1978 93:1:62-66); формула Gehan и George BSA (м2) = 0,0235 × Рост(см)0,42246 × Масса тела(кг)0,51456 (Gehan EA и George SL, Cancer Chemother Rep 1970 54:225-35); и формула Boyd: BSA (м2) = 0,0003207 × Рост(см)0,3 × Масса тела(грамм)(0,7285-(0,0188 × LOG(граммы)).
Соответственно, средство может быть введено субъекту в дозе от 0,1 до 5 мг/м2 площади поверхности тела пациента, предпочтительно от 0,1 до 2,5 мг/м2 и, наиболее предпочтительно, от 0,25 до 1,5 мг/м2. Альтернативно, доза может быть рассчитана на основании массы тела субъекта, таким образом, что в дополнительном аспекте изобретения средство должно вводиться субъекту в дозе от 2 до 150 мкг/кг, предпочтительно от 2 до 75 мкг/кг и, наиболее предпочтительно, от 5 до 45 мкг/кг. Как указано выше, особенно предпочтительно, чтобы эти дозировки применялись, когда средство вводят внутривенно.
Как указано выше, в одном аспекте изобретения средство и/или метотрексат вводят подкожно. В целом, как известно в данной области, подкожные дозы должны быть больше, чем внутривенные дозы, чтобы достичь эквивалентного терапевтического эффекта. Авторы настоящего изобретения продемонстрировали при испытаниях монотерапии на пациентах с ревматоидным артритом с антителом BT061, что терапевтический эффект, достигаемый после 2 мг внутривенного введения приблизительно эквивалентен эффекту, достигаемому после 50 мг подкожного введения. Эти результаты представлены ниже в Таблице 2.
| Таблица 2 Процент пациентов с ревматоидным артритом, показавших ACR улучшения на неделе 7 после лечения однократными еженедельными дозами BT061 (2 мг внутривенно или 50 мг подкожно) в течение полного периода лечения, равного шести неделям. Результаты представляют данные, полученные слепым методом от 8 индивидуумов, 2 получавших плацебо и шести, получавших BT061. |
|||
| Неделя 7 | ACR20(%) | ACR50(%) | ACR70(%) |
| 2 мг внутривенно | 50 | 25 | 12,5 |
| 50 мг подкожно | 50 | 25 | 12,5 |
Соответственно, в дополнительном предпочтительном аспекте изобретения средство вводят пациенту подкожно или внутримышечно в дозе от 20 мг до 80 мг и, более предпочтительно от 30 мг до 70 мг. Альтернативно, средство может быть введено в дозировке от 8 до 50 мг/м2 или от 0,2 до 1,5 мг/кг. В данном аспекте изобретения особенно предпочтительным является, чтобы введение осуществляли, по большей мере, приблизительно однократно каждые две недели. Отмечают, что аспекты изобретения, описанные в этом параграфе, могут сочетаться с другими аспектами и предпочтительными признаками изобретения, изложенными в данной заявке.
В соответствии с настоящим изобретением фармацевтическая композиция или набор дополнительно содержат метотрексат (MTX). Лечение RA с помощью MTX является хорошо известным в данной области и предусмотрено, что в настоящем изобретении MTX должен вводиться в дозировках, описанных прежде. В частности, в изобретении MTX обычно вводят в дозе в интервале от 5 до 30 мг, предпочтительно в интервале от 7,5 мг до 30 мг и, наиболее предпочтительно, от 10 до 25 мг. В некоторых случаях доза будет зависеть от предварительного лечения пациента с помощью MTX или переносимости для данного лекарственного средства.
В еще одном аспекте способ изобретения включает дополнительную стадию введения дополнительного терапевтического средства, пригодного для лечения ревматического заболевания. Дополнительные терапевтические средства содержат одно или более из следующих средств: нестероидного противовоспалительного лекарственного средства, противовоспалительного стероида, соединения золота, противомалярийного лекарственного средства, фолиевой кислоты, циклоспорина, лефлуномида, азатиоприна, сульфасалазина, d-пеницилламина, циклофосфамида, микофенолата, миноциклина и хлорамбуцила. Эти дополнительные терапевтические средства могут вводиться раздельно, одновременно или последовательно со средством, способным к активации CD4+CD25+ регуляторных Т-клеток и MTX.
Как упомянуто выше, авторы настоящего изобретения неожиданно показали, что фармацевтическая композиция и набор настоящего изобретения обладают способностью к лечению ревматических заболеваний. В частности, как показано ниже в Примере 2, лечение ревматоидного артрита приводит к значительному улучшению протекания заболевания. Соответственно, в еще дополнительном аспекте изобретения, когда заболевание представляет собой ревматоидный артрит, лечение предоставляет улучшение протекания заболевания у пациента, равное, по меньшей мере, ACR20, предпочтительно, по меньшей мере, ACR 50 и, более предпочтительно, по меньшей мере, ACR 70, в соответствии с балльной системой оценки Американского Колледжа Ревматологии. Другими словами, лечение предоставляет, по меньшей мере, 20%, предпочтительно, по меньшей мере, 50% и, наиболее предпочтительно, по меньшей мере, 70% улучшение параметров заболевания в соответствии с балльной оценкой пациента Американского Колледжа Ревматологии (ACR).
Наиболее предпочтительно, лечение предоставляет, по меньшей мере, ACR 70 ответ у пациента в интервале от 6 до 8 недель после начала лечения.
Как также можно увидеть из Примера 2 и относящихся к нему фигур, лечение настоящего изобретения обладает способностью к улучшению ревматоидного артрита у ряда пациентов. Соответственно, способ лечения настоящего изобретения обладает способностью к лечению ревматоидного артрита, предоставляя, по меньшей мере, улучшение состояния заболевания, равное ACR 20, для, по меньшей мере, 20% пациентов. Дополнительно, способ лечения настоящего изобретения обладает способностью к лечению ревматоидного артрита, предоставляя, по меньшей мере, улучшение состояния заболевания, равное ACR 50, более предпочтительно ACR 70, для, по меньшей мере, 10% пациентов.
Изобретение теперь будет описано дополнительно с использованием следующих примеров.
ПРИМЕР 1: Исследование пролиферации in vitro c антителом BT061, с использованием свежевыделенных CD4+CD25+ регуляторных Т-клеток
Способ
Выделение человеческих CD4+CD25+ регуляторных Т-клеток
Образцы крови по 50 мл с ЭДТА получали от здоровых контрольных доноров. Мононуклеарные клетки периферической крови (PBMC), регуляторные Т-клетки (Treg) и T-хелперные клетки в как T-респондерные клетки (Tresp) выделяли из образцов периферической крови, как описано ранее (Haas et al., 2007).
Исследования пролиферации in vitro
Свежевыделенные Treg предварительно инкубировали в течение 48 часов с 1 мкг/мл антитела, связанного с плашкой (BT061), 1 мкг/мл растворимого BT061 или средой.
Свежевыделенные Treg (2,5×104, донор A), полученные от 2 доноров (Эксп. 1 и Эксп. 2), предварительно инкубировали в течение 48 часов с 1 мкг/мл либо растворимого или связанного с плашкой BT061. Для достижения аллогенной стимуляции, 2,5×104 предварительно инкубированных Treg далее переносили к 1×105 Т-клеток, как клеток-респондеров (Tresp) от второго донора (донор B) в присутствии 2×105 очищенных от T-клеток и облученных (30 Грэй) PBMC (донор A). Через 4 дня после стимуляции добавляли 1 мкКи [3H]-тимидина на лунку и пролиферацию измеряли через дополнительные 16 часов.
Результаты
Процент Treg-опосредованного ингибирования пролиферации показан на Фиг.1, как процент подавления пролиферации Tresp, инкубированных PBMC в отсутствии Treg. Результаты показаны для Treg, полученных от двух доноров (Эксп. 1 и Эксп. 2). Заштрихованные столбцы представляют результаты, полученные с Treg клетками, предварительно инкубированными с растворимым антителом, в то время как зачерненные столбцы представляют результаты, полученные с Treg клетками, предварительно инкубированными с антителом, связанным с плашкой. В качестве контроля показана супрессивная активность обработанных средой Treg (полые столбцы). Числа сверху столбцов представляют процент ингибирования пролиферации Tresp.
Как показывает Фиг.1, Treg, предварительно инкубированные со связанным с плашкой или растворимым антителом, обладали способностью понижать средние пролиферативные ответы от аллогенных стимулированных Tresp в отличие от Treg, инкубированных только со средой. Дополнительно, подавление, полученное со связанным с плашкой антителом, было сильнее по сравнению с подавлением, полученным с растворимым антителом.
В физиологических условиях in vivo ожидают, что BT061 как IgG1 антитело будет связываться с Fc рецепторами на клетках, экспрессирующих Fc рецептор. Это взаимодействие будет приводить к рекрутингу гомогенно распределенного BT061 (связанного с CD4) в локальный участок взаимодействия клеток-мишеней и клеток, экспрессирующих Fc рецептор, приводя к сшивке BT061 и, таким образом, CD4. Ожидают, что взаимодействие BT061 с клетками, экспрессирующими Fc рецептор, обеспечивает передачу сходного сигнала Treg клеткам-мишеням, как наблюдается с антителом, связанным с плашкой, так как оба механизма рекрутируют несколько молекул мишеней (CD4) в тесную близость на поверхности клетки.
ПРИМЕР 2: Клиническое испытание у пациентов с ревматоидным артритом
Способность фармацевтических композиций и наборов по настоящему изобретению предоставлять эффективное лечение RA было продемонстрировано у пациентов, страдающих от RA.
Комбинационное испытание, в котором BT061 исследовали в комбинации с MTX, включало в себя рандомизированное плацебо-контролируемое двойное слепое на фазе II исследование, проводимое на пациентах с RA от умеренного до тяжелого. Все пациенты принимали стабильные дозы MTX в течение, по меньшей мере, 3 месяцев перед началом испытания, и эти дозы были продолжены у всех пациентов в интервале от 15 до 20 мг в неделю во время прохождения испытания, при пероральном или внутримышечном введении.
Пациенты были разделены на три группы. Пациенты в группе I (14 пациентов) получали 0,5 мг внутривенной дозы BT061 и дозу MTX в интервале от 15 до 20 мг. Пациенты в группе II (42 пациента) получали 2,0 мг внутривенной дозы BT061 и дозы MTX в интервале от 15 до 20 мг. Пациенты в группе III (14 пациентов) получали дозы MTX в интервале от 15 до 20 мг. Пациенты принимали дозы один раз в неделю в течение периода, равного восьми неделям.
Для внутривенного введения средство вводили посредством инфузии в вену предплечья в соответствии с принятыми медицинскими процедурами.
Эффективность лечения оценивали еженедельно в течение периода дозирования и в течение ряда недель после завершения дозирования, посредством оценки параметров ACR (Американское Общество Ревматологии, домашняя страница ACR), и, конкретно, исследуя число болезненных и набухших суставов и определяя уровни С-реактивного белка (CRP) и скорость осаждения эритроцитов (СОЭ). Эти параметры также оценивали перед испытанием для получения значения "базовой линии" в день 0.
Результаты испытания показаны на Фиг.2-4, на которых данные, полученные от пациентов в дозовой группе II, получавшей дозы 2 мг BT061+MTX, сравнивают с наиболее эффективными дозовыми группами, полученными в двух испытаниях с опубликованной фазой III, включающей антитела анти-TNF-альфа, Humira (адалимумаб), Keystone et al., (2004 - испытание DE019) и Simponi (голимумаб), Keystone et al., (2009 - продолженное испытание). Наиболее эффективные дозовые группы показаны для всех исследований.
Следует отметить, что результаты из предшествующего уровня техники, включенные для сравнительных целей, представляют собой испытания фазы III, в которой дозы фармацевтических композиций были оптимизированы.
В частности, Фиг.2 показывает процентное соотношение пациентов из группы 2 мг, достигающих балльной оценки ACR20, в то время как Фиг.3 и 4 показывают процентное соотношение пациентов из группы 2 мг, достигающих балльных оценок ACR50 и ACR 70, соответственно.
Как можно видеть на фигурах, в клинических испытаниях с терапевтическими антителами анти-TNF-альфа, достижение пика терапевтической активности, как измеряют по улучшению балльной оценки ACR, обычно требует нескольких месяцев. В целом, процент пациентов, показывающих ACR20 ответ, является максимальным и достигает плато через 3 месяца. Для ACR50 плато достигается через 4 месяца, и для ACR70 плато достигается через 6 месяцев.
Однако результаты комбинационной терапии настоящего изобретения показывают ряд различий. В частности, на фигурах, показывающих плацебо-корректированные результаты, можно видеть, что наступление терапевтического эффекта является замедленным; процент пациентов, достигающих балльной оценки ACR20, не поднимается свыше 5% до недели 8. Однако после наступления терапевтический эффект быстро нарастает, так что на неделе 9 процент пациентов, достигающих ACR50, является сравнимым с процентом, достигнутым на фазе III испытаний с антителами к TNF-альфа, Humira и Simponi. Процент пациентов, достигающих ACR20, ACR50 и ACR70, возрастает быстро в интервале между неделями от 7 до 9 таким образом, что на неделе 9 процент ACR20, ACR50 и ACR70 пациентов составляет приблизительно 25%, 18% и 17%, соответственно. Отмечают, что это процентное соотношение пациентов с ACR70 не достигается в испытаниях с Humira и Simponi до наступления 24-26 недель после начала лечения.
В дополнение авторы настоящего изобретения отмечают, что количество неблагоприятных побочных эффектов, наблюдаемых при комбинационной терапии с BT061 и MTX, является более низким, чем наблюдают в испытаниях, осуществляемых с BT061 по отдельности, и, следовательно, MTX обладает способностью снижать побочные эффекты терапевтических антител, которые активируют CD4+CD25+ регуляторные Т-клетки.
Эти результаты демонстрируют эффективность и удивительные преимущества комбинации средства, способного к активации CD4+CD25+ регуляторных Т-клеток и MTX по настоящему изобретению при лечении ревматического заболевания.
Claims (57)
1. Фармацевтическая комбинация для лечения ревматического заболевания, содержащая гуманизированное анти-CD4 антитело, способное к активации CD4+CD25+ регуляторных T-клеток, и метотрексат, где гуманизированное анти-CD4 антитело содержит V домен H цепи, V домен L цепи и константный домен IgG1, при этом (a) V домен H цепи содержит последовательности DCRMY, VISVKSENYGANYAESVRG и SYYRYDVGAWFAY, и V домен L цепи содержит последовательности RASKSVSTSGYSYIY, LASILES и QHSRELPWT; и/или (b) V домен H цепи имеет, по меньшей мере, 80%-ную идентичность последовательности с SEQ ID NO: 1, и V домен L цепи имеет, по меньшей мере, 80%-ную идентичность последовательности с SEQ ID NO: 2.
2. Фармацевтическая комбинация по п.1, где гуманизированное анти-CD4 антитело является пригодным для парентерального введения.
3. Фармацевтическая комбинация по п.2, где гуманизированное анти-CD4 антитело является пригодным для внутримышечного, внутривенного или подкожного введения.
4. Фармацевтическая комбинация по п.1, где метотрексат является пригодным для перорального, внутримышечного, внутривенного или подкожного введения.
5. Фармацевтическая комбинация по п.1, где гуманизированное антитело анти-CD4 имеет V домены, определяемые следующими полипептидными последовательностями:
- H цепь V домен:
EEQLVESGGGLVKPGGSLRLSCAASGFSFSDCRMYWLRQAPGKGLEWIGVISVKSENYGANYAESVRGRFTISRDDSKNTVYLQMNSLKTEDTAVYYCSASYYRYDVGAWFAYWGQGTLVTVSS (SEQ ID NO: 1)
- L цепь V домен:
DIVMTQSPDSLAVSLGERATINCRASKSVSTSGYSYIYWYQQKPGQPPKLLIYLASILESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQHSRELPWTFGQGTKVEIK (SEQ ID NO: 2).
или V домены, содержащие полипептидные последовательности, имеющие, по меньшей мере, 95%-ную идентичность последовательности с SEQ ID NO: 1 и SEQ ID NO: 2.
- H цепь V домен:
EEQLVESGGGLVKPGGSLRLSCAASGFSFSDCRMYWLRQAPGKGLEWIGVISVKSENYGANYAESVRGRFTISRDDSKNTVYLQMNSLKTEDTAVYYCSASYYRYDVGAWFAYWGQGTLVTVSS (SEQ ID NO: 1)
- L цепь V домен:
DIVMTQSPDSLAVSLGERATINCRASKSVSTSGYSYIYWYQQKPGQPPKLLIYLASILESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQHSRELPWTFGQGTKVEIK (SEQ ID NO: 2).
или V домены, содержащие полипептидные последовательности, имеющие, по меньшей мере, 95%-ную идентичность последовательности с SEQ ID NO: 1 и SEQ ID NO: 2.
6. Фармацевтическая комбинация по п.1, где гуманизированное анти-CD4 антитело предназначено для внутривенного введения и предоставлено в объеме дозировки от 0,5 до 500 мл.
7. Фармацевтическая комбинация по п.1, где гуманизированное анти-CD4 антитело предоставлено в объеме дозировки от 0,5 до 1,5 мл.
8. Фармацевтическая комбинация по п.1, где гуманизированное анти-CD4 антитело предоставлено в объеме дозировки от 15 до 25 мл.
9. Фармацевтическая комбинация по п.1, где гуманизированное анти-CD4 антитело пригодно для подкожного или внутримышечного введения и предоставлено в объеме дозировки от 0,1 до 3 мл.
10. Способ лечения ревматического заболевания у пациента, включающий стадию (a) введения гуманизированного анти-CD4 антитела, способного к активации CD4+CD25+ регуляторных Т-клеток, и стадию (b) введения метотрексата, где стадия (a) и стадия (b) могут быть проведены одновременно, раздельно или последовательно и в любом порядке и проводятся в пределах одной и той же недели, где гуманизированное анти-CD4 антитело содержит V домен H цепи, V домен L цепи и константный домен IgG1, при этом (i) V домен H цепи содержит последовательности DCRMY, VISVKSENYGANYAESVRG и SYYRYDVGAWFAY, и V домен L цепи содержит последовательности RASKSVSTSGYSYIY, LASILES и QHSRELPWT; и/или (ii) V домен Н цепи имеет, по меньшей мере, 80%-ную идентичность последовательности с SEQ ID NO: 1, и V домен L цепи имеет, по меньшей мере, 80%-ную идентичность последовательности с SEQ ID NO: 2.
11. Способ лечения ревматического заболевания у пациента по п.10, где ревматическое заболевание выбрано из ревматоидного артрита, псориатического артрита, ювенильного ревматоидного артрита и анкилозирующего спондилита.
12. Способ лечения ревматического заболевания у пациента по п.11, где ревматическое заболевание представляет собой ревматоидный артрит.
13. Способ лечения по п.10, где гуманизированное анти-CD4 антитело вводят парентерально.
14. Способ лечения по п.13, где гуманизированное анти-CD4 антитело вводят внутримышечно, внутривенно или подкожно.
15. Способ лечения по п.10, где метотрексат вводят перорально, внутримышечно, внутривенно или подкожно.
16. Способ лечения по п.10, где гуманизированное анти-CD4 антитело вводят пациенту в количестве от 0,2 до 10 мг.
17. Способ лечения по п.16, где гуманизированное анти-CD4 антитело вводят пациенту в количестве от 0,2 до 5 мг.
18. Способ лечения по п.17, где гуманизированное анти-CD4 антитело вводят пациенту в количестве от 0,5 до 3 мг.
19. Способ лечения по п.16, где гуманизированное анти-CD4 антитело вводят внутривенно, и где максимальная концентрация гуманизированного анти-CD4 антитела в плазме пациента через 3 часа после конца введения составляет меньше, чем 2,5 мкг/мл.
20. Способ лечения по п.17, где гуманизированное анти-CD4 антитело вводят внутривенно, и где максимальная концентрация гуманизированного анти-CD4 антитела в плазме пациента через 3 часа после конца введения составляет меньше, чем 0,3 мкг/мл.
21. Способ лечения по п.18, где гуманизированное анти-CD4 антитело вводят внутривенно, и где максимальная концентрация гуманизированного анти-CD4 антитела в плазме пациента через 3 часа после конца введения составляет меньше, чем 0,1 мкг/мл.
22. Способ лечения по п.16, где гуманизированное анти-CD4 антитело вводят внутривенно однократно каждую неделю, и где максимальная концентрация гуманизированного анти-CD4 антитела в плазме пациента через 3 часа после конца второго введения составляет меньше, чем 2,5 мкг/мл.
23. Способ лечения по п.17, где гуманизированное анти-CD4 антитело вводят внутривенно однократно каждую неделю, и где максимальная концентрация гуманизированного анти-CD4 антитела в плазме пациента через 3 часа после конца второго введения составляет меньше, чем 0,3 мкг/мл.
24. Способ лечения по п.18, где гуманизированное анти-CD4 антитело вводят внутривенно однократно каждую неделю, и где максимальная концентрация гуманизированного анти-CD4 антитела в плазме пациента через 3 часа после конца второго введения составляет меньше, чем 0,1 мкг/мл.
25. Способ лечения по п.16, где гуманизированное анти-CD4 антитело вводят внутривенно однократно каждую неделю, и где максимальная концентрация гуманизированного анти-CD4 антитела в плазме пациента через 3 часа после конца любого введения составляет меньше, чем 2,5 мкг/мл.
26. Способ лечения по п.17, где гуманизированное анти-CD4 антитело вводят внутривенно однократно каждую неделю, и где максимальная концентрация гуманизированного анти-CD4 антитела в плазме пациента через 3 часа после конца любого введения составляет меньше, чем 0,3 мкг/мл.
27. Способ лечения по п.18, где гуманизированное анти-CD4 антитело вводят внутривенно однократно каждую неделю, и где максимальная концентрация гуманизированного анти-CD4 антитела в плазме пациента через 3 часа после конца любого введения составляет меньше, чем 0,1 мкг/мл.
28. Способ лечения по п.10, где гуманизированное анти-CD4 антитело вводят пациенту в количестве от 2 до 150 мкг/кг.
29. Способ лечения по п.28, где гуманизированное анти-CD4 антитело вводят пациенту в количестве от 2 до 75 мкг/кг.
30. Способ лечения по п.29, где гуманизированное анти-CD4 антитело вводят пациенту в количестве от 5 до 45 мкг/кг.
31. Способ лечения по п.10, где гуманизированное анти-CD4 антитело вводят пациенту в количестве от 0,1 до 5 мг/м2 площади поверхности тела пациента.
32. Способ лечения по п.31, где гуманизированное анти-CD4 антитело вводят пациенту в количестве от 0,1 до 2,5 мг/м2 площади поверхности тела пациента.
33. Способ лечения по п.32, где гуманизированное анти-CD4 антитело вводят пациенту в количестве от 0,25 до 1,5 мг/м2 площади поверхности тела пациента.
34. Способ лечения по п.10, где пациенту вводят однократную дозу гуманизированного анти-CD4 антитела.
35. Способ лечения по п.10, где пациенту вводят множество доз гуманизированного анти-CD4 антитела.
36. Способ лечения по п.35, где гуманизированное анти-CD4 антитело и/или метотрексат вводят, по большей мере, каждую неделю.
37. Способ лечения по п.36, где гуманизированное анти-CD4 антитело и/или метотрексат вводят каждые две недели, каждые три недели или каждые четыре недели.
38. Способ лечения по п.10, который включает дополнительную стадию введения дополнительного терапевтического средства, пригодного для лечения заболевания, выбранного из нестероидного противовоспалительного лекарственного средства, противовоспалительного стероида, соединения золота, противомалярийного лекарственного средства, фолиевой кислоты, циклоспорина, лефлуномида, азатиоприна, сульфасалазин, d-пеницилламина, циклофосфамида, микофенолата, миноциклина и хлорамбуцила.
39. Способ лечения по п.10, где лечение предоставляет улучшение заболевания у пациента, равное, по меньшей мере, ACR50, в соответствии с системой балльной оценки Американского Колледжа Ревматологии (ACR).
40. Способ лечения по п.39, где лечение предоставляет улучшение заболевания у пациента, равное, по меньшей мере, ACR70, в соответствии с системой балльной оценки Американского Колледжа Ревматологии (ACR).
41. Способ лечения по п.40, где лечение предоставляет ответ у пациента, равный, по меньшей мере, ACR 70 в интервале от 6 до 8 недель после начала лечения.
42. Способ лечения по любому из пп.10-41, где гуманизированное антитело анти-CD4 имеет V домены, определяемые следующими полипептидными последовательностями:
- H цепь V домен:
EEQLVESGGGLVKPGGSLRLSCAASGFSFSDCRMYWLRQAPGKGLEWIGVISVKSENYGANYAESVRGRFTISRDDSKNTVYLQMNSLKTEDTAVYYCSASYYRYDVGAWFAYWGQGTLVTVSS (SEQ ID NO: 1)
- L цепь V домен:
DIVMTQSPDSLAVSLGERATINCRASKSVSTSGYSYIYWYQQKPGQPPKLLIYLASILESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQHSRELPWTFGQGTKVEIK (SEQ ID NO: 2).
или V домены, содержащие полипептидные последовательности имеющие, по меньшей мере, 95%-ную идентичность последовательности с SEQ ID NO: 1 и SEQ ID NO: 2.
- H цепь V домен:
EEQLVESGGGLVKPGGSLRLSCAASGFSFSDCRMYWLRQAPGKGLEWIGVISVKSENYGANYAESVRGRFTISRDDSKNTVYLQMNSLKTEDTAVYYCSASYYRYDVGAWFAYWGQGTLVTVSS (SEQ ID NO: 1)
- L цепь V домен:
DIVMTQSPDSLAVSLGERATINCRASKSVSTSGYSYIYWYQQKPGQPPKLLIYLASILESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQHSRELPWTFGQGTKVEIK (SEQ ID NO: 2).
или V домены, содержащие полипептидные последовательности имеющие, по меньшей мере, 95%-ную идентичность последовательности с SEQ ID NO: 1 и SEQ ID NO: 2.
43. Способ лечения ревматического заболевания у пациента, проходящего лечение метотрексатом, включающий стадию введения гуманизированного антитела анти-CD4, способного к активации CD4+CD25+ регуляторных Т-клеток, где гуманизированное анти-CD4 антитело содержит V домен Н цепи, V домен L цепи и константный домен IgG1, при этом: (i) V домен Н цепи содержит последовательности DCRMY, VISVKSENYGANYAESVRG и SYYRYDVGAWFAY, и V домен L цепи содержит последовательности RASKSVSTSGYSYIY, LASILES и QHSRELPWT; и/или (ii) V домен H цепи имеет, по меньшей мере, 80%-ную идентичность последовательности с SEQ ID NO: 1, и V домен L цепи имеет, по меньшей мере, 80%-ную идентичность последовательности с SEQ ID NO: 2.
44. Способ лечения ревматического заболевания у пациента по п.43, где ревматическое заболевание выбрано из ревматоидного артрита, псориатического артрита, ювенильного ревматоидного артрита и анкилозирующего спондилита.
45. Способ лечения ревматического заболевания у пациента по п.44, где ревматическое заболевание представляет собой ревматоидный артрит.
46. Способ лечения по любому из пп.43-45, где гуманизированное анти-CD4 антитело имеет V домены Н цепи, определенные посредством SEQ ID NO: 1, и V домены L цепи, определенные посредством SEQ ID NO: 2,
или имеет V домены, содержащие полипептидные последовательности, имеющие, по меньшей мере, 95%-ную идентичность с SEQ ID NO: 1 и SEQ ID NO: 2.
или имеет V домены, содержащие полипептидные последовательности, имеющие, по меньшей мере, 95%-ную идентичность с SEQ ID NO: 1 и SEQ ID NO: 2.
47. Способ лечения ревматического заболевания у пациента, проходящего лечение гуманизированным антителом анти-CD4, способным к активации CD4+CD25+ регуляторных Т-клеток, включающий стадию введения метотрексата, где гуманизированное анти-CD4 антитело содержит V домен H цепи, V домен L цепи и константный домен IgG1, при этом: (i) V домен H цепи содержит последовательности DCRMY, VISVKSENYGANYAESVRG и SYYRYDVGAWFAY, и V домен L цепи содержит последовательности RASKSVSTSGYSYIY, LASILES и QHSRELPWT; и/или (ii) V домен H цепи имеет, по меньшей мере, 80%-ную идентичность последовательности с SEQ ID NO: 1, и V домен L цепи имеет, по меньшей мере, 80%-ную идентичность последовательности с SEQ ID NO: 2.
48. Способ лечения ревматического заболевания у пациента по п.47, где ревматическое заболевание выбрано из ревматоидного артрита, псориатического артрита, ювенильного ревматоидного артрита и анкилозирующего спондилита.
49. Способ лечения ревматического заболевания у пациента по п.48, где ревматическое заболевание представляет собой ревматоидный артрит.
50. Способ лечения по любому из пп.47-49, где гуманизированное анти-CD4 антитело имеет V домены Н цепи, определенные посредством SEQ ID NO: 1, и V домены L цепи, определенные посредством SEQ ID NO: 2,
или имеет V домены, содержащие полипептидные последовательности, имеющие, по меньшей мере, 95%-ную идентичность с SEQ ID NO: 1 и SEQ ID NO: 2.
или имеет V домены, содержащие полипептидные последовательности, имеющие, по меньшей мере, 95%-ную идентичность с SEQ ID NO: 1 и SEQ ID NO: 2.
51. Способ лечения ревматоидного артрита у пациента, который не реагирует на лечение модифицирующим заболевание противоревматическим лекарственным средством (DMARD), включающий стадию (a) введения гуманизированного анти-CD4 антитела, способного к активации CD4+CD25+ регуляторных Т-клеток, и стадию (b) введения метотрексата, где стадия (a) и стадия (b) могут быть проведены одновременно, раздельно или последовательно и в любом порядке и проводятся в пределах одной и той же недели, при этом гуманизированное анти-CD4 антитело содержит V домен H цепи, V домен L цепи и константный домен IgG1, при этом (i) V домен H цепи содержит последовательности DCRMY, VISVKSENYGANYAESVRG и SYYRYDVGAWFAY, и V домен L цепи содержит последовательности RASKSVSTSGYSYIY, LASILES и QHSRELPWT; и/или (ii) V домен H цепи имеет, по меньшей мере, 80%-ную идентичность последовательности с SEQ ID NO: 1, и V домен L цепи имеет, по меньшей мере, 80%-ную идентичность последовательности с SEQ ID NO: 2.
52. Способ лечения ревматоидного артрита у пациента по п.51, где DMARD представляет собой метотрексат.
53. Способ лечения ревматоидного артрита у пациента по п.51 или 52, где гуманизированное анти-CD4 антитело имеет V домены Н цепи, определенные посредством SEQ ID NO: 1, и V домены L цепи, определенные посредством SEQ ID NO: 2,
или имеет V домены, содержащие полипептидные последовательности, имеющие, по меньшей мере, 95%-ную идентичность с SEQ ID NO: 1 и SEQ ID NO: 2.
или имеет V домены, содержащие полипептидные последовательности, имеющие, по меньшей мере, 95%-ную идентичность с SEQ ID NO: 1 и SEQ ID NO: 2.
54. Набор для лечения ревматического заболевания, содержащий раздельно гуманизированное анти-CD4 антитело, способное к активации CD4+CD25+ регуляторных Т-клеток, и метотрексат, где гуманизированное анти-CD4 антитело содержит V домен H цепи, V домен L цепи и константный домен IgG1, при этом (a) V домен H цепи содержит последовательности DCRMY, VISVKSENYGANYAESVRG и SYYRYDVGAWFAY, и V домен L цепи содержит последовательности RASKSVSTSGYSYIY, LASILES и QHSRELPWT; и/или (b) V домен H цепи имеет, по меньшей мере, 80%-ную идентичность последовательности с SEQ ID NO: 1, и V домен L цепи имеет, по меньшей мере, 80%-ную идентичность последовательности с SEQ ID NO: 2.
55. Набор по п.54, где гуманизированное антитело анти-CD4 содержит V домены, определяемые следующими полипептидными последовательностями:
- H цепь V домен:
EEQLVESGGGLVKPGGSLRLSCAASGFSFSDCRMYWLRQAPGKGLEWIGVISVKSENYGANYAESVRGRFTISRDDSKNTVYLQMNSLKTEDTAVYYCSASYYRYDVGAWFA YWGQGTLVTVSS (SEQ ID NO: 1)
- L цепь V домен:
DIVMTQSPDSLAVSLGERATINCRASKSVSTSGYSYIYWYQQKPGQPPKLLIYLASILESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQHSRELPWTFGQGTKVEIK (SEQ ID NO:2).
или V домены, содержащие полипептидные последовательности, имеющие, по меньшей мере, 95%-ную идентичность последовательности с SEQ ID NO: 1 и SEQ ID NO: 2.
- H цепь V домен:
EEQLVESGGGLVKPGGSLRLSCAASGFSFSDCRMYWLRQAPGKGLEWIGVISVKSENYGANYAESVRGRFTISRDDSKNTVYLQMNSLKTEDTAVYYCSASYYRYDVGAWFA YWGQGTLVTVSS (SEQ ID NO: 1)
- L цепь V домен:
DIVMTQSPDSLAVSLGERATINCRASKSVSTSGYSYIYWYQQKPGQPPKLLIYLASILESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQHSRELPWTFGQGTKVEIK (SEQ ID NO:2).
или V домены, содержащие полипептидные последовательности, имеющие, по меньшей мере, 95%-ную идентичность последовательности с SEQ ID NO: 1 и SEQ ID NO: 2.
56. Способ получения фармацевтической комбинации по любому из пп.1-9, включающий стадию комбинирования гуманизированного антитела анти-CD4 и метотрексата, с получением фармацевтической комбинации, где гуманизированное анти-CD4 антитело содержит V домен H цепи, V домен L цепи и константный домен IgG1, при этом (a) V домен H цепи содержит последовательности DCRMY, VISVKSENYGANYAESVRG и SYYRYDVGAWFAY, и V домен L цепи содержит последовательности RASKSVSTSGYSYIY, LASILES и QHSRELPWT; и/или (b) V домен H цепи имеет, по меньшей мере, 80%-ную идентичность последовательности с SEQ ID NO: 1, и V домен L цепи имеет, по меньшей мере, 80%-ную идентичность последовательности с SEQ ID NO: 2.
57. Способ получения набора по п.54 или 55, включающий стадию комбинирования отдельной части, содержащей гуманизированное анти-CD4 антитело, и отдельной части, содержащей метотрексат, с получением набора, где гуманизированное анти-CD4 антитело содержит V домен H цепи, V домен L цепи и константный домен IgG1, при этом (a) V домен H цепи содержит последовательности DCRMY, VISVKSENYGANYAESVRG и SYYRYDVGAWFAY, и V домен L цепи содержит последовательности RASKSVSTSGYSYIY, LASILES и QHSRELPWT; и/или (b) V домен H цепи имеет, по меньшей мере, 80%-ную идентичность последовательности с SEQ ID NO: 1, и V домен L цепи имеет, по меньшей мере, 80%-ную идентичность последовательности с SEQ ID NO: 2.
Applications Claiming Priority (13)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB0817811.3 | 2008-09-29 | ||
| GB0817810.5 | 2008-09-29 | ||
| GB0817810A GB0817810D0 (en) | 2008-09-29 | 2008-09-29 | Agent for treating disease |
| GB0817809.7 | 2008-09-29 | ||
| GB0817811A GB0817811D0 (en) | 2008-09-29 | 2008-09-29 | Agent for treating disease |
| GB0817809A GB0817809D0 (en) | 2008-09-29 | 2008-09-29 | Agent for treating disease |
| EPPCT/EP2009/052810 | 2009-03-10 | ||
| EPPCT/EP2009/052809 | 2009-03-10 | ||
| EPPCT/EP2009/052811 | 2009-03-10 | ||
| PCT/EP2009/052810 WO2009112502A1 (en) | 2008-03-13 | 2009-03-10 | Agent for treating disease |
| PCT/EP2009/052811 WO2009124815A1 (en) | 2008-03-13 | 2009-03-10 | Agent for treating disease |
| PCT/EP2009/052809 WO2009121690A1 (en) | 2008-03-13 | 2009-03-10 | Agent for treating disease |
| PCT/EP2009/061210 WO2010034590A1 (en) | 2008-09-29 | 2009-08-31 | Composition for treating disease |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2011117293A RU2011117293A (ru) | 2012-11-10 |
| RU2531548C2 true RU2531548C2 (ru) | 2014-10-20 |
Family
ID=41138980
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2011117293/10A RU2531548C2 (ru) | 2008-09-29 | 2009-08-31 | Композиция для лечения заболевания |
Country Status (17)
| Country | Link |
|---|---|
| US (1) | US20110229465A1 (ru) |
| JP (2) | JP2012504110A (ru) |
| KR (1) | KR20110061630A (ru) |
| CN (1) | CN102215867B (ru) |
| AU (1) | AU2009296078B2 (ru) |
| BR (1) | BRPI0919489A2 (ru) |
| CA (1) | CA2738598C (ru) |
| CR (1) | CR20110226A (ru) |
| DK (1) | DK2341937T3 (ru) |
| ES (1) | ES2528419T3 (ru) |
| HK (1) | HK1154797A1 (ru) |
| IL (1) | IL211904A (ru) |
| MX (1) | MX2011003335A (ru) |
| PT (1) | PT2341937E (ru) |
| RU (1) | RU2531548C2 (ru) |
| SG (1) | SG194362A1 (ru) |
| WO (1) | WO2010034590A1 (ru) |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1460088A1 (en) | 2003-03-21 | 2004-09-22 | Biotest AG | Humanized anti-CD4 antibody with immunosuppressive properties |
| MX2010010028A (es) * | 2008-03-13 | 2011-08-17 | Biotest Ag | Agente para tratar enfermedad. |
| SG190627A1 (en) * | 2008-03-13 | 2013-06-28 | Biotest Ag | Agent for treating disease |
| EP2262838B1 (en) * | 2008-03-13 | 2016-04-13 | Biotest AG | Agent for treating disease |
| GB0920944D0 (en) | 2009-11-30 | 2010-01-13 | Biotest Ag | Agents for treating disease |
| EP3019193B1 (en) * | 2013-07-10 | 2019-09-25 | The U.S.A. as represented by the Secretary, Department of Health and Human Services | Apoptotic cell-mediated induction of antigen specific regulatory t-cells for the therapy of autoimmune diseases in animals and humans |
| GB202017681D0 (en) * | 2020-11-09 | 2020-12-23 | T Balance Therapeutics Gmbh | Anti-CD4 antibody or fragment thereof for medical use |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1460088A1 (en) * | 2003-03-21 | 2004-09-22 | Biotest AG | Humanized anti-CD4 antibody with immunosuppressive properties |
| RU2316337C2 (ru) * | 2001-04-24 | 2008-02-10 | Мерк Патент Гмбх | КОМБИНИРОВАННАЯ ТЕРАПИЯ, ИСПОЛЬЗУЮЩАЯ АНТИАНГИОГЕННЫЕ СРЕДСТВА И TNF-α |
Family Cites Families (41)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5530101A (en) * | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| US5690933A (en) * | 1989-05-31 | 1997-11-25 | Glaxo Wellcome Inc. | Monoclonal antibodies for inducing tolerance |
| US20020099179A1 (en) * | 1989-12-21 | 2002-07-25 | Linda K. Jolliffe | Cdr-grafted antibodies |
| US5859205A (en) * | 1989-12-21 | 1999-01-12 | Celltech Limited | Humanised antibodies |
| US7084260B1 (en) * | 1996-10-10 | 2006-08-01 | Genpharm International, Inc. | High affinity human antibodies and human antibodies against human antigens |
| EP0512112B1 (en) * | 1990-11-27 | 1997-05-28 | Biogen, Inc. | Anti cd-4 antibodies blocking hiv-induced syncytia |
| US7192584B2 (en) * | 1991-03-18 | 2007-03-20 | Centocor, Inc. | Methods of treating psoriasis with anti-TNF antibodies |
| US6136310A (en) * | 1991-07-25 | 2000-10-24 | Idec Pharmaceuticals Corporation | Recombinant anti-CD4 antibodies for human therapy |
| JPH05244982A (ja) * | 1991-12-06 | 1993-09-24 | Sumitomo Chem Co Ltd | 擬人化b−b10 |
| US5777085A (en) * | 1991-12-20 | 1998-07-07 | Protein Design Labs, Inc. | Humanized antibodies reactive with GPIIB/IIIA |
| US6270766B1 (en) * | 1992-10-08 | 2001-08-07 | The Kennedy Institute Of Rheumatology | Anti-TNF antibodies and methotrexate in the treatment of arthritis and crohn's disease |
| DK0614984T4 (da) * | 1993-03-05 | 2010-12-20 | Bayer Healthcare Llc | Humane monoklonale anti-TNF-alfa-antistoffer |
| EP0631783A1 (en) * | 1993-06-03 | 1995-01-04 | Mitsubishi Chemical Corporation | Antiviral combinations of 2',3'-di-deoxyribonucleosides with 6-benzyl-1-ethoxymethyl-5-substituted uracil derivatives |
| US20020068057A1 (en) * | 1994-03-10 | 2002-06-06 | Marc Feldmann | Treatment of autoimmune and inflammatory disorders |
| US20010056066A1 (en) * | 1996-07-26 | 2001-12-27 | Smithkline Beecham Corporation | Method of treating immune cell mediated systemic diseases |
| DE19722888A1 (de) * | 1997-05-28 | 1998-12-03 | Thomas Prof Dr Huenig | Human-CD28 spezifische monoklonale Antikörper zur antigenunspezifischen Aktivierung von T-Lymphozyten |
| DE60042785D1 (de) * | 1999-06-09 | 2009-10-01 | Immunomedics Inc | Immuntherapie von autoimmunerkrankungen durch die verwendung von b-zell spezifischen antikörpern |
| AU2001275186A1 (en) * | 2000-06-02 | 2001-12-17 | Nicole Kirchhof | Immunotherapeutic method to prevent islet cell rejection |
| KR20040023565A (ko) * | 2000-09-18 | 2004-03-18 | 아이덱 파마슈티칼즈 코포레이션 | B 세포 고갈/면역조절 항체 조합을 이용한 자가면역질환의 치료를 위한 조합 요법 |
| DE10050935A1 (de) * | 2000-10-11 | 2002-05-02 | Tegenero Gmbh | Verwendung CD28 spezifischer monoklonaler Antikörper zur Stimulation von Blutzellen, welche kein CD28 tragen |
| US6726923B2 (en) * | 2001-01-16 | 2004-04-27 | Vascular Therapies, Llc | Apparatus and methods for preventing or treating failure of hemodialysis vascular access and other vascular grafts |
| WO2002072759A2 (en) * | 2001-03-07 | 2002-09-19 | Children's Medical Center Corporation | Method to screen peptide display libraries using minicell display |
| US7541443B2 (en) * | 2001-06-14 | 2009-06-02 | Tolerrx, Inc. | Anti-CD4 antibodies |
| AU2002357427A1 (en) * | 2001-12-04 | 2003-06-17 | Tegenero Ag | Peptide or protein containing a c'-d loop of the cd28 receptor family |
| DE10212108A1 (de) * | 2002-03-13 | 2003-10-02 | Tegenero Ag | Verwendung einer an CD28 bindenden Wirksubstanz zur Herstellung einer pharmazeutischen Zusammensetzung |
| DE10230223A1 (de) * | 2002-07-04 | 2004-01-22 | Tegenero Ag | Mikropartikel mit CD28-spezifischen monoklonalen Antikörpern |
| US7501494B2 (en) * | 2003-01-15 | 2009-03-10 | United Biomedical, Inc. | Designed deimmunized monoclonal antibodies for protection against HIV exposure and treatment of HIV infection |
| JP2006522811A (ja) * | 2003-04-09 | 2006-10-05 | ジェネンテック・インコーポレーテッド | TNFαインヒビターに対して不十分な反応を示す患者の自己免疫疾患治療法 |
| GB0314461D0 (en) * | 2003-06-20 | 2003-07-23 | Isis Innovation | Suppression of transplant rejection |
| EP1600164A3 (de) * | 2003-09-22 | 2006-05-17 | TeGenero AG | Verwendung einer an CD28 bindenden Wirksubstanz zur Herstellung einer Pharmazeutischen Zusammensetzung mit dosisabhängiger Wirkung |
| DE10352900A1 (de) * | 2003-11-11 | 2005-06-16 | Tegenero Ag | Verwendung einer an CD28 bindenden Wirksubstanz zur Herstellung einer pharmazeutischen Zusammensetzung zur Behandlung von B-CLL |
| WO2006035876A1 (ja) * | 2004-09-29 | 2006-04-06 | Kowa Co., Ltd. | 関節リウマチの予防及び/又は治療薬 |
| DE102004063494A1 (de) * | 2004-12-23 | 2006-07-13 | Tegenero Ag | Antikörper |
| JP4730733B2 (ja) * | 2005-05-02 | 2011-07-20 | 国立大学法人京都大学 | 4型葉酸受容体の発現を指標とした制御性t細胞の検出方法、及び免疫賦活剤 |
| SG163615A1 (en) * | 2005-07-11 | 2010-08-30 | Macrogenics Inc | Methods for the treatment of autoimmune disorders using immunosuppressive monoclonal antibodies with reduced toxicity |
| BRPI0615397B1 (pt) * | 2005-08-26 | 2023-10-03 | Roche Glycart Ag | Anticorpo anti-cd20, composição farmacêutica que o contém e uso do mesmo |
| JP2009530290A (ja) * | 2006-03-16 | 2009-08-27 | ジェネンテック・インコーポレーテッド | Cd4抗体を使用するループスの治療方法 |
| SG190627A1 (en) | 2008-03-13 | 2013-06-28 | Biotest Ag | Agent for treating disease |
| EP2262838B1 (en) | 2008-03-13 | 2016-04-13 | Biotest AG | Agent for treating disease |
| MX2010010028A (es) | 2008-03-13 | 2011-08-17 | Biotest Ag | Agente para tratar enfermedad. |
| ES2351456B1 (es) * | 2009-06-24 | 2011-11-28 | Fundacio Institut De Recerca De L'hospital Universitari Vall D'hebron | Metodo in vitro para el pronostico o prediccion de la respuesta por parte de pacientes con artritis reumatoide al tratamiento con agentes que reconocen el receptor de membrana cd20 de los linfocitos b |
-
2009
- 2009-08-31 DK DK09782400.7T patent/DK2341937T3/en active
- 2009-08-31 MX MX2011003335A patent/MX2011003335A/es active IP Right Grant
- 2009-08-31 RU RU2011117293/10A patent/RU2531548C2/ru not_active IP Right Cessation
- 2009-08-31 KR KR1020117009215A patent/KR20110061630A/ko not_active Application Discontinuation
- 2009-08-31 WO PCT/EP2009/061210 patent/WO2010034590A1/en active Application Filing
- 2009-08-31 ES ES09782400.7T patent/ES2528419T3/es active Active
- 2009-08-31 JP JP2011528278A patent/JP2012504110A/ja active Pending
- 2009-08-31 CN CN200980143326.7A patent/CN102215867B/zh not_active Expired - Fee Related
- 2009-08-31 AU AU2009296078A patent/AU2009296078B2/en not_active Ceased
- 2009-08-31 PT PT97824007T patent/PT2341937E/pt unknown
- 2009-08-31 SG SG2013070859A patent/SG194362A1/en unknown
- 2009-08-31 CA CA2738598A patent/CA2738598C/en active Active
- 2009-08-31 BR BRPI0919489A patent/BRPI0919489A2/pt not_active IP Right Cessation
-
2011
- 2011-03-24 IL IL211904A patent/IL211904A/en not_active IP Right Cessation
- 2011-03-29 US US13/074,357 patent/US20110229465A1/en not_active Abandoned
- 2011-04-29 CR CR20110226A patent/CR20110226A/es not_active Application Discontinuation
- 2011-08-29 HK HK11109118.5A patent/HK1154797A1/xx not_active IP Right Cessation
-
2015
- 2015-05-13 JP JP2015097888A patent/JP6154847B2/ja not_active Expired - Fee Related
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2316337C2 (ru) * | 2001-04-24 | 2008-02-10 | Мерк Патент Гмбх | КОМБИНИРОВАННАЯ ТЕРАПИЯ, ИСПОЛЬЗУЮЩАЯ АНТИАНГИОГЕННЫЕ СРЕДСТВА И TNF-α |
| EP1460088A1 (en) * | 2003-03-21 | 2004-09-22 | Biotest AG | Humanized anti-CD4 antibody with immunosuppressive properties |
Non-Patent Citations (1)
| Title |
|---|
| SOUNDARARJAN D., ET AL., Clinical and immunological effects of a primatized anti CD4 antibody used concomentantly with methotrexate in rheumatoid arthritis, Journal of Allergy and Clinical Immunology, 1997, vol.99, N1, part 2, page S193. . LUGGEN M.E., ET AL., Results of a phase II, double-blind, randomized study of a nondepleting anti-CD4 monoclonal antibody (Clenoliximab) given in combination with methotrexate (MTX) in patients with moderate to severe rheumatoid arthritis (RA), Annals of the rheumatic diseases, 01.07.2003, vol.62, no.Suppl.1, p.99. . SOUNDARARJAN D., ET AL., Clinical and immunological effects of a primatized anti CD4 antibody used concomentantly with methotrexate in rheumatoid arthritis, Journal of Allergy and Clinical Immunology, 1997, vol.99, N1, part 2, page S193. . CHOY E.H., ET AL., Pharmacokinetic, pharmacodynamic and clinical effects of a humanized IgG1 anti-CD4 monoclonal antibody in the peripheral blood and synovial fluid of rheumatoid arthritis patients, Rh * |
Also Published As
| Publication number | Publication date |
|---|---|
| US20110229465A1 (en) | 2011-09-22 |
| CR20110226A (es) | 2011-12-05 |
| WO2010034590A1 (en) | 2010-04-01 |
| PT2341937E (pt) | 2015-02-18 |
| MX2011003335A (es) | 2011-04-27 |
| RU2011117293A (ru) | 2012-11-10 |
| IL211904A (en) | 2016-03-31 |
| HK1154797A1 (en) | 2012-05-04 |
| SG194362A1 (en) | 2013-11-29 |
| KR20110061630A (ko) | 2011-06-09 |
| JP2012504110A (ja) | 2012-02-16 |
| CN102215867A (zh) | 2011-10-12 |
| DK2341937T3 (en) | 2015-02-09 |
| CA2738598A1 (en) | 2010-04-01 |
| ES2528419T3 (es) | 2015-02-09 |
| AU2009296078A1 (en) | 2010-04-01 |
| IL211904A0 (en) | 2011-06-30 |
| CN102215867B (zh) | 2017-04-19 |
| JP6154847B2 (ja) | 2017-06-28 |
| BRPI0919489A2 (pt) | 2015-12-01 |
| AU2009296078B2 (en) | 2015-08-20 |
| JP2015172060A (ja) | 2015-10-01 |
| CA2738598C (en) | 2017-11-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5597553B2 (ja) | 疾患治療剤 | |
| JP5795167B2 (ja) | 疾患治療剤 | |
| JP6154847B2 (ja) | 疾患治療組成物 | |
| RU2540018C2 (ru) | Средство для лечения заболевания | |
| RU2607022C2 (ru) | Способы и композиции для лечения волчанки | |
| KR20220028177A (ko) | 류마티스 관절염에 대한 치료 | |
| JP2023113655A (ja) | 小児の障害を処置する方法 | |
| Egan et al. | Treatment of epidermolysis bullosa acquisita with the humanized anti-Tac mAb daclizumab | |
| EP2341937B1 (en) | Composition for treating disease | |
| Ostör | Beyond methotrexate: biologic therapy in rheumatoid arthritis | |
| TW202302146A (zh) | 使用抗baffr抗體治療全身性紅斑狼瘡 | |
| WO2024039268A1 (ru) | Способ лечения заболевания, опосредованного т-лимфоцитами | |
| JP2024517796A (ja) | 抗baffr抗体を使用するループス腎炎の治療 | |
| El-Miedany | The evolving therapy of rheumatic diseases, the future is now | |
| UN IV ERS et al. | EMILIA CHADAJ, AGNIESZKA KRAKOWSKA, ANNA MICHALAK-STOMA, DANIEL PIETRZAK, ALDONA PIETRZAK, DOROTA KRASOWSKA |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20190901 |