RU2496188C2 - Электролит для батареи гальванических элементов - Google Patents
Электролит для батареи гальванических элементов Download PDFInfo
- Publication number
- RU2496188C2 RU2496188C2 RU2010123840/07A RU2010123840A RU2496188C2 RU 2496188 C2 RU2496188 C2 RU 2496188C2 RU 2010123840/07 A RU2010123840/07 A RU 2010123840/07A RU 2010123840 A RU2010123840 A RU 2010123840A RU 2496188 C2 RU2496188 C2 RU 2496188C2
- Authority
- RU
- Russia
- Prior art keywords
- electrolyte
- battery
- gel
- cell
- reaction
- Prior art date
Links
Images
Classifications
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M10/00—Secondary cells; Manufacture thereof
- H01M10/24—Alkaline accumulators
- H01M10/26—Selection of materials as electrolytes
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M2300/00—Electrolytes
- H01M2300/0085—Immobilising or gelification of electrolyte
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E60/00—Enabling technologies; Technologies with a potential or indirect contribution to GHG emissions mitigation
- Y02E60/10—Energy storage using batteries
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T29/00—Metal working
- Y10T29/49—Method of mechanical manufacture
- Y10T29/49002—Electrical device making
- Y10T29/49108—Electric battery cell making
Landscapes
- Engineering & Computer Science (AREA)
- Manufacturing & Machinery (AREA)
- Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Electrochemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Secondary Cells (AREA)
- Hybrid Cells (AREA)
Abstract
Предложенное изобретение относится в основном к неорганическим электролитам, предпочтительно не содержащим атомы углерода, вместе с тем оно применимо к электролитам, которые содержат органические компоненты, такие как ацетонитрил. В заявке описан электролит для батареи гальванических элементов, который содержит двуокись серы и проводящую соль. Электролит представляет собой гель, который образуется с участием фторосульфината. Также описан элемент батареи, который содержит такой электролит. Предложенный электролит обеспечивает высокую плотность допустимого тока и высокую эксплуатационную безопасность. Кроме того, гель обладает тиксотропными свойствами и становится текучим при перемешивании, что удобно при изготовлении элементов батареи. 5 н.п. и 8 з.п. ф-лы, 6 ил.
Description
Изобретение относится к батарее гальванических элементов, более точно, к перезаряжаемым элементам с неводным электролитом. Такие элементы и батареи, состоящие из одного или нескольких таких элементов, необходимы для применения в разнообразных целях. При разработке новых элементов батареи, в частности, ставятся задачи обеспечения высокой плотности энергии, высокой пропускной способности по току (низкого внутреннего сопротивления), длительного срока службы на протяжении множества циклов заряда-разряда, низкой стоимости и высокого уровня эксплуатационной безопасности.
Одним из важных функциональных элементов является электролит, находящийся в контакте с положительным электродом и отрицательным электродом элементов батареи. Электролит содержит проводящую соль. По меньшей мере один ион проводящей соли (анион или катион) электролита является подвижным в том смысле, что за счет ионной проводимости может происходить перенос заряда между электродами, что важно для функционирования элемента.
Изобретение, в частности, относится к электролитам на основе SO2. “Электролит на основе SO2” означает электролит, в котором SO2 по меньшей мере до определенной степени способствует подвижности ионов проводящей соли, содержащейся в электролите, и тем самым обеспечивает перенос заряда, в отличие от электролита, который содержит SO2 в низкой концентрации просто в качестве добавки.
Такой электролит предпочтительно используется в щелочном элементе, у которого активным металлом (состояние окисления которого изменяется при заряде и разряде элемента вследствие реакции, происходящей на отрицательном электроде) является щелочной металл, предпочтительно литий. Тем не менее, активным металлом также может являться щелочноземельный металл второй подгруппы периодической системы. В качестве примера (но без ограничения универсальности) далее в качестве активного металла отрицательного электрода будет в основном иметься в виду литий.
В случае щелочного элемента в качестве проводящей соли предпочтительно используют четырехгалоидный алюминат щелочного металла, например, LiAlCl4. Далее щелочной элемент с электролитом на основе SO2 будет именоваться щелочным элементом на основе SO2. Другими предпочтительными проводящими солями являются алюминаты, галоиды, оксалаты, бораты, фосфаты, арсенаты и галлаты щелочного металла, в частности, лития.
Раствор электролита, используемый для элементов батареи, обычно находится в жидком виде. Например, электролит на основе двуокиси серы с содержанием двуокиси серы по меньшей мере около 0,5 моля SO2 на моль проводящей соли является жидким при комнатной температуре. Одни из основных преимуществ жидких электролитов является их высокая ионная проводимость, поскольку ионы способны легко перемещаться в жидкости. Элементы имеют низкое внутреннее сопротивление и рассчитаны на высокие токи заряда и разряда.
Тем не менее, жидкий электролит имеет не только преимущества, но также и недостатки. Они, в частности, касаются безопасности элементов батареи. Если корпус начинает протекать из-за повреждения или неправильного обращения во время эксплуатации, жидкий электролит, немедленно вытекает, и его летучие компоненты, такие как двуокись серы, испаряются. Вытекающий электролит способен создавать значительные неудобства или даже опасности. Например, вытекающая SO2 является веществом с неприятным запахом. По меньшей мере в случае щелочного элемента жидкий раствор электролита вступает в бурную реакцию при контакте с водой. Помимо образования густых белых облаков, реагирующие компоненты электролита также могут разбрызгиваться, что приводит к раздражающим кожным воспалениям.
Дополнительным недостатком жидких растворов электролита является необходимость сложных приспособлений, чтобы предотвратить замыкание накоротко между внутренними перемычками элемента, которые обеспечивают электрическое соединение между наружными контактами элемент и электродами внутри элемента. Элементы обычно должны быть способны функционировать вне зависимости от их положения, иными словами на них не должна влиять их ориентация в пространстве. Если между внутренними перемычками элемента находится электролит, в этом месте может осаждаться больше металла, такого как литий, поскольку электрическое соединение в этом месте ниже, чем где-либо еще в элементе. В результате, металл осаждается на одном из проводников и в конечном итоге вызывает замыкание накоротко, если он соприкоснется с другим проводником. Для предотвращения этого требуются изощренные способы изоляции.
По этой и другим причинам предпринималось множество попыток с целью устранить риски и недостатки, связанные с жидким электролитом. В частности, что касается органических электролитов, как, например, используемых в ионно-литиевых батареях, предлагалось множество вариантов полимерных электролитов. Хотя они обеспечивают преимущества с точки зрения безопасности, в остальном они по-прежнему имеют значительные недостатки, в частности, с точки зрения электрического сопротивления и, следовательно, также электрической мощности элемента. Относительно оптимальные свойства в этом смысле могут быть получены при использовании “гель-полимерных электролитов”. Краткая информация об этих разработках содержится в публикации A.M. Stephan, “Review on gel polymer electrolytes for lithium batteries”, European Polymer Journal 42 (2006), 21-42.
Настоящее изобретение относится в основном к неорганическим электролитам. Они предпочтительно не содержат атомов углерода. Вместе с тем, изобретение также применимо к электролитам, которые содержат органические компоненты, такие как ацетонитрил.
Что касается неорганических электролитов, например, в EP 1149429 предложено помещать твердофазную соль в пористую структуру вблизи отрицательного электрода элемента таким образом, чтобы она входила в контакт с активным материалом, который осаждается на отрицательном электроде. Предполагаемое усовершенствование безопасности объясняется как химическим воздействием добавляемой соли, так и физическим воздействием, связанным, среди прочего, с уменьшенной подвижностью вблизи твердой соли. В заявке WO 02/071507 предложено использовать добавление твердых неорганических частиц для повышения вязкости в случае электролита на основе двуокиси серы. В WO 2003/061036 предложено использовать в элементе пористую структуру, предпочтительно состоящую по меньшей мере из двух фракций твердых частиц с различающейся средней величиной частиц. Хотя эти предложения применимы для повышения безопасности батареи гальванических элементовз и обеспечения хороших функциональных характеристик, по-прежнему существует потребность в техническом решении, в котором по возможности сохранены преимущества жидкого электролита, в частности, что касается низкого внутреннего сопротивления элемента, и при этом сведены к минимуму угрозы безопасности.
Таким образом, в основу изобретения положена техническая задача создания электролита для батареи гальванических элементов и элемента батареи, содержащего такой электролит, в котором по возможности оптимально сочетаются свойства высокой плотности допустимого тока и высокой эксплуатационной безопасности даже вопреки тому, что эти свойства являются до некоторой степени взаимно противоречащими.
Эта задача решена с помощью электролита по п.1. Предпочтительные варианты осуществления описаны в зависимых пунктах. В изобретении дополнительно предложен элемент батареи, который содержит такой электролит. Используемый в формуле изобретения термин “один из” следует понимать как форму неопределенности, а не показатель единственного числа. Соответственно, в любом из вариантов осуществления может присутствовать несколько соответствующих элементов формулы изобретения.
Электролит согласно изобретению содержит двуокись серы. Содержание SO2 относительно проводящей соли составляет предпочтительно по меньшей мере 0,5 моля SO2 на моль проводящей соли, особо предпочтительно по меньшей мере 0,1 моля SO2 на моль проводящей соли. При слишком низкой концентрации SO2 наблюдается увеличение удельного сопротивления электролита. Электролит представляет собой гель, который получают с участием фторосульфината. В этом контексте под фторосульфинатом подразумевается одна из солей аниона [SO2F]- и любого катиона.
Под гелем обычно подразумевается дисперсная система, состоящая по меньшей мере из двух компонентов, один из которых является твердым веществом с коллоидной степенью дисперсности, которое часто называют загустителем или также гелеобразующим агентом. Далее будет использоваться обозначение “гелеобразующий агент”. Гелеобразующий агент формирует в геле пространственную сетку, в которой его частицы связаны друг с другом в определенных точках (например, силами Ван-дер-Ваальса, ионными мостиками, мостиками SO2). Второй компонент занимает поровые пространства сетки.
Авторами изобретения обнаружено, что, если в реакции гелеобразования участвует соль с анионом в виде фторосульфината, может быть получен гелеобразный электролит, обладающий выгодными свойствами. Этот вывод основан на основе экспериментального наблюдения образования геля электролитной системой LiAlCl4*xSO4 (электролит на основе SO2 с тетрахлороалюминатом лития в качестве проводящей соли) при добавлении соответствующего фторида. Как показали дальнейшие эксперименты, фторид вступает в реакцию с содержащейся в электролите SO2 и образует соль, анионом которой является [SO2F]-. Если катион во фториде обозначить как Me, реакция образования фторосульфината может быть представлена следующим образом:
Для дальнейшего гелеобразования предлагается следующий еще целиком не подтвержденный механизм, основанный на нынешнем состоянии знаний авторов изобретения. Далее он в качестве примера пояснен применительно к катиону Ме+ одновалентного металла.
Реакция фторосульфината с проводящей солью тетрахлороалюминатом. В результате этой реакции образуется кислота Льюиса в виде хлорида алюминия, который вступает в реакцию с фторосульфинатом в ходе реакции кислоты Льюиса/ основания Льюиса. В результате этой реакции образуется комплексное соединение металла и твердый LiCl. Выпадение в осадок твердого LiCl может быть замедлено или целиком предотвращено путем предварительного добавления в раствор электролита галоида металла MX, в котором M означает металл третьей основной группы периодической системы, а X означает один из галогенов, фтор, хлор, бром или йод:
Связывание комплексных ионов двуокисью серы раствора электролита и образование сетчатой структуры:
На фиг.6 графически представлена предполагаемая сетчатая структура электролита в гелевой фазе согласно нынешнему состоянию знаний авторов изобретении.
Обычно особо применимым для гелеобразования является фторид, имеющий катион, который соответствует катиону проводящей соли (который также является активным металлом элемента), следовательно, Li+ в случае литиевого элемента. Из литературы (F. Seel, L. Riehl “Über Fluorsulfinate”, Z. Anorg. Allgem. Chem. 282, 293 (1955)) известно, что фторосульфинаты могут быть получены из щелочных металлов посредством реакции фторидов щелочных металлов с жидкой или газообразной SO2. Тем не менее, первичная реакция присоединения с целью получения сульфината происходит не со всеми фторидами. Она наблюдалась с участием NaF, KF, RbF и CsF, при этом скорость преобразования увеличивается в указанном порядке (иными словами по мере увеличения размера катиона). Обычно реакция является очень медленной и может протекать несколько недель. В самом благоприятном случае она длится несколько суток.
Как известно из литературы, реакция присоединения с образованием соответствующих сульфонатов не происходит с участием LiF и CaF2. Тем не менее, в настоящем изобретении было обнаружено, что сульфинат и впоследствии гель могут быть получены также с использованием LiF, если будут осуществлены дополнительные стадии. В частности, медленная реакция может быть ускорена соответствующими способами, например, путем перемешивания или воздействия ультразвуком. Гелеобразование также может быть ускорено за счет присутствия небольших количеств более крупного катиона, чем катион Li, например ионов калия K+. Этот эффект основан на том факте, что KF легче растворяется в растворе электролита, чем LiF.
В связи с этим предполагается следующий механизм.
Реакция ионов калия с фторидом лития (ионный обмен):
Реакция фторида калия с двуокисью серы раствора электролита с образованием фторосульфината калия:
Комплексообразующая реакция по аналогии с предыдущей формулой (II):
Реакция ионного обмена комплексных катионов:
Образующийся в результате ион калия в свою очередь доступен для использования в реакции (Ia). Эффект ускорения при очень небольших количествах добавляемого калия объясняется циклическим процессом.
Формирование структуры по аналогии с предыдущей формулой (III):
Решающим реагентом в описанных процессах гелеобразования является анион фторосульфината. Он может быть получен посредством реакции с соответствующим фторидом согласно приведенной выше формуле (I) реакции. Эта реакция может происходить внутри или снаружи элемента батареи в зависимости от применяемого способа изготовления (как это подробнее описано далее).
Для получения аниона фторосульфината применимы различные фториды. В их число входят фториды щелочных или щелочноземельных металлов, такие как CsF, RbF, SrF2 или BaF2. Могут использоваться фториды металлов, в частности, фториды переходных металлов с небольшими катионами (переходных металлов), такие как MnF3. Как пояснено ранее, LiF и CaF2 не взаимодействуют с SO2 и не образуют сульфонаты без осуществления дополнительных стадий и, следовательно, также не обеспечивают спонтанное гелеобразование. Вместе с тем, они могут использоваться в случае осуществления дополнительных мер, способствующих гелеобразованию, в частности, добавления более крупных катионов в количестве, достаточном для каталитического действия, и/или воздействия механической энергией (например, путем перемешивания или обработки ультразвуком) в течение длительного времени. Применимость отдельных фторидов может быть определена экспериментальным путем, при этом в том, что касается соли, используемой для получения аниона фторосульфината, важны следующие свойства:
фторид металла должен вступать в реакцию с SO2 (в чистом виде или в составе электролита), катион фторида не должен ухудшать функционирование элемента, в частности, электрохимические реакции, которые протекают в элементе.
Как отмечено ранее, описанные выше механизмы (II) и (III) формирования сетчатой гелеобразной структуры еще не полностью доказаны. Тем не менее, можно предположить, что SO2 в геле входит в гелеобразующую структуру. Например, в структуре, показанной на фиг.6, часть исходного количества SO2 связано с фторосульфинатом. Другая часть еще находится в форме молекул SO2, но неподвижно зафиксирована в структуре (в проиллюстрированном случае в форме мостиков SO2 между комплексами). Тем не менее, SO2 по-прежнему обеспечивает подвижность (по меньшей мере частичную) ионов проводящей соли в геле (в смысле приведенного выше определения электролита на основе SO2), поскольку SO2 обеспечивает энергию сольватации, позволяющую проводящей соли диссоциировать в электролите. В этом смысле SO2 действует в качестве растворителя проводящей соли даже вопреки тому, что она присутствует в геле в основном в связанной и/или зафиксированной форме.
Гелеобразный электролит согласно изобретению отличается множеством выгодных свойств.
Электрические свойства соответствуют свойствам электролита на основе двуокиси серы, который не был преобразован в гель. Например, раствор электролита с составом LiAlCl4*1,4SO2 обладает удельной электрической проводимостью при комнатной температуре 50 мС см-1, которая не изменяется при образовании геля.
Давление пара раствора электролита с упомянутым составом равно примерно 0,1*105 Па при 20°C. Если из него получают гель, давление пара дополнительно снижается.
Эффектом реакции получения фторосульфоната из SO2 является снижение концентрации SO2 в растворе электролита. За счет этого повышается безопасность элемента, но из-за снижения концентрации не связанной SO2 (что выгодно с точки зрения безопасности) не ухудшаются электрические свойства.
Гель обладает тиксотропными свойствами, т.е. становится текучим при перемешивании. Это выгодно с точки зрения обработки при изготовлении элемента батареи.
Поскольку большая часть двуокиси серы в электролите согласно изобретению присутствует в связанной и/или зафиксированной форме, происходит очень небольшой перенос SO2 вместе с переносом ионов активного металла. В результате, в элементе не образуется градиент концентрации двуокиси серы вследствие переноса в нем ионного тока. Вместо этого связанная и зафиксированная SO2 остается равномерно распределенной в элементе.
По данным наблюдений ослаблялись реакции избыточной зарядки. Это объясняется тем фактом, что при более высоких потенциалах гелеобразующий анион или комплекс, содержащий гелеобразующий анион, адсорбируется на поверхности положительного электрода. Реакция избыточной зарядки представляет собой гетерогенное электрохимическое окисление аниона проводящей соли, и она ослабляется, если доступные для абсорбции пространства электрода заняты гелеобразующим анионом. Гелеобразующий анион является инертным по отношению к реакции избыточной зарядки.
Ослабление реакций избыточной зарядки позволяет увеличивать напряжение в элементе. Например, существуют электродные материалы, применимые для производства элементов с напряжением до 5 вольт. Тем не менее, до настоящего времени было невозможно найти им полное применение, поскольку не существовал электролит, стабильный при таких высоких напряжениях.
Свойства геля можно варьировать регулируемым способом путем изменения относительных количеств SO2, проводящей соли и гелеобразующего аниона. Если количество гелеобразующего аниона увеличить, у получаемого геля повысится сопротивление деформации. При достаточно высокой концентрации получают электролит со свойствами, как у твердого электролита.
Для изготовления элемента батареи, содержащего гелеобразный электролит согласно изобретению, элемент должен быть заполнен электролитом, и должен быть обеспечен требуемый тесный контакт с электродами, которые часто имеют микропористые структуры. Далее пояснены различные возможные способы, обеспечивающие выполнение этих требований.
1. Производство на месте путем ввода фторида в элемент Фторид растворяют в соответствующем растворителе (например, воде или ацетонитриле), раствор вводят в элемент, и затем испаряют растворитель.
Элемент заполняют газообразной двуокисью серы, чтобы получить фторосульфинат (формула (I) реакция). Дают выйти избытку SO2.
Элемент заполняют раствором электролита. В зависимости от используемого фторида образование геля не происходит спонтанно. Для содействия гелеобразованию могут быть необходимы дополнительные меры. В частности, с этой целью используют соль, в которой происходит обмен катиона на катион добавляемого фторида, как это пояснено в качестве примера со ссылкой на описанные выше формулы (Ia) и (IIa) реакции. Чтобы замедлить образование твердого LiCl согласно формуле (II) реакции, может быть выгодным использовать раствор электролита, который был обогащен хлоридом алюминия (AlCl3).
2. Ввод заранее полученного фторосульфината
Фторосульфинат растворяют в соответствующем растворителе. В данном случае следует использовать органический (не содержащий протонов) растворитель. Раствор вводят в элемент, и затем испаряют растворитель.
После этого элемент заполняют нормальным раствором электролита или раствором электролита, обогащенным хлоридом алюминия, как в способе 1, и ожидают определенное время для того, чтобы произошло гелеобразование.
3. Ввод заранее полученного фторосульфинатного комплекса
Фторосульфинатный комплекс растворяют в соответствующем растворителе, раствор вводят в элемент, и испаряют из него растворитель.
После заполнения элемента раствором электролита, как это описано в способах 1 и 2, происходит спонтанное гелеобразование.
4. Прямое заполнение элемента
Поскольку гель является тиксотропным, его можно превратить в жидкость путем воздействия механическими усилиями, например, путем перемешивания, взбалтывания или обработки ультразвуком и ввести в элемент гель в жидком состоянии.
Исходные компоненты, участвующие в описанной выше реакции, могут быть получены следующим образом,
a) Фторосульфинат
Фторосульфинат получают посредством реакции соответствующего фторида с двуокисью серы. С этой целью реагенты, например, смешивают в атмосфере инертного газа и затем перемешивают. По завершении реакции, которая обычно может длиться от нескольких часов до нескольких суток в зависимости от используемого фторида и условий реакции, не преобразованная SO2 может быть удалена путем испарения, и полученный продукт может быть использован.
Существует множество известных способов получения фторосульфината, в которых используют SO2 в различных формах и агрегатных состояниях. В качестве лишь одного из примеров укажем способ, уже описанный в 1955 г. у F. Seel, L. Riehl “Über Fluorsulfinate”, Z. Anorg. Allgem. Chem. 282, 293 (1955)
b) Фторосульфинатный комплекс
Фторосульфинат смешивают с
(i) электролитом на основе SO2, предпочтительно с добавлением AlCl3 или
(ii) жидкой SO2, предпочтительно с добавлением AlCl3.
Реакция происходит спонтанно. Избыток SO2 испаряют, и полученный продукт может быть использован. В случае (i) проводящую соль элюируют жидкой SO2, и получают продукт после удаления избытка SO2. В случае (ii) испаряют избыток SO2, чтобы получить готовый к использованию продукт.
Далее будут пояснены положительные свойства гелеобразного электролита и элементов батареи, изготовляемых с его использованием, со ссылкой на результаты экспериментов, представленные на фиг.1-5.
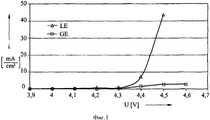
С целью исследования свойств гелеобразного электролита в том, что касается реакции избыточной зарядки, измеряли электрический ток на единицу площади (плотность тока) электрода на основе лития и окиси кобальта при различных значениях потенциала. На фиг.1 показана плотность тока i в мА/см2 в качестве функции потенциала электрода в вольтах при использовании, соответственно, жидкого электролита LE (треугольные точки измерений) и гелеобразного электролита GE (квадратные точки измерений).
Ясно показано, что при использовании жидкого электролита плотность тока резко возрастает после значения около 4,2 вольта, поскольку ток расходуется реакцией избыточной зарядки и преобразуется в тепло. В отличие от этого, при использовании гелеобразного электролита согласно изобретению реакция избыточной зарядки преимущественно замедляется, ток остается низким, и количество необратимо расходуемой энергии является небольшим.
Рассматриваемое свойство элементов согласно изобретению можно корректировать путем изменения количества гелеобразующего аниона в соответствии с требованиями, существующими в конкретном случае. Если реакция избыточной зарядки является выгодной в определенном случае, для получения электролита используют относительно небольшое количество фторосульфината. С другой стороны, высокие концентрации фторосульфината выгодны, если напряжение элемента должно быть максимально высоким, и, например, поскольку операция зарядки тщательно регулируется, реакция избыточной зарядки не требуется.
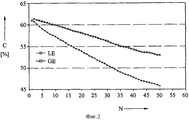
На фиг.2 показаны результаты экспериментов, в которых была исследована разрядная емкость электродов на основе лития и окиси кобальта в качестве функции числа циклов заряд-разряд. С этой целью была осуществлена циклическая вольтаметрия трехэлектродной системы (рабочий электрод: литий и окись кобальта; противоэлектрод: литий; контрольный электрод: литий). Электроды поместили в стеклянный электрический элемент и заполнили соответствующим раствором электролита для исследования. Циклическая вольтаметрия осуществлялась в диапазоне потенциалов от 3,5 до 4,5 вольта со скоростью 0,2 мВ/с.
На фиг.2 показаны полученные этим способом данные разрядной емкости в процентах C теоретической емкости и в качестве функции числа N операций заряда и разряда электрода на основе лития и окиси кобальта. Таким же способом, как и ранее, сравнивали жидкий раствор электролита LE (кружки) и гелеобразный раствор электролита GE (квадраты), полученный путем добавления фторида литий и использованием другим мер, способствующих гелеобразованию. Очевидно, что разрядная емкость элемента с гелеобразным электролитом значительно выше и является более постоянной на протяжении цикловой программы, чем у жидкого электролита. Этот можно объяснить тем фактом, что при использовании гелеобразного электролита расходуется меньше энергии на реакцию избыточной зарядки, не обеспечивающую реальную зарядку.
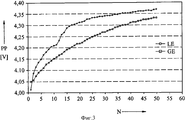
На фиг.3 также приведены данные измерений, полученные в результате осуществления упомянутой ранее циклической вольтаметрии. Показана высшая точка PP пика зарядки положительного электрода в вольтах для жидкого электролита LE (кружки) и гелеобразного электролита GE (квадраты) в качестве функции числа циклов N. Сдвиг пика в сторону более высоких потенциалов является показателем увеличения сопротивления, вызываемого покровным слоем положительного электрода. Из результатов следует, что такой сдвиг является значительно менее выраженным у гелеобразного электролита, чем у жидкого электролита. Это можно объяснить тем фактом, что при использовании геля в меньших количествах образуются продукты избыточной зарядки, необходимые для образования покровного слоя.
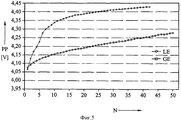
На фиг.4 и 5 показаны результаты экспериментов, сходные с результатами, представленными на фиг.2 и 3, но в этом случае гелеобразный электролит был получен с использованием фторида марганца (MnF3). Приведенные данные подтверждают сделанные на основании фиг.2 и 3 выводы о выгодных результатах применения гелеобразного электролита.
Claims (13)
1. Электролит для батареи гальванических элементов, содержащий двуокись серы и проводящую соль, отличающийся тем, что он представляет собой гель, который образуется с участием фторосульфината.
2. Электролит по п.1, отличающийся тем, что реакция гелеобразования включает реакцию кислоты Льюиса/основания Льюиса между фторосульфинатом и кислотой Льюиса.
3. Электролит по п.1, отличающийся тем, что он содержит галоид металла MX, в котором M означает металл третьей основной группы периодической системы, а Х означает один из галогенов, фтор, хлор, бром или йод.
4. Электролит по п.1, отличающийся тем, что гель содержит сольват проводящей соли с SO2.
5. Электролит по п.1, отличающийся тем, что количество SO2 относительно количества проводящей соли в электролит составляет, но меньшей мере, 0,1, предпочтительно, по меньшей мере, 0,5 моля SO2 на моль проводящей соли.
6. Электролит по п.1, отличающийся тем, что проводящую соль выбирают из группы, включающей алюминаты, галоиды, оксалаты, бораты, фосфаты, арсенаты и галлаты щелочного металла, в частности лития.
7. Батарея гальванических элементов, содержащая положительный электрод, отрицательный электрод и электролит по п.1.
8. Батарея гальванических элементов по п.1, отличающаяся тем, что активная масса положительного электрода содержит соединение металла, предпочтительно окись металла.
9. Батарея гальванических элементов по п.8, отличающаяся тем, что активная масса положительного электрода содержит окись переходного металла M, в частности, элемента с атомным числом от 22 до 28.
10. Батарея гальванических элементов по п.7, отличающаяся тем, что активная масса положительного электрода содержит интеркалированное соединение.
11. Батарея гальванических элементов по п.7, в которой во время зарядки элемента в результате электродной реакции на отрицательном электроде образуется активный металл, отличающаяся тем, что активный металл выбирают из группы, включающей щелочные металлы, щелочноземельные металлы и металлы второй подгруппы периодической системы, при этом активным металлом, в частности, является литий, натрий, кальций, цинк или алюминий.
12. Способ изготовления элемента батареи по п.7, отличающийся тем, что внутри элемента получают гель посредством реакции с участием фторосульфината и электролита, содержащего SO2 и проводящую соль.
13. Способ изготовления элемента батареи по п.7, отличающийся тем, что получают гель снаружи элемента, преобразуют его в жидкое состояние путем воздействия механическими усилиями и вводят в элемент в виде жидкости.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP07024275A EP2071658A1 (de) | 2007-12-14 | 2007-12-14 | Elektrolyt für eine elektrochemische Batteriezelle |
| EP07024275.5 | 2007-12-14 | ||
| PCT/EP2008/010613 WO2009077140A1 (de) | 2007-12-14 | 2008-12-12 | Elektrolyt für eine elektrochemische batteriezelle |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2010123840A RU2010123840A (ru) | 2012-01-20 |
| RU2496188C2 true RU2496188C2 (ru) | 2013-10-20 |
Family
ID=39317897
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2010123840/07A RU2496188C2 (ru) | 2007-12-14 | 2008-12-12 | Электролит для батареи гальванических элементов |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US8410759B2 (ru) |
| EP (2) | EP2071658A1 (ru) |
| JP (1) | JP5584902B2 (ru) |
| CN (1) | CN101897074B (ru) |
| AT (1) | ATE528823T1 (ru) |
| ES (1) | ES2374597T3 (ru) |
| RU (1) | RU2496188C2 (ru) |
| WO (1) | WO2009077140A1 (ru) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2713912C1 (ru) * | 2016-11-28 | 2020-02-11 | Тойота Дзидося Кабусики Кайся | Жидкий электролит для литий-ионных аккумуляторных батарей, способ получения жидкого электролита и литий-ионная аккумуляторная батарея |
Families Citing this family (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2355229A1 (de) | 2010-02-08 | 2011-08-10 | Fortu Intellectual Property AG | Hochstrombatteriesystem und Verfahren zur Steuerung eines Hochstrombatteriesystems |
| US9209458B2 (en) | 2010-02-10 | 2015-12-08 | Alevo Research Ag | Rechargeable electrochemical battery cell |
| EP2360772A1 (de) | 2010-02-12 | 2011-08-24 | Fortu Intellectual Property AG | Wiederaufladbare elektrochemische Zelle |
| MX365048B (es) | 2013-02-07 | 2019-05-16 | Innolith Assets Ag | Electrolito para una celda de bateria electroquimica y una celda de bateria que contiene el electrolito. |
| US9209488B2 (en) * | 2013-07-17 | 2015-12-08 | Electronics And Telecommunications Research Institute | Method for manufacturing a solid electrolyte |
| CN112542655B (zh) | 2015-05-08 | 2023-09-08 | 赛尔格有限责任公司 | 被改进的、被涂层的或被处理的微孔电池隔板、可再充电锂电池、系统 |
| CN108075186B (zh) * | 2016-11-09 | 2020-04-14 | 微宏动力系统(湖州)有限公司 | 一种无机电解液、其制备方法及其锂电池 |
| JP6926991B2 (ja) * | 2017-11-27 | 2021-08-25 | トヨタ自動車株式会社 | 非水電解液二次電池の製造方法 |
| KR102373313B1 (ko) * | 2018-07-12 | 2022-03-10 | 주식회사 엘지에너지솔루션 | 무기 전해액을 포함하는 리튬 이차전지 |
| DE102021132747A1 (de) | 2021-12-10 | 2023-06-15 | Bayerische Motoren Werke Aktiengesellschaft | Batteriezelle sowie Batteriespeicher mit der Batteriezelle |
| DE102021132746A1 (de) | 2021-12-10 | 2023-06-15 | Bayerische Motoren Werke Aktiengesellschaft | Batteriespeicher mit einer Sicherheitsvorrichtung sowie Verfahren zum Auslösen der Sicherheitsvorrichtung |
| DE102021132740A1 (de) | 2021-12-10 | 2023-06-15 | Bayerische Motoren Werke Aktiengesellschaft | Batteriespeicher mit einer Filtervorrichtung |
| DE102021132739A1 (de) | 2021-12-10 | 2023-06-15 | Bayerische Motoren Werke Aktiengesellschaft | Batteriespeicher mit einer Sicherheitsvorrichtung und ein Verfahren zum Auslösen der Sicherheitsvorrichtung |
| DE102021132742A1 (de) | 2021-12-10 | 2023-06-15 | Bayerische Motoren Werke Aktiengesellschaft | Batteriespeicher mit einer Sicherheitsvorrichtung sowie Verfahren zum Auslösen der Sicherheitsvorrichtung |
| DE102021132745A1 (de) | 2021-12-10 | 2023-06-15 | Bayerische Motoren Werke Aktiengesellschaft | Batteriespeicher mit einer Sicherheitsvorrichtung sowie Verfahren zum Auslösen der Sicherheitsvorrichtung |
Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB2124821A (en) * | 1982-08-09 | 1984-02-22 | Duracell Int | Electrochemical cells having low vapor pressure complexed SO2 electrolytes |
| RU2119702C1 (ru) * | 1991-09-24 | 1998-09-27 | Дьюраселл Инк. | Электрохимический источник тока и электронное устройство, имеющее чувствительный к влажности компонент |
| RU2125753C1 (ru) * | 1993-04-22 | 1999-01-27 | Дайкин Индастриз, Лтд. | Способ производства электрической энергии, устройство для его осуществления и соединение |
| US6280882B1 (en) * | 1997-01-17 | 2001-08-28 | Hydro-Quebec | Electrolytic composition with polymer base for electrochemical generator |
| WO2002071507A2 (de) * | 2001-03-07 | 2002-09-12 | Fortu Bat Batterien Gmbh | Wiederaufladbare nichtwässrige batteriezelle mit auf so2 basierendem elektrolytsystem |
| RU2213395C2 (ru) * | 1996-03-29 | 2003-09-27 | Басф Акциенгезелльшафт | Композиция, пригодная в качестве твердого электролита или сепаратора для электрохимических элементов |
| WO2005031908A2 (de) * | 2003-09-23 | 2005-04-07 | Hambitzer Guenther | Elektrochemische batteriezelle |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2000017076A (ja) * | 1998-07-01 | 2000-01-18 | Fuji Photo Film Co Ltd | 架橋重合体およびこれを用いた電解質とその製造方法 |
| US6709789B1 (en) * | 1999-01-23 | 2004-03-23 | Hambitzer Guenther | Non-aqueous electrochemical cell |
| ES2233416T3 (es) * | 1999-06-18 | 2005-06-16 | Hambitzer, Gunther, Dr. | Celdas electroquimicas recargables. |
| US6350543B2 (en) * | 1999-12-29 | 2002-02-26 | Kimberly-Clark Worldwide, Inc. | Manganese-rich quaternary metal oxide materials as cathodes for lithium-ion and lithium-ion polymer batteries |
| DE10128970A1 (de) * | 2001-06-15 | 2002-12-19 | Fortu Bat Batterien Gmbh | Bei Normaltemperatur betreibbare, wiederaufladbare Batteriezelle |
| DE10201936A1 (de) * | 2002-01-19 | 2003-07-31 | Fortu Bat Batterien Gmbh | Wiederaufladbare elektrochemische Batteriezelle |
| JP2006172775A (ja) * | 2004-12-14 | 2006-06-29 | Hitachi Ltd | エネルギー貯蔵デバイスとそのモジュール及びそれを用いた自動車 |
-
2007
- 2007-12-14 EP EP07024275A patent/EP2071658A1/de not_active Withdrawn
-
2008
- 2008-12-12 CN CN2008801203595A patent/CN101897074B/zh active Active
- 2008-12-12 RU RU2010123840/07A patent/RU2496188C2/ru active
- 2008-12-12 AT AT08862842T patent/ATE528823T1/de active
- 2008-12-12 US US12/745,967 patent/US8410759B2/en active Active
- 2008-12-12 ES ES08862842T patent/ES2374597T3/es active Active
- 2008-12-12 EP EP08862842A patent/EP2227838B1/de active Active
- 2008-12-12 JP JP2010537328A patent/JP5584902B2/ja active Active
- 2008-12-12 WO PCT/EP2008/010613 patent/WO2009077140A1/de active Application Filing
Patent Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB2124821A (en) * | 1982-08-09 | 1984-02-22 | Duracell Int | Electrochemical cells having low vapor pressure complexed SO2 electrolytes |
| RU2119702C1 (ru) * | 1991-09-24 | 1998-09-27 | Дьюраселл Инк. | Электрохимический источник тока и электронное устройство, имеющее чувствительный к влажности компонент |
| RU2125753C1 (ru) * | 1993-04-22 | 1999-01-27 | Дайкин Индастриз, Лтд. | Способ производства электрической энергии, устройство для его осуществления и соединение |
| RU2213395C2 (ru) * | 1996-03-29 | 2003-09-27 | Басф Акциенгезелльшафт | Композиция, пригодная в качестве твердого электролита или сепаратора для электрохимических элементов |
| US6280882B1 (en) * | 1997-01-17 | 2001-08-28 | Hydro-Quebec | Electrolytic composition with polymer base for electrochemical generator |
| WO2002071507A2 (de) * | 2001-03-07 | 2002-09-12 | Fortu Bat Batterien Gmbh | Wiederaufladbare nichtwässrige batteriezelle mit auf so2 basierendem elektrolytsystem |
| WO2005031908A2 (de) * | 2003-09-23 | 2005-04-07 | Hambitzer Guenther | Elektrochemische batteriezelle |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2713912C1 (ru) * | 2016-11-28 | 2020-02-11 | Тойота Дзидося Кабусики Кайся | Жидкий электролит для литий-ионных аккумуляторных батарей, способ получения жидкого электролита и литий-ионная аккумуляторная батарея |
Also Published As
| Publication number | Publication date |
|---|---|
| JP5584902B2 (ja) | 2014-09-10 |
| JP2011507171A (ja) | 2011-03-03 |
| RU2010123840A (ru) | 2012-01-20 |
| CN101897074A (zh) | 2010-11-24 |
| EP2227838A1 (de) | 2010-09-15 |
| EP2071658A1 (de) | 2009-06-17 |
| EP2227838B1 (de) | 2011-10-12 |
| WO2009077140A1 (de) | 2009-06-25 |
| CN101897074B (zh) | 2013-07-03 |
| ES2374597T3 (es) | 2012-02-20 |
| ATE528823T1 (de) | 2011-10-15 |
| US8410759B2 (en) | 2013-04-02 |
| US20100259224A1 (en) | 2010-10-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2496188C2 (ru) | Электролит для батареи гальванических элементов | |
| Deivanayagam et al. | Progress in development of electrolytes for magnesium batteries | |
| US11476495B2 (en) | Stable room-temperature sodium-sulfur battery | |
| Guo et al. | Opportunities and challenges of zinc anodes in rechargeable aqueous batteries | |
| He et al. | A three-dimensional interconnected V 6 O 13 nest with a V 5+-rich state for ultrahigh Zn ion storage | |
| US12100803B2 (en) | Aqueous zinc-metal batteries comprising “water-in-salt” electrolyte | |
| US8951676B2 (en) | Non-aqueous electrolyte for high voltage rechargeable magnesium batteries | |
| WO2015008496A1 (ja) | 非水電解液およびそれを用いた非水電解質二次電池 | |
| US20140220450A1 (en) | Non-aqueous electrolyte for rechargeable magnesium ion cell | |
| WO2019234393A1 (en) | Aqueous electrolytes | |
| Schoetz et al. | Aluminium deposition in EMImCl-AlCl3 ionic liquid and ionogel for improved aluminium batteries | |
| Gao et al. | LiAlCl4· 3SO2 as a high conductive, non-flammable and inorganic non-aqueous liquid electrolyte for lithium ion batteries | |
| KR20180027429A (ko) | 전기화학적 전지 | |
| Zeng et al. | A long cycle-life Na-Mg hybrid battery with a chlorine-free electrolyte based on Mg (TFSI) 2 | |
| Shaik et al. | Simultaneous tailoring of hydrogen evolution and dendrite growth via a fertilizer-derived additive for the stabilization of the zinc anode interface | |
| Kaland et al. | Dipentamethylene thiuram tetrasulfide-based cathodes for rechargeable magnesium batteries | |
| JP7326352B2 (ja) | 充電式電気化学バッテリーセル用の固体イオン伝導体 | |
| CN110537285A (zh) | 聚合物电解质组合物及聚合物二次电池 | |
| Wu et al. | Surface-modification of Doping and Coating Li1. 2Ni0. 2Co0. 08Mn0. 52O2 as a Long Life Cathode Material of Lithium-Ion Battery by Sodium Salt Treatment | |
| Xie et al. | Reversible multi-electron transfer I-/IO3-cathode enabled by hetero-halogen for ultra-high energy density aqueous batteries | |
| US20240347767A1 (en) | Rechargeable battery systems and methods thereof | |
| DE10110716A1 (de) | Wiederaufladbare nichtwässrige Batteriezelle | |
| Kim et al. | Enhancing the electrochemical properties of composite solid electrolytes with Ga–Rb-doped Li6. 5Ga0. 2La2. 95Rb0. 05Zr2O12 through composition control | |
| Dani | Synthesis, Characterization and Electrochemical Analysis of Copper Catalyzed Silicon Half Cells | |
| Fan et al. | Balancing vacancy and carrier concentration in halide solid electrolytes for all-solid-state sodium batteries |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PC41 | Official registration of the transfer of exclusive right |
Effective date: 20141226 |
|
| PC41 | Official registration of the transfer of exclusive right |
Effective date: 20161201 |
|
| PC41 | Official registration of the transfer of exclusive right |
Effective date: 20190329 |
|
| PC41 | Official registration of the transfer of exclusive right |
Effective date: 20190403 |