RU2454999C2 - Лекарственное средство, применяющееся при поражениях хряща - Google Patents
Лекарственное средство, применяющееся при поражениях хряща Download PDFInfo
- Publication number
- RU2454999C2 RU2454999C2 RU2008123806/15A RU2008123806A RU2454999C2 RU 2454999 C2 RU2454999 C2 RU 2454999C2 RU 2008123806/15 A RU2008123806/15 A RU 2008123806/15A RU 2008123806 A RU2008123806 A RU 2008123806A RU 2454999 C2 RU2454999 C2 RU 2454999C2
- Authority
- RU
- Russia
- Prior art keywords
- alpha
- akg
- pharmaceutically acceptable
- gastrectomy
- placebo
- Prior art date
Links
- 239000003814 drug Substances 0.000 title abstract description 5
- 208000015100 cartilage disease Diseases 0.000 title abstract 2
- 229940079593 drug Drugs 0.000 title description 2
- 238000002360 preparation method Methods 0.000 title description 2
- KPGXRSRHYNQIFN-UHFFFAOYSA-N 2-oxoglutaric acid Chemical compound OC(=O)CCC(=O)C(O)=O KPGXRSRHYNQIFN-UHFFFAOYSA-N 0.000 claims abstract description 51
- 238000013110 gastrectomy Methods 0.000 claims abstract description 46
- 150000003839 salts Chemical class 0.000 claims abstract description 28
- HWXBTNAVRSUOJR-UHFFFAOYSA-N alpha-hydroxyglutaric acid Natural products OC(=O)C(O)CCC(O)=O HWXBTNAVRSUOJR-UHFFFAOYSA-N 0.000 claims abstract description 25
- 229940009533 alpha-ketoglutaric acid Drugs 0.000 claims abstract description 25
- 239000000126 substance Substances 0.000 claims abstract description 17
- 238000011282 treatment Methods 0.000 claims abstract description 16
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 9
- 230000002496 gastric effect Effects 0.000 claims abstract description 5
- 230000036961 partial effect Effects 0.000 claims abstract description 5
- 230000004580 weight loss Effects 0.000 claims abstract description 5
- 230000002265 prevention Effects 0.000 claims abstract description 4
- KPGXRSRHYNQIFN-UHFFFAOYSA-L 2-oxoglutarate(2-) Chemical compound [O-]C(=O)CCC(=O)C([O-])=O KPGXRSRHYNQIFN-UHFFFAOYSA-L 0.000 claims description 108
- 229940024606 amino acid Drugs 0.000 claims description 36
- 235000001014 amino acid Nutrition 0.000 claims description 36
- 150000001413 amino acids Chemical class 0.000 claims description 35
- 238000000034 method Methods 0.000 claims description 21
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 claims description 18
- 235000013922 glutamic acid Nutrition 0.000 claims description 18
- 239000004220 glutamic acid Substances 0.000 claims description 18
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 claims description 17
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 claims description 17
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 claims description 15
- 230000037396 body weight Effects 0.000 claims description 14
- 210000000845 cartilage Anatomy 0.000 claims description 14
- -1 alkali metal salt Chemical class 0.000 claims description 9
- 229910052784 alkaline earth metal Inorganic materials 0.000 claims description 9
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 claims description 8
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 claims description 8
- AHLPHDHHMVZTML-BYPYZUCNSA-N L-Ornithine Chemical compound NCCC[C@H](N)C(O)=O AHLPHDHHMVZTML-BYPYZUCNSA-N 0.000 claims description 7
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 claims description 7
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 claims description 7
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 claims description 7
- 208000002720 Malnutrition Diseases 0.000 claims description 7
- AHLPHDHHMVZTML-UHFFFAOYSA-N Orn-delta-NH2 Natural products NCCCC(N)C(O)=O AHLPHDHHMVZTML-UHFFFAOYSA-N 0.000 claims description 7
- UTJLXEIPEHZYQJ-UHFFFAOYSA-N Ornithine Natural products OC(=O)C(C)CCCN UTJLXEIPEHZYQJ-UHFFFAOYSA-N 0.000 claims description 7
- 229960000310 isoleucine Drugs 0.000 claims description 7
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 claims description 7
- 230000003902 lesion Effects 0.000 claims description 7
- 230000001071 malnutrition Effects 0.000 claims description 7
- 235000000824 malnutrition Nutrition 0.000 claims description 7
- 208000015380 nutritional deficiency disease Diseases 0.000 claims description 7
- 229960003104 ornithine Drugs 0.000 claims description 7
- 239000004475 Arginine Substances 0.000 claims description 6
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical class C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 claims description 6
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 claims description 6
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 claims description 6
- 239000011734 sodium Substances 0.000 claims description 6
- 229910052708 sodium Inorganic materials 0.000 claims description 6
- 239000011575 calcium Chemical class 0.000 claims description 4
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical class [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 claims description 3
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical class [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 claims description 3
- 239000003513 alkali Substances 0.000 claims description 3
- 229910052783 alkali metal Inorganic materials 0.000 claims description 3
- 229910052791 calcium Inorganic materials 0.000 claims description 3
- 239000011777 magnesium Chemical class 0.000 claims description 3
- 239000011591 potassium Chemical class 0.000 claims description 3
- 229910052700 potassium Inorganic materials 0.000 claims description 3
- 150000001342 alkaline earth metals Chemical class 0.000 claims 3
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical class [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 claims 2
- 229910052749 magnesium Inorganic materials 0.000 claims 2
- 208000002193 Pain Diseases 0.000 abstract description 15
- 230000000694 effects Effects 0.000 abstract description 14
- 230000036407 pain Effects 0.000 abstract description 14
- 206010003246 arthritis Diseases 0.000 abstract description 4
- 208000030212 nutrition disease Diseases 0.000 abstract 1
- 208000019180 nutritional disease Diseases 0.000 abstract 1
- 235000003784 poor nutrition Nutrition 0.000 abstract 1
- 239000000902 placebo Substances 0.000 description 62
- 229940068196 placebo Drugs 0.000 description 62
- 241000700159 Rattus Species 0.000 description 46
- 210000000988 bone and bone Anatomy 0.000 description 35
- 238000004088 simulation Methods 0.000 description 19
- 229960002989 glutamic acid Drugs 0.000 description 16
- 229960002743 glutamine Drugs 0.000 description 15
- 239000000243 solution Substances 0.000 description 14
- 210000000689 upper leg Anatomy 0.000 description 14
- 241001465754 Metazoa Species 0.000 description 13
- 210000003625 skull Anatomy 0.000 description 13
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 12
- 238000001356 surgical procedure Methods 0.000 description 10
- 210000002303 tibia Anatomy 0.000 description 10
- 210000001188 articular cartilage Anatomy 0.000 description 9
- 108010035532 Collagen Proteins 0.000 description 8
- 102000008186 Collagen Human genes 0.000 description 8
- 108010016626 Dipeptides Proteins 0.000 description 8
- 229920001436 collagen Polymers 0.000 description 8
- 210000004349 growth plate Anatomy 0.000 description 8
- 239000011780 sodium chloride Substances 0.000 description 8
- 239000004480 active ingredient Substances 0.000 description 7
- 150000001875 compounds Chemical class 0.000 description 7
- 235000015872 dietary supplement Nutrition 0.000 description 7
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 6
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 6
- 208000029725 Metabolic bone disease Diseases 0.000 description 6
- 206010049088 Osteopenia Diseases 0.000 description 6
- 208000001132 Osteoporosis Diseases 0.000 description 6
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 6
- 235000013361 beverage Nutrition 0.000 description 6
- 210000004027 cell Anatomy 0.000 description 6
- 238000002474 experimental method Methods 0.000 description 6
- 239000000203 mixture Substances 0.000 description 6
- 229960002429 proline Drugs 0.000 description 6
- UGKYJAWJZICPEX-UHFFFAOYSA-N 4-oxoglutaramic acid Chemical class NC(=O)C(=O)CCC(O)=O UGKYJAWJZICPEX-UHFFFAOYSA-N 0.000 description 5
- 206010065687 Bone loss Diseases 0.000 description 5
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 5
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 5
- 239000004472 Lysine Substances 0.000 description 5
- 239000002253 acid Substances 0.000 description 5
- 239000000654 additive Substances 0.000 description 5
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 5
- 239000008121 dextrose Substances 0.000 description 5
- 239000004615 ingredient Substances 0.000 description 5
- 229960003136 leucine Drugs 0.000 description 5
- 229960003646 lysine Drugs 0.000 description 5
- 238000005259 measurement Methods 0.000 description 5
- 210000002784 stomach Anatomy 0.000 description 5
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 4
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 4
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 4
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 4
- 150000007513 acids Chemical class 0.000 description 4
- 229960003121 arginine Drugs 0.000 description 4
- 210000003321 cartilage cell Anatomy 0.000 description 4
- 230000006378 damage Effects 0.000 description 4
- 238000011161 development Methods 0.000 description 4
- 230000018109 developmental process Effects 0.000 description 4
- 235000013305 food Nutrition 0.000 description 4
- 229910052500 inorganic mineral Chemical class 0.000 description 4
- 239000011707 mineral Chemical class 0.000 description 4
- 235000010755 mineral Nutrition 0.000 description 4
- 201000008482 osteoarthritis Diseases 0.000 description 4
- 239000000725 suspension Substances 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 4
- 206010007710 Cartilage injury Diseases 0.000 description 3
- WHUUTDBJXJRKMK-GSVOUGTGSA-N D-glutamic acid Chemical compound OC(=O)[C@H](N)CCC(O)=O WHUUTDBJXJRKMK-GSVOUGTGSA-N 0.000 description 3
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 3
- 108010050808 Procollagen Proteins 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- 238000010521 absorption reaction Methods 0.000 description 3
- 150000001408 amides Chemical class 0.000 description 3
- 239000007864 aqueous solution Substances 0.000 description 3
- AGVAZMGAQJOSFJ-WZHZPDAFSA-M cobalt(2+);[(2r,3s,4r,5s)-5-(5,6-dimethylbenzimidazol-1-yl)-4-hydroxy-2-(hydroxymethyl)oxolan-3-yl] [(2r)-1-[3-[(1r,2r,3r,4z,7s,9z,12s,13s,14z,17s,18s,19r)-2,13,18-tris(2-amino-2-oxoethyl)-7,12,17-tris(3-amino-3-oxopropyl)-3,5,8,8,13,15,18,19-octamethyl-2 Chemical compound [Co+2].N#[C-].[N-]([C@@H]1[C@H](CC(N)=O)[C@@]2(C)CCC(=O)NC[C@@H](C)OP(O)(=O)O[C@H]3[C@H]([C@H](O[C@@H]3CO)N3C4=CC(C)=C(C)C=C4N=C3)O)\C2=C(C)/C([C@H](C\2(C)C)CCC(N)=O)=N/C/2=C\C([C@H]([C@@]/2(CC(N)=O)C)CCC(N)=O)=N\C\2=C(C)/C2=N[C@]1(C)[C@@](C)(CC(N)=O)[C@@H]2CCC(N)=O AGVAZMGAQJOSFJ-WZHZPDAFSA-M 0.000 description 3
- 230000001066 destructive effect Effects 0.000 description 3
- 239000003937 drug carrier Substances 0.000 description 3
- 239000003755 preservative agent Substances 0.000 description 3
- 238000011321 prophylaxis Methods 0.000 description 3
- 230000001681 protective effect Effects 0.000 description 3
- 206010039073 rheumatoid arthritis Diseases 0.000 description 3
- 239000002904 solvent Substances 0.000 description 3
- 208000024891 symptom Diseases 0.000 description 3
- ALYNCZNDIQEVRV-UHFFFAOYSA-N 4-aminobenzoic acid Chemical compound NC1=CC=C(C(O)=O)C=C1 ALYNCZNDIQEVRV-UHFFFAOYSA-N 0.000 description 2
- 206010002091 Anaesthesia Diseases 0.000 description 2
- 208000006820 Arthralgia Diseases 0.000 description 2
- 208000036487 Arthropathies Diseases 0.000 description 2
- 241000287828 Gallus gallus Species 0.000 description 2
- WZUVPPKBWHMQCE-UHFFFAOYSA-N Haematoxylin Chemical compound C12=CC(O)=C(O)C=C2CC2(O)C1C1=CC=C(O)C(O)=C1OC2 WZUVPPKBWHMQCE-UHFFFAOYSA-N 0.000 description 2
- 208000012659 Joint disease Diseases 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- 241000286209 Phasianidae Species 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- 239000008156 Ringer's lactate solution Substances 0.000 description 2
- 241000270666 Testudines Species 0.000 description 2
- 229930003779 Vitamin B12 Natural products 0.000 description 2
- 230000037005 anaesthesia Effects 0.000 description 2
- 238000010171 animal model Methods 0.000 description 2
- 239000003963 antioxidant agent Substances 0.000 description 2
- 235000006708 antioxidants Nutrition 0.000 description 2
- 229910052786 argon Inorganic materials 0.000 description 2
- 230000037182 bone density Effects 0.000 description 2
- ZEWYCNBZMPELPF-UHFFFAOYSA-J calcium;potassium;sodium;2-hydroxypropanoic acid;sodium;tetrachloride Chemical compound [Na].[Na+].[Cl-].[Cl-].[Cl-].[Cl-].[K+].[Ca+2].CC(O)C(O)=O ZEWYCNBZMPELPF-UHFFFAOYSA-J 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 210000001612 chondrocyte Anatomy 0.000 description 2
- 238000010586 diagram Methods 0.000 description 2
- 235000005911 diet Nutrition 0.000 description 2
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 2
- 239000003995 emulsifying agent Substances 0.000 description 2
- 239000000839 emulsion Substances 0.000 description 2
- YQGOJNYOYNNSMM-UHFFFAOYSA-N eosin Chemical compound [Na+].OC(=O)C1=CC=CC=C1C1=C2C=C(Br)C(=O)C(Br)=C2OC2=C(Br)C(O)=C(Br)C=C21 YQGOJNYOYNNSMM-UHFFFAOYSA-N 0.000 description 2
- 230000009246 food effect Effects 0.000 description 2
- 210000004051 gastric juice Anatomy 0.000 description 2
- 230000000762 glandular Effects 0.000 description 2
- 235000011187 glycerol Nutrition 0.000 description 2
- 230000002757 inflammatory effect Effects 0.000 description 2
- 210000001699 lower leg Anatomy 0.000 description 2
- 239000012457 nonaqueous media Substances 0.000 description 2
- 239000000346 nonvolatile oil Substances 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 108090000765 processed proteins & peptides Proteins 0.000 description 2
- 102000004196 processed proteins & peptides Human genes 0.000 description 2
- HEMHJVSKTPXQMS-UHFFFAOYSA-M sodium hydroxide Inorganic materials [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 2
- 235000021055 solid food Nutrition 0.000 description 2
- 238000010254 subcutaneous injection Methods 0.000 description 2
- 239000007929 subcutaneous injection Substances 0.000 description 2
- 239000003826 tablet Substances 0.000 description 2
- 235000019163 vitamin B12 Nutrition 0.000 description 2
- 239000011715 vitamin B12 Substances 0.000 description 2
- 208000016261 weight loss Diseases 0.000 description 2
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 241000271566 Aves Species 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 208000020084 Bone disease Diseases 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 241000700198 Cavia Species 0.000 description 1
- 208000000094 Chronic Pain Diseases 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- ZZZCUOFIHGPKAK-UHFFFAOYSA-N D-erythro-ascorbic acid Natural products OCC1OC(=O)C(O)=C1O ZZZCUOFIHGPKAK-UHFFFAOYSA-N 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 206010017076 Fracture Diseases 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- PMMYEEVYMWASQN-DMTCNVIQSA-N Hydroxyproline Chemical compound O[C@H]1CN[C@H](C(O)=O)C1 PMMYEEVYMWASQN-DMTCNVIQSA-N 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 229920004011 Macrolon® Polymers 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- 208000008589 Obesity Diseases 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 208000006735 Periostitis Diseases 0.000 description 1
- 229920000954 Polyglycolide Polymers 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 238000000692 Student's t-test Methods 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- 229930003268 Vitamin C Natural products 0.000 description 1
- 229930003316 Vitamin D Natural products 0.000 description 1
- QYSXJUFSXHHAJI-XFEUOLMDSA-N Vitamin D3 Natural products C1(/[C@@H]2CC[C@@H]([C@]2(CCC1)C)[C@H](C)CCCC(C)C)=C/C=C1\C[C@@H](O)CCC1=C QYSXJUFSXHHAJI-XFEUOLMDSA-N 0.000 description 1
- 230000003187 abdominal effect Effects 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 230000001476 alcoholic effect Effects 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- 230000036592 analgesia Effects 0.000 description 1
- 238000000540 analysis of variance Methods 0.000 description 1
- 239000004599 antimicrobial Substances 0.000 description 1
- 210000000702 aorta abdominal Anatomy 0.000 description 1
- 239000008365 aqueous carrier Substances 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000012752 auxiliary agent Substances 0.000 description 1
- XTKDAFGWCDAMPY-UHFFFAOYSA-N azaperone Chemical compound C1=CC(F)=CC=C1C(=O)CCCN1CCN(C=2N=CC=CC=2)CC1 XTKDAFGWCDAMPY-UHFFFAOYSA-N 0.000 description 1
- 239000002585 base Substances 0.000 description 1
- 239000003613 bile acid Substances 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- RMRJXGBAOAMLHD-IHFGGWKQSA-N buprenorphine Chemical compound C([C@]12[C@H]3OC=4C(O)=CC=C(C2=4)C[C@@H]2[C@]11CC[C@]3([C@H](C1)[C@](C)(O)C(C)(C)C)OC)CN2CC1CC1 RMRJXGBAOAMLHD-IHFGGWKQSA-N 0.000 description 1
- AXCZMVOFGPJBDE-UHFFFAOYSA-L calcium dihydroxide Chemical compound [OH-].[OH-].[Ca+2] AXCZMVOFGPJBDE-UHFFFAOYSA-L 0.000 description 1
- 239000000920 calcium hydroxide Substances 0.000 description 1
- 229910001861 calcium hydroxide Inorganic materials 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 230000000747 cardiac effect Effects 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000008355 cartilage degradation Effects 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 235000013330 chicken meat Nutrition 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- 230000000378 dietary effect Effects 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- PMMYEEVYMWASQN-UHFFFAOYSA-N dl-hydroxyproline Natural products OC1C[NH2+]C(C([O-])=O)C1 PMMYEEVYMWASQN-UHFFFAOYSA-N 0.000 description 1
- 239000008298 dragée Substances 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 210000001198 duodenum Anatomy 0.000 description 1
- 230000004821 effect on bone Effects 0.000 description 1
- 239000007938 effervescent tablet Substances 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 210000003743 erythrocyte Anatomy 0.000 description 1
- HQPMKSGTIOYHJT-UHFFFAOYSA-N ethane-1,2-diol;propane-1,2-diol Chemical compound OCCO.CC(O)CO HQPMKSGTIOYHJT-UHFFFAOYSA-N 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 230000003203 everyday effect Effects 0.000 description 1
- 239000003925 fat Substances 0.000 description 1
- 235000019197 fats Nutrition 0.000 description 1
- 235000013373 food additive Nutrition 0.000 description 1
- 239000002778 food additive Substances 0.000 description 1
- 235000012041 food component Nutrition 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 239000000017 hydrogel Substances 0.000 description 1
- 229960002591 hydroxyproline Drugs 0.000 description 1
- 230000001969 hypertrophic effect Effects 0.000 description 1
- 239000011261 inert gas Substances 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 229940029329 intrinsic factor Drugs 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- 235000014413 iron hydroxide Nutrition 0.000 description 1
- NCNCGGDMXMBVIA-UHFFFAOYSA-L iron(ii) hydroxide Chemical compound [OH-].[OH-].[Fe+2] NCNCGGDMXMBVIA-UHFFFAOYSA-L 0.000 description 1
- 229940039412 ketalar Drugs 0.000 description 1
- VCMGMSHEPQENPE-UHFFFAOYSA-N ketamine hydrochloride Chemical compound [Cl-].C=1C=CC=C(Cl)C=1C1([NH2+]C)CCCCC1=O VCMGMSHEPQENPE-UHFFFAOYSA-N 0.000 description 1
- 210000003127 knee Anatomy 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 210000002414 leg Anatomy 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- VTHJTEIRLNZDEV-UHFFFAOYSA-L magnesium dihydroxide Chemical compound [OH-].[OH-].[Mg+2] VTHJTEIRLNZDEV-UHFFFAOYSA-L 0.000 description 1
- 239000000347 magnesium hydroxide Substances 0.000 description 1
- 229910001862 magnesium hydroxide Inorganic materials 0.000 description 1
- 159000000003 magnesium salts Chemical class 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 230000009245 menopause Effects 0.000 description 1
- 229910021645 metal ion Inorganic materials 0.000 description 1
- 239000000693 micelle Substances 0.000 description 1
- 239000004530 micro-emulsion Substances 0.000 description 1
- 239000003607 modifier Substances 0.000 description 1
- 230000003020 moisturizing effect Effects 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 235000016709 nutrition Nutrition 0.000 description 1
- 235000020824 obesity Nutrition 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 238000009806 oophorectomy Methods 0.000 description 1
- 150000002895 organic esters Chemical class 0.000 description 1
- 210000002997 osteoclast Anatomy 0.000 description 1
- 239000006179 pH buffering agent Substances 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 210000003460 periosteum Anatomy 0.000 description 1
- 230000002085 persistent effect Effects 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- WVDDGKGOMKODPV-ZQBYOMGUSA-N phenyl(114C)methanol Chemical compound O[14CH2]C1=CC=CC=C1 WVDDGKGOMKODPV-ZQBYOMGUSA-N 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- 210000004560 pineal gland Anatomy 0.000 description 1
- 229920001993 poloxamer 188 Polymers 0.000 description 1
- 229920000747 poly(lactic acid) Polymers 0.000 description 1
- 239000004633 polyglycolic acid Substances 0.000 description 1
- 239000004626 polylactic acid Substances 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 1
- 229920000053 polysorbate 80 Polymers 0.000 description 1
- 230000002062 proliferating effect Effects 0.000 description 1
- 235000018102 proteins Nutrition 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 238000002271 resection Methods 0.000 description 1
- 230000000284 resting effect Effects 0.000 description 1
- HRZFUMHJMZEROT-UHFFFAOYSA-L sodium disulfite Chemical compound [Na+].[Na+].[O-]S(=O)S([O-])(=O)=O HRZFUMHJMZEROT-UHFFFAOYSA-L 0.000 description 1
- 229940001584 sodium metabisulfite Drugs 0.000 description 1
- 235000010262 sodium metabisulphite Nutrition 0.000 description 1
- WGRULTCAYDOGQK-UHFFFAOYSA-M sodium;sodium;hydroxide Chemical compound [OH-].[Na].[Na+] WGRULTCAYDOGQK-UHFFFAOYSA-M 0.000 description 1
- 210000004872 soft tissue Anatomy 0.000 description 1
- 238000013223 sprague-dawley female rat Methods 0.000 description 1
- 238000012453 sprague-dawley rat model Methods 0.000 description 1
- 230000005985 stomach dysfunction Effects 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- RTKIYNMVFMVABJ-UHFFFAOYSA-L thimerosal Chemical compound [Na+].CC[Hg]SC1=CC=CC=C1C([O-])=O RTKIYNMVFMVABJ-UHFFFAOYSA-L 0.000 description 1
- 229940033663 thimerosal Drugs 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- FGMPLJWBKKVCDB-UHFFFAOYSA-N trans-L-hydroxy-proline Natural products ON1CCCC1C(O)=O FGMPLJWBKKVCDB-UHFFFAOYSA-N 0.000 description 1
- 238000007473 univariate analysis Methods 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 229930003231 vitamin Natural products 0.000 description 1
- 235000013343 vitamin Nutrition 0.000 description 1
- 239000011782 vitamin Substances 0.000 description 1
- 229940088594 vitamin Drugs 0.000 description 1
- 235000019154 vitamin C Nutrition 0.000 description 1
- 239000011718 vitamin C Substances 0.000 description 1
- 235000019166 vitamin D Nutrition 0.000 description 1
- 239000011710 vitamin D Substances 0.000 description 1
- 150000003710 vitamin D derivatives Chemical class 0.000 description 1
- 229940046008 vitamin d Drugs 0.000 description 1
- 210000000707 wrist Anatomy 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/05—Dipeptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/194—Carboxylic acids, e.g. valproic acid having two or more carboxyl groups, e.g. succinic, maleic or phthalic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/195—Carboxylic acids, e.g. valproic acid having an amino group
- A61K31/197—Carboxylic acids, e.g. valproic acid having an amino group the amino and the carboxyl groups being attached to the same acyclic carbon chain, e.g. gamma-aminobutyric acid [GABA], beta-alanine, epsilon-aminocaproic acid or pantothenic acid
- A61K31/198—Alpha-amino acids, e.g. alanine or edetic acid [EDTA]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/401—Proline; Derivatives thereof, e.g. captopril
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/06—Tripeptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/04—Drugs for skeletal disorders for non-specific disorders of the connective tissue
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
- A61P19/10—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease for osteoporosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical & Material Sciences (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Physical Education & Sports Medicine (AREA)
- Organic Chemistry (AREA)
- Rheumatology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Immunology (AREA)
- General Chemical & Material Sciences (AREA)
- Gastroenterology & Hepatology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Pain & Pain Management (AREA)
- Biomedical Technology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
Изобретение относится к области медицины и фармакологии и представляет собой применение фармацевтически приемлемой соли альфа-кетоглутаровой кислоты для получения фармацевтической композиции для лечения или профилактики поражений хряща в условиях, включающих потерю веса и/или нарушенного питания, недостаточного питания, гастрэктомии, частичной гастрэктомии или перевязки желудка. Изобретение обеспечивает эффективное облегчение и лечение суставных болей и артрита. 2 н. и 18 з.п. ф-лы, 8 табл., 3 ил.
Description
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к лекарственным композициям и применению таких композиций для лечения, облегчения и профилактики состояний, связанных с поражением хряща и связанных с ними болей, или профилактики артроза и ревматоидного артрита и связанных с ними болей.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Каждый третий взрослый человек в промышленном мире страдает хроническими болями, связанными с симптомами артрита. Самый распространенный симптом - постоянная боль в суставе - может проявляться в виде боли в бедре, боли в колене, боли в руке и боли в запястье, а также в виде суставной боли в других частях тела. Симптомы вызывают страдание и приводят к экономическим потерям, когда субъект вынужден прекратить работу или сократить количество рабочих часов. Также большие суммы тратятся на медикаментозное лечение. Очевидно, что существует необходимость эффективных по стоимости решений для облегчения или лечения суставных болей и артрита.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Осуществление изобретения включает применение вещества, включающего по меньшей мере один член из группы, состоящей из альфа-кетоглутаровой кислоты, глутамина, глутаминовой кислоты и фармацевтически приемлемых солей этих кислот, амидов альфа-кетоглутаровой кислоты и аминокислот или ди- или трипептидов глутамина и других аминокислот, трипептидов глутамина и других аминокислот, дипептидов глутаминовой кислоты и других аминокислот, трипептидов глутаминовой кислоты и других аминокислот и фармацевтически приемлемых солей указанных дипептидов и трипептидов, фармацевтически приемлемых физических растворов альфа-кетоглутаровой кислоты или ее фармацевтически приемлемых солей и по меньшей мере одной аминокислоты для получения фармацевтической композиции для лечения или профилактики состояний воспалительного или невоспалительного поражения хряща и боли, связанной с ним.
Дальнейшее осуществление изобретения включает применение вышеуказанных веществ для лечения или профилактики артроза и ревматоидного артрита и связанной с ними боли.
Дальнейшее осуществление изобретения включает применение вышеуказанных веществ для лечения или профилактики поражений суставного хряща при состояниях, включающих потерю веса и/или нарушения питания, или гастректомию, частичную гастрэктомию или перевязку желудка.
Дальнейшее осуществление изобретения включает применение вышеуказанных веществ для лечения или профилактики поражений суставного хряща при состояниях, включающих недостаточное питание.
Дальнейшее осуществление изобретения включает применение вышеуказанных веществ для облегчения боли, связанной с поражениями суставного хряща при вышеупомянутых состояниях.
Дальнейшее осуществление изобретения включает применение вышеуказанных веществ для лечения или профилактики остеопороза, связанного с гастрэктомией.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Настоящее изобретение будет объяснено в нижеследующем описании при помощи предпочтительных осуществлений, примеров исследований и сопровождающих чертежей, на которых
Фиг.1 - диаграмма, описывающая влияние рациона альфа-кетоглутарата и гастрэктомии на вес тела крыс,
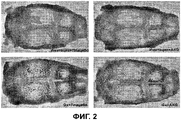
Фиг.2 - четыре трансиллюминационных фотографии верхнего отдела черепа (свода черепа) экспериментальных крыс,
Фиг.3 - диаграмма, показывающая область углублений, обнаруженных на траниллюминационных фотографиях свода черепа экспериментальных крыс.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Таким образом, согласно одному из аспектов настоящего изобретения обеспечивается новое применение по меньшей мере одного из членов группы, состоящей из альфа-кетоглутаровой кислоты, глутамина, глутаминовой кислоты и фармацевтически приемлемых солей этих кислот, амидов альфа-кетоглутаровой кислоты и аминокислот или ди- или трипептидов глутамина и других аминокислот, трипептидов глутамина и других аминокислот, дипептидов глутаминовой кислоты и других аминокислот, трипептидов глутаминовой кислоты и других аминокислот и фармацевтически приемлемых солей названных дипептидов и трипептидов, фармацевтически приемлемых физических растворов альфа-кетоглутаровой кислоты или ее фармацевтически приемлемых солей и по меньшей мере одной аминокислоты для получения фармацевтической композиции для лечения или профилактики состояний артроза, ревматоидного артрита и разрушения хряща и боли, связанной с вышеупомянутыми нарушениями.
Согласно предпочтительному осуществлению изобретения применяются альфа-кетоглутаровая кислота, или ее соли щелочных или щелочноземельных металлов, или комбинация вышеуказанных соединений.
Согласно другому аспекту настоящего изобретения обеспечивается способ лечения или профилактики состояния усиливающейся боли для по меньшей мере одного из членов группы, состоящей из артроза у млекопитающих, включая человека, где способ включает в себя введение субъекту в целях такового лечения или профилактики действительной боли доз по меньшей мере одного из членов группы, состоящей из альфа-кетоглутаровой кислоты, глутамина, глутаминовой кислоты и фармацевтически приемлемых солей этих кислот, амидов альфа-кетоглутаровой кислоты и аминокислот или ди- или трипептидов глутамина и других аминокислот, трипептидов глутамина и других аминокислот, дипептидов глутаминовой кислоты и других аминокислот, трипептидов глутаминовой кислоты и других аминокислот и фармацевтически приемлемых солей названных дипептидов и трипептидов, фармацевтически приемлемых физических растворов альфа-кетоглутаровой кислоты или фармацевтически приемлемых ее солей и по меньшей мере одной аминокислоты.
Согласно предпочтительному осуществлению этих аспектов вводятся альфа-кетоглутаровая кислота, или ее соли щелочных или щелочноземельных металлов, или комбинация вышеуказанных соединений. Наиболее предпочтительно введение альфа-кетоглутарата натрия.
Фармацевтические препараты активного компонента или компонентов, применяемых в соответствии с настоящим изобретением, могут вводиться позвоночным, включая млекопитающих, таким как грызуны, таким как мыши, крысы, морские свинки или кролики; птицам, таким, как индюки, курицы или цыплята и другие бройлеры и животные свободного содержания; коровам, лошадям, свиньям и поросятам и другим сельскохозяйственным животным, собакам, кошкам и другим домашним животным, а также человеку.
Введение может осуществляться различными способами в зависимости от вида позвоночного, которому оказывается лечение, от состояния позвоночного, нуждающегося в названных методах и конкретных показаний к лечению.
В одном из осуществлений введение осуществляется в форме пищи или пищевых добавок, таких как диетические добавки и/или ингредиенты в форме твердой пищи или напитков. Следующие осуществления могут быть в суспензиях или растворах, как напиток, описанный ниже. Также форма выпуска может быть в таблетках или капсулах, жевательных или растворимых, например шипучих таблетках, а также порошках и других сухих формах, известных квалифицированному специалисту в данной области, таких как драже, микропеллеты и гранулы.
Введение может быть парентеральным, ректальным или в виде пероральной пищи или пищевой добавки, как указывается выше. Парентеральная среда включает раствор хлорида натрия, декстрозу Рингера, декстрозу и хлорид натрия, лактат Рингера или нелетучие масла.
Пища и пищевые добавки также могут быть эмульгированы. Активный терапевтический ингредиент или ингредиенты затем могут быть смешаны с формообразующими основами, которые фармацевтически приемлемы и совместимы с активным ингредиентом. Подходящие ингредиенты, например вода, солевой раствор, декстроза, глицерин, этанол или подобные и их сочетания. К тому же при необходимости композиция может содержать незначительные количества вспомогательных средств, таких как увлажняющие или эмульгирующие агенты, pH буферные агенты, которые усиливают эффективность активного ингредиента.
Могут применяться различные формы парентеральной пищи, такие как твердая пища, жидкости, лиофилизированные или, напротив, обезвоженные формы. Они могут включать растворители или различные буферы (например, трис-HCl, ацетат, фосфат), pH и ионные усилители, добавки, такие как альбумин или желатин для предотвращения поверхностного всасывания, детергенты (например, Твин 20, Твин 80, Плюроник F68, соли желчных кислот), растворяющие агенты (например, глицерин, полиэтиленглицерин), антиоксиданты (например, аскорбиновая кислота, метабисульфит натрия), консерванты (например, тимеросал, бензиловый спирт, парааминбензойная кислота), разрыхляющие субстанции или модификаторы тонуса (например, лактоза, маннитол), ковалентные соединения с композицией полимеров, таких как полиэтиленгликоль, формирование комплексов с ионами металлов, включение материала в или к препаратам из полимерных композиций, таких как полимолочная кислота, полигликолевая кислота, гидрогели и т.д., или внутрь липосом, микроэмульсий, мицеллей, униламеллярных или мультиламелярных везикул, гемолизированных эритроцитов или сферопластов.
В одном осуществлении изобретения пища или пищевая добавка вводятся в форме напитка или сухой композиции вышеуказанных соединений в каждом из методов согласно изобретению.
Напиток включает эффективное количество активного ингредиента или ингредиентов вышеуказанных соединений, вместе с пищевым водорастворимым носителем, таким как минералы, витамины, углеводы, жиры и белки. Все эти компоненты применяются в сухом виде, если напиток производится в сухой форме. Напиток, производящийся готовым к употреблению, содержит воду. Готовый раствор также может иметь определенный тонус и кислотность, как, например, буферный раствор, согласно общим указаниям в предыдущем абзаце.
Предпочтителен pH в диапазоне от 2 до 5, и в особенности от 2 до 4, чтобы избежать роста бактерий и грибков. Простерилизованный напиток может также применяться при pH около 6-8.
Напиток может применяться один или в сочетании с одним или более терапевтически эффективными соединениями.
Согласно дальнейшему осуществлению изобретения фармацевтический препарат в виде лекарства для перорального и ректального применения может быть в форме таблеток, пастилок, капсул, порошков, водных или масляных суспензий, сиропов, эликсиров, водных растворов и подобных, включающих в себя активный ингредиент с примесью фармацевтически приемлемых носителей и/или добавок, таких как растворители, консерванты, солюбилизаторы, эмульгаторы, адъюванты и/или носители, применяемые в методе и открыто применяющиеся в настоящем изобретении.
Использующееся в дальнейшем словосочетание «фармацевтически приемлемые носители» известно квалифицированным специалистам в данной области и может включать, но не ограничивается, 0,01-0,05 М фосфатным буфером или 0,8% солевым раствором. Кроме того, такие фармацевтически приемлемые носители могут быть водными или неводными растворами, суспензиями и эмульсиями. Примерами неводных растворов являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и инъецируемые органические эфиры, такие как этилолеат. Водные носители включают воду, алкогольные/водные растворы, эмульсии или суспензии, включая солевой раствор и буферную среду. Парентеральные основы включают раствор хлорида натрия, декстрозу Рингера, декстрозу и хлорид натрия, лактат Рингера или нелетучие масла. Также могут присутствовать консерванты и другие добавки, такие как, например, антимикробные вещества, антиоксиданты, хелатообразующие агенты, инертные газы и подобные.
Аминокислоты, составляющие часть амидов с альфа-кетоглутаровой кислотой или дипептидов с глутамином или глутаминовой кислотой или трипептидов с глутамином и/или глутаминовой кислотой, могут быть любой аминокислотой, встречающейся в природе в составе пептидов. То же относится к фармацевтически приемлемым физическим растворам альфа-кетоглутаровой кислоты или солей вышеуказанных соединений с по меньшей мере одной аминокислотой. Предпочтительны аминокислота/аминокислоты, выбранные из группы, состоящей из аргинина, орнитина, лейцина, изолейцина и лизина.
Названные аминокислоты предпочтительно применять в L-конфигурации.
Примеры амидов из альфа-кетоглутаровой кислоты с аминокислотой и ди- или трипептидом включают, но не ограничиваются, амидом альфа-кетоглутаровой кислоты с аминокислотой выбранной из группы, состоящей из глутамина, глутаминовой кислоты, аргинина, орнитина, лизина, пролина, изолейцина и лейцина и амидов альфа-кетоглутаровой кислоты с дипептидом глутамина и любым из следующих веществ: глутаминовой кислотой, аргинином, орнитином, лизином, пролином, изолейцином и лейцином и с дипептидом глутаминовой кислоты и любым из следующих веществ: аргинином, орнитином, лизином, пролином, изолейцином и лейцином.
Примеры ди- и пептидов глутамина и глутаминовой кислоты с другими аминокислотами включают вышеупомянутые в соединении с амидами альфа-кетоглутаровой кислоты с ди- и трипептидами.
Примеры физических растворов α-кетоглутаровой кислоты и ее солей с по меньшей мере одной аминокислотой включают, но не ограничиваются, физическим раствором по меньшей мере одного из компонентов группы, состоящей из альфа-кетоглутаровой кислоты и ее солей натрия, калия, кальция, магния с любым из следующих веществ: глутамином, глутаминовой кислотой, аргинином, орнитином, лейцином, изолейцином, лизином и пролином и любой комбинацией названных аминокислот.
Молярное соотношение между альфа-кетоглутаровой кислотой или ее солями и аминокислотой или аминокислотами из названного физического раствора должно в общем находиться в пределах от 1:0,01 до 1:2, предпочтительно от 1:0,1 до 1:1,5 и наиболее предпочтительно от 1:0,2 до 1:1,0.
Вводимая доза варьируется в зависимости от применяющегося действующего компонента или компонентов, заболевания, возраста, пола, веса и т.д. пациента, но должна в общем находиться в пределах от 1 до 1000 мг/кг веса в день или от 10 до 400 мг/кг веса в день, предпочтительно от 10 до 100 мг/кг веса в день.
Изобретение будет в дальнейшем проиллюстрировано рядом примеров, которые не следует толковать как ограничивающие объем изобретения.
ПРИМЕР
Анамнез: Хирургическое удаление желудка (гастрэктомия, Gx) ведет к остеопорозу у людей и животных. Гастрэктомия преимущественно повреждает структуру губчатой кости. Неясно, оказывает ли она также отрицательное воздействие на эпифизарный хрящ. Пищевой альфа-кетоглутарат (AKG) - источник гидроксипролина, наиболее богатого аминокислотой в кости и хряще про-коллагена. Целью исследований было осветить влияние AKG на костные/хрящевые поражения, связанные с гастрэктомией.
Способы: были использованы 40 самок крыс Спрейга-Дэули. Двадцать крыс были подвергнуты гастрэктомии и разделены на две группы: Gx+AKG и Gx+Плацебо. Другие двадцать крыс были подвергнуты имитации операции и разделены на две другие группы: Имитация+AKG и Имитация+Плацебо. Через 8 недель животные были умерщвлены и были отобраны черепа, бедренные кости и голени. Были установлены плотность костей (BMD) и минеральная насыщенность костной ткани (BMC) в правых бедренных костях и костях голени и проведена гистоморфометрия левых костей. Были также выполнены измерения черепов по трансиллюминационным снимкам.
Результаты: пищевой альфа-кетоглутарат оказывает сильное защитное воздействие на пораженные кости черепа крыс, подвергшихся гастрэктомии. AKG проявляет сильное антидеструктивное действие на клетки эпифизарного хряща, объем губчатых костей и форму трабекул крыс, подвергнутых гастрэктомии.
Заключение: AKG минимизирует повреждения кости и хряща, связанные с резекцией желудка у крыс.
Хирургическое удаление желудка ведет к остеопении и артриту у людей, крыс и других экспериментальных животных. У людей гастрэктомия связана с остеопенией. Дисфункция желудка также может способствовать развитию остеопороза с возрастом. Поэтому в большинстве исследований, связанных с заболеваниями костей, участвуют пациенты после резекции желудка.
Гастрэктомия поражает преимущественно губчатые кости, а порой также трубчатые кости, включая упомянутый эффект на разрушение костей черепа. Имеются сведения о сокращении массы трубчатых и губчатых костей у людей обоего пола. Объем губчатых костей бедра и голени сокращается на 60% через 16 недель после гастрэктомии. Потери костной массы повышают риск переломов бедра, позвоночника и других участков тела пациентов, подвергшихся гастрэктомии, что представляет серьезную проблему в настоящее время.
Предполагается, что потеря костной массы у пациентов, подвергшихся гастрэктомии, не является результатом недостаточности питания или недостатком желудочного сока или витамина D. Механизм гастрэктомия-индуцированной остеопении до сих пор неизвестен. Однако предполагается, что главной причиной остеопорозов является малоэффективная резистентность коллагена кости после массового разрушения его остеокластами. Основным компонентом костного про-коллагена является пролин - аминокислоты, синтезируемые в желудочно-кишечном тракте из AKG и через пролин, который в свою очередь превращается из костного про-коллагена в гидрокоспролин в присутствии AKG, витамина С и Fe²+. Недавно было показано, что AKG эффективен для предотвращения потери костной массы у крыс, подвергнутых овариэктомии, и в денервированных костях у индюков. С учетом всего вышесказанного главной целью исследований было установить, может ли пищевой AKG предотвратить потери костной и хрящевой массы у крыс, подвергнутых гастрэктомии.
Животные и хирургические операции
Сорок самок крыс Спрейга-Дэули в возрасте 10 недель (220-230 г) содержались в клетках Macrolon® (по 2 крысы в каждой клетке) и получали питание из стандартного сухого корма для крыс (Lactamin, Vadstena, Sweden) и плацебо или AKG ad libitum, растворенный в воде (Таблица 1). Исследование продолжалось 8 недель. Крыс каждую неделю взвешивали.
Крысы пили от 25 до 50 миллилитров каждый день. В целом можно считать, что крысы выпивали от 10 до 20% от массы тела.
Крысы из группы AKG выпивали приблизительно 25 мл AKG напитка в день. В 25 мл AKG напитка содержится 0,36 г AKG, что дает примерно от 1 до 1,4 г AKG на кг веса крысы в день. Крысы в группе плацебо (контрольной группе) пили приблизительно 50 мл напитка-плацебо в день.
Хирургическая операция
Двадцать крыс были подвергнуты гастрэктомии и разделены на 2 группы: Gx+AKG и Gx+плацебо (10 крыс в каждой группе). Железистый отдел желудка (т.е. часть, выделяющая кислоту, дно и пилорическая полость) были отсечены, после чего не-железистый отдел (кардиальный отдел желудка) был соединен с двенадцатиперстной кишкой конец-в-конец. 20 крыс были подвергнуты имитации операции и разделены на две группы: Имитация+AKG и Имитация+Плацебо. Имитация операции включала абдоминальный разрез по средней линии, манипуляции с желудком и закрытие разреза. Для анестезии применялись подкожные инъекции Ketalar® (50 мг/кг, Parke-Davis, Morris Plains, NJ, U.S.A.) и Stresnil® (40 мг/кг; Janssen-Cilag Pharma, Vienna, Austria). Для анальгезии применялись подкожные инъекции Temgesic® (0,18 мг/кг, Schering-Plough, Kenilworht, NJ, U.S.A.). Лечение групп Имитация+Плацебо и Gx+Плацебо проводилось путем применения плацебо, в то время как группы Gx+AKG и Имитация+AKG получали лечение AKG.
Крысы Gx каждую вторую неделю (начиная с первой недели после операции) получали внутримышечную инъекцию 0,4 мг/кг витамина B12 (Betolvex® 1 мг/мл, Dumex, Copenhagen, Denmark), чтобы возместить потери внутреннего фактора, влияющего на абсорбцию витамина В12, и 20 мг Fe³+/кг из полимальтозного комплекса гидроксида железа (Ferrum 50мг Fe³+ мг/мл, Vifor (International) Inc., St.Gallen/Switzerland) как добавку, предупреждающую плохое всасывание железа в связи с потерей желудочного сока.
Эти добавки не оказывали воздействия на развитие веса тела крыс, не подвергавшихся хирургическим процедурам.
В течение эксперимента 8 животных умерло. Количество животных (n) составляло 7 в группе Имитация+Плацебо, 10 в группе Имитация+AKG, 8 в группе Gx+Плацебо и 7 в группе Gx+AKG.
Все животные были умерщвлены путем вскрытия брюшной аорты под анестезией, упомянутой выше.
Исследования были одобрены местным Комитетом по защите прав животных, Lund, Sweden.
Отбор и анализ тканей
Череп каждой крысы был вскрыт и очищен от мягких тканей путем тщательного удаления надкостницы. Высушивание достигалось покрытием каждого черепа марлей, смоченной в солевом растворе, и помещением их в воздухонепроницаемый контейнер при +4°С до изучения. Каждый череп был помещен в стеклянную чашку Петри на вершину источника света (промышленной осветительной трубы), излучающей свет постоянной интенсивности. Получившиеся трансиллюминационные изображения были сделаны камерой, присоединенной к операционному микроскопу, увеличение ×16. Изображения были подвергнуты анализу на гистоморфометрическом компьютере, выполненному ImageJ v. 1.33a. Была оценена потеря костной массы (при наблюдении площади лакун).
И бедренная, и большеберцовая кость были отобраны и хранились в 70% растворе этанола до дальнейшего анализа.
Правые бедренная и большеберцовая кости были подвергнуты анализу PIXIMUS, который показывает BMD в г/см и BMC в г/см.
Закрепленные этанолом бедренная и большеберцовая кость были декальцинорованы в 7% азотной кислоте в течение 48 часов. Образцы дистальной части бедренной кости и проксимальной части большеберцовой кости (состоящей из эпифиза с восьмимиллиметровой частью метафиза) были использованы в дальнейшем гистологическом процессе. Образцы были погружены в парафин. Лонгитюдинальный срез образцов бедренной и большеберцовой кости (6 μм толщиной) был сделан автоматическим микромом Microm HM 360. Было сделано 20 срезов каждой кости (с промежутком 20 µм после каждых 5) одной особи. Срезы были окрашены гематоксилин/эозином при стандартных условиях. Были сняты микроскопические изображения каждого окрашенного среза. Снимки для оценки состояния губчатой кости были сделаны с помощью Nikon Eclipse E800 - светового микроскопа, увеличение ×40 и Nikon D70 - цифровой фотокамеры. Микроскопическое изображение срезов бедренной и большеберцовой кости были подвергнуты гистоморфометрическому компьютерному анализу. Анализ трабекул был сделан при помощи ImageJ v. 1.33a. Снимки для оценки состояния эпифизарного хряща были сделаны посредством контрастной техники Нормански и отобраны с оснащенного AXIOVERT 200 М с LSM 5 Pascal сканирующей лазерной головкой, Zeiss, увеличение ×100, с аргоновым лазером с длиной волны 514 нм. Анализ эпифизарного хряща был сделан при помощи Analysis v 3.0. Снимки суставного хряща были получены при помощи флуоресцентного режима AXIOVERT 200 М с LSM 5 Pascal сканирующей лазерной головкой, Zeiss, увеличение ×100, с аргоновым лазером с длиной волны 514 нм. Снимки суставного хряща были оценены Zeiss LSM Image Examiner v. 3.1.0.99. Параметрами оценки трабекул под эпифизарным хрящом были: объем губчатой кости (BV/TV %), измеряемый для получения характеристик губчатой кости, и фрактальный размер трабекул (Box Counting Method). Параметрами оценки эпифизарного хряща были: количество хрящевых клеток в ROI (зоне интереса), состоящей из зоны покоя, пролиферативной зоны и зоны гипертрофированного хряща. Оценка относительного содержания коллагена в суставном хряще была сделана при помощи измерения флуоресцентной интенсивности эозин-окрашенного коллагена в произвольно выбранной ROI (с такой же площадью каждого среза - 6 пластинок по 83 μм в диаметре каждая по всему протяжению суставного хряща), с детектором LSM 5 Pascal сканирующей лазерной головки с 12-битовым уровнем серого в качестве шкалы измерения. Измерения каждого среза были проведены в абсолютно одинаковых стандартных условиях.
Статистика
Данные были сверены при помощи однофакторного дисперсионного анализа (ANOVA), т-теста Стьюдента и p<0,05 рассматривалась как статистически достоверная.
РЕЗУЛЬТАТЫ
В конце эксперимента масса тела животных, подвергнутых операции, была на 8% меньше, чем у животных, подвергнутых имитации операции. Статистически достоверной разницы между группами не было (Фиг.1).
Трансиллюминационные снимки черепа
Трансиллюминационные снимки черепа показывают достоверный рост процента костных лакун в группах крыс Gx+плацебо и Gx+AKG по сравнению с группами Имитация+Плацебо и Имитация+AKG (Фиг.2). В группе крыс Gx+AKG также был выявлен достоверно более низкий процент лакун по сравнению с группой Gx+плацебо. (*p = 0,031) (Фиг.3) Разница между группами Имитация+Плацебо и Имитация+ AKG не была статистически достоверной.
Плотность костей (BMD) и минеральная насыщенность костной ткани (BMC) в бедренной и большеберцовой костях
В группах Gx+плацебо и Gx+AKG BMD и BMC был ниже, чем в группах Имитация+Плацебо и Имитация+AKG (данные не показаны). Однако BMD в группе Gx+AKG имел тенденцию быть выше, чем в группе Gx+плацебо (p=0,19).
Гистоморфометрия
Анализ суставного хряща
Количество хрящевого коллагена в группе Gx+AKG было то же, что в контрольных (подвергнутых имитации операции группах), и было достоверно выше по сравнению с группой Gx+плацебо (Таблица 2).
Анализ эпифизарного хряща
Количественная оценка роста клеток эпифизарного хряща показала снижение количества клеток в группе крыс Gx+AKG по сравнению с группами крыс Имитация+Плацебо и Имитация+AKG. Кроме того, количество хрящевых клеток в группе Gx+AKG было достоверно больше, чем в обеих группах имитации (Таблица 3, 4).
Объем губчатой кости
Объем губчатой кости снижался в группах Gx+плацебо и Gx+AKG по сравнению с группами Имитация+Плацебо и Имитация+AKG. Однако сокращение площади трабекул в Gx+AKG было меньше, чем в Gx+плацебо группе (Таблица 5, 6).
Фрактальный размер костной трабекулы
Фрактальный размер костной трабекулы в Gx+AKG был одинаковым в контрольных группах и был выше, чем в Gx+плацебо (Таблица 7, 8).
ПОЯСНЕНИЕ
Целью эксперимента была оценка влияния пищевого альфа-кетоглутарата на потерю костной массы, вызванную гастрэктомией. Полученные данные подтвердили эту гипотезу. Действительно пищевой AKG предотвращает потерю костной и хрящевой массы у крыс, подвергшихся гастрэктомии. Наши результаты согласуются с данными последних экспериментов, показывающих, что AKG предотвращает развитие остеопороза у крыс, подвергнутых овариэктомии и у женщин после менопаузы.
Гастрэктомия вызвала потерю хрящевого коллагена и хрящевых клеток в группах Gx+плацебо, но не в группе Gx+AKG. В группе Gx+AKG было подтверждено наличие на 22% больше хрящевых клеток, чем в Gx+плацебо группе. Это свидетельствует о том, что AKG эффективен для предотвращения потери хрящевой массы у крыс, подвергшихся гастрэктомии. Анализ выявил защитное влияние AKG на костный и хрящевой коллаген. Количество коллагена в группе Gx+AKG находилось в пределах диапазона контрольной группы эксперимента и было примерно на 18% выше, чем у группы крыс Gx+Плацебо.
Наблюдался защитный эффект AKG на кости черепа крыс, подвергнутых гастрэктомии. В черепах крыс группы Gx+AKG обнаружилось на 20% меньше повреждений, чем в черепах крыс группы Gx+Плацебо. Значения BMD и BMC показывали, что гастрэктомия вызвала остеопению в Gx+плацебо и Gx+AKG группах, что согласуется с другими экспериментами. Однако применяя более чувствительные гистоморфометрические технологии, мы показали, что AKG, возможно, эффективен для предотвращения остеопении у Gx крыс.
Далее исследование объема костных трабекул показало на 38% меньше снижения в группе крыс Gx+AKG по сравнению с группой животных Gx+Плацебо. Более того, фрактальное измерение трабекул в группе Gx+AKG показало почти тот же уровень, что в группах имитации операции. Таким образом, альфа-кетоглутарат действительно оказывает сильное влияние на обновление костных трабекул.
Гастрэктомия оказывает сильное деструктивное влияние на скелет, вызывая остеопению и артропатию. AKG не может полностью остановить эти повреждения, но он определенно ограничивал развитие деструктивных изменений кости и хряща, связанных с гастрэктомией, и, вероятно, способствовал обновлению скелетной системы. Итоги этих исследований могут быть важны для клинического наблюдения людей, например, когда частичная гастрэктомия рекомендована для снижения веса пациентам, страдающим ожирением. У всех этих пациентов развивается остеопороз и артропатия. Таким образом, введение этим пациентам пищевого AKG может остановить или ограничить деструктивные изменения костей.
| Таблица 1 Композиции напитков AKG и плацебо |
||
| Ингредиенты | AKG (г/дм³) |
Плацебо (г/дм³) |
| AKG (альфа-кетоглутарат) | 14,6 | 0 |
| HCl соляная кислота | 0 | 3,32 |
| С6H12O6 глюкоза | 30,0 | 30,0 |
| C12H22O11 сахароза | 15,0 | 15,0 |
| NaOH гидроксид натрия | 3,6 | 3,6 |
| KOH гидроксид калия | 0,75 | 0,75 |
| Ca(OH)2 гидроксид кальция | 0,46 | 0,46 |
| Mg(OH)2 гидроксид магния | 0,18 | 0,18 |
| pH | 4,6 | 4,6 |
Для достижения одинакового уровня pH в каждом растворе напиток плацебо был оттитрован 0,1M HCl до pH 4,6 ( уровень pH AKG-напитка).
| Таблица 2 Влияние AKG и гастрэктомии на относительное содержание коллагена в суставном хряще |
||
| Лечение | Флуоресценция | SD |
| Gx+AKG | 2363a | 623 |
| Gx+Плацебо | 1928b | 647 |
| Имитация+AKG | 2475a | 457 |
| Имитация+Плацебо | 2171a | 374 |
Разные буквы, приведенные в столбце результатов, описывают достоверную разницу при p<0,05.
n=7 в Gx+AKG, n=8 в Gx+Плацебо, n=10 в Имитация+AKG, n=7 в Имитация+Плацебо
| Таблица 3 Влияние AKG и гастрэктомии на количество хондроцитов в эпифизарном хряще бедра |
||
| Лечение | Количество, клеток/мм² | SD |
| Gx+AKG | 2220a | 490 |
| Gx+Плацебо | 1760b | 360 |
| Имитация+AKG | 1890b | 330 |
| Имитация+Плацебо | 1850b | 220 |
Разные буквы, приведенные в столбце результатов, описывают достоверную разницу при p<0,05.
n=7 в Gx+AKG, n=8 в Gx+Плацебо, n=10 в Имитация+AKG, n=7 в Имитация+Плацебо
| Таблица 4 Влияние AKG и гастрэктомии на количество хондроцитов в эпифизарном хряще большеберцовой кости |
||
| Лечение | Количество, клеток/мм² | SD |
| Gx+AKG | 2470a | 470 |
| Gx+Плацебо | 1950b | 330 |
| Имитация+AKG | 1840b | 410 |
| Имитация+Плацебо | 2110b | 340 |
Разные буквы, приведенные в столбце результатов, описывают достоверную разницу при p<0,05.
n=7 в Gx+AKG, n=8 в Gx+Плацебо, n=10 в Имитация+AKG, n=7 в Имитация+Плацебо
| Таблица 5 Влияние альфа-кетоглутарата и гастрэктомии на объем губчатой кости бедра |
||
| Лечение | Площадь трабекул (%) | SD |
| Gx+AKG | 18,8a | 3,7 |
| Gx+Плацебо | 11,2b | 2,1 |
| Имитация+AKG | 25,5c | 7,8 |
| Имитация+Плацебо | 24,5c | 5,9 |
Разные буквы, приведенные в столбце результатов, описывают достоверную разницу при p<0,05.
n=7 в Gx+AKG, n=8 в Gx+Плацебо, n=10 в Имитация+AKG, n=7 в Имитация+Плацебо
| Таблица 6 Влияние альфа-кетоглутарата и гастрэктомии на объем губчатой кости в большеберцовой кости |
||
| Лечение | Площадь трабекул (%) | SD |
| Gx+AKG | 16,7a | 3,4 |
| Gx+Плацебо | 10,5b | 2,5 |
| Имитация+AKG | 24,9c | 5,3 |
| Имитация+Плацебо | 21,1c | 5,7 |
Разные буквы, приведенные в столбце результатов, описывают достоверную разницу при p<0,05.
n=7 в Gx+AKG, n=8 в Gx+Плацебо, n=10 в Имитация+AKG, n=7 в Имитация+Плацебо
| Таблица 7 Влияние альфа-кетоглутарата и гастрэктомии на фрактальном измерении бедренной кости |
||
| Лечение | Площадь трабекул (%) | SD |
| Gx+AKG | 1,22b | 0,02 |
| Gx+Плацебо | 1,19a | 0,03 |
| Имитация+AKG | 1,24b | 0,04 |
| Имитация+Плацебо | 1,25b | 0,03 |
Разные буквы, приведенные в столбце результатов, описывают достоверную разницу при p<0,05.
n=7 в Gx+AKG, n=8 в Gx+Плацебо, n=10 в Имитация+AKG, n=7 в Имитация+Плацебо
| Таблица 8 Влияние альфа-кетоглутарата и гастрэктомии на фрактальном измерении большеберцовой кости |
||
| Лечение | Площадь трабекул (%) | SD |
| Gx+AKG | 1,22b | 0,02 |
| Gx+Плацебо | 1,17a | 0,02 |
| Имитация+AKG | 1,22b | 0,03 |
| Имитация+Плацебо | 1,21b | 0,04 |
Разные буквы, приведенные в столбце результатов, описывают достоверную разницу при p<0,05.
n=7 в Gx+AKG, n=8 в Gx+Плацебо, n=10 в Имитация+AKG, n=7 в Имитация+Плацебо
Пояснение к чертежам:
Фиг.1 Влияние пищевого альфа-кетоглутарата и гастрэктомии на вес тела крыс. Контрольные группы: ИМИТАЦИЯ+ПЛАЦ, GX+ПЛАЦ. Экспериментальные группы: ИМИТАЦИЯ+AKG, GX+AKG (ИМИТАЦИЯ - крысы, подвергнутые имитации операции, GX - крысы, подвергнутые гастрэктомии).
Фиг.2 Отобранные снимки черепов экспериментальных животных. Контрольные группы: ИМИТАЦИЯ+ПЛАЦ, GX+ПЛАЦ. Экспериментальные группы: ИМИТАЦИЯ+AKG, GX+AKG (ИМИТАЦИЯ - крысы, подвергшиеся имитации операции, GX - крысы, подвергшиеся гастрэктомии).
Фиг.3 Влияние пищевого альфа-кетоглутарата и гастрэктомии на трансиллюминационных снимках черепа. Контрольные группы: ИМИТАЦИЯ+ПЛАЦ, GX+ПЛАЦ. Экспериментальные группы: ИМИТАЦИЯ+AKG, GX+AKG (ИМИТАЦИЯ - крысы, подвергшиеся имитации операции, GX - крысы, подвергшиеся гастрэктомии).
Claims (20)
1. Применение фармацевтически приемлемой соли альфа-кетоглутаровой кислоты для получения фармацевтической композиции для лечения или профилактики поражений хряща в условиях, включающих потерю веса и/или нарушенного питания, недостаточного питания, гастрэктомии, частичной гастрэктомии или перевязки желудка.
2. Применение по п.1, в котором фармацевтически приемлемая соль альфа-кетоглутаровой кислоты является солью щелочных или щелочноземельных металлов или их комбинаций, выбранных из солей натрия, калия, кальция, магния.
3. Применение по п.1, в котором фармацевтическая композиция дополнительно содержит по меньшей мере одну аминокислоту.
4. Применение по п.3, в котором аминокислота выбирается из: глутамина, глутаминовой кислоты, аргинина, орнитина, лейцина, изолейцина, пролина и их сочетаний.
5. Применение по п.2, где фармацевтически приемлемая соль альфа-кетоглутаровой кислоты является солью щелочных металлов.
6. Применение по п.2, где фармацевтически приемлемая соль альфа-кетоглутаровой кислоты является солью щелочноземельных металлов.
7. Применение по п.1, где фармацевтически приемлемой солью альфа-кетоглутаровой кислоты является альфа-кетоглутарат натрия.
8. Применение по любому из пп.1-7, в котором вводимая пациенту доза вещества находится в интервале от 1 до 1000 мг/кг массы тела/день.
9. Применение по любому из пп.1-7, в котором вводимая пациенту доза вещества находится в интервале от 10 до 400 мг/кг массы тела/день.
10. Применение по любому из пп.1-7, в котором вводимая пациенту доза вещества находится в интервале от 10 до 100 мг/кг массы тела/день.
11. Способ лечения или профилактики поражений хряща в условиях, включающих потерю веса и/или нарушенного питания, недостаточного питания, гастрэктомии, частичной гастрэктомии или перевязки желудка, где способ включает введение фармацевтической композиции, содержащей фармацевтически приемлемую соль альфа-кетоглутаровой кислоты.
12. Способ по п.11, в котором фармацевтически приемлемая соль альфа-кетоглутаровой кислоты является солью щелочных или щелочноземельных металлов или их комбинаций, выбранных из солей натрия, калия, кальция, магния.
13. Способ по п.11, в котором фармацевтическая композиция дополнительно содержит по меньшей мере одну аминокислоту.
14. Способ по п.13, в котором аминокислота выбирается из: глутамина, глутаминовой кислоты, аргинина, орнитина, лейцина, изолейцина, пролина и их сочетаний.
15. Способ по п.12, где фармацевтически приемлемая соль альфа-кетоглутаровой кислоты является солью щелочных металлов.
16. Способ по п.12, где фармацевтически приемлемая соль альфа-кетоглутаровой кислоты является солью щелочноземельных металлов.
17. Способ по п.11, где фармацевтически приемлемой солью альфа-кетоглутаровой кислоты является альфа-кетоглутарат натрия.
18. Способ по любому из пп.11-17, в котором вводимая пациенту доза вещества находится в интервале от 1 до 1000 мг/кг массы тела/день.
19. Способ по любому из пп.11-17, в котором вводимая пациенту доза вещества находится в интервале от 10 до 400 мг/кг массы тела/день.
20. Способ по любому из пп.11-17, в котором вводимая пациенту доза вещества находится в интервале от 10 до 100 мг/кг массы тела/день.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US59717205P | 2005-11-15 | 2005-11-15 | |
| US60/597,172 | 2005-11-15 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2008123806A RU2008123806A (ru) | 2009-12-27 |
| RU2454999C2 true RU2454999C2 (ru) | 2012-07-10 |
Family
ID=38048916
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2008123806/15A RU2454999C2 (ru) | 2005-11-15 | 2006-11-15 | Лекарственное средство, применяющееся при поражениях хряща |
Country Status (11)
| Country | Link |
|---|---|
| US (2) | US20090312427A1 (ru) |
| EP (1) | EP1951218A4 (ru) |
| JP (1) | JP2009515953A (ru) |
| KR (1) | KR20080074182A (ru) |
| CN (2) | CN101843609A (ru) |
| AU (1) | AU2006316059A1 (ru) |
| BR (1) | BRPI0618599A2 (ru) |
| CA (1) | CA2629683A1 (ru) |
| HK (1) | HK1126128A1 (ru) |
| RU (1) | RU2454999C2 (ru) |
| WO (1) | WO2007058612A1 (ru) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20080074182A (ko) * | 2005-11-15 | 2008-08-12 | 엔트레스 에이비 | 연골 손상에 사용하기 위한 약제 |
| PL226695B1 (pl) | 2006-07-03 | 2017-08-31 | Danuta Kruszewska | Środek do zastosowania w zapobieganiu i/lub hamowaniu kolonizacji Helicobacter pylori, zastosowanie soli kwasu alfa‑ketoglutarowego z metalami alkalicznymi i ziem alkalicznych do wytwarzania środka leczniczego oraz dodatku do żywności do zapobiegania i/lub hamowania kolonizacji Helicobacter pylori |
| EP2106791A1 (en) * | 2008-03-31 | 2009-10-07 | Biotempt B.V. | Glutamine or glutamine-containing dipeptide in a specific dosage for the treatment of inflammation |
| KR101080271B1 (ko) * | 2009-03-31 | 2011-11-08 | 주식회사 웰스킨 | 다이펩타이드를 유효성분으로 포함하는 자외선에 의한 홍반반응 억제용 화장품 조성물 |
| WO2011126163A1 (ko) * | 2010-04-08 | 2011-10-13 | 주식회사 웰스킨 | 다이펩타이드를 포함하는 피부 미백용 조성물 |
| CN113018288A (zh) * | 2019-12-25 | 2021-06-25 | 同济大学 | α-酮戊二酸在制备药物中的用途 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2002039978A1 (de) * | 2000-11-17 | 2002-05-23 | Fresenius Kabi Deutschland Gmbh | Enteral zu verabreichendes supplement zur parenteralen ernährung oder partiellen enteralen/oralen ernährung bei kritisch kranken, chronisch kranken und mangelernährten |
| RU2211037C1 (ru) * | 2001-12-29 | 2003-08-27 | Институт органической и физической химии им. А.Е.Арбузова Казанского научного центра РАН | Препарат селективного действия и способ лечения остеоартрозов |
| WO2004028448A2 (en) * | 2002-09-13 | 2004-04-08 | Miller Kenneth E | Method of alleviating pain via inhibition of neurotransmitter synthesis |
| WO2004098619A2 (en) * | 2003-05-07 | 2004-11-18 | Osteologix A/S | Treating cartilage / bone conditions with water-soluble strontium salts |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4687782A (en) * | 1984-12-10 | 1987-08-18 | Nutri-Fuels Systems, Inc. | Nutritional composition for enhancing skeletal muscle adaptation to exercise training |
| SE9303691D0 (sv) * | 1993-11-09 | 1993-11-09 | Gramineer Ab | New beverage |
| AU7984498A (en) * | 1997-06-25 | 1999-01-04 | Government Of The United States Of America, As Represented By The Secretary Of The Department Of Health And Human Services, The | Serum-free cell growth medium |
| US6846501B2 (en) * | 2000-04-12 | 2005-01-25 | Mid-America Commercialization Corporation | Traditional snacks having balanced nutritional profiles |
| SE0201713D0 (sv) * | 2001-11-23 | 2002-06-06 | Gramineer Internat Ab | New methods and use III |
| US20050176807A1 (en) * | 2004-02-09 | 2005-08-11 | Friesen Kim G. | Composition and method for use in cartilage affecting conditions |
| JP2005312402A (ja) * | 2004-04-30 | 2005-11-10 | Kanazawa Univ Tlo Inc | グルタミン酸伝達系を利用した骨・軟骨疾患治療薬の評価方法 |
| PL368573A1 (en) * | 2004-06-17 | 2005-12-27 | Sgp & Sons Ab | Pharmaceutical compound influencing growth and mineralization processes in the axial and the appendicular skeleton as well as bone diseases of mature years among humans and animals as well as application of the pharmaceutical compound in the process of growth and mineralization of axial and appendicular skeleton and bone diseases of mature years among humans and animals |
| PL371081A1 (pl) * | 2004-11-08 | 2006-05-15 | Sgp & Sons Ab | Preparat farmaceutyczny wpływający na procesy wzrostu i mineralizacji układu kostno-szkieletowego oraz chorób kości i chrząstki wieku dojrzałego u ludzi i zwierząt oraz zastosowanie preparatu farmaceutycznego w procesie wzrostu i mineralizacji układu kostno-szkieletowego oraz chorób kości i chrząstki wieku dojrzałego u ludzi i zwierząt |
| KR20080074182A (ko) * | 2005-11-15 | 2008-08-12 | 엔트레스 에이비 | 연골 손상에 사용하기 위한 약제 |
-
2006
- 2006-11-15 KR KR1020087014596A patent/KR20080074182A/ko not_active Application Discontinuation
- 2006-11-15 BR BRPI0618599-1A patent/BRPI0618599A2/pt not_active IP Right Cessation
- 2006-11-15 EP EP06824548A patent/EP1951218A4/en not_active Withdrawn
- 2006-11-15 CN CN201010170906A patent/CN101843609A/zh active Pending
- 2006-11-15 WO PCT/SE2006/050479 patent/WO2007058612A1/en active Application Filing
- 2006-11-15 CA CA002629683A patent/CA2629683A1/en not_active Abandoned
- 2006-11-15 CN CN2006800426722A patent/CN101309678B/zh not_active Expired - Fee Related
- 2006-11-15 JP JP2008541124A patent/JP2009515953A/ja active Pending
- 2006-11-15 AU AU2006316059A patent/AU2006316059A1/en not_active Abandoned
- 2006-11-15 US US12/084,947 patent/US20090312427A1/en not_active Abandoned
- 2006-11-15 RU RU2008123806/15A patent/RU2454999C2/ru not_active IP Right Cessation
-
2009
- 2009-05-19 HK HK09104552.3A patent/HK1126128A1/xx not_active IP Right Cessation
-
2010
- 2010-10-04 US US12/897,313 patent/US20110082086A1/en not_active Abandoned
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2002039978A1 (de) * | 2000-11-17 | 2002-05-23 | Fresenius Kabi Deutschland Gmbh | Enteral zu verabreichendes supplement zur parenteralen ernährung oder partiellen enteralen/oralen ernährung bei kritisch kranken, chronisch kranken und mangelernährten |
| RU2211037C1 (ru) * | 2001-12-29 | 2003-08-27 | Институт органической и физической химии им. А.Е.Арбузова Казанского научного центра РАН | Препарат селективного действия и способ лечения остеоартрозов |
| WO2004028448A2 (en) * | 2002-09-13 | 2004-04-08 | Miller Kenneth E | Method of alleviating pain via inhibition of neurotransmitter synthesis |
| WO2004098619A2 (en) * | 2003-05-07 | 2004-11-18 | Osteologix A/S | Treating cartilage / bone conditions with water-soluble strontium salts |
Also Published As
| Publication number | Publication date |
|---|---|
| CA2629683A1 (en) | 2007-05-24 |
| EP1951218A1 (en) | 2008-08-06 |
| US20090312427A1 (en) | 2009-12-17 |
| RU2008123806A (ru) | 2009-12-27 |
| WO2007058612A1 (en) | 2007-05-24 |
| CN101309678B (zh) | 2011-04-20 |
| BRPI0618599A2 (pt) | 2011-09-06 |
| CN101843609A (zh) | 2010-09-29 |
| US20110082086A1 (en) | 2011-04-07 |
| AU2006316059A1 (en) | 2007-05-24 |
| CN101309678A (zh) | 2008-11-19 |
| JP2009515953A (ja) | 2009-04-16 |
| HK1126128A1 (en) | 2009-08-28 |
| EP1951218A4 (en) | 2010-11-10 |
| KR20080074182A (ko) | 2008-08-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2454999C2 (ru) | Лекарственное средство, применяющееся при поражениях хряща | |
| Fantino et al. | Evidence for a direct central anorectic effect of tumor-necrosis-factor-alpha in the rat | |
| RU2375055C2 (ru) | Применение альфа-кетоглутарата и родственных соединений для снижения липидов плазмы | |
| JP4447913B2 (ja) | オステオポローシス治療のための組成物の製造のためのグルタミン酸塩、グルタミン酸塩誘導体又はグルタミン酸塩代謝物、グルタミン酸塩アナログ或いはそれらの混合物の使用 | |
| US20210128640A1 (en) | Hyaluronic acid production promoting agent | |
| Dobrowolski et al. | Can 2-oxoglutarate prevent changes in bone evoked by omeprazole? | |
| US20090325891A1 (en) | Cartilage regeneration-promoting agent | |
| CN106262809A (zh) | 一种增强骨密度缓解中老年关节疼痛的组合物 | |
| US11298327B2 (en) | Methods and compositions for treating and preventing arthritis | |
| KR100304312B1 (ko) | 아연이보충된전립선추출물 | |
| US20160310578A1 (en) | Method of accelerating osteogenesis | |
| KR101455275B1 (ko) | 발기 부전의 치료를 위한 아세틸 엘 카르니틴과 프로피오닐엘 카르니틴 및 실데나필과의 병용된 용도 | |
| JP4340042B2 (ja) | 軟骨生成促進剤及び軟骨損傷由来疾病予防治療剤 | |
| Kouguchi et al. | Vasoprotective effect of foods as treatments: chicken collagen hydrolysate | |
| JP2005232089A (ja) | 骨量増加作用を有する機能性経口投与剤 | |
| MX2008006203A (en) | Medicament for use in connection with cartilage impairment | |
| JP6301136B2 (ja) | ポリアミンを有効成分とする、軟骨組織の再生を促進するための組成物 | |
| US20240091185A1 (en) | Composition for improving cognitive function, agent for improving cognitive function, and food for improving cognitive function | |
| JP2023048160A (ja) | 破骨細胞分化抑制、筋肉量増加、運動機能改善、及び/又は筋力増強用組成物 | |
| JP4998880B2 (ja) | 骨粗鬆症の予防又は改善剤 | |
| JP2007254403A (ja) | ガラクツロン酸を有効成分とする軟骨生成促進剤 | |
| KR20170094584A (ko) | 레바미피드 전구체를 포함하는 면역질환 및 대사성질환의 예방 또는 치료를 위한 경구투여용 약제학적 조성물 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20141116 |