RU2441918C2 - In vitro диагностический набор для идентификации папилломавируса человека в клинических образцах - Google Patents
In vitro диагностический набор для идентификации папилломавируса человека в клинических образцах Download PDFInfo
- Publication number
- RU2441918C2 RU2441918C2 RU2008108517/10A RU2008108517A RU2441918C2 RU 2441918 C2 RU2441918 C2 RU 2441918C2 RU 2008108517/10 A RU2008108517/10 A RU 2008108517/10A RU 2008108517 A RU2008108517 A RU 2008108517A RU 2441918 C2 RU2441918 C2 RU 2441918C2
- Authority
- RU
- Russia
- Prior art keywords
- hpv
- probes
- amplification
- specific
- seq
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/70—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving virus or bacteriophage
- C12Q1/701—Specific hybridization probes
- C12Q1/708—Specific hybridization probes for papilloma
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6813—Hybridisation assays
- C12Q1/6834—Enzymatic or biochemical coupling of nucleic acids to a solid phase
- C12Q1/6837—Enzymatic or biochemical coupling of nucleic acids to a solid phase using probe arrays or probe chips
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6888—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for detection or identification of organisms
Landscapes
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Engineering & Computer Science (AREA)
- Immunology (AREA)
- Analytical Chemistry (AREA)
- Biotechnology (AREA)
- Microbiology (AREA)
- Molecular Biology (AREA)
- Physics & Mathematics (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Virology (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
Abstract
Изобретение относится к области биотехнологии, а именно к способу детектирования и типирования папилломавируса человека (HPV) в образце, а также к реакционному сосуду, набору и зонду для детектирования и типирования HPV. Способ включает проведение реакции амплификации нуклеиновых кислот в образце, причем реакция амплификации предназначена для амплификации мишеневой последовательности HPV неспецифическим для типа образом. Получают одноцепочечные олигонуклеотиды из любых продуктов амплификации. Осуществляют гибридизацию одноцепочечных олигонуклеотидов с множеством HPV-типоспецифических зондов, выбранных из группы, содержащей SEQ ID NO:1 - SEQ ID NO:133 и отобранных по типу, как указано в таблице 1, находящихся на твердом носителе, причем носитель расположен в реакционном сосуде, подходящем для этого образца. Детектируют гибридизованные олигонуклеотиды, если HPV присутствует в образце. Предложенное изобретение позволяет осуществлять специфическую идентификацию типов HPV, если HPV присутствует в образце. 4 н. и 59 з.п. ф-лы, 7 ил., 2 табл.
Description
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к in vitro диагностическому набору и к способу для идентификации папилломавируса человека (HPV) в клинических образцах. Настоящее изобретение также относится к устройству для применения этого набора и способа.
Более конкретно, в предпочтительных вариантах осуществления настоящее изобретение относится к in vitro диагностическому набору для специфического детектирования генотипов папилломавируса человека в клинических образцах с использованием зондов для генотипирования HPV, к платформе, на которой объединены матрицы нуклеиновых кислот, включая зонды, и стандартный лабораторный реакционный сосуд, к устройству для автоматической обработки результатов и к способу диагностики инфекции HPV с использованием этого in vitro диагностического набора.
УРОВЕНЬ ТЕХНИКИ
До настоящего времени было описано приблизительно 100 типов папилломавируса человека (HPV). Тип HPV считается новым типом, когда по меньшей мере 10% последовательностей генов в областях Е6, Е7 и L1 HPV отличаются от ранее известного типа. Подтипы, или варианты, отличаются от первичного типа менее чем на 2-5%. Эти вирусы имеют тропизм к эпителию человека и связаны с серьезными заболеваниями человека, в частности с карциномой слизистой оболочки половых органов и полости рта.
Приблизительно 50 типов HPV были выделены из аногенитальной слизистой оболочки. Они были подразделены на типы низкого риска (например, тип HPV 6, 11, 42, 43 и 44) и типы высокого риска (например, тип 16, 18, 31, 33 и 45) в зависимости от их связи с раком шейки матки. Детектирование и идентификация типов HPV является крайне важной, так как персистирующая инфекция типов HPV высокого риска является главным этиологическим фактором рака шейки матки.
Детектирование и идентификацию генотипов HPV проводят тестированием ДНК HPV. Эти способы могут выполняться прямым детектированием ДНК HPV или детектированием амплифицированной ДНК HPV. Способы прямого детектирования ДНК HPV включают способ захвата гибридов (НС) от Digene Corp., Gaithersburg, Md., USA и способы гибридизации in situ. Способ НС одобрен FDA и основан на способе усиления сигнала гибридизации. Использующиеся гибридизационные зонды представляют собой HPV-специфические РНК-последовательности. После инкубирования этих зондов с денатурированной ДНК HPV из клинического образца образуются гибриды РНК/ДНК, которые могут быть детектированы с помощью специфического антитела. Способ НС позволяет провести различия типов HPV высокого и низкого риска, но не может идентифицировать тип HPV. Еще одним недостатком этого тест-способа является то, что применение коктейля (смеси) зондов часто приводит к перекрестным реакциям между типами HPV этих двух классов.
Способы идентификации типа HPV посредством амплификации вирусного генома проводили в основном с помощью полимеразной цепной реакции (ПЦР). Генотипирование HPV может быть выполнено типоспецифической ПЦР с использованием праймеров, которые распознают только один конкретный тип. Альтернативным подходом является применение ПЦР с универсальными праймерами для амплификации всех типов HPV. Папилломавирусы типируют последующим анализом последовательности амплифицированного фрагмента гена. Анализ этой последовательности может проводиться различными способами, такими как секвенирование ДНК, полиморфизм длин рестрикционных фрагментов (RFLP) или гибридизация нуклеиновых кислот. Способы гибридизации, такие как обращенная блот-гибридизация, считаются наиболее подходящими для диагностических целей (Kleter et al., J Clin Microbiol. 1999, 37: 2508-21517; Van den Brule et al., J Clin Micrоbiol. 2002, 40: 779-787).
Недавно была разработана технология анализа микроматриц (см., например, патент США No. 5445934). Термин микроматриц обозначает анализ многих малых пятен для облегчения крупномасштабного анализа нуклеиновых кислот, позволяющий проводить одновременно анализ тысяч последовательностей ДНК. Как известно в данной области, обращенный блоттинг обычно проводят на мембранах, тогда как анализ микроматрицы обычно проводят на твердом носителе, и его, кроме того, можно проводить в небольшом масштабе. Технология микроматриц успешно применялась в области диагностики HPV (см. патентные публикации WO0168915 и № СА2484681).
Однако существует отрицательная сторона в применении технологии микроматриц, заключающаяся в том, что требуется дорогостоящее оборудование и трудоемкое манипулирование. Это неудобство было устранено благодаря Заявке на патент № US2005064469, в которой предложена «пробирка-микроматрица». Термин «пробирка-микроматрица» относится к реакционному сосуду, который имеет форму и размер, обычные для реакционного сосуда (например, пробирки Эппендоф по 1,5 мл), с микроматрицей, размещенным на его основании, в которой могут проводиться тесты, основанные на микроматрицах.
ЦЕЛИ ИЗОБРЕТЕНИЯ
В соответствии с описанным выше, целью настоящего изобретения является создание надежного способа для специфической идентификации типов HPV, возможно, присутствующих в клиническом образце.
Более конкретно, целью настоящего изобретения является создание способа специфической идентификации типов HPV с использованием платформы «пробирки-микроматрицы».
Целью настоящего изобретения также является создание зондов для специфического детектирования и/или идентификации различных типов HPV.
Кроме того, целью настоящего изобретения является создание набора для детектирования и/или идентификации типов HPV, содержащего реагенты, протоколы и HPV-специфические зонды, размещенные на «пробирке-микроматрице», позволяющие надежное специфическое детектирование и/или идентификацию типов HPV, возможно, присутствующих в клиническом образце.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Согласно первому аспекту изобретение относится к анализу детектирования и типирования папилломавируса человека (HPV) в образце, причем этот анализ включает: проведение реакции амплификации нуклеиновых кислот в образце, причем эта реакция амплификации предназначена для амплификации мишеневой последовательности HPV неспецифическим для типа образом; получение одноцепочечных олигонуклеотидов из любых продуктов амплификации; гибридизацию одноцепочечного олигонуклеотида, если возможно, со множеством HPV-типоспецифических зондов, обеспеченных на твердом носителе, причем этот носитель расположен в реакционном сосуде, подходящем для содержания этого образца; и детектирование гибридизованных олигонуклеотидов.
К аспектам изобретения также относятся анализ детектирования и типирования папилломавируса человека (HPV) в образце, включающий проведение реакции амплификации нуклеиновых кислот в образце, причем этот образец находится в контакте с твердым носителем, с иммобилизированном на нем множеством HPV-типоспецифических зондов, причем реакция амплификации предназначена для амплификации мишеневой последовательности HPV неспецифическим для типа образом; получение одноцепочечных олигонуклеотидов из любых продуктов амплификации; гибридизацию одноцепочечных олигонуклеотидов, если возможно, со множеством типоспецифических зондов HPV и детектирование гибридизованных олигонуклеотидов.
Реакцией амплификации является предпочтительно ПЦР. Одноцепочечные олигонуклеотиды могут быть получены денатурацией любых присутствующих двухцепочечных олигонуклеотидов, например, путем нагревания. Гибридизацию одноцепочечных олигонуклеотидов, предпочтительно, проводят при строгих условиях; такие условия будут известны специалистам в данной области, и, предпочтительно, включают в себя инкубирование денатурированных олигонуклеотидов с мишенью при 55°С в буфере, содержащем 1×SSC.
В предпочтительных вариантах осуществления, образец и твердый носитель находятся внутри реакционного сосуда; например, сосуда, описанного в US 2005064469.
Предпочтительно, используют зонды, специфические по меньшей мере для типов HPV 5, 10, 15, 20, 25, 30, 35, 40 или 42, которые, предпочтительно, выбраны из типов HPV 6, 11, 16, 18, 26, 30, 31, 32, 33, 34/64, 35, 39, 40, 42, 43, 44, 45, 51, 52, 53, 54, 56, 57, 58, 59, 61, 62, 66, 67, 68, 69, 70, 71, 72, 73, 74, 81, 82, 83, 84, 85 и 89. Эти зонды предпочтительно имеют длину 20-40 нт, предпочтительно 25-35 нт, более предпочтительно 28-32 нт и наиболее предпочтительно приблизительно 30 нт. Все зонды не обязательно должны быть одной и той же длины. Эти зонды предпочтительно являются специфическими в отношении L1-области HPV. Каждый типоспецифический зонд может отличаться от зондов, специфических в отношении другого типа HPV по меньшей мере 1, 2, 3 или предпочтительно более чем 3 нуклеотидами. Предпочтительные зонды выбраны из группы, содержащей SEQ ID NO:1 - SEQ ID NO:133; несколько из этих зондов детектируют один и тот же тип HPV, как описано ниже. Предпочтительно, множество зондов являются специфическими для одного и того же типа HPV и, более предпочтительно, используют по меньшей мере два зонда, специфических для каждого типа HPV. Смеси этих зондов могут быть иммобилизованы в одном и том же местоположении на твердом носителе или каждый типоспецифический зонд может быть иммобилизован в отличающемся положении. Каждый зонд, специфический в отношении одного и того же типа HPV, детектирует отличающуюся часть мишеневой последовательности этого HPV.
Зонды могут находиться на двух повторностях твердого носителя для обеспечения множественных местоположений детектирования на избыточность.
Могут также детектироваться одна или несколько контрольных последовательностей; например, зонд, иммобилизованный на твердом носителе, который не гибридизуется ни с какой мишеневой последовательностью из типов HPV. Этим зондом может быть геномная мишеневая последовательность человека; кроме того, этот анализ может включать амплификацию мишеневой последовательности человека из этого образца и детектирование, произошла ли гибридизация. Дополнительный контроль может быть введен с использованием неспецифически меченных последовательностей, иммобилизованных на этом твердом носителе; детектирование этой метки может гарантировать, что метка работает правильным образом. Еще один контроль может быть обеспечен включением контрольной последовательности амплификации, которая может быть амплифицирована с теми же самыми праймерами, что и мишень человека, но которая будет детектироваться отличающимся олигонуклеотидом на этом твердом носителе. Этот контроль гарантирует, что амплификация работает корректно.
Настоящее изобретение также относится к реакционному сосуду, включающему твердый носитель, имеющий множество HPV-типоспецифических зондов, иммобилизованных на нем. Также изобретение относится к набору для детектирования и типирования HPV, содержащему такой реакционный сосуд вместе со смесью для амплификации нуклеиновых кислот. Эта смесь может содержать HPV-консенсусные праймеры, такие как MY09 и MY11; и, необязательно, НМВ01; праймеры для амплификации мишеневой последовательности человека и контрольную мишеневую последовательность амплификации, включающую последовательности, соответствующие фланкирующим частям последовательности-мишени человека, так что амплификация обеих мишеневых последовательностей будет происходить с использованием одних и тех же праймеров. Этот набор может также включать в себя инструкции для его применения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 показано расположение зондов на поверхности микроматрицы с 12×11=132 положениями. Номера соответствуют номеру SEQ ID NO из списка последовательностей. Отдельные зонды фиксировали в двух разных положениях для детектирования 21 различного типа HPV, контроль качества образца ДНК и контроль амплификации. LR = зонды для стандарта местоположения (SEQ ID NO:140 + SEQ ID NO:141).
На фиг.2 показано расположение зондов на поверхности микроматрицы с 12×11=132 положениями. Номера соответствуют номеру SEQ ID NO из списка последовательностей. Отдельные зонды фиксировали в двух разных местоположениях для детектирования 23 различных типов HPV, контроль качества образца ДНК и контроль амплификации. LR = зонды для стандарта местоположения (SEQ ID NO:140 + SEQ ID NO:141).
На Фиг.3 показано расположение зондов на поверхности микроматрицы с 12×11=132 местоположениями. Номера соответствуют номеру SEQ ID NO: из списка последовательностей. Смеси зондов фиксировали в двух разных местоположениях для детектирования 42 различных типов HPV и контроль качества образца ДНК. LR = зонды для стандарта местоположения (SEQ ID NO:140 + SEQ ID NO:141); М1 = SEQ ID NO:76 + SEQ ID NO:77 + SEQ ID NO:78; М2 = SEQ ID NO:122 + SEQ ID NO:123 + SEQ ID NO:124; М3 = SEQ ID NO:116 + SEQ ID NO:117 + SEQ ID NO:118 + SEQ ID NO:119.
На Фиг. 4 показано расположение зондов на поверхности микроматрицы с 12×10=120 положениями. Номера соответствуют номеру SEQ ID NO из списка последовательностей. Отдельные зонды или смеси зондов фиксировали в трех разных местоположениях для детектирования 35 различных типов HPV, контроль качества образца ДНК и контроль амплификации. LR = зонды для стандарта местоположения (SEQ ID NO:140 + SEQ ID NO:141); М1 = SEQ ID NO:76 + SEQ ID NO:77 + SEQ ID NO:78; М2 = SEQ ID NO:122 + SEQ ID NO:123 + SEQ ID NO:124.
На фиг. 5 показано расположение зондов на поверхности микроматрицы с 12×10=120 положениями. Номера соответствуют номеру SEQ ID NO из списка последовательностей. Отдельные зонды фиксировали в двух разных положениях для детектирования 14 различных типов HPV, контроль качества образца ДНК и контроль амплификации. LR = зонды для стандарта местоположения (SEQ ID NO:140 + SEQ ID NO:141); М4 = SEQ ID NO:100 + SEQ ID NO:101 + SEQ ID NO:102.
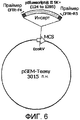
На фиг. 6 схематически показана рекомбинантная плазмида pPG44, используемая в реакции ПЦР в качестве положительного контроля амплификации.
На фиг. 7 показана фотография «пробирки-матрицы», используемой в настоящем изобретении.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Способ специфического детектирования и/или идентификации типов HPV предусматривет стадии:
(i) Амплификацию ДНК-образца: ДНК, полученную из клинических образцов, амплифицируют, предпочтительно при помощи ПЦР, с использованием универсальных праймеров для всех известных типов HPV, которые фланкируют геномный район, достаточно разнообразных для возможности дальнейшего генотипирования. Хотя ПЦР является предпочтительным способом амплификации, амплификация мишеневых последовательностей может быть выполнена любым другим способом, известным в данной области (лигазной цепной реакцией, системой амплификации на основе транскрипции, амплификацией замещения цепи и т.д.). В одном из вариантов осуществления настоящего изобретения, использовали праймеры MY11 и MY09 (Manos et al., Molecular Diagnostics of Human Cancer; Furth M, Greaves MF, eds.; Cold Spring Harbor Press, 1989, vol. 7: 209-214), которые амплифицируют вариабельный район L1.
Метку вводят в амплифицированную ДНК во время ее амплификации для создания возможности дальнейшего детектирования, предпочтительно метку, которая обеспечивает сигнал, который может быть детектирован колориметрическими способами. В предпочтительном варианте осуществления, по меньшей мере один из используемых праймеров метят на его 5'-конце биотином. Однако может быть использован любой другой тип метки, известный в данной области (например, дигоксигенин). Кроме того, мечение амплифицированной ДНК может альтернативно достигаться добавлением модифицированных нуклеотидов, несущих метку (например, биотинилированных или содержащих дигоксигенин производных dUTP) в ПЦР-смеси. Могут быть использованы радиоактивные метки или флуорофоры в некоторых вариантах осуществления.
(ii) Гибридизацию: амплифицированную ДНК из стадии (I) денатурируют (например, нагреванием) и наносят в «пробирку-микроматрицу» с одним или несколькими зондами из зондов, показанных в таблице 1 (SEQ ID NO:1-133). Могут быть также использованы другие способы получения одноцепочечной ДНК после амплификации. Каждый зонд, показанный в таблице 1 (SEQ ID NO:1-133), способен к специфической гибридизации с амплифицированным L1-районом из стадии (I) только одного типа HPV и, следовательно, позволяет специфически идентифицировать этот тип HPV, когда этот тип присутствует в биологическом образце. Другие типы HPV в образце могут быть идентифицированы гибридизацией амплифицированной ДНК из указанных типов HPV по меньшей мере с одним, но предпочтительно с несколькими зондами.
(iii) Детектирование: ДНК-гибриды могут быть детектированы узнаванием этой метки по специфическому связыванию с лигандом или посредством иммунодетектирования. В предпочтительном варианте осуществления, метку биотин детектируют по специфическому связыванию со стрептавидином, конъюгированным с пероксидазой хрена (HRP), и последующему превращению тетраметилбензидина (ТМВ) в синий пигмент, который осаждается в конкретном местоположении, где связан соответствующий специфический зонд. Конъюгаты другого типа, хорошо известные в данной области, могут быть также пригодными для целей настоящего изобретения (например, конъюгат стрептавидин-Au). Вместо этого могут использоваться флуоресцентно меченные системы детектирования, меченные опосредованно или непосредственно. Альтернативно, могут быть использованы другие системы на основе ферментов.
(iv) Анализ и обработка результатов: «пробирки-микроматрицы», обработанные таким образом, могут считываться с использованием простых оптических устройств, таких как оптический микроскоп или ATR01- и ATS-ридеры, изготовляемые CLONDIAC chip technologies GmbH (Jena, Germany).
В альтернативном варианте осуществления стадии амплификации и гибридизации могут выполняться в одной и той же пробирке-микроматрице; то есть, образец добавляют в пробирку-микроматрицу и затем этот образец амплифицируют и гибридизуют с зондами внутри этой пробирки.
Один из способов получения «пробирки-микроматрицы» описан в заявке на патент US2005064469. В предпочтительном варианте осуществления настоящего изобретения, 5'-амино-связанные олигонуклеотидные зонды связывают с поверхностью твердого носителя в известных раздельных местоположениях. Указанные зонды могут быть иммобилизованы по отдельности или в виде смесей с очерченными местоположениями на этом твердом носителе. В предпочтительном варианте осуществления, используют два типоспецифических зонда для каждого типа HPV, что обеспечивает дополнительную гарантию того, что все HPV будут типированы правильно, в том числе варианты, в которых произошли замены нуклеотидов в районе одного типоспецифического зонда. Предпочтительно, используют два типоспецифических зонда, которые способны гибридизоваться в отдельных районах амплифицированного продукта.
Указанные зонды или смеси зондов могут быть иммобилизованы в единственном местоположении твердого носителя, предпочтительно в двух отдельных местоположениях твердого носителя. Фиг. 1-5 в качестве примеров показывают схематические представления различных расположений зондов на поверхности этой микроматрицы.
«Пробирка-микроматрица», используемая в настоящем изобретении, может содержать один или несколько зондов HPV, выбранных из нуклеотидных последовательностей из списка последовательностей (SEQ ID NO:1-133). Кроме того, она может содержать один или несколько зондов для специфического детектирования контролей, таких как контроль реакции ПЦР или адекватности ДНК из этого образца контроля. Кроме того, он может также содержать один или несколько меченых олигонуклеотидов (например, модифицированных биотином олигонуклеотидов) для положительного контроля реакции детектирования и для позиционирования стандарта, так что могут быть определены местоположения всех остальных зондов.
Специфические зонды для идентификации типов HPV были сконструированы следующим образом. Последовательности для всех ссылочных HPV (стандартов), депонированных в GenBank, в том числе известных вариантов, для амплифицированного L1-района сопоставляли с использованием общепринятой программы сопоставления нуклеиновых кислот, такой как BloEdit (4.8.6 version; Hall. Nucl. Acids Symp Ser. 1999, 41: 95-98), и определили местоположение районов наиболее вариабельных последовательностей среди различных типов HPV. Для использования в качестве специфических зондов из этих вариабельных последовательностей отбирали потенциальные последовательности олигонуклеотидов, имеющие следующие признаки: длина 20-40 оснований, предпочтительно приблизительная длина 30 оснований; предпочтительно без вторичных структур или нитей последовательного одного и того же нуклеотида, более длинных чем 4 нуклеотида; предпочтительно с отношением G+C 50% и Tm, как можно более сходной среди всех отобранных зондов; и предпочтительно с ошибочно спаренными нуклеотидами среди последовательностей разных типов HPV, находящимися как можно более в центре последовательности олигонуклеотида.
Каждую потенциальную последовательность зонда, отобранную, как описано выше, сравнивали со всеми известными последовательностями HPV в амплифицированном L1-районе с использованием программы BLAST из NCBI webpage (Altschul et al., Nucleic Acid Res. 1997, 25: 3389-3402). Наконец, зонды, имеющие по меньшей мере три ошибочно спаренных нуклеотида при сравнении со всеми известными типами HPV (за исключением случая, когда их сравнивали с типом HPV, в отношении которого этот олигонуклеотидный зонд был специфическим), отбирали с предпочтением в отношении зондов, имеющих более трех ошибочных спариваний.
Настоящее изобретение относится к зондам для специфического детектирования 42 наиболее клинически важных типов HPV: 6, 11, 16, 18, 26, 30, 31, 32, 33, 34/64, 35, 39, 40, 42, 43, 44, 45, 51, 52. 53, 54, 56, 57, 58, 59, 61, 62, 66, 67, 68, 69, 70, 71, 72, 73, 74, 81, 82, 83, 84, 85 и 89 (таблица 1; SEQ ID NO:1-133). Последовательности зондов представлены в виде одноцепочечных ДНК-олигонуклеотидов от 5'-конца к 3'-концу. В предпочтительном варианте осуществления этого изобретения, последовательности зондов соответствуют антисмысловой цепи, но любому специалисту с квалификацией в данной области очевидно, что любой из этих зондов может быть использован как таковой или в его комплементарной форме, или в форме его РНК (где Т заменен на U). Зонды по изобретению также могут быть получены путем добавления или изменения одного или нескольких нуклеотидов их последовательностей без значительного влияния на функциональность.
Нуклеотиды этих последовательностей имеют следующие обозначения: G=гуанин, А=аденин, Т=тимин, С=цитозин, R=G или A, Y=Е или С, М=А или С, К=G или Т, S=G или C, W=А или Т, Н=А или С или Т, В=G или Т или С, V=G или С или А, D=G или Т и, наконец, N=G или А или Т или С. Нуклеотиды, используемые в изобретении, могут быть рибонуклеотидами, дезоксирибонуклеотидами и модифицированными нуклеотидами, такими как инозин, или нуклеотидами, содержащими модифицированные группы, которые по существу не изменяют их гибридизационных свойств.
Зонды по настоящему изобретению могут быть получены различными способами, такими как химический синтез (например, общепринятым фосфотриэфирным способом), или способами генетической инженерии, например, молекулярным клонированием рекомбинантных плазмид, в которых были встроены соответствующие нуклеотидные последовательности, и последние могут быть получены расщеплением нуклеазами.
Для некоторых типов HPV зонды конструировали из района последовательности, который содержал отличающиеся нуклеотиды в конкретном положении для различных вариантов указанного типа HPV. В этих случаях, использовали вырожденные зонды, то есть смесь олигонуклеотидов, каждый из которых содержал альтернативные нуклеотиды в указанном положении. Это имеет место для зондов 39C3d [SEQ ID NO:41], 39C4d [SEQ ID NO:43], 45C1d [SEQ ID NO:57], 45C3d [SEQ ID NO:58] 57A1d [SEQ ID NO:74] 59C3_3d [SEQ ID NO:81], 66B1 [SEQ ID NO:91], 66C3d [SEQ ID NO:93] и 83B1d [SEQ ID NO:126]. Альтернативно, эквимолекулярные смеси двух олигонуклеотидов, содержащие точно один и тот же район последовательности, но отличающиеся в нуклеотидном составе для определенных положений, использовали в виде единого зонда (смесь олигонуклеотида 58В1а [SEQ ID NO:77] и 58B1b [SEQ ID NO:78]; 68C4b [SEQ ID NO:100] и 68С4 с [SEQ ID NO:101]; 74A1a [SEQ ID NO:116] и 74A1b [SEQ ID NO:117]; 74B1a [SEQ ID NO:118] и 74B1b [SEQ ID NO:119] и смесь олигонуклеотида 82A2a-AS [SEQ ID NO:122] и 82A2b-AS [SEQ ID NO:123]).
Все зонды, описанные в изобретении, испытывали на специфическую гибридизацию с их мишеневыми последовательностями при тех же самых условиях гибридизации в платформе (позиции) «пробирки-микроматрицы». Этот факт делает возможным применение этих зондов для одновременной идентификации 42 различных типов с использованием этой платформы (позиции) микроматрицы. Высокое число типов HPV, идентифицированных с использованием «пробирки-микроматрицы», развитой в данном изобретении, позволяет рассматривать эту методологию также как прямой способ детектирования, так как остальные типы HPV являются клинически нерелевантными.
Одним из слабых моментов диагностических способов являются ложноотрицательные результаты. В случае данного способа ложные отрицательные результаты могут быть обусловлены образцами ДНК плохого качества или присутствием ингибиторов ДНК-полимеразы в анализируемых образцах. Настоящее изобретение иллюстрирует способ устранения этих ложных отрицательных результатов посредством использования двух типов контролей.
Один контроль, состоящий из амплификации собственной ДНК пациента, используют предпочтительно для гарантии хорошего качества образца ДНК. Любой фрагмент последовательности из ДНК человека может быть использован в качестве мишени для этой цели. Фрагмент из однокопийного гена, такого как ген CFTR, считают особенно подходящей мишенью для положительного контроля качества ДНК в данном изобретении. Были сконструированы праймеры CFTR-F4 (SEQ ID NO:134) и CFTR-R5 (SEQ ID NO:135) для амплификации фрагмента 892 п.н. из гена CFTR. Использование однокопийной против многокопийной мишени и большего размера амплифицированного продукта контроля качества ДНК в сравнении с амплифицированным продуктом HPV, который имеет величину 892 п.н. против 450 п.н., позволило включать праймеры для амплификации CFTR в ту же реакционную смесь, которую использовали для амплификации L1-района генома HPV, с минимальными эффектами конкуренции. Таким образом, контроль качества ДНК может быть выполнен одновременно в той же самой реакционной пробирке, в которой анализируют образец, без влияния на чувствительность детектирования HPV.
Второй контроль может быть использован в качестве положительного контроля амплификации, который детектирует неуспешность ПЦР-реакции, обусловленную, например, присутствием ингибиторов ДНК-полимеразы. В предпочтительном варианте осуществления, положительный контроль амплификации состоит из рекомбинантной плазмиды, которая может быть амплифицирована с использованием тех же праймеров и тех же условий ПЦР, которые используют для амплификации фрагмента гена CFTR. Как размер, так и внутренняя последовательность относительно этих праймеров являются различными между ПЦР-продуктами, происходящими из амплификации гена CFTR и из амплификации рекомбинантной плазмиды. Таким образом, оба типа продуктов амплификации могут быть легко различены при помощи гель-электрофореза или гибридизации со специфическими зондами. Фиг. 6 показывает схематическое представление рекомбинантной плазмиды pPG44, имеющей эти характеристики.
Плазмиду pPG44 конструировали способами молекулярного клонирования. Коротко, ДНК-инсерт, состоящий из фрагмента 1162 п.н. от положения 124 до положения 1285 вектора pBlueScript® II SK + (Stratagene, La Jolla, CA, USA), фланкированный праймерами CFTR, CFTR-F4 и CFTR-R5, клонировали в pGEM®-T Easy Vector с использованием коммерчески доступного набора из Promega Corporation, Madison, WI, USA. Очищенный препарат полученной рекомбинантной плазмиды pPG44 дополнительно характеризовали с использованием рестрикционных ферментов и анализа последовательности. Плазмиду pPG44 использовали в качестве положительного контроля процесса амплификации в линеаризованной форме.
Присутствие положительного контроля в виде указанной рекомбинантной плазмиды в той же смеси для ПЦР-амплификации, в которой анализируют образец, предотвращает появление ложных отрицательных результатов, т.е. это предотвращает появление отрицательного результата даже в присутствии генома HPV-мишени в этом образце, так как в случае отсутствия генерирования продуктов амплификации следует предположить, что ПЦР-амплификация не работала правильно, и невозможно сделать вывод о присутствии или отсутствии генома HPV в данном образце.
Зонды для специфического детектирования описанных двух типов положительных контролей, то есть контроля качества ДНК и контроля реакции амплификации, обеспечены в таблице 2 (SEQ ID NO:136-139 и SEQ ID NO:145-147). Олигонуклеотидные последовательности без значимой гомологии с любым из амплифицированных продуктов настоящего изобретения также обеспечены в этой таблице 2 (SEQ ID NO:140-141). При иммобилизации на поверхности этой микроматрицы модифицированные биотином олигонуклеотиды SEQ ID NO:140 и SEQ ID NO:141 служат в качестве положительного контроля реакции детектирования ПЦР-продуктов и в качестве стандарта позиционирования, так что может быть определено местоположение всех остальных зондов.
| Таблица 2 | |||
| SEQ ID NO | Название зонда | Тип контроля | Последовательность (5'→3') |
| 136 | CFTR-A1-AS | Качество ДНК образца | |
| 137 | CFTR-B3 | Качество ДНК образца | |
| 145 | CFTR-B1-AS | Качество ДНК образца | |
| 146 | CFTR-B2 | Качество ДНК образца | |
| 138 | CIA1-AS | ПЦР-реакция | |
| 139 | CIA2-AS | ПЦР-реакция | |
| 147 | CIA3-AS | ПЦР-реакция | |
| 140 | Маркер-1 | Детектирование & местоположение | |
| 141 | Маркер-2 | Детектирование & местоположение | |
Данное изобретение относится также к in vitro диагностическому набору для специфического детектирования типов HPV в клинических образцах. Предпочтительно, указанный набор может включать в себя любой из следующих компонентов или все следующие компоненты: смесь для амплификации, в том числе буфер для амплификации, dNTP, праймеры и контрольную плазмиду; промывочный буфер; реагенты детектирования; пробирку-микроматрицу, включающую в себя твердый носитель, включающий в себя HPV-типоспецифические зонды; реагенты для получения и приготовления образца. Конкретные компоненты будут зависеть от точных условий, при которых должен быть использован этот набор, хотя квалифицированный в данной области специалист сможет определить подходящие компоненты набора и буферные композиции.
ПРИМЕРЫ
Примеры, представленные ниже, даны только для иллюстрации изобретения и никаким образом не ограничивают объем сопроводительной формулы изобретения.
ПРИМЕР 1: получение «пробирок-микроматриц»
«Пробирки-микроматрицы» по изобретению были получены в CLONDIAG chip Technologies GmbH (Jena, Germany) следующим образом. Стандартную реакционную тест-пробирку Eppendorf из полипропилена и имеющую номинальный вмещаемый объем 1,5 мл, модифицировали переплавкой, создавая открытое углубление для носителя микроматрицы с адгезивным краем в пробирке.
Микроматрицы, которые вставляли в эти пробирки, получали с использованием MicroGrid II Arrayer (BioRobotics, Cambridge, Great Britain). Зонды, состоящие из модифицированных на 5'-амино-конце олигонуклеотидов, имеющих последовательность из списка последовательностей, помещали в определенных участках на поверхности эпоксидированного предметного стекла (размер предметного стекла: 75 мм × 25 мм) и ковалентно иммобилизовали. Единая микроматрица включала в себя 12×10=120 или 12×11=132 конкретных положений, в которые могли быть помещены олигонуклеотиды. Эти положения имеют промежутки 0,2 мм, так что ДНК-библиотека, включенная в каждую микроматрицу, покрывала площадь 2,4 мм × 2,4 мм, и, в целом, более 100 идентичных ДНК-библиотек могли бы быть получены таким образом на одном предметном стекле. В зависимости от типа эксперимента, либо единственный зонд, либо смесь зондов могли быть помещены в каждое из этих положений. Обычно, единственные зонды помещали в каждое местоположение при проведении экспериментов по специфичности и чувствительности для отбора зондов. После валидизации этих зондов смеси зондов, способных гибридизоваться в отдельных районах амплифицированного продукта конкретного типа HPV, могли быть помещены в то же самое местоположение при выполнении анализов идентификации генотипов HPV. На фиг. 1-5 показано различное положение зондов в микроматрицах, используемое в настоящем изобретении. В каждую микроматрицу включали два или три повтора для каждого зонда или каждой смеси зондов.
Кроме специфических зондов для генотипирования HPV и для контроля детектирования амплификации и контроля адекватности ДНК, микроматрицы включали в себя ссылочные маркеры в нескольких местоположениях, состоящие из модифицированных на 5'-конце биотином олигонуклеотидов (Маркер-1 [SEQ ID NO:140] и Маркер-2 [SEQ ID NO:141]) без значимой гомологии с любой из амплифицированных последовательностей из этого изобретения. Эти ссылочные маркеры служили как для подтверждения правильного осуществления реакции детектирования, так и для оптической ориентации изображения ридером, так чтобы местоположение всех остальных зондов могли быть определены и данные могли быть анализированы.
Все олигонуклеотиды были помещены на предметное стекло от 1× QMT Spotting Solution I (Quantifoil Micro Tools GmbH, Jena, Germany). Общая концентрация олигонуклеотидов в каждом растворе для нанесения пятен находится в диапазоне от 2,5 мкМ для ссылочных маркеров до 20 мкМ для специфических зондов. Затем олигонуклеотиды ковалентно связывали с эпоксигруппами на поверхности стекла термообработкой при 60°С в течение 30 минут с последующим многостадийным процессом промывки. Высушенные предметные стекла нарезают на кусочки стекла 3,15 мм × 3,15 мм, которые, строго говоря, и являются тем, что авторы называют микроматрицами. Затем, в конечной стадии изготовления «пробирок-микроматриц» эти микроматрицы вставляют в вышеуказанные модифицированные пробирки Эппендорфа и приклеивают к адгезивному краю. Фиг.7 показывает фотографию «пробирки-матрицы», изготовленной, как описано в данном примере.
ПРИМЕР 2: получение образцов ДНК
2.1. ДНК-стандарты HPV
ДНК HPV, используемыми для оценки специфичности и чувствительности типоспецифических зондов, были либо рекомбинантные плазмиды, содержащие амплифицированный L1-район (типы HPV 6, 11, 13, 16, 18, 26, 31, 33, 35, 39, 40, 42, 44, 45, 51, 52, 53, 54, 56, 58, 61, 62, 66, 68, 70, 71, 72, 73, 81, 82, 83, 84, 85 и 89), либо ДНК, экстрагированные из клинических образцов, которые амплифицировали L1-район и были дополнительно охарактеризованы секвенированием ДНК. Рекомбинантные плазмиды конструировали способами молекулярного клонирования. Коротко, амплифицированный L1-район из каждого типа HPV клонировали в pGEM®-T Easy Vector с использованием коммерчески доступного набора из Promega Corporation, Madison, WI, USA. Очищенный препарат, полученный из каждой рекомбинантной плазмиды, дополнительно характеризовали анализом последовательности. 1-10 пг плазмидной ДНК использовали в оценке экспериментов по специфичности.
ДНК клеточной линии К562 (Cataloge No. DD2011, Promega Corporation, Madison, WI, USA) использовали для оценки специфичности и чувствительности CFTR-специфических зондов.
2.2. Клинические образцы
Для детектирования HPV необходимо прежде всего отделить ДНК от остального биологического материала. Процедуры получения ДНК изменяются в зависимости от источника образцы. Конкретные примеры представлены для получения ДНК из образцов из различных источников:
А. Мазки: образцы брали чистым, сухим хлопчатобумажным тампоном. Клетки из клинических мазков извлекали добавлением 1,5 мл солевого раствора непосредственно в контейнер с образцом и интенсивным встряхиванием на вортексе. Материал образца переносили в пробирку Эппендорф на 1,5 мл и осаждали центрифугированием. Супернатант отбрасывали и осажденные клетки суспендировали в 100 мкл лизисного буфера, содержащего 10 мМ Трис-HCl (рН 9,0 при 25°С) 50 мМ KCl, 0,15 мМ MgCl2, 0,1% Тритон® Х-100, 0,5% Твин 20 и 0,25 мг/мл протеиназы К. Смесь инкубировали при 56оС в течение приблизительно 2 часов и протеиназу К инактивировали нагреванием инкубированием этой смеси при 100°С в течение 10 минут. Детрит осаждали центрифугированием и супернатант переносили в чистую и стерильную пробирку. В ПЦР-реакции использовали аликвоту 5 мкл.
В. Суспензии клеток: этот тип образца относится к образцам, используемым в цитологических тестах на основе шеечно-влагалищной жидкости. Шеечные пробы брали кистью или шпателем и ресуспендировали в растворе PreservCyt (Cytus Corp., Marlborough, MA, USA). Аликвоту 1 мл центрифугировали и осадок ресуспендировали в 100 мкл лизисного буфера, такого же, какой использовали с образцами мазков в параграфе А, и протокол продолжали таким же образом, как описано в указанном разделе.
С. Фиксированные формалином и залитые в парафин биопсии: несколько срезов тканей шириной 5 мкм использовали в данном способе, обычно 2-5 срезов, в зависимости от площади поверхности из этой биопсии. Срезы помещали в стерильную пробирку на 1,5 мл и добавляли 100 мкл лизисного буфера, такого же, какой использовали с образцами мазков в параграфе А. Протокол продолжали таким же образом, как описано в указанном разделе, за исключением того, что обработку протеиназой К проводили в течение 3 часов.
Альтернативно, коммерческий набор (NucleoSpin® Tissue kit Catalogue No. 635966 из BD Biosciebces Clontech, Palo Alto, CS, USA), предназначенный для выделения ДНК из образцов из различных источников, использовали для обработки мазков, суспензий клеток или фиксированных формалином или залитых в парафин образцов биопсий. В этом случае, начало протокола выделения ДНК было таким же, какое описано в разделах А, В и С. Вместо 100 мкл лизисного буфера к образцу добавляли 180 мкл Буфера Т1. Протокол продолжали в соответствии с указаниями изготовителя для выделения геномной ДНК из клеток и ткани.
Независимо от того, использовали ли этот тип клинического образца или этот способ получения ДНК, отрицательные контроли обрабатывали параллельно с каждой серией образцов. Эти отрицательные контроли, состоящие из 1 мл солевого раствора, обрабатывали таким же образом, какой описан в разделе А.
ПРИМЕР 3: ПЦР-амплификация
ПЦР-амплификацию выполняли с использованием консенсусных праймеров MY11 и MY09 (Manos et al., Molecular Diagnostics of Human Cancer; Furth M, Greaves MF, eds.; Cold Spring Harbor Press, 1989, vol. 7: 209-214). Третий праймер, НМВ01, который часто используют в комбинации с MY09 и MY11 для амплификации типа 51 HPV, который не амплифицируется эффективно только с MY09 и MY11 (Hildesheim et al., J Infect Dis. 1994, 169: 235-240), также включали в ПЦР-реакцию. Коротко, ПЦР-реакцию проводили в конечном объеме реакции 50 мкл, содержащем 10 мМ Трис-HCl рН 8,3, 50 мМ KCl, 1 мМ MgCl2, 0,3 мкМ каждый праймер MY09 и MY11 (SEQ ID NO:142 и 143), 0,03 мкМ праймер НМВ01 (SEQ ID NO:144) 200 мкМ каждый dNTP, 4 единицы AmpliTaq Gold ДНК-полимеразы (Applied Biosystems, Foster City, CA, USA) и 5 мкл каждого стандарта ДНК HPV из примера 2.1 или ДНК клинического образца из примера 2.2. Для тестирования пригодности ДНК образца 0,08 мкМ каждого праймера CFTR-F4 и CGTR-R5 (SEQ ID NO:134 и 135) также добавляли к реакционной смеси. Дополнительно, для проверки процесса амплификации и элиминации ложных отрицательных результатов вследствие неуспешности реакции 20 фг внутреннего контроля pPG44 включали в ту же самую реакционную пробирку, в которой анализировали эти образцы. Все прямые праймеры, использованные в ПЦР-реакции (MY11 [SEQ ID NO:143] и CFTR-F4 [SEQ ID NO:134]), были модифицированы биотином на 5'-конце таким образом, что любая амплифицированная ДНК могла быть затем детектирована.
Отрицательные контроли, состоящие из 5 мкл слепых образцов из примера 2.2, или 5 мкл деионизованной воды, обрабатывали параллельно с ДНК образцов. Применение этих типов отрицательных контролей служит для подтверждения, что загрязнения нет ни в одной точке манипулирования с образцом или в установке ПЦР-реакции и что все положительные результаты представляют истинное присутствие ДНК в конкретном образце.
ПЦР-реакции проводили в термоциклере Mastercycler (Eppendorf, Hamburg, Germany), программируемом со следующим профилем циклов: один начальный цикл денатурации при 95°С в течение 9 минут, 45 циклов 30 секунд при 94°С, 60 секунд при 55°С и 90 секунд при 72°С, и один конечный цикл удлинения при 72°С в течение 8 минут. После амплификации 5 мкл каждой реакционной смеси использовали для последующего детектирования со специфическими зондами.
ПРИМЕР 4: одновременная идентификация генотипов HPV с использованием «пробирок-микроматриц»
«Пробирки-микроматрицы» предварительно промывали непосредственно перед использованием добавлением 300 мкл 0,5х ЗФР-Твин 20-буфера в каждую пробирку и перевертыванием пробирок несколько раз. Всю жидкость изнутри каждой пробирки удаляли с использованием пастеровской пипетки с вакуумной системой.
Реакции амплификации из примера 3 денатурировали нагреванием их до 95°С в течение 10 минут и, сразу же после этого, охлаждением их в течение 5 минут на льду. Пять микролитров денатурированной реакции амплификации вносили в «пробирку-микроматрицу», приготовленную в примере 1, вместе с 100 мкл раствора для гибридизации (200 мМ натрий-фосфатаный буфер, pH 7,2; 1× SSC; 0,2% Тритон® Х-100; 1 мМ ЭДТА, pH 8,0). Реакцию гибридизации проводили в Thermomixer comfort (Eppendorf, Hamburg, Germany) инкубированием «пробирок-микроматриц» при 55°С в течение одного часа при встряхивании при 550 об/мин. После периода инкубирования реакцию гибридизации удаляли Пастеровской пипеткой, присоединенной к вакуумной системе, и проводили стадию промывания 300 мкл 0,5× ЗФР-Твин 20-буфера.
Гибридизованную ДНК детектировали инкубированием в 100 мкл раствора 0,075 мкг/мл Поли-НRP-стрептавидина (Pierce Biotechnology Inc., Rockford, IL, USA) при 30°С в течение 15 минут со встряхиванием при 550 об/мин. Затем всю жидкость из «пробирки-микроматрицы» быстро удаляли и проводили две стадии промывки, как указано выше. Реакцию развития окраски выполняли в 100 мкл субстрата пероксидазы True Blue™ (KPL, Gaithersburg, MD, USA), который состоит из забуференного раствора, содержащего 3,3',5,5'-тетраметилбензидина (ТМВ) и Н2О2, инкубированием при 25°С в течение 10 минут. Окрашенные осадки, полученные таким образом, вызывают изменения в прозрачности для света в конкретных местоположениях микроматрицы, которые могут быть считаны с использованием ATR01- или ATS-ридера, изготавливаемого CLONDIAG chip technologies GmbH (Jena, Germany). Необязательно, ATS-ридер может иметь специальную программу, установленную для автоматической обработки результата анализа образцов, полученного с использованием «пробирки-микроматрицы», разработанной в данном изобретении.
Claims (63)
1. Способ детектирования и типирования папилломавируса человека (HPV) в образце, включающий:
осуществление реакции амплификации нуклеиновых кислот в образце, причем реакция амплификации предназначена для амплификации мишеневой последовательности HPV неспецифическим для типа образом;
получение одноцепочечных олигонуклеотидов из любых продуктов амплификации;
осуществление гибридизации одноцепочечных олигонуклеотидов с множеством HPV-типоспецифических зондов, выбранных из группы, содержащей SEQ ID NO:1 - SEQ ID NO:133, и отобранных по типу, как указано в таблице 1, находящихся на твердом носителе, причем носитель расположен в реакционном сосуде, подходящем для этого образца; и
детектирование гибридизованных олигонуклеотидов, если HPV присутствует в образце.
осуществление реакции амплификации нуклеиновых кислот в образце, причем реакция амплификации предназначена для амплификации мишеневой последовательности HPV неспецифическим для типа образом;
получение одноцепочечных олигонуклеотидов из любых продуктов амплификации;
осуществление гибридизации одноцепочечных олигонуклеотидов с множеством HPV-типоспецифических зондов, выбранных из группы, содержащей SEQ ID NO:1 - SEQ ID NO:133, и отобранных по типу, как указано в таблице 1, находящихся на твердом носителе, причем носитель расположен в реакционном сосуде, подходящем для этого образца; и
детектирование гибридизованных олигонуклеотидов, если HPV присутствует в образце.
2. Способ по п.1, где указанные HPV-типоспецифические зонды содержат ДНК.
3. Способ по п.1, где стадию амплификации нуклеиновых кислот осуществляют в образце в реакционном сосуде в контакте с HPV-типоспецифическими зондами на твердом носителе.
4. Способ по п.1 или 2, где стадию амплификации нуклеиновых кислот осуществляют в образце перед введением амплифицированного образца в реакционный сосуд для контакта с HPV-типоспецифическими зондами на твердом носителе.
5. Способ по п.1 или 3, где зонды выбраны для специфического связывания с мишеневой последовательностью HPV при одних и тех же условиях гибридизации для всех зондов.
6. Способ по п.1 или 3, где используют зонды, специфические по меньшей мере для 20 типов HPV.
7. Способ по п.1 или 3, где используют зонды, специфические по меньшей мере для 20 типов HPV 6, 11, 16, 18, 26, 30, 31, 32, 33, 34/64, 35, 39, 40, 42, 43, 44, 45, 51, 52, 53, 54, 56, 57, 58, 59, 61, 62, 66, 67, 68, 69, 70, 71, 72, 73, 74, 81, 82, 83, 84, 85 и 89.
8. Способ по п.1 или 3, где длина зондов выбрана из группы, состоящей 20-40 нуклеотидов, длину 25-35 нуклеотидов, длину 28-32 нуклеотида или длину приблизительно 30 нуклеотидов.
9. Способ по п.1 или 3, где множество зондов выбрано из одного или нескольких следующих групп SEQ ID NO: 1 или 2; 3 или 4; 5-9; 10-13; 14-18; 19, 20 или 21; 22-25; 26 или 27; 28-31; 32 или 33; 34-37; 38-43; 44 или 45; 46-50; 51 или 52; 53 или 54; 55-59; 60-64; 65 или 66; 67 или 68; 69, 70 или 71; 72 или 73; 74 или 75; 76, 77 или 78; 79-83; 84, 85 или 86; 87, 88 или 89; 90-94; 95, 96 или 97; 98-102; 103 или 104; 105 или 106; 107 или 108; 109 или 110; 111-115; 116-119; 120 или 121; 122, 123 или 124; 125 или 126; 127 или 128; 129 или 130; 131, 132 или 133.
10. Способ по п.9, где зонд выбран из каждой указанной группы.
11. Способ по п.9, где каждый зонд выбран из указанных групп и по меньшей мере один зонд выбран из каждой указанной группы.
12. Способ по п.9, где два или более зондов выбраны из каждой из указанных групп.
13. Способ по п.1 или 3, где эти зонды выбраны из следующих SEQ ID NO:2, 4, 7, 8, 9, 12, 13, 16, 17, 18, 19, 20, 21, 24, 25, 26, 27, 30, 31, 32, 33, 36, 37, 40, 41, 42, 43, 45, 48, 49, 50, 51, 52, 53, 54, 57, 58, 59, 61, 62, 63, 64, 66, 67, 68, 70, 71, 73, 74, 75, 76, 81, 82, 83, 84, 85, 86, 87, 88, 89, 91, 92, 93, 94, 95, 96, 97, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 112, 114, 115, 116, 117, 118, 119, 120, 121, 124, 126, 128, 129, 130, 131, 132, 133.
14. Способ по п.1 или 3, где множество зондов специфично в отношении одного и того же типа HPV.
15. Способ по п.1 или 3, где множество зондов специфично в отношении каждого подлежащего детектированию типа HPV.
16. Способ по п.1 или 3, где каждый из указанного множества зондов иммобилизован в одном и том же участке твердого носителя.
17. Способ по п.1 или 3, где каждый из указанного множества зондов иммобилизован в отличающемся участке твердого носителя.
18. Способ по п.1 или 3, где каждый зонд, специфический в отношении одного и того же типа HPV, детектирует отличающуюся часть мишеневой последовательности HPV.
19. Способ по п.1 или 3, где по меньшей мере один зонд присутствует на твердом носителе по меньшей мере в двух разных местоположениях.
20. Способ по п.1 или 3, где все зонды присутствуют на твердом носителе по меньшей мере в двух разных местоположениях.
21. Способ по п.1, дополнительно предусматривающий детектирование одной или нескольких контрольных последовательностей.
22. Способ по п.1, дополнительно предусматривающий амплификацию известной контрольной последовательности и детектирование продукта амплификации.
23. Способ по п.1 или 22, предусматривающий объединение смеси реакции амплификации с образцом для выполнения реакции амплификации.
24. Способ по п.1, где одноцепочечные олигонуклеотиды получают денатурацией любых присутствующих двухцепочечных олигонуклеотидов.
25. Способ по п.24, где указанную стадию денатурации проводят в образце, содержащемся в реакционном сосуде.
26. Способ по п.24, где одноцепочечные олигонуклеотиды гибридизируют в жестких условиях.
27. Реакционный сосуд для осуществления анализа детектирования и типирования HPV в образце, отличающийся тем, что сосуд содержит твердый носитель, имеющий множество HPV-типоспецифических зондов, выбранных из группы, содержащей SEQ ID NO:1 - SEQ ID NO:133, иммобилизованных на нем, и подходит для приведения образца в контакте с твердым носителем.
28. Сосуд по п.27, где сосуд подходит для проведения реакции амплификации нуклеиновых кислот образца при контакте с твердым носителем.
29. Сосуд по п.27 или 28, где зонды выбраны для специфического связывания мишеневых последовательностей HPV при одних и тех же условиях гибридизации для всех зондов.
30. Сосуд по п.27 или 28, где зонды выбраны для специфического связывания мишеневых последовательностей HPV в образце, содержащем реакционную смесь, подходящую для проведения реакции амплификации нуклеиновых кислот.
31. Сосуд по п.27 или 28, где указанные HPV-типоспецифические зонды содержат ДНК.
32. Сосуд по п.27 или 28, содержащий зонды, специфические по меньшей мере для 20 типов HPV.
33. Сосуд по п.27, содержащий зонды, специфические по меньшей мере для 20 типов HPV 6, 11, 16, 18, 26, 30, 31, 32, 33, 34/64, 35, 39, 40, 42, 43, 44, 45, 51, 52, 53, 54, 56, 57, 58, 59, 61, 62, 66, 67, 68, 69, 70, 71, 72, 73, 74, 81, 82, 83, 84, 85 и 89.
34. Сосуд по п.27 или 33, где эти зонды имеют длину 20-40 нуклеотидов, длину 25-35 нуклеотидов, длину 28-32 нуклеотида или длину приблизительно 30 нуклеотидов.
35. Сосуд по п.27, где множество зондов выбрано из одного или нескольких из следующих групп SEQ ID NO:1 или 2; 3 или 4; 5-9; 10-13; 14-18; 19, 20 или 21; 22-25; 26 или 27; 28-31; 32 или 33; 34-37; 38-43; 44 или 45; 46-50; 51 или 52; 53 или 54; 55-59; 60-64; 65 или 66; 67 или 68; 70 или 71; 72 или 73; 74 или 75; 76, 77 или 78; 79-83; 84, 85 или 86; 87, 88 или 89; 90-94; 95, 96 или 97; 98-102; 103 или 104; 105 или 106; 107 или 108; 109 или 110; 111-115; 116-119; 120 или 121; 122, 123 или 124; 125 или 126; 127 или 128; 129 или 130; 131, 132 или 133.
36. Сосуд по п.27 или 35, где зонд выбран из каждой из указанных групп.
37. Сосуд по п.27 или 35, где каждый зонд выбран из указанных групп и по меньшей мере один зонд выбран из каждой из указанных групп.
38. Сосуд по п.27 или 35, где два или более зондов выбраны из каждой из указанных групп.
39. Сосуд по п.27, где эти зонды выбраны из следующих SEQ ID NO: 2, 4, 7, 8, 9, 12, 13, 16, 17, 18, 19, 20, 21, 24, 25, 26, 27, 30, 31, 32, 33, 36, 37, 40, 41, 42, 43, 45, 48, 49, 50, 51, 52, 53, 54, 57, 58, 59, 61, 62, 63, 64, 66, 67, 68, 70, 71, 73, 74, 75, 76, 81, 82, 83, 84, 85, 86, 87, 88, 89, 91, 92, 93, 94, 95, 96, 97, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 112, 114, 115, 116, 117, 118, 119, 120, 121, 124, 126, 128, 129, 130, 131, 132, 133.
40. Сосуд по п.27 или 39, где множество зондов специфично в отношении одного и того же типа HPV.
41. Сосуд по п.27 или 39, где множество зондов специфично в отношении каждого подлежащего детектированию типа HPV.
42. Сосуд по п.27 или 39, где каждый из указанного множества зондов иммобилизован в одном и том же участке твердого носителя.
43. Сосуд по п.27 или 39, где каждый из указанного множества зондов иммобилизован в отличающемся участке твердого носителя.
44. Сосуд по п.27 или 39, где каждый зонд, специфический в отношении одного и того же типа HPV, детектирует отличающуюся часть последовательности-мишени HPV.
45. Сосуд по п.27 или 39, где по меньшей мере один зонд присутствует на твердом носителе по меньшей мере в двух разных местоположениях.
46. Сосуд по п.27 или 39, где все зонды присутствуют на твердом носителе по меньшей мере в двух разных местоположениях.
47. Сосуд по п.27, дополнительно содержащий одну или несколько контрольных последовательностей на твердом носителе.
48. Сосуд по п.47, где контрольная последовательность содержит зонд, иммобилизованный на твердом носителе, который не гибридизуется с мишеневой последовательностью из любого типа HPV.
49. Набор для детектирования и типирования HPV, содержащий реакционный сосуд по п.27, вместе с одним или несколькими из следующих компонентов:
i) реагенты для экстракции и/или очистки ДНК;
ii) смесь для амплификации нуклеиновых кислот;
iii) реагенты для визуализации гибридизации нуклеиновых кислот с зондами реакционного сосуда.
i) реагенты для экстракции и/или очистки ДНК;
ii) смесь для амплификации нуклеиновых кислот;
iii) реагенты для визуализации гибридизации нуклеиновых кислот с зондами реакционного сосуда.
50. Набор по п.49, где смесь для амплификации находится в реакционном сосуде, отдельном от реакционного сосуда, содержащего твердый носитель с HPV-типоспецифическими зондами.
51. Набор по п.49, где смесь для амплификации находится в реакционном сосуде, содержащем твердый носитель с HPV-типоспецифическими зондами.
52. Набор по п.49, где смесь для амплификации содержит меченые dNTP.
53. Набор по п.49, где смесь для амплификации содержит консенсусные праймеры HPV, которые гибридизуются с частями мишеневой последовательности HPV.
54. Набор по п.53, где консенсусные праймеры HPV включают в себя MY09 и MY11 и, необязательно, НМВ01.
55. Набор по п.50, где смесь для амплификации содержит праймеры для амплификации мишеневой последовательности человека.
56. Набор по п.55, где мишеневая последовательность человека имеет другую длину, чем длина мишеневой последовательности HPV.
57. Набор по п.55, где мишеневая последовательность человека является по меньшей мере частью гена CFTR.
58. Набор по п.55, где эти праймеры содержат по меньшей мере один из CFTR-F4 (SEQ ID NO:134) и CFTR-R5 (SEQ ID NO:135).
59. Набор по п.53, где эти праймеры являются мечеными праймерами.
60. Набор по п.50, содержащий контрольную мишеневую последовательность амплификации.
61. Набор по п.60, где контрольная мишеневая последовательность амплификации включает в себя последовательности, соответствующие фланкирующим частям мишеневой последовательности человека, так что амплификация обеих мишеневых последовательностей будет происходить с использованием одних и тех же праймеров.
62. Зонд для детектирования и типирования HPV, причем зонд выбран из SEQ ID NO:1-133.
63. Зонд по п.62, выбранный из следующих SEQ ID NO: 2, 4, 7, 8, 9, 12, 13, 16, 17, 18, 19, 20, 21, 24, 25, 26, 27, 30, 31, 32, 33, 36, 37, 40, 41, 42, 43, 45, 48, 49, 50, 51, 52, 53, 54, 57, 58, 59, 61, 62, 63, 64, 66, 67, 68, 70, 71, 73, 74, 75, 76, 81, 82, 83, 84, 85, 86, 87, 88, 89, 91, 92, 93, 94, 95, 96, 97, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 112, 114, 115, 116, 117, 118, 119, 120, 121, 124, 126, 128, 129,130, 131, 132, 133.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB0516145.0 | 2005-08-05 | ||
| GBGB0516145.0A GB0516145D0 (en) | 2005-08-05 | 2005-08-05 | In vitro diagnostic kit for identification of human papillomavirus in clinical samples |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2008108517A RU2008108517A (ru) | 2009-09-10 |
| RU2441918C2 true RU2441918C2 (ru) | 2012-02-10 |
Family
ID=34984158
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2008108517/10A RU2441918C2 (ru) | 2005-08-05 | 2006-08-04 | In vitro диагностический набор для идентификации папилломавируса человека в клинических образцах |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US20110070576A1 (ru) |
| EP (1) | EP1910576A2 (ru) |
| JP (1) | JP2009502190A (ru) |
| KR (1) | KR20080045167A (ru) |
| CN (1) | CN101379196B (ru) |
| AU (1) | AU2006277711A1 (ru) |
| BR (1) | BRPI0614388A2 (ru) |
| CA (1) | CA2617978A1 (ru) |
| GB (1) | GB0516145D0 (ru) |
| IL (1) | IL189281A (ru) |
| RU (1) | RU2441918C2 (ru) |
| WO (1) | WO2007017699A2 (ru) |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20110111389A1 (en) * | 2001-11-07 | 2011-05-12 | Diagcor Bioscience Incorporation Limited | Rapid genotyping analysis for human papillomavirus and the device thereof |
| CN101487042B (zh) * | 2008-01-18 | 2012-05-30 | 中山大学达安基因股份有限公司 | Hpv高危和低危亚型分型dna微阵列芯片 |
| WO2010043418A2 (de) * | 2008-10-17 | 2010-04-22 | Febit Holding Gmbh | Integrierte amplifikation, prozessierung und analyse von biomolekülen in einem mikrofluidischen reaktionsträger |
| CN101864493B (zh) * | 2009-04-17 | 2012-11-28 | 上海生物信息技术研究中心 | 检测人乳头瘤病毒的检测试剂盒及其制备和使用 |
| WO2011099664A1 (ko) * | 2010-02-12 | 2011-08-18 | 엠앤디(주) | Hpv 유전자형 진단용 프로브 및 그 분석방법 |
| ES2372840B1 (es) * | 2010-03-24 | 2012-11-22 | Genómica S.A.U. | Kit para la detección del virus del papiloma humano. |
| CN103409553B (zh) * | 2013-02-01 | 2016-04-20 | 港龙生物技术(深圳)有限公司 | 一种用于高通量分型检测人乳头瘤病毒的基因芯片、试剂及其试剂盒 |
| GB2525024A (en) * | 2014-04-10 | 2015-10-14 | Vela Operations Pte Ltd | Universal controls for sequencing assays |
| CN104818342B (zh) * | 2015-03-23 | 2017-09-22 | 厦门艾德生物医药科技有限公司 | 用于19种高危型人乳头瘤病毒(hpv)的检测试剂盒、检测体系及方法 |
| GB201511470D0 (en) * | 2015-06-30 | 2015-08-12 | Cellcall Kft | HPV detection method |
| KR101886278B1 (ko) * | 2016-11-04 | 2018-08-08 | 주식회사 퀀타매트릭스 | 인유두종바이러스 유전자형 검출용 조성물 |
| EP3321376A1 (en) | 2016-11-11 | 2018-05-16 | Genomica S.A.U. | Electrochemical dna detection |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ATE222295T1 (de) * | 1994-02-21 | 2002-08-15 | Stichting Res Fonds Pathologie | Nachweis humaner papillomviren mit nukleinsäüre amplifikation die generelle primer verwendet |
| WO1999014377A2 (en) * | 1997-09-16 | 1999-03-25 | Innogenetics N.V. | Detection and identification of human papillomavirus by pcr and type-specific reverse hybridization |
| DE10201463B4 (de) * | 2002-01-16 | 2005-07-21 | Clondiag Chip Technologies Gmbh | Reaktionsgefäß zur Durchführung von Array-Verfahren |
| KR100517275B1 (ko) * | 2003-03-04 | 2005-09-27 | 주식회사 바이오메드랩 | 인유두종 바이러스의 감염을 진단하기 위한 유전형 분석프로브 및 이를 포함하는 바이오칩 |
| US7741042B2 (en) * | 2004-04-19 | 2010-06-22 | Genomictree, Inc. | Method for preparing a DNA chip and use thereof |
| KR100663992B1 (ko) * | 2004-07-05 | 2007-01-02 | (주)바이오메드랩 | 인유두종 바이러스의 유전형을 분석하기 위한 특이도 높은 프로브 선택방법 및 그 선택된 프로브 |
-
2005
- 2005-08-05 GB GBGB0516145.0A patent/GB0516145D0/en not_active Ceased
-
2006
- 2006-08-04 CN CN2006800371448A patent/CN101379196B/zh not_active Expired - Fee Related
- 2006-08-04 BR BRPI0614388-1A patent/BRPI0614388A2/pt not_active Application Discontinuation
- 2006-08-04 US US11/997,994 patent/US20110070576A1/en not_active Abandoned
- 2006-08-04 AU AU2006277711A patent/AU2006277711A1/en not_active Abandoned
- 2006-08-04 WO PCT/GB2006/050231 patent/WO2007017699A2/en active Application Filing
- 2006-08-04 KR KR1020087005439A patent/KR20080045167A/ko not_active Application Discontinuation
- 2006-08-04 JP JP2008524595A patent/JP2009502190A/ja active Pending
- 2006-08-04 EP EP06765379A patent/EP1910576A2/en not_active Withdrawn
- 2006-08-04 RU RU2008108517/10A patent/RU2441918C2/ru active
- 2006-08-04 CA CA002617978A patent/CA2617978A1/en not_active Abandoned
-
2008
- 2008-02-05 IL IL189281A patent/IL189281A/en active IP Right Grant
Non-Patent Citations (1)
| Title |
|---|
| AMBRETTI ET AL., High-throughput polymerase chain reaction chemiluminescent enzyme immunoassay for typing and quantifying human papillomavirus DNAs, Anal Biochem., 2004, v.332, n.2, pp.349-357. * |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2007017699A3 (en) | 2007-08-09 |
| JP2009502190A (ja) | 2009-01-29 |
| RU2008108517A (ru) | 2009-09-10 |
| US20110070576A1 (en) | 2011-03-24 |
| CA2617978A1 (en) | 2007-02-15 |
| CN101379196A (zh) | 2009-03-04 |
| KR20080045167A (ko) | 2008-05-22 |
| IL189281A0 (en) | 2008-06-05 |
| CN101379196B (zh) | 2012-10-24 |
| IL189281A (en) | 2012-09-24 |
| WO2007017699A2 (en) | 2007-02-15 |
| AU2006277711A1 (en) | 2007-02-15 |
| BRPI0614388A2 (pt) | 2011-03-22 |
| GB0516145D0 (en) | 2005-09-14 |
| EP1910576A2 (en) | 2008-04-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2441918C2 (ru) | In vitro диагностический набор для идентификации папилломавируса человека в клинических образцах | |
| EP0433396B1 (en) | Detection of human papillomavirus by the polymerase chain reaction | |
| JP3744548B2 (ja) | Hiv−1およびhiv−2を検出するための核酸プライマーおよびプローブ | |
| EP1294939B1 (en) | Detection and typing of human papillomavirus using pna probes | |
| AU741141B2 (en) | Specific and sensitive method for detecting nucleic acids | |
| US20060166228A1 (en) | Markers of alterations in the Y chromosome and uses therefor | |
| EP1082466B1 (en) | Method, reagent and kit for genotyping of human papillomavirus | |
| US20070281295A1 (en) | Detection of human papillomavirus E6 mRNA | |
| CN110885906A (zh) | 用于检测人乳头瘤病毒核酸的组合物和方法 | |
| EA008388B1 (ru) | Способ обнаружения и определения типа папилломавируса человека с использованием амплификации-гибридизации | |
| JP4628369B2 (ja) | 高感度核酸多重解析法 | |
| WO2009126517A2 (en) | Optimized probes and primers and methods of using same for the detection, quantification and grouping of hiv-1 | |
| ES2253279T3 (es) | Metodos y composiciones para la deteccion de especies del complejo de mycobacterium avium. | |
| EP3885455A1 (en) | Method and kit for the detection of sars-cov-2 virus in a sample based on reverse transcription loop-mediated isothermal amplification (rt-lamp) | |
| EP2336369A1 (en) | Probes for genotyping low-risk-HPV | |
| US10190176B2 (en) | Primers, probes, and methods for mycobacterium tuberculosis specific diagnosis | |
| Käller et al. | Tag-array based HPV genotyping by competitive hybridization and extension | |
| MX2008001751A (es) | Equipo de diagnóstico in vitro para la identificación de virus de papiloma humano en muestras clínicas | |
| US20110039715A1 (en) | Influenza b virus detection method and kit therefor | |
| WO2013102061A1 (en) | Actb primers and probes | |
| JPH0819400A (ja) | 腎症候性出血熱ウイルスの検出方法 |