RU2441069C2 - Стабилизатор ферментных белков - Google Patents
Стабилизатор ферментных белков Download PDFInfo
- Publication number
- RU2441069C2 RU2441069C2 RU2010108916/10A RU2010108916A RU2441069C2 RU 2441069 C2 RU2441069 C2 RU 2441069C2 RU 2010108916/10 A RU2010108916/10 A RU 2010108916/10A RU 2010108916 A RU2010108916 A RU 2010108916A RU 2441069 C2 RU2441069 C2 RU 2441069C2
- Authority
- RU
- Russia
- Prior art keywords
- activity
- enzyme
- stabilizer
- stability
- alkyl phenols
- Prior art date
Links
- 239000003381 stabilizer Substances 0.000 title claims abstract description 32
- 230000002255 enzymatic effect Effects 0.000 title description 7
- 102000004169 proteins and genes Human genes 0.000 title description 4
- 108090000623 proteins and genes Proteins 0.000 title description 4
- 102000004190 Enzymes Human genes 0.000 claims abstract description 63
- 108090000790 Enzymes Proteins 0.000 claims abstract description 63
- 239000000203 mixture Substances 0.000 claims description 15
- -1 alkyl phenols Chemical class 0.000 claims description 12
- OSAYNTCWNTVWHD-UHFFFAOYSA-N OC1=C(C(=CC(=C1)C1=CC(=C(C(=C1)C)O)O)C)O Chemical compound OC1=C(C(=CC(=C1)C1=CC(=C(C(=C1)C)O)O)C)O OSAYNTCWNTVWHD-UHFFFAOYSA-N 0.000 claims description 4
- OOXFYOMIPZSLEW-UHFFFAOYSA-N OC1=C(C=C(C(=C1)C1=CC(=C(C=C1CCCCCC)O)O)CCCCCC)O Chemical compound OC1=C(C=C(C(=C1)C1=CC(=C(C=C1CCCCCC)O)O)CCCCCC)O OOXFYOMIPZSLEW-UHFFFAOYSA-N 0.000 claims description 4
- ABFCOJLLBHXNOU-UHFFFAOYSA-N 2-(2-hydroxyphenyl)ethanol Chemical compound OCCC1=CC=CC=C1O ABFCOJLLBHXNOU-UHFFFAOYSA-N 0.000 claims description 2
- WFJIVOKAWHGMBH-UHFFFAOYSA-N 4-hexylbenzene-1,3-diol Chemical compound CCCCCCC1=CC=C(O)C=C1O WFJIVOKAWHGMBH-UHFFFAOYSA-N 0.000 claims description 2
- AXTGIOSZSDVMFS-UHFFFAOYSA-N OC1=CC(=C(C(=C1)O)C=1C(=CC(=CC=1)O)O)CC Chemical compound OC1=CC(=C(C(=C1)O)C=1C(=CC(=CC=1)O)O)CC AXTGIOSZSDVMFS-UHFFFAOYSA-N 0.000 claims description 2
- OIPPWFOQEKKFEE-UHFFFAOYSA-N orcinol Chemical compound CC1=CC(O)=CC(O)=C1 OIPPWFOQEKKFEE-UHFFFAOYSA-N 0.000 claims description 2
- 230000000694 effects Effects 0.000 abstract description 58
- 239000000126 substance Substances 0.000 abstract description 12
- 238000003860 storage Methods 0.000 abstract description 9
- 238000006555 catalytic reaction Methods 0.000 abstract description 8
- 230000002411 adverse Effects 0.000 abstract description 2
- 239000003814 drug Substances 0.000 abstract description 2
- 229940088598 enzyme Drugs 0.000 description 51
- 239000000243 solution Substances 0.000 description 24
- 239000007788 liquid Substances 0.000 description 11
- YCIMNLLNPGFGHC-UHFFFAOYSA-N catechol Chemical compound OC1=CC=CC=C1O YCIMNLLNPGFGHC-UHFFFAOYSA-N 0.000 description 9
- 238000006243 chemical reaction Methods 0.000 description 8
- 230000007062 hydrolysis Effects 0.000 description 8
- 238000006460 hydrolysis reaction Methods 0.000 description 8
- 102000016911 Deoxyribonucleases Human genes 0.000 description 7
- 108010053770 Deoxyribonucleases Proteins 0.000 description 7
- 230000006641 stabilisation Effects 0.000 description 7
- 238000011105 stabilization Methods 0.000 description 7
- 102000004139 alpha-Amylases Human genes 0.000 description 6
- 108090000637 alpha-Amylases Proteins 0.000 description 6
- 229940024171 alpha-amylase Drugs 0.000 description 6
- 238000010438 heat treatment Methods 0.000 description 6
- 239000011541 reaction mixture Substances 0.000 description 6
- 239000000758 substrate Substances 0.000 description 6
- 150000001875 compounds Chemical class 0.000 description 5
- 238000000034 method Methods 0.000 description 5
- 238000002360 preparation method Methods 0.000 description 5
- 108010073178 Glucan 1,4-alpha-Glucosidase Proteins 0.000 description 4
- 102100022624 Glucoamylase Human genes 0.000 description 4
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 4
- 102000003992 Peroxidases Human genes 0.000 description 4
- 230000007423 decrease Effects 0.000 description 4
- 239000008103 glucose Substances 0.000 description 4
- 108040007629 peroxidase activity proteins Proteins 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 4
- PGSWEKYNAOWQDF-UHFFFAOYSA-N 3-methylcatechol Chemical compound CC1=CC=CC(O)=C1O PGSWEKYNAOWQDF-UHFFFAOYSA-N 0.000 description 3
- GXCLVBGFBYZDAG-UHFFFAOYSA-N N-[2-(1H-indol-3-yl)ethyl]-N-methylprop-2-en-1-amine Chemical compound CN(CCC1=CNC2=C1C=CC=C2)CC=C GXCLVBGFBYZDAG-UHFFFAOYSA-N 0.000 description 3
- 108091005804 Peptidases Proteins 0.000 description 3
- 102000035195 Peptidases Human genes 0.000 description 3
- 229920002472 Starch Polymers 0.000 description 3
- 230000009471 action Effects 0.000 description 3
- 239000007864 aqueous solution Substances 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 230000003197 catalytic effect Effects 0.000 description 3
- 230000008859 change Effects 0.000 description 3
- 238000001914 filtration Methods 0.000 description 3
- 230000000415 inactivating effect Effects 0.000 description 3
- 238000002156 mixing Methods 0.000 description 3
- 239000008363 phosphate buffer Substances 0.000 description 3
- 229920005862 polyol Polymers 0.000 description 3
- 235000018102 proteins Nutrition 0.000 description 3
- 230000000087 stabilizing effect Effects 0.000 description 3
- 235000019698 starch Nutrition 0.000 description 3
- 239000008107 starch Substances 0.000 description 3
- LWFUFLREGJMOIZ-UHFFFAOYSA-N 3,5-dinitrosalicylic acid Chemical compound OC(=O)C1=CC([N+]([O-])=O)=CC([N+]([O-])=O)=C1O LWFUFLREGJMOIZ-UHFFFAOYSA-N 0.000 description 2
- ZBCATMYQYDCTIZ-UHFFFAOYSA-N 4-methylcatechol Chemical compound CC1=CC=C(O)C(O)=C1 ZBCATMYQYDCTIZ-UHFFFAOYSA-N 0.000 description 2
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 2
- 102000013142 Amylases Human genes 0.000 description 2
- 108010065511 Amylases Proteins 0.000 description 2
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 2
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 2
- 102000005431 Molecular Chaperones Human genes 0.000 description 2
- 108010006519 Molecular Chaperones Proteins 0.000 description 2
- 229940024606 amino acid Drugs 0.000 description 2
- 235000001014 amino acid Nutrition 0.000 description 2
- 150000001413 amino acids Chemical class 0.000 description 2
- 235000019418 amylase Nutrition 0.000 description 2
- TXXHDPDFNKHHGW-CCAGOZQPSA-N cis,cis-muconic acid Chemical compound OC(=O)\C=C/C=C\C(O)=O TXXHDPDFNKHHGW-CCAGOZQPSA-N 0.000 description 2
- 238000004925 denaturation Methods 0.000 description 2
- 238000006911 enzymatic reaction Methods 0.000 description 2
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 2
- 229910052740 iodine Inorganic materials 0.000 description 2
- 239000011630 iodine Substances 0.000 description 2
- 230000003647 oxidation Effects 0.000 description 2
- 238000007254 oxidation reaction Methods 0.000 description 2
- VLTRZXGMWDSKGL-UHFFFAOYSA-N perchloric acid Chemical compound OCl(=O)(=O)=O VLTRZXGMWDSKGL-UHFFFAOYSA-N 0.000 description 2
- 150000003077 polyols Chemical class 0.000 description 2
- 238000004321 preservation Methods 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 238000010792 warming Methods 0.000 description 2
- TXXHDPDFNKHHGW-UHFFFAOYSA-N (2E,4E)-2,4-hexadienedioic acid Natural products OC(=O)C=CC=CC(O)=O TXXHDPDFNKHHGW-UHFFFAOYSA-N 0.000 description 1
- 150000005206 1,2-dihydroxybenzenes Chemical class 0.000 description 1
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 1
- GQKDZDYQXPOXEM-UHFFFAOYSA-N 3-chlorocatechol Chemical compound OC1=CC=CC(Cl)=C1O GQKDZDYQXPOXEM-UHFFFAOYSA-N 0.000 description 1
- QHRTZMDBPOUHPU-UHFFFAOYSA-N 4-(4-amino-3-methoxyphenyl)-2-methoxyaniline;hydrochloride Chemical compound Cl.C1=C(N)C(OC)=CC(C=2C=C(OC)C(N)=CC=2)=C1 QHRTZMDBPOUHPU-UHFFFAOYSA-N 0.000 description 1
- WWOBYPKUYODHDG-UHFFFAOYSA-N 4-chlorocatechol Chemical compound OC1=CC=C(Cl)C=C1O WWOBYPKUYODHDG-UHFFFAOYSA-N 0.000 description 1
- 102100036475 Alanine aminotransferase 1 Human genes 0.000 description 1
- 108010082126 Alanine transaminase Proteins 0.000 description 1
- 239000004382 Amylase Substances 0.000 description 1
- 108010003415 Aspartate Aminotransferases Proteins 0.000 description 1
- 102000004625 Aspartate Aminotransferases Human genes 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 108090000317 Chymotrypsin Proteins 0.000 description 1
- 230000007064 DNA hydrolysis Effects 0.000 description 1
- 102000016680 Dioxygenases Human genes 0.000 description 1
- 108010028143 Dioxygenases Proteins 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 102000006382 Ribonucleases Human genes 0.000 description 1
- 108010083644 Ribonucleases Proteins 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 229940025131 amylases Drugs 0.000 description 1
- 230000003625 amylolytic effect Effects 0.000 description 1
- 230000008033 biological extinction Effects 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- KGBXLFKZBHKPEV-UHFFFAOYSA-N boric acid Chemical compound OB(O)O KGBXLFKZBHKPEV-UHFFFAOYSA-N 0.000 description 1
- 239000004327 boric acid Substances 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 239000003054 catalyst Substances 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 235000013339 cereals Nutrition 0.000 description 1
- 238000007385 chemical modification Methods 0.000 description 1
- 229960002376 chymotrypsin Drugs 0.000 description 1
- 239000013068 control sample Substances 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 230000036425 denaturation Effects 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 230000007515 enzymatic degradation Effects 0.000 description 1
- 230000009144 enzymatic modification Effects 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 238000007710 freezing Methods 0.000 description 1
- 230000008014 freezing Effects 0.000 description 1
- 230000005714 functional activity Effects 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 235000011868 grain product Nutrition 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 238000005360 mashing Methods 0.000 description 1
- 229910021645 metal ion Inorganic materials 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 235000019833 protease Nutrition 0.000 description 1
- 239000012460 protein solution Substances 0.000 description 1
- 229940024999 proteolytic enzymes for treatment of wounds and ulcers Drugs 0.000 description 1
- ZUFQODAHGAHPFQ-UHFFFAOYSA-N pyridoxine hydrochloride Chemical compound Cl.CC1=NC=C(CO)C(CO)=C1O ZUFQODAHGAHPFQ-UHFFFAOYSA-N 0.000 description 1
- 229960004172 pyridoxine hydrochloride Drugs 0.000 description 1
- 235000019171 pyridoxine hydrochloride Nutrition 0.000 description 1
- 239000011764 pyridoxine hydrochloride Substances 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 238000006722 reduction reaction Methods 0.000 description 1
- 108091008146 restriction endonucleases Proteins 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 239000000523 sample Substances 0.000 description 1
- 238000002741 site-directed mutagenesis Methods 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 125000001424 substituent group Chemical group 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- 239000004474 valine Substances 0.000 description 1
Images
Landscapes
- Enzymes And Modification Thereof (AREA)
- Cosmetics (AREA)
Abstract
Группа изобретений относится к области биохимии. Предложены пять вариантов стабилизаторов ферментов на основе алкилфенолов. Стабилизаторы представляют собой смесь алкилфенолов, взятых в количестве от 1% до 99% от суммарного содержания алкилфенолов при любом их соотношении. Изобретение позволяет повысить устойчивость ферментов к инактивирующим воздействиям температуры, рН и других неблагоприятных факторов, сохранить высокую активность ферментов при неоптимальных параметрах каталитических реакций и при неоптимальных условиях их хранения. 5 н.п. ф-лы, 3 ил., 7 табл.
Description
Изобретение относится к биотехнологической, медицинской, пищевой, комбикормовой и легкой промышленности.
Ферменты - биологические катализаторы, широко используются в различных областях хозяйственной деятельности человека. Одной из отрицательных сторон использования ферментов является свойственная им нестабильность в денатурирующих условиях. Активность ферментных белков зависит от сохранения нативной структуры, которая может быть нарушена физическими, химическими и биологическими воздействиями, такими как нагревание, замораживание, окисление, восстановление, действием растворителей, ионов металлов, ионной силой растворов, ферментативной модификацией и деградацией. Применение ферментов в различных областях человеческой практики предполагает сохранение ими активности в широком диапазоне температур, рН, высоких концентраций солей и других параметров среды, выходящих за пределы оптимальных для катализа.
Обеспечить стабилизацию белковой молекулы можно следующими способами:
1. иммобилизацией ферментов на твердых носителях;
2. использованием добавок, стабилизирующих конформацию белка;
3. химической модификацией молекулы;
4. приемами белковой инженерии через сайт - направленный мутагенез.
Добавление стабилизирующих веществ в растворы белков является наиболее простым способом сохранения активности ферментов в денатурирующих или неоптимальных для катализа условиях.
Известно использование для стабилизации аспартатаминотрансферазы и аланинаминотрансферазы водных растворов аминокислот - валина или пролина или их комбинации (ЕР 1136550, 2001).
Эффект стабилизации выражается в сохранении достаточно высокой остаточной активности после хранения ферментных растворов при 45°С в течение 4 дней.
В патенте RU 2008354, 1994 для сохранения водных растворов протеиназ используют диметилсулфоксид (20-30% об.). В патенте RU 2020154, 1991 при хранении дезоксирибонуклеазы в ее раствор в качестве стабилизатора вносят смесь гидрохлорида пиридоксина (5-10% вес.) и борной кислоты (1-2% вес.). Недостатком этих известных стабилизирующих веществ является необходимость их использования в высокой концентрации.
Известно использование для стабилизации протеолитических ферментов водорастворимых полиолов (US 4169817, 1979). Эффективность применения полиолов выражается в увеличении остаточной активности при хранении ферментов в течение года, а также в повышении совместимости протеаз с различными детергентами.
В патенте ЕР 0821058, 2002 для сохранения высокой ферментативной активности деполимераз и рестриктаз при высоких значениях температуры используют стабилизирующие вещества, обладающие функциями химических шаперонов, к которым относят сахара, полиольные спирты, аминокислоты и их производные, а также используют белки-шапероны. Недостатком известных веществ является то, что стабильность ферментативной активности проявляется лишь при супраоптимальных температурах.
Известно применение С7-алкилоксибензола в виде его раствора в этаноле в качестве стабилизатора ферментов, в частности, его использование для стабилизации и активации РНКазы и химотрипсина ("Микробиология", 2000, том 69, №2, 224-230).
Ближайшим аналогом настоящего изобретения является патент ЕР 0189838 1996, в котором для термостабилизации водного раствора α-амилазы применяют некоторые амфифильные соединения.
Действие описанных в патенте стабилизаторов позволяет сохранять высокую ферментативную активность при воздействии высоких, в том числе денатурирующих, значений температуры. Однако действие этих стабилизаторов сопровождается снижением каталитической активности.
Недостатками известных технических решений является то, что стабилизация ферментов ориентирована в основном на их хранение, т.е. обеспечивается функциональная стабильность, но эффекты стабилизации, как правило, сопровождаются снижением каталитической активности. Кроме того, известные стабилизаторы не обеспечивают расширения рабочего диапазона катализа с сохранением высокой активности в области неоптимальных (высоких или низких) значений температуры и рН.
Задачей настоящего изобретения является разработка стабилизаторов ферментов, которые способны повысить устойчивость ферментов к инактивирующим воздействиям температуры, рН и других неблагоприятных факторов и сохранить высокую активность ферментов при неоптимальных для катализа параметрах реакции.
Поставленная задача решается применением описываемых пяти вариантов стабилизаторов ферментных белков на основе алкилфенолов, которые содержат смесь следующих соединений в количестве от 1% до 99%:
1. смесь 3-гидрокси-4-гексилфенола и 2,2'-дигидрокси-5,5'-дигексил-4,4'-бифенола.
2. смесь 2,2'-дигидрокси-5,5'-дигексил-4,4'-бифенола и бициклогексадиена-3,5.
3. смесь 3-гидрокси-5-метилфенола и 2,2'-дигидрокси-6,6'-диметил-4,4'-бифенола.
4. смесь 2,2'-дигидрокси-6,6'-диметил-4,4'-бифенола и бициклогексадиена-3,5.
5. смесь гидроксиэтилфенола и 5,5'-дигидроксиэтил-2,2'-бифенола.
Все пять заявленных вариантов стабилизаторов ферментных белков позволяют обеспечить достижение технического результата, заключающегося в том, что за счет модификации пространственной структуры ферментных белков (как моно-, так и полисубъединичных) обеспечивается их устойчивость к инактивирующим воздействиям химической, физической и биологической природы и сохранение высокой активности при неоптимальных для катализа значениях температуры и рН.
По химической природе все химические соединения, входящие в состав заявленных стабилизаторов, являются соединениями с одним или несколькими шестиатомными углеродными циклами с различными заместителями, не менее чем один из которых является гидроксилом или оксигруппой.
Заявленные варианты композиций АФ1-АФ5 могут быть получены например, путем смешения компонентов I-VIII, входящих в их состав приобретенных коммерчески (например: http://www.reaxys.com; http://mntc.ru/synthesis.html и http://chemexpress.fatal.ru/Navigator/Deliver.html). Активность модифицирующих композиций проявляется при наличии указанных выше АФ I-VIII в количествах от 1% до 99% от суммарного содержания АФ при любом их соотношении.
В таблице 1 представлены заявленные варианты стабилизаторов (далее используется условное обозначение АФ) и входящие в их состав химические соединения, при этом радикалы R1-R5 относятся к первому кольцу, радикалы R'1-R'5 - ко второму, R"1-R"5 - к третьему.
Применение предлагаемых стабилизаторов можно осуществить двумя способами: 1) смешивая растворы ферментов и стабилизаторов; 2) путем введения растворов стабилизаторов в реакционную смесь одновременно с растворами фермента и субстрата.
Заявленные стабилизаторы не обладают токсическим действием и могут действовать на ферменты даже в составе живых организмов.
Достижение технического результата продемонстрировано с помощью конкретных примеров и проиллюстрировано на представленных фиг.1-3.
Примеры использования заявленных стабилизаторов
Пример 1. Влияние АФ-5 и АФ-1 на активность жидкого ФП α-амилазы (α-malt-LKu5038, Германия) при различных значениях температуры (операционная стабильность)
Ферментативную активность α-амилазы определяют по количеству редуцирующих веществ (метод с 3,5-динитросалициловой кислотой), образующихся при гидролизе крахмала. Реакционная смесь включает 2.5 мл раствора фермента (5 ед./мл), 1.5 мл раствора АФ №5 или АФ №1 с концентрацией 0.04 г/л и с концентрацией 0.3 г/л, соответственно, 5 мл 1% раствора крахмала. Гидролиз проводят в течение 10 мин при рН 6.0. Реакцию останавливают добавлением равного объема 0.2 н. HCl.
Гидролиз ведут при различных температурах в интервале 20-80°С. Результаты представлены в табл.2. Активность стабилизированного АФ №5 (0.3 г/л) фермента больше чем в 2 раза при всех температурах реакции, стабилизированного АФ №1 (0.04 г/л) - в 1,5 раза. Температурный оптимум гидролиза не изменяется, но существенно расширяется рабочий Т-диапазон катализа. Активность стабилизированного фермента в интервале температур 35-75°С равна или больше, чем максимальная активность нестабилизированной амилазы при Топт=60°С.
| Таблица 2 | |||||
| Активность стабилизированного АФ-5 и АФ-1 жидкого ФП α-амилазы α-malt-LKu5038 при различных температурах (операционная стабильность) |
|||||
| Температура гидролиза, °С | Концентрация глюкозы в гидролизате, г/л | ||||
| без АФ | с АФ-5, 0.3 г/л | с АФ-5, 1.5 г/л | с АФ-1, 0.04 г/л | с АФ-1, 0.15 г/л | |
| 20 | 0.20 | 0.66 | 0.47 | 0.32 | 0.25 |
| 30 | 0.27 | 0.71 | 0.64 | 0.46 | 0.35 |
| 40 | 0.34 | 0.87 | 0.82 | 0.82 | 0.63 |
| 50 | 0.62 | 1.25 | 1.17 | 0.93 | 0.81 |
| 60 | 0.77 | 1.38 | 1.27 | 1.05 | 0.90 |
| 70 | 0.56 | 1.15 | 1.03 | 1.0 | 0.91 |
| 80 | 0.23 | 0.60 | 0.40 | 0.51 | 0.38 |
Пример 2. Влияние АФ-4 на активность жидкого ФП α-амилазы (α-malt-LKu5038, Германия) при различных значениях рН (операционная стабильность)
Опыты проводят, как описано в примере 1, за исключением того, что гидролиз ведут в интервале рН 2.5-7.5. Результаты представлены в табл.3. Активность стабилизированного АФ-4 (0.2 и 1.5 г/л) фермента при различных значениях рН реакционной смеси существенно выше по сравнению с контролем при рНопт 3.5-4.0 (более чем в 2 раза). Это указывает на повышение стабильности модифицированного фермента в широком диапазоне неоптимальных значений рН.
| Таблица 3 | ||
| Активность стабилизированного АФ-4 жидкого ФП α-амилазы при различных значениях рН (операционная стабильность) | ||
| рН гидролиза | Концентрация глюкозы в гидролизате, г/л | |
| без АФ | с АФ-4, 0,2 (1.5)г/л | |
| 2.5 | 0.30 | 0.73 (0.77) |
| 3.5 | 0.37 | 0.81 (0.85) |
| 4.7 | 0.33 | 0.76 (0.81) |
| 5.5 | 0.27 | 0.70 (0.75) |
| 6.5 | 0.14 | 0.61 (0.70) |
| 7.5 | 0 | 0.47 (0.50) |
Пример 3. Влияние АФ-2, 3, 5 на термостабильность диоксигеназ (функциональная стабильность)
Активность метилпирокатехин - 1,2-диоксигеназы (МПК - 1,2-ДО) определяют модифицированным методом Хаяиси. Реакционная смесь содержит в 50 мМ буфере Tris-HCl (рН 7.2) 0.25 мМ пирокатехин или замещенный пирокатехин, 1.3 мМ ЭДТА и фермент. Реакцию начинают добавлением фермента. Активность фермента рассчитывают по скорости образования продукта (цис, цис-муконовой кислоты или замещенных муконатов) спектрофотометрически при длине волны 260 нм. При расчете активностей используют коэффициенты молярной экстинкции, определенные Дорном и Кнакмуссом: 16800 М-1 · см-1 для пирокатехина; 17100 М-1 · см-1 для 3-хлорпирокатехина; 12400 М-1 · см-1 для 4-хлорпирокатехина; 12000 M-1 · см-1 для 3,5-хлорпирокатехина; 18000 М-1 · см-1 для 3-метилпирокатехина; 13900 M-1 · см-1 для 4-метилпирокатехина. Единицу активности определяют как количество фермента, катализирующее превращение 1 мкмоля субстрата или образование 1 мкмоля продукта в минуту. Термостабильность ферментов определяют при использовании АФ в концентрациях, которые максимально увеличивают скорость протекания реакции ферментов с пирокатехином: АФ-2 - 0.36 г/л; АФ-3 - 0.42 г/л; АФ-5 - 0.8 г/л. Влияние АФ на термостабильность ферментов изучена после их прогревания при 50°С. Остаточную активность определяют в районе значений температурного максимума. Ферменты инкубируют с АФ при 50°С в течение 9 час, пробы отбирают каждые 10-30 мин, реакцию начинают добавлением пирокатехина. В контрольном варианте фермент инкубируют без добавления АФ в тех же условиях.
Метилпирокатехин - 1,2-диоксигеназа (МПК1,2-ДО), инкубируемая при 50°С в отсутствие АФ (контрольный вариант), практически инактивируется через 1.5 ч (фиг.1). АФ-2, 3, 5 повышают термостабильность МПК 1,2-ДО при 50°С: в присутствии АФ-2 фермент инактивируется через 2 ч; в присутствии АФ-3 - через 2.5 ч, а в присутствии АФ-5 - только через 3 ч.
Данный пример показывает, что использование заявленных вариантов АФ значительно удлиняет время активности ферментов за счет увеличения их функциональной стабильности (сохранения функции после денатурирующих воздействий).
Пример 4. Влияние АФ-4 на термостабильность пероксидазы (функциональная стабильность).
Термостабильность пероксидазы определяют при ее модификации АФ №4 в концентрациях 0.05-2.0 г/л. Фермент, модифицированный и контрольный (без АФ), подвергают прогреванию при температурах 60°С, 20 минут и 70°С, 10 минут, охлаждают до комнатной температуры и проводят ферментативную реакцию. Для окисления субстрата, о-дианизидингидрохлорида, готовят на фосфатном буфере 0.05 М (рН 7.0) растворы: субстрата - о-дианизидингидрохлорида - 5 мг/мл; АФ - с диапазоном концентраций от 0.018 до 0.36 мг/л, ферментного препарата - 0.002 мг/мл. Реакционная смесь включает 840 мкл 0.05 М К-фосфатного буфера (рН 7.0); 10 мкл 3% H2O2; 100 мкл субстрата, по 25 мкл ферментного препарата и раствора определенных концентраций АФ. В течение 5 мин измеряют изменение поглощения при 436 нм. В контрольных вариантах вместо раствора АФ вносят 25 мкл 0.05 М К-фосфатного буфера. Активность в контроле принимают за 100%. Результаты представлены в таблице 4.
Модифицированный фермент (0.05 г/л) сохраняет функциональную активность после термообработки 60°С 20 минут практически полностью (98%), тогда как у контрольного фермента она снижается на 27%. Термообработка при 70°С в течение 10 минут модифицированного фермента при всех концентрациях АФ-4 показала сохранение активности на 13-19% выше контрольного.
| Таблица 4 | |||
| Термостабильность пероксидазы, модифицированной АФ-4 | |||
| Концентрация АФ, г/л | Активность пероксидазы, % от активности до термообработки | ||
| До термообработки | 60° 20 мин | 70° 10 мин | |
| 0 | 100 | 73 | 32 |
| 0.05 | 100 | 98 | 45 |
| 0.12 | 100 | 77 | 40 |
| 2.0 | 100 | 76 | 41 |
Пример 5. Влияние АФ-3 на стабильность дезоксирибонуклеазы при хранении
Одной из проблем в практике применения фермента ДНКазы является быстрая потеря ее активности в растворах. Исследовали сохранение активности ДНКазы, модифицированной АФ-3, в растворах, хранившихся в течение 24, 48 и 144 часов в стеклянной или пластмассовой посуде при температурах 25°С и 4°С. Фермент стабилизируют АФ-3 в концентрациях 0.05-0.5 г/л.
Ферментативную активность ДНКазы определяют по количеству кислоторастворимых веществ, освобождаемых ферментом при гидролизе ДНК в стандартных условиях (37°С, 30 мин). В реакционную смесь вносят по 0.25 мл субстрата (ДНК, 2 мг/мл воды) и 0.15 мл 0.2 М трис-буфера рН 7.0, 0.1 мл раствора стабилизированного АФ фермента. Реакцию останавливают внесением 0.5 мл 1 М раствора хлорной кислоты. В контрольном варианте фермент не стабилизируют. После охлаждения и центрифугирования из надосадочного слоя отбирают 0.5 мл раствора, прибавляют 2.5 мл воды и измеряют поглощение при 260 нм. За единицу активности фермента принимают такое его количество, которое вызывает увеличение оптической плотности на 1 ед. при 260 нм за 1 час инкубации.
На фиг.2 представлены результаты зависимости стабильности ДНКазы от концентрации АФ при хранении растворов при комнатной температуре.
Активность фермента при хранении в стеклянной посуде через 24 часа составляла до 25% от исходной и была на 21% выше, чем в контроле, а через 48 часов составляла 14% и была на 11% выше контрольной. При хранении раствора фермента в пластмассовой посуде активность фермента сохранялась на уровне 11%, тогда как в контрольном варианте была нулевой.
При хранении тех же образцов при температуре 4°С активность модифицированной ДНКазы сохранялась на более высоком уровне: при концентрации АФ 0.1 г/л через 48 ч сохранялась до 25% от исходной активности, что на 22% больше, чем в контроле. Соответствующие данные проиллюстрированы на фиг.3.
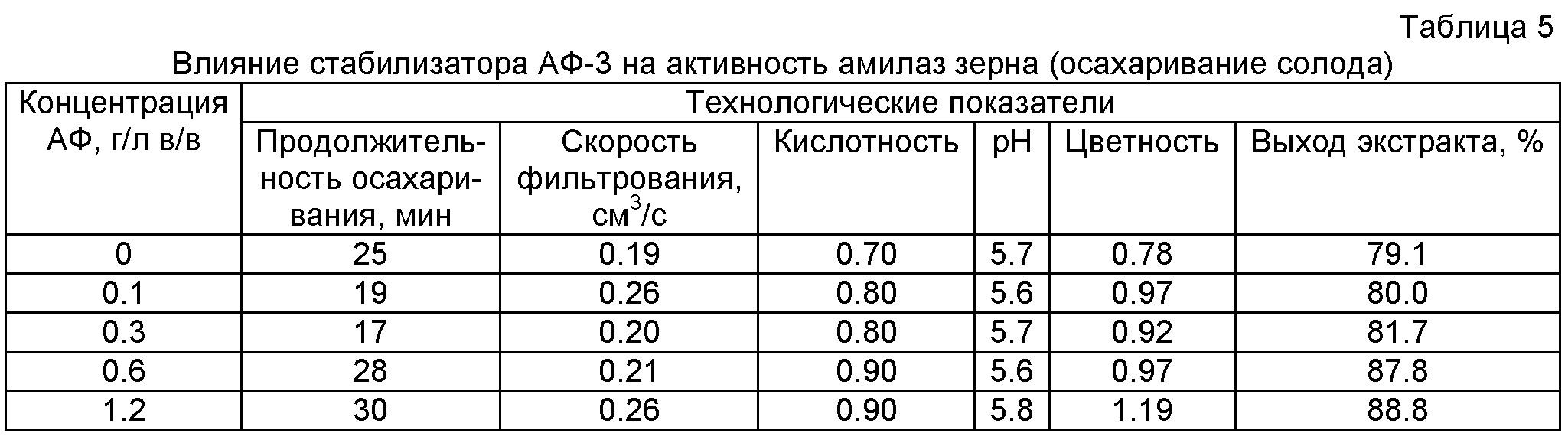
Пример 6. Влияние стабилизатора АФ-3 на стабильность амилаз зерна при осахаривании солода
Затирание готовят, смешивая 40 г дробленного солода с 450 мл воды, проводят температурную паузу при 45°С в течение 30 минут, затем поднимают температуру до 55°С и выдерживают 20 минут, затем поднимают температуру до 65°С и выдерживают 20 минут. После этого затор разделяют фильтрованием на жидкую и густую часть. Жидкую часть инкубируют с препаратом АФ-3 (0.1, 0.3, 0.6, 1.2 г/л) в течение 20 минут. В это время постепенно поднимают температуру густой отварочной части до 70°С, затем охлаждают до 65°С и объединяют с жидкой частью. Поднимают температуру общего затора до 70°С, доливают 20 мл воды (70°С) и проводят осахаривание затора.
В полученном заторе определяют продолжительность осахаривания по капельной йодной пробе. После того как йод перестает изменять цвет, затор фильтруют до появления трещин. В полученном жидком сусле определяют содержание сухих веществ (СВ) весовым методом, титруемую кислотность, рН, цветность, а также скорость фильтрования сусла.
Как видно из таблицы 5, происходит значительное снижение (на 32.0%) продолжительности осахаривания в варианте внесения АФ-3 в количестве 0.5% от массы зернопродуктов, скорость фильтрования при этом остается почти неизменной. Выход экстракта у всех опытных образцов лучше, чем у контрольного образца. Пример доказывает стабилизацию комплекса амилолитических ферментов, участвующих в процессе осахаривания солодового затора при высоких температурах (65-70°С).
Пример 7. Влияние стабилизатора АФ-3 на сохранение активности глюкоамилазы (Сан-Ультра Л, Novozyme, Дания) в денатурирующих условиях температуры и рН (функциональная стабильность).
Ферментативную активность определяют по количеству редуцирующих веществ (с 3,5-динитросалициловой кислотой), образующихся при гидролизе крахмала, как в примере 1. Для определения термостабильности и рН-стабильности глюкоамилазу - жидкий концентрированный препарат с активностью 2.5 ед./мл, модифицируют добавлением раствора АФ-3 (1 и 20 г/л). Полученный раствор экспонируют (0-60 мин) при температуре 70°, затем охлаждают и определяют активность при стандартной температуре (30°С). В варианте определения рН-стабильности ферментный раствор экспонируют (0-60 мин) при рН 2 или 9.5, затем нейтрализуют и определяют активность при рН 6.0 (оптимуме). Из таблиц 6 и 7 видно, что активность модифицированного фермента в условиях термо- или рН-денатурации была выше, чем немодифицированного (контроль) на протяжении всего времени экспонирования. Эффективность дозы 20 г/л была существенно выше чем 1 г/л.
| Таблица 6 | ||
| Влияние АФ-3 на термостабильность жидкого ФП глюкоамилазы (Сан-Ультра Л, Novozyme, Дания) (функциональная стабильность) | ||
| Время прогревания (70°С), мин | Концентрация глюкозы в гидролизате, г/л | |
| без АФ | с АФ, 20 г/л (1 г/л) | |
| 0 (контроль) | 0.3 | 0.38 (0.33) |
| 20 | 0.22 | 0.28 (0.24) |
| 40 | 0.20 | 0.29 (0.22) |
| 60 | 0.18 | 0.28 (0.20) |
| Таблица 7 | ||
| Влияние стабилизатора АФ - 3 на рН стабильность жидкого ФП глюкоамилазы (Сан-Ультра Л, Novozyme, Дания) (функциональная стабильность) | ||
| Время рН-денатурации (рН 9.5) | Концентрация глюкозы в гидролизате, г/л | |
| Без АФ | С АФ, 20 г/л (1 г/л) | |
| 0 | 0.3 | 0.38 (0.32) |
| 30 | 0.25 | 0.38 (0.28) |
| 60 | 0.20 | 0.30 (0.22) |
Таким образом, заявленные варианты стабилизаторов позволяют не только повысить устойчивость макромолекул к инактивирующим воздействиям, но и обеспечивает сохранение высокой каталитической активности ферментов при неоптимальных условиях (Т°С и рН) катализа, что в свою очередь позволяет расширить рабочий температурный и рН диапазоны ферментативных реакций, включая область низких температур.
Краткое описание чертежей:
Фиг.1. Влияние АФ на термостабильность фермента МПК1,2-ДО при 50°С: 1 - контроль; 2 - АФ-3 (0.42 г/л); 3 - АФ-5 (0.8 г/л); 4 - №2 (0.36 г/л).
По оси ординат отложена остаточная активность фермента, в % от исходной, до прогрева при 50°С.
Фиг.2. Активность модифицированных АФ-3 препаратов ДНКазы после хранения в течение 24 и 48 часов при температуре 25°С.
Фиг.3. Активность модифицированных АФ-3 препаратов ДНКазы после хранения в течение 24, 48 и 144 часов при температуре 4°С.
Claims (5)
1. Стабилизатор ферментных белков на основе алкилфенолов, отличающийся тем, что стабилизатор представляет собой смесь 3-гидрокси-4-гексилфенола и 2,2'-дигидрокси-5,5'-дигексил-4,4'-бифенола, взятых в количестве от 1% до 99% от суммарного содержания алкилфенолов при любом их соотношении.
2. Стабилизатор ферментных белков на основе алкилфенолов, отличающийся тем, что стабилизатор представляет собой смесь 2,2'-дигидрокси-5,5'-дигексил-4,4'-бифенола и бициклогексадиена-3,5, взятых в количестве от 1% до 99% от суммарного содержания алкилфенолов при любом их соотношении.
3. Стабилизатор ферментных белков на основе алкилфенолов, отличающийся тем, что стабилизатор представляет собой смесь 3-гидрокси-5-метилфенола и 2,2'-дигидрокси-6,6'-диметил-4,4'-бифенола, взятых в количестве от 1% до 99% от суммарного содержания алкилфенолов при любом их соотношении.
4. Стабилизатор ферментных белков на основе алкилфенолов, отличающийся тем, что стабилизатор представляет собой смесь 2,2'-дигидрокси-6,6'-диметил-4,4'-бифенола и бициклогексадиена-3,5, взятых в количестве от 1% до 99% от суммарного содержания алкилфенолов при любом их соотношении.
5. Стабилизатор ферментных белков на основе алкилфенолов, отличающийся тем, что стабилизатор представляет собой смесь гидроксиэтилфенола и 5,5'-дигидроксиэтил-2,2'-бифенола, взятых в количестве от 1% до 99% от суммарного содержания алкилфенолов при любом их соотношении.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2010108916/10A RU2441069C2 (ru) | 2010-03-11 | 2010-03-11 | Стабилизатор ферментных белков |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2010108916/10A RU2441069C2 (ru) | 2010-03-11 | 2010-03-11 | Стабилизатор ферментных белков |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2010108916A RU2010108916A (ru) | 2011-09-20 |
| RU2441069C2 true RU2441069C2 (ru) | 2012-01-27 |
Family
ID=44758358
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2010108916/10A RU2441069C2 (ru) | 2010-03-11 | 2010-03-11 | Стабилизатор ферментных белков |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2441069C2 (ru) |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2238318C1 (ru) * | 2003-06-20 | 2004-10-20 | Открытое акционерное общество "Восток" | Способ стабилизации и активации гидролитических ферментов |
| RU2239657C2 (ru) * | 2002-10-21 | 2004-11-10 | Институт биологии Коми Научного центра Уральского отделения РАН | Способ очистки пектолитического ферментного препарата |
| RU2288228C2 (ru) * | 2001-03-15 | 2006-11-27 | Астразенека Аб | Ингибиторы металлопротеиназ, их применение и фармацевтические композиции на их основе |
| RU2395510C2 (ru) * | 2004-12-17 | 2010-07-27 | Ипсен Фарма С.А.С. | ИНГИБИТОРЫ ФОСФАТАЗ Сdc25 |
-
2010
- 2010-03-11 RU RU2010108916/10A patent/RU2441069C2/ru not_active IP Right Cessation
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2288228C2 (ru) * | 2001-03-15 | 2006-11-27 | Астразенека Аб | Ингибиторы металлопротеиназ, их применение и фармацевтические композиции на их основе |
| RU2239657C2 (ru) * | 2002-10-21 | 2004-11-10 | Институт биологии Коми Научного центра Уральского отделения РАН | Способ очистки пектолитического ферментного препарата |
| RU2238318C1 (ru) * | 2003-06-20 | 2004-10-20 | Открытое акционерное общество "Восток" | Способ стабилизации и активации гидролитических ферментов |
| RU2395510C2 (ru) * | 2004-12-17 | 2010-07-27 | Ипсен Фарма С.А.С. | ИНГИБИТОРЫ ФОСФАТАЗ Сdc25 |
Non-Patent Citations (2)
| Title |
|---|
| BECK B.D. Utilization of Quantitative Structure-Activity Relationships (QSARs) in Risk Assessment: Alkylphenols // Regulatory Toxycology and Pharmacology, №14, 1991, pp.273-285. * |
| реферат. * |
Also Published As
| Publication number | Publication date |
|---|---|
| RU2010108916A (ru) | 2011-09-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Dingle et al. | Studies on the mode of action of excess of vitamin A. 1. Effect of excess of vitamin A on the metabolism and composition of embryonic chick-limb cartilage grown in organ culture | |
| KR101086189B1 (ko) | 플라빈 결합형 글루코오스 디히드로게나아제 | |
| Noda et al. | Sweet potato β-amylase immobilized on chitosan beads and its application in the semi-continuous production of maltose | |
| US9506042B2 (en) | Glucose dehydrogenase | |
| CN114058603B (zh) | 一种鞘磷脂酶的冻干保护剂及制备方法 | |
| Vasileva et al. | Study of the effect of some organic solvents on the activity and stability of glucose oxidase | |
| RU2441069C2 (ru) | Стабилизатор ферментных белков | |
| CN113633759A (zh) | 用于提高超氧化物歧化酶的活性和/或热稳定性的制剂及其应用 | |
| EP3682013B1 (en) | Bacterial strain clostridium histolyticum and its use | |
| Ellenrieder et al. | Hydrolysis of supersaturated naringin solutions by free and immobilized naringinase | |
| Gonaus et al. | Transcription analysis of pyranose dehydrogenase from the basidiomycete Agaricus bisporus and characterization of the recombinantly expressed enzyme | |
| CN101596311B (zh) | 稳定的激肽释放酶-1注射液 | |
| Čaušević et al. | Enzymatic activities in honey | |
| Nakajima et al. | Unique metal dependency of cytosolic α-mannosidase from Thermotoga maritima, a hyperthermophilic bacterium | |
| JP2004000159A (ja) | シイタケラッカーゼの調製法とフェノール性環境汚染物質の分解法 | |
| JP6455714B2 (ja) | フラビン結合型グルコース脱水素酵素 | |
| CN109576255B (zh) | 一种酶的防腐剂及其使用方法 | |
| Al-Bar | Characterization of partially purified catalase from camel (Camelus dromedarius) liver | |
| JP2020501525A (ja) | グルタチオンレダクターゼ | |
| JPH0276579A (ja) | 耐塩性カタラーゼ | |
| Tafazoli et al. | Safety evaluation of amylomaltase from Thermus aquaticus | |
| Al-Baarri et al. | Lactoperoxidase immobilized onto various beads for producing natural preservatives solution | |
| RU2748307C1 (ru) | Способ получения питательного субстрата для выращивания сибиреязвенного микроба | |
| Simpson | Isolation, purification and characterization of a novel glucose oxidase from Penicillium canescens Tt42 | |
| JP2011160758A (ja) | 酵素安定化剤 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20120312 |
|
| NF4A | Reinstatement of patent |
Effective date: 20130827 |
|
| PC41 | Official registration of the transfer of exclusive right |
Effective date: 20140314 |
|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20170312 |