RU2301263C2 - Способ выявления парвовируса b19 человека в биологическом образце (варианты) и набор для его осуществления - Google Patents
Способ выявления парвовируса b19 человека в биологическом образце (варианты) и набор для его осуществления Download PDFInfo
- Publication number
- RU2301263C2 RU2301263C2 RU2004102205/13A RU2004102205A RU2301263C2 RU 2301263 C2 RU2301263 C2 RU 2301263C2 RU 2004102205/13 A RU2004102205/13 A RU 2004102205/13A RU 2004102205 A RU2004102205 A RU 2004102205A RU 2301263 C2 RU2301263 C2 RU 2301263C2
- Authority
- RU
- Russia
- Prior art keywords
- seq
- sequence
- oligonucleotide
- parvovirus
- dna
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
- C12N15/1131—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing against viruses
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6813—Hybridisation assays
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6888—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for detection or identification of organisms
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/70—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving virus or bacteriophage
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/70—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving virus or bacteriophage
- C12Q1/701—Specific hybridization probes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/112—Disease subtyping, staging or classification
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/166—Oligonucleotides used as internal standards, controls or normalisation probes
Landscapes
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Immunology (AREA)
- Genetics & Genomics (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Molecular Biology (AREA)
- General Engineering & Computer Science (AREA)
- Biotechnology (AREA)
- General Health & Medical Sciences (AREA)
- Analytical Chemistry (AREA)
- Biochemistry (AREA)
- Microbiology (AREA)
- Biophysics (AREA)
- Physics & Mathematics (AREA)
- Virology (AREA)
- Biomedical Technology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Communicable Diseases (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Medicinal Chemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Oncology (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Plant Pathology (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Ultra Sonic Daignosis Equipment (AREA)
- Peptides Or Proteins (AREA)
- Investigating Or Analysing Materials By The Use Of Chemical Reactions (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
Abstract
Изобретение относится к области биотехнологии. Предложен способ выявления парвовируса В19 человека. Способ предусматривает выделение нуклеиновых кислот и амплификацию выделенных аминокислот с использованием смыслового и антисмыслового праймера. При этом выделение нуклеиновых кислот проводят путем взаимодействия биологического образца с твердой подложкой, включающей связанные с ней захваченные парвовирус-специфичные нуклеиновые кислоты. В качестве смысловых праймеров используют праймеры SEQ ID NO:60 и 88, а в качестве антисмысловых праймеров SEQ ID NO:59 и 89. Предложен также набор для осуществления такого способа. Изобретение позволяет выявлять парвовирус В19 человека в биологическом образце. Изобретение может быть использовано в медицине и вирусологии. 3 н. и 23 з.п. ф-лы, 12 ил., 1 табл.
Description
Область техники
Настоящее изобретение относится, главным образом, к диагностике вирусов. В частности, изобретение относится к анализам на основе нуклеиновой кислоты для точной диагностики инфекции, вызванной парвовирусом В19, а также к праймерам и зондам для применения в указанных анализах.
Предпосылки к созданию изобретения
Парвовирус В19 человека является членом семейства Parvoviridae, рода Erythrovirus и представляет собой маленький 22 нм двадцатигранный безоболочечный вирус с линейной одноцепочечной молекулой ДНК, состоящей приблизительно из 5600 нуклеотидов. Вирусный геном кодирует три главных белка, VP1, VP2 и NS1. См. Shade et al., J. Virol. (1986) 58:921-936 и фиг.1 в настоящей заявке. VP1 (83 кДа) и VP2 (58 кДа) представляют собой структурные капсидные белки. Указанные два белка кодируются в перекрывающихся рамках считывания приблизительно от нуклеотидов 2444 до 4789 и от 3125 до 4789, соответственно. VP2 составляет 95% капсида, а белок больших размеров VP1 - только 5% капсида. VP1 требуется для зрелой конформации вируса. NS1 (77 кДа) представляет собой неструктурный белок и присутствует только в ядерной фракции инфицированных клеток и отсутствует в цитоплазме и интактных вирионах в сыворотке крови.
Парвовирус В19 был первым вирусом, открытым в сыворотке здоровых доноров крови, и является единственным членом семейства Parvoviridae, известным как патогенный для человека. Данный вирус связан с обширным рядом болезненных проявлений. Парвовирус В19 человека обычно вызывает бессимптомную или умеренную самоограничивающуюся инфекцию у детей. У взрослых парвовирус В19 может вызывать сыпь, преходящую симметричную полиартралгию и артрит. Парвовирус В19 связан с преходящим апластическим кризисом (ТАС) у пациентов с имеющимися гемолитическими нарушениями. Сообщается о хронической инфекции В19 и персистирующей анемии у иммуноскомпрометированных пациентов с острым лейкозом, врожденными иммунодефицитами, СПИДом и состояниями после пересадки костного мозга. Парвовирус В19 также связан с внутриутробной гибелью плода у беременных женщин.
В большинстве стран инфицирование вирусом В19 обычно наблюдается в детстве; приблизительно 50% детей к 15-летнему возрасту имеют анти-В19 антитела. Распространенность антител против В19 может в дальнейшем возрастать в течение жизни и достигает величин более 90% среди лиц старшего возраста.
При инфицировании парвовирусом В19 человека первоначальная репликация вируса, как полагают, происходит в дыхательных путях. Затем вирус поражает клетки костного мозга. Это приводит к широкомасштабной репликации вируса с виремией, по сообщениям, от 102 до 1014 частиц/мл, наблюдающейся через 7-10 дней после инфицирования, но до появления симптомов. Исчезновение виремии совпадает с выявлением специфичных IgM антител, уровень которых остается повышенным в течение двух - трех месяцев. Анти-В19 IgG антитела выявляются спустя несколько дней после появления антител IgM и сохраняются в течение всей жизни.
Отсутствие липидной оболочки и ограниченное содержание ДНК делают парвовирус В19 крайне резистентным к физико-химической инактивации. Парвовирус В19, особенно в высокой концентрации, может выдерживать обычную тепловую обработку продуктов крови, и документально подтверждена передача В19 через введение препаратов фактора VIII, прошедшего обработку растворителем и детергентом, и факторов VIII и IX, прошедших тепловую паровую или сухую обработку.
Парвовирус В19 человека нельзя выращивать в обычных клеточных культурах, что делает лабораторное выявление и выделение вируса крайне трудным. Так, в течение многих лет единственным источником антигена являлась сыворотка крови пациентов с виремией. В качестве попытки обойти указанные проблемы для использования в серологических анализах были получены рекомбинантные антигены. См., например, Sisk и Berman, Biotechnology (1987) 5:1077-1080; патент США № 6204044. Иммуноферментные анализы с захватом IgM использовались для выявления анти-В19 IgM, а также для диагностики недавнего заражения В19. Диагностическая эффективность ряда имеющихся в продаже тестов, однако, неоднородна. Кроме того, диагностические тесты на основе IgM не могут обнаружить вирус на виремической стадии инфицирования, а после того, как антитела IgM синтезированы, они могут оставаться в кровотоке в течение нескольких месяцев после окончания виремии.
Большая распространенность антител против В19 в здоровой популяции, а также тот факт, что виремия высокой степени обычно сохраняется в течение только одной недели, делают использование тестов на серологической основе непрактичными. Помимо этого, у иммуноскомпрометированных пациентов серологический диагноз может быть ненадежным.
Для обнаружения В19 используются анализы на основе гибридизации нуклеиновой кислоты, такие как дот-блоттинг и гибридизация in situ. Указанные анализы обычно имеют пределы обнаружения от 1 до 0,1 пг вирусной ДНК (~104-105 вирусных частиц). ПЦР имеет более высокую чувствительность (~100 геномных копий). Однако методики гибридизации ДНК занимают много времени и ограничены в применении, а ПЦР является непрактичной для скрининга больших количеств образцов.
Следовательно, остается потребность в разработке надежных диагностических тестов для обнаружения парвовируса В19 в виремических образцах с целью предотвращения передачи вируса с препаратами крови и плазмы или путем близкого личного контакта.
Краткое описание существа изобретения
Настоящее изобретение основано на открытии уникальных праймеров и зондов для применения в анализах на основе нуклеиновой кислоты, а также на разработке чувствительного надежного диагностического теста на основе нуклеиновой кислоты для обнаружения парвовируса В19 в биологических образцах от потенциально инфицированных лиц. В методике, описанной в настоящей заявке, используется экстрагированная ДНК-образец в качестве матрицы для амплификации консервативных областей последовательности генома В19, с использованием опосредованной транскрипцией амплификации (ТМА), как в анализе с 5'-нуклеазой, таком как методика TaqManTM. Данные способы позволяют обнаруживать ДНК В19 в виремических образцах, имеющих такие низкие вирусные титры как 103 вирусных частиц/мл. Соответственно, инфицированные образцы можно идентифицировать и исключить из трансфузии, а также не использовать их для изготовления препаратов крови. Зонды и праймеры, описанные в настоящем изобретении, также пригодны, например, для стандартных гидридизационных методов, а также для методик на основе ПЦР, амплификации на основе последовательности нуклеиновой кислоты (NASBA) и анализов, в которых используются разветвленные молекулы ДНК.
Соответственно, в одном варианте осуществления настоящее изобретение относится к способу обнаружения инфицирования парвовирусом В19 человека в биологическом образце. Способ включает:
(а) выделение нуклеиновой кислоты из биологического образца, предположительно содержащего ДНК парвовируса В19 человека, причем нуклеиновая кислота включает последовательность-мишень РНК;
(b) взаимодействие выделенной нуклеиновой кислоты парвовируса В19 с первым олигонуклеотидом, который включает первый праймер, включающий способную образовывать комплекс последовательность, достаточно комплементарную 3'-концевой части последовательности-мишени РНК для образования с ней комплекса, причем первый праймер дополнительно включает промотор для ДНК-зависимой РНК-полимеразы 5' и функционально связан со способной образовывать комплекс последовательностью, причем взаимодействие происходит в таких условиях, которые обеспечивают образование комплекса олигонуклеотид/последовательность-мишень и инициацию синтеза ДНК;
(с) изменение первого праймера в реакции изменения с использованием последовательности-мишени РНК в качестве матрицы, с получением первого продукта удлинения ДНК-праймера, комплементарного последовательности-мишени РНК;
(d) отделение первого продукта удлинения ДНК-праймера от последовательности-мишени РНК с использованием фермента, который избирательно расщепляет последовательность-мишень РНК;
(е) обработку продукта удлинения ДНК-праймера вторым олигонуклеотидом, который включает второй праймер, включающий способную образовывать комплекс последовательность, достаточно комплементарную 3'-концевой части продукта удлинения ДНК-праймера, чтобы образовывать с ней комплекс, в таких условиях, которые обеспечивают образование комплекса олигонуклеотид/последовательность-мишень и инициацию синтеза ДНК;
(f) удлинение 3'-конца второго праймера в реакции удлинения ДНК с получением второго продукта удлинения ДНК-праймера, в результате чего получают матрицу для ДНК-зависимой РНК-полимеразы;
(g) использование матрицы для получения множества РНК-копий последовательности-мишени с использованием ДНК-зависимой РНК-полимеразы, которая распознает последовательность промотора;
и (h) использование РНК-копий со стадии (g) для аутокаталитического повторения стадий с (b) по (g) для амплификации последовательности-мишени.
В некоторых вариантах осуществления настоящего изобретения способ дополнительно включает стадии:
(i) добавление меченого олигонуклеотидного зонда к продукту стадии (h), причем олигонуклеотидный зонд является комплементарным части последовательности-мишени, в таких условиях, которые обеспечивают гибридизацию зонда с последовательностью-мишенью, с образованием комплекса зонд:мишень; и
(j) выявление наличия или отсутствия метки как показателя наличия или отсутствия последовательности-мишени.
В дополнительных вариантах осуществления настоящего изобретения метка представляет собой сложный эфир акридиния.
В еще одних вариантах осуществления настоящего изобретения первый и второй праймеры и зонд, используемые в описанных выше способах, получают из VP1 области генома парвовируса В19 человека, такого как из полинуклеотидной последовательности, изображенной на любой из фиг.2А-2U или 11А-11Z.
В другом варианте осуществления настоящее изобретение относится к способу обнаружения инфицирования парвовирусом В19 человека в биологическом образце. Способ включает:
(а) выделение нуклеиновой кислоты из биологического образца, предположительно содержащего ДНК парвовируса В19 человека, причем нуклеиновая кислота включает последовательность-мишень РНК;
(b) взаимодействие выделенной нуклеиновой кислоты парвовируса В19 с первым олигонуклеотидом, который включает первый праймер, включающий способную образовывать комплекс последовательность, достаточно комплементарную 3'-концевой части последовательности-мишени РНК, чтобы образовывать с ней комплекс, причем первый праймер дополнительно включает промотор для ДНК-зависимой РНК-полимеразы 5' и функционально связан со способной образовывать комплекс последовательностью, причем первый праймер включает последовательность, полученную из полинуклеотидной последовательности, изображенной на любой из фиг.2А-2U или фиг.11А-11Z, а взаимодействие осуществляют в таких условиях, которые обеспечивают образование комплекса олигонуклеотид/последовательность-мишень и инициацию синтеза ДНК;
(с) удлинение первого праймера в реакции удлинения с использованием последовательности-мишени РНК в качестве матрицы, с получением первого продукта удлинения ДНК-праймера, комплементарного последовательности-мишени РНК;
(d) отделение первого продукта удлинения ДНК-праймера от последовательности-мишени РНК с использованием фермента, который избирательно расщепляет последовательность-мишень РНК;
(е) обработку продукта удлинения ДНК-праймера вторым олигонуклеотидом, который включает второй праймер, включающий способную образовывать комплекс последовательность, достаточно комплементарную 3'-концевой части продукта удлинения ДНК-праймера, чтобы образовывать с ней комплекс, причем второй праймер получают из полинуклеотидной последовательности, изображенной на любой из фиг.2А-2U или фиг.11А-11Z, а обработку осуществляют в таких условиях, которые обеспечивают образование комплекса олигонуклеотид/последовательность-мишень и инициацию синтеза ДНК;
(f) удлинение 3'-конца второго праймера в реакции удлинения ДНК, с получением второго продукта удлинения ДНК-праймера, в результате чего получают матрицу для ДНК-зависимой РНК-полимеразы;
(g) использование матрицы для получения множества РНК-копий последовательности-мишени с использованием ДНК-зависимой РНК-полимеразы, которая распознает последовательность промотора;
и (h) использование РНК-копий со стадии (g) для аутокаталитического повторения стадий с (b) по (g) для амплификации последовательности-мишени;
(i) добавление меченного сложным эфиром акридиния олигонуклеотидного зонда к продукту стадии (h), причем олигонуклеотидный зонд является комплементарным части указанной последовательности-мишени, и зонд получают из полинуклеотидной последовательности, изображенной на любой из фиг.2А-2U, причем зонд добавляют в таких условиях, которые обеспечивают гибридизацию зонда с последовательностью-мишенью, с образованием комплекса зонд:мишень; и
(j) выявление наличия или отсутствия метки как показателя наличия или отсутствия последовательности-мишени.
В еще одном варианте осуществления настоящее изобретение относится к способу амплификации нуклеотидной последовательности-мишени парвовируса В19. Способ включает:
(а) выделение нуклеиновой кислоты из биологического образца, предположительно содержащего ДНК парвовируса В19 человека, причем нуклеиновая кислота включает последовательность-мишень РНК;
(b) добавление одного или более праймеров, способных к гибридизации с последовательностью-мишенью РНК, причем один или более праймеров получают из полинуклеотидных последовательностей, изображенных на любой из фиг.2А-2U и фиг.11А-11Z;
(с) добавление олигонуклеотидного зонда, способного к гибридизации с последовательностью-мишенью РНК 3', сходной с одним или более праймерами;
(d) удлинение одного или более праймеров с использованием полимеразы.
В некоторых вариантах осуществления настоящего изобретения последовательность-мишень РНК стадии (а) подвергают обратной транскрипции для получения кДНК, и способ может дополнительно включать амплификацию кДНК с использованием полимеразной цепной реакции (ОТ-ПЦР) или асимметричной гэп-лигазной цепной реакции (RT-AGLCR). В других вариантах осуществления настоящего изобретения полимераза представляет собой термостабильную полимеразу, такую, без ограничения, как Taq-полимераза или Vent-полимераза. В дополнительных вариантах осуществления настоящего изобретения полимераза представляет собой ДНК-полимеразу I E.coli, фрагмент Klenow ДНК-полимеразы I E.coli или ДНК-полимеразу Т4.
В некоторых вариантах осуществления различных способов, описанных выше, обеспечивается внутренний контроль. Внутренний контроль может осуществляться с помощью последовательности, изображенной на фиг.12 (SEQ ID NO:92). В дополнительных вариантах осуществления настоящего изобретения внутренний контроль включает SEQ ID NO:90.
В дополнительных вариантах осуществления настоящее изобретение относится к способу обнаружения инфицирования парвовирусом В19 человека в биологическом образце. Способ включает:
(а) выделение нуклеиновой кислоты из биологического образца, предположительно содержащего ДНК парвовируса В19 человека, причем нуклеиновая кислота включает последовательность-мишень;
(b) взаимодействие выделенной нуклеиновой кислоты парвовируса В19 с меченным поддающейся обнаружению меткой зондом, достаточно комплементарным и способным к гибридизации с последовательностью-мишенью, причем зонд получают из полинуклеотидных последовательностей, изображенных на любой из фиг.2А-2U и фиг.11А-11Z, и причем взаимодействие происходит в таких условиях, которые обеспечивают образование комплекса зонд/последовательность-мишень; и
(с) выявление наличия или отсутствия метки как показателя наличия или отсутствия последовательности-мишени.
В других вариантах осуществления настоящее изобретение относится к полинуклеотиду, включающему нуклеотидную последовательность, включающую любую из нуклеотидных последовательностей, изображенных на фиг.2А-2U или фиг.11А-11Z.
В дополнительных вариантах осуществления настоящее изобретение относится к полинуклеотиду, как описано выше, в котором нуклеотидная последовательность состоит из нуклеотидной последовательности, изображенной на фиг.2A, 2B, 2C, 2D, 2E, 2F, 2G, 2H, 2I, 2J, 2K, 2L, 2M, 2N, 2O, 2P, 2Q, 2R, 2S, 2T, 2U, 11A, 11B, 11C, 11D, 11E, 11F, 11G, 11H, 11I, 11J, 11K, 11L, 11M, 11N, 11O, 11P, 11Q, 11R, 11S, 11T, 11U, 11V, 11W, 11X, 11Y или 11Z.
В еще одних вариантах осуществления настоящее изобретение относится к полинуклеотиду, включающему нуклеотидную последовательность, включающую любую из нуклеотидных последовательностей, изображенных на фиг.3А-3С или 4А-4С.
В дополнительных вариантах осуществления настоящее изобретение относится к полинуклеотиду, как описано выше, в котором нуклеотидная последовательность состоит из нуклеотидной последовательности, изображенной на фиг.3А-3С или на фиг.4А-4С.
В другом варианте осуществления настоящее изобретение относится к олигонуклеотидному праймеру, состоящему из промоторной области, распознаваемой ДНК-зависимой РНК-полимеразой, функционально связанной со специфичной для парвовируса В19 человека способной образовывать комплекс последовательностью приблизительно из 10-75 нуклеотидов. В некоторых вариантах осуществления настоящего изобретения промоторная область представляет собой промотор Т7, а указанная полимераза представляет собой РНК-полимеразу Т7. Помимо этого, специфичная для парвовируса В19 человека последовательность может состоять из VP1 области генома парвовируса В19 человека, такая как из полинуклеотидной последовательности, изображенной на любой из фиг.2А-2U или фиг.11А-11Z.
В еще одних вариантах осуществления настоящее изобретение относится к олигонуклеотидному праймеру, состоящему из промотора Т7, функционально связанному со специфичной для парвовируса В19 человека способной образовывать комплекс последовательностью приблизительно из 10-75 нуклеотидов, причем специфичную для парвовируса В19 человека способную образовывать комплекс последовательность получают из полинуклеотидной последовательности, изображенной на любой из фиг.2А-2U или 11А-11Z.
В другом варианте осуществления настоящее изобретение относится к олигонуклеотидному зонду, включающему специфичную для парвовируса В19 гибридизующуюся последовательность приблизительно из 10-50 нуклеотидов, связанную с меткой, представляющей собой сложный эфир акридиния. В некоторых вариантах осуществления настоящего изобретения специфичную для парвовируса В19 человека гибридизующуюся последовательность получают из VP1 области генома парвовируса В19 человека, такого как из полинуклеотидной последовательности, изображенной на любой из фиг.2А-2U или фиг.11А-11Z.
В еще одном дополнительном варианте осуществления настоящее изобретение относится к набору для диагностического исследования, включающему один или более олигонуклеотидных праймеров, описанных в настоящей заявке, и инструкции по проведению диагностического исследования. В некоторых вариантах осуществления настоящего изобретения набор для исследования дополнительно включает олигонуклеотидный зонд, включающий специфичную для парвовируса В19 гибридизующуюся последовательность приблизительно из 10-50 нуклеотидов, связанную с меткой, представляющей собой сложный эфир акридиния.
Указанные и другие аспекты настоящего изобретения будут очевидны для специалиста в данной области благодаря следующему подробному описанию и прилагаемым рисункам.
Краткое описание фигур
Фиг.1 представляет собой схему генома парвовируса В19 человека, изображающую различные кодирующие области вируса. Изображены три ПЦР фрагмента, один приблизительно из 700 п.н., соответствующих нуклеотидным положениям 2936-3635 генома парвовируса В19, описанным в Shade et al., J. Virol. (1986) 58:921-936; один приблизительно из 370 п.н. в пределах фрагмента из 700 п.н., соответствующих нуклеотидным положениям 3073-3442 генома парвовируса В19, описанным в Shade et al., J. Virol. (1986) 58:921-936; и один приблизительно из 214 п.н., соответствующих нуклеотидным положениям 4728-4941 генома парвовируса В19, описанным в Shade et al., J. Virol. (1986) 58:921-936.
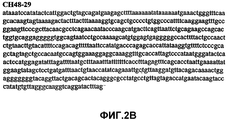
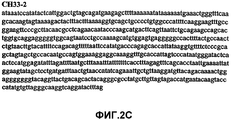
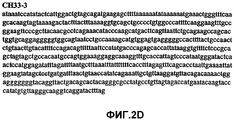
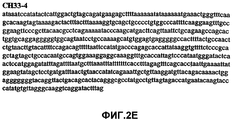
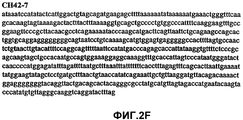
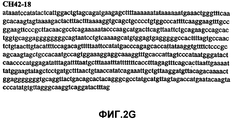
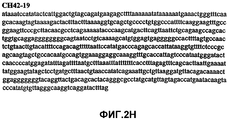
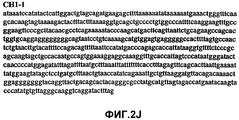
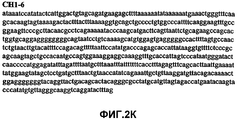
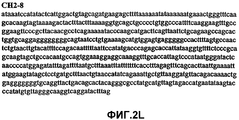
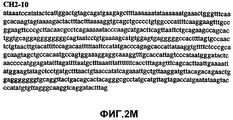
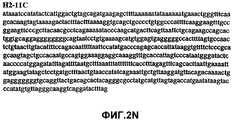
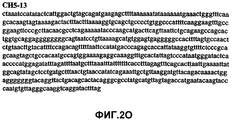
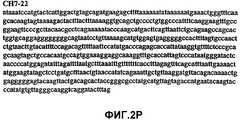
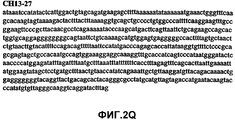
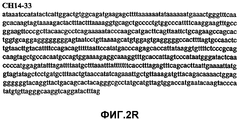
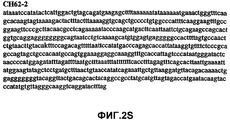
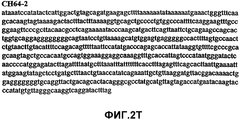
Фиг.2А-2U (SEQ ID NO:1-21) изображают последовательности ДНК из различных изолятов парвовируса В19 человека, которые включают последовательности, соответствующие нуклеотидным положениям 2936-3635 генома парвовируса В19, описанным в Shade et al., J. Virol. (1986) 58:921-936 (фрагмент из 700 п.н., изображенный на фиг.1). Фиг.2А (SEQ ID NO:1) представляет собой соответствующую последовательность из изолята СН47-26; фиг.2В (SEQ ID NO:2) представляет собой соответствующую последовательность из изолята СН48-29; фиг.2С (SEQ ID NO:3) представляет собой соответствующую последовательность из изолята СН33-2; фиг.2D (SEQ ID NO:4) представляет собой соответствующую последовательность из изолята СН33-3; фиг.2Е (SEQ ID NO:5) представляет собой соответствующую последовательность из изолята СН33-4; фиг.2F (SEQ ID NO:6) представляет собой соответствующую последовательность из изолята СН42-7; фиг.2G (SEQ ID NO:7) представляет собой соответствующую последовательность из изолята СН42-18; фиг.2H (SEQ ID NO:8) представляет собой соответствующую последовательность из изолята СН42-19; фиг.2I (SEQ ID NO:9) представляет собой соответствующую последовательность из изолята СН46-23; фиг.2J (SEQ ID NO:10) представляет собой соответствующую последовательность из изолята СН1-1; фиг.2K (SEQ ID NO:11) представляет собой соответствующую последовательность из изолята СН1-6; фиг.2L (SEQ ID NO:12) представляет собой соответствующую последовательность из изолята СН2-8; фиг.2M (SEQ ID NO:13) представляет собой соответствующую последовательность из изолята СН2-10; фиг.2N (SEQ ID NO:14) представляет собой соответствующую последовательность из изолята СН2-11C; фиг.2O (SEQ ID NO:15) представляет собой соответствующую последовательность из изолята СН5-13; фиг.2P (SEQ ID NO:16) представляет собой соответствующую последовательность из изолята СН7-22; фиг.2Q (SEQ ID NO:17) представляет собой соответствующую последовательность из изолята СН13-27; фиг.2R (SEQ ID NO:18) представляет собой соответствующую последовательность из изолята СН14-33; фиг.2S (SEQ ID NO:19) представляет собой соответствующую последовательность из изолята СН62-2; фиг.2T (SEQ ID NO:20) представляет собой соответствующую последовательность из изолята СН64-2; и фиг.2U (SEQ ID NO:21) представляет собой соответствующую последовательность из изолята СН67-2.
Фиг.3А-3С (SEQ ID NO:22) показывают последовательность ПЦР-фрагмента приблизительно из 4,7 т.п.н., показанного на фиг.1, из клона 2-В1 парвовируса В19. Последовательность представляет собой фрагмент из 4677 нуклеотидов, соответствующий нуклеотидным положениям 217-4893, описанным в Shade et al., J. Virol. (1986) 58:921-936. Изображенная последовательность содержит полную открытую рамку считывания парвовируса В19, которая кодирует NS1, VP1 и VP2, плюс дополнительные нетранслируемые последовательности 5' и 3'.
Фиг.4А-4С (SEQ ID NO:23) показывают последовательность ПЦР-фрагмента приблизительно из 4,7 т.п.н., показанного на фиг.1, из клона 2-В6 парвовируса В19. Последовательность представляет собой фрагмент из 4677 нуклеотидов, соответствующий нуклеотидным положениям 217-4893, описанным в Shade et al., J. Virol. (1986) 58:921-936. Изображенная последовательность содержит полную открытую рамку считывания парвовируса В19, которая кодирует NS1, VP1 и VP2, плюс дополнительные нетранслируемые последовательности 5' и 3'.
Фиг.5А (SEQ ID NO:24) и 5В (SEQ ID NO:25) показывают нуклеотидную и белковую последовательности NS1, соответственно, из клона 2-В1 парвовируса В19.
Фиг.6А (SEQ ID NO:26) и 6В (SEQ ID NO:27) показывают нуклеотидную и белковую последовательности VP1, соответственно, из клона 2-В1 парвовируса В19.
Фиг.7А (SEQ ID NO:28) и 7В (SEQ ID NO:29) показывают нуклеотидную и белковую последовательности VP2, соответственно, из клона 2-В1 парвовируса В19.
Фиг.8А (SEQ ID NO:30) и 8В (SEQ ID NO:31) показывают нуклеотидную и белковую последовательности NS1, соответственно, из клона 2-В6 парвовируса В19.
Фиг.9А (SEQ ID NO:32) и 9В (SEQ ID NO:33) показывают нуклеотидную и белковую последовательности VP1, соответственно, из клона 2-В6 парвовируса В19.
Фиг.10А (SEQ ID NO:34) и 10В (SEQ ID NO:35) показывают нуклеотидную и белковую последовательности VP2, соответственно, из клона 2-В6 парвовируса В19.
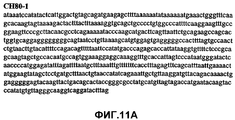
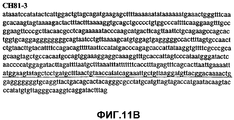
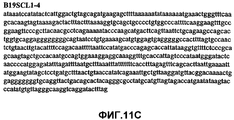
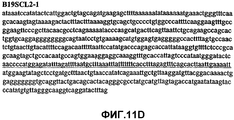
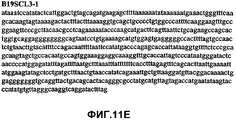
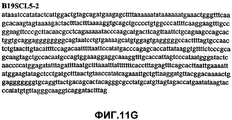
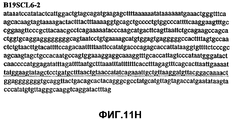
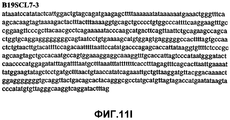
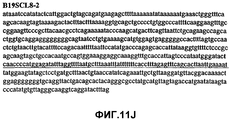
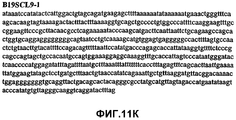
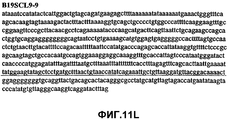
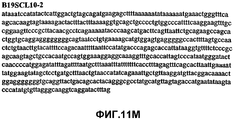
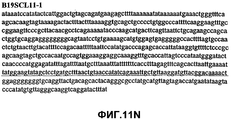
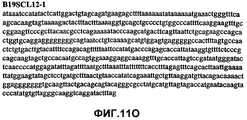
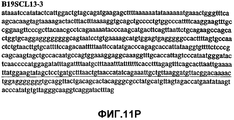
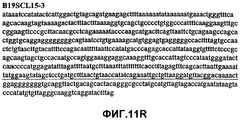
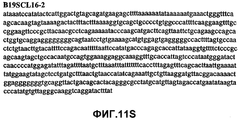
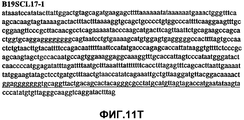
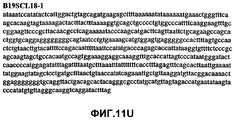
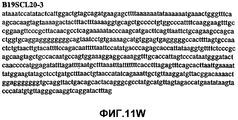
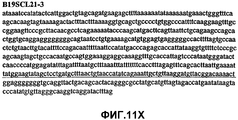
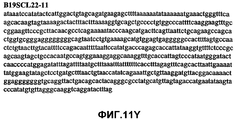
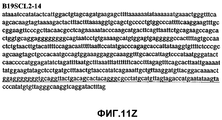
Фиг.11А-11Z (SEQ ID NO:62-87) изображают последовательности ДНК из различных изолятов парвовируса В19, которые включают последовательности, соответствующие нуклеотидным положениям 2936-3635 генома парвовируса В19, описанным в Shade et al., J. Virol. (1986) 58:921-936 (фрагмент из 700 п.н., изображенный на фиг.1). Фиг.11А (SEQ ID NO:62) представляет собой соответствующую последовательность из изолята СН80-1; фиг.11B (SEQ ID NO:63) представляет собой соответствующую последовательность из изолята СН81-3; фиг.11C (SEQ ID NO:64) представляет собой соответствующую последовательность из изолята B19SCL1-4; фиг.11D (SEQ ID NO:65) представляет собой соответствующую последовательность из изолята B19SCL2-1; фиг.11E (SEQ ID NO:66) представляет собой соответствующую последовательность из изолята B19SCL3-1; фиг.11F (SEQ ID NO:67) представляет собой соответствующую последовательность из изолята B19SCL4-3; фиг.11G (SEQ ID NO:68) представляет собой соответствующую последовательность из изолята B19SCL5-2; фиг.11H (SEQ ID NO:69) представляет собой соответствующую последовательность из изолята B19SCL6-2; фиг.11I (SEQ ID NO:70) представляет собой соответствующую последовательность из изолята B19SCL7-3; фиг.11J (SEQ ID NO:71) представляет собой соответствующую последовательность из изолята B19SCL8-2; фиг.11K (SEQ ID NO:72) представляет собой соответствующую последовательность из изолята B19SCL9-1; фиг.11L (SEQ ID NO:73) представляет собой соответствующую последовательность из изолята B19SCL9-9; фиг.11M (SEQ ID NO:74) представляет собой соответствующую последовательность из изолята B19SCL10-2; фиг.11N (SEQ ID NO:75) представляет собой соответствующую последовательность из изолята B19SCL11-1; фиг.11O (SEQ ID NO:76) представляет собой соответствующую последовательность из изолята B19SCL12-1; фиг.11P (SEQ ID NO:77) представляет собой соответствующую последовательность из изолята B19SCL13-3; фиг.11Q (SEQ ID NO:78) представляет собой соответствующую последовательность из изолята B19SCL14-1; фиг.11R (SEQ ID NO:79) представляет собой соответствующую последовательность из изолята B19SCL15-3; фиг.11S (SEQ ID NO:80) представляет собой соответствующую последовательность из изолята B19SCL16-2; фиг.11T (SEQ ID NO:81) представляет собой соответствующую последовательность из изолята B19SCL17-1; фиг.11U (SEQ ID NO:82) представляет собой соответствующую последовательность из изолята B19SCL18-1; фиг.11V (SEQ ID NO:83) представляет собой соответствующую последовательность из изолята B19SCL19-1; фиг.11W (SEQ ID NO:84) представляет собой соответствующую последовательность из изолята B19SCL20-3; фиг.11X (SEQ ID NO:85) представляет собой соответствующую последовательность из изолята B19SCL21-3; фиг.11Y (SEQ ID NO:86) представляет собой соответствующую последовательность из изолята B19SCL22-11; фиг.11Z (SEQ ID NO:87) представляет собой соответствующую последовательность из изолята B19SCL2-14.
Фиг.12 (SEQ ID NO:92) изображает пример последовательности, из которой можно получить внутренний контроль (IC) для захвата и амплификации мишени.
Подробное описание изобретения
Для осуществления настоящего изобретения будут использоваться, если не указано иное, обычные методы химии, биохимии, методики рекомбинантной ДНК и вирусологии, известные специалистам в данных областях. Данные методики исчерпывающим образом раскрыты в научной литературе. См., например, Fundamental Virology, 2-е издание, тома I и II (B.N. Fields and D.M. Knipe, eds.); A.L. Lehninger, Biochemistry (Worth Publishers, Inc., последнее дополнение); Sambrook, et al., Molecular Cloning: A Laboratory Manual (2-е издание, 1989); Methods In Enzymology (S. Colowick and N. Kaplan eds., Academic Press, Inc.); Oligonucleotide Synthesis (N. Gait, ed., 1984); A Practical Guide to Molecular Cloning (1984).
Следует отметить, что в данном описании и прилагаемой формуле изобретения единственные формы существительных включают в себя и упомянутые значения во множественном числе, если в контексте ясно не указано иное. Так, например, ссылка на "антиген" включает в себя смесь двух или более антигенов и т.п. В тексте используются следующие аббревиатуры для аминокислот:
| Аланин: Ala (A) | Аргинин: Arg (R) |
| Аспарагин: Asn (N) | Аспарагиновая кислота: Asp (D) |
| Цистеин: Cys (C) | Глутамин: Gln (Q) |
| Глутаминовая кислота: Glu (E) | Глицин: Gly (G) |
| Гистидин: His (H) | Изолейцин: Ile (I) |
| Лейцин: Leu (L) | Лизин: Lys (K) |
| Метионин: Met (M) | Фенилаланин: Phe (F) |
| Пролин: Pro (P) | Серин: Ser (S) |
| Треонин: Thr (T) | Триптофан: Trp (W) |
| Тирозин: Tyr (Y) | Валин: Val (V) |
I. Определения
При описании настоящего изобретения будут использоваться следующие термины, которые имеют определения, указанные ниже.
Термины "полипептид" и "белок" относятся к полимеру, состоящему из аминокислотных остатков, и не ограничиваются минимальной длиной продукта. Так, пептиды, олигопептиды, димеры, мультимеры и т.п. включены в данное определение. Данное определение охватывает также полноразмерные белки и их фрагменты. Данные термины также включают постэкспрессионные модификации полипептида, например, гликозилирование, ацетилирование, фосфорилирование и т.п. Кроме того, для целей настоящего изобретения "полипептид" относится к белку, который включает модификации, такие как делеции, добавления и замещения (обычно консервативные по природе), нативной последовательности, при условии, что белок сохраняет желательную активность. Данные модификации могут быть преднамеренными, например, посредством сайт-направленного мутагенеза, или могут быть случайными, например, посредством мутаций хозяев, которые продуцируют белки, или посредством ошибок при ПЦР-амплификации.
Полипептид парвовируса В19 представляет собой полипептид, как определено выше, полученный из белка, кодируемого геномом В19, такой как полипептид из неструктурных белков, NS1 и NS2, а также из белков, которые образуют капсид вируса, VP1 (длиной около 781 аминокислоты) или VP2 (длиной около 554 аминокислот). Характерные последовательности NS1, VP1 и VP2 изображены на фиг.5-10 в настоящей заявке. Полипептид необязательно должен быть физически получен из парвовируса В19, а может быть получен синтетическим или рекомбинантным путем. Более того, полипептид может быть получен из любого из различных штаммов и изолятов парвовируса В19. Среди данных штаммов и изолятов известен ряд консервативных и вариабельных областей, и, в общем, аминокислотные последовательности, например, эпитопов, полученных из указанных областей, будут иметь высокую степень гомологии последовательности, например, гомологию аминокислотной последовательности более 30%, предпочтительно, более 40%, при сопоставлении двух последовательностей. Так, например, термин "VP1" полипептид относится к нативному VP1 из любого из различных штаммов и изолятов парвовируса В19. Полные генотипы и последовательности для упомянутых выше белков многих штаммов и изолятов парвовируса В19 известны. См., например, Shade et al., J. Virol. (1986) 58:921-936; Gallinella et al., J. Virol. Methods (1993) 41:203-211. Более того, эпитопы из парвовируса В19, полученные из указанных областей, также известны. См., например, патент США № 5436127 и международную публикацию № WO 91/12269.
Термины "аналог" и "мутеин" относятся к биологически активным производным ссылочной молекулы или к фрагментам указанных производных, которые сохраняют желательную активность, такую как иммунологическая реактивность в диагностических анализах. В общем, термин "аналог" относится к соединениям, имеющим последовательность и структуру нативного полипептида с одним или более добавлений, замещений (обычно консервативных по природе) и/или делеций аминокислот, по сравнению с нативной молекулой, при условии, что модификации не уничтожают иммуногенную активность. Термин "мутеин" относится к пептидам, имеющим один или более пептидомиметиков ("пептоидов"), например, которые описаны в международной публикации № WO 91/04282. Предпочтительно, аналог или мутеин имеет по меньшей мере такую же иммунологическую активность, как у нативной молекулы. Способы получения полипептидных аналогов и мутеинов известны специалистам в данной области и дополнительно описаны ниже.
Особенно предпочтительные аналоги включают замещения, которые являются консервативными по природе, т.е. такие замещения, которые имеют место в пределах семейства аминокислот, имеющих родственные боковые цепи. Конкретно, аминокислоты обычно разделяют на четыре семейства: (1) кислые - аспартат и глутамат; (2) основные - лизин, аргинин, гистидин; (3) неполярные - аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан; и (4) не имеющие заряда полярные - глицин, аспарагин, глутамин, цистеин, серин, треонин, тирозин. Фенилаланин, триптофан и тирозин иногда классифицируют как ароматические аминокислоты. Например, можно с полным основанием предсказать, что изолированная замена лейцина на изолейцин или валин, аспартат на глутамат, треонин на серин или сходная консервативная замена аминокислоты на структурно родственную аминокислоту, не окажет большого влияния на биологическую активность. Например, полипептид, представляющий интерес, может включать приблизительно до 5-10 консервативных или неконсервативных аминокислотных замещений, или даже приблизительно до 15-25 консервативных или неконсервативных аминокислотных замещений, или любое целое число от 5 до 25, если желательная функция молекулы остается прежней. Специалист может легко определить области молекулы, представляющей интерес, которые могут перенести изменения, в соответствии со схемами Hopp/Woods и Kyte-Doolittle, хорошо известными специалистам в данной области.
Под "выделенным", если речь идет о полипептиде, подразумевают, что указанная молекула находится отдельно от целого организма, в котором молекулу находят в природе, или присутствует в практическом отсутствии других биологических макромолекул того же типа. Под термином "выделенный", если речь идет о полинуклеотиде, подразумевают молекулу нуклеиновой кислоты, лишенную, полностью или частично, последовательностей, обычно связанных с ней в природе; или последовательность, в том виде, в котором она существует в природе, но имеющую связанные с ней гетерологичные последовательности; или молекулу, отделенную от хромосомы.
Полинуклеотид, "полученный из" или "специфичный в отношении" обозначенной последовательности, относится к полинуклеотидной последовательности, которая включает смежную последовательность по меньшей мере приблизительно из 6 нуклеотидов, предпочтительно, по меньшей мере приблизительно из 8 нуклеотидов, более предпочтительно, по меньшей мере приблизительно из 10-12 нуклеотидов, и даже более предпочтительно, по меньшей мере приблизительно из 15-20 нуклеотидов, соответствующую, т.е. идентичную или комплементарную области обозначенной нуклеотидной последовательности. Полученный полинуклеотид не обязательно будет получен физически из нуклеотидной последовательности, представляющей интерес, но может быть получен любым способом, включая, без ограничения, химический синтез, репликацию, обратную транскрипцию или транскрипцию, который основан на информации, обеспеченной последовательностью оснований в области (областях), из которой получен полинуклеотид. В качестве такового он может представлять смысловую или антисмысловую ориентацию исходного полинуклеотида.
"Гомологичность" относится к проценту сходства между двумя полинуклеотидными или двумя полипептидными частями. Две ДНК или две полипептидные последовательности являются "практически гомологичными" друг с другом, когда последовательности имеют по меньшей мере приблизительно 50%, предпочтительно, по меньшей мере приблизительно 75%, более предпочтительно, по меньшей мере приблизительно 80%-85%, предпочтительно, по меньшей мере приблизительно 90%, и, наиболее предпочтительно, по меньшей мере приблизительно 95%-98% сходства последовательности по определенной длине молекул. Используемый в настоящей заявке термин "практически гомологичные" также относится к последовательностям, демонстрирующим полную идентичность конкретной ДНК или полипептидной последовательности.
В общем, "идентичность" относится к точному нуклеотид-нуклеотидному или аминокислота-аминокислотному соответствию двух полинуклеотидных или полипептидных последовательностей, соответственно. Процент идентичности можно определить прямым сравнением информации о последовательности между двумя молекулами путем сопоставления последовательностей, подсчета точного количества совпадений между двумя сопоставленными последовательностями, деления на длину более короткой последовательности и умножения результата на 100.
Для облегчения анализа гомологии и идентичности можно использовать общедоступные компьютерные программы, такие как ALIGN, Dayhoff, M.O., в Atlas of Protein Sequence and Structure M.O. Dayhoff ed., 5 Suppl. 3:353-358, National Biomedical Research Foundation, Washington, DC, которые адаптируют локальный алгоритм гомологичности Смита-Уотермана Advances в Appl. Math. 2:482-489, 1981, для анализа пептидов. Программы для определения гомологии нуклеотидных последовательностей имеются в пакете Wisconsin Sequence Analysis Package, версия 8 (от компании Genetics Computer Group, Madison, WI), например, программы BESTFIT, FASTA И GAP, которые также основаны на алгоритме Смита-Уотермана. Указанные программы легко используются с параметрами по умолчанию, рекомендованными производителем, и описаны в пакете Wisconsin Sequence Analysis Package, упоминавшемся выше. Например, процент гомологии конкретной нуклеотидной последовательности по отношению к ссылочной последовательности можно определить с помощью алгоритма гомологии Смита-Уотермана с таблицей количественных показателей и потери по пробелу в шесть нуклеотидных положений по умолчанию.
Другим способом определения процента гомологии в контексте настоящего изобретения является использование пакета программ MPSRCH, авторское право университета Эдинбурга, разработанного John F. Collins и Shane S. Sturrok и распространяемого компанией IntelliGenetics, Inc. (Mountain View, CA). Из этого комплекта пакетов можно применять алгоритм Смита-Уотермана, где для таблицы количественных показателей используются параметры по умолчанию (например, потери по открытому пробелу 12, потери по протяженности пробела один и пробел шесть). Из полученных данных величина "Match" отражает "гомологию последовательности". Другие подходящие программы для расчета процента идентичности или сходности последовательностей обычно известны специалистам в данной области, например, другой программой для сопоставления является BLAST, которую используют с параметрами по умолчанию. Например, можно использовать BLASTN и BLASTP со следующими параметрами по умолчанию: генетический код = стандарт; фильтр = отсутствует; цепь = обе; отсекающая величина = 60; ожидание = 10; матрикс = BLOSUM62; описания = 50 последовательностей; сортировка посредством = HIGH SCORE; базы данных = не резервируемые, GenBank + EMBL + DDBJ + PDB + GenBank CDS трансляции + швейцарский белок + Spupdate + PIR. Подробности указанных программ можно найти по следующему адресу в интернете: http://www.ncbi.nlm.gov/cgi-bin/BLAST.
Альтернативно, гомологию можно определить путем гибридизации полинуклеотидов в таких условиях, при которых образуются стабильные дуплексы между гомологичными областями, с последующим отщеплением специфичной в отношении одной цепи нуклеазой (нуклеазами) и определением размеров отщепленных фрагментов. Последовательности ДНК, которые являются практически гомологичными, могут быть идентифицированы в эксперименте гибридизации с использованием саузерн-блоттинга, например, при строгих условиях, как определено для данной конкретной системы. Определение адекватных условий гибридизации известно специалистам в данной области. См., например, Sambrook et al., указано выше; DNA Cloning, указано выше; Nucleic Acid Hybridization, указано выше.
"Функционально связанный" относится к такому расположению элементов, при котором описанные таким образом компоненты имеют такую конфигурацию, которая позволяет им осуществлять желательную функцию. Так, данный промотор, функционально связанный с последовательностью нуклеиновой кислоты, способен влиять на транскрипцию, а в случае кодирующей последовательности, на экспрессию кодирующей последовательности, если имеются соответствующие факторы транскрипции и т.п. Промотор необязательно должен быть смежным с последовательностью нуклеиновой кислоты, если он в состоянии осуществлять функцию управления ее транскрипцией и/или экспрессией. Так, например, вставочные нетранслируемые, хотя и транскрибируемые, последовательности могут присутствовать между промоторной последовательностью и кодирующей последовательностью, как это может быть с транскрибируемыми интронами, а промоторная последовательность все равно может считаться "функционально связанной" с кодирующей последовательностью.
"Рекомбинантный", когда используется в настоящей заявке для описания молекулы нуклеиновой кислоты, означает полинуклеотид геномного, кДНК, вирусного, полусинтетического или синтетического происхождения, который, в силу своего происхождения или произведенных с ним манипуляций, не связан со всем полинуклеотидом или с его частью, с которыми он связан в природе. Термин "рекомбинантный", когда он используется в отношении белка или полипептида, означает полипептид, полученный экспрессией рекомбинантного полинуклеотида. В общем, ген, представляющий интерес, клонируют, а затем экспрессируют в трансформированных организмах, как описано далее. Организм-хозяин экспрессирует чужеродный ген для продуцирования белка в условиях, необходимых для экспрессии.
"Контролирующий элемент" относится к полинуклеотидной последовательности, которая способствует транскрипции и/или трансляции нуклеотидной последовательности, с которой она связана. Термин включает промоторы, последовательности терминации транскрипции, "верхние" регуляторные домены, сигналы полиаденилирования, нетранслируемые области, включая 5'-UTR и 3'-UTR, и, когда необходимо, лидерные последовательности и энхансеры, которые все вместе обеспечивают транскрипцию и трансляцию кодирующей последовательности в клетке-хозяине.
"Промотор", когда используется в настоящей заявке, означает регулирующую область, способную связывать полимеразу и инициировать транскрипцию нуклеотидной последовательности по ходу транскрипции (в направлении 3'), функционально связанную с ней. Для целей настоящего изобретения промоторная последовательность включает минимальное количество оснований или элементов, необходимое для инициации транскрипции последовательности, представляющей интерес, на уровнях, поддающихся обнаружению по сравнению с фоном. В пределах промоторной последовательности находится сайт инициации транскрипции, а также протеин-связывающие домены (консунсусные последовательности), ответственные за связывание РНК- или ДНК-полимеразы. Например, промотор может представлять собой последовательность нуклеиновой кислоты, которая распознается ДНК-зависимой РНК-полимеразой ("транскриптазой") в качестве сигнала к связыванию с нуклеиновой кислотой и началу транскрипции РНК на специфичном сайте. Для связывания указанным транскриптазам обычно требуется ДНК, которая имеет двухцепочечную структуру в части, включающей промоторную последовательность, и ее комплемент; матричная часть (последовательность, подлежащая транскрипции) не должна быть обязательно двухцепочечной. Отдельные ДНК-зависимые РНК-полимеразы распознают ряд различных промоторных последовательностей, которые могут значительно отличаться друг от друга по своей эффективности способствовать транскрипции. Когда РНК-полимераза связывается с промоторной последовательностью для инициации транскрипции, то промоторная последовательность не является частью транскрибируемой последовательности. Так, полученные таким образом транскрипты РНК не будут включать данную последовательность.
Контролирующая последовательность "управляет транскрипцией" нуклеотидной последовательности, когда РНК- или ДНК-полимераза свяжется с промоторной последовательностью и будет транскрибировать смежную последовательность.
"ДНК-зависимая ДНК-полимераза" представляет собой фермент, который синтезирует комплементарную ДНК-копию на ДНК-матрице. Примерами являются ДНК-полимераза I из E.coli и ДНК-полимераза бактериофага Т7. Все известные ДНК-зависимые ДНК-полимеразы для инициации синтеза требуют комплементарного праймера. При подходящих условиях ДНК-зависимая ДНК-полимераза может синтезировать комплементарную ДНК-копию на РНК-матрице.
"ДНК-зависимая РНК-полимераза" или "транскриптаза" представляет собой фермент, который синтезирует многочисленные РНК-копии из двухцепочечной или частично двухцепочечной молекуле ДНК, имеющей (обычно двухцепочечную) промоторную последовательность. Молекулы РНК ("транскрипты") синтезируются в направлении от 5' к 3', начиная с конкретного положения, расположенной непосредственно ниже промотора. Примерами транскриптаз являются ДНК-зависимая РНК-полимераза из E.coli и бактериофагов Т7, Т3 и SP6.
"РНК-зависимая ДНК-полимераза" или "обратная транскриптаза" представляет собой фермент, который синтезирует комплементарную ДНК-копию на РНК-матрице. Все известные обратные транскриптазы также обладают способностью синтезировать комплементарную ДНК-копию на ДНК-матрице; таким образом, они являются как РНК-, так и ДНК-зависимыми ДНК-полимеразами. Для инициации синтеза как на РНК-, так и на ДНК-матрицах требуется праймер.
"РНКаза Н" представляет собой фермент, который отщепляет часть РНК от дуплекса РНК:ДНК. Указанные ферменты могут представлять собой эндонуклеазы или экзонуклеазы. Большинство обратных транскриптаз, помимо своей полимеразной активности, обычно обладает активностью РНКазы Н. Однако имеются другие источники РНКазы Н, не имеющие ассоциированной полимеразной активности. Результатом отщепления может быть отделение РНК от комплекса РНК:ДНК. Альтернативно, РНКаза Н может просто разрезать РНК в разных местах так, что части РНК исчезают, или позволять ферментам раскручивать части РНК.
Термины "полинуклеотид", "олигонуклеотид", "нуклеиновая кислота" и "молекула нуклеиновой кислоты", используемые в настоящей заявке, включают полимерную форму нуклеотидов любой длины, как рибонуклеотидов, так и дезоксирибонуклеотидов. Данный термин относится только к первичной структуре молекулы. Так, термин включает трех-, двух- и одноцепочечную ДНК, а также трех-, двух- и одноцепочечную РНК. Он также включает модификации, такие как модификации, полученные метилированием и/или кэппированием, и немодифицированные формы полинуклеотида. Более конкретно, термины "полинуклеотид", "олигонуклеотид", "нуклеиновая кислота" и "молекула нуклеиновой кислоты" включают полидезоксирибонуклеотиды (содержащие 2-дезокси-D-рибозу), полирибонуклеотиды (содержащие D-рибозу), любой другой тип полинуклеотида, который представляет собой N- или С-гликозид пуринового или пиримидинового основания, и другие полимеры, содержащие ненуклеотидные скелеты, например, полиамидные (например, пептидные нуклеиновые кислоты (ПНК)) и полиморфолиновые (продаются компанией Anti-Virals, Inc., Corvallis, Oregon, как Neugene) полимеры, и другие синтетические полимеры нуклеиновых кислот со специфичными последовательностями, при условии, что полимеры содержат нуклеотидные основания в такой конфигурации, которая позволяет образование пар и стекинг оснований, такие, которые имеются в ДНК и РНК. Между терминами "полинуклеотид", "олигонуклеотид", "нуклеиновая кислота" и "молекула нуклеиновой кислоты" не предусмотрено преднамеренного различия по длине, и данные термины будут использоваться взаимозаменяемым образом. Данные термины относятся только к первичной структуре молекулы. Так, данные термины включают, например, 3'-дезокси-2',5'-ДНК, олигодезоксирибокулеотидные N3'P5' фосфорамидаты, 2'-О-алкилзамещенную РНК, двух- и одноцепочечную ДНК, а также двух- и одноцепочечную РНК, гибриды ДНК:РНК и гибриды между ПНК и ДНК или РНК, а также включают известные типы модификаций, например, метки, известные специалистам в данной области, метилирование, "кэпы", замещение одного или более встречающихся в природе нуклеотидов аналогом, межнуклеотидные модификации, такие как, например, модификации с не имеющими заряда связями (например, метилфосфонаты, сложные фосфотриэфиры, фосфорамидаты, карбаматы и т.п.), с отрицательно заряженными связями (например, фосфоротиоаты, фосфородитиоаты и т.п.) и с положительно заряженными связями (например, аминоалкилфосфорамидаты, сложные аминоалкилфосфотриэфиры), модификации, содержащие боковые части, такие как, например, белки (включая нуклеазы, токсины, антитела, сигнальные пептиды, поли-L-лизин и т.п.), модификации, содержащие интеркаляторы (например, акридин, псорален и т.п.), модификации, содержащие хелаторы (например, металлы, радиоактивные металлы, бор, окислительные металлы и т.п.), модификации, содержащие алкиляторы, модификации, содержащие модифицированные связи (например, альфа-аномерные нуклеиновые кислоты и т.п.), а также немодифицированные формы полинуклеотида или олигонуклеотида. В частности, ДНК представляет собой дезоксирибонуклеиновую кислоту.
Используемый в настоящей заявке термин "область-мишень нуклеиновой кислоты" или "нуклеиновая кислота-мишень" обозначает молекулу нуклеиновой кислоты с "последовательностью-мишенью", подлежащей амплификации. Нуклеиновая кислота-мишень может быть как одноцепочечной, так и двухцепочечной, и может включать другие последовательности, помимо последовательности-мишени, которые могут не амплифицироваться. Термин "последовательность-мишень" относится к конкретной последовательности в нуклеиновой кислоте-мишени, которая должна быть амплифицирована. Последовательность-мишень может включать область гибридизации с зондом, содержащуюся в молекуле-мишени, с которой зонд будет образовывать стабильный гибрид при желательных условиях. "Последовательность-мишень" может также включать способные образовывать комплекс последовательности, с которыми образуют комплекс олигонуклеотидные праймеры и которые могут удлиняться с помощью последовательности-мишени в качестве матрицы. В случае, когда нуклеиновая кислота-мишень исходно является одноцепочечной, термин "последовательность-мишень" также относится к последовательности, комплементарной "последовательности-мишени", в том виде, в котором она присутствует в нуклеиновой кислоте-мишени. Если "нуклеиновая кислота-мишень" исходно является двухцепочечной, термин "последовательность-мишень" относится и к плюс (+), и к минус (-) цепям.
Термин "праймер" или "олигонуклеотидный праймер", используемый в настоящей заявке, относится к олигонуклеотиду, функция которого заключается в инициации синтеза комплементарной цепи ДНК при помещении в условия, при которых индуцируется синтез продукта удлинения праймера, т.е. в присутствии нуклеотидов и агента, индуцирующего полимеризацию, такого как ДНК- или РНК-полимераза, и при подходящей температуре, рН, концентрации металлов и концентрации солей. Для максимальной эффективности при амплификации праймер предпочтительно является одноцепочечным, но альтернативно может быть двухцепочечным. Если праймер двухцепочечный, его сначала обрабатывают для разделения цепей, перед использованием для получения продуктов удлинения. Данный этап денатурации обычно осуществляют с помощью нагревания, но альтернативно его можно осуществлять с помощью щелочи, с последующей нейтрализацией. Таким образом, "праймер" является комплементарным по отношению к матрице и способен образовывать комплекс посредством водородных связей или гибридизации с матрицей, с образованием комплекса праймер/матрица для инициации синтеза полимеразой, который удлиняется добавлением ковалентно связанных оснований, связанных своим 3'-концом комплементарно матрице, с процессе синтеза ДНК.
Используемый в настоящей заявке термин "зонд" или "олигонуклеотидный зонд" относится к структуре, составленной из полинуклеотида, как определено выше, который содержит последовательность нуклеиновой кислоты, комплементарную последовательности нуклеиновой кислоты, присутствующей в нуклеиновой кислоте-мишени, подвергаемой анализу. Полинуклеотидные области зондов могут быть составлены из ДНК и/или РНК и/или синтетических нуклеотидных аналогов. В случае, если "олигонуклеотидный зонд" должен использоваться в 5'-нуклеазном анализе, таком как методика TaqManTM, зонд будет содержать по меньшей мере один флуоресцентный агент и по меньшей мере один гаситель, который расщепляется 5'-эндонуклеазной активностью полимеразы, используемой в реакции, с целью выявления любых амплифицированных олигонуклеотидных последовательностей-мишеней. В данном контексте олигонуклеотидный зонд будет иметь достаточное количество сложных фосфодиэфирных связей, смежных с его 5'-концом, таким образом, чтобы направленная от 5' к 3' используемая нуклеазная активность могла эффективно отщеплять связанный зонд для отделения флуоресцентных агентов и гасителей. В случае, когда олигонуклеотидный зонд используют в методике ТМА, его будут соответствующим образом метить, как описано ниже.
Следует оценить тот факт, что гибридизующиеся последовательности необязательно должны быть абсолютно комплементарными, чтобы образовывать стабильные гибриды. Во многих ситуациях будут образовываться стабильные гибриды, когда менее приблизительно 10% оснований спарены ошибочно, игнорируя петли из четырех или более нуклеотидов. Соответственно, используемый в настоящей заявке термин "комплементарный" относится к олигонуклеотиду, который образует стабильный дуплекс со своим "комплементом" в условиях анализа, обычно когда гомологичность составляет приблизительно 90% или более.
Термины "гибридизировать" и "гибридизация" относятся к образованию комплексов между нуклеотидными последовательностями, которые являются достаточно комплементарными для образования комплекса посредством спаривания оснований по Уотсону-Крику. В случае, когда праймер "гибридизуется" с мишенью (матрицей), такие комплексы (или гибриды) являются достаточно стабильными, чтобы выполнять затравочную функцию, требующуюся, например, ДНК-полимеразе для инициации синтеза ДНК.
Используемый в настоящей заявке термин "связывающаяся пара" относится к первой и второй молекулам, которые специфичным образом связываются друг с другом, таким как комплементарные полинуклеотидные пары, способные образовывать дуплексы нуклеиновых кислот. О "специфичном связывании" первого члена связывающейся пары со вторым членом связывающейся пары в образце свидетельствует связывание первого члена со вторым членом, или наоборот, с более высокой аффинностью и специфичностью, чем с другими компонентами в образце. Связывание между членами связывающейся пары обычно является нековалентным. Если в контексте ясно не указано иное, термины "аффинная молекула" и "аналит-мишень", используемые в настоящей заявке, относятся к первому и второму членам связывающейся пары, соответственно.
Термины "специфично связывающаяся молекула" и "аффинная молекула" в настоящей заявке используются взаимозаменяемым образом и относятся к молекуле, которая будет избирательно связываться посредством химических или физических средств, с выявляемым веществом, присутствующим в образце. Под "избирательным связыванием" подразумевается, что молекула предпочтительно связывается с мишенью, представляющей интерес, или связывается с более высокой аффинностью с мишенью, чем с другими молекулами. Например, молекула ДНК будет связываться с практически комплементарной последовательностью, а не с неродственными последовательностями.
"Температура плавления" или "Т.пл." двухцепочечной ДНК определяется как температура, при которой половина спиральной структуры ДНК утрачивается из-за нагревания или другой диссоциации водородных связей между парами оснований, например, благодаря обработке кислотой или щелочью, и т.п. Т.пл. молекулы ДНК зависит от ее длины и нуклеотидного состава. Молекулы ДНК, содержащие много пар оснований GC, имеют более высокую Т.пл., чем молекулы ДНК, содержащие множество пар оснований АТ. Разделенные комплементарные цепи ДНК спонтанно реассоциируют или отжигаются с образованием дуплекса ДНК, когда температуру понижают ниже Т.пл.. Наивысшая скорость гибридизации нуклеиновой кислоты наблюдается при температуре приблизительно на 25°С ниже Т.пл.. Т.пл. можно установить с помощью следующего отношения: Т.пл. = 69,3 + 0,41 (GC)% (Marmur et al. (1962) J. Mol. Biol. 5:109-118).
Используемый в настоящей заявке термин "биологический образец" относится к образцу ткани или жидкости, выделенной от субъекта, который обычно включает антитела, выработанные субъектом. Типичные образцы, которые включают указанные антитела, известны специалистам в данной области, и включают, без ограничения, кровь, плазму, сыворотку, фекалии, мочу, костный мозг, желчь, спинномозговую жидкость, лимфу, образцы кожи, секреты кожи, дыхательных, кишечных и мочеполовых путей, слезы, слюну, молоко, клетки крови, органы, биоптаты, а также образцы составных частей клеточных культур in vitro, включая, без ограничения, кондиционированные среды, полученные в результате роста клеток и тканей в культуральной среде, например, рекомбинантные клетки и клеточные компоненты.
Используемые в настоящей заявке термины "метка" и "детектируемая метка" относятся к молекуле, способной быть обнаруженной, включая, без ограничения, радиоактивные изотопы, флуоресцентные агенты, хемилюминесцентные агенты, хромофоры, ферменты, ферментные субстраты, кофакторы ферментов, ингибиторы ферментов, хромофоры, краски, ионы металлов, золи металлов, лиганды (например, биотин, авидин, стрепавидин или гаптены) и т.п. Термин "флуоресцентный агент" относится к веществу или его части, которые способны флуоресцировать в выявляемых пределах.
II. Способы осуществления настоящего изобретения
Перед описанием настоящего изобретения в подробностях, следует понять, что данное изобретение не ограничивается конкретными композициями или параметрами процессов, поскольку таковые могут, разумеется, изменяться. Следует понять также, что терминология, используемая в настоящем изобретении, служит только целям описания конкретных вариантов осуществления настоящего изобретения и не предназначена для какого бы то ни было ограничения.
Несмотря на то, что при осуществлении настоящего изобретения можно использовать ряд композиций и способов, сходных или эквивалентных описанным в настоящей заявке, здесь описаны предпочтительные материалы и методы.
Как отмечалось выше, настоящее изобретение основано на открытии новых праймеров и зондов и диагностических способов для точного обнаружения инфицирования парвовирусом В19 в биологическом образце. Способы основаны на чувствительной методике выявления нуклеиновых кислот, которая позволяет идентифицировать последовательности-мишени нуклеиновой кислоты парвовируса В19 в образцах, содержащих малые количества вируса.
В частности, авторы изобретения охарактеризовали области в геноме парвовируса В19, которые являются желательными мишенями для диагностических тестов. Праймеры и зонды, полученные из указанных областей, являются крайне полезными для обнаружения инфицирования парвовирусом В19 в биологических образцах.
Праймеры и зонды парвовируса В19, описанные выше, используют в анализах на основе нуклеиновой кислоты для обнаружения инфицирования парвовирусом В19 человека в биологических образцах.
В частности, праймеры и зонды для применения в данных анализах предпочтительно получают из фрагмента генома парвовируса В19 приблизительно из 4,7 т.п.н., соответствующего нуклеотидным положениям 217-4678, описанным Shade et al., J. Virol. (1986) 58:921-936. Нуклеотидные последовательности данной области из двух различных изолятов парвовируса В19 изображены на фиг.3А-3С и 4А-4С настоящей заявки. Как объяснялось выше, указанный фрагмент содержит кодирующие области NS1, VP1 и VP2.
Особенно предпочтительные праймеры и зонды для применения в настоящих анализах конструируют из высококонсервативных областей генома парвовируса В19 для возможности обнаружения инфицирования парвовирусом В19 в различных изолятах. Как описано в настоящей заявке, высококонсервативная область генома парвовируса В19 обнаружена в области из 700 п.н., перекрывающей нуклеотидные положении 2936-3635, пронумерованные относительно генома парвовируса В19, описанного в Shade et al., J. Virol. (1986) 58:921-936. Данная область обнаружена в пределах VP1 области генома. Последовательность данной области из 21 различного изолята парвовируса В19 показана в настоящей заявке на фиг.2А-2U. Последовательности из дополнительных 26 изолятов показаны в настоящей заявке на фиг.11А-11Z. Сравнение последовательностей показывает, что данная область демонстрирует гомологичность последовательностей из различных изолятов приблизительно от 98% до 99,5%, что делает их весьма желательной последовательностью-мишенью. Также желательной для построения праймеров и зондов является область из 370 п.н., обнаруженная в пределах VP1, которая перекрывает нуклеотидные положении приблизительно 3073-3442, пронумерованные согласно Shade et al., J. Virol. (1986) 58:921-936, а также фрагмент из 214 п.н., изображенный на фиг.1, который наблюдается в пределах 3' части фрагмента из 4,7 т.п.н. и перекрывает нуклеотидные положении 4728-4941, пронумерованные согласно Shade et al., J. Virol. (1986) 58:921-936.
Области из 4,7 т.п.н., 700 п.н. и 370 п.н. легко получают из дополнительных изолятов, используя части последовательности парвовируса В19, обнаруженные в данных конкретных участках, в качестве праймеров в ПЦР-реакциях, таких, которые описаны в настоящей заявке, а также в патентах США №№ 4683195, 4683202 и 4889818, и на основе последовательностей, полученных в настоящем изобретении. Другой способ получения нуклеотидных последовательностей с желательными последовательностями заключается в отжиге комплементарных серий перекрывающихся синтетических олигонуклеотидов, полученных с помощью обычного автоматизированного синтезатора полинуклеотидов, с последующим лигированием подходящей ДНК-лигазой и амплификацией лигированной нуклеотидной последовательности посредством ПЦР. См., например, Jayaraman et al. (1991) Proc. Natl. Acad. Sci. USA 88:4084-4088. После того, как последовательности были изготовлены или выделены, их можно клонировать в любой подходящий вектор или репликон. Многочисленные клонирующие векторы известны специалистам в данной области, и предметом выбора является селекция подходящего клонирующего вектора. Подходящие векторы включают, без ограничения, плазмиды, фаги, транспозоны, космиды, хромосомы или вирусы, которые способны реплицироваться, когда связываются с подходящими контролирующими элементами.
Рекомбинантные клоны легко идентифицируются рестрикционным анализом и электрофорезом в полиакриламидном или агарозном геле, с использованием методик, хорошо известных специалистам в данной области и описанных в примерах ниже.
Праймеры и зонды для использования в анализах по настоящему изобретению получают из указанных последовательностей и легко синтезируются с помощью обычных методик, например, твердофазного синтеза через реакции с фосфорамидатом, как описано в патентах США №№ 4458066 и 4415732; Beaucage et al. (1992) Tetrahedron 48:2223-2311 и Applied Biosystems User Bulletin № 13 (1 апреля 1987 г.). Другие способы химического синтеза включают, например, фосфотриэфирный метод, описанный Narang et al., Meth. Enzymol. (1979) 68:90, и фосфодиэфирный метод, описанный Brown et al., Meth. Enzymol. (1979) 68:109. Поли(А) или поли(С) или другие некомплементарные нуклеотидные изменения могут быть включены в зонды с помощью тех же способов. Удлинения оксида гексаэтилена можно сопрягать в зондами с помощью способов, известных специалистам в данной области. Cload et al. (1991) J. Am. Chem. Soc. 113:6324-6326; патент США № 4914210, выданный Levenson et al.; Durand et al. (1990) Nucleic Acid Res. 18:6353-6359 и Horn et al. (1986) Tet. Lett. 27:4705-4708. Обычно длина праймерных последовательностей составляет 10-75 нуклеотидов, такая как 15-60, 20-40 и т.д., более типично, в пределах длины 18-40 нуклеотидов, и любая длина в указанных пределах. Обычная длина зонда составляет 10-50 нуклеотидов, такая как 15-40, 18-30 и т.д., и любая длина в указанных пределах.
Помимо этого, для обнаружения зонды можно сопрягать с метками. Существует несколько средств, известных для дериватизации олигонуклеотидов реакционно активными функциональностями, которые позволяют добавить метку. Например, имеется несколько подходов для биотинилирования зондов так, что радиоактивные, флуоресцентные, хемилюминесцентные, ферментативные или электронноплотные метки могут быть присоединены через авидин. См., например, Broken et al., Nucl. Acids Res. (1978) 5:363-384, где описано применение ферритин-авидин-биотиновых меток, и Chollet et al. Nucl. Acids Res. (1985) 13:1529-1541, где описано биотинилирование 5'-концов олигонуклеотидов через аминоалкилфосфорамидное линкерное плечо. Имеется также несколько способов для синтеза амино-дериватизированных олигонуклеотидов, которые легко метить флуоресцентными или другими типами соединений, дериватизированных аминореактивными группами, такими как изотиоцианат, N-гидроксисукцинимид и т.п., см., например, Connolly (1987) Nucl. Acids Res. 15:3131-3139, Gibson et al. (1987) Nucl. Acids Res. 15:6455-6467 и патент США № 4605735, выданный Miyoshi et al. Имеются также способы синтеза сульфгидрил-дериватизированных олигонуклеотидов, которые могут взаимодействовать с тиол-специфичными метками, см., например, патент США № 4757141, выданный Fung et al., Connolly et al. (1985) Nucl. Acids Res. 13:4485-4502 и Spoat et al. (1987) Nucl. Acids Res. 15:4837-4848. Исчерпывающий обзор методик мечения фрагментов ДНК представлен в Mattews et al., Anal. Biochem. (1998) 169:1-25.
Например, зонды можно метить флуоресцентной меткой путем связывания флуоресцентной молекулы с нелигирующим концом зонда. Руководство по отбору подходящих флуоресцентных меток можно найти в Smith et al., Meth. Enzymol. (1987) 155:260-301; Karger et al., Nucl. Acids Res. (1991) 19:4955-4962; Haugland (1989) Handbook of Fluorescent Probes and Research Chemicals (Molecular Probes, Inc., Eugene, OR). Предпочтительные флуоресцентные метки включают флуоресцеин и его производные, такие, которые описаны в патенте США № 4318846 и в Lee et al., Cytometry (1989) 10:151-164, и 6-FAM, JOE, TAMRA, ROX, HEX-1, HEX-2, ZOE, TET-1 или NAN-2 и т.п.
Помимо этого, зонды можно метить сложным эфиром акридиния (АЕ) с использованием методики, описанной ниже. Современные технологии позволяют помещать метку АЕ в любой участок зонда. См., например, Nelson et al. (1995) "Detection of Acridinium Esters by Chemiluminescence" в Nonisotopic Probing, Blotting and Sequencing, Kricka L.J. (ed) Academic Press, San Diego, CA; Nelson et al. (1994) "Application of the Hybridization Protection Assay (HPA) to PCR" в The Polymerase Chain Reaction, Mullis et al. (eds.) Birkhauser, Boston, MA; Weeks et al., Clin. Chem. (1983) 29:1474-1479; Berry et al., Clin. Chem. (1988) 34:2087-2090. Молекулу АЕ можно непосредственно присоединять к зонду с использованием реакций с линкерами на ненуклеотидной основе, которые позволяют помещать метку в любой участок зонда. См., например, патенты США №№ 5585481 и 5185439.
В некоторых вариантах осуществления настоящего изобретения внутренний контроль (IC) или внутренний стандарт добавляют, чтобы он служил контролем для захвата и амплификации мишени. Предпочтительно, IC включает последовательность, которая отличается от последовательности-мишени, способна гибридизоваться с последовательностями зонда, используемыми для отделения олигонуклеотидов, специфичных для организма из образца, и способна амплифицироваться. Использование IC позволяет контролировать процесс разделения, процесс амплификации и систему обнаружения, и позволяет осуществлять мониторинг хода анализа и количественного определения для образца (образцов). Пример последовательности, из которой можно получить IC, показан на фиг.12. IC можно включать в любой подходящий участок, например, в лизисный буфер. В одном варианте осуществления настоящего изобретения IC включает оцДНК М13, содержащую нуклеотидную последовательность из парвовируса В19 и уникальную последовательность, которая гибридизуется с зондом, например, включающую последовательности из области VP1, где последовательность-мишень модифицируется путем замещения или делеции 5-20 оснований или более, предпочтительно, 5-15 оснований, например, 5, 10 или 15 оснований или любого количества в указанных пределах. Замещенные или делетированные основания предпочтительно имеют место по всей длине последовательности-мишени, таким образом, что заменяются только 2 или 3 последовательности подряд. Так, например, если последовательность-мишень представляет собой CTACTTGCTGCGGGAGAAAAACACCT (SEQ ID NO:91), то в IC последовательность может быть замещена на, например, AGCTAGACCTGCATGTCACTG (SEQ ID NO:90).
Твердая подложка может дополнительно включать зонды, специфичные для внутреннего стандарта (IC зонд), что облегчает захват при использовании IC зонда. IC зонд может быть, необязательно, сопряжен с детектируемой меткой, которая отличается от детектируемой метки для последовательности-мишени. В тех вариантах осуществления настоящего изобретения, в которых детектируемая метка представляет собой флуорофор, IC можно количественно определять спектрофотометрическим способом и ограничением исследований по обнаружению. Обычно количество копий IC, которое не мешает обнаружению мишени, определяют титрованием IC с фиксированной МЕ мишени, предпочтительно, по нижней границе, а стандартную кривую получают разведением образца международно принятой МЕ. Для количественного определения парвовируса В19 можно использовать панель с восемью ячейками от 8000 МЕ до 125 МЕ.
В другом варианте осуществления настоящего изобретения IC, как описано в настоящей заявке, объединяют с РНК, выделенной из образца, согласно стандартным методикам, известным специалистам в данной области и описанным в настоящей заявке. РНК затем подвергают обратной транскрипции с использованием обратной транскриптазы для получения ДНК-копии. Последовательности кДНК можно, необязательно, амплифицировать (например, посредством ПЦР) с использованием меченых праймеров. Продукты амплификации разделяют, обычно, электрофорезом, и определяют количество радиоактивности (пропорционально количеству амплифицированного продукта). Затем рассчитывают количество мРНК в образце путем сравнения с сигналом, получаемым от известных стандартов.
Праймеры и зонды, описанные выше, можно использовать в методике на основе полимеразной цепной реакции (ПЦР), чтобы обнаружить инфицирование парвовирусом В19 в биологических образцах. ПЦР представляет собой методику для амплификации желательной последовательности-мишени нуклеиновой кислоты, содержащейся в молекуле или смеси молекул нуклеиновой кислоты. В ПЦР используют пару праймеров в избыточном количестве, чтобы гибридизировать комплементарные цепи нуклеиновой кислоты-мишени. Каждый праймер удлиняют с помощью полимеразы с использованием нуклеиновой кислоты-мишени в качестве матрицы. Продукты удлинения сами становятся последовательностями-мишенями после отщепления от исходной цепи-мишени. Новые праймеры затем гибридизуются и распрямляются полимеразой, и цикл повторяется с геометрическим увеличением количества молекул последовательности-мишени. Метод ПЦР для амплификации последовательностей-мишеней нуклеиновой кислоты в образце хорошо известен специалистам в данной области и описан, например, в Innis et al. (eds.) PCR Protocols (Academic Press, NY 1990); Taylor (1991) Polymerase chain reaction: basic principles and autimation, в PCR: A Practical Approach, McPherson et al. (eds.) IRL Press, Oxford; Saiki et al. (1986) Nature 324:163; а также в патентах США №№ 4683195, 4683202 и 4889818.
В частности, в ПЦР используют относительно короткие олигонуклеотидные праймеры, которые фланкируют нуклеотидную последовательность-мишень, которую нужно амплифицировать, ориентированные таким образом, что их 3'-концы обращены друг на друга, каждый праймер удлиняется по направлению к другому. Полинуклеотидный образец экстрагируют и денатурируют, предпочтительно, нагреванием, и гибридизуют с первым и вторым праймерами, которые присутствуют в молярном избытке. Полимеризацию катализируют в присутствии четырех дезоксирибонуклеотидтрифосфатов (dNTP-dATP, dGTP, dCTP и dTTP), используя праймер- и матрица-зависимый полинуклеотидный полимеризующий агент, такой как любой фермент, способный продуцировать продукты удлинения праймера, например, ДНК-полимераза I E.coli, фрагмент Klenow ДНК-полимеразы I, ДНК-пролимераза Т4, термостабильные ДНК-полимеразы, выделенные из Thermus aquaticus (Taq), которые можно приобрести у многих компаний (например, Perkin Elmer), Thermus thermophilus (United States Biochemicals), Bacillus stereothermophilus (Bio-Rad) или Thermococcus litoralis ("Vent" полимераза, New England Biolabs). В результате получают два "длинных продукта", которые содержат соответствующие праймеры на своих 5'-концах, ковалентно связанные с вновь синтезированными комплементами исходных цепей. Реакционную смесь затем возвращают в условия полимеризации, например, понижением температуры, инактивацией денатурирующего агента или добавлением дополнительного количества полимеразы, и инициируется второй цикл. В результате второго цикла получают две исходные цепи, два длинных продукта с первого цикла, два новых длинных продукта, реплицированных с исходных цепей, и два "коротких продукта", реплицированных с длинных продуктов. Короткие продукты имеют последовательность последовательности-мишени с праймером на каждом конце. В каждом дополнительном цикле образуются два дополнительных длинных продукта, а также количество коротких продуктов, равное количеству длинных и коротких продуктов, остающихся к концу предыдущего цикла. Таким образом, количество коротких продуктов, содержащих последовательность-мишень, возрастает по экспоненте с каждым циклом. Предпочтительно, ПЦР осуществляют с коммерчески доступным термальным циклером, например, Perkin Elmer.
РНК можно амплифицировать посредством обратной транскрипции мРНК в кДНК, а затем осуществляя ПЦР (ОТ-ПЦР), как описано выше. Альтернативно, для обоих этапов можно использовать единственный фермент, как описано в патенте США № 5322770. мРНК также можно обратно транскрибировать в кДНК, с последующей асимметричной гэп-лигазной цепной реакцией (RT-AGLCR), как описано Marshall et al. (1994) PCR Meth. App. 4:80-84.
Флуорогенный анализ с 5'-нуклеазой, известный как анализ TaqManTM (Perkin Elmer), представляет собой эффективную и гибкую систему обнаружения нуклеиновых кислот-мишеней на основе ПЦР. Следовательно, праймеры и зонды, полученные из областей генома парвовируса В19, описанные в настоящей заявке, можно использовать в анализах TaqManTM для обнаружения присутствия инфекции в биологическом образце. Анализ выполняют в сочетании с термальным циклированием путем мониторинга генерации флуоресцентных сигналов. Система анализа обходится без электрофореза и обладает способностью генерировать количественные данные, позволяющие определить количество копий мишени.
Флуорогенный анализ с 5'-нуклеазой удобно выполнять с использованием, например, ДНК-полимеразы AmpliTaq GoldTM, которая обладает эндогенной 5'-нуклеазной активностью, для расщепления внутреннего олигонуклеотидного зонда, меченного флуоресцентным репортерным красителям и гасителем (см. Holland et al., Proc. Natl. Acad. Sci. USA (1991) 88:7276-7280; и Lee et al., Nucl. Acid Res. (1993) 21:3761-3766). Результаты анализа выявляются путем измерения изменений флуоресценции, которые наблюдаются во время цикла амплификации после расщепления флуоресцентного зонда, отсоединения меток красителя и гасителя и вызывая увеличение флуоресцентного сигнала, которое пропорционально амплификации ДНК-мишени.
Продукты амплификации можно обнаружить в растворе или с использованием твердых подложек. В данном способе конструируется зонд TaqManTM для гибридизации с последовательностью-мишенью внутри желательного ПЦР-продукта. 5'-конец зонда TaqManTM содержит флуоресцентный рецепторный краситель. 3'-конец зонда блокируется для предотвращения удлинения зонда и содержит краситель, который будет гасить флуоресценцию 5' флуорофора. Во время последующей амплификации 5' флуоресцентная метка отщепляется, если в реакционной смеси присутствует полимераза с 5'-экзонуклеазной активностью. Врезание 5' флуорофора приводит к повышению флуоресценции, которое можно обнаружить.
В частности, олигонуклеотидный зонд конструируют таким образом, чтобы зонд существовал по меньшей мере в одной одноцепочечной конформации, когда он не гибридизирован, где молекула-гаситель находится достаточно близко к молекуле-репортеру, чтобы гасить флуоресценцию молекулы-репортера. Олигонуклеотидный зонд также существует по меньшей мере в одной конформации, когда он гибридизирован с полинуклеотидом-мишенью, таким образом, чтобы молекула гасителя не располагалась достаточно близко к молекуле-репортеру, чтобы гасить флуоресценцию молекулы-репортера. Принимая указанные гибридизированные и негибридизированные конформации, молекула-репортер и молекула-гаситель в зонде проявляют флуоресцентные сигналы разной интенсивности, когда зонд гибридизирован и не гибридизирован. В результате становится возможным определить, гибридизирован зонд или не гибридизирован на основании изменения интенсивности флуоресценции молекулы-репортера, молекулы-гасителя или их комбинации. Помимо этого, поскольку зонд можно сконструировать таким образом, что молекула-гаситель гасит молекулу-репортер, когда зонд не гибридизирован, зонд можно сконструировать таким образом, что молекула-репортер будет проявлять ограниченную флуоресценцию, пока зонд не будет гибридизирован или отщеплен.
Соответственно, настоящее изобретение относится к способу амплификации нуклеотидной последовательности-мишени парвовируса В19 с использованием полимеразы нуклеиновых кислот, обладающей нуклеазной активностью в направлении от 5' к 3', одного или более праймеров, способных гибридизироваться с последовательностью-мишенью В19, и олигонуклеотидного зонда, способного гибридизироваться с последовательностью-мишенью В19 3' относительно праймера. Во время амплификации полимераза расщепляет олигонуклеотидный зонд, когда он гибридизирован с последовательностью-мишенью, отделяя, таким образом, молекулу-репортер от молекулы-гасителя. По мере осуществления амплификации осуществляют мониторинг флуоресценции молекулы-репортера; при этом флуоресценция соответствует наличию амплификации нуклеиновой кислоты. Молекула-репортер предпочтительно представляет собой флуоресцентный краситель, а молекула-гаситель предпочтительно представляет собой родаминовый краситель.
В то время как праймеры и зонды могут варьировать по длине, последовательности зондов выбирают таким образом, чтобы они имели более низкую температуру плавления, чем последовательности праймеров. Следовательно, последовательности праймеров обычно длиннее, чем последовательности зондов. Обычно длина последовательности праймеров составляет 10-75 нуклеотидов, более обычно, в пределах 20-45. Типичная длина последовательности зондов составляет 10-50 нуклеотидов, более обычно, в пределах 15-40 нуклеотидов.
Если используется твердая подложка, олигонуклеотидный зонд может быть присоединен к твердой подложке различными способами. Например, зонд может быть присоединен к твердой подложке присоединением 3'- или 5'-концевого нуклеотида зонда к твердой подложке. Более предпочтительно, зонд присоединяют к твердой подложке посредством линкера, который служит дистанцированию зонда от твердой подложки. Линкер обычно имеет длину по меньшей мере 15-30 атомов, более предпочтительно, длину по меньшей мере 15-50 атомов. Требующаяся длина линкера будет зависеть от конкретной используемой твердой подложки. Например, линкер из шести атомов обычно является достаточным, когда в качестве твердой подложки используется сшитый полистирол.
Специалистам в данной области известен обширный ряд линкеров, которые можно использовать для присоединения олигонуклеотидного зонда к твердой подложке. Линкер может быть образован любым соединением, который значительным образом не мешает гибридизации последовательности-мишени с зондом, присоединенным к твердой подложке. Линкер может быть образован гомополимерным олигонуклеотидом, которые можно легко добавлять к линкеру посредством автоматизированного синтеза. Альтернативно, в качестве линкера можно использовать полимеры, такие как функционализированный полиэтиленгликоль. Указанные полимеры являются предпочтительными по сравнению с гомополимерными олигонуклеотидами, поскольку они значительным образом не мешают гибридизации зонда с последовательностью-мишенью. Особенно предпочтительным является полиэтиленгликоль.
Связи между твердой подложкой, линкером и зондом предпочтительно не разрываются во время удаления защитных групп нуклеотидов при основных условиях с высокой температурой. Примеры предпочтительных связей включают карбаматные и амидные связи.
Примеры предпочтительных типов твердых подложек для иммобилизации олигонуклеотидного зонда включают контролируемое пористое стекло, стеклянные пластины, полистирол, полистироловые гранулы, покрытые авидином, целлюлозу, нейлон, акриламидный гель и активированный декстран.
Подробное описание анализа TaqManTM, реагентов и условий для его осуществления см., например, в Holland et al., Proc. Natl. Acad. Sci. USA (1991) 88:7276-7280; в патентах США №№ 5538848, 5723591 и 5876930.
Последовательности парвовируса В19, описанные в настоящей заявке, можно также использовать в качестве основы для анализов опосредованной транскрипцией амплификации (ТМА). ТМА обеспечивает способ идентификации последовательностей-мишеней нуклеиновых кислот, присутствующих в биологическом образце в очень малых количествах. Указанные последовательности может быть трудно или невозможно обнаружить с помощью прямых аналитических методов. В частности, ТМА представляет собой изотермальную, аутокаталитическую систему амплификации нуклеиновой кислоты-мишени, которая может давать более миллиарда РНК-копий последовательности-мишени. Анализ может служить качественным анализом для точного обнаружения наличия или отсутствия последовательности-мишени в биологическом образце. Анализ может также обеспечивать количественное измерение количества последовательности-мишени в пределах концентрации в несколько порядков величин. ТМА обеспечивает способ аутокаталитического синтеза множества копий последовательности нуклеиновой кислоты-мишени, без повторных манипуляций с условиями реакции, такими как температура, концентрация ионов и рН.
Обычно ТМА включает следующие стадии: (а) выделение нуклеиновой кислоты, включая РНК, из биологического образца, представляющего интерес, предположительно инфицированного парвовирусом В19; и (b) объединение в реакционную смесь (i) выделенной нуклеиновой кислоты, (ii) первого и второго олигонуклеотидных праймеров, причем первый праймер имеет способную образовывать комплекс последовательность, достаточно комплементарную 3'-концевой части последовательности-мишени РНК, если она присутствует (например, (+) цепь), чтобы образовывать с ней комплекс, и второй праймер имеет способную образовывать комплекс последовательность, достаточно комлементарную 3'-концевой части последовательности-мишени или ее комплементу (например (-) цепь), чтобы образовывать с ней комплекс, при этом первый олигонуклеотид дополнительно включает последовательность 5' в отношении способной образовывать комплекс последовательности, которая включает промотор, (iii) обратную транскриптазу или РНК- или ДНК-зависимую ДНК-полимеразу, (iv) обладает ферментативной активностью, которая избирательно разрушает цепь РНК комплекса РНК-ДНК, (такой как РНКаза Н), и (v) РНК-полимеразы, которая распознает промотор.
Компоненты реакционной смеси можно объединять поэтапно или сразу. Реакционную смесь инкубируют при таких условиях, при которых образуется комплекс олигонуклеотид/последовательность-мишень, включая прайминг ДНК и условия для синтеза нуклеиновой кислоты (включая рибонуклеотидтрифосфаты и дезоксирибонуклеотидтрифосфаты), в течение периода времени, достаточного для получения множества копий последовательности-мишени. Реакция благоприятно протекает в условиях, подходящих для поддержания стабильности компонентов реакции, таких как ферменты, и не требует модификации или манипуляций с условиями реакции в ходе реакции амплификации. Соответственно, реакция может протекать в таких условиях, которые являются практически изотермальными и включают практически постоянную концентрацию ионов и рН. Удобно, что реакция не требует стадии денатурации для разделения комплекса РНК-ДНК, полученного в результате первой реакции удлинения ДНК. Подходящие ДНК-полимеразы включают обратные транскриптазы, такие как обратная транскриптаза вируса миелобластоза птиц (AMV) (которую можно приобрести, например, у компании Seikagaku America, Inc.) и обратная транскриптаза вируса лейкоза мышей Moloney (MMLV) (которую можно приобрести, например, у компании Bethesda Research Laboratories).
Промоторы или промоторные последовательности, подходящие для включения в праймеры, представляют собой последовательности нуклеиновой кислоты (встречающиеся в природе, полученные синтетически или продукт рестрикционного расщепления), которые специфично распознаются РНК-полимеразами, которые распознают и связываются с такой последовательностью и инициируют процесс транскрипции, во время которого продуцируются транскрипты РНК. Последовательность может, необязательно, включать нуклеотидные основания, лежащие вне истинного сайта распознавания для РНК-полимеразы, которые могут сообщать дополнительную стабильность или чувствительность к процессам деградации или повышенную эффективность транскрипции. Примеры подходящих промоторов включают промоторы, которые распознаются определенными полимеразами бактериофагов, такими как полимеразы из бактериофага Т3, Т7 или SP6, или промотор из E.coli. Указанные РНК-полимеразы легко доступны из коммерческих источников, такие как New England Biolabs и Epicentre.
Некоторые из обратных транскриптаз, подходящих для применения в способах, упомянутых в настоящей заявке, обладают активностью РНКазы Н, такие как обратная транскриптаза AMV. Может быть, однако, предпочтительным добавление экзогенной РНКазы Н, такой как РНКаза Н E.coli, даже когда используется обратная транскриптаза AMV. РНКазу Н можно легко приобрести, например, у компании Bethesda Research Laboratories.
Транскрипты РНК, полученные данными способами, могут служить матрицами для получения дополнительных копий последовательности-мишени, посредством описанных выше механизмов. Система является аутокаталитической, и амплификация наблюдается аутокаталитически, без необходимости повторной модификации или изменения условий реакции, таких как температура, рН, концентрация ионов и т.п.
Обнаружение можно осуществлять с помощью обширного ряда способов, включая прямое секвенирование, гибридизацию со специфичными в отношении последовательности олигомерами, электрофорез в геле и масс-спектрометрию. В данных способах можно использовать гетерогенный или гомогенный форматы, изотопные или неизотопные метки, а также вовсе не использовать метки.
Одним предпочтительным способом обнаружения является применение олигонуклеотидных зондов, специфичных в отношении последовательности-мишени, полученных из фрагментов из 4,7 т.п.н., 700 п.н. и 214 п.н., описанных выше. Зонды можно использовать в анализах защиты гибридизации (НРА). В данном варианте осуществления настоящего изобретения зонды удобно метить сложным эфиром акридиния (АЕ), молекулой с высокой интенсивностью хемилюминесценции. См., например, Nelson et al. (1995) "Detection of Acridinium Esters by Chemiluminescence" в Nonisotopic Probing, Blotting and Sequencing, Kricka L.J. (ed) Academic Press, San Diego, CA; Nelson et al. (1994) "Application of the Hybridization Protection Assay (HPA) to PCR" в The Polymerase Chain Reaction, Mullis et al. (eds.) Birkhauser, Boston, MA; Weeks et al., Clin. Chem. (1983) 29:1474-1479; Berry et al., Clin. Chem. (1988) 34:2087-2090. Молекулу АЕ можно непосредственно присоединять к зонду с использованием реакций с линкерами на ненуклеотидной основе, которые позволяют помещать метку в любой участок зонда. См., например, патенты США №№ 5585481 и 5185439. Запуском хемилюминесценции служит реакция с щелочным пероксидом водорода, которая дает возбужденный N-метилакридон, который впоследствии разряжается до "земли" с эмиссией фотона. Кроме того, АЕ вызывает гидролиз сложного эфира, в результате чего получается агент, не обладающий хемилюминесценцией, метилакридиний-карбоновая кислота.
В случае, когда молекула АЕ ковалентно связана с зондом из нуклеиновой кислоты, гидролиз происходит быстро в слабощелочной среде. В случае, когда меченный АЕ зонд является абсолютно комплементарным нуклеиновой кислоте-мишени, скорость гидролиза АЕ сильно уменьшается. Так, гибридизированный и негибридизированный меченный АЕ зонд можно обнаружить непосредственно в растворе, без необходимости физического разделения.
НРА обычно состоит из следующих стадий: (а) меченный АЕ зонд гибридизуют с нуклеиновой кислотой-мишенью в растворе в течение приблизительно от 15 до 30 минут. Затем добавляют слабый раствор щелочи, и АЕ, соединенный с негибридизированным зондом, подвергается гидролизу. Данная реакция занимает приблизительно от 5 до 10 минут. Оставшийся АЕ, связанный с гибридом, выявляют как меру количества присутствующей мишени. Данная стадия занимает приблизительно от 2 до 5 секунд. Предпочтительно, стадию дифференциального гидролиза осуществляют при той же температуре, что и стадию гибридизации, обычно от 50 до 70°С. Альтернативно, вторую стадию дифференциального гидролиза можно выполнять при комнатной температуре. Это позволяет использовать повышенную величину рН, например, в пределах 10-11, что дает более выраженную разницу в скорости гидролиза между гибридизированным и негибридизированным меченным АЕ зондом. НРА подробно описан, например, в патентах США №№ 6004745, 5948899 и 5283174.
ТМА подробно описан, например, в патенте США № 5399491. В одном примере типичного анализа, образец выделенной нуклеиновой кислоты, предположительно содержащий последовательность-мишень парвовируса В19, смешивают с буферным концентратом, содержащим буфер, соли, магний, нуклеотидтрифосфаты, праймеры, дитиотреитол и спермидин. Реакционную смесь, необязательно, инкубируют приблизительно при 100°С в течение приблизительно двух минут для денатурации любой вторичной структуры. После охлаждения до комнатной температуры добавляют обратную транскриптазу, РНК-полимеразу и РНКазу Н, и смесь инкубируют в течение двух - четырех часов при 37°С. Реакционную смесь затем можно анализировать путем денатурации продукта, добавления раствора зонда, инкубации в течение 20 минут при 60°С, добавления раствора для избирательного гидролиза негибридизированного зонда, инкубации реакционной смеси в течение шести минут при 60°С и измерения оставшейся хемилюминесценции на люминометре.
Олигонуклеотидные молекулы по настоящему изобретению можно также использовать для амплификации на основе последовательности нуклеиновой кислоты (NASBA). Данный способ представляет собой регулируемый промотором ферментативный процесс, который индуцирует in vitro непрерывную, гомогенную и изотермальную амплификацию специфичной нуклеиновой кислоты для получения РНК-копий нуклеиновой кислоты. Реагенты для выполнения NASBA включают первый ДНК-праймер с 5'-концом, включающим промотор, второй ДНК-праймер, обратную транскриптазу, РНКазу-Н, РНК-полимеразу Т7, NTP и dNTP. С помощью NASBA генерируются большие количества одноцепочечной РНК как с одноцепочечной РНК или ДНК, так и с двухцепочечной ДНК. Если нужно амплифицировать РНК, оцРНК служит матрицей для синтеза первой цепи ДНК путем удлинения первого праймера, содержащего сайт распознавания РНК-полимеразы. Указанная цепь ДНК, в свою очередь, служит матрицей для синтеза второй, комплементарной, цепи ДНК путем удлинения второго праймера, в результате чего получают двухцепочечный активный РНК-полимеразный промоторный сайт, а вторая цепь ДНК служит матрицей для синтеза больших количеств первой матрицы, оцРНК, с помощью РНК-полимеразы. Методика NASBA известна специалистам в данной области и описана, например, в европейском патенте 329822, международной патентной заявке № WO 91/02814 и патентах США №№ 6063603, 5554517 и 5409818.
Последовательности парвовируса В19, описанные в настоящей заявке, являются также пригодными для методик гибридизации и амплификации нуклеиновых кислот, в которых используются разветвленные молекулы ДНК. В базовом анализе гибридизации нуклеиновых кислот одноцепочечную анализируемую нуклеиновую кислоту гибридизуют с меченой одноцепочечной нуклеиновой кислотой-зондом и выявляют полученные меченые дуплексы. Разработаны вариации указанной базовой схемы для облегчения разделения дуплексов, подлежащих выявлению в маргинальных материалах, и/или для амплификации выявляемого сигнала. В одном способе амплификации сигнала используют мультимеры амплификации, которые представляют собой полинуклеотиды с первым сегментом, который специфично гибридизуется с анализируемой нуклеиновой кислотой или цепью нуклеиновой кислоты, связанной с аналитом, и итерациями второго сегмента, который специфично гибридизуется с меченым зондом. Амплификация теоретически является пропорциональной числу итераций второго сегмента. Мультимеры могут быть как линейными, так и разветвленными. Два общих типа разветвленных мультимеров являются пригодными для указанных методик: вилкообразные и гребнеобразные. Способы получения и применения разветвленных молекул нуклеиновых кислот известны специалистам в данной области и описаны, например, в патенте США № 5849481.
В другом аспекте настоящего изобретения два или более тестов, описанных выше, выполняют для подтверждения присутствия организма. Например, если первый тест использовали для опосредованной транскрипцией амплификации (ТМА), чтобы амплифицировать нуклеиновые кислоты для их обнаружения, то выполняют альтернативный анализ тестирования нуклеиновой кислоты (NAT), например, с использованием ПЦР-амплификации, ОТ-ПЦР и т.п., как описано в настоящей заявке. Таким образом, парвовирус В19 можно специфично и избирательно обнаружить, даже когда образец содержит другие организмы, такие как ВИЧ и вирус гепатита В, например.
Легко можно видеть, что схему анализов, описанных в настоящей заявке, можно подвергать различным изменениям, и специалистам в данной области известно множество форматов. Приведенные выше описания служат лишь руководством, и специалист может легко модифицировать описанные протоколы, используя методики, хорошо известные специалистам в данной области.
Описанные выше реагенты для анализов, включая праймеры, зонды, твердую подложку с присоединенными зондами, а также другие реагенты для обнаружения, могут поставляться в наборах, с подходящими инструкциями и другими необходимыми реагентами, с целью проведения анализов, как описано выше. Набор обычно будет содержать в отдельных контейнерах комбинацию праймеров и зондов (уже присоединенные к твердой подложке или отдельные реагенты для связывания их с матриксом), контрольные композиции (положительные и/или отрицательные), меченые реагенты, если формат анализа требует их наличия, и реагенты, генерирующие сигнал (например, субстрат фермента), если метка не генерирует сигнал непосредственным образом. Инструкции (например, написанные, напечатанные, в виде VCR, CD-ROM и т.п.) по выполнению анализа обычно будут включаться в набор. Набор может также содержать, в зависимости от конкретного используемого анализа, другие упакованные реагенты и материалы (т.е. промывающие буферы и т.п.). С помощью указанных наборов можно выполнять стандартные анализы, такие как те, которые описаны выше.
III. Экспериментальная часть
Ниже описаны конкретные варианты для осуществления настоящего изобретения. Данные примеры предлагаются только для целей иллюстрации и не предназначены для какого бы то ни было ограничения объема настоящего изобретения.
Предпринимались попытки обеспечения точности с точки зрения используемых числовых значений (например, количеств, температур и т.п.), но, разумеется, некоторые ошибки и отклонения экспериментов являются допустимыми.
В следующих примерах ферменты приобретались в коммерческих источниках и использовались согласно инструкциям производителей. Нитроцеллюлозные фильтры и т.п. материалы также приобретались в коммерческих источниках.
Для выделения фрагментов ДНК, за исключением особо отмеченных, все манипуляции с ДНК выполнялись согласно стандартным процедурам. См. Sambrook et al., указано выше. Рестрикционные ферменты, ДНК-лигазу Т4, E.coli, ДНК-полимеразу I, фрагмент Klenow и другие биологические реагенты можно приобрести у коммерческих поставщиков и использовать согласно инструкциям производителей. Фрагменты двухцепочечной ДНК разделяли на агарозных гелях.
Пример 1
Экстракция нуклеиновой кислоты парвовируса В19 для ПЦР
Образцы человеческой сыворотки, которые предварительно тестировались на наличие парвовируса В19 человека с помощью анализов с IgM или ПЦР и показали положительный результат, получали из коммерческих источников и использовали для выделения ДНК для последующих ПЦР-экспериментов. До использования образцы хранили при -80°С.
ДНК экстрагировали из 0,2 мл сыворотки, используя QIAamp DNA Blood Mini Kit (QIAGEN, Valencia, CA), согласно описанию производителя, при следующих условиях. ДНК-носитель добавляли к лизисному буферу для усиления связывания и выхода нуклеиновой кислоты. В частности, добавляли 5,6 мкг на образец полиадениловой кислоты 5' (Sigma, St. Louis, MO) или poly-dA (Roche, Indianopolis, IN). Дополнительно ДНК парвовируса В19 элюировали 200 мкл буфера АЕ (Qiagen) вместо воды.
Пример 2
Обнаружение образцов, положительных на нуклеиновую кислоту парвовируса В19, с помощью ПЦР
Две различные процедуры ПЦР использовали для амплификации фрагментов парвовируса В19. Один способ, описанный в подробностях ниже, использовали для амплификации фрагментов приблизительно из 700 п.н., 370 п.н. и 214 п.н. (см. фиг.1). Высокоразрешающую ПЦР (Roche) использовали для амплификации фрагментов приблизительно из 4,7 т.п.н. Фрагмент приблизительно из 700 п.н. соответствует нуклеотидным положениям 2936-3635 генома парвовируса В19, описанного в Shade et al., J. Virol. (1986) 58:921-936. Приблизительно 370 п.н. наблюдается в пределах фрагмента из 700 п.н. в нуклеотидных положениях 3073-3442. Фрагмент приблизительно из 4,7 т.п.н. представляет собой фрагмент из 4677 нуклеотидов, соответствующих нуклеотидным положениям 217-4893 по Shade et al., J. Virol. (1986) 58:921-936.
С целью амплификации фрагментов В19 приблизительно из 700 п.н., 370 п.н. и 214 п.н. использовали праймеры, показанные в таблице 1.
Для данного эксперимента ПЦР выполняли в конечном объеме 100 мкл с использованием 2 мкл очищенной ДНК парвовируса В19 (очищенной как описано выше), 0,2 мМ каждого дезоксинуклеотидтрифосфата и 1,25 единиц готовой к употреблению ДНК-полимеразы (Stratagene, La Jolla, CA). Профиль амплификации включал денатурацию при 94°С в течение 2 минут, отжиг праймера при 37°С в течение 3 минут и удлинение при 72°С в течение 3 минут, в течение 35 циклов. 3-минутная предварительная инкубация при 94°С для обеспечения первоначальной денатурации и конечная 7-минутная инкубация при 72°С для обеспечения полного удлинения фрагментов, предшествовала и следовала, соответственно, в течение 35 циклов ПЦР. Продукты ПЦР подвергали электрофорезу на 7% полиакриламидных гелях, окрашивали бромидом этидия и визуализировали под У/Ф источником. Очистку амплифицированных фрагментов выполняли с использованием набора QiaQuick PCR purification kit (QIAGEN).
Гнездную ПЦР для амплификации фрагмента В19 из 370 п.н. выполняли, если 700 п.н. полоса не визуализировалась на полиакриламидных гелях. Для гнездной ПЦР использовали материал ДНК из 700 п.н. с использованием праймеров, показанных в таблице 1.
Высокоразрешающую ПЦР (Roche) использовали для амплификации фрагментов парвовируса В19 из 4,7 т.п.н. следующим образом. Набор для высокоразрешающей ПЦР (Roche) и праймеры Hicks-5 (5'CCCGCCTTATGCAAATGGGCAG3') (SEQ ID NO:42) и Hicks-3 (5'TTGTGTTAGGCTGTCTTATAGG3') (SEQ ID NO:43) использовали в соответствии с рекомендациями продавца. Условия амплификации представляли собой 94°С в течение 1 минуты, 50°С в течение 2 минут и 68°С в течение 4 минут, в течение 35 или 45 циклов. Также были включены предварительная инкубация при 94°С в течение 2 минут и последующая инкубация при 75°С в течение 7 минут. Продукты ПЦР разделяли на 1% агарозных гелях и очищали с использованием набора ПЦР Purification kit (Promega, Madison, WI).
Пример 3
Клонирование фрагментов ДНК парвовируса В19
ПЦР-фрагменты клонировали в векторы TOPO-TA (Invitrogen, Carlsbad, CA). Клонирование в данные векторы сильно облегчается, если амплифицированная ДНК содержит единственный дезоксиаденозин (А) на своем 3'-конце. Соответственно, использовали каталитическую реакцию для добавления верхушки 3'(A). Реакционная смесь содержала 1,25 мМ dATP, 0,5 единиц Taq-полимеразы (Perkin Elmer, Boston, MA), и реакция протекала при 72°С в течение 15 минут.
ПЦР-Фрагменты клонировали в вектор pCR2.1-TOPO с использованием набора ТА cloning kit компании Invitrogen (TOPOТМ TA CloningR Kit с One Shot TOP10 Electrocompetent Cells), согласно описаниям производителя. Бактериальные клетки инкубировали при 37°С на планшетах с бульоном Luria, содержавших ампициллин в концентрации 100 мкг/мл, 0,66 мМ IPTG и 0,033% X-Gal. Ряд белых колоний инокулировали в 4 мл бульона Luria с ампициллином (100 мкг/мл) и инкубировали в течение ночи при 37°С при встряхивании. Три мл инкубированных в течение ночи культур использовали для изготовления ДНК-плазмиды с использованием набора QIAprep Miniprep kit (QIAGEN). Рекомбинантные клоны идентифицировали с помощью рестрикционного анализа с EcoRI (New England and Biolabs) и электрофореза в 7% полиакриламидном или 1% агарозном геле, как описано выше.
Для того, чтобы определить последовательности клонов ДНК, изготавливали большие количества плазмид из рекомбинантных клонов, как описано выше, и ДНК суспендировали в ТЕ (10 мМ Tris-HCl, рН 8,0, 1 мМ ЕДТА) в концентрации 0,2 мг/мл. Определение последовательности нуклеотидов фрагментов парвовируса В19 выполняли с использованием секвенатора ДНК Applied Biosystems модели 373 (или модели 377). Фиг.2А-2U (SEQ ID NO:1-21) изображают последовательности ДНК из 21 изолята парвовируса В19, очищенные, амплифицированные и секвенированные, как описано выше, которые соответствуют нуклеотидным положениям 2936-3635 генома парвовируса В19, описанного в Shade et al., J. Virol. (1986) 58:921-936 (фрагмент из 700 п.н., изображенный на фиг.1 и описанный выше). Фиг.2А (SEQ ID NO:1) представляет собой последовательность из изолята СН47-26; фиг.2В (SEQ ID NO:2) представляет собой последовательность из изолята СН48-29; фиг.2С (SEQ ID NO:3) представляет собой последовательность из изолята СН33-2; фиг.2D (SEQ ID NO:4) представляет собой последовательность из изолята СН33-3; фиг.2Е (SEQ ID NO:5) представляет собой последовательность из изолята СН33-4; фиг.2F (SEQ ID NO:6) представляет собой последовательность из изолята СН42-7; фиг.2G (SEQ ID NO:7) представляет собой последовательность из изолята СН42-18; фиг.2H (SEQ ID NO:8) представляет собой последовательность из изолята СН42-19; фиг.2I (SEQ ID NO:9) представляет собой последовательность из изолята СН46-23; фиг.2J (SEQ ID NO:10) представляет собой последовательность из изолята СН1-1; фиг.2K (SEQ ID NO:11) представляет собой последовательность из изолята СН1-6; фиг.2L (SEQ ID NO:12) представляет собой последовательность из изолята СН2-8; фиг.2M (SEQ ID NO:13) представляет собой последовательность из изолята СН2-10; фиг.2N (SEQ ID NO:14) представляет собой последовательность из изолята СН2-11C; фиг.2O (SEQ ID NO:15) представляет собой последовательность из изолята СН5-13; фиг.2P (SEQ ID NO:16) представляет собой последовательность из изолята СН7-22; фиг.2Q (SEQ ID NO:17) представляет собой последовательность из изолята СН13-17; фиг.2R (SEQ ID NO:18) представляет собой последовательность из изолята СН14-33; фиг.2S (SEQ ID NO:19) представляет собой последовательность из изолята СН62-2; фиг.2T (SEQ ID NO:20) представляет собой последовательность из изолята СН64-2 и фиг.2U (SEQ ID NO:21) представляет собой последовательность из изолята СН67-2.
Фиг.11А-11Z (SEQ ID NO:62-87) изображают последовательности ДНК из дополнительных 26 изолятов парвовируса В19, очищенные, амплифицированные и секвенированные, как описано выше, которые соответствуют нуклеотидным положениям 2936-3635 генома парвовируса В19, описанного в Shade et al., J. Virol. (1986) 58:921-936 (фрагмент из 700 п.н., изображенный на фиг.1 и описанный выше). Фиг.11А (SEQ ID NO:62) представляет собой последовательность из изолята СН80-1; фиг.11B (SEQ ID NO:63) представляет собой последовательность из изолята СН81-3; фиг.11C (SEQ ID NO:64) представляет собой последовательность из изолята B19SCL1-4; фиг.11D (SEQ ID NO:65) представляет собой последовательность из изолята B19SCL2-1; фиг.11E (SEQ ID NO:66) представляет собой последовательность из изолята B19SCL3-1; фиг.11F (SEQ ID NO:67) представляет собой последовательность из изолята B19SCL4-3; фиг.11G (SEQ ID NO:68) представляет собой последовательность из изолята B19SCL5-2; фиг.11H (SEQ ID NO:69) представляет собой последовательность из изолята B19SCL6-2; фиг.11I (SEQ ID NO:70) представляет собой последовательность из изолята B19SCL7-3; фиг.11J (SEQ ID NO:71) представляет собой последовательность из изолята B19SCL8-2; фиг.11K (SEQ ID NO:72) представляет собой последовательность из изолята B19SCL9-1; фиг.11L (SEQ ID NO:73) представляет собой последовательность из изолята B19SCL9-9; фиг.11M (SEQ ID NO:74) представляет собой последовательность из изолята B19SCL10-2; фиг.11N (SEQ ID NO:75) представляет собой последовательность из изолята B19SCL11-1; фиг.11O (SEQ ID NO:76) представляет собой последовательность из изолята B19SCL12-1; фиг.11P (SEQ ID NO:77) представляет собой последовательность из изолята B19SCL13-3; фиг.11Q (SEQ ID NO:78) представляет собой последовательность из изолята B19SCL14-1; фиг.11R (SEQ ID NO:79) представляет собой последовательность из изолята B19SCL15-3; фиг.11S (SEQ ID NO:80) представляет собой последовательность из изолята B19SCL16-2; фиг.11T (SEQ ID NO:81) представляет собой последовательность из изолята B19SCL17-1; фиг.11U (SEQ ID NO:82) представляет собой последовательность из изолята B19SCL18-1; фиг.11V (SEQ ID NO:83) представляет собой последовательность из изолята B19SCL19-1; фиг.11W (SEQ ID NO:84) представляет собой последовательность из изолята B19SCL20-3; фиг.11X (SEQ ID NO:85) представляет собой последовательность из изолята B19SCL21-3; фиг.11Y (SEQ ID NO:86) представляет собой последовательность из изолята B19SCL22-11; фиг.11Z (SEQ ID NO:87) представляет собой последовательность из изолята B19SCL2-14.
Сравнение последовательностей выявило 98%-99,5% гомологию последовательностей данной последовательности из 700 п.н. между различными изолятами.
Фиг.3А-3С (SEQ ID NO:22) показывают последовательность ПЦР-фрагмента приблизительно из 4,7 т.п.н., показанного на фиг.1 и описанного выше, из клона 2-В1 парвовируса В19. Последовательность, изображенная на данных фигурах, представляет собой фрагмент из 4677 нуклеотидов, соответствующий нуклеотидным положениям 217-4893, по Shade et al., J. Virol. (1986) 58:921-936. Изображенная последовательность содержит полную открытую рамку считывания парвовируса В19, которая кодирует NS1, VP1 и VP2, плюс дополнительные нетранслируемые последовательности 5' и 3'. Секвенированный фрагмент содержал дополнительный нуклеотид в 5' некодирующей области между нуклеотидными положениями 367 и 368 последовательности В19, описанной Shade et al., J. Virol. (1986) 58:921-936.
Фиг.4А-4С (SEQ ID NO:23) показывают последовательность ПЦР-фрагмента приблизительно из 4,7 т.п.н., показанного на фиг.1, из клона 2-В6 парвовируса В19. Последовательность представляет собой фрагмент из 4677 нуклеотидов, соответствующий нуклеотидным положениям 217-4893, по Shade et al., J. Virol. (1986) 58:921-936. Изображенная последовательность содержит полную открытую рамку считывания парвовируса В19, которая кодирует NS1, VP1 и VP2, плюс дополнительные нетранслируемые последовательности 5' и 3'. Секвенированный фрагмент содержал дополнительный нуклеотид в 5' некодирующей области между нуклеотидными положениями 367 и 368 последовательности В19, описанной Shade et al., J. Virol. (1986) 58:921-936.
Пример 4
Клонирование и экспрессия рекомбинантных белков NS1, VP1 и VP2 парвовируса В19
Фрагменты, кодирующие NS1, VP1 и VP2 (см. фиг.1), амплифицировали с использованием фрагмента парвовируса В19 из 4,7 т.п.н., клонированного в pCR2.1-TOPO (описано выше). В частности, ПЦР-праймеры (см. ниже) были сконструированы для осуществления ПЦР областей NS1, VP1 и VP2 парвовируса В19. Для облегчения клонирования указанных областей в экспрессирующие векторы дрожжей, в праймеры, как это требуется, были внесены сайты рестрикции XbaI, HindIII и SalI.
Праймеры, которые использовались для клонирования и амплификации фрагментов парвовируса В19 для экспрессии в дрожжах рекомбинантных белков NS1, VP1 и VP2, были основаны на последовательностях, полученных выше, и были следующими:
NS1-5 (смысловой праймер)
5'ATACTCTCTAGACAAAACAAAATGGAGCTATTTAGAGGGGTGCTTCAAGTTTCT3'
(SEQ ID NO:44)
NS1-3 (антисмысловой праймер)
5'GAGTATGTCGACTTACTCATAATCTACAAAGCTTTGCAATCCAGACAG3'
(SEQ ID NO:45)
VP1-5SN (смысловой праймер)
5'ATACTCAAGCTTACAAAACAAAATGAGTAAAGAAAGTGGCAAATGGTGGGAAAGT3'
(SEQ ID NO:46)
VPALL-3 (антисмысловой праймер)
5'GAGTATGTCGACTTACAATGGGTGCACACGGCTTTTGGCTGTCCACAATTC3'
(SEQ ID NO:47)
VP2-5SN (смысловой праймер)
5'ATACTCAAGCTTACAAAACAAAATGACTTCAGTTAATTCTGCAGAAGCCAGCACT3'
(SEQ ID NO:48)
ПЦР-праймеры синтезировали, очищали и суспендировали в 300 мкл dH2O и определяли их оптическую плотность на 260 нм. Реакционная смесь содержала 0,25 нг матрицы, 100 пмоль каждого праймера, 10 мкл 1,25 мМ каждого dNTP и 1 единицу Taq-полимеразы (Perkin Elmer, Boston, MA) в конечном объеме 50 мкл. Условия амплификации представляли собой 94°С в течение 1 минуты, 50°С в течение 2 минут и 68°С в течение 4 минут, в течение 35 циклов. Была включена последующая инкубация при 75°С в течение 7 минут для обеспечения полного удлинения фрагментов. Для проверки ПЦР-синтеза путем электрофореза в 1% агарозных гелях использовали аликвоты 5 мкл. Вест продукт ПЦР затем подвергали электрофорезу, а фрагменты ожидаемых размеров очищали с использованием набора ПЦР Purification kit (Promega, Madison, WI), согласно рекомендациям продавца. Приблизительно 0,8 мкг очищенной ПЦР ДНК расщепляли соответствующими рестрикционными ферментами (Roche) в течение 3 часов при 37°С, а продукты еще раз очищали с использованием набора ПЦР Purification kit компании Promega.
Для гетерологичной экспрессии рекомбинантных белков парвовируса В19 использовали плазмиду pBS24.1. Данный дрожжевой экспрессирующий вектор содержит 2 мк последовательности и инвертированные повторы (IR) для автономной репликации в дрожжах, терминатор α-фактора для обеспечения терминации транскрипции и дрожжевые leu2-d и URA3 для селекции. Точка начала репликации ColE1 и β-лактамазы также присутствуют для размножения и селекции в E.coli (Pichuantes et al. (1996) "Expression of Heterologous gene Products in Yeast". В источнике: Protein Engineering: A Guide to Design and Production, глава 5. J.L. Cleland and C. Craik, eds., Wiley-Liss, Inc., New York, N.Y., стр. 129-161. Плазмиду pBS24.1 расщепляли с использованием BamHI/SalI и дефосфорилировали 10 единицами щелочной фосфатазы кишечника теленка (Boheringer Manheim, Indianopolis, IN) в условиях, рекомендованных продавцом. Расщепленные и очищенные ПЦР-фрагменты смешивали с pBS24.1, расщепленной с использованием BamHI/SalI, и с фрагментом ДНК, содержащим дрожжевой гибридный промотор ADH2/GAPDH (Cousens et al., Gene (1987) 61:265-275), расщепленным с использованием BamHI/SfuI или BamHI/HindIII, в зависимости от сайтов рестрикции, присутствующих в ПЦР-фрагментах, подлежащих клонированию. Лигирование осуществляли с использованием набора и протокола Roche Rapid Ligation. Лигированную смесь затем использовали для трансформации компетентных клеток E.coli HB101, а трансформанты отбирали на планшетах с бульоном Luria, содержавших ампициллин в концентрации 100 мкг/мл, после инкубации в течение ночи при 37°С. Несколько колоний каждой трансформации собирали и инокулировали в 3 мл бульона Luria с ампициллином в концентрации 100 мкг/мл и инкубировали при 37°С при встряхивании в течение ночи.
Плазмидную ДНК изготавливали с использованием 1,5 мл культур и набора QIAprep Miniprep (QIAGEN). Рекомбинантные клоны идентифицировали с помощью рестрикционного анализа с BamHI/SalI. Для выполнения секвенирования с целью подтверждения нуклеотидной последовательности клонированных фрагментов парвовируса В19 изготавливали препараты рекомбинантных плазмид в большом количестве. Для трансформации дрожжей использовали дрожжевые экспрессирующие плазмиды, демонстрирующие ожидаемую последовательность для NS1, VP1 и VP2, следующим образом. Компетентные клетки Saccharomyces cerevisiae AD3 [Mat a, trp1+, ura3-52, prbl-1122, pep4-3, prcl-407, [cir0],::pDM15(pGAP/ADR1::G418R)], leu2(ΔAD)] трансформировали плазмидными ДНК, кодирующими NS1, VP1 или VP2, клонированными, как описано выше. Селекцию дрожжевых рекомбинантов осуществляли двумя циклами на планшетах без урацила, с последующим одним циклом на планшетах без лейцина, после инкубации при 30°С в течение 48-72 часов. Культуры затем выращивали на средах без лейцина, а затем на YEP с добавлением 2% глюкозы (Pichuantes et al., Proteins: Struct. Funct. Genet. (1989) 6:324-337) в течение 48 часов перед проверкой экспрессии рекомбинантных белков.
Последовательности для различных белков из двух разных изолятов показаны на фиг.5-10. В частности, фиг.5А (SEQ ID NO:24) и 5В (SEQ ID NO:25) показывают нуклеотидную и белковую последовательности NS1, соответственно, из клона 2-В1 парвовируса В19. Фиг.6А (SEQ ID NO:26) и 6В (SEQ ID NO:27) показывают нуклеотидную и белковую последовательности VP1, соответственно, из клона 2-В1 парвовируса В19. Фиг.7А (SEQ ID NO:28) и 7В (SEQ ID NO:29) показывают нуклеотидную и белковую последовательности VP2, соответственно, из клона 2-В1 парвовируса В19. Фиг.8А (SEQ ID NO:30) и 8В (SEQ ID NO:31) показывают нуклеотидную и белковую последовательности NS1, соответственно, из клона 2-В6 парвовируса В19. Фиг.9А (SEQ ID NO:32) и 9В (SEQ ID NO:33) показывают нуклеотидную и белковую последовательности VP1, соответственно, из клона 2-В6 парвовируса В19. Фиг.10А (SEQ ID NO:34) и 10В (SEQ ID NO:35) показывают нуклеотидную и белковую последовательности VP2, соответственно, из клона 2-В6 парвовируса В19.
Пример 5
Обнаружение и количественное определение ДНК парвовируса В19 посредством TaqManTM
Чувствительный диагностический способ для обнаружения инфицирования парвовирусом В19 был построен следующим образом. В частности, для обнаружения и количественного определения ДНК парвовируса В19 использовали технологию ПЦР TaqManTM. Количественная ПЦР требует эффективной экстракции нуклеиновой кислоты. Объем плазмы/сыворотки, используемый для экстракции ДНК, также влияет на чувствительность обнаружения. Для выделения нуклеиновой кислоты из 0,5 мл плазмы/сыворотки использовали два подхода. В частности, ДНК экстрагировали (а) связыванием с диоксидом кремния и (b) отжигом со специфичными в отношении мишени олигонуклеотидами.
(а) Выделение нуклеиновой кислоты связыванием с диоксидом кремния
В присутствии высоких концентраций хаотропной соли, такой как изотиоцианат гуанидиния, нуклеиновые кислоты связываются с диоксидом кремния. Нуклеиновые кислоты маленького размера более эффективно связываются с диоксидом кремния при кислых величинах рН. Связанные нуклеиновые кислоты эффективно элюируются слабосолевым буфером с щелочным значеним рН при высоких температурах. Замена обычного диоксида кремния на намагниченный диоксид кремния сильно облегчает стадии промывки и элюирования при выделении нуклеиновых кислот. Магнитную основу использовали для захвата частиц нуклеиновых кислот, связанных с диоксидом кремния, избавляясь, таким образом, от центрифугирования, которое требуется для осаждения частиц с обычным диоксидом кремния.
Использовали лизисный буфер от Organon-Teknika (Durham, NC). Указанный лизисный буфер содержит изотиоцианат гуанидиния для солюбилизации белков и инактивации РНКаз и ДНКаз. Детергент Triton X-100 еще более облегчает процесс солюбилизации и дезинтеграции клеточной структуры и ядерных белков, высвобождая, таким образом, нуклеиновую кислоту. Лизисный реагент подкисляли для усиления связывания нуклеиновой кислоты и использовали 50 мкл щелочного элюирующего буфера для элюирования связанной нуклеиновой кислоты. После выделения нуклеиновой кислоты определяли наличие парвовирусной ДНК с помощью ПЦР TaqManTM, как описано ниже.
(b) Выделение нуклеиновой кислоты отжигом со специфичными в отношении мишени олигонуклеотидами
Несмотря на то, что использование намагниченного диоксида кремния сильно облегчает быстрые и легкие манипуляции на стадиях промывки и элюирования, выделение нуклеиновой кислоты все еще остается трудоемким и длительным процессом. Поэтому использовали одноэтапный захват специфичной нуклеиновой кислоты-мишени из плазмы или сыворотки с использованием магнитных гранул. Для того, чтобы указанный способ можно было применять для тестов по захвату обширного ряда вирусных нуклеиновых кислот, использовали обычные магнитные гранулы, с присоединенными олиго dT. Магнитные олиго (dT) гранулы Sera-Mag (Seradyn, Indianopolis, IN) с длиной олиго dT 14 мономеров использовали в комбинации с олигонуклеотидами-ловушками, содержащими 20 поли А на 3'-конце, смежные с используемой парвовирус-специфичной последовательностью (обозначенной на конце последовательности, описанной ниже).
Использованные антисмысловые олигонуклеотиды-ловушки были получены из фрагмента из 700 п.н. и были следующими:
VSPC1 - AAAAAAAAAAAAAAAAAAAAATCCTTAACAGCAATTTCTGATA (nt 3492-3513)(*) (SEQ ID NO:49)
VSPC2 - AAAAAAAAAAAAAAAAAAAACGCCCTGTAGTGCTGTCAG (nt 3549-3568) (SEQ ID NO:50)
VSPC3 - AAAAAAAAAAAAAAAAAAAATATACCCAAATAGGAAGTTCTG (nt 3639-3660) (SEQ ID NO:51)
VSPC4 - AAAAAAAAAAAAAAAAAAAATAAAATGCTGATTCTTCACTTGC (nt 3737-3759) (SEQ ID NO:52)
VSPC5 - AAAAAAAAAAAAAAAAAAAATGCTGTACCTCCTGTACCTA (nt 3789-3808) (SEQ ID NO:53)
VSPC6 - AAAAAAAAAAAAAAAAAAAAAGCCCTCTAAATTTTCTGGG (nt 3838-3857) (SEQ ID NO:54)
VSPC7 - AAAAAAAAAAAAAAAAAAAACTCCTAATGTGTCAGGAACC (nt 3910-3929) (SEQ ID NO:55)
(*) Нумерация нуклеотидов по Shade et al., J. Virol. (1986) 58:921-936.
Магнитные гранулы суспендировали в лизисном буфере Novagen (Madison, WI) и серию из семи олигонуклеотидов-ловушек (VSPC1-VSPC7, описаны выше) испытывали по отдельности или в комбинации для захвата ДНК парвовируса В19 из панели, полученной из центра FDA Center for Biologic Evaluation and Research (FDA-CBER) департамента здравоохранения США.
(c) Промывка гранул промывающим буфером
После захвата гранулы промывали буфером, содержавшим 10 мМ Hepes с величиной рН, доведенной до 7,5, в 0,3 М NaCl и 0,5% NP-40. После обработки сыворотки лизисным буфером, гибридизации, магнитной адсорбции гранул и удаления лизисного буфера, к гранулам добавляли 1,5 мл промывающего буфера. После обычного перемешивания с использованием вихревой воронки, магнитной адсорбции и удаления промывающего буфера, гранулы промывали второй раз с использованием 0,5 мл того же буфера, так, чтобы магнитные гранулы можно было получить в компактном виде для легкого суспендирования в 100 мл универсального буфера для ПЦР, содержащего все реагенты для анализа Taqman. Гранулы с захваченной ДНК переносили на планшет для обнаружения посредством ПЦР TaqManTM, как описано ниже. Несколько олигонуклеотидных комбинаций оказались эффективными для захвата В19, как было установлено в анализе TaqManTM.
В частности, технология TaqManTM амплифицирует захваченную нуклеиновую кислоту-мишень в виде ДНК-ампликонов. Альтернативой является амплификация захваченной мишени в виде РНК. Для этого олигонуклеотиды для амплификации состояли из праймера, специфичного в отношении парвовируса В19, с промоторной последовательностью Т7, с целью генерировать РНК-ампликоны с использованием РНК-полимеразы Т7. Три праймера для амплификации (VSA1-A3, описаны ниже), полученных из последовательности из 700 п.н., соответствующей нуклеотидным положениям 2936-3635 генома парвовируса В19, описанного в Shade et al., J. Virol. (1986) 58:921-936, испытывали на предмет их способности к амплификации. Праймеры были следующими:
Смысловые праймеры для амплификации цепи
VSA1 - AATTCTAATACGACTCACTATAGGGAGAAGGCCATATACTCATTGGACTGT (nt 2942-2961) (SEQ ID NO:56)
VSA2 - AATTCTAATACGACTCACTATAGGGAGAAGGCCAGAGCACCATTATAA (nt 3272-3288) (SEQ ID NO:57)
VSA3 - AATTCTAATACGACTCACTATAGGGAGAAGGCACAATGCCAGTGGAAA (nt 3317-3333) (SEQ ID NO:58)
VSP2 - GTGCTGAAACTCTAAAGGT (антисмысловой праймер - nt 3424-3442) (SEQ ID NO:59)
Набор реагентов RNamplifire (Qiagen) использовали для изучения эффективности амплификации с использованием 50 копий ДНК парвовируса В19 в качестве мишени, в конечном объеме 20 мл. Праймеры для амплификации испытывали по отдельности или в комбинации, с использованием VSP2 в качестве второго праймера. После одного часа инкубации при 42°С, как рекомендует производитель, аликвоту амплифицированного материала разводили в 100 раз для обнаружения посредством анализа TaqManTM, для оценки эффективности праймеров для амплификации.
Комбинация двух праймеров для амплификации, VSA2 и VSA3, с VSР2 оказалась высокоэффективной для генерации РНК-ампликонов.
Чувствительность анализа TaqManTM, удобство ПЦР-праймеров и оптимальные условия реакции устанавливали с использованием плазмидной ДНК, содержащей фрагмент из 4,7 т.п.н., описанный выше. Указанный фрагмент включает область VP1, а также области NS1 и VP2 (см. фиг.1). Использовали праймеры для ПЦР-амплификации, полученные из области VP1, как подробно описано ниже. Нумерация представлена согласно Shade et al., J. Virol. (1986) 58:921-936. Х представляет фосфорамидит 5'-флуоресцеина, а Z представляет DABCYL-dT, оба получены от компании Glen Research Corporation, Sterling, VA. Числа, указанные справа от последовательности, относятся к нуклеотидам в праймерах из последовательности парвовируса В19.
VSP1 - GGAGGCAAAGGTTTGCA (смысловой праймер - nt 3334-3350) (SEQ ID NO:60)
VSP2 - GTGCTGAAACTCTAAAGGT (антисмысловой праймер - nt 3424-3442) (SEQ ID NO:59)
VSPPR1 - XCCCATGGAGATATTTAGATTZ (зонд - nt 3379-3398) (SEQ ID NO:61)
Vpara 8: TCCATATGACCCAGAGCACCA (nt 3262-3460) (SEQ ID NO:88)
Vpara 9: TTTCCACTGGCATTGTGGC (антисмысловой праймер - nt 3313-3331) (SEQ ID NO:89)
Vpara 10: X AGCTAGACCTGCATGTCACTG Z, где Х представляет собой Fam, а Z представляет собой Tamra. (nt 3286-3310) (SEQ ID NO:90)
Концентрацию плазмидной ДНК оценивали спектрофотометрически и выполняли серию разведений для получения 5000 - 10 копий/20 мкл. Реакционная смесь в конечном объеме 50 мкл содержала 20 мкл образца, 1Х буфера для амплификации Gold Taq (Perkin Elmer) c 3,2 мМ MgCl2, 300 мкМ каждого из dNTP, 1 пмоль каждого из праймеров для амплификации, 0,4 пмоль зонда и 1 единицу фермента AmpliTaq. Условия реакции включали 10 минут при 95°С для активации фермента, с последующими 45 циклами по 30 секунд при температуре 95°С, перемежающейся с 60°С, на детекторе последовательностей ABI 7700.
С использованием пары праймеров VSP1 и VSP2, которые генерировали ПЦР-продукт из 109 п.н., и зонд VSPPR1 поддавались обнаружению 10 копий на анализ. Поскольку объем образца составлял 20 мкл в конечном объеме 50 мкл, это позволяет предположить, что образцы плазмы, содержащие всего 50 копий/мл ДНК парвовируса В19, можно экстрагировать и выявлять в них вирус с помощью технологии TaqManTM. Поскольку парвовирус представляет собой вирус с высоким титром, объемы плазмы/сыворотки в 50 мкл можно экстрагировать и использовать для анализа.
При использовании положительного образца ДНК парвовируса В19 FDA-CBER (106 копий/мл) технология TaqManTM обнаруживала всего 50 копий в анализе. Пытаясь скоррелировать нуклеиновую кислоту и иммунный титр, нагрузку вирусной ДНК количественно определяли в нескольких образцах, положительных на наличие антител.
Соответственно, раскрыты новые последовательности парвовируса В19 человека и анализы, в которых используются указанные последовательности. Из вышеизложенного будет ясно, что, несмотря на то, что для целей иллюстрации в настоящей заявке были описаны конкретные варианты осуществления настоящего изобретения, можно производить различные модификации, не отклоняясь от его идеи и объема.
Claims (28)
1. Способ выявления парвовируса В19 человека в биологическом образце, включающий:
выделение нуклеиновых кислот из биологического образца, предположительно содержащего парвовирус человека, путем взаимодействия твердой подложки, включающей связанные с ней захваченные парвовирус-специфичные нуклеиновые кислоты, с биологическим образцом в условиях гибридизации, при этом цепи нуклеиновой кислоты-мишени, если присутствуют в биологическом образце, гибридизуются с захваченными нуклеиновыми кислотами, и отделения твердой подложки от образца;
амплификацию выделенных нуклеиновых кислот с использованием смыслового и антисмыслового праймера, при этом каждый из праймеров не превышает в длину 60 нуклеотидов и в достаточной степени комплементарен части антисмысловой и смысловой цепей, соответственно, нуклеиновой кислоты-мишени для возможности гибридизации с ней; и где
(а) смысловой праймер включает (i) SEQ ID NO:60 или нуклеотидную последовательность, обладающую по крайней мере 90%-ной идентичностью по последовательности к ней, или (ii) SEQ ID NO:88 или нуклеотидную последовательность, обладающую по крайней мере 90%-ной идентичностью по последовательности к ней, и
(b) антисмысловой праймер включает (i) SEQ ID NO:59 или нуклеотидную последовательность, обладающую по крайней мере 90%-ной идентичностью по последовательности к ней в случае, когда смысловой праймер включает SEQ ID NO:60 или нуклеотидную последовательность, обладающую по крайней мере 90%-ной идентичностью по последовательности к ней, или (ii) SEQ ID NO:89 или нуклеотидную последовательность, обладающую по крайней мере 90%-ной идентичностью по последовательности к ней в случае, когда смысловой праймер включает SEQ ID NO:88 или нуклеотидную последовательность, обладающую по крайней мере 90%-ной идентичностью по последовательности к ней; и
выявление наличия амплифицированных нуклеиновых кислот как показателя наличия парвовируса В19 человека в образце.
2. Способ по п.1, отличающийся тем, что твердая подложка включает гранулы.
3. Способ по п.2, отличающийся тем, что гранулы представляют собой магнитные гранулы.
4. Способ по любому из пп.1-3, отличающийся тем, что захваченная нуклеиновая кислота дополнительно включает гомополимерную цепь для связывания захваченной нуклеиновой кислоты с твердой подложкой.
5. Способ по п.4, отличающийся тем, что гомополимерная цепь представляет собой поли А-цепь.
6. Способ по любому из пп.1-3, отличающийся тем, что захваченные нуклеиновые кислоты включают один или более олигонуклеотидов, выбранных из группы, состоящей из олигонуклеотида с последовательностью TCCTTAACAGCAATTTCTGATA, олигонуклеотида с последовательностью CGCCCTGTAGTGCTGTCAG, олигонуклеотида с последовательностью TATACCCAAATAGGAAGTTCTG, олигонуклеотида с последовательностью TGCTGATTCTTCACTTGC, олигонуклеотида с последовательностью TGCTGTACCTCCTGTACCTA, олигонуклеотида с последовательностью GCCCTCTAAATTTTCTGGG, олигонуклеотида с последовательностью CTCCTAATGTGTCAGGAACC, олигонуклеотида, обладающего по крайней мере 90%-ной идентичностью по последовательности к олигонуклеотиду с последовательностью TCCTTAACAGCAATTTCTGATA, олигонуклеотида, обладающего по крайней мере 90%-ной идентичностью по последовательности к олигонуклеотиду с последовательностью CGCCCTGTAGTGCTGTCAG, олигонуклеотида, обладающего по крайней мере 90%-ной идентичностью по последовательности к олигонуклеотиду с последовательностью TATACCCAAATAGGAAGTTCTG, олигонуклеотида, обладающего по крайней мере 90%-ной идентичностью по последовательности к олигонуклеотиду с последовательностью TGCTGATTCTCCACTTGC, олигонуклеотида, обладающего по крайней мере 90%-ной идентичностью по последовательности к олигонуклеотиду с последовательностью TGCTGTACCTCCTGTACCTA, олигонуклеотида, обладающего по крайней мере 90%-ной идентичностью по последовательности к олигонуклеотиду с последовательностью GCCCTCTAAATTTTCTGGG, олигонуклеотида, обладающего по крайней мере 90%-ной идентичностью по последовательности к олигонуклеотиду с последовательностью CTCCTAATGTGTCAGGAACC.
7. Способ по любому из пп.1-3, отличающийся тем, что захваченные нуклеиновые кислоты включают один или более олигонуклеотидов, выбранных из группы, состоящей из олигонуклеотида с SEQ ID NO:49, олигонуклеотида с SEQ ID NO:50, олигонуклеотида с SEQ ID NO:51, олигонуклеотида с SEQ ID NO: 52, олигонуклеотида с SEQ ID NO: 53, олигонуклеотида SEQ ID NO:54, олигонуклеотида с SEQ ID NO:55, олигонуклеотида, обладающего по крайней мере 90%-ной идентичностью по последовательности к SEQ ID NO:49, олигонуклеотида, обладающего по крайней мере 90%-ной идентичностью по последовательности к SEQ ID NO:50, олигонуклеотида, обладающего по крайней мере 90%-ной идентичностью по последовательности к SEQ ID NO:51, олигонуклеотида, обладающего по крайней мере 90%-ной идентичностью по последовательности к SEQ ID NO:52, олигонуклеотида, обладающего по крайней мере 90%-ной идентичностью по последовательности к SEQ ID NO:53, олигонуклеотида, обладающего по крайней мере 90%-ной идентичностью по последовательности к SEQ ID NO:54, олигонуклеотида, обладающего по крайней мере 90%-ной идентичностью по последовательности к SEQ ID NO:55.
8. Способ по любому из пп.1-3, отличающийся тем, что амплификация включает ОТ-ПЦР, амплификацию, опосредованную транскрипцией, флуорогенный анализ с 5'-нуклеазой или их сочетания.
9. Способ по п.8, отличающийся тем, что амплификация включает флуорогенный анализ с 5'-нуклеазой с использованием смыслового праймера и антисмыслового праймера и выявление осуществляют с использованием по крайней мере одного зонда, включающего выявляемую метку.
10. Способ по п.9, отличающийся тем, что выявляемая метка представляет собой флуоресцентную метку, выбранную из группы, состоящей из 6-карбоксифлуоресцеина (6-FAM), тетраметилродамина (TAMRA) и 2', 4', 5', 7'-тетрахлор-4-7-дихлорфлуоресцеина (ТЕТ).
11. Способ по п.10, отличающийся тем, что зонд дополнительно включает выявляемые метки на 5'-конце и 3'-конце.
12. Способ по п.11, отличающийся тем, что по крайней мере один зонд не превышает в длину 50 нуклеотидов и включает (i) нуклеотидную последовательность SEQ ID NO:61 в случае, когда смысловой праймер включает SEQ ID NO:60 или нуклеотидную последовательность, обладающую по крайней мере 90%-ной идентичностью по последовательности к ней, или (и) нуклеотидную последовательность SEQ ID NO:93 в случае, когда смысловой праймер включает SEQ ID NO:88 или нуклеотидную последовательность, обладающую по крайней мере 90%-ной идентичностью по последовательности к ней.
13. Способ по любому из пп.1-3, отличающийся тем, что присутствует внутренняя контрольная последовательность.
14. Способ по п.13, отличающийся тем, что внутренняя контрольная последовательность получена из нуклеотидной последовательности SEQ ID NO:92.
15. Способ по п.14, отличающийся тем, что дополнительно включает выявляемую меченую последовательность зонда для внутренней контрольной последовательности.
16. Способ выявления парвовируса В19 человека в биологическом образце с использованием флуорогенного анализа с 5'-нуклеазой, включающий:
(а) выделение нуклеотидных кислот из биологического образца, предположительно содержащего парвовирус В19 человека, путем взаимодействия магнитных гранул, включающих связанные с ними захваченные нуклеиновые кислоты, с биологическим образцом в условиях гибридизации, при этом цепи нуклеиновой кислоты, если присутствуют в биологическом образце, гибридизуются с захваченными нуклеиновыми кислотами, при этом захваченные нуклеиновые кислоты включают один или более олигонуклеотидов, выбранных из группы, состоящей из SEQ ID NO:49-55, и отделения магнитных гранул от образца;
(b) амплификацию нуклеиновых кислот с использованием смыслового и антисмыслового праймеров, при этом каждый из праймеров не превышает в длину 60 нуклеотидов и в достаточной степени комплементарен части смысловой и антисмысловой цепей, соответственно, выделенной нуклеиновой кислоты для возможности гибридизации с ней, при этом (i) смысловой праймер включает SEQ ID NO:60 и антисмысловой праймер включает SEQ ID NO:59 или (ii) смысловой праймер включает SEQ ID NO:88 и антисмысловой праймер включает SEQ ID NO:89; и
(c) выявление наличия амплифицированных нуклеиновых кислот с использованием зонда, не превышающего в длину 50 нуклеотидов, который включает (i) нуклеотидную последовательность SEQ ID NO:61 в случае, когда смысловой праймер включает SEQ ID NO:60, или (ii) нуклеотидную последовательность SEQ ID NO:93 в случае, когда смысловой праймер включает SEQ ID NO:88 как показателя наличия парвовируса В19 человека в образце.
17. Способ по п.16, отличающийся тем, что присутствует внутренняя контрольная последовательность.
18. Способ по п.17, отличающийся тем, что внутренняя контрольная последовательность получена из нуклеотидной последовательности SEQ ID NO:92.
19. Способ по п.18, отличающийся тем, что дополнительно включает выявляемую меченую последовательность зонда для внутренней контрольной последовательности.
20. Набор для выявления парвовируса В19 человека в биологическом образце, включающий:
захваченные нуклеиновые кислоты, включающие один или более олигонуклеотидов, выбранных из группы, состоящей из SEQ ID NO:49-55;
пару олигонуклеотидных праймеров, при этом каждый из олигонуклеотидных праймеров не превышает в длину 60 нуклеотидов и (i) один из олигонуклеотидных праймеров включает SEQ ID NO:60 и другой олигонуклеотидный праймер включает SEQ ID NO:59 или (ii) один из олигонуклеотидных праймеров включает SEQ ID NO:88 и другой олигонуклеотидный праймер включает SEQ ID NO:89; и
письменные инструкции для идентификации наличия парвовируса В19 человека.
21. Набор по п.20, отличающийся тем, что дополнительно включает полимеразу и буферы.
22. Набор по п.20, отличающийся тем, что дополнительно включает по крайней мере один олигонуклеотидный зонд, включающий выявляемую метку.
23. Набор по п.22, отличающийся тем, что выявляемая метка представляет собой флуоресцентную метку, выбранную из группы, состоящей из 6-карбоксифлуоресцеина (6-FAM), тетраметилродамина (TAMRA) и 2', 4', 5', 7'-тетрахлор-4-7-дихлорфлуоресцеина (ТЕТ).
24. Набор по п.23, отличающийся тем, что зонд дополнительно включает выявляемые метки на 5'-конце и 3'-конце.
25. Набор по п.24, отличающийся тем, что по крайней мере один зонд не превышает в длину 50 нуклеотидов и включает (i) нуклеотидную последовательность SEQ ID NO:61 в случае, когда один из олигонуклеотидных праймеров включает SEQ ID NO:60, или (ii) нуклеотидную последовательность SEQ ID NO:93 в случае, когда один из олигонуклеотидных праймеров включает SEQ ID NO:88.
26. Набор по п.20, отличающийся тем, что дополнительно включает внутреннюю контрольную последовательность, полученную из нуклеотидной последовательности SEQ ID NO:92.
Приоритет по пунктам формулы изобретения:
28.06.2001 - признаки, ассоциированные с SEQ ID NO:59, 60 и 61.
29.03.2002 - признаки, ассоциированные с SEQ ID NO:88, 89 и 93.
Applications Claiming Priority (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US30207701P | 2001-06-28 | 2001-06-28 | |
| US60/302,077 | 2001-06-28 | ||
| US36595602P | 2002-03-19 | 2002-03-19 | |
| US60/365,956 | 2002-03-19 | ||
| US36922402P | 2002-03-29 | 2002-03-29 | |
| US60/369,224 | 2002-03-29 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2004102205A RU2004102205A (ru) | 2005-06-10 |
| RU2301263C2 true RU2301263C2 (ru) | 2007-06-20 |
Family
ID=28794978
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2004102205/13A RU2301263C2 (ru) | 2001-06-28 | 2002-06-28 | Способ выявления парвовируса b19 человека в биологическом образце (варианты) и набор для его осуществления |
Country Status (20)
| Country | Link |
|---|---|
| US (2) | US6936442B2 (ru) |
| EP (1) | EP1537235B1 (ru) |
| JP (5) | JP2005511004A (ru) |
| KR (2) | KR100944674B1 (ru) |
| CN (1) | CN1324147C (ru) |
| AU (2) | AU2002318450B2 (ru) |
| BG (1) | BG66283B1 (ru) |
| BR (1) | BRPI0211191B8 (ru) |
| CA (2) | CA2779653C (ru) |
| CZ (1) | CZ308201B6 (ru) |
| ES (1) | ES2537549T3 (ru) |
| HK (1) | HK1080516B (ru) |
| HU (1) | HU230244B1 (ru) |
| MX (1) | MXPA03011802A (ru) |
| NO (1) | NO337901B1 (ru) |
| NZ (1) | NZ530602A (ru) |
| PL (1) | PL210849B1 (ru) |
| RU (1) | RU2301263C2 (ru) |
| SK (1) | SK15752003A3 (ru) |
| WO (1) | WO2003002753A2 (ru) |
Families Citing this family (26)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2456715A1 (en) | 2001-08-31 | 2003-03-13 | Gen-Probe Incorporated | Assay for detection of human parvovirus b19 nucleic acid |
| US8288523B2 (en) | 2003-09-11 | 2012-10-16 | Ibis Biosciences, Inc. | Compositions for use in identification of bacteria |
| WO2005071401A2 (en) * | 2004-01-15 | 2005-08-04 | Chiron Corporation | Homogeneous multiplex assay for nucleic acid targets |
| EP1799856A4 (en) * | 2004-09-10 | 2009-03-04 | Focus Diagnostics Inc | METHOD AND COMPOSITIONS FOR DETECTING ERYTHROVIRUS GENOTYPES |
| JP5192238B2 (ja) * | 2004-11-09 | 2013-05-08 | ジェン−プローブ・インコーポレーテッド | A群連鎖球菌属を検出するための組成物及び方法 |
| US7572584B2 (en) * | 2005-06-02 | 2009-08-11 | The United States Of America As Represented By The U.S. Environmental Protection Agency | Species-specific primer sets and identification of species-specific DNA sequences using genome fragment enrichment |
| US8058000B2 (en) | 2005-06-02 | 2011-11-15 | The United States Of America As Represented By The U.S. Environmental Protection Agency | Species-specific primer sets and identification of species-specific DNA sequences using genome fragment enrichment |
| DE102006034844B3 (de) * | 2006-07-27 | 2007-12-06 | DRK-Blutspendedienst Baden-Württemberg-Hessen gGmbH | Zusammensetzungen und Verfahren zur Amplifikation von Hepatitis A-Viren (HAV) und/oder Parvoviren B19 (PB19) mittels Multiplex-PCR |
| CA2673770A1 (en) * | 2007-01-16 | 2008-07-24 | Talecris Biotherapeutics, Inc. | Human erythrovirus |
| WO2009038840A2 (en) * | 2007-06-14 | 2009-03-26 | Ibis Biosciences, Inc. | Compositions for use in identification of adventitious contaminant viruses |
| US8227583B2 (en) * | 2007-06-14 | 2012-07-24 | The Board Of Regents For Oklahoma State University | Vaccines containing canine parvovirus genetic variants |
| RU2519210C2 (ru) * | 2007-06-14 | 2014-06-10 | Дзе Борд Оф Риджентс Фор Оклахома Стейт Юниверсити | Вакцины, содержащие генетические варианты парвовируса собак |
| EP2300819A4 (en) * | 2008-07-23 | 2011-11-23 | Nat Univ Gyeongsang Iacf | METHOD AND SYSTEM FOR VIRAL DIAGNOSIS |
| EP3705486B1 (en) | 2009-02-26 | 2022-11-16 | Gen-Probe Incorporated | Assay for detection of human parvovirus nucleic acid |
| US9598739B1 (en) | 2009-03-13 | 2017-03-21 | Grifols Therapeutics Inc. | Human erythrovirus |
| WO2011127316A1 (en) * | 2010-04-07 | 2011-10-13 | Novartis Ag | Method for generating a parvovirus b19 virus-like particle |
| CA3113828A1 (en) * | 2011-07-15 | 2013-01-24 | Gen-Probe Incorporated | Compositions and method for detecting human parvovirus nucleic acid and for detecting hepatitis a virus nucleic acids in single-plex or multiplex assays |
| CN103451320B (zh) * | 2013-08-09 | 2015-05-06 | 中国人民解放军军事医学科学院野战输血研究所 | 人细小病毒B19三种基因型的实时荧光定量PCR检测方法及其通用检测引物、TaqMan探针与试剂盒 |
| US9410172B2 (en) * | 2013-09-16 | 2016-08-09 | General Electric Company | Isothermal amplification using oligocation-conjugated primer sequences |
| CA2977760A1 (en) | 2014-03-10 | 2015-09-17 | University Of Louisville Research Foundation, Inc. | Compositions and methods for treating, including preventing, parvovirus infections and related diseases |
| CN103820581B (zh) * | 2014-03-17 | 2016-01-13 | 成都蓉生药业有限责任公司 | 一种检测人细小病毒b19的试剂盒和方法 |
| JP6414409B2 (ja) * | 2014-07-29 | 2018-10-31 | 株式会社微生物化学研究所 | 弱毒化パルボウイルスおよび弱毒化パルボウイルスを用いたワクチン |
| WO2016071926A1 (en) * | 2014-11-05 | 2016-05-12 | Indian Council Of Medical Research | In-vitro detection of human parvovirus 4 |
| TWI735433B (zh) | 2015-03-27 | 2021-08-11 | 美商再生元醫藥公司 | 偵測生物污染物之組成物及方法 |
| CN105158471A (zh) * | 2015-08-24 | 2015-12-16 | 北京中检安泰诊断科技有限公司 | 人细小病毒B19型IgM抗体检测试剂盒及其制备方法 |
| CN114410836B (zh) * | 2021-12-17 | 2024-03-01 | 上海交通大学医学院附属仁济医院 | 一种集样本处理、核酸提取及多重恒温扩增一体化的检测人细小病毒b19的试剂盒和方法 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6004044A (en) * | 1995-05-03 | 1999-12-21 | Itt Cannon, Inc. | Optoelectric connector |
| RU2146372C1 (ru) * | 1998-04-16 | 2000-03-10 | Гематологический научный центр РАМН | Способ определения парвовируса б19 |
Family Cites Families (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5516630A (en) | 1983-09-30 | 1996-05-14 | The United States Of America As Represented By The Department Of Health And Human Services | Methods of detecting hepatitis A virus |
| US5283174A (en) | 1987-09-21 | 1994-02-01 | Gen-Probe, Incorporated | Homogenous protection assay |
| CA2020958C (en) * | 1989-07-11 | 2005-01-11 | Daniel L. Kacian | Nucleic acid sequence amplification methods |
| US6379885B1 (en) * | 1989-09-14 | 2002-04-30 | Rijksuniversiteit Te Leiden | Human parvovirus B19 proteins and virus-like particles, their production and their use in diagnostic assays and vaccines |
| US6204044B1 (en) * | 1989-09-14 | 2001-03-20 | Caroline Sarah Brown | Human parvovirus B19 proteins and virus-like particles, their production and their use in diagnostic assays and vaccines |
| NL8902301A (nl) | 1989-09-14 | 1991-04-02 | Rijksuniversiteit | Humaan parvovirus b19 eiwitten, hun produktie en hun gebruik in diagnostische assays en vaccins. |
| DE4003826C2 (de) | 1990-02-08 | 1995-11-23 | Mikrogen Molekularbiol Entw | Peptide der Kapsidproteine VP1 oder VP2 des Parvovirus B19 |
| WO1994010294A1 (en) | 1992-10-23 | 1994-05-11 | New York University | Human monoclonal antibodies to human parvovirus and methods of making and using thereof |
| US5449608A (en) | 1993-03-22 | 1995-09-12 | The United States Of America As Represented By The Department Of Health And Human Services | Parvovirus B19 receptor and parvovirus B19 detection |
| JPH06293798A (ja) | 1993-04-06 | 1994-10-21 | Shin Etsu Chem Co Ltd | ヒトパルボウイルスb19のエピトープ関連ペプチド |
| US5538848A (en) * | 1994-11-16 | 1996-07-23 | Applied Biosystems Division, Perkin-Elmer Corp. | Method for detecting nucleic acid amplification using self-quenching fluorescence probe |
| WO1996009391A2 (en) | 1994-09-22 | 1996-03-28 | Hans Wolf | Dna sequence and protein of the non-structural reading frame i of the human parvovirus b19 |
| JPH0910000A (ja) | 1995-06-26 | 1997-01-14 | Nippon Sekijiyuujishiya | ヒトパルボウイルスの検出方法及びそのための試薬 |
| AU710395B2 (en) * | 1995-11-13 | 1999-09-16 | Shionogi & Co., Ltd. | Diagnosis of coronary artery spasm-associated diseases |
| WO1997021346A1 (en) | 1995-12-14 | 1997-06-19 | Cerus Corporation | Inactivation of non-enveloped virus |
| US6094338A (en) * | 1997-07-09 | 2000-07-25 | Mitsubishi Chemical Corporation | Electric double-layer capacitor |
| WO1999018227A1 (en) | 1997-10-08 | 1999-04-15 | Advanced Research And Technology Institute | Chimeric parvovirus-based recombinant vector system that specifically targets the erythroid lineage |
| DE19752898A1 (de) | 1997-11-28 | 1999-08-05 | Centeon Pharma Gmbh | Verfahren zum Nachweis hoher Vierenkonzentrationen im Blutplasma und/oder Blutserum mittels der Polymerasekettenreaktion |
| EP1053348B1 (en) * | 1998-02-04 | 2010-06-02 | Life Technologies Corporation | Determination of a genotype of an amplification product at multiple allelic sites |
| US6238860B1 (en) * | 1998-11-05 | 2001-05-29 | Dyax Corp. | Binding moieties for human parvovirus B19 |
| US6642033B1 (en) | 1999-07-20 | 2003-11-04 | V.I. Technologies, Inc. | Nucleic acids for detecting parvovirus and methods of using same |
| US6294338B1 (en) * | 1999-07-23 | 2001-09-25 | Gen-Probe Incorporated | Polynucleotide amplification method |
-
2002
- 2002-06-28 HU HU0600779A patent/HU230244B1/hu not_active IP Right Cessation
- 2002-06-28 BR BRPI0211191A patent/BRPI0211191B8/pt not_active IP Right Cessation
- 2002-06-28 ES ES02748013.6T patent/ES2537549T3/es not_active Expired - Lifetime
- 2002-06-28 KR KR1020087029745A patent/KR100944674B1/ko active IP Right Grant
- 2002-06-28 CN CNB028128168A patent/CN1324147C/zh not_active Expired - Fee Related
- 2002-06-28 US US10/187,253 patent/US6936442B2/en not_active Expired - Lifetime
- 2002-06-28 NZ NZ530602A patent/NZ530602A/en not_active IP Right Cessation
- 2002-06-28 CA CA2779653A patent/CA2779653C/en not_active Expired - Lifetime
- 2002-06-28 JP JP2003508717A patent/JP2005511004A/ja active Pending
- 2002-06-28 MX MXPA03011802A patent/MXPA03011802A/es active IP Right Grant
- 2002-06-28 CA CA002451756A patent/CA2451756A1/en not_active Abandoned
- 2002-06-28 EP EP02748013.6A patent/EP1537235B1/en not_active Expired - Lifetime
- 2002-06-28 SK SK1575-2003A patent/SK15752003A3/sk unknown
- 2002-06-28 AU AU2002318450A patent/AU2002318450B2/en not_active Ceased
- 2002-06-28 PL PL368049A patent/PL210849B1/pl unknown
- 2002-06-28 RU RU2004102205/13A patent/RU2301263C2/ru active
- 2002-06-28 CZ CZ2003-3516A patent/CZ308201B6/cs not_active IP Right Cessation
- 2002-06-28 KR KR1020037017171A patent/KR100888377B1/ko active IP Right Grant
- 2002-06-28 WO PCT/US2002/020684 patent/WO2003002753A2/en active Application Filing
-
2003
- 2003-12-19 NO NO20035732A patent/NO337901B1/no not_active IP Right Cessation
-
2004
- 2004-01-13 BG BG108526A patent/BG66283B1/bg unknown
-
2005
- 2005-05-23 US US11/135,189 patent/US20050221300A1/en not_active Abandoned
-
2006
- 2006-01-06 HK HK06100271.4A patent/HK1080516B/zh not_active IP Right Cessation
-
2007
- 2007-11-05 AU AU2007231822A patent/AU2007231822B2/en not_active Ceased
-
2008
- 2008-08-21 JP JP2008213329A patent/JP2009011324A/ja not_active Withdrawn
-
2011
- 2011-11-11 JP JP2011247977A patent/JP2012075440A/ja not_active Withdrawn
-
2013
- 2013-12-27 JP JP2013271027A patent/JP6026401B2/ja not_active Expired - Fee Related
-
2016
- 2016-07-28 JP JP2016148172A patent/JP2016182149A/ja not_active Withdrawn
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6004044A (en) * | 1995-05-03 | 1999-12-21 | Itt Cannon, Inc. | Optoelectric connector |
| RU2146372C1 (ru) * | 1998-04-16 | 2000-03-10 | Гематологический научный центр РАМН | Способ определения парвовируса б19 |
Non-Patent Citations (1)
| Title |
|---|
| DURIGON E.L. et. al., «Multiple primer pairs for polymerase chain reaction (PCR) amplification of human parvovirus В19 DNA», J Virol Methods. 1993 Oct; 44(2-3):155-65. * |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2301263C2 (ru) | Способ выявления парвовируса b19 человека в биологическом образце (варианты) и набор для его осуществления | |
| AU2002318450A1 (en) | Diagnostic assays for parvovirus B19 | |
| US20120219941A1 (en) | Identification of Oligonucleotides for the Capture, Detection and Quantitation of Hepatitis A Viral Nucleic Acid | |
| EP1910578A2 (en) | Methods and compositions for detecting bk virus | |
| MXPA05006158A (es) | Identificacion de oligonucleotidos para la captura, deteccion y cuantificacion del virus del nilo occidental. | |
| CA2943122A1 (en) | Methods and compositions for detecting rhinoviruses | |
| US20030143527A1 (en) | Identification of oligonucleotides for the capture, detection and quantitation of hepatitis B viral DNA |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PD4A | Correction of name of patent owner | ||
| HE4A | Change of address of a patent owner | ||
| PC41 | Official registration of the transfer of exclusive right |
Effective date: 20161003 |
|
| PD4A | Correction of name of patent owner |